キノプロテイングルコース脱水素酵素およびその製造方法
【課題】耐熱性および耐pH性に優れ、温度安定性およびpH安定性に優れたキノプロテイングルコース脱水素酵素の提供。
【解決手段】ピロバキュラム由来の、下記の性質を有するキノプロテイングルコース脱水素酵素。(1)分子量(SDS−PAGE法):33±6kDa(2)一量体タンパク質(3)最適pH:pH7〜9(4)最適温度:75℃以上(5)温度安定性:80℃以下(6)pH安定性:pH4〜11および、該酵素の製造方法、この酵素と補酵素との複合体、グルコース測定キット、前記酵素遺伝子、前記酵素遺伝子を含むベクター、前記ベクターを含む形質転換体。
【解決手段】ピロバキュラム由来の、下記の性質を有するキノプロテイングルコース脱水素酵素。(1)分子量(SDS−PAGE法):33±6kDa(2)一量体タンパク質(3)最適pH:pH7〜9(4)最適温度:75℃以上(5)温度安定性:80℃以下(6)pH安定性:pH4〜11および、該酵素の製造方法、この酵素と補酵素との複合体、グルコース測定キット、前記酵素遺伝子、前記酵素遺伝子を含むベクター、前記ベクターを含む形質転換体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、キノプロテイングルコース脱水素酵素およびその製造方法、前記酵素と補酵素との複合体、グルコース測定キット、前記酵素遺伝子、前記酵素遺伝子を含むベクター、ならびに前記ベクターを含む形質転換体に関する。
【背景技術】
【0002】
キノプロテイングルコース脱水素酵素(EC 1.1.5.2、以下、「キノプロテインGDH」という場合もある)は、ピロールキノリンキノン(以下、「PQQ」という場合もある)を補酵素とし、D−グルコースからD−グルコノ−1,5−ラクトンを産生する反応を触媒するグルコース脱水素酵素である。
【0003】
グルコース脱水素酵素は、近年、その基質特異性を利用した、酵素電池、バイオセンサー等に応用されている。このような応用の場面では、電力供給、測定精度等の安定化の観点から、幅広い条件下で利用できる酵素が望まれる。このため、従来、温度、pH等の安定性に優れた酵素開発が行われている(例えば、特許文献1および2等)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第4036667号公報
【特許文献2】特開2006−262767号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、従来のグルコース脱水素酵素は、温度およびpH共に、優れた耐性と安定性を実現するという点からは、未だ十分とはいえなかった。そこで、本発明は、耐熱性および耐pH性に優れ、かつ温度安定性およびpH安定性に優れた、グルコース脱水素酵素の提供を目的とする。
【課題を解決するための手段】
【0006】
本発明のキノプロテイングルコース脱水素酵素は、下記(1)から(6)の性質を有することを特徴とする。
(1)分子量(SDS−PAGE法):33±6kDa
(2)一量体タンパク質
(3)最適pH:pH7〜9
(4)最適温度:75℃以上
(5)温度安定性:80℃以下
(6)pH安定性:pH4〜11
【0007】
本発明のキノプロテイングルコース脱水素酵素−補酵素複合体は、本発明のキノプロテイングルコース脱水素酵素と、ピロールキノリンキノンとを含むことを特徴とする。
【0008】
本発明のグルコース測定キットは、本発明のキノプロテイングルコース脱水素酵素および本発明のキノプロテイングルコース脱水素酵素−補酵素複合体の少なくとも一方を含むことを特徴とする。
【0009】
本発明のキノプロテイングルコース脱水素酵素遺伝子は、下記(a)から(c)のいずれかのタンパク質をコードすることを特徴とする。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0010】
本発明のキノプロテイングルコース脱水素酵素遺伝子は、下記(d)から(g)のいずれかの遺伝子であることを特徴とする。
(d)配列番号5の塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(e)配列番号5の塩基配列において、1もしくは数個の塩基が、置換、付加、挿入もしくは欠失した塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(f)配列番号5の塩基配列と40%以上の相同性を有する塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(g)配列番号5の塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
【0011】
本発明の発現ベクターは、本発明のキノプロテイングルコース脱水素酵素遺伝子を含むことを特徴とする。
【0012】
本発明の形質転換体は、本発明の発現ベクターを含むことを特徴とする。
【0013】
本発明のキノプロテイングルコース脱水素酵素の製造方法は、本発明の形質転換体を培養する工程を含むことを特徴とする。
【発明の効果】
【0014】
本発明のキノプロテイングルコース脱水素酵素は、耐熱性および耐pH性に優れ、温度安定性およびpH安定性に優れるため、高温、高pHおよび低pH条件下でも、高い酵素活性が維持される。このため、本発明の酵素によれば、幅広い温度またはpH条件下において、化学反応を安定的に触媒可能である。また、本発明の酵素は、一般的な酵素と比べてその耐熱性および耐pH性に優れるため、製造工程で熱処理またはpH処理を行うことにより、他の酵素と容易に分離できる。このため、本発明の酵素は、製造性にも優れる。
【図面の簡単な説明】
【0015】
【図1】図1は、本発明の酵素の一例について、SDS−PAGEの泳動結果を示す写真である。
【図2】図2は、本発明の酵素の一例について、最適温度の測定結果を示すグラフである。
【図3】図3は、本発明の酵素の一例および本発明の酵素−補酵素複合体の一例について、温度安定性の測定結果を示すグラフである。
【図4】図4は、本発明の酵素の一例について、最適pHの測定結果を示すグラフである。
【図5】図5は、本発明の酵素の一例について、pH安定性の測定結果を示すグラフである。
【図6】図6は、本発明の酵素の一例について、PQQ濃度と酵素活性との関係を示すグラフである。
【図7】図7は、本発明の酵素の一例および本発明の酵素−補酵素複合体の一例について、250〜550nmにおける吸光度の測定結果を示すグラフである。
【発明を実施するための形態】
【0016】
本発明のキノプロテイングルコース脱水素酵素は、例えば、ピロバキュラム(Pyrobaculum)属の菌体に由来するのが好ましい。前記ピロバキュラム(Pyrobaculum)属の菌体としては、例えば、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体が好ましい。前記ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体としては、例えば、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株であるのが好ましい。なお、前記IM2株のゲノムは公知であるが、ゲノム上にキノプロテイングルコース脱水素酵素をコードする遺伝子があることを見出したのは、本発明者が初めてである。
【0017】
本発明のキノプロテイングルコース脱水素酵素は、配列番号1または2のアミノ酸配列における配列番号3および配列番号4のアミノ酸配列以外の配列において、1以上のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなることが好ましい。
【0018】
本発明のキノプロテイングルコース脱水素酵素は、下記(a)から(c)のいずれかのタンパク質からなることが好ましい。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0019】
また、別の局面では、本発明のキノプロテイングルコース脱水素酵素は、下記(a)から(c)のいずれかのタンパク質からなることを特徴とする。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0020】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素は、配列番号1または2のアミノ酸配列における配列番号3および配列番号4のアミノ酸配列以外の配列において、1以上のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなることが好ましい。
【0021】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素は、下記(4)および(6)からなる群から選択される少なくとも一つの性質を有するのが好ましい。
(4)最適温度:75℃以上
(5)温度安定性:80℃以下
(6)pH安定性:pH4〜11
【0022】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素は、例えば、ピロバキュラム(Pyrobaculum)属の菌体に由来するのが好ましい。前記ピロバキュラム(Pyrobaculum)属の菌体としては、例えば、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体が好ましい。前記ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体としては、例えば、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株であるのが好ましい。
【0023】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素−補酵素複合体は、本発明のキノプロテイングルコース脱水素酵素と、ピロールキノリンキノンとを含むことを特徴とする。
【0024】
前記別の局面において、本発明のグルコース測定キットは、本発明のキノプロテイングルコース脱水素酵素および本発明のキノプロテイングルコース脱水素酵素−補酵素複合体の少なくとも一方を含むことを特徴とする。
【0025】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素遺伝子は、下記(a)から(c)のいずれかのタンパク質をコードすることを特徴とする。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0026】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素遺伝子は、下記(d)から(g)のいずれかの遺伝子であることを特徴とする。
(d)配列番号5の塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(e)配列番号5の塩基配列において、1もしくは数個の塩基が、置換、付加、挿入もしくは欠失した塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(f)配列番号5の塩基配列と40%以上の相同性を有する塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(g)配列番号5の塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
【0027】
前記別の局面において、本発明の発現ベクターは、本発明のキノプロテイングルコース脱水素酵素遺伝子を含むことを特徴とする。
【0028】
前記別の局面において、本発明の形質転換体は、本発明の発現ベクターを含むことを特徴とする。
【0029】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素の製造方法は、本発明の形質転換体を培養する工程を含むことを特徴とする。
【0030】
以下に、本発明について、例をあげて説明する。なお、本発明は、これに限定されない。
【0031】
<本発明のキノプロテイングルコース脱水素酵素>
(1)由来
本発明のキノプロテインGDHの由来は、特に制限されないが、前述のように、例えば、ピロバキュラム(Pyrobaculum)属の菌体が好ましい。前記ピロバキュラム(Pyrobaculum)属の菌体としては、特に制限されないが、例えば、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)、ピロバキュラム・アーセナティカム(Pyrobaculum arsenaticum)、ピロバキュラム・カリディフォンティス(Pyrobaculum calidifontis)、ピロバキュラム・イスランディカム(Pyrobaculum islandicum)、ピロバキュラム・オギュニエンス(Pyrobaculum oguniense)、ピロバキュラム・オルガノトロファム(Pyrobaculum organotrophum)種が挙げられ、好ましくは、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体である。前記ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体としては、例えば、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株が好ましい。本発明のキノプロテインGDHは、組換えタンパク質である場合、例えば、前述のピロバキュラム(Pyrobaculum)属の菌体由来のDNA断片を導入した形質転換体から得られたものであってもよい。本発明では、このような形質転換体由来のキノプロテインGDHも、ピロバキュラム(Pyrobaculum)属の菌体由来のキノプロテインGDHに含まれる。前記形質転換体の宿主としては、特に制限されないが、例えば、大腸菌、酵母、糸状菌、放線菌、COS細胞、CHO細胞、Sf9細胞等が挙げられる。前記大腸菌としては、特に制限されないが、例えば、S17−1、BL21(DE3)、BL21−CodonPlus(DE3)−RIL、Rosetta2(DE3)、Rosetta−gami2(DE3)等の菌株が挙げられる。
【0032】
(2)採取方法
前記キノプロテインGDHは、特に制限されないが、例えば、前記キノプロテインGDHを発現する微生物の菌体、動物細胞、植物細胞、形質転換体等の細胞を培養し、その培養物から回収してもよい。前記細胞は、特に制限されないが、例えば、前記ピロバキュラム(Pyrobaculum)属の菌体、前記キノプロテインGDHをコードする遺伝子を導入した形質転換体等が挙げられ、好ましくは、前記キノプロテインGDHをコードする遺伝子を導入した形質転換体である。前記細胞の培養方法は、特に制限されず、例えば、従来公知の方法等を採用できる。
【0033】
前記培養物は、特に制限されないが、例えば、培養上清、培養細胞、細胞抽出物等が挙げられる。前記培養物は、例えば、前記培養上清、前記培養細胞、前記細胞抽出物等の処理物であってもよい。前記培養物の処理としては、特に制限されないが、例えば、濃縮、乾燥、凍結乾燥、溶媒処理、界面活性剤処理、酵素処理、タンパク質分画、超音波処理、磨砕処理等が挙げられる。また、前記培養物は、例えば、前記培養上清、前記培養細胞、前記細胞抽出物、前記処理物等の混合物であってもよい。前記混合物は、構成物を任意の組み合わせおよび比率で混合することができ、特に制限されない。前記培養物からの前記キノプロテインGDHの回収方法は、特に制限されず、例えば、従来公知の方法等を採用できる。
【0034】
(3)精製方法
前記キノプロテインGDHは、例えば、タンパク質の単離精製に用いられる一般的な生化学的方法を、単独で、または、適宜組み合わせて用いることにより、前記培養物から精製可能である。前記生化学的方法としては、特に制限されないが、例えば、硫安沈殿、ゲルクロマトグラフィー、イオン交換クロマトグラフィー、アフィニティクロマトグラフィー等が挙げられる。前記生化学的方法を組み合わせて精製する場合、例えば、精製工程毎に、キノプロテインGDH活性を測定し、前記活性の検出された分画物を選抜してもよい。前記活性の測定方法としては、特に制限されず、従来公知の方法を採用できる。
【0035】
(4)分子量
前記キノプロテインGDHは、前述のように、分子量が33±6kDaの一量体タンパク質である。なお、本発明において、前記分子量は、例えば、熱変性還元条件下のSDS−PAGE法による測定値である。前記熱変性還元条件下は、例えば、タンパク質を加熱変性させ、2−メルカプトエタノール等の還元剤により、そのS−S結合を切断する条件下である。本発明のキノプロテインGDHの分子量の理論値は、例えば、38452Daであってもよい。
【0036】
(5)最適温度
前記キノプロテインGDHの最適温度は、前述のように、75℃以上である。また、前記キノプロテインGDHは、75℃におけるキノプロテインGDH活性を100%としたときに、50℃における前記活性が、20〜40%、60℃における前記活性が、40〜60%、70℃における前記活性が、70〜90%であってもよい。
【0037】
(6)最適pH
前記キノプロテインGDHの最適pHは、前述のように、pH7〜9であり、好ましくは、pH7.5〜8.5であり、より好ましくは、pH8である。
【0038】
(7)温度安定性
前記キノプロテインGDHは、前述のように、80℃以下で安定である。なお、本発明において、「酵素が80℃以下で安定である」とは、例えば、pH8、80℃以下の条件下で酵素を10分間熱処理し、50℃で酵素活性を測定した場合に、残存酵素活性率(熱処理前の酵素活性率を100%としたときの、熱処理後の酵素活性率)が高いことをいう。高い残存酵素活性率とは、特に制限されないが。例えば、60〜130%であり、好ましくは、70〜120%であり、より好ましくは、80〜110%である。また、前記キノプロテインGDHは、pH8、90℃以下の条件下で酵素を10分間熱処理し、50℃で酵素活性を測定した場合に、例えば、残存酵素活性率が50%以上であってもよい。
【0039】
(8)pH安定性
前記キノプロテインGDHは、前述のように、pH4〜11で安定である。なお、本発明において、「酵素がpH4〜11で安定である」とは、例えば、pH4〜11、70℃の条件下で酵素を30分間維持し、50℃で酵素活性を測定した場合に、比活性(酵素活性が最も高いpHにおける酵素活性率を100%としたときの酵素活性率)が高いことをいう。高い比活性とは、特に制限されないが、例えば、例えば、60〜100%であり、好ましくは、70〜100%であり、より好ましくは、80〜100%である。
【0040】
このように、本発明のキノプロテインGDHは、耐熱性および耐pH性に優れ、温度安定性およびpH安定性にも優れる。なお、本発明において、「耐熱性に優れる」とは、例えば、高温条件下において、酵素活性を有することをいい、「耐pH性に優れる」とは、例えば、低pH条件および高pH条件下において、酵素活性を有することをいう。
【0041】
(9)基質特異性
前記キノプロテインGDHは、D−グルコースを基質とする。また、前記キノプロテインGDHは、例えば、D−グルコース以外の、他の基質に対する酵素活性を有してもよい。前記他の基質としては、特に制限されないが、例えば、単糖、二糖、アミノ糖、ウロン酸等が挙げられる。前記単糖としては、例えば、エリトロース、トレオース、キシロース、リボース、アラビノース、リキソース、アピオース、アロース、ガラクトース、タロース、グロース、アルトロース、マンノース、イドース等のアルドース、エリトルロース、リブロース、キシルロース、タガロース、プシコース、フルクトース、ソルボース、セドヘプツロース、コリオース等のケトースが挙げられる。前記二糖としては、例えば、トレハロース、マルトース、ラクトース、スクロース等が挙げられる。前記アミノ糖としては、例えば、グルコサミン、ガラクトサミン等が挙げられる。前記ウロン酸としては、例えば、グルクロン酸、ガラクツロン酸等が挙げられる。
【0042】
(10)補酵素
前記キノプロテインGDHは、ピロールキノリンキノン(PQQ)を補酵素とする。前記キノプロテインGDHとPQQとは、例えば、カルシウムイオン存在下で結合可能であってもよく、カルシウムイオン不在下で結合可能であってもよい。
【0043】
(11)アミノ酸配列
本発明のキノプロテインGDHは、前記(1)〜(6)の特徴に加えて、例えば、さらに、下記(a)から(c)のいずれかのタンパク質をコードするのが好ましい。なお、配列番号2のアミノ酸配列は、配列番号1のアミノ酸配列におけるN末端1番目〜17番目のアミノ酸残基を欠失したアミノ酸配列である。本発明のキノプロテインGDHは、下記(a)から(c)において、配列番号2のものが好ましい。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0044】
前記(b)における配列番号1のアミノ酸配列において、置換、付加、挿入もしくは欠失した前記アミノ酸残基の数は、例えば、1個以上222個以下、好ましくは、1個以上185個以下、より好ましくは、1個以上148個以下、さらに好ましくは、1個以上111個以下、さらに好ましくは、1個以上92個以下、さらに好ましくは、1個以上74個以下、さらに好ましくは、1個以上55個以下、さらに好ましくは、1個以上37個以下、さらに好ましくは、1個以上18個以下、さらに好ましくは、1個以上9個以下、さらに好ましくは、1個以上5個以下である。
【0045】
前記(b)における配列番号2のアミノ酸配列において、置換、付加、挿入もしくは欠失した前記アミノ酸残基の数は、例えば、1個以上212個以下、好ましくは、1個以上177個以下、より好ましくは、1個以上141個以下、さらに好ましくは、1個以上106個以下、さらに好ましくは、1個以上88個以下、さらに好ましくは、1個以上70個以下、さらに好ましくは、1個以上53個以下、さらに好ましくは、1個以上35個以下、さらに好ましくは、1個以上17個以下、さらに好ましくは、1個以上9個以下、さらに好ましくは、1個以上5個以下である。
【0046】
前記(c)において、配列番号1または2に対する相同性は、好ましくは、40%以上、より好ましくは、50%以上、さらに好ましくは、60%以上、さらに好ましくは、70%以上、さらに好ましくは、75%以上、さらに好ましくは、80%以上、さらに好ましくは、85%以上、さらに好ましくは、90%以上、さらに好ましくは、95%以上である。前記タンパク質の相同性(ホモロジー)は、通常、2つのタンパク質のアミノ酸配列同士を適切に整列(アライメント)したときの同一性のパーセント値で表すことができ、一般に、前記両アミノ酸配列間の正確な一致の出現率を意味する。同一性比較のための配列間での適切な整列は、種々のアルゴリズム、例えば、BLASTアルゴリズムを用いて決定できる(Altschu SF、外4名、J.Mol.Biol.、1990年10月5日、第215巻、第3号、p.403−410)。
【0047】
また、本発明のキノプロテインGDHは、前記(1)〜(6)の特徴に加えて、例えば、さらに、配列番号1または2のアミノ酸配列における配列番号3および配列番号4のアミノ酸配列以外の配列において、1以上のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなることが好ましい。前記キノプロテインGDHは、例えば、配列番号3のアミノ酸配列および配列番号4のアミノ酸配列を含むアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなることが好ましい。置換、付加、挿入もしくは欠失した前記アミノ酸残基の数は、例えば、1個以上354個以下、より好ましくは、1個以上300個以下、さらに好ましくは、1個以上250個以下、さらに好ましくは、1個以上200個以下、さらに好ましくは、1個以上150個以下、さらに好ましくは、1個以上100個以下、さらに好ましくは、1個以上75個以下、さらに好ましくは、1個以上50個以下、さらに好ましくは、1個以上25個以下、さらに好ましくは、1個以上10個以下である。
【0048】
配列番号3および配列番号4のアミノ酸配列は、本発明の酵素の機能を発現するために必須の配列である。配列番号3のアミノ酸配列(His−Xaa−Gly−Gly−Arg)において、ヒスチジン残基は、基質との反応に関与し、残りの4アミノ酸残基は、前記ヒスチジン残基を適切な位置に配置するための足場を形成している。配列番号4のアミノ酸配列(Gly−Xaa−Arg−Asn−Pro−Gln−Gly)において、アルギニン残基およびアスパラギン残基は、補酵素との結合に関与し、残りの5アミノ酸残基は、前記両残基を適切な位置に配置するための足場を形成している。前記ヒスチジン残基、アルギニン残基およびアスパラギン残基が、本発明のキノプロテインGDHの酵素活性中心の一部を形成している。
【0049】
例えば、前記基質がグルコースの場合、前記ヒスチジン残基の側鎖のアミノ基(−NH2)は、グルコースの1位の炭素原子に結合する水酸基からプロトンを引き抜き、これと同時に、グルコースの1位の炭素原子からPQQの5位の炭素原子へのヒドリド移動が起こり、グルコノラクトンが生成する。また、前記アルギニン残基の側鎖末端のイミノ基(=NH)およびアミノ基(−NH2)は、PQQの5位の酸素原子と水素結合し、前記アスパラギン残基の側鎖末端のアミノ基(−NH2)は、PQQの4位の酸素原子と水素結合する。なお、前記アルギニン残基およびアスパラギン残基と前記補酵素との結合は、本発明のキノプロテインGDHのX線結晶構造解析により確認した。また、前記酵素活性中心は、アシネトバクター・カルコアセティカス(Acinetobacter calcoaceticus)のGDH(プロテインデータバンク PDB ID:1CQ1)との構造比較から推定した。
【0050】
配列番号3のアミノ酸配列は、例えば、配列番号1のアミノ酸配列において、N末端から152番目のアミノ酸残基から、N末端から156番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号3のアミノ酸配列は、例えば、配列番号2のアミノ酸配列において、N末端から135番目のアミノ酸残基から、N末端から139番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号3において、Xaaで表されるN末端から2番目のアミノ酸残基(X)は、特に制限されず、任意である。例えば、配列番号2のアミノ酸配列において、前記アミノ酸残基(X)は、アスパラギン(N)である。
【0051】
配列番号4のアミノ酸配列は、配列番号1のアミノ酸配列において、N末端から212番目のアミノ酸残基から、N末端から218番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号4のアミノ酸配列は、配列番号2のアミノ酸配列において、N末端から195番目のアミノ酸残基から、N末端から201番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号4において、Xaaで表されるN末端から2番目のアミノ酸残基(Y)は、特に制限されず、任意である。例えば、配列番号2のアミノ酸配列において、前記アミノ酸残基(Y)は、ヒスチジン(H)である。
【0052】
前記キノプロテインGDHは、さらに、配列番号6のアミノ酸配列を含んでもよい。配列番号6のアミノ酸配列は、例えば、配列番号1のアミノ酸配列において、N末端から246番目のアミノ酸残基から、N末端から253番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号6のアミノ酸配列は、例えば、配列番号2のアミノ酸配列において、N末端から229番目のアミノ酸残基から、N末端から236番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号6において、Xaaで表されるN末端から3番目のアミノ酸残基(Z)は、特に制限されず、任意である。例えば、配列番号2のアミノ酸配列において、前記アミノ酸残基(Z)は、グリシン(G)である。
【0053】
<本発明のキノプロテイングルコース脱水素酵素遺伝子>
本発明のキノプロテインGDH遺伝子は、その発現により、本発明のキノプロテインGDHを合成可能であれば制限されないが、前述のように、前記(a)から(c)のいずれかのタンパク質をコードする遺伝子である。また、前記キノプロテインGDH遺伝子は、別の態様においては、前述のように、下記(d)から(g)のいずれかの遺伝子である。
(d)配列番号5の塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(e)配列番号5の塩基配列において、1もしくは数個の塩基が、置換、付加、挿入もしくは欠失した塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(f)配列番号5の塩基配列と40%以上の相同性を有する塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(g)配列番号5の塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
【0054】
前記(e)において、置換、付加、挿入もしくは欠失した塩基の数は、例えば、1個以上636個以下、好ましくは、1個以上531個以下、より好ましくは、1個以上423個以下、さらに好ましくは、1個以上318個以下、さらに好ましくは、1個以上264個以下、さらに好ましくは、1個以上210個以下、さらに好ましくは、1個以上159個以下、さらに好ましくは、1個以上105個以下、さらに好ましくは、1個以上51個以下、さらに好ましくは、1個以上25個以下、1個以上9個以下、さらに好ましくは、1個以上5個以下である。
【0055】
前記(f)において、配列番号5に対する相同性は、好ましくは、40%以上、より好ましくは、50%以上、好ましくは、60%以上、より好ましくは、70%以上、さらに好ましくは、75%以上、さらに好ましくは、80%以上、さらに好ましくは、85%以上、さらに好ましくは、90%以上、さらに好ましくは、95%以上である。前記相同性は、例えば、BLAST等を用いてデフォルトの条件で計算することにより、求めることができる。また、前記キノプロテインGDH遺伝子は、配列番号5の塩基配列に相補的な塩基配列からなる遺伝子も含む。前記キノプロテインGDH遺伝子は、例えば、本発明のキノプロテインGDHのみをコードするものでもよいし、ペプチドおよび他のタンパク質等との融合タンパク質をコードするものでもよい。融合させる前記ペプチドおよび他のタンパク質等としては、特に制限されないが、例えば、マルトース結合タンパク質、ヒスチジンタグ、GSTタンパク質等が挙げられる。このような、酵素の融合タンパク質化により、酵素精製における手順の簡略化および低廉化、酵素の安定性向上および可溶化等が可能である。
【0056】
前記(g)において、「ストリンジェントな条件下でハイブリダイズする」とは、例えば、当該技術分野の当業者において、周知のハイブリダイゼーションの実験技術である。具体的には、「ストリンジェントな条件」とは、例えば、0.7〜1mol/LのNaCl存在下、60〜68℃でハイブリダイゼーションを行った後、0.1〜2倍のSSC溶液を用い、65〜68℃で洗浄することにより同定することができる条件をいう。なお、1倍のSSC溶液は、150mmol/L NaClおよび15mmol/L クエン酸ナトリウムからなる。
【0057】
本発明のキノプロテインGDH遺伝子の製造方法としては、特に制限されないが、例えば、本発明のキノプロテインGDHのアミノ酸配列、または本発明のキノプロテインGDH遺伝子の塩基配列に基づいて、従来公知の遺伝子工学的手法、化学合成法等により製造できる。前記遺伝子工学的手法としては、特に制限されないが、例えば、本発明のキノプロテインGDH遺伝子の塩基配列を基に設計したプライマーを用い、ゲノムDNAを鋳型として、PCR等の核酸増幅を行う方法が挙げられる。前記ゲノムDNAの由来生物としては、特に制限されないが、例えば、前述のピロバキュラム(Pyrobaculum)属の菌体等が挙げられる。
【0058】
さらに、本発明のキノプロテインGDH遺伝子は、本発明のキノプロテインGDHを発現可能な遺伝子であれば制限されず、例えば、変異導入により改変したものも含む。前記変異導入方法としては、特に制限されないが、例えば、Kunlel法またはギャップ二重鎖法等の公知手法、これに準じる方法等が挙げられる。前記変異導入方法は、例えば、部位特異的突然変異誘発法を利用した市販の変異導入用キット等を利用してもよい。
【0059】
<本発明の発現ベクター>
本発明の発現ベクターは、前述のように、本発明のキノプロテインGDH遺伝子を含む。前記キノプロテインGDH遺伝子を挿入するベクターは、特に制限されず、例えば、大腸菌、放線菌、枯草菌、酵母由来のプラスミド、λファージ等が挙げられる。前記挿入用のベクターは、具体的には、例えば、pET11a、pIJ702、pACYC177、pACYC184、pBluescript、pBR322、pHSG367、pNUT4、pTrc99A、pUC19、pUB110、YEp13、λgt10、pTONA5a、pET28等が挙げられる。前記発現ベクターに、前記キノプロテインGDH遺伝子を挿入する方法は、特に制限されず、従来公知の方法を採用できる。前記キノプロテインGDH遺伝子の挿入方法は、具体的には、例えば、前記キノプロテインGDH遺伝子の精製DNAを、適当な制限酵素で切断後、適当な挿入用ベクターの制限酵素部位またはマルチクローニングサイトに挿入する方法等が挙げられる。このような方法により、前記挿入用ベクターに前記キノプロテインGDH遺伝子が連結した、本発明の発現ベクターを得ることができる。
【0060】
また、前記発現ベクターは、本発明のキノプロテインGDH遺伝子を発現し得るものであればよく、例えば、前記キノプロテインGDH遺伝子以外の構造は制限されない。前記キノプロテインGDH遺伝子以外の構造としては、例えば、発現を制御する塩基配列や形質転換体を選択するための遺伝子マーカー等が挙げられる。前記発現を制御する塩基配列としては、特に制限されないが、例えば、プロモーター、エンハンサー等のシスエレメント、スプライシングシグナル、ポリA付加シグナル、リボソーム結合配列(SD配列)等が挙げられる。前記遺伝子マーカーとしては、特に制限されないが、例えば、ジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子、カナマイシン耐性遺伝子等が挙げられる。
【0061】
<本発明の形質転換体>
本発明の形質転換体は、前述のように、本発明の発現ベクターを含む。本発明の形質転換体は、本発明の発現ベクターを含むため、前記キノプロテインGDHを産生可能である。前記形質転換体は、例えば、前記キノプロテインGDH遺伝子を発現可能な発現ベクターを、宿主に導入して得られる。前記宿主としては、例えば、導入する発現ベクターに応じて選択すればよく、特に限定されないが、例えば、大腸菌、酵母、糸状菌、放線菌、COS細胞、CHO細胞、Sf9細胞等の細胞が挙げられ、好ましくは、大腸菌(Escherichia coli)である。前記大腸菌としては、特に制限されないが、例えば、前述の、S17−1、BL21(DE3)、BL21−CodonPlus(DE3)−RIL、Rosetta2(DE3)、Rosetta−gami2(DE3)等の菌株が挙げられる。前記宿主への前記発現ベクターの導入方法は、特に制限されず、例えば、エレクトロポレーション法、プロトプラスト−PEG法、アグロバクテリウム法、Li法、Biolistic法、パーティクル・ガン法等の従来公知の方法を適宜用いることができる。
【0062】
前記形質転換体の培養により得られた培養物から、本発明のキノプロテインGDHを採取できる。前記培養の方法、培養条件および培地等は、特に限定されず、前述の宿主に応じた方法、培養条件および培地等を適宜採用できる。
【0063】
<本発明のキノプロテインGDHの製造方法>
本発明のキノプロテインGDHの製造方法は、前述のように、本発明のキノプロテインGDHを産生する形質転換体を培養する工程を含む。前記培養工程としては、特に制限されず、前述の宿主に応じた方法、培養条件および培地等を適宜採用できる。また、前記製造方法は、前記培養工程以外に、さらに他の工程を含んでいてもよい。前記他の工程としては、特に制限されないが、例えば、培養工程により得られる培養物を採取する工程、採取した培養物を精製する工程等が挙げられる。前記培養物としては、特に制限されないが、例えば、前述の培養物等が挙げられる。また、前記精製方法としては、特に制限されないが、例えば、前述の精製方法等が挙げられる。
【0064】
<本発明のキノプロテインGDH−補酵素複合体>
本発明のキノプロテインGDH−補酵素複合体は、前述のように、アポ酵素である前記キノプロテインGDHと、前記PQQとを含む。前記キノプロテインGDH−補酵素複合体は、例えば、アポ酵素である前記キノプロテインGDHに、PQQを結合(再構成)させたホロ酵素であってもよい。前記キノプロテインGDH−補酵素複合体は、前記キノプロテインGDHとPQQを含む以外は制限されず、例えば、さらに他の物質を含んでいてもよい。前記キノプロテインGDH−補酵素複合体に含まれる他の成分としては、特に制限されない。
【0065】
本発明のキノプロテインGDH−補酵素複合体の製造方法は、例えば、本発明のキノプロテインGDHの製造工程と、前記キノプロテインGDHに、PQQを結合する結合工程(再構成工程)とを含んでいてもよい。前記結合工程は、特に制限されないが、例えば、前記キノプロテインGDHと前記PQQとを、緩衝液中で反応させてもよい。前記緩衝液は、特に制限されないが、例えば、緩衝剤、無機塩類等を含んでもよい。前記緩衝剤としては、特に制限されないが、例えば、HEPES、Tris、Bis−Tris、KPB(リン酸カリウム緩衝液、K2HPO4/KH2PO4)等が挙げられる。前記無機塩類としては、特に制限されないが、例えば、ナトリウム塩、カルシウム塩等が挙げられる。前記ナトリウム塩は、特に制限されないが、例えば、塩化ナトリウム、クエン酸ナトリウム等が挙げられる。前記カルシウム塩は、特に制限されないが、例えば、塩化カルシウム、クエン酸カルシウム、酢酸カルシウム等が挙げられる。前記反応温度は、特に制限されないが、例えば、4℃以上であり、好ましくは、4℃である。前記反応時間は、特に制限されないが、例えば、16〜20時間であり、好ましくは、16時間である。
【0066】
<本発明のグルコース測定キット>
本発明のグルコース測定キットは、前述のように、本発明のキノプロテインGDHおよび本発明のキノプロテインGDH−補酵素複合体の少なくとも一方を含む。前記グルコース測定キットは、本発明のキノプロテインGDHおよび本発明のキノプロテインGDH−補酵素複合体の少なくとも一方が含まれていればよく、その他の構成物は特に制限されない。前記その他の構成物は、特に制限されないが、例えば、緩衝剤、発色剤、PQQ、カルシウム塩等が挙げられる。前記緩衝剤としては、特に制限されず、例えば、前述の緩衝剤等が挙げられる。前記発色剤としては、特に制限されないが、例えば、2,6−ジクロロインドフェノール(DCIP)、5−メチルフェナジニウムメチルサルフェート(PMS)、2−(4−イオドフェニル)−3−(4−ニトロフェニル)−5−フェニル−2H−テトラゾリウムクロライド(INT)、ニトロブルーテトラゾリウムクロライド(NBT)、1−メトキシ−5−メチルフェナジニウムメチルサルフェート(1−メトキシ−PMS)、2−(4−イオドフェニル)−3−(4−ニトロフェニル)−5−(2,4−ジサルフォフェニル)−2H−テトラゾリウムモノナトリウム塩(WST−1)等が挙げられる。
【実施例】
【0067】
つぎに、本発明の実施例について説明する。なお、本発明は、以下の実施例により制限されない。
【0068】
本例のキノプロテインGDHは、以下のようにして、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株のゲノムDNAから、キノプロテインGDH遺伝子をクローニングし、この遺伝子を導入した形質転換体の培養上清から精製した。
【0069】
[キノプロテインGDH遺伝子]
以下のようにして、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株のゲノムDNAから、配列番号5で表される塩基配列からなるDNA断片をクローニングした。なお、配列番号5で表される塩基配列がコードするアミノ酸配列を、配列番号2に示す。
【0070】
[発現ベクターの作製]
まず、以下のようにして、前記DNA断片を含む発現ベクターを作製した。
【0071】
チューブ内に、下記組成のPCR反応液50μLを添加し、プログラムテンプコントロールシステム PC−816S(アステック社製)を用いてPCRを行った。前記PCRは、98℃で15秒、65℃で2秒および74℃で30秒を1サイクルとして25サイクル繰り返した。
【0072】
(PCR反応液の組成)
成分 配合量 最終濃度
ゲノムDNA 0.5μL(500ng)
センスプライマー 1.0μL(100pmol) 2μmol/L
アンチセンスプライマー 1.0μL(100pmol) 2μmol/L
Buffer#1※ 5.0μL
塩化マグネシウム 2.0μL(50nmol) 1mmol/L
dNTPs 5.0μL(10nmol) 0.2mmol/L
KOD DNAポリメラーゼ 1.0μL(2.5U)
水 34.5μL
計 50.0μL
※Buffer#1の組成
成分 濃度
(NH4)2SO4 60mmol/L
KCl 100mmol/L
Tris−HCl(pH8.0) 1.2mol/L
Triton(登録商標)X−100 1w/v%
BSA 0.01w/v%
【0073】
なお、前記PCR反応液における前記センスプライマーおよびアンチセンスプライマーとしては、以下のプライマーセットを用いた。
【0074】
センスプライマー(配列番号7)
5’−catatgagtctgggcttgttgacc−3’
アンチセンスプライマー(配列番号8)
5’−aggatccttaagtgtgttgctcagatacg−3’
【0075】
プラスミドpET11aと増幅した前記DNA断片とを、制限酵素BamHIおよびNdeI(New England Biolabs社製)で処理後、混合して連結し、発現ベクターを得た。前記発現ベクターを大腸菌BL21−CodonPlus(DE3)−RILに導入した。この大腸菌を、下記組成のSB培地中で、37℃で6時間培養した。得られた培養液1Lを、10分間、遠心分離(7000×g)して、菌体を回収した。前記菌体を、0.85w/v%塩化ナトリウム水溶液を用いて懸濁した。この懸濁液を、10分間、再度遠心分離(7000×g)して、前記菌体を回収した。この菌体(菌体湿重量10g)を、0.2mol/L NaClを含む10mmol/L KPB(pH7.0)50mLに懸濁し、氷冷しながら、超音波破砕機を用いて破砕した。得られた破砕液を、20分間、遠心分離(15000×g)し、上清(粗酵素液)を回収した。ブラッドフォード法(Bio−Rad Protein Assay)により、この粗酵素液のタンパク質量を測定した。
【0076】
(SB培地の組成)
成分 濃度
バクトトリプトン 12.0g/L
酵母エキス 24.0g/L
グリセロール 5mL/L
K2HPO4 12.5g/L
KH2PO4 3.8g/L
【0077】
[キノプロテインGDH活性の測定]
前記粗酵素液の酵素活性は、以下のようにして測定した。まず、所定濃度(10、20および30μg/mL)の前記粗酵素液を含む下記組成の測定試薬1mLに、100mmol/Lの濃度となるようにD−グルコースを添加し、50℃で10分間反応させた。50℃の条件下、各反応液の測定波長600nmにおける吸光度を、分光光度計(セルの光路長0.4cm)を用いて測定した。なお、コントロールとして、前記粗酵素液を無添加とした以外は同様にして、吸光度を測定した。得られた吸光度変化量を下記式1に代入し、キノプロテインGDH活性(unit/mg)を算出した。なお、本例において、キノプロテインGDH活性 1単位(1 unit)とは、1分間に1μmolのDCIPを還元する酵素活性である。また、前記粗酵素液の前記タンパク質量とキノプロテインGDH活性から、前記タンパク質1mgあたりの酵素活性(比活性(unit/mg))および全タンパク質の酵素活性(総活性(unit))を算出した。
【0078】
(測定試薬の組成)
成分 濃度
1,3−ビス[トリス(ヒドロキシメチル)メチルアミノ]プロパン
(Bis−Tris propane、pH8) 50mmol/mL
ピロールキノリンキノン(PQQ) 1.2μmol/mL
2,6−ジクロロフェノールインドフェノール(DCIP) 0.1mmol/mL
粗酵素液 10〜30μg/mL
【0079】
【数1】

【0080】
[キノプロテインGDHの精製]
前記粗酵素液を、80℃で10分間熱処理した。この処理酵素液を、HiPrep SP強陽イオンクロマトカラム(GEヘルスサイエンス・ジャパン社製)を用いて精製した。この精製酵素および前記処理酵素液について、前述の[キノプロテインGDH活性の測定]と同様にして、タンパク質量と酵素活性を測定し、比活性(unit/mg)および総活性(unit)を算出した。前記粗酵素液の総活性を100%としたときの、前記処理酵素液および前記精製酵素の総活性の割合を、収率(%)として算出した。前記粗酵素液の比活性を1としたときの、前記処理酵素液および前記精製酵素の比活性の倍率を、精製倍率として算出した。また、前記粗酵素液、処理酵素液および精製酵素と分子量マーカーとを、熱変性還元条件下のSDS−PAGEに供した。
【0081】
下記表1に、前記粗酵素液、処理酵素液および精製酵素のタンパク質量(mg)、総活性(unit)、比活性(unit/mg)、収率(%)および精製倍率の結果を示す。
【0082】
(表1)
タンパク質量 総活性 比活性 収率 精製倍率
(mg) (unit) (unit/mg) (%)
粗酵素液 554.84 28.89 0.052 100 1
処理酵素液 46.04 29.16 0.063 101 12.16
精製酵素 29.59 22.91 0.77 79 14.81
【0083】
図1の写真に、前記粗酵素液、処理酵素液および精製酵素を、熱変性還元条件下のSDS−PAGEで泳動した結果を示す。同図において、レーン1は分子量マーカー、レーン2は粗酵素液、レーン3は処理酵素液、レーン4は精製酵素の泳動結果である。同図に示すように、キノプロテインGDHの分子量は、約33kDaであった。
【0084】
[最適温度]
所定温度(50、60、70および75℃)に加温した前記測定試薬に、D−グルコースを添加し、直ちに吸光度を測定した以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定し、酵素活性を算出した。
【0085】
図2のグラフに、前記精製酵素の最適温度の測定結果を示す。同図において、横軸は、測定温度(℃)であり、縦軸は、酵素活性である。同図に示すように、前記精製酵素の酵素活性は、75℃において最も高かった。なお、前記DCIPの褪色のため、75℃を超えた温度条件では、測定できなかった。
【0086】
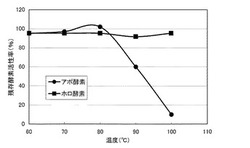
[温度安定性]
前記精製酵素(アポ酵素)、PQQを再構成させた前記精製酵素(ホロ酵素、酵素−補酵素複合体)の温度安定性を、それぞれ評価した。まず、以下のようにして、前記ホロ酵素を調製した。すなわち、前記アポ酵素を、0.0286mmol/Lとなるように、下記組成の再構成液に添加し、4℃で16時間反応させた。この反応液を、Sephadex(登録商標)G−25(PD−10、GEヘルスサイエンス・ジャパン社製)に添加して、酵素に結合していないPQQを除去し、ホロ酵素を回収した。その後、同じカラムで緩衝液を10mmol/L KPB(pH7.0)に置換して、前記ホロ酵素を調製した。前記両酵素を所定温度(60、70、80、90および100℃)で10分間熱処理した。前記アポ酵素は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。前記ホロ酵素は、前記粗酵素液の濃度を3.67μg/mLとし、前記PQQを無添加とした前記測定試薬を用いた以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。得られた各吸光度を下記式2に代入して、残存酵素活性率(%)を算出した。
【0087】
(再構成液の組成)
成分 濃度
ピロールキノリンキノン(PQQ) 0.28mmol/L
NaCl 100mmol/L
HEPES(pH7.5) 20mmol/L
【0088】
残存酵素活性率(%)=A/B×100 ・・・(2)
A=熱処理後の各酵素を添加した反応液の吸光度
B=熱処理なしの各酵素を添加した反応液の吸光度
【0089】
図3のグラフに、各酵素の温度安定性の測定結果を示す。同図において、横軸は、測定温度(℃)であり、縦軸は、残存酵素活性率(%)である。また、同図の各プロットは、前記アポ酵素が、黒丸(●)であり、前記ホロ酵素が、黒四角(■)である。同図に示すように、前記アポ酵素の残存酵素活性率は、60〜80℃において、約100%であり、90℃において、約60%であった。前記ホロ酵素の残存酵素活性率は、60〜100℃において、約100%であった。このように、PQQを再構築させていない前記精製酵素は、60〜80℃において、酵素活性が維持され、100℃においても、約60%の高い残存酵素活性率を有した。また、PQQを再構築させた前記精製酵素は、60〜100℃において、酵素活性が維持された。このように、前記精製酵素は、補酵素非結合の状態において、高い温度安定性を示し、補酵素が結合した状態では、さらに高い温度安定性を示した。
【0090】
[最適pH]
前記精製酵素の最適pHを、以下のようにして評価した。まず、前述のBis−Tris propane(pH8)に代えて、以下の、所定pHに設定した50mmol/Lの各緩衝剤を用いた以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。得られた吸光度を下記式3に代入して、pH8.02(HEPES)における酵素活性率を100%としたときの比活性(%)を算出した。
【0091】
(緩衝液)
緩衝剤 pH
リン酸緩衝液(KPB) 6.33、6.82、7.33
HEPES 6.95、8.02、8.4
Tris/HCl 7.48、8.05、8.5、8.91
Bis−Tris propane 8、8.5、9
Glycine/NaOH 8.93、9.49
【0092】
比活性(%)=C/D×100 ・・・(3)
C=各pHの反応液の吸光度
D=pH8.02(HEPES)の反応液の吸光度
【0093】
図4および下記表2に、前記精製酵素の最適pHの測定結果を示す。同図において、横軸は、測定pH(pH)であり、縦軸は、比活性(%)である。同図および同表に示すように、前記精製酵素の比活性は、pH8.02において最も高かった。このように、前記精製酵素の酵素活性は、pH約8において最も高いことが示された。
【0094】
(表2)
pH 緩衝剤 比活性(%)
6.33 KPB 10
6.82 KPB 22.5
6.95 HEPES 37.5
7.33 KPB 42.5
7.48 Tris/HCl 68.75
8 Bis−Tris propane 87.5
8.02 HEPES 100
8.05 Tris/HCl 87.5
8.4 HEPES 63.75
8.5 Tris/HCl 81.25
8.5 Bis−Tris propane 82.5
8.91 Tris/HCl 75
8.93 Glycine/NaOH 50
9 Bis−Tris propane 77.5
9.49 Glycine/NaOH 30
【0095】
[pH安定性]
前記精製酵素のpH安定性を、以下のようにして評価した。まず、前述の[最適pH]測定に用いた各緩衝剤を100mmol/Lに調整した各緩衝液0.1mLに、前記精製酵素49.5μgを添加し、70℃で30分間前処理した。この前処理液を、前記精製酵素量が11μgとなるように、前記測定試薬に添加した以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。得られた吸光度を下記式4に代入して、pH11における酵素活性を100%としたときの比活性(%)を算出した。
【0096】
比活性(%)=E/F×100 ・・・(4)
E=各pHの反応液の吸光度
F=pH11の反応液の吸光度
【0097】
図5のグラフに、前記精製酵素のpH安定性の測定結果を示す。同図において、横軸は、測定pH(pH)であり、縦軸は、比活性(%)である。同図に示すように、前記精製酵素の比活性は、pH4〜11において、85%以上であった。このように、前記精製酵素は、幅広いpH範囲で酵素活性が維持され、高いpH安定性を示した。
【0098】
[基質特異性]
前記精製酵素の基質特異性を、以下のようにして評価した。まず、前記D−グルコースに代えて、以下の各基質を用いた以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。得られた吸光度を下記式5に代入して、前記D−グルコースを基質としたときの酵素活性を100%としたときの、比活性(%)を算出した。
【0099】
比活性(%)=G/H×100 ・・・(5)
G=各基質を含む反応液の吸光度
H=D−グルコースを含む反応液の吸光度
【0100】
下記表3に、基質特異性の測定結果を示す。同表に示すように、前記精製酵素は、種々のアルドースおよびケトースの基質に対する酵素活性を有した。
【0101】
(表3)
基質 比活性(%)
D−グルコース 100
D−マンノース 84
D−キシロース 86
D−リボース 86
D−アロース 160
L−アラビノース 164
D−ガラクトース 186
D−フルクトース 10
D−タガトース 34
L−タガトース 41
D−プシコース 27
L−プシコース 14
L−フルクトース 20
D−ソルボース 16
【0102】
[PQQ結合性]
前記精製酵素のPQQ結合性を、以下のようにして評価した。すなわち、PQQ濃度を、1.2μmol/Lに代えて、所定濃度(1、0.333、0.111、0.037および0μmol/L)とした以外は、前述の[キノプロテインGDH活性の測定]と同様にして、各PQQ濃度におけるキノプロテインGDH活性を測定した。
【0103】
図6のグラフに、前記精製酵素のPQQ結合性の測定結果を示す。同図において、横軸は、PQQ濃度(μmol/L)であり、縦軸は、酵素活性(U/mg)である。同図に示すように、前記精製酵素の活性は、PQQ 0.11〜0.333μmol/L間で直線的に増加し、1μmol/Lのときに、最も高い活性(0.77U/mg)を示した。
【0104】
[PQQ結合におけるカルシウムイオンの影響]
前記精製酵素のPQQ結合(PQQ再構成)における、カルシウムイオンの影響を評価した。まず、以下のようにして、カルシウムイオン存在下で再構成させたホロ酵素(以下、「ホロ酵素(Ca+)」という)と、カルシウムイオン不在下で再構成させたホロ酵素(以下、「ホロ酵素(Ca−)」という)とを調製した。前記ホロ酵素(Ca−)は、前述の[温度安定性]と同様にして調製した。前記ホロ酵素(Ca+)は、1mmol/L 塩化カルシウムを添加した前記再構成液を用いた以外は、前述の[温度安定性]と同様にして調製した。前記精製酵素(アポ酵素)に代えて、これらのホロ酵素を用い、前記測定試薬として、PQQを含まない前記測定試薬とPQQを含む前記測定試薬とを用いた以外は、前述の[キノプロテインGDH活性の測定]と同様にして、各ホロ酵素の酵素活性を測定した。また、分光光度計を用いて、250〜550nmにおける各ホロ酵素および前記精製酵素(アポ酵素)の反応液の吸光度を測定した。
【0105】
図7のグラフに、各ホロ酵素および前記精製酵素(アポ酵素)について、吸光度の測定結果を示す。同図において、横軸は、測定波長(nm)であり、縦軸は、吸光度である。同図に示すように、前記ホロ酵素(Ca+)およびホロ酵素(Ca−)は、共に、350nm付近にPQQの吸収を示すピークが認められた。他方、アポ酵素は、同じ波長領域にピークが認められなかった。したがって、ホロ酵素(Ca+)およびホロ酵素(Ca−)共に、PQQの結合が確認された。また、ホロ酵素(Ca+)およびホロ酵素(Ca−)の酵素活性は、前記測定試薬中にPQQを含む場合と、PQQを含まない場合とで、変化しなかった。このため、アポ酵素からホロ酵素への転換において、カルシウムイオンは不要であることが示された。
【産業上の利用可能性】
【0106】
以上のように、本発明のキノプロテイングルコース脱水素酵素は、耐熱性および耐pH性に優れ、温度安定性およびpH安定性に優れる。したがって、本発明のキノプロテイングルコース脱水素酵素は、幅広い温度およびpH条件下で安定的に利用可能である。このため、本発明のキノプロテイングルコース脱水素酵素の用途は、例えば、その基質特異性を利用した様々な用途が挙げられ、広い分野に適用可能である。
【技術分野】
【0001】
本発明は、キノプロテイングルコース脱水素酵素およびその製造方法、前記酵素と補酵素との複合体、グルコース測定キット、前記酵素遺伝子、前記酵素遺伝子を含むベクター、ならびに前記ベクターを含む形質転換体に関する。
【背景技術】
【0002】
キノプロテイングルコース脱水素酵素(EC 1.1.5.2、以下、「キノプロテインGDH」という場合もある)は、ピロールキノリンキノン(以下、「PQQ」という場合もある)を補酵素とし、D−グルコースからD−グルコノ−1,5−ラクトンを産生する反応を触媒するグルコース脱水素酵素である。
【0003】
グルコース脱水素酵素は、近年、その基質特異性を利用した、酵素電池、バイオセンサー等に応用されている。このような応用の場面では、電力供給、測定精度等の安定化の観点から、幅広い条件下で利用できる酵素が望まれる。このため、従来、温度、pH等の安定性に優れた酵素開発が行われている(例えば、特許文献1および2等)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第4036667号公報
【特許文献2】特開2006−262767号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、従来のグルコース脱水素酵素は、温度およびpH共に、優れた耐性と安定性を実現するという点からは、未だ十分とはいえなかった。そこで、本発明は、耐熱性および耐pH性に優れ、かつ温度安定性およびpH安定性に優れた、グルコース脱水素酵素の提供を目的とする。
【課題を解決するための手段】
【0006】
本発明のキノプロテイングルコース脱水素酵素は、下記(1)から(6)の性質を有することを特徴とする。
(1)分子量(SDS−PAGE法):33±6kDa
(2)一量体タンパク質
(3)最適pH:pH7〜9
(4)最適温度:75℃以上
(5)温度安定性:80℃以下
(6)pH安定性:pH4〜11
【0007】
本発明のキノプロテイングルコース脱水素酵素−補酵素複合体は、本発明のキノプロテイングルコース脱水素酵素と、ピロールキノリンキノンとを含むことを特徴とする。
【0008】
本発明のグルコース測定キットは、本発明のキノプロテイングルコース脱水素酵素および本発明のキノプロテイングルコース脱水素酵素−補酵素複合体の少なくとも一方を含むことを特徴とする。
【0009】
本発明のキノプロテイングルコース脱水素酵素遺伝子は、下記(a)から(c)のいずれかのタンパク質をコードすることを特徴とする。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0010】
本発明のキノプロテイングルコース脱水素酵素遺伝子は、下記(d)から(g)のいずれかの遺伝子であることを特徴とする。
(d)配列番号5の塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(e)配列番号5の塩基配列において、1もしくは数個の塩基が、置換、付加、挿入もしくは欠失した塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(f)配列番号5の塩基配列と40%以上の相同性を有する塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(g)配列番号5の塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
【0011】
本発明の発現ベクターは、本発明のキノプロテイングルコース脱水素酵素遺伝子を含むことを特徴とする。
【0012】
本発明の形質転換体は、本発明の発現ベクターを含むことを特徴とする。
【0013】
本発明のキノプロテイングルコース脱水素酵素の製造方法は、本発明の形質転換体を培養する工程を含むことを特徴とする。
【発明の効果】
【0014】
本発明のキノプロテイングルコース脱水素酵素は、耐熱性および耐pH性に優れ、温度安定性およびpH安定性に優れるため、高温、高pHおよび低pH条件下でも、高い酵素活性が維持される。このため、本発明の酵素によれば、幅広い温度またはpH条件下において、化学反応を安定的に触媒可能である。また、本発明の酵素は、一般的な酵素と比べてその耐熱性および耐pH性に優れるため、製造工程で熱処理またはpH処理を行うことにより、他の酵素と容易に分離できる。このため、本発明の酵素は、製造性にも優れる。
【図面の簡単な説明】
【0015】
【図1】図1は、本発明の酵素の一例について、SDS−PAGEの泳動結果を示す写真である。
【図2】図2は、本発明の酵素の一例について、最適温度の測定結果を示すグラフである。
【図3】図3は、本発明の酵素の一例および本発明の酵素−補酵素複合体の一例について、温度安定性の測定結果を示すグラフである。
【図4】図4は、本発明の酵素の一例について、最適pHの測定結果を示すグラフである。
【図5】図5は、本発明の酵素の一例について、pH安定性の測定結果を示すグラフである。
【図6】図6は、本発明の酵素の一例について、PQQ濃度と酵素活性との関係を示すグラフである。
【図7】図7は、本発明の酵素の一例および本発明の酵素−補酵素複合体の一例について、250〜550nmにおける吸光度の測定結果を示すグラフである。
【発明を実施するための形態】
【0016】
本発明のキノプロテイングルコース脱水素酵素は、例えば、ピロバキュラム(Pyrobaculum)属の菌体に由来するのが好ましい。前記ピロバキュラム(Pyrobaculum)属の菌体としては、例えば、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体が好ましい。前記ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体としては、例えば、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株であるのが好ましい。なお、前記IM2株のゲノムは公知であるが、ゲノム上にキノプロテイングルコース脱水素酵素をコードする遺伝子があることを見出したのは、本発明者が初めてである。
【0017】
本発明のキノプロテイングルコース脱水素酵素は、配列番号1または2のアミノ酸配列における配列番号3および配列番号4のアミノ酸配列以外の配列において、1以上のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなることが好ましい。
【0018】
本発明のキノプロテイングルコース脱水素酵素は、下記(a)から(c)のいずれかのタンパク質からなることが好ましい。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0019】
また、別の局面では、本発明のキノプロテイングルコース脱水素酵素は、下記(a)から(c)のいずれかのタンパク質からなることを特徴とする。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0020】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素は、配列番号1または2のアミノ酸配列における配列番号3および配列番号4のアミノ酸配列以外の配列において、1以上のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなることが好ましい。
【0021】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素は、下記(4)および(6)からなる群から選択される少なくとも一つの性質を有するのが好ましい。
(4)最適温度:75℃以上
(5)温度安定性:80℃以下
(6)pH安定性:pH4〜11
【0022】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素は、例えば、ピロバキュラム(Pyrobaculum)属の菌体に由来するのが好ましい。前記ピロバキュラム(Pyrobaculum)属の菌体としては、例えば、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体が好ましい。前記ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体としては、例えば、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株であるのが好ましい。
【0023】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素−補酵素複合体は、本発明のキノプロテイングルコース脱水素酵素と、ピロールキノリンキノンとを含むことを特徴とする。
【0024】
前記別の局面において、本発明のグルコース測定キットは、本発明のキノプロテイングルコース脱水素酵素および本発明のキノプロテイングルコース脱水素酵素−補酵素複合体の少なくとも一方を含むことを特徴とする。
【0025】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素遺伝子は、下記(a)から(c)のいずれかのタンパク質をコードすることを特徴とする。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0026】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素遺伝子は、下記(d)から(g)のいずれかの遺伝子であることを特徴とする。
(d)配列番号5の塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(e)配列番号5の塩基配列において、1もしくは数個の塩基が、置換、付加、挿入もしくは欠失した塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(f)配列番号5の塩基配列と40%以上の相同性を有する塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(g)配列番号5の塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
【0027】
前記別の局面において、本発明の発現ベクターは、本発明のキノプロテイングルコース脱水素酵素遺伝子を含むことを特徴とする。
【0028】
前記別の局面において、本発明の形質転換体は、本発明の発現ベクターを含むことを特徴とする。
【0029】
前記別の局面において、本発明のキノプロテイングルコース脱水素酵素の製造方法は、本発明の形質転換体を培養する工程を含むことを特徴とする。
【0030】
以下に、本発明について、例をあげて説明する。なお、本発明は、これに限定されない。
【0031】
<本発明のキノプロテイングルコース脱水素酵素>
(1)由来
本発明のキノプロテインGDHの由来は、特に制限されないが、前述のように、例えば、ピロバキュラム(Pyrobaculum)属の菌体が好ましい。前記ピロバキュラム(Pyrobaculum)属の菌体としては、特に制限されないが、例えば、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)、ピロバキュラム・アーセナティカム(Pyrobaculum arsenaticum)、ピロバキュラム・カリディフォンティス(Pyrobaculum calidifontis)、ピロバキュラム・イスランディカム(Pyrobaculum islandicum)、ピロバキュラム・オギュニエンス(Pyrobaculum oguniense)、ピロバキュラム・オルガノトロファム(Pyrobaculum organotrophum)種が挙げられ、好ましくは、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体である。前記ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体としては、例えば、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株が好ましい。本発明のキノプロテインGDHは、組換えタンパク質である場合、例えば、前述のピロバキュラム(Pyrobaculum)属の菌体由来のDNA断片を導入した形質転換体から得られたものであってもよい。本発明では、このような形質転換体由来のキノプロテインGDHも、ピロバキュラム(Pyrobaculum)属の菌体由来のキノプロテインGDHに含まれる。前記形質転換体の宿主としては、特に制限されないが、例えば、大腸菌、酵母、糸状菌、放線菌、COS細胞、CHO細胞、Sf9細胞等が挙げられる。前記大腸菌としては、特に制限されないが、例えば、S17−1、BL21(DE3)、BL21−CodonPlus(DE3)−RIL、Rosetta2(DE3)、Rosetta−gami2(DE3)等の菌株が挙げられる。
【0032】
(2)採取方法
前記キノプロテインGDHは、特に制限されないが、例えば、前記キノプロテインGDHを発現する微生物の菌体、動物細胞、植物細胞、形質転換体等の細胞を培養し、その培養物から回収してもよい。前記細胞は、特に制限されないが、例えば、前記ピロバキュラム(Pyrobaculum)属の菌体、前記キノプロテインGDHをコードする遺伝子を導入した形質転換体等が挙げられ、好ましくは、前記キノプロテインGDHをコードする遺伝子を導入した形質転換体である。前記細胞の培養方法は、特に制限されず、例えば、従来公知の方法等を採用できる。
【0033】
前記培養物は、特に制限されないが、例えば、培養上清、培養細胞、細胞抽出物等が挙げられる。前記培養物は、例えば、前記培養上清、前記培養細胞、前記細胞抽出物等の処理物であってもよい。前記培養物の処理としては、特に制限されないが、例えば、濃縮、乾燥、凍結乾燥、溶媒処理、界面活性剤処理、酵素処理、タンパク質分画、超音波処理、磨砕処理等が挙げられる。また、前記培養物は、例えば、前記培養上清、前記培養細胞、前記細胞抽出物、前記処理物等の混合物であってもよい。前記混合物は、構成物を任意の組み合わせおよび比率で混合することができ、特に制限されない。前記培養物からの前記キノプロテインGDHの回収方法は、特に制限されず、例えば、従来公知の方法等を採用できる。
【0034】
(3)精製方法
前記キノプロテインGDHは、例えば、タンパク質の単離精製に用いられる一般的な生化学的方法を、単独で、または、適宜組み合わせて用いることにより、前記培養物から精製可能である。前記生化学的方法としては、特に制限されないが、例えば、硫安沈殿、ゲルクロマトグラフィー、イオン交換クロマトグラフィー、アフィニティクロマトグラフィー等が挙げられる。前記生化学的方法を組み合わせて精製する場合、例えば、精製工程毎に、キノプロテインGDH活性を測定し、前記活性の検出された分画物を選抜してもよい。前記活性の測定方法としては、特に制限されず、従来公知の方法を採用できる。
【0035】
(4)分子量
前記キノプロテインGDHは、前述のように、分子量が33±6kDaの一量体タンパク質である。なお、本発明において、前記分子量は、例えば、熱変性還元条件下のSDS−PAGE法による測定値である。前記熱変性還元条件下は、例えば、タンパク質を加熱変性させ、2−メルカプトエタノール等の還元剤により、そのS−S結合を切断する条件下である。本発明のキノプロテインGDHの分子量の理論値は、例えば、38452Daであってもよい。
【0036】
(5)最適温度
前記キノプロテインGDHの最適温度は、前述のように、75℃以上である。また、前記キノプロテインGDHは、75℃におけるキノプロテインGDH活性を100%としたときに、50℃における前記活性が、20〜40%、60℃における前記活性が、40〜60%、70℃における前記活性が、70〜90%であってもよい。
【0037】
(6)最適pH
前記キノプロテインGDHの最適pHは、前述のように、pH7〜9であり、好ましくは、pH7.5〜8.5であり、より好ましくは、pH8である。
【0038】
(7)温度安定性
前記キノプロテインGDHは、前述のように、80℃以下で安定である。なお、本発明において、「酵素が80℃以下で安定である」とは、例えば、pH8、80℃以下の条件下で酵素を10分間熱処理し、50℃で酵素活性を測定した場合に、残存酵素活性率(熱処理前の酵素活性率を100%としたときの、熱処理後の酵素活性率)が高いことをいう。高い残存酵素活性率とは、特に制限されないが。例えば、60〜130%であり、好ましくは、70〜120%であり、より好ましくは、80〜110%である。また、前記キノプロテインGDHは、pH8、90℃以下の条件下で酵素を10分間熱処理し、50℃で酵素活性を測定した場合に、例えば、残存酵素活性率が50%以上であってもよい。
【0039】
(8)pH安定性
前記キノプロテインGDHは、前述のように、pH4〜11で安定である。なお、本発明において、「酵素がpH4〜11で安定である」とは、例えば、pH4〜11、70℃の条件下で酵素を30分間維持し、50℃で酵素活性を測定した場合に、比活性(酵素活性が最も高いpHにおける酵素活性率を100%としたときの酵素活性率)が高いことをいう。高い比活性とは、特に制限されないが、例えば、例えば、60〜100%であり、好ましくは、70〜100%であり、より好ましくは、80〜100%である。
【0040】
このように、本発明のキノプロテインGDHは、耐熱性および耐pH性に優れ、温度安定性およびpH安定性にも優れる。なお、本発明において、「耐熱性に優れる」とは、例えば、高温条件下において、酵素活性を有することをいい、「耐pH性に優れる」とは、例えば、低pH条件および高pH条件下において、酵素活性を有することをいう。
【0041】
(9)基質特異性
前記キノプロテインGDHは、D−グルコースを基質とする。また、前記キノプロテインGDHは、例えば、D−グルコース以外の、他の基質に対する酵素活性を有してもよい。前記他の基質としては、特に制限されないが、例えば、単糖、二糖、アミノ糖、ウロン酸等が挙げられる。前記単糖としては、例えば、エリトロース、トレオース、キシロース、リボース、アラビノース、リキソース、アピオース、アロース、ガラクトース、タロース、グロース、アルトロース、マンノース、イドース等のアルドース、エリトルロース、リブロース、キシルロース、タガロース、プシコース、フルクトース、ソルボース、セドヘプツロース、コリオース等のケトースが挙げられる。前記二糖としては、例えば、トレハロース、マルトース、ラクトース、スクロース等が挙げられる。前記アミノ糖としては、例えば、グルコサミン、ガラクトサミン等が挙げられる。前記ウロン酸としては、例えば、グルクロン酸、ガラクツロン酸等が挙げられる。
【0042】
(10)補酵素
前記キノプロテインGDHは、ピロールキノリンキノン(PQQ)を補酵素とする。前記キノプロテインGDHとPQQとは、例えば、カルシウムイオン存在下で結合可能であってもよく、カルシウムイオン不在下で結合可能であってもよい。
【0043】
(11)アミノ酸配列
本発明のキノプロテインGDHは、前記(1)〜(6)の特徴に加えて、例えば、さらに、下記(a)から(c)のいずれかのタンパク質をコードするのが好ましい。なお、配列番号2のアミノ酸配列は、配列番号1のアミノ酸配列におけるN末端1番目〜17番目のアミノ酸残基を欠失したアミノ酸配列である。本発明のキノプロテインGDHは、下記(a)から(c)において、配列番号2のものが好ましい。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【0044】
前記(b)における配列番号1のアミノ酸配列において、置換、付加、挿入もしくは欠失した前記アミノ酸残基の数は、例えば、1個以上222個以下、好ましくは、1個以上185個以下、より好ましくは、1個以上148個以下、さらに好ましくは、1個以上111個以下、さらに好ましくは、1個以上92個以下、さらに好ましくは、1個以上74個以下、さらに好ましくは、1個以上55個以下、さらに好ましくは、1個以上37個以下、さらに好ましくは、1個以上18個以下、さらに好ましくは、1個以上9個以下、さらに好ましくは、1個以上5個以下である。
【0045】
前記(b)における配列番号2のアミノ酸配列において、置換、付加、挿入もしくは欠失した前記アミノ酸残基の数は、例えば、1個以上212個以下、好ましくは、1個以上177個以下、より好ましくは、1個以上141個以下、さらに好ましくは、1個以上106個以下、さらに好ましくは、1個以上88個以下、さらに好ましくは、1個以上70個以下、さらに好ましくは、1個以上53個以下、さらに好ましくは、1個以上35個以下、さらに好ましくは、1個以上17個以下、さらに好ましくは、1個以上9個以下、さらに好ましくは、1個以上5個以下である。
【0046】
前記(c)において、配列番号1または2に対する相同性は、好ましくは、40%以上、より好ましくは、50%以上、さらに好ましくは、60%以上、さらに好ましくは、70%以上、さらに好ましくは、75%以上、さらに好ましくは、80%以上、さらに好ましくは、85%以上、さらに好ましくは、90%以上、さらに好ましくは、95%以上である。前記タンパク質の相同性(ホモロジー)は、通常、2つのタンパク質のアミノ酸配列同士を適切に整列(アライメント)したときの同一性のパーセント値で表すことができ、一般に、前記両アミノ酸配列間の正確な一致の出現率を意味する。同一性比較のための配列間での適切な整列は、種々のアルゴリズム、例えば、BLASTアルゴリズムを用いて決定できる(Altschu SF、外4名、J.Mol.Biol.、1990年10月5日、第215巻、第3号、p.403−410)。
【0047】
また、本発明のキノプロテインGDHは、前記(1)〜(6)の特徴に加えて、例えば、さらに、配列番号1または2のアミノ酸配列における配列番号3および配列番号4のアミノ酸配列以外の配列において、1以上のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなることが好ましい。前記キノプロテインGDHは、例えば、配列番号3のアミノ酸配列および配列番号4のアミノ酸配列を含むアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなることが好ましい。置換、付加、挿入もしくは欠失した前記アミノ酸残基の数は、例えば、1個以上354個以下、より好ましくは、1個以上300個以下、さらに好ましくは、1個以上250個以下、さらに好ましくは、1個以上200個以下、さらに好ましくは、1個以上150個以下、さらに好ましくは、1個以上100個以下、さらに好ましくは、1個以上75個以下、さらに好ましくは、1個以上50個以下、さらに好ましくは、1個以上25個以下、さらに好ましくは、1個以上10個以下である。
【0048】
配列番号3および配列番号4のアミノ酸配列は、本発明の酵素の機能を発現するために必須の配列である。配列番号3のアミノ酸配列(His−Xaa−Gly−Gly−Arg)において、ヒスチジン残基は、基質との反応に関与し、残りの4アミノ酸残基は、前記ヒスチジン残基を適切な位置に配置するための足場を形成している。配列番号4のアミノ酸配列(Gly−Xaa−Arg−Asn−Pro−Gln−Gly)において、アルギニン残基およびアスパラギン残基は、補酵素との結合に関与し、残りの5アミノ酸残基は、前記両残基を適切な位置に配置するための足場を形成している。前記ヒスチジン残基、アルギニン残基およびアスパラギン残基が、本発明のキノプロテインGDHの酵素活性中心の一部を形成している。
【0049】
例えば、前記基質がグルコースの場合、前記ヒスチジン残基の側鎖のアミノ基(−NH2)は、グルコースの1位の炭素原子に結合する水酸基からプロトンを引き抜き、これと同時に、グルコースの1位の炭素原子からPQQの5位の炭素原子へのヒドリド移動が起こり、グルコノラクトンが生成する。また、前記アルギニン残基の側鎖末端のイミノ基(=NH)およびアミノ基(−NH2)は、PQQの5位の酸素原子と水素結合し、前記アスパラギン残基の側鎖末端のアミノ基(−NH2)は、PQQの4位の酸素原子と水素結合する。なお、前記アルギニン残基およびアスパラギン残基と前記補酵素との結合は、本発明のキノプロテインGDHのX線結晶構造解析により確認した。また、前記酵素活性中心は、アシネトバクター・カルコアセティカス(Acinetobacter calcoaceticus)のGDH(プロテインデータバンク PDB ID:1CQ1)との構造比較から推定した。
【0050】
配列番号3のアミノ酸配列は、例えば、配列番号1のアミノ酸配列において、N末端から152番目のアミノ酸残基から、N末端から156番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号3のアミノ酸配列は、例えば、配列番号2のアミノ酸配列において、N末端から135番目のアミノ酸残基から、N末端から139番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号3において、Xaaで表されるN末端から2番目のアミノ酸残基(X)は、特に制限されず、任意である。例えば、配列番号2のアミノ酸配列において、前記アミノ酸残基(X)は、アスパラギン(N)である。
【0051】
配列番号4のアミノ酸配列は、配列番号1のアミノ酸配列において、N末端から212番目のアミノ酸残基から、N末端から218番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号4のアミノ酸配列は、配列番号2のアミノ酸配列において、N末端から195番目のアミノ酸残基から、N末端から201番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号4において、Xaaで表されるN末端から2番目のアミノ酸残基(Y)は、特に制限されず、任意である。例えば、配列番号2のアミノ酸配列において、前記アミノ酸残基(Y)は、ヒスチジン(H)である。
【0052】
前記キノプロテインGDHは、さらに、配列番号6のアミノ酸配列を含んでもよい。配列番号6のアミノ酸配列は、例えば、配列番号1のアミノ酸配列において、N末端から246番目のアミノ酸残基から、N末端から253番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号6のアミノ酸配列は、例えば、配列番号2のアミノ酸配列において、N末端から229番目のアミノ酸残基から、N末端から236番目のアミノ酸残基までのアミノ酸配列に該当する。配列番号6において、Xaaで表されるN末端から3番目のアミノ酸残基(Z)は、特に制限されず、任意である。例えば、配列番号2のアミノ酸配列において、前記アミノ酸残基(Z)は、グリシン(G)である。
【0053】
<本発明のキノプロテイングルコース脱水素酵素遺伝子>
本発明のキノプロテインGDH遺伝子は、その発現により、本発明のキノプロテインGDHを合成可能であれば制限されないが、前述のように、前記(a)から(c)のいずれかのタンパク質をコードする遺伝子である。また、前記キノプロテインGDH遺伝子は、別の態様においては、前述のように、下記(d)から(g)のいずれかの遺伝子である。
(d)配列番号5の塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(e)配列番号5の塩基配列において、1もしくは数個の塩基が、置換、付加、挿入もしくは欠失した塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(f)配列番号5の塩基配列と40%以上の相同性を有する塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(g)配列番号5の塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
【0054】
前記(e)において、置換、付加、挿入もしくは欠失した塩基の数は、例えば、1個以上636個以下、好ましくは、1個以上531個以下、より好ましくは、1個以上423個以下、さらに好ましくは、1個以上318個以下、さらに好ましくは、1個以上264個以下、さらに好ましくは、1個以上210個以下、さらに好ましくは、1個以上159個以下、さらに好ましくは、1個以上105個以下、さらに好ましくは、1個以上51個以下、さらに好ましくは、1個以上25個以下、1個以上9個以下、さらに好ましくは、1個以上5個以下である。
【0055】
前記(f)において、配列番号5に対する相同性は、好ましくは、40%以上、より好ましくは、50%以上、好ましくは、60%以上、より好ましくは、70%以上、さらに好ましくは、75%以上、さらに好ましくは、80%以上、さらに好ましくは、85%以上、さらに好ましくは、90%以上、さらに好ましくは、95%以上である。前記相同性は、例えば、BLAST等を用いてデフォルトの条件で計算することにより、求めることができる。また、前記キノプロテインGDH遺伝子は、配列番号5の塩基配列に相補的な塩基配列からなる遺伝子も含む。前記キノプロテインGDH遺伝子は、例えば、本発明のキノプロテインGDHのみをコードするものでもよいし、ペプチドおよび他のタンパク質等との融合タンパク質をコードするものでもよい。融合させる前記ペプチドおよび他のタンパク質等としては、特に制限されないが、例えば、マルトース結合タンパク質、ヒスチジンタグ、GSTタンパク質等が挙げられる。このような、酵素の融合タンパク質化により、酵素精製における手順の簡略化および低廉化、酵素の安定性向上および可溶化等が可能である。
【0056】
前記(g)において、「ストリンジェントな条件下でハイブリダイズする」とは、例えば、当該技術分野の当業者において、周知のハイブリダイゼーションの実験技術である。具体的には、「ストリンジェントな条件」とは、例えば、0.7〜1mol/LのNaCl存在下、60〜68℃でハイブリダイゼーションを行った後、0.1〜2倍のSSC溶液を用い、65〜68℃で洗浄することにより同定することができる条件をいう。なお、1倍のSSC溶液は、150mmol/L NaClおよび15mmol/L クエン酸ナトリウムからなる。
【0057】
本発明のキノプロテインGDH遺伝子の製造方法としては、特に制限されないが、例えば、本発明のキノプロテインGDHのアミノ酸配列、または本発明のキノプロテインGDH遺伝子の塩基配列に基づいて、従来公知の遺伝子工学的手法、化学合成法等により製造できる。前記遺伝子工学的手法としては、特に制限されないが、例えば、本発明のキノプロテインGDH遺伝子の塩基配列を基に設計したプライマーを用い、ゲノムDNAを鋳型として、PCR等の核酸増幅を行う方法が挙げられる。前記ゲノムDNAの由来生物としては、特に制限されないが、例えば、前述のピロバキュラム(Pyrobaculum)属の菌体等が挙げられる。
【0058】
さらに、本発明のキノプロテインGDH遺伝子は、本発明のキノプロテインGDHを発現可能な遺伝子であれば制限されず、例えば、変異導入により改変したものも含む。前記変異導入方法としては、特に制限されないが、例えば、Kunlel法またはギャップ二重鎖法等の公知手法、これに準じる方法等が挙げられる。前記変異導入方法は、例えば、部位特異的突然変異誘発法を利用した市販の変異導入用キット等を利用してもよい。
【0059】
<本発明の発現ベクター>
本発明の発現ベクターは、前述のように、本発明のキノプロテインGDH遺伝子を含む。前記キノプロテインGDH遺伝子を挿入するベクターは、特に制限されず、例えば、大腸菌、放線菌、枯草菌、酵母由来のプラスミド、λファージ等が挙げられる。前記挿入用のベクターは、具体的には、例えば、pET11a、pIJ702、pACYC177、pACYC184、pBluescript、pBR322、pHSG367、pNUT4、pTrc99A、pUC19、pUB110、YEp13、λgt10、pTONA5a、pET28等が挙げられる。前記発現ベクターに、前記キノプロテインGDH遺伝子を挿入する方法は、特に制限されず、従来公知の方法を採用できる。前記キノプロテインGDH遺伝子の挿入方法は、具体的には、例えば、前記キノプロテインGDH遺伝子の精製DNAを、適当な制限酵素で切断後、適当な挿入用ベクターの制限酵素部位またはマルチクローニングサイトに挿入する方法等が挙げられる。このような方法により、前記挿入用ベクターに前記キノプロテインGDH遺伝子が連結した、本発明の発現ベクターを得ることができる。
【0060】
また、前記発現ベクターは、本発明のキノプロテインGDH遺伝子を発現し得るものであればよく、例えば、前記キノプロテインGDH遺伝子以外の構造は制限されない。前記キノプロテインGDH遺伝子以外の構造としては、例えば、発現を制御する塩基配列や形質転換体を選択するための遺伝子マーカー等が挙げられる。前記発現を制御する塩基配列としては、特に制限されないが、例えば、プロモーター、エンハンサー等のシスエレメント、スプライシングシグナル、ポリA付加シグナル、リボソーム結合配列(SD配列)等が挙げられる。前記遺伝子マーカーとしては、特に制限されないが、例えば、ジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子、カナマイシン耐性遺伝子等が挙げられる。
【0061】
<本発明の形質転換体>
本発明の形質転換体は、前述のように、本発明の発現ベクターを含む。本発明の形質転換体は、本発明の発現ベクターを含むため、前記キノプロテインGDHを産生可能である。前記形質転換体は、例えば、前記キノプロテインGDH遺伝子を発現可能な発現ベクターを、宿主に導入して得られる。前記宿主としては、例えば、導入する発現ベクターに応じて選択すればよく、特に限定されないが、例えば、大腸菌、酵母、糸状菌、放線菌、COS細胞、CHO細胞、Sf9細胞等の細胞が挙げられ、好ましくは、大腸菌(Escherichia coli)である。前記大腸菌としては、特に制限されないが、例えば、前述の、S17−1、BL21(DE3)、BL21−CodonPlus(DE3)−RIL、Rosetta2(DE3)、Rosetta−gami2(DE3)等の菌株が挙げられる。前記宿主への前記発現ベクターの導入方法は、特に制限されず、例えば、エレクトロポレーション法、プロトプラスト−PEG法、アグロバクテリウム法、Li法、Biolistic法、パーティクル・ガン法等の従来公知の方法を適宜用いることができる。
【0062】
前記形質転換体の培養により得られた培養物から、本発明のキノプロテインGDHを採取できる。前記培養の方法、培養条件および培地等は、特に限定されず、前述の宿主に応じた方法、培養条件および培地等を適宜採用できる。
【0063】
<本発明のキノプロテインGDHの製造方法>
本発明のキノプロテインGDHの製造方法は、前述のように、本発明のキノプロテインGDHを産生する形質転換体を培養する工程を含む。前記培養工程としては、特に制限されず、前述の宿主に応じた方法、培養条件および培地等を適宜採用できる。また、前記製造方法は、前記培養工程以外に、さらに他の工程を含んでいてもよい。前記他の工程としては、特に制限されないが、例えば、培養工程により得られる培養物を採取する工程、採取した培養物を精製する工程等が挙げられる。前記培養物としては、特に制限されないが、例えば、前述の培養物等が挙げられる。また、前記精製方法としては、特に制限されないが、例えば、前述の精製方法等が挙げられる。
【0064】
<本発明のキノプロテインGDH−補酵素複合体>
本発明のキノプロテインGDH−補酵素複合体は、前述のように、アポ酵素である前記キノプロテインGDHと、前記PQQとを含む。前記キノプロテインGDH−補酵素複合体は、例えば、アポ酵素である前記キノプロテインGDHに、PQQを結合(再構成)させたホロ酵素であってもよい。前記キノプロテインGDH−補酵素複合体は、前記キノプロテインGDHとPQQを含む以外は制限されず、例えば、さらに他の物質を含んでいてもよい。前記キノプロテインGDH−補酵素複合体に含まれる他の成分としては、特に制限されない。
【0065】
本発明のキノプロテインGDH−補酵素複合体の製造方法は、例えば、本発明のキノプロテインGDHの製造工程と、前記キノプロテインGDHに、PQQを結合する結合工程(再構成工程)とを含んでいてもよい。前記結合工程は、特に制限されないが、例えば、前記キノプロテインGDHと前記PQQとを、緩衝液中で反応させてもよい。前記緩衝液は、特に制限されないが、例えば、緩衝剤、無機塩類等を含んでもよい。前記緩衝剤としては、特に制限されないが、例えば、HEPES、Tris、Bis−Tris、KPB(リン酸カリウム緩衝液、K2HPO4/KH2PO4)等が挙げられる。前記無機塩類としては、特に制限されないが、例えば、ナトリウム塩、カルシウム塩等が挙げられる。前記ナトリウム塩は、特に制限されないが、例えば、塩化ナトリウム、クエン酸ナトリウム等が挙げられる。前記カルシウム塩は、特に制限されないが、例えば、塩化カルシウム、クエン酸カルシウム、酢酸カルシウム等が挙げられる。前記反応温度は、特に制限されないが、例えば、4℃以上であり、好ましくは、4℃である。前記反応時間は、特に制限されないが、例えば、16〜20時間であり、好ましくは、16時間である。
【0066】
<本発明のグルコース測定キット>
本発明のグルコース測定キットは、前述のように、本発明のキノプロテインGDHおよび本発明のキノプロテインGDH−補酵素複合体の少なくとも一方を含む。前記グルコース測定キットは、本発明のキノプロテインGDHおよび本発明のキノプロテインGDH−補酵素複合体の少なくとも一方が含まれていればよく、その他の構成物は特に制限されない。前記その他の構成物は、特に制限されないが、例えば、緩衝剤、発色剤、PQQ、カルシウム塩等が挙げられる。前記緩衝剤としては、特に制限されず、例えば、前述の緩衝剤等が挙げられる。前記発色剤としては、特に制限されないが、例えば、2,6−ジクロロインドフェノール(DCIP)、5−メチルフェナジニウムメチルサルフェート(PMS)、2−(4−イオドフェニル)−3−(4−ニトロフェニル)−5−フェニル−2H−テトラゾリウムクロライド(INT)、ニトロブルーテトラゾリウムクロライド(NBT)、1−メトキシ−5−メチルフェナジニウムメチルサルフェート(1−メトキシ−PMS)、2−(4−イオドフェニル)−3−(4−ニトロフェニル)−5−(2,4−ジサルフォフェニル)−2H−テトラゾリウムモノナトリウム塩(WST−1)等が挙げられる。
【実施例】
【0067】
つぎに、本発明の実施例について説明する。なお、本発明は、以下の実施例により制限されない。
【0068】
本例のキノプロテインGDHは、以下のようにして、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株のゲノムDNAから、キノプロテインGDH遺伝子をクローニングし、この遺伝子を導入した形質転換体の培養上清から精製した。
【0069】
[キノプロテインGDH遺伝子]
以下のようにして、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株のゲノムDNAから、配列番号5で表される塩基配列からなるDNA断片をクローニングした。なお、配列番号5で表される塩基配列がコードするアミノ酸配列を、配列番号2に示す。
【0070】
[発現ベクターの作製]
まず、以下のようにして、前記DNA断片を含む発現ベクターを作製した。
【0071】
チューブ内に、下記組成のPCR反応液50μLを添加し、プログラムテンプコントロールシステム PC−816S(アステック社製)を用いてPCRを行った。前記PCRは、98℃で15秒、65℃で2秒および74℃で30秒を1サイクルとして25サイクル繰り返した。
【0072】
(PCR反応液の組成)
成分 配合量 最終濃度
ゲノムDNA 0.5μL(500ng)
センスプライマー 1.0μL(100pmol) 2μmol/L
アンチセンスプライマー 1.0μL(100pmol) 2μmol/L
Buffer#1※ 5.0μL
塩化マグネシウム 2.0μL(50nmol) 1mmol/L
dNTPs 5.0μL(10nmol) 0.2mmol/L
KOD DNAポリメラーゼ 1.0μL(2.5U)
水 34.5μL
計 50.0μL
※Buffer#1の組成
成分 濃度
(NH4)2SO4 60mmol/L
KCl 100mmol/L
Tris−HCl(pH8.0) 1.2mol/L
Triton(登録商標)X−100 1w/v%
BSA 0.01w/v%
【0073】
なお、前記PCR反応液における前記センスプライマーおよびアンチセンスプライマーとしては、以下のプライマーセットを用いた。
【0074】
センスプライマー(配列番号7)
5’−catatgagtctgggcttgttgacc−3’
アンチセンスプライマー(配列番号8)
5’−aggatccttaagtgtgttgctcagatacg−3’
【0075】
プラスミドpET11aと増幅した前記DNA断片とを、制限酵素BamHIおよびNdeI(New England Biolabs社製)で処理後、混合して連結し、発現ベクターを得た。前記発現ベクターを大腸菌BL21−CodonPlus(DE3)−RILに導入した。この大腸菌を、下記組成のSB培地中で、37℃で6時間培養した。得られた培養液1Lを、10分間、遠心分離(7000×g)して、菌体を回収した。前記菌体を、0.85w/v%塩化ナトリウム水溶液を用いて懸濁した。この懸濁液を、10分間、再度遠心分離(7000×g)して、前記菌体を回収した。この菌体(菌体湿重量10g)を、0.2mol/L NaClを含む10mmol/L KPB(pH7.0)50mLに懸濁し、氷冷しながら、超音波破砕機を用いて破砕した。得られた破砕液を、20分間、遠心分離(15000×g)し、上清(粗酵素液)を回収した。ブラッドフォード法(Bio−Rad Protein Assay)により、この粗酵素液のタンパク質量を測定した。
【0076】
(SB培地の組成)
成分 濃度
バクトトリプトン 12.0g/L
酵母エキス 24.0g/L
グリセロール 5mL/L
K2HPO4 12.5g/L
KH2PO4 3.8g/L
【0077】
[キノプロテインGDH活性の測定]
前記粗酵素液の酵素活性は、以下のようにして測定した。まず、所定濃度(10、20および30μg/mL)の前記粗酵素液を含む下記組成の測定試薬1mLに、100mmol/Lの濃度となるようにD−グルコースを添加し、50℃で10分間反応させた。50℃の条件下、各反応液の測定波長600nmにおける吸光度を、分光光度計(セルの光路長0.4cm)を用いて測定した。なお、コントロールとして、前記粗酵素液を無添加とした以外は同様にして、吸光度を測定した。得られた吸光度変化量を下記式1に代入し、キノプロテインGDH活性(unit/mg)を算出した。なお、本例において、キノプロテインGDH活性 1単位(1 unit)とは、1分間に1μmolのDCIPを還元する酵素活性である。また、前記粗酵素液の前記タンパク質量とキノプロテインGDH活性から、前記タンパク質1mgあたりの酵素活性(比活性(unit/mg))および全タンパク質の酵素活性(総活性(unit))を算出した。
【0078】
(測定試薬の組成)
成分 濃度
1,3−ビス[トリス(ヒドロキシメチル)メチルアミノ]プロパン
(Bis−Tris propane、pH8) 50mmol/mL
ピロールキノリンキノン(PQQ) 1.2μmol/mL
2,6−ジクロロフェノールインドフェノール(DCIP) 0.1mmol/mL
粗酵素液 10〜30μg/mL
【0079】
【数1】

【0080】
[キノプロテインGDHの精製]
前記粗酵素液を、80℃で10分間熱処理した。この処理酵素液を、HiPrep SP強陽イオンクロマトカラム(GEヘルスサイエンス・ジャパン社製)を用いて精製した。この精製酵素および前記処理酵素液について、前述の[キノプロテインGDH活性の測定]と同様にして、タンパク質量と酵素活性を測定し、比活性(unit/mg)および総活性(unit)を算出した。前記粗酵素液の総活性を100%としたときの、前記処理酵素液および前記精製酵素の総活性の割合を、収率(%)として算出した。前記粗酵素液の比活性を1としたときの、前記処理酵素液および前記精製酵素の比活性の倍率を、精製倍率として算出した。また、前記粗酵素液、処理酵素液および精製酵素と分子量マーカーとを、熱変性還元条件下のSDS−PAGEに供した。
【0081】
下記表1に、前記粗酵素液、処理酵素液および精製酵素のタンパク質量(mg)、総活性(unit)、比活性(unit/mg)、収率(%)および精製倍率の結果を示す。
【0082】
(表1)
タンパク質量 総活性 比活性 収率 精製倍率
(mg) (unit) (unit/mg) (%)
粗酵素液 554.84 28.89 0.052 100 1
処理酵素液 46.04 29.16 0.063 101 12.16
精製酵素 29.59 22.91 0.77 79 14.81
【0083】
図1の写真に、前記粗酵素液、処理酵素液および精製酵素を、熱変性還元条件下のSDS−PAGEで泳動した結果を示す。同図において、レーン1は分子量マーカー、レーン2は粗酵素液、レーン3は処理酵素液、レーン4は精製酵素の泳動結果である。同図に示すように、キノプロテインGDHの分子量は、約33kDaであった。
【0084】
[最適温度]
所定温度(50、60、70および75℃)に加温した前記測定試薬に、D−グルコースを添加し、直ちに吸光度を測定した以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定し、酵素活性を算出した。
【0085】
図2のグラフに、前記精製酵素の最適温度の測定結果を示す。同図において、横軸は、測定温度(℃)であり、縦軸は、酵素活性である。同図に示すように、前記精製酵素の酵素活性は、75℃において最も高かった。なお、前記DCIPの褪色のため、75℃を超えた温度条件では、測定できなかった。
【0086】
[温度安定性]
前記精製酵素(アポ酵素)、PQQを再構成させた前記精製酵素(ホロ酵素、酵素−補酵素複合体)の温度安定性を、それぞれ評価した。まず、以下のようにして、前記ホロ酵素を調製した。すなわち、前記アポ酵素を、0.0286mmol/Lとなるように、下記組成の再構成液に添加し、4℃で16時間反応させた。この反応液を、Sephadex(登録商標)G−25(PD−10、GEヘルスサイエンス・ジャパン社製)に添加して、酵素に結合していないPQQを除去し、ホロ酵素を回収した。その後、同じカラムで緩衝液を10mmol/L KPB(pH7.0)に置換して、前記ホロ酵素を調製した。前記両酵素を所定温度(60、70、80、90および100℃)で10分間熱処理した。前記アポ酵素は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。前記ホロ酵素は、前記粗酵素液の濃度を3.67μg/mLとし、前記PQQを無添加とした前記測定試薬を用いた以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。得られた各吸光度を下記式2に代入して、残存酵素活性率(%)を算出した。
【0087】
(再構成液の組成)
成分 濃度
ピロールキノリンキノン(PQQ) 0.28mmol/L
NaCl 100mmol/L
HEPES(pH7.5) 20mmol/L
【0088】
残存酵素活性率(%)=A/B×100 ・・・(2)
A=熱処理後の各酵素を添加した反応液の吸光度
B=熱処理なしの各酵素を添加した反応液の吸光度
【0089】
図3のグラフに、各酵素の温度安定性の測定結果を示す。同図において、横軸は、測定温度(℃)であり、縦軸は、残存酵素活性率(%)である。また、同図の各プロットは、前記アポ酵素が、黒丸(●)であり、前記ホロ酵素が、黒四角(■)である。同図に示すように、前記アポ酵素の残存酵素活性率は、60〜80℃において、約100%であり、90℃において、約60%であった。前記ホロ酵素の残存酵素活性率は、60〜100℃において、約100%であった。このように、PQQを再構築させていない前記精製酵素は、60〜80℃において、酵素活性が維持され、100℃においても、約60%の高い残存酵素活性率を有した。また、PQQを再構築させた前記精製酵素は、60〜100℃において、酵素活性が維持された。このように、前記精製酵素は、補酵素非結合の状態において、高い温度安定性を示し、補酵素が結合した状態では、さらに高い温度安定性を示した。
【0090】
[最適pH]
前記精製酵素の最適pHを、以下のようにして評価した。まず、前述のBis−Tris propane(pH8)に代えて、以下の、所定pHに設定した50mmol/Lの各緩衝剤を用いた以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。得られた吸光度を下記式3に代入して、pH8.02(HEPES)における酵素活性率を100%としたときの比活性(%)を算出した。
【0091】
(緩衝液)
緩衝剤 pH
リン酸緩衝液(KPB) 6.33、6.82、7.33
HEPES 6.95、8.02、8.4
Tris/HCl 7.48、8.05、8.5、8.91
Bis−Tris propane 8、8.5、9
Glycine/NaOH 8.93、9.49
【0092】
比活性(%)=C/D×100 ・・・(3)
C=各pHの反応液の吸光度
D=pH8.02(HEPES)の反応液の吸光度
【0093】
図4および下記表2に、前記精製酵素の最適pHの測定結果を示す。同図において、横軸は、測定pH(pH)であり、縦軸は、比活性(%)である。同図および同表に示すように、前記精製酵素の比活性は、pH8.02において最も高かった。このように、前記精製酵素の酵素活性は、pH約8において最も高いことが示された。
【0094】
(表2)
pH 緩衝剤 比活性(%)
6.33 KPB 10
6.82 KPB 22.5
6.95 HEPES 37.5
7.33 KPB 42.5
7.48 Tris/HCl 68.75
8 Bis−Tris propane 87.5
8.02 HEPES 100
8.05 Tris/HCl 87.5
8.4 HEPES 63.75
8.5 Tris/HCl 81.25
8.5 Bis−Tris propane 82.5
8.91 Tris/HCl 75
8.93 Glycine/NaOH 50
9 Bis−Tris propane 77.5
9.49 Glycine/NaOH 30
【0095】
[pH安定性]
前記精製酵素のpH安定性を、以下のようにして評価した。まず、前述の[最適pH]測定に用いた各緩衝剤を100mmol/Lに調整した各緩衝液0.1mLに、前記精製酵素49.5μgを添加し、70℃で30分間前処理した。この前処理液を、前記精製酵素量が11μgとなるように、前記測定試薬に添加した以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。得られた吸光度を下記式4に代入して、pH11における酵素活性を100%としたときの比活性(%)を算出した。
【0096】
比活性(%)=E/F×100 ・・・(4)
E=各pHの反応液の吸光度
F=pH11の反応液の吸光度
【0097】
図5のグラフに、前記精製酵素のpH安定性の測定結果を示す。同図において、横軸は、測定pH(pH)であり、縦軸は、比活性(%)である。同図に示すように、前記精製酵素の比活性は、pH4〜11において、85%以上であった。このように、前記精製酵素は、幅広いpH範囲で酵素活性が維持され、高いpH安定性を示した。
【0098】
[基質特異性]
前記精製酵素の基質特異性を、以下のようにして評価した。まず、前記D−グルコースに代えて、以下の各基質を用いた以外は、前述の[キノプロテインGDH活性の測定]と同様にして、吸光度を測定した。得られた吸光度を下記式5に代入して、前記D−グルコースを基質としたときの酵素活性を100%としたときの、比活性(%)を算出した。
【0099】
比活性(%)=G/H×100 ・・・(5)
G=各基質を含む反応液の吸光度
H=D−グルコースを含む反応液の吸光度
【0100】
下記表3に、基質特異性の測定結果を示す。同表に示すように、前記精製酵素は、種々のアルドースおよびケトースの基質に対する酵素活性を有した。
【0101】
(表3)
基質 比活性(%)
D−グルコース 100
D−マンノース 84
D−キシロース 86
D−リボース 86
D−アロース 160
L−アラビノース 164
D−ガラクトース 186
D−フルクトース 10
D−タガトース 34
L−タガトース 41
D−プシコース 27
L−プシコース 14
L−フルクトース 20
D−ソルボース 16
【0102】
[PQQ結合性]
前記精製酵素のPQQ結合性を、以下のようにして評価した。すなわち、PQQ濃度を、1.2μmol/Lに代えて、所定濃度(1、0.333、0.111、0.037および0μmol/L)とした以外は、前述の[キノプロテインGDH活性の測定]と同様にして、各PQQ濃度におけるキノプロテインGDH活性を測定した。
【0103】
図6のグラフに、前記精製酵素のPQQ結合性の測定結果を示す。同図において、横軸は、PQQ濃度(μmol/L)であり、縦軸は、酵素活性(U/mg)である。同図に示すように、前記精製酵素の活性は、PQQ 0.11〜0.333μmol/L間で直線的に増加し、1μmol/Lのときに、最も高い活性(0.77U/mg)を示した。
【0104】
[PQQ結合におけるカルシウムイオンの影響]
前記精製酵素のPQQ結合(PQQ再構成)における、カルシウムイオンの影響を評価した。まず、以下のようにして、カルシウムイオン存在下で再構成させたホロ酵素(以下、「ホロ酵素(Ca+)」という)と、カルシウムイオン不在下で再構成させたホロ酵素(以下、「ホロ酵素(Ca−)」という)とを調製した。前記ホロ酵素(Ca−)は、前述の[温度安定性]と同様にして調製した。前記ホロ酵素(Ca+)は、1mmol/L 塩化カルシウムを添加した前記再構成液を用いた以外は、前述の[温度安定性]と同様にして調製した。前記精製酵素(アポ酵素)に代えて、これらのホロ酵素を用い、前記測定試薬として、PQQを含まない前記測定試薬とPQQを含む前記測定試薬とを用いた以外は、前述の[キノプロテインGDH活性の測定]と同様にして、各ホロ酵素の酵素活性を測定した。また、分光光度計を用いて、250〜550nmにおける各ホロ酵素および前記精製酵素(アポ酵素)の反応液の吸光度を測定した。
【0105】
図7のグラフに、各ホロ酵素および前記精製酵素(アポ酵素)について、吸光度の測定結果を示す。同図において、横軸は、測定波長(nm)であり、縦軸は、吸光度である。同図に示すように、前記ホロ酵素(Ca+)およびホロ酵素(Ca−)は、共に、350nm付近にPQQの吸収を示すピークが認められた。他方、アポ酵素は、同じ波長領域にピークが認められなかった。したがって、ホロ酵素(Ca+)およびホロ酵素(Ca−)共に、PQQの結合が確認された。また、ホロ酵素(Ca+)およびホロ酵素(Ca−)の酵素活性は、前記測定試薬中にPQQを含む場合と、PQQを含まない場合とで、変化しなかった。このため、アポ酵素からホロ酵素への転換において、カルシウムイオンは不要であることが示された。
【産業上の利用可能性】
【0106】
以上のように、本発明のキノプロテイングルコース脱水素酵素は、耐熱性および耐pH性に優れ、温度安定性およびpH安定性に優れる。したがって、本発明のキノプロテイングルコース脱水素酵素は、幅広い温度およびpH条件下で安定的に利用可能である。このため、本発明のキノプロテイングルコース脱水素酵素の用途は、例えば、その基質特異性を利用した様々な用途が挙げられ、広い分野に適用可能である。
【特許請求の範囲】
【請求項1】
下記(1)から(6)の性質を有する、キノプロテイングルコース脱水素酵素。
(1)分子量(SDS−PAGE法):33±6kDa
(2)一量体タンパク質
(3)最適pH:pH7〜9
(4)最適温度:75℃以上
(5)温度安定性:80℃以下
(6)pH安定性:pH4〜11
【請求項2】
ピロバキュラム(Pyrobaculum)属の菌体に由来する請求項1記載のキノプロテイングルコース脱水素酵素。
【請求項3】
前記ピロバキュラム(Pyrobaculum)属の菌体が、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体である請求項2記載のキノプロテイングルコース脱水素酵素。
【請求項4】
前記ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体が、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株である、請求項3記載のキノプロテイングルコース脱水素酵素。
【請求項5】
配列番号1または2のアミノ酸配列における配列番号3および配列番号4のアミノ酸配列以外の配列において、1以上のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなる、請求項1から4のいずれか一項に記載のキノプロテイングルコース脱水素酵素。
【請求項6】
下記(a)から(c)のいずれかのタンパク質からなる、キノプロテイングルコース脱水素酵素。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【請求項7】
請求項1から6のいずれか一項に記載のキノプロテイングルコース脱水素酵素と、ピロールキノリンキノンとを含む、キノプロテイングルコース脱水素酵素−補酵素複合体。
【請求項8】
請求項1から6のいずれか一項に記載のキノプロテイングルコース脱水素酵素および請求項7記載のキノプロテイングルコース脱水素酵素−補酵素複合体の少なくとも一方を含むグルコース測定キット。
【請求項9】
下記(a)から(c)のいずれかのタンパク質をコードすることを特徴とするキノプロテイングルコース脱水素酵素遺伝子。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【請求項10】
下記(d)から(g)のいずれかの遺伝子である、キノプロテイングルコース脱水素酵素遺伝子。
(d)配列番号5の塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(e)配列番号5の塩基配列において、1もしくは数個の塩基が、置換、付加、挿入もしくは欠失した塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(f)配列番号5の塩基配列と40%以上の相同性を有する塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(g)配列番号5の塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
【請求項11】
請求項9または10記載のキノプロテイングルコース脱水素酵素遺伝子を含む発現ベクター。
【請求項12】
請求項11記載の発現ベクターを含む形質転換体。
【請求項13】
請求項12記載の形質転換体を培養する工程を含む、キノプロテイングルコース脱水素酵素の製造方法。
【請求項1】
下記(1)から(6)の性質を有する、キノプロテイングルコース脱水素酵素。
(1)分子量(SDS−PAGE法):33±6kDa
(2)一量体タンパク質
(3)最適pH:pH7〜9
(4)最適温度:75℃以上
(5)温度安定性:80℃以下
(6)pH安定性:pH4〜11
【請求項2】
ピロバキュラム(Pyrobaculum)属の菌体に由来する請求項1記載のキノプロテイングルコース脱水素酵素。
【請求項3】
前記ピロバキュラム(Pyrobaculum)属の菌体が、ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体である請求項2記載のキノプロテイングルコース脱水素酵素。
【請求項4】
前記ピロバキュラム・エアロフィラム(Pyrobaculum aerophilum)種の菌体が、ピロバキュラム・エアロフィラム・エスティーアール(Pyrobaculum aerophilum str.)IM2株である、請求項3記載のキノプロテイングルコース脱水素酵素。
【請求項5】
配列番号1または2のアミノ酸配列における配列番号3および配列番号4のアミノ酸配列以外の配列において、1以上のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質からなる、請求項1から4のいずれか一項に記載のキノプロテイングルコース脱水素酵素。
【請求項6】
下記(a)から(c)のいずれかのタンパク質からなる、キノプロテイングルコース脱水素酵素。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【請求項7】
請求項1から6のいずれか一項に記載のキノプロテイングルコース脱水素酵素と、ピロールキノリンキノンとを含む、キノプロテイングルコース脱水素酵素−補酵素複合体。
【請求項8】
請求項1から6のいずれか一項に記載のキノプロテイングルコース脱水素酵素および請求項7記載のキノプロテイングルコース脱水素酵素−補酵素複合体の少なくとも一方を含むグルコース測定キット。
【請求項9】
下記(a)から(c)のいずれかのタンパク質をコードすることを特徴とするキノプロテイングルコース脱水素酵素遺伝子。
(a)配列番号1または2のアミノ酸配列からなるタンパク質
(b)配列番号1または2のアミノ酸配列において、1もしくは数個のアミノ酸残基が、置換、付加、挿入または欠失したアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
(c)配列番号1または2のアミノ酸配列と40%以上の相同性を有するアミノ酸配列からなり、かつ、キノプロテイングルコース脱水素酵素活性を有するタンパク質
【請求項10】
下記(d)から(g)のいずれかの遺伝子である、キノプロテイングルコース脱水素酵素遺伝子。
(d)配列番号5の塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(e)配列番号5の塩基配列において、1もしくは数個の塩基が、置換、付加、挿入もしくは欠失した塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(f)配列番号5の塩基配列と40%以上の相同性を有する塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
(g)配列番号5の塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列からなるキノプロテイングルコース脱水素酵素遺伝子
【請求項11】
請求項9または10記載のキノプロテイングルコース脱水素酵素遺伝子を含む発現ベクター。
【請求項12】
請求項11記載の発現ベクターを含む形質転換体。
【請求項13】
請求項12記載の形質転換体を培養する工程を含む、キノプロテイングルコース脱水素酵素の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2011−83251(P2011−83251A)
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願番号】特願2009−239902(P2009−239902)
【出願日】平成21年10月16日(2009.10.16)
【出願人】(304028346)国立大学法人 香川大学 (285)
【Fターム(参考)】
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願日】平成21年10月16日(2009.10.16)
【出願人】(304028346)国立大学法人 香川大学 (285)
【Fターム(参考)】
[ Back to top ]

