キラル補助剤を用い、ステレオ選択的に4−BMAを製造する方法、及びキラル補助剤
【課題】キラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤を提供する。
【解決手段】キラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤は、(3R, 4S)- 3-[[[R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone) (β-メチルアゼチジン(methylazetidin)-ジオン(2-one):4BMA)を製造し、カルバペネム(carbapenem)及びペネム(penem)の主要中間体を合成する方法で、先ず、安価なL-フェニールプロピルアミンアルコールによりキラル補助剤を製造し、続いて、一般の工業条件下で、高生産効率及び高選択性で4-BMAを製造する。
【解決手段】キラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤は、(3R, 4S)- 3-[[[R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone) (β-メチルアゼチジン(methylazetidin)-ジオン(2-one):4BMA)を製造し、カルバペネム(carbapenem)及びペネム(penem)の主要中間体を合成する方法で、先ず、安価なL-フェニールプロピルアミンアルコールによりキラル補助剤を製造し、続いて、一般の工業条件下で、高生産効率及び高選択性で4-BMAを製造する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は合成ペネム(penem)或いはカルバペネム(carbapenem)中間体を製造する方法に関し、特に中間体(3R,4S)-3-[[[R]-1’ _t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2-アゼチジノン(azetidinone)(β-メチルアゼチジン(methylazetidin)-2-1:4BMA)及びキラル補助剤を製造する方法に関する。
【背景技術】
【0002】
4-BMAをタンパク抗菌活性を備える合成1β-メチルカルバペネム(methylcarbapenem)の中間体とする方法は既に業界に熟知されており、4- BMAを使用し、多種のカルバペネム類を製造することができる。
【0003】
その典型的な例は、メロペネム(Meropenem)、エルタペネム(Ertapenem)、及びドリペネム(Doripenem)で、
【化1】

【化2】

【化3】

グラム陽性菌、及びグラム陰性菌に対する幅広い抗菌活性を備える。
すなわち、極めて優れた抗微生物効果を備え、グラム陰性菌種、及びメタラクタマーゼの菌種の生成を抑制することができる。
別に、βメチルが存在することで、メロペネム、エルタペネム、及びドリペネムは、既存のイミペネム(Imipenem) (抗微生物因子及び化学治療剤 33,215-222 (1984))のカルバペネム因子に比べ、腎臓の加水分解ペプチダーゼ-1 (DRP-1)に、より安定的に抵抗することができる。
その結果、イミペネムとは反対に、シラスタチン(cilastatin)と一緒に服用しなくても、体内での安定を維持可能で、しかも単独で服用することができる。
【0004】
カルバペネム及びペネム抗生物質などの重要な薬剤を製造するための主要中間体である4-BMAを調整する方法は、既にさまざまに開発されている。
初期の研究中では、 4-ポジションβメチル化合物中に残留する酢酸の1-ポジション水素原子を、強アルカリを用いて除去し、及びメチル[ヘテロ環化合物,21,29 (19840)]を注入する。
しかし、この種の方法は、リチウムジイソプロピラミド(Lithium diisopropylamide)を使用するため、処理が容易でないという問題があり、-78℃などの超低温下で完成しなければならない。
しかも、該化合物は、以下の処方に基づき大量の1 a-メチル副製品(β/a=4/l)を生成してしまうという欠点を備える。
【化4】

既に、多くの方法により上記した問題の解決が試みられている。
最も有利な方法は、キラル補助剤をp-メチル[四面体 52,331-375 (1996)]に注入する方法である。
【0005】
<初期のキラル補助剤を製造する方法>
大部分の合成4-BMAキラル補助剤を製造する方法は、プロピオニル基(propionyl group)をアクリル基として注入する。
プロピオニルブロミド(propionyl bromide)などの処理が容易でないハロゲン化合物を、プロピオニル基として使用し、及び一種の金属触媒、n-ブチルリチウム(n-butyllithium)を、カップリング反応に用いる(特許文献1、2、3、4、5参照)。
【0006】
<初期の4-BMAを製造する方法>
キラル補助剤、トリメチルクロロシラン(trimethylchlorosilane)(TMSCI)/リチウムジイソプロピラミド(lithium diisopropylamide) (LAD)、チントリフレート(tintriflate) [Sn(OTf)2]、ジエチルボロトリフレート(diethylborotriflate)(Et2BOTf) /ジンクブロミド(zinc bromide) (ZnBr2)、テルトジメチルシリルトリフレート(Tert-butyldimethylsilyltriflate )(TBDMSOTf) /ジンククロライド(zinc chloride) (ZnCl2)、LDA-Zr(Cp)などを用いた、(3R, 4R)-4-アセトキシ(acetoxy)-3-[(R)-1’_(t-ブチルジメチルシリル(butyldimethylsilyl))オキシル(oxyl)]エチル(ethyl)-2-アゼチジノン(azetidinone )(4-AA)のカップリング反応は、既に使用されている( 特許文献6、7、及びJAM Chem. SAC,1986,108,467参照)。
しかし、これら物質は、起爆性金属触媒であるため、超低温(-78℃)で反応させなければならず、工業としては不経済で、使用が難しい。
以上のように、既に4-BMAを製造する多種の方法があるが、高生産効率及び高選択性に適し、工業生産への使用で、処理が容易な物質の製造方法は未だ開発されていない。
本発明は、上記した欠点を解決するキラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤を提供するものである。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】日本国特許公示第JP2789190号明細書
【特許文献2】ドイツ特許公示第DE3632916号明細書
【特許文献3】アメリカ合衆国特許公示第US5104984号明細書
【特許文献4】韓国特許公示第KR940008748号明細書
【特許文献5】アメリカ合衆国特許公示第US5231179号明細書
【特許文献6】ヨーロッパ特許公示第EP0974582号明細書
【特許文献7】アメリカ合衆国特許公示第US5104984号明細書
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明が解決しようとする第一の課題は、安価な原料を使用し、一般の条件下で、高生産効率及び高品質β/a比を備える4-BMAキラル補助剤を提供することである。
本発明が解決しようとする第二の課題は、カルバペネム、或いはペネム抗生物質を効果的に製造することができる新しい4-BMAの製造方法を提供することである。
本発明が解決しようとする第三の課題は、ステレオ選択的に4-BMAを効果的に製造することができる新しいキラル補助剤の製造方法を提供することである。
【課題を解決するための手段】
【0009】
上記課題を解決するため、本発明は下記のキラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤を提供する。
【発明の効果】
【0010】
本発明キラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤は、安価な原料を使用し、一般の条件下で、高生産効率及び高品質β/a比を備える4-BMAキラル補助剤を提供でき、またカルバペネム、或いはペネム抗生物質を効果的に製造することができ、ステレオ選択的に4-BMAを効果的に製造することができる。
【図面の簡単な説明】
【0011】
【図1】第一実施例の化学式である。
【図2】第二実施例の化学式である。
【図3】第三実施例の化学式である。
【図4】第四、第五実施例の化学式である。
【図5】第六実施例の化学式である。
【図6】第七実施例の化学式である。
【発明を実施するための形態】
【0012】
以下に図面を参照しながら本発明を実施するための最良の形態について詳細に説明する。
【実施例】
【0013】
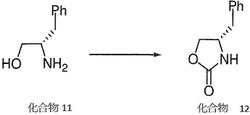
第一実施例:(S)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(2)の製造
図1に示すように、無水ポタジウムカーボネート(20 g,0.14 mol)を、(2S)-2-アミノ(amino)- 3-フェニール(phenyl)-1-プロパノール(propanol)(649 g,4.29 mol)混合物内に加える。
混合物を温度120- 130℃で3時間撹拌する。
冷卻後、1Nハイドロクロリック酸(1.5L)及びエチルアセテート(約20 L)を加え、撹拌する。
有機層を分離し、塩水で洗浄する。
減圧下で、溶剤を蒸留し、(4S)-4-ベンジルオキサゾリジン(benzyloxazolidin )-2- 1の無色固体 (760 g 收獲量)を得る。
分析用サンプルは、シクロヘキサン及びトルエン混合溶剤(1:1)により再結晶し、無色結晶. M P,88 -89 ℃を得る。
[→] 20 d -63 (c=1.0 in CHC13);IR (KBr);1751,1710,1408,1246,1020,944,760,710,618,532;1H-NMR (CDCI3);δ7. 33 (t, 3H),7. 26 (t, 3H),7. 16 (d, 2H),5.39 (br, 1H),4.44 (t, 1H), 4.,14 (dd, 1H),4.07 (m, 1H),2. 86 (d, 2H);(iR, bs ),7. 29 (SR, m);+質量 m/e;177 (M);計算:C, 67. 78%:N,7. 90%。
獲得:C,67. 82%;H,6. 34%;N,7. 86%。
【0014】
第二実施例:(S)-4-ベンジル-3-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(2)の製造
図2に示すように、第一実施例製造の化合物(12)(120 g)を、ジクロメタン(984 ml)に溶解させ、0℃まで冷却する。
塩化亜鉛(ZnCl2 )(52 g)を加え、次に、トリエチルアミン(101 g)を添加し、混合物を30分間撹拌する。
30分の間に、無水プロピオニックアシッド(96.9 g)をゆっくりと加える。
反応混合物をリフラックス温度まで加熱し、1-1.5時間撹拌する。
反応溶液を冷却し、300 mlの水を加え、混合物を30分間撹拌する。
ジクロメタンを分離し、再度、1.5 Nハイドロクロリック酸溶液(300 ml)を用いて、抽出する。
再度、5%の炭酸水素ナトリウム水溶液(240 ml)を用いて有機溶液を洗浄する。
有機溶液から、真空蒸留を用いて、ジクロメタンが流出しなくなるまで除去する。
溶液を生じるまでペプタンを添加し、5-0℃で1時間撹拌する。
続いて、ろ過及び乾燥させ、白色固体化合物(2) (150 g, 生産効率95%)を製造する。
H-NMR 0 (CDCI3);δ7. 33 (dd, 2H) 7. 30 (m,1H),7. 19 (d,2H),4. 65 (m,1H),4. 19 - 4. 14 (m,2H),3. 29 (dd,1H),3. 00 - 2. 89 (m,2H),2. 75 (dd,1H),1. 19 (t,3H)。
【0015】
第三実施例:(S)-4-ベンジル-3-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(2)の製造
図3に示すように、第一実施例製造の化合物(12)(120 g)を、テトラハイドロフラン(tetrahydrofuran)(600 ml)に溶解させ、0℃まで冷却し、塩化リチウム(33.3 g)を添加する。
続いて、ゆっくりとトリエチルアミン(101 g)を添加し、混合物を30分間撹拌する。
30分の間に、無水プロピオニックアシッド(96.9 g)をゆっくりと加える。
反応混合物を室温まで加熱し、1-1.5時間撹拌する。
反応溶液を冷却し、1. N食塩水溶液(300 ml)を加え、混合物を30分間撹拌する。
エチルアセテート (300 ml)を加え、相分離を生じる。
再度、エチルアセテート (300 ml)を用いて抽出する。
1.5Nハイドロクロリック酸溶液(300 ml)で洗浄後、再度、食塩水溶液(240 ml)で有機溶液を洗浄する。
エチルアセテート溶液を真空蒸留し、エチルアセテートが流出しなくなるまで除去する。
溶液を生じるまでペプタンを添加し、0-10℃で1時間撹拌する。
続いて、ろ過及び乾燥し、白色固体化合物(2) (145. 3 g, 生産効率92%)を製造する。
【0016】
第四実施例:(S)-3-((R)-2-(3-((R)-1-(t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy))エチル(ethyl))-4-オキサゾリジン(oxazolidine)-2-イル)プロパノイル(propanoyl)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(10)の製造
図4に示すように、第二実施例或いは第三実施例製造の化合物(12)(50. 0 g)を、ジクロメタン(140 ml)に溶解させ、0℃まで冷却し、塩化チタン(43.6 g)を添加し、1時間後に、4ラッカフラン(etrahydrofuran)(150 ml)を添加する。
先ず、ジイソプロピルエチルアミン(diisopropylethylamine)(42. 4g)を加え、さらに、ジンクブロミド( zinc bromide) (24.1g)を加える。
続いて、4-AA(50.0g)を加える。
混合物5-15℃で2時間反応させ、水(300ml)を加え、相分離を生じる。
さらに、1,5Nハイドロクロリック酸 (300 g)を添加する。
相分離後、再度、炭酸水素ナトリウム水溶液で洗浄し、蒸留して、いくらかの不純物を含む化合物(98g)を製造する。
H-NMR (300MHz,CDCI3);δ7. 32 (m, 2H),7. 25 (m,1H),7. 19 (d,2H),5. 91 (s,1H),4. 66 - 4. 63 (m,1H),4..22- 4. 17 (m,4H),3. 95 (m,1H),3. 30 (dd,1H),3. 06 (m,1H),2.68 (dd,1H),1. 24-1. 19(m,6H),0. 87(s,12H)。
【0017】
第五実施例:(S)-3-((R)-2-(3-((R)-1-(t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy))エチル(ethyl))-4-オキサゾリジン(oxazolidine)-2-イル)プロパノイル(propanoyl)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(10)の製造
図4に示すように、第二実施例或いは第三実施例製造の化合物(12)(50. 0 g)を、ジクロメタン(140 ml)に溶解させ、0℃まで冷却し、塩化チタン(43.6 g)を添加する。
30分後に、0℃で、ジイソプロピルエチルアミン( diisopropylethylamine)(42. 4g)を加える。
続いて、4-AA(50.0g)を添加する。
混合物を5-15℃で4時間反応させ、水(300ml)を加え相分離を生じる。
さらに、1,5Nハイドロクロリック酸 (300 g)を加える。
相分離後、再度、炭酸水素ナトリウム水溶液で洗浄し、蒸留して、いくらかの不純物を備える化合物(99g)を製造する。
H-NMR (300MHz,CDCI3) δ7. 32 (m, 2H),7. 25 (m,1H),7. 19 (d,2H),5. 91 (s,1H),4. 66 - 4. 63 (m,1H),4..22- 4. 17 (m,4H),3. 95 (m,1H),3. 30 (dd,1H),3. 06 (m,1H),2.68 (dd,1H),1. 24-1. 19(m,6H),0. 87(s,12H)。
【0018】
第六実施例:(3R, 4S)- 3-[[ [R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone) (1)の製造
図5に示すように、第四実施例製造の化合物(10)(98 g)をアセトン(350 ml)及び水(200ml)に溶解させる。
さらに、過酸化水素(50 ml)を加え、混合物を0℃で攪拌する。
続いて、30分の間に、水酸化ナトリウム(19g)の水溶液(150 ml)を添加する。
反応溶液を、15-25℃で1時間攪拌し、白色固体の化合物(12)を沈殿させる。
ろ過後、水(20ml)を用いて洗浄する。
続いて、得られた化合物(12)を乾燥させ、実施例2 (30. 4g、純度98.5%、計算された化合物(2)の生産効率は82%)のように、化合物(2)の製造に用いる。
水(500ml)及びジクロメタン(500 ml)を、ろ過液に加え、相分離を生じ、有機相を蒸留し、化合物(2) (20 g)を製造する。
水相を、6Nハイドロクロリック酸を用いて、pH3.5に調整し、結晶を生じる。
結晶をろ過し、目標化合物を得る。
続いて、ジクロメタン及びペプタン(50 ml)混合溶液を用いて、-5〜5℃で、ウェットケーキ製品を洗浄する。
40℃以上で乾燥後に38.0g >99.9/ 0.1の比率を得る(4-AA化合物より計算された生産効率は72%。純度99.0%及びHPLC試験は99.5%)。
IH NMR (300 MHz,CDCl3)δ6.5(br s,1H),4.3(m,1H)3.97(dd,1H),3.05 (ddm,1H),2.85(m,1H),1. 29(d,3H),1. 22(d,3H),0. 89(s,9H),0. 08(s,6H)[相當4-BMAの異構物] IH NMR (300 MHz,CDCl3)δ6.5(br s,1H),4.2(m,1H),3.72(dd,1H),2. 85 (ddm,1H),2. 65(m,1H),1. 3(d,3H),1. 23(d,3H),0. 90(s,9H),0. 08(s,6H)。
【0019】
第七実施例:(3R, 4S)- 3-[[ [R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone) (1)の製造
図6に示すように、第四実施例製造の化合物(10)(98 g)を、アセトン(350 ml)及び水 (200ml)に溶解させる。
さらに、過酸化水素(50 ml)を加え、混合物を0℃で攪拌する。
続いて、30分の間に、水酸化ナトリウム(19g)の水溶液(150 ml)を加える。
反応溶液を15-25℃で1時間攪拌し、白色固体の化合物(12)を沈殿させる。
ろ過後に水(20ml)を用いて洗浄する。
続いて、得られた化合物(12)を乾燥させ、実施例2 (30. 4g、純度98.5%、計算された化合物(2)の生産効率は82%)のように、化合物(2)の製造に用いる。
水(500ml)及びジクロメタン(500 ml)を、ろ過液に加え、相分離を生じる。
有機相を蒸留し、化合物(2) (20 g)を製造する。
水相6Nハイドロクロリック酸を用いて、pH3.5に調整し、結晶を生じる。
結晶をろ過し、目標化合物を得る。
続いて、ジクロメタン及びペプタン(50 ml)混合溶液を用いて、-5〜5℃で、ウェットケーキ製品を洗浄する。
40℃以上で乾燥後に38.0g >99.9/ 0.1の比率を得る(4-AA化合物より計算された生産効率は72%。純度99.0%及びHPLC試験は99.5%)。
【0020】
本発明は、モデルと実施例により、上記の通り説明を完成した。しかし、本発明は、上記のモデル及び実施例に限定するものではなく、一般的な技術者が一般的な知識範囲において行う修正、或いは変更を含むものとする。
【産業上の利用可能性】
【0021】
本発明は特許の要件である新規性を備え、従来の同類製品に比べ十分な進歩を有し、実用性が高く、社会のニーズに合致しており、産業上の利用価値は非常に大きい。
【技術分野】
【0001】
本発明は合成ペネム(penem)或いはカルバペネム(carbapenem)中間体を製造する方法に関し、特に中間体(3R,4S)-3-[[[R]-1’ _t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2-アゼチジノン(azetidinone)(β-メチルアゼチジン(methylazetidin)-2-1:4BMA)及びキラル補助剤を製造する方法に関する。
【背景技術】
【0002】
4-BMAをタンパク抗菌活性を備える合成1β-メチルカルバペネム(methylcarbapenem)の中間体とする方法は既に業界に熟知されており、4- BMAを使用し、多種のカルバペネム類を製造することができる。
【0003】
その典型的な例は、メロペネム(Meropenem)、エルタペネム(Ertapenem)、及びドリペネム(Doripenem)で、
【化1】

【化2】

【化3】

グラム陽性菌、及びグラム陰性菌に対する幅広い抗菌活性を備える。
すなわち、極めて優れた抗微生物効果を備え、グラム陰性菌種、及びメタラクタマーゼの菌種の生成を抑制することができる。
別に、βメチルが存在することで、メロペネム、エルタペネム、及びドリペネムは、既存のイミペネム(Imipenem) (抗微生物因子及び化学治療剤 33,215-222 (1984))のカルバペネム因子に比べ、腎臓の加水分解ペプチダーゼ-1 (DRP-1)に、より安定的に抵抗することができる。
その結果、イミペネムとは反対に、シラスタチン(cilastatin)と一緒に服用しなくても、体内での安定を維持可能で、しかも単独で服用することができる。
【0004】
カルバペネム及びペネム抗生物質などの重要な薬剤を製造するための主要中間体である4-BMAを調整する方法は、既にさまざまに開発されている。
初期の研究中では、 4-ポジションβメチル化合物中に残留する酢酸の1-ポジション水素原子を、強アルカリを用いて除去し、及びメチル[ヘテロ環化合物,21,29 (19840)]を注入する。
しかし、この種の方法は、リチウムジイソプロピラミド(Lithium diisopropylamide)を使用するため、処理が容易でないという問題があり、-78℃などの超低温下で完成しなければならない。
しかも、該化合物は、以下の処方に基づき大量の1 a-メチル副製品(β/a=4/l)を生成してしまうという欠点を備える。
【化4】

既に、多くの方法により上記した問題の解決が試みられている。
最も有利な方法は、キラル補助剤をp-メチル[四面体 52,331-375 (1996)]に注入する方法である。
【0005】
<初期のキラル補助剤を製造する方法>
大部分の合成4-BMAキラル補助剤を製造する方法は、プロピオニル基(propionyl group)をアクリル基として注入する。
プロピオニルブロミド(propionyl bromide)などの処理が容易でないハロゲン化合物を、プロピオニル基として使用し、及び一種の金属触媒、n-ブチルリチウム(n-butyllithium)を、カップリング反応に用いる(特許文献1、2、3、4、5参照)。
【0006】
<初期の4-BMAを製造する方法>
キラル補助剤、トリメチルクロロシラン(trimethylchlorosilane)(TMSCI)/リチウムジイソプロピラミド(lithium diisopropylamide) (LAD)、チントリフレート(tintriflate) [Sn(OTf)2]、ジエチルボロトリフレート(diethylborotriflate)(Et2BOTf) /ジンクブロミド(zinc bromide) (ZnBr2)、テルトジメチルシリルトリフレート(Tert-butyldimethylsilyltriflate )(TBDMSOTf) /ジンククロライド(zinc chloride) (ZnCl2)、LDA-Zr(Cp)などを用いた、(3R, 4R)-4-アセトキシ(acetoxy)-3-[(R)-1’_(t-ブチルジメチルシリル(butyldimethylsilyl))オキシル(oxyl)]エチル(ethyl)-2-アゼチジノン(azetidinone )(4-AA)のカップリング反応は、既に使用されている( 特許文献6、7、及びJAM Chem. SAC,1986,108,467参照)。
しかし、これら物質は、起爆性金属触媒であるため、超低温(-78℃)で反応させなければならず、工業としては不経済で、使用が難しい。
以上のように、既に4-BMAを製造する多種の方法があるが、高生産効率及び高選択性に適し、工業生産への使用で、処理が容易な物質の製造方法は未だ開発されていない。
本発明は、上記した欠点を解決するキラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤を提供するものである。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】日本国特許公示第JP2789190号明細書
【特許文献2】ドイツ特許公示第DE3632916号明細書
【特許文献3】アメリカ合衆国特許公示第US5104984号明細書
【特許文献4】韓国特許公示第KR940008748号明細書
【特許文献5】アメリカ合衆国特許公示第US5231179号明細書
【特許文献6】ヨーロッパ特許公示第EP0974582号明細書
【特許文献7】アメリカ合衆国特許公示第US5104984号明細書
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明が解決しようとする第一の課題は、安価な原料を使用し、一般の条件下で、高生産効率及び高品質β/a比を備える4-BMAキラル補助剤を提供することである。
本発明が解決しようとする第二の課題は、カルバペネム、或いはペネム抗生物質を効果的に製造することができる新しい4-BMAの製造方法を提供することである。
本発明が解決しようとする第三の課題は、ステレオ選択的に4-BMAを効果的に製造することができる新しいキラル補助剤の製造方法を提供することである。
【課題を解決するための手段】
【0009】
上記課題を解決するため、本発明は下記のキラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤を提供する。
【発明の効果】
【0010】
本発明キラル補助剤を用い、ステレオ選択的に4-BMAを製造する方法、及びキラル補助剤は、安価な原料を使用し、一般の条件下で、高生産効率及び高品質β/a比を備える4-BMAキラル補助剤を提供でき、またカルバペネム、或いはペネム抗生物質を効果的に製造することができ、ステレオ選択的に4-BMAを効果的に製造することができる。
【図面の簡単な説明】
【0011】
【図1】第一実施例の化学式である。
【図2】第二実施例の化学式である。
【図3】第三実施例の化学式である。
【図4】第四、第五実施例の化学式である。
【図5】第六実施例の化学式である。
【図6】第七実施例の化学式である。
【発明を実施するための形態】
【0012】
以下に図面を参照しながら本発明を実施するための最良の形態について詳細に説明する。
【実施例】
【0013】
第一実施例:(S)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(2)の製造
図1に示すように、無水ポタジウムカーボネート(20 g,0.14 mol)を、(2S)-2-アミノ(amino)- 3-フェニール(phenyl)-1-プロパノール(propanol)(649 g,4.29 mol)混合物内に加える。
混合物を温度120- 130℃で3時間撹拌する。
冷卻後、1Nハイドロクロリック酸(1.5L)及びエチルアセテート(約20 L)を加え、撹拌する。
有機層を分離し、塩水で洗浄する。
減圧下で、溶剤を蒸留し、(4S)-4-ベンジルオキサゾリジン(benzyloxazolidin )-2- 1の無色固体 (760 g 收獲量)を得る。
分析用サンプルは、シクロヘキサン及びトルエン混合溶剤(1:1)により再結晶し、無色結晶. M P,88 -89 ℃を得る。
[→] 20 d -63 (c=1.0 in CHC13);IR (KBr);1751,1710,1408,1246,1020,944,760,710,618,532;1H-NMR (CDCI3);δ7. 33 (t, 3H),7. 26 (t, 3H),7. 16 (d, 2H),5.39 (br, 1H),4.44 (t, 1H), 4.,14 (dd, 1H),4.07 (m, 1H),2. 86 (d, 2H);(iR, bs ),7. 29 (SR, m);+質量 m/e;177 (M);計算:C, 67. 78%:N,7. 90%。
獲得:C,67. 82%;H,6. 34%;N,7. 86%。
【0014】
第二実施例:(S)-4-ベンジル-3-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(2)の製造
図2に示すように、第一実施例製造の化合物(12)(120 g)を、ジクロメタン(984 ml)に溶解させ、0℃まで冷却する。
塩化亜鉛(ZnCl2 )(52 g)を加え、次に、トリエチルアミン(101 g)を添加し、混合物を30分間撹拌する。
30分の間に、無水プロピオニックアシッド(96.9 g)をゆっくりと加える。
反応混合物をリフラックス温度まで加熱し、1-1.5時間撹拌する。
反応溶液を冷却し、300 mlの水を加え、混合物を30分間撹拌する。
ジクロメタンを分離し、再度、1.5 Nハイドロクロリック酸溶液(300 ml)を用いて、抽出する。
再度、5%の炭酸水素ナトリウム水溶液(240 ml)を用いて有機溶液を洗浄する。
有機溶液から、真空蒸留を用いて、ジクロメタンが流出しなくなるまで除去する。
溶液を生じるまでペプタンを添加し、5-0℃で1時間撹拌する。
続いて、ろ過及び乾燥させ、白色固体化合物(2) (150 g, 生産効率95%)を製造する。
H-NMR 0 (CDCI3);δ7. 33 (dd, 2H) 7. 30 (m,1H),7. 19 (d,2H),4. 65 (m,1H),4. 19 - 4. 14 (m,2H),3. 29 (dd,1H),3. 00 - 2. 89 (m,2H),2. 75 (dd,1H),1. 19 (t,3H)。
【0015】
第三実施例:(S)-4-ベンジル-3-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(2)の製造
図3に示すように、第一実施例製造の化合物(12)(120 g)を、テトラハイドロフラン(tetrahydrofuran)(600 ml)に溶解させ、0℃まで冷却し、塩化リチウム(33.3 g)を添加する。
続いて、ゆっくりとトリエチルアミン(101 g)を添加し、混合物を30分間撹拌する。
30分の間に、無水プロピオニックアシッド(96.9 g)をゆっくりと加える。
反応混合物を室温まで加熱し、1-1.5時間撹拌する。
反応溶液を冷却し、1. N食塩水溶液(300 ml)を加え、混合物を30分間撹拌する。
エチルアセテート (300 ml)を加え、相分離を生じる。
再度、エチルアセテート (300 ml)を用いて抽出する。
1.5Nハイドロクロリック酸溶液(300 ml)で洗浄後、再度、食塩水溶液(240 ml)で有機溶液を洗浄する。
エチルアセテート溶液を真空蒸留し、エチルアセテートが流出しなくなるまで除去する。
溶液を生じるまでペプタンを添加し、0-10℃で1時間撹拌する。
続いて、ろ過及び乾燥し、白色固体化合物(2) (145. 3 g, 生産効率92%)を製造する。
【0016】
第四実施例:(S)-3-((R)-2-(3-((R)-1-(t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy))エチル(ethyl))-4-オキサゾリジン(oxazolidine)-2-イル)プロパノイル(propanoyl)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(10)の製造
図4に示すように、第二実施例或いは第三実施例製造の化合物(12)(50. 0 g)を、ジクロメタン(140 ml)に溶解させ、0℃まで冷却し、塩化チタン(43.6 g)を添加し、1時間後に、4ラッカフラン(etrahydrofuran)(150 ml)を添加する。
先ず、ジイソプロピルエチルアミン(diisopropylethylamine)(42. 4g)を加え、さらに、ジンクブロミド( zinc bromide) (24.1g)を加える。
続いて、4-AA(50.0g)を加える。
混合物5-15℃で2時間反応させ、水(300ml)を加え、相分離を生じる。
さらに、1,5Nハイドロクロリック酸 (300 g)を添加する。
相分離後、再度、炭酸水素ナトリウム水溶液で洗浄し、蒸留して、いくらかの不純物を含む化合物(98g)を製造する。
H-NMR (300MHz,CDCI3);δ7. 32 (m, 2H),7. 25 (m,1H),7. 19 (d,2H),5. 91 (s,1H),4. 66 - 4. 63 (m,1H),4..22- 4. 17 (m,4H),3. 95 (m,1H),3. 30 (dd,1H),3. 06 (m,1H),2.68 (dd,1H),1. 24-1. 19(m,6H),0. 87(s,12H)。
【0017】
第五実施例:(S)-3-((R)-2-(3-((R)-1-(t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy))エチル(ethyl))-4-オキサゾリジン(oxazolidine)-2-イル)プロパノイル(propanoyl)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)-(10)の製造
図4に示すように、第二実施例或いは第三実施例製造の化合物(12)(50. 0 g)を、ジクロメタン(140 ml)に溶解させ、0℃まで冷却し、塩化チタン(43.6 g)を添加する。
30分後に、0℃で、ジイソプロピルエチルアミン( diisopropylethylamine)(42. 4g)を加える。
続いて、4-AA(50.0g)を添加する。
混合物を5-15℃で4時間反応させ、水(300ml)を加え相分離を生じる。
さらに、1,5Nハイドロクロリック酸 (300 g)を加える。
相分離後、再度、炭酸水素ナトリウム水溶液で洗浄し、蒸留して、いくらかの不純物を備える化合物(99g)を製造する。
H-NMR (300MHz,CDCI3) δ7. 32 (m, 2H),7. 25 (m,1H),7. 19 (d,2H),5. 91 (s,1H),4. 66 - 4. 63 (m,1H),4..22- 4. 17 (m,4H),3. 95 (m,1H),3. 30 (dd,1H),3. 06 (m,1H),2.68 (dd,1H),1. 24-1. 19(m,6H),0. 87(s,12H)。
【0018】
第六実施例:(3R, 4S)- 3-[[ [R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone) (1)の製造
図5に示すように、第四実施例製造の化合物(10)(98 g)をアセトン(350 ml)及び水(200ml)に溶解させる。
さらに、過酸化水素(50 ml)を加え、混合物を0℃で攪拌する。
続いて、30分の間に、水酸化ナトリウム(19g)の水溶液(150 ml)を添加する。
反応溶液を、15-25℃で1時間攪拌し、白色固体の化合物(12)を沈殿させる。
ろ過後、水(20ml)を用いて洗浄する。
続いて、得られた化合物(12)を乾燥させ、実施例2 (30. 4g、純度98.5%、計算された化合物(2)の生産効率は82%)のように、化合物(2)の製造に用いる。
水(500ml)及びジクロメタン(500 ml)を、ろ過液に加え、相分離を生じ、有機相を蒸留し、化合物(2) (20 g)を製造する。
水相を、6Nハイドロクロリック酸を用いて、pH3.5に調整し、結晶を生じる。
結晶をろ過し、目標化合物を得る。
続いて、ジクロメタン及びペプタン(50 ml)混合溶液を用いて、-5〜5℃で、ウェットケーキ製品を洗浄する。
40℃以上で乾燥後に38.0g >99.9/ 0.1の比率を得る(4-AA化合物より計算された生産効率は72%。純度99.0%及びHPLC試験は99.5%)。
IH NMR (300 MHz,CDCl3)δ6.5(br s,1H),4.3(m,1H)3.97(dd,1H),3.05 (ddm,1H),2.85(m,1H),1. 29(d,3H),1. 22(d,3H),0. 89(s,9H),0. 08(s,6H)[相當4-BMAの異構物] IH NMR (300 MHz,CDCl3)δ6.5(br s,1H),4.2(m,1H),3.72(dd,1H),2. 85 (ddm,1H),2. 65(m,1H),1. 3(d,3H),1. 23(d,3H),0. 90(s,9H),0. 08(s,6H)。
【0019】
第七実施例:(3R, 4S)- 3-[[ [R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone) (1)の製造
図6に示すように、第四実施例製造の化合物(10)(98 g)を、アセトン(350 ml)及び水 (200ml)に溶解させる。
さらに、過酸化水素(50 ml)を加え、混合物を0℃で攪拌する。
続いて、30分の間に、水酸化ナトリウム(19g)の水溶液(150 ml)を加える。
反応溶液を15-25℃で1時間攪拌し、白色固体の化合物(12)を沈殿させる。
ろ過後に水(20ml)を用いて洗浄する。
続いて、得られた化合物(12)を乾燥させ、実施例2 (30. 4g、純度98.5%、計算された化合物(2)の生産効率は82%)のように、化合物(2)の製造に用いる。
水(500ml)及びジクロメタン(500 ml)を、ろ過液に加え、相分離を生じる。
有機相を蒸留し、化合物(2) (20 g)を製造する。
水相6Nハイドロクロリック酸を用いて、pH3.5に調整し、結晶を生じる。
結晶をろ過し、目標化合物を得る。
続いて、ジクロメタン及びペプタン(50 ml)混合溶液を用いて、-5〜5℃で、ウェットケーキ製品を洗浄する。
40℃以上で乾燥後に38.0g >99.9/ 0.1の比率を得る(4-AA化合物より計算された生産効率は72%。純度99.0%及びHPLC試験は99.5%)。
【0020】
本発明は、モデルと実施例により、上記の通り説明を完成した。しかし、本発明は、上記のモデル及び実施例に限定するものではなく、一般的な技術者が一般的な知識範囲において行う修正、或いは変更を含むものとする。
【産業上の利用可能性】
【0021】
本発明は特許の要件である新規性を備え、従来の同類製品に比べ十分な進歩を有し、実用性が高く、社会のニーズに合致しており、産業上の利用価値は非常に大きい。
【特許請求の範囲】
【請求項1】
以下のステップを含むステレオ選択的に4-BMAのキラル補助剤を製造する方法において、(S)-4-ベンジルオキサゾリジン(benzyloxazoil dine) -ジオン(2-one)
【化1】

を、一種の溶剤に溶解させ溶液を形成し、
アルカリ、触媒及び有機酸無水物を、前記溶液に添加し、
前記溶液を冷却し、続いて、水で混合し、溶剤相分離を生じさせ、
溶液中の溶剤を除去し、
有機溶剤を前記溶液に添加し、
前記溶液をろ過し、固体(S)-4-ベンジル-3-プロピオニルオキサゾリジン-ジオン(2-one)
【化2】

を得ることを特徴とするステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項2】
前記溶剤は、ジクロメタン(methane dichloride)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項3】
前記アルカリは、ジンククロライド(zinc dichloride)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項4】
前記触媒は、トリエチルアミン(triethylamine)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項5】
前記有機酸無水物は、無水プロピオニックアシッド(propionic acid anhydride)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項6】
前記有機溶剤は、ペプタン(heptane)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項7】
前記ジクロメタンを除去するステップは、真空蒸留方法を使用し、溶剤を除去することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項8】
以下のステップを含むステレオ選択的に4-BMAのキラル補助剤を製造する方法において、(S)-4-ベンジルオキサゾリジン(benzyloxazoil dine )-ジオン(2-one)
【化3】

を、一種の溶剤に溶解させ溶液を形成し、
アルカリ、触媒及び有機酸無水物を、前記溶液に添加し、
前記溶液を冷却し、続いて、食塩水を混合し、
抽出剤を、前記溶液に添加し、相分離を生じ、
ハイドロクロリック酸溶液及び食塩水を使用し、前記溶液を洗浄し、
前記溶液中の抽出剤を除去し、
有機溶剤を前記溶液に添加し、
前記溶液をろ過し、固体の (S)-4-ベンジル-3-プロピオニルオキサゾリジン(propionyloxazoil dine )-ジオン(2-one)
【化4】

を得ることを特徴とするステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項9】
前記溶剤は、テトラハイドロフラン(tetrahydrofuran)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項10】
前記アルカリは、リチウムクロライド(lithium chloride)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項11】
前記触媒は、トリエチルアミン(trithylamine)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項12】
前記有機酸無水物は、無水プロピオニックアシッド(propionic acid anhydride)を使用する ことを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項13】
前記抽出剤は、エチルアセテート(ethyl acetate)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項14】
前記有機溶剤は、ペプタン(heptane)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項15】
前記エチルアセテートを除去するステップは、真空蒸留方法を使用し、溶剤を除去することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項16】
以下のステップを含むキラル補助剤を使用して4-BMAを製造する方法において、
(S)-3-((R)-1-(t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy))エチル(ethyl))-4-オキサゾリジン(oxazolidine)-2-イル)プロパノイル(propanoyl)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)を溶解させ、
【化5】

溶液を形成し、
水酸化ナトリウム水溶液を、前記溶液に添加し、
前記溶液ろ過後のろ過液に、水及び溶剤を加え、続いて、水相を形成し、
ろ過液のpHを調整し、結晶の(3R, 4S)- 3-[[ [R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone)
【化6】

を生じることを特徴とするキラル補助剤を使用して4-BMAを製造する方法。
【請求項17】
前記酸化剤は、過酸化水素(hydrogen peroxide)を使用することを特徴とする請求項16に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項18】
前記溶剤は、ジクロメタン(methane dichloride)を使用することを特徴とする請求項16に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項19】
前記ろ過液のpHを調整するステップは、ハイドロクロリック酸を使用し、pH 4.5以下に調整することを特徴とする請求項16に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項20】
以下のステップを含むキラル補助剤を使用して4-BMAを製造する方法において、
((S)-3-((R)-1-(t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy))エチル(ethyl))-4-オキサゾリジン(oxazolidine)-2-イル)プロパノイル(propanoyl)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)を溶解させ、
【化7】

溶液を形成し、
溶液ろ過後のろ過液に、水及び溶剤を加え、続いて、水相を形成し、
ろ過液のpH?を調整し、結晶の (3R, 4S)- 3-[[ [R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone)
【化8】

を生じることを特徴とするキラル補助剤を使用して4-BMAを製造する方法。
【請求項21】
前記酸化剤は、過酸化水素(hydrogen peroxide)を使用することを特徴とする請求項20に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項22】
前記アルカリは、リチウムハイドロキシドモノハイドレート(lithium hydroxide monohydrate)を使用することを特徴とする請求項20に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項23】
前記ろ過液のpHを調整するステップは、ハイドロクロリック酸を使用し、pH 4.5以下に調整することを特徴とする請求項20に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項24】
以下のステップを含むキラル補助剤を使用して4-BMAを製造する方法において、
(S)-4-ベンジル-3プロピオニルオキサゾリジン(propionyloxazoil dine )-ジオン(2-one)
【化9】

及びアゼチジノン(azetidinone)化合物
【化10】

を提供し、
有機アルカリ及びルイス酸溶剤中に、塩化チタンを添加し、
加水分解し、(3R, 4S)- 3-[[ [R]-1’- t-RO]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone)
【化11】

を生じ、
内、Rは、水素或いは水酸化保護基を表すことを特徴とするキラル補助剤を使用して4-BMAを製造する方法。
【請求項25】
前記有機アルカリは、トリエチルアミン(TEA)、ジイソプロピルエチルアミン(DIPEA)、ジエチルアミン(DEA)、及びブチルアミンから選択することを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項26】
前記ルイス酸は、リチウムクロライド(LiCl)、塩化アルミニウム(AlCl4)、臭化アルミニウム(AlBr4 )、四塩化鉄(FeCl4)、ジンククロライド(ZnCl2)、トリフオロボランNICl2、BaCl2、CoCl2、MnCl2、Ce(S04)2、Sml2、NbCl5、B(OEt)3、ScCl3、ReCl5、YCl3、VCl3、TaCl3、HfCl4、ZrCl4、AlCl3、及びSnCl4から選択することを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項27】
前記溶剤は、ジクロメタン、ジクロエタン、及びクロフォームから選択することを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項28】
前記水酸化保護基は、一種の有機シリル基で、選自t-ブチルジメチルシリル、t-ブチルジフェニールシリル、トリエチルシリル、及びトリメチルシリルの組成基から選択することを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項29】
前記加水分解は、過酸化水素、及び水酸化リチウム、或いは水酸化ナトリウムがあることにより起こることを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項30】
以下のステップを含む4-BMAを立体的に製造するキラル補助剤の製造方法において、
【化12】

を提供し、
アルカリ及びジメチルカーボネートを混合し、
【化13】

を形成し、及び有機アルカリ、溶剤、及びルイス酸の協力の下、プロピオニック酸無水物(propionic acid anhydride)と反応させることを特徴とする4-BMAを立体的に製造するキラル補助剤の製造方法。
【請求項31】
前記ルイス酸は、リチウムクロライド(LiCl)、塩化アルミニウム(AlCl4)、臭化アルミニウム(AlBr4)、四塩化鉄(FeCl4)、ジンクブロミド(ZnBr4)、ジンククロライド(ZnCl2)、トリフオロボランから選択することを特徴とする請求項30に記載の4-BMAを立体的に製造するキラル補助剤の製造方法。
【請求項32】
前記有機アルカリは、トリエチルアミン(TEA)、ジイソプロピルエチルアミン(DIPEA)、ジエチルアミン(DEA)から選択することを特徴とする請求項30に記載の4-BMAを立体的に製造するキラル補助剤の製造方法。
【請求項33】
前記溶剤は、テトラハイドロフラン(THF)、ジメチルフォルマミド(DMF)、ヂメチルサルフォキシド(DMSO)、ジメチルアセタミド(DMAc)、及びアセトニトリル(ACN)から選択することを特徴とする請求項30に記載の4-BMAを立体的に製造するキラル補助剤の製造方法。
【請求項1】
以下のステップを含むステレオ選択的に4-BMAのキラル補助剤を製造する方法において、(S)-4-ベンジルオキサゾリジン(benzyloxazoil dine) -ジオン(2-one)
【化1】

を、一種の溶剤に溶解させ溶液を形成し、
アルカリ、触媒及び有機酸無水物を、前記溶液に添加し、
前記溶液を冷却し、続いて、水で混合し、溶剤相分離を生じさせ、
溶液中の溶剤を除去し、
有機溶剤を前記溶液に添加し、
前記溶液をろ過し、固体(S)-4-ベンジル-3-プロピオニルオキサゾリジン-ジオン(2-one)
【化2】

を得ることを特徴とするステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項2】
前記溶剤は、ジクロメタン(methane dichloride)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項3】
前記アルカリは、ジンククロライド(zinc dichloride)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項4】
前記触媒は、トリエチルアミン(triethylamine)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項5】
前記有機酸無水物は、無水プロピオニックアシッド(propionic acid anhydride)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項6】
前記有機溶剤は、ペプタン(heptane)を使用することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項7】
前記ジクロメタンを除去するステップは、真空蒸留方法を使用し、溶剤を除去することを特徴とする請求項1に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項8】
以下のステップを含むステレオ選択的に4-BMAのキラル補助剤を製造する方法において、(S)-4-ベンジルオキサゾリジン(benzyloxazoil dine )-ジオン(2-one)
【化3】

を、一種の溶剤に溶解させ溶液を形成し、
アルカリ、触媒及び有機酸無水物を、前記溶液に添加し、
前記溶液を冷却し、続いて、食塩水を混合し、
抽出剤を、前記溶液に添加し、相分離を生じ、
ハイドロクロリック酸溶液及び食塩水を使用し、前記溶液を洗浄し、
前記溶液中の抽出剤を除去し、
有機溶剤を前記溶液に添加し、
前記溶液をろ過し、固体の (S)-4-ベンジル-3-プロピオニルオキサゾリジン(propionyloxazoil dine )-ジオン(2-one)
【化4】

を得ることを特徴とするステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項9】
前記溶剤は、テトラハイドロフラン(tetrahydrofuran)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項10】
前記アルカリは、リチウムクロライド(lithium chloride)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項11】
前記触媒は、トリエチルアミン(trithylamine)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項12】
前記有機酸無水物は、無水プロピオニックアシッド(propionic acid anhydride)を使用する ことを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項13】
前記抽出剤は、エチルアセテート(ethyl acetate)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項14】
前記有機溶剤は、ペプタン(heptane)を使用することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項15】
前記エチルアセテートを除去するステップは、真空蒸留方法を使用し、溶剤を除去することを特徴とする請求項8に記載のステレオ選択的に4-BMAのキラル補助剤を製造する方法。
【請求項16】
以下のステップを含むキラル補助剤を使用して4-BMAを製造する方法において、
(S)-3-((R)-1-(t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy))エチル(ethyl))-4-オキサゾリジン(oxazolidine)-2-イル)プロパノイル(propanoyl)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)を溶解させ、
【化5】

溶液を形成し、
水酸化ナトリウム水溶液を、前記溶液に添加し、
前記溶液ろ過後のろ過液に、水及び溶剤を加え、続いて、水相を形成し、
ろ過液のpHを調整し、結晶の(3R, 4S)- 3-[[ [R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone)
【化6】

を生じることを特徴とするキラル補助剤を使用して4-BMAを製造する方法。
【請求項17】
前記酸化剤は、過酸化水素(hydrogen peroxide)を使用することを特徴とする請求項16に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項18】
前記溶剤は、ジクロメタン(methane dichloride)を使用することを特徴とする請求項16に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項19】
前記ろ過液のpHを調整するステップは、ハイドロクロリック酸を使用し、pH 4.5以下に調整することを特徴とする請求項16に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項20】
以下のステップを含むキラル補助剤を使用して4-BMAを製造する方法において、
((S)-3-((R)-1-(t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy))エチル(ethyl))-4-オキサゾリジン(oxazolidine)-2-イル)プロパノイル(propanoyl)-4-ベンジルオキサゾリジン(benzyloxazolidine)-ジオン(2-one)を溶解させ、
【化7】

溶液を形成し、
溶液ろ過後のろ過液に、水及び溶剤を加え、続いて、水相を形成し、
ろ過液のpH?を調整し、結晶の (3R, 4S)- 3-[[ [R]-1’- t-ブチルジメチルシリルオキシ(butyldimethylsilyloxy)]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone)
【化8】

を生じることを特徴とするキラル補助剤を使用して4-BMAを製造する方法。
【請求項21】
前記酸化剤は、過酸化水素(hydrogen peroxide)を使用することを特徴とする請求項20に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項22】
前記アルカリは、リチウムハイドロキシドモノハイドレート(lithium hydroxide monohydrate)を使用することを特徴とする請求項20に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項23】
前記ろ過液のpHを調整するステップは、ハイドロクロリック酸を使用し、pH 4.5以下に調整することを特徴とする請求項20に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項24】
以下のステップを含むキラル補助剤を使用して4-BMAを製造する方法において、
(S)-4-ベンジル-3プロピオニルオキサゾリジン(propionyloxazoil dine )-ジオン(2-one)
【化9】

及びアゼチジノン(azetidinone)化合物
【化10】

を提供し、
有機アルカリ及びルイス酸溶剤中に、塩化チタンを添加し、
加水分解し、(3R, 4S)- 3-[[ [R]-1’- t-RO]エチル(ethyl)]-4-[(R)-1”-カーボキシエチル(carboxyethyl)]-2- アゼチジノン(azetidinone)
【化11】

を生じ、
内、Rは、水素或いは水酸化保護基を表すことを特徴とするキラル補助剤を使用して4-BMAを製造する方法。
【請求項25】
前記有機アルカリは、トリエチルアミン(TEA)、ジイソプロピルエチルアミン(DIPEA)、ジエチルアミン(DEA)、及びブチルアミンから選択することを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項26】
前記ルイス酸は、リチウムクロライド(LiCl)、塩化アルミニウム(AlCl4)、臭化アルミニウム(AlBr4 )、四塩化鉄(FeCl4)、ジンククロライド(ZnCl2)、トリフオロボランNICl2、BaCl2、CoCl2、MnCl2、Ce(S04)2、Sml2、NbCl5、B(OEt)3、ScCl3、ReCl5、YCl3、VCl3、TaCl3、HfCl4、ZrCl4、AlCl3、及びSnCl4から選択することを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項27】
前記溶剤は、ジクロメタン、ジクロエタン、及びクロフォームから選択することを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項28】
前記水酸化保護基は、一種の有機シリル基で、選自t-ブチルジメチルシリル、t-ブチルジフェニールシリル、トリエチルシリル、及びトリメチルシリルの組成基から選択することを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項29】
前記加水分解は、過酸化水素、及び水酸化リチウム、或いは水酸化ナトリウムがあることにより起こることを特徴とする請求項24に記載のキラル補助剤を使用して4-BMAを製造する方法。
【請求項30】
以下のステップを含む4-BMAを立体的に製造するキラル補助剤の製造方法において、
【化12】

を提供し、
アルカリ及びジメチルカーボネートを混合し、
【化13】

を形成し、及び有機アルカリ、溶剤、及びルイス酸の協力の下、プロピオニック酸無水物(propionic acid anhydride)と反応させることを特徴とする4-BMAを立体的に製造するキラル補助剤の製造方法。
【請求項31】
前記ルイス酸は、リチウムクロライド(LiCl)、塩化アルミニウム(AlCl4)、臭化アルミニウム(AlBr4)、四塩化鉄(FeCl4)、ジンクブロミド(ZnBr4)、ジンククロライド(ZnCl2)、トリフオロボランから選択することを特徴とする請求項30に記載の4-BMAを立体的に製造するキラル補助剤の製造方法。
【請求項32】
前記有機アルカリは、トリエチルアミン(TEA)、ジイソプロピルエチルアミン(DIPEA)、ジエチルアミン(DEA)から選択することを特徴とする請求項30に記載の4-BMAを立体的に製造するキラル補助剤の製造方法。
【請求項33】
前記溶剤は、テトラハイドロフラン(THF)、ジメチルフォルマミド(DMF)、ヂメチルサルフォキシド(DMSO)、ジメチルアセタミド(DMAc)、及びアセトニトリル(ACN)から選択することを特徴とする請求項30に記載の4-BMAを立体的に製造するキラル補助剤の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−140445(P2011−140445A)
【公開日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願番号】特願2010−530(P2010−530)
【出願日】平成22年1月5日(2010.1.5)
【出願人】(508079038)展旺生命科技股▲ふん▼有限公司 (4)
【Fターム(参考)】
【公開日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願日】平成22年1月5日(2010.1.5)
【出願人】(508079038)展旺生命科技股▲ふん▼有限公司 (4)
【Fターム(参考)】
[ Back to top ]

