ギガヘルツまたはテラヘルツ分光測定を介するリアルタイムPCR
本発明は、PCR増幅(PCR=ポリメラーゼ連鎖反応)において核酸分子、特にポリヌクレオチド配列を分光学的にリアルタイム検出する方法であって、ここにおいて、PCR増幅が、緩衝液中のPCR溶液を作製するために必要な初期物質を準備することと、並びに、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すこととを含み、ここにおいて、前記PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームにおける照射線源からの電磁放射が定められた時点で当該PCR溶液に照射され、それにより、検出器によりリアルタイム検出で、ポリヌクレオチド配列の少なくとも存在または不在が検出される方法に関する。
【発明の詳細な説明】
【発明の概要】
【0001】
本発明は、核酸分子、特に、PCR増幅プロセス並びに対応するPCRアレンジメントにおけるポリヌクレオチド配列の光学的なリアルタイム検出のための方法に関する(PCR=ポリメラーゼ連鎖反応)。
【0002】
そのような方法並びにPCRアレンジメントは、典型的に、あるゲノム配列の発現の定量分析のために使用される。一般的にPCR増幅プロセスは、原理上、ポリヌクレオチド配列の合成的な生成においても使用されるが、多くの生物系において見出されるものであるので、多くの場合、DNAまたはRNAの増幅および試験における使用が見出されている。
【0003】
現在の場合において記載される方法は、PCR増幅プロセスにおける分光学的なリアルタイム検出に関連する。これは、PCR増幅プロセスの反応工程の全てのプロセスにおける検出と、またPCR増幅プロセスの前後での適切な検出の両方に関する。従って、例えば、ポリヌクレオチド配列の複製のための実際のPCR反応工程の実行の前の導入工程において使用される物質が、定性的並びに定量的に分光学的な検出により試験される。更に、分光学的な試験工程は、同様にPCR増幅プロセスの間に行われてもよく、また、PCR増幅プロセスが既に完了したときに行われてもよい。
【0004】
PCR増幅プロセスは、典型的に、ヒトゲノムに関してそれらの組成が明瞭に特徴付けされた比較的短いポリヌクレオチド配列を増幅するために使用される。生体とは対照的に、PCR増幅プロセスは、数千塩基対配列を有するポリヌクレオチド配列のみの増幅を保証できる。PCR増幅プロセスの実行のために、最初に、適切な化学的環境としての緩衝液に加えて、PCRを進行するために必要な多くの他の初期物質を含むPCR溶液の作製が必要である。これらの初期物質は、典型的に、増幅されるべき原型ポリヌクレオチド配列、プライマーにより定義される部分を複製し、増幅されるべきポリヌクレオチド配列の最初の部分と最後の部分とを固定するためのプライマー、並びに複製されたポリヌクレオチド配列の構成要素を意味するデオキシヌクレオシド三リン酸を含む。初期物質に加えて、PCR溶液はまた、例えば、有効性に関してPCR増幅プロセスのプロセスを増大または最適化を可能にする多くの更なる機能的成分を含んでもよい。
【0005】
PCR増幅プロセスは、例えば、典型的な実験用のサーモサイクラーにおいて実行されるように、典型的な繰り返される一連のPCR反応工程を含む。各繰り返しは、ここにおいて、変性、プライマーのハイブリダイゼーションおよび伸長の3つのPCR反応工程を含む。変性は、最初に2本鎖ポリヌクレオチド配列の融解を引き起こし、同時にPCR溶液は約95℃の温度にまで加熱され、それにより2つの1本鎖ポリヌクレオチド配列を互いに維持する水素化共結合が分解される。温度レベルは1本鎖ポリヌクレオチド配列が常にPCR溶液に存在することを保証するまで維持される。プライマーハイブリダイゼーションのPCR反応工程において、温度は、典型的にはポリヌクレオチド配列上にプライマーが特異的に集積することを可能にするレベルで数秒間維持される。
【0006】
指定された温度レベルは、通常、特異的集積によって生成されるプライマー配列の融点より僅かに下回り、かつ通常、55℃と65℃の間の温度に対応する。もし、PCR反応工程の伸長において、ポリヌクレオチド配列の予め決められた位置でプライマーの集積が停止されるならば、ポリメラーゼ効果の下、欠けている鎖による充填または遊離ヌクレチドでのブロックの構築がなされる。ここで、プライマーは1塩基ずつ複製される、最初の新しい1本鎖を形成する。このPCR反応の間に設定されるべき温度は、使用されるべきポリメラーゼの最適使用に依存するが、通常はプライマーハイブリダイゼーションの10℃から15℃を上回る温度レベルにある。PCR反応工程の伸長の完了後に、反応系は繰り返しかつ所望のポリヌクレオチド配列は最良の反応の場合に指数関数的に増加し、それは各付加的反応工程において、以前に合成されたポリヌクレオチド配列もまた付加的鎖の合成のために鋳型として用いられるからである。
【0007】
リアルタイム定量的PCR、従来から知られているPCR増幅法の開発において、PCR増幅法はポリヌクレオチド配列の複製に対して遂行され、同時に、この手法で得られるポリヌクレオチド配列の定量化の可能性が提供される。ここでの定量化は、蛍光測定の実行に基づき、それはPCR増幅法の過程の間に実行される。ここでの検出蛍光シグナルは複製されたポリヌクレオチド配列の量で比例的に増加する。したがって、PCR増幅法後のみに用いることができる、最もありふれた定量的検出方法とは異なり、リアルタイム定量的PCRはそれらの増幅の間のPCR増幅法において複製されるポリヌクレオチド配列の定量的評価をも可能にする。
【0008】
この点で、ここにおける、および以下の定量的検出はリアルタイム定量的PCRと関連した定量化の意味で理解されるべきであることが注目されるべきである。これは、種々の公知の定量化モデルに基づくといえる。単純な場合では、例えば、その事実は、直線、逆比例関係がポリヌクレオチド配列の使用される量の対数とCT(閾値サイクル、すなわち検出された蛍光が最初にバックグラウンドの蛍光を充分に上回るときのサイクル)との間に存在する。仮に、使用される量が例えば最初に知られているならば、次に標準曲線が作成でき、その増加に対してポリヌクレオチド配列のいずれかの未知量が比較され、かつ定量化される。他方、開始量が未知であるならば、しばしばCTの測定を通して、当該開始量もまた測定できる。更なる計算方法は当業者に公知である。
【0009】
ここで、リアルタイム 定量的PCRは、蛍光色素またはいわゆる蛍光標識を必要とし、これは複製されたポリヌクレオチド配列と化学的にまたは物理的に相互作用し、かつそれら自身の蛍光応答を結果的に変化させる。従って、繰り返されるPCR反応工程に従う検出蛍光シグナルの強度増加は、複製されたポリヌクレオチド配列の対応増加に相関する。測定された蛍光シグナルによるPCR 増幅法のプロファイル検出は、例えば単純な蛍光色素の使用で確認でき、蛍光色素は相対的に非特異的な手法で複製されるべきポリヌクレオチド配列に結合する。そのような蛍光色素は、例えばSybrGreenであり、それは非対称シラニン色素分子であり、かつ複製されるべきDNA分子とDNA蛍光色素複合体を形成し、この複合体はλmax = 494nmの波長で青色光を吸収し、λmax = 521nmの波長で緑色光を放射する。別の頻繁に用いられる蛍光色素は臭化エチジウムである。これらの蛍光色素の添加において、FRETプローブ、ライトサイクラープローブ(Lightcycler probes、登録商標)、タックマンプローブ(TaqMan probes、登録商標)、分子ビーコン、スコーピオンプライマーまたはラックスプリマー(Lux プライマー(登録商標)のような蛍光標識もまた使用され、それらはポリヌクレオチド配列の個別点で実際に特異的結合を可能にし、かつ結果的に密接に明確な蛍光特性を有するが、比較的に高価である。したがって、そのような蛍光標識は例えば、蛍光色素に対して典型的であるほどには広い使用においては見出されていない。さらに、例えば分子ビーコンはさらに最適化された、したがってPCR増幅法を行うためには高価なプリマーを必要とする相対的な複合構造を表わす。さらに、そのような複合構造はPCR反応条件の最適化設定をより困難にし、したがってポリヌクレオチド配列の相対的に非効率的な増幅とまた多くの望ましくない副生物の提示も導く。
【0010】
蛍光シグナルの検出に関するリアルタイム定量的PCRのこれらの不利益さを回避するために、従来から知られた、WO 03/102238 A2は、PCR溶液の干渉性の核酸分子の提示を検出するための方法、並びにその方法を実施するためのアレンジメントを提案する。その方法は、チャンバでのPCR 初期物質の調製、並びに変性、プライマーハイブリダイゼーションおよび伸長の繰り返しPCR反応工程の実行を含む。これらのPCR反応工程の実行の間に、連続核酸分子の提示がPCR溶液中へのUV光の放射および引き続く吸収光強度の検出によって遂行される。ここでPCR溶液はPCR増幅法の実行に適合され、かつUV光源の光エネルギーが放射されるチャンバによって吸収される。
【0011】
しかしながら、WO 03/102238 A2に記述される方法は蛍光標識の使用を不要にし、この方法はPCR溶液の個々の成分に対して、または以前の単離反応、例えばフェノールなどの反応工程からの残留物に対して非常に影響されやすいという欠陥にそれ自身を曝している。UV吸収による定量的測定のもう1つの不利益は、1本鎖核酸分子が2本鎖核酸分子のみから制限された範囲に対してのみ優れているようであり、結果として非常に非特異的検出の可能性がポリヌクレオチド配列に対して使用可能である。
【0012】
WO 2008/109706 A1は、多くの異なる手法でのテラヘルツ分光法の使用を記述している。その文献において、2本鎖および1本鎖DNAの検出もまた記述されている。PCR産物の検出に対するリアルタイム法はその刊行物に一切記述されていない。
【0013】
WO 2006/064192 A1は、テラヘルツ範囲のバンドフィルタを記述している。核酸分子の検出に関する方法はその刊行物に記述されていない。
【0014】
US 2006/0216742はギガヘルツまたはテラヘルツ照射を使用して生体分子結合現象を検出するための方法およびシステムを記述している。
【0015】
WO 03/100396 A1は、生物学的サンプルに対する特異性リガンドの検出のための方法を記述している。
【0016】
DE 100 54 476 A1は、試験媒体と接するサンプルの屈折指数または等価パラメータが入射電磁放射との相互作用によって測定される、ポリヌクレオチド配列の検出のための方法を記述している。
【0017】
WO 2004/024949 A2は、突然変異およびスペクトルデータの使用でのヌクレチド多型の迅速検出のための方法を記述している。
【0018】
2つの分子間の生体分子結合存在の検出のためのより特異的方法は、US 2006/0216742 A1によって提案され、それは検出方法並びに対応デバイスに関する。その開示によれば、テラヘルツ照射によって、2つの分子の生体分子結合の存在が検出され、テラヘルツ照射線は源から放射され、かつ分子の1つを含むサンプルを通過した後に検出器で検出される。しかしながら、ここで開示される方法は使用される分子の量の定量化はできず、また結果としてPCR増幅法でのリアルタイム検出に対する使用に対して不適切である。
【0019】
したがって、目的は、それ自身、PCR増幅法でポリヌクレオチド配列のリアルタイム検出のための標識を使用しない方法であって、ポリヌクレオチド配列、特に1本鎖および2本鎖のポリヌクレオチド配列の相違の特異的、定量的検出を可能にし、かつ当該溶液の純度および質によって本質的に影響されない方法を提案する。
【0020】
この目的は、請求項1および15に従う方法並びに請求項14に従うPCRアレンジメントによって達成される。
【0021】
特に、当該目的は、PCR増幅プロセスにおいて核酸分子、特にポリヌクレオチド配列を定量的、且つ分光学的にリアルタイムで検出するための方法であって、ここにおいて、PCR増幅プロセスが、緩衝液中でPCR溶液を作製するために必要な初期物質を調製することと、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すこととを含み、ここにおいて、定量的なリアルタイム検出プロセスにおいて検出器により少なくともポリヌクレオチド配列の存在または不在を検出するために、PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームの電磁放射が定められた時点で照射線源からPCR溶液に照射される方法により達成される。
【0022】
更に、当該目的は、PCR増幅プロセスにおいて核酸分子、特にポリヌクレオチド配列を定量的且つ分光学的にリアルタイムで検出するための方法であって、ここにおいて、PCR増幅プロセスが緩衝液中でPCR溶液の作製のために必要な初期物質を調製することと、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すこととを含み、ここにおいて、リアルタイム検出プロセスにおいて検出器により少なくともポリヌクレオチド配列の存在または不在が検出されるために、PCR増幅プロセスの間に、定められた時点でギガヘルツまたはテラヘルツレジームの電磁放射が照射線源からPCR溶液に照射され、ここにおいて、変性の反応工程が、放射源からのテラヘルツ照射により生じる方法により達成される。
【0023】
更に、当該目的は、PCR増幅プロセスにおいてポリヌクレオチド配列を定量的且つ分光学的にリアルタイムで検出するためのPCRアレンジメントであって、ここにおいて、PCRアレンジメントは、必要な初期物質と緩衝液からなるPCR溶液のための吸着領域を有する支持体と、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すことを可能にするためのそれによりPCR溶液が特定の温度に加熱および/または冷却される温度変更手段と、ギガヘルツまたはテラヘルツレジームの電磁放射をPCR溶液に照射するための照射線源と、定量的な光学的様式で、PCR溶液を介して伝達される放射線を検出するための検出器とを含むPCRアレンジメントにより達成される。
【0024】
本方法および本発明に従うPCRアレンジメントの中心概念は、PCR増幅プロセスと、電磁スペクトルのギガヘルツまたはテラヘルツレジームでの分光学的なリアルタイム検出プロセスの実行にある。本周波数レンジにおいて典型的に使用される放射線は、100ギガヘルツと20テラヘルツレジームの間、特に、300ギガヘルツと10テラヘルツレジームの間にある。これらの照射周波数は、1本鎖および2本鎖ポリヌクレオチド配列のある励起状態(典型的には、振動オシレイションモード(vibration oscillation modes)を引き起こすために適切である。これらのポリヌクレオチド配列の個々の、官能基の励起状態は、その結果として、予め決定された電磁放射の周波数と相関し、且つエクスティンクション(extinction)測定において検出できる。以下のエクスティンクション測定において、一般的に、定量性と同様に、全ての分光学的な検出が示され、それから放射された光強度の一部との関係において、PCR溶液に照射された光強度の一部が設定され、検出器で検出され、それにより、PCR溶液において検出されるべき物質および構造における結果を得ることが可能になる。これらの励起モード(励起周波数)は、更に、これらの官能基の化学的結合状態によって特徴があり、その結果として結合状態の変化が電磁励起周波数の変化を伴う。特に、励起モードが検出でき、その出現は2本鎖ポリヌクレオチド配列における2つの1本鎖ポリヌクレオチド配列の間の水素架橋結合の存在による。従って、この指定された周波数レンジにおけるエクスティンクション測定により、PCR溶液に1本鎖または2本鎖ポリヌクレオチド配列の混合物の何れが存在するのかについて、定量的な結果が得られる。
【0025】
PCR溶液におけるポリヌクレオチド配列の予め決定された励起状態の分光学的なエクスティンクション測定による検出は、蛍光測定による検出の従来の方法と比較して、PCR溶液に添加されるべき蛍光標識が完全に不要である。この構成に伴って、一方では、PCR溶液の調製は、より簡単であり、且つより安価な構成を有する。他方で、PCR溶液に有害な紫外線の使用が排除される。まさに生体高分子において電子的励起を生じる紫外線によって、その結果として、紫外線照射により惹起される二次的な化学反応によるエラーの有力源が非常に問題となる。ギガヘルツおよびテラヘルツレジームの電磁放射は、しかしながら、典型的には、振動励起のみを生じることを可能にし、従って、実際の観点からはPCR溶液における化学反応環境を滅多に破壊することはない。更に、ギガヘルツおよびテラヘルツレジーム照射の照射周波数は、干渉性の核酸分子またはポリヌクレオチド配列のハイブリダイゼーション状態を検出するために適切である。紫外線レジームにおける蛍光測定によるリアルタイム定量PCR法における場合とは異なり、本発明に従う方法に対応する検出は、その結果として、個々のハイブリダイゼーション状体の存在、特に、1本鎖および2本鎖ポリヌクレオチド配列の存在を検出することが可能である。従って、PCR増幅の実行が決め手となるこの同様な定量的検出は、結果を進行中に出すと同時に、PCR溶液中で行われる反応工程が優秀であり、従って、一般的にPCR増幅プロセスの効率を高めることが可能になる。
【0026】
本発明に従う方法のもう1つの中心概念は、更に、分光学的なリアルタイム検出のために使用される照射線源にあり、これは電磁放射によりPCR増幅プロセスにおける変性反応工程を引き起こすためにも使用することが可能である。
【0027】
照射された周波数レンジは、PCR溶液の全体的な系に対して直接的に熱エネルギーを加えることを必要とせずに、2本鎖ポリヌクレオチド配列における2つの1本鎖の間の水素化共結合を融解するために例外なく、明確に適切である。従って、変性の反応工程において、ポリヌクレオチド配列の個々の鎖の間の化学結合の融解を生じさせるために、PCR溶液の温度上昇が不要となる。その代わりに、予め決定されたギガヘルツおよびテラヘルツレジームの周波数の電磁放射のPCR溶液への照射を介して、PCR溶液それ自身について温度の大きな変化を被る必要なく、照射線源が、2本酸ポリヌクレオチド配列の融解を生じる。そのような方法は、従って、繰り返すPCR反応工程に必要なPCR溶液の加熱および冷却相を短縮し、増幅すべき所望の量のポリヌクレオチド配列のより迅速な提供を可能にする。
【0028】
本発明に従う第1の態様において、緩衝液中のPCR溶液の作製のために必要な初期物質は、化学的または物理的検出標識、特に蛍光標識を含まないことを提供する。これらは、従来から知られる測定方法においてポリヌクレオチド配列の存在を検出するための、更に上述されるPCR溶液の産生のためには必要とされない初期物質として添加される標識を含む。本発明に従う方法のために提供されるPCR溶液は、その結果として、必要とされる初期物質、例えば、リアルタイム検出を伴わない従来のPCR 増幅のために必要とされるものなどが制限されてよい。この構成を利用して、一方では、化学的および物理的性質を崩壊させる可能性のある影響が、PCR増幅プロセスの方法において減少され、同時に反応条件の制御性が増大する。
【0029】
もう1つの態様において、ギガヘルツまたはテラヘルツレジームで照射された電磁放射の強度を、それが予め決定されたPCR溶液の層厚さを貫通するように選択されることが提供される。ここで、層厚さは、照射された電磁放射により貫通されるサンプル横断面全体に関してもよく、またはサンプル横断面の一部の領域のみに関してもよい。層厚さは、特定の照射強度の照射のためのエクスティンクションシグナルと、ある検出閾値よりも上のポリヌクレオチド配列の数の存在とを検出するために適切である。電磁放射強度の減衰に起因するエクスティンクションシグナルは、例えば、吸収、散乱(scattering)、回折並びに反射に起因する。仮に貫通する層厚さが一定であれば、また照射された電磁放射はその強度において一定であり、牽いては、結果が与えられたポリヌクレオチド配列の量において、例えば、ポリヌクレオチド配列の公知のエクスティンクション横断面について得られる。
【0030】
本方法の更なる態様において、照射された電磁放射の周波数が、100 GHzと20 THzとの間、特に、300 GHzと10 THzとの間のギガヘルツまたはテラヘルツレジームにあることが提供される。これらの周波数レンジは、励起周波数に及び、殆どのポリヌクレオチド配列について分光学的な様式で容易に検出することが可能であり、従って、分光学的な様式、特に、分光学的且つ定量的な様式において励起周期的変動が検出されることを可能にする。
【0031】
本発明のもう1つの有利な態様において、PCR溶液の緩衝液は、ギガヘルツまたはテラヘルツレジームでの照射された電磁放射の周波数に関して選択され、それにより、照射強度が予め決定されたPCR溶液の層厚さを経た伝達の後に検出器で本質的に減衰しない方法において検出することが可能になることが提供される。緩衝液それ自身が、従って、使用における電磁放射周波数に関して選択され、それにより、照射された予め決定された周波数レンジの電磁放射が最大可能な伝達を体験する。仮に、これらの周波数レンジがポリヌクレオチド配列において検出されるべき励起状態と重複する場合には、PCR溶液との相互作用に従う電磁放射の減少が緩衝液自体のエクスティンクション反応には基づかず、代わりに、初期物質のエクスティンクションのみ、および与えられた分子との相互作用とに従うことが保証される。更に、仮にPCR増幅プロセスの副産物によるエクスティンクションが排除できる場合であれば、ポリヌクレオチド配列の励起状態の領域における電磁放射強度の減弱は、基本的に電磁放射とポリヌクレオチド配列との相互作用のみに基づく。使用に適したシグナルと望まない電磁放射の減弱の割合はその結果として増大し、同様に、定量的、分光学的なリアルタイム検出の質が改善される。
【0032】
本方法の更なる態様において、これは、それ自身を、PCR溶液が持体、特に、支持体の予め決定された吸着領域において付着されるところにおいて識別し、ここにおいて、この領域はギガヘルツまたはテラヘルツレジームで照射された電磁放射のために本質的に透過性である。そのような吸着領域は、制限された容量またはPCR溶液の付着のための表面領域としてのみにより形成される。支持体それ自身が、無機物の支持体、例えば、ガラス、またはその代わりにプラスチック支持体であってよい。仮に支持体それ自身が、照射された電磁放射について本質的に透過性である場合、分光学的なリアルタイム検出において検出されるエクスティンクションシグナルの単にごく一部のみが生じるのみである。検出されたエクスティンクションは従って、仮に、PCR溶液の緩衝液自身が同様に照射された電磁放射の周波数レンジにおける照射強度の減弱を引き起こさないか、または殆ど引き起こさない場合には、本質的に電磁放射とPCR溶液またはそこに含まれる物質との相互作用に基づく。更に、それがプラスチックの場合では、支持体は、照射強度の減弱を可能な限り最低限にするために、適切なプラスチックの選択によって、照射された電磁放射の使用に適した周波数レンジに適合される。
【0033】
本方法のもう1つの態様において、支持体は、ギガヘルツまたはテラヘルツレジームの電磁放射のための少なくとも1つのウェーブガイド含む。このウェーブガイドは、一方で、照射ガイド手段として使用されてもよく、また同時にPCR溶液のために可能な吸着領域を伴う支持体として同時に使用されてもよい。従って、PCR溶液への電磁放射の照射は、局所的に容易な制御可能な方法で実行されてもよい。加えて、従来の視準および焦点調節方法において生じるような散乱照射または損失照射は減少でき、分光学的なリアルタイム検出は改善される。特に有利な方法において、ウェーブガイドは、PCR溶液のために予め決定された吸着領域がウェーブガイドのエバネッセント照射野により貫通される領域に位置する場合に使用できる。ポリヌクレオチド配列の検出は、その結果として、一方でウェーブガイドにより誘導された電磁放射により行われ、しかしながら他方では、ウェーブガイドの外側表面の領域と連絡している。
【0034】
更に、分光学的なリアルタイム検出のための本方法の更なる態様において、温度変更手段が、PCR溶液が提供され、それにより特定の温度に加熱および/または冷却できる。そのような温度変更手段は、PCR溶液を直接的または間接的の何れかにより加熱または冷却できる。直接の温度上昇は、例えば、直接照射加熱または抵抗加熱に基づいてよい。冷却は、例えば、適切に配置されたペルチエ素子により、または代わりに冷却媒体、例えば、熱交換器に連絡された空気により引き起こされてよい。ここで、温度変更手段は、個々のPCR反応工程のために必要な温度にすることが可能な最速および最も厳格な変更を容易にすることを保証する。
【0035】
本方法の更なる態様において、温度変更手段は、支持体を介して間接的にPCR溶液を加熱および/または冷却する熱媒体を加熱および/または冷却することを提供する。更に、支持体自身の熱容量を低くすること、熱伝導性を可能な限りに大きくすることが考慮されるべきである。この構成に従うと、熱媒体は、表面領域に亘り相互作用してもよく、またはその代わりに、これが、例えば、チャネルなどのように、この目的のために提供されてガイド手段に貫通される。支持体の加熱または冷却により、PCR溶液の支持体との適切な接触のために、PCR溶液の温度は適宜変更される。その結果として、PCR反応工程の過程のために必要とする温度条件が、保証されてもよい。
【0036】
本方法の1つの有利な態様において、変性および/またはプライマーハイブリダイゼーションおよび/または伸長の工程の前および/または後で、照射線源からPCR溶液に、ギガヘルツまたはテラヘルツレジームの電磁放射が照射されることが提供される。従って、開始条件およびまた、PCR増幅プロセスにおいて行われる反応工程の各々の後の反応結果についても、分光学的な検出プロセスにより試験されてもよい。仮に、検出により、例えば、続くPCR反応のための開始条件が好ましくないことが発見された場合、例えば、温度選択におけるなどの反応条件の対応する変更が行われて、改善された結果が齎される。1つの代替的な構成において、ギガヘルツまたはテラヘルツレジームの電磁放射はまた、PCR増幅プロセスの間に生じる変性、プライマーハイブリダイゼーションまたは伸長の反応工程において照射されて、それによりブロックを構築する個々の分子の結合性挙動をオンタイムで結果を得ることが可能である。
【0037】
本方法の特に有利な1つの態様において、電磁放射の周波数を選択し、それにより、1本鎖および/または2本鎖ポリヌクレオチド配列の定められた振動励起モードを励起し、それにより、特に、2本鎖ポリヌクレオチド配列のハイブリダイゼーション状態の存在によって特徴があるこれらのモードを検出する。その結果として、PCR増幅プロセスに間に、ポリヌクレオチド配列の分子構造の存在が検出され、それにより、PCR増幅プロセスの進行の質が点検および検出できる。更に、ポリヌクレオチド配列の成功裏な検出の後に、PCR増幅の遮断がまた開始される。特に、定められた励起モードの励起周波数のシフトの検出により、ポリヌクレオチド配列の構造における結果、特に、他のそれらのハイブリダイゼーション状態についても得ることが可能である。
【0038】
本発明のもう1つの態様において、PCR増幅プロセスの間に、先の検出が、当該検出の解析において後に続く検出ためのバックグラウンドとしてのギガヘルツまたはテラヘルツレジームの電磁放射によって検討される。先の検出は、エクスティンクション測定において必要なバックグラウンドの差し引きのために直接に、平均化され、またはフィルターをかけられて何れかにおいて、その後の検出から除外されてもよい。バックグラウンドを差し引くこの工程は、定量的な結果を得るために必要であり、従って、PCRアレンジメントの実際のエクスティンクション反応において更なる従前の知見は必要とせず、しかしながら、その代わりに、大凡リアルタイム法における良好なバックグラウンド測定を可能にする。
【0039】
ポリヌクレオチド配列の分光学的なリアルタイム検出のための方法のもう1つの態様において、ギガヘルツまたはテラヘルツレジームの電磁放射は、PCR増幅プロセスにおいて使用されるべき初期物質の溶液でPCR増幅プロセスを実行する前に、照射線源から照射され、それにより、個々の初期物質の化学的または物理的性質、特に、分光学的な検出により質、特異性およびそれらの結合性挙動が測定される。ここで、典型的には、リアルタイム定量的PCRプロセスの実行の前に、PCR増幅プロセスの殆どの使用者は、PCR装置においてコストの理由から、結合性挙動(ポリヌクレオチド配列の質、プライマー結合性、プライマー特異性、増幅量)を試験するが、それは、蛍光測定の使用下での分光学的なリアルタイム検出の可能性を維持するものではないことに留意されたい。本態様に従う方法の1つの実行に従うと、この別の試験は、従って、排除されてもよく、個々の初期物質の物理的および化学的性質は本発明に従うPCRアレンジメントにより直接に測定されてよい。更に、PCR増幅プロセスにおいて使用されるプライマーは、典型的には、分光学的なリアルタイム検出を伴わない従来のPCRアレンジメントにおける使用を意図するものであり、蛍光標識、蛍光標識を有するプライマーを含むPCR溶液のための反応条件の革新的な最適化の使用に基づく分光学的なリアルタイム検出によるPCRアレンジメントにおける使用を求めている。この新たな最適化が通常必要であり、それは蛍光標識の添加がポリヌクレオチド配列の融点に影響し、それによりプライマー結合に影響を与えるからである。プライマー結合またはプライマー特性は、PCRアレンジメントにおいて前もって測定することが可能であったとしても、そこにおいては、その後になってから、ポリヌクレオチド配列の分光学的なリアルタイム検出がギガヘルツまたはテラヘルツ照射により行うことも可能であり、従って、高価な最適化の必要は排除される。
【0040】
更に、蛍光測定において紫外線レジームで使用される反応容器は、例えば、指紋などによる汚染のために、容易に不正確な測定の原因になり、不正確な吸収評価が生じ得ることも留意されるべきである。ギガヘルツまたはテラヘルツレジームにおける電磁放射は、より大きな波長のために、反応容器のそのような汚染およびまた緩衝液成分に関してもより明確に非感受性である。加えて、汚染し易く、または不正確な取り付けされた蛍光色素の使用は、分光学的な検出についてエラーの有力な原因となるため、従って、本方法においては排除される。
【0041】
本発明の更なる態様は、以下の特許請求の範囲から得られる。
【0042】
本発明を以下に態様に関して記載し、図面を参照して詳細に説明する。ここで示される図面は以下の通りである。
【図面の簡単な説明】
【0043】
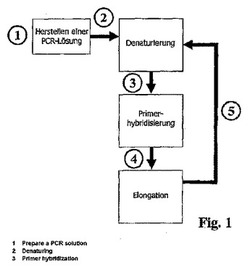
【図1】図1は、本発明の第1の態様に係るPCR 増幅プロセスでのポリヌクレオチド配列の分光学的リアルタイム検出のための方法における個々の工程の時間進行を示すフローチャートである。
【図2】図2は、PCR溶液の予め決定されたポリヌクレオチド配列の励起状態に一致する放射周波数でのPCR 増幅プロセスの過程でのPCR溶液のエクスティンクション反応の模式的図である。
【図3】図3は、本発明に従うPCRアレンジメントの第2の態様の模式的な描写の部分図である。
【図4】図4は、本発明に従うPCRアレンジメントの第3の態様の部分図である。
【図5】図5は、本発明に従うPCRアレンジメントの第4の態様の部分図である。
【図6】図6は、本発明に従うPCRアレンジメントの第5の態様の部分図である。
【図7】図7は、図5に示される第4の態様の部分図に基づく、本発明に従うPCRアレンジメントの第6の態様の図である。
【図8】図8は、ギガヘルツおよび/またはテラヘルツレジームの周波数レジームのPCR溶液の調製に用いられる緩衝液並びにポリヌクレオチド配列のエクスティンクション(吸光度)反応の模式的な描写である。
【発明を実施するための形態】
【0044】
図1は、本発明に従うPCR増幅プロセスにおいてポリヌクレオチド配列10を分光学的にリアルタイム検出するための方法の1つの態様の典型的な進行のフローチャート図を示す。そのような方法では、最初に、緩衝液13が調製されることが必要であり、そこにおいて、PCR溶液を作製するために必要な初期物質が吸着または溶解される。必要な初期物質12は、複製されるべきポリヌクレオチド配列10、適切なプライマー、ポリメラーゼ、並びにポリヌクレオチド配列の合成のためのデオキシヌクレオシド三リン酸である。更に、PCR溶液11の調製前に、個々の初期物質の質、特異性および形成挙動が光学的なリアルタイム検出プロセスにおいて決定される。この検出は、図1で図示される時点で行われる。PCR溶液11の調製の後に、PCR溶液11の新たな、更なる分光学的なリアルタイム検出が行われる(時点2)。ポリヌクレオチド配列の増幅が、次に、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程の繰り返しを経てのみ行われ、ここにおいて、各成功裏のPCR反応工程の後に、分光学的なリアルタイム検出が行われる(時点3、4および5)。ここで、1本鎖ポリヌクレオチド配列の好ましい励起状態は、変性(時点3)のPCR反応工程の後に測定され、ここにおいて、2本鎖ポリヌクレオチド配列の励起状態は、伸長のPCR反応工程の後(時点5)で適切な方法で測定される。この態様に従う方法により、分光学的なリアルタイム検出はPCR増幅プロセスの全体の進行の間に行われ、PCR増幅プロセスにおいて生じるポリヌクレオチド配列の時間的経過もまた定量的な様式で特徴付けられる。更にまた、PCR増幅プロセスが完了した後でも分光学的なリアルタイム検出測定を実施することが当然ながら可能である。
【0045】
本発明に従う本方法の1つの側面に従うと、仮に変性のPCR反応工程が、テラヘルツレジームでの電磁放射を経て引き起こされる場合、次いで、本方法は、変性の完了した時点で対応する電磁放射を行うであろう。
【0046】
図2は、PCR溶液におけるエクスティンクション経過(Extinction course)の模式図を示し、これは、ギガヘルツまたはテラヘルツレジームでの電磁放射を用いる本発明の1つの態様に従い測定できる。ここで、照射される電磁放射の周波数は、これが個々のポリヌクレオチド配列の予め決定された励起状態の周波数と一致するように選択され、且つPCR溶液への対応する照射の後にこれらによりエクスティンクションされる。通常はPCR増幅において複製されるべきポリマーの数は時間と共に指数関数的に増大するために、エクスティンクションの分光学的なリアルタイム検出の測定点は指数関数的な経過との曲線上にのる。この場合におけるPCR溶液のエクスティンクションの個々の検出を十字により図示する。ここで、経時変化は、PCR増幅効率および速度に影響する物理的並びに化学的パラメータに従って決定される。次いで、特定のポリヌクレオチド配列の量が、計算法によりエクスティンクション測定から決定される。
【0047】
PCR増幅プロセスの間のポリヌクレオチド配列の分光学的なリアルタイム検出の実際の実行において、ある者は、単に予め決定された検出閾値D1よりも上にあるそれらの検出が明白な検出結果であり、それらがまた更なる評価のために使用できることを見出す。シグナル対ノイズ比は明白なエクスティンクション判定を可能にするものではないので、この検出閾値D1以下の検出値は、単に、理論的な性質のものである。その結果として、明白な分光学的なリアルタイム検出のための最早時点T1は測定されたエクスティンクションが検出閾値D1よりも上にあるときに生じる。照射される電磁放射の対応する周波数選択のために、検出閾値D2は可能な限り低く、他の周波数の電磁放射のための検出閾値D1よりも下にすることも実現できる。その結果として、従来のリアルタイム定量的なPCR法よりも少ないPCR反応工程で実行される。更に、最早時点T2も可能な限り小さく、特に他の周波数の電磁放射のためのT1よりも短い。
【0048】
図3は、本発明に従うPCR増幅プロセスにおけるポリヌクレオチド配列の分光学的なリアルタイム検出のためのPCRアレンジメントの態様の模式的な描写の部分図を示す。この態様に従うと、照射線源20は、PCR溶液11においてギガヘルツまたはテラヘルツレジームの電磁放射を発する。PCR溶液11は、その形態により限定される支持体24の吸着領域に配置され、PCR溶液の層厚さSを介して電磁放射21が照射される。この場合、そのような吸着領域23は、容器のように、少なくとも部分的に限られた容量により形成される。ここで、放射線の周波数は、それがPCR溶液11内に位置する予め決定されたポリヌクレオチド配列10の励起状態の周波数に一致するように設定される。吸着領域23の横断面を介して照射された電磁放射21の伝達の後に、電磁放射21の対応する減弱された強度が検出器22により検出される。
【0049】
この場合において、光学的構成において典型的な付加的な光学的構成要素、例えば、焦点調節要素、視準要素、ビームガイド要素およびフィルターなどは詳細な記載を省く。そのようなビームを調節するための従来の光学的要素の更なる設備は、それ自身等業者には明白に示される。
【0050】
図4は、PCR増幅プロセスにおけるポリヌクレオチド配列の分光学的なリアルタイム検出のためのPCRアレンジメントの態様のもう1つの部分図を示す。図3に従う第1の態様の吸着領域23に対して、図4に従う第2の態様は、2重壁の吸着領域23を提供するものではなく、その代わりに、1重壁領域のみにおいてPCR溶液11が吸着される。ここで、例えば、支持体の吸着領域23においてPCR溶液の薄膜付着が含まれてもよい。更に、PCR溶液11の配置が、地球の重力場において支持体24の吸着領域23上に方向付けられてもよく、それにより分光学的なリアルタイム検出の間、一定な層厚さSが保証できる。加えて、支持体24の吸着領域23は、更にPCR溶液11と支持体24の吸着領域23との間の付着を増大する構造上の設備を含んでもよい。そのような設備は、例えば、支持体24条でのPCR溶液11の付着を補助する精密表面構造である。
【0051】
図5は、本発明に従うPCR増幅におけるポリヌクレオチド配列の分光学的なリアルタイム検出のためのPCRアレンジメントの第4の態様の部分図を示す。ここで、照射線源20から発せられた電磁放射21の方向と検出器22により検出される放射線の方向は、互いに対する延長上には配置されない。その代わりに、電磁放射21はPCR溶液11および/または吸着領域23の支持体により湾曲され、それにより、直線のビームパスが実現する。そのようなビームパスは、例えば、散乱測定のために有利である。照射線源20および検出器22のそのような相対的な配置もまた、種々の構成要素の空間的配置を改善するために寄与し、それはこの態様に従うPCRアレンジメントの外形寸法の縮小に寄与する。
【0052】
図3〜図5に従う図における電磁放射21の開放されたビームパスの態様に比べて、図6に従う対応の部分図においては、電磁放射21は、放射線の周波数レンジに適したウェーブガイドW内に導かれている。ここで、電磁放射21は、放射源20で直接的にウェーブガイドW内に結合されてもよく、しかしながら適切な調節のみがなされた後に結合されてもよい。従って、ウェーブガイドWは、検出器22に直接的に連結されてもよく、または最初に放射線が、検出器22による検出のために調節されてもよい。ウェーブガイドWは、エバネッセント照射野としての吸着領域23に電磁放射21を放出するために構成され、その結果として、外面のウェーブガイドW上に付着したPCR溶液との相互作用のために電磁放射21のエクスティンクションが生じてもよい。ウェーブガイドWの態様は、絶縁されたウェーブガイド構造を含んでもよく、しかしながら、ウェーブガイド部分もまた更なる吸着装置に一体化されてもよい。1つの好ましい態様において、ウェーブガイドWは、チップ構造物に一体化される。
【0053】
図7は、PCR増幅プロセスにおけるポリヌクレオチド配列の分光学的なリアルタイム検出のための図5における第4の態様の部分図に基づくPCRアレンジメントの態様を示し、もう1つの態様として、吸着領域23の支持体24と相互作用する温度変更手段25を提示する。温度変更手段25は、PCR溶液11の吸着のための吸着領域23の反対側の側面の支持体24を加熱および/または冷却するために構成される。対応する熱伝導を介して加熱支持体24の温度が変化することにより、PCR溶液11の温度変更が実現される。仮に、付着されたPCR溶液11の熱容量と比較して、支持体24の温度抵抗が低い場合、およびまた温度変更手段25の加熱および/または冷却性能が大きい場合、PCR溶液11の比較的迅速な温度変更が実現され、且つ繰り返されるPCR反応工程の迅速な進行が保証される。熱伝導を改善するために、温度変更手段25と支持体24との間に、熱伝導を補助する手段が存在してもよい。本発明に従うPCRアレンジメントの1つの態様において、温度変更手段25は空気循環を加熱および/または冷却してもよく、それが直接に支持体24に誘導され、それによって支持体24を介する対応する熱伝導の後にPCR溶液11の温度を変更してもよい。
【0054】
図8は、PCR溶液11の調製のために必要とされる緩衝液13のエクスティンクション反応13'と、ギガヘルツまたはテラヘルツレジームの周波数レンジにおいて検出されるべきポリヌクレオチド配列の予め決定された励起状態のエクスティンクション反応10'を示す。その回折反応のために、緩衝液13のエクスティンクションは、検出可能な様式における予め決定された周波数レンジを越えて変化する。多くの典型的な実験用緩衝液13は、そのようなエクスティンクション反応を示す。ポリヌクレオチド配列10の励起状態の最低限可能なノイズ検出のために、ポリヌクレオチド配列10の指定された励起状態の周波数レンジにおいて、そのエクスティンクション反応が最小値を有する緩衝液13を選択することが必要である。従って、緩衝液13を経てPCR溶液11に照射された電磁放射21のエクスティンクションは、PCR溶液11中のポリヌクレオチド配列10を介したエクスティンクション検出と比較して低く、ポリヌクレオチド配列10の励起状態のエクスティンクション検出は、緩衝液13を介する混乱(崩壊)の殆どないことによってのみ実現される。
【0055】
検出されるべきポリヌクレオチド配列10およびその励起周波数に対する対応する緩衝液13の選択または設定により、有利なシグナル対ノイズ比が達成される。
【0056】
現在のところ、上記に記載された部分の全ては、単独および何れかの組み合わせにおいて、特に図面において説明された詳細に見られる本発明に必要であるとして、権利請求されていることに留意されるべきである。これらの一部分の変更も、当業者には、理解される。
【符号の説明】
【0057】
10 ポリヌクレオチド配列
10’ エクスティンクション(吸光度、Extinction) of the 励起状態(excited state) of a ポリヌクレオチド配列
11 PCR溶液
12 初期物質
13 緩衝液
13’ エクスティンクション(吸光度、Extinction) of the 緩衝液
14 標識(Marker)
20 照射線源
21 電磁放射
22 検出器
23 吸着領域
24 支持体
25 温度変更手段
26 熱媒体
S 層厚さ
W ウェーブガイド(waveguide)
D1 検出閾値
D2 検出閾値
T 最早検出時点
【発明の概要】
【0001】
本発明は、核酸分子、特に、PCR増幅プロセス並びに対応するPCRアレンジメントにおけるポリヌクレオチド配列の光学的なリアルタイム検出のための方法に関する(PCR=ポリメラーゼ連鎖反応)。
【0002】
そのような方法並びにPCRアレンジメントは、典型的に、あるゲノム配列の発現の定量分析のために使用される。一般的にPCR増幅プロセスは、原理上、ポリヌクレオチド配列の合成的な生成においても使用されるが、多くの生物系において見出されるものであるので、多くの場合、DNAまたはRNAの増幅および試験における使用が見出されている。
【0003】
現在の場合において記載される方法は、PCR増幅プロセスにおける分光学的なリアルタイム検出に関連する。これは、PCR増幅プロセスの反応工程の全てのプロセスにおける検出と、またPCR増幅プロセスの前後での適切な検出の両方に関する。従って、例えば、ポリヌクレオチド配列の複製のための実際のPCR反応工程の実行の前の導入工程において使用される物質が、定性的並びに定量的に分光学的な検出により試験される。更に、分光学的な試験工程は、同様にPCR増幅プロセスの間に行われてもよく、また、PCR増幅プロセスが既に完了したときに行われてもよい。
【0004】
PCR増幅プロセスは、典型的に、ヒトゲノムに関してそれらの組成が明瞭に特徴付けされた比較的短いポリヌクレオチド配列を増幅するために使用される。生体とは対照的に、PCR増幅プロセスは、数千塩基対配列を有するポリヌクレオチド配列のみの増幅を保証できる。PCR増幅プロセスの実行のために、最初に、適切な化学的環境としての緩衝液に加えて、PCRを進行するために必要な多くの他の初期物質を含むPCR溶液の作製が必要である。これらの初期物質は、典型的に、増幅されるべき原型ポリヌクレオチド配列、プライマーにより定義される部分を複製し、増幅されるべきポリヌクレオチド配列の最初の部分と最後の部分とを固定するためのプライマー、並びに複製されたポリヌクレオチド配列の構成要素を意味するデオキシヌクレオシド三リン酸を含む。初期物質に加えて、PCR溶液はまた、例えば、有効性に関してPCR増幅プロセスのプロセスを増大または最適化を可能にする多くの更なる機能的成分を含んでもよい。
【0005】
PCR増幅プロセスは、例えば、典型的な実験用のサーモサイクラーにおいて実行されるように、典型的な繰り返される一連のPCR反応工程を含む。各繰り返しは、ここにおいて、変性、プライマーのハイブリダイゼーションおよび伸長の3つのPCR反応工程を含む。変性は、最初に2本鎖ポリヌクレオチド配列の融解を引き起こし、同時にPCR溶液は約95℃の温度にまで加熱され、それにより2つの1本鎖ポリヌクレオチド配列を互いに維持する水素化共結合が分解される。温度レベルは1本鎖ポリヌクレオチド配列が常にPCR溶液に存在することを保証するまで維持される。プライマーハイブリダイゼーションのPCR反応工程において、温度は、典型的にはポリヌクレオチド配列上にプライマーが特異的に集積することを可能にするレベルで数秒間維持される。
【0006】
指定された温度レベルは、通常、特異的集積によって生成されるプライマー配列の融点より僅かに下回り、かつ通常、55℃と65℃の間の温度に対応する。もし、PCR反応工程の伸長において、ポリヌクレオチド配列の予め決められた位置でプライマーの集積が停止されるならば、ポリメラーゼ効果の下、欠けている鎖による充填または遊離ヌクレチドでのブロックの構築がなされる。ここで、プライマーは1塩基ずつ複製される、最初の新しい1本鎖を形成する。このPCR反応の間に設定されるべき温度は、使用されるべきポリメラーゼの最適使用に依存するが、通常はプライマーハイブリダイゼーションの10℃から15℃を上回る温度レベルにある。PCR反応工程の伸長の完了後に、反応系は繰り返しかつ所望のポリヌクレオチド配列は最良の反応の場合に指数関数的に増加し、それは各付加的反応工程において、以前に合成されたポリヌクレオチド配列もまた付加的鎖の合成のために鋳型として用いられるからである。
【0007】
リアルタイム定量的PCR、従来から知られているPCR増幅法の開発において、PCR増幅法はポリヌクレオチド配列の複製に対して遂行され、同時に、この手法で得られるポリヌクレオチド配列の定量化の可能性が提供される。ここでの定量化は、蛍光測定の実行に基づき、それはPCR増幅法の過程の間に実行される。ここでの検出蛍光シグナルは複製されたポリヌクレオチド配列の量で比例的に増加する。したがって、PCR増幅法後のみに用いることができる、最もありふれた定量的検出方法とは異なり、リアルタイム定量的PCRはそれらの増幅の間のPCR増幅法において複製されるポリヌクレオチド配列の定量的評価をも可能にする。
【0008】
この点で、ここにおける、および以下の定量的検出はリアルタイム定量的PCRと関連した定量化の意味で理解されるべきであることが注目されるべきである。これは、種々の公知の定量化モデルに基づくといえる。単純な場合では、例えば、その事実は、直線、逆比例関係がポリヌクレオチド配列の使用される量の対数とCT(閾値サイクル、すなわち検出された蛍光が最初にバックグラウンドの蛍光を充分に上回るときのサイクル)との間に存在する。仮に、使用される量が例えば最初に知られているならば、次に標準曲線が作成でき、その増加に対してポリヌクレオチド配列のいずれかの未知量が比較され、かつ定量化される。他方、開始量が未知であるならば、しばしばCTの測定を通して、当該開始量もまた測定できる。更なる計算方法は当業者に公知である。
【0009】
ここで、リアルタイム 定量的PCRは、蛍光色素またはいわゆる蛍光標識を必要とし、これは複製されたポリヌクレオチド配列と化学的にまたは物理的に相互作用し、かつそれら自身の蛍光応答を結果的に変化させる。従って、繰り返されるPCR反応工程に従う検出蛍光シグナルの強度増加は、複製されたポリヌクレオチド配列の対応増加に相関する。測定された蛍光シグナルによるPCR 増幅法のプロファイル検出は、例えば単純な蛍光色素の使用で確認でき、蛍光色素は相対的に非特異的な手法で複製されるべきポリヌクレオチド配列に結合する。そのような蛍光色素は、例えばSybrGreenであり、それは非対称シラニン色素分子であり、かつ複製されるべきDNA分子とDNA蛍光色素複合体を形成し、この複合体はλmax = 494nmの波長で青色光を吸収し、λmax = 521nmの波長で緑色光を放射する。別の頻繁に用いられる蛍光色素は臭化エチジウムである。これらの蛍光色素の添加において、FRETプローブ、ライトサイクラープローブ(Lightcycler probes、登録商標)、タックマンプローブ(TaqMan probes、登録商標)、分子ビーコン、スコーピオンプライマーまたはラックスプリマー(Lux プライマー(登録商標)のような蛍光標識もまた使用され、それらはポリヌクレオチド配列の個別点で実際に特異的結合を可能にし、かつ結果的に密接に明確な蛍光特性を有するが、比較的に高価である。したがって、そのような蛍光標識は例えば、蛍光色素に対して典型的であるほどには広い使用においては見出されていない。さらに、例えば分子ビーコンはさらに最適化された、したがってPCR増幅法を行うためには高価なプリマーを必要とする相対的な複合構造を表わす。さらに、そのような複合構造はPCR反応条件の最適化設定をより困難にし、したがってポリヌクレオチド配列の相対的に非効率的な増幅とまた多くの望ましくない副生物の提示も導く。
【0010】
蛍光シグナルの検出に関するリアルタイム定量的PCRのこれらの不利益さを回避するために、従来から知られた、WO 03/102238 A2は、PCR溶液の干渉性の核酸分子の提示を検出するための方法、並びにその方法を実施するためのアレンジメントを提案する。その方法は、チャンバでのPCR 初期物質の調製、並びに変性、プライマーハイブリダイゼーションおよび伸長の繰り返しPCR反応工程の実行を含む。これらのPCR反応工程の実行の間に、連続核酸分子の提示がPCR溶液中へのUV光の放射および引き続く吸収光強度の検出によって遂行される。ここでPCR溶液はPCR増幅法の実行に適合され、かつUV光源の光エネルギーが放射されるチャンバによって吸収される。
【0011】
しかしながら、WO 03/102238 A2に記述される方法は蛍光標識の使用を不要にし、この方法はPCR溶液の個々の成分に対して、または以前の単離反応、例えばフェノールなどの反応工程からの残留物に対して非常に影響されやすいという欠陥にそれ自身を曝している。UV吸収による定量的測定のもう1つの不利益は、1本鎖核酸分子が2本鎖核酸分子のみから制限された範囲に対してのみ優れているようであり、結果として非常に非特異的検出の可能性がポリヌクレオチド配列に対して使用可能である。
【0012】
WO 2008/109706 A1は、多くの異なる手法でのテラヘルツ分光法の使用を記述している。その文献において、2本鎖および1本鎖DNAの検出もまた記述されている。PCR産物の検出に対するリアルタイム法はその刊行物に一切記述されていない。
【0013】
WO 2006/064192 A1は、テラヘルツ範囲のバンドフィルタを記述している。核酸分子の検出に関する方法はその刊行物に記述されていない。
【0014】
US 2006/0216742はギガヘルツまたはテラヘルツ照射を使用して生体分子結合現象を検出するための方法およびシステムを記述している。
【0015】
WO 03/100396 A1は、生物学的サンプルに対する特異性リガンドの検出のための方法を記述している。
【0016】
DE 100 54 476 A1は、試験媒体と接するサンプルの屈折指数または等価パラメータが入射電磁放射との相互作用によって測定される、ポリヌクレオチド配列の検出のための方法を記述している。
【0017】
WO 2004/024949 A2は、突然変異およびスペクトルデータの使用でのヌクレチド多型の迅速検出のための方法を記述している。
【0018】
2つの分子間の生体分子結合存在の検出のためのより特異的方法は、US 2006/0216742 A1によって提案され、それは検出方法並びに対応デバイスに関する。その開示によれば、テラヘルツ照射によって、2つの分子の生体分子結合の存在が検出され、テラヘルツ照射線は源から放射され、かつ分子の1つを含むサンプルを通過した後に検出器で検出される。しかしながら、ここで開示される方法は使用される分子の量の定量化はできず、また結果としてPCR増幅法でのリアルタイム検出に対する使用に対して不適切である。
【0019】
したがって、目的は、それ自身、PCR増幅法でポリヌクレオチド配列のリアルタイム検出のための標識を使用しない方法であって、ポリヌクレオチド配列、特に1本鎖および2本鎖のポリヌクレオチド配列の相違の特異的、定量的検出を可能にし、かつ当該溶液の純度および質によって本質的に影響されない方法を提案する。
【0020】
この目的は、請求項1および15に従う方法並びに請求項14に従うPCRアレンジメントによって達成される。
【0021】
特に、当該目的は、PCR増幅プロセスにおいて核酸分子、特にポリヌクレオチド配列を定量的、且つ分光学的にリアルタイムで検出するための方法であって、ここにおいて、PCR増幅プロセスが、緩衝液中でPCR溶液を作製するために必要な初期物質を調製することと、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すこととを含み、ここにおいて、定量的なリアルタイム検出プロセスにおいて検出器により少なくともポリヌクレオチド配列の存在または不在を検出するために、PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームの電磁放射が定められた時点で照射線源からPCR溶液に照射される方法により達成される。
【0022】
更に、当該目的は、PCR増幅プロセスにおいて核酸分子、特にポリヌクレオチド配列を定量的且つ分光学的にリアルタイムで検出するための方法であって、ここにおいて、PCR増幅プロセスが緩衝液中でPCR溶液の作製のために必要な初期物質を調製することと、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すこととを含み、ここにおいて、リアルタイム検出プロセスにおいて検出器により少なくともポリヌクレオチド配列の存在または不在が検出されるために、PCR増幅プロセスの間に、定められた時点でギガヘルツまたはテラヘルツレジームの電磁放射が照射線源からPCR溶液に照射され、ここにおいて、変性の反応工程が、放射源からのテラヘルツ照射により生じる方法により達成される。
【0023】
更に、当該目的は、PCR増幅プロセスにおいてポリヌクレオチド配列を定量的且つ分光学的にリアルタイムで検出するためのPCRアレンジメントであって、ここにおいて、PCRアレンジメントは、必要な初期物質と緩衝液からなるPCR溶液のための吸着領域を有する支持体と、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すことを可能にするためのそれによりPCR溶液が特定の温度に加熱および/または冷却される温度変更手段と、ギガヘルツまたはテラヘルツレジームの電磁放射をPCR溶液に照射するための照射線源と、定量的な光学的様式で、PCR溶液を介して伝達される放射線を検出するための検出器とを含むPCRアレンジメントにより達成される。
【0024】
本方法および本発明に従うPCRアレンジメントの中心概念は、PCR増幅プロセスと、電磁スペクトルのギガヘルツまたはテラヘルツレジームでの分光学的なリアルタイム検出プロセスの実行にある。本周波数レンジにおいて典型的に使用される放射線は、100ギガヘルツと20テラヘルツレジームの間、特に、300ギガヘルツと10テラヘルツレジームの間にある。これらの照射周波数は、1本鎖および2本鎖ポリヌクレオチド配列のある励起状態(典型的には、振動オシレイションモード(vibration oscillation modes)を引き起こすために適切である。これらのポリヌクレオチド配列の個々の、官能基の励起状態は、その結果として、予め決定された電磁放射の周波数と相関し、且つエクスティンクション(extinction)測定において検出できる。以下のエクスティンクション測定において、一般的に、定量性と同様に、全ての分光学的な検出が示され、それから放射された光強度の一部との関係において、PCR溶液に照射された光強度の一部が設定され、検出器で検出され、それにより、PCR溶液において検出されるべき物質および構造における結果を得ることが可能になる。これらの励起モード(励起周波数)は、更に、これらの官能基の化学的結合状態によって特徴があり、その結果として結合状態の変化が電磁励起周波数の変化を伴う。特に、励起モードが検出でき、その出現は2本鎖ポリヌクレオチド配列における2つの1本鎖ポリヌクレオチド配列の間の水素架橋結合の存在による。従って、この指定された周波数レンジにおけるエクスティンクション測定により、PCR溶液に1本鎖または2本鎖ポリヌクレオチド配列の混合物の何れが存在するのかについて、定量的な結果が得られる。
【0025】
PCR溶液におけるポリヌクレオチド配列の予め決定された励起状態の分光学的なエクスティンクション測定による検出は、蛍光測定による検出の従来の方法と比較して、PCR溶液に添加されるべき蛍光標識が完全に不要である。この構成に伴って、一方では、PCR溶液の調製は、より簡単であり、且つより安価な構成を有する。他方で、PCR溶液に有害な紫外線の使用が排除される。まさに生体高分子において電子的励起を生じる紫外線によって、その結果として、紫外線照射により惹起される二次的な化学反応によるエラーの有力源が非常に問題となる。ギガヘルツおよびテラヘルツレジームの電磁放射は、しかしながら、典型的には、振動励起のみを生じることを可能にし、従って、実際の観点からはPCR溶液における化学反応環境を滅多に破壊することはない。更に、ギガヘルツおよびテラヘルツレジーム照射の照射周波数は、干渉性の核酸分子またはポリヌクレオチド配列のハイブリダイゼーション状態を検出するために適切である。紫外線レジームにおける蛍光測定によるリアルタイム定量PCR法における場合とは異なり、本発明に従う方法に対応する検出は、その結果として、個々のハイブリダイゼーション状体の存在、特に、1本鎖および2本鎖ポリヌクレオチド配列の存在を検出することが可能である。従って、PCR増幅の実行が決め手となるこの同様な定量的検出は、結果を進行中に出すと同時に、PCR溶液中で行われる反応工程が優秀であり、従って、一般的にPCR増幅プロセスの効率を高めることが可能になる。
【0026】
本発明に従う方法のもう1つの中心概念は、更に、分光学的なリアルタイム検出のために使用される照射線源にあり、これは電磁放射によりPCR増幅プロセスにおける変性反応工程を引き起こすためにも使用することが可能である。
【0027】
照射された周波数レンジは、PCR溶液の全体的な系に対して直接的に熱エネルギーを加えることを必要とせずに、2本鎖ポリヌクレオチド配列における2つの1本鎖の間の水素化共結合を融解するために例外なく、明確に適切である。従って、変性の反応工程において、ポリヌクレオチド配列の個々の鎖の間の化学結合の融解を生じさせるために、PCR溶液の温度上昇が不要となる。その代わりに、予め決定されたギガヘルツおよびテラヘルツレジームの周波数の電磁放射のPCR溶液への照射を介して、PCR溶液それ自身について温度の大きな変化を被る必要なく、照射線源が、2本酸ポリヌクレオチド配列の融解を生じる。そのような方法は、従って、繰り返すPCR反応工程に必要なPCR溶液の加熱および冷却相を短縮し、増幅すべき所望の量のポリヌクレオチド配列のより迅速な提供を可能にする。
【0028】
本発明に従う第1の態様において、緩衝液中のPCR溶液の作製のために必要な初期物質は、化学的または物理的検出標識、特に蛍光標識を含まないことを提供する。これらは、従来から知られる測定方法においてポリヌクレオチド配列の存在を検出するための、更に上述されるPCR溶液の産生のためには必要とされない初期物質として添加される標識を含む。本発明に従う方法のために提供されるPCR溶液は、その結果として、必要とされる初期物質、例えば、リアルタイム検出を伴わない従来のPCR 増幅のために必要とされるものなどが制限されてよい。この構成を利用して、一方では、化学的および物理的性質を崩壊させる可能性のある影響が、PCR増幅プロセスの方法において減少され、同時に反応条件の制御性が増大する。
【0029】
もう1つの態様において、ギガヘルツまたはテラヘルツレジームで照射された電磁放射の強度を、それが予め決定されたPCR溶液の層厚さを貫通するように選択されることが提供される。ここで、層厚さは、照射された電磁放射により貫通されるサンプル横断面全体に関してもよく、またはサンプル横断面の一部の領域のみに関してもよい。層厚さは、特定の照射強度の照射のためのエクスティンクションシグナルと、ある検出閾値よりも上のポリヌクレオチド配列の数の存在とを検出するために適切である。電磁放射強度の減衰に起因するエクスティンクションシグナルは、例えば、吸収、散乱(scattering)、回折並びに反射に起因する。仮に貫通する層厚さが一定であれば、また照射された電磁放射はその強度において一定であり、牽いては、結果が与えられたポリヌクレオチド配列の量において、例えば、ポリヌクレオチド配列の公知のエクスティンクション横断面について得られる。
【0030】
本方法の更なる態様において、照射された電磁放射の周波数が、100 GHzと20 THzとの間、特に、300 GHzと10 THzとの間のギガヘルツまたはテラヘルツレジームにあることが提供される。これらの周波数レンジは、励起周波数に及び、殆どのポリヌクレオチド配列について分光学的な様式で容易に検出することが可能であり、従って、分光学的な様式、特に、分光学的且つ定量的な様式において励起周期的変動が検出されることを可能にする。
【0031】
本発明のもう1つの有利な態様において、PCR溶液の緩衝液は、ギガヘルツまたはテラヘルツレジームでの照射された電磁放射の周波数に関して選択され、それにより、照射強度が予め決定されたPCR溶液の層厚さを経た伝達の後に検出器で本質的に減衰しない方法において検出することが可能になることが提供される。緩衝液それ自身が、従って、使用における電磁放射周波数に関して選択され、それにより、照射された予め決定された周波数レンジの電磁放射が最大可能な伝達を体験する。仮に、これらの周波数レンジがポリヌクレオチド配列において検出されるべき励起状態と重複する場合には、PCR溶液との相互作用に従う電磁放射の減少が緩衝液自体のエクスティンクション反応には基づかず、代わりに、初期物質のエクスティンクションのみ、および与えられた分子との相互作用とに従うことが保証される。更に、仮にPCR増幅プロセスの副産物によるエクスティンクションが排除できる場合であれば、ポリヌクレオチド配列の励起状態の領域における電磁放射強度の減弱は、基本的に電磁放射とポリヌクレオチド配列との相互作用のみに基づく。使用に適したシグナルと望まない電磁放射の減弱の割合はその結果として増大し、同様に、定量的、分光学的なリアルタイム検出の質が改善される。
【0032】
本方法の更なる態様において、これは、それ自身を、PCR溶液が持体、特に、支持体の予め決定された吸着領域において付着されるところにおいて識別し、ここにおいて、この領域はギガヘルツまたはテラヘルツレジームで照射された電磁放射のために本質的に透過性である。そのような吸着領域は、制限された容量またはPCR溶液の付着のための表面領域としてのみにより形成される。支持体それ自身が、無機物の支持体、例えば、ガラス、またはその代わりにプラスチック支持体であってよい。仮に支持体それ自身が、照射された電磁放射について本質的に透過性である場合、分光学的なリアルタイム検出において検出されるエクスティンクションシグナルの単にごく一部のみが生じるのみである。検出されたエクスティンクションは従って、仮に、PCR溶液の緩衝液自身が同様に照射された電磁放射の周波数レンジにおける照射強度の減弱を引き起こさないか、または殆ど引き起こさない場合には、本質的に電磁放射とPCR溶液またはそこに含まれる物質との相互作用に基づく。更に、それがプラスチックの場合では、支持体は、照射強度の減弱を可能な限り最低限にするために、適切なプラスチックの選択によって、照射された電磁放射の使用に適した周波数レンジに適合される。
【0033】
本方法のもう1つの態様において、支持体は、ギガヘルツまたはテラヘルツレジームの電磁放射のための少なくとも1つのウェーブガイド含む。このウェーブガイドは、一方で、照射ガイド手段として使用されてもよく、また同時にPCR溶液のために可能な吸着領域を伴う支持体として同時に使用されてもよい。従って、PCR溶液への電磁放射の照射は、局所的に容易な制御可能な方法で実行されてもよい。加えて、従来の視準および焦点調節方法において生じるような散乱照射または損失照射は減少でき、分光学的なリアルタイム検出は改善される。特に有利な方法において、ウェーブガイドは、PCR溶液のために予め決定された吸着領域がウェーブガイドのエバネッセント照射野により貫通される領域に位置する場合に使用できる。ポリヌクレオチド配列の検出は、その結果として、一方でウェーブガイドにより誘導された電磁放射により行われ、しかしながら他方では、ウェーブガイドの外側表面の領域と連絡している。
【0034】
更に、分光学的なリアルタイム検出のための本方法の更なる態様において、温度変更手段が、PCR溶液が提供され、それにより特定の温度に加熱および/または冷却できる。そのような温度変更手段は、PCR溶液を直接的または間接的の何れかにより加熱または冷却できる。直接の温度上昇は、例えば、直接照射加熱または抵抗加熱に基づいてよい。冷却は、例えば、適切に配置されたペルチエ素子により、または代わりに冷却媒体、例えば、熱交換器に連絡された空気により引き起こされてよい。ここで、温度変更手段は、個々のPCR反応工程のために必要な温度にすることが可能な最速および最も厳格な変更を容易にすることを保証する。
【0035】
本方法の更なる態様において、温度変更手段は、支持体を介して間接的にPCR溶液を加熱および/または冷却する熱媒体を加熱および/または冷却することを提供する。更に、支持体自身の熱容量を低くすること、熱伝導性を可能な限りに大きくすることが考慮されるべきである。この構成に従うと、熱媒体は、表面領域に亘り相互作用してもよく、またはその代わりに、これが、例えば、チャネルなどのように、この目的のために提供されてガイド手段に貫通される。支持体の加熱または冷却により、PCR溶液の支持体との適切な接触のために、PCR溶液の温度は適宜変更される。その結果として、PCR反応工程の過程のために必要とする温度条件が、保証されてもよい。
【0036】
本方法の1つの有利な態様において、変性および/またはプライマーハイブリダイゼーションおよび/または伸長の工程の前および/または後で、照射線源からPCR溶液に、ギガヘルツまたはテラヘルツレジームの電磁放射が照射されることが提供される。従って、開始条件およびまた、PCR増幅プロセスにおいて行われる反応工程の各々の後の反応結果についても、分光学的な検出プロセスにより試験されてもよい。仮に、検出により、例えば、続くPCR反応のための開始条件が好ましくないことが発見された場合、例えば、温度選択におけるなどの反応条件の対応する変更が行われて、改善された結果が齎される。1つの代替的な構成において、ギガヘルツまたはテラヘルツレジームの電磁放射はまた、PCR増幅プロセスの間に生じる変性、プライマーハイブリダイゼーションまたは伸長の反応工程において照射されて、それによりブロックを構築する個々の分子の結合性挙動をオンタイムで結果を得ることが可能である。
【0037】
本方法の特に有利な1つの態様において、電磁放射の周波数を選択し、それにより、1本鎖および/または2本鎖ポリヌクレオチド配列の定められた振動励起モードを励起し、それにより、特に、2本鎖ポリヌクレオチド配列のハイブリダイゼーション状態の存在によって特徴があるこれらのモードを検出する。その結果として、PCR増幅プロセスに間に、ポリヌクレオチド配列の分子構造の存在が検出され、それにより、PCR増幅プロセスの進行の質が点検および検出できる。更に、ポリヌクレオチド配列の成功裏な検出の後に、PCR増幅の遮断がまた開始される。特に、定められた励起モードの励起周波数のシフトの検出により、ポリヌクレオチド配列の構造における結果、特に、他のそれらのハイブリダイゼーション状態についても得ることが可能である。
【0038】
本発明のもう1つの態様において、PCR増幅プロセスの間に、先の検出が、当該検出の解析において後に続く検出ためのバックグラウンドとしてのギガヘルツまたはテラヘルツレジームの電磁放射によって検討される。先の検出は、エクスティンクション測定において必要なバックグラウンドの差し引きのために直接に、平均化され、またはフィルターをかけられて何れかにおいて、その後の検出から除外されてもよい。バックグラウンドを差し引くこの工程は、定量的な結果を得るために必要であり、従って、PCRアレンジメントの実際のエクスティンクション反応において更なる従前の知見は必要とせず、しかしながら、その代わりに、大凡リアルタイム法における良好なバックグラウンド測定を可能にする。
【0039】
ポリヌクレオチド配列の分光学的なリアルタイム検出のための方法のもう1つの態様において、ギガヘルツまたはテラヘルツレジームの電磁放射は、PCR増幅プロセスにおいて使用されるべき初期物質の溶液でPCR増幅プロセスを実行する前に、照射線源から照射され、それにより、個々の初期物質の化学的または物理的性質、特に、分光学的な検出により質、特異性およびそれらの結合性挙動が測定される。ここで、典型的には、リアルタイム定量的PCRプロセスの実行の前に、PCR増幅プロセスの殆どの使用者は、PCR装置においてコストの理由から、結合性挙動(ポリヌクレオチド配列の質、プライマー結合性、プライマー特異性、増幅量)を試験するが、それは、蛍光測定の使用下での分光学的なリアルタイム検出の可能性を維持するものではないことに留意されたい。本態様に従う方法の1つの実行に従うと、この別の試験は、従って、排除されてもよく、個々の初期物質の物理的および化学的性質は本発明に従うPCRアレンジメントにより直接に測定されてよい。更に、PCR増幅プロセスにおいて使用されるプライマーは、典型的には、分光学的なリアルタイム検出を伴わない従来のPCRアレンジメントにおける使用を意図するものであり、蛍光標識、蛍光標識を有するプライマーを含むPCR溶液のための反応条件の革新的な最適化の使用に基づく分光学的なリアルタイム検出によるPCRアレンジメントにおける使用を求めている。この新たな最適化が通常必要であり、それは蛍光標識の添加がポリヌクレオチド配列の融点に影響し、それによりプライマー結合に影響を与えるからである。プライマー結合またはプライマー特性は、PCRアレンジメントにおいて前もって測定することが可能であったとしても、そこにおいては、その後になってから、ポリヌクレオチド配列の分光学的なリアルタイム検出がギガヘルツまたはテラヘルツ照射により行うことも可能であり、従って、高価な最適化の必要は排除される。
【0040】
更に、蛍光測定において紫外線レジームで使用される反応容器は、例えば、指紋などによる汚染のために、容易に不正確な測定の原因になり、不正確な吸収評価が生じ得ることも留意されるべきである。ギガヘルツまたはテラヘルツレジームにおける電磁放射は、より大きな波長のために、反応容器のそのような汚染およびまた緩衝液成分に関してもより明確に非感受性である。加えて、汚染し易く、または不正確な取り付けされた蛍光色素の使用は、分光学的な検出についてエラーの有力な原因となるため、従って、本方法においては排除される。
【0041】
本発明の更なる態様は、以下の特許請求の範囲から得られる。
【0042】
本発明を以下に態様に関して記載し、図面を参照して詳細に説明する。ここで示される図面は以下の通りである。
【図面の簡単な説明】
【0043】
【図1】図1は、本発明の第1の態様に係るPCR 増幅プロセスでのポリヌクレオチド配列の分光学的リアルタイム検出のための方法における個々の工程の時間進行を示すフローチャートである。
【図2】図2は、PCR溶液の予め決定されたポリヌクレオチド配列の励起状態に一致する放射周波数でのPCR 増幅プロセスの過程でのPCR溶液のエクスティンクション反応の模式的図である。
【図3】図3は、本発明に従うPCRアレンジメントの第2の態様の模式的な描写の部分図である。
【図4】図4は、本発明に従うPCRアレンジメントの第3の態様の部分図である。
【図5】図5は、本発明に従うPCRアレンジメントの第4の態様の部分図である。
【図6】図6は、本発明に従うPCRアレンジメントの第5の態様の部分図である。
【図7】図7は、図5に示される第4の態様の部分図に基づく、本発明に従うPCRアレンジメントの第6の態様の図である。
【図8】図8は、ギガヘルツおよび/またはテラヘルツレジームの周波数レジームのPCR溶液の調製に用いられる緩衝液並びにポリヌクレオチド配列のエクスティンクション(吸光度)反応の模式的な描写である。
【発明を実施するための形態】
【0044】
図1は、本発明に従うPCR増幅プロセスにおいてポリヌクレオチド配列10を分光学的にリアルタイム検出するための方法の1つの態様の典型的な進行のフローチャート図を示す。そのような方法では、最初に、緩衝液13が調製されることが必要であり、そこにおいて、PCR溶液を作製するために必要な初期物質が吸着または溶解される。必要な初期物質12は、複製されるべきポリヌクレオチド配列10、適切なプライマー、ポリメラーゼ、並びにポリヌクレオチド配列の合成のためのデオキシヌクレオシド三リン酸である。更に、PCR溶液11の調製前に、個々の初期物質の質、特異性および形成挙動が光学的なリアルタイム検出プロセスにおいて決定される。この検出は、図1で図示される時点で行われる。PCR溶液11の調製の後に、PCR溶液11の新たな、更なる分光学的なリアルタイム検出が行われる(時点2)。ポリヌクレオチド配列の増幅が、次に、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程の繰り返しを経てのみ行われ、ここにおいて、各成功裏のPCR反応工程の後に、分光学的なリアルタイム検出が行われる(時点3、4および5)。ここで、1本鎖ポリヌクレオチド配列の好ましい励起状態は、変性(時点3)のPCR反応工程の後に測定され、ここにおいて、2本鎖ポリヌクレオチド配列の励起状態は、伸長のPCR反応工程の後(時点5)で適切な方法で測定される。この態様に従う方法により、分光学的なリアルタイム検出はPCR増幅プロセスの全体の進行の間に行われ、PCR増幅プロセスにおいて生じるポリヌクレオチド配列の時間的経過もまた定量的な様式で特徴付けられる。更にまた、PCR増幅プロセスが完了した後でも分光学的なリアルタイム検出測定を実施することが当然ながら可能である。
【0045】
本発明に従う本方法の1つの側面に従うと、仮に変性のPCR反応工程が、テラヘルツレジームでの電磁放射を経て引き起こされる場合、次いで、本方法は、変性の完了した時点で対応する電磁放射を行うであろう。
【0046】
図2は、PCR溶液におけるエクスティンクション経過(Extinction course)の模式図を示し、これは、ギガヘルツまたはテラヘルツレジームでの電磁放射を用いる本発明の1つの態様に従い測定できる。ここで、照射される電磁放射の周波数は、これが個々のポリヌクレオチド配列の予め決定された励起状態の周波数と一致するように選択され、且つPCR溶液への対応する照射の後にこれらによりエクスティンクションされる。通常はPCR増幅において複製されるべきポリマーの数は時間と共に指数関数的に増大するために、エクスティンクションの分光学的なリアルタイム検出の測定点は指数関数的な経過との曲線上にのる。この場合におけるPCR溶液のエクスティンクションの個々の検出を十字により図示する。ここで、経時変化は、PCR増幅効率および速度に影響する物理的並びに化学的パラメータに従って決定される。次いで、特定のポリヌクレオチド配列の量が、計算法によりエクスティンクション測定から決定される。
【0047】
PCR増幅プロセスの間のポリヌクレオチド配列の分光学的なリアルタイム検出の実際の実行において、ある者は、単に予め決定された検出閾値D1よりも上にあるそれらの検出が明白な検出結果であり、それらがまた更なる評価のために使用できることを見出す。シグナル対ノイズ比は明白なエクスティンクション判定を可能にするものではないので、この検出閾値D1以下の検出値は、単に、理論的な性質のものである。その結果として、明白な分光学的なリアルタイム検出のための最早時点T1は測定されたエクスティンクションが検出閾値D1よりも上にあるときに生じる。照射される電磁放射の対応する周波数選択のために、検出閾値D2は可能な限り低く、他の周波数の電磁放射のための検出閾値D1よりも下にすることも実現できる。その結果として、従来のリアルタイム定量的なPCR法よりも少ないPCR反応工程で実行される。更に、最早時点T2も可能な限り小さく、特に他の周波数の電磁放射のためのT1よりも短い。
【0048】
図3は、本発明に従うPCR増幅プロセスにおけるポリヌクレオチド配列の分光学的なリアルタイム検出のためのPCRアレンジメントの態様の模式的な描写の部分図を示す。この態様に従うと、照射線源20は、PCR溶液11においてギガヘルツまたはテラヘルツレジームの電磁放射を発する。PCR溶液11は、その形態により限定される支持体24の吸着領域に配置され、PCR溶液の層厚さSを介して電磁放射21が照射される。この場合、そのような吸着領域23は、容器のように、少なくとも部分的に限られた容量により形成される。ここで、放射線の周波数は、それがPCR溶液11内に位置する予め決定されたポリヌクレオチド配列10の励起状態の周波数に一致するように設定される。吸着領域23の横断面を介して照射された電磁放射21の伝達の後に、電磁放射21の対応する減弱された強度が検出器22により検出される。
【0049】
この場合において、光学的構成において典型的な付加的な光学的構成要素、例えば、焦点調節要素、視準要素、ビームガイド要素およびフィルターなどは詳細な記載を省く。そのようなビームを調節するための従来の光学的要素の更なる設備は、それ自身等業者には明白に示される。
【0050】
図4は、PCR増幅プロセスにおけるポリヌクレオチド配列の分光学的なリアルタイム検出のためのPCRアレンジメントの態様のもう1つの部分図を示す。図3に従う第1の態様の吸着領域23に対して、図4に従う第2の態様は、2重壁の吸着領域23を提供するものではなく、その代わりに、1重壁領域のみにおいてPCR溶液11が吸着される。ここで、例えば、支持体の吸着領域23においてPCR溶液の薄膜付着が含まれてもよい。更に、PCR溶液11の配置が、地球の重力場において支持体24の吸着領域23上に方向付けられてもよく、それにより分光学的なリアルタイム検出の間、一定な層厚さSが保証できる。加えて、支持体24の吸着領域23は、更にPCR溶液11と支持体24の吸着領域23との間の付着を増大する構造上の設備を含んでもよい。そのような設備は、例えば、支持体24条でのPCR溶液11の付着を補助する精密表面構造である。
【0051】
図5は、本発明に従うPCR増幅におけるポリヌクレオチド配列の分光学的なリアルタイム検出のためのPCRアレンジメントの第4の態様の部分図を示す。ここで、照射線源20から発せられた電磁放射21の方向と検出器22により検出される放射線の方向は、互いに対する延長上には配置されない。その代わりに、電磁放射21はPCR溶液11および/または吸着領域23の支持体により湾曲され、それにより、直線のビームパスが実現する。そのようなビームパスは、例えば、散乱測定のために有利である。照射線源20および検出器22のそのような相対的な配置もまた、種々の構成要素の空間的配置を改善するために寄与し、それはこの態様に従うPCRアレンジメントの外形寸法の縮小に寄与する。
【0052】
図3〜図5に従う図における電磁放射21の開放されたビームパスの態様に比べて、図6に従う対応の部分図においては、電磁放射21は、放射線の周波数レンジに適したウェーブガイドW内に導かれている。ここで、電磁放射21は、放射源20で直接的にウェーブガイドW内に結合されてもよく、しかしながら適切な調節のみがなされた後に結合されてもよい。従って、ウェーブガイドWは、検出器22に直接的に連結されてもよく、または最初に放射線が、検出器22による検出のために調節されてもよい。ウェーブガイドWは、エバネッセント照射野としての吸着領域23に電磁放射21を放出するために構成され、その結果として、外面のウェーブガイドW上に付着したPCR溶液との相互作用のために電磁放射21のエクスティンクションが生じてもよい。ウェーブガイドWの態様は、絶縁されたウェーブガイド構造を含んでもよく、しかしながら、ウェーブガイド部分もまた更なる吸着装置に一体化されてもよい。1つの好ましい態様において、ウェーブガイドWは、チップ構造物に一体化される。
【0053】
図7は、PCR増幅プロセスにおけるポリヌクレオチド配列の分光学的なリアルタイム検出のための図5における第4の態様の部分図に基づくPCRアレンジメントの態様を示し、もう1つの態様として、吸着領域23の支持体24と相互作用する温度変更手段25を提示する。温度変更手段25は、PCR溶液11の吸着のための吸着領域23の反対側の側面の支持体24を加熱および/または冷却するために構成される。対応する熱伝導を介して加熱支持体24の温度が変化することにより、PCR溶液11の温度変更が実現される。仮に、付着されたPCR溶液11の熱容量と比較して、支持体24の温度抵抗が低い場合、およびまた温度変更手段25の加熱および/または冷却性能が大きい場合、PCR溶液11の比較的迅速な温度変更が実現され、且つ繰り返されるPCR反応工程の迅速な進行が保証される。熱伝導を改善するために、温度変更手段25と支持体24との間に、熱伝導を補助する手段が存在してもよい。本発明に従うPCRアレンジメントの1つの態様において、温度変更手段25は空気循環を加熱および/または冷却してもよく、それが直接に支持体24に誘導され、それによって支持体24を介する対応する熱伝導の後にPCR溶液11の温度を変更してもよい。
【0054】
図8は、PCR溶液11の調製のために必要とされる緩衝液13のエクスティンクション反応13'と、ギガヘルツまたはテラヘルツレジームの周波数レンジにおいて検出されるべきポリヌクレオチド配列の予め決定された励起状態のエクスティンクション反応10'を示す。その回折反応のために、緩衝液13のエクスティンクションは、検出可能な様式における予め決定された周波数レンジを越えて変化する。多くの典型的な実験用緩衝液13は、そのようなエクスティンクション反応を示す。ポリヌクレオチド配列10の励起状態の最低限可能なノイズ検出のために、ポリヌクレオチド配列10の指定された励起状態の周波数レンジにおいて、そのエクスティンクション反応が最小値を有する緩衝液13を選択することが必要である。従って、緩衝液13を経てPCR溶液11に照射された電磁放射21のエクスティンクションは、PCR溶液11中のポリヌクレオチド配列10を介したエクスティンクション検出と比較して低く、ポリヌクレオチド配列10の励起状態のエクスティンクション検出は、緩衝液13を介する混乱(崩壊)の殆どないことによってのみ実現される。
【0055】
検出されるべきポリヌクレオチド配列10およびその励起周波数に対する対応する緩衝液13の選択または設定により、有利なシグナル対ノイズ比が達成される。
【0056】
現在のところ、上記に記載された部分の全ては、単独および何れかの組み合わせにおいて、特に図面において説明された詳細に見られる本発明に必要であるとして、権利請求されていることに留意されるべきである。これらの一部分の変更も、当業者には、理解される。
【符号の説明】
【0057】
10 ポリヌクレオチド配列
10’ エクスティンクション(吸光度、Extinction) of the 励起状態(excited state) of a ポリヌクレオチド配列
11 PCR溶液
12 初期物質
13 緩衝液
13’ エクスティンクション(吸光度、Extinction) of the 緩衝液
14 標識(Marker)
20 照射線源
21 電磁放射
22 検出器
23 吸着領域
24 支持体
25 温度変更手段
26 熱媒体
S 層厚さ
W ウェーブガイド(waveguide)
D1 検出閾値
D2 検出閾値
T 最早検出時点
【特許請求の範囲】
【請求項1】
PCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、ここにおいて、当該PCR増幅プロセスは、緩衝液(13)中のPCR溶液(11)を作製するために必要な初期物質(12)を準備することと、並びに、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すこととを含み、ここにおいて、前記PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームにおける照射線源(20)からの電磁放射(21)が定められた時点で当該PCR溶液(11)に照射され、それにより、検出器(22)によりリアルタイム検出で、ポリヌクレオチド配列(10)の少なくとも存在または不在が検出される方法。
【請求項2】
請求項1に記載の方法であって、当該核酸分子がポリヌクレオチド配列を含むことを特徴とする方法。
【請求項3】
請求項1または2に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、緩衝液(13)中でのPCR溶液(11)の作製のために必要な当該初期物質(12)が、化学的または物理的標識、特に蛍光標識を含まないことを特徴とする方法。
【請求項4】
請求項1〜3の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該PCR溶液(11)の予め決定された層厚さ(S)を貫通するように、当該照射される電磁放射(21)の強度が、ギガヘルツまたはテラヘルツレジームに選択されることを特徴とする方法。
【請求項5】
請求項1〜4の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該ギガヘルツまたはテラヘルツレジームで照射される電磁放射(21)の周波数が、100GHzと20THzとの間、特に300GHzと10THzとの間にあることを特徴とする方法。
【請求項6】
請求項1〜5の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該照射強度が当該PCR溶液の予め決定された層厚さを経て伝達された後に、本質的にエクスティンクションされずに当該検出器(22)で検出されるように、当該PCR溶液(11)の当該緩衝液(13)が、当該照射された電磁放射(21)の周波数に関してギガヘルツまたはテラヘルツレジームで選択されることを特徴とする方法。
【請求項7】
請求項1〜6の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該PCR溶液(11)が、当該ギガヘルツまたはテラヘルツレジームで照射される当該電磁放射(21)が本質的に透過する支持体(24)、特に、当該支持体(24)の予め決定された吸着領域(23)に置かれることを特徴とする方法。
【請求項8】
請求項7に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該支持体(24)が、当該ギガヘルツまたはテラヘルツレジームでの電磁放射のための少なくとも1つのウェーブガイド(W)を含むことを特徴とする方法。
【請求項9】
請求項1〜8の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、付加的な温度変更手段(24)が備えられ、それにより、当該PCR溶液(11)が予め決定された温度に加熱および/または冷却されることを特徴とする方法。
【請求項10】
請求項9に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該温度変更手段(24)が、熱媒体(26)を加熱および/または冷却し、当該熱媒体(26)は当該支持体を介して直接または間接的に当該PCR溶液を加熱および/または冷却することを特徴とする方法。
【請求項11】
請求項1〜10の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、ギガヘルツまたはテラヘルツレジームでの電磁放射(21)が、変性および/またはプライマーハイブリダイゼーションおよび/または伸長の前および/または後に当該照射線源(20)から当該PCR溶液(11)に照射されることを特徴とする方法。
【請求項12】
請求項1〜11の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、1本鎖および/または2本鎖ポリヌクレオチド配列(10)の定められた振動励起モードを励起し、これらのモード、特に、2本鎖ポリヌクレオチド配列(10)のハイブリダイゼーション状態の存在に特徴的なモードを検出するために、電磁放射の周波数が選択されることを特徴とする方法。
【請求項13】
請求項1〜12の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームでの電磁放射(21)による前検出が、続く検出のために、当該検出の分析におけるバックグラウンドとして考慮されることを特徴とする方法。
【請求項14】
請求項1〜13の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、分光学的な検出により、個々の初期物質(12)の化学的または物理的特性、特に、それらの質、特異性およびそれらの結合性挙動を決定するために、PCR増幅プロセスの実行の前に、ギガヘルツまたはテラヘルツレジームでの電磁放射(21)が、照射線源(20)からPCR増幅プロセスにおいて使用されるべき初期物質(12)の溶液に照射されることを特徴とする方法。
【請求項15】
PCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するためのPCRアレンジメントであって、
ここにおいて、これが、
− 必要な初期物質(12)と緩衝液とを含むPCR溶液(11)のための吸着領域(23)を伴う支持体(24)、
− 変性、プライマーハイブリダイゼーションまたは伸長のための特定の温度に当該PCR溶液(11)を加熱および/または冷却する温度変更手段(24)、
− 当該PCR溶液(11)にギガヘルツまたはテラヘルツレジームで電磁放射(13)を照射するための照射線源(20)、および
− 分光学的な方法で、当該PCR溶液(11)を経て伝達された放射線を検出するための検出器(22)、
を含むアレンジメント。
【請求項16】
PCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、
ここにおいて、当該PCR増幅プロセスは、緩衝液(13)中のPCR溶液(11)の作製並びに変性、プライマーハイブリダイゼーションおよび伸長の繰り返されるPCR反応工程に必要な初期物質(12)を調製することを含み、および
ここにおいて、当該PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームでの電磁放射(21)が、定められた時点で放射源(20)から当該PCR溶液(11)に照射されて、検出器(22)による分光学的なリアルタイム検出プロセスにおいてポリヌクレオチド配列(10)の少なくとも存在または不在が検出され、および
ここにおいて、変性の反応工程が照射線源(20)からのテラヘルツ照射により生じる方法。
【請求項17】
請求項16に記載の方法であって、当該核酸分子がポリヌクレオチド配列を含む方法。
【請求項1】
PCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、ここにおいて、当該PCR増幅プロセスは、緩衝液(13)中のPCR溶液(11)を作製するために必要な初期物質(12)を準備することと、並びに、変性、プライマーハイブリダイゼーションおよび伸長のPCR反応工程を繰り返すこととを含み、ここにおいて、前記PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームにおける照射線源(20)からの電磁放射(21)が定められた時点で当該PCR溶液(11)に照射され、それにより、検出器(22)によりリアルタイム検出で、ポリヌクレオチド配列(10)の少なくとも存在または不在が検出される方法。
【請求項2】
請求項1に記載の方法であって、当該核酸分子がポリヌクレオチド配列を含むことを特徴とする方法。
【請求項3】
請求項1または2に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、緩衝液(13)中でのPCR溶液(11)の作製のために必要な当該初期物質(12)が、化学的または物理的標識、特に蛍光標識を含まないことを特徴とする方法。
【請求項4】
請求項1〜3の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該PCR溶液(11)の予め決定された層厚さ(S)を貫通するように、当該照射される電磁放射(21)の強度が、ギガヘルツまたはテラヘルツレジームに選択されることを特徴とする方法。
【請求項5】
請求項1〜4の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該ギガヘルツまたはテラヘルツレジームで照射される電磁放射(21)の周波数が、100GHzと20THzとの間、特に300GHzと10THzとの間にあることを特徴とする方法。
【請求項6】
請求項1〜5の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該照射強度が当該PCR溶液の予め決定された層厚さを経て伝達された後に、本質的にエクスティンクションされずに当該検出器(22)で検出されるように、当該PCR溶液(11)の当該緩衝液(13)が、当該照射された電磁放射(21)の周波数に関してギガヘルツまたはテラヘルツレジームで選択されることを特徴とする方法。
【請求項7】
請求項1〜6の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該PCR溶液(11)が、当該ギガヘルツまたはテラヘルツレジームで照射される当該電磁放射(21)が本質的に透過する支持体(24)、特に、当該支持体(24)の予め決定された吸着領域(23)に置かれることを特徴とする方法。
【請求項8】
請求項7に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該支持体(24)が、当該ギガヘルツまたはテラヘルツレジームでの電磁放射のための少なくとも1つのウェーブガイド(W)を含むことを特徴とする方法。
【請求項9】
請求項1〜8の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、付加的な温度変更手段(24)が備えられ、それにより、当該PCR溶液(11)が予め決定された温度に加熱および/または冷却されることを特徴とする方法。
【請求項10】
請求項9に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該温度変更手段(24)が、熱媒体(26)を加熱および/または冷却し、当該熱媒体(26)は当該支持体を介して直接または間接的に当該PCR溶液を加熱および/または冷却することを特徴とする方法。
【請求項11】
請求項1〜10の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、ギガヘルツまたはテラヘルツレジームでの電磁放射(21)が、変性および/またはプライマーハイブリダイゼーションおよび/または伸長の前および/または後に当該照射線源(20)から当該PCR溶液(11)に照射されることを特徴とする方法。
【請求項12】
請求項1〜11の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、1本鎖および/または2本鎖ポリヌクレオチド配列(10)の定められた振動励起モードを励起し、これらのモード、特に、2本鎖ポリヌクレオチド配列(10)のハイブリダイゼーション状態の存在に特徴的なモードを検出するために、電磁放射の周波数が選択されることを特徴とする方法。
【請求項13】
請求項1〜12の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、当該PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームでの電磁放射(21)による前検出が、続く検出のために、当該検出の分析におけるバックグラウンドとして考慮されることを特徴とする方法。
【請求項14】
請求項1〜13の何れか1項に記載のPCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、分光学的な検出により、個々の初期物質(12)の化学的または物理的特性、特に、それらの質、特異性およびそれらの結合性挙動を決定するために、PCR増幅プロセスの実行の前に、ギガヘルツまたはテラヘルツレジームでの電磁放射(21)が、照射線源(20)からPCR増幅プロセスにおいて使用されるべき初期物質(12)の溶液に照射されることを特徴とする方法。
【請求項15】
PCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するためのPCRアレンジメントであって、
ここにおいて、これが、
− 必要な初期物質(12)と緩衝液とを含むPCR溶液(11)のための吸着領域(23)を伴う支持体(24)、
− 変性、プライマーハイブリダイゼーションまたは伸長のための特定の温度に当該PCR溶液(11)を加熱および/または冷却する温度変更手段(24)、
− 当該PCR溶液(11)にギガヘルツまたはテラヘルツレジームで電磁放射(13)を照射するための照射線源(20)、および
− 分光学的な方法で、当該PCR溶液(11)を経て伝達された放射線を検出するための検出器(22)、
を含むアレンジメント。
【請求項16】
PCR増幅プロセスにおいて核酸分子を光学的にリアルタイム検出するための方法であって、
ここにおいて、当該PCR増幅プロセスは、緩衝液(13)中のPCR溶液(11)の作製並びに変性、プライマーハイブリダイゼーションおよび伸長の繰り返されるPCR反応工程に必要な初期物質(12)を調製することを含み、および
ここにおいて、当該PCR増幅プロセスの間に、ギガヘルツまたはテラヘルツレジームでの電磁放射(21)が、定められた時点で放射源(20)から当該PCR溶液(11)に照射されて、検出器(22)による分光学的なリアルタイム検出プロセスにおいてポリヌクレオチド配列(10)の少なくとも存在または不在が検出され、および
ここにおいて、変性の反応工程が照射線源(20)からのテラヘルツ照射により生じる方法。
【請求項17】
請求項16に記載の方法であって、当該核酸分子がポリヌクレオチド配列を含む方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2012−510626(P2012−510626A)
【公表日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願番号】特願2011−538983(P2011−538983)
【出願日】平成21年11月30日(2009.11.30)
【国際出願番号】PCT/EP2009/066081
【国際公開番号】WO2010/063683
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(510109165)ドリッテ・パテントポートフォリオ・ベタイリグンスゲゼルシャフト・エムベーハー・ウント・コンパニー・カーゲー (8)
【氏名又は名称原語表記】Dritte Patentportfolio Beteiligungsgesellschaft mbH & Co. KG
【住所又は居所原語表記】Berliner Str. 1, 12529 Schoenefeld/Waltersdorf, Germany
【Fターム(参考)】
【公表日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願日】平成21年11月30日(2009.11.30)
【国際出願番号】PCT/EP2009/066081
【国際公開番号】WO2010/063683
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(510109165)ドリッテ・パテントポートフォリオ・ベタイリグンスゲゼルシャフト・エムベーハー・ウント・コンパニー・カーゲー (8)
【氏名又は名称原語表記】Dritte Patentportfolio Beteiligungsgesellschaft mbH & Co. KG
【住所又は居所原語表記】Berliner Str. 1, 12529 Schoenefeld/Waltersdorf, Germany
【Fターム(参考)】
[ Back to top ]

