クラミジア・トラコマチス(Chlamydiatrachomatis)抗原のワクチンおよび診断への使用
【課題】クラミジア種の細菌が原因である感染の予防、治療または診断に用いる薬学的組成物の提供。
【解決手段】特定の配列、または長さが少なくとも7個のアミノ酸残基である特定の配列によりコードされるポリペプチドの免疫原性部分、または特定の配列に対して少なくとも80%の配列同一性を有するアミノ酸配列によりコードされる免疫原性ポリペプチドから選択されるアミノ酸配列を含み、クラミジア種に由来する融合パートナーに融合しているポリペプチドの使用。
【解決手段】特定の配列、または長さが少なくとも7個のアミノ酸残基である特定の配列によりコードされるポリペプチドの免疫原性部分、または特定の配列に対して少なくとも80%の配列同一性を有するアミノ酸配列によりコードされる免疫原性ポリペプチドから選択されるアミノ酸配列を含み、クラミジア種に由来する融合パートナーに融合しているポリペプチドの使用。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、クラミジア・トラコマチスに由来するポリペプチドおよび核酸に基づいた免疫原性ポリペプチドならびに免疫原性組成物のワクチンおよび診断薬としての使用を開示するものである。
【背景技術】
【0002】
(一般的背景)
クラミジア種は、動物およびヒトの両方において、広範な疾患の原因となる。特に重要なのは、偏性細胞内細菌であるクラミジア・トラコマチスであり、これは、上皮細胞に感染し、そこで増殖する。クラミジア・トラコマチスは、先進諸国においては、性感染症(STD)の最も頻繁な原因であり、発展途上国においては、眼疾患の最も共通の原因である(Schachter、Moncadaら、1988)。世界全体で、9200万人がクラミジア感染を保有していると推定されている(WHO、1999)。
【0003】
クラミジア性感染症は、治療をしないと長引き、完全な排除までには、治療開始後12カ月以上を要することが多い。感染中に誘発された防御免疫は、血清変異株に特異的であって持続しないと考えられており、したがって、頻繁に再感染を起こし得る(Katz、Batteigerら、1987)。これらの状況、すなわち感染が長引くこと、および再感染の可能性があることのために、骨盤の炎症性疾患、不妊症および子宮外妊娠を含む重症の続発症を発症する恐れがある(Branham、1999)。
【0004】
クラミジア感染は、抗生物質療法によって効果的に制御することができる。しかし、無症状の症例が多いことから、クラミジアの持続的な制御は、有効なクラミジアワクチンの開発によって、ようやく達成が可能となるであろう。過去数十年にわたり、クラミジア感染に対するワクチンに対して多くの努力がなされてきたが、これまでのところ、ワクチンの開発には至っていない。
【0005】
このような状況下、クラミジアに対するワクチンの開発は、緊急課題である。クラミジアに対する防御物質を定義する多くの試みがなされている。しかし、特異的な長期にわたる防御免疫応答は、いまだに達成されていない。過去数十年にわたり、クラミジア感染に対するワクチンを開発する多くの努力がなされてきたが、これまでのところ、ワクチンの開発には至っていない。初期の努力の一部は、トラコーマの制御を重点的に取り扱い、生存している生物体の全体または不活性化した生物体の全体を抗原として使用して、ヒトおよびサルを免疫した(Wang、Graystonら、1967;GraystonおよびWang、1978)。不活性化した全細胞ワクチンを用いて、小児に予防接種をしたところ、はじめは防御が得られたが、この防御は、血清型に特異的で、持続しなかった(GraystonおよびWang、1978)。さらに、部分的に防御された個人が再感染すると、予防接種されていない対照で起きた疾患よりも症状の重い臨床疾患に至った(GraystonおよびWang、1978)。不活性化した生物体の全体を用いた初期の試みが、過敏症反応と思われるいくつかの症例に至った事実から、サブユニットワクチンの開発が試みられるようになった。
【0006】
クラミジア・トラコマチスは、クラミジアワクチンの生産に関係する可能性があるいくつかのタンパク質を、保持および分泌する。長年の間、候補分子の探索では、感染体である基本小体(EB:Elementary Body)の表面に結合するタンパク質が重点的に取り扱われてきた。多くのそのようなタンパク質が特徴付けられたにも関わらず、これらの数個のみが、動物モデルにおいてサブユニットワクチンとして部分的な防御の誘発を示したにすぎない。はじめて記載された免疫原性分子は、主要外膜タンパク質(MOMP:major outer membrane protein)であり、したがって、この分子は、候補ワクチンとして、非常に詳細に研究されてきている。しかし、クラミジア・トラコマチスまたは組換え調製物から抽出したMOMPで種々の動物を免疫する多くの試みがなされたが、一貫した結果は得られなかった(Su、Parnellら、1995;Pal、Barnhartら、1999;Zhang、Yangら、1999;Pal、Theodorら、2001;Shaw、Grundら、2002)。MOMPのワクチンとしての効果が比較的低い理由は、不明であるが、不適切なアジュバントもしくは送達系、またはタンパク質の未変性構造を模倣していないMOMP免疫原の使用が原因である可能性がある(Pal、Theodorら、2001)。
【0007】
より最近になって、その他の免疫原性分子がいくつか、同定されている(Hassell、Reynoldsら、1993;KuboおよびStephens、2000;LaVerda、Albaneseら、2000;Fling、Sutherlandら、2001;Goodall,Yeoら、2001;Starnbach、Loomisら、2003)。
【0008】
クラミジア・トラコマチスに対する免疫は、いつくかの基本的な特徴によって特徴付けられる。すなわち、特異的に感作したTリンパ球が防御を仲介し(SuおよびCaldwell、1995;Morrison、Suetら、2000;MorrisonおよびCaldwell、2002)、最も重要なメディエーター分子は、インターフェロンγ(IFNγ)であるようである(MorrisonおよびCaldwell、2002)。さらに、IgG、IgMおよびIgAのアイソタイプの抗体も、ある役割を果たしている可能性がある(Cotter、Mengら、1995)。1995年には、Tripplesら(TipplesおよびMcClarty、1995)は、CTPシンテターゼの遺伝子を単離し、Guら(Gu、Wenmanら、1995)は、RNAポリメラーゼのαサブユニットの遺伝子の周辺の領域をクローン化した。この領域には、タンパク質であるSecY、S13、S11およびL17の遺伝子もまた含有されており、これらは、大腸菌(Escherichia coli)および枯草菌(Bacillus subtilis)のタンパク質と等価である。1997年には、伸長因子Tsの遺伝子が単離された(Zhang、Taoら、1997)。
【0009】
1998年には、Stevensらが、クラミジア・トラコマチスの完全なゲノム配列を報告し、約875個のオープンリーディングフレームの存在を予想した。とりわけ、CT442、CT460、CT509、CT579、CT587、CT713、CT812またはCT681(MOMP)を構成するヌクレオチド配列が記載されており、上記配列に対する仮想タンパク質の配列も提案されている。いかに重要であろうとも、この配列情報を使用して、DNAがin vivoで転写されてタンパク質に翻訳されているか否かを予想することはできない。
【0010】
さらに重要なのは、配列情報に基づいて、所与の配列が、免疫原性タンパク質をコードするものであるのか、それとも不活性なタンパク質をコードするものであるのかを予想することは不可能である。WO99/28475には、クラミジア・トラコマチスの完全なゲノム配列が記載されているが、何らかの免疫原性効果を裏付ける証拠はない。同様に、WO99/27105には、クラミジア・ニューモニエ(C. pneumoniae)の完全なゲノム配列が記載されている。
【0011】
クラミジア・トラコマチスによる感染中または感染後に、タンパク質が免疫系によって認識されるか否かを決定するには、所与のタンパク質を調製し、本明細書に記載されている適切なアッセイで試験し、可能であれば、免疫原性効果を有する断片またはエピトープを決定する方法しかない。
【発明の概要】
【発明が解決しようとする課題】
【0012】
(発明の概要)
本発明は、クラミジア種(クラミジア・トラコマチス亜種(C. trachomatis ssp)およびクラミジア・ニューモニエ(C. pneumonia))が原因である感染の、クラミジア・トラコマチス抗原またはその免疫原性部分もしくは他の変異体を含むポリペプチドの使用による、あるいはクラミジア・トラコマチス抗原またはその免疫原性部分もしくは他の変異体をコードするDNA配列の使用による予防、治療および検出に関する。
【課題を解決するための手段】
【0013】
(発明の詳細な説明)
本発明は、クラミジア種の細菌が原因である感染の予防、治療または診断用の薬学的組成物の調製に用いる、クラミジア抗原(ポリペプチドまたは核酸)ct043、ct511、ct521、ct616、ct803、ct067、ct679、ct583、ct603、ct026、ct093、ct357、ct659、ct111、ct509、ct587、ct023、ct025、ct078、ct082、ct118、ct174、ct003、ct005、ct027、ct032、ct008、ct016、ct028、ct035、ct141、ct643、ct414、ct874、ct456、ct681、ct123、ct125、ct126、ct133、ct150、ct175、ct376、ct083、ct089、ct155、ct168、ct175、ct184、ct124、ct082、ct336、ct342、ct842、ct323、ct080、ct084、ct110、ct119、ct541、ct443、ct795、ct396、ct283、ct051、ct002、ct009、ct015、ct030、ct048、ct061、ct063、ct068、ct071、ct051、ct080、ct115、ct119、ct678、ct561、ct538、ct582、ct875、ct322、ct112、ct315、ct610、、ct147、ct228、ct232、ct614、ct098、ct265、ct375、ct004、ct038、ct040、ct052、ct053、ct201、ct245、ct246、ct405、ct420、ct426、ct507、ct512、ct513、ct514、ct516、ct316、ct439、ct492、ct520、ct523、ct526、ct611、ct613、ct626、ct630、ct647、ct649、ct725、ct734、ct779、ct801、ct833、ct835、ct836、ct845、またはそれらの断片(免疫原性部分、例えば、T細胞またはB細胞エピトープ)もしくは相同体の使用を開示する。
【0014】
また、本発明は、クラミジア種の細菌が原因である感染の予防、治療または診断用の薬学的組成物の調製に用いる、特定のペプチド断片、例えば、CT541−PF1(アミノ酸位置111−243)、CT443−PF1(アミノ酸位置214−291)、CT795−PF1(アミノ酸位置1−163)、CT396−PF1(アミノ酸位置170−318)、CT842−PF1(アミノ酸位置433−515)、CT283−PF1(アミノ酸位置477−577)、CT874−PF1(アミノ酸位置330−426)、CT051−PF1(アミノ酸位置38−177)、CT141−PF1(アミノ酸位置17−126)、CT643−PF1(アミノ酸位置769−841)、CT681−PF1(アミノ酸位置156−391)、CT681−PF2(アミノ酸位置199−329)、CT681−PF3(アミノ酸位置294−349)、CT414−PF1(アミノ酸位置605−722)、CT414−PF2(アミノ酸位置463−530)、CT456−PF1(アミノ酸位置695−840)、CT456−PF2(アミノ酸位置137−229)、CT456−PF3(アミノ酸位置243−321)、CT456−PF4(アミノ酸位置209−291)、CT456−PF5(アミノ酸位置175−279)、CT456−PF6(アミノ酸位置567−730)、CT456−PF7(アミノ酸位置210−540)、CT456−PF8(アミノ酸位置190−279)、CT521−PF1(アミノ酸位置14−36)、CT521−PF2(アミノ酸位置40−62)、CT521−PF3(アミノ酸位置52−75)、CT521−PF4(アミノ酸位置66−88)、CT521−PF5(アミノ酸位置116−138)、CT504−PF1またはこれらペプチド断片をコードする核酸の使用も開示する。
【0015】
また、本発明は、ワクチンまたは診断薬の形態をとる薬学的組成物も開示する。
【0016】
薬学的組成物を調製するために使用するポリペプチドは、脂質が付加されて自己アジュバント作用を可能にするか、または融合パートナーに融合させることができる。ここでの融合パートナーは、クラミジア・トラコマチスに由来する別のポリペプチドであることができる。それらには、CT812、CT579、CT587、Cap、CT713、CT442またはMOMPあるいは上記のいずれかのT細胞またはB細胞のエピトープの少なくとも1種に由来するポリペプチド断片の1つまたは複数が含まれるが、それらに限定されない。また、本発明は、本発明のポリペプチド(またはそれらの免疫原性部分)の2つ以上の相互融合体を含む融合ポリペプチドにも関する。
【0017】
本発明によって開示されているワクチンを、クラミジア種、例えば、クラミジア・トラコマチスによる感染を予防または治療するために使用することできる。
【0018】
本発明によって開示されている診断薬(上記の抗原またはそれに対する抗体)を、クラミジア種、例えば、クラミジア・トラコマチスによる感染を診断するために使用することできる。
【0019】
開示されている診断方法は、細胞性免疫、血清学、または単純な皮膚試験に基づく。クラミジア種の細菌による過去または現在進行中の感染の細胞性免疫による診断は、検体、例えば、単核細胞(例えば、Tリンパ球)を含む血液検体を、陽性反応、例えば、細胞増殖またはIFNγ等のサイトカインの放出を検出するために、診断試薬と接触させるステップを含む。クラミジア種の細菌による過去または現在進行中の感染の血清学による診断方法は、感染がある場合には陽性反応を検出するために、検体、例えば、血液検体をその抗原に対する抗体と接触させるステップ、または抗原を対象の体液と接触させるステップを含み、抗体の当該ポリペプチドへの結合を検出する場合には、当該結合は、対象がクラミジア種の細菌に感染していることを示す。皮膚試験は、診断薬を、皮内注射するか、または皮膚に(例えば、パッチによって)施用するステップを含み、注射または施用の部位の陽性皮膚応答が、クラミジア種の細菌による感染を示す。
【0020】
また、本発明は、クラミジア種の細菌による感染に対して免疫する方法も開示する。この方法は、上記の本発明のワクチンを、哺乳類に投与するステップを含む。
【0021】
(定義)
ポリペプチド
本発明における「ポリペプチド」という用語は、通常の意味を有するものとする。すなわち、アミノ酸残基がペプチド共有結合によって連結している、完全長タンパク質、オリゴペプチド、短いペプチドおよびそれらの断片を含む、アミノ酸の鎖であり、いかなる長さであってもよい。
【0022】
ポリペプチドを、グリコシル化によって、脂質付加(例えば、Mowatら、1991によって記載されているようにパルミトイルオキシスクシンイミド、またはLustigら、1976によって記載されているように塩化ドデカノイルを用いた化学的な脂質付加)によって、補欠分子族を含むことによって、または例えば、ヒスチジンタグまたはシグナルペプチド等の追加のアミノ酸を含有させることによって、化学的に修飾することができる。
【0023】
したがって、各ポリペプチドを、特定のアミノ酸によって特徴付け、特定の核酸配列によってコードされることができる。そのような配列には、組換え法または合成法によって生成される類似体および変異体が含まれ、そのようなポリペプチド配列は、組換えポリペプチドのアミノ酸残基の1個または複数が置換、挿入、付加または欠失によって改変されているにも関わらず、本明細書に記載されている生物学的アッセイのいずれかにおいて、免疫原性を示すことが理解されよう。置換は、「保存的」であることが好ましい。これらは、以下の表によって定義される。第2列の同じ四角内、好ましくは第3列の同じ行内にあるアミノ酸を相互に置換することができる。第3列では、アミノ酸を1文字コードで示している。
【表1】

【0024】
本発明内の好ましいポリペプチドは、クラミジア・トラコマチスの免疫原性抗原である。そのような抗原は、例えば、クラミジア・トラコマチスの細胞および/またはクラミジア・トラコマチスの培地の濾液から得ることができる。したがって、上記の抗原のうちの1つの免疫原性部分を含むポリペプチドは、そのような免疫原性部分のみから構成されていてもよいし、または追加の配列を含有していてもよい。追加の配列は、天然のクラミジア・トラコマチスの抗原から得てもよいし、または異種であってもよく、そのような配列は、免疫原性であってもよいが、そうである必要はない。
【0025】
各ポリペプチドは、特定の核酸配列によってコードされる。そのような配列には、それらの類似体および変異体が含まれ、そのような核酸配列は、1個または複数の核酸が置換、挿入、付加または欠失によって改変されていることが理解されよう。置換は、アミノ酸配列に何らかの変化が起きることはないコドンの使用のサイレント置換が好ましいが、置換を導入してタンパク質の発現を促進してもよい。
【0026】
本明細書の文脈では、「実質的に純粋なポリペプチド断片」という用語は、純粋なポリペプチド断片が未変性状態で結合しているその他のポリペプチド材料を最大で5重量%含有するポリペプチド調製物を意味する(その他のポリペプチド材料の比率は、より低い方が好ましく、例えば、最大で4%、最大で3%、最大で2%、および最大で1/2%である)。実質的に純粋なポリペプチド断片が、少なくとも96%純粋であること、すなわち、調製物中、実質的に純粋なポリペプチド断片が、ポリペプチド材料の全量に対して、少なくとも96重量%を占めることが好ましい。実質的に純粋なポリペプチド断片の占める比率は、より高い方が好ましく、例えば、少なくとも97%、少なくとも98%、少なくとも99%、少なくとも99.25%、少なくとも99.5%、および少なくとも99.75%である。ポリペプチド断片が、「実質的に純粋な形態」であること、すなわち、純粋なポリペプチド断片が未変性状態で結合するその他の抗原のいずれもが基本的に存在しないこと、つまり、クラミジア種に属する細菌からのその他の抗原のいずれもが存在しないことが特に好ましい。これは、以下に詳細に説明するような非クラミジア系宿主細胞中での組換え法によって、あるいはよく知られている固相または液相ペプチド合成法、例えば、Merrifieldによって記載されている方法もしくはその変法によりポリペプチド断片を合成することによって、ポリペプチド断片を調製することにより、達成することができる。
【0027】
「クラミジア種」という用語は、動物またはヒトにおいてクラミジア感染を起こすことができる細菌と理解されている。例として、クラミジア・トラコマチス(C. trachomatis)、クラミジア・ニューモニエ(C. pneumonia)、およびC. muridarumがあげられる。
【0028】
クラミジア・トラコマチスの主要外膜タンパク質(MOMP)は、クラミジア・トラコマチスの発達の生涯過程のあらゆる段階で発現し、クラミジアの外膜の全タンパク質量の約60%を占める。MOMPは、保存ドメインと、それらの間に存在する4つの高度可変ドメイン(VD1〜4)とに分けることができる(Stephens、Wagarら、1988)。通常、T細胞エピトープは、保存領域に位置し(Ortiz、Demickら、1996)、ヒト抗体の応答は、主として可変ドメインに対して起きる。特異的モノクローナル抗体の反応性および可変領域の詳細な配列解析に基づいて、クラミジア・トラコマチスは、15の異なる血清変異株に分類することができ、これらの変異株中、A、B、BaおよびCがトラコーマの原因となり、D〜Kが性感染症(STD)の原因となり、L1〜L3が鼠径リンパ肉芽腫症の原因となり、MoPn(C. muridarum)はマウスに感染する。
【0029】
「クラミジア患者」という用語は、培養またはPCRによってクラミジア亜種感染が証明された個体と理解されている。培養、顕微鏡およびPCRによるクラミジアの診断は、当業者にはよく知られている。
【0030】
「遅延型過敏症反応(DTH:delayed type hypersensitivity reaction)」という用語は、ポリペプチドの皮内注射または皮膚への施用の後に誘発される、T細胞によって仲介される炎症応答であり、当該炎症応答は、ポリペプチドの注射または施用の72〜96時間後に現れると理解されている。
【0031】
「IFNγ」という用語は、インターフェロンガンマと理解されている。IFNγの測定は、免疫学的応答の指標として用いられる。
【0032】
「核酸断片」および「核酸配列」という用語は、DNA、RNA、LNA(locked nucleic acid)、PNA、RNA、dsRNAおよびRNA−DNAハイブリッドを含むいずれかの核酸分子と理解されている。また、自然に存在しないヌクレオシドを含む核酸分子も含まれる。この用語には、使用に応じて、いかなる長さ、例えば、10〜10000個のヌクレオチドを含む核酸分子も含む。核酸分子を医薬品として、例えば、DNA療法に使用するか、または本発明に従ってポリペプチドを調製する方法に使用する場合、少なくとも1種のエピトープをコードする、約18〜約1000ヌクレオチド長の分子を使用するのが好ましく、場合によっては、この分子をベクター内に導入する。核酸分子をプローブとして、プライマーとして、またはアンチセンス療法に使用する場合、10〜100ヌクレオチド長の分子を使用するのが好ましい。本発明によれば、その他の分子の長さ、例えば、少なくとも12、15、21、24、27、30、33、36、39、42、50、60、70、80、90、100、200、300、400、500または1000個のヌクレオチド(またはヌクレオチド誘導体)を有する分子、あるいは最大で10000、5000、4000、3000、2000、1000、700、500、400、300、200、100、50、40、30または20個のヌクレオチド(またはヌクレオチド誘導体)を有する分子を使用することもできる。
【0033】
ハイブリダイゼーションの条件と共に使用される場合の「緊縮性」という用語は、当技術分野で定義されているように、すなわち、ハイブリダイゼーションを、融解温度Tmより15〜20℃低い温度で行うと定義されている。Sambrookら、1989、11.45−11.49頁を参照されたい。「高緊縮性の」条件、すなわち、融解温度Tmより5〜10℃低い温度が好ましい。
【0034】
本明細書を通して、文脈上別の意味が要求されない限り、「含む(comprise)」または「含む(comprises)」もしくは「含む(comprising)」等のその変形は、述べられている構成要素または整数または構成要素もしくは整数の群を含むことを意味するが、その他の構成要素または整数または構成要素もしくは整数の群のいずれをも排除することを意味するものではないと理解されたい。
【0035】
配列同一性
「配列同一性」という用語は、等しい長さの2つのアミノ酸配列間または等しい長さの2つのヌクレオチド配列間の相同性の程度の定量的な尺度を意味する。比較しようとする2つの配列は、ギャップの挿入またはタンパク質配列の末端の切断によって可能になる、最も一致した状態に整列化させる必要がある。配列同一性は、
【数1】

【0036】
として計算することができる。ただし、式中、Ndifは、整列化したときに2つの配列間で一致しない残基の全数であり、Nrefは、1つの配列中の残基の数である。したがって、DNA配列AGTCAGTCは、配列AATCAATCと、75%の配列同一性を有することになる(Ndif=2およびNref=8)。ギャップは、特定の残基に対して一致しないとして数えられ、すなわち、DNA配列AGTGTCは、DNA配列AGTCAGTCと、75%の配列同一性を有することになる(Ndif=2およびNref=8)。別法として、配列同一性は、ブラスト(BLAST)プログラム、例えば、BLASTPプログラム(PearsonおよびLipman、1988)(www.ncbi.nlm.nih.gov/cgi-bin/BLAST)によって計算することもできる。本発明のある態様では、Thompson J.ら、1994に記載されているように、http://www2.ebi.ac.uk/clustalw/ で入手できるデフォルトパラメーターを用い、配列比較法ClustalWで、配列化を実施している。
【0037】
配列同一性の好ましい最低パーセントは、少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、および99.5%等の、少なくとも80%である。
【0038】
免疫原性部分
本発明のより好ましい実施形態では、ポリペプチドが、B細胞またはT細胞に対するエピトープ等の、ポリペプチドの免疫原性部分を含む。ポリペプチドの免疫原性部分は、当該ポリペプチドの一部であり、免疫原性部分は、動物もしくはヒトにおいて免疫応答を誘発する、かつ/または生物学的試料において、本明細書に記載されている生物学的アッセイのいずれかで測定される免疫応答を誘発する。ポリペプチドの免疫原性部分は、T細胞のエピトープであってもよいし、またはB細胞のエピトープであってもよい。免疫原性部分は、ポリペプチドの比較的小さな部分の1つもしくはいくつかに関係していてもよいし、ポリペプチド配列全体に散在していてもよいし、またはポリペプチドの特定の部分に存在していてもよい。いくつかのポリペプチドに関して、ポリペプチド全体に配列全長にわたり、エピトープが散在していることが示されている(Ravn、Demissieら、1999)。免疫応答において認識される適切なT細胞エピトープを同定するために、「強力な」方法を使用することができる。すなわち、T細胞エピトープは線形であることから、ポリペプチドの欠失変異体は、系統的に構築すれば、ポリペプチドのどの領域が、免疫認識において必須であるかを示すであろう。例えば、これらの欠失変異体に対して、具体的には、本明細書に記載されているIFNγアッセイを実施する。別法では、重複しているオリゴペプチドを利用し、MHCクラスIIエピトープを検出する。好ましくは、このオリゴペプチドは、当該ポリペプチドに由来するアミノ酸の、例えば、20個からなる長さを有する合成オリゴペプチドである。これらのペプチドを生物学的アッセイ(例えば、本明細書に記載されているIFNγアッセイ)で試験することができ、これらのうちのいくつかは、ペプチド中にT細胞エピトープが存在する証拠として、陽性の応答(それによって免疫原性)を示すであろう。MHCクラスIエピトープを検出するためには、結合するであろうペプチドを予想し(Stryhn、Pedersenら、1996)、それに次いで、これらのペプチドを合成し、適切な生物学的アッセイ、例えば、本明細書に記載されているIFNγアッセイで試験することができる。好ましくは、このペプチドは、当該ポリペプチドに由来するアミノ酸残基の、例えば、8〜11個からなる長さを有する。B細胞エピトープは、例えば、Harboeらによって記載されているように(Harboe、Oettingerら、1996)、目的のポリペプチド全体に重複しているペプチドに対するB細胞の認識を解析することによって決定することができる。
【0039】
T細胞エピトープの最も短い長さは、少なくとも6個のアミノ酸であることが示されているが、T細胞エピトープは、より長いアミノ酸からなることが普通である。したがって、本発明のポリペプチド断片は、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも12個、少なくとも14個、少なくとも16個、少なくとも18個、少なくとも20個、少なくとも22個、少なくとも24個および少なくとも30個のアミノ酸残基等、少なくとも7個のアミノ酸残基からなる長さを有する。したがって、本発明の方法の重要な実施形態では、ポリペプチド断片が、最大で40個、35個、30個、25個および20個のアミノ酸残基等、最大で50個のアミノ酸残基からなる長さを有することが好ましい。10〜20個のアミノ酸残基からなる長さを有するペプチドが、MCHクラスIIエピトープとして最も効率がよいと証明されるであろうと予想され、したがって、本発明の方法で使用するポリペプチド断片の特に好ましい長さは、15個、14個、13個、12個および特に11個等、18個のアミノ酸残基である。7〜12個のアミノ酸残基からなる長さを有するペプチドが、MCHクラスIエピトープとして最も効率がよいと証明されるであろうと予想され、したがって、本発明の方法で使用するポリペプチド断片の特に好ましい長さは、10個、9個、8個および特に7個等、11個のアミノ酸残基である。
【0040】
ポリペプチドの免疫原性部分は、遺伝子的に異型なヒトの集団の広範な部分によって認識される場合(高頻度)、またはそのごく一部によって認識される場合(低頻度)がある。さらに、一部の免疫原性部分は、高い免疫学的応答(ドミナント)を誘発し、別の免疫原性部分は、顕著であるものの、低めの応答(サブドミナント)を誘発する。高頻度><低頻度は、広範に分布しているMHC分子(HLA型)に結合する免疫原性部分、または複数のMHC分子にさえ結合する免疫原性部分と関係付けることができる(Kilgus、Jardetzkyら、1991)(Sinigaglia、Guttingerら、1988)。
【0041】
しかし、クラミジア感染に対する新しいワクチンに用いる候補分子を提供するという状況では、サブドミナントなエピトープも、ドミナントなエピトープと同様、適切である。というのは、サブドミナントであるにもかかわらず、そのようなエピトープは、防御を誘発することができることが示されているからである。
【0042】
変異体
本発明のポリペプチドに共通する特徴は、実施例で説明するように、免疫学的応答を誘発する能力である。置換、挿入、付加または欠失によって作製される本発明のポリペプチドの変異体も、本明細書に記載されているいずれかのアッセイによって測定すると免疫原性であることを理解されたい。
【0043】
免疫個体
免疫個体とは、クラミジア感染が排除または制御されているヒトまたは動物と定義される。
【0044】
免疫原性
免疫原性のポリペプチドとは、現在クラミジアに感染しているか、または過去にクラミジアに感染した生物学的試料または個体において、免疫応答を誘発するポリペプチドと定義される。免疫応答は、以下の方法のいずれかでモニターすることができる。
【0045】
・in vitroにおける細胞応答は、現在クラミジアに感染しているか、または過去にクラミジアに感染した動物またはヒトから採取したリンパ球からの、IFNγ等の関連性があるサイトカインの放出によって、またはこれらのT細胞の増殖の検出によって測定される。誘発は、ポリペプチドまたは免疫原性部分を、1×105〜3×105細胞/ウェルを含む懸濁液に加えることによって行われる。細胞は、血液、脾臓、肝臓または肺のいずれかから単離する。ポリペプチドまたは免疫原性部分を、20μg/ml以下の濃度になるように、懸濁液に加える。2〜5日間、刺激する。細胞増殖をモニターするために、細胞に、放射標識したチミジンを加え、パルスを発生させ、16〜22時間インキュベーションした後、液体シンチレーションカウンターでカウントして増殖を検出する。陽性の応答は、{バックグラウンド+2×(標準偏差)}超である応答とする。IFNγの放出は、当業者によく知られたELISA法によって測定することができる。陽性の応答は、{バックグラウンド+2×(標準偏差)}超である応答とする。ペプチドに対する免疫学的応答をモニターする場合、IL−12、TNF−α、IL−4、IL−5、IL−10、IL−6、TGF−β等のIFNγ以外のサイトカインも関連性があるであろう。サイトカイン(例えば、IFNγ)の存在を測定する別のさらに感度の高い方法は、ELISPOT法であり、この方法では、血液、脾臓、肝臓または肺のいずれかから単離した細胞を、好ましくは1〜4×106細胞/mlの濃度に希釈し、最終濃度が20μg/ml以下であるポリペプチドまたは免疫原性部分の存在下で、18〜22時間インキュベーションする。その後、細胞の懸濁液を1〜2×106/mlに希釈し、抗IFNγで被覆したMaxisorpプレートに移し、好ましくは、4〜16時間インキュベーションする。IFNγ産生細胞を、標識された二次抗IFNγ抗体およびスポットの発生に関わる基質を使用して測定する。発生したスポットは、解剖顕微鏡を使用して数えることができる。PCR法を使用して、関連性があるサイトカインをコードするmRNAの存在を測定することも可能である。通常、1種または複数のサイトカインを、例えば、PCR法、ELISPOT法またはELISA法を利用して測定することになる。特定のペプチドによって誘発されるこれらのサイトカインのいずれかの量の顕著な増加または減少を使用して、ペプチドの免疫学的活性を評価することができることが、当業者であれば理解できよう。
【0046】
・また、in vitroにおける細胞応答は、免疫個体またはクラミジア・トラコマチスに感染したヒトに由来するT細胞株を使用することによっても測定できる。この場合、T細胞株は、生存しているクラミジアまたは細菌細胞の抽出液と共に、IL−2を添加して、10〜20日間処理されている。1×105〜3×105細胞/ウェルを含有するT培養細胞株の懸濁液に、20μg/ml以下の濃度になるようにポリペプチドを加えてインキュベーションする。インキュベーションは、2〜6日間行う。IFNγの誘導または別のサイトカインの放出を、ELISA法で検出する。T細胞の刺激を、上記のように、放射標識したチミジンを使用して細胞増殖を検出することによってモニターすることもできる。どちらのアッセイも、陽性の応答は、{バックグラウンド+2×(標準偏差)}超である応答とする。
【0047】
・in vitroにおける細胞応答は、臨床的または準臨床的にクラミジアに感染している個人に、最大で100μgのポリペプチドまたは免疫原性部分を皮内注射またはパッチから局所施用した後に、陽性のDTH応答として測定することができ、陽性の応答は、注射または施用の72〜96時間後に少なくとも5mmの直径を有する。
【0048】
・in vitroにおける液性の応答は、免疫個体または感染している個体における特異的な抗体の応答によって測定することができる。抗体の存在は、ELISA法またはウェスタンブロット法によって測定することができる。ウェスタンブロット法の場合、ポリペプチドまたは免疫原性部分をニトロセルロース膜またはポリスチレン表面のいずれかに吸収させる。血清を、好ましくは、PBS中で、1:10〜1:100に希釈し、吸収させたポリペプチドに加え、1〜12時間インキュベーションする。標識した二次抗体を使用することにより、特異抗体の存在を、光学濃度(OD)を、例えば、ELISA法によって測定することができる。この場合、陽性の応答は、{バックグラウンド+2×(標準偏差)}超である応答とし、または別法として、ウェスタンブロット法においては、目視で確認できる応答とする。
【0049】
・別の関連性があるパラメーターは、アジュバント中のポリペプチドによる予防接種後またはDNAによる予防接種後に誘発された、動物モデルにおける防御の測定である。適切な動物モデルとして、霊長類、モルモットまたはマウスがあげられ、これらは、クラミジア感染に曝されている。誘発された防御の読み取りは、予防接種されていない動物と比較した標的臓器中のクラミジア細菌の量の減少、予防接種されていない動物と比較した生存期間の延長、および予防接種されていない動物と比較した体重減少の抑制であることができるであろう。
【0050】
調製方法
一般に、クラミジア・トラコマチス抗原およびそのような抗原をコードするDNA配列を、種々の方法のいずれかを使用して調製することができる。それらは、クラミジア・トラコマチスの細胞から、上記の方法等の方法で、未変性タンパク質として精製することができる。免疫原性のある抗原を、抗原をコードするDNA配列を使用して組換えによって調製することもできる。このDNA配列は、発現ベクターに挿入され、適切な宿主中で発現させられている。宿主細胞の例として、大腸菌があげられる。本発明のポリペプチドまたは免疫原性部分を、約100個未満のアミノ酸、一般的には、50個未満のアミノ酸を有するように、合成によって調製することもでき、成長しているアミノ酸の鎖にアミノ酸を順次加える市販の固相技術等の当業者によく知られた技術を使用して調製することができる。
【0051】
DNAワクチンと定義される、ポリペプチドをコードするプラスミドDNAの構築および調製においては、大腸菌等の宿主株を使用することができる。次いで、プラスミドDNAを、目的のプラスミドを保有している宿主株を一晩培養することによって調製し、菌体内毒素を除去するステップを含む、例えば、Qiagen Giga-Plasmidカラムキット(Qiagen社製、Santa Clarita、カリフォルニア州、米国)を使用して精製することができる。DNAワクチンに使用するプラスミドは、菌体内毒素を含まないことが必須である。
【0052】
融合タンパク質
免疫原性ポリペプチドを、融合タンパク質として調製することもでき、この方法によって、本発明のポリペプチドの優れた特徴を達成することができる。例えば、組換えにより調製する場合には、ポリペプチドの搬出を促進する融合パートナー、ポリペプチドの精製を促進する融合パートナー、および本発明のポリペプチド断片の免疫原性を促進する融合パートナーは、いずれも興味深い、可能性のあるものである。したがって、本発明は、上記で定義したポリペプチドまたは免疫原性部分の少なくとも1つと、融合パートナーの少なくとも1つとを含む融合ポリペプチドにも関する。融合パートナーは、免疫原性を促進するために、クラミジア・トラコマチスに由来する別のポリペプチド、例えば、クラミジア種に由来するポリペプチド断片、具体的には、CT812、CT579、CT587(Goodall、Yeoら、2001)、Cap(Fling、Sutherlandら、2001)、CT713(KuboおよびStephens、2000)、CT442(Starnbach、Loomisら、2003)、もしくはMOMP(Stephens、Wagarら、1988)、または上記のいずれかのT細胞エピトープもしくはB細胞エピトープの少なくとも1種であることができる。また、本発明は、本発明の2つ以上のポリペプチド(またはそれらの免疫原性部分)の相互融合体を含む融合ポリペプチドにも関する。
【0053】
生成物の免疫原性を促進することができるであろう、その他の融合パートナーは、IFNγ、IL−2およびIL−12等のリンホカインである。発現および/または精製を促進するためには、融合パートナーは、例えば、細菌の線毛タンパク質、具体的には、ピリ線毛の成分であるピリンおよびpapA;プロテインA;ZZ−ペプチド(ZZ−融合体は、スウェーデンのPharrnacia社から販売されている);マルトース結合タンパク質;グルタチオンSトランスフェラーゼ;β−ガラクトシダーゼ;またはポリヒスチジンであることができる。融合タンパク質を、宿主細胞中で、組換えによって調製することができる。この宿主細胞は、大腸菌であることができるであろう。異なる融合パートナーの間に、リンカー領域を導入することも可能である。
【0054】
その他の興味深い融合パートナーは、脂質を付加されているポリペプチドである。それによって、免疫系に適するように免疫原性ポリペプチドが提示される。この効果は、例えば、WO96/40718Aに記載されているボレリア・ブルグドルフェリ(Borrelia burgdorferi)のOspAポリペプチドに基づいたワクチン、または緑膿菌(Pseudomonas aeruginosa)のOprlリポタンパク質に基づいたワクチン(Cote-SIerra、Jongertら、1998)から知られている。別の可能性として、免疫原性ポリペプチドへの、既知のシグナル配列のN末端の融合体、およびN末端のシステインがある。適切な調製の宿主内で調製すると、そのような融合体により、N末端のシステインで免疫原性ポリペプチドに脂質が付加される。
【0055】
薬学的組成物
薬学的組成物は、以下に説明するいずれかのワクチン(治療用および予防用の両方)またはいずれかの診断用試薬と定義される。
【0056】
ワクチン、タンパク質
本発明の別の部分は、本発明のポリペプチド(もしくはその免疫原性部分の少なくとも1つ)または融合ポリペプチドを含むワクチン組成物に関する。そのようなワクチン組成物の最適化された性能を保証するために、ワクチン組成物は、免疫学的および薬学的に許容される担体、賦形剤またはアジュバントを含むことが好ましい。
【0057】
本発明のポリペプチドが動物によって認識される、有効なワクチンとは、動物モデルにおいて、病原性のあるクラミジアに曝露した後、予防接種されていない動物と比較して、標的臓器中のクラミジア細菌の量を減少させ、生存期間を延長し、かつ/または体重減少を抑制することができるものとする。
【0058】
適切な担体は、ポリペプチドが疎水性の非共有結合によって結合するポリマー、例えば、プラスチック、具体的には、ポリスチレン;ポリペプチドが共有結合によって結合するポリマー、例えば、多糖類;またはポリペプチド、具体的には、ウシ血清アルブミン、卵白アルブミンもしくはスカシ貝ヘモシアニンからなる群から選択される。適切な賦形剤は、希釈剤および懸濁化剤からなる群から選択される。アジュバントは、ジメチルジオクタデシルアンモニウムブロマイド(DDA)、クィルA、ポリI:C、水酸化アルミニウム、フロインドの不完全アジュバント、IFNγ、IL−2、IL−12、モノホスホリル脂質A(MPL)、トレハロースジマイコレート(TDM)、トレハロースジベヘネート(TDB)およびムラミルジペプチド(MDP)からなる群から選択されるのが好ましい。
【0059】
有効成分としてペプチド配列を含有するワクチンの調製は、いずれも参照によって本明細書に組み入れられている米国特許第4,608,251号、第4,601,903号、第4,599,231号および第4,599,230号に例示されているように、通常、当業者にはよく知られている。
【0060】
ワクチンのアジュバント効果を達成するためのその他の方法として、水酸化アルミニウムもしくはリン酸アルミニウム(ミョウバン)等の薬剤、糖の合成ポリマー(カルボポール;Carbopol)、熱処理によるワクチン中のタンパク質の凝集化、アルブミンに対するペプシン処理(Fab)抗体を用いた再活性化による凝集化、クリプトスポリジウムパルブム(Cryptosporidium parvum)等の細菌細胞、菌体内毒素もしくはグラム陰性細菌のリポ多糖成分との混合物、mannide monooleate(アラセル(Aracel)A)等の生理学的に許容される油性の賦形剤中の乳濁液、または代用血液として使用されるパーフルオロカーボン(Fluosol-DA)の20%溶液を用いた乳濁液の使用があげられる。その他の可能性としては、上記のアジュバントと組み合わせてサイトカイン等の免疫調節物質、またはポリI:C等の合成IFNγ誘発剤を使用することが含まれる。
【0061】
アジュバント効果を達成するための別の興味深い方法は、(参照によって本明細書に組み入れられている)(Gosselin、Wardwellら、1992)に記載されている技術を利用することである。要するに、本発明の抗原等の適切な抗原を、単核球/マクロファージ上のFcγ受容体に対する抗体(または抗原結合抗体断片)に結合させることができる。
【0062】
ワクチンは、剤形に対応した方法で投与され、治療に有効かつ免疫原性を示す量で投与するものとする。投与量は、免疫応答を開始する個々の免疫系の能力および所望する防御の程度等を含め、治療対象によって異なる。適切な投与量の範囲として、ワクチンあたり、約数百μg、好ましくは約1〜300μg等の約0.1〜1000μg、特に約10〜50μgの有効成分を含む。初期投与および追加免疫に関する適切な投与計画も多様であるが、通常、初期投与、それに続く接種またはその他の投与に代表される。
【0063】
多種多様な投与形態をとることができる。ワクチンを投与する従来からの方法のいずれかを適用できる。これらには、固体の生理学的に許容される基剤上もしくは生理学的に許容される分散剤の形態での経口投与、または注射等による非経口投与が含まれると考えられる。ワクチンの投与量は、投与経路によって異なるものであり、ワクチンを投与される個人の年齢によって、またそれよりは程度は低いが、ワクチンを投与される個人の大きさによって、変動するものである。
【0064】
ワクチンは、従来法に従って、注射により、例えば皮下注射または筋肉内注射により非経口的に投与される。その他の投与形態に適する別の剤形として、坐剤、および、場合によっては、経口製剤があげられる。坐剤には、従来からの結合剤および担体、例えば、ポリアルキレングリコールまたはトリグリセリドを含むことができる。そのような坐剤を、0.5〜10%、好ましくは1〜2%の範囲の有効成分を含む混合物から形成することができる。経口製剤には、通常利用される賦形剤、例えば、製薬グレードのマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、セルロース、および炭酸マグネシウム等を含む。これらの組成物は、液剤、懸濁剤、錠剤、丸剤、カプセル剤、徐放性製剤または散剤の形態をとり、有効成分を10〜95%、好ましくは25〜70%含有するのが都合がよい。
【0065】
多くの場合、ワクチンを複数回投与する必要があるであろう。特に、ワクチンは、クラミジア感染を防止し、かつ/または確立したクラミジア感染を治療するために投与することができる。感染防止のために投与する場合には、ワクチンは、感染の臨床的な徴候または症状が明確に現れる前に、予防的に投与される。
【0066】
遺伝的変動のために、各個人は、同一のペプチドに対して異なる強度の免疫応答で反応することがある。したがって、本発明のワクチンは、免疫応答を高めるために、いくつかの異なるポリペプチドを含むことができる。ワクチンは、2つ以上のポリペプチドまたは免疫原性を含むことができ、その場合、ポリペプチドは全部、上記で定義されているペプチドであってもよいし、全部ではないが一部のペプチドが、その他のクラミジア血清変異株の1種または複数に由来していてもよい。後者の例では、ポリペプチドについて上記で記載されている基準を、ポリペプチドが必ずしも満たす必要はなく、それ自体の免疫原性に基づいて作用するか、または単にアジュバントとして作用するかのいずれかであってよい。
【0067】
ワクチンは、2〜20個もしくは特に3〜20個の異なるポリペプチドもしくは融合ポリペプチド等、または3〜10個のポリペプチドもしくは融合ポリペプチド等の、1〜20個の異なるポリペプチドもしくは融合ポリペプチドを含むことができる。
【0068】
また、本発明は、クラミジア種が原因であるクラミジア感染に対して、ヒトを含む動物を免疫する方法であって、本発明のポリペプチドまたは上記の本発明のワクチン組成物または上記の生ワクチンを、動物に投与するステップを含む方法にも関する。
【0069】
また、本発明は、本発明の免疫原性組成物を調製する方法にも関する。この方法は、本発明のポリペプチドを調製、合成または単離するステップと、ワクチン用の媒体中にポリペプチドを溶解または分散させるステップと、場合により、その他のクラミジア・トラコマチス抗原および/または担体すなわち賦形剤および/またはアジュバント物質を加えるステップとを含む。
【0070】
ワクチンDNA
本発明の核酸断片を、in vivoにおいて抗原を発現させるために使用することができる。すなわち、核酸断片を、参照によって組み入れられている総論(Ulmer、Donnellyら、1993)で述べられているように、いわゆるDNAワクチンに使用することができる。
【0071】
したがって、本発明は、本発明の核酸断片を含むワクチンにも関する。このワクチンは、ワクチンを投与されたヒトを含む動物によってin vivoで抗原を発現させ、発現する抗原の量は、ヒトを含む動物において、病原性のクラミジアが原因である感染に対する抵抗を実質的に高めるのに有効である。
【0072】
そのようなDNAワクチンの効果は、免疫応答を調節することができるポリペプチドをコードするDNA断片と共に、発現生成物をコードする遺伝子を投与することによって、促進することができるであろう。
【0073】
組換え生ワクチン
ワクチンに対する細胞性免疫応答を効果的に活性化させる1つの可能性として、非病原性の微生物またはウイルスにおいて、ワクチン中に適切な抗原を発現させることによって達成することができる。そのような微生物のよく知られた例が、ウシ型結核菌BCG(Mycobacterium bovis BCG)、サルモネラ属(Salmonella)およびシュードモナス属(Pseudomona)であり、ウイルスの例がワクシニアウイルス(Vaccinia Virus)およびアデノウイルス(Adenovirus)である。
【0074】
別の可能性では、ワクシニアウイルスまたはアデノウイルス等の弱毒化したウイルスに、本発明のポリペプチドをコードするDNAを統合することである(RolphおよびRamshaw、1997)。組換えワクシニアウイルスは、感染した宿主細胞の細胞質中で複製することができ、したがって、目的のポリペプチドが免疫応答を誘発することができる。この免疫応答によって、クラミジアに対する防御が誘発されるのをねらう。
【0075】
治療用ワクチン
また、本発明は、D. Lowry(Lowryら、1999)の文献に記載されているように、治療用ワクチンとして使用するための本発明のポリペプチドまたは核酸の使用にも関する。ワクチンとして投与する場合、実験動物におけるクラミジア・トラコマチス感染の重症度を低下させる能力、または過去の感染の再活性化を防止する能力に基づいて、治療的特徴を有する抗原を同定することができる。治療用ワクチンに使用する組成物は、ワクチンについて上記で記載したように調製することができる。
【0076】
診断用タンパク質
また、本発明は、ヒトを含む動物におけるクラミジアが原因であるクラミジア感染を診断する方法にも関する。この方法は、本発明のポリペプチドを動物に皮内注射するステップを含み、注射部位における陽性の皮膚応答は、当該動物がクラミジアに感染していることを示唆し、注射部位における陰性の皮膚応答は、当該動物がクラミジアに感染していないことを示唆する。
【0077】
病原性のクラミジアによる過去または進行中の感染の診断を目指す場合には、単核細胞(すなわちTリンパ球)を含む患者の血液検体を、1つまたは複数の本発明のポリペプチドの検体と接触させることができるであろう。このような接触は、in vitroで行うことができ、陽性の反応は、例えば、T細胞の増殖またはIFNγ等のサイトカインの細胞外の相への放出であり得る。対象の血清検体を本発明のポリペプチドと接触させることもまた可能であり、血清検体中の抗体とポリペプチドとの結合が実証されることにより、過去または進行中の感染が示される。
【0078】
したがって、本発明は、動物またはヒトにおけるクラミジア種による進行中または過去の感作をin vitro診断する方法にも関する。この方法は、動物またはヒトから血液検体を供給するステップと、当該動物の検体を本発明のポリペプチドと接触させるステップとを含み、血液検体中の単核細胞による少なくとも1種のサイトカインの細胞外の相への顕著な放出は、当該動物に感作が生じていることを示唆する。陽性応答は、患者の血液検体からの放出が、{クラミジアと診断されていない患者の血液検体からの放出+2×(標準偏差)}超である応答とする。また、本発明は、動物またはヒトにおけるクラミジアによる進行中または過去の感作をin vitroで診断する方法にも関する。この方法は、動物またはヒトから血液検体を供給するステップを含み、当該動物の検体を本発明のポリペプチドと接触させることによって、血清検体中に本発明のポリペプチドを認識する抗体が存在することを示す。診断するために使用する免疫原性組成物は、2〜20個もしくは特に3〜20個の異なるポリペプチドもしくは融合ペプチド等、または3〜10個のポリペプチドもしくは融合ペプチド等の、1〜20個の異なるポリペプチドもしくは融合ペプチドを含むことができる。
【0079】
診断用DNA
本発明のポリペプチドをコードする核酸のプローブを、所与の検体中の病原体の存在を検出するための多様な診断アッセイに使用することができる。本発明の核酸断片を動物に投与するステップ、または検体を本発明の核酸断片もしくはそれに対して相補的な核酸断片と共にインキュベーションするステップと、インキュベーションによってハイブリダイゼーションした核酸の存在を(当技術分野でよく知られたハイブリダイゼーションアッセイを使用して)検出するステップとを含む、ヒトを含む動物中または検体中のクラミジアの核酸の存在を測定する方法もまた、本発明に含まれる。そのようなクラミジア感染を診断する方法では、上記で定義したヌクレオチド配列の少なくとも一部を含む組成物を使用し、試験しようとする動物またはヒトの検体中の、核酸断片(または相補的な断片)とハイブリダイゼーションするヌクレオチド配列の存在を、PCR法を使用して検出することになるであろう。
【0080】
抗体
また、イムノアッセイにおいて本発明のポリペプチドと特異的に反応するモノクローナル抗体もしくはポリクローナル抗体または当該抗体の特異的結合断片もまた、本発明の一部である。抗体は、当業者に既知の方法で調製することができる。ポリクローナル抗体は、哺乳類中で、例えば、本発明のポリペプチドおよび必要であればアジュバントを1回または複数回注射することによって育てることができる。本発明のモノクローナル抗体は、例えば、KohlerおよびMilstein(1975)によってはじめて記載されたハイブリドーマ法によって、または米国特許第4,816,567号に記載されているような組換えDNA法によって調製することができる。また、モノクローナル抗体は、例えば、(McCafferty、Griffithsら、1990)によって記載されている技術を使用して生成したファージライブラリーから単離することもできる。抗体を調製する方法は、文献、例えば、米国6136958に記載されている。
【0081】
感染している恐れのある臓器の検体を、本発明のポリペプチドを認識するそのような抗体と接触させることができる。当技術分野でよく知られた方法により検体と抗体との間での反応が認められる場合、進行中の感染が示唆されることになる。もちろん、対象の血清検体を本発明のポリペプチド断片の少なくとも1つと接触させた後、抗体と抗原との間の反応を可視化するよく知られた方法を使用することによって、血清中の抗クラミジア抗体の存在を示すことも可能である。
【0082】
診断に際しては、本発明の抗体、核酸断片および/またはポリペプチドを、組成物中で、単独または1つの成分としてのいずれかで使用することができる。そのような組成物は、当技術分野においては既知であり、本発明の抗体、核酸断片またはポリペプチドが、少なくとも1種のその他の分子、例えば、(放射性もしくは蛍光)標識または担体分子に、結合、好ましくは共有結合している組成物を含む。
【0083】
本発明は、
1)クラミジア泌尿生殖器感染患者のT細胞を刺激し、INFγを分泌させる能力、あるいは
2)クラミジア泌尿生殖器感染患者のT細胞を刺激し、in vitroにおけるクラミジアの増殖を抑制するサイトカインを分泌させる能力、あるいは
3)クラミジア泌尿生殖器感染患者の血清IgG抗体および/またはIgM抗体および/またはIgA抗体による認識、あるいは
4)Chlamydia muridarumおよび/またはクラミジア・トラコマチスに実験的に感染しているマウスのT細胞および/または抗体による認識、あるいは
5)マウスへの投与によって、クラミジア・トラコマチスの細菌抗原を認識する免疫応答を誘発する能力、あるいは
6)予防接種によって、Chlamydia muridarumおよび/またはクラミジア・トラコマチスによる実験的攻撃感染に対して少なくとも部分免疫をもたらす能力
を有するクラミジア・トラコマチスの抗原性成分を開示する。
【0084】
第1に、クラミジア・トラコマチスのタンパク質から防御T細胞の分子標的を同定するために、クラミジア・トラコマチス血清型D(UW−3/Cx株、ATCC番号:VR−885)のタンパク質の可溶化液を、マルチ溶出法(AndersenおよびHeron、1993)によって分画した。この方法では、複合タンパク質の混合物中のタンパク質を、分子量によって狭い画分に分離し、次いで、分離したタンパク質を使用して、in vitroにおいて末梢血単核球(PBMC:Peripheral Blood Mononuclear Cell)を刺激する。数日間インキュベーションした後、INFγの放出をELISAによってモニターする(図1)。クラミジア患者の応答を、過去にクラミジア感染と診断されたことのない正常な血液提供者の応答と比較した。こうして比較することによって、ヒトへの感染の第1段階において、エフェクターT細胞を刺激してINFγを放出させる能力のあるクラミジア・トラコマチスのタンパク質を同定することができる。この方法を使用して、これらの防御T細胞の標的が、5〜12、16〜20、25〜35および58〜74kDaの見かけ分子量を有するタンパク質またはタンパク質の断片であることが示された(図2および3)。各刺激領域内の細菌のタンパク質の正確なアイデンティティーを、質量分析によって決定した。
【0085】
刺激抗原をさらに同定し、特徴付けると、特異的なクラミジア・トラコマチス抗原のそれぞれは、a)実施例1で例示するように、クラミジア・トラコマチスの抽出液の抗原から精製することができ、b)実施例1で例示するような、大腸菌から生成および精製された抗原であることができ、c)実施例1で例示するような、重複している合成ペプチドであることができ、またはd)実施例5で例示するような、組換えアデノウイルス構築物を直接用いた標的患者PBMCの形質導入体であることができるものである。図4に例示するように、この方法によって、INFγの放出によって測定された極めて強力な刺激能力を有する刺激領域のそれぞれの中にある、単一の抗原およびそれに由来するペプチドを同定することができた。
【0086】
第2に、5’−プライマーにコザック配列および3’−プライマーに終止コドンを含有する遺伝子特異的オリゴヌクレオチドを使用したポリメラーゼ連鎖反応法(PCR)により、完全長のクラミジア・トラコマチスの遺伝子を増幅することによって、定方向発現ライブラリーを構築した。クラミジア・トラコマチス血清型DのゲノムDNAを、PCR反応の鋳型として使用し、目的の遺伝子内のプライマーの位置およびTmを含む自動化プライマー設計のために、新たに開発されたUNIX(登録商標)プログラムを使用した。まず、単位複製配列を、組換えにより、Gateway「entry vector」(Invitrogen製)内に挿入し、次いで、組換えにより、His6タグおよびentry vectorと同一の組換え配列を含有するpDEST17発現ベクター(Invitrogen製)内に移動させた。高いレベルのクラミジア・トラコマチスに特異的なIgG、IgMまたはIgA抗体を有するヒト血清検体のプールを使用し、コロニーブロット法(French maulおよびmaul、1986)により、クラミジア・トラコマチス抗原の発現について、個々のクローンをスクリーニングした。細胞溶解の前に、プラスミドによってコードされているプロモーターに向けてはじまる転写を誘発するために、コロニーリフトのために使用するニトロセルロース製フィルターを、1%アラビノース溶液にあらかじめ浸漬した。クラミジア患者の血清IgG、IgMまたはIgA抗体に結合する陽性のクローンは、はじめのスクリーニングに使用したものと同一の血清検体のプールを使用して、ウェスタンブロット法によって、さらに分析するために選択した。この方法によって、ワクチンおよび診断に適切な、免疫反応性のクラミジア・トラコマチスのタンパク質をコードするクローンの同定に至った。
【0087】
第3に、ゲノム発現ライブラリーを、大腸菌ファージラムダgtl1(λgtl1)中で構築した。クラミジア・トラコマチス血清型Dの高分子量の染色体DNAを、基本小体から、SDS(1%)およびプロテイナーゼK(100μg/ml)を含有する溶解緩衝液中に抽出後、フェノールで抽出し、エタノールで沈殿させた。DNAを超音波処理によって部分的に分解し、0.2〜0.8kbのサイズのDNA断片を、λgtl1に連結した。連結混合物をin vitroパッケージし、組換えファージを大腸菌Y1090r−上に蒔いて培養し、約3.4×105の一次ラムダファージを含有するゲノム発現ライブラリーを得た。この一次ライブラリーを増幅して、6.7×109PFU/mlのゲノムのランダム発現ライブラリーを得た。第1の実験では、このライブラリーを、完全長の発現ライブラリーのスクリーニングのために上記で使用したものと同一のヒト血清検体のプールを使用し、プラークリフト法によってスクリーニングした。クラミジア・トラコマチスに特異的なIgG、IgMまたはIgA抗体に結合する、免疫反応性のプラーク88個を同定した。これらのプラークを、8個のプール(IgA反応性プラークのプール2個、IgG反応性プラークのプール5個、およびIgM反応性プラークのプール1個)として貯蔵した。はじめのスクリーニングに使用したものと同一の血清プール(一次抗体)を用いて、再スクリーニングした。個々の血清反応性のファージプラークを単離し、個別に血清反応性であるファージの挿入DNA配列を決定した。この方法により、ワクチンおよび診断に適切な、特異的クラミジア・トラコマチス免疫反応性ペプチドをコードするいくつかのクローンを同定した。
【0088】
最後に、実験的クラミジア感染においてマウスの免疫系によって認識される抗原を同定するか、または攻撃感染に対して少なくとも部分免疫をもたらすために、感染症の動物モデルを小型齧歯類において確立した。クラミジアは種によって、自然の宿主に対して、高い程度の特異性を示す。したがって、上記の種々のスクリーニング戦略に使用したクラミジア・トラコマチス血清型Dは、ヒトの病原体であり、これは、ヒトへの感染に通常伴う病理学的変化をマウスでは起こさない。一方、マウスを近縁のC.muridarum MoPn株に実験的に感染させることができ、何人かの研究者が、実験的MoPn感染に対する部分免疫の誘発を過去に実証している。したがって、性器感染モデルは確立されており、かつC57マウスにおいて確認されている。このモデルにおいて、異なる抗原の防御効果が、1)子宮頚部の拭き取りによる細菌数、2)生殖器の病理学的変化、および3)免疫反応性細胞のin vitroにおける細胞アッセイを評価することによって研究された。
【0089】
表1:クラミジア抗原
【表2】

【0090】

【0091】

【0092】

【0093】

【表3】

【図面の簡単な説明】
【0094】
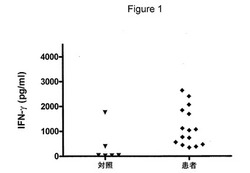
【図1】図1は、クラミジア・トラコマチス血清型D溶菌液の細胞反応性を示す図である。6人の対照提供者および15人の患者から単離したPBMCのIFNγの応答を示す。PBMCを、5μg/mlのクラミジア・トラコマチス溶菌液で刺激し、IFNγの放出を、上澄み中で、5日後に測定した。
【図2】図2は、クラミジア・トラコマチス血清型Dのタンパク質画分を示す図である。細菌の溶菌液を、マルチ溶出法によって狭い分子画分に分離した。画分を、SDS−PAGEおよび銀染色によって分析した。分子量マーカーの泳動を、右(レーン1)にキロダルトンで示す。溶菌液を、第1および残りのレーンに示す。
【図3】図3は、クラミジア・トラコマチス血清型Dのタンパク質画分のヒトT細胞認識を示す図である。8人のクラミジア患者(>1000pg/mlで溶菌液全体に応答)および6人の対照提供者から単離したPBMCを、2μg/mlの個々の画分で刺激した。IFNγの放出を、上澄み中で、5日後に測定した。短い線は、IFNγ放出量の平均値を示す。
【図4】図4は、4人の患者および3人の対照における組換えタンパク質に対するT細胞の応答を示す図である。PBMCを、5μg/mlのrCT521、rCT511、rCT616、rCT043およびrCT803で刺激した。三連の培地のIFNγの平均値を示す。
【図5】図5は、41人のクラミジア患者(いずれも1500pg/ml超のIFNγでクラミジア・トラコマチス血清型Dの溶菌液に応答)および1500pg/ml未満のIFNγで溶菌液に応答した11人の対照提供者におけるrCT521の認識を示す図である。PBMCを、rCT521(5μg/ml)および重複CT521ペプチド(各10μg/ml)のプールで刺激し、IFNγのレベルを上澄み中で測定した。C:抗原を含有しない対照のウェル。短い線は、IFNγの平均値(pg/ml)を示す。
【図6】図6は、CT521ペプチド(10μg/ml)の刺激によるIFNγの放出を示す図である。短い線は、各ペプチドに対するIFNγ放出量の平均値を示す。カットオフ値を、200pg/mlのIFNγと設定する(線)。
【図7】図7は、クラミジア・トラコマチス抗原をコードする異なる組換えアデノウイルスで形質転換したPBMCによるIFNγの放出を示す図である。患者のPBMCを、表示するアデノウイルスを用いて感染効率1で形質転換し、INFγの放出を第2日目に測定した。AdVaMockは、挿入断片のない形質転換アデノウイルスの活性を示す。
【図8】図8は、PID7およびPID14における封入体形成単位を示す図である。
【図9】図9は、PID49における卵管水腫のスコアを示す図である。
【図10】図10は、クラミジア・トラコマチスのタンパク質に対するT細胞の応答を示す図である(図10a〜10i)。タンパク質を、10人の患者(黒丸)および5人の対照(四角)において試験した。C、抗原を含有しない細胞培地。平均ならびに75および25パーセンタイルを示す。
【図11】図11は、5人以上の患者が全対照を超えるIFNγのレベルで応答したクラミジア・トラコマチスのタンパク質に対するT細胞の応答を示す図である。タンパク質を、10人の患者(黒丸)および5人の対照(四角)において試験した。C、抗原を含有しない細胞培地。平均ならびに75および25パーセンタイルを示す。
【図12】図12は、最後の免疫化の1週間後の血液リンパ球による抗原特異的応答を示す棒グラフである。IFNγ応答を、10匹の動物からプールした細胞培地中で測定した。各棒は、三連の値の平均値±標準偏差を示す。
【図13】図13は、C3H/HeNマウスにおける感染7、14および21日後の封入体形成単位を示す図である。値は、log10 IFU/mlで示す。値はすべて、10匹の動物の平均値±平均値の標準誤差を示す。
【図14】図14は、ELISA法によって、OD=1.0における希釈度として測定した免疫原に対する血清の反応性を示す図である。各点は、4匹の動物の平均値±平均値の標準誤差を示す。
【図15】図15は、C. muridarum(MoPnのEB)またはクラミジア・トラコマチス(血清型DのEB)の基本小体の可溶化液全体に対する特異的な血清の反応性を示す図である。陽性を、赤の点で示す。理論的な大きさと一致する大きさのバンドを、陽性とする。
【図16】図16は、最後の免疫化の3週間後の脾細胞による抗原特異的応答を示す。IFNγの応答を、4匹の個別の動物の細胞培地中で測定した。各棒は、三連の値の平均値±標準偏差を示す。
【発明を実施するための形態】
【実施例】
【0095】
(実施例1:クラミジア・トラコマチス血清型DのヒトT細胞抗原の同定)
緒言
本発明者らは、SDS−PAGE、次いで電気溶出により分離した複合タンパク質の混合物から得た狭い分子量の画分を使用して、クラミジア・トラコマチスのタンパク質に対するT細胞の応答を分析した。この方法により、免疫応答を直接分析し、刺激性のタンパク質画分を比較することができる。これによって、いくつかの刺激性のタンパク質画分の同定およびT細胞の標的の同定に至った。これらのT細胞標的を、組換え法およびタンパク質配列の全体に広がって重複しているペプチドを使用して、さらに評価した。
【0096】
材料および方法
微生物および培養
クラミジア・トラコマチス血清型D(UW−3/Cx株)を、Hela229細胞(ATCC製、Rockville、メリーランド州、米国)内で増殖させた。5%ウシ胎児血清(Gibco BRL製、熱により不活性化)、1%v/v Hepes、1%v/v L−グルタミン、1%v/v ピルビン酸、および10μg/mlのゲンタマイシンを含有する継代培地RPMI1640(Gibco BRL製、Grand Island、ニューヨーク州、米国)中で、T細胞を培養した。
【0097】
175cm2のフラスコ中のHela229細胞のセミコンフルエントな単層を、DEAE−デキストラン(HBSS中45μg/ml)で、室温にて15分間前処理した後、3mlのHBSS中の1封入体形成単位/細胞のクラミジア・トラコマチス血清型Dに感染させた。フラスコを、プレート振とう器上で、37℃にて2時間インキュベーションした。2時間後に、5%グルコースおよび1μg/mlのシクロヘキシミドを追加した50mlの継代培地RPMI1640を各フラスコに加え、細胞を加湿空気中で、5%のCO2雰囲気下、72時間、さらにインキュベーションした。
【0098】
クラミジア・トラコマチスの収集
クラミジアを、感染後72時間で収集した。細胞を、セルスクレーパーを用いてフラスコから取り出し、4℃にて35,000gで30分間遠心分離した。ペレットを、フラスコあたり5mlのHBSS中に再懸濁させ、氷上で超音波処理し、500gおよび4℃で15分間遠心分離した。上澄みを採取し、氷上で保存し、ペレットを、前回と同量に再懸濁させ、超音波処理および遠心分離を繰り返した。2つの上澄みをプールし、30000gおよび4℃で30分間遠心分離し、ペレットを、針と注射器を用いてSPG緩衝液(3ml/T175)中に再懸濁させた。短時間の超音波処理の後、懸濁液を、30%ジアトリゾ酸溶液(76mlの水中にジアトリゾ酸メグルミン50g、ジアトリゾ酸ナトリウム7.7g)上に穏やかに層状に置き、40,000gで30分間遠心分離した。遠心分離後、ペレットをSPG緩衝液中に再懸濁させ、−70℃で保存した。
【0099】
分画用クラミジア・トラコマチスの溶菌液の調製
6〜8mgのクラミジア・トラコマチスを、30000gで30分間遠心分離し、ペレットを、1:1でWFIおよび検体緩衝液/DTT中に再懸濁させ、5分間沸騰させた。12秒間の超音波処理を2回行った後、懸濁液を、30000gで30分間遠心分離した。上澄みを、使用するまで−70℃で保存した。
【0100】
クラミジア・トラコマチスの溶菌液の分画
クラミジア・トラコマチスの溶菌液を、AndersenおよびHeron(1993)の記載に準じて分画した。簡単に説明すると、クラミジア・トラコマチスの溶菌液を、タンパク質として約6〜8mgの量で、SDS−PAGE(10〜20%ゲル)により一晩かけて分離した(11cm中心幅のウェル、0.75mmゲル)。溶出緩衝液(アンモニアCAPS緩衝液、pH10.2)中で、あらかじめ平衡化したゲルをMulti-Eluterに移し、20分間電気溶出した。タンパク質画分を吸引した後、SDS10〜20%ポリアクリルアミドゲル上で分離、銀染色(BlumおよびGross、1987)することにより分析した。画分中のタンパク質濃度を、Micro BCA法(Pierce製、Oud-beijerland、オランダ)によって推定した。全画分のうちの0.5mlを、0.5%ヒトAB血清で安定化させ、使用するまで−70℃で保存した。残りは、質量分析に使用するために、血清を添加せずに−70℃で保存した。
【0101】
質量分析
ペプチドの質量による対応付けのための試料を、銀染色したSDS−PAGEゲルから切り出した。バンドを洗浄、乾燥、還元し、ヨードアセトアミドでアルキル化してから、Shevchenkoら、1998の記載に基本的に準じて、改変トリプシンで一晩消化した。
【0102】
提供者
デンマークのBispebjerg病院でクラミジアと診断された患者に、研究への参加および抗生物質療法の開始前に血液検体の提供を依頼した。クラミジア感染の記録のない対照である対象にも、研究への参加を依頼した。個々の患者の検体を、男女別にMまたはKとし、場合によっては、特定の患者から採取した第1、2、3、...番目の検体に、A、B、C...として続き番号を割り当てることにより、独自の同定可能なコードを用いてアノテートした。いずれの場合も、検体Aは、あらゆる治療をはじめる前に採取した。例えば、12MBは、患者番号が12である男性から採取した、第2番目の検体を示す。対照検体は、KK−xxとアノテートした。
【0103】
リンパ球の調製および細胞培養
末梢血単核球(PBMC)を、全血から、Lymphoprep(Nycomed A/S製、オスロ、ノルウェー)の密度勾配遠心分離によって分離し、使用するまで、液体窒素内で凍結した。PBMCを解凍後、1%ペニシリン/ストレプトマイシン、1%非必須アミノ酸、1%グルタミン(Gibco製)、1%ピルビン酸、1%Hepes、および10%ヒトAB血清(地元の血液銀行、Rigshospitalet製、コペンハーゲン)を追加したRPMI1640中に、再懸濁した。細胞の生存率および数を、ニグロシン染色法によって測定した。細胞を、三連とし、丸底マイクロタイタープレート(Nunc製、Roskilde、デンマーク)中で、全量100μl中に1.25×105細胞/ウェルで培養した。はじめの用量−応答研究に基づいて、抗原を以下の濃度で添加した。SvD溶菌液:2μg/ml、SvD画分2μg/ml、rCT521 5μg/ml、CT521重複ペプチド 10μg/ml。フィトヘマグルチニン(PHA、2μg/ml)を陽性対照として使用し、抗原を含まない細胞培養を陰性対照として含めた。37℃にて加湿空気(5%のCO2および95%空気)中で5日間インキュベーションした後、上澄みを収集した。
【0104】
IFNγアッセイ
上澄み中のIFNγの量を、市販の抗体(Endogen製)を用いて、ELISA法によって測定し、メーカーの指示に従って使用した。組換えIFNγを、標準(Endogen製)として使用した。
【0105】
重複ペプチド
CT521の完全な一次配列を網羅する、22〜23塩基のペプチド(9〜12個のアミノ酸が重複)10個を、固相法(Schafer-N製)によって合成した。
【0106】
大腸菌内でのクラミジア・トラコマチス抗原の生成
質量分析法によって同定した抗原をコードするCT遺伝子を、Gateway Cloning Technology Manual(Invitrogen製)に従って、pDEST17ベクターのNH2−末端(His)6配列を有するフレーム中にクローン化した。組換えクラミジア・トラコマチス抗原の生成のために、プラスミドベクターを、アラビノースの存在下で高いレベルの組換えタンパク質生成を促進するBL21−AI大腸菌株(Invitrogen製)内にクローン化した。
【0107】
組換えクラミジア・トラコマチス抗原の小規模な精製
細菌細胞ペレットを、10mMイミダゾール、20mM NaH2PO4、500mM NaCl、8M尿素中に懸濁させ、メーカー(BioSpec Products, Inc)の指示に従って、BeadBeaterによって細胞を破壊した後、室温にて穏やかに振とうしながら1時間インキュベーションした。清澄な上澄みを、HisTrapカラム(Pharmacia Biotech製)上に加え、洗浄後、0.5Mイミダゾール、20mM NaH2PO4、500mM NaCl、8M尿素で溶出した。溶出試料を、調製用SDS−PAGE上で電気泳動して分離した。目的の組換えポリペプチドを、クーマシーブルー染色法によって同定し、切り出し、422型Electro-Eluterをメーカー(BioRad)の取り扱い説明書に従って使用して、ゲル切片から電気溶出した。電気溶出した組換え抗原を、80〜90%アセトン(Aldrich製、HPLCグレード)中で沈殿させ、95%エタノール中で洗浄後、最小量の10mMイミダゾール、20mM NaH2PO4、500mM NaCl、8M尿素中に再懸濁させた。最後に、試料を50mM Tris、pH7.5;150mM NaCl、40%グリセロールへ透析し、−20℃で保存した。
【0108】
結果:
クラミジア溶菌液に対するT細胞の応答
Hela細胞感染72時間後に収集したクラミジア・トラコマチス血清型D溶菌液のT細胞認識に関して、クラミジア患者をスクリーニングした。この溶菌液は、クラミジア・トラコマチスの全成分の混合物を意味し、クラミジア・トラコマチスの抗原のレパートリー全体を網羅するものである。この調製物を使用して、15人のクラミジア患者および6人の対照提供者からのPBMCを刺激した(図1)。溶菌液に対する応答は、15人の患者中8人において、顕著なレベル(>1000pg/ml)のIFNγに関連があった。1人の対照提供者においてのみ、1000pg/ml超のIFNγで、溶菌液に対し応答した。
【0109】
クラミジア患者は、複数の抗原を認識する
T細胞の応答の特異性を、マルチ溶出法によって得たタンパク質画分を用いて、PBMCを刺激することによって調べた。この方法を溶菌液に使用し、隣接する画分とは最低限しか重複しない狭い画分を得た(図2)。各画分のポリペプチドの数を、10〜30個と推定する。そのような画分のパネルを使用して、溶菌液全体に応答した8人の患者および6人の対照提供者の抗原認識パターンをスクリーニングした(図3)。これらの画分に対する細胞性応答は、応答が複数の抗原に対するものであることを示した。しかし、IFNγを生成するピークが、5〜12、16〜20、25〜35および58〜74KDaの分子量の領域で認められた。
【0110】
クラミジア患者による組換えタンパク質の認識
分子量領域16〜20(図2)を含む画分7ならびに隣接する画分6および8について、SDS−PAGEを行った。ゲルを銀染色し、画分を含有する部分をゲルから切り出し、Milli Q水中に置き、タンパク質を同定するために質量分析に送った。CT521、CT043、CT511、CT616、CT315およびCT803の6個のヒットが同定された。分子量領域25〜35を含む画分10、11、12、13、14および15も、さらに質量分析に送った。CT603、CT678、CT561、CT610、CT538、CT582、CT583、CT679、CT067、CT681の10個のヒットが同定された。分子量領域58〜74を含む画分22を、質量分析に送った。CT875、CT110、CT112の3個のヒットが同定された。最後に、画分18を質量分析に送り、CT587およびCT322の2個のヒットが同定された。
【0111】
組換えタンパク質、rCT043、rCT511、rCT521、rCT616、rCT803を大腸菌から精製し、1KA、15KA、7KAおよび12KAの4人の患者において、5種のクラミジア・トラコマチスのタンパク質の免疫学的活性を調べた(図4)。rCT521は、試験した4つの中で、最も有望な抗原であった。対照提供者に比べ、4人の患者のうち3人(1KA、7KAおよび15KA)が、rCT521に対して強力(>1000pg/m)に応答した。rCT803、rCT511およびrCT616は、4人の患者のうち2人(1KA、7KA)において、高いレベルのIFNγを誘発し、rCT043は、すべての患者において、低いレベルのIFNγを誘発した。組換えタンパク質、CT043、CT511、CT603、CT561、CT610、CT583、CT679、CT067、CT681、CT875、CT110、CT112、CT587およびCT322を大腸菌内で生成し、10人の患者および5人の対照でT細胞認識を試験した(実施例8)。
【0112】
クラミジア患者によるCT521の認識
クラミジア感染患者によるCT521の認識を、提供者のより大きなパネルで試験した。いずれも1500pg/ml超のIFNγでクラミジアの溶菌液に応答した、全部で41人のクラミジア患者を、CT521の認識について試験した。さらに、1500pg/ml未満のIFNγで溶菌液に応答した11人の対照提供者も含めた(図5)。500pg/mlを超えるIFNγの応答に基づいて、患者をCT521陽性およびCT521陰性に分類することができた。41人の患者のうち34人が、CT521陽性であり(82.9%)、11人の対照のうち2人のみが、CT521に応答した(18.2%)。これらの結果から、CT521が、クラミジアの溶菌液全体に応答したクラミジア患者によって、高頻度で認識されることが示されている。
【0113】
合成ペプチドより対応付けした、CT521に対するT細胞応答の精密な特異性
CT521に対するT細胞応答の精密な特異性を、CT521の完全な配列を網羅する重複ペプチドのパネルをスクリーニングすることによって対応付けた。ペプチドを、9〜12個のアミノ酸が重複する22〜23塩基として合成し、41人のクラミジア患者および11人の対照のPBMCを刺激するために使用した(図6)。応答は非常に不均一であるにもかかわらず、特定の領域が応答の強力な標的となっている特定の階層が存在した。タンパク質のN末端部分(アミノ酸14〜アミノ酸36)、中心部分(アミノ酸40〜アミノ酸88)、およびC末端部分(アミノ酸116〜アミノ酸138)に存在するエピトープが、その他よりも、強力にまたは頻繁に認識された。
【0114】
(実施例2:定方向性ライブラリー戦略(抗体標的のスクリーニング))
緒言
高スループットな手法をとり、クラミジア・トラコマチス血清型Dゲノム中の血清反応性抗原を試験した。最初の200個のオープンリーディングフレーム(ORF)から、完全長ライブラリーを構築した。このライブラリーは、大腸菌内で、抗原を組換えによって発現するように設計されていた。このライブラリーをスクリーニングするために、本発明者らは、ウェスタンブロット分析法によってクラミジア・トラコマチスの基本小体(EB)の抽出液全体に対する反応性に基づいて選択した、5人の高い応答の患者の血清プールを使用した。
【0115】
材料および方法
完全長ライブラリーの構築
クラミジア・トラコマチス血清型Dのゲノムは、公的に入手可能であり、Stephensら(Stephens、Kalmanら、1998)によって定義されている一次アノーテーションを使用した。遺伝子Ct001〜Ct200を、クローニングのために選択した。特定の遺伝子の増幅用の5’および3’プライマーを、「社内製の」ソフトウェアによって設計した。200個の特異的なクラミジア・トラコマチス遺伝子からなる完全長配列を、Entry Vector、pDONR 201(Invitrogen製)内にクローン化した。このベクターによって、目的の遺伝子を、Gatewayクローニングシステム(Invitrogen製)の異なる目的ベクターにクローン化することができる。pDEST17目的ベクターは、6×ヒスチジン親和性タグを有する、大腸菌内での組換えクラミジア・トラコマチスのタンパク質の発現のために使用した。細菌宿主は、アラビノースによる誘発によって組換えクラミジア・トラコマチスのタンパク質を生成するためのBL21−AI(登録商標)であった。
【0116】
発現
1mlの培地を含有する2×96ウェルプレートを、37℃にて一晩、増殖させた。培地をOD600=0.1になるまで希釈し、OD600=0.5になるまで、37℃にて振とう(180rpm)しながらインキュベーションした。その後、L−アラビノースを、最終濃度が0.2%になるように加えることによって、培養を誘発した。4時間誘発した後、培養物を氷上に移し、細菌のペレットを遠心分離(3,000g/20分)によって収集した。ペレットを、コロニーブロット法の結果が得られるまで、冷蔵庫に保管した。
【0117】
患者の血清
ライブラリーのスクリーニングに使用する患者の血清プールを調製するために、5人の陽性クラミジア・トラコマチス患者、3KA、11KA、12KA、13KAおよび17KAを選択した。アルカリホスファターゼ結合ウサギ抗ヒト−IgA、−IgGおよび−IgMのそれぞれを二次検出マーカーとして使用するウェスタンブロット分析法(DakoCytomation製、デンマーク)において、クラミジア・トラコマチス血清型Dの基本小体の抽出液に対する特異的かつ高い反応性に基づいて、これらの患者の血清を選択した。
【0118】
患者の血清プール(10倍希釈)は、全大腸菌タンパク質抽出液を2mg/mlで用いて、室温にて3時間前処理した。作用患者血清プールは、10mM Tris−HCl、pH8、150mM NaCl、0.05%Tween20(TBST製)中に1:200で希釈した。
【0119】
コロニーブロット
完全長大腸菌発現ライブラリーのスクリーニングは、基本的には、Frenchら(1986)に従って行った。Ct001〜Ct200およびゲノム全体から選択された遺伝子をコードする細菌培養物(1ml)を、2つの96穴ディープウェルプレート中で、37℃にて、一晩、増殖させた。(6×8)のグリッパー用具を使用して、細菌培養物を、(100μg/mlのアンピシリンを含有する)LB寒天を含有するペトリ皿に移した。コロニーを、30℃にて一晩放置した。コロニーを1%L−アラビノース中にあらかじめ浸漬したニトロセルロース製の膜上で複製し、コロニーの面が下になるようにして、(100μg/mlアンピシリンおよび0.2%L−アラビノースを含有する)新しいLB寒天プレートに移した。プレートを、37℃にて4時間インキュベーションし、最後に、膜を空のペトリ皿に移し、クロロホルム中にあらかじめ浸漬した紙製のフィルター上で、コロニーの面が上になるようにして、15分間保った。こうして、細菌は、クロロホルムの蒸気に曝された。膜を、リゾチームおよびDNA分解酵素を含有する溶菌緩衝液中で、一晩インキュベーションした。洗浄工程を繰り返した後、膜を一次抗体(作用患者血清プール)と共に、室温にて2時間インキュベーションした。膜を繰り返し(過剰の1×TBSTで4回)洗浄した後、二次抗体中で、1時間インキュベーションした。二次抗体は、
A.ウサギ抗ヒトIgG(DO336)DakoCytomation製、
B.ウサギ抗ヒトIgA(DO338)DakoCytomation製、
C.ウサギ抗ヒトIgM(DO337)DakoCytomation製、または
D.ウサギ抗ヒトIgG(DO336)およびウサギ抗ヒトIgA(DO338)のプール
のいずれかであった。すべて、アルカリホスファターゼと結合していた。
【0120】
1×TBST中で2回洗浄後、膜を、BCIP/NBT基質(Sigma Fast製)で展開した。
【0121】
全カテゴリー(IgG、IgAおよびIgM)で陽性のクローンを選択した。
【0122】
コロニーブロット法で陽性のクローンを用いたウェスタンブロット法
1mlの培養物からの細菌のペレットを、200μlのSDS−PAGE試料緩衝液中に再懸濁させ、95℃にて5分間加熱、SDS−PAGEにより電気泳動後、標準的なウェスタンブロット法によってニトロセルロースに移動させた。上記と同一の患者血清プールおよび二次抗体(A〜C)のプールと共に、膜をインキュベーションした。タンパク質の誘発の対照として、複製膜を、抗Penta−His抗体と共にインキュベーションし、メーカー(Qiagen)の指示に従って処理した。コロニーブロット法で反応しなかった2つのコロニーを、対照として含めた。
【0123】
結果:
細菌コロニースクリーニング手法における患者血清により認識されたCT抗原の同定結果を以下に示す。
【表4】

【0124】
(実施例3:ランダムライブラリー戦略)
緒言
クラミジア・トラコマチス血清型Dゲノム中の血清反応性抗原をスクリーニングするために、ランダム発現ライブラリーを、発現ベクターλgtl1内で構築した。このライブラリーは、β−ガラクトシダーゼを有するフレーム内に融合させた100〜400個のアミノ酸残基からなるクラミジア・トラコマチスのペプチド断片を、ランダムに発現するように設計されていた。ライブラリーを、ウェスタンブロット分析法によってクラミジア・トラコマチスの基本小体(EB)の抽出液全体に対する反応性に基づいて選択した患者の血清を用いてスクリーニングした。
【0125】
材料および方法
高分子量クラミジア・トラコマチス血清型DゲノムDNAの単離
約8.6×109IFU(感染単位)を含有するクラミジア・トラコマチス血清型Dの基本小体の粗調製物を、40,000×gで60分間、44〜54%ジアトリゾ酸溶液で段階密度勾配超遠心分離することによって、さらに精製した。54%界面にバンドを形成した基本小体を採取し、10倍量のSPG緩衝液(250mMスクロース;10mM Na2HPO4;5mM L−グルタミン酸)中に希釈し、30,000×gで30分間遠心分離することによって沈殿させた。基本小体のペレットを、5mlのTENS緩衝液(50mM Tris、pH 9;100mM EDTA;200mM NaCl;1%SDS)中に再懸濁させ、100μg/mlプロテイナーゼKと共に、37℃にて60分間インキュベーションした。試料をTENS緩衝液中に1回希釈し、核酸をフェノール/クロロホルム抽出により精製後、エタノールで沈殿させた(Maniatisら、1987)。RNAを、RNA分解酵素T1およびRNA分解酵素Aの混合物(Stratagene製)25U/mlで、37℃にて60分間処理することによって除去し、フェノール/クロロホルムよる抽出およびエタノールによる沈殿を再度行った。クラミジア・トラコマチス血清型DゲノムDNAの調製物を、TE中に0.4μg/μlで再懸濁させ、一部をアガロースゲル電気泳動法により試験したところ、高分子量、≫50kbのDNAを含有していることが示された。
【0126】
クラミジア・トラコマチスの全ゲノムランダム発現ライブラリーの構築
175μlのTM緩衝液(10mM Tris、pH8;10mM MgCl2)中に50ugのDNAを含有する微量遠心機用チューブを、Soniprep 150超音波処理器(MSE製)内に置かれた氷水浴内に入れて、超音波処理することによって、クラミジア・トラコマチスゲノムDNAのランダムな断片を生成させた。マイクロチップ(1/8インチφ)を試料の表面下約2mmに入れ、超音波処理を15μの振幅で80分間継続的に行った。このような条件下では、ゲノムDNAは、ランダムに分割され、アガロースゲル電気泳動で分析すると、0.05〜1kbの範囲の大きさの断片となっていた。これに続く、超音波処理したCTゲノムDNAのフェノール/クロロホルム抽出およびエタノールによる沈殿工程の調製の過程は、適宜場合によって加えた。約10μgの超音波処理DNA断片の末端の修復およびリン酸化を、T4DNAポリメラーゼ、クレノウDNAポリメラーゼおよびT4ポリヌクレオチドキナーゼを組み合わせてインキュベーションすることにより行った。さらに、ランダム断片化CTゲノムDNAを、EcoRIメチラーゼで処理した後、50倍モル過剰のリン酸化EcoRIリンカー(12塩基、BioLabs製)を用いて、リンカーの連結を行った。DNAをEcoRIで処理し、最終DNA標本は、6%アクリルアミドゲル上でサイズ分画を行い、0.2〜0.8kbの大きさの断片を500μlのGES緩衝液(0.5M酢酸アンモニウム;10mM酢酸マグネシウム;0.1mM EDTA;0.1%SDS)中で42℃にて一晩インキュベーションすることによって、ゲル切片から溶出させた。清澄な上澄みをエタノールで2回沈殿させ、最終的なペレットを10μlのTE中に再懸濁させた。DNAをEcoRIにより消化し、脱リン酸化したλgtl1ファージのベクターアーム(Stratagene製)に連結した。ライゲーションミックスは、Gigapack III Gold抽出液を用いて、メーカー(Stratagene)の指示に従って、in vitroパッケージした。組換えファージを大腸菌Y1090r−上に蒔いて培養し、全部で約340,000種の一次ラムダファージを生成した。IPTGおよびX−galの存在下でファージを蒔いて培養し、青/白選択アッセイから判断すると、これらのうち約60%が、真の組換え
ファージであった。一次ファージ発現ライブラリーを約3×104PFU/135mmφプレートの密度で増殖させた後、採取し、7%v/v DMSO中に小分け分注して、−80℃にて保存した。増殖させたクラミジア・トラコマチスの全ゲノムランダム発現ライブラリーの力価は、6.7×109PFU/mlであった。
【0127】
患者の血清
ランダム発現ライブラリーのスクリーニングにおいて使用した患者の血清のプールは、実施例2において先に記載したものと同一であった。
【0128】
クラミジア・トラコマチスの全ゲノムランダム発現ライブラリーのスクリーニング
増殖させたλgtl1発現ライブラリーを、大腸菌Y1090r−細胞に吸収させ、5×104〜1×105PFU/135mm寒天プレートで蒔き、42℃にて3時間半インキュベーションした。プレートを、水中の10mM IPTGであらかじめ飽和させてから乾燥させたニトロセルロース製のメンブランフィルター(BioTrace NT、Pall Corporation製)上に重ね、37℃にてさらに3.5時間インキュベーションした。フィルターを、1.5%BSAを含有するTBSTに移し、室温にて30分間インキュベーションした後、200倍に希釈した患者の血清のプールと共に室温にて30分間インキュベーションした。過剰な患者の血清を、TBST中で各10分間3回洗浄後、アルカリホスファターゼ結合ウサギ抗ヒト−IgA、−IgGまたは−IgMのいずれかと共に室温にて30分間インキュベーションした。最後に、TBST中で各10分間3回洗浄した後、フィルターをBCIP/NBT基質(Sigma Fast製)で展開した。
【0129】
免疫反応性が陽性のプラークの部分を10個の部分からなるプールに採取し、滴定後、個々の陽性プラークを同定するために、2.5〜5×103PFU/135mm寒天プレートの密度で蒔き、再度スクリーニングした。
【0130】
DNA配列決定および配列解析
個々の陽性として選択されたファージのプラークを、プラークの部分をかき取ることによって採取し、20μlの水中に懸濁させ、10秒間ボルテックスした後、37℃にて15分間インキュベーションした。懸濁液を、微量遠心管中で、最大スピードで30秒間遠心分離し、4.5μlの清澄な上澄みを、それぞれ2.5pmolの順方向プライマー、5’−ccagccatcgccatctgctgcacg−3’、およびλgtl1 EcoRI逆方向プライマー(BioLabs製)、ならびに1容量のHot StarTaq Master Mix(Qiagen製)を使用するPCR法による増幅に使用した。残りのファージ懸濁液を100μlのSM緩衝液中に希釈し、25μlのCHCl3と一緒にして、ファージストックとして4℃にて保存した。
【0131】
PCR法による増幅を、Gene Amp PCR System 9700サーモサイクラー(Applied Biosystem製)内で、95℃で15分間、次いで、95℃で1分間、60℃で1分間および72℃で1分間の30サイクル行った。4μlをアガロースゲル電気泳動によって試験した。増幅したDNAの配列決定のために、PCR反応の残りの6μlを5倍希釈し、MicroSpin S−300 HRカラムを用いて、メーカー(Amersham Biosciences)の指示に従って精製した。配列決定は、28塩基下流でLacZ遺伝子のEcoRIクローニング部位をプライムする、5’−CACCAGACCAACTGGTAATG−3’、または85塩基上流でLacZ遺伝子のEcoRIクローニング部位をプライムする、5’−GCCATCGCCATCTGCTGCACG−3’のいずれかの配列決定プライマーを使用するジデオキシ鎖停止法(MWG-BIOTECH(ドイツ)によって契約)によって行った。配列は、Vector NTI Suiteソフトウェアパッケージ(InforMax製)を用いて解析した。
【0132】
結果:
発現ライブラリースクリーニングによるクラミジア・トラコマチスの血清反応性抗原の同定
一次抗体としてプールした患者の血清を使用したクラミジア・トラコマチスλgtl1発現ライブラリーの第1スクリーニングによって、抗ヒト−IgA、−IgGまたは−IgMのいずれかをそれぞれの第2検出抗体として使用した場合において、いくつかの免疫反応性プラークを同定した。要約すると、88個の陽性プラークの部分を採取し、プールした。
【0133】
再スクリーニングのために採取したプラーク部分の数:
血清反応性のクラス プラークヒット数 スクリーニングのためのプールの数
IgA 24 各12個のプラーク部分からなる2個のプール
IgG 50 各10個のプラーク部分からなる5個のプール
IgM 14 各14個のプラーク部分からなる1個のプール
合計 88 8個のプール
【0134】
生成されたファージプールは、個々の陽性のファージのプラークの同定を可能にするために、培養の密度がはるかに低い以外は、はじめのスクリーニングと同一の条件を使用して再スクリーニングした。要約すると、全部で129個の陽性のプラークを個別に採取し、アノテートした後、直接配列解析およびファージストックの生成のそれぞれに使用した。
【0135】
個別に採取した陽性プラークの数:
血清反応性のクラス 個別のプラーク数
IgA 41
IgG 79
IgM 9
合計 129
【0136】
個別に単離した陽性のファージ中で、β−ガラクトシダーゼ融合体として発現した挿入断片のアイデンティティーを、配列決定法およびBlast解析(EMBL−EBI)によって同定した。
【0137】
CT抗原のアイデンティティーを、ランダム発現ライブラリーをスクリーニングすることによって同定した。
【0138】
全部で103個の個別のプラークの配列を決定し、22個の特有な配列相同性に分類した(PF=ペプチド断片):
CT541−PF1(アミノ酸位置111−243)
CT443−PF1(アミノ酸位置214−291)
CT795−PF1(アミノ酸位置1−163)
CT396−PF1(アミノ酸位置170−318)
CT842−PF1(アミノ酸位置433−515)
CT283−PF1(アミノ酸位置477−577)
CT874−PF1(アミノ酸位置330−426)
CT051−PF1(アミノ酸位置38−177)
CT141−PF1(アミノ酸位置17−126)
CT643−PF1(アミノ酸位置769−841)
CT681−PF1(アミノ酸位置156−391)
CT681−PF2(アミノ酸位置199−329)
CT681−PF3(アミノ酸位置294−349)
CT414−PF1(アミノ酸位置605−722)
CT414−PF2(アミノ酸位置463−530)
CT456−PF1(アミノ酸位置695−840)
CT456−PF2(アミノ酸位置137−229)
CT456−PF3(アミノ酸位置243−321)
CT456−PF4(アミノ酸位置209−291)
CT456−PF5(アミノ酸位置175−279)
CT456−PF6(アミノ酸位置567−730)
CT456−PF7(アミノ酸位置71−180)
CT456−PF8(アミノ酸位置190−279)
CT504−PF1
【0139】
(実施例5:クラミジア・トラコマチス抗原をコードする組換えアデノウイルスの生成)
緒言
T細胞反応性をスクリーニングのために、標的細胞に対するクラミジア・トラコマチス抗原の別の送達経路を探索するために、本発明者らは、患者のPBMCを直接形質導入することによって、抗原をコードする組換えアデノウイルスを構築し、試験した。
【0140】
材料および方法
組換えアデノウイルスのストックの構築
選択されたクラミジア・トラコマチス抗原をコードする組換えアデノウイルスは、基本的にViraPower Adenoviral Gateway Expression System(Invitrogen製)を使用することによって、コザック配列、ACCATGG、の状況におけるATG開始コドンを有するフレーム内のCT遺伝子をpAd/CMV/V5−DEST vector(Invitrogen製)内に導入して、生成した。停止コドンを、CT遺伝子のORFのすぐ下流に導入した。生存組換えアデノウイルスを、形質移入した293A細胞中で、メーカー(Invitrogen)の指示に従って生産した。一次組換えアデノウイルスのストックを凍結解凍法によって調製し、小分け分注して−80℃にて保存した。組換えアデノウイルスのストックの293A細胞中で、TCID50として計る力価を、エンドポイント法によって測定した。
【0141】
結果:
アデノウイルスのストックの調製
直接形質導入し、PBMC標的細胞アッセイにおいてCT抗原を発現させるために、アデノウイルスにおいて完全長クラミジア・トラコマチス抗原をクローン化した。
【0142】
以下のCT抗原が、アデノウイルスのストックとして利用可能:
CT460、CT529、CT579、CT587、CT681、CT509、CT713、CT043、CT511、CT521、CT616。
【0143】
アデノウイルスの形質転換クラミジア・トラコマチス抗原に対するT細胞の応答
4種のアデノウイルス構築物(AdVpCT043、AdVpCT511、AdVpCT521およびAdVpCT616)の免疫学的活性を、9人の患者および4人の対照において調べた(図7)。AdVpCT521は、9人中6人の患者で、強力な(>500pg/ml)IFNγの応答を誘発した。AdVpCT511は、9人中4人の患者で、500pg/mlを上回るIFNγのレベルで認識されたが、AdVpCT616およびAdVpCT043のそれぞれは、3人および2人の患者で、応答が刺激されたのみであった。対照群では、1人の提供者が、AdVpCT511およびAdVpCT521に応答した。
【0144】
(実施例6:齧歯類防御戦略)
緒言
齧歯類防御戦略を使用して、クラミジア抗原の効力を評価した。簡単に説明すると、抗原で免疫化した動物を、C. muridarumに、膣において攻撃感染させる。抗原で免疫化することによる防御能力は、膣のクラミジアの数を定量化し、慢性の病理学的変化をスコア化することによって評価する。ワクチン抗原に対する攻撃前の免疫応答には、脾臓細胞の再刺激後にINFgを定量化することによって、かつ、クラミジア・トラコマチスEB溶菌液に対する血清抗体の反応性および免疫原に対するELISA反応性を評価することによってアクセスする。このモデルで調べた抗原は、Ct015、Ct025、Ct026、Ct030、Ct048、Ct063、Ct078、Ct080、Ct184、Ct521、Ct051、Ct089、Ct175、Ct443、Ct456、Ct511、Ct541、Ct583およびCt603である。
【0145】
材料および方法
動物
C57BL/6Jマウス、雌、8〜12週齢をHarlan Laboratoriesから入手した。マウスを、標準的な環境条件で飼育し、標準的な飼料および水を自由に与えた。マウスの使用は、デンマーク法務省(Lov om dyreforsog、jvf lovbekendelser nr.726 of 9. 1993年9月)および動物保護委員会が進める規制にしたがった。提案する実験の詳細な説明を、申請者による地域の倫理調査委員会(2003/561−786)に提出し、許可を得た。
【0146】
Chlamydia muridarum
C. muridarumを、HeLa229細胞(ATCC製、Rockville、メリーランド州、米国)中で増殖させた。HeLa細胞を、完全培地(RPMI−1640(Gibco BRL製);5%熱不活性化ウシ胎児血清(Cambrex bioscience製);1%v/v Hepes;1%v/v L−グルタミン、1%v/vピルビン酸、および10μg/mlのゲンタマイシン中で増殖させた。175cm2のフラスコ内に蒔いたHeLa229細胞のサブコンフルエントな単層を、Hanks緩衝食塩溶液(HBSS)中の45μg/ml DEAE−デキストランで、室温にて15分間前処理した後、3mlのHBSS中の1MOI(すなわち、1封入体形成単位(IFU)のC. muridarum/HeLa細胞)に感染させた。37℃にて2時間インキュベーション後に、5%グルコースおよび1μg/mlのシクロヘキシミドを追加した50mlの完全培地を加え、感染させた細胞は、5%のCO2を含有する加湿したインキュベーター内で42〜44時間さらにインキュベーションした。適切な量の標的細胞内の封入体の存在を顕微鏡的に確認した後、単層を、セルスクレーパーを用いてフラスコから取り出し、4℃にて35,000gで30分間遠心分離した。ペレットを、フラスコあたり5mlのHBSS中に再懸濁させ、氷上で2×1000ジュールで超音波処理後、4℃にて500gで15分間遠心分離した。上澄みを採取し、氷上で保存した。ペレットを、5mlのHBSS中に再懸濁させ、最終ステップとして、超音波処理および遠心分離を行った。上澄みをプールし、4℃にて30,000gで30分間遠心分離し、ペレットをSPG緩衝液(250mMスクロース;10mM Na2HPO4;5mM L−グルタミン酸)中に再懸濁させた。短時間の超音波処理の後、懸濁液を、30%ジアトリゾ酸溶液上に穏やかに層状に置き、40,000gで30分間遠心分離した。遠心分離後、ペレットを、SPG緩衝液中に再懸濁させ、−70℃で保存した。
【0147】
C. muridarum調製物の感染力を、McCoy細胞上で滴定することによって定量化後、免疫蛍光アッセイで、封入体を数え上げた。簡単に説明すると、90〜95%サブコンフルエントなHeLa229の単層を、滴定した接種材料と共に室温にて750gで1時間遠心分離した後、35℃にて2時間インキュベーションした。接種材料を、5%グルコースおよび1μg/mlのシクロヘキシミドを追加した完全培地で置き換え、37℃にて42〜44時間さらにインキュベーションした。染色するために、細胞を99%の氷冷したエタノール中で、15分間固定した。固定した細胞を、ウサギポリクローナル抗−クラミジアMOMP抗体と共に1時間インキュベーションした後、FITC標識化ブタ−抗ウサギIg抗体で二次染色した。細胞を、ヨウ化プロピジウムで対比染色した。20高出力(×40)電界における封入陽性細胞を、蛍光顕微鏡を用いて数え上げて、C. muridarumストックの感染力を定量化した(IFU/μlで表示)。
【0148】
マウスの感染
マウスを、膣内において、105〜107IFU(100〜10,000ID50)で感染させた。感染は、接種後第7日目および第14日目に頚膣部の拭き取りを得て、蛍光染色し、検体中の感染単位を数え上げることによってモニターした。
【0149】
免疫
マウスを、尾の底部において、皮下(sc)で、2週間の間隔をおいて3回免疫化した。ワクチンは、250μgのDDAおよび100μgのTDB中に乳化させた1〜5μgのペプチド(上記を参照)で構成されていた。陰性対照として、ペプチドを含有しないDDA/TDBを単独で注射した。陽性対照として、マウスを、105IFUのC. muridarumに、55〜75日間、鼻腔内感染させた。鼻腔内感染させた場合、マウスは、ほとんど完全に防御され、膣からの感染により誘発された防御に匹敵するものであった。
【0150】
リンパ球の培養、血清抗体および免疫誘発能力の評価
強力な免疫応答を誘発する能力を評価するために、脾臓を、最後の免疫化後第21日目に取り出し、組織を金属製メッシュで擦り通すことによって脾臓のリンパ球を得て、単一の細胞懸濁液とし、RPMI−1640中で、室温にて800gで1回洗浄後、再刺激培地(RPMI−1640、Gibo製;10%熱不活性化ウシ胎児血清、Biochrom AG製、ベルリン;ペニシリンG、100U/ml;ストレプトマイシン、100μg/ml;10mM Hepes;2mM L−グルタミン;1mMピルビン酸)中に再懸濁した。
【0151】
単離した細胞を、三連で、丸底96ウェルプレート内で、200μlの再刺激培地中、2×105細胞/ウェルで培養した。ペプチドを0.08〜5μg/mlの範囲の濃度で添加し、72時間インキュベーションした。陰性および陽性対照(培地または5μg/ConAのいずれか)は、必要に応じて、すべての実験で含められた。再刺激後、上澄みを収集し、IFNγを酵素結合免疫吸着測定法(Brandt、Elhayら、2000)によって定量化した。臨界である2000pg/μl超の高いレベルのIFNγをもたらすワクチンの候補は、Ct015、Ct025、Ct026、Ct030、Ct048、Ct063、Ct078、Ct080、Ct184、Ct521、天然C. muridarumのMOMP、Ct051、Ct175、Cy443、Ct456およびCt603であった(図16)。
【0152】
同一の時点で、眼房から血液検体を採取し、血清を調製した。クラミジア・トラコマチス血清型DおよびC. muridarumの基本小体に対する反応性について、ウェスタンブロット解析法(Theisen、Soeら、2004)によって、血清を試験した。簡単に説明すると、密度勾配によって精製した基本小体を、4〜12%ポリアクリルアミドゲルで電気泳動し、ニトロセルロース上にエレクトロブロット後、Mesh緩衝液中のスキムミルク中でブロックした。血清のプール(それぞれのワクチン群から各4匹)を、100倍に希釈し、ブロットを加え、1時間インキュベーションし、洗浄後、アルカリホスファターゼ結合二次抗体を加え、さらに1時間インキュベーションした。反応は、BCIP/NBT(Sigma製)基質を加えてインキュベーションすることによって可視化した。観察された大きさが理論的な大きさと一致する場合、バンドを陽性と評価した。陽性は、Ct015、Ct030、Ct048、Ct078、Ct184およびCt521(図15)であった。
【0153】
免疫化に使用した組換えタンパク質および熱不活性化したC. muridarumの基本小体に対する反応性について、ELISA法(Rosenkrands、Aggerら、2005)によって、血清を試験した。簡単に説明すると、プレートを炭酸緩衝液o/n中の抗原(0.5μg/ml)でコーティングし、BSAでブロック後、洗浄した。プレートに、あらかじめ希釈した検体を加え、室温にて2時間インキュベーションし、洗浄後、ペルオキシダーゼ結合二次抗体を加え、1時間インキュベーションした。反応は、TMB基質を加えてインキュベーションすることによって可視化し、この反応を、硫酸を加えて停止し、450nmにおいて読み取った。データに4パラメーターフィットを適用した後、OD=1.0における力価を計算した(図14)。IgG1が高い抗原は、Ct015およびCt030であった。IgG2bが高い抗原は、Ct063、Ct521Highであった。
【0154】
防御効力の評価
ワクチンの効力を評価するために、第1回目の免疫化の8〜12週間後に、105〜107IFU(100〜10,000ID50)で膣内感染させることによって、マウスを攻撃した。ワクチン候補の防御効力を、病理学的評価および頚膣部の拭き取りにより得た感染単位を数え上げることによってモニターした。
【0155】
細菌数は、攻撃の7、14および/または21日後に得た頚膣部の拭き取りによって測定した。拭き取り検体を、1mlのSPG緩衝液に、4℃にて、準備ができるまで浸した。同じ日に、検体をmmガラスビーズの存在下全速で30秒間ボルテックスすることによって、C. muridarumの基本小体を、拭き取り検体から機械的に振り落とした。緩衝液をエッペンドルフチューブに移し、分析するまで−80℃にて保存した。上記に準じて、免疫蛍光アッセイで、サブコンフルエントなMcCoy細胞への封入体を数え上げることによって、感染性の基本小体を定量化した(図8)。PID7における拭き取り検体のIFUの数え上げ後に防御を誘発する抗原は、Ct015、Ct025、Ct048、Ct184、Ct521、Ct443、Ct603および天然C. muridarumのMOMPである。
【0156】
病理学的には、PID49において、急性および慢性の病態の徴候に関して、生殖器官全体を顕微鏡的に評価した。肉眼的な病理学的評価から、卵管水腫のスコアを計算した。スコアは、個々のワクチン群における卵管水腫の卵管の全数に対する比として計算した(図9)。PID42において、かなりの防御を誘発した抗原は、Ct025、Ct063、Ct184、Ct521である。
【0157】
入手可能な材料に基づくと、Ct184およびCt521が、攻撃モデルにおいて最も効果が高い抗原である。Lipovaccに処方すると、これらは、膣クラミジアに対して、最も少ない病態および最良の防御を誘発している。
【0158】
(実施例7:全ゲノムランダム発現ライブラリーを使用したクラミジア・トラコマチスの特異的T細胞エピトープのスクリーニング)
緒言
患者のPBMC内のT細胞の増殖を刺激する、有望なクラミジア・トラコマチスの特異的な抗原標的を直接スクリーニングするために、全ゲノムランダム発現ライブラリーを使用した。(溶原菌ファージの増殖を促進する)溶原菌宿主細菌Y1089r−内でβ−ガラクトシダーゼと融合した組換えポリペプチドを発現する、ランダムに選択されるλgtl1ファージを発現する細菌のプールを、患者のPBMC細胞に直接投与する。細菌が発現したクラミジア・トラコマチスの抗原に暴露されたことにより、おそらくは特異的なエフェクターT細胞を介して、インキュベーション中に患者のPBMCが活性化されるが、そのインキュベーション後、細菌をさらに増殖させるために、抗生物質を添加することによって、混合物を清澄化し、実施例1の記載に基本的に準じて、さらに2〜4日間インキュベーションする。読み取りは、INFγおよび/または特異的なT細胞の増殖であり得る。
【0159】
理論的には、個々のランダムに発現される大きさが0.4〜0.8kbのクラミジア・トラコマチスの遺伝子配列を含有する全ゲノムランダム発現ライブラリーは、約1:10,000の個々のラムダクローンにおいて、いずれの遺伝子配列をも(正しい配向で、かつ融合パートナー、β−ガラクトシダーゼを有するリーディングフレームにおいて)網羅する。したがって、それぞれ500〜1000個のランダムに選択される細菌のクローンを含有する10〜20個のプールをスクリーニングすれば、クラミジア・トラコマチスのゲノム全体を網羅することになる。Aldersonら(2000)によるデータから、わずか104のT細胞を含有する106もの対照細菌/ウェルを添加したところ、低レベルの非特異的INFγおよび増殖しか得られなかったことが示されている。顕著でかつ特異的なINFγの放出および特異的T細胞の増殖は、わずか104のT細胞を含有する、わずか103の抗原特異的な細菌/ウェルを添加することによって認められた。したがって、105のPBMC細胞/ウェルに添加される500個の異なる個々のクローンを含有する106の細菌を有するプールは、各ウェルにおいて、T細胞の集団を、特定の組換え融合体を特異的に発現する2000個の細菌に暴露することができる。
【0160】
材料および方法
β−ガラクトシダーゼ/CT521融合体を発現するλgtl1ファージクローンの構築
陽性のT細胞エピトープ標的対照として使用するためにλgtl1−βgal/CT521を構築した。CT521をコードする完全長の配列を、鋳型としてクラミジア・トラコマチス血清型DゲノムDNA、ならびに特異的な順方向プライマー、5’−TATAGAATTCATGTTAATGCCTAAACGAACAAAA−3’、および逆方向プライマー、5’−TATAGAATTCTTATACCCTTTCCACACGCTTAACAAATCG−3’を使用してPCR法によって増幅した。この逆方向プライマーは、β−ガラクトシダーゼオープンリーディングフレームを有するフレーム内におけるλgtl1発現ベクターのEcoRIクローニング部位へのクローニングのためにEcoRI部位を含有していた。クローン化した組換えファージ構築物を、正しい配向および配列に関して、個々のファージプラークの配列を直接決定する(実施例3を参照)ことによって確認した。
【0161】
λgtl1溶原菌ライブラリーとしてのクラミジア・トラコマチスの全ゲノムランダム発現ライブラリーの調製
Y1089r−中のクラミジア・トラコマチスの全ゲノムランダム発現ライブラリーの溶原菌の細菌ストックを、Singhら(1989)によって記載されている方法に基本的に準じて構築した。
【0162】
(実施例8)
10人のクラミジア患者および5人の対照からPBMCを単離し、先の記載(実施例1)に準じて、培養した。細胞培養物を、1.25×105のPBMCの三連の培養物として確立し、5μgのタンパク質で刺激した。抗原を含有しない細胞培養物を陰性対照(C)として含め、PHA(2μg/ml)を分裂促進性の陽性対照として使用した(結果は示されていない)。以下の抗原を試験した。CT043、CT008 CT016 CT025 CT026、CT048、CT098、CT110、CT125、CT155、CT003、CT005、CT023、CT027、CT028、CT032、CT035、CT078、CT082、CT093、CT111、CT123、CT126、CT133、CT175、CT184、CT002、CT009、CT015、CT061、CT063、CT068、CT071、CT080;CT089、CT141、CT509、CT803、CT004、CT030、CT038、CT040、CT052、CT053、CT067、CT511、CT583、CT603、CT681、CT265、CT323、CT322、CT342、CT357r、CT375、CT376、CT456、CT213、CT168、CT396、CT443、CT587、CT610、CT679、CT842、CT875、CT561、CT659、CT112、CT124、CT150、CT201、CT245、CT246、CT405、CT420、CT426、CT507、CT512、CT513、CT514、CT516、CT316、CT439、CT492、CT520、CT523、CT526、CT611、CT613、CT626、CT630、CT647、CT649、CT725、CT734、CT779、CT801、CT833、CT835、CT836、CT845およびCT541(図10)。
【0163】
図10に示すように、ヒトによる認識の程度は多様である。強力かつ高頻度で認識されるものがある−5人以上の患者が、全対照を超えるIFNγのレベルで応答している。これらには、CT375、CT376、CT004、CT048、CT078、CT110、CT583、CT603、CT681、CT184、CT175、CT025、CT002、CT015、CT063、CT456、CT168、CT396、CT443、CT124、CT028、CT030、CT43、CT048、CT080、CT111、CT316、CT322、CT342、CT375、CT492、CT512、CT520、CT521、CT523、CT541、CT611、CT613、CT630、CT649、CT734、CT801、CT803(図11)が含まれ、その他は、まったく認識されていない(例えば、CT071、CT133、CT005)。
【0164】
(実施例9)
抗体標的の複数抗原プリントイムノアッセイ(Mapia:Multiple Antigen Print Immunoassay)試験−Lyashchenkoら(2000)の記載に基本的に順ずる。簡単に説明すると、実施例2および3の抗原を、実施例1の記載に準じて、精製した。抗原をニトロセルロース製の膜上にプリントし、患者の血清および対照血清(各20個)に対する反応を試験した。対照は、目視によるカットオフを定義するために使用した。目視によるカットオフを上回る明確な反応を示した患者の血清を、陽性とみなし、1〜20個の陽性として順位付けた。
【表5】

【0165】
(実施例10:C3H/HeNマウスにおける防御戦略)
このモデルにおいて試験した抗原は、CT521、TC0052(muridarumの主要外膜タンパク質)およびこれら2種のタンパク質の組合せである。
【0166】
材料および方法
動物
C3H/HeNマウス、雌、8〜12週齢をHarlan Laboratoryから入手した。マウスを、標準的な環境条件で飼育し、標準的な飼料および水を自由に与えた。
【0167】
Chlamydia muridarum
実施例6の記載に準じて、C. muridarumを、HeLa229細胞中で増殖させ、収集した。
【0168】
マウスの感染
マウスを、子宮内において、105IFUで感染させた。感染を、接種後第7日目および第14日目および第21日目に、頚膣部の拭き取り後、実施例6の記載に準じて、蛍光染色し、検体中の感染単位を数え上げることによってモニターした。
【0169】
免疫
マウスを、尾の底部において、皮下(sc)で、2週間の間隔をおいて3回免疫化した。ワクチンは、250μgのDDAおよび100μgのTDB中に乳化させた5μgのrCT521、5μgのrTC0052、またはそれらの組合せ(5μgのrCT521+5μgのrTC0052)で構成されていた。陰性対照として、タンパク質を含有しないDDA/TDBを単独で注射した。
【0170】
リンパ球の培養および免疫誘発能力の評価
強力な免疫応答を誘発する能力を評価するために、血液検体を、眼房から最後の免疫化後第7日目に取り出し、グループ(マウス10匹)としてプールし、血液リンパ球を、密度勾配により精製後、再刺激培地(RPMI−1640、Gibo製;10%熱不活性化ウシ胎児血清、Biochrom AG製、ベルリン;ペニシリンG、100U/ml;ストレプトマイシン、100μg/ml;10mM Hepes;2mM L−グルタミン;1mMピルビン酸)中に再懸濁した。
【0171】
単離した細胞を、三連で、丸底96ウェルプレート内で、200μlの再刺激培地中、2×105細胞/ウェルで培養した。タンパク質を、0.31〜10μg/mlの範囲の濃度で添加し、72時間インキュベーションした。陰性および陽性対照(培地または5μg/ConAのいずれか)を含めた。再刺激後、上澄みを収集し、IFNγを、酵素結合免疫吸着測定法(Brandtら、2000)によって定量化した(図12)。rCT521を用いた免疫化により、rCT521による再刺激に応答して、強力なIFNγの放出が誘発され、rCT521のエピトープの対応付け(実施例1に記載されているペプチド)により、P4(アミノ酸40〜62)が、ドミナントなエピトープであることが明らかになった(図12a)。同様に、rTC0052を用いた免疫化によっても、相同なタンパク質に応答して、強力なIFNγの放出が誘発された(図12b)。興味深いことに、rCT521とrTC0052との混合物は、rCT521単独による免疫化に比べ、rCT521への応答を非常に効率よく促進した(図12c)。
【0172】
防御効力の評価
ワクチンの効力を評価するために、第1回目の免疫化の10週間後に、105で膣内感染させることによって、マウスを攻撃した。ワクチン候補の防御効力を、実施例6の記載に準じて、頚膣部の拭き取りにより得た感染単位を数え上げることによってモニターした。rCT521およびrTC0052はいずれも、高いレベルの防御を誘発し、2種のタンパク質の組合せは、防御に対して正の付加効果を有した(図13)。rCT521を用いた防御実験を、C3H/HeNマウスで繰り返したところ、同様な結果が得られ、BALB/c×C57BL/6j F1マウスにおいても、rCT521を用いた免疫化後に高いレベルの防御が認められている(結果は示されていない)。
【0173】
(参考文献)
Alderson, M. R., Bement, T., Day, C. H., Zhu, L., Molesh, D., Sleiky, Y. A. W., Coler, R., Lewinsohn, D. M., Reed, S. G., and Dillon, D. C. (2000). "Wxpression cloning of an immunodominant family of Mycobacterium tuberculosos antigen using human CD4+ T cells.(ヒトCD4+ T細胞を使用した免疫優性なファミリーの結核菌抗原の発現クローニング)" J. Exp. Med. 191(3): 551-9.
Andersen, P. and I. Heron (1993). "Simultaneous electroelution of whole SDS-polyacrylamide gels for the direct cellular analysis of complex protein mixtures.(複合タンパク質混合物の直接細胞分析のための全SDS−ポリアクリルアミドゲルの同時電気溶出)" J Immunol Methods 161(1): 29-39.
Brandt, L., M. Elhay, et al. (2000). "ESAT-6 subunit vaccination against Mycobacterium tuberculosis.(結核菌に対するESAT−6サブユニットの予防接種)" Infect Immun, 68(2): 791-5.
Brunham, R. C. (1999). Human immunity to Chlamydia. Chlamydia Intracellular biology, Pathogenesis, and Immunity.(クラミジアに対するヒトの免疫。クラミジアの細胞内生物学、病原性および免疫)R. S. Stephens. Washington,D. C., ASM Press: 211-238.
Cote-Sierra, J., E. Jongert, et at. (1998). "A new membrane-bound Oprl lipoprotein expression vector. High production of heterologous fusion proteins in gram (-) bacteria and the implications for oral vaccination.(新しい膜結合Oprlリポタンパク質発現ベクター。グラム陰性菌における異種融合タンパク質の高生成および経口ワクチンへの影響)" Gene 221(1): 25-34.
Cotter, T. W., Q. Meng, at al. (1995). "Protective efficacy of major outer membrane protein-specific immunoglobulin A (IgA) and IgG monoclonal antibodies in a murine model of Chlamydia trachomatis genital tract infection.(クラミジア・トラコマチス生殖器感染のマウスモデルにおける主要外膜タンパク質特異的免疫グロブリンA(IgA)およびIgGのモノクローナル抗体の防御効力)" Infect. Immun. 63(12): 4704-4714.
Fling, S. P., R. A. Sutherland, at al. (2001). "CD8+ T cells recognize an inclusion membrane-associated protein from the vacuolar pathogen Chlamydia trachomatis.(CD8+ T細胞は液胞性病原体クラミジア・トラコマチスの封入膜関連タンパク質を認識する)" Proc. Natl. Acad. Sci. U.S.A 98(3): 1160-1165.
Goodall, J. C., G. Yeo, et al. (2001). "Identification of Chlamydia trachomatis antigens recognized by human CD4+ T lymphocytes by screening an expression library.(発現ライブラリーのスクリーニングによるヒトCD4+ Tリンパ球に認識されるクラミジア・トラコマチス抗原の同定)" Eur. J. Immunol. 31(5): 1513-1522.
Gosselin, E. J., K. Wardwell, at al. (1992). "Enhanced antigen presentation using human Fc gamma receptor (monocyte/macrophage)-specific immunogens.(ヒトFcγ受容体(単核球/マクロファージ)特異的免疫原を使用する抗原提示の促進)" J Immunol 149(11): 3477-81.
Grayston, J. T. and S. P. Wang (1978). "The potential for vaccine against infection of the genital tract with Chlamydia trachomatis.(クラミジア・トラコマチス生殖器感染に対するワクチンの可能性)" Sex Transm. Dis. 5: 73-77.
Gu, L., W. M. Wenman, et al. (1995). "Chlamydia trachomatis RNA polymerase alpha subunit: sequence and structural analysis.(クラミジア・トラコマチスRNAポリメラーゼのαサブユニット:配列および構造解析)" J. Bacteriol. 177(9): 2594-2601.
Harboe, M., T. Oettinger, et al. (1996). "Evidence for occurrence of the ESAT-6 protein in Mycobacterium tuberculosis and virulent Mycobacterium bovis and for its absence in Mycobacterium bovis BCG.(ESAT−6タンパク質が、ヒト型結核菌および病原性ウシ型結核菌には存在し、ウシ型結核菌BCGには存在しない証拠)" Infect Immun 64(1): 16-22.
Hassell, A. B., D. J. Reynolds, et al. (1993). "Identification of T-cell stimulatory antigens of Chlamydia trachomatis using synovial fluid-derived T-cell clones.(滑液由来T細胞クローンを使用するクラミジア・トラコマチスのT細胞刺激性抗原の同定)" Immunology, 79(4): 513-519.
Katz, B. P., B. E. Batteiger, et al. (1987). "Effect of prior sexually transmitted disease on the isolation of Chlamydia trachomatis.(過去の性感染症のクラミジア・トラコマチスの単離に及ぼす影響)" Sex Transm. Dis. 14(3): 160-164.
Kilgus, J., T. Jardetzky, et al. (1991). "Analysis of the permissive association of a malaria T cell epitope with DR molecules.(マラリアT細胞エピトープのDR分子との許容的な結合の分析)" J Immunol 146(1): 307-15.
Kubo, A. and R. S. Stephens (2000). "Characterization and functional analysis of PorB, a Chlamydia porin and neutralizing target.(PorB、クラミジアのポリンおよび中和標的の特徴づけおよび機能解析)" Mol. Microbiol. 38(4): 772-780.
LaVerda, D., L. N. Albanese, et al. (2000). "Seroreactivity to Chlamydia trachomatis Hsp10 correlates with severity of human genital tract disease.(クラミジア・トラコマチスHsp10の血清反応性は、ヒト生殖器疾患の程度と相関する)" Infect. Immun. 68(1): 303-309.
McCafferty, J., A. D. Griffiths, et al. (1990). "Phage antibodies: filamentous phage displaying antibody variable domains.(ファージ抗体:抗体可変ドメインを提示する糸状ファージ)" Nature 348(6301): 552-4.
Morrison, R. P. and H. D. Caldwell (2002). "Immunity to murine chiamydial genital infection.(マウスのクラミジア性器感染に対する免疫)" Infect Immun 70(6): 2741-51.
Morrison, S. G., H. Su, et al. (2000). "Immunity to murine Chlamydia trachomatis genital tract reinfection involves B cells and CD4(+) T cells but not CD8(+) T cells.(マウスのマチス生殖器再感染に対する免疫には、B細胞およびCD4(+)T細胞が関与するが、CD8(+)T細胞は関与しない)" Infect. Immun. 68(12): 6979-6987.
Ortiz, L., K. P. Demick, et al. (1996). "Chlamydia trachomatis major outer membrane protein (MOMP) epitopes that activate HLA class II-restricted T cells from infected humans.(感染したヒトのHLAクラスII拘束性T細胞を活性化するクラミジア・トラコマチスの主要外膜タンパク質(MOMP)エピトープ)" J Immunol 157(10): 4554-67.
Pal, S., K. M. Barnhart, et al. (1999). "Vaccination of mice with DNA plasmids coding for the Chlamydia trachomatis major outer membrane protein elicits an immune response but fails to protect against a genital challenge.(クラミジア・トラコマチスの主要外膜タンパク質をコードするDNAプラスミドを用いた予防接種は、免疫応答を誘発するが、性器曝露に対する防御は得られない)" Vaccine 17(5): 459-465.
Pal, S., I. Theodor, et al. (2001). "Immunization with the Chlamydia trachomatis mouse pneumonitis major outer membrane protein can elicit a protective immune response against a genital challenge.(クラミジア・トラコマチスのマウスの間質性肺炎の主要外膜タンパク質を用いた予防接種は、性器曝露に対する防御免疫応答を誘発することができる)" Infect. Immun. 69(10): 6240-6247.
Pearson, W. R. and D. J. Lipman (1988). "Improved tools for biological sequence comparison.(生物学的配列比較手段の改良)" Proc Natl Acad Sci U S A 85(8): 2444-8.
Ravn, P., A. Demissie, et al. (1999). "Human T cell responses to the ESAT-6 antigen from Mycobacterium tuberculosis.(結核菌のESAT−6抗原に対するヒトT細胞応答)" J Infect Dis 179(3): 637-45.
Rolph, M. S. and I. A. Ramshaw (1997). "Recombinant viruses as vaccines and immunological tools.(ワクチンおよび免疫学的手段としての組換えウイルス)" Curr Opin Immunol 9(4): 517-24.
Rosenkrands, I., E. M. Agger, et al. (2005). "Cationic liposomes containing mycobacterial lipids: a new powerful Th1 adjuvant system.(マイコバクテリアの脂質を含有するカチオン性リポソーム:新しい強力なTh1アジュバント系)" Infect Immun, 73(9): 5817-26.
Schachter, J., J. Moncada, et al. (1988). "Nonculture methods for diagnosing chlamydial infection in patients with trachoma: a clue to the pathogenesis of the disease?(トラコーマ患者のクラミジア感染診断の非培養法:疾患の病原の糸口?)" J. Infect. Dis. 158(6): 1347-1352.
Shaw, J., V. Grund, et al. (2002). "Dendritic cells pulsed with a recombinant chlamydial major outer membrane protein antigen elicit a CD4(+) type 2 rather than type 1 immune response that is not protective.(組換えクラミジア主要外膜タンパク質抗原と共にパルスを加えた樹状細胞は、防御性のないCD4(+)タイプ1ではなく、CD4(+)タイプ2の免疫応答を誘発する)" Infect. Immun. 70(3): 1097-1105.
Sinigaglia, F., M. Guttinger, et al. (1988). "A malaria T-cell epitope recognized in association with most mouse and human MHC class II molecules.(大部分のマウスおよびヒトのMHCクラスII分子に関連して認識されるマラリアT細胞エピトープ)" Nature 336(6201): 778-80.
Starnbach, M. N., W. P. Loomis, et al. (2003). "An inclusion membrane protein from Chlamydia trachomatis enters the MHC class I pathway and stimulates a CD8+ T cell response.(クラミジア・トラコマチスの封入膜タンパク質は、MHCクラスI経路に入り、CD8+ T細胞応答を刺激する)" J Immunol 171(9): 4742-9.
Stephens, R. S., S. Kalman, et al. (1998). "Genome sequence of an obligate intracellular pathogen of humans: Chlamydia trachomatis.(ヒトの偏性細胞内病原体であるヒトクラミジア・トラコマチスのゲノム配列)" Science 282(5389): 754-759.
Stephens, R. S., E. A. Wagar, et al. (1988). "High-resolution mapping of serovar-specific and common antigenic determinants of the major outer membrane protein of Chlamydia trachomatis.(クラミジア・トラコマチスの主要外膜タンパク質の血清特異的および共通抗原決定基の高分解能マッピング)" J. Exp. Med. 167(3): 817-831.
Stryhn, A., L. O. Pedersen, et al. (1996). "Peptide binding specificity of major histocompatibility complex class I resolved into an array of apparently independent subspecificities: quantitation by peptide libraries and improved prediction of binding.(明らかに独立の下位特異性に分離した一群の主要組織適合複合体クラスIのペプチド結合特異性:ペプチドライブラリーの定量化および結合予測の向上)" Eur J Immunol 26(8): 1911-8.
Su, H. and H. D. Caldwell (1995). "CD4+ T cells play a significant role in adoptive immunity to Chlamydia trachomatis infection of the mouse genital tract.(CD4+ T細胞は、マウスのクラミジア・トラコマチス生殖器感染に対する養子免疫において重要な役割をになっている)" Infect. Immun. 63(9): 3302-3308.
Su, H., M. Parnell, et al. (1995). "Protective efficacy of a parenterally administered MOMP-derived synthetic oligopeptide vaccine in a murine model of Chlamydia trachomatis genital tract infection: serum neutralizing IgG antibodies do not protect against chlamydial genital tract infection.(クラミジア・トラコマチス生殖器感染のマウスモデルにおけるMOMP由来合成オリゴペプチドワクチンの非経口投与による防御効力:血清中和IgG抗体は、クラミジア生殖器感染を防御しない)" Vaccine 13(11): 1023-1032.
Theisen, M., S. Soe, et al. (2004). "A Plasmodium falciparum GLURP-MSP3 chimeric protein; expression in Lactococcus lactis, immunogenicity and induction of biologically active antibodies.(熱帯熱マラリア原虫GLURP−MSP3キメラタンパク質:ラクトコッカスラクティス中での発現、免疫原性および生物学的に活性な抗体の誘発)" Vaccine 22(9-10): 1188-98.
Tipples, G. and G. McClarty (1995). "Cloning and expression of the Chlamydia trachomatis gene for CTP synthetase.(クラミジア・トラコマチスのCTPシンテターゼ遺伝子のクローン化および発現)" J. Biol. Chem. 270(14): 7908-7914.
Ulmer, J. B., J. J. Donnelly, et al. (1993). "Heterologous protection against influenza by injection of DNA encoding a viral protein.(ウイルスタンパク質をコードするDNAの注射によるインフルエンザに対する異種性の防御)" Science 259(5102): 1745-9.
Wang, S. P., J. T. Grayston, et al. (1967). "Trachoma vaccine studies in monkeys.(サルにおけるトラコーマワクチンの研究)" Am. J. Ophthalmol. 63(5): Suppl-30.
Zhang, D. J., X. Yang, et al. (1999). "Characterization of immune responses following intramuscular DNA immunization with the MOMP gene of Chlamydia trachomatis mouse pneumonitis strain.(クラミジア・トラコマチスのマウス間質性肺炎株のMOMP遺伝子を用いた筋肉内からのDNAによる免疫化後の免疫応答の特徴づけ)" Immunology 96(2): 314-321.
Zhang, Y., J. Tao, et al. (1997). "Elongation factor Ts of Chlamydia trachomatis: structure of the gene and properties of the protein.(クラミジア・トラコマチスの伸長因子Ts:遺伝子の構造およびタンパク質の性質)" Arch. Biochem. Biophys. 344(1): 43-52.
【技術分野】
【0001】
(発明の分野)
本発明は、クラミジア・トラコマチスに由来するポリペプチドおよび核酸に基づいた免疫原性ポリペプチドならびに免疫原性組成物のワクチンおよび診断薬としての使用を開示するものである。
【背景技術】
【0002】
(一般的背景)
クラミジア種は、動物およびヒトの両方において、広範な疾患の原因となる。特に重要なのは、偏性細胞内細菌であるクラミジア・トラコマチスであり、これは、上皮細胞に感染し、そこで増殖する。クラミジア・トラコマチスは、先進諸国においては、性感染症(STD)の最も頻繁な原因であり、発展途上国においては、眼疾患の最も共通の原因である(Schachter、Moncadaら、1988)。世界全体で、9200万人がクラミジア感染を保有していると推定されている(WHO、1999)。
【0003】
クラミジア性感染症は、治療をしないと長引き、完全な排除までには、治療開始後12カ月以上を要することが多い。感染中に誘発された防御免疫は、血清変異株に特異的であって持続しないと考えられており、したがって、頻繁に再感染を起こし得る(Katz、Batteigerら、1987)。これらの状況、すなわち感染が長引くこと、および再感染の可能性があることのために、骨盤の炎症性疾患、不妊症および子宮外妊娠を含む重症の続発症を発症する恐れがある(Branham、1999)。
【0004】
クラミジア感染は、抗生物質療法によって効果的に制御することができる。しかし、無症状の症例が多いことから、クラミジアの持続的な制御は、有効なクラミジアワクチンの開発によって、ようやく達成が可能となるであろう。過去数十年にわたり、クラミジア感染に対するワクチンに対して多くの努力がなされてきたが、これまでのところ、ワクチンの開発には至っていない。
【0005】
このような状況下、クラミジアに対するワクチンの開発は、緊急課題である。クラミジアに対する防御物質を定義する多くの試みがなされている。しかし、特異的な長期にわたる防御免疫応答は、いまだに達成されていない。過去数十年にわたり、クラミジア感染に対するワクチンを開発する多くの努力がなされてきたが、これまでのところ、ワクチンの開発には至っていない。初期の努力の一部は、トラコーマの制御を重点的に取り扱い、生存している生物体の全体または不活性化した生物体の全体を抗原として使用して、ヒトおよびサルを免疫した(Wang、Graystonら、1967;GraystonおよびWang、1978)。不活性化した全細胞ワクチンを用いて、小児に予防接種をしたところ、はじめは防御が得られたが、この防御は、血清型に特異的で、持続しなかった(GraystonおよびWang、1978)。さらに、部分的に防御された個人が再感染すると、予防接種されていない対照で起きた疾患よりも症状の重い臨床疾患に至った(GraystonおよびWang、1978)。不活性化した生物体の全体を用いた初期の試みが、過敏症反応と思われるいくつかの症例に至った事実から、サブユニットワクチンの開発が試みられるようになった。
【0006】
クラミジア・トラコマチスは、クラミジアワクチンの生産に関係する可能性があるいくつかのタンパク質を、保持および分泌する。長年の間、候補分子の探索では、感染体である基本小体(EB:Elementary Body)の表面に結合するタンパク質が重点的に取り扱われてきた。多くのそのようなタンパク質が特徴付けられたにも関わらず、これらの数個のみが、動物モデルにおいてサブユニットワクチンとして部分的な防御の誘発を示したにすぎない。はじめて記載された免疫原性分子は、主要外膜タンパク質(MOMP:major outer membrane protein)であり、したがって、この分子は、候補ワクチンとして、非常に詳細に研究されてきている。しかし、クラミジア・トラコマチスまたは組換え調製物から抽出したMOMPで種々の動物を免疫する多くの試みがなされたが、一貫した結果は得られなかった(Su、Parnellら、1995;Pal、Barnhartら、1999;Zhang、Yangら、1999;Pal、Theodorら、2001;Shaw、Grundら、2002)。MOMPのワクチンとしての効果が比較的低い理由は、不明であるが、不適切なアジュバントもしくは送達系、またはタンパク質の未変性構造を模倣していないMOMP免疫原の使用が原因である可能性がある(Pal、Theodorら、2001)。
【0007】
より最近になって、その他の免疫原性分子がいくつか、同定されている(Hassell、Reynoldsら、1993;KuboおよびStephens、2000;LaVerda、Albaneseら、2000;Fling、Sutherlandら、2001;Goodall,Yeoら、2001;Starnbach、Loomisら、2003)。
【0008】
クラミジア・トラコマチスに対する免疫は、いつくかの基本的な特徴によって特徴付けられる。すなわち、特異的に感作したTリンパ球が防御を仲介し(SuおよびCaldwell、1995;Morrison、Suetら、2000;MorrisonおよびCaldwell、2002)、最も重要なメディエーター分子は、インターフェロンγ(IFNγ)であるようである(MorrisonおよびCaldwell、2002)。さらに、IgG、IgMおよびIgAのアイソタイプの抗体も、ある役割を果たしている可能性がある(Cotter、Mengら、1995)。1995年には、Tripplesら(TipplesおよびMcClarty、1995)は、CTPシンテターゼの遺伝子を単離し、Guら(Gu、Wenmanら、1995)は、RNAポリメラーゼのαサブユニットの遺伝子の周辺の領域をクローン化した。この領域には、タンパク質であるSecY、S13、S11およびL17の遺伝子もまた含有されており、これらは、大腸菌(Escherichia coli)および枯草菌(Bacillus subtilis)のタンパク質と等価である。1997年には、伸長因子Tsの遺伝子が単離された(Zhang、Taoら、1997)。
【0009】
1998年には、Stevensらが、クラミジア・トラコマチスの完全なゲノム配列を報告し、約875個のオープンリーディングフレームの存在を予想した。とりわけ、CT442、CT460、CT509、CT579、CT587、CT713、CT812またはCT681(MOMP)を構成するヌクレオチド配列が記載されており、上記配列に対する仮想タンパク質の配列も提案されている。いかに重要であろうとも、この配列情報を使用して、DNAがin vivoで転写されてタンパク質に翻訳されているか否かを予想することはできない。
【0010】
さらに重要なのは、配列情報に基づいて、所与の配列が、免疫原性タンパク質をコードするものであるのか、それとも不活性なタンパク質をコードするものであるのかを予想することは不可能である。WO99/28475には、クラミジア・トラコマチスの完全なゲノム配列が記載されているが、何らかの免疫原性効果を裏付ける証拠はない。同様に、WO99/27105には、クラミジア・ニューモニエ(C. pneumoniae)の完全なゲノム配列が記載されている。
【0011】
クラミジア・トラコマチスによる感染中または感染後に、タンパク質が免疫系によって認識されるか否かを決定するには、所与のタンパク質を調製し、本明細書に記載されている適切なアッセイで試験し、可能であれば、免疫原性効果を有する断片またはエピトープを決定する方法しかない。
【発明の概要】
【発明が解決しようとする課題】
【0012】
(発明の概要)
本発明は、クラミジア種(クラミジア・トラコマチス亜種(C. trachomatis ssp)およびクラミジア・ニューモニエ(C. pneumonia))が原因である感染の、クラミジア・トラコマチス抗原またはその免疫原性部分もしくは他の変異体を含むポリペプチドの使用による、あるいはクラミジア・トラコマチス抗原またはその免疫原性部分もしくは他の変異体をコードするDNA配列の使用による予防、治療および検出に関する。
【課題を解決するための手段】
【0013】
(発明の詳細な説明)
本発明は、クラミジア種の細菌が原因である感染の予防、治療または診断用の薬学的組成物の調製に用いる、クラミジア抗原(ポリペプチドまたは核酸)ct043、ct511、ct521、ct616、ct803、ct067、ct679、ct583、ct603、ct026、ct093、ct357、ct659、ct111、ct509、ct587、ct023、ct025、ct078、ct082、ct118、ct174、ct003、ct005、ct027、ct032、ct008、ct016、ct028、ct035、ct141、ct643、ct414、ct874、ct456、ct681、ct123、ct125、ct126、ct133、ct150、ct175、ct376、ct083、ct089、ct155、ct168、ct175、ct184、ct124、ct082、ct336、ct342、ct842、ct323、ct080、ct084、ct110、ct119、ct541、ct443、ct795、ct396、ct283、ct051、ct002、ct009、ct015、ct030、ct048、ct061、ct063、ct068、ct071、ct051、ct080、ct115、ct119、ct678、ct561、ct538、ct582、ct875、ct322、ct112、ct315、ct610、、ct147、ct228、ct232、ct614、ct098、ct265、ct375、ct004、ct038、ct040、ct052、ct053、ct201、ct245、ct246、ct405、ct420、ct426、ct507、ct512、ct513、ct514、ct516、ct316、ct439、ct492、ct520、ct523、ct526、ct611、ct613、ct626、ct630、ct647、ct649、ct725、ct734、ct779、ct801、ct833、ct835、ct836、ct845、またはそれらの断片(免疫原性部分、例えば、T細胞またはB細胞エピトープ)もしくは相同体の使用を開示する。
【0014】
また、本発明は、クラミジア種の細菌が原因である感染の予防、治療または診断用の薬学的組成物の調製に用いる、特定のペプチド断片、例えば、CT541−PF1(アミノ酸位置111−243)、CT443−PF1(アミノ酸位置214−291)、CT795−PF1(アミノ酸位置1−163)、CT396−PF1(アミノ酸位置170−318)、CT842−PF1(アミノ酸位置433−515)、CT283−PF1(アミノ酸位置477−577)、CT874−PF1(アミノ酸位置330−426)、CT051−PF1(アミノ酸位置38−177)、CT141−PF1(アミノ酸位置17−126)、CT643−PF1(アミノ酸位置769−841)、CT681−PF1(アミノ酸位置156−391)、CT681−PF2(アミノ酸位置199−329)、CT681−PF3(アミノ酸位置294−349)、CT414−PF1(アミノ酸位置605−722)、CT414−PF2(アミノ酸位置463−530)、CT456−PF1(アミノ酸位置695−840)、CT456−PF2(アミノ酸位置137−229)、CT456−PF3(アミノ酸位置243−321)、CT456−PF4(アミノ酸位置209−291)、CT456−PF5(アミノ酸位置175−279)、CT456−PF6(アミノ酸位置567−730)、CT456−PF7(アミノ酸位置210−540)、CT456−PF8(アミノ酸位置190−279)、CT521−PF1(アミノ酸位置14−36)、CT521−PF2(アミノ酸位置40−62)、CT521−PF3(アミノ酸位置52−75)、CT521−PF4(アミノ酸位置66−88)、CT521−PF5(アミノ酸位置116−138)、CT504−PF1またはこれらペプチド断片をコードする核酸の使用も開示する。
【0015】
また、本発明は、ワクチンまたは診断薬の形態をとる薬学的組成物も開示する。
【0016】
薬学的組成物を調製するために使用するポリペプチドは、脂質が付加されて自己アジュバント作用を可能にするか、または融合パートナーに融合させることができる。ここでの融合パートナーは、クラミジア・トラコマチスに由来する別のポリペプチドであることができる。それらには、CT812、CT579、CT587、Cap、CT713、CT442またはMOMPあるいは上記のいずれかのT細胞またはB細胞のエピトープの少なくとも1種に由来するポリペプチド断片の1つまたは複数が含まれるが、それらに限定されない。また、本発明は、本発明のポリペプチド(またはそれらの免疫原性部分)の2つ以上の相互融合体を含む融合ポリペプチドにも関する。
【0017】
本発明によって開示されているワクチンを、クラミジア種、例えば、クラミジア・トラコマチスによる感染を予防または治療するために使用することできる。
【0018】
本発明によって開示されている診断薬(上記の抗原またはそれに対する抗体)を、クラミジア種、例えば、クラミジア・トラコマチスによる感染を診断するために使用することできる。
【0019】
開示されている診断方法は、細胞性免疫、血清学、または単純な皮膚試験に基づく。クラミジア種の細菌による過去または現在進行中の感染の細胞性免疫による診断は、検体、例えば、単核細胞(例えば、Tリンパ球)を含む血液検体を、陽性反応、例えば、細胞増殖またはIFNγ等のサイトカインの放出を検出するために、診断試薬と接触させるステップを含む。クラミジア種の細菌による過去または現在進行中の感染の血清学による診断方法は、感染がある場合には陽性反応を検出するために、検体、例えば、血液検体をその抗原に対する抗体と接触させるステップ、または抗原を対象の体液と接触させるステップを含み、抗体の当該ポリペプチドへの結合を検出する場合には、当該結合は、対象がクラミジア種の細菌に感染していることを示す。皮膚試験は、診断薬を、皮内注射するか、または皮膚に(例えば、パッチによって)施用するステップを含み、注射または施用の部位の陽性皮膚応答が、クラミジア種の細菌による感染を示す。
【0020】
また、本発明は、クラミジア種の細菌による感染に対して免疫する方法も開示する。この方法は、上記の本発明のワクチンを、哺乳類に投与するステップを含む。
【0021】
(定義)
ポリペプチド
本発明における「ポリペプチド」という用語は、通常の意味を有するものとする。すなわち、アミノ酸残基がペプチド共有結合によって連結している、完全長タンパク質、オリゴペプチド、短いペプチドおよびそれらの断片を含む、アミノ酸の鎖であり、いかなる長さであってもよい。
【0022】
ポリペプチドを、グリコシル化によって、脂質付加(例えば、Mowatら、1991によって記載されているようにパルミトイルオキシスクシンイミド、またはLustigら、1976によって記載されているように塩化ドデカノイルを用いた化学的な脂質付加)によって、補欠分子族を含むことによって、または例えば、ヒスチジンタグまたはシグナルペプチド等の追加のアミノ酸を含有させることによって、化学的に修飾することができる。
【0023】
したがって、各ポリペプチドを、特定のアミノ酸によって特徴付け、特定の核酸配列によってコードされることができる。そのような配列には、組換え法または合成法によって生成される類似体および変異体が含まれ、そのようなポリペプチド配列は、組換えポリペプチドのアミノ酸残基の1個または複数が置換、挿入、付加または欠失によって改変されているにも関わらず、本明細書に記載されている生物学的アッセイのいずれかにおいて、免疫原性を示すことが理解されよう。置換は、「保存的」であることが好ましい。これらは、以下の表によって定義される。第2列の同じ四角内、好ましくは第3列の同じ行内にあるアミノ酸を相互に置換することができる。第3列では、アミノ酸を1文字コードで示している。
【表1】

【0024】
本発明内の好ましいポリペプチドは、クラミジア・トラコマチスの免疫原性抗原である。そのような抗原は、例えば、クラミジア・トラコマチスの細胞および/またはクラミジア・トラコマチスの培地の濾液から得ることができる。したがって、上記の抗原のうちの1つの免疫原性部分を含むポリペプチドは、そのような免疫原性部分のみから構成されていてもよいし、または追加の配列を含有していてもよい。追加の配列は、天然のクラミジア・トラコマチスの抗原から得てもよいし、または異種であってもよく、そのような配列は、免疫原性であってもよいが、そうである必要はない。
【0025】
各ポリペプチドは、特定の核酸配列によってコードされる。そのような配列には、それらの類似体および変異体が含まれ、そのような核酸配列は、1個または複数の核酸が置換、挿入、付加または欠失によって改変されていることが理解されよう。置換は、アミノ酸配列に何らかの変化が起きることはないコドンの使用のサイレント置換が好ましいが、置換を導入してタンパク質の発現を促進してもよい。
【0026】
本明細書の文脈では、「実質的に純粋なポリペプチド断片」という用語は、純粋なポリペプチド断片が未変性状態で結合しているその他のポリペプチド材料を最大で5重量%含有するポリペプチド調製物を意味する(その他のポリペプチド材料の比率は、より低い方が好ましく、例えば、最大で4%、最大で3%、最大で2%、および最大で1/2%である)。実質的に純粋なポリペプチド断片が、少なくとも96%純粋であること、すなわち、調製物中、実質的に純粋なポリペプチド断片が、ポリペプチド材料の全量に対して、少なくとも96重量%を占めることが好ましい。実質的に純粋なポリペプチド断片の占める比率は、より高い方が好ましく、例えば、少なくとも97%、少なくとも98%、少なくとも99%、少なくとも99.25%、少なくとも99.5%、および少なくとも99.75%である。ポリペプチド断片が、「実質的に純粋な形態」であること、すなわち、純粋なポリペプチド断片が未変性状態で結合するその他の抗原のいずれもが基本的に存在しないこと、つまり、クラミジア種に属する細菌からのその他の抗原のいずれもが存在しないことが特に好ましい。これは、以下に詳細に説明するような非クラミジア系宿主細胞中での組換え法によって、あるいはよく知られている固相または液相ペプチド合成法、例えば、Merrifieldによって記載されている方法もしくはその変法によりポリペプチド断片を合成することによって、ポリペプチド断片を調製することにより、達成することができる。
【0027】
「クラミジア種」という用語は、動物またはヒトにおいてクラミジア感染を起こすことができる細菌と理解されている。例として、クラミジア・トラコマチス(C. trachomatis)、クラミジア・ニューモニエ(C. pneumonia)、およびC. muridarumがあげられる。
【0028】
クラミジア・トラコマチスの主要外膜タンパク質(MOMP)は、クラミジア・トラコマチスの発達の生涯過程のあらゆる段階で発現し、クラミジアの外膜の全タンパク質量の約60%を占める。MOMPは、保存ドメインと、それらの間に存在する4つの高度可変ドメイン(VD1〜4)とに分けることができる(Stephens、Wagarら、1988)。通常、T細胞エピトープは、保存領域に位置し(Ortiz、Demickら、1996)、ヒト抗体の応答は、主として可変ドメインに対して起きる。特異的モノクローナル抗体の反応性および可変領域の詳細な配列解析に基づいて、クラミジア・トラコマチスは、15の異なる血清変異株に分類することができ、これらの変異株中、A、B、BaおよびCがトラコーマの原因となり、D〜Kが性感染症(STD)の原因となり、L1〜L3が鼠径リンパ肉芽腫症の原因となり、MoPn(C. muridarum)はマウスに感染する。
【0029】
「クラミジア患者」という用語は、培養またはPCRによってクラミジア亜種感染が証明された個体と理解されている。培養、顕微鏡およびPCRによるクラミジアの診断は、当業者にはよく知られている。
【0030】
「遅延型過敏症反応(DTH:delayed type hypersensitivity reaction)」という用語は、ポリペプチドの皮内注射または皮膚への施用の後に誘発される、T細胞によって仲介される炎症応答であり、当該炎症応答は、ポリペプチドの注射または施用の72〜96時間後に現れると理解されている。
【0031】
「IFNγ」という用語は、インターフェロンガンマと理解されている。IFNγの測定は、免疫学的応答の指標として用いられる。
【0032】
「核酸断片」および「核酸配列」という用語は、DNA、RNA、LNA(locked nucleic acid)、PNA、RNA、dsRNAおよびRNA−DNAハイブリッドを含むいずれかの核酸分子と理解されている。また、自然に存在しないヌクレオシドを含む核酸分子も含まれる。この用語には、使用に応じて、いかなる長さ、例えば、10〜10000個のヌクレオチドを含む核酸分子も含む。核酸分子を医薬品として、例えば、DNA療法に使用するか、または本発明に従ってポリペプチドを調製する方法に使用する場合、少なくとも1種のエピトープをコードする、約18〜約1000ヌクレオチド長の分子を使用するのが好ましく、場合によっては、この分子をベクター内に導入する。核酸分子をプローブとして、プライマーとして、またはアンチセンス療法に使用する場合、10〜100ヌクレオチド長の分子を使用するのが好ましい。本発明によれば、その他の分子の長さ、例えば、少なくとも12、15、21、24、27、30、33、36、39、42、50、60、70、80、90、100、200、300、400、500または1000個のヌクレオチド(またはヌクレオチド誘導体)を有する分子、あるいは最大で10000、5000、4000、3000、2000、1000、700、500、400、300、200、100、50、40、30または20個のヌクレオチド(またはヌクレオチド誘導体)を有する分子を使用することもできる。
【0033】
ハイブリダイゼーションの条件と共に使用される場合の「緊縮性」という用語は、当技術分野で定義されているように、すなわち、ハイブリダイゼーションを、融解温度Tmより15〜20℃低い温度で行うと定義されている。Sambrookら、1989、11.45−11.49頁を参照されたい。「高緊縮性の」条件、すなわち、融解温度Tmより5〜10℃低い温度が好ましい。
【0034】
本明細書を通して、文脈上別の意味が要求されない限り、「含む(comprise)」または「含む(comprises)」もしくは「含む(comprising)」等のその変形は、述べられている構成要素または整数または構成要素もしくは整数の群を含むことを意味するが、その他の構成要素または整数または構成要素もしくは整数の群のいずれをも排除することを意味するものではないと理解されたい。
【0035】
配列同一性
「配列同一性」という用語は、等しい長さの2つのアミノ酸配列間または等しい長さの2つのヌクレオチド配列間の相同性の程度の定量的な尺度を意味する。比較しようとする2つの配列は、ギャップの挿入またはタンパク質配列の末端の切断によって可能になる、最も一致した状態に整列化させる必要がある。配列同一性は、
【数1】

【0036】
として計算することができる。ただし、式中、Ndifは、整列化したときに2つの配列間で一致しない残基の全数であり、Nrefは、1つの配列中の残基の数である。したがって、DNA配列AGTCAGTCは、配列AATCAATCと、75%の配列同一性を有することになる(Ndif=2およびNref=8)。ギャップは、特定の残基に対して一致しないとして数えられ、すなわち、DNA配列AGTGTCは、DNA配列AGTCAGTCと、75%の配列同一性を有することになる(Ndif=2およびNref=8)。別法として、配列同一性は、ブラスト(BLAST)プログラム、例えば、BLASTPプログラム(PearsonおよびLipman、1988)(www.ncbi.nlm.nih.gov/cgi-bin/BLAST)によって計算することもできる。本発明のある態様では、Thompson J.ら、1994に記載されているように、http://www2.ebi.ac.uk/clustalw/ で入手できるデフォルトパラメーターを用い、配列比較法ClustalWで、配列化を実施している。
【0037】
配列同一性の好ましい最低パーセントは、少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、および99.5%等の、少なくとも80%である。
【0038】
免疫原性部分
本発明のより好ましい実施形態では、ポリペプチドが、B細胞またはT細胞に対するエピトープ等の、ポリペプチドの免疫原性部分を含む。ポリペプチドの免疫原性部分は、当該ポリペプチドの一部であり、免疫原性部分は、動物もしくはヒトにおいて免疫応答を誘発する、かつ/または生物学的試料において、本明細書に記載されている生物学的アッセイのいずれかで測定される免疫応答を誘発する。ポリペプチドの免疫原性部分は、T細胞のエピトープであってもよいし、またはB細胞のエピトープであってもよい。免疫原性部分は、ポリペプチドの比較的小さな部分の1つもしくはいくつかに関係していてもよいし、ポリペプチド配列全体に散在していてもよいし、またはポリペプチドの特定の部分に存在していてもよい。いくつかのポリペプチドに関して、ポリペプチド全体に配列全長にわたり、エピトープが散在していることが示されている(Ravn、Demissieら、1999)。免疫応答において認識される適切なT細胞エピトープを同定するために、「強力な」方法を使用することができる。すなわち、T細胞エピトープは線形であることから、ポリペプチドの欠失変異体は、系統的に構築すれば、ポリペプチドのどの領域が、免疫認識において必須であるかを示すであろう。例えば、これらの欠失変異体に対して、具体的には、本明細書に記載されているIFNγアッセイを実施する。別法では、重複しているオリゴペプチドを利用し、MHCクラスIIエピトープを検出する。好ましくは、このオリゴペプチドは、当該ポリペプチドに由来するアミノ酸の、例えば、20個からなる長さを有する合成オリゴペプチドである。これらのペプチドを生物学的アッセイ(例えば、本明細書に記載されているIFNγアッセイ)で試験することができ、これらのうちのいくつかは、ペプチド中にT細胞エピトープが存在する証拠として、陽性の応答(それによって免疫原性)を示すであろう。MHCクラスIエピトープを検出するためには、結合するであろうペプチドを予想し(Stryhn、Pedersenら、1996)、それに次いで、これらのペプチドを合成し、適切な生物学的アッセイ、例えば、本明細書に記載されているIFNγアッセイで試験することができる。好ましくは、このペプチドは、当該ポリペプチドに由来するアミノ酸残基の、例えば、8〜11個からなる長さを有する。B細胞エピトープは、例えば、Harboeらによって記載されているように(Harboe、Oettingerら、1996)、目的のポリペプチド全体に重複しているペプチドに対するB細胞の認識を解析することによって決定することができる。
【0039】
T細胞エピトープの最も短い長さは、少なくとも6個のアミノ酸であることが示されているが、T細胞エピトープは、より長いアミノ酸からなることが普通である。したがって、本発明のポリペプチド断片は、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも12個、少なくとも14個、少なくとも16個、少なくとも18個、少なくとも20個、少なくとも22個、少なくとも24個および少なくとも30個のアミノ酸残基等、少なくとも7個のアミノ酸残基からなる長さを有する。したがって、本発明の方法の重要な実施形態では、ポリペプチド断片が、最大で40個、35個、30個、25個および20個のアミノ酸残基等、最大で50個のアミノ酸残基からなる長さを有することが好ましい。10〜20個のアミノ酸残基からなる長さを有するペプチドが、MCHクラスIIエピトープとして最も効率がよいと証明されるであろうと予想され、したがって、本発明の方法で使用するポリペプチド断片の特に好ましい長さは、15個、14個、13個、12個および特に11個等、18個のアミノ酸残基である。7〜12個のアミノ酸残基からなる長さを有するペプチドが、MCHクラスIエピトープとして最も効率がよいと証明されるであろうと予想され、したがって、本発明の方法で使用するポリペプチド断片の特に好ましい長さは、10個、9個、8個および特に7個等、11個のアミノ酸残基である。
【0040】
ポリペプチドの免疫原性部分は、遺伝子的に異型なヒトの集団の広範な部分によって認識される場合(高頻度)、またはそのごく一部によって認識される場合(低頻度)がある。さらに、一部の免疫原性部分は、高い免疫学的応答(ドミナント)を誘発し、別の免疫原性部分は、顕著であるものの、低めの応答(サブドミナント)を誘発する。高頻度><低頻度は、広範に分布しているMHC分子(HLA型)に結合する免疫原性部分、または複数のMHC分子にさえ結合する免疫原性部分と関係付けることができる(Kilgus、Jardetzkyら、1991)(Sinigaglia、Guttingerら、1988)。
【0041】
しかし、クラミジア感染に対する新しいワクチンに用いる候補分子を提供するという状況では、サブドミナントなエピトープも、ドミナントなエピトープと同様、適切である。というのは、サブドミナントであるにもかかわらず、そのようなエピトープは、防御を誘発することができることが示されているからである。
【0042】
変異体
本発明のポリペプチドに共通する特徴は、実施例で説明するように、免疫学的応答を誘発する能力である。置換、挿入、付加または欠失によって作製される本発明のポリペプチドの変異体も、本明細書に記載されているいずれかのアッセイによって測定すると免疫原性であることを理解されたい。
【0043】
免疫個体
免疫個体とは、クラミジア感染が排除または制御されているヒトまたは動物と定義される。
【0044】
免疫原性
免疫原性のポリペプチドとは、現在クラミジアに感染しているか、または過去にクラミジアに感染した生物学的試料または個体において、免疫応答を誘発するポリペプチドと定義される。免疫応答は、以下の方法のいずれかでモニターすることができる。
【0045】
・in vitroにおける細胞応答は、現在クラミジアに感染しているか、または過去にクラミジアに感染した動物またはヒトから採取したリンパ球からの、IFNγ等の関連性があるサイトカインの放出によって、またはこれらのT細胞の増殖の検出によって測定される。誘発は、ポリペプチドまたは免疫原性部分を、1×105〜3×105細胞/ウェルを含む懸濁液に加えることによって行われる。細胞は、血液、脾臓、肝臓または肺のいずれかから単離する。ポリペプチドまたは免疫原性部分を、20μg/ml以下の濃度になるように、懸濁液に加える。2〜5日間、刺激する。細胞増殖をモニターするために、細胞に、放射標識したチミジンを加え、パルスを発生させ、16〜22時間インキュベーションした後、液体シンチレーションカウンターでカウントして増殖を検出する。陽性の応答は、{バックグラウンド+2×(標準偏差)}超である応答とする。IFNγの放出は、当業者によく知られたELISA法によって測定することができる。陽性の応答は、{バックグラウンド+2×(標準偏差)}超である応答とする。ペプチドに対する免疫学的応答をモニターする場合、IL−12、TNF−α、IL−4、IL−5、IL−10、IL−6、TGF−β等のIFNγ以外のサイトカインも関連性があるであろう。サイトカイン(例えば、IFNγ)の存在を測定する別のさらに感度の高い方法は、ELISPOT法であり、この方法では、血液、脾臓、肝臓または肺のいずれかから単離した細胞を、好ましくは1〜4×106細胞/mlの濃度に希釈し、最終濃度が20μg/ml以下であるポリペプチドまたは免疫原性部分の存在下で、18〜22時間インキュベーションする。その後、細胞の懸濁液を1〜2×106/mlに希釈し、抗IFNγで被覆したMaxisorpプレートに移し、好ましくは、4〜16時間インキュベーションする。IFNγ産生細胞を、標識された二次抗IFNγ抗体およびスポットの発生に関わる基質を使用して測定する。発生したスポットは、解剖顕微鏡を使用して数えることができる。PCR法を使用して、関連性があるサイトカインをコードするmRNAの存在を測定することも可能である。通常、1種または複数のサイトカインを、例えば、PCR法、ELISPOT法またはELISA法を利用して測定することになる。特定のペプチドによって誘発されるこれらのサイトカインのいずれかの量の顕著な増加または減少を使用して、ペプチドの免疫学的活性を評価することができることが、当業者であれば理解できよう。
【0046】
・また、in vitroにおける細胞応答は、免疫個体またはクラミジア・トラコマチスに感染したヒトに由来するT細胞株を使用することによっても測定できる。この場合、T細胞株は、生存しているクラミジアまたは細菌細胞の抽出液と共に、IL−2を添加して、10〜20日間処理されている。1×105〜3×105細胞/ウェルを含有するT培養細胞株の懸濁液に、20μg/ml以下の濃度になるようにポリペプチドを加えてインキュベーションする。インキュベーションは、2〜6日間行う。IFNγの誘導または別のサイトカインの放出を、ELISA法で検出する。T細胞の刺激を、上記のように、放射標識したチミジンを使用して細胞増殖を検出することによってモニターすることもできる。どちらのアッセイも、陽性の応答は、{バックグラウンド+2×(標準偏差)}超である応答とする。
【0047】
・in vitroにおける細胞応答は、臨床的または準臨床的にクラミジアに感染している個人に、最大で100μgのポリペプチドまたは免疫原性部分を皮内注射またはパッチから局所施用した後に、陽性のDTH応答として測定することができ、陽性の応答は、注射または施用の72〜96時間後に少なくとも5mmの直径を有する。
【0048】
・in vitroにおける液性の応答は、免疫個体または感染している個体における特異的な抗体の応答によって測定することができる。抗体の存在は、ELISA法またはウェスタンブロット法によって測定することができる。ウェスタンブロット法の場合、ポリペプチドまたは免疫原性部分をニトロセルロース膜またはポリスチレン表面のいずれかに吸収させる。血清を、好ましくは、PBS中で、1:10〜1:100に希釈し、吸収させたポリペプチドに加え、1〜12時間インキュベーションする。標識した二次抗体を使用することにより、特異抗体の存在を、光学濃度(OD)を、例えば、ELISA法によって測定することができる。この場合、陽性の応答は、{バックグラウンド+2×(標準偏差)}超である応答とし、または別法として、ウェスタンブロット法においては、目視で確認できる応答とする。
【0049】
・別の関連性があるパラメーターは、アジュバント中のポリペプチドによる予防接種後またはDNAによる予防接種後に誘発された、動物モデルにおける防御の測定である。適切な動物モデルとして、霊長類、モルモットまたはマウスがあげられ、これらは、クラミジア感染に曝されている。誘発された防御の読み取りは、予防接種されていない動物と比較した標的臓器中のクラミジア細菌の量の減少、予防接種されていない動物と比較した生存期間の延長、および予防接種されていない動物と比較した体重減少の抑制であることができるであろう。
【0050】
調製方法
一般に、クラミジア・トラコマチス抗原およびそのような抗原をコードするDNA配列を、種々の方法のいずれかを使用して調製することができる。それらは、クラミジア・トラコマチスの細胞から、上記の方法等の方法で、未変性タンパク質として精製することができる。免疫原性のある抗原を、抗原をコードするDNA配列を使用して組換えによって調製することもできる。このDNA配列は、発現ベクターに挿入され、適切な宿主中で発現させられている。宿主細胞の例として、大腸菌があげられる。本発明のポリペプチドまたは免疫原性部分を、約100個未満のアミノ酸、一般的には、50個未満のアミノ酸を有するように、合成によって調製することもでき、成長しているアミノ酸の鎖にアミノ酸を順次加える市販の固相技術等の当業者によく知られた技術を使用して調製することができる。
【0051】
DNAワクチンと定義される、ポリペプチドをコードするプラスミドDNAの構築および調製においては、大腸菌等の宿主株を使用することができる。次いで、プラスミドDNAを、目的のプラスミドを保有している宿主株を一晩培養することによって調製し、菌体内毒素を除去するステップを含む、例えば、Qiagen Giga-Plasmidカラムキット(Qiagen社製、Santa Clarita、カリフォルニア州、米国)を使用して精製することができる。DNAワクチンに使用するプラスミドは、菌体内毒素を含まないことが必須である。
【0052】
融合タンパク質
免疫原性ポリペプチドを、融合タンパク質として調製することもでき、この方法によって、本発明のポリペプチドの優れた特徴を達成することができる。例えば、組換えにより調製する場合には、ポリペプチドの搬出を促進する融合パートナー、ポリペプチドの精製を促進する融合パートナー、および本発明のポリペプチド断片の免疫原性を促進する融合パートナーは、いずれも興味深い、可能性のあるものである。したがって、本発明は、上記で定義したポリペプチドまたは免疫原性部分の少なくとも1つと、融合パートナーの少なくとも1つとを含む融合ポリペプチドにも関する。融合パートナーは、免疫原性を促進するために、クラミジア・トラコマチスに由来する別のポリペプチド、例えば、クラミジア種に由来するポリペプチド断片、具体的には、CT812、CT579、CT587(Goodall、Yeoら、2001)、Cap(Fling、Sutherlandら、2001)、CT713(KuboおよびStephens、2000)、CT442(Starnbach、Loomisら、2003)、もしくはMOMP(Stephens、Wagarら、1988)、または上記のいずれかのT細胞エピトープもしくはB細胞エピトープの少なくとも1種であることができる。また、本発明は、本発明の2つ以上のポリペプチド(またはそれらの免疫原性部分)の相互融合体を含む融合ポリペプチドにも関する。
【0053】
生成物の免疫原性を促進することができるであろう、その他の融合パートナーは、IFNγ、IL−2およびIL−12等のリンホカインである。発現および/または精製を促進するためには、融合パートナーは、例えば、細菌の線毛タンパク質、具体的には、ピリ線毛の成分であるピリンおよびpapA;プロテインA;ZZ−ペプチド(ZZ−融合体は、スウェーデンのPharrnacia社から販売されている);マルトース結合タンパク質;グルタチオンSトランスフェラーゼ;β−ガラクトシダーゼ;またはポリヒスチジンであることができる。融合タンパク質を、宿主細胞中で、組換えによって調製することができる。この宿主細胞は、大腸菌であることができるであろう。異なる融合パートナーの間に、リンカー領域を導入することも可能である。
【0054】
その他の興味深い融合パートナーは、脂質を付加されているポリペプチドである。それによって、免疫系に適するように免疫原性ポリペプチドが提示される。この効果は、例えば、WO96/40718Aに記載されているボレリア・ブルグドルフェリ(Borrelia burgdorferi)のOspAポリペプチドに基づいたワクチン、または緑膿菌(Pseudomonas aeruginosa)のOprlリポタンパク質に基づいたワクチン(Cote-SIerra、Jongertら、1998)から知られている。別の可能性として、免疫原性ポリペプチドへの、既知のシグナル配列のN末端の融合体、およびN末端のシステインがある。適切な調製の宿主内で調製すると、そのような融合体により、N末端のシステインで免疫原性ポリペプチドに脂質が付加される。
【0055】
薬学的組成物
薬学的組成物は、以下に説明するいずれかのワクチン(治療用および予防用の両方)またはいずれかの診断用試薬と定義される。
【0056】
ワクチン、タンパク質
本発明の別の部分は、本発明のポリペプチド(もしくはその免疫原性部分の少なくとも1つ)または融合ポリペプチドを含むワクチン組成物に関する。そのようなワクチン組成物の最適化された性能を保証するために、ワクチン組成物は、免疫学的および薬学的に許容される担体、賦形剤またはアジュバントを含むことが好ましい。
【0057】
本発明のポリペプチドが動物によって認識される、有効なワクチンとは、動物モデルにおいて、病原性のあるクラミジアに曝露した後、予防接種されていない動物と比較して、標的臓器中のクラミジア細菌の量を減少させ、生存期間を延長し、かつ/または体重減少を抑制することができるものとする。
【0058】
適切な担体は、ポリペプチドが疎水性の非共有結合によって結合するポリマー、例えば、プラスチック、具体的には、ポリスチレン;ポリペプチドが共有結合によって結合するポリマー、例えば、多糖類;またはポリペプチド、具体的には、ウシ血清アルブミン、卵白アルブミンもしくはスカシ貝ヘモシアニンからなる群から選択される。適切な賦形剤は、希釈剤および懸濁化剤からなる群から選択される。アジュバントは、ジメチルジオクタデシルアンモニウムブロマイド(DDA)、クィルA、ポリI:C、水酸化アルミニウム、フロインドの不完全アジュバント、IFNγ、IL−2、IL−12、モノホスホリル脂質A(MPL)、トレハロースジマイコレート(TDM)、トレハロースジベヘネート(TDB)およびムラミルジペプチド(MDP)からなる群から選択されるのが好ましい。
【0059】
有効成分としてペプチド配列を含有するワクチンの調製は、いずれも参照によって本明細書に組み入れられている米国特許第4,608,251号、第4,601,903号、第4,599,231号および第4,599,230号に例示されているように、通常、当業者にはよく知られている。
【0060】
ワクチンのアジュバント効果を達成するためのその他の方法として、水酸化アルミニウムもしくはリン酸アルミニウム(ミョウバン)等の薬剤、糖の合成ポリマー(カルボポール;Carbopol)、熱処理によるワクチン中のタンパク質の凝集化、アルブミンに対するペプシン処理(Fab)抗体を用いた再活性化による凝集化、クリプトスポリジウムパルブム(Cryptosporidium parvum)等の細菌細胞、菌体内毒素もしくはグラム陰性細菌のリポ多糖成分との混合物、mannide monooleate(アラセル(Aracel)A)等の生理学的に許容される油性の賦形剤中の乳濁液、または代用血液として使用されるパーフルオロカーボン(Fluosol-DA)の20%溶液を用いた乳濁液の使用があげられる。その他の可能性としては、上記のアジュバントと組み合わせてサイトカイン等の免疫調節物質、またはポリI:C等の合成IFNγ誘発剤を使用することが含まれる。
【0061】
アジュバント効果を達成するための別の興味深い方法は、(参照によって本明細書に組み入れられている)(Gosselin、Wardwellら、1992)に記載されている技術を利用することである。要するに、本発明の抗原等の適切な抗原を、単核球/マクロファージ上のFcγ受容体に対する抗体(または抗原結合抗体断片)に結合させることができる。
【0062】
ワクチンは、剤形に対応した方法で投与され、治療に有効かつ免疫原性を示す量で投与するものとする。投与量は、免疫応答を開始する個々の免疫系の能力および所望する防御の程度等を含め、治療対象によって異なる。適切な投与量の範囲として、ワクチンあたり、約数百μg、好ましくは約1〜300μg等の約0.1〜1000μg、特に約10〜50μgの有効成分を含む。初期投与および追加免疫に関する適切な投与計画も多様であるが、通常、初期投与、それに続く接種またはその他の投与に代表される。
【0063】
多種多様な投与形態をとることができる。ワクチンを投与する従来からの方法のいずれかを適用できる。これらには、固体の生理学的に許容される基剤上もしくは生理学的に許容される分散剤の形態での経口投与、または注射等による非経口投与が含まれると考えられる。ワクチンの投与量は、投与経路によって異なるものであり、ワクチンを投与される個人の年齢によって、またそれよりは程度は低いが、ワクチンを投与される個人の大きさによって、変動するものである。
【0064】
ワクチンは、従来法に従って、注射により、例えば皮下注射または筋肉内注射により非経口的に投与される。その他の投与形態に適する別の剤形として、坐剤、および、場合によっては、経口製剤があげられる。坐剤には、従来からの結合剤および担体、例えば、ポリアルキレングリコールまたはトリグリセリドを含むことができる。そのような坐剤を、0.5〜10%、好ましくは1〜2%の範囲の有効成分を含む混合物から形成することができる。経口製剤には、通常利用される賦形剤、例えば、製薬グレードのマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、セルロース、および炭酸マグネシウム等を含む。これらの組成物は、液剤、懸濁剤、錠剤、丸剤、カプセル剤、徐放性製剤または散剤の形態をとり、有効成分を10〜95%、好ましくは25〜70%含有するのが都合がよい。
【0065】
多くの場合、ワクチンを複数回投与する必要があるであろう。特に、ワクチンは、クラミジア感染を防止し、かつ/または確立したクラミジア感染を治療するために投与することができる。感染防止のために投与する場合には、ワクチンは、感染の臨床的な徴候または症状が明確に現れる前に、予防的に投与される。
【0066】
遺伝的変動のために、各個人は、同一のペプチドに対して異なる強度の免疫応答で反応することがある。したがって、本発明のワクチンは、免疫応答を高めるために、いくつかの異なるポリペプチドを含むことができる。ワクチンは、2つ以上のポリペプチドまたは免疫原性を含むことができ、その場合、ポリペプチドは全部、上記で定義されているペプチドであってもよいし、全部ではないが一部のペプチドが、その他のクラミジア血清変異株の1種または複数に由来していてもよい。後者の例では、ポリペプチドについて上記で記載されている基準を、ポリペプチドが必ずしも満たす必要はなく、それ自体の免疫原性に基づいて作用するか、または単にアジュバントとして作用するかのいずれかであってよい。
【0067】
ワクチンは、2〜20個もしくは特に3〜20個の異なるポリペプチドもしくは融合ポリペプチド等、または3〜10個のポリペプチドもしくは融合ポリペプチド等の、1〜20個の異なるポリペプチドもしくは融合ポリペプチドを含むことができる。
【0068】
また、本発明は、クラミジア種が原因であるクラミジア感染に対して、ヒトを含む動物を免疫する方法であって、本発明のポリペプチドまたは上記の本発明のワクチン組成物または上記の生ワクチンを、動物に投与するステップを含む方法にも関する。
【0069】
また、本発明は、本発明の免疫原性組成物を調製する方法にも関する。この方法は、本発明のポリペプチドを調製、合成または単離するステップと、ワクチン用の媒体中にポリペプチドを溶解または分散させるステップと、場合により、その他のクラミジア・トラコマチス抗原および/または担体すなわち賦形剤および/またはアジュバント物質を加えるステップとを含む。
【0070】
ワクチンDNA
本発明の核酸断片を、in vivoにおいて抗原を発現させるために使用することができる。すなわち、核酸断片を、参照によって組み入れられている総論(Ulmer、Donnellyら、1993)で述べられているように、いわゆるDNAワクチンに使用することができる。
【0071】
したがって、本発明は、本発明の核酸断片を含むワクチンにも関する。このワクチンは、ワクチンを投与されたヒトを含む動物によってin vivoで抗原を発現させ、発現する抗原の量は、ヒトを含む動物において、病原性のクラミジアが原因である感染に対する抵抗を実質的に高めるのに有効である。
【0072】
そのようなDNAワクチンの効果は、免疫応答を調節することができるポリペプチドをコードするDNA断片と共に、発現生成物をコードする遺伝子を投与することによって、促進することができるであろう。
【0073】
組換え生ワクチン
ワクチンに対する細胞性免疫応答を効果的に活性化させる1つの可能性として、非病原性の微生物またはウイルスにおいて、ワクチン中に適切な抗原を発現させることによって達成することができる。そのような微生物のよく知られた例が、ウシ型結核菌BCG(Mycobacterium bovis BCG)、サルモネラ属(Salmonella)およびシュードモナス属(Pseudomona)であり、ウイルスの例がワクシニアウイルス(Vaccinia Virus)およびアデノウイルス(Adenovirus)である。
【0074】
別の可能性では、ワクシニアウイルスまたはアデノウイルス等の弱毒化したウイルスに、本発明のポリペプチドをコードするDNAを統合することである(RolphおよびRamshaw、1997)。組換えワクシニアウイルスは、感染した宿主細胞の細胞質中で複製することができ、したがって、目的のポリペプチドが免疫応答を誘発することができる。この免疫応答によって、クラミジアに対する防御が誘発されるのをねらう。
【0075】
治療用ワクチン
また、本発明は、D. Lowry(Lowryら、1999)の文献に記載されているように、治療用ワクチンとして使用するための本発明のポリペプチドまたは核酸の使用にも関する。ワクチンとして投与する場合、実験動物におけるクラミジア・トラコマチス感染の重症度を低下させる能力、または過去の感染の再活性化を防止する能力に基づいて、治療的特徴を有する抗原を同定することができる。治療用ワクチンに使用する組成物は、ワクチンについて上記で記載したように調製することができる。
【0076】
診断用タンパク質
また、本発明は、ヒトを含む動物におけるクラミジアが原因であるクラミジア感染を診断する方法にも関する。この方法は、本発明のポリペプチドを動物に皮内注射するステップを含み、注射部位における陽性の皮膚応答は、当該動物がクラミジアに感染していることを示唆し、注射部位における陰性の皮膚応答は、当該動物がクラミジアに感染していないことを示唆する。
【0077】
病原性のクラミジアによる過去または進行中の感染の診断を目指す場合には、単核細胞(すなわちTリンパ球)を含む患者の血液検体を、1つまたは複数の本発明のポリペプチドの検体と接触させることができるであろう。このような接触は、in vitroで行うことができ、陽性の反応は、例えば、T細胞の増殖またはIFNγ等のサイトカインの細胞外の相への放出であり得る。対象の血清検体を本発明のポリペプチドと接触させることもまた可能であり、血清検体中の抗体とポリペプチドとの結合が実証されることにより、過去または進行中の感染が示される。
【0078】
したがって、本発明は、動物またはヒトにおけるクラミジア種による進行中または過去の感作をin vitro診断する方法にも関する。この方法は、動物またはヒトから血液検体を供給するステップと、当該動物の検体を本発明のポリペプチドと接触させるステップとを含み、血液検体中の単核細胞による少なくとも1種のサイトカインの細胞外の相への顕著な放出は、当該動物に感作が生じていることを示唆する。陽性応答は、患者の血液検体からの放出が、{クラミジアと診断されていない患者の血液検体からの放出+2×(標準偏差)}超である応答とする。また、本発明は、動物またはヒトにおけるクラミジアによる進行中または過去の感作をin vitroで診断する方法にも関する。この方法は、動物またはヒトから血液検体を供給するステップを含み、当該動物の検体を本発明のポリペプチドと接触させることによって、血清検体中に本発明のポリペプチドを認識する抗体が存在することを示す。診断するために使用する免疫原性組成物は、2〜20個もしくは特に3〜20個の異なるポリペプチドもしくは融合ペプチド等、または3〜10個のポリペプチドもしくは融合ペプチド等の、1〜20個の異なるポリペプチドもしくは融合ペプチドを含むことができる。
【0079】
診断用DNA
本発明のポリペプチドをコードする核酸のプローブを、所与の検体中の病原体の存在を検出するための多様な診断アッセイに使用することができる。本発明の核酸断片を動物に投与するステップ、または検体を本発明の核酸断片もしくはそれに対して相補的な核酸断片と共にインキュベーションするステップと、インキュベーションによってハイブリダイゼーションした核酸の存在を(当技術分野でよく知られたハイブリダイゼーションアッセイを使用して)検出するステップとを含む、ヒトを含む動物中または検体中のクラミジアの核酸の存在を測定する方法もまた、本発明に含まれる。そのようなクラミジア感染を診断する方法では、上記で定義したヌクレオチド配列の少なくとも一部を含む組成物を使用し、試験しようとする動物またはヒトの検体中の、核酸断片(または相補的な断片)とハイブリダイゼーションするヌクレオチド配列の存在を、PCR法を使用して検出することになるであろう。
【0080】
抗体
また、イムノアッセイにおいて本発明のポリペプチドと特異的に反応するモノクローナル抗体もしくはポリクローナル抗体または当該抗体の特異的結合断片もまた、本発明の一部である。抗体は、当業者に既知の方法で調製することができる。ポリクローナル抗体は、哺乳類中で、例えば、本発明のポリペプチドおよび必要であればアジュバントを1回または複数回注射することによって育てることができる。本発明のモノクローナル抗体は、例えば、KohlerおよびMilstein(1975)によってはじめて記載されたハイブリドーマ法によって、または米国特許第4,816,567号に記載されているような組換えDNA法によって調製することができる。また、モノクローナル抗体は、例えば、(McCafferty、Griffithsら、1990)によって記載されている技術を使用して生成したファージライブラリーから単離することもできる。抗体を調製する方法は、文献、例えば、米国6136958に記載されている。
【0081】
感染している恐れのある臓器の検体を、本発明のポリペプチドを認識するそのような抗体と接触させることができる。当技術分野でよく知られた方法により検体と抗体との間での反応が認められる場合、進行中の感染が示唆されることになる。もちろん、対象の血清検体を本発明のポリペプチド断片の少なくとも1つと接触させた後、抗体と抗原との間の反応を可視化するよく知られた方法を使用することによって、血清中の抗クラミジア抗体の存在を示すことも可能である。
【0082】
診断に際しては、本発明の抗体、核酸断片および/またはポリペプチドを、組成物中で、単独または1つの成分としてのいずれかで使用することができる。そのような組成物は、当技術分野においては既知であり、本発明の抗体、核酸断片またはポリペプチドが、少なくとも1種のその他の分子、例えば、(放射性もしくは蛍光)標識または担体分子に、結合、好ましくは共有結合している組成物を含む。
【0083】
本発明は、
1)クラミジア泌尿生殖器感染患者のT細胞を刺激し、INFγを分泌させる能力、あるいは
2)クラミジア泌尿生殖器感染患者のT細胞を刺激し、in vitroにおけるクラミジアの増殖を抑制するサイトカインを分泌させる能力、あるいは
3)クラミジア泌尿生殖器感染患者の血清IgG抗体および/またはIgM抗体および/またはIgA抗体による認識、あるいは
4)Chlamydia muridarumおよび/またはクラミジア・トラコマチスに実験的に感染しているマウスのT細胞および/または抗体による認識、あるいは
5)マウスへの投与によって、クラミジア・トラコマチスの細菌抗原を認識する免疫応答を誘発する能力、あるいは
6)予防接種によって、Chlamydia muridarumおよび/またはクラミジア・トラコマチスによる実験的攻撃感染に対して少なくとも部分免疫をもたらす能力
を有するクラミジア・トラコマチスの抗原性成分を開示する。
【0084】
第1に、クラミジア・トラコマチスのタンパク質から防御T細胞の分子標的を同定するために、クラミジア・トラコマチス血清型D(UW−3/Cx株、ATCC番号:VR−885)のタンパク質の可溶化液を、マルチ溶出法(AndersenおよびHeron、1993)によって分画した。この方法では、複合タンパク質の混合物中のタンパク質を、分子量によって狭い画分に分離し、次いで、分離したタンパク質を使用して、in vitroにおいて末梢血単核球(PBMC:Peripheral Blood Mononuclear Cell)を刺激する。数日間インキュベーションした後、INFγの放出をELISAによってモニターする(図1)。クラミジア患者の応答を、過去にクラミジア感染と診断されたことのない正常な血液提供者の応答と比較した。こうして比較することによって、ヒトへの感染の第1段階において、エフェクターT細胞を刺激してINFγを放出させる能力のあるクラミジア・トラコマチスのタンパク質を同定することができる。この方法を使用して、これらの防御T細胞の標的が、5〜12、16〜20、25〜35および58〜74kDaの見かけ分子量を有するタンパク質またはタンパク質の断片であることが示された(図2および3)。各刺激領域内の細菌のタンパク質の正確なアイデンティティーを、質量分析によって決定した。
【0085】
刺激抗原をさらに同定し、特徴付けると、特異的なクラミジア・トラコマチス抗原のそれぞれは、a)実施例1で例示するように、クラミジア・トラコマチスの抽出液の抗原から精製することができ、b)実施例1で例示するような、大腸菌から生成および精製された抗原であることができ、c)実施例1で例示するような、重複している合成ペプチドであることができ、またはd)実施例5で例示するような、組換えアデノウイルス構築物を直接用いた標的患者PBMCの形質導入体であることができるものである。図4に例示するように、この方法によって、INFγの放出によって測定された極めて強力な刺激能力を有する刺激領域のそれぞれの中にある、単一の抗原およびそれに由来するペプチドを同定することができた。
【0086】
第2に、5’−プライマーにコザック配列および3’−プライマーに終止コドンを含有する遺伝子特異的オリゴヌクレオチドを使用したポリメラーゼ連鎖反応法(PCR)により、完全長のクラミジア・トラコマチスの遺伝子を増幅することによって、定方向発現ライブラリーを構築した。クラミジア・トラコマチス血清型DのゲノムDNAを、PCR反応の鋳型として使用し、目的の遺伝子内のプライマーの位置およびTmを含む自動化プライマー設計のために、新たに開発されたUNIX(登録商標)プログラムを使用した。まず、単位複製配列を、組換えにより、Gateway「entry vector」(Invitrogen製)内に挿入し、次いで、組換えにより、His6タグおよびentry vectorと同一の組換え配列を含有するpDEST17発現ベクター(Invitrogen製)内に移動させた。高いレベルのクラミジア・トラコマチスに特異的なIgG、IgMまたはIgA抗体を有するヒト血清検体のプールを使用し、コロニーブロット法(French maulおよびmaul、1986)により、クラミジア・トラコマチス抗原の発現について、個々のクローンをスクリーニングした。細胞溶解の前に、プラスミドによってコードされているプロモーターに向けてはじまる転写を誘発するために、コロニーリフトのために使用するニトロセルロース製フィルターを、1%アラビノース溶液にあらかじめ浸漬した。クラミジア患者の血清IgG、IgMまたはIgA抗体に結合する陽性のクローンは、はじめのスクリーニングに使用したものと同一の血清検体のプールを使用して、ウェスタンブロット法によって、さらに分析するために選択した。この方法によって、ワクチンおよび診断に適切な、免疫反応性のクラミジア・トラコマチスのタンパク質をコードするクローンの同定に至った。
【0087】
第3に、ゲノム発現ライブラリーを、大腸菌ファージラムダgtl1(λgtl1)中で構築した。クラミジア・トラコマチス血清型Dの高分子量の染色体DNAを、基本小体から、SDS(1%)およびプロテイナーゼK(100μg/ml)を含有する溶解緩衝液中に抽出後、フェノールで抽出し、エタノールで沈殿させた。DNAを超音波処理によって部分的に分解し、0.2〜0.8kbのサイズのDNA断片を、λgtl1に連結した。連結混合物をin vitroパッケージし、組換えファージを大腸菌Y1090r−上に蒔いて培養し、約3.4×105の一次ラムダファージを含有するゲノム発現ライブラリーを得た。この一次ライブラリーを増幅して、6.7×109PFU/mlのゲノムのランダム発現ライブラリーを得た。第1の実験では、このライブラリーを、完全長の発現ライブラリーのスクリーニングのために上記で使用したものと同一のヒト血清検体のプールを使用し、プラークリフト法によってスクリーニングした。クラミジア・トラコマチスに特異的なIgG、IgMまたはIgA抗体に結合する、免疫反応性のプラーク88個を同定した。これらのプラークを、8個のプール(IgA反応性プラークのプール2個、IgG反応性プラークのプール5個、およびIgM反応性プラークのプール1個)として貯蔵した。はじめのスクリーニングに使用したものと同一の血清プール(一次抗体)を用いて、再スクリーニングした。個々の血清反応性のファージプラークを単離し、個別に血清反応性であるファージの挿入DNA配列を決定した。この方法により、ワクチンおよび診断に適切な、特異的クラミジア・トラコマチス免疫反応性ペプチドをコードするいくつかのクローンを同定した。
【0088】
最後に、実験的クラミジア感染においてマウスの免疫系によって認識される抗原を同定するか、または攻撃感染に対して少なくとも部分免疫をもたらすために、感染症の動物モデルを小型齧歯類において確立した。クラミジアは種によって、自然の宿主に対して、高い程度の特異性を示す。したがって、上記の種々のスクリーニング戦略に使用したクラミジア・トラコマチス血清型Dは、ヒトの病原体であり、これは、ヒトへの感染に通常伴う病理学的変化をマウスでは起こさない。一方、マウスを近縁のC.muridarum MoPn株に実験的に感染させることができ、何人かの研究者が、実験的MoPn感染に対する部分免疫の誘発を過去に実証している。したがって、性器感染モデルは確立されており、かつC57マウスにおいて確認されている。このモデルにおいて、異なる抗原の防御効果が、1)子宮頚部の拭き取りによる細菌数、2)生殖器の病理学的変化、および3)免疫反応性細胞のin vitroにおける細胞アッセイを評価することによって研究された。
【0089】
表1:クラミジア抗原
【表2】

【0090】

【0091】

【0092】

【0093】

【表3】

【図面の簡単な説明】
【0094】
【図1】図1は、クラミジア・トラコマチス血清型D溶菌液の細胞反応性を示す図である。6人の対照提供者および15人の患者から単離したPBMCのIFNγの応答を示す。PBMCを、5μg/mlのクラミジア・トラコマチス溶菌液で刺激し、IFNγの放出を、上澄み中で、5日後に測定した。
【図2】図2は、クラミジア・トラコマチス血清型Dのタンパク質画分を示す図である。細菌の溶菌液を、マルチ溶出法によって狭い分子画分に分離した。画分を、SDS−PAGEおよび銀染色によって分析した。分子量マーカーの泳動を、右(レーン1)にキロダルトンで示す。溶菌液を、第1および残りのレーンに示す。
【図3】図3は、クラミジア・トラコマチス血清型Dのタンパク質画分のヒトT細胞認識を示す図である。8人のクラミジア患者(>1000pg/mlで溶菌液全体に応答)および6人の対照提供者から単離したPBMCを、2μg/mlの個々の画分で刺激した。IFNγの放出を、上澄み中で、5日後に測定した。短い線は、IFNγ放出量の平均値を示す。
【図4】図4は、4人の患者および3人の対照における組換えタンパク質に対するT細胞の応答を示す図である。PBMCを、5μg/mlのrCT521、rCT511、rCT616、rCT043およびrCT803で刺激した。三連の培地のIFNγの平均値を示す。
【図5】図5は、41人のクラミジア患者(いずれも1500pg/ml超のIFNγでクラミジア・トラコマチス血清型Dの溶菌液に応答)および1500pg/ml未満のIFNγで溶菌液に応答した11人の対照提供者におけるrCT521の認識を示す図である。PBMCを、rCT521(5μg/ml)および重複CT521ペプチド(各10μg/ml)のプールで刺激し、IFNγのレベルを上澄み中で測定した。C:抗原を含有しない対照のウェル。短い線は、IFNγの平均値(pg/ml)を示す。
【図6】図6は、CT521ペプチド(10μg/ml)の刺激によるIFNγの放出を示す図である。短い線は、各ペプチドに対するIFNγ放出量の平均値を示す。カットオフ値を、200pg/mlのIFNγと設定する(線)。
【図7】図7は、クラミジア・トラコマチス抗原をコードする異なる組換えアデノウイルスで形質転換したPBMCによるIFNγの放出を示す図である。患者のPBMCを、表示するアデノウイルスを用いて感染効率1で形質転換し、INFγの放出を第2日目に測定した。AdVaMockは、挿入断片のない形質転換アデノウイルスの活性を示す。
【図8】図8は、PID7およびPID14における封入体形成単位を示す図である。
【図9】図9は、PID49における卵管水腫のスコアを示す図である。
【図10】図10は、クラミジア・トラコマチスのタンパク質に対するT細胞の応答を示す図である(図10a〜10i)。タンパク質を、10人の患者(黒丸)および5人の対照(四角)において試験した。C、抗原を含有しない細胞培地。平均ならびに75および25パーセンタイルを示す。
【図11】図11は、5人以上の患者が全対照を超えるIFNγのレベルで応答したクラミジア・トラコマチスのタンパク質に対するT細胞の応答を示す図である。タンパク質を、10人の患者(黒丸)および5人の対照(四角)において試験した。C、抗原を含有しない細胞培地。平均ならびに75および25パーセンタイルを示す。
【図12】図12は、最後の免疫化の1週間後の血液リンパ球による抗原特異的応答を示す棒グラフである。IFNγ応答を、10匹の動物からプールした細胞培地中で測定した。各棒は、三連の値の平均値±標準偏差を示す。
【図13】図13は、C3H/HeNマウスにおける感染7、14および21日後の封入体形成単位を示す図である。値は、log10 IFU/mlで示す。値はすべて、10匹の動物の平均値±平均値の標準誤差を示す。
【図14】図14は、ELISA法によって、OD=1.0における希釈度として測定した免疫原に対する血清の反応性を示す図である。各点は、4匹の動物の平均値±平均値の標準誤差を示す。
【図15】図15は、C. muridarum(MoPnのEB)またはクラミジア・トラコマチス(血清型DのEB)の基本小体の可溶化液全体に対する特異的な血清の反応性を示す図である。陽性を、赤の点で示す。理論的な大きさと一致する大きさのバンドを、陽性とする。
【図16】図16は、最後の免疫化の3週間後の脾細胞による抗原特異的応答を示す。IFNγの応答を、4匹の個別の動物の細胞培地中で測定した。各棒は、三連の値の平均値±標準偏差を示す。
【発明を実施するための形態】
【実施例】
【0095】
(実施例1:クラミジア・トラコマチス血清型DのヒトT細胞抗原の同定)
緒言
本発明者らは、SDS−PAGE、次いで電気溶出により分離した複合タンパク質の混合物から得た狭い分子量の画分を使用して、クラミジア・トラコマチスのタンパク質に対するT細胞の応答を分析した。この方法により、免疫応答を直接分析し、刺激性のタンパク質画分を比較することができる。これによって、いくつかの刺激性のタンパク質画分の同定およびT細胞の標的の同定に至った。これらのT細胞標的を、組換え法およびタンパク質配列の全体に広がって重複しているペプチドを使用して、さらに評価した。
【0096】
材料および方法
微生物および培養
クラミジア・トラコマチス血清型D(UW−3/Cx株)を、Hela229細胞(ATCC製、Rockville、メリーランド州、米国)内で増殖させた。5%ウシ胎児血清(Gibco BRL製、熱により不活性化)、1%v/v Hepes、1%v/v L−グルタミン、1%v/v ピルビン酸、および10μg/mlのゲンタマイシンを含有する継代培地RPMI1640(Gibco BRL製、Grand Island、ニューヨーク州、米国)中で、T細胞を培養した。
【0097】
175cm2のフラスコ中のHela229細胞のセミコンフルエントな単層を、DEAE−デキストラン(HBSS中45μg/ml)で、室温にて15分間前処理した後、3mlのHBSS中の1封入体形成単位/細胞のクラミジア・トラコマチス血清型Dに感染させた。フラスコを、プレート振とう器上で、37℃にて2時間インキュベーションした。2時間後に、5%グルコースおよび1μg/mlのシクロヘキシミドを追加した50mlの継代培地RPMI1640を各フラスコに加え、細胞を加湿空気中で、5%のCO2雰囲気下、72時間、さらにインキュベーションした。
【0098】
クラミジア・トラコマチスの収集
クラミジアを、感染後72時間で収集した。細胞を、セルスクレーパーを用いてフラスコから取り出し、4℃にて35,000gで30分間遠心分離した。ペレットを、フラスコあたり5mlのHBSS中に再懸濁させ、氷上で超音波処理し、500gおよび4℃で15分間遠心分離した。上澄みを採取し、氷上で保存し、ペレットを、前回と同量に再懸濁させ、超音波処理および遠心分離を繰り返した。2つの上澄みをプールし、30000gおよび4℃で30分間遠心分離し、ペレットを、針と注射器を用いてSPG緩衝液(3ml/T175)中に再懸濁させた。短時間の超音波処理の後、懸濁液を、30%ジアトリゾ酸溶液(76mlの水中にジアトリゾ酸メグルミン50g、ジアトリゾ酸ナトリウム7.7g)上に穏やかに層状に置き、40,000gで30分間遠心分離した。遠心分離後、ペレットをSPG緩衝液中に再懸濁させ、−70℃で保存した。
【0099】
分画用クラミジア・トラコマチスの溶菌液の調製
6〜8mgのクラミジア・トラコマチスを、30000gで30分間遠心分離し、ペレットを、1:1でWFIおよび検体緩衝液/DTT中に再懸濁させ、5分間沸騰させた。12秒間の超音波処理を2回行った後、懸濁液を、30000gで30分間遠心分離した。上澄みを、使用するまで−70℃で保存した。
【0100】
クラミジア・トラコマチスの溶菌液の分画
クラミジア・トラコマチスの溶菌液を、AndersenおよびHeron(1993)の記載に準じて分画した。簡単に説明すると、クラミジア・トラコマチスの溶菌液を、タンパク質として約6〜8mgの量で、SDS−PAGE(10〜20%ゲル)により一晩かけて分離した(11cm中心幅のウェル、0.75mmゲル)。溶出緩衝液(アンモニアCAPS緩衝液、pH10.2)中で、あらかじめ平衡化したゲルをMulti-Eluterに移し、20分間電気溶出した。タンパク質画分を吸引した後、SDS10〜20%ポリアクリルアミドゲル上で分離、銀染色(BlumおよびGross、1987)することにより分析した。画分中のタンパク質濃度を、Micro BCA法(Pierce製、Oud-beijerland、オランダ)によって推定した。全画分のうちの0.5mlを、0.5%ヒトAB血清で安定化させ、使用するまで−70℃で保存した。残りは、質量分析に使用するために、血清を添加せずに−70℃で保存した。
【0101】
質量分析
ペプチドの質量による対応付けのための試料を、銀染色したSDS−PAGEゲルから切り出した。バンドを洗浄、乾燥、還元し、ヨードアセトアミドでアルキル化してから、Shevchenkoら、1998の記載に基本的に準じて、改変トリプシンで一晩消化した。
【0102】
提供者
デンマークのBispebjerg病院でクラミジアと診断された患者に、研究への参加および抗生物質療法の開始前に血液検体の提供を依頼した。クラミジア感染の記録のない対照である対象にも、研究への参加を依頼した。個々の患者の検体を、男女別にMまたはKとし、場合によっては、特定の患者から採取した第1、2、3、...番目の検体に、A、B、C...として続き番号を割り当てることにより、独自の同定可能なコードを用いてアノテートした。いずれの場合も、検体Aは、あらゆる治療をはじめる前に採取した。例えば、12MBは、患者番号が12である男性から採取した、第2番目の検体を示す。対照検体は、KK−xxとアノテートした。
【0103】
リンパ球の調製および細胞培養
末梢血単核球(PBMC)を、全血から、Lymphoprep(Nycomed A/S製、オスロ、ノルウェー)の密度勾配遠心分離によって分離し、使用するまで、液体窒素内で凍結した。PBMCを解凍後、1%ペニシリン/ストレプトマイシン、1%非必須アミノ酸、1%グルタミン(Gibco製)、1%ピルビン酸、1%Hepes、および10%ヒトAB血清(地元の血液銀行、Rigshospitalet製、コペンハーゲン)を追加したRPMI1640中に、再懸濁した。細胞の生存率および数を、ニグロシン染色法によって測定した。細胞を、三連とし、丸底マイクロタイタープレート(Nunc製、Roskilde、デンマーク)中で、全量100μl中に1.25×105細胞/ウェルで培養した。はじめの用量−応答研究に基づいて、抗原を以下の濃度で添加した。SvD溶菌液:2μg/ml、SvD画分2μg/ml、rCT521 5μg/ml、CT521重複ペプチド 10μg/ml。フィトヘマグルチニン(PHA、2μg/ml)を陽性対照として使用し、抗原を含まない細胞培養を陰性対照として含めた。37℃にて加湿空気(5%のCO2および95%空気)中で5日間インキュベーションした後、上澄みを収集した。
【0104】
IFNγアッセイ
上澄み中のIFNγの量を、市販の抗体(Endogen製)を用いて、ELISA法によって測定し、メーカーの指示に従って使用した。組換えIFNγを、標準(Endogen製)として使用した。
【0105】
重複ペプチド
CT521の完全な一次配列を網羅する、22〜23塩基のペプチド(9〜12個のアミノ酸が重複)10個を、固相法(Schafer-N製)によって合成した。
【0106】
大腸菌内でのクラミジア・トラコマチス抗原の生成
質量分析法によって同定した抗原をコードするCT遺伝子を、Gateway Cloning Technology Manual(Invitrogen製)に従って、pDEST17ベクターのNH2−末端(His)6配列を有するフレーム中にクローン化した。組換えクラミジア・トラコマチス抗原の生成のために、プラスミドベクターを、アラビノースの存在下で高いレベルの組換えタンパク質生成を促進するBL21−AI大腸菌株(Invitrogen製)内にクローン化した。
【0107】
組換えクラミジア・トラコマチス抗原の小規模な精製
細菌細胞ペレットを、10mMイミダゾール、20mM NaH2PO4、500mM NaCl、8M尿素中に懸濁させ、メーカー(BioSpec Products, Inc)の指示に従って、BeadBeaterによって細胞を破壊した後、室温にて穏やかに振とうしながら1時間インキュベーションした。清澄な上澄みを、HisTrapカラム(Pharmacia Biotech製)上に加え、洗浄後、0.5Mイミダゾール、20mM NaH2PO4、500mM NaCl、8M尿素で溶出した。溶出試料を、調製用SDS−PAGE上で電気泳動して分離した。目的の組換えポリペプチドを、クーマシーブルー染色法によって同定し、切り出し、422型Electro-Eluterをメーカー(BioRad)の取り扱い説明書に従って使用して、ゲル切片から電気溶出した。電気溶出した組換え抗原を、80〜90%アセトン(Aldrich製、HPLCグレード)中で沈殿させ、95%エタノール中で洗浄後、最小量の10mMイミダゾール、20mM NaH2PO4、500mM NaCl、8M尿素中に再懸濁させた。最後に、試料を50mM Tris、pH7.5;150mM NaCl、40%グリセロールへ透析し、−20℃で保存した。
【0108】
結果:
クラミジア溶菌液に対するT細胞の応答
Hela細胞感染72時間後に収集したクラミジア・トラコマチス血清型D溶菌液のT細胞認識に関して、クラミジア患者をスクリーニングした。この溶菌液は、クラミジア・トラコマチスの全成分の混合物を意味し、クラミジア・トラコマチスの抗原のレパートリー全体を網羅するものである。この調製物を使用して、15人のクラミジア患者および6人の対照提供者からのPBMCを刺激した(図1)。溶菌液に対する応答は、15人の患者中8人において、顕著なレベル(>1000pg/ml)のIFNγに関連があった。1人の対照提供者においてのみ、1000pg/ml超のIFNγで、溶菌液に対し応答した。
【0109】
クラミジア患者は、複数の抗原を認識する
T細胞の応答の特異性を、マルチ溶出法によって得たタンパク質画分を用いて、PBMCを刺激することによって調べた。この方法を溶菌液に使用し、隣接する画分とは最低限しか重複しない狭い画分を得た(図2)。各画分のポリペプチドの数を、10〜30個と推定する。そのような画分のパネルを使用して、溶菌液全体に応答した8人の患者および6人の対照提供者の抗原認識パターンをスクリーニングした(図3)。これらの画分に対する細胞性応答は、応答が複数の抗原に対するものであることを示した。しかし、IFNγを生成するピークが、5〜12、16〜20、25〜35および58〜74KDaの分子量の領域で認められた。
【0110】
クラミジア患者による組換えタンパク質の認識
分子量領域16〜20(図2)を含む画分7ならびに隣接する画分6および8について、SDS−PAGEを行った。ゲルを銀染色し、画分を含有する部分をゲルから切り出し、Milli Q水中に置き、タンパク質を同定するために質量分析に送った。CT521、CT043、CT511、CT616、CT315およびCT803の6個のヒットが同定された。分子量領域25〜35を含む画分10、11、12、13、14および15も、さらに質量分析に送った。CT603、CT678、CT561、CT610、CT538、CT582、CT583、CT679、CT067、CT681の10個のヒットが同定された。分子量領域58〜74を含む画分22を、質量分析に送った。CT875、CT110、CT112の3個のヒットが同定された。最後に、画分18を質量分析に送り、CT587およびCT322の2個のヒットが同定された。
【0111】
組換えタンパク質、rCT043、rCT511、rCT521、rCT616、rCT803を大腸菌から精製し、1KA、15KA、7KAおよび12KAの4人の患者において、5種のクラミジア・トラコマチスのタンパク質の免疫学的活性を調べた(図4)。rCT521は、試験した4つの中で、最も有望な抗原であった。対照提供者に比べ、4人の患者のうち3人(1KA、7KAおよび15KA)が、rCT521に対して強力(>1000pg/m)に応答した。rCT803、rCT511およびrCT616は、4人の患者のうち2人(1KA、7KA)において、高いレベルのIFNγを誘発し、rCT043は、すべての患者において、低いレベルのIFNγを誘発した。組換えタンパク質、CT043、CT511、CT603、CT561、CT610、CT583、CT679、CT067、CT681、CT875、CT110、CT112、CT587およびCT322を大腸菌内で生成し、10人の患者および5人の対照でT細胞認識を試験した(実施例8)。
【0112】
クラミジア患者によるCT521の認識
クラミジア感染患者によるCT521の認識を、提供者のより大きなパネルで試験した。いずれも1500pg/ml超のIFNγでクラミジアの溶菌液に応答した、全部で41人のクラミジア患者を、CT521の認識について試験した。さらに、1500pg/ml未満のIFNγで溶菌液に応答した11人の対照提供者も含めた(図5)。500pg/mlを超えるIFNγの応答に基づいて、患者をCT521陽性およびCT521陰性に分類することができた。41人の患者のうち34人が、CT521陽性であり(82.9%)、11人の対照のうち2人のみが、CT521に応答した(18.2%)。これらの結果から、CT521が、クラミジアの溶菌液全体に応答したクラミジア患者によって、高頻度で認識されることが示されている。
【0113】
合成ペプチドより対応付けした、CT521に対するT細胞応答の精密な特異性
CT521に対するT細胞応答の精密な特異性を、CT521の完全な配列を網羅する重複ペプチドのパネルをスクリーニングすることによって対応付けた。ペプチドを、9〜12個のアミノ酸が重複する22〜23塩基として合成し、41人のクラミジア患者および11人の対照のPBMCを刺激するために使用した(図6)。応答は非常に不均一であるにもかかわらず、特定の領域が応答の強力な標的となっている特定の階層が存在した。タンパク質のN末端部分(アミノ酸14〜アミノ酸36)、中心部分(アミノ酸40〜アミノ酸88)、およびC末端部分(アミノ酸116〜アミノ酸138)に存在するエピトープが、その他よりも、強力にまたは頻繁に認識された。
【0114】
(実施例2:定方向性ライブラリー戦略(抗体標的のスクリーニング))
緒言
高スループットな手法をとり、クラミジア・トラコマチス血清型Dゲノム中の血清反応性抗原を試験した。最初の200個のオープンリーディングフレーム(ORF)から、完全長ライブラリーを構築した。このライブラリーは、大腸菌内で、抗原を組換えによって発現するように設計されていた。このライブラリーをスクリーニングするために、本発明者らは、ウェスタンブロット分析法によってクラミジア・トラコマチスの基本小体(EB)の抽出液全体に対する反応性に基づいて選択した、5人の高い応答の患者の血清プールを使用した。
【0115】
材料および方法
完全長ライブラリーの構築
クラミジア・トラコマチス血清型Dのゲノムは、公的に入手可能であり、Stephensら(Stephens、Kalmanら、1998)によって定義されている一次アノーテーションを使用した。遺伝子Ct001〜Ct200を、クローニングのために選択した。特定の遺伝子の増幅用の5’および3’プライマーを、「社内製の」ソフトウェアによって設計した。200個の特異的なクラミジア・トラコマチス遺伝子からなる完全長配列を、Entry Vector、pDONR 201(Invitrogen製)内にクローン化した。このベクターによって、目的の遺伝子を、Gatewayクローニングシステム(Invitrogen製)の異なる目的ベクターにクローン化することができる。pDEST17目的ベクターは、6×ヒスチジン親和性タグを有する、大腸菌内での組換えクラミジア・トラコマチスのタンパク質の発現のために使用した。細菌宿主は、アラビノースによる誘発によって組換えクラミジア・トラコマチスのタンパク質を生成するためのBL21−AI(登録商標)であった。
【0116】
発現
1mlの培地を含有する2×96ウェルプレートを、37℃にて一晩、増殖させた。培地をOD600=0.1になるまで希釈し、OD600=0.5になるまで、37℃にて振とう(180rpm)しながらインキュベーションした。その後、L−アラビノースを、最終濃度が0.2%になるように加えることによって、培養を誘発した。4時間誘発した後、培養物を氷上に移し、細菌のペレットを遠心分離(3,000g/20分)によって収集した。ペレットを、コロニーブロット法の結果が得られるまで、冷蔵庫に保管した。
【0117】
患者の血清
ライブラリーのスクリーニングに使用する患者の血清プールを調製するために、5人の陽性クラミジア・トラコマチス患者、3KA、11KA、12KA、13KAおよび17KAを選択した。アルカリホスファターゼ結合ウサギ抗ヒト−IgA、−IgGおよび−IgMのそれぞれを二次検出マーカーとして使用するウェスタンブロット分析法(DakoCytomation製、デンマーク)において、クラミジア・トラコマチス血清型Dの基本小体の抽出液に対する特異的かつ高い反応性に基づいて、これらの患者の血清を選択した。
【0118】
患者の血清プール(10倍希釈)は、全大腸菌タンパク質抽出液を2mg/mlで用いて、室温にて3時間前処理した。作用患者血清プールは、10mM Tris−HCl、pH8、150mM NaCl、0.05%Tween20(TBST製)中に1:200で希釈した。
【0119】
コロニーブロット
完全長大腸菌発現ライブラリーのスクリーニングは、基本的には、Frenchら(1986)に従って行った。Ct001〜Ct200およびゲノム全体から選択された遺伝子をコードする細菌培養物(1ml)を、2つの96穴ディープウェルプレート中で、37℃にて、一晩、増殖させた。(6×8)のグリッパー用具を使用して、細菌培養物を、(100μg/mlのアンピシリンを含有する)LB寒天を含有するペトリ皿に移した。コロニーを、30℃にて一晩放置した。コロニーを1%L−アラビノース中にあらかじめ浸漬したニトロセルロース製の膜上で複製し、コロニーの面が下になるようにして、(100μg/mlアンピシリンおよび0.2%L−アラビノースを含有する)新しいLB寒天プレートに移した。プレートを、37℃にて4時間インキュベーションし、最後に、膜を空のペトリ皿に移し、クロロホルム中にあらかじめ浸漬した紙製のフィルター上で、コロニーの面が上になるようにして、15分間保った。こうして、細菌は、クロロホルムの蒸気に曝された。膜を、リゾチームおよびDNA分解酵素を含有する溶菌緩衝液中で、一晩インキュベーションした。洗浄工程を繰り返した後、膜を一次抗体(作用患者血清プール)と共に、室温にて2時間インキュベーションした。膜を繰り返し(過剰の1×TBSTで4回)洗浄した後、二次抗体中で、1時間インキュベーションした。二次抗体は、
A.ウサギ抗ヒトIgG(DO336)DakoCytomation製、
B.ウサギ抗ヒトIgA(DO338)DakoCytomation製、
C.ウサギ抗ヒトIgM(DO337)DakoCytomation製、または
D.ウサギ抗ヒトIgG(DO336)およびウサギ抗ヒトIgA(DO338)のプール
のいずれかであった。すべて、アルカリホスファターゼと結合していた。
【0120】
1×TBST中で2回洗浄後、膜を、BCIP/NBT基質(Sigma Fast製)で展開した。
【0121】
全カテゴリー(IgG、IgAおよびIgM)で陽性のクローンを選択した。
【0122】
コロニーブロット法で陽性のクローンを用いたウェスタンブロット法
1mlの培養物からの細菌のペレットを、200μlのSDS−PAGE試料緩衝液中に再懸濁させ、95℃にて5分間加熱、SDS−PAGEにより電気泳動後、標準的なウェスタンブロット法によってニトロセルロースに移動させた。上記と同一の患者血清プールおよび二次抗体(A〜C)のプールと共に、膜をインキュベーションした。タンパク質の誘発の対照として、複製膜を、抗Penta−His抗体と共にインキュベーションし、メーカー(Qiagen)の指示に従って処理した。コロニーブロット法で反応しなかった2つのコロニーを、対照として含めた。
【0123】
結果:
細菌コロニースクリーニング手法における患者血清により認識されたCT抗原の同定結果を以下に示す。
【表4】

【0124】
(実施例3:ランダムライブラリー戦略)
緒言
クラミジア・トラコマチス血清型Dゲノム中の血清反応性抗原をスクリーニングするために、ランダム発現ライブラリーを、発現ベクターλgtl1内で構築した。このライブラリーは、β−ガラクトシダーゼを有するフレーム内に融合させた100〜400個のアミノ酸残基からなるクラミジア・トラコマチスのペプチド断片を、ランダムに発現するように設計されていた。ライブラリーを、ウェスタンブロット分析法によってクラミジア・トラコマチスの基本小体(EB)の抽出液全体に対する反応性に基づいて選択した患者の血清を用いてスクリーニングした。
【0125】
材料および方法
高分子量クラミジア・トラコマチス血清型DゲノムDNAの単離
約8.6×109IFU(感染単位)を含有するクラミジア・トラコマチス血清型Dの基本小体の粗調製物を、40,000×gで60分間、44〜54%ジアトリゾ酸溶液で段階密度勾配超遠心分離することによって、さらに精製した。54%界面にバンドを形成した基本小体を採取し、10倍量のSPG緩衝液(250mMスクロース;10mM Na2HPO4;5mM L−グルタミン酸)中に希釈し、30,000×gで30分間遠心分離することによって沈殿させた。基本小体のペレットを、5mlのTENS緩衝液(50mM Tris、pH 9;100mM EDTA;200mM NaCl;1%SDS)中に再懸濁させ、100μg/mlプロテイナーゼKと共に、37℃にて60分間インキュベーションした。試料をTENS緩衝液中に1回希釈し、核酸をフェノール/クロロホルム抽出により精製後、エタノールで沈殿させた(Maniatisら、1987)。RNAを、RNA分解酵素T1およびRNA分解酵素Aの混合物(Stratagene製)25U/mlで、37℃にて60分間処理することによって除去し、フェノール/クロロホルムよる抽出およびエタノールによる沈殿を再度行った。クラミジア・トラコマチス血清型DゲノムDNAの調製物を、TE中に0.4μg/μlで再懸濁させ、一部をアガロースゲル電気泳動法により試験したところ、高分子量、≫50kbのDNAを含有していることが示された。
【0126】
クラミジア・トラコマチスの全ゲノムランダム発現ライブラリーの構築
175μlのTM緩衝液(10mM Tris、pH8;10mM MgCl2)中に50ugのDNAを含有する微量遠心機用チューブを、Soniprep 150超音波処理器(MSE製)内に置かれた氷水浴内に入れて、超音波処理することによって、クラミジア・トラコマチスゲノムDNAのランダムな断片を生成させた。マイクロチップ(1/8インチφ)を試料の表面下約2mmに入れ、超音波処理を15μの振幅で80分間継続的に行った。このような条件下では、ゲノムDNAは、ランダムに分割され、アガロースゲル電気泳動で分析すると、0.05〜1kbの範囲の大きさの断片となっていた。これに続く、超音波処理したCTゲノムDNAのフェノール/クロロホルム抽出およびエタノールによる沈殿工程の調製の過程は、適宜場合によって加えた。約10μgの超音波処理DNA断片の末端の修復およびリン酸化を、T4DNAポリメラーゼ、クレノウDNAポリメラーゼおよびT4ポリヌクレオチドキナーゼを組み合わせてインキュベーションすることにより行った。さらに、ランダム断片化CTゲノムDNAを、EcoRIメチラーゼで処理した後、50倍モル過剰のリン酸化EcoRIリンカー(12塩基、BioLabs製)を用いて、リンカーの連結を行った。DNAをEcoRIで処理し、最終DNA標本は、6%アクリルアミドゲル上でサイズ分画を行い、0.2〜0.8kbの大きさの断片を500μlのGES緩衝液(0.5M酢酸アンモニウム;10mM酢酸マグネシウム;0.1mM EDTA;0.1%SDS)中で42℃にて一晩インキュベーションすることによって、ゲル切片から溶出させた。清澄な上澄みをエタノールで2回沈殿させ、最終的なペレットを10μlのTE中に再懸濁させた。DNAをEcoRIにより消化し、脱リン酸化したλgtl1ファージのベクターアーム(Stratagene製)に連結した。ライゲーションミックスは、Gigapack III Gold抽出液を用いて、メーカー(Stratagene)の指示に従って、in vitroパッケージした。組換えファージを大腸菌Y1090r−上に蒔いて培養し、全部で約340,000種の一次ラムダファージを生成した。IPTGおよびX−galの存在下でファージを蒔いて培養し、青/白選択アッセイから判断すると、これらのうち約60%が、真の組換え
ファージであった。一次ファージ発現ライブラリーを約3×104PFU/135mmφプレートの密度で増殖させた後、採取し、7%v/v DMSO中に小分け分注して、−80℃にて保存した。増殖させたクラミジア・トラコマチスの全ゲノムランダム発現ライブラリーの力価は、6.7×109PFU/mlであった。
【0127】
患者の血清
ランダム発現ライブラリーのスクリーニングにおいて使用した患者の血清のプールは、実施例2において先に記載したものと同一であった。
【0128】
クラミジア・トラコマチスの全ゲノムランダム発現ライブラリーのスクリーニング
増殖させたλgtl1発現ライブラリーを、大腸菌Y1090r−細胞に吸収させ、5×104〜1×105PFU/135mm寒天プレートで蒔き、42℃にて3時間半インキュベーションした。プレートを、水中の10mM IPTGであらかじめ飽和させてから乾燥させたニトロセルロース製のメンブランフィルター(BioTrace NT、Pall Corporation製)上に重ね、37℃にてさらに3.5時間インキュベーションした。フィルターを、1.5%BSAを含有するTBSTに移し、室温にて30分間インキュベーションした後、200倍に希釈した患者の血清のプールと共に室温にて30分間インキュベーションした。過剰な患者の血清を、TBST中で各10分間3回洗浄後、アルカリホスファターゼ結合ウサギ抗ヒト−IgA、−IgGまたは−IgMのいずれかと共に室温にて30分間インキュベーションした。最後に、TBST中で各10分間3回洗浄した後、フィルターをBCIP/NBT基質(Sigma Fast製)で展開した。
【0129】
免疫反応性が陽性のプラークの部分を10個の部分からなるプールに採取し、滴定後、個々の陽性プラークを同定するために、2.5〜5×103PFU/135mm寒天プレートの密度で蒔き、再度スクリーニングした。
【0130】
DNA配列決定および配列解析
個々の陽性として選択されたファージのプラークを、プラークの部分をかき取ることによって採取し、20μlの水中に懸濁させ、10秒間ボルテックスした後、37℃にて15分間インキュベーションした。懸濁液を、微量遠心管中で、最大スピードで30秒間遠心分離し、4.5μlの清澄な上澄みを、それぞれ2.5pmolの順方向プライマー、5’−ccagccatcgccatctgctgcacg−3’、およびλgtl1 EcoRI逆方向プライマー(BioLabs製)、ならびに1容量のHot StarTaq Master Mix(Qiagen製)を使用するPCR法による増幅に使用した。残りのファージ懸濁液を100μlのSM緩衝液中に希釈し、25μlのCHCl3と一緒にして、ファージストックとして4℃にて保存した。
【0131】
PCR法による増幅を、Gene Amp PCR System 9700サーモサイクラー(Applied Biosystem製)内で、95℃で15分間、次いで、95℃で1分間、60℃で1分間および72℃で1分間の30サイクル行った。4μlをアガロースゲル電気泳動によって試験した。増幅したDNAの配列決定のために、PCR反応の残りの6μlを5倍希釈し、MicroSpin S−300 HRカラムを用いて、メーカー(Amersham Biosciences)の指示に従って精製した。配列決定は、28塩基下流でLacZ遺伝子のEcoRIクローニング部位をプライムする、5’−CACCAGACCAACTGGTAATG−3’、または85塩基上流でLacZ遺伝子のEcoRIクローニング部位をプライムする、5’−GCCATCGCCATCTGCTGCACG−3’のいずれかの配列決定プライマーを使用するジデオキシ鎖停止法(MWG-BIOTECH(ドイツ)によって契約)によって行った。配列は、Vector NTI Suiteソフトウェアパッケージ(InforMax製)を用いて解析した。
【0132】
結果:
発現ライブラリースクリーニングによるクラミジア・トラコマチスの血清反応性抗原の同定
一次抗体としてプールした患者の血清を使用したクラミジア・トラコマチスλgtl1発現ライブラリーの第1スクリーニングによって、抗ヒト−IgA、−IgGまたは−IgMのいずれかをそれぞれの第2検出抗体として使用した場合において、いくつかの免疫反応性プラークを同定した。要約すると、88個の陽性プラークの部分を採取し、プールした。
【0133】
再スクリーニングのために採取したプラーク部分の数:
血清反応性のクラス プラークヒット数 スクリーニングのためのプールの数
IgA 24 各12個のプラーク部分からなる2個のプール
IgG 50 各10個のプラーク部分からなる5個のプール
IgM 14 各14個のプラーク部分からなる1個のプール
合計 88 8個のプール
【0134】
生成されたファージプールは、個々の陽性のファージのプラークの同定を可能にするために、培養の密度がはるかに低い以外は、はじめのスクリーニングと同一の条件を使用して再スクリーニングした。要約すると、全部で129個の陽性のプラークを個別に採取し、アノテートした後、直接配列解析およびファージストックの生成のそれぞれに使用した。
【0135】
個別に採取した陽性プラークの数:
血清反応性のクラス 個別のプラーク数
IgA 41
IgG 79
IgM 9
合計 129
【0136】
個別に単離した陽性のファージ中で、β−ガラクトシダーゼ融合体として発現した挿入断片のアイデンティティーを、配列決定法およびBlast解析(EMBL−EBI)によって同定した。
【0137】
CT抗原のアイデンティティーを、ランダム発現ライブラリーをスクリーニングすることによって同定した。
【0138】
全部で103個の個別のプラークの配列を決定し、22個の特有な配列相同性に分類した(PF=ペプチド断片):
CT541−PF1(アミノ酸位置111−243)
CT443−PF1(アミノ酸位置214−291)
CT795−PF1(アミノ酸位置1−163)
CT396−PF1(アミノ酸位置170−318)
CT842−PF1(アミノ酸位置433−515)
CT283−PF1(アミノ酸位置477−577)
CT874−PF1(アミノ酸位置330−426)
CT051−PF1(アミノ酸位置38−177)
CT141−PF1(アミノ酸位置17−126)
CT643−PF1(アミノ酸位置769−841)
CT681−PF1(アミノ酸位置156−391)
CT681−PF2(アミノ酸位置199−329)
CT681−PF3(アミノ酸位置294−349)
CT414−PF1(アミノ酸位置605−722)
CT414−PF2(アミノ酸位置463−530)
CT456−PF1(アミノ酸位置695−840)
CT456−PF2(アミノ酸位置137−229)
CT456−PF3(アミノ酸位置243−321)
CT456−PF4(アミノ酸位置209−291)
CT456−PF5(アミノ酸位置175−279)
CT456−PF6(アミノ酸位置567−730)
CT456−PF7(アミノ酸位置71−180)
CT456−PF8(アミノ酸位置190−279)
CT504−PF1
【0139】
(実施例5:クラミジア・トラコマチス抗原をコードする組換えアデノウイルスの生成)
緒言
T細胞反応性をスクリーニングのために、標的細胞に対するクラミジア・トラコマチス抗原の別の送達経路を探索するために、本発明者らは、患者のPBMCを直接形質導入することによって、抗原をコードする組換えアデノウイルスを構築し、試験した。
【0140】
材料および方法
組換えアデノウイルスのストックの構築
選択されたクラミジア・トラコマチス抗原をコードする組換えアデノウイルスは、基本的にViraPower Adenoviral Gateway Expression System(Invitrogen製)を使用することによって、コザック配列、ACCATGG、の状況におけるATG開始コドンを有するフレーム内のCT遺伝子をpAd/CMV/V5−DEST vector(Invitrogen製)内に導入して、生成した。停止コドンを、CT遺伝子のORFのすぐ下流に導入した。生存組換えアデノウイルスを、形質移入した293A細胞中で、メーカー(Invitrogen)の指示に従って生産した。一次組換えアデノウイルスのストックを凍結解凍法によって調製し、小分け分注して−80℃にて保存した。組換えアデノウイルスのストックの293A細胞中で、TCID50として計る力価を、エンドポイント法によって測定した。
【0141】
結果:
アデノウイルスのストックの調製
直接形質導入し、PBMC標的細胞アッセイにおいてCT抗原を発現させるために、アデノウイルスにおいて完全長クラミジア・トラコマチス抗原をクローン化した。
【0142】
以下のCT抗原が、アデノウイルスのストックとして利用可能:
CT460、CT529、CT579、CT587、CT681、CT509、CT713、CT043、CT511、CT521、CT616。
【0143】
アデノウイルスの形質転換クラミジア・トラコマチス抗原に対するT細胞の応答
4種のアデノウイルス構築物(AdVpCT043、AdVpCT511、AdVpCT521およびAdVpCT616)の免疫学的活性を、9人の患者および4人の対照において調べた(図7)。AdVpCT521は、9人中6人の患者で、強力な(>500pg/ml)IFNγの応答を誘発した。AdVpCT511は、9人中4人の患者で、500pg/mlを上回るIFNγのレベルで認識されたが、AdVpCT616およびAdVpCT043のそれぞれは、3人および2人の患者で、応答が刺激されたのみであった。対照群では、1人の提供者が、AdVpCT511およびAdVpCT521に応答した。
【0144】
(実施例6:齧歯類防御戦略)
緒言
齧歯類防御戦略を使用して、クラミジア抗原の効力を評価した。簡単に説明すると、抗原で免疫化した動物を、C. muridarumに、膣において攻撃感染させる。抗原で免疫化することによる防御能力は、膣のクラミジアの数を定量化し、慢性の病理学的変化をスコア化することによって評価する。ワクチン抗原に対する攻撃前の免疫応答には、脾臓細胞の再刺激後にINFgを定量化することによって、かつ、クラミジア・トラコマチスEB溶菌液に対する血清抗体の反応性および免疫原に対するELISA反応性を評価することによってアクセスする。このモデルで調べた抗原は、Ct015、Ct025、Ct026、Ct030、Ct048、Ct063、Ct078、Ct080、Ct184、Ct521、Ct051、Ct089、Ct175、Ct443、Ct456、Ct511、Ct541、Ct583およびCt603である。
【0145】
材料および方法
動物
C57BL/6Jマウス、雌、8〜12週齢をHarlan Laboratoriesから入手した。マウスを、標準的な環境条件で飼育し、標準的な飼料および水を自由に与えた。マウスの使用は、デンマーク法務省(Lov om dyreforsog、jvf lovbekendelser nr.726 of 9. 1993年9月)および動物保護委員会が進める規制にしたがった。提案する実験の詳細な説明を、申請者による地域の倫理調査委員会(2003/561−786)に提出し、許可を得た。
【0146】
Chlamydia muridarum
C. muridarumを、HeLa229細胞(ATCC製、Rockville、メリーランド州、米国)中で増殖させた。HeLa細胞を、完全培地(RPMI−1640(Gibco BRL製);5%熱不活性化ウシ胎児血清(Cambrex bioscience製);1%v/v Hepes;1%v/v L−グルタミン、1%v/vピルビン酸、および10μg/mlのゲンタマイシン中で増殖させた。175cm2のフラスコ内に蒔いたHeLa229細胞のサブコンフルエントな単層を、Hanks緩衝食塩溶液(HBSS)中の45μg/ml DEAE−デキストランで、室温にて15分間前処理した後、3mlのHBSS中の1MOI(すなわち、1封入体形成単位(IFU)のC. muridarum/HeLa細胞)に感染させた。37℃にて2時間インキュベーション後に、5%グルコースおよび1μg/mlのシクロヘキシミドを追加した50mlの完全培地を加え、感染させた細胞は、5%のCO2を含有する加湿したインキュベーター内で42〜44時間さらにインキュベーションした。適切な量の標的細胞内の封入体の存在を顕微鏡的に確認した後、単層を、セルスクレーパーを用いてフラスコから取り出し、4℃にて35,000gで30分間遠心分離した。ペレットを、フラスコあたり5mlのHBSS中に再懸濁させ、氷上で2×1000ジュールで超音波処理後、4℃にて500gで15分間遠心分離した。上澄みを採取し、氷上で保存した。ペレットを、5mlのHBSS中に再懸濁させ、最終ステップとして、超音波処理および遠心分離を行った。上澄みをプールし、4℃にて30,000gで30分間遠心分離し、ペレットをSPG緩衝液(250mMスクロース;10mM Na2HPO4;5mM L−グルタミン酸)中に再懸濁させた。短時間の超音波処理の後、懸濁液を、30%ジアトリゾ酸溶液上に穏やかに層状に置き、40,000gで30分間遠心分離した。遠心分離後、ペレットを、SPG緩衝液中に再懸濁させ、−70℃で保存した。
【0147】
C. muridarum調製物の感染力を、McCoy細胞上で滴定することによって定量化後、免疫蛍光アッセイで、封入体を数え上げた。簡単に説明すると、90〜95%サブコンフルエントなHeLa229の単層を、滴定した接種材料と共に室温にて750gで1時間遠心分離した後、35℃にて2時間インキュベーションした。接種材料を、5%グルコースおよび1μg/mlのシクロヘキシミドを追加した完全培地で置き換え、37℃にて42〜44時間さらにインキュベーションした。染色するために、細胞を99%の氷冷したエタノール中で、15分間固定した。固定した細胞を、ウサギポリクローナル抗−クラミジアMOMP抗体と共に1時間インキュベーションした後、FITC標識化ブタ−抗ウサギIg抗体で二次染色した。細胞を、ヨウ化プロピジウムで対比染色した。20高出力(×40)電界における封入陽性細胞を、蛍光顕微鏡を用いて数え上げて、C. muridarumストックの感染力を定量化した(IFU/μlで表示)。
【0148】
マウスの感染
マウスを、膣内において、105〜107IFU(100〜10,000ID50)で感染させた。感染は、接種後第7日目および第14日目に頚膣部の拭き取りを得て、蛍光染色し、検体中の感染単位を数え上げることによってモニターした。
【0149】
免疫
マウスを、尾の底部において、皮下(sc)で、2週間の間隔をおいて3回免疫化した。ワクチンは、250μgのDDAおよび100μgのTDB中に乳化させた1〜5μgのペプチド(上記を参照)で構成されていた。陰性対照として、ペプチドを含有しないDDA/TDBを単独で注射した。陽性対照として、マウスを、105IFUのC. muridarumに、55〜75日間、鼻腔内感染させた。鼻腔内感染させた場合、マウスは、ほとんど完全に防御され、膣からの感染により誘発された防御に匹敵するものであった。
【0150】
リンパ球の培養、血清抗体および免疫誘発能力の評価
強力な免疫応答を誘発する能力を評価するために、脾臓を、最後の免疫化後第21日目に取り出し、組織を金属製メッシュで擦り通すことによって脾臓のリンパ球を得て、単一の細胞懸濁液とし、RPMI−1640中で、室温にて800gで1回洗浄後、再刺激培地(RPMI−1640、Gibo製;10%熱不活性化ウシ胎児血清、Biochrom AG製、ベルリン;ペニシリンG、100U/ml;ストレプトマイシン、100μg/ml;10mM Hepes;2mM L−グルタミン;1mMピルビン酸)中に再懸濁した。
【0151】
単離した細胞を、三連で、丸底96ウェルプレート内で、200μlの再刺激培地中、2×105細胞/ウェルで培養した。ペプチドを0.08〜5μg/mlの範囲の濃度で添加し、72時間インキュベーションした。陰性および陽性対照(培地または5μg/ConAのいずれか)は、必要に応じて、すべての実験で含められた。再刺激後、上澄みを収集し、IFNγを酵素結合免疫吸着測定法(Brandt、Elhayら、2000)によって定量化した。臨界である2000pg/μl超の高いレベルのIFNγをもたらすワクチンの候補は、Ct015、Ct025、Ct026、Ct030、Ct048、Ct063、Ct078、Ct080、Ct184、Ct521、天然C. muridarumのMOMP、Ct051、Ct175、Cy443、Ct456およびCt603であった(図16)。
【0152】
同一の時点で、眼房から血液検体を採取し、血清を調製した。クラミジア・トラコマチス血清型DおよびC. muridarumの基本小体に対する反応性について、ウェスタンブロット解析法(Theisen、Soeら、2004)によって、血清を試験した。簡単に説明すると、密度勾配によって精製した基本小体を、4〜12%ポリアクリルアミドゲルで電気泳動し、ニトロセルロース上にエレクトロブロット後、Mesh緩衝液中のスキムミルク中でブロックした。血清のプール(それぞれのワクチン群から各4匹)を、100倍に希釈し、ブロットを加え、1時間インキュベーションし、洗浄後、アルカリホスファターゼ結合二次抗体を加え、さらに1時間インキュベーションした。反応は、BCIP/NBT(Sigma製)基質を加えてインキュベーションすることによって可視化した。観察された大きさが理論的な大きさと一致する場合、バンドを陽性と評価した。陽性は、Ct015、Ct030、Ct048、Ct078、Ct184およびCt521(図15)であった。
【0153】
免疫化に使用した組換えタンパク質および熱不活性化したC. muridarumの基本小体に対する反応性について、ELISA法(Rosenkrands、Aggerら、2005)によって、血清を試験した。簡単に説明すると、プレートを炭酸緩衝液o/n中の抗原(0.5μg/ml)でコーティングし、BSAでブロック後、洗浄した。プレートに、あらかじめ希釈した検体を加え、室温にて2時間インキュベーションし、洗浄後、ペルオキシダーゼ結合二次抗体を加え、1時間インキュベーションした。反応は、TMB基質を加えてインキュベーションすることによって可視化し、この反応を、硫酸を加えて停止し、450nmにおいて読み取った。データに4パラメーターフィットを適用した後、OD=1.0における力価を計算した(図14)。IgG1が高い抗原は、Ct015およびCt030であった。IgG2bが高い抗原は、Ct063、Ct521Highであった。
【0154】
防御効力の評価
ワクチンの効力を評価するために、第1回目の免疫化の8〜12週間後に、105〜107IFU(100〜10,000ID50)で膣内感染させることによって、マウスを攻撃した。ワクチン候補の防御効力を、病理学的評価および頚膣部の拭き取りにより得た感染単位を数え上げることによってモニターした。
【0155】
細菌数は、攻撃の7、14および/または21日後に得た頚膣部の拭き取りによって測定した。拭き取り検体を、1mlのSPG緩衝液に、4℃にて、準備ができるまで浸した。同じ日に、検体をmmガラスビーズの存在下全速で30秒間ボルテックスすることによって、C. muridarumの基本小体を、拭き取り検体から機械的に振り落とした。緩衝液をエッペンドルフチューブに移し、分析するまで−80℃にて保存した。上記に準じて、免疫蛍光アッセイで、サブコンフルエントなMcCoy細胞への封入体を数え上げることによって、感染性の基本小体を定量化した(図8)。PID7における拭き取り検体のIFUの数え上げ後に防御を誘発する抗原は、Ct015、Ct025、Ct048、Ct184、Ct521、Ct443、Ct603および天然C. muridarumのMOMPである。
【0156】
病理学的には、PID49において、急性および慢性の病態の徴候に関して、生殖器官全体を顕微鏡的に評価した。肉眼的な病理学的評価から、卵管水腫のスコアを計算した。スコアは、個々のワクチン群における卵管水腫の卵管の全数に対する比として計算した(図9)。PID42において、かなりの防御を誘発した抗原は、Ct025、Ct063、Ct184、Ct521である。
【0157】
入手可能な材料に基づくと、Ct184およびCt521が、攻撃モデルにおいて最も効果が高い抗原である。Lipovaccに処方すると、これらは、膣クラミジアに対して、最も少ない病態および最良の防御を誘発している。
【0158】
(実施例7:全ゲノムランダム発現ライブラリーを使用したクラミジア・トラコマチスの特異的T細胞エピトープのスクリーニング)
緒言
患者のPBMC内のT細胞の増殖を刺激する、有望なクラミジア・トラコマチスの特異的な抗原標的を直接スクリーニングするために、全ゲノムランダム発現ライブラリーを使用した。(溶原菌ファージの増殖を促進する)溶原菌宿主細菌Y1089r−内でβ−ガラクトシダーゼと融合した組換えポリペプチドを発現する、ランダムに選択されるλgtl1ファージを発現する細菌のプールを、患者のPBMC細胞に直接投与する。細菌が発現したクラミジア・トラコマチスの抗原に暴露されたことにより、おそらくは特異的なエフェクターT細胞を介して、インキュベーション中に患者のPBMCが活性化されるが、そのインキュベーション後、細菌をさらに増殖させるために、抗生物質を添加することによって、混合物を清澄化し、実施例1の記載に基本的に準じて、さらに2〜4日間インキュベーションする。読み取りは、INFγおよび/または特異的なT細胞の増殖であり得る。
【0159】
理論的には、個々のランダムに発現される大きさが0.4〜0.8kbのクラミジア・トラコマチスの遺伝子配列を含有する全ゲノムランダム発現ライブラリーは、約1:10,000の個々のラムダクローンにおいて、いずれの遺伝子配列をも(正しい配向で、かつ融合パートナー、β−ガラクトシダーゼを有するリーディングフレームにおいて)網羅する。したがって、それぞれ500〜1000個のランダムに選択される細菌のクローンを含有する10〜20個のプールをスクリーニングすれば、クラミジア・トラコマチスのゲノム全体を網羅することになる。Aldersonら(2000)によるデータから、わずか104のT細胞を含有する106もの対照細菌/ウェルを添加したところ、低レベルの非特異的INFγおよび増殖しか得られなかったことが示されている。顕著でかつ特異的なINFγの放出および特異的T細胞の増殖は、わずか104のT細胞を含有する、わずか103の抗原特異的な細菌/ウェルを添加することによって認められた。したがって、105のPBMC細胞/ウェルに添加される500個の異なる個々のクローンを含有する106の細菌を有するプールは、各ウェルにおいて、T細胞の集団を、特定の組換え融合体を特異的に発現する2000個の細菌に暴露することができる。
【0160】
材料および方法
β−ガラクトシダーゼ/CT521融合体を発現するλgtl1ファージクローンの構築
陽性のT細胞エピトープ標的対照として使用するためにλgtl1−βgal/CT521を構築した。CT521をコードする完全長の配列を、鋳型としてクラミジア・トラコマチス血清型DゲノムDNA、ならびに特異的な順方向プライマー、5’−TATAGAATTCATGTTAATGCCTAAACGAACAAAA−3’、および逆方向プライマー、5’−TATAGAATTCTTATACCCTTTCCACACGCTTAACAAATCG−3’を使用してPCR法によって増幅した。この逆方向プライマーは、β−ガラクトシダーゼオープンリーディングフレームを有するフレーム内におけるλgtl1発現ベクターのEcoRIクローニング部位へのクローニングのためにEcoRI部位を含有していた。クローン化した組換えファージ構築物を、正しい配向および配列に関して、個々のファージプラークの配列を直接決定する(実施例3を参照)ことによって確認した。
【0161】
λgtl1溶原菌ライブラリーとしてのクラミジア・トラコマチスの全ゲノムランダム発現ライブラリーの調製
Y1089r−中のクラミジア・トラコマチスの全ゲノムランダム発現ライブラリーの溶原菌の細菌ストックを、Singhら(1989)によって記載されている方法に基本的に準じて構築した。
【0162】
(実施例8)
10人のクラミジア患者および5人の対照からPBMCを単離し、先の記載(実施例1)に準じて、培養した。細胞培養物を、1.25×105のPBMCの三連の培養物として確立し、5μgのタンパク質で刺激した。抗原を含有しない細胞培養物を陰性対照(C)として含め、PHA(2μg/ml)を分裂促進性の陽性対照として使用した(結果は示されていない)。以下の抗原を試験した。CT043、CT008 CT016 CT025 CT026、CT048、CT098、CT110、CT125、CT155、CT003、CT005、CT023、CT027、CT028、CT032、CT035、CT078、CT082、CT093、CT111、CT123、CT126、CT133、CT175、CT184、CT002、CT009、CT015、CT061、CT063、CT068、CT071、CT080;CT089、CT141、CT509、CT803、CT004、CT030、CT038、CT040、CT052、CT053、CT067、CT511、CT583、CT603、CT681、CT265、CT323、CT322、CT342、CT357r、CT375、CT376、CT456、CT213、CT168、CT396、CT443、CT587、CT610、CT679、CT842、CT875、CT561、CT659、CT112、CT124、CT150、CT201、CT245、CT246、CT405、CT420、CT426、CT507、CT512、CT513、CT514、CT516、CT316、CT439、CT492、CT520、CT523、CT526、CT611、CT613、CT626、CT630、CT647、CT649、CT725、CT734、CT779、CT801、CT833、CT835、CT836、CT845およびCT541(図10)。
【0163】
図10に示すように、ヒトによる認識の程度は多様である。強力かつ高頻度で認識されるものがある−5人以上の患者が、全対照を超えるIFNγのレベルで応答している。これらには、CT375、CT376、CT004、CT048、CT078、CT110、CT583、CT603、CT681、CT184、CT175、CT025、CT002、CT015、CT063、CT456、CT168、CT396、CT443、CT124、CT028、CT030、CT43、CT048、CT080、CT111、CT316、CT322、CT342、CT375、CT492、CT512、CT520、CT521、CT523、CT541、CT611、CT613、CT630、CT649、CT734、CT801、CT803(図11)が含まれ、その他は、まったく認識されていない(例えば、CT071、CT133、CT005)。
【0164】
(実施例9)
抗体標的の複数抗原プリントイムノアッセイ(Mapia:Multiple Antigen Print Immunoassay)試験−Lyashchenkoら(2000)の記載に基本的に順ずる。簡単に説明すると、実施例2および3の抗原を、実施例1の記載に準じて、精製した。抗原をニトロセルロース製の膜上にプリントし、患者の血清および対照血清(各20個)に対する反応を試験した。対照は、目視によるカットオフを定義するために使用した。目視によるカットオフを上回る明確な反応を示した患者の血清を、陽性とみなし、1〜20個の陽性として順位付けた。
【表5】

【0165】
(実施例10:C3H/HeNマウスにおける防御戦略)
このモデルにおいて試験した抗原は、CT521、TC0052(muridarumの主要外膜タンパク質)およびこれら2種のタンパク質の組合せである。
【0166】
材料および方法
動物
C3H/HeNマウス、雌、8〜12週齢をHarlan Laboratoryから入手した。マウスを、標準的な環境条件で飼育し、標準的な飼料および水を自由に与えた。
【0167】
Chlamydia muridarum
実施例6の記載に準じて、C. muridarumを、HeLa229細胞中で増殖させ、収集した。
【0168】
マウスの感染
マウスを、子宮内において、105IFUで感染させた。感染を、接種後第7日目および第14日目および第21日目に、頚膣部の拭き取り後、実施例6の記載に準じて、蛍光染色し、検体中の感染単位を数え上げることによってモニターした。
【0169】
免疫
マウスを、尾の底部において、皮下(sc)で、2週間の間隔をおいて3回免疫化した。ワクチンは、250μgのDDAおよび100μgのTDB中に乳化させた5μgのrCT521、5μgのrTC0052、またはそれらの組合せ(5μgのrCT521+5μgのrTC0052)で構成されていた。陰性対照として、タンパク質を含有しないDDA/TDBを単独で注射した。
【0170】
リンパ球の培養および免疫誘発能力の評価
強力な免疫応答を誘発する能力を評価するために、血液検体を、眼房から最後の免疫化後第7日目に取り出し、グループ(マウス10匹)としてプールし、血液リンパ球を、密度勾配により精製後、再刺激培地(RPMI−1640、Gibo製;10%熱不活性化ウシ胎児血清、Biochrom AG製、ベルリン;ペニシリンG、100U/ml;ストレプトマイシン、100μg/ml;10mM Hepes;2mM L−グルタミン;1mMピルビン酸)中に再懸濁した。
【0171】
単離した細胞を、三連で、丸底96ウェルプレート内で、200μlの再刺激培地中、2×105細胞/ウェルで培養した。タンパク質を、0.31〜10μg/mlの範囲の濃度で添加し、72時間インキュベーションした。陰性および陽性対照(培地または5μg/ConAのいずれか)を含めた。再刺激後、上澄みを収集し、IFNγを、酵素結合免疫吸着測定法(Brandtら、2000)によって定量化した(図12)。rCT521を用いた免疫化により、rCT521による再刺激に応答して、強力なIFNγの放出が誘発され、rCT521のエピトープの対応付け(実施例1に記載されているペプチド)により、P4(アミノ酸40〜62)が、ドミナントなエピトープであることが明らかになった(図12a)。同様に、rTC0052を用いた免疫化によっても、相同なタンパク質に応答して、強力なIFNγの放出が誘発された(図12b)。興味深いことに、rCT521とrTC0052との混合物は、rCT521単独による免疫化に比べ、rCT521への応答を非常に効率よく促進した(図12c)。
【0172】
防御効力の評価
ワクチンの効力を評価するために、第1回目の免疫化の10週間後に、105で膣内感染させることによって、マウスを攻撃した。ワクチン候補の防御効力を、実施例6の記載に準じて、頚膣部の拭き取りにより得た感染単位を数え上げることによってモニターした。rCT521およびrTC0052はいずれも、高いレベルの防御を誘発し、2種のタンパク質の組合せは、防御に対して正の付加効果を有した(図13)。rCT521を用いた防御実験を、C3H/HeNマウスで繰り返したところ、同様な結果が得られ、BALB/c×C57BL/6j F1マウスにおいても、rCT521を用いた免疫化後に高いレベルの防御が認められている(結果は示されていない)。
【0173】
(参考文献)
Alderson, M. R., Bement, T., Day, C. H., Zhu, L., Molesh, D., Sleiky, Y. A. W., Coler, R., Lewinsohn, D. M., Reed, S. G., and Dillon, D. C. (2000). "Wxpression cloning of an immunodominant family of Mycobacterium tuberculosos antigen using human CD4+ T cells.(ヒトCD4+ T細胞を使用した免疫優性なファミリーの結核菌抗原の発現クローニング)" J. Exp. Med. 191(3): 551-9.
Andersen, P. and I. Heron (1993). "Simultaneous electroelution of whole SDS-polyacrylamide gels for the direct cellular analysis of complex protein mixtures.(複合タンパク質混合物の直接細胞分析のための全SDS−ポリアクリルアミドゲルの同時電気溶出)" J Immunol Methods 161(1): 29-39.
Brandt, L., M. Elhay, et al. (2000). "ESAT-6 subunit vaccination against Mycobacterium tuberculosis.(結核菌に対するESAT−6サブユニットの予防接種)" Infect Immun, 68(2): 791-5.
Brunham, R. C. (1999). Human immunity to Chlamydia. Chlamydia Intracellular biology, Pathogenesis, and Immunity.(クラミジアに対するヒトの免疫。クラミジアの細胞内生物学、病原性および免疫)R. S. Stephens. Washington,D. C., ASM Press: 211-238.
Cote-Sierra, J., E. Jongert, et at. (1998). "A new membrane-bound Oprl lipoprotein expression vector. High production of heterologous fusion proteins in gram (-) bacteria and the implications for oral vaccination.(新しい膜結合Oprlリポタンパク質発現ベクター。グラム陰性菌における異種融合タンパク質の高生成および経口ワクチンへの影響)" Gene 221(1): 25-34.
Cotter, T. W., Q. Meng, at al. (1995). "Protective efficacy of major outer membrane protein-specific immunoglobulin A (IgA) and IgG monoclonal antibodies in a murine model of Chlamydia trachomatis genital tract infection.(クラミジア・トラコマチス生殖器感染のマウスモデルにおける主要外膜タンパク質特異的免疫グロブリンA(IgA)およびIgGのモノクローナル抗体の防御効力)" Infect. Immun. 63(12): 4704-4714.
Fling, S. P., R. A. Sutherland, at al. (2001). "CD8+ T cells recognize an inclusion membrane-associated protein from the vacuolar pathogen Chlamydia trachomatis.(CD8+ T細胞は液胞性病原体クラミジア・トラコマチスの封入膜関連タンパク質を認識する)" Proc. Natl. Acad. Sci. U.S.A 98(3): 1160-1165.
Goodall, J. C., G. Yeo, et al. (2001). "Identification of Chlamydia trachomatis antigens recognized by human CD4+ T lymphocytes by screening an expression library.(発現ライブラリーのスクリーニングによるヒトCD4+ Tリンパ球に認識されるクラミジア・トラコマチス抗原の同定)" Eur. J. Immunol. 31(5): 1513-1522.
Gosselin, E. J., K. Wardwell, at al. (1992). "Enhanced antigen presentation using human Fc gamma receptor (monocyte/macrophage)-specific immunogens.(ヒトFcγ受容体(単核球/マクロファージ)特異的免疫原を使用する抗原提示の促進)" J Immunol 149(11): 3477-81.
Grayston, J. T. and S. P. Wang (1978). "The potential for vaccine against infection of the genital tract with Chlamydia trachomatis.(クラミジア・トラコマチス生殖器感染に対するワクチンの可能性)" Sex Transm. Dis. 5: 73-77.
Gu, L., W. M. Wenman, et al. (1995). "Chlamydia trachomatis RNA polymerase alpha subunit: sequence and structural analysis.(クラミジア・トラコマチスRNAポリメラーゼのαサブユニット:配列および構造解析)" J. Bacteriol. 177(9): 2594-2601.
Harboe, M., T. Oettinger, et al. (1996). "Evidence for occurrence of the ESAT-6 protein in Mycobacterium tuberculosis and virulent Mycobacterium bovis and for its absence in Mycobacterium bovis BCG.(ESAT−6タンパク質が、ヒト型結核菌および病原性ウシ型結核菌には存在し、ウシ型結核菌BCGには存在しない証拠)" Infect Immun 64(1): 16-22.
Hassell, A. B., D. J. Reynolds, et al. (1993). "Identification of T-cell stimulatory antigens of Chlamydia trachomatis using synovial fluid-derived T-cell clones.(滑液由来T細胞クローンを使用するクラミジア・トラコマチスのT細胞刺激性抗原の同定)" Immunology, 79(4): 513-519.
Katz, B. P., B. E. Batteiger, et al. (1987). "Effect of prior sexually transmitted disease on the isolation of Chlamydia trachomatis.(過去の性感染症のクラミジア・トラコマチスの単離に及ぼす影響)" Sex Transm. Dis. 14(3): 160-164.
Kilgus, J., T. Jardetzky, et al. (1991). "Analysis of the permissive association of a malaria T cell epitope with DR molecules.(マラリアT細胞エピトープのDR分子との許容的な結合の分析)" J Immunol 146(1): 307-15.
Kubo, A. and R. S. Stephens (2000). "Characterization and functional analysis of PorB, a Chlamydia porin and neutralizing target.(PorB、クラミジアのポリンおよび中和標的の特徴づけおよび機能解析)" Mol. Microbiol. 38(4): 772-780.
LaVerda, D., L. N. Albanese, et al. (2000). "Seroreactivity to Chlamydia trachomatis Hsp10 correlates with severity of human genital tract disease.(クラミジア・トラコマチスHsp10の血清反応性は、ヒト生殖器疾患の程度と相関する)" Infect. Immun. 68(1): 303-309.
McCafferty, J., A. D. Griffiths, et al. (1990). "Phage antibodies: filamentous phage displaying antibody variable domains.(ファージ抗体:抗体可変ドメインを提示する糸状ファージ)" Nature 348(6301): 552-4.
Morrison, R. P. and H. D. Caldwell (2002). "Immunity to murine chiamydial genital infection.(マウスのクラミジア性器感染に対する免疫)" Infect Immun 70(6): 2741-51.
Morrison, S. G., H. Su, et al. (2000). "Immunity to murine Chlamydia trachomatis genital tract reinfection involves B cells and CD4(+) T cells but not CD8(+) T cells.(マウスのマチス生殖器再感染に対する免疫には、B細胞およびCD4(+)T細胞が関与するが、CD8(+)T細胞は関与しない)" Infect. Immun. 68(12): 6979-6987.
Ortiz, L., K. P. Demick, et al. (1996). "Chlamydia trachomatis major outer membrane protein (MOMP) epitopes that activate HLA class II-restricted T cells from infected humans.(感染したヒトのHLAクラスII拘束性T細胞を活性化するクラミジア・トラコマチスの主要外膜タンパク質(MOMP)エピトープ)" J Immunol 157(10): 4554-67.
Pal, S., K. M. Barnhart, et al. (1999). "Vaccination of mice with DNA plasmids coding for the Chlamydia trachomatis major outer membrane protein elicits an immune response but fails to protect against a genital challenge.(クラミジア・トラコマチスの主要外膜タンパク質をコードするDNAプラスミドを用いた予防接種は、免疫応答を誘発するが、性器曝露に対する防御は得られない)" Vaccine 17(5): 459-465.
Pal, S., I. Theodor, et al. (2001). "Immunization with the Chlamydia trachomatis mouse pneumonitis major outer membrane protein can elicit a protective immune response against a genital challenge.(クラミジア・トラコマチスのマウスの間質性肺炎の主要外膜タンパク質を用いた予防接種は、性器曝露に対する防御免疫応答を誘発することができる)" Infect. Immun. 69(10): 6240-6247.
Pearson, W. R. and D. J. Lipman (1988). "Improved tools for biological sequence comparison.(生物学的配列比較手段の改良)" Proc Natl Acad Sci U S A 85(8): 2444-8.
Ravn, P., A. Demissie, et al. (1999). "Human T cell responses to the ESAT-6 antigen from Mycobacterium tuberculosis.(結核菌のESAT−6抗原に対するヒトT細胞応答)" J Infect Dis 179(3): 637-45.
Rolph, M. S. and I. A. Ramshaw (1997). "Recombinant viruses as vaccines and immunological tools.(ワクチンおよび免疫学的手段としての組換えウイルス)" Curr Opin Immunol 9(4): 517-24.
Rosenkrands, I., E. M. Agger, et al. (2005). "Cationic liposomes containing mycobacterial lipids: a new powerful Th1 adjuvant system.(マイコバクテリアの脂質を含有するカチオン性リポソーム:新しい強力なTh1アジュバント系)" Infect Immun, 73(9): 5817-26.
Schachter, J., J. Moncada, et al. (1988). "Nonculture methods for diagnosing chlamydial infection in patients with trachoma: a clue to the pathogenesis of the disease?(トラコーマ患者のクラミジア感染診断の非培養法:疾患の病原の糸口?)" J. Infect. Dis. 158(6): 1347-1352.
Shaw, J., V. Grund, et al. (2002). "Dendritic cells pulsed with a recombinant chlamydial major outer membrane protein antigen elicit a CD4(+) type 2 rather than type 1 immune response that is not protective.(組換えクラミジア主要外膜タンパク質抗原と共にパルスを加えた樹状細胞は、防御性のないCD4(+)タイプ1ではなく、CD4(+)タイプ2の免疫応答を誘発する)" Infect. Immun. 70(3): 1097-1105.
Sinigaglia, F., M. Guttinger, et al. (1988). "A malaria T-cell epitope recognized in association with most mouse and human MHC class II molecules.(大部分のマウスおよびヒトのMHCクラスII分子に関連して認識されるマラリアT細胞エピトープ)" Nature 336(6201): 778-80.
Starnbach, M. N., W. P. Loomis, et al. (2003). "An inclusion membrane protein from Chlamydia trachomatis enters the MHC class I pathway and stimulates a CD8+ T cell response.(クラミジア・トラコマチスの封入膜タンパク質は、MHCクラスI経路に入り、CD8+ T細胞応答を刺激する)" J Immunol 171(9): 4742-9.
Stephens, R. S., S. Kalman, et al. (1998). "Genome sequence of an obligate intracellular pathogen of humans: Chlamydia trachomatis.(ヒトの偏性細胞内病原体であるヒトクラミジア・トラコマチスのゲノム配列)" Science 282(5389): 754-759.
Stephens, R. S., E. A. Wagar, et al. (1988). "High-resolution mapping of serovar-specific and common antigenic determinants of the major outer membrane protein of Chlamydia trachomatis.(クラミジア・トラコマチスの主要外膜タンパク質の血清特異的および共通抗原決定基の高分解能マッピング)" J. Exp. Med. 167(3): 817-831.
Stryhn, A., L. O. Pedersen, et al. (1996). "Peptide binding specificity of major histocompatibility complex class I resolved into an array of apparently independent subspecificities: quantitation by peptide libraries and improved prediction of binding.(明らかに独立の下位特異性に分離した一群の主要組織適合複合体クラスIのペプチド結合特異性:ペプチドライブラリーの定量化および結合予測の向上)" Eur J Immunol 26(8): 1911-8.
Su, H. and H. D. Caldwell (1995). "CD4+ T cells play a significant role in adoptive immunity to Chlamydia trachomatis infection of the mouse genital tract.(CD4+ T細胞は、マウスのクラミジア・トラコマチス生殖器感染に対する養子免疫において重要な役割をになっている)" Infect. Immun. 63(9): 3302-3308.
Su, H., M. Parnell, et al. (1995). "Protective efficacy of a parenterally administered MOMP-derived synthetic oligopeptide vaccine in a murine model of Chlamydia trachomatis genital tract infection: serum neutralizing IgG antibodies do not protect against chlamydial genital tract infection.(クラミジア・トラコマチス生殖器感染のマウスモデルにおけるMOMP由来合成オリゴペプチドワクチンの非経口投与による防御効力:血清中和IgG抗体は、クラミジア生殖器感染を防御しない)" Vaccine 13(11): 1023-1032.
Theisen, M., S. Soe, et al. (2004). "A Plasmodium falciparum GLURP-MSP3 chimeric protein; expression in Lactococcus lactis, immunogenicity and induction of biologically active antibodies.(熱帯熱マラリア原虫GLURP−MSP3キメラタンパク質:ラクトコッカスラクティス中での発現、免疫原性および生物学的に活性な抗体の誘発)" Vaccine 22(9-10): 1188-98.
Tipples, G. and G. McClarty (1995). "Cloning and expression of the Chlamydia trachomatis gene for CTP synthetase.(クラミジア・トラコマチスのCTPシンテターゼ遺伝子のクローン化および発現)" J. Biol. Chem. 270(14): 7908-7914.
Ulmer, J. B., J. J. Donnelly, et al. (1993). "Heterologous protection against influenza by injection of DNA encoding a viral protein.(ウイルスタンパク質をコードするDNAの注射によるインフルエンザに対する異種性の防御)" Science 259(5102): 1745-9.
Wang, S. P., J. T. Grayston, et al. (1967). "Trachoma vaccine studies in monkeys.(サルにおけるトラコーマワクチンの研究)" Am. J. Ophthalmol. 63(5): Suppl-30.
Zhang, D. J., X. Yang, et al. (1999). "Characterization of immune responses following intramuscular DNA immunization with the MOMP gene of Chlamydia trachomatis mouse pneumonitis strain.(クラミジア・トラコマチスのマウス間質性肺炎株のMOMP遺伝子を用いた筋肉内からのDNAによる免疫化後の免疫応答の特徴づけ)" Immunology 96(2): 314-321.
Zhang, Y., J. Tao, et al. (1997). "Elongation factor Ts of Chlamydia trachomatis: structure of the gene and properties of the protein.(クラミジア・トラコマチスの伸長因子Ts:遺伝子の構造およびタンパク質の性質)" Arch. Biochem. Biophys. 344(1): 43-52.
【特許請求の範囲】
【請求項1】
クラミジア種の細菌が原因である感染の予防、治療または診断に用いる薬学的組成物を調製するための、
(a)配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、101、103、105、107、109、111、113、115、117、119、121、123、125、185、187、189、191、193、195、197、199、201、203、205、207、209、211、213、215、217、219、221、223、225、227、229、231、233、235、237、239、241、243、245、247、249、251、253、255、257、259、261、263、265、267、269、271、273、275、277、279、281、283、285、287、289、291、293、295、297、299、301、303、305、307、または
(b)(a)の配列のいずれか1つの免疫原性部分、例えば、T細胞もしくはB細胞のエピトープ、または
(c)(a)もしくは(b)の配列のいずれか1つに対して少なくとも70%の配列同一性を有すると同時に免疫原性でもあるアミノ酸配列類似体
から選択されるアミノ酸配列を含む、実質的に純粋なポリペプチド、
あるいは(a)、(b)または(c)のポリペプチドをコードする核酸の使用。
【請求項2】
免疫原性部分が、配列番号127、129、131、133、135、137、139、141、143、145、147、149、151、153、155、157、159、161、163、165、167、169、171、173、175、177、179、181、183から選択される、請求項1に記載の使用。
【請求項3】
ポリペプチドに自己アジュバント作用が付与されるようにポリペプチドに脂質が付加されている、請求項1から2に記載の使用。
【請求項4】
ポリペプチドが融合パートナーに融合している、請求項1から3に記載の使用。
【請求項5】
融合パートナーが、
(a)CT812、CT579、CT587、Cap、CT713、CT442もしくはMOMP等のクラミジア種に由来するポリペプチド、または
(b)(a)の前記ポリペプチドのいずれかの少なくとも1つの免疫原性部分、例えば、T細胞もしくはB細胞のエピトープ
を含む、請求項4に記載の使用。
【請求項6】
(a)のポリペプチドをコードする核酸配列が以下の対応する配列:配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、186、188、190、192、194、196、198、200、202、204、206、208、210、212、214、216、218、220、222、224、226、228、230、232、234、236、238、240、242、244、246、248、250、252、254、256、258、260、262、264、266、268、270、272、274、276、278、280、282、284、286、288、290、292、294、296、298、300、302、304、306、308を有し、かつ(b)の免疫原性部分をコードする核酸配列が以下の配列:配列番号128、130、132、134、136、138、140、142、144、146、148、150、152、154、156、158、160、162、164、166、168、170、172、174、176、178、180、182、184を有する、請求項1に記載の使用。
【請求項7】
配列番号127、129、131、133、135、137、139、141、143、145、147、149、151、153、155、157、159、161、163、165、167、169、171、173、175、177、179、181、183から選択される実質的に純粋なポリペプチド。
【請求項8】
請求項7に記載のポリペプチドをコードする、配列番号128、130、132、134、136、138、140、142、144、146、148、150、152、154、156、158、160、162、164、166、168、170、172、174、176、178、180、182、184から選択される核酸断片。
【請求項9】
(a)配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、101、103、105、107、109、111、113、115、117、119、121、123、125、185、187、189、191、193、195、197、199、201、203、205、207、209、211、213、215、217、219、221、223、225、227、229、231、233、235、237、239、241、243、245、247、249、251、253、255、257、259、261、263、265、267、269、271、273、275、277、279、281、283、285、287、289、291、293、295、297、299、301、303、305、307、または
(b)(a)の配列のいずれか1つの免疫原性部分、例えば、T細胞もしくはB細胞のエピトープ、および/または
(c)(a)もしくは(b)の配列のいずれか1つに対して少なくとも70%の配列同一性を有すると同時に免疫原性でもあるアミノ酸配列類似体
から選択されるアミノ酸配列を含む実質的に純粋なポリペプチド、
あるいは(a)、(b)または(c)をコードする核酸
を含む、クラミジア種の細菌が原因である感染の予防、治療または診断に用いる薬学的組成物。
【請求項10】
免疫原性部分が、配列番号127、129、131、133、135、137、139、141、143、145、147、149、151、153、155、157、159、161、163、165、167、169、171、173、175、177、179、181、183から選択される、請求項9に記載の薬学的組成物。
【請求項11】
ポリペプチドに自己アジュバント作用が付与されるようにポリペプチドに脂質が付加されている、請求項9から10に記載の薬学的組成物。
【請求項12】
ポリペプチドが融合パートナーに融合している、請求項9から11に記載の薬学的組成物。
【請求項13】
融合パートナーが、
(a)CT812、CT579、CT587、Cap、CT713、CT442もしくはMOMP等のクラミジア種に由来するポリペプチド、または
(b)(a)の前記ポリペプチドのいずれかの少なくとも1つの免疫原性部分、例えば、T細胞もしくはB細胞のエピトープ、あるいは
それらをコードする核酸
を含む、請求項12に記載の薬学的組成物。
【請求項14】
(a)のポリペプチドをコードする核酸配列が以下の対応する配列:配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、186、188、190、192、194、196、198、200、202、204、206、208、210、212、214、216、218、220、222、224、226、228、230、232、234、236、238、240、242、244、246、248、250、252、254、256、258、260、262、264、266、268、270、272、274、276、278、280、282、284、286、288、290、292、294、296、298、300、302、304、306、308を有し、かつ(b)の免疫原性部分をコードする核酸配列が以下の配列:配列番号128、130、132、134、136、138、140、142、144、146、148、150、152、154、156、158、160、162、164、166、168、170、172、174、176、178、180、182、184を有する、請求項9から10に記載の薬学的組成物。
【請求項15】
ワクチンの形態である、請求項9から14に記載の薬学的組成物。
【請求項16】
診断用試薬の形態である、請求項9から14に記載の薬学的組成物。
【請求項17】
クラミジア種の細菌が原因である感染に対して免疫する、またはクラミジア種の細菌が原因である感染を治療するための、請求項15に記載のワクチン。
【請求項18】
クラミジア種がクラミジア・トラコマチス(Chlamydia trachomatis)である、請求項17に記載のワクチン。
【請求項19】
クラミジア感染を予防するために、クラミジア種の細菌に感染していない対象において予防的に、またはクラミジア感染を治療するために、クラミジア種の細菌にすでに感染している対象において治療的に、使用することができることを特徴とする、請求項17から18に記載のワクチン、または請求項9から15に記載の薬学的組成物
【請求項20】
クラミジア種による感染を診断するための、請求項16に記載の診断用試薬。
【請求項21】
クラミジア種がクラミジア・トラコマチスである、請求項20に記載の診断用試薬。
【請求項22】
イムノアッセイにおいて請求項20から21に記載の診断用試薬と特異的に反応するモノクローナル抗体またはポリクローナル抗体、あるいは前記抗体の特異的結合断片。
【請求項23】
過去または現在進行中のクラミジア種の細菌による感染を診断するための方法であって、陽性反応、例えば、細胞の増殖またはIFNγ等のサイトカインの放出を検出するために、検体、例えば、単核細胞(例えば、Tリンパ球)を含む血液検体を、請求項20から21に記載の診断用試薬と接触させるステップを含む方法。
【請求項24】
過去または現在進行中のクラミジア種の細菌による感染を診断するための方法であって、
(a)感染の場合の陽性反応を検出するために、検体、例えば、血液検体を、請求項22に記載の抗体と接触させるステップ
を含む方法。
【請求項25】
対象における過去または現在進行中のクラミジア種の細菌による感染を診断する方法であって、
(a)請求項20から21に記載の診断用試薬を、対象の体液と接触させるステップと、
(b)前記ペプチドへの抗体の結合を検出するステップであって、前記結合が、前記対象がクラミジア種の細菌に感染していることを示唆するステップと
を含む方法。
【請求項26】
過去または現在進行中のクラミジア種の細菌による感染を診断する方法であって、請求項20から21に記載の診断用試薬を、皮内注射または皮膚に施用するステップであって、注射または施用の部位における陽性の皮膚応答が、クラミジア種の細菌による感染を示唆するステップを含む方法。
【請求項27】
クラミジア種の細菌による感染を治療または予防するための方法であって、請求項19に記載のワクチンを、哺乳類に投与するステップを含む方法。
【請求項1】
クラミジア種の細菌が原因である感染の予防、治療または診断に用いる薬学的組成物を調製するための、
(a)配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、101、103、105、107、109、111、113、115、117、119、121、123、125、185、187、189、191、193、195、197、199、201、203、205、207、209、211、213、215、217、219、221、223、225、227、229、231、233、235、237、239、241、243、245、247、249、251、253、255、257、259、261、263、265、267、269、271、273、275、277、279、281、283、285、287、289、291、293、295、297、299、301、303、305、307、または
(b)(a)の配列のいずれか1つの免疫原性部分、例えば、T細胞もしくはB細胞のエピトープ、または
(c)(a)もしくは(b)の配列のいずれか1つに対して少なくとも70%の配列同一性を有すると同時に免疫原性でもあるアミノ酸配列類似体
から選択されるアミノ酸配列を含む、実質的に純粋なポリペプチド、
あるいは(a)、(b)または(c)のポリペプチドをコードする核酸の使用。
【請求項2】
免疫原性部分が、配列番号127、129、131、133、135、137、139、141、143、145、147、149、151、153、155、157、159、161、163、165、167、169、171、173、175、177、179、181、183から選択される、請求項1に記載の使用。
【請求項3】
ポリペプチドに自己アジュバント作用が付与されるようにポリペプチドに脂質が付加されている、請求項1から2に記載の使用。
【請求項4】
ポリペプチドが融合パートナーに融合している、請求項1から3に記載の使用。
【請求項5】
融合パートナーが、
(a)CT812、CT579、CT587、Cap、CT713、CT442もしくはMOMP等のクラミジア種に由来するポリペプチド、または
(b)(a)の前記ポリペプチドのいずれかの少なくとも1つの免疫原性部分、例えば、T細胞もしくはB細胞のエピトープ
を含む、請求項4に記載の使用。
【請求項6】
(a)のポリペプチドをコードする核酸配列が以下の対応する配列:配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、186、188、190、192、194、196、198、200、202、204、206、208、210、212、214、216、218、220、222、224、226、228、230、232、234、236、238、240、242、244、246、248、250、252、254、256、258、260、262、264、266、268、270、272、274、276、278、280、282、284、286、288、290、292、294、296、298、300、302、304、306、308を有し、かつ(b)の免疫原性部分をコードする核酸配列が以下の配列:配列番号128、130、132、134、136、138、140、142、144、146、148、150、152、154、156、158、160、162、164、166、168、170、172、174、176、178、180、182、184を有する、請求項1に記載の使用。
【請求項7】
配列番号127、129、131、133、135、137、139、141、143、145、147、149、151、153、155、157、159、161、163、165、167、169、171、173、175、177、179、181、183から選択される実質的に純粋なポリペプチド。
【請求項8】
請求項7に記載のポリペプチドをコードする、配列番号128、130、132、134、136、138、140、142、144、146、148、150、152、154、156、158、160、162、164、166、168、170、172、174、176、178、180、182、184から選択される核酸断片。
【請求項9】
(a)配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、101、103、105、107、109、111、113、115、117、119、121、123、125、185、187、189、191、193、195、197、199、201、203、205、207、209、211、213、215、217、219、221、223、225、227、229、231、233、235、237、239、241、243、245、247、249、251、253、255、257、259、261、263、265、267、269、271、273、275、277、279、281、283、285、287、289、291、293、295、297、299、301、303、305、307、または
(b)(a)の配列のいずれか1つの免疫原性部分、例えば、T細胞もしくはB細胞のエピトープ、および/または
(c)(a)もしくは(b)の配列のいずれか1つに対して少なくとも70%の配列同一性を有すると同時に免疫原性でもあるアミノ酸配列類似体
から選択されるアミノ酸配列を含む実質的に純粋なポリペプチド、
あるいは(a)、(b)または(c)をコードする核酸
を含む、クラミジア種の細菌が原因である感染の予防、治療または診断に用いる薬学的組成物。
【請求項10】
免疫原性部分が、配列番号127、129、131、133、135、137、139、141、143、145、147、149、151、153、155、157、159、161、163、165、167、169、171、173、175、177、179、181、183から選択される、請求項9に記載の薬学的組成物。
【請求項11】
ポリペプチドに自己アジュバント作用が付与されるようにポリペプチドに脂質が付加されている、請求項9から10に記載の薬学的組成物。
【請求項12】
ポリペプチドが融合パートナーに融合している、請求項9から11に記載の薬学的組成物。
【請求項13】
融合パートナーが、
(a)CT812、CT579、CT587、Cap、CT713、CT442もしくはMOMP等のクラミジア種に由来するポリペプチド、または
(b)(a)の前記ポリペプチドのいずれかの少なくとも1つの免疫原性部分、例えば、T細胞もしくはB細胞のエピトープ、あるいは
それらをコードする核酸
を含む、請求項12に記載の薬学的組成物。
【請求項14】
(a)のポリペプチドをコードする核酸配列が以下の対応する配列:配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122、124、126、186、188、190、192、194、196、198、200、202、204、206、208、210、212、214、216、218、220、222、224、226、228、230、232、234、236、238、240、242、244、246、248、250、252、254、256、258、260、262、264、266、268、270、272、274、276、278、280、282、284、286、288、290、292、294、296、298、300、302、304、306、308を有し、かつ(b)の免疫原性部分をコードする核酸配列が以下の配列:配列番号128、130、132、134、136、138、140、142、144、146、148、150、152、154、156、158、160、162、164、166、168、170、172、174、176、178、180、182、184を有する、請求項9から10に記載の薬学的組成物。
【請求項15】
ワクチンの形態である、請求項9から14に記載の薬学的組成物。
【請求項16】
診断用試薬の形態である、請求項9から14に記載の薬学的組成物。
【請求項17】
クラミジア種の細菌が原因である感染に対して免疫する、またはクラミジア種の細菌が原因である感染を治療するための、請求項15に記載のワクチン。
【請求項18】
クラミジア種がクラミジア・トラコマチス(Chlamydia trachomatis)である、請求項17に記載のワクチン。
【請求項19】
クラミジア感染を予防するために、クラミジア種の細菌に感染していない対象において予防的に、またはクラミジア感染を治療するために、クラミジア種の細菌にすでに感染している対象において治療的に、使用することができることを特徴とする、請求項17から18に記載のワクチン、または請求項9から15に記載の薬学的組成物
【請求項20】
クラミジア種による感染を診断するための、請求項16に記載の診断用試薬。
【請求項21】
クラミジア種がクラミジア・トラコマチスである、請求項20に記載の診断用試薬。
【請求項22】
イムノアッセイにおいて請求項20から21に記載の診断用試薬と特異的に反応するモノクローナル抗体またはポリクローナル抗体、あるいは前記抗体の特異的結合断片。
【請求項23】
過去または現在進行中のクラミジア種の細菌による感染を診断するための方法であって、陽性反応、例えば、細胞の増殖またはIFNγ等のサイトカインの放出を検出するために、検体、例えば、単核細胞(例えば、Tリンパ球)を含む血液検体を、請求項20から21に記載の診断用試薬と接触させるステップを含む方法。
【請求項24】
過去または現在進行中のクラミジア種の細菌による感染を診断するための方法であって、
(a)感染の場合の陽性反応を検出するために、検体、例えば、血液検体を、請求項22に記載の抗体と接触させるステップ
を含む方法。
【請求項25】
対象における過去または現在進行中のクラミジア種の細菌による感染を診断する方法であって、
(a)請求項20から21に記載の診断用試薬を、対象の体液と接触させるステップと、
(b)前記ペプチドへの抗体の結合を検出するステップであって、前記結合が、前記対象がクラミジア種の細菌に感染していることを示唆するステップと
を含む方法。
【請求項26】
過去または現在進行中のクラミジア種の細菌による感染を診断する方法であって、請求項20から21に記載の診断用試薬を、皮内注射または皮膚に施用するステップであって、注射または施用の部位における陽性の皮膚応答が、クラミジア種の細菌による感染を示唆するステップを含む方法。
【請求項27】
クラミジア種の細菌による感染を治療または予防するための方法であって、請求項19に記載のワクチンを、哺乳類に投与するステップを含む方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8−1】


【図8−2】


【図9】


【図10a】


【図10b】


【図10c】


【図10d】


【図10e】


【図10f】


【図10g】


【図10h】


【図10i】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8−1】


【図8−2】


【図9】


【図10a】


【図10b】


【図10c】


【図10d】


【図10e】


【図10f】


【図10g】


【図10h】


【図10i】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2012−102108(P2012−102108A)
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−273006(P2011−273006)
【出願日】平成23年12月14日(2011.12.14)
【分割の表示】特願2007−537113(P2007−537113)の分割
【原出願日】平成17年10月11日(2005.10.11)
【出願人】(507136268)ステーテンズ セーラム インスティテュート (2)
【Fターム(参考)】
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願番号】特願2011−273006(P2011−273006)
【出願日】平成23年12月14日(2011.12.14)
【分割の表示】特願2007−537113(P2007−537113)の分割
【原出願日】平成17年10月11日(2005.10.11)
【出願人】(507136268)ステーテンズ セーラム インスティテュート (2)
【Fターム(参考)】
[ Back to top ]

