クラミジア属にわたる(Genus−WideChlamydial)ペプチドワクチン抗原
クラミジア糖脂質外抗原(GLXA)に対するモノクローナル抗体に結合し、したがって該抗原を模倣する、ランダムライブラリーから作製されたペプチドを開示する。広範囲にわたり反応性を有する属特異的抗クラミジア抗体を誘導するための免疫原として、GLXAの分子模倣体として機能する、抗GLXA抗体(Ab1)に特異的な抗イディオタイプ抗体(mAb2)の抗原結合領域に相当するペプチドを開示する。これらのペプチドおよびmAb2様ペプチドをコードする免疫原性DNA、マイクロ粒子もしくはナノ粒子製剤、およびこれらのペプチドの他の製剤、ならびに属特異的な抗クラミジア抗体を得るために対象を免疫化するための方法、およびクラミジア関連もしくは誘導化関節リウマチを処置もしくは予防するための方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
連邦政府による資金提供を受けた発明に対する権利の記載
本発明は、National Institute of Health, Department of Health and Human Servicesからの助成金によって一部支援を受けたものであり、アメリカ合衆国政府は本発明について一定の権利を有する。
【0002】
発明の背景
発明の分野
免疫学および感染症の分野における本発明は、クラミジア糖脂質外抗原(GLXA)に対する抗体により選択されるランダムライブラリー由来の新規ペプチド免疫原、または抗GLXA抗体(Ab1)に特異的であり、GLXAの分子模倣体として使用される抗イディオタイプ抗体(mAb2)の抗原結合領域に相当するもの、およびGLXA(属にわたる(「属特異的な」)クラミジア抗原)に対する抗体の誘導におけるそれらの使用に関する。
【背景技術】
【0003】
背景技術の記載
100万人を超える新規クラミジア感染の症例が2006年において報告されており、10億ドルを超える費用が費やされている。増大した監視および処置にもかかわらず、クラミジアの性感染症(STD)による感染は、上昇し続けている。Chlamydia trachomatisは、卵管性不妊症および骨盤内炎症性疾患の主な原因である(1,2)。無症候性および未診断のクラミジア感染は、報告されている感染率の2倍に昇ると推定されている。クラミジア生殖管感染は、淋病の5倍以上であり(3)、HIVおよび他のSTD病原体の増加した感染リスクと相関している(4)。クラミジア生殖器感染は妊婦の5-15%で生じ、その新生児の50%が封入体結膜炎または呼吸器感染を発症することから(5)、C. trachomatisは、乳幼児において最も共通する眼疾患の病原体である(6)。クラミジアの性行為による感染において、反復曝露、無症候性(無症状)および/または持続的感染のような他の要因は、診断を困難にする。抗生物質は多くのクラミジア感染を除去し得るが、それらは再感染を予防しない。
【0004】
インビトロにおいて、抗生物質は、クラミジアを培養不能な持続的状態に誘導し得る(7)。インビトロにおいて、持続的感染細胞は、アジスロマイシンに対して耐性である(8)。動物における研究は、早期の抗生物質処置がいくつかの天然の防御免疫の開発を妨害し得て、したがって、患者に骨盤炎症性疾患およびひどい後遺症と関連するより広範な病変を生じやすさせることを示す(9)。生殖器感染はまた、かなりの割合の反応性関節炎の発症を生じやすくし、そこでは、生存能力のある代謝的に活性な生物が滑膜に存在する(10, 11)。クラミジアに関する最近の概説については、例えば、Ref 12を参照のこと。
【0005】
ヒトにおける感染性盲目の主な原因であるトラコーマは、C. trachomatisの眼次亜種(ocular biovars)での繰り返される眼感染により生じる(13, 14)。数百万人のうちの10人がトラコーマを患い、4分の1までが盲目になる。トラコーマは、北米および欧州からはすでに消滅したが、そこでは、眼球外クラミジア感染が重大な問題のままである。成人において院外感染性肺炎の原因であるChlamydia pneumoniae (Cpn)は、アテローム性動脈硬化症と関連しており(15,16)、血清疫学的な研究は、大多数の成人がCpnに曝露されていることを示す。Cpnは、遅発性アルツハイマー病(17, 18)、1個またはそれ以上の型の多発性硬化症(19, 20)、および顎関節症(TMJD) (21, 22, 23)を含む他の慢性炎症性疾患と関連している。アテローム性動脈硬化症とアルツハイマー病(AD)との関連は、いくつかの症例において疑われている(例えば、24)。
【0006】
C. psittaciは、鳥類に感染し、鶏肉産業に主な経済的影響を与え、生産に影響を与えるだけでなく、養鶏業者を危機にさらす(25)。したがって、クラミジア感染の公衆衛生の意義は大きい。C trachomatisの血清型を超えた広範囲にわたる保護能力を有する属特異的保護ワクチンは、極めて高い価値を有する。
【0007】
ワクチン候補のナノカプセル化および送達
ワクチン候補の新規送達法は、過去10年間にわたって開発されてきた。ナノテクノロジーおよび「ナノ医学」の出現と共に、ナノ粒子(NP)の治療的使用は、急速に拡大してきている。本発明者および同僚等は、クラミジアワクチンとしてのポリ(乳酸およびグリコール酸) (PLGA) ミクロスフィア封入化保護抗体のそれらの使用について報告しており、それは、経口でおよび鼻腔内に送達される(26, 27)。最近、本発明者および同僚等は、ナノ粒子がインビトロにおいてクラミジア感染細胞に急速に摂取され、ナノ粒子が感染組織に標的化され得ることを見出した(例えば、28,29,30)。他者は、PLGAナノ粒子がインビボにおいて、ペプチド、オリゴマー(DNA)または薬剤を送達するために使用され得ることを示した(31-36)。別のポリマー、例えば、キトサンもしくはアルギン酸を用いたNP製剤は、粘膜送達について成功している(31,37)。NPのサイズおよび表面特性の効果が調べられている(38, 39)。
【0008】
本発明者および同僚等は、もともと、類似の薬剤についてのナノサイズ化材料およびペプチド送達がまだ利用できなかったので、一部それらの最初のワクチン候補をミクロスフィアで試験した。カプセル化は、主に少なくとも2個の利点を有する: (1) 封入化ワクチン抗原(「Ag」)、例えば、モノクローナル抗体(mAb)もしくはペプチドもしくはポリヌクレオチドは、胃酸からの保護のために機能を欠損することなく経口で送達され得る。あるいは、鼻腔内または経気管で送達されるNP中の抗原は、局所抗原提示細胞、例えば、肺マクロファージもしくは樹状細胞(DC)に取り込まれるのに十分な長い時間、鼻咽頭または肺に留まるであろう。
【0009】
1990年代の定説は、パイエル板での摂取により粘膜的に免疫するための粒子に基づくワクチン/抗原の摂取は、1-10 μmの直径を有する粒子を必要とすることであった(40, 138)。それ以来、Amidi et al.(31)、Saltzmanおよび他の者は、NP(直径500 nm未満)が粘膜的に送達され、送達されたAgに対する免疫に成功したこと、およびそれがより有効であったことを証明した。後者の成功の一部は、DC成熟を誘導するAg搭載NPによるものであり(36)、NPは、DCおよびマクロファージの両方により効率的に摂取される(141)。NPサイズ送達ビヒクルは、研究中であり(38 , 41, 137)、新規な材料およびNP設計についての可能性は、ワクチン送達ビヒクルとしてのそれらの魅力を高めている。
【0010】
PLGAコポリマーは、ヒトでの使用(溶解性縫合糸)についてFDAに承認されており、そのアジュバント特性に加えて、遊離Agと比較した場合に遅延した送達デバイスとして機能する(42)。PLGA NPは、(a) 細胞および組織における摂取を追跡するように蛍光標識され、(b) 特定の型の細胞に標的化され、そして(c) それらの血中半減期を持続させるためにポリエチレングリコール(PEG)(また「ペグ化」として既知である)と結合され得る。ワクチン候補を含む推定上のナノサイズ粒子は、おそらく腸細胞またはDCへのピノサイトーシスによりパイエル板以外の部分で摂取され得て、外因性Agについて消化管または他の粘膜表面に局所的に吸収される。DCにより認識かつ摂取されると、これらのAg提示細胞は、局所排泄リンパ節に移動し、DCの内側においてNPから放出されたAgは、Tリンパ球に提示され得る。これは、T細胞を活性化し、免疫Ag (または全個体、この場合にはC. trachomatis)への次の曝露に応答する。そのような応答は、粘膜部位から感染性微生物を除去するのに必要とされる。
【0011】
クラミジア生物学およびワクチン標的
クラミジアは、下記に示す二相の成長サイクルを有する複雑な偏性の細胞内細菌である: (a) 胞子のように感染性はあるが、代謝的に不活性な基本小体(EB)および(b) 非感染性ではあるが、代謝的に活性な網様体(RB)。
【0012】
成長サイクルの略図を図1に示す。概略は、抗体(「Ab」)による細胞外EBおよび細胞内段階(RBおよびEB)に対する免疫応答+強力なCD4 T細胞応答およびおそらくはCD8細胞障害性T細胞による「異常体(aberrant bodies)」 (「AB」)の持続型に対する免疫応答が「完全な」ワクチンのために必要とされることである。
【0013】
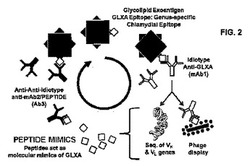
図2は、マイクロ粒子で送達された(26,27)初期のmAb2ワクチン候補およびペプチド模倣体によるその置換を示す略図である。
【0014】
精製化Agまたは組み換えペプチドを有する伝統的な方法は、それらの免疫原性にもかかわらず保護に失敗したので、クラミジア感染についての新規ワクチン戦略が必要とされる(46, 47)。予防効果のあるワクチン法を設計することにおける困難性のいくつかは、さまざまな異なる動物モデルの使用に関連する。新規分子および生化学的方法論は、保護的細胞障害性Tリンパ球(CTL)応答を誘導し得る高い免疫原性を有するAg構築体/ペプチドを提供し(48)、それは、「主要外膜タンパク質」(MOMP) Agについての新規DNAワクチン構築またはCpGのような新規アジュバントの試験を可能にする(47, 49, 50)。本発明者等により採用される別の方法は、ワクチン候補として、標準的な許容される方法により送達されるペプチドを用いることである。過去10年の間に、抗イディオタイプ(抗Id) Ab (mAbを含む)または慣用的なmAbに由来する配列を有するペプチドは、(142-144)に対して免疫化および保護することが示され、癌ワクチン開発のために広く使用されている(142-144)。
【0015】
抗クラミジア免疫は、保護的もしくは病原性であり得る
最初のクラミジア感染は、次の再感染に対する持続免疫を生じない(51-53)。感染に対する免疫病原性応答は、ワクチン開発を困難なものにする。最初の感染後、再感染に対する局所免疫応答の一部は、hsp60または他のクラミジアAgに対する破壊的局所CD4+ T細胞仲介遅延型過敏反応(DTH)応答であるように思われる(54-58)。
【0016】
クラミジア感染の複雑な免疫学は、いくつかのモデルにおいて広く研究されている(60)が、保護免疫についての細胞および分子的必要性については、ほとんど解明されていない。MOMPペプチドでパルスされたDCは免疫原性を出現させたが、死滅MoPnのDC送達が保護的であったとしても、C. muridarum (MoPn)生殖器チャレンジに対して保護的ではなかった(59, 60)。Igietseme et al. (61)は、IL-10ノックアウト(KO)ドナーから得られたEBパルス化DCで免疫されたマウスにおける保護を示し、IL10KOを有するDCは、IFNγ依存的な方法でより迅速にTh1応答を刺激した。この集団は、より早期に、クラミジアAg-Ab複合体が細胞のFcR会合(engagement)によりAgのDC摂取を増大させ、インビトロおよびインビボにおいて改善されたエフェクター応答を産生することを示した(62, 103)。これらの結果は、FcR会合によりAPCに標的化されたAgが炎症性免疫応答をそれらの同じAgに対する抗炎症性免疫応答に遷移させ得ることを示す他の試験を補う(63, 64)。感染のCD4仲介除去における重要なB細胞構成要素に関するMorrisonの最近の結果(79)と組み合わせると、現在、TおよびB細胞の両方が抗クラミジア保護免疫のために必要とされることが明白である。
【0017】
中和Abを含むクラミジアに対する粘膜免疫応答は、中和Ab単独の存在では保護免疫を保証しないが、おそらくは部分的に標的とされるクラミジアAgのために感染からの保護において必要であると考えられる。感染した個体の血清もしくは分泌物において測定される多くのクラミジアAg、例えば、MOMP、CPAFと呼ばれるクラミジア分泌プロテアーゼ因子およびリポ多糖(LPS)に対する活発なAb応答は、1個またはそれ以上の後者のワクチンの可能性を支持し、これらの多くが試験され、種々の成功をもたらした(例えば、47、49、65、66)。LPSは属特異的ではあるが、LPSに基づくワクチンは、予防効果がなかった(145)。MOMPに基づくワクチンは、本発明の属にわたり保護的な免疫原とは対照的に、血清型特異的であり、カクテルワクチン法を必要とし得る。
【0018】
LPS (67-74)とは異なる属特異的な分泌型クラミジア糖脂質外抗原(「GLXA」)は、免疫原性があり、また免疫学的に関連のある標的である。C. trachomatis、C. psittaci、およびCpnに感染した患者由来のAbは、GLXAと反応する(81)。多くの抗クラミジア免疫応答は、T細胞依存性である。MOMPおよび他のAgに対する特異的T細胞応答が示されており、CD4細胞は除去において役割を果たす(75-80)。
【0019】
最近の新規クラミジアAgは、患者サンプルのプロテオームスクリーニングにより同定されるものを含む(81)。Barker et al.は、最近、クラミジアT細胞抗原(リボヌクレオチドレダクターゼ小鎖タンパク質を示すNrdB)を示した(82)。Karunakaran et al.は、イムノプロテオミクスを用いて、C. muridarumマウスモデルにおいてMHCクラスIもしくはII分子と結合する新規ペプチドを同定した(83)。MoPnおよび他の血清型に対するサイトカイン/ケモカイン応答は、Th1およびTh2 CD4細胞の両方が除去において重要であることを示す(84-87)。しかしながら、より高いレベルのIL-10は、MoPnの感受性と関連している(88)。優性Thにおける遷移は、他の細胞内病原体、例えば、LeishmaniaおよびMycobacteriaに対する保護と関連しており(89-91)、任意のクラミジアワクチン候補についてのこの効果はまた示されている。抗GLXA Ab3におけるmAb2誘導アイソタイプ遷移は、抗Idワクチンが免疫付与の経路の影響を深く受けるTh1およびTh2細胞仲介抗GLXA応答を誘導することを示す。
【0020】
本発明によると、適当なThおよびCTLエピトープを有する保護ペプチドワクチン候補は、各々、Th1およびTh2応答、ならびにおそらくはCD8+ CTL応答を含み得る。
【0021】
多くの予期されるレスポンダー/エフェクターおよびそれらのサイトカインが、クラミジア感染および除去の間に見出されている(85, 92)。しかしながら、これらの免疫組織化学(IHC)法は、ワクチン接種に対する応答よりも感染に対する先天的および適応免疫応答に集中している。トランスジェニック(Tg)およびKOマウスを用いた試験は、MHCクラスII+ T細胞がクラミジア(MoPn)除去において重要であるが、MHCクラスI経路に関与するT細胞は重要ではないことを示した(93)。Th1対Th2関連応答が連続して生じ得て(94, 95)、Ag処理経路を含む多くの因子(96)が出力に影響を与え得る。
【0022】
慢性クラミジア炎症性疾患における潜在的な保護メカニズムは、炎症性Th1細胞および単球/マクロファージ/DC応答の制御により仲介される。この細胞内病原体に対する応答におけるCD8+ T細胞についての役割が長期にわたって示されており、C. trachomatisおよびCpnに対するCD8+ CTLについての証拠が公開されている(48,97-99)。しかしながら、血清型または種にわたりCD8応答を含む免疫原性保護ペプチドは、未だ証明されていない。APC、特に(UV)-EBでパルスされたDCの操作は、種々のレベルの保護免疫を誘導した。例えば、生きたEBに曝されたDCは、UV-EBで見られるものよりも成熟したDC表現型を獲得し、CD4 Th1応答を促進し得るより高いレベルのIL-12を産生した(113, 114)。
【0023】
クラミジアワクチン開発の進展には、下記を必要とする:
(1) 1個またはそれ以上の標的Agの同定;
(2) 病原性免疫応答を克服するための改善された保護応答の誘導; および
(3) 1個またはそれ以上の動物モデルにおける一次、二次および異種感染に対する持続的な保護。
【0024】
実際の臨床におけるクラミジア曝露は、おそらく低用量であり、したがって、最少の免疫原性である(インビボ複製が始まるまで)。動物モデルにおけるより多量のチャレンジに対する免疫応答の証拠は、天然感染のよりわずかな応答とは異なる複数の刺激の経路を反映し得るので、それらを解釈する必要がある。単独感染は、通常、自己限定的であるために、以前の感染のみではヒトにおいて十分な保護免疫を誘導しないので、炎症性要素に悪影響を与えることなく、上記のものを超える免疫応答を同定および誘導することがより重要である。クラミジア感染に対する早期の抗生物質による処置は、いくらかの天然の保護免疫の発達を減少させ得るという観察に対して、この方法では、一層悪化した後の後遺症、例えば、不妊症を生じ得るという新たな疑問が最近提示されてきている(146, 147)。
【0025】
一方、微生物の天然の除去は、保護免疫に対する必要とされる応答を提示しないかもしれない。高度に免疫優性なAgは、他のAgに対する潜在的な保護応答を阻害しますか?保護的免疫付与と病原性免疫付与との間の平衡を達成することが、継続してクラミジアに再曝露されるか、または以前にクラミジアに曝露されたヒト集団についてのワクチンのために重要である。非粘膜部位における播種および慢性感染の確立を阻害する方法を理解すると、これらのイベントにおける任意の抗クラミジアワクチン接種の効果は、極めて重要である。本発明は、該平衡およびヒト疾患を反映する播種性クラミジア感染に関するペプチド免疫原、例えば、mAb2可変領域の配列に由来するものの効果を同定する。
【0026】
クラミジア・トラコマチスおよび播種性感染の動物モデル
クラミジア感染の播種性段階についての新たな見解が最近現れてきた。循環細胞(おそらくは、単球および/または単球由来DC)は、1個またはそれ以上の部位に循環して(traffic)、集まるか、または該部位に捕捉される。C. trachomatis播種の共通部位は、滑膜であり、実際に一部の患者は、反応性関節炎(ReA)を発症する。クラミジアは、ReA滑膜において唯一生存可能で代謝的に活性な細菌であり、患者がリウマチ専門医を訪れた場合に、分子的に既定された持続型である(形態および遺伝子発現について) (10, 100-107)。
【0027】
滑膜は、感染性微生物、循環微粒子などの捕捉部位であることが既定されている。IHCおよび免疫電子顕微鏡試験は、インタクトクラミジアおよびクラミジアAgの両方がReA滑膜に存在することを示した(110, 11)。しかしながら、関節からの培養可能クラミジアの単離は一度だけ報告されており(112)、多くの試みは失敗に終わった(106)。ある条件下において、C. trachomatisは、極めて低いレベルのEBが産生され、MOMP、chsp60、ftsK、ftsWなどをコードする多くの遺伝子が下方調節もしくは上方調節されるが、持続感染を生じる(10, 101, 107, 113-116)。
【0028】
本発明者等を含む多くの集団がPCRに基づくクラミジア検出系を開発した(117-122)。いくつかのC trachomatis血清型についてのゲノムが公開されると共に、さらなるクラミジア遺伝子転写産物についてのPCR/qPCRが可能になってきた。C. trachomatisゲノムプロジェクトは、個体が持続状態に入ると異常に発現することが予測される選択されたクラミジア遺伝子の本発明者等自身による試験を可能にした。クラミジア発達および分化の特定の段階に関与する選択された遺伝子を標的とすることは、活性な感染細胞におけるクラミジア遺伝子発現がインビトロでReA滑膜組織および持続的感染ヒト単球において観察されたものとはかなり異なることを示す(118,123)。かなりわずかな動物試験がクラミジア関連ReAについて行われた。
【0029】
本発明者および同僚等は、最初に、マウスにおいてワクチンにより仲介される実験的ReAの減少を示した。最初に、マウス結膜(眼粘膜組織)への眼感染が、滑膜へのクラミジア播種を生じた(124)。より最近、本発明者等は、米国および欧州においてヒトクラミジア関連ReA症例のより代表的なモデルである生殖器感染モデルに焦点を当てた。最近のモデルにおいて、滑膜組織へのC. trachomatisの播種およびその結果生じる膝の病状が報告された。
【0030】
本発明者等の眼および生殖器感染モデルにおいて誘導される滑膜炎症の概略が公開されている(124-126)。クラミジア播種は、他の動物モデルにおいて生じ、Cpnは、マウスの経鼻チャレンジ後、または感染PECの移植後、遠隔部位に播種されることが示されたが(127)、滑膜およびCNSについてはアッセイされなかった。MoPn誘導生殖器感染を用いた試験(128)は、急性関節炎を生じた。最近の試験は、前感作または関節内クラミジアチャレンジを利用し、それは、生殖器感染からの天然の播種を弱く模倣する。同じ集団(129)は、モルモットにおいて生殖管から関節へのGPIC (Chlamydiophila pecorum)の播種を示した。最近のクラミジアReAの近交ラットモデル(130)は、C. trachomatisに感染した滑膜細胞の関節内注入を利用する。それは、ReAに関連するいくつかの疑問を調べることを可能にするが、天然のヒト感染とは基本的に異なり、ここで、最初の感染細胞は、線維芽細胞ではなく、これは、関節へのクラミジア播種に関与する宿主細胞でもない。したがって、C. trachomatis関連ReAについての本発明者等のモデルは、疾患作製の非侵襲モデルのために、本発明のワクチンの開発および試験について、最もとりわけ、クラミジアReAおよび滑膜感染の試験により仲介される減少について有利である。
【0031】
クラミジア感染を保護するための有効な送達戦略と結合した有効なワクチンの本発明者等による同定は、世界中で公衆衛生に関する巨大な衝撃を与えるであろう。免疫原性ペプチドの生分解性NPへの封入は、改善された粘膜ワクチン付与を促進し、冷却保存(cold chain)の必要性を減少させるのを助ける。ナノ技術は、以前、クラミジアの研究に適用されていなかったので、本発明は、クラミジア関連疾患の予防に対する新規方法を提示する。さらに、本発明により開発された方法は、他の細胞内ヒト病原体についてのワクチン製剤の開発のための基盤として使用され得る。
【0032】
現在、保護的クラミジアワクチンは存在しない。性行為による感染は、女性において主に無症候性であり、これは、感染、骨盤内炎症性疾患、子宮外妊娠および不妊を高め得る。広がったスクリーニングおよび処置プログラムにもかかわらず、クラミジア性感染症(STI)の症例数はなお増加しており、2007において100万超の新規STI症例/年を示す。これらの抗原性エピトープは、属特異的(属にわたる)、血清型に特異的ではない、または推定上の次亜種特異的(C. trachomatisとC. pneumoniaeとC. psittaci)であるので、本発明のワクチン組成物は、不妊症のような慢性炎症性疾患後遺症は言うまでもなく、STI、心臓血管疾患、クラミジア肺炎、アルツハイマー病および多発性硬化症の一部に対して保護的であるはずである。
【0033】
上記文献の引用は、上記のいずれかが関連のある先行技術であることを認めることを意図するものではない。これらの文献の内容についての日付または記載に関するすべての提示は、出願人に利用可能な情報に基づくものであり、これらの文献の日付または内容の正確性についてのいかなる承認をも構成するものではない。
【発明の概要】
【0034】
発明の要約
本発明者等は、抗原性エピトープを示すペプチドおよびクラミジアGXLA抗原に特異的な抗体に特異的な抗Id-mAb2の結合領域の一部もしくは全部を示すペプチドの配列を同定および/または推定した。本明細書において記載されるとおり、さまざまなペプチドが試験され、感染細胞においてEBおよびRB、ならびに封入体の構成要素(マトリックス材料および/または封入体膜)を認識する抗体を誘導することが見出された。重要なことは、これらのペプチドが感染性クラミジアを用いたチャレンジに対して保護活性を示し、C trachomatis、C pneumoniae、C psittaci、C pecorumなどの広範囲にわたる抗クラミジアワクチンとしての潜在性を有する属特異的抗原を示すことである。
【0035】
本発明者等は、mAb2のIgG分子のH鎖およびL鎖の超可変もしくは相補性決定領域(CDR)が一緒になってこれらのmAb2 IgG分子のAg結合領域を示すので、それらが候補ワクチンであると考えた。抗Idワクチンは、専ら、抗癌ワクチン候補として研究されてきた(43-45)。
【0036】
本発明は、新規免疫原性ペプチドおよび改善された粘膜ワクチン接種を促進するための生分解性NPへのそれらの封入に向けられる。本発明は、クラミジア関連疾患の予防のための新規組成物および方法を提供し、ナノテクノロジーをクラミジア感染の予防および処置に適用する。本発明は、本発明者および同僚等のうちの1人による初期の発見(米国特許第5,656,271号および第5,840,297号ならびにRef. 27を参照のこと)から前進した概念的な飛躍である、1個またはそれ以上のGLXAエピトープ(その構造は未だ生化学的に定義されていない)の分子模倣体として機能する抗GLXA mAb (mAb1)に対して作製された「mAb2」と呼ばれる抗Id mAbの新規組成物を提供する。
【0037】
GLXAは精製するのが困難で、十分な材料のために多量のクラミジアを必要とする。このために、このAgは決して十分には特徴づけられておらず、その正確な性質は未知のままである。「属特異的な」(また「属にわたる」と呼ばれる)抗原は、既知の種にわたってクラミジア属の生物において存在することを意味することが知られている。それは、クラミジアにおいて唯一他の既知である属にわたる抗原であるクラミジアリポ多糖(LPS)とは異なる(26, 27, 68-74, 126)。
【0038】
本発明者等の新規な方法は、有利なペプチド免疫原に集中することにより、GLXA特徴づけおよび精製についての必要性を避けるように設計されている。それらは、経済的に多量に、かつ容易に生産される。それらは、免疫原性担体と連結されていてもよく、および/またはより効率的な送達および免疫化のために、マイクロスフィア、NPおよびウイルス様粒子(VLP)を含むさまざまな送達ビヒクルに封入されていてもよく、および/または他のナノ材料、例えば、デンドリマー/樹枝状ポリマー(該用語は同義である)と連結されていてもよい。
【0039】
本発明によると、ペプチド免疫化により誘導される免疫血清は、持続的な感染細胞を認識し、持続的な状態で存在するクラミジアに結合する。したがって、1個またはそれ以上のペプチドに対する免疫は、持続的な感染を除去し、それにより慢性的なクラミジア感染を予防する可能性を有し得る。
【0040】
より特には、本発明は、少なくとも約10アミノ酸長であるが、抗体VHもしくはVLドメインまたは一本鎖抗体(scFv)鎖の長さよりも短い免疫原性ペプチドに向けられる。該ペプチドは、クラミジア属特異的糖脂質外抗原(GLXA)の構造を免疫学的に模倣しており、該ペプチドが十分な量かつ免疫原性形態で哺乳動物対象に投与された場合に、例えば、下記:
(a) 免疫ペプチドに対するイムノアッセイ;
(b) GLXAに対するイムノアッセイ; および/または
(c) 複数の(好ましくは、全部の)クラミジア種のクラミジア個体への結合、またはその機能、増殖もしくは生存の阻害を測定するイムノアッセイまたは生物学的アッセイ
において測定可能な抗体応答を誘導するという点で特徴づけられる。
【0041】
上記の免疫原性ペプチドは、好ましくは、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約25、約30、約35、約40、約45、約50、約60、約70、約80、約90もしくは約100アミノ酸残基長(および、それらの間のすべての値)を超えず、最も好ましくは、約30アミノ酸残基長を超えない。
【0042】
免疫原性ペプチドは、抗GLXA抗体Ab1を用いた結合についての選択によるファージディスプレイペプチドライブラリーに由来し得る。1つの規定された抗GLXA抗体Ab1は、受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである。
【0043】
1つの態様において、上記免疫原性ペプチドは、下記:
(a) Pep1、配列番号1;
(b) Pep2、配列番号2;
(c) Pep3、配列番号3;
(d) Pep1、配列番号4;
(e) Pep4、配列番号5;
(f) Pep5、配列番号6;
(g) Pep6、配列番号7;
(h) Pep11、配列番号11;
(i) Pep12、配列番号12;
(j) Pep13、配列番号13;
(k) Pep14、配列番号14; および
(l) ペプチドの抗体反応性および免疫原性を保持する、(a) - (k)のペプチドのいずれかの保存的アミノ酸置換変異型または付加変異型
からなる群から選択される(下記で詳細に定義する)。
【0044】
免疫原性ペプチドはまた、N末端およびC末端残基が、両末端においてCys残基、または一方の末端において架橋可能なLys (K)および他方の末端においてGlu (E)を導入するように付加された環化ペプチドであり得る。該ペプチドの好ましい例は、配列番号14; 配列番号15; 配列番号16; 配列番号17; 配列番号18; 配列番号23; 配列番号24; 配列番号25; 配列番号26; 配列番号27; 配列番号28; 配列番号20; 配列番号30; 配列番号34; 配列番号35; 配列番号36; 配列番号37; 配列番号38; 配列番号39; 配列番号40; 配列番号41; 配列番号42; 配列番号43; 配列番号44; 配列番号45; 配列番号46; 配列番号47; 配列番号48; 配列番号49; 配列番号50; 配列番号51; 配列番号52; 配列番号53; 配列番号54; 配列番号55; 配列番号56; 配列番号57; および配列番号58からなる群から選択される直鎖配列を有するペプチドである。
【0045】
好ましい態様において、免疫原性ペプチドは、抗GLXA抗体Ab1に特異的である抗Id抗体Ab2のV領域ドメインのアミノ酸配列を有し、イムノアッセイにおいて抗GLXA抗体に結合するペプチドである。抗GLXA抗体Ab1は、mAbであり得て、好ましい例において、抗GLXA抗体Ab1は、受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである。抗Id Ab2抗体は、好ましくは、mAb(mAb2)であり得て、好ましい例において、抗Id Ab2抗体は、受託番号HB-11301としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである。該mAb2に由来する好ましいペプチドは、下記:
(a) Pep8、配列番号8;
(b) Pep9、配列番号9;
(c) Pep10、配列番号10; または
(d) ペプチドの抗体反応性および免疫原性を保持する、(a) - (c)のペプチドのいずれかの保存的アミノ酸置換変異型または付加変異型
である。
【0046】
mAb2のペプチド配列に由来するか、もしくはそれに類似する免疫原性ペプチドは、N末端およびC末端残基について、両末端が例えばCys残基、または一方の末端が架橋可能なLysおよび他方の末端がGluである環化ペプチドである。この群の好ましい環化ペプチドは、配列番号22; 配列番号23; 配列番号24; 配列番号25; 配列番号38; 配列番号39; 配列番号40; 配列番号52; 配列番号53; および配列番号54からなる群から選択される直鎖配列を有する環化ペプチドである。
【0047】
上記のペプチドのいずれかのペプチドの約2から約20リピートを含む(モノマー単位)、免疫原性直鎖オリゴマーもしくはマルチマーペプチドまたはポリペプチドがまた提供される。そのようなオリゴマーもしくはマルチマーは、各々が任意の2個の隣接するペプチドのリピート「基本」単位の間に位置する、1個またはそれ以上のリンカーペプチドを含み得る。オリゴマーまたはマルチマーは、環化していてもよい。
【0048】
他の好ましい態様は、タンデムに(隣接して)連結された上記ペプチドモノマーの2もしくは3個のリピートを含む、免疫原性タンデムオリゴマーペプチドである。
【0049】
1つの態様は、分枝を提供し、かつ、16個までの末端官能基を含むように少なくとも二機能性であるコア分子上に構築された樹枝状ポリマーであって、ペプチドモノマーが該樹枝状ポリマーの官能基と共有結合している、樹枝状ポリマーである。
【0050】
本発明はまた、下記:
(a) 上記の免疫原性ペプチド、オリゴマーもしくはマルチマー、または樹枝状ポリマー; および
(b) 免疫学的および薬学的に許容される担体もしくは賦形剤
を含む免疫原性組成物に向けられる。
【0051】
免疫原性組成物は、好ましくはさらに、薬学的に許容されるポリマーから形成された固相マトリックスを含むマイクロスフィアまたはナノ粒子を含み、該マイクロスフィアは、該ペプチドを含む。好ましいポリマーは、ポリ乳酸(PLA)またはPLGAである。
【0052】
上記の組成物において、ペプチド(またはオリゴマーまたはマルチマー)は、糸状バクテリオファージに連結されていてもよい。
【0053】
ペプチドオリゴマーまたはマルチマーは、標的化部分と連結、結合、もしくは混合されていてもよい。標的化部分は、好ましくは、望まれる細胞型の表面または望まれる環境への結合、もしくは選択的標的化を促進するポリペプチドである。最も好ましくは、標的化部分は、標的化されるべき細胞の細胞表面抗原に結合する抗体(または抗体の抗原結合部分もしくは変異型)である。抗原提示細胞、最も好ましくは樹状細胞(DC) (すなわち、未成熟DCまたはDC前駆体)への免疫原性部分の結合/標的化および処理を促進する抗体が最も好ましい。
【0054】
上記免疫原性組成物はさらに、アジュバント、免疫刺激タンパク質(免疫原性ペプチド/ポリペプチド)、またはCpGオリゴヌクレオチドを含み得る。好ましい免疫刺激タンパク質の例は、サイトカイン、例えば、インターロイキン-2もしくはGM-CSFである。
【0055】
好ましいアジュバントの例は、下記:
(a) 0.4 mg トレオニル-ムラミルジペプチドを含むリン酸緩衝液中のISAF-1 (5% スクアレン、2.5% プルロニックL121、0.2% Tween 80);
(b) 油中に溶解した脱油(de-oiled)レシチン;
(c) 水酸化アルミニウムゲル;
(d) (b)と(c)の混合物;
(e) QS-21; および
(f) モノホスホリルリピドAアジュバント
である。
【0056】
免疫原性組成物は、アジュバントおよびさらなる免疫刺激剤部分、例えば、サイトカイン、好ましくは、IL-2を含み得る。
【0057】
本発明はまた、免疫原性DNA分子に向けられる。好ましくは、免疫原性DNAは、1個またはそれ以上の本発明の上記ペプチドをコードする。
【0058】
免疫原性DNA分子は、抗GLXA抗体であるAb1に特異的であるAb2抗Id抗体のVHもしくはVL領域の1個、2個または3個のCDR (CDR1、CDR2またはCDR3)を任意の順序で含むポリペプチドをコードし得る。抗Id抗体は、好ましくは、mAb、例えば、受託番号HB-11301としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである。DNA分子の好ましい例は、配列番号59もしくは配列番号61を含むか、または配列番号59もしくは配列番号61の少なくとも1個のCDRコード領域を含むDNA分子である。1つの好ましい態様は、配列番号59または配列番号61の断片からなるDNA分子、または少なくとも1個のCDRをコードするこれらの配列の断片である。
【0059】
DNA分子が配列番号59を含む場合に、該分子は、かなり短いものであり得るが、約411ヌクレオチド長を超えない。DNA分子が配列番号61を含む場合に、該分子は、かなり短いものであり得るが、約387ヌクレオチド長を超えない。
【0060】
1つの態様において、免疫原性DNA分子は、上記の直鎖ペプチドオリゴマーもしくはマルチマーをコードする。他の態様において、免疫原性DNA分子は、下記:
(a) 第1融合パートナーとして、上記のペプチド;
(b) 存在する場合、所望によりインフレームで(c)に結合したリンカーまたはスペーサーペプチド;
(c) 第2融合パートナー
を含む一本鎖融合ポリペプチドをコードする。
【0061】
対象が該キメラDNA分子で免疫された場合に、該ペプチドに対する抗体応答は、該第2融合パートナーを含まないで(リンカー/スペーサーの有無で)投与された同じペプチドにより誘導される抗体応答と比較して増大される。
【0062】
免疫原性DNA分子は、好ましくは、免疫原の意図される対象、好ましくは、ヒトの細胞において発現可能な発現ベクターの形態である。そのような発現ベクターは、
(a) 上記のDNA分子; および
(b) それと操作可能に結合したプロモーター、および所望により、意図される細胞または対象においてDNAの発現を促進する1個またはそれ以上の転写制御配列
を含む。
【0063】
本発明はまた、クラミジア感染に対して哺乳動物対象、好ましくは、ヒトを免疫する方法を提供する。該方法は、下記:
(a) 上記免疫原性ペプチド;
(b) 上記オリゴマーもしくはマルチマーペプチドまたはポリペプチドまたはポリマー
(c) 上記融合ポリペプチド;
(d) 上記DNA分子または発現ベクター; または
(e) 上記免疫原性組成物
の有効な免疫原性量を該対象に投与することを含み、クラミジア属にわたる(属特異的な)クラミジアGLXA抗原に特異的な抗体応答を誘導することを含む。上記方法は、好ましくは、対象におけるクラミジアの感染性、増殖、まん延もしくは病原性(例えば、反応性関節炎)を予防または阻害する中和抗体応答である抗体応答を誘導する。
【図面の簡単な説明】
【0064】
【図1】図1は、クラミジア感染の発生サイクルの略図を示す。RB: 網様体−生物の非感染性ではあるが、代謝的に活性な形態。RBの主要目的は、宿主代謝産物を用いた二分裂による細胞内複製である。EB: 胞子様球状粒子であるクラミジア基本小体(直径約300 nm) (感染性はあるが、代謝的に不活性である)。
【図2】図2は、クラミジア抗原GLXAに対する抗体応答に適用される場合における、初期のmAb2ワクチン候補およびイディオタイプネットワークを示す略図である。
【図3】図3A-3Fは、個々のペプチドに対するペプチド免疫化マウスの抗体応答(ELISAで測定された)を示す一連の図式である。各群のマウスは、継続的な免疫付与で各免疫ペプチドに対する増加した抗体応答を示し; 事前に採血されたコントロール値を各希釈物における各マウスの血清吸光度(すなわち、OD)から引いた。
【図4】図4A-Cは、ELISAによるペプチド間の交差反応を示す一連の図式である。Im# - Pep4、Pep7またはPep8で免疫されたマウス; 「X-Rx」: パネルで示される交差反応。Pep4またはPep7で免疫されたマウスからの血清を各々Pep7およびPep4と交差反応させた。Pep8は、Pep10と交差反応しなかった(後者のペプチドが異なるH鎖CDRを示すので)。
【図5】図5は、mAb2免疫化ドナーからの脾臓細胞の免疫不全SCIDマウスへの適合移植(次いで、該マウスをChlamydia trachomatis (K血清型)でチャレンジした)の結果を示す。図5は、免疫細胞移植なしに増加した、結果として生じた感染性細菌負荷を示す。記号は、下記のとおりである: □−□: mAb2免疫リンパ球(T細胞を含む)の移植; ●−●: T細胞欠損mAb2免疫リンパ球の移植; ○−○: 正常な(コントロール)リンパ球の移植(これらの3群をクラミジアでチャレンジした); ▲−▲: 正常な(コントロール)リンパ球の移植(レシピエントは、感染されず、抗ペプチド抗体応答は、検出されなかった)。
【図6】図6は、mAb2免疫化ドナーからの脾臓細胞の免疫不全SCIDマウスへの適合移植(次いで、該マウスをChlamydia trachomatis (K血清型)でチャレンジした)の結果を示す。図6は、本発明の4個のペプチドに対する抗体応答を示す(ELISAによる)。記号は、下記のとおりである: □−□: mAb2免疫リンパ球(T細胞を含む)の移植; ●−●: T細胞欠損mAb2免疫リンパ球の移植; ○−○: 正常な(コントロール)リンパ球の移植(これらの3群をクラミジアでチャレンジした); ▲−▲: 正常な(コントロール)リンパ球の移植(レシピエントは、感染されず、抗ペプチド抗体応答は、検出されなかった)。
【図7】図7は、より初期のマイクロ封入型でのmAb2ワクチンで免疫付与されたマウスによるC. trachomatis (血清型E)を用いたチャレンジ後の結果を示す。図7は、細菌チャレンジの14日後のウイルス排出を示し、いくつかのマウスは、重複する値を有する。群を、皮下(SC)、経口(PO)または両経路で免疫付与し(または、免疫付与しない)、血清型EのC trachomatisを感染させた(または、感染させなかった)。
【図8】図8A-8Dは、より初期のマイクロ封入型でのmAb2ワクチンで免疫付与されたマウスによるC. trachomatis (血清型E)を用いたチャレンジ後の結果を示す。図8A-8Fは、ELISAにより測定された、示されたペプチドに対する同じ動物の抗体応答を示す。群を、皮下(SC)、経口(PO)または両経路で免疫付与し(または、免疫付与しない)、血清型EのC trachomatisを感染させた(または、感染させなかった)。K、L、MおよびP群のみを最初の抗ペプチドELISAで試験した。
【表1】

【図9】図9A-9Fは、ペプチド免疫血清がC trachomatis感染HEp-2細胞を認識することを示す。C. trachomatisで感染されたHEp2の顕微鏡写真は、指定されたペプチド(A-E)または可溶性mAb2(F)で免疫付与されたマウスからの血清(1:40希釈)で免疫染色(間接免疫蛍光による)されている。FITC抗マウスIgGは、検出抗体であった。矢印は、免疫血清の標的における異なる差異を示す。パネルA-Cにおける抗体は、EBおよびRB、ならびにおそらくは封入体におけるいくつかのマトリックス材料を認識した。D-Eにおける抗体はまた、より後の(older)ワクチン候補である全mAb2 (F)に対して作製された免疫血清と同様に、封入体マトリクスおよび封入体膜における標的を認識した。元の倍率は、40xである。エバンスブルーを用いてサンプルを対比染色する。
【図10】図10は、感染後7日での膣スミア細胞におけるクラミジア生物の免疫染色の結果を示す(直接蛍光)図式である。
【図11】図11は、感染後14日での膣スミア細胞におけるクラミジア生物の免疫染色の結果を示す(直接蛍光)図式である。
【図12】図12は、走査電子顕微鏡法により調べられた、ペプチド4を搭載したPLGA NPの顕微鏡写真である。長さのスケールを示す。
【図13】図13Aおよび13Bは、NPからのペプチド4の放出プロファイルを示す図式である。図13Aにおいて、リン酸緩衝生理食塩水(PBS)または炭酸緩衝液中のNPについて、逆相HPLCにより放出を決定した。図13Bは、既知の陽性抗Pep4抗血清を用いてELISAにより調べられた、放出ペプチド4 (炭酸緩衝液中)の免疫化学解析の結果を示す。
【図14】図14A-14Fは、微生物での感染後、1時間(t0) (A-C)または18時間(t18) (D-F)でのペニシリンG (PenG)添加の結果としてChlamydia trachomatisに持続感染したMcCoy細胞(148)の顕微鏡写真である。感染の48時間後に細胞をメタノールで固定し、Pep4 (A,D)、Pep7 (B,E)またはPep4とPep7の混合物(C,F)で免疫された動物からの抗血清で染色した。パネルD-Fにおける挿入図は、代表的な「コントロール」感染細胞(PenGなし)を示す。
【図15】図15A-15Cは、Pep4またはPep7を用いてより初期に免疫付与され、次いで28日後にチャレンジされたマウスの雌生殖器官の組織の巨視的な形態を示す一組の3枚の写真である。上記したとおり、マウスを抗原刺激し、2回のSC追加免疫を行い、クラミジアでチャレンジし、2週間後に再チャレンジし、その4週間後に安楽死させた。炎症した生殖管を破線で示す。矢印の部分は、子宮角であり、極めて暗く(炎症しており、インサイチュでは紫色である)、一方で、ペプチド4もしくは7で免疫されたマウスの該部分は、ほとんど炎症を示さず、より明るい色であった。
【図16】図16A-16Bは、BALB/cマウス(n=4-5)をPep4または無関連のペプチドで免疫付与し、Pep4を用いて動物の血清の反応性を試験する、図3で示される実験の繰り返し実験の結果(ELISA)を示す一組の図式である。
【図17】図17A-17Fは、遊離ペプチドまたはPLAマイクロ粒子に封入された形態での、免疫原としてさまざまなPep4(Pep4-MP)の用量でSC免疫付与された血清のELISAによる結果を示す。MPは、mg PLAあたり約7.5〜約9μgのペプチドレベルで搭載された。△−△: 事前(免疫付与前)の採血の結果。▲−▲: 最初の免疫付与後の結果。○−○: 1回目の追加免疫後の結果。●−●: 2回目の追加免疫後の結果。▼−▼: 最終採血の時点での結果(28日)。各点は、指定された群の4もしくは5個体マウスの血清についての平均吸光度(OD405)を示す。
【図18】図18は、示された時間において得られた膣スメアの直接蛍光抗体染色(DFA)の結果を示す。アッセイは、遊離基本小体(EB)を検出し、スコアは(任意ユニットで)、スメア中の遊離EBの相対数を示す(最小1000個の細胞が有効なサンプルのために必要とされる)。
【図19】図19A-19Bは、Pep4マイクロ粒子による封入化ペプチドの放出の経時変化を示す。
【発明を実施するための形態】
【0065】
好ましい態様の説明
本願発明者および同僚等のうちの1人は、以前、それ自体が「微量抗原」クラミジア糖脂質抗原(GLXA)に特異的である抗体(Ab1)に特異的な抗イディオタイプ(Id)モノクローナル抗体mAb2が、GLXAを認識する抗抗Id Ab (総称Ab3)を誘導する分子模倣体ワクチンとして使用され得ることを発見した(米国特許第5,656,271号および第5,840,297号を参照のこと)。受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生される該mAb2は、クラミジアに対して動物を免疫し、インビボでのクラミジア感染を中和した。ポリクローナルAb2または異なるモノクローナルAb2が同様に使用され得る。Ab1 (GLXAに特異的である)自体は、クラミジアに対して免疫化するか、もしくはそれを中和する重要な活性を有していなかった。好ましい(および例示的な)mAb2は、クラミジアAgに特異的なmAb1(本明細書においてまた「GLXA-mAb1」と呼ばれ、受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生される)を用いた免疫により誘導された。該Ab1は、マウスGLXA特異的Abと関連する1個またはそれ以上のイディオタイプを有するが、それ自体は、クラミジアを中和することにおいて、またはクラミジアに対して免疫化する免疫原として活性ではないId Abである。
【0066】
上記mAb2は、免疫原性を有し、保護的ではあるが、ヒトにおいて望まれない免疫応答を産生するマウス特異的エピトープのためにヒトワクチンとしての既知の不利益を有するマウスAbである。その潜在的な利用はまた、特定のマウス(または部分的マウス)mAbが臨床において使用されるという事実により危険にさらされており、したがって、対象をmAb2型免疫原に対する望まれない危険性が生じ得る免疫(アナフィラキシーを含む)応答にさらし得る(prime)。
【0067】
本発明は、完全マウスmAbまたは全鎖もしくはそのドメインの代わりに、ランダムファージディスプレイライブラリーに由来するか、もしくはGLXA抗原を模倣するmAb2の抗原結合領域(CDR)に由来する鎖/ドメインまたはペプチドをコードするDNAを用いることにより、これらの欠点を克服する一手段として考えられた。
【0068】
抗GLXA (Ab1) 抗Id (Ab2)抗体の作製および特徴づけ
下記の説明において、免疫学、細胞生物学および分子生物学の当業者に既知のさまざまな方法論が参照され得る。そのような既知の方法論について説明する公開物および他の材料は、十分に説明されているかのようにそれらの全体を引用により本明細書の一部とする。免疫学の一般的な原理について説明する標準的な参照となる仕事は、A.K. Abbas et al., Cellular and Molecular Immunology (6th Ed.), W.B. Saunders Co., Philadelphia, 2007; C.A. Janeway et al., Immunobiology. The Immune System in Health and Disease, 6th ed., Garland Publishing Co., New York, 2005; P. Delves et al. (eds.) Roitt's Essential Immunology (11th ed.) Wiley-Blackwell, 2006; I. Roitt et al., , Immunology (7th ed.) C.V. Mosby Co., St. Louis, MO (2006); Klein, J et al., Immunology (2nd ed), Blackwell Scientific Publications, Inc., Cambridge, MA, (1997)を含む。
【0069】
さらに、ポリクローナルおよびモノクローナル抗体の産生、単離、特徴づけ、および使用についてのとりわけ有用な方法は、下記の標準的な参照において記載されている: Harlow, E. et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1988); Harlow, E. et al., Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1998; Monoclonal Antibodies and Hybridomas: A New Dimension in Biological Analyses, Plenum Press, New York, NY (1980); H. Zola et al., in Monoclonal Hybridoma Antibodies: Techniques and Applications, CRC Press, 1982)。
【0070】
GLXAの製造および部分精製について、米国特許第5,716,793号(A.B. MacDonald et al.)を参照のこと。抗GLXA抗体(Ab1)は、ポリクローナルまたはモノクローナルであり得る。mAbの産生について、Id抗体GLXA-Ab1は、抗原としてGLXAまたは全クラミジア細菌を用いて、動物、一般的にはマウスを免疫することにより産生される。該動物の血清は、ポリクローナルAb1の起源であり得て、それは、多くの慣用的な方法のいずれかにより富化または精製され得る。次いで、慣用的な手順を用いて、動物の免疫脾臓細胞が同定され、単離され、リンパ腫もしくは骨髄腫細胞と融合される。その後、融合した細胞を選択培地においてインキュベートし、非融合腫瘍細胞の増殖を妨害する。ハイブリドーマ細胞は、例えば、限定希釈によりクローン化され、上清が分泌型mAbの望まれる特異性または反応性についてアッセイされる。MAbはまた、インビボにおいて腹腔内腹水腫瘍の形態でハイブリドーマ細胞を増殖させることにより産生され得る。あるいは、Bリンパ球産生抗GLXA Abは、エプスタイン・バーウイルスでの感染により不死化され得る。
【0071】
GLXA-mAb1を産生する適当なおよび好ましいハイブリドーマは、受託番号HB-11300としてAmerican Type Culture Collectionに寄託されいる。このmAbは、ELISA型酵素イムノアッセイ(EIA)において、C. trachomatis、C. pneumoniae、およびC. psittaciの15個の血清型のすべてと反応し、これは、属にわたる抗原の認識を証明する。
【0072】
本発明によると、微量抗原GLXAに特異的なId抗体(GLXA-Ab1)、好ましくは、mAb 抗GLXA Ab、最も好ましくは、HB-11300により産生されるmAb(米国特許第5,716,793号、第5,656,271号および第5,840,297号を参照のこと)は、下記の2つの主要な目的のために使用される:
(1) ライブラリー、例えばランダムファージディスプレイライブラリーにおいて、GLXAエピトープと立体構造を共有するペプチド(下記において「カテゴリー1」ペプチドと定義される)を同定すること; および
(2) GLXAエピトープの模倣体であるイディオタイプまたは「内部イメージ(internal images)」を示す、抗原結合部位、好ましくはVHもしくはVLドメインのCDR領域のペプチド(下記において「カテゴリー2」ペプチドと定義される)配列の起源として。これらのペプチドは、抗体VHもしくはVLドメインまたは一本鎖抗体(scFv)の長さよりも短いものとして定義される(Skerra, A. et al. (1988) Science, 240:1038-41; Huston JS et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-83; Pluckthun, A. et al. (1989) Methods Enzymol. 178:497-515; Winter, G. et al. (1991) Nature 349:293-9; Jost CR et al,. J Biol Chem. 1994 269:26267-73; 米国特許第4,704,692号、第4,853,871号、第4,946,778号、第5,260,203号、第5,455,030号)。
【0073】
本発明の基礎を形成する最初のペプチドは、下記の方法で得られるか、または推定された。
【0074】
(1) 「カテゴリー1」ペプチド
本発明者等は、偶然にGLXAを模倣したペプチドを検出するために、GLXAに特異的なGLXA-mAb1 (HB11300の産物)を用いてファージディスプレイライブラリー(New England BiolabsからのPhD-12ペプチドライブラリー、# E8110S) (また131を参照のこと)をスクリーニングすることにより、該ライブラリーからペプチド配列を得た。数回のパニングに基づいて、mAb1に結合した一組のペプチドを同定した。解析のために2個のペプチド(Pep4およびPep7)を最初に選択し、合成した(表1を参照のこと)。この群から同定され、試験されるペプチドは、ライブラリーが構築される方法に基づいて12merであるが、これと同じ手順が、同様の免疫学的特性を有し、同じ方法で免疫原として使用され得る異なるサイズの(より長いまたはより短い)ペプチドを同定するために有効であるであろう。
【0075】
(2) 「カテゴリー2」ペプチド
ハイブリドーマHB-11300により産生されるmAb2の重(H)鎖可変ドメイン(VH)および軽(L)鎖可変ドメイン(VL)をクローン化し、塩基配列を決定した。抗GLXA/抗クラミジアAbを誘導するための免疫原として有用なペプチドは、試験のために最初に選択され、VH鎖配列から生じ、本明細書に開示される他方は、VL鎖配列から生じるペプチドのこの「クラス」の基礎を形成するペプチドを含む。
【0076】
該mAb2のVH領域は、下記のDNAおよびコード化ペプチド配列を有する(ヌクレオチド配列は配列番号59であり、アミノ酸配列は配列番号60である。3個のCDR領域には下線が引かれて、標識されている)。
【0077】
【表2】

【0078】
該mAb2のVL領域は、下記のDNAおよびコード化ペプチド配列を有する(ヌクレオチド配列は配列番号61であり、アミノ酸配列は配列番号62である。3個のCDR領域には下線が引かれて、標識されている)。
【0079】
【表3】

【0080】
少なくとも1個のCDR領域をコードするV領域DNA配列またはその断片は、それ自体が抗Id免疫原であり、本発明によりGLXAと反応する抗抗Id抗体を誘導するDNAワクチンとして使用され得る。これらのDNA免疫原は、該DNA分子によりコードされるペプチド/ポリペプチドに対して免疫を誘導するために、当分野において既知の製剤、用量、および経路により投与される。好ましくは、DNA免疫原は、レシピエント、好ましくは、ヒトの細胞および組織において発現される発現ベクターである。したがって、DNA免疫原は、好ましくは、それらが発現されるべき種について好ましいコドンを利用し、最適な発現のための必須のプロモーター、エンハンサーなどを含む。
【0081】
同定された最初のペプチドは、VH CDR1、2および3 (各々、配列番号8、9および10)ならびにVL CDR1、2および3 (各々、配列番号12、13および14)の配列である(表1を参照のこと)。これらは、IMGT/V-QUEST (132)を用いて同定された。アミノ酸配列は、コードヌクレオチド配列から推定された。これらの6個の中で、VH CDR1 (Pep8と呼ばれる)およびVH CDR3ペプチド(Pep10と呼ばれる)が最初に選択され、合成された。
【0082】
また、mAb2のVL-ペプチドは、本発明の範囲内に含まれる。これらのペプチド配列は本明細書において提示されていないが、それらはまた、mAb2抗原結合領域が微量抗原(本明細書におけるGLXA)の分子模倣体として作用する(114)様式のために、GLXAを模倣する関連するエピトープを示す。mAb1は、mAb2 Ag結合部位(それは、VHおよびVLの両方のCDR1-3を含む)に特異的に結合する。
【0083】
表1: 免疫原性ペプチドの最初の群
【表4】

* 最初の試験は、Pep4、Pep7、Pep8およびPep10を用いて行われた(太字で示されている)。アンカー残基には下線が引かれている(下記を参照)。
# ペプチドカテゴリーが議論され、上記で定義されている。
【0084】
微量抗原、抗原に対する抗体、抗Id抗体および抗抗Id抗体の間のこの構造的関係は、当分野において既知であり、Niels Jerneにより最初に開発され、その後他者により発展させられたイディオタイプネットワーク概念の基礎となるものである。例えば、Westen-Schnurr, I., ed., Idiotypes: Antigens on the Inside: Workshop at the Basel Institute for Immunology, November 1981, Editiones Roche, Basel, 1982; Kohler, H, (ed) Idiotypy in Biology and Medicine, Academic Press, New York, 1984; Shoenfeld, Y et al.(eds) Idiotypes in Medicine: Autoimmunity, Infection and Cancer, Elsevier Science; 1st Ed., 1997; Jerne, NK, Ann. Immunol. 125C:373-389 (1974); Jerne, NK, Harvey Lectures 70:93-110 (1976); Jerne, NK EMBO J. 1:243-247, 1982; Jerne, NK , Immunol Rev 79:5-24 1984; Bona, C and Hiernaux. J. et al., Immune-Response - Idiotype Anti-Idiotype Network, CRC Crit. Rev. Immunol., 2:33-81 (1981); Schreiber, H., Adv. Canc. Res. 41:291-321 (1984); ); Augustin AA et al.,. Surv Immunol Res. 1983;2:78-87 Kohler H et al., Proc Soc Exp Biol Med. 1985; 178:189-95; Kieber-Emmons T et al., Int Rev Immunol. 1986; 1:1-26; Kennedy, RC et al., Scientific Amer. 255:48-56, 1986;; Kennedy RC et al., J Clin Invest. 1987;80:1217-24; Ertl HC and Bona CA, Vaccine. 1988 Apr;6:80-4; Bhattacharya-Chatterjee M and Kohler H, Adv Exp Med Biol. 1989;251:113-27: Raychaudhuri S, et al., Crit Rev Oncol Hematol. 1989; 9:109-24; Koehler H et al., Methods Enzymol. 1989;178:3-35; Kieber-Emmons T et al., Int Rev Immunol. 1987; 2:339-56; Nisonoff A., J Immunol. 1991;147:2429-38; Bhattacharya-Chatterjee M et al., Int Rev Immunol. 1991;7:289-302; Greenspan NS and Bona CA, Idiotypes: structure and immunogenicity. FASEB J. 1993, 7:437-44. Bona CA, Proc Soc Exp Biol Med. 1996:213:32-42を参照のこと。
【0085】
表1で示される好ましいペプチドは、カテゴリー1またはカテゴリー2ペプチドであるものとして示される。
【0086】
既知のアミノ酸配列を有するカテゴリー1(mAb1により認識され、GLXAを模倣する)の配列相同性についての広域Blastサーチは、本質的に関連しない相同性を示した。したがって、これらのペプチドは、新規であると考えられる。これと同じ方法および手段により開発される他のペプチドは、同様に評価される。
【0087】
予期されるとおり、mAb2に基づくCDR配列は、他のIgG H鎖またはscFv断片配列と相同である。しかしながら、本発明のペプチドは、特定かつ新規なものであると考えられ、それらは、明確に、免疫血清による免疫染色に基づいてクラミジアに特異的な免疫応答を誘導する。
【0088】
MHCアンカー残基について試験するために、プログラムPREDBALB/C (133)が用いられた。表1におけるすべてのペプチドは、抗原提示のために重要であり得る2個の推定上のアンカー残基を含む。
【0089】
本発明の免疫原は、記載されたさまざまな形態および製剤での、本明細書に開示された2個またはそれ以上のペプチドもしくは変異型の混合物を含む。
【0090】
アミノ酸置換変異型
上記のすべてのアミノ酸は、それらがDアミノ酸であることについての特別な言及がなければ、Lアミノ酸である。本発明は、1個またはそれ以上のLアミノ酸がそのD異性体で置換されている態様を含むことが理解されるべきである。
【0091】
本発明のペプチドの好ましい変異型は、ペプチド配列中の多くの特定の残基、好ましくは約4より多くの残基、より好ましくは3より多くの残基、より好ましくは2より多くの残基、または1より多くの残基が異なる残基で保存的に置換されたものである。タンパク質化学および構造の詳細な記載については、Schulz, GE et al., Principles of Protein Structure, Springer-Verlag, New York, 1979, and Creighton, TE, Proteins: Structure and Molecular Principles, W.H. Freeman & Co., San Francisco, 1984を参照のこと(該文献は、引用により本明細書の一部とする)。
【0092】
保存的置換は、下記の群のうちの1つの中で交換を含むものである:
1. 小脂肪族、非極性もしくはわずかな極性残基: 例えば、Ala、Ser、Thr、Gly;
2. 極性、負荷電残基およびそれらのアミド: 例えば、Asp、Asn、Glu、Gln;
3. 極性、正荷電残基: 例えば、His、Arg、Lys;
4. 大脂肪族、非極性残基: Met、Leu、Ile、Val (Cys); および
5. 大芳香族残基: Phe、Tyr、Trp。
Tyr (第5群中)は、その水素結合の可能性のために、Ser、Thrなど(1群)といくつかの関連を有する。そのまれな幾何学のために、Proは、その鎖を強固に拘束する。
【0093】
したがって、配列番号1-14のいずれかにおける下記の置換が存在し得る:
【表5】

【0094】
特に一般に見られるアミノ酸(また、有用な置換基を提供する)は、β-アラニン(β-Ala)および他のω-アミノ酸、例えば、3-アミノプロピオン酸、2,3-ジアミノプロピオン酸(Dpr)、4-アミノブチル酸など; α-アミノイソブチル酸(Aib); ε-アミノヘキサン酸(Aha); δ-アミノバレリアン酸(Ava); N-メチルグリシンまたはサルコシン(MeGly); オルニチン(Orn); シトルリン(Cit); t-ブチルアラニン(t-BuA); t-ブチルグリシン(t-BuG); N-メチルイソロイシン(MeIle); フェニルグリシン(Phg); シクロヘキシルアラニン(Cha); ノルロイシン(Nle); ナフチルアラニン(Nal); 4-クロロフェニルアラニン(Phe(4-Cl)); 2-フルオロフェニルアラニン(Phe(2-F)); 3-フルオロフェニルアラニン(Phe(3-F)); 4-フルオロフェニルアラニン(Phe(4-F)); ペニシラミン(Pen); 1,2,3,4-テトラヒドロイソキノリン-3-カルボン酸(Tic); β-2-チエニルアラニン(Thi); メチオニンスルホキシド(MSO); ホモアルギニン(hArg); N-アセチルリシン(AcLys); 2,4-ジアミノブチル酸(Dbu); 2,4-ジアミノブチル酸(Dab); p-アミノフェニルアラニン(Phe(pNH.sub.2)); N-メチルバリン(MeVal); ホモシステイン(hCys)、ホモフェニルアラニン(hPhe)およびホモセリン(hSer); ヒドロキシプロリン(Hyp)、ホモプロリン(hPro)、N-メチル化アミノ酸(例えば、N-置換グリシン)を含むが、これらに限定されない。
【0095】
アミノ酸およびペプチドの共有結合的修飾
ペプチドの共有結合的修飾が含まれ、ペプチドの標的アミノ酸残基を、選択される側鎖もしくは末端残基と反応することが可能な有機誘導体化剤と反応させることにより導入され得る。
【0096】
システイニル残基は、最も一般には、α-ハロアセテート(および相当するアミン)と反応し、カルボキシメチルもしくはカルボキシアミドメチル誘導体を生じる。システイニル残基はまた、ブロモトリフルオロアセトン、α-ブロモ-β-(5-イミドゾリル)プロピオン酸、クロロアセチルリン酸、N-アルキルマレイミド、3-ニトロ-2-ピリジルジスルフィド、メチル 2-ピリジルジスルフィド、p-クロロメルクリ安息香酸、2-クロロメルクリ-4-ニトロフェノール、またはクロロ-7-ニトロベンゾ-2-オキサ-1,3-ジアゾールとの反応により誘導体化される。
【0097】
ヒスチジル残基は、相対的にヒスチジル側鎖に特異的な薬剤であるジエチルプロカーボネートとの反応(pH 5.5-7.0)により誘導体化される。p-ブロモフェナシルブロミドがまた有用であり、該反応は、好ましくは、pH 6.0での0.1 M カコジル酸ナトリウム中で行われる。
【0098】
リシニルおよびアミノ末端残基は、コハク酸または他のカルボン酸無水物と反応する。これらの薬剤を用いた誘導体化は、リシニル残基の荷電を逆にする。α-アミノ含有残基を誘導体化するための他の適当な試薬は、イミドエステル、例えば、メチルピコリンイミデート; ピリドキサールリン酸; ピリドキサル; クロロボロハイドライド; トリニトロベンゼンスルホン酸; O-メチルイソウレア; 2,4ペンタンジオン; およびグリオキシル酸とのトランスアミナーゼ触媒反応を含む。
【0099】
アルギニル残基は、フェニルグリオキサール、2,3-ブタンジオン、1,2-シクロヘキサンジオンおよびニンヒドリンを含む1個またはいくつかの慣用的な試薬を用いた反応により修飾される。該誘導体化は、グアニジン官能基の高pKaのために、反応がアルカリ条件下で行われることを必要とする。さらに、これらの試薬は、リシンの基およびアルギニンα-アミノ基と反応し得る。
【0100】
チロシル残基の修飾は、スペクトル標識のペプチドへの導入を可能にした。これは、芳香族ジアゾニウム化合物またはテトラニトロメタンとの反応により達成される。最も一般的には、N-アセチルイミジソール(imidizol)およびテトラニトロメタンの各々が、O-アセチルチロシル種および3-ニトロ誘導体を製造するために使用される。
【0101】
カルボキシル側鎖基(アスパルチルまたはグルタミル)は、カルボジイミド(R'-N-C-N-R')、例えば、1-シクロヘキシル-3-(2-モルフォリニル-(4-エチル)カルボジイミドもしくは1-エチル-3-(4-アゾニア-4,4-ジメチルペンチル)カルボジイミドと反応することにより選択的に修飾される。
【0102】
アスパルチルおよびグルタミル残基は、アンモニウムイオンとの反応によりアスパラギニルおよびグルタミニル残基に変換される。逆に、グルタミニルおよびアスパラギニル残基は、対応するグルタミルおよびアスパルチル残基に脱アミド化され得る。脱アミド化は、穏やかな酸性条件下で行われ得る。これらの残基のいずれかの形態は、本発明の範囲内である。
【0103】
二機能性試薬を用いた誘導体化は、ペプチドを不水溶性担体マトリクスまたは他の高分子担体と架橋させるために有用である。通常使用される架橋剤は、1,1-ビス(ジアゾアセチル)-2-フェニルエタン、グルタルアルデヒド、N-ヒドロキシスクシンイミドエステル、4-アジドサリチル酸とのエステル、同種二機能性(homobifunctional)イミドエステル(ジスクシンイミジルエステル、例えば、3,3'-ジチオビス(スクシンイミジルプロピオネート)を含む)、および二機能性マレイミド、例えば、ビス-N-マレイミド-1,8-オクタンを含む。
【0104】
メチル-3-[(p-アジドフェニル)ジチオ]プロピオイミデートのような誘導体化剤は、光の存在下で架橋を形成することが可能な光活性化中間体を産生する。あるいは、不水溶性マトリクス、例えば、臭化シアン活性化糖質、ならびに米国特許第3,969,287号; 第3,691,016号; 第4,195,128号; 第4,247,642号; 第4,229,537号; および第4,330,440号に記載された反応基質がタンパク質固定化のために使用される。
【0105】
他の化学修飾は、プロリンおよびリシンの水酸化、セリルもしくはスレオニル残基のヒドロキシル基のリン酸化、リシン、アルギニンおよびヒスチジン側鎖のα-アミノ基のメチル化(上記のCreighton)、N末端アミンのアセチル化、およびある場合においてC末端カルボキシルのアミド化を含む。
【0106】
そのような化学的に修飾および誘導体化された部分は、ペプチドの溶解性、吸収、生物学的半減期などを改善し得る。これらの変化は、インビボにおけるタンパク質の望まれない副作用を除去するか、もしくは減少させ得る。そのような効果を仲介することが可能な部分は、例えば、Gennaro, AR, Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins Publishers; 21st Ed, 2005 (すなわち、最新版)に開示されている。
【0107】
合成ペプチド複合体の作製
1つの態様において、合成ペプチドは、免疫原を製剤化するために使用される。合成ペプチドは、固相化学合成により商業的に生産され得る。それらは、下記の表2および3で示されるペプチドような環状ペプチドを含む。
【0108】
2個の異なる環状化方法が使用され得る。(a) 2個の付加されたCys残基間のジスルフィド結合(または、末端CysがPep9において存在する場合には、反対側の末端における単一のCysで十分であり得る)。下記の表2において、付加された末端Cys残基には下線が引かれている。
【0109】
表2: 環状ペプチドの直線配列(C-C結合*)
【表6】

* 元のペプチドに付加されたCys (C)残基には下線が引かれている。
【0110】
(b) 上記の末端Cys残基の部分に導入され得るGluおよびLysの側鎖の共有化学結合(それは、N末端GluとC末端LysまたはN末端LysとC末端Gluにより結合されるペプチドを生じる)。付加された末端KおよびE残基には、下記の表3において下線が引かれている。
【0111】
表3: 環状ペプチドの直線配列(K-EまたはE-K結合*)
【表7】

* 元のペプチドに付加されたGlu (E)またはLys (K)残基には下線が引かれている。
【0112】
隣接するGluおよびLys残基側鎖による環状化は、NもしくはC末端Cysがマレイミド部分により架橋されるためのチオールドナーとして機能するために導入され得るという点で、付加された利点を有する。
【0113】
合成ペプチドは、モノマー、またはペプチドの免疫原性の発現を促進するか、もしくは可能にする任意の適当な「担体」分子と結合したものとして作製され得る(下記を参照のこと)。
【0114】
1つの態様において、合成ペプチドは、分枝ポリ-LysまたはLysデンドリマー(4、8および16残基)に結合され得る。
【0115】
合成ペプチドは、好ましくは、例えばHPLCにより少なくとも80%の純度まで精製される。
【0116】
ペプチドは、(a) mAb1 (抗クラミジアGLXA)に効率的に結合する、および/または(b) GLXAまたは非修飾ペプチド(例えば、Pep1-Pep11のいずれか)に対するその特異性により特徴づけられる抗体応答を誘導するするそれらの能力について調べられる。(b)において産生される抗体は、クラミジア感染細胞への結合または生物学的活性、例えば、クラミジア中和もしくは微生物に対する特異的応答の誘導、例えば、ペプチド免疫化マウスまたは他の哺乳動物から得られたTおよび/またはB細胞によるサイトカイン放出について試験され得るが、再び、これは、ELISAにより最も効率的に実施され得る。
【0117】
ペプチドはまた、既知の方法を用いてファージ上に提示され得る。ファージ上に提示されたペプチドについて、ファージは、ペプチドをその長さに沿って固定した「スカホールド」として機能する。この例示は、免疫原性活性のために極めて有効である。あるいは、合成ペプチドは、N末端マルトース結合タンパク質(MBP)融合物として効率的に発現される。
【0118】
Ab1のための特定のペプチド(すなわち、抗原)の親和性は、さらなる架橋剤を必要とすることなく、複合体が免疫原として投与されるために十分であり得る。
【0119】
架橋はタンパク質を変性させ得るが、にもかかわらず、架橋剤は、ワクチンにおいて使用される免疫原を安定化させるか、もしくは病原体を不活化するために使用される。したがって、架橋剤の使用は、本発明の免疫原と適合するものである。架橋された免疫原は、通常の方法を用いて、架橋複合体と一連の定義されたmAbの結合を試験することにより評価される。
【0120】
マルチマーペプチドおよび融合タンパク質(ポリタンパク質)
本発明はまた、本発明の免疫原性GLXA模倣ペプチドまたはその置換もしくは付加変異型、またはその化学的誘導体の配列が、介在スペーサーまたはリンカーの有無で2から約100回繰り返されたより長いペプチドまたはポリペプチドを含む。そのような分子は、当分野において、マルチマー、コンカテマーまたはマルチエピトープポリタンパク質と交換可能に呼ばれ、本明細書において主にペプチドマルチマーとして記載されている。それらが組み換え的に産生されると、また融合ポリペプチドまたは融合タンパク質であると考えられる。
【0121】
この節において「P」として記号化されたペプチドのマルチマーは、式(P Xm )n P(式中、m= 0または1であり、n = 1-100である)により示される。Xは、例えば1-20 Gly残基からなるスペーサー基、切断可能リンカーを含む他の既知のスペーサー/リンカー(下記を参照のこと)または化学的架橋剤である。したがって、m=0であるとき、スペーサーは、ペプチドに付加されていない。n=1であるとき、マルチマーは、ダイマーなどである。
【0122】
これらのマルチマーは、本明細書に記載された本発明の免疫原性ペプチドまたは変異型のいずれかから構築され得る。さらに、ペプチドマルチマーは、ペプチドモノマー(天然配列またはその変異型から)の異なる組み合わせを含み得る。したがって、マルチマーは、最初のペプチドの数回の連続した繰り返し、次いで、第2ペプチドなどの1回またはそれ以上の繰り返しを含み得る。そのようなマルチマーペプチドは、個々のペプチドの化学合成、組み換えDNA技術または組み合わせ、例えば、組み換え的に産生されたマルチマーの化学的結合により作製され得る。
【0123】
化学合成により産生される場合には、マルチマーは、コアペプチド配列の2-12リピート、より好ましくは2-8リピートを有し、マルチマー中の全アミノ酸数は、約110残基(または、リンカーまたはスペーサーを含む場合にはそれらの同等体)を超えないはずである。
【0124】
好ましい合成化学ペプチドマルチマーは、式P1n(式中、P1は、本発明の免疫原性ペプチド(または該ペプチドの置換もしくは付加変異型)であり、n=2-8である)を有し、ここで、単独もしくはマルチマー型でのペプチドは、望まれる免疫反応性を有する。
【0125】
他の好ましい態様において、好ましい合成化学ペプチドマルチマーは、式(P1-Xm )n P2(式中、P1およびP2は、免疫原性ペプチドまたはこれらのペプチドの付加変異型であり、(a) P1およびP2は、同じであるか、または異なるものであり得て; さらに、マルチマー中に各々生じるP1は、その隣接するものとは異なるペプチド(または、変異型)であり; (b) Xは、4個までの酸素原子を含むC1-C5アルキル、C1-C5アルケニル、C1-C5アルキニル、C1-C5ポリエステルであり、m = 0または1であり、そしてn = 1-7であり; Xはまた、Glyzであってもよく、z = 1-6である)を有し、ここで、単独もしくはマルチマー型でのペプチドは、抗GLXA抗体(Ab1)、好ましくは、HB11300により産生されたmAbと反応する免疫学的活性を有する。
【0126】
組み換え的に産生される場合において、スペーサーは、上記のGlyz (式中、z=1-6である)であり、マルチマーは、発現系により可能な多くのコアペプチド配列のリピート、例えば、2〜約100リピートを有し得る。好ましい組み換え的に産生されるペプチドマルチマーは、式P1 Glyz )n P2(式中、(a) P1およびP2は、明細書において記載された免疫原性のGLXA模倣ペプチド、またはこれらのペプチドの置換もしくは付加変異型であり、P1およびP2は、同じであるか、または異なるものであり得て; さらに、マルチマー中に各々生じるP1は、その隣接するものとは異なるペプチド(または、変異型)であり、n = 1-100であり、z = 0-6であり; そして(b) 単独もしくはマルチマー型でのペプチドは、望まれる免疫反応性を有する)を有する。
【0127】
上記のペプチドマルチマーにおいて、P1およびP2は、好ましくは、Pep1-Pep14 (すなわち、配列番号1から配列番号14)のうちのいずれか1個から選択される。マルチマーは、所望により、そのNもしくはC末端でキャップされる。
【0128】
該マルチマーは、本明細書に記載されたペプチドまたは変異型のいずれかから構築され得ることが理解される。マルチマーのさらなる変異型モノマーユニットが上記の生物学的活性を有すること好ましいが、これは、それらがその一部であるマルチマーが活性を有するかぎりにおいて必要ではない。
【0129】
本発明は、末端間で直接、もしくはモノマーリピート間のリンカー配列により結合した上記ペプチドモノマーの2個またはそれ以上のリピートの直鎖マルチマーを含み得る融合ポリペプチドを含み、それはさらに、本発明による本発明の免疫原性ペプチドの活性を高めることを可能にする他のポリペプチド配列と融合し得る。一般的な例は、ペプチドと免疫原性ポリペプチドの複合体であり、特に、強力なヘルパーT細胞活性を誘導するものである。これらの多くは、当分野において既知である。
【0130】
したがって、本発明のマルチマーおよび融合ポリペプチドは、2個以上のGLXA様エピトープを含み得て、免疫原性組成物は、各々が1個またはそれ以上の本発明のペプチドを含む該マルチマーまたは融合タンパク質の混合物を含み得る。
【0131】
また、タンデムに(「並んで」)結合した上記ペプチドの2個または3個のリピートを含む「タンデム」オリゴマーペプチドが本発明に包含される。
【0132】
ペプチドおよびマルチマーはさらに化学的に結合され得て、より複雑なマルチマーおよびより大きな凝集体を形成し得る。好ましい複合体マルチマーは、Cysを含み、これらの残基の-SH基間のジスルフィド結合を形成することにより産生され、その結果、分岐鎖および直鎖ペプチドもしくはポリペプチドを生じる。
【0133】
上記のスペーサー/リンカーに加えて、またはその代替物として、本発明のマルチマーおよび融合ポリペプチドは、酵素、好ましくは、マトリクスメタロプロテアーゼ、ウロキナーゼ、カテプシン、プラスミンまたはトロンビンにより切断可能なリンカーを含み得る。これらは、例えば、配列VPRGSD (配列番号63)またはDDKDWH (配列番号64)のペプチドリンカーであるが、それに限定されるものではない。マルチマー中のペプチドの免疫原性能力を妨害しない限り、当分野において既知である任意の切断可能もしくは非切断可能リンカーが使用され得る。
【0134】
本発明のペプチドは、上記のマルチマーおよび融合ポリペプチドの形態のいずれか、または単一ペプチドまたは他のタンパク質、例えば、免疫原性もしくはワクチン組成物として用いられた場合にそれらの免疫原性を高め得る担体分子もしくは他のタンパク質と融合した該ペプチドの混合物の1個またはそれ以上のリピートを含むことが当分野において既知のマルチマーおよび融合ポリペプチドの形態のいずれかで組み合わせることができる。
【0135】
アジュバント、免疫刺激剤およびペプチド免疫原製剤
本ペプチド免疫原の免疫原性は、外因性アジュバント、免疫刺激剤、デポ材料などの存在下で促進される。したがって、本明細書に記載されたペプチドまたはペプチド複合体に加えて、本発明の免疫原性組成物は、好ましくは、1個またはそれ以上のアジュバントもしくは免疫刺激剤を含む。ペプチド免疫原と関連して下記されているものの多くはまた、DNA免疫原、例えば、mAb2 V領域鎖の関連する部分、ドメイン、またはそのより短い配列をコードするDNAにおいて適用可能であることが当分野において既知であり、それは、本発明の別の態様である。
【0136】
免疫原としてのペプチドの有効性に付加され得るアジュバントまたは薬剤は、例えば、水酸化アルミニウム、リン酸アルミニウム、硫酸アルミニウムカリウム(alum)、硫酸ベリリウム、シリカ、カオリン、カーボン、油中水型乳剤、水中油型乳剤、ムラミールジペプチド、細菌エンドトキシン、リピドX、細菌Propionobacterium acnesまたはBordetella pertussisの全個体もしくは細胞内画分、ポリリボヌクレオチド、アルギン酸ナトリウム、ラノリン、リソレシチン、ビタミンA、サポニンおよびサポニン誘導体(例えば、QS21(登録商標))、リポソーム、レバミゾール、DEAE-デキストラン、妨害コポリマーもしくは他の合成アジュバント、またはCpGオリゴヌクレオチドを含む。他のアジュバントは、ISAF-1 (0.4mgのthreonyl-muramyl dipeptideを含有するリン酸緩衝液中の5%スクアレン、2.5%プルロニックL121、0.2% Tween 80)である(Kwak, LW et al., 1992, N. Engl. J. Med., 327: 1209-1238)。そのようなアジュバントは、さまざまな起源から市販で入手可能であり、例えば、Merck Adjuvant 65 (Merck and Company, Inc., Rahway, NJ)またはフロイント不完全アジュバントおよび完全アジュバント(Difco Laboratories, Detroit, MI)、Amphigen(登録商標) (水中油型)、Alhydrogel(登録商標) (水酸化アルミニウム)、またはAmphigen(登録商標)およびAlhydrogel(登録商標)の混合物である。アルミニウムは、ヒト使用のために承認されている。ワクチン材料は、ビーズ、例えば、ラテックスもしくは金ビーズ、ISCOMなどに吸着するか、もしくは結合され得る。ワクチンを製造する一般的な方法は、上記のGennaro, Remington's Pharmaceutical Sciencesに記載されている。
【0137】
アジュバントは、好ましくは、1個またはそれ以上の(a) Ribiアジュバント; (b) 0.4 mg トレオニル-ムラミルジペプチドを含むリン酸緩衝液中のISAF-1 (5% スクアレン、2.5% プルロニックL121、0.2% Tween 80); (c) Amphigen(登録商標); (d) Alhydrogel; (e) Amphigen(登録商標)とAlhydrogel(登録商標)の混合物;(f) QS21(登録商標); または(g) モノホスホリルリピドAアジュバントである。好ましいアジュバントは、モノホスホリルリピドAである。
【0138】
リポソームは医薬組成物であり、ここで、活性なペプチドまたはタンパク質は、分散して含まれるか、または脂質層に接着した水性同心円層からなる微粒子でさまざまに存在する。活性ペプチドは、好ましくは、水性層および脂質層に、内側もしくは外側に、またはとにかくリポソーム懸濁液として一般に知られている非均一系で存在する。親油性層、すなわち脂質層は、一般に(常にではない)、レシチンおよびスフィンゴミエリンのようなホスホリピド、コレステロールのようなステロイド、ジセチルホスフェート、ステアリルアミンもしくはホスファチジン酸のような事実上のイオン性界面活性物質、および/または親油性の性質を有する他の材料を含む。リポソームを含むアジュバントは、下記の文献において議論されており、該文献は、引用により本明細書の一部とする: Gregoriades, G. et al., Immunological Adjuvants and Vaccines, Plenum Press, New York, 1989; Michalek, S.M. et al., 1989, Curr. Top. Microbiol. Immunol. 146:51-8。
【0139】
ワクチン設計、特に制御放出系のさらなる議論は、Powell, M.F. et al. (eds), Vaccine Design: The Subunit and Adjuvant Approach, Powell, M.F. et al. (eds), Plenum Press, New York, 1995, p 389-412において見出され得る。制御放出系は、薬物およびホルモンを送達するための「デポ」として、ヒトにおいてすでに使用されている(Langer, R., 1990, Science 249: 1527-1533)。そのような系は、それらが継続して、または決められた速度での間隔パルス(spaced pulses)で、制御された量の免疫原を送達するように設計され得て(Cohen et al., 1991, Pharm. Res. 8:713 720; Eldridge et al., 1991a, Mol. Immunol. 28:287 294; Gander et al. 1993, in: Proc. Int'l Symp . Control. Rel. Bioact. Mater., Controlled Release Society, Washington, DC, pp. 65 66)、同時に、未送達の抗原性材料のインビボにおける急速な分解から保護するので、免疫付与においてかなりの影響を与え得る。
【0140】
'
制御放出マイクロスフィアを含むマイクロスフィアは、経口免疫のためのかなりの可能性を有する(Edelman et al., 1993, Vaccine 11:155 158; Eldridge et al., 1990, J. Control. Rel. 11:205 214; McQueen et al., 1993, Vaccine 11:201 206; Moldoveanu et al., 1989,, Curr Top. Microbiol. Immunol. 146:91 99; O'Hagan et al., 1993b, Vaccine 11: 149 154; Reid et al. 1993, Vaccine 11:159 167 Panyam J and Labhasetwar V (2003) Adv Drug Deliv Rev 55:329-47; およびPanyam J and Labhasetwar V (2004) Mol Pharm. 1:77-84, 2004)。ポリマー制御放出系の潜在的な他の利点は、下記を含む: 減少したコストを生じるより少ない投与量の必要性; 抗原の抗原提示細胞またはリンパ系への局在もしくは標的化送達; 1回の投与で2個以上のペプチドまたはいくつかのエピトープに対して個体を免疫化し得る製剤の設計を促進する、封入化され得る2個以上の抗原; および改善された患者コンプライアンス。さらに、制御放出系は、最適なワクチン接種のために必要とされる免疫原投与の数を1回までに減少させ得る。
【0141】
マイクロスフィアは、下記の2つの理由のために制御放出免疫原担体として特に研究されている: (1) 直径が10 μmよりも大きな粒子は、投与部位において、持続される高レベルの抗体免疫応答のために必要とされ得る抗原の長期持続を提供することができ、および(2) 1-10 μmのサイズ範囲におけるマイクロ粒子は、マクロファージに容易に取り込まれ(Eldridge et al., 1989, Adv. Exp. Med. Biol. 251:192202; Tabata et al., 1988, Biomaterials 9:356 362; J. Biomed Mater Res. 22:837 858)、その結果、抗原の抗原提示細胞への直接的な細胞内送達を生じる。
【0142】
マクロファージによりマイクロスフィア食作用は、一般に疎水性表面を有するマイクロスフィアが親水性表面を有するものよりも容易に取り込まれるので、表面特性を変えることにより増大させることができる(Tabata et al., 1988, Biomaterials 9:356 362; Tabata et al., 1990, Crit. Rev. Ther Drug Carrier Syst. 7:121 148)。
【0143】
免疫原送達のためにポリマーマイクロスフィアを用いることの利点は、抗原が放出される投与後の時間を制御する能力である。この能力により、投与後の決められた時間に、複数の免疫原の「パルス」または免疫原を放出する単回投与製剤の製造が可能となる(Gilley et al., 1992, In: Proc. Int'l. Symp. Control. Rel. Bioact. Mater, Controlled Release Society, Orlando, pp. 110 111)。ポリマーマイクロスフィアからの抗原放出動態は、ポリマー組成物および分子量、免疫原とポリマーの重量比(すなわち、免疫原搭載)、ならびにマイクロスフィアサイズ(Hanes et al., In: Reproductive Immunology, 1995, R. Bronson et al., eds, Blackwell. Oxford)のような変数の単純な操作により、かなりの程度まで制御され得る。
【0144】
より小さい(1-10 μm)およびより大きい(20-50 μm)マイクロスフィアの組み合わせを含む製剤は、専ら1つの範囲または他の範囲の直径を有するマイクロスフィアに封入された免疫原の投与と比較してより強くかつ長期にわたり持続する応答を産生し得る(Eldridge et al., 1991a, Mol. Immunol. 28:287 294; and Keegan et al.) (42)。1つの試験において、破傷風トキソイド(TT)含有マイクロスフィアが、慣用的なワクチン接種計画を模倣するために、投与後最初の数日の間、次いで、各々1および3ヶ月後の2回の「追加免疫」後に放出される強力な抗原刺激用量を産生するように調製された(上記のGander et al.)。
【0145】
上記したmAb2 (ハイブリドーマHB11301の生成物)、ひいては本発明のペプチドのマイクロ封入は、特に、経口または粘膜免疫付与を達成するために有用である。本発明者等により観察されたそのような製剤の1つの利点は、樹状細胞(DC)成熟の誘導であった。したがって、この調製物を用いた未成熟骨髄由来単核細胞のパルス化(pulsing)は、それらの成熟DC表現型に影響を与えた。細胞は、5-7日間、GM-CSFと共にインキュベートされた後に、マイクロスフィア中の1.2または12 μg/mlのmAb2で24時間パルスされた。細胞は、DCマーカーCD11cおよび成熟DCマーカーCD86で染色された。二重陽性DCの割合は、非パルス細胞またはLPSで刺激された細胞と比較して、マイクロスフィアパルス化で増加した。UV不活化クラミジアEBは、DC成熟マーカーについて同様の効果を有し、粒子抗原がDCについてのこの効果を有するという理解と一致する。
【0146】
ワクチンのマイクロ封入のために最も広く使用されるポリマーは、乳酸およびグリコール酸に基づくポリエステルであった。これらのポリマーは、いくつかの利点を有し、それは、それらのインビトロおよびインビボ分解速度についての広範なデータ(Lewis, 1990, In: Biodegradable Polymers as Drug Delivery Systems (Chasin and Langer, eds.), Dekker, New York, pp. 1 41; Tice and Tabibi, 1992, In: Treatise on Controlled Drug Delivery (A. Kydonieus, ed.), Dekker, New York, pp. 315 39)、および外科縫合のようなヒトにおける多くの臨床適用についてのFDAによる承認(Gilding et al., 1979, Polymer 20:1459 1464; Schneider, 1972, U.S. 3,636,956)、および酢酸ロイプロリドについての30日間のマイクロスフィアに基づく制御送達系(Lupron Depot) (Okada et al., 1991, Pharm. Res. 8:787 791; 上記のKeegan et al.; 上記のPanyam et al.)を含む。
【0147】
ラクチド/グリコリドポリエステルについてのいくつかの代替物は、アジュバント特性を有する特定の分子に分解される生分解性ポリマーを含み、特に、より弱い免疫原性抗原の担体として有用であり得る。L-チロシン誘導体(Wheeler et al, 1982, Int. Arch. Allergy Appl. Immunol. 69:113 119; Wheeler et al., 1984, Int. Arch. Allergy Appl. Immunol. 75:294 299)の既知のアジュバント性のために、ジチロシン誘導体に基づくポリマーがLangerおよび同僚等により合成され(Kohn et al., 1986, Biomaterials 7:176 82)、モデル抗原としてウシ血清アルブミンBSAを用いて試験された(Kohn et al., 1986, J. Immunol. Methods 95:31 38)。生分解性ポリ(CTTHイミノカーボネート)が、その主な分解産物N-ベンジルオキシカルボニル-L-チロシル-L-チロシンヘキシルエステル(CTTH)が完全フロイント(CFA)およびムラミルジペプチド(MDP)と同じくらいのアジュバントとして有力であることが見出されたために選択された。
【0148】
マクロファージにより取り込まれる固有の性質(Tabata et al., 1986, J. Bioact. Compat. Polym. 1:32 46)ならびに医薬および医療適用における広範囲の使用のために、ゼラチンは、ワクチンのマイクロ封入のための有用なポリマーである(Tabata et al., 1993, in: Proc. Int. Symp. Control. Rel. Bioact. Mater, Controlled Release Society, Washington, DC, pp. 392 393)。ゼラチンマイクロスフィアはまた、免疫刺激剤、例えば、MDPおよびインターフェロン-αを封入するために使用されている(Tabata et al., 1987, J Pharm Pharmacol. 39:698 704; 1989, Pharm. Res. 6:422-7)。マイクロスフィア封入MDPは、約2000倍低い濃度で、遊離MDPよりもずっと短い時間でマクロファージを活性化する。MDPおよびワクチン含有ゼラチンマイクロスフィアの組み合わせは、極めて有力なワクチン製剤を産生し得る。
【0149】
リポソームは、その多くはマクロファージおよび高密度リポタンパク質による素早い分解のために、しばしばインビボにおいて不安定であり(Schreier et al., 1987, J. Control. Rel. 5:187 92)、したがって、皮下または筋肉内に投与されると、短時間の抗原補給(depot)効果のみを提供する(Eppstein et al., 1985, Proc Natl Acad Sci USA 82:3688 92; Weiner et al., 1985, J. Pharm. Sci. 74:922 5)。リポソームのインビボ半減期を延長させる1つの方法(Cohen et al., 1991, Proc Natl Acad Sci USA 88:10440 44)は、免疫原含有リポソームをマイクロスフィアに封入するアルギン酸塩ポリマーの使用であり、それにより、インビボにおける素早い分解からそれらを保護する。アルギン酸塩NPは、本発明者等のうちの1人により、容易に感染細胞に導入されることが示され、本明細書において意図される他の製剤である。拍動性の免疫原放出動態を提供することができる酵素学的に活性なマイクロスフィア封入リポソーム(MEL)がまた製造されている(Kibat et al., 1990, FASEB J. 4:2533 39)。MELはまた、経口/粘膜投与のための担体として増大した安定性を示すことが予期される。
【0150】
さまざまな放出様式および持続性を可能にする免疫原搭載マイクロスフィアを製造するために、さまざまな方法が使用され得る。一般に最適な方法は、適当なサイズのマイクロスフィアを製造する方法の能力と組み合わされた、製造条件と抗原および使用されるポリマー賦形剤との相対的な適合性(例えば、最も少ない免疫原性の欠損を生じる方法)により決定される。
【0151】
溶媒蒸発技術は、調製の相対的な容易さ、大規模化の容易さ、および高封入効率が達成され得るために一般的である。有機溶媒に感受性のある免疫原について特に重要なのは、複数のエマルジョン技術であり得る(上記のCohen et al., 1991, Pharm. Res.)。スプレー乾燥およびフィルム被覆(film casing)技術がまた、単一のポリマーマイクロスフィアを製造するために使用されている。
【0152】
本発明者および同僚等は、PLGA NPがキトサンコアシェル粒子に封入され得ることを示した。ペプチドがNPまたはCS粒子に搭載される場合に、肺により免疫するための経肺送達が使用され得る。
【0153】
マイクロカプセルは、薄いポリマー膜により囲まれた免疫原搭載コアからなり、そのために、しばしば「貯留(reservoir)」系と呼ばれる。
【0154】
デバイス開発の間の担体および免疫原の安定性、貯蔵、およびインビボ補給は、関心のある事項である。ポリペプチド抗原は、免疫原性に重要な不安定な三次元構造を有し得る。この3D構造は、抗原が変性もしくは凝集しやすいものである場合には、傷つけられるか、または失われ得る。制御放出装置の製造における有機溶媒への曝露、湿気への曝露について凍結乾燥後の再水和、またはポリマー賦形剤または他の化学薬品との複雑な化学的相互作用は、ペプチド/タンパク質に基づくワクチンの免疫原性の欠損もしくは減少を生じ得る。下記の文献には、複合体抗原の安定性について記載されている: Arakawa et al., 1993, Adv. Drug Deliv. Rev. 10: 1 28; Liu et al., 1991, Biotechnol. Bioeng. 37:177 184; Volin and Klibanov, 1989, In: Protein Function: A Practical Approach (T. E. Creighton, ed.). IRL Press, Oxford, pp. 1 24。
【0155】
ペプチド搭載ポリラクチド(PLA)またはPLGAマイクロおよび/またはナノ粒子の製造における1つの好ましい方法は、下記のとおりである。選択されたペプチドを搭載した生分解性PLAまたはPLGAナノ粒子(NP)は、以前にLiおよび同僚等により記載されたもの(139)と同様の手順で、二重エマルジョン溶媒蒸発技術の修飾版を用いて製造される。この方法は、ペプチドの生物学的活性を維持するのに十分に穏やかであることが証明されており、高い搭載効率を生じる。簡潔には、ペプチドの水性溶液が、PLGAを含むジクロロメタンで乳化され(超音波ホモジナイザーを用いて)、その結果、最初の油中水型(w/o)エマルジョンが形成される。次いで、製造されたw/oエマルジョンが、安定化剤としてポリビニルアルコール(PVA)を含む第2の水性層で乳化され、その結果、複数のw/o/wエマルジョンが生じる。その後、2倍のエマルジョンを多量のPVAの水性溶液に加え、数時間撹拌し、有機溶媒を蒸発させる。次いで、生じたナノ粒子を遠心分離により回収し、数時間洗浄し(PVAを除去する)、その後、凍結乾燥し、残りの水を除去する(139,140)。粉末は、使用まで−80℃で維持される。ペプチドおよびポリマーの濃度は、マウスあたり約10 μgペプチド/mlの経口送達について、1-10 μg/mgポリマーのペプチド濃度を達成するように変えられる。NPは、マウスへの投与または培養細胞への添加前にフィルター滅菌される。エンドトキシンがクラミジアの生存を大幅に減少させるので、汚染を回避するあらゆる努力が望ましい。保護免疫付与のための最適なペプチド搭載濃度は、経験的に、例えば、経口的に送達されるペプチド-NPを皮下で送達される遊離ペプチドと比較することにより決定される。注意が払われるべきパラメーターは、溶媒および安定化剤の型を含む形態(サイズおよびサイズ分布)、搭載効率および放出プロファイルに影響を与えるものであり、投入エネルギーおよびw/o比率は、最初の実験で調べられるであろう(134, 135)。直径50-200 nmのNPが粘膜摂取のために最も有効であると考えられる(136, 137)。
【0156】
免疫付与前に、ペプチド-NPの各々の新規調製物は、好ましくは、4-5個体のマウスのSC免疫付与により、保存された免疫原性について試験される。血液は、ELISAによる試験のために、各免疫付与/追加免疫の前に回収される。既知のポジティブおよびネガティブコントロールは、関連するELISAに含まれる。
【0157】
ポリマーマイクロスフィア製剤の利点は、多くのポリマーが、乾燥が保たれる場合には、長期間室温で安定であることである。例えば、ラクチド/グリコリドポリエステルは、乾燥が保たれ、約40℃以下である場合には、安定であることが報告されている(Aguado et al., 1992, Immunobiology 184:113 25)。さらに、ワクチンは、マイクロスフィア製剤中で、乾燥状態で保存され得て、これは、何人かの患者が湿度誘導凝集を受けやすいことを考慮すると、重要な利点である(上記のLiu et al.)。
【0158】
組成物は、好ましくは、(1) 有効量の免疫原または免疫原性複合体、(2) 適当な量の担体分子、または所望により担体ビヒクル、ならびに所望により(3) 保存剤、緩衝液などを含む。製剤の記載は、Voller, A. et al., New Trends and Developments in Vaccines, University Park Press, Baltimore, MD, 1978において見出される。
【0159】
1つの態様において、免疫原性組成物は、1個またはそれ以上のサイトカイン、例えば、IL-2、GM-CSF、IL-4などを含む。インターフェロン誘導性タンパク質10およびMCP-3のような炎症性サイトカインが付加され得る(Biragyn A et al., 1999, Nature Biotechnol. 17:253-8)。一般に、炎症性応答を誘導もしくは促進し、抗原提示細胞(APC)を集め、ポリペプチド抗原のケモカイン受容体仲介摂取のためにAPCの標的化を促進する任意のサイトカインまたはケモカインが、本発明の製剤において有用であると考えられる。
【0160】
免疫を誘導するすべての免疫原性組成物と同様に、本発明の免疫学的に有効な量のポリペプチド複合体は、経験的に決定されるに違いない。本発明のペプチドの免疫原性を含む考慮されるべき因子は、アジュバントもしくは担体タンパク質もしくは他の担体とさらなる複合体を生じるか否か、またはそれらと共有的に結合するか否か、ならびに投与経路および投与されるべき免疫投与の回数である。そのような因子は、ワクチン分野において既知であり、過度の負担なくそのような決定を行うことは免疫学者の能力の範囲内である。
【0161】
ペプチド免疫原とアジュバントの比率は、両者が有効量で存在するかぎりにおいて、広範囲で変わり得る。例えば、水酸化アルミニウムは、混合物の約0.5%の量で存在し得る(A12O3を基礎として)。
【0162】
製剤後、組成物は滅菌容器に入れられ、密閉され、低温、例えば、4℃または−20℃または−80℃で保存され得る。あるいは、材料は、凍結乾燥され得て、それは、安定化形態での長期間の貯蔵を可能にする。
【0163】
医薬製剤は、医薬化学の慣用的な技術に基づいて製造される。医薬組成物はまた、少量の非毒性補助物質、例えば、湿潤もしくは乳化剤、pH緩衝剤などを含み得る。ペプチド/複合体は、注射による投与のために慣用的な薬学的に許容される非経口ビヒクルを用いて製剤化される。これらのビヒクルは、非毒性および治療的であり、多くの製剤がGennaro (上記のRemington's Pharmaceutical Sciences)において説明されている。賦形剤は、例えば、水、生理食塩水、リンガー液、デキストロース溶液およびハンクス平衡塩溶液であるが、これらに限定されない。本発明による製剤はまた、少量の添加剤、例えば、等張性、生理学的pHおよび安定性を維持する物質を含み得る。さらに、適当な油性注射用懸濁液としての活性化合物の懸濁液が投与され得る。適当な親油性溶媒またはビヒクルは、脂肪油、例えば、ゴマ油、または合成脂肪酸エステル、例えば、オレイン酸エチルもしくはトリグリセリドを含む。水性注射懸濁液は、懸濁液の粘性を増大させる物質を含み得る。所望により、懸濁液は、安定化剤を含み得る。
【0164】
本発明のペプチドおよび他の有用な組成物は、好ましくは、約1.0 ng/ml〜100 mg/mlの濃度で、好ましくは、凝集体および他のタンパク質材料を実質的に含まない精製型で製剤化される。
【0165】
免疫原性担体としてのウイルス、バクテリオファージまたは細菌
さらなるバリエーションにおいて、本発明の免疫原性ペプチドまたは複合体は、免疫原性組成物の一部としてウイルスまたは細菌により提示され得る。免疫原性ペプチドをコードする核酸は、ウイルスまたは細菌のゲノムもしくはエピソームに組み込まれる。所望により、核酸は、免疫原性ペプチドが、分泌型タンパク質として、またはウイルスの外部表面タンパク質もしくは細菌の膜貫通タンパク質との融合タンパク質として発現されるような方法で組み込まれる(後者の場合には、その結果としてペプチドが提示される)。該方法で使用されるウイルスまたは細菌は、非病原性であるか、または弱毒化されているべきである。適当なウイルスは、アデノウイルス、HSV、ベネズエラウマ脳炎ウイルスおよび他のアルファウイルス、水疱性口内炎ウイルスおよび他のラブドウイルス、ワクシニアおよび鶏痘ウイルスを含む。適当な細菌は、SalmonellaおよびShigellaを含む。
【0166】
ファージ表面と融合した免疫原性エピトープを含むもののような短いペプチドの提示はまた、有用な免疫原として使用される。糸状バクテリオファージは、さまざまな生物学的系における上記ペプチドの発現および提示のための優れたビヒクルである(Willis, EA et al., 1993, Gene 128:79-83; Meola, A. et al., 1995, J. Immunol. 154: 3162-72: Bastein, N et al., 1997, Virology 234:118-22)。糸状ファージの投与は、任意の毒性効果の証拠なしに、試験されたすべての動物においてファージタンパク質に対する強力な免疫応答を誘導する。ファージタンパク質pIIIおよびpVIIIは、ファージディスプレイのためにしばしば使用されるタンパク質である。さらに、組み換え糸状ファージは、例えば抗原としての使用のために、特定のペプチドの起源を産生するために使用される。化学合成を超えたこの方法の重要な利点は、得られる産物が翻訳機構の生物学的な忠実度の結果であり、ペプチドの固相合成において共通する70-94%の純度レベルに影響されないという事実である。ファージは、追加の材料が細菌培養の増殖により産生され得る場合に、容易に再生可能なペプチドの起源を提供する。したがって、遺伝学的に改変された糸状ファージは、アジュバントの使用を必要とすることなく、抗体産生のためのペプチドおよび免疫原性担体を得るための手段として機能する。また、Frenkel, D et al., 2000, Proc Natl Acad Sci USA 97:11455-59を参照のこと。
【0167】
ファージにより提示されるペプチドを用いた免疫付与は、一般に、1010から1012ファージ粒子/注射を必要とする。Yip, YL et al., 2001, Immunol Lett 79:197-202に記載されたような方法が使用され得る。この方法は、マウスの腹腔内免疫付与のために1012ファージ/100μlを使用し、同様のファージ量がウサギの免疫付与のために適当である。
【0168】
E. coli細胞におけるファージの産生は、一般に、0.5-1.0リットルの培養培地あたり1013ファージである。したがって、意図されるパイロット試験のための十分な量のファージにより提示されたm2ペプチドの産生は容易である。gp120BaLは、市販で入手可能であり、gp120もしくはgp160発現ベクターおよびBaL株分子のワクシニア発現ベクターは、容易に利用可能である。
【0169】
ペプチドは、糸状ファージにおけるpIIIタンパク質(ファージあたり5個のコピー数)またはpVIIIタンパク質(ファージあたり2700個のコピー数)上で提示され得る(上記のYip et al.)。fth1発現系は、キメラファージにおけるpVIIIタンパク質上でペプチドを提示し、ここで、組み換えpVIIIタンパク質は、大半の野生型pVIIIタンパク質に組み込まれ、それによりモザイクファージを産生する。
【0170】
Pep1-Pep11、より特には、Pep4、7、8および/または10により本明細書において例示されたペプチドまたはペプチド複合体の調製物は、(a) Ab1 (抗GLXA抗体)、または(b) 1個またはそれ以上の抗抗Id (mAb2の免疫付与により作製されたAb3抗体)、または(c) 培養クラミジア個体に対して試験される。
【0171】
所望により、さまざまな架橋剤が探索され、インビボでのペプチド免疫原の免疫原性を妨害することなく、結合され架橋されたペプチド免疫原の構造/抗原性を維持する適合した架橋剤が見出されることを保証し得る。このために、ペプチド結合調製物は、トリス緩衝液、リン酸緩衝液、または任意の他の標準的な適合する緩衝液で製造され、氷上で一晩、さまざまな同種二機能性および異種二機能性架橋剤と反応させられる。本発明のさまざまなペプチドは、架橋剤のための潜在的な官能性R基を有する種々の数のAspまたはArg残基を含む。豊富な量の遊離カルボキシル基は、カルボジイミドに基づく架橋剤の使用を可能にするであろう。また、Arg残基は、それ自身をp-アジドフェニルグリオキサールモノハイドレート(APG; Pierce Biotechnology Inc)のような架橋剤に結びつける(lend)。
【0172】
有用なバクテリオファージの他の例は、Fuse 5およびf88、ならびに例えば8-20個のアミノ酸のペプチドに基づくファージペプチドライブラリーである。
【0173】
109個のファージ粒子を含むライブラリーサンプルが、3回のバイオパニングおよび増幅にかけられる。例えば、Frenkel, D et al., 1999, J. Neuroimmunol. 95:136-42を参照のこと。選択されたファージは、ELISAアッセイにより抗ファージ抗体に結合するそれらの能力について試験される。マイクロプレートのウェルは、二次抗体調製物、例えば、ウサギ抗ファージ抗血清の適当な希釈物で覆われ、4℃で一晩インキュベートされる。陽性ファージクローンを増殖させ、挿入領域におけるそれらのDNAの塩基配列が決定される。
【0174】
タンパク質VIIIの融合物としての最適なペプチドを提示する組み換えファージが選択され、免疫付与のために大量生産される。例えば、適当なE. coli株または突然変異遺体のコロニーの、2-mlの一晩培養物が、例えばテトラサイクリンを含む2YT培地中において37℃で増殖される。この前培養のアリコートは、2 mM イソプロピル-D-チオガラクトシドを含む1リットルの2YT/tetを副次培養するために使用される。37℃で16 hのインキュベーション後、培養物は、7,500×gで30分間遠心分離され、感染ファージを含む上清が、ポリエチレングリコール-8000および濃縮NaClを含む0.15当量の溶液の添加により4℃で2 h沈殿される。遠心分離後、ファージペレットはPBSに再懸濁され、再び細菌汚染物質除去のために遠心分離され、上清が再沈殿され、PBSに再懸濁され、ファージ濃度が分光学的に概算される(269 nmでの1 ODユニットは、1011ファージ/mlを示す)。
【0175】
ファージ製剤は、好ましくは、免疫付与前にUVにより不活化される。例えば、Galfre, G et al., 1997, Vaccine 15:1276-85を参照のこと。
【0176】
樹枝状ポリマー/デンドリマー
この態様は、複数のエピトープを有する複数の抗原ペプチドが、相当する等しい量の一価エピトープで免疫付与した後の応答と比較して優れた免疫応答を誘導するという当分野における知見に基づくものである。
【0177】
本発明は、複数抗原ペプチド系において本発明のペプチドの複数のコピーを有する抗原性産物を広く包含することが意図される。
【0178】
本発明の樹枝状ポリマーは、抗原/エピトープがコア分子から放射状に伸びた分枝と共有的に結合している樹枝状ポリマーに基づく本発明による抗原性産物である。これらの樹枝状ポリマーは、通常のポリマーと比較して、分子量の単位あたりでのより高い濃度の官能基により特徴づけられる。一般的に、それらは、少なくとも2個の官能基を有するコア分子から生じる2個またはそれ以上の同一の分枝に基づく。そのようなポリマーは、Denkewalter et al. (米国特許第4,289,872号)およびTomalia et al. (米国特許第4,599,400号および第4,507,466号)に記載されている。このクラスの他のポリマーは、米国特許第4,515,920号に記載されている。また、Solomon (米国特許出願公開2005/0053575)を参照のこと。
【0179】
該ポリマーは、それらの構造がコア主要部およびいくつかの枝を有するツリーとして象徴され得るために、しばしば、樹枝状ポリマーと呼ばれる。しかしながら、ツリーとは異なり、樹枝状ポリマーにおける分枝は、実質的に同一である。
【0180】
この樹枝状系は、「複数抗原ペプチド系」(MAPS)と呼ばれ、それは、抗原/抗原担体の組み合わせについて通常使用される名称であり、該組み合わせは、少なくとも二機能性/二官能性である主要ユニットからなる樹枝状コアに結合した通常は同一である2個またはそれ以上の抗原性分子からなる。分枝中の各二機能性ユニットは、付加される成長のための基盤を提供する。
【0181】
複数抗原ペプチド系の樹枝状コアは、リシン分子から構成され得る。例えば、リシンは、そのアミノ基の各々を介したペプチド結合により2個のさらなるリシンに結合する。この第二代の分子は、4個の遊離アミノ基を有しており、その各々は、さらなるリシンに共有的に結合し、8個の遊離アミノ基を有する第三代の分子を形成し得る。ペプチドは、これらの遊離基の各々に結合され、8価の複数ペプチド抗原(MAP)を形成し得る。該過程は繰り返され、第四またはそれ以上の世代の分子を形成し得る。各々の世代と共に、遊離アミノ基の数は、幾何学的に増加し、2n(式中、nは、世代の数である)により示され得る。あるいは、4個の遊離アミノ基を有する第二代の分子は、コアと共有的に結合した4個のペプチドを有する四価MAPを形成するために使用され得る。例えばアミノ酸AspおよびGlu(その各々は、2個のカルボキシル基および1個のアミノ基を有し、2nの遊離カルボキシル基を有するポリ-Aspまたはポリ-Gluを産生する)を含む多くの他の分子は、MAPSの樹枝状コアを形成するために使用され得る。
【0182】
「樹枝状ポリマー」または「デンドリマー」なる用語は、時折、本明細書において本発明の産物を定義するものとして使用される。該用語は、ポリマーと見なされるのに十分に大きな担体分子およびわずか3個のモノマーを含み得る担体分子を含む。
【0183】
樹枝状ポリマーを合成するための化学は既知であり、利用可能である。反応するべきではない官能基を妨害し、次いで官能基が反応することが望まれるときに該妨害する基を除去するための化学は、アミノ酸と共に、多くの特許および科学文献において詳述されている。樹枝状ポリマーおよび全MAPは、Merrifield合成において樹脂上で産生され、次いで該ポリマーから除去され得る。Tomalia (上記)は、コア分子としてアンモニアまたはエチレンジアミンを利用した。この手順において、コア分子は、Michael付加によりアクリレートエステルと反応し、エステル基は、加水分解により除去される。生じた第一代の分子は、アンモニアの場合には3個の遊離カルボキシル基およびエチレンジアミンが使用された場合には4個の遊離カルボキシル基を含む。Tomaliaおよび同僚等(下記を参照)は、樹枝状ポリマーをエチレンジアミン、次いで、他のアクリルエステルモノマーで伸長させ、望まれる分子量が得られるまで配列を繰り返した。樹枝状ポリマーの各分枝が、多くの選択される手順のいずれかにより伸長され得ることが当業者には容易に理解される。例えば、各分枝は、Lys分子を用いた複数の反応により伸長され得る。
【0184】
Erickson (上記)は、古典的なMerrifield技術を利用し、ここで、実質的に任意の望まれる分子量のポリペプチドは、固相樹脂支持体から成長する。該技術が樹枝状ポリマーの製造のために利用されるとき、ポリマーを樹脂支持体に結合させる架橋分子は、三機能性である。官能基のうちの1つは、樹脂への結合に関与し、他の2つの官能基は、ポリマーの成長のための出発点として機能する。該ポリマーは、望まれる分子量が得られると、レジンから除去される。1つの標準的な切断手順は、液体フッ化水素を用いた0℃で1時間の処理である。他のより満足の行く手順は、Tam et al., 1983, J Amer Chem Soc 105:6442に記載されたとおり、フッ化水素とジメチルスルフィドの複合体(HF:DMF)を利用し、副反応およびペプチドの損失を最小化することである。
【0185】
1つの例において、Denkewalter et al. (上記)は、コア分子としてLysを利用した。コア分子のアミノ基は、ウレタン基への変換により妨害される。カルボキシル基は、ベンズヒドリルアミンとの反応により妨害される。ウレタンの加水分解は、樹枝状ポリマーの成長のための出発点として機能する2個の遊離アミノ基を有するリシンのベンズヒドリルアミンを産生する。
【0186】
樹枝状ポリマーを製造するために利用可能な3つの手順についてのこの簡潔な考察は、当業者がこれらの一般的な教示から離れるのに十分であるはずであり、当業者にポリマーの顕著な特徴、例えば、少ない分子の量での多量の利用可能な官能基の提供を教示する。結果は、エピトープ/抗原をそれらの利用可能な官能基に加えることにより少量中の高濃度のエピトープが達成され得ることを示す。生じた産物は、相対的に少ない担体上での高い比率のエピトープを含む(抗原:担体の比率は、極めて高い)。これは、ワクチンを製剤化するために使用される他の慣用的な産物とは対照的であり、該産物は一般に多量の担体上に少量の抗原を含む。
【0187】
免疫原性担体としての樹枝状ポリマーの他の重要な特徴は、正確な構造が知られており、「抗原性」汚染物質、または組織を刺激するか、もしくは望まれない反応を引き起こす汚染物質が存在しないことである。ペプチドの正確な濃度が知られており、該ペプチドは担体上に対称に分布しており、該担体は1個より多くのペプチドまたは複合体のための基盤として利用され得て、その結果、多価免疫原またはワクチンが産生され得る。例えば、Parag-Kolhe, P et al., 2006, Biomaterials 27:660-9を参照のこと。
【0188】
MAPSがワクチンまたは免疫原性組成物を作製するために使用される場合、デンドリマーのコア分子は、天然に生じるアミノ酸、例えば、Lysであり、その結果、それは適当に代謝され得ることが好ましい。しかしながら、非天然アミノ酸は、α-アミノ酸でなかったとしても使用され得る。コア分子の構築において使用されるアミノ酸は、D型またはL型であり得る。
【0189】
樹枝状ポリマーの化学および医薬使用についてのより詳細な説明は、Tomalia DA et al., 2007, Biochem Soc Trans. 35:61-7; Braun CS et al., 2005, J Pharm Sci. 94:423-36; Svenson S et al., 2005, Adv Drug Deliv Rev. 57:2106-29ならびに米国特許第4,289,872号; 第4,558,120号; 第4,376,861号; 第4,568,737号; 第4,507,466号; 第4,587,329号; 第4,515,920号; 第4,599,400号; 第4,517,122号; および第4,600,535号において見出され得る。
【0190】
レジン結合樹枝状ポリマーは、本発明の実施において使用され得る。そのような製剤は、多くの供給者(例えば、Advanced Chem Tech, Inc. Louisville, KY)から商業的に入手され得る。ポリマーは、好ましい薬剤としてHF:DMSを用いて、レジンから切断され得る。樹枝状ポリ-Lysは、もともとベンジルリンカーを介してレジンに付加されたGlyリンカーから構築される。Alaのような他のリンカーが使用されるか、リンカーが除去されるか、またはリンカー分子が利用され得る。
【0191】
ペプチドまたは免疫原のさらなる起源
mAb2は、タバコ植物、例えば、Nicotiana benthamianaの主に葉および任意の植物部分、例えば、根シュート、花もしくは植物細胞において発現され得る(例えば、米国特許第7,084,256号を参照のこと)。同様に、本発明のペプチドは、免疫原としての使用または植物におけるそれらの産生のためにウイルス粒子またはウイルス被覆タンパク質と融合され得る。植物におけるペプチド産生の記載について、例えばワクチン適用において有用なウイルス被覆タンパク質融合物として、例えば、米国特許第7,033,835号、第6,660,500号および第5,977,438号; Smith ML et al., 2006, Virology 348:475-88を参照のこと。ワクチン使用は、米国特許第7,084,256号; McCormick AA et al., 1999, Proc Natl Acad Sci USA, 96:703-8およびMcCormick AA et al., 2008, Proc Natl Acad Sci USA 105:10131-6に記載されている。本発明のペプチドを含む植物産生免疫原は、上記したとおり、VLPまたはマイクロスフィアへの封入により製剤化され得る。植物ワクチンのさらなる議論については、Thanavala Y et al., 2006, Expert Rev Vaccines 5:249-60を参照のこと。
【0192】
免疫付与の用量および経路
本発明の処置を必要とする対象、好ましくはヒトを処置するための好ましい有効量は、約100mg/kg体重までの活性化合物の量である。ペプチドまたはペプチド複合体もしくは複合体の一般的な単回投与量は、約1μg〜約100mg/kg体重、好ましくは、約10μg〜約50 mg/kg体重である。約0.1mg〜約7gの範囲内の1日全投与量が、筋肉内(I.M.)またはSC投与のために好ましい。
【0193】
しかしながら、個々の処置レジメンにおける変数が大きいので、上記の範囲は示唆的なものであり、これらの好ましい値からのかなりの逸脱が予測される。当分野における当業者に明らかなとおり、免疫原性組成物の投与量は、感染を処置する(すなわち、ウイルスの拡散を限定する)ために使用される化合物の用量よりも高いものであり得る。有効量および有効な投与頻度は、意図される使用により決定され、過度の実験なしに当業者により確立され得る。各処置のために必要とされる全用量は、複数回または単回で投与され得る。ペプチド複合体は、単独で、または疾患もしくは状態の処置のための他の治療薬と組み合わせて投与され得る。
【0194】
塩基性基を含む本発明の特定の化合物の薬学的に許容される酸付加塩は、所望により、当分野において既知の方法を用いて、強いまたはやや強い、非毒性の有機もしくは非有機酸で形成される。本発明に包含される酸付加塩の例は、マレイン酸塩、フマル酸塩、乳酸塩、シュウ酸塩、メタンスルホン酸塩、エタンスルホン酸塩、ベンゼンスルホン酸塩、酒石酸塩、クエン酸塩、塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩および硝酸塩である。酸性基を含む本発明の化合物の薬学的に許容される塩基付加塩は、有機および無機塩基から既知の方法により製造され、例えば、非毒性アルカリ金属およびアルカリ土類塩基、例えば、水酸化カルシウム、水酸化ナトリウム、水酸化カリウムおよび水酸化アンモニウム; ならびに非毒性有機塩基、例えば、トリエチルアミン、ブチルアミン、ピペラジンおよびトリ(ヒドロキシメチル)メチルアミンを含む。
【0195】
本発明の化合物および薬学的に許容されるその塩は、慣用的な用量形、例えば、カプセル、含浸ウエハース(impregnated wafers)、錠剤、または好ましくは、注射用製剤に組み込まれ得る。固体または液体の薬学的に許容される担体が使用され得る。
【0196】
本発明は、眼、生殖管、肺または心臓のクラミジア感染に対する保護、またはその処置のために有用である。保護され得る他の解剖学的部位/組織は、任意の関節の滑膜組織、中枢神経系、消化管などを含む。クラミジアは、主に粘膜表面(結膜、生殖器、呼吸器)に感染し、新生児では主に粘膜表面で生じる。
【0197】
好ましくは、本発明の化合物は、全身的に、例えば、注射もしくは点滴により投与される。任意の既知の経路、好ましくは、静脈内、皮下、筋肉内または腹腔内により投与され得る。他の許容される経路は、経鼻、皮内、髄腔内(鞘内)などを含む。本発明の最も好ましい経路は、経口および/または粘膜部位への局所投与であり、口、咽頭および消化管、眼/結膜、または生殖管、および肺、ならびに間接的に、心臓、中枢神経系、滑膜組織の局所的な粘膜保護を達成する。
【0198】
C. trachomatis感染のマウスモデル
本発明者等は、2個のマウスモデルを用いて、そこで彼らは、より初期のmAb2ワクチンを用いたワクチン接種の有効性を証明した(26,27)。また米国特許第5,656,271号および第5,840,297号を参照のこと。これらの文献は、その全体を引用により本明細書の一部とする。
【0199】
マウスは、C trachomatisのヒト次亜種(泌尿生殖器感染のためにKもしくはE血清型; 眼感染のためにCもしくはB血清型)を用いてチャレンジされる。
【0200】
4-8個体のマウスの群が、生きた基本小体(EB)でのチャレンジ前に、前処理について「マスク」される。週1回の間隔で少なくとも4週間、膣(または結膜)スワブが単離培養およびEBについての直接蛍光抗体染色のために回収される。
【0201】
例えば、C. trachomatis C血清型(TW-3)基本小体5000 IFU/20 μlが、本発明による免疫原またはコントロール免疫原(例えば、非処理もしくはスクランブルペプチド)で免疫されたレシピエントマウスの各眼に接種される。
【0202】
臨床疾患は、繰り返し感染(毎日、毎週繰り返し、週に1回)で最も顕著であるが、感染性クラミジアの1回投与でさえ、瞼の肥厚(eyelid thickening)および滲出液の形成を誘導した。組織病理学的に、炎症性単核細胞浸潤の強度、杯細胞の欠損、および滲出液の出現は、用量依存的であった。12-14日での平均組織病理学的疾患スコアは、正常な組織についての0 + 0と比較して6.8.+-.0.8であった。
【0203】
インキュベーションの前日、ならびにインキュベーションの7日、10日、14日、21日、28日および35日後に、両方の結膜が採取される。該領域は、下瞼板および円蓋、側円蓋、上瞼板および円蓋、ならびに内側円蓋(medial fornix)を含んでいた。結膜スワブは、即座に回収培地に浸され、ボルテックスにより2分間破壊され、培養まで氷上で維持される。
【0204】
10匹のBALB/cマウスからの結膜スワブで得られた典型的な微生物経時変化は、米国特許第5.656.271号(上記)の図17において示される。
【0205】
下記の実施例5は、これらのモデルにおいて本発明のペプチドを用いた免疫付与の結果を提供する。
【0206】
上記されたとおり、クラミジアによる生殖器感染は、かなりの割合の反応性関節炎症例を発症させやすくし、生存する代謝的に活性な個体がこれらの患者の滑膜に存在する。本発明の免疫原性組成物(ペプチド、ポリペプチドまたはDNA)は、関節炎がクラミジアと関連しているか、またはそれにより引き起こされる場合に、予防もしくは処置を必要とする対象における関節炎を予防もしくは処置するための方法において使用され得る。
【0207】
本明細書において本発明が一般的に記載されているが、下記の実施例を参照することにより、同様のことがより容易に理解される(実施例は、例示の手段により提供されるものであって、特に断りがない限り、本発明を限定することを意図するものではない)。
【実施例】
【0208】
実施例I
GLXAを模倣する両方のカテゴリーのペプチドは、マウスにおいて免疫原性である
完全フロイントアジュバント(CFA)を用いてPep4、7、8および10 (100 pg/投与)でマウスを免疫し(皮下投与(SC)による)、次いで、不完全フロイントアジュバント(IFA)を用いて2回の追加免疫を行った。さらなる群のマウスは、Pep4およびPep7が該群のより強い免疫原であることが疑われているので、これらの組み合わせを投与された。ポジティブコントロール群は、アジュバント中の可溶性mAb2を投与された。ネガティブコントロール群は、希釈物(アジュバント中のリン酸緩衝生理食塩水/PBS)を投与された。この方法はまた、ペプチド免疫原の別の製剤、例えば、ナノ粒子のための最初のポジティブコントロールとして利用される。
【0209】
免疫および2回の追加免疫前に、血液を回収した。ELISAにより血清を試験した。本明細書の実施例において使用されるELISA法を下記する(パラメーターおよび条件のすべてではないがその多くが、当分野において完全に慣用的である方法において変更されるか、もしくは修飾され得る)。
1. 96ウェルプレート(Immulon HBX4)を50μlの希釈抗原(炭酸緩衝液で調製された1μg/ウェルでのペプチド)で覆い、4℃で一晩インキュベートした。
2. さらなる洗浄を行うことなく、プレートの内容物を軽くはじいてシンクに流すことにより、非結合抗原を除去した。
3. 300μL/ウェルの4%BSA/PBS-Tween 20 (0.05%)を加えることにより、非特異的結合を妨害もしくは阻止した。これは、室温で2時間インキュベートすることにより行われた。
4. プレートをPBS-Tween 20 (0.05%)で1回洗浄し、50μlの一次抗体を適当な希釈で各ウェルに加えた。血清を用いる場合、出発希釈は、1:40であり、さらに1:80、1:160、および1:320(または所望によりそれ以上)まで倍々希釈を行った。プレートを37℃で1時間インキュベートした。
5. プレートを上記のPBS-Tween (0.05%)で3回洗浄し、100μlの二次抗体を適当な希釈で各ウェルに加えた。アルカリホスファターゼ共役ヤギ抗マウスIgG-APのために、1:500の希釈物をここで用いた。プレートを37℃で1時間インキュベートした。
6. プレートを再び上記のとおり3回洗浄し、アルカリホスファターゼについての200μlの基質溶液(p-ニトロフェニルリン酸またはpNPP)を5mg/mlの濃度で加えた。発色反応を、自動マイクロプレートリーダーを用いて405 mmの波長で読み取り、吸光度(または光学密度)を記録した(A405またはOD405と呼ばれる)。
【0210】
いくつかの重要な観察が4個のペプチドに対するこれらの試験において行われた: (a) すべての4個のペプチドは、免疫原性であり、すべてのマウス(1匹の非応答マウスを除く)において次の追加免疫で増加した抗ペプチド応答が誘導された(図3)。各群のマウスは、各免疫ペプチドに対する増加した抗体応答を示すことが見出されており、(n)が各群について示されている。また、図16A-16Bを参照のこと。
【0211】
図4は、ペプチド間の交差反応パターンを示す。3個のパネルの各々は、Pep4に対して作製された単一のペプチド(Pep 4、7または8) Abで免疫された対象においてすべての4個のペプチドに対する応答がPep7と交差反応することを示す(逆もまた然り)。これらの両方は、カテゴリー番号1のペプチドである。Pep8に対するAbは、Peps 4、7または10のいずれとも交差反応しなかった。これは、mAb2のCDR1およびCDR3が抗原的に異なるという考えを支持する。
【0212】
実施例II
ペプチド免疫原を用いた免疫付与の保護効果
1つの実験において、免疫不全SCIDマウスに同系mAb2免疫化ドナーマウスからの脾臓細胞を適合移植し、C. trachomatisのK血清型(株)2000 TCID50 (〜107 IFU/30 μlの局所、経膣的)でチャレンジし; マウスは、ヒト次亜種による感染性を高めるために、チャレンジの7および3日前にDepo-Proveraで前処理された。結果を図5に示す。mAb2免疫リンパ球を投与された免疫不全マウスは、細菌の減少した排出から明らかなとおり、感染性チャレンジからかなり保護された。
【0213】
細胞ドナーマウス(初期ワクチン候補(マイクロスフィアでのmAb2)で直接免疫した)由来の血清を、ELISAにより(上記したとおり)本発明のペプチド免疫原を用いた反応性について試験した。これらの結果を図6のパネルB-Eに示す。
【0214】
全mAb2で免疫された動物は、ペプチドに対する劇的な反応性を示し、これは、示された保護および抗GLXA応答と相関していた。C trachomatis感染細胞を用いた抗mAb2血清の反応性をまた図に示している。
【0215】
コントロール、非免疫脾臓細胞を投与されたマウスの感染のみはまた、ペプチドに対する測定可能な抗体応答を誘導したことが注目されるべきである。これは、下記の重要な点を確認している: Ab(全mAb2により誘導され、本発明の示されたペプチド内に存在する)が作製されたエピトープは、インタクトの感染微生物上に存在している。
【0216】
4個のペプチド免疫原(Pep4、7、8および10)に対する反応性について、これらの群のマウス由来の血清をELISAにより試験した(図6)。T細胞を含む(+T)非分画免疫脾臓細胞のレシピエントは、最大の免疫応答を示した。T細胞欠損(-T)脾臓細胞(T細胞は、抗T細胞抗体、例えば、抗Thy-1および補体を用いた処理により除去された)のレシピエントは、通常の細胞のレシピエントと同様の抗ペプチド応答を有していた。予期されたとおり、後者の群は、それが感染されると、クラミジア個体がこれらのエピトープを有しているために、該ペプチドに対するAbを産生した。
【0217】
実施例III
免疫原性ペプチドは、ナノ粒子として投与され得るクラミジア抗原性エピトープの保護型として機能する
全mAb2調製物で免疫された動物からの血清を本発明のペプチドの4個に対するそれらの反応性について試験することにより、ナノ粒子での本発明の免疫原の経口/粘膜送達の実現可能性を確認する試験を行った。マウスを、マイクロ封入mAb2を用いて、2-3週間の間隔で3回免疫し(下記の表を参照のこと)、C trachomatis E 血清型を用いて膣内でチャレンジした(2000 TCID50/30 μl)。週1回の間隔で膣スメアの単離培養または直接蛍光抗体(DFA)染色のために、膣スワブを回収した。実験の最後に、血液および組織を回収した。これらの最終採血由来の血清をペプチドELISAにより試験した。
【0218】
図7および8において結果を示す。図7は、免疫化動物からの細菌の排出を示す(インビトロ培養により検出される)。
【0219】
下記のレジメンを用いて、皮下(SC)もしくは経口(PO)経路、または組み合わせにより、マウスをmAb2マイクロスフィアで直接免疫した(表4; 図において標識されている)。チャレンジの14日後での排出における変動性にもかかわらず、初期mAb2ワクチンの経口のみの送達(P群)は、微生物の膣排出において最も強い効果を示した(図7)。
【0220】
SC経路(K群)または経口経路(P群)により専ら免疫された対象からの血清を、4個のペプチドに対するAbについて、免疫なし、感染ありの対象(M群)および免疫なし、感染なしのコントロール(L群)と比較した(n=4-5/grp)。
【0221】
表4
【表8】

【0222】
図8におけるELISAの結果は、感染のみが抗ペプチド抗体応答を誘導したことを示す(M群、-O-)。マイクロ封入mAb2のSCおよび経口送達の両方が、抗ペプチドAb応答を誘導した。非感染コントロールは、陰性であった。同じ希釈で試験された免疫前血清は、すべて陰性であり、実際に、それらのサンプルの吸光度値は、任意の特定の実験におけるK-P群の値から差し引かれた。
【0223】
マウスがペプチド免疫原自体に曝されず、さらに異なるクラミジア血清型(上記で考察された図5の場合にはK血清型、および図7および8で示される試験においてはE血清型)でチャレンジされたために、これらの観察は重要であった。
【0224】
実施例IV
インサイチュにおいて基本小体(EB)を認識するペプチド誘導クラミジア特異的抗体応答
2回目の追加免疫後、かつ、全個体に曝露される前に得られた血清(実施例IIIに記載された試験から)(ELISAによりペプチドに対して陽性であった)は、C trachomatis感染細胞を認識することが見出された。これは、間接免疫蛍光を用いて示された。同じマウスからの事前の採血は、免疫染色により全体的に陰性であった(データは示していない)。
【0225】
我々は、属特異的クラミジア抗原の2個またはそれ以上のエピトープ/ホモログを示す新規ペプチドを推定した。これらは、ヒトまたは脊椎動物タンパク質、クラミジアタンパク質/抗原に対して明らかな相同性を有していない。
【0226】
C. trachomatisで感染させたHEp2細胞を細胞遠心分離にかけ、顕微鏡スライドにそれらを置いた。固定(MeOH)後、示されたペプチドまたは可溶性mAb2で免疫されたマウスからの血清(1:40希釈)を用いて、それらを染色した。蛍光(FITC標識化)二次Ab、抗マウスIgGを用いて抗体の細胞への結合を検出した。結果を図9A-Fに示す。
【0227】
同じマウスからの事前の採血は、完全に陰性であった(データは示していない)。矢印は、免疫血清の標的における異なる差異を示す。
【0228】
Pep4、Pep7またはその両方(それぞれ、A-C)(その両方は、カテゴリー番号1のペプチドである)で免疫された対象からの血清は、EBおよび代謝的に活性な非感染性網様体(RB)を認識した。
【0229】
mAb2のCDR1およびCDR2における配列に相当するカテゴリー2ペプチドであるPep8および10 (図9Dおよび9E)で免疫された対象からの血清はまた、mAb2免疫血清(F)と同様に、封入体マトリクスおよび膜中の標的を認識する。これらの抗血清の特異性は、ファージ由来mAb1ペプチドとペプチドの2個の群について標的とされる構造に基づくPep 8およびPep 10のmAb2 CDR領域を比較した場合に変動するように思われた(mAb1に由来するPep 4、Pep 7; Pep 8およびPep 10は、各々mAb2重鎖のCDR1およびCDR3を示す)。
【0230】
実施例V
ペプチドを用いて免疫したマウスにおける減少した微生物負荷
上記のマウスモデルを用いて、本発明者等は、4個のペプチド(Pep4、7、8または10)のうちの1個を用いてマウスを免疫した(100 μgの用量で3回投与された)。直接蛍光抗体(DFA)染色の結果を、チャレンジ後7日および14日について要約する(図10-11)。
【0231】
結果は、Pep4、Pep4 + Pep7またはPep8での免疫がDFA染色により測定される細菌排出を減少させたことを示す。ペプチド7での免疫は、DFAスコアを減少させなかったが、Pep4での免疫はまた、DFAスコアを減少させた。対照的に、2個のペプチド(Pep4 & Pep7)の組み合わせは、DFAスコアを著しく減少させた。
【0232】
DFA試験は細菌を検出するが、それらの生存についての情報は提供しない。しかしながら、一般には、減少した排出は、減少した培養物陽性(culture positivity)と相関することが受け入れられる。
【0233】
これらの結果は、Pep4とPep7の混合物が一緒になって、mAb1により認識される保護的抗原性エピトープを有することを示す。本明細書に記載された2個またはそれ以上の免疫原性ペプチドの他の組み合わせが、個々のペプチドと比較して促進された免疫原性および保護を示し得ることは、十分に予期される。
【0234】
封入された全mAb2ワクチンの経口送達を用いてより有効な保護免疫を示す発明者等およびそれらの同僚等の以前の結果に基づいて、本発明者等は、促進された保護免疫を達成するためにマイクロ粒子またはナノ粒子に封入された本発明のペプチドの単独または組合せでの経口/粘膜投与を提供する。
【0235】
実施例VI
PLGAに封入されたペプチド免疫原の解析
上記の二重エマルジョン溶媒蒸発技術(Li and co-workersによる(139))の修飾版を用いて、Pep4をPLGAナノ粒子(NP)に封入した。
【0236】
封入効率は、mg PLGAあたり7.8 μgペプチドの最終濃度で、38.8%であることが見出された。図12は、NPの形態の一例を示す。図13AおよびBは、5mg NPのペプチド放出プロファイルを示す。図13Aは、PBSおよび炭酸緩衝液中のNPの逆相(RP) HPLCにより決定された放出を示す。放出速度は、約3 μg/ml/日であった(また、PLAからの放出について、下記の実施例X、特に図19A-Bを参照のこと)。
【0237】
炭酸緩衝液中のサンプルをまた、ELISAを用いて免疫学的に調べた。図13Bの結果は、Pep4および抗Pep4抗血清を用いた標準曲線に基づいて、約3.8μg/ml/日の放出を示し、それは、HPLCの結果と一致する。
【0238】
これらの結果は、かなりの量の活性免疫原性ペプチドのNP内への封入およびペプチドの制御された放出についての能力を示し、特定の抗体により認識されるインタクト(非変性)状態を維持する。封入効率、放出プロファイルおよび粒子形態は、既知の方法に基づいて製造パラメーターを変えることにより、修飾および改善され得る。
【0239】
実施例VII
抗ペプチド抗血清は、C trachomatisに持続的に感染した細胞と反応する
インビトロにおいて急性感染細胞を染色することが上記で示された血清を、持続的感染細胞(ペニシリンG (PenG)により誘導された)との反応性について試験した。4ウェルチャンバースライドでサンプル中の活性を調べて、ここで、PenGは、t0 (接種の1時間後)または18時間後(t18)で加えられた。細胞を感染の48時間後に固定した。各血清サンプルを、t0およびt18で、スライド上のPenG処理細胞およびPenG非処理コントロール細胞について試験した。
【0240】
Pep4、Pep7、Pep4 + Pep7、Pep8またはPep10で免疫されたすべての処理群からの血清を3回の別々の実験で試験した。感染McCoy細胞(異種二倍体マウス線維芽細胞; 148)におけるPep4、Pep7、Pep4 + Pep7についての結果を図14A-Fに示す。図14A-Cは、t0における細胞を示し、図14D-Fは、t18における平行処理群を示す。図14D-Fにおける挿入図は、同じ実験からの代表的な「コントロール」感染細胞(PenGなし)を示す。本明細書において記載されたものと同様の結果がヒト上皮細胞(HEp20)で得られた。t0 PenGでの3個の大きな異常RB (aRB)とt18 PenGでの複数のaRBを含むより大きな封入体に注目して下さい。
【0241】
これらの結果は、これらのペプチドが持続的な感染細胞を認識する抗体応答を誘導することを示し、それは、本発明のペプチド免疫原を用いた持続的感染の処置についての根拠である。これは、クラミジアに対するそのように強力な属にわたる保護免疫の誘導を可能にするそのような応答を誘導する抗クラミジア免疫原(ワクチン候補)の最初の例であると考えられる。
【0242】
実施例VIII
報告された生殖器クラミジア感染を有する患者からの血清は、抗ペプチド抗体を有する
抗ペプチド免疫とヒト感染との関連を調べるために、既知の生殖管クラミジア感染を有する患者からのコードされた(「脱同定化された(de-identified)」)ヒト血清およびクラミジア多型膜タンパク質(Pmp)に対する抗体(例えば、Grimwood, J et al., 2001, Infect. Immunity 69:2383-9)を、抗ヒトIgG検出試薬を用いて、Pep4、Pep7、Pep8およびPep10ならびにコントロール「非関連」ペプチドに対してELISAにより試験した。蛍光色素(FITCまたはAlexa色素488)と結合した抗ヒトIgGがヒト血清反応性を検出するために使用されること以外は上記と同じ方法を用いて、免疫組織化学(IHC)により、C. trachomatis感染(48 hr) HEp2細胞に結合(および染色)するそれらの能力について血清を試験した。結果を表5に示す。
【0243】
関連しないペプチドに対する応答は、一様に陰性であった(データは示していない)。非感染細胞は、染色されなかった。クラミジアに対する増大した曝露と共に、上記の2群において示されたとおり、ペプチド(およびPmps)に対する血清反応性は増加した。未報告の(Undocumented)または持続的な感染は、1群および3群の患者の血清における抗ペプチド反応性を説明し得る。
【0244】
クラミジアに曝露された患者からの血清における抗ペプチドELISAの陽性、Pmp反応性および感染細胞の染色(IHC)の関連は、抗クラミジア免疫に対する本発明のペプチドの重要性ならびに抗クラミジア免疫原としてのおよびワクチンにおける該ペプチドの利用の重要性を示す。
【0245】
表5
【表9】

IHC: 免疫組織化学; +は、かすかな染色を示し、++は、中間の染色を示し、
+++は、明るい染色を示す。
【0246】
実施例IX
ペプチド免疫化対象の巨視的な解剖学的観察
免疫された雌マウスの生殖領域における組織の検査は、ペプチド免疫が炎症を減少させたことを示す。
【0247】
チャレンジの28日後に生殖管を解剖し、炎症性変化を記録する(その後、組織学的解析のために取り出される)。結果を図15に示す。左側のパネルは、アジュバントのみを投与されたコントロール動物における、極めて紫色の子宮角(卵巣を見ることは困難である)の強い炎症を示す。ペプチドで免疫した動物のいずれもがそのような強い炎症を示さなかった。ペプチド4および7のレシピエントについての例示をそれぞれ中央および右側のパネルに示す。黄色の矢印は、子宮角を示す(それはさらに、破線で区切られる)。ペプチド免疫原がチャレンジの数週間後においてさえ生殖管の巨視的な病理を減少させたことは明らかである。これは、コントロールマウスがペプチド4もしくは7の代わりに無関係のペプチドを投与された2回目の実験で再び生じた。他の内容から当分野において既知であることに基づいて、組織病理学的結果は、これらの巨視的な解剖学的観察と一致することが予期される。
【0248】
実施例X
遊離ペプチドとマイクロ封入ペプチドを用いた免疫付与
遊離の場合と、PLAマイクロ粒子(MP)でのマイクロ封入形態の場合とで、本発明のペプチドを用いた免疫付与の効果を評価および比較するためにさらなる試験を行った。結果を図17、18A-18Fおよび19A-19Bに示す。図17は結果を示し、一方で、図18A-18Fは、感染(チャレンジ)マウスにおけるDFA結果を示す。さまざまな用量の遊離Pep4または封入化(Pep4-MP)型を用いて、皮下投与により動物を免疫した。
【0249】
マウスは、示されたペプチド抗原または可溶性mAb2ポリペプチドを用いて、下記の計画に基づいて皮下で3回免疫されているか(最初、14日目での1回目の追加免疫、28日目での2回目の追加免疫)、または感染されているが、免役されていないコントロール動物であった(図18A-Fと関連)。遊離Pep4ペプチドを40μgの用量で試験し、Pep4-MPを10、20および40μgの用量で試験した。各免疫付与前および実験の最後(+28日)に血液を回収した。各群における対象の数(n)を図17に示す。
【0250】
免疫付与および採血計画:
【表10】

【0251】
図18は、上記のとおり得られた膣スワブのDFA染色の結果を示す。このアッセイは、膣スミアに存在する生物を検出する。統計学的に有意な差異を表6に示す(ここで、スチューデントt検定を用いて、pは、<0.05またはそれ以下である)。この表に現れていない結果(変数は、免疫後の日数、抗原の用量もしくは形態などである)は、それらのコントロールと統計学的に異なっていなかった。
【0252】
表6: 膣スワブにおけるクラミジア負荷のDFA検出での有意差(図18参照)
【表11】

Pep4-MP = PLAマイクロ粒子中のPep4; Sol. mAb2 = 可溶性mAb2; P値は、コントロールと比較してスチューデントt検定を用いて得られた。
【0253】
マイクロ粒子で送達されたPep4は、用量依存的な方法で感染膣チャレンジ後の細菌負荷をかなり減少させることがこれらの試験から結論づけられた。この結果は、より強い免疫応答と相関しており(ELISAにより示される)、抗Pep4抗体応答はまた、抗原がマイクロ粒子で送達された場合にかなり強かった。したがって、保護的な効果は、より強い免疫の結果である。ELISAの結果は、遊離Pep4 (40 μgの用量)での免疫が、等量または低い用量での封入化Pep4での免疫ほどの免疫原性を有さないことを示した。
【0254】
好ましい態様において、2個またはそれ以上の本発明のペプチドの封入化組み合わせ(個々に封入され、MPと混合されていようと、または共封入されていようと)は、免疫および保護を誘導するために使用される(実施例IVにおいてPep4とPep7の組み合わせについて示されるとおり(図9C参照))。
【0255】
20 μg Pep4-MPの皮下投与と経口投与を用いた免疫原性および保護効果を比較した試験は、経口免疫付与がまた抗Pep4抗体を誘導することにおいて有効であることを示し、それはまた、DFAによりクラミジア感染細胞と非感染細胞に特異的に結合する。したがって、マイクロ粒子およびナノ粒子に封入された本発明のペプチドを用いた経口免疫付与は、クラミジアに対する保護免疫を誘導するための有効な手段である。インタクトmAb2を用いた結果は、100μgの可溶性mAb2が皮下で投与された場合と比較して封入化mAb2 (6-10 μg/投与)が経口で送達された場合に、免疫付与および保護において10-25倍の改善を示した。
【0256】
上記で使用された封入化製剤(PLA)からの免疫原性ペプチドの放出を確認および解析するための試験を行った。結果を図19A-Bに示す。時間をかけて回収された上清のサンプルについてHPLCを行うことにより、Pep 4の異なる2個の封入化調製物の累積ペプチド放出速度を計算し、残りのサンプルを用いて、ELISAによりPep 4をアッセイした。ペプチドの放出速度は、2個の調製物において類似していた。図19A(「放出-1」)におけるPep4-MPの最初の調製物を上記の実験のために使用した。両調製物はまた、経口投与により送達された場合に免疫を誘導し得る。
【0257】
実施例XI
ヒトサンプルにおけるPCR (クラミジアについて)および免疫学的解析の相関
いくつかのクラミジア遺伝子の発現についてPCRにより、C. trachomatis感染細胞に対してIHCにより、本発明のいくつかのペプチドに対してELISAにより、ヒト血清を試験した。結果を表7に示しており(下記)、それは、ヒト末梢血単核細胞(PBMC) (それは、主に、リンパ球および単球である)および子宮頸部スワブにおけるクラミジア主要外膜タンパク質(MOMP)をコードするDNAの存在についてのPCR試験からの結果を含む。
【0258】
また、C. trachomatis感染ヒトHEp2細胞のIHC染色およびELISAによる患者サンプル中の抗体の、本発明の4個のペプチド(Pep4、7、8および10)への結合を示す。
【0259】
表7は、9/24のサンプルがPCRに陽性であり(PCRアッセイのいずれかによる)、IHC染色およびELISAについて陽性であることを示す(1:40および1:80の血清の希釈で; 多くは両方において陽性であった)。13/24のサンプルは、PCR(任意のアッセイ)に陽性であり、IHC染色および/またはELISAにおいて陽性であった。24個のうち11個のサンプルは、MOMPまたはクラミジアプラスミドについてのアッセイにおいてPCR陽性であり(プラスミドは、すべてのクラミジア株において実施されているわけではない)、IHCおよび/またはELISAにおいて陽性であった(すべてのサンプルがELISAにより試験されたわけではない)。
【0260】
17/24個の血清が、PCR陽性に基づいてクラミジア感染を有することが報告されている対象に由来するものであることは明らかである。感染した個体のこれらの血清は、4個のペプチドを用いて、C. trachomatis感染細胞の染色およびELISAの陽性結果を生じた(染色およびELISAの異なる力価および強度ではあるが)。
【0261】
したがって、確認されたクラミジア感染を有する患者は、本発明のペプチドに対する抗体を産生し、これはさらに、動物試験に加えて、これらのペプチドが診断のために、および免疫原性組成物で投与された(すなわち、適当なアジュバントまたは他の免疫刺激部分と共に、マイクロもしくはナノ粒子として封入された形などで投与される)場合にはヒト免疫付与のために有効であるという予測を支持する。患者の血清がEBもしくはRB段階において全クラミジア個体を認識する抗体を含む場合には、また、4個すべてのペプチドを認識する抗体が存在し得て、これは、これらのペプチドが適当なワクチンおよび診断抗原として機能し得るという考えを強める。
【0262】
表7: ヒト血清サンプルにおけるPCRおよび免疫反応性
【表12】

【表13】

【表14】

【表15】

【表16】

【0263】
MOMPについてのPCRを入れ子にしている(is nested)。本明細書において使用されるMOMP-PCRについてのより多くの情報に関しては、MOMP PCR: B. Dutilh et al., Res Microbiol. 1989, 140:7-16; . P. Rodriguez et al., J. Clin Micro. 1991,29: 1132-36を参照のこと。プラスミドPCRについて、S. Bas et al., Arthritis Rheum. 1995, 38:005-13を参照のこと(それらの全体を引用により本明細書の一部とする)。
【0264】
PCR欄における複数の記入(+、-など)は、異なる研究者により行われた独立したPCR試験を示す。PCRの陽性および陰性は、偽陽性および偽陰性を除外する注意深い制御により示されており、したがってPCRの陽性は、ロバストである。
【0265】
子宮頸部スワブの陰性は、現在において感染していないこと(すなわち、頸部および膣スワブからの高められた感染は、脱落した病原体を検出しないであろうこと)を意味する。
【0266】
「染色」の陽性およびELISA反応性を示す任意の数の存在はまた、以前の感染または上昇した感染(ascended infection)を示す。
【0267】
PCRに陰性な結果に対して感染細胞の抗体染色における陽性は、以前の(現在ではない)感染の存在を示す。
【0268】
ELISAの結果は、染色結果と完全に一致している。4個のペプチドに対する類似しないELISA値は、弱い免疫染色と相関するように思われる。
【0269】
番号により引用された文献
【表17】

【0270】
【表18】

【0271】
【表19】

【0272】
【表20】

【0273】
【表21】

【0274】
【表22】

【0275】
【表23】

【0276】
上記で引用され記載された参照は、それらが特別に本明細書に組み込まれているか否かにかかわらず、それらの全体を引用により本明細書の一部とする。
【0277】
本発明は本明細書において十分に記載されているので、同様のことが、本発明の精神および範囲から離れることなく、かつ、過度の実験をすることなく、広範な同等のパラメーター、濃度、および条件内で実施され得ることが当業者により理解されるであろう。
【技術分野】
【0001】
連邦政府による資金提供を受けた発明に対する権利の記載
本発明は、National Institute of Health, Department of Health and Human Servicesからの助成金によって一部支援を受けたものであり、アメリカ合衆国政府は本発明について一定の権利を有する。
【0002】
発明の背景
発明の分野
免疫学および感染症の分野における本発明は、クラミジア糖脂質外抗原(GLXA)に対する抗体により選択されるランダムライブラリー由来の新規ペプチド免疫原、または抗GLXA抗体(Ab1)に特異的であり、GLXAの分子模倣体として使用される抗イディオタイプ抗体(mAb2)の抗原結合領域に相当するもの、およびGLXA(属にわたる(「属特異的な」)クラミジア抗原)に対する抗体の誘導におけるそれらの使用に関する。
【背景技術】
【0003】
背景技術の記載
100万人を超える新規クラミジア感染の症例が2006年において報告されており、10億ドルを超える費用が費やされている。増大した監視および処置にもかかわらず、クラミジアの性感染症(STD)による感染は、上昇し続けている。Chlamydia trachomatisは、卵管性不妊症および骨盤内炎症性疾患の主な原因である(1,2)。無症候性および未診断のクラミジア感染は、報告されている感染率の2倍に昇ると推定されている。クラミジア生殖管感染は、淋病の5倍以上であり(3)、HIVおよび他のSTD病原体の増加した感染リスクと相関している(4)。クラミジア生殖器感染は妊婦の5-15%で生じ、その新生児の50%が封入体結膜炎または呼吸器感染を発症することから(5)、C. trachomatisは、乳幼児において最も共通する眼疾患の病原体である(6)。クラミジアの性行為による感染において、反復曝露、無症候性(無症状)および/または持続的感染のような他の要因は、診断を困難にする。抗生物質は多くのクラミジア感染を除去し得るが、それらは再感染を予防しない。
【0004】
インビトロにおいて、抗生物質は、クラミジアを培養不能な持続的状態に誘導し得る(7)。インビトロにおいて、持続的感染細胞は、アジスロマイシンに対して耐性である(8)。動物における研究は、早期の抗生物質処置がいくつかの天然の防御免疫の開発を妨害し得て、したがって、患者に骨盤炎症性疾患およびひどい後遺症と関連するより広範な病変を生じやすさせることを示す(9)。生殖器感染はまた、かなりの割合の反応性関節炎の発症を生じやすくし、そこでは、生存能力のある代謝的に活性な生物が滑膜に存在する(10, 11)。クラミジアに関する最近の概説については、例えば、Ref 12を参照のこと。
【0005】
ヒトにおける感染性盲目の主な原因であるトラコーマは、C. trachomatisの眼次亜種(ocular biovars)での繰り返される眼感染により生じる(13, 14)。数百万人のうちの10人がトラコーマを患い、4分の1までが盲目になる。トラコーマは、北米および欧州からはすでに消滅したが、そこでは、眼球外クラミジア感染が重大な問題のままである。成人において院外感染性肺炎の原因であるChlamydia pneumoniae (Cpn)は、アテローム性動脈硬化症と関連しており(15,16)、血清疫学的な研究は、大多数の成人がCpnに曝露されていることを示す。Cpnは、遅発性アルツハイマー病(17, 18)、1個またはそれ以上の型の多発性硬化症(19, 20)、および顎関節症(TMJD) (21, 22, 23)を含む他の慢性炎症性疾患と関連している。アテローム性動脈硬化症とアルツハイマー病(AD)との関連は、いくつかの症例において疑われている(例えば、24)。
【0006】
C. psittaciは、鳥類に感染し、鶏肉産業に主な経済的影響を与え、生産に影響を与えるだけでなく、養鶏業者を危機にさらす(25)。したがって、クラミジア感染の公衆衛生の意義は大きい。C trachomatisの血清型を超えた広範囲にわたる保護能力を有する属特異的保護ワクチンは、極めて高い価値を有する。
【0007】
ワクチン候補のナノカプセル化および送達
ワクチン候補の新規送達法は、過去10年間にわたって開発されてきた。ナノテクノロジーおよび「ナノ医学」の出現と共に、ナノ粒子(NP)の治療的使用は、急速に拡大してきている。本発明者および同僚等は、クラミジアワクチンとしてのポリ(乳酸およびグリコール酸) (PLGA) ミクロスフィア封入化保護抗体のそれらの使用について報告しており、それは、経口でおよび鼻腔内に送達される(26, 27)。最近、本発明者および同僚等は、ナノ粒子がインビトロにおいてクラミジア感染細胞に急速に摂取され、ナノ粒子が感染組織に標的化され得ることを見出した(例えば、28,29,30)。他者は、PLGAナノ粒子がインビボにおいて、ペプチド、オリゴマー(DNA)または薬剤を送達するために使用され得ることを示した(31-36)。別のポリマー、例えば、キトサンもしくはアルギン酸を用いたNP製剤は、粘膜送達について成功している(31,37)。NPのサイズおよび表面特性の効果が調べられている(38, 39)。
【0008】
本発明者および同僚等は、もともと、類似の薬剤についてのナノサイズ化材料およびペプチド送達がまだ利用できなかったので、一部それらの最初のワクチン候補をミクロスフィアで試験した。カプセル化は、主に少なくとも2個の利点を有する: (1) 封入化ワクチン抗原(「Ag」)、例えば、モノクローナル抗体(mAb)もしくはペプチドもしくはポリヌクレオチドは、胃酸からの保護のために機能を欠損することなく経口で送達され得る。あるいは、鼻腔内または経気管で送達されるNP中の抗原は、局所抗原提示細胞、例えば、肺マクロファージもしくは樹状細胞(DC)に取り込まれるのに十分な長い時間、鼻咽頭または肺に留まるであろう。
【0009】
1990年代の定説は、パイエル板での摂取により粘膜的に免疫するための粒子に基づくワクチン/抗原の摂取は、1-10 μmの直径を有する粒子を必要とすることであった(40, 138)。それ以来、Amidi et al.(31)、Saltzmanおよび他の者は、NP(直径500 nm未満)が粘膜的に送達され、送達されたAgに対する免疫に成功したこと、およびそれがより有効であったことを証明した。後者の成功の一部は、DC成熟を誘導するAg搭載NPによるものであり(36)、NPは、DCおよびマクロファージの両方により効率的に摂取される(141)。NPサイズ送達ビヒクルは、研究中であり(38 , 41, 137)、新規な材料およびNP設計についての可能性は、ワクチン送達ビヒクルとしてのそれらの魅力を高めている。
【0010】
PLGAコポリマーは、ヒトでの使用(溶解性縫合糸)についてFDAに承認されており、そのアジュバント特性に加えて、遊離Agと比較した場合に遅延した送達デバイスとして機能する(42)。PLGA NPは、(a) 細胞および組織における摂取を追跡するように蛍光標識され、(b) 特定の型の細胞に標的化され、そして(c) それらの血中半減期を持続させるためにポリエチレングリコール(PEG)(また「ペグ化」として既知である)と結合され得る。ワクチン候補を含む推定上のナノサイズ粒子は、おそらく腸細胞またはDCへのピノサイトーシスによりパイエル板以外の部分で摂取され得て、外因性Agについて消化管または他の粘膜表面に局所的に吸収される。DCにより認識かつ摂取されると、これらのAg提示細胞は、局所排泄リンパ節に移動し、DCの内側においてNPから放出されたAgは、Tリンパ球に提示され得る。これは、T細胞を活性化し、免疫Ag (または全個体、この場合にはC. trachomatis)への次の曝露に応答する。そのような応答は、粘膜部位から感染性微生物を除去するのに必要とされる。
【0011】
クラミジア生物学およびワクチン標的
クラミジアは、下記に示す二相の成長サイクルを有する複雑な偏性の細胞内細菌である: (a) 胞子のように感染性はあるが、代謝的に不活性な基本小体(EB)および(b) 非感染性ではあるが、代謝的に活性な網様体(RB)。
【0012】
成長サイクルの略図を図1に示す。概略は、抗体(「Ab」)による細胞外EBおよび細胞内段階(RBおよびEB)に対する免疫応答+強力なCD4 T細胞応答およびおそらくはCD8細胞障害性T細胞による「異常体(aberrant bodies)」 (「AB」)の持続型に対する免疫応答が「完全な」ワクチンのために必要とされることである。
【0013】
図2は、マイクロ粒子で送達された(26,27)初期のmAb2ワクチン候補およびペプチド模倣体によるその置換を示す略図である。
【0014】
精製化Agまたは組み換えペプチドを有する伝統的な方法は、それらの免疫原性にもかかわらず保護に失敗したので、クラミジア感染についての新規ワクチン戦略が必要とされる(46, 47)。予防効果のあるワクチン法を設計することにおける困難性のいくつかは、さまざまな異なる動物モデルの使用に関連する。新規分子および生化学的方法論は、保護的細胞障害性Tリンパ球(CTL)応答を誘導し得る高い免疫原性を有するAg構築体/ペプチドを提供し(48)、それは、「主要外膜タンパク質」(MOMP) Agについての新規DNAワクチン構築またはCpGのような新規アジュバントの試験を可能にする(47, 49, 50)。本発明者等により採用される別の方法は、ワクチン候補として、標準的な許容される方法により送達されるペプチドを用いることである。過去10年の間に、抗イディオタイプ(抗Id) Ab (mAbを含む)または慣用的なmAbに由来する配列を有するペプチドは、(142-144)に対して免疫化および保護することが示され、癌ワクチン開発のために広く使用されている(142-144)。
【0015】
抗クラミジア免疫は、保護的もしくは病原性であり得る
最初のクラミジア感染は、次の再感染に対する持続免疫を生じない(51-53)。感染に対する免疫病原性応答は、ワクチン開発を困難なものにする。最初の感染後、再感染に対する局所免疫応答の一部は、hsp60または他のクラミジアAgに対する破壊的局所CD4+ T細胞仲介遅延型過敏反応(DTH)応答であるように思われる(54-58)。
【0016】
クラミジア感染の複雑な免疫学は、いくつかのモデルにおいて広く研究されている(60)が、保護免疫についての細胞および分子的必要性については、ほとんど解明されていない。MOMPペプチドでパルスされたDCは免疫原性を出現させたが、死滅MoPnのDC送達が保護的であったとしても、C. muridarum (MoPn)生殖器チャレンジに対して保護的ではなかった(59, 60)。Igietseme et al. (61)は、IL-10ノックアウト(KO)ドナーから得られたEBパルス化DCで免疫されたマウスにおける保護を示し、IL10KOを有するDCは、IFNγ依存的な方法でより迅速にTh1応答を刺激した。この集団は、より早期に、クラミジアAg-Ab複合体が細胞のFcR会合(engagement)によりAgのDC摂取を増大させ、インビトロおよびインビボにおいて改善されたエフェクター応答を産生することを示した(62, 103)。これらの結果は、FcR会合によりAPCに標的化されたAgが炎症性免疫応答をそれらの同じAgに対する抗炎症性免疫応答に遷移させ得ることを示す他の試験を補う(63, 64)。感染のCD4仲介除去における重要なB細胞構成要素に関するMorrisonの最近の結果(79)と組み合わせると、現在、TおよびB細胞の両方が抗クラミジア保護免疫のために必要とされることが明白である。
【0017】
中和Abを含むクラミジアに対する粘膜免疫応答は、中和Ab単独の存在では保護免疫を保証しないが、おそらくは部分的に標的とされるクラミジアAgのために感染からの保護において必要であると考えられる。感染した個体の血清もしくは分泌物において測定される多くのクラミジアAg、例えば、MOMP、CPAFと呼ばれるクラミジア分泌プロテアーゼ因子およびリポ多糖(LPS)に対する活発なAb応答は、1個またはそれ以上の後者のワクチンの可能性を支持し、これらの多くが試験され、種々の成功をもたらした(例えば、47、49、65、66)。LPSは属特異的ではあるが、LPSに基づくワクチンは、予防効果がなかった(145)。MOMPに基づくワクチンは、本発明の属にわたり保護的な免疫原とは対照的に、血清型特異的であり、カクテルワクチン法を必要とし得る。
【0018】
LPS (67-74)とは異なる属特異的な分泌型クラミジア糖脂質外抗原(「GLXA」)は、免疫原性があり、また免疫学的に関連のある標的である。C. trachomatis、C. psittaci、およびCpnに感染した患者由来のAbは、GLXAと反応する(81)。多くの抗クラミジア免疫応答は、T細胞依存性である。MOMPおよび他のAgに対する特異的T細胞応答が示されており、CD4細胞は除去において役割を果たす(75-80)。
【0019】
最近の新規クラミジアAgは、患者サンプルのプロテオームスクリーニングにより同定されるものを含む(81)。Barker et al.は、最近、クラミジアT細胞抗原(リボヌクレオチドレダクターゼ小鎖タンパク質を示すNrdB)を示した(82)。Karunakaran et al.は、イムノプロテオミクスを用いて、C. muridarumマウスモデルにおいてMHCクラスIもしくはII分子と結合する新規ペプチドを同定した(83)。MoPnおよび他の血清型に対するサイトカイン/ケモカイン応答は、Th1およびTh2 CD4細胞の両方が除去において重要であることを示す(84-87)。しかしながら、より高いレベルのIL-10は、MoPnの感受性と関連している(88)。優性Thにおける遷移は、他の細胞内病原体、例えば、LeishmaniaおよびMycobacteriaに対する保護と関連しており(89-91)、任意のクラミジアワクチン候補についてのこの効果はまた示されている。抗GLXA Ab3におけるmAb2誘導アイソタイプ遷移は、抗Idワクチンが免疫付与の経路の影響を深く受けるTh1およびTh2細胞仲介抗GLXA応答を誘導することを示す。
【0020】
本発明によると、適当なThおよびCTLエピトープを有する保護ペプチドワクチン候補は、各々、Th1およびTh2応答、ならびにおそらくはCD8+ CTL応答を含み得る。
【0021】
多くの予期されるレスポンダー/エフェクターおよびそれらのサイトカインが、クラミジア感染および除去の間に見出されている(85, 92)。しかしながら、これらの免疫組織化学(IHC)法は、ワクチン接種に対する応答よりも感染に対する先天的および適応免疫応答に集中している。トランスジェニック(Tg)およびKOマウスを用いた試験は、MHCクラスII+ T細胞がクラミジア(MoPn)除去において重要であるが、MHCクラスI経路に関与するT細胞は重要ではないことを示した(93)。Th1対Th2関連応答が連続して生じ得て(94, 95)、Ag処理経路を含む多くの因子(96)が出力に影響を与え得る。
【0022】
慢性クラミジア炎症性疾患における潜在的な保護メカニズムは、炎症性Th1細胞および単球/マクロファージ/DC応答の制御により仲介される。この細胞内病原体に対する応答におけるCD8+ T細胞についての役割が長期にわたって示されており、C. trachomatisおよびCpnに対するCD8+ CTLについての証拠が公開されている(48,97-99)。しかしながら、血清型または種にわたりCD8応答を含む免疫原性保護ペプチドは、未だ証明されていない。APC、特に(UV)-EBでパルスされたDCの操作は、種々のレベルの保護免疫を誘導した。例えば、生きたEBに曝されたDCは、UV-EBで見られるものよりも成熟したDC表現型を獲得し、CD4 Th1応答を促進し得るより高いレベルのIL-12を産生した(113, 114)。
【0023】
クラミジアワクチン開発の進展には、下記を必要とする:
(1) 1個またはそれ以上の標的Agの同定;
(2) 病原性免疫応答を克服するための改善された保護応答の誘導; および
(3) 1個またはそれ以上の動物モデルにおける一次、二次および異種感染に対する持続的な保護。
【0024】
実際の臨床におけるクラミジア曝露は、おそらく低用量であり、したがって、最少の免疫原性である(インビボ複製が始まるまで)。動物モデルにおけるより多量のチャレンジに対する免疫応答の証拠は、天然感染のよりわずかな応答とは異なる複数の刺激の経路を反映し得るので、それらを解釈する必要がある。単独感染は、通常、自己限定的であるために、以前の感染のみではヒトにおいて十分な保護免疫を誘導しないので、炎症性要素に悪影響を与えることなく、上記のものを超える免疫応答を同定および誘導することがより重要である。クラミジア感染に対する早期の抗生物質による処置は、いくらかの天然の保護免疫の発達を減少させ得るという観察に対して、この方法では、一層悪化した後の後遺症、例えば、不妊症を生じ得るという新たな疑問が最近提示されてきている(146, 147)。
【0025】
一方、微生物の天然の除去は、保護免疫に対する必要とされる応答を提示しないかもしれない。高度に免疫優性なAgは、他のAgに対する潜在的な保護応答を阻害しますか?保護的免疫付与と病原性免疫付与との間の平衡を達成することが、継続してクラミジアに再曝露されるか、または以前にクラミジアに曝露されたヒト集団についてのワクチンのために重要である。非粘膜部位における播種および慢性感染の確立を阻害する方法を理解すると、これらのイベントにおける任意の抗クラミジアワクチン接種の効果は、極めて重要である。本発明は、該平衡およびヒト疾患を反映する播種性クラミジア感染に関するペプチド免疫原、例えば、mAb2可変領域の配列に由来するものの効果を同定する。
【0026】
クラミジア・トラコマチスおよび播種性感染の動物モデル
クラミジア感染の播種性段階についての新たな見解が最近現れてきた。循環細胞(おそらくは、単球および/または単球由来DC)は、1個またはそれ以上の部位に循環して(traffic)、集まるか、または該部位に捕捉される。C. trachomatis播種の共通部位は、滑膜であり、実際に一部の患者は、反応性関節炎(ReA)を発症する。クラミジアは、ReA滑膜において唯一生存可能で代謝的に活性な細菌であり、患者がリウマチ専門医を訪れた場合に、分子的に既定された持続型である(形態および遺伝子発現について) (10, 100-107)。
【0027】
滑膜は、感染性微生物、循環微粒子などの捕捉部位であることが既定されている。IHCおよび免疫電子顕微鏡試験は、インタクトクラミジアおよびクラミジアAgの両方がReA滑膜に存在することを示した(110, 11)。しかしながら、関節からの培養可能クラミジアの単離は一度だけ報告されており(112)、多くの試みは失敗に終わった(106)。ある条件下において、C. trachomatisは、極めて低いレベルのEBが産生され、MOMP、chsp60、ftsK、ftsWなどをコードする多くの遺伝子が下方調節もしくは上方調節されるが、持続感染を生じる(10, 101, 107, 113-116)。
【0028】
本発明者等を含む多くの集団がPCRに基づくクラミジア検出系を開発した(117-122)。いくつかのC trachomatis血清型についてのゲノムが公開されると共に、さらなるクラミジア遺伝子転写産物についてのPCR/qPCRが可能になってきた。C. trachomatisゲノムプロジェクトは、個体が持続状態に入ると異常に発現することが予測される選択されたクラミジア遺伝子の本発明者等自身による試験を可能にした。クラミジア発達および分化の特定の段階に関与する選択された遺伝子を標的とすることは、活性な感染細胞におけるクラミジア遺伝子発現がインビトロでReA滑膜組織および持続的感染ヒト単球において観察されたものとはかなり異なることを示す(118,123)。かなりわずかな動物試験がクラミジア関連ReAについて行われた。
【0029】
本発明者および同僚等は、最初に、マウスにおいてワクチンにより仲介される実験的ReAの減少を示した。最初に、マウス結膜(眼粘膜組織)への眼感染が、滑膜へのクラミジア播種を生じた(124)。より最近、本発明者等は、米国および欧州においてヒトクラミジア関連ReA症例のより代表的なモデルである生殖器感染モデルに焦点を当てた。最近のモデルにおいて、滑膜組織へのC. trachomatisの播種およびその結果生じる膝の病状が報告された。
【0030】
本発明者等の眼および生殖器感染モデルにおいて誘導される滑膜炎症の概略が公開されている(124-126)。クラミジア播種は、他の動物モデルにおいて生じ、Cpnは、マウスの経鼻チャレンジ後、または感染PECの移植後、遠隔部位に播種されることが示されたが(127)、滑膜およびCNSについてはアッセイされなかった。MoPn誘導生殖器感染を用いた試験(128)は、急性関節炎を生じた。最近の試験は、前感作または関節内クラミジアチャレンジを利用し、それは、生殖器感染からの天然の播種を弱く模倣する。同じ集団(129)は、モルモットにおいて生殖管から関節へのGPIC (Chlamydiophila pecorum)の播種を示した。最近のクラミジアReAの近交ラットモデル(130)は、C. trachomatisに感染した滑膜細胞の関節内注入を利用する。それは、ReAに関連するいくつかの疑問を調べることを可能にするが、天然のヒト感染とは基本的に異なり、ここで、最初の感染細胞は、線維芽細胞ではなく、これは、関節へのクラミジア播種に関与する宿主細胞でもない。したがって、C. trachomatis関連ReAについての本発明者等のモデルは、疾患作製の非侵襲モデルのために、本発明のワクチンの開発および試験について、最もとりわけ、クラミジアReAおよび滑膜感染の試験により仲介される減少について有利である。
【0031】
クラミジア感染を保護するための有効な送達戦略と結合した有効なワクチンの本発明者等による同定は、世界中で公衆衛生に関する巨大な衝撃を与えるであろう。免疫原性ペプチドの生分解性NPへの封入は、改善された粘膜ワクチン付与を促進し、冷却保存(cold chain)の必要性を減少させるのを助ける。ナノ技術は、以前、クラミジアの研究に適用されていなかったので、本発明は、クラミジア関連疾患の予防に対する新規方法を提示する。さらに、本発明により開発された方法は、他の細胞内ヒト病原体についてのワクチン製剤の開発のための基盤として使用され得る。
【0032】
現在、保護的クラミジアワクチンは存在しない。性行為による感染は、女性において主に無症候性であり、これは、感染、骨盤内炎症性疾患、子宮外妊娠および不妊を高め得る。広がったスクリーニングおよび処置プログラムにもかかわらず、クラミジア性感染症(STI)の症例数はなお増加しており、2007において100万超の新規STI症例/年を示す。これらの抗原性エピトープは、属特異的(属にわたる)、血清型に特異的ではない、または推定上の次亜種特異的(C. trachomatisとC. pneumoniaeとC. psittaci)であるので、本発明のワクチン組成物は、不妊症のような慢性炎症性疾患後遺症は言うまでもなく、STI、心臓血管疾患、クラミジア肺炎、アルツハイマー病および多発性硬化症の一部に対して保護的であるはずである。
【0033】
上記文献の引用は、上記のいずれかが関連のある先行技術であることを認めることを意図するものではない。これらの文献の内容についての日付または記載に関するすべての提示は、出願人に利用可能な情報に基づくものであり、これらの文献の日付または内容の正確性についてのいかなる承認をも構成するものではない。
【発明の概要】
【0034】
発明の要約
本発明者等は、抗原性エピトープを示すペプチドおよびクラミジアGXLA抗原に特異的な抗体に特異的な抗Id-mAb2の結合領域の一部もしくは全部を示すペプチドの配列を同定および/または推定した。本明細書において記載されるとおり、さまざまなペプチドが試験され、感染細胞においてEBおよびRB、ならびに封入体の構成要素(マトリックス材料および/または封入体膜)を認識する抗体を誘導することが見出された。重要なことは、これらのペプチドが感染性クラミジアを用いたチャレンジに対して保護活性を示し、C trachomatis、C pneumoniae、C psittaci、C pecorumなどの広範囲にわたる抗クラミジアワクチンとしての潜在性を有する属特異的抗原を示すことである。
【0035】
本発明者等は、mAb2のIgG分子のH鎖およびL鎖の超可変もしくは相補性決定領域(CDR)が一緒になってこれらのmAb2 IgG分子のAg結合領域を示すので、それらが候補ワクチンであると考えた。抗Idワクチンは、専ら、抗癌ワクチン候補として研究されてきた(43-45)。
【0036】
本発明は、新規免疫原性ペプチドおよび改善された粘膜ワクチン接種を促進するための生分解性NPへのそれらの封入に向けられる。本発明は、クラミジア関連疾患の予防のための新規組成物および方法を提供し、ナノテクノロジーをクラミジア感染の予防および処置に適用する。本発明は、本発明者および同僚等のうちの1人による初期の発見(米国特許第5,656,271号および第5,840,297号ならびにRef. 27を参照のこと)から前進した概念的な飛躍である、1個またはそれ以上のGLXAエピトープ(その構造は未だ生化学的に定義されていない)の分子模倣体として機能する抗GLXA mAb (mAb1)に対して作製された「mAb2」と呼ばれる抗Id mAbの新規組成物を提供する。
【0037】
GLXAは精製するのが困難で、十分な材料のために多量のクラミジアを必要とする。このために、このAgは決して十分には特徴づけられておらず、その正確な性質は未知のままである。「属特異的な」(また「属にわたる」と呼ばれる)抗原は、既知の種にわたってクラミジア属の生物において存在することを意味することが知られている。それは、クラミジアにおいて唯一他の既知である属にわたる抗原であるクラミジアリポ多糖(LPS)とは異なる(26, 27, 68-74, 126)。
【0038】
本発明者等の新規な方法は、有利なペプチド免疫原に集中することにより、GLXA特徴づけおよび精製についての必要性を避けるように設計されている。それらは、経済的に多量に、かつ容易に生産される。それらは、免疫原性担体と連結されていてもよく、および/またはより効率的な送達および免疫化のために、マイクロスフィア、NPおよびウイルス様粒子(VLP)を含むさまざまな送達ビヒクルに封入されていてもよく、および/または他のナノ材料、例えば、デンドリマー/樹枝状ポリマー(該用語は同義である)と連結されていてもよい。
【0039】
本発明によると、ペプチド免疫化により誘導される免疫血清は、持続的な感染細胞を認識し、持続的な状態で存在するクラミジアに結合する。したがって、1個またはそれ以上のペプチドに対する免疫は、持続的な感染を除去し、それにより慢性的なクラミジア感染を予防する可能性を有し得る。
【0040】
より特には、本発明は、少なくとも約10アミノ酸長であるが、抗体VHもしくはVLドメインまたは一本鎖抗体(scFv)鎖の長さよりも短い免疫原性ペプチドに向けられる。該ペプチドは、クラミジア属特異的糖脂質外抗原(GLXA)の構造を免疫学的に模倣しており、該ペプチドが十分な量かつ免疫原性形態で哺乳動物対象に投与された場合に、例えば、下記:
(a) 免疫ペプチドに対するイムノアッセイ;
(b) GLXAに対するイムノアッセイ; および/または
(c) 複数の(好ましくは、全部の)クラミジア種のクラミジア個体への結合、またはその機能、増殖もしくは生存の阻害を測定するイムノアッセイまたは生物学的アッセイ
において測定可能な抗体応答を誘導するという点で特徴づけられる。
【0041】
上記の免疫原性ペプチドは、好ましくは、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約25、約30、約35、約40、約45、約50、約60、約70、約80、約90もしくは約100アミノ酸残基長(および、それらの間のすべての値)を超えず、最も好ましくは、約30アミノ酸残基長を超えない。
【0042】
免疫原性ペプチドは、抗GLXA抗体Ab1を用いた結合についての選択によるファージディスプレイペプチドライブラリーに由来し得る。1つの規定された抗GLXA抗体Ab1は、受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである。
【0043】
1つの態様において、上記免疫原性ペプチドは、下記:
(a) Pep1、配列番号1;
(b) Pep2、配列番号2;
(c) Pep3、配列番号3;
(d) Pep1、配列番号4;
(e) Pep4、配列番号5;
(f) Pep5、配列番号6;
(g) Pep6、配列番号7;
(h) Pep11、配列番号11;
(i) Pep12、配列番号12;
(j) Pep13、配列番号13;
(k) Pep14、配列番号14; および
(l) ペプチドの抗体反応性および免疫原性を保持する、(a) - (k)のペプチドのいずれかの保存的アミノ酸置換変異型または付加変異型
からなる群から選択される(下記で詳細に定義する)。
【0044】
免疫原性ペプチドはまた、N末端およびC末端残基が、両末端においてCys残基、または一方の末端において架橋可能なLys (K)および他方の末端においてGlu (E)を導入するように付加された環化ペプチドであり得る。該ペプチドの好ましい例は、配列番号14; 配列番号15; 配列番号16; 配列番号17; 配列番号18; 配列番号23; 配列番号24; 配列番号25; 配列番号26; 配列番号27; 配列番号28; 配列番号20; 配列番号30; 配列番号34; 配列番号35; 配列番号36; 配列番号37; 配列番号38; 配列番号39; 配列番号40; 配列番号41; 配列番号42; 配列番号43; 配列番号44; 配列番号45; 配列番号46; 配列番号47; 配列番号48; 配列番号49; 配列番号50; 配列番号51; 配列番号52; 配列番号53; 配列番号54; 配列番号55; 配列番号56; 配列番号57; および配列番号58からなる群から選択される直鎖配列を有するペプチドである。
【0045】
好ましい態様において、免疫原性ペプチドは、抗GLXA抗体Ab1に特異的である抗Id抗体Ab2のV領域ドメインのアミノ酸配列を有し、イムノアッセイにおいて抗GLXA抗体に結合するペプチドである。抗GLXA抗体Ab1は、mAbであり得て、好ましい例において、抗GLXA抗体Ab1は、受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである。抗Id Ab2抗体は、好ましくは、mAb(mAb2)であり得て、好ましい例において、抗Id Ab2抗体は、受託番号HB-11301としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである。該mAb2に由来する好ましいペプチドは、下記:
(a) Pep8、配列番号8;
(b) Pep9、配列番号9;
(c) Pep10、配列番号10; または
(d) ペプチドの抗体反応性および免疫原性を保持する、(a) - (c)のペプチドのいずれかの保存的アミノ酸置換変異型または付加変異型
である。
【0046】
mAb2のペプチド配列に由来するか、もしくはそれに類似する免疫原性ペプチドは、N末端およびC末端残基について、両末端が例えばCys残基、または一方の末端が架橋可能なLysおよび他方の末端がGluである環化ペプチドである。この群の好ましい環化ペプチドは、配列番号22; 配列番号23; 配列番号24; 配列番号25; 配列番号38; 配列番号39; 配列番号40; 配列番号52; 配列番号53; および配列番号54からなる群から選択される直鎖配列を有する環化ペプチドである。
【0047】
上記のペプチドのいずれかのペプチドの約2から約20リピートを含む(モノマー単位)、免疫原性直鎖オリゴマーもしくはマルチマーペプチドまたはポリペプチドがまた提供される。そのようなオリゴマーもしくはマルチマーは、各々が任意の2個の隣接するペプチドのリピート「基本」単位の間に位置する、1個またはそれ以上のリンカーペプチドを含み得る。オリゴマーまたはマルチマーは、環化していてもよい。
【0048】
他の好ましい態様は、タンデムに(隣接して)連結された上記ペプチドモノマーの2もしくは3個のリピートを含む、免疫原性タンデムオリゴマーペプチドである。
【0049】
1つの態様は、分枝を提供し、かつ、16個までの末端官能基を含むように少なくとも二機能性であるコア分子上に構築された樹枝状ポリマーであって、ペプチドモノマーが該樹枝状ポリマーの官能基と共有結合している、樹枝状ポリマーである。
【0050】
本発明はまた、下記:
(a) 上記の免疫原性ペプチド、オリゴマーもしくはマルチマー、または樹枝状ポリマー; および
(b) 免疫学的および薬学的に許容される担体もしくは賦形剤
を含む免疫原性組成物に向けられる。
【0051】
免疫原性組成物は、好ましくはさらに、薬学的に許容されるポリマーから形成された固相マトリックスを含むマイクロスフィアまたはナノ粒子を含み、該マイクロスフィアは、該ペプチドを含む。好ましいポリマーは、ポリ乳酸(PLA)またはPLGAである。
【0052】
上記の組成物において、ペプチド(またはオリゴマーまたはマルチマー)は、糸状バクテリオファージに連結されていてもよい。
【0053】
ペプチドオリゴマーまたはマルチマーは、標的化部分と連結、結合、もしくは混合されていてもよい。標的化部分は、好ましくは、望まれる細胞型の表面または望まれる環境への結合、もしくは選択的標的化を促進するポリペプチドである。最も好ましくは、標的化部分は、標的化されるべき細胞の細胞表面抗原に結合する抗体(または抗体の抗原結合部分もしくは変異型)である。抗原提示細胞、最も好ましくは樹状細胞(DC) (すなわち、未成熟DCまたはDC前駆体)への免疫原性部分の結合/標的化および処理を促進する抗体が最も好ましい。
【0054】
上記免疫原性組成物はさらに、アジュバント、免疫刺激タンパク質(免疫原性ペプチド/ポリペプチド)、またはCpGオリゴヌクレオチドを含み得る。好ましい免疫刺激タンパク質の例は、サイトカイン、例えば、インターロイキン-2もしくはGM-CSFである。
【0055】
好ましいアジュバントの例は、下記:
(a) 0.4 mg トレオニル-ムラミルジペプチドを含むリン酸緩衝液中のISAF-1 (5% スクアレン、2.5% プルロニックL121、0.2% Tween 80);
(b) 油中に溶解した脱油(de-oiled)レシチン;
(c) 水酸化アルミニウムゲル;
(d) (b)と(c)の混合物;
(e) QS-21; および
(f) モノホスホリルリピドAアジュバント
である。
【0056】
免疫原性組成物は、アジュバントおよびさらなる免疫刺激剤部分、例えば、サイトカイン、好ましくは、IL-2を含み得る。
【0057】
本発明はまた、免疫原性DNA分子に向けられる。好ましくは、免疫原性DNAは、1個またはそれ以上の本発明の上記ペプチドをコードする。
【0058】
免疫原性DNA分子は、抗GLXA抗体であるAb1に特異的であるAb2抗Id抗体のVHもしくはVL領域の1個、2個または3個のCDR (CDR1、CDR2またはCDR3)を任意の順序で含むポリペプチドをコードし得る。抗Id抗体は、好ましくは、mAb、例えば、受託番号HB-11301としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである。DNA分子の好ましい例は、配列番号59もしくは配列番号61を含むか、または配列番号59もしくは配列番号61の少なくとも1個のCDRコード領域を含むDNA分子である。1つの好ましい態様は、配列番号59または配列番号61の断片からなるDNA分子、または少なくとも1個のCDRをコードするこれらの配列の断片である。
【0059】
DNA分子が配列番号59を含む場合に、該分子は、かなり短いものであり得るが、約411ヌクレオチド長を超えない。DNA分子が配列番号61を含む場合に、該分子は、かなり短いものであり得るが、約387ヌクレオチド長を超えない。
【0060】
1つの態様において、免疫原性DNA分子は、上記の直鎖ペプチドオリゴマーもしくはマルチマーをコードする。他の態様において、免疫原性DNA分子は、下記:
(a) 第1融合パートナーとして、上記のペプチド;
(b) 存在する場合、所望によりインフレームで(c)に結合したリンカーまたはスペーサーペプチド;
(c) 第2融合パートナー
を含む一本鎖融合ポリペプチドをコードする。
【0061】
対象が該キメラDNA分子で免疫された場合に、該ペプチドに対する抗体応答は、該第2融合パートナーを含まないで(リンカー/スペーサーの有無で)投与された同じペプチドにより誘導される抗体応答と比較して増大される。
【0062】
免疫原性DNA分子は、好ましくは、免疫原の意図される対象、好ましくは、ヒトの細胞において発現可能な発現ベクターの形態である。そのような発現ベクターは、
(a) 上記のDNA分子; および
(b) それと操作可能に結合したプロモーター、および所望により、意図される細胞または対象においてDNAの発現を促進する1個またはそれ以上の転写制御配列
を含む。
【0063】
本発明はまた、クラミジア感染に対して哺乳動物対象、好ましくは、ヒトを免疫する方法を提供する。該方法は、下記:
(a) 上記免疫原性ペプチド;
(b) 上記オリゴマーもしくはマルチマーペプチドまたはポリペプチドまたはポリマー
(c) 上記融合ポリペプチド;
(d) 上記DNA分子または発現ベクター; または
(e) 上記免疫原性組成物
の有効な免疫原性量を該対象に投与することを含み、クラミジア属にわたる(属特異的な)クラミジアGLXA抗原に特異的な抗体応答を誘導することを含む。上記方法は、好ましくは、対象におけるクラミジアの感染性、増殖、まん延もしくは病原性(例えば、反応性関節炎)を予防または阻害する中和抗体応答である抗体応答を誘導する。
【図面の簡単な説明】
【0064】
【図1】図1は、クラミジア感染の発生サイクルの略図を示す。RB: 網様体−生物の非感染性ではあるが、代謝的に活性な形態。RBの主要目的は、宿主代謝産物を用いた二分裂による細胞内複製である。EB: 胞子様球状粒子であるクラミジア基本小体(直径約300 nm) (感染性はあるが、代謝的に不活性である)。
【図2】図2は、クラミジア抗原GLXAに対する抗体応答に適用される場合における、初期のmAb2ワクチン候補およびイディオタイプネットワークを示す略図である。
【図3】図3A-3Fは、個々のペプチドに対するペプチド免疫化マウスの抗体応答(ELISAで測定された)を示す一連の図式である。各群のマウスは、継続的な免疫付与で各免疫ペプチドに対する増加した抗体応答を示し; 事前に採血されたコントロール値を各希釈物における各マウスの血清吸光度(すなわち、OD)から引いた。
【図4】図4A-Cは、ELISAによるペプチド間の交差反応を示す一連の図式である。Im# - Pep4、Pep7またはPep8で免疫されたマウス; 「X-Rx」: パネルで示される交差反応。Pep4またはPep7で免疫されたマウスからの血清を各々Pep7およびPep4と交差反応させた。Pep8は、Pep10と交差反応しなかった(後者のペプチドが異なるH鎖CDRを示すので)。
【図5】図5は、mAb2免疫化ドナーからの脾臓細胞の免疫不全SCIDマウスへの適合移植(次いで、該マウスをChlamydia trachomatis (K血清型)でチャレンジした)の結果を示す。図5は、免疫細胞移植なしに増加した、結果として生じた感染性細菌負荷を示す。記号は、下記のとおりである: □−□: mAb2免疫リンパ球(T細胞を含む)の移植; ●−●: T細胞欠損mAb2免疫リンパ球の移植; ○−○: 正常な(コントロール)リンパ球の移植(これらの3群をクラミジアでチャレンジした); ▲−▲: 正常な(コントロール)リンパ球の移植(レシピエントは、感染されず、抗ペプチド抗体応答は、検出されなかった)。
【図6】図6は、mAb2免疫化ドナーからの脾臓細胞の免疫不全SCIDマウスへの適合移植(次いで、該マウスをChlamydia trachomatis (K血清型)でチャレンジした)の結果を示す。図6は、本発明の4個のペプチドに対する抗体応答を示す(ELISAによる)。記号は、下記のとおりである: □−□: mAb2免疫リンパ球(T細胞を含む)の移植; ●−●: T細胞欠損mAb2免疫リンパ球の移植; ○−○: 正常な(コントロール)リンパ球の移植(これらの3群をクラミジアでチャレンジした); ▲−▲: 正常な(コントロール)リンパ球の移植(レシピエントは、感染されず、抗ペプチド抗体応答は、検出されなかった)。
【図7】図7は、より初期のマイクロ封入型でのmAb2ワクチンで免疫付与されたマウスによるC. trachomatis (血清型E)を用いたチャレンジ後の結果を示す。図7は、細菌チャレンジの14日後のウイルス排出を示し、いくつかのマウスは、重複する値を有する。群を、皮下(SC)、経口(PO)または両経路で免疫付与し(または、免疫付与しない)、血清型EのC trachomatisを感染させた(または、感染させなかった)。
【図8】図8A-8Dは、より初期のマイクロ封入型でのmAb2ワクチンで免疫付与されたマウスによるC. trachomatis (血清型E)を用いたチャレンジ後の結果を示す。図8A-8Fは、ELISAにより測定された、示されたペプチドに対する同じ動物の抗体応答を示す。群を、皮下(SC)、経口(PO)または両経路で免疫付与し(または、免疫付与しない)、血清型EのC trachomatisを感染させた(または、感染させなかった)。K、L、MおよびP群のみを最初の抗ペプチドELISAで試験した。
【表1】

【図9】図9A-9Fは、ペプチド免疫血清がC trachomatis感染HEp-2細胞を認識することを示す。C. trachomatisで感染されたHEp2の顕微鏡写真は、指定されたペプチド(A-E)または可溶性mAb2(F)で免疫付与されたマウスからの血清(1:40希釈)で免疫染色(間接免疫蛍光による)されている。FITC抗マウスIgGは、検出抗体であった。矢印は、免疫血清の標的における異なる差異を示す。パネルA-Cにおける抗体は、EBおよびRB、ならびにおそらくは封入体におけるいくつかのマトリックス材料を認識した。D-Eにおける抗体はまた、より後の(older)ワクチン候補である全mAb2 (F)に対して作製された免疫血清と同様に、封入体マトリクスおよび封入体膜における標的を認識した。元の倍率は、40xである。エバンスブルーを用いてサンプルを対比染色する。
【図10】図10は、感染後7日での膣スミア細胞におけるクラミジア生物の免疫染色の結果を示す(直接蛍光)図式である。
【図11】図11は、感染後14日での膣スミア細胞におけるクラミジア生物の免疫染色の結果を示す(直接蛍光)図式である。
【図12】図12は、走査電子顕微鏡法により調べられた、ペプチド4を搭載したPLGA NPの顕微鏡写真である。長さのスケールを示す。
【図13】図13Aおよび13Bは、NPからのペプチド4の放出プロファイルを示す図式である。図13Aにおいて、リン酸緩衝生理食塩水(PBS)または炭酸緩衝液中のNPについて、逆相HPLCにより放出を決定した。図13Bは、既知の陽性抗Pep4抗血清を用いてELISAにより調べられた、放出ペプチド4 (炭酸緩衝液中)の免疫化学解析の結果を示す。
【図14】図14A-14Fは、微生物での感染後、1時間(t0) (A-C)または18時間(t18) (D-F)でのペニシリンG (PenG)添加の結果としてChlamydia trachomatisに持続感染したMcCoy細胞(148)の顕微鏡写真である。感染の48時間後に細胞をメタノールで固定し、Pep4 (A,D)、Pep7 (B,E)またはPep4とPep7の混合物(C,F)で免疫された動物からの抗血清で染色した。パネルD-Fにおける挿入図は、代表的な「コントロール」感染細胞(PenGなし)を示す。
【図15】図15A-15Cは、Pep4またはPep7を用いてより初期に免疫付与され、次いで28日後にチャレンジされたマウスの雌生殖器官の組織の巨視的な形態を示す一組の3枚の写真である。上記したとおり、マウスを抗原刺激し、2回のSC追加免疫を行い、クラミジアでチャレンジし、2週間後に再チャレンジし、その4週間後に安楽死させた。炎症した生殖管を破線で示す。矢印の部分は、子宮角であり、極めて暗く(炎症しており、インサイチュでは紫色である)、一方で、ペプチド4もしくは7で免疫されたマウスの該部分は、ほとんど炎症を示さず、より明るい色であった。
【図16】図16A-16Bは、BALB/cマウス(n=4-5)をPep4または無関連のペプチドで免疫付与し、Pep4を用いて動物の血清の反応性を試験する、図3で示される実験の繰り返し実験の結果(ELISA)を示す一組の図式である。
【図17】図17A-17Fは、遊離ペプチドまたはPLAマイクロ粒子に封入された形態での、免疫原としてさまざまなPep4(Pep4-MP)の用量でSC免疫付与された血清のELISAによる結果を示す。MPは、mg PLAあたり約7.5〜約9μgのペプチドレベルで搭載された。△−△: 事前(免疫付与前)の採血の結果。▲−▲: 最初の免疫付与後の結果。○−○: 1回目の追加免疫後の結果。●−●: 2回目の追加免疫後の結果。▼−▼: 最終採血の時点での結果(28日)。各点は、指定された群の4もしくは5個体マウスの血清についての平均吸光度(OD405)を示す。
【図18】図18は、示された時間において得られた膣スメアの直接蛍光抗体染色(DFA)の結果を示す。アッセイは、遊離基本小体(EB)を検出し、スコアは(任意ユニットで)、スメア中の遊離EBの相対数を示す(最小1000個の細胞が有効なサンプルのために必要とされる)。
【図19】図19A-19Bは、Pep4マイクロ粒子による封入化ペプチドの放出の経時変化を示す。
【発明を実施するための形態】
【0065】
好ましい態様の説明
本願発明者および同僚等のうちの1人は、以前、それ自体が「微量抗原」クラミジア糖脂質抗原(GLXA)に特異的である抗体(Ab1)に特異的な抗イディオタイプ(Id)モノクローナル抗体mAb2が、GLXAを認識する抗抗Id Ab (総称Ab3)を誘導する分子模倣体ワクチンとして使用され得ることを発見した(米国特許第5,656,271号および第5,840,297号を参照のこと)。受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生される該mAb2は、クラミジアに対して動物を免疫し、インビボでのクラミジア感染を中和した。ポリクローナルAb2または異なるモノクローナルAb2が同様に使用され得る。Ab1 (GLXAに特異的である)自体は、クラミジアに対して免疫化するか、もしくはそれを中和する重要な活性を有していなかった。好ましい(および例示的な)mAb2は、クラミジアAgに特異的なmAb1(本明細書においてまた「GLXA-mAb1」と呼ばれ、受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生される)を用いた免疫により誘導された。該Ab1は、マウスGLXA特異的Abと関連する1個またはそれ以上のイディオタイプを有するが、それ自体は、クラミジアを中和することにおいて、またはクラミジアに対して免疫化する免疫原として活性ではないId Abである。
【0066】
上記mAb2は、免疫原性を有し、保護的ではあるが、ヒトにおいて望まれない免疫応答を産生するマウス特異的エピトープのためにヒトワクチンとしての既知の不利益を有するマウスAbである。その潜在的な利用はまた、特定のマウス(または部分的マウス)mAbが臨床において使用されるという事実により危険にさらされており、したがって、対象をmAb2型免疫原に対する望まれない危険性が生じ得る免疫(アナフィラキシーを含む)応答にさらし得る(prime)。
【0067】
本発明は、完全マウスmAbまたは全鎖もしくはそのドメインの代わりに、ランダムファージディスプレイライブラリーに由来するか、もしくはGLXA抗原を模倣するmAb2の抗原結合領域(CDR)に由来する鎖/ドメインまたはペプチドをコードするDNAを用いることにより、これらの欠点を克服する一手段として考えられた。
【0068】
抗GLXA (Ab1) 抗Id (Ab2)抗体の作製および特徴づけ
下記の説明において、免疫学、細胞生物学および分子生物学の当業者に既知のさまざまな方法論が参照され得る。そのような既知の方法論について説明する公開物および他の材料は、十分に説明されているかのようにそれらの全体を引用により本明細書の一部とする。免疫学の一般的な原理について説明する標準的な参照となる仕事は、A.K. Abbas et al., Cellular and Molecular Immunology (6th Ed.), W.B. Saunders Co., Philadelphia, 2007; C.A. Janeway et al., Immunobiology. The Immune System in Health and Disease, 6th ed., Garland Publishing Co., New York, 2005; P. Delves et al. (eds.) Roitt's Essential Immunology (11th ed.) Wiley-Blackwell, 2006; I. Roitt et al., , Immunology (7th ed.) C.V. Mosby Co., St. Louis, MO (2006); Klein, J et al., Immunology (2nd ed), Blackwell Scientific Publications, Inc., Cambridge, MA, (1997)を含む。
【0069】
さらに、ポリクローナルおよびモノクローナル抗体の産生、単離、特徴づけ、および使用についてのとりわけ有用な方法は、下記の標準的な参照において記載されている: Harlow, E. et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1988); Harlow, E. et al., Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1998; Monoclonal Antibodies and Hybridomas: A New Dimension in Biological Analyses, Plenum Press, New York, NY (1980); H. Zola et al., in Monoclonal Hybridoma Antibodies: Techniques and Applications, CRC Press, 1982)。
【0070】
GLXAの製造および部分精製について、米国特許第5,716,793号(A.B. MacDonald et al.)を参照のこと。抗GLXA抗体(Ab1)は、ポリクローナルまたはモノクローナルであり得る。mAbの産生について、Id抗体GLXA-Ab1は、抗原としてGLXAまたは全クラミジア細菌を用いて、動物、一般的にはマウスを免疫することにより産生される。該動物の血清は、ポリクローナルAb1の起源であり得て、それは、多くの慣用的な方法のいずれかにより富化または精製され得る。次いで、慣用的な手順を用いて、動物の免疫脾臓細胞が同定され、単離され、リンパ腫もしくは骨髄腫細胞と融合される。その後、融合した細胞を選択培地においてインキュベートし、非融合腫瘍細胞の増殖を妨害する。ハイブリドーマ細胞は、例えば、限定希釈によりクローン化され、上清が分泌型mAbの望まれる特異性または反応性についてアッセイされる。MAbはまた、インビボにおいて腹腔内腹水腫瘍の形態でハイブリドーマ細胞を増殖させることにより産生され得る。あるいは、Bリンパ球産生抗GLXA Abは、エプスタイン・バーウイルスでの感染により不死化され得る。
【0071】
GLXA-mAb1を産生する適当なおよび好ましいハイブリドーマは、受託番号HB-11300としてAmerican Type Culture Collectionに寄託されいる。このmAbは、ELISA型酵素イムノアッセイ(EIA)において、C. trachomatis、C. pneumoniae、およびC. psittaciの15個の血清型のすべてと反応し、これは、属にわたる抗原の認識を証明する。
【0072】
本発明によると、微量抗原GLXAに特異的なId抗体(GLXA-Ab1)、好ましくは、mAb 抗GLXA Ab、最も好ましくは、HB-11300により産生されるmAb(米国特許第5,716,793号、第5,656,271号および第5,840,297号を参照のこと)は、下記の2つの主要な目的のために使用される:
(1) ライブラリー、例えばランダムファージディスプレイライブラリーにおいて、GLXAエピトープと立体構造を共有するペプチド(下記において「カテゴリー1」ペプチドと定義される)を同定すること; および
(2) GLXAエピトープの模倣体であるイディオタイプまたは「内部イメージ(internal images)」を示す、抗原結合部位、好ましくはVHもしくはVLドメインのCDR領域のペプチド(下記において「カテゴリー2」ペプチドと定義される)配列の起源として。これらのペプチドは、抗体VHもしくはVLドメインまたは一本鎖抗体(scFv)の長さよりも短いものとして定義される(Skerra, A. et al. (1988) Science, 240:1038-41; Huston JS et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-83; Pluckthun, A. et al. (1989) Methods Enzymol. 178:497-515; Winter, G. et al. (1991) Nature 349:293-9; Jost CR et al,. J Biol Chem. 1994 269:26267-73; 米国特許第4,704,692号、第4,853,871号、第4,946,778号、第5,260,203号、第5,455,030号)。
【0073】
本発明の基礎を形成する最初のペプチドは、下記の方法で得られるか、または推定された。
【0074】
(1) 「カテゴリー1」ペプチド
本発明者等は、偶然にGLXAを模倣したペプチドを検出するために、GLXAに特異的なGLXA-mAb1 (HB11300の産物)を用いてファージディスプレイライブラリー(New England BiolabsからのPhD-12ペプチドライブラリー、# E8110S) (また131を参照のこと)をスクリーニングすることにより、該ライブラリーからペプチド配列を得た。数回のパニングに基づいて、mAb1に結合した一組のペプチドを同定した。解析のために2個のペプチド(Pep4およびPep7)を最初に選択し、合成した(表1を参照のこと)。この群から同定され、試験されるペプチドは、ライブラリーが構築される方法に基づいて12merであるが、これと同じ手順が、同様の免疫学的特性を有し、同じ方法で免疫原として使用され得る異なるサイズの(より長いまたはより短い)ペプチドを同定するために有効であるであろう。
【0075】
(2) 「カテゴリー2」ペプチド
ハイブリドーマHB-11300により産生されるmAb2の重(H)鎖可変ドメイン(VH)および軽(L)鎖可変ドメイン(VL)をクローン化し、塩基配列を決定した。抗GLXA/抗クラミジアAbを誘導するための免疫原として有用なペプチドは、試験のために最初に選択され、VH鎖配列から生じ、本明細書に開示される他方は、VL鎖配列から生じるペプチドのこの「クラス」の基礎を形成するペプチドを含む。
【0076】
該mAb2のVH領域は、下記のDNAおよびコード化ペプチド配列を有する(ヌクレオチド配列は配列番号59であり、アミノ酸配列は配列番号60である。3個のCDR領域には下線が引かれて、標識されている)。
【0077】
【表2】

【0078】
該mAb2のVL領域は、下記のDNAおよびコード化ペプチド配列を有する(ヌクレオチド配列は配列番号61であり、アミノ酸配列は配列番号62である。3個のCDR領域には下線が引かれて、標識されている)。
【0079】
【表3】

【0080】
少なくとも1個のCDR領域をコードするV領域DNA配列またはその断片は、それ自体が抗Id免疫原であり、本発明によりGLXAと反応する抗抗Id抗体を誘導するDNAワクチンとして使用され得る。これらのDNA免疫原は、該DNA分子によりコードされるペプチド/ポリペプチドに対して免疫を誘導するために、当分野において既知の製剤、用量、および経路により投与される。好ましくは、DNA免疫原は、レシピエント、好ましくは、ヒトの細胞および組織において発現される発現ベクターである。したがって、DNA免疫原は、好ましくは、それらが発現されるべき種について好ましいコドンを利用し、最適な発現のための必須のプロモーター、エンハンサーなどを含む。
【0081】
同定された最初のペプチドは、VH CDR1、2および3 (各々、配列番号8、9および10)ならびにVL CDR1、2および3 (各々、配列番号12、13および14)の配列である(表1を参照のこと)。これらは、IMGT/V-QUEST (132)を用いて同定された。アミノ酸配列は、コードヌクレオチド配列から推定された。これらの6個の中で、VH CDR1 (Pep8と呼ばれる)およびVH CDR3ペプチド(Pep10と呼ばれる)が最初に選択され、合成された。
【0082】
また、mAb2のVL-ペプチドは、本発明の範囲内に含まれる。これらのペプチド配列は本明細書において提示されていないが、それらはまた、mAb2抗原結合領域が微量抗原(本明細書におけるGLXA)の分子模倣体として作用する(114)様式のために、GLXAを模倣する関連するエピトープを示す。mAb1は、mAb2 Ag結合部位(それは、VHおよびVLの両方のCDR1-3を含む)に特異的に結合する。
【0083】
表1: 免疫原性ペプチドの最初の群
【表4】

* 最初の試験は、Pep4、Pep7、Pep8およびPep10を用いて行われた(太字で示されている)。アンカー残基には下線が引かれている(下記を参照)。
# ペプチドカテゴリーが議論され、上記で定義されている。
【0084】
微量抗原、抗原に対する抗体、抗Id抗体および抗抗Id抗体の間のこの構造的関係は、当分野において既知であり、Niels Jerneにより最初に開発され、その後他者により発展させられたイディオタイプネットワーク概念の基礎となるものである。例えば、Westen-Schnurr, I., ed., Idiotypes: Antigens on the Inside: Workshop at the Basel Institute for Immunology, November 1981, Editiones Roche, Basel, 1982; Kohler, H, (ed) Idiotypy in Biology and Medicine, Academic Press, New York, 1984; Shoenfeld, Y et al.(eds) Idiotypes in Medicine: Autoimmunity, Infection and Cancer, Elsevier Science; 1st Ed., 1997; Jerne, NK, Ann. Immunol. 125C:373-389 (1974); Jerne, NK, Harvey Lectures 70:93-110 (1976); Jerne, NK EMBO J. 1:243-247, 1982; Jerne, NK , Immunol Rev 79:5-24 1984; Bona, C and Hiernaux. J. et al., Immune-Response - Idiotype Anti-Idiotype Network, CRC Crit. Rev. Immunol., 2:33-81 (1981); Schreiber, H., Adv. Canc. Res. 41:291-321 (1984); ); Augustin AA et al.,. Surv Immunol Res. 1983;2:78-87 Kohler H et al., Proc Soc Exp Biol Med. 1985; 178:189-95; Kieber-Emmons T et al., Int Rev Immunol. 1986; 1:1-26; Kennedy, RC et al., Scientific Amer. 255:48-56, 1986;; Kennedy RC et al., J Clin Invest. 1987;80:1217-24; Ertl HC and Bona CA, Vaccine. 1988 Apr;6:80-4; Bhattacharya-Chatterjee M and Kohler H, Adv Exp Med Biol. 1989;251:113-27: Raychaudhuri S, et al., Crit Rev Oncol Hematol. 1989; 9:109-24; Koehler H et al., Methods Enzymol. 1989;178:3-35; Kieber-Emmons T et al., Int Rev Immunol. 1987; 2:339-56; Nisonoff A., J Immunol. 1991;147:2429-38; Bhattacharya-Chatterjee M et al., Int Rev Immunol. 1991;7:289-302; Greenspan NS and Bona CA, Idiotypes: structure and immunogenicity. FASEB J. 1993, 7:437-44. Bona CA, Proc Soc Exp Biol Med. 1996:213:32-42を参照のこと。
【0085】
表1で示される好ましいペプチドは、カテゴリー1またはカテゴリー2ペプチドであるものとして示される。
【0086】
既知のアミノ酸配列を有するカテゴリー1(mAb1により認識され、GLXAを模倣する)の配列相同性についての広域Blastサーチは、本質的に関連しない相同性を示した。したがって、これらのペプチドは、新規であると考えられる。これと同じ方法および手段により開発される他のペプチドは、同様に評価される。
【0087】
予期されるとおり、mAb2に基づくCDR配列は、他のIgG H鎖またはscFv断片配列と相同である。しかしながら、本発明のペプチドは、特定かつ新規なものであると考えられ、それらは、明確に、免疫血清による免疫染色に基づいてクラミジアに特異的な免疫応答を誘導する。
【0088】
MHCアンカー残基について試験するために、プログラムPREDBALB/C (133)が用いられた。表1におけるすべてのペプチドは、抗原提示のために重要であり得る2個の推定上のアンカー残基を含む。
【0089】
本発明の免疫原は、記載されたさまざまな形態および製剤での、本明細書に開示された2個またはそれ以上のペプチドもしくは変異型の混合物を含む。
【0090】
アミノ酸置換変異型
上記のすべてのアミノ酸は、それらがDアミノ酸であることについての特別な言及がなければ、Lアミノ酸である。本発明は、1個またはそれ以上のLアミノ酸がそのD異性体で置換されている態様を含むことが理解されるべきである。
【0091】
本発明のペプチドの好ましい変異型は、ペプチド配列中の多くの特定の残基、好ましくは約4より多くの残基、より好ましくは3より多くの残基、より好ましくは2より多くの残基、または1より多くの残基が異なる残基で保存的に置換されたものである。タンパク質化学および構造の詳細な記載については、Schulz, GE et al., Principles of Protein Structure, Springer-Verlag, New York, 1979, and Creighton, TE, Proteins: Structure and Molecular Principles, W.H. Freeman & Co., San Francisco, 1984を参照のこと(該文献は、引用により本明細書の一部とする)。
【0092】
保存的置換は、下記の群のうちの1つの中で交換を含むものである:
1. 小脂肪族、非極性もしくはわずかな極性残基: 例えば、Ala、Ser、Thr、Gly;
2. 極性、負荷電残基およびそれらのアミド: 例えば、Asp、Asn、Glu、Gln;
3. 極性、正荷電残基: 例えば、His、Arg、Lys;
4. 大脂肪族、非極性残基: Met、Leu、Ile、Val (Cys); および
5. 大芳香族残基: Phe、Tyr、Trp。
Tyr (第5群中)は、その水素結合の可能性のために、Ser、Thrなど(1群)といくつかの関連を有する。そのまれな幾何学のために、Proは、その鎖を強固に拘束する。
【0093】
したがって、配列番号1-14のいずれかにおける下記の置換が存在し得る:
【表5】

【0094】
特に一般に見られるアミノ酸(また、有用な置換基を提供する)は、β-アラニン(β-Ala)および他のω-アミノ酸、例えば、3-アミノプロピオン酸、2,3-ジアミノプロピオン酸(Dpr)、4-アミノブチル酸など; α-アミノイソブチル酸(Aib); ε-アミノヘキサン酸(Aha); δ-アミノバレリアン酸(Ava); N-メチルグリシンまたはサルコシン(MeGly); オルニチン(Orn); シトルリン(Cit); t-ブチルアラニン(t-BuA); t-ブチルグリシン(t-BuG); N-メチルイソロイシン(MeIle); フェニルグリシン(Phg); シクロヘキシルアラニン(Cha); ノルロイシン(Nle); ナフチルアラニン(Nal); 4-クロロフェニルアラニン(Phe(4-Cl)); 2-フルオロフェニルアラニン(Phe(2-F)); 3-フルオロフェニルアラニン(Phe(3-F)); 4-フルオロフェニルアラニン(Phe(4-F)); ペニシラミン(Pen); 1,2,3,4-テトラヒドロイソキノリン-3-カルボン酸(Tic); β-2-チエニルアラニン(Thi); メチオニンスルホキシド(MSO); ホモアルギニン(hArg); N-アセチルリシン(AcLys); 2,4-ジアミノブチル酸(Dbu); 2,4-ジアミノブチル酸(Dab); p-アミノフェニルアラニン(Phe(pNH.sub.2)); N-メチルバリン(MeVal); ホモシステイン(hCys)、ホモフェニルアラニン(hPhe)およびホモセリン(hSer); ヒドロキシプロリン(Hyp)、ホモプロリン(hPro)、N-メチル化アミノ酸(例えば、N-置換グリシン)を含むが、これらに限定されない。
【0095】
アミノ酸およびペプチドの共有結合的修飾
ペプチドの共有結合的修飾が含まれ、ペプチドの標的アミノ酸残基を、選択される側鎖もしくは末端残基と反応することが可能な有機誘導体化剤と反応させることにより導入され得る。
【0096】
システイニル残基は、最も一般には、α-ハロアセテート(および相当するアミン)と反応し、カルボキシメチルもしくはカルボキシアミドメチル誘導体を生じる。システイニル残基はまた、ブロモトリフルオロアセトン、α-ブロモ-β-(5-イミドゾリル)プロピオン酸、クロロアセチルリン酸、N-アルキルマレイミド、3-ニトロ-2-ピリジルジスルフィド、メチル 2-ピリジルジスルフィド、p-クロロメルクリ安息香酸、2-クロロメルクリ-4-ニトロフェノール、またはクロロ-7-ニトロベンゾ-2-オキサ-1,3-ジアゾールとの反応により誘導体化される。
【0097】
ヒスチジル残基は、相対的にヒスチジル側鎖に特異的な薬剤であるジエチルプロカーボネートとの反応(pH 5.5-7.0)により誘導体化される。p-ブロモフェナシルブロミドがまた有用であり、該反応は、好ましくは、pH 6.0での0.1 M カコジル酸ナトリウム中で行われる。
【0098】
リシニルおよびアミノ末端残基は、コハク酸または他のカルボン酸無水物と反応する。これらの薬剤を用いた誘導体化は、リシニル残基の荷電を逆にする。α-アミノ含有残基を誘導体化するための他の適当な試薬は、イミドエステル、例えば、メチルピコリンイミデート; ピリドキサールリン酸; ピリドキサル; クロロボロハイドライド; トリニトロベンゼンスルホン酸; O-メチルイソウレア; 2,4ペンタンジオン; およびグリオキシル酸とのトランスアミナーゼ触媒反応を含む。
【0099】
アルギニル残基は、フェニルグリオキサール、2,3-ブタンジオン、1,2-シクロヘキサンジオンおよびニンヒドリンを含む1個またはいくつかの慣用的な試薬を用いた反応により修飾される。該誘導体化は、グアニジン官能基の高pKaのために、反応がアルカリ条件下で行われることを必要とする。さらに、これらの試薬は、リシンの基およびアルギニンα-アミノ基と反応し得る。
【0100】
チロシル残基の修飾は、スペクトル標識のペプチドへの導入を可能にした。これは、芳香族ジアゾニウム化合物またはテトラニトロメタンとの反応により達成される。最も一般的には、N-アセチルイミジソール(imidizol)およびテトラニトロメタンの各々が、O-アセチルチロシル種および3-ニトロ誘導体を製造するために使用される。
【0101】
カルボキシル側鎖基(アスパルチルまたはグルタミル)は、カルボジイミド(R'-N-C-N-R')、例えば、1-シクロヘキシル-3-(2-モルフォリニル-(4-エチル)カルボジイミドもしくは1-エチル-3-(4-アゾニア-4,4-ジメチルペンチル)カルボジイミドと反応することにより選択的に修飾される。
【0102】
アスパルチルおよびグルタミル残基は、アンモニウムイオンとの反応によりアスパラギニルおよびグルタミニル残基に変換される。逆に、グルタミニルおよびアスパラギニル残基は、対応するグルタミルおよびアスパルチル残基に脱アミド化され得る。脱アミド化は、穏やかな酸性条件下で行われ得る。これらの残基のいずれかの形態は、本発明の範囲内である。
【0103】
二機能性試薬を用いた誘導体化は、ペプチドを不水溶性担体マトリクスまたは他の高分子担体と架橋させるために有用である。通常使用される架橋剤は、1,1-ビス(ジアゾアセチル)-2-フェニルエタン、グルタルアルデヒド、N-ヒドロキシスクシンイミドエステル、4-アジドサリチル酸とのエステル、同種二機能性(homobifunctional)イミドエステル(ジスクシンイミジルエステル、例えば、3,3'-ジチオビス(スクシンイミジルプロピオネート)を含む)、および二機能性マレイミド、例えば、ビス-N-マレイミド-1,8-オクタンを含む。
【0104】
メチル-3-[(p-アジドフェニル)ジチオ]プロピオイミデートのような誘導体化剤は、光の存在下で架橋を形成することが可能な光活性化中間体を産生する。あるいは、不水溶性マトリクス、例えば、臭化シアン活性化糖質、ならびに米国特許第3,969,287号; 第3,691,016号; 第4,195,128号; 第4,247,642号; 第4,229,537号; および第4,330,440号に記載された反応基質がタンパク質固定化のために使用される。
【0105】
他の化学修飾は、プロリンおよびリシンの水酸化、セリルもしくはスレオニル残基のヒドロキシル基のリン酸化、リシン、アルギニンおよびヒスチジン側鎖のα-アミノ基のメチル化(上記のCreighton)、N末端アミンのアセチル化、およびある場合においてC末端カルボキシルのアミド化を含む。
【0106】
そのような化学的に修飾および誘導体化された部分は、ペプチドの溶解性、吸収、生物学的半減期などを改善し得る。これらの変化は、インビボにおけるタンパク質の望まれない副作用を除去するか、もしくは減少させ得る。そのような効果を仲介することが可能な部分は、例えば、Gennaro, AR, Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins Publishers; 21st Ed, 2005 (すなわち、最新版)に開示されている。
【0107】
合成ペプチド複合体の作製
1つの態様において、合成ペプチドは、免疫原を製剤化するために使用される。合成ペプチドは、固相化学合成により商業的に生産され得る。それらは、下記の表2および3で示されるペプチドような環状ペプチドを含む。
【0108】
2個の異なる環状化方法が使用され得る。(a) 2個の付加されたCys残基間のジスルフィド結合(または、末端CysがPep9において存在する場合には、反対側の末端における単一のCysで十分であり得る)。下記の表2において、付加された末端Cys残基には下線が引かれている。
【0109】
表2: 環状ペプチドの直線配列(C-C結合*)
【表6】

* 元のペプチドに付加されたCys (C)残基には下線が引かれている。
【0110】
(b) 上記の末端Cys残基の部分に導入され得るGluおよびLysの側鎖の共有化学結合(それは、N末端GluとC末端LysまたはN末端LysとC末端Gluにより結合されるペプチドを生じる)。付加された末端KおよびE残基には、下記の表3において下線が引かれている。
【0111】
表3: 環状ペプチドの直線配列(K-EまたはE-K結合*)
【表7】

* 元のペプチドに付加されたGlu (E)またはLys (K)残基には下線が引かれている。
【0112】
隣接するGluおよびLys残基側鎖による環状化は、NもしくはC末端Cysがマレイミド部分により架橋されるためのチオールドナーとして機能するために導入され得るという点で、付加された利点を有する。
【0113】
合成ペプチドは、モノマー、またはペプチドの免疫原性の発現を促進するか、もしくは可能にする任意の適当な「担体」分子と結合したものとして作製され得る(下記を参照のこと)。
【0114】
1つの態様において、合成ペプチドは、分枝ポリ-LysまたはLysデンドリマー(4、8および16残基)に結合され得る。
【0115】
合成ペプチドは、好ましくは、例えばHPLCにより少なくとも80%の純度まで精製される。
【0116】
ペプチドは、(a) mAb1 (抗クラミジアGLXA)に効率的に結合する、および/または(b) GLXAまたは非修飾ペプチド(例えば、Pep1-Pep11のいずれか)に対するその特異性により特徴づけられる抗体応答を誘導するするそれらの能力について調べられる。(b)において産生される抗体は、クラミジア感染細胞への結合または生物学的活性、例えば、クラミジア中和もしくは微生物に対する特異的応答の誘導、例えば、ペプチド免疫化マウスまたは他の哺乳動物から得られたTおよび/またはB細胞によるサイトカイン放出について試験され得るが、再び、これは、ELISAにより最も効率的に実施され得る。
【0117】
ペプチドはまた、既知の方法を用いてファージ上に提示され得る。ファージ上に提示されたペプチドについて、ファージは、ペプチドをその長さに沿って固定した「スカホールド」として機能する。この例示は、免疫原性活性のために極めて有効である。あるいは、合成ペプチドは、N末端マルトース結合タンパク質(MBP)融合物として効率的に発現される。
【0118】
Ab1のための特定のペプチド(すなわち、抗原)の親和性は、さらなる架橋剤を必要とすることなく、複合体が免疫原として投与されるために十分であり得る。
【0119】
架橋はタンパク質を変性させ得るが、にもかかわらず、架橋剤は、ワクチンにおいて使用される免疫原を安定化させるか、もしくは病原体を不活化するために使用される。したがって、架橋剤の使用は、本発明の免疫原と適合するものである。架橋された免疫原は、通常の方法を用いて、架橋複合体と一連の定義されたmAbの結合を試験することにより評価される。
【0120】
マルチマーペプチドおよび融合タンパク質(ポリタンパク質)
本発明はまた、本発明の免疫原性GLXA模倣ペプチドまたはその置換もしくは付加変異型、またはその化学的誘導体の配列が、介在スペーサーまたはリンカーの有無で2から約100回繰り返されたより長いペプチドまたはポリペプチドを含む。そのような分子は、当分野において、マルチマー、コンカテマーまたはマルチエピトープポリタンパク質と交換可能に呼ばれ、本明細書において主にペプチドマルチマーとして記載されている。それらが組み換え的に産生されると、また融合ポリペプチドまたは融合タンパク質であると考えられる。
【0121】
この節において「P」として記号化されたペプチドのマルチマーは、式(P Xm )n P(式中、m= 0または1であり、n = 1-100である)により示される。Xは、例えば1-20 Gly残基からなるスペーサー基、切断可能リンカーを含む他の既知のスペーサー/リンカー(下記を参照のこと)または化学的架橋剤である。したがって、m=0であるとき、スペーサーは、ペプチドに付加されていない。n=1であるとき、マルチマーは、ダイマーなどである。
【0122】
これらのマルチマーは、本明細書に記載された本発明の免疫原性ペプチドまたは変異型のいずれかから構築され得る。さらに、ペプチドマルチマーは、ペプチドモノマー(天然配列またはその変異型から)の異なる組み合わせを含み得る。したがって、マルチマーは、最初のペプチドの数回の連続した繰り返し、次いで、第2ペプチドなどの1回またはそれ以上の繰り返しを含み得る。そのようなマルチマーペプチドは、個々のペプチドの化学合成、組み換えDNA技術または組み合わせ、例えば、組み換え的に産生されたマルチマーの化学的結合により作製され得る。
【0123】
化学合成により産生される場合には、マルチマーは、コアペプチド配列の2-12リピート、より好ましくは2-8リピートを有し、マルチマー中の全アミノ酸数は、約110残基(または、リンカーまたはスペーサーを含む場合にはそれらの同等体)を超えないはずである。
【0124】
好ましい合成化学ペプチドマルチマーは、式P1n(式中、P1は、本発明の免疫原性ペプチド(または該ペプチドの置換もしくは付加変異型)であり、n=2-8である)を有し、ここで、単独もしくはマルチマー型でのペプチドは、望まれる免疫反応性を有する。
【0125】
他の好ましい態様において、好ましい合成化学ペプチドマルチマーは、式(P1-Xm )n P2(式中、P1およびP2は、免疫原性ペプチドまたはこれらのペプチドの付加変異型であり、(a) P1およびP2は、同じであるか、または異なるものであり得て; さらに、マルチマー中に各々生じるP1は、その隣接するものとは異なるペプチド(または、変異型)であり; (b) Xは、4個までの酸素原子を含むC1-C5アルキル、C1-C5アルケニル、C1-C5アルキニル、C1-C5ポリエステルであり、m = 0または1であり、そしてn = 1-7であり; Xはまた、Glyzであってもよく、z = 1-6である)を有し、ここで、単独もしくはマルチマー型でのペプチドは、抗GLXA抗体(Ab1)、好ましくは、HB11300により産生されたmAbと反応する免疫学的活性を有する。
【0126】
組み換え的に産生される場合において、スペーサーは、上記のGlyz (式中、z=1-6である)であり、マルチマーは、発現系により可能な多くのコアペプチド配列のリピート、例えば、2〜約100リピートを有し得る。好ましい組み換え的に産生されるペプチドマルチマーは、式P1 Glyz )n P2(式中、(a) P1およびP2は、明細書において記載された免疫原性のGLXA模倣ペプチド、またはこれらのペプチドの置換もしくは付加変異型であり、P1およびP2は、同じであるか、または異なるものであり得て; さらに、マルチマー中に各々生じるP1は、その隣接するものとは異なるペプチド(または、変異型)であり、n = 1-100であり、z = 0-6であり; そして(b) 単独もしくはマルチマー型でのペプチドは、望まれる免疫反応性を有する)を有する。
【0127】
上記のペプチドマルチマーにおいて、P1およびP2は、好ましくは、Pep1-Pep14 (すなわち、配列番号1から配列番号14)のうちのいずれか1個から選択される。マルチマーは、所望により、そのNもしくはC末端でキャップされる。
【0128】
該マルチマーは、本明細書に記載されたペプチドまたは変異型のいずれかから構築され得ることが理解される。マルチマーのさらなる変異型モノマーユニットが上記の生物学的活性を有すること好ましいが、これは、それらがその一部であるマルチマーが活性を有するかぎりにおいて必要ではない。
【0129】
本発明は、末端間で直接、もしくはモノマーリピート間のリンカー配列により結合した上記ペプチドモノマーの2個またはそれ以上のリピートの直鎖マルチマーを含み得る融合ポリペプチドを含み、それはさらに、本発明による本発明の免疫原性ペプチドの活性を高めることを可能にする他のポリペプチド配列と融合し得る。一般的な例は、ペプチドと免疫原性ポリペプチドの複合体であり、特に、強力なヘルパーT細胞活性を誘導するものである。これらの多くは、当分野において既知である。
【0130】
したがって、本発明のマルチマーおよび融合ポリペプチドは、2個以上のGLXA様エピトープを含み得て、免疫原性組成物は、各々が1個またはそれ以上の本発明のペプチドを含む該マルチマーまたは融合タンパク質の混合物を含み得る。
【0131】
また、タンデムに(「並んで」)結合した上記ペプチドの2個または3個のリピートを含む「タンデム」オリゴマーペプチドが本発明に包含される。
【0132】
ペプチドおよびマルチマーはさらに化学的に結合され得て、より複雑なマルチマーおよびより大きな凝集体を形成し得る。好ましい複合体マルチマーは、Cysを含み、これらの残基の-SH基間のジスルフィド結合を形成することにより産生され、その結果、分岐鎖および直鎖ペプチドもしくはポリペプチドを生じる。
【0133】
上記のスペーサー/リンカーに加えて、またはその代替物として、本発明のマルチマーおよび融合ポリペプチドは、酵素、好ましくは、マトリクスメタロプロテアーゼ、ウロキナーゼ、カテプシン、プラスミンまたはトロンビンにより切断可能なリンカーを含み得る。これらは、例えば、配列VPRGSD (配列番号63)またはDDKDWH (配列番号64)のペプチドリンカーであるが、それに限定されるものではない。マルチマー中のペプチドの免疫原性能力を妨害しない限り、当分野において既知である任意の切断可能もしくは非切断可能リンカーが使用され得る。
【0134】
本発明のペプチドは、上記のマルチマーおよび融合ポリペプチドの形態のいずれか、または単一ペプチドまたは他のタンパク質、例えば、免疫原性もしくはワクチン組成物として用いられた場合にそれらの免疫原性を高め得る担体分子もしくは他のタンパク質と融合した該ペプチドの混合物の1個またはそれ以上のリピートを含むことが当分野において既知のマルチマーおよび融合ポリペプチドの形態のいずれかで組み合わせることができる。
【0135】
アジュバント、免疫刺激剤およびペプチド免疫原製剤
本ペプチド免疫原の免疫原性は、外因性アジュバント、免疫刺激剤、デポ材料などの存在下で促進される。したがって、本明細書に記載されたペプチドまたはペプチド複合体に加えて、本発明の免疫原性組成物は、好ましくは、1個またはそれ以上のアジュバントもしくは免疫刺激剤を含む。ペプチド免疫原と関連して下記されているものの多くはまた、DNA免疫原、例えば、mAb2 V領域鎖の関連する部分、ドメイン、またはそのより短い配列をコードするDNAにおいて適用可能であることが当分野において既知であり、それは、本発明の別の態様である。
【0136】
免疫原としてのペプチドの有効性に付加され得るアジュバントまたは薬剤は、例えば、水酸化アルミニウム、リン酸アルミニウム、硫酸アルミニウムカリウム(alum)、硫酸ベリリウム、シリカ、カオリン、カーボン、油中水型乳剤、水中油型乳剤、ムラミールジペプチド、細菌エンドトキシン、リピドX、細菌Propionobacterium acnesまたはBordetella pertussisの全個体もしくは細胞内画分、ポリリボヌクレオチド、アルギン酸ナトリウム、ラノリン、リソレシチン、ビタミンA、サポニンおよびサポニン誘導体(例えば、QS21(登録商標))、リポソーム、レバミゾール、DEAE-デキストラン、妨害コポリマーもしくは他の合成アジュバント、またはCpGオリゴヌクレオチドを含む。他のアジュバントは、ISAF-1 (0.4mgのthreonyl-muramyl dipeptideを含有するリン酸緩衝液中の5%スクアレン、2.5%プルロニックL121、0.2% Tween 80)である(Kwak, LW et al., 1992, N. Engl. J. Med., 327: 1209-1238)。そのようなアジュバントは、さまざまな起源から市販で入手可能であり、例えば、Merck Adjuvant 65 (Merck and Company, Inc., Rahway, NJ)またはフロイント不完全アジュバントおよび完全アジュバント(Difco Laboratories, Detroit, MI)、Amphigen(登録商標) (水中油型)、Alhydrogel(登録商標) (水酸化アルミニウム)、またはAmphigen(登録商標)およびAlhydrogel(登録商標)の混合物である。アルミニウムは、ヒト使用のために承認されている。ワクチン材料は、ビーズ、例えば、ラテックスもしくは金ビーズ、ISCOMなどに吸着するか、もしくは結合され得る。ワクチンを製造する一般的な方法は、上記のGennaro, Remington's Pharmaceutical Sciencesに記載されている。
【0137】
アジュバントは、好ましくは、1個またはそれ以上の(a) Ribiアジュバント; (b) 0.4 mg トレオニル-ムラミルジペプチドを含むリン酸緩衝液中のISAF-1 (5% スクアレン、2.5% プルロニックL121、0.2% Tween 80); (c) Amphigen(登録商標); (d) Alhydrogel; (e) Amphigen(登録商標)とAlhydrogel(登録商標)の混合物;(f) QS21(登録商標); または(g) モノホスホリルリピドAアジュバントである。好ましいアジュバントは、モノホスホリルリピドAである。
【0138】
リポソームは医薬組成物であり、ここで、活性なペプチドまたはタンパク質は、分散して含まれるか、または脂質層に接着した水性同心円層からなる微粒子でさまざまに存在する。活性ペプチドは、好ましくは、水性層および脂質層に、内側もしくは外側に、またはとにかくリポソーム懸濁液として一般に知られている非均一系で存在する。親油性層、すなわち脂質層は、一般に(常にではない)、レシチンおよびスフィンゴミエリンのようなホスホリピド、コレステロールのようなステロイド、ジセチルホスフェート、ステアリルアミンもしくはホスファチジン酸のような事実上のイオン性界面活性物質、および/または親油性の性質を有する他の材料を含む。リポソームを含むアジュバントは、下記の文献において議論されており、該文献は、引用により本明細書の一部とする: Gregoriades, G. et al., Immunological Adjuvants and Vaccines, Plenum Press, New York, 1989; Michalek, S.M. et al., 1989, Curr. Top. Microbiol. Immunol. 146:51-8。
【0139】
ワクチン設計、特に制御放出系のさらなる議論は、Powell, M.F. et al. (eds), Vaccine Design: The Subunit and Adjuvant Approach, Powell, M.F. et al. (eds), Plenum Press, New York, 1995, p 389-412において見出され得る。制御放出系は、薬物およびホルモンを送達するための「デポ」として、ヒトにおいてすでに使用されている(Langer, R., 1990, Science 249: 1527-1533)。そのような系は、それらが継続して、または決められた速度での間隔パルス(spaced pulses)で、制御された量の免疫原を送達するように設計され得て(Cohen et al., 1991, Pharm. Res. 8:713 720; Eldridge et al., 1991a, Mol. Immunol. 28:287 294; Gander et al. 1993, in: Proc. Int'l Symp . Control. Rel. Bioact. Mater., Controlled Release Society, Washington, DC, pp. 65 66)、同時に、未送達の抗原性材料のインビボにおける急速な分解から保護するので、免疫付与においてかなりの影響を与え得る。
【0140】
'
制御放出マイクロスフィアを含むマイクロスフィアは、経口免疫のためのかなりの可能性を有する(Edelman et al., 1993, Vaccine 11:155 158; Eldridge et al., 1990, J. Control. Rel. 11:205 214; McQueen et al., 1993, Vaccine 11:201 206; Moldoveanu et al., 1989,, Curr Top. Microbiol. Immunol. 146:91 99; O'Hagan et al., 1993b, Vaccine 11: 149 154; Reid et al. 1993, Vaccine 11:159 167 Panyam J and Labhasetwar V (2003) Adv Drug Deliv Rev 55:329-47; およびPanyam J and Labhasetwar V (2004) Mol Pharm. 1:77-84, 2004)。ポリマー制御放出系の潜在的な他の利点は、下記を含む: 減少したコストを生じるより少ない投与量の必要性; 抗原の抗原提示細胞またはリンパ系への局在もしくは標的化送達; 1回の投与で2個以上のペプチドまたはいくつかのエピトープに対して個体を免疫化し得る製剤の設計を促進する、封入化され得る2個以上の抗原; および改善された患者コンプライアンス。さらに、制御放出系は、最適なワクチン接種のために必要とされる免疫原投与の数を1回までに減少させ得る。
【0141】
マイクロスフィアは、下記の2つの理由のために制御放出免疫原担体として特に研究されている: (1) 直径が10 μmよりも大きな粒子は、投与部位において、持続される高レベルの抗体免疫応答のために必要とされ得る抗原の長期持続を提供することができ、および(2) 1-10 μmのサイズ範囲におけるマイクロ粒子は、マクロファージに容易に取り込まれ(Eldridge et al., 1989, Adv. Exp. Med. Biol. 251:192202; Tabata et al., 1988, Biomaterials 9:356 362; J. Biomed Mater Res. 22:837 858)、その結果、抗原の抗原提示細胞への直接的な細胞内送達を生じる。
【0142】
マクロファージによりマイクロスフィア食作用は、一般に疎水性表面を有するマイクロスフィアが親水性表面を有するものよりも容易に取り込まれるので、表面特性を変えることにより増大させることができる(Tabata et al., 1988, Biomaterials 9:356 362; Tabata et al., 1990, Crit. Rev. Ther Drug Carrier Syst. 7:121 148)。
【0143】
免疫原送達のためにポリマーマイクロスフィアを用いることの利点は、抗原が放出される投与後の時間を制御する能力である。この能力により、投与後の決められた時間に、複数の免疫原の「パルス」または免疫原を放出する単回投与製剤の製造が可能となる(Gilley et al., 1992, In: Proc. Int'l. Symp. Control. Rel. Bioact. Mater, Controlled Release Society, Orlando, pp. 110 111)。ポリマーマイクロスフィアからの抗原放出動態は、ポリマー組成物および分子量、免疫原とポリマーの重量比(すなわち、免疫原搭載)、ならびにマイクロスフィアサイズ(Hanes et al., In: Reproductive Immunology, 1995, R. Bronson et al., eds, Blackwell. Oxford)のような変数の単純な操作により、かなりの程度まで制御され得る。
【0144】
より小さい(1-10 μm)およびより大きい(20-50 μm)マイクロスフィアの組み合わせを含む製剤は、専ら1つの範囲または他の範囲の直径を有するマイクロスフィアに封入された免疫原の投与と比較してより強くかつ長期にわたり持続する応答を産生し得る(Eldridge et al., 1991a, Mol. Immunol. 28:287 294; and Keegan et al.) (42)。1つの試験において、破傷風トキソイド(TT)含有マイクロスフィアが、慣用的なワクチン接種計画を模倣するために、投与後最初の数日の間、次いで、各々1および3ヶ月後の2回の「追加免疫」後に放出される強力な抗原刺激用量を産生するように調製された(上記のGander et al.)。
【0145】
上記したmAb2 (ハイブリドーマHB11301の生成物)、ひいては本発明のペプチドのマイクロ封入は、特に、経口または粘膜免疫付与を達成するために有用である。本発明者等により観察されたそのような製剤の1つの利点は、樹状細胞(DC)成熟の誘導であった。したがって、この調製物を用いた未成熟骨髄由来単核細胞のパルス化(pulsing)は、それらの成熟DC表現型に影響を与えた。細胞は、5-7日間、GM-CSFと共にインキュベートされた後に、マイクロスフィア中の1.2または12 μg/mlのmAb2で24時間パルスされた。細胞は、DCマーカーCD11cおよび成熟DCマーカーCD86で染色された。二重陽性DCの割合は、非パルス細胞またはLPSで刺激された細胞と比較して、マイクロスフィアパルス化で増加した。UV不活化クラミジアEBは、DC成熟マーカーについて同様の効果を有し、粒子抗原がDCについてのこの効果を有するという理解と一致する。
【0146】
ワクチンのマイクロ封入のために最も広く使用されるポリマーは、乳酸およびグリコール酸に基づくポリエステルであった。これらのポリマーは、いくつかの利点を有し、それは、それらのインビトロおよびインビボ分解速度についての広範なデータ(Lewis, 1990, In: Biodegradable Polymers as Drug Delivery Systems (Chasin and Langer, eds.), Dekker, New York, pp. 1 41; Tice and Tabibi, 1992, In: Treatise on Controlled Drug Delivery (A. Kydonieus, ed.), Dekker, New York, pp. 315 39)、および外科縫合のようなヒトにおける多くの臨床適用についてのFDAによる承認(Gilding et al., 1979, Polymer 20:1459 1464; Schneider, 1972, U.S. 3,636,956)、および酢酸ロイプロリドについての30日間のマイクロスフィアに基づく制御送達系(Lupron Depot) (Okada et al., 1991, Pharm. Res. 8:787 791; 上記のKeegan et al.; 上記のPanyam et al.)を含む。
【0147】
ラクチド/グリコリドポリエステルについてのいくつかの代替物は、アジュバント特性を有する特定の分子に分解される生分解性ポリマーを含み、特に、より弱い免疫原性抗原の担体として有用であり得る。L-チロシン誘導体(Wheeler et al, 1982, Int. Arch. Allergy Appl. Immunol. 69:113 119; Wheeler et al., 1984, Int. Arch. Allergy Appl. Immunol. 75:294 299)の既知のアジュバント性のために、ジチロシン誘導体に基づくポリマーがLangerおよび同僚等により合成され(Kohn et al., 1986, Biomaterials 7:176 82)、モデル抗原としてウシ血清アルブミンBSAを用いて試験された(Kohn et al., 1986, J. Immunol. Methods 95:31 38)。生分解性ポリ(CTTHイミノカーボネート)が、その主な分解産物N-ベンジルオキシカルボニル-L-チロシル-L-チロシンヘキシルエステル(CTTH)が完全フロイント(CFA)およびムラミルジペプチド(MDP)と同じくらいのアジュバントとして有力であることが見出されたために選択された。
【0148】
マクロファージにより取り込まれる固有の性質(Tabata et al., 1986, J. Bioact. Compat. Polym. 1:32 46)ならびに医薬および医療適用における広範囲の使用のために、ゼラチンは、ワクチンのマイクロ封入のための有用なポリマーである(Tabata et al., 1993, in: Proc. Int. Symp. Control. Rel. Bioact. Mater, Controlled Release Society, Washington, DC, pp. 392 393)。ゼラチンマイクロスフィアはまた、免疫刺激剤、例えば、MDPおよびインターフェロン-αを封入するために使用されている(Tabata et al., 1987, J Pharm Pharmacol. 39:698 704; 1989, Pharm. Res. 6:422-7)。マイクロスフィア封入MDPは、約2000倍低い濃度で、遊離MDPよりもずっと短い時間でマクロファージを活性化する。MDPおよびワクチン含有ゼラチンマイクロスフィアの組み合わせは、極めて有力なワクチン製剤を産生し得る。
【0149】
リポソームは、その多くはマクロファージおよび高密度リポタンパク質による素早い分解のために、しばしばインビボにおいて不安定であり(Schreier et al., 1987, J. Control. Rel. 5:187 92)、したがって、皮下または筋肉内に投与されると、短時間の抗原補給(depot)効果のみを提供する(Eppstein et al., 1985, Proc Natl Acad Sci USA 82:3688 92; Weiner et al., 1985, J. Pharm. Sci. 74:922 5)。リポソームのインビボ半減期を延長させる1つの方法(Cohen et al., 1991, Proc Natl Acad Sci USA 88:10440 44)は、免疫原含有リポソームをマイクロスフィアに封入するアルギン酸塩ポリマーの使用であり、それにより、インビボにおける素早い分解からそれらを保護する。アルギン酸塩NPは、本発明者等のうちの1人により、容易に感染細胞に導入されることが示され、本明細書において意図される他の製剤である。拍動性の免疫原放出動態を提供することができる酵素学的に活性なマイクロスフィア封入リポソーム(MEL)がまた製造されている(Kibat et al., 1990, FASEB J. 4:2533 39)。MELはまた、経口/粘膜投与のための担体として増大した安定性を示すことが予期される。
【0150】
さまざまな放出様式および持続性を可能にする免疫原搭載マイクロスフィアを製造するために、さまざまな方法が使用され得る。一般に最適な方法は、適当なサイズのマイクロスフィアを製造する方法の能力と組み合わされた、製造条件と抗原および使用されるポリマー賦形剤との相対的な適合性(例えば、最も少ない免疫原性の欠損を生じる方法)により決定される。
【0151】
溶媒蒸発技術は、調製の相対的な容易さ、大規模化の容易さ、および高封入効率が達成され得るために一般的である。有機溶媒に感受性のある免疫原について特に重要なのは、複数のエマルジョン技術であり得る(上記のCohen et al., 1991, Pharm. Res.)。スプレー乾燥およびフィルム被覆(film casing)技術がまた、単一のポリマーマイクロスフィアを製造するために使用されている。
【0152】
本発明者および同僚等は、PLGA NPがキトサンコアシェル粒子に封入され得ることを示した。ペプチドがNPまたはCS粒子に搭載される場合に、肺により免疫するための経肺送達が使用され得る。
【0153】
マイクロカプセルは、薄いポリマー膜により囲まれた免疫原搭載コアからなり、そのために、しばしば「貯留(reservoir)」系と呼ばれる。
【0154】
デバイス開発の間の担体および免疫原の安定性、貯蔵、およびインビボ補給は、関心のある事項である。ポリペプチド抗原は、免疫原性に重要な不安定な三次元構造を有し得る。この3D構造は、抗原が変性もしくは凝集しやすいものである場合には、傷つけられるか、または失われ得る。制御放出装置の製造における有機溶媒への曝露、湿気への曝露について凍結乾燥後の再水和、またはポリマー賦形剤または他の化学薬品との複雑な化学的相互作用は、ペプチド/タンパク質に基づくワクチンの免疫原性の欠損もしくは減少を生じ得る。下記の文献には、複合体抗原の安定性について記載されている: Arakawa et al., 1993, Adv. Drug Deliv. Rev. 10: 1 28; Liu et al., 1991, Biotechnol. Bioeng. 37:177 184; Volin and Klibanov, 1989, In: Protein Function: A Practical Approach (T. E. Creighton, ed.). IRL Press, Oxford, pp. 1 24。
【0155】
ペプチド搭載ポリラクチド(PLA)またはPLGAマイクロおよび/またはナノ粒子の製造における1つの好ましい方法は、下記のとおりである。選択されたペプチドを搭載した生分解性PLAまたはPLGAナノ粒子(NP)は、以前にLiおよび同僚等により記載されたもの(139)と同様の手順で、二重エマルジョン溶媒蒸発技術の修飾版を用いて製造される。この方法は、ペプチドの生物学的活性を維持するのに十分に穏やかであることが証明されており、高い搭載効率を生じる。簡潔には、ペプチドの水性溶液が、PLGAを含むジクロロメタンで乳化され(超音波ホモジナイザーを用いて)、その結果、最初の油中水型(w/o)エマルジョンが形成される。次いで、製造されたw/oエマルジョンが、安定化剤としてポリビニルアルコール(PVA)を含む第2の水性層で乳化され、その結果、複数のw/o/wエマルジョンが生じる。その後、2倍のエマルジョンを多量のPVAの水性溶液に加え、数時間撹拌し、有機溶媒を蒸発させる。次いで、生じたナノ粒子を遠心分離により回収し、数時間洗浄し(PVAを除去する)、その後、凍結乾燥し、残りの水を除去する(139,140)。粉末は、使用まで−80℃で維持される。ペプチドおよびポリマーの濃度は、マウスあたり約10 μgペプチド/mlの経口送達について、1-10 μg/mgポリマーのペプチド濃度を達成するように変えられる。NPは、マウスへの投与または培養細胞への添加前にフィルター滅菌される。エンドトキシンがクラミジアの生存を大幅に減少させるので、汚染を回避するあらゆる努力が望ましい。保護免疫付与のための最適なペプチド搭載濃度は、経験的に、例えば、経口的に送達されるペプチド-NPを皮下で送達される遊離ペプチドと比較することにより決定される。注意が払われるべきパラメーターは、溶媒および安定化剤の型を含む形態(サイズおよびサイズ分布)、搭載効率および放出プロファイルに影響を与えるものであり、投入エネルギーおよびw/o比率は、最初の実験で調べられるであろう(134, 135)。直径50-200 nmのNPが粘膜摂取のために最も有効であると考えられる(136, 137)。
【0156】
免疫付与前に、ペプチド-NPの各々の新規調製物は、好ましくは、4-5個体のマウスのSC免疫付与により、保存された免疫原性について試験される。血液は、ELISAによる試験のために、各免疫付与/追加免疫の前に回収される。既知のポジティブおよびネガティブコントロールは、関連するELISAに含まれる。
【0157】
ポリマーマイクロスフィア製剤の利点は、多くのポリマーが、乾燥が保たれる場合には、長期間室温で安定であることである。例えば、ラクチド/グリコリドポリエステルは、乾燥が保たれ、約40℃以下である場合には、安定であることが報告されている(Aguado et al., 1992, Immunobiology 184:113 25)。さらに、ワクチンは、マイクロスフィア製剤中で、乾燥状態で保存され得て、これは、何人かの患者が湿度誘導凝集を受けやすいことを考慮すると、重要な利点である(上記のLiu et al.)。
【0158】
組成物は、好ましくは、(1) 有効量の免疫原または免疫原性複合体、(2) 適当な量の担体分子、または所望により担体ビヒクル、ならびに所望により(3) 保存剤、緩衝液などを含む。製剤の記載は、Voller, A. et al., New Trends and Developments in Vaccines, University Park Press, Baltimore, MD, 1978において見出される。
【0159】
1つの態様において、免疫原性組成物は、1個またはそれ以上のサイトカイン、例えば、IL-2、GM-CSF、IL-4などを含む。インターフェロン誘導性タンパク質10およびMCP-3のような炎症性サイトカインが付加され得る(Biragyn A et al., 1999, Nature Biotechnol. 17:253-8)。一般に、炎症性応答を誘導もしくは促進し、抗原提示細胞(APC)を集め、ポリペプチド抗原のケモカイン受容体仲介摂取のためにAPCの標的化を促進する任意のサイトカインまたはケモカインが、本発明の製剤において有用であると考えられる。
【0160】
免疫を誘導するすべての免疫原性組成物と同様に、本発明の免疫学的に有効な量のポリペプチド複合体は、経験的に決定されるに違いない。本発明のペプチドの免疫原性を含む考慮されるべき因子は、アジュバントもしくは担体タンパク質もしくは他の担体とさらなる複合体を生じるか否か、またはそれらと共有的に結合するか否か、ならびに投与経路および投与されるべき免疫投与の回数である。そのような因子は、ワクチン分野において既知であり、過度の負担なくそのような決定を行うことは免疫学者の能力の範囲内である。
【0161】
ペプチド免疫原とアジュバントの比率は、両者が有効量で存在するかぎりにおいて、広範囲で変わり得る。例えば、水酸化アルミニウムは、混合物の約0.5%の量で存在し得る(A12O3を基礎として)。
【0162】
製剤後、組成物は滅菌容器に入れられ、密閉され、低温、例えば、4℃または−20℃または−80℃で保存され得る。あるいは、材料は、凍結乾燥され得て、それは、安定化形態での長期間の貯蔵を可能にする。
【0163】
医薬製剤は、医薬化学の慣用的な技術に基づいて製造される。医薬組成物はまた、少量の非毒性補助物質、例えば、湿潤もしくは乳化剤、pH緩衝剤などを含み得る。ペプチド/複合体は、注射による投与のために慣用的な薬学的に許容される非経口ビヒクルを用いて製剤化される。これらのビヒクルは、非毒性および治療的であり、多くの製剤がGennaro (上記のRemington's Pharmaceutical Sciences)において説明されている。賦形剤は、例えば、水、生理食塩水、リンガー液、デキストロース溶液およびハンクス平衡塩溶液であるが、これらに限定されない。本発明による製剤はまた、少量の添加剤、例えば、等張性、生理学的pHおよび安定性を維持する物質を含み得る。さらに、適当な油性注射用懸濁液としての活性化合物の懸濁液が投与され得る。適当な親油性溶媒またはビヒクルは、脂肪油、例えば、ゴマ油、または合成脂肪酸エステル、例えば、オレイン酸エチルもしくはトリグリセリドを含む。水性注射懸濁液は、懸濁液の粘性を増大させる物質を含み得る。所望により、懸濁液は、安定化剤を含み得る。
【0164】
本発明のペプチドおよび他の有用な組成物は、好ましくは、約1.0 ng/ml〜100 mg/mlの濃度で、好ましくは、凝集体および他のタンパク質材料を実質的に含まない精製型で製剤化される。
【0165】
免疫原性担体としてのウイルス、バクテリオファージまたは細菌
さらなるバリエーションにおいて、本発明の免疫原性ペプチドまたは複合体は、免疫原性組成物の一部としてウイルスまたは細菌により提示され得る。免疫原性ペプチドをコードする核酸は、ウイルスまたは細菌のゲノムもしくはエピソームに組み込まれる。所望により、核酸は、免疫原性ペプチドが、分泌型タンパク質として、またはウイルスの外部表面タンパク質もしくは細菌の膜貫通タンパク質との融合タンパク質として発現されるような方法で組み込まれる(後者の場合には、その結果としてペプチドが提示される)。該方法で使用されるウイルスまたは細菌は、非病原性であるか、または弱毒化されているべきである。適当なウイルスは、アデノウイルス、HSV、ベネズエラウマ脳炎ウイルスおよび他のアルファウイルス、水疱性口内炎ウイルスおよび他のラブドウイルス、ワクシニアおよび鶏痘ウイルスを含む。適当な細菌は、SalmonellaおよびShigellaを含む。
【0166】
ファージ表面と融合した免疫原性エピトープを含むもののような短いペプチドの提示はまた、有用な免疫原として使用される。糸状バクテリオファージは、さまざまな生物学的系における上記ペプチドの発現および提示のための優れたビヒクルである(Willis, EA et al., 1993, Gene 128:79-83; Meola, A. et al., 1995, J. Immunol. 154: 3162-72: Bastein, N et al., 1997, Virology 234:118-22)。糸状ファージの投与は、任意の毒性効果の証拠なしに、試験されたすべての動物においてファージタンパク質に対する強力な免疫応答を誘導する。ファージタンパク質pIIIおよびpVIIIは、ファージディスプレイのためにしばしば使用されるタンパク質である。さらに、組み換え糸状ファージは、例えば抗原としての使用のために、特定のペプチドの起源を産生するために使用される。化学合成を超えたこの方法の重要な利点は、得られる産物が翻訳機構の生物学的な忠実度の結果であり、ペプチドの固相合成において共通する70-94%の純度レベルに影響されないという事実である。ファージは、追加の材料が細菌培養の増殖により産生され得る場合に、容易に再生可能なペプチドの起源を提供する。したがって、遺伝学的に改変された糸状ファージは、アジュバントの使用を必要とすることなく、抗体産生のためのペプチドおよび免疫原性担体を得るための手段として機能する。また、Frenkel, D et al., 2000, Proc Natl Acad Sci USA 97:11455-59を参照のこと。
【0167】
ファージにより提示されるペプチドを用いた免疫付与は、一般に、1010から1012ファージ粒子/注射を必要とする。Yip, YL et al., 2001, Immunol Lett 79:197-202に記載されたような方法が使用され得る。この方法は、マウスの腹腔内免疫付与のために1012ファージ/100μlを使用し、同様のファージ量がウサギの免疫付与のために適当である。
【0168】
E. coli細胞におけるファージの産生は、一般に、0.5-1.0リットルの培養培地あたり1013ファージである。したがって、意図されるパイロット試験のための十分な量のファージにより提示されたm2ペプチドの産生は容易である。gp120BaLは、市販で入手可能であり、gp120もしくはgp160発現ベクターおよびBaL株分子のワクシニア発現ベクターは、容易に利用可能である。
【0169】
ペプチドは、糸状ファージにおけるpIIIタンパク質(ファージあたり5個のコピー数)またはpVIIIタンパク質(ファージあたり2700個のコピー数)上で提示され得る(上記のYip et al.)。fth1発現系は、キメラファージにおけるpVIIIタンパク質上でペプチドを提示し、ここで、組み換えpVIIIタンパク質は、大半の野生型pVIIIタンパク質に組み込まれ、それによりモザイクファージを産生する。
【0170】
Pep1-Pep11、より特には、Pep4、7、8および/または10により本明細書において例示されたペプチドまたはペプチド複合体の調製物は、(a) Ab1 (抗GLXA抗体)、または(b) 1個またはそれ以上の抗抗Id (mAb2の免疫付与により作製されたAb3抗体)、または(c) 培養クラミジア個体に対して試験される。
【0171】
所望により、さまざまな架橋剤が探索され、インビボでのペプチド免疫原の免疫原性を妨害することなく、結合され架橋されたペプチド免疫原の構造/抗原性を維持する適合した架橋剤が見出されることを保証し得る。このために、ペプチド結合調製物は、トリス緩衝液、リン酸緩衝液、または任意の他の標準的な適合する緩衝液で製造され、氷上で一晩、さまざまな同種二機能性および異種二機能性架橋剤と反応させられる。本発明のさまざまなペプチドは、架橋剤のための潜在的な官能性R基を有する種々の数のAspまたはArg残基を含む。豊富な量の遊離カルボキシル基は、カルボジイミドに基づく架橋剤の使用を可能にするであろう。また、Arg残基は、それ自身をp-アジドフェニルグリオキサールモノハイドレート(APG; Pierce Biotechnology Inc)のような架橋剤に結びつける(lend)。
【0172】
有用なバクテリオファージの他の例は、Fuse 5およびf88、ならびに例えば8-20個のアミノ酸のペプチドに基づくファージペプチドライブラリーである。
【0173】
109個のファージ粒子を含むライブラリーサンプルが、3回のバイオパニングおよび増幅にかけられる。例えば、Frenkel, D et al., 1999, J. Neuroimmunol. 95:136-42を参照のこと。選択されたファージは、ELISAアッセイにより抗ファージ抗体に結合するそれらの能力について試験される。マイクロプレートのウェルは、二次抗体調製物、例えば、ウサギ抗ファージ抗血清の適当な希釈物で覆われ、4℃で一晩インキュベートされる。陽性ファージクローンを増殖させ、挿入領域におけるそれらのDNAの塩基配列が決定される。
【0174】
タンパク質VIIIの融合物としての最適なペプチドを提示する組み換えファージが選択され、免疫付与のために大量生産される。例えば、適当なE. coli株または突然変異遺体のコロニーの、2-mlの一晩培養物が、例えばテトラサイクリンを含む2YT培地中において37℃で増殖される。この前培養のアリコートは、2 mM イソプロピル-D-チオガラクトシドを含む1リットルの2YT/tetを副次培養するために使用される。37℃で16 hのインキュベーション後、培養物は、7,500×gで30分間遠心分離され、感染ファージを含む上清が、ポリエチレングリコール-8000および濃縮NaClを含む0.15当量の溶液の添加により4℃で2 h沈殿される。遠心分離後、ファージペレットはPBSに再懸濁され、再び細菌汚染物質除去のために遠心分離され、上清が再沈殿され、PBSに再懸濁され、ファージ濃度が分光学的に概算される(269 nmでの1 ODユニットは、1011ファージ/mlを示す)。
【0175】
ファージ製剤は、好ましくは、免疫付与前にUVにより不活化される。例えば、Galfre, G et al., 1997, Vaccine 15:1276-85を参照のこと。
【0176】
樹枝状ポリマー/デンドリマー
この態様は、複数のエピトープを有する複数の抗原ペプチドが、相当する等しい量の一価エピトープで免疫付与した後の応答と比較して優れた免疫応答を誘導するという当分野における知見に基づくものである。
【0177】
本発明は、複数抗原ペプチド系において本発明のペプチドの複数のコピーを有する抗原性産物を広く包含することが意図される。
【0178】
本発明の樹枝状ポリマーは、抗原/エピトープがコア分子から放射状に伸びた分枝と共有的に結合している樹枝状ポリマーに基づく本発明による抗原性産物である。これらの樹枝状ポリマーは、通常のポリマーと比較して、分子量の単位あたりでのより高い濃度の官能基により特徴づけられる。一般的に、それらは、少なくとも2個の官能基を有するコア分子から生じる2個またはそれ以上の同一の分枝に基づく。そのようなポリマーは、Denkewalter et al. (米国特許第4,289,872号)およびTomalia et al. (米国特許第4,599,400号および第4,507,466号)に記載されている。このクラスの他のポリマーは、米国特許第4,515,920号に記載されている。また、Solomon (米国特許出願公開2005/0053575)を参照のこと。
【0179】
該ポリマーは、それらの構造がコア主要部およびいくつかの枝を有するツリーとして象徴され得るために、しばしば、樹枝状ポリマーと呼ばれる。しかしながら、ツリーとは異なり、樹枝状ポリマーにおける分枝は、実質的に同一である。
【0180】
この樹枝状系は、「複数抗原ペプチド系」(MAPS)と呼ばれ、それは、抗原/抗原担体の組み合わせについて通常使用される名称であり、該組み合わせは、少なくとも二機能性/二官能性である主要ユニットからなる樹枝状コアに結合した通常は同一である2個またはそれ以上の抗原性分子からなる。分枝中の各二機能性ユニットは、付加される成長のための基盤を提供する。
【0181】
複数抗原ペプチド系の樹枝状コアは、リシン分子から構成され得る。例えば、リシンは、そのアミノ基の各々を介したペプチド結合により2個のさらなるリシンに結合する。この第二代の分子は、4個の遊離アミノ基を有しており、その各々は、さらなるリシンに共有的に結合し、8個の遊離アミノ基を有する第三代の分子を形成し得る。ペプチドは、これらの遊離基の各々に結合され、8価の複数ペプチド抗原(MAP)を形成し得る。該過程は繰り返され、第四またはそれ以上の世代の分子を形成し得る。各々の世代と共に、遊離アミノ基の数は、幾何学的に増加し、2n(式中、nは、世代の数である)により示され得る。あるいは、4個の遊離アミノ基を有する第二代の分子は、コアと共有的に結合した4個のペプチドを有する四価MAPを形成するために使用され得る。例えばアミノ酸AspおよびGlu(その各々は、2個のカルボキシル基および1個のアミノ基を有し、2nの遊離カルボキシル基を有するポリ-Aspまたはポリ-Gluを産生する)を含む多くの他の分子は、MAPSの樹枝状コアを形成するために使用され得る。
【0182】
「樹枝状ポリマー」または「デンドリマー」なる用語は、時折、本明細書において本発明の産物を定義するものとして使用される。該用語は、ポリマーと見なされるのに十分に大きな担体分子およびわずか3個のモノマーを含み得る担体分子を含む。
【0183】
樹枝状ポリマーを合成するための化学は既知であり、利用可能である。反応するべきではない官能基を妨害し、次いで官能基が反応することが望まれるときに該妨害する基を除去するための化学は、アミノ酸と共に、多くの特許および科学文献において詳述されている。樹枝状ポリマーおよび全MAPは、Merrifield合成において樹脂上で産生され、次いで該ポリマーから除去され得る。Tomalia (上記)は、コア分子としてアンモニアまたはエチレンジアミンを利用した。この手順において、コア分子は、Michael付加によりアクリレートエステルと反応し、エステル基は、加水分解により除去される。生じた第一代の分子は、アンモニアの場合には3個の遊離カルボキシル基およびエチレンジアミンが使用された場合には4個の遊離カルボキシル基を含む。Tomaliaおよび同僚等(下記を参照)は、樹枝状ポリマーをエチレンジアミン、次いで、他のアクリルエステルモノマーで伸長させ、望まれる分子量が得られるまで配列を繰り返した。樹枝状ポリマーの各分枝が、多くの選択される手順のいずれかにより伸長され得ることが当業者には容易に理解される。例えば、各分枝は、Lys分子を用いた複数の反応により伸長され得る。
【0184】
Erickson (上記)は、古典的なMerrifield技術を利用し、ここで、実質的に任意の望まれる分子量のポリペプチドは、固相樹脂支持体から成長する。該技術が樹枝状ポリマーの製造のために利用されるとき、ポリマーを樹脂支持体に結合させる架橋分子は、三機能性である。官能基のうちの1つは、樹脂への結合に関与し、他の2つの官能基は、ポリマーの成長のための出発点として機能する。該ポリマーは、望まれる分子量が得られると、レジンから除去される。1つの標準的な切断手順は、液体フッ化水素を用いた0℃で1時間の処理である。他のより満足の行く手順は、Tam et al., 1983, J Amer Chem Soc 105:6442に記載されたとおり、フッ化水素とジメチルスルフィドの複合体(HF:DMF)を利用し、副反応およびペプチドの損失を最小化することである。
【0185】
1つの例において、Denkewalter et al. (上記)は、コア分子としてLysを利用した。コア分子のアミノ基は、ウレタン基への変換により妨害される。カルボキシル基は、ベンズヒドリルアミンとの反応により妨害される。ウレタンの加水分解は、樹枝状ポリマーの成長のための出発点として機能する2個の遊離アミノ基を有するリシンのベンズヒドリルアミンを産生する。
【0186】
樹枝状ポリマーを製造するために利用可能な3つの手順についてのこの簡潔な考察は、当業者がこれらの一般的な教示から離れるのに十分であるはずであり、当業者にポリマーの顕著な特徴、例えば、少ない分子の量での多量の利用可能な官能基の提供を教示する。結果は、エピトープ/抗原をそれらの利用可能な官能基に加えることにより少量中の高濃度のエピトープが達成され得ることを示す。生じた産物は、相対的に少ない担体上での高い比率のエピトープを含む(抗原:担体の比率は、極めて高い)。これは、ワクチンを製剤化するために使用される他の慣用的な産物とは対照的であり、該産物は一般に多量の担体上に少量の抗原を含む。
【0187】
免疫原性担体としての樹枝状ポリマーの他の重要な特徴は、正確な構造が知られており、「抗原性」汚染物質、または組織を刺激するか、もしくは望まれない反応を引き起こす汚染物質が存在しないことである。ペプチドの正確な濃度が知られており、該ペプチドは担体上に対称に分布しており、該担体は1個より多くのペプチドまたは複合体のための基盤として利用され得て、その結果、多価免疫原またはワクチンが産生され得る。例えば、Parag-Kolhe, P et al., 2006, Biomaterials 27:660-9を参照のこと。
【0188】
MAPSがワクチンまたは免疫原性組成物を作製するために使用される場合、デンドリマーのコア分子は、天然に生じるアミノ酸、例えば、Lysであり、その結果、それは適当に代謝され得ることが好ましい。しかしながら、非天然アミノ酸は、α-アミノ酸でなかったとしても使用され得る。コア分子の構築において使用されるアミノ酸は、D型またはL型であり得る。
【0189】
樹枝状ポリマーの化学および医薬使用についてのより詳細な説明は、Tomalia DA et al., 2007, Biochem Soc Trans. 35:61-7; Braun CS et al., 2005, J Pharm Sci. 94:423-36; Svenson S et al., 2005, Adv Drug Deliv Rev. 57:2106-29ならびに米国特許第4,289,872号; 第4,558,120号; 第4,376,861号; 第4,568,737号; 第4,507,466号; 第4,587,329号; 第4,515,920号; 第4,599,400号; 第4,517,122号; および第4,600,535号において見出され得る。
【0190】
レジン結合樹枝状ポリマーは、本発明の実施において使用され得る。そのような製剤は、多くの供給者(例えば、Advanced Chem Tech, Inc. Louisville, KY)から商業的に入手され得る。ポリマーは、好ましい薬剤としてHF:DMSを用いて、レジンから切断され得る。樹枝状ポリ-Lysは、もともとベンジルリンカーを介してレジンに付加されたGlyリンカーから構築される。Alaのような他のリンカーが使用されるか、リンカーが除去されるか、またはリンカー分子が利用され得る。
【0191】
ペプチドまたは免疫原のさらなる起源
mAb2は、タバコ植物、例えば、Nicotiana benthamianaの主に葉および任意の植物部分、例えば、根シュート、花もしくは植物細胞において発現され得る(例えば、米国特許第7,084,256号を参照のこと)。同様に、本発明のペプチドは、免疫原としての使用または植物におけるそれらの産生のためにウイルス粒子またはウイルス被覆タンパク質と融合され得る。植物におけるペプチド産生の記載について、例えばワクチン適用において有用なウイルス被覆タンパク質融合物として、例えば、米国特許第7,033,835号、第6,660,500号および第5,977,438号; Smith ML et al., 2006, Virology 348:475-88を参照のこと。ワクチン使用は、米国特許第7,084,256号; McCormick AA et al., 1999, Proc Natl Acad Sci USA, 96:703-8およびMcCormick AA et al., 2008, Proc Natl Acad Sci USA 105:10131-6に記載されている。本発明のペプチドを含む植物産生免疫原は、上記したとおり、VLPまたはマイクロスフィアへの封入により製剤化され得る。植物ワクチンのさらなる議論については、Thanavala Y et al., 2006, Expert Rev Vaccines 5:249-60を参照のこと。
【0192】
免疫付与の用量および経路
本発明の処置を必要とする対象、好ましくはヒトを処置するための好ましい有効量は、約100mg/kg体重までの活性化合物の量である。ペプチドまたはペプチド複合体もしくは複合体の一般的な単回投与量は、約1μg〜約100mg/kg体重、好ましくは、約10μg〜約50 mg/kg体重である。約0.1mg〜約7gの範囲内の1日全投与量が、筋肉内(I.M.)またはSC投与のために好ましい。
【0193】
しかしながら、個々の処置レジメンにおける変数が大きいので、上記の範囲は示唆的なものであり、これらの好ましい値からのかなりの逸脱が予測される。当分野における当業者に明らかなとおり、免疫原性組成物の投与量は、感染を処置する(すなわち、ウイルスの拡散を限定する)ために使用される化合物の用量よりも高いものであり得る。有効量および有効な投与頻度は、意図される使用により決定され、過度の実験なしに当業者により確立され得る。各処置のために必要とされる全用量は、複数回または単回で投与され得る。ペプチド複合体は、単独で、または疾患もしくは状態の処置のための他の治療薬と組み合わせて投与され得る。
【0194】
塩基性基を含む本発明の特定の化合物の薬学的に許容される酸付加塩は、所望により、当分野において既知の方法を用いて、強いまたはやや強い、非毒性の有機もしくは非有機酸で形成される。本発明に包含される酸付加塩の例は、マレイン酸塩、フマル酸塩、乳酸塩、シュウ酸塩、メタンスルホン酸塩、エタンスルホン酸塩、ベンゼンスルホン酸塩、酒石酸塩、クエン酸塩、塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩および硝酸塩である。酸性基を含む本発明の化合物の薬学的に許容される塩基付加塩は、有機および無機塩基から既知の方法により製造され、例えば、非毒性アルカリ金属およびアルカリ土類塩基、例えば、水酸化カルシウム、水酸化ナトリウム、水酸化カリウムおよび水酸化アンモニウム; ならびに非毒性有機塩基、例えば、トリエチルアミン、ブチルアミン、ピペラジンおよびトリ(ヒドロキシメチル)メチルアミンを含む。
【0195】
本発明の化合物および薬学的に許容されるその塩は、慣用的な用量形、例えば、カプセル、含浸ウエハース(impregnated wafers)、錠剤、または好ましくは、注射用製剤に組み込まれ得る。固体または液体の薬学的に許容される担体が使用され得る。
【0196】
本発明は、眼、生殖管、肺または心臓のクラミジア感染に対する保護、またはその処置のために有用である。保護され得る他の解剖学的部位/組織は、任意の関節の滑膜組織、中枢神経系、消化管などを含む。クラミジアは、主に粘膜表面(結膜、生殖器、呼吸器)に感染し、新生児では主に粘膜表面で生じる。
【0197】
好ましくは、本発明の化合物は、全身的に、例えば、注射もしくは点滴により投与される。任意の既知の経路、好ましくは、静脈内、皮下、筋肉内または腹腔内により投与され得る。他の許容される経路は、経鼻、皮内、髄腔内(鞘内)などを含む。本発明の最も好ましい経路は、経口および/または粘膜部位への局所投与であり、口、咽頭および消化管、眼/結膜、または生殖管、および肺、ならびに間接的に、心臓、中枢神経系、滑膜組織の局所的な粘膜保護を達成する。
【0198】
C. trachomatis感染のマウスモデル
本発明者等は、2個のマウスモデルを用いて、そこで彼らは、より初期のmAb2ワクチンを用いたワクチン接種の有効性を証明した(26,27)。また米国特許第5,656,271号および第5,840,297号を参照のこと。これらの文献は、その全体を引用により本明細書の一部とする。
【0199】
マウスは、C trachomatisのヒト次亜種(泌尿生殖器感染のためにKもしくはE血清型; 眼感染のためにCもしくはB血清型)を用いてチャレンジされる。
【0200】
4-8個体のマウスの群が、生きた基本小体(EB)でのチャレンジ前に、前処理について「マスク」される。週1回の間隔で少なくとも4週間、膣(または結膜)スワブが単離培養およびEBについての直接蛍光抗体染色のために回収される。
【0201】
例えば、C. trachomatis C血清型(TW-3)基本小体5000 IFU/20 μlが、本発明による免疫原またはコントロール免疫原(例えば、非処理もしくはスクランブルペプチド)で免疫されたレシピエントマウスの各眼に接種される。
【0202】
臨床疾患は、繰り返し感染(毎日、毎週繰り返し、週に1回)で最も顕著であるが、感染性クラミジアの1回投与でさえ、瞼の肥厚(eyelid thickening)および滲出液の形成を誘導した。組織病理学的に、炎症性単核細胞浸潤の強度、杯細胞の欠損、および滲出液の出現は、用量依存的であった。12-14日での平均組織病理学的疾患スコアは、正常な組織についての0 + 0と比較して6.8.+-.0.8であった。
【0203】
インキュベーションの前日、ならびにインキュベーションの7日、10日、14日、21日、28日および35日後に、両方の結膜が採取される。該領域は、下瞼板および円蓋、側円蓋、上瞼板および円蓋、ならびに内側円蓋(medial fornix)を含んでいた。結膜スワブは、即座に回収培地に浸され、ボルテックスにより2分間破壊され、培養まで氷上で維持される。
【0204】
10匹のBALB/cマウスからの結膜スワブで得られた典型的な微生物経時変化は、米国特許第5.656.271号(上記)の図17において示される。
【0205】
下記の実施例5は、これらのモデルにおいて本発明のペプチドを用いた免疫付与の結果を提供する。
【0206】
上記されたとおり、クラミジアによる生殖器感染は、かなりの割合の反応性関節炎症例を発症させやすくし、生存する代謝的に活性な個体がこれらの患者の滑膜に存在する。本発明の免疫原性組成物(ペプチド、ポリペプチドまたはDNA)は、関節炎がクラミジアと関連しているか、またはそれにより引き起こされる場合に、予防もしくは処置を必要とする対象における関節炎を予防もしくは処置するための方法において使用され得る。
【0207】
本明細書において本発明が一般的に記載されているが、下記の実施例を参照することにより、同様のことがより容易に理解される(実施例は、例示の手段により提供されるものであって、特に断りがない限り、本発明を限定することを意図するものではない)。
【実施例】
【0208】
実施例I
GLXAを模倣する両方のカテゴリーのペプチドは、マウスにおいて免疫原性である
完全フロイントアジュバント(CFA)を用いてPep4、7、8および10 (100 pg/投与)でマウスを免疫し(皮下投与(SC)による)、次いで、不完全フロイントアジュバント(IFA)を用いて2回の追加免疫を行った。さらなる群のマウスは、Pep4およびPep7が該群のより強い免疫原であることが疑われているので、これらの組み合わせを投与された。ポジティブコントロール群は、アジュバント中の可溶性mAb2を投与された。ネガティブコントロール群は、希釈物(アジュバント中のリン酸緩衝生理食塩水/PBS)を投与された。この方法はまた、ペプチド免疫原の別の製剤、例えば、ナノ粒子のための最初のポジティブコントロールとして利用される。
【0209】
免疫および2回の追加免疫前に、血液を回収した。ELISAにより血清を試験した。本明細書の実施例において使用されるELISA法を下記する(パラメーターおよび条件のすべてではないがその多くが、当分野において完全に慣用的である方法において変更されるか、もしくは修飾され得る)。
1. 96ウェルプレート(Immulon HBX4)を50μlの希釈抗原(炭酸緩衝液で調製された1μg/ウェルでのペプチド)で覆い、4℃で一晩インキュベートした。
2. さらなる洗浄を行うことなく、プレートの内容物を軽くはじいてシンクに流すことにより、非結合抗原を除去した。
3. 300μL/ウェルの4%BSA/PBS-Tween 20 (0.05%)を加えることにより、非特異的結合を妨害もしくは阻止した。これは、室温で2時間インキュベートすることにより行われた。
4. プレートをPBS-Tween 20 (0.05%)で1回洗浄し、50μlの一次抗体を適当な希釈で各ウェルに加えた。血清を用いる場合、出発希釈は、1:40であり、さらに1:80、1:160、および1:320(または所望によりそれ以上)まで倍々希釈を行った。プレートを37℃で1時間インキュベートした。
5. プレートを上記のPBS-Tween (0.05%)で3回洗浄し、100μlの二次抗体を適当な希釈で各ウェルに加えた。アルカリホスファターゼ共役ヤギ抗マウスIgG-APのために、1:500の希釈物をここで用いた。プレートを37℃で1時間インキュベートした。
6. プレートを再び上記のとおり3回洗浄し、アルカリホスファターゼについての200μlの基質溶液(p-ニトロフェニルリン酸またはpNPP)を5mg/mlの濃度で加えた。発色反応を、自動マイクロプレートリーダーを用いて405 mmの波長で読み取り、吸光度(または光学密度)を記録した(A405またはOD405と呼ばれる)。
【0210】
いくつかの重要な観察が4個のペプチドに対するこれらの試験において行われた: (a) すべての4個のペプチドは、免疫原性であり、すべてのマウス(1匹の非応答マウスを除く)において次の追加免疫で増加した抗ペプチド応答が誘導された(図3)。各群のマウスは、各免疫ペプチドに対する増加した抗体応答を示すことが見出されており、(n)が各群について示されている。また、図16A-16Bを参照のこと。
【0211】
図4は、ペプチド間の交差反応パターンを示す。3個のパネルの各々は、Pep4に対して作製された単一のペプチド(Pep 4、7または8) Abで免疫された対象においてすべての4個のペプチドに対する応答がPep7と交差反応することを示す(逆もまた然り)。これらの両方は、カテゴリー番号1のペプチドである。Pep8に対するAbは、Peps 4、7または10のいずれとも交差反応しなかった。これは、mAb2のCDR1およびCDR3が抗原的に異なるという考えを支持する。
【0212】
実施例II
ペプチド免疫原を用いた免疫付与の保護効果
1つの実験において、免疫不全SCIDマウスに同系mAb2免疫化ドナーマウスからの脾臓細胞を適合移植し、C. trachomatisのK血清型(株)2000 TCID50 (〜107 IFU/30 μlの局所、経膣的)でチャレンジし; マウスは、ヒト次亜種による感染性を高めるために、チャレンジの7および3日前にDepo-Proveraで前処理された。結果を図5に示す。mAb2免疫リンパ球を投与された免疫不全マウスは、細菌の減少した排出から明らかなとおり、感染性チャレンジからかなり保護された。
【0213】
細胞ドナーマウス(初期ワクチン候補(マイクロスフィアでのmAb2)で直接免疫した)由来の血清を、ELISAにより(上記したとおり)本発明のペプチド免疫原を用いた反応性について試験した。これらの結果を図6のパネルB-Eに示す。
【0214】
全mAb2で免疫された動物は、ペプチドに対する劇的な反応性を示し、これは、示された保護および抗GLXA応答と相関していた。C trachomatis感染細胞を用いた抗mAb2血清の反応性をまた図に示している。
【0215】
コントロール、非免疫脾臓細胞を投与されたマウスの感染のみはまた、ペプチドに対する測定可能な抗体応答を誘導したことが注目されるべきである。これは、下記の重要な点を確認している: Ab(全mAb2により誘導され、本発明の示されたペプチド内に存在する)が作製されたエピトープは、インタクトの感染微生物上に存在している。
【0216】
4個のペプチド免疫原(Pep4、7、8および10)に対する反応性について、これらの群のマウス由来の血清をELISAにより試験した(図6)。T細胞を含む(+T)非分画免疫脾臓細胞のレシピエントは、最大の免疫応答を示した。T細胞欠損(-T)脾臓細胞(T細胞は、抗T細胞抗体、例えば、抗Thy-1および補体を用いた処理により除去された)のレシピエントは、通常の細胞のレシピエントと同様の抗ペプチド応答を有していた。予期されたとおり、後者の群は、それが感染されると、クラミジア個体がこれらのエピトープを有しているために、該ペプチドに対するAbを産生した。
【0217】
実施例III
免疫原性ペプチドは、ナノ粒子として投与され得るクラミジア抗原性エピトープの保護型として機能する
全mAb2調製物で免疫された動物からの血清を本発明のペプチドの4個に対するそれらの反応性について試験することにより、ナノ粒子での本発明の免疫原の経口/粘膜送達の実現可能性を確認する試験を行った。マウスを、マイクロ封入mAb2を用いて、2-3週間の間隔で3回免疫し(下記の表を参照のこと)、C trachomatis E 血清型を用いて膣内でチャレンジした(2000 TCID50/30 μl)。週1回の間隔で膣スメアの単離培養または直接蛍光抗体(DFA)染色のために、膣スワブを回収した。実験の最後に、血液および組織を回収した。これらの最終採血由来の血清をペプチドELISAにより試験した。
【0218】
図7および8において結果を示す。図7は、免疫化動物からの細菌の排出を示す(インビトロ培養により検出される)。
【0219】
下記のレジメンを用いて、皮下(SC)もしくは経口(PO)経路、または組み合わせにより、マウスをmAb2マイクロスフィアで直接免疫した(表4; 図において標識されている)。チャレンジの14日後での排出における変動性にもかかわらず、初期mAb2ワクチンの経口のみの送達(P群)は、微生物の膣排出において最も強い効果を示した(図7)。
【0220】
SC経路(K群)または経口経路(P群)により専ら免疫された対象からの血清を、4個のペプチドに対するAbについて、免疫なし、感染ありの対象(M群)および免疫なし、感染なしのコントロール(L群)と比較した(n=4-5/grp)。
【0221】
表4
【表8】

【0222】
図8におけるELISAの結果は、感染のみが抗ペプチド抗体応答を誘導したことを示す(M群、-O-)。マイクロ封入mAb2のSCおよび経口送達の両方が、抗ペプチドAb応答を誘導した。非感染コントロールは、陰性であった。同じ希釈で試験された免疫前血清は、すべて陰性であり、実際に、それらのサンプルの吸光度値は、任意の特定の実験におけるK-P群の値から差し引かれた。
【0223】
マウスがペプチド免疫原自体に曝されず、さらに異なるクラミジア血清型(上記で考察された図5の場合にはK血清型、および図7および8で示される試験においてはE血清型)でチャレンジされたために、これらの観察は重要であった。
【0224】
実施例IV
インサイチュにおいて基本小体(EB)を認識するペプチド誘導クラミジア特異的抗体応答
2回目の追加免疫後、かつ、全個体に曝露される前に得られた血清(実施例IIIに記載された試験から)(ELISAによりペプチドに対して陽性であった)は、C trachomatis感染細胞を認識することが見出された。これは、間接免疫蛍光を用いて示された。同じマウスからの事前の採血は、免疫染色により全体的に陰性であった(データは示していない)。
【0225】
我々は、属特異的クラミジア抗原の2個またはそれ以上のエピトープ/ホモログを示す新規ペプチドを推定した。これらは、ヒトまたは脊椎動物タンパク質、クラミジアタンパク質/抗原に対して明らかな相同性を有していない。
【0226】
C. trachomatisで感染させたHEp2細胞を細胞遠心分離にかけ、顕微鏡スライドにそれらを置いた。固定(MeOH)後、示されたペプチドまたは可溶性mAb2で免疫されたマウスからの血清(1:40希釈)を用いて、それらを染色した。蛍光(FITC標識化)二次Ab、抗マウスIgGを用いて抗体の細胞への結合を検出した。結果を図9A-Fに示す。
【0227】
同じマウスからの事前の採血は、完全に陰性であった(データは示していない)。矢印は、免疫血清の標的における異なる差異を示す。
【0228】
Pep4、Pep7またはその両方(それぞれ、A-C)(その両方は、カテゴリー番号1のペプチドである)で免疫された対象からの血清は、EBおよび代謝的に活性な非感染性網様体(RB)を認識した。
【0229】
mAb2のCDR1およびCDR2における配列に相当するカテゴリー2ペプチドであるPep8および10 (図9Dおよび9E)で免疫された対象からの血清はまた、mAb2免疫血清(F)と同様に、封入体マトリクスおよび膜中の標的を認識する。これらの抗血清の特異性は、ファージ由来mAb1ペプチドとペプチドの2個の群について標的とされる構造に基づくPep 8およびPep 10のmAb2 CDR領域を比較した場合に変動するように思われた(mAb1に由来するPep 4、Pep 7; Pep 8およびPep 10は、各々mAb2重鎖のCDR1およびCDR3を示す)。
【0230】
実施例V
ペプチドを用いて免疫したマウスにおける減少した微生物負荷
上記のマウスモデルを用いて、本発明者等は、4個のペプチド(Pep4、7、8または10)のうちの1個を用いてマウスを免疫した(100 μgの用量で3回投与された)。直接蛍光抗体(DFA)染色の結果を、チャレンジ後7日および14日について要約する(図10-11)。
【0231】
結果は、Pep4、Pep4 + Pep7またはPep8での免疫がDFA染色により測定される細菌排出を減少させたことを示す。ペプチド7での免疫は、DFAスコアを減少させなかったが、Pep4での免疫はまた、DFAスコアを減少させた。対照的に、2個のペプチド(Pep4 & Pep7)の組み合わせは、DFAスコアを著しく減少させた。
【0232】
DFA試験は細菌を検出するが、それらの生存についての情報は提供しない。しかしながら、一般には、減少した排出は、減少した培養物陽性(culture positivity)と相関することが受け入れられる。
【0233】
これらの結果は、Pep4とPep7の混合物が一緒になって、mAb1により認識される保護的抗原性エピトープを有することを示す。本明細書に記載された2個またはそれ以上の免疫原性ペプチドの他の組み合わせが、個々のペプチドと比較して促進された免疫原性および保護を示し得ることは、十分に予期される。
【0234】
封入された全mAb2ワクチンの経口送達を用いてより有効な保護免疫を示す発明者等およびそれらの同僚等の以前の結果に基づいて、本発明者等は、促進された保護免疫を達成するためにマイクロ粒子またはナノ粒子に封入された本発明のペプチドの単独または組合せでの経口/粘膜投与を提供する。
【0235】
実施例VI
PLGAに封入されたペプチド免疫原の解析
上記の二重エマルジョン溶媒蒸発技術(Li and co-workersによる(139))の修飾版を用いて、Pep4をPLGAナノ粒子(NP)に封入した。
【0236】
封入効率は、mg PLGAあたり7.8 μgペプチドの最終濃度で、38.8%であることが見出された。図12は、NPの形態の一例を示す。図13AおよびBは、5mg NPのペプチド放出プロファイルを示す。図13Aは、PBSおよび炭酸緩衝液中のNPの逆相(RP) HPLCにより決定された放出を示す。放出速度は、約3 μg/ml/日であった(また、PLAからの放出について、下記の実施例X、特に図19A-Bを参照のこと)。
【0237】
炭酸緩衝液中のサンプルをまた、ELISAを用いて免疫学的に調べた。図13Bの結果は、Pep4および抗Pep4抗血清を用いた標準曲線に基づいて、約3.8μg/ml/日の放出を示し、それは、HPLCの結果と一致する。
【0238】
これらの結果は、かなりの量の活性免疫原性ペプチドのNP内への封入およびペプチドの制御された放出についての能力を示し、特定の抗体により認識されるインタクト(非変性)状態を維持する。封入効率、放出プロファイルおよび粒子形態は、既知の方法に基づいて製造パラメーターを変えることにより、修飾および改善され得る。
【0239】
実施例VII
抗ペプチド抗血清は、C trachomatisに持続的に感染した細胞と反応する
インビトロにおいて急性感染細胞を染色することが上記で示された血清を、持続的感染細胞(ペニシリンG (PenG)により誘導された)との反応性について試験した。4ウェルチャンバースライドでサンプル中の活性を調べて、ここで、PenGは、t0 (接種の1時間後)または18時間後(t18)で加えられた。細胞を感染の48時間後に固定した。各血清サンプルを、t0およびt18で、スライド上のPenG処理細胞およびPenG非処理コントロール細胞について試験した。
【0240】
Pep4、Pep7、Pep4 + Pep7、Pep8またはPep10で免疫されたすべての処理群からの血清を3回の別々の実験で試験した。感染McCoy細胞(異種二倍体マウス線維芽細胞; 148)におけるPep4、Pep7、Pep4 + Pep7についての結果を図14A-Fに示す。図14A-Cは、t0における細胞を示し、図14D-Fは、t18における平行処理群を示す。図14D-Fにおける挿入図は、同じ実験からの代表的な「コントロール」感染細胞(PenGなし)を示す。本明細書において記載されたものと同様の結果がヒト上皮細胞(HEp20)で得られた。t0 PenGでの3個の大きな異常RB (aRB)とt18 PenGでの複数のaRBを含むより大きな封入体に注目して下さい。
【0241】
これらの結果は、これらのペプチドが持続的な感染細胞を認識する抗体応答を誘導することを示し、それは、本発明のペプチド免疫原を用いた持続的感染の処置についての根拠である。これは、クラミジアに対するそのように強力な属にわたる保護免疫の誘導を可能にするそのような応答を誘導する抗クラミジア免疫原(ワクチン候補)の最初の例であると考えられる。
【0242】
実施例VIII
報告された生殖器クラミジア感染を有する患者からの血清は、抗ペプチド抗体を有する
抗ペプチド免疫とヒト感染との関連を調べるために、既知の生殖管クラミジア感染を有する患者からのコードされた(「脱同定化された(de-identified)」)ヒト血清およびクラミジア多型膜タンパク質(Pmp)に対する抗体(例えば、Grimwood, J et al., 2001, Infect. Immunity 69:2383-9)を、抗ヒトIgG検出試薬を用いて、Pep4、Pep7、Pep8およびPep10ならびにコントロール「非関連」ペプチドに対してELISAにより試験した。蛍光色素(FITCまたはAlexa色素488)と結合した抗ヒトIgGがヒト血清反応性を検出するために使用されること以外は上記と同じ方法を用いて、免疫組織化学(IHC)により、C. trachomatis感染(48 hr) HEp2細胞に結合(および染色)するそれらの能力について血清を試験した。結果を表5に示す。
【0243】
関連しないペプチドに対する応答は、一様に陰性であった(データは示していない)。非感染細胞は、染色されなかった。クラミジアに対する増大した曝露と共に、上記の2群において示されたとおり、ペプチド(およびPmps)に対する血清反応性は増加した。未報告の(Undocumented)または持続的な感染は、1群および3群の患者の血清における抗ペプチド反応性を説明し得る。
【0244】
クラミジアに曝露された患者からの血清における抗ペプチドELISAの陽性、Pmp反応性および感染細胞の染色(IHC)の関連は、抗クラミジア免疫に対する本発明のペプチドの重要性ならびに抗クラミジア免疫原としてのおよびワクチンにおける該ペプチドの利用の重要性を示す。
【0245】
表5
【表9】

IHC: 免疫組織化学; +は、かすかな染色を示し、++は、中間の染色を示し、
+++は、明るい染色を示す。
【0246】
実施例IX
ペプチド免疫化対象の巨視的な解剖学的観察
免疫された雌マウスの生殖領域における組織の検査は、ペプチド免疫が炎症を減少させたことを示す。
【0247】
チャレンジの28日後に生殖管を解剖し、炎症性変化を記録する(その後、組織学的解析のために取り出される)。結果を図15に示す。左側のパネルは、アジュバントのみを投与されたコントロール動物における、極めて紫色の子宮角(卵巣を見ることは困難である)の強い炎症を示す。ペプチドで免疫した動物のいずれもがそのような強い炎症を示さなかった。ペプチド4および7のレシピエントについての例示をそれぞれ中央および右側のパネルに示す。黄色の矢印は、子宮角を示す(それはさらに、破線で区切られる)。ペプチド免疫原がチャレンジの数週間後においてさえ生殖管の巨視的な病理を減少させたことは明らかである。これは、コントロールマウスがペプチド4もしくは7の代わりに無関係のペプチドを投与された2回目の実験で再び生じた。他の内容から当分野において既知であることに基づいて、組織病理学的結果は、これらの巨視的な解剖学的観察と一致することが予期される。
【0248】
実施例X
遊離ペプチドとマイクロ封入ペプチドを用いた免疫付与
遊離の場合と、PLAマイクロ粒子(MP)でのマイクロ封入形態の場合とで、本発明のペプチドを用いた免疫付与の効果を評価および比較するためにさらなる試験を行った。結果を図17、18A-18Fおよび19A-19Bに示す。図17は結果を示し、一方で、図18A-18Fは、感染(チャレンジ)マウスにおけるDFA結果を示す。さまざまな用量の遊離Pep4または封入化(Pep4-MP)型を用いて、皮下投与により動物を免疫した。
【0249】
マウスは、示されたペプチド抗原または可溶性mAb2ポリペプチドを用いて、下記の計画に基づいて皮下で3回免疫されているか(最初、14日目での1回目の追加免疫、28日目での2回目の追加免疫)、または感染されているが、免役されていないコントロール動物であった(図18A-Fと関連)。遊離Pep4ペプチドを40μgの用量で試験し、Pep4-MPを10、20および40μgの用量で試験した。各免疫付与前および実験の最後(+28日)に血液を回収した。各群における対象の数(n)を図17に示す。
【0250】
免疫付与および採血計画:
【表10】

【0251】
図18は、上記のとおり得られた膣スワブのDFA染色の結果を示す。このアッセイは、膣スミアに存在する生物を検出する。統計学的に有意な差異を表6に示す(ここで、スチューデントt検定を用いて、pは、<0.05またはそれ以下である)。この表に現れていない結果(変数は、免疫後の日数、抗原の用量もしくは形態などである)は、それらのコントロールと統計学的に異なっていなかった。
【0252】
表6: 膣スワブにおけるクラミジア負荷のDFA検出での有意差(図18参照)
【表11】

Pep4-MP = PLAマイクロ粒子中のPep4; Sol. mAb2 = 可溶性mAb2; P値は、コントロールと比較してスチューデントt検定を用いて得られた。
【0253】
マイクロ粒子で送達されたPep4は、用量依存的な方法で感染膣チャレンジ後の細菌負荷をかなり減少させることがこれらの試験から結論づけられた。この結果は、より強い免疫応答と相関しており(ELISAにより示される)、抗Pep4抗体応答はまた、抗原がマイクロ粒子で送達された場合にかなり強かった。したがって、保護的な効果は、より強い免疫の結果である。ELISAの結果は、遊離Pep4 (40 μgの用量)での免疫が、等量または低い用量での封入化Pep4での免疫ほどの免疫原性を有さないことを示した。
【0254】
好ましい態様において、2個またはそれ以上の本発明のペプチドの封入化組み合わせ(個々に封入され、MPと混合されていようと、または共封入されていようと)は、免疫および保護を誘導するために使用される(実施例IVにおいてPep4とPep7の組み合わせについて示されるとおり(図9C参照))。
【0255】
20 μg Pep4-MPの皮下投与と経口投与を用いた免疫原性および保護効果を比較した試験は、経口免疫付与がまた抗Pep4抗体を誘導することにおいて有効であることを示し、それはまた、DFAによりクラミジア感染細胞と非感染細胞に特異的に結合する。したがって、マイクロ粒子およびナノ粒子に封入された本発明のペプチドを用いた経口免疫付与は、クラミジアに対する保護免疫を誘導するための有効な手段である。インタクトmAb2を用いた結果は、100μgの可溶性mAb2が皮下で投与された場合と比較して封入化mAb2 (6-10 μg/投与)が経口で送達された場合に、免疫付与および保護において10-25倍の改善を示した。
【0256】
上記で使用された封入化製剤(PLA)からの免疫原性ペプチドの放出を確認および解析するための試験を行った。結果を図19A-Bに示す。時間をかけて回収された上清のサンプルについてHPLCを行うことにより、Pep 4の異なる2個の封入化調製物の累積ペプチド放出速度を計算し、残りのサンプルを用いて、ELISAによりPep 4をアッセイした。ペプチドの放出速度は、2個の調製物において類似していた。図19A(「放出-1」)におけるPep4-MPの最初の調製物を上記の実験のために使用した。両調製物はまた、経口投与により送達された場合に免疫を誘導し得る。
【0257】
実施例XI
ヒトサンプルにおけるPCR (クラミジアについて)および免疫学的解析の相関
いくつかのクラミジア遺伝子の発現についてPCRにより、C. trachomatis感染細胞に対してIHCにより、本発明のいくつかのペプチドに対してELISAにより、ヒト血清を試験した。結果を表7に示しており(下記)、それは、ヒト末梢血単核細胞(PBMC) (それは、主に、リンパ球および単球である)および子宮頸部スワブにおけるクラミジア主要外膜タンパク質(MOMP)をコードするDNAの存在についてのPCR試験からの結果を含む。
【0258】
また、C. trachomatis感染ヒトHEp2細胞のIHC染色およびELISAによる患者サンプル中の抗体の、本発明の4個のペプチド(Pep4、7、8および10)への結合を示す。
【0259】
表7は、9/24のサンプルがPCRに陽性であり(PCRアッセイのいずれかによる)、IHC染色およびELISAについて陽性であることを示す(1:40および1:80の血清の希釈で; 多くは両方において陽性であった)。13/24のサンプルは、PCR(任意のアッセイ)に陽性であり、IHC染色および/またはELISAにおいて陽性であった。24個のうち11個のサンプルは、MOMPまたはクラミジアプラスミドについてのアッセイにおいてPCR陽性であり(プラスミドは、すべてのクラミジア株において実施されているわけではない)、IHCおよび/またはELISAにおいて陽性であった(すべてのサンプルがELISAにより試験されたわけではない)。
【0260】
17/24個の血清が、PCR陽性に基づいてクラミジア感染を有することが報告されている対象に由来するものであることは明らかである。感染した個体のこれらの血清は、4個のペプチドを用いて、C. trachomatis感染細胞の染色およびELISAの陽性結果を生じた(染色およびELISAの異なる力価および強度ではあるが)。
【0261】
したがって、確認されたクラミジア感染を有する患者は、本発明のペプチドに対する抗体を産生し、これはさらに、動物試験に加えて、これらのペプチドが診断のために、および免疫原性組成物で投与された(すなわち、適当なアジュバントまたは他の免疫刺激部分と共に、マイクロもしくはナノ粒子として封入された形などで投与される)場合にはヒト免疫付与のために有効であるという予測を支持する。患者の血清がEBもしくはRB段階において全クラミジア個体を認識する抗体を含む場合には、また、4個すべてのペプチドを認識する抗体が存在し得て、これは、これらのペプチドが適当なワクチンおよび診断抗原として機能し得るという考えを強める。
【0262】
表7: ヒト血清サンプルにおけるPCRおよび免疫反応性
【表12】

【表13】

【表14】

【表15】

【表16】

【0263】
MOMPについてのPCRを入れ子にしている(is nested)。本明細書において使用されるMOMP-PCRについてのより多くの情報に関しては、MOMP PCR: B. Dutilh et al., Res Microbiol. 1989, 140:7-16; . P. Rodriguez et al., J. Clin Micro. 1991,29: 1132-36を参照のこと。プラスミドPCRについて、S. Bas et al., Arthritis Rheum. 1995, 38:005-13を参照のこと(それらの全体を引用により本明細書の一部とする)。
【0264】
PCR欄における複数の記入(+、-など)は、異なる研究者により行われた独立したPCR試験を示す。PCRの陽性および陰性は、偽陽性および偽陰性を除外する注意深い制御により示されており、したがってPCRの陽性は、ロバストである。
【0265】
子宮頸部スワブの陰性は、現在において感染していないこと(すなわち、頸部および膣スワブからの高められた感染は、脱落した病原体を検出しないであろうこと)を意味する。
【0266】
「染色」の陽性およびELISA反応性を示す任意の数の存在はまた、以前の感染または上昇した感染(ascended infection)を示す。
【0267】
PCRに陰性な結果に対して感染細胞の抗体染色における陽性は、以前の(現在ではない)感染の存在を示す。
【0268】
ELISAの結果は、染色結果と完全に一致している。4個のペプチドに対する類似しないELISA値は、弱い免疫染色と相関するように思われる。
【0269】
番号により引用された文献
【表17】

【0270】
【表18】

【0271】
【表19】

【0272】
【表20】

【0273】
【表21】

【0274】
【表22】

【0275】
【表23】

【0276】
上記で引用され記載された参照は、それらが特別に本明細書に組み込まれているか否かにかかわらず、それらの全体を引用により本明細書の一部とする。
【0277】
本発明は本明細書において十分に記載されているので、同様のことが、本発明の精神および範囲から離れることなく、かつ、過度の実験をすることなく、広範な同等のパラメーター、濃度、および条件内で実施され得ることが当業者により理解されるであろう。
【特許請求の範囲】
【請求項1】
少なくとも約10アミノ酸長であるが、抗体VHもしくはVLドメインまたはscFV鎖の長さよりも短い免疫原性ペプチドであって、該ペプチドは、クラミジア属特異的糖脂質外抗原(GLXA)の構造を免疫学的に模倣しており、該ペプチドが十分な量かつ免疫原性形態で哺乳動物対象に投与された場合に、下記:
(a) 免疫ペプチドに対するイムノアッセイ;
(b) GLXAに対するイムノアッセイ; および/または
(c) 全クラミジア種のクラミジア個体への結合、またはその機能、増殖もしくは生存の阻害を測定するイムノアッセイまたは生物学的アッセイ
において測定可能な抗体応答を誘導する、免疫原性ペプチド。
【請求項2】
約30アミノ酸残基長を超えない、請求項1に記載の免疫原性ペプチド。
【請求項3】
抗GLXA抗体Ab1に結合するライブラリーメンバーの選択によるファージディスプレイペプチドライブラリーに由来する、請求項1に記載の免疫原性ペプチド。
【請求項4】
抗GLXA抗体Ab1が受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生されるモノクローナル抗体(mAb)である、請求項3に記載の免疫原性ペプチド。
【請求項5】
ペプチドが、下記:
(a) Pep1、配列番号1;
(b) Pep2、配列番号2;
(c) Pep3、配列番号3;
(d) Pep1、配列番号4;
(e) Pep4、配列番号5;
(f) Pep5、配列番号6;
(g) Pep6、配列番号7;
(h) Pep11、配列番号11;
(i) Pep12、配列番号12;
(j) Pep13、配列番号13;
(k) Pep14、配列番号14; および
(l) ペプチドの抗体反応性および免疫原性を保持する、(a) - (k)のペプチドのいずれかの保存的アミノ酸置換変異型または付加変異型
からなる群から選択される、請求項3に記載の免疫原性ペプチド。
【請求項6】
N末端およびC末端残基が、(i) 両末端においてCys残基、または(ii) 一方の末端において架橋可能なLysおよび他方の末端においてGluを導入するように付加された環化ペプチドである、請求項1-5のいずれか1項に記載の免疫原性ペプチド。
【請求項7】
ペプチドの直鎖配列が、配列番号14; 配列番号15; 配列番号16; 配列番号17; 配列番号18; 配列番号23; 配列番号24; 配列番号25; 配列番号26; 配列番号27; 配列番号28; 配列番号20; 配列番号30; 配列番号34; 配列番号35; 配列番号36; 配列番号37; 配列番号38; 配列番号39; 配列番号40; 配列番号41; 配列番号42; 配列番号43; 配列番号44; 配列番号45; 配列番号46; 配列番号47; 配列番号48; 配列番号49; 配列番号50; 配列番号51; 配列番号52; 配列番号53; 配列番号54; 配列番号55; 配列番号56; 配列番号57; および配列番号58からなる群から選択される、請求項6に記載の免疫原性ペプチド。
【請求項8】
抗GLXA抗体Ab1に特異的である抗イディオタイプ抗体Ab2のV領域ドメインのアミノ酸配列を有し、イムノアッセイにおいて抗GLXA抗体に結合する、請求項1に記載の免疫原性ペプチド。
【請求項9】
抗GLXA抗体Ab1が受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生されるモノクローナル抗体(mAb)である、請求項8に記載の免疫原性ペプチド。
【請求項10】
抗イディオタイプAb2抗体がモノクローナル抗体である、請求項8に記載の免疫原性ペプチド。
【請求項11】
モノクローナル抗イディオタイプ抗体Ab2が受託番号HB-11301としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである、請求項10に記載の免疫原性ペプチド。
【請求項12】
ペプチドが、下記:
(a) Pep8、配列番号8;
(b) Pep9、配列番号9;
(c) Pep10、配列番号10; および
(d) ペプチドの抗体反応性および免疫原性を保持する、(a) - (c)のペプチドのいずれかの保存的アミノ酸置換変異型または付加変異型
からなる群から選択される、請求項11に記載の免疫原性ペプチド。
【請求項13】
N末端およびC末端残基が、(i) 両末端においてCys残基、または(ii) 一方の末端において架橋可能なLysおよび他方の末端においてGluを導入するように付加された環化ペプチドである、請求項8-12のいずれか1項に記載の免疫原性ペプチド。
【請求項14】
ペプチドの直鎖配列が、配列番号22; 配列番号23; 配列番号24; 配列番号25; 配列番号38; 配列番号39; 配列番号40; 配列番号52; 配列番号53; および配列番号54からなる群から選択される、請求項13に記載の免疫原性ペプチド。
【請求項15】
請求項1-14のいずれか1項に記載のペプチドの約2から約20リピートを含む、免疫原性直鎖オリゴマーもしくはマルチマーペプチドまたはポリペプチド。
【請求項16】
各々が該ペプチドの任意の2個の隣接するリピート単位の間に位置する1個またはそれ以上のリンカーを含む、請求項15に記載のオリゴマーもしくはマルチマーペプチドまたはポリペプチド。
【請求項17】
環化している、請求項15または16に記載のオリゴマーもしくはマルチマーペプチドまたはポリペプチド。
【請求項18】
請求項1-14のいずれか1項に記載のペプチドのタンデムに連結された2もしくは3個のリピートを含む、免疫原性タンデムオリゴマーペプチド。
【請求項19】
分枝を提供し、かつ、16個までの末端官能基を含むように少なくとも二機能性であるコア分子上に構築された樹枝状ポリマーであって、請求項1-14のいずれか1項に記載のペプチドが該官能基と共有結合している、樹枝状ポリマー。
【請求項20】
(a) 請求項1-14のいずれか1項に記載の免疫原性ペプチド、請求項15-17のいずれか1項に記載のオリゴマーもしくはマルチマー、請求項18に記載のタンデムオリゴマーペプチドまたは請求項19に記載の樹枝状ポリマー; および
(b) 免疫学的および薬学的に許容される担体もしくは賦形剤
を含む、免疫原性組成物。
【請求項21】
さらに、薬学的に許容されるポリマーから形成された固相マトリックスを含むマイクロスフィア、マイクロ粒子またはナノ粒子を含む、請求項20に記載の免疫原性組成物であって、該マイクロスフィア、マイクロ粒子またはナノ粒子が該ペプチドを含む、免疫原性組成物。
【請求項22】
ポリマーがPLAまたはPLGAである、請求項21に記載の免疫原性組成物。
【請求項23】
ペプチドが直鎖オリゴマーもしくはマルチマーの形態である、請求項20に記載の免疫原性組成物。
【請求項24】
ペプチド、オリゴマーまたはマルチマーが糸状バクテリオファージに連結されている、請求項20に記載の免疫原性組成物。
【請求項25】
さらにアジュバント、該免疫原性ペプチドとは異なる免疫刺激タンパク質、またはCpGオリゴヌクレオチドを含む、請求項20-24のいずれか1項に記載の免疫原性組成物。
【請求項26】
免疫刺激タンパク質がサイトカインである、請求項25に記載の免疫原性組成物。
【請求項27】
サイトカインがインターロイキン-2またはGM-CSFである、請求項26に記載の免疫原性組成物。
【請求項28】
アジュバントが、下記:
(a) 0.4 mg トレオニル-ムラミルジペプチドを含むリン酸緩衝液中のISAF-1 (5% スクアレン、2.5% プルロニックL121、0.2% Tween 80);
(b) 油中に溶解した脱油レシチン;
(c) 水酸化アルミニウムゲル;
(d) (b)と(c)の混合物;
(e) QS-21; および
(f) モノホスホリルリピドAアジュバント
からなる群から選択される、請求項25-27のいずれか1項に記載の免疫原性組成物。
【請求項29】
さらに組み換えインターロイキン-2を含む、請求項18に記載の免疫原性組成物。
【請求項30】
請求項1-14のいずれか1項に記載のペプチドをコードする免疫原性DNA分子。
【請求項31】
Ab1抗GLXA抗体に特異的であるAb2抗イディオタイプ抗体の重鎖もしくは軽鎖可変領域の1個、2個または3個の相補性決定領域(CDR)を任意の順序で含むポリペプチドをコードする免疫原性DNA分子。
【請求項32】
抗イディオタイプ抗体がモノクローナル抗体である、請求項31に記載のDNA分子。
【請求項33】
モノクローナル抗体が受託番号HB-11301としてATCCに寄託されたハイブリドーマ細胞株により産生される、請求項32に記載のDNA分子。
【請求項34】
配列番号59もしくは配列番号61を含むか、または配列番号59もしくは配列番号61の少なくとも1個のCDRコード領域を含む、請求項33に記載のDNA分子。
【請求項35】
配列番号59または配列番号61からなる、請求項34に記載のDNA分子。
【請求項36】
少なくとも1個のCDRをコードする配列番号59または配列番号61の断片からなる、請求項34に記載のDNA分子。
【請求項37】
(a) 分子が配列番号59を含む場合に、約411ヌクレオチド長を超えず; および
(b) 分子が配列番号61を含む場合に、約387ヌクレオチド長を超えない
、請求項34に記載のDNA分子。
【請求項38】
請求項15または16に記載の直鎖オリゴマーもしくはマルチマーをコードする、免疫原性DNA分子。
【請求項39】
一本鎖融合ポリペプチドをコードする免疫原性DNA分子であって、該ポリペプチドが、下記:
(a) 第1融合パートナーとして、所望によりインフレームで(b)に結合した請求項1-14のいずれか1項に記載のペプチド
(b) 存在する場合、インフレームで(c)に結合したリンカーまたはスペーサーペプチド
(c) 第2融合パートナー
を含み、該DNA分子を用いた対象の免疫化が、該第2融合パートナーを含まないで投与されたペプチドに対する抗体応答と比較して該ペプチドに対する抗体応答を増大させる、免疫原性DNA分子。
【請求項40】
対象に投与され、該対象において発現した場合に免疫原として有用な発現ベクターであって、下記:
(a) 請求項30-39のいずれか1項に記載のDNA分子; および
(b) それと操作可能に結合したプロモーター、および所望により、意図される細胞または対象においてDNAの発現を促進する1個またはそれ以上の転写制御配列
を含む、発現ベクター。
【請求項41】
クラミジア感染に対して哺乳動物対象を免疫する方法であって、請求項1-14のいずれか1項に記載のペプチドの有効な免疫原性量を該対象に投与することを含み、クラミジア属に特異的であるクラミジア抗原GLXA特異的抗体応答を生じる、方法。
【請求項42】
クラミジア感染に対して哺乳動物対象を免疫する方法であって、請求項15-19のいずれか1項に記載のオリゴマーもしくはマルチマーペプチドまたはポリペプチドまたはポリマーの有効な免疫原性量を該対象に投与することを含み、クラミジア属に特異的であるクラミジア抗原GLXA特異的抗体応答を生じる、方法。
【請求項43】
クラミジア感染に対して哺乳動物対象を免疫する方法であって、請求項20-29のいずれか1項に記載の組成物の有効な免疫原性量を該対象に投与することを含み、クラミジア属に特異的であるクラミジア抗原GLXA特異的抗体応答を生じる、方法。
【請求項44】
クラミジア感染に対して哺乳動物対象を免疫する方法であって、請求項30-39のいずれか1項に記載のDNA組成物または請求項40に記載の発現ベクターの有効な免疫原性量を該対象に投与することを含み、クラミジア属に特異的であるクラミジア抗原GLXA特異的抗体応答を生じる、方法。
【請求項45】
抗体応答が、該対象における該クラミジアの感染性、増殖、まん延もしくは病原性を予防または阻害する中和抗体応答である、請求項41-44のいずれか1項に記載の方法。
【請求項46】
対象がヒトである、請求項41-45のいずれか1項に記載の方法。
【請求項1】
少なくとも約10アミノ酸長であるが、抗体VHもしくはVLドメインまたはscFV鎖の長さよりも短い免疫原性ペプチドであって、該ペプチドは、クラミジア属特異的糖脂質外抗原(GLXA)の構造を免疫学的に模倣しており、該ペプチドが十分な量かつ免疫原性形態で哺乳動物対象に投与された場合に、下記:
(a) 免疫ペプチドに対するイムノアッセイ;
(b) GLXAに対するイムノアッセイ; および/または
(c) 全クラミジア種のクラミジア個体への結合、またはその機能、増殖もしくは生存の阻害を測定するイムノアッセイまたは生物学的アッセイ
において測定可能な抗体応答を誘導する、免疫原性ペプチド。
【請求項2】
約30アミノ酸残基長を超えない、請求項1に記載の免疫原性ペプチド。
【請求項3】
抗GLXA抗体Ab1に結合するライブラリーメンバーの選択によるファージディスプレイペプチドライブラリーに由来する、請求項1に記載の免疫原性ペプチド。
【請求項4】
抗GLXA抗体Ab1が受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生されるモノクローナル抗体(mAb)である、請求項3に記載の免疫原性ペプチド。
【請求項5】
ペプチドが、下記:
(a) Pep1、配列番号1;
(b) Pep2、配列番号2;
(c) Pep3、配列番号3;
(d) Pep1、配列番号4;
(e) Pep4、配列番号5;
(f) Pep5、配列番号6;
(g) Pep6、配列番号7;
(h) Pep11、配列番号11;
(i) Pep12、配列番号12;
(j) Pep13、配列番号13;
(k) Pep14、配列番号14; および
(l) ペプチドの抗体反応性および免疫原性を保持する、(a) - (k)のペプチドのいずれかの保存的アミノ酸置換変異型または付加変異型
からなる群から選択される、請求項3に記載の免疫原性ペプチド。
【請求項6】
N末端およびC末端残基が、(i) 両末端においてCys残基、または(ii) 一方の末端において架橋可能なLysおよび他方の末端においてGluを導入するように付加された環化ペプチドである、請求項1-5のいずれか1項に記載の免疫原性ペプチド。
【請求項7】
ペプチドの直鎖配列が、配列番号14; 配列番号15; 配列番号16; 配列番号17; 配列番号18; 配列番号23; 配列番号24; 配列番号25; 配列番号26; 配列番号27; 配列番号28; 配列番号20; 配列番号30; 配列番号34; 配列番号35; 配列番号36; 配列番号37; 配列番号38; 配列番号39; 配列番号40; 配列番号41; 配列番号42; 配列番号43; 配列番号44; 配列番号45; 配列番号46; 配列番号47; 配列番号48; 配列番号49; 配列番号50; 配列番号51; 配列番号52; 配列番号53; 配列番号54; 配列番号55; 配列番号56; 配列番号57; および配列番号58からなる群から選択される、請求項6に記載の免疫原性ペプチド。
【請求項8】
抗GLXA抗体Ab1に特異的である抗イディオタイプ抗体Ab2のV領域ドメインのアミノ酸配列を有し、イムノアッセイにおいて抗GLXA抗体に結合する、請求項1に記載の免疫原性ペプチド。
【請求項9】
抗GLXA抗体Ab1が受託番号HB-11300としてATCCに寄託されたハイブリドーマ細胞株により産生されるモノクローナル抗体(mAb)である、請求項8に記載の免疫原性ペプチド。
【請求項10】
抗イディオタイプAb2抗体がモノクローナル抗体である、請求項8に記載の免疫原性ペプチド。
【請求項11】
モノクローナル抗イディオタイプ抗体Ab2が受託番号HB-11301としてATCCに寄託されたハイブリドーマ細胞株により産生されるmAbである、請求項10に記載の免疫原性ペプチド。
【請求項12】
ペプチドが、下記:
(a) Pep8、配列番号8;
(b) Pep9、配列番号9;
(c) Pep10、配列番号10; および
(d) ペプチドの抗体反応性および免疫原性を保持する、(a) - (c)のペプチドのいずれかの保存的アミノ酸置換変異型または付加変異型
からなる群から選択される、請求項11に記載の免疫原性ペプチド。
【請求項13】
N末端およびC末端残基が、(i) 両末端においてCys残基、または(ii) 一方の末端において架橋可能なLysおよび他方の末端においてGluを導入するように付加された環化ペプチドである、請求項8-12のいずれか1項に記載の免疫原性ペプチド。
【請求項14】
ペプチドの直鎖配列が、配列番号22; 配列番号23; 配列番号24; 配列番号25; 配列番号38; 配列番号39; 配列番号40; 配列番号52; 配列番号53; および配列番号54からなる群から選択される、請求項13に記載の免疫原性ペプチド。
【請求項15】
請求項1-14のいずれか1項に記載のペプチドの約2から約20リピートを含む、免疫原性直鎖オリゴマーもしくはマルチマーペプチドまたはポリペプチド。
【請求項16】
各々が該ペプチドの任意の2個の隣接するリピート単位の間に位置する1個またはそれ以上のリンカーを含む、請求項15に記載のオリゴマーもしくはマルチマーペプチドまたはポリペプチド。
【請求項17】
環化している、請求項15または16に記載のオリゴマーもしくはマルチマーペプチドまたはポリペプチド。
【請求項18】
請求項1-14のいずれか1項に記載のペプチドのタンデムに連結された2もしくは3個のリピートを含む、免疫原性タンデムオリゴマーペプチド。
【請求項19】
分枝を提供し、かつ、16個までの末端官能基を含むように少なくとも二機能性であるコア分子上に構築された樹枝状ポリマーであって、請求項1-14のいずれか1項に記載のペプチドが該官能基と共有結合している、樹枝状ポリマー。
【請求項20】
(a) 請求項1-14のいずれか1項に記載の免疫原性ペプチド、請求項15-17のいずれか1項に記載のオリゴマーもしくはマルチマー、請求項18に記載のタンデムオリゴマーペプチドまたは請求項19に記載の樹枝状ポリマー; および
(b) 免疫学的および薬学的に許容される担体もしくは賦形剤
を含む、免疫原性組成物。
【請求項21】
さらに、薬学的に許容されるポリマーから形成された固相マトリックスを含むマイクロスフィア、マイクロ粒子またはナノ粒子を含む、請求項20に記載の免疫原性組成物であって、該マイクロスフィア、マイクロ粒子またはナノ粒子が該ペプチドを含む、免疫原性組成物。
【請求項22】
ポリマーがPLAまたはPLGAである、請求項21に記載の免疫原性組成物。
【請求項23】
ペプチドが直鎖オリゴマーもしくはマルチマーの形態である、請求項20に記載の免疫原性組成物。
【請求項24】
ペプチド、オリゴマーまたはマルチマーが糸状バクテリオファージに連結されている、請求項20に記載の免疫原性組成物。
【請求項25】
さらにアジュバント、該免疫原性ペプチドとは異なる免疫刺激タンパク質、またはCpGオリゴヌクレオチドを含む、請求項20-24のいずれか1項に記載の免疫原性組成物。
【請求項26】
免疫刺激タンパク質がサイトカインである、請求項25に記載の免疫原性組成物。
【請求項27】
サイトカインがインターロイキン-2またはGM-CSFである、請求項26に記載の免疫原性組成物。
【請求項28】
アジュバントが、下記:
(a) 0.4 mg トレオニル-ムラミルジペプチドを含むリン酸緩衝液中のISAF-1 (5% スクアレン、2.5% プルロニックL121、0.2% Tween 80);
(b) 油中に溶解した脱油レシチン;
(c) 水酸化アルミニウムゲル;
(d) (b)と(c)の混合物;
(e) QS-21; および
(f) モノホスホリルリピドAアジュバント
からなる群から選択される、請求項25-27のいずれか1項に記載の免疫原性組成物。
【請求項29】
さらに組み換えインターロイキン-2を含む、請求項18に記載の免疫原性組成物。
【請求項30】
請求項1-14のいずれか1項に記載のペプチドをコードする免疫原性DNA分子。
【請求項31】
Ab1抗GLXA抗体に特異的であるAb2抗イディオタイプ抗体の重鎖もしくは軽鎖可変領域の1個、2個または3個の相補性決定領域(CDR)を任意の順序で含むポリペプチドをコードする免疫原性DNA分子。
【請求項32】
抗イディオタイプ抗体がモノクローナル抗体である、請求項31に記載のDNA分子。
【請求項33】
モノクローナル抗体が受託番号HB-11301としてATCCに寄託されたハイブリドーマ細胞株により産生される、請求項32に記載のDNA分子。
【請求項34】
配列番号59もしくは配列番号61を含むか、または配列番号59もしくは配列番号61の少なくとも1個のCDRコード領域を含む、請求項33に記載のDNA分子。
【請求項35】
配列番号59または配列番号61からなる、請求項34に記載のDNA分子。
【請求項36】
少なくとも1個のCDRをコードする配列番号59または配列番号61の断片からなる、請求項34に記載のDNA分子。
【請求項37】
(a) 分子が配列番号59を含む場合に、約411ヌクレオチド長を超えず; および
(b) 分子が配列番号61を含む場合に、約387ヌクレオチド長を超えない
、請求項34に記載のDNA分子。
【請求項38】
請求項15または16に記載の直鎖オリゴマーもしくはマルチマーをコードする、免疫原性DNA分子。
【請求項39】
一本鎖融合ポリペプチドをコードする免疫原性DNA分子であって、該ポリペプチドが、下記:
(a) 第1融合パートナーとして、所望によりインフレームで(b)に結合した請求項1-14のいずれか1項に記載のペプチド
(b) 存在する場合、インフレームで(c)に結合したリンカーまたはスペーサーペプチド
(c) 第2融合パートナー
を含み、該DNA分子を用いた対象の免疫化が、該第2融合パートナーを含まないで投与されたペプチドに対する抗体応答と比較して該ペプチドに対する抗体応答を増大させる、免疫原性DNA分子。
【請求項40】
対象に投与され、該対象において発現した場合に免疫原として有用な発現ベクターであって、下記:
(a) 請求項30-39のいずれか1項に記載のDNA分子; および
(b) それと操作可能に結合したプロモーター、および所望により、意図される細胞または対象においてDNAの発現を促進する1個またはそれ以上の転写制御配列
を含む、発現ベクター。
【請求項41】
クラミジア感染に対して哺乳動物対象を免疫する方法であって、請求項1-14のいずれか1項に記載のペプチドの有効な免疫原性量を該対象に投与することを含み、クラミジア属に特異的であるクラミジア抗原GLXA特異的抗体応答を生じる、方法。
【請求項42】
クラミジア感染に対して哺乳動物対象を免疫する方法であって、請求項15-19のいずれか1項に記載のオリゴマーもしくはマルチマーペプチドまたはポリペプチドまたはポリマーの有効な免疫原性量を該対象に投与することを含み、クラミジア属に特異的であるクラミジア抗原GLXA特異的抗体応答を生じる、方法。
【請求項43】
クラミジア感染に対して哺乳動物対象を免疫する方法であって、請求項20-29のいずれか1項に記載の組成物の有効な免疫原性量を該対象に投与することを含み、クラミジア属に特異的であるクラミジア抗原GLXA特異的抗体応答を生じる、方法。
【請求項44】
クラミジア感染に対して哺乳動物対象を免疫する方法であって、請求項30-39のいずれか1項に記載のDNA組成物または請求項40に記載の発現ベクターの有効な免疫原性量を該対象に投与することを含み、クラミジア属に特異的であるクラミジア抗原GLXA特異的抗体応答を生じる、方法。
【請求項45】
抗体応答が、該対象における該クラミジアの感染性、増殖、まん延もしくは病原性を予防または阻害する中和抗体応答である、請求項41-44のいずれか1項に記載の方法。
【請求項46】
対象がヒトである、請求項41-45のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【公表番号】特表2012−502663(P2012−502663A)
【公表日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願番号】特願2011−528039(P2011−528039)
【出願日】平成21年9月21日(2009.9.21)
【国際出願番号】PCT/US2009/057700
【国際公開番号】WO2010/033923
【国際公開日】平成22年3月25日(2010.3.25)
【出願人】(399029721)ウェイン・ステイト・ユニバーシティ (2)
【Fターム(参考)】
【公表日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願日】平成21年9月21日(2009.9.21)
【国際出願番号】PCT/US2009/057700
【国際公開番号】WO2010/033923
【国際公開日】平成22年3月25日(2010.3.25)
【出願人】(399029721)ウェイン・ステイト・ユニバーシティ (2)
【Fターム(参考)】
[ Back to top ]

