クレアチニン測定用乾式試験片及びクレアチニン測定法
【課題】低濃度領域でクレアチニンを測定する際の誤差が小さく、簡便な構造を有するクレアチニン測定用乾式試験片及び該試験片を用いたクレアチニン測定法を提供する。
【解決手段】クレアチニン測定用乾式試験片10は、支持体2と、該支持体2の上に設けられた試薬層4と、該試薬層4の上に設けられた試薬保持層5と、試薬層4と試薬保持層5とを接着する斑点状に形成された接着剤からなる接続層6とを有し、前記試薬層4は、クレアチニナーゼ及び4−アミノアンチピリンを含有し、前記試薬保持層5は、クレアチナーゼ、ザルコシンオキシダーゼ、ペルオキシダーゼ、及び、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリンを含有し、接続層6は、試薬保持層5に点着された液状試料の試薬層4への到達を遅延させることを特徴とする。
【解決手段】クレアチニン測定用乾式試験片10は、支持体2と、該支持体2の上に設けられた試薬層4と、該試薬層4の上に設けられた試薬保持層5と、試薬層4と試薬保持層5とを接着する斑点状に形成された接着剤からなる接続層6とを有し、前記試薬層4は、クレアチニナーゼ及び4−アミノアンチピリンを含有し、前記試薬保持層5は、クレアチナーゼ、ザルコシンオキシダーゼ、ペルオキシダーゼ、及び、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリンを含有し、接続層6は、試薬保持層5に点着された液状試料の試薬層4への到達を遅延させることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、クレアチニン測定用乾式試験片及びクレアチニン測定法に関する。
【背景技術】
【0002】
クレアチニンは、クレアチン経路の最終代謝物であり、クレアチンが脱水、環化した構造を有する。体内においては、大半はクレアチン又はクレアチンリン酸として筋肉中に存在する。クレアチンは、ATPから高エネルギーリン酸を受けてクレアチンリン酸となり、エネルギー貯蔵物質として機能し、筋収縮などのエネルギー消費時にはADPに高エネルギーリン酸を転移してクレアチンに戻るか、非酵素的反応によってクレアチニンとなる。その後、生成したクレアチニンは、腎臓を介して尿中へ排泄される。
【0003】
このため、クレアチニンの尿中排泄量すなわち尿中濃度は、筋肉疾患や腎機能障害の指標に用いられている。また、腎機能障害がある場合等、血中のクレアチニン濃度が疾患の指標となり得る。
【0004】
集団検診の現場やスクリーニング検査等の初期診断の場面において、クレアチニンの尿中、血清中又は血漿中の濃度の測定を迅速に行うため、クレアチニンと反応して呈色する試薬を予め支持体に塗布又は含浸させ乾燥させた乾式試験片が広く用いられている。
【0005】
従来のクレアチニン測定用乾式試験片は、強アルカリ性条件下におけるクレアチニンとピクリン酸との縮合物による呈色反応(ヤッフェ反応)を利用している。こうした試験片の一つとして、特許文献1は、支持体と、該支持体上に担持された3,5−ジニトロ安息香酸を含む試薬層と、該試薬層上に設けられた水酸化リチウム等の強アルカリ性物質を含む展開層とからなるクレアチニン測定用試験片を開示する。
【0006】
また、クレアチニンを測定するための呈色反応としては、酵素法も知られている。特許文献2は、クレアチニンとクレアチニンイミノヒドラーゼとの反応により生じるガス状アンモニアを定量する乾式の分析要素であって、透明支持体の上に、ガス状アンモニアにより検知可能な変化を生じる指示薬を含む指示薬層、ガス状アンモニアを通過させる液体遮断層、アルカリ性緩衝剤を含有し必要により基質と反応してアンモニアを生成することのできる試薬層、及び、展開層がこの順に一体に積層された分析要素を開示する。
【0007】
また、従来の湿式クレアチニン測定試薬キットでは、酵素法の一種である、クレアチナーゼ−ザルコシンオキシダーゼ−ペルオキシダーゼ法が用いられている。非特許文献1、非特許文献2、及び、非特許文献3は、クレアチニナーゼにより試料中の内因性のクレアチンを予め分解する第1反応試薬と、第1反応試薬を添加し反応させた後の試料中に添加することで、試料中のクレアチニンをクレアチナーゼによりクレアチンに変換し、該クレアチンをクレアチニナーゼによりザルコシンと尿素とに分解し、該ザルコシンをザルコシンオキシダーゼと反応させて過酸化水素を生成し、該過酸化水素及びペルオキシダーゼ存在下で水素供与体化合物及び4−アミノアンチピリンを酸化縮合させることでキノン色素を生成する第2反応試薬とからなる湿式クレアチニン測定試薬キットを開示する。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平09−061430号公報
【特許文献2】特許第4243255号
【非特許文献】
【0009】
【非特許文献1】CRE−L試薬 カイノス 添付文書、第4版、カイノス株式会社、2010
【非特許文献2】N−アッセイ CRE−L ニットーボー 添付文書、第11版、日東紡績株式会社、2008
【非特許文献3】エクセライザCRE 添付文書、第6版、積水メディカル株式会社、2008
【発明の概要】
【発明が解決しようとする課題】
【0010】
特許文献1に示すような従来のヤッフェ反応を用いるクレアチニン測定用乾式試験片は、低濃度領域でクレアチニンを測定する際、誤差が大きいという欠点があった。
【0011】
特許文献2に開示される乾式の分析要素は、低濃度領域でクレアチニンを測定する際の誤差はヤッフェ反応を用いる場合と比較して小さいものの、試料中の内因性アンモニアの影響をうち消しきれず、また、反応生成物であるアンモニアガスを制御するため複雑な層構造を必要とし、製造の歩留まりが低いという欠点があった。
【0012】
また、従来の乾式試験片では該試験片に含まれる全ての試薬が試料中に取り込まれ反応するため、特許文献2に記載のようにアンモニアガス等の気体を介するのでなければ、2段階以上からなる反応系を乾式試験に適用することはできない。そのため、反応過程において気体が発生しない2段階反応系である、非特許文献1、非特許文献2、及び、非特許文献3に記載のクレアチナーゼ−ザルコシンオキシダーゼ−ペルオキシダーゼ法は、これまで、乾式試験片に用いることはできなかった。
【0013】
本発明は上記問題に鑑みなされたものであり、低濃度領域でクレアチニンを測定する際の誤差が小さく、簡便な構造を有するクレアチニン測定用乾式試験片及び該試験片を用いたクレアチニン測定法を提供することを目的とする。
【課題を解決するための手段】
【0014】
上記目的を達成するため、本発明の第1の観点に係るクレアチニン測定用乾式試験片は、
支持体と、
該支持体上に設けられた試薬層と、
該試薬層上に設けられた試薬保持層と、
前記試薬層と前記試薬保持層との間に設けられ、前記試薬層と前記試薬保持層とを接続する接続層と、
を有し、
前記試薬層は、クレアチニナーゼを含有し、
前記試薬保持層は、クレアチナーゼ及びザルコシンオキシダーゼを含有し、
ペルオキシダーゼ、4−アミノアンチピリン、及び、水素供与体化合物が、それぞれ、前記試薬層と前記試薬保持層とのいずれか一方の層にのみ含まれるか、又は両方の層に含まれ、
前記接続層は、前記試薬保持層に点着された液状試料の前記試薬層への到達を遅延させることを特徴とする。
【0015】
前記接続層は、互いに離隔する複数の斑点を形成するように塗布された接着剤からなり、前記斑点間に前記接着剤のない部分が存在することが好ましい。
【0016】
前記水素供与体は、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリンであることが好ましい。
【0017】
前記試薬保持層及び/又は前記試薬層は、緩衝剤をさらに含むことが好ましい。
【0018】
上記目的を達成するため、本発明の第2の観点に係るクレアチニン測定法は、
本発明の第1の観点に係るクレアチニン測定用乾式試験片を用いるクレアチニン測定法であって、
前記試薬保持層に液状試料を点着する工程と、
前記液状試料中の内因性のクレアチンが前記クレアチナーゼにより分解しきった後に前記クレアチニン測定用乾式試験片の呈色度合いを測定する第1測定工程と、
前記第1測定工程から所定の時間が経過した後に、前記クレアチニン測定用乾式試験片の呈色度合いを測定する第2測定工程と、
前記第2測定工程で測定した呈色度合いから前記第1測定工程で測定した呈色度合いを減算して、前記第1測定工程から前記第2測定工程までの呈色度合いの変化量を獲得する工程と、
前記変化量に対応する検量線の値を求めることで前記液状試料中のクレアチニン濃度を決定する工程と、
を備えることを特徴とする。
【0019】
上記目的を達成するため、本発明の第3の観点に係るクレアチニン測定法は、
本発明の第1の観点に係るクレアチニン測定用乾式試験片を用いるクレアチニン測定法であって、
前記試薬保持層に液状試料を点着する点着工程と、
前記点着工程後、前記クレアチニン測定用乾式試験片が液状試料と反応して呈色がプラトーに達するまで、前記クレアチニン測定用乾式試験片の呈色度合いを経時的に記録する工程と、
前記記録において、前記呈色度合いの変化率が変化した時点から呈色がプラトーに達する時点までの前記呈色度合いの単位時間あたりの変化量を獲得する工程と、
前記変化量に対応する検量線の値を求めることで前記液状試料中のクレアチニン濃度を決定する工程と、
を備えることを特徴とする。
【発明の効果】
【0020】
本発明によれば、低濃度領域でクレアチニンを測定する際の誤差が小さく、簡便な構造を有するクレアチニン測定用乾式試験片及び該試験片を用いたクレアチニン測定法が提供される。
【図面の簡単な説明】
【0021】
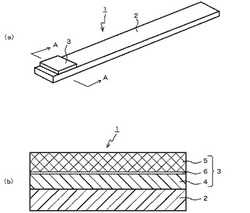
【図1】(a)は本発明の実施の形態に係るクレアチニン測定用乾式試験片の構成を示す斜視図、(b)は(a)のA−A縦断面図である。
【図2】実施例1のクレアチニン測定用乾式試験片を用い、高クレアチン試料を測定した場合のK/S値の経時的変化を示す図(a)と高クレアチニン試料を測定した場合のK/S値の経時的変化を示す図(b)である。
【図3】実施例1のクレアチニン測定用乾式試験片を用い反応時間差測定法により測定したΔK/S値と分析装置を用いて測定したクレアチニン濃度測定値とをプロットして示した図である。
【図4】実施例1及び2のクレアチニン測定用乾式試験片を用いて、クレアチニン濃度の低い試料を測定した場合のK/S値の経時的変化を示す図(a)とクレアチニン濃度の高い試料を測定した場合のK/S値の経時的変化を示す図(b)である。
【発明を実施するための形態】
【0022】
以下、本発明の実施形態について図面を参照しながら詳細に説明する。
【0023】
(実施の形態)
本発明の実施の形態に係るクレアチニン測定用乾式試験片1は、図1に示すように、支持体2と、支持体2に担持された試薬部3とから構成されている。試薬部3は、支持体2上に形成された試薬層4と、該試薬層4を覆うように形成された試薬保持層5と、試薬層4と試薬保持層5との間に形成され試薬層4と試薬保持層5とを接続する接続層6とから構成されている。
【0024】
支持体2は、液体浸透性のないことが好ましい。これによって、本実施の形態に係るクレアチニン測定用乾式試験片1を用いてクレアチニンを測定する際、試薬層4、試薬保持層5に滴下される液状試料が試薬層4及び試薬保持層5内に留まるため、精度よく測定することができる。支持体2としては、紙片、プラスチック(合成樹脂)片、金属片等を用いることができる。量産性・低コスト・保存性・耐水性等の観点からは、合成樹脂片を用いるのが好ましい。
【0025】
また、液状試料を滴下して検出反応を起こさせた後の光学的分析において、光を支持体側から照射する場合には、支持体2は光透過性を有する必要がある。これに対して、光を試薬保持層5側から照射する場合には、光透過性は要求されない。
【0026】
試薬層4は、クレアチニナーゼを含む。試薬層4は、液体浸透性を有する材質を主体として構成される。特に、水溶性の材質を主体として、その中に試薬が分散していることが好ましい。これにより、測定時に、試薬層4に含有される試薬は、上層に位置する試薬保持層5に滴下された液状試料に取り込まれる。水溶性の材質としては、ポリビニルピロリドン(PVP)を始めとする水溶性高分子化合物等を用いることができる。また、試薬層4は、液体浸透性を有する紙、編物、織物等の布帛材中に、試薬が分散している構成であってもよい。
【0027】
試薬保持層5は、クレアチナーゼ、ザルコシンオキシダーゼを含む。試薬保持層5は、液体浸透性を有する材質を主体として構成される。特に、水溶性の材質を主体として、その中に試薬が分散していることが好ましい。これにより、測定時に、試薬保持層5に滴下された液状試料は、試薬保持層5中を迅速かつ均一に拡散する。水溶性の材質としては、ポリビニルピロリドン(PVP)を始めとする水溶性高分子化合物等を用いることができる。また、試薬保持層5は、液体浸透性を有する紙、編物、織物等の布帛材中に、試薬が分散している構成であってもよい。
【0028】
接続層6は、試薬層4の表面に互いに離隔された複数の斑点が形成されるように接着剤を塗布して、試薬層4と試薬保持層5とを接着することで形成されている。複数の斑点状の接着剤から構成された接続層6は、試薬保持層5と試薬層4とを、その間に若干の空隙を挟んで接続する。試料が試薬保持層5に点着されたとき、この空隙の存在により、試薬保持層5から試薬層4へ液状試料が移動するまでに遅延が生じる。このため、試薬保持層5に点着された液状試料は、まず、試薬保持層5中を優先的に拡散し、その後、試薬層4へ移動することとなる。
【0029】
本実施の形態では、呈色反応は、ザルコシンオキシダーゼによるザルコシンの加水分解によって生じた過酸化水素及びペルオキシダーゼの存在下で4−アミノアンチピリン及び水素供与体化合物のカップリング反応により有色キノンを形成することで行われる。そのため、ペルオキシダーゼ、4−アミノアンチピリン、及び、水素供与体化合物が、試薬層4又は試薬保持層5の少なくとも一層に含まれる。
【0030】
水素供与体化合物として、N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリン(HDAOS)、N−エチル−N−スルホプロピル−3−メトキシアニリン(ADPS)、N−エチル−N−スルホプロピルアニリン(ALPS)、N−エチル−N−スルホプロピル−3,5−ジメトキシアニリン(DAPS)、N−スルホプロピル−3,5−ジメトキシアニリン(HDAPS)、N−エチル−N−スルホプロピル−3,5−ジメチルアニリン(MAPS)、N−エチル−N−スルホプロピル−3−メチルアニリン(TOPS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3−メトキシアニリン(ADOS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)アニリン(ALOS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリン(DAOS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメチルアニリン(MAOS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3−メチルアニリン(TOOS)およびN−スルホプロピルアニリン(HALPS)等がある。
【0031】
試薬層4及び/又は試薬保持層5は、それらに含まれる酵素の反応又は保存の安定性を高めるための緩衝剤を含んでもよい。好ましくは、水素イオン濃度指数(pH)がpH6〜9の範囲内である。緩衝剤としては、例えばリン酸緩衝剤、N,N−ビス(2−ヒドロキシエチル)−2−アミノエタンスルホン酸(BES)、N−トリスメチル−2−アミノエタンスルホン酸(TES)、2−[4−(2−ヒドロキシエチル)−1−ピペラジル]エタンスルホン酸(HEPES)、ピペラジン−1,4−ビス(2−ヒドロキシ−3−プロパンスルホン酸)・2水和物(POPSO)等の公知の緩衝剤を用いることができる。
【0032】
クレアチニン測定用乾式試験片1の測定対象として意図している液状試料が、微量、例えば、5μl程度である場合、試薬層4及び試薬保持層5は、数mm×数mm程度の面積であればよい。さらに、これらの層を手などで保持することは困難であるため、持ち手として用いることができるように、支持体2を、数mm〜1cm程度の幅の細長い片として設けることが好ましい。
【0033】
また、クレアチニン測定用乾式試験片1中の各試薬の含有量について、クレアチニナーゼは、少なくとも、所定の測定上限量のクレアチニンと反応するのに十分な量あればよく、その他の試薬は、少なくとも、所定の測定上限量のクレアチニンに加えて液状試料中の内因性のクレアチンと反応するのに十分な量あればよい。
【0034】
例えば、測定対象が血清である場合、患者由来のものを含む血清中のクレアチニン濃度は、約0.3〜20mg/dl、クレアチン濃度は、約0.2〜0.6mg/dlである。NCCLS(National Committee for Clinical Laboratory Standards)によれば、対象物質を測定する際、その測定に影響を与える干渉物質については、干渉物質の上限値の3倍程度を基準にすればよいとされる。従って、クレアチニンの測定上限は20mg/dl、内因性のクレアチン濃度の基準値は1.8mg/dlとして、各試薬の濃度を定めればよい。また、血中のクレアチン濃度はサプリメントなどの摂取によって健常者においても増加し得る。そのため、このような見込まれる血中クレアチン濃度の上昇分を考慮にいれて、内因性のクレアチン濃度の基準値を定めることがさらに好ましい。例えば、上記の例の場合、内因性のクレアチン濃度の基準値を5.0mg/dlとすることがさらに好ましい。
【0035】
液状試料が滴下されたときに形成される反応液中での各試薬の好ましい濃度は以下のとおりである。
クレアチニナーゼ:20−1000U/ml
クレアチナーゼ:20−1000U/ml
ザルコシンオキシダーゼ:20−300U/ml
ペルオキシダーゼ:50−3000U/ml
4−アミノアンチピリン:5−100mM
水素供与体化合物:5−100mM
【0036】
本発明の実施の形態に係るクレアチニン測定用乾式試験片1は、次のようにして作製することができる。
【0037】
まず、支持体2となる所定の材質の所定の厚さを有するシートを、所定の寸法を有する細長い片として切り出す。この細長い片を洗浄、乾燥することにより、支持体2が作製される。
【0038】
次に、試薬層4を作製する。まず、液体浸透性を有する材質に、クレアチニナーゼに加えて、必要に応じて、ペルオキシダーゼ、4−アミノアンチピリン、水素供与体化合物、pH緩衝剤を分散させる。
【0039】
液体浸透性を有する材質が、水溶性高分子化合物等の水溶性の材質である場合には、純水に溶解させて水溶液として、この水溶液に上記各試薬を溶解させて攪拌することによって、分散させる。そして、支持体2の所定箇所に塗布し、乾燥して試薬層4とする。
【0040】
液体浸透性を有する材質が、紙、編物、織物等の布帛材の場合には、純水に上記各試薬を溶解させて攪拌した水溶液を、所定の寸法の布帛材に吸収させることで、分散させる。そして、乾燥して水分を除去して、試薬層4とする。その後、試薬層4を、支持体2に積層する。その方法としては、試薬層4が水溶性の材質を主体としたものである場合には、底面を純水で濡らして、支持体2の所定の位置に圧着する。これによって、底面の水溶性の材質が溶解して、接着剤としての役割を果たす。別の方法としては、接着剤で試薬層4を支持体2上に接着してもよい。
【0041】
次に、試薬保持層5を作成する。まず、試薬保持層5は、液体浸透性を有する材質に、クレアチナーゼ、ザルコシンオキシダーゼに加えて、必要に応じて、ペルオキシダーゼ、4−アミノアンチピリン、水素供与体化合物、pH緩衝剤を分散させる。
【0042】
液体浸透性を有する材質が、水溶性高分子化合物等の水溶性の材質である場合には、純水に溶解させて水溶液として、この水溶液に上記各試薬を溶解させて攪拌することによって、分散させる。そして、平坦な基材の上に塗布し、乾燥して、基材から引き剥がして、試薬保持層5とする。
【0043】
液体浸透性を有する材質が、紙、編物、織物等の布帛材の場合には、純水に上記各試薬を溶解させて攪拌した水溶液を、所定の寸法の布帛材に吸収させることで、分散させる。そして、乾燥して水分を除去して試薬保持層5とする。
【0044】
次に、試薬保持層5を、試薬層4上に積層し、接着剤を用いて接着する。接着剤は、上記各酵素の反応を阻害しないものであればよい。試薬層の上に互いに離隔された複数の斑点が形成されるように接着剤を塗布して、斑点間に接着剤のない部分が形成されるようにして接着することが好ましい。これにより、接続層6が形成される。
【0045】
このようにして、本発明の実施の形態に係るクレアチニン測定用乾式試験片1を作製することができる。
【0046】
次に、本実施の形態に係る試験片を用いて、血清、血漿又は尿などの液状試料からクレアチニン濃度を測定する方法について説明する。
【0047】
まず、液状試料を試薬保持層5に点着する。点着された液状試料は、試薬保持層5で横方向に拡散しながら、試薬保持層5に含まれる各種試薬を取り込む。このとき、取り込まれたクレアチナーゼの働きにより、まず最初に、試料中に含まれる内因性のクレアチンが尿素とザルコシンに分解される。その後、試料中に取り込まれたザルコシンオキシダーゼの働きにより、ザルコシンの加水分解によって、過酸化水素が発生する。
【0048】
【化1】

【0049】
以上の反応の進行と並行して、試薬保持層5中に拡散した試料は、次に、試薬層4に到達する。このように、試料の拡散が段階的に進行するのは、接続層6により、試薬保持層5と試薬層4とが若干の空隙を持って接続されているためである。試料の拡散が段階的に進行することにより、本実施の形態に係る試験片では、試薬保持層5でクレアチナーゼ及びザルコシンオキシダーゼによる酵素反応がある程度進んでから、試料は試薬層4に到達する。ここでようやく、試料は試薬層4中のクレアチニナーゼを取り込み、クレアチニナーゼの働きにより、試料中のクレアチニンがクレアチンに変換される。その後、既に試料中に取り込まれているクレアチナーゼとザルコシンオキシダーゼとの働きにより、クレアチニン由来のクレアチン量に応じて過酸化水素が発生する。試薬保持層5と試薬層4とには、ペルオキシダーゼ、4−アミノアンチピリン、及び、水素供与体化合物が含まれているため、これら試薬による呈色反応により、この段階の試料中では、過酸化水素量に応じた量のキノン色素が形成される。
【0050】
【化2】

【0051】
以上により、内因性のクレアチンに由来する過酸化水素の発生量、及び、クレアチニン由来のクレアチンに由来する過酸化水素の発生量に応じてキノン色素が形成される。内因性のクレアチンに由来する過酸化水素の発生は、クレアチニン由来のクレアチンに由来する過酸化水素の発生に先立って開始されるため、内因性のクレアチンが消尽され内因性のクレアチンに由来する過酸化水素の発生が終了した後でも、クレアチニン由来のクレアチンに由来する過酸化水素の発生は継続しうる。内因性のクレアチンとクレアチニン由来のクレアチンとの反応の時間差によって、内因性のクレアチンとクレアチニン由来のクレアチンとを区別することが可能となる。
【0052】
具体的には、試料を点着した後、経時的に、光学的測定手段を用いて、呈色度合い(K/S値)を測定する。測定波長は、形成される有色キノンの吸収ピークに近い波長であればよく、好ましくは、400〜700nm、特に好ましくは、580〜640nmである。呈色反応がプラトーに達した後、経時的K/S値の変化を解析する。このとき、経時的にプロットしたK/S値の傾きが変化するところで、内因性のクレアチンに由来する過酸化水素の発生が終了し、クレアチニン由来のクレアチンに由来する過酸化水素の発生は継続している状態が始まっていると推定できる。何故なら、クレアチナーゼ及びクレアチニナーゼとそれぞれの基質との反応速度が異なるため、内因性のクレアチンに由来する過酸化水素の発生速度とクレアチニン由来のクレアチンに由来する過酸化水素の発生速度とは異なるからである。クレアチニン由来のクレアチンに由来する過酸化水素の発生のみが継続している時間域におけるK/S値の単位時間あたりの変化量を読み取ることで、内因性のクレアチンの影響を除外しながら試料中に含まれるクレアチニンに由来する呈色量を求めることができる。最後に、検出したこのK/S値の単位時間あたりの変化量を予め作成しておいた検量線と比較する等して試料中に含まれていたクレアチニン濃度を決定する。
【0053】
また、経時的にK/S値を測定する代わりに、液状試料を点着した後、所定の時間t1が経過した後に、1回目のK/S値測定を行い、その後、さらに所定の時間t2が経過した後に、2回目のK/S値測定を行い、2回目に測定したK/S値と1回目に測定したK/S値との差を取ることで、クレアチニン由来のクレアチンに由来する過酸化水素の発生のみが継続している時間域におけるK/S値の単位時間あたりの変化量を求めることができる。所定の時間t1は、本試験片と試料とを反応させた際の内因性のクレアチンに由来する過酸化水素の発生が終了する時間の上限以上であればよい。血清、血漿又は尿等の液状試料中に含まれる内因性のクレアチンの量は、液状試料の由来毎に概ね一定の範囲内に収まる。そのため、本試験片と試料とを反応させた際に内因性のクレアチンに由来する過酸化水素の発生が終了する時間の上限は、液状試料の由来と測定量とから推定することができる。所定の時間t2は、本試験片と測定下限量のクレアチニンを含む液状試料とを反応させた際の過酸化水素の発生が終了する時間未満であればよい。所定の時間t2をこのように定めれば、意図した測定範囲内のクレアチニンを含む液状試料を本試験片で測定する場合、その呈色反応が継続している時間帯に所定の時間t2が収まることとなる。呈色反応が継続している時間帯から所定の時間t2が外れる場合、検量線の直線性が失われ、正確なクレアチニン濃度が測定できないおそれがある。
【0054】
(変形例)
実施の形態では、接続層6は、複数の斑点状に形成された接着剤から形成されるが、代わりに、接続層6を、試薬層4の一面全体に塗布された液体浸透性の接着剤により試薬層4と試薬保持層5とを接着することで形成することとしてもよい。このとき、接着剤としては、該接着剤中の液状試料の浸透速度が、試薬保持層5中の液状試料の拡散速度よりも遅いものを用いることが好ましい。接続層6がこのような接着剤から構成されている場合、試薬保持層5に点着された液状試料は、接続層6よりも優先的に試薬保持層5中に拡散する。このため、液状試料は、試薬保持層5中にある程度拡散してから、接続層6を浸透する時間差をもって、試薬層4に到達する。すなわち、接続層6を浸透する時間だけ、試薬保持層5から試薬層4への試料の伝達が遅延する。
【0055】
上記の変形例の他にも、接続層6は、試薬保持層5から試薬層4への液状試料の伝達時間を、接続層6を介さず試薬保持層5と試薬層4とが密着されている場合の伝達時間よりも遅延させるような構造であれば任意である。例えば、実施の形態では、試薬保持層5と試薬層4との間に空隙を設けるために斑点状に複数設けた接着剤からなる接続層6を用いたが、代わりに、接着剤を含浸させた液体浸透性を有するメッシュ状の布帛からなる接続層6を用いてもよい。また、試薬層4に対向する試薬保持層5の一面に、液体浸透性を低下させる非水溶性ポリマーを含浸させることで接続層6としてもよい。この接続層6を製造する場合、試薬保持層5と試薬層4との接続は、接着剤を用いずに、湿った状態の接続層6を試薬層4に圧着させた後乾燥させることで行うことができる。また、試薬保持層5の底面を純粋で濡らして試薬層4上に積層し乾燥させることで、試薬保持層5と試薬層4とを接着した場合も、試薬保持層5の底面は接続層6として機能しうる。
【実施例】
【0056】
(実施例1)
以下、実施例を示しながら本発明についてさらに詳細に説明するが、本発明は以下の実施例の範囲に限定されるものではない。なお、特にことわりのない限り、純水は脱イオン水を用いた。
【0057】
まず、厚さ0.2mmの白色のポリエチレンテレフタレート(PET)シートから、長さ70mm×幅5mmの寸法の細長い片を切り出して支持体とした。
【0058】
次に、リン酸緩衝液(pH7.5)22mlに、クレアチニナーゼ(キッコーマン株式会社製)300U、4−アミノアンチピリン(キシダ化学株式会社製)81mg、アルギン酸ナトリウム(ナカライテスク株式会社製)435mgを溶解させた。この水溶液を十分攪拌した後、脱泡して、その全量を支持体の一端に、長さ7mm×幅5mm×厚さ0.1mmの寸法になるように塗布した。その後、40℃で20分間乾燥させて、水分を完全に蒸発させて、フィルム状の試薬層とした。
【0059】
この試薬層の上に、布帛材を主体として構成した試薬保持層を積層した。布帛材としては、KBセーレン株式会社のザヴィーナ(登録商標)を用いた。12mLのリン酸緩衝液(pH7.5)に、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメチルアニリンアトリウム塩(DAOS)(同仁化学研究所株式会社製)49mg、クレアチナーゼ(キッコーマン株式会社製)10KU、ザルコシンオキシダーゼ(キッコーマン株式会社製)600U、ペルオキシダーゼ(東洋紡株式会社製)10KU、を溶解させた。この水溶液を十分攪拌した後、脱泡して、全量を、長さ7mm×幅5mm×厚さ0.2mmのザヴィーナに染み込ませた。そして、40℃で20分間乾燥して水分を蒸発させた。
【0060】
この試薬保持層を、接着剤を用いて試薬層の上に接着して積層した。接着剤としては、アクリル系接着剤用いて、試薬層の上にドット状に塗布して、ドット間に接着剤のない部分が形成されるようにして接着した。
【0061】
(実施例2)
実施例1と同様に支持体、試薬層、試薬保持層を作成し、試薬保持層を試薬層上に接着剤を用いて接着する代わりに、試薬保持層の底面を純粋で濡らして、試薬層上に積層し、乾燥させることで接着した。
【0062】
(クレアチンとクレアチニンとの反応タイムコース)
内因性のクレアチンによる呈色反応とクレアチニン由来のクレアチンによる呈色反応とを識別できるか否かを検討するため、クレアチンが多い試料A(クレアチニン濃度0.79mg/dL、クレアチン濃度5.47mg/dL)及びクレアチニンが多い試料B(クレアチン濃度5.08mg/dL、クレアチニン濃度0.49mg/dL)を実施例1のクレアチニン測定用乾式試験片と反応させたときの、呈色の程度(K/S値)の経時変化を比較した。測定装置として、アークレイ株式会社の卓上反射率測定装置スポットケム(登録商標)EZを使用した。テーブル上に試験片を乗せ、上から5.0μlの試料を点着した。その後、経時的に波長610nmにおける反射率(R)を測定した。反射率(R)はクベルカ−ムンクの式(K/S=(1−R)2/2R)によりK/S値に換算した。それぞれの試料について6回測定を行った。試料Aの呈色反応の経時変化を示したものが、図2(A)であり、試料Bの呈色反応の経時変化を示したものが、図2(B)である。それぞれの図で、試料A及びBのK/S値は6回の測定の平均値をプロットしている。図2(A)から分かるように、内因性クレアチンに由来する呈色反応は、試料点着後180秒にはプラトーに達している。一方、図2(B)から分かるように、試料中のクレアチニン由来のクレアチンによる呈色反応は、試料点着後300秒まで継続している。従って、試料点着後180〜300秒間の吸光変化量を算出することで、クレアチニン由来のクレアチンによる呈色反応量、即ち、試料中のクレアチン量を決定することができることが明らかとなった。
【0063】
(測定操作)
上記の知見に基づき、本実施例では、以下のようにクレアチニン測定用乾式試験片を用いてクレアチニン濃度を測定した。測定装置として、アークレイ株式会社の卓上反射率測定装置スポットケム(登録商標)EZを使用した。テーブル上にクレアチニン測定用乾式試験片を乗せ、上から5.0μlの試料を点着した。その後、経時的に波長610nmにおける反射率(R)を測定した。反射率(R)はクベルカ−ムンクの式(K/S=(1−R)2/2R)によりK/S値に換算した。既知濃度試料を測定することにより、測定後180秒から300秒の間のK/S値の変化量(ΔK/S値)とクレアチニン濃度との検量線を予め作成した。測定後180秒から300秒の間のK/S値の変化量とこの検量線を基に、試料中のクレアチニン濃度を算出した。なお、以下、このK/S値の測定法を、反応時間差測定法と呼称する。
【0064】
(内因性クレアチン濃度の影響)
実施例1のクレアチニン測定用乾式試験片における内因性クレアチンの影響の有無を検証するため、クレアチニン濃度は同じであるが(0.54mg/dL)クレアチン濃度は異なる試料C(クレアチン濃度0.42mg/dL)及び試料D(クレアチン濃度5.59mg/dL)のクレアチン濃度を実施例1のクレアチニン測定用乾式試験片により6回測定した。その結果、実施例1のクレアチニン測定用乾式試験片により測定した試料Cの平均クレアチン濃度は0.52mg/dL、試料Dの平均クレアチン濃度は0.52mg/dLであった。実施例1のクレアチニン測定用乾式試験片を反応時間差測定法と組み合わせてクレアチン濃度を測定する場合、内因性クレアチンの影響は観察されなかった。
【0065】
(相関試験)
実施例1のクレアチニン測定用乾式試験片の正確性を比較するため、クレアチニン分析装置(栄研化学株式会社製)により予めクレアチニン濃度を測定してあった85人分の血清試料中のクレアチニン濃度を測定した。分析装置を用いて測定したクレアチニン濃度測定値(0.54〜16.33mg/dL)と実施例1のクレアチニン測定用乾式試験片を用い反応時間差測定法により測定したΔK/S値とをプロットして示したものが図3である。分析装置を用いた場合の測定値と実施例1のクレアチニン測定用乾式試験片を用い反応時間差測定法により測定したΔK/S値とは、0.99と強い相関を示した。また、本試験の結果、実施例1のクレアチニン測定用乾式試験片によるクレアチニン濃度測定が、0.54〜16.33mg/dLと幅広い濃度域に渡って直線性の良い測定結果を得られるものであることが明らかとなった。
【0066】
(同時測定試験)
実施例1のクレアチニン測定用乾式試験片の同時再現性及び正確性を検討するため、クレアチニン濃度の異なる2つの試料、試料E(クレアチニン濃度0.75mg/dL)及び試料F(クレアチニン濃度9.14mg/dL)のクレアチニン濃度を、それぞれ、24回ずつ同時測定した。その結果、実施例1のクレアチニン測定用乾式試験片により測定した試料Eの平均クレアチン濃度は0.78mg/dL、試料Fの平均クレアチン濃度は9.17mg/dLであった。また、実施例1のクレアチニン測定用乾式試験片により測定したそれぞれの試料の変動係数は3%以内と非常に良好な同時再現性を示した。
【0067】
【表1】

【0068】
(接続層の影響の比較)
接続層の性質が反応時間差測定法にもたらす影響を調べるために、接続層の異なる実施例1及び実施例2のクレアチニン測定用乾式試験片を用いて、試料G(クレアチニン濃度0.89mg/dL、クレアチン濃度6.1mg/dl)及び試料H(クレアチニン濃度22.30mg/dL、クレアチン濃度5.8mg/dl)のK/S値を経時的に測定した。図4(a)はクレアチニン濃度の低い試料を測定した場合のK/S値の経時的変化を示し、図4(b)はとクレアチニン濃度の高い試料を測定した場合のK/S値の経時的変化を示す。また、それぞれのクレアチニン測定用乾式試験片によるクレアチニン濃度の測定値を表2に示す。図4に示した反応タイムコースから明らかなように、いずれの試料においても、実施例2のクレアチニン測定用乾式試験片は実施例1のクレアチニン測定用乾式試験片と比較して高いK/S値を示した。これは、実施例2のクレアチニン測定用乾式試験片では、実施例1のクレアチニン測定用乾式試験片と比較して、試薬保持層から試薬層への試料の移動が速やかに生じるため、内因性クレアチンが試薬保持層で呈色を伴わずに反応する時間が短く、その結果、より多くの内因性クレアチン由来の過酸化水素が呈色反応を生じるためと考えられる。また、表2に示すように、実施例2のクレアチニン測定用乾式試験片を用いた場合の測定結果は、実施例1のクレアチニン測定用乾式試験片を用いた場合と比較して、低い値を示した。これは、実施例2のクレアチニン測定用乾式試験片では、実施例1のクレアチニン測定用乾式試験片と比較して、試薬保持層から試薬層への試料の移動が速やかに生じるため、クレアチニンの呈色反応もより早い時点から生じ、その結果、180〜300秒の測定時間帯においては既に試料中のクレアチニンの多くが消費されてしまっているためと考えられる。さらに、クレアチニン濃度の異なる試料G及びHを比較すると、実施例1のクレアチニン測定用乾式試験片を用いた場合は、実際のクレアチニン濃度と測定値との間の乖離は両試料で同程度である。一方、実施例2のクレアチニン測定用乾式試験片を用いた場合は、実際のクレアチニン濃度と測定値との間の乖離は、クレアチニン濃度の高い試料Hにおいて試料Gよりも大きかった。このことから、実施例2のクレアチニン測定用乾式試験片のように試薬保持層から試薬層への試料の移動が速やかに生じる場合、高濃度のクレアチニンを測定する際に内因性クレアチンの影響を受けやすくなるものと考えられる。
【0069】
【表2】

【符号の説明】
【0070】
1 クレアチニン測定用乾式試験片
2 支持体
3 試薬部
4 試薬層
5 試薬保持層
6 接続層
【技術分野】
【0001】
本発明は、クレアチニン測定用乾式試験片及びクレアチニン測定法に関する。
【背景技術】
【0002】
クレアチニンは、クレアチン経路の最終代謝物であり、クレアチンが脱水、環化した構造を有する。体内においては、大半はクレアチン又はクレアチンリン酸として筋肉中に存在する。クレアチンは、ATPから高エネルギーリン酸を受けてクレアチンリン酸となり、エネルギー貯蔵物質として機能し、筋収縮などのエネルギー消費時にはADPに高エネルギーリン酸を転移してクレアチンに戻るか、非酵素的反応によってクレアチニンとなる。その後、生成したクレアチニンは、腎臓を介して尿中へ排泄される。
【0003】
このため、クレアチニンの尿中排泄量すなわち尿中濃度は、筋肉疾患や腎機能障害の指標に用いられている。また、腎機能障害がある場合等、血中のクレアチニン濃度が疾患の指標となり得る。
【0004】
集団検診の現場やスクリーニング検査等の初期診断の場面において、クレアチニンの尿中、血清中又は血漿中の濃度の測定を迅速に行うため、クレアチニンと反応して呈色する試薬を予め支持体に塗布又は含浸させ乾燥させた乾式試験片が広く用いられている。
【0005】
従来のクレアチニン測定用乾式試験片は、強アルカリ性条件下におけるクレアチニンとピクリン酸との縮合物による呈色反応(ヤッフェ反応)を利用している。こうした試験片の一つとして、特許文献1は、支持体と、該支持体上に担持された3,5−ジニトロ安息香酸を含む試薬層と、該試薬層上に設けられた水酸化リチウム等の強アルカリ性物質を含む展開層とからなるクレアチニン測定用試験片を開示する。
【0006】
また、クレアチニンを測定するための呈色反応としては、酵素法も知られている。特許文献2は、クレアチニンとクレアチニンイミノヒドラーゼとの反応により生じるガス状アンモニアを定量する乾式の分析要素であって、透明支持体の上に、ガス状アンモニアにより検知可能な変化を生じる指示薬を含む指示薬層、ガス状アンモニアを通過させる液体遮断層、アルカリ性緩衝剤を含有し必要により基質と反応してアンモニアを生成することのできる試薬層、及び、展開層がこの順に一体に積層された分析要素を開示する。
【0007】
また、従来の湿式クレアチニン測定試薬キットでは、酵素法の一種である、クレアチナーゼ−ザルコシンオキシダーゼ−ペルオキシダーゼ法が用いられている。非特許文献1、非特許文献2、及び、非特許文献3は、クレアチニナーゼにより試料中の内因性のクレアチンを予め分解する第1反応試薬と、第1反応試薬を添加し反応させた後の試料中に添加することで、試料中のクレアチニンをクレアチナーゼによりクレアチンに変換し、該クレアチンをクレアチニナーゼによりザルコシンと尿素とに分解し、該ザルコシンをザルコシンオキシダーゼと反応させて過酸化水素を生成し、該過酸化水素及びペルオキシダーゼ存在下で水素供与体化合物及び4−アミノアンチピリンを酸化縮合させることでキノン色素を生成する第2反応試薬とからなる湿式クレアチニン測定試薬キットを開示する。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平09−061430号公報
【特許文献2】特許第4243255号
【非特許文献】
【0009】
【非特許文献1】CRE−L試薬 カイノス 添付文書、第4版、カイノス株式会社、2010
【非特許文献2】N−アッセイ CRE−L ニットーボー 添付文書、第11版、日東紡績株式会社、2008
【非特許文献3】エクセライザCRE 添付文書、第6版、積水メディカル株式会社、2008
【発明の概要】
【発明が解決しようとする課題】
【0010】
特許文献1に示すような従来のヤッフェ反応を用いるクレアチニン測定用乾式試験片は、低濃度領域でクレアチニンを測定する際、誤差が大きいという欠点があった。
【0011】
特許文献2に開示される乾式の分析要素は、低濃度領域でクレアチニンを測定する際の誤差はヤッフェ反応を用いる場合と比較して小さいものの、試料中の内因性アンモニアの影響をうち消しきれず、また、反応生成物であるアンモニアガスを制御するため複雑な層構造を必要とし、製造の歩留まりが低いという欠点があった。
【0012】
また、従来の乾式試験片では該試験片に含まれる全ての試薬が試料中に取り込まれ反応するため、特許文献2に記載のようにアンモニアガス等の気体を介するのでなければ、2段階以上からなる反応系を乾式試験に適用することはできない。そのため、反応過程において気体が発生しない2段階反応系である、非特許文献1、非特許文献2、及び、非特許文献3に記載のクレアチナーゼ−ザルコシンオキシダーゼ−ペルオキシダーゼ法は、これまで、乾式試験片に用いることはできなかった。
【0013】
本発明は上記問題に鑑みなされたものであり、低濃度領域でクレアチニンを測定する際の誤差が小さく、簡便な構造を有するクレアチニン測定用乾式試験片及び該試験片を用いたクレアチニン測定法を提供することを目的とする。
【課題を解決するための手段】
【0014】
上記目的を達成するため、本発明の第1の観点に係るクレアチニン測定用乾式試験片は、
支持体と、
該支持体上に設けられた試薬層と、
該試薬層上に設けられた試薬保持層と、
前記試薬層と前記試薬保持層との間に設けられ、前記試薬層と前記試薬保持層とを接続する接続層と、
を有し、
前記試薬層は、クレアチニナーゼを含有し、
前記試薬保持層は、クレアチナーゼ及びザルコシンオキシダーゼを含有し、
ペルオキシダーゼ、4−アミノアンチピリン、及び、水素供与体化合物が、それぞれ、前記試薬層と前記試薬保持層とのいずれか一方の層にのみ含まれるか、又は両方の層に含まれ、
前記接続層は、前記試薬保持層に点着された液状試料の前記試薬層への到達を遅延させることを特徴とする。
【0015】
前記接続層は、互いに離隔する複数の斑点を形成するように塗布された接着剤からなり、前記斑点間に前記接着剤のない部分が存在することが好ましい。
【0016】
前記水素供与体は、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリンであることが好ましい。
【0017】
前記試薬保持層及び/又は前記試薬層は、緩衝剤をさらに含むことが好ましい。
【0018】
上記目的を達成するため、本発明の第2の観点に係るクレアチニン測定法は、
本発明の第1の観点に係るクレアチニン測定用乾式試験片を用いるクレアチニン測定法であって、
前記試薬保持層に液状試料を点着する工程と、
前記液状試料中の内因性のクレアチンが前記クレアチナーゼにより分解しきった後に前記クレアチニン測定用乾式試験片の呈色度合いを測定する第1測定工程と、
前記第1測定工程から所定の時間が経過した後に、前記クレアチニン測定用乾式試験片の呈色度合いを測定する第2測定工程と、
前記第2測定工程で測定した呈色度合いから前記第1測定工程で測定した呈色度合いを減算して、前記第1測定工程から前記第2測定工程までの呈色度合いの変化量を獲得する工程と、
前記変化量に対応する検量線の値を求めることで前記液状試料中のクレアチニン濃度を決定する工程と、
を備えることを特徴とする。
【0019】
上記目的を達成するため、本発明の第3の観点に係るクレアチニン測定法は、
本発明の第1の観点に係るクレアチニン測定用乾式試験片を用いるクレアチニン測定法であって、
前記試薬保持層に液状試料を点着する点着工程と、
前記点着工程後、前記クレアチニン測定用乾式試験片が液状試料と反応して呈色がプラトーに達するまで、前記クレアチニン測定用乾式試験片の呈色度合いを経時的に記録する工程と、
前記記録において、前記呈色度合いの変化率が変化した時点から呈色がプラトーに達する時点までの前記呈色度合いの単位時間あたりの変化量を獲得する工程と、
前記変化量に対応する検量線の値を求めることで前記液状試料中のクレアチニン濃度を決定する工程と、
を備えることを特徴とする。
【発明の効果】
【0020】
本発明によれば、低濃度領域でクレアチニンを測定する際の誤差が小さく、簡便な構造を有するクレアチニン測定用乾式試験片及び該試験片を用いたクレアチニン測定法が提供される。
【図面の簡単な説明】
【0021】
【図1】(a)は本発明の実施の形態に係るクレアチニン測定用乾式試験片の構成を示す斜視図、(b)は(a)のA−A縦断面図である。
【図2】実施例1のクレアチニン測定用乾式試験片を用い、高クレアチン試料を測定した場合のK/S値の経時的変化を示す図(a)と高クレアチニン試料を測定した場合のK/S値の経時的変化を示す図(b)である。
【図3】実施例1のクレアチニン測定用乾式試験片を用い反応時間差測定法により測定したΔK/S値と分析装置を用いて測定したクレアチニン濃度測定値とをプロットして示した図である。
【図4】実施例1及び2のクレアチニン測定用乾式試験片を用いて、クレアチニン濃度の低い試料を測定した場合のK/S値の経時的変化を示す図(a)とクレアチニン濃度の高い試料を測定した場合のK/S値の経時的変化を示す図(b)である。
【発明を実施するための形態】
【0022】
以下、本発明の実施形態について図面を参照しながら詳細に説明する。
【0023】
(実施の形態)
本発明の実施の形態に係るクレアチニン測定用乾式試験片1は、図1に示すように、支持体2と、支持体2に担持された試薬部3とから構成されている。試薬部3は、支持体2上に形成された試薬層4と、該試薬層4を覆うように形成された試薬保持層5と、試薬層4と試薬保持層5との間に形成され試薬層4と試薬保持層5とを接続する接続層6とから構成されている。
【0024】
支持体2は、液体浸透性のないことが好ましい。これによって、本実施の形態に係るクレアチニン測定用乾式試験片1を用いてクレアチニンを測定する際、試薬層4、試薬保持層5に滴下される液状試料が試薬層4及び試薬保持層5内に留まるため、精度よく測定することができる。支持体2としては、紙片、プラスチック(合成樹脂)片、金属片等を用いることができる。量産性・低コスト・保存性・耐水性等の観点からは、合成樹脂片を用いるのが好ましい。
【0025】
また、液状試料を滴下して検出反応を起こさせた後の光学的分析において、光を支持体側から照射する場合には、支持体2は光透過性を有する必要がある。これに対して、光を試薬保持層5側から照射する場合には、光透過性は要求されない。
【0026】
試薬層4は、クレアチニナーゼを含む。試薬層4は、液体浸透性を有する材質を主体として構成される。特に、水溶性の材質を主体として、その中に試薬が分散していることが好ましい。これにより、測定時に、試薬層4に含有される試薬は、上層に位置する試薬保持層5に滴下された液状試料に取り込まれる。水溶性の材質としては、ポリビニルピロリドン(PVP)を始めとする水溶性高分子化合物等を用いることができる。また、試薬層4は、液体浸透性を有する紙、編物、織物等の布帛材中に、試薬が分散している構成であってもよい。
【0027】
試薬保持層5は、クレアチナーゼ、ザルコシンオキシダーゼを含む。試薬保持層5は、液体浸透性を有する材質を主体として構成される。特に、水溶性の材質を主体として、その中に試薬が分散していることが好ましい。これにより、測定時に、試薬保持層5に滴下された液状試料は、試薬保持層5中を迅速かつ均一に拡散する。水溶性の材質としては、ポリビニルピロリドン(PVP)を始めとする水溶性高分子化合物等を用いることができる。また、試薬保持層5は、液体浸透性を有する紙、編物、織物等の布帛材中に、試薬が分散している構成であってもよい。
【0028】
接続層6は、試薬層4の表面に互いに離隔された複数の斑点が形成されるように接着剤を塗布して、試薬層4と試薬保持層5とを接着することで形成されている。複数の斑点状の接着剤から構成された接続層6は、試薬保持層5と試薬層4とを、その間に若干の空隙を挟んで接続する。試料が試薬保持層5に点着されたとき、この空隙の存在により、試薬保持層5から試薬層4へ液状試料が移動するまでに遅延が生じる。このため、試薬保持層5に点着された液状試料は、まず、試薬保持層5中を優先的に拡散し、その後、試薬層4へ移動することとなる。
【0029】
本実施の形態では、呈色反応は、ザルコシンオキシダーゼによるザルコシンの加水分解によって生じた過酸化水素及びペルオキシダーゼの存在下で4−アミノアンチピリン及び水素供与体化合物のカップリング反応により有色キノンを形成することで行われる。そのため、ペルオキシダーゼ、4−アミノアンチピリン、及び、水素供与体化合物が、試薬層4又は試薬保持層5の少なくとも一層に含まれる。
【0030】
水素供与体化合物として、N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリン(HDAOS)、N−エチル−N−スルホプロピル−3−メトキシアニリン(ADPS)、N−エチル−N−スルホプロピルアニリン(ALPS)、N−エチル−N−スルホプロピル−3,5−ジメトキシアニリン(DAPS)、N−スルホプロピル−3,5−ジメトキシアニリン(HDAPS)、N−エチル−N−スルホプロピル−3,5−ジメチルアニリン(MAPS)、N−エチル−N−スルホプロピル−3−メチルアニリン(TOPS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3−メトキシアニリン(ADOS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)アニリン(ALOS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリン(DAOS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメチルアニリン(MAOS)、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3−メチルアニリン(TOOS)およびN−スルホプロピルアニリン(HALPS)等がある。
【0031】
試薬層4及び/又は試薬保持層5は、それらに含まれる酵素の反応又は保存の安定性を高めるための緩衝剤を含んでもよい。好ましくは、水素イオン濃度指数(pH)がpH6〜9の範囲内である。緩衝剤としては、例えばリン酸緩衝剤、N,N−ビス(2−ヒドロキシエチル)−2−アミノエタンスルホン酸(BES)、N−トリスメチル−2−アミノエタンスルホン酸(TES)、2−[4−(2−ヒドロキシエチル)−1−ピペラジル]エタンスルホン酸(HEPES)、ピペラジン−1,4−ビス(2−ヒドロキシ−3−プロパンスルホン酸)・2水和物(POPSO)等の公知の緩衝剤を用いることができる。
【0032】
クレアチニン測定用乾式試験片1の測定対象として意図している液状試料が、微量、例えば、5μl程度である場合、試薬層4及び試薬保持層5は、数mm×数mm程度の面積であればよい。さらに、これらの層を手などで保持することは困難であるため、持ち手として用いることができるように、支持体2を、数mm〜1cm程度の幅の細長い片として設けることが好ましい。
【0033】
また、クレアチニン測定用乾式試験片1中の各試薬の含有量について、クレアチニナーゼは、少なくとも、所定の測定上限量のクレアチニンと反応するのに十分な量あればよく、その他の試薬は、少なくとも、所定の測定上限量のクレアチニンに加えて液状試料中の内因性のクレアチンと反応するのに十分な量あればよい。
【0034】
例えば、測定対象が血清である場合、患者由来のものを含む血清中のクレアチニン濃度は、約0.3〜20mg/dl、クレアチン濃度は、約0.2〜0.6mg/dlである。NCCLS(National Committee for Clinical Laboratory Standards)によれば、対象物質を測定する際、その測定に影響を与える干渉物質については、干渉物質の上限値の3倍程度を基準にすればよいとされる。従って、クレアチニンの測定上限は20mg/dl、内因性のクレアチン濃度の基準値は1.8mg/dlとして、各試薬の濃度を定めればよい。また、血中のクレアチン濃度はサプリメントなどの摂取によって健常者においても増加し得る。そのため、このような見込まれる血中クレアチン濃度の上昇分を考慮にいれて、内因性のクレアチン濃度の基準値を定めることがさらに好ましい。例えば、上記の例の場合、内因性のクレアチン濃度の基準値を5.0mg/dlとすることがさらに好ましい。
【0035】
液状試料が滴下されたときに形成される反応液中での各試薬の好ましい濃度は以下のとおりである。
クレアチニナーゼ:20−1000U/ml
クレアチナーゼ:20−1000U/ml
ザルコシンオキシダーゼ:20−300U/ml
ペルオキシダーゼ:50−3000U/ml
4−アミノアンチピリン:5−100mM
水素供与体化合物:5−100mM
【0036】
本発明の実施の形態に係るクレアチニン測定用乾式試験片1は、次のようにして作製することができる。
【0037】
まず、支持体2となる所定の材質の所定の厚さを有するシートを、所定の寸法を有する細長い片として切り出す。この細長い片を洗浄、乾燥することにより、支持体2が作製される。
【0038】
次に、試薬層4を作製する。まず、液体浸透性を有する材質に、クレアチニナーゼに加えて、必要に応じて、ペルオキシダーゼ、4−アミノアンチピリン、水素供与体化合物、pH緩衝剤を分散させる。
【0039】
液体浸透性を有する材質が、水溶性高分子化合物等の水溶性の材質である場合には、純水に溶解させて水溶液として、この水溶液に上記各試薬を溶解させて攪拌することによって、分散させる。そして、支持体2の所定箇所に塗布し、乾燥して試薬層4とする。
【0040】
液体浸透性を有する材質が、紙、編物、織物等の布帛材の場合には、純水に上記各試薬を溶解させて攪拌した水溶液を、所定の寸法の布帛材に吸収させることで、分散させる。そして、乾燥して水分を除去して、試薬層4とする。その後、試薬層4を、支持体2に積層する。その方法としては、試薬層4が水溶性の材質を主体としたものである場合には、底面を純水で濡らして、支持体2の所定の位置に圧着する。これによって、底面の水溶性の材質が溶解して、接着剤としての役割を果たす。別の方法としては、接着剤で試薬層4を支持体2上に接着してもよい。
【0041】
次に、試薬保持層5を作成する。まず、試薬保持層5は、液体浸透性を有する材質に、クレアチナーゼ、ザルコシンオキシダーゼに加えて、必要に応じて、ペルオキシダーゼ、4−アミノアンチピリン、水素供与体化合物、pH緩衝剤を分散させる。
【0042】
液体浸透性を有する材質が、水溶性高分子化合物等の水溶性の材質である場合には、純水に溶解させて水溶液として、この水溶液に上記各試薬を溶解させて攪拌することによって、分散させる。そして、平坦な基材の上に塗布し、乾燥して、基材から引き剥がして、試薬保持層5とする。
【0043】
液体浸透性を有する材質が、紙、編物、織物等の布帛材の場合には、純水に上記各試薬を溶解させて攪拌した水溶液を、所定の寸法の布帛材に吸収させることで、分散させる。そして、乾燥して水分を除去して試薬保持層5とする。
【0044】
次に、試薬保持層5を、試薬層4上に積層し、接着剤を用いて接着する。接着剤は、上記各酵素の反応を阻害しないものであればよい。試薬層の上に互いに離隔された複数の斑点が形成されるように接着剤を塗布して、斑点間に接着剤のない部分が形成されるようにして接着することが好ましい。これにより、接続層6が形成される。
【0045】
このようにして、本発明の実施の形態に係るクレアチニン測定用乾式試験片1を作製することができる。
【0046】
次に、本実施の形態に係る試験片を用いて、血清、血漿又は尿などの液状試料からクレアチニン濃度を測定する方法について説明する。
【0047】
まず、液状試料を試薬保持層5に点着する。点着された液状試料は、試薬保持層5で横方向に拡散しながら、試薬保持層5に含まれる各種試薬を取り込む。このとき、取り込まれたクレアチナーゼの働きにより、まず最初に、試料中に含まれる内因性のクレアチンが尿素とザルコシンに分解される。その後、試料中に取り込まれたザルコシンオキシダーゼの働きにより、ザルコシンの加水分解によって、過酸化水素が発生する。
【0048】
【化1】

【0049】
以上の反応の進行と並行して、試薬保持層5中に拡散した試料は、次に、試薬層4に到達する。このように、試料の拡散が段階的に進行するのは、接続層6により、試薬保持層5と試薬層4とが若干の空隙を持って接続されているためである。試料の拡散が段階的に進行することにより、本実施の形態に係る試験片では、試薬保持層5でクレアチナーゼ及びザルコシンオキシダーゼによる酵素反応がある程度進んでから、試料は試薬層4に到達する。ここでようやく、試料は試薬層4中のクレアチニナーゼを取り込み、クレアチニナーゼの働きにより、試料中のクレアチニンがクレアチンに変換される。その後、既に試料中に取り込まれているクレアチナーゼとザルコシンオキシダーゼとの働きにより、クレアチニン由来のクレアチン量に応じて過酸化水素が発生する。試薬保持層5と試薬層4とには、ペルオキシダーゼ、4−アミノアンチピリン、及び、水素供与体化合物が含まれているため、これら試薬による呈色反応により、この段階の試料中では、過酸化水素量に応じた量のキノン色素が形成される。
【0050】
【化2】

【0051】
以上により、内因性のクレアチンに由来する過酸化水素の発生量、及び、クレアチニン由来のクレアチンに由来する過酸化水素の発生量に応じてキノン色素が形成される。内因性のクレアチンに由来する過酸化水素の発生は、クレアチニン由来のクレアチンに由来する過酸化水素の発生に先立って開始されるため、内因性のクレアチンが消尽され内因性のクレアチンに由来する過酸化水素の発生が終了した後でも、クレアチニン由来のクレアチンに由来する過酸化水素の発生は継続しうる。内因性のクレアチンとクレアチニン由来のクレアチンとの反応の時間差によって、内因性のクレアチンとクレアチニン由来のクレアチンとを区別することが可能となる。
【0052】
具体的には、試料を点着した後、経時的に、光学的測定手段を用いて、呈色度合い(K/S値)を測定する。測定波長は、形成される有色キノンの吸収ピークに近い波長であればよく、好ましくは、400〜700nm、特に好ましくは、580〜640nmである。呈色反応がプラトーに達した後、経時的K/S値の変化を解析する。このとき、経時的にプロットしたK/S値の傾きが変化するところで、内因性のクレアチンに由来する過酸化水素の発生が終了し、クレアチニン由来のクレアチンに由来する過酸化水素の発生は継続している状態が始まっていると推定できる。何故なら、クレアチナーゼ及びクレアチニナーゼとそれぞれの基質との反応速度が異なるため、内因性のクレアチンに由来する過酸化水素の発生速度とクレアチニン由来のクレアチンに由来する過酸化水素の発生速度とは異なるからである。クレアチニン由来のクレアチンに由来する過酸化水素の発生のみが継続している時間域におけるK/S値の単位時間あたりの変化量を読み取ることで、内因性のクレアチンの影響を除外しながら試料中に含まれるクレアチニンに由来する呈色量を求めることができる。最後に、検出したこのK/S値の単位時間あたりの変化量を予め作成しておいた検量線と比較する等して試料中に含まれていたクレアチニン濃度を決定する。
【0053】
また、経時的にK/S値を測定する代わりに、液状試料を点着した後、所定の時間t1が経過した後に、1回目のK/S値測定を行い、その後、さらに所定の時間t2が経過した後に、2回目のK/S値測定を行い、2回目に測定したK/S値と1回目に測定したK/S値との差を取ることで、クレアチニン由来のクレアチンに由来する過酸化水素の発生のみが継続している時間域におけるK/S値の単位時間あたりの変化量を求めることができる。所定の時間t1は、本試験片と試料とを反応させた際の内因性のクレアチンに由来する過酸化水素の発生が終了する時間の上限以上であればよい。血清、血漿又は尿等の液状試料中に含まれる内因性のクレアチンの量は、液状試料の由来毎に概ね一定の範囲内に収まる。そのため、本試験片と試料とを反応させた際に内因性のクレアチンに由来する過酸化水素の発生が終了する時間の上限は、液状試料の由来と測定量とから推定することができる。所定の時間t2は、本試験片と測定下限量のクレアチニンを含む液状試料とを反応させた際の過酸化水素の発生が終了する時間未満であればよい。所定の時間t2をこのように定めれば、意図した測定範囲内のクレアチニンを含む液状試料を本試験片で測定する場合、その呈色反応が継続している時間帯に所定の時間t2が収まることとなる。呈色反応が継続している時間帯から所定の時間t2が外れる場合、検量線の直線性が失われ、正確なクレアチニン濃度が測定できないおそれがある。
【0054】
(変形例)
実施の形態では、接続層6は、複数の斑点状に形成された接着剤から形成されるが、代わりに、接続層6を、試薬層4の一面全体に塗布された液体浸透性の接着剤により試薬層4と試薬保持層5とを接着することで形成することとしてもよい。このとき、接着剤としては、該接着剤中の液状試料の浸透速度が、試薬保持層5中の液状試料の拡散速度よりも遅いものを用いることが好ましい。接続層6がこのような接着剤から構成されている場合、試薬保持層5に点着された液状試料は、接続層6よりも優先的に試薬保持層5中に拡散する。このため、液状試料は、試薬保持層5中にある程度拡散してから、接続層6を浸透する時間差をもって、試薬層4に到達する。すなわち、接続層6を浸透する時間だけ、試薬保持層5から試薬層4への試料の伝達が遅延する。
【0055】
上記の変形例の他にも、接続層6は、試薬保持層5から試薬層4への液状試料の伝達時間を、接続層6を介さず試薬保持層5と試薬層4とが密着されている場合の伝達時間よりも遅延させるような構造であれば任意である。例えば、実施の形態では、試薬保持層5と試薬層4との間に空隙を設けるために斑点状に複数設けた接着剤からなる接続層6を用いたが、代わりに、接着剤を含浸させた液体浸透性を有するメッシュ状の布帛からなる接続層6を用いてもよい。また、試薬層4に対向する試薬保持層5の一面に、液体浸透性を低下させる非水溶性ポリマーを含浸させることで接続層6としてもよい。この接続層6を製造する場合、試薬保持層5と試薬層4との接続は、接着剤を用いずに、湿った状態の接続層6を試薬層4に圧着させた後乾燥させることで行うことができる。また、試薬保持層5の底面を純粋で濡らして試薬層4上に積層し乾燥させることで、試薬保持層5と試薬層4とを接着した場合も、試薬保持層5の底面は接続層6として機能しうる。
【実施例】
【0056】
(実施例1)
以下、実施例を示しながら本発明についてさらに詳細に説明するが、本発明は以下の実施例の範囲に限定されるものではない。なお、特にことわりのない限り、純水は脱イオン水を用いた。
【0057】
まず、厚さ0.2mmの白色のポリエチレンテレフタレート(PET)シートから、長さ70mm×幅5mmの寸法の細長い片を切り出して支持体とした。
【0058】
次に、リン酸緩衝液(pH7.5)22mlに、クレアチニナーゼ(キッコーマン株式会社製)300U、4−アミノアンチピリン(キシダ化学株式会社製)81mg、アルギン酸ナトリウム(ナカライテスク株式会社製)435mgを溶解させた。この水溶液を十分攪拌した後、脱泡して、その全量を支持体の一端に、長さ7mm×幅5mm×厚さ0.1mmの寸法になるように塗布した。その後、40℃で20分間乾燥させて、水分を完全に蒸発させて、フィルム状の試薬層とした。
【0059】
この試薬層の上に、布帛材を主体として構成した試薬保持層を積層した。布帛材としては、KBセーレン株式会社のザヴィーナ(登録商標)を用いた。12mLのリン酸緩衝液(pH7.5)に、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメチルアニリンアトリウム塩(DAOS)(同仁化学研究所株式会社製)49mg、クレアチナーゼ(キッコーマン株式会社製)10KU、ザルコシンオキシダーゼ(キッコーマン株式会社製)600U、ペルオキシダーゼ(東洋紡株式会社製)10KU、を溶解させた。この水溶液を十分攪拌した後、脱泡して、全量を、長さ7mm×幅5mm×厚さ0.2mmのザヴィーナに染み込ませた。そして、40℃で20分間乾燥して水分を蒸発させた。
【0060】
この試薬保持層を、接着剤を用いて試薬層の上に接着して積層した。接着剤としては、アクリル系接着剤用いて、試薬層の上にドット状に塗布して、ドット間に接着剤のない部分が形成されるようにして接着した。
【0061】
(実施例2)
実施例1と同様に支持体、試薬層、試薬保持層を作成し、試薬保持層を試薬層上に接着剤を用いて接着する代わりに、試薬保持層の底面を純粋で濡らして、試薬層上に積層し、乾燥させることで接着した。
【0062】
(クレアチンとクレアチニンとの反応タイムコース)
内因性のクレアチンによる呈色反応とクレアチニン由来のクレアチンによる呈色反応とを識別できるか否かを検討するため、クレアチンが多い試料A(クレアチニン濃度0.79mg/dL、クレアチン濃度5.47mg/dL)及びクレアチニンが多い試料B(クレアチン濃度5.08mg/dL、クレアチニン濃度0.49mg/dL)を実施例1のクレアチニン測定用乾式試験片と反応させたときの、呈色の程度(K/S値)の経時変化を比較した。測定装置として、アークレイ株式会社の卓上反射率測定装置スポットケム(登録商標)EZを使用した。テーブル上に試験片を乗せ、上から5.0μlの試料を点着した。その後、経時的に波長610nmにおける反射率(R)を測定した。反射率(R)はクベルカ−ムンクの式(K/S=(1−R)2/2R)によりK/S値に換算した。それぞれの試料について6回測定を行った。試料Aの呈色反応の経時変化を示したものが、図2(A)であり、試料Bの呈色反応の経時変化を示したものが、図2(B)である。それぞれの図で、試料A及びBのK/S値は6回の測定の平均値をプロットしている。図2(A)から分かるように、内因性クレアチンに由来する呈色反応は、試料点着後180秒にはプラトーに達している。一方、図2(B)から分かるように、試料中のクレアチニン由来のクレアチンによる呈色反応は、試料点着後300秒まで継続している。従って、試料点着後180〜300秒間の吸光変化量を算出することで、クレアチニン由来のクレアチンによる呈色反応量、即ち、試料中のクレアチン量を決定することができることが明らかとなった。
【0063】
(測定操作)
上記の知見に基づき、本実施例では、以下のようにクレアチニン測定用乾式試験片を用いてクレアチニン濃度を測定した。測定装置として、アークレイ株式会社の卓上反射率測定装置スポットケム(登録商標)EZを使用した。テーブル上にクレアチニン測定用乾式試験片を乗せ、上から5.0μlの試料を点着した。その後、経時的に波長610nmにおける反射率(R)を測定した。反射率(R)はクベルカ−ムンクの式(K/S=(1−R)2/2R)によりK/S値に換算した。既知濃度試料を測定することにより、測定後180秒から300秒の間のK/S値の変化量(ΔK/S値)とクレアチニン濃度との検量線を予め作成した。測定後180秒から300秒の間のK/S値の変化量とこの検量線を基に、試料中のクレアチニン濃度を算出した。なお、以下、このK/S値の測定法を、反応時間差測定法と呼称する。
【0064】
(内因性クレアチン濃度の影響)
実施例1のクレアチニン測定用乾式試験片における内因性クレアチンの影響の有無を検証するため、クレアチニン濃度は同じであるが(0.54mg/dL)クレアチン濃度は異なる試料C(クレアチン濃度0.42mg/dL)及び試料D(クレアチン濃度5.59mg/dL)のクレアチン濃度を実施例1のクレアチニン測定用乾式試験片により6回測定した。その結果、実施例1のクレアチニン測定用乾式試験片により測定した試料Cの平均クレアチン濃度は0.52mg/dL、試料Dの平均クレアチン濃度は0.52mg/dLであった。実施例1のクレアチニン測定用乾式試験片を反応時間差測定法と組み合わせてクレアチン濃度を測定する場合、内因性クレアチンの影響は観察されなかった。
【0065】
(相関試験)
実施例1のクレアチニン測定用乾式試験片の正確性を比較するため、クレアチニン分析装置(栄研化学株式会社製)により予めクレアチニン濃度を測定してあった85人分の血清試料中のクレアチニン濃度を測定した。分析装置を用いて測定したクレアチニン濃度測定値(0.54〜16.33mg/dL)と実施例1のクレアチニン測定用乾式試験片を用い反応時間差測定法により測定したΔK/S値とをプロットして示したものが図3である。分析装置を用いた場合の測定値と実施例1のクレアチニン測定用乾式試験片を用い反応時間差測定法により測定したΔK/S値とは、0.99と強い相関を示した。また、本試験の結果、実施例1のクレアチニン測定用乾式試験片によるクレアチニン濃度測定が、0.54〜16.33mg/dLと幅広い濃度域に渡って直線性の良い測定結果を得られるものであることが明らかとなった。
【0066】
(同時測定試験)
実施例1のクレアチニン測定用乾式試験片の同時再現性及び正確性を検討するため、クレアチニン濃度の異なる2つの試料、試料E(クレアチニン濃度0.75mg/dL)及び試料F(クレアチニン濃度9.14mg/dL)のクレアチニン濃度を、それぞれ、24回ずつ同時測定した。その結果、実施例1のクレアチニン測定用乾式試験片により測定した試料Eの平均クレアチン濃度は0.78mg/dL、試料Fの平均クレアチン濃度は9.17mg/dLであった。また、実施例1のクレアチニン測定用乾式試験片により測定したそれぞれの試料の変動係数は3%以内と非常に良好な同時再現性を示した。
【0067】
【表1】

【0068】
(接続層の影響の比較)
接続層の性質が反応時間差測定法にもたらす影響を調べるために、接続層の異なる実施例1及び実施例2のクレアチニン測定用乾式試験片を用いて、試料G(クレアチニン濃度0.89mg/dL、クレアチン濃度6.1mg/dl)及び試料H(クレアチニン濃度22.30mg/dL、クレアチン濃度5.8mg/dl)のK/S値を経時的に測定した。図4(a)はクレアチニン濃度の低い試料を測定した場合のK/S値の経時的変化を示し、図4(b)はとクレアチニン濃度の高い試料を測定した場合のK/S値の経時的変化を示す。また、それぞれのクレアチニン測定用乾式試験片によるクレアチニン濃度の測定値を表2に示す。図4に示した反応タイムコースから明らかなように、いずれの試料においても、実施例2のクレアチニン測定用乾式試験片は実施例1のクレアチニン測定用乾式試験片と比較して高いK/S値を示した。これは、実施例2のクレアチニン測定用乾式試験片では、実施例1のクレアチニン測定用乾式試験片と比較して、試薬保持層から試薬層への試料の移動が速やかに生じるため、内因性クレアチンが試薬保持層で呈色を伴わずに反応する時間が短く、その結果、より多くの内因性クレアチン由来の過酸化水素が呈色反応を生じるためと考えられる。また、表2に示すように、実施例2のクレアチニン測定用乾式試験片を用いた場合の測定結果は、実施例1のクレアチニン測定用乾式試験片を用いた場合と比較して、低い値を示した。これは、実施例2のクレアチニン測定用乾式試験片では、実施例1のクレアチニン測定用乾式試験片と比較して、試薬保持層から試薬層への試料の移動が速やかに生じるため、クレアチニンの呈色反応もより早い時点から生じ、その結果、180〜300秒の測定時間帯においては既に試料中のクレアチニンの多くが消費されてしまっているためと考えられる。さらに、クレアチニン濃度の異なる試料G及びHを比較すると、実施例1のクレアチニン測定用乾式試験片を用いた場合は、実際のクレアチニン濃度と測定値との間の乖離は両試料で同程度である。一方、実施例2のクレアチニン測定用乾式試験片を用いた場合は、実際のクレアチニン濃度と測定値との間の乖離は、クレアチニン濃度の高い試料Hにおいて試料Gよりも大きかった。このことから、実施例2のクレアチニン測定用乾式試験片のように試薬保持層から試薬層への試料の移動が速やかに生じる場合、高濃度のクレアチニンを測定する際に内因性クレアチンの影響を受けやすくなるものと考えられる。
【0069】
【表2】

【符号の説明】
【0070】
1 クレアチニン測定用乾式試験片
2 支持体
3 試薬部
4 試薬層
5 試薬保持層
6 接続層
【特許請求の範囲】
【請求項1】
支持体と、
該支持体上に設けられた試薬層と、
該試薬層上に設けられた試薬保持層と、
前記試薬層と前記試薬保持層との間に設けられ、前記試薬層と前記試薬保持層とを接続する接続層と、
を有し、
前記試薬層は、クレアチニナーゼを含有し、
前記試薬保持層は、クレアチナーゼ及びザルコシンオキシダーゼを含有し、
ペルオキシダーゼ、4−アミノアンチピリン、及び、水素供与体化合物が、それぞれ、前記試薬層と前記試薬保持層とのいずれか一方の層にのみ含まれるか、又は両方の層に含まれ、
前記接続層は、前記試薬保持層に点着された液状試料の前記試薬層への到達を遅延させることを特徴とするクレアチニン測定用乾式試験片。
【請求項2】
前記接続層は、互いに離隔する複数の斑点を形成するように塗布された接着剤からなり、前記斑点間に前記接着剤のない部分が存在する請求項1に記載のクレアチニン測定用乾式試験片。
【請求項3】
前記水素供与体は、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリンである、請求項1又は2に記載のクレアチニン測定用乾式試験片。
【請求項4】
前記試薬保持層及び/又は前記試薬層は、緩衝剤をさらに含むことを特徴とする、請求項1から3のいずれか1項に記載のクレアチニン測定用乾式試験片。
【請求項5】
請求項1から4のいずれか1項に記載のクレアチニン測定用乾式試験片を用いるクレアチニン測定法であって、
前記試薬保持層に液状試料を点着する工程と、
前記液状試料中の内因性のクレアチンが前記クレアチナーゼにより分解しきった後に前記クレアチニン測定用乾式試験片の呈色度合いを測定する第1測定工程と、
前記第1測定工程から所定の時間が経過した後に、前記クレアチニン測定用乾式試験片の呈色度合いを測定する第2測定工程と、
前記第2測定工程で測定した呈色度合いから前記第1測定工程で測定した呈色度合いを減算して、前記第1測定工程から前記第2測定工程までの呈色度合いの変化量を獲得する工程と、
前記変化量に対応する検量線の値を求めることで前記液状試料中のクレアチニン濃度を決定する工程と、
を備える、クレアチニン測定法。
【請求項6】
請求項1から4のいずれか1項に記載のクレアチニン測定用乾式試験片を用いるクレアチニン測定法であって、
前記試薬保持層に液状試料を点着する点着工程と、
前記点着工程後、前記クレアチニン測定用乾式試験片が液状試料と反応して呈色がプラトーに達するまで、前記クレアチニン測定用乾式試験片の呈色度合いを経時的に記録する工程と、
前記記録において、前記呈色度合いの変化率が変化した時点から呈色がプラトーに達する時点までの前記呈色度合いの単位時間あたりの変化量を獲得する工程と、
前記変化量に対応する検量線の値を求めることで前記液状試料中のクレアチニン濃度を決定する工程と、
を備える、クレアチニン測定法。
【請求項1】
支持体と、
該支持体上に設けられた試薬層と、
該試薬層上に設けられた試薬保持層と、
前記試薬層と前記試薬保持層との間に設けられ、前記試薬層と前記試薬保持層とを接続する接続層と、
を有し、
前記試薬層は、クレアチニナーゼを含有し、
前記試薬保持層は、クレアチナーゼ及びザルコシンオキシダーゼを含有し、
ペルオキシダーゼ、4−アミノアンチピリン、及び、水素供与体化合物が、それぞれ、前記試薬層と前記試薬保持層とのいずれか一方の層にのみ含まれるか、又は両方の層に含まれ、
前記接続層は、前記試薬保持層に点着された液状試料の前記試薬層への到達を遅延させることを特徴とするクレアチニン測定用乾式試験片。
【請求項2】
前記接続層は、互いに離隔する複数の斑点を形成するように塗布された接着剤からなり、前記斑点間に前記接着剤のない部分が存在する請求項1に記載のクレアチニン測定用乾式試験片。
【請求項3】
前記水素供与体は、N−エチル−N−(2−ヒドロキシ−3−スルホプロピル)−3,5−ジメトキシアニリンである、請求項1又は2に記載のクレアチニン測定用乾式試験片。
【請求項4】
前記試薬保持層及び/又は前記試薬層は、緩衝剤をさらに含むことを特徴とする、請求項1から3のいずれか1項に記載のクレアチニン測定用乾式試験片。
【請求項5】
請求項1から4のいずれか1項に記載のクレアチニン測定用乾式試験片を用いるクレアチニン測定法であって、
前記試薬保持層に液状試料を点着する工程と、
前記液状試料中の内因性のクレアチンが前記クレアチナーゼにより分解しきった後に前記クレアチニン測定用乾式試験片の呈色度合いを測定する第1測定工程と、
前記第1測定工程から所定の時間が経過した後に、前記クレアチニン測定用乾式試験片の呈色度合いを測定する第2測定工程と、
前記第2測定工程で測定した呈色度合いから前記第1測定工程で測定した呈色度合いを減算して、前記第1測定工程から前記第2測定工程までの呈色度合いの変化量を獲得する工程と、
前記変化量に対応する検量線の値を求めることで前記液状試料中のクレアチニン濃度を決定する工程と、
を備える、クレアチニン測定法。
【請求項6】
請求項1から4のいずれか1項に記載のクレアチニン測定用乾式試験片を用いるクレアチニン測定法であって、
前記試薬保持層に液状試料を点着する点着工程と、
前記点着工程後、前記クレアチニン測定用乾式試験片が液状試料と反応して呈色がプラトーに達するまで、前記クレアチニン測定用乾式試験片の呈色度合いを経時的に記録する工程と、
前記記録において、前記呈色度合いの変化率が変化した時点から呈色がプラトーに達する時点までの前記呈色度合いの単位時間あたりの変化量を獲得する工程と、
前記変化量に対応する検量線の値を求めることで前記液状試料中のクレアチニン濃度を決定する工程と、
を備える、クレアチニン測定法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−235771(P2012−235771A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−92589(P2012−92589)
【出願日】平成24年4月16日(2012.4.16)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成24年4月16日(2012.4.16)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

