グリコマクロペプチド由来の血圧降下ペプチド
タンパク質源が、−I−P−P−配列を有し、タンパク質アミノ酸配列中に−V−P−P−よりも少なくとも6倍多く存在する−I−P−P−(モル基準)を有するタンパク質を含み、タンパク質源を加水分解して少なくとも40%のI−P−P−配列10をペプチドIPPに遊離させることを含み、タンパク質源中に存在するプロリン残基のカルボキシ末端で切断するタンパク質分解酵素を使用し、酵素が好ましくはプロリン特異的エンドプロテアーゼまたはプロリン特異的オリゴペプチダーゼ、より好ましくはプロリン特異的エンドプロテアーゼ、および場合によりアミノペプチダーゼである、タンパク質源からIPPを生成する方法。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
[技術分野]
本発明は、IPPの生成に関する。
【0002】
[発明の背景]
高血圧症は、ヒトにおける比較的一般的な病状であり、心臓血管疾患、腎不全および脳卒中の、流行性の危険因子を引き起こす。カルシウム遮断薬、β遮断薬、利尿薬、α遮断薬、中心的なαアンタゴニスト、アンジオテンシンIIアンタゴニストおよびACE阻害薬等の多くの医薬品の利用可能性は、高血圧症の基礎にある生理学的機序が多面的であることを示す。
【0003】
高血圧症の生理学的機序のうち、特にレニン−アンジオテンシン機序は、多くの科学的注目を受けている。この機序において、アンジオテンシンは肝臓によって分泌され、ペプチダーゼであるレニンによって切断されて、生物学的に不活性なデカペプチドであるアンジオテンシンIを生じる。アンジオテンシンIが肺毛細血管を通過すると、アンジオテンシン変換酵素(以下ACEと呼ぶ)と呼ばれる別のペプチダーゼが、アンジオテンシンIの最後の2つの残基(His−Leu)を除去することによって、アンジオテンシンIに作用して、オクタペプチドであるアンジオテンシンIIを形成する。アンジオテンシンIIオクタペプチドは、強力な血管収縮活性を示し、したがって、血圧を上昇させる。より低いレベルのアンジオテンシンIIにつながるACE阻害は、血管収縮を防ぎ、そのため高血圧を防ぐ。
【0004】
アンジオテンシンIを切断する他に、ACEはまた、同様に血圧調節に関与するノナペプチドであるブラジキニンを加水分解することもできる。後者の機序において、ACE阻害は、血管拡張を促進し、同様に血圧を降下させる、ブラジキニンレベルの増大につながる。ACEを阻害することは、このようにして、少なくとも2つの別々の機序によって、血圧降下効果につながる。
【0005】
オクタペプチドであるアンジオテンシンIIが副腎皮質によるアルドステロンの放出を刺激することもまた、公知である。アルドステロンの標的器官は腎臓であり、ここでアルドステロンは、腎細尿管からのナトリウムの再吸収の増大を促進する。この第三の機序によっても、ACE阻害は血圧を減少させるが、この場合はナトリウム再吸収を減少させることによって減少させる。
【0006】
その多重の生理学的効果のために、ACEのタンパク質分解活性を阻害することは、血圧を抑制する有効な方法である。この観察から、カプトプリルおよびエナラプリル等のいくつかの有効な血圧降下医薬品が生じた(オンデッティ(Ondetti),M.A.ら、1977年、サイエンス(Science)、ワシントンDC(Washington DC)、196、441〜444頁)。
【0007】
高血圧症は比較的一般的な病状なので、現代の生活様式の、この望ましくない結果を、穏やかに活性のある天然成分で相殺することは、有利である。特に、穏やかに活性のある天然成分は、かかる製品は定期的に消費されるので、食品または飲料に組み込むことができる。あるいは、かかる穏やかに活性のある天然成分は、栄養補助食品に組み込むことができた。過去数十年の間に、発酵乳中に存在する特異的ペプチドがACE阻害能力を有し、高血圧症被験者において血圧低下を引き起こすことができることが発見されている。最近では、多くのインビトロおよび少数の動物試験から、種々のタンパク質源から得られた種々のペプチドのACE阻害効果が示されている。インビトロACE阻害アッセイからは多くの種々のペプチド配列が明らかになっているが、ACE阻害ペプチドは、血液中を循環させてインビボ効果を発揮させる必要があることを、強調しなければならない。効果的なACE阻害ペプチドは、胃腸内タンパク質分解性消化系による分解に抵抗するべきであり、それに続く腸壁を越える輸送の間にインタクトなままであるべきであるようである。
【0008】
種々のACE阻害ペプチドの構造機能研究から、それらがしばしばそれらのC末端配列にPro−Pro、Ala−ProまたはAla−Hypを有することが示唆されている(マルヤマ(Maruyama),S.およびスズキ(Suzuki),H.、1982年、アグリカルチュラル・アンド・バイオロジカル・ケミストリー(Agric Biol Chem.)、46(5):1393〜1394頁)。この発見は、ACEが、プロリンを伴うペプチド結合を切断することができないペプチジルジペプチダーゼ(EC3.4.15.1)であることによって、部分的に説明される。したがって、Xaa−Pro結合は切断することができないので、構造Xaa−Pro−Proを有するトリペプチドから、ジペプチドPro−Proを除去することはできない。したがって、比較的高濃度で存在する場合、Xaa−Pro−Pro構造を有するトリペプチドは、ACE活性を阻害するであろうと考えることができる。ACEのみでなく、全てのタンパク質分解酵素はXaa−ProまたはPro−Pro結合を切断するのが難しいので、ペプチドのカルボキシ末端での(複数の)プロリン残基の存在によって、比較的プロテアーゼ耐性の分子が生じるという考えは、ほとんど自明である。同様に、プロリンの代わりにヒドロキシプロリン(Hyp)を含むペプチドは、比較的プロテアーゼ耐性である。このことから、そのカルボキシ末端に1つ以上の(ヒドロキシ)プロリン残基を保有するペプチドは、胃腸管におけるタンパク質分解を免れるようであると推論することができる。これらの結論は、特異的ACE阻害ペプチドの顕著なインビボ血圧降下効果を理解する助けとなるであろう。これらはACE阻害の構造上の要件を満たすだけでなく、胃腸内のタンパク質分解性消化系による分解に抵抗し、それに続く腸壁を越える輸送の間、インタクトなままである。
【0009】
トリペプチドLeu−Pro−Pro(特願平2−36127号公報)、Val−Pro−Pro(EP0583074号明細書)およびIle−Pro−Pro(ジャーナル・オブ・デアリ・サイエンス(J.Dairy Sci.)、78:777〜783頁(1995年))について、強力なACE阻害活性が報告されている。最初に、全てのACE阻害ペプチドは、ACE活性に対するそれらのインビトロ効果に基づいて特徴付けられ、トリペプチドIle−Pro−Pro(以下IPPと呼ぶ)Val−Pro−Pro(以下VPPと呼ぶ)およびLeu−Pro−Pro(以下LPPと呼ぶ)が、比較的低いIC50値を生じる、それらの強力なACE阻害効果のために、抜きん出ていた。後に、トリペプチドVPPならびにIPPの、推定される降圧効果を、自然発症高血圧ラットにおいて確かめることができた(ナカムラ(Nakamura)ら、ジャーナル・オブ・デアリ・サイエンス(J.Dairy Sci.)、78:12531257(1995年))。これらの実験において、阻害トリペプチドは、乳酸菌発酵牛乳に由来した。乳発酵の間、望ましいペプチドは、増殖する乳酸菌によって産生されるプロテイナーゼによって生成される。この発酵アプローチの欠点は、乳酸菌が、生きている生物であり、そのため分泌される酵素の型および量を制御するのが難しい点である。したがって、ACE阻害ペプチドの生成はほとんど再現可能でなく、最適な酵素の組が産生されて必要なペプチドの最大収量を確実にする可能性も低い。必要な発酵時間もまた、比較的長く、これは、低い収量と組み合わされ、生物活性ペプチドの、望ましくないコスト構造を含意する。さらに、a.o.固形食への発酵製品は直接の取り込みに、より適さず、厳しい官能制限を引き起こす。かかる発酵乳製品の乏しい嗜好性、およびかかる発酵ブロスからのACE阻害ペプチドの回収の間に遭遇する多くの処理の難点は、米国特許第6,428,812号明細書に記載されている。これらの欠点にもかかわらず、発酵乳製品は、経口投与される血管降圧薬として、実際に適用されている。ACE阻害ペプチドは、電気透析法、中空線維膜透析またはクロマトグラフィー法によって発酵乳製品から濃縮されて、錠剤またはロゼンジ等の、濃縮された栄養補助食品の形態での、それらの市場売買を可能にしている。
【0010】
発酵製造ルートの、上述の欠点は、a.o.特許出願国際公開第01/68115号パンフレットおよびEP1231279号明細書において認識されている。後者の出願において、純粋に酵素による方法が、トリペプチドVal−Pro−ProおよびIle−Pro−Proを乳カゼインから回収すると記載されている。この出願は、乳カゼインを含む材料をプロテイナーゼで、および中間体ペプチドを介してペプチダーゼで消化することによって、これらのトリペプチドを生成する方法を特許請求している。これらの酵素インキュベーションのそれぞれは、12時間もの時間がかかることがあり、微生物不純物の増殖に有利な条件下で起こることがある。ペプチダーゼとのインキュベーションの前に、中間体ペプチドは、好ましくは精製され、高い終濃度のACE阻害ペプチドは、中間体ペプチドのさらなるクロマトグラフィー精製工程の後でしか得ることができない。
【0011】
[発明の概要]
科学文献において、多くの種々のペプチドおよび加水分解物が、血圧降下効果と相関があった。さらに、多くの生理学的機序が、血圧調節に関係することが公知である。本発明によると、関係するペプチドおよび生理学的機序は、加水分解の後に主な血圧降下成分としてIPPを有するペプチド画分を生じる、適したタンパク質基質を選択することによって、最小限になる。本発明者らは、かかるペプチド画分であるκカゼイン、より好ましくはκカゼイン由来のグリコマクロペプチド(GMP)が、好ましい出発点を形成することを見出した。このようにして生じた血圧降下ペプチド混合物または画分において、特にIPPが重要な役割を果たす。IPP、VPPおよび多くの他の製剤的な生物活性ペプチドの混合物を生じる従来技術の加水分解方法と対照的に、本方法は、IPPの生成を対象とし、それによって、例えばVPPの生成を防ぐ。本発明によると、好ましくは、それらのアミノ酸配列中に−I−P−P−配列を含む、20kDa未満、好ましくは10kDa未満の分子量のタンパク質が、出発タンパク質として使用される。上述のように、GMPは、好ましい基質タンパク質である。GMPは、κ−カゼインから、後述のように得ることができる。牛乳が、κ−カゼインの好ましい起源である。κカゼイン分子のGMP部分が−IPP−配列を含む場合、他の哺乳動物由来の乳、例えばヤギ由来の乳もまた、使用することができる。全てのκカゼインをウシキモシンによって切断することができるわけではないので、GMP部分を得ることは、より適当な凝固酵素の使用を必要とする場合がある。
【0012】
本発明は、それらのアミノ酸配列中に−V−P−P−よりも少なくとも6倍多く存在する−I−P−P−を有するタンパク質(またはタンパク質もしくはペプチドの混合物)の使用を開示する。好ましくは、−V−P−P−配列は、タンパク質またはペプチド配列(または加水分解の基質として使用されるタンパク質もしくはペプチド混合物の配列中)に存在しない。好ましいタンパク質源は、−V−P−P−を含まないタンパク質もしくはペプチド、または前記−V−P−P−を含まないタンパク質を含むタンパク質もしくはペプチドの混合物である。したがって、この混合物は、好ましくは、少なくとも50%、より好ましくは少なくとも80%、さらにより好ましくは少なくとも90%、最も好ましくは少なくとも95%(w/w)の、−V−P−P−を含まないタンパク質またはペプチドを含む。より好ましくは、−V−P−P−配列は、−P−V−P−P−または−A−V−P−P−配列の一部である。かかるタンパク質の好ましい例は、牛乳から得ることができるGMP(グリコマクロペプチド)である。
【0013】
血圧降下ペプチドIPPを、純粋な状態で、すなわちペプチドVPPによる有意な量の混入なしで提供することが、本発明の目的である。
【0014】
血圧降下ペプチドIPPを、高価な精製工程の使用なしに高度に濃縮された形態で提供することが、本発明の別の目的である。
【0015】
血圧降下ペプチドIPPを、苦くない製剤中で提供することが、本発明のさらに別の目的である。苦くない製剤は、好ましくは、実施例8で定義されるような、2以下の苦味強度を有する。
【0016】
好ましくはプロリン特異的プロテアーゼ、より好ましくはプロリン特異的エンドプロテアーゼ、最も好ましくは酸性の最適pHを有するプロリン特異的エンドプロテアーゼを用いてκカゼインのGMP部分からIPPを選択的に切除する、酵素による方法を提供することが、本発明のさらに別の目的である。
【0017】
GMPが好ましくは最初にアミノペプチダーゼとともにインキュベートされ、その後好ましくはアミノペプチダーゼの活性がもはやない条件下で、プロリン特異的プロテアーゼとともにインキュベートされる、GMPからIPPを選択的に生成する、酵素による方法を提供することもまた、本発明の目的である。
【0018】
オピオイドペプチドが同じ製剤中に存在しない、IPPを含む組成物を提供することもまた、本発明の目的である。
【0019】
低アレルギー誘発性製剤中にIPPを含む組成物を提供することもまた、本発明の目的である。
【0020】
30%未満、好ましくは20%未満、より好ましくは15%未満の加水分解度を有するペプチド混合物中にIPPを含む組成物を提供することもまた、本発明の目的である。
【0021】
加水分解物を含み、前記加水分解物がIPPを含み、30%未満、好ましくは20%未満、より好ましくは15%未満の加水分解度を有する、組成物を提供することもまた、本発明の目的である。好ましくは、加水分解物は、少なくとも1%、より好ましくは少なくとも2%の加水分解度を有する。
【0022】
IPPを含み、10%(w/w)を超えない、好ましくは7%を超えない、最も好ましくは3%を超えない遊離アミノ酸レベルを含む組成物を提供することもまた、本発明の目的である。
【0023】
酸沈殿カゼインからのκカゼインのGMP部分の回収のための方法を提供することもまた、本発明の目的である。
【0024】
さらに、本発明は、健康の改善、または疾患の予防および/もしくは治療のための機能性食品、好ましくは薬剤の製造、または高血圧(高血圧症)、心不全、糖尿病前症もしくは糖尿病、肥満、グルコース寛容減損またはストレス等の疾患の治療もしくは予防のための機能性食品、好ましくは薬剤の製造のための、本発明の組成物の使用、または本方法によって機能性食品、好ましくは薬剤として生成される組成物の使用を提供する。
【0025】
好ましくは、本発明の組成物は、栄養補助食品の形態、ローション剤、ゲルまたはエマルジョンの形態の局所適用を含む個人医療用途の形態で、または食品、飼料もしくはペットフード成分としての形態にある。
【0026】
本発明の組成物はまた、肥満の予防もしくは体重制御のための機能性食品の製造のため、または心臓血管の健康維持のための機能性食品の製造のために使用することもでき、好ましくは、心臓血管の健康維持は、アンジオテンシン変換酵素の阻害または血中コレステロールレベルの制御を含む。
【0027】
本発明の組成物は、その消費者に健康上の利益を提供することができる機能性食品中で使用することができ、前記健康上の利益は、好ましくは、肥満の予防、体重制御および心臓血管の健康維持から選択される。
【0028】
この機能性食品は、好ましくは、1つ以上のビタミンBまたは3〜25重量%のステロールを含む。
【0029】
本発明はまた、本発明の、または本発明の方法によって生成される組成物の生成、および食品、飲料または栄養補助食品への前記組成物の組み込みを含む、食品、飲料または栄養補助食品を調製する方法を提供する。
【0030】
好ましくは、この食品、飲料または栄養補助食品は、マーガリン、スプレッド、バター、乳製品もしくはホエー含有飲料、好ましくはヨーグルトまたはヨーグルトもしくは乳等の乳ベースの製品からなる群より選択される。
【0031】
[発明の詳細な説明]
本発明は、ペプチドIPPが、好ましくは−V−P−P−と比較して多量の−I−P−P−をそのアミノ酸配列中に有する低分子量タンパク質から、高収量で生じる方法に関する。好ましくは、κカゼイン、より好ましくはκ−カゼインのGMP画分が使用される。方法は、好ましくは、単一の酵素インキュベーション工程を含む。本発明による方法は、使用されるタンパク質基質に対して高度に特異的であるが、種々のタンパク質分解酵素調製物を使用して、血圧降下活性を比較的純粋な状態で得ることができる。単一の酵素から複雑な酵素混合物までの範囲にわたる、適したタンパク質分解酵素調製物を使用することができる。好ましくは、プロリンのカルボキシ末端で切断する単一の酵素が使用され、好ましくは、この酵素はプロリン特異的プロテアーゼまたはプロリン特異的オリゴペプチダーゼである。好ましくは、基質分子は、−A−I−P−P−または−P−I−P−P−配列を組み込む。プロリン特異的エンドプロテアーゼもまた、適したアミノペプチダーゼと組み合わせて、使用することができる。後者の場合、GMP含有画分は、好ましくは、まず、好ましくは中性に近い条件下、例えばpH5〜8で、アミノペプチダーゼとともにインキュベートされる。このアプローチはまた、Xが任意のアミノ酸残基を表すことができる−X−I−P−P−配列を組み込む基質の使用を可能にする。好ましくは、アミノペプチダーゼのインキュベーション後またはアミノペプチダーゼの活性がないpH条件下で、N末端がトランケートされたGMP分子が、プロリン特異的プロテアーゼとともにインキュベートされる。好ましくは、プロリン特異的エンドプロテアーゼ等の、プロリンのカルボキシ末端で切断するプロテアーゼ、ならびにアミノペプチダーゼ活性は、いかなるエンドプロテアーゼ活性の混入もない。好ましくは、プロリン特異的エンドプロテアーゼ等の、プロリンのカルボキシ末端で切断するプロテアーゼ、ならびにアミノペプチダーゼ活性は、カルボキシペプチダーゼ活性の混入がない。エンドプロテアーゼ活性の混入のないプロリン特異的エンドプロテアーゼは、好ましくは、1より大きい、より好ましくは100より大きいプロリン特異的活性/エンド比を有する酵素調製物である。エンドプロテアーゼ活性の混入のないアミノペプチダーゼ活性は、好ましくは、少なくとも0.1、より好ましくは少なくとも0.5、最も好ましくは少なくとも1のAP/エンド比を有する酵素調製物である。
【0032】
カルボキシペプチダーゼ活性の混入のないプロリン特異的エンドプロテアーゼは、好ましくは、少なくとも1、より好ましくは少なくとも10のプロリン特異的活性/CPD比を有する酵素調製物である。
【0033】
カルボキシペプチダーゼ活性の混入のないアミノペプチダーゼ活性は、好ましくは、少なくとも0.1、より好ましくは少なくとも0.3のAP/CPDを有する酵素調製物である。上述の比は、実施例5に記載されているように決定される。
【0034】
タンパク質配列中に存在する−I−P−P−配列の、好ましくは少なくとも20%、より好ましくは少なくとも40%、さらにより好ましくは少なくとも60%、最も好ましくは少なくとも70%が、ペプチドIPPに変換される。プロリン特異的プロテアーゼは、好ましくは、基質タンパク質自体等の、大きいタンパク質分子を加水分解することができる。本発明による方法は、一般に、24時間未満のインキュベーション時間、好ましくは10時間未満のインキュベーション時間、より好ましくは4時間未満のインキュベーション時間を有する。インキュベーション温度は、一般に、30℃より高く、好ましくは40℃より高く、より好ましくは50℃より高い。本発明の別の態様は、傾瀉、遠心分離またはろ過によってIPP含有ペプチド混合物を精製して、可溶性加水分解物を形成する方法である。
【0035】
本発明はさらに、
1〜5mg IPP/gの間(乾物またはタンパク質に基づく)、または20〜50mg IPP/gの間(乾物またはタンパク質に基づく)を含むペプチド組成物、ならびに
少なくとも20mg IPP/g(乾物またはタンパク質に基づく)、好ましくは20〜100mg IPP/g(乾物またはタンパク質に基づく)を含む15〜90%(乾物重量)のペプチドを含む、ペプチド組成物
を開示する。
【0036】
従来技術において、トリペプチドIPP、VPPおよびLPPは、有効なACE阻害薬として記載されている。公知のアミノ酸配列から判断されるように、牛乳のホエータンパク質は、これらの3つのACE阻害トリペプチドのいずれに対応するアミノ酸配列も組み込まない。したがって、ペプチドIPP、VPPおよびLPPは、ホエータンパク質から単離することができない。しかしながら、これらのペプチドは、牛乳のカゼイン画分中では生じる。例えば、β−カゼインは、−I−P−P−(74〜76)、−V−P−P−(84〜86)ならびに−L−P−P−(151〜153)配列を包含する。さらに、κ−カゼインもまた、−I−P−P−を包含するが、他の2つの配列は包含しない。κカゼイン中に存在するIPP配列は、109〜110位、すなわち、κカゼイン中の独特のキモシンPhe(105)〜Met(106)切断部位のカルボキシ末端のいくつかのアミノ酸に位置している。したがって、κカゼインにおいて、−I−P−P−配列は、この分子のGMP部分に位置している。本発明者らは、酵素凝固乳において、κカゼイン由来IPP実体が、チーズホエー中に見られ、酸凝固乳において、沈殿したカゼイン部分に見られることを見出した。
【0037】
重量の観点でκ−カゼインがカゼインの重要な画分でないことにもかかわらず、本発明者らは、分子の観点から、その存在が極めて重要であると気づいた。例えば、β−カゼインは、1立方メートルの乳あたり大体400mmolの濃度で存在し、κ−カゼインは1立方メートルの乳あたり180mmolの濃度で存在する。チーズホエーにおいても、GMPは、重要な画分を代表する。組み合わせた血清タンパク質の濃度は1立方メートルあたり320mmolであるが、GMPは、1立方メートルのチーズホエーあたり400mmolの濃度で存在する。
【0038】
意外なことに、GMPは、容易に得ることができる。本発明によると、GMPは、選択されたpH条件下で、キモシンでの酵素処理によって、酸沈殿カゼインから選択的に遊離させることができる。チーズホエーからのGMPの単離はより困難であるが、GMP濃縮ホエー画分を得る産業上の方法は、公知である。これらの公知の方法で得られる、これらの市販のGMP濃縮画分は、現在、種々の機能性食品用途に使用されている。
【0039】
本願において、本発明者らは、GMPの使用を、血圧降下IPPを高度に精製された状態で得るための、好ましい出発物質として記載する。
【0040】
乳のタンパク質画分は、ミセル状カゼイン画分および可溶化ホエータンパク質画分を組み込む。ホエータンパク質の中でも、β−ラクトグロブリンおよびα−ラクトアルブミンが、量的に、最も重要である。カゼインタンパク質の中でも、比較的疎水性のα−およびβ−カゼインが、量的に主である。カゼインミセルは、κ−カゼインによって溶液中に維持される。κカゼインの親水性部分、いわゆるグリコマクロペプチド(GMP)は、ミセル表面から突出し、それによって疎水性カゼインを水溶液中で安定させる。
【0041】
確立した多くの産業上の方法によると、カゼイン画分は、例えばチーズを製造するための、乳から単離することができる。これらの方法の1つにおいて、乳は酸性化されて、乳からカゼイン画分を選択的に沈殿させる。酸沈殿物質は、全てのカゼイン、すなわち、α、β、κおよびγ−カゼインを取り込む。沈殿しなかった酸性化乳画分は、「乳清」と呼ばれる。別の方法において、乳は凝乳酵素、例えばウシキモシン(「レンネット」)とともにインキュベートされる。キモシンは、κ−カゼインのPhe(105)〜Met(106)ペプチド結合を非常に選択的に切断するプロテアーゼである。この反応によって、κ−カゼインの親水性GMP部分が切断され、これによって、ミセル状カゼイン画分の、即座の凝集および沈殿が生じる。この場合、沈殿したカゼイン画分は「カード」と呼ばれる。κカゼインのGMP部分は切り取られるので、この酵素アプローチにおいて、親水性GMP断片は、いわゆる「チーズ」または「甘味」ホエーを形成する種々の血清タンパク質とともに溶液中に残る。
【0042】
種々の刊行物が、GMP濃縮乳画分を消費することの生理学的利益を主張している。さらに、GMP濃縮チーズホエー画分を単離するための、費用効果の高い経路を記載している多くの刊行物が存在する。例えば、限外ろ過の使用は、EP1037537号明細書に記載されており、陰イオン性樹脂の使用は米国特許第6787158号明細書に記載されている。
【0043】
本発明の一態様は、血圧降下剤としての、GMPの加水分解物の使用に関する。本発明者らは、GMP中の比較的高レベルのIPPおよびカルボキシ末端のプロリンを有する他のペプチドが、血圧降下効果と関連付けることができることを見出した。
【0044】
加水分解物によって、基質タンパク質の加水分解によって形成される生成物(タンパク質加水分解物または加水分解されたタンパク質)、本明細書中にも可溶性ペプチド含有組成物もしくは可溶性ペプチドを含む組成物として記載されているタンパク質分解酵素の(水)可溶性画分である可溶性加水分解物、またはタンパク質加水分解物および可溶性加水分解物の混合物を意味する。
【0045】
「ペプチド」または「オリゴペプチド」は、本明細書中で、ペプチド結合によって連結された少なくとも2つのアミノ酸の、鎖として定義される。用語「ペプチド」および「オリゴペプチド」は、同義(一般に認識されるように)と考えられ、各用語は、文脈によって必要な場合、同義的に使用することができる。「ポリペプチド」または「タンパク質」は、本明細書中で、30個より多いアミノ酸残基を含む、鎖として定義される。本明細書中の全ての(オリゴ)ペプチドおよびポリペプチドの式または配列は、一般的な慣習に従って、左から右に、アミノ末端からカルボキシ末端の方向で記される。本明細書中で使用されるアミノ酸の一文字表記は、当該分野で一般に公知であり、サンブルック(Sambrook)ら(モレキュラー・クローニング:ラボラトリー・マニュアル(Molecular Cloning:A Laboratory Manual)、第2版、コールドスプリングハーバーラボラトリー(Cold Spring Harbor Laboratory)、コールドスプリングハーバーラボラトリープレス(Cold Spring Harbor Laboratory Press)、ニューヨーク州コールドスプリングハーバー、1989年)に見ることができる。
【0046】
オピオイドペプチドは、アヘン受容体に結合することができるペプチドである。
【0047】
IUMBからの、全ての酵素の分類および命名法の、国際的に認識されている概略は、プロテアーゼを含む。プロテアーゼEC番号についてアップデートされたIUMBテキストは、インターネットサイト:
HTTP://www.chem.qmw/ac.uk/iubmb/enzyme/EC3/4/11/
で見ることができる。このシステムにおいて、酵素は、それらが単一の反応を触媒することによって定義される。これは、いくつかの異なるタンパク質が全て同じ酵素として記載されているという重要な意味を有し、1つより多い反応を触媒するタンパク質は、1つより多い酵素によって処理される。システムは、プロテアーゼをエンドプロテアーゼおよびエキソプロテアーゼに分類する。エンドプロテアーゼは、内部のペプチド結合を加水分解する酵素であり、エキソプロテアーゼは、末端のα−アミノ基に隣接するペプチド結合(「アミノペプチダーゼ」)または末端のカルボキシ基と末端から2番目のアミノ酸との間のペプチド結合(「カルボキシペプチダーゼ」)を加水分解する。エンドプロテアーゼは、触媒機序に基づいて、サブサブクラスに分けられる。セリンエンドプロテアーゼ(EC3.4.21)、システインエンドプロテアーゼ(EC3.4.22)、アスパラギン酸エンドプロテアーゼ(EC3.4.23)、メタロエンドプロテアーゼ(EC3.4.24)およびスレオニンエンドプロテアーゼ(EC3.4.25)のサブサブクラスがある。
【0048】
アミノペプチダーゼは、クラス3.4.11にある。細分類は、20の異なるアミノ酸が除去される相対的効率に基づく。狭い特異性および広範な特異性を有するアミノペプチダーゼを、区別することができる。アミノペプチダーゼは、タンパク質およびペプチド基質から、単一のアミノ末端のアミノ酸を段階的に除去することができる。狭い特異性を有するアミノペプチダーゼは、基質ペプチドから遊離するP1位のアミノ酸残基の型に対して強力な選択を示す。広範な特異性のアミノペプチダーゼは、N末端またはP1位で、様々な異なるアミノ酸を放出させることができる(シェクターの命名法:シェクター(Schechter),I.およびベルガー(Berger),A.1967年、バイオケミカル・アンド・バイオフィジカル・リサーチ・コミュニケーションズ(Biochem Biophys Res Commun)27:157〜162頁による)。カルボキシペプチダーゼは、タンパク質およびペプチド基質から、単一のカルボキシ末端のアミノ酸を段階的に除去することができる。エンドプロテアーゼの場合と同様に、カルボキシペプチダーゼは、触媒機序に基づいてサブサブクラスに分けられる。セリン型カルボキシペプチダーゼはクラスEC3.4.16にあり、メタロカルボキシペプチダーゼはクラスEC3.4.17にあり、システイン型カルボキシペプチダーゼはクラスEC3.4.18にある。プロテアーゼのECリストの値は、種々の型のプロテアーゼ活性の標準的な用語法を提供し、特に、独特の識別番号および各プロテアーゼの推奨名が割り当てられている。
【0049】
κカゼイン分子のGMP部分は、64アミノ酸残基の長さを有するポリペプチドである。全てのIPPが定量的に回収される場合、純粋なGMP調製物は、VPPまたはLPPのいずれかによる有意な混入なしに、大体5%(w/w)のIPP濃度を生じることができる。本願において、本発明者らは、場合により単一のインキュベーション工程で、および高収量で、GMPポリペプチドからIPPトリペプチドを単離するための、いくつかのタンパク質分解方法を記載する。したがって、本発明の方法によると、直接、または単一の精製工程の後に直接使用するのに十分な程IPP濃度が高く、そのためクロマトグラフィーによる単離または精製等の複雑で高価な精製方法の必要がない、IPPを含む組成物を得ることが可能である。
【0050】
第一のタンパク質分解方法によると、単離されたGMP分子は、スミチーム(Sumizyme)FP(新日本(Shin Nihon)またはフレーバーザイム(Flavourzyme)(ノボ(NOVO))またはウマミザイム(Umamizyme)(天野(Amano))等の複雑な微生物プロテアーゼ酵素調製物とともにインキュベートされる。スミチーム(Sumizyme)FP、フレーバーザイム(Flavourzyme)およびウマミザイム(Umamizyme)は、種々のエンド型タンパク質分解酵素+アミノペプチダーゼおよびカルボキシペプチダーゼ等のエキソ型タンパク質分解活性を含む酵素調製物である。酵素投薬およびpH条件の注意深い選択によって、本発明者らは、スミチーム(Sumizyme)FPまたはフレーバーザイム(Flavourzyme)調製物のいずれかを使用して、単一のインキュベーション工程でIPPトリペプチドを得ることができた。しかしながら、この第一のタンパク質分解戦略の欠点は、種々の異なるペプチドが、存在する種々の酵素活性によって形成される場合があることである。さらに、加水分解物がさらに精製されなければ最終的なIPP含有生成物にブロスの味の変化を与える、比較的多量の遊離アミノ酸が生じる。
【0051】
第二のタンパク質分解方法によると、単離されたGMP分子は、プロリン特異的オリゴペプチダーゼ(EC3.4.21.26)またはプロリン特異的エンドペプチダーゼとともにインキュベートされる。このアプローチにおいて、これらの2つの型の酵素の独特の特異性が、有利に使用される。両方の型のプロリン特異的プロテアーゼは、好ましくは、プロリン残基のC末端のペプチド結合を加水分解する。しかしながら、これらの2つの酵素の固有の副活性は、アラニン残基のC末端を加水分解することを対象とする。GMP中に存在する−I−P−P−配列は、N末端でアラニン残基に先行されるので、純粋なプロリン特異的オリゴペプチダーゼまたは純粋なプロリン特異的エンドペプチダーゼとのGMPのインキュベーションによって、直接IPPが生じる。この経路の重要な利点は、非常に苦い味の変化につながることおよび望ましくない生物活性も示すことのある、多数の他のペプチドを同時に生じることなく、高いIPP収量が得られることである。さらに、この方法の間に生じる遊離アミノ酸はほとんどなく、高濃度のIPPを含む、淡白な味の生成物が得られる。
【0052】
さらなるタンパク質分解方法によると、単離されたGMP分子は、まず、アミノペプチダーゼとともにインキュベートされて、GMPのIPP配列に先行するGMPのN末端アミノ酸(MetおよびAla)が除去される。このインキュベーションの後にのみ、プロリン特異的プロテアーゼが反応混合物に加えられて、IPPペプチドを放出させる。好ましくは、アミノペプチダーゼは、プロリン特異的プロテアーゼとのインキュベーションの間または後に、もはや活性がない。本発明者らは、このアプローチが、より高いIPP収量につながり、さらに、味の変化の発生につながらず、最終製品中に存在する遊離アミノ酸の量にほとんど寄与しないことを見出した。さらに、IPPが、他のペプチドに対して、特にトリペプチドに対して、多量に存在する。調製されたIPPは、さらに、大きい方のペプチドから分離することができる。アミノペプチダーゼは、ペプチドのN末端側からアミノ酸を段階的に除去することができるので、IPP配列に先行するメチオニン(「M」)およびアラニン(「A」)残基を効率的に遊離させることができるアミノペプチド分解酵素活性が必要である。IPPトリペプチド中に存在するI−PおよびP−Pペプチド結合は、酵素による切断に抵抗することがわかっており、インタクトなGMP分子のインキュベーションの後、かかるアミノペプチド分解酵素は、GMP分子のN末端をトランケートし、配列IPPで始まる。
【0053】
所望のアミノペプチダーゼ活性を有する商業的な酵素調製物は、コロラーゼ(Corolase)LAP(ABエンザイムス(AB Enzymes))である。コロラーゼ(Corolase)LAPは、アスペルギルス(Aspergillus)由来の、比較的純粋な、クローニングおよび過剰発現された、ロイシンアミノペプチダーゼ活性を表す。この調製物は非特異的エンド型タンパク質分解およびカルボキシペプチド分解活性を欠くので、GMP基質分子の望ましくない切断が防がれる。比較的広範な特異性を有する、別の、クローニングおよび過剰発現されたアミノペプチダーゼは、黒色アスペルギルス(A.niger)由来のアミノペプチダーゼである(国際公開第02/068623号パンフレットの配列番号171)。
【0054】
最後に、本発明者らは、GMPがまた、発酵経路によってIPPが生成される方法において、有利に使用されることに気づいた。実施例で説明されるように、特異的乳酸桿菌とのGMPのインキュベーションは、全乳発酵に特徴的な味の変化の発生なしに、IPPを生じる。
【0055】
全ての上述の態様は、望まれない生物活性または味または臭いのプロフィールなしに高度に標準化された生成物の生成を可能にするので、特に重要である。かかる高度に標準化された生成物は、種々の食物用途において、または錠剤もしくはロゼンジ等の濃縮された食品において、その後の精製工程なしに、組み込むことができる。例えばより小さい錠剤またはロゼンジを製造するための、さらに高いIPP濃度を含む、高度に標準化された生成物は、IPP以外のペプチドの選択的除去によって得ることができる。有意な血圧降下活性のないペプチドのかかる除去は、例えば、これらの非活性ペプチドの沈殿、その後の(限外)ろ過または傾瀉工程によって、達成することができる。さらに別のアプローチにおいて、ペプチドIPPの非常に疎水性の特徴を利用するその後の精製によって、生物活性成分の濃度をさらに増大させることができる。これらの精製方法としては、ナノろ過、例えばブタノールでの抽出、その後の蒸発/沈殿、または、例えばアンバーライト(Amberlite)XAD範囲(ローム(Rohm))からの、活性炭もしくはクロマトグラフィー樹脂等の結合剤で得られるような酸性化された加水分解物を接触させることが挙げられる。例えばファルマシア(Pharmacia)によって供給されるような、ブチルセファロース樹脂もまた、使用することができる。かかる物質からの血圧降下ペプチドの脱着は、メタノール/エタノール混合物等の有機性溶媒で、またはプロパノールで、行うことができる。さらに、CO2またはN2Oを使用した超臨界抽出法を用いて、高度に精製された生物活性ペプチドを得ることができる。
【0056】
EP1231279号明細書において、純粋に酵素による方法が、乳カゼインからトリペプチドVPPおよびIPPを回収すると記載されている。この出願は、乳カゼインを含む材料を、配列−V−P−P−を含むがこれら以外のProをこの配列中に含まないペプチドならびに配列−I−P−P−を含むがこれら以外のProをこの配列中に含まないペプチドからなる群より選択される、いわゆる「中間体ペプチド」を介して、プロテイナーゼおよびペプチダーゼで消化することによってトリペプチドを生成するための方法を特許請求している。EP1231279号明細書の実施例に記載されているように、この方法は、2段階プロセスを伴う。第一に、VPPまたはIPPのいずれかを包含する中間体ペプチドが生成される。これは、適したプロテイナーゼとともにカゼインをインキュベートすることによって行われる。実施例の1つによると、37℃で12時間。次いで、使用されたプロテイナーゼは、この第一の加水分解物を100℃まで3分間加熱することによって不活性化され、再び冷ました後、別の酵素調製物(実際は、エキソ型タンパク質分解活性を有する調製物)が加えられる。この、他の酵素調製物との37℃でさらに12時間のインキュベーションの後、トリペプチドVPPおよびIPPの存在を、実証することができる。より高い収量の、これらのACE阻害ペプチドを得るために、EP1231279号明細書は、エキソ型タンパク質分解活性に曝露する前に、中間体ペプチドを精製および濃縮することをさらに示唆している。EP1231279号明細書はまた、手順において、中間体ペプチドを得た後、および中間体ペプチドをペプチダーゼに接触させる前に、例えば5000〜20000rpmで3〜10分間の遠心分離による、未反応タンパク質の除去等の種々の操作を、場合により行ってもよいことを示唆している。したがって、所望のトリペプチドの複雑な混合物が、産業上やや扱いにくい2段階酵素プロセスで、得られる。酵素インキュベーションのそれぞれに、pH4.5〜7.0および25〜50℃の温度で12時間もの時間がかかるので、この手順がまた、微生物学的観点から容認できないことが、明らかである。25〜50℃の低いインキュベーション温度と組み合わせた、これらの長いインキュベーション時間は、タンパク質含有溶液の感染を容易に生じる場合がある。
【0057】
EP1231279号明細書に記載されている方法と比較すると、本願中で特定される進歩性の科学的精密さと簡潔さが明らかになる。まず、本願は、κカゼインのGMP断片のみの使用を記載している。その結果、IPPのみが放出され、カゼインに包含されることが公知である多くの他の潜在的に非常に苦いペプチドが発生しない。第二に、本発明による、プロリン特異的プロテアーゼを用いたインキュベーションは、単一のインキュベーション工程で、単一の純粋な酵素によって行われる。この特定のエンドプロテアーゼに固有である、プロリン特異的プロテアーゼの非常に選択的な切断パターンのために、所望のIPPペプチドが、非常に限られた数の他のペプチドと同時に、即座に放出される。意外なことに、EP1231279号明細書で言及されているような「中間体ペプチド」は形成されない。第三に、GMPカゼイン断片が、まず純粋なアミノペプチダーゼとともにインキュベートされ、その後プロリン特異的プロテアーゼとともにインキュベートされる、本発明によるインキュベーションは、本質的に、EP1231279号明細書に記載されている経路と異なるが、高い効率ならびに最小限のレベルのペプチドおよび遊離アミノ酸の混入で、IPPをさらに放出する。好ましいインキュベーションは、プロテイナーゼの代わりにアミノペプチダーゼ(EP1231279号明細書によると「ペプチダーゼ」)で始まり、「中間体ペプチド」を生じない。以下の工程において、プロテイナーゼの代わりのエンドプロテアーゼが使用され、ここでも「中間体ペプチド」は形成されない。
【0058】
従来技術の製品について言及された全ての欠点にもかかわらず、発酵乳製品は、経口投与される血管降圧薬として、実際に適用されている。ACE阻害ペプチドはまた、電気透析法、中空繊維膜透析またはクロマトグラフィー法によって発酵乳製品から濃縮され、錠剤またはロゼンジ等の濃縮された栄養補助食品の形態での、それらの市場売買を可能にしている。
【0059】
ペプチドIPPを、純粋な状態で、すなわちVPPまたはLPP等のペプチドによる有意な混入なしに提供することが、本発明の目的である。
【0060】
ペプチドIPPを、高価な精製工程の使用なしに高度に濃縮された形態で提供することが、本発明の別の目的である。
【0061】
血圧降下ペプチドIPPを、苦くない製剤中で提供することもまた、本発明の目的である。
【0062】
本発明は、機能性食品、好ましくは薬剤として使用するための、ペプチド含有組成物に関する。本発明はまた、機能性食品、好ましくは薬剤としての、本ペプチド含有組成物の使用、機能性食品、好ましくは薬剤の製造のための、本ペプチド含有組成物の使用、健康の改善または疾患の予防および/もしくは治療のための、本ペプチド含有組成物の使用、機能性食品、好ましくは薬剤の製造のための、本ペプチド含有組成物の使用、高血圧症および心不全等の心臓血管疾患の治療のための本ペプチド含有組成物の使用、糖尿病前症または糖尿病の治療のための、本ペプチド含有組成物の使用、肥満の治療または予防のための、本ペプチド含有組成物の使用、血漿インスリンを増大させるためまたは血漿インスリンの感受性を増大させるための、本ペプチド含有組成物の使用、2型糖尿病または糖尿病前症の血漿インスリンを増大させるためまたは血漿インスリンの感受性を増大させるための、本ペプチド含有組成物の使用、2型糖尿病または糖尿病前症の血液中の食後のグルコース濃度を低下させるための、本ペプチド含有組成物の使用、2型糖尿病または糖尿病前症の血液中の食後のインスリン分泌を増大させるための、本ペプチド含有組成物の使用、本ペプチド含有組成物が栄養補助食品の形態である、本ペプチド含有組成物の使用、ストレスの影響の治療的処置のための機能性食品の製造のための、本ペプチド含有組成物の使用、局所適用、好ましくは個人医療用途における、本ペプチド含有組成物の使用、ならびに飼料およびペットフードにおける、本ペプチド含有組成物の使用に関する。
【0063】
さらに、本発明は、かかる治療を必要とする被験体に本ペプチド含有組成物を投与することを含む、1型および2型糖尿病の治療の方法、ならびに糖尿病前症またはグルコース寛容減損(IGT)を有する個体における2型糖尿病の予防のための方法、ならびに、かかる治療を必要とする被験体に本ペプチド含有組成物を投与し、そのようにして血圧降下効果を示すことを含む、高血圧症もしくは心不全を患う人々の治療またはその予防の方法に関する。ACEの阻害は、血管収縮の減少、血管拡張の増強、ナトリウムおよび水排出の改善を生じ、これらは次に、末梢血管抵抗および血圧の減少ならびに局所血流の改善につながる。したがって、ペプチドを含む、本加水分解物は、高血圧症、心不全、狭心症、心筋梗塞、脳卒中、末梢動脈閉塞性疾患、アテローム性動脈硬化症、腎症、腎不全、勃起不全、内皮障害、左室肥大、糖尿病性脈管障害、体液貯留、および高アルドステロン症を含むがこれらに限定されない、ACE阻害によって影響を及ぼすことができる疾患の予防および治療に特に効果的である。組成物はまた、胃腸障害(下痢、過敏性腸症候群)、炎症、真性糖尿病、肥満、認知症、てんかん、老人性錯乱、およびメニエール病の予防および治療に有用な場合がある。さらに、組成物は、認知機能および記憶(アルツハイマー病を含む)、満腹感を増強し、虚血性障害を限定し、バイパス手術または血管形成術の後の動脈の再閉塞を防ぐことができる。
【0064】
真性糖尿病は、これまでに治療法のない、広まっている慢性疾患である。真性糖尿病の発生率および有病率は指数関数的に増大しており、先進国および発展途上国における、最も一般的な代謝障害の1つである。真性糖尿病は、複数の病因に由来する複雑な疾患であり、インスリン分泌の欠乏および/またはインスリン抵抗性に関連する炭化水素、タンパク質および脂肪代謝障害によって特徴付けられる。これは、無処置のまま放置されると合併症につながる、空腹および食後の血清グルコース濃度の高まりを生じる。疾患の2つの主なカテゴリーである、インスリン依存性糖尿病(IDDM、T1DM)およびインスリン非依存性糖尿病(NIDDM、T2DM)がある。T1DM=1型糖尿病。T2DM=2型糖尿病。
【0065】
T1DMおよびT2DM糖尿病は、高血糖、高ステロール血症および高脂血症と関連がある。それぞれT1DMおよびT2DMにおける、絶対的インスリン欠乏およびインスリンに対する非感受性は、肝臓、筋肉および脂肪組織におけるグルコース利用の減少および血中グルコースレベルの増大につながる。制御されない高血糖は、腎症、神経障害、網膜症、高血圧症、脳卒中および心疾患を含む微小血管障害および大血管障害のリスクの増大による、増大した、および若年の、死亡率に関連する。最近の証拠から、堅固な血糖管理が、T1DMおよびT2DMの両方におけるこれらの合併症の予防における主な要因であることが示された。したがって、薬物または治療計画による最適な血糖管理は、糖尿病の治療のための重要なアプローチである。
【0066】
T2DMの治療は、まず、食事および生活様式の変化を伴い、これらの手段によって十分な血糖管理が維持できない場合は、患者は経口血糖降下薬および/または外因性インスリンを投与される。T2DMの治療のための現在の経口の薬理学的薬剤としては、インスリン分泌を増強するもの(スルホニルウレア剤)、肝臓におけるインスリンの作用を改善するもの(ビグアナイド剤)、インスリン感受性改善薬(チアゾリジンジオン)およびグルコースの取り込みを阻害するよう作用する薬剤(α−グルコシダーゼ阻害剤)が挙げられる。しかしながら、現在利用可能な薬剤は、一般に、膵臓細胞機能の進行性の損失に起因する高血糖の進行性の悪化のために、長期間十分な血糖管理を維持することができない。標的血糖レベルを維持することができる患者の割合は、経時的に顕著に減少し、追加/代替の薬理学的薬剤の投与を必要とする。さらに、薬物は、望まれない副作用を有することがあり、高い一次および二次失敗率と関連する。最後に、血糖降下薬は、血中グルコースレベルの制御に効果的である場合があるが、糖尿病の全ての合併症を防ぐことはできない。したがって、全ての型の真性糖尿病の現在の治療の方法は、正常血糖の理想および糖尿病合併症の予防を達成することができない。したがって、T1DMおよびT2DMの治療における最適な治療は本質的にインスリンおよび経口血糖降下薬の投与に基づくが、副作用が最小限の、糖尿病の治療および予防のための、安全かつ効果的な栄養補助食品の必要性がある。多くの患者は、高用量の薬物に関連する副作用を最小限にすることができ、さらなる臨床上の利益を生じることができる、代替療法に興味がある。真性糖尿病患者は、補助療法として使用することができる、穏やかな抗糖尿病効果を有し、主な副作用がない、「天然」と考えられる治療に特に興味がある。T2DMは、進行性および慢性の疾患であり、これは、通常、インスリンの産生に関与する脾臓細胞(ランゲルハンス島のβ細胞)に相当な損傷が起こるまで認識されない。したがって、β細胞損傷、したがってリスクのある人々、特にT2DMを発症するリスクの高い高齢者における明白なT2DMの進行の、予防に使用することができる栄養補助食品の開発への興味が増大している。膵臓β細胞の保護は、グルコースおよび脂質がβ細胞に対して損傷効果を示すので、血中グルコースレベルおよび/または脂質レベルを減少させることによって達成することができる。血中グルコースレベルの減少は、種々の機序、例えばインスリン感受性の増強および/または肝臓のグルコース生成の減少によって、達成することができる。血中脂質レベルの減少はまた、種々の機序、例えば脂質酸化および/または脂質貯蔵の増強によって達成することができる。膵臓β細胞を保護するための、別の可能性のある戦略は、酸化的ストレスを減少させる。酸化的ストレスはまた、β細胞損傷と、それに続くインスリン分泌の損失および明白なT2DMの進行を引き起こす。したがって、T2DMは、複数の器官部位に共存する欠陥:筋肉および脂肪組織におけるインスリン作用の抵抗性、膵臓インスリン分泌障害、抑制のない肝臓グルコース生成に起因する、複雑な疾患である。それらの欠陥は、しばしば、脂質異常および内皮障害に関連する。T2DMにおける複数の病態生理学的病変を考慮すれば、併用療法が、その管理に対する魅力的なアプローチである。
【0067】
本発明は、本発明のペプチド含有組成物を含む、新規の機能性食品組成物に関する。本発明のペプチド含有組成物を含む機能性食品組成物はまた、真性糖尿病、もしくはグルコース寛容減損に関連するX症候群等の他の状態の治療または予防のための有効成分として、加水分解されていないタンパク質および炭化水素を含んでもよい。別の態様において、本発明は、前記治療または予防のための栄養補助食品、例えば正常な代謝機能の維持に必須だが体内で合成されないビタミンおよびミネラルを含むマルチビタミン調製物への添加物としての、かかる組成物の使用に関する。さらに別の態様において、本発明は、かかる治療を必要とする被験体に、本発明のペプチド含有組成物ならびにタンパク質加水分解物または加水分解されていないタンパク質および/または炭化水素を投与することを含む、1型および2型両方の真性糖尿病の治療のため、および糖尿病前症またはグルコース寛容減損(IGT)または肥満の個体におけるT2DMの予防のための方法に関する。
【0068】
本発明の組成物は、特に、T1DMおよびT2DMの両方の治療のため、ならびに糖尿病前症、またはグルコース寛容減損(IGT)の個体におけるT2DMの予防のために意図される。
【0069】
本ペプチド含有組成物は、2型糖尿病または糖尿病前症のために使用して、好ましくは食後のグルコース濃度を低下させるか、または食後の血中のインスリン分泌を増大させることができることがわかっている。
【0070】
ペプチドおよび場合により炭化水素を含む組成物は、インスリン分泌を刺激し、脂肪組織、骨格筋および肝臓等のインスリン感受性標的組織へのグルコース処理を増大させ、したがって、真性糖尿病の治療における共同効果を提供する。
【0071】
ストレス関連疾患、および体に対するストレスの負の効果が、多くの人々に対して相当な影響を有すると、一般に認識されている。近年、ストレスの影響、および種々の疾患および状態の発症に対するその寄与は、医学および科学界で、より広い認識を得てきた。消費者は、今や、これらの潜在的な問題にますます気づいてきており、彼らの健康に対する、ストレスの、可能性のある負の影響を減少または予防することに、ますます興味を持つようになってきている。
【0072】
体がストレスの影響を処理するのを助けるのに使用するのに適した、食品、またはそこに組み込むことができる成分を提供することが、本発明のさらなる目的である。
【0073】
体がストレスの負の効果を処理するのを助ける等の、健康上の利益を提供する、本ペプチド含有組成物を含む食品を提供することが、本発明のさらなる目的である。
【0074】
用語、機能性食品は、本明細書中で使用される場合、栄養および薬学的適用分野の両方における有用性を意味する。したがって、新規の機能性食品組成物は、食物および飲料への栄養補給物として、ならびにカプセル剤もしくは錠剤等の固体製剤、または溶液もしくは懸濁液等の液体製剤であってもよい腸または非経口適用のための薬学的製剤または薬剤としての、使用を提供することができる。上記から明らかなように、用語、機能性食品組成物はまた、本ペプチド含有組成物、および、場合により炭化水素を含む食物および飲料、ならびに前述の有効成分を含む、栄養補給物、例えば栄養補助食品を含む。
【0075】
用語、栄養補助食品は、本明細書中で使用される場合、食事に補充することを意図された「食物成分」を含む、口によって摂取される製品を意味する。これらの製品中の「食物成分」としては、ビタミン、ミネラル、薬草または他の植物性薬品、アミノ酸、ならびに酵素、器官組織、腺、および代謝産物等の物質を挙げることができる。栄養補助食品はまた、抽出物または濃縮物であってもよく、錠剤、カプセル剤、ソフトゲル、ゲルカプセル、液体、または散剤等の、多くの形態で提供されることができる。これらはまた、棒等の他の形態でも提供されることができるが、その場合、栄養補助食品のラベル上の情報は、一般に、製品を、従来の食物、または食事(meal)もしくは食事(diet)の単独の商品として表さない。
【0076】
マルチビタミンおよびミネラル栄養補給物は、本発明の機能性食品組成物に添加されて、一部の食事で欠かれている十分な量の必須栄養素を得ることができる。マルチビタミンおよびミネラル栄養補給物はまた、生活様式パターン、および糖尿病で時々見られる一般的な不十分な食事パターンによる、栄養の損失および欠損に対する疾患予防および保護に有用な場合がある。さらに、酸化的ストレスは、インスリン抵抗性の発症に含意されている。反応性の酸素種は、インスリン受容体シグナリングカスケードを阻害することによって、インスリン刺激グルコース取り込みを損なう場合がある。α−トコフェロール(ビタミンE)アスコルビン酸(ビタミンC)等の酸化防止剤での酸化的ストレスの制御は、糖尿病の治療において価値がある場合がある。したがって、マルチビタミン栄養補給物の摂取は、上記の活性物質に加えて、十分バランスの取れた栄養を維持することができる。
【0077】
さらに、本ペプチド含有組成物と、マグネシウム(Mg2+)、カルシウム(Ca2+)および/またはカリウム(K+)等のミネラルとの組み合わせは、健康の改善、ならびに心臓血管疾患および糖尿病を含むがこれらに限定されない疾患の予防および/または治療に使用することができる。
【0078】
本発明の好ましい態様において、本発明の機能性食品組成物は、本ペプチド含有組成物を含む。IPPは、本発明による組成物中に、それが投与される被験体の体重1kgあたり約0.001g〜体重1kgあたり約1gの一日の投薬量を提供する量で、存在する。食物または飲料は、適当には、一食あたり約0.05g〜一食あたり約50gのIPPを含む。機能性食品組成物が薬学的製剤である場合、かかる製剤は、IPPを、投薬単位あたり、例えばカプセル剤もしくは錠剤あたり、約0.001g〜約1g、または液体製剤の一日の投薬量あたり約0.035g〜一日の投薬量あたり約70gの量で含んでもよい。本ペプチド含有組成物は、適当には、それが投与される被験体の体重1kgあたり約0.01g〜体重1kgあたり約3gの一日の投薬量を提供する量で、本発明による組成物中に存在する。食物または飲料は、適当には、一食あたり約0.1g〜一食あたり約100gのタンパク質加水分解物を含む。機能性食品組成物が薬学的製剤である場合、かかる製剤は、ペプチド含有組成物を、投薬単位あたり、例えばカプセル剤もしくは錠剤あたり約0.01g〜約5g、または液体製剤の一日の投薬量あたり約0.7g〜一日の投薬量あたり約210gの量で含んでもよい。
【0079】
本発明のさらに別の好ましい態様において、組成物は、上記で特定されたような本ペプチド、および場合により、炭化水素を含む。炭化水素は、適当には、それが投与される被験体の体重1kgあたり約0.01g〜体重1kgあたり約7gの一日の投薬量を提供する量で、本発明による組成物中に存在する。食物または飲料は、適当には、一食あたり約0.5g〜一食あたり約200gの炭化水素を含む。機能性食品組成物が薬学的製剤である場合、かかる製剤は、炭化水素を、投薬単位あたり、例えばカプセル剤もしくは錠剤あたり約0.05g〜約10g、または液体製剤の一日の投薬量あたり約0.7g〜一日の投薬量あたり約490gの量で含んでもよい。
【0080】
投薬範囲(70kgのヒトに対して)
IPP:0.005〜70g/日(それぞれ)
タンパク質加水分解物:0.07〜210g/日
加水分解されていないタンパク質:0.07〜210g/日
炭化水素:0.1〜490g/日
【0081】
それを消費する被験体に健康上の利益を提供するために使用することができる食用物質を提供することが、本発明の目的である。単離された形態または食品に組み込まれた形態のいずれかで簡便に摂取することができる食用物質を提供することが、さらなる目的である。
【0082】
体重制御プログラムにおける使用に適した、食品、またはそこに組み込むことができる成分を提供することが、本発明のさらなる目的である。例えばACE阻害によって、心臓血管の健康を維持するのを助けるのに適した、食品、またはそこに組み込むことができる成分を提供することが、本発明のさらなる目的である。
【0083】
苦味がないか、または許容され得るレベルの苦味しかない等の特に良い味で、許容され得る安定性および/または官能特性を有する、食品、またはそこに組み込むことができる成分を提供することが、本発明のさらなる目的である。肥満の予防/体重管理を助けることおよび/または心臓血管の健康を維持するのを助けること等の健康上の利益を提供する高濃度の成分を有する食品を提供することが、さらなる目的である。
【0084】
意外なことに、これらの目的の1つ以上は、消費すると健康上の利益を提供する食品の調製のための本ペプチド含有組成物の使用によって、本発明に従って達成される。
【0085】
第一の態様によると、本発明は、肥満の予防または体重制御のための機能性食品の製造のための、本ペプチド含有組成物の使用を提供する。
【0086】
第二の態様によると、本発明は、心臓血管の健康維持のための機能性食品の製造のための、本ペプチド含有組成物の使用を提供する。
【0087】
本発明によると、心臓血管の健康維持がアンジオテンシン変換(ACE)酵素の阻害および/または血中グルコースレベルの制御を含むことが、特に好ましい。
【0088】
第三の態様によると、本発明は、その消費者に健康上の利益を提供することができる機能性食品を提供し、前記健康上の利益は、肥満の予防、体重制御および心臓血管の健康維持から選択され、本ペプチド含有組成物を含む。
【0089】
本発明によるペプチド含有組成物のさらなる利点は、このペプチド含有組成物を簡便に食品に組み込んで、その安定性および/または官能特性に、許容できない影響を及ぼすことなく、機能性食品を製造することができることである。
【0090】
本発明による「健康上有益な薬剤」は、摂取された場合に健康の側面に良い効果を有するか、または良い健康の側面を維持するのを助ける、健康上の利益を提供する物質であり、これらの良い健康の側面は、肥満の予防、体重制御および心臓血管の健康維持である。
【0091】
「健康上の利益」は、健康の側面に対して良い効果を有すること、または良い健康の側面を維持するのを助けることを意味する。本発明による「機能性食品」は、ヒトの消費に適した食品(疑いを避けるため、飲料も含む)として定義され、ここで本発明のペプチド含有組成物は、食品の消費者に対する顕著な健康上の利益が得られるような有効量で、成分として使用される。
【0092】
用語「含む」は、本明細書中で使用される場合、いかなる後述の要素も限定するよう意図されないが、大きな、または小さな機能的重要性の非特異的要素を包含するよう意図される。換言すれば、挙げられている工程、要素または選択肢は、徹底的である必要はない。単語「含む(including)」または「有する」が使用される場合はいつでも、これらの用語は、上記で定義されるような「含む(comprising)」と同等であるよう意図される。
【0093】
好ましくはプロリン特異的プロテアーゼ、より好ましくはプロリン特異的エンドプロテアーゼ、最も好ましくは酸性の最適pHを有するプロリン特異的エンドプロテアーゼを用いて、κカゼインのGMP部分からIPPを選択的に切除する、酵素による方法を提供することが、本発明のさらに別の目的である。
【0094】
酸沈殿カゼインからκカゼインのGMP部分の回収のための方法を提供することもまた、本発明の目的である。
【0095】
有効な血圧降下ペプチドIPPは、ペプチドのカルボキシ末端に、2つのプロリン残基を有する。プロリル残基を組み込むペプチド結合はタンパク質分解性切断に抵抗することが公知であるので、血圧降下ペプチド中の2つのプロリン残基の存在は、かかるペプチドに、タンパク質分解に対する増大した抵抗性を与える。この態様は、複雑な酵素調製物とのインキュベーションの間に、関連性のあるトリペプチドが全体的な加水分解を免れる可能性を増大させる。同様に、IPPは、これらのペプチドが、血流にインタクトなまま到達する、より高い可能性に耐えるように、胃腸内消化にもかかわらず残存するようである。それらのカルボキシ末端側に、少なくとも単一の、好ましくは複数のプロリン残基を有するペプチドを得るために、プロリン残基のカルボキシ末端側で切断することができるプロテアーゼの使用は、興味深い選択肢を提供する。いわゆるプロリルオリゴペプチダーゼ(EC.3.4.21.26)は、プロリン残基のカルボキシ側でペプチドを選択的に切断し、より低い効率ではあっても、アラニンのカルボキシ側で切断する、独特の可能性を有する。哺乳動物ならびに微生物供給源から単離された、全ての十分特徴付けられたプロリン特異的プロテアーゼにおいて、酵素の活性部位から大きいペプチドを排除する、独特のペプチダーゼドメインが同定されている。実際は、これらの酵素は、約30より多いアミノ酸残基を含むポリペプチドを分解することができないので、これらの酵素は、現在、「プロリルオリゴペプチダーゼ」と呼ばれている(ファロップ(Fulop)ら、セル(Cell)第94巻、161〜170頁、1998年7月24日)。結果として、これらのプロリルオリゴペプチダーゼは、それらがそれらの加水分解作用を示すことができる前に、他のエンドプロテアーゼでの徹底的な前加水分解を必要とする。しかしながら、国際公開第02/45523号パンフレットに記載されているように、プロリルオリゴペプチダーゼとかかる別のエンドプロテアーゼとの組み合わせであっても、カルボキシ末端プロリン残基を有する有意に増強された割合のペプチドによって特徴付けられる加水分解物を生じる。このために、かかる加水分解物は、インビトロACE阻害効果ならびに胃腸内タンパク質分解に対する改善された抵抗性を有するペプチドの単離のための、優れた出発点を形成する。これらの潜在的な利益にもかかわらず、我々は、IPPの選択的生成のためは言うまでもなく、血圧降下ペプチドの回収のためのプロリン特異的プロテアーゼの使用を特定する用途に気づいていない。
【0096】
国際公開第02/45524号パンフレットは、黒色アスペルギルス(Aspergillus niger)から得ることができる、プロリン特異的プロテアーゼを記載している。黒色アスペルギルス(A.niger)由来酵素は、プロリンのカルボキシ末端で選択的に切断するが、ヒドロキシプロリンのカルボキシ末端でも切断することができ、より低い効率ではあっても、アラニンのカルボキシ末端でも切断することができる。国際公開第02/45524号パンフレットはまた、この黒色アスペルギルス(A.niger)由来酵素と他の微生物または哺乳動物供給源由来の公知のプロリルオリゴペプチダーゼとの間に明らかな相同性がないことを教示している。公知のプロリルオリゴペプチダーゼと対照的に、黒色アスペルギルス(A.niger)酵素は、酸性の最適pHを有する。公知のプロリルオリゴペプチダーゼならびに黒色アスペルギルス(A.niger)由来酵素は、いわゆるセリンプロテアーゼであるが、本発明者らは、実施例1で、黒色アスペルギルス(A.niger)酵素が、完全に異なるサブファミリーに属することを示す。分泌された黒色アスペルギルス(A.niger)酵素は、ほとんどの細胞質プロリルオリゴペプチダーゼがグループ分けされるS9ファミリーよりむしろ、セリンペプチダーゼのファミリーS28のメンバーであるようである(ローリングス(Rawlings),N.D.およびバレ(Barret),A.J.、ビオキミカ・エ・ビオフィジカ・アクタ(Biochim.Biophys.Acta)1298(1996年)1〜3)。
【0097】
実施例2において、本発明者らは、微生物フラボバクテリウム・メニンゴセプチカム(Flavobacterium meningosepticum)から得られたプロリン特異的オリゴペプチダーゼと比較した、黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼの最適pHおよび温度を示す。タンパク質を含む水溶液は、特に何時間も5.0より高いpH値および50℃以下の温度で維持された場合、微生物感染に対して高度に感受性がある。特に、かかる長期のインキュベーション工程の間に生成されることがある微生物毒素は、その後の加熱工程にもかかわらず残存して、食品グレードの方法への潜在的な脅威を形成する。EP1231279号明細書に記載されている条件とは異なり、本発明による方法は、好ましくは、50℃より高いインキュベーション温度を使用する。酵素インキュベーションが24時間未満、好ましくは8時間未満、より好ましくは4時間未満の時間行われる一段階の酵素による方法と組み合わせて、本発明による方法は、微生物学的安定性の改善の利点を提供する。
【0098】
実施例3において、本発明者らは、本発明の方法において使用される場合、黒色アスペルギルス(A.niger)由来酵素調製物が非常に狭い基質特異性を示し、プロリンまたはアラニン残基を伴うペプチド結合に対する以外の有意なエンド型タンパク質分解活性が存在しないことを意味することを実証する。本願の実施例4において、本発明者らは、アスペルギルス(Aspergillus)酵素がオリゴペプチダーゼでなく、補助的なエンドプロテアーゼの必要なしにインタクトなタンパク質、大きなペプチドならびにより小さいペプチド分子を加水分解することができる真のエンドプロテアーゼであることを示す。この、新しい意外な発見によって、本発明者らは、補助的なエンドプロテアーゼの使用を省くことができ、カルボキシ末端プロリン残基を有する先例のない高い含有量のペプチドを含む加水分解物を生じることができる。さらに、補助的なエンドプロテアーゼを省くことは、ポリペプチドまたはオリゴペプチドのいずれかを加水分解したときに非常に限られた数のペプチドを生じるために、好ましい。その結果、存在するペプチドのほとんどがカルボキシ末端プロリン残基を有することによって特徴付けられる、比較的単純なペプチド混合物が得られる。
【0099】
実施例5において、本発明者らは、存在するエンド型タンパク質分解、アミノペプチド分解およびカルボキシペプチド分解活性に関して使用される酵素調製物を特徴付ける。プロリン特異的エンドプロテアーゼは無視してよい副活性を有するが、スミチーム(Sumizyme)FPおよびフレーバーザイム(Flavourzyme)調製物は、多くの様々な酵素型の、豊富な供給源を形成する。
【0100】
実施例6において、本発明者らは、GMPの単離のための代替的経路、すなわち、市販のカゼイン塩からの単離を記載する。プロリン特異的エンドプロテアーゼを使用して、本発明者らはまた、このようにして単離されたGMPからIPPを回収する。黒色アスペルギルス(A.niger)由来酵素が有意なアミノ−ペプチダーゼ活性を含まないこと(実施例5参照)から、形成されたIPPがκ−カゼイン中に存在する−A107−I108−P109−P110−配列から放出されることが、強力に示唆される。おそらくは、IPPのカルボキシ末端のペプチド結合は、黒色アスペルギルス(A.niger)由来プロリルエンドプロテアーゼの主な活性によって切断されるが、先行するAla−Ile結合の切断は、Ala特異的副活性によって達成される。この経路の利点は、GMPの選択的除去の後、残ったカゼイン塩画分を代替的用途に使用することができる点である。
【0101】
実施例7において、本発明者らは、プロリン特異的エンドプロテアーゼならびに複雑なスミチーム(Sumizyme)FP調製物の両方を使用して、商業的に得られたGMPから、IPPを遊離させることができることを示している。好ましくは、この組成物は、0.1〜100mg/gの間のIPP(乾物およびタンパク質に基づく)、より好ましくは1〜50mg/gの間のIPP(乾物およびタンパク質に基づく)、最も好ましくは2〜35mg/gの間のIPP(乾物およびタンパク質に基づく)を含む。本発明者らはまた、GMPの加水分解が、プロリン特異的エンドプロテアーゼが使用される場合とほとんど同一な量でトリペプチドIPPおよびテトラペプチドTSTPを含む組成物を生じることを見出した。したがって、本発明はまた、IPPおよびTSTPを含む組成物に関し、ここでIPP:TSTPのモル比は1.5〜0.5の間、好ましくは1.3〜0.7の間、より好ましくは1.2〜0.8の間である。好ましくは、この組成物は、0.1〜100mg/gの間のIPP(乾物およびタンパク質に基づく)、より好ましくは1〜50mg/gの間のIPP(乾物およびタンパク質に基づく)、最も好ましくは2〜35mg/gの間のIPP(乾物およびタンパク質に基づく)を含む。
【0102】
実施例8において、本発明者らは、GMP加水分解物を使用することの、官能上の利点を実証する。
【0103】
実施例9において、本発明者らは、GMPの使用によって、発酵アプローチによるIPP含有製品の調製も可能になることを説明する。
【0104】
したがって、本発明は、従来技術に対する、いくつかの利点を生じる。最も重要なことに、本発明による方法は、より少ない種類の水溶性ペプチドを生じ、これらの水溶性ペプチドの中でも、ペプチドIPPが、多量に存在する。これは、淡白な味の生成物中の高濃度のIPPが必要とされる場合、特に重要である。本方法によると、タンパク質中に存在する−A−I−P−P配列の好ましくは少なくとも20%、より好ましくは少なくとも30%、最も好ましくは少なくとも40%が、IPPに変換される。
【0105】
加水分解後、溶液を加熱してもよい。場合により、溶液のpHを調節するか、または溶液を溶媒と混合してもよい。
【0106】
本発明の一態様によると、タンパク質源の加水分解の間に形成される、IPPを含む可溶性ペプチドは、分離され、場合により乾燥される。例えば、形成された沈殿を除去するための傾瀉、ろ過または低速遠心分離の後、生物学的に活性のある可溶性ペプチドを含む上清を、例えば逆浸透または蒸発によって回収して、場合によりさらなる精製工程と、場合によりそれに続く噴霧乾燥工程と組み合わせて、高い生物活性および良好な水溶性を有する食品グレードのペーストまたは粉末を得るための経済的な経路を生じることができる。プロリン特異的エンドプロテアーゼによって、GMP等の適した基質タンパク質を消化すると、高濃度のIPPおよび意外なほど低い加水分解度を有する、白色で無臭の粉末が得られる。
【0107】
機能性食品用途ならびに食物および飲料用途において、本発明の加水分解物が、有利に使用される。タンパク質加水分解物、可溶性加水分解物ならびにそれらの混合物を、機能性食品用途、食物用途または飲料に使用することができる。好ましくは、存在する高い含有量の活性ペプチドのために、可溶性加水分解物が、機能性食品用途、食物用途または飲料において使用される。
【0108】
正しいトリペプチド濃度に適当に希釈された場合、あらゆる種類の食物および飲料に血圧降下特性を与えるのに適した、優れた嗜好性を有する用途の広い出発物質が得られる。
【0109】
例えばクロマトグラフィー等のさらなる精製工程の前または後のいずれかに得られるペプチド混合物を、定期的に広く消費される食品への組み込みのために使用してもよい。かかる製品の例は、マーガリン、スプレッド、バターもしくはヨーグルト等の種々の乳製品または乳もしくはホエー含有飲料、ケーキもしくはクッキー等のパン・菓子類、スープ等の流動食、ならびにキャンディーおよび甘味料および角砂糖である。本発明によるIPP含有加水分解物の非常に淡白な味の結果、現在の、瓶入りのテーブルウォーター、清涼飲料、スポーツドリンク、フルーツジュース、レモネードならびにインスタント紅茶およびコーヒーを含むあらゆる種類の飲料における加水分解物の組み込みが可能である。
【0110】
スポーツドリンクは、運動選手の水分を元の状態に戻すと考えられ、電解質、糖、および他の栄養分を回復させる、飲料である。スポーツドリンクは通常、等張であり、それらが、人体で見られるのと同じ割合の栄養分を含むことを意味する。(出典:http://en.wikipedia.org/wiki/Sports_drink)
栄養飲料は、使用者にエネルギーの奮発を生じさせるよう意図された、(適法の)刺激物、ビタミン(特にビタミンB)およびミネラルを含む飲料である。一般的な成分としては、カフェイン、ガラナ(ガラナ植物から得られるカフェイン)、タウリン、種々の形態の朝鮮人参、マルトデキストリン、イノシトール、カルニチン、クレアチン、グルクロノラクトンおよびイチョウ(ginkgo biloba)が挙げられる。高レベルの糖、またはグルコースを含むものもある。多くのかかる飲料は、風味付けおよび/または着色されている。(出典:http://en.wikipedia.org/wiki/Energy_drink)
【0111】
清涼飲料は、アルコールを含むハードドリンクに対して、アルコールを含まない飲料である。一般に、この用語は、冷たい飲料にのみ使用される。ホットチョコレート、茶、およびコーヒーは、清涼飲料と見なされない。この用語は、元々、排他的に炭酸飲料をいい、依然として一般にそのように使用されている。(出典:http://en.wikipedia.org/wiki/Soft_drink)
【0112】
かかる組成物は、典型的にはヒトに投与されるが、これらはまた、高血圧症を軽減するために、動物、好ましくは哺乳動物に投与されてもよい。さらに、得られる製品中の高濃度の血圧降下ペプチドによって、これらの製品は、丸剤、錠剤または高度に濃縮された溶液もしくはペーストまたは散剤の形態の栄養補助食品への組み込みに非常に有用になる。ペプチドの継続的放出を確実にする持続放出性栄養補助食品が、特に重要である。本発明によるペプチドは、例えば丸剤、錠剤、顆粒剤、小袋またはカプセル剤中の乾燥粉末として製剤化されてもよい。あるいは、本発明によるペプチド混合物は、例えばシロップ剤またはカプセル剤中の液体として製剤化されてもよい。種々の製剤中で使用され、本発明による酵素を含む組成物はまた、生理学的に許容され得る担体、佐剤、賦形剤、安定剤、バッファーおよび希釈剤からなる群の少なくとも1つの化合物を組み込んでもよく、これらの用語は、それらの元来の意味で使用されて、包装、送達、吸収、安定化を補助するか、または佐剤の場合、生理学的効果を増強する、物質を示す。粉末形態の本発明によるペプチド混合物と組み合わせて使用することができる種々の化合物に関する関連のあるバックグラウンドは、「ファーマシューティカル・ドーセージ・フォームス(Pharmaceutical Dosage Forms)」、第2版、第1、2および3巻、ISBN0−8247−8044−2マルセルデッカー社(Marcel Dekker,Inc.)またはレミントンズ・ファーマシューティカル・サイエンシーズ(Remington’s Pharmaceutical Sciences)第20版、ウィリアムス(Williams)およびウィルキンズ(Wilkins)、米国ペンシルバニア州)に見ることができる。経口投与のために、適した結合剤、例えばゼラチンまたはポリビニルピロリドン、適した充填剤、例えば乳糖またはデンプン、適した潤滑剤、例えばステアリン酸マグネシウム、および場合によりさらなる添加物を含む、錠剤およびカプセル剤が好ましく使用される。
【0113】
比較的新しい経口適用形態は、種々の型のゼラチンカプセル剤またはゼラチンベースの錠剤の使用である。
【0114】
本発明のさらなる態様に対して、フェニルアラニン、トリプトファンおよびチロシンを含まない加水分解物が提供される。GMPを出発タンパク質として使用することによって、フェニルアラニン、トリプトファンおよびチロシンを欠く加水分解物が得られる。これによって、この加水分解物が、フェニルケトン尿症(PKU)の個体にとって安全になる。
【0115】
高血圧症に対抗するための天然のペプチドの関連性の観点から、本発明の、新しく費用効果の高い経路は、穏やかな降圧性の食事またはさらには動物用製品のための、魅力的な出発点を提供する。本経路は、意外なほど単純な精製工程を組み込むので、血圧降下濃縮栄養補助食品の可能性もまた、拡大される。
【0116】
本発明による方法は、任意のプロリン特異的なオリゴまたはエンドプロテアーゼを用いて達成することができる。本発明による、または本発明に従って使用される、プロリン特異的オリゴペプチダーゼによって、EC3.4.21.26に属する酵素を意味する。本発明による、または本発明に従って使用される、プロリン特異的エンドプロテアーゼによって、セリンプロテアーゼのファミリーS28に属するプロリン特異的エンドプロテアーゼ(ハンドブック・オブ・プロテオリティック・エンザイムス(Handbook of Proteolytic Enzymes)、バレ(Barrett),A.J.、ローリングス(Rawlings),N.D.、ウォスナー(Woessner),J.F.編、アカデミック・プレス(Academic Press)、英国ロンドン、1998年、369〜415頁)、またはより好ましくは、国際公開第02/45524号パンフレットの請求項1〜5、11および13で言及されているポリペプチドを意味する。したがって、このプロリン特異的エンドプロテアーゼは、
(a)配列番号2のアミノ酸1〜526またはその断片と、少なくとも40%のアミノ酸配列同一性を有するアミノ酸配列を有するポリペプチド、
(b)(i)60ヌクレオチドにわたって、好ましくは100ヌクレオチドにわたって、少なくとも80%または90%同一な、より好ましくは200ヌクレオチドにわたって少なくとも90%同一な、配列番号1の核酸配列もしくはその断片、または(ii)配列番号1の核酸配列に相補的な核酸配列と低ストリンジェンシー条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドからなる群より選択される、プロリン特異的エンド型タンパク質分解活性を有するポリペプチドである。配列番号1および配列番号2は、国際公開第02/45524号パンフレットに示されている通りである。好ましくは、ポリペプチドは、単離された形態である。
【0117】
本発明に従って使用される、好ましいポリペプチドは、配列番号2のアミノ酸1〜526と、少なくとも50%、より好ましくは少なくとも60%、好ましくは少なくとも65%、好ましくは少なくとも70%、より好ましくは少なくとも80%、さらにより好ましくは少なくとも90%、最も好ましくは少なくとも95%、さらに最も好ましくは少なくとも約97%の同一性を有する、または配列番号2のアミノ酸配列を含む、アミノ酸配列を有する。
【0118】
好ましくは、ポリペプチドは、(i)配列番号1の核酸配列もしくはその断片、または(ii)配列番号1の核酸配列に相補的な核酸配列と低ストリンジェンシー条件下、より好ましくは中ストリンジェンシー条件下、最も好ましくは高ストリンジェンシー条件下でハイブリダイズする、ポリヌクレオチドによってコードされる。
【0119】
用語「ハイブリダイズすることができる」は、本発明の標的ポリヌクレオチドが、プローブとして使用される核酸(例えば、配列番号1に示されるヌクレオチド配列、もしくはその断片、または配列番号1の相補物)に、バックグラウンドよりも有意に高いレベルでハイブリダイズできることを意味する。本発明はまた、本発明のプロリン特異的エンドプロテアーゼをコードするポリヌクレオチド、ならびにそれに相補的なヌクレオチド配列を含む。ヌクレオチド配列は、RNAでもDNAでもよく、ゲノムDNA、合成DNAまたはcDNAを含む。好ましくは、ヌクレオチド配列はDNAであり、最も好ましくはゲノムDNA配列である。典型的には、本発明のポリヌクレオチドは、選択的条件下で配列番号1のコード配列またはコード配列の相補物にハイブリダイズすることができる、連続したヌクレオチドの配列を含む。かかるヌクレオチドは、当該分野で周知の方法に従って合成することができる。
【0120】
本発明のポリヌクレオチドは、配列番号1のコード配列またはコード配列の相補物に、バックグラウンドよりも有意に高いレベルでハイブリダイズすることができる。バックグラウンドハイブリダイゼーションは、例えば、cDNAライブラリー中に存在する他のcDNAのために、起こる場合がある。本発明のポリヌクレオチドと配列番号1のコード配列またはコード配列の相補物との間の相互作用によって発生するシグナルレベルは、典型的には、他のポリヌクレオチドと配列番号1のコード配列との間の相互作用よりも、少なくとも10倍、好ましくは少なくとも20倍、より好ましくは少なくとも50倍、さらにより好ましくは少なくとも100倍強い。相互作用の強度は、例えば、プローブを、例えば32Pで放射性同位元素標識することによって、測定してもよい。選択的ハイブリダイゼーションは、典型的には、低ストリンジェンシー(約40℃で、0.3M塩化ナトリウムおよび0.03Mクエン酸ナトリウム)、中ストリンジェンシー(例えば、約50℃で、0.3M塩化ナトリウムおよび0.03Mクエン酸ナトリウム)または高ストリンジェンシー(例えば、約60℃で、0.3M塩化ナトリウムおよび0.03Mクエン酸ナトリウム)の条件を用いて達成してもよい。
【0121】
UWGCGパッケージは、同一性の計算に使用することができるBESTFITプログラムを提供する(例えば、そのデフォルト設定に基づいて使用される)。
【0122】
PILEUPおよびBLAST Nアルゴリズムもまた、配列同一性を計算するのに、または(例えばそれらのデフォルト設定に基づいて、同等または対応する配列を同定すること等の)配列を並べるのに使用することができる。
【0123】
BLAST解析を行うためのソフトウエアは、全米バイオテクノロジー情報センター(http://www.ncbi.nlm.nih.gov/)によって、公的に入手可能である。このアルゴリズムは、まず、データベース配列中の同じ長さの文字列と整列させた場合にいくつかの正の値の閾値スコアTに適合するか、または満たすかのいずれかの、クエリー配列中の長さWの短い文字列を同定することによって、高スコア配列対(HSP)を同定することを伴う。Tは、近縁ワードスコア閾値と呼ばれる。これらの最初の近縁ワードヒットは、それらを含むHSPを見つけるための検索を開始するためのシードとして作用する。ワードヒットは、累積アラインメントスコアが増大できる限りは、各配列に沿って両方向に延長される。各方向へのワードヒットの延長は、累積アラインメントスコアが、その最大の得られた値から量Xだけ低下した場合、1つ以上の負のスコアの残基アラインメントの累積によって累積スコアがゼロ以下になった場合、または配列のいずれかの末端に達した場合に中止される。BLASTアルゴリズムパラメータであるW、TおよびXは、アラインメントの感度および速度を判定する。BLASTプログラムは、デフォルトとして、11の文字列長(W)、50のBLOSUM62スコア行列アラインメント(B)、10の期待値(E)、M=5、N=4、および両方の鎖の比較を使用する。
【0124】
BLASTアルゴリズムは、2つの配列の間の類似性の統計的解析を行う。BLASTアルゴリズムによって提供される、ある類似性の測定は、2つのヌクレオチドまたはアミノ酸配列の間の適合が偶然生じる確率の指標を提供する、最小の合計の確率(P(N))である。例えば、配列は、第一の配列と第二の配列との比較における最小の合計の確率が約1未満、好ましくは約0.1未満、より好ましくは約0.01未満、最も好ましくは約0.001未満である場合に、別の配列と類似していると見なされる。
【0125】
アスペルギルス(Aspergillus)属の株は、食品グレードの状態を有し、これらの微生物由来の酵素は、疑われていない食品グレードの供給源に由来する。別の好ましい実施形態によると、酵素は、分泌されない、いわゆる細胞質酵素よりむしろ、その産生細胞によって分泌される。このようにして、酵素を、高価な精製工程なしに、本質的に純粋な状態で、細胞ブロスから回収することができる。好ましくは、酵素は、一般のpHおよび温度条件下で、その基質に対して、高い親和性を有する。
【0126】
材料および方法
食用カゼイン酸ナトリウムおよびカゼイン酸カリウムスプレー(88%)を、オランダのDMVインターナショナル(DMV International)から入手した。GMPを、デンマークのアルラ(Arla)から入手した(ラクプロダン(Lacprodan)CGMP−10、ロット番号P340205)。合成色素形成ペプチドを、オランダのペップスキャンシステムズ(Pepscan Systems)B.V.またはスイスのバッヘム(Bachem)から入手した。フレーバーザイム(Flavourzyme)1000LバッチHPN00218を、ノボザイム(Novozyme)(デンマーク)から入手し、スミチーム(Sumizyme)FPを新日本(日本)から入手し、コロラーゼ(Corolase)LAP Ch.:4123をABエンザイムス(AB Enzymes)(英国)から入手した。
【0127】
黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼ
黒色アスペルギルス(Aspergillus niger)由来のプロリン特異的エンドプロテアーゼの過剰産生を、国際公開第02/45524号パンフレットに記載されているように達成した。クエン酸塩/二リン酸ナトリウムバッファーpH4.6中、37℃で、合成ペプチドZ−Gly−Pro−pNAに関して、酵素の活性を試験した。反応生成物を、405nMで、分光光度計によってモニタリングした。単位を、これらの試験条件下および0.37mM Z−Gly−Pro−pNAの基質濃度で1分あたり1μmolのp−ニトロアニリドを遊離させる酵素の量として定義する。
【0128】
黒色アスペルギルス(A.niger)由来エンドプロテアーゼの、クロマトグラフィーによる精製
過剰産生している黒色アスペルギルス(A.niger)株から得られた培養ブロスを、混入している任意のエンド型およびエキソ型タンパク質分解活性を除去するための、プロテアーゼのクロマトグラフィーによる精製に使用した。そのため、発酵ブロスをまず遠心分離して、真菌の塊の大部分を除去し、次いで上清を、減少していく孔サイズを有するいくつかのフィルターに通過させて、全ての細胞断片を除去した。最後に、得られた限外ろ過液を20mmol/lの酢酸ナトリウムpH5.1中で10倍希釈し、Q−セファロース(Q−Sepharose)FFカラムに加えた。20mmol/lの酢酸ナトリウムpH5.1中、0〜0.4mol/lのNaClのグラジエントでタンパク質を溶出させた。ワールド・ジャーナル・オブ・マイクロバイオロジー・アンド・バイオテクノロジー(World Journal of Microbiology & Biotechnology)11、209〜212頁(1995年)に記載されているプロトコールに従うがわずかに改変したアッセイ条件下で、Z−Gly−Pro−pNAの切断に対する活性を示していたピーク画分を収集し、貯蔵した。黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼの酸性の最適pHを考慮して、酵素アッセイを、37℃で、クエン酸塩/二リン酸塩バッファー中、pH4.6で行った。活性画分の貯蔵と、それに続く濃縮によって、最終的に、SDS−PAGEの単一のバンドおよびHP−SECでの1つのピークのみを示す調製物を生じた。疎水性相互作用クロマトグラフィーによるさらなる分析によって、得られた酵素調製物の純度を確認した。
【0129】
ケルダール窒素
フローインジェクション分析によって、全体的なケルダール窒素を測定した。TKN法カセット5000−040を備えたテカター(Tecator)FIASTAR5000フローインジェクションシステム、SOFIAソフトウエアを有するペンティアム(Pentium)4コンピュータ、およびテカター(Tecator)5027オートサンプラーを使用して、タンパク質含有溶液から放出されたアンモニアを590nmで定量した。方法のダイナミックレンジ(0.5〜20mgのN/l)に対応する試料の量を、95〜97%硫酸およびケルタブとともに消化チューブに入れ、200℃で30分間と、それに続く360℃で90分間の消化プログラムに供する。FIASTAR5000システムへの注入の後、測定されたタンパク質の量を推定することができる窒素ピークを測定する。
【0130】
アミノ酸分析
正確に計量したタンパク質性物質の試料を希酸中で希釈し、エッペンドルフ(Eppendorf)遠心分離機による遠心分離によって沈殿を除去した。ウォーターズ(Waters)(米国マサチューセッツ州ミルフォード)のアミノ酸分析システムの操作手引きで特定されているようなピコタグ(PipcoTag)法に従って、透明な上清でアミノ酸分析を行った。そのため、適した試料を液体から得、次いで、乾燥させ、気相酸加水分解に供し、フェニルイソチオシアネートを用いて誘導体化した。存在する、種々の誘導体化されたアミノ酸を、HPLC法を用いて定量し、合計して、計量された試料中の、誘導体化Ileを含む遊離アミノ酸の総レベルを計算した。アミノ酸CysおよびTrpは、この分析で得られるデータに含まれない。
【0131】
LC/MS/MS分析
本発明の酵素混合物によって生成された、酵素によるタンパク質加水分解物中の、目的のペプチド、中でもトリペプチドIPP、LPPおよびVPPの定量において、P4000ポンプ(サーモクエスト(Thermoquest)(登録商標)、オランダ、ブレダ)に結合させたイオントラップ質量分析計(サーモクエスト(Thermoquest)(登録商標)、オランダ、ブレダ)を用いたHPLCを使用した。形成されたペプチドを、溶出のためのミリQ(Milli Q)水(ミリポア(Millipore)、米国マサチューセッツ州ベッドフォード)中の0.1%ギ酸(溶液A)およびアセトニトリル中の0.1%ギ酸(溶液B)のグラジエントと組み合わせたイナートシル(Inertsil)3ODS3、3mm、150*2.1mm(バリアン・ベルジウム(Varian Belgium)、ベルギー)カラムを用いて分離した。グラジエントは溶液Aの100%で開始し、それを5分間維持し、10分で5%Bに線形に増大させ、続いて30分で溶液Bの45%に線形に増大させ、直ちに開始時の条件にし、それを15分間安定化のために維持した。使用した注射体積は50μlであり、流速は200μl/分であり、カラム温度は55℃で維持した。注射した試料のタンパク質濃度は、およそ50μg/mlであった。
【0132】
個々のペプチドに関する詳細な情報は、約30%の最適衝突エネルギーを用いて、目的のペプチドの専用のMS/MSを用いることによって得た。定量は、マトリクス効果を補正するための標識された内部標準での較正線を用いて、C13+N15標識IPP基準でのエレクトロスプレー正イオン化モードを用いたLC/MS/MSモードで行う。保持時間、前駆体イオンおよび特徴的な断片化の比によって、同定を行う。
【0133】
トリペプチドLPP(M=325.2)を用いて、MSモードでの最適感度およびMS/MSモードでの最適断片化を調整し、5mg/mlの一定の注入を行い、MSモードでプロトン化分子を生じ、MS/MSモードで約30%の最適衝突エネルギーを生じ、B−およびY−イオン系列を生じた。
【0134】
LC/MS/MSの前に、酵素によるタンパク質加水分解物を周囲温度および13000rpmで10分間遠心分離し、0.22μmフィルターを通してろ過し、上清をミリQ(Milli Q)水で1:100に希釈した。
【0135】
種々のタンパク質分解混合物とのインキュベーションの間に得られた加水分解度(DH)を、迅速なOPA試験(JFS、第66巻5号、2001年)を用いてモニタリングした。
【0136】
実施例1
黒色アスペルギルス(A.niger)から得られた酵素は、新しいクラスのプロリン特異的酵素を表す。
国際公開第02/45524号パンフレットに提供されている黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼのコード配列全体から、526アミノ酸のタンパク質配列を決定することができる。酵素の新規性は、スイスプロット(SwissProt)、PIRおよびtrEMBL等のデータベースのBLASTサーチによって確認した。本発明者らが驚いたことに、黒色アスペルギルス(A.niger)酵素と公知のプロリルオリゴペプチダーゼとの間に、明らかな相同性は検出できなかった。しかしながら、アミノ酸配列の、より密接な観察から、Pro−Xカルボキシペプチダーゼ(EC3.4.16.2)、ジペプチジルアミノペプチダーゼI(EC3.4.14.2)、および胸腺特異的セリンプロテアーゼに対する、低いが有意な相同性が明らかになった。これらの酵素の全ては、セリンペプチダーゼのファミリーS28に割り振られている(ハンドブック・オブ・プロテオリティック・エンザイムス(Handbook of Proteolytic Enzymes)、バレ(Barret),A.J.、ローリングス(Rawlings),N.D.、ウォスナー(Woessner),J.F.編、アカデミック・プレス(Academic Press)、英国ロンドン、1998年、369〜415頁)。また、活性部位セリンの周りのGxSYxG配置は、これらの酵素と黒色アスペルギルス(A.niger)由来エンドプロテアーゼとの間で保存されている。また、ファミリーS28のメンバーは、酸性の最適pHを有し、プロリン残基のカルボキシ末端側で切断する特異性を有し、シグナル配列、およびちょうど黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼ等のプロペプチドとともに、合成される。また、黒色アスペルギルス(A.niger)酵素のサイズは、ファミリーS28のメンバーのものと類似している。したがって、黒色アスペルギルス(A.niger)プロリン特異的エンドプロテアーゼは、フラボバクテリウム・メニンゴセプチカム(Flavobacterium meningosepticum)から得られる酵素を含むほとんどの細胞性プロリルオリゴペプチダーゼがグループ分けされているS9ファミリーよりむしろ、セリンプロテアーゼのファミリーS28のメンバーであるようである。これらの構造的および生理学的特性に基づいて、本発明者らは、黒色アスペルギルス(A.niger)酵素が、セリンプロテアーゼのS9ファミリーよりむしろ、S28に属すると結論付けた。黒色アスペルギルス(A.niger)由来酵素を、S9ファミリーに属するプロリルオリゴペプチダーゼから識別するさらなる特性は、前者のファミリーに属する細胞質プロリルエンドプロテアーゼとは異なり、新しく同定された黒色アスペルギルス(A.niger)酵素は、増殖培地中に分泌されることである。これは、低級真核生物由来の、ファミリーS28のメンバーの単離および特徴付けに関する、最初の報告である。
【0137】
実施例2
黒色アスペルギルス(A.niger)プロリン特異的エンドプロテアーゼおよびF.メニンゴセプチカム(F.meningosepticum)由来のプロリン特異的オリゴペプチダーゼのpH活性スペクトル
アスペルギルス(Aspergillus)由来プロリン特異的エンドプロテアーゼとフラボバクテリウム・メニンゴセプチカム(Flavobacterium meningosepticum)由来のプロリン特異的オリゴペプチダーゼとの間に存在する最適pHの差を実証するために、本発明者らは、それらの活性を、種々のpH条件下で測定した。アスペルギルス(Aspergillus)由来エンドプロテアーゼを、材料および方法の項に記載されているように得た。フラボバクテリウム由来オリゴペプチダーゼを、ICNバイオメディカルス(ICN Biomedicals)から購入した(35単位/mg、カタログ番号32082、米国オハイオ州)。
【0138】
2つの酵素のpH活性スペクトルを確立するために、異なるpH値を有するバッファーを調製した。pH2.0〜7.0の範囲のバッファーを、0.1mol/lクエン酸塩を用いて調製し、pH6.0〜9.0の範囲のバッファーを、0.1mol/l trisを用いて調製し、pH8.0〜12.0の範囲のバッファーを、0.2mol/lグリシンを用いて調製した。必要なpH値は、HClまたはNaOHを用いて調節した。色素形成合成ペプチドZ−Gly−Pro−AMC(バッヘム(Bachem)、スイス)を、両方の酵素の基質として使用した。各ウェル(コスター(Costar)番号3631プレート)中85uLのバッファー、10uLの酵素溶液および5uLの基質(60%メタノール中の4mM Z−Gly−Pro−AMC)を導入した。黒色アスペルギルス(A.niger)酵素の終濃度は32ug/ml(3.2ミリ単位/ml)であり、F.メニンゴセプチカム(F.meningosepticum)酵素の終濃度は0.21ug/ml(7.4ミリ単位/ml)であった。反応を混合した後、37.0℃で30分間進行させ、その後、パーセプティブ・バイオサイエンシーズ(PerSeptive Biosciences)のサイトフラー(CytoFluor)マルチウェルプレートリーダー中で蛍光を測定した。得られた相対的データを図1に示す。また、プロリルエンドプロテアーゼの最適温度を確立した。そのため、精製された酵素調製物を、0.02mol/l CaCl2を含有する0.1mol/l酢酸Na中、pH5.0で2時間、カゼインレゾルフィン(ロシュ(Roche)バーション3)を基質として用い、異なる温度でインキュベートし、574nmで測定することによって酵素活性を定量した。得られた結果によると、黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼは、およそ50℃の最適温度を有する。
【0139】
実施例3
黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼの特異性
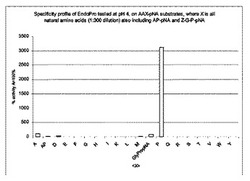
複数コピーの発現カセットを含む、黒色アスペルギルス(A.niger)株から得られた、そのまま、ならびにクロマトグラフィーによって精製された酵素試料(国際公開第02/45524号パンフレット参照)を、色素形成ペプチド基質の収集に対して試験して、コードされるエンドプロテアーゼの特異性を確立した。酵素のエンド型タンパク質分解活性をAAXpNA基質に関して試験した。「pNA」(p−ニトロアニリド)基質は、X−pNAペプチド結合が切断されると、色の変化を引き起こす。「X」は、種々の天然アミノ酸残基を表す。AAX−pNA基質のストック溶液(150mmol/l)を、20 CaCl2を含有する0.1M酢酸塩バッファーpH4.0中で100倍希釈した。TECAN ゲニオス(Genios)MTPリーダー(ウィーン、ザルツブルグ)において、405nmで、40℃で10分間の運動測定によって、エクセルでのデータ処理によって図2に示される画像を生じる、光学密度の増大が記録された。結果から、黒色アスペルギルス(A.niger)由来エンドプロテアーゼが、アラニル結合に対する副活性ありで、プロリルペプチド結合に対して高度に特異的であることが明らかである。そのまま、およびクロマトグラフィーによって精製された調製物は、同様の活性プロフィールを示した。黒色アスペルギルス(A.niger)由来エンドプロテアーゼの、アミノペプチダーゼ、カルボキシペプチダーゼまたは非プロリン特異的エンドプロテアーゼでの混入は、有意でないと示すことができた(実施例5参照)。
【0140】
実施例4
黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼは、大きいタンパク質ならびに小さいペプチドを加水分解することができ、したがって真のエンドプロテアーゼである。
特異的な構造上の特性のために、S9ファミリーに属するプロリルオリゴペプチダーゼは、30アミノ酸より大きいペプチドを消化することができない。この制限は、種々のタンパク質を可能な限り迅速かつ効率的に加水分解しなければならない酵素にとって明らかな欠点である。黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼが、基質分子の大きさに関して同じ制限を示すかどうかを調べるために、本発明者らは、黒色アスペルギルス(A.niger)由来の、クロマトグラフィーによって精製したプロリルエンドペプチダーゼを、小さい合成ペプチドとともに、および大きいオボアルブミン分子とともにインキュベートし、形成された加水分解産物をSDS−PAGEによって分析した。
【0141】
使用した合成ペプチドは、配列NH2−FRASDNDRVIDPGKVETLTIRRLHIPR−COOHの27マーであり、ペップスキャン(Pepscan)社(オランダ、レリスタット)から贈られた。そのアミノ酸配列によって示されるように、このペプチドは、2つのプロリン残基を、一方を中央に、一方をペプチドのカルボキシ末端近くに含む。
【0142】
インタクトなオボアルブミン分子(ピアス・イムジェクト(Pierce Imject)、20mgの凍結乾燥物質を含むバイアル)は、分子量が42750Daの、385アミノ酸からなる。この分子は、14個のプロリン残基を含み、その一つは分子の最C末端に位置し、プロリン特異的エンドプロテアーゼによって切断することができない。オボアルブミンおよびオリゴペプチドを、精製された黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼとともに、50℃で別々にインキュベートした。いくらかの時間間隔で、試料を採取し、次いでそれをSDS−PAGEを用いて分析した。
【0143】
4.5単位/mlの活性を有する、クロマトグラフィーによって精製された黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼを、20mM CaCl2を含有する0.1M酢酸塩バッファーpH4で100倍希釈した。オボアルブミンを、酢酸塩バッファーpH4中に、1mg/ml(22μM)の濃度まで溶解させた。27マーを、0.48mg/ml(152μM)の濃度に達するまで、同じバッファー中に溶解させた。オボアルブミンおよび27マー溶液のモル濃度を、両方の溶液が切断可能なプロリン残基の同じモル濃度を含むように選択した。オボアルブミンは、13個の潜在的なプロリン切断部位を含むが、27マーペプチドは、2つしか有さない。両方の基質溶液のうち、0.5mlを、エッペンドルフ(Eppendorf)サーモミキサー中、50℃で、10μl(0.45ミリU)の酵素溶液とともにインキュベートした。いくらかの時間間隔で、10μlの試料をインキュベーション混合物から採取し、SDS−PAGEまで20℃で維持した。SDS−PAGEおよび染色に使用した全ての物質を、インビトロジェン(Invitrogen)から購入した。製造業者の使用説明書に従ってSDSバッファーを使用して試料を調製し、製造業者の使用説明書に従ってMES−SDSバッファー系を使用して、12%Bis−Trisゲルで分離した。染色は、シンプリー・ブルー・セイフ・ステイン(Simply Blue Safe Stain)(コロイド状クマシーG250)を使用して行った。
【0144】
図3に見られるように、オボアルブミンは、アスペルギルス(Aspergillus)由来酵素によって、インキュベーションの最初の4.75時間で約35〜36kDの別個のバンドに切断される(レーン3)。長期のインキュベーション期間によって、種々の分子量の、より小さい生成物への、さらなる分解が生じる(レーン7)。
【0145】
レーン2と比較して、レーン4、6および8の、よりかすかなバンドによって判断されるように、27マーペプチドもまた分解する。生成物の、非常に小さい分子量変化(レーン9および8を比較)は、ペプチドのカルボキシ末端でのアルギニン残基の切断による可能性が最も高い。差は約200D(アルファイメージャー(AlphaImager)2000システムでアルファイメージャー(AlphaImager)3.3dソフトウエアを使用して測定)であり、アルギニンは、174の分子量を有する。この小さい分子量変化は、おそらくは、ペプチドの分解における最初の段階である。
【0146】
生成物のさらなる崩壊はまた、SDSゲルでのバンドの強度の減少によってのみ見られる。ゲルにおいて、約1000の分子量を有する成分の染色はクマシーブリリアントブルーでは可能でないので、さらなる崩壊の生成物は目に見えない。この実験から、S9ファミリーに属する公知のプロリルオリゴペプチダーゼとは異なり、黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼは、より大きいタンパク質と比べて、小型のペプチドの切断に対して特異的選択性を有さないと結論付けることができる。このように、黒色アスペルギルス(A.niger)由来酵素は真のエンドプロテアーゼを表し、種々の型のタンパク質を加水分解するための好ましい酵素である。
【0147】
実施例5
血圧降下ペプチドの生成における、望ましい、および混入している酵素活性の定量。
本発明によると、GMPからIPPを回収することによって、比較的純粋なIPPを、単純な一段階プロセスで得ることができる。種々の異なる酵素調製物によって、IPP含有画分を、GMPから得ることができる。例えば、GMPを、(GMPを、オリゴペプチダーゼに対する改善された基質を形成する、より小さい断片に切断するために)サブチリシンもしくはメタロプロテアーゼ等の極微量の別の純粋なエンドペプチダーゼと組み合わせて、純粋なプロリン特異的エンドプロテアーゼ、もしくは純粋なプロリン特異的エンドプロテアーゼ+純粋なアミノペプチダーゼ、もしくは純粋なプロリン特異的オリゴペプチダーゼのいずれかとともに、またはプロリン特異的トリペプチジルアミノペプチダーゼ(日本の天野の商業的な「ウマミザイム(Umamizyme)」調製物中に存在するような)と組み合わせて、純粋なアミノペプチダーゼとともに、または種々の種類のタンパク質分解活性を含む複雑な酵素調製物とともにインキュベートすることによって。この実施例において、3つの商業的酵素調製物を、それらの種々のタンパク質分解活性について試験した。すなわち、フレーバーザイム(Flavourzyme)1000LバッチHPN00218(ノボザイム(Novozyme)、スミチーム(Sumizyme)FP(新日本(Shin Nihon)、日本)およびコロラーゼ(Corolase)LAP Ch.:4123(ABエンザイムス(AB Enzymes)、英国)。フレーバーザイム(Flavourzyme)およびスミチーム(Sumizyme)FPの両方とも、非特異的エンド型タンパク質分解およびカルボキシペプチド分解活性の他に、いくつかのアミノペプチド分解酵素活性を含む、複雑な酵素調製物として公知である。コロラーゼ(Corolase)LAPは、アスペルギルス(Aspergillus)由来の、比較的純粋な、クローニングおよび過剰発現された、ロイシンアミノペプチダーゼ活性を表す。
【0148】
本質的に純粋な、は、使用されるインキュベーション条件下での、混入しているエンドプロテアーゼならびに混入しているカルボキシペプチダーゼまたはアミノペプチダーゼの活性が最小限であるか、または好ましくはないことを意味する。以下の試験手順を考案して、かかる混入しているエンド、アミノ、およびカルボキシペプチダーゼ活性を定量した。
【0149】
試験手順のための基礎を、種々の選択的色素形成ペプチドの収集によって形成する。プロリン特異的オリゴおよびエンドプロテアーゼのみが、ペプチドZ−AAAP−pNAからpNAを放出させることができるので、この特定のペプチドを用いて、所望のプロリン特異的エンド型タンパク質分解活性を定量した。多くのエンドプロテアーゼがペプチドZ−AAAF−pNAおよびZ−AAAR−pNAからpNAを放出させることができるので、これらの2つのペプチドを用いて、混入している、非プロリン特異的エンド型タンパク質分解活性を定量した。β−カゼイン分子中に存在するようなペプチドQNIPPおよびVVVPPの、それぞれIPPおよびVPPへの転換は、GlnおよびVal残基を効率的に除去することができるアミノペプチダーゼを必要とするので、ペプチドQ−pNAおよびV−pNAを用いて、所望のアミノペプチダーゼ活性を定量した。多くのカルボキシペプチダーゼが、ペプチドからPheおよびArg残基を放出させることができるので、これらの残基を含むペプチドを選択して、混入しているカルボキシペプチダーゼ活性を定量した。しかしながら、カルボキシペプチダーゼ活性を測定するための、適した色素形成基は入手できないので、合成ペプチドZ−AFおよびZ−ARを用いた代替的方法を開発しなければならなかった。この代替的方法を、下記に提供する。使用した全ての合成ペプチドにおいて、「Z」はベンジルオキシカルボニルを表し、「pNA」は発色団パラ−ニトロアニリドを表す。全ての色素形成ペプチドは、ペップスキャン(Pepscan)(オランダ、レリスタット)から入手した。ペプチドZ−AFおよびZ−ARは、バッヘム(Bachem)(スイス)から購入した。全てのインキュベーションは、40℃で行った。希釈した酵素調製物を、商業的製品の濃度に再計算した。
【0150】
アミノペプチダーゼ活性の測定
100%DMSO中の150mmol/lのV−pNAおよびQ−pNAのストック溶液を、0.1M BisTrisバッファーpH6中で80倍希釈して、V−pNAおよびQ−pNAを1:1の比で含有する3.75mmol/l V−pNA+Q−pNA基質溶液を作製した。このアミノペプチダーゼ基質溶液の200μlのアリコートを、マイクロタイタープレート(MTP)の別々のウェルにピペットで入れた。MTPを、マゼラン(Magellan)4ソフトウエアで稼動しているテカン・ゲニオス(Tecan Genios)MTP(ウィーン、ザルツブルグ)中、40℃でプレインキュベートした。3mMの基質濃度でインキュベーションが起こるように、50μlの適当な酵素溶液を加えることによって反応を開始させた。典型的には、液体酵素試料、フレーバーザイム(Flavourzyme)、コロラーゼ(Corolase)LAPおよびプロリン特異的エンドプロテアーゼの1:50希釈を使用した。乾燥スミチーム(Sumizyme)FP製品のうち、1%溶液を使用した。アミノ酸−pNA結合の切断の結果として発生する、テカン・ゲニオス(Tecan Genios)MTPによって405nmで測定した黄色を、少なくとも20運動サイクルの間(約10分間)追跡した。ソフトウエアから、OD405/分として得られるデータを生じた。
【0151】
プロリン特異的エンドプロテアーゼ活性の測定
測定を、アミノペプチダーゼアッセイと本質的に同じように行ったが、この場合は、Z−AAAP−pNAを唯一の基質として、3mmol/lの終濃度で使用した。懸濁液をpH6バッファー中50〜55℃で加熱することによって、この基質を可溶化させ、室温で透明な溶液を生じた。測定を40℃で行った。典型的には、液体酵素試料フレーバーザイム(Flavourzyme)およびコロラーゼ(Corolase)LAPの1:50希釈を使用した。スミチーム(Sumizyme)FPは1%溶液で使用した。プロリン特異的エンドプロテアーゼは、典型的には、1:5000期尺で使用した。
ソフトウエアから、OD405/分としてデータを生じた。
【0152】
混入している非プロリン特異的エンドプロテアーゼ活性の測定
この測定も、アミノペプチダーゼアッセイについて記載されているのと本質的に同じように行ったが、この試験においては、Z−AAAF−pNAおよびZ−AAAR−pNAを1:1の比および3mmol/lの終濃度で基質として使用した。基質Z−AAAF−pNAは、使用したpH6.0試験条件下で可溶性が乏しいことがわかったが、サブチリシンと試験インキュベーションは、pNA放出と同時の、基質の迅速な可溶化を生じた。測定は、40℃で行った。しかしながら、この乏しい可溶性を補償するために、MTPリーダーをプログラムして、運動サイクルの間で振とうさせた。
【0153】
ここでも、ソフトウエアから、OD405/分としてデータを生じた。
【0154】
混入しているカルボキシペプチダーゼ活性の測定
カルボキシペプチダーゼ活性を測定するための感度の高い色素形成ペプチドが入手できないので、カルボキシペプチダーゼCの定量のためのベーリンガープロトコールに基づいて、方法を使用した。
【0155】
2つの、エタノール中のZ−A−FおよびZ−A−Rの150mmol/lストック溶液を、0.1mol/l BisTrisバッファーpH6中で80倍希釈して、Z−A−FおよびZ−A−Rを1:1の比で含有する3.75mmol/l Z−A−F+Z−A−R基質溶液を作製した。次いで、200μlの基質溶液を、ピペットでエッペンドルフバイアルに入れ、40℃でプレインキュベートした。50μlの適当な酵素希釈を加えることによって、反応を開始させた。典型的には、フレーバーザイム(Flavourzyme)およびコロラーゼ(Corolase)LAPおよびプロリン特異的エンドプロテアーゼの1:50希釈を使用した。スミチーム(Sumizyme)FPについては、1%溶液を使用した。5分後、250μlのニンヒドリン試薬を加えることによって、反応を停止させた。ニンヒドリン試薬は、15mlのDMSOに溶解させた400mgのニンヒドリン(メルク(Merck))および60mgのヒドリンダンチンでできており、そこに5mlの4.0mol/l酢酸リチウムバッファーpH5.2を加えた。4.0mol/l酢酸リチウムバッファーは、LiOH(シグマ(Sigma))を溶解させ、その後氷酢酸(メルク(Merck))を用いて溶液のpHをpH5.2に調節することによって、作製した。
【0156】
反応を停止させた後、各試料を95℃で15分間加熱して、色形成を促進し、続いて、純粋なエタノールで10倍希釈した。形成された色を、ユビコン(Uvikon)分光光度計において、578nmで測定した。活性試料と同様にブランクを作製したが、ニンヒドリン試薬および酵素添加は逆転させた。カルボキシペプチダーゼ活性によって生じた遊離アミノ酸の量を定量するために、アミノ酸L−フェニルアラニンを用いて、較正曲線を作成した。0.1875、0.375、0.75、1.5および3.0mmol/lのL−フェニルアラニン(シグマ(Sigma))を含有するバッファーpH6中の溶液を、試料と同様に、すなわち250μlバイアル中で処理した。得られたOD578値から、エクセルで曲線を構築した。Z−A−FおよびZ−A−R基質を含む試料中に存在する遊離アミノ酸の濃度を、この曲線を用いて計算した。得られた値から、試験した酵素の量あたりのμmol/分でカルボキシ−ペプチダーゼ活性を計算した。
【0157】
活性比の計算
本発明による方法のための種々の酵素調製物の適合性を確立するために、関連性のある酵素活性の比率を計算した。MTPリーダーベースのアッセイにおいて、酵素活性は、経時的なpNA放出によって、すなわちΔOD405/分として、特徴付けられる。MTPリーダーによって得られた酵素活性の比率を、単純に同一の量の酵素で得られたΔOD/分値で割ることによって計算した。
【0158】
しかしながら、カルボキシ−ペプチダーゼアッセイの場合、MTP−pNAベースのアッセイによって生じるΔOD/分と直接比較できないODが生じる。ここで、測定されたODを、まず、1分間あたりに放出されたμmolアミノ酸(μmol/分)に変換した。次いで、放出されたpNAのΔOD/分をμmol/分に変換した。そのため、純粋なpNA(シグマ(Sigma))の希釈0.25、0.125、0.0625、0.0312および0.015mmol/lおよびMTPリーダーで較正曲線を生じ、ウェルあたり250μlを測定した。得られたデータから、エクセルで較正曲線を構築した。pNAベースの測定値をニンヒドリンベースの測定値と比較できるように、この較正曲線から、ΔOD/分をμmol/分に変換した。
【0159】
上述の試験で生じたデータに基づいて、使用した種々の酵素調製物を特徴付けた。提供される各酵素調製物中に存在するプロリン特異的オリゴまたはエンド型タンパク質分解活性に関するデータを、表1中、「プロリン特異的活性」欄に示す。所望のアミノペプチダーゼ活性(AP/プロリン特異的活性)および混入しているカルボキシペプチダーゼ(CPD/プロリン特異的活性)およびエンド型タンパク質分解活性(エンド/プロリン特異的活性)に関するデータを、存在するプロリン特異的活性に関して示す。各調製物中に存在する、混入しているカルボキシペプチダーゼ活性に関する、所望のアミノペプチダーゼ活性を、(AP/CPD)として示す。
【0160】
試験した商業的酵素調製物のうち、任意のプロリン特異的オリゴまたはエンド型タンパク質分解活性を含むものがないことが明らかである。さらに、試験した全ての商業的酵素調製物は、カルボキシペプチダーゼおよびエンド型タンパク質分解活性を含む。酵素の組み合わせC1は、4つの単位のプロリン特異的エンドプロテアーゼ+130μlの商業的コロラーゼ(Corolase)LAPからなり、その非常に低いレベルの混入しているカルボキシペプチダーゼおよびエンド型タンパク質分解活性のために目立っている高収量のACE阻害IPP、VPPおよびLPPペプチドを生じる、存在するタンパク質性基質1gあたりに適用される。
【0161】
【表1】

【0162】
それらの、高い含有量のアミノおよびカルボキシペプチダーゼ活性に基づいて、複雑な酵素混合物スミチーム(Sumizyme)FPおよびフレーバーザイム(Flavourzyme)とのGMPのインキュベーションは、高レベルの遊離アミノ酸を生じると予想することができる。これらの遊離アミノ酸は、マイヤール反応の増大の結果としてブロスの味の変化を与えると予想することができる。さらに、これらの酵素調製物中の非プロリンまたは非アラニン特異的エンド型タンパク質分解活性の存在は、最終製品中の、さらなる、およびおそらく生物活性ペプチドの可溶化につながり、それによってIPPの純粋な血圧降下効果が不鮮明になる。これら全ての望ましくない副反応を最小限にするために、本質的に純粋なアミノペプチダーゼとの、本質的に純粋なプロリン特異的プロテアーゼの組み合わせが好ましい。本質的に純粋なプロリン特異的エンドプロテアーゼのみの使用が、さらにより好ましい。
【0163】
実施例6
カゼイン塩からのGMPおよびIPPの単離
市販のGMPを、チーズホエーから得る。この方法において、乳をキモシンとともにインキュベートして、水溶性GMP部分をκ−カゼインから放出させる。その結果、カゼイン塩が沈殿してカードを形成し、それによってGMP部分が最後に、種々の方法によって単離することができるチーズホエーになる。この実施例において、本発明者らは、GMPの単離のための代替的経路、すなわち、市販のカゼイン塩からの単離を記載する。この経路の利点は、GMPの選択的除去の後、残ったカゼイン塩画分を代替的用途に使用することができる点である。本方法によると、当該分野で公知の方法に従って(脱脂)乳を酸性化して、カゼイン画分を選択的に沈殿させる。沈殿した画分は全てのカゼイン、すなわち、α、β、κ(GMP部分を含む)およびγ−カゼインを組み込む。この、形成されたカゼインカードを、「甘味ホエー」画分から分離し、洗浄して、残りのホエー成分および酸性化プロセスによって生じたイオンを除去する。脱水後、例えばKOHを用いた中和によって、カゼインカードを再溶解させて、関連性のある「カゼイン塩」を生じる。
【0164】
10%(w/v)カゼイン酸カリウム溶液(およそpH6.4)を31℃で1時間、ウシキモシンとともにインキュベーションして、GMP部分をκ−カゼインから放出させた。この場合、2.2IMCUマキシレン(Maxiren)(DSMフード・スペシャリティーズ(DSM Food Specialities)、オランダ、デルフト)を、カゼイン塩1gあたりに使用した。得られた溶液を1つ以上のろ過工程に供して、溶解した低分子量GMP部分を、カゼインおよびキモシンの両方を含む高分子量画分から分離した。GMP含有浸透液をpH4.5まで酸性化し、黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼを、存在するタンパク質1gあたり4単位の濃度で加えた。温度を55℃まで上昇させて、酵素の活性を最大限にし、インキュベーションを3時間続行した。次いで、得られた溶液を、蒸発によって濃縮し、95℃まで5分間加熱して、プロリン特異的エンドプロテアーゼを不活性化させた。最後に、加熱した濃縮物を限外ろ過して、沈殿したタンパク質を可能な限り除去し、噴霧乾燥した。噴霧乾燥した物質のLC/MS/MS分析によると、IPP濃度は、カゼイン塩出発物質1gあたり、0.6mgのIPPと定量された。
【0165】
実施例7
単一のインキュベーション工程でのGMPからのIPPの遊離
一連のインキュベーションを行って、黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼおよびスミチーム(Sumizyme)FPが、血圧降下トリペプチドIPPをGMPから遊離させるのに適していることを実証した。この実験において、市販のGMP調製物を使用した(デンマークのアルラ(Arla)からのラクプロダン(Lacprodan)CGMP−10、ロット番号P340205)。その規格によると、得られた粉末は、(存在するタンパク質の)約80%のGMP含有量で、およそ85%のタンパク質を含み、すなわち、1gのラクプロダン(Lacprodan)CGMP−10粉末は、およそ0.85×0.8=0.7gの純粋なGMPを含む。
【0166】
GMPを、脱塩水中に溶解させた(450ml中に50gのGMP)。この溶液のpHは6.7である。この溶液のうち、135mlを、4N HClを用いてpH4にし、さらなる水を加えて150mlの体積および10%固体のGMP濃度に到達させた。pH6.7溶液のうち、45mlを、4N HClでpH6にし、90mlを、4N KOHを用いてpH8にした。両方の溶液に余分な水を加えて、10%GMP固体の濃度にも到達させた。プロリン特異的エンドプロテアーゼとのインキュベーションのpH4.0は、pH4がこの酵素の最適を表すので、選択した。スミチーム(Sumizyme)FPは、全てそれら自体の最適pHを有する、種々のエンドプロテアーゼ、アミノペプチダーゼおよびカルボキシペプチダーゼの混合物からなるので、このインキュベーションは、種々のpH条件下で行った。
【0167】
表に示すように、種々のpH値に調節したこれら3つの溶液とともに、種々の酵素とのインキュベーションを行った。プロリン特異的エンドプロテアーゼを0.4U/ml(約4.2U/grのタンパク質)の濃度で使用し、スミチーム(Sumizyme)FPを1mg/mlの終濃度(約10.4mg/grのタンパク質)で使用した。全てのインキュベーションは、40℃に設定した水浴中の50mlコニカルグライナー(Greiner)チューブで6時間、穏やかな振とう下で行った。インキュベーション後、LC/MS/MS分析まで、試料を−20℃で冷凍保存した。後者の分析で得られたデータを表に示し、IPP、VPPおよびLPP参照溶液を用いて測定した。
【0168】
【表2】

【0169】
【表3】

【0170】
得られた結果から、純粋なプロリン特異的エンドプロテアーゼとのインキュベーションが、ペプチドVPPおよびLPPを欠くIPP含有生成物を生じることが明らかである。この非最適化インキュベーションにおいて放出されたIPPの量は、GMP中に存在するIPP部分のおよそ50%を表す。最も重要なことに、複雑なスミチーム(Sumizyme)FP酵素とのインキュベーションもまた、GMPからのIPPの形成につながった。本発明者らのデータによると、最も効率的には、pH8条件下。スミチーム(Sumizyme)FPでは、プロリン特異的エンドプロテアーゼとのインキュベーションにおけるよりもIPP収量が低いことは、単に、実験におけるスミチーム(Sumizyme)FP酵素の投与下の状態を反映するだけである。極めて意外なことに、スミチーム(Sumizyme)FPはIPPを生じるだけでなく、ラクプロダン(Lacprodan)物質からVPPおよびLPPも生じた。トリペプチドVPPおよびLPPはβ−カゼインアミノ酸配列でのみ生じるので、それらの存在は、得られたGMP物質にβ−カゼインが混入していることを明らかに示す。
【0171】
実施例8
GMPから得られるIPP含有加水分解物の官能上の利点を実証するために、試験実験を行った。この実験において、3つの異なる基質、すなわち、GMP、カゼイン酸カリウムおよび脱脂乳を、黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼとともにインキュベートした。この純粋な酵素を用いて、κカゼイン中に存在するIPPのみを切除することができる(国際公開第2006/005757号パンフレット参照)。3つ全てのインキュベーションは、3.5%(w/w)のタンパク質の、同じタンパク質濃度を含み、同じ量の酵素、すなわち、4単位/gタンパク質を含んでいた。カゼインの沈殿を防ぐために、溶液のpHを6.2に調節した。インキュベーションを3時間進行させ、次いで、短い熱処理によって終了させた。
【0172】
3つ全てのインキュベーションにおいて、相当な沈殿が存在した。遠心分離によってこれらの沈殿を除去した後、透明な(IPP含有)上清を、5人からなる訓練された回答者団によって試験した。回答者団のメンバーは、以下の濃度の硫酸キニーネ溶液で訓練した。15mg/L硫酸キニーネ>強度苦味=1、20mg/L硫酸キニーネ>強度苦味=2、30mg/L硫酸キニーネ>強度苦味=3および50mg/L硫酸キニーネ>強度苦味=4。回答者団は、0(苦くない)〜4(非常に苦い)の尺度に基づいて、各加水分解物の苦味のスコアをつけた。回答者は、味のセッションの前に15mg/L硫酸キニーネの参照試料を与えられ、1の苦味強度値を割り振った。カゼイン加水分解物は、味の回答者団の全てのメンバーに、非常に苦い、すなわち4と判断された。脱脂乳加水分解物もまた、回答者団の全てのメンバーが3をつけ、苦かった。GMP加水分解物を味見すると、回答者団は、全員一致で1のスコアをつけた。GMP加水分解物はまた、最も高い濃度のIPPを生じると予想することができることを考慮すると、本発明による方法の意外な利益が、明らかに実証される。
【0173】
実施例9
発酵による、GMPからのIPPの遊離
発酵乳製品の乏しい嗜好性、および発酵ブロスからのACE阻害ペプチドの回収の間に遭遇する多くの処理の難点は、米国特許第6,428,812号明細書に記載されている。この実施例において、本発明者らは、GMP分子がまた、発酵によるIPPの生成のための適した基質であることを実証する。
【0174】
2つの乳酸桿菌(Lactobacillus)株、アシドフィルス菌(Lactobacillus acidophilus)ラフティ(LAFTI)(登録商標)L10およびカセイ菌(Lactobacillus casei)ラフティ(LAFTI)(登録商標)L26(DSMフード・スペシャリティーズ(DSM Food Specialities)、オーストラリア)を、この試験において使用した。嫌気ジャー中、CO2+N2雰囲気下(アネロゲン(AnaeroGen)(商標)、オキソイド(Oxoid))、MRSブロス(オキソイド(Oxoid))中37℃で24時間、両方の株を増殖させた。得られた前培養物を、次いで、発酵ブロス「a」または発酵ブロス「ay」に接種した。発酵ブロス「a」は、Tween80(1ml/l)、K2HPO4(2g/l)、NaAc(3g/l)、クエン酸(NH4)3(2g/l)、MgSO4.7H2O(0.2g/l)、MnSO4.4H2O(0.05g/l)、グルコース(20g/l)、GMP(ラクプロダン(Lacprodan)、アルラ(Arla)、22g/l)を含有した。発酵ブロス「ay」は、酵母抽出物も含有した(4.0g/l)。新しく接種した発酵ブロス「a」および「ay」を、上記で概略を述べた条件下で、さらに24時間インキュベートした。その後、これらの発酵ブロスを遠心分離し、トリペプチドIPP、LPPおよびVPPの存在について、上清をLC/MSによって分析した。表4に示されるように、L10株とのインキュベーションにおいてのみ、IPPの存在が、0.3mg/lのレベルで検出できた。LPPおよびVPPは存在しなかった。試料1および5の味見からは、有意な味の変化は現れなかった。
【0175】
【表4】

【図面の簡単な説明】
【0176】
【図1】種々のpH条件下で蛍光基質Z−Gly−Pro−AMCに基づいて測定した、F.メニンゴセプチカム(F.meningosepticum)のプロリン特異的オリゴペプチダーゼおよび黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼの活性プロフィール。蛍光は、30分後に37℃で測定した。
【図2】黒色アスペルギルス(A.niger)由来プロリルエンドプロテアーゼの特異性プロフィール。
【図3】クロマトグラフィーによって精製した黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼとのインキュベーションの後の、インタクトなオボアルブミンおよび合成27マーペプチドのSDS−PAGE。
【発明の詳細な説明】
【0001】
[技術分野]
本発明は、IPPの生成に関する。
【0002】
[発明の背景]
高血圧症は、ヒトにおける比較的一般的な病状であり、心臓血管疾患、腎不全および脳卒中の、流行性の危険因子を引き起こす。カルシウム遮断薬、β遮断薬、利尿薬、α遮断薬、中心的なαアンタゴニスト、アンジオテンシンIIアンタゴニストおよびACE阻害薬等の多くの医薬品の利用可能性は、高血圧症の基礎にある生理学的機序が多面的であることを示す。
【0003】
高血圧症の生理学的機序のうち、特にレニン−アンジオテンシン機序は、多くの科学的注目を受けている。この機序において、アンジオテンシンは肝臓によって分泌され、ペプチダーゼであるレニンによって切断されて、生物学的に不活性なデカペプチドであるアンジオテンシンIを生じる。アンジオテンシンIが肺毛細血管を通過すると、アンジオテンシン変換酵素(以下ACEと呼ぶ)と呼ばれる別のペプチダーゼが、アンジオテンシンIの最後の2つの残基(His−Leu)を除去することによって、アンジオテンシンIに作用して、オクタペプチドであるアンジオテンシンIIを形成する。アンジオテンシンIIオクタペプチドは、強力な血管収縮活性を示し、したがって、血圧を上昇させる。より低いレベルのアンジオテンシンIIにつながるACE阻害は、血管収縮を防ぎ、そのため高血圧を防ぐ。
【0004】
アンジオテンシンIを切断する他に、ACEはまた、同様に血圧調節に関与するノナペプチドであるブラジキニンを加水分解することもできる。後者の機序において、ACE阻害は、血管拡張を促進し、同様に血圧を降下させる、ブラジキニンレベルの増大につながる。ACEを阻害することは、このようにして、少なくとも2つの別々の機序によって、血圧降下効果につながる。
【0005】
オクタペプチドであるアンジオテンシンIIが副腎皮質によるアルドステロンの放出を刺激することもまた、公知である。アルドステロンの標的器官は腎臓であり、ここでアルドステロンは、腎細尿管からのナトリウムの再吸収の増大を促進する。この第三の機序によっても、ACE阻害は血圧を減少させるが、この場合はナトリウム再吸収を減少させることによって減少させる。
【0006】
その多重の生理学的効果のために、ACEのタンパク質分解活性を阻害することは、血圧を抑制する有効な方法である。この観察から、カプトプリルおよびエナラプリル等のいくつかの有効な血圧降下医薬品が生じた(オンデッティ(Ondetti),M.A.ら、1977年、サイエンス(Science)、ワシントンDC(Washington DC)、196、441〜444頁)。
【0007】
高血圧症は比較的一般的な病状なので、現代の生活様式の、この望ましくない結果を、穏やかに活性のある天然成分で相殺することは、有利である。特に、穏やかに活性のある天然成分は、かかる製品は定期的に消費されるので、食品または飲料に組み込むことができる。あるいは、かかる穏やかに活性のある天然成分は、栄養補助食品に組み込むことができた。過去数十年の間に、発酵乳中に存在する特異的ペプチドがACE阻害能力を有し、高血圧症被験者において血圧低下を引き起こすことができることが発見されている。最近では、多くのインビトロおよび少数の動物試験から、種々のタンパク質源から得られた種々のペプチドのACE阻害効果が示されている。インビトロACE阻害アッセイからは多くの種々のペプチド配列が明らかになっているが、ACE阻害ペプチドは、血液中を循環させてインビボ効果を発揮させる必要があることを、強調しなければならない。効果的なACE阻害ペプチドは、胃腸内タンパク質分解性消化系による分解に抵抗するべきであり、それに続く腸壁を越える輸送の間にインタクトなままであるべきであるようである。
【0008】
種々のACE阻害ペプチドの構造機能研究から、それらがしばしばそれらのC末端配列にPro−Pro、Ala−ProまたはAla−Hypを有することが示唆されている(マルヤマ(Maruyama),S.およびスズキ(Suzuki),H.、1982年、アグリカルチュラル・アンド・バイオロジカル・ケミストリー(Agric Biol Chem.)、46(5):1393〜1394頁)。この発見は、ACEが、プロリンを伴うペプチド結合を切断することができないペプチジルジペプチダーゼ(EC3.4.15.1)であることによって、部分的に説明される。したがって、Xaa−Pro結合は切断することができないので、構造Xaa−Pro−Proを有するトリペプチドから、ジペプチドPro−Proを除去することはできない。したがって、比較的高濃度で存在する場合、Xaa−Pro−Pro構造を有するトリペプチドは、ACE活性を阻害するであろうと考えることができる。ACEのみでなく、全てのタンパク質分解酵素はXaa−ProまたはPro−Pro結合を切断するのが難しいので、ペプチドのカルボキシ末端での(複数の)プロリン残基の存在によって、比較的プロテアーゼ耐性の分子が生じるという考えは、ほとんど自明である。同様に、プロリンの代わりにヒドロキシプロリン(Hyp)を含むペプチドは、比較的プロテアーゼ耐性である。このことから、そのカルボキシ末端に1つ以上の(ヒドロキシ)プロリン残基を保有するペプチドは、胃腸管におけるタンパク質分解を免れるようであると推論することができる。これらの結論は、特異的ACE阻害ペプチドの顕著なインビボ血圧降下効果を理解する助けとなるであろう。これらはACE阻害の構造上の要件を満たすだけでなく、胃腸内のタンパク質分解性消化系による分解に抵抗し、それに続く腸壁を越える輸送の間、インタクトなままである。
【0009】
トリペプチドLeu−Pro−Pro(特願平2−36127号公報)、Val−Pro−Pro(EP0583074号明細書)およびIle−Pro−Pro(ジャーナル・オブ・デアリ・サイエンス(J.Dairy Sci.)、78:777〜783頁(1995年))について、強力なACE阻害活性が報告されている。最初に、全てのACE阻害ペプチドは、ACE活性に対するそれらのインビトロ効果に基づいて特徴付けられ、トリペプチドIle−Pro−Pro(以下IPPと呼ぶ)Val−Pro−Pro(以下VPPと呼ぶ)およびLeu−Pro−Pro(以下LPPと呼ぶ)が、比較的低いIC50値を生じる、それらの強力なACE阻害効果のために、抜きん出ていた。後に、トリペプチドVPPならびにIPPの、推定される降圧効果を、自然発症高血圧ラットにおいて確かめることができた(ナカムラ(Nakamura)ら、ジャーナル・オブ・デアリ・サイエンス(J.Dairy Sci.)、78:12531257(1995年))。これらの実験において、阻害トリペプチドは、乳酸菌発酵牛乳に由来した。乳発酵の間、望ましいペプチドは、増殖する乳酸菌によって産生されるプロテイナーゼによって生成される。この発酵アプローチの欠点は、乳酸菌が、生きている生物であり、そのため分泌される酵素の型および量を制御するのが難しい点である。したがって、ACE阻害ペプチドの生成はほとんど再現可能でなく、最適な酵素の組が産生されて必要なペプチドの最大収量を確実にする可能性も低い。必要な発酵時間もまた、比較的長く、これは、低い収量と組み合わされ、生物活性ペプチドの、望ましくないコスト構造を含意する。さらに、a.o.固形食への発酵製品は直接の取り込みに、より適さず、厳しい官能制限を引き起こす。かかる発酵乳製品の乏しい嗜好性、およびかかる発酵ブロスからのACE阻害ペプチドの回収の間に遭遇する多くの処理の難点は、米国特許第6,428,812号明細書に記載されている。これらの欠点にもかかわらず、発酵乳製品は、経口投与される血管降圧薬として、実際に適用されている。ACE阻害ペプチドは、電気透析法、中空線維膜透析またはクロマトグラフィー法によって発酵乳製品から濃縮されて、錠剤またはロゼンジ等の、濃縮された栄養補助食品の形態での、それらの市場売買を可能にしている。
【0010】
発酵製造ルートの、上述の欠点は、a.o.特許出願国際公開第01/68115号パンフレットおよびEP1231279号明細書において認識されている。後者の出願において、純粋に酵素による方法が、トリペプチドVal−Pro−ProおよびIle−Pro−Proを乳カゼインから回収すると記載されている。この出願は、乳カゼインを含む材料をプロテイナーゼで、および中間体ペプチドを介してペプチダーゼで消化することによって、これらのトリペプチドを生成する方法を特許請求している。これらの酵素インキュベーションのそれぞれは、12時間もの時間がかかることがあり、微生物不純物の増殖に有利な条件下で起こることがある。ペプチダーゼとのインキュベーションの前に、中間体ペプチドは、好ましくは精製され、高い終濃度のACE阻害ペプチドは、中間体ペプチドのさらなるクロマトグラフィー精製工程の後でしか得ることができない。
【0011】
[発明の概要]
科学文献において、多くの種々のペプチドおよび加水分解物が、血圧降下効果と相関があった。さらに、多くの生理学的機序が、血圧調節に関係することが公知である。本発明によると、関係するペプチドおよび生理学的機序は、加水分解の後に主な血圧降下成分としてIPPを有するペプチド画分を生じる、適したタンパク質基質を選択することによって、最小限になる。本発明者らは、かかるペプチド画分であるκカゼイン、より好ましくはκカゼイン由来のグリコマクロペプチド(GMP)が、好ましい出発点を形成することを見出した。このようにして生じた血圧降下ペプチド混合物または画分において、特にIPPが重要な役割を果たす。IPP、VPPおよび多くの他の製剤的な生物活性ペプチドの混合物を生じる従来技術の加水分解方法と対照的に、本方法は、IPPの生成を対象とし、それによって、例えばVPPの生成を防ぐ。本発明によると、好ましくは、それらのアミノ酸配列中に−I−P−P−配列を含む、20kDa未満、好ましくは10kDa未満の分子量のタンパク質が、出発タンパク質として使用される。上述のように、GMPは、好ましい基質タンパク質である。GMPは、κ−カゼインから、後述のように得ることができる。牛乳が、κ−カゼインの好ましい起源である。κカゼイン分子のGMP部分が−IPP−配列を含む場合、他の哺乳動物由来の乳、例えばヤギ由来の乳もまた、使用することができる。全てのκカゼインをウシキモシンによって切断することができるわけではないので、GMP部分を得ることは、より適当な凝固酵素の使用を必要とする場合がある。
【0012】
本発明は、それらのアミノ酸配列中に−V−P−P−よりも少なくとも6倍多く存在する−I−P−P−を有するタンパク質(またはタンパク質もしくはペプチドの混合物)の使用を開示する。好ましくは、−V−P−P−配列は、タンパク質またはペプチド配列(または加水分解の基質として使用されるタンパク質もしくはペプチド混合物の配列中)に存在しない。好ましいタンパク質源は、−V−P−P−を含まないタンパク質もしくはペプチド、または前記−V−P−P−を含まないタンパク質を含むタンパク質もしくはペプチドの混合物である。したがって、この混合物は、好ましくは、少なくとも50%、より好ましくは少なくとも80%、さらにより好ましくは少なくとも90%、最も好ましくは少なくとも95%(w/w)の、−V−P−P−を含まないタンパク質またはペプチドを含む。より好ましくは、−V−P−P−配列は、−P−V−P−P−または−A−V−P−P−配列の一部である。かかるタンパク質の好ましい例は、牛乳から得ることができるGMP(グリコマクロペプチド)である。
【0013】
血圧降下ペプチドIPPを、純粋な状態で、すなわちペプチドVPPによる有意な量の混入なしで提供することが、本発明の目的である。
【0014】
血圧降下ペプチドIPPを、高価な精製工程の使用なしに高度に濃縮された形態で提供することが、本発明の別の目的である。
【0015】
血圧降下ペプチドIPPを、苦くない製剤中で提供することが、本発明のさらに別の目的である。苦くない製剤は、好ましくは、実施例8で定義されるような、2以下の苦味強度を有する。
【0016】
好ましくはプロリン特異的プロテアーゼ、より好ましくはプロリン特異的エンドプロテアーゼ、最も好ましくは酸性の最適pHを有するプロリン特異的エンドプロテアーゼを用いてκカゼインのGMP部分からIPPを選択的に切除する、酵素による方法を提供することが、本発明のさらに別の目的である。
【0017】
GMPが好ましくは最初にアミノペプチダーゼとともにインキュベートされ、その後好ましくはアミノペプチダーゼの活性がもはやない条件下で、プロリン特異的プロテアーゼとともにインキュベートされる、GMPからIPPを選択的に生成する、酵素による方法を提供することもまた、本発明の目的である。
【0018】
オピオイドペプチドが同じ製剤中に存在しない、IPPを含む組成物を提供することもまた、本発明の目的である。
【0019】
低アレルギー誘発性製剤中にIPPを含む組成物を提供することもまた、本発明の目的である。
【0020】
30%未満、好ましくは20%未満、より好ましくは15%未満の加水分解度を有するペプチド混合物中にIPPを含む組成物を提供することもまた、本発明の目的である。
【0021】
加水分解物を含み、前記加水分解物がIPPを含み、30%未満、好ましくは20%未満、より好ましくは15%未満の加水分解度を有する、組成物を提供することもまた、本発明の目的である。好ましくは、加水分解物は、少なくとも1%、より好ましくは少なくとも2%の加水分解度を有する。
【0022】
IPPを含み、10%(w/w)を超えない、好ましくは7%を超えない、最も好ましくは3%を超えない遊離アミノ酸レベルを含む組成物を提供することもまた、本発明の目的である。
【0023】
酸沈殿カゼインからのκカゼインのGMP部分の回収のための方法を提供することもまた、本発明の目的である。
【0024】
さらに、本発明は、健康の改善、または疾患の予防および/もしくは治療のための機能性食品、好ましくは薬剤の製造、または高血圧(高血圧症)、心不全、糖尿病前症もしくは糖尿病、肥満、グルコース寛容減損またはストレス等の疾患の治療もしくは予防のための機能性食品、好ましくは薬剤の製造のための、本発明の組成物の使用、または本方法によって機能性食品、好ましくは薬剤として生成される組成物の使用を提供する。
【0025】
好ましくは、本発明の組成物は、栄養補助食品の形態、ローション剤、ゲルまたはエマルジョンの形態の局所適用を含む個人医療用途の形態で、または食品、飼料もしくはペットフード成分としての形態にある。
【0026】
本発明の組成物はまた、肥満の予防もしくは体重制御のための機能性食品の製造のため、または心臓血管の健康維持のための機能性食品の製造のために使用することもでき、好ましくは、心臓血管の健康維持は、アンジオテンシン変換酵素の阻害または血中コレステロールレベルの制御を含む。
【0027】
本発明の組成物は、その消費者に健康上の利益を提供することができる機能性食品中で使用することができ、前記健康上の利益は、好ましくは、肥満の予防、体重制御および心臓血管の健康維持から選択される。
【0028】
この機能性食品は、好ましくは、1つ以上のビタミンBまたは3〜25重量%のステロールを含む。
【0029】
本発明はまた、本発明の、または本発明の方法によって生成される組成物の生成、および食品、飲料または栄養補助食品への前記組成物の組み込みを含む、食品、飲料または栄養補助食品を調製する方法を提供する。
【0030】
好ましくは、この食品、飲料または栄養補助食品は、マーガリン、スプレッド、バター、乳製品もしくはホエー含有飲料、好ましくはヨーグルトまたはヨーグルトもしくは乳等の乳ベースの製品からなる群より選択される。
【0031】
[発明の詳細な説明]
本発明は、ペプチドIPPが、好ましくは−V−P−P−と比較して多量の−I−P−P−をそのアミノ酸配列中に有する低分子量タンパク質から、高収量で生じる方法に関する。好ましくは、κカゼイン、より好ましくはκ−カゼインのGMP画分が使用される。方法は、好ましくは、単一の酵素インキュベーション工程を含む。本発明による方法は、使用されるタンパク質基質に対して高度に特異的であるが、種々のタンパク質分解酵素調製物を使用して、血圧降下活性を比較的純粋な状態で得ることができる。単一の酵素から複雑な酵素混合物までの範囲にわたる、適したタンパク質分解酵素調製物を使用することができる。好ましくは、プロリンのカルボキシ末端で切断する単一の酵素が使用され、好ましくは、この酵素はプロリン特異的プロテアーゼまたはプロリン特異的オリゴペプチダーゼである。好ましくは、基質分子は、−A−I−P−P−または−P−I−P−P−配列を組み込む。プロリン特異的エンドプロテアーゼもまた、適したアミノペプチダーゼと組み合わせて、使用することができる。後者の場合、GMP含有画分は、好ましくは、まず、好ましくは中性に近い条件下、例えばpH5〜8で、アミノペプチダーゼとともにインキュベートされる。このアプローチはまた、Xが任意のアミノ酸残基を表すことができる−X−I−P−P−配列を組み込む基質の使用を可能にする。好ましくは、アミノペプチダーゼのインキュベーション後またはアミノペプチダーゼの活性がないpH条件下で、N末端がトランケートされたGMP分子が、プロリン特異的プロテアーゼとともにインキュベートされる。好ましくは、プロリン特異的エンドプロテアーゼ等の、プロリンのカルボキシ末端で切断するプロテアーゼ、ならびにアミノペプチダーゼ活性は、いかなるエンドプロテアーゼ活性の混入もない。好ましくは、プロリン特異的エンドプロテアーゼ等の、プロリンのカルボキシ末端で切断するプロテアーゼ、ならびにアミノペプチダーゼ活性は、カルボキシペプチダーゼ活性の混入がない。エンドプロテアーゼ活性の混入のないプロリン特異的エンドプロテアーゼは、好ましくは、1より大きい、より好ましくは100より大きいプロリン特異的活性/エンド比を有する酵素調製物である。エンドプロテアーゼ活性の混入のないアミノペプチダーゼ活性は、好ましくは、少なくとも0.1、より好ましくは少なくとも0.5、最も好ましくは少なくとも1のAP/エンド比を有する酵素調製物である。
【0032】
カルボキシペプチダーゼ活性の混入のないプロリン特異的エンドプロテアーゼは、好ましくは、少なくとも1、より好ましくは少なくとも10のプロリン特異的活性/CPD比を有する酵素調製物である。
【0033】
カルボキシペプチダーゼ活性の混入のないアミノペプチダーゼ活性は、好ましくは、少なくとも0.1、より好ましくは少なくとも0.3のAP/CPDを有する酵素調製物である。上述の比は、実施例5に記載されているように決定される。
【0034】
タンパク質配列中に存在する−I−P−P−配列の、好ましくは少なくとも20%、より好ましくは少なくとも40%、さらにより好ましくは少なくとも60%、最も好ましくは少なくとも70%が、ペプチドIPPに変換される。プロリン特異的プロテアーゼは、好ましくは、基質タンパク質自体等の、大きいタンパク質分子を加水分解することができる。本発明による方法は、一般に、24時間未満のインキュベーション時間、好ましくは10時間未満のインキュベーション時間、より好ましくは4時間未満のインキュベーション時間を有する。インキュベーション温度は、一般に、30℃より高く、好ましくは40℃より高く、より好ましくは50℃より高い。本発明の別の態様は、傾瀉、遠心分離またはろ過によってIPP含有ペプチド混合物を精製して、可溶性加水分解物を形成する方法である。
【0035】
本発明はさらに、
1〜5mg IPP/gの間(乾物またはタンパク質に基づく)、または20〜50mg IPP/gの間(乾物またはタンパク質に基づく)を含むペプチド組成物、ならびに
少なくとも20mg IPP/g(乾物またはタンパク質に基づく)、好ましくは20〜100mg IPP/g(乾物またはタンパク質に基づく)を含む15〜90%(乾物重量)のペプチドを含む、ペプチド組成物
を開示する。
【0036】
従来技術において、トリペプチドIPP、VPPおよびLPPは、有効なACE阻害薬として記載されている。公知のアミノ酸配列から判断されるように、牛乳のホエータンパク質は、これらの3つのACE阻害トリペプチドのいずれに対応するアミノ酸配列も組み込まない。したがって、ペプチドIPP、VPPおよびLPPは、ホエータンパク質から単離することができない。しかしながら、これらのペプチドは、牛乳のカゼイン画分中では生じる。例えば、β−カゼインは、−I−P−P−(74〜76)、−V−P−P−(84〜86)ならびに−L−P−P−(151〜153)配列を包含する。さらに、κ−カゼインもまた、−I−P−P−を包含するが、他の2つの配列は包含しない。κカゼイン中に存在するIPP配列は、109〜110位、すなわち、κカゼイン中の独特のキモシンPhe(105)〜Met(106)切断部位のカルボキシ末端のいくつかのアミノ酸に位置している。したがって、κカゼインにおいて、−I−P−P−配列は、この分子のGMP部分に位置している。本発明者らは、酵素凝固乳において、κカゼイン由来IPP実体が、チーズホエー中に見られ、酸凝固乳において、沈殿したカゼイン部分に見られることを見出した。
【0037】
重量の観点でκ−カゼインがカゼインの重要な画分でないことにもかかわらず、本発明者らは、分子の観点から、その存在が極めて重要であると気づいた。例えば、β−カゼインは、1立方メートルの乳あたり大体400mmolの濃度で存在し、κ−カゼインは1立方メートルの乳あたり180mmolの濃度で存在する。チーズホエーにおいても、GMPは、重要な画分を代表する。組み合わせた血清タンパク質の濃度は1立方メートルあたり320mmolであるが、GMPは、1立方メートルのチーズホエーあたり400mmolの濃度で存在する。
【0038】
意外なことに、GMPは、容易に得ることができる。本発明によると、GMPは、選択されたpH条件下で、キモシンでの酵素処理によって、酸沈殿カゼインから選択的に遊離させることができる。チーズホエーからのGMPの単離はより困難であるが、GMP濃縮ホエー画分を得る産業上の方法は、公知である。これらの公知の方法で得られる、これらの市販のGMP濃縮画分は、現在、種々の機能性食品用途に使用されている。
【0039】
本願において、本発明者らは、GMPの使用を、血圧降下IPPを高度に精製された状態で得るための、好ましい出発物質として記載する。
【0040】
乳のタンパク質画分は、ミセル状カゼイン画分および可溶化ホエータンパク質画分を組み込む。ホエータンパク質の中でも、β−ラクトグロブリンおよびα−ラクトアルブミンが、量的に、最も重要である。カゼインタンパク質の中でも、比較的疎水性のα−およびβ−カゼインが、量的に主である。カゼインミセルは、κ−カゼインによって溶液中に維持される。κカゼインの親水性部分、いわゆるグリコマクロペプチド(GMP)は、ミセル表面から突出し、それによって疎水性カゼインを水溶液中で安定させる。
【0041】
確立した多くの産業上の方法によると、カゼイン画分は、例えばチーズを製造するための、乳から単離することができる。これらの方法の1つにおいて、乳は酸性化されて、乳からカゼイン画分を選択的に沈殿させる。酸沈殿物質は、全てのカゼイン、すなわち、α、β、κおよびγ−カゼインを取り込む。沈殿しなかった酸性化乳画分は、「乳清」と呼ばれる。別の方法において、乳は凝乳酵素、例えばウシキモシン(「レンネット」)とともにインキュベートされる。キモシンは、κ−カゼインのPhe(105)〜Met(106)ペプチド結合を非常に選択的に切断するプロテアーゼである。この反応によって、κ−カゼインの親水性GMP部分が切断され、これによって、ミセル状カゼイン画分の、即座の凝集および沈殿が生じる。この場合、沈殿したカゼイン画分は「カード」と呼ばれる。κカゼインのGMP部分は切り取られるので、この酵素アプローチにおいて、親水性GMP断片は、いわゆる「チーズ」または「甘味」ホエーを形成する種々の血清タンパク質とともに溶液中に残る。
【0042】
種々の刊行物が、GMP濃縮乳画分を消費することの生理学的利益を主張している。さらに、GMP濃縮チーズホエー画分を単離するための、費用効果の高い経路を記載している多くの刊行物が存在する。例えば、限外ろ過の使用は、EP1037537号明細書に記載されており、陰イオン性樹脂の使用は米国特許第6787158号明細書に記載されている。
【0043】
本発明の一態様は、血圧降下剤としての、GMPの加水分解物の使用に関する。本発明者らは、GMP中の比較的高レベルのIPPおよびカルボキシ末端のプロリンを有する他のペプチドが、血圧降下効果と関連付けることができることを見出した。
【0044】
加水分解物によって、基質タンパク質の加水分解によって形成される生成物(タンパク質加水分解物または加水分解されたタンパク質)、本明細書中にも可溶性ペプチド含有組成物もしくは可溶性ペプチドを含む組成物として記載されているタンパク質分解酵素の(水)可溶性画分である可溶性加水分解物、またはタンパク質加水分解物および可溶性加水分解物の混合物を意味する。
【0045】
「ペプチド」または「オリゴペプチド」は、本明細書中で、ペプチド結合によって連結された少なくとも2つのアミノ酸の、鎖として定義される。用語「ペプチド」および「オリゴペプチド」は、同義(一般に認識されるように)と考えられ、各用語は、文脈によって必要な場合、同義的に使用することができる。「ポリペプチド」または「タンパク質」は、本明細書中で、30個より多いアミノ酸残基を含む、鎖として定義される。本明細書中の全ての(オリゴ)ペプチドおよびポリペプチドの式または配列は、一般的な慣習に従って、左から右に、アミノ末端からカルボキシ末端の方向で記される。本明細書中で使用されるアミノ酸の一文字表記は、当該分野で一般に公知であり、サンブルック(Sambrook)ら(モレキュラー・クローニング:ラボラトリー・マニュアル(Molecular Cloning:A Laboratory Manual)、第2版、コールドスプリングハーバーラボラトリー(Cold Spring Harbor Laboratory)、コールドスプリングハーバーラボラトリープレス(Cold Spring Harbor Laboratory Press)、ニューヨーク州コールドスプリングハーバー、1989年)に見ることができる。
【0046】
オピオイドペプチドは、アヘン受容体に結合することができるペプチドである。
【0047】
IUMBからの、全ての酵素の分類および命名法の、国際的に認識されている概略は、プロテアーゼを含む。プロテアーゼEC番号についてアップデートされたIUMBテキストは、インターネットサイト:
HTTP://www.chem.qmw/ac.uk/iubmb/enzyme/EC3/4/11/
で見ることができる。このシステムにおいて、酵素は、それらが単一の反応を触媒することによって定義される。これは、いくつかの異なるタンパク質が全て同じ酵素として記載されているという重要な意味を有し、1つより多い反応を触媒するタンパク質は、1つより多い酵素によって処理される。システムは、プロテアーゼをエンドプロテアーゼおよびエキソプロテアーゼに分類する。エンドプロテアーゼは、内部のペプチド結合を加水分解する酵素であり、エキソプロテアーゼは、末端のα−アミノ基に隣接するペプチド結合(「アミノペプチダーゼ」)または末端のカルボキシ基と末端から2番目のアミノ酸との間のペプチド結合(「カルボキシペプチダーゼ」)を加水分解する。エンドプロテアーゼは、触媒機序に基づいて、サブサブクラスに分けられる。セリンエンドプロテアーゼ(EC3.4.21)、システインエンドプロテアーゼ(EC3.4.22)、アスパラギン酸エンドプロテアーゼ(EC3.4.23)、メタロエンドプロテアーゼ(EC3.4.24)およびスレオニンエンドプロテアーゼ(EC3.4.25)のサブサブクラスがある。
【0048】
アミノペプチダーゼは、クラス3.4.11にある。細分類は、20の異なるアミノ酸が除去される相対的効率に基づく。狭い特異性および広範な特異性を有するアミノペプチダーゼを、区別することができる。アミノペプチダーゼは、タンパク質およびペプチド基質から、単一のアミノ末端のアミノ酸を段階的に除去することができる。狭い特異性を有するアミノペプチダーゼは、基質ペプチドから遊離するP1位のアミノ酸残基の型に対して強力な選択を示す。広範な特異性のアミノペプチダーゼは、N末端またはP1位で、様々な異なるアミノ酸を放出させることができる(シェクターの命名法:シェクター(Schechter),I.およびベルガー(Berger),A.1967年、バイオケミカル・アンド・バイオフィジカル・リサーチ・コミュニケーションズ(Biochem Biophys Res Commun)27:157〜162頁による)。カルボキシペプチダーゼは、タンパク質およびペプチド基質から、単一のカルボキシ末端のアミノ酸を段階的に除去することができる。エンドプロテアーゼの場合と同様に、カルボキシペプチダーゼは、触媒機序に基づいてサブサブクラスに分けられる。セリン型カルボキシペプチダーゼはクラスEC3.4.16にあり、メタロカルボキシペプチダーゼはクラスEC3.4.17にあり、システイン型カルボキシペプチダーゼはクラスEC3.4.18にある。プロテアーゼのECリストの値は、種々の型のプロテアーゼ活性の標準的な用語法を提供し、特に、独特の識別番号および各プロテアーゼの推奨名が割り当てられている。
【0049】
κカゼイン分子のGMP部分は、64アミノ酸残基の長さを有するポリペプチドである。全てのIPPが定量的に回収される場合、純粋なGMP調製物は、VPPまたはLPPのいずれかによる有意な混入なしに、大体5%(w/w)のIPP濃度を生じることができる。本願において、本発明者らは、場合により単一のインキュベーション工程で、および高収量で、GMPポリペプチドからIPPトリペプチドを単離するための、いくつかのタンパク質分解方法を記載する。したがって、本発明の方法によると、直接、または単一の精製工程の後に直接使用するのに十分な程IPP濃度が高く、そのためクロマトグラフィーによる単離または精製等の複雑で高価な精製方法の必要がない、IPPを含む組成物を得ることが可能である。
【0050】
第一のタンパク質分解方法によると、単離されたGMP分子は、スミチーム(Sumizyme)FP(新日本(Shin Nihon)またはフレーバーザイム(Flavourzyme)(ノボ(NOVO))またはウマミザイム(Umamizyme)(天野(Amano))等の複雑な微生物プロテアーゼ酵素調製物とともにインキュベートされる。スミチーム(Sumizyme)FP、フレーバーザイム(Flavourzyme)およびウマミザイム(Umamizyme)は、種々のエンド型タンパク質分解酵素+アミノペプチダーゼおよびカルボキシペプチダーゼ等のエキソ型タンパク質分解活性を含む酵素調製物である。酵素投薬およびpH条件の注意深い選択によって、本発明者らは、スミチーム(Sumizyme)FPまたはフレーバーザイム(Flavourzyme)調製物のいずれかを使用して、単一のインキュベーション工程でIPPトリペプチドを得ることができた。しかしながら、この第一のタンパク質分解戦略の欠点は、種々の異なるペプチドが、存在する種々の酵素活性によって形成される場合があることである。さらに、加水分解物がさらに精製されなければ最終的なIPP含有生成物にブロスの味の変化を与える、比較的多量の遊離アミノ酸が生じる。
【0051】
第二のタンパク質分解方法によると、単離されたGMP分子は、プロリン特異的オリゴペプチダーゼ(EC3.4.21.26)またはプロリン特異的エンドペプチダーゼとともにインキュベートされる。このアプローチにおいて、これらの2つの型の酵素の独特の特異性が、有利に使用される。両方の型のプロリン特異的プロテアーゼは、好ましくは、プロリン残基のC末端のペプチド結合を加水分解する。しかしながら、これらの2つの酵素の固有の副活性は、アラニン残基のC末端を加水分解することを対象とする。GMP中に存在する−I−P−P−配列は、N末端でアラニン残基に先行されるので、純粋なプロリン特異的オリゴペプチダーゼまたは純粋なプロリン特異的エンドペプチダーゼとのGMPのインキュベーションによって、直接IPPが生じる。この経路の重要な利点は、非常に苦い味の変化につながることおよび望ましくない生物活性も示すことのある、多数の他のペプチドを同時に生じることなく、高いIPP収量が得られることである。さらに、この方法の間に生じる遊離アミノ酸はほとんどなく、高濃度のIPPを含む、淡白な味の生成物が得られる。
【0052】
さらなるタンパク質分解方法によると、単離されたGMP分子は、まず、アミノペプチダーゼとともにインキュベートされて、GMPのIPP配列に先行するGMPのN末端アミノ酸(MetおよびAla)が除去される。このインキュベーションの後にのみ、プロリン特異的プロテアーゼが反応混合物に加えられて、IPPペプチドを放出させる。好ましくは、アミノペプチダーゼは、プロリン特異的プロテアーゼとのインキュベーションの間または後に、もはや活性がない。本発明者らは、このアプローチが、より高いIPP収量につながり、さらに、味の変化の発生につながらず、最終製品中に存在する遊離アミノ酸の量にほとんど寄与しないことを見出した。さらに、IPPが、他のペプチドに対して、特にトリペプチドに対して、多量に存在する。調製されたIPPは、さらに、大きい方のペプチドから分離することができる。アミノペプチダーゼは、ペプチドのN末端側からアミノ酸を段階的に除去することができるので、IPP配列に先行するメチオニン(「M」)およびアラニン(「A」)残基を効率的に遊離させることができるアミノペプチド分解酵素活性が必要である。IPPトリペプチド中に存在するI−PおよびP−Pペプチド結合は、酵素による切断に抵抗することがわかっており、インタクトなGMP分子のインキュベーションの後、かかるアミノペプチド分解酵素は、GMP分子のN末端をトランケートし、配列IPPで始まる。
【0053】
所望のアミノペプチダーゼ活性を有する商業的な酵素調製物は、コロラーゼ(Corolase)LAP(ABエンザイムス(AB Enzymes))である。コロラーゼ(Corolase)LAPは、アスペルギルス(Aspergillus)由来の、比較的純粋な、クローニングおよび過剰発現された、ロイシンアミノペプチダーゼ活性を表す。この調製物は非特異的エンド型タンパク質分解およびカルボキシペプチド分解活性を欠くので、GMP基質分子の望ましくない切断が防がれる。比較的広範な特異性を有する、別の、クローニングおよび過剰発現されたアミノペプチダーゼは、黒色アスペルギルス(A.niger)由来のアミノペプチダーゼである(国際公開第02/068623号パンフレットの配列番号171)。
【0054】
最後に、本発明者らは、GMPがまた、発酵経路によってIPPが生成される方法において、有利に使用されることに気づいた。実施例で説明されるように、特異的乳酸桿菌とのGMPのインキュベーションは、全乳発酵に特徴的な味の変化の発生なしに、IPPを生じる。
【0055】
全ての上述の態様は、望まれない生物活性または味または臭いのプロフィールなしに高度に標準化された生成物の生成を可能にするので、特に重要である。かかる高度に標準化された生成物は、種々の食物用途において、または錠剤もしくはロゼンジ等の濃縮された食品において、その後の精製工程なしに、組み込むことができる。例えばより小さい錠剤またはロゼンジを製造するための、さらに高いIPP濃度を含む、高度に標準化された生成物は、IPP以外のペプチドの選択的除去によって得ることができる。有意な血圧降下活性のないペプチドのかかる除去は、例えば、これらの非活性ペプチドの沈殿、その後の(限外)ろ過または傾瀉工程によって、達成することができる。さらに別のアプローチにおいて、ペプチドIPPの非常に疎水性の特徴を利用するその後の精製によって、生物活性成分の濃度をさらに増大させることができる。これらの精製方法としては、ナノろ過、例えばブタノールでの抽出、その後の蒸発/沈殿、または、例えばアンバーライト(Amberlite)XAD範囲(ローム(Rohm))からの、活性炭もしくはクロマトグラフィー樹脂等の結合剤で得られるような酸性化された加水分解物を接触させることが挙げられる。例えばファルマシア(Pharmacia)によって供給されるような、ブチルセファロース樹脂もまた、使用することができる。かかる物質からの血圧降下ペプチドの脱着は、メタノール/エタノール混合物等の有機性溶媒で、またはプロパノールで、行うことができる。さらに、CO2またはN2Oを使用した超臨界抽出法を用いて、高度に精製された生物活性ペプチドを得ることができる。
【0056】
EP1231279号明細書において、純粋に酵素による方法が、乳カゼインからトリペプチドVPPおよびIPPを回収すると記載されている。この出願は、乳カゼインを含む材料を、配列−V−P−P−を含むがこれら以外のProをこの配列中に含まないペプチドならびに配列−I−P−P−を含むがこれら以外のProをこの配列中に含まないペプチドからなる群より選択される、いわゆる「中間体ペプチド」を介して、プロテイナーゼおよびペプチダーゼで消化することによってトリペプチドを生成するための方法を特許請求している。EP1231279号明細書の実施例に記載されているように、この方法は、2段階プロセスを伴う。第一に、VPPまたはIPPのいずれかを包含する中間体ペプチドが生成される。これは、適したプロテイナーゼとともにカゼインをインキュベートすることによって行われる。実施例の1つによると、37℃で12時間。次いで、使用されたプロテイナーゼは、この第一の加水分解物を100℃まで3分間加熱することによって不活性化され、再び冷ました後、別の酵素調製物(実際は、エキソ型タンパク質分解活性を有する調製物)が加えられる。この、他の酵素調製物との37℃でさらに12時間のインキュベーションの後、トリペプチドVPPおよびIPPの存在を、実証することができる。より高い収量の、これらのACE阻害ペプチドを得るために、EP1231279号明細書は、エキソ型タンパク質分解活性に曝露する前に、中間体ペプチドを精製および濃縮することをさらに示唆している。EP1231279号明細書はまた、手順において、中間体ペプチドを得た後、および中間体ペプチドをペプチダーゼに接触させる前に、例えば5000〜20000rpmで3〜10分間の遠心分離による、未反応タンパク質の除去等の種々の操作を、場合により行ってもよいことを示唆している。したがって、所望のトリペプチドの複雑な混合物が、産業上やや扱いにくい2段階酵素プロセスで、得られる。酵素インキュベーションのそれぞれに、pH4.5〜7.0および25〜50℃の温度で12時間もの時間がかかるので、この手順がまた、微生物学的観点から容認できないことが、明らかである。25〜50℃の低いインキュベーション温度と組み合わせた、これらの長いインキュベーション時間は、タンパク質含有溶液の感染を容易に生じる場合がある。
【0057】
EP1231279号明細書に記載されている方法と比較すると、本願中で特定される進歩性の科学的精密さと簡潔さが明らかになる。まず、本願は、κカゼインのGMP断片のみの使用を記載している。その結果、IPPのみが放出され、カゼインに包含されることが公知である多くの他の潜在的に非常に苦いペプチドが発生しない。第二に、本発明による、プロリン特異的プロテアーゼを用いたインキュベーションは、単一のインキュベーション工程で、単一の純粋な酵素によって行われる。この特定のエンドプロテアーゼに固有である、プロリン特異的プロテアーゼの非常に選択的な切断パターンのために、所望のIPPペプチドが、非常に限られた数の他のペプチドと同時に、即座に放出される。意外なことに、EP1231279号明細書で言及されているような「中間体ペプチド」は形成されない。第三に、GMPカゼイン断片が、まず純粋なアミノペプチダーゼとともにインキュベートされ、その後プロリン特異的プロテアーゼとともにインキュベートされる、本発明によるインキュベーションは、本質的に、EP1231279号明細書に記載されている経路と異なるが、高い効率ならびに最小限のレベルのペプチドおよび遊離アミノ酸の混入で、IPPをさらに放出する。好ましいインキュベーションは、プロテイナーゼの代わりにアミノペプチダーゼ(EP1231279号明細書によると「ペプチダーゼ」)で始まり、「中間体ペプチド」を生じない。以下の工程において、プロテイナーゼの代わりのエンドプロテアーゼが使用され、ここでも「中間体ペプチド」は形成されない。
【0058】
従来技術の製品について言及された全ての欠点にもかかわらず、発酵乳製品は、経口投与される血管降圧薬として、実際に適用されている。ACE阻害ペプチドはまた、電気透析法、中空繊維膜透析またはクロマトグラフィー法によって発酵乳製品から濃縮され、錠剤またはロゼンジ等の濃縮された栄養補助食品の形態での、それらの市場売買を可能にしている。
【0059】
ペプチドIPPを、純粋な状態で、すなわちVPPまたはLPP等のペプチドによる有意な混入なしに提供することが、本発明の目的である。
【0060】
ペプチドIPPを、高価な精製工程の使用なしに高度に濃縮された形態で提供することが、本発明の別の目的である。
【0061】
血圧降下ペプチドIPPを、苦くない製剤中で提供することもまた、本発明の目的である。
【0062】
本発明は、機能性食品、好ましくは薬剤として使用するための、ペプチド含有組成物に関する。本発明はまた、機能性食品、好ましくは薬剤としての、本ペプチド含有組成物の使用、機能性食品、好ましくは薬剤の製造のための、本ペプチド含有組成物の使用、健康の改善または疾患の予防および/もしくは治療のための、本ペプチド含有組成物の使用、機能性食品、好ましくは薬剤の製造のための、本ペプチド含有組成物の使用、高血圧症および心不全等の心臓血管疾患の治療のための本ペプチド含有組成物の使用、糖尿病前症または糖尿病の治療のための、本ペプチド含有組成物の使用、肥満の治療または予防のための、本ペプチド含有組成物の使用、血漿インスリンを増大させるためまたは血漿インスリンの感受性を増大させるための、本ペプチド含有組成物の使用、2型糖尿病または糖尿病前症の血漿インスリンを増大させるためまたは血漿インスリンの感受性を増大させるための、本ペプチド含有組成物の使用、2型糖尿病または糖尿病前症の血液中の食後のグルコース濃度を低下させるための、本ペプチド含有組成物の使用、2型糖尿病または糖尿病前症の血液中の食後のインスリン分泌を増大させるための、本ペプチド含有組成物の使用、本ペプチド含有組成物が栄養補助食品の形態である、本ペプチド含有組成物の使用、ストレスの影響の治療的処置のための機能性食品の製造のための、本ペプチド含有組成物の使用、局所適用、好ましくは個人医療用途における、本ペプチド含有組成物の使用、ならびに飼料およびペットフードにおける、本ペプチド含有組成物の使用に関する。
【0063】
さらに、本発明は、かかる治療を必要とする被験体に本ペプチド含有組成物を投与することを含む、1型および2型糖尿病の治療の方法、ならびに糖尿病前症またはグルコース寛容減損(IGT)を有する個体における2型糖尿病の予防のための方法、ならびに、かかる治療を必要とする被験体に本ペプチド含有組成物を投与し、そのようにして血圧降下効果を示すことを含む、高血圧症もしくは心不全を患う人々の治療またはその予防の方法に関する。ACEの阻害は、血管収縮の減少、血管拡張の増強、ナトリウムおよび水排出の改善を生じ、これらは次に、末梢血管抵抗および血圧の減少ならびに局所血流の改善につながる。したがって、ペプチドを含む、本加水分解物は、高血圧症、心不全、狭心症、心筋梗塞、脳卒中、末梢動脈閉塞性疾患、アテローム性動脈硬化症、腎症、腎不全、勃起不全、内皮障害、左室肥大、糖尿病性脈管障害、体液貯留、および高アルドステロン症を含むがこれらに限定されない、ACE阻害によって影響を及ぼすことができる疾患の予防および治療に特に効果的である。組成物はまた、胃腸障害(下痢、過敏性腸症候群)、炎症、真性糖尿病、肥満、認知症、てんかん、老人性錯乱、およびメニエール病の予防および治療に有用な場合がある。さらに、組成物は、認知機能および記憶(アルツハイマー病を含む)、満腹感を増強し、虚血性障害を限定し、バイパス手術または血管形成術の後の動脈の再閉塞を防ぐことができる。
【0064】
真性糖尿病は、これまでに治療法のない、広まっている慢性疾患である。真性糖尿病の発生率および有病率は指数関数的に増大しており、先進国および発展途上国における、最も一般的な代謝障害の1つである。真性糖尿病は、複数の病因に由来する複雑な疾患であり、インスリン分泌の欠乏および/またはインスリン抵抗性に関連する炭化水素、タンパク質および脂肪代謝障害によって特徴付けられる。これは、無処置のまま放置されると合併症につながる、空腹および食後の血清グルコース濃度の高まりを生じる。疾患の2つの主なカテゴリーである、インスリン依存性糖尿病(IDDM、T1DM)およびインスリン非依存性糖尿病(NIDDM、T2DM)がある。T1DM=1型糖尿病。T2DM=2型糖尿病。
【0065】
T1DMおよびT2DM糖尿病は、高血糖、高ステロール血症および高脂血症と関連がある。それぞれT1DMおよびT2DMにおける、絶対的インスリン欠乏およびインスリンに対する非感受性は、肝臓、筋肉および脂肪組織におけるグルコース利用の減少および血中グルコースレベルの増大につながる。制御されない高血糖は、腎症、神経障害、網膜症、高血圧症、脳卒中および心疾患を含む微小血管障害および大血管障害のリスクの増大による、増大した、および若年の、死亡率に関連する。最近の証拠から、堅固な血糖管理が、T1DMおよびT2DMの両方におけるこれらの合併症の予防における主な要因であることが示された。したがって、薬物または治療計画による最適な血糖管理は、糖尿病の治療のための重要なアプローチである。
【0066】
T2DMの治療は、まず、食事および生活様式の変化を伴い、これらの手段によって十分な血糖管理が維持できない場合は、患者は経口血糖降下薬および/または外因性インスリンを投与される。T2DMの治療のための現在の経口の薬理学的薬剤としては、インスリン分泌を増強するもの(スルホニルウレア剤)、肝臓におけるインスリンの作用を改善するもの(ビグアナイド剤)、インスリン感受性改善薬(チアゾリジンジオン)およびグルコースの取り込みを阻害するよう作用する薬剤(α−グルコシダーゼ阻害剤)が挙げられる。しかしながら、現在利用可能な薬剤は、一般に、膵臓細胞機能の進行性の損失に起因する高血糖の進行性の悪化のために、長期間十分な血糖管理を維持することができない。標的血糖レベルを維持することができる患者の割合は、経時的に顕著に減少し、追加/代替の薬理学的薬剤の投与を必要とする。さらに、薬物は、望まれない副作用を有することがあり、高い一次および二次失敗率と関連する。最後に、血糖降下薬は、血中グルコースレベルの制御に効果的である場合があるが、糖尿病の全ての合併症を防ぐことはできない。したがって、全ての型の真性糖尿病の現在の治療の方法は、正常血糖の理想および糖尿病合併症の予防を達成することができない。したがって、T1DMおよびT2DMの治療における最適な治療は本質的にインスリンおよび経口血糖降下薬の投与に基づくが、副作用が最小限の、糖尿病の治療および予防のための、安全かつ効果的な栄養補助食品の必要性がある。多くの患者は、高用量の薬物に関連する副作用を最小限にすることができ、さらなる臨床上の利益を生じることができる、代替療法に興味がある。真性糖尿病患者は、補助療法として使用することができる、穏やかな抗糖尿病効果を有し、主な副作用がない、「天然」と考えられる治療に特に興味がある。T2DMは、進行性および慢性の疾患であり、これは、通常、インスリンの産生に関与する脾臓細胞(ランゲルハンス島のβ細胞)に相当な損傷が起こるまで認識されない。したがって、β細胞損傷、したがってリスクのある人々、特にT2DMを発症するリスクの高い高齢者における明白なT2DMの進行の、予防に使用することができる栄養補助食品の開発への興味が増大している。膵臓β細胞の保護は、グルコースおよび脂質がβ細胞に対して損傷効果を示すので、血中グルコースレベルおよび/または脂質レベルを減少させることによって達成することができる。血中グルコースレベルの減少は、種々の機序、例えばインスリン感受性の増強および/または肝臓のグルコース生成の減少によって、達成することができる。血中脂質レベルの減少はまた、種々の機序、例えば脂質酸化および/または脂質貯蔵の増強によって達成することができる。膵臓β細胞を保護するための、別の可能性のある戦略は、酸化的ストレスを減少させる。酸化的ストレスはまた、β細胞損傷と、それに続くインスリン分泌の損失および明白なT2DMの進行を引き起こす。したがって、T2DMは、複数の器官部位に共存する欠陥:筋肉および脂肪組織におけるインスリン作用の抵抗性、膵臓インスリン分泌障害、抑制のない肝臓グルコース生成に起因する、複雑な疾患である。それらの欠陥は、しばしば、脂質異常および内皮障害に関連する。T2DMにおける複数の病態生理学的病変を考慮すれば、併用療法が、その管理に対する魅力的なアプローチである。
【0067】
本発明は、本発明のペプチド含有組成物を含む、新規の機能性食品組成物に関する。本発明のペプチド含有組成物を含む機能性食品組成物はまた、真性糖尿病、もしくはグルコース寛容減損に関連するX症候群等の他の状態の治療または予防のための有効成分として、加水分解されていないタンパク質および炭化水素を含んでもよい。別の態様において、本発明は、前記治療または予防のための栄養補助食品、例えば正常な代謝機能の維持に必須だが体内で合成されないビタミンおよびミネラルを含むマルチビタミン調製物への添加物としての、かかる組成物の使用に関する。さらに別の態様において、本発明は、かかる治療を必要とする被験体に、本発明のペプチド含有組成物ならびにタンパク質加水分解物または加水分解されていないタンパク質および/または炭化水素を投与することを含む、1型および2型両方の真性糖尿病の治療のため、および糖尿病前症またはグルコース寛容減損(IGT)または肥満の個体におけるT2DMの予防のための方法に関する。
【0068】
本発明の組成物は、特に、T1DMおよびT2DMの両方の治療のため、ならびに糖尿病前症、またはグルコース寛容減損(IGT)の個体におけるT2DMの予防のために意図される。
【0069】
本ペプチド含有組成物は、2型糖尿病または糖尿病前症のために使用して、好ましくは食後のグルコース濃度を低下させるか、または食後の血中のインスリン分泌を増大させることができることがわかっている。
【0070】
ペプチドおよび場合により炭化水素を含む組成物は、インスリン分泌を刺激し、脂肪組織、骨格筋および肝臓等のインスリン感受性標的組織へのグルコース処理を増大させ、したがって、真性糖尿病の治療における共同効果を提供する。
【0071】
ストレス関連疾患、および体に対するストレスの負の効果が、多くの人々に対して相当な影響を有すると、一般に認識されている。近年、ストレスの影響、および種々の疾患および状態の発症に対するその寄与は、医学および科学界で、より広い認識を得てきた。消費者は、今や、これらの潜在的な問題にますます気づいてきており、彼らの健康に対する、ストレスの、可能性のある負の影響を減少または予防することに、ますます興味を持つようになってきている。
【0072】
体がストレスの影響を処理するのを助けるのに使用するのに適した、食品、またはそこに組み込むことができる成分を提供することが、本発明のさらなる目的である。
【0073】
体がストレスの負の効果を処理するのを助ける等の、健康上の利益を提供する、本ペプチド含有組成物を含む食品を提供することが、本発明のさらなる目的である。
【0074】
用語、機能性食品は、本明細書中で使用される場合、栄養および薬学的適用分野の両方における有用性を意味する。したがって、新規の機能性食品組成物は、食物および飲料への栄養補給物として、ならびにカプセル剤もしくは錠剤等の固体製剤、または溶液もしくは懸濁液等の液体製剤であってもよい腸または非経口適用のための薬学的製剤または薬剤としての、使用を提供することができる。上記から明らかなように、用語、機能性食品組成物はまた、本ペプチド含有組成物、および、場合により炭化水素を含む食物および飲料、ならびに前述の有効成分を含む、栄養補給物、例えば栄養補助食品を含む。
【0075】
用語、栄養補助食品は、本明細書中で使用される場合、食事に補充することを意図された「食物成分」を含む、口によって摂取される製品を意味する。これらの製品中の「食物成分」としては、ビタミン、ミネラル、薬草または他の植物性薬品、アミノ酸、ならびに酵素、器官組織、腺、および代謝産物等の物質を挙げることができる。栄養補助食品はまた、抽出物または濃縮物であってもよく、錠剤、カプセル剤、ソフトゲル、ゲルカプセル、液体、または散剤等の、多くの形態で提供されることができる。これらはまた、棒等の他の形態でも提供されることができるが、その場合、栄養補助食品のラベル上の情報は、一般に、製品を、従来の食物、または食事(meal)もしくは食事(diet)の単独の商品として表さない。
【0076】
マルチビタミンおよびミネラル栄養補給物は、本発明の機能性食品組成物に添加されて、一部の食事で欠かれている十分な量の必須栄養素を得ることができる。マルチビタミンおよびミネラル栄養補給物はまた、生活様式パターン、および糖尿病で時々見られる一般的な不十分な食事パターンによる、栄養の損失および欠損に対する疾患予防および保護に有用な場合がある。さらに、酸化的ストレスは、インスリン抵抗性の発症に含意されている。反応性の酸素種は、インスリン受容体シグナリングカスケードを阻害することによって、インスリン刺激グルコース取り込みを損なう場合がある。α−トコフェロール(ビタミンE)アスコルビン酸(ビタミンC)等の酸化防止剤での酸化的ストレスの制御は、糖尿病の治療において価値がある場合がある。したがって、マルチビタミン栄養補給物の摂取は、上記の活性物質に加えて、十分バランスの取れた栄養を維持することができる。
【0077】
さらに、本ペプチド含有組成物と、マグネシウム(Mg2+)、カルシウム(Ca2+)および/またはカリウム(K+)等のミネラルとの組み合わせは、健康の改善、ならびに心臓血管疾患および糖尿病を含むがこれらに限定されない疾患の予防および/または治療に使用することができる。
【0078】
本発明の好ましい態様において、本発明の機能性食品組成物は、本ペプチド含有組成物を含む。IPPは、本発明による組成物中に、それが投与される被験体の体重1kgあたり約0.001g〜体重1kgあたり約1gの一日の投薬量を提供する量で、存在する。食物または飲料は、適当には、一食あたり約0.05g〜一食あたり約50gのIPPを含む。機能性食品組成物が薬学的製剤である場合、かかる製剤は、IPPを、投薬単位あたり、例えばカプセル剤もしくは錠剤あたり、約0.001g〜約1g、または液体製剤の一日の投薬量あたり約0.035g〜一日の投薬量あたり約70gの量で含んでもよい。本ペプチド含有組成物は、適当には、それが投与される被験体の体重1kgあたり約0.01g〜体重1kgあたり約3gの一日の投薬量を提供する量で、本発明による組成物中に存在する。食物または飲料は、適当には、一食あたり約0.1g〜一食あたり約100gのタンパク質加水分解物を含む。機能性食品組成物が薬学的製剤である場合、かかる製剤は、ペプチド含有組成物を、投薬単位あたり、例えばカプセル剤もしくは錠剤あたり約0.01g〜約5g、または液体製剤の一日の投薬量あたり約0.7g〜一日の投薬量あたり約210gの量で含んでもよい。
【0079】
本発明のさらに別の好ましい態様において、組成物は、上記で特定されたような本ペプチド、および場合により、炭化水素を含む。炭化水素は、適当には、それが投与される被験体の体重1kgあたり約0.01g〜体重1kgあたり約7gの一日の投薬量を提供する量で、本発明による組成物中に存在する。食物または飲料は、適当には、一食あたり約0.5g〜一食あたり約200gの炭化水素を含む。機能性食品組成物が薬学的製剤である場合、かかる製剤は、炭化水素を、投薬単位あたり、例えばカプセル剤もしくは錠剤あたり約0.05g〜約10g、または液体製剤の一日の投薬量あたり約0.7g〜一日の投薬量あたり約490gの量で含んでもよい。
【0080】
投薬範囲(70kgのヒトに対して)
IPP:0.005〜70g/日(それぞれ)
タンパク質加水分解物:0.07〜210g/日
加水分解されていないタンパク質:0.07〜210g/日
炭化水素:0.1〜490g/日
【0081】
それを消費する被験体に健康上の利益を提供するために使用することができる食用物質を提供することが、本発明の目的である。単離された形態または食品に組み込まれた形態のいずれかで簡便に摂取することができる食用物質を提供することが、さらなる目的である。
【0082】
体重制御プログラムにおける使用に適した、食品、またはそこに組み込むことができる成分を提供することが、本発明のさらなる目的である。例えばACE阻害によって、心臓血管の健康を維持するのを助けるのに適した、食品、またはそこに組み込むことができる成分を提供することが、本発明のさらなる目的である。
【0083】
苦味がないか、または許容され得るレベルの苦味しかない等の特に良い味で、許容され得る安定性および/または官能特性を有する、食品、またはそこに組み込むことができる成分を提供することが、本発明のさらなる目的である。肥満の予防/体重管理を助けることおよび/または心臓血管の健康を維持するのを助けること等の健康上の利益を提供する高濃度の成分を有する食品を提供することが、さらなる目的である。
【0084】
意外なことに、これらの目的の1つ以上は、消費すると健康上の利益を提供する食品の調製のための本ペプチド含有組成物の使用によって、本発明に従って達成される。
【0085】
第一の態様によると、本発明は、肥満の予防または体重制御のための機能性食品の製造のための、本ペプチド含有組成物の使用を提供する。
【0086】
第二の態様によると、本発明は、心臓血管の健康維持のための機能性食品の製造のための、本ペプチド含有組成物の使用を提供する。
【0087】
本発明によると、心臓血管の健康維持がアンジオテンシン変換(ACE)酵素の阻害および/または血中グルコースレベルの制御を含むことが、特に好ましい。
【0088】
第三の態様によると、本発明は、その消費者に健康上の利益を提供することができる機能性食品を提供し、前記健康上の利益は、肥満の予防、体重制御および心臓血管の健康維持から選択され、本ペプチド含有組成物を含む。
【0089】
本発明によるペプチド含有組成物のさらなる利点は、このペプチド含有組成物を簡便に食品に組み込んで、その安定性および/または官能特性に、許容できない影響を及ぼすことなく、機能性食品を製造することができることである。
【0090】
本発明による「健康上有益な薬剤」は、摂取された場合に健康の側面に良い効果を有するか、または良い健康の側面を維持するのを助ける、健康上の利益を提供する物質であり、これらの良い健康の側面は、肥満の予防、体重制御および心臓血管の健康維持である。
【0091】
「健康上の利益」は、健康の側面に対して良い効果を有すること、または良い健康の側面を維持するのを助けることを意味する。本発明による「機能性食品」は、ヒトの消費に適した食品(疑いを避けるため、飲料も含む)として定義され、ここで本発明のペプチド含有組成物は、食品の消費者に対する顕著な健康上の利益が得られるような有効量で、成分として使用される。
【0092】
用語「含む」は、本明細書中で使用される場合、いかなる後述の要素も限定するよう意図されないが、大きな、または小さな機能的重要性の非特異的要素を包含するよう意図される。換言すれば、挙げられている工程、要素または選択肢は、徹底的である必要はない。単語「含む(including)」または「有する」が使用される場合はいつでも、これらの用語は、上記で定義されるような「含む(comprising)」と同等であるよう意図される。
【0093】
好ましくはプロリン特異的プロテアーゼ、より好ましくはプロリン特異的エンドプロテアーゼ、最も好ましくは酸性の最適pHを有するプロリン特異的エンドプロテアーゼを用いて、κカゼインのGMP部分からIPPを選択的に切除する、酵素による方法を提供することが、本発明のさらに別の目的である。
【0094】
酸沈殿カゼインからκカゼインのGMP部分の回収のための方法を提供することもまた、本発明の目的である。
【0095】
有効な血圧降下ペプチドIPPは、ペプチドのカルボキシ末端に、2つのプロリン残基を有する。プロリル残基を組み込むペプチド結合はタンパク質分解性切断に抵抗することが公知であるので、血圧降下ペプチド中の2つのプロリン残基の存在は、かかるペプチドに、タンパク質分解に対する増大した抵抗性を与える。この態様は、複雑な酵素調製物とのインキュベーションの間に、関連性のあるトリペプチドが全体的な加水分解を免れる可能性を増大させる。同様に、IPPは、これらのペプチドが、血流にインタクトなまま到達する、より高い可能性に耐えるように、胃腸内消化にもかかわらず残存するようである。それらのカルボキシ末端側に、少なくとも単一の、好ましくは複数のプロリン残基を有するペプチドを得るために、プロリン残基のカルボキシ末端側で切断することができるプロテアーゼの使用は、興味深い選択肢を提供する。いわゆるプロリルオリゴペプチダーゼ(EC.3.4.21.26)は、プロリン残基のカルボキシ側でペプチドを選択的に切断し、より低い効率ではあっても、アラニンのカルボキシ側で切断する、独特の可能性を有する。哺乳動物ならびに微生物供給源から単離された、全ての十分特徴付けられたプロリン特異的プロテアーゼにおいて、酵素の活性部位から大きいペプチドを排除する、独特のペプチダーゼドメインが同定されている。実際は、これらの酵素は、約30より多いアミノ酸残基を含むポリペプチドを分解することができないので、これらの酵素は、現在、「プロリルオリゴペプチダーゼ」と呼ばれている(ファロップ(Fulop)ら、セル(Cell)第94巻、161〜170頁、1998年7月24日)。結果として、これらのプロリルオリゴペプチダーゼは、それらがそれらの加水分解作用を示すことができる前に、他のエンドプロテアーゼでの徹底的な前加水分解を必要とする。しかしながら、国際公開第02/45523号パンフレットに記載されているように、プロリルオリゴペプチダーゼとかかる別のエンドプロテアーゼとの組み合わせであっても、カルボキシ末端プロリン残基を有する有意に増強された割合のペプチドによって特徴付けられる加水分解物を生じる。このために、かかる加水分解物は、インビトロACE阻害効果ならびに胃腸内タンパク質分解に対する改善された抵抗性を有するペプチドの単離のための、優れた出発点を形成する。これらの潜在的な利益にもかかわらず、我々は、IPPの選択的生成のためは言うまでもなく、血圧降下ペプチドの回収のためのプロリン特異的プロテアーゼの使用を特定する用途に気づいていない。
【0096】
国際公開第02/45524号パンフレットは、黒色アスペルギルス(Aspergillus niger)から得ることができる、プロリン特異的プロテアーゼを記載している。黒色アスペルギルス(A.niger)由来酵素は、プロリンのカルボキシ末端で選択的に切断するが、ヒドロキシプロリンのカルボキシ末端でも切断することができ、より低い効率ではあっても、アラニンのカルボキシ末端でも切断することができる。国際公開第02/45524号パンフレットはまた、この黒色アスペルギルス(A.niger)由来酵素と他の微生物または哺乳動物供給源由来の公知のプロリルオリゴペプチダーゼとの間に明らかな相同性がないことを教示している。公知のプロリルオリゴペプチダーゼと対照的に、黒色アスペルギルス(A.niger)酵素は、酸性の最適pHを有する。公知のプロリルオリゴペプチダーゼならびに黒色アスペルギルス(A.niger)由来酵素は、いわゆるセリンプロテアーゼであるが、本発明者らは、実施例1で、黒色アスペルギルス(A.niger)酵素が、完全に異なるサブファミリーに属することを示す。分泌された黒色アスペルギルス(A.niger)酵素は、ほとんどの細胞質プロリルオリゴペプチダーゼがグループ分けされるS9ファミリーよりむしろ、セリンペプチダーゼのファミリーS28のメンバーであるようである(ローリングス(Rawlings),N.D.およびバレ(Barret),A.J.、ビオキミカ・エ・ビオフィジカ・アクタ(Biochim.Biophys.Acta)1298(1996年)1〜3)。
【0097】
実施例2において、本発明者らは、微生物フラボバクテリウム・メニンゴセプチカム(Flavobacterium meningosepticum)から得られたプロリン特異的オリゴペプチダーゼと比較した、黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼの最適pHおよび温度を示す。タンパク質を含む水溶液は、特に何時間も5.0より高いpH値および50℃以下の温度で維持された場合、微生物感染に対して高度に感受性がある。特に、かかる長期のインキュベーション工程の間に生成されることがある微生物毒素は、その後の加熱工程にもかかわらず残存して、食品グレードの方法への潜在的な脅威を形成する。EP1231279号明細書に記載されている条件とは異なり、本発明による方法は、好ましくは、50℃より高いインキュベーション温度を使用する。酵素インキュベーションが24時間未満、好ましくは8時間未満、より好ましくは4時間未満の時間行われる一段階の酵素による方法と組み合わせて、本発明による方法は、微生物学的安定性の改善の利点を提供する。
【0098】
実施例3において、本発明者らは、本発明の方法において使用される場合、黒色アスペルギルス(A.niger)由来酵素調製物が非常に狭い基質特異性を示し、プロリンまたはアラニン残基を伴うペプチド結合に対する以外の有意なエンド型タンパク質分解活性が存在しないことを意味することを実証する。本願の実施例4において、本発明者らは、アスペルギルス(Aspergillus)酵素がオリゴペプチダーゼでなく、補助的なエンドプロテアーゼの必要なしにインタクトなタンパク質、大きなペプチドならびにより小さいペプチド分子を加水分解することができる真のエンドプロテアーゼであることを示す。この、新しい意外な発見によって、本発明者らは、補助的なエンドプロテアーゼの使用を省くことができ、カルボキシ末端プロリン残基を有する先例のない高い含有量のペプチドを含む加水分解物を生じることができる。さらに、補助的なエンドプロテアーゼを省くことは、ポリペプチドまたはオリゴペプチドのいずれかを加水分解したときに非常に限られた数のペプチドを生じるために、好ましい。その結果、存在するペプチドのほとんどがカルボキシ末端プロリン残基を有することによって特徴付けられる、比較的単純なペプチド混合物が得られる。
【0099】
実施例5において、本発明者らは、存在するエンド型タンパク質分解、アミノペプチド分解およびカルボキシペプチド分解活性に関して使用される酵素調製物を特徴付ける。プロリン特異的エンドプロテアーゼは無視してよい副活性を有するが、スミチーム(Sumizyme)FPおよびフレーバーザイム(Flavourzyme)調製物は、多くの様々な酵素型の、豊富な供給源を形成する。
【0100】
実施例6において、本発明者らは、GMPの単離のための代替的経路、すなわち、市販のカゼイン塩からの単離を記載する。プロリン特異的エンドプロテアーゼを使用して、本発明者らはまた、このようにして単離されたGMPからIPPを回収する。黒色アスペルギルス(A.niger)由来酵素が有意なアミノ−ペプチダーゼ活性を含まないこと(実施例5参照)から、形成されたIPPがκ−カゼイン中に存在する−A107−I108−P109−P110−配列から放出されることが、強力に示唆される。おそらくは、IPPのカルボキシ末端のペプチド結合は、黒色アスペルギルス(A.niger)由来プロリルエンドプロテアーゼの主な活性によって切断されるが、先行するAla−Ile結合の切断は、Ala特異的副活性によって達成される。この経路の利点は、GMPの選択的除去の後、残ったカゼイン塩画分を代替的用途に使用することができる点である。
【0101】
実施例7において、本発明者らは、プロリン特異的エンドプロテアーゼならびに複雑なスミチーム(Sumizyme)FP調製物の両方を使用して、商業的に得られたGMPから、IPPを遊離させることができることを示している。好ましくは、この組成物は、0.1〜100mg/gの間のIPP(乾物およびタンパク質に基づく)、より好ましくは1〜50mg/gの間のIPP(乾物およびタンパク質に基づく)、最も好ましくは2〜35mg/gの間のIPP(乾物およびタンパク質に基づく)を含む。本発明者らはまた、GMPの加水分解が、プロリン特異的エンドプロテアーゼが使用される場合とほとんど同一な量でトリペプチドIPPおよびテトラペプチドTSTPを含む組成物を生じることを見出した。したがって、本発明はまた、IPPおよびTSTPを含む組成物に関し、ここでIPP:TSTPのモル比は1.5〜0.5の間、好ましくは1.3〜0.7の間、より好ましくは1.2〜0.8の間である。好ましくは、この組成物は、0.1〜100mg/gの間のIPP(乾物およびタンパク質に基づく)、より好ましくは1〜50mg/gの間のIPP(乾物およびタンパク質に基づく)、最も好ましくは2〜35mg/gの間のIPP(乾物およびタンパク質に基づく)を含む。
【0102】
実施例8において、本発明者らは、GMP加水分解物を使用することの、官能上の利点を実証する。
【0103】
実施例9において、本発明者らは、GMPの使用によって、発酵アプローチによるIPP含有製品の調製も可能になることを説明する。
【0104】
したがって、本発明は、従来技術に対する、いくつかの利点を生じる。最も重要なことに、本発明による方法は、より少ない種類の水溶性ペプチドを生じ、これらの水溶性ペプチドの中でも、ペプチドIPPが、多量に存在する。これは、淡白な味の生成物中の高濃度のIPPが必要とされる場合、特に重要である。本方法によると、タンパク質中に存在する−A−I−P−P配列の好ましくは少なくとも20%、より好ましくは少なくとも30%、最も好ましくは少なくとも40%が、IPPに変換される。
【0105】
加水分解後、溶液を加熱してもよい。場合により、溶液のpHを調節するか、または溶液を溶媒と混合してもよい。
【0106】
本発明の一態様によると、タンパク質源の加水分解の間に形成される、IPPを含む可溶性ペプチドは、分離され、場合により乾燥される。例えば、形成された沈殿を除去するための傾瀉、ろ過または低速遠心分離の後、生物学的に活性のある可溶性ペプチドを含む上清を、例えば逆浸透または蒸発によって回収して、場合によりさらなる精製工程と、場合によりそれに続く噴霧乾燥工程と組み合わせて、高い生物活性および良好な水溶性を有する食品グレードのペーストまたは粉末を得るための経済的な経路を生じることができる。プロリン特異的エンドプロテアーゼによって、GMP等の適した基質タンパク質を消化すると、高濃度のIPPおよび意外なほど低い加水分解度を有する、白色で無臭の粉末が得られる。
【0107】
機能性食品用途ならびに食物および飲料用途において、本発明の加水分解物が、有利に使用される。タンパク質加水分解物、可溶性加水分解物ならびにそれらの混合物を、機能性食品用途、食物用途または飲料に使用することができる。好ましくは、存在する高い含有量の活性ペプチドのために、可溶性加水分解物が、機能性食品用途、食物用途または飲料において使用される。
【0108】
正しいトリペプチド濃度に適当に希釈された場合、あらゆる種類の食物および飲料に血圧降下特性を与えるのに適した、優れた嗜好性を有する用途の広い出発物質が得られる。
【0109】
例えばクロマトグラフィー等のさらなる精製工程の前または後のいずれかに得られるペプチド混合物を、定期的に広く消費される食品への組み込みのために使用してもよい。かかる製品の例は、マーガリン、スプレッド、バターもしくはヨーグルト等の種々の乳製品または乳もしくはホエー含有飲料、ケーキもしくはクッキー等のパン・菓子類、スープ等の流動食、ならびにキャンディーおよび甘味料および角砂糖である。本発明によるIPP含有加水分解物の非常に淡白な味の結果、現在の、瓶入りのテーブルウォーター、清涼飲料、スポーツドリンク、フルーツジュース、レモネードならびにインスタント紅茶およびコーヒーを含むあらゆる種類の飲料における加水分解物の組み込みが可能である。
【0110】
スポーツドリンクは、運動選手の水分を元の状態に戻すと考えられ、電解質、糖、および他の栄養分を回復させる、飲料である。スポーツドリンクは通常、等張であり、それらが、人体で見られるのと同じ割合の栄養分を含むことを意味する。(出典:http://en.wikipedia.org/wiki/Sports_drink)
栄養飲料は、使用者にエネルギーの奮発を生じさせるよう意図された、(適法の)刺激物、ビタミン(特にビタミンB)およびミネラルを含む飲料である。一般的な成分としては、カフェイン、ガラナ(ガラナ植物から得られるカフェイン)、タウリン、種々の形態の朝鮮人参、マルトデキストリン、イノシトール、カルニチン、クレアチン、グルクロノラクトンおよびイチョウ(ginkgo biloba)が挙げられる。高レベルの糖、またはグルコースを含むものもある。多くのかかる飲料は、風味付けおよび/または着色されている。(出典:http://en.wikipedia.org/wiki/Energy_drink)
【0111】
清涼飲料は、アルコールを含むハードドリンクに対して、アルコールを含まない飲料である。一般に、この用語は、冷たい飲料にのみ使用される。ホットチョコレート、茶、およびコーヒーは、清涼飲料と見なされない。この用語は、元々、排他的に炭酸飲料をいい、依然として一般にそのように使用されている。(出典:http://en.wikipedia.org/wiki/Soft_drink)
【0112】
かかる組成物は、典型的にはヒトに投与されるが、これらはまた、高血圧症を軽減するために、動物、好ましくは哺乳動物に投与されてもよい。さらに、得られる製品中の高濃度の血圧降下ペプチドによって、これらの製品は、丸剤、錠剤または高度に濃縮された溶液もしくはペーストまたは散剤の形態の栄養補助食品への組み込みに非常に有用になる。ペプチドの継続的放出を確実にする持続放出性栄養補助食品が、特に重要である。本発明によるペプチドは、例えば丸剤、錠剤、顆粒剤、小袋またはカプセル剤中の乾燥粉末として製剤化されてもよい。あるいは、本発明によるペプチド混合物は、例えばシロップ剤またはカプセル剤中の液体として製剤化されてもよい。種々の製剤中で使用され、本発明による酵素を含む組成物はまた、生理学的に許容され得る担体、佐剤、賦形剤、安定剤、バッファーおよび希釈剤からなる群の少なくとも1つの化合物を組み込んでもよく、これらの用語は、それらの元来の意味で使用されて、包装、送達、吸収、安定化を補助するか、または佐剤の場合、生理学的効果を増強する、物質を示す。粉末形態の本発明によるペプチド混合物と組み合わせて使用することができる種々の化合物に関する関連のあるバックグラウンドは、「ファーマシューティカル・ドーセージ・フォームス(Pharmaceutical Dosage Forms)」、第2版、第1、2および3巻、ISBN0−8247−8044−2マルセルデッカー社(Marcel Dekker,Inc.)またはレミントンズ・ファーマシューティカル・サイエンシーズ(Remington’s Pharmaceutical Sciences)第20版、ウィリアムス(Williams)およびウィルキンズ(Wilkins)、米国ペンシルバニア州)に見ることができる。経口投与のために、適した結合剤、例えばゼラチンまたはポリビニルピロリドン、適した充填剤、例えば乳糖またはデンプン、適した潤滑剤、例えばステアリン酸マグネシウム、および場合によりさらなる添加物を含む、錠剤およびカプセル剤が好ましく使用される。
【0113】
比較的新しい経口適用形態は、種々の型のゼラチンカプセル剤またはゼラチンベースの錠剤の使用である。
【0114】
本発明のさらなる態様に対して、フェニルアラニン、トリプトファンおよびチロシンを含まない加水分解物が提供される。GMPを出発タンパク質として使用することによって、フェニルアラニン、トリプトファンおよびチロシンを欠く加水分解物が得られる。これによって、この加水分解物が、フェニルケトン尿症(PKU)の個体にとって安全になる。
【0115】
高血圧症に対抗するための天然のペプチドの関連性の観点から、本発明の、新しく費用効果の高い経路は、穏やかな降圧性の食事またはさらには動物用製品のための、魅力的な出発点を提供する。本経路は、意外なほど単純な精製工程を組み込むので、血圧降下濃縮栄養補助食品の可能性もまた、拡大される。
【0116】
本発明による方法は、任意のプロリン特異的なオリゴまたはエンドプロテアーゼを用いて達成することができる。本発明による、または本発明に従って使用される、プロリン特異的オリゴペプチダーゼによって、EC3.4.21.26に属する酵素を意味する。本発明による、または本発明に従って使用される、プロリン特異的エンドプロテアーゼによって、セリンプロテアーゼのファミリーS28に属するプロリン特異的エンドプロテアーゼ(ハンドブック・オブ・プロテオリティック・エンザイムス(Handbook of Proteolytic Enzymes)、バレ(Barrett),A.J.、ローリングス(Rawlings),N.D.、ウォスナー(Woessner),J.F.編、アカデミック・プレス(Academic Press)、英国ロンドン、1998年、369〜415頁)、またはより好ましくは、国際公開第02/45524号パンフレットの請求項1〜5、11および13で言及されているポリペプチドを意味する。したがって、このプロリン特異的エンドプロテアーゼは、
(a)配列番号2のアミノ酸1〜526またはその断片と、少なくとも40%のアミノ酸配列同一性を有するアミノ酸配列を有するポリペプチド、
(b)(i)60ヌクレオチドにわたって、好ましくは100ヌクレオチドにわたって、少なくとも80%または90%同一な、より好ましくは200ヌクレオチドにわたって少なくとも90%同一な、配列番号1の核酸配列もしくはその断片、または(ii)配列番号1の核酸配列に相補的な核酸配列と低ストリンジェンシー条件下でハイブリダイズするポリヌクレオチドによってコードされるポリペプチドからなる群より選択される、プロリン特異的エンド型タンパク質分解活性を有するポリペプチドである。配列番号1および配列番号2は、国際公開第02/45524号パンフレットに示されている通りである。好ましくは、ポリペプチドは、単離された形態である。
【0117】
本発明に従って使用される、好ましいポリペプチドは、配列番号2のアミノ酸1〜526と、少なくとも50%、より好ましくは少なくとも60%、好ましくは少なくとも65%、好ましくは少なくとも70%、より好ましくは少なくとも80%、さらにより好ましくは少なくとも90%、最も好ましくは少なくとも95%、さらに最も好ましくは少なくとも約97%の同一性を有する、または配列番号2のアミノ酸配列を含む、アミノ酸配列を有する。
【0118】
好ましくは、ポリペプチドは、(i)配列番号1の核酸配列もしくはその断片、または(ii)配列番号1の核酸配列に相補的な核酸配列と低ストリンジェンシー条件下、より好ましくは中ストリンジェンシー条件下、最も好ましくは高ストリンジェンシー条件下でハイブリダイズする、ポリヌクレオチドによってコードされる。
【0119】
用語「ハイブリダイズすることができる」は、本発明の標的ポリヌクレオチドが、プローブとして使用される核酸(例えば、配列番号1に示されるヌクレオチド配列、もしくはその断片、または配列番号1の相補物)に、バックグラウンドよりも有意に高いレベルでハイブリダイズできることを意味する。本発明はまた、本発明のプロリン特異的エンドプロテアーゼをコードするポリヌクレオチド、ならびにそれに相補的なヌクレオチド配列を含む。ヌクレオチド配列は、RNAでもDNAでもよく、ゲノムDNA、合成DNAまたはcDNAを含む。好ましくは、ヌクレオチド配列はDNAであり、最も好ましくはゲノムDNA配列である。典型的には、本発明のポリヌクレオチドは、選択的条件下で配列番号1のコード配列またはコード配列の相補物にハイブリダイズすることができる、連続したヌクレオチドの配列を含む。かかるヌクレオチドは、当該分野で周知の方法に従って合成することができる。
【0120】
本発明のポリヌクレオチドは、配列番号1のコード配列またはコード配列の相補物に、バックグラウンドよりも有意に高いレベルでハイブリダイズすることができる。バックグラウンドハイブリダイゼーションは、例えば、cDNAライブラリー中に存在する他のcDNAのために、起こる場合がある。本発明のポリヌクレオチドと配列番号1のコード配列またはコード配列の相補物との間の相互作用によって発生するシグナルレベルは、典型的には、他のポリヌクレオチドと配列番号1のコード配列との間の相互作用よりも、少なくとも10倍、好ましくは少なくとも20倍、より好ましくは少なくとも50倍、さらにより好ましくは少なくとも100倍強い。相互作用の強度は、例えば、プローブを、例えば32Pで放射性同位元素標識することによって、測定してもよい。選択的ハイブリダイゼーションは、典型的には、低ストリンジェンシー(約40℃で、0.3M塩化ナトリウムおよび0.03Mクエン酸ナトリウム)、中ストリンジェンシー(例えば、約50℃で、0.3M塩化ナトリウムおよび0.03Mクエン酸ナトリウム)または高ストリンジェンシー(例えば、約60℃で、0.3M塩化ナトリウムおよび0.03Mクエン酸ナトリウム)の条件を用いて達成してもよい。
【0121】
UWGCGパッケージは、同一性の計算に使用することができるBESTFITプログラムを提供する(例えば、そのデフォルト設定に基づいて使用される)。
【0122】
PILEUPおよびBLAST Nアルゴリズムもまた、配列同一性を計算するのに、または(例えばそれらのデフォルト設定に基づいて、同等または対応する配列を同定すること等の)配列を並べるのに使用することができる。
【0123】
BLAST解析を行うためのソフトウエアは、全米バイオテクノロジー情報センター(http://www.ncbi.nlm.nih.gov/)によって、公的に入手可能である。このアルゴリズムは、まず、データベース配列中の同じ長さの文字列と整列させた場合にいくつかの正の値の閾値スコアTに適合するか、または満たすかのいずれかの、クエリー配列中の長さWの短い文字列を同定することによって、高スコア配列対(HSP)を同定することを伴う。Tは、近縁ワードスコア閾値と呼ばれる。これらの最初の近縁ワードヒットは、それらを含むHSPを見つけるための検索を開始するためのシードとして作用する。ワードヒットは、累積アラインメントスコアが増大できる限りは、各配列に沿って両方向に延長される。各方向へのワードヒットの延長は、累積アラインメントスコアが、その最大の得られた値から量Xだけ低下した場合、1つ以上の負のスコアの残基アラインメントの累積によって累積スコアがゼロ以下になった場合、または配列のいずれかの末端に達した場合に中止される。BLASTアルゴリズムパラメータであるW、TおよびXは、アラインメントの感度および速度を判定する。BLASTプログラムは、デフォルトとして、11の文字列長(W)、50のBLOSUM62スコア行列アラインメント(B)、10の期待値(E)、M=5、N=4、および両方の鎖の比較を使用する。
【0124】
BLASTアルゴリズムは、2つの配列の間の類似性の統計的解析を行う。BLASTアルゴリズムによって提供される、ある類似性の測定は、2つのヌクレオチドまたはアミノ酸配列の間の適合が偶然生じる確率の指標を提供する、最小の合計の確率(P(N))である。例えば、配列は、第一の配列と第二の配列との比較における最小の合計の確率が約1未満、好ましくは約0.1未満、より好ましくは約0.01未満、最も好ましくは約0.001未満である場合に、別の配列と類似していると見なされる。
【0125】
アスペルギルス(Aspergillus)属の株は、食品グレードの状態を有し、これらの微生物由来の酵素は、疑われていない食品グレードの供給源に由来する。別の好ましい実施形態によると、酵素は、分泌されない、いわゆる細胞質酵素よりむしろ、その産生細胞によって分泌される。このようにして、酵素を、高価な精製工程なしに、本質的に純粋な状態で、細胞ブロスから回収することができる。好ましくは、酵素は、一般のpHおよび温度条件下で、その基質に対して、高い親和性を有する。
【0126】
材料および方法
食用カゼイン酸ナトリウムおよびカゼイン酸カリウムスプレー(88%)を、オランダのDMVインターナショナル(DMV International)から入手した。GMPを、デンマークのアルラ(Arla)から入手した(ラクプロダン(Lacprodan)CGMP−10、ロット番号P340205)。合成色素形成ペプチドを、オランダのペップスキャンシステムズ(Pepscan Systems)B.V.またはスイスのバッヘム(Bachem)から入手した。フレーバーザイム(Flavourzyme)1000LバッチHPN00218を、ノボザイム(Novozyme)(デンマーク)から入手し、スミチーム(Sumizyme)FPを新日本(日本)から入手し、コロラーゼ(Corolase)LAP Ch.:4123をABエンザイムス(AB Enzymes)(英国)から入手した。
【0127】
黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼ
黒色アスペルギルス(Aspergillus niger)由来のプロリン特異的エンドプロテアーゼの過剰産生を、国際公開第02/45524号パンフレットに記載されているように達成した。クエン酸塩/二リン酸ナトリウムバッファーpH4.6中、37℃で、合成ペプチドZ−Gly−Pro−pNAに関して、酵素の活性を試験した。反応生成物を、405nMで、分光光度計によってモニタリングした。単位を、これらの試験条件下および0.37mM Z−Gly−Pro−pNAの基質濃度で1分あたり1μmolのp−ニトロアニリドを遊離させる酵素の量として定義する。
【0128】
黒色アスペルギルス(A.niger)由来エンドプロテアーゼの、クロマトグラフィーによる精製
過剰産生している黒色アスペルギルス(A.niger)株から得られた培養ブロスを、混入している任意のエンド型およびエキソ型タンパク質分解活性を除去するための、プロテアーゼのクロマトグラフィーによる精製に使用した。そのため、発酵ブロスをまず遠心分離して、真菌の塊の大部分を除去し、次いで上清を、減少していく孔サイズを有するいくつかのフィルターに通過させて、全ての細胞断片を除去した。最後に、得られた限外ろ過液を20mmol/lの酢酸ナトリウムpH5.1中で10倍希釈し、Q−セファロース(Q−Sepharose)FFカラムに加えた。20mmol/lの酢酸ナトリウムpH5.1中、0〜0.4mol/lのNaClのグラジエントでタンパク質を溶出させた。ワールド・ジャーナル・オブ・マイクロバイオロジー・アンド・バイオテクノロジー(World Journal of Microbiology & Biotechnology)11、209〜212頁(1995年)に記載されているプロトコールに従うがわずかに改変したアッセイ条件下で、Z−Gly−Pro−pNAの切断に対する活性を示していたピーク画分を収集し、貯蔵した。黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼの酸性の最適pHを考慮して、酵素アッセイを、37℃で、クエン酸塩/二リン酸塩バッファー中、pH4.6で行った。活性画分の貯蔵と、それに続く濃縮によって、最終的に、SDS−PAGEの単一のバンドおよびHP−SECでの1つのピークのみを示す調製物を生じた。疎水性相互作用クロマトグラフィーによるさらなる分析によって、得られた酵素調製物の純度を確認した。
【0129】
ケルダール窒素
フローインジェクション分析によって、全体的なケルダール窒素を測定した。TKN法カセット5000−040を備えたテカター(Tecator)FIASTAR5000フローインジェクションシステム、SOFIAソフトウエアを有するペンティアム(Pentium)4コンピュータ、およびテカター(Tecator)5027オートサンプラーを使用して、タンパク質含有溶液から放出されたアンモニアを590nmで定量した。方法のダイナミックレンジ(0.5〜20mgのN/l)に対応する試料の量を、95〜97%硫酸およびケルタブとともに消化チューブに入れ、200℃で30分間と、それに続く360℃で90分間の消化プログラムに供する。FIASTAR5000システムへの注入の後、測定されたタンパク質の量を推定することができる窒素ピークを測定する。
【0130】
アミノ酸分析
正確に計量したタンパク質性物質の試料を希酸中で希釈し、エッペンドルフ(Eppendorf)遠心分離機による遠心分離によって沈殿を除去した。ウォーターズ(Waters)(米国マサチューセッツ州ミルフォード)のアミノ酸分析システムの操作手引きで特定されているようなピコタグ(PipcoTag)法に従って、透明な上清でアミノ酸分析を行った。そのため、適した試料を液体から得、次いで、乾燥させ、気相酸加水分解に供し、フェニルイソチオシアネートを用いて誘導体化した。存在する、種々の誘導体化されたアミノ酸を、HPLC法を用いて定量し、合計して、計量された試料中の、誘導体化Ileを含む遊離アミノ酸の総レベルを計算した。アミノ酸CysおよびTrpは、この分析で得られるデータに含まれない。
【0131】
LC/MS/MS分析
本発明の酵素混合物によって生成された、酵素によるタンパク質加水分解物中の、目的のペプチド、中でもトリペプチドIPP、LPPおよびVPPの定量において、P4000ポンプ(サーモクエスト(Thermoquest)(登録商標)、オランダ、ブレダ)に結合させたイオントラップ質量分析計(サーモクエスト(Thermoquest)(登録商標)、オランダ、ブレダ)を用いたHPLCを使用した。形成されたペプチドを、溶出のためのミリQ(Milli Q)水(ミリポア(Millipore)、米国マサチューセッツ州ベッドフォード)中の0.1%ギ酸(溶液A)およびアセトニトリル中の0.1%ギ酸(溶液B)のグラジエントと組み合わせたイナートシル(Inertsil)3ODS3、3mm、150*2.1mm(バリアン・ベルジウム(Varian Belgium)、ベルギー)カラムを用いて分離した。グラジエントは溶液Aの100%で開始し、それを5分間維持し、10分で5%Bに線形に増大させ、続いて30分で溶液Bの45%に線形に増大させ、直ちに開始時の条件にし、それを15分間安定化のために維持した。使用した注射体積は50μlであり、流速は200μl/分であり、カラム温度は55℃で維持した。注射した試料のタンパク質濃度は、およそ50μg/mlであった。
【0132】
個々のペプチドに関する詳細な情報は、約30%の最適衝突エネルギーを用いて、目的のペプチドの専用のMS/MSを用いることによって得た。定量は、マトリクス効果を補正するための標識された内部標準での較正線を用いて、C13+N15標識IPP基準でのエレクトロスプレー正イオン化モードを用いたLC/MS/MSモードで行う。保持時間、前駆体イオンおよび特徴的な断片化の比によって、同定を行う。
【0133】
トリペプチドLPP(M=325.2)を用いて、MSモードでの最適感度およびMS/MSモードでの最適断片化を調整し、5mg/mlの一定の注入を行い、MSモードでプロトン化分子を生じ、MS/MSモードで約30%の最適衝突エネルギーを生じ、B−およびY−イオン系列を生じた。
【0134】
LC/MS/MSの前に、酵素によるタンパク質加水分解物を周囲温度および13000rpmで10分間遠心分離し、0.22μmフィルターを通してろ過し、上清をミリQ(Milli Q)水で1:100に希釈した。
【0135】
種々のタンパク質分解混合物とのインキュベーションの間に得られた加水分解度(DH)を、迅速なOPA試験(JFS、第66巻5号、2001年)を用いてモニタリングした。
【0136】
実施例1
黒色アスペルギルス(A.niger)から得られた酵素は、新しいクラスのプロリン特異的酵素を表す。
国際公開第02/45524号パンフレットに提供されている黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼのコード配列全体から、526アミノ酸のタンパク質配列を決定することができる。酵素の新規性は、スイスプロット(SwissProt)、PIRおよびtrEMBL等のデータベースのBLASTサーチによって確認した。本発明者らが驚いたことに、黒色アスペルギルス(A.niger)酵素と公知のプロリルオリゴペプチダーゼとの間に、明らかな相同性は検出できなかった。しかしながら、アミノ酸配列の、より密接な観察から、Pro−Xカルボキシペプチダーゼ(EC3.4.16.2)、ジペプチジルアミノペプチダーゼI(EC3.4.14.2)、および胸腺特異的セリンプロテアーゼに対する、低いが有意な相同性が明らかになった。これらの酵素の全ては、セリンペプチダーゼのファミリーS28に割り振られている(ハンドブック・オブ・プロテオリティック・エンザイムス(Handbook of Proteolytic Enzymes)、バレ(Barret),A.J.、ローリングス(Rawlings),N.D.、ウォスナー(Woessner),J.F.編、アカデミック・プレス(Academic Press)、英国ロンドン、1998年、369〜415頁)。また、活性部位セリンの周りのGxSYxG配置は、これらの酵素と黒色アスペルギルス(A.niger)由来エンドプロテアーゼとの間で保存されている。また、ファミリーS28のメンバーは、酸性の最適pHを有し、プロリン残基のカルボキシ末端側で切断する特異性を有し、シグナル配列、およびちょうど黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼ等のプロペプチドとともに、合成される。また、黒色アスペルギルス(A.niger)酵素のサイズは、ファミリーS28のメンバーのものと類似している。したがって、黒色アスペルギルス(A.niger)プロリン特異的エンドプロテアーゼは、フラボバクテリウム・メニンゴセプチカム(Flavobacterium meningosepticum)から得られる酵素を含むほとんどの細胞性プロリルオリゴペプチダーゼがグループ分けされているS9ファミリーよりむしろ、セリンプロテアーゼのファミリーS28のメンバーであるようである。これらの構造的および生理学的特性に基づいて、本発明者らは、黒色アスペルギルス(A.niger)酵素が、セリンプロテアーゼのS9ファミリーよりむしろ、S28に属すると結論付けた。黒色アスペルギルス(A.niger)由来酵素を、S9ファミリーに属するプロリルオリゴペプチダーゼから識別するさらなる特性は、前者のファミリーに属する細胞質プロリルエンドプロテアーゼとは異なり、新しく同定された黒色アスペルギルス(A.niger)酵素は、増殖培地中に分泌されることである。これは、低級真核生物由来の、ファミリーS28のメンバーの単離および特徴付けに関する、最初の報告である。
【0137】
実施例2
黒色アスペルギルス(A.niger)プロリン特異的エンドプロテアーゼおよびF.メニンゴセプチカム(F.meningosepticum)由来のプロリン特異的オリゴペプチダーゼのpH活性スペクトル
アスペルギルス(Aspergillus)由来プロリン特異的エンドプロテアーゼとフラボバクテリウム・メニンゴセプチカム(Flavobacterium meningosepticum)由来のプロリン特異的オリゴペプチダーゼとの間に存在する最適pHの差を実証するために、本発明者らは、それらの活性を、種々のpH条件下で測定した。アスペルギルス(Aspergillus)由来エンドプロテアーゼを、材料および方法の項に記載されているように得た。フラボバクテリウム由来オリゴペプチダーゼを、ICNバイオメディカルス(ICN Biomedicals)から購入した(35単位/mg、カタログ番号32082、米国オハイオ州)。
【0138】
2つの酵素のpH活性スペクトルを確立するために、異なるpH値を有するバッファーを調製した。pH2.0〜7.0の範囲のバッファーを、0.1mol/lクエン酸塩を用いて調製し、pH6.0〜9.0の範囲のバッファーを、0.1mol/l trisを用いて調製し、pH8.0〜12.0の範囲のバッファーを、0.2mol/lグリシンを用いて調製した。必要なpH値は、HClまたはNaOHを用いて調節した。色素形成合成ペプチドZ−Gly−Pro−AMC(バッヘム(Bachem)、スイス)を、両方の酵素の基質として使用した。各ウェル(コスター(Costar)番号3631プレート)中85uLのバッファー、10uLの酵素溶液および5uLの基質(60%メタノール中の4mM Z−Gly−Pro−AMC)を導入した。黒色アスペルギルス(A.niger)酵素の終濃度は32ug/ml(3.2ミリ単位/ml)であり、F.メニンゴセプチカム(F.meningosepticum)酵素の終濃度は0.21ug/ml(7.4ミリ単位/ml)であった。反応を混合した後、37.0℃で30分間進行させ、その後、パーセプティブ・バイオサイエンシーズ(PerSeptive Biosciences)のサイトフラー(CytoFluor)マルチウェルプレートリーダー中で蛍光を測定した。得られた相対的データを図1に示す。また、プロリルエンドプロテアーゼの最適温度を確立した。そのため、精製された酵素調製物を、0.02mol/l CaCl2を含有する0.1mol/l酢酸Na中、pH5.0で2時間、カゼインレゾルフィン(ロシュ(Roche)バーション3)を基質として用い、異なる温度でインキュベートし、574nmで測定することによって酵素活性を定量した。得られた結果によると、黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼは、およそ50℃の最適温度を有する。
【0139】
実施例3
黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼの特異性
複数コピーの発現カセットを含む、黒色アスペルギルス(A.niger)株から得られた、そのまま、ならびにクロマトグラフィーによって精製された酵素試料(国際公開第02/45524号パンフレット参照)を、色素形成ペプチド基質の収集に対して試験して、コードされるエンドプロテアーゼの特異性を確立した。酵素のエンド型タンパク質分解活性をAAXpNA基質に関して試験した。「pNA」(p−ニトロアニリド)基質は、X−pNAペプチド結合が切断されると、色の変化を引き起こす。「X」は、種々の天然アミノ酸残基を表す。AAX−pNA基質のストック溶液(150mmol/l)を、20 CaCl2を含有する0.1M酢酸塩バッファーpH4.0中で100倍希釈した。TECAN ゲニオス(Genios)MTPリーダー(ウィーン、ザルツブルグ)において、405nmで、40℃で10分間の運動測定によって、エクセルでのデータ処理によって図2に示される画像を生じる、光学密度の増大が記録された。結果から、黒色アスペルギルス(A.niger)由来エンドプロテアーゼが、アラニル結合に対する副活性ありで、プロリルペプチド結合に対して高度に特異的であることが明らかである。そのまま、およびクロマトグラフィーによって精製された調製物は、同様の活性プロフィールを示した。黒色アスペルギルス(A.niger)由来エンドプロテアーゼの、アミノペプチダーゼ、カルボキシペプチダーゼまたは非プロリン特異的エンドプロテアーゼでの混入は、有意でないと示すことができた(実施例5参照)。
【0140】
実施例4
黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼは、大きいタンパク質ならびに小さいペプチドを加水分解することができ、したがって真のエンドプロテアーゼである。
特異的な構造上の特性のために、S9ファミリーに属するプロリルオリゴペプチダーゼは、30アミノ酸より大きいペプチドを消化することができない。この制限は、種々のタンパク質を可能な限り迅速かつ効率的に加水分解しなければならない酵素にとって明らかな欠点である。黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼが、基質分子の大きさに関して同じ制限を示すかどうかを調べるために、本発明者らは、黒色アスペルギルス(A.niger)由来の、クロマトグラフィーによって精製したプロリルエンドペプチダーゼを、小さい合成ペプチドとともに、および大きいオボアルブミン分子とともにインキュベートし、形成された加水分解産物をSDS−PAGEによって分析した。
【0141】
使用した合成ペプチドは、配列NH2−FRASDNDRVIDPGKVETLTIRRLHIPR−COOHの27マーであり、ペップスキャン(Pepscan)社(オランダ、レリスタット)から贈られた。そのアミノ酸配列によって示されるように、このペプチドは、2つのプロリン残基を、一方を中央に、一方をペプチドのカルボキシ末端近くに含む。
【0142】
インタクトなオボアルブミン分子(ピアス・イムジェクト(Pierce Imject)、20mgの凍結乾燥物質を含むバイアル)は、分子量が42750Daの、385アミノ酸からなる。この分子は、14個のプロリン残基を含み、その一つは分子の最C末端に位置し、プロリン特異的エンドプロテアーゼによって切断することができない。オボアルブミンおよびオリゴペプチドを、精製された黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼとともに、50℃で別々にインキュベートした。いくらかの時間間隔で、試料を採取し、次いでそれをSDS−PAGEを用いて分析した。
【0143】
4.5単位/mlの活性を有する、クロマトグラフィーによって精製された黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼを、20mM CaCl2を含有する0.1M酢酸塩バッファーpH4で100倍希釈した。オボアルブミンを、酢酸塩バッファーpH4中に、1mg/ml(22μM)の濃度まで溶解させた。27マーを、0.48mg/ml(152μM)の濃度に達するまで、同じバッファー中に溶解させた。オボアルブミンおよび27マー溶液のモル濃度を、両方の溶液が切断可能なプロリン残基の同じモル濃度を含むように選択した。オボアルブミンは、13個の潜在的なプロリン切断部位を含むが、27マーペプチドは、2つしか有さない。両方の基質溶液のうち、0.5mlを、エッペンドルフ(Eppendorf)サーモミキサー中、50℃で、10μl(0.45ミリU)の酵素溶液とともにインキュベートした。いくらかの時間間隔で、10μlの試料をインキュベーション混合物から採取し、SDS−PAGEまで20℃で維持した。SDS−PAGEおよび染色に使用した全ての物質を、インビトロジェン(Invitrogen)から購入した。製造業者の使用説明書に従ってSDSバッファーを使用して試料を調製し、製造業者の使用説明書に従ってMES−SDSバッファー系を使用して、12%Bis−Trisゲルで分離した。染色は、シンプリー・ブルー・セイフ・ステイン(Simply Blue Safe Stain)(コロイド状クマシーG250)を使用して行った。
【0144】
図3に見られるように、オボアルブミンは、アスペルギルス(Aspergillus)由来酵素によって、インキュベーションの最初の4.75時間で約35〜36kDの別個のバンドに切断される(レーン3)。長期のインキュベーション期間によって、種々の分子量の、より小さい生成物への、さらなる分解が生じる(レーン7)。
【0145】
レーン2と比較して、レーン4、6および8の、よりかすかなバンドによって判断されるように、27マーペプチドもまた分解する。生成物の、非常に小さい分子量変化(レーン9および8を比較)は、ペプチドのカルボキシ末端でのアルギニン残基の切断による可能性が最も高い。差は約200D(アルファイメージャー(AlphaImager)2000システムでアルファイメージャー(AlphaImager)3.3dソフトウエアを使用して測定)であり、アルギニンは、174の分子量を有する。この小さい分子量変化は、おそらくは、ペプチドの分解における最初の段階である。
【0146】
生成物のさらなる崩壊はまた、SDSゲルでのバンドの強度の減少によってのみ見られる。ゲルにおいて、約1000の分子量を有する成分の染色はクマシーブリリアントブルーでは可能でないので、さらなる崩壊の生成物は目に見えない。この実験から、S9ファミリーに属する公知のプロリルオリゴペプチダーゼとは異なり、黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼは、より大きいタンパク質と比べて、小型のペプチドの切断に対して特異的選択性を有さないと結論付けることができる。このように、黒色アスペルギルス(A.niger)由来酵素は真のエンドプロテアーゼを表し、種々の型のタンパク質を加水分解するための好ましい酵素である。
【0147】
実施例5
血圧降下ペプチドの生成における、望ましい、および混入している酵素活性の定量。
本発明によると、GMPからIPPを回収することによって、比較的純粋なIPPを、単純な一段階プロセスで得ることができる。種々の異なる酵素調製物によって、IPP含有画分を、GMPから得ることができる。例えば、GMPを、(GMPを、オリゴペプチダーゼに対する改善された基質を形成する、より小さい断片に切断するために)サブチリシンもしくはメタロプロテアーゼ等の極微量の別の純粋なエンドペプチダーゼと組み合わせて、純粋なプロリン特異的エンドプロテアーゼ、もしくは純粋なプロリン特異的エンドプロテアーゼ+純粋なアミノペプチダーゼ、もしくは純粋なプロリン特異的オリゴペプチダーゼのいずれかとともに、またはプロリン特異的トリペプチジルアミノペプチダーゼ(日本の天野の商業的な「ウマミザイム(Umamizyme)」調製物中に存在するような)と組み合わせて、純粋なアミノペプチダーゼとともに、または種々の種類のタンパク質分解活性を含む複雑な酵素調製物とともにインキュベートすることによって。この実施例において、3つの商業的酵素調製物を、それらの種々のタンパク質分解活性について試験した。すなわち、フレーバーザイム(Flavourzyme)1000LバッチHPN00218(ノボザイム(Novozyme)、スミチーム(Sumizyme)FP(新日本(Shin Nihon)、日本)およびコロラーゼ(Corolase)LAP Ch.:4123(ABエンザイムス(AB Enzymes)、英国)。フレーバーザイム(Flavourzyme)およびスミチーム(Sumizyme)FPの両方とも、非特異的エンド型タンパク質分解およびカルボキシペプチド分解活性の他に、いくつかのアミノペプチド分解酵素活性を含む、複雑な酵素調製物として公知である。コロラーゼ(Corolase)LAPは、アスペルギルス(Aspergillus)由来の、比較的純粋な、クローニングおよび過剰発現された、ロイシンアミノペプチダーゼ活性を表す。
【0148】
本質的に純粋な、は、使用されるインキュベーション条件下での、混入しているエンドプロテアーゼならびに混入しているカルボキシペプチダーゼまたはアミノペプチダーゼの活性が最小限であるか、または好ましくはないことを意味する。以下の試験手順を考案して、かかる混入しているエンド、アミノ、およびカルボキシペプチダーゼ活性を定量した。
【0149】
試験手順のための基礎を、種々の選択的色素形成ペプチドの収集によって形成する。プロリン特異的オリゴおよびエンドプロテアーゼのみが、ペプチドZ−AAAP−pNAからpNAを放出させることができるので、この特定のペプチドを用いて、所望のプロリン特異的エンド型タンパク質分解活性を定量した。多くのエンドプロテアーゼがペプチドZ−AAAF−pNAおよびZ−AAAR−pNAからpNAを放出させることができるので、これらの2つのペプチドを用いて、混入している、非プロリン特異的エンド型タンパク質分解活性を定量した。β−カゼイン分子中に存在するようなペプチドQNIPPおよびVVVPPの、それぞれIPPおよびVPPへの転換は、GlnおよびVal残基を効率的に除去することができるアミノペプチダーゼを必要とするので、ペプチドQ−pNAおよびV−pNAを用いて、所望のアミノペプチダーゼ活性を定量した。多くのカルボキシペプチダーゼが、ペプチドからPheおよびArg残基を放出させることができるので、これらの残基を含むペプチドを選択して、混入しているカルボキシペプチダーゼ活性を定量した。しかしながら、カルボキシペプチダーゼ活性を測定するための、適した色素形成基は入手できないので、合成ペプチドZ−AFおよびZ−ARを用いた代替的方法を開発しなければならなかった。この代替的方法を、下記に提供する。使用した全ての合成ペプチドにおいて、「Z」はベンジルオキシカルボニルを表し、「pNA」は発色団パラ−ニトロアニリドを表す。全ての色素形成ペプチドは、ペップスキャン(Pepscan)(オランダ、レリスタット)から入手した。ペプチドZ−AFおよびZ−ARは、バッヘム(Bachem)(スイス)から購入した。全てのインキュベーションは、40℃で行った。希釈した酵素調製物を、商業的製品の濃度に再計算した。
【0150】
アミノペプチダーゼ活性の測定
100%DMSO中の150mmol/lのV−pNAおよびQ−pNAのストック溶液を、0.1M BisTrisバッファーpH6中で80倍希釈して、V−pNAおよびQ−pNAを1:1の比で含有する3.75mmol/l V−pNA+Q−pNA基質溶液を作製した。このアミノペプチダーゼ基質溶液の200μlのアリコートを、マイクロタイタープレート(MTP)の別々のウェルにピペットで入れた。MTPを、マゼラン(Magellan)4ソフトウエアで稼動しているテカン・ゲニオス(Tecan Genios)MTP(ウィーン、ザルツブルグ)中、40℃でプレインキュベートした。3mMの基質濃度でインキュベーションが起こるように、50μlの適当な酵素溶液を加えることによって反応を開始させた。典型的には、液体酵素試料、フレーバーザイム(Flavourzyme)、コロラーゼ(Corolase)LAPおよびプロリン特異的エンドプロテアーゼの1:50希釈を使用した。乾燥スミチーム(Sumizyme)FP製品のうち、1%溶液を使用した。アミノ酸−pNA結合の切断の結果として発生する、テカン・ゲニオス(Tecan Genios)MTPによって405nmで測定した黄色を、少なくとも20運動サイクルの間(約10分間)追跡した。ソフトウエアから、OD405/分として得られるデータを生じた。
【0151】
プロリン特異的エンドプロテアーゼ活性の測定
測定を、アミノペプチダーゼアッセイと本質的に同じように行ったが、この場合は、Z−AAAP−pNAを唯一の基質として、3mmol/lの終濃度で使用した。懸濁液をpH6バッファー中50〜55℃で加熱することによって、この基質を可溶化させ、室温で透明な溶液を生じた。測定を40℃で行った。典型的には、液体酵素試料フレーバーザイム(Flavourzyme)およびコロラーゼ(Corolase)LAPの1:50希釈を使用した。スミチーム(Sumizyme)FPは1%溶液で使用した。プロリン特異的エンドプロテアーゼは、典型的には、1:5000期尺で使用した。
ソフトウエアから、OD405/分としてデータを生じた。
【0152】
混入している非プロリン特異的エンドプロテアーゼ活性の測定
この測定も、アミノペプチダーゼアッセイについて記載されているのと本質的に同じように行ったが、この試験においては、Z−AAAF−pNAおよびZ−AAAR−pNAを1:1の比および3mmol/lの終濃度で基質として使用した。基質Z−AAAF−pNAは、使用したpH6.0試験条件下で可溶性が乏しいことがわかったが、サブチリシンと試験インキュベーションは、pNA放出と同時の、基質の迅速な可溶化を生じた。測定は、40℃で行った。しかしながら、この乏しい可溶性を補償するために、MTPリーダーをプログラムして、運動サイクルの間で振とうさせた。
【0153】
ここでも、ソフトウエアから、OD405/分としてデータを生じた。
【0154】
混入しているカルボキシペプチダーゼ活性の測定
カルボキシペプチダーゼ活性を測定するための感度の高い色素形成ペプチドが入手できないので、カルボキシペプチダーゼCの定量のためのベーリンガープロトコールに基づいて、方法を使用した。
【0155】
2つの、エタノール中のZ−A−FおよびZ−A−Rの150mmol/lストック溶液を、0.1mol/l BisTrisバッファーpH6中で80倍希釈して、Z−A−FおよびZ−A−Rを1:1の比で含有する3.75mmol/l Z−A−F+Z−A−R基質溶液を作製した。次いで、200μlの基質溶液を、ピペットでエッペンドルフバイアルに入れ、40℃でプレインキュベートした。50μlの適当な酵素希釈を加えることによって、反応を開始させた。典型的には、フレーバーザイム(Flavourzyme)およびコロラーゼ(Corolase)LAPおよびプロリン特異的エンドプロテアーゼの1:50希釈を使用した。スミチーム(Sumizyme)FPについては、1%溶液を使用した。5分後、250μlのニンヒドリン試薬を加えることによって、反応を停止させた。ニンヒドリン試薬は、15mlのDMSOに溶解させた400mgのニンヒドリン(メルク(Merck))および60mgのヒドリンダンチンでできており、そこに5mlの4.0mol/l酢酸リチウムバッファーpH5.2を加えた。4.0mol/l酢酸リチウムバッファーは、LiOH(シグマ(Sigma))を溶解させ、その後氷酢酸(メルク(Merck))を用いて溶液のpHをpH5.2に調節することによって、作製した。
【0156】
反応を停止させた後、各試料を95℃で15分間加熱して、色形成を促進し、続いて、純粋なエタノールで10倍希釈した。形成された色を、ユビコン(Uvikon)分光光度計において、578nmで測定した。活性試料と同様にブランクを作製したが、ニンヒドリン試薬および酵素添加は逆転させた。カルボキシペプチダーゼ活性によって生じた遊離アミノ酸の量を定量するために、アミノ酸L−フェニルアラニンを用いて、較正曲線を作成した。0.1875、0.375、0.75、1.5および3.0mmol/lのL−フェニルアラニン(シグマ(Sigma))を含有するバッファーpH6中の溶液を、試料と同様に、すなわち250μlバイアル中で処理した。得られたOD578値から、エクセルで曲線を構築した。Z−A−FおよびZ−A−R基質を含む試料中に存在する遊離アミノ酸の濃度を、この曲線を用いて計算した。得られた値から、試験した酵素の量あたりのμmol/分でカルボキシ−ペプチダーゼ活性を計算した。
【0157】
活性比の計算
本発明による方法のための種々の酵素調製物の適合性を確立するために、関連性のある酵素活性の比率を計算した。MTPリーダーベースのアッセイにおいて、酵素活性は、経時的なpNA放出によって、すなわちΔOD405/分として、特徴付けられる。MTPリーダーによって得られた酵素活性の比率を、単純に同一の量の酵素で得られたΔOD/分値で割ることによって計算した。
【0158】
しかしながら、カルボキシ−ペプチダーゼアッセイの場合、MTP−pNAベースのアッセイによって生じるΔOD/分と直接比較できないODが生じる。ここで、測定されたODを、まず、1分間あたりに放出されたμmolアミノ酸(μmol/分)に変換した。次いで、放出されたpNAのΔOD/分をμmol/分に変換した。そのため、純粋なpNA(シグマ(Sigma))の希釈0.25、0.125、0.0625、0.0312および0.015mmol/lおよびMTPリーダーで較正曲線を生じ、ウェルあたり250μlを測定した。得られたデータから、エクセルで較正曲線を構築した。pNAベースの測定値をニンヒドリンベースの測定値と比較できるように、この較正曲線から、ΔOD/分をμmol/分に変換した。
【0159】
上述の試験で生じたデータに基づいて、使用した種々の酵素調製物を特徴付けた。提供される各酵素調製物中に存在するプロリン特異的オリゴまたはエンド型タンパク質分解活性に関するデータを、表1中、「プロリン特異的活性」欄に示す。所望のアミノペプチダーゼ活性(AP/プロリン特異的活性)および混入しているカルボキシペプチダーゼ(CPD/プロリン特異的活性)およびエンド型タンパク質分解活性(エンド/プロリン特異的活性)に関するデータを、存在するプロリン特異的活性に関して示す。各調製物中に存在する、混入しているカルボキシペプチダーゼ活性に関する、所望のアミノペプチダーゼ活性を、(AP/CPD)として示す。
【0160】
試験した商業的酵素調製物のうち、任意のプロリン特異的オリゴまたはエンド型タンパク質分解活性を含むものがないことが明らかである。さらに、試験した全ての商業的酵素調製物は、カルボキシペプチダーゼおよびエンド型タンパク質分解活性を含む。酵素の組み合わせC1は、4つの単位のプロリン特異的エンドプロテアーゼ+130μlの商業的コロラーゼ(Corolase)LAPからなり、その非常に低いレベルの混入しているカルボキシペプチダーゼおよびエンド型タンパク質分解活性のために目立っている高収量のACE阻害IPP、VPPおよびLPPペプチドを生じる、存在するタンパク質性基質1gあたりに適用される。
【0161】
【表1】

【0162】
それらの、高い含有量のアミノおよびカルボキシペプチダーゼ活性に基づいて、複雑な酵素混合物スミチーム(Sumizyme)FPおよびフレーバーザイム(Flavourzyme)とのGMPのインキュベーションは、高レベルの遊離アミノ酸を生じると予想することができる。これらの遊離アミノ酸は、マイヤール反応の増大の結果としてブロスの味の変化を与えると予想することができる。さらに、これらの酵素調製物中の非プロリンまたは非アラニン特異的エンド型タンパク質分解活性の存在は、最終製品中の、さらなる、およびおそらく生物活性ペプチドの可溶化につながり、それによってIPPの純粋な血圧降下効果が不鮮明になる。これら全ての望ましくない副反応を最小限にするために、本質的に純粋なアミノペプチダーゼとの、本質的に純粋なプロリン特異的プロテアーゼの組み合わせが好ましい。本質的に純粋なプロリン特異的エンドプロテアーゼのみの使用が、さらにより好ましい。
【0163】
実施例6
カゼイン塩からのGMPおよびIPPの単離
市販のGMPを、チーズホエーから得る。この方法において、乳をキモシンとともにインキュベートして、水溶性GMP部分をκ−カゼインから放出させる。その結果、カゼイン塩が沈殿してカードを形成し、それによってGMP部分が最後に、種々の方法によって単離することができるチーズホエーになる。この実施例において、本発明者らは、GMPの単離のための代替的経路、すなわち、市販のカゼイン塩からの単離を記載する。この経路の利点は、GMPの選択的除去の後、残ったカゼイン塩画分を代替的用途に使用することができる点である。本方法によると、当該分野で公知の方法に従って(脱脂)乳を酸性化して、カゼイン画分を選択的に沈殿させる。沈殿した画分は全てのカゼイン、すなわち、α、β、κ(GMP部分を含む)およびγ−カゼインを組み込む。この、形成されたカゼインカードを、「甘味ホエー」画分から分離し、洗浄して、残りのホエー成分および酸性化プロセスによって生じたイオンを除去する。脱水後、例えばKOHを用いた中和によって、カゼインカードを再溶解させて、関連性のある「カゼイン塩」を生じる。
【0164】
10%(w/v)カゼイン酸カリウム溶液(およそpH6.4)を31℃で1時間、ウシキモシンとともにインキュベーションして、GMP部分をκ−カゼインから放出させた。この場合、2.2IMCUマキシレン(Maxiren)(DSMフード・スペシャリティーズ(DSM Food Specialities)、オランダ、デルフト)を、カゼイン塩1gあたりに使用した。得られた溶液を1つ以上のろ過工程に供して、溶解した低分子量GMP部分を、カゼインおよびキモシンの両方を含む高分子量画分から分離した。GMP含有浸透液をpH4.5まで酸性化し、黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼを、存在するタンパク質1gあたり4単位の濃度で加えた。温度を55℃まで上昇させて、酵素の活性を最大限にし、インキュベーションを3時間続行した。次いで、得られた溶液を、蒸発によって濃縮し、95℃まで5分間加熱して、プロリン特異的エンドプロテアーゼを不活性化させた。最後に、加熱した濃縮物を限外ろ過して、沈殿したタンパク質を可能な限り除去し、噴霧乾燥した。噴霧乾燥した物質のLC/MS/MS分析によると、IPP濃度は、カゼイン塩出発物質1gあたり、0.6mgのIPPと定量された。
【0165】
実施例7
単一のインキュベーション工程でのGMPからのIPPの遊離
一連のインキュベーションを行って、黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼおよびスミチーム(Sumizyme)FPが、血圧降下トリペプチドIPPをGMPから遊離させるのに適していることを実証した。この実験において、市販のGMP調製物を使用した(デンマークのアルラ(Arla)からのラクプロダン(Lacprodan)CGMP−10、ロット番号P340205)。その規格によると、得られた粉末は、(存在するタンパク質の)約80%のGMP含有量で、およそ85%のタンパク質を含み、すなわち、1gのラクプロダン(Lacprodan)CGMP−10粉末は、およそ0.85×0.8=0.7gの純粋なGMPを含む。
【0166】
GMPを、脱塩水中に溶解させた(450ml中に50gのGMP)。この溶液のpHは6.7である。この溶液のうち、135mlを、4N HClを用いてpH4にし、さらなる水を加えて150mlの体積および10%固体のGMP濃度に到達させた。pH6.7溶液のうち、45mlを、4N HClでpH6にし、90mlを、4N KOHを用いてpH8にした。両方の溶液に余分な水を加えて、10%GMP固体の濃度にも到達させた。プロリン特異的エンドプロテアーゼとのインキュベーションのpH4.0は、pH4がこの酵素の最適を表すので、選択した。スミチーム(Sumizyme)FPは、全てそれら自体の最適pHを有する、種々のエンドプロテアーゼ、アミノペプチダーゼおよびカルボキシペプチダーゼの混合物からなるので、このインキュベーションは、種々のpH条件下で行った。
【0167】
表に示すように、種々のpH値に調節したこれら3つの溶液とともに、種々の酵素とのインキュベーションを行った。プロリン特異的エンドプロテアーゼを0.4U/ml(約4.2U/grのタンパク質)の濃度で使用し、スミチーム(Sumizyme)FPを1mg/mlの終濃度(約10.4mg/grのタンパク質)で使用した。全てのインキュベーションは、40℃に設定した水浴中の50mlコニカルグライナー(Greiner)チューブで6時間、穏やかな振とう下で行った。インキュベーション後、LC/MS/MS分析まで、試料を−20℃で冷凍保存した。後者の分析で得られたデータを表に示し、IPP、VPPおよびLPP参照溶液を用いて測定した。
【0168】
【表2】

【0169】
【表3】

【0170】
得られた結果から、純粋なプロリン特異的エンドプロテアーゼとのインキュベーションが、ペプチドVPPおよびLPPを欠くIPP含有生成物を生じることが明らかである。この非最適化インキュベーションにおいて放出されたIPPの量は、GMP中に存在するIPP部分のおよそ50%を表す。最も重要なことに、複雑なスミチーム(Sumizyme)FP酵素とのインキュベーションもまた、GMPからのIPPの形成につながった。本発明者らのデータによると、最も効率的には、pH8条件下。スミチーム(Sumizyme)FPでは、プロリン特異的エンドプロテアーゼとのインキュベーションにおけるよりもIPP収量が低いことは、単に、実験におけるスミチーム(Sumizyme)FP酵素の投与下の状態を反映するだけである。極めて意外なことに、スミチーム(Sumizyme)FPはIPPを生じるだけでなく、ラクプロダン(Lacprodan)物質からVPPおよびLPPも生じた。トリペプチドVPPおよびLPPはβ−カゼインアミノ酸配列でのみ生じるので、それらの存在は、得られたGMP物質にβ−カゼインが混入していることを明らかに示す。
【0171】
実施例8
GMPから得られるIPP含有加水分解物の官能上の利点を実証するために、試験実験を行った。この実験において、3つの異なる基質、すなわち、GMP、カゼイン酸カリウムおよび脱脂乳を、黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼとともにインキュベートした。この純粋な酵素を用いて、κカゼイン中に存在するIPPのみを切除することができる(国際公開第2006/005757号パンフレット参照)。3つ全てのインキュベーションは、3.5%(w/w)のタンパク質の、同じタンパク質濃度を含み、同じ量の酵素、すなわち、4単位/gタンパク質を含んでいた。カゼインの沈殿を防ぐために、溶液のpHを6.2に調節した。インキュベーションを3時間進行させ、次いで、短い熱処理によって終了させた。
【0172】
3つ全てのインキュベーションにおいて、相当な沈殿が存在した。遠心分離によってこれらの沈殿を除去した後、透明な(IPP含有)上清を、5人からなる訓練された回答者団によって試験した。回答者団のメンバーは、以下の濃度の硫酸キニーネ溶液で訓練した。15mg/L硫酸キニーネ>強度苦味=1、20mg/L硫酸キニーネ>強度苦味=2、30mg/L硫酸キニーネ>強度苦味=3および50mg/L硫酸キニーネ>強度苦味=4。回答者団は、0(苦くない)〜4(非常に苦い)の尺度に基づいて、各加水分解物の苦味のスコアをつけた。回答者は、味のセッションの前に15mg/L硫酸キニーネの参照試料を与えられ、1の苦味強度値を割り振った。カゼイン加水分解物は、味の回答者団の全てのメンバーに、非常に苦い、すなわち4と判断された。脱脂乳加水分解物もまた、回答者団の全てのメンバーが3をつけ、苦かった。GMP加水分解物を味見すると、回答者団は、全員一致で1のスコアをつけた。GMP加水分解物はまた、最も高い濃度のIPPを生じると予想することができることを考慮すると、本発明による方法の意外な利益が、明らかに実証される。
【0173】
実施例9
発酵による、GMPからのIPPの遊離
発酵乳製品の乏しい嗜好性、および発酵ブロスからのACE阻害ペプチドの回収の間に遭遇する多くの処理の難点は、米国特許第6,428,812号明細書に記載されている。この実施例において、本発明者らは、GMP分子がまた、発酵によるIPPの生成のための適した基質であることを実証する。
【0174】
2つの乳酸桿菌(Lactobacillus)株、アシドフィルス菌(Lactobacillus acidophilus)ラフティ(LAFTI)(登録商標)L10およびカセイ菌(Lactobacillus casei)ラフティ(LAFTI)(登録商標)L26(DSMフード・スペシャリティーズ(DSM Food Specialities)、オーストラリア)を、この試験において使用した。嫌気ジャー中、CO2+N2雰囲気下(アネロゲン(AnaeroGen)(商標)、オキソイド(Oxoid))、MRSブロス(オキソイド(Oxoid))中37℃で24時間、両方の株を増殖させた。得られた前培養物を、次いで、発酵ブロス「a」または発酵ブロス「ay」に接種した。発酵ブロス「a」は、Tween80(1ml/l)、K2HPO4(2g/l)、NaAc(3g/l)、クエン酸(NH4)3(2g/l)、MgSO4.7H2O(0.2g/l)、MnSO4.4H2O(0.05g/l)、グルコース(20g/l)、GMP(ラクプロダン(Lacprodan)、アルラ(Arla)、22g/l)を含有した。発酵ブロス「ay」は、酵母抽出物も含有した(4.0g/l)。新しく接種した発酵ブロス「a」および「ay」を、上記で概略を述べた条件下で、さらに24時間インキュベートした。その後、これらの発酵ブロスを遠心分離し、トリペプチドIPP、LPPおよびVPPの存在について、上清をLC/MSによって分析した。表4に示されるように、L10株とのインキュベーションにおいてのみ、IPPの存在が、0.3mg/lのレベルで検出できた。LPPおよびVPPは存在しなかった。試料1および5の味見からは、有意な味の変化は現れなかった。
【0175】
【表4】

【図面の簡単な説明】
【0176】
【図1】種々のpH条件下で蛍光基質Z−Gly−Pro−AMCに基づいて測定した、F.メニンゴセプチカム(F.meningosepticum)のプロリン特異的オリゴペプチダーゼおよび黒色アスペルギルス(A.niger)由来のプロリン特異的エンドプロテアーゼの活性プロフィール。蛍光は、30分後に37℃で測定した。
【図2】黒色アスペルギルス(A.niger)由来プロリルエンドプロテアーゼの特異性プロフィール。
【図3】クロマトグラフィーによって精製した黒色アスペルギルス(A.niger)由来プロリン特異的エンドプロテアーゼとのインキュベーションの後の、インタクトなオボアルブミンおよび合成27マーペプチドのSDS−PAGE。
【特許請求の範囲】
【請求項1】
タンパク質源を加水分解して少なくとも40%の−I−P−P−配列をペプチドIPPに遊離させることを含み、タンパク質源中に存在するプロリン残基のカルボキシ末端で切断するタンパク質分解酵素が使用され、酵素が好ましくはプロリン特異的エンドプロテアーゼまたはプロリン特異的オリゴペプチダーゼ、より好ましくはプロリン特異的エンドプロテアーゼ、および場合によりアミノペプチダーゼであり、タンパク質源が、−I−P−P−配列を有し、タンパク質アミノ酸配列中に−V−P−P−よりも少なくとも6倍多く存在する−I−P−P−(モル基準)を有するタンパク質を含む、タンパク質源からIPPを生成する方法。
【請求項2】
プロリンのカルボキシ末端で切断する前記タンパク質分解酵素およびアミノペプチダーゼが、好ましくは単一の工程で、ともにインキュベートされる、請求項1に記載の方法。
【請求項3】
プロテアーゼの混合物が使用される、請求項1または2に記載の方法。
【請求項4】
前記タンパク質源が、少なくとも50%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%(w/w)の、−V−P−P−を含まないタンパク質を含む、タンパク質の混合物を含む、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記タンパク質源がGMPを含む、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
少なくとも50%(w/w)、好ましくは少なくとも80%(w/w)、より好ましくは少なくとも90%(w/w)のタンパク質がGMPである、請求項5に記載の方法。
【請求項7】
GMP中に存在する−I−P−P−配列の、少なくとも20%、好ましくは少なくとも40%、より好ましくは少なくとも60%、最も好ましくは少なくとも70%がペプチドIPPに変換される、請求項5または6に記載の方法。
【請求項8】
アミノペプチダーゼおよびプロリン特異的プロテアーゼとのGMPのインキュベーションを含み、好ましくはGMPがまずアミノペプチダーゼとともにインキュベートされ、その後プロリン特異的プロテアーゼ、好ましくはプロリン特異的エンドプロテアーゼとともにインキュベートされる、GMPからIPPを生成する方法。
【請求項9】
前記プロリン特異的プロテアーゼが加えられた場合に前記アミノペプチダーゼに活性がない、請求項8に記載の方法。
【請求項10】
前記タンパク質源を加水分解する間に形成される、IPPを含む可溶性ペプチドが、分離され、場合により乾燥される、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
加水分解物を含む組成物であって、前記加水分解物がIPPを含み、30%未満、好ましくは20%未満、より好ましくは15%未満の加水分解度を有する、組成物。
【請求項12】
加水分解物を含む組成物であって、前記加水分解物がIPPを含み、オピオイドペプチドを欠いている、組成物。
【請求項13】
1.5〜0.5の間、好ましくは1.3〜0.7の間のモル比でIPPおよびTSTPを含む組成物。
【請求項14】
請求項1〜10のいずれか一項に記載の方法によって得ることができる、ペプチド組成物。
【請求項15】
GMPからIPPを生成するための、プロリン特異的エンドプロテアーゼ、またはプロリン特異的オリゴペプチダーゼおよびアミノペプチダーゼの使用。
【請求項16】
健康の改善または疾患の予防および/もしくは治療のための機能性食品、好ましくは薬剤の製造のため、または高血圧(高血圧症)、心不全、糖尿病前症もしくは糖尿病、肥満、グルコース寛容減損またはストレス等の疾患の治療もしくは予防のための機能性食品、好ましくは薬剤の製造のための、機能性食品、好ましくは薬剤としての、請求項11〜14のいずれか一項に記載の組成物または請求項1〜10のいずれか一項に従って生成された組成物の使用。
【請求項17】
前記組成物が、栄養補助食品の形態、ローション剤、ゲル、もしくはエマルジョンの形態の局所適用を含む個人医療用途の形態で、または食物、飼料もしくはペットフード成分としての形態にある、請求項16に記載の使用。
【請求項18】
肥満の予防または体重制御のための機能性食品の製造のための、請求項11〜14のいずれか一項に記載の組成物の使用。
【請求項19】
心臓血管の健康維持のための機能性食品の製造のための、請求項11〜14のいずれか一項に記載の組成物の使用。
【請求項20】
前記心臓血管の健康維持が、アンジオテンシン変換酵素の阻害を含む、請求項18または19に記載の使用。
【請求項21】
前記心臓血管の健康維持が、血中コレステロールレベルの制御を含む、請求項20に記載の使用。
【請求項22】
その消費者に健康上の利益を提供することができ、前記健康上の利益が、肥満の予防、体重制御および心臓血管の健康維持から選択され、請求項11〜14のいずれか一項に記載の組成物を含む、機能性食品。
【請求項23】
前記心臓血管の健康維持の利益が、アンジオテンシン変換酵素の阻害および/または血中コレステロールレベルの制御を含む、請求項22に記載の機能性食品。
【請求項24】
50〜200mmol/kgのK+および/または15〜60mmol/kgのCa2+および/または6〜25mmol/kgのMg2+を含む、請求項22または23のいずれかに記載の機能性食品。
【請求項25】
110〜135mmol/kgのK+および/または35〜45mmol/kgのCa2+および/または13〜20mmol/kgのMg2+を含む、請求項24に記載の機能性食品。
【請求項26】
1つ以上のビタミンBを含む、請求項22〜25のいずれかに記載の機能性食品。
【請求項27】
ギ酸、ビタミンB6およびビタミンB12を含む、請求項26に記載の機能性食品。
【請求項28】
3〜25重量%のステロール、より好ましくは7〜15重量%のステロールを含む、請求項22〜27のいずれかに記載の機能性食品。
【請求項29】
(a)請求項1〜10のいずれか一項に記載の、IPPを含む組成物の生成、および
(b)前記IPP含有組成物の、食品、飲料または栄養補助食品への組み込み
を含む、食品、飲料または栄養補助食品を調製する方法。
【請求項30】
工程(a)において、乳タンパク質、好ましくはカゼインが使用される、請求項29に記載の方法。
【請求項31】
工程(c)加水分解されたタンパク質からの可溶性ペプチドの分離も含む、請求項29に記載の方法。
【請求項32】
工程(c)が、工程(a)の後かつ工程(b)の前に起こる、請求項31に記載の方法。
【請求項33】
前記食品、飲料または栄養補助食品が、マーガリン、スプレッド、バター、乳製品もしくはホエー含有飲料、好ましくはヨーグルト、またはヨーグルトもしくは乳等の乳ベースの製品からなる群より選択される、請求項29に記載の方法。
【請求項34】
請求項29〜33のいずれか一項の記載の方法によって得ることができる、食品、飲料または栄養補助食品。
【請求項35】
0.05〜10重量%、より好ましくは0.1〜5重量%、最も好ましくは0.2〜4重量%の前記IPP含有組成物を含む、請求項34に記載の食品、飲料または栄養補助食品。
【請求項36】
それぞれ製品100gあたり0.05〜50mg、より好ましくは0.1〜40mg、最も好ましくは0.2〜30mgのIPPおよびTSTPを含む、請求項34または35に記載の食品、飲料または栄養補助食品。
【請求項37】
IPP対TSTPの重量比が1.5〜0.5、より好ましくは1.3〜0.7である、請求項34〜36のいずれか一項に記載の食品、飲料または栄養補助食品。
【請求項38】
ヒトの高血圧症を軽減するための使用のための、請求項34〜37のいずれか一項に記載の食品、飲料または栄養補助食品。
【請求項39】
TSTP。
【請求項1】
タンパク質源を加水分解して少なくとも40%の−I−P−P−配列をペプチドIPPに遊離させることを含み、タンパク質源中に存在するプロリン残基のカルボキシ末端で切断するタンパク質分解酵素が使用され、酵素が好ましくはプロリン特異的エンドプロテアーゼまたはプロリン特異的オリゴペプチダーゼ、より好ましくはプロリン特異的エンドプロテアーゼ、および場合によりアミノペプチダーゼであり、タンパク質源が、−I−P−P−配列を有し、タンパク質アミノ酸配列中に−V−P−P−よりも少なくとも6倍多く存在する−I−P−P−(モル基準)を有するタンパク質を含む、タンパク質源からIPPを生成する方法。
【請求項2】
プロリンのカルボキシ末端で切断する前記タンパク質分解酵素およびアミノペプチダーゼが、好ましくは単一の工程で、ともにインキュベートされる、請求項1に記載の方法。
【請求項3】
プロテアーゼの混合物が使用される、請求項1または2に記載の方法。
【請求項4】
前記タンパク質源が、少なくとも50%、好ましくは少なくとも80%、より好ましくは少なくとも90%、最も好ましくは少なくとも95%(w/w)の、−V−P−P−を含まないタンパク質を含む、タンパク質の混合物を含む、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記タンパク質源がGMPを含む、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
少なくとも50%(w/w)、好ましくは少なくとも80%(w/w)、より好ましくは少なくとも90%(w/w)のタンパク質がGMPである、請求項5に記載の方法。
【請求項7】
GMP中に存在する−I−P−P−配列の、少なくとも20%、好ましくは少なくとも40%、より好ましくは少なくとも60%、最も好ましくは少なくとも70%がペプチドIPPに変換される、請求項5または6に記載の方法。
【請求項8】
アミノペプチダーゼおよびプロリン特異的プロテアーゼとのGMPのインキュベーションを含み、好ましくはGMPがまずアミノペプチダーゼとともにインキュベートされ、その後プロリン特異的プロテアーゼ、好ましくはプロリン特異的エンドプロテアーゼとともにインキュベートされる、GMPからIPPを生成する方法。
【請求項9】
前記プロリン特異的プロテアーゼが加えられた場合に前記アミノペプチダーゼに活性がない、請求項8に記載の方法。
【請求項10】
前記タンパク質源を加水分解する間に形成される、IPPを含む可溶性ペプチドが、分離され、場合により乾燥される、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
加水分解物を含む組成物であって、前記加水分解物がIPPを含み、30%未満、好ましくは20%未満、より好ましくは15%未満の加水分解度を有する、組成物。
【請求項12】
加水分解物を含む組成物であって、前記加水分解物がIPPを含み、オピオイドペプチドを欠いている、組成物。
【請求項13】
1.5〜0.5の間、好ましくは1.3〜0.7の間のモル比でIPPおよびTSTPを含む組成物。
【請求項14】
請求項1〜10のいずれか一項に記載の方法によって得ることができる、ペプチド組成物。
【請求項15】
GMPからIPPを生成するための、プロリン特異的エンドプロテアーゼ、またはプロリン特異的オリゴペプチダーゼおよびアミノペプチダーゼの使用。
【請求項16】
健康の改善または疾患の予防および/もしくは治療のための機能性食品、好ましくは薬剤の製造のため、または高血圧(高血圧症)、心不全、糖尿病前症もしくは糖尿病、肥満、グルコース寛容減損またはストレス等の疾患の治療もしくは予防のための機能性食品、好ましくは薬剤の製造のための、機能性食品、好ましくは薬剤としての、請求項11〜14のいずれか一項に記載の組成物または請求項1〜10のいずれか一項に従って生成された組成物の使用。
【請求項17】
前記組成物が、栄養補助食品の形態、ローション剤、ゲル、もしくはエマルジョンの形態の局所適用を含む個人医療用途の形態で、または食物、飼料もしくはペットフード成分としての形態にある、請求項16に記載の使用。
【請求項18】
肥満の予防または体重制御のための機能性食品の製造のための、請求項11〜14のいずれか一項に記載の組成物の使用。
【請求項19】
心臓血管の健康維持のための機能性食品の製造のための、請求項11〜14のいずれか一項に記載の組成物の使用。
【請求項20】
前記心臓血管の健康維持が、アンジオテンシン変換酵素の阻害を含む、請求項18または19に記載の使用。
【請求項21】
前記心臓血管の健康維持が、血中コレステロールレベルの制御を含む、請求項20に記載の使用。
【請求項22】
その消費者に健康上の利益を提供することができ、前記健康上の利益が、肥満の予防、体重制御および心臓血管の健康維持から選択され、請求項11〜14のいずれか一項に記載の組成物を含む、機能性食品。
【請求項23】
前記心臓血管の健康維持の利益が、アンジオテンシン変換酵素の阻害および/または血中コレステロールレベルの制御を含む、請求項22に記載の機能性食品。
【請求項24】
50〜200mmol/kgのK+および/または15〜60mmol/kgのCa2+および/または6〜25mmol/kgのMg2+を含む、請求項22または23のいずれかに記載の機能性食品。
【請求項25】
110〜135mmol/kgのK+および/または35〜45mmol/kgのCa2+および/または13〜20mmol/kgのMg2+を含む、請求項24に記載の機能性食品。
【請求項26】
1つ以上のビタミンBを含む、請求項22〜25のいずれかに記載の機能性食品。
【請求項27】
ギ酸、ビタミンB6およびビタミンB12を含む、請求項26に記載の機能性食品。
【請求項28】
3〜25重量%のステロール、より好ましくは7〜15重量%のステロールを含む、請求項22〜27のいずれかに記載の機能性食品。
【請求項29】
(a)請求項1〜10のいずれか一項に記載の、IPPを含む組成物の生成、および
(b)前記IPP含有組成物の、食品、飲料または栄養補助食品への組み込み
を含む、食品、飲料または栄養補助食品を調製する方法。
【請求項30】
工程(a)において、乳タンパク質、好ましくはカゼインが使用される、請求項29に記載の方法。
【請求項31】
工程(c)加水分解されたタンパク質からの可溶性ペプチドの分離も含む、請求項29に記載の方法。
【請求項32】
工程(c)が、工程(a)の後かつ工程(b)の前に起こる、請求項31に記載の方法。
【請求項33】
前記食品、飲料または栄養補助食品が、マーガリン、スプレッド、バター、乳製品もしくはホエー含有飲料、好ましくはヨーグルト、またはヨーグルトもしくは乳等の乳ベースの製品からなる群より選択される、請求項29に記載の方法。
【請求項34】
請求項29〜33のいずれか一項の記載の方法によって得ることができる、食品、飲料または栄養補助食品。
【請求項35】
0.05〜10重量%、より好ましくは0.1〜5重量%、最も好ましくは0.2〜4重量%の前記IPP含有組成物を含む、請求項34に記載の食品、飲料または栄養補助食品。
【請求項36】
それぞれ製品100gあたり0.05〜50mg、より好ましくは0.1〜40mg、最も好ましくは0.2〜30mgのIPPおよびTSTPを含む、請求項34または35に記載の食品、飲料または栄養補助食品。
【請求項37】
IPP対TSTPの重量比が1.5〜0.5、より好ましくは1.3〜0.7である、請求項34〜36のいずれか一項に記載の食品、飲料または栄養補助食品。
【請求項38】
ヒトの高血圧症を軽減するための使用のための、請求項34〜37のいずれか一項に記載の食品、飲料または栄養補助食品。
【請求項39】
TSTP。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2008−537476(P2008−537476A)
【公表日】平成20年9月18日(2008.9.18)
【国際特許分類】
【出願番号】特願2007−556603(P2007−556603)
【出願日】平成18年2月23日(2006.2.23)
【国際出願番号】PCT/EP2006/060198
【国際公開番号】WO2006/089921
【国際公開日】平成18年8月31日(2006.8.31)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.ペンティアム
2.PENTIUM
【出願人】(503220392)ディーエスエム アイピー アセッツ ビー.ブイ. (873)
【Fターム(参考)】
【公表日】平成20年9月18日(2008.9.18)
【国際特許分類】
【出願日】平成18年2月23日(2006.2.23)
【国際出願番号】PCT/EP2006/060198
【国際公開番号】WO2006/089921
【国際公開日】平成18年8月31日(2006.8.31)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.ペンティアム
2.PENTIUM
【出願人】(503220392)ディーエスエム アイピー アセッツ ビー.ブイ. (873)
【Fターム(参考)】
[ Back to top ]

