グリシンベタイン合成酵素遺伝子で形質転換された環境ストレス耐性ヤトロファ
【課題】環境ストレス耐性ヤトロファを作出することであり、そのために野生型ヤトロファを環境ストレス耐性に形質転換させることのできる遺伝子等を見出すことである。
【解決手段】グリシンサルコシンメチルトランスフェラーゼ遺伝子およびN,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子で形質転換された、環境ストレス耐性ヤトロファである。この環境ストレス耐性ヤトロファは、グリシンベタインを過剰に合成するために、浸透圧ストレス、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して、優れた耐性を有する。
【解決手段】グリシンサルコシンメチルトランスフェラーゼ遺伝子およびN,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子で形質転換された、環境ストレス耐性ヤトロファである。この環境ストレス耐性ヤトロファは、グリシンベタインを過剰に合成するために、浸透圧ストレス、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して、優れた耐性を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、グリシンベタイン合成酵素遺伝子で形質転換された環境ストレス耐性ヤトロファ、その製造および利用に関する。
【背景技術】
【0002】
ヤトロファ・クルカス(Jatropha curcas)は、非食用ヤトロファ油を製造することから、バイオディーゼル燃料生産のための生物資源として注目を集めている。また、ヤトロファは、水分や無機栄養について、他の作物の生育不適地でも栽培できる植物として知られており、半乾燥地の有効利用と緑化のために非常に有益であると考えられている。一方、ヤトロファ属植物は、荒地で育つものの、結実回数も年1回、実のサイズもパームよりかなり小さいため、自然栽培による油脂の生産効率は高くない。このような理由から、生産性の高いヤトロファの開発が求められている。
【0003】
ヤトロファ油の生産性効率の改善の方法の1つとしては、例えば特許文献1に開示されているように、種子の油含有量を増大させるべく、アセチルCoAカルボキシラーゼ(ACCアーゼ)を過剰発現可能に形質転換する方法がある。
【0004】
一方、ヤトロファ自体の生産性を上げる観点から、水不足条件下でも高い成長性を確保できるような乾燥耐性の付与が考えられる。
一般に、植物は、乾燥、塩、低温などの環境要因によって、生育が大きく左右されることから、環境ストレス耐性を付与した農作物の開発が期待されている。乾燥ストレス耐性遺伝子組換え植物としては、乾燥ストレスに対して適応または応答できるように、ストレス応答シグナル伝達強度、機構を改変したもの、耐性に関与するタンパク質分子(環境ストレスに応答するタンパク質)を過剰生産するように改良する方法などが考えられる。植物をはじめ多くの生物は、様々な環境ストレスに遭遇した場合、グリシンベタインやプロリンなどの適合溶質を蓄積して蛋白質、核酸等の変性および失活を防止することが知られている(横田明穂編、植物分子生理学入門p203-207)。
【0005】
アカザ科植物のオオムギやホウレンソウおよび好塩菌、従属栄養細菌の多くは、浸透圧ストレスに応答して、適合溶質としてグリシンベタインを細胞質に蓄積するが、これらの生物においてはコリンを起点とした酸化反応によりグリシンベタインを産生、蓄積する経路を持っている。
【0006】
特許文献2には、そのコリンからのグリシンベタインの合成に関与する遺伝子を植物に導入することで、当該植物が塩などによる浸透圧ストレスのみならず、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して耐性を有することが記載されている。具体的には、コリンからグリシンベタインへの2段階の生合成に関与するコリンデヒドロゲナーゼおよびベタインアルデヒドデヒドロゲナーゼの2つの遺伝子を、淡水性ラン藻シネココッカス(Synechococcus)属に導入したところ、導入していないものに比べて、塩ストレス下でも高い増殖性を示したことが示されている。
【0007】
また、グリシンベタインの生合成ルートとしては、上記のコリンからのルートの他に、数種の好塩性光合成細菌およびメタン細菌類が有するグリシンを起点とするグリシンベタイン合成ルートが知られている(非特許文献1〜3)。これらの細菌類では、S−アデノシルメチオニンをメチル基供与体として利用し、グリシンを3段階でメチル化することによりグリシンベタインを合成する。この反応はグリシンサルコシンメチルトランスフェラーゼ(Glycine sarcosine methyltransferase:以下GSMTと略す)およびN,N−ジメチルグリシンメチルトランスフェラーゼ(N,N-dimethylglycine methyltransferase:以下DMTと略す)によって触媒される(図1)。非特許文献1〜3には、アクチノポリスポラ・ハロフィラ(Actinopolyspora halophila)、エクトチオロロドスピラ・ハロクロリス(Ectothiorhorhodospira halochloris)、アファノティーキ・ハロフィティカ(Aphanothece halophytica)、シネココッカス(Synechococcus)sp. WH8102、マイコバクテリウム・マリナム(Mycobacterium marinum)、プロクロロコツカス・マリヌス(Prochlorococcus marinus)およびハロロドスピラ・ハロクロリス(Halorhodospira halochloris)のそれぞれに由来する、GSMTおよびDMTのアミノ酸配列が記載されており、相互に類似している。
【0008】
非特許文献4では、死海から単離した好塩性ラン藻アファノティーキ・ハロフィティカに由来するGSMTおよびDMTの遺伝子を、シロイヌナズナおよび淡水性ラン藻シネココッカス属に導入したところ、環境ストレス耐性が著しく向上したことが報告されている。特に乾燥耐性に関してはシロイヌナズナの場合、苗を灌水後、水を3日間絶ち、再灌水した実験がなされた結果、光合成量子収率および、外観的生育状態が野生株に比べて高い乾燥耐性を示すことが報告されている。
しかし、GSMTおよびDMTの遺伝子をヤトロファに導入したとの報告はない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表2009−536029号公報
【特許文献2】特許第3144260号公報
【非特許文献】
【0010】
【非特許文献1】Nyyssola A et al., "Extreme Halophiles Synthesize Betaine from Glycine by Methylation" J. Biol. Chem. 275:22196-22201 (2000)
【非特許文献2】Waditee R et al., "Isolation and Functional Characterization of N-Methyltransferases That Catalyze Betaine Synthesis from Glycine in a Halotolerant Photosynthetic Organism Aphanothece halophytica" J. Biol. Chem. 278:4932-4942 (2003)
【非特許文献3】Lu W et al., "Identification of glycine betaine as compatible solute in Synechococcus sp. WH8102 and characterization of its N-methyltransferase genes involved in betaine synthesis" Arch. Microbiol. 186:495-506 (2006)
【非特許文献4】Waditee R et al., "Genes for direct methylation of glycine provide high levels of glycinebetaine and abiotic-stress tolerance in Synechococcus and Arabidopsis" PNAS 102:1318-1323 (2005)
【発明の概要】
【発明が解決しようとする課題】
【0011】
環境ストレスに対するシグナル伝達経路のメカニズムは複雑であり、乾燥ストレス耐性植物の作出についても、上記のように、種々の形質転換方法が提案されている。しかしながら、ヤトロファに関しては、乾燥ストレスにかかわる制御タンパク質、耐性にかかわる機能タンパク質などは明らかにされていない。
本発明が解決しようとする課題は、環境ストレス耐性ヤトロファを作出することにあり、そのために野生型ヤトロファを環境ストレス耐性に形質転換させることのできる遺伝子等を見出すことにある。
【課題を解決するための手段】
【0012】
その課題を解決するために、本発明者らは、ヤトロファを環境ストレス耐性に形質転換するための遺伝子について検討した結果、グリシンベタインの生合成に関与するグリシンサルコシンメチルトランスフェラーゼ(GSMT)およびN,N−ジメチルグリシンメチルトランスフェラーゼ(DMT)の遺伝子をヤトロファに導入したところ、得られた形質転換ヤトロファが、浸透圧ストレス、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して、優れた耐性を有することを見出して、本発明を完成した。すなわち、本発明は、以下の通りである。
【0013】
[1] GSMT遺伝子およびDMT遺伝子で形質転換された、環境ストレス耐性ヤトロファ。
[2] GSMT遺伝子が、
(a)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスまたはハロロドスピラ・ハロクロリスに由来するGSMTをコードするポリヌクレオチド、および
(b)(a)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(a)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチドから選択され、
DMT遺伝子が、
(c)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスまたはハロロドスピラ・ハロクロリスに由来するDMTをコードするポリヌクレオチド、および
(d)(c)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(c)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチドから選択される、
[1]記載の環境ストレス耐性ヤトロファ。
【0014】
[3] GSMT遺伝子およびDMT遺伝子が、それぞれ配列番号1および2で示される塩基配列を有するポリヌクレオチドである、[1]記載の環境ストレス耐性ヤトロファ。
[4] GSMT遺伝子および/またはDMT遺伝子が組み入れられた、ヤトロファ形質転換用ベクター。
[5] [4]記載のヤトロファ形質転換用ベクターを、野生型ヤトロファに導入することによる、環境ストレス耐性ヤトロファの製造方法。
[6] [1]〜[3]のいずれか1つに記載の環境ストレス耐性ヤトロファから収穫される種子。
[7] [6]記載の種子を圧搾して精製することによる、ヤトロファ油の製造方法。
[8] [7]記載の製造方法で製造されうる、ヤトロファ油。
【発明の効果】
【0015】
本発明に係る形質転換ヤトロファは、ヤトロファ内でGSMTおよびDMTが過剰に発現され、それによってグリシンベタインが過剰に生合成される。このグリシンベタインによって、浸透圧ストレス、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して、優れた耐性を有する。
【図面の簡単な説明】
【0016】
【図1】グリシンサルコシンメチルトランスフェラーゼ(GSMT)およびN,N−ジメチルグリシンメチルトランスフェラーゼ(DMT)によって触媒されるグリシンベタイン合成経路を示す図である。
【図2】pGWB11プラスミドの遺伝子マップ(Nakagawa et al., "Development of Series of Gateway Binary Vectors, pGWBs, for Realizing Efficient Construction of Fusion Genes for Plant Transformation", Journal of Bioscience and Bioengineering Vol. 104 (2007), No. 1 p.38より転載)である。
【図3】DMTおよびGSMTの遺伝子を一つのプラスミドベクターに導入したpGWB/DMT/GSMTの作成概要図である。
【図4】DMT遺伝子およびGSMTの遺伝子で形質転換したヤトロファの幼苗の写真である。1、2、4および5の幼苗はベクターpGWB/DMT/GSMTを用いて形質転換をして得られたものであり、3の幼苗はベクターpGWB/DMTとベクターpGWB/GSMTとを用いて形質転換して得られたものである。
【図5】GSMT遺伝子およびDMT遺伝子の存在をPCR法を用いて識別した結果を示す図である。Pは、ベクターpGWB/DMTまたはベクターpGWB/GSMTのものであり、NはDNAサンプルを入れずにPCRを行ったものである。1、2、4および5はベクターpGWB/DMT/GSMTを用いて形質転換をして得られた幼苗のものであり、3はベクターpGWB/DMTとベクターpGWB/GSMTとを用いて形質転換して得られた幼苗のものである。
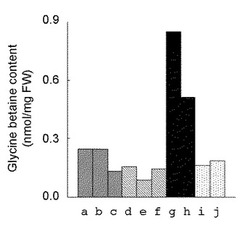
【図6】種々のヤトロファに含まれるグリシンベタイン含量の測定結果を示す図である。a〜cのサンプルは充分に潅水して育てている野性型ヤトロファ(コントロール)の葉であり、d〜fのサンプルは2週間、潅水を停止して乾燥ストレスを与えた野性型ヤトロファの葉であり、gおよびhのサンプルは形質転換した1および2の幼苗であり、iおよびjのサンプルは野性型ヤトロファから調製した幼苗である。
【発明を実施するための形態】
【0017】
〔GSMTおよびDMTの遺伝子〕
本発明におけるヤトロファに導入されるGSMT遺伝子およびDMT遺伝子は、ヤトロファ内でGSMTおよびDMTを生合成する限り、いかなる生物に由来するものでもよく、またそれらの置換、欠失または付加されたものであってもよい。
好ましいGSMT遺伝子としては、例えば、
(a)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスもしくはハロロドスピラ・ハロクロリスに由来するGSMTをコードするポリヌクレオチド、または
(b)(a)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(a)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチド等が挙げられる。ここで、(b)のポリヌクレオチドの塩基配列は、(a)のポリヌクレオチドの塩基配列と好ましくは95%以上の相同性を有し、さらに好ましくは98%以上の相同性を有し、特に好ましくは99%以上の相同性を有する。さらに好ましいGSMT遺伝子としては、(a)のポリヌクレオチドが挙げられる。さらに好ましくは、シネココッカスsp. WH8102に由来するGSMTである配列番号3で示されるポリペプチドをコードするポリヌクレオチドが挙げられ、特に好ましくは、配列番号1で示される塩基配列を有するポリヌクレオチドが挙げられる。
【0018】
好ましいDMT遺伝子としては、例えば、
(c)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスもしくはハロロドスピラ・ハロクロリスに由来するDMTをコードするポリヌクレオチド、または
(d)(c)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(c)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチド等が挙げられる。ここで、(d)のポリヌクレオチドの塩基配列は、(c)のポリヌクレオチドの塩基配列と好ましくは95%以上の相同性を有し、さらに好ましくは98%以上の相同性を有し、特に好ましくは99%以上の相同性を有する。さらに好ましいDMT遺伝子としては、(c)のポリヌクレオチドが挙げられる。さらに好ましくは、シネココッカスsp. WH8102に由来するDMTである配列番号4で示されるポリペプチドをコードするポリヌクレオチドが挙げられ、特に好ましくは、配列番号2で示される塩基配列を有するポリヌクレオチドが挙げられる。
【0019】
本発明におけるGSMT遺伝子およびDMT遺伝子の調製方法は特に限定されない。例えば、入手可能なGSMT遺伝子およびDMT遺伝子を購入するか、あるいは既知のGSMT遺伝子およびDMT遺伝子の配列を利用して既知または未知の生物のゲノムDNAから取得することができる。また、これらの遺伝子において、常法に従って、所定の塩基を置換させ、欠失させ、または付加させることで、人工的に合成することもできる。
【0020】
耐塩性ラン藻シネココッカスsp. WH8102のGSMTおよびDMTをコードするDNAは、シネココッカスsp. WH8102のゲノムDNAより取得できる。シネココッカスsp. WH8102ゲノムデータベースのアクセションナンバーBX569694の領域79539〜80387がGSMTに、アクセションナンバーBX569694の領域78691〜79533がDMTにそれぞれ対応する。それぞれのDNA配列を配列番号1および2に示す。本発明の遺伝子を発現させて得られるタンパク質、すなわちシネココッカスsp. WH8102のDMTおよびGSMTのアミノ酸配列を配列番号3および4にそれぞれ示す。以下、「GSMT遺伝子」および「DMT遺伝子」という場合は、本発明において利用されるGSMT遺伝子およびDMT遺伝子を総称する。
【0021】
例えば、耐塩性ラン藻シネココッカスsp. WH8102ゲノムから、下記プライマーセットを用いてPCR反応を行うことにより、直接、目的とするGSMT遺伝子およびDMT遺伝子それぞれのPCR産物を得ることができる。
(GSMTのフォワードプライマー:配列番号5)
5'- CACCATGGGCACGACGAACGGCTG -3'
(GSMTのリバースプライマー:配列番号6)
5'- ACCAGGCTTGCGCAACCGCATC-3'
(DMTのフォワードプライマー:配列番号7)
5'- CACCATGACGTCAACGCAGAACCATCCATTGC -3'
(DMTリバースプライマー:配列番号8)
5'- GTGCATGGTGGTGTCGACGTCG -3'
得られたPCR産物の塩基配列の決定、確認は、従来より公知の手法、例えば、マキサム−ギルバートの化学修飾法、またはM13ファージを用いるジデオキシヌクレオチド鎖終結法等の公知手法により行えばよい。
【0022】
〔乾燥ストレス耐性形質転換ヤトロファの作出〕
本発明の乾燥ストレス耐性形質転換ヤトロファは、GSMT遺伝子およびDMT遺伝子を発現または発現調節のためのプロモータと作動可能に連結した発現カセットを、野生型ヤトロファに遺伝子導入することにより作製される。
本発明が対象とするヤトロファの種類は特に限定されず、ヤトロファ・クルカス(Jatropha curcus)、ヤトロファ・ポタグリカ(Jatropha potagurica)、ヤトロファ・ムルチフィダ(Jatropha multifida)、ヤトロファ・ベルランディエリ(Jatropha berlandieri)、ヤトロファ・インテゲリマ(Jatropha integerrima)などを用いることができる。これらのうち、油脂含有量が多いという点から、ヤトロファ・クルカスが好ましく用いられる。
【0023】
遺伝子導入方法は、プロトプラスト同士を融合させる方法、電気穿孔法、遺伝子ショットガン法等の細胞に直接的にDNAを導入する方法;アグロバクテリウム(Agrobacterium tumefaciens)やAgrobacterium rhizogenesを利用して間接的に導入する方法のいずれの方法により行ってもよいが、好ましくはアグロバクテリウムを用いる方法である。以下、アグロバクテリウムを用いる形質転換方法について説明する。
【0024】
アグロバクテリウムは植物病細菌で、LB(レフトボーダー)とRB(ライトボーダー)に挟まれた領域(T−DNA(Transferred DNA)領域)を切り出して宿主ゲノムに挿入することができるTiプラスミドをもっている。このT−DNA領域内に、導入しようとする遺伝子、すなわちDMT遺伝子およびGSMT遺伝子を組み込んだプラスミドを有するアグロバクテリウムを、宿主植物へ感染させると、T−DNA領域が切り出されて、vir領域にコードされているタンパク質群と複合体を形成して植物細胞内に侵入し、さらに宿主ゲノムに挿入することができる。
【0025】
アグロバクテリウムを用いる形質転換方法としては、バイナリーベクター法が好ましい。バイナリーベクター法とは、TiプラスミドのT−DNAを欠落させたプラスミド(pAL4404など)とは別に、T−DNA領域のボーダー(LBおよびRB)を有するプラスミドのT−DNA領域に目的の外来遺伝子を組み込んだプラスミドをアグロバクテリウムに導入して植物に感染させることにより、目的遺伝子を植物ゲノムに挿入する方法である。
【0026】
バイナリーベクター法を利用した、形質転換ヤトロファの作出に用いられる発現カセットは、T−DNA領域に、上記本発明に係るGSMT遺伝子およびDMT遺伝子、ならびに当該ヌクレオチド発現のためのプロモータ、マーカー遺伝子、レポータ遺伝子を含んでいる。
プロモータとしては、35Sカリフラワーモザイクウィルスプロモータ、ノパリンシンターゼ(NOS)プロモータ、およびβファゼオリン、ナピン、ユビキチンなどの他の胚乳特異的プロモータが挙げられる。
【0027】
選択マーカー遺伝子としては、抗生物質または除草剤のような選択剤に対する抵抗性を付与する遺伝子が用いられる。具体的には、カナマイシン耐性遺伝子、パロモマイシンB耐性遺伝子、またはグルフォシネートおよびグリフォセートのような除草剤に対する抵抗性遺伝子などが挙げられる。形質転換体を視覚的に同定できる選択マーカー、例えば、ルシフェラーゼ、または緑色蛍光タンパク質(GFP)のような発色または蛍光タンパク質を発現する遺伝子または種々の発色体基質が知られているβ−グルクロニダーゼまたはGUSを発現する遺伝子も利用することができる。このような選択マーカーは、レポータ遺伝子としても利用できる。
【0028】
必要に応じて、さらにエンハンサー、ターミネータ、タグなどを含んでもよい。エンハンサーは、目的遺伝子の発現効率を高めるために用いられ、CaMV35Sプロモーター内の上流側の配列を含むエンハンサー領域などが挙げられる。ターミネータとしては、プロモータにより転写された遺伝子の転写を終結できる配列であればよく、例えば、ノパリン合成酵素(NOS)遺伝子のターミネータ、オクトビン合成酵素(OCS)、CaMV35SRNA遺伝子のターミネータが挙げられる。
【0029】
バイナリーベクター法によるヤトロファの形質転換に用いるバイナリーベクターとしては、上記発現カセットをT−DNA領域に含むもので、具体的には、pBI系、pPZP系、pSMA系、pGWB系などの市販ベクターに上記発現カセットを組み入れたものを用いることができる。特に、Gateway(登録商標)のクローニングシステムが適用可能な植物形質転換用バイナリーベクターが好ましく、このようなベクターとしては、pGWB系ベクターが挙げられる。このpGWB系ベクターは、プロモータとしてカリフラワーモザイクウィルス(CaMV)35Sプロモータ;選択マーカー遺伝子としては、ハイグロマイシン耐性遺伝子、カナマイシン耐性遺伝子;レポータとしてβ−グルクロニダーゼ(GUS)、緑色蛍光タンパク質(GFP)、ルシフェラーゼ(LUC)、黄色蛍光タンパク質(YFP)、シアン蛍光タンパク質(CFP);タグとして、6xHis、FLAG、3xHA、4xMyc、GST、T7−エピトープを用いて、目的遺伝子およびレポータが作動可能に連結されている。さらにN末端、C末端の双方に融合できるように、レポータ、タグをコードする配列がある。今回用いたpGWB11プラスミドベクターの模式図を図2に示す。
【0030】
Gateway(登録商標)クローニングシステムとは、Gateway(登録商標)シグナル(att)を用いることによって、発現ベクターの構築を容易にしたものである。attP1、attP2配列を有するドナーベクターと目的遺伝子の両端にattB1、attB2配列を付加したものとの間で反応(BP反応)させることにより、目的遺伝子が組み込まれたエントリーベクター(両端にattL1、attL2配列を有する)を作製し、次いで、このエントリーベクターと発現に必要なプロモータが組み込まれたデスティネーションベクター(attR1、attR2配列を付加)と組みかえ反応(LR反応)することにより、目的遺伝子が挿入されたベクター(発現ベクター)を作製する方法である。
【0031】
従って、まず、クローニングしたDMT遺伝子およびGSMT遺伝子を、ドナーベクターとの間でBP反応させることによりドナーベクターに組み入れたエントリーベクターを調製し、次いでこのエントリーベクターとデスティネーションベクター(pGWB)とをLR反応させることにより、目的とする遺伝子(GSMT遺伝子およびDMT遺伝子)が35Sプロモーターの制御下に組み入れられた発現ベクター(pGWB11/GSMT、pGWB11/DMT)を作製することができる。また、図3のようにpGWB11/GSMT、pGWB11/DMTを改良し、GSMT遺伝子およびDMT遺伝子を同一のpGWB11ベクター上に組み込むことが出来る。
【0032】
Gateway(登録商標)バイナリーベクター(pGWB)を用いた植物形質転換用発現カセットの構築については、Nakagawa et al., "Development of Series of Gateway Binary Vectors, pGWBs, for Realizing Efficient Construction of Fusion Genes for Plant Transformation", Journal of Bioscience and Bioengineering Vol. 104, No.1, 34-41(2007)に詳述されている。
【0033】
以上のようにして作成した発現ベクター(植物形質転換用ベクター)は、大腸菌中で増幅させることができる。増幅した形質転換用ベクターは、エレクトロポレーション法等により、アグロバクテリウムに導入すればよい。このようにして発現ベクターを導入したアグロバクテリウムを、ヤトロファの形質転換に用いる。
植物形質転換用ベクターを搭載したアグロバクテリウムの感染によるヤトロファへの目的遺伝子(GSMT遺伝子およびDMT遺伝子)の導入は、リーフディスク法などの公知の方法を用いて行うことができる。
【0034】
具体的には、アグロバクテリウムをMS培地に懸濁した感染用菌液を調製し、この菌液に宿主となるヤトロファの一部(好ましくは子葉のカット片、以下「ヤトロファ葉片」という)を浸漬後、ヤトロファ葉片を取り出し、3日間程度共培養する。共培養に先立って、ヤトロファの葉片を、MS培地に2日間程度浸漬し、さらにはソニケーションしておくことが好ましい。これにより導入効率を高くすることができる。さらにまた、ヤトロファの葉をアグロバクテリウム菌の懸濁液に浸漬した状態で減圧処理すると、アグロバクテリウムの感染率が高まり、好ましい。
共培養培地としては、MS培地などに、3−インドール酪酸(IBA)、6−ベンジルアミノプリン(BA)などの植物ホルモンを添加した培地が用いられる。
【0035】
共培養後、ヤトロファ葉片を洗浄し、選択培地(形質転換用ベクターの発現カセットで用いられた選択マーカー遺伝子に対応する抗生物質を含有)に移して、インキュベートした後、葉片に形成されたカルスを切り取り、選択培地に移して、さらに、形質転換されたヤトロファ(組換え細胞)のスクリーニングを行う。
選択培地としては、選択用物質となる抗生物質(カナマイシン、ハイグロマイシン)を、前培養に用いた培地(MS培地など)に添加し、さらに植物ホルモンとして、IBA、BAなどを含有したものが好ましく用いられる。
【0036】
次に、選抜したカルスをRoot induction(RI)培地、MS培地などの培地に移して、発根させ、植物体へ再分化させる。再分化誘導は、培地におけるオーキシンやサイトカイニン等の植物成長調節物質、炭素源等の各種成分の種類や量、光、温度等を適切に設定することにより行うことができる。例えば、特開2011−155968号公報の記載に従って、以下の3つの工程によって、カルスから植物体を調製することができる。
[工程a]植物成長調節物質としてIBAとBAのみを含むMS培地でヤトロファ属植物の細胞からシュートを形成させる工程
[工程b]前記形成されたシュートを植物成長調節物質としてBAのみを含むMS培地に移植して伸長させる工程
[工程c]前記伸長させたシュートを植物成長調節物質としてIBAのみを含む1/2MS培地に移植して発根させる工程
なお、工程aにおいて、子葉に由来する細胞を用いる場合は、MS培地にチジアズロン(TDZ)を加える必要がないが、成葉に由来する細胞を用いる場合は、まずTDZを含むMS培地でシュートの誘導を行うことが好ましい。成葉は子葉と異なって再分化能力が劣り、内在性ホルモンが相違するためである。その後、TDZの影響を残さないようにTDZを含まない培地でシュートの増殖を促進する。また、工程cにおいて、1/2MS培地に代えて、ガンボーグB5培地を用いることが好ましく、特に形質転換体の場合、1/2MS培地よりも、ガンボーグB5培地を用いたほうが、発根の効率が格段に促進される。
【0037】
〔形質転換ヤトロファの識別方法〕
形質転換ヤトロファ植物体におけるGSMT遺伝子およびDMT遺伝子の存在はPCR法で簡便に識別することが出来る。形質転換体の組織から抽出したゲノムDNAサンプルに対して、以下のプライマーセットを用いてPCRを行なう。具体的には、GSMTの検出には下記の配列番号9および10のプライマーを、DMTの検出には下記の配列番号11および12のプライマーを用いる。PCRによる形質転換体の識別は、例えば後述の実施例および図5に記載の通り実施できる。
(GSMTのフォワードプライマー:配列番号9)
5’- TCTCCTGAATCGGTTCGCGAGAC -3’
(GSMTのリバースプライマー:配列番号10)
5’- GCGGTGATCAAGAATCAAGATGCC -3’
(DMTのフォワードプライマー:配列番号11)
5’- GACGCTGATCAGTTTTACGAACAGG -3’
(DMTのリバースプライマー:配列番号12)
5’- CAGCAATCCCATCTCCACACCA -3’
また、植物体のGSMTタンパク質およびDMTタンパク質の生成をより直接的に予測するため、GSMTおよびDMTのmRNAの存在量で確認することもできる。上記形質転換細胞(GSMTおよびDMTタンパク質をプロモータによって発現する形質転換双子葉細胞)および、コントロール(野生型ヤトロファの双子葉細胞)の個体から各々のmRNAを抽出して、通常用いられるノーザンブロッティング法またはRT−PCR法によってmRNA量を測定して、比較することで確認することができる。
【0038】
〔ヤトロファからのグリシンベタイン分析用サンプル抽出方法〕
ヤトロファからのグリシンベタイン抽出方法は以下のように行なう。2mLエッペンドルフチューブに植物サンプルを入れ、重量を測定する(約25mg)。そこにクロロホルムを250μL、メタノールを250μL、破砕用のジルコニアビーズ(直径4mm)を入れる。ミキサーミル(QIAGEN)にセットし、25Hz/秒で2分間破砕する。1mMメチオニンスルフォン(内部標準)を25μL、超純水175μLを加えボルテックスでよく混合し、17,500gで5分間遠心してクロロホルム層と水/メタノール層に分離した。水/メタノール層をフィルター付1.5mLチューブ(Millipore)に移し、17,500gで2時間遠心する。ろ液を1.5mLエッペンドルフチューブに移し遠心エバポレーター(EYELA)で2時間乾燥させる。完全に乾燥が終わったら超純水30μLに溶解し、さらに超純水で5倍希釈した溶液を測定に使用する。
【0039】
〔質量分析装置(CE−MS)を用いたヤトロファにおけるグリシンベタイン含量の測定方法〕
分析にはキャピラリー電気泳動システム(Agilent 1100)を用い、キャピラリーは内径50μm、長さ100cmフューズドシリカキャピラリーを使用する。電気泳動バッファは1Mギ酸(pH1.9)を使用し、分析開始前に約950mbarの圧力で30分間平衡化を行う。各分析の前にも泳動バッファで10分間のカラム内部の洗浄および平衡化を行ってから50mbarで2秒間の圧力をかけサンプルの注入を行う(約2nL)。電気泳動は27kVで20分間行い、エレクトロスプレーイオン化法を用い、シース液として5mM酢酸アンモニウムの50%メタノール溶液を10μL/分、ドライガスとして300℃の窒素ガスを10L/分で流す。MSの設定はフラグメント電圧70V、キャピラリー電圧3,000Vで行う。検出はグリシンベタインと内部標準のm/z118と182のみを選択的に測定する。
【0040】
本発明の形質転換ヤトロファでは、グリシンベタインの生合成に関与する酵素GSMTおよびDMTをコードする遺伝子を野生型と比べて多量に有しているので、グリシンベタインを野生株よりも高い含量で蓄積することができる。具体的には、植物葉組織細胞中で、グリシンベタインの含量は野生型の場合、生葉重量1mgあたり約0.2nmol以下であるのに対し、形質転換体では0.5〜0.8nmol以上のレベルで生成されることができる。分析は、例えば後述の実施例および図6に記載の通り実施できる。
【0041】
本発明の形質転換植物体は、形質転換処理を施した「T1世代」のほか、その植物の種子から得られた後代である「T2世代」、薬剤選抜あるいはPCR法、サザン法等による解析により形質転換であることが判明した「T2世代」植物の花を自家受粉して得られる次世代(T3世代)などの後代植物も含まれる。
【0042】
〔ヤトロファ油の製造〕
ヤトロファ油は本発明の形質転換ヤトロファから収穫される種子から、常法に従って製造することができる。例えば、種子を圧搾して原料油を得て、その原料油をフィルターでろ過することで、バイオディーゼルとして使用しうるヤトロファ油を製造することができる。ヤトロファ油をさらに精製したい場合は、例えば蒸留により精製することでき、また特開2010−209177号公報に記載された方法でホルボールエステルを除去することもできる。
【実施例】
【0043】
本発明を実施するための形態を実施例により説明する。下記実施例は、本発明の範囲を限定するものではない。
【0044】
〔シネココッカスsp. WH8102のGSMTおよびDMTを含むDNAの取得〕
シネココッカスsp. WH8102のGSMTおよびDMTをコードする遺伝子は耐塩性ラン藻シネココッカスsp. WH8102のゲノムDNAを用いた。
シネココッカスsp. WH8102のゲノムDNAを鋳型として、下記プライマーセットを用いて、PCR反応を行うことにより、目的とするGSMT遺伝子およびDMT遺伝子を増幅した。
(GSMTのフォワードプライマー:配列番号5)
5'- CACCATGGGCACGACGAACGGCTG -3'
(GSMTのリバースプライマー:配列番号6)
5'- ACCAGGCTTGCGCAACCGCATC-3'
(DMTのフォワードプライマー:配列番号7)
5'- CACCATGACGTCAACGCAGAACCATCCATTGC -3'
(DMTリバースプライマー:配列番号8)
5'- GTGCATGGTGGTGTCGACGTCG -3'
【0045】
PCRに用いた反応液は、下記の通りである。
1.25Unit Ex taq(タカラバイオ)
1x Ex taq緩衝液(タカラバイオ)
0.2mM dNTPs(タカラバイオ)
1μM フォワードプライマー(配列番号5もしくは7)
1μM リバースプライマー(配列番号6もしくは8)
上記で調製した反応液に、100倍希釈したシネココッカスsp. WH8102のゲノムDNA溶液1μLを加えて全量50μLとして、以下の条件でPCR反応を行った。
96℃、5分間保持した後、[96℃,30秒→58℃,30秒→72℃,1分]を30回繰り返し、次いで、72℃、5分間保持した後、4℃まで冷却した。
反応終了後、増幅により得られたDNAをアガロース電気泳動で確認した。
【0046】
得られたPCR産物の配列をDNAシークエンサーで配列決定した。タンパク質コード領域の配列は、配列番号1および2で示される通りである。
配列番号1および2で示すDNA(GSMT遺伝子およびDMT遺伝子)に対応するPCRフラグメントをシャトルベクターpTopoEntr(Invitrogten)中にクローニングし、トポイソメラーゼ反応を使用してエントリーベクターとなるGSMT/pTopoEntrおよびDMT/pTopoEntrを得、これをそれぞれ大腸菌DH5α株に導入した。
【0047】
〔植物組み換え用ベクターの作製(形質転換用プラスミドの構築)〕
GSMT/pTopoEntrおよびDMT/pTopoEntrプラスミドをそれぞれ大腸菌から抽出し、制限酵素XhoI(タカラバイオ)により直鎖化したプラスミドベクター(デスティネーションベクター)pGWB11と混合後、LRクロナーゼ(Invitrogten)を用いて組み替え反応を行った。
pGWB11は、図1に示すように、プロモータとして35Sプロモータを有し、C末端にFLAGタグが付加されている。また、HindIII−SacI間に、35Sプロモータ−R1−CmR−ccdB−R2−FLAGが入っている。R1−CmR−ccdB−R2の部分が、エントリーベクターとのLR反応によりattB1−(DMT, GSMT)−attB2に入れ替わることができる。このようにして、植物組み換え用ベクターとなるpGWB11/GSMTおよびpGWB11/DMTを得た。
【0048】
pGWB11/GSMTおよびpGWB11/DMTプラスミドを改良し、GSMT遺伝子およびDMT遺伝子を一つのプラスミドベクターに導入したpGWB/DMT/GSMTを作成した。作成概要を図2に示す。pGWB11/GSMTプラスミドDNAを制限酵素HindIIIとStuIで処理し、35Sプロモータ−GSMT−FLAG−NosターミネータのDNA断片を得た。また、pGWB11/DMTプラスミドDNAを制限酵素HindIIIで処理した。この2つをT4DNAポリメラーゼにより処理により平滑末端処理し、T4DNAリガーゼによる連結反応を行なってpGWB/DMT/GSMTを得た。なお、別法として、pGWB11/DMTプラスミドDNAを制限酵素HindIIIとStuIで処理し、35Sプロモータ−DMT−FLAG−NosターミネータのDNA断片を得て、pGWB11/GSMTプラスミドDNAを制限酵素HindIIIで処理し、この2つをT4DNAポリメラーゼにより処理により平滑末端処理し、T4DNAリガーゼによる連結反応を行なってもpGWB/DMT/GSMTを得られる。
【0049】
〔形質転換体の作製〕
(1)形質転換用アグロバクテリウムの調製
上記組換え用ベクター(pGWB11/GSMTおよびpGWB11/DMT)をエレクトロポレーション法によりアグロバクテリウムに導入し、形質転換した。この形質転換アグロバクテリウムを、YEB液体培地(50mg/Lカナマイシン、50mg/Lハイグロマイシン添加)で、30℃、2日間振とう培養した後、遠心分離により集菌した。集菌した菌をYEB培地に再懸濁して、感染用菌液を調製した。ヤトロファにGSMTとDMTの両方を導入する必要があるため、pGWB11/GSMTおよびpGWB11/DMTをもつアグロバクテリウム培養液を混合してヤトロファの形質転換に用いた。また、pGWB/DMT/GSMTをもつアグロバクテリウム培養液によってもヤトロファにDMTとGSMTの両方を導入することが出来る。
【0050】
(2)ヤトロファの形質転換
宿主となるヤトロファ細胞には、ゲノム抽出に用いたヤトロファと同種のタイ系統ヤトロファ(Jatropha curcas)を用いた。このヤトロファの成葉を用いて、リーフディスク法により形質転換を行った。具体的には、まず、宿主となるヤトロファの成葉のカット片(約25mm2、以下「ヤトロファ葉片」という)を、家庭用漂白剤を希釈した液で滅菌し、MS基本培地に植物ホルモン(IBA、BA)を添加したPre-conditioning寒天培地上に2日間25℃で静置した。アグロバクテリウムをMS培地に懸濁した感染用菌液を調製し、この菌液に先のヤトロファ葉片を浸漬し、1分間超音波で処理して9分間振とうした。その後、3日間、25℃の遮光環境下の寒天培地上で共培養した。共培養培地としては、Pre-conditioning培地に、アセトシリンゴンを添加したCo-cultivation培地を用いた。
【0051】
(3)形質転換ヤトロファのスクリーニング
上記で作製した発現カセットが、ヤトロファの染色体ゲノムに安定して挿入された形質転換体をスクリーニングした。
具体的には、共培養後のヤトロファ葉片をセフォタキシムナトリウム水溶液(200mg/L)で洗浄し、形質転換されたヤトロファ(組換え細胞)のスクリーニングを行った。スクリーニング用抗生物質としてはカナマイシン(20mg/L)を用いた。まず、Shoot regeneration I寒天培地(SR−I)に移して、2週間、25℃で培養してシュートを誘導して、続いて、Shoot regeneration II(SR−II)寒天培地に移して、シュートを増殖させた。なお、上記SR−1は、成葉に由来する細胞のためのものである。子葉に由来する細胞を用いる場合は、SR−1にチジアズロン(TDZ)を加える必要がないが、成葉の場合は、子葉と異なって再分化能力が劣り、内在性ホルモンが相違するため、TDZを加える必要がある。
【0052】
次に、選抜したカルスをShoot elongation I(SE−I)寒天培地、Shoot elongation II(SE−II)寒天培地に移して、シュートを伸長させた。さらに、伸長させたシュートをRI培地において発根を誘導し、再分化したヤトロファ植物の幼苗を得た。得られた幼苗の写真を図4に示す。1、2、4および5の幼苗は上記の通りベクターpGWB/DMT/GSMTを用いて形質転換をして得られたものである。3の幼苗はベクターpGWB/DMTとベクターpGWB/GSMTとを用いて形質転換して得られたものである。
【0053】
使用した培地組成を以下に示す。
<MS基本培地>
MS 1x,(pH5.8)
スクロース 3%
ミオイノシトール 100mg/L
チアミン塩酸塩(pH5.8) 10mg/L
寒天 0.8%
<Pre-conditioning培地>
MS基本培地
6−ベンジルアミノプリン(BA) 1mg/L
3−インドール酪酸(IBA) 0.075mg/L
<Co-cultivation培地>
MS基本培地
6−ベンジルアミノプリン(BA) 1mg/L
3−インドール酪酸(IBA) 0.075mg/L
アセトシリンゴン(AS) 20mg/L
【0054】
<SR−I培地>
MS基本培地
チジアズロン(TDZ) 0.5mg/L
6−ベンジルアミノプリン(BA) 1mg/L
3−インドール酪酸(IBA) 0.075mg/L
セフォタキシムナトリウム 200mg/L
カナマイシン 20mg/L
<SR−II培地>
MS基本培地
6−ベンジルアミノプリン(BA) 3mg/L
3−インドール酪酸(IBA) 0.5mg/L
セフォタキシムナトリウム 200mg/L
カナマイシン 20mg/L
【0055】
<SE−I培地>
MS基本培地
6−ベンジルアミノプリン(BA) 2mg/L
セフォタキシムナトリウム 200mg/L
カナマイシン 20mg/L
<SE−II培地>
MS基本培地
6−ベンジルアミノプリン(BA) 2mg/L
カナマイシン 20mg/L
<RI培地>
ガンボーグB5培地
スクロース 2%
ミオイノシトール 100mg/L
チアミン塩酸塩(pH5.8) 10mg/L
3−インドール酪酸(IBA) 0.2mg/L
寒天 0.7%
【0056】
(4)GSMT遺伝子およびDMT遺伝子の発現の確認
前記(3)で得られた幼苗の若葉およびコントロール(野生型ヤトロファ)の若葉から、マニュアルに従ってDNeasy Plant Mini kit(QIAGEN)を用いて、ゲノムDNAを単離した。Go Taq Green Master Mix(Promega)を用いて、単離したゲノムDNAについて前記の配列番号9〜12のプライマーを用いてPCR分析を行った。95℃、2分間保持した後、[95℃,30秒→50℃,30秒→72℃,40秒]を35回繰り返し、次いで、72℃、5分間保持した後、4℃まで冷却して、PCR反応を行った。反応終了後、PCR生成物を1%アガロース上で電気泳動を行い、エチジウムブロマイドで染色して、UVトランスイルミネーターで可視化した。その結果を、図5に示す。
【0057】
図5から分かる通り、ベクターpGWB/DMT/GSMTを用いて形質転換をして得られた幼苗1、2、4および5では、GSMT遺伝子およびDMT遺伝子が共に維持されている。他方、ベクターpGWB/DMTとベクターpGWB/GSMTとを用いて形質転換して得られた幼苗3は、GSMT遺伝子しか維持されていない。この結果から、GSMT遺伝子およびDMT遺伝子を共に有する形質転換体を得ることは容易ではないことが分かる。
【0058】
(5)グリシベタイン含量の測定
前記の〔ヤトロファからのグリシンベタイン分析用サンプル抽出方法〕および〔質量分析装置(CE−MS)を用いたヤトロファにおけるグリシンベタイン含量の測定方法〕に従って、充分に潅水して育てている野性型ヤトロファの葉(コントロール:サンプルa〜c)、2週間、潅水を停止して乾燥ストレスを与えた野性型ヤトロファの葉(サンプルd〜f)、形質転換した幼苗(前記(3)で得られた幼苗1および1:サンプルgおよびh)、野性型ヤトロファから調製した幼苗(サンプルiおよびj)について、グリシンベタイン含量を測定した。その結果を図6に示す。
【0059】
充分に潅水して育てている野性型ヤトロファの葉では、グリシンベタイン含量は0.1〜0.3mmol/mgFWであり、2週間、潅水を停止しても、同含量は増加していない。この結果から、野生型ヤトロファはグリシンベタインを蓄積する植物ではないことが示される。他方、形質転換をしていない幼苗のグリシンベタイン含量は0.2mmol/mgFWであるのに対して、GSMT遺伝子およびDMT遺伝子で形質転換した幼苗では同含量が約0.5および約0.9mmol/mgFWと非常に高くなっている。この結果から、GSMT遺伝子およびDMT遺伝子の導入によってヤトロファ内のグリシンベタイン合成が顕著に増加することが示された。従って、同遺伝子の導入は、ヤトロファの乾燥耐性の改良に有効である。
【0060】
(6)形質転換ヤトロファの作出および生育性の確認
作出に際して、発根の根の長さ、葉の面積等を測定し、野生型と比較する。また、再分化させて得られた植物体を砂耕栽培し、任意の時点における灌水を中断した後の水不足条件で栽培した際の光合成速度およびクロロフィル蛍光、蒸散速度および、成葉の黄変、巻き上がり、落葉を野生株と比較し、乾燥ストレス耐性を評価する。
【産業上の利用可能性】
【0061】
本発明によって、グリシンベタインが過剰に生合成されることで、浸透圧ストレス、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して、優れた耐性を有する環境ストレス耐性ヤトロファが提供される。
【技術分野】
【0001】
本発明は、グリシンベタイン合成酵素遺伝子で形質転換された環境ストレス耐性ヤトロファ、その製造および利用に関する。
【背景技術】
【0002】
ヤトロファ・クルカス(Jatropha curcas)は、非食用ヤトロファ油を製造することから、バイオディーゼル燃料生産のための生物資源として注目を集めている。また、ヤトロファは、水分や無機栄養について、他の作物の生育不適地でも栽培できる植物として知られており、半乾燥地の有効利用と緑化のために非常に有益であると考えられている。一方、ヤトロファ属植物は、荒地で育つものの、結実回数も年1回、実のサイズもパームよりかなり小さいため、自然栽培による油脂の生産効率は高くない。このような理由から、生産性の高いヤトロファの開発が求められている。
【0003】
ヤトロファ油の生産性効率の改善の方法の1つとしては、例えば特許文献1に開示されているように、種子の油含有量を増大させるべく、アセチルCoAカルボキシラーゼ(ACCアーゼ)を過剰発現可能に形質転換する方法がある。
【0004】
一方、ヤトロファ自体の生産性を上げる観点から、水不足条件下でも高い成長性を確保できるような乾燥耐性の付与が考えられる。
一般に、植物は、乾燥、塩、低温などの環境要因によって、生育が大きく左右されることから、環境ストレス耐性を付与した農作物の開発が期待されている。乾燥ストレス耐性遺伝子組換え植物としては、乾燥ストレスに対して適応または応答できるように、ストレス応答シグナル伝達強度、機構を改変したもの、耐性に関与するタンパク質分子(環境ストレスに応答するタンパク質)を過剰生産するように改良する方法などが考えられる。植物をはじめ多くの生物は、様々な環境ストレスに遭遇した場合、グリシンベタインやプロリンなどの適合溶質を蓄積して蛋白質、核酸等の変性および失活を防止することが知られている(横田明穂編、植物分子生理学入門p203-207)。
【0005】
アカザ科植物のオオムギやホウレンソウおよび好塩菌、従属栄養細菌の多くは、浸透圧ストレスに応答して、適合溶質としてグリシンベタインを細胞質に蓄積するが、これらの生物においてはコリンを起点とした酸化反応によりグリシンベタインを産生、蓄積する経路を持っている。
【0006】
特許文献2には、そのコリンからのグリシンベタインの合成に関与する遺伝子を植物に導入することで、当該植物が塩などによる浸透圧ストレスのみならず、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して耐性を有することが記載されている。具体的には、コリンからグリシンベタインへの2段階の生合成に関与するコリンデヒドロゲナーゼおよびベタインアルデヒドデヒドロゲナーゼの2つの遺伝子を、淡水性ラン藻シネココッカス(Synechococcus)属に導入したところ、導入していないものに比べて、塩ストレス下でも高い増殖性を示したことが示されている。
【0007】
また、グリシンベタインの生合成ルートとしては、上記のコリンからのルートの他に、数種の好塩性光合成細菌およびメタン細菌類が有するグリシンを起点とするグリシンベタイン合成ルートが知られている(非特許文献1〜3)。これらの細菌類では、S−アデノシルメチオニンをメチル基供与体として利用し、グリシンを3段階でメチル化することによりグリシンベタインを合成する。この反応はグリシンサルコシンメチルトランスフェラーゼ(Glycine sarcosine methyltransferase:以下GSMTと略す)およびN,N−ジメチルグリシンメチルトランスフェラーゼ(N,N-dimethylglycine methyltransferase:以下DMTと略す)によって触媒される(図1)。非特許文献1〜3には、アクチノポリスポラ・ハロフィラ(Actinopolyspora halophila)、エクトチオロロドスピラ・ハロクロリス(Ectothiorhorhodospira halochloris)、アファノティーキ・ハロフィティカ(Aphanothece halophytica)、シネココッカス(Synechococcus)sp. WH8102、マイコバクテリウム・マリナム(Mycobacterium marinum)、プロクロロコツカス・マリヌス(Prochlorococcus marinus)およびハロロドスピラ・ハロクロリス(Halorhodospira halochloris)のそれぞれに由来する、GSMTおよびDMTのアミノ酸配列が記載されており、相互に類似している。
【0008】
非特許文献4では、死海から単離した好塩性ラン藻アファノティーキ・ハロフィティカに由来するGSMTおよびDMTの遺伝子を、シロイヌナズナおよび淡水性ラン藻シネココッカス属に導入したところ、環境ストレス耐性が著しく向上したことが報告されている。特に乾燥耐性に関してはシロイヌナズナの場合、苗を灌水後、水を3日間絶ち、再灌水した実験がなされた結果、光合成量子収率および、外観的生育状態が野生株に比べて高い乾燥耐性を示すことが報告されている。
しかし、GSMTおよびDMTの遺伝子をヤトロファに導入したとの報告はない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表2009−536029号公報
【特許文献2】特許第3144260号公報
【非特許文献】
【0010】
【非特許文献1】Nyyssola A et al., "Extreme Halophiles Synthesize Betaine from Glycine by Methylation" J. Biol. Chem. 275:22196-22201 (2000)
【非特許文献2】Waditee R et al., "Isolation and Functional Characterization of N-Methyltransferases That Catalyze Betaine Synthesis from Glycine in a Halotolerant Photosynthetic Organism Aphanothece halophytica" J. Biol. Chem. 278:4932-4942 (2003)
【非特許文献3】Lu W et al., "Identification of glycine betaine as compatible solute in Synechococcus sp. WH8102 and characterization of its N-methyltransferase genes involved in betaine synthesis" Arch. Microbiol. 186:495-506 (2006)
【非特許文献4】Waditee R et al., "Genes for direct methylation of glycine provide high levels of glycinebetaine and abiotic-stress tolerance in Synechococcus and Arabidopsis" PNAS 102:1318-1323 (2005)
【発明の概要】
【発明が解決しようとする課題】
【0011】
環境ストレスに対するシグナル伝達経路のメカニズムは複雑であり、乾燥ストレス耐性植物の作出についても、上記のように、種々の形質転換方法が提案されている。しかしながら、ヤトロファに関しては、乾燥ストレスにかかわる制御タンパク質、耐性にかかわる機能タンパク質などは明らかにされていない。
本発明が解決しようとする課題は、環境ストレス耐性ヤトロファを作出することにあり、そのために野生型ヤトロファを環境ストレス耐性に形質転換させることのできる遺伝子等を見出すことにある。
【課題を解決するための手段】
【0012】
その課題を解決するために、本発明者らは、ヤトロファを環境ストレス耐性に形質転換するための遺伝子について検討した結果、グリシンベタインの生合成に関与するグリシンサルコシンメチルトランスフェラーゼ(GSMT)およびN,N−ジメチルグリシンメチルトランスフェラーゼ(DMT)の遺伝子をヤトロファに導入したところ、得られた形質転換ヤトロファが、浸透圧ストレス、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して、優れた耐性を有することを見出して、本発明を完成した。すなわち、本発明は、以下の通りである。
【0013】
[1] GSMT遺伝子およびDMT遺伝子で形質転換された、環境ストレス耐性ヤトロファ。
[2] GSMT遺伝子が、
(a)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスまたはハロロドスピラ・ハロクロリスに由来するGSMTをコードするポリヌクレオチド、および
(b)(a)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(a)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチドから選択され、
DMT遺伝子が、
(c)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスまたはハロロドスピラ・ハロクロリスに由来するDMTをコードするポリヌクレオチド、および
(d)(c)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(c)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチドから選択される、
[1]記載の環境ストレス耐性ヤトロファ。
【0014】
[3] GSMT遺伝子およびDMT遺伝子が、それぞれ配列番号1および2で示される塩基配列を有するポリヌクレオチドである、[1]記載の環境ストレス耐性ヤトロファ。
[4] GSMT遺伝子および/またはDMT遺伝子が組み入れられた、ヤトロファ形質転換用ベクター。
[5] [4]記載のヤトロファ形質転換用ベクターを、野生型ヤトロファに導入することによる、環境ストレス耐性ヤトロファの製造方法。
[6] [1]〜[3]のいずれか1つに記載の環境ストレス耐性ヤトロファから収穫される種子。
[7] [6]記載の種子を圧搾して精製することによる、ヤトロファ油の製造方法。
[8] [7]記載の製造方法で製造されうる、ヤトロファ油。
【発明の効果】
【0015】
本発明に係る形質転換ヤトロファは、ヤトロファ内でGSMTおよびDMTが過剰に発現され、それによってグリシンベタインが過剰に生合成される。このグリシンベタインによって、浸透圧ストレス、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して、優れた耐性を有する。
【図面の簡単な説明】
【0016】
【図1】グリシンサルコシンメチルトランスフェラーゼ(GSMT)およびN,N−ジメチルグリシンメチルトランスフェラーゼ(DMT)によって触媒されるグリシンベタイン合成経路を示す図である。
【図2】pGWB11プラスミドの遺伝子マップ(Nakagawa et al., "Development of Series of Gateway Binary Vectors, pGWBs, for Realizing Efficient Construction of Fusion Genes for Plant Transformation", Journal of Bioscience and Bioengineering Vol. 104 (2007), No. 1 p.38より転載)である。
【図3】DMTおよびGSMTの遺伝子を一つのプラスミドベクターに導入したpGWB/DMT/GSMTの作成概要図である。
【図4】DMT遺伝子およびGSMTの遺伝子で形質転換したヤトロファの幼苗の写真である。1、2、4および5の幼苗はベクターpGWB/DMT/GSMTを用いて形質転換をして得られたものであり、3の幼苗はベクターpGWB/DMTとベクターpGWB/GSMTとを用いて形質転換して得られたものである。
【図5】GSMT遺伝子およびDMT遺伝子の存在をPCR法を用いて識別した結果を示す図である。Pは、ベクターpGWB/DMTまたはベクターpGWB/GSMTのものであり、NはDNAサンプルを入れずにPCRを行ったものである。1、2、4および5はベクターpGWB/DMT/GSMTを用いて形質転換をして得られた幼苗のものであり、3はベクターpGWB/DMTとベクターpGWB/GSMTとを用いて形質転換して得られた幼苗のものである。
【図6】種々のヤトロファに含まれるグリシンベタイン含量の測定結果を示す図である。a〜cのサンプルは充分に潅水して育てている野性型ヤトロファ(コントロール)の葉であり、d〜fのサンプルは2週間、潅水を停止して乾燥ストレスを与えた野性型ヤトロファの葉であり、gおよびhのサンプルは形質転換した1および2の幼苗であり、iおよびjのサンプルは野性型ヤトロファから調製した幼苗である。
【発明を実施するための形態】
【0017】
〔GSMTおよびDMTの遺伝子〕
本発明におけるヤトロファに導入されるGSMT遺伝子およびDMT遺伝子は、ヤトロファ内でGSMTおよびDMTを生合成する限り、いかなる生物に由来するものでもよく、またそれらの置換、欠失または付加されたものであってもよい。
好ましいGSMT遺伝子としては、例えば、
(a)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスもしくはハロロドスピラ・ハロクロリスに由来するGSMTをコードするポリヌクレオチド、または
(b)(a)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(a)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチド等が挙げられる。ここで、(b)のポリヌクレオチドの塩基配列は、(a)のポリヌクレオチドの塩基配列と好ましくは95%以上の相同性を有し、さらに好ましくは98%以上の相同性を有し、特に好ましくは99%以上の相同性を有する。さらに好ましいGSMT遺伝子としては、(a)のポリヌクレオチドが挙げられる。さらに好ましくは、シネココッカスsp. WH8102に由来するGSMTである配列番号3で示されるポリペプチドをコードするポリヌクレオチドが挙げられ、特に好ましくは、配列番号1で示される塩基配列を有するポリヌクレオチドが挙げられる。
【0018】
好ましいDMT遺伝子としては、例えば、
(c)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスもしくはハロロドスピラ・ハロクロリスに由来するDMTをコードするポリヌクレオチド、または
(d)(c)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(c)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチド等が挙げられる。ここで、(d)のポリヌクレオチドの塩基配列は、(c)のポリヌクレオチドの塩基配列と好ましくは95%以上の相同性を有し、さらに好ましくは98%以上の相同性を有し、特に好ましくは99%以上の相同性を有する。さらに好ましいDMT遺伝子としては、(c)のポリヌクレオチドが挙げられる。さらに好ましくは、シネココッカスsp. WH8102に由来するDMTである配列番号4で示されるポリペプチドをコードするポリヌクレオチドが挙げられ、特に好ましくは、配列番号2で示される塩基配列を有するポリヌクレオチドが挙げられる。
【0019】
本発明におけるGSMT遺伝子およびDMT遺伝子の調製方法は特に限定されない。例えば、入手可能なGSMT遺伝子およびDMT遺伝子を購入するか、あるいは既知のGSMT遺伝子およびDMT遺伝子の配列を利用して既知または未知の生物のゲノムDNAから取得することができる。また、これらの遺伝子において、常法に従って、所定の塩基を置換させ、欠失させ、または付加させることで、人工的に合成することもできる。
【0020】
耐塩性ラン藻シネココッカスsp. WH8102のGSMTおよびDMTをコードするDNAは、シネココッカスsp. WH8102のゲノムDNAより取得できる。シネココッカスsp. WH8102ゲノムデータベースのアクセションナンバーBX569694の領域79539〜80387がGSMTに、アクセションナンバーBX569694の領域78691〜79533がDMTにそれぞれ対応する。それぞれのDNA配列を配列番号1および2に示す。本発明の遺伝子を発現させて得られるタンパク質、すなわちシネココッカスsp. WH8102のDMTおよびGSMTのアミノ酸配列を配列番号3および4にそれぞれ示す。以下、「GSMT遺伝子」および「DMT遺伝子」という場合は、本発明において利用されるGSMT遺伝子およびDMT遺伝子を総称する。
【0021】
例えば、耐塩性ラン藻シネココッカスsp. WH8102ゲノムから、下記プライマーセットを用いてPCR反応を行うことにより、直接、目的とするGSMT遺伝子およびDMT遺伝子それぞれのPCR産物を得ることができる。
(GSMTのフォワードプライマー:配列番号5)
5'- CACCATGGGCACGACGAACGGCTG -3'
(GSMTのリバースプライマー:配列番号6)
5'- ACCAGGCTTGCGCAACCGCATC-3'
(DMTのフォワードプライマー:配列番号7)
5'- CACCATGACGTCAACGCAGAACCATCCATTGC -3'
(DMTリバースプライマー:配列番号8)
5'- GTGCATGGTGGTGTCGACGTCG -3'
得られたPCR産物の塩基配列の決定、確認は、従来より公知の手法、例えば、マキサム−ギルバートの化学修飾法、またはM13ファージを用いるジデオキシヌクレオチド鎖終結法等の公知手法により行えばよい。
【0022】
〔乾燥ストレス耐性形質転換ヤトロファの作出〕
本発明の乾燥ストレス耐性形質転換ヤトロファは、GSMT遺伝子およびDMT遺伝子を発現または発現調節のためのプロモータと作動可能に連結した発現カセットを、野生型ヤトロファに遺伝子導入することにより作製される。
本発明が対象とするヤトロファの種類は特に限定されず、ヤトロファ・クルカス(Jatropha curcus)、ヤトロファ・ポタグリカ(Jatropha potagurica)、ヤトロファ・ムルチフィダ(Jatropha multifida)、ヤトロファ・ベルランディエリ(Jatropha berlandieri)、ヤトロファ・インテゲリマ(Jatropha integerrima)などを用いることができる。これらのうち、油脂含有量が多いという点から、ヤトロファ・クルカスが好ましく用いられる。
【0023】
遺伝子導入方法は、プロトプラスト同士を融合させる方法、電気穿孔法、遺伝子ショットガン法等の細胞に直接的にDNAを導入する方法;アグロバクテリウム(Agrobacterium tumefaciens)やAgrobacterium rhizogenesを利用して間接的に導入する方法のいずれの方法により行ってもよいが、好ましくはアグロバクテリウムを用いる方法である。以下、アグロバクテリウムを用いる形質転換方法について説明する。
【0024】
アグロバクテリウムは植物病細菌で、LB(レフトボーダー)とRB(ライトボーダー)に挟まれた領域(T−DNA(Transferred DNA)領域)を切り出して宿主ゲノムに挿入することができるTiプラスミドをもっている。このT−DNA領域内に、導入しようとする遺伝子、すなわちDMT遺伝子およびGSMT遺伝子を組み込んだプラスミドを有するアグロバクテリウムを、宿主植物へ感染させると、T−DNA領域が切り出されて、vir領域にコードされているタンパク質群と複合体を形成して植物細胞内に侵入し、さらに宿主ゲノムに挿入することができる。
【0025】
アグロバクテリウムを用いる形質転換方法としては、バイナリーベクター法が好ましい。バイナリーベクター法とは、TiプラスミドのT−DNAを欠落させたプラスミド(pAL4404など)とは別に、T−DNA領域のボーダー(LBおよびRB)を有するプラスミドのT−DNA領域に目的の外来遺伝子を組み込んだプラスミドをアグロバクテリウムに導入して植物に感染させることにより、目的遺伝子を植物ゲノムに挿入する方法である。
【0026】
バイナリーベクター法を利用した、形質転換ヤトロファの作出に用いられる発現カセットは、T−DNA領域に、上記本発明に係るGSMT遺伝子およびDMT遺伝子、ならびに当該ヌクレオチド発現のためのプロモータ、マーカー遺伝子、レポータ遺伝子を含んでいる。
プロモータとしては、35Sカリフラワーモザイクウィルスプロモータ、ノパリンシンターゼ(NOS)プロモータ、およびβファゼオリン、ナピン、ユビキチンなどの他の胚乳特異的プロモータが挙げられる。
【0027】
選択マーカー遺伝子としては、抗生物質または除草剤のような選択剤に対する抵抗性を付与する遺伝子が用いられる。具体的には、カナマイシン耐性遺伝子、パロモマイシンB耐性遺伝子、またはグルフォシネートおよびグリフォセートのような除草剤に対する抵抗性遺伝子などが挙げられる。形質転換体を視覚的に同定できる選択マーカー、例えば、ルシフェラーゼ、または緑色蛍光タンパク質(GFP)のような発色または蛍光タンパク質を発現する遺伝子または種々の発色体基質が知られているβ−グルクロニダーゼまたはGUSを発現する遺伝子も利用することができる。このような選択マーカーは、レポータ遺伝子としても利用できる。
【0028】
必要に応じて、さらにエンハンサー、ターミネータ、タグなどを含んでもよい。エンハンサーは、目的遺伝子の発現効率を高めるために用いられ、CaMV35Sプロモーター内の上流側の配列を含むエンハンサー領域などが挙げられる。ターミネータとしては、プロモータにより転写された遺伝子の転写を終結できる配列であればよく、例えば、ノパリン合成酵素(NOS)遺伝子のターミネータ、オクトビン合成酵素(OCS)、CaMV35SRNA遺伝子のターミネータが挙げられる。
【0029】
バイナリーベクター法によるヤトロファの形質転換に用いるバイナリーベクターとしては、上記発現カセットをT−DNA領域に含むもので、具体的には、pBI系、pPZP系、pSMA系、pGWB系などの市販ベクターに上記発現カセットを組み入れたものを用いることができる。特に、Gateway(登録商標)のクローニングシステムが適用可能な植物形質転換用バイナリーベクターが好ましく、このようなベクターとしては、pGWB系ベクターが挙げられる。このpGWB系ベクターは、プロモータとしてカリフラワーモザイクウィルス(CaMV)35Sプロモータ;選択マーカー遺伝子としては、ハイグロマイシン耐性遺伝子、カナマイシン耐性遺伝子;レポータとしてβ−グルクロニダーゼ(GUS)、緑色蛍光タンパク質(GFP)、ルシフェラーゼ(LUC)、黄色蛍光タンパク質(YFP)、シアン蛍光タンパク質(CFP);タグとして、6xHis、FLAG、3xHA、4xMyc、GST、T7−エピトープを用いて、目的遺伝子およびレポータが作動可能に連結されている。さらにN末端、C末端の双方に融合できるように、レポータ、タグをコードする配列がある。今回用いたpGWB11プラスミドベクターの模式図を図2に示す。
【0030】
Gateway(登録商標)クローニングシステムとは、Gateway(登録商標)シグナル(att)を用いることによって、発現ベクターの構築を容易にしたものである。attP1、attP2配列を有するドナーベクターと目的遺伝子の両端にattB1、attB2配列を付加したものとの間で反応(BP反応)させることにより、目的遺伝子が組み込まれたエントリーベクター(両端にattL1、attL2配列を有する)を作製し、次いで、このエントリーベクターと発現に必要なプロモータが組み込まれたデスティネーションベクター(attR1、attR2配列を付加)と組みかえ反応(LR反応)することにより、目的遺伝子が挿入されたベクター(発現ベクター)を作製する方法である。
【0031】
従って、まず、クローニングしたDMT遺伝子およびGSMT遺伝子を、ドナーベクターとの間でBP反応させることによりドナーベクターに組み入れたエントリーベクターを調製し、次いでこのエントリーベクターとデスティネーションベクター(pGWB)とをLR反応させることにより、目的とする遺伝子(GSMT遺伝子およびDMT遺伝子)が35Sプロモーターの制御下に組み入れられた発現ベクター(pGWB11/GSMT、pGWB11/DMT)を作製することができる。また、図3のようにpGWB11/GSMT、pGWB11/DMTを改良し、GSMT遺伝子およびDMT遺伝子を同一のpGWB11ベクター上に組み込むことが出来る。
【0032】
Gateway(登録商標)バイナリーベクター(pGWB)を用いた植物形質転換用発現カセットの構築については、Nakagawa et al., "Development of Series of Gateway Binary Vectors, pGWBs, for Realizing Efficient Construction of Fusion Genes for Plant Transformation", Journal of Bioscience and Bioengineering Vol. 104, No.1, 34-41(2007)に詳述されている。
【0033】
以上のようにして作成した発現ベクター(植物形質転換用ベクター)は、大腸菌中で増幅させることができる。増幅した形質転換用ベクターは、エレクトロポレーション法等により、アグロバクテリウムに導入すればよい。このようにして発現ベクターを導入したアグロバクテリウムを、ヤトロファの形質転換に用いる。
植物形質転換用ベクターを搭載したアグロバクテリウムの感染によるヤトロファへの目的遺伝子(GSMT遺伝子およびDMT遺伝子)の導入は、リーフディスク法などの公知の方法を用いて行うことができる。
【0034】
具体的には、アグロバクテリウムをMS培地に懸濁した感染用菌液を調製し、この菌液に宿主となるヤトロファの一部(好ましくは子葉のカット片、以下「ヤトロファ葉片」という)を浸漬後、ヤトロファ葉片を取り出し、3日間程度共培養する。共培養に先立って、ヤトロファの葉片を、MS培地に2日間程度浸漬し、さらにはソニケーションしておくことが好ましい。これにより導入効率を高くすることができる。さらにまた、ヤトロファの葉をアグロバクテリウム菌の懸濁液に浸漬した状態で減圧処理すると、アグロバクテリウムの感染率が高まり、好ましい。
共培養培地としては、MS培地などに、3−インドール酪酸(IBA)、6−ベンジルアミノプリン(BA)などの植物ホルモンを添加した培地が用いられる。
【0035】
共培養後、ヤトロファ葉片を洗浄し、選択培地(形質転換用ベクターの発現カセットで用いられた選択マーカー遺伝子に対応する抗生物質を含有)に移して、インキュベートした後、葉片に形成されたカルスを切り取り、選択培地に移して、さらに、形質転換されたヤトロファ(組換え細胞)のスクリーニングを行う。
選択培地としては、選択用物質となる抗生物質(カナマイシン、ハイグロマイシン)を、前培養に用いた培地(MS培地など)に添加し、さらに植物ホルモンとして、IBA、BAなどを含有したものが好ましく用いられる。
【0036】
次に、選抜したカルスをRoot induction(RI)培地、MS培地などの培地に移して、発根させ、植物体へ再分化させる。再分化誘導は、培地におけるオーキシンやサイトカイニン等の植物成長調節物質、炭素源等の各種成分の種類や量、光、温度等を適切に設定することにより行うことができる。例えば、特開2011−155968号公報の記載に従って、以下の3つの工程によって、カルスから植物体を調製することができる。
[工程a]植物成長調節物質としてIBAとBAのみを含むMS培地でヤトロファ属植物の細胞からシュートを形成させる工程
[工程b]前記形成されたシュートを植物成長調節物質としてBAのみを含むMS培地に移植して伸長させる工程
[工程c]前記伸長させたシュートを植物成長調節物質としてIBAのみを含む1/2MS培地に移植して発根させる工程
なお、工程aにおいて、子葉に由来する細胞を用いる場合は、MS培地にチジアズロン(TDZ)を加える必要がないが、成葉に由来する細胞を用いる場合は、まずTDZを含むMS培地でシュートの誘導を行うことが好ましい。成葉は子葉と異なって再分化能力が劣り、内在性ホルモンが相違するためである。その後、TDZの影響を残さないようにTDZを含まない培地でシュートの増殖を促進する。また、工程cにおいて、1/2MS培地に代えて、ガンボーグB5培地を用いることが好ましく、特に形質転換体の場合、1/2MS培地よりも、ガンボーグB5培地を用いたほうが、発根の効率が格段に促進される。
【0037】
〔形質転換ヤトロファの識別方法〕
形質転換ヤトロファ植物体におけるGSMT遺伝子およびDMT遺伝子の存在はPCR法で簡便に識別することが出来る。形質転換体の組織から抽出したゲノムDNAサンプルに対して、以下のプライマーセットを用いてPCRを行なう。具体的には、GSMTの検出には下記の配列番号9および10のプライマーを、DMTの検出には下記の配列番号11および12のプライマーを用いる。PCRによる形質転換体の識別は、例えば後述の実施例および図5に記載の通り実施できる。
(GSMTのフォワードプライマー:配列番号9)
5’- TCTCCTGAATCGGTTCGCGAGAC -3’
(GSMTのリバースプライマー:配列番号10)
5’- GCGGTGATCAAGAATCAAGATGCC -3’
(DMTのフォワードプライマー:配列番号11)
5’- GACGCTGATCAGTTTTACGAACAGG -3’
(DMTのリバースプライマー:配列番号12)
5’- CAGCAATCCCATCTCCACACCA -3’
また、植物体のGSMTタンパク質およびDMTタンパク質の生成をより直接的に予測するため、GSMTおよびDMTのmRNAの存在量で確認することもできる。上記形質転換細胞(GSMTおよびDMTタンパク質をプロモータによって発現する形質転換双子葉細胞)および、コントロール(野生型ヤトロファの双子葉細胞)の個体から各々のmRNAを抽出して、通常用いられるノーザンブロッティング法またはRT−PCR法によってmRNA量を測定して、比較することで確認することができる。
【0038】
〔ヤトロファからのグリシンベタイン分析用サンプル抽出方法〕
ヤトロファからのグリシンベタイン抽出方法は以下のように行なう。2mLエッペンドルフチューブに植物サンプルを入れ、重量を測定する(約25mg)。そこにクロロホルムを250μL、メタノールを250μL、破砕用のジルコニアビーズ(直径4mm)を入れる。ミキサーミル(QIAGEN)にセットし、25Hz/秒で2分間破砕する。1mMメチオニンスルフォン(内部標準)を25μL、超純水175μLを加えボルテックスでよく混合し、17,500gで5分間遠心してクロロホルム層と水/メタノール層に分離した。水/メタノール層をフィルター付1.5mLチューブ(Millipore)に移し、17,500gで2時間遠心する。ろ液を1.5mLエッペンドルフチューブに移し遠心エバポレーター(EYELA)で2時間乾燥させる。完全に乾燥が終わったら超純水30μLに溶解し、さらに超純水で5倍希釈した溶液を測定に使用する。
【0039】
〔質量分析装置(CE−MS)を用いたヤトロファにおけるグリシンベタイン含量の測定方法〕
分析にはキャピラリー電気泳動システム(Agilent 1100)を用い、キャピラリーは内径50μm、長さ100cmフューズドシリカキャピラリーを使用する。電気泳動バッファは1Mギ酸(pH1.9)を使用し、分析開始前に約950mbarの圧力で30分間平衡化を行う。各分析の前にも泳動バッファで10分間のカラム内部の洗浄および平衡化を行ってから50mbarで2秒間の圧力をかけサンプルの注入を行う(約2nL)。電気泳動は27kVで20分間行い、エレクトロスプレーイオン化法を用い、シース液として5mM酢酸アンモニウムの50%メタノール溶液を10μL/分、ドライガスとして300℃の窒素ガスを10L/分で流す。MSの設定はフラグメント電圧70V、キャピラリー電圧3,000Vで行う。検出はグリシンベタインと内部標準のm/z118と182のみを選択的に測定する。
【0040】
本発明の形質転換ヤトロファでは、グリシンベタインの生合成に関与する酵素GSMTおよびDMTをコードする遺伝子を野生型と比べて多量に有しているので、グリシンベタインを野生株よりも高い含量で蓄積することができる。具体的には、植物葉組織細胞中で、グリシンベタインの含量は野生型の場合、生葉重量1mgあたり約0.2nmol以下であるのに対し、形質転換体では0.5〜0.8nmol以上のレベルで生成されることができる。分析は、例えば後述の実施例および図6に記載の通り実施できる。
【0041】
本発明の形質転換植物体は、形質転換処理を施した「T1世代」のほか、その植物の種子から得られた後代である「T2世代」、薬剤選抜あるいはPCR法、サザン法等による解析により形質転換であることが判明した「T2世代」植物の花を自家受粉して得られる次世代(T3世代)などの後代植物も含まれる。
【0042】
〔ヤトロファ油の製造〕
ヤトロファ油は本発明の形質転換ヤトロファから収穫される種子から、常法に従って製造することができる。例えば、種子を圧搾して原料油を得て、その原料油をフィルターでろ過することで、バイオディーゼルとして使用しうるヤトロファ油を製造することができる。ヤトロファ油をさらに精製したい場合は、例えば蒸留により精製することでき、また特開2010−209177号公報に記載された方法でホルボールエステルを除去することもできる。
【実施例】
【0043】
本発明を実施するための形態を実施例により説明する。下記実施例は、本発明の範囲を限定するものではない。
【0044】
〔シネココッカスsp. WH8102のGSMTおよびDMTを含むDNAの取得〕
シネココッカスsp. WH8102のGSMTおよびDMTをコードする遺伝子は耐塩性ラン藻シネココッカスsp. WH8102のゲノムDNAを用いた。
シネココッカスsp. WH8102のゲノムDNAを鋳型として、下記プライマーセットを用いて、PCR反応を行うことにより、目的とするGSMT遺伝子およびDMT遺伝子を増幅した。
(GSMTのフォワードプライマー:配列番号5)
5'- CACCATGGGCACGACGAACGGCTG -3'
(GSMTのリバースプライマー:配列番号6)
5'- ACCAGGCTTGCGCAACCGCATC-3'
(DMTのフォワードプライマー:配列番号7)
5'- CACCATGACGTCAACGCAGAACCATCCATTGC -3'
(DMTリバースプライマー:配列番号8)
5'- GTGCATGGTGGTGTCGACGTCG -3'
【0045】
PCRに用いた反応液は、下記の通りである。
1.25Unit Ex taq(タカラバイオ)
1x Ex taq緩衝液(タカラバイオ)
0.2mM dNTPs(タカラバイオ)
1μM フォワードプライマー(配列番号5もしくは7)
1μM リバースプライマー(配列番号6もしくは8)
上記で調製した反応液に、100倍希釈したシネココッカスsp. WH8102のゲノムDNA溶液1μLを加えて全量50μLとして、以下の条件でPCR反応を行った。
96℃、5分間保持した後、[96℃,30秒→58℃,30秒→72℃,1分]を30回繰り返し、次いで、72℃、5分間保持した後、4℃まで冷却した。
反応終了後、増幅により得られたDNAをアガロース電気泳動で確認した。
【0046】
得られたPCR産物の配列をDNAシークエンサーで配列決定した。タンパク質コード領域の配列は、配列番号1および2で示される通りである。
配列番号1および2で示すDNA(GSMT遺伝子およびDMT遺伝子)に対応するPCRフラグメントをシャトルベクターpTopoEntr(Invitrogten)中にクローニングし、トポイソメラーゼ反応を使用してエントリーベクターとなるGSMT/pTopoEntrおよびDMT/pTopoEntrを得、これをそれぞれ大腸菌DH5α株に導入した。
【0047】
〔植物組み換え用ベクターの作製(形質転換用プラスミドの構築)〕
GSMT/pTopoEntrおよびDMT/pTopoEntrプラスミドをそれぞれ大腸菌から抽出し、制限酵素XhoI(タカラバイオ)により直鎖化したプラスミドベクター(デスティネーションベクター)pGWB11と混合後、LRクロナーゼ(Invitrogten)を用いて組み替え反応を行った。
pGWB11は、図1に示すように、プロモータとして35Sプロモータを有し、C末端にFLAGタグが付加されている。また、HindIII−SacI間に、35Sプロモータ−R1−CmR−ccdB−R2−FLAGが入っている。R1−CmR−ccdB−R2の部分が、エントリーベクターとのLR反応によりattB1−(DMT, GSMT)−attB2に入れ替わることができる。このようにして、植物組み換え用ベクターとなるpGWB11/GSMTおよびpGWB11/DMTを得た。
【0048】
pGWB11/GSMTおよびpGWB11/DMTプラスミドを改良し、GSMT遺伝子およびDMT遺伝子を一つのプラスミドベクターに導入したpGWB/DMT/GSMTを作成した。作成概要を図2に示す。pGWB11/GSMTプラスミドDNAを制限酵素HindIIIとStuIで処理し、35Sプロモータ−GSMT−FLAG−NosターミネータのDNA断片を得た。また、pGWB11/DMTプラスミドDNAを制限酵素HindIIIで処理した。この2つをT4DNAポリメラーゼにより処理により平滑末端処理し、T4DNAリガーゼによる連結反応を行なってpGWB/DMT/GSMTを得た。なお、別法として、pGWB11/DMTプラスミドDNAを制限酵素HindIIIとStuIで処理し、35Sプロモータ−DMT−FLAG−NosターミネータのDNA断片を得て、pGWB11/GSMTプラスミドDNAを制限酵素HindIIIで処理し、この2つをT4DNAポリメラーゼにより処理により平滑末端処理し、T4DNAリガーゼによる連結反応を行なってもpGWB/DMT/GSMTを得られる。
【0049】
〔形質転換体の作製〕
(1)形質転換用アグロバクテリウムの調製
上記組換え用ベクター(pGWB11/GSMTおよびpGWB11/DMT)をエレクトロポレーション法によりアグロバクテリウムに導入し、形質転換した。この形質転換アグロバクテリウムを、YEB液体培地(50mg/Lカナマイシン、50mg/Lハイグロマイシン添加)で、30℃、2日間振とう培養した後、遠心分離により集菌した。集菌した菌をYEB培地に再懸濁して、感染用菌液を調製した。ヤトロファにGSMTとDMTの両方を導入する必要があるため、pGWB11/GSMTおよびpGWB11/DMTをもつアグロバクテリウム培養液を混合してヤトロファの形質転換に用いた。また、pGWB/DMT/GSMTをもつアグロバクテリウム培養液によってもヤトロファにDMTとGSMTの両方を導入することが出来る。
【0050】
(2)ヤトロファの形質転換
宿主となるヤトロファ細胞には、ゲノム抽出に用いたヤトロファと同種のタイ系統ヤトロファ(Jatropha curcas)を用いた。このヤトロファの成葉を用いて、リーフディスク法により形質転換を行った。具体的には、まず、宿主となるヤトロファの成葉のカット片(約25mm2、以下「ヤトロファ葉片」という)を、家庭用漂白剤を希釈した液で滅菌し、MS基本培地に植物ホルモン(IBA、BA)を添加したPre-conditioning寒天培地上に2日間25℃で静置した。アグロバクテリウムをMS培地に懸濁した感染用菌液を調製し、この菌液に先のヤトロファ葉片を浸漬し、1分間超音波で処理して9分間振とうした。その後、3日間、25℃の遮光環境下の寒天培地上で共培養した。共培養培地としては、Pre-conditioning培地に、アセトシリンゴンを添加したCo-cultivation培地を用いた。
【0051】
(3)形質転換ヤトロファのスクリーニング
上記で作製した発現カセットが、ヤトロファの染色体ゲノムに安定して挿入された形質転換体をスクリーニングした。
具体的には、共培養後のヤトロファ葉片をセフォタキシムナトリウム水溶液(200mg/L)で洗浄し、形質転換されたヤトロファ(組換え細胞)のスクリーニングを行った。スクリーニング用抗生物質としてはカナマイシン(20mg/L)を用いた。まず、Shoot regeneration I寒天培地(SR−I)に移して、2週間、25℃で培養してシュートを誘導して、続いて、Shoot regeneration II(SR−II)寒天培地に移して、シュートを増殖させた。なお、上記SR−1は、成葉に由来する細胞のためのものである。子葉に由来する細胞を用いる場合は、SR−1にチジアズロン(TDZ)を加える必要がないが、成葉の場合は、子葉と異なって再分化能力が劣り、内在性ホルモンが相違するため、TDZを加える必要がある。
【0052】
次に、選抜したカルスをShoot elongation I(SE−I)寒天培地、Shoot elongation II(SE−II)寒天培地に移して、シュートを伸長させた。さらに、伸長させたシュートをRI培地において発根を誘導し、再分化したヤトロファ植物の幼苗を得た。得られた幼苗の写真を図4に示す。1、2、4および5の幼苗は上記の通りベクターpGWB/DMT/GSMTを用いて形質転換をして得られたものである。3の幼苗はベクターpGWB/DMTとベクターpGWB/GSMTとを用いて形質転換して得られたものである。
【0053】
使用した培地組成を以下に示す。
<MS基本培地>
MS 1x,(pH5.8)
スクロース 3%
ミオイノシトール 100mg/L
チアミン塩酸塩(pH5.8) 10mg/L
寒天 0.8%
<Pre-conditioning培地>
MS基本培地
6−ベンジルアミノプリン(BA) 1mg/L
3−インドール酪酸(IBA) 0.075mg/L
<Co-cultivation培地>
MS基本培地
6−ベンジルアミノプリン(BA) 1mg/L
3−インドール酪酸(IBA) 0.075mg/L
アセトシリンゴン(AS) 20mg/L
【0054】
<SR−I培地>
MS基本培地
チジアズロン(TDZ) 0.5mg/L
6−ベンジルアミノプリン(BA) 1mg/L
3−インドール酪酸(IBA) 0.075mg/L
セフォタキシムナトリウム 200mg/L
カナマイシン 20mg/L
<SR−II培地>
MS基本培地
6−ベンジルアミノプリン(BA) 3mg/L
3−インドール酪酸(IBA) 0.5mg/L
セフォタキシムナトリウム 200mg/L
カナマイシン 20mg/L
【0055】
<SE−I培地>
MS基本培地
6−ベンジルアミノプリン(BA) 2mg/L
セフォタキシムナトリウム 200mg/L
カナマイシン 20mg/L
<SE−II培地>
MS基本培地
6−ベンジルアミノプリン(BA) 2mg/L
カナマイシン 20mg/L
<RI培地>
ガンボーグB5培地
スクロース 2%
ミオイノシトール 100mg/L
チアミン塩酸塩(pH5.8) 10mg/L
3−インドール酪酸(IBA) 0.2mg/L
寒天 0.7%
【0056】
(4)GSMT遺伝子およびDMT遺伝子の発現の確認
前記(3)で得られた幼苗の若葉およびコントロール(野生型ヤトロファ)の若葉から、マニュアルに従ってDNeasy Plant Mini kit(QIAGEN)を用いて、ゲノムDNAを単離した。Go Taq Green Master Mix(Promega)を用いて、単離したゲノムDNAについて前記の配列番号9〜12のプライマーを用いてPCR分析を行った。95℃、2分間保持した後、[95℃,30秒→50℃,30秒→72℃,40秒]を35回繰り返し、次いで、72℃、5分間保持した後、4℃まで冷却して、PCR反応を行った。反応終了後、PCR生成物を1%アガロース上で電気泳動を行い、エチジウムブロマイドで染色して、UVトランスイルミネーターで可視化した。その結果を、図5に示す。
【0057】
図5から分かる通り、ベクターpGWB/DMT/GSMTを用いて形質転換をして得られた幼苗1、2、4および5では、GSMT遺伝子およびDMT遺伝子が共に維持されている。他方、ベクターpGWB/DMTとベクターpGWB/GSMTとを用いて形質転換して得られた幼苗3は、GSMT遺伝子しか維持されていない。この結果から、GSMT遺伝子およびDMT遺伝子を共に有する形質転換体を得ることは容易ではないことが分かる。
【0058】
(5)グリシベタイン含量の測定
前記の〔ヤトロファからのグリシンベタイン分析用サンプル抽出方法〕および〔質量分析装置(CE−MS)を用いたヤトロファにおけるグリシンベタイン含量の測定方法〕に従って、充分に潅水して育てている野性型ヤトロファの葉(コントロール:サンプルa〜c)、2週間、潅水を停止して乾燥ストレスを与えた野性型ヤトロファの葉(サンプルd〜f)、形質転換した幼苗(前記(3)で得られた幼苗1および1:サンプルgおよびh)、野性型ヤトロファから調製した幼苗(サンプルiおよびj)について、グリシンベタイン含量を測定した。その結果を図6に示す。
【0059】
充分に潅水して育てている野性型ヤトロファの葉では、グリシンベタイン含量は0.1〜0.3mmol/mgFWであり、2週間、潅水を停止しても、同含量は増加していない。この結果から、野生型ヤトロファはグリシンベタインを蓄積する植物ではないことが示される。他方、形質転換をしていない幼苗のグリシンベタイン含量は0.2mmol/mgFWであるのに対して、GSMT遺伝子およびDMT遺伝子で形質転換した幼苗では同含量が約0.5および約0.9mmol/mgFWと非常に高くなっている。この結果から、GSMT遺伝子およびDMT遺伝子の導入によってヤトロファ内のグリシンベタイン合成が顕著に増加することが示された。従って、同遺伝子の導入は、ヤトロファの乾燥耐性の改良に有効である。
【0060】
(6)形質転換ヤトロファの作出および生育性の確認
作出に際して、発根の根の長さ、葉の面積等を測定し、野生型と比較する。また、再分化させて得られた植物体を砂耕栽培し、任意の時点における灌水を中断した後の水不足条件で栽培した際の光合成速度およびクロロフィル蛍光、蒸散速度および、成葉の黄変、巻き上がり、落葉を野生株と比較し、乾燥ストレス耐性を評価する。
【産業上の利用可能性】
【0061】
本発明によって、グリシンベタインが過剰に生合成されることで、浸透圧ストレス、乾燥ストレス、低温ストレス、高温ストレス等の多様な環境ストレスに対して、優れた耐性を有する環境ストレス耐性ヤトロファが提供される。
【特許請求の範囲】
【請求項1】
グリシンサルコシンメチルトランスフェラーゼ遺伝子およびN,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子で形質転換された、環境ストレス耐性ヤトロファ。
【請求項2】
グリシンサルコシンメチルトランスフェラーゼ遺伝子が、
(a)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスまたはハロロドスピラ・ハロクロリスに由来するグリシンサルコシンメチルトランスフェラーゼをコードするポリヌクレオチド、および
(b)(a)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(a)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチドから選択され、
N,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子が、
(c)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスまたはハロロドスピラ・ハロクロリスに由来するN,N−ジメチルグリシンメチルトランスフェラーゼをコードするポリヌクレオチド、および
(d)(c)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(c)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチドから選択される、
請求項1記載の環境ストレス耐性ヤトロファ。
【請求項3】
グリシンサルコシンメチルトランスフェラーゼ遺伝子およびN,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子が、それぞれ配列番号1および2で示される塩基配列を有するポリヌクレオチドである、請求項1記載の環境ストレス耐性ヤトロファ。
【請求項4】
グリシンサルコシンメチルトランスフェラーゼ遺伝子および/またはN,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子が組み入れられた、ヤトロファ形質転換用ベクター。
【請求項5】
請求項4記載のヤトロファ形質転換用ベクターを、野生型ヤトロファに導入することによる、環境ストレス耐性ヤトロファの製造方法。
【請求項6】
請求項1〜3のいずれか1項に記載の環境ストレス耐性ヤトロファから収穫される種子。
【請求項7】
請求項6記載の種子を圧搾して精製することによる、ヤトロファ油の製造方法。
【請求項8】
請求項7記載の製造方法で製造されうる、ヤトロファ油。
【請求項1】
グリシンサルコシンメチルトランスフェラーゼ遺伝子およびN,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子で形質転換された、環境ストレス耐性ヤトロファ。
【請求項2】
グリシンサルコシンメチルトランスフェラーゼ遺伝子が、
(a)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスまたはハロロドスピラ・ハロクロリスに由来するグリシンサルコシンメチルトランスフェラーゼをコードするポリヌクレオチド、および
(b)(a)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(a)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチドから選択され、
N,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子が、
(c)アクチノポリスポラ・ハロフィラ、エクトチオロロドスピラ・ハロクロリス、アファノティーキ・ハロフィティカ、シネココッカスsp. WH8102、マイコバクテリウム・マリナム、プロクロロコツカス・マリヌスまたはハロロドスピラ・ハロクロリスに由来するN,N−ジメチルグリシンメチルトランスフェラーゼをコードするポリヌクレオチド、および
(d)(c)のポリヌクレオチドの塩基配列と90%以上の相同性を有する塩基配列を有し、(c)のポリヌクレオチドがコードするポリペプチドの酵素活性をそのコードするポリペプチドが維持しているポリヌクレオチドから選択される、
請求項1記載の環境ストレス耐性ヤトロファ。
【請求項3】
グリシンサルコシンメチルトランスフェラーゼ遺伝子およびN,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子が、それぞれ配列番号1および2で示される塩基配列を有するポリヌクレオチドである、請求項1記載の環境ストレス耐性ヤトロファ。
【請求項4】
グリシンサルコシンメチルトランスフェラーゼ遺伝子および/またはN,N−ジメチルグリシンメチルトランスフェラーゼ遺伝子が組み入れられた、ヤトロファ形質転換用ベクター。
【請求項5】
請求項4記載のヤトロファ形質転換用ベクターを、野生型ヤトロファに導入することによる、環境ストレス耐性ヤトロファの製造方法。
【請求項6】
請求項1〜3のいずれか1項に記載の環境ストレス耐性ヤトロファから収穫される種子。
【請求項7】
請求項6記載の種子を圧搾して精製することによる、ヤトロファ油の製造方法。
【請求項8】
請求項7記載の製造方法で製造されうる、ヤトロファ油。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−17472(P2013−17472A)
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2012−89435(P2012−89435)
【出願日】平成24年4月10日(2012.4.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、独立行政法人新エネルギー・産業技術総合開発機構、「新エネルギー技術研究開発/バイオマスエネルギー等高効率転換技術開発(先導技術開発)/乾燥ストレス耐性改良型ヤトロファの創出とその機能評価に関する研究開発」に係る委託業務、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000002130)住友電気工業株式会社 (12,747)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願日】平成24年4月10日(2012.4.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、独立行政法人新エネルギー・産業技術総合開発機構、「新エネルギー技術研究開発/バイオマスエネルギー等高効率転換技術開発(先導技術開発)/乾燥ストレス耐性改良型ヤトロファの創出とその機能評価に関する研究開発」に係る委託業務、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000002130)住友電気工業株式会社 (12,747)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
[ Back to top ]

