グルコースセンサ用障壁層
グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域と、検知用領域へ入射光を導くための光学的導波管と、検知用領域の少なくとも一部に設けられている親水性のグルコース透過性ポリマー障壁層とを具備する光学的グルコースセンサであって、グルコースが障壁層を通ってセンサの前記検知用領域に入るように構成されている光学的グルコースセンサ。
【発明の詳細な説明】
【技術分野】
【0001】
[技術分野]
本発明は、グルコースセンサ、そのグルコースセンサを作製する方法、及び試料中のグルコースの量を検出又は決定する方法に関する。
【0002】
[発明の背景]
ボロネートが糖類と可逆的な5員環複合体を形成することは、しばらく前から公知である。近年、ボロネートのこの特性は、生体液中のグルコースを測定するセンサの開発に利用されてきた。例えばセンサは、グルコース受容体(ボロン酸)及び信号の伝達物質として働く発蛍光団を含むことができる。これらの指示化学物質は、適切な直径の光ファイバーに容易に固定化することができ、次いでそのファイバーを体液又は組織中に置いてグルコースを測定できる。
【0003】
ボロン酸がグリコシル化及び糖化したタンパク質と可逆的に複合体形成することは、しばらく前から公知である。選択的である検知用ボロン酸化学物質を考案しようと試みられてきたが、ボロン酸をセンサとして使用する場合、体液中のグルコースの定量において、糖化タンパク質が潜在的な干渉物質となることは明らかである。また、他の中分子量から高分子量の内在性物質が、信号を伝達する発蛍光団の消光物質として働くことによって、ボロン酸受容体に干渉する潜在的可能性もある。したがって、指示化学物質であるボロン酸/発蛍光団を使用するグルコースセンサからこれらの干渉物質を除去する手段の必要性がある。
【0004】
[発明の概要]
本発明は、グルコース指示化学物質であるボロン酸/発蛍光団を、グルコースに対して透過性であるがタンパク質及び糖化タンパク質など高分子量の分子の通過を制限する保護障壁層で包むことによって上記の問題を解決する。したがって、本発明は、
グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域と、
前記検知用領域へ入射光を導くための光学的導波管と、
前記検知用領域の少なくとも一部に設けられている、親水性のグルコース透過性ポリマー障壁層と
を具備する光学的グルコースセンサであって、
グルコースが前記障壁層を通ってセンサの前記検知用領域に入るように構成されている光学的グルコースセンサを提供する。
【0005】
障壁層は、タンパク質及び糖化タンパク質が検知用領域に通過することを制限することができる。通常、障壁層は、タンパク質及び糖化タンパク質に対して実質的に不透過性である。例えば、障壁層は、6000より大きい、好ましくは5000より大きい、好ましくは4000より大きい分子量を有する分子の通過を制限若しくは防止する、又はこの分子に対して実質的に不透過性である障壁層であってもよい。
【0006】
好ましい実施形態において、障壁層は半透膜、例えば透析膜により提供される。膜の孔径は、グルコースに対する透過性を確保するが、タンパク質及び糖化タンパク質などのより大きな高分子の通過を制限又は防止するように選択できる。1000〜5000の分画分子量(MWCO)を有する透析膜の使用することにより、インスリン、β−ミクログロブリン及びアルブミン並びにそれらの糖化誘導体など潜在的干渉物質が除去される。
【0007】
この実施形態の特定の態様において、親水性及び/又は負電荷を持つポリマーは膜の孔内部に存在する。通常これは、膜の孔内部での、1つ若しくは複数の親水性モノマー及び/又は負電荷を持つ1つ若しくは複数のモノマーを含むモノマー混合物のin situ重合によって達成される。得られた膜は、その親水性及び/又は負電荷によりタンパク質及び糖化タンパク質に対する障壁として特に有効であり、その重合法を使用して膜の孔径を制御し、さらに減少させることができるというさらなる利点を有する。
【0008】
代替の実施形態において、障壁層はヒドロゲルにより提供される。ヒドロゲルの高い親水性は、センサ表面においてタンパク質をはじき、タンパク質の吸着に対する抵抗性を与えるのに特に有益である。
【0009】
本発明はまた、本発明によるグルコースセンサを試料に挿入するステップと、センサの検出領域へ入射光を供給するステップと、発蛍光団の発光パターンを検出するステップとを含む、試料中のグルコースの量を検出又は定量化する方法も提供する。
【0010】
本発明のさらに好ましい特徴及び実施形態は、付随の説明及び添付の特許請求の範囲に記載されている。
【図面の簡単な説明】
【0011】
【図1】図1及び図1aはセンサ用の光ファイバー及びモニタを組み込んでいる本発明のセンサを示す図である。
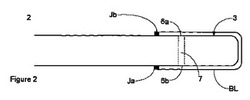
【図2】図2は本発明のセンサの検知用領域の様々な実施形態を示す図である。
【図3】図3は本発明のセンサの検知用領域の様々な実施形態を示す図である。
【図4】(a)実施例1に記載のin situ重合法により修飾された、又は(b)非修飾のポリエーテルスルホン中空繊維透析膜で包まれた、光ファイバーセンサのグルコース較正のグラフである。較正はヒト血液で実行した。
【0012】
[発明の詳細な説明]
本明細書では、親水性という用語は、水に対して親和性を有する物質を示す。通常本発明のグルコースセンサは、水溶液中のグルコースを検出又は定量化するために使用される。したがって、検知用領域の外側の親水性の障壁層は、グルコースが溶解した水溶液に対する親和性を有する。さらに障壁層の親水性は、センサが体液、特に血液中で使用される場合に血漿タンパク質をはじくのに役立つ。
【0013】
本明細書では、グルコース透過性障壁層とは、グルコースが層を通過することを可能にするが、タンパク質及び糖化タンパク質の通過を制限する物質である。
【0014】
本発明は、グルコース検知用化学物質であるボロン酸/発蛍光団を使用する任意の光学的グルコースセンサの使用を想定している。特に光ファイバセンサが想定されるが、本発明は、異なる型の光学的導波管を備えているセンサを使用することもできる。グルコースの検知は通常、間質組織又は血液など体液中で実施されるが、いかなる水溶液の検知も本発明のセンサを使用して実施できる。本明細書に記載の特定の実施形態は、血管に挿入する侵襲性センサとして使用することが想定される。しかし、本発明は、このような侵襲性センサに限定されない。in vitroで使用するための非侵襲性センサ、移植可能なセンサ及び皮下センサもまた本発明の範囲内である。
【0015】
光ファイバを組み込んでいる本発明のセンサの例を、図1及び図1aに示す。センサ1は、検知用領域3をその遠位端に含む光ファイバ2を備える。侵襲性センサの場合、ファイバー2は患者に挿入される、例えばカニューレを通して血管に挿入されるように構成されている。検知用領域3(図2及び図3に詳細に示される)は、指示化学物質を含有するセル又はチャンバ7を含む。光ファイバは、ケーブル4を通じてコネクタ5まで伸び、コネクタ5は適切なモニタ8と結合するように構成される。通常モニタは、5aにおいてコネクタと結合し、他方の二叉において(a)光学的センサ用の適切な入射光の光源9、及び(b)帰還信号用の検出器10と接続するためのさらなる光学的ケーブル4aを含む。
【0016】
一実施形態において、本発明のセンサは使い捨てのセンサである。通常センサは、光源9及び検出器10を備える使い捨てでないモニタに接続されるように構成されている。
【0017】
図2に図示するように、検知用領域3は、ファイバ内部にチャンバ形態のセル7を組み込む。指示化学物質が導波管(ここではファイバ)によって導かれる入射光路に含有され得る限り、セルは任意の形態をとることができる。したがって、セルは、ファイバ若しくは導波管の遠位端に取り付けられていてもよく、又は任意の望ましい形状を有するファイバ内部のチャンバの形態であってもよい。
【0018】
セル7は、指示化学物質、すなわちグルコースに結合するためのボロン酸受容体及び受容体に会合している発蛍光団を含有する。発蛍光団の発光パターン(例えば波長、強度、寿命)は、受容体に分析物が結合すると変わり、これによってグルコースの光学的な検出が可能になる。受容体と発蛍光団は、受容体−発蛍光団構造体として互いに直接結合していてもよい。適切な発蛍光団の例として、アントラセン、ピレン及びその誘導体が挙げられる。適切なボロン酸受容体の例は、少なくとも1つ、好ましくは2つのボロン酸基を有する化合物である。
【0019】
好ましい実施形態において、受容体は式(I)の基であり、
【0020】
【化1】

【0021】
式中、m及びnは、同じか又は異なり、通常1又は2、好ましくは1であり、Spは、脂肪族スペーサであり、通常はアルキレン部分、例えばC1〜C12アルキレン部分、例えばC6アルキレン部分であり、L1及びL2は、他の部分、例えば発蛍光団又はヒドロゲルに対する可能な付着点を表す。例えば、L1及びL2は、官能基に連結したアルキレン、アルキレン−アリーレン、又はアルキレン−アリーレン−アルキレン部分を表すことができる。他の部分に対する付着が想定されない場合、官能基は水素原子によって保護されている又は置き換えられている。L1及びL2の典型的なアルキレン基は、C1〜C4アルキレン基、例えばメチレン及びエチレンである。典型的なアリーレン基は、フェニレン基である。官能基は通常、例えば反応して発蛍光団又はヒドロゲルとの結合を形成できる任意の基、例えばエステル、アミド、アルデヒド又はアジドである。
【0022】
スペーサSpの長さを変化させることにより、受容体の選択性が変わる。通常、C6−アルキレン鎖は、グルコースに対して良好な選択性を有する受容体を提供する。
【0023】
このような受容体のさらなる詳細は米国特許第6,387,672号に見出され、その内容の全体は参照により本明細書に組み込まれている。
【0024】
受容体及び発蛍光団は通常互いに結合しており、ポリマーマトリクスとさらに結合していてもよい。ヒドロゲルは、適切なポリマーマトリクスの一例である。
【0025】
グルコースセンサの検知用領域3は、グルコースがセルに入ることができるように1つ又は複数の開口部6a、6bを有する。本発明の障壁層は、グルコースがセルに障壁層を通って入るように、通常これらの開口部を横切って設けられている。図2及び図3において、障壁層は検知用領域3の全体を覆って設けられている。しかし、別法として、障壁層は検知用領域の一部だけに、例えば開口部6a及び6bを横切ってのみ設けられていてもよい。
【0026】
センサは、通常それを通ってグルコースが通過できる検知用領域へのいかなる開口部も、障壁層で覆われるように設計される。これにより、タンパク質の吸着を少なくとも検知用領域への開口部においてタンパク質の吸着が制限することが確保される。しかし、好ましい実施形態において、検知用領域の全体、又は被験試料と接触することになるセンサの表面全体が障壁層で被覆又は包まれる。これは、センサのいかなる表面においてもタンパク質の吸着を防止するのに役立ち、侵襲性又は植込み型センサの場合には、センサの生体適合性を改善する。
【0027】
図2に示すように、障壁層BLは検知用領域、図2では光ファイバの先端に直接適用できる。図3に示す代替の実施形態において、検知用領域3は別個の支持体11内部に設けられており、障壁層は支持体11上に設けられている。別個の支持構造体を使用することにより、それ自体が壊れやすい可能性がある障壁層に追加の強度が付与される。グルコースが検知用領域3に入ることができるように、穴又は孔が支持体に設けられている。適切な支持構造体は、例えばレーザー切断法によって穴が開けられたポリマーチューブである。医学的な酸素供給器で一般的に使用され直径約0.2ミクロンの孔を有する微細孔中空繊維は、光ファイバセンサとともに使用するのに適切な支持構造体を提供する。代替の支持構造体は、その内容の全体が参照により本明細書に組み込まれている国際公開第2009/019470号パンフレットに記載されるようなポリマー又は金属物質を編んだ外筒である。
【0028】
必要であれば、障壁層は、センサの表面、例えば光ファイバ自体又は支持体11に接着させることができる。これは、シアノアクリル酸など適切な接着剤の適用によって達成することができる。別法として、センサ表面及び障壁層物質が適切である場合、障壁層とセンサとの間の接合部は、例えば図2及び図3のJa、Jbで熱形成できる。
【0029】
障壁層は、親水性であり、グルコースに対して透過性であり、タンパク質など高分子量物質の通過に対していくらかの制限をもたらすポリマー物質から形成される。一実施形態において、障壁層はヒドロゲルである。本明細書では、ヒドロゲルは水中に置いたときに膨張する親水性のポリマーマトリクスである。水中に置いたとき、水はマトリックスの全体にわたって分散する。適切なヒドロゲル物質の例には、架橋したポリアクリルアミド、ポリジメチルアクリルアミド、ポリヒドロキシルエチルメタクリレート、ポリビニルピロリドン、ポリエチレングリコールアクリレート及びポリエチレングリコールメタクリレートが含まれる。ヒドロゲルは通常、検知用領域の外表面に直接被覆されており、光ファイバの場合、通常光ファイバの先端に直接被覆されている。さらに後述するように、ヒドロゲル障壁層は陰イオンなど追加の物質を組み込むことができる。
【0030】
他の実施形態において、障壁層は透析膜など半透膜により形成される。透析膜は、分子の大きさ、形状、水和作用及び極性に基づいて分子を分離する半透膜である。半透膜は本発明において使用するのに特に適しており、この理由は、半透膜の孔径は、グルコースの膜への透過を可能にするが、タンパク質の通過を可能にするには小さ過ぎるためである。透析膜は通常中空繊維の形態であり、ポリアリールエーテルスルホン、ポリアミド、ポリカーボネート、ポリアクリロニトリル、ポリスルホン、ポリエーテルスルホン、ポリフッ化ビニリデン及びセルロース系物質又はその混合物若しくは修飾体などの物質で利用可能である。
【0031】
この実施形態の別の態様において、以下に詳細に記載するが、半透膜は、ポリマーが膜の孔内部に組み込まれた(例えば孔内部でのin situ重合によって)微細孔膜から形成される。孔内部にポリマーが存在することによって、膜が半透膜として作用するように孔径の減少が起こり、これによってタンパク質及び糖化タンパク質など高分子量物質に対する障壁が形成される。この態様での使用に適している微細孔膜は通常、0.1〜10μmの範囲、例えば2μmまで又は1μmまで、例えば約0.2μmの孔径を有する。
【0032】
半透膜は、膜の分画分子量(MWCO)に関して異なる孔径で利用可能である。分画分子量は、膜の孔を通過できる分子の最大分子量を示す。小さい孔径は、低MWCOを有する「低流量」と称され、より大きな孔径は、高MWCOを有する「高流量」と称される。タンパク質は、分子量がインスリンの約6,000からβ−ミクログロブリンの11,800、アルブミンの66,200、IGNの970,000に及ぶ高分子である。したがって、これら潜在的な干渉物質及びその誘導体を除去するには、分子量6,000以上の物質は通過できないが、グルコース(MW180)は通過できる低MWCO物質が選択されるべきである。しかし、センサ内へのグルコースの流量を最大にするために、これらの干渉物質を除去する一方で孔径は最大にするべきである。
【0033】
グルコースを連続的に測定する血管内センサの許容可能な応答時間を実現するために、その膜は、3分以下、好ましくは2分半以下の90%応答時間を実現するように、好ましくは選択されるべきである。好ましい膜は、少なくとも1,000、好ましくは5,000以下のMWCOを有する。例えば、MWCOは、少なくとも1,500又は少なくとも2,000であり、例えば4,000以下であることができる。好ましい有効な孔径(好ましい孔径)は、1〜20nm、好ましくは1〜10nm、例えば約6nmである。
【0034】
重合が膜の孔内部で実施される下記の本発明の実施形態において、重合ステップは膜の有効なMWCO及び孔径を減少させる。上記の好ましいMWCO及び孔径とは、グルコースセンサで使用する最終的な膜を指し、したがって、in situ重合後に得られた膜の有効なMWCO及び有効な孔径である。
【0035】
センサは膜で直接被覆又は包むことができるが、膜は支持体、例えばセンサが内部に置かれたチューブ(図3を参照)上に設けられることが好ましい。一実施形態において、センサの検知用領域はヒドロゲルで被覆され、膜、例えば透析膜障壁層はヒドロゲル層上に置かれる。
【0036】
透析膜物質として使用される物質のいくつかは、本質的に疎水性であり、例えばポリスルホン、ポリエーテルスルホン及びポリフッ化ビニリデンである。本発明によれば、障壁層は、血清タンパク質が層に吸着することを回避するために親水性である。したがって、本質的に疎水性である物質は、いくらかの親水性を付与するために、例えば親水性基をポリマーにグラフトする又は親水性モノマーを使用してグラフト重合することによって修飾される。適切な親水性基及びモノマーには、メタクリル酸2−ヒドロキシエチル、(メタ)アクリル酸、及びヒドロキシル若しくはスルホニルを持つ基又はモノマーが含まれる。
【0037】
グラフト重合は、M Belfortら(J. Membr Sci.、1996年、111巻、193〜215頁)の技術に従って達成することができる。これは、メタクリル酸2−ヒドロキシエチル、アシル酸及びメタクリル酸など親水性モノマーをポリスルホン膜表面にグラフト重合することによって、流量が増加した膜を得るための、放射線技術の使用について記述している。Higuchietら(J.Membr Sci.、1991年、57巻、175〜185頁)によって、スルホニル及びヒドロキシル末端基がポリスルホン膜表面に化学的にグラフトされて、タンパク質吸着の減少がもたらされる別の技術が記述されている。
【0038】
別法として、親水性の膜は、膜に対する表面修飾添加物として両親媒性のグラフト又はくし型ポリマーを使用することによって得ることができる(Mayesら、Macromolecules、2002年、35巻、7652〜61頁)。同様に、Mayesら(Biomaterials、2006年、27巻、856〜865頁)により記述される通り、ポリエチレングリコール基をポリスルホンポリマーに組み込むことができる。これらの膜は、タンパク質の吸着及び細胞の付着に対して有意な抵抗性を示した。適切な膜の例は、米国特許第6,193,077号に記述されるものである。これらの膜は、予備形成した高分子量ポリアルキレン酸化物ポリマー(25,000〜1,000,000ダルトン)及び多官能モノマーの水溶液で表面を被覆し、それに続けてプラズマ重合することによって調製した非クラッキング親水性マクロ多孔性(0.1〜100ミクロン孔)ポリエーテルスルホン膜である。適切な膜のさらなる例は、米国特許第5,468,390号に記述されるものである。これらの膜は、開始剤を使用せずに表面上に単官能性モノマーを重合することにより修飾されたアリールポリスルホン膜である。
【0039】
代替の実施形態において、透析膜を湿式紡糸形成する間に、1つ又は複数の親水性ポリマーを組み込むことによって親水性が付与される。通常透析膜は、所望の膜構造体(例えば、センサを包むために使用することができる中空繊維透析膜)を形成するために、適切なポリマー溶液を紡糸することにより作製される。この実施形態において、親水性ポリマーをポリマー溶液に添加し、その後回転させて、主要膜ポリマー(複数可)(例えばポリスルホン、ポリエーテルスルホン又はポリフッ化ビニリデン)及び親水性ポリマー(複数可)から形成された透析膜が生じる。したがって、得られた膜は水の通過を可能にする親水性の区域又はくぼみを含む。得られた膜の親水性は、組み込まれる親水性ポリマーの量を変化させることによって制御できる。通常親水性ポリマーは、回転させる前の溶液の全ポリマー含有量の約10%を構成する。
【0040】
本明細書では、親水性ポリマーは親水性を有する構成単位を含むポリマーであり、例えばこれは、モノマーの少なくとも1つが親水性を有するモノマーの混合物から調製される。適切な親水性ポリマーの例には、ポリエチレングリコール、ポリエチレンオキシド及びポリビニルピロリドンがある。
【0041】
さらなる別の実施形態において、親水性は、タンパク質をはじく公知の特性を伴う官能基を通常有する親水性ポリマーを、膜の孔内部に供給することによってもたらされる。ポリマーを膜の孔内部に供給することは通常、1つ又は複数の適切な親水性モノマーを膜(例えば孔径6〜20nm)に拡散させることと、重合を例えば、紫外線活性化を開始剤の存在下で適用することによって開始することとにより達成される。これによって、膜の孔内部で起こる重合が引き起こされ、得られたポリマーは孔内部に閉じ込められる。必要に応じて、拡散及び重合のステップを1回又は複数回繰り返して、膜孔内部で形成されるポリマーの量を増加させることができる。膜は例えば、得られたチューブを使用してセンサを包んで必要な障壁特性をもたらすことができるような中空繊維透析膜の形態である。
【0042】
この実施形態の代替の態様において、親水性ポリマーは、微細孔膜、例えば微細孔中空繊維の孔内部(典型的な孔径0.1〜10μm、例えば2μmまで又は1μmまで、例えば約0.2μm)に供給される。膜孔内部でのin situ重合に起因する孔径の固有の減少により、タンパク質及び糖化タンパク質など干渉物質に対して適当な障壁である膜がもたらされる。
【0043】
微細孔膜を使用する場合、図3に示すように、これは別個の支持体11に適用できる。或いは、微細孔膜自体が支持体及び障壁層の両方として機能できる。
【0044】
この実施形態において、膜(例えば微細孔膜又は透析膜)に組み込まれる官能基は、タンパク質をはじく公知の特性を有するポリエチレングリコール又はポリエチレンオキシドであることが好ましい。したがって、この実施形態で使用するのに適切な親水性モノマーには、ポリエチレングリコールジメタクリレート、ポリエチレングリコールジメタクリルアミド、ポリエチレングリコールジアクリレート及びポリエチレングリコールジアクリルアミド又はそれらの組合せが含まれる。ポリエチレングリコールジメタクリレートが好ましい。異なる分子量のポリエチレングリコールジメタクリレート及びポリエチレングリコールジアクリレート並びに各種誘導体は、Sigma−Aldrich、UKから容易に入手できる。
【0045】
通常、膜孔に拡散される重合混合物は、親水性モノマー(複数可)に加えて鎖延長モノマーを含む。適切な鎖延長剤の例には、ジ(メタ)アクリレート、及びジ(メタ)アクリルアミドが含まれる。
【0046】
本発明のこの実施形態による膜が、タンパク質吸着に対する有意な抑制、及びボロン酸受容体/発蛍光団干渉物質に対する障壁としての増強を実現することが示された。加えて、これらの処理した膜は膜孔径を減少させ、微調整する能力を提供する。親水性モノマー(複数可)は膜の孔に拡散され、in situで重合されるので、孔径は減少することになり、よってMWCOが減少することになる。この孔径の減少は、タンパク質及び糖化タンパク質に対してより効果的な障壁として作用する膜をもたらす。したがって、拡散モノマー溶液及び架橋剤の濃度、並びに拡散及び重合が実施される回数の変動によって孔径及びMWCOを調節し、実験によって決定することができる。MWCOは、分子量が公知であり蛍光分子が付着した単分散物質を拡散させることによって決定できる。分子量を段階的に増加させた物質は膜を通過し、拡散の進展は検出器として蛍光光度計を使用して決定できる。適切な単分散物質の例は、Sigma−Aldrichから入手可能な様々な分子量のフルオレセイン標識デキストランである。
【0047】
本発明のさらなる態様において、障壁層の有効性は、負電荷を障壁層に組み込むことによって増強できる。タンパク質は生理的pHで負電荷を持つので、障壁層への負電荷の組込みは、糖化タンパク質を含めたタンパク質又は他の負電荷を持つ干渉物質に対する反発物質として作用する。これは、負に荷電したモノマー若しくはポリマー又は陰イオンを障壁層に組み込むことによって達成できる。
【0048】
陰イオンは、ヒドロゲル障壁層に組み込むのに特に適している。適切な陰イオンの例には、ハロゲン化物、スルホン酸、カルボン酸、アルコキシドが含まれる。
【0049】
負電荷を持つモノマー又はポリマーは、膜(例えば微細孔膜又は透析膜)の障壁層への組込みに適している。適切な負電荷を持つモノマー又はポリマーには、スルホプロピルメタクリル酸カリウム、アクリル酸若しくはメタクリル酸又はそれらの相当するポリマーが含まれる。
【0050】
膜障壁層の場合、負電荷を持つモノマー又はポリマーは膜自体にグラフトすることができる。別法として、負電荷を持つ1つ又は複数のポリマーは、透析膜を湿式紡糸形成する間に、ポリマー混合物に組み込むことができる。これにより、負電荷を持つモノマーは膜構造に直接組み込まれる。負電荷を持つ1つ若しくは複数のポリマーは単独で使用してもよく、又は1つ若しくは複数の親水性ポリマーと組み合わせて使用してもよい。
【0051】
別法として、スルホプロピルメタクリル酸カリウムなど負電荷を持つ1つ又は複数のモノマーは、膜(例えば微細孔膜又は透析膜)中に拡散させ、次いでin situで重合することができる。重合は、ポリエチレングリコールジメタクリル酸など親水性モノマーについて上で論じたものと同様の様式で実施できる。この方法は負電荷を持つポリマーの形成を引き起こし、このポリマーはその大きさに基づいて、又は親水性モノマーとの共重合によって、膜(例えば微細孔膜若しくは透析膜)の孔内部に閉じ込められる。このような重合は、負電荷を持つ1つ若しくは複数のモノマーを単独で使用して、又は上述の1つ若しくは複数の親水性モノマーと負電荷を持つ1つ若しくは複数のモノマーとの混合物を使用して実施できる。
【0052】
代替の実施形態において、負電荷を持つ物質はヘパリンである。これは、ヘパリン分子上にある負電荷がタンパク質をはじくという利点を有するが、抗血栓性であるという付加的な利益を有する。ヘパリンは、ヒドロゲルに組み込む、又は膜(例えば微細孔膜又は透析膜)にグラフト若しくはこれと重合させることができる。
【0053】
センサは、グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域を用意するステップと、検知用領域へ入射光を導くための光学的導波管を用意するステップと、検知用領域の少なくとも一部に親水性のグルコース透過性ポリマー障壁層を設けるステップとにより製造され、ここでセンサは、グルコースが前記障壁層を通ってセンサの検知用領域に入るように構成されている。
【0054】
特定の実施形態において、障壁層は半透膜であり、方法は親水性及び負電荷を持つモノマーから選択される1つ又は複数のモノマーを、膜(例えば透析膜又は微細孔膜)の孔に拡散させるステップと、重合を開始するステップとを含む。これによって、親水性及び/又は負電荷を持つポリマーが膜(例えば微細孔膜又は透析膜の)の孔内部で形成され、孔径の減少がもたらされる。親水性又は負電荷を持つポリマーを形成する重合は、膜(例えば微細孔膜又は透析膜)をセンサの検知用領域に適用する前又はこの後のいずれかにおいて実施できる。
【0055】
実施例1
以下に記載の通り、ポリエーテルスルホン中空繊維透析膜を重合混合物に10分間浸漬し、次いで、240nmの紫外線によって、8.3ミリワットの電力設定で30秒間重合を開始した。得られた膜を37Cのリン酸緩衝液溶液で12時間洗浄し、蒸留水ですすぎ、次いで風乾した。
【0056】
重合混合物
2.00g ポリエチレングリコールジメタクリル酸(600)
1.00g ジメチルアクリルアミド
0.50g プロピルスルホメタクリル酸カリウム
0.02g イルガキュア651(Irgacure 651)
0.20g トライトンX(Triton X)
3.50 水
【0057】
得られた膜はその孔内部に、ジメチルアクリルアミド、スルホプロピルメタクリル酸カリウムに由来し、ポリエチレングリコールジメタクリル酸と架橋した構成単位を有するポリマーを含む。
【0058】
米国特許第6,387,672号に記載のものによる、ジボロン酸/発蛍光団指示薬を利用する光ファイバーグルコースセンサの検知用領域を上記の膜で包み、この検知用領域を使用してヒト血液のグルコース濃度を決定した。比較のために、非修飾のポリエーテルスルホン中空繊維透析膜で包まれていることを除いて上述のセンサと同一のセンサを使用して、同じ血液試料でも実験を実施した。
【0059】
適切な励起波長を使用して励起し、検知用化学物質からの発光信号を測定することによって、センサを試験した。3点だがグルコース濃度を変化させることによってグルコースに対する応答曲線を定義し、任意の所与の測定した発光強度におけるグルコース濃度の算出を可能にする3つの定数の一組によって応答曲線をさらに定義した。調整値(modulation)は、グルコース濃度の所与の変化についての強度変化の基準であり、したがってセンサの感度の基準である。時間0に、等張リン酸緩衝食塩水における3点較正から初期調整値を決定し、センサをヒト血液に対して5時間及び20時間の両方で曝露した後のさらなる3点較正から算出された調整値と初期調整値を比較した。その結果を、図4に示す。
【0060】
図4は、各センサの蛍光発光強度を比較して示す。経時的な蛍光強度の減少は、修飾した膜を備えるセンサより非修飾膜を有するセンサにおいて、はるかに大きいことが分かる。修飾した膜は、ヒト血液中に存在するタンパク質及び糖化タンパク質に対してはるかにより良好な障壁特性を有し、これによってセンサの感度に著しい改善がもたらされる。
【0061】
本発明は、いくつかの特定の実施形態及び実施例を参照して記述された。しかし、本発明は、これらの特定の実施形態及び実施例に限定されない。
【技術分野】
【0001】
[技術分野]
本発明は、グルコースセンサ、そのグルコースセンサを作製する方法、及び試料中のグルコースの量を検出又は決定する方法に関する。
【0002】
[発明の背景]
ボロネートが糖類と可逆的な5員環複合体を形成することは、しばらく前から公知である。近年、ボロネートのこの特性は、生体液中のグルコースを測定するセンサの開発に利用されてきた。例えばセンサは、グルコース受容体(ボロン酸)及び信号の伝達物質として働く発蛍光団を含むことができる。これらの指示化学物質は、適切な直径の光ファイバーに容易に固定化することができ、次いでそのファイバーを体液又は組織中に置いてグルコースを測定できる。
【0003】
ボロン酸がグリコシル化及び糖化したタンパク質と可逆的に複合体形成することは、しばらく前から公知である。選択的である検知用ボロン酸化学物質を考案しようと試みられてきたが、ボロン酸をセンサとして使用する場合、体液中のグルコースの定量において、糖化タンパク質が潜在的な干渉物質となることは明らかである。また、他の中分子量から高分子量の内在性物質が、信号を伝達する発蛍光団の消光物質として働くことによって、ボロン酸受容体に干渉する潜在的可能性もある。したがって、指示化学物質であるボロン酸/発蛍光団を使用するグルコースセンサからこれらの干渉物質を除去する手段の必要性がある。
【0004】
[発明の概要]
本発明は、グルコース指示化学物質であるボロン酸/発蛍光団を、グルコースに対して透過性であるがタンパク質及び糖化タンパク質など高分子量の分子の通過を制限する保護障壁層で包むことによって上記の問題を解決する。したがって、本発明は、
グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域と、
前記検知用領域へ入射光を導くための光学的導波管と、
前記検知用領域の少なくとも一部に設けられている、親水性のグルコース透過性ポリマー障壁層と
を具備する光学的グルコースセンサであって、
グルコースが前記障壁層を通ってセンサの前記検知用領域に入るように構成されている光学的グルコースセンサを提供する。
【0005】
障壁層は、タンパク質及び糖化タンパク質が検知用領域に通過することを制限することができる。通常、障壁層は、タンパク質及び糖化タンパク質に対して実質的に不透過性である。例えば、障壁層は、6000より大きい、好ましくは5000より大きい、好ましくは4000より大きい分子量を有する分子の通過を制限若しくは防止する、又はこの分子に対して実質的に不透過性である障壁層であってもよい。
【0006】
好ましい実施形態において、障壁層は半透膜、例えば透析膜により提供される。膜の孔径は、グルコースに対する透過性を確保するが、タンパク質及び糖化タンパク質などのより大きな高分子の通過を制限又は防止するように選択できる。1000〜5000の分画分子量(MWCO)を有する透析膜の使用することにより、インスリン、β−ミクログロブリン及びアルブミン並びにそれらの糖化誘導体など潜在的干渉物質が除去される。
【0007】
この実施形態の特定の態様において、親水性及び/又は負電荷を持つポリマーは膜の孔内部に存在する。通常これは、膜の孔内部での、1つ若しくは複数の親水性モノマー及び/又は負電荷を持つ1つ若しくは複数のモノマーを含むモノマー混合物のin situ重合によって達成される。得られた膜は、その親水性及び/又は負電荷によりタンパク質及び糖化タンパク質に対する障壁として特に有効であり、その重合法を使用して膜の孔径を制御し、さらに減少させることができるというさらなる利点を有する。
【0008】
代替の実施形態において、障壁層はヒドロゲルにより提供される。ヒドロゲルの高い親水性は、センサ表面においてタンパク質をはじき、タンパク質の吸着に対する抵抗性を与えるのに特に有益である。
【0009】
本発明はまた、本発明によるグルコースセンサを試料に挿入するステップと、センサの検出領域へ入射光を供給するステップと、発蛍光団の発光パターンを検出するステップとを含む、試料中のグルコースの量を検出又は定量化する方法も提供する。
【0010】
本発明のさらに好ましい特徴及び実施形態は、付随の説明及び添付の特許請求の範囲に記載されている。
【図面の簡単な説明】
【0011】
【図1】図1及び図1aはセンサ用の光ファイバー及びモニタを組み込んでいる本発明のセンサを示す図である。
【図2】図2は本発明のセンサの検知用領域の様々な実施形態を示す図である。
【図3】図3は本発明のセンサの検知用領域の様々な実施形態を示す図である。
【図4】(a)実施例1に記載のin situ重合法により修飾された、又は(b)非修飾のポリエーテルスルホン中空繊維透析膜で包まれた、光ファイバーセンサのグルコース較正のグラフである。較正はヒト血液で実行した。
【0012】
[発明の詳細な説明]
本明細書では、親水性という用語は、水に対して親和性を有する物質を示す。通常本発明のグルコースセンサは、水溶液中のグルコースを検出又は定量化するために使用される。したがって、検知用領域の外側の親水性の障壁層は、グルコースが溶解した水溶液に対する親和性を有する。さらに障壁層の親水性は、センサが体液、特に血液中で使用される場合に血漿タンパク質をはじくのに役立つ。
【0013】
本明細書では、グルコース透過性障壁層とは、グルコースが層を通過することを可能にするが、タンパク質及び糖化タンパク質の通過を制限する物質である。
【0014】
本発明は、グルコース検知用化学物質であるボロン酸/発蛍光団を使用する任意の光学的グルコースセンサの使用を想定している。特に光ファイバセンサが想定されるが、本発明は、異なる型の光学的導波管を備えているセンサを使用することもできる。グルコースの検知は通常、間質組織又は血液など体液中で実施されるが、いかなる水溶液の検知も本発明のセンサを使用して実施できる。本明細書に記載の特定の実施形態は、血管に挿入する侵襲性センサとして使用することが想定される。しかし、本発明は、このような侵襲性センサに限定されない。in vitroで使用するための非侵襲性センサ、移植可能なセンサ及び皮下センサもまた本発明の範囲内である。
【0015】
光ファイバを組み込んでいる本発明のセンサの例を、図1及び図1aに示す。センサ1は、検知用領域3をその遠位端に含む光ファイバ2を備える。侵襲性センサの場合、ファイバー2は患者に挿入される、例えばカニューレを通して血管に挿入されるように構成されている。検知用領域3(図2及び図3に詳細に示される)は、指示化学物質を含有するセル又はチャンバ7を含む。光ファイバは、ケーブル4を通じてコネクタ5まで伸び、コネクタ5は適切なモニタ8と結合するように構成される。通常モニタは、5aにおいてコネクタと結合し、他方の二叉において(a)光学的センサ用の適切な入射光の光源9、及び(b)帰還信号用の検出器10と接続するためのさらなる光学的ケーブル4aを含む。
【0016】
一実施形態において、本発明のセンサは使い捨てのセンサである。通常センサは、光源9及び検出器10を備える使い捨てでないモニタに接続されるように構成されている。
【0017】
図2に図示するように、検知用領域3は、ファイバ内部にチャンバ形態のセル7を組み込む。指示化学物質が導波管(ここではファイバ)によって導かれる入射光路に含有され得る限り、セルは任意の形態をとることができる。したがって、セルは、ファイバ若しくは導波管の遠位端に取り付けられていてもよく、又は任意の望ましい形状を有するファイバ内部のチャンバの形態であってもよい。
【0018】
セル7は、指示化学物質、すなわちグルコースに結合するためのボロン酸受容体及び受容体に会合している発蛍光団を含有する。発蛍光団の発光パターン(例えば波長、強度、寿命)は、受容体に分析物が結合すると変わり、これによってグルコースの光学的な検出が可能になる。受容体と発蛍光団は、受容体−発蛍光団構造体として互いに直接結合していてもよい。適切な発蛍光団の例として、アントラセン、ピレン及びその誘導体が挙げられる。適切なボロン酸受容体の例は、少なくとも1つ、好ましくは2つのボロン酸基を有する化合物である。
【0019】
好ましい実施形態において、受容体は式(I)の基であり、
【0020】
【化1】

【0021】
式中、m及びnは、同じか又は異なり、通常1又は2、好ましくは1であり、Spは、脂肪族スペーサであり、通常はアルキレン部分、例えばC1〜C12アルキレン部分、例えばC6アルキレン部分であり、L1及びL2は、他の部分、例えば発蛍光団又はヒドロゲルに対する可能な付着点を表す。例えば、L1及びL2は、官能基に連結したアルキレン、アルキレン−アリーレン、又はアルキレン−アリーレン−アルキレン部分を表すことができる。他の部分に対する付着が想定されない場合、官能基は水素原子によって保護されている又は置き換えられている。L1及びL2の典型的なアルキレン基は、C1〜C4アルキレン基、例えばメチレン及びエチレンである。典型的なアリーレン基は、フェニレン基である。官能基は通常、例えば反応して発蛍光団又はヒドロゲルとの結合を形成できる任意の基、例えばエステル、アミド、アルデヒド又はアジドである。
【0022】
スペーサSpの長さを変化させることにより、受容体の選択性が変わる。通常、C6−アルキレン鎖は、グルコースに対して良好な選択性を有する受容体を提供する。
【0023】
このような受容体のさらなる詳細は米国特許第6,387,672号に見出され、その内容の全体は参照により本明細書に組み込まれている。
【0024】
受容体及び発蛍光団は通常互いに結合しており、ポリマーマトリクスとさらに結合していてもよい。ヒドロゲルは、適切なポリマーマトリクスの一例である。
【0025】
グルコースセンサの検知用領域3は、グルコースがセルに入ることができるように1つ又は複数の開口部6a、6bを有する。本発明の障壁層は、グルコースがセルに障壁層を通って入るように、通常これらの開口部を横切って設けられている。図2及び図3において、障壁層は検知用領域3の全体を覆って設けられている。しかし、別法として、障壁層は検知用領域の一部だけに、例えば開口部6a及び6bを横切ってのみ設けられていてもよい。
【0026】
センサは、通常それを通ってグルコースが通過できる検知用領域へのいかなる開口部も、障壁層で覆われるように設計される。これにより、タンパク質の吸着を少なくとも検知用領域への開口部においてタンパク質の吸着が制限することが確保される。しかし、好ましい実施形態において、検知用領域の全体、又は被験試料と接触することになるセンサの表面全体が障壁層で被覆又は包まれる。これは、センサのいかなる表面においてもタンパク質の吸着を防止するのに役立ち、侵襲性又は植込み型センサの場合には、センサの生体適合性を改善する。
【0027】
図2に示すように、障壁層BLは検知用領域、図2では光ファイバの先端に直接適用できる。図3に示す代替の実施形態において、検知用領域3は別個の支持体11内部に設けられており、障壁層は支持体11上に設けられている。別個の支持構造体を使用することにより、それ自体が壊れやすい可能性がある障壁層に追加の強度が付与される。グルコースが検知用領域3に入ることができるように、穴又は孔が支持体に設けられている。適切な支持構造体は、例えばレーザー切断法によって穴が開けられたポリマーチューブである。医学的な酸素供給器で一般的に使用され直径約0.2ミクロンの孔を有する微細孔中空繊維は、光ファイバセンサとともに使用するのに適切な支持構造体を提供する。代替の支持構造体は、その内容の全体が参照により本明細書に組み込まれている国際公開第2009/019470号パンフレットに記載されるようなポリマー又は金属物質を編んだ外筒である。
【0028】
必要であれば、障壁層は、センサの表面、例えば光ファイバ自体又は支持体11に接着させることができる。これは、シアノアクリル酸など適切な接着剤の適用によって達成することができる。別法として、センサ表面及び障壁層物質が適切である場合、障壁層とセンサとの間の接合部は、例えば図2及び図3のJa、Jbで熱形成できる。
【0029】
障壁層は、親水性であり、グルコースに対して透過性であり、タンパク質など高分子量物質の通過に対していくらかの制限をもたらすポリマー物質から形成される。一実施形態において、障壁層はヒドロゲルである。本明細書では、ヒドロゲルは水中に置いたときに膨張する親水性のポリマーマトリクスである。水中に置いたとき、水はマトリックスの全体にわたって分散する。適切なヒドロゲル物質の例には、架橋したポリアクリルアミド、ポリジメチルアクリルアミド、ポリヒドロキシルエチルメタクリレート、ポリビニルピロリドン、ポリエチレングリコールアクリレート及びポリエチレングリコールメタクリレートが含まれる。ヒドロゲルは通常、検知用領域の外表面に直接被覆されており、光ファイバの場合、通常光ファイバの先端に直接被覆されている。さらに後述するように、ヒドロゲル障壁層は陰イオンなど追加の物質を組み込むことができる。
【0030】
他の実施形態において、障壁層は透析膜など半透膜により形成される。透析膜は、分子の大きさ、形状、水和作用及び極性に基づいて分子を分離する半透膜である。半透膜は本発明において使用するのに特に適しており、この理由は、半透膜の孔径は、グルコースの膜への透過を可能にするが、タンパク質の通過を可能にするには小さ過ぎるためである。透析膜は通常中空繊維の形態であり、ポリアリールエーテルスルホン、ポリアミド、ポリカーボネート、ポリアクリロニトリル、ポリスルホン、ポリエーテルスルホン、ポリフッ化ビニリデン及びセルロース系物質又はその混合物若しくは修飾体などの物質で利用可能である。
【0031】
この実施形態の別の態様において、以下に詳細に記載するが、半透膜は、ポリマーが膜の孔内部に組み込まれた(例えば孔内部でのin situ重合によって)微細孔膜から形成される。孔内部にポリマーが存在することによって、膜が半透膜として作用するように孔径の減少が起こり、これによってタンパク質及び糖化タンパク質など高分子量物質に対する障壁が形成される。この態様での使用に適している微細孔膜は通常、0.1〜10μmの範囲、例えば2μmまで又は1μmまで、例えば約0.2μmの孔径を有する。
【0032】
半透膜は、膜の分画分子量(MWCO)に関して異なる孔径で利用可能である。分画分子量は、膜の孔を通過できる分子の最大分子量を示す。小さい孔径は、低MWCOを有する「低流量」と称され、より大きな孔径は、高MWCOを有する「高流量」と称される。タンパク質は、分子量がインスリンの約6,000からβ−ミクログロブリンの11,800、アルブミンの66,200、IGNの970,000に及ぶ高分子である。したがって、これら潜在的な干渉物質及びその誘導体を除去するには、分子量6,000以上の物質は通過できないが、グルコース(MW180)は通過できる低MWCO物質が選択されるべきである。しかし、センサ内へのグルコースの流量を最大にするために、これらの干渉物質を除去する一方で孔径は最大にするべきである。
【0033】
グルコースを連続的に測定する血管内センサの許容可能な応答時間を実現するために、その膜は、3分以下、好ましくは2分半以下の90%応答時間を実現するように、好ましくは選択されるべきである。好ましい膜は、少なくとも1,000、好ましくは5,000以下のMWCOを有する。例えば、MWCOは、少なくとも1,500又は少なくとも2,000であり、例えば4,000以下であることができる。好ましい有効な孔径(好ましい孔径)は、1〜20nm、好ましくは1〜10nm、例えば約6nmである。
【0034】
重合が膜の孔内部で実施される下記の本発明の実施形態において、重合ステップは膜の有効なMWCO及び孔径を減少させる。上記の好ましいMWCO及び孔径とは、グルコースセンサで使用する最終的な膜を指し、したがって、in situ重合後に得られた膜の有効なMWCO及び有効な孔径である。
【0035】
センサは膜で直接被覆又は包むことができるが、膜は支持体、例えばセンサが内部に置かれたチューブ(図3を参照)上に設けられることが好ましい。一実施形態において、センサの検知用領域はヒドロゲルで被覆され、膜、例えば透析膜障壁層はヒドロゲル層上に置かれる。
【0036】
透析膜物質として使用される物質のいくつかは、本質的に疎水性であり、例えばポリスルホン、ポリエーテルスルホン及びポリフッ化ビニリデンである。本発明によれば、障壁層は、血清タンパク質が層に吸着することを回避するために親水性である。したがって、本質的に疎水性である物質は、いくらかの親水性を付与するために、例えば親水性基をポリマーにグラフトする又は親水性モノマーを使用してグラフト重合することによって修飾される。適切な親水性基及びモノマーには、メタクリル酸2−ヒドロキシエチル、(メタ)アクリル酸、及びヒドロキシル若しくはスルホニルを持つ基又はモノマーが含まれる。
【0037】
グラフト重合は、M Belfortら(J. Membr Sci.、1996年、111巻、193〜215頁)の技術に従って達成することができる。これは、メタクリル酸2−ヒドロキシエチル、アシル酸及びメタクリル酸など親水性モノマーをポリスルホン膜表面にグラフト重合することによって、流量が増加した膜を得るための、放射線技術の使用について記述している。Higuchietら(J.Membr Sci.、1991年、57巻、175〜185頁)によって、スルホニル及びヒドロキシル末端基がポリスルホン膜表面に化学的にグラフトされて、タンパク質吸着の減少がもたらされる別の技術が記述されている。
【0038】
別法として、親水性の膜は、膜に対する表面修飾添加物として両親媒性のグラフト又はくし型ポリマーを使用することによって得ることができる(Mayesら、Macromolecules、2002年、35巻、7652〜61頁)。同様に、Mayesら(Biomaterials、2006年、27巻、856〜865頁)により記述される通り、ポリエチレングリコール基をポリスルホンポリマーに組み込むことができる。これらの膜は、タンパク質の吸着及び細胞の付着に対して有意な抵抗性を示した。適切な膜の例は、米国特許第6,193,077号に記述されるものである。これらの膜は、予備形成した高分子量ポリアルキレン酸化物ポリマー(25,000〜1,000,000ダルトン)及び多官能モノマーの水溶液で表面を被覆し、それに続けてプラズマ重合することによって調製した非クラッキング親水性マクロ多孔性(0.1〜100ミクロン孔)ポリエーテルスルホン膜である。適切な膜のさらなる例は、米国特許第5,468,390号に記述されるものである。これらの膜は、開始剤を使用せずに表面上に単官能性モノマーを重合することにより修飾されたアリールポリスルホン膜である。
【0039】
代替の実施形態において、透析膜を湿式紡糸形成する間に、1つ又は複数の親水性ポリマーを組み込むことによって親水性が付与される。通常透析膜は、所望の膜構造体(例えば、センサを包むために使用することができる中空繊維透析膜)を形成するために、適切なポリマー溶液を紡糸することにより作製される。この実施形態において、親水性ポリマーをポリマー溶液に添加し、その後回転させて、主要膜ポリマー(複数可)(例えばポリスルホン、ポリエーテルスルホン又はポリフッ化ビニリデン)及び親水性ポリマー(複数可)から形成された透析膜が生じる。したがって、得られた膜は水の通過を可能にする親水性の区域又はくぼみを含む。得られた膜の親水性は、組み込まれる親水性ポリマーの量を変化させることによって制御できる。通常親水性ポリマーは、回転させる前の溶液の全ポリマー含有量の約10%を構成する。
【0040】
本明細書では、親水性ポリマーは親水性を有する構成単位を含むポリマーであり、例えばこれは、モノマーの少なくとも1つが親水性を有するモノマーの混合物から調製される。適切な親水性ポリマーの例には、ポリエチレングリコール、ポリエチレンオキシド及びポリビニルピロリドンがある。
【0041】
さらなる別の実施形態において、親水性は、タンパク質をはじく公知の特性を伴う官能基を通常有する親水性ポリマーを、膜の孔内部に供給することによってもたらされる。ポリマーを膜の孔内部に供給することは通常、1つ又は複数の適切な親水性モノマーを膜(例えば孔径6〜20nm)に拡散させることと、重合を例えば、紫外線活性化を開始剤の存在下で適用することによって開始することとにより達成される。これによって、膜の孔内部で起こる重合が引き起こされ、得られたポリマーは孔内部に閉じ込められる。必要に応じて、拡散及び重合のステップを1回又は複数回繰り返して、膜孔内部で形成されるポリマーの量を増加させることができる。膜は例えば、得られたチューブを使用してセンサを包んで必要な障壁特性をもたらすことができるような中空繊維透析膜の形態である。
【0042】
この実施形態の代替の態様において、親水性ポリマーは、微細孔膜、例えば微細孔中空繊維の孔内部(典型的な孔径0.1〜10μm、例えば2μmまで又は1μmまで、例えば約0.2μm)に供給される。膜孔内部でのin situ重合に起因する孔径の固有の減少により、タンパク質及び糖化タンパク質など干渉物質に対して適当な障壁である膜がもたらされる。
【0043】
微細孔膜を使用する場合、図3に示すように、これは別個の支持体11に適用できる。或いは、微細孔膜自体が支持体及び障壁層の両方として機能できる。
【0044】
この実施形態において、膜(例えば微細孔膜又は透析膜)に組み込まれる官能基は、タンパク質をはじく公知の特性を有するポリエチレングリコール又はポリエチレンオキシドであることが好ましい。したがって、この実施形態で使用するのに適切な親水性モノマーには、ポリエチレングリコールジメタクリレート、ポリエチレングリコールジメタクリルアミド、ポリエチレングリコールジアクリレート及びポリエチレングリコールジアクリルアミド又はそれらの組合せが含まれる。ポリエチレングリコールジメタクリレートが好ましい。異なる分子量のポリエチレングリコールジメタクリレート及びポリエチレングリコールジアクリレート並びに各種誘導体は、Sigma−Aldrich、UKから容易に入手できる。
【0045】
通常、膜孔に拡散される重合混合物は、親水性モノマー(複数可)に加えて鎖延長モノマーを含む。適切な鎖延長剤の例には、ジ(メタ)アクリレート、及びジ(メタ)アクリルアミドが含まれる。
【0046】
本発明のこの実施形態による膜が、タンパク質吸着に対する有意な抑制、及びボロン酸受容体/発蛍光団干渉物質に対する障壁としての増強を実現することが示された。加えて、これらの処理した膜は膜孔径を減少させ、微調整する能力を提供する。親水性モノマー(複数可)は膜の孔に拡散され、in situで重合されるので、孔径は減少することになり、よってMWCOが減少することになる。この孔径の減少は、タンパク質及び糖化タンパク質に対してより効果的な障壁として作用する膜をもたらす。したがって、拡散モノマー溶液及び架橋剤の濃度、並びに拡散及び重合が実施される回数の変動によって孔径及びMWCOを調節し、実験によって決定することができる。MWCOは、分子量が公知であり蛍光分子が付着した単分散物質を拡散させることによって決定できる。分子量を段階的に増加させた物質は膜を通過し、拡散の進展は検出器として蛍光光度計を使用して決定できる。適切な単分散物質の例は、Sigma−Aldrichから入手可能な様々な分子量のフルオレセイン標識デキストランである。
【0047】
本発明のさらなる態様において、障壁層の有効性は、負電荷を障壁層に組み込むことによって増強できる。タンパク質は生理的pHで負電荷を持つので、障壁層への負電荷の組込みは、糖化タンパク質を含めたタンパク質又は他の負電荷を持つ干渉物質に対する反発物質として作用する。これは、負に荷電したモノマー若しくはポリマー又は陰イオンを障壁層に組み込むことによって達成できる。
【0048】
陰イオンは、ヒドロゲル障壁層に組み込むのに特に適している。適切な陰イオンの例には、ハロゲン化物、スルホン酸、カルボン酸、アルコキシドが含まれる。
【0049】
負電荷を持つモノマー又はポリマーは、膜(例えば微細孔膜又は透析膜)の障壁層への組込みに適している。適切な負電荷を持つモノマー又はポリマーには、スルホプロピルメタクリル酸カリウム、アクリル酸若しくはメタクリル酸又はそれらの相当するポリマーが含まれる。
【0050】
膜障壁層の場合、負電荷を持つモノマー又はポリマーは膜自体にグラフトすることができる。別法として、負電荷を持つ1つ又は複数のポリマーは、透析膜を湿式紡糸形成する間に、ポリマー混合物に組み込むことができる。これにより、負電荷を持つモノマーは膜構造に直接組み込まれる。負電荷を持つ1つ若しくは複数のポリマーは単独で使用してもよく、又は1つ若しくは複数の親水性ポリマーと組み合わせて使用してもよい。
【0051】
別法として、スルホプロピルメタクリル酸カリウムなど負電荷を持つ1つ又は複数のモノマーは、膜(例えば微細孔膜又は透析膜)中に拡散させ、次いでin situで重合することができる。重合は、ポリエチレングリコールジメタクリル酸など親水性モノマーについて上で論じたものと同様の様式で実施できる。この方法は負電荷を持つポリマーの形成を引き起こし、このポリマーはその大きさに基づいて、又は親水性モノマーとの共重合によって、膜(例えば微細孔膜若しくは透析膜)の孔内部に閉じ込められる。このような重合は、負電荷を持つ1つ若しくは複数のモノマーを単独で使用して、又は上述の1つ若しくは複数の親水性モノマーと負電荷を持つ1つ若しくは複数のモノマーとの混合物を使用して実施できる。
【0052】
代替の実施形態において、負電荷を持つ物質はヘパリンである。これは、ヘパリン分子上にある負電荷がタンパク質をはじくという利点を有するが、抗血栓性であるという付加的な利益を有する。ヘパリンは、ヒドロゲルに組み込む、又は膜(例えば微細孔膜又は透析膜)にグラフト若しくはこれと重合させることができる。
【0053】
センサは、グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域を用意するステップと、検知用領域へ入射光を導くための光学的導波管を用意するステップと、検知用領域の少なくとも一部に親水性のグルコース透過性ポリマー障壁層を設けるステップとにより製造され、ここでセンサは、グルコースが前記障壁層を通ってセンサの検知用領域に入るように構成されている。
【0054】
特定の実施形態において、障壁層は半透膜であり、方法は親水性及び負電荷を持つモノマーから選択される1つ又は複数のモノマーを、膜(例えば透析膜又は微細孔膜)の孔に拡散させるステップと、重合を開始するステップとを含む。これによって、親水性及び/又は負電荷を持つポリマーが膜(例えば微細孔膜又は透析膜の)の孔内部で形成され、孔径の減少がもたらされる。親水性又は負電荷を持つポリマーを形成する重合は、膜(例えば微細孔膜又は透析膜)をセンサの検知用領域に適用する前又はこの後のいずれかにおいて実施できる。
【0055】
実施例1
以下に記載の通り、ポリエーテルスルホン中空繊維透析膜を重合混合物に10分間浸漬し、次いで、240nmの紫外線によって、8.3ミリワットの電力設定で30秒間重合を開始した。得られた膜を37Cのリン酸緩衝液溶液で12時間洗浄し、蒸留水ですすぎ、次いで風乾した。
【0056】
重合混合物
2.00g ポリエチレングリコールジメタクリル酸(600)
1.00g ジメチルアクリルアミド
0.50g プロピルスルホメタクリル酸カリウム
0.02g イルガキュア651(Irgacure 651)
0.20g トライトンX(Triton X)
3.50 水
【0057】
得られた膜はその孔内部に、ジメチルアクリルアミド、スルホプロピルメタクリル酸カリウムに由来し、ポリエチレングリコールジメタクリル酸と架橋した構成単位を有するポリマーを含む。
【0058】
米国特許第6,387,672号に記載のものによる、ジボロン酸/発蛍光団指示薬を利用する光ファイバーグルコースセンサの検知用領域を上記の膜で包み、この検知用領域を使用してヒト血液のグルコース濃度を決定した。比較のために、非修飾のポリエーテルスルホン中空繊維透析膜で包まれていることを除いて上述のセンサと同一のセンサを使用して、同じ血液試料でも実験を実施した。
【0059】
適切な励起波長を使用して励起し、検知用化学物質からの発光信号を測定することによって、センサを試験した。3点だがグルコース濃度を変化させることによってグルコースに対する応答曲線を定義し、任意の所与の測定した発光強度におけるグルコース濃度の算出を可能にする3つの定数の一組によって応答曲線をさらに定義した。調整値(modulation)は、グルコース濃度の所与の変化についての強度変化の基準であり、したがってセンサの感度の基準である。時間0に、等張リン酸緩衝食塩水における3点較正から初期調整値を決定し、センサをヒト血液に対して5時間及び20時間の両方で曝露した後のさらなる3点較正から算出された調整値と初期調整値を比較した。その結果を、図4に示す。
【0060】
図4は、各センサの蛍光発光強度を比較して示す。経時的な蛍光強度の減少は、修飾した膜を備えるセンサより非修飾膜を有するセンサにおいて、はるかに大きいことが分かる。修飾した膜は、ヒト血液中に存在するタンパク質及び糖化タンパク質に対してはるかにより良好な障壁特性を有し、これによってセンサの感度に著しい改善がもたらされる。
【0061】
本発明は、いくつかの特定の実施形態及び実施例を参照して記述された。しかし、本発明は、これらの特定の実施形態及び実施例に限定されない。
【特許請求の範囲】
【請求項1】
グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域と、
前記検知用領域へ入射光を導くための光学的導波管と、
前記検知用領域の少なくとも一部に設けられている、親水性のグルコース透過性ポリマー障壁層と
を具備する光学的グルコースセンサであって、
グルコースが前記障壁層を通ってセンサの前記検知用領域に入るように構成されている光学的グルコースセンサ。
【請求項2】
前記障壁層が半透膜を備える、請求項1に記載のグルコースセンサ。
【請求項3】
前記膜が、6000以上の分子量を有するタンパク質及び糖化タンパク質の通過を制限する、請求項2に記載のグルコースセンサ。
【請求項4】
前記膜が、5000以上の分子量を有するタンパク質及び糖化タンパク質の通過を制限する、請求項2又は3に記載のグルコースセンサ。
【請求項5】
前記膜が、1〜20nmの有効な孔径を有する、請求項2〜4のいずれか一項に記載のグルコースセンサ。
【請求項6】
前記膜の孔内部に親水性ポリマーが存在する、請求項2〜5のいずれか一項に記載のグルコースセンサ。
【請求項7】
前記膜の孔内部に負電荷を持つポリマーが存在する、請求項2〜6のいずれか一項に記載のグルコースセンサ。
【請求項8】
親水性モノマー及び/又は負電荷を持つモノマーを膜の孔に拡散させ、重合を開始することによって、前記親水性ポリマー及び/又は負電荷を持つポリマーをin situで生成させることにより、前記半透膜が形成される、請求項6又は7に記載のグルコースセンサ。
【請求項9】
親水性モノマー及び/又は負電荷を持つモノマーを透析膜の孔に拡散させ、重合を開始することにより、前記半透膜が形成される、請求項8に記載のグルコースセンサ。
【請求項10】
親水性モノマー及び/又は負電荷を持つモノマーを微細孔膜の孔に拡散させ、重合を開始することにより、前記半透膜が形成される、請求項8に記載のグルコースセンサ。
【請求項11】
前記障壁層がヒドロゲルを備える、請求項1に記載のグルコースセンサ。
【請求項12】
前記障壁層が陰イオン又は負電荷を持つ基若しくは分子を組み込む、請求項1〜11のいずれか一項に記載のグルコースセンサ。
【請求項13】
前記障壁層がヘパリンを備える、請求項1〜12のいずれか一項に記載のグルコースセンサ。
【請求項14】
前記検知用領域が支持体内部に設けられており、前記障壁層が前記支持体に設けられている、請求項1〜13のいずれか一項に記載のグルコースセンサ。
【請求項15】
請求項1〜14のいずれか一項に記載のグルコースセンサを製造する方法であって、
グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域を用意するステップと、
前記検知用領域へ入射光を導くための光学的導波管を用意するステップと、
前記検知用領域の少なくとも一部に親水性のグルコース透過性ポリマー障壁層を設けるステップと
を含み、
前記センサが、グルコースが前記障壁層を通ってセンサの前記検知用領域に入るように構成されている、方法。
【請求項16】
前記障壁層が半透膜であり、前記方法が、親水性モノマー及び/又は負電荷を持つモノマー(複数可)を膜の孔に拡散させるステップと、重合を開始して、前記膜の孔内部に親水性及び/又は負電荷を持つポリマーを備える半透膜を得るステップとを含む、請求項15に記載の方法。
【請求項17】
親水性モノマー及び/又は負電荷を持つ1又は複数のモノマーを微細孔膜の孔に拡散させるステップと、重合を開始するステップとを含む、請求項16に記載の方法。
【請求項18】
親水性モノマー及び/又は負電荷を持つ1又は複数のモノマーを透析膜の孔に拡散させるステップと、重合を開始させるステップとを含む、請求項16に記載の方法。
【請求項19】
前記障壁層が、少なくとも1つの親水性ポリマー及び/又は負電荷を持つポリマーを含むポリマー溶液を回転させることによって生成される透析膜である、請求項15に記載の方法。
【請求項20】
請求項1〜14のいずれか一項に記載のグルコースセンサを試料に挿入するステップと、前記センサの前記検知用領域へ入射光を供給するステップと、前記発蛍光団の発光パターンを検出するステップとを含む、試料中のグルコースの量を検出及び/又は定量化する方法。
【請求項1】
グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域と、
前記検知用領域へ入射光を導くための光学的導波管と、
前記検知用領域の少なくとも一部に設けられている、親水性のグルコース透過性ポリマー障壁層と
を具備する光学的グルコースセンサであって、
グルコースが前記障壁層を通ってセンサの前記検知用領域に入るように構成されている光学的グルコースセンサ。
【請求項2】
前記障壁層が半透膜を備える、請求項1に記載のグルコースセンサ。
【請求項3】
前記膜が、6000以上の分子量を有するタンパク質及び糖化タンパク質の通過を制限する、請求項2に記載のグルコースセンサ。
【請求項4】
前記膜が、5000以上の分子量を有するタンパク質及び糖化タンパク質の通過を制限する、請求項2又は3に記載のグルコースセンサ。
【請求項5】
前記膜が、1〜20nmの有効な孔径を有する、請求項2〜4のいずれか一項に記載のグルコースセンサ。
【請求項6】
前記膜の孔内部に親水性ポリマーが存在する、請求項2〜5のいずれか一項に記載のグルコースセンサ。
【請求項7】
前記膜の孔内部に負電荷を持つポリマーが存在する、請求項2〜6のいずれか一項に記載のグルコースセンサ。
【請求項8】
親水性モノマー及び/又は負電荷を持つモノマーを膜の孔に拡散させ、重合を開始することによって、前記親水性ポリマー及び/又は負電荷を持つポリマーをin situで生成させることにより、前記半透膜が形成される、請求項6又は7に記載のグルコースセンサ。
【請求項9】
親水性モノマー及び/又は負電荷を持つモノマーを透析膜の孔に拡散させ、重合を開始することにより、前記半透膜が形成される、請求項8に記載のグルコースセンサ。
【請求項10】
親水性モノマー及び/又は負電荷を持つモノマーを微細孔膜の孔に拡散させ、重合を開始することにより、前記半透膜が形成される、請求項8に記載のグルコースセンサ。
【請求項11】
前記障壁層がヒドロゲルを備える、請求項1に記載のグルコースセンサ。
【請求項12】
前記障壁層が陰イオン又は負電荷を持つ基若しくは分子を組み込む、請求項1〜11のいずれか一項に記載のグルコースセンサ。
【請求項13】
前記障壁層がヘパリンを備える、請求項1〜12のいずれか一項に記載のグルコースセンサ。
【請求項14】
前記検知用領域が支持体内部に設けられており、前記障壁層が前記支持体に設けられている、請求項1〜13のいずれか一項に記載のグルコースセンサ。
【請求項15】
請求項1〜14のいずれか一項に記載のグルコースセンサを製造する方法であって、
グルコースに結合するためのボロン酸受容体及び前記受容体に会合している発蛍光団を備える検知用領域を用意するステップと、
前記検知用領域へ入射光を導くための光学的導波管を用意するステップと、
前記検知用領域の少なくとも一部に親水性のグルコース透過性ポリマー障壁層を設けるステップと
を含み、
前記センサが、グルコースが前記障壁層を通ってセンサの前記検知用領域に入るように構成されている、方法。
【請求項16】
前記障壁層が半透膜であり、前記方法が、親水性モノマー及び/又は負電荷を持つモノマー(複数可)を膜の孔に拡散させるステップと、重合を開始して、前記膜の孔内部に親水性及び/又は負電荷を持つポリマーを備える半透膜を得るステップとを含む、請求項15に記載の方法。
【請求項17】
親水性モノマー及び/又は負電荷を持つ1又は複数のモノマーを微細孔膜の孔に拡散させるステップと、重合を開始するステップとを含む、請求項16に記載の方法。
【請求項18】
親水性モノマー及び/又は負電荷を持つ1又は複数のモノマーを透析膜の孔に拡散させるステップと、重合を開始させるステップとを含む、請求項16に記載の方法。
【請求項19】
前記障壁層が、少なくとも1つの親水性ポリマー及び/又は負電荷を持つポリマーを含むポリマー溶液を回転させることによって生成される透析膜である、請求項15に記載の方法。
【請求項20】
請求項1〜14のいずれか一項に記載のグルコースセンサを試料に挿入するステップと、前記センサの前記検知用領域へ入射光を供給するステップと、前記発蛍光団の発光パターンを検出するステップとを含む、試料中のグルコースの量を検出及び/又は定量化する方法。
【図1】


【図1a】


【図2】


【図3】


【図4】




【図1a】


【図2】


【図3】


【図4】


【公表番号】特表2013−519895(P2013−519895A)
【公表日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2012−553393(P2012−553393)
【出願日】平成23年2月15日(2011.2.15)
【国際出願番号】PCT/GB2011/000209
【国際公開番号】WO2011/101626
【国際公開日】平成23年8月25日(2011.8.25)
【出願人】(512212863)ライトシップ メディカル リミテッド (4)
【Fターム(参考)】
【公表日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年2月15日(2011.2.15)
【国際出願番号】PCT/GB2011/000209
【国際公開番号】WO2011/101626
【国際公開日】平成23年8月25日(2011.8.25)
【出願人】(512212863)ライトシップ メディカル リミテッド (4)
【Fターム(参考)】
[ Back to top ]

