グルコース代謝障害を治療する方法および試薬
【課題】グルコース代謝に影響する、II型糖尿病のような疾患に対する治療法を提供する。
【解決手段】膵島又は単離β細胞に、PYY活性のPYYペプチド又はPYY作用薬を投与する
【解決手段】膵島又は単離β細胞に、PYY活性のPYYペプチド又はPYY作用薬を投与する
【発明の詳細な説明】
【技術分野】
【0001】
(技術分野)
本発明は、グルコース代謝障害(例えば、グルコース不耐性、インスリン抵抗性、高血糖、高インスリン血症、及びII型糖尿病)を治療するための治療法に関する。該治療法は、PYYが、胎児及び成体の膵島におけるグルコース応答性を誘導するとの発見に基づく。
【背景技術】
【0002】
(発明の背景)
糖尿病は、米国で最も蔓延している慢性疾患であり、死因の筆頭であって、現在、世界中で4億人を越える糖尿病患者を苦しめている。1993年の国民保健面接調査(NHIS)に基づく推計は、糖尿病が、45歳未満の米国の人口の1%、45〜64歳のそれの6.2%、及び65歳以上のそれの10.4%で診断されたことを示している。1995年現在、米国の推定800万人が、この慢性的状態を有すると報告された。
【0003】
米国における糖尿病の出費総額は、医学的製品に対する支出、病院加療、及び労働損失の価値を含めて、年間920億ドルと見積もられている。社会とその市民との双方に対する実質的な出費が、糖尿病のための医療の直接的出費だけでなく、糖尿病に関連する罹患率、及び過早の死亡率を包含する間接的出費に対しても余儀なくされている。糖尿病罹患者は、糖尿病ケトアシドーシス、末期腎疾患、糖尿病性網膜症及び切断を包含する、大併発症の危険性の下にある。より直接的でない関連状態、例えば高血圧、心疾患、末梢血管疾患及び感染の保有者も存在し、そのために、糖尿病罹患者は、実質的に増大した危険性の下にある。
【0004】
糖尿病は、血中のグルコースの慢性的上昇(高血糖)へと導く、混成的な一群の代謝疾患である。糖尿病は、グルコース調節の喪失へと導く、膵島の破壊又は機能不全を特徴とする。糖尿病の主な二つの型は、「インスリン依存性糖尿病」(「IDDM」)又は「若年性糖尿病」としても知られるI型、及び「インスリン非依存性」(「NIDDM」)又は「成人発病型糖尿病」としても知られるII型である。
【0005】
IDDMは、膵臓β細胞の自己免疫を介しての破壊に起因して、インスリン産生の結果的な喪失を伴い、それが高血糖を招く。I型糖尿病は、生存を確保するためにインスリン代置療法を必要とする。注射可能インスリン及び経口血糖降下剤のような医薬は、糖尿病患者がより長く生存するのを許すが、糖尿病は、心疾患及び癌に次ぐ第三の主要な死因であり続けている。しかしながら、これらの医薬は、高血糖と低血糖との間のレベルの揺れを防ぐだけ充分に血糖レベルを制御することはなく、その結果、腎臓、目及び血管に対する損傷を生じる。糖尿病制御及び併発症試験(DCCT)からのデータは、血中グルコースの集中的な制御が、糖尿病の併発症、例えば網膜症、腎障害及び神経障害を、1日1、2回のインスリン注射からなる旧来の治療法と比較して有意に遅延させることを示している。DCCTにおける集中治療法は、1日3回又はそれ以上のインスリンの多数回注射、又は外部ポンプによるインスリンの連続的皮下注入(CSII)を包含した。インスリンポンプは、インスリンの生理学的代置に近付ける、皮下多数回日次注射(MDI)に対する様々な代替的な取組み方の一つである。
【0006】
II型糖尿病は、正常値より高いレベルの血漿インスリン(高インスリン血)の存在下での高血糖を特徴とし、全症例の90%以上を占め、40歳を越える過剰体重の成人に最も頻発する。II型糖尿病の進行は、グルコース誘導インスリン分泌速度の相対的上昇と結合した、血中グルコース濃度の上昇を伴う。II型糖尿病では、炭水化物代謝を制御する組織過程が、インスリンに対する感受性を低下させ、そのため,インスリン産生の欠如ではなく、血中のグルコースレベルの上昇に対する感受性の低下、及びインスリン産生による応答の不能から生じると考えられている。これに代えて、糖尿病は、インスリンのその標的細胞に対する作用を媒介する分子的機構の様々な欠陥、例えばその細胞表面でのインスリン受容体の欠如に起因する可能性もある。したがって、II型糖尿病の治療は、インスリンの投与を必要としないことが多く、食餌及び生活スタイルの変化を基本として、例えばスルホニル尿素のような経口血糖降下剤による治療法によって補強される。
【0007】
膵臓の内分泌部分は、外分泌性膵臓内に埋め込まれた、島細胞の丸みを帯びた集塊のように見えるランゲルハンス島で構成される。4種類の島細胞が、膵臓の内分泌部分を構成する:(1)島細胞の20%を占め、血糖レベルを上昇させるホルモンのグルカゴンを分泌する、アルファ(α)細胞;(2)血糖レベルを低下させるホルモンのインスリンを分泌する、ベータ(β)細胞;(3)インスリン及びグルカゴンの分泌を阻害するホルモンの成長ホルモン阻害ホルモン(GHIH)又はソマトスタチンを分泌する、デルタ(δ)細胞;並びに(4)膵ポリペプチドを合成するφ細胞、又は膵ポリペプチド(PP)細胞。グルカゴンは、いくつかの組織に作用して、食間期に利用できるエネルギーを生成する。肝臓では、グルカゴンは、グリコーゲンの分解を生起し、アミノ酸前駆体からの糖新生を促進する。膵ポリペプチドは、重炭酸塩及び酵素の膵外分泌腺による分泌を阻害し、胆嚢の弛緩を生じ、胆汁分泌を低下させる。インスリンは、食事の際及び直後に生じる過剰な栄養素の貯蔵を生起することが知られている。インスリンの主な標的器官は、肝臓、筋、及びエネルギー貯蔵に専門化した脂肪器官である。
【0008】
島で最も豊富な細胞は、細胞のうち60〜80%を構成する、インスリン産生β細胞である。ヒトの胎児膵臓のβ細胞は、グルコースに応答して僅かしか、又は全くインスリンを放出しないという点で、成体膵臓のβ細胞とは異なる[例えば、Tuch, B.E. et al. (1992) J. Endocrin. 132l:159-67を参照されたい]。これは、ヒトとげっ歯類との双方で観察されており、II型糖尿病又は悪性島細胞腫の患者で観察される、グルコースに対する遅延インスリン応答に似ている[Hellerstrom & Swenne (1991) Diabetes 40(2):89-93]。胎児β細胞がグルコースに応答してインスリンを産生できないことは、インスリン前駆体を処理できないことによるとは考えられない。ヒト成人β細胞は、プレプロインスリンを合成し、これを細網内皮系でプロインスリン(hPI)に転化する。その後、hPIは、分泌性顆粒で、調節的経路を経由してインスリンとCペプチドとに分割される。成体β細胞におけるhPIの転化率は、高く、含有量と分泌との双方に関して低いhPI:インスリン比を生じる[Gold et al. (1981) Diabetes 30:77-82]。これは、胎児β細胞についても観察され、β細胞の未成熟は、プロインスリンの貯蔵及び放出における相違によらないことを示唆する[Tuch et al.、前掲]。Ca2+及びcAMPの増加に応答した胎児β細胞からのhPI及びインスリン双方の急性放出は、細胞が、その分泌産物を、構成的経路ではなく調節的経路を経由して放出することを示唆する[Rhodes & Halban (1987) J. Cell Biol. 105:145-53]。
【0009】
胎児β細胞におけるグルコース応答性の欠如は、未成熟なグルコース代謝によると考えられる。成体β細胞におけるグルコース誘導インスリン分泌を裏付ける分子的機序には、原形質膜におけるATP感受性K+(KATP)チャンネルを閉じ、そのためにKATPチャンネルからのK+流出を阻害して、細胞膜の分極へと導くことが関与している[Jones, P.M. & Persaud, S.J. (1998) Endocrine Review 19(4):429-61;Mendonca et al.、前掲;Cook, D.L. & Hales, C.N. (1984) Nature (London) 311:271-73]。その結果、細胞質ゾルのCa2+濃度は、膜分極、及びL型(電位差感受性)Ca2+チャンネルからのCa2+流入の結果として上昇する。グルコースは、cAMPと、イノシトール三リン酸(IP3)、ジアシルグリセロール(DAG)、アラキドン酸(AA)及びホスファチジン酸を包含する膜リン脂質から誘導されるレギュレーターとの細胞内濃度を上昇させる[Jones & Persaud、前掲を参照されたい]。グルコースに応答したインスリン分泌の低下は、グルコース代謝と膜細胞分極との間の脱共役の反映であることが示唆されている[Mendonca et al.、前掲]。研究は、ATP感受性K+チャンネルが、たとえ完全に発育していても、胎児β細胞では適正に調節されないこと、及びグルコースに対する不完全な分泌応答が、未成熟なミトコンドリアのグルコース代謝の反映であって、さもなければ正常であるATP感受性K+チャンネルの閉鎖の不能を招き得ることを示している[Hellerstrom & Swenne、前掲]。
【0010】
膵臓の発生は、独立した時期に生じ、膵細胞自体、又は他の組織が産生した内分泌ホルモンによって調節される。ラットでは、膵臓原基は、十二指腸内胚葉からの突起として生じる、背側と腹側との膵臓原芽の融合によって、胚の(「e」)10.5日目(「e10.5」)に形成される[Pictet, R. & Rutter, W.J. (1972) "Development of the Embryonic Endocrine Pancreas", in D. Steiner & N. Freinkel (eds.) Handbook of Physiology, The Endocrine Pancreas, Vol. 1, Section 8, Am. Physiol. Soc., pp.25-66;Myrsen-Axcrona, U. et al. (1997) Regulatory Peptides 68:165-75]。膵島ホルモンは、発生中の膵臓で逐次出現し;例えばグルカゴンは、マウスではe10、ラットではe11に出現し、インスリン産生細胞は、e12に出現し、ソマトスタチン産生細胞は、e17に出現する[Myrsen-Axcrona et al.、前掲]。膵島細胞は、膵管内の共通前駆細胞からの内分泌シグナルに応答して分化すると考えられる。ラットの胎児期の終点(e21)と、新生児期(出生後)との間のある時点で、胎児β細胞は、グルコースに応答してインスリンを分泌する能力を獲得する。この時期のインスリン応答は、単相的であり、Ca2+拮抗薬によって遮断されない。グルコースに応答したインスリン分泌の明瞭な二相パターンは、出生後3日目においてのみ検出されるにすぎない[Mendonca, A.C. et al. (1998) Brazilian J. Med. Biol. Res. 31(6):841-46]。この「機能の獲得」又は「グルコース応答性の獲得」が達成される機序は、知られておらず、機能の成熟及び獲得を調節する因子も、特定又は特徴付けされていない。加えて、膵臓β細胞におけるグルコース応答性の獲得に付随する生理学的変化も、未知である。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Tuch, B.E. et al. (1992) J. Endocrin. 132l:159-67
【非特許文献2】Hellerstrom & Swenne (1991) Diabetes 40(2):89-93]
【非特許文献3】Gold et al. (1981) Diabetes 30:77-82
【非特許文献4】Rhodes & Halban (1987) J. Cell Biol. 105:145-53
【非特許文献5】Jones, P.M. & Persaud, S.J. (1998) Endocrine Review 19(4):429-61
【非特許文献6】Cook, D.L. & Hales, C.N. (1984) Nature (London) 311:271-73
【非特許文献7】Pictet, R. & Rutter, W.J. (1972) "Development of the Embryonic Endocrine Pancreas", in D. Steiner & N. Freinkel (eds.) Handbook of Physiology, The Endocrine Pancreas, Vol. 1, Section 8, Am. Physiol. Soc., pp.25-66
【非特許文献8】Myrsen-Axcrona, U. et al. (1997) Regulatory Peptides 68:165-75
【非特許文献9】Mendonca, A.C. et al. (1998) Brazilian J. Med. Biol. Res. 31(6):841-46
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、ある因子、すなわち「ペプチドyY」又は「PYY」が、グルコース非応答性の胎児及び成体における、グルコース応答性へと導く機能の獲得を誘発するとの発見に基づき、そのため、グルコース代謝に影響する、II型糖尿病のような疾患に対する治療法を提供する。
【課題を解決するための手段】
【0013】
(発明の要約)
本発明は、PYYが、胎児及び成体膵島におけるグルコース応答性を誘導かつ維持することができるとの発見に関する。例えば、胎児のラット膵からのグルコース非応答性e21膵島への、in vitroでのPYYの5日間の投与は、膵島の成熟を誘導し、次いで、これが、グルコースに対してインスリンを放出することによって応答することを、本発明者らは示す。また、グルコース感知は、成体膵島では、PYYの投与によって回復することができること、及びグルコース感知は、PYYを投与した成体膵島では、より長く維持できることも、本発明者らは示す。本発明以前は、膵島の成熟を刺激できる栄養又は成長因子は、従来から、当技術では特定されていなかった。
【0014】
一態様では、本発明は、膵島細胞の分化した状態を変える方法であって、膵島又は単離β細胞に、PYY活性の(例えばそれを模倣するか、又は強化する)PYYペプチド又はPYY作用薬(本明細書では「PYY治療薬」と総称する)を投与することを含む方法を含む。一実施態様では、PYY治療薬の投与は、膵島又は細胞がグルコース応答性になるようにする。グルコース応答性の島又は細胞は、それによって刺激されて、グルコースに接触させたときにインスリンを産生する。もう一つの態様では、本発明は、島又は細胞をPYY治療薬に接触させることによって、成熟膵島を示すマーカーを発現するよう島を誘導するか、又は成熟β細胞を示すマーカーを発現するようβ細胞を誘導する方法を含む。好適実施態様では、島又は細胞は、ヒトの膵島又はβ細胞である。
【0015】
本発明は、更に、グルコース応答性の膵島又はβ細胞を調製する方法であって、グルコース非応答性の膵島又はβ細胞に、有効量のPYY治療薬含有組成物を投与することを含む方法を提供する。
【0016】
もう一つの態様では、本発明は、動物のグルコース代謝を変更する方法であって、それによって膵臓β細胞のグルコース応答性を高めるために、該動物に、製薬上有効量のPYY治療薬含有組成物、及び製薬上許容され得る担体を投与することを含む方法を提供する。好適実施態様では、本発明は、変化したグルコース代謝に付随する疾患を治療する方法であって、動物に、製薬上有効量のPYY治療薬含有組成物、及び製薬上許容され得る担体を、膵臓β細胞のグルコース応答性を増大させるのに充分な量で投与することを含む方法を提供する。
【0017】
もう一つの態様では、本発明は、脊椎動物からの未分化な島又は細胞をPYY治療薬に接触させることによって生成された、分化した島及びβ細胞を提供する。好適実施態様では、本発明は、グルコースに応答してインスリンを分泌する膵島及びβ細胞、及び動物への製剤投与に適する、製薬上許容され得る担体を提供するが、該細胞性組成物は、グルコースに応答してin vivoでインスリンを分泌することができる。
【0018】
更にもう一つの態様では、本発明は、変化したグルコース代謝に付随する疾患を治療する方法であって、本発明によるPYY治療薬で治療することによってグルコース応答性を獲得した、膵島又はβ細胞を含む、製薬上有効量の組成物を動物に投与することを含む方法を提供する。一実施態様では膵島又はβ細胞をPYY治療薬で治療することによって得られたグルコース応答性の島又は細胞を、動物のグルコース応答性を高めるのに充分な量の、製薬上許容され得る担体を含有する組成物として動物に投与する。もう一つの実施態様では、PYY治療されたグルコース応答性細胞の組成物は、追加の薬剤、例えばPYY治療薬を含む。この細胞組成物は、PYY治療薬と同時にか、順次にか、又は別個にかのいずれかで、連携して投与してよい。この方法は、動物におけるインスリン抵抗性、グルコース不耐性又はグルコース非応答性、高血糖、肥満、高脂血症、及び高リポタンパク質血症のような状態に付随する疾患を治療するのに用いてよい。好適実施態様では、本発明は、II型糖尿病を治療するのに用いられる。
【0019】
好適なPYYペプチドは、成熟PYYタンパク質、又は生物学的活性を有するそのフラグメントに相当するポリペプチドを包含する。PYYペプチドは、好ましくは、哺乳動物PYY、例えば、哺乳動物PYY遺伝子にコードされているそれ、はるかに好ましくは、ヒトPYYタンパク質、例えばSEQ ID NO:2に示されるそれである。一定の実施態様では、PYYペプチドは、SEQ ID NO:2のアミノ酸配列と70%以上同一、より好ましくは80、85、90又は95%以上同一であることになる。一定の実施態様では、PYYペプチドは、好ましくは65℃での2.0xSSCという洗浄段階を含む緊縮条件下、はるかに好ましくは65℃での0.2xSSCという洗浄段階を含む緊縮条件下で、SEQ ID NO:1とハイブリダイズする、核酸によってコードされていることができる。
【0020】
PYY治療薬として用いることができるPYY作用薬は、PYYの活性を誘導する効果を有するいかなる化合物も包含する。好適な作用薬は、ジペプチジルペプチダーゼ、好ましくはジペプチジルペプチダーゼIV(DPIV)を阻害できる化合物を含む。
【0021】
もう一つの好適実施態様では、PYY治療薬、PYY治療薬投与された島及び/又はPYY治療薬投与された細胞を、PYY治療薬の分解を阻害できる薬剤とともに、該PYY治療薬と同時にか、順次にか、若しくは別個にかのいずれかで動物に投与する。好適実施態様では、該薬剤は、PYY治療薬と同時投与する。好適な阻害剤は、ジペプチジルペプチダーゼ阻害剤である。もう一つの好適実施態様では、該薬剤は、本発明によるPYY治療薬による治療によってグルコース応答性にさせた膵島又は細胞とともに投与する。もう一つの好適実施態様では、該薬剤は、PYY、及び本発明によるPYY治療薬による治療によってグルコース応答性にさせた膵島又は細胞とともに投与する。
【0022】
その他の実施態様では、PYY治療薬は、PYY−Y1受容体のようなPYY受容体に結合し、PYYに対する活性を模倣するか(作用薬)、又は阻害する(拮抗薬として)化合物である。好適実施態様では、そのような薬剤は、例えば7,000amu未満、より好ましくは5,000amu、1,000amu、又は500amu未満でさえもの分子量を有する、小さい有機分子である。作用薬は、グルコース感知を誘導及び/又は維持するために用いることができる。作用薬は、例えば高インスリン症又は高血糖症を治療するよう、グルコース感知を阻害、又は別途抑制するのに用いることができる。
【0023】
好適実施態様では、本発明は、島又は細胞移植片における正常な膵島機能(すなわちグルコース応答性)を維持する方法であって、ex vivoで膵島又は細胞にPYY治療薬を投与することを含む方法を提供する。このようにして、宿主動物に移植しようとする提供者の膵島又は細胞は、インスリンを産生することによってグルコースに応答できるその能力に関して機能的であるとして、維持することができる。これに代えて、膵島細胞は、PYY治療薬で治療して、グルコース応答性を強化してか、又はそのグルコース応答性を回復させてから、動物に再移植した、宿主の不全であった自己β細胞であってもよい。
【0024】
更にもう一つの態様では、本発明は、PYY治療薬を特定する方法であって、グルコースに非応答性である胎児膵島若しくは細胞、又は成体膵細胞に、有効量の薬剤を投与し、該薬剤に対する細胞の応答をPYYに対する細胞の応答と比較することを含む方法を提供する。好適実施態様では、PYY治療薬は、不応性膵島又は細胞にグルコース応答性を誘導する。もう一つの好適実施態様では、PYY治療薬は、部分的にグルコース不耐性であるか、又は低いインスリン発現性である膵島若しくはβ細胞におけるグルコース応答性を高める。更に一つの好適実施態様では、PYY治療薬は、不全であった膵島又は細胞におけるグルコース応答性を回復させる。
【0025】
もう一つの態様では、本発明は、PYYの拮抗薬(すなわち阻害剤)を特定する方法を提供する。そのような拮抗薬は、膵細胞(例えば始原細胞又は島細胞腫細胞)におけるグルコース応答性を妨害又は阻害することができる手段を提供し得る。一実施態様では、PYY拮抗薬は、膵始原細胞に対する未変性PYYの効果を、直接的にか、又は間接的にかのいずれかで阻害することができる。もう一つの実施態様では、PYY拮抗薬は、(例えば、島細胞腫に起因するような)高インスリン血症に悩む患者に投与したとき、インスリンレベルに対するPYYの効果を、直接的にか、又は間接的にかのいずれかで阻害することができる。そうして、PYY拮抗薬の特定は、PYY拮抗薬の阻害剤(「PYY拮抗薬阻害剤」)を特定するのに用いることができる。
【0026】
更にもう一つの態様では、本発明は、PYY作用薬、PYY拮抗薬、PYY阻害剤又はPYY拮抗薬阻害剤をコードしている遺伝子の存在について、DNAライブラリーをスクリーニングする方法を提供する。一実施態様では、核酸レベルでの組合せ突然変異誘発によって、PYY同族体又は作用薬の斑入りライブラリーを生成し、斑入りの遺伝子ライブラリーによってコード化する。例えば、可能性のあるPYY配列の縮重したセットが、個々のポリペプチドとしてか、又はこれに代えて、PYY配列のそのセットを含む、より大きい融合タンパク質のセット(例えばファージ表示のための)として発現可能になるように、合成オリゴヌクレオチドの混合物を遺伝子配列中に酵素的に結合することができる。
【0027】
更にもう一つの実施態様では、本発明は、グルコース代謝障害を有すると疑われる患者が、そのPYY機能に欠陥を有するか否かを査定するための診断用アッセイを提供する。例えば、このアッセイは、血清その他の体液中のPYYのレベルを検出することができる。他の実施態様では、該アッセイは、PYY遺伝子に対する、例えばコードされているタンパク質の分泌、血清半減期又は効力に影響する、突然変異を検出することができる。一好適実施態様では、主題の方法は、患者が、タンパク質の分泌レベルを低下させる、分泌シグナル配列中の突然変異を保有するPYY遺伝子を有するか否かを確認するのに用いることができる。
【0028】
更にもう一つの実施態様では、本発明は、PYY誘導経路が、拮抗性PYYポリペプチドの発現、又はPYY若しくはPYY作用薬をコードしている遺伝子の破壊のいずれか一方によって、その1種類又はそれ以上の組織で阻害されている、ヒトでないトランスジェニック脊椎動物を提供する。
【0029】
本発明の実施は、別途指示されない限り、細胞生物学、細胞培養、分子生物学、トランスジェニック生物学、微生物学、組換えDNA及び免疫学の、当業者の技量の範囲内にある慣用の手法を用いることになる。そのような手法は、文献中に記載されている。例えば、Molecular Cloning, A Laboratory Mannual, 2nd Ed., Sambrook, Fritsch & Maniatis (eds.) (Cold Spring Harbor Laboratory Press: 1989);DNA Cloning, Vols. I and II (D.N. Glover ed., 1985);Oligonucleotide Synthesis (M.J. Gait ed., 1984);Mullis et al.米国特許第4,683,195号明細書;Nucleic Acid Hybridization (B.D. Hames & S.J. Higgins, eds., 1984);Culture of Animal Cells (R.I. Freschney, Alan R. Liss, Inc., 1987);Immobilized Cells And Enzymes (IRL Press, 1986);B. Perbal, A Practical Guide to Molecular Cloning (1984);論文、Methods in Enzymology, Vols. 154 & 155 (Wu et al., eds.);Immunochemical Methods In Cell and Molecular Biology (Mayer & Walker, eds., Academic Press, London, 1987);Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir & C.C. Blackwell, eds., 1986);Manipulating the Mouse Embryo (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986)を参照されたい。
【図面の簡単な説明】
【0030】
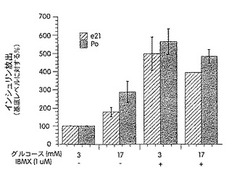
【図1】e21/P0の膵臓におけるインスリン放出に対するIBMXの効果を示す図である。
【図2】e21の島におけるIBMX刺激カルシウム流入を示す図である。
【図3A】PYYが胎児の島の成熟を誘導することを示す図である。
【図3B】PYYが胎児の島の成熟を誘導することを示す図である。
【図4】e21の島に対するPYYの効果が時間依存性であることを示す図である。
【図5】e21の島に対するPYYの効果が用量依存性であることを示す図である。
【図6】成体の島に対するPYYの効果を示す図である。
【図7】グルコース応答性の獲得に対するPYYの効果は、遺伝子転写の活性化を必要とすることを示す図である。
【図8】アクチノマイシンDの効果は、島のインスリン含有量の低下を介さないことを示す図である。
【図9】PYYの存在は、基底分泌率に影響しないことを示す図である。
【図10A】ラット成体の島におけるグルコース応答の回復に対する効果を示す図である。
【図10B】ラット成体の島におけるグルコース応答の回復に対する効果を示す図である。
【発明を実施するための形態】
【0031】
本発明のその他の特徴及び利点は、以下の図面、詳細な説明及びクレームから明白になる。
【0032】
(発明の詳細な説明)
(i) 発明の全体像
胎児の発生の間に、膵臓のβ細胞の成熟(すなわち、グルコースに応答してインスリンを産生できる能力の獲得)に必要とされるホルモンのシグナル、及びホルモンによるシグナリングが生じる時点が、今では特定されている。膵島の発生は、不連続な遷移によって区切られた、胎児の妊娠の際の段階を通じて進行する。最初の時期は、原分化した状態であって、インスリン及びグルカゴンの発現によって示されるとおり、島細胞系譜への多能性幹細胞の傾倒を特徴とする。
【0033】
本発明は、胎児膵島へのin vitroでのペプチドYY(PYY)の投与が、グルコース不応性膵島の成熟膵島への成熟を生起し、インスリンの放出によってグルコースに応答したことの発見に関する。重要なことに、PYYは、グルコースに応答してインスリンを分泌する能力を別途失った、成体の膵島にグルコース応答性を回復させることも示された(図6)。これらの知見は、PYY作用薬を、始原細胞集団からのグルコース応答性膵組織の形成を、ex vivo及びin vivoの双方で誘導するのに用い得ることを示す。同様に、これらの完璧な知見は、PYY作用薬を、β細胞がグルコース応答性である時間を維持又は別途延長するためばかりでなく、グルコース応答性をβ細胞に回復させるためにも用い得ることを立証している。
【0034】
一態様では、本発見は、膵始原細胞からグルコース応答性細胞を生成するための試薬及び方法を提供する。他の実施態様では、主題の方法は、培養された膵島その他の膵細胞、特に動物、好ましくはヒトへの移植に調製される膵島又は細胞に、グルコース応答性を回復又は維持するのに用いることができる。他の実施態様では、主題の方法は、in vivoでのグルコース応答性膵細胞の喪失を防ぐのに用いることができる。
【0035】
一般的には、本発明は、グルコース応答性である膵島又は単離β細胞を、PYYペプチド、PYYの類似体もしくは誘導体、又はその作用薬(以下、「PYY作用薬」)の使用を通じて調節(誘導又は維持)する方法に関する。読解を容易にするために、両分類群の薬剤を、ここでは「PYY治療薬」と総称する。主題の方法によるPYY治療薬の投与は、投与された膵細胞にグルコース応答性を獲得させ、それによって、島、又はβ細胞の集団をグルコース応答性β細胞に富ませるか、又はグルコースに応答できる能力を失った島若しくは細胞にグルコース応答性を取り戻させることになる。
【0036】
PYY治療薬は、製薬上許容され得る組成物として対象者にin vivoで投与してよいか、又は培養された島若しくは細胞系にex vivoで投与してよい。移植片材料(すなわち、PYY投与された膵島またはβ細胞)の場合、単独でか、又はその効果を高めることができる別のPYY治療薬と組み合わせてPYY治療薬を有する、細胞を動物に投与してよい。
【0037】
更にもう一つの実施態様では、動物、又はその膵島若しくは細胞に、PYYで誘導されるグルコース応答性を増強し得るその他の因子の、島細胞自体による産生を誘導若しくは増強し得る因子を投与してよい。例えば、インスリン遺伝子は、インスリンプロモーターの基礎活性、組織特異性及び代謝応答に寄与する、多数のcis作用性要素(すなわちグルコース応答性エンハンサー及びリプレッサー要素)を含む[Sander, M. et al. (1998) Proc. Natl. Acad. Sci. USA 95: 11572-77;Odagiri, H. et al. (1996) J. Biol. Chem. 271:1909-1915]。Sanderらは、初代培養されたラットの胎児及び成体の膵島でエンハンサーとして機能するグルコース応答性要素が、完全に発達したβ細胞腫瘍細胞と、前腫瘍形成性の過形成性細胞からのβ過形成細胞(すなわち、それぞれ、分化した細胞系と、脱分化した細胞系)との双方でリプレッサーとして機能することを立証し、不死化したβ細胞と未変性の島細胞との間のインスリン遺伝子調節の根本的な相違を示唆している。Sanderらは、グルコース応答性エンハンサー要素に結合した、明確なグルコース応答性複合体は、培養された島細胞にのみ見出されること、及びこれらの相違は、初代培養β細胞でのリプレッサーの不在が、おそらく、普遍的な活性化因子が機能するのを許すか、又は普遍的なリプレッサーの効果を無効にする、初代島細胞中にのみ存在する活性化因子によって説明できることを見出した。したがって、β細胞へのPYYの投与の効果は、そのような因子(例えば転写因子)、又はグルコースに応答したインスリン遺伝子の調節に参加するその他の因子のレベルを変化させる薬剤の同時投与によって増強することができると思われる。
【0038】
これに代えて、膵島又は細胞に、PYYで誘導されるグルコース応答性を増強し得るその他の因子の、その他の細胞型による産生を生起又は増強し得る因子を投与してもよい。例えば、α、δ又はPP細胞をPYYで刺激して、動物における遺伝子発現又はグルコース代謝を変化させ得る因子を産生させてもよい。
【0039】
PYY受容体の作用薬を、本発明を用いて特定してもよい。PYYは、「PPファミリー」と名付けられた一群のペプチドに属するが、この群のその他の成員は、NPY及びPPを包含する。いくつかのPPファミリーの受容体サブタイプが、クローニングされている。これらはすべて、いくつかの貫膜ドメインを有し、受容体のGタンパク質共役スーバーファミリーに属する。PP受容体ファミリーは、Y1−R、Y2−R、Y3−R、Y4−R、Y5−R及びY6−Rを包含し、各受容体は、結合特性、組織分布及び配列同一性が異なる[Jackerott, M. & Larsson, L.I. (1997) Endocrinol. 138:5013-18]。例えば、Y1、Y2、Y5及びY6は、PYYおよびNPY3−36及びPYY3−36のC末端フラグメントに結合する。総説については、Gehlert, D.R. (1998) Proc. Soc. Exp. Biol. Med. 218(1):7-22を参照されたい。天然に産するPYY受容体の内因性作用薬が記載されている(例えばPYY1−36及びNPY1−36)。
【0040】
これに代えて、膵細胞でのPYY受容体発現を増大できる因子を、ex vivoで対象者又は島若しくは細胞に投与して、PYYのグルコース応答性効果を増強してもよい[例えば、Holliday, N.D. & Cox, H.M. (1996) Br. J. Pharmacol. 119(2):321-9を参照されたい]。上昇したPYY受容体レベルは、膵β細胞に対するPYY治療薬の効果を更に増強すると思われる。加えて、PYY受容体をコードしているDNA配列を含む、組換えベクターの導入によって、膵β細胞におけるPYY受容体数を増加させてもよい。P2及びP5受容体が好ましいが、P1、P3、P4及びP6その他のPYY特異的受容体を、誘導又は導入してもよい。
【0041】
これに代えて、グルコース輸送又はリン酸化を増強できる薬剤(例えば、グルコキナーゼの発現によって調節されるもの)を、PYY治療薬と結び付けて投与してもよい[例えば、Schuit, F.C. (1996) Horm. Res. 46:99-106を参照されたい]。また更に、グルコース輸送体のGLUT2の発現レベルは、糖尿病の動物モデルで低下することが見出されており、細胞系へのGLUT2のトランスフェクションは、その細胞、又は下向調節されたGLUT2をβ細胞に有するトランスジェニックマウス、又は糖尿病ラットにグルコース感受性を与えることができる[Thorens, B. et al. (1990) Proc. Natl. Acad. Sci. USA 87:6492-96;Hughes, S.D. et al. (1992) Proc. Natl. Acad. Sci. USA 89:688-92;Valera et al. (1994) J. Biol. Chem. 269:28543-46;Johnson, D. et al. (1990) Science 250:546-49]。膵臓性ではない脳下垂体細胞系のAtT−20insへのGLUT2遺伝子導入は、グルコースで刺激されるインスリン放出、グルコースでない分泌促進剤のグルコースによる強化、及びインスリン含有量の増加[Hughes et al.、前掲]を与え、GLUT2発現の回復は、ラット島細胞腫(RIN)細胞におけるグルコース応答性、及びグルコキナーゼ活性の上昇を与える[Ferber, S. et al. (1994) J. Biol. Chem. 269(15):11523-29]。
【0042】
移植の前に、提供者の膵島細胞を培養すると、グルコースに応答してインスリンを分泌できる能力の喪失を招く。本明細書で提供される方法は、培養された膵細胞を、インスリンを産生し続ける、完全に成熟したグルコース応答性β細胞として維持する手段を提供する。これに代えて、グルコース応答性を失った膵細胞の培養は、本発明によって、グルコース応答性細胞に戻すことができる。
【0043】
したがって、好適実施態様では、本発明は、例えば血中のグルコース又はその副生物の上昇若しくは低下したレベルに応答できないことを特徴とする疾患において、変化したか、又は欠陥のあるグルコース代謝に付随する疾患を治療する方法を提供する。PYYがグルコース応答性を強化又は回復するとの発見は、動物、好ましくはヒトにおけるインスリン産生を回復又は増強するための無数の大方針を提供する。
【0044】
もう一つの好適実施態様では、PYY類似体、作用薬又は拮抗薬を、本発明の方法により、グルコース非応答性細胞(例えば、胎児の島若しくはβ細胞、又は非応答性である成体の島若しくはβ細胞)への試験因子の投与の比較、及びそれらの効果をPYYで誘発された効果と比較することによって特定してよい。本発明は、タンパク質、ペプチド又はDNAライブラリーを、当技術に公知の方法に従って、PYY類似体、作用薬若しくはPYY拮抗薬をコードしている遺伝子の存在についてスクリーニングする方法を提供する。
【0045】
好適実施態様では、本発明は、PYYの拮抗薬、及びそれらをコードしている遺伝子を特定する方法を提供する。拮抗薬は、天然に産する遺伝子産物若しくはその変異体、又は例えばアンチセンス、リボザイム分子、及び小さい有機分子のような、ある種の合成分子であってよい。本発明は、PYY拮抗薬を阻害若しくは中和する、天然に産するか、又は合成による拮抗薬を特定する方法も提供する。そのようなPYYの「拮抗薬に対する拮抗薬」(又は「PYY拮抗薬阻害剤」)を特定して、PYYに対する細胞の応答を増強するために、PYY拮抗薬を阻害する大方針を提供することができる。
【0046】
本発明の好適な態様では、変化したグルコース代謝に付随する疾患は、製薬上有効量のPYY投与膵β細胞(グルコース応答性を獲得している)を投与することによって治療することができる。一実施態様では、グルコース応答性細胞を、製薬上許容され得る担体を含有する組成物として、動物に投与する。もう一つの実施態様では、グルコース応答性細胞の組成物は、インスリン分泌を強化し得るその他の因子、例えばPYY治療薬を更に含む。
【0047】
これに代えて、該組成物は、例えばジペプチジルペプチダーゼ阻害剤のような、PYY治療薬の血清半減期を延長するプロテアーゼ阻害剤と連携して、同時にか、順次にか、又は別個に投与してもよい。好適実施態様では、ジペプチジルペプチダーゼ阻害剤は、IPIV阻害剤である。該細胞組成物は、追加の因子とともに、同時にか、順次にか、又は別個にかのいずれかで、投与してよい。該方法は、動物における、インスリン抵抗性、グルコース不耐性又はグルコース非応答性、高血糖、肥満、高脂血症、及び高リポタンパク質血症のような状態に付随する疾患を治療するのに用いてよい。
【0048】
好適実施態様では、PYY治療薬は、膵臓系譜の不応細胞にグルコース応答性を誘導する。もう一つの好適実施態様では、PYY治療薬は、膵始原細胞の成熟を生起することによって、グルコース応答性を増強する。もう一つの好適実施態様では、PYY治療薬は、分娩後の動物からの、部分的にグルコース不耐性であるか、インスリン低発現性である膵β細胞のグルコース応答性を増強する。更にもう一つの好適実施態様では、PYY治療薬は、分娩後の動物からの、欠陥のある膵細胞のグルコース応答性を回復させる。
【0049】
もう一つの態様では、本発明は、脊椎動物からの未分化な細胞をPYY治療薬に接触させることによって細胞培養中に生成された、分化したβ細胞を提供する。好適実施態様では、本発明は、移植に用いるための、グルコースに応答してインスリンを分泌する膵β細胞、及び動物への製剤投与に適する、製薬上許容され得る担体を提供するが、該細胞組成物は、グルコースに応答してin vivoでインスリンを分泌することができる。
【0050】
本発明は、更に、PYYタンパク質の組合せ突然変異体のセットはもとより、断端突然変異体のライブラリーを生成する方法を企図し、PPタンパク質に対する受容体に結合する際に機能的であり、膵島又は細胞のグルコース応答性を変化させる、潜在的な変異体配列(例えば同族体又は類似体)を特定するのに特に役立つ。そのような組合せライブラリーをスクリーニングする目的は、例えば、作用薬若しくは拮抗薬のいずれかであるか、又はこれに代えて、全く新規な活性を有する、新規なPYY同族体若しくは類似体を生成することである。例示すると、PYY同族体又は類似体は、本方法によって、同類受容体とのより効果的な結合を提供するが、PYYに関連する活性の少なくとも一部をなおも保持するように加工することができる。したがって、組合せにより誘導された同族体は、タンパク質の天然に産する形態よりも増強された効力を有するよう容易に生成することができる。同様に、PYY同族体又は類似体は、本発明の組合せの取組み方によって、例えば、他の細胞外基質成分(例えば受容体)との結合を模倣できるが、いかなる生物学的応答も誘導できないために、真正のPYY治療薬の作用を阻害するという点で、拮抗薬として作用するよう生成することができる。その上、本方法によるPYYの一定のドメインの操作は、融合タンパク質、例えば細胞外基質に由来するか、及び/又は細胞外基質成分に結合する、他のタンパク質の部分を組み込んだそれに用いるのにより適するドメインを提供することができる。
【0051】
この方法の一態様では、PYYの同族体、類似体その他の関連タンパク質の集団についてのアミノ酸配列を、好ましくは可能な限り最高の相同性を促進するよう整列させる。変異体のそのような集団は、例えば、グルコース応答性を誘導できる、1種類又はそれ以上の種からのPYY同族体を包含する。整列させた配列の各位置に出現するアミノ酸を、組合せ配列の縮重したセットを生成するように選ぶ。好適実施態様では、核酸レベルでの組合せ突然変異誘発によって、PYY変異体の斑入りのライブラリーを生成し、斑入りの遺伝子ライブラリーによってコード化する。例えば、可能性のあるPYY配列の縮重したセットが、個々のポリペプチドとしてか、又はこれに代えて、PYY配列のそのセットを含む、より大きい融合タンパク質のセット(例えばファージ表示のため)として発現可能になるように、合成オリゴヌクレオチドの混合物を遺伝子配列中に酵素的に結合することができる。
【0052】
更にもう一つの実施態様では、本発明は、PYY誘導経路が、拮抗性PYYポリペプチドの発現、又はPYY治療薬をコードしている遺伝子の破壊のいずれか一方によって、その1種類又はそれ以上の組織で阻害されている、ヒトでないトランスジェニック脊椎動物を提供する。
【0053】
好適実施態様では、始原細胞は、膵β細胞へと分化するよう誘導可能である。対象となる膵β細胞を、特異的な抗原マーカー、又は細胞表面で発現され得るその他のマーカー、例えばインテグリン、レクチン、ガングリオシド若しくは輸送体に基づいてか、又は特異的な細胞形態学に基づいて特徴付けることもできる。これらの手法は、すべて、当業者には公知かつ利用可能である。そのような膵β細胞は、一定の状況では、STF−1のようなホメオドメイン型の転写因子;PAX6のようなPAX遺伝子(類);PTF−1;hXBP−1;HNF遺伝子(類);ビリン;チロシンヒドロキシラーゼ;インスリン;グルカゴン;及び/又は神経ペプチドYのうち一つ若しくはそれ以上の発現によって特徴付けられる可能性がある。
【0054】
好適実施態様では、本発明の対象となる動物は、哺乳動物、好ましくはヒトである。
【0055】
(ii) 定義
便宜のために、本明細書、実施例、及び付記されたクレームに用いられる一定の用語を、ここに採集する。
【0056】
用語「作用薬」は、本明細書に用いられる限りで、少なくとも一つのPYY生物活性を上向調節する(例えば模倣又は増強する)作用因を意味するものとする。PYY作用薬は、野生型PYYタンパク質、若しくは野生型PYYタンパク質の少なくとも一つの生物活性を有するその誘導体、又はPYY活性として機能する(例えば模倣する)、PYYのペプチド模倣体であることができる。PYY作用薬は、PYY遺伝子の発現を上向調節するか、又はPYYタンパク質の少なくとも一つの生物活性を増大させる化合物であることもできる。したがって、PYY作用薬は、グルコースに応答してインスリンの産生及び/又は分泌を上向調節する作用因を包含する。作用薬は、PYYポリペプチドと、もう一つの分子、例えばPPファミリー受容体との相互作用を増強するか、又は未変性PYYによるPYY受容体との結合、若しくはそれの歪曲を模倣する化合物であることもできる。もう一つの例示的な作用薬は、PYY若しくはPYY受容体遺伝子の上流領域とのPYY若しくはPYY受容体転写因子のか、又はインスリン遺伝子の上流領域とのインスリン遺伝子転写因子の結合を増強し、それによってインスリンタンパク質の合成を増強する化合物である。作用薬は、PYY若しくはインスリン遺伝子の発現を上向調節するか、又は例えばタンパク質合成を増大させるか、若しくはタンパク質の代謝回転を低下させることによって、存在するPYY若しくはインスリンの量を増加させる化合物であることもできる。更に、PYY作用薬は、PYY拮抗薬阻害剤であることができる。
【0057】
「α細胞」は、膵臓内のランゲルハンス島に見出される。α細胞は、インスリンのそれと反対の効果を有するホルモンである、グルカゴンを分泌する(それは血中グルコースレベルを上昇させる)。
【0058】
用語「血中グルコースレベル」は、血液中のグルコースの濃度を意味する。正常な血中グルコースレベル(正常血糖)は、約120mg/dlである。この値は、非糖尿病者では30mg/dlも変動する。
【0059】
本明細書に用いられる限りで、用語「動物」は、脊椎動物、好ましくは哺乳動物、最も好ましくはヒトを意味する。同様に、本発明の方法によって治療しようとする「患者」又は「対象者」は、ヒト、又はヒトでない動物のいずれを意味することもできる。
【0060】
用語「拮抗薬」は、本明細書に用いられる限りで、少なくとも一つのPYY生物活性を下向調節する(例えば抑制又は阻害する)作用因を意味するものとする。PYY拮抗薬は、PYYタンパク質と、もう一つの分子、例えばPYY受容体との相互作用を阻害若しくは低下させる化合物であることができる。これに代えて、好適な拮抗薬は、PYY若しくはPYY受容体遺伝子の上流領域とのPYY若しくはPYY受容体転写因子のか、又はインスリン遺伝子の上流領域とのインスリン遺伝子転写因子の結合を阻害若しくは低下させ、それによってインスリンタンパク質の合成を遮断する化合物である。拮抗薬は、PYY若しくはインスリン遺伝子の発現を下向調節するか、又は例えばタンパク質合成を低下させるか、若しくはタンパク質の代謝回転を増大することによって、存在するPYY若しくはインスリンの量を減少させる化合物であることもできる。PYY拮抗薬は、PYYポリペプチドの優性陰性形態であることができる。PYY拮抗薬は、PYYポリペプチドの優性陰性形態をコードしている核酸、PYYアンチセンス核酸、又はPYYRNAと特異的に作用し合えるリボザイムであることもできる。更に別のPYY拮抗薬は、PYYポリペプチド、又はその受容体に結合し、その作用を阻害する分子である。そのような分子は、ペプチド、抗体、及び小さい分子を包含する。
【0061】
用語「β細胞」又は「膵β細胞」は、本明細書に用いられる限りで互換性があり、膵島内の、グルコースに応答してインスリンを産生する細胞の系譜に属する細胞を意味する。β細胞は、膵臓内のランゲルハンス島に見出される。β細胞は、血中グルコースレベルに応答して、調節された様式でインスリンを分泌する。I型又はインスリン依存性糖尿病(IDDM)では、β細胞は、自己免疫過程を通じて破壊される。身体は、内因性インスリンをもはや産生できないため、正常な血中グルコースレベルを維持するために外来性インスリンの注射を必要とする。
【0062】
「生物学的活性」又は「生物活性」又は「活性」又は「生物学的機能」は、互換的に用いられ、本明細書での目的には、(その未変性の配座であれ、変性した配座であれ)PYY治療薬が、又はその何らかの結果が直接若しくは間接的に実行する、エフェクター又は抗原の機能を意味する。生物学的活性は、PYYで誘導される転写因子によって調節される、標的核酸、例えば遺伝子の上流領域との結合を包含する。PYY生物活性は、PYYポリペプチドに影響を直接及ぼすことによって、調整することができる。これに代えて、PYY生物活性は、PYYポリペプチドのレベルを調整すること、例えば、PYY遺伝子の発現を調整すること、又はPYYタンパク質の代謝回転を調整することによって、調整することができる。
【0063】
本明細書に用いられる限りで、用語「細胞組成物」は、細胞の調製品を意味し、細胞に加えて、細胞培養の培地の非細胞成分、例えばタンパク質、アミノ酸、核酸、ヌクレオチド、補酵素、抗酸化剤、金属などを包含してよい。更に、細胞組成物は、細胞成分の増殖又は生存性には影響しないが、細胞を特定の体裁にさせるために、例えば封入のための重合体性基質、又は製剤調製品として、用いられる成分を有することができる。
【0064】
用語「培地」は、当技術に認められており、一般的には、生細胞の培養に用いられるいかなる物質又は調製品をも意味する。したがって、「組織培養」は、組織(例えば器官原基又は成体器官の外植片)の、その構造及び機能を保存するようなex vivoでの維持若しくは成長を意味する。「細胞培養」は、細胞は増殖するが、それ自体では組織へと組織化されない、細胞のex vivo又はin vivoでの成長(増殖)を意味する。
【0065】
主題の微小器官外植片や、増幅された始原細胞又はβ細胞の集団の組織及び細胞培養調製品は、様々な体裁をとることができる。例えば、「懸濁培養」は、適する培地に懸濁されつつ細胞が累増する、培養を意味する。同様に、「連続流培養」は、細胞増殖、例えば生存率を維持するための新鮮な培地の連続流の中での、細胞、又は管の外植片の培養を意味する。用語「調整培地」は、細胞によって産生され、培地中に分泌された一定の傍分泌及び/又は自己分泌因子を含むよう、培地を変化させるために、ある期間培養細胞と接触させた後に得られた、例えば培養細胞/組織を含まない、上清を意味する。
【0066】
用語「DPIV阻害剤」は、本明細書では、プロテアーゼ阻害剤、好ましくはセリンプロテアーゼ阻害剤、例えばペプチジルホウ酸(ボロプロリン)、ペプチジルアルデヒド、ペプチジルクロロメチルハライドなどを包含するとされる。
【0067】
「細胞の増強分化」によって、本来の細胞のそれと異なる一つ又はそれ以上の特徴性若しくは機能の獲得若しくは保有(すなわち細胞分化)の程度を増大させる作用を意味させる。これは、細胞の表現型の変化についてスクリーニングする(例えば、細胞、及び/又は細胞の表面マーカーの形態学的変化を特定する)ことによって、検出することができる。
【0068】
「細胞の生存又は維持を増強する」によって、本来の細胞のそれと同じである一つ又はそれ以上の特徴性若しくは機能の保有(すなわち細胞表現型維持)の程度を増大させる段階を包含する。
【0069】
用語「外植片」は、身体から取り出され、人工的な培地で成長させられた器官の一部を意味する。
【0070】
「高血糖」(高い血糖値)の状態は、血中グルコースレベルが高過ぎる状態である。代表的には、高血糖は、血中グルコースレベルが、約180ml/dlを越えて上昇したときに生じる。高血糖の症状は、頻尿、過度の渇き、及びより長い期間にわたる体重の喪失を包含する。
【0071】
一方、「低血糖」(低い血糖値)は、血中グルコースレベルが低過ぎる状態である。代表的には、低血糖は、血中グルコースレベルが、70mg/dlより低く降下したときに生じる。低血糖の症状は、不機嫌、(特に手や腕の)四肢の麻痺、錯乱、震え又は眩暈を包含する。この状態は、利用できるグルコースの量を超える、過剰量のインスリンが存在するときに生じるため、ときにはインスリン反応と呼ばれる。
【0072】
用語「損なわれたグルコース耐性」は、グルコース耐性試験を受けたときに、正常と高血糖との間に属する血中グルコースレベルを有する人物を記載するのに用いられる。そのような人物は、糖尿病を有するとは見なされないが、糖尿病を発症する危険性が比較的高い。
【0073】
本明細書に用いられる限りで、用語「遺伝子」又は「組換え遺伝子」は、本発明のポリペプチドをコードしている、エキソン及び(場合により)イントロン配列の双方を包含する読取り枠を含む、核酸を意味する。「組換え遺伝子」は、そのような調節ポリペプチドをコードしている、染色体DNAにいずれも由来するイントロン配列を場合により含む、核酸を意味する。
【0074】
本明細書に用いられる限りでの用語「グルコース非応答性の」又は「グルコース非応答性」は、細胞、島又は動物がグルコースの処置若しくは投与に全く応答できないこと、並びに(例えば、グルコースに応答して充分なレベルのインスリンを産生しないか、又は正常なレベルで応答するのに有意に高いレベルのグルコースを必要とする細胞による)グルコースに対する応答の低下の双方を記載する。
【0075】
本明細書に用いられる限りで、「異種DNA」又は「異種核酸」は、天然には、それが存在するゲノムの一部としては産しないか、又はそれが天然に産するのとは異なるゲノム中の単数若しくは複数の位置で見出される、DNAを包含する。異種DNAは、それを導入しようとする細胞に対しては内因性ではないが、別の細胞から得られている。一般に、必ずしもではないが、そのようなDNAは、通常は、それを発現させる細胞によって産生されないRNA及びタンパク質をコードしている。異種DNAは、外来DNAと呼ばれることもある。それを発現させる細胞に対して異種若しくは外来性であると当業者が認めるか、又は見なすと思われる、いかなるDNAも、本明細書では、異種DNAに包含される。
【0076】
用語「系譜に傾倒した細胞」は、もはや多能性ではなくて、特定の細胞型、例えば膵、肝又は腸細胞に分化するよう誘導されてしまった始原細胞を意味する。
【0077】
本明細書に用いられる限りで、用語「核酸」は、デオキシリボ核酸(DNA)、及び適切な場合、リボ核酸(RNA)のようなポリヌクレオチドを意味する。この用語は、ヌクレオチド類似体から作成されたRNA又はDNAのいずれかの類似体、及び説明しようとする実施態様に適用できる限りで、(センス又はアンチセンスのような)一本鎖及び二本鎖ポリヌクレオチドを、等価物として、包含するとも理解しなければならない。
【0078】
用語「器官」は、ある種の形態の細胞−細胞及び/又は細胞−基質相互作用を維持して、微細構造を形成する、組織の2枚又はそれ以上の隣接する層を意味する。
【0079】
用語「膵臓」は、当技術に認められており、一般的には、胃の後方、脾臓と十二指腸との間に横断的に位置する、大きく細長い、ブドウ状の腺を意味する。膵臓の外分泌機能、例えば外的分泌は、消化酵素源を与える。実際、「パンクレアチン」は、酵素、主としてアミラーゼ、プロテアーゼ及びリパーゼを含有する、消化助剤として用いられる、膵臓からの物質を意味する。外分泌部分は、腔を囲むいくつかの漿液性細胞で構成される。これらの細胞は、トリプシノーゲン、キモトリプシノーゲン、カルボキシペプチダーゼ、リボヌクレアーゼ、デオキシリボヌクレアーゼ、トリアシルグリセロールリパーゼ、ホスホリパーゼA2、エラスターゼ及びアミラーゼのような消化酵素を合成かつ分泌する。
【0080】
用語「膵細胞」は、膵細胞が通常産生するホルモン又は酵素を産生できる細胞、例えば、少なくとも部分的に分化したα、β、δ又はPP細胞、及び膵細胞が通常産生するホルモン又は酵素を産生できる細胞へと分化できる細胞、例えば膵前駆細胞を意味する。一実施態様では、膵細胞は、グルカゴン及び/又はソマトスタチンを産生できる能力を特徴とする。本発明の膵細胞は、対象者に投与する前に、細胞の増殖及び分化を促進する条件下で培養することもできる。これらの条件は、細胞を培養して、細胞が、擬似的な島様の凝集体又は集塊を形成し、インスリン、グルカゴン及びソマトスタチンを分泌する時点でのin vitroでの増殖及び密集を許すことを包含する。
【0081】
用語「膵内分泌細胞」は、膵臓ホルモンを分泌する膵細胞(例えばα、β、δ又はPP細胞)を意味する。例えば、本発明の膵内分泌細胞は、グルコースに応答してインスリンを産生するようPYYで処理した、胎児性β細胞又は分娩後β細胞であってよい。
【0082】
用語「膵始原細胞」は、膵臓系譜の細胞、例えば、膵細胞が通常産生するホルモン又は酵素を産生できる細胞へと分化することができる細胞を意味する。例えば、膵始原細胞は、少なくとも部分的には、α、β、δ若しくはφ細胞、又は外分泌性になる運命の細胞へと分化させ得る。膵始原細胞は、対象者に投与する前に、細胞の増殖及び分化を促進する条件下で培養することもできる。これらの条件は、細胞を培養して、細胞が、擬似的な島様の凝集体又は集塊を形成し、インスリン、グルカゴン及びソマトスタチンを分泌する時点でのin vitroでの増殖及び密集を許すことを包含する。細胞増殖を測定する方法は、当技術に周知であり、最も一般的には、細胞複製のDNA合成の特徴性を決定することを包含する。当技術には、DNA合成を測定するための無数の方法があり、いずれを本発明に従って用いてもよい。本発明の一実施態様では、DNA合成は、放射性標識(3H−チミジン)、又は標識化されたヌクレオチド類似体(BrdU)を免疫蛍光による検出に用いて決定している。しかしながら、DNA及びRNA合成の測定に加え、それぞれの胎児細胞又は始原細胞の集団を特徴付けるための根拠として、インスリン分泌に依拠することができ、好ましくはそうすることになる。
【0083】
始原細胞は、培地での自己再生、及び膵臓系譜への分化のための能力を特徴とする。例えば、始原細胞は、例えば剖検によって単離された、小葉内膵管外植片から単離することができるか、又はそのような細胞の細胞培養による子孫である。始原細胞は、膵島細胞、例えばβ島細胞、α島細胞、δ島細胞又はφ島細胞に分化するよう誘導することができる。そのような膵始原細胞は、一定の状況では、STF−1のようなホメオドメイン型の転写因子;PAX6のようなPAX遺伝子(類);PTF−1;hXBP−1;HNF遺伝子(類);ビリン;チロシンヒドロキシラーゼ;インスリン;グルカゴン;及び/又は神経ペプチドYのうち一つ若しくはそれ以上の発現を特徴としてよい。好適な始原細胞は、哺乳動物を起源とすることになり、例えば、ヒトのような霊長類、ミニブタ、若しくはトランスジェニック哺乳動物から単離された細胞、又はそのような細胞の細胞培養による子孫である。膵管性組織は、患者から単離し、膵始原細胞(又はそれらに由来する分化した細胞)の結果的な培養を与えるために、本方法に付してよい。遺伝子置換その他の遺伝子療法は、ex vivoで実施され、単離された細胞は、当初の提供者である患者、又は第二の宿主患者に戻し移植される。
【0084】
一般に、「有幹性」と、内分泌及び外分泌細胞へと分化できる能力とを維持しつつ、膵管上皮の複製可能な拡大を許す培養系を用いてよい。膵管上皮は、例えば外植片又は酵素消化によって得て、密集まで培養する。密集細胞集団は、培養集団内で始原細胞の分化を生起する作用因、例えば成長因子のような栄養因子に接触させる。次いで、この作用因に応答して増殖する、外植片からの始原細胞を、例えば、外植片の残余からの新たに出現する芽の直接の機械的分離、又は外植片の全部若しくは一部の溶解、及びその後の始原細胞集団の単離によって単離する。作用因は、フォルスコリン、ジブチルcAMP、酪酸ナトリウム、デキサメタゾン若しくはコレラ毒、又はIGF、TGF、FGF、EGF、HGF、ヘッジホッグ若しくはVEGFその他のTGFβスーパーファミリー、好ましくはDVR(dpp及びvg1関連)ファミリーの一員、例えばBMP2及び/又はBMP7のような成長因子であってもよい。上記により、本発明のもう一つの態様は、主題の始原細胞の子孫、例えば、最初の外植片の培養体の細胞に由来する細胞に関する。そのような子孫は、始原細胞のその後の世代はもとより、主題の始原細胞を、外植片からのそれらの単離後に分化を誘導することによって生成された、例えばin vitroで誘導された、系譜傾倒細胞を包含することができる。
【0085】
例示的な生存始原細胞、及びそのような細胞を膵管組織から単離する方法は、引用により本明細書に組み込まれる、米国仮特許出願弁理士整理番号第ONV-060.60号に提供されている。略述すると、ラット膵臓からの小管を、コラゲナーゼA又はコラゲナーゼH(Boehringer-Mannheim)中の酵素消化の後に単離し、洗浄し、HBSS(Ca/Mg含まぬ)に再懸濁させ、500μmのメッシュ越しに注いで、大きい粒子を除去し、再び洗浄する。より年長の動物(2週以後)に対しては、消化物をHBSSに再懸濁させ、100mmのプレートに入れる。浮遊する管の断片をピペットを用いて手動で単離する。より高い収率のためには、2週のラット仔からの膵臓を、Percoll(Pharmacia)上で分離することができる。ラット仔からの消化された膵臓を、40%のPercoll溶液上に敷き、1,900rpmで10分間遠心分離する。管断片を、試験管頂の緩衝液とPercollとの境界面に置く。この材料を洗浄し、100mmの皿に入れる。混入する島(非常に少数)を、手動で除去する。断片(単細胞を含む)を、再び洗浄し、培養のために平板播種する。管断片は、5%FBS及びペニシリン/ストレプトマイシン添加Iscoves修正DMEM中で優先的に培養される。理想的には、細胞を、5日間培養して、密集単層を達成すると、次いで分化するよう誘導することができる。単層全体の密集は、不可欠ではなく、分化は、密集細胞のいかなるパッチにおいても生じることができる。単層は、成長を促進するためのEGF(10ng/ml)又はTGF−α(10ng/ml)の存在下で、成長させることができる。分化の誘導は、cAMP依存性であると考えられる。細胞内cAMPレベルの上昇を誘導する作用因は、分化を誘導することが期待される。デキサメタゾン、コレラ毒、フォルスコリン、ジブチルcAMP及び酪酸ナトリウムは、すべて、試験され、分化を誘導することが見出されている。分化の誘導は、48時間の1回処理で優先的に実施される。始原細胞は、48時間の処理の経過にわたって出現する。処理は、24時間でも実施することができて、始原細胞を生じる。
【0086】
用語「%同一である」は、二つのアミノ酸配列、又は二つのヌクレオチド配列の間の配列同一性を意味する。同一性は、それぞれ、各配列中の、比較を目的として整列させ得る位置を比較することによって決定することができる。比較される配列中の同等の位置が、同じ塩基又はアミノ酸で占められているときは、分子はその位置が同一であり;同等部位が、同じであるか、又は類似のアミノ酸残基(例えば空間的及び/又は電子的性質が類似)によって占められているときは、分子はその位置が相同である(類似する)と呼ぶことができる。相同性/類似性又は同一性の百分率としての表現は、比較される配列が共有する位置で同一であるか、又は類似するアミノ酸の数の関数を意味する。FASTA、BLAST又はENTREZを包含する、様々な整列のアルゴリズム及び/又はプログラムを用いてよい。FASTA及びBLASTは、GCG配列分析パッケージ(University of Wisconsin, Madison, Wis.)の一部として入手可能であり、例えば不履行の設定で用いることができる。ENTREZは、National Center for Biotechnology Information, National Library of Medicine, National Institute of Health, Bethesda, MDを通じて利用可能である。一実施態様では、2配列の同一性百分率は、GCGプログラムによって、ギャップ加重を1として、例えば、各アミノ酸のギャップを、2配列間の単一のアミノ酸又はヌクレオチドの不適合であるかのように加重することによって決定することができる。
【0087】
本明細書に用いられる限りで、「表現型」は、例えば何らかの一形質、又は何らかの形質群を有する、細胞の物理的、生化学的及び生理学的成り立ち全体を意味する。
【0088】
用語「始原細胞」は、多数の母細胞(次いで、分化したか、又は分化し得る娘細胞を生じることができる)を生成できる能力を有する未分化の細胞を意味する。本明細書に用いられる限りで、用語「始原細胞」は、ときには当技術において「幹細胞」と呼ばれる細胞を包含することも意図される。好適実施態様では、用語「始原細胞」は、その後代(子孫)が、分化によって、例えば、胚の細胞及び組織の累進的多様化の際に生じるとおり、完全に個体的特徴性を獲得することによって、しばしば異なる方向に特殊化する一般化された母細胞を意味する。
【0089】
用語「対象者」は、不充分なインスリン活性を特徴とする疾患に罹患し易い哺乳動物、特にヒトを包含することが意図される。
【0090】
本明細書に用いられる限りで、始原細胞に関しての用語「実質的に純粋な」は、全細胞集団を構成する始原細胞に関して、約75%以上、好ましくは約85%以上、より好ましくは約90%以上、最も好ましくは約95%以上純粋である、始原細胞の集団を意味する。換言すれば、用語「実質的に純粋な」は、その後の培養及び増幅の前の、増幅かつ単離されていない集団中に、約20%未満、より好ましくは約10%未満、最も好ましくは約5%未満の系譜傾倒細胞を含有する、本発明の始原細胞の集団を意味する。
【0091】
用語「組織」は、同様に特殊化した、まとまって一定の特別の機能を実行する、一群又は一層の細胞を意味する。
【0092】
用語「移植片」は、本明細書に用いられる限りで、動物に導入され、同種異系のか、自己のか、又は異種のそれであってよい細胞、組織若しくは装置を包含することが意図される。
【0093】
「転写調節配列」は、それらを機能的に結合するタンパク質コーディング配列の転写を誘導若しくは制御するDNA配列、例えば開始シグナル、エンハンサー及びプロモーターを表すために、本明細書全体を通して用いられる総称的用語である。好適実施態様では、組換え遺伝子の転写は、その中で発現が意図される、ある細胞型でのその組換え遺伝子の発現を制御する、プロモーター配列(又は他の転写調節配列)の制御下にある。この組換え遺伝子は、天然に産する形態のタンパク質の転写を制御する配列と同じであるか、又は異なる、転写調節配列の制御下にあることができることも理解されると思われる。
【0094】
本明細書に用いられる限りで、用語「ベクター」は、それが結合されている、もう一つの核酸を輸送することができる核酸分子を意味する。好適なベクターの一つの種類は、エピソーム、すなわち、染色体外複製が可能な核酸である。好適なベクターは、それが結合されている核酸の自律的複製及び発現が可能なそれである。それが機能的に結合されている遺伝子の発現を指図することができるベクターは、本明細書では、「発現ベクター」と呼ばれる。一般に、組換えDNAの手法で利用価値のある発現ベクターは、環状の二本鎖DNAの、そのベクター形態では染色体に結合されていないループを意味する、「プラスミド」の形態をなすことが多い。本明細書では、「プラスミド」及び「ベクター」は、プラスミドが最も一般的に用いられる形態のベクターであるため、互換的に用いられる。しかし、本発明は、同等の機能に役立ち、今後は当技術に公知になる、発現ベクターのそのような他の形態も包含することが意図される。
【0095】
追加的な用語は、適切な場合は、下記に定義される。
【0096】
(iii) 例示的なPYYペプチド及びPYY作用薬
PYYは、発生中のマウス及びラット膵では、膵臓ポリペプチドファミリーの支配的なホルモンである。それは、神経ペプチドY(NPY)及び膵臓ポリペプチド(PP)も包含する、タンパク質のPPファミリーの一員である。ヒトPYYに対する配列は、
YPIKPEAPGEDASPEELNRYYASLRHYLNLVTRQRY(SEQ ID No:1)
で示される。
【0097】
PYYは、腸の運動性、及び胃腸管及び膵臓への腸間膜血流を阻害し、胃、膵臓及び腸の外分泌性の分泌を媒介し、正味の吸収を刺激する[例えば、Laburthe (1990) Trends Endocrinol. Metabol. 1:168;Lundberg, J.M. et al. (1982) Proc. Natl. Acad. Sci. USA 79:4471-75;Suzuki, T. (1983) Gastroenterology 85:114-21;Pappas, T.N. (1985) Am. J. Physiol. 248:G118-G123;Cox et al. (1990) Br. J. Pharmacol. 101:247;Playford et al. (1990) Cancer 335:1555;McFayden et al. (1986) Neuropeptides 7:219を参照されたい]。PYYは、様々な動物でCCK、インスリン及びグルカゴンの放出を阻害することも示されている[Lluis, F. et al. (1988) Gastroenterology 94:137-44;Guo, Y.S. et al. (1988) Pancreas 3:128-34;Botteher, G. et al. (1989) Pancreas 4:282-88;Guo, Y.S. et al. (1989) Gastroenterology 96:690-94;Greeley et al. (1988) Am. J. Physiol. 254:E513-17]。PYYmRNAは、ラットのe15、及びマウスのe10.5に、膵内分泌細胞で検出されていて、ピークPYYmRNAレベルは、妊娠後期に発生し、成体ラットではより低いレベルで存続する[Krasinski, S. et al. (1991) Mol. Endocrinol. 5:433-40;Upchurch, B.H. (1994) Development 120:245-52]。PYY細胞は、NPY及びPP細胞より早期に出現し、より多量であり、PYYが最も早く発現される膵臓ホルモンであることを示唆している[Jackerott, M. (1996) J. Histochem. and Cytochem. 44(8):809-17]。マウスでは、PYYは、発生の際、すべての島細胞型で発現され、主要な4細胞型のすべてが、共通のPYY産生多ホルモン性始原細胞から発生することを示唆している[Myrsen-Axcrona、前掲;Upchurch et al.、前掲]。例えば、PYY、インスリン及びグルカゴンは、胚の初期段階(e12〜e15)では同じ島細胞内に存在するが、インスリン−及びグルカゴン−含有細胞の別個の集団の形成後(e16〜P0)は、島の非β細胞(主としてグルカゴン含有細胞)に限定される[Myrsen-Axcrona et al.、前掲]。これらの知見は、インスリン含有細胞が、グルカゴン及びPYYを同時発現する細胞から分化することを示唆している[Myrsen-Axcrona et al.、前掲]。
【0098】
主題の方法は、未変性の精製されたペプチドYY若しくは組換えペプチドYY、又はそのフラグメントはもとより、そのペプチド模倣体を用いて実施することができる。ペプチドのチロシンチロシン又はペプチドYY(「PYY」)は、36アミノ酸残基のペプチドアミドであり、ブタの腸から初めて単離され、専ら遠位の腸の粘膜内分泌細胞で定位され、近位の腸及び膵臓でも産生される[Tatemotu et al. (1982) Proc. Natl. Acad. Sci. USA 79:2514;Aponte, G.W. et al. (1989) FASEB J. 3:1949-55]。PYYの同族体及び類似体は、突然変異誘発、例えば不連続点突然変異によってか、又は断端によって生成することができる。例えば、突然変異は、PYYの、実質的に同じ生物学的活性、又はその単なるサブセットを保持する同族体を生じることができる。これに代えて、天然に産する形態のPYYの機能を、例えばPYYの同族受容体に競合的に結合し、こうしてシグナル導入を遮断することによって阻害することができる、このタンパク質の拮抗薬形態を生成することができる。加えて、構成的に活性を有する、PYYの拮抗薬形態を生成してもよい。したがって、PYY及びその同族体は、膵島又はβ細胞におけるグルコース応答性の、陽性又は陰性のいずれの調節因子でもあり得る。
【0099】
ヒトPYY及びそのフラグメントは、商業的に購入することができる(Bachem California 1993-1994 Catalogue, Torrance, CA;Sigma Peptide and Amino Acids 1994 Catalogue, St. Louis, MO)。PYYの類似体及び模倣体は、ペプチド技術の当業者に公知である多くの手法によって、合成してもよい。利用できる多くの手法の要約が、Solid Phase Peptide Synthesis 2nd ed.(Stewart, J.M. & Young, J.D., Pierce Chemical Company, Rockford, IL, 1984)に見出し得る。その他のPYY類似体は、当技術に通常の技量を有する者の能力の範囲内で、適切な修正を施すことによって製造することができる。
【0100】
一般に、本明細書ではPYYの活性を有する(例えば「生物活性」を有する)と称されるポリペプチドは、PYYのアミノ酸配列の全部又は一部に相当する(例えば同一又は相同である)アミノ酸配列を有し、天然に産するPYYタンパク質の生物学的/生化学的活性の全部又は一部を模倣又は中和する、ポリペプチドとして定義される。そのような生物学的活性は、誘導若しくは増強されたインスリン産生によって立証されるとおりのグルコース応答性の誘導又は増強、又はその他の、例えば、STF−1のようなホメオドメイン型の転写因子;PAX6のようなPAX遺伝子(類);PTF−1;hXBP−1;HNF遺伝子(類);ビリン;チロシンヒドロキシラーゼ;インスリン;グルカゴン;及び/若しくは神経ペプチドYのような、β細胞分化の指標を包含する。
【0101】
PYY類似体の生物活性は、例えば、PYY類似体とその同族受容体との相互作用によって開始されるシグナル導入カスケードの下流の構成要素としての、遺伝子の転写率を変えられる能力を包含してもよい。
【0102】
PYY治療薬のその他の生物学的活性は、本明細書に説明されるか、又は当業者には合理的に明白であると思われる。
【0103】
完全長ポリペプチドの一部を表すPYYポリペプチドは、天然に産する形態のタンパク質の生物学的活性の(例えば模倣又は増強する)作用薬、又はこれに代えて拮抗薬のいずれかであることができ、例えば、該ポリペプチドは、分化、及び/又は真正PYYタンパク質に対するグルコース応答性を調整することができる。主題のPYYタンパク質の同族体は、例えば、潜在的な切断配列を変化させるか、又は該タンパク質に付随する酵素活性を不活性化する突然変異によるような、タンパク質分解性の切断に耐性を有する、該タンパク質のバージョンを包含する。
【0104】
完全長ポリペプチドの部分を表し、グリコシル化されたか、又は逆に、糖鎖形成を排除するための発現系の選択、若しくはタンパク質配列の修飾によって還元された、炭水化物の類似体であることができる、本発明のPYYポリペプチドを提供することもできる。グリコシル化された形態は、グリコサミノグリカン鎖を有する誘導体化を包含する。
【0105】
主題のタンパク質は、キメラ性分子として、例えば融合タンパク質の形態で提供することもできる。例えば、PYYタンパク質は、第二のポリペプチド部分、例えばPYYに無関係のアミノ酸配列を有する、第二のポリペプチドを含む組換え融合タンパク質として提供することができ、例えば第二のポリペプチド部分は、グルタチオンSトランスフェラーゼであり、例えば第二のポリペプチド部分は、アルカリ性ホスファターゼのような酵素活性であり、例えば第二のポリペプチド部分は、エピトープタグである。
【0106】
膵腫瘍の治療の際に、天然のペプチドの持続性、効果、生物学的活性及び選択性を模倣かつ増強する、PYYの類似体が報告されている[米国特許願第5,574,010号明細書を参照されたい:引用により本明細書に組み込まれる]。
【0107】
(iv) PYY治療薬の例示的な使用
一態様では、本発明は、本発明の膵細胞培養の利用を伴う治療方法を提供する。例えば、本発明は、血糖レベルを変化させる方法であって、本発明によって生成された膵内分泌細胞の細胞培養体を動物に投与することを含む方法を提供する。血糖レベルを変化させるために用いられる細胞培養体は、膵内分泌細胞の初代細胞培養体、又はその継代培養体であってよい。培養された本発明の膵内分泌細胞は、グルコース濃度に応答してインスリンを分泌する、β細胞を包含する。
【0108】
一定の実施態様では、主題の方法は、妊娠のe21日とほぼ同等な発生段階の胚(好ましくは「ヒト化された」ヒトでない哺乳動物のそれ)から得られた細胞の、単離された集団を利用する。胚から得られた膵細胞は、例えばPYY治療薬の存在下で非インスリン分泌性である、単層の付着細胞として培養することができる。これらの細胞は、密集に到達するのを許したとき、島様の凝集体又は集塊を形成し、膵臓ホルモン、例えばインスリン、グルカゴン及びソマトスタチン、並びに酵素を分泌し始める。この時点で、そのような凝集体は、単離し、集積し、受容対象者に投与することができて、それらがインスリンを分泌する。好ましくは、それぞれ、約300〜500個の細胞を含有する、約100,000〜500,000の凝集体を用いて、一人のヒトを治療することができる。ヒトにおいては、6〜12週の胎児は、グルコースに応答しないが、17週と20週との間で、単相性の方式でインスリンを産生するよう誘導できることが立証されているが、この応答は弱い(1.6倍)。インスリンの二相性分泌は、出生後26〜44週に達成される[Otonkoski, T. et al., Diabetes, 1988 Mar., 37(3):286-91]。これは、ヒトの胎児膵が、妊娠の前半の間に既にグルコース応答性になっているが、二相性のインスリン放出は、産後の時期まで成熟を開始しないことを示唆する。血糖レベルを変化させる方法は、組織様形態で培養された膵内分泌細胞を用いて達成することもできる。そのような、個別のβ細胞としてか、又は他の細胞型と組み合わせてかのいずれかで培養された膵内分泌細胞は、自発的にか、又は当技術に公知の培養手法によって、密着した凝集体を形成することができる。そのような密着凝集体を、本明細書では「擬似島」と名付ける。好ましくは、擬似島は、当技術に公知の方法を用いて、適切な生体適合性基質、例えばコラーゲン中に包埋する。培養された膵内分泌細胞は、適切な生体適合性材料、例えばコラーゲンとの同時培養によって密着凝集体に形成することができるが、同時培養以前は、細胞は、遊離した懸濁液の形態をなす。いずれかの方法によって形成された細胞の密着凝集体を、「擬似組織」と名付ける。擬似組織は、哺乳動物に移植し、その中で、血糖レベルを変化させるよう機能することができる、生物学的に適合性である移植片を形成する。
【0109】
本明細書に記載された方法に従って調製され、下記に例示される、膵内分泌細胞の初代、二代及びその後のか、若しくはクローン性の培養体、又はその組合せは、そのような擬似組織として用いてよい。この方法は、膵内分泌細胞を擬似組織として、例えば哺乳動物に移植することを含み、擬似組織は、血管が形成され、血中グルコースレベルが充分に高いレベルに達しているときに、インスリンを分泌することによって、宿主の哺乳動物の血中グルコースレベルに応答する。擬似組織の血管形成は、擬似組織に血管が形成されなかった場合の実験では、血糖レベルが調節されなかったという点で、重要であると思われる。同様に、擬似組織の血管形成の遅延も、擬似組織が血糖レベルを調節できる能力を損なうように思われた。
【0110】
その他の実施態様では、本発明は、グルコース応答性インスリン分泌能を、そのような能力を必要とする哺乳動物に与える方法を対象とする。この方法は、一般的には、グルコースに応答してインスリンを分泌する、加工された細胞を、そのような哺乳動物に移植することを包含する。島の移植に現在用いられている手法は、本発明に従って加工された細胞の移植にも適用可能であると、本発明者らは提唱する。一つの方法は、加工された細胞の生体適合性コーティングへの封入を含む。この取組み方では、細胞を、封入された細胞を免疫学的応答から保護し、クローン的に加工された細胞の無制御の増殖を防止することにも役立つ、カプセル状のコーティング内に捕捉する。好適なカプセル封入の手法は、アルギン酸−ポリリシン−アルギン酸によるカプセル封入を含む。この手法を用いて作成されたカプセルは、一般的には、数百個の細胞を内容し、約1mmの直径を有する。
【0111】
代替的な取組み方は、加工された細胞とともにAmicon繊維を播種することである。細胞は、半透性である繊維の網目に捕捉され、こうして、マイクロカプセル封入体に似た方式で保護される[Altman, et al., 1986]。
【0112】
カプセル封入又は繊維播種に成功した後、一般的には約1,000〜10,000の細胞は、通常は大ゲージの針(23ゲージ)からの腹腔内への注射によって、腹腔内移植してよい。
【0113】
本発明者らが本発明の実施に利用し得るであろうと提案する多様な他のカプセル封入技術が開発された〔例えば、Lacyら(1991)Science 254:1782−84、およびSulivanら(1991)Science 252:718−21;WO9110470;WO9110425;WO9015637;WO9002580;米国特許第5,011,472号;米国特許第4,892,538号;WO8901967号(これらはいずれも本明細書に文献援用される)参照〕。現在市場で入手し得るサイトセラプティックス社(Cytotherapeutics)によって開発されたカプセル封入技術は、本発明に用いると有用であろう。さらに1つの血管装置が、マサチューセッツ州シュルーズベリ所在のバイオハイブリッド社(Biohybrid,of Shrewsbury,Mass.)によって開発されており、本発明の技術に適用し得る。
【0114】
哺乳動物にグルコース応答性インスリン分泌能を与えるために用い得る移植法に関して、最近、Lacyら、前掲;Sullivanら、前掲(これらはいずれも本明細書に文献援用される)に記載されている方法が特定の利点を有すると考えられる。これらは、最初がカプセル封入された膵島を皮下異種組織移植する方法、次が動静脈シャントとして血管系に連結し得る「人工膵臓」として膵島組織を長期移植する方法に関する。これらの移植法は、従来法の「膵島組織」の代わりに本明細書に開示されているような工学的に設計された細胞を用いて、本発明用に適合させると有利であろう。
【0115】
他の重要な実施態様は、インスリンの産生、特に、IDDMの治療に用い得るヒトインスリンの産生に本発明の工学的に設計された細胞を用いる方法に関する。いくつかの態様においては、工学的に設計された人工β細胞を培養して増殖させ、次いで、グルコールを含む緩衝液と接触させることにより、インスリンを産生するように細胞を刺激し、インスリンを分泌させ、これを周囲培地から回収して精製することができる。本発明のこの態様に関連して使用するためには、工学的に設計されたCTG−6細胞が特に有用であると考えられるが、グルコースに応答してインスリンを分泌するように造られた任意の細胞を用いてよい。本発明のさらなる態様は、患者、特にヒト患者のインスリン活性不全を特徴とする疾患または他の障害を治療する方法を含む。これらの方法は、患者に、PYY製剤と、インスリン産生細胞(例えば、β細胞)を含むか、または患者に投与した後でインスリン分泌細胞を形成するように分化する能力を有する単離された膵臓細胞集団とを投与することを含む。本明細書において、用語「導入」、「投与」および「移植」とは、細胞を所望の場所に送出する方法または経路にしたがって細胞を患者に送出することを表すように交換可能に用いられる。本明細書に用いられている限りにおいて、用語「治療する」とは、インスリン活性不全を特徴とする疾患の少なくとも1つの副作用または症状、例えば、絶対的もしくは相対的インスリン欠乏症、空腹時高血糖症、糖尿、アテローム性動脈硬化症の発症、小血管症、ネフロパシー、ニューロパシーを軽減もしくは緩和することを含む。本明細書に用いられている限りにおいて、用語「インスリン活性不全を特徴とする疾患」には、インスリン機能異常によるグルコースの異常利用が存在する疾患が含まれる。インスリン機能異常としては、インスリンの産生におけるすべての異常または不全、例えば、IDDM(I型糖尿病)におけるような細胞の減損に起因するインスリン欠乏症などの細胞オルガネラを介した発現および/もしくは輸送異常または不全、NIDDM(II型糖尿病)におけるようなインスリン分泌応答不全などの分泌異常または不全、インスリン分子自体の形態、例えば、一次、二次もしくは三次構造の異常または不全、標的細胞に対するインスリンの作用、例えば、末梢組織などの体組織におけるインスリン抵抗性の異常または不全、およびインスリンに対する標的細胞の応答の異常または不全が含まれる。IDDMおよびNIDDMならびに他の形態の糖尿病におけるインスリン活性異常のさらなる説明については、Braunwald,E.ら編(1987)Harrison’s Principles of Internal Medicine,Eleventh Edition,McGraw−Hill Book Company,New York,pp.1778−97;Robbins,S.L.ら(1984)Pathologic Basis of Disease,3rd Edition,W.B.Saunders Company,Philadelphia,p.972を参照されたい。
【0116】
グルコース恒常性を改善する種々の薬理学的方法が存在するが、現在、臨床診療に用いられているものは、ほとんどの患者で正常血糖の回復に失敗するか、または種々の期間後に失敗に帰している。〔Scheen,A.J.(1997)Drugs 54(3):355−68〕。現在のところ、4種の薬剤が用いられている。スルホニル尿素、ビグアニド(メトホルミン)、α−グルコシダーゼ阻害剤(アカルボース)およびインスリンである。インスリン療法は、特に疾患後期の合併症を最小限にするために高血糖の制御を必要とし得る。II型糖尿病の最も有効な療法は、複合糖質の腸消化を遅らせて食後のグルコースレベルを低下させるα−グルコシダーゼ阻害剤、アカルボースである。他の代謝活性剤は毒性が強すぎることが証明された。一方、スルホニル尿素は、インスリンの分泌を増大させ、肝臓および膵臓組織に対するインスリンの作用を増強して高血糖を低下させる。チアゾリジンジオン〔例えば、トログリタゾン、ピオグリタゾン、ダルグリタゾン(darglitazone)およびYM268〕などの薬剤は、インスリンの作用を促進する(すなわち、「インスリン増感剤」である)。
【0117】
代替法として、ヒト膵臓の移植は可能ではあるが、この方法は、ドナー不足や免疫拒絶反応問題のために、選択された患者に限定されている。β細胞の移植はヒトでは成功を治めているが、大量のβ細胞が必要であり、かつ免疫拒絶反応が障害となっている。したがって、有効かつ経済的な療法が不足している。
【0118】
膵臓細胞を適切な経路を介して患者に投与して細胞を患者の所望の場所に送出し、そこで細胞を増殖させ、膵臓ホルモン、例えばインスリン、または酵素を分泌させることができる。膵臓細胞の投与に好ましい場所としては、急速に血管が発達する場所が挙げられる。患者、特にヒト患者に膵臓細胞を投与する一般的方法には、大網嚢への細胞移植〔Yoneda,K.ら(1989)Diabetes 38(Suppl.1):213−216〕、細胞の腹腔内注射〔Wahoff,D.C.ら(1994)Transplant.Proc.26:804〕、患者の腎被膜下への細胞移植〔例えば、Liu,X.ら(1991)Diabetes 40:858−866;Korsgren,O.ら(1988)Transplantation 45(3):509−514;Simeonovic,D.J.ら(1982)Aust.J.Exp.Biol.Med.Sci.60:383参照〕、および例えば門脈への細胞の血管内注射〔Braesch,M.K.ら(1992)Transplant.Proc.24(2):679−680;Groth,C.G.ら(1992)Transplant.Proc.24(3):972−973〕がある。腎被膜下に膵臓細胞を移植しやすくするために、細胞を、例えば、被移植患者由来の血漿から調製した血漿塊〔Simeonovic,D.J.ら(1982)Aust.J.Exp.Biol.Med.Sci.60:383〕またはコラーゲンマトリックスに埋め込むことができる。細胞は、医薬上許容し得る担体または希釈剤中で投与し得る。
【0119】
(v) 医薬製剤
PYYまたはPYYアゴニストもしくはアンタゴニストあるいは細胞組成物は、純粋または実質的に純粋な化合物/組成物として投与することは可能ではあるが、医薬配合物または製剤として投与するのが好ましい。ヒト用かつ動物用に本発明に用いられる配合物としては、PYY、PYYアゴニストもしくはアンタゴニストまたは細胞組成物と共に、1種以上の医薬上許容し得る担体および場合により他の治療成分が含まれる。
【0120】
担体は、配合物の有効成分に適合し得るという意味で「許容し得る」ものでなければならず、かつ治療を受ける患者に対して有害であってはならない。
【0121】
配合物は、単位剤形として提供するのが便利であり、薬学業界で周知のいずれの方法によっても製造し得る。どの方法も、有効成分と、1種以上の補助成分を構成する担体とを混合するステップを含む。
【0122】
本発明は、PYY治療剤または細胞組成物の医薬組成物、ならびにペプチドホルモンの恒常性を変えることにより改善させ得る疾患の治療および/または予防における上記医薬組成物の使用法に関する。好ましい実施態様において、これらの阻害剤は、低血糖誘導活性および抗糖尿病活性を有しており、グルコース貯蔵を含めたグルコース代謝異常を特徴とする疾患の治療に用いることができる。特定の実施態様において、本発明の方法の組成物は、インスリン向性剤(insulinotropic agent)として、またはGLP−1のような分子のインスリン向性作用の増強に有用である。この点に関し、本発明の方法は、高脂血症、高血糖症、肥満症、糖耐性不全症、インスリン抵抗性および糖尿病合併症の1種以上を含む多様な疾患の治療および/または予防に有用であり得る。
【0123】
PYY治療剤または細胞組成物は、当業では周知のように、治療すべき疾患や、患者の年齢、状態および体重に応じて種々の形態で投与し得る。例えば、経口投与する場合、化合物は、錠剤、カプセル剤、顆粒剤、散剤もしくはシロップ剤として配合してよく、非経口投与の場合、化合物は、(血管内、筋肉内もしくは皮下)注射剤、滴下注入剤または座剤として配合し得る。眼の粘膜経由で投与する場合、化合物は、点眼剤または眼軟膏として配合し得る。これらの配合物は、慣用手段によって調製することができ、所望なら、有効成分を、賦形剤、バインダー、崩壊剤、滑潤剤、矯味剤、可溶化剤、懸濁助剤、乳化剤またはコーティング剤などの任意の慣用添加剤と混合し得る。用量は、患者の症状、年齢および体重、治療もしくは予防すべき疾患の性質および重篤度、薬剤の投与経路および形態に応じて異なるが、一般に、ヒト成人患者には、1日当たり0.01〜2000mg用量の化合物が推奨され、これを1回または複数回に分けて投与し得る。
【0124】
グルコース代謝は変更可能であり、II型糖尿病にかかわる症状は、PYY治療剤の「調時」(timed)投与により軽減または排除することができ、その場合、(用量および/またはタイミングを含めた)治療の有効性を評価するために、例えば、グルコース抵抗性、グルコースレベル、インスリンレベル、インスリン感受性またはグリコシル化ヘモグロビンなどのグルコース代謝および/またはII型糖尿病の1種以上の適切な指数を用い得る。
【0125】
PYY治療剤の投与に効果的な時間を同定する必要がある。これは、1グループ以上の動物(好ましくは1グループ当たり少なくとも動物5匹)を用いて、以下に記載のような日常的実験により達成することができる。動物の場合、PYY治療によるインスリン向性活性の評価は、PYY治療剤を1日の特定の時間に投与し、グルコース代謝、好ましくはインスリン放出に係わる1種以上の指数を測定し、治療後のこれらの指数値を治療前もしくは対照治療の同じ指数値と比較して投与効果(もしあれば)を測定して実施し得る。
【0126】
所与の患者の治療効力に関して最も有効な結果を生じるPYY治療剤の厳密な投与時間および/または用量は、特定の化合物の活性、薬物動態学および生体内利用率、(年齢、性別、疾患のタイプおよび段階、一般的な健康状態、所与の用量およびタイプの薬剤に対する応答性を含めた)患者の生理的状態、投与経路などに依存する。しかし、上記ガイドラインは、治療の微調整、例えば投与の最適時間および/または量を決定するためのベースとして用いることができ、微調整には、ただ患者をモニターし、用量および/またはタイミングを調整することからなる日常的実験が必要なだけである。
【0127】
患者が治療を受けている間、24時間の所与の時間に1種以上の関連指数を測定してグルコース代謝をモニターする。そのようなモニターの結果にしたがって、治療(薬剤の量、投与時間およびタイプ)を調整し得る。患者は、改善度を確認するために定期的に同じパラメータを測定して再評価するが、そのような再評価は、典型的には、先ず、療法開始から4週間後に行い、その後、療法中4〜8週毎に、次いで、その後3ヶ月毎に行う。療法は数ヶ月または数年にもわたることがあるが、ヒトの場合、療法の典型的な長さは6ヶ月である。
【0128】
これらの再評価をベースとして、投与する薬剤の量および恐らく投与時間を調整し得る。例えば、4週間の治療後に、代謝指数のうち1つは改善されていないが、少なくとも1つの他の指数が改善されていた場合、投与時間は変えずに、用量を1/3だけ増加させ得る。
【0129】
治療は、化合物の最適用量より少ない小用量から始めてよい。その後、その状況下で最適な効果に達するまで少しずつ用量を増加させるのが望ましい。所望なら、1日当たりの総用量を分割して、1日の間に少量ずつ投与するのが便利である。
【0130】
本明細書に用いられている限りにおいて、用語「治療上有効量」とは、例えば、任意の医学的治療に適用可能な妥当な利益/危険比で膵臓β細胞のグルコース応答性を高めることによりある程度の所望の治療効果を得るのに有効な、例えばPYY治療剤の量を意味する。
【0131】
本明細書において、用語「医薬上許容し得る」とは、健全な医学的判断の範囲内で、妥当な利益/危険比に対応する、過剰な毒性、刺激、アレルギー反応、または他の問題もしくは合併症無しに、人間および動物の組織に接触させて使用するのに適した、PYY、材料、組成物および/または剤形を表すのに用いられる。
【0132】
本明細書に用いられている限りにおいて、用語「医薬上許容し得る担体」とは、当該化学物質を1つの器官または身体の一部から別の器官または身体の一部に運んだり輸送したりすることに関与する液体または固体充填剤、希釈剤、賦形剤、溶液または封入材料などの医薬上許容し得る材料、組成物またはビヒクルを意味する。どの担体も、配合物の他の成分に適合し得るという意味で「許容し得る」ものでなければならず、かつ患者に有害であってはならない。医薬上許容し得る担体として働き得る材料の例としては、(1)ラクトース、グルコースおよびスクロースなどの糖質;(2)コーンスターチおよびジャガイモデンプンなどのデンプン;(3)ナトリウムカルボキシメチルセルロース、エチルセルロースおよび酢酸セルロースなどのセルロースおよびその誘導体;(4)粉末トラガカント;(5)麦芽;(6)ゼラチン;(7)タルク;(8)カカオバターおよび座剤ろうなどの賦形剤;(9)落花生油、棉実油、サフラワー油、ごま油、オリーブ油、コーン油および大豆油などの油;(10)プロピレングリコールなどのグリコール;(11)グリセリン、ソルビトール、マンニトールおよびポリエチレングリコールなどのポリオール;(12)オレイン酸エチルおよびラウリン酸エチルなどのエステル;(13)寒天;(14)水酸化マグネシウムおよび水酸化アルミニウムなどの緩衝剤;(15)アルギン酸;(16)パイロジェンフリー水;(17)等張塩類溶液;(18)リンガー液;(19)エチルアルコール;(20)リン酸緩衝溶液;および(21)医薬配合物に用いられる他の無毒性の適合性物質が挙げられる。
【0133】
用語「医薬上許容し得る塩」とは、PYY治療剤の比較的無毒性の無機および有機酸付加塩を表す。これらの塩は、PYY治療剤の最終的な単離および精製時にその場で調製するか、または別個に、遊離塩基形態の精製PYY治療剤を適当な有機または無機酸と反応させ、そのようにして生成した塩を単離して調製することができる。代表的な塩としては、ヒドロブロミド、ヒドロクロリド、スルフェート、ビスルフェート、ホスフェート、ニトレート、アセテート、バレレート、オレエート、パルミテート、ステアレート、ラウレート、ベンゾエート、ラクテート、ホスフェート、トシラート、シトレート、マレエート、フマレート、スクシネート、タルトレート、ナフチレート、メシレート、グルコへプトネート、ラクトビオネート、およびラウリルスルホネートの塩などがある〔例えば、Bergeら(1977)J.Pharm.Sci.66:1−19参照〕。
【0134】
他の場合、本発明の方法に有用なPYYは、1種以上の酸性官能基を含んでいることがあり、それゆえ、医薬上許容し得る塩基と医薬上許容し得る塩を形成し得る。これらの場合において、用語「医薬上許容し得る塩」とは、PYY治療剤の比較的無毒性の無機および有機塩基付加塩を表す。これらの塩も同様に、PYY治療剤の最終的な単離および精製時にその場で製造するか、あるいは、別個に、遊離酸形態の精製PYY治療剤を、医薬上許容し得る金属カチオンの水酸化物塩、炭酸塩もしくは重炭酸塩などの適当な塩基、または医薬上許容し得る有機第一級、第二級もしくは第三級アミンと反応させて調節することができる。代表的なアルカリまたはアルカリ土類金属塩としては、リチウム、ナトリウム、カリウム、カルシウム、マグネシウムおよびアルミニウムの塩などがある。塩基付加塩の生成に有用な代表的有機アミンとしては、エチルアミン、ジエチルアミン、エチレンジアミン、エタノールアミン、ジエタノールアミン、ピペラジンなどがある(例えば、Bergeら,前掲参照)。
【0135】
組成物中には、例えば、ラウリル硫酸ナトリウムおよびステアリン酸マグネシウムなどの湿潤剤、乳化剤および滑潤剤と共に、着色剤、剥離剤、コーティング剤、甘味剤、矯味矯臭剤および芳香剤、保存剤および酸化防止剤も存在し得る。
【0136】
医薬上許容し得る酸化防止剤の例には、(1)アスコルビン酸、塩酸システイン、重硫酸ナトリウム、メタ重亜硫酸ナトリウム、亜硫酸ナトリウムなどの水溶性酸化防止剤;(2)パルミチン酸アスコルビル、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、レシチン、没食子酸プロピル、αトコフェロールなどの油溶性酸化防止剤;ならびに(3)クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸などの金属キレート剤が含まれる。
【0137】
本発明の方法に有用な配合物には、経口、経鼻、(頬側および舌下を含めた)局所、経腸、経膣、エアゾールおよび/または非経口投与に適したものが含まれる。配合物は、単位剤形で投与するのが便利であり、薬学業界で周知の任意の方法によって製造し得る。単位剤形を構成するために担体材料と組み合せ得る有効成分の量は、治療を受ける宿主や特定の投与モードに応じて異なる。単位剤形を構成するために担体材料と組み合わせ得る有効成分の量は、一般に、治療効果を生じる化合物量であろう。通常、有効成分の量は、100%中、約1〜約99%、好ましくは約5〜約70%、最も好ましくは約10〜約30%の範囲であろう。
【0138】
これらの配合物または組成物の製造法は、PYY治療剤を、担体および場合によって1種以上の補助成分と混合するステップを含む。一般に、配合物は、PYY治療剤と液体担体もしくは微細固体担体または両方とを均一かつ均質に混合し、必要ならその後で生成物を成形して製造する。
【0139】
経口投与に適した配合物は、カプセル剤、カシェット剤、丸剤、錠剤、(矯味基剤、通常、スクロースおよびアカシアもしくはトラガカントを用いた)トローチ剤、散剤、顆粒剤の形態で、または水性もしくは非水性液体中の液剤もしくは懸濁剤、または水中油滴型もしくは油中水滴型エマルションとして、またはエリキシル剤もしくはシロップ剤、または(ゼラチンおよびグリセリン、もしくはスクロースおよびアカシアなどの不活性基剤を用いた)パステル剤、ならびに/またはマウスウォッシュなどであってよく、それぞれ有効成分として所与の量のPYY治療剤を含む。化合物は、濃縮塊、舐剤またはパスタ剤として投与してもよい。
【0140】
経口投与用の固体剤形(例えば、カプセル剤、錠剤、丸剤、糖剤、散剤、顆粒剤など)の場合、有効成分は、1種以上の医薬上許容し得る担体、例えば、クエン酸ナトリウムまたはリン酸二カルシウムならびに/または以下のいずれかと混合する:(1)デンプン、ラクトース、スクロース、グルコース、マンニトール、および/もしくはケイ酸などの充填剤もしくは増量剤;(2)例えば、カルボキシメチルセルロース、アルギネート、ゼラチン、ポリビニルピロリドン、スクロースおよび/もしくはアカシアなどのバインダー;(3)グリセロールなどの湿潤剤;(4)寒天、炭酸カルシウム、ジャガイモもしくはタピオカデンプン、アルギン酸、ある種のケイ酸塩および炭酸ナトリウムなどの崩壊剤;(5)パラフィンなどの溶解遅延剤;(6)第四級アンモニウム化合物などの吸収促進剤;(7)例えば、アセチルアルコールおよびグリセロールモノステアレートなどの湿潤剤;(8)カオリンおよびベントナイト粘土などの吸収剤;(9)タルク、ステアリン酸カルシウム、ステアリン酸マグネシウム、固体ポリエチレングリコール、ラウリル硫酸ナトリウム、およびそれらの混合物などの潤滑剤;ならびに(10)着色剤。カプセル剤、錠剤および丸剤の場合には、医薬組成物はさらに緩衝剤を含み得る。同様なタイプの固体組成物は、ラクトースまたは乳糖および高分子量ポリエチレングリコールなどの賦形剤を用いた軟質または硬質ゼラチンカプセル中の充填剤として用いてもよい。
【0141】
錠剤は、場合によって1種以上の補助成分と共に圧縮または成形して製造し得る。圧縮錠剤は、バインダー(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロース)、潤滑剤、不活性希釈剤、保存剤、崩壊剤(例えば、ナトリウムスターチグリコレートまたは架橋ナトリウムカルボキシメチルセルロース)、界面活性剤または分散剤を用いて製造し得る。成形錠剤は、不活性液体希釈剤で湿らせた粉末ペプチドまたはペプチドミメティック混合物を適当な機械で成形して製造し得る。
【0142】
錠剤や、糖剤、カプセル剤、丸剤および顆粒剤などの固体剤形は、場合によって刻み目をつけたり、腸溶コーティングおよび医薬配合技術において周知の他のコーティングやシェルを用いて製造し得る。錠剤や他の固体剤形は、例えば、所望の放出外形、他のポリマーマトリックス、リポソームおよび/またはマイクロスフェアを提供するために種々の比率のヒドロキシメチルセルロースを用いて、有効成分を遅延または制御放出するように配合し得る。錠剤や他の固体剤形は、例えば、細菌捕集フィルターを介して濾過するか、または、使用直前に滅菌水または他の注射可能な滅菌媒体中に溶解し得る滅菌固体組成物形態の滅菌剤を組み込むことによって滅菌し得る。これらの組成物は、場合によってさらに乳白剤を含んでいてよく、有効成分を、胃腸管の特定の部分だけにまたはその部分に選択的に、場合によって持続的に、放出する構成を有し得る。使用し得る包埋組成物の例には高分子物質やろうが含まれる。有効成分は、適切な場合には、1種以上の上記賦形剤を用いたマイクロカプセル化形態であってもよい。
【0143】
経口投与用の液体剤形としては、医薬上許容し得るエマルション、マイクロエマルション、液剤、懸濁剤、シロップ剤およびエリキシル剤がある。液体剤形は、有効成分に加えて、例えば、水または他の溶液などの当業で一般的に用いられている不活性希釈剤、可溶化剤、およびエチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3−ブチレングリコール、油(特に、棉実油、落花生油、コーン油、胚芽油、オリーブ油、ひまし油およびごま油)、グリセロール、テトラヒドロフリルアルコール、ポリエチレングリコールおよびソルビタン脂肪酸エステルなどの乳化剤、ならびにそれらの混合物を包含し得る。
【0144】
経口組成物は、不活性希釈剤の他に、湿潤剤、乳化剤、沈殿防止剤、甘味剤、矯味矯臭剤、着色剤、芳香剤および保存剤などのアジュバントを含んでいてよい。
【0145】
懸濁剤は、活性PYY治療剤または細胞組成物に加えて、例えば、エトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微晶質セルロース、アルミニウムメタヒドロキシド、ベントナイト、寒天およびトラガカント、ならびにそれらの混合物などの沈殿防止剤を含み得る。
【0146】
経腸および経膣投与用配合物は座剤として提供してもよく、座剤は、1種以上のPYY治療剤と、室温下には固体であるが体温下には液体であり、したがって直腸腔または膣腔内で融解して有効物質を放出する、例えば、カカオバター、ポリエチレングリコール、座剤ろうまたはサリチレートを含む1種以上の適当な無刺激性賦形剤または担体とを混合して調製することができる。
【0147】
膣内投与に適した配合物には、当業において適切であると知られているような担体を含むペッサリー、タンポン、クリーム、ゲル、パスタ、フォームまたはスプレー配合物も含まれる。
【0148】
PYY治療剤の局所または経皮投与用剤形としては、散剤、噴霧剤、軟膏、パスタ剤、クリーム剤、ローション剤、ゲル剤、液剤、パッチおよび吸入剤が挙げられる。有効成分は、滅菌条件下に、医薬上許容し得る担体や、必要な場合には任意の保存剤、緩衝剤または推進剤と混合し得る。
【0149】
軟膏、パスタ剤、クリーム剤およびゲル剤は、PYY治療剤に加えて、動物および植物油脂、油、ろう、パラフィン、デンプン、トラガカント、セルロース誘導体、ポリエチレングリコール、シリコーン、ベントナイト、ケイ酸、タルクおよび酸化亜鉛、またはそれらの混合物などの賦形剤を含み得る。
【0150】
散剤および噴霧剤は、PYY治療剤に加えて、ラクトース、タルク、ケイ酸、水酸化アルミニウム、ケイ酸カルシウムおよびポリアミド粉末、またはこれらの物質の混合物などの賦形剤を含み得る。噴霧剤はさらに、クロロフルオロ炭化水素や揮発性非置換炭化水素などの慣用推進剤、例えばブタンおよびプロパンなどを含み得る。
【0151】
あるいは、PYY治療剤はエアゾール剤として投与してもよい。これは、この化合物を含有する水性エアゾール、リポソーム製剤または固体粒子を製造することにより達成される。非水性(例えば、フルオロカーボン推進剤)懸濁液を使ってもよい。超音波式ネブライザー(sonic nebulizer)は、化合物を分解し得る物質のせん断への暴露を最小限にするので好ましい。
【0152】
通常、水性エアゾール剤は、物質の水溶液または懸濁液を慣用の医薬上許容し得る担体および安定剤と配合して製造する。担体および安定剤は、特定の化合物の要件に応じて異なるが、典型的には、非イオン界面活性剤(トゥイーン、プルロニックまたはポリエチレングリコール)や、血清アルブミン、ソルビタンエステル、オレイン酸、レシチンなどの無害タンパク質、グリシンなどのアミノ酸、緩衝液、塩、糖質または糖アルコールを包含する。一般に、エアゾール剤は等張溶液から製造される。
【0153】
経皮パッチは、身体にPYY治療剤を制御放出するという付加利点を有している。そのような剤形は、物質を適当な媒体に溶解または分散させて製造し得る。さらに吸収促進剤を用いて、皮膚を介したペプチドミメティックのフラックスを増強することもできる。そのようなフラックスの速度は、速度制御膜を用いるか、またはポリマーマトリックスもしくはゲル中にペプチドミメティックを分散させて制御し得る。
【0154】
眼科配合物、眼軟膏、散剤、液剤なども本発明の範囲内に含まれると考えられる。
非経口投与に適した本発明の医薬組成物は、PYY治療剤と組み合わせて、1種以上の医薬上許容し得る無菌等張水性もしくは非水性溶液、分散液、懸濁液またはエマルション、あるいは、使用直前に無菌注射可能な溶液もしくは分散液中に再構成し得、酸化防止剤、緩衝剤、静菌剤、配合物を目的受容者の血液と等張にする溶質または沈殿防止もしくは濃厚剤を含み得る無菌散剤を含んでなる。
【0155】
本発明の医薬組成物に用い得る適当な水性および非水性担体の例としては、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコールなど)およびそれらの適当な混合物、オリーブ油などの植物油、オレイン酸エチルなどの注射可能な有機エステルが挙げられる。適切な流動性は、例えば、レシチンなどのコーティング材料を用い、分散剤の場合には要求粒度を維持し、かつ界面活性剤を用いることにより維持し得る。
【0156】
これらの組成物はさらに、保存剤、湿潤剤、乳化剤および分散剤などのアジュバントを含み得る。種々の抗菌剤および抗真菌剤、例えば、パラベン、クロロブタノール、フェノールソルビン酸などを含有させて、微生物の作用を確実に防止し得る。また、組成物中に、糖、塩化ナトリウムなどの等張剤を入れるのも望ましい。さらに、ナトリウムモノステアレートやゼラチンなどの吸収を遅らせる物質を含有させて、注射可能な形態の医薬品の吸収を持続させてもよい。
【0157】
場合によって、薬剤の効果を持続させるために、皮下または筋肉内注射からの薬剤の吸収を遅らせるのが望ましい。これは、水溶解度の低い結晶質または非晶質材料の液体懸濁液を用いることによって達成し得る。その場合、薬剤の吸収速度は、その溶解速度に依存し、溶解速度は、結晶サイズおよび結晶形態に依存し得る。あるいは、非経口投与剤形の遅延吸収は、薬剤を油性ビヒクルに溶解または懸濁させることにより達成される。
【0158】
注射可能なデポー剤形は、PYY治療剤のマイクロカプセルマトリックスを形成するか、またはポリラクチド−ポリグリコリドなどの生物分解性ポリマー中で製造する。薬剤とポリマーとの比率や、用いられる特定のポリマーの性質に応じて、薬剤の放出速度を制御し得る。他の生物分解性ポリマーの例としては、ポリ(オルトエステル)およびポリ(無水物)がある。また、注射可能なデポー製剤は、薬剤を、体組織に適合し得るリポソームまたはマイクロエマルション中に捕捉して製造する。
【0159】
PYY治療剤または細胞組成物は、医薬品としてヒトおよび動物に投与するとき、それ自体を投与することもできるし、例えば、0.1〜99.5%(より好ましくは、0.5〜90%)の有効成分と組み合わせて医薬上許容し得る担体を含む医薬組成物として投与することもできる。
【0160】
作用物質製剤は、経口、非経口、局所または経直腸投与し得る。作用物質製剤がそれぞれの投与経路に適した形態で投与されるのは勿論である。例えば、作用物質製剤は、錠剤またはカプセル形態で、注射剤、吸入剤、眼ローション、軟膏、座剤などの注射、侵出、吸入により、ローションまたは軟膏により局所的に、また座剤により経直腸投与される。経口投与が好ましい。
【0161】
本明細書に用いられている限りにおいて、用語「非経口投与」および「非経口投与された」とは、腸内および局所投与以外の、通常、注射による投与モードを意味し、血管内、筋肉内、動脈内、鞘内、包内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、くも膜下、髄腔内および胸骨内注射ならびに注入を包含するが、それらには限定されない。
【0162】
本明細書に用いられている限りにおいて、用語「全身投与」「全身投与された」、「末梢投与」および「末梢投与された」とは、PYY治療剤、薬剤または他の材料が患者の中枢神経系に入り、その結果、代謝および他の同様なプロセスを受けるように、物質を中枢神経系に直接投与するのではなく、例えば、皮下投与することを意味する。
【0163】
PYY治療剤は、療法のために、口内、例えば噴霧によるような鼻腔内、直腸内、膣内、非経口、槽内、ならびに散剤、軟膏またはドロップ剤によるような頬側および舌下を含めた局所投与を含めた任意の適当な投与経路により、ヒトおよび他の動物に投与し得る。
【0164】
選択される投与経路に関係なく、適当な水和形態で用い得るPYY治療剤および/または本発明の医薬組成物は、当業者には公知の慣用法により医薬上許容し得る剤形に配合される。
【0165】
本発明の医薬組成物中の有効成分の実際の用量レベルは、特定の患者、組成物および投与モードに対する所望の治療応答を達成するのに有効であると共に患者に対して毒性ではない有効成分の量が得られるように変えてよい。
【0166】
(vi) 併用投与
本発明の別の態様は、1種以上の他の治療剤をPYY治療剤または細胞組成物と共に投与する併用療法を提供する。そのような併用療法は、個々の治療成分を同時、順次または別個に投与することにより達成し得る。
【0167】
1つの実施態様において、PYY治療剤または細胞組成物は、単独で、あるいは、PYYの生物活性、PYYの生物学的作用を高めるか、または発生する可能性がある副作用を軽減する他の物質と組み合わせて投与し得る。例えば、WO9511689は、ジペプチジルペプチダーゼ IV(DPIV)酵素阻害剤などのジペプチジルペプチダーゼ阻害剤の使用を記載しており、ジペプチジルペプチダーゼ阻害剤は、PYYのタンパク分解を阻止し、それによってPYYの血漿半減期を延ばすことができる。したがって、好ましい実施態様において、PYY治療剤は、ジペプチジルペプチダーゼ阻害剤と一緒に投与し得る。
【0168】
別の例証的実施態様において、PYY治療剤または細胞組成物は、M1受容体アンタゴニストと一緒に投与し得る。コリン物質は、ムスカリン受容体を介して作用する強力なインスリン放出モデュレーターである。さらに、そのような物質の使用は、HDLレベルを増大させると同時にコレステロールレベルを低下させるという付加利点を有し得る。適当なムスカリン受容体アンタゴニストとしては、直接または間接的にムスカリン性アセチルコリン受容体の活性化をブロックする物質が挙げられる。そのような物質は、M1受容体に対して選択的である(またはそのような選択性を促進する量で用いる)のが好ましい。非限定的例としては、第四級アミン(例えば、メタンテリン、イプラトロピウム、およびプロパンテリン)、第三級アミン(例えば、ジシクロミン、スコポラミン)および三環系アミン(例えば、テレンゼピン)がある。ピレンゼピンおよびメチルスコポラミンが好ましい。他の適当なムスカリン受容体アンタゴニストとしては、ベンズトロピン〔メルク社(Merck)からCOGENTINとして市販されている〕、ヘキサヒドロ−シラ−ジフェニドールヒドロクロリド〔Lambrechtら(1989)Trends in Pharmacol.Sci.10(Suppl.):60に開示されているHHSIDヒドロクロリド〕、(+/−)−3−キヌクリジニルキサンテン−9−カルボキシレートヘミオキサレート〔QNX−ヘミオキサレート;Birdsallら(1983)Trends in Pharmacol.Sci.4:459〕、テレンゼピンジヒドロクロリド〔Coruzziら(1989)Arch.Int.Pharmacodyn.Ther.302:232;およびKawashimaら(1990)Gen.Pharmacol.21:17〕ならびにアトロピンがある。そのようなムスカリン受容体アンタゴニストの用量は、一般に、先に略記されているように最適化される。脂質代謝障害の場合、投与タイミングが脂質代謝応答性窓を参照して決められているかどうかとは関係なく、用量の最適化が必要であり得る。
【0169】
インスリンおよび脂質代謝の調節ならびに上述の障害に関して、PYY治療剤または細胞組成物も、d2ド−パミンアゴニスト(例えば、ブロモクリプチン)などのプロラクチン阻害剤と相乗作用し得る。したがって、本発明の方法は、プロラクチン抑制エルゴアルカロイドおよびプロラクチン抑制ドーパミンアゴニストなどのプロラクチン阻害剤の併用投与を含み得る。適当な化合物の例としては、2−ブロモ−α−エルゴクリプチン、6−メチル−8−β−カルボベンジルオキシアミノエチル−10−α−エルゴリン、8−アシルアミノエルゴリン、6−メチル−8−α−(N−アシル)アミノ−9−エルゴリン、6−メチル−8−α−(N−フェニルアセチル)アミノ−9−エルゴリン、エルゴコルニン、9,10−ジヒドロエルゴコルニン、D−2−ハロ−6−アルキル−8−置換エルゴリン、D−2−ブロモ−6−メチル−8−シアノメチルエルゴリン、カルビドーパ、ベンセラジドおよび他のドーパデカルボキシラーゼインヒビター、L−ド−パ、ドーパミンならびにそれらの無毒性塩が挙げられる。
【0170】
Ach、コレシストキニン(CCK)またはボンベシンなどのアゴニストは、ヘテロ三量体Gタンパク質Gqを介してホスホリパーゼC(PLC)に結合している細胞表面受容体に結合する。受容体に結合すると、PLCが活性化され、その結果、PIP3の加水分解によりIP3およびDAGが生成する。IP3により小胞体から放出されたCa2+は、PKCのαおよびβイソ型の活性化に重要であり、DAGはPKCのα、β、δおよびεイソ型を活性化し得る。
【0171】
本発明にしたがって用いられるPYY治療剤または細胞組成物は、グリベンクラミド、グリピシド、グリクラジドおよびAG−EE623ZWなどのβ細胞のAPT依存カリウムチャンネルに作用する物質と併用してもよい。PYYまたはそのアナログもしくはミメティックを、メトホルミンおよび関連化合物または例えばアカルボースのようなグルコシダーゼ阻害剤などの他の経口物質と組み合わせて投与するのも有利である。
【0172】
(vii) PYY遺伝子型の検出
本発明の別の態様は、糖尿病または他のグルコース代謝障害を発症する患者のリスクにアクセスし、かつ既にそのような障害があると診断を受けた患者の病理学を決定する診断アッセイに関する。好ましい実施態様において、II型糖尿病を発症する恐れのある患者を同定するために、PYYの調節をモニターする。
【0173】
特に、このアッセイは、患者の血清または他の体液中のPYYレベルの低下を評価し得る。そのような低下は、とりわけ、PYYの発現もしくは分泌レベルの低下、またはタンパク質の血清半減期短縮の結果であり得る。他の実施態様において、このアッセイは、例えば、活性の低下、例えば、受容体結合の低下もしくは喪失またはアゴニスト活性の低下をもたらし得る、エピトープの生物活性または出現もしくは消失に基づいて、突然変異PYYタンパク質を検出する。さらに他の実施態様において、このアッセイは、PYY遺伝子レベルの異常性、例えば、塩基対の変化、コード配列または転写調節配列に対する付加または欠失などの点突然変異を検出する。
【0174】
したがって、本発明の方法は、患者がグルコース反応(sensing)の低下を特徴とする疾患に罹患する恐れがあるかどうかを決定する方法を提供する。好ましい実施態様において、本発明の方法は、一般に、患者由来の細胞試料中で、(i)PYYタンパク質をコードする遺伝子の完全性に影響を与える変化、(ii)PYY遺伝子の誤発現、または(iii)PYY遺伝子産物の異常修飾のうち少なくとも1つを特徴とする遺伝子障害の有無の検出を含むとみなすことができる。例を示すと、そのような遺伝子障害は、(i)PYY遺伝子からの1つ以上のヌクレオチドの欠失、(ii)PYY遺伝子への1つ以上のヌクレオチドの付加、(iii)PYY遺伝子の1つ以上のヌクレオチドの置換、(iv)PYY遺伝子の総体的な染色体転移、(v)PYY遺伝子のメッセンジャーRNA転写レベルにおける総体的な変化、(vi)ゲノムDNAのメチル化パターンなどのPYY遺伝子の異常修飾、(vii)PYY遺伝子のメッセンジャーRNA転写物の非野生型スプライシングパターンの存在、(viii)PYYタンパク質の非野生型レベル、(ix)PYY遺伝子の対立遺伝子の欠損、および(x)PYYタンパク質の不適切な翻訳後修飾のうち少なくとも1つの存在を確認することにより検出し得る。以下に説明するように、本発明は、PYY遺伝子の障害を検出するための多数のアッセイ法を提供し、かつ重要なことには、PYY依存性の異常な細胞成長、増殖および/または分化を引き起こす異なる分子原因を識別する能力を提供する。1つの好ましい実施態様において、このアッセイを用いて、成熟PYYタンパク質の分泌部位を排除する分泌シグナル配列に対する点突然変異を検出する。例えば、このアッセイは、Thr(−17)→AsnまたはThr(−16)→Proを生起する塩基対の変化を検出し得る。
【0175】
細胞および組織試料のPYY表現型を同定するために、例えば、患者由来の細胞試料中のPYYコード核酸レベルの測定、PYYのmRNAレベルの検出、またはゲノムPYY遺伝子が突然変異もしくは欠失しているかどうかの確認などによりPYYを誤発現する細胞または組織を同定するための診断試験キットの一部として核酸プローブを用いることができる。
【0176】
例を示すと、当該PYY遺伝子から、PYYコード転写物の存在(または不在)に関する無傷の組織または組織試料の組織学的スクリーニングを容易にするヌクレオチドプローブを作ることができる。以下のような抗PYY抗体を診断に使用する場合と同様に、PYYメッセージまたはゲノムPYY配列に向けられるプローブの使用は、例えば、組織の腫瘍もしくは過形成障害(例えば、望ましくない細胞異常増殖)または異常分化で明らかにされ得る対立遺伝子の突然変異の予測的評価にも治療的評価にも利用することができる。以下に説明するようなイムノアッセイと併用すると、オリゴヌクレオチドプローブは、PYYタンパク質の発現(または欠失)に関連するある種の異常性が関与し得る発育異常症の分子ベースの決定をしやすくする。例えば、ポリペプチド合成、翻訳後修飾、または半減期における変化は、コード配列における突然変異から分化し得る。
【0177】
例証的実施態様において、(精製)オリゴヌクレオチドプローブを含む核酸組成物が提供され、このプローブは、配列番号1によって表されるようなPYY遺伝子もしくはその天然突然変異体のセンスまたはアンチセンス配列、または当該PYY遺伝子もしくはその天然突然変異体が天然に持ち合わせている5′もしくは3′フランキング配列もしくはイントロン配列にハイブリダイズし得るヌクレオチド配列領域を含んでいる。細胞の核酸をハイブリダイゼーションに利用されやすい状態にし、プローブを試料核酸に暴露し、プローブと試料核酸とのハイブリダイゼーションを検出する。そのような方法は、欠失、置換などを含めたゲノムまたはmRNAレベルでの障害の検出にもmRNA転写レベルの定量にも使用し得る。
【0178】
いくつかの実施態様において、障害の検出は、アンカーPCRもしくはRACE PCRなどのポリメラーゼ連鎖反応(PCR)(例えば、米国特許第4,683,195号および同第4,683,202号参照)、または、連結連鎖反応(LCR)〔例えば、Landegranら(1988)Science 241:1077−1080;およびNakazawaら(1944)PNAS 91:360−364参照〕においてプローブ/プライマーを利用することを含み、連結連鎖反応は、PYY遺伝子における点突然変異の検出に特に有用であり得る。単に例証的な実施態様において、本発明の方法は、(i)患者から細胞試料を採取するステップと、(ii)試料の細胞から核酸(例えば、ゲノム、mRNAまたは両方)を単離するステップと、(iii)PYY遺伝子(存在する場合)のハイブリダイゼーションおよび増幅が生じるような条件下に、核酸試料を、PYY遺伝子に特異的にハイブリダイズする1つ以上のプライマーと接触させるステップと、(iv)増幅産物の有無を検出するか、または増幅産物のサイズを検出して、対照試料と長さを比較するステップとを含む。
【0179】
当該アッセイの好ましい実施態様において、試料細胞由来のPYY遺伝子の突然変異は、制限酵素切断パターンにおける変化によって確認される。例えば、試料および対照のDNAを単離し、(場合によって)増幅し、1種以上の制限エンドヌクレアーゼで消化し、ゲル電気泳動にかけて断片長の大きさを測定する。さらに、配列特異的リボザイム(例えば、米国特許第5,498,531号参照)を用いて、リボザイム切断部位の発生または喪失による特定の突然変異の存在を採点することができる。
【0180】
さらに別の実施態様において、当業において公知の多様な配列決定反応のいずれかを用いて、PYY遺伝子を直接配列決定し、試料PYYの配列を対応野生型(対照)配列と比較して突然変異を検出することができる。配列決定反応の例としては、MaximおよびGilbert〔Proc.Natl.Acad.Sci.USA(1977)74:560〕またはSanger〔Sangerら(1977)Proc.Nat.Acad.Sci.74:5463〕によって開発された方法に基づくものが含まれる。当該アッセイ〔Biotechniques(1995)19:448〕を実施する際には、質量分析〔例えば、PCT公開WO94/16101;Cohenら(1996)Adv.Chromatogr.36:127−162;およびGriffinら(1993)Appl.Biolchem.Biotehnol.38:147−159〕による配列決定を含めた多様な自動配列決定法のいずれを利用してもよいと考えられる。いくつかの実施態様の場合には、配列決定反応で、わずか1個、2個または3個の核酸塩基の存在しか決定する必要がないことは当業者には明らかであろう。例としては、例えば単一の核酸が検出されるAトラクトなどを実施し得る。
【0181】
さらなる実施態様において、RNA/RNAまたはRNA/DNAへテロ二本鎖のミスマッチ塩基を検出するために、(ヌクレアーゼ、ヒドロキシルアミンまたは四酸化オスミウムなどにピペリジンを加えた)切断剤からの保護を用いることができる〔Myersら(1985)Science 230:1242〕。一般に、「ミスマッチ切断」法は、野生型PYY配列を含む(標識)RNAまたはDNAを、組織試料から得た潜在的突然変異RNAまたはDNAとハイブリダイズさせて形成したヘテロ二本鎖を得ることから出発する。二本鎖重複部位を、対照鎖と試料鎖の間の塩基対ミスマッチにより存在するようなヘテロ二本鎖の一本鎖領域を切断する物質で処理する。例えば、RNA/DNA重複部位をRNアーゼで処理し、DNA/DNAハイブリッドをS1ヌクレアーゼで処理して、ミスマッチ領域を酵素消化し得る。他の実施態様において、ミスマッチ領域を消化するために、DNA/DNAまたはRNA/DNA重複部位を、ヒドロキシルアミンまたは四酸化オスミウムとピペリジンで処理し得る。ミスマッチ領域を消化した後、得られた材料を変性ポリアクリルアミドゲル上でサイズ分離して、突然変異部位を決定する。例えば、Cottonら(1988)Proc.Natl.Acad.Sci.USA 85:4397;Saleebaら(1992)Methods Enzymod.217:286−295を参照されたい。好ましい実施態様において、検出のために、対照DNAまたはRNAを標識し得る。
【0182】
さらに別の実施態様において、ミスマッチ切断反応は、細胞試料から得たPYY cDNA中で点突然変異を検出してマッピングするために限定された系の二本鎖DNA中のミスマッチ塩基対を認識する1つ以上のタンパク質(いわゆる「DNAミスマッチ修復」酵素)を用いる。例えば、E.coliのmutY酵素はG/A三須マッチでAを切断し、HeLa細胞由来のチミジンDNAグリコシラーゼはG/TミスマッチでTを切断する〔Hsuら(1994)Carcinogenesis 15:1657−1662〕。例示的実施態様によれば、PYY配列、例えば野生型PYY配列をベースとするプローブは、試験細胞由来のcDNAまたは他のDNA産物とハイブリダイズする。二本鎖をDNAミスマッチ修復酵素で処理し、切断産物(もしあれば)を電気泳動プロトコルなどから検出することができる。例えば、米国特許第5,459,039号を参照されたい。
【0183】
他の実施態様において、PYY遺伝子の突然変異を同定するために、電気泳動移動度の変化を利用する。例えば、突然変異核酸と野生型核酸との電気泳動移動度の違いを検出するためには、一本鎖コンホメーション多型性〔single strand conformation polymorphism(SSCP)〕を用い得る〔Oritaら(1989)Proc.Natl.Acad.Sci.USA 86:2766,さらにCotton(1993)Mutat.Res.285:125−144;およびHayashi(1992)Genet.Anal.Tech.Appl.9:73−79参照〕。試料および対照PYY核酸の一本鎖DNA断片を変性させ、再結合させる。一本鎖核酸の二次構造は配列に応じて異なり、得られた電気泳動移動度の変化により、単一塩基の変化でも検出することができる。DNA断片を標識してもよいし、標識プローブを用いて検出してもよい。このアッセイの感度は、(DNAでなく)二次構造が配列中の変化に対してより感受性が高いRNAを用いることによって高められる。好ましい実施態様において、本方法は、電気泳動移動度における変化をベースとしてヘテロ二本鎖重複部位分子を分離するためにヘテロ二本鎖分析を利用する〔Keenら(1991)Trends Genet.7:5〕。
【0184】
さらに別の実施態様において、変性剤濃度勾配ゲル電気泳動〔denaturing gradient gel electrophoresis(DGGE)〕を用いて、濃度勾配変性剤を含むポリアクリルアミドゲル中の突然変異体または野生型断片の移動を検定する〔Myersら(1985)Nature 313:495〕。分析法としてDGGEを用いる場合、DNAは、例えば、PCRにより約40bpのGCに富む高融解性DNAのGCクランプを添加して、完全には変性させないように修飾する。さらなる実施態様において、対照および試料DNAの移動度の差を検出するために、変性剤濃度勾配の代わりに温度勾配を用いる〔RosenbaumおよびReissner(1987)Bioophys.Chem.265:12753〕。
【0185】
点突然変異を検出するための他の方法の例としては、選択的オリゴヌクレオチドハイブリダイゼーション法、選択的増幅法、または選択的プライマー伸張法があるが、それらには限定されない。例えば、オリゴヌクレオチドプライマーは、既知突然変異を中央に配置し、次いで、完全なマッチを見つけた場合にのみハイブリダイゼーションを可能にする条件下に標的DNAとハイブリダイズするように調製し得る〔Saikiら(1986)Nature 324:163;Saikiら(1989)Proc.Natl.Acad.Sci.USA 86:6230〕。そのような対立遺伝子特異的オリゴヌクレオチドハイブリダイゼーション法を使って、オリゴヌクレオチドがPCR増幅された標的DNAとハイブリダイズしているときには1回の反応で1つの突然変異を試験し、またオリゴヌクレオチドがハイブリダイズ膜に結合して、標識された標的DNAとハイブリダイズしているときには多くの異なる突然変異を試験し得る。
【0186】
あるいは、選択的PCR増幅に依存する対立遺伝子特異的増幅法を本発明と併用してもよい。特異的増幅のためのプライマーとして用いられるオリゴヌクレオチドは、(増幅がディファレンシャルハイブリダイゼーションに依存するように)分子の中心に目的の突然変異を有している〔Gibbsら(1989)Nucleic Acids Res.17:2437−2448〕か、または、適切な条件下に、ミスマッチがポリメラーゼの伸張を阻止もしくは低減させ得る1つのプライマーの3′末端に目的の突然変異を有し得る〔Prossner(1993)Tibtech.11:238〕。さらに、切断に基づいて検出できるように、突然変異領域に1つの新規な制限部位を導入することが望ましいであろう〔Gaspariniら(1992)Mol.Cell Probes 6:1〕。いくつかの実施態様において、増幅は、増幅用のTaqリガーゼを用いても実施し得ると予想される〔Barany(1991)Proc.Natl.Acad.Sci.USA 88:189〕。そのような場合、増幅の有無を捜すことによって特定部位における既知突然変異の存在を検出し得る5′配列の3′末端に完全マッチが存在する場合にのみ連結が生じるであろう。
【0187】
さらに別の代表的実施態様において、PYY遺伝子の異常メチル化パターンは、患者試料由来のゲノムDNAを、メチル化に感受性であり、かつその認識部位が(フランキングおよびイントロン配列中を含めた)PYY遺伝子中に存在する1種以上の制限エンドヌクレアーゼで消化することにより検出することができる。例えば、Buitingら(1994)Human Mol.Genet.3:893−895を参照されたい。消化されたDNAをゲル電気泳動で分離し、例えば、ゲノムまたはcDNA配列由来のプローブとハイブリダイズさせる。PYY遺伝子のメチル化状態は、試料DNAから生成した制限パターンと既知メチル化の標準の制限パターンとを比較して決定し得る。
【0188】
さらに別の実施態様において、PYYタンパク質のレベルはイムノアッセイによって検出し得る。例えば、血清試料を得て、その試料中に存在するPYYタンパク質のレベルを標準イムノアッセイ法により定量することができる。
【0189】
さらに他の実施態様において、当該アッセイは、異常なリン酸化、プレニル化、脂質修飾、ユビキチン化、および/または分解などのPYYタンパク質の異常翻訳後修飾を検出するように設計し得る。このアッセイは、PYYの組織局在の評価にも用い得る。
【0190】
本発明の診断および予後法により、PYYの機能喪失を起こす野生型PYY遺伝子座が検出される。さらに、本発明の方法は、野生型PYY遺伝子座を検出し、そのPYY遺伝子座に糖尿病素質が無いことを確認して実施し得る。「野生型遺伝子の変化」とは、コード領域および非コード領域における欠失、挿入および点突然変異を含めたすべての形態の突然変異を包含する。欠失は、全遺伝子または遺伝子の一部だけのものであり得る。点突然変異は、終止コドン、フレームシフト変異またはアミノ酸置換に帰し得る。体細胞突然変異は、特定の組織でのみ発生し、生殖細胞系列では伝達されないものである。したがって、PYY突然変異の発見は、診断情報と予後情報とを提供し得る。欠失していない(例えば、PYY欠失を有する染色体の姉妹染色体上に検出される)PYY対立遺伝子を、挿入、小欠失および点突然変異などの他の突然変異についてスクリーニングし得る。点突然変異事象は、遺伝子のプロモーターなどの調節領域に発生し、mRNA発現の喪失または低下をもたらし得る。点突然変異はまた、適切なRNAプロセシングを無効にして、PYY遺伝子産物の発現を失わせるか、またはmRNAの安定性もしくは翻訳効率を低下させる。
【0191】
上述のように、有用な診断法には、蛍光in situハイブリダイゼーション〔fluorescent in situ hybridization(FISH)〕、直接DNA配列決定〔direct DNA sequencing〕、PFGE分析、サザンブロット分析、一本鎖コンホメーション分析〔single strand conformation analysis(SSCA)〕、RNアーゼ保護アッセイ(RNaze protection assay)、対立遺伝子特異的オリゴヌクレオチド〔allele−specific oligonucleotide(ASO)〕、ドットブロット分析LCR、およびPCR−SSCPが含まれるが、それらには限定されない。
【0192】
上記のものに続いて、DNA配列変化の検出に用い得るいくつかの方法がある。直接DNA配列決定は、手動配列決定でも自動蛍光配列決定でも、配列の変化を検出し得る。PYYと同じような大きさの遺伝子の場合、手動配列決定は必ずしも労働集約的ではなく、最適条件下には、遺伝子のコード配列中の突然変異を見逃すことはめったにない。別の方法は、一本鎖コンホメーション多型性アッセイ(SSCA)である。この方法は、特に、DNA断片のサイズが200bpより大きい場合には全ての配列変化を検出することはできないが、ほとんどのDNA配列の変化を検出するように最適化することはできる。検出感度の低さは不利であるが、SSCAによる処理量の多さは魅力的であり、研究ベースで突然変異を検出するための実用的な代替直接配列決定法である。この方法では、DNA配列変化の正確な性質を決定するために、SSCAゲル上で変化した移動度を有する断片を配列決定する。2つの相補的DNA鎖間のミスマッチの検出に基づく他の方法としては、均一変性剤濃度勾配ゲル電気泳動〔clamped denaturing gel electrophoresis(CDGE)〕、ヘテロ二本鎖分析(HA)および化学的ミスマッチ切断(CMC)がある。上記方法はいずれも、大きな欠失、重複または挿入を検出しないし、タンパク質の転写または翻訳に影響を与える規定突然変異も検出しない。これらの突然変異群を検出し得るタンパク質切断アッセイ(protein truncation assay)または不斉アッセイ(asymmetric assay)などの他の方法は、特定のタイプの突然変異だけを検出し、ミスセンス突然変異は検出しない。1つの突然変異がわかったら、対立遺伝子特異的オリゴヌクレオチド(ASO)ハイブリダイゼーションなどの対立遺伝子特異的検出法を利用して、わかっている突然変異について多くの他の試料を速やかにスクリーニングすることができる。
【0193】
DNA配列における多型性を検出する高速予備分析は、1種以上の制限酵素、好ましくは大量の制限酵素で切断されたDNAを一連のサザンブロットで検査して実施し得る。各ブロットは、一連の正常個体と、一連のガン症例、腫瘍、またはその両方とを含む。(PYY遺伝子座の近くまたはPYY遺伝子座を含む配列で検査したときに対照DNAと長さが異なる)ハイブリッド形成断片を表示するサザンブロットは、突然変異の可能性を示す。極めて大きな制限断片を生成する制限酵素を用いる場合には、パルスフィールドゲル電気泳動(PPGE)を用いる。
【0194】
点突然変異の検出は、当業において周知の方法を用いたPYY対立遺伝子の分子クローニングおよび対立遺伝子の配列決定により達成し得る。あるいは、遺伝子配列は、公知方法を用いてゲノムDNA標本から直接増幅し得る。次いで、増幅した配列のDNA配列を決定し得る。
【0195】
感受性対立遺伝子の存在を確認するためのより複雑かつ間接的な試験用には多くの周知方法があり、それらには以下が含まれる:1)一本鎖コンホメーション分析(SSCA);2)変性剤濃度勾配ゲル電気泳動(DGGE);3)RNアーゼ保護アッセイ;4)対立遺伝子特異的オリゴヌクレオチド(ASOs);5)E.coli mutSタンパク質などのヌクレオチドミスマッチを認識するタンパク質の使用;および6)対立遺伝子特異的PCR。対立遺伝子特異的PCRの場合、3′末端で特定のPYY突然変異にハイブリダイズするプライマーを用いる。特定のPYY突然変異が存在しない場合には、増幅産物は観測されない。ヨーロッパ特許出願公開第0332435号に開示されているようなAmplification Refractory Mutation System(ARMS)を用いてもよい。遺伝子の挿入および欠失は、クローニング、配列決定および増幅によって検出することもできる。さらに、遺伝子または周囲のマーカー遺伝子の制限断片長多型性〔restriction fragment length polymorphism(RFLP)〕プローブを用いて、多型断片における対立遺伝子または挿入の変化を採点することができる。
【0196】
そのような方法は、罹患個体の血縁関係者をその個体に検出されたPYY突然変異の存在についてスクリーニングするために特に有用である。当業において公知の他の挿入および欠失検出法を用いてもよい。
【0197】
最初の3つの方法(SSCA、DGGEおよびRNアーゼ保護アッセイ)では、新規な電気泳動バンドが現れる。SSCAは、配列変化によって一本鎖の分子内塩基の対形成に差が生じるために示差的に移動するバンドを検出する。RNアーゼ保護は、突然変異ポリヌクレオチドを2つ以上の小さい断片に切断することを含む。DGGEは、変性剤濃度勾配ゲルを用いて、野生型配列と比較した突然変異配列の移動速度の差を検出する。対立遺伝子特異的オリゴヌクレオチドアッセイにおいては、特定の配列を検出するオリゴヌクレオチドを設計するが、このアッセイは、ハイブリッド形成シグナルの有無を検出することにより実施される。mutSアッセイにおいて、タンパク質は、突然変異配列と野生型配列との間にヘテロ二本鎖ヌクレオチドミスマッチを含む配列にのみ結合する。
【0198】
本発明によるミスマッチとは、2本の鎖が100%相補的ではないハイブリッド核酸重複部位である。全体相同性の欠如は、欠失、挿入、逆位または置換によるものであろう。遺伝子またはそのmRNA産物中の点突然変異を検出するためには、ミスマッチ検出を用いることができる。これらの方法は、配列決定より感度が低いが、大量の腫瘍試料に関して実施する場合には配列決定より簡単である。ミスマッチ切断法の1例はRNアーゼ保護法である。本発明を実施する際に、この方法は、ヒト野生型PYY遺伝子コード配列に相補的な標識リボプローブの使用を含む。このリボプローブを、腫瘍組織から単離したmRNAまたはDNAと一緒にアニーリング(ハイブリダイズ)し、その後、二本鎖RNA構造中のミスマッチを検出し得る酵素RNアーゼAで消化する。RNアーゼAは、ミスマッチを検出すると、そのミスマッチ部位で切断する。したがって、アニーリングされたRNA標本を電気泳動ゲルマトリックス上で分離すると、1つのミスマッチが検出され、RNアーゼAで切断されている場合には、リボプローブおよびmRNAまたはDNAの全長二本鎖RNAより小さいRNA産物が見つかるであろう。リボプローブは、PYYのmRNAまたは遺伝子の全長である必要はないが、どちらかのセグメントであり得る。リボプローブがPYYのmRNAまたは遺伝子のセグメントのみを含む場合、全mRNA配列をミスマッチについてスクリーニングするためには、これらのプローブを多数用いることが望ましい。
【0199】
同じようにして、酵素的または化学的切断によりミスマッチを検出するために、DNAプローブを用いることができる。あるいは、ミスマッチは、マッチ二本鎖と比べたミスマッチ二本鎖の電気泳動移動度の変化によって検出することができる。リボプローブまたはDNAプローブの場合、突然変異を含み得る細胞のmRNAまたはDNAをハイブリダイゼーション前にPCR(以下参照)を用いて増幅し得る。PYY遺伝子のDNAの変化は、特にその変化が欠失および挿入などの大きな転位である場合には、サザンハイブリダイゼーションを用いて検出することもできる。
【0200】
PCRを用いて増幅したPYY遺伝子のDNA配列は、対立遺伝子特異的プローブを用いてスクリーニングすることもできる。これらのプローブは複数の核酸オリゴマーであり、各オリゴマーは既知突然変異を有するPYY遺伝子配列領域を含んでいる。例えば、1つのオリゴマーは、PYY遺伝子配列の一部に対応する約30ヌクレオチド長のものであり得る。そのような1群の対立遺伝子特異的プローブを用いることにより、PCR増幅産物をスクリーニングして、PYY遺伝子中の既に同定された突然変異の存在を確認することができる。対立遺伝子特異的プローブと増幅PYY配列とのハイブリダイゼーションは、例えば、ナイロンフィルター上で実施し得る。緊縮ハイブリダイゼーション条件下に特定のプローブとハイブリッドを形成するということは、対立遺伝子特異的プローブ中にあるものと同じ突然変異が腫瘍組織中に存在することを示している。
【0201】
候補遺伝子座の突然変異に関する最も確定的な試験は、糖尿病患者由来のゲノムPYY配列と対照集団由来のものとを直接比較することである。あるいは、例えば、PCR増幅後でメッセンジャーRNAの配列を決定し、それによって、候補遺伝子のエキソン構造決定の必要をなくしてもよい。
【0202】
PYYのコード領域外に含まれる糖尿病患者由来の突然変異は、イントロンやPYY遺伝子の近くまたは内部の調節配列などの非コード領域を調べて検出することができる。非コード領域における突然変異が重要であるという初期の指摘は、糖尿病患者では対照個体に比べて異常なサイズまたは量のメッセンジャーRNA分子を示すノーザンブロット実験から得られたものであろう。
【0203】
PYYのmRNA発現の変化は、当業において公知の任意の方法によって検出し得る。公知方法には、ノーザンブロット分析、PCR増幅およびRNアーゼ保護が含まれる。RNA発現の低下は、野生型PYY遺伝子の変化を示している。野生型PYY遺伝子の変化は、野生型PYYタンパク質の変化についてスクリーニングして検出することもできる。例えば、PYYに対して免疫応答性のモノクローナル抗体を用いて組織をスクリーニングしてもよい。同種抗原の欠如は、PYY突然変異を示していると考えられる。突然変異PYY遺伝子産物の検出には、突然変異対立遺伝子産物に特異的な抗体を用いることもできる。そのような免疫アッセイは、当業において公知の任意の便利なフォーマットで実施し得る。そのようなフォーマットとしては、ウエスタンブロット、免疫組織化学アッセイおよびELISAアッセイがある。野生型PYY遺伝子の変化を検出するには、変性PYYタンパク質を検出するための任意の手段を用い得る。タンパク質結合決定などの機能的アッセイを用いてもよい。さらに、PYYの生化学的機能を検出するアッセイも用い得る。突然変異PYY遺伝子産物が見つかるということは、野生型PYY遺伝子が変化していることを示している。
【0204】
突然変異PYY遺伝子または遺伝子産物は、血清、便、尿およびたんなどの他のヒト体試料においても検出し得る。組織中の突然変異PYY遺伝子または遺伝子産物を検出するために上述のものと同じ方法を他の体試料にも適用し得る。ガン細胞が腫瘍から脱落し、そのような体試料中に現れる。この体試料をスクリーニングすることにより、膵臓グルコース反応の喪失を含む多くのタイプのグルコース代謝障害に関する簡単な初期診断を達成し得る。さらに、化学療法や放射線療法の進歩により、そのような体試料は、突然変異PYY遺伝子または遺伝子産物について試験することにより、さらに容易にモニターすることができる。
【0205】
本発明のプライマー対は、PCRを用いた特定のPYY対立遺伝子のヌクレオチド配列の決定に有用である。一本鎖DNAプライマー対は、PYY遺伝子自体の増幅DNA合成を加速するために、染色体上のPYY遺伝子内またはそれを取り囲む配列にアニーリングすることができる。これらのプライマーの完全セットにより、PYY遺伝子コード配列のすべてのヌクレオチド、すなわちエキソンが合成される。プライマーセットは、イントロン配列とエキソン配列を共に合成し得るのが好ましい。対立遺伝子特異的プライマーを用いてもよい。そのようなプライマーは、特定のPYY突然変異対立遺伝子にのみアニーリングし、したがって、鋳型としての突然変異対立遺伝子の存在下に産物を増幅するに過ぎないであろう。
【0206】
その後の増幅配列のクローニングを容易にするために、プライマーは、それらの5′末端に付加された制限酵素部位配列を有し得る。したがって、プライマーのすべてのヌクレオチドは、制限酵素部位の形成に必要な数個のヌクレオチドを除いて、PYY配列またはPYYに隣接する配列由来である。そのような酵素および部位は当業では周知である。プライマー自体は、当業において周知の方法を用いて合成し得る。一般に、プライマーは、市販されているオリゴヌクレオチド合成機を用いて製造し得る。配列番号1で表されるPYY読み取り枠の配列が得られたら、以下に開示されているものに加えて、特定のプライマーの設計は十分に当業の技術の範囲内である。
【0207】
(ix) 使用法:核酸診断および診断キット
個体を糖尿病体質とするPYY対立遺伝子の存在を検出するために、血液試料または生検などの生物試料を調製し、PYY感受性対立遺伝子の有無について分析する。糖尿病の存在を検出するために、糖尿病への進行または予後の指標として、生物試料を調製し、PYY突然変異対立遺伝子の有無について分析する。これらの試験の結果および解釈情報を試験した個体に伝えるためにヘルスケアプロバイダーに返す。そのような診断は診断試験室で実施してもよいし、あるいは、診断キットを製造し、自己診断用にヘルスケアプロバイダーまたは個人に販売する。
【0208】
先ず、このスクリーニング法は、関連PYY配列を増幅することを含む。本発明のいくつかの実施態様において、このスクリーニング法は、鎖置換増幅〔strand−displacement amplification(SDA)〕法などの非PCRベースの増幅法を含む。そのようなスクリーニング法は、当業では周知の2段階標識増幅法(two−step label amplification methodologies)を含み得る。PCRおよび非PCRベースのスクリーニング法はどちらも高感度で標的配列を検出し得る。
【0209】
今日最もよく用いられている方法は標的増幅法である。この方法では、ポリメラーゼを用いて標的核酸配列を増幅する。ポリメラーゼ誘導増幅(polymerase−driven amplification)を用いた1つの特に好ましい方法は、ポリメラーゼ連鎖反応(PCR)である。ポリメラーゼ連鎖反応および他のポリメラーゼ誘導増幅アッセイは、ポリメラーゼ誘導増幅サイクルを用いることによって百万倍を超えるコピー数の増加を達成することができる。増幅後、得られた核酸を配列決定し、DNAプローブ用の基質として用いることができる。
【0210】
プローブを用いて標的配列の存在を検出するとき(例えば、糖尿病感受性についてスクリーニングする際)、所望なら、血液または血清などの分析すべき生物試料を処理して核酸を抽出し得る。試料の核酸は、標的配列の検出を容易にする種々の方法:例えば、変性、制限消化、電気泳動またはドットブロットで調製し得る。分析物核酸の標的領域は、通常、プローブの標的配列とハイブリッドを形成するために少なくとも部分的に一本鎖になっていなければならない。その配列が天然の一本鎖である場合、変性は必要ないであろう。しかし、その配列が二本鎖の場合、恐らく配列を変性させる必要があろう。変性は当業において公知の種々の方法で実施し得る。
【0211】
分析物核酸およびプローブを、プローブ中の標的配列と分析物中の推定標的配列との安定したハイブリッド形成を促進する条件下にインキュベートする。分析物との結合に用いられるプローブの領域は、PYY遺伝子を含めたヒト染色体の標的領域と完全に相補的にすることができる。したがって、擬陽性を阻止するために高緊縮条件が望ましい。しかし、高緊縮性条件は、プローブがゲノム中に唯1つである染色体の領域に相補的な場合にのみ用いられる。ハイブリダイゼーションの緊縮性は、ハイブリダイゼーション時および洗浄手順時の温度、イオン強度、塩基組成物、プローブ長、およびホルムアミドの濃度を含めた多くの要素によって決められる。これらの要素は、例えば、Maniatisら,前掲およびSambrookら,前掲に略述されている。ある種の条件下には、標的配列検出手段を提供するために、三本鎖、四本鎖などの高次ハイブリッドの形成が望ましい。
【0212】
得られたハイブリッド(もしあれば)の検出は、通常、標識プローブを用いて達成される。あるいは、プローブは、標識されていなくてもよいが、直接または間接的に標識されたリガンドとの特異的結合によって検出し得る。適当な標識やプローブおよびリガンドの標識法は当業では公知であり、例えば、公知方法〔例えば、ニックトランスレーション、ランダムプライミングまたはキナージング(kinasing)〕に組み込まれている放射性標識、ビオチン、蛍光基、化学発光基(例えば、ジオキセタン、特に励起されたジオキセタン)、酵素、抗体などが含まれる。この基本的方式の変型は当業では公知であり、そのような変型には、生体外材料からの検出すべきハイブリッドの分離を容易にするか、かつ/または標識部分からのシグナルを増幅させるものが含まれる。
【0213】
上述のように、本発明では、非PCRベースのスクリーニングアッセイも企図される。代表的な非PCRベース法は、核酸プローブ(または正常なホスホジエステルを置換するメチルホスホネート主鎖などのアナログ)と低レベルのDNA標的とのハイブリダイゼーションである。このプローブは、共有結合がハイブリダイゼーションの特殊性に干渉しないように、プローブに共有結合させた酵素を有し得る。次いで、この酵素−プローブ−接合体−標的核酸複合体を遊離プローブ酵素接合体から分離して、酵素検出のために基質を添加する。酵素活性は、感度の103〜106の増大をもたらす発色または発光における変化として観測される。
【0214】
2段階標識増幅法は当業では公知である。これらのアッセイは、(ジゴキシゲニン、ビオチンなどの)小リガンドが特異的にPYYに結合し得る核酸プローブに結合するという原理に基づいている。代表的なプローブは、配列番号1で表される配列に基づいて生成し得る。対立遺伝子特異的プローブもこの例の範囲内であると考えられ、代表的な対立遺伝子特異的プローブには、PYY分泌の喪失または血清半減期の短縮をもたらす素因となる突然変異を取り囲むプローブが含まれる。
【0215】
1つの例において、核酸プローブに結合している小リガンドは、抗体−酵素接合体によって特異的に認識される。この例の1つの具体化において、ジゴキシゲニンは核酸プローブに結合する。ハイブリダイゼーションは、化学発光基質を励起させる抗体−アルカリホスファターゼ接合体によって検出される。第2の例において、小リガンドは、第1リガンドと特異的に複合体を形成し得る第2リガンド−酵素接合体によって認識される。この例の周知具体化は、ビオチン−アビジンタイプの相互作用である。
【0216】
本発明の核酸プローブアッセイがPYY配列を検出し得る核酸プローブカクテルを用いる得ることも本発明の範囲内であると考えられる。したがって、1つの例において、細胞試料中のPYYの存在を検出するために、PYYに相補的な2つ以上のプローブが用いられ、特に、異なるプローブの数が2つ、3つ、または5つの異なる核酸プローブ配列である。別の例では、患者のPYY遺伝子配列中の突然変異の存在を検出するために、PYYに相補的な2つ以上のプローブが用いられ、プローブカクテルは、PYYに変化を有する患者集団で同定された対立遺伝子特異的突然変異に結合し得るプローブを含んでいる。この実施態様では、任意の数のプローブを用い得るが、例えば、個体を特定のガン体質にすると同定された多数の遺伝子突然変異に対応するプローブを含むのが好ましい。
【実施例】
【0217】
実施例
実施例1: 膵島の単離および培養
PP、NPY、NPK、PYY、セクレチン、GLP−1およびホンベシンを含む腸由来ホルモンペプチドは、シグマ社(Sigma)から購入した。XI型コラゲナーゼは、ジブコ社(Gibco)から得た。抗インスリン抗体([125I]−RIAキット)を含むラジオイムノアッセイキットは、セントルイス所在のリンコ社(Linco,St.Louis)から購入した。
【0218】
分娩後ラットの膵島はP0〜2年齢のラットから得た。成体ラットの膵島は6〜8週齢のラットから得た。胎児ラットの膵島は以下のようにして得た。妊娠雌ラットを妊娠e21日目に殺した。子宮から胎児を取り出した。各同腹仔から10〜14個の膵臓を切り出し、ハンクス緩衝液で2回洗浄した。膵臓をプールし、6mlの1mg/mlコラゲナーゼ(XI型、シグマ社)に懸濁し、37℃で8〜10分間、常に振とうしながらインキュベートした。10容量の氷冷ハンクス緩衝液を加えて消化を停止した後、ハンクス緩衝液で3回洗浄した。次いで、膵島をフィコール勾配にかけて精製し、1μM IBMXを添加するかまたは添加せずに、10%ウシ胎児血清(FBS)/RPM1培地中で培養した。5日間培養した後、20個の膵島を手で取り出して各管に入れ、静置インスリン放出について検定した。一般に、膵島は、先ずKRP緩衝液で洗浄し、次いで、3mM(低)グルコースを含む1mlのKRP緩衝液で30分間37℃で常に振とうしながらインキュベートした。上清を回収した後、膵島を17mM(高)グルコースと共に1時間37℃でインキュベートした。低または高グルコース刺激により放出されたインスリンを、[125I]−RIAキットを用いてラジオイムノアッセイ(RIA)にかけて検定した(図1参照)。
【0219】
実施例2: e21膵島におけるIBMX刺激カルシウムインフラックス
実施例1にしたがって、e21膵島を単離し、培養した。次いで、膵島を17mMグルコースまたは3mM(低)グルコース中1μM IBMXで処理した(図2)。非グルコース応答性e21膵島は、高グルコースを添加しても細胞内カルシウムインフラックスが増大しなかった。IBMXを添加するとカルシウムインフラックスが誘発され、これは、e21膵島のインスリン放出を刺激するIBMXのメカニズムもカルシウムチャンネルの活性化を利用することを示唆している。これはさらに、P0膵島で観測されたグルコース応答性の増加がカルシウムチャンネルの上流で発生することを示唆している。
【0220】
実施例3: PYYは胎児膵島の成熟を誘発する
実施例1のように胎児ラット膵島を単離した。e21胎児膵島を、5日間、200ng/mlのPYY、PPP、CCK、NPK、NPY、セクレチン、GLP−1またはボンベシンの存在下に培養した。次いで、各培養グループのグルコース刺激インスリン放出を測定した(図3Aおよび図3B)。PYYは、インスリン分泌により、膵島のグルコース応答能を著しく刺激した。約70%アミノ酸相同性を共有するPPPおよびNPYなどの関連ペプチドは、グルコース応答性の増加を刺激しなかった。
【0221】
実施例4: e21膵島に及ぼすPYYの効果は時間依存性である
実施例1のように胎児ラット膵島を単離した。次いで、e21膵島を200ng/mlのPYYで2日、5日または7日間培養した。各培養グループでグルコース刺激インスリン放出を測定した(図4)。対照グループは、培養中で5日後に、インスリン放出で測定して、時間0および2日目の時間点(三角)に比べてわずかな応答性の増加を示した。5日間PYYを添加すると、対照に比べてグルコースに応答して放出されるインスリンの量がほぼ倍になった。この効果は1日目時間点で維持された。PYYインキュベーション2日後ではグルコース応答性の増加に及ぼすPYYの効果はなかった。
【0222】
実施例5: PYYの用量応答は最適用量が200ng/mlであることを示している
実施例1のように胎児ラット膵島を単離した。e21膵島に、5日間、50、100、200、500および1000ng/mlのPYYを添加した。次いで、各培養グループのグルコース刺激インスリン放出を測定した(図5)。PYYの最適効果は、インスリン放出により測定して、200ng/mlで観測された。500および1000ng/mlではPYYの効果は減少したが、これは、既に図5で認められる。
【0223】
実施例6: 成体膵島に及ぼすPYYの効果
実施例1のように成体ラット膵島を単離し、16日間にわたり、対照培地または200ng/mlのPYYを含む培地で処理した。グルコース刺激インスリン放出を指定日に測定した(図6)。成体膵島では、培地を含む標準10%FBS中で培養して2日以内にグルコース刺激インスリン分泌がなくなった。しかし、PYYは、培養10日目以降でも応答性を守ることができた。
【0224】
実施例7: グルコース応答性の増加に及ぼすPYYの効果は遺伝子転写の活性化を必要とする
実施例1のように胎児ラット膵島を単離し、1μM IBMXを添加するかまたは添加せずに、200ng/mlのPYYで5日間処理し、最後の16時間の間に0.1μg/mlのアクチノマイシンDを添加した。次いで、各培養グループのグルコース刺激インスリン放出を測定した(図7)。アクチノマイシンDは、インスリン放出により測定して、PYYによって誘発される機能性の増加を完全に阻害することができた。これは、膵島に対する薬剤の非特異的毒性によるものではない。というのは、IBMXは依然としてアクチノマイシンDで処理した膵島でエキソサイトーシスを誘発し得るからである。
【0225】
実施例8: アクチノマイシンDの作用は膵島のインスリン含量を低下させることによって仲介されるのではない
実施例1のように胎児ラット膵島を単離し、200ng/mlのpyyで5日間処理し、最後の16時間の間に0.1、0.2、0.5および1.0μg/mlのアクチノマイシンDを添加した。次いで、各培養グループのインスリン含量を測定した(図8)。表は、アクチノマイシンDの量を増大させても、膵島の全インスリン含量が有意に減少しなかったことを示している。
【0226】
実施例9: PYYは基底分泌速度に影響を与えない
実施例1のようにe21およびP14ラット膵島を単離し、200ng/mlのPYYで処理した。次いで、膵島を洗浄し、インスリン放出により測定して、グルコース応答性について検定した。次いで、アッセイ緩衝液(クレブス・リンゲルホスフェート)にPYYを添加して、PYYの存在が実際に基底または刺激インスリン分泌速度に影響を与えるかどうかを確認した。次いで、各培養グループのグルコース刺激インスリン放出を測定した(図8)。アッセイ緩衝液中へのPYY添加の効果は無視できる程度であり、これは、PYYの主要効果がPYYが存在する培養期間中に及ぼされることを示している。新たに単離したP14膵島を正の対照として含めた。
【0227】
実施例10: 成体ラット膵島のグルコース応答の回復に及ぼすPYYの効果
実施例1のように成体ラット膵島を単離し、10%FBS中で7日間培養し、その間の図10に指示されている日に、培地に200ng/mlのPYYを添加した。7日培養した膵島だけはグルコース応答性を失ったが、アッセイ終了前の最後の2〜3日の間にPYYを添加すると、膵島はグルコース応答を回復した。培地中にPYYが5日以上存在すると、膵島はその回復機能を失ってしまうようであり、これは、ペプチドシグナル分解の可能性を示唆している。
【0228】
上記の参考文献および刊行物はすべて本明細書に文献援用される。
等価物
当業者には、本明細書に記載されている本発明の特定の実施態様に対する多くの等価物が認識されるであろうし、それらは、ただ日常実験を用いるだけで確認することができるであろう。そのような等価物は以下の特許請求の範囲に包含されるものとする。
【技術分野】
【0001】
(技術分野)
本発明は、グルコース代謝障害(例えば、グルコース不耐性、インスリン抵抗性、高血糖、高インスリン血症、及びII型糖尿病)を治療するための治療法に関する。該治療法は、PYYが、胎児及び成体の膵島におけるグルコース応答性を誘導するとの発見に基づく。
【背景技術】
【0002】
(発明の背景)
糖尿病は、米国で最も蔓延している慢性疾患であり、死因の筆頭であって、現在、世界中で4億人を越える糖尿病患者を苦しめている。1993年の国民保健面接調査(NHIS)に基づく推計は、糖尿病が、45歳未満の米国の人口の1%、45〜64歳のそれの6.2%、及び65歳以上のそれの10.4%で診断されたことを示している。1995年現在、米国の推定800万人が、この慢性的状態を有すると報告された。
【0003】
米国における糖尿病の出費総額は、医学的製品に対する支出、病院加療、及び労働損失の価値を含めて、年間920億ドルと見積もられている。社会とその市民との双方に対する実質的な出費が、糖尿病のための医療の直接的出費だけでなく、糖尿病に関連する罹患率、及び過早の死亡率を包含する間接的出費に対しても余儀なくされている。糖尿病罹患者は、糖尿病ケトアシドーシス、末期腎疾患、糖尿病性網膜症及び切断を包含する、大併発症の危険性の下にある。より直接的でない関連状態、例えば高血圧、心疾患、末梢血管疾患及び感染の保有者も存在し、そのために、糖尿病罹患者は、実質的に増大した危険性の下にある。
【0004】
糖尿病は、血中のグルコースの慢性的上昇(高血糖)へと導く、混成的な一群の代謝疾患である。糖尿病は、グルコース調節の喪失へと導く、膵島の破壊又は機能不全を特徴とする。糖尿病の主な二つの型は、「インスリン依存性糖尿病」(「IDDM」)又は「若年性糖尿病」としても知られるI型、及び「インスリン非依存性」(「NIDDM」)又は「成人発病型糖尿病」としても知られるII型である。
【0005】
IDDMは、膵臓β細胞の自己免疫を介しての破壊に起因して、インスリン産生の結果的な喪失を伴い、それが高血糖を招く。I型糖尿病は、生存を確保するためにインスリン代置療法を必要とする。注射可能インスリン及び経口血糖降下剤のような医薬は、糖尿病患者がより長く生存するのを許すが、糖尿病は、心疾患及び癌に次ぐ第三の主要な死因であり続けている。しかしながら、これらの医薬は、高血糖と低血糖との間のレベルの揺れを防ぐだけ充分に血糖レベルを制御することはなく、その結果、腎臓、目及び血管に対する損傷を生じる。糖尿病制御及び併発症試験(DCCT)からのデータは、血中グルコースの集中的な制御が、糖尿病の併発症、例えば網膜症、腎障害及び神経障害を、1日1、2回のインスリン注射からなる旧来の治療法と比較して有意に遅延させることを示している。DCCTにおける集中治療法は、1日3回又はそれ以上のインスリンの多数回注射、又は外部ポンプによるインスリンの連続的皮下注入(CSII)を包含した。インスリンポンプは、インスリンの生理学的代置に近付ける、皮下多数回日次注射(MDI)に対する様々な代替的な取組み方の一つである。
【0006】
II型糖尿病は、正常値より高いレベルの血漿インスリン(高インスリン血)の存在下での高血糖を特徴とし、全症例の90%以上を占め、40歳を越える過剰体重の成人に最も頻発する。II型糖尿病の進行は、グルコース誘導インスリン分泌速度の相対的上昇と結合した、血中グルコース濃度の上昇を伴う。II型糖尿病では、炭水化物代謝を制御する組織過程が、インスリンに対する感受性を低下させ、そのため,インスリン産生の欠如ではなく、血中のグルコースレベルの上昇に対する感受性の低下、及びインスリン産生による応答の不能から生じると考えられている。これに代えて、糖尿病は、インスリンのその標的細胞に対する作用を媒介する分子的機構の様々な欠陥、例えばその細胞表面でのインスリン受容体の欠如に起因する可能性もある。したがって、II型糖尿病の治療は、インスリンの投与を必要としないことが多く、食餌及び生活スタイルの変化を基本として、例えばスルホニル尿素のような経口血糖降下剤による治療法によって補強される。
【0007】
膵臓の内分泌部分は、外分泌性膵臓内に埋め込まれた、島細胞の丸みを帯びた集塊のように見えるランゲルハンス島で構成される。4種類の島細胞が、膵臓の内分泌部分を構成する:(1)島細胞の20%を占め、血糖レベルを上昇させるホルモンのグルカゴンを分泌する、アルファ(α)細胞;(2)血糖レベルを低下させるホルモンのインスリンを分泌する、ベータ(β)細胞;(3)インスリン及びグルカゴンの分泌を阻害するホルモンの成長ホルモン阻害ホルモン(GHIH)又はソマトスタチンを分泌する、デルタ(δ)細胞;並びに(4)膵ポリペプチドを合成するφ細胞、又は膵ポリペプチド(PP)細胞。グルカゴンは、いくつかの組織に作用して、食間期に利用できるエネルギーを生成する。肝臓では、グルカゴンは、グリコーゲンの分解を生起し、アミノ酸前駆体からの糖新生を促進する。膵ポリペプチドは、重炭酸塩及び酵素の膵外分泌腺による分泌を阻害し、胆嚢の弛緩を生じ、胆汁分泌を低下させる。インスリンは、食事の際及び直後に生じる過剰な栄養素の貯蔵を生起することが知られている。インスリンの主な標的器官は、肝臓、筋、及びエネルギー貯蔵に専門化した脂肪器官である。
【0008】
島で最も豊富な細胞は、細胞のうち60〜80%を構成する、インスリン産生β細胞である。ヒトの胎児膵臓のβ細胞は、グルコースに応答して僅かしか、又は全くインスリンを放出しないという点で、成体膵臓のβ細胞とは異なる[例えば、Tuch, B.E. et al. (1992) J. Endocrin. 132l:159-67を参照されたい]。これは、ヒトとげっ歯類との双方で観察されており、II型糖尿病又は悪性島細胞腫の患者で観察される、グルコースに対する遅延インスリン応答に似ている[Hellerstrom & Swenne (1991) Diabetes 40(2):89-93]。胎児β細胞がグルコースに応答してインスリンを産生できないことは、インスリン前駆体を処理できないことによるとは考えられない。ヒト成人β細胞は、プレプロインスリンを合成し、これを細網内皮系でプロインスリン(hPI)に転化する。その後、hPIは、分泌性顆粒で、調節的経路を経由してインスリンとCペプチドとに分割される。成体β細胞におけるhPIの転化率は、高く、含有量と分泌との双方に関して低いhPI:インスリン比を生じる[Gold et al. (1981) Diabetes 30:77-82]。これは、胎児β細胞についても観察され、β細胞の未成熟は、プロインスリンの貯蔵及び放出における相違によらないことを示唆する[Tuch et al.、前掲]。Ca2+及びcAMPの増加に応答した胎児β細胞からのhPI及びインスリン双方の急性放出は、細胞が、その分泌産物を、構成的経路ではなく調節的経路を経由して放出することを示唆する[Rhodes & Halban (1987) J. Cell Biol. 105:145-53]。
【0009】
胎児β細胞におけるグルコース応答性の欠如は、未成熟なグルコース代謝によると考えられる。成体β細胞におけるグルコース誘導インスリン分泌を裏付ける分子的機序には、原形質膜におけるATP感受性K+(KATP)チャンネルを閉じ、そのためにKATPチャンネルからのK+流出を阻害して、細胞膜の分極へと導くことが関与している[Jones, P.M. & Persaud, S.J. (1998) Endocrine Review 19(4):429-61;Mendonca et al.、前掲;Cook, D.L. & Hales, C.N. (1984) Nature (London) 311:271-73]。その結果、細胞質ゾルのCa2+濃度は、膜分極、及びL型(電位差感受性)Ca2+チャンネルからのCa2+流入の結果として上昇する。グルコースは、cAMPと、イノシトール三リン酸(IP3)、ジアシルグリセロール(DAG)、アラキドン酸(AA)及びホスファチジン酸を包含する膜リン脂質から誘導されるレギュレーターとの細胞内濃度を上昇させる[Jones & Persaud、前掲を参照されたい]。グルコースに応答したインスリン分泌の低下は、グルコース代謝と膜細胞分極との間の脱共役の反映であることが示唆されている[Mendonca et al.、前掲]。研究は、ATP感受性K+チャンネルが、たとえ完全に発育していても、胎児β細胞では適正に調節されないこと、及びグルコースに対する不完全な分泌応答が、未成熟なミトコンドリアのグルコース代謝の反映であって、さもなければ正常であるATP感受性K+チャンネルの閉鎖の不能を招き得ることを示している[Hellerstrom & Swenne、前掲]。
【0010】
膵臓の発生は、独立した時期に生じ、膵細胞自体、又は他の組織が産生した内分泌ホルモンによって調節される。ラットでは、膵臓原基は、十二指腸内胚葉からの突起として生じる、背側と腹側との膵臓原芽の融合によって、胚の(「e」)10.5日目(「e10.5」)に形成される[Pictet, R. & Rutter, W.J. (1972) "Development of the Embryonic Endocrine Pancreas", in D. Steiner & N. Freinkel (eds.) Handbook of Physiology, The Endocrine Pancreas, Vol. 1, Section 8, Am. Physiol. Soc., pp.25-66;Myrsen-Axcrona, U. et al. (1997) Regulatory Peptides 68:165-75]。膵島ホルモンは、発生中の膵臓で逐次出現し;例えばグルカゴンは、マウスではe10、ラットではe11に出現し、インスリン産生細胞は、e12に出現し、ソマトスタチン産生細胞は、e17に出現する[Myrsen-Axcrona et al.、前掲]。膵島細胞は、膵管内の共通前駆細胞からの内分泌シグナルに応答して分化すると考えられる。ラットの胎児期の終点(e21)と、新生児期(出生後)との間のある時点で、胎児β細胞は、グルコースに応答してインスリンを分泌する能力を獲得する。この時期のインスリン応答は、単相的であり、Ca2+拮抗薬によって遮断されない。グルコースに応答したインスリン分泌の明瞭な二相パターンは、出生後3日目においてのみ検出されるにすぎない[Mendonca, A.C. et al. (1998) Brazilian J. Med. Biol. Res. 31(6):841-46]。この「機能の獲得」又は「グルコース応答性の獲得」が達成される機序は、知られておらず、機能の成熟及び獲得を調節する因子も、特定又は特徴付けされていない。加えて、膵臓β細胞におけるグルコース応答性の獲得に付随する生理学的変化も、未知である。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Tuch, B.E. et al. (1992) J. Endocrin. 132l:159-67
【非特許文献2】Hellerstrom & Swenne (1991) Diabetes 40(2):89-93]
【非特許文献3】Gold et al. (1981) Diabetes 30:77-82
【非特許文献4】Rhodes & Halban (1987) J. Cell Biol. 105:145-53
【非特許文献5】Jones, P.M. & Persaud, S.J. (1998) Endocrine Review 19(4):429-61
【非特許文献6】Cook, D.L. & Hales, C.N. (1984) Nature (London) 311:271-73
【非特許文献7】Pictet, R. & Rutter, W.J. (1972) "Development of the Embryonic Endocrine Pancreas", in D. Steiner & N. Freinkel (eds.) Handbook of Physiology, The Endocrine Pancreas, Vol. 1, Section 8, Am. Physiol. Soc., pp.25-66
【非特許文献8】Myrsen-Axcrona, U. et al. (1997) Regulatory Peptides 68:165-75
【非特許文献9】Mendonca, A.C. et al. (1998) Brazilian J. Med. Biol. Res. 31(6):841-46
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、ある因子、すなわち「ペプチドyY」又は「PYY」が、グルコース非応答性の胎児及び成体における、グルコース応答性へと導く機能の獲得を誘発するとの発見に基づき、そのため、グルコース代謝に影響する、II型糖尿病のような疾患に対する治療法を提供する。
【課題を解決するための手段】
【0013】
(発明の要約)
本発明は、PYYが、胎児及び成体膵島におけるグルコース応答性を誘導かつ維持することができるとの発見に関する。例えば、胎児のラット膵からのグルコース非応答性e21膵島への、in vitroでのPYYの5日間の投与は、膵島の成熟を誘導し、次いで、これが、グルコースに対してインスリンを放出することによって応答することを、本発明者らは示す。また、グルコース感知は、成体膵島では、PYYの投与によって回復することができること、及びグルコース感知は、PYYを投与した成体膵島では、より長く維持できることも、本発明者らは示す。本発明以前は、膵島の成熟を刺激できる栄養又は成長因子は、従来から、当技術では特定されていなかった。
【0014】
一態様では、本発明は、膵島細胞の分化した状態を変える方法であって、膵島又は単離β細胞に、PYY活性の(例えばそれを模倣するか、又は強化する)PYYペプチド又はPYY作用薬(本明細書では「PYY治療薬」と総称する)を投与することを含む方法を含む。一実施態様では、PYY治療薬の投与は、膵島又は細胞がグルコース応答性になるようにする。グルコース応答性の島又は細胞は、それによって刺激されて、グルコースに接触させたときにインスリンを産生する。もう一つの態様では、本発明は、島又は細胞をPYY治療薬に接触させることによって、成熟膵島を示すマーカーを発現するよう島を誘導するか、又は成熟β細胞を示すマーカーを発現するようβ細胞を誘導する方法を含む。好適実施態様では、島又は細胞は、ヒトの膵島又はβ細胞である。
【0015】
本発明は、更に、グルコース応答性の膵島又はβ細胞を調製する方法であって、グルコース非応答性の膵島又はβ細胞に、有効量のPYY治療薬含有組成物を投与することを含む方法を提供する。
【0016】
もう一つの態様では、本発明は、動物のグルコース代謝を変更する方法であって、それによって膵臓β細胞のグルコース応答性を高めるために、該動物に、製薬上有効量のPYY治療薬含有組成物、及び製薬上許容され得る担体を投与することを含む方法を提供する。好適実施態様では、本発明は、変化したグルコース代謝に付随する疾患を治療する方法であって、動物に、製薬上有効量のPYY治療薬含有組成物、及び製薬上許容され得る担体を、膵臓β細胞のグルコース応答性を増大させるのに充分な量で投与することを含む方法を提供する。
【0017】
もう一つの態様では、本発明は、脊椎動物からの未分化な島又は細胞をPYY治療薬に接触させることによって生成された、分化した島及びβ細胞を提供する。好適実施態様では、本発明は、グルコースに応答してインスリンを分泌する膵島及びβ細胞、及び動物への製剤投与に適する、製薬上許容され得る担体を提供するが、該細胞性組成物は、グルコースに応答してin vivoでインスリンを分泌することができる。
【0018】
更にもう一つの態様では、本発明は、変化したグルコース代謝に付随する疾患を治療する方法であって、本発明によるPYY治療薬で治療することによってグルコース応答性を獲得した、膵島又はβ細胞を含む、製薬上有効量の組成物を動物に投与することを含む方法を提供する。一実施態様では膵島又はβ細胞をPYY治療薬で治療することによって得られたグルコース応答性の島又は細胞を、動物のグルコース応答性を高めるのに充分な量の、製薬上許容され得る担体を含有する組成物として動物に投与する。もう一つの実施態様では、PYY治療されたグルコース応答性細胞の組成物は、追加の薬剤、例えばPYY治療薬を含む。この細胞組成物は、PYY治療薬と同時にか、順次にか、又は別個にかのいずれかで、連携して投与してよい。この方法は、動物におけるインスリン抵抗性、グルコース不耐性又はグルコース非応答性、高血糖、肥満、高脂血症、及び高リポタンパク質血症のような状態に付随する疾患を治療するのに用いてよい。好適実施態様では、本発明は、II型糖尿病を治療するのに用いられる。
【0019】
好適なPYYペプチドは、成熟PYYタンパク質、又は生物学的活性を有するそのフラグメントに相当するポリペプチドを包含する。PYYペプチドは、好ましくは、哺乳動物PYY、例えば、哺乳動物PYY遺伝子にコードされているそれ、はるかに好ましくは、ヒトPYYタンパク質、例えばSEQ ID NO:2に示されるそれである。一定の実施態様では、PYYペプチドは、SEQ ID NO:2のアミノ酸配列と70%以上同一、より好ましくは80、85、90又は95%以上同一であることになる。一定の実施態様では、PYYペプチドは、好ましくは65℃での2.0xSSCという洗浄段階を含む緊縮条件下、はるかに好ましくは65℃での0.2xSSCという洗浄段階を含む緊縮条件下で、SEQ ID NO:1とハイブリダイズする、核酸によってコードされていることができる。
【0020】
PYY治療薬として用いることができるPYY作用薬は、PYYの活性を誘導する効果を有するいかなる化合物も包含する。好適な作用薬は、ジペプチジルペプチダーゼ、好ましくはジペプチジルペプチダーゼIV(DPIV)を阻害できる化合物を含む。
【0021】
もう一つの好適実施態様では、PYY治療薬、PYY治療薬投与された島及び/又はPYY治療薬投与された細胞を、PYY治療薬の分解を阻害できる薬剤とともに、該PYY治療薬と同時にか、順次にか、若しくは別個にかのいずれかで動物に投与する。好適実施態様では、該薬剤は、PYY治療薬と同時投与する。好適な阻害剤は、ジペプチジルペプチダーゼ阻害剤である。もう一つの好適実施態様では、該薬剤は、本発明によるPYY治療薬による治療によってグルコース応答性にさせた膵島又は細胞とともに投与する。もう一つの好適実施態様では、該薬剤は、PYY、及び本発明によるPYY治療薬による治療によってグルコース応答性にさせた膵島又は細胞とともに投与する。
【0022】
その他の実施態様では、PYY治療薬は、PYY−Y1受容体のようなPYY受容体に結合し、PYYに対する活性を模倣するか(作用薬)、又は阻害する(拮抗薬として)化合物である。好適実施態様では、そのような薬剤は、例えば7,000amu未満、より好ましくは5,000amu、1,000amu、又は500amu未満でさえもの分子量を有する、小さい有機分子である。作用薬は、グルコース感知を誘導及び/又は維持するために用いることができる。作用薬は、例えば高インスリン症又は高血糖症を治療するよう、グルコース感知を阻害、又は別途抑制するのに用いることができる。
【0023】
好適実施態様では、本発明は、島又は細胞移植片における正常な膵島機能(すなわちグルコース応答性)を維持する方法であって、ex vivoで膵島又は細胞にPYY治療薬を投与することを含む方法を提供する。このようにして、宿主動物に移植しようとする提供者の膵島又は細胞は、インスリンを産生することによってグルコースに応答できるその能力に関して機能的であるとして、維持することができる。これに代えて、膵島細胞は、PYY治療薬で治療して、グルコース応答性を強化してか、又はそのグルコース応答性を回復させてから、動物に再移植した、宿主の不全であった自己β細胞であってもよい。
【0024】
更にもう一つの態様では、本発明は、PYY治療薬を特定する方法であって、グルコースに非応答性である胎児膵島若しくは細胞、又は成体膵細胞に、有効量の薬剤を投与し、該薬剤に対する細胞の応答をPYYに対する細胞の応答と比較することを含む方法を提供する。好適実施態様では、PYY治療薬は、不応性膵島又は細胞にグルコース応答性を誘導する。もう一つの好適実施態様では、PYY治療薬は、部分的にグルコース不耐性であるか、又は低いインスリン発現性である膵島若しくはβ細胞におけるグルコース応答性を高める。更に一つの好適実施態様では、PYY治療薬は、不全であった膵島又は細胞におけるグルコース応答性を回復させる。
【0025】
もう一つの態様では、本発明は、PYYの拮抗薬(すなわち阻害剤)を特定する方法を提供する。そのような拮抗薬は、膵細胞(例えば始原細胞又は島細胞腫細胞)におけるグルコース応答性を妨害又は阻害することができる手段を提供し得る。一実施態様では、PYY拮抗薬は、膵始原細胞に対する未変性PYYの効果を、直接的にか、又は間接的にかのいずれかで阻害することができる。もう一つの実施態様では、PYY拮抗薬は、(例えば、島細胞腫に起因するような)高インスリン血症に悩む患者に投与したとき、インスリンレベルに対するPYYの効果を、直接的にか、又は間接的にかのいずれかで阻害することができる。そうして、PYY拮抗薬の特定は、PYY拮抗薬の阻害剤(「PYY拮抗薬阻害剤」)を特定するのに用いることができる。
【0026】
更にもう一つの態様では、本発明は、PYY作用薬、PYY拮抗薬、PYY阻害剤又はPYY拮抗薬阻害剤をコードしている遺伝子の存在について、DNAライブラリーをスクリーニングする方法を提供する。一実施態様では、核酸レベルでの組合せ突然変異誘発によって、PYY同族体又は作用薬の斑入りライブラリーを生成し、斑入りの遺伝子ライブラリーによってコード化する。例えば、可能性のあるPYY配列の縮重したセットが、個々のポリペプチドとしてか、又はこれに代えて、PYY配列のそのセットを含む、より大きい融合タンパク質のセット(例えばファージ表示のための)として発現可能になるように、合成オリゴヌクレオチドの混合物を遺伝子配列中に酵素的に結合することができる。
【0027】
更にもう一つの実施態様では、本発明は、グルコース代謝障害を有すると疑われる患者が、そのPYY機能に欠陥を有するか否かを査定するための診断用アッセイを提供する。例えば、このアッセイは、血清その他の体液中のPYYのレベルを検出することができる。他の実施態様では、該アッセイは、PYY遺伝子に対する、例えばコードされているタンパク質の分泌、血清半減期又は効力に影響する、突然変異を検出することができる。一好適実施態様では、主題の方法は、患者が、タンパク質の分泌レベルを低下させる、分泌シグナル配列中の突然変異を保有するPYY遺伝子を有するか否かを確認するのに用いることができる。
【0028】
更にもう一つの実施態様では、本発明は、PYY誘導経路が、拮抗性PYYポリペプチドの発現、又はPYY若しくはPYY作用薬をコードしている遺伝子の破壊のいずれか一方によって、その1種類又はそれ以上の組織で阻害されている、ヒトでないトランスジェニック脊椎動物を提供する。
【0029】
本発明の実施は、別途指示されない限り、細胞生物学、細胞培養、分子生物学、トランスジェニック生物学、微生物学、組換えDNA及び免疫学の、当業者の技量の範囲内にある慣用の手法を用いることになる。そのような手法は、文献中に記載されている。例えば、Molecular Cloning, A Laboratory Mannual, 2nd Ed., Sambrook, Fritsch & Maniatis (eds.) (Cold Spring Harbor Laboratory Press: 1989);DNA Cloning, Vols. I and II (D.N. Glover ed., 1985);Oligonucleotide Synthesis (M.J. Gait ed., 1984);Mullis et al.米国特許第4,683,195号明細書;Nucleic Acid Hybridization (B.D. Hames & S.J. Higgins, eds., 1984);Culture of Animal Cells (R.I. Freschney, Alan R. Liss, Inc., 1987);Immobilized Cells And Enzymes (IRL Press, 1986);B. Perbal, A Practical Guide to Molecular Cloning (1984);論文、Methods in Enzymology, Vols. 154 & 155 (Wu et al., eds.);Immunochemical Methods In Cell and Molecular Biology (Mayer & Walker, eds., Academic Press, London, 1987);Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir & C.C. Blackwell, eds., 1986);Manipulating the Mouse Embryo (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986)を参照されたい。
【図面の簡単な説明】
【0030】
【図1】e21/P0の膵臓におけるインスリン放出に対するIBMXの効果を示す図である。
【図2】e21の島におけるIBMX刺激カルシウム流入を示す図である。
【図3A】PYYが胎児の島の成熟を誘導することを示す図である。
【図3B】PYYが胎児の島の成熟を誘導することを示す図である。
【図4】e21の島に対するPYYの効果が時間依存性であることを示す図である。
【図5】e21の島に対するPYYの効果が用量依存性であることを示す図である。
【図6】成体の島に対するPYYの効果を示す図である。
【図7】グルコース応答性の獲得に対するPYYの効果は、遺伝子転写の活性化を必要とすることを示す図である。
【図8】アクチノマイシンDの効果は、島のインスリン含有量の低下を介さないことを示す図である。
【図9】PYYの存在は、基底分泌率に影響しないことを示す図である。
【図10A】ラット成体の島におけるグルコース応答の回復に対する効果を示す図である。
【図10B】ラット成体の島におけるグルコース応答の回復に対する効果を示す図である。
【発明を実施するための形態】
【0031】
本発明のその他の特徴及び利点は、以下の図面、詳細な説明及びクレームから明白になる。
【0032】
(発明の詳細な説明)
(i) 発明の全体像
胎児の発生の間に、膵臓のβ細胞の成熟(すなわち、グルコースに応答してインスリンを産生できる能力の獲得)に必要とされるホルモンのシグナル、及びホルモンによるシグナリングが生じる時点が、今では特定されている。膵島の発生は、不連続な遷移によって区切られた、胎児の妊娠の際の段階を通じて進行する。最初の時期は、原分化した状態であって、インスリン及びグルカゴンの発現によって示されるとおり、島細胞系譜への多能性幹細胞の傾倒を特徴とする。
【0033】
本発明は、胎児膵島へのin vitroでのペプチドYY(PYY)の投与が、グルコース不応性膵島の成熟膵島への成熟を生起し、インスリンの放出によってグルコースに応答したことの発見に関する。重要なことに、PYYは、グルコースに応答してインスリンを分泌する能力を別途失った、成体の膵島にグルコース応答性を回復させることも示された(図6)。これらの知見は、PYY作用薬を、始原細胞集団からのグルコース応答性膵組織の形成を、ex vivo及びin vivoの双方で誘導するのに用い得ることを示す。同様に、これらの完璧な知見は、PYY作用薬を、β細胞がグルコース応答性である時間を維持又は別途延長するためばかりでなく、グルコース応答性をβ細胞に回復させるためにも用い得ることを立証している。
【0034】
一態様では、本発見は、膵始原細胞からグルコース応答性細胞を生成するための試薬及び方法を提供する。他の実施態様では、主題の方法は、培養された膵島その他の膵細胞、特に動物、好ましくはヒトへの移植に調製される膵島又は細胞に、グルコース応答性を回復又は維持するのに用いることができる。他の実施態様では、主題の方法は、in vivoでのグルコース応答性膵細胞の喪失を防ぐのに用いることができる。
【0035】
一般的には、本発明は、グルコース応答性である膵島又は単離β細胞を、PYYペプチド、PYYの類似体もしくは誘導体、又はその作用薬(以下、「PYY作用薬」)の使用を通じて調節(誘導又は維持)する方法に関する。読解を容易にするために、両分類群の薬剤を、ここでは「PYY治療薬」と総称する。主題の方法によるPYY治療薬の投与は、投与された膵細胞にグルコース応答性を獲得させ、それによって、島、又はβ細胞の集団をグルコース応答性β細胞に富ませるか、又はグルコースに応答できる能力を失った島若しくは細胞にグルコース応答性を取り戻させることになる。
【0036】
PYY治療薬は、製薬上許容され得る組成物として対象者にin vivoで投与してよいか、又は培養された島若しくは細胞系にex vivoで投与してよい。移植片材料(すなわち、PYY投与された膵島またはβ細胞)の場合、単独でか、又はその効果を高めることができる別のPYY治療薬と組み合わせてPYY治療薬を有する、細胞を動物に投与してよい。
【0037】
更にもう一つの実施態様では、動物、又はその膵島若しくは細胞に、PYYで誘導されるグルコース応答性を増強し得るその他の因子の、島細胞自体による産生を誘導若しくは増強し得る因子を投与してよい。例えば、インスリン遺伝子は、インスリンプロモーターの基礎活性、組織特異性及び代謝応答に寄与する、多数のcis作用性要素(すなわちグルコース応答性エンハンサー及びリプレッサー要素)を含む[Sander, M. et al. (1998) Proc. Natl. Acad. Sci. USA 95: 11572-77;Odagiri, H. et al. (1996) J. Biol. Chem. 271:1909-1915]。Sanderらは、初代培養されたラットの胎児及び成体の膵島でエンハンサーとして機能するグルコース応答性要素が、完全に発達したβ細胞腫瘍細胞と、前腫瘍形成性の過形成性細胞からのβ過形成細胞(すなわち、それぞれ、分化した細胞系と、脱分化した細胞系)との双方でリプレッサーとして機能することを立証し、不死化したβ細胞と未変性の島細胞との間のインスリン遺伝子調節の根本的な相違を示唆している。Sanderらは、グルコース応答性エンハンサー要素に結合した、明確なグルコース応答性複合体は、培養された島細胞にのみ見出されること、及びこれらの相違は、初代培養β細胞でのリプレッサーの不在が、おそらく、普遍的な活性化因子が機能するのを許すか、又は普遍的なリプレッサーの効果を無効にする、初代島細胞中にのみ存在する活性化因子によって説明できることを見出した。したがって、β細胞へのPYYの投与の効果は、そのような因子(例えば転写因子)、又はグルコースに応答したインスリン遺伝子の調節に参加するその他の因子のレベルを変化させる薬剤の同時投与によって増強することができると思われる。
【0038】
これに代えて、膵島又は細胞に、PYYで誘導されるグルコース応答性を増強し得るその他の因子の、その他の細胞型による産生を生起又は増強し得る因子を投与してもよい。例えば、α、δ又はPP細胞をPYYで刺激して、動物における遺伝子発現又はグルコース代謝を変化させ得る因子を産生させてもよい。
【0039】
PYY受容体の作用薬を、本発明を用いて特定してもよい。PYYは、「PPファミリー」と名付けられた一群のペプチドに属するが、この群のその他の成員は、NPY及びPPを包含する。いくつかのPPファミリーの受容体サブタイプが、クローニングされている。これらはすべて、いくつかの貫膜ドメインを有し、受容体のGタンパク質共役スーバーファミリーに属する。PP受容体ファミリーは、Y1−R、Y2−R、Y3−R、Y4−R、Y5−R及びY6−Rを包含し、各受容体は、結合特性、組織分布及び配列同一性が異なる[Jackerott, M. & Larsson, L.I. (1997) Endocrinol. 138:5013-18]。例えば、Y1、Y2、Y5及びY6は、PYYおよびNPY3−36及びPYY3−36のC末端フラグメントに結合する。総説については、Gehlert, D.R. (1998) Proc. Soc. Exp. Biol. Med. 218(1):7-22を参照されたい。天然に産するPYY受容体の内因性作用薬が記載されている(例えばPYY1−36及びNPY1−36)。
【0040】
これに代えて、膵細胞でのPYY受容体発現を増大できる因子を、ex vivoで対象者又は島若しくは細胞に投与して、PYYのグルコース応答性効果を増強してもよい[例えば、Holliday, N.D. & Cox, H.M. (1996) Br. J. Pharmacol. 119(2):321-9を参照されたい]。上昇したPYY受容体レベルは、膵β細胞に対するPYY治療薬の効果を更に増強すると思われる。加えて、PYY受容体をコードしているDNA配列を含む、組換えベクターの導入によって、膵β細胞におけるPYY受容体数を増加させてもよい。P2及びP5受容体が好ましいが、P1、P3、P4及びP6その他のPYY特異的受容体を、誘導又は導入してもよい。
【0041】
これに代えて、グルコース輸送又はリン酸化を増強できる薬剤(例えば、グルコキナーゼの発現によって調節されるもの)を、PYY治療薬と結び付けて投与してもよい[例えば、Schuit, F.C. (1996) Horm. Res. 46:99-106を参照されたい]。また更に、グルコース輸送体のGLUT2の発現レベルは、糖尿病の動物モデルで低下することが見出されており、細胞系へのGLUT2のトランスフェクションは、その細胞、又は下向調節されたGLUT2をβ細胞に有するトランスジェニックマウス、又は糖尿病ラットにグルコース感受性を与えることができる[Thorens, B. et al. (1990) Proc. Natl. Acad. Sci. USA 87:6492-96;Hughes, S.D. et al. (1992) Proc. Natl. Acad. Sci. USA 89:688-92;Valera et al. (1994) J. Biol. Chem. 269:28543-46;Johnson, D. et al. (1990) Science 250:546-49]。膵臓性ではない脳下垂体細胞系のAtT−20insへのGLUT2遺伝子導入は、グルコースで刺激されるインスリン放出、グルコースでない分泌促進剤のグルコースによる強化、及びインスリン含有量の増加[Hughes et al.、前掲]を与え、GLUT2発現の回復は、ラット島細胞腫(RIN)細胞におけるグルコース応答性、及びグルコキナーゼ活性の上昇を与える[Ferber, S. et al. (1994) J. Biol. Chem. 269(15):11523-29]。
【0042】
移植の前に、提供者の膵島細胞を培養すると、グルコースに応答してインスリンを分泌できる能力の喪失を招く。本明細書で提供される方法は、培養された膵細胞を、インスリンを産生し続ける、完全に成熟したグルコース応答性β細胞として維持する手段を提供する。これに代えて、グルコース応答性を失った膵細胞の培養は、本発明によって、グルコース応答性細胞に戻すことができる。
【0043】
したがって、好適実施態様では、本発明は、例えば血中のグルコース又はその副生物の上昇若しくは低下したレベルに応答できないことを特徴とする疾患において、変化したか、又は欠陥のあるグルコース代謝に付随する疾患を治療する方法を提供する。PYYがグルコース応答性を強化又は回復するとの発見は、動物、好ましくはヒトにおけるインスリン産生を回復又は増強するための無数の大方針を提供する。
【0044】
もう一つの好適実施態様では、PYY類似体、作用薬又は拮抗薬を、本発明の方法により、グルコース非応答性細胞(例えば、胎児の島若しくはβ細胞、又は非応答性である成体の島若しくはβ細胞)への試験因子の投与の比較、及びそれらの効果をPYYで誘発された効果と比較することによって特定してよい。本発明は、タンパク質、ペプチド又はDNAライブラリーを、当技術に公知の方法に従って、PYY類似体、作用薬若しくはPYY拮抗薬をコードしている遺伝子の存在についてスクリーニングする方法を提供する。
【0045】
好適実施態様では、本発明は、PYYの拮抗薬、及びそれらをコードしている遺伝子を特定する方法を提供する。拮抗薬は、天然に産する遺伝子産物若しくはその変異体、又は例えばアンチセンス、リボザイム分子、及び小さい有機分子のような、ある種の合成分子であってよい。本発明は、PYY拮抗薬を阻害若しくは中和する、天然に産するか、又は合成による拮抗薬を特定する方法も提供する。そのようなPYYの「拮抗薬に対する拮抗薬」(又は「PYY拮抗薬阻害剤」)を特定して、PYYに対する細胞の応答を増強するために、PYY拮抗薬を阻害する大方針を提供することができる。
【0046】
本発明の好適な態様では、変化したグルコース代謝に付随する疾患は、製薬上有効量のPYY投与膵β細胞(グルコース応答性を獲得している)を投与することによって治療することができる。一実施態様では、グルコース応答性細胞を、製薬上許容され得る担体を含有する組成物として、動物に投与する。もう一つの実施態様では、グルコース応答性細胞の組成物は、インスリン分泌を強化し得るその他の因子、例えばPYY治療薬を更に含む。
【0047】
これに代えて、該組成物は、例えばジペプチジルペプチダーゼ阻害剤のような、PYY治療薬の血清半減期を延長するプロテアーゼ阻害剤と連携して、同時にか、順次にか、又は別個に投与してもよい。好適実施態様では、ジペプチジルペプチダーゼ阻害剤は、IPIV阻害剤である。該細胞組成物は、追加の因子とともに、同時にか、順次にか、又は別個にかのいずれかで、投与してよい。該方法は、動物における、インスリン抵抗性、グルコース不耐性又はグルコース非応答性、高血糖、肥満、高脂血症、及び高リポタンパク質血症のような状態に付随する疾患を治療するのに用いてよい。
【0048】
好適実施態様では、PYY治療薬は、膵臓系譜の不応細胞にグルコース応答性を誘導する。もう一つの好適実施態様では、PYY治療薬は、膵始原細胞の成熟を生起することによって、グルコース応答性を増強する。もう一つの好適実施態様では、PYY治療薬は、分娩後の動物からの、部分的にグルコース不耐性であるか、インスリン低発現性である膵β細胞のグルコース応答性を増強する。更にもう一つの好適実施態様では、PYY治療薬は、分娩後の動物からの、欠陥のある膵細胞のグルコース応答性を回復させる。
【0049】
もう一つの態様では、本発明は、脊椎動物からの未分化な細胞をPYY治療薬に接触させることによって細胞培養中に生成された、分化したβ細胞を提供する。好適実施態様では、本発明は、移植に用いるための、グルコースに応答してインスリンを分泌する膵β細胞、及び動物への製剤投与に適する、製薬上許容され得る担体を提供するが、該細胞組成物は、グルコースに応答してin vivoでインスリンを分泌することができる。
【0050】
本発明は、更に、PYYタンパク質の組合せ突然変異体のセットはもとより、断端突然変異体のライブラリーを生成する方法を企図し、PPタンパク質に対する受容体に結合する際に機能的であり、膵島又は細胞のグルコース応答性を変化させる、潜在的な変異体配列(例えば同族体又は類似体)を特定するのに特に役立つ。そのような組合せライブラリーをスクリーニングする目的は、例えば、作用薬若しくは拮抗薬のいずれかであるか、又はこれに代えて、全く新規な活性を有する、新規なPYY同族体若しくは類似体を生成することである。例示すると、PYY同族体又は類似体は、本方法によって、同類受容体とのより効果的な結合を提供するが、PYYに関連する活性の少なくとも一部をなおも保持するように加工することができる。したがって、組合せにより誘導された同族体は、タンパク質の天然に産する形態よりも増強された効力を有するよう容易に生成することができる。同様に、PYY同族体又は類似体は、本発明の組合せの取組み方によって、例えば、他の細胞外基質成分(例えば受容体)との結合を模倣できるが、いかなる生物学的応答も誘導できないために、真正のPYY治療薬の作用を阻害するという点で、拮抗薬として作用するよう生成することができる。その上、本方法によるPYYの一定のドメインの操作は、融合タンパク質、例えば細胞外基質に由来するか、及び/又は細胞外基質成分に結合する、他のタンパク質の部分を組み込んだそれに用いるのにより適するドメインを提供することができる。
【0051】
この方法の一態様では、PYYの同族体、類似体その他の関連タンパク質の集団についてのアミノ酸配列を、好ましくは可能な限り最高の相同性を促進するよう整列させる。変異体のそのような集団は、例えば、グルコース応答性を誘導できる、1種類又はそれ以上の種からのPYY同族体を包含する。整列させた配列の各位置に出現するアミノ酸を、組合せ配列の縮重したセットを生成するように選ぶ。好適実施態様では、核酸レベルでの組合せ突然変異誘発によって、PYY変異体の斑入りのライブラリーを生成し、斑入りの遺伝子ライブラリーによってコード化する。例えば、可能性のあるPYY配列の縮重したセットが、個々のポリペプチドとしてか、又はこれに代えて、PYY配列のそのセットを含む、より大きい融合タンパク質のセット(例えばファージ表示のため)として発現可能になるように、合成オリゴヌクレオチドの混合物を遺伝子配列中に酵素的に結合することができる。
【0052】
更にもう一つの実施態様では、本発明は、PYY誘導経路が、拮抗性PYYポリペプチドの発現、又はPYY治療薬をコードしている遺伝子の破壊のいずれか一方によって、その1種類又はそれ以上の組織で阻害されている、ヒトでないトランスジェニック脊椎動物を提供する。
【0053】
好適実施態様では、始原細胞は、膵β細胞へと分化するよう誘導可能である。対象となる膵β細胞を、特異的な抗原マーカー、又は細胞表面で発現され得るその他のマーカー、例えばインテグリン、レクチン、ガングリオシド若しくは輸送体に基づいてか、又は特異的な細胞形態学に基づいて特徴付けることもできる。これらの手法は、すべて、当業者には公知かつ利用可能である。そのような膵β細胞は、一定の状況では、STF−1のようなホメオドメイン型の転写因子;PAX6のようなPAX遺伝子(類);PTF−1;hXBP−1;HNF遺伝子(類);ビリン;チロシンヒドロキシラーゼ;インスリン;グルカゴン;及び/又は神経ペプチドYのうち一つ若しくはそれ以上の発現によって特徴付けられる可能性がある。
【0054】
好適実施態様では、本発明の対象となる動物は、哺乳動物、好ましくはヒトである。
【0055】
(ii) 定義
便宜のために、本明細書、実施例、及び付記されたクレームに用いられる一定の用語を、ここに採集する。
【0056】
用語「作用薬」は、本明細書に用いられる限りで、少なくとも一つのPYY生物活性を上向調節する(例えば模倣又は増強する)作用因を意味するものとする。PYY作用薬は、野生型PYYタンパク質、若しくは野生型PYYタンパク質の少なくとも一つの生物活性を有するその誘導体、又はPYY活性として機能する(例えば模倣する)、PYYのペプチド模倣体であることができる。PYY作用薬は、PYY遺伝子の発現を上向調節するか、又はPYYタンパク質の少なくとも一つの生物活性を増大させる化合物であることもできる。したがって、PYY作用薬は、グルコースに応答してインスリンの産生及び/又は分泌を上向調節する作用因を包含する。作用薬は、PYYポリペプチドと、もう一つの分子、例えばPPファミリー受容体との相互作用を増強するか、又は未変性PYYによるPYY受容体との結合、若しくはそれの歪曲を模倣する化合物であることもできる。もう一つの例示的な作用薬は、PYY若しくはPYY受容体遺伝子の上流領域とのPYY若しくはPYY受容体転写因子のか、又はインスリン遺伝子の上流領域とのインスリン遺伝子転写因子の結合を増強し、それによってインスリンタンパク質の合成を増強する化合物である。作用薬は、PYY若しくはインスリン遺伝子の発現を上向調節するか、又は例えばタンパク質合成を増大させるか、若しくはタンパク質の代謝回転を低下させることによって、存在するPYY若しくはインスリンの量を増加させる化合物であることもできる。更に、PYY作用薬は、PYY拮抗薬阻害剤であることができる。
【0057】
「α細胞」は、膵臓内のランゲルハンス島に見出される。α細胞は、インスリンのそれと反対の効果を有するホルモンである、グルカゴンを分泌する(それは血中グルコースレベルを上昇させる)。
【0058】
用語「血中グルコースレベル」は、血液中のグルコースの濃度を意味する。正常な血中グルコースレベル(正常血糖)は、約120mg/dlである。この値は、非糖尿病者では30mg/dlも変動する。
【0059】
本明細書に用いられる限りで、用語「動物」は、脊椎動物、好ましくは哺乳動物、最も好ましくはヒトを意味する。同様に、本発明の方法によって治療しようとする「患者」又は「対象者」は、ヒト、又はヒトでない動物のいずれを意味することもできる。
【0060】
用語「拮抗薬」は、本明細書に用いられる限りで、少なくとも一つのPYY生物活性を下向調節する(例えば抑制又は阻害する)作用因を意味するものとする。PYY拮抗薬は、PYYタンパク質と、もう一つの分子、例えばPYY受容体との相互作用を阻害若しくは低下させる化合物であることができる。これに代えて、好適な拮抗薬は、PYY若しくはPYY受容体遺伝子の上流領域とのPYY若しくはPYY受容体転写因子のか、又はインスリン遺伝子の上流領域とのインスリン遺伝子転写因子の結合を阻害若しくは低下させ、それによってインスリンタンパク質の合成を遮断する化合物である。拮抗薬は、PYY若しくはインスリン遺伝子の発現を下向調節するか、又は例えばタンパク質合成を低下させるか、若しくはタンパク質の代謝回転を増大することによって、存在するPYY若しくはインスリンの量を減少させる化合物であることもできる。PYY拮抗薬は、PYYポリペプチドの優性陰性形態であることができる。PYY拮抗薬は、PYYポリペプチドの優性陰性形態をコードしている核酸、PYYアンチセンス核酸、又はPYYRNAと特異的に作用し合えるリボザイムであることもできる。更に別のPYY拮抗薬は、PYYポリペプチド、又はその受容体に結合し、その作用を阻害する分子である。そのような分子は、ペプチド、抗体、及び小さい分子を包含する。
【0061】
用語「β細胞」又は「膵β細胞」は、本明細書に用いられる限りで互換性があり、膵島内の、グルコースに応答してインスリンを産生する細胞の系譜に属する細胞を意味する。β細胞は、膵臓内のランゲルハンス島に見出される。β細胞は、血中グルコースレベルに応答して、調節された様式でインスリンを分泌する。I型又はインスリン依存性糖尿病(IDDM)では、β細胞は、自己免疫過程を通じて破壊される。身体は、内因性インスリンをもはや産生できないため、正常な血中グルコースレベルを維持するために外来性インスリンの注射を必要とする。
【0062】
「生物学的活性」又は「生物活性」又は「活性」又は「生物学的機能」は、互換的に用いられ、本明細書での目的には、(その未変性の配座であれ、変性した配座であれ)PYY治療薬が、又はその何らかの結果が直接若しくは間接的に実行する、エフェクター又は抗原の機能を意味する。生物学的活性は、PYYで誘導される転写因子によって調節される、標的核酸、例えば遺伝子の上流領域との結合を包含する。PYY生物活性は、PYYポリペプチドに影響を直接及ぼすことによって、調整することができる。これに代えて、PYY生物活性は、PYYポリペプチドのレベルを調整すること、例えば、PYY遺伝子の発現を調整すること、又はPYYタンパク質の代謝回転を調整することによって、調整することができる。
【0063】
本明細書に用いられる限りで、用語「細胞組成物」は、細胞の調製品を意味し、細胞に加えて、細胞培養の培地の非細胞成分、例えばタンパク質、アミノ酸、核酸、ヌクレオチド、補酵素、抗酸化剤、金属などを包含してよい。更に、細胞組成物は、細胞成分の増殖又は生存性には影響しないが、細胞を特定の体裁にさせるために、例えば封入のための重合体性基質、又は製剤調製品として、用いられる成分を有することができる。
【0064】
用語「培地」は、当技術に認められており、一般的には、生細胞の培養に用いられるいかなる物質又は調製品をも意味する。したがって、「組織培養」は、組織(例えば器官原基又は成体器官の外植片)の、その構造及び機能を保存するようなex vivoでの維持若しくは成長を意味する。「細胞培養」は、細胞は増殖するが、それ自体では組織へと組織化されない、細胞のex vivo又はin vivoでの成長(増殖)を意味する。
【0065】
主題の微小器官外植片や、増幅された始原細胞又はβ細胞の集団の組織及び細胞培養調製品は、様々な体裁をとることができる。例えば、「懸濁培養」は、適する培地に懸濁されつつ細胞が累増する、培養を意味する。同様に、「連続流培養」は、細胞増殖、例えば生存率を維持するための新鮮な培地の連続流の中での、細胞、又は管の外植片の培養を意味する。用語「調整培地」は、細胞によって産生され、培地中に分泌された一定の傍分泌及び/又は自己分泌因子を含むよう、培地を変化させるために、ある期間培養細胞と接触させた後に得られた、例えば培養細胞/組織を含まない、上清を意味する。
【0066】
用語「DPIV阻害剤」は、本明細書では、プロテアーゼ阻害剤、好ましくはセリンプロテアーゼ阻害剤、例えばペプチジルホウ酸(ボロプロリン)、ペプチジルアルデヒド、ペプチジルクロロメチルハライドなどを包含するとされる。
【0067】
「細胞の増強分化」によって、本来の細胞のそれと異なる一つ又はそれ以上の特徴性若しくは機能の獲得若しくは保有(すなわち細胞分化)の程度を増大させる作用を意味させる。これは、細胞の表現型の変化についてスクリーニングする(例えば、細胞、及び/又は細胞の表面マーカーの形態学的変化を特定する)ことによって、検出することができる。
【0068】
「細胞の生存又は維持を増強する」によって、本来の細胞のそれと同じである一つ又はそれ以上の特徴性若しくは機能の保有(すなわち細胞表現型維持)の程度を増大させる段階を包含する。
【0069】
用語「外植片」は、身体から取り出され、人工的な培地で成長させられた器官の一部を意味する。
【0070】
「高血糖」(高い血糖値)の状態は、血中グルコースレベルが高過ぎる状態である。代表的には、高血糖は、血中グルコースレベルが、約180ml/dlを越えて上昇したときに生じる。高血糖の症状は、頻尿、過度の渇き、及びより長い期間にわたる体重の喪失を包含する。
【0071】
一方、「低血糖」(低い血糖値)は、血中グルコースレベルが低過ぎる状態である。代表的には、低血糖は、血中グルコースレベルが、70mg/dlより低く降下したときに生じる。低血糖の症状は、不機嫌、(特に手や腕の)四肢の麻痺、錯乱、震え又は眩暈を包含する。この状態は、利用できるグルコースの量を超える、過剰量のインスリンが存在するときに生じるため、ときにはインスリン反応と呼ばれる。
【0072】
用語「損なわれたグルコース耐性」は、グルコース耐性試験を受けたときに、正常と高血糖との間に属する血中グルコースレベルを有する人物を記載するのに用いられる。そのような人物は、糖尿病を有するとは見なされないが、糖尿病を発症する危険性が比較的高い。
【0073】
本明細書に用いられる限りで、用語「遺伝子」又は「組換え遺伝子」は、本発明のポリペプチドをコードしている、エキソン及び(場合により)イントロン配列の双方を包含する読取り枠を含む、核酸を意味する。「組換え遺伝子」は、そのような調節ポリペプチドをコードしている、染色体DNAにいずれも由来するイントロン配列を場合により含む、核酸を意味する。
【0074】
本明細書に用いられる限りでの用語「グルコース非応答性の」又は「グルコース非応答性」は、細胞、島又は動物がグルコースの処置若しくは投与に全く応答できないこと、並びに(例えば、グルコースに応答して充分なレベルのインスリンを産生しないか、又は正常なレベルで応答するのに有意に高いレベルのグルコースを必要とする細胞による)グルコースに対する応答の低下の双方を記載する。
【0075】
本明細書に用いられる限りで、「異種DNA」又は「異種核酸」は、天然には、それが存在するゲノムの一部としては産しないか、又はそれが天然に産するのとは異なるゲノム中の単数若しくは複数の位置で見出される、DNAを包含する。異種DNAは、それを導入しようとする細胞に対しては内因性ではないが、別の細胞から得られている。一般に、必ずしもではないが、そのようなDNAは、通常は、それを発現させる細胞によって産生されないRNA及びタンパク質をコードしている。異種DNAは、外来DNAと呼ばれることもある。それを発現させる細胞に対して異種若しくは外来性であると当業者が認めるか、又は見なすと思われる、いかなるDNAも、本明細書では、異種DNAに包含される。
【0076】
用語「系譜に傾倒した細胞」は、もはや多能性ではなくて、特定の細胞型、例えば膵、肝又は腸細胞に分化するよう誘導されてしまった始原細胞を意味する。
【0077】
本明細書に用いられる限りで、用語「核酸」は、デオキシリボ核酸(DNA)、及び適切な場合、リボ核酸(RNA)のようなポリヌクレオチドを意味する。この用語は、ヌクレオチド類似体から作成されたRNA又はDNAのいずれかの類似体、及び説明しようとする実施態様に適用できる限りで、(センス又はアンチセンスのような)一本鎖及び二本鎖ポリヌクレオチドを、等価物として、包含するとも理解しなければならない。
【0078】
用語「器官」は、ある種の形態の細胞−細胞及び/又は細胞−基質相互作用を維持して、微細構造を形成する、組織の2枚又はそれ以上の隣接する層を意味する。
【0079】
用語「膵臓」は、当技術に認められており、一般的には、胃の後方、脾臓と十二指腸との間に横断的に位置する、大きく細長い、ブドウ状の腺を意味する。膵臓の外分泌機能、例えば外的分泌は、消化酵素源を与える。実際、「パンクレアチン」は、酵素、主としてアミラーゼ、プロテアーゼ及びリパーゼを含有する、消化助剤として用いられる、膵臓からの物質を意味する。外分泌部分は、腔を囲むいくつかの漿液性細胞で構成される。これらの細胞は、トリプシノーゲン、キモトリプシノーゲン、カルボキシペプチダーゼ、リボヌクレアーゼ、デオキシリボヌクレアーゼ、トリアシルグリセロールリパーゼ、ホスホリパーゼA2、エラスターゼ及びアミラーゼのような消化酵素を合成かつ分泌する。
【0080】
用語「膵細胞」は、膵細胞が通常産生するホルモン又は酵素を産生できる細胞、例えば、少なくとも部分的に分化したα、β、δ又はPP細胞、及び膵細胞が通常産生するホルモン又は酵素を産生できる細胞へと分化できる細胞、例えば膵前駆細胞を意味する。一実施態様では、膵細胞は、グルカゴン及び/又はソマトスタチンを産生できる能力を特徴とする。本発明の膵細胞は、対象者に投与する前に、細胞の増殖及び分化を促進する条件下で培養することもできる。これらの条件は、細胞を培養して、細胞が、擬似的な島様の凝集体又は集塊を形成し、インスリン、グルカゴン及びソマトスタチンを分泌する時点でのin vitroでの増殖及び密集を許すことを包含する。
【0081】
用語「膵内分泌細胞」は、膵臓ホルモンを分泌する膵細胞(例えばα、β、δ又はPP細胞)を意味する。例えば、本発明の膵内分泌細胞は、グルコースに応答してインスリンを産生するようPYYで処理した、胎児性β細胞又は分娩後β細胞であってよい。
【0082】
用語「膵始原細胞」は、膵臓系譜の細胞、例えば、膵細胞が通常産生するホルモン又は酵素を産生できる細胞へと分化することができる細胞を意味する。例えば、膵始原細胞は、少なくとも部分的には、α、β、δ若しくはφ細胞、又は外分泌性になる運命の細胞へと分化させ得る。膵始原細胞は、対象者に投与する前に、細胞の増殖及び分化を促進する条件下で培養することもできる。これらの条件は、細胞を培養して、細胞が、擬似的な島様の凝集体又は集塊を形成し、インスリン、グルカゴン及びソマトスタチンを分泌する時点でのin vitroでの増殖及び密集を許すことを包含する。細胞増殖を測定する方法は、当技術に周知であり、最も一般的には、細胞複製のDNA合成の特徴性を決定することを包含する。当技術には、DNA合成を測定するための無数の方法があり、いずれを本発明に従って用いてもよい。本発明の一実施態様では、DNA合成は、放射性標識(3H−チミジン)、又は標識化されたヌクレオチド類似体(BrdU)を免疫蛍光による検出に用いて決定している。しかしながら、DNA及びRNA合成の測定に加え、それぞれの胎児細胞又は始原細胞の集団を特徴付けるための根拠として、インスリン分泌に依拠することができ、好ましくはそうすることになる。
【0083】
始原細胞は、培地での自己再生、及び膵臓系譜への分化のための能力を特徴とする。例えば、始原細胞は、例えば剖検によって単離された、小葉内膵管外植片から単離することができるか、又はそのような細胞の細胞培養による子孫である。始原細胞は、膵島細胞、例えばβ島細胞、α島細胞、δ島細胞又はφ島細胞に分化するよう誘導することができる。そのような膵始原細胞は、一定の状況では、STF−1のようなホメオドメイン型の転写因子;PAX6のようなPAX遺伝子(類);PTF−1;hXBP−1;HNF遺伝子(類);ビリン;チロシンヒドロキシラーゼ;インスリン;グルカゴン;及び/又は神経ペプチドYのうち一つ若しくはそれ以上の発現を特徴としてよい。好適な始原細胞は、哺乳動物を起源とすることになり、例えば、ヒトのような霊長類、ミニブタ、若しくはトランスジェニック哺乳動物から単離された細胞、又はそのような細胞の細胞培養による子孫である。膵管性組織は、患者から単離し、膵始原細胞(又はそれらに由来する分化した細胞)の結果的な培養を与えるために、本方法に付してよい。遺伝子置換その他の遺伝子療法は、ex vivoで実施され、単離された細胞は、当初の提供者である患者、又は第二の宿主患者に戻し移植される。
【0084】
一般に、「有幹性」と、内分泌及び外分泌細胞へと分化できる能力とを維持しつつ、膵管上皮の複製可能な拡大を許す培養系を用いてよい。膵管上皮は、例えば外植片又は酵素消化によって得て、密集まで培養する。密集細胞集団は、培養集団内で始原細胞の分化を生起する作用因、例えば成長因子のような栄養因子に接触させる。次いで、この作用因に応答して増殖する、外植片からの始原細胞を、例えば、外植片の残余からの新たに出現する芽の直接の機械的分離、又は外植片の全部若しくは一部の溶解、及びその後の始原細胞集団の単離によって単離する。作用因は、フォルスコリン、ジブチルcAMP、酪酸ナトリウム、デキサメタゾン若しくはコレラ毒、又はIGF、TGF、FGF、EGF、HGF、ヘッジホッグ若しくはVEGFその他のTGFβスーパーファミリー、好ましくはDVR(dpp及びvg1関連)ファミリーの一員、例えばBMP2及び/又はBMP7のような成長因子であってもよい。上記により、本発明のもう一つの態様は、主題の始原細胞の子孫、例えば、最初の外植片の培養体の細胞に由来する細胞に関する。そのような子孫は、始原細胞のその後の世代はもとより、主題の始原細胞を、外植片からのそれらの単離後に分化を誘導することによって生成された、例えばin vitroで誘導された、系譜傾倒細胞を包含することができる。
【0085】
例示的な生存始原細胞、及びそのような細胞を膵管組織から単離する方法は、引用により本明細書に組み込まれる、米国仮特許出願弁理士整理番号第ONV-060.60号に提供されている。略述すると、ラット膵臓からの小管を、コラゲナーゼA又はコラゲナーゼH(Boehringer-Mannheim)中の酵素消化の後に単離し、洗浄し、HBSS(Ca/Mg含まぬ)に再懸濁させ、500μmのメッシュ越しに注いで、大きい粒子を除去し、再び洗浄する。より年長の動物(2週以後)に対しては、消化物をHBSSに再懸濁させ、100mmのプレートに入れる。浮遊する管の断片をピペットを用いて手動で単離する。より高い収率のためには、2週のラット仔からの膵臓を、Percoll(Pharmacia)上で分離することができる。ラット仔からの消化された膵臓を、40%のPercoll溶液上に敷き、1,900rpmで10分間遠心分離する。管断片を、試験管頂の緩衝液とPercollとの境界面に置く。この材料を洗浄し、100mmの皿に入れる。混入する島(非常に少数)を、手動で除去する。断片(単細胞を含む)を、再び洗浄し、培養のために平板播種する。管断片は、5%FBS及びペニシリン/ストレプトマイシン添加Iscoves修正DMEM中で優先的に培養される。理想的には、細胞を、5日間培養して、密集単層を達成すると、次いで分化するよう誘導することができる。単層全体の密集は、不可欠ではなく、分化は、密集細胞のいかなるパッチにおいても生じることができる。単層は、成長を促進するためのEGF(10ng/ml)又はTGF−α(10ng/ml)の存在下で、成長させることができる。分化の誘導は、cAMP依存性であると考えられる。細胞内cAMPレベルの上昇を誘導する作用因は、分化を誘導することが期待される。デキサメタゾン、コレラ毒、フォルスコリン、ジブチルcAMP及び酪酸ナトリウムは、すべて、試験され、分化を誘導することが見出されている。分化の誘導は、48時間の1回処理で優先的に実施される。始原細胞は、48時間の処理の経過にわたって出現する。処理は、24時間でも実施することができて、始原細胞を生じる。
【0086】
用語「%同一である」は、二つのアミノ酸配列、又は二つのヌクレオチド配列の間の配列同一性を意味する。同一性は、それぞれ、各配列中の、比較を目的として整列させ得る位置を比較することによって決定することができる。比較される配列中の同等の位置が、同じ塩基又はアミノ酸で占められているときは、分子はその位置が同一であり;同等部位が、同じであるか、又は類似のアミノ酸残基(例えば空間的及び/又は電子的性質が類似)によって占められているときは、分子はその位置が相同である(類似する)と呼ぶことができる。相同性/類似性又は同一性の百分率としての表現は、比較される配列が共有する位置で同一であるか、又は類似するアミノ酸の数の関数を意味する。FASTA、BLAST又はENTREZを包含する、様々な整列のアルゴリズム及び/又はプログラムを用いてよい。FASTA及びBLASTは、GCG配列分析パッケージ(University of Wisconsin, Madison, Wis.)の一部として入手可能であり、例えば不履行の設定で用いることができる。ENTREZは、National Center for Biotechnology Information, National Library of Medicine, National Institute of Health, Bethesda, MDを通じて利用可能である。一実施態様では、2配列の同一性百分率は、GCGプログラムによって、ギャップ加重を1として、例えば、各アミノ酸のギャップを、2配列間の単一のアミノ酸又はヌクレオチドの不適合であるかのように加重することによって決定することができる。
【0087】
本明細書に用いられる限りで、「表現型」は、例えば何らかの一形質、又は何らかの形質群を有する、細胞の物理的、生化学的及び生理学的成り立ち全体を意味する。
【0088】
用語「始原細胞」は、多数の母細胞(次いで、分化したか、又は分化し得る娘細胞を生じることができる)を生成できる能力を有する未分化の細胞を意味する。本明細書に用いられる限りで、用語「始原細胞」は、ときには当技術において「幹細胞」と呼ばれる細胞を包含することも意図される。好適実施態様では、用語「始原細胞」は、その後代(子孫)が、分化によって、例えば、胚の細胞及び組織の累進的多様化の際に生じるとおり、完全に個体的特徴性を獲得することによって、しばしば異なる方向に特殊化する一般化された母細胞を意味する。
【0089】
用語「対象者」は、不充分なインスリン活性を特徴とする疾患に罹患し易い哺乳動物、特にヒトを包含することが意図される。
【0090】
本明細書に用いられる限りで、始原細胞に関しての用語「実質的に純粋な」は、全細胞集団を構成する始原細胞に関して、約75%以上、好ましくは約85%以上、より好ましくは約90%以上、最も好ましくは約95%以上純粋である、始原細胞の集団を意味する。換言すれば、用語「実質的に純粋な」は、その後の培養及び増幅の前の、増幅かつ単離されていない集団中に、約20%未満、より好ましくは約10%未満、最も好ましくは約5%未満の系譜傾倒細胞を含有する、本発明の始原細胞の集団を意味する。
【0091】
用語「組織」は、同様に特殊化した、まとまって一定の特別の機能を実行する、一群又は一層の細胞を意味する。
【0092】
用語「移植片」は、本明細書に用いられる限りで、動物に導入され、同種異系のか、自己のか、又は異種のそれであってよい細胞、組織若しくは装置を包含することが意図される。
【0093】
「転写調節配列」は、それらを機能的に結合するタンパク質コーディング配列の転写を誘導若しくは制御するDNA配列、例えば開始シグナル、エンハンサー及びプロモーターを表すために、本明細書全体を通して用いられる総称的用語である。好適実施態様では、組換え遺伝子の転写は、その中で発現が意図される、ある細胞型でのその組換え遺伝子の発現を制御する、プロモーター配列(又は他の転写調節配列)の制御下にある。この組換え遺伝子は、天然に産する形態のタンパク質の転写を制御する配列と同じであるか、又は異なる、転写調節配列の制御下にあることができることも理解されると思われる。
【0094】
本明細書に用いられる限りで、用語「ベクター」は、それが結合されている、もう一つの核酸を輸送することができる核酸分子を意味する。好適なベクターの一つの種類は、エピソーム、すなわち、染色体外複製が可能な核酸である。好適なベクターは、それが結合されている核酸の自律的複製及び発現が可能なそれである。それが機能的に結合されている遺伝子の発現を指図することができるベクターは、本明細書では、「発現ベクター」と呼ばれる。一般に、組換えDNAの手法で利用価値のある発現ベクターは、環状の二本鎖DNAの、そのベクター形態では染色体に結合されていないループを意味する、「プラスミド」の形態をなすことが多い。本明細書では、「プラスミド」及び「ベクター」は、プラスミドが最も一般的に用いられる形態のベクターであるため、互換的に用いられる。しかし、本発明は、同等の機能に役立ち、今後は当技術に公知になる、発現ベクターのそのような他の形態も包含することが意図される。
【0095】
追加的な用語は、適切な場合は、下記に定義される。
【0096】
(iii) 例示的なPYYペプチド及びPYY作用薬
PYYは、発生中のマウス及びラット膵では、膵臓ポリペプチドファミリーの支配的なホルモンである。それは、神経ペプチドY(NPY)及び膵臓ポリペプチド(PP)も包含する、タンパク質のPPファミリーの一員である。ヒトPYYに対する配列は、
YPIKPEAPGEDASPEELNRYYASLRHYLNLVTRQRY(SEQ ID No:1)
で示される。
【0097】
PYYは、腸の運動性、及び胃腸管及び膵臓への腸間膜血流を阻害し、胃、膵臓及び腸の外分泌性の分泌を媒介し、正味の吸収を刺激する[例えば、Laburthe (1990) Trends Endocrinol. Metabol. 1:168;Lundberg, J.M. et al. (1982) Proc. Natl. Acad. Sci. USA 79:4471-75;Suzuki, T. (1983) Gastroenterology 85:114-21;Pappas, T.N. (1985) Am. J. Physiol. 248:G118-G123;Cox et al. (1990) Br. J. Pharmacol. 101:247;Playford et al. (1990) Cancer 335:1555;McFayden et al. (1986) Neuropeptides 7:219を参照されたい]。PYYは、様々な動物でCCK、インスリン及びグルカゴンの放出を阻害することも示されている[Lluis, F. et al. (1988) Gastroenterology 94:137-44;Guo, Y.S. et al. (1988) Pancreas 3:128-34;Botteher, G. et al. (1989) Pancreas 4:282-88;Guo, Y.S. et al. (1989) Gastroenterology 96:690-94;Greeley et al. (1988) Am. J. Physiol. 254:E513-17]。PYYmRNAは、ラットのe15、及びマウスのe10.5に、膵内分泌細胞で検出されていて、ピークPYYmRNAレベルは、妊娠後期に発生し、成体ラットではより低いレベルで存続する[Krasinski, S. et al. (1991) Mol. Endocrinol. 5:433-40;Upchurch, B.H. (1994) Development 120:245-52]。PYY細胞は、NPY及びPP細胞より早期に出現し、より多量であり、PYYが最も早く発現される膵臓ホルモンであることを示唆している[Jackerott, M. (1996) J. Histochem. and Cytochem. 44(8):809-17]。マウスでは、PYYは、発生の際、すべての島細胞型で発現され、主要な4細胞型のすべてが、共通のPYY産生多ホルモン性始原細胞から発生することを示唆している[Myrsen-Axcrona、前掲;Upchurch et al.、前掲]。例えば、PYY、インスリン及びグルカゴンは、胚の初期段階(e12〜e15)では同じ島細胞内に存在するが、インスリン−及びグルカゴン−含有細胞の別個の集団の形成後(e16〜P0)は、島の非β細胞(主としてグルカゴン含有細胞)に限定される[Myrsen-Axcrona et al.、前掲]。これらの知見は、インスリン含有細胞が、グルカゴン及びPYYを同時発現する細胞から分化することを示唆している[Myrsen-Axcrona et al.、前掲]。
【0098】
主題の方法は、未変性の精製されたペプチドYY若しくは組換えペプチドYY、又はそのフラグメントはもとより、そのペプチド模倣体を用いて実施することができる。ペプチドのチロシンチロシン又はペプチドYY(「PYY」)は、36アミノ酸残基のペプチドアミドであり、ブタの腸から初めて単離され、専ら遠位の腸の粘膜内分泌細胞で定位され、近位の腸及び膵臓でも産生される[Tatemotu et al. (1982) Proc. Natl. Acad. Sci. USA 79:2514;Aponte, G.W. et al. (1989) FASEB J. 3:1949-55]。PYYの同族体及び類似体は、突然変異誘発、例えば不連続点突然変異によってか、又は断端によって生成することができる。例えば、突然変異は、PYYの、実質的に同じ生物学的活性、又はその単なるサブセットを保持する同族体を生じることができる。これに代えて、天然に産する形態のPYYの機能を、例えばPYYの同族受容体に競合的に結合し、こうしてシグナル導入を遮断することによって阻害することができる、このタンパク質の拮抗薬形態を生成することができる。加えて、構成的に活性を有する、PYYの拮抗薬形態を生成してもよい。したがって、PYY及びその同族体は、膵島又はβ細胞におけるグルコース応答性の、陽性又は陰性のいずれの調節因子でもあり得る。
【0099】
ヒトPYY及びそのフラグメントは、商業的に購入することができる(Bachem California 1993-1994 Catalogue, Torrance, CA;Sigma Peptide and Amino Acids 1994 Catalogue, St. Louis, MO)。PYYの類似体及び模倣体は、ペプチド技術の当業者に公知である多くの手法によって、合成してもよい。利用できる多くの手法の要約が、Solid Phase Peptide Synthesis 2nd ed.(Stewart, J.M. & Young, J.D., Pierce Chemical Company, Rockford, IL, 1984)に見出し得る。その他のPYY類似体は、当技術に通常の技量を有する者の能力の範囲内で、適切な修正を施すことによって製造することができる。
【0100】
一般に、本明細書ではPYYの活性を有する(例えば「生物活性」を有する)と称されるポリペプチドは、PYYのアミノ酸配列の全部又は一部に相当する(例えば同一又は相同である)アミノ酸配列を有し、天然に産するPYYタンパク質の生物学的/生化学的活性の全部又は一部を模倣又は中和する、ポリペプチドとして定義される。そのような生物学的活性は、誘導若しくは増強されたインスリン産生によって立証されるとおりのグルコース応答性の誘導又は増強、又はその他の、例えば、STF−1のようなホメオドメイン型の転写因子;PAX6のようなPAX遺伝子(類);PTF−1;hXBP−1;HNF遺伝子(類);ビリン;チロシンヒドロキシラーゼ;インスリン;グルカゴン;及び/若しくは神経ペプチドYのような、β細胞分化の指標を包含する。
【0101】
PYY類似体の生物活性は、例えば、PYY類似体とその同族受容体との相互作用によって開始されるシグナル導入カスケードの下流の構成要素としての、遺伝子の転写率を変えられる能力を包含してもよい。
【0102】
PYY治療薬のその他の生物学的活性は、本明細書に説明されるか、又は当業者には合理的に明白であると思われる。
【0103】
完全長ポリペプチドの一部を表すPYYポリペプチドは、天然に産する形態のタンパク質の生物学的活性の(例えば模倣又は増強する)作用薬、又はこれに代えて拮抗薬のいずれかであることができ、例えば、該ポリペプチドは、分化、及び/又は真正PYYタンパク質に対するグルコース応答性を調整することができる。主題のPYYタンパク質の同族体は、例えば、潜在的な切断配列を変化させるか、又は該タンパク質に付随する酵素活性を不活性化する突然変異によるような、タンパク質分解性の切断に耐性を有する、該タンパク質のバージョンを包含する。
【0104】
完全長ポリペプチドの部分を表し、グリコシル化されたか、又は逆に、糖鎖形成を排除するための発現系の選択、若しくはタンパク質配列の修飾によって還元された、炭水化物の類似体であることができる、本発明のPYYポリペプチドを提供することもできる。グリコシル化された形態は、グリコサミノグリカン鎖を有する誘導体化を包含する。
【0105】
主題のタンパク質は、キメラ性分子として、例えば融合タンパク質の形態で提供することもできる。例えば、PYYタンパク質は、第二のポリペプチド部分、例えばPYYに無関係のアミノ酸配列を有する、第二のポリペプチドを含む組換え融合タンパク質として提供することができ、例えば第二のポリペプチド部分は、グルタチオンSトランスフェラーゼであり、例えば第二のポリペプチド部分は、アルカリ性ホスファターゼのような酵素活性であり、例えば第二のポリペプチド部分は、エピトープタグである。
【0106】
膵腫瘍の治療の際に、天然のペプチドの持続性、効果、生物学的活性及び選択性を模倣かつ増強する、PYYの類似体が報告されている[米国特許願第5,574,010号明細書を参照されたい:引用により本明細書に組み込まれる]。
【0107】
(iv) PYY治療薬の例示的な使用
一態様では、本発明は、本発明の膵細胞培養の利用を伴う治療方法を提供する。例えば、本発明は、血糖レベルを変化させる方法であって、本発明によって生成された膵内分泌細胞の細胞培養体を動物に投与することを含む方法を提供する。血糖レベルを変化させるために用いられる細胞培養体は、膵内分泌細胞の初代細胞培養体、又はその継代培養体であってよい。培養された本発明の膵内分泌細胞は、グルコース濃度に応答してインスリンを分泌する、β細胞を包含する。
【0108】
一定の実施態様では、主題の方法は、妊娠のe21日とほぼ同等な発生段階の胚(好ましくは「ヒト化された」ヒトでない哺乳動物のそれ)から得られた細胞の、単離された集団を利用する。胚から得られた膵細胞は、例えばPYY治療薬の存在下で非インスリン分泌性である、単層の付着細胞として培養することができる。これらの細胞は、密集に到達するのを許したとき、島様の凝集体又は集塊を形成し、膵臓ホルモン、例えばインスリン、グルカゴン及びソマトスタチン、並びに酵素を分泌し始める。この時点で、そのような凝集体は、単離し、集積し、受容対象者に投与することができて、それらがインスリンを分泌する。好ましくは、それぞれ、約300〜500個の細胞を含有する、約100,000〜500,000の凝集体を用いて、一人のヒトを治療することができる。ヒトにおいては、6〜12週の胎児は、グルコースに応答しないが、17週と20週との間で、単相性の方式でインスリンを産生するよう誘導できることが立証されているが、この応答は弱い(1.6倍)。インスリンの二相性分泌は、出生後26〜44週に達成される[Otonkoski, T. et al., Diabetes, 1988 Mar., 37(3):286-91]。これは、ヒトの胎児膵が、妊娠の前半の間に既にグルコース応答性になっているが、二相性のインスリン放出は、産後の時期まで成熟を開始しないことを示唆する。血糖レベルを変化させる方法は、組織様形態で培養された膵内分泌細胞を用いて達成することもできる。そのような、個別のβ細胞としてか、又は他の細胞型と組み合わせてかのいずれかで培養された膵内分泌細胞は、自発的にか、又は当技術に公知の培養手法によって、密着した凝集体を形成することができる。そのような密着凝集体を、本明細書では「擬似島」と名付ける。好ましくは、擬似島は、当技術に公知の方法を用いて、適切な生体適合性基質、例えばコラーゲン中に包埋する。培養された膵内分泌細胞は、適切な生体適合性材料、例えばコラーゲンとの同時培養によって密着凝集体に形成することができるが、同時培養以前は、細胞は、遊離した懸濁液の形態をなす。いずれかの方法によって形成された細胞の密着凝集体を、「擬似組織」と名付ける。擬似組織は、哺乳動物に移植し、その中で、血糖レベルを変化させるよう機能することができる、生物学的に適合性である移植片を形成する。
【0109】
本明細書に記載された方法に従って調製され、下記に例示される、膵内分泌細胞の初代、二代及びその後のか、若しくはクローン性の培養体、又はその組合せは、そのような擬似組織として用いてよい。この方法は、膵内分泌細胞を擬似組織として、例えば哺乳動物に移植することを含み、擬似組織は、血管が形成され、血中グルコースレベルが充分に高いレベルに達しているときに、インスリンを分泌することによって、宿主の哺乳動物の血中グルコースレベルに応答する。擬似組織の血管形成は、擬似組織に血管が形成されなかった場合の実験では、血糖レベルが調節されなかったという点で、重要であると思われる。同様に、擬似組織の血管形成の遅延も、擬似組織が血糖レベルを調節できる能力を損なうように思われた。
【0110】
その他の実施態様では、本発明は、グルコース応答性インスリン分泌能を、そのような能力を必要とする哺乳動物に与える方法を対象とする。この方法は、一般的には、グルコースに応答してインスリンを分泌する、加工された細胞を、そのような哺乳動物に移植することを包含する。島の移植に現在用いられている手法は、本発明に従って加工された細胞の移植にも適用可能であると、本発明者らは提唱する。一つの方法は、加工された細胞の生体適合性コーティングへの封入を含む。この取組み方では、細胞を、封入された細胞を免疫学的応答から保護し、クローン的に加工された細胞の無制御の増殖を防止することにも役立つ、カプセル状のコーティング内に捕捉する。好適なカプセル封入の手法は、アルギン酸−ポリリシン−アルギン酸によるカプセル封入を含む。この手法を用いて作成されたカプセルは、一般的には、数百個の細胞を内容し、約1mmの直径を有する。
【0111】
代替的な取組み方は、加工された細胞とともにAmicon繊維を播種することである。細胞は、半透性である繊維の網目に捕捉され、こうして、マイクロカプセル封入体に似た方式で保護される[Altman, et al., 1986]。
【0112】
カプセル封入又は繊維播種に成功した後、一般的には約1,000〜10,000の細胞は、通常は大ゲージの針(23ゲージ)からの腹腔内への注射によって、腹腔内移植してよい。
【0113】
本発明者らが本発明の実施に利用し得るであろうと提案する多様な他のカプセル封入技術が開発された〔例えば、Lacyら(1991)Science 254:1782−84、およびSulivanら(1991)Science 252:718−21;WO9110470;WO9110425;WO9015637;WO9002580;米国特許第5,011,472号;米国特許第4,892,538号;WO8901967号(これらはいずれも本明細書に文献援用される)参照〕。現在市場で入手し得るサイトセラプティックス社(Cytotherapeutics)によって開発されたカプセル封入技術は、本発明に用いると有用であろう。さらに1つの血管装置が、マサチューセッツ州シュルーズベリ所在のバイオハイブリッド社(Biohybrid,of Shrewsbury,Mass.)によって開発されており、本発明の技術に適用し得る。
【0114】
哺乳動物にグルコース応答性インスリン分泌能を与えるために用い得る移植法に関して、最近、Lacyら、前掲;Sullivanら、前掲(これらはいずれも本明細書に文献援用される)に記載されている方法が特定の利点を有すると考えられる。これらは、最初がカプセル封入された膵島を皮下異種組織移植する方法、次が動静脈シャントとして血管系に連結し得る「人工膵臓」として膵島組織を長期移植する方法に関する。これらの移植法は、従来法の「膵島組織」の代わりに本明細書に開示されているような工学的に設計された細胞を用いて、本発明用に適合させると有利であろう。
【0115】
他の重要な実施態様は、インスリンの産生、特に、IDDMの治療に用い得るヒトインスリンの産生に本発明の工学的に設計された細胞を用いる方法に関する。いくつかの態様においては、工学的に設計された人工β細胞を培養して増殖させ、次いで、グルコールを含む緩衝液と接触させることにより、インスリンを産生するように細胞を刺激し、インスリンを分泌させ、これを周囲培地から回収して精製することができる。本発明のこの態様に関連して使用するためには、工学的に設計されたCTG−6細胞が特に有用であると考えられるが、グルコースに応答してインスリンを分泌するように造られた任意の細胞を用いてよい。本発明のさらなる態様は、患者、特にヒト患者のインスリン活性不全を特徴とする疾患または他の障害を治療する方法を含む。これらの方法は、患者に、PYY製剤と、インスリン産生細胞(例えば、β細胞)を含むか、または患者に投与した後でインスリン分泌細胞を形成するように分化する能力を有する単離された膵臓細胞集団とを投与することを含む。本明細書において、用語「導入」、「投与」および「移植」とは、細胞を所望の場所に送出する方法または経路にしたがって細胞を患者に送出することを表すように交換可能に用いられる。本明細書に用いられている限りにおいて、用語「治療する」とは、インスリン活性不全を特徴とする疾患の少なくとも1つの副作用または症状、例えば、絶対的もしくは相対的インスリン欠乏症、空腹時高血糖症、糖尿、アテローム性動脈硬化症の発症、小血管症、ネフロパシー、ニューロパシーを軽減もしくは緩和することを含む。本明細書に用いられている限りにおいて、用語「インスリン活性不全を特徴とする疾患」には、インスリン機能異常によるグルコースの異常利用が存在する疾患が含まれる。インスリン機能異常としては、インスリンの産生におけるすべての異常または不全、例えば、IDDM(I型糖尿病)におけるような細胞の減損に起因するインスリン欠乏症などの細胞オルガネラを介した発現および/もしくは輸送異常または不全、NIDDM(II型糖尿病)におけるようなインスリン分泌応答不全などの分泌異常または不全、インスリン分子自体の形態、例えば、一次、二次もしくは三次構造の異常または不全、標的細胞に対するインスリンの作用、例えば、末梢組織などの体組織におけるインスリン抵抗性の異常または不全、およびインスリンに対する標的細胞の応答の異常または不全が含まれる。IDDMおよびNIDDMならびに他の形態の糖尿病におけるインスリン活性異常のさらなる説明については、Braunwald,E.ら編(1987)Harrison’s Principles of Internal Medicine,Eleventh Edition,McGraw−Hill Book Company,New York,pp.1778−97;Robbins,S.L.ら(1984)Pathologic Basis of Disease,3rd Edition,W.B.Saunders Company,Philadelphia,p.972を参照されたい。
【0116】
グルコース恒常性を改善する種々の薬理学的方法が存在するが、現在、臨床診療に用いられているものは、ほとんどの患者で正常血糖の回復に失敗するか、または種々の期間後に失敗に帰している。〔Scheen,A.J.(1997)Drugs 54(3):355−68〕。現在のところ、4種の薬剤が用いられている。スルホニル尿素、ビグアニド(メトホルミン)、α−グルコシダーゼ阻害剤(アカルボース)およびインスリンである。インスリン療法は、特に疾患後期の合併症を最小限にするために高血糖の制御を必要とし得る。II型糖尿病の最も有効な療法は、複合糖質の腸消化を遅らせて食後のグルコースレベルを低下させるα−グルコシダーゼ阻害剤、アカルボースである。他の代謝活性剤は毒性が強すぎることが証明された。一方、スルホニル尿素は、インスリンの分泌を増大させ、肝臓および膵臓組織に対するインスリンの作用を増強して高血糖を低下させる。チアゾリジンジオン〔例えば、トログリタゾン、ピオグリタゾン、ダルグリタゾン(darglitazone)およびYM268〕などの薬剤は、インスリンの作用を促進する(すなわち、「インスリン増感剤」である)。
【0117】
代替法として、ヒト膵臓の移植は可能ではあるが、この方法は、ドナー不足や免疫拒絶反応問題のために、選択された患者に限定されている。β細胞の移植はヒトでは成功を治めているが、大量のβ細胞が必要であり、かつ免疫拒絶反応が障害となっている。したがって、有効かつ経済的な療法が不足している。
【0118】
膵臓細胞を適切な経路を介して患者に投与して細胞を患者の所望の場所に送出し、そこで細胞を増殖させ、膵臓ホルモン、例えばインスリン、または酵素を分泌させることができる。膵臓細胞の投与に好ましい場所としては、急速に血管が発達する場所が挙げられる。患者、特にヒト患者に膵臓細胞を投与する一般的方法には、大網嚢への細胞移植〔Yoneda,K.ら(1989)Diabetes 38(Suppl.1):213−216〕、細胞の腹腔内注射〔Wahoff,D.C.ら(1994)Transplant.Proc.26:804〕、患者の腎被膜下への細胞移植〔例えば、Liu,X.ら(1991)Diabetes 40:858−866;Korsgren,O.ら(1988)Transplantation 45(3):509−514;Simeonovic,D.J.ら(1982)Aust.J.Exp.Biol.Med.Sci.60:383参照〕、および例えば門脈への細胞の血管内注射〔Braesch,M.K.ら(1992)Transplant.Proc.24(2):679−680;Groth,C.G.ら(1992)Transplant.Proc.24(3):972−973〕がある。腎被膜下に膵臓細胞を移植しやすくするために、細胞を、例えば、被移植患者由来の血漿から調製した血漿塊〔Simeonovic,D.J.ら(1982)Aust.J.Exp.Biol.Med.Sci.60:383〕またはコラーゲンマトリックスに埋め込むことができる。細胞は、医薬上許容し得る担体または希釈剤中で投与し得る。
【0119】
(v) 医薬製剤
PYYまたはPYYアゴニストもしくはアンタゴニストあるいは細胞組成物は、純粋または実質的に純粋な化合物/組成物として投与することは可能ではあるが、医薬配合物または製剤として投与するのが好ましい。ヒト用かつ動物用に本発明に用いられる配合物としては、PYY、PYYアゴニストもしくはアンタゴニストまたは細胞組成物と共に、1種以上の医薬上許容し得る担体および場合により他の治療成分が含まれる。
【0120】
担体は、配合物の有効成分に適合し得るという意味で「許容し得る」ものでなければならず、かつ治療を受ける患者に対して有害であってはならない。
【0121】
配合物は、単位剤形として提供するのが便利であり、薬学業界で周知のいずれの方法によっても製造し得る。どの方法も、有効成分と、1種以上の補助成分を構成する担体とを混合するステップを含む。
【0122】
本発明は、PYY治療剤または細胞組成物の医薬組成物、ならびにペプチドホルモンの恒常性を変えることにより改善させ得る疾患の治療および/または予防における上記医薬組成物の使用法に関する。好ましい実施態様において、これらの阻害剤は、低血糖誘導活性および抗糖尿病活性を有しており、グルコース貯蔵を含めたグルコース代謝異常を特徴とする疾患の治療に用いることができる。特定の実施態様において、本発明の方法の組成物は、インスリン向性剤(insulinotropic agent)として、またはGLP−1のような分子のインスリン向性作用の増強に有用である。この点に関し、本発明の方法は、高脂血症、高血糖症、肥満症、糖耐性不全症、インスリン抵抗性および糖尿病合併症の1種以上を含む多様な疾患の治療および/または予防に有用であり得る。
【0123】
PYY治療剤または細胞組成物は、当業では周知のように、治療すべき疾患や、患者の年齢、状態および体重に応じて種々の形態で投与し得る。例えば、経口投与する場合、化合物は、錠剤、カプセル剤、顆粒剤、散剤もしくはシロップ剤として配合してよく、非経口投与の場合、化合物は、(血管内、筋肉内もしくは皮下)注射剤、滴下注入剤または座剤として配合し得る。眼の粘膜経由で投与する場合、化合物は、点眼剤または眼軟膏として配合し得る。これらの配合物は、慣用手段によって調製することができ、所望なら、有効成分を、賦形剤、バインダー、崩壊剤、滑潤剤、矯味剤、可溶化剤、懸濁助剤、乳化剤またはコーティング剤などの任意の慣用添加剤と混合し得る。用量は、患者の症状、年齢および体重、治療もしくは予防すべき疾患の性質および重篤度、薬剤の投与経路および形態に応じて異なるが、一般に、ヒト成人患者には、1日当たり0.01〜2000mg用量の化合物が推奨され、これを1回または複数回に分けて投与し得る。
【0124】
グルコース代謝は変更可能であり、II型糖尿病にかかわる症状は、PYY治療剤の「調時」(timed)投与により軽減または排除することができ、その場合、(用量および/またはタイミングを含めた)治療の有効性を評価するために、例えば、グルコース抵抗性、グルコースレベル、インスリンレベル、インスリン感受性またはグリコシル化ヘモグロビンなどのグルコース代謝および/またはII型糖尿病の1種以上の適切な指数を用い得る。
【0125】
PYY治療剤の投与に効果的な時間を同定する必要がある。これは、1グループ以上の動物(好ましくは1グループ当たり少なくとも動物5匹)を用いて、以下に記載のような日常的実験により達成することができる。動物の場合、PYY治療によるインスリン向性活性の評価は、PYY治療剤を1日の特定の時間に投与し、グルコース代謝、好ましくはインスリン放出に係わる1種以上の指数を測定し、治療後のこれらの指数値を治療前もしくは対照治療の同じ指数値と比較して投与効果(もしあれば)を測定して実施し得る。
【0126】
所与の患者の治療効力に関して最も有効な結果を生じるPYY治療剤の厳密な投与時間および/または用量は、特定の化合物の活性、薬物動態学および生体内利用率、(年齢、性別、疾患のタイプおよび段階、一般的な健康状態、所与の用量およびタイプの薬剤に対する応答性を含めた)患者の生理的状態、投与経路などに依存する。しかし、上記ガイドラインは、治療の微調整、例えば投与の最適時間および/または量を決定するためのベースとして用いることができ、微調整には、ただ患者をモニターし、用量および/またはタイミングを調整することからなる日常的実験が必要なだけである。
【0127】
患者が治療を受けている間、24時間の所与の時間に1種以上の関連指数を測定してグルコース代謝をモニターする。そのようなモニターの結果にしたがって、治療(薬剤の量、投与時間およびタイプ)を調整し得る。患者は、改善度を確認するために定期的に同じパラメータを測定して再評価するが、そのような再評価は、典型的には、先ず、療法開始から4週間後に行い、その後、療法中4〜8週毎に、次いで、その後3ヶ月毎に行う。療法は数ヶ月または数年にもわたることがあるが、ヒトの場合、療法の典型的な長さは6ヶ月である。
【0128】
これらの再評価をベースとして、投与する薬剤の量および恐らく投与時間を調整し得る。例えば、4週間の治療後に、代謝指数のうち1つは改善されていないが、少なくとも1つの他の指数が改善されていた場合、投与時間は変えずに、用量を1/3だけ増加させ得る。
【0129】
治療は、化合物の最適用量より少ない小用量から始めてよい。その後、その状況下で最適な効果に達するまで少しずつ用量を増加させるのが望ましい。所望なら、1日当たりの総用量を分割して、1日の間に少量ずつ投与するのが便利である。
【0130】
本明細書に用いられている限りにおいて、用語「治療上有効量」とは、例えば、任意の医学的治療に適用可能な妥当な利益/危険比で膵臓β細胞のグルコース応答性を高めることによりある程度の所望の治療効果を得るのに有効な、例えばPYY治療剤の量を意味する。
【0131】
本明細書において、用語「医薬上許容し得る」とは、健全な医学的判断の範囲内で、妥当な利益/危険比に対応する、過剰な毒性、刺激、アレルギー反応、または他の問題もしくは合併症無しに、人間および動物の組織に接触させて使用するのに適した、PYY、材料、組成物および/または剤形を表すのに用いられる。
【0132】
本明細書に用いられている限りにおいて、用語「医薬上許容し得る担体」とは、当該化学物質を1つの器官または身体の一部から別の器官または身体の一部に運んだり輸送したりすることに関与する液体または固体充填剤、希釈剤、賦形剤、溶液または封入材料などの医薬上許容し得る材料、組成物またはビヒクルを意味する。どの担体も、配合物の他の成分に適合し得るという意味で「許容し得る」ものでなければならず、かつ患者に有害であってはならない。医薬上許容し得る担体として働き得る材料の例としては、(1)ラクトース、グルコースおよびスクロースなどの糖質;(2)コーンスターチおよびジャガイモデンプンなどのデンプン;(3)ナトリウムカルボキシメチルセルロース、エチルセルロースおよび酢酸セルロースなどのセルロースおよびその誘導体;(4)粉末トラガカント;(5)麦芽;(6)ゼラチン;(7)タルク;(8)カカオバターおよび座剤ろうなどの賦形剤;(9)落花生油、棉実油、サフラワー油、ごま油、オリーブ油、コーン油および大豆油などの油;(10)プロピレングリコールなどのグリコール;(11)グリセリン、ソルビトール、マンニトールおよびポリエチレングリコールなどのポリオール;(12)オレイン酸エチルおよびラウリン酸エチルなどのエステル;(13)寒天;(14)水酸化マグネシウムおよび水酸化アルミニウムなどの緩衝剤;(15)アルギン酸;(16)パイロジェンフリー水;(17)等張塩類溶液;(18)リンガー液;(19)エチルアルコール;(20)リン酸緩衝溶液;および(21)医薬配合物に用いられる他の無毒性の適合性物質が挙げられる。
【0133】
用語「医薬上許容し得る塩」とは、PYY治療剤の比較的無毒性の無機および有機酸付加塩を表す。これらの塩は、PYY治療剤の最終的な単離および精製時にその場で調製するか、または別個に、遊離塩基形態の精製PYY治療剤を適当な有機または無機酸と反応させ、そのようにして生成した塩を単離して調製することができる。代表的な塩としては、ヒドロブロミド、ヒドロクロリド、スルフェート、ビスルフェート、ホスフェート、ニトレート、アセテート、バレレート、オレエート、パルミテート、ステアレート、ラウレート、ベンゾエート、ラクテート、ホスフェート、トシラート、シトレート、マレエート、フマレート、スクシネート、タルトレート、ナフチレート、メシレート、グルコへプトネート、ラクトビオネート、およびラウリルスルホネートの塩などがある〔例えば、Bergeら(1977)J.Pharm.Sci.66:1−19参照〕。
【0134】
他の場合、本発明の方法に有用なPYYは、1種以上の酸性官能基を含んでいることがあり、それゆえ、医薬上許容し得る塩基と医薬上許容し得る塩を形成し得る。これらの場合において、用語「医薬上許容し得る塩」とは、PYY治療剤の比較的無毒性の無機および有機塩基付加塩を表す。これらの塩も同様に、PYY治療剤の最終的な単離および精製時にその場で製造するか、あるいは、別個に、遊離酸形態の精製PYY治療剤を、医薬上許容し得る金属カチオンの水酸化物塩、炭酸塩もしくは重炭酸塩などの適当な塩基、または医薬上許容し得る有機第一級、第二級もしくは第三級アミンと反応させて調節することができる。代表的なアルカリまたはアルカリ土類金属塩としては、リチウム、ナトリウム、カリウム、カルシウム、マグネシウムおよびアルミニウムの塩などがある。塩基付加塩の生成に有用な代表的有機アミンとしては、エチルアミン、ジエチルアミン、エチレンジアミン、エタノールアミン、ジエタノールアミン、ピペラジンなどがある(例えば、Bergeら,前掲参照)。
【0135】
組成物中には、例えば、ラウリル硫酸ナトリウムおよびステアリン酸マグネシウムなどの湿潤剤、乳化剤および滑潤剤と共に、着色剤、剥離剤、コーティング剤、甘味剤、矯味矯臭剤および芳香剤、保存剤および酸化防止剤も存在し得る。
【0136】
医薬上許容し得る酸化防止剤の例には、(1)アスコルビン酸、塩酸システイン、重硫酸ナトリウム、メタ重亜硫酸ナトリウム、亜硫酸ナトリウムなどの水溶性酸化防止剤;(2)パルミチン酸アスコルビル、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、レシチン、没食子酸プロピル、αトコフェロールなどの油溶性酸化防止剤;ならびに(3)クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸などの金属キレート剤が含まれる。
【0137】
本発明の方法に有用な配合物には、経口、経鼻、(頬側および舌下を含めた)局所、経腸、経膣、エアゾールおよび/または非経口投与に適したものが含まれる。配合物は、単位剤形で投与するのが便利であり、薬学業界で周知の任意の方法によって製造し得る。単位剤形を構成するために担体材料と組み合せ得る有効成分の量は、治療を受ける宿主や特定の投与モードに応じて異なる。単位剤形を構成するために担体材料と組み合わせ得る有効成分の量は、一般に、治療効果を生じる化合物量であろう。通常、有効成分の量は、100%中、約1〜約99%、好ましくは約5〜約70%、最も好ましくは約10〜約30%の範囲であろう。
【0138】
これらの配合物または組成物の製造法は、PYY治療剤を、担体および場合によって1種以上の補助成分と混合するステップを含む。一般に、配合物は、PYY治療剤と液体担体もしくは微細固体担体または両方とを均一かつ均質に混合し、必要ならその後で生成物を成形して製造する。
【0139】
経口投与に適した配合物は、カプセル剤、カシェット剤、丸剤、錠剤、(矯味基剤、通常、スクロースおよびアカシアもしくはトラガカントを用いた)トローチ剤、散剤、顆粒剤の形態で、または水性もしくは非水性液体中の液剤もしくは懸濁剤、または水中油滴型もしくは油中水滴型エマルションとして、またはエリキシル剤もしくはシロップ剤、または(ゼラチンおよびグリセリン、もしくはスクロースおよびアカシアなどの不活性基剤を用いた)パステル剤、ならびに/またはマウスウォッシュなどであってよく、それぞれ有効成分として所与の量のPYY治療剤を含む。化合物は、濃縮塊、舐剤またはパスタ剤として投与してもよい。
【0140】
経口投与用の固体剤形(例えば、カプセル剤、錠剤、丸剤、糖剤、散剤、顆粒剤など)の場合、有効成分は、1種以上の医薬上許容し得る担体、例えば、クエン酸ナトリウムまたはリン酸二カルシウムならびに/または以下のいずれかと混合する:(1)デンプン、ラクトース、スクロース、グルコース、マンニトール、および/もしくはケイ酸などの充填剤もしくは増量剤;(2)例えば、カルボキシメチルセルロース、アルギネート、ゼラチン、ポリビニルピロリドン、スクロースおよび/もしくはアカシアなどのバインダー;(3)グリセロールなどの湿潤剤;(4)寒天、炭酸カルシウム、ジャガイモもしくはタピオカデンプン、アルギン酸、ある種のケイ酸塩および炭酸ナトリウムなどの崩壊剤;(5)パラフィンなどの溶解遅延剤;(6)第四級アンモニウム化合物などの吸収促進剤;(7)例えば、アセチルアルコールおよびグリセロールモノステアレートなどの湿潤剤;(8)カオリンおよびベントナイト粘土などの吸収剤;(9)タルク、ステアリン酸カルシウム、ステアリン酸マグネシウム、固体ポリエチレングリコール、ラウリル硫酸ナトリウム、およびそれらの混合物などの潤滑剤;ならびに(10)着色剤。カプセル剤、錠剤および丸剤の場合には、医薬組成物はさらに緩衝剤を含み得る。同様なタイプの固体組成物は、ラクトースまたは乳糖および高分子量ポリエチレングリコールなどの賦形剤を用いた軟質または硬質ゼラチンカプセル中の充填剤として用いてもよい。
【0141】
錠剤は、場合によって1種以上の補助成分と共に圧縮または成形して製造し得る。圧縮錠剤は、バインダー(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロース)、潤滑剤、不活性希釈剤、保存剤、崩壊剤(例えば、ナトリウムスターチグリコレートまたは架橋ナトリウムカルボキシメチルセルロース)、界面活性剤または分散剤を用いて製造し得る。成形錠剤は、不活性液体希釈剤で湿らせた粉末ペプチドまたはペプチドミメティック混合物を適当な機械で成形して製造し得る。
【0142】
錠剤や、糖剤、カプセル剤、丸剤および顆粒剤などの固体剤形は、場合によって刻み目をつけたり、腸溶コーティングおよび医薬配合技術において周知の他のコーティングやシェルを用いて製造し得る。錠剤や他の固体剤形は、例えば、所望の放出外形、他のポリマーマトリックス、リポソームおよび/またはマイクロスフェアを提供するために種々の比率のヒドロキシメチルセルロースを用いて、有効成分を遅延または制御放出するように配合し得る。錠剤や他の固体剤形は、例えば、細菌捕集フィルターを介して濾過するか、または、使用直前に滅菌水または他の注射可能な滅菌媒体中に溶解し得る滅菌固体組成物形態の滅菌剤を組み込むことによって滅菌し得る。これらの組成物は、場合によってさらに乳白剤を含んでいてよく、有効成分を、胃腸管の特定の部分だけにまたはその部分に選択的に、場合によって持続的に、放出する構成を有し得る。使用し得る包埋組成物の例には高分子物質やろうが含まれる。有効成分は、適切な場合には、1種以上の上記賦形剤を用いたマイクロカプセル化形態であってもよい。
【0143】
経口投与用の液体剤形としては、医薬上許容し得るエマルション、マイクロエマルション、液剤、懸濁剤、シロップ剤およびエリキシル剤がある。液体剤形は、有効成分に加えて、例えば、水または他の溶液などの当業で一般的に用いられている不活性希釈剤、可溶化剤、およびエチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3−ブチレングリコール、油(特に、棉実油、落花生油、コーン油、胚芽油、オリーブ油、ひまし油およびごま油)、グリセロール、テトラヒドロフリルアルコール、ポリエチレングリコールおよびソルビタン脂肪酸エステルなどの乳化剤、ならびにそれらの混合物を包含し得る。
【0144】
経口組成物は、不活性希釈剤の他に、湿潤剤、乳化剤、沈殿防止剤、甘味剤、矯味矯臭剤、着色剤、芳香剤および保存剤などのアジュバントを含んでいてよい。
【0145】
懸濁剤は、活性PYY治療剤または細胞組成物に加えて、例えば、エトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微晶質セルロース、アルミニウムメタヒドロキシド、ベントナイト、寒天およびトラガカント、ならびにそれらの混合物などの沈殿防止剤を含み得る。
【0146】
経腸および経膣投与用配合物は座剤として提供してもよく、座剤は、1種以上のPYY治療剤と、室温下には固体であるが体温下には液体であり、したがって直腸腔または膣腔内で融解して有効物質を放出する、例えば、カカオバター、ポリエチレングリコール、座剤ろうまたはサリチレートを含む1種以上の適当な無刺激性賦形剤または担体とを混合して調製することができる。
【0147】
膣内投与に適した配合物には、当業において適切であると知られているような担体を含むペッサリー、タンポン、クリーム、ゲル、パスタ、フォームまたはスプレー配合物も含まれる。
【0148】
PYY治療剤の局所または経皮投与用剤形としては、散剤、噴霧剤、軟膏、パスタ剤、クリーム剤、ローション剤、ゲル剤、液剤、パッチおよび吸入剤が挙げられる。有効成分は、滅菌条件下に、医薬上許容し得る担体や、必要な場合には任意の保存剤、緩衝剤または推進剤と混合し得る。
【0149】
軟膏、パスタ剤、クリーム剤およびゲル剤は、PYY治療剤に加えて、動物および植物油脂、油、ろう、パラフィン、デンプン、トラガカント、セルロース誘導体、ポリエチレングリコール、シリコーン、ベントナイト、ケイ酸、タルクおよび酸化亜鉛、またはそれらの混合物などの賦形剤を含み得る。
【0150】
散剤および噴霧剤は、PYY治療剤に加えて、ラクトース、タルク、ケイ酸、水酸化アルミニウム、ケイ酸カルシウムおよびポリアミド粉末、またはこれらの物質の混合物などの賦形剤を含み得る。噴霧剤はさらに、クロロフルオロ炭化水素や揮発性非置換炭化水素などの慣用推進剤、例えばブタンおよびプロパンなどを含み得る。
【0151】
あるいは、PYY治療剤はエアゾール剤として投与してもよい。これは、この化合物を含有する水性エアゾール、リポソーム製剤または固体粒子を製造することにより達成される。非水性(例えば、フルオロカーボン推進剤)懸濁液を使ってもよい。超音波式ネブライザー(sonic nebulizer)は、化合物を分解し得る物質のせん断への暴露を最小限にするので好ましい。
【0152】
通常、水性エアゾール剤は、物質の水溶液または懸濁液を慣用の医薬上許容し得る担体および安定剤と配合して製造する。担体および安定剤は、特定の化合物の要件に応じて異なるが、典型的には、非イオン界面活性剤(トゥイーン、プルロニックまたはポリエチレングリコール)や、血清アルブミン、ソルビタンエステル、オレイン酸、レシチンなどの無害タンパク質、グリシンなどのアミノ酸、緩衝液、塩、糖質または糖アルコールを包含する。一般に、エアゾール剤は等張溶液から製造される。
【0153】
経皮パッチは、身体にPYY治療剤を制御放出するという付加利点を有している。そのような剤形は、物質を適当な媒体に溶解または分散させて製造し得る。さらに吸収促進剤を用いて、皮膚を介したペプチドミメティックのフラックスを増強することもできる。そのようなフラックスの速度は、速度制御膜を用いるか、またはポリマーマトリックスもしくはゲル中にペプチドミメティックを分散させて制御し得る。
【0154】
眼科配合物、眼軟膏、散剤、液剤なども本発明の範囲内に含まれると考えられる。
非経口投与に適した本発明の医薬組成物は、PYY治療剤と組み合わせて、1種以上の医薬上許容し得る無菌等張水性もしくは非水性溶液、分散液、懸濁液またはエマルション、あるいは、使用直前に無菌注射可能な溶液もしくは分散液中に再構成し得、酸化防止剤、緩衝剤、静菌剤、配合物を目的受容者の血液と等張にする溶質または沈殿防止もしくは濃厚剤を含み得る無菌散剤を含んでなる。
【0155】
本発明の医薬組成物に用い得る適当な水性および非水性担体の例としては、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコールなど)およびそれらの適当な混合物、オリーブ油などの植物油、オレイン酸エチルなどの注射可能な有機エステルが挙げられる。適切な流動性は、例えば、レシチンなどのコーティング材料を用い、分散剤の場合には要求粒度を維持し、かつ界面活性剤を用いることにより維持し得る。
【0156】
これらの組成物はさらに、保存剤、湿潤剤、乳化剤および分散剤などのアジュバントを含み得る。種々の抗菌剤および抗真菌剤、例えば、パラベン、クロロブタノール、フェノールソルビン酸などを含有させて、微生物の作用を確実に防止し得る。また、組成物中に、糖、塩化ナトリウムなどの等張剤を入れるのも望ましい。さらに、ナトリウムモノステアレートやゼラチンなどの吸収を遅らせる物質を含有させて、注射可能な形態の医薬品の吸収を持続させてもよい。
【0157】
場合によって、薬剤の効果を持続させるために、皮下または筋肉内注射からの薬剤の吸収を遅らせるのが望ましい。これは、水溶解度の低い結晶質または非晶質材料の液体懸濁液を用いることによって達成し得る。その場合、薬剤の吸収速度は、その溶解速度に依存し、溶解速度は、結晶サイズおよび結晶形態に依存し得る。あるいは、非経口投与剤形の遅延吸収は、薬剤を油性ビヒクルに溶解または懸濁させることにより達成される。
【0158】
注射可能なデポー剤形は、PYY治療剤のマイクロカプセルマトリックスを形成するか、またはポリラクチド−ポリグリコリドなどの生物分解性ポリマー中で製造する。薬剤とポリマーとの比率や、用いられる特定のポリマーの性質に応じて、薬剤の放出速度を制御し得る。他の生物分解性ポリマーの例としては、ポリ(オルトエステル)およびポリ(無水物)がある。また、注射可能なデポー製剤は、薬剤を、体組織に適合し得るリポソームまたはマイクロエマルション中に捕捉して製造する。
【0159】
PYY治療剤または細胞組成物は、医薬品としてヒトおよび動物に投与するとき、それ自体を投与することもできるし、例えば、0.1〜99.5%(より好ましくは、0.5〜90%)の有効成分と組み合わせて医薬上許容し得る担体を含む医薬組成物として投与することもできる。
【0160】
作用物質製剤は、経口、非経口、局所または経直腸投与し得る。作用物質製剤がそれぞれの投与経路に適した形態で投与されるのは勿論である。例えば、作用物質製剤は、錠剤またはカプセル形態で、注射剤、吸入剤、眼ローション、軟膏、座剤などの注射、侵出、吸入により、ローションまたは軟膏により局所的に、また座剤により経直腸投与される。経口投与が好ましい。
【0161】
本明細書に用いられている限りにおいて、用語「非経口投与」および「非経口投与された」とは、腸内および局所投与以外の、通常、注射による投与モードを意味し、血管内、筋肉内、動脈内、鞘内、包内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、くも膜下、髄腔内および胸骨内注射ならびに注入を包含するが、それらには限定されない。
【0162】
本明細書に用いられている限りにおいて、用語「全身投与」「全身投与された」、「末梢投与」および「末梢投与された」とは、PYY治療剤、薬剤または他の材料が患者の中枢神経系に入り、その結果、代謝および他の同様なプロセスを受けるように、物質を中枢神経系に直接投与するのではなく、例えば、皮下投与することを意味する。
【0163】
PYY治療剤は、療法のために、口内、例えば噴霧によるような鼻腔内、直腸内、膣内、非経口、槽内、ならびに散剤、軟膏またはドロップ剤によるような頬側および舌下を含めた局所投与を含めた任意の適当な投与経路により、ヒトおよび他の動物に投与し得る。
【0164】
選択される投与経路に関係なく、適当な水和形態で用い得るPYY治療剤および/または本発明の医薬組成物は、当業者には公知の慣用法により医薬上許容し得る剤形に配合される。
【0165】
本発明の医薬組成物中の有効成分の実際の用量レベルは、特定の患者、組成物および投与モードに対する所望の治療応答を達成するのに有効であると共に患者に対して毒性ではない有効成分の量が得られるように変えてよい。
【0166】
(vi) 併用投与
本発明の別の態様は、1種以上の他の治療剤をPYY治療剤または細胞組成物と共に投与する併用療法を提供する。そのような併用療法は、個々の治療成分を同時、順次または別個に投与することにより達成し得る。
【0167】
1つの実施態様において、PYY治療剤または細胞組成物は、単独で、あるいは、PYYの生物活性、PYYの生物学的作用を高めるか、または発生する可能性がある副作用を軽減する他の物質と組み合わせて投与し得る。例えば、WO9511689は、ジペプチジルペプチダーゼ IV(DPIV)酵素阻害剤などのジペプチジルペプチダーゼ阻害剤の使用を記載しており、ジペプチジルペプチダーゼ阻害剤は、PYYのタンパク分解を阻止し、それによってPYYの血漿半減期を延ばすことができる。したがって、好ましい実施態様において、PYY治療剤は、ジペプチジルペプチダーゼ阻害剤と一緒に投与し得る。
【0168】
別の例証的実施態様において、PYY治療剤または細胞組成物は、M1受容体アンタゴニストと一緒に投与し得る。コリン物質は、ムスカリン受容体を介して作用する強力なインスリン放出モデュレーターである。さらに、そのような物質の使用は、HDLレベルを増大させると同時にコレステロールレベルを低下させるという付加利点を有し得る。適当なムスカリン受容体アンタゴニストとしては、直接または間接的にムスカリン性アセチルコリン受容体の活性化をブロックする物質が挙げられる。そのような物質は、M1受容体に対して選択的である(またはそのような選択性を促進する量で用いる)のが好ましい。非限定的例としては、第四級アミン(例えば、メタンテリン、イプラトロピウム、およびプロパンテリン)、第三級アミン(例えば、ジシクロミン、スコポラミン)および三環系アミン(例えば、テレンゼピン)がある。ピレンゼピンおよびメチルスコポラミンが好ましい。他の適当なムスカリン受容体アンタゴニストとしては、ベンズトロピン〔メルク社(Merck)からCOGENTINとして市販されている〕、ヘキサヒドロ−シラ−ジフェニドールヒドロクロリド〔Lambrechtら(1989)Trends in Pharmacol.Sci.10(Suppl.):60に開示されているHHSIDヒドロクロリド〕、(+/−)−3−キヌクリジニルキサンテン−9−カルボキシレートヘミオキサレート〔QNX−ヘミオキサレート;Birdsallら(1983)Trends in Pharmacol.Sci.4:459〕、テレンゼピンジヒドロクロリド〔Coruzziら(1989)Arch.Int.Pharmacodyn.Ther.302:232;およびKawashimaら(1990)Gen.Pharmacol.21:17〕ならびにアトロピンがある。そのようなムスカリン受容体アンタゴニストの用量は、一般に、先に略記されているように最適化される。脂質代謝障害の場合、投与タイミングが脂質代謝応答性窓を参照して決められているかどうかとは関係なく、用量の最適化が必要であり得る。
【0169】
インスリンおよび脂質代謝の調節ならびに上述の障害に関して、PYY治療剤または細胞組成物も、d2ド−パミンアゴニスト(例えば、ブロモクリプチン)などのプロラクチン阻害剤と相乗作用し得る。したがって、本発明の方法は、プロラクチン抑制エルゴアルカロイドおよびプロラクチン抑制ドーパミンアゴニストなどのプロラクチン阻害剤の併用投与を含み得る。適当な化合物の例としては、2−ブロモ−α−エルゴクリプチン、6−メチル−8−β−カルボベンジルオキシアミノエチル−10−α−エルゴリン、8−アシルアミノエルゴリン、6−メチル−8−α−(N−アシル)アミノ−9−エルゴリン、6−メチル−8−α−(N−フェニルアセチル)アミノ−9−エルゴリン、エルゴコルニン、9,10−ジヒドロエルゴコルニン、D−2−ハロ−6−アルキル−8−置換エルゴリン、D−2−ブロモ−6−メチル−8−シアノメチルエルゴリン、カルビドーパ、ベンセラジドおよび他のドーパデカルボキシラーゼインヒビター、L−ド−パ、ドーパミンならびにそれらの無毒性塩が挙げられる。
【0170】
Ach、コレシストキニン(CCK)またはボンベシンなどのアゴニストは、ヘテロ三量体Gタンパク質Gqを介してホスホリパーゼC(PLC)に結合している細胞表面受容体に結合する。受容体に結合すると、PLCが活性化され、その結果、PIP3の加水分解によりIP3およびDAGが生成する。IP3により小胞体から放出されたCa2+は、PKCのαおよびβイソ型の活性化に重要であり、DAGはPKCのα、β、δおよびεイソ型を活性化し得る。
【0171】
本発明にしたがって用いられるPYY治療剤または細胞組成物は、グリベンクラミド、グリピシド、グリクラジドおよびAG−EE623ZWなどのβ細胞のAPT依存カリウムチャンネルに作用する物質と併用してもよい。PYYまたはそのアナログもしくはミメティックを、メトホルミンおよび関連化合物または例えばアカルボースのようなグルコシダーゼ阻害剤などの他の経口物質と組み合わせて投与するのも有利である。
【0172】
(vii) PYY遺伝子型の検出
本発明の別の態様は、糖尿病または他のグルコース代謝障害を発症する患者のリスクにアクセスし、かつ既にそのような障害があると診断を受けた患者の病理学を決定する診断アッセイに関する。好ましい実施態様において、II型糖尿病を発症する恐れのある患者を同定するために、PYYの調節をモニターする。
【0173】
特に、このアッセイは、患者の血清または他の体液中のPYYレベルの低下を評価し得る。そのような低下は、とりわけ、PYYの発現もしくは分泌レベルの低下、またはタンパク質の血清半減期短縮の結果であり得る。他の実施態様において、このアッセイは、例えば、活性の低下、例えば、受容体結合の低下もしくは喪失またはアゴニスト活性の低下をもたらし得る、エピトープの生物活性または出現もしくは消失に基づいて、突然変異PYYタンパク質を検出する。さらに他の実施態様において、このアッセイは、PYY遺伝子レベルの異常性、例えば、塩基対の変化、コード配列または転写調節配列に対する付加または欠失などの点突然変異を検出する。
【0174】
したがって、本発明の方法は、患者がグルコース反応(sensing)の低下を特徴とする疾患に罹患する恐れがあるかどうかを決定する方法を提供する。好ましい実施態様において、本発明の方法は、一般に、患者由来の細胞試料中で、(i)PYYタンパク質をコードする遺伝子の完全性に影響を与える変化、(ii)PYY遺伝子の誤発現、または(iii)PYY遺伝子産物の異常修飾のうち少なくとも1つを特徴とする遺伝子障害の有無の検出を含むとみなすことができる。例を示すと、そのような遺伝子障害は、(i)PYY遺伝子からの1つ以上のヌクレオチドの欠失、(ii)PYY遺伝子への1つ以上のヌクレオチドの付加、(iii)PYY遺伝子の1つ以上のヌクレオチドの置換、(iv)PYY遺伝子の総体的な染色体転移、(v)PYY遺伝子のメッセンジャーRNA転写レベルにおける総体的な変化、(vi)ゲノムDNAのメチル化パターンなどのPYY遺伝子の異常修飾、(vii)PYY遺伝子のメッセンジャーRNA転写物の非野生型スプライシングパターンの存在、(viii)PYYタンパク質の非野生型レベル、(ix)PYY遺伝子の対立遺伝子の欠損、および(x)PYYタンパク質の不適切な翻訳後修飾のうち少なくとも1つの存在を確認することにより検出し得る。以下に説明するように、本発明は、PYY遺伝子の障害を検出するための多数のアッセイ法を提供し、かつ重要なことには、PYY依存性の異常な細胞成長、増殖および/または分化を引き起こす異なる分子原因を識別する能力を提供する。1つの好ましい実施態様において、このアッセイを用いて、成熟PYYタンパク質の分泌部位を排除する分泌シグナル配列に対する点突然変異を検出する。例えば、このアッセイは、Thr(−17)→AsnまたはThr(−16)→Proを生起する塩基対の変化を検出し得る。
【0175】
細胞および組織試料のPYY表現型を同定するために、例えば、患者由来の細胞試料中のPYYコード核酸レベルの測定、PYYのmRNAレベルの検出、またはゲノムPYY遺伝子が突然変異もしくは欠失しているかどうかの確認などによりPYYを誤発現する細胞または組織を同定するための診断試験キットの一部として核酸プローブを用いることができる。
【0176】
例を示すと、当該PYY遺伝子から、PYYコード転写物の存在(または不在)に関する無傷の組織または組織試料の組織学的スクリーニングを容易にするヌクレオチドプローブを作ることができる。以下のような抗PYY抗体を診断に使用する場合と同様に、PYYメッセージまたはゲノムPYY配列に向けられるプローブの使用は、例えば、組織の腫瘍もしくは過形成障害(例えば、望ましくない細胞異常増殖)または異常分化で明らかにされ得る対立遺伝子の突然変異の予測的評価にも治療的評価にも利用することができる。以下に説明するようなイムノアッセイと併用すると、オリゴヌクレオチドプローブは、PYYタンパク質の発現(または欠失)に関連するある種の異常性が関与し得る発育異常症の分子ベースの決定をしやすくする。例えば、ポリペプチド合成、翻訳後修飾、または半減期における変化は、コード配列における突然変異から分化し得る。
【0177】
例証的実施態様において、(精製)オリゴヌクレオチドプローブを含む核酸組成物が提供され、このプローブは、配列番号1によって表されるようなPYY遺伝子もしくはその天然突然変異体のセンスまたはアンチセンス配列、または当該PYY遺伝子もしくはその天然突然変異体が天然に持ち合わせている5′もしくは3′フランキング配列もしくはイントロン配列にハイブリダイズし得るヌクレオチド配列領域を含んでいる。細胞の核酸をハイブリダイゼーションに利用されやすい状態にし、プローブを試料核酸に暴露し、プローブと試料核酸とのハイブリダイゼーションを検出する。そのような方法は、欠失、置換などを含めたゲノムまたはmRNAレベルでの障害の検出にもmRNA転写レベルの定量にも使用し得る。
【0178】
いくつかの実施態様において、障害の検出は、アンカーPCRもしくはRACE PCRなどのポリメラーゼ連鎖反応(PCR)(例えば、米国特許第4,683,195号および同第4,683,202号参照)、または、連結連鎖反応(LCR)〔例えば、Landegranら(1988)Science 241:1077−1080;およびNakazawaら(1944)PNAS 91:360−364参照〕においてプローブ/プライマーを利用することを含み、連結連鎖反応は、PYY遺伝子における点突然変異の検出に特に有用であり得る。単に例証的な実施態様において、本発明の方法は、(i)患者から細胞試料を採取するステップと、(ii)試料の細胞から核酸(例えば、ゲノム、mRNAまたは両方)を単離するステップと、(iii)PYY遺伝子(存在する場合)のハイブリダイゼーションおよび増幅が生じるような条件下に、核酸試料を、PYY遺伝子に特異的にハイブリダイズする1つ以上のプライマーと接触させるステップと、(iv)増幅産物の有無を検出するか、または増幅産物のサイズを検出して、対照試料と長さを比較するステップとを含む。
【0179】
当該アッセイの好ましい実施態様において、試料細胞由来のPYY遺伝子の突然変異は、制限酵素切断パターンにおける変化によって確認される。例えば、試料および対照のDNAを単離し、(場合によって)増幅し、1種以上の制限エンドヌクレアーゼで消化し、ゲル電気泳動にかけて断片長の大きさを測定する。さらに、配列特異的リボザイム(例えば、米国特許第5,498,531号参照)を用いて、リボザイム切断部位の発生または喪失による特定の突然変異の存在を採点することができる。
【0180】
さらに別の実施態様において、当業において公知の多様な配列決定反応のいずれかを用いて、PYY遺伝子を直接配列決定し、試料PYYの配列を対応野生型(対照)配列と比較して突然変異を検出することができる。配列決定反応の例としては、MaximおよびGilbert〔Proc.Natl.Acad.Sci.USA(1977)74:560〕またはSanger〔Sangerら(1977)Proc.Nat.Acad.Sci.74:5463〕によって開発された方法に基づくものが含まれる。当該アッセイ〔Biotechniques(1995)19:448〕を実施する際には、質量分析〔例えば、PCT公開WO94/16101;Cohenら(1996)Adv.Chromatogr.36:127−162;およびGriffinら(1993)Appl.Biolchem.Biotehnol.38:147−159〕による配列決定を含めた多様な自動配列決定法のいずれを利用してもよいと考えられる。いくつかの実施態様の場合には、配列決定反応で、わずか1個、2個または3個の核酸塩基の存在しか決定する必要がないことは当業者には明らかであろう。例としては、例えば単一の核酸が検出されるAトラクトなどを実施し得る。
【0181】
さらなる実施態様において、RNA/RNAまたはRNA/DNAへテロ二本鎖のミスマッチ塩基を検出するために、(ヌクレアーゼ、ヒドロキシルアミンまたは四酸化オスミウムなどにピペリジンを加えた)切断剤からの保護を用いることができる〔Myersら(1985)Science 230:1242〕。一般に、「ミスマッチ切断」法は、野生型PYY配列を含む(標識)RNAまたはDNAを、組織試料から得た潜在的突然変異RNAまたはDNAとハイブリダイズさせて形成したヘテロ二本鎖を得ることから出発する。二本鎖重複部位を、対照鎖と試料鎖の間の塩基対ミスマッチにより存在するようなヘテロ二本鎖の一本鎖領域を切断する物質で処理する。例えば、RNA/DNA重複部位をRNアーゼで処理し、DNA/DNAハイブリッドをS1ヌクレアーゼで処理して、ミスマッチ領域を酵素消化し得る。他の実施態様において、ミスマッチ領域を消化するために、DNA/DNAまたはRNA/DNA重複部位を、ヒドロキシルアミンまたは四酸化オスミウムとピペリジンで処理し得る。ミスマッチ領域を消化した後、得られた材料を変性ポリアクリルアミドゲル上でサイズ分離して、突然変異部位を決定する。例えば、Cottonら(1988)Proc.Natl.Acad.Sci.USA 85:4397;Saleebaら(1992)Methods Enzymod.217:286−295を参照されたい。好ましい実施態様において、検出のために、対照DNAまたはRNAを標識し得る。
【0182】
さらに別の実施態様において、ミスマッチ切断反応は、細胞試料から得たPYY cDNA中で点突然変異を検出してマッピングするために限定された系の二本鎖DNA中のミスマッチ塩基対を認識する1つ以上のタンパク質(いわゆる「DNAミスマッチ修復」酵素)を用いる。例えば、E.coliのmutY酵素はG/A三須マッチでAを切断し、HeLa細胞由来のチミジンDNAグリコシラーゼはG/TミスマッチでTを切断する〔Hsuら(1994)Carcinogenesis 15:1657−1662〕。例示的実施態様によれば、PYY配列、例えば野生型PYY配列をベースとするプローブは、試験細胞由来のcDNAまたは他のDNA産物とハイブリダイズする。二本鎖をDNAミスマッチ修復酵素で処理し、切断産物(もしあれば)を電気泳動プロトコルなどから検出することができる。例えば、米国特許第5,459,039号を参照されたい。
【0183】
他の実施態様において、PYY遺伝子の突然変異を同定するために、電気泳動移動度の変化を利用する。例えば、突然変異核酸と野生型核酸との電気泳動移動度の違いを検出するためには、一本鎖コンホメーション多型性〔single strand conformation polymorphism(SSCP)〕を用い得る〔Oritaら(1989)Proc.Natl.Acad.Sci.USA 86:2766,さらにCotton(1993)Mutat.Res.285:125−144;およびHayashi(1992)Genet.Anal.Tech.Appl.9:73−79参照〕。試料および対照PYY核酸の一本鎖DNA断片を変性させ、再結合させる。一本鎖核酸の二次構造は配列に応じて異なり、得られた電気泳動移動度の変化により、単一塩基の変化でも検出することができる。DNA断片を標識してもよいし、標識プローブを用いて検出してもよい。このアッセイの感度は、(DNAでなく)二次構造が配列中の変化に対してより感受性が高いRNAを用いることによって高められる。好ましい実施態様において、本方法は、電気泳動移動度における変化をベースとしてヘテロ二本鎖重複部位分子を分離するためにヘテロ二本鎖分析を利用する〔Keenら(1991)Trends Genet.7:5〕。
【0184】
さらに別の実施態様において、変性剤濃度勾配ゲル電気泳動〔denaturing gradient gel electrophoresis(DGGE)〕を用いて、濃度勾配変性剤を含むポリアクリルアミドゲル中の突然変異体または野生型断片の移動を検定する〔Myersら(1985)Nature 313:495〕。分析法としてDGGEを用いる場合、DNAは、例えば、PCRにより約40bpのGCに富む高融解性DNAのGCクランプを添加して、完全には変性させないように修飾する。さらなる実施態様において、対照および試料DNAの移動度の差を検出するために、変性剤濃度勾配の代わりに温度勾配を用いる〔RosenbaumおよびReissner(1987)Bioophys.Chem.265:12753〕。
【0185】
点突然変異を検出するための他の方法の例としては、選択的オリゴヌクレオチドハイブリダイゼーション法、選択的増幅法、または選択的プライマー伸張法があるが、それらには限定されない。例えば、オリゴヌクレオチドプライマーは、既知突然変異を中央に配置し、次いで、完全なマッチを見つけた場合にのみハイブリダイゼーションを可能にする条件下に標的DNAとハイブリダイズするように調製し得る〔Saikiら(1986)Nature 324:163;Saikiら(1989)Proc.Natl.Acad.Sci.USA 86:6230〕。そのような対立遺伝子特異的オリゴヌクレオチドハイブリダイゼーション法を使って、オリゴヌクレオチドがPCR増幅された標的DNAとハイブリダイズしているときには1回の反応で1つの突然変異を試験し、またオリゴヌクレオチドがハイブリダイズ膜に結合して、標識された標的DNAとハイブリダイズしているときには多くの異なる突然変異を試験し得る。
【0186】
あるいは、選択的PCR増幅に依存する対立遺伝子特異的増幅法を本発明と併用してもよい。特異的増幅のためのプライマーとして用いられるオリゴヌクレオチドは、(増幅がディファレンシャルハイブリダイゼーションに依存するように)分子の中心に目的の突然変異を有している〔Gibbsら(1989)Nucleic Acids Res.17:2437−2448〕か、または、適切な条件下に、ミスマッチがポリメラーゼの伸張を阻止もしくは低減させ得る1つのプライマーの3′末端に目的の突然変異を有し得る〔Prossner(1993)Tibtech.11:238〕。さらに、切断に基づいて検出できるように、突然変異領域に1つの新規な制限部位を導入することが望ましいであろう〔Gaspariniら(1992)Mol.Cell Probes 6:1〕。いくつかの実施態様において、増幅は、増幅用のTaqリガーゼを用いても実施し得ると予想される〔Barany(1991)Proc.Natl.Acad.Sci.USA 88:189〕。そのような場合、増幅の有無を捜すことによって特定部位における既知突然変異の存在を検出し得る5′配列の3′末端に完全マッチが存在する場合にのみ連結が生じるであろう。
【0187】
さらに別の代表的実施態様において、PYY遺伝子の異常メチル化パターンは、患者試料由来のゲノムDNAを、メチル化に感受性であり、かつその認識部位が(フランキングおよびイントロン配列中を含めた)PYY遺伝子中に存在する1種以上の制限エンドヌクレアーゼで消化することにより検出することができる。例えば、Buitingら(1994)Human Mol.Genet.3:893−895を参照されたい。消化されたDNAをゲル電気泳動で分離し、例えば、ゲノムまたはcDNA配列由来のプローブとハイブリダイズさせる。PYY遺伝子のメチル化状態は、試料DNAから生成した制限パターンと既知メチル化の標準の制限パターンとを比較して決定し得る。
【0188】
さらに別の実施態様において、PYYタンパク質のレベルはイムノアッセイによって検出し得る。例えば、血清試料を得て、その試料中に存在するPYYタンパク質のレベルを標準イムノアッセイ法により定量することができる。
【0189】
さらに他の実施態様において、当該アッセイは、異常なリン酸化、プレニル化、脂質修飾、ユビキチン化、および/または分解などのPYYタンパク質の異常翻訳後修飾を検出するように設計し得る。このアッセイは、PYYの組織局在の評価にも用い得る。
【0190】
本発明の診断および予後法により、PYYの機能喪失を起こす野生型PYY遺伝子座が検出される。さらに、本発明の方法は、野生型PYY遺伝子座を検出し、そのPYY遺伝子座に糖尿病素質が無いことを確認して実施し得る。「野生型遺伝子の変化」とは、コード領域および非コード領域における欠失、挿入および点突然変異を含めたすべての形態の突然変異を包含する。欠失は、全遺伝子または遺伝子の一部だけのものであり得る。点突然変異は、終止コドン、フレームシフト変異またはアミノ酸置換に帰し得る。体細胞突然変異は、特定の組織でのみ発生し、生殖細胞系列では伝達されないものである。したがって、PYY突然変異の発見は、診断情報と予後情報とを提供し得る。欠失していない(例えば、PYY欠失を有する染色体の姉妹染色体上に検出される)PYY対立遺伝子を、挿入、小欠失および点突然変異などの他の突然変異についてスクリーニングし得る。点突然変異事象は、遺伝子のプロモーターなどの調節領域に発生し、mRNA発現の喪失または低下をもたらし得る。点突然変異はまた、適切なRNAプロセシングを無効にして、PYY遺伝子産物の発現を失わせるか、またはmRNAの安定性もしくは翻訳効率を低下させる。
【0191】
上述のように、有用な診断法には、蛍光in situハイブリダイゼーション〔fluorescent in situ hybridization(FISH)〕、直接DNA配列決定〔direct DNA sequencing〕、PFGE分析、サザンブロット分析、一本鎖コンホメーション分析〔single strand conformation analysis(SSCA)〕、RNアーゼ保護アッセイ(RNaze protection assay)、対立遺伝子特異的オリゴヌクレオチド〔allele−specific oligonucleotide(ASO)〕、ドットブロット分析LCR、およびPCR−SSCPが含まれるが、それらには限定されない。
【0192】
上記のものに続いて、DNA配列変化の検出に用い得るいくつかの方法がある。直接DNA配列決定は、手動配列決定でも自動蛍光配列決定でも、配列の変化を検出し得る。PYYと同じような大きさの遺伝子の場合、手動配列決定は必ずしも労働集約的ではなく、最適条件下には、遺伝子のコード配列中の突然変異を見逃すことはめったにない。別の方法は、一本鎖コンホメーション多型性アッセイ(SSCA)である。この方法は、特に、DNA断片のサイズが200bpより大きい場合には全ての配列変化を検出することはできないが、ほとんどのDNA配列の変化を検出するように最適化することはできる。検出感度の低さは不利であるが、SSCAによる処理量の多さは魅力的であり、研究ベースで突然変異を検出するための実用的な代替直接配列決定法である。この方法では、DNA配列変化の正確な性質を決定するために、SSCAゲル上で変化した移動度を有する断片を配列決定する。2つの相補的DNA鎖間のミスマッチの検出に基づく他の方法としては、均一変性剤濃度勾配ゲル電気泳動〔clamped denaturing gel electrophoresis(CDGE)〕、ヘテロ二本鎖分析(HA)および化学的ミスマッチ切断(CMC)がある。上記方法はいずれも、大きな欠失、重複または挿入を検出しないし、タンパク質の転写または翻訳に影響を与える規定突然変異も検出しない。これらの突然変異群を検出し得るタンパク質切断アッセイ(protein truncation assay)または不斉アッセイ(asymmetric assay)などの他の方法は、特定のタイプの突然変異だけを検出し、ミスセンス突然変異は検出しない。1つの突然変異がわかったら、対立遺伝子特異的オリゴヌクレオチド(ASO)ハイブリダイゼーションなどの対立遺伝子特異的検出法を利用して、わかっている突然変異について多くの他の試料を速やかにスクリーニングすることができる。
【0193】
DNA配列における多型性を検出する高速予備分析は、1種以上の制限酵素、好ましくは大量の制限酵素で切断されたDNAを一連のサザンブロットで検査して実施し得る。各ブロットは、一連の正常個体と、一連のガン症例、腫瘍、またはその両方とを含む。(PYY遺伝子座の近くまたはPYY遺伝子座を含む配列で検査したときに対照DNAと長さが異なる)ハイブリッド形成断片を表示するサザンブロットは、突然変異の可能性を示す。極めて大きな制限断片を生成する制限酵素を用いる場合には、パルスフィールドゲル電気泳動(PPGE)を用いる。
【0194】
点突然変異の検出は、当業において周知の方法を用いたPYY対立遺伝子の分子クローニングおよび対立遺伝子の配列決定により達成し得る。あるいは、遺伝子配列は、公知方法を用いてゲノムDNA標本から直接増幅し得る。次いで、増幅した配列のDNA配列を決定し得る。
【0195】
感受性対立遺伝子の存在を確認するためのより複雑かつ間接的な試験用には多くの周知方法があり、それらには以下が含まれる:1)一本鎖コンホメーション分析(SSCA);2)変性剤濃度勾配ゲル電気泳動(DGGE);3)RNアーゼ保護アッセイ;4)対立遺伝子特異的オリゴヌクレオチド(ASOs);5)E.coli mutSタンパク質などのヌクレオチドミスマッチを認識するタンパク質の使用;および6)対立遺伝子特異的PCR。対立遺伝子特異的PCRの場合、3′末端で特定のPYY突然変異にハイブリダイズするプライマーを用いる。特定のPYY突然変異が存在しない場合には、増幅産物は観測されない。ヨーロッパ特許出願公開第0332435号に開示されているようなAmplification Refractory Mutation System(ARMS)を用いてもよい。遺伝子の挿入および欠失は、クローニング、配列決定および増幅によって検出することもできる。さらに、遺伝子または周囲のマーカー遺伝子の制限断片長多型性〔restriction fragment length polymorphism(RFLP)〕プローブを用いて、多型断片における対立遺伝子または挿入の変化を採点することができる。
【0196】
そのような方法は、罹患個体の血縁関係者をその個体に検出されたPYY突然変異の存在についてスクリーニングするために特に有用である。当業において公知の他の挿入および欠失検出法を用いてもよい。
【0197】
最初の3つの方法(SSCA、DGGEおよびRNアーゼ保護アッセイ)では、新規な電気泳動バンドが現れる。SSCAは、配列変化によって一本鎖の分子内塩基の対形成に差が生じるために示差的に移動するバンドを検出する。RNアーゼ保護は、突然変異ポリヌクレオチドを2つ以上の小さい断片に切断することを含む。DGGEは、変性剤濃度勾配ゲルを用いて、野生型配列と比較した突然変異配列の移動速度の差を検出する。対立遺伝子特異的オリゴヌクレオチドアッセイにおいては、特定の配列を検出するオリゴヌクレオチドを設計するが、このアッセイは、ハイブリッド形成シグナルの有無を検出することにより実施される。mutSアッセイにおいて、タンパク質は、突然変異配列と野生型配列との間にヘテロ二本鎖ヌクレオチドミスマッチを含む配列にのみ結合する。
【0198】
本発明によるミスマッチとは、2本の鎖が100%相補的ではないハイブリッド核酸重複部位である。全体相同性の欠如は、欠失、挿入、逆位または置換によるものであろう。遺伝子またはそのmRNA産物中の点突然変異を検出するためには、ミスマッチ検出を用いることができる。これらの方法は、配列決定より感度が低いが、大量の腫瘍試料に関して実施する場合には配列決定より簡単である。ミスマッチ切断法の1例はRNアーゼ保護法である。本発明を実施する際に、この方法は、ヒト野生型PYY遺伝子コード配列に相補的な標識リボプローブの使用を含む。このリボプローブを、腫瘍組織から単離したmRNAまたはDNAと一緒にアニーリング(ハイブリダイズ)し、その後、二本鎖RNA構造中のミスマッチを検出し得る酵素RNアーゼAで消化する。RNアーゼAは、ミスマッチを検出すると、そのミスマッチ部位で切断する。したがって、アニーリングされたRNA標本を電気泳動ゲルマトリックス上で分離すると、1つのミスマッチが検出され、RNアーゼAで切断されている場合には、リボプローブおよびmRNAまたはDNAの全長二本鎖RNAより小さいRNA産物が見つかるであろう。リボプローブは、PYYのmRNAまたは遺伝子の全長である必要はないが、どちらかのセグメントであり得る。リボプローブがPYYのmRNAまたは遺伝子のセグメントのみを含む場合、全mRNA配列をミスマッチについてスクリーニングするためには、これらのプローブを多数用いることが望ましい。
【0199】
同じようにして、酵素的または化学的切断によりミスマッチを検出するために、DNAプローブを用いることができる。あるいは、ミスマッチは、マッチ二本鎖と比べたミスマッチ二本鎖の電気泳動移動度の変化によって検出することができる。リボプローブまたはDNAプローブの場合、突然変異を含み得る細胞のmRNAまたはDNAをハイブリダイゼーション前にPCR(以下参照)を用いて増幅し得る。PYY遺伝子のDNAの変化は、特にその変化が欠失および挿入などの大きな転位である場合には、サザンハイブリダイゼーションを用いて検出することもできる。
【0200】
PCRを用いて増幅したPYY遺伝子のDNA配列は、対立遺伝子特異的プローブを用いてスクリーニングすることもできる。これらのプローブは複数の核酸オリゴマーであり、各オリゴマーは既知突然変異を有するPYY遺伝子配列領域を含んでいる。例えば、1つのオリゴマーは、PYY遺伝子配列の一部に対応する約30ヌクレオチド長のものであり得る。そのような1群の対立遺伝子特異的プローブを用いることにより、PCR増幅産物をスクリーニングして、PYY遺伝子中の既に同定された突然変異の存在を確認することができる。対立遺伝子特異的プローブと増幅PYY配列とのハイブリダイゼーションは、例えば、ナイロンフィルター上で実施し得る。緊縮ハイブリダイゼーション条件下に特定のプローブとハイブリッドを形成するということは、対立遺伝子特異的プローブ中にあるものと同じ突然変異が腫瘍組織中に存在することを示している。
【0201】
候補遺伝子座の突然変異に関する最も確定的な試験は、糖尿病患者由来のゲノムPYY配列と対照集団由来のものとを直接比較することである。あるいは、例えば、PCR増幅後でメッセンジャーRNAの配列を決定し、それによって、候補遺伝子のエキソン構造決定の必要をなくしてもよい。
【0202】
PYYのコード領域外に含まれる糖尿病患者由来の突然変異は、イントロンやPYY遺伝子の近くまたは内部の調節配列などの非コード領域を調べて検出することができる。非コード領域における突然変異が重要であるという初期の指摘は、糖尿病患者では対照個体に比べて異常なサイズまたは量のメッセンジャーRNA分子を示すノーザンブロット実験から得られたものであろう。
【0203】
PYYのmRNA発現の変化は、当業において公知の任意の方法によって検出し得る。公知方法には、ノーザンブロット分析、PCR増幅およびRNアーゼ保護が含まれる。RNA発現の低下は、野生型PYY遺伝子の変化を示している。野生型PYY遺伝子の変化は、野生型PYYタンパク質の変化についてスクリーニングして検出することもできる。例えば、PYYに対して免疫応答性のモノクローナル抗体を用いて組織をスクリーニングしてもよい。同種抗原の欠如は、PYY突然変異を示していると考えられる。突然変異PYY遺伝子産物の検出には、突然変異対立遺伝子産物に特異的な抗体を用いることもできる。そのような免疫アッセイは、当業において公知の任意の便利なフォーマットで実施し得る。そのようなフォーマットとしては、ウエスタンブロット、免疫組織化学アッセイおよびELISAアッセイがある。野生型PYY遺伝子の変化を検出するには、変性PYYタンパク質を検出するための任意の手段を用い得る。タンパク質結合決定などの機能的アッセイを用いてもよい。さらに、PYYの生化学的機能を検出するアッセイも用い得る。突然変異PYY遺伝子産物が見つかるということは、野生型PYY遺伝子が変化していることを示している。
【0204】
突然変異PYY遺伝子または遺伝子産物は、血清、便、尿およびたんなどの他のヒト体試料においても検出し得る。組織中の突然変異PYY遺伝子または遺伝子産物を検出するために上述のものと同じ方法を他の体試料にも適用し得る。ガン細胞が腫瘍から脱落し、そのような体試料中に現れる。この体試料をスクリーニングすることにより、膵臓グルコース反応の喪失を含む多くのタイプのグルコース代謝障害に関する簡単な初期診断を達成し得る。さらに、化学療法や放射線療法の進歩により、そのような体試料は、突然変異PYY遺伝子または遺伝子産物について試験することにより、さらに容易にモニターすることができる。
【0205】
本発明のプライマー対は、PCRを用いた特定のPYY対立遺伝子のヌクレオチド配列の決定に有用である。一本鎖DNAプライマー対は、PYY遺伝子自体の増幅DNA合成を加速するために、染色体上のPYY遺伝子内またはそれを取り囲む配列にアニーリングすることができる。これらのプライマーの完全セットにより、PYY遺伝子コード配列のすべてのヌクレオチド、すなわちエキソンが合成される。プライマーセットは、イントロン配列とエキソン配列を共に合成し得るのが好ましい。対立遺伝子特異的プライマーを用いてもよい。そのようなプライマーは、特定のPYY突然変異対立遺伝子にのみアニーリングし、したがって、鋳型としての突然変異対立遺伝子の存在下に産物を増幅するに過ぎないであろう。
【0206】
その後の増幅配列のクローニングを容易にするために、プライマーは、それらの5′末端に付加された制限酵素部位配列を有し得る。したがって、プライマーのすべてのヌクレオチドは、制限酵素部位の形成に必要な数個のヌクレオチドを除いて、PYY配列またはPYYに隣接する配列由来である。そのような酵素および部位は当業では周知である。プライマー自体は、当業において周知の方法を用いて合成し得る。一般に、プライマーは、市販されているオリゴヌクレオチド合成機を用いて製造し得る。配列番号1で表されるPYY読み取り枠の配列が得られたら、以下に開示されているものに加えて、特定のプライマーの設計は十分に当業の技術の範囲内である。
【0207】
(ix) 使用法:核酸診断および診断キット
個体を糖尿病体質とするPYY対立遺伝子の存在を検出するために、血液試料または生検などの生物試料を調製し、PYY感受性対立遺伝子の有無について分析する。糖尿病の存在を検出するために、糖尿病への進行または予後の指標として、生物試料を調製し、PYY突然変異対立遺伝子の有無について分析する。これらの試験の結果および解釈情報を試験した個体に伝えるためにヘルスケアプロバイダーに返す。そのような診断は診断試験室で実施してもよいし、あるいは、診断キットを製造し、自己診断用にヘルスケアプロバイダーまたは個人に販売する。
【0208】
先ず、このスクリーニング法は、関連PYY配列を増幅することを含む。本発明のいくつかの実施態様において、このスクリーニング法は、鎖置換増幅〔strand−displacement amplification(SDA)〕法などの非PCRベースの増幅法を含む。そのようなスクリーニング法は、当業では周知の2段階標識増幅法(two−step label amplification methodologies)を含み得る。PCRおよび非PCRベースのスクリーニング法はどちらも高感度で標的配列を検出し得る。
【0209】
今日最もよく用いられている方法は標的増幅法である。この方法では、ポリメラーゼを用いて標的核酸配列を増幅する。ポリメラーゼ誘導増幅(polymerase−driven amplification)を用いた1つの特に好ましい方法は、ポリメラーゼ連鎖反応(PCR)である。ポリメラーゼ連鎖反応および他のポリメラーゼ誘導増幅アッセイは、ポリメラーゼ誘導増幅サイクルを用いることによって百万倍を超えるコピー数の増加を達成することができる。増幅後、得られた核酸を配列決定し、DNAプローブ用の基質として用いることができる。
【0210】
プローブを用いて標的配列の存在を検出するとき(例えば、糖尿病感受性についてスクリーニングする際)、所望なら、血液または血清などの分析すべき生物試料を処理して核酸を抽出し得る。試料の核酸は、標的配列の検出を容易にする種々の方法:例えば、変性、制限消化、電気泳動またはドットブロットで調製し得る。分析物核酸の標的領域は、通常、プローブの標的配列とハイブリッドを形成するために少なくとも部分的に一本鎖になっていなければならない。その配列が天然の一本鎖である場合、変性は必要ないであろう。しかし、その配列が二本鎖の場合、恐らく配列を変性させる必要があろう。変性は当業において公知の種々の方法で実施し得る。
【0211】
分析物核酸およびプローブを、プローブ中の標的配列と分析物中の推定標的配列との安定したハイブリッド形成を促進する条件下にインキュベートする。分析物との結合に用いられるプローブの領域は、PYY遺伝子を含めたヒト染色体の標的領域と完全に相補的にすることができる。したがって、擬陽性を阻止するために高緊縮条件が望ましい。しかし、高緊縮性条件は、プローブがゲノム中に唯1つである染色体の領域に相補的な場合にのみ用いられる。ハイブリダイゼーションの緊縮性は、ハイブリダイゼーション時および洗浄手順時の温度、イオン強度、塩基組成物、プローブ長、およびホルムアミドの濃度を含めた多くの要素によって決められる。これらの要素は、例えば、Maniatisら,前掲およびSambrookら,前掲に略述されている。ある種の条件下には、標的配列検出手段を提供するために、三本鎖、四本鎖などの高次ハイブリッドの形成が望ましい。
【0212】
得られたハイブリッド(もしあれば)の検出は、通常、標識プローブを用いて達成される。あるいは、プローブは、標識されていなくてもよいが、直接または間接的に標識されたリガンドとの特異的結合によって検出し得る。適当な標識やプローブおよびリガンドの標識法は当業では公知であり、例えば、公知方法〔例えば、ニックトランスレーション、ランダムプライミングまたはキナージング(kinasing)〕に組み込まれている放射性標識、ビオチン、蛍光基、化学発光基(例えば、ジオキセタン、特に励起されたジオキセタン)、酵素、抗体などが含まれる。この基本的方式の変型は当業では公知であり、そのような変型には、生体外材料からの検出すべきハイブリッドの分離を容易にするか、かつ/または標識部分からのシグナルを増幅させるものが含まれる。
【0213】
上述のように、本発明では、非PCRベースのスクリーニングアッセイも企図される。代表的な非PCRベース法は、核酸プローブ(または正常なホスホジエステルを置換するメチルホスホネート主鎖などのアナログ)と低レベルのDNA標的とのハイブリダイゼーションである。このプローブは、共有結合がハイブリダイゼーションの特殊性に干渉しないように、プローブに共有結合させた酵素を有し得る。次いで、この酵素−プローブ−接合体−標的核酸複合体を遊離プローブ酵素接合体から分離して、酵素検出のために基質を添加する。酵素活性は、感度の103〜106の増大をもたらす発色または発光における変化として観測される。
【0214】
2段階標識増幅法は当業では公知である。これらのアッセイは、(ジゴキシゲニン、ビオチンなどの)小リガンドが特異的にPYYに結合し得る核酸プローブに結合するという原理に基づいている。代表的なプローブは、配列番号1で表される配列に基づいて生成し得る。対立遺伝子特異的プローブもこの例の範囲内であると考えられ、代表的な対立遺伝子特異的プローブには、PYY分泌の喪失または血清半減期の短縮をもたらす素因となる突然変異を取り囲むプローブが含まれる。
【0215】
1つの例において、核酸プローブに結合している小リガンドは、抗体−酵素接合体によって特異的に認識される。この例の1つの具体化において、ジゴキシゲニンは核酸プローブに結合する。ハイブリダイゼーションは、化学発光基質を励起させる抗体−アルカリホスファターゼ接合体によって検出される。第2の例において、小リガンドは、第1リガンドと特異的に複合体を形成し得る第2リガンド−酵素接合体によって認識される。この例の周知具体化は、ビオチン−アビジンタイプの相互作用である。
【0216】
本発明の核酸プローブアッセイがPYY配列を検出し得る核酸プローブカクテルを用いる得ることも本発明の範囲内であると考えられる。したがって、1つの例において、細胞試料中のPYYの存在を検出するために、PYYに相補的な2つ以上のプローブが用いられ、特に、異なるプローブの数が2つ、3つ、または5つの異なる核酸プローブ配列である。別の例では、患者のPYY遺伝子配列中の突然変異の存在を検出するために、PYYに相補的な2つ以上のプローブが用いられ、プローブカクテルは、PYYに変化を有する患者集団で同定された対立遺伝子特異的突然変異に結合し得るプローブを含んでいる。この実施態様では、任意の数のプローブを用い得るが、例えば、個体を特定のガン体質にすると同定された多数の遺伝子突然変異に対応するプローブを含むのが好ましい。
【実施例】
【0217】
実施例
実施例1: 膵島の単離および培養
PP、NPY、NPK、PYY、セクレチン、GLP−1およびホンベシンを含む腸由来ホルモンペプチドは、シグマ社(Sigma)から購入した。XI型コラゲナーゼは、ジブコ社(Gibco)から得た。抗インスリン抗体([125I]−RIAキット)を含むラジオイムノアッセイキットは、セントルイス所在のリンコ社(Linco,St.Louis)から購入した。
【0218】
分娩後ラットの膵島はP0〜2年齢のラットから得た。成体ラットの膵島は6〜8週齢のラットから得た。胎児ラットの膵島は以下のようにして得た。妊娠雌ラットを妊娠e21日目に殺した。子宮から胎児を取り出した。各同腹仔から10〜14個の膵臓を切り出し、ハンクス緩衝液で2回洗浄した。膵臓をプールし、6mlの1mg/mlコラゲナーゼ(XI型、シグマ社)に懸濁し、37℃で8〜10分間、常に振とうしながらインキュベートした。10容量の氷冷ハンクス緩衝液を加えて消化を停止した後、ハンクス緩衝液で3回洗浄した。次いで、膵島をフィコール勾配にかけて精製し、1μM IBMXを添加するかまたは添加せずに、10%ウシ胎児血清(FBS)/RPM1培地中で培養した。5日間培養した後、20個の膵島を手で取り出して各管に入れ、静置インスリン放出について検定した。一般に、膵島は、先ずKRP緩衝液で洗浄し、次いで、3mM(低)グルコースを含む1mlのKRP緩衝液で30分間37℃で常に振とうしながらインキュベートした。上清を回収した後、膵島を17mM(高)グルコースと共に1時間37℃でインキュベートした。低または高グルコース刺激により放出されたインスリンを、[125I]−RIAキットを用いてラジオイムノアッセイ(RIA)にかけて検定した(図1参照)。
【0219】
実施例2: e21膵島におけるIBMX刺激カルシウムインフラックス
実施例1にしたがって、e21膵島を単離し、培養した。次いで、膵島を17mMグルコースまたは3mM(低)グルコース中1μM IBMXで処理した(図2)。非グルコース応答性e21膵島は、高グルコースを添加しても細胞内カルシウムインフラックスが増大しなかった。IBMXを添加するとカルシウムインフラックスが誘発され、これは、e21膵島のインスリン放出を刺激するIBMXのメカニズムもカルシウムチャンネルの活性化を利用することを示唆している。これはさらに、P0膵島で観測されたグルコース応答性の増加がカルシウムチャンネルの上流で発生することを示唆している。
【0220】
実施例3: PYYは胎児膵島の成熟を誘発する
実施例1のように胎児ラット膵島を単離した。e21胎児膵島を、5日間、200ng/mlのPYY、PPP、CCK、NPK、NPY、セクレチン、GLP−1またはボンベシンの存在下に培養した。次いで、各培養グループのグルコース刺激インスリン放出を測定した(図3Aおよび図3B)。PYYは、インスリン分泌により、膵島のグルコース応答能を著しく刺激した。約70%アミノ酸相同性を共有するPPPおよびNPYなどの関連ペプチドは、グルコース応答性の増加を刺激しなかった。
【0221】
実施例4: e21膵島に及ぼすPYYの効果は時間依存性である
実施例1のように胎児ラット膵島を単離した。次いで、e21膵島を200ng/mlのPYYで2日、5日または7日間培養した。各培養グループでグルコース刺激インスリン放出を測定した(図4)。対照グループは、培養中で5日後に、インスリン放出で測定して、時間0および2日目の時間点(三角)に比べてわずかな応答性の増加を示した。5日間PYYを添加すると、対照に比べてグルコースに応答して放出されるインスリンの量がほぼ倍になった。この効果は1日目時間点で維持された。PYYインキュベーション2日後ではグルコース応答性の増加に及ぼすPYYの効果はなかった。
【0222】
実施例5: PYYの用量応答は最適用量が200ng/mlであることを示している
実施例1のように胎児ラット膵島を単離した。e21膵島に、5日間、50、100、200、500および1000ng/mlのPYYを添加した。次いで、各培養グループのグルコース刺激インスリン放出を測定した(図5)。PYYの最適効果は、インスリン放出により測定して、200ng/mlで観測された。500および1000ng/mlではPYYの効果は減少したが、これは、既に図5で認められる。
【0223】
実施例6: 成体膵島に及ぼすPYYの効果
実施例1のように成体ラット膵島を単離し、16日間にわたり、対照培地または200ng/mlのPYYを含む培地で処理した。グルコース刺激インスリン放出を指定日に測定した(図6)。成体膵島では、培地を含む標準10%FBS中で培養して2日以内にグルコース刺激インスリン分泌がなくなった。しかし、PYYは、培養10日目以降でも応答性を守ることができた。
【0224】
実施例7: グルコース応答性の増加に及ぼすPYYの効果は遺伝子転写の活性化を必要とする
実施例1のように胎児ラット膵島を単離し、1μM IBMXを添加するかまたは添加せずに、200ng/mlのPYYで5日間処理し、最後の16時間の間に0.1μg/mlのアクチノマイシンDを添加した。次いで、各培養グループのグルコース刺激インスリン放出を測定した(図7)。アクチノマイシンDは、インスリン放出により測定して、PYYによって誘発される機能性の増加を完全に阻害することができた。これは、膵島に対する薬剤の非特異的毒性によるものではない。というのは、IBMXは依然としてアクチノマイシンDで処理した膵島でエキソサイトーシスを誘発し得るからである。
【0225】
実施例8: アクチノマイシンDの作用は膵島のインスリン含量を低下させることによって仲介されるのではない
実施例1のように胎児ラット膵島を単離し、200ng/mlのpyyで5日間処理し、最後の16時間の間に0.1、0.2、0.5および1.0μg/mlのアクチノマイシンDを添加した。次いで、各培養グループのインスリン含量を測定した(図8)。表は、アクチノマイシンDの量を増大させても、膵島の全インスリン含量が有意に減少しなかったことを示している。
【0226】
実施例9: PYYは基底分泌速度に影響を与えない
実施例1のようにe21およびP14ラット膵島を単離し、200ng/mlのPYYで処理した。次いで、膵島を洗浄し、インスリン放出により測定して、グルコース応答性について検定した。次いで、アッセイ緩衝液(クレブス・リンゲルホスフェート)にPYYを添加して、PYYの存在が実際に基底または刺激インスリン分泌速度に影響を与えるかどうかを確認した。次いで、各培養グループのグルコース刺激インスリン放出を測定した(図8)。アッセイ緩衝液中へのPYY添加の効果は無視できる程度であり、これは、PYYの主要効果がPYYが存在する培養期間中に及ぼされることを示している。新たに単離したP14膵島を正の対照として含めた。
【0227】
実施例10: 成体ラット膵島のグルコース応答の回復に及ぼすPYYの効果
実施例1のように成体ラット膵島を単離し、10%FBS中で7日間培養し、その間の図10に指示されている日に、培地に200ng/mlのPYYを添加した。7日培養した膵島だけはグルコース応答性を失ったが、アッセイ終了前の最後の2〜3日の間にPYYを添加すると、膵島はグルコース応答を回復した。培地中にPYYが5日以上存在すると、膵島はその回復機能を失ってしまうようであり、これは、ペプチドシグナル分解の可能性を示唆している。
【0228】
上記の参考文献および刊行物はすべて本明細書に文献援用される。
等価物
当業者には、本明細書に記載されている本発明の特定の実施態様に対する多くの等価物が認識されるであろうし、それらは、ただ日常実験を用いるだけで確認することができるであろう。そのような等価物は以下の特許請求の範囲に包含されるものとする。
【特許請求の範囲】
【請求項1】
膵臓細胞をペプチドYY(PYY)またはそのアゴニストを含む組成物に接触させることを含む、膵臓細胞の増殖を促進する方法。
【請求項2】
膵臓組織をペプチドYY(PYY)またはそのアゴニストを含む組成物に接触させることを含む、膵臓組織の変性を低下させる方法。
【請求項3】
膵臓細胞または組織が外分泌細胞を含む、請求項1または2に記載の方法。
【請求項4】
膵臓細胞または組織が内分泌細胞を含む、請求項1または2に記載の方法。
【請求項5】
膵臓細胞または組織がα、β、δまたはψ細胞を含む、請求項1または2に記載の方法。
【請求項6】
膵臓組織がインスリン産生島を含む、請求項2に記載の方法。
【請求項7】
配列番号1と同一もしくは相同のPYYペプチドまたはその活性断片を利用する、請求項1または2に記載の方法。
【請求項8】
PYYペプチドミメティックを利用する、請求項1または2に記載の方法。
【請求項9】
PYYペプチドミメティックが、プロテアーゼ耐性結合で置換された1つ以上のアミド結合を有する配列番号1に相同のペプチドであり、配列番号1で表されるペプチドより長い血清半減期を有する、請求項8に記載の方法。
【請求項10】
非ペプチジルPYYアゴニストを利用する、請求項1または2に記載の方法。
【請求項11】
PYYアゴニストが低有機分子である、請求項10に記載の方法。
【請求項12】
PYYアゴニストがDPIV阻害剤である、請求項10に記載の方法。
【請求項13】
膵島または膵臓細胞にPYY治療剤を投与することを含む、膵島または膵臓細胞の分化状態を変える方法。
【請求項14】
PYY治療剤の投与により膵島または膵臓細胞をグルコース応答性にする、請求項13に記載の方法。
【請求項15】
前記グルコース応答性膵島または膵臓細胞が、グルコースで処理するとインスリンを産生する、請求項14に記載の方法。
【請求項16】
膵島が胎児膵島である、請求項13に記載の方法。
【請求項17】
膵臓細胞が胎児膵臓細胞である、請求項13に記載の方法。
【請求項18】
膵島が分娩後膵島である、請求項13に記載の方法。
【請求項19】
膵臓細胞が分娩後膵臓細胞である、請求項13に記載の方法。
【請求項20】
膵臓細胞が膵臓β細胞である、請求項13、17または19に記載の方法。
【請求項21】
動物に医薬上有効量のPYY治療剤含有組成物を投与することを含む、動物のグルコース代謝を変える方法。
【請求項22】
前記PYY治療剤が膵島または膵臓細胞のグルコース応答性を誘発または促進する、請求項21に記載の方法。
【請求項23】
動物に、膵島または膵臓細胞のグルコース応答性の増強に十分な量のPYY治療剤含有組成物を医薬上有効量投与することを含む、グルコース代謝異常に関連する疾患を治療する方法。
【請求項24】
動物に、膵島または膵臓細胞のグルコース応答性の増強に十分な量のPYYアンタゴニストアンタゴニスト含有組成物を医薬上有効量投与することを含む、グルコース代謝異常に関連する疾患を治療する方法。
【請求項25】
動物に、請求項13、14、15、17、19または20に記載のグルコース応答性膵島または膵臓細胞を含む組成物を医薬上有効量投与することを含む、グルコース代謝異常に関連する疾患を治療する方法。
【請求項26】
前記組成物がPYY治療剤をさらに含む、請求項25に記載の方法。
【請求項27】
前記組成物を、PYY治療剤と、同時、順次または別個に併用投与する、請求項26に記載の方法。
【請求項28】
前記疾患が、被験者のインスリン抵抗性、グルコース不耐性またはグルコース非応答性、高血糖症、肥満症、高脂質血症および高リポタンパク血症からなる群から選択される症状に関連する、請求項23、24または25に記載の方法。
【請求項29】
前記疾患がII型糖尿病(NIDD)である、請求項23、24または24に記載の方法。
【請求項30】
前記組成物が、ジペプチジルペプチダーゼ阻害剤、インスリンまたはGLP−1をさらに含む、請求項13から29のいずれか1項に記載の方法。
【請求項31】
前記組成物を、ジペプチジルペプチダーゼ阻害剤、インスリンまたはGLP−1と同時、順次または別個に併用投与する、請求項13から29のいずれか1項に記載の方法。
【請求項32】
前記ジペプチジルペプチダーゼがDPIVである、請求項30または31に記載の方法。
【請求項33】
膵島または膵臓細胞にPYY治療剤含有組成物を投与することを含む、機能性膵臓β細胞を得る方法。
【請求項34】
前記アゴニストが低有機分子である、請求項13から33のいずれか1項に記載の方法。
【請求項35】
前記組成物がPYY治療剤の分解を阻止し得る作用物質をさらに含む、請求項13から33のいずれか1項に記載の方法。
【請求項36】
動物に、前記PYYまたはPYYアゴニストと同時、順次または別個に、PYY治療剤の分解を阻止し得る作用物質を投与するステップをさらに含む、請求項13から33のいずれか1項に記載の方法。
【請求項37】
前記作用物質をPYY治療剤と併用投与する、請求項34に記載の方法。
【請求項38】
膵島または膵臓細胞に有効量の作用物質を投与し、前記作用物質に対する細胞応答をPYYまたはアゴニストに対する細胞応答と比較することを含む、PYYホモログ、PYYアナログ、PYYアゴニスト、PYYアンタゴニストまたはPYYアンタゴニストアンタゴニストを同定する方法。
【請求項39】
前記PYY治療剤がグルコース応答性を促進または回復させる、請求項13から38のいずれか1項に記載の方法。
【請求項40】
PYYホモログ、PYYアナログ、PYYアゴニスト、PYYアンタゴニストまたはPYYアンタゴニストアンタゴニストの存在についてDNAライブラリーをスクリーニングする方法。
【請求項41】
膵島または膵臓細胞にある作用物質を投与し、その作用物質で処理していない細胞と比べてグルコース反応性を決定することを含む、PYYアンタゴニストを同定する方法。
【請求項42】
アンタゴニストが天然アゴニストである、請求項39に記載の方法。
【請求項43】
アンタゴニストが合成アゴニストである、請求項39に記載の方法。
【請求項44】
前記アンタゴニストが、アンチセンス、リボザイム分子および低有機分子からなる群から選択される、請求項41から43のいずれか1項に記載の方法。
【請求項45】
培養膵島または膵臓細胞にPYY治療剤を投与することを含む、正常な膵島機能を維持する方法。
【請求項46】
前記膵島が不全β細胞である、請求項45に記載の方法。
【請求項47】
動物由来の未分化細胞をPYY治療剤と接触させることにより細胞培養中に産生された機能的に成熟した島またはβ細胞。
【請求項48】
医薬品として投与するのに適した組成物であって、
(i) 脊椎動物PYYタンパク質の少なくとも1種の生物活性のアゴニストか前記脊椎動物PYYタンパク質の少なくとも1種の生物活性のアンタゴニストのどちらか一方の役割を果たし得る少なくとも1つのポリペプチド、および、
(ii) 医薬上許容し得る担体
を含み、
膵島または膵臓細胞のグルコース応答性を誘発する組成物。
【請求項49】
拮抗性PYYポリペプチドの発現またはPYY治療剤をコードする遺伝子の破壊のいずれかによって1つ以上の組織でPYY誘導経路が阻害されているトランスジェニック非ヒト動物。
【請求項50】
前記動物がヒトである、請求項13から49のいずれか1項に記載の方法。
【請求項1】
膵臓細胞をペプチドYY(PYY)またはそのアゴニストを含む組成物に接触させることを含む、膵臓細胞の増殖を促進する方法。
【請求項2】
膵臓組織をペプチドYY(PYY)またはそのアゴニストを含む組成物に接触させることを含む、膵臓組織の変性を低下させる方法。
【請求項3】
膵臓細胞または組織が外分泌細胞を含む、請求項1または2に記載の方法。
【請求項4】
膵臓細胞または組織が内分泌細胞を含む、請求項1または2に記載の方法。
【請求項5】
膵臓細胞または組織がα、β、δまたはψ細胞を含む、請求項1または2に記載の方法。
【請求項6】
膵臓組織がインスリン産生島を含む、請求項2に記載の方法。
【請求項7】
配列番号1と同一もしくは相同のPYYペプチドまたはその活性断片を利用する、請求項1または2に記載の方法。
【請求項8】
PYYペプチドミメティックを利用する、請求項1または2に記載の方法。
【請求項9】
PYYペプチドミメティックが、プロテアーゼ耐性結合で置換された1つ以上のアミド結合を有する配列番号1に相同のペプチドであり、配列番号1で表されるペプチドより長い血清半減期を有する、請求項8に記載の方法。
【請求項10】
非ペプチジルPYYアゴニストを利用する、請求項1または2に記載の方法。
【請求項11】
PYYアゴニストが低有機分子である、請求項10に記載の方法。
【請求項12】
PYYアゴニストがDPIV阻害剤である、請求項10に記載の方法。
【請求項13】
膵島または膵臓細胞にPYY治療剤を投与することを含む、膵島または膵臓細胞の分化状態を変える方法。
【請求項14】
PYY治療剤の投与により膵島または膵臓細胞をグルコース応答性にする、請求項13に記載の方法。
【請求項15】
前記グルコース応答性膵島または膵臓細胞が、グルコースで処理するとインスリンを産生する、請求項14に記載の方法。
【請求項16】
膵島が胎児膵島である、請求項13に記載の方法。
【請求項17】
膵臓細胞が胎児膵臓細胞である、請求項13に記載の方法。
【請求項18】
膵島が分娩後膵島である、請求項13に記載の方法。
【請求項19】
膵臓細胞が分娩後膵臓細胞である、請求項13に記載の方法。
【請求項20】
膵臓細胞が膵臓β細胞である、請求項13、17または19に記載の方法。
【請求項21】
動物に医薬上有効量のPYY治療剤含有組成物を投与することを含む、動物のグルコース代謝を変える方法。
【請求項22】
前記PYY治療剤が膵島または膵臓細胞のグルコース応答性を誘発または促進する、請求項21に記載の方法。
【請求項23】
動物に、膵島または膵臓細胞のグルコース応答性の増強に十分な量のPYY治療剤含有組成物を医薬上有効量投与することを含む、グルコース代謝異常に関連する疾患を治療する方法。
【請求項24】
動物に、膵島または膵臓細胞のグルコース応答性の増強に十分な量のPYYアンタゴニストアンタゴニスト含有組成物を医薬上有効量投与することを含む、グルコース代謝異常に関連する疾患を治療する方法。
【請求項25】
動物に、請求項13、14、15、17、19または20に記載のグルコース応答性膵島または膵臓細胞を含む組成物を医薬上有効量投与することを含む、グルコース代謝異常に関連する疾患を治療する方法。
【請求項26】
前記組成物がPYY治療剤をさらに含む、請求項25に記載の方法。
【請求項27】
前記組成物を、PYY治療剤と、同時、順次または別個に併用投与する、請求項26に記載の方法。
【請求項28】
前記疾患が、被験者のインスリン抵抗性、グルコース不耐性またはグルコース非応答性、高血糖症、肥満症、高脂質血症および高リポタンパク血症からなる群から選択される症状に関連する、請求項23、24または25に記載の方法。
【請求項29】
前記疾患がII型糖尿病(NIDD)である、請求項23、24または24に記載の方法。
【請求項30】
前記組成物が、ジペプチジルペプチダーゼ阻害剤、インスリンまたはGLP−1をさらに含む、請求項13から29のいずれか1項に記載の方法。
【請求項31】
前記組成物を、ジペプチジルペプチダーゼ阻害剤、インスリンまたはGLP−1と同時、順次または別個に併用投与する、請求項13から29のいずれか1項に記載の方法。
【請求項32】
前記ジペプチジルペプチダーゼがDPIVである、請求項30または31に記載の方法。
【請求項33】
膵島または膵臓細胞にPYY治療剤含有組成物を投与することを含む、機能性膵臓β細胞を得る方法。
【請求項34】
前記アゴニストが低有機分子である、請求項13から33のいずれか1項に記載の方法。
【請求項35】
前記組成物がPYY治療剤の分解を阻止し得る作用物質をさらに含む、請求項13から33のいずれか1項に記載の方法。
【請求項36】
動物に、前記PYYまたはPYYアゴニストと同時、順次または別個に、PYY治療剤の分解を阻止し得る作用物質を投与するステップをさらに含む、請求項13から33のいずれか1項に記載の方法。
【請求項37】
前記作用物質をPYY治療剤と併用投与する、請求項34に記載の方法。
【請求項38】
膵島または膵臓細胞に有効量の作用物質を投与し、前記作用物質に対する細胞応答をPYYまたはアゴニストに対する細胞応答と比較することを含む、PYYホモログ、PYYアナログ、PYYアゴニスト、PYYアンタゴニストまたはPYYアンタゴニストアンタゴニストを同定する方法。
【請求項39】
前記PYY治療剤がグルコース応答性を促進または回復させる、請求項13から38のいずれか1項に記載の方法。
【請求項40】
PYYホモログ、PYYアナログ、PYYアゴニスト、PYYアンタゴニストまたはPYYアンタゴニストアンタゴニストの存在についてDNAライブラリーをスクリーニングする方法。
【請求項41】
膵島または膵臓細胞にある作用物質を投与し、その作用物質で処理していない細胞と比べてグルコース反応性を決定することを含む、PYYアンタゴニストを同定する方法。
【請求項42】
アンタゴニストが天然アゴニストである、請求項39に記載の方法。
【請求項43】
アンタゴニストが合成アゴニストである、請求項39に記載の方法。
【請求項44】
前記アンタゴニストが、アンチセンス、リボザイム分子および低有機分子からなる群から選択される、請求項41から43のいずれか1項に記載の方法。
【請求項45】
培養膵島または膵臓細胞にPYY治療剤を投与することを含む、正常な膵島機能を維持する方法。
【請求項46】
前記膵島が不全β細胞である、請求項45に記載の方法。
【請求項47】
動物由来の未分化細胞をPYY治療剤と接触させることにより細胞培養中に産生された機能的に成熟した島またはβ細胞。
【請求項48】
医薬品として投与するのに適した組成物であって、
(i) 脊椎動物PYYタンパク質の少なくとも1種の生物活性のアゴニストか前記脊椎動物PYYタンパク質の少なくとも1種の生物活性のアンタゴニストのどちらか一方の役割を果たし得る少なくとも1つのポリペプチド、および、
(ii) 医薬上許容し得る担体
を含み、
膵島または膵臓細胞のグルコース応答性を誘発する組成物。
【請求項49】
拮抗性PYYポリペプチドの発現またはPYY治療剤をコードする遺伝子の破壊のいずれかによって1つ以上の組織でPYY誘導経路が阻害されているトランスジェニック非ヒト動物。
【請求項50】
前記動物がヒトである、請求項13から49のいずれか1項に記載の方法。
【図1】


【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】




【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【公開番号】特開2011−128(P2011−128A)
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願番号】特願2010−208097(P2010−208097)
【出願日】平成22年9月16日(2010.9.16)
【分割の表示】特願2000−598171(P2000−598171)の分割
【原出願日】平成12年2月10日(2000.2.10)
【出願人】(501188889)キュリス,インコーポレイテッド (23)
【Fターム(参考)】
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願日】平成22年9月16日(2010.9.16)
【分割の表示】特願2000−598171(P2000−598171)の分割
【原出願日】平成12年2月10日(2000.2.10)
【出願人】(501188889)キュリス,インコーポレイテッド (23)
【Fターム(参考)】
[ Back to top ]

