グルコース取り込み促進剤及びその用途
【課題】飽和脂肪酸を多量に含む高脂肪食を摂取したときに、筋肉細胞組織へのインスリン依存的及び/又は非インスリン依存的な糖の取り込みの低下を微量の添加で抑制可能なグルコース取り込み促進剤を提供する。
【解決手段】本発明のグルコース取り込み促進剤は、有効成分としてアラキドン酸を含有する。このグルコース取り込み促進剤は、特にインスリン抵抗性を改善する。
【解決手段】本発明のグルコース取り込み促進剤は、有効成分としてアラキドン酸を含有する。このグルコース取り込み促進剤は、特にインスリン抵抗性を改善する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、グルコース取り込み促進剤及びその用途に関し、より詳細には、筋肉細胞組織への非インスリン依存的及び/又はインスリン依存的な糖取り込みの低下を抑制する機能を有するグルコース取り込み促進剤、それを含有する油脂組成物等に関する。
【背景技術】
【0002】
先進諸国では、糖尿病の罹患者数が増大している。糖尿病による高血糖状態の持続は、網膜症、白内障や血管新生緑内障による失明、腎臓病、神経障害、冠動脈、能動脈や手足での動脈硬化症等の合併症を引き起こす。腎臓病では人工透析治療が必要になる。このように、糖尿病は、患者のQOLを著しく損ない、また医療コストを多大に引き上げる。
【0003】
糖尿病は、発症に自己免疫機序が関与すると考えられている1型糖尿病と、カロリーの過剰摂取や運動不足に基づく肥満状態の継続により発症する2型糖尿病とに大別される。患者の大部分は2型糖尿病に属する。
【0004】
2型糖尿病を発症する要因として、インスリン抵抗性がある。インスリンは、膵臓のランゲルハンス島から分泌される、グルコース(以下、単に糖ということがある)の代謝や脂質の代謝に関わるホルモンである。インスリンは、血糖値を適正値に保つために、肝臓に蓄えたグリコーゲンの糖への分解を抑制する、肝臓や筋肉中の糖からグリコーゲンへの合成を促進する、血糖を筋肉細胞や脂肪細胞へ運搬する、脂肪細胞中の糖から脂肪への合成を促進する等の機能を有する。糖尿病の患者は、健常人と比べて同じ量のインスリンを投与しても血糖値が下がりにくく、また軽症糖尿病患者よりも重症糖尿病患者の方が下がりにくい。これらの事実から、インスリンが効きにくい状態をインスリン抵抗性と称して、2型糖尿病の主要因子とされている。
【0005】
インスリン抵抗性の有無を簡便に調べるため、HOMA−IR値(Homeostasis model assessment−Insulin Resistance、インスリン抵抗性指数)が測定される。この指標は、以下の数式:
【数1】

により求めることができる。日本人の統計では、HOMA−IR値が2以上であるとインスリン抵抗性があり、4以上であると強いインスリン抵抗性があるとされる。
【0006】
インスリン抵抗性の発症は、食生活、運動、不規則な生活等に左右される。食事の中でも、脂質は、炭水化物やタンパク質と比較して単位重量当たりの熱量が大きいため優れたエネルギー源となる反面、過剰摂取によるエネルギー過多になり易いため、食生活に基づく2型糖尿病予防の重要な因子である。一方で、脂質は、必須脂肪酸の供給源であり、また脂溶性ビタミンの吸収を助けるという生理的意義を有する。よって、脂質の摂取を闇雲に抑えることは好ましくない。
【0007】
非特許文献1(Marek Straczkowski et. al., Relationship Between Insulin Sensitivity and Sphingomyelin Signaling Pathway in Human Skeletal Muscle)によれば、インスリン抵抗性は、セラミド(スフィンゴミエリンシグナル経路の第二メッセンジャー)の細胞内形成と関係すること、インスリン抵抗性は、骨格筋細胞内の総セラミド含量と相関すること、そして、パルミチン酸からなるセラミドと最も強く相関することを開示する。
【0008】
本発明者らは、マウスに高脂肪食を16週間摂取させて慢性的肥満状態のマウスを作製した。このマウスは、インスリン抵抗性を惹起する動物モデルとなる。この動物モデルを用いた試験(参考例1参照)によって、高脂肪食の摂取により惹起されるインスリン抵抗性は、飼料に添加された油脂の種類で異なることを確認している。
【0009】
上記動物実験モデルの基礎となる細胞試験(本明細書の参考例2〜4)に示すように、ラード等に多く含まれるパルミチン酸やステアリン酸のような飽和脂肪酸は、骨格筋細胞への非インスリン依存的な糖の取り込み量を著しく減少させる。さらに、インスリン処理しても糖の取り込み量があまり増えないことから、飽和脂肪酸の摂取によってインスリン感受性が損なわれる(すなわち、インスリン抵抗性が誘導される)。
【0010】
上記インスリン抵抗性の誘導は、本明細書の比較例1に示すように、不飽和脂肪酸であるα−リノレン酸の同時摂取により抑制される。しかし、この抑制のためには、多量のα−リノレン酸で置換するか、又は添加が必要となる。
【0011】
特許文献1(油脂組成物)には、トリグリセリド10.1〜94.9重量%、モノグリセリド0.1〜30重量%及び構成脂肪酸の15〜90重量%が炭素数20未満のω3系不飽和脂肪酸であるジグリセリドを5〜59.9重量%を含有する油脂組成物にインスリン抵抗性改善作用があることが開示されている。当該ジグリセリドのω3系不飽和脂肪酸の好適な例がα−リノレン酸である。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特開2002−138297
【非特許文献】
【0013】
【非特許文献1】Diabetes,2004,vol.53,no.5,1215−1221
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明の目的は、高脂肪食、特に飽和脂肪酸を多量に含む高脂肪食を摂取したときに、筋肉細胞組織へのインスリン依存的及び/又は非インスリン依存的なグルコース取り込みの低下を微量の添加で抑制可能なグルコース取り込み促進剤を提供することにある。
【課題を解決するための手段】
【0015】
本発明者らは、上記課題について鋭意検討した結果、特定の高度不飽和脂肪酸は、飽和脂肪酸との低濃度の共存において飽和脂肪酸によるインスリン依存的及び/又は非インスリン依存的な糖取り込みの低下を抑制することを見出して、本発明に至った。すなわち、本発明は、有効成分としてアラキドン酸を含有するグルコース取り込み促進剤を提供する。本明細書において、「アラキドン酸」という用語は、アラキドン酸自身の他に、アラキドン酸を構成脂肪酸とする化合物を含む意味で使用する。
【0016】
従来、アラキドン酸の効能については、一般に免疫系の調節や妊娠後期の胎児や出生直後の乳児の健全な発育に必要とされることや、抗疲労作用(特開2009−73747)や血管の老化防止作用(特開2009−219500)が公知である。しかし、グルコース取り込み促進作用、すなわち、筋肉細胞組織へのインスリン依存的及び/又は非インスリン依存的な糖の取り込みの低下を抑制することは全く知られていない。
【0017】
本発明は、また、上記グルコース取り込み促進剤を含有する油脂組成物を提供する。
【0018】
上記油脂組成物は、特に飽和脂肪酸を含有する場合に産業用の利用価値が高まる。本明細書において、「飽和脂肪酸」という用語は、飽和脂肪酸自身の他に、構成脂肪酸として飽和脂肪酸を含む化合物を含む意味で使用する。
【0019】
特に上記油脂組成物は、前記アラキドン酸の飽和脂肪酸に対するモル比率は、0.01〜3であることが好ましい。
【0020】
上記油脂組成物には、例えばラード、牛脂、パーム油、パーム核油、ヤシ油等の元来飽和脂肪酸含量の多い油脂に加え、大豆油、菜種油、コーン油、米油等の液状油を水素添加して得た加工油脂、並びにこれらをエステル交換処理して製造した油脂があり、さらに、前記に例示した油脂を分別した油脂がある。上記油脂組成物は、これらの油脂からなる群から選ばれる少なくとも一種を含む。
【0021】
本発明は、また、上記油脂組成物を用いて製造した食品を提供する。
【発明の効果】
【0022】
パーム油並びに液状油を水素添加して製造する硬化油は、飽和脂肪酸含量が高いため、酸化安定性に優れるという特性や常温で固体である特性を利用して、様々な食品に利用されており、加工食品の製造においては欠く事ができない。しかし、昨今の研究により、飽和脂肪酸の過剰摂取がインスリン抵抗性発症に繋がることが指摘されている(Diabetologia (1997),40,430−438)。有効成分としてアラキドン酸を含有する本発明のグルコース取り込み促進剤によれば、飽和脂肪酸に高度不飽和脂肪酸の一種であるアラキドン酸を共存させることで、飽和脂肪酸による非インスリン依存的なグルコース取り込み量の減少を抑制し、そしてまた、飽和脂肪酸によるインスリン依存的なグルコース取り込みの減少を回復させ、その結果として、血糖値の上昇を抑えることが可能である。
【0023】
本発明のグルコース取り込み促進剤は、1型糖尿病及び2型糖尿病のいずれの予防や回復にも有効なことが期待される。しかも、本発明のグルコース取り込み促進剤は、α−リノレン酸のような不飽和脂肪酸と比較して一桁低い濃度で同等の効果を奏する点で優れ、産業上の利用性も非常に高い。
【0024】
飽和脂肪酸を含有する油脂組成物に本発明のグルコース取り込み促進剤を添加することで、飽和脂肪酸による非インスリン依存的及び/又はインスリン依存的なグルコース取り込みの減少を回復させることができる。そのような油脂組成物は、ラード、牛脂、パーム核油、ヤシ油、米油、天然油脂のグリセロール骨格の1,2,3位の少なくとも一位に化学的又は生化学的手法により飽和脂肪酸を結合させた加工油脂等を含む。
【図面の簡単な説明】
【0025】
【図1】各種濃度のパルミチン酸で24時間処理したL6細胞で発現したインスリン受容体タンパク質を、ウエスタンブロット法により検出した結果である。インスリン受容体タンパク質の発現量は、パルミチン酸の濃度に依存して減少している。
【図2】0.75mMのパルミチン酸で8〜16時間処理したL6細胞で発現したインスリン受容体タンパク質を、ウエスタンブロット法で検出した結果である。インスリン受容体タンパク質の発現量は、パルミチン酸の処理時間に依存して減少している。
【図3】0.75mMのパルミチン酸で14時間処理したL6細胞で発現したグルコーストランスポーター−4(GLUT4)タンパク質を、ウエスタンブロット法で検出した結果である。GLUT4タンパク質の発現量は、パルミチン酸処理により減少している。
【図4】パルミチン酸がL6細胞の糖取り込みに及ぼす影響を、インスリン処理無し(□)及び100nMインスリン処理(■)の二種類について調べたグラフである。□バーが示すように、パルミチン酸は、インスリン非依存的な糖取り込みを処理時間に依存して減少させる。また、■バーが示すように、パルミチン酸未処理では、インスリン刺激により、糖の取り込み量が60%増したが、8時間処理では、インスリン刺激による糖取り込み量の増加は20%に留まり、さらに10時間処理では、インスリン刺激による糖取り込み量の増加が認められなかった。
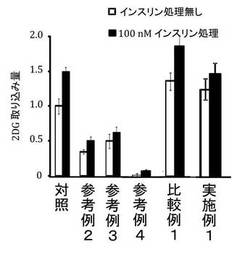
【図5】各種脂肪酸がL6細胞の糖取り込みに及ぼす影響を、インスリン処理無し(□)及び100nMインスリン処理(■)の二種類について調べたグラフである。各種脂肪酸でのL6細胞の処理時間は14時間である。パルミチン酸(参考例2)及びステアリン酸(参考例3)でL6細胞を処理すると、L6細胞の非インスリン依存的な糖の取り込みを著しく減少させ、インスリン処理による糖取り込みの増加(インスリン感受性)も低下させた。パルミチン酸及びステアリン酸の共存(参考例4)は、非インスリン依存的糖取り込み及びインスリン感受性を著しく低下させた。一方、パルミチン酸とα−リノレン酸の共存(比較例1)は、非インスリン依存的糖取り込みをパルミチン酸無処理レベルあるいはそれ以上に高め、そして、インスリン感受性の低下を抑制した。パルミチン酸とアラキドン酸の共存(実施例1)は、非インスリン依存的な糖取り込み量の減少を抑制し、そして、パルミチン酸によるインスリン依存的な糖の取り込みの減少を回復させた。
【図6】パルミチン酸0.75mMに各種濃度のアラキドン酸を共存させた場合のL6細胞の糖取り込みに及ぼす影響を、インスリン処理無し(□)及び100nMインスリン処理(■)の二種類について調べたグラフである。アラキドン酸は、濃度10μM以上で、パルミチン酸によるインスリン非依存的な糖取り込み量の減少を濃度依存的に抑制した。そして、アラキドン酸は、濃度75μMまでは、パルミチン酸によるインスリン依存的な糖の取り込みの減少を濃度依存的に回復させた。
【発明を実施するための形態】
【0026】
以下に、本発明の実施態様を詳細に説明する。本発明のグルコース取り込み促進剤は、有効成分としてアラキドン酸を含有する。アラキドン酸は、分子式C20H32Oで示され、4個の二重結合を含む20個の炭素鎖からなるカルボン酸であり、n−6系不飽和脂肪酸に分類される。本発明に使用するアラキドン酸は、アラキドン酸自身の他に、アラキドン酸を構成脂肪酸とする化合物であってもよく、例えば構成脂肪酸の少なくとも一部がアラキドン酸であるトリグリセリド、グリセリン脂肪酸エステル、リン脂質、糖脂質、エステル等;アラキドン酸とアルコール(メタノール、エタノール等)とのエステル;アラキドン酸塩等が挙げられる。
【0027】
本発明に使用するアラキドン酸の入手方法は特に制限されない。例えばアラキドン酸を構成成分とするトリグリセリドを産生する能力を有する微生物(例えばMortierella属糸状菌)を工業的に培養する方法等である。本発明は、市販のアラキドン酸を使用可能である。
【0028】
本発明のグルコース取り込み促進剤は、有効成分としてのアラキドン酸以外に、食品分野の添加剤として公知のものを特に制限なく使用可能である。その具体例としては、不飽和脂肪酸(n−9、n−7、n−6、n−3系不飽和脂肪酸等)、賦形剤、崩壊剤、結合剤、滑沢剤、ビタミン、アミノ酸、懸濁化剤、粘稠剤、溶解補助剤、抗酸化剤、可塑剤、界面活性剤、アルコール類、甘味料、矯味剤、酸味料、香料、着色剤等が挙げられる。
【0029】
本発明のグルコース取り込み促進剤の形態は特に制限がない。例えば、液剤、錠剤、散剤、顆粒剤、カプセル、乳剤、懸濁剤等が挙げられる。
【0030】
本発明のグルコース取り込み促進剤の有効成分としてのアラキドン酸の含有量は、使用方法によって適宜調整されるが、通常、0.01〜100重量%、好ましくは0.1〜80重量%、特に好ましくは1〜50重量%である。
【0031】
本発明のグルコース取り込み促進剤の使用量は、アラキドン酸の飽和脂肪酸に対するモル比率に換算して、通常、0.01〜3であり、好ましくは0.01〜0.2であり、より好ましくは0.03〜0.1である。モル比率が0.01より低すぎると、飽和脂肪酸による非インスリン依存的及び/又はインスリン依存的グルコース取り込み抑制を緩和することができない場合がある。一方、モル比率が3より高すぎても、使用量に見合った抑制が得られないだけでなく、アラキドン酸の過剰摂取による弊害(例えばアラキドン酸の酸化による生体内酸化ストレスの増大等)が出てくる可能性がある。
【0032】
本発明のグルコース取り込み促進剤の使用方法は特に限定するものではないが、飽和脂肪酸の入った油脂組成物や食品を使用する際にその添加剤として摂取することでより産業上の利用価値がある。本発明のグルコース取り込み促進剤の使用時期は、飽和脂肪酸を含む食事の前、中、後のいずれでもよいが、好ましくは摂取と同時である。
【0033】
本発明は、また、グルコース取り込み促進剤を含有する油脂組成物を提供する。特に飽和脂肪酸の含有量が高い油脂組成物にグルコース取り込み促進剤を添加することで、飽和脂肪酸による糖の取り込みの低下を確実に緩和することができる。
【0034】
本発明のグルコース取り込み促進剤の油脂組成物への添加は、飽和脂肪酸の含量が、通常、20重量%以上、特に40重量%以上の油脂組成物において特に有効である。
【0035】
油脂組成物におけるアラキドン酸の含量は、飽和脂肪酸に対するモル比率で換算して、通常、0.01〜3であり、好ましくは0.01〜0.2であり、より好ましくは0.03〜0.1である。モル比率が0.01より低すぎると、飽和脂肪酸による非インスリン依存的及び/又はインスリン依存的なグルコース取り込み抑制を緩和することができない場合がある。一方、モル比率が3より高すぎても、添加量に見合った緩和がなく、アラキドン酸の過剰添加による弊害が出る場合がありえる。
【0036】
本発明の油脂組成物は、飽和脂肪酸を多く含んでいるラード、牛脂、パーム核油、ヤシ油、米油、天然油脂のグリセロール骨格の1,2,3位の少なくとも一位に化学的又は生化学的手法により飽和脂肪酸を結合させた加工油脂(エステル交換油、分別油、硬化油等)を含む場合に、効果が顕著である。
【0037】
本発明の油脂組成物には、グルコース取り込み促進剤以外に、食品分野の油脂組成物への添加剤を特に制限なく使用可能である。その具体例は、モノグリセリド、ジグリセリド、トリグリセリド、抗酸化剤(トコフェロール、カテキン等)、ビタミン、ミネラル、乳化剤、消泡剤(シリコーン樹脂等)、結晶抑制剤、安定剤、呈味料、香料、着色剤等が挙げられる。
【0038】
本発明の油脂組成物の使用形態は特に制限されず、例えば、揚げ物油、サラダ油、マーガリン、バター、ショートニング、ソフトカプセル、錠剤、乳化タイプ飲料等が挙げられる。
【0039】
本発明は、また、上記油脂組成物を用いて製造した食品を提供する。そのような例は、特に飽和脂肪酸を多く含む食品である。具体的には、高脂肪食品(ピザ、てんぷら、とんかつ、スパゲッティ、ラーメン、フライドポテト、クロワッサン、デニッシュパン)、食肉加工品(ベーコン、サラミ、ハム、ソーセージ、ハンバーグ、パテ)、魚肉練り物(かまぼこ、魚肉ソーセージ)、揚げ物(油揚げ)、ピーナッツバター、ココナッツミルク、マーガリン、フレンチドレッシング、即席加工食品(カップ麺、スープ等)、卵・乳製品(バター、各種チーズ、マヨネーズ、生クリーム)、菓子・スナック類(ケーキ、ドーナッツ、ポテトチップス、チョコレート)、サプリメント等が挙げられる。
【0040】
本発明は、また、上記油脂組成物を用いて製造した食品を提供する。そのような例は、牛、豚、鶏、羊等の家畜用の飼料、ウサギ、ラット、マウス等の小動物用の飼料、ウナギ、タイ、ハマチ、エビ等の魚介類用の飼料、並びに犬、猫、小鳥、リス等の愛玩動物の飼料が挙げられる。
【実施例】
【0041】
以下に、実施例、比較例及び参考例を示し、本発明をより詳細に説明する。しかし、本発明は、以下の実施例に限定されるものではない。
【0042】
〔参考例1〕モデルマウスを用いたインスリン抵抗性試験
マウスに高脂肪食を長期間摂取させて慢性的肥満状態のモデルマウスを作製し、このモデルマウスで高脂肪食摂取により惹起されるインスリン抵抗性と飼料中の油脂との相関を調べた。
【0043】
飼料は、AIN−76基本組成改変飼料をもとに、対照食としてコーン油を5重量%配合したもの(以下、SCという)、高脂肪食群として対照食にさらにラード(株式会社J−オイルミルズ製)30%重量%で配合したラード配合食(以下、HF−Lという)、及びラード15重量%と亜麻仁油(株式会社J−オイルミルズ製)15重量%を添加したラード・亜麻仁油配合食(以下、HF−0.5Fという)を作製した。ラード及び亜麻仁油の組成を表1に、そして各飼料の組成を表2に示す。
【0044】
【表1】

【0045】
【表2】

【0046】
実験動物は、生後5週齢のC57BL/6Cr雄性マウス(日本SLC社より入手)30匹を25±2℃、明期9:00−21:00、暗期21:00−9:00に調節した飼育室にて1週間予備飼育した後、平均体重が等しくなるように群分けを行った。群分けしたマウスは、以下、各飼料に応じてSC群、HF−L群及びHF−0.5L群と呼ぶ。
【0047】
これらの飼料を2〜3日毎に交換し、マウスに各群間における摂食量がほぼ等しくなるように16週間摂取させた。飲水としては全群に蒸留水を自由摂取させた。飼育期間中は1週間ごとにマウスの摂餌量、摂水量、ならびに体重を測定した。
【0048】
16週後、同様に15時間絶食させた後に、ネンブタール麻酔下で心臓採血することで屠殺した。マウスから両下肢の全筋肉組織を摘出後、分析時まで−80℃下で保存した。
【0049】
心臓採血により得た血液に20mg/mlヘパリンナトリウム水溶液を3μl添加し、4℃、1,500×gで20分間遠心分離することで血漿を調製し、これを用いて血糖と血漿脂質としてのトリアシルグリセロール、遊離脂肪酸、総コレステロールならびにインスリンを測定した。実験結果は、Tukcy法を用いて多群間の比較検定を行い、p<0.05になった場合に有意差があるとみなした。
【0050】
飼育終了時の各マウスの血糖値、血中インスリン値、ならびにこれらの値から算出したHOLIA―IR値を表3に示す。
【0051】
【表3】

【0052】
表3に示すとおり、血糖値は、SC群に対してHF−L群のみが有意な高値を示し、亜麻仁油置換のHF−0.5L群ではSC群に対して有意差がなかった。また、HF−0.5F群の血糖値は、HF−L群のそれに対して有意な低値を示した。
【0053】
HF−L群の血中インスリン値が65.4μIU/mlであったのに対し、HF−0.5F群の値は27.9μIU/mlとなり、血中インスリン値においても、HF−L群がSC群に対して有意な上昇を示したのに対し、亜麻仁油で置換したHF−0.5F群は、SC群との間に有意差がなかった。また、HF−0.5F群の値は、HF−L群の値に対して有意な低値となった。
【0054】
血糖値とインスリン値から算出したHOMA−IR値は、インスリン値と同様の傾向を示し、HF−L群がSC群に対して有意な高値を示したのに対し、亜麻仁油で置換したHF−0.5F群はSC群に対して有意差がなかつた。さらに、HF−0.5F群の値は、HF−L群の値に対して有意に低く、ラードを亜麻仁油で置換することでインスリン抵抗性発症の程度が軽微になることがわかった。
【0055】
〔参考例2〕
(1)L6細胞のインスリン受容体発現に対する飽和脂肪酸の影響
インスリン受容体タンパク質は、インスリンと結合することによって糖の細胞内取り込みとグリコーゲン合成を開始させるシグナル伝達を開始させる。グルコーストランスポーター−4(GLUT4)は、インスリンの刺激を受けて細胞質から細胞膜上に移動してインスリン依存的なグルコースを取り込みに関与することが知られている。これらのタンパク質の発現量の減少は、インスリン抵抗性の直接的な原因となる。そこで、ラードに多量に含まれるパルミチン酸のL6細胞におけるインスリン受容体タンパク質及びのGLUT4の発現量に対する影響を、以下の細胞培養試験で評価した。
【0056】
(細胞培養)
10%ウシ胎児血清(FBS)を含むEagle’s Minimum Essential Medium(以下、MEMと略す)培地内で、ラット骨格筋由来のL6細胞株を37℃、5%CO2下で培養した。L6細胞を60mmφのディッシュに播種し、10%FBSを含むMEM培地でセミコンフルーエント状態まで培養した。この培地を、2%FBSを含むMEM培地に置換し、さらに8日間培養することにより、筋管細胞へと分化させた。この筋管細胞をタンパク質発現の解析に供した。
【0057】
(脂肪酸処理)
2%FBSと2%ウシ血清アルブミン(BSA)を含有するMEM培地へ、パルミチン酸(株式会社フナコシより入手)のエタノール溶液を培地中のエタノール含量が1vol%となるように添加した後、超音波処理により分散させた。このパルミチン酸を含む培地中で、分化したL6細胞(筋管細胞)を8〜24時間培養した。
【0058】
(ウエスタンブロッティング)
パルミチン酸で処理したL6細胞を可溶化することにより、細胞溶解液を調製した。この溶解液をウエスタンブロッティング法にかけて、インスリン受容体タンパク質及びGLUT4タンパク質を検出した。
【0059】
図1に、0.375〜1.5mMのパルミチン酸で24時間処理したL6細胞中に発現したインスリン受容体タンパク質のウエスタンブロッドを示す。また、ローディング量の校正用にβ−アクチンを同様に検出した。図1から、筋管細胞でのインスリン受容体タンパク質の発現量は、パルミチン酸の濃度依存的に減少したことがわかる。
【0060】
図2に、0.75mMのパルミチン酸で8〜16時間処理したL6細胞中に発現したインスリン受容体タンパク質のウエスタンブロッドを示す。また、ローディング量の校正用にβ−アクチンを同様に検出した。図2から、筋管細胞でのインスリン受容体タンパク質の発現量は、0.75mMのパルミチン酸の処理時間依存的に減少したことがわかる。
【0061】
図3に、0.75mMのパルミチン酸で14時間処理したL6細胞中に発現したGLUT4タンパク質のウエスタンブロッドを示す。また、ローディング量の校正用にβ−アクチンを同様に検出した。図3から、筋管細胞でのGLUT4タンパク質の発現量は、パルミチン酸処理により減少したことがわかる。
【0062】
(2)パルミチン酸処理によるL6細胞への糖取り込みの影響
飽和脂肪酸であるパルミチン酸は、濃度及び処理時間依存的に、インスリン受容体の発現量を低下させることを確認したので、パルミチン酸処理により、インスリン依存的又は非インスリン依存的なL6細胞の糖取り込みが抑制させるかを調べた。
【0063】
(細胞培養)
ラット骨格筋由来のL6細胞株を5%CO2下で10%ウシ胎児血清(FBS)を含むMEM培地内で、37℃で培養した。L6細胞を96穴マルチプレートに4×103セル/ウエル播種し、10%FBSを含むMEM培地でセミコンフルーエント状態まで培養した。この培地を、2%FBSを含むMEM培地に置換し、さらに5日間培養することにより、筋管細胞へと分化させた。
【0064】
(脂肪酸処理)
2%FBSと2%ウシ血清アルブミン(BSA)を含有するMEM培地へ、各種脂肪酸のエタノール溶液を培地中のエタノール含量が1vol%となるように添加した後、超音波処理により分散させた。0.75mMのパルミチン酸を含む培地中で、分化したL6細胞(筋管細胞)を0〜16時間培養した。
【0065】
(L6細胞への糖取り込み量の測定)
L6細胞の糖の取り込み量の測定は、Yamamotoらの方法(An enzymatic fluorimetric assay to quantitate 2−deoxyglucose and 2−deoxyglucose−6−phosphate for in vitro and in vivo use,Analytical Biochemistry,404,2,2010,238−240、及びA nonradioisotope, enzymatic assay for 2−deoxyglucose uptake in L6 skeletal muscle cells cultured in a 96−well microplate,Anal Biochem. 2006,351,1,139−45)に従った。具体的には、上記のパルミチン酸で処理したL6細胞を、2%FBS及び2%BSAを含むMEM培地で洗浄した後、0.2%BSAを含むMEM培地に置換して、18時間培養し、脱感作させた。
【0066】
上記脱感作させたL6細胞を、0.1%BSAを含むKrebs−Ringer−phosphate−Hepes(以下、KRPHと略す)緩衝液で洗浄後、2デオキシグルコース(以下、2DGという)と0.1%BSAを含むKRPH緩衝液で20分間培養した。
【0067】
また、インスリン刺激による糖取り込みの改善を調べるため、上記脱感作させたL6細胞にインスリン100nMを4時間作用させた後、0.1%BSAを含むKRPH緩衝液で洗浄後、2DGと0.1%BSAを含むKRPH緩衝液で20分間培養した。
【0068】
インスリン無処理又は処理したL6細胞を、それぞれ、0.1%BSAを含むKRPH緩衝液で洗浄後、0.1N NaOHで可溶化した。細胞内に存在するNAD(P)H、NAD(P)+及び酵素類を分解させるため、凍結融解処理と熱処理(85℃×40分間)を行った。0.1N塩酸で中和後、150mMtriethanolamine hydrochloride (TEA)を添加して、測定用試料を得た。測定用試料に発色試薬を添加し、1時間反応させた後、蛍光プレートリーダー(Ex:530nm、Em:570nm)を用いて2DG量を測定した。2DG量は、パルミチン酸で処理しなかった細胞の2DG取り込み量に対する相対値で表した。
【0069】
図4に、パルミチン酸がL6細胞の糖取り込みに及ぼす影響を、インスリン処理無し(□)及び100nMインスリン処理(■)の二種類について調べたグラフを示す。図4の□バーが示すように、パルミチン酸は、非インスリン依存的な糖の取り込みを処理時間依存的に減少させた。
【0070】
また、図4の■バーが示すように、パルミチン酸で処理しなかった細胞(処理時間0)では、インスリン刺激により、糖の取り込み量が60%増した。一方、パルミチン酸の8時間処理では、インスリン刺激による糖取り込み量の増加は20%に留まった。さらに、10時間処理では、インスリン刺激による糖取り込み量の増加が認められなかった。
【0071】
〔参考例3〕ステアリン酸処理によるL6細胞への糖取り込みの影響
参考例2(2)において、パルミチン酸0.75mMに代えて、飽和脂肪酸のステアリン酸(株式会社フナコシより入手)0.75mMで14時間処理した以外は、同様の手順で、糖の取り込み試験を行った。その結果を表4及び図5に、パルミチン酸0.75mMの場合とともに示す。
【0072】
図5から、ステアリン酸処理についても、パルミチン酸と同様の糖取り込みの影響が見られた。すなわち、この飽和脂肪酸もまた、L6細胞の非インスリン依存的な糖の取り込みを著しく減少させた。そして、インスリン刺激による糖取り込みの増加(インスリン感受性)も低下させた。
【0073】
〔参考例4〕パルミチン酸及びステアリン酸処理によるL6細胞への糖取り込みの影響
参考例2(2)において、パルミチン酸0.75mMにステアリン酸0.75mMを加えた以外は、同様の手順で、糖の取り込み試験を行った。その結果を表4及び図5に示す。
【0074】
図5から、ステアリン酸は、パルミチン酸のL6細胞に対する影響を憎悪させた。すなわち、飽和脂肪酸の共存は、非インスリン依存的糖取り込み及びインスリン感受性を著しく低下させた。
【0075】
〔比較例1〕パルミチン酸及びα−リノレン酸処理によるL6細胞への糖取り込みの影響
【0076】
参考例2(2)において、パルミチン酸0.75mMにα−リノレン酸(株式会社フナコシより入手)を0.75mM共存させた以外は同様の手順で、糖の取り込み試験を行った。その結果を表4及び図5に示す。
【0077】
図5から、α−リノレン酸は、パルミチン酸のL6細胞に対する影響を緩和させた。すなわち、パルミチン酸とα−リノレン酸の共存は、非インスリン依存的糖取り込みをパルミチン酸無処理レベルあるいはそれ以上に高め、そして、インスリン感受性の低下を抑制した。
【0078】
〔実施例1〕パルミチン酸及びアラキドン酸処理によるL6細胞への糖取り込みの影響
参考例2(2)において、パルミチン酸0.75mMにアラキドン酸(株式会社フナコシより入手)を75μM共存させた以外は同様の手順で、糖の取り込み試験を行った。その結果を表4及び図5に示す。
【0079】
図5から、パルミチン酸にアラキドン酸を共存させることで、非インスリン依存的な糖取り込み量の減少を抑制し、そして、パルミチン酸によるインスリン依存的な糖の取り込みの減少を回復させた。比較例1のα−リノレン酸と対比しても、アラキドン酸が1桁低い濃度で同等の効果を示したことは、アラキドン酸のグルコース取り込み促進剤としての優位性を証明している。
【0080】
【表4】

※:非インスリン依存的糖取り込みは、L6細胞の脂肪酸処理無しの2DG糖取り込み量を1.0とした相対値で示す。
※※:インスリン感受性低下抑制効果は、L6細胞の脂肪酸処理無しの2DG糖取り込み量を1.0とした相対値で示す。
【0081】
〔実施例2〜5〕パルミチン酸の存在下、各種濃度のアラキドン酸処理によるL6細胞への糖取り込みの影響
参考例2(2)において、パルミチン酸0.75mMにアラキドン酸を表2に示す濃度範囲で共存させた以外は同様の手順で、糖の取り込み試験を行った。その結果を、表5及び図6に示す。
【0082】
【表5】

※:非インスリン依存的糖取り込みは、L6細胞の脂肪酸処理無しの2DG糖取り込み量を1.0とした相対値で示す。
※※:インスリン感受性低下抑制効果は、L6細胞の脂肪酸処理無しの2DG糖取り込み量を1.0とした相対値で示す。
【0083】
表5及び図6から、アラキドン酸は、濃度10μM以上で、パルミチン酸によるインスリン非依存的な糖取り込み量の減少を濃度依存的に抑制した。そして、アラキドン酸は、濃度75μMまでは、パルミチン酸によるインスリン依存的な糖の取り込みの減少を濃度依存的に回復させた。アラキドン酸の下限は、パルミチン酸0.75mMに対して好ましくは10μM(モル比率0.013)、より好ましくは25μM(0.03)であり、アラキドン酸の上限は、パルミチン酸0.75mMに対して好ましくは100μM(モル比率0.13)、より好ましくは75μM(モル比率0.1)であることが判明した。
【技術分野】
【0001】
本発明は、グルコース取り込み促進剤及びその用途に関し、より詳細には、筋肉細胞組織への非インスリン依存的及び/又はインスリン依存的な糖取り込みの低下を抑制する機能を有するグルコース取り込み促進剤、それを含有する油脂組成物等に関する。
【背景技術】
【0002】
先進諸国では、糖尿病の罹患者数が増大している。糖尿病による高血糖状態の持続は、網膜症、白内障や血管新生緑内障による失明、腎臓病、神経障害、冠動脈、能動脈や手足での動脈硬化症等の合併症を引き起こす。腎臓病では人工透析治療が必要になる。このように、糖尿病は、患者のQOLを著しく損ない、また医療コストを多大に引き上げる。
【0003】
糖尿病は、発症に自己免疫機序が関与すると考えられている1型糖尿病と、カロリーの過剰摂取や運動不足に基づく肥満状態の継続により発症する2型糖尿病とに大別される。患者の大部分は2型糖尿病に属する。
【0004】
2型糖尿病を発症する要因として、インスリン抵抗性がある。インスリンは、膵臓のランゲルハンス島から分泌される、グルコース(以下、単に糖ということがある)の代謝や脂質の代謝に関わるホルモンである。インスリンは、血糖値を適正値に保つために、肝臓に蓄えたグリコーゲンの糖への分解を抑制する、肝臓や筋肉中の糖からグリコーゲンへの合成を促進する、血糖を筋肉細胞や脂肪細胞へ運搬する、脂肪細胞中の糖から脂肪への合成を促進する等の機能を有する。糖尿病の患者は、健常人と比べて同じ量のインスリンを投与しても血糖値が下がりにくく、また軽症糖尿病患者よりも重症糖尿病患者の方が下がりにくい。これらの事実から、インスリンが効きにくい状態をインスリン抵抗性と称して、2型糖尿病の主要因子とされている。
【0005】
インスリン抵抗性の有無を簡便に調べるため、HOMA−IR値(Homeostasis model assessment−Insulin Resistance、インスリン抵抗性指数)が測定される。この指標は、以下の数式:
【数1】

により求めることができる。日本人の統計では、HOMA−IR値が2以上であるとインスリン抵抗性があり、4以上であると強いインスリン抵抗性があるとされる。
【0006】
インスリン抵抗性の発症は、食生活、運動、不規則な生活等に左右される。食事の中でも、脂質は、炭水化物やタンパク質と比較して単位重量当たりの熱量が大きいため優れたエネルギー源となる反面、過剰摂取によるエネルギー過多になり易いため、食生活に基づく2型糖尿病予防の重要な因子である。一方で、脂質は、必須脂肪酸の供給源であり、また脂溶性ビタミンの吸収を助けるという生理的意義を有する。よって、脂質の摂取を闇雲に抑えることは好ましくない。
【0007】
非特許文献1(Marek Straczkowski et. al., Relationship Between Insulin Sensitivity and Sphingomyelin Signaling Pathway in Human Skeletal Muscle)によれば、インスリン抵抗性は、セラミド(スフィンゴミエリンシグナル経路の第二メッセンジャー)の細胞内形成と関係すること、インスリン抵抗性は、骨格筋細胞内の総セラミド含量と相関すること、そして、パルミチン酸からなるセラミドと最も強く相関することを開示する。
【0008】
本発明者らは、マウスに高脂肪食を16週間摂取させて慢性的肥満状態のマウスを作製した。このマウスは、インスリン抵抗性を惹起する動物モデルとなる。この動物モデルを用いた試験(参考例1参照)によって、高脂肪食の摂取により惹起されるインスリン抵抗性は、飼料に添加された油脂の種類で異なることを確認している。
【0009】
上記動物実験モデルの基礎となる細胞試験(本明細書の参考例2〜4)に示すように、ラード等に多く含まれるパルミチン酸やステアリン酸のような飽和脂肪酸は、骨格筋細胞への非インスリン依存的な糖の取り込み量を著しく減少させる。さらに、インスリン処理しても糖の取り込み量があまり増えないことから、飽和脂肪酸の摂取によってインスリン感受性が損なわれる(すなわち、インスリン抵抗性が誘導される)。
【0010】
上記インスリン抵抗性の誘導は、本明細書の比較例1に示すように、不飽和脂肪酸であるα−リノレン酸の同時摂取により抑制される。しかし、この抑制のためには、多量のα−リノレン酸で置換するか、又は添加が必要となる。
【0011】
特許文献1(油脂組成物)には、トリグリセリド10.1〜94.9重量%、モノグリセリド0.1〜30重量%及び構成脂肪酸の15〜90重量%が炭素数20未満のω3系不飽和脂肪酸であるジグリセリドを5〜59.9重量%を含有する油脂組成物にインスリン抵抗性改善作用があることが開示されている。当該ジグリセリドのω3系不飽和脂肪酸の好適な例がα−リノレン酸である。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特開2002−138297
【非特許文献】
【0013】
【非特許文献1】Diabetes,2004,vol.53,no.5,1215−1221
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明の目的は、高脂肪食、特に飽和脂肪酸を多量に含む高脂肪食を摂取したときに、筋肉細胞組織へのインスリン依存的及び/又は非インスリン依存的なグルコース取り込みの低下を微量の添加で抑制可能なグルコース取り込み促進剤を提供することにある。
【課題を解決するための手段】
【0015】
本発明者らは、上記課題について鋭意検討した結果、特定の高度不飽和脂肪酸は、飽和脂肪酸との低濃度の共存において飽和脂肪酸によるインスリン依存的及び/又は非インスリン依存的な糖取り込みの低下を抑制することを見出して、本発明に至った。すなわち、本発明は、有効成分としてアラキドン酸を含有するグルコース取り込み促進剤を提供する。本明細書において、「アラキドン酸」という用語は、アラキドン酸自身の他に、アラキドン酸を構成脂肪酸とする化合物を含む意味で使用する。
【0016】
従来、アラキドン酸の効能については、一般に免疫系の調節や妊娠後期の胎児や出生直後の乳児の健全な発育に必要とされることや、抗疲労作用(特開2009−73747)や血管の老化防止作用(特開2009−219500)が公知である。しかし、グルコース取り込み促進作用、すなわち、筋肉細胞組織へのインスリン依存的及び/又は非インスリン依存的な糖の取り込みの低下を抑制することは全く知られていない。
【0017】
本発明は、また、上記グルコース取り込み促進剤を含有する油脂組成物を提供する。
【0018】
上記油脂組成物は、特に飽和脂肪酸を含有する場合に産業用の利用価値が高まる。本明細書において、「飽和脂肪酸」という用語は、飽和脂肪酸自身の他に、構成脂肪酸として飽和脂肪酸を含む化合物を含む意味で使用する。
【0019】
特に上記油脂組成物は、前記アラキドン酸の飽和脂肪酸に対するモル比率は、0.01〜3であることが好ましい。
【0020】
上記油脂組成物には、例えばラード、牛脂、パーム油、パーム核油、ヤシ油等の元来飽和脂肪酸含量の多い油脂に加え、大豆油、菜種油、コーン油、米油等の液状油を水素添加して得た加工油脂、並びにこれらをエステル交換処理して製造した油脂があり、さらに、前記に例示した油脂を分別した油脂がある。上記油脂組成物は、これらの油脂からなる群から選ばれる少なくとも一種を含む。
【0021】
本発明は、また、上記油脂組成物を用いて製造した食品を提供する。
【発明の効果】
【0022】
パーム油並びに液状油を水素添加して製造する硬化油は、飽和脂肪酸含量が高いため、酸化安定性に優れるという特性や常温で固体である特性を利用して、様々な食品に利用されており、加工食品の製造においては欠く事ができない。しかし、昨今の研究により、飽和脂肪酸の過剰摂取がインスリン抵抗性発症に繋がることが指摘されている(Diabetologia (1997),40,430−438)。有効成分としてアラキドン酸を含有する本発明のグルコース取り込み促進剤によれば、飽和脂肪酸に高度不飽和脂肪酸の一種であるアラキドン酸を共存させることで、飽和脂肪酸による非インスリン依存的なグルコース取り込み量の減少を抑制し、そしてまた、飽和脂肪酸によるインスリン依存的なグルコース取り込みの減少を回復させ、その結果として、血糖値の上昇を抑えることが可能である。
【0023】
本発明のグルコース取り込み促進剤は、1型糖尿病及び2型糖尿病のいずれの予防や回復にも有効なことが期待される。しかも、本発明のグルコース取り込み促進剤は、α−リノレン酸のような不飽和脂肪酸と比較して一桁低い濃度で同等の効果を奏する点で優れ、産業上の利用性も非常に高い。
【0024】
飽和脂肪酸を含有する油脂組成物に本発明のグルコース取り込み促進剤を添加することで、飽和脂肪酸による非インスリン依存的及び/又はインスリン依存的なグルコース取り込みの減少を回復させることができる。そのような油脂組成物は、ラード、牛脂、パーム核油、ヤシ油、米油、天然油脂のグリセロール骨格の1,2,3位の少なくとも一位に化学的又は生化学的手法により飽和脂肪酸を結合させた加工油脂等を含む。
【図面の簡単な説明】
【0025】
【図1】各種濃度のパルミチン酸で24時間処理したL6細胞で発現したインスリン受容体タンパク質を、ウエスタンブロット法により検出した結果である。インスリン受容体タンパク質の発現量は、パルミチン酸の濃度に依存して減少している。
【図2】0.75mMのパルミチン酸で8〜16時間処理したL6細胞で発現したインスリン受容体タンパク質を、ウエスタンブロット法で検出した結果である。インスリン受容体タンパク質の発現量は、パルミチン酸の処理時間に依存して減少している。
【図3】0.75mMのパルミチン酸で14時間処理したL6細胞で発現したグルコーストランスポーター−4(GLUT4)タンパク質を、ウエスタンブロット法で検出した結果である。GLUT4タンパク質の発現量は、パルミチン酸処理により減少している。
【図4】パルミチン酸がL6細胞の糖取り込みに及ぼす影響を、インスリン処理無し(□)及び100nMインスリン処理(■)の二種類について調べたグラフである。□バーが示すように、パルミチン酸は、インスリン非依存的な糖取り込みを処理時間に依存して減少させる。また、■バーが示すように、パルミチン酸未処理では、インスリン刺激により、糖の取り込み量が60%増したが、8時間処理では、インスリン刺激による糖取り込み量の増加は20%に留まり、さらに10時間処理では、インスリン刺激による糖取り込み量の増加が認められなかった。
【図5】各種脂肪酸がL6細胞の糖取り込みに及ぼす影響を、インスリン処理無し(□)及び100nMインスリン処理(■)の二種類について調べたグラフである。各種脂肪酸でのL6細胞の処理時間は14時間である。パルミチン酸(参考例2)及びステアリン酸(参考例3)でL6細胞を処理すると、L6細胞の非インスリン依存的な糖の取り込みを著しく減少させ、インスリン処理による糖取り込みの増加(インスリン感受性)も低下させた。パルミチン酸及びステアリン酸の共存(参考例4)は、非インスリン依存的糖取り込み及びインスリン感受性を著しく低下させた。一方、パルミチン酸とα−リノレン酸の共存(比較例1)は、非インスリン依存的糖取り込みをパルミチン酸無処理レベルあるいはそれ以上に高め、そして、インスリン感受性の低下を抑制した。パルミチン酸とアラキドン酸の共存(実施例1)は、非インスリン依存的な糖取り込み量の減少を抑制し、そして、パルミチン酸によるインスリン依存的な糖の取り込みの減少を回復させた。
【図6】パルミチン酸0.75mMに各種濃度のアラキドン酸を共存させた場合のL6細胞の糖取り込みに及ぼす影響を、インスリン処理無し(□)及び100nMインスリン処理(■)の二種類について調べたグラフである。アラキドン酸は、濃度10μM以上で、パルミチン酸によるインスリン非依存的な糖取り込み量の減少を濃度依存的に抑制した。そして、アラキドン酸は、濃度75μMまでは、パルミチン酸によるインスリン依存的な糖の取り込みの減少を濃度依存的に回復させた。
【発明を実施するための形態】
【0026】
以下に、本発明の実施態様を詳細に説明する。本発明のグルコース取り込み促進剤は、有効成分としてアラキドン酸を含有する。アラキドン酸は、分子式C20H32Oで示され、4個の二重結合を含む20個の炭素鎖からなるカルボン酸であり、n−6系不飽和脂肪酸に分類される。本発明に使用するアラキドン酸は、アラキドン酸自身の他に、アラキドン酸を構成脂肪酸とする化合物であってもよく、例えば構成脂肪酸の少なくとも一部がアラキドン酸であるトリグリセリド、グリセリン脂肪酸エステル、リン脂質、糖脂質、エステル等;アラキドン酸とアルコール(メタノール、エタノール等)とのエステル;アラキドン酸塩等が挙げられる。
【0027】
本発明に使用するアラキドン酸の入手方法は特に制限されない。例えばアラキドン酸を構成成分とするトリグリセリドを産生する能力を有する微生物(例えばMortierella属糸状菌)を工業的に培養する方法等である。本発明は、市販のアラキドン酸を使用可能である。
【0028】
本発明のグルコース取り込み促進剤は、有効成分としてのアラキドン酸以外に、食品分野の添加剤として公知のものを特に制限なく使用可能である。その具体例としては、不飽和脂肪酸(n−9、n−7、n−6、n−3系不飽和脂肪酸等)、賦形剤、崩壊剤、結合剤、滑沢剤、ビタミン、アミノ酸、懸濁化剤、粘稠剤、溶解補助剤、抗酸化剤、可塑剤、界面活性剤、アルコール類、甘味料、矯味剤、酸味料、香料、着色剤等が挙げられる。
【0029】
本発明のグルコース取り込み促進剤の形態は特に制限がない。例えば、液剤、錠剤、散剤、顆粒剤、カプセル、乳剤、懸濁剤等が挙げられる。
【0030】
本発明のグルコース取り込み促進剤の有効成分としてのアラキドン酸の含有量は、使用方法によって適宜調整されるが、通常、0.01〜100重量%、好ましくは0.1〜80重量%、特に好ましくは1〜50重量%である。
【0031】
本発明のグルコース取り込み促進剤の使用量は、アラキドン酸の飽和脂肪酸に対するモル比率に換算して、通常、0.01〜3であり、好ましくは0.01〜0.2であり、より好ましくは0.03〜0.1である。モル比率が0.01より低すぎると、飽和脂肪酸による非インスリン依存的及び/又はインスリン依存的グルコース取り込み抑制を緩和することができない場合がある。一方、モル比率が3より高すぎても、使用量に見合った抑制が得られないだけでなく、アラキドン酸の過剰摂取による弊害(例えばアラキドン酸の酸化による生体内酸化ストレスの増大等)が出てくる可能性がある。
【0032】
本発明のグルコース取り込み促進剤の使用方法は特に限定するものではないが、飽和脂肪酸の入った油脂組成物や食品を使用する際にその添加剤として摂取することでより産業上の利用価値がある。本発明のグルコース取り込み促進剤の使用時期は、飽和脂肪酸を含む食事の前、中、後のいずれでもよいが、好ましくは摂取と同時である。
【0033】
本発明は、また、グルコース取り込み促進剤を含有する油脂組成物を提供する。特に飽和脂肪酸の含有量が高い油脂組成物にグルコース取り込み促進剤を添加することで、飽和脂肪酸による糖の取り込みの低下を確実に緩和することができる。
【0034】
本発明のグルコース取り込み促進剤の油脂組成物への添加は、飽和脂肪酸の含量が、通常、20重量%以上、特に40重量%以上の油脂組成物において特に有効である。
【0035】
油脂組成物におけるアラキドン酸の含量は、飽和脂肪酸に対するモル比率で換算して、通常、0.01〜3であり、好ましくは0.01〜0.2であり、より好ましくは0.03〜0.1である。モル比率が0.01より低すぎると、飽和脂肪酸による非インスリン依存的及び/又はインスリン依存的なグルコース取り込み抑制を緩和することができない場合がある。一方、モル比率が3より高すぎても、添加量に見合った緩和がなく、アラキドン酸の過剰添加による弊害が出る場合がありえる。
【0036】
本発明の油脂組成物は、飽和脂肪酸を多く含んでいるラード、牛脂、パーム核油、ヤシ油、米油、天然油脂のグリセロール骨格の1,2,3位の少なくとも一位に化学的又は生化学的手法により飽和脂肪酸を結合させた加工油脂(エステル交換油、分別油、硬化油等)を含む場合に、効果が顕著である。
【0037】
本発明の油脂組成物には、グルコース取り込み促進剤以外に、食品分野の油脂組成物への添加剤を特に制限なく使用可能である。その具体例は、モノグリセリド、ジグリセリド、トリグリセリド、抗酸化剤(トコフェロール、カテキン等)、ビタミン、ミネラル、乳化剤、消泡剤(シリコーン樹脂等)、結晶抑制剤、安定剤、呈味料、香料、着色剤等が挙げられる。
【0038】
本発明の油脂組成物の使用形態は特に制限されず、例えば、揚げ物油、サラダ油、マーガリン、バター、ショートニング、ソフトカプセル、錠剤、乳化タイプ飲料等が挙げられる。
【0039】
本発明は、また、上記油脂組成物を用いて製造した食品を提供する。そのような例は、特に飽和脂肪酸を多く含む食品である。具体的には、高脂肪食品(ピザ、てんぷら、とんかつ、スパゲッティ、ラーメン、フライドポテト、クロワッサン、デニッシュパン)、食肉加工品(ベーコン、サラミ、ハム、ソーセージ、ハンバーグ、パテ)、魚肉練り物(かまぼこ、魚肉ソーセージ)、揚げ物(油揚げ)、ピーナッツバター、ココナッツミルク、マーガリン、フレンチドレッシング、即席加工食品(カップ麺、スープ等)、卵・乳製品(バター、各種チーズ、マヨネーズ、生クリーム)、菓子・スナック類(ケーキ、ドーナッツ、ポテトチップス、チョコレート)、サプリメント等が挙げられる。
【0040】
本発明は、また、上記油脂組成物を用いて製造した食品を提供する。そのような例は、牛、豚、鶏、羊等の家畜用の飼料、ウサギ、ラット、マウス等の小動物用の飼料、ウナギ、タイ、ハマチ、エビ等の魚介類用の飼料、並びに犬、猫、小鳥、リス等の愛玩動物の飼料が挙げられる。
【実施例】
【0041】
以下に、実施例、比較例及び参考例を示し、本発明をより詳細に説明する。しかし、本発明は、以下の実施例に限定されるものではない。
【0042】
〔参考例1〕モデルマウスを用いたインスリン抵抗性試験
マウスに高脂肪食を長期間摂取させて慢性的肥満状態のモデルマウスを作製し、このモデルマウスで高脂肪食摂取により惹起されるインスリン抵抗性と飼料中の油脂との相関を調べた。
【0043】
飼料は、AIN−76基本組成改変飼料をもとに、対照食としてコーン油を5重量%配合したもの(以下、SCという)、高脂肪食群として対照食にさらにラード(株式会社J−オイルミルズ製)30%重量%で配合したラード配合食(以下、HF−Lという)、及びラード15重量%と亜麻仁油(株式会社J−オイルミルズ製)15重量%を添加したラード・亜麻仁油配合食(以下、HF−0.5Fという)を作製した。ラード及び亜麻仁油の組成を表1に、そして各飼料の組成を表2に示す。
【0044】
【表1】

【0045】
【表2】

【0046】
実験動物は、生後5週齢のC57BL/6Cr雄性マウス(日本SLC社より入手)30匹を25±2℃、明期9:00−21:00、暗期21:00−9:00に調節した飼育室にて1週間予備飼育した後、平均体重が等しくなるように群分けを行った。群分けしたマウスは、以下、各飼料に応じてSC群、HF−L群及びHF−0.5L群と呼ぶ。
【0047】
これらの飼料を2〜3日毎に交換し、マウスに各群間における摂食量がほぼ等しくなるように16週間摂取させた。飲水としては全群に蒸留水を自由摂取させた。飼育期間中は1週間ごとにマウスの摂餌量、摂水量、ならびに体重を測定した。
【0048】
16週後、同様に15時間絶食させた後に、ネンブタール麻酔下で心臓採血することで屠殺した。マウスから両下肢の全筋肉組織を摘出後、分析時まで−80℃下で保存した。
【0049】
心臓採血により得た血液に20mg/mlヘパリンナトリウム水溶液を3μl添加し、4℃、1,500×gで20分間遠心分離することで血漿を調製し、これを用いて血糖と血漿脂質としてのトリアシルグリセロール、遊離脂肪酸、総コレステロールならびにインスリンを測定した。実験結果は、Tukcy法を用いて多群間の比較検定を行い、p<0.05になった場合に有意差があるとみなした。
【0050】
飼育終了時の各マウスの血糖値、血中インスリン値、ならびにこれらの値から算出したHOLIA―IR値を表3に示す。
【0051】
【表3】

【0052】
表3に示すとおり、血糖値は、SC群に対してHF−L群のみが有意な高値を示し、亜麻仁油置換のHF−0.5L群ではSC群に対して有意差がなかった。また、HF−0.5F群の血糖値は、HF−L群のそれに対して有意な低値を示した。
【0053】
HF−L群の血中インスリン値が65.4μIU/mlであったのに対し、HF−0.5F群の値は27.9μIU/mlとなり、血中インスリン値においても、HF−L群がSC群に対して有意な上昇を示したのに対し、亜麻仁油で置換したHF−0.5F群は、SC群との間に有意差がなかった。また、HF−0.5F群の値は、HF−L群の値に対して有意な低値となった。
【0054】
血糖値とインスリン値から算出したHOMA−IR値は、インスリン値と同様の傾向を示し、HF−L群がSC群に対して有意な高値を示したのに対し、亜麻仁油で置換したHF−0.5F群はSC群に対して有意差がなかつた。さらに、HF−0.5F群の値は、HF−L群の値に対して有意に低く、ラードを亜麻仁油で置換することでインスリン抵抗性発症の程度が軽微になることがわかった。
【0055】
〔参考例2〕
(1)L6細胞のインスリン受容体発現に対する飽和脂肪酸の影響
インスリン受容体タンパク質は、インスリンと結合することによって糖の細胞内取り込みとグリコーゲン合成を開始させるシグナル伝達を開始させる。グルコーストランスポーター−4(GLUT4)は、インスリンの刺激を受けて細胞質から細胞膜上に移動してインスリン依存的なグルコースを取り込みに関与することが知られている。これらのタンパク質の発現量の減少は、インスリン抵抗性の直接的な原因となる。そこで、ラードに多量に含まれるパルミチン酸のL6細胞におけるインスリン受容体タンパク質及びのGLUT4の発現量に対する影響を、以下の細胞培養試験で評価した。
【0056】
(細胞培養)
10%ウシ胎児血清(FBS)を含むEagle’s Minimum Essential Medium(以下、MEMと略す)培地内で、ラット骨格筋由来のL6細胞株を37℃、5%CO2下で培養した。L6細胞を60mmφのディッシュに播種し、10%FBSを含むMEM培地でセミコンフルーエント状態まで培養した。この培地を、2%FBSを含むMEM培地に置換し、さらに8日間培養することにより、筋管細胞へと分化させた。この筋管細胞をタンパク質発現の解析に供した。
【0057】
(脂肪酸処理)
2%FBSと2%ウシ血清アルブミン(BSA)を含有するMEM培地へ、パルミチン酸(株式会社フナコシより入手)のエタノール溶液を培地中のエタノール含量が1vol%となるように添加した後、超音波処理により分散させた。このパルミチン酸を含む培地中で、分化したL6細胞(筋管細胞)を8〜24時間培養した。
【0058】
(ウエスタンブロッティング)
パルミチン酸で処理したL6細胞を可溶化することにより、細胞溶解液を調製した。この溶解液をウエスタンブロッティング法にかけて、インスリン受容体タンパク質及びGLUT4タンパク質を検出した。
【0059】
図1に、0.375〜1.5mMのパルミチン酸で24時間処理したL6細胞中に発現したインスリン受容体タンパク質のウエスタンブロッドを示す。また、ローディング量の校正用にβ−アクチンを同様に検出した。図1から、筋管細胞でのインスリン受容体タンパク質の発現量は、パルミチン酸の濃度依存的に減少したことがわかる。
【0060】
図2に、0.75mMのパルミチン酸で8〜16時間処理したL6細胞中に発現したインスリン受容体タンパク質のウエスタンブロッドを示す。また、ローディング量の校正用にβ−アクチンを同様に検出した。図2から、筋管細胞でのインスリン受容体タンパク質の発現量は、0.75mMのパルミチン酸の処理時間依存的に減少したことがわかる。
【0061】
図3に、0.75mMのパルミチン酸で14時間処理したL6細胞中に発現したGLUT4タンパク質のウエスタンブロッドを示す。また、ローディング量の校正用にβ−アクチンを同様に検出した。図3から、筋管細胞でのGLUT4タンパク質の発現量は、パルミチン酸処理により減少したことがわかる。
【0062】
(2)パルミチン酸処理によるL6細胞への糖取り込みの影響
飽和脂肪酸であるパルミチン酸は、濃度及び処理時間依存的に、インスリン受容体の発現量を低下させることを確認したので、パルミチン酸処理により、インスリン依存的又は非インスリン依存的なL6細胞の糖取り込みが抑制させるかを調べた。
【0063】
(細胞培養)
ラット骨格筋由来のL6細胞株を5%CO2下で10%ウシ胎児血清(FBS)を含むMEM培地内で、37℃で培養した。L6細胞を96穴マルチプレートに4×103セル/ウエル播種し、10%FBSを含むMEM培地でセミコンフルーエント状態まで培養した。この培地を、2%FBSを含むMEM培地に置換し、さらに5日間培養することにより、筋管細胞へと分化させた。
【0064】
(脂肪酸処理)
2%FBSと2%ウシ血清アルブミン(BSA)を含有するMEM培地へ、各種脂肪酸のエタノール溶液を培地中のエタノール含量が1vol%となるように添加した後、超音波処理により分散させた。0.75mMのパルミチン酸を含む培地中で、分化したL6細胞(筋管細胞)を0〜16時間培養した。
【0065】
(L6細胞への糖取り込み量の測定)
L6細胞の糖の取り込み量の測定は、Yamamotoらの方法(An enzymatic fluorimetric assay to quantitate 2−deoxyglucose and 2−deoxyglucose−6−phosphate for in vitro and in vivo use,Analytical Biochemistry,404,2,2010,238−240、及びA nonradioisotope, enzymatic assay for 2−deoxyglucose uptake in L6 skeletal muscle cells cultured in a 96−well microplate,Anal Biochem. 2006,351,1,139−45)に従った。具体的には、上記のパルミチン酸で処理したL6細胞を、2%FBS及び2%BSAを含むMEM培地で洗浄した後、0.2%BSAを含むMEM培地に置換して、18時間培養し、脱感作させた。
【0066】
上記脱感作させたL6細胞を、0.1%BSAを含むKrebs−Ringer−phosphate−Hepes(以下、KRPHと略す)緩衝液で洗浄後、2デオキシグルコース(以下、2DGという)と0.1%BSAを含むKRPH緩衝液で20分間培養した。
【0067】
また、インスリン刺激による糖取り込みの改善を調べるため、上記脱感作させたL6細胞にインスリン100nMを4時間作用させた後、0.1%BSAを含むKRPH緩衝液で洗浄後、2DGと0.1%BSAを含むKRPH緩衝液で20分間培養した。
【0068】
インスリン無処理又は処理したL6細胞を、それぞれ、0.1%BSAを含むKRPH緩衝液で洗浄後、0.1N NaOHで可溶化した。細胞内に存在するNAD(P)H、NAD(P)+及び酵素類を分解させるため、凍結融解処理と熱処理(85℃×40分間)を行った。0.1N塩酸で中和後、150mMtriethanolamine hydrochloride (TEA)を添加して、測定用試料を得た。測定用試料に発色試薬を添加し、1時間反応させた後、蛍光プレートリーダー(Ex:530nm、Em:570nm)を用いて2DG量を測定した。2DG量は、パルミチン酸で処理しなかった細胞の2DG取り込み量に対する相対値で表した。
【0069】
図4に、パルミチン酸がL6細胞の糖取り込みに及ぼす影響を、インスリン処理無し(□)及び100nMインスリン処理(■)の二種類について調べたグラフを示す。図4の□バーが示すように、パルミチン酸は、非インスリン依存的な糖の取り込みを処理時間依存的に減少させた。
【0070】
また、図4の■バーが示すように、パルミチン酸で処理しなかった細胞(処理時間0)では、インスリン刺激により、糖の取り込み量が60%増した。一方、パルミチン酸の8時間処理では、インスリン刺激による糖取り込み量の増加は20%に留まった。さらに、10時間処理では、インスリン刺激による糖取り込み量の増加が認められなかった。
【0071】
〔参考例3〕ステアリン酸処理によるL6細胞への糖取り込みの影響
参考例2(2)において、パルミチン酸0.75mMに代えて、飽和脂肪酸のステアリン酸(株式会社フナコシより入手)0.75mMで14時間処理した以外は、同様の手順で、糖の取り込み試験を行った。その結果を表4及び図5に、パルミチン酸0.75mMの場合とともに示す。
【0072】
図5から、ステアリン酸処理についても、パルミチン酸と同様の糖取り込みの影響が見られた。すなわち、この飽和脂肪酸もまた、L6細胞の非インスリン依存的な糖の取り込みを著しく減少させた。そして、インスリン刺激による糖取り込みの増加(インスリン感受性)も低下させた。
【0073】
〔参考例4〕パルミチン酸及びステアリン酸処理によるL6細胞への糖取り込みの影響
参考例2(2)において、パルミチン酸0.75mMにステアリン酸0.75mMを加えた以外は、同様の手順で、糖の取り込み試験を行った。その結果を表4及び図5に示す。
【0074】
図5から、ステアリン酸は、パルミチン酸のL6細胞に対する影響を憎悪させた。すなわち、飽和脂肪酸の共存は、非インスリン依存的糖取り込み及びインスリン感受性を著しく低下させた。
【0075】
〔比較例1〕パルミチン酸及びα−リノレン酸処理によるL6細胞への糖取り込みの影響
【0076】
参考例2(2)において、パルミチン酸0.75mMにα−リノレン酸(株式会社フナコシより入手)を0.75mM共存させた以外は同様の手順で、糖の取り込み試験を行った。その結果を表4及び図5に示す。
【0077】
図5から、α−リノレン酸は、パルミチン酸のL6細胞に対する影響を緩和させた。すなわち、パルミチン酸とα−リノレン酸の共存は、非インスリン依存的糖取り込みをパルミチン酸無処理レベルあるいはそれ以上に高め、そして、インスリン感受性の低下を抑制した。
【0078】
〔実施例1〕パルミチン酸及びアラキドン酸処理によるL6細胞への糖取り込みの影響
参考例2(2)において、パルミチン酸0.75mMにアラキドン酸(株式会社フナコシより入手)を75μM共存させた以外は同様の手順で、糖の取り込み試験を行った。その結果を表4及び図5に示す。
【0079】
図5から、パルミチン酸にアラキドン酸を共存させることで、非インスリン依存的な糖取り込み量の減少を抑制し、そして、パルミチン酸によるインスリン依存的な糖の取り込みの減少を回復させた。比較例1のα−リノレン酸と対比しても、アラキドン酸が1桁低い濃度で同等の効果を示したことは、アラキドン酸のグルコース取り込み促進剤としての優位性を証明している。
【0080】
【表4】

※:非インスリン依存的糖取り込みは、L6細胞の脂肪酸処理無しの2DG糖取り込み量を1.0とした相対値で示す。
※※:インスリン感受性低下抑制効果は、L6細胞の脂肪酸処理無しの2DG糖取り込み量を1.0とした相対値で示す。
【0081】
〔実施例2〜5〕パルミチン酸の存在下、各種濃度のアラキドン酸処理によるL6細胞への糖取り込みの影響
参考例2(2)において、パルミチン酸0.75mMにアラキドン酸を表2に示す濃度範囲で共存させた以外は同様の手順で、糖の取り込み試験を行った。その結果を、表5及び図6に示す。
【0082】
【表5】

※:非インスリン依存的糖取り込みは、L6細胞の脂肪酸処理無しの2DG糖取り込み量を1.0とした相対値で示す。
※※:インスリン感受性低下抑制効果は、L6細胞の脂肪酸処理無しの2DG糖取り込み量を1.0とした相対値で示す。
【0083】
表5及び図6から、アラキドン酸は、濃度10μM以上で、パルミチン酸によるインスリン非依存的な糖取り込み量の減少を濃度依存的に抑制した。そして、アラキドン酸は、濃度75μMまでは、パルミチン酸によるインスリン依存的な糖の取り込みの減少を濃度依存的に回復させた。アラキドン酸の下限は、パルミチン酸0.75mMに対して好ましくは10μM(モル比率0.013)、より好ましくは25μM(0.03)であり、アラキドン酸の上限は、パルミチン酸0.75mMに対して好ましくは100μM(モル比率0.13)、より好ましくは75μM(モル比率0.1)であることが判明した。
【特許請求の範囲】
【請求項1】
アラキドン酸を有効成分として含有するグルコース取り込み促進剤。
【請求項2】
インスリン抵抗性を改善する、請求項1に記載のグルコース取り込み促進剤。
【請求項3】
請求項1又2に記載のグルコース取り込み促進剤を含有する油脂組成物。
【請求項4】
飽和脂肪酸を含有する、請求項3に記載の油脂組成物。
【請求項5】
前記アラキドン酸の飽和脂肪酸に対するモル比率は、0.01〜3である、請求項4に記載の油脂組成物。
【請求項6】
ラード、牛脂、パーム核油、ヤシ油、米油、天然油脂のグリセロール骨格の1,2,3位の少なくとも一位に化学的又は生化学的手法により飽和脂肪酸を結合させた加工油脂からなる群から選ばれる少なくとも一種を含む、請求項3〜5のいずれか一項に記載の油脂組成物。
【請求項7】
請求項3〜6のいずれか一項に記載の油脂組成物を用いて製造した加工食品。
【請求項1】
アラキドン酸を有効成分として含有するグルコース取り込み促進剤。
【請求項2】
インスリン抵抗性を改善する、請求項1に記載のグルコース取り込み促進剤。
【請求項3】
請求項1又2に記載のグルコース取り込み促進剤を含有する油脂組成物。
【請求項4】
飽和脂肪酸を含有する、請求項3に記載の油脂組成物。
【請求項5】
前記アラキドン酸の飽和脂肪酸に対するモル比率は、0.01〜3である、請求項4に記載の油脂組成物。
【請求項6】
ラード、牛脂、パーム核油、ヤシ油、米油、天然油脂のグリセロール骨格の1,2,3位の少なくとも一位に化学的又は生化学的手法により飽和脂肪酸を結合させた加工油脂からなる群から選ばれる少なくとも一種を含む、請求項3〜5のいずれか一項に記載の油脂組成物。
【請求項7】
請求項3〜6のいずれか一項に記載の油脂組成物を用いて製造した加工食品。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−162469(P2012−162469A)
【公開日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願番号】特願2011−22283(P2011−22283)
【出願日】平成23年2月4日(2011.2.4)
【出願人】(302042678)株式会社J−オイルミルズ (75)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
【公開日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願日】平成23年2月4日(2011.2.4)
【出願人】(302042678)株式会社J−オイルミルズ (75)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
[ Back to top ]

