グルコース親和性タンパク質の精製方法
【課題】試料から、グルコース親和性タンパク質を選択的に精製する方法を提供する。
【解決手段】吸着剤としてパラハイドロキシアセトフェノンを含むアフィニティカラムに、グルコース親和性タンパク質を含む試料を適用し、上記パラハイドロキシアセトフェノンに、上記グルコース親和性タンパク質を結合させる第1ステップと、グルコースを含む第1溶液により、上記アフィニティカラムに結合した上記グルコース親和性タンパク質の少なくとも一部を分離させ、少なくとも上記グルコースと上記グルコース親和性タンパク質とを含む第2溶液を得る第2ステップと、上記第2溶液から、上記グルコース親和性タンパク質の少なくとも一部を分離させる第3ステップと、を含む。
【解決手段】吸着剤としてパラハイドロキシアセトフェノンを含むアフィニティカラムに、グルコース親和性タンパク質を含む試料を適用し、上記パラハイドロキシアセトフェノンに、上記グルコース親和性タンパク質を結合させる第1ステップと、グルコースを含む第1溶液により、上記アフィニティカラムに結合した上記グルコース親和性タンパク質の少なくとも一部を分離させ、少なくとも上記グルコースと上記グルコース親和性タンパク質とを含む第2溶液を得る第2ステップと、上記第2溶液から、上記グルコース親和性タンパク質の少なくとも一部を分離させる第3ステップと、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、吸着剤としてパラハイドロキシアセトフェノン(p−HAP)が用いられたアフィニティクロマトグラフィーに基づき、グルコース親和性タンパク質を精製する方法に関する。
【背景技術】
【0002】
従来より、セファロース樹脂と共有結合したp−HAP(p−HAP−Sepharose)には、機能的には殆ど関連性のないタンパク質群との親和性が認められている。それらは、例えば、糖代謝(グリコーゲンフォスフォリラーゼ),薬物代謝(アルコール デヒドロゲナーゼ,アルデヒド デヒドロゲナーゼ,グルタチオン S−トランスフェラーゼ),サイトカイン(マクロファージ遊走阻止因子),癌抑制遺伝子(プロテイン キナーゼ C インタラクティング プロテイン)などである。
【0003】
上述されたp−HAPとタンパク質群との親和性に着目し、タンパク質を精製する方法が知られている。概要を以下に説明する。まず、タンパク質を含んだ試料に、p−HAPを担体としたアフィニティクロマトグラフィーが適用される。担体と結合したタンパク質はp−HAPで溶出され、電気泳動で分離される。アフィニティクロマトグラフィーには、GhenbotとWeinerが提唱する方法により製造された、p−HAP−Sepharose 6Bカラムが使用される。この方法は、従来より、トランスフェラーゼ、アルデヒドデヒドロゲナーゼ、又はアルコールデヒドロゲナーゼなどの精製に利用されている(非特許文献1)。
【0004】
また、タンパク質のうち、マクロファージ遊走阻止因子(MIF)の精製に特化した方法が知られている。この方法は、MIFとグルコースとの親和性に着目したものである。概要を以下に説明する。まず、マクロファージをグルタルアルデヒドで固定したマクロファージカラムを作成する。アフィニティクロマトグラフィーにより、細胞表面のMIF受容体にMIFを結合させる。結合したMIFを、グルコースで溶出させる(非特許文献2)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Ghenbot G and Weiner H “Purification of the liver aldehyde dehydrogenase by p−hydroxyacetophenone−sepharose affinity matrix and the coelution of chloramphenicol acetyl transferase from the same matrix with recombinantly expressed aldehyde” Protein Expression and Purification, 3:470−478, 1992
【0006】
【非特許文献2】Kikuo Onozaki, Sinji Haga, Kaoru Miura, and Tatsuichiro Hashimoto “Partial Purification of Guinea MIF by Affinity Column Chromatography Using Macrophages” Microbiol Immunol, Vol.23(6), 533−541, 1979
【発明の概要】
【発明が解決しようとする課題】
【0007】
非特許文献1に記載されたp−HAPによる精製法において、担体と結合したタンパク質は、p−HAPの溶液により溶出される。しかしながら、p−HAPによる溶出では、特定の性質を持つタンパク質のみを選択的に溶出させることが困難であった。
【0008】
また、非特許文献2に記載されたマクロファージによる精製法において、細胞を固定するためには、マクロファージの純化が必要であった。また、この方法では、MIF以外のグルコース親和性のタンパク質を精製することはできなかった。カラムの再生や寿命についても、十分な検討がなされていなかった。
【0009】
本発明は、前述された事情に鑑みてなされたものであり、その目的は、試料から、グルコース親和性タンパク質を選択的に精製することにある。
【課題を解決するための手段】
【0010】
(1) 本発明に係るグルコース親和性タンパク質の精製方法は、吸着剤としてパラハイドロキシアセトフェノンを含むアフィニティカラムに、グルコース親和性タンパク質を含む試料を適用し、上記吸着剤に、上記グルコース親和性タンパク質を結合させる第1ステップと、グルコースを含む第1溶液により、上記吸着剤に結合した上記グルコース親和性タンパク質の少なくとも一部を分離させ、少なくとも上記グルコースと上記グルコース親和性タンパク質とを含む第2溶液を得る第2ステップと、上記第2溶液から、上記グルコース親和性タンパク質の少なくとも一部を分離させる第3ステップと、を含む。
【0011】
p−HAP親和性タンパク質として、アルデヒドを認識するアルデヒドロゲナーゼやアルコールデヒドロゲナーゼが確認されている。本発明は、オープンチェーン形式のブドウ糖が、水相に遊離アルデヒド基を有している点に着眼を得て為されたものである。本発明の発明者は、p−HAPと結合したタンパク質には、グルコースによって溶出可能なものが存在することを新規に発見し、本発明を想到するに至った。
【0012】
グルコース親和性タンパク質を含む試料が、吸着剤としてパラハイドロキシアセトフェノンを含むアフィニティカラムに適用されることで、吸着剤に、グルコース親和性タンパク質の少なくとも一部が結合される。グルコースを含む第1溶液によって、吸着剤に結合したグルコース親和性タンパク質の少なくとも一部が分離される。こうして、少なくともグルコースとグルコース親和性タンパク質とを含む第2溶液が得られる。得られた第2溶液から、グルコース親和性タンパク質の少なくとも一部が分離される。この方法によるとタンパク質を含んだ試料から、グルコースに親和性を有するタンパク質だけを選択的に分離することが可能である。
【0013】
(2) 上記第3ステップにおける上記グルコース親和性タンパク質の分離は、電気泳動によって行われてもよい。
【0014】
(3) 上記吸着剤は、セファロース樹脂とパラハイドロキシアセトフェノンとの共有結合により構成されたものであってもよい。
【0015】
(4) 上記試料は、哺乳動物の臓器中の組織の一部を含んだものであってもよい。
【0016】
試料に哺乳動物の臓器中の組織が使用されることで、哺乳動物の臓器中の組織からグルコース親和性タンパクを精製することが可能である。
【0017】
(5) 上記グルコース親和性タンパク質が、グリコーゲン ホスホリラーゼ,アルコール デヒドロゲナーゼ,グルタチオン S−トランスフェラーゼ,及びマクロファージ遊走阻止因子から成る群より選択されたものであってもよい。
【0018】
(6) 上記試料は、哺乳動物の臓器中の組織から遠心分離された細胞質基質を含むものであってもよい。
【発明の効果】
【0019】
本発明によれば、試料から、グルコース親和性タンパク質を選択的に精製することができる。
【図面の簡単な説明】
【0020】
【図1】図1は、試料Aに関する各画分について、SDS−PAGEによって得られたバンドをクマシブリリアントブルーによって染色したものである。
【図2】図2は、試料Bに関する各画分について、SDS−PAGEによって得られたバンドをクマシブリリアントブルーによって染色したものである。
【図3】図3は、グルコースの添加量と、アルコール デヒドロゲナーゼ(Alcol dehydrogenaze(ADH))の活性との関係を示すグラフである。
【発明を実施するための形態】
【0021】
本実施形態は、以下の第1から第3ステップを含むものである。各ステップについて以下に説明する。
【0022】
本実施形態における第1ステップは、吸着剤としてパラハイドロキシアセトフェノン(p−HAP)を含むアフィニティカラムに、グルコース親和性タンパク質を含む試料を適用し、上記吸着剤に、上記グルコース親和性タンパク質を結合させるものである。
【0023】
アフィニティカラムには、たとえば、GhenbotとWeinerによって提案されたp−HAP−Separose 6Bカラムが使用可能である。p−HAP−Separose 6Bカラムは、セファロース樹脂とp−HAPとが共有結合されたものを吸着剤(固定層)として含んでいる。
【0024】
アフィニティカラムは、平衡化バッファによって平衡化される。平衡化バッファには、たとえば、ジチオスレイトール(DTT)、エチレンジアミン四酢酸(EDTA)、塩化ナトリウム(NaCl)、及びフェニルメチルスルフォニル フルオライド(PMSF)などを含んだ燐酸塩バッファが使用可能である。
【0025】
グルコース親和性タンパク質を含む試料として、生物、特に哺乳動物の組織が使用されてもよい。哺乳動物の組織は、肝臓、心臓、又は脳などの臓器から取り出されたものであってもよく、たとえば、ラット肝臓やウマ肝臓(HALAD)が使用されてもよい。灌流や遠心分離などの処理を経て、臓器中の組織から細胞質基質が分離される。この細胞質基質を含んだ溶液が、試料として使用される。ただし、本実施形態の試料は、上記に限定されるものではなく、グルコース親和性タンパク質を含んだものであればよい。試料の他の一例として、食品、又はペットや家畜の餌などから精製されたものが挙げられる。
【0026】
試料は、吸着剤のp−HAPが充填されたアフィニティカラムに適用される。この操作によって、試料に含まれるタンパク質のうち、p−HAPと親和性を有するものがp−HAPと結合される。試料に哺乳動物の臓器が使用される場合、ここで結合されるタンパク質の一例として、たとえば、グリコーゲン ホスホリラーゼ(Glycogen phosphorylase(GP))、アルコール デヒドロゲナーゼ(Alcol dehydrogenaze(ADH))、グルタチオン S−トランスフェラーゼ(Glutathion S−transferase(GST))、マクロファージ遊走阻止因子(Macrophase migration inhibitory factor(MIF))、アルデヒド デヒドロゲナーゼ(Aldehyde dehydrogenase(ALDH))、アデノシン キナーゼ(Adenosine kinase(AK))、又はプロテイン キナーゼ C インタラクティング プロテイン(Protein kinaze C interacting protein(PKCI))などが挙げられる。
【0027】
本実施形態における第2ステップは、グルコースを含む第1溶液により、上記吸着剤に結合した上記グルコース親和性タンパク質の少なくとも一部を分離させ、少なくとも上記グルコースと上記グルコース親和性タンパク質とを含む第2溶液を得るものである。
【0028】
ここで、グルコースを含む第1溶液とは、たとえばカラムの平衡化に使用される平衡化バッファにグルコースが混合されたものである。
【0029】
まず、アフィニティカラムは、平衡化バッファによって洗浄される。これにより、アフィニティカラムに付着した試料が洗い流される。続けて、移動相としての第1溶液がアフィニティカラムに通液される。このとき、固定層のp−HAPからタンパク質が分離され、移動相と共に流出する。このときに流出する液体が第2溶液である。
【0030】
ここで分離されるタンパク質は、p−HAPと結合していたもののうち、グルコースと親和性を有するものである。一例として、GP、ADH、GST、及びMIFなどが挙げられる。
【0031】
本実施形態における第3ステップは、上記第2溶液から、上記グルコース親和性タンパク質の少なくとも一部を分離させるものである。
【0032】
第2溶液からのグルコース親和性タンパク質の分離には、たとえばポリアクリルアミドゲル電気泳動が使用可能であり、好適には、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)が使用される。ただし、グルコース親和性タンパク質の分離にはこれとは異なる方法が用いられてもよい。
【0033】
まず、第2溶液に含まれる分離されたアリコットが集められて、たとえば限外濾過セルによって濃縮される。濃縮された画分は、SDSのサンプルバッファに溶かされて、調整される。詳細には、ジチオスレイトール(DTT)及びヨードアセトアミドが用いられて、カルボキシメチル化が行われる。これにより、タンパク質の鎖内ジスルフィド結合が分断される。また、水酸化ナトリウム(NaOH)によって溶液のpHが調整される。
【0034】
調整された溶液は、SDS−PAGEにかけられる。SDS−PAGEは当業者が任意の方法によって行うことができるものであるが、一般的な方法を以下に説明する。
【0035】
溶液は、たとえばゲル中に添加される。ゲルに電位差が与えられて、電荷を有したタンパク質はゲル中を移動させられる。タンパク質の分子量が大きいほど、移動抵抗が大きくなる。したがって、分子量が小さいタンパク質ほど多くの距離を移動する。これにより、タンパク質の分子量に応じた複数のバンドがゲルに発生する。発生したバンドは、分子量マーカーなどを用いて染色されてもよい。以上の手順によって、グルコース親和性タンパク質が試料から選択的に分離される。
【実施例】
【0036】
実施形態の実施例を以下に説明する。本実施例においては、試料として、ラット肝臓から採取された細胞質基質、及び、ウマ肝臓アルコール脱水素酵素(HLADH)がそれぞれ使用される。
【0037】
[材料]
全ての化学物質は試薬グレードのものである。 エポキシ活性のSepharose 6B、μRPC C2/C18 SC2.1/10カラムは、アマーシャム ファルマシア バイオテクノロジー社から購入されたものである。p−HAPとグルコースは和光Pureケミカル社から購入されたものである。ウマ肝臓アルコール脱水素酵素(HLADH)はシグマ社から購入されたものである。SDS−PAGEのための分子重量マーカーは、バイオ ラッド ラボラトリーズ社から購入されたものである。ニコチンアミドアデニンジヌクレオチド(NAD)は、ベーリンガー マンハイム社から購入されたものである。限界濾過の材料(amicon centripulus YM10)はミリポア社から購入されたものである。
【0038】
[試料の準備]
雄ウィスターラットは、ナトリウムペントバルビタール(50mg/kg)による麻酔状態で断頭された。肝臓は解剖されて、すぐに、冷却されたリン酸緩衝生理食塩水で灌流された。肝臓は、冷却された溶液(5mMのTris−HCL、0.25Mの蔗糖(pH7.2)、2mMの2メルカプトエタノール、及び1mMのフッ化フェニルメタンスルホニル(PMSF)を含む)によって均質化され、700xgにおいて10分間遠心分離された。画分は、ミトコンドリアを取り除くために、7,000xgにおいて10分間遠心分離され、続けて、マイクロソームの汚染の可能性を排除するために105,000xgにおいて1時間遠心分離された。結果として、細胞質基質の画分(試料Aとする)が得られた。また、HLADHは10mMのリン酸ナトリウムバッファ(pH7.5)によって溶かされた(試料Bとする)。これらの操作はすべて4℃において実行された。試料A,Bは、それぞれ後述するアフィニティクロマトグラフィーに使用される。
【0039】
[アフィニティクロマトグラフィー]
非特許文献1に記載のGhenbotとWeinerによって説明された方法によって、p−HAP−Sepharose 6Bカラムが準備された。p−HAP−Sepharose 6Bカラムは公知なものであるため、製造手順の一例を簡単に説明する。
【0040】
エポキシ活性のSepharose 6Bの乾燥粉末1gをグラスフイルター(G3)上で膨潤し、3.0mlのゲルを得る。ゲルを200ml/gの蒸留水によって洗浄する。カップリング溶液にリガンド(p−HAP)を溶解させる。得られたゲル懸濁液とリガンド溶液とを混合し、25〜40℃において16時間、ウオーターバス中のシェーカー内で反応に供する。
【0041】
ゲルを、カップリング溶液についで、蒸留水、重炭酸バッファー(0.1M、pH8.0)、及び酢酸水溶液(0.1M、pH4.0)によって洗浄する。続けて、1Mのエタノールアミンに、40〜50℃において一晩放置し、活性基をブロックする。得られたp−HAP−Sepharose結合体を充填し、p−HAP−Sepharose 6Bカラムを得る。
【0042】
上記方法によって、カラムは、試料A,Bの実験のためにそれぞれ複数が準備された。カラムは、それぞれ、0.1mMのジチオスレイトール(DTT)、1mMの エチレンジアミン四酢酸(EDTA)、50mMの 塩化ナトリウム(NaCl)、及び1mMのフェニルメチルスルフォニル フルオライド(PMSF)を含んだ20mMの燐酸塩バッファ(pH7.4)によって平衡された。
【0043】
試料A,Bの硫安沈殿(post−ammonium sulfate (70%) presipitant)が、それぞれカラムに適用された。この操作が、本発明の第1ステップに相当する。なお、試料A,Bのカラムは、異なる溶出液によって溶出の実験を行うためにそれぞれ複数が準備された。
【0044】
カラムは、4カラム体積の平衡化バッファによって、それぞれ洗浄された。続けて、カラムと結びついたタンパク質は、流出量がそれぞれ0.5ml/minであり、グルコースを含む2カラム体積の平衡化バッファの通液により溶出された。試料Aのカラムには1mM,10mMのグルコースを含む平衡化バッファ(それぞれ解離液A,Bとする)がそれぞれ通液された。試料Bのカラムには10mM,50mM,250mMのグルコースを含む平衡化バッファ(それぞれ解離液C,D,Eとする。本発明の第1溶液に相当)がそれぞれ通液された。また、比較例として、試料A,試料Bのカラムには、それぞれ10mMのp−HAPを含む2カラム体積の平衡化バッファ(解離液Fとする)が通液された。ここで、グルコースを含む平衡化バッファをカラムに通液する操作が、本発明の第2ステップに相当する。
【0045】
[SDS−PAGE]
カラムから流出する溶液(本発明の第2溶液に相当)に含まれる画分のアリコットはそれぞれプールされ、限外濾過セルの中で濃縮された。濃縮サンプルは、SDS−PAGEに使用される。濃縮サンプルは、SDSのサンプルバッファ(0.625Mの Tris−HCL(pH6.8)、2%のSDS、10%のグリセロール、5%の2−メルカプトエタノール、及び0.01%のブロモフェノールブルー)に溶かされ、400mMのジチオスレイトールと共に、37℃において2時間の間、1/10の体積まで減らされた。次に、800mMのヨードアセトアミドが同体積のジチオスレイトールと共に添加され、カルボキシメチル化が37℃において2時間行われた。水酸化ナトリウムにより、溶液のpHが6.8に調整された後、溶液は、SDS−PAGEにかけられた。ゲルはタンパク質染色色素で染色された。ここで、カラムから流出する溶液に対してSDS−PAGEを行う一連の操作が本発明の第3ステップに相当する。
【0046】
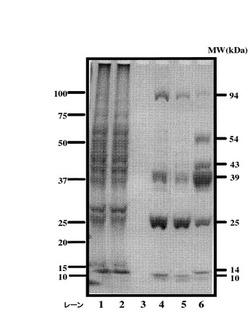
図1は、試料Aに関する各画分について、SDS−PAGEによって得られたバンドをクマシブリリアントブルーによって染色したものである。縦軸は、統一原子質量単位(kDa)を示している。レーン1は、試料Aとして用いられるラット肝臓の細胞質基質から得られたものである。レーン2は、硫安沈殿された後のラット肝臓の細胞質基質から得られたものである。レーン3は、試料Aのカラムの洗浄された画分から得られたものである。レーン4は、試料Aのカラムに通液された解離液A(1mMのグルコースを含む)から得られたものである。レーン5、試料Aのカラムに通液された解離液B(10mMのグルコースを含む)から得られたものである。レーン6は試料Aのカラムに通液された解離液F(10mMのp−HAPを含む)から得られたものである。
【0047】
レーン3が示すように、洗浄された画分からは、バンドは検出されなかった。これは、カラムが十分に洗浄され、p−HAP−Sepharoseと結合しているもの以外のタンパク質がカラムに存在しないことを意味している。レーン4は、カラムから溶出したタンパク質の4つの主要なバンドが、SDS−PAGEによって分離したことを示している。レーン4が示すように、94kDa,39kDa,25kDa,10kDaの分子重量の4つのポリペプチドが、1mMのグルコースによって同時に溶出した。94kDa,39kDa,25kDaのポリペプチドは、10kDaのポリペプチドよりも容易に検出された。25kDaのポリペプチドは、レーン4に検出されたすべてのポリペプチドの中で最も効果的に溶出した。
【0048】
レーン5は、94kDa,39kDa,25kDa,10kDaの分子重量の4つのポリペプチドが、10mMのグルコースによって同時に溶出したことを示している。レーン5は、レーン4と類似しているが、レーン4よりもパターンがわずかに弱く検出されている。レーン6は、94kDa,54kDa,43kDa,39kDa,25kDa,14kDaのポリペプチドが、p−HAPによって同時に溶出したことを示している。39kDaのポリペプチドは、レーン6に検出されたすべてのポリペプチドの中で最も効果的に溶出した。
【0049】
図2は、試料Bに関する各画分について、SDS−PAGEによって得られたバンドをクマシブリリアントブルーによって染色したものである。縦軸は、統一原子質量単位(kDa)を示している。レーン1は、37kDaのリコンビナント合成ポリペプチドの分子量マーカーから得られたものである。レーン2は、矢印A1に示されるように、商用のウマ肝臓アルコール脱水素酵素(HLADH)から得られたものである。レーン3は、試料Bを通液した際にカラムから流出した画分から得られたものである。レーン4は、試料Bのカラムの洗浄された画分から得られたものである。レーン5は、試料Bのカラムに通液された解離液C(10mMのグルコースを含む)から得られたものである。レーン6は、試料Bのカラムに通液された解離液D(50mMのグルコースを含む)から得られたものである。レーン7は、試料Bのカラムに通液された解離液E(250mMのグルコースを含む)から得られたものである。レーン8は、試料Bのカラムに通液された解離液F(10mMのp−HAPを含む)から得られたものである。
【0050】
レーン3に検出されたバンドは、カラムに過剰の試料Bが通液されたため、p−HAP−Sepharoseと結合せずに流出したHLADHである。レーン4が示すように、洗浄された画分からはHLADHのバンドが検出されなかった。これは、カラムが十分に洗浄され、p−HAP−Sepharoseと結合しているもの以外のタンパク質がカラムに存在しないことを意味している。レーン5〜8が示すように、3つの異なった濃度(10mM,50mM,250mM)のグルコースと10mMのp−HAPとが、カラムからHLADHを溶出させることに成功した。つまり、HLADHは、テストされたすべての解離液において、効果的に溶出した。
【0051】
[タンパク質配列の特定]
SDS−PAGEの後、ゲルの染色された各部分は脱染色の後に切除されて、エッペンドルフチューブに移された。 それぞれの切除されたゲルは、0.05MのTris−HCl(pH9.0)及びアセトニトリルの混合液(1:1)によって3回濯がれた後、乾かされた。 次に、ゲルは、0.05MのTris−HCl(pH9.0,37℃)中で、アクロモバクターによるLys特異的な蛋白酵素により12時間の間処理された。ペプチド画分の混合物は、逆相高速液体クロマトグラフィー(HPLC)(アマーシャム ファルマシア バイオテクノロジー社のSMART SYSTEM)を使用して、分離された。μRPC C2/C18 SC2.1/10カラム(3xmm,250xmm)が使用されて、0.060−0.055%のトリフルオロ酢酸(TFA)中でアセトニトリルの濃度勾配が適用された。カラムは、アセトニトリル水溶液(84%のアセトニトリル,0.005%のトリフルオロ酢酸)の直線的な濃度勾配において変化を示した。流速は0.1ml/minであった。UV吸収は214nMでモニターされた。これらの条件は、アマーシャム ファルマシア バイオテクノロジー社の解説に従って決定された。
【0052】
それぞれのペプチド画分に関するマッピングの後に、3個の画分(14kDaからの1個と10kDaからの2個)が2つのタンパク質のアミノ酸配列を特定するために選択された。ABI 447Aシーケンサ(アプライド バイオシステムス社)が使用されて、配列の解読が行われた。それぞれの配列は、ゲノムネットのデータベースを使用したデータバンクから得られたタンパク質の配列と比較された。
【0053】
3個の画分の推定アミノ酸配列の分析結果が表1に示される。データバンクの検索によって、ペプチドA1のアミノ酸残基の配列がラットのPKCIの部分的なアミノ酸配列(7−16)と同じであることが示された。また、ペプチドB1の6つのアミノ酸残基とペプチドB2の8つのアミノ酸残基は、ラットのMIFの部分的なアミノ酸配列(それぞれ33−38,45−55)と同じであった。
【0054】
【表1】

【0055】
[グルコースによるHLADHの活性の減少]
続けて、HLADHによるエタノールの酸化に対するグルコースの効果がテストされた。予備実験では、500mMまでのグルコースは、ADHの反応に関するアッセイバッファを含んだ100mMの燐酸塩(pH7.5)のpHに影響しなかった。そして、アッセイ溶液中のNADHの生産は溶液へのエタノールの追加の前には観測されなった。したがって、500mM以下の濃度のグルコースが本実験で使用された。グルコースは、エタノールが存在しないときにも、ADHによるNAD−NADH反応を引き起こさなかった。
【0056】
図3は、HLADAの相対的な活性がグルコースの存在によって抑制されたことを示している。横軸はグルコースの添加量(ml)、縦軸は、グルコースの添加量0mlを基準とした、HLADAの相対的な活性(%)をそれぞれ示している。グルコース(250mM,500mM)は、HLADHの酵素の活性(p<0.01)を濃度依存的に、大幅に減少させた。250mM,500mMの濃度のグルコースによるインキュベーションは、本来のHLADHの活性を93.2±1.5%,80.7±1.2%まで、それぞれ相対的に減少させた。
【0057】
SDS−PAGEによって得られたバンド及びタンパク質配列の特定の結果より、p−HAP−Separose樹脂が肝臓中のPKCI及びMIFと結合することが示された。また、グルコースが、ラット肝臓のMIFと親和性を有することが示された。また、グルコースが、ラットADH及びHLADHと親和性を有することが示された。
【0058】
一方、図1のレーン4,5にAK、ALDH、PKCIに対応する分子重量のバンドが検出されなかったことから、グルコースは、AK、及び細胞質基質のALDH,PKCIとの親和性を有さないことが示された。この相違は、グルコースとの親和性の有無に応じて、p−HAP−sepharoseと結合するタンパク質が2つのグループに分類されることを示している。p−HAP親和性タンパク質の分類が表2に示される。
【0059】
【表2】

【0060】
また、本実施例の結果より、グルコースの添加量に依存して、HLADHの活性が阻害されることが示された。
【0061】
[実施形態の作用効果]
本実施形態によると、タンパク質を含んだ試料から、グルコース親和性のタンパク質だけを選択的に精製することが可能である。したがって、患者の体組織からグルコース親和性のタンパク質を同定し、糖尿病の予防や治療に有用な情報を得ることができる。
【0062】
また、哺乳動物の臓器中の組織からグルコース親和性タンパクを容易に精製することが可能である。
【0063】
また、食品、又はペットや家畜の餌などからグルコース親和性のタンパク質を同定することで、当該食品又は餌が健康に与える影響を分析することができる。
【符号の説明】
【0064】
Y1・・・矢印
【技術分野】
【0001】
本発明は、吸着剤としてパラハイドロキシアセトフェノン(p−HAP)が用いられたアフィニティクロマトグラフィーに基づき、グルコース親和性タンパク質を精製する方法に関する。
【背景技術】
【0002】
従来より、セファロース樹脂と共有結合したp−HAP(p−HAP−Sepharose)には、機能的には殆ど関連性のないタンパク質群との親和性が認められている。それらは、例えば、糖代謝(グリコーゲンフォスフォリラーゼ),薬物代謝(アルコール デヒドロゲナーゼ,アルデヒド デヒドロゲナーゼ,グルタチオン S−トランスフェラーゼ),サイトカイン(マクロファージ遊走阻止因子),癌抑制遺伝子(プロテイン キナーゼ C インタラクティング プロテイン)などである。
【0003】
上述されたp−HAPとタンパク質群との親和性に着目し、タンパク質を精製する方法が知られている。概要を以下に説明する。まず、タンパク質を含んだ試料に、p−HAPを担体としたアフィニティクロマトグラフィーが適用される。担体と結合したタンパク質はp−HAPで溶出され、電気泳動で分離される。アフィニティクロマトグラフィーには、GhenbotとWeinerが提唱する方法により製造された、p−HAP−Sepharose 6Bカラムが使用される。この方法は、従来より、トランスフェラーゼ、アルデヒドデヒドロゲナーゼ、又はアルコールデヒドロゲナーゼなどの精製に利用されている(非特許文献1)。
【0004】
また、タンパク質のうち、マクロファージ遊走阻止因子(MIF)の精製に特化した方法が知られている。この方法は、MIFとグルコースとの親和性に着目したものである。概要を以下に説明する。まず、マクロファージをグルタルアルデヒドで固定したマクロファージカラムを作成する。アフィニティクロマトグラフィーにより、細胞表面のMIF受容体にMIFを結合させる。結合したMIFを、グルコースで溶出させる(非特許文献2)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Ghenbot G and Weiner H “Purification of the liver aldehyde dehydrogenase by p−hydroxyacetophenone−sepharose affinity matrix and the coelution of chloramphenicol acetyl transferase from the same matrix with recombinantly expressed aldehyde” Protein Expression and Purification, 3:470−478, 1992
【0006】
【非特許文献2】Kikuo Onozaki, Sinji Haga, Kaoru Miura, and Tatsuichiro Hashimoto “Partial Purification of Guinea MIF by Affinity Column Chromatography Using Macrophages” Microbiol Immunol, Vol.23(6), 533−541, 1979
【発明の概要】
【発明が解決しようとする課題】
【0007】
非特許文献1に記載されたp−HAPによる精製法において、担体と結合したタンパク質は、p−HAPの溶液により溶出される。しかしながら、p−HAPによる溶出では、特定の性質を持つタンパク質のみを選択的に溶出させることが困難であった。
【0008】
また、非特許文献2に記載されたマクロファージによる精製法において、細胞を固定するためには、マクロファージの純化が必要であった。また、この方法では、MIF以外のグルコース親和性のタンパク質を精製することはできなかった。カラムの再生や寿命についても、十分な検討がなされていなかった。
【0009】
本発明は、前述された事情に鑑みてなされたものであり、その目的は、試料から、グルコース親和性タンパク質を選択的に精製することにある。
【課題を解決するための手段】
【0010】
(1) 本発明に係るグルコース親和性タンパク質の精製方法は、吸着剤としてパラハイドロキシアセトフェノンを含むアフィニティカラムに、グルコース親和性タンパク質を含む試料を適用し、上記吸着剤に、上記グルコース親和性タンパク質を結合させる第1ステップと、グルコースを含む第1溶液により、上記吸着剤に結合した上記グルコース親和性タンパク質の少なくとも一部を分離させ、少なくとも上記グルコースと上記グルコース親和性タンパク質とを含む第2溶液を得る第2ステップと、上記第2溶液から、上記グルコース親和性タンパク質の少なくとも一部を分離させる第3ステップと、を含む。
【0011】
p−HAP親和性タンパク質として、アルデヒドを認識するアルデヒドロゲナーゼやアルコールデヒドロゲナーゼが確認されている。本発明は、オープンチェーン形式のブドウ糖が、水相に遊離アルデヒド基を有している点に着眼を得て為されたものである。本発明の発明者は、p−HAPと結合したタンパク質には、グルコースによって溶出可能なものが存在することを新規に発見し、本発明を想到するに至った。
【0012】
グルコース親和性タンパク質を含む試料が、吸着剤としてパラハイドロキシアセトフェノンを含むアフィニティカラムに適用されることで、吸着剤に、グルコース親和性タンパク質の少なくとも一部が結合される。グルコースを含む第1溶液によって、吸着剤に結合したグルコース親和性タンパク質の少なくとも一部が分離される。こうして、少なくともグルコースとグルコース親和性タンパク質とを含む第2溶液が得られる。得られた第2溶液から、グルコース親和性タンパク質の少なくとも一部が分離される。この方法によるとタンパク質を含んだ試料から、グルコースに親和性を有するタンパク質だけを選択的に分離することが可能である。
【0013】
(2) 上記第3ステップにおける上記グルコース親和性タンパク質の分離は、電気泳動によって行われてもよい。
【0014】
(3) 上記吸着剤は、セファロース樹脂とパラハイドロキシアセトフェノンとの共有結合により構成されたものであってもよい。
【0015】
(4) 上記試料は、哺乳動物の臓器中の組織の一部を含んだものであってもよい。
【0016】
試料に哺乳動物の臓器中の組織が使用されることで、哺乳動物の臓器中の組織からグルコース親和性タンパクを精製することが可能である。
【0017】
(5) 上記グルコース親和性タンパク質が、グリコーゲン ホスホリラーゼ,アルコール デヒドロゲナーゼ,グルタチオン S−トランスフェラーゼ,及びマクロファージ遊走阻止因子から成る群より選択されたものであってもよい。
【0018】
(6) 上記試料は、哺乳動物の臓器中の組織から遠心分離された細胞質基質を含むものであってもよい。
【発明の効果】
【0019】
本発明によれば、試料から、グルコース親和性タンパク質を選択的に精製することができる。
【図面の簡単な説明】
【0020】
【図1】図1は、試料Aに関する各画分について、SDS−PAGEによって得られたバンドをクマシブリリアントブルーによって染色したものである。
【図2】図2は、試料Bに関する各画分について、SDS−PAGEによって得られたバンドをクマシブリリアントブルーによって染色したものである。
【図3】図3は、グルコースの添加量と、アルコール デヒドロゲナーゼ(Alcol dehydrogenaze(ADH))の活性との関係を示すグラフである。
【発明を実施するための形態】
【0021】
本実施形態は、以下の第1から第3ステップを含むものである。各ステップについて以下に説明する。
【0022】
本実施形態における第1ステップは、吸着剤としてパラハイドロキシアセトフェノン(p−HAP)を含むアフィニティカラムに、グルコース親和性タンパク質を含む試料を適用し、上記吸着剤に、上記グルコース親和性タンパク質を結合させるものである。
【0023】
アフィニティカラムには、たとえば、GhenbotとWeinerによって提案されたp−HAP−Separose 6Bカラムが使用可能である。p−HAP−Separose 6Bカラムは、セファロース樹脂とp−HAPとが共有結合されたものを吸着剤(固定層)として含んでいる。
【0024】
アフィニティカラムは、平衡化バッファによって平衡化される。平衡化バッファには、たとえば、ジチオスレイトール(DTT)、エチレンジアミン四酢酸(EDTA)、塩化ナトリウム(NaCl)、及びフェニルメチルスルフォニル フルオライド(PMSF)などを含んだ燐酸塩バッファが使用可能である。
【0025】
グルコース親和性タンパク質を含む試料として、生物、特に哺乳動物の組織が使用されてもよい。哺乳動物の組織は、肝臓、心臓、又は脳などの臓器から取り出されたものであってもよく、たとえば、ラット肝臓やウマ肝臓(HALAD)が使用されてもよい。灌流や遠心分離などの処理を経て、臓器中の組織から細胞質基質が分離される。この細胞質基質を含んだ溶液が、試料として使用される。ただし、本実施形態の試料は、上記に限定されるものではなく、グルコース親和性タンパク質を含んだものであればよい。試料の他の一例として、食品、又はペットや家畜の餌などから精製されたものが挙げられる。
【0026】
試料は、吸着剤のp−HAPが充填されたアフィニティカラムに適用される。この操作によって、試料に含まれるタンパク質のうち、p−HAPと親和性を有するものがp−HAPと結合される。試料に哺乳動物の臓器が使用される場合、ここで結合されるタンパク質の一例として、たとえば、グリコーゲン ホスホリラーゼ(Glycogen phosphorylase(GP))、アルコール デヒドロゲナーゼ(Alcol dehydrogenaze(ADH))、グルタチオン S−トランスフェラーゼ(Glutathion S−transferase(GST))、マクロファージ遊走阻止因子(Macrophase migration inhibitory factor(MIF))、アルデヒド デヒドロゲナーゼ(Aldehyde dehydrogenase(ALDH))、アデノシン キナーゼ(Adenosine kinase(AK))、又はプロテイン キナーゼ C インタラクティング プロテイン(Protein kinaze C interacting protein(PKCI))などが挙げられる。
【0027】
本実施形態における第2ステップは、グルコースを含む第1溶液により、上記吸着剤に結合した上記グルコース親和性タンパク質の少なくとも一部を分離させ、少なくとも上記グルコースと上記グルコース親和性タンパク質とを含む第2溶液を得るものである。
【0028】
ここで、グルコースを含む第1溶液とは、たとえばカラムの平衡化に使用される平衡化バッファにグルコースが混合されたものである。
【0029】
まず、アフィニティカラムは、平衡化バッファによって洗浄される。これにより、アフィニティカラムに付着した試料が洗い流される。続けて、移動相としての第1溶液がアフィニティカラムに通液される。このとき、固定層のp−HAPからタンパク質が分離され、移動相と共に流出する。このときに流出する液体が第2溶液である。
【0030】
ここで分離されるタンパク質は、p−HAPと結合していたもののうち、グルコースと親和性を有するものである。一例として、GP、ADH、GST、及びMIFなどが挙げられる。
【0031】
本実施形態における第3ステップは、上記第2溶液から、上記グルコース親和性タンパク質の少なくとも一部を分離させるものである。
【0032】
第2溶液からのグルコース親和性タンパク質の分離には、たとえばポリアクリルアミドゲル電気泳動が使用可能であり、好適には、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)が使用される。ただし、グルコース親和性タンパク質の分離にはこれとは異なる方法が用いられてもよい。
【0033】
まず、第2溶液に含まれる分離されたアリコットが集められて、たとえば限外濾過セルによって濃縮される。濃縮された画分は、SDSのサンプルバッファに溶かされて、調整される。詳細には、ジチオスレイトール(DTT)及びヨードアセトアミドが用いられて、カルボキシメチル化が行われる。これにより、タンパク質の鎖内ジスルフィド結合が分断される。また、水酸化ナトリウム(NaOH)によって溶液のpHが調整される。
【0034】
調整された溶液は、SDS−PAGEにかけられる。SDS−PAGEは当業者が任意の方法によって行うことができるものであるが、一般的な方法を以下に説明する。
【0035】
溶液は、たとえばゲル中に添加される。ゲルに電位差が与えられて、電荷を有したタンパク質はゲル中を移動させられる。タンパク質の分子量が大きいほど、移動抵抗が大きくなる。したがって、分子量が小さいタンパク質ほど多くの距離を移動する。これにより、タンパク質の分子量に応じた複数のバンドがゲルに発生する。発生したバンドは、分子量マーカーなどを用いて染色されてもよい。以上の手順によって、グルコース親和性タンパク質が試料から選択的に分離される。
【実施例】
【0036】
実施形態の実施例を以下に説明する。本実施例においては、試料として、ラット肝臓から採取された細胞質基質、及び、ウマ肝臓アルコール脱水素酵素(HLADH)がそれぞれ使用される。
【0037】
[材料]
全ての化学物質は試薬グレードのものである。 エポキシ活性のSepharose 6B、μRPC C2/C18 SC2.1/10カラムは、アマーシャム ファルマシア バイオテクノロジー社から購入されたものである。p−HAPとグルコースは和光Pureケミカル社から購入されたものである。ウマ肝臓アルコール脱水素酵素(HLADH)はシグマ社から購入されたものである。SDS−PAGEのための分子重量マーカーは、バイオ ラッド ラボラトリーズ社から購入されたものである。ニコチンアミドアデニンジヌクレオチド(NAD)は、ベーリンガー マンハイム社から購入されたものである。限界濾過の材料(amicon centripulus YM10)はミリポア社から購入されたものである。
【0038】
[試料の準備]
雄ウィスターラットは、ナトリウムペントバルビタール(50mg/kg)による麻酔状態で断頭された。肝臓は解剖されて、すぐに、冷却されたリン酸緩衝生理食塩水で灌流された。肝臓は、冷却された溶液(5mMのTris−HCL、0.25Mの蔗糖(pH7.2)、2mMの2メルカプトエタノール、及び1mMのフッ化フェニルメタンスルホニル(PMSF)を含む)によって均質化され、700xgにおいて10分間遠心分離された。画分は、ミトコンドリアを取り除くために、7,000xgにおいて10分間遠心分離され、続けて、マイクロソームの汚染の可能性を排除するために105,000xgにおいて1時間遠心分離された。結果として、細胞質基質の画分(試料Aとする)が得られた。また、HLADHは10mMのリン酸ナトリウムバッファ(pH7.5)によって溶かされた(試料Bとする)。これらの操作はすべて4℃において実行された。試料A,Bは、それぞれ後述するアフィニティクロマトグラフィーに使用される。
【0039】
[アフィニティクロマトグラフィー]
非特許文献1に記載のGhenbotとWeinerによって説明された方法によって、p−HAP−Sepharose 6Bカラムが準備された。p−HAP−Sepharose 6Bカラムは公知なものであるため、製造手順の一例を簡単に説明する。
【0040】
エポキシ活性のSepharose 6Bの乾燥粉末1gをグラスフイルター(G3)上で膨潤し、3.0mlのゲルを得る。ゲルを200ml/gの蒸留水によって洗浄する。カップリング溶液にリガンド(p−HAP)を溶解させる。得られたゲル懸濁液とリガンド溶液とを混合し、25〜40℃において16時間、ウオーターバス中のシェーカー内で反応に供する。
【0041】
ゲルを、カップリング溶液についで、蒸留水、重炭酸バッファー(0.1M、pH8.0)、及び酢酸水溶液(0.1M、pH4.0)によって洗浄する。続けて、1Mのエタノールアミンに、40〜50℃において一晩放置し、活性基をブロックする。得られたp−HAP−Sepharose結合体を充填し、p−HAP−Sepharose 6Bカラムを得る。
【0042】
上記方法によって、カラムは、試料A,Bの実験のためにそれぞれ複数が準備された。カラムは、それぞれ、0.1mMのジチオスレイトール(DTT)、1mMの エチレンジアミン四酢酸(EDTA)、50mMの 塩化ナトリウム(NaCl)、及び1mMのフェニルメチルスルフォニル フルオライド(PMSF)を含んだ20mMの燐酸塩バッファ(pH7.4)によって平衡された。
【0043】
試料A,Bの硫安沈殿(post−ammonium sulfate (70%) presipitant)が、それぞれカラムに適用された。この操作が、本発明の第1ステップに相当する。なお、試料A,Bのカラムは、異なる溶出液によって溶出の実験を行うためにそれぞれ複数が準備された。
【0044】
カラムは、4カラム体積の平衡化バッファによって、それぞれ洗浄された。続けて、カラムと結びついたタンパク質は、流出量がそれぞれ0.5ml/minであり、グルコースを含む2カラム体積の平衡化バッファの通液により溶出された。試料Aのカラムには1mM,10mMのグルコースを含む平衡化バッファ(それぞれ解離液A,Bとする)がそれぞれ通液された。試料Bのカラムには10mM,50mM,250mMのグルコースを含む平衡化バッファ(それぞれ解離液C,D,Eとする。本発明の第1溶液に相当)がそれぞれ通液された。また、比較例として、試料A,試料Bのカラムには、それぞれ10mMのp−HAPを含む2カラム体積の平衡化バッファ(解離液Fとする)が通液された。ここで、グルコースを含む平衡化バッファをカラムに通液する操作が、本発明の第2ステップに相当する。
【0045】
[SDS−PAGE]
カラムから流出する溶液(本発明の第2溶液に相当)に含まれる画分のアリコットはそれぞれプールされ、限外濾過セルの中で濃縮された。濃縮サンプルは、SDS−PAGEに使用される。濃縮サンプルは、SDSのサンプルバッファ(0.625Mの Tris−HCL(pH6.8)、2%のSDS、10%のグリセロール、5%の2−メルカプトエタノール、及び0.01%のブロモフェノールブルー)に溶かされ、400mMのジチオスレイトールと共に、37℃において2時間の間、1/10の体積まで減らされた。次に、800mMのヨードアセトアミドが同体積のジチオスレイトールと共に添加され、カルボキシメチル化が37℃において2時間行われた。水酸化ナトリウムにより、溶液のpHが6.8に調整された後、溶液は、SDS−PAGEにかけられた。ゲルはタンパク質染色色素で染色された。ここで、カラムから流出する溶液に対してSDS−PAGEを行う一連の操作が本発明の第3ステップに相当する。
【0046】
図1は、試料Aに関する各画分について、SDS−PAGEによって得られたバンドをクマシブリリアントブルーによって染色したものである。縦軸は、統一原子質量単位(kDa)を示している。レーン1は、試料Aとして用いられるラット肝臓の細胞質基質から得られたものである。レーン2は、硫安沈殿された後のラット肝臓の細胞質基質から得られたものである。レーン3は、試料Aのカラムの洗浄された画分から得られたものである。レーン4は、試料Aのカラムに通液された解離液A(1mMのグルコースを含む)から得られたものである。レーン5、試料Aのカラムに通液された解離液B(10mMのグルコースを含む)から得られたものである。レーン6は試料Aのカラムに通液された解離液F(10mMのp−HAPを含む)から得られたものである。
【0047】
レーン3が示すように、洗浄された画分からは、バンドは検出されなかった。これは、カラムが十分に洗浄され、p−HAP−Sepharoseと結合しているもの以外のタンパク質がカラムに存在しないことを意味している。レーン4は、カラムから溶出したタンパク質の4つの主要なバンドが、SDS−PAGEによって分離したことを示している。レーン4が示すように、94kDa,39kDa,25kDa,10kDaの分子重量の4つのポリペプチドが、1mMのグルコースによって同時に溶出した。94kDa,39kDa,25kDaのポリペプチドは、10kDaのポリペプチドよりも容易に検出された。25kDaのポリペプチドは、レーン4に検出されたすべてのポリペプチドの中で最も効果的に溶出した。
【0048】
レーン5は、94kDa,39kDa,25kDa,10kDaの分子重量の4つのポリペプチドが、10mMのグルコースによって同時に溶出したことを示している。レーン5は、レーン4と類似しているが、レーン4よりもパターンがわずかに弱く検出されている。レーン6は、94kDa,54kDa,43kDa,39kDa,25kDa,14kDaのポリペプチドが、p−HAPによって同時に溶出したことを示している。39kDaのポリペプチドは、レーン6に検出されたすべてのポリペプチドの中で最も効果的に溶出した。
【0049】
図2は、試料Bに関する各画分について、SDS−PAGEによって得られたバンドをクマシブリリアントブルーによって染色したものである。縦軸は、統一原子質量単位(kDa)を示している。レーン1は、37kDaのリコンビナント合成ポリペプチドの分子量マーカーから得られたものである。レーン2は、矢印A1に示されるように、商用のウマ肝臓アルコール脱水素酵素(HLADH)から得られたものである。レーン3は、試料Bを通液した際にカラムから流出した画分から得られたものである。レーン4は、試料Bのカラムの洗浄された画分から得られたものである。レーン5は、試料Bのカラムに通液された解離液C(10mMのグルコースを含む)から得られたものである。レーン6は、試料Bのカラムに通液された解離液D(50mMのグルコースを含む)から得られたものである。レーン7は、試料Bのカラムに通液された解離液E(250mMのグルコースを含む)から得られたものである。レーン8は、試料Bのカラムに通液された解離液F(10mMのp−HAPを含む)から得られたものである。
【0050】
レーン3に検出されたバンドは、カラムに過剰の試料Bが通液されたため、p−HAP−Sepharoseと結合せずに流出したHLADHである。レーン4が示すように、洗浄された画分からはHLADHのバンドが検出されなかった。これは、カラムが十分に洗浄され、p−HAP−Sepharoseと結合しているもの以外のタンパク質がカラムに存在しないことを意味している。レーン5〜8が示すように、3つの異なった濃度(10mM,50mM,250mM)のグルコースと10mMのp−HAPとが、カラムからHLADHを溶出させることに成功した。つまり、HLADHは、テストされたすべての解離液において、効果的に溶出した。
【0051】
[タンパク質配列の特定]
SDS−PAGEの後、ゲルの染色された各部分は脱染色の後に切除されて、エッペンドルフチューブに移された。 それぞれの切除されたゲルは、0.05MのTris−HCl(pH9.0)及びアセトニトリルの混合液(1:1)によって3回濯がれた後、乾かされた。 次に、ゲルは、0.05MのTris−HCl(pH9.0,37℃)中で、アクロモバクターによるLys特異的な蛋白酵素により12時間の間処理された。ペプチド画分の混合物は、逆相高速液体クロマトグラフィー(HPLC)(アマーシャム ファルマシア バイオテクノロジー社のSMART SYSTEM)を使用して、分離された。μRPC C2/C18 SC2.1/10カラム(3xmm,250xmm)が使用されて、0.060−0.055%のトリフルオロ酢酸(TFA)中でアセトニトリルの濃度勾配が適用された。カラムは、アセトニトリル水溶液(84%のアセトニトリル,0.005%のトリフルオロ酢酸)の直線的な濃度勾配において変化を示した。流速は0.1ml/minであった。UV吸収は214nMでモニターされた。これらの条件は、アマーシャム ファルマシア バイオテクノロジー社の解説に従って決定された。
【0052】
それぞれのペプチド画分に関するマッピングの後に、3個の画分(14kDaからの1個と10kDaからの2個)が2つのタンパク質のアミノ酸配列を特定するために選択された。ABI 447Aシーケンサ(アプライド バイオシステムス社)が使用されて、配列の解読が行われた。それぞれの配列は、ゲノムネットのデータベースを使用したデータバンクから得られたタンパク質の配列と比較された。
【0053】
3個の画分の推定アミノ酸配列の分析結果が表1に示される。データバンクの検索によって、ペプチドA1のアミノ酸残基の配列がラットのPKCIの部分的なアミノ酸配列(7−16)と同じであることが示された。また、ペプチドB1の6つのアミノ酸残基とペプチドB2の8つのアミノ酸残基は、ラットのMIFの部分的なアミノ酸配列(それぞれ33−38,45−55)と同じであった。
【0054】
【表1】

【0055】
[グルコースによるHLADHの活性の減少]
続けて、HLADHによるエタノールの酸化に対するグルコースの効果がテストされた。予備実験では、500mMまでのグルコースは、ADHの反応に関するアッセイバッファを含んだ100mMの燐酸塩(pH7.5)のpHに影響しなかった。そして、アッセイ溶液中のNADHの生産は溶液へのエタノールの追加の前には観測されなった。したがって、500mM以下の濃度のグルコースが本実験で使用された。グルコースは、エタノールが存在しないときにも、ADHによるNAD−NADH反応を引き起こさなかった。
【0056】
図3は、HLADAの相対的な活性がグルコースの存在によって抑制されたことを示している。横軸はグルコースの添加量(ml)、縦軸は、グルコースの添加量0mlを基準とした、HLADAの相対的な活性(%)をそれぞれ示している。グルコース(250mM,500mM)は、HLADHの酵素の活性(p<0.01)を濃度依存的に、大幅に減少させた。250mM,500mMの濃度のグルコースによるインキュベーションは、本来のHLADHの活性を93.2±1.5%,80.7±1.2%まで、それぞれ相対的に減少させた。
【0057】
SDS−PAGEによって得られたバンド及びタンパク質配列の特定の結果より、p−HAP−Separose樹脂が肝臓中のPKCI及びMIFと結合することが示された。また、グルコースが、ラット肝臓のMIFと親和性を有することが示された。また、グルコースが、ラットADH及びHLADHと親和性を有することが示された。
【0058】
一方、図1のレーン4,5にAK、ALDH、PKCIに対応する分子重量のバンドが検出されなかったことから、グルコースは、AK、及び細胞質基質のALDH,PKCIとの親和性を有さないことが示された。この相違は、グルコースとの親和性の有無に応じて、p−HAP−sepharoseと結合するタンパク質が2つのグループに分類されることを示している。p−HAP親和性タンパク質の分類が表2に示される。
【0059】
【表2】

【0060】
また、本実施例の結果より、グルコースの添加量に依存して、HLADHの活性が阻害されることが示された。
【0061】
[実施形態の作用効果]
本実施形態によると、タンパク質を含んだ試料から、グルコース親和性のタンパク質だけを選択的に精製することが可能である。したがって、患者の体組織からグルコース親和性のタンパク質を同定し、糖尿病の予防や治療に有用な情報を得ることができる。
【0062】
また、哺乳動物の臓器中の組織からグルコース親和性タンパクを容易に精製することが可能である。
【0063】
また、食品、又はペットや家畜の餌などからグルコース親和性のタンパク質を同定することで、当該食品又は餌が健康に与える影響を分析することができる。
【符号の説明】
【0064】
Y1・・・矢印
【特許請求の範囲】
【請求項1】
吸着剤としてパラハイドロキシアセトフェノンを含むアフィニティカラムに、グルコース親和性タンパク質を含む試料を適用し、上記パラハイドロキシアセトフェノンに、上記グルコース親和性タンパク質を結合させる第1ステップと、
グルコースを含む第1溶液により、上記アフィニティカラムに結合した上記グルコース親和性タンパク質の少なくとも一部を分離させ、少なくとも上記グルコースと上記グルコース親和性タンパク質とを含む第2溶液を得る第2ステップと、
上記第2溶液から、上記グルコース親和性タンパク質の少なくとも一部を分離させる第3ステップと、を含むグルコース親和性タンパク質の精製方法。
【請求項2】
上記第3ステップにおける上記グルコース親和性タンパク質の分離は、電気泳動によって行われる請求項1に記載のグルコース親和性タンパク質の精製方法。
【請求項3】
上記吸着剤は、セファロース樹脂とパラハイドロキシアセトフェノンとの共有結合により構成されたものである請求項1または2に記載のグルコース親和性タンパク質の精製方法。
【請求項4】
上記試料は、哺乳動物の臓器中の組織の一部を含んだものである請求項1から3のいずれかに記載のグルコース親和性タンパク質の精製方法。
【請求項5】
上記グルコース親和性タンパク質が、グリコーゲン ホスホリラーゼ,アルコール デヒドロゲナーゼ,グルタチオン S−トランスフェラーゼ,及びマクロファージ遊走阻止因子から成る群より選択されたものである請求項1から4のいずれかに記載のグルコース親和性タンパク質の精製方法。
【請求項6】
上記試料は、哺乳動物の臓器中の組織から遠心分離された細胞質基質を含むものである請求項1から5のいずれかに記載のグルコース親和性タンパク質の精製方法。
【請求項1】
吸着剤としてパラハイドロキシアセトフェノンを含むアフィニティカラムに、グルコース親和性タンパク質を含む試料を適用し、上記パラハイドロキシアセトフェノンに、上記グルコース親和性タンパク質を結合させる第1ステップと、
グルコースを含む第1溶液により、上記アフィニティカラムに結合した上記グルコース親和性タンパク質の少なくとも一部を分離させ、少なくとも上記グルコースと上記グルコース親和性タンパク質とを含む第2溶液を得る第2ステップと、
上記第2溶液から、上記グルコース親和性タンパク質の少なくとも一部を分離させる第3ステップと、を含むグルコース親和性タンパク質の精製方法。
【請求項2】
上記第3ステップにおける上記グルコース親和性タンパク質の分離は、電気泳動によって行われる請求項1に記載のグルコース親和性タンパク質の精製方法。
【請求項3】
上記吸着剤は、セファロース樹脂とパラハイドロキシアセトフェノンとの共有結合により構成されたものである請求項1または2に記載のグルコース親和性タンパク質の精製方法。
【請求項4】
上記試料は、哺乳動物の臓器中の組織の一部を含んだものである請求項1から3のいずれかに記載のグルコース親和性タンパク質の精製方法。
【請求項5】
上記グルコース親和性タンパク質が、グリコーゲン ホスホリラーゼ,アルコール デヒドロゲナーゼ,グルタチオン S−トランスフェラーゼ,及びマクロファージ遊走阻止因子から成る群より選択されたものである請求項1から4のいずれかに記載のグルコース親和性タンパク質の精製方法。
【請求項6】
上記試料は、哺乳動物の臓器中の組織から遠心分離された細胞質基質を含むものである請求項1から5のいずれかに記載のグルコース親和性タンパク質の精製方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−112607(P2013−112607A)
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2011−256704(P2011−256704)
【出願日】平成23年11月24日(2011.11.24)
【出願人】(511285428)
【Fターム(参考)】
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年11月24日(2011.11.24)
【出願人】(511285428)

【Fターム(参考)】
[ Back to top ]

