ケイアルデヒド含有量の保持方法
【課題】 生薬成分であるケイヒ末中のケイアルデヒドの含有量を、安定に保持する方法ならびにケイアルデヒドの含有量の減少を防止する方法を提供すること。
【解決手段】 ケイヒ末を乾燥させること、あるいはケイヒ末を含有する漢方製剤を乾燥させることにより、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることによる、ケイヒ末中のケイアルデヒドの含有量を保持する方法、ならびにケイヒ末中のケイアルデヒドの含有量の減少を防止する方法である。
【解決手段】 ケイヒ末を乾燥させること、あるいはケイヒ末を含有する漢方製剤を乾燥させることにより、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることによる、ケイヒ末中のケイアルデヒドの含有量を保持する方法、ならびにケイヒ末中のケイアルデヒドの含有量の減少を防止する方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ケイヒ末中に含有されるケイアルデヒドの含有量を安定に保持させ得る方法に関し、さらにはケイヒ末を含有する混合物、造粒物等の製剤中に配合されたケイヒ末中に含有されるケイアルデヒドの含有量の保持方法に関する。
【0002】
詳細には、本発明は、ケイアルデヒドを含有する生薬成分配合の顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の医薬品、あるいはシナモンスティック、シナモンパウダー等の食品、化粧品等において、生薬中に含有されるケイアルデヒドの含有量を良好に保持させる方法、ならびにケイアルデヒドの含有量の減少を防止する方法に関するものである。
【背景技術】
【0003】
ケイヒ末の主成分であるケイアルデヒドには、鎮けい作用、鎮静、体温降下および解熱作用を主とする中枢抑制作用、中枢興奮作用、血圧降下、末梢血管拡張、心臓収縮力増強、軽度の消化管運動抑制、ストレス性胃びらん予防効果、胆汁分泌促進などの諸作用、中枢起源の脳波賦活作用、摘出心臓に対する陽性変力・変時作用、副腎からのカテコールアミン遊離作用、血小板凝集抑制作用等の効果があることが知られている。
【0004】
したがって、これらの効果を目的として、ケイヒ末を含有する風邪薬、鎮痛鎮けい薬、解熱鎮痛消炎薬、動悸抑制薬、保健強壮薬、婦人薬、芳香健胃薬等として、桂枝茯苓丸、八味地黄丸、安中散、茵チン五苓散、五苓散、五積散、牛膝散、女神散等の漢方製剤が広く用いられている。
【0005】
一方最近に至り、漢方薬として生薬エキス配合製剤が多く利用されているが、漢方薬としてのエキス製剤中に本来含有されているべき生薬成分である揮発性成分、水難溶性成分、あるいは水不溶性成分の含有量が、散剤や丸剤と比較して、減少している点が問題となり、薬効の相違点等が指摘されてきている。
【0006】
例えば、ケイヒ末を含有する漢方製剤の一つである桂枝茯苓丸については、傷寒論、金匱要略等の古典にそって製造された丸剤と、現在市場で多く用いられているエキス製剤との比較研究が盛んに行われている[鳥居塚和生ら:桂枝茯苓丸の製剤学的検討,日本東洋医学雑誌,35,185−189,1985(非特許文献1);舟川昌代ら:漢方製剤の品質に関する研究(第4報),家庭薬研究,9:69−75,1990(非特許文献2);成川一郎:丸剤型の検討,現代科学と漢方製剤−漢方の主張,健友館,東京,1991,210−219(非特許文献3);および成川一郎:漢方処方製剤化の問題点(下),月刊薬事,35:339−343,1993(非特許文献4)]。
【0007】
これらの報告は、傷寒論、金匱要略等の古典にそって、煉蜜[蜂蜜を重湯煎等で濃縮し、軟エキス状としたもの(日本薬剤師会編,改訂4版漢方業務指針,薬業時報社,東京,1997,310)(非特許文献5)]を用いて作製されたケイヒ末含有製剤に関するもの、あるいは水分を除いた蜂蜜(非特許文献2)を用いて作製されたケイヒ末含有製剤に関するものである。
【0008】
ケイヒ末を含有する漢方製剤の問題点の一つに、その主成分の一つである生薬成分中のケイアルデヒドが、保存時において、その含有量が減少してしまう問題点がある。すなわち、ケイヒ末の主成分の一つであるケイアルデヒドは、揮発性を有するものであり、ケイヒ末を含有する製剤にあっては、常温においても、その保存期間中に、徐々にケイヒ末中のケイアルデヒドの含有量が減少することが知られている。また常温以上の温度条件下の場合には、ケイアルデヒドの含有量の減少は、特に著しいものである。
【0009】
ケイヒ末を含有する漢方製剤について、製剤中のケイアルデヒドの含有量を安定化させる方法として、水分を除いた蜂蜜を用い、これにケイヒ末等の生薬混合末、賦形剤、滑沢剤等を加え、打錠した錠剤が提案されており、先の舟川ら、あるいは成川らの報告によれば、この錠剤は、加速条件(40℃、湿度75%)下において、6カ月間安定であったとされている。
【0010】
このように、水分を除いた蜂蜜を用いることによって、生薬成分中のケイアルデヒドの含有量を安定に保つ改善方法が提案されているが、特異的な賦形剤として製剤中に水分を除いた蜂蜜を使用しなければならない。したがって、経済的な面で好ましいものとはいえず、また、製剤の製造上ならびに実際の使用上においても、それほど好ましいものとはいえない。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】鳥居塚和生ら:桂枝茯苓丸の製剤学的検討,日本東洋医学雑誌,35,185−189,1985
【非特許文献2】舟川昌代ら:漢方製剤の品質に関する研究(第4報),家庭薬研究,9:69−75,1990
【非特許文献3】成川一郎:丸剤型の検討,現代科学と漢方製剤−漢方の主張,健友館,東京,1991,210−219
【非特許文献4】成川一郎:漢方処方製剤化の問題点(下),月刊薬事,35:339−343,1993)
【非特許文献5】日本薬剤師会編,改訂4版漢方業務指針,薬業時報社,東京,1997,310
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、賦形剤として、水分を除いた蜂蜜を用いることなく、ケイヒ末中のケイアルデヒドの含有量を、安定に保持する方法を提供することを課題とする。
かかる課題を解決するべく鋭意検討した結果、本発明者らは、ケイヒ末の水分を除くことで、ケイヒ末中に含まれるケイアルデヒドの含有量を良好に保持し得ることを見出し、本発明を完成するに至った。
【課題を解決するための手段】
【0013】
したがって本発明は、その一つの態様として、ケイヒ末を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることを特徴とする、ケイヒ末中のケイアルデヒドの含有量を保持する方法を提供する。
【0014】
また本発明は、別の形態として、ケイヒ末中のケイアルデヒド含有量の減少を防止させる得る方法をも提供するものであり、具体的には、ケイヒ末を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値との差で、1%以上となるように減少させることを特徴とする、ケイヒ末中に含有されるケイアルデヒドの含有量の減少を防止する方法を提供する。
【0015】
本発明にあっては、ケイヒ末のみならずケイヒ末を含有する製剤にあっても、その製剤中に含有されるケイヒ末中のケイアルデヒドの含有量について、その減少を防止し得るものであり、具体的には、ケイヒ末を含有する製剤を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることを特徴とする、製剤中のケイヒ末に含有されるケイアルデヒドの含有量の減少を防止する方法を提供する。
【0016】
より好ましい態様としては、本発明は、ケイヒ末に他の生薬成分、賦形剤を加えて造粒・成形した顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の製剤中のケイヒ末に含有されるケイアルデヒドの含有量を保持する方法、さらには、上記した製剤中のケイヒ末に含有されるケイアルデヒドの含有量の減少を防止する方法を提供するものである。
なお、本発明にいう製剤とは、上記した顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の医薬品製剤のみならず、シナモンスティック、シナモンパウダー等の食品、化粧品等におけるケイアルデヒドを含有する製品をも包含する。
【発明の効果】
【0017】
本発明は、水分を除いた蜂蜜を賦形剤として使用することなく、ケイヒ末の水分を除くこと、あるいはケイヒ末と他の賦形剤との混合物、あるいはそれら混合物を用いて乾式造粒法で作製した造粒物、もしくは顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の全体の水分をさらに意図的に除くことで、ケイアルデヒドの保持が良好な、ケイヒ末および/またはそれを含有する混合・造粒物等を提供できる有用で広範囲に応用可能な新しい製法である。
【図面の簡単な説明】
【0018】
【図1】ケイヒ末における加熱乾燥条件と、ケイヒ末中のケイアルデヒドの残存率との関係を示す図である。
【図2】桂枝茯苓丸における加熱乾燥条件と、桂枝茯苓丸に配合したケイヒ末中のケイアルデヒド残存率との関係を示す図である。
【図3】安定性試験1における、桂枝茯苓丸顆粒中のケイアルデヒド残存率の変化を示す図である。
【図4】安定性試験2における、桂枝茯苓丸錠剤中のケイアルデヒド残存率の変化を示す図である。
【図5】安定性試験3における、八味地黄丸錠剤中のケイアルデヒド残存率の変化を示す図である。
【図6】安定性試験4における、五苓散錠剤中のケイアルデヒド残存率の変化を示す図である。
【図7】安定性試験5における、桂枝茯苓丸錠剤に用いた賦形剤の種類によるケイアルデヒド残存率の変化を示す図である。
【図8】安定性試験6における、本発明の実施例と市販製剤におけるケイアルデヒド残存率の比較を示す図である。
【発明を実施するための形態】
【0019】
以下に、本発明のケイヒ末、あるいはケイヒ末を含有する製剤、特に顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の製剤中に配合されたケイヒ末に含有されるケイアルデヒドの含有量を保持する方法について、詳細に説明する。
【0020】
第一に本発明者らは、日本薬局方適合のケイヒ末(乾燥減量8.51%)を用いて、60℃保存時におけるケイヒ末中のケイアルデヒドの残存率を検討した。その結果、ケイヒ末に比べて、水を意図的に添加したケイヒ末では、ケイヒ末中に含有されたケイアルデヒドの含有量の保持が著しく悪くなることから、ケイアルデヒドの減少には水分が影響していることを確認した。
【0021】
そこで本発明者らは、ケイヒ末に対して乾燥操作を加えて水分を除くことによる、ケイヒ末中に含有されるケイアルデヒド含有量の減少状況について検討を行った。その結果、乾燥操作により水分を除いた乾燥ケイヒ末は、乾燥前のケイヒ末に比べ、ケイヒ末中に含有されるケイアルデヒドの含有量の保持が著しく改善されていることを見出した。
これらの結果を、下記の表1にまとめて示す。
【0022】
【表1】

【0023】
表中の結果からも明らかなように、ケイヒ末中の水分を除くことによって、容易にケイアルデヒドの含有量を良好に保持できるケイヒ末を得ることが可能となった。特に、ケイヒ末の乾燥減量を、乾燥前のケイヒ末の乾燥減量より1%以上となるよう減少させた場合には、ケイヒ末中のケイアルデヒドの含有量が良好に保持されていることが判明した。
【0024】
すなわち本発明は、ケイヒ末単独もしくは、ケイヒ末を含有する顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の製剤を、さらに乾燥させることにより、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることにより、ケイアルデヒドの含有量について、安定な保持を図ることを特徴とするものである。
【0025】
本発明は、ケイヒ末それ自体、あるいはケイヒ末を含む混合物、それを用いて乾式造粒法で作製した造粒物、さらには該造粒物を用いて成形した顆粒剤、細粒剤、散剤、錠剤、カプセル剤等において、全体の水分を意図的に減少させることでケイアルデヒドの含量を保持しようとする点に特徴がある。したがって、前述した水分を除いた蜂蜜を賦形剤として用いてケイアルデヒドの安定化を図る方法とは、その性質を全く異にする。さらにまた、傷寒論、金匱要略等の古典には、生薬もしくは製剤全体の水分を意図的に除いて漢方製剤を製造する記述はなく、本発明の特徴を、何ら開示しているものではない。
【0026】
上述のごとく本発明は、ケイヒ末単独、もしくはケイヒ末を含有する製剤である顆粒剤、細粒剤、散剤、錠剤、カプセル剤等を、乾燥させることにより、ケイヒ末、あるいは製剤のケイヒ末に含有されているケイアルデヒドの含有量を、良好に保持するものである。
【0027】
この場合の本発明に用いられるケイヒ末としての生薬は、ケイヒに属するものであれば特に限定されるものではなく、ベトナムケイヒ、サイゴンケイヒ、ジャワケイヒ、セイロンケイヒ、ニッケイヒ等が例示でき、また、類似生薬としてケイヨウヘイ、ケイヨウ、ケイシ等が例示できる。
【0028】
本発明の具体的な方法としては、ケイヒ末単独の水分を、例えば、加熱乾燥、凍結乾燥、減圧乾燥等の方法で除くことにより、ケイアルデヒドの保持効果を得ることができる。さらにケイヒ末と他の生薬とを混合したもの、もしくはそれに賦形剤を加えたもの、さらには、顆粒、散剤、錠剤等に造粒・成形したものを乾燥して水分を除くことによっても、混合されたケイヒ末について、ケイアルデヒドの含有量の保持効果を得ることができる。
【0029】
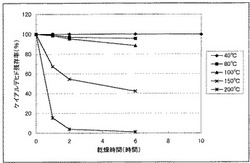
乾燥方法としては、乾燥する手段、温度等を適宜選択して行うことができる。その具体例として、ケイヒ末における乾燥条件によるケイアルデヒドの残存率の関係を図1に、また、桂枝茯苓丸錠剤における乾燥条件によるケイアルデヒドの残存率の関係を図2に示した。
【0030】
ケイヒ末にあっては、乾燥温度は30℃〜200℃、好ましくは40℃〜100℃であり、また、桂枝茯苓丸錠剤にあっては、乾燥温度は30℃〜200℃、好ましくは40℃〜100℃である。なお、ケイヒ末、桂枝茯苓丸錠剤のどちらの場合も、200℃においては完全に焦げた状態となるため、200℃以上での加熱乾燥は好ましくない。また、図1および2に示すように、高い温度での長時間の乾燥は、ケイアルデヒドの含有量を減少させるため、乾燥時間はケイアルデヒドの初期含量およびその後の保持効果から必要に応じて任意に設定することができる。
【0031】
本発明は、具体例として示した加熱乾燥方法に限定されるものではないが、乾燥による乾燥減量を、乾燥前の乾燥減量より1%以上減少させることで、乾燥前の保持状態と比べ良好に改善される効果を得るものであり、より好ましくは、乾燥により乾燥減量を、乾燥前の乾燥減量より2%以上減少させるものである。
【0032】
ここで、本明細書における「乾燥減量」とは、乾燥減量、生薬試験法、第十三改正日本薬局方解説書(東京廣川書店、1996)に準じた方法で行ったものである。
【0033】
具体的には、粉砕機もしくは乳鉢で300μm以下になるまで粉砕した生薬末、顆粒および錠剤4gをあらかじめ重量をはかったシャーレに入れ、その重量を精密に量り、105℃で5時間乾燥し、デシケーター(シリカゲル)で放冷し、その重量を精密に量る。再びこれを105℃で乾燥し、1時間ごとに重量を精密に量り、恒量(前後の秤量差が前回に量った乾燥物の質量の0.25%以下とする)になったときの減量を乾燥減量(%)とした。
【0034】
本発明の製剤に用いる賦形剤は、医薬品添加物として通常用いるものでよい。例えば、デンプン、軽質無水ケイ酸、乳糖、白糖、マンニット、カルボキシメチルセルロース、トウモロコシデンプン、低置換ヒドロキシプロピルセルロース、無機塩類等が挙げられ、これらの1種または2種以上を用いることができる。
適宜、前記賦形剤の他に、例えばステアリン酸マグネシウム、ラウリル硫酸ナトリウム、タルク等の滑沢剤、デキストリン、結晶セルロース、ポリビニルピロリドン、アラビアゴム、ゼラチン等の結合剤、バレイショデンプン、カルボキシメチルセルロース等の崩壊剤を使用することができる。
さらに、これらの賦形剤に加え、矯味矯臭剤、着色剤を含有してもよい。
【実施例】
【0035】
以下、本発明を、具体的実施例およびその安定性試験により更に詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0036】
[実施例1〜2、および安定性試験1]
【0037】
実施例1:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、結晶セルロース270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、乾燥減量4.40%の桂枝茯苓丸顆粒を得た。
この桂枝茯苓丸顆粒を、さらに送風乾燥機で60℃、0.5時間乾燥させて水分を除き、乾燥減量2.00%の桂枝茯苓丸顆粒を得た。
【0038】
実施例2:
実施例1で得た乾燥減量4.40%の桂枝茯苓丸顆粒を、さらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量1.36%の桂枝茯苓丸顆粒を得た。
【0039】
安定性試験1:
実施例1および2で得られた桂枝茯苓丸顆粒を、60℃の条件下に保存し、製剤中のケイアルデヒドの含有量を、経時的にHPLCで測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例1として、実施例1で得た、乾燥前の乾燥減量4.40%の桂枝茯苓丸顆粒を同様に保存し、ケイアルデヒドの含有量を同様に測定した。
その結果を図3に示す。
【0040】
図中の結果からも明らかなように、実施例1および2の桂枝茯苓丸顆粒は、乾燥前の比較例1の桂枝茯苓丸顆粒に比較して、製剤中におけるケイアルデヒドの含有量の保持が著しく改善されていることが判明する。
以上から判断すれば、製剤に配合させるケイヒ末を予め乾燥させることなく、ケイヒ末を含有する桂枝茯苓丸顆粒を乾燥させることでケイアルデヒドの保持効果が得られることが判明した。
【0041】
[実施例3〜8、および安定性試験2]
【0042】
実施例3:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、結晶セルロース470g、軽質無水ケイ酸200gを均一に混合した後、乾式造粒法で造粒し、得られた顆粒を用いて錠剤に打錠して、乾燥減量5.48%の桂枝茯苓丸錠剤を得た。
この桂枝茯苓丸錠剤をさらに送風乾燥機で40℃、2時間乾燥させて水分を除き、乾燥減量4.45%の桂枝茯苓丸錠剤を得た。
【0043】
実施例4:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて40℃、6時間乾燥させて水分を除き、乾燥減量3.98%の桂枝茯苓丸錠剤を得た。
【0044】
実施例5:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて60℃、1時間乾燥させて水分を除き、乾燥減量2.89%の桂枝茯苓丸錠剤を得た。
【0045】
実施例6:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて60℃、2時間乾燥させて水分を除き、乾燥減量2.15%の桂枝茯苓丸錠剤を得た。
【0046】
実施例7:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて80℃、1時間乾燥させて水分を除き、乾燥減量0.93%の桂枝茯苓丸錠剤を得た。
【0047】
実施例8:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて80℃、4時間乾燥させて水分を除き、乾燥減量0.30%の桂枝茯苓丸錠剤を得た。
【0048】
安定性試験2:
安定性試験例1と同様の方法により、実施例3ないし8で得た桂枝茯苓丸錠剤を、60℃の条件下に保存し、製剤中のケイアルデヒドの含有量を、経時的にHPLCで測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例2として、実施例3と同様の方法で得た、乾燥前の乾燥減量5.48%の桂枝茯苓丸錠剤を同様に保存し、ケイアルデヒドの含有量を同様に測定した。
その結果を図4に示した。
【0049】
図中の結果からも明らかなように、実施例3〜8の桂枝茯苓丸錠剤は、乾燥前の比較例2の桂枝茯苓丸錠剤に比較して、製剤中のケイアルデヒド含有量の保持が著しく改善されていることが判明する。
したがって、この試験結果からも、製剤に配合させるケイヒ末を予め乾燥させることなく、ケイヒ末を含有する錠剤を乾燥させることで、ケイアルデヒドの保持効果が得られることが判明した。
【0050】
[実施例9〜10、および安定性試験3]
【0051】
実施例9:
ブシ末50g、ジオウ末600g、サンシュユ末300g、サンヤク末300g、タクシャ末300g、ブクリョウ末300g、ボタンピ末300g、ケイヒ末100g、結晶セルロース270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた顆粒を打錠して、乾燥減量7.24%の八味地黄丸錠剤を得た。
この錠剤をさらに送風乾燥機で60℃、0.5時間乾燥させ、乾燥減量4.71%の八味地黄丸錠剤を得た。
【0052】
実施例10:
実施例9と同様の方法で得た乾燥減量7.24%の八味地黄丸錠剤を、さらに送風乾燥機にて60℃、6時間乾燥させて水分を除き、乾燥減量1.92%の八味地黄丸錠剤を得た。
【0053】
安定性試験3:
安定性試験例1と同様の方法により、実施例9および10で得た八味地黄丸錠剤を、60℃の条件下に保存し、製剤中のケイアルデヒドの含有量を、経時的にHPLCで測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例3として、実施例9と同様の方法で得た、乾燥前の乾燥減量7.24%の八味地黄丸錠剤を同様に保存し、ケイアルデヒド含有量を同様に測定した。
その結果を図5に示した。
【0054】
図中に示した結果からも判明するように、実施例9および10の乾燥させた八味地黄丸錠剤は、比較例3の八味地黄丸錠剤に比較して、ケイアルデヒドの保持が著しく改善されている。
【0055】
[実施例11〜12、および安定性試験4]
【0056】
実施例11:
タクシャ末500g、チョレイ末300g、ブクリョウ末300g、ジュツ末300g、ケイヒ末200g、結晶セルロース270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量7.73%の五苓散錠剤を得た。
かくして得られた錠剤を、さらに送風乾燥機で60℃、0.5時間乾燥させて水分を除き、乾燥減量4.40%の五苓散錠剤を得た。
【0057】
実施例12:
実施例11と同様の方法により、乾燥減量7.73%の五苓散錠剤を得た。こ錠剤をさらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量1.97%の五苓散錠剤を得た。
【0058】
安定性試験4:
安定性試験例1と同様の方法により、実施例11および12で得た五苓散錠剤を、60℃の条件下に保存し、製剤中のケイアルデヒド含有量を、経時的に測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例4として、実施例11と同様の方法で得た、乾燥前の乾燥減量7.73%の五苓散錠剤を同様に保存して、製剤中のケイアルデヒド含有量を同様に測定した。
その結果を図6に示した。
【0059】
図中に示した結果からも判明するように、実施例11および12で得た乾燥させた五苓散錠剤は、比較例4で得た乾燥前の五苓散錠剤に比較して、製剤中のケイアルデヒド含有量の保持が著しく改善されている。
【0060】
上記の安定性試験4、および前述の安定性試験3の事実からは、本発明の方法による製剤中に配合されるケイヒ末におけるケイアルデヒドの保持効果は、特定の処方によることなく、ケイヒ末を配合する製剤全てについて得られるものであることが理解される。
【0061】
[実施例13〜15、および安定性試験5]
【0062】
実施例13:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、デキストリン270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量7.03%の桂枝茯苓丸錠剤を得た。
この錠剤をさらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量2.08%の桂枝茯苓丸錠剤を得た。
【0063】
実施例14:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、トウモロコシデンプン270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量7.54%の桂枝茯苓丸錠剤を得た。
この錠剤をさらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量2.46%の桂枝茯苓丸錠剤を得た。
【0064】
実施例15:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、結晶セルロース190g、乳糖3000gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量5.09%の桂枝茯苓丸錠剤を得た。
この錠剤をさらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量3.99%の桂枝茯苓丸錠剤を得た。
【0065】
安定性試験5:
安定性試験例1と同様の方法により、実施例13ないし15で得た桂枝茯苓丸錠剤を、60℃の条件下に保存し、製剤中のケイアルデヒド含有量を、経時的に測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例5として、実施例13と同様の方法で得た乾燥前の乾燥減量7.03%の桂枝茯苓丸錠剤を、比較例6として、実施例14と同様の方法で得た乾燥前の乾燥減量7.54%の桂枝茯苓丸錠剤を、比較例7として、実施例15と同様の方法で得た乾燥前の乾燥減量5.09%の桂枝茯苓丸錠剤を用い、それぞれを同様に保存して、製剤中のケイアルデヒド含有量を同様に測定した。
その結果を図7に示した。
【0066】
図中に示した結果からも判明するように、実施例13ないし15で得た乾燥させた桂枝茯苓丸錠剤は、比較例5〜7として得た乾燥前の桂枝茯苓丸錠剤に比較して、ケイアルデヒドの含有量の保持が著しく改善されている。
以上の事実からは、製剤中に配合されるケイヒ末におけるケイアルデヒドの保持効果は、配合する賦形剤の種類によることなく得られるものであることが理解される。
【0067】
実施例16:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、結晶セルロース270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量4.39%の桂枝茯苓丸錠剤を得た。
かくして得られた桂枝茯苓丸錠剤を、さらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量2.12%の桂枝茯苓丸錠剤を得た。
【0068】
安定性試験6:
実施例16で得られた本発明のケイヒ末配合の製剤と、市販のケイヒ末配合製剤との間の安定性試験を行った。
すなわち、水分を除いた蜂蜜を使用して製造されている市販の桂枝茯苓丸錠剤(市販製剤)と、実施例16で得た本発明の桂枝茯苓丸錠剤の両者を用い、安定性試験1と同様にして、60℃条件下で保存し、製剤中のケイアルデヒドの含有量を経時的に測定して、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
その結果を図8に示した。
【0069】
図中の結果からも明らかなように、保存開始後10日後における市販製剤中のケイアルデヒド残存率は72.88%であったのに対し、実施例16の桂枝茯苓丸錠剤のケイアルデヒド残存率は、89.10%であり、製剤中にケイアルデヒドが良好に保存されていることが理解される。
【0070】
以上の各実施例ならびに各安定性試験の結果から判断すると、本発明によるケイヒ末、あるいはケイヒ末を配合した製剤中におけるケイアルデヒドの保持効果は、ケイヒ末を直接乾燥させること、さらにはケイヒ末を配合した製剤をさらに乾燥させることにより得られるものであり、製剤の剤形、処方あるいは使用する賦形剤の種類には関係ないものであることが理解される。
【産業上の利用可能性】
【0071】
以上説明したように、水分を除いた蜂蜜を賦形剤として使用することなく、本発明によりケイヒ末の水分を除くことにより、更には、ケイヒ末と他の賦形剤との混合物、あるいはそれら混合物を用いて乾式造粒法で作製した造粒物、もしくは顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の全体の水分を意図的に除くことで、ケイアルデヒドの保持が良好な、ケイヒ末および/またはそれを含有する混合・造粒物等を提供でき、その産業上の利用性は多大なものである。
【技術分野】
【0001】
本発明は、ケイヒ末中に含有されるケイアルデヒドの含有量を安定に保持させ得る方法に関し、さらにはケイヒ末を含有する混合物、造粒物等の製剤中に配合されたケイヒ末中に含有されるケイアルデヒドの含有量の保持方法に関する。
【0002】
詳細には、本発明は、ケイアルデヒドを含有する生薬成分配合の顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の医薬品、あるいはシナモンスティック、シナモンパウダー等の食品、化粧品等において、生薬中に含有されるケイアルデヒドの含有量を良好に保持させる方法、ならびにケイアルデヒドの含有量の減少を防止する方法に関するものである。
【背景技術】
【0003】
ケイヒ末の主成分であるケイアルデヒドには、鎮けい作用、鎮静、体温降下および解熱作用を主とする中枢抑制作用、中枢興奮作用、血圧降下、末梢血管拡張、心臓収縮力増強、軽度の消化管運動抑制、ストレス性胃びらん予防効果、胆汁分泌促進などの諸作用、中枢起源の脳波賦活作用、摘出心臓に対する陽性変力・変時作用、副腎からのカテコールアミン遊離作用、血小板凝集抑制作用等の効果があることが知られている。
【0004】
したがって、これらの効果を目的として、ケイヒ末を含有する風邪薬、鎮痛鎮けい薬、解熱鎮痛消炎薬、動悸抑制薬、保健強壮薬、婦人薬、芳香健胃薬等として、桂枝茯苓丸、八味地黄丸、安中散、茵チン五苓散、五苓散、五積散、牛膝散、女神散等の漢方製剤が広く用いられている。
【0005】
一方最近に至り、漢方薬として生薬エキス配合製剤が多く利用されているが、漢方薬としてのエキス製剤中に本来含有されているべき生薬成分である揮発性成分、水難溶性成分、あるいは水不溶性成分の含有量が、散剤や丸剤と比較して、減少している点が問題となり、薬効の相違点等が指摘されてきている。
【0006】
例えば、ケイヒ末を含有する漢方製剤の一つである桂枝茯苓丸については、傷寒論、金匱要略等の古典にそって製造された丸剤と、現在市場で多く用いられているエキス製剤との比較研究が盛んに行われている[鳥居塚和生ら:桂枝茯苓丸の製剤学的検討,日本東洋医学雑誌,35,185−189,1985(非特許文献1);舟川昌代ら:漢方製剤の品質に関する研究(第4報),家庭薬研究,9:69−75,1990(非特許文献2);成川一郎:丸剤型の検討,現代科学と漢方製剤−漢方の主張,健友館,東京,1991,210−219(非特許文献3);および成川一郎:漢方処方製剤化の問題点(下),月刊薬事,35:339−343,1993(非特許文献4)]。
【0007】
これらの報告は、傷寒論、金匱要略等の古典にそって、煉蜜[蜂蜜を重湯煎等で濃縮し、軟エキス状としたもの(日本薬剤師会編,改訂4版漢方業務指針,薬業時報社,東京,1997,310)(非特許文献5)]を用いて作製されたケイヒ末含有製剤に関するもの、あるいは水分を除いた蜂蜜(非特許文献2)を用いて作製されたケイヒ末含有製剤に関するものである。
【0008】
ケイヒ末を含有する漢方製剤の問題点の一つに、その主成分の一つである生薬成分中のケイアルデヒドが、保存時において、その含有量が減少してしまう問題点がある。すなわち、ケイヒ末の主成分の一つであるケイアルデヒドは、揮発性を有するものであり、ケイヒ末を含有する製剤にあっては、常温においても、その保存期間中に、徐々にケイヒ末中のケイアルデヒドの含有量が減少することが知られている。また常温以上の温度条件下の場合には、ケイアルデヒドの含有量の減少は、特に著しいものである。
【0009】
ケイヒ末を含有する漢方製剤について、製剤中のケイアルデヒドの含有量を安定化させる方法として、水分を除いた蜂蜜を用い、これにケイヒ末等の生薬混合末、賦形剤、滑沢剤等を加え、打錠した錠剤が提案されており、先の舟川ら、あるいは成川らの報告によれば、この錠剤は、加速条件(40℃、湿度75%)下において、6カ月間安定であったとされている。
【0010】
このように、水分を除いた蜂蜜を用いることによって、生薬成分中のケイアルデヒドの含有量を安定に保つ改善方法が提案されているが、特異的な賦形剤として製剤中に水分を除いた蜂蜜を使用しなければならない。したがって、経済的な面で好ましいものとはいえず、また、製剤の製造上ならびに実際の使用上においても、それほど好ましいものとはいえない。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】鳥居塚和生ら:桂枝茯苓丸の製剤学的検討,日本東洋医学雑誌,35,185−189,1985
【非特許文献2】舟川昌代ら:漢方製剤の品質に関する研究(第4報),家庭薬研究,9:69−75,1990
【非特許文献3】成川一郎:丸剤型の検討,現代科学と漢方製剤−漢方の主張,健友館,東京,1991,210−219
【非特許文献4】成川一郎:漢方処方製剤化の問題点(下),月刊薬事,35:339−343,1993)
【非特許文献5】日本薬剤師会編,改訂4版漢方業務指針,薬業時報社,東京,1997,310
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、賦形剤として、水分を除いた蜂蜜を用いることなく、ケイヒ末中のケイアルデヒドの含有量を、安定に保持する方法を提供することを課題とする。
かかる課題を解決するべく鋭意検討した結果、本発明者らは、ケイヒ末の水分を除くことで、ケイヒ末中に含まれるケイアルデヒドの含有量を良好に保持し得ることを見出し、本発明を完成するに至った。
【課題を解決するための手段】
【0013】
したがって本発明は、その一つの態様として、ケイヒ末を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることを特徴とする、ケイヒ末中のケイアルデヒドの含有量を保持する方法を提供する。
【0014】
また本発明は、別の形態として、ケイヒ末中のケイアルデヒド含有量の減少を防止させる得る方法をも提供するものであり、具体的には、ケイヒ末を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値との差で、1%以上となるように減少させることを特徴とする、ケイヒ末中に含有されるケイアルデヒドの含有量の減少を防止する方法を提供する。
【0015】
本発明にあっては、ケイヒ末のみならずケイヒ末を含有する製剤にあっても、その製剤中に含有されるケイヒ末中のケイアルデヒドの含有量について、その減少を防止し得るものであり、具体的には、ケイヒ末を含有する製剤を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることを特徴とする、製剤中のケイヒ末に含有されるケイアルデヒドの含有量の減少を防止する方法を提供する。
【0016】
より好ましい態様としては、本発明は、ケイヒ末に他の生薬成分、賦形剤を加えて造粒・成形した顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の製剤中のケイヒ末に含有されるケイアルデヒドの含有量を保持する方法、さらには、上記した製剤中のケイヒ末に含有されるケイアルデヒドの含有量の減少を防止する方法を提供するものである。
なお、本発明にいう製剤とは、上記した顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の医薬品製剤のみならず、シナモンスティック、シナモンパウダー等の食品、化粧品等におけるケイアルデヒドを含有する製品をも包含する。
【発明の効果】
【0017】
本発明は、水分を除いた蜂蜜を賦形剤として使用することなく、ケイヒ末の水分を除くこと、あるいはケイヒ末と他の賦形剤との混合物、あるいはそれら混合物を用いて乾式造粒法で作製した造粒物、もしくは顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の全体の水分をさらに意図的に除くことで、ケイアルデヒドの保持が良好な、ケイヒ末および/またはそれを含有する混合・造粒物等を提供できる有用で広範囲に応用可能な新しい製法である。
【図面の簡単な説明】
【0018】
【図1】ケイヒ末における加熱乾燥条件と、ケイヒ末中のケイアルデヒドの残存率との関係を示す図である。
【図2】桂枝茯苓丸における加熱乾燥条件と、桂枝茯苓丸に配合したケイヒ末中のケイアルデヒド残存率との関係を示す図である。
【図3】安定性試験1における、桂枝茯苓丸顆粒中のケイアルデヒド残存率の変化を示す図である。
【図4】安定性試験2における、桂枝茯苓丸錠剤中のケイアルデヒド残存率の変化を示す図である。
【図5】安定性試験3における、八味地黄丸錠剤中のケイアルデヒド残存率の変化を示す図である。
【図6】安定性試験4における、五苓散錠剤中のケイアルデヒド残存率の変化を示す図である。
【図7】安定性試験5における、桂枝茯苓丸錠剤に用いた賦形剤の種類によるケイアルデヒド残存率の変化を示す図である。
【図8】安定性試験6における、本発明の実施例と市販製剤におけるケイアルデヒド残存率の比較を示す図である。
【発明を実施するための形態】
【0019】
以下に、本発明のケイヒ末、あるいはケイヒ末を含有する製剤、特に顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の製剤中に配合されたケイヒ末に含有されるケイアルデヒドの含有量を保持する方法について、詳細に説明する。
【0020】
第一に本発明者らは、日本薬局方適合のケイヒ末(乾燥減量8.51%)を用いて、60℃保存時におけるケイヒ末中のケイアルデヒドの残存率を検討した。その結果、ケイヒ末に比べて、水を意図的に添加したケイヒ末では、ケイヒ末中に含有されたケイアルデヒドの含有量の保持が著しく悪くなることから、ケイアルデヒドの減少には水分が影響していることを確認した。
【0021】
そこで本発明者らは、ケイヒ末に対して乾燥操作を加えて水分を除くことによる、ケイヒ末中に含有されるケイアルデヒド含有量の減少状況について検討を行った。その結果、乾燥操作により水分を除いた乾燥ケイヒ末は、乾燥前のケイヒ末に比べ、ケイヒ末中に含有されるケイアルデヒドの含有量の保持が著しく改善されていることを見出した。
これらの結果を、下記の表1にまとめて示す。
【0022】
【表1】

【0023】
表中の結果からも明らかなように、ケイヒ末中の水分を除くことによって、容易にケイアルデヒドの含有量を良好に保持できるケイヒ末を得ることが可能となった。特に、ケイヒ末の乾燥減量を、乾燥前のケイヒ末の乾燥減量より1%以上となるよう減少させた場合には、ケイヒ末中のケイアルデヒドの含有量が良好に保持されていることが判明した。
【0024】
すなわち本発明は、ケイヒ末単独もしくは、ケイヒ末を含有する顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の製剤を、さらに乾燥させることにより、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることにより、ケイアルデヒドの含有量について、安定な保持を図ることを特徴とするものである。
【0025】
本発明は、ケイヒ末それ自体、あるいはケイヒ末を含む混合物、それを用いて乾式造粒法で作製した造粒物、さらには該造粒物を用いて成形した顆粒剤、細粒剤、散剤、錠剤、カプセル剤等において、全体の水分を意図的に減少させることでケイアルデヒドの含量を保持しようとする点に特徴がある。したがって、前述した水分を除いた蜂蜜を賦形剤として用いてケイアルデヒドの安定化を図る方法とは、その性質を全く異にする。さらにまた、傷寒論、金匱要略等の古典には、生薬もしくは製剤全体の水分を意図的に除いて漢方製剤を製造する記述はなく、本発明の特徴を、何ら開示しているものではない。
【0026】
上述のごとく本発明は、ケイヒ末単独、もしくはケイヒ末を含有する製剤である顆粒剤、細粒剤、散剤、錠剤、カプセル剤等を、乾燥させることにより、ケイヒ末、あるいは製剤のケイヒ末に含有されているケイアルデヒドの含有量を、良好に保持するものである。
【0027】
この場合の本発明に用いられるケイヒ末としての生薬は、ケイヒに属するものであれば特に限定されるものではなく、ベトナムケイヒ、サイゴンケイヒ、ジャワケイヒ、セイロンケイヒ、ニッケイヒ等が例示でき、また、類似生薬としてケイヨウヘイ、ケイヨウ、ケイシ等が例示できる。
【0028】
本発明の具体的な方法としては、ケイヒ末単独の水分を、例えば、加熱乾燥、凍結乾燥、減圧乾燥等の方法で除くことにより、ケイアルデヒドの保持効果を得ることができる。さらにケイヒ末と他の生薬とを混合したもの、もしくはそれに賦形剤を加えたもの、さらには、顆粒、散剤、錠剤等に造粒・成形したものを乾燥して水分を除くことによっても、混合されたケイヒ末について、ケイアルデヒドの含有量の保持効果を得ることができる。
【0029】
乾燥方法としては、乾燥する手段、温度等を適宜選択して行うことができる。その具体例として、ケイヒ末における乾燥条件によるケイアルデヒドの残存率の関係を図1に、また、桂枝茯苓丸錠剤における乾燥条件によるケイアルデヒドの残存率の関係を図2に示した。
【0030】
ケイヒ末にあっては、乾燥温度は30℃〜200℃、好ましくは40℃〜100℃であり、また、桂枝茯苓丸錠剤にあっては、乾燥温度は30℃〜200℃、好ましくは40℃〜100℃である。なお、ケイヒ末、桂枝茯苓丸錠剤のどちらの場合も、200℃においては完全に焦げた状態となるため、200℃以上での加熱乾燥は好ましくない。また、図1および2に示すように、高い温度での長時間の乾燥は、ケイアルデヒドの含有量を減少させるため、乾燥時間はケイアルデヒドの初期含量およびその後の保持効果から必要に応じて任意に設定することができる。
【0031】
本発明は、具体例として示した加熱乾燥方法に限定されるものではないが、乾燥による乾燥減量を、乾燥前の乾燥減量より1%以上減少させることで、乾燥前の保持状態と比べ良好に改善される効果を得るものであり、より好ましくは、乾燥により乾燥減量を、乾燥前の乾燥減量より2%以上減少させるものである。
【0032】
ここで、本明細書における「乾燥減量」とは、乾燥減量、生薬試験法、第十三改正日本薬局方解説書(東京廣川書店、1996)に準じた方法で行ったものである。
【0033】
具体的には、粉砕機もしくは乳鉢で300μm以下になるまで粉砕した生薬末、顆粒および錠剤4gをあらかじめ重量をはかったシャーレに入れ、その重量を精密に量り、105℃で5時間乾燥し、デシケーター(シリカゲル)で放冷し、その重量を精密に量る。再びこれを105℃で乾燥し、1時間ごとに重量を精密に量り、恒量(前後の秤量差が前回に量った乾燥物の質量の0.25%以下とする)になったときの減量を乾燥減量(%)とした。
【0034】
本発明の製剤に用いる賦形剤は、医薬品添加物として通常用いるものでよい。例えば、デンプン、軽質無水ケイ酸、乳糖、白糖、マンニット、カルボキシメチルセルロース、トウモロコシデンプン、低置換ヒドロキシプロピルセルロース、無機塩類等が挙げられ、これらの1種または2種以上を用いることができる。
適宜、前記賦形剤の他に、例えばステアリン酸マグネシウム、ラウリル硫酸ナトリウム、タルク等の滑沢剤、デキストリン、結晶セルロース、ポリビニルピロリドン、アラビアゴム、ゼラチン等の結合剤、バレイショデンプン、カルボキシメチルセルロース等の崩壊剤を使用することができる。
さらに、これらの賦形剤に加え、矯味矯臭剤、着色剤を含有してもよい。
【実施例】
【0035】
以下、本発明を、具体的実施例およびその安定性試験により更に詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0036】
[実施例1〜2、および安定性試験1]
【0037】
実施例1:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、結晶セルロース270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、乾燥減量4.40%の桂枝茯苓丸顆粒を得た。
この桂枝茯苓丸顆粒を、さらに送風乾燥機で60℃、0.5時間乾燥させて水分を除き、乾燥減量2.00%の桂枝茯苓丸顆粒を得た。
【0038】
実施例2:
実施例1で得た乾燥減量4.40%の桂枝茯苓丸顆粒を、さらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量1.36%の桂枝茯苓丸顆粒を得た。
【0039】
安定性試験1:
実施例1および2で得られた桂枝茯苓丸顆粒を、60℃の条件下に保存し、製剤中のケイアルデヒドの含有量を、経時的にHPLCで測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例1として、実施例1で得た、乾燥前の乾燥減量4.40%の桂枝茯苓丸顆粒を同様に保存し、ケイアルデヒドの含有量を同様に測定した。
その結果を図3に示す。
【0040】
図中の結果からも明らかなように、実施例1および2の桂枝茯苓丸顆粒は、乾燥前の比較例1の桂枝茯苓丸顆粒に比較して、製剤中におけるケイアルデヒドの含有量の保持が著しく改善されていることが判明する。
以上から判断すれば、製剤に配合させるケイヒ末を予め乾燥させることなく、ケイヒ末を含有する桂枝茯苓丸顆粒を乾燥させることでケイアルデヒドの保持効果が得られることが判明した。
【0041】
[実施例3〜8、および安定性試験2]
【0042】
実施例3:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、結晶セルロース470g、軽質無水ケイ酸200gを均一に混合した後、乾式造粒法で造粒し、得られた顆粒を用いて錠剤に打錠して、乾燥減量5.48%の桂枝茯苓丸錠剤を得た。
この桂枝茯苓丸錠剤をさらに送風乾燥機で40℃、2時間乾燥させて水分を除き、乾燥減量4.45%の桂枝茯苓丸錠剤を得た。
【0043】
実施例4:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて40℃、6時間乾燥させて水分を除き、乾燥減量3.98%の桂枝茯苓丸錠剤を得た。
【0044】
実施例5:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて60℃、1時間乾燥させて水分を除き、乾燥減量2.89%の桂枝茯苓丸錠剤を得た。
【0045】
実施例6:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて60℃、2時間乾燥させて水分を除き、乾燥減量2.15%の桂枝茯苓丸錠剤を得た。
【0046】
実施例7:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて80℃、1時間乾燥させて水分を除き、乾燥減量0.93%の桂枝茯苓丸錠剤を得た。
【0047】
実施例8:
実施例3と同様の方法で得た乾燥減量5.48%の桂枝茯苓丸錠剤を、さらに送風乾燥機にて80℃、4時間乾燥させて水分を除き、乾燥減量0.30%の桂枝茯苓丸錠剤を得た。
【0048】
安定性試験2:
安定性試験例1と同様の方法により、実施例3ないし8で得た桂枝茯苓丸錠剤を、60℃の条件下に保存し、製剤中のケイアルデヒドの含有量を、経時的にHPLCで測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例2として、実施例3と同様の方法で得た、乾燥前の乾燥減量5.48%の桂枝茯苓丸錠剤を同様に保存し、ケイアルデヒドの含有量を同様に測定した。
その結果を図4に示した。
【0049】
図中の結果からも明らかなように、実施例3〜8の桂枝茯苓丸錠剤は、乾燥前の比較例2の桂枝茯苓丸錠剤に比較して、製剤中のケイアルデヒド含有量の保持が著しく改善されていることが判明する。
したがって、この試験結果からも、製剤に配合させるケイヒ末を予め乾燥させることなく、ケイヒ末を含有する錠剤を乾燥させることで、ケイアルデヒドの保持効果が得られることが判明した。
【0050】
[実施例9〜10、および安定性試験3]
【0051】
実施例9:
ブシ末50g、ジオウ末600g、サンシュユ末300g、サンヤク末300g、タクシャ末300g、ブクリョウ末300g、ボタンピ末300g、ケイヒ末100g、結晶セルロース270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた顆粒を打錠して、乾燥減量7.24%の八味地黄丸錠剤を得た。
この錠剤をさらに送風乾燥機で60℃、0.5時間乾燥させ、乾燥減量4.71%の八味地黄丸錠剤を得た。
【0052】
実施例10:
実施例9と同様の方法で得た乾燥減量7.24%の八味地黄丸錠剤を、さらに送風乾燥機にて60℃、6時間乾燥させて水分を除き、乾燥減量1.92%の八味地黄丸錠剤を得た。
【0053】
安定性試験3:
安定性試験例1と同様の方法により、実施例9および10で得た八味地黄丸錠剤を、60℃の条件下に保存し、製剤中のケイアルデヒドの含有量を、経時的にHPLCで測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例3として、実施例9と同様の方法で得た、乾燥前の乾燥減量7.24%の八味地黄丸錠剤を同様に保存し、ケイアルデヒド含有量を同様に測定した。
その結果を図5に示した。
【0054】
図中に示した結果からも判明するように、実施例9および10の乾燥させた八味地黄丸錠剤は、比較例3の八味地黄丸錠剤に比較して、ケイアルデヒドの保持が著しく改善されている。
【0055】
[実施例11〜12、および安定性試験4]
【0056】
実施例11:
タクシャ末500g、チョレイ末300g、ブクリョウ末300g、ジュツ末300g、ケイヒ末200g、結晶セルロース270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量7.73%の五苓散錠剤を得た。
かくして得られた錠剤を、さらに送風乾燥機で60℃、0.5時間乾燥させて水分を除き、乾燥減量4.40%の五苓散錠剤を得た。
【0057】
実施例12:
実施例11と同様の方法により、乾燥減量7.73%の五苓散錠剤を得た。こ錠剤をさらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量1.97%の五苓散錠剤を得た。
【0058】
安定性試験4:
安定性試験例1と同様の方法により、実施例11および12で得た五苓散錠剤を、60℃の条件下に保存し、製剤中のケイアルデヒド含有量を、経時的に測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例4として、実施例11と同様の方法で得た、乾燥前の乾燥減量7.73%の五苓散錠剤を同様に保存して、製剤中のケイアルデヒド含有量を同様に測定した。
その結果を図6に示した。
【0059】
図中に示した結果からも判明するように、実施例11および12で得た乾燥させた五苓散錠剤は、比較例4で得た乾燥前の五苓散錠剤に比較して、製剤中のケイアルデヒド含有量の保持が著しく改善されている。
【0060】
上記の安定性試験4、および前述の安定性試験3の事実からは、本発明の方法による製剤中に配合されるケイヒ末におけるケイアルデヒドの保持効果は、特定の処方によることなく、ケイヒ末を配合する製剤全てについて得られるものであることが理解される。
【0061】
[実施例13〜15、および安定性試験5]
【0062】
実施例13:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、デキストリン270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量7.03%の桂枝茯苓丸錠剤を得た。
この錠剤をさらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量2.08%の桂枝茯苓丸錠剤を得た。
【0063】
実施例14:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、トウモロコシデンプン270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量7.54%の桂枝茯苓丸錠剤を得た。
この錠剤をさらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量2.46%の桂枝茯苓丸錠剤を得た。
【0064】
実施例15:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、結晶セルロース190g、乳糖3000gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量5.09%の桂枝茯苓丸錠剤を得た。
この錠剤をさらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量3.99%の桂枝茯苓丸錠剤を得た。
【0065】
安定性試験5:
安定性試験例1と同様の方法により、実施例13ないし15で得た桂枝茯苓丸錠剤を、60℃の条件下に保存し、製剤中のケイアルデヒド含有量を、経時的に測定し、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
なお、比較例5として、実施例13と同様の方法で得た乾燥前の乾燥減量7.03%の桂枝茯苓丸錠剤を、比較例6として、実施例14と同様の方法で得た乾燥前の乾燥減量7.54%の桂枝茯苓丸錠剤を、比較例7として、実施例15と同様の方法で得た乾燥前の乾燥減量5.09%の桂枝茯苓丸錠剤を用い、それぞれを同様に保存して、製剤中のケイアルデヒド含有量を同様に測定した。
その結果を図7に示した。
【0066】
図中に示した結果からも判明するように、実施例13ないし15で得た乾燥させた桂枝茯苓丸錠剤は、比較例5〜7として得た乾燥前の桂枝茯苓丸錠剤に比較して、ケイアルデヒドの含有量の保持が著しく改善されている。
以上の事実からは、製剤中に配合されるケイヒ末におけるケイアルデヒドの保持効果は、配合する賦形剤の種類によることなく得られるものであることが理解される。
【0067】
実施例16:
ケイヒ末200g、ブクリョウ末200g、シャクヤク末200g、ボタンピ末200g、トウニン末200g、結晶セルロース270g、軽質無水ケイ酸400gを均一に混合した後、乾式造粒法で造粒し、得られた造粒物を打錠して、乾燥減量4.39%の桂枝茯苓丸錠剤を得た。
かくして得られた桂枝茯苓丸錠剤を、さらに送風乾燥機で60℃、6時間乾燥させて水分を除き、乾燥減量2.12%の桂枝茯苓丸錠剤を得た。
【0068】
安定性試験6:
実施例16で得られた本発明のケイヒ末配合の製剤と、市販のケイヒ末配合製剤との間の安定性試験を行った。
すなわち、水分を除いた蜂蜜を使用して製造されている市販の桂枝茯苓丸錠剤(市販製剤)と、実施例16で得た本発明の桂枝茯苓丸錠剤の両者を用い、安定性試験1と同様にして、60℃条件下で保存し、製剤中のケイアルデヒドの含有量を経時的に測定して、製剤中のケイアルデヒドの初期値に対する残存率(%)を求めた。
その結果を図8に示した。
【0069】
図中の結果からも明らかなように、保存開始後10日後における市販製剤中のケイアルデヒド残存率は72.88%であったのに対し、実施例16の桂枝茯苓丸錠剤のケイアルデヒド残存率は、89.10%であり、製剤中にケイアルデヒドが良好に保存されていることが理解される。
【0070】
以上の各実施例ならびに各安定性試験の結果から判断すると、本発明によるケイヒ末、あるいはケイヒ末を配合した製剤中におけるケイアルデヒドの保持効果は、ケイヒ末を直接乾燥させること、さらにはケイヒ末を配合した製剤をさらに乾燥させることにより得られるものであり、製剤の剤形、処方あるいは使用する賦形剤の種類には関係ないものであることが理解される。
【産業上の利用可能性】
【0071】
以上説明したように、水分を除いた蜂蜜を賦形剤として使用することなく、本発明によりケイヒ末の水分を除くことにより、更には、ケイヒ末と他の賦形剤との混合物、あるいはそれら混合物を用いて乾式造粒法で作製した造粒物、もしくは顆粒剤、細粒剤、散剤、錠剤、カプセル剤等の全体の水分を意図的に除くことで、ケイアルデヒドの保持が良好な、ケイヒ末および/またはそれを含有する混合・造粒物等を提供でき、その産業上の利用性は多大なものである。
【特許請求の範囲】
【請求項1】
ケイヒ末を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることを特徴とする、ケイヒ末中のケイアルデヒドの含有量を保持する方法。
【請求項2】
ケイヒ末を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることを特徴とする、ケイヒ末中に含有されるケイアルデヒドの含有量の減少を防止する方法。
【請求項1】
ケイヒ末を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることを特徴とする、ケイヒ末中のケイアルデヒドの含有量を保持する方法。
【請求項2】
ケイヒ末を乾燥させて、その乾燥減量値を、乾燥前の乾燥減量値より1%以上減少させることを特徴とする、ケイヒ末中に含有されるケイアルデヒドの含有量の減少を防止する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2010−95545(P2010−95545A)
【公開日】平成22年4月30日(2010.4.30)
【国際特許分類】
【出願番号】特願2010−19882(P2010−19882)
【出願日】平成22年2月1日(2010.2.1)
【分割の表示】特願平11−135805の分割
【原出願日】平成11年5月17日(1999.5.17)
【出願人】(000215958)帝國製薬株式会社 (44)
【出願人】(599066872)帝國漢方製薬株式会社 (1)
【Fターム(参考)】
【公開日】平成22年4月30日(2010.4.30)
【国際特許分類】
【出願日】平成22年2月1日(2010.2.1)
【分割の表示】特願平11−135805の分割
【原出願日】平成11年5月17日(1999.5.17)
【出願人】(000215958)帝國製薬株式会社 (44)
【出願人】(599066872)帝國漢方製薬株式会社 (1)
【Fターム(参考)】
[ Back to top ]

