ケラチン水溶液の製造方法
【課題】還元剤、タンパク質変性剤又は界面活性剤等の薬剤を含まない、各種酵素によって修飾、加水分解可能で、再重合可能な水可溶性であるケラチンを提供すること。
【解決手段】ケラチン含有物質を低温下、還元剤、タンパク質変性剤、及び/又は界面活性剤等の各種薬剤存在下で反応させ、次いで透析膜又は限外濾過等でこれら薬剤を除去することで得られる還元型水溶性ケラチンを含むケラチン水溶液の製造方法、該製造方法で得られるケラチン水溶液、該ケラチン水溶液の酵素処理物、及び、これらの重合処理から得られるケラチン加工物。
【解決手段】ケラチン含有物質を低温下、還元剤、タンパク質変性剤、及び/又は界面活性剤等の各種薬剤存在下で反応させ、次いで透析膜又は限外濾過等でこれら薬剤を除去することで得られる還元型水溶性ケラチンを含むケラチン水溶液の製造方法、該製造方法で得られるケラチン水溶液、該ケラチン水溶液の酵素処理物、及び、これらの重合処理から得られるケラチン加工物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新しいケラチン水溶液の製造方法、該製造方法で得られるケラチン水溶液、該ケラチン水溶液の酵素処理物、及び、これらの重合処理から得られるケラチン加工物等に関する。
【背景技術】
【0002】
従来より、羽毛や毛髪などの動物組織中に存在するケラチンは、産業用素材として注目されている。しかし、ケラチンは、強固に重合したタンパク質として知られており、多くの場合に、還元剤、タンパク質変性剤及び界面活性剤等の薬剤を含む水溶液で処理することによって可溶化されてきた。即ち、通常、ケラチンの可溶化には還元剤およびタンパク質変性剤等の存在下でケラチン含有物を加熱撹拌することが行われてきた。
【0003】
或いは、このような薬剤を使用しない場合には、ケラチンの抽出は、有機溶剤を使用したり、高圧・高温下という過酷な条件で行われてきた。
【0004】
例えば、特開平9−124699号公報にはタンパク質含有溶液の製造方法が開示されている。該方法においては、ケラチン等のタンパク質含有材料を炭素数3のアルコール含有溶液に浸漬して該材料に含有されるタンパク質を抽出されているが、当該アルコールは具体的にはn−プロピルアルコール(沸点:97.4℃)及びイソプロピルアルコール(沸点:82.7℃)であり、更に、タンパク質の抽出に際して、当該アルコール含有溶液の沸点〜(沸点−30℃)〜沸点、より好ましくは、(沸点−5℃)〜(沸点−25℃)の温度範囲で加熱攪拌することが記載されており、実施例においては75℃で攪拌処理されている。
【0005】
又、特開2000−234268号公報には獣毛ケラチン蛋白質の水可溶化処理方法が開示されている。該方法においては、0.35−1.4重量%濃度の過酸化水素にアンモニアを添加してpH 7−9に調整した水溶液に獣毛を常圧下、室温〜50℃で10〜30分間浸漬する前処理と、密閉状態で130〜200℃、30〜60分間の加圧熱処理工程が含まれる。
【0006】
更に、例えば、特開2005−120286号公報には羽毛ケラチン加水分解物の製造方法が開示されている。該方法においては、羽毛を浸漬した非アルカリ性水溶液を0.2−0.32MPa に加圧し、121〜136℃の高温で処理することにより、ケラチン成分が抽出された羽毛含有非アルカリ性水溶液を調製し、その後、該溶液をアルカリに調整した後にプロテアーゼを添加して加水分解が行われている。
【特許文献1】特開平9−124699号公報
【特許文献2】特開2000−234268号公報
【特許文献3】特開2005−120286号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
上記の様に、従来のケラチン含有物質から還元剤、タンパク質変性剤及び界面活性剤等の薬剤を用いて抽出したケラチンは、このような薬剤を除去すると、再び酸化、凝集等によって不溶化するため、これら薬剤を含まない高濃度のケラチン水溶液を製造するこことはできなかった。その結果、従来の方法で得られたケラチンをタンパク質分解酵素などの基質として使用する場合には、アルカリpHや特殊な界面活性剤存在下でも活性を失わない特定のタンパク質分解酵素が必要があり、通常、このようなケラチンからペプチド及びアミノ酸を製造することは非常に煩雑かつ困難であった。
【課題を解決するための手段】
【0008】
そこで、本発明者らは上記課題を解決すべく検討の結果、ケラチン可溶化の条件を検討することで、ケラチン可溶化後に還元剤、タンパク質変性剤及び界面活性剤等の薬剤の除去を行っても不溶化しない、還元型水溶性ケラチンを含む水溶液の製造が可能であることを見出し、本発明を完成した。
【0009】
すなわち本発明は、以下の各態様に係るものである。
[態様1]物理的衝撃を与えずに、ケラチン可溶化溶液の凝固点温度〜65℃の範囲の水溶液中でケラチン含有物質からケラチンを抽出する工程を含む、ケラチン水溶液の製造方法。
[態様2]ケラチン可溶化溶液の凝固点温度〜5℃の範囲の水溶液中でケラチン含有物質からケラチンを抽出する工程を含む、ケラチン水溶液の製造方法。
[態様3]抽出時間1〜12時間である、請態様1又は2記載の製造方法。
[態様4]抽出の際の水溶液が薬剤を含む、態様1〜3のいずれか一項に記載の製造方法。
[態様5]ケラチン抽出工程の後に、水溶液中に含まれる薬剤を除去する工程を含む、態様1〜4のいずれか一項に記載の製造方法。
[態様6]ケラチン含有物質が鳥類又は哺乳類に由来する、態様1〜5のいずれか一項に記載の製造方法。
[態様7]ケラチン濃度0.1 mg/ml 、25℃、光路長1 mmの条件で円偏光二色性を測定した際に200 nm におけるΔω値が-10から-40の範囲にあり、210 nmにおけるΔω値が-12から-30の範囲にある、態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液。
[態様8]態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は態様7記載のケラチン水溶液を、タンパク質、ぺプチド又はアミノ酸を基質の一部とする酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
[態様9]態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は態様7記載のケラチン水溶液を、タンパク質・ぺプチド修飾酵素及び/又はタンパク質分解酵素によって処理することによって得られる、ケラチンぺプチド水溶液である酵素処理物。
[態様10]態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は態様7記載のケラチン水溶液を、架橋酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
[態様11]態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、態様7記載のケラチン水溶液、若しくは、態様8〜10のいずれか一項に記載のケラチン水溶液の酵素処理物、又は、該ケラチン水溶液若しくは該ケラチン水溶液の酵素処理物と天然高分子との混合溶液を重合処理することにより得られる、ケラチン加工品。
【発明の効果】
【0010】
本発明の製造方法は、有機溶剤を使用せずに、又、高温・高圧処理等のための装置等も必要とせずに、穏やかな(常圧・低温)条件下で、きわめて簡便な工程によって、抽出時に水容液中に共存させた薬剤を除去しても、酸化及び凝集などによってケラチンが不溶化することがないケラチン水溶液を短時間で得ることが出来る。又、製造方法の全ての工程が水溶液で行われるために、反応後に系から有機溶剤を除去処理する必要がない。このように、本発明方法は、効率的、経済的及び環境的観点からも非常に優れた方法である。
【0011】
このように、本発明の製造方法により得られる、上記薬剤を含まない高濃度のケラチン水溶液を使用して、これまでは実現していなかった各種タンパク質・ぺプチド修飾酵素によるケラチン処理が可能となる。その結果、ケラチンに新たな特性を付与することができ、こうして得られる酵素修飾ケラチンを重合させることによって、ケラチンそのものを重合させた場合と異なる物性を持つものも作製することができる。更に、ケラチン水溶液や、酵素修飾ケラチンを特異性の異なる任意のタンパク質分解酵素で処理することが可能になり、これまで得ることのできなかったペプチドの製造が可能になる。また、重合処理にもトランスグルタミナーゼなどの酵素を用いることができ、チオール結合以外のイソペプチド結合で重合したケラチン重合物の作成が可能になる。
【発明を実施するための最良の形態】
【0012】
本発明において、原料として用いるケラチン含有物質としては、当業者に公知の任意の物質、好ましくは、羽毛等の鳥類由来、羊毛等の獣毛や人の毛髪等の哺乳類由来のものが挙げられる。
【0013】
本発明の主な特徴のひとつは、ケラチン含有物質からケラチンを抽出(可溶化)する際の温度を低温に維持することである。即ち、該抽出工程は、物理的衝撃を与えずに、ケラチン可溶化溶液の凝固点温度〜65℃の範囲、例えば、37℃の水溶液中で行われるか、又は、ケラチン可溶化溶液の凝固点温度〜5℃の範囲、例えば、4℃の水溶液中で行われる。5℃以下で抽出を行う場合には、物理的衝撃を加えても良い。
【0014】
尚、本明細書において、「物理的衝撃」とは、当業者に公知の任意の方法・手段によってケラチン含有物質又は抽出されるケラチンに対して、抽出工程中に直接又間接的に物理的応力が加えられることであり、例えば、振盪、攪拌、せん断、及び粉砕等の操作による。又、「物理的衝撃を与えない」場合の一具体例として、例えば、本明細書の実施例に示されるように、反応系を静置させることを挙げることが出来る。
【0015】
本発明方法における抽出操作の所要時間に特に制限はなく、ケラチン含有物質の種類、抽出工程における温度、効率、経済性等の各種条件に応じて当業者が適宜選択することが出来るが、通常、一晩、例えば、1〜12時間の範囲、例えば、2時間程度の比較的短い時間で行うことが可能である。
【0016】
本発明において、ケラチン含有物質からケラチンを抽出する際のその他の操作・条件等は当業者に公知の例に従うことが出来る。例えば、ケラチン含有物質を還元剤、タンパク質変性剤、界面活性剤、及び/又は金属キレート剤などの各種薬剤を含む水溶液(例えば、Tris等の緩衝液)中に浸漬して、上記の条件でケラチンを抽出することが可能である。又、抽出工程において、水溶液中に含まれる酸素を除去するために、適宜、反応系の脱気又は窒素置換を行うことが出来る。
【0017】
還元剤はケラチン含有物中に存在するケラチンのシステイン残基が形成するジスルフィド結合を還元し、チオール基として遊離するために加えるものである。還元剤の種類としては、メタ重亜硫酸ナトリウムなどの重亜硫酸塩、亜硫酸水素ナトリウムなどの亜硫酸塩、ジチオスレイトールなどのチオール化合物があげられる。還元剤の使用量は、通常、ケラチン含有物質100グラムに対して0.1から5.0モル程度であるが、還元剤の種類によってその濃度は異なるためこの範囲に限定されるものではない。
【0018】
タンパク質変性剤は、ケラチン含有物質中に存在するケラチンやその他のタンパク質の立体構造をほぐすために加えられる。タンパク質変性剤としては、尿素、チオ尿素、グアニジン塩酸などが用いられる。通常、タンパク質変性剤は、ケラチン含有物処理用水溶液に3〜12モル/リットルの濃度で用いられる。
【0019】
可界面活性剤は、可溶化したケラチンの安定化のために加えることができる。界面活性剤としては、アニオン系、カチオン系、ノニオン系のいずれの界面活性剤を用いることもできる。界面活性剤は、限界ミセル形成濃度になる様に添加することが望ましいが、この濃度に限定されるものではない。
【0020】
金属キレート剤は、可溶化したケラチンの再凝固を防ぐために加えることができる。金属キレート剤としては、エチレンジアミン四酢酸、エチレングリコール-ビス(ベータ-アミノエチルエーテル)-N, N, N’, N’-四酢酸、1, 10-フェナントロリンなどが用いられる。通常金属キレート剤は、ケラチン含有物処理水溶液に0.5〜10 ミリモル/リットルの濃度で用いられるが、この濃度に限定されるものではない。
【0021】
本発明方法においては、次に、こうして抽出して得られた可溶化ケラチンを含む水溶液中に含まれる各種の薬剤を、例えば、精製水に対する透析等の当業者に公知の任意の方法・手段によって除去する工程が含まれる。透析の手段としては、透析膜、限外濾過膜、脱塩用カラムなどを挙げることが出来るが、特にその手段は特定されるものではない。
【0022】
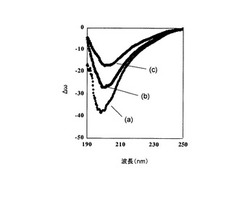
こうして、透析などによって上記の薬剤が除去された、本発明のケラチン水溶液が得られる。尚、該ケラチン水溶液の代表的な物性値として、図1に示される円偏光二色性を挙げることができる。又、該ケラチン水溶液中のケラチンの濃度は、通常、0.5〜2重量%程度である。尚、円偏光二色性は本明細書の実施例に記載した方法によって測定することが出来る。
【0023】
既に記載したように、こうして調製されたケラチン水溶液は酸化及び凝集などによってケラチンが不溶化することがない特性を有する。従って、タンパク質、ぺプチド又はアミノ酸を基質の一部とする酵素によって該ケラチン水溶液を処理することによって、ケラチン水溶液の酵素処理物を得ることが出来る。このような酵素は当業者には周知であり、例えば、各種のタンパク質・ぺプチド修飾酵素、タンパク質分解酵素、及び、架橋酵素等を挙げることが出来る。これらの中から複数の同種又は異種の酵素を適当に組み合わせ、それらを順次作用させて酵素処理物を調製することもできる。尚、各種の酵素反応条件は、各酵素の種類、特性等の酵素の使用条件に応じて、当業者が適宜選択することができ、特に限定されるものではない。
【0024】
タンパク質・ぺプチド修飾酵素は、ケラチン水溶液に新たな性質を付加させるのに用いる。修飾酵素の具体例としては、リン酸化酵素、硫酸化酵素、糖鎖付加酵素等を挙げることが出来る。
【0025】
タンパク質分解酵素は、ケラチン水溶液や酵素修飾ケラチンからケラチンぺプチドやアミノ酸またこれらの混合物を作製するのに用いる。
【0026】
架橋酵素としては、トランスグルタミナーゼ、プロテインジスルフィドイソメラーゼなどを用いることができる。
【0027】
更に、本発明方法で製造されたケラチン水溶液、又は、このように調製された酵素処理物を重合処理することによって、ケラチン加工品を製造することが出来る。尚、このような重合処理には、当業者に公知の化学的方法による架橋処理等も含まれる。
【0028】
重合処理は、当業者に公知の方法・条件に準じて、金属塩、有機溶媒、酸化剤、架橋酵素等の任意の物質を用いて行うことができる。金属塩としては、塩化カルシウム、酢酸カルシウム、塩化マグネシウ行うム、酢酸マグネシウム、塩化亜鉛、酢酸亜鉛などを用いることができる。有機溶媒としては、エタノール、メタノール、プロパノール、アセトンなどを用いることができる。酸化剤としては、過酸化水素、次亜塩素酸などをもちいることができる。
【0029】
又、当業者に公知の様々な天然の高分子は、上記の重合処理の際にケラチン水溶液、又は酵素処理物に添加・混合し、重合物の物性を変化させるために用いることができる。天然の高分子として、例えば、でんぷん、キチン、キトサン、セルロース、デキストラン、グルカンなどの糖類、コラーゲン、ゼラチンなどのタンパク質、DNA、RNA などの核酸を挙げることができる。こうしてケラチン含有複合体を作製することができる。
【0030】
更に、こうして得られるケラチン重合体及びケラチン含有複合体は、押し出し、射出、遠心などの当業者に公知の方法で、固形物、発泡体(スポンジ)、薄膜(フィルム)、繊維、接着剤等の各種のケラチン加工品に成形・加工することができる。
【0031】
以下、実施例に則して本発明を詳しく説明するが、本発明の技術的範囲はこれらの記載に限定されるものではなく、本明細書の記載に基づき当業者が容易に想到し得る様々な変型又は修飾された態様も本発明に含まれるものである。
【実施例】
【0032】
(ケラチン水溶液の製造方法1)
1グラムの羽毛に対して、3M尿素、250 mM 2-メルカプトエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、37℃、一晩静置し羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0033】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。6時間ごとに外液を2度以上交換した後、内液を回収した。得られた内液をケラチン水溶液とした。
【0034】
得られたケラチン水溶液(約17ml)のタンパク質濃度をBradford法にて測定したところ、10mg/mlであった。次に、これを100マイクログラム/ml になる様に精製水で希釈し、日本分光社製J-725circular dichroism spectrometer にて25℃、光路長 1 mm、解像度 0.2 nm、バンド幅 1 nm、検出感度 50 mdeg、レスポンス 1 sec、スキャンスピード200 nm/min で円偏光二色性を測定した。その結果、図1(a)に示される様な、円偏光二色性のグラフを得た。
【0035】
(ケラチン水溶液の製造方法2)
1グラムの羽毛に対して、3 M尿素、250 mM 2-メルカプトエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、4℃、一晩静置し羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0036】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。6時間ごとに外液を2度以上交換した後、内液を回収した。得られた内液をケラチン水溶液とした。
【0037】
得られたケラチン水溶液(約17ml)のタンパク質濃度をBradford法にて測定したところ、10mg/mlであった。次に、これを100マイクログラム/ml になる様に精製水で希釈し、日本分光社製J-725circular dichroism spectrometer にて25℃、光路長 1 mm、解像度 0.2 nm、バンド幅 1 nm、検出感度 50 mdeg、レスポンス 1 sec、スキャンスピード200 nm/min で円偏光二色性を測定した。その結果、図1(b)に示される様な、円偏光二色性のグラフを得た。
【0038】
(ケラチン水溶液の製造方法3)
1グラムの羽毛に対して、3 M尿素、250 mM 2-メルカプトエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、4℃、一晩120 rpmで振盪し、羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0039】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。6時間ごとに外液を2度以上交換した後、内液を回収した。得られた内液をケラチン水溶液とした。
【0040】
得られたケラチン水溶液(約17ml)のタンパク質濃度をBradford法にて測定したところ、10mg/mlであった。次に、これを、100マイクログラム/ml になる様に精製水で希釈し、日本分光社製J-725circular dichroism spectrometer にて25℃、光路長 1 mm、解像度 0.2 nm、バンド幅 1 nm、検出感度 50 mdeg、レスポンス 1 sec、スキャンスピード200 nm/min で円偏光二色性を測定した。その結果、図1(c)に示される様な、円偏光二色性のグラフを得た。
【0041】
(ケラチン水溶液の製造方法4)
1グラムの羽毛に対して、3 M尿素、250 mM 2-メルカプトエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、60℃、一晩静置し、羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0042】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。6時間ごとに外液を2度以上交換した後、内液を回収した。得られた内液をケラチン水溶液とした。
【0043】
得られたケラチン水溶液(約17ml)のタンパク質濃度をBradford法にて測定したところ、10mg/mlであった。
【0044】
(比較例1)
1グラムの羽毛に対して、3 M尿素、250 mM 2-メルカプとエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、37℃、一晩120 rpmで振盪し、羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0045】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。透析開始後6時間で透析チューブ内に存在していたケラチンは、不溶化した。
【0046】
(ケラチン水溶液からのペプチドの製造)
市販酵素剤 プロテアーゼ M 「アマノG」(天野エンザイム)、プロチンNY (大和化成工業)を用いた。各酵素剤 1 グラムを10 ml の精製水に溶解し、よく撹拌し溶解した。溶解後、蒸留水に対して4℃で透析し、その後、4℃、12,000 gで10分間遠心し、その上清を回収し、酵素液とした。さらに、この酵素液を10倍に希釈した。1%ケラチン水溶液溶液(製造方法2で作製)0.5ml に上記酵素液0.5ml を加え50℃で9時間反応させた。反応後、4℃、1,000 gで15分間遠心し、上清を回収した。回収した上清を分画分子量10000用のセントリカットに供し、分解されずに残った基質や酵素等を除去した。得られた濾液の220 nm における吸光度を測定し、低分子化した分解物量の変化を確認した。コントロールとして氷上で上記1%ケラチン水溶液に酵素液を加え、直ちにセントリカットによって得た濾液の220 nm における吸光度を測定した。その結果、表1に示した様に酵素処理したもので220nm の吸収が増大しており、ケラチン水溶液がタンパク質分解酵素によって分解され、低分子化したぺプチド(本発明の酵素処理物)が得られた。
【0047】
【表1】

【0048】
(ぺプチドの有用性)
上記の様にして得たケラチン水溶液酵素分解物には、生理活性が存在することが予想されたため、血圧上昇抑制効果の指針となるアンジオテンシン変換酵素阻害活性を測定した。
アンジオテンシン変換酵素阻害活性の測定は以下の様に行った。
【0049】
試験管で30マイクロリットルの試料と250マイクロリットルの7.6 mM Bz-Gly-His-Leu を混合し、37℃の高温水層中で5分間予温した。これに、100マイクロリットルのアンジオテンシン変換酵素(6 mU)を加え直ちに撹拌し、37℃で反応させた。反応開始から30分後、250マイクロリットルの1 N 塩酸を添加しアンジオテンシン変換酵素を失活させた。1.5 ml の酢酸エチルを添加し、良く撹拌した後、遊離したBz-Gly(馬尿酸)を抽出した。3000 rpm、10分間遠心した後、上層の酢酸エチルから0.5 ml を別の試験管に回収した。試験管をデシケーターに入れ、酢酸エチルを吸引除去した。酢酸エチルを完全に除去した後、蒸留水4 ml を加え、充分に撹拌し、馬尿酸を溶解し、同溶液の228nm の吸光度を測定した。盲試験として、あらかじめ塩酸を加えて反応を行わなかったもの、試料溶液の代わりに蒸留水を加えたもの、試料溶液の代わりに蒸留水を加えさらに塩酸を加えて反応を行わなかったものについて測定を行った。また、試料は、上記の方法で加水分解したケラチン水溶液のぺプチド画分を10倍、100倍に希釈したものを用いた。コントロールは、酵素によって加水分解されていない上記の方法で作製した未反応液を用いた。その結果を表2に示した。
【0050】
【表2】

【0051】
(ケラチン水溶液の重合1)
1%ケラチン水溶液溶液(製造方法2で作製)を透析チューブに入れ、30 mM 塩化カルシウム溶液に対して透析を行った。外液を1度交換した後、外液を蒸留水としてさらに透析を行い、余分な塩を除いた。透析チューブ内で円柱状に固化したケラチンを乾燥させ、光沢を持つ透明なケラチン再重合物(ケラチン加工品)を作製した。(図2)
【0052】
(ケラチン水溶液の重合2)
1%ケラチン水溶液(製造方法2で作製)に等量のエタノールを加えケラチン水溶液を不溶化させた。得られた沈殿を12000 g で、5分間遠心し得られたゲルを再び50%エタノールを加え懸濁した。再び12000 g で5分間遠心した後、沈殿を回収した。回収した沈殿を乾燥させ、光沢を持つケラチン再重合物(ケラチン加工品)を作製した。(図3)
【産業上の利用可能性】
【0053】
本発明によって得られるケラチン水溶液に含まれる還元型水溶性ケラチンから、利用目的に応じて、種々の架橋度のケラチン加工物を製造することができる。例えば、フィルム、繊維、スポンジなどへの成形加工があげられる。また、該ケラチン水溶液は還元剤、タンパク質変性剤及び界面活性剤等の薬剤を含まないため、これまでケラチンに作用させることができなかった種々のタンパク質・ぺプチド修飾酵素による修飾やタンパク質分解酵素等で加水分解が可能になる。これにより、ケラチンを新しい生分解性素材原料やぺプチド、アミノ酸原料として利用できる。例えば、ケラチンをスポンジ、医療用材料、保湿性ぺプチド、酵素阻害ぺプチド、生理活性ぺプチドなどの原料として使用することが可能となる。
【図面の簡単な説明】
【0054】
【図1】本発明の製造方法で得られたケラチン水溶液に含まれるケラチンの円偏光二色性を示すグラフである。
【図2】ケラチン水溶液の重合により形成されたケラチン加工品の外観を示す写真である。
【図3】ケラチン水溶液の重合により形成されたケラチン加工品の外観を示す写真である。
【技術分野】
【0001】
本発明は、新しいケラチン水溶液の製造方法、該製造方法で得られるケラチン水溶液、該ケラチン水溶液の酵素処理物、及び、これらの重合処理から得られるケラチン加工物等に関する。
【背景技術】
【0002】
従来より、羽毛や毛髪などの動物組織中に存在するケラチンは、産業用素材として注目されている。しかし、ケラチンは、強固に重合したタンパク質として知られており、多くの場合に、還元剤、タンパク質変性剤及び界面活性剤等の薬剤を含む水溶液で処理することによって可溶化されてきた。即ち、通常、ケラチンの可溶化には還元剤およびタンパク質変性剤等の存在下でケラチン含有物を加熱撹拌することが行われてきた。
【0003】
或いは、このような薬剤を使用しない場合には、ケラチンの抽出は、有機溶剤を使用したり、高圧・高温下という過酷な条件で行われてきた。
【0004】
例えば、特開平9−124699号公報にはタンパク質含有溶液の製造方法が開示されている。該方法においては、ケラチン等のタンパク質含有材料を炭素数3のアルコール含有溶液に浸漬して該材料に含有されるタンパク質を抽出されているが、当該アルコールは具体的にはn−プロピルアルコール(沸点:97.4℃)及びイソプロピルアルコール(沸点:82.7℃)であり、更に、タンパク質の抽出に際して、当該アルコール含有溶液の沸点〜(沸点−30℃)〜沸点、より好ましくは、(沸点−5℃)〜(沸点−25℃)の温度範囲で加熱攪拌することが記載されており、実施例においては75℃で攪拌処理されている。
【0005】
又、特開2000−234268号公報には獣毛ケラチン蛋白質の水可溶化処理方法が開示されている。該方法においては、0.35−1.4重量%濃度の過酸化水素にアンモニアを添加してpH 7−9に調整した水溶液に獣毛を常圧下、室温〜50℃で10〜30分間浸漬する前処理と、密閉状態で130〜200℃、30〜60分間の加圧熱処理工程が含まれる。
【0006】
更に、例えば、特開2005−120286号公報には羽毛ケラチン加水分解物の製造方法が開示されている。該方法においては、羽毛を浸漬した非アルカリ性水溶液を0.2−0.32MPa に加圧し、121〜136℃の高温で処理することにより、ケラチン成分が抽出された羽毛含有非アルカリ性水溶液を調製し、その後、該溶液をアルカリに調整した後にプロテアーゼを添加して加水分解が行われている。
【特許文献1】特開平9−124699号公報
【特許文献2】特開2000−234268号公報
【特許文献3】特開2005−120286号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
上記の様に、従来のケラチン含有物質から還元剤、タンパク質変性剤及び界面活性剤等の薬剤を用いて抽出したケラチンは、このような薬剤を除去すると、再び酸化、凝集等によって不溶化するため、これら薬剤を含まない高濃度のケラチン水溶液を製造するこことはできなかった。その結果、従来の方法で得られたケラチンをタンパク質分解酵素などの基質として使用する場合には、アルカリpHや特殊な界面活性剤存在下でも活性を失わない特定のタンパク質分解酵素が必要があり、通常、このようなケラチンからペプチド及びアミノ酸を製造することは非常に煩雑かつ困難であった。
【課題を解決するための手段】
【0008】
そこで、本発明者らは上記課題を解決すべく検討の結果、ケラチン可溶化の条件を検討することで、ケラチン可溶化後に還元剤、タンパク質変性剤及び界面活性剤等の薬剤の除去を行っても不溶化しない、還元型水溶性ケラチンを含む水溶液の製造が可能であることを見出し、本発明を完成した。
【0009】
すなわち本発明は、以下の各態様に係るものである。
[態様1]物理的衝撃を与えずに、ケラチン可溶化溶液の凝固点温度〜65℃の範囲の水溶液中でケラチン含有物質からケラチンを抽出する工程を含む、ケラチン水溶液の製造方法。
[態様2]ケラチン可溶化溶液の凝固点温度〜5℃の範囲の水溶液中でケラチン含有物質からケラチンを抽出する工程を含む、ケラチン水溶液の製造方法。
[態様3]抽出時間1〜12時間である、請態様1又は2記載の製造方法。
[態様4]抽出の際の水溶液が薬剤を含む、態様1〜3のいずれか一項に記載の製造方法。
[態様5]ケラチン抽出工程の後に、水溶液中に含まれる薬剤を除去する工程を含む、態様1〜4のいずれか一項に記載の製造方法。
[態様6]ケラチン含有物質が鳥類又は哺乳類に由来する、態様1〜5のいずれか一項に記載の製造方法。
[態様7]ケラチン濃度0.1 mg/ml 、25℃、光路長1 mmの条件で円偏光二色性を測定した際に200 nm におけるΔω値が-10から-40の範囲にあり、210 nmにおけるΔω値が-12から-30の範囲にある、態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液。
[態様8]態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は態様7記載のケラチン水溶液を、タンパク質、ぺプチド又はアミノ酸を基質の一部とする酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
[態様9]態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は態様7記載のケラチン水溶液を、タンパク質・ぺプチド修飾酵素及び/又はタンパク質分解酵素によって処理することによって得られる、ケラチンぺプチド水溶液である酵素処理物。
[態様10]態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は態様7記載のケラチン水溶液を、架橋酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
[態様11]態様1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、態様7記載のケラチン水溶液、若しくは、態様8〜10のいずれか一項に記載のケラチン水溶液の酵素処理物、又は、該ケラチン水溶液若しくは該ケラチン水溶液の酵素処理物と天然高分子との混合溶液を重合処理することにより得られる、ケラチン加工品。
【発明の効果】
【0010】
本発明の製造方法は、有機溶剤を使用せずに、又、高温・高圧処理等のための装置等も必要とせずに、穏やかな(常圧・低温)条件下で、きわめて簡便な工程によって、抽出時に水容液中に共存させた薬剤を除去しても、酸化及び凝集などによってケラチンが不溶化することがないケラチン水溶液を短時間で得ることが出来る。又、製造方法の全ての工程が水溶液で行われるために、反応後に系から有機溶剤を除去処理する必要がない。このように、本発明方法は、効率的、経済的及び環境的観点からも非常に優れた方法である。
【0011】
このように、本発明の製造方法により得られる、上記薬剤を含まない高濃度のケラチン水溶液を使用して、これまでは実現していなかった各種タンパク質・ぺプチド修飾酵素によるケラチン処理が可能となる。その結果、ケラチンに新たな特性を付与することができ、こうして得られる酵素修飾ケラチンを重合させることによって、ケラチンそのものを重合させた場合と異なる物性を持つものも作製することができる。更に、ケラチン水溶液や、酵素修飾ケラチンを特異性の異なる任意のタンパク質分解酵素で処理することが可能になり、これまで得ることのできなかったペプチドの製造が可能になる。また、重合処理にもトランスグルタミナーゼなどの酵素を用いることができ、チオール結合以外のイソペプチド結合で重合したケラチン重合物の作成が可能になる。
【発明を実施するための最良の形態】
【0012】
本発明において、原料として用いるケラチン含有物質としては、当業者に公知の任意の物質、好ましくは、羽毛等の鳥類由来、羊毛等の獣毛や人の毛髪等の哺乳類由来のものが挙げられる。
【0013】
本発明の主な特徴のひとつは、ケラチン含有物質からケラチンを抽出(可溶化)する際の温度を低温に維持することである。即ち、該抽出工程は、物理的衝撃を与えずに、ケラチン可溶化溶液の凝固点温度〜65℃の範囲、例えば、37℃の水溶液中で行われるか、又は、ケラチン可溶化溶液の凝固点温度〜5℃の範囲、例えば、4℃の水溶液中で行われる。5℃以下で抽出を行う場合には、物理的衝撃を加えても良い。
【0014】
尚、本明細書において、「物理的衝撃」とは、当業者に公知の任意の方法・手段によってケラチン含有物質又は抽出されるケラチンに対して、抽出工程中に直接又間接的に物理的応力が加えられることであり、例えば、振盪、攪拌、せん断、及び粉砕等の操作による。又、「物理的衝撃を与えない」場合の一具体例として、例えば、本明細書の実施例に示されるように、反応系を静置させることを挙げることが出来る。
【0015】
本発明方法における抽出操作の所要時間に特に制限はなく、ケラチン含有物質の種類、抽出工程における温度、効率、経済性等の各種条件に応じて当業者が適宜選択することが出来るが、通常、一晩、例えば、1〜12時間の範囲、例えば、2時間程度の比較的短い時間で行うことが可能である。
【0016】
本発明において、ケラチン含有物質からケラチンを抽出する際のその他の操作・条件等は当業者に公知の例に従うことが出来る。例えば、ケラチン含有物質を還元剤、タンパク質変性剤、界面活性剤、及び/又は金属キレート剤などの各種薬剤を含む水溶液(例えば、Tris等の緩衝液)中に浸漬して、上記の条件でケラチンを抽出することが可能である。又、抽出工程において、水溶液中に含まれる酸素を除去するために、適宜、反応系の脱気又は窒素置換を行うことが出来る。
【0017】
還元剤はケラチン含有物中に存在するケラチンのシステイン残基が形成するジスルフィド結合を還元し、チオール基として遊離するために加えるものである。還元剤の種類としては、メタ重亜硫酸ナトリウムなどの重亜硫酸塩、亜硫酸水素ナトリウムなどの亜硫酸塩、ジチオスレイトールなどのチオール化合物があげられる。還元剤の使用量は、通常、ケラチン含有物質100グラムに対して0.1から5.0モル程度であるが、還元剤の種類によってその濃度は異なるためこの範囲に限定されるものではない。
【0018】
タンパク質変性剤は、ケラチン含有物質中に存在するケラチンやその他のタンパク質の立体構造をほぐすために加えられる。タンパク質変性剤としては、尿素、チオ尿素、グアニジン塩酸などが用いられる。通常、タンパク質変性剤は、ケラチン含有物処理用水溶液に3〜12モル/リットルの濃度で用いられる。
【0019】
可界面活性剤は、可溶化したケラチンの安定化のために加えることができる。界面活性剤としては、アニオン系、カチオン系、ノニオン系のいずれの界面活性剤を用いることもできる。界面活性剤は、限界ミセル形成濃度になる様に添加することが望ましいが、この濃度に限定されるものではない。
【0020】
金属キレート剤は、可溶化したケラチンの再凝固を防ぐために加えることができる。金属キレート剤としては、エチレンジアミン四酢酸、エチレングリコール-ビス(ベータ-アミノエチルエーテル)-N, N, N’, N’-四酢酸、1, 10-フェナントロリンなどが用いられる。通常金属キレート剤は、ケラチン含有物処理水溶液に0.5〜10 ミリモル/リットルの濃度で用いられるが、この濃度に限定されるものではない。
【0021】
本発明方法においては、次に、こうして抽出して得られた可溶化ケラチンを含む水溶液中に含まれる各種の薬剤を、例えば、精製水に対する透析等の当業者に公知の任意の方法・手段によって除去する工程が含まれる。透析の手段としては、透析膜、限外濾過膜、脱塩用カラムなどを挙げることが出来るが、特にその手段は特定されるものではない。
【0022】
こうして、透析などによって上記の薬剤が除去された、本発明のケラチン水溶液が得られる。尚、該ケラチン水溶液の代表的な物性値として、図1に示される円偏光二色性を挙げることができる。又、該ケラチン水溶液中のケラチンの濃度は、通常、0.5〜2重量%程度である。尚、円偏光二色性は本明細書の実施例に記載した方法によって測定することが出来る。
【0023】
既に記載したように、こうして調製されたケラチン水溶液は酸化及び凝集などによってケラチンが不溶化することがない特性を有する。従って、タンパク質、ぺプチド又はアミノ酸を基質の一部とする酵素によって該ケラチン水溶液を処理することによって、ケラチン水溶液の酵素処理物を得ることが出来る。このような酵素は当業者には周知であり、例えば、各種のタンパク質・ぺプチド修飾酵素、タンパク質分解酵素、及び、架橋酵素等を挙げることが出来る。これらの中から複数の同種又は異種の酵素を適当に組み合わせ、それらを順次作用させて酵素処理物を調製することもできる。尚、各種の酵素反応条件は、各酵素の種類、特性等の酵素の使用条件に応じて、当業者が適宜選択することができ、特に限定されるものではない。
【0024】
タンパク質・ぺプチド修飾酵素は、ケラチン水溶液に新たな性質を付加させるのに用いる。修飾酵素の具体例としては、リン酸化酵素、硫酸化酵素、糖鎖付加酵素等を挙げることが出来る。
【0025】
タンパク質分解酵素は、ケラチン水溶液や酵素修飾ケラチンからケラチンぺプチドやアミノ酸またこれらの混合物を作製するのに用いる。
【0026】
架橋酵素としては、トランスグルタミナーゼ、プロテインジスルフィドイソメラーゼなどを用いることができる。
【0027】
更に、本発明方法で製造されたケラチン水溶液、又は、このように調製された酵素処理物を重合処理することによって、ケラチン加工品を製造することが出来る。尚、このような重合処理には、当業者に公知の化学的方法による架橋処理等も含まれる。
【0028】
重合処理は、当業者に公知の方法・条件に準じて、金属塩、有機溶媒、酸化剤、架橋酵素等の任意の物質を用いて行うことができる。金属塩としては、塩化カルシウム、酢酸カルシウム、塩化マグネシウ行うム、酢酸マグネシウム、塩化亜鉛、酢酸亜鉛などを用いることができる。有機溶媒としては、エタノール、メタノール、プロパノール、アセトンなどを用いることができる。酸化剤としては、過酸化水素、次亜塩素酸などをもちいることができる。
【0029】
又、当業者に公知の様々な天然の高分子は、上記の重合処理の際にケラチン水溶液、又は酵素処理物に添加・混合し、重合物の物性を変化させるために用いることができる。天然の高分子として、例えば、でんぷん、キチン、キトサン、セルロース、デキストラン、グルカンなどの糖類、コラーゲン、ゼラチンなどのタンパク質、DNA、RNA などの核酸を挙げることができる。こうしてケラチン含有複合体を作製することができる。
【0030】
更に、こうして得られるケラチン重合体及びケラチン含有複合体は、押し出し、射出、遠心などの当業者に公知の方法で、固形物、発泡体(スポンジ)、薄膜(フィルム)、繊維、接着剤等の各種のケラチン加工品に成形・加工することができる。
【0031】
以下、実施例に則して本発明を詳しく説明するが、本発明の技術的範囲はこれらの記載に限定されるものではなく、本明細書の記載に基づき当業者が容易に想到し得る様々な変型又は修飾された態様も本発明に含まれるものである。
【実施例】
【0032】
(ケラチン水溶液の製造方法1)
1グラムの羽毛に対して、3M尿素、250 mM 2-メルカプトエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、37℃、一晩静置し羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0033】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。6時間ごとに外液を2度以上交換した後、内液を回収した。得られた内液をケラチン水溶液とした。
【0034】
得られたケラチン水溶液(約17ml)のタンパク質濃度をBradford法にて測定したところ、10mg/mlであった。次に、これを100マイクログラム/ml になる様に精製水で希釈し、日本分光社製J-725circular dichroism spectrometer にて25℃、光路長 1 mm、解像度 0.2 nm、バンド幅 1 nm、検出感度 50 mdeg、レスポンス 1 sec、スキャンスピード200 nm/min で円偏光二色性を測定した。その結果、図1(a)に示される様な、円偏光二色性のグラフを得た。
【0035】
(ケラチン水溶液の製造方法2)
1グラムの羽毛に対して、3 M尿素、250 mM 2-メルカプトエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、4℃、一晩静置し羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0036】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。6時間ごとに外液を2度以上交換した後、内液を回収した。得られた内液をケラチン水溶液とした。
【0037】
得られたケラチン水溶液(約17ml)のタンパク質濃度をBradford法にて測定したところ、10mg/mlであった。次に、これを100マイクログラム/ml になる様に精製水で希釈し、日本分光社製J-725circular dichroism spectrometer にて25℃、光路長 1 mm、解像度 0.2 nm、バンド幅 1 nm、検出感度 50 mdeg、レスポンス 1 sec、スキャンスピード200 nm/min で円偏光二色性を測定した。その結果、図1(b)に示される様な、円偏光二色性のグラフを得た。
【0038】
(ケラチン水溶液の製造方法3)
1グラムの羽毛に対して、3 M尿素、250 mM 2-メルカプトエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、4℃、一晩120 rpmで振盪し、羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0039】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。6時間ごとに外液を2度以上交換した後、内液を回収した。得られた内液をケラチン水溶液とした。
【0040】
得られたケラチン水溶液(約17ml)のタンパク質濃度をBradford法にて測定したところ、10mg/mlであった。次に、これを、100マイクログラム/ml になる様に精製水で希釈し、日本分光社製J-725circular dichroism spectrometer にて25℃、光路長 1 mm、解像度 0.2 nm、バンド幅 1 nm、検出感度 50 mdeg、レスポンス 1 sec、スキャンスピード200 nm/min で円偏光二色性を測定した。その結果、図1(c)に示される様な、円偏光二色性のグラフを得た。
【0041】
(ケラチン水溶液の製造方法4)
1グラムの羽毛に対して、3 M尿素、250 mM 2-メルカプトエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、60℃、一晩静置し、羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0042】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。6時間ごとに外液を2度以上交換した後、内液を回収した。得られた内液をケラチン水溶液とした。
【0043】
得られたケラチン水溶液(約17ml)のタンパク質濃度をBradford法にて測定したところ、10mg/mlであった。
【0044】
(比較例1)
1グラムの羽毛に対して、3 M尿素、250 mM 2-メルカプとエタノール、3 mM EDTA、200 mM Tris 溶液(pH 10)12.5 ml を加え、脱気、窒素置換を繰り返した後、37℃、一晩120 rpmで振盪し、羽毛を溶解した。これを目開き63 マイクロメートルのナイロンメッシュで濾過し、濾液を得た。これを可溶化ケラチンとした。
【0045】
可溶化ケラチン溶液を透析チューブに入れ、精製水に対して透析を行った。透析開始後6時間で透析チューブ内に存在していたケラチンは、不溶化した。
【0046】
(ケラチン水溶液からのペプチドの製造)
市販酵素剤 プロテアーゼ M 「アマノG」(天野エンザイム)、プロチンNY (大和化成工業)を用いた。各酵素剤 1 グラムを10 ml の精製水に溶解し、よく撹拌し溶解した。溶解後、蒸留水に対して4℃で透析し、その後、4℃、12,000 gで10分間遠心し、その上清を回収し、酵素液とした。さらに、この酵素液を10倍に希釈した。1%ケラチン水溶液溶液(製造方法2で作製)0.5ml に上記酵素液0.5ml を加え50℃で9時間反応させた。反応後、4℃、1,000 gで15分間遠心し、上清を回収した。回収した上清を分画分子量10000用のセントリカットに供し、分解されずに残った基質や酵素等を除去した。得られた濾液の220 nm における吸光度を測定し、低分子化した分解物量の変化を確認した。コントロールとして氷上で上記1%ケラチン水溶液に酵素液を加え、直ちにセントリカットによって得た濾液の220 nm における吸光度を測定した。その結果、表1に示した様に酵素処理したもので220nm の吸収が増大しており、ケラチン水溶液がタンパク質分解酵素によって分解され、低分子化したぺプチド(本発明の酵素処理物)が得られた。
【0047】
【表1】

【0048】
(ぺプチドの有用性)
上記の様にして得たケラチン水溶液酵素分解物には、生理活性が存在することが予想されたため、血圧上昇抑制効果の指針となるアンジオテンシン変換酵素阻害活性を測定した。
アンジオテンシン変換酵素阻害活性の測定は以下の様に行った。
【0049】
試験管で30マイクロリットルの試料と250マイクロリットルの7.6 mM Bz-Gly-His-Leu を混合し、37℃の高温水層中で5分間予温した。これに、100マイクロリットルのアンジオテンシン変換酵素(6 mU)を加え直ちに撹拌し、37℃で反応させた。反応開始から30分後、250マイクロリットルの1 N 塩酸を添加しアンジオテンシン変換酵素を失活させた。1.5 ml の酢酸エチルを添加し、良く撹拌した後、遊離したBz-Gly(馬尿酸)を抽出した。3000 rpm、10分間遠心した後、上層の酢酸エチルから0.5 ml を別の試験管に回収した。試験管をデシケーターに入れ、酢酸エチルを吸引除去した。酢酸エチルを完全に除去した後、蒸留水4 ml を加え、充分に撹拌し、馬尿酸を溶解し、同溶液の228nm の吸光度を測定した。盲試験として、あらかじめ塩酸を加えて反応を行わなかったもの、試料溶液の代わりに蒸留水を加えたもの、試料溶液の代わりに蒸留水を加えさらに塩酸を加えて反応を行わなかったものについて測定を行った。また、試料は、上記の方法で加水分解したケラチン水溶液のぺプチド画分を10倍、100倍に希釈したものを用いた。コントロールは、酵素によって加水分解されていない上記の方法で作製した未反応液を用いた。その結果を表2に示した。
【0050】
【表2】

【0051】
(ケラチン水溶液の重合1)
1%ケラチン水溶液溶液(製造方法2で作製)を透析チューブに入れ、30 mM 塩化カルシウム溶液に対して透析を行った。外液を1度交換した後、外液を蒸留水としてさらに透析を行い、余分な塩を除いた。透析チューブ内で円柱状に固化したケラチンを乾燥させ、光沢を持つ透明なケラチン再重合物(ケラチン加工品)を作製した。(図2)
【0052】
(ケラチン水溶液の重合2)
1%ケラチン水溶液(製造方法2で作製)に等量のエタノールを加えケラチン水溶液を不溶化させた。得られた沈殿を12000 g で、5分間遠心し得られたゲルを再び50%エタノールを加え懸濁した。再び12000 g で5分間遠心した後、沈殿を回収した。回収した沈殿を乾燥させ、光沢を持つケラチン再重合物(ケラチン加工品)を作製した。(図3)
【産業上の利用可能性】
【0053】
本発明によって得られるケラチン水溶液に含まれる還元型水溶性ケラチンから、利用目的に応じて、種々の架橋度のケラチン加工物を製造することができる。例えば、フィルム、繊維、スポンジなどへの成形加工があげられる。また、該ケラチン水溶液は還元剤、タンパク質変性剤及び界面活性剤等の薬剤を含まないため、これまでケラチンに作用させることができなかった種々のタンパク質・ぺプチド修飾酵素による修飾やタンパク質分解酵素等で加水分解が可能になる。これにより、ケラチンを新しい生分解性素材原料やぺプチド、アミノ酸原料として利用できる。例えば、ケラチンをスポンジ、医療用材料、保湿性ぺプチド、酵素阻害ぺプチド、生理活性ぺプチドなどの原料として使用することが可能となる。
【図面の簡単な説明】
【0054】
【図1】本発明の製造方法で得られたケラチン水溶液に含まれるケラチンの円偏光二色性を示すグラフである。
【図2】ケラチン水溶液の重合により形成されたケラチン加工品の外観を示す写真である。
【図3】ケラチン水溶液の重合により形成されたケラチン加工品の外観を示す写真である。
【特許請求の範囲】
【請求項1】
物理的衝撃を与えずに、ケラチン可溶化溶液の凝固点温度〜65℃の範囲の水溶液中でケラチン含有物質からケラチンを抽出する工程を含む、ケラチン水溶液の製造方法。
【請求項2】
ケラチン可溶化溶液の凝固点温度〜5℃の範囲の水溶液中でケラチン含有物質からケラチンを抽出する工程を含む、ケラチン水溶液の製造方法。
【請求項3】
抽出時間が1〜12時間である、請求項1又は2記載の製造方法。
【請求項4】
抽出の際の水溶液が薬剤を含む、請求項1〜3のいずれか一項に記載の製造方法。
【請求項5】
ケラチン抽出工程の後に、水溶液中に含まれる薬剤を除去する工程を含む、請求項1〜4のいずれか一項に記載の製造方法。
【請求項6】
ケラチン含有物質が鳥類又は哺乳類に由来する、請求項1〜5のいずれか一項に記載の製造方法。
【請求項7】
ケラチン濃度0.1 mg/ml 、25℃、光路長1 mmの条件で円偏光二色性を測定した際に200 nm におけるΔω値が-10から-40の範囲にあり、210 nmにおけるΔω値が-12から-30の範囲にある、請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液。
【請求項8】
請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は請求項7記載のケラチン水溶液を、タンパク質、ぺプチド又はアミノ酸を基質の一部とする酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
【請求項9】
請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は請求項7記載のケラチン水溶液を、タンパク質・ぺプチド修飾酵素及び/又はタンパク質分解酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
【請求項10】
請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は請求項7記載のケラチン水溶液を、架橋酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
【請求項11】
請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、請求項7記載のケラチン水溶液、若しくは、請求項8〜10のいずれか一項に記載のケラチン水溶液の酵素処理物、又は、該ケラチン水溶液若しくは該ケラチン水溶液の酵素処理物と天然高分子との混合溶液を重合処理することにより得られる、ケラチン加工品。
【請求項1】
物理的衝撃を与えずに、ケラチン可溶化溶液の凝固点温度〜65℃の範囲の水溶液中でケラチン含有物質からケラチンを抽出する工程を含む、ケラチン水溶液の製造方法。
【請求項2】
ケラチン可溶化溶液の凝固点温度〜5℃の範囲の水溶液中でケラチン含有物質からケラチンを抽出する工程を含む、ケラチン水溶液の製造方法。
【請求項3】
抽出時間が1〜12時間である、請求項1又は2記載の製造方法。
【請求項4】
抽出の際の水溶液が薬剤を含む、請求項1〜3のいずれか一項に記載の製造方法。
【請求項5】
ケラチン抽出工程の後に、水溶液中に含まれる薬剤を除去する工程を含む、請求項1〜4のいずれか一項に記載の製造方法。
【請求項6】
ケラチン含有物質が鳥類又は哺乳類に由来する、請求項1〜5のいずれか一項に記載の製造方法。
【請求項7】
ケラチン濃度0.1 mg/ml 、25℃、光路長1 mmの条件で円偏光二色性を測定した際に200 nm におけるΔω値が-10から-40の範囲にあり、210 nmにおけるΔω値が-12から-30の範囲にある、請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液。
【請求項8】
請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は請求項7記載のケラチン水溶液を、タンパク質、ぺプチド又はアミノ酸を基質の一部とする酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
【請求項9】
請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は請求項7記載のケラチン水溶液を、タンパク質・ぺプチド修飾酵素及び/又はタンパク質分解酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
【請求項10】
請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、又は請求項7記載のケラチン水溶液を、架橋酵素によって処理することによって得られる、ケラチン水溶液の酵素処理物。
【請求項11】
請求項1〜6のいずれか一項に記載の製造方法で調製されたケラチン水溶液、請求項7記載のケラチン水溶液、若しくは、請求項8〜10のいずれか一項に記載のケラチン水溶液の酵素処理物、又は、該ケラチン水溶液若しくは該ケラチン水溶液の酵素処理物と天然高分子との混合溶液を重合処理することにより得られる、ケラチン加工品。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2008−50279(P2008−50279A)
【公開日】平成20年3月6日(2008.3.6)
【国際特許分類】
【出願番号】特願2006−226019(P2006−226019)
【出願日】平成18年8月23日(2006.8.23)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成20年3月6日(2008.3.6)
【国際特許分類】
【出願日】平成18年8月23日(2006.8.23)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

