コレステロール代謝および輸送の測定方法
本発明は、コレステロール逆輸送(RCT)を測定するための生化学的方法に関する。具体的には、RCTの3つの成分(流出成分、血漿成分および排出成分)を、同位体標識コレステロールまたはコレステロール関連分子もしくはコレステロール関連複合体を投与するステップ、および続いて種々のコレステロールまたはコレステロール関連分子もしくはコレステロール関連複合体での同位体の希釈または出現、ならびにステロール最終産物(RCTの一部分である)中への回収を測定するステップにより、in vivoで測定する。生体で初めて、組織から血中へのコレステロール流出速度と血液から体外へのコレステロール排出速度との組み合わせを表す、包括的RCT流(Global RCT flux)のパラメータが作成される。そのような方法は、創薬および薬物開発、アテローム硬化その他の血管疾患および症状の診断および予後診断、疾患治療のための適正な用量の選択、ならびにRCT流を標的とする治療法のための被験体の選択に用いられる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明の技術分野
本発明は、コレステロール代謝の分野に関する。具体的には、コレステロール逆輸送に重点を置いたコレステロール代謝および輸送の定量的測定方法が記載される。
【背景技術】
【0002】
動脈硬化の最も一般的な型であるアテローム硬化は、大動脈および中動脈(例えば、冠状動脈、頸動脈、および下肢動脈)、ならびに大動脈および腸骨血管などの弾性動脈の疾患である。アテローム、すなわち脂質コアおよび線維性被膜からなる血管内膜中の線維脂肪プラークが特徴的である(Robbins Pathologic Basis of Disease 557 (Cotranら編、第4版、1989))。心筋梗塞および脳梗塞の第1のリスクファクターであるだけでなく、アテローム硬化は、慢性的な下肢虚血および壊疽のような症状、ならびに腸間膜閉塞の原因となる。近年の冠状動脈性心臓病による死亡率の減少にもかかわらず、米国における総死亡者数の約50%は、今もなおアテローム硬化を原因とする(Scientific American Medicine 第1章(Rubensteinら編、1991))。
【0003】
疫学、解剖および血管造影法による研究は、血清コレステロール値の上昇とアテローム硬化の形成との間の因果関係を確証している(Levineら、Cholesterol Reduction In Cardiovascular Disease, N Eng J Med 332(8):512-521 (1995))。リスクについてそれらを特定する単独の血漿コレステロールレベルはないが、一般的にそのレベルが高いほどリスクも高くなる。リスクは、200mg/dlを超えるコレステロールレベルで有意に上昇する(Robbins Pathologic Basis of Disease、上掲、559)。総コレステロールレベルは通常、望ましい値(<200mg/dl)、高境界値(200〜239mg/dl)、または高値(>240mg/dl)に分類される。食事療法は通常、リスクの高い低密度リポタンパク質(LDL)コレステロールレベルを有する被験体、および少なくとも2つのさらなるアテローム硬化に対するリスクファクター(例えば、高血圧、糖尿病、喫煙など)を有する高境界値の者に勧められる。しかし、食事療法は、彼らの食事がコレステロールおよび飽和脂肪について平均より高い被験体においてのみ有効であることが発見されており(Adult Treatment Panel II. National Cholesterol Education Program: Second Report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adult, Circulation 89:1333-1445 (1994))、高コレステロール血症の遺伝的素因を有する被験体には無効であろう。持続性の高コレステロールレベルの場合には、薬物療法が処方されうる。
【0004】
高コレステロール血症の治療のために現在市販されている薬物は、de novoコレステロール合成の阻害および/もしくは低密度リポタンパク質(LDL)コレステロールのLDL受容体によるクリアランスの促進(例えば、ロバスタチン、その他のスタチン、図1参照)、超低密度リポタンパク質(VLDL)の産生の減少(例えば、ゲムフィブロジル)、または腸での胆汁酸再吸収の阻害(例えば、コレスチラミン)のような方法によって作用する。しかし、コレステロール代謝の試験はまた、コレステロール逆輸送(RCT)の過程がコレステロールを組織から除去し、体から排出しうる経路を可能にすることを示す。現在のところ、生体でRCT経路を介した組織から排出までのコレステロール流出速度を測定する既知の方法はない。
【0005】
RCTは、コレステロールが細胞から体外へ動員され、輸送される生物学的経路である(図1)。RCTは3つの成分:すなわち(1)組織から血液中へのコレステロールの流出(「流出成分」);(2)血漿中でのコレステロールの輸送および分布(「血漿成分」);ならびに(3)肝臓または腸を介した糞便への排出(「肝臓成分」または「排出成分」)に分割され得る。コレステロールは胆汁酸または遊離コレステロールのいずれかとして胆汁分泌に取り込まれ、その後、腸管腔に分泌され、その一部は体から糞便内に出る。ステロールはまた、腸組織によって腸管内腔に直接放出され、その後一部の排出が起こり得る。これらのRCT経路は、コレステロールが体から除去され得る唯一の有効な機序である。
【発明の開示】
【発明が解決しようとする課題】
【0006】
従って、RCTのこれらのステップの測定を可能にする方法を有することが望ましい。機能的観点から、流出成分ならびに肝臓成分または排出成分は、それぞれ細胞からおよび体からのコレステロールの出口に相当するため、重要なステップである。RCT、ならびに具体的にはこれらのステップの測定方法は、製薬会社および他の薬物開発者が、被験体の利益のために組織からのおよび体外へのコレステロールの流出を調節する薬剤または候補治療法をスクリーニングすることを可能にし;臨床医がRCTに影響を及ぼす薬剤の至適用量を選択することを可能にし;臨床医がコレステロール関連疾患の進行を診断および観察することを可能にし;臨床医がコレステロール関連疾患のリスクを評価することを可能にし;臨床医がRCTに基づく候補治療法に反応するであろう被験体を選択する、または被験体群を同定することを可能にし;コレステロール関連疾患の機序の詳細な研究を可能にするであろう。このような方法は本明細書において開示される。
【課題を解決するための手段】
【0007】
発明の概要
これらの必要性を満たすために、本発明は、コレステロール代謝および輸送速度の測定方法を提供し、ヒトおよび実験動物においてRCTの測定を可能にする。
【0008】
1つの態様では、RCTの流出成分が被験体において測定されうる。1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体が既知の速度で被験体に投与される。一定期間後、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体を含有する1つ以上の生物学的サンプルを被験体から取得する。その後、コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンが測定される。その後、投与された標識分子の、対応する内在性非標識分子による希釈が算出されることにより、被験体におけるRCTの流出成分の活性または速度(出現速度[Ra])が決定される。投与される分子は同位体標識遊離コレステロールであり、定常状態に静脈内注入され、血漿中の標識遊離コレステロールの希釈は、注入期間に渡って一定間隔を置いた多数の時点で血漿コレステロールの同位体含量または同位体パターンを測定することによって測定されうる。
【0009】
別の態様では、RCTの肝臓成分または排出成分の活性(例えば、輸送速度、輸送もしくは変換されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の質量、あるいはRCTに由来する胆汁酸または中性ステロールの割合)が測定されうる。1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体が被験体に投与される。一定期間後、胆汁酸、糞便中性ステロール、またはコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体を含有する1つ以上のサンプルを被験体から取得する。その後、コレステロール、コレステロール関連分子もしくはコレステロール関連複合体から取り込まれた胆汁酸、排出中性ステロールにおける同位体含量または同位体パターンが測定される。その後、RCTの肝臓成分または排出成分を介した同位体標識の取り込みが算出されることにより、被験体におけるRCTの肝臓成分もしくは排出成分の活性または速度が決定される。上述のようなRCTの肝臓成分または排出成分の測定は、一部には、静脈内投与された同位体標識遊離コレステロールに由来する同位体標識の胆汁酸への取り込みを測定することによって実施され、胆汁酸プールサイズの測定が同時に実施されうる。胆汁酸プールサイズは、既知量の1種以上の同位体標識胆汁酸を被験体に投与し、一定期間後に被験体から胆汁酸を含有するサンプルを取得し、サンプル中の胆汁酸の同位体含量、同位体パターン、または同位体含量もしくは同位体パターンの変化速度を測定し、投与された標識胆汁酸の内在性胆汁酸による希釈を算出し、その系における総胆汁酸プールサイズの測定を行うことによって測定されうる。本発明のこの態様に適した胆汁酸は、コール酸、ケノデオキシコール酸、デオキシコール酸およびリトコール酸を含むがそれらに限定されない。その胆汁酸はコール酸でありうる。
【0010】
本開示の別の態様では、流出/動員速度(流出成分)を糞便ステロール中への標識回収効率(肝臓成分または排出成分)と組み合わせることによって、「包括的(global)RCT」パラメータが測定され得ることが発見された。包括的RCT流は、最終的に糞便ステロールとして排出される組織からのコレステロール流出、または糞便ステロールとして回収される、1日当たりに血漿プールに入るコレステロール分子数を示す。この包括的RCT測定基準は、ヒト被験体をはじめとする生体において組織から糞便までのコレステロール流量の総合的な測定を初めて提供する。当業者は、この測定基準が組織から血流を介して体外へのコレステロール流速−包括的RCTの定義を示すことを理解し得る。この測定基準は、流出速度(Ra)に排出効率を乗じることによって算出され得る。
【0011】
本発明のさらに別の態様では、RCTの血漿成分が測定される。1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体が被験体に投与される。一定期間後、対象となるコレステロールまたはコレステロール関連分子またはコレステロール関連複合体を含有する1つ以上の血漿サンプルが被験体から取得され、その後、コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンが測定される。その後、RCTの血漿成分の異なる部分(図2参照)を介したコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の輸送または代謝は、様々なコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体中の同位体標識の消失または出現によって測定される。
【0012】
本発明の方法は、RCTに対する候補治療法の効果を評価するために適用されうる。その方法は、候補治療法を被験体に施行すること、RCTの成分のいずれかまたはすべてを候補治療法の施行前後の被験者において、または候補治療法を受けていない対応する被験者もしくは過去のデータと比較すること、および候補治療法の施行前後または候補治療法の有無でのRCTの差異を算出することを含む。候補治療法は単一の薬剤または化合物でありうる。あるいは、候補治療法は薬剤または化合物の組合せでありうる。候補治療法はまた、生活様式の変更(例えば、食餌の変更、運動の増加)などのいくつかの他の介入と合わせた、単一の薬剤もしくは化合物または薬剤もしくは化合物の組合せでもありうる。
【0013】
別の変形形態では、食餌変更の前後の被験者においてRCTの速度を比較すること、および食餌変更の前後でのRCTの速度の差異を算出することによって、アテローム硬化のリスクに対する食餌変更の効果が評価される。
【0014】
さらなる変形形態では、RCTの速度を測定するためのキットが提供される。キットは、標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体、標識胆汁酸、またはそれらの組合せ、およびキットの使用説明書を含みうる。キットはまた、任意選択で、上記の標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体、または標識胆汁酸の被験体への投与のための用具、および被験体からサンプルを採取するための器具をも含みうる。
【0015】
さらなる変形形態では、生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定する方法が記載される。その方法は、(a)同位体標識コレステロール分子または同位体標識コレステロール関連分子を生体系に投与するステップ;(b)1種以上の同位体標識コレステロール分子、胆汁酸または生体系からの排出中性ステロールを含むサンプルを生体系から取得するステップ;(c)同位体標識コレステロール分子、胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(d)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子の、コレステロール分子、胆汁酸または排出中性ステロールへの取り込み速度または移動速度を算出することにより、生体系でのRCTの肝臓成分または排出成分の分子流速を測定するステップを含みうる。
【0016】
さらなる実施形態では、サンプルは糞便、尿または血液サンプルでありうる。
【0017】
同位体標識コレステロール分子または同位体標識コレステロール関連分子の標識は、2H、3H、13C、14Cまたは18Oでありうる。
【0018】
生体系は哺乳動物でありうる。哺乳動物は、ヒト、ハムスター、ウサギ、非ヒト霊長類および齧歯類を含む。
【0019】
さらなる実施形態では、(i)既知量の同位体標識胆汁酸を生体系に投与するステップ;(ii)一定時間後に生体系での胆汁酸の同位体含量または同位体含量の変化速度を測定するステップ;および(iii)同位体標識胆汁酸の希釈量を測定することにより、生体系中の胆汁酸の総量を測定するステップによって、生体系中の胆汁酸の総量が測定されうる。
【0020】
標識胆汁酸は、コール酸、ケノデオキシコール酸、デオキシコール酸またはリトコール酸を含みうる。
【0021】
別の実施形態では、胆汁酸に対するde novoコレステロール合成の寄与を測定する方法が提供され、それは、(i)所定の標識濃度を有する同位体標識コレステロール前駆体を生体系に投与するステップ;(ii)標識胆汁酸、排出中性ステロールまたは血中コレステロールを含む生物学的サンプルを生体系から取得するステップ;(iii)標識胆汁酸、排出中性ステロールまたは血中コレステロールの同位体含量または同位体パターンを測定するステップ;および(iv)胆汁酸、中性ステロールまたはコレステロールの同位体含量を、安定同位体標識コレステロール前駆体の標識濃度と比較することにより、新規に合成されたコレステロールに由来するコレステロール、中性ステロールまたは胆汁酸の割合を測定し、それにより胆汁酸に対するde novoコレステロール合成の寄与を測定するステップを含む。さらなる実施形態では、サンプルは糞便サンプルであり、単位時間当たりに被験体によって排出される中性ステロールおよび胆汁酸の総量は、被験体に経口投与された、糞便中で検出される内部標準との比較によって測定される。内部標準はシトスタノールでありうる。
【0022】
さらなる実施形態では、生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定する方法が記載される。その方法は、(a)安定な同位体標識コレステロール分子または安定な同位体標識コレステロール関連分子を生体系に投与するステップ;(b)同位体標識コレステロール分子または同位体標識コレステロール関連分子のin vivo変換産物を含むサンプルを生体系から取得するステップ;(c)in vivo変換産物の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(d)同位体標識コレステロール分子または同位体標識コレステロール関連分子の希釈速度を算出することにより、生体系でのコレステロール逆輸送の血漿成分の分子流速を測定するステップを含みうる。
【0023】
さらなる実施形態では、生体系での血中コレステロールの出現速度を測定する方法が記載される。その方法は、(a)脂質エマルジョン中の13C2標識コレステロールを、生体系内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分な投与速度で生体系に静脈内投与するステップ;(b)標識遊離コレステロール分子を含むサンプルを生体系から取得するステップ;(c)標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(d)標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、13C2標識コレステロールの投与速度と比較することにより、生体系での血中コレステロールの出現速度を算出するステップを含みうる。
【0024】
1つの実施形態では、生体系での血中コレステロールの出現速度は、プラトーの原則により、同位体希釈により、同位体プラトーの存在の確立により、同位体プラトー値の推定により、または同位体プラトー値の外挿により算出される。
【0025】
生体系でのコレステロール流の包括的RCT速度(the global rate of RCT the flux of cholesterol)を算出する方法もまた記載される。その方法は、(a)(i)脂質エマルジョン中の13C2標識コレステロールを、生体系内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分な投与速度で生体系に静脈内投与するステップ;(ii)標識遊離コレステロール分子を含むサンプルを生体系から取得するステップ;(iii)標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(iv)標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、13C2標識コレステロールの投与速度と比較することにより、生体系での血中コレステロールの出現速度を算出するステップにより、血中コレステロールの出現速度を測定するステップ;(b)(i)同位体標識コレステロール分子または同位体標識コレステロール関連分子を生体系に投与するステップ;(ii)1種以上の生体系からの同位体標識コレステロール分子、胆汁酸または排出中性ステロールを含むサンプルを生体系から取得するステップ;(iii)同位体標識コレステロール分子、胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(iv)同位体標識コレステロール分子または同位体標識コレステロール関連分子のコレステロール分子、胆汁酸もしくは排出中性ステロールへの取り込み速度または移動速度を算出することにより、生体系でのRCTの肝臓成分または排出成分の回収割合を測定するステップにより、コレステロール逆輸送(RCT)の肝臓部分または排出部分の回収割合を測定するステップ;(c)ステップ(a)(iii)からの血中コレステロールの出現速度に、ステップ(b)(iv)からのRCTの肝臓部分または排出部分の回収割合を乗じることにより、生体系でのコレステロール流の包括的RCT速度を算出するステップを含みうる。
【0026】
さらなる実施形態では、生体系でのアテローム硬化のリスクおよび発生率に対する候補薬剤および/または食餌変更の効果を評価する方法が記載される。その方法は、(a)生体系でのコレステロール流の包括的RCT速度を算出するステップ;(b)候補薬剤を生体系に投与し、かつ/または生体系の食餌を変更するステップ;(c)生体系で2回目のコレステロール流の包括的RCTを算出するステップ;および(d)ステップ(a)とステップ(c)とのコレステロール流速の差異を比較することにより、アテローム硬化に対する候補薬剤および/または食餌変更の効果を評価するステップを含みうる。
【0027】
その方法はまた、(a)生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定するステップ;(b)候補薬剤を生体系に投与し、かつ/または生体系の食餌を変更するステップ;(c)生体系で2回目のコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定するステップ;および(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する候補薬剤および/または食餌変更の効果を評価するステップを含みうる。
【0028】
その方法はさらに、(a)生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ;(b)候補薬剤を生体系に投与し、かつ/または生体系の食餌を変更するステップ;(c)生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ;および(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する候補薬剤および/または食餌変更の効果を評価するステップを含みうる。
【発明を実施するための最良の形態】
【0029】
発明の詳細な説明
本発明は、同位体および質量分析技術を用いてin vivoでのRCTを定量的に測定する方法を提供する。
【0030】
一般的方法
本発明の実施は通常、他に指示のない限り、当技術分野の技術の範囲内である分子生物学、微生物学、細胞生物学、生化学、および免疫学の従来技術を利用する。このような技術は、例えば、Cell Biology: A Laboratory Notebook (J.E. Cellis編、1998); Current Protocols in Molecular Biology (F.M. Ausubelら編、1987); Short Protocols in Molecular Biology (WileyおよびSons, 1999); Mass Isotopomer Distribution Analysis: A Technique for Measuring Biosynthesis and Turnover of Polymers (Hellersteinら、Am J Physiol 263 (Endocrinol Metab 26):E988-1001 (1992));ならびにMass Isotopomer Distribution Analysis at Eight years: Theoretical, Analytic, and Experimental Considerations (Hellersteinら、Am J Physiol 276 (Endocrinol Metab 39):E1146-1170 (1999))などの文献において十分に説明される。さらに、市販のアッセイキットおよび試薬を用いる方法は通常、他に指定のない限り、製造業者に規定された手順に従って使用される。
【0031】
本発明の実施はさらに、他に指示のない限り、当技術分野の技術の範囲内である化学および分析化学の従来技術を利用する。このような技術は、例えば、Fundamentals of Analytical Chemistry (D. Skoog, D West, F Holler, S Crouch著、2003); Analytical Chemistry (S. Higson著、2004); Advanced Instrumental Methods of Chemical Analysis (J. Churacek編、1994);およびAdvanced mass spectrometry: Applications in organic and analytical chemistry (U. Schlunegger) などの文献において十分に説明される。
【0032】
本発明の実施はさらに、他に指示のない限り、当技術分野の技術の範囲内である前臨床研究および臨床研究の従来技術を利用する。このような技術は文献において十分に説明される。
【0033】
定義
「コレステロールまたはコレステロール関連分子またはコレステロール関連複合体」とは、コレステロールの代謝および輸送に関与する分子および複合体を意味する。これらは、コレステロールおよびコレステロール代謝産物もしくは前駆体、またはコレステロール前駆体(例えば、水、アセチルCoA)ならびにリポタンパク質(例えば、高密度リポタンパク質)のようなコレステロールおよびコレステロールの代謝産物もしくは前駆体の担体との複合体を含む。下記の非限定的なリストは、「コレステロールまたはコレステロール関連分子もしくは複合体」の例を含む。すなわち、カイロミクロン、高トリグリセリドリポタンパク質(TGRL)、高密度リポタンパク質(HDL)、中間密度リポタンパク質(IDL)、低密度リポタンパク質(LDL)、または超低密度リポタンパク質(VLDL)に由来するコレステロール;カイロミクロン、TGRL、HDL、IDL、LDL、またはVLDLに由来するコレステロールエステル;血液、糞便、胆汁、尿、または任意の他の生物学的サンプルに由来する胆汁酸;血液、糞便、胆汁、尿、または任意の他の生物学的サンプルに由来する中性ステロール;ケノデオキシコレート、コレート、デオキシコレート、リトコレート、ウルソデオキシコレート、リン脂質、またはビリルビン;消化管微生物によって生成される胆汁酸の代謝産物;消化管微生物によって生成される中性ステロールの代謝産物(例えば、コプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノール)、などである。
【0034】
「分子または複合体を含有するサンプル」とは、指示された分子または複合体を含む任意のサンプルを意味する。指示された分子または複合体の任意の濃度が考えられる。指示された分子もしくは複合体の同位体含量または同位体パターンは様々でありうる。それはゼロであってもよい。指示された分子または複合体は、サンプル中に別の複合体の一部としてしか存在しないかもしれない。
【0035】
「複合体」とは、1つ以上の分子で構成される任意の高分子集合体を意味する。分子は、脂質、小分子、タンパク質、リポタンパク質、またはその他でありうる。複合体の一例はHDLであり、より小さい分子(コレステロールおよびコレステロールエステルを含む)ならびにより大きい分子(例えば、リポタンパク質)を含む様々な分子を含有する。複合体の他の例はLDLである。
【0036】
「胆汁酸」とは、糞便、血液、または他の生物学的サンプルもしくは成分中に見られる任意の胆汁酸または胆汁酸代謝生成物(すなわち、代謝産物)を意味する。胆汁酸の例は、コール酸、デオキシコール酸、ケノデオキシコール酸、および任意の他の胆汁酸または胆汁酸代謝産物を含む。
【0037】
「胆汁」とは、胆嚢から消化管腔内への分泌物を意味する。胆汁成分の部分的なリストは、胆汁酸、中性ステロール、ケノデオキシコレート、コレート、デオキシコレート、リトコレート、コレステロール、ウルソデオキシコレート、リン脂質、またはビリルビンを含む。消化管腔において、いくらかの胆汁成分は常在微生物により胆汁成分誘導体または代謝産物に代謝される(例えば、コプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノールは胆汁コレステロールの代謝産物である)。本発明の目的では、これらの誘導体は同様に胆汁の成分と見なされる。
【0038】
「活性」とは、本発明の方法を用いて被験体で測定され得るRCTまたはRCTの成分の指標を意味する。活性は、速度(例えば、単位時間当たりの量、すなわち単位時間当たりに変換もしくは輸送されるコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の量)、質量(例えば、グラム、すなわちコレステロールまたはコレステロール関連分子またはコレステロール関連複合体のグラム)、割合またはパーセンテージ(例えば、RCTに由来する胆汁酸の割合、またはRCTに由来する中性ステロールのパーセンテージ)、あるいは本明細書において開示される方法の実施中に得られるデータの任意の他の表現によって表されうる。活性は、異なる被験体間で比較されるもの、または同一の被験体の候補治療法の施行前後で比較されるもの、または過去のデータと比較されるものでありうる。状況によって、同一のデータは多数の異なる種類の活性として表されうる。新しい種類の活性を算出するために、データは、過去のデータ、ベースラインデータ、または新しいデータと組み合わされうる(例えば、胆汁酸に対するRCTの寄与率は、胆汁酸プールサイズと組み合わせることにより、胆汁酸に変換されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の質量を決定し得る)。
【0039】
「過去のデータ」とは、実験の開始前に存在する任意のデータを意味する。
【0040】
「候補治療法」とは、本明細書において概説されるように有効性がスクリーニングされ得る、疾患を治療しうる任意の過程を意味する。候補治療法は、行動療法、運動療法、食事療法を含みうる。候補治療法はまた、医療機器による治療、または医療機器の移植をも含みうる。候補治療法はまた、任意の「候補薬剤」または「候補薬物」(下記参照)による治療をも含みうる。
【0041】
候補治療法は、候補治療法の組合せを含みうる。このような組合せは、2つの異なる候補薬剤でありうる。組合せはまた、候補薬剤および食事療法でもありうる。組合せはまた、運動療法および食事療法でもありうる。組合せはまた、運動療法および食事療法および候補薬剤でもありうる。組合せはまた、運動療法もしくは食事療法またはその両方のような別の候補治療法と併用される候補薬剤または候補薬剤の組合せとの併用でもありうる。従って組合せは、同一の被験体に施行される複数の候補治療法である。
【0042】
候補治療法は、適切な規制機関(例えば、米国食品医薬品局または他国の同等機関)によってヒトでの使用が既に認可されていてもよい。候補治療法は、アテローム生成、動脈硬化、アテローム硬化、または他のコレステロール関連疾患の治療もしくは予防のためのヒトでの使用が既に認可されていてもよい。
【0043】
「候補薬剤」または「候補薬物」とは、本明細書において概説されるように活性がスクリーニングされ得る、任意の化合物、分子、ポリマー、高分子または分子複合体(例えば、抗体および酵素などの生物製剤を含むタンパク質、既知の薬物および薬物候補を含む有機小分子、他の種類の小分子、多糖類、脂肪酸、ワクチン、核酸など)を意味する。候補薬剤は、本発明においてコレステロール代謝および輸送に影響を及ぼす潜在的な治療薬を発見するために評価される。
【0044】
候補薬剤は多数の化学的分類を包含する。1つの実施形態では、候補薬剤は、通常100〜約2,500ダルトンの分子量を有する低分子有機化合物のような有機分子である。好ましくは、100ダルトン以上約2,000ダルトン以下、より好ましくは約1500ダルトン以下、さらにより好ましくは約1000ダルトン以下、さらにより好ましくは500ダルトン以下の分子量を有する低分子有機化合物である。候補薬剤は、タンパク質または他の宿主分子との構造的相互作用、特に水素結合のために必要な官能基を含み、通常、少なくとも1つのアミン基、カルボニル基、ヒドロキシル基またはカルボキシル基、好ましくは少なくとも2つの化学官能基を含む。候補薬剤はしばしば、1つ以上の上記の官能基で置換された環状炭素もしくは複素環構造および/または芳香族もしくは多環芳香族構造を含む。候補薬剤はまた、ペプチド、糖類、脂肪酸、ステロイド、プリン、ピリミジン、誘導体、構造類似体またはそれらの組合せを含む生体分子の中からも見いだされる。
【0045】
候補薬剤は、「既知の薬物」または「既知の薬剤」または「既に認可された薬剤」を含み、このような用語は、米国もしくは他の法的権限においてヒトまたは動物での薬剤としての治療的使用が認可されている薬剤を指す。既知の薬物はまた、例えば、The Merck Indexの第13版(米国の出版物、Whitehouse Station, N.J., USA)(参照によりその全体が本明細書に組み入れられる)において開示される任意の化合物または組成物を含むが、それらに限定されない。
【0046】
候補薬剤は、合成または天然化合物のライブラリーを含む幅広い種類の起源から入手される。例えば、ランダム化オリゴヌクレオチドおよびペプチドの発現および/または合成を含む、幅広い種類の有機化合物ならびに生体分子のランダム合成ならびに指向性合成のために当技術分野においてよく知られている、多数の方法が利用可能である。あるいは、細菌、菌類、植物および動物抽出物の形での天然化合物のライブラリーが利用可能であり、容易に作製される。加えて、天然または合成によって作製されたライブラリーおよび化合物は、従来の化学的、物理的および生化学的方法によって容易に改変される。既知の薬剤は、構造的類似体を作製し、それによってそれらを異なる候補薬剤にするために、アシル化、アルキル化、エステル化、アミド化(amidification)などの、部位指定化学修飾またはランダム化学修飾を受けてもよい。
【0047】
候補薬剤はタンパク質でありうる。本明細書において「タンパク質」とは、少なくとも2つの共有結合したアミノ酸を意味し、タンパク質、ポリペプチド、オリゴペプチドおよびペプチドを含む。タンパク質は、天然のアミノ酸およびペプチド結合、または合成ペプチド模倣薬構造で構成されうる。従って、本明細書において用いられる場合、「アミノ酸」または「ペプチド残基」とは、天然のアミノ酸と合成アミノ酸の両方を意味する。例えば、ホモフェニルアラニン、シトルリン、ノルロイシンは、本発明のためにはアミノ酸と見なされる。「アミノ酸」はまた、プロリンおよびヒドロキシプロリンなどのイミノ酸残基を含む。側鎖は、(R)または(S)立体配置のいずれかでありうる。非天然の側鎖が用いられる場合、例えば、in vivoでの分解を防止または遅延させるために、非アミノ酸置換基が使用されうる。酵素のペプチド阻害剤は具体的な用途であると思われる。
【0048】
候補薬剤は、天然のタンパク質または天然のタンパク質の断片でありうる。従って、例えば、タンパク質を含有する細胞抽出物、またはタンパク質性細胞抽出物のランダム消化物もしくは部位指定消化物が使用されうる。このようにして、原核生物タンパク質および真核生物タンパク質のライブラリーは、本明細書に記載されるシステムにおけるスクリーニングのために作製されうる。この実施形態において特に好ましいのは、細菌、菌類、ウイルス、および哺乳動物のタンパク質のライブラリーであるが、後者が好ましく、ヒトタンパク質は特に好ましい。
【0049】
候補薬剤は、タンパク質の一種である抗体でありうる。「抗体」という用語は、完全長ならびに、当技術分野において知られているような、Fab、Fab2、一本鎖抗体(例えばFv)を含む抗体フラグメント、キメラ抗体、ヒト化抗体およびヒト抗体など、完全な抗体の改変によって作製されるものまたは組換えDNA技術を用いてde novo合成されるもののいずれか、およびそれらの誘導体を含む。
【0050】
候補薬剤は核酸でありうる。「核酸」または「オリゴヌクレオチド」または本明細書における文法的同等物は、ともに共有結合した少なくとも2つのヌクレオチドを意味する。本発明の核酸は通常ホスホジエステル結合を含むが、ある場合には、下記に概説されるように、代替骨格を有しうる核酸類似体が含まれ、例えば、ホスホルアミド(phosphoramide)(Beaucageら、Tetrahedron, 49(10):1925 (1993)およびその参考文献;Letsinger, J. Org. Chem., 35:3800 (1970); Sprinzlら、Eur. J. Biochem., 81:579 (1977); Letsingerら、Nucl. Acids Res., 14:3487 (1986); Sawaiら、Chem. Lett., 805 (1984), Letsingerら、J. Am. Chem. Soc., 110:4470 (1988); およびPauwelsら、Chemica Scripta, 26:141 (1986))、ホスホロチオエート(Magら、Nucleic Acids Res., 19:1437 (1991); および米国特許第5,644,048号)、ホスホロジチオエート(Briuら、J. Am. Chem. Soc., 111:2321 (1989))、O−メチルホスホロアミダイト結合(Eckstein, Oligonucleotides and Analogues: A Practical Approach, Oxford University Press参照)、ならびにペプチド核酸骨格および結合(Egholm, J. Am. Chem. Soc., 114:1895 (1992); Meierら、Chem. Int. Ed. Engl., 31:1008 (1992); Nielsen, Nature, 365:566 (1993); Carlssonら、Nature, 380:207 (1996)参照、そのすべては参照により組み入れられる)を含む。他の類似体核酸は、正の骨格を有するもの(Denpcyら、Proc. Natl. Acad. Sci. USA, 92:6097 (1995));非イオン性骨格を有するもの(米国特許第5,386,023号;同第5,637,684号;同第5,602,240号;同第5,216,141号;および同第4,469,863号;Kiedrowshiら、Angew. Chem. Intl. Ed. English, 30:423 (1991); Letsingerら、J. Am. Chem. Soc., 110:4470 (1988); Letsingerら、Nucleoside & Nucleotide, 13:1597 (1994); ASC Symposium Series 580, “Carbohydrate Modifications in Antisense Research”, 編Y.S. SanghuiおよびP. Dan Cookの2章および3章; Mesmaekerら、Bioorganic & Medicinal Chem. Lett., 4:395 (1994); Jeffsら、J. Biomolecular NMR, 34:17 (1994); Tetrahedron Lett., 37:743 (1996))ならびに、米国特許第5,235,033号および同第5,034,506号およびASC Symposium Series 580, “Carbohydrate Modifications in Antisense Research”, 編Y.S. SanghuiおよびP. Dan Cookの6章および7章に記載されるものを含む非リボース骨格を有するもの、ならびにペプチド核酸を含む。1つ以上の炭素環糖を含む核酸もまた核酸の定義に含まれる(Jenkinsら、Chem. Soc. Rev., (1995) pp. 169-176参照)。いくつかの核酸類似体は、Rawls, C & E News, June 2, 1997, 35ページに記載される。これらの参考文献はすべて、参照により本明細書に明確に組み入れられる。リボース−リン酸骨格のこれらの改変は、標識などのさらなる部分の付加を容易にするために、または生理環境においてこのような分子の安定性および半減期を増加させるために行われうる。さらに、天然の核酸と類似体の混合物が作製され得る。あるいは、異なる核酸類似体の混合物、および天然の核酸と類似体の混合物が作製されうる。核酸は、規定されているように、一本鎖または二本鎖でありえ、または二本鎖もしくは一本鎖配列の両方の部分を含みうる。核酸は、DNA、ゲノムDNAとcDNAの両方、RNAまたはハイブリッドでありえ、その核酸はデオキシリボヌクレオチドとリボヌクレオチドの任意の組合せを含み、ウラシル、アデニン、チミン、シトシン、グアニン、イノシン、キサンチン(xathanine)、ヒポキサンチン(hypoxathanine)、イソシトシン、イソグアニン、4−アセチルシトシン、8−ヒドロキシ−N6−メチルアデノシン、アジリジニルシトシン、シュードイソシトシン、5−(カルボキシヒドロキシルメチル)ウラシル、5−フルオロウラシル、5−ブロモウラシル、5−カルボシキメチルアミノメチル−2−チオウラシル、5−カルボシキメチル−アミノメチルウラシル、ジヒドロウラシル、イノシン、N6−イソペンテニルアデニン、1−メチルアデニン、1−メチルシュードウラシル、1−メチルグアニン、1−メチルイノシン、2,2−ジメチルグアニン、2−メチルアデニン、2−メチルグアニン、3−メチルシトシン、5−メチルシトシン、N6−メチルアデニン、7−メチルグアニン、5−メチルアミノメチルウラシル、5−メトキシアミノメチル−2−チオウラシル、β−D−マンノシルキューオシン、5−メトキシカルボニルメチルウラシル、5−メトキシウラシル、2−メチルチオ−N6−イソペンテニルアデニン、ウラシル−5−オキシ酢酸メチルエステル、ウラシル−5−オキシ酢酸、オキシブトキソシン、シュードウラシル、キューオシン、2−チオシトシン、5−メチル−2−チオウラシル、2−チオウラシル、4−チオウラシル、5−メチルウラシル、N−ウラシル−5−オキシ酢酸メチルエステル、ウラシル−5−オキシ酢酸、シュードウラシル、キューオシン、2−チオシトシン、および2,6−ジアミノプリンなどを含む塩基の任意の組合せを含む。
【0051】
タンパク質について一般的に上述されたように、核酸候補薬剤は、天然の核酸、ランダムおよび/または合成核酸でありうる。例えば、原核生物ゲノムまたは真核生物ゲノムの消化物は、タンパク質について上記に概説されたように使用されうる。加えて、RNA干渉配列(RNAi)は本明細書に含まれる。
【0052】
「被験体」とは、記載されている実験または手順または過程の、生きている対象を意味する。すべての被験体は生体系である。1つの実施形態では、被験体はヒトでありうる。別の実施形態では、被験体はウサギまたは齧歯類または非ヒト霊長類でありうる。さらに、「被験体」という用語は、任意の他の生体系を包含する。
【0053】
「生体系」とは、本明細書において、細胞、細胞株、組織、器官または生物を含む任意の生きている存在を意味する。生物の例は、任意の動物、好ましくは脊椎動物、より好ましくは哺乳動物、最も好ましくはヒトを含む。哺乳動物の例は、非ヒト霊長類、家畜、愛玩動物(例えば、ネコおよびイヌ)、ならびに研究動物(例えば、マウス、ラット、およびヒト)を含む。
【0054】
「生物学的サンプル」は、生体系または被験体から取得される任意のサンプルを包含する。その定義は、血液、組織、および生体系または被験体から採取され得る生物由来の他のサンプルを包含する。好ましくは、生物学的サンプルは最小限の侵襲性または非侵襲性の方法(例えば、採尿、便の採取、採血、針吸引、および最小限のリスク、不快感または労力を必要とする他の方法)によるサンプリングによって取得される。生物学的サンプルはしばしば液体(時に「体液」と呼ばれる)である。液体の生物学的サンプルは、尿、血液、腸液、浮腫液、唾液、涙液、炎症浸出液、滑液、膿腫、蓄膿症または他の感染体液、脳脊髄液、汗、気道内分泌物(喀痰)、精液、糞便、胆汁、腸分泌物などを含むが、それらに限定されない。生物学的サンプルは、それらの取得後、試薬による処理、可溶化、または例えばタンパク質もしくはポリヌクレオチドなど、特定の成分の濃縮などによる任意の方法で処理されたサンプルを含む。「生物学的サンプル」という用語はまた、血清、血漿、他の体液、または組織サンプルなどの臨床サンプルをも包含し、また培養細胞、細胞上清および細胞溶解液をも含む。
【0055】
「同位体含量または同位体パターンまたは同位体含量もしくは同位体パターンの変化速度」は、同位体含量、同位体パターン、同位体含量の変化速度、同位体パターンの変化速度、または分子の同位体分布の他の測定結果を指す。同位体含量または同位体パターンまたは同位体含量の変化速度または同位体パターンの変化速度は、分子もしくは分子集団における同位体のパターンまたは含量または分布を指す。この用語は、幅広い意味および分子特性を含む。同位体含量または同位体パターンは、同位体含量の経時的な変化(例えば、時間の関数としての同位体含量)を含みうる。1つの実施形態では、同位体含量または同位体パターンは、サンプル中での特定の同位体のモルパーセントを表す。別の実施形態では、同位体含量または同位体パターンは、1つ以上の質量アイソトポマーの相対量を表す。別の実施形態では、同位体含量または同位体パターンは、質量アイソトポマーの分布全体を指す場合があり、巨大分子のそれは何百にも達しうる。同位体含量または同位体パターンはまた、高度に標識された単一の分子種(例えば、4つの重水素を有する前駆体)の相対量をも表しうる。同位体含量または同位体パターンは、単一アイソトポマーの超過モル百分率(molar percent excess)を指すことができ、またはそれは特定の同位体の超過原子百分率(atom percent excess)を指すことができる。同位体含量または同位体パターンは、本明細書に記載される本方法の実施の間に行われる質量分析により測定されるものを含む。これらの分析は、特定の質量アイソトポマーの超過モル百分率(MPE)(例えば、コレステロールのM1アイソトポマーのMPE、またはコール酸のM4アイソトポマーのMPE、または血中の2H2OのMPE)の測定を含みうる。これらの分析は、特定の原子同位体の超過原子百分率(APE)(例えば、コレステロール中の13CのAPE)の測定を含みうる。
【0056】
「対象となる分子」とは、本明細書に記載される方法の実施の間に精製もしくは分析のために選択される、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体を意味する。このような対象となる分子は、本明細書に記載される方法を実施する間に被験体において見いだされるかまたは生成される同位体標識生成物である。例えば、RCTの肝臓成分または排出成分の測定は、被験体の肝臓における13C2標識コレステロールの13C2標識コール酸への変換に基づきうる。この場合は、コール酸が対象となる分子であり、それはその13C同位体含量または同位体パターンについて分析される。同様に、RCTの血漿成分の測定は、HDL中の14C2標識コレステロールの、VLDL中の14C2標識コレステロールエステルへの変換に基づきうる。この場合は、VLDLに由来するコレステロールエステルが対象となる分子であり、それはその14C同位体含量または同位体パターンについて分析される。対象となる分子は被験体に投与された同位体標識分子(コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体もしくコレステロール前駆体)と同一であってもよく、またはそれは異なる同位体標識分子、例えば、被験体もしくは微生物のいずれかによる被験体内での代謝性事象により生成されたものであってもよい。
【0057】
対象となる分子は、コレステロールまたはコレステロールエステルを含みうる。対象となる分子はまた、カイロミクロン、TGRL、HDL、IDL、LDL、またはVLDLに由来するコレステロールを含みうる。対象となる分子はまた、カイロミクロン、TGRL、HDL、IDL、LDL、またはVLDLに由来するコレステロールエステルを含みうる。対象となる分子はまた、血液、糞便、胆汁、尿、または任意の他の生物学的サンプル由来の胆汁酸を含みうる。対象となる分子はまた、血液、糞便、胆汁、尿、または任意の他の生物学的サンプル由来の中性ステロールを含みうる。対象となる分子はまた、ケノデオキシコレート、コレート、デオキシコレート、リトコレート、ウルソデオキシコレート、リン脂質、またはビリルビンを含みうる。対象となる分子はまた、消化管微生物によって生成される胆汁酸の代謝産物を含みうる。対象となる分子はまた、消化管微生物によって生成される中性ステロールの代謝産物(例えば、コプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノール)を含みうる。このような微生物代謝産物は糞便内において見いだされ、またはそれらは被験体に再吸収されて、他の生物学的サンプル中に出現しうる。
【0058】
被験体または生物学的サンプル中の対象となる分子の全プールの一部である、同位体標識された対象となる分子は、本発明の方法の実施により生成された生成物である。
【0059】
「モノアイソトピック質量」は、すべて1H、12C、14N、16O、32Sなどを含む分子種の正確な質量を指す。C、H、N、O、P、S、F、Cl、BrおよびIからなるアイソトポログに関して、最も低い質量を有するアイソトポログの同位体組成は一つしかない一義的なものである。なぜなら、これらの元素の最も豊富な同位体もまた最も低い質量を有するからである。モノアイソトピック質量はm0と略され、他の質量アイソトポマーの質量は、それらの質量のm0との差異によって区別される(m1、m2など)。
【0060】
「質量アイソトポマー」または「アイソトポマー」は、同位体組成よりむしろ見掛けの質量に基づいて分類される同位体異性体群を指す。質量アイソトポマーは、アイソトポログとは異なり、異なる同位体組成の分子を含みうる(例えば、CH3NHD、13CH3NH2、CH315NH2は同一の質量アイソトポマーの一部であるが、異なるアイソトポログである)。実務上の用語では、質量アイソトポマーは、質量分析計によって分離されないアイソトポログ群である。四重極質量分析計では、これは通常、質量アイソトポマーは見掛けの質量を共有するアイソトポログ群であるということを意味する。従って、アイソトポログCH3NH2とCH3NHDは見掛けの質量が異なり、異なる質量アイソトポマーとして区別されるが、アイソトポログCH3NHD、CH2DNH2、13CH3NH2およびCH315NH2はすべて同一の見掛けの質量であり、従って同一の質量アイソトポマーである。従って、それぞれの質量アイソトポマーは通常、1つ以上のアイソトポログからなり、1つ以上の正確な質量を有する。すべての個々のアイソトポログは四重極質量分析計によって分離されず、より高い質量分解能を実現する質量分析計を用いても分離されないかもしれないため、質量分析データからの算出は、アイソトポログよりむしろ質量アイソトポマーの存在度で行われなければならないので、アイソトポログと質量アイソトポマーとの区別は実際面で有用である。最も低い質量の質量アイソトポマーはM0で表され;ほとんどの有機分子にとって、これはすべて12C、1H、16O、14Nなどを含む分子種である。他の質量アイソトポマーは、それらの質量のM0との差異によって区別される(M1、M2など)。特定の質量アイソトポマーに関して、分子内の同位体の配置または位置は特定されず、異なりうる(すなわち、「位置アイソトポマー」は区別されない)。
【0061】
「同位体標識」とは、同一の数の陽子を有し、従って同一の元素であるが、異なる数の中性子を有する原子による標識を意味する(例えば、1Hに対する2H)。同位体標識分子は任意の可能性のある同位体によって標識される。同位体は安定同位体(例えば、2H、13C)であってもよく、またはそれらは放射性同位体(例えば、3H、14C)であってもよい。
【0062】
「同位体標識基質」は、生体系または被験体において対象となる分子に取り込まれ得る、任意の同位体標識前駆体分子を含む。同位体標識基質の例は、2H2O、3H2O、2H−グルコース、2H標識アミノ酸、2H標識有機分子、13C標識有機分子、14C標識有機分子、13CO2、14CO2、15N標識有機分子および15NH3を含むが、それらに限定されない。
【0063】
「精製」は、他の類似した化合物の混合物の1つ以上の成分を取り出す方法を指す。例えば、「タンパク質またはペプチドの精製」は、タンパク質またはペプチドの混合物中の1つ以上のタンパク質またはペプチドからタンパク質またはペプチドを取り出すことを指す。
【0064】
「単離」は、化合物の混合物から1つの化合物を分離することを指す。例えば、「タンパク質またはペプチドの単離」は、1つ以上のタンパク質またはペプチドの混合物中の他のすべてのタンパク質またはペプチドから1つの特定のタンパク質またはペプチドを分離することを指す。
【0065】
「前駆体分子」は、特定の分子の合成の間に用いられる代謝前駆体を指す。前駆体分子の例は、アセチルCoA、リボ核酸、デオキシリボ核酸、アミノ酸、グルコース、水などを含む。
【0066】
「標識水」は、本明細書において用いられる場合、同位体を含有する水を指す。標識水の例は、2H2O、3H2O、およびH218Oを含む。本明細書において用いられる場合、「同位体標識水」は「標識水」と同義に用いられる。
【0067】
「分子流速」は、細胞、組織、もしくは生物内での分子の合成速度および/または分解速度を指す。「分子流速」はまた、分子プール内への分子の流入または分子プールからの移動を指し、従って分子プール内へまたは分子プールからの流量と同義である。
【0068】
コレステロール輸送および代謝の測定方法
コレステロール逆輸送(RCT)は、コレステロールが動員され体外へ輸送される生物学的経路である(図1)。RCTの3つの成分:(1)組織、特に肝臓外の組織から血流へのコレステロールの流出(流出成分、図2);(2)血漿画分内でのコレステロールの輸送および分布(血漿成分、図3);ならびに(3)肝臓または腸を介した糞便内への排出(肝臓成分もしくは排出成分、図4)がある。コレステロールは、胆汁酸または遊離コレステロール(ステロール)のいずれかとして胆汁分泌に組み込まれ、その後、腸管腔に分泌され、その一部は体から糞便内に出る。ステロールはまた、腸から腸管内腔に直接放出され、その後一部が糞便内に排出されうる。これらの経路は、コレステロールが体から除去され得る唯一の有効な機序である。機能的観点から、成分#1および#3(すなわち、流出成分および肝臓成分または排出成分)は、それぞれ細胞からのおよび体からのコレステロールの出口であるため、重要なステップである。上述のように、アテローム生成、アテローム硬化ならびに他のコレステロール関連疾患および血管疾患におけるコレステロールの確立された役割のため、RCTは、重要な抗アテローム生成過程および抗アテローム硬化過程と考えられ、心血管系リスクの低下と血漿の高密度リポタンパク質(HDL)画分との臨床相関と同様に、抗アテローム生成特性および抗アテローム硬化特性に対する理由であると一般に信じられている。
【0069】
しかし、HDLレベルは、RCTの分子経路の1つの成分しか反映せず、RCT経路を介したコレステロールの真の流れを必ずしも反映しないことが現在は認識されている。RCT経路の分子詳細は、この数年間でさらに重視されるようになった。分子的理解におけるこれらの最近の進歩の1つの重要な意味は、単独での血漿HDLc(HDL−コレステロール)レベルは、HDLcの変化に関与する根底の機序によって、その経路を介した真の流れを反映するかもしれず、またはしないかもしれないという認識である。例えば、個体におけるHDLcの血漿濃度が、突然変異体ABC(A)−1ヘテロ接合体でのように、組織からABC(A)−1(ATP結合カセットトランスポーター)を介した血漿apoA1含有粒子への流れである場合、HDLcは有用なマーカーである。しかし、別の個体においてHDLcが、そのアクセプターへのHDLcの送達阻害のために蓄積する場合(例えばコレステロールエステル輸送タンパク質活性の低下または肝臓のスカベンジャー受容体−B1[SR−B1]活性の低下による場合)、HDLcレベルはRCTを反映しない。スタチンのような、apoB含有粒子の産生および運命を変化させる治療のRCTに対する影響を考慮した場合、状況は特に複雑であり得る。apoB粒子は逆方向(すなわち、肝臓に戻す)だけでなく、コレステロールを前方に(すなわち、組織に)運ぶこともできるため、個体におけるapoB粒子の実際の運命は、いずれの血漿HDLレベルでもRCTの効率に寄与しうる。従って、HDLc濃度とRCTとの間の既存の解離を増加させる可能性は、効果的なスタチン治療もしくはVLDLおよびLDL粒子の肝臓への回帰を促進する他の治療の背景において、またはコレステロール代謝もしくは脂質代謝の改変に対して行われる事実上任意の治療(例えば、スタチン治療、フィブラート治療など)において生じる。
【0070】
RCT活性とHDLcレベルとの間の違いは、本開示の基礎を説明する。RCTなどの生化学的過程の測定は、生化学的分子の濃度の測定と同じではない。HDLcの濃度の測定は技術的に単純な作業であるが、単独では、必ずしも情報を提供するとは限らない。対象となる過程は血漿中のHDLc濃度ではなく、対象となる過程はコレステロールの体からの除去(すなわち、RCT)である。HDLcの測定、それ自体は、単に実際の過程の代用である。この違いのいくつかの例は、動物モデルならびにヒトについて当技術分野において知られている。アテローム硬化を生じやすいマウスにおけるSR−BI受容体の遺伝子欠失は、HDLからのコレステロールの取り込みが低下することによってRCT過程を低下させ、それによって、血漿HDLコレステロールレベルを著しく増加させる。しかし、より高いHDLレベルにもかかわらず、これらのマウスはより悪化したアテローム硬化を呈する。このHDLコレステロールレベルと心臓保護との間の解離は、HDLの濃度よりも流れの優位性を反映する。同様に、アテローム硬化を生じやすいマウスにおけるタンパク質ABC−A1の遺伝子の過剰発現は、より低いHDLコレステロールレベルをもたらすが、アテローム硬化に対する保護をもたらす。実際、通常のHDLと血管系リスクとの間の関係とは反対に、HDLレベルがより高いほど、より悪化したアテローム硬化が観察された。さらに、突然変異apoA1−ミラノを有するヒトは、低いHDLコレステロールレベルを有するが、著しく低下した心血管系リスクを有し、おそらく、血流中での蓄積なしにRCT経路を介してコレステロールを運ぶapoA1−ミラノの優れた能力を反映している。
【0071】
従って、RCT経路によって組織から血液を介して体外へ輸送されるコレステロールの量を実際に測定しうる方法は、問題となっている過程の直接測定であろう。本開示は、RCT経路に重点を置いて、生体系もしくは被験体によって合成され、輸送され、修飾され、代謝され、分泌され、または別の方法で移動される、コレステロールあるいはコレステロール関連分子あるいはコレステロール関連複合体の量(絶対量、相対量、または割合)の測定を記載する。これらのような方法は、必ずではないが、時に経時実験を含むため、またはデータを速度の形(すなわち、単位時間当たりの量)に返すため、しばしば「キネティック」測定の項目に分類される。本開示では、RCT経路の異なる成分を介するコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の動きを追跡するために、同位体標識が用いられる。同位体標識分子は非標識分子と化学的に同一であり、生化学的に区別できないが、それらは異なる質量を有し、様々な質量分析またはレーザー分光光度法もしくはレーザー分光法などの他の方法によって測定され得る特性を有する。同位体標識分子の出現、希釈、濃縮、もしくは消失を追跡することによって、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の輸送あるいは代謝が測定され得る。
【0072】
コレステロール関連疾患の世界的な影響の増大のため、ならびにコレステロール代謝の複雑さおよびその研究のため、RCT速度を測定するin vivoでの方法が必要とされ、医療ならびに創薬および薬剤開発に対して大きな実用性を有する。候補治療法の同定、選択、評価および開発(例えば、臨床または前臨床用量設定および用量の最適化、有効性の測定)、コレステロール関連疾患の診断、疾患進行または治療への反応の評価を含む被験体の管理、ならびにコレステロール関連疾患の管理、診断もしくは治療に使用するための医療機器または医療用具の設計および試験は、本発明の方法の実施から利益を受けるすべての過程である。臨床試験への登録前の被験体の評価は、本発明の1つの有益な用途である。彼らが候補治療法に反応するか否かを予測するために被験体を評価することは、本発明の別の有益な用途である。本発明は、コレステロール関連疾患のリスクを変える遺伝的要因の同定および研究、ならびに被験体を分類するためおよび治療を推奨するために使用され得る疾患基準(すなわち、疾患状態または前疾患状態を示すリスクファクターの組合せ)の開発に対するさらなる用途を有する。
【0073】
本開示は、in vivoでのコレステロール輸送および代謝の測定方法を提供する。1つの実施形態では、本開示は、さらに具体的には、コレステロールを細胞および体から出す機序である、RCTの測定を対象とする。「コレステロール逆輸送」または「RCT」という用語は、コレステロールが細胞から血流へ、および血流から体外へ移動する全過程を表すために用いられる。RCT過程は、コレステロールの一時的もしくは永続的な代謝または修飾を含み、コレステロールの輸送だけを扱うのではなく、むしろ様々なコレステロール前駆体および派生生成物を扱う。さらに、RCTの間、コレステロールおよびその様々な代謝産物は、HDLサブクラスおよび超低密度リポタンパク質(VLDL)などの様々な担体分子または複合体と関連し、それらの間を輸送される。RCTのいくつかの成分(例えば、胆汁酸)は分泌および再吸収され、他のものは可逆的に輸送または修飾されて平衡状態(すなわち、問題となっている過程の両方向での自由な輸送がある状態)で存在するように、RCT過程は必ずしも一方向性ではない。本開示の文脈では、「RCT」という用語は、コレステロールおよびコレステロール代謝産物またはコレステロール関連分子が生体(すなわち、生体系もしくは被験体)から最終的に除去される過程を表すために用いられる。RCT過程は、「流出成分」、「血漿成分」、および「肝臓成分または排出成分」の3部の過程として特徴づけされうる(図1)。本開示は、3つの成分のいずれも他の成分を測定または評価することなく独立して測定され得るが、全体としてのRCTの測定を対象とする。
【0074】
測定は通常、ヒトを含む哺乳動物被験体において実施される。哺乳動物は、霊長類、家畜、競技動物、ネコおよびイヌなどの愛玩動物、モルモット、ウサギ、ハムスター、マウス、ラット、ヒトなどを含むが、それらに限定されない。
【0075】
I.被験体におけるRCTの流出成分の速度の測定
1つの態様では、RCTの流出成分が被験体において測定されうる。1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体が被験体に投与される。一定期間後、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体を含有する、血漿サンプルなどの1つ以上のサンプルが被験体から取得され、その分子もしくは複合体の同位体含量または同位体パターンが測定される。組織由来の内在性コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の流出による、投与された標識の希釈量がこのデータから算出され、それは実験の間の流出量を直接反映する。さらに、標識分子または複合体の内在性非標識分子もしくは複合体による希釈速度を算出することによって、被験体におけるコレステロール逆輸送の流出成分の速度が測定され得る。この過程は下記の実施例1に例示される。
【0076】
A.同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与
同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、経口、非経口、皮下、血管内(例えば、静脈内もしくは動脈内)、腹腔内または筋肉内を含むがそれらに限定されない様々な経路によって被験体に投与され得る。
【0077】
投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、下記のいずれかでありうるが、それらに限定されない:
・同位体標識コレステロール
・脂質エマルジョンに懸濁された同位体標識コレステロール
・高密度リポタンパク質(HDL)粒子に結合した同位体標識コレステロール
・低密度リポタンパク質(LDL)粒子に結合した同位体標識コレステロール
・超低密度リポタンパク質(VLDL)粒子に結合した同位体標識コレステロール
・中間密度リポタンパク質(IDL)粒子に結合した同位体標識コレステロール
・カイロミクロンに結合した同位体標識コレステロール
・同位体標識コレステロールエステル
・脂質エマルジョンに懸濁された同位体標識コレステロールエステル
・HDL粒子に結合した同位体標識コレステロールエステル
・LDL粒子に結合した同位体標識コレステロールエステル
・VLDL粒子に結合した同位体標識コレステロールエステル
・IDL粒子に結合した同位体標識コレステロールエステル
・カイロミクロンに結合した同位体標識コレステロールエステル。
【0078】
コレステロールまたはコレステロール関連分子またはコレステロール関連複合体を標識するために使用される同位体は、安定同位体(例えば、2H、18O、もしくは13C)であってもよく、またはそれは放射性同位体(例えば、3Hもしくは14C)であってもよい。コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、複数の異なる同位体標識を有しうる。それは、複数の位置で同一の同位体標識によって標識されてもよい。それは、複数の位置で複数の異なる標識によって標識されてもよい。例えば、2Hおよび18Oまたは2Hおよび13Cまたは任意の標識の組合せによって標識することができる。
【0079】
また、同位体標識されたものの代わりに修飾されたコレステロールまたはコレステロール関連分子もしくは複合体を用いることもできる。修飾されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体がその内在性対応物と識別され得る限り、本方法は修飾されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体を用いて実施され得る。修飾されたコレステロール分子の一例は、メチル基によって修飾されているメチルコレステロールである。メチルコレステロールの場合、コレステロールに非常によく似ているが、質量分析、NMRまたはレーザー分光光度法もしくはレーザー分光法などの他の方法(下記参照)によって識別できるコレステロール分子を作製するために、単一のメチル基がコレステロールに付加される。付加的なメチル基を含む対象となる分子の割合の測定は、対象となる分子の同位体含量の測定に代わることができる(下記参照)。同様に、超過モル百分率は、対象となるメチル化分子について表される(例えば、MmethylのMPE)。MPEの算出は下記において議論される。
【0080】
上記に記載された同位体標識分子もしくは複合体、または他の同位体標識分子もしくは複合体の調製方法は、当業者にとって既知である。
【0081】
同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、様々な方法で投与されうる。それらは、連続的、反復的、不連続的に、または他の方法によって投与され得る。1つの実施形態では、脂質エマルジョン中の既知量の同位体標識コレステロールは、一定の速度で、血漿コレステロールについて定常状態レベルに達するのに十分な時間注入される。
【0082】
B.1つ以上の生物学的サンプルの取得
同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の投与後または投与の間に、生物学的サンプルが取得される。生物学的サンプリングの頻度は様々な要因によって異なりうる。このような要因は、生物学的サンプルの性質、サンプリングの容易さおよび安全性、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の生物学的速度定数および代謝回転の反応速度、ならびに被験体に施行される候補治療法の性質を含むが、それらに限定されない。1つの実施形態では、同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の注入後または注入の間に、被験体から複数の生物学的サンプルが採取される。
【0083】
生物学的サンプルの性質は大きく異なりうる。1つの実施形態では、サンプルは尿または糞便である。別の実施形態では、サンプルは血液である。サンプルは、十分な量のコレステロールまたはコレステロール関連分子またはコレステロール関連複合体(対象となる分子)を得るために選択され、その同位体含量または同位体パターンについて分析される。対象となる分子は実験計画によって異なり、上記のI−A項に記載されるように投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の選択に基づいて選択されうる。サンプルは複数の対象となる分子を含んでもよく、単一の対象となる分子を分析するために、複数のサンプルが採取されてもよい。1つの実施形態では、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は脂質エマルジョン中の13C標識コレステロールであり、生物学的サンプルはコレステロールを含有するであろう血液サンプルである。血中のコレステロールの同位体含量または同位体パターンはその後、下記に記載されるように測定されるであろう。
【0084】
続いて、対象となる分子の同位体含量または同位体パターンの測定が行われる。この測定は直接サンプルに対して行われてもよく、またはそれはサンプルを処理した後に行われてもよい。ある場合には、サンプルは、同位体含量または同位体パターンが測定される前に広範に処理されうる。サンプルは、HDLもしくはHDLのサブクラスなど、特定のコレステロール関連分子またはコレステロール関連複合体を単離するために処理され、単離された分子または複合体はその後、質量分析に適した形にさらに処理されうる。
【0085】
コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体を精製、部分精製、または単離するために生物学的サンプルに適用されうる技術のいくつかは、遠心分離、溶媒沈殿、塩析沈殿、またはpHによる沈殿、高圧液体クロマトグラフィー(HPLC)、高速液体クロマトグラフィー(FPLC)、逆相クロマトグラフィー、サイズ排除クロマトグラフィー、薄層クロマトグラフィー、ガスクロマトグラフィー、ゲル電気泳動、限外ろ過、超遠心分離法、アフィニティークロマトグラフィー、キャピラリー電気泳動、選択的タンパク質分解または示差的(differential)タンパク質分解、示差的(differential)化学分解、結晶化、再結晶化、制限タンパク質分解、制限化学的分解、ならびに/あるいは、当業者にとって既知の化学的なおよび/もしくは生化学的なおよび/もしくは高分子の化合物、生体分子または複合体を分離する任意の他の方法を含むが、それらに限定されない。さらに、コレステロールおよび/またはコレステロール関連分子および/またはコレステロール関連複合体を取得、精製、ならびに単離する方法は、例えば、Cell Biology: A Laboratory Notebook (J.E. Cellis編、1998); Current Protocols in Molecular Biology (F.M. Ausubelら編、1987); Short Protocols in Molecular Biology (WileyおよびSons, 1999)、ならびに当技術分野において周知の他の情報源において見いだされうる。
【0086】
精製もしくは部分精製されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、化学的加水分解、熱加水分解、酸加水分解、化学誘導体化(例えば、アシル化、アセチル化)、水性・有機溶媒抽出、化学的乾燥、真空乾燥、および当技術分野において既知の他の技術を含むがそれらに限定されない技術によって、同位体含量または同位体パターンの分析のためにさらに処理されうる。精製もしくは部分精製されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、分析の前に他の分子とコンジュゲートされうる。例えば、コレステロールは、同位体含量または同位体パターンの分析の前に、そのトリメチルシリル誘導体に誘導体化されうる。
【0087】
別の実施形態では、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、より小さい分子を形成するために加水分解または別の方法で分解されうる。加水分解法は、化学的加水分解(酸加水分解など)および生化学的分解を含むがそれらに限定されない、当技術分野において既知の任意の方法でありうる。加水分解または分解は、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の精製および/または単離の前後いずれかに実施されうる。
【0088】
C.コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンの測定
その後、対象となるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンが測定される。同位体含量または同位体パターンは、質量分析、核磁気共鳴(NMR)分光法、レーザー分光光度法、レーザー分光法、液体シンチレーション計数、または当技術分野において既知の他の方法を含むがそれらに限定されない方法によって測定されうる。同位体含量または同位体パターンは直接測定されてもよく、またはコレステロールが上述のように化学的もしくは生化学的に修飾された後に分析されてもよい。
【0089】
コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体における同位体含量または同位体パターンは、ガスクロマトグラフィー質量分析(GC−MS)、同位体比質量分析、GC−同位体比燃焼MS、GC−同位体比熱分解MS、液体クロマトグラフィーMS、エレクトロスプレーイオン化MS、マトリックス支援レーザー脱離飛行時間型MS、フーリエ変換イオンサイクロトロン共鳴MS、サイクロイドMSなどを含むがそれらに限定されない様々な質量分析法によって測定されうる。
【0090】
質量分析計は分子を高速移動する気体イオンに変換し、それはその後、質量電荷比に基づいて分析される。従って、イオンもしくはイオン断片の同位体またはアイソトポログの分布は、複数の分子における同位体含量または同位体パターンを測定するために使用されうる。
【0091】
通常、質量分析計はイオン化装置および質量分析器を含む。多数の異なる種類の質量分析器が当技術分野において知られている。これらは、磁場型分析器、エレクトロスプレーイオン化、四重極、イオントラップ、飛行時間型質量分析器、およびフーリエ変換分析器を含むが、それらに限定されない。
【0092】
質量分析計はまた、多数の異なるイオン化方法を含みうる。これらは、電子衝撃、化学イオン化、および電場イオン化などの気相イオン化源、ならびに、電場脱離、高速原子衝撃、マトリックス支援レーザー脱離/イオン化、および表面増強レーザー脱離/イオン化などの脱離イオン化源を含むが、それらに限定されない。
【0093】
加えて、最初に前駆イオンを分離し、次に気相断片イオンを分離、測定するために、2つ以上の質量分析計が連結されうる(MS/MS)。これらの機器は、分子の一連の初期イオン断片を発生させ、次に初期イオンの二次断片を発生させる。MS/MSフラグメンテーションパターンおよび質量分析によってもたらされる正確な分子質量決定は、分子の化学組成に関する固有の情報を提供する。未知の分子は、1回の質量分析の実行により数分のうちに同定され得る。現在利用可能な化学物質フラグメンテーションパターンのライブラリーは、複雑な混合物の成分をほぼ確実に同定する機会を提供する。このような技術は、対象となるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンを、関連した生物学的サンプルのいかなる処理も必要とせずに(すなわち、直接測定で)分析するために使用されうる。
【0094】
様々なイオン化方法もまた当技術分野において知られている。1つの重要な進歩は、大きな不揮発性の巨大分子をイオン化するための技術の開発であった。この種の技術は、エレクトロスプレーイオン化(ESI)およびマトリックス支援レーザー脱離/イオン化(MALDI)を含んでいる。これらは、MSが液体クロマトグラフィーおよびキャピラリーゾーン電気泳動などの強力なサンプル分離導入技術と組み合わせて利用されることを可能にした。
【0095】
加えて、質量分析計は、ガスクロマトグラフィー(GC)および高速液体クロマトグラフィー(HPLC)などの分離手段と連結されうる。ガスクロマトグラフィー質量分析(GC/MS)では、ガスクロマトグラフィーからのキャピラリーカラムは、任意選択でジェットセパレーターを用いて、質量分析計に直接連結される。このような適用では、ガスクロマトグラフィー(GC)カラムはサンプルガス混合物からサンプル成分を分離し、分離された成分は質量分析計においてイオン化され化学的に分析される。
【0096】
加えて、同位体が放射性同位体である場合、同位体含量または同位体パターンまたは存在度は、液体シンチレーション計数、ガイガー計数、CCDによる検出、フィルムによる検出などを含むがそれらに限定されない、放射性同位体の測定のために当技術分野において既知の技術を用いて測定されうる。
【0097】
通常、本明細書において企図される測定は、幅広い種類の機器によって実施され得る。上記の列挙は非限定的である。
【0098】
本開示では、2つの分類の同位体標識分子が検討される。第一の分類は、被験体に投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体である。第二の分類は、対象となる分子である。対象となる分子とは、その同位体含量または同位体パターンが後に測定される分子である。対象となる分子は生物学的サンプル中に含まれる。対象となる分子はコレステロールまたはコレステロール関連分子またはコレステロール関連複合体でありうる。対象となる分子は被験体の代謝作用によって標識されうる。対象となる分子は、被験体に投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体と同一でありうる。要するに、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は被験体に投与され、対象となる分子の同位体含量または同位体パターンはその後に測定されるものである。
【0099】
通常、本開示から導かれる生物学的サンプル中のコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンは、任意の同位体標識分子を投与する前の、同一分子のベースラインの同位体含量または同位体パターンと比較して表される。選択されたコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体(対象となる分子)に関するベースラインの同位体含量または同位体パターンを測定するため、サンプルは同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与前に採取され得、対象となる分子の同位体含量または同位体パターンはベースラインサンプルで分析され得る。このような測定は、生物体内での対象となる分子の天然の同位体含量または同位体パターンを確立する1つの方法である。多くの場合、ベースラインの同位体含量または同位体パターンは、いずれの種類の標識分子も投与されていない被験体から採取された生物学的サンプル由来の過去の(既存の)データに基づき推定され得る。これは、ある生物が類似の環境履歴を有する被験体の集団の一部である場合、特に当てはまる。さらに、このようなベースラインの同位体含量または同位体パターンは、同位体の既知の平均天然存在度を用いて推定されうる。例えば、天然では、有機炭素中に存在する13Cの天然存在度は1.11%である。このようなアイソトポマー頻度分布の予測方法は当技術分野においてよく知られており、文献に記載されている(下記参照)。
【0100】
実際の同位体含量または同位体パターンは、上記に記載されたように得られたデータから算出されうる。これらの算出は、利用可能な過去のデータまたはベースラインデータの量、実施者の好み、目的とする測定の精度、分析に使用される機器の種類、および他の要因に応じて、様々な形式を取り得る。算出の例を下記に示す。
【0101】
1.相対的および絶対的な質量アイソトポマー存在度の測定
質量分析計は、サンプル中の異なる質量の分子または原子の相対量を測定する。これらの量は、時に存在度と呼ばれる。測定された質量スペクトルピークの高さ、あるいはピーク下面積は、元の(ゼロ質量アイソトープ(zero mass isotope))アイソトポマーに対する比として表されうる。本開示のためのこのようなデータの記載において、サンプル中のアイソトポマーの存在度に対する相対値および絶対値を提供する任意の算出方法を使用できることが認識される。1つの実施形態では、異なる質量アイソトポマーの相対存在度がGC/MSによって測定され、所定のアイソトポマーの超過モル百分率が算出される。別の実施形態では、異なる同位体の相対存在度が、GC燃焼同位体比質量分析(GCC−IRMS)、またはGC熱分解同位体比質量分析(GCP−IRMS)によって原子レベルで測定され、所定のアイソトポマーの超過原子百分率が算出される。
【0102】
2.同位体含量または同位体パターンの算出
a.超過モル百分率(MPE)
同位体含量または同位体パターンは、上記のI−C−1項に記載されるように収集された存在度データから算出されうる。1つの実施形態では、同位体含量または同位体パターンは超過モル百分率(MPE)として表される。MPEを決定するために、実施者はまず、対象となる分子のアイソトポマーの存在度の割合を決定する(アイソトポマーは、対象となる分子の性質および被験体に投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の性質に基づいて選択される)。これは、GC/MSに由来するような存在度データから、質量アイソトポマーMxの存在度の割合を決定するための一般的な形式である、下記の方程式を用いて算出され得る。すなわち、
【数1】

【0103】
であり、式中、0〜nは、存在量が生じる、最も低い質量の(M0)質量アイソトポマーに対する見掛けの質量の範囲である。
【0104】
存在度の割合を決定したら、それをベースライン、過去のベースライン、理論上のベースライン、または(上述のようにして得られる)他のこのような参照値と比較することにより、MPEを決定する。これは下記の方程式を用いて算出される。すなわち、
【数2】

【0105】
であり、式中、下付きのeは富化(enriched)を指し、bはベースライン(baseline)すなわち天然の存在量を指す。
【0106】
MPEを決定したら、新たに合成された分子の割合または内在性分子による希釈の程度が決定され得る。両方の場合において、MPEは、最大限可能な超過モル百分率を示す値と比較される。対象となる分子が同位体標識前駆体の代謝によって生成される場合(例えば、2H4−コレステロールから2H4−コール酸の生成)、前駆体のMPEが測定され、最大限可能なMPEの算出に直接またはその基盤として使用されうる。最大限可能なMPEはまた、過去のデータ、投与される同位体標識の量に基づく計算、被験体の性質(例えば、体重、身体組成)を考慮に入れた同様の計算、純粋に理論上の計算、ならびに他の概算、測定、および遡及的データ分析の組合せからも決定されうる。最大限可能なMPEはまた、完全に標識された対象となる分子を含有することが知られている別の生物学的サンプルにおけるMPEを測定することによっても決定されうる。標識の希釈の場合には、最大限可能なMPEは、投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体のMPEに基づく。
【0107】
出願者は同位体標識の取り込みおよびアイソトポマー分布の分野において十分な経験を有し、同位体含量または同位体パターンの算出および分析に関する多数の技術および算出方法を開発している。これらは質量アイソトポマー分布解析(MIDA)を含み、詳細には米国特許第5,338,686号、同第5,910,403号、および同第6,010,846号に広範に記載され、それらは参照により全文が本明細書に組み入れられる。MIDAの変形形態および他の関連技術はさらに、HellersteinおよびNeese (1999)、ならびに Chinkesら(1996)、ならびにKelleherおよびMasterson (1992)、ならびに米国特許出願第10/279,399号を含む、当業者にとって既知の多数の異なる情報源に記載され、それらすべては参照によりその全文が本明細書に組み入れられる。
【0108】
上記の参考文献に加えて、その方法を実行する計算ソフトウェアは、University of California, BerkeleyのMarc Hellerstein教授から公的に入手可能である。
【0109】
b.超過原子百分率(APE)
同位体含量または同位体パターンは、上記に記載されるように収集された存在度データから算出されうる。1つの実施形態では、同位体含量または同位体パターンは超過原子百分率(APE)として表される。APEを決定するために、実施者はまず、対象となる分子中の対象となる同位体の存在度の割合を決定する(対象となる同位体は、対象となる分子の性質および被験体に投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の性質に基づいて選択される)。これは、GCC−IR−MSまたはGCP−IR−MSに由来するような存在度データから、同位体Ixの存在度の割合を決定するための一般的な形式である、下記の方程式を用いて算出され得る。すなわち、
【数3】

【0110】
であり、式中、0〜nは、存在量が測定される選択された原子の可能性のある同位体の範囲である。
【0111】
存在度の割合を決定したら、それをベースライン、過去のベースライン、理論上のベースライン、または(上述のようにして得られる)他のこのような参照値と比較して、超過原子百分率(APE)を決定する。これは下記の方程式を用いて算出される。すなわち、
【数4】

【0112】
であり、式中、下付きのeは富化(enriched)を指し、bはベースライン(baseline)すなわち天然の存在量を指す。
【0113】
APEを決定したら、新たに合成された分子の割合または内在性分子による希釈の程度が決定され得る。これは上述のように実施されるが、理論上の最大APEの場合にはさらなる計算を必要としうる。このような計算は当業者にとって公知である。
【0114】
3.同位体含量または同位体パターンの種類
本開示では、同位体含量または同位体パターンはしばしば、MPEまたはAPEとして表される。超過モル百分率は時にEMXと書かれ、(ベースラインサンプル、過去のベースラインデータ、または予測されるベースライン値と比較した分析されている分子の考えられる質量すべてに対する)所定の質量の超過モル百分率を指す。投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体および対象となる分子の多数の組合せが、本開示において検討される。可能性のある方法の範囲の説明を目的とする非限定的な計画は下記のとおりである。
【0115】
計画1:13C2−コレステロール(天然の存在分子において主要な12C原子の代わりに2原子の13Cを含有するコレステロールと定義される)を被験体に投与し、その後、血中コレステロールをGC/MSにより分析することによって、コレステロールの同位体含量または同位体パターンが測定されうる。このような場合、ベースラインまたは同様のデータと組み合わせて、EM2(他の天然のアイソトポログに加えて、2原子の13Cで標識されたコレステロールを表す)が決定されてもよく、これは同位体含量または同位体パターンの関連測定値である。あるいは、同一サンプル由来のコレステロールは、13CのAPEを測定するために、ガスクロマトグラフィー/熱分解/同位体比質量分析によって分析されてもよく、それもまた同位体含量または同位体パターンの関連測定値である。
【0116】
計画2:2H4−コレステロールを被験体に投与し、その後、血中コレステロールをGC/MSにより分析することによって、コレステロールの同位体含量または同位体パターンが測定されうる。このような場合、ベースラインまたは同様のデータと組み合わせて、EM4(他の天然のアイソトポログに加えて、4原子の2Hで標識されたコレステロールを表す)が決定されてもよく、これは同位体含量または同位体パターンの関連測定値である。あるいは、同一サンプル由来のコレステロールは、2HのAPEを測定するために、ガスクロマトグラフィー/熱分解/同位体比質量分析によって分析されてもよく、それもまた同位体含量または同位体パターンの関連測定値である。
【0117】
計画3:2H4−コレステロールを被験体に投与し、その後、血中コレステロールエステルをGC/MSにより分析することによって、コレステロールの同位体含量または同位体パターンが測定されうる。このような場合、ベースラインまたは同様のデータと組み合わせて、EM4(他の天然のアイソトポログに加えて、4つの2H原子で標識されたコレステロールエステルを表す)が決定されてもよく、これは同位体含量または同位体パターンの関連測定値である。あるいは、同一サンプル由来のコレステロールエステルは、2HのAPEを測定するために、ガスクロマトグラフィー/熱分解/同位体比質量分析によって分析されてもよく、それもまた同位体含量または同位体パターンの関連測定値である。
【0118】
D.同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の希釈速度の算出
生物学的サンプルにおいて測定される対象となるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンは、被験体に投与された同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンと比較されうる。この比較は、標識されていない内在性の対象となる分子による希釈の算出を可能にする。希釈方程式は当技術分野において既知であり、例えば、上記のHellersteinら(1992)によって記載されている。希釈速度またはRaはその後、RCTの流出成分に相当する、組織コレステロールの血中リポタンパク質への分子流速を決定するために使用される。
【数5】

【0119】
1つの実施形態では、脂質エマルジョンに懸濁された安定同位体標識コレステロールを、血漿コレステロール富化の定常状態レベルに達するのに十分な時間注入する。注入の間、血漿サンプルを定期的に採取し、血漿サンプル中のコレステロールの同位体含量または同位体パターンを上述のように測定する。同位体含量または同位体パターンの経時的な変化は、同位体含量または同位体パターンの定常状態レベルならびに血漿コレステロールの半減期を決定するために使用される。この場合、血漿コレステロールの希釈速度は、上記の方程式を用いて直接決定されうる。希釈速度はコレステロール流出速度と同一であり、研究中の被験体におけるRCTの流出(Ra)成分の速度を表す。
【0120】
本開示の他の実施形態、特に、対象となるコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の定常状態富化が達成されない実施形態では、RCTの流出成分の算出はより複雑である。しかし、血漿中の標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の出現が数学的に(時間の関数としての注入に由来する血清中での量で)記述され得る限り、RCTの流出成分は本開示の方法を用いて、当技術分野においてよく知られている方程式および数学的手法の使用によって測定され得る。
【0121】
E.体内の代謝回転の速いコレステロールプールのプールサイズの算出
代謝回転の速いプールサイズは、本明細書に記載される方法によって、流出モデルから導かれる方程式を用いて算出され得る。すなわち、
【数6】

【0122】
II.被験体におけるRCTの肝臓成分または排出成分の分子流速の測定
別の態様では、本開示はRCTの肝臓成分または排出成分の測定を対象とする。RCTの肝臓成分または排出成分では、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、胆汁酸に変換されその後腸管内腔に分泌される、または直接中性ステロールとして分泌される(胆汁中性ステロールは胆汁コレステロールを含む)。排泄物中の胆汁酸もしくは中性ステロール、または両方に対するRCTの寄与が測定されうる。
【0123】
A.1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与
安定同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、上述のように投与される。任意の投与方法、投与経路、または任意の量の安定同位体標識が、上述のように使用され得る。
【0124】
B.1つ以上の生物学的サンプルの取得
同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の投与後または投与と投与の間に、生物学的サンプルが取得される。RCTの肝臓成分または排出成分を測定する場合、サンプルは好ましくは糞便胆汁酸および糞便中性ステロールを含有する。生物学的サンプルの数、それらの頻度、およびそれらの時期は様々な要因によって変更しうる。このような要因は、生物学的サンプルの性質、サンプリングの容易さおよび安全性、対象となるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の生物学的速度定数または代謝挙動、ならびに被験体に施行される候補治療法の性質を含むが、それらに限定されない。サンプルは1つだけでもよい。それは同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の投与の間に採取されてもよく、または投与後に採取されてもよい。投与後に採取される場合、サンプルは投与後直ちに採取されてもよく、または投与後サンプリングの前に一定期間が経っていてもよい。1つの実施形態では、糞便、尿、および血液を含む、複数の生物学的サンプルが被験体から採取されうる。別の実施形態では、血液の単一の生物学的サンプルが取得されうる。生物学的サンプルは、上述のように広範に処理されうる。1つの実施形態では、胆汁酸および胆汁中性ステロールは生物学的サンプルから単離され、質量分析のために誘導体化されうる。
【0125】
C.胆汁酸および中性ステロールの同位体含量または同位体パターンの測定
胆汁酸および中性ステロールの同位体含量または同位体パターンが測定され、胆汁酸および中性ステロールのAPEまたはMPEを決定するために、投与前の胆汁酸もしくは中性ステロールの同位体含量または同位体パターンと比較されうる。このAPEまたはMPEはその後、胆汁酸もしくは中性ステロールに対する最大限可能なAPEまたはMPEと比較される(この最大値は、被験体において適切な期間後、胆汁酸もしくは中性ステロールに変換されている同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンを測定することによって決定されうる)。それはまた、過去のデータから算出されてもよく、または文献に由来してもよい。対象となる胆汁酸もしくは中性ステロールに対して観察されたAPEまたはMPEを、同一の胆汁酸もしくは胆汁中性ステロールの最大限可能なAPEまたはMPEで割ると、RCTに由来する胆汁酸または胆汁中性ステロールの割合を生じる。同位体標識コレステロールもしくはコレステロール関連分子の中性ステロールへの輸送または変換もまた算出される。このように、RCTの肝臓成分または排出成分(図1)が測定され得る。
【0126】
さらに、生物学的サンプルが糞便である場合、コレステロール自体の同位体含量または同位体パターンが測定されうる。
【0127】
糞便コレステロールは、RCTによって体から除去されるコレステロールの重要な部分に相当する。上述のように、糞便コレステロールの同位体含量または同位体パターンは、生物学的サンプルが糞便である場合に測定され得る。一旦分泌されると、腸管腔のコレステロールの一部は消化管から再吸収され、循環コレステロールの血漿プールに再度加わる。腸内コレステロールと血漿中の循環コレステロールとの混合は、排出コレステロールの同位体含量または同位体パターンが糞便以外のいずれの生物学的サンプルにおいても正確に直接測定できないことを意味する。この制限を克服するために、代わりに、腸に特異的なコレステロールの代謝産物の同位体含量または同位体パターンが非糞便生物学的サンプルから測定され得る。胆汁コレステロールは、消化管微生物によって、コプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノールを含む多数の代謝産物に変換される。これらのコレステロール代謝産物もまた再吸収され、全身に分布し、血液や尿を含むがそれらに限定されない他の組織および体液に向かう。1つの実施形態では、これらのコレステロール代謝産物の同位体含量または同位体パターンは尿において測定される。別の実施形態では、これらのコレステロール代謝産物の同位体含量または同位体パターンは血液において測定される。このようなコレステロール代謝産物の同位体含量または同位体パターンは、胆汁コレステロールにおいて見いだされるものと同一であり、このような測定は、糞便中の胆汁コレステロールの同位体含量または同位体パターンの直接測定に代わり得る。別の実施形態では、腸に特異的なコレステロール代謝産物および胆汁酸の同位体含量または同位体パターンの両方が、単一の尿サンプルから測定される。
【0128】
同位体含量または同位体パターン、合成速度または変換速度、およびMPEまたはAPE値は、上述のように決定される。
【0129】
D.胆汁酸プールサイズの測定
総胆汁酸量(胆汁酸プールサイズ)は、RCTの肝臓成分または排出成分の測定と同時、測定前または測定後に測定されうる。これは、実施者が異なる胆汁酸プールサイズを有する異なる被験体間で結果を比較することを可能にする目的を果たし、胆汁酸に変換された対象となる同位体標識コレステロールまたはコレステロール関連分子の絶対質量の決定を可能にする。この絶対質量は、投与された同位体標識コレステロールまたはコレステロール関連分子に由来する胆汁酸の割合(上述のように決定される)に胆汁酸プールサイズを乗じた積である。
【0130】
胆汁酸プールサイズは、例えば希釈法によって測定され、そこでは、既知量の同位体標識胆汁酸が被験体に投与され、一定期間後、被験体における胆汁酸の同位体含量または同位体パターンが単一のサンプルまたは複数のサンプルから測定される。同位体標識胆汁酸の希釈量(すなわち、問題となっている胆汁酸に対するAPEもしくはMPEの減少)またはAPEもしくはMPEの減少速度を示す曲線からの逆外挿(back-extrapolation)は、被験体における胆汁酸の全質量を算出するために用いられる。
【0131】
1.同位体標識胆汁酸の投与
1種以上の同位体標識胆汁酸が被験体に投与されうる。胆汁酸プールサイズの測定をRCTの肝臓成分または排出成分の測定と同時に行う場合、同位体標識胆汁酸は、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体とは異なる形で標識される。例えば、胆汁酸は4つの重水素(2H)原子で標識され、コレステロールは2つの13C原子で標識される。胆汁酸およびコレステロールまたはコレステロール関連分子またはコレステロール関連複合体が異なる同位体で標識される限り、任意の数の同位体が使用されうる。あるいは、胆汁酸は同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体と同一の同位体で標識され得るが、コレステロールまたはコレステロール前駆体の投与に使用される方法と識別可能な方法で投与される(例えば、異なる時間、パルス、停止対連続、および当業者にとって周知の他の識別可能な特性)。
【0132】
適切な同位体標識胆汁酸は、コール酸、ケノデオキシコール酸、デオキシコール酸、およびリトコール酸を含む。1つの実施形態では、標識胆汁酸はコール酸またはケノデオキシコール酸でありうる。胆汁酸の標識に使用されうる同位体は、2H、13C、または18Oを含むが、それらに限定されない。
【0133】
同位体標識胆汁酸は、同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体と同時に、またはそれとは別に投与されうる。同位体標識胆汁酸は、適切な担体中、既定の容量および同位体含量または同位体パターンで投与される。適切な担体は、食塩溶液、トリグリセリドエマルジョンおよびイントラリピド(intralipid)を含む。標識胆汁酸の被験体への投与は、上述のようなあらゆる経路によって行われうる。1つの実施形態では、胆汁酸は経口投与される。
【0134】
2.生物学的サンプルの取得
一定期間後、胆汁酸を含有する生物学的サンプルが取得される。同位体標識胆汁酸の投与と生物学的サンプルの採取との間の期間は、投与経路および投与方法、被験体の性質(例えば、被験体の動物種または病状)、同位体標識胆汁酸の選択、ならびに当業者にとって既知の他の要因に応じて変更しうる。生物学的サンプルは、血液、糞便、尿、または任意の他の種類の生物学的サンプルでありうる。生物学的サンプルは、他の同位体含量または同位体パターンの測定のため、例えばRCTの肝臓成分もしくは排出成分の測定(上記のII−B項参照)などのために採取されたものと同一のサンプルであってもよい。
【0135】
採取されたら、サンプルは処理または部分的に処理されてもよく、胆汁酸は上述のように精製、単離、または部分精製されうる。一般的に、このような操作は当技術分野において知られている。
【0136】
3.胆汁酸の同位体含量または同位体パターンの測定
生物学的サンプル中の胆汁酸の同位体含量または同位体パターンは、上述のように測定され、算出される。対象となる胆汁酸は、被験体に投与される同位体標識胆汁酸の性質に基づいて決定される。例えば、被験体が既知量および既知濃度の2H4−コール酸を投与される場合、対象となる適切な胆汁酸はコール酸であり、M4アイソトポマーのMPEが決定される。あるいは、2HのAPEが決定されてもよい。
【0137】
4.胆汁酸プールサイズの算出
被験体における胆汁酸のプールサイズは、下記の方程式を用いて決定されうる。すなわち、
【数7】

【0138】
であり、式中、質量(g)admは被験体に投与された同位体標識胆汁酸のグラム表示での質量であり、MPEadmは投与された安定同位体標識胆汁酸の超過モル百分率であり、MPEsampleは生物学的サンプル中の同一の胆汁酸アイソトポマーのピークまたは最大の超過モル百分率である。
【0139】
この方程式の代替形式は、
【数8】

【0140】
であり、式中、質量(g)admは被験体に投与された同位体標識胆汁酸のグラム表示での質量であり、APEadmは投与された同位体標識胆汁酸中の同位体標識胆汁酸を標識するために使用された同位体の超過原子百分率であり、APEsampleは生物学的サンプル中の同一の胆汁酸内の同一の同位体のピークまたは最大の超過原子百分率である。
【0141】
あるいは、血流中の同位体標識胆汁酸の同位体富化のピークは、当技術分野において周知の方法によって、標識減衰曲線の形から推定され得る。体内の胆汁酸のプールサイズはその後、希釈法によって算出され得る。
【0142】
E.胆汁酸、中性ステロールおよびコレステロールに対するde novoコレステロール合成の寄与の測定
任意選択で、RCTの肝臓成分または排出成分の測定と同時に、胆汁酸、中性ステロールおよびコレステロールに対するde novo合成コレステロールの寄与が測定されうる。RCTの肝臓成分または排出成分の一部では、コレステロールおよび/またはコレステロール関連分子および/またはコレステロール関連複合体は、胆汁酸に変換され、または中性ステロールとして分泌され、その過程の測定は上記のII−A〜II−C項に記載される。しかし、いくらかの胆汁酸および中性ステロールは、他の組織から除去された既存のコレステロールに由来するのではなく、むしろRCTの測定期間に肝臓または他の組織においてde novo合成されたコレステロールに由来する。de novoコレステロール合成はまた、本明細書に記載されるような同位体に基づく方法によって測定され得る過程である。de novoコレステロール合成の測定およびその胆汁酸に対する寄与の測定は、候補治療法が疾患に影響を及ぼす方法の理解に関連し、個体におけるRCT流に関して補足的または補助的な情報を提供しうる。RCTの肝臓成分または排出成分および胆汁酸もしくは中性ステロールに対するde novoコレステロール合成の寄与の被験体での同時測定は、RCTの肝臓成分または排出成分の測定を改善する。RCTの肝臓成分または排出成分に由来する胆汁酸および中性ステロールは、上記のII−A〜II−C項に記載されたように測定される。de novoコレステロール合成に由来する胆汁酸は、下記に記載されるように測定される。残りの胆汁酸は、既存の、すなわち実験の開始時に既に存在している胆汁酸に由来する。
【0143】
de novoコレステロール合成の測定およびその胆汁酸、中性ステロールまたはコレステロールに対する寄与の測定は、1種以上の同位体標識コレステロール前駆体の投与によって測定される。1種以上の同位体標識コレステロール前駆体の投与間もしくは投与後の、一定期間後、胆汁酸、中性ステロールまたはコレステロールを含有する1つ以上の生物学的サンプルが採取される。これらのサンプル中の胆汁酸、コレステロール、中性ステロール、もしくはコレステロール代謝産物の同位体含量または同位体パターンは上述のように測定され、結果として生じるデータは新たに合成されたコレステロールに由来する胆汁酸の割合または質量を算出するために使用される。
【0144】
1.同位体標識コレステロール前駆体の投与
1種以上の同位体標識コレステロール前駆体の投与方法は、同位体標識コレステロール前駆体の吸収特性およびそれが標的とする特定の生合成プールにより異なりうる。前駆体は、上記において以前に企図された任意の経路を介して、または当技術分野において既知の他の経路によって投与されうる。
【0145】
1つの実施形態では、投与方法は、生合成プール内および/または少なくとも一時的な期間このようなプールを供給する貯蔵部に、定常状態レベルの前駆体を生じるものである。血管内投与または経口投与経路は、このような前駆体を被験体に投与するために一般的に使用される。任意で徐放性基質組成物とともに使用される場合、皮下投与または筋肉内投与などの他の投与経路もまた適切である。注射用組成物は通常、滅菌した医薬品賦形剤で調製され、それらは当業者によく知られている。
【0146】
本明細書において議論されるように、投与は連続的に(例えばサンプリング時までおよび/もしくはそれを含んで)または不連続的に(長期間の単回投与もしくは反復投与のいずれかとして)行われ得る。不連続投与が行われる場合、個々の投与時間は同一であり得、または異なり得る。
【0147】
同位体標識前駆体の例は、米国特許出願第11/064197号(参照によりその全文が本明細書に組み入れられる)、特に「precursor molecules (isotope-labeled substrates)」と題されたIV−B−1−a−2項、および「Method for measuring in vivo synthesis of biopolymers」と題された米国特許第5,338,686号(参照によりその全文が本明細書に組み入れられる)において詳細に議論される。同位体標識コレステロール前駆体は、被験体に投与された場合、de novo合成コレステロールへの同位体の取り込みをもたらす安定同位体標識分子でありうる。同位体標識コレステロール前駆体は、同位体標識前駆体に由来するコレステロール、中性ステロールまたは胆汁酸分子が、RCTの肝臓成分もしくは排出成分の測定(上記のII−A〜II−C項)のために投与された同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体に由来するものとは同位体的に異なり、また胆汁酸プールサイズの測定(上記のII−D項)のために投与された同位体標識胆汁酸とも同位体的に異なるように選択される。あるいは、同様の識別が行われることを可能にするために、同位体標識コレステロール前駆体の投与の時期および投与経路は変更されうる。1つの実施形態では、同位体標識コレステロール前駆体は重水素標識水(2H2O)である。別の実施形態では、同位体標識コレステロール前駆体はH218Oである。
【0148】
2.1つ以上の生物学的サンプルの取得
一定期間後、胆汁酸、胆汁中性ステロールまたはコレステロールを含有する1つ以上の生物学的サンプルが取得されうる。同位体標識コレステロール前駆体の投与と生物学的サンプルの採取との間の期間は、投与経路および投与方法、被験体の性質、同位体標識コレステロール前駆体の選択、ならびに当業者にとって既知の他の要因に応じて変更しうる。1つ以上の生物学的サンプルは、血液、糞便、尿、または任意の他の種類のサンプルでありうる。1つ以上の生物学的サンプルは、RCTの肝臓成分もしくは排出成分の測定(上記のII−B項参照)のため、または胆汁酸プールサイズの測定(上記のII−D項参照)のためなどの、他の同位体含量あるいは同位体パターンの測定のために採取されたものと同一のサンプルでありうる。
【0149】
採取されたら、サンプルは処理または部分的に処理されてもよく、胆汁酸は上述のように精製、単離、または部分精製されうる。一般的に、このような操作は当技術分野において知られている。
【0150】
3.胆汁酸もしくは中性ステロールの同位体含量または同位体パターンの測定
対象となる分子(胆汁酸もしくはコレステロールもしくは他のコレステロール関連分子もしくはコレステロール関連複合体)の同位体含量または同位体パターンは、上述のように測定され、算出される。胆汁酸に対するde novoコレステロール合成の寄与は、胆汁酸の同位体含量または同位体パターンの測定によって測定される。中性ステロールに対するde novoコレステロール合成の寄与は、中性ステロールの同位体含量または同位体パターンの測定によって測定される。1つの実施形態では、両方が測定される。
【0151】
本開示の1つの態様では、胆汁酸および腸管微生物の胆汁コレステロールに対する作用に由来するコレステロール代謝産物の同位体含量または同位体パターンが、尿および血液において測定される。上述のように、非糞便生物学的サンプル中のコレステロールは、糞便コレステロールの同位体含量を測定するために直接分析されることはできない。しかし、遊離コレステロールは、消化管微生物によってコプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノールを含む多数の代謝産物に変換される。これらもまた再吸収され、他の組織および血液または尿を含む体液中に出現する。これらの代謝産物は腸コレステロールからしか生じないため、腸コレステロールを反映する同位体含量または同位体パターンを有する。従って、尿中のこれらのコレステロール代謝産物の同位体含量または同位体パターンの測定は、胆汁コレステロールもしくは他の中性ステロールの同位体含量または同位体パターンの測定方法に相当する。
【0152】
4.胆汁酸および中性ステロールに対するde novoコレステロール合成の寄与の算出
胆汁酸もしくは中性ステロールもしくは胆汁コレステロール代謝産物の同位体含量または同位体パターンを、測定されたもしくは既知の同位体標識コレステロール前駆体の濃度と比較することにより、新たに合成された中性ステロールの割合、または新たに合成されたコレステロールに由来する胆汁酸の割合を決定しうる。割合の算出は、上述のように、または米国特許出願第11/064197号(参照によりその全文が本明細書に組み入れられる)および「Method for measuring in vivo synthesis of biopolymers」と題された米国特許第5,338,686号(参照によりその全文が本明細書に組み入れられる)に既述されたように行われる。このような計算はまた、当業者にとって既知の多数の出版物に広く記載されている。
【0153】
F.RCTの肝臓成分または排出成分の活性の算出
RCTの肝臓成分または排出成分の活性(すなわち、コレステロール関連分子もしくはコレステロール関連複合体を含む投与されたコレステロール、または血中コレステロールの、対象となる排出ステロール生成物への変換速度または分泌速度;分泌される、コレステロール関連分子もしくはコレステロール関連複合体を含むコレステロール、または血中コレステロールの質量;あるいはRCTに由来する胆汁酸および/または中性ステロールの割合)は、単離された胆汁酸もしくは中性ステロールの同位体含量または同位体パターンを用いて算出されうる。胆汁酸の同位体含量または同位体パターンは、被験体に投与された同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の総量と比較されうる(すなわち、投与された標識の対象となる生成物中への同位体回収)。胆汁酸プールサイズのデータが利用できる場合、投与された標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の胆汁酸中への回収は、胆汁酸プールの質量を乗じて、RCTの肝臓成分または排出成分により輸送された質量を与える。利用可能な場合には、異なる標識コレステロール前駆体に由来する胆汁酸の同位体含量または同位体パターンは、同様の方法で、胆汁酸合成に対するde novo合成コレステロール(DNC)の寄与を算出するために使用され得る。RCTおよびDNCからの糞便中性ステロールに対する寄与は、同様に算出される。
【0154】
III.RCTの血漿成分の測定
RCTの血漿成分は様々な代謝および輸送ステップを含む(図3)。RCTの血漿成分の測定は、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与、およびそれに続く異なるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンの測定によって行われる。この「異なる」コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、投与された分子のin vivo変換産物である;すなわち、それはin vivoで生成される。このようにしてRCTの特定の成分の活性または速度が測定され得る。例えば、コレステロールのコレステロールエステルへの変換(LCAT活性、図3)は、同位体標識コレステロールの投与、およびコレステロールエステルの同位体含量または同位体パターンの測定によって測定され得る。同様にコレステロールエステルのHDLからLDLまたはVLDLへの輸送(CETP活性、図3)は、HDLと複合した同位体標識コレステロールエステルの投与、およびLDLもしくはVLDL中のコレステロールエステルの同位体含量または同位体パターンの測定によって測定され得る。血漿RCTの複数のステップの合計は、例えば、HDLと複合した同位体標識コレステロールの投与、およびその後のLDLもしくはVLDL由来のコレステロールエステルの同位体含量または同位体パターンの測定によって測定され得る(すなわち、LCAT活性およびCETP活性の合計の同時測定)。
【0155】
RCTの血漿成分では、様々な種類のコレステロールまたはコレステロール関連分子またはコレステロール関連複合体が、異なる種類のコレステロールまたはコレステロール関連分子またはコレステロール関連複合体に変換される。RCTの血漿成分を測定するために、ある種類が投与され、別の種類(対象となる分子)が測定される。
【0156】
1.同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与
同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は上述のように投与される。任意の投与方法、投与経路、または任意の同位体標識の量が、上述のように使用されうる。1つの実施形態では、投与経路は静脈内である。標識分子または複合体の選択は、RCTの血漿成分のどの部分を測定したいかによって行われる。
【0157】
2.1つ以上の生物学的サンプルの取得
一定期間後、生物学的サンプルが取得される。取得される生物学的サンプルの性質および時期は、RCTの血漿成分のどの部分を測定しているかによって決定される。好ましい実施形態では、生物学的サンプルは血液サンプルである。複数の生物学的サンプルが取得されうる。
【0158】
3.対象となる分子の同位体含量または同位体パターンの測定
同位体含量または同位体パターンは、上述のように対象となる分子について測定される。対象となる分子は投与された同位体標識分子または複合体のin vivo変換産物である。
【0159】
4.RCTの血漿成分の速度の算出
標準的な前駆体−生成物の関係は、投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体と下流の対象となる分子との間にも存在しうる。このような関係は当技術分野においてよく知られている。前駆体プール同位体含量または同位体パターンは、投与された標識の量に基づいて推定されるか、または過去のデータもしくは他のデータの使用によって決定されるかのいずれかであり、あるいはそれは直接測定される。投与された同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の、対象となるコレステロールまたはコレステロール関連分子またはコレステロール関連複合体に対する寄与率は、上述のように決定される。
【0160】
IV.要約:
A.希釈法およびプラトーの原則の使用による、組織から血液へのコレステロール流出/動員速度の算出
注入されたトレーサーの希釈は、その中に注入される(またはそれと迅速に連絡している)プールの出現(Ra、流出、代謝回転)速度を示し、同位体プラトーが実現され実証され得る場合、確実に行われる。代謝研究では、この多数の一般的な例が存在する(例えば、Raグルコース、FA、グリセロール、アミノ酸)。しかし、このアプローチは、いくつかの理由から以前にはコレステロールに対して使用されたことがなかった。第一に、複雑な調節性のコレステロール流出系(輸送体、血漿アクセプター、ドッキングタンパク質など)の発見以前には、Raコレステロールを測定する生理学的な論理的根拠がなかった。第二に、コレステロールは生理食塩水に難溶性であるため、持続注入によって投与することが容易ではない。さらに、血漿コレステロール特異的活性または富化においてプラトーに達するために必要とされる時間もまた不明であり、数日または数週間かかるかもしれないと思われていた。
【0161】
重要な発見は、ヒトおよび実験動物における血漿コレステロール富化におけるプラトーの観察であった。プラトーの達成(下記および図5参照)は、機能的に分離した、測定可能な代謝回転の速いプールの存在を支持し、末梢組織から血液と連絡しているこの代謝回転の速いプール(図4)へのコレステロールのRaまたは流出/動員速度の算出を可能にする。これは方法論上主要な発見である。
【0162】
別の重要な発見は、流出/動員(Ra)および排出効率を測定するために、標識コレステロールはHDL複合体または他のリポタンパク質関連粒子の形で投与される必要はなく、遊離コレステロールの形で投与され得ることである(下記および図5参照)。
【0163】
流出速度(Ra)は、1時間当たりに、大きな細胞内貯蔵プールから代謝回転の速いプールに入る分子数、すなわち貯蔵プールに出入りする動員された遊離コレステロール(「フラッシュ速度(flush-rate)」)を表す。これは、それ自体で重要な新しいRCTの測定基準であり(図1および3〜7)、末梢組織全体にわたる流入/流出への糞便ステロール中への標識回収の修正をも可能にする(下記参照)。
【0164】
そのデータはまた、コレステロールを用いた組織の食餌負荷による調節を実証する(図7)。Raおよびプールサイズはともに、ヒトにおいて妥当ではあるが過度ではない個人差を示し(例えば、多くの調節性生理的パラメータと一致する、約20%の標準偏差(図6A))、それが改変可能なパラメータであることを示唆する。また、プールサイズ(Ra/kとして算出され得る)も約5〜10gであり、Schwartzのデータ(6g(Schwartzら、J Clin Invest))と一致する。
【0165】
B.末梢組織を超える流入/流出に対する糞便ステロール中への標識コレステロール排出効率の補正
投与された血漿コレステロールの糞便中への標識回収は、排出効率および血漿コレステロールから糞便ステロール中への流速を示す(RCTの部分2、図1参照)。しかし、この測定は、血漿コレステロール代謝回転(組織からおよび組織への流出/流入)の変化によって混乱させられる可能性がある。投与された標識が個体において代謝回転の遅い組織プールに迅速に出入りして交換される場合(すなわち、流出/流入速度が大きい場合)、例えば、血漿中の標識は組織中に失われ、非標識コレステロールに置換されるため、糞便ステロール中に回収されないであろう(図9A)。これは小さい回収速度として解釈されるであろう。しかし、この状況は、実際には抗アテローム硬化リスクに関して良いこと(組織からのより高いコレステロール動員速度またはフラッシュ速度(flush-rate))であるかもしれず、個体における包括的RCT過程の効率に対して不利に作用しないはずである。従って、標識された血漿コレステロール排出の任意の機能的指標は、好ましくは組織全体にわたる流出/流入へと修正すべきである(図9B)。これらの考慮はまた、コレステロール標識を細胞中に投与する方法(例えば、ex vivoで標識されたマクロファージ)にも当てはまる。
【0166】
C.「包括的RCT」パラメータの算出
本明細書において開示されるように、流出/動員速度を糞便ステロール中への標識回収効率と組み合わせることによって、「包括的RCT」パラメータが測定され得る(図9B〜C、図10〜13)。この包括的RCT測定基準は、ヒト被験体を含む生体において組織から糞便までのコレステロール流の総合的な測定を提供する。
【0167】
包括的RCT流は、最終的に糞便ステロールとして排出される組織からのコレステロール流出を表す。これは、糞便ステロールとして回収される血漿コレステロール分子の割合を乗じた、1日当たりに血漿プールに入るコレステロール分子数として直感的に理解され得る。この測定基準が組織から血流を介して体外へのコレステロール流速−包括的RCTの定義を表すことは、当業者に理解され得る。
【0168】
加えて、このパラメータは、生物全身での包括的RCT流に対する潜在的な治療薬の効果を解析するために広く使用された(下記の実施例参照)。
【0169】
D.RCTを増加させる治療薬の作用部位を分析するための、包括的RCTパラメータのRCTの2つの部分への分割
本明細書において開示されるように、RCTを増加させる治療薬の作用部位を分析するために、包括的RCTパラメータを2つの成分(流出/動員および排出、図9Cおよび図10〜13)に分割することが有用であることも発見された。薬物または症状によってRCTのどちらの特徴が変化するかを知ることは、創薬または被験体研究において非常に有用であり得る。この実施例が提供される(図10〜13および下記参照)。
【0170】
IV.さらなる実施形態
本明細書に記載される方法は、実施者の好みに応じて様々な方法で実施されうる。これらの実施形態の一部は下記において議論されるが、それらは限定することを意図しない。
【0171】
A.RCTの流出成分の測定
本発明の1つの実施形態では、RCTの流出成分は、ヒトもしくは実験動物モデルにおいて脂質エマルジョン中の13C2標識コレステロールの定速での静脈内注入によって測定され、血中総コレステロールの同位体含量または同位体パターンは、同位体プラトーを解析する必要に応じて、または簡易には約12〜18時間、約1〜2時間毎に測定される。血中総コレステロールまたは血漿遊離コレステロールまたはリポタンパク質結合タンパク質が精製され、同位体含量または同位体パターンがGC/C−IR/MSもしくは他の当技術分野において既知の方法によって測定され、その後13Cの超過原子百分率として表される。流出速度はその後上述のように算出される。
【0172】
本明細書において開示されるように、いくつかの重要な発見が、ヒトを含む生体の細胞からのコレステロール流出速度の測定を可能にする。すなわち、(1)希釈法による流量の測定は、「プラトーの原則」が利用できる場合に最適に行われる。この原則は、基本的には、トレーサーの持続注入の間の同位体プラトー到達は、単に到達した同位体富化または比放射能から内在性プールの代謝回転(出現速度、流量)の算出を可能にするということを述べる。血漿コレステロールが、このアプローチによる流量の算出を可能にするために妥当な期間にわたって同位体プラトーを実現するかどうかは、以前には知られていなかった。本明細書において開示されるように、この状況はヒトと動物被験体との両方において実際に当てはまる(図5および下記参照)。(2)血漿コレステロールプールの流出速度または出現速度は、流量およびプールサイズに関する今までの間接的な発見と一致する範囲内(ヒトでは約10mg/kg/hr、図6A)であることが発見された。また(3)流出速度は、予期されるように組織コレステロール負荷によって影響を受ける(図7および下記参照)。
【0173】
本発明の別の実施形態では、血漿リポタンパク質の特定のサブクラス(例えば、小型もしくは大型HDL粒子)中へのRCTの流出成分が、ヒトまたは実験動物モデルにおいて脂質エマルジョン中の13C2標識コレステロールの定速での静脈内注入によって測定される。対象となる血漿リポタンパク質粒子中のコレステロールの同位体含量または同位体パターンは、約12〜18時間、約1〜2時間毎に測定される。遊離コレステロールが精製され、同位体含量または同位体パターンがGCC−IR−MSもしくは他の当技術分野において既知の方法によって測定され、その後13Cの超過原子百分率として表される。血漿リポタンパク質の特定のサブクラス中への流出速度は、その後上述のように算出される。
【0174】
B.RCTの肝臓成分または排出成分の測定
本発明の別の実施形態では、RCTの肝臓成分または排出成分は、ヒトにおいて脂質エマルジョン中の13C2標識コレステロールを静脈内経路で投与することによって測定される。尿または糞便の生物学的サンプルは、ボーラス投与の前、およびその後28日までの期間毎日採取される。コール酸およびデオキシコール酸、ならびに中性ステロールが尿または糞便サンプルから精製され、その後GCC−IRMSまたは同位体含量もしくは同位体パターンを検出するための他の当技術分野において既知の方法によって分析される(図8A)。同位体含量または同位体パターンは13Cの超過原子百分率(APE)として表される。13C2標識コレステロールの投与前に測定されるコール酸の同位体含量または同位体パターンはベースライン値として用いられ、最大限可能なAPEは被験体に投与される13C2標識コレステロールの量ならびに被験体の体重および身体組成に基づいて推定される。胆汁酸として回収される投与された13C2標識コレステロールの割合、投与された13C2標識コレステロールの胆汁酸または中性ステロールへの総変換速度、および血漿コレステロールに由来する胆汁酸の割合はその後、上述のように算出される(図8B)。
【0175】
C.胆汁酸プールサイズの測定を含むRCTの肝臓成分または排出成分の測定
本発明のさらに別の実施形態では、RCTの肝臓成分または排出成分は、例えばヒトにおいて脂質エマルジョン中の13C2標識コレステロールの静脈内ボーラスを投与することによって測定される。加えて、既知量の2H4−コール酸が経口投与される。尿の生物学的サンプルは、ボーラス投与の前、およびその後28日までの期間毎日採取される。血液の生物学的サンプルは、標識投与前(0日目)および標識投与後2、4、7、14日目に採取される。コール酸は標識投与後0〜48時間の間に採取された血液サンプルから精製され、コール酸の2H同位体含量または同位体パターンはGC/MSもしくは他の当技術分野において既知の方法によって測定され、M4イオンの超過モル百分率として表される。コレステロールはすべての血液サンプルから精製され、13C同位体含量または同位体パターンはGCC−IRMSもしくは他の当技術分野において既知の方法によって測定され、13CのAPEとして表される。コール酸は尿から精製され、13C同位体含量または同位体パターンはGCC−IRMSもしくは他の当技術分野において既知の方法によって測定され、13CのAPEとして表される。血中コール酸の2H同位体含量または同位体パターンは、胆汁酸プールサイズを算出するために用いられる。胆汁酸として回収される投与された13C2標識コレステロールの割合、投与された13C2標識コレステロールの胆汁酸への総変換速度、および血漿コレステロールに由来する胆汁酸の割合は、ベースライン値として用いられる0日目の尿中コール酸の13C同位体含量または同位体パターン、および尿中コール酸について最大限可能な13CのAPEを決定するために用いられる血中コレステロールの13C同位体含量または同位体パターンとともに、尿中コール酸の13C同位体含量または同位体パターンを用いて決定される。これらの値はその後、質量排出速度(これは当技術分野において既知の簡単な方法によって直接測定される)と組み合わされることにより、実験期間中の胆汁酸および胆汁ステロールへの血中コレステロール変換速度または輸送速度が算出される。これは下記の単位を有する質量変換速度(流量)として表されうる。
【数9】

【0176】
この量はRCTの肝臓成分または排出成分を介した流量を表す。
【0177】
D.胆汁酸プールサイズの測定ならびにde novoコレステロール合成およびその胆汁酸への寄与の定量を含むRCTの肝臓成分または排出成分の測定
さらに別の実施形態では、RCTの肝臓成分または排出成分は、上記のIV−C項に記載されるように測定される。加えて、好ましい実施形態では、被験体は約70%の重水の複数回経口投与を受ける。13CのAPEおよびM1のMPEは、尿中コール酸に対して測定される。13CのAPEおよびM1のMPEは、尿中胆汁中性ステロール代謝産物に対して測定される。血液中の重水の濃度もまた血液サンプルから測定されうる。胆汁酸および中性ステロールに対するde novo合成コレステロールの寄与はその後、M1 MPE、0日目のM1 MPE(ベースラインとして)、および血液中の重水(同位体標識コレステロール前駆体)の濃度に基づいて算出される最大限可能なM1 MPEを用いて決定される。これらの算出は上述のように行われる。
【0178】
この実験に由来するデータは、RCTの肝臓成分もしくは排出成分に由来する胆汁酸および中性ステロールの質量または割合、de novo合成コレステロールに由来する胆汁酸および中性ステロールの質量または割合、ならびに、研究の開始前に被験体に存在していた、もしくは研究の開始前に被験体に存在する胆汁酸および中性ステロールに由来する胆汁酸および中性ステロールの質量または割合を算出するために使用され得る。
【0179】
この実験に由来するデータはまた、組織から出るすべてのコレステロールは組織中でのコレステロールのde novo合成によって定常状態で平衡が保たれなければならないという原則に基づき、組織からのRCT速度の補足的な証拠としても使用され得る。従って、末梢組織からのコレステロールの流出および/または体からのコレステロールの排出の証拠は、コレステロールのde novo合成速度の増加をもたらすと期待されうる(図14)。
【0180】
(当技術分野において既知の技術を用いて)排出速度が決定された場合、その後、RCTまたはDNCのいずれかに由来する胆汁酸および中性ステロールの排出速度が同様に算出され得る。
【0181】
E.RCTの流出成分および肝臓成分または排出成分の同時測定
さらに別の実施形態では、RCTの流出成分および肝臓成分または排出成分は同時に測定される。この場合には、被験体に投与される13C2標識コレステロールは、12〜18時間の持続静脈内注入として投与される。血液サンプルは、RCTの流出成分を測定するために注入の間1〜2時間毎に採取される。RCTの肝臓成分または排出成分の測定のための他の要素は、上述のように行われる(図10〜13)。
【0182】
F.RCTの血漿成分の測定
本発明のさらに別の好ましい実施形態では、RCTの血漿成分の一部(LCAT/CETP媒介性の成分)が測定される。HDLと複合した13C2−コレステロールは静脈内ボーラスとして被験体に投与される。血液サンプルは、ボーラス投与前、ボーラス投与後24時間まで2時間ごとに、およびより低い頻度でその後さらに3日後まで採取される。HDL、VLDLおよびLDLが血液サンプルから単離され、HDLコレステロール、LDLコレステロールエステル、およびVLDLコレステロールエステルの同位体含量または同位体パターンがGCC−IRMSによって測定される。コレステロールのコレステロールエステルへの変換およびコレステロールエステルのHDLからLDLまたはVLDLへの輸送はこの方法によって測定される。血漿RCTのLCAT成分はまた、同様にHDLコレステロールエステルの同位体含量または同位体パターンの測定によって特異的に測定されうる。
【0183】
G.動物におけるコレステロール輸送および代謝
上記の実施形態は、動物において上記にヒトのために記載されたような方法を用いて実施され得る。1つの実施形態では、動物はサルなどの霊長類である。別の実施形態では、動物は、ウサギ、モルモットまたはハムスターである。さらに別の実施形態では、動物はラットまたはマウスなどの齧歯類である。
【0184】
H.組合せ
上記の方法は、異なる同位体または同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体、同位体標識胆汁酸もしくは同位体標識コレステロール前駆体を用いて、様々な形に組み合わされうる。このような標識分子の様々な組合せが使用されうる。あるいは、様々な投与経路および投与方法、生物学的サンプリングの種類および時期、サンプル処理の方法、ならびに同位体含量分析の方法、データの算出方法、データの解析方法、ならびにデータの解釈方法が上記において企図され、実施者の要求に合うように組み合わされてもよく、それらは当技術分野の技術の範囲内である。
【0185】
V.本発明の生成物
本発明の実施を通じて、多数の生成物が生じる。特に、同位体標識成分を含有する対象となる分子が生じる。このような生成物は多くの形をとる。
【0186】
A.生物学的サンプル
本発明の実施は、対象となる分子を含有する生物学的サンプルの採取を伴う。対象となる分子の一部は安定同位体標識される。生成物は、対象となる分子のプール(例えば、1ミリグラムのデオキシコール酸)を含有し、そのうちのいくらかは同位体標識されている生物学的サンプルである。
【0187】
B.生物学的サンプルの一部
生成物はまた、本発明の方法の実施によって取得される生物学的サンプルに由来する、(分析のために)精製、単離、部分精製された、または誘導体化もしくは修飾された対象となる分子のプール(例えば、ヒトの尿から単離された500マイクログラムのコプロスタノール)でありうる。生成物は、対象となる分子を濃縮するため、または分析を妨害しうる不要な分子を除去するために調製された、生物学的サンプルの画分(例えば、血液のリポタンパク質画分)でありうる。
【0188】
C.対象となる標識分子
本発明によって生じる生成物はまた、特定の同位体標識分子を含む。このような分子の非限定的なリストは図15および16に示され、それらは様々な対象となる分子を図解し、13Cに関する標識位置を示す。本明細書に記載される実施形態は他の同位体によって標識されるものを含む様々な対象となる同位体標識分子を生じうるが、これらの特定の分子は、本発明の実施の間の13C2標識コレステロールの投与に由来する。
【0189】
本発明の使用
本発明の方法は、様々な目的のために使用されうる。例えば、本方法は、被験体においてRCTの成分の速度を測定するために使用されうる。次に、その速度は、アテローム生成および/もしくはアテローム硬化または冠状動脈性心臓病、末梢血管疾患および脳血管疾患を含む他のコレステロール関連疾患に対する、様々な候補治療法の効果を評価するために使用されうる。
【0190】
1つの態様では、本方法は、RCTに対する候補治療法の効果を決定するために使用されうる。候補治療法を被験体に施行した後、候補治療法の施行前後での被験体におけるRCTの1つ以上の成分の速度が比較されうる。被験体はアテローム硬化を有しても、有さなくてもよい。候補治療法の効果は、候補治療法の施行前後に測定される速度の変化(例えば、増加、減少、または差異なし)によって決定される。このような効果はまた、被験体の1群に候補治療法を施行し、他の群にプラセボ治療を施行するかまたは治療を施行せずに、2群でのRCTを比較することによっても測定され得る。同様に、候補治療法は1群に施行され、この群の流出成分はコレステロール流出に関する過去のデータと比較されてもよい。当業者にとって既知の他の種類の前臨床試験または臨床試験計画は、本発明の方法の実施の際に使用され得る。
【0191】
本発明の別の態様では、本方法は、創薬、薬剤開発および認可(DDA)計画において使用される。RCTに対する効果は、生体系が候補治療法または候補治療法の組合せを受けた後で観察される。作成され分析されたデータはDDAの方針決定過程を容易にする;すなわち、それは、(例えば、RCTデータが有望であると思われる場合)候補治療法のさらなる開発を続ける、または、例えば、RCTデータが好ましくないと思われる場合、試みを停止するという決断において方針決定に有用な情報を提供する。この方法により、提案された分子標的は、例えば、コレステロール輸送、および特にRCTに対する阻害または促進によって、それらの活性の変化の効果について評価され得る。コレステロール輸送、およびRCTにおける提案された分子標的の機能的重要性ならびに役割は、それによってヒトおよび実験動物において効率的に評価され得る。
【0192】
本発明のさらに別の態様では、本方法は、用量設定および/または用量の最適化に使用される。候補治療法は、様々な用量または投与計画にわたって被験体(動物もしくはヒト)に施行され、その後、候補治療法に対するRCTの用量反応に基づいて最適な用量が選択されうる。本方法はさらに、いずれの用量が、異なる種類の被験体、例えば、既にスタチン治療もしくはフィブラート治療を受けている被験体、またはRCTに対して有益な効果を持つために異なる用量の候補治療法を必要としうる、コレステロール代謝に遺伝的欠損を有する被験体に適しているかを決定するために使用されうる。
【0193】
本発明のさらに別の態様では、本方法は、処方開発のために使用される。候補治療法は様々な賦形剤中に処方されてもよく、または様々な経路で投与されうる。RCTに対する効果はその後、いずれの賦形剤または経路が最適であるかを決定するために使用される。例えば、候補治療法は、1日2回投与される場合、または食事時間に投与される場合、RCTの調節においてより効果的であることが見いだされるかもしれない。候補治療法はまた、徐放性製剤で与えられる場合により効果的であることが見いだされるかもしれず、または、迅速に吸収される単回投与で与えられる場合により効果的であることが見いだされるかもしれず、または、特定の賦形剤もしくは特定の賦形剤の比率によって処方される場合により効果的であることが見いだされるかもしれない。
【0194】
本発明のさらに別の態様では、本方法は、候補治療法の評価のための(例えば、臨床試験において)、または候補治療法に反応する彼らの能力について、被験体の選択を可能にする。コレステロール関連疾患の原因の範囲を考慮すると、特定の患者だけが所定の候補治療法に反応しうる可能性がある。この場合、本方法は、被験体が臨床試験に適しているか否かを決定するために使用され得る。例えば、高レベルの血漿HDLをも有する高コレステロール血症の被験体は、RCT治療に対して有利に反応しないかもしれない。このような被験体は臨床試験から除外されうる。同様に、被験体を治療するために使用されている候補治療法(すなわち、ヒトでの使用が認可されている候補治療法−候補治療法のサブクラス)に関して、本発明の方法は、臨床医が特定の被験体または被験体に対する特定の候補治療法の妥当性を決定することを可能にする。
【0195】
本発明のさらに別の態様では、本方法は、当業者が1群の候補治療法(例えば、同一のリード化合物に由来する複数の候補治療法、もしくは部分的に開発されている複数の候補治療法、もしくは同一の化合物ライブラリー由来の複数の候補治療法)から最適な候補治療法を同定、選択、および/または特性化することを可能にする。同定、選択、および/または特性化された時点で、当業者は、本発明の方法によって作成された情報に基づいて、最適な候補治療法をさらに開発もしくは評価すること、または製薬会社もしくはバイオ企業などの他の企業に候補治療法の使用を許諾することを決定しうる。
【0196】
さらに別の態様では、本発明の方法によって作成されたデータは、1つ以上のコレステロール関連疾患の根本的な分子病態論または原因の理解に関連しうる。別の態様では、本発明の方法によって作成されたデータは、対象となるコレステロール関連疾患の発生、進行、重症度、病理学、攻撃性、悪性度、活動性、障害、死亡率、罹患率、疾患の下位分類、または根本的な病原性もしくは病理学的特性の基本的な特徴を解明しうる。
【0197】
さらに別の態様では、本発明の方法によって作成されたデータは、対象となるコレステロール関連疾患の予後、生存率、罹患率、死亡率、病期、治療効果、症状、障害または他の臨床学的要因の基本的な特徴の解明を提供しうる。
【0198】
別の態様では、本方法は、RCTを含むコレステロール代謝および輸送に対する食餌変更の効果を評価するために使用されうる。上述のものと同様に、その効果は、食餌変更の前後に測定されるRCTの1つ以上の成分の速度における変化(例えば、増加、減少、または差異なし)によって決定される。
【0199】
別の態様では、本方法は、コレステロール代謝および輸送に対する運動の効果を評価するために使用されうる。
【0200】
別の態様では、候補薬剤の投与、食餌変更、および/または運動などの候補治療法の組合せが本発明の方法の使用によって評価されることにより、RCTの1つ以上の成分の速度に対してこのような候補治療法の組合せを評価しうる。
【0201】
さらなる態様では、本発明は、本発明の方法を実施するためのキットを提供する。キットは、様々な同位体濃度および事前に測定された容量で、同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体、同位体標識胆汁酸、または同位体標識コレステロール前駆体、またはそれらの組合せなどの成分を含むように構成されうる。キットは、キット成分の使用説明書およびコレステロール希釈の算出方法の説明書とともに包装されうる。
【0202】
様々な同位体標識成分の投与のための用具(例えば、計量カップ、針、注射器、ピペット、IVチューブ)などの他のキット構成部品は、任意選択でキット内に提供されうる。同様に、被験体からサンプルを取得するための器具(例えば、試料カップ、針、注射器)もまた、任意選択で提供されうる。
【0203】
下記の実施例は、本発明の方法がヒトおよび動物においてコレステロール逆輸送の様々な成分を測定するために使用されうることを示すために提供される。当業者は、特定の実施形態が説明され、記載されているが、それらが本発明の限定を意図していないことを認識するであろう。
【実施例】
【0204】
実施例1
ヒトにおけるRCTの流出成分の測定
序論
RCTの流出成分は、組織および生物全身からのコレステロールの除去の第一段階である。
【0205】
方法
6人の健康なヒトボランティアに200mgの100%13C2−コレステロールを16.66mg/時間の速度で12時間静脈内投与した(図17A)。注入の間に6〜8回、各被験者から20〜40mlの血液を採取した。6人の被験者のうち5人については注入の直前に血液を採取した。当技術分野において既知の方法を用いた水性・有機溶媒抽出によって血清総コレステロールを単離した。その後、塩化アセチルを用いてコレステロールをそのアセチル誘導体に誘導体化し、石油エーテル中に抽出し、硫酸ナトリウムを用いて、窒素下で乾燥させ、トルエン中に再調製した。続いてそれを燃焼モードで稼動するMAT 253 Thermo-Finnigan IRMSに連結したAgilent model 6890ガスクロマトグラフに注入した。各サンプルのAPEを決定するために、データを既知の13C APEを有する一連の標準と比較した。
【0206】
図5は、3人の被験者に関する注入時間の関数としてのAPEデータを示す。3人の被験者すべてにおいて、血清総コレステロールの13C APEはプラトーに向かって上昇しているのが見て取れる。プラトー値は、標識コレステロールの内在性コレステロール流出による希釈を算出するために使用され得る定常状態富化の値に相当する。すべての被験者が実験の終わりまでに定常状態富化に達するとは限らないため、プラトーは利用可能なデータを下記のような指数曲線にフィッティングすることによって決定され、
【数10】

【0207】
式中、「a」はプラトー値である。
【0208】
内在性コレステロールによる希釈速度(すなわち、内在性コレステロールの出現速度)は下記の(および上述のような)方程式を用いて算出された。
【数11】

【0209】
例えば、被験者3は0.00138%のプラトー13C APE値を有し、16.66mg/時間の速度でコレステロールを投与された。注入されたコレステロールは27個の炭素のうち2個が標識されたので、測定された13C APEに対する倍率は27/2である(これは概念的には13C APEのコレステロールM2 MPEへの変換と考えることができる。このような倍率は当技術分野において知られている)。希釈速度方程式はその結果、下記のようになる:
【数12】

【0210】
結果および意義
コレステロール流出速度は、6人の被験者すべてに対して、記載したように測定した:
被験者ID 流出速度
001 891mg/hr
002 640mg/hr
003 647mg/hr
004 878mg/hr
005 979mg/hr
006 959mg/hr
これらの速度は各被験体でのRCTの第1の成分を表す。
さらに15人の被験者を研究し、プラトーフィットへの上昇から算出されるkおよびRaの両方についての測定の個人差を実証した(図6A)。
【0211】
この実験は、RCTの流出成分がヒトにおいて測定され得ることを説明する。その技術は正確であり、比較的迅速である。RCTの流出成分の測定は、RCTに対する様々な候補治療法の作用を評価するため、またはアテローム生成、アテローム硬化、もしくは動脈硬化の予防もしくは治療に対する様々な候補治療法の有用性を評価するために使用されうる。例えば、薬剤の投与前後で被験体におけるRCTの流出成分を比較することができる。被験体はアテローム硬化を有しても有しなくてもよい。候補治療法の効果は、候補治療法の施行前後に測定した場合のRCTの流出成分の変化(例えば、増加、減少、または差異なし)によって決定されるであろう。このような差異はまた、被験体の1群に候補治療法を施行し、他の群にプラセボ治療を施行するかまたは治療を施行せずに、2群でのRCTの流出成分を比較することによっても測定され得る。同様に、候補治療法を1群に施行し、この群の流出成分をコレステロール流出に関する過去のデータと比較してもよい。
【0212】
この方法によって特定された候補治療法は、重要な商業的価値を有する。
【0213】
実施例2
ヒトにおけるRCTの血漿成分の測定;コレステロールエステルの生成
序論
コレステロールの代謝および様々なキャリア分子間でのその輸送はRCTの重要な成分である。製薬産業にとって主要な現在の分子標的はCETPである(図1参照)。同様に、LCATの阻害はRCT経路を介するコレステロールの動きを有利に調節しうるため、LCATの活性の調節は、新規の治療法を開発するための合理的な標的である。本発明は、in vivoでのLCAT作用、CETP作用、または両方の作用の測定方法を含む、RCTの血漿成分の測定のための手段を提供する。
【0214】
方法
2人の健康なボランティアに脂質エマルジョンに懸濁された100mgまたは200mgの13C2−コレステロールの静脈内ボーラスを投与した。標識の投与後最初の24時間に3〜4回、ならびにその後、標識投与後約5日目および10日目に2回、20〜40mlの血液サンプルを採取した。各血液サンプルから、遠心分離とそれに続くメタノール/クロロホルム抽出およびその後の薄層クロマトグラフィー(TLC)よってコレステロールを単離した。同じ技術によるが、異なるTLC法を用いて、コレステロールエステルを単離した。コレステロールとコレステロールエステルはともに、上述のようにそれらの塩化アセチル誘導体に変換された。各サンプル由来のコレステロールおよびコレステロールエステルに対する13C APEを、上述のようにGCC−IRMSによって測定した。
【0215】
結果および意義
両被験者について、コレステロールおよびコレステロールエステルの13C APEを時間に対してプロットした(データは示していない)。コレステロールからコレステロールエステルへの変換は12時間の間に起こる。これらのデータは、in vivoでのLCATの活性を直接示し、RCTの血漿成分のこの部分が迅速に起こることを示す。RCTの流出成分と同様に、RCTの血漿成分の一部または全体の測定は、特に候補治療法の開発という背景において、in vivoでの候補治療法活性および薬効について有益な情報を与えうる。
【0216】
この実験は、RCTの血漿成分がヒトにおいて測定され得ることを説明する。RCTの血漿成分の測定は、CETP阻害剤、LCAT阻害剤、もしくは他のこのような候補治療法を含む、RCTまたはコレステロール輸送に対する様々な候補治療法の作用を評価するために使用されうる。RCTの他の成分と同様に、RCTの血漿成分を調節できる候補治療法の特定は、重要な商業的価値を有するであろう。
【0217】
実施例3
ラットにおけるRCTの流出成分の測定
序論
RCTの流出成分はRCTの最初の成分であり、候補治療法の標的となりうるプロセスである。あらゆる候補治療法は、開発プロセスの一環として動物で試験されなければならない。実施例1は、流出成分がヒトにおいて測定されうることを実証した。本実施例は、ラットにおいて実施された同一の実験を示す。
【0218】
方法
方法は、わずか1.2mgの13C2−コレステロールが静脈内注入によって投与され(100μg/時間)、わずか100μlの血液が各時点で採取されたこと以外は、上記の実施例1において記載されたものと同一である。さらに4つの動物群:標準的なラットの食餌を与えたラット;高コレステロール食を与えたラット;コール酸を加えた高コレステロール食を与えたラット;およびコール酸を加えた高コレステロール食を14日間与え、その後通常食に4日間戻したラットが研究された。この場合、疾患の動物モデルは食餌誘導性高コレステロール血症であり、血漿コレステロールを増加させることに対するコール酸の効果に続いて、食餌の切り替えによる比較的迅速な正常コレステロールレベルへの回復が起こる。図7は、血漿中へのコレステロールの流出に対するコレステロール/コール酸摂食(コレステロール負荷)の効果、およびその後の通常食への回復(コレステロール除荷)の効果を示す。
【0219】
結果および意義
図7は、各処理群についての平均流出速度を示す。コレステロール/コール酸摂食動物は最も高い流出速度を有し、コレステロール負荷食のコレステロール代謝への影響を補償するためにRCTの流出成分がアップレギュレートされうることを示唆する。通常食への回復では、Raはより低くなるがまだ正常化されず、それはラットからの持続性のコレステロール流出を示唆し、コレステロール/コール酸食が組織にコレステロールを負荷し、これがいまだに除去されているという見解と一致する。ここでのデータは、前臨床(齧歯類)モデルにおける介入試験を実証することに成功した。
【0220】
実施例4
ラットにおけるコレステロール排出RCTの測定;コレステロールの胆汁中への輸送およびコレステロールの胆汁酸への変換の測定
序論
RCTの肝臓成分は、それがRCTの最後の成分に相当し、コレステロールが実際に体から出る点であるため、RCTの研究にとって有意義である。理想的には、RCTの肝臓成分の測定は、特に、中性ステロール(例えば、RCTまたは肝臓でのde novoコレステロール合成に由来する胆汁コレステロール)ならびに胆汁酸(例えば、RCTコレステロールまたは肝臓でのde novo合成コレステロールに由来するデオキシコレート)をはじめとする胆汁のすべての成分の供給源および合成速度の決定を可能にする。
【0221】
方法
標識投与および生物学的サンプリング
あらゆる安定同位体標識の投与前(「0日目」と呼ばれる)に、血液および糞便サンプルを採取する。
【0222】
体内水分が約5%過剰な重水素の同位体含量に達するように、ラットに100%重水のIPボーラスを投与した。その後、体内水分の重水素の定常状態レベルを維持するために、ラットに飲料水中8%過剰な重水を与えた。重水に由来する重水素の肝臓でのde novo合成コレステロールへの取り込みは、de novo合成コレステロールに由来する胆汁コレステロールまたは胆汁酸の割合の測定を可能にする(図11B)。
【0223】
また、重水ボーラスと同時に、ラットに脂質エマルジョン中の1.2mgの13C2−コレステロールの静脈内ボーラスをも投与した。
【0224】
ボーラス投与後6日間にわたり血液サンプルを毎日採取した。ボーラス投与後6日間にわたり糞便サンプルを毎日採取した。
【0225】
ステロール排出速度の測定
当技術分野において既知の技術を用いて、毎日排出される各胆汁成分(コレステロール、コプロスタノール、およびデオキシコール酸)の質量を測定した。あるいは、質量値はまた、過去のデータから、または対象となるラットの系統が以前に同様の条件下で研究されている場合には文献からも取得される。
【0226】
同位体含量または同位体パターン測定:de novoコレステロールの寄与の測定
様々な同位体含量または同位体パターン測定が行われた。1日目〜6日目に採取した血液サンプルでの2H2Oの濃度は、血漿を炭化カルシウムと反応させ、その結果生じたアセチレンガスをMonitor series 3000サイクロイド質量分析計を用いて分析することにより測定された。このデータは、対象となる分子の最大限可能なMPEの算出根拠を提供する。
【0227】
コレステロール、コプロスタノール、およびデオキシコレートは、1日目〜6日目の糞便サンプルから、以下のようにして精製した:糞便を一晩水酸化ナトリウム溶液中でインキュベーションし、中性ステロールを単離するためにヘキサン抽出を行い、残りの水相を塩酸で中和し、その後胆汁酸を単離するために酢酸エチルで抽出した。その後、コレステロール、コプロスタノール、およびデオキシコール酸のM1同位体のMPEをGC/MSによって測定した。血漿重水濃度と組み合わせた場合、これらの測定結果は、肝臓でのde novo合成コレステロールに由来する対象となる各分子の割合(図14)およびRCTの他の測定基準と組織コレステロールバランスとの相関の決定を可能にする。
【0228】
同位体含量または同位体パターン測定:肝臓RCTの寄与の測定
様々な同位体含量または同位体パターン測定が行われた。0日目〜6日目に採取した血液サンプルからコレステロールを精製し、GCC−IRMSによって上述のように13C APEについて分析した。0日目の測定は、上述のような13C APE算出のためのベースライン測定を提供する。血中コレステロールの13C APEは、糞便コレステロール、コプロスタノール、またはデオキシコレートにおいて予期され得る最大限可能なAPEを算出するために使用される。
【0229】
0日目〜6日目に採取した糞便サンプルからコプロスタノール、コレステロール、およびデオキシコレートを精製した。それらの分子をその後、GCC−IRMSにより13C APEについて分析した。血中コレステロールの13C APEと組み合わせた場合、これらの測定結果は、RCTに由来するそれぞれの対象となる分子の割合の決定を可能にする。
【0230】
寄与率の算出
de novo合成コレステロールについては、最大限可能なM1アイソトポマーのMPEは、血漿中の過剰な重水の量に、MIDAの計算により決定されるスカラー係数を乗じることによって、または過去のデータによって決定される。観察された糞便コレステロール、コプロスタノール、およびデオキシコール酸のMPE EM1富化をこの最大限可能な値で割ることによって、肝臓でのde novo合成コレステロールに由来するそれぞれの割合を得る。
【0231】
RCTについては、糞便コレステロール、コプロスタノール、およびデオキシコール酸で観察される13C APEを、適切なサンプリング期間(サンプル採取の頻度に基づいて決定される)にわたって平均された血漿コレステロールで観察される13C APEで割ることによって、RCTに由来する各分子の割合を得る。この場合には、平均期間は24時間であった。例えば、2日目の糞便サンプル由来の糞便コレステロール、コプロスタノール、およびデオキシコール酸の13C APEを、2日目および1日目の血中コレステロールの13C APE値の平均で割った。この時間の平均化は、寄与率を算出するために使用される最大限可能なAPEが、サンプリングされた対象となる分子が合成されていた期間全体にわたる血中コレステロール濃度を反映することを確実にする。理論的には、ラットの場合、理想的な平均期間は、2つの糞粒の含量(生物学的サンプルサイズ)が排出されるためにかかる期間にわたって平均化される。しかし、当業者は、(図8の3日目以降から観察されるように)血中コレステロールの13C APEがサンプリング頻度ごとに定常状態に近づいていく場合、平均化の重要性は低下することを理解し得る。これらの状況では、単一サンプルからの血中コレステロールの実際の13C APEが最大値として使用され得る。
【0232】
結果および意義
対象となる各分子(コレステロール、コプロスタノール、およびデオキシコール酸)に対するそれぞれのコレステロール供給源(RCTまたはde novo合成)の寄与率に、各分子の排出速度を乗じることにより、それぞれの供給源から1日当たりに排出される質量を得た。
【0233】
本発明の方法は、候補治療法の発見および開発のために幅広い前臨床用途を有する。胆汁排出に対するde novo合成およびRCTの寄与を理解することは、このような分析にとって不可欠であり、単にいずれかまたはすべての胆汁成分の分泌速度を測定するだけでは不十分である。例えば、胆汁の排出速度を増加させた治療は、RCTの増加によってそのような結果をもたらしたのかもしれないが、それはまた肝臓でのde novoコレステロール合成の増加によるのかもしれず、その場合、その治療は、RCTの増加(すなわち、RCTを介した体からのコレステロールの除去の増加)およびアテローム硬化のリスクまたは発生率の減少に有効ではないだろう。あるいは、胆汁分泌速度を増加させるが、RCTが実質的に減少するようなレベルまで肝臓でのコレステロール合成が増加することによってそのような結果がもたらされる候補治療法は、望ましくない作用機序であり、まったく治療しないよりも事実上有害であるかもしれない。本発明の方法は、RCTを増加させる候補治療法と、胆汁分泌を増加させるが実質的にRCTを減少させる候補治療法との識別を可能にする。本発明の方法はまた、至適用量を特定するためにも使用され得る。
【0234】
RCTの肝臓成分または排出成分の測定はまた、様々な動物モデルにおいて候補治療法の効果を評価するためにも使用されうる。例えば、薬剤の投与前後でのRCTの肝臓部分が比較され得る。候補治療法の効果は、候補治療法の施行前後に測定した場合の肝臓RCTの変化(例えば、増加、減少、または差異なし)によって決定されるであろう。RCT関連作用に関する、用量範囲または有効量、用量反応曲線の性質、および候補治療法の作用機序の他の指標もまた、この方法で測定され得る。
【0235】
別の変形形態では、本方法は、RCTの肝臓成分に対する食餌変更の効果を評価するために使用されうる。上述のものと同様に、その効果は、食餌変更の前後に測定した場合の肝臓RCTの変化(例えば、増加、減少、または差異なし)によって決定される。
【0236】
このような差異はまた、動物の1群に候補治療法を施行し、他の群にプラセボ治療を施行するかまたは治療を施行せずに、2群でのRCTの肝臓成分を比較することによっても測定され得る。
【0237】
実施例5
ラットにおける「包括的コレステロールRCT」パラメータの測定
実施例1において概説されたアプローチの改良は、血漿コレステロールのRaを算出すること、およびその測定結果を実施例4に記載された投与コレステロールの排出速度と組み合わせることを含む。
【0238】
方法
血漿コレステロールの糞便中への回収は、糞便中性ステロール中に排出された投与標識コレステロールの割合と定義される。それは、注入後1〜4日目の回収された標識の割合(%)として表される。それは、糞便中性ステロール中の13C富化の割合(%)(中性ステロール排出(mg/日)を投与された13Cコレステロールの全mgで割ったもの)から算出される。
【数13】

【0239】
糞便中に排出される胆汁酸中への血漿コレステロールの回収について、同じ計算が行われる。ラットを一般的な試験用のコレステロール降下薬であるコレスチラミン、エゼチミブ、LXRアゴニスト(TO−901317)で処理した。コレステロールのRaは記載されたように算出され、投与されたコレステロールの糞便ステロールまたは胆汁酸中への回収は記載されたように算出される。
【0240】
結果および意義
図11に示されるのは、コレスチラミンで処理された、中性ステロール(図11A)および胆汁酸(図11B)中へのRCT流で観察される変化である。コレスチラミンは胆汁酸吸収を選択的に阻害するが、中性ステロール吸収を阻害しないことが知られている。これは、中性ステロールで観察されるものより大きな血漿コレステロールの糞便胆汁酸中への流量の増加に反映されている。
【0241】
図12に示されるのは、RCTに対するエゼチミブの効果である。中性ステロールへの血漿流量の増加は、肝臓から胆汁および腸内に分泌された内在性コレステロールの再吸収を含む腸のコレステロール吸収を阻害する、エゼチミブの既知の作用機序と一致する。
【0242】
図10に示されるのは、血漿コレステロールの中性ステロール中への排出およびRCTの包括的パラメータに対するLXRアゴニストの効果である。LXRアゴニストはマウスモデルにおいてアテローム硬化に拮抗することが示されている。観察されるRCTの増加はこの効果と一致する。遺伝子発現との相関(図10B)はまた、測定されるRCT流との相関によって創薬および薬剤開発の治療標的の有効性を確認する戦略を支持する。
【0243】
これらの結果は、RCTに対する薬剤介入の効果を記述することの有効性を実証し、その経路における活性の改善を評価または特定するために、それらがどのように使用されうるかを説明する。
【0244】
実施例6
ヒトにおけるRCTの肝臓成分の測定;胆汁酸のde novo合成、胆汁酸プールサイズの測定、血漿コレステロールから胆汁酸への変換の測定
序論
RCTの肝臓成分または排出成分はRCTの研究に有意義であり、コレステロールが実際に体から出るときのRCTの成分に相当する。ヒトにおいてRCTの肝臓成分または排出成分を測定することは様々な目的を果たすことができ、そのいくつかは上述されている。RCTの肝臓部分または排出部分の測定によるヒト被験体での候補治療法の評価は、本発明の例示的な用途である。臨床試験を正当化し、計画し、もしくは中止するため、または候補治療法の開発の継続もしくは認可に関する規制当局への申請を支持するためのこのようなデータの使用もまた、本発明の例示的な用途である。
【0245】
理想的には、RCTの肝臓成分または排出成分の測定は、特に、中性ステロール(例えば、RCTまたは肝臓でのde novoコレステロール合成に由来する胆汁コレステロール)ならびに胆汁酸(例えば、RCTコレステロールまたは肝臓でのde novo合成コレステロールに由来するデオキシコレート)をはじめとする胆汁のすべての成分の供給源および合成速度の決定を可能にする。
【0246】
方法
標識投与および生物学的サンプリング
いずれの安定同位体標識の投与前(「0日目」と呼ばれる)にも、ヒト被験体およびラットにおいて血液、糞便、ならびに尿サンプルを採取した。
【0247】
体内水分が約1%過剰な重水素の富化に達するように、被験体に重水の複数回投与を行った。また、被験体に13C2−コレステロールの静脈内ボーラスを投与し、50mgの2H4−コール酸を経口投与した。重水に由来する重水素の肝臓でのde novo合成コレステロールへの取り込みは、de novo合成コレステロールに由来する胆汁コレステロールまたは胆汁酸の割合の測定を可能にする。13Cの胆汁酸および胆汁コレステロール中への出現は、血中コレステロール(すなわち、RCT)に由来するこれらの分子の割合の測定を可能にする。2H4−コール酸の希釈は、胆汁酸プールサイズの測定を可能にする。
【0248】
複数の生物学的サンプルが採取された。ラットでは標識投与後7日目まで毎日、ヒトでは4、7および14日目に糞便を採取した。血液は定期的に10日目まで採取された(1〜2ml)。尿はヒトでは定期的に10日目まで採取された(少なくとも50mlのサンプル)。
【0249】
異なる被験体は異なる標識分子を投与されてもよく、異なる生物学的サンプリング計画を受けてもよい。被験体または被験体群からのデータは、被験体集団(例えば、健康な成人、高コレステロール血症の人など)におけるRCTの全体像を形成するために、他の同様の被験体からのデータと組み合わされうる。1つの実施形態では、すべての測定結果は、異なる薬物治療計画を受けたラットにおいて作成される。
【0250】
同位体含量または同位体パターン測定:de novoコレステロールの寄与の測定、胆汁成分に対するDNCの寄与率の算出
0日目〜7日目に採取した血液サンプルでの2H2Oの濃度を、血漿を炭化カルシウムと反応させ、その結果生じたアセチレンガスをMonitor series 3000サイクロイド質量分析計を用いて分析することにより測定した。このデータは、de novo合成コレステロールの最大限可能なMPEの算出根拠を提供する。
【0251】
コレステロールおよびコール酸を4日目〜7日目の糞便サンプルから精製し、コール酸を4日目〜7日目の尿サンプルから精製した。これらの分子を(上述のように)さらに処理し、その後、GC/MSによって分析する。M1 MPEは、ベースラインについては過去の参照値を用いて、上述のように算出された。最大限可能なMPEは、重水とコレステロール合成との間の関係に関する過去のデータを用いて、血液中で測定された体内水分の値から算出された。
【0252】
de novo合成肝臓コレステロールに由来する尿中コール酸、糞便コール酸、または糞便コレステロールの割合は、対象となる各分子で観察されるM1 MPEを、血中重水素値から算出される最大限可能なM1 MPEで割ることによって算出された。
【0253】
同位体含量または同位体パターン測定:肝臓RCTの寄与の測定、胆汁成分に対するRCTの寄与率の算出
RCTについては、RCTに由来する各分子の割合を得る1つの方法として、尿中コール酸で観察される13C APEを、適切なサンプリング期間(サンプル採取の頻度に基づいて決定される)にわたって平均された血漿コレステロールで観察される13C APEで割る。ヒトの場合には、血漿コレステロールの13C APEは、過去のデータから、サンプルを採取した期間中は約0.02で一定であることが知られている。2人の健康な被験者由来の2つのサンプル(2週目および3週目)からのデータが図12に示される。その計算は、被験者1では約81%の胆汁酸がRCTに由来し、被験者2では51%の胆汁酸がRCTに由来することを示す。これらの差異は、RCTにおいて臨床的に意義のある差異であり、より少ないコレステロールを胆汁中に排出する被験者2でのアテローム生成またはアテローム硬化のリスクを示唆しうる。
【0254】
同位体含量または同位体パターン測定:胆汁酸プールサイズの決定のための測定、胆汁酸プールサイズの算出
10日の研究期間中に採取された血液サンプルからコール酸を単離した。その後、コール酸を精製し、GC/MSによって分析し、ベースライン値として過去のデータを用いてM4イオンのMPEを決定した。その後、コール酸の希釈を、投与したコール酸の量に基づいて算出した。胆汁酸プールサイズは、当技術分野において既知の方程式、具体的には、Measurement of parameters of cholic acid kinetics in plasma using a microscale stable isotope dilution technique: application to rodents and humans, Hulzebos et al, J. of Lipid Research, volume 42, 2001, pp 1923-1929に見られるものを用いて算出された。
【0255】
胆汁ステロールの代用としての尿中ステロールの使用
尿由来の胆汁酸および尿由来の胆汁コレステロールへの腸管微生物の作用に由来するコレステロールの代謝産物の同位体含量または同位体パターンを測定した。この場合、胆汁コレステロールおよび胆汁酸の同位体含量または同位体パターンは尿サンプルから測定され得る。この技術の詳細は、上記のII−C項に記載されている。標識水を投与された被験体での糞便コプロスタノールおよび尿中コプロスタノールの2H同位体含量または同位体パターン測定結果は、その2つが平衡状態にあることを示す。尿中コプロスタノールの同位体含量または同位体パターンを測定することによって、糞便中の胆汁コレステロールの同位体含量を決定した。様々な処理計画は、研究されたとおりに、ラットでのde novoコレステロール合成を変化させた(図14)。
【0256】
実施例7
ヒトにおける「包括的コレステロールRCT」パラメータの測定
実施例6において概説されたアプローチの改良は、血漿コレステロールのRaを算出すること、およびその測定結果を実施例4および5に記載された投与コレステロールの排出速度と組み合わせることを含む。
【0257】
方法
同位体は実施例6に記載されるように投与される。経口投与シトスタノールは1日3回投与され、その糞便サンプル中への回収は、当技術分野において既知の方法を用いて絶対的な糞便中性ステロールおよび胆汁酸排出速度を決定するために用いられた。
【0258】
結果
研究された7人の被験者に対するRCTが示され、被験者間の個人差が示される。さらに、低い血漿HDLコレステロール濃度(<40mg/dl)および高い血漿HDLコレステロール濃度(>60mg/dl)を有する被験者が特定される。最も低いRCT値は最も低いHDLを有する被験者で見られ(図13Aおよび13Bにおいて*で示される)、最も高いRCT値は最も高いHDLを有する被験者で見られる(#で示される)。
【0259】
この実験は、中性ステロールおよび胆汁酸中へのRCT流がヒトにおいて効果的に測定され得ることを示す。さらに、血漿HDLレベルはRCT流パラメータ、特に包括的RCT流パラメータと関連しうることを示唆する。
【図面の簡単な説明】
【0260】
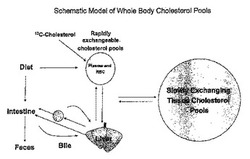
【図1】図1は、RCT経路およびコレステロールの全身プールを図解する。略語;「RBC」は赤血球である。末梢組織中の大きな代謝回転の遅いコレステロールプール、ならびに血漿、RBCおよび肝臓遊離コレステロールを含む代謝回転の速いコレステロールプールの存在が示されている。代謝回転の速いプールに投与された標識コレステロールは、組織と交換され得、または糞便ステロールの形で排出され得る。
【図2】図2は、認識されているRCT経路の分子要素を図解する(A.Tall, Journal of Clinical Investigation, 2001から)。
【図3】図3は、RCT経路の2つの成分または部分である流出/動員および排出を説明する。
【図4A】図4Aは、プラトーの原則、および同位体希釈による分子流速または分子出現速度(Ra)の測定のためのモデルを図解する。
【図4B】図4Bは、コレステロールのRaを測定するためのプラトーの原則の適用、およびRaコレステロールを測定するためのプロトコルを説明する。
【図5】図5は、3人のヒト被験体についての13C2−コレステロール注入時間に対する13C APEを示す。プラトーへの指数近似のための曲線フィッティングおよびフィッティングパラメータはそれぞれのグラフ上に含まれる。
【図6A】図6Aは、ヒト被験体において測定されたコレステロール流出/動員速度、すなわちRaコレステロールの代表値を示す。
【図6B】図6Bは、Raコレステロールの反復測定に対する被験体内再現性を示す。
【図7】図7は、様々な食餌を与えられたラットにおけるコレステロールの流出速度を示す。コレステロール/コール酸摂食により増加した血漿コレステロールRaの変化は、通常食に戻した4日後も持続する。
【図8A】図8Aは、投与された標識コレステロールの糞便ステロール中への排出効率の測定プロトコルを説明する。
【図8B】図8Bは、投与された標識コレステロールの排出効率に対する、7日間のラットのLXRアゴニストによる処理の効果を示す。
【図9A】図9Aは、Raが個体において増加した場合、アーチファクトとして排出効率が低下するため、投与された標識コレステロールの排出効率を、組織での流出/流入(Raコレステロール)に対して修正することの必要性を図解する。
【図9B】図9Bは、組織からの血液を介した糞便内へのコレステロールの流れを示す、包括的RCTパラメータの算出の基礎を説明する。
【図9C】図9Cは、組織から血液への流れ(流出/動員)および血液から糞便への流れ(排出)を包含する、測定される包括的RCT過程を図解する。
【図10A】図10Aは、LXRアゴニスト(TO−901317)を投与されたラットでの、RCTの成分および中性ステロール中へのRCTの「包括的パラメータ」の算出を示す。ラットにLXRアゴニストを7日間投与し、RCT流を測定した。A)Raコレステロール。B)血漿コレステロールの胆汁酸中への排出。C)2つの成分の積(有意な増加が観察された)。
【図10B】図10Bは、LXR誘導性遺伝子発現と包括的RCT流との間の関係を示す。
【図11A】図11Aは、コレスチラミンを投与されたラットでの、RCTの成分および中性ステロール中へのRCTの「包括的パラメータ」の算出を示す。ラットに胆汁酸結合物質であるコレスチラミンを7日間投与し、RCT流を測定した。A)Raコレステロール。B)血漿コレステロールの中性ステロール中への排出。C)2つの成分の積(有意な効果は観察されなかった)。
【図11B】図11Bは、コレスチラミンを投与されたラットでの、RCTの成分および胆汁酸中へのRCTの「包括的パラメータ」の算出を示す。ラットに胆汁酸結合物質(コレスチラミン)を7日間投与し、RCT流を測定した。A)Raコレステロール。B)血漿コレステロールの胆汁酸への排出。C)2つの成分の積(有意な増加が観察された)。
【図12】図12Aは、エゼチミブを投与されたラットでの、RCTの成分および中性ステロール中へのRCTの「包括的パラメータ」の算出を示す。ラットにエゼチミブを7日間投与し、その後RCT流を測定した。A)Raコレステロール。B)血漿コレステロールの中世ステロールへの排出。C)2つの成分の積(有意な増加が観察された)。
【図13A】図13Aは、包括的RCTおよびRCTの2つの成分を含む、ヒト被験体で測定された糞便中性ステロール中へのRCTパラメータを示す。被験体での低濃度または高濃度のHDLコレステロールとの関係が示される。
【図13B】図13Bは、包括的RCTおよびRCTの2つの成分を含む、ヒト被験体で測定された糞便胆汁酸中へのRCTパラメータを示す。被験体での低濃度または高濃度のHDLコレステロールとの関係が示される。
【図13C】図13Cは、ヒト被験体での糞便中性ステロールおよび胆汁酸中への包括的RCTの平均値を示す。
【図14】図14は、ラットにおいて測定されたde novoコレステロール合成速度、ならびにde novoコレステロール合成速度に対する薬物および食餌の効果を示す。
【図15】図15は、同位体標識コレステロール誘導体(コレステロールを含む)およびコレステロールエステルの非限定的なリストを示し、それらの構造および標識が各分子に付加されうる位置を詳述する。
【図16】図16は、同位体標識胆汁酸および胆汁酸代謝産物の非限定的なリストを示し、それらの構造および標識が各分子に付加されうる位置を詳述する。
【図17A】図17Aは、ヒトでの流出/動員(Ra)の測定プロトコルを図解する。
【図17B】図17Bは、ヒトでのコレステロール排出効率の測定プロトコルを図解する。
【技術分野】
【0001】
本発明の技術分野
本発明は、コレステロール代謝の分野に関する。具体的には、コレステロール逆輸送に重点を置いたコレステロール代謝および輸送の定量的測定方法が記載される。
【背景技術】
【0002】
動脈硬化の最も一般的な型であるアテローム硬化は、大動脈および中動脈(例えば、冠状動脈、頸動脈、および下肢動脈)、ならびに大動脈および腸骨血管などの弾性動脈の疾患である。アテローム、すなわち脂質コアおよび線維性被膜からなる血管内膜中の線維脂肪プラークが特徴的である(Robbins Pathologic Basis of Disease 557 (Cotranら編、第4版、1989))。心筋梗塞および脳梗塞の第1のリスクファクターであるだけでなく、アテローム硬化は、慢性的な下肢虚血および壊疽のような症状、ならびに腸間膜閉塞の原因となる。近年の冠状動脈性心臓病による死亡率の減少にもかかわらず、米国における総死亡者数の約50%は、今もなおアテローム硬化を原因とする(Scientific American Medicine 第1章(Rubensteinら編、1991))。
【0003】
疫学、解剖および血管造影法による研究は、血清コレステロール値の上昇とアテローム硬化の形成との間の因果関係を確証している(Levineら、Cholesterol Reduction In Cardiovascular Disease, N Eng J Med 332(8):512-521 (1995))。リスクについてそれらを特定する単独の血漿コレステロールレベルはないが、一般的にそのレベルが高いほどリスクも高くなる。リスクは、200mg/dlを超えるコレステロールレベルで有意に上昇する(Robbins Pathologic Basis of Disease、上掲、559)。総コレステロールレベルは通常、望ましい値(<200mg/dl)、高境界値(200〜239mg/dl)、または高値(>240mg/dl)に分類される。食事療法は通常、リスクの高い低密度リポタンパク質(LDL)コレステロールレベルを有する被験体、および少なくとも2つのさらなるアテローム硬化に対するリスクファクター(例えば、高血圧、糖尿病、喫煙など)を有する高境界値の者に勧められる。しかし、食事療法は、彼らの食事がコレステロールおよび飽和脂肪について平均より高い被験体においてのみ有効であることが発見されており(Adult Treatment Panel II. National Cholesterol Education Program: Second Report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adult, Circulation 89:1333-1445 (1994))、高コレステロール血症の遺伝的素因を有する被験体には無効であろう。持続性の高コレステロールレベルの場合には、薬物療法が処方されうる。
【0004】
高コレステロール血症の治療のために現在市販されている薬物は、de novoコレステロール合成の阻害および/もしくは低密度リポタンパク質(LDL)コレステロールのLDL受容体によるクリアランスの促進(例えば、ロバスタチン、その他のスタチン、図1参照)、超低密度リポタンパク質(VLDL)の産生の減少(例えば、ゲムフィブロジル)、または腸での胆汁酸再吸収の阻害(例えば、コレスチラミン)のような方法によって作用する。しかし、コレステロール代謝の試験はまた、コレステロール逆輸送(RCT)の過程がコレステロールを組織から除去し、体から排出しうる経路を可能にすることを示す。現在のところ、生体でRCT経路を介した組織から排出までのコレステロール流出速度を測定する既知の方法はない。
【0005】
RCTは、コレステロールが細胞から体外へ動員され、輸送される生物学的経路である(図1)。RCTは3つの成分:すなわち(1)組織から血液中へのコレステロールの流出(「流出成分」);(2)血漿中でのコレステロールの輸送および分布(「血漿成分」);ならびに(3)肝臓または腸を介した糞便への排出(「肝臓成分」または「排出成分」)に分割され得る。コレステロールは胆汁酸または遊離コレステロールのいずれかとして胆汁分泌に取り込まれ、その後、腸管腔に分泌され、その一部は体から糞便内に出る。ステロールはまた、腸組織によって腸管内腔に直接放出され、その後一部の排出が起こり得る。これらのRCT経路は、コレステロールが体から除去され得る唯一の有効な機序である。
【発明の開示】
【発明が解決しようとする課題】
【0006】
従って、RCTのこれらのステップの測定を可能にする方法を有することが望ましい。機能的観点から、流出成分ならびに肝臓成分または排出成分は、それぞれ細胞からおよび体からのコレステロールの出口に相当するため、重要なステップである。RCT、ならびに具体的にはこれらのステップの測定方法は、製薬会社および他の薬物開発者が、被験体の利益のために組織からのおよび体外へのコレステロールの流出を調節する薬剤または候補治療法をスクリーニングすることを可能にし;臨床医がRCTに影響を及ぼす薬剤の至適用量を選択することを可能にし;臨床医がコレステロール関連疾患の進行を診断および観察することを可能にし;臨床医がコレステロール関連疾患のリスクを評価することを可能にし;臨床医がRCTに基づく候補治療法に反応するであろう被験体を選択する、または被験体群を同定することを可能にし;コレステロール関連疾患の機序の詳細な研究を可能にするであろう。このような方法は本明細書において開示される。
【課題を解決するための手段】
【0007】
発明の概要
これらの必要性を満たすために、本発明は、コレステロール代謝および輸送速度の測定方法を提供し、ヒトおよび実験動物においてRCTの測定を可能にする。
【0008】
1つの態様では、RCTの流出成分が被験体において測定されうる。1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体が既知の速度で被験体に投与される。一定期間後、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体を含有する1つ以上の生物学的サンプルを被験体から取得する。その後、コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンが測定される。その後、投与された標識分子の、対応する内在性非標識分子による希釈が算出されることにより、被験体におけるRCTの流出成分の活性または速度(出現速度[Ra])が決定される。投与される分子は同位体標識遊離コレステロールであり、定常状態に静脈内注入され、血漿中の標識遊離コレステロールの希釈は、注入期間に渡って一定間隔を置いた多数の時点で血漿コレステロールの同位体含量または同位体パターンを測定することによって測定されうる。
【0009】
別の態様では、RCTの肝臓成分または排出成分の活性(例えば、輸送速度、輸送もしくは変換されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の質量、あるいはRCTに由来する胆汁酸または中性ステロールの割合)が測定されうる。1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体が被験体に投与される。一定期間後、胆汁酸、糞便中性ステロール、またはコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体を含有する1つ以上のサンプルを被験体から取得する。その後、コレステロール、コレステロール関連分子もしくはコレステロール関連複合体から取り込まれた胆汁酸、排出中性ステロールにおける同位体含量または同位体パターンが測定される。その後、RCTの肝臓成分または排出成分を介した同位体標識の取り込みが算出されることにより、被験体におけるRCTの肝臓成分もしくは排出成分の活性または速度が決定される。上述のようなRCTの肝臓成分または排出成分の測定は、一部には、静脈内投与された同位体標識遊離コレステロールに由来する同位体標識の胆汁酸への取り込みを測定することによって実施され、胆汁酸プールサイズの測定が同時に実施されうる。胆汁酸プールサイズは、既知量の1種以上の同位体標識胆汁酸を被験体に投与し、一定期間後に被験体から胆汁酸を含有するサンプルを取得し、サンプル中の胆汁酸の同位体含量、同位体パターン、または同位体含量もしくは同位体パターンの変化速度を測定し、投与された標識胆汁酸の内在性胆汁酸による希釈を算出し、その系における総胆汁酸プールサイズの測定を行うことによって測定されうる。本発明のこの態様に適した胆汁酸は、コール酸、ケノデオキシコール酸、デオキシコール酸およびリトコール酸を含むがそれらに限定されない。その胆汁酸はコール酸でありうる。
【0010】
本開示の別の態様では、流出/動員速度(流出成分)を糞便ステロール中への標識回収効率(肝臓成分または排出成分)と組み合わせることによって、「包括的(global)RCT」パラメータが測定され得ることが発見された。包括的RCT流は、最終的に糞便ステロールとして排出される組織からのコレステロール流出、または糞便ステロールとして回収される、1日当たりに血漿プールに入るコレステロール分子数を示す。この包括的RCT測定基準は、ヒト被験体をはじめとする生体において組織から糞便までのコレステロール流量の総合的な測定を初めて提供する。当業者は、この測定基準が組織から血流を介して体外へのコレステロール流速−包括的RCTの定義を示すことを理解し得る。この測定基準は、流出速度(Ra)に排出効率を乗じることによって算出され得る。
【0011】
本発明のさらに別の態様では、RCTの血漿成分が測定される。1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体が被験体に投与される。一定期間後、対象となるコレステロールまたはコレステロール関連分子またはコレステロール関連複合体を含有する1つ以上の血漿サンプルが被験体から取得され、その後、コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンが測定される。その後、RCTの血漿成分の異なる部分(図2参照)を介したコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の輸送または代謝は、様々なコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体中の同位体標識の消失または出現によって測定される。
【0012】
本発明の方法は、RCTに対する候補治療法の効果を評価するために適用されうる。その方法は、候補治療法を被験体に施行すること、RCTの成分のいずれかまたはすべてを候補治療法の施行前後の被験者において、または候補治療法を受けていない対応する被験者もしくは過去のデータと比較すること、および候補治療法の施行前後または候補治療法の有無でのRCTの差異を算出することを含む。候補治療法は単一の薬剤または化合物でありうる。あるいは、候補治療法は薬剤または化合物の組合せでありうる。候補治療法はまた、生活様式の変更(例えば、食餌の変更、運動の増加)などのいくつかの他の介入と合わせた、単一の薬剤もしくは化合物または薬剤もしくは化合物の組合せでもありうる。
【0013】
別の変形形態では、食餌変更の前後の被験者においてRCTの速度を比較すること、および食餌変更の前後でのRCTの速度の差異を算出することによって、アテローム硬化のリスクに対する食餌変更の効果が評価される。
【0014】
さらなる変形形態では、RCTの速度を測定するためのキットが提供される。キットは、標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体、標識胆汁酸、またはそれらの組合せ、およびキットの使用説明書を含みうる。キットはまた、任意選択で、上記の標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体、または標識胆汁酸の被験体への投与のための用具、および被験体からサンプルを採取するための器具をも含みうる。
【0015】
さらなる変形形態では、生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定する方法が記載される。その方法は、(a)同位体標識コレステロール分子または同位体標識コレステロール関連分子を生体系に投与するステップ;(b)1種以上の同位体標識コレステロール分子、胆汁酸または生体系からの排出中性ステロールを含むサンプルを生体系から取得するステップ;(c)同位体標識コレステロール分子、胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(d)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子の、コレステロール分子、胆汁酸または排出中性ステロールへの取り込み速度または移動速度を算出することにより、生体系でのRCTの肝臓成分または排出成分の分子流速を測定するステップを含みうる。
【0016】
さらなる実施形態では、サンプルは糞便、尿または血液サンプルでありうる。
【0017】
同位体標識コレステロール分子または同位体標識コレステロール関連分子の標識は、2H、3H、13C、14Cまたは18Oでありうる。
【0018】
生体系は哺乳動物でありうる。哺乳動物は、ヒト、ハムスター、ウサギ、非ヒト霊長類および齧歯類を含む。
【0019】
さらなる実施形態では、(i)既知量の同位体標識胆汁酸を生体系に投与するステップ;(ii)一定時間後に生体系での胆汁酸の同位体含量または同位体含量の変化速度を測定するステップ;および(iii)同位体標識胆汁酸の希釈量を測定することにより、生体系中の胆汁酸の総量を測定するステップによって、生体系中の胆汁酸の総量が測定されうる。
【0020】
標識胆汁酸は、コール酸、ケノデオキシコール酸、デオキシコール酸またはリトコール酸を含みうる。
【0021】
別の実施形態では、胆汁酸に対するde novoコレステロール合成の寄与を測定する方法が提供され、それは、(i)所定の標識濃度を有する同位体標識コレステロール前駆体を生体系に投与するステップ;(ii)標識胆汁酸、排出中性ステロールまたは血中コレステロールを含む生物学的サンプルを生体系から取得するステップ;(iii)標識胆汁酸、排出中性ステロールまたは血中コレステロールの同位体含量または同位体パターンを測定するステップ;および(iv)胆汁酸、中性ステロールまたはコレステロールの同位体含量を、安定同位体標識コレステロール前駆体の標識濃度と比較することにより、新規に合成されたコレステロールに由来するコレステロール、中性ステロールまたは胆汁酸の割合を測定し、それにより胆汁酸に対するde novoコレステロール合成の寄与を測定するステップを含む。さらなる実施形態では、サンプルは糞便サンプルであり、単位時間当たりに被験体によって排出される中性ステロールおよび胆汁酸の総量は、被験体に経口投与された、糞便中で検出される内部標準との比較によって測定される。内部標準はシトスタノールでありうる。
【0022】
さらなる実施形態では、生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定する方法が記載される。その方法は、(a)安定な同位体標識コレステロール分子または安定な同位体標識コレステロール関連分子を生体系に投与するステップ;(b)同位体標識コレステロール分子または同位体標識コレステロール関連分子のin vivo変換産物を含むサンプルを生体系から取得するステップ;(c)in vivo変換産物の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(d)同位体標識コレステロール分子または同位体標識コレステロール関連分子の希釈速度を算出することにより、生体系でのコレステロール逆輸送の血漿成分の分子流速を測定するステップを含みうる。
【0023】
さらなる実施形態では、生体系での血中コレステロールの出現速度を測定する方法が記載される。その方法は、(a)脂質エマルジョン中の13C2標識コレステロールを、生体系内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分な投与速度で生体系に静脈内投与するステップ;(b)標識遊離コレステロール分子を含むサンプルを生体系から取得するステップ;(c)標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(d)標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、13C2標識コレステロールの投与速度と比較することにより、生体系での血中コレステロールの出現速度を算出するステップを含みうる。
【0024】
1つの実施形態では、生体系での血中コレステロールの出現速度は、プラトーの原則により、同位体希釈により、同位体プラトーの存在の確立により、同位体プラトー値の推定により、または同位体プラトー値の外挿により算出される。
【0025】
生体系でのコレステロール流の包括的RCT速度(the global rate of RCT the flux of cholesterol)を算出する方法もまた記載される。その方法は、(a)(i)脂質エマルジョン中の13C2標識コレステロールを、生体系内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分な投与速度で生体系に静脈内投与するステップ;(ii)標識遊離コレステロール分子を含むサンプルを生体系から取得するステップ;(iii)標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(iv)標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、13C2標識コレステロールの投与速度と比較することにより、生体系での血中コレステロールの出現速度を算出するステップにより、血中コレステロールの出現速度を測定するステップ;(b)(i)同位体標識コレステロール分子または同位体標識コレステロール関連分子を生体系に投与するステップ;(ii)1種以上の生体系からの同位体標識コレステロール分子、胆汁酸または排出中性ステロールを含むサンプルを生体系から取得するステップ;(iii)同位体標識コレステロール分子、胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および(iv)同位体標識コレステロール分子または同位体標識コレステロール関連分子のコレステロール分子、胆汁酸もしくは排出中性ステロールへの取り込み速度または移動速度を算出することにより、生体系でのRCTの肝臓成分または排出成分の回収割合を測定するステップにより、コレステロール逆輸送(RCT)の肝臓部分または排出部分の回収割合を測定するステップ;(c)ステップ(a)(iii)からの血中コレステロールの出現速度に、ステップ(b)(iv)からのRCTの肝臓部分または排出部分の回収割合を乗じることにより、生体系でのコレステロール流の包括的RCT速度を算出するステップを含みうる。
【0026】
さらなる実施形態では、生体系でのアテローム硬化のリスクおよび発生率に対する候補薬剤および/または食餌変更の効果を評価する方法が記載される。その方法は、(a)生体系でのコレステロール流の包括的RCT速度を算出するステップ;(b)候補薬剤を生体系に投与し、かつ/または生体系の食餌を変更するステップ;(c)生体系で2回目のコレステロール流の包括的RCTを算出するステップ;および(d)ステップ(a)とステップ(c)とのコレステロール流速の差異を比較することにより、アテローム硬化に対する候補薬剤および/または食餌変更の効果を評価するステップを含みうる。
【0027】
その方法はまた、(a)生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定するステップ;(b)候補薬剤を生体系に投与し、かつ/または生体系の食餌を変更するステップ;(c)生体系で2回目のコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定するステップ;および(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する候補薬剤および/または食餌変更の効果を評価するステップを含みうる。
【0028】
その方法はさらに、(a)生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ;(b)候補薬剤を生体系に投与し、かつ/または生体系の食餌を変更するステップ;(c)生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ;および(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する候補薬剤および/または食餌変更の効果を評価するステップを含みうる。
【発明を実施するための最良の形態】
【0029】
発明の詳細な説明
本発明は、同位体および質量分析技術を用いてin vivoでのRCTを定量的に測定する方法を提供する。
【0030】
一般的方法
本発明の実施は通常、他に指示のない限り、当技術分野の技術の範囲内である分子生物学、微生物学、細胞生物学、生化学、および免疫学の従来技術を利用する。このような技術は、例えば、Cell Biology: A Laboratory Notebook (J.E. Cellis編、1998); Current Protocols in Molecular Biology (F.M. Ausubelら編、1987); Short Protocols in Molecular Biology (WileyおよびSons, 1999); Mass Isotopomer Distribution Analysis: A Technique for Measuring Biosynthesis and Turnover of Polymers (Hellersteinら、Am J Physiol 263 (Endocrinol Metab 26):E988-1001 (1992));ならびにMass Isotopomer Distribution Analysis at Eight years: Theoretical, Analytic, and Experimental Considerations (Hellersteinら、Am J Physiol 276 (Endocrinol Metab 39):E1146-1170 (1999))などの文献において十分に説明される。さらに、市販のアッセイキットおよび試薬を用いる方法は通常、他に指定のない限り、製造業者に規定された手順に従って使用される。
【0031】
本発明の実施はさらに、他に指示のない限り、当技術分野の技術の範囲内である化学および分析化学の従来技術を利用する。このような技術は、例えば、Fundamentals of Analytical Chemistry (D. Skoog, D West, F Holler, S Crouch著、2003); Analytical Chemistry (S. Higson著、2004); Advanced Instrumental Methods of Chemical Analysis (J. Churacek編、1994);およびAdvanced mass spectrometry: Applications in organic and analytical chemistry (U. Schlunegger) などの文献において十分に説明される。
【0032】
本発明の実施はさらに、他に指示のない限り、当技術分野の技術の範囲内である前臨床研究および臨床研究の従来技術を利用する。このような技術は文献において十分に説明される。
【0033】
定義
「コレステロールまたはコレステロール関連分子またはコレステロール関連複合体」とは、コレステロールの代謝および輸送に関与する分子および複合体を意味する。これらは、コレステロールおよびコレステロール代謝産物もしくは前駆体、またはコレステロール前駆体(例えば、水、アセチルCoA)ならびにリポタンパク質(例えば、高密度リポタンパク質)のようなコレステロールおよびコレステロールの代謝産物もしくは前駆体の担体との複合体を含む。下記の非限定的なリストは、「コレステロールまたはコレステロール関連分子もしくは複合体」の例を含む。すなわち、カイロミクロン、高トリグリセリドリポタンパク質(TGRL)、高密度リポタンパク質(HDL)、中間密度リポタンパク質(IDL)、低密度リポタンパク質(LDL)、または超低密度リポタンパク質(VLDL)に由来するコレステロール;カイロミクロン、TGRL、HDL、IDL、LDL、またはVLDLに由来するコレステロールエステル;血液、糞便、胆汁、尿、または任意の他の生物学的サンプルに由来する胆汁酸;血液、糞便、胆汁、尿、または任意の他の生物学的サンプルに由来する中性ステロール;ケノデオキシコレート、コレート、デオキシコレート、リトコレート、ウルソデオキシコレート、リン脂質、またはビリルビン;消化管微生物によって生成される胆汁酸の代謝産物;消化管微生物によって生成される中性ステロールの代謝産物(例えば、コプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノール)、などである。
【0034】
「分子または複合体を含有するサンプル」とは、指示された分子または複合体を含む任意のサンプルを意味する。指示された分子または複合体の任意の濃度が考えられる。指示された分子もしくは複合体の同位体含量または同位体パターンは様々でありうる。それはゼロであってもよい。指示された分子または複合体は、サンプル中に別の複合体の一部としてしか存在しないかもしれない。
【0035】
「複合体」とは、1つ以上の分子で構成される任意の高分子集合体を意味する。分子は、脂質、小分子、タンパク質、リポタンパク質、またはその他でありうる。複合体の一例はHDLであり、より小さい分子(コレステロールおよびコレステロールエステルを含む)ならびにより大きい分子(例えば、リポタンパク質)を含む様々な分子を含有する。複合体の他の例はLDLである。
【0036】
「胆汁酸」とは、糞便、血液、または他の生物学的サンプルもしくは成分中に見られる任意の胆汁酸または胆汁酸代謝生成物(すなわち、代謝産物)を意味する。胆汁酸の例は、コール酸、デオキシコール酸、ケノデオキシコール酸、および任意の他の胆汁酸または胆汁酸代謝産物を含む。
【0037】
「胆汁」とは、胆嚢から消化管腔内への分泌物を意味する。胆汁成分の部分的なリストは、胆汁酸、中性ステロール、ケノデオキシコレート、コレート、デオキシコレート、リトコレート、コレステロール、ウルソデオキシコレート、リン脂質、またはビリルビンを含む。消化管腔において、いくらかの胆汁成分は常在微生物により胆汁成分誘導体または代謝産物に代謝される(例えば、コプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノールは胆汁コレステロールの代謝産物である)。本発明の目的では、これらの誘導体は同様に胆汁の成分と見なされる。
【0038】
「活性」とは、本発明の方法を用いて被験体で測定され得るRCTまたはRCTの成分の指標を意味する。活性は、速度(例えば、単位時間当たりの量、すなわち単位時間当たりに変換もしくは輸送されるコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の量)、質量(例えば、グラム、すなわちコレステロールまたはコレステロール関連分子またはコレステロール関連複合体のグラム)、割合またはパーセンテージ(例えば、RCTに由来する胆汁酸の割合、またはRCTに由来する中性ステロールのパーセンテージ)、あるいは本明細書において開示される方法の実施中に得られるデータの任意の他の表現によって表されうる。活性は、異なる被験体間で比較されるもの、または同一の被験体の候補治療法の施行前後で比較されるもの、または過去のデータと比較されるものでありうる。状況によって、同一のデータは多数の異なる種類の活性として表されうる。新しい種類の活性を算出するために、データは、過去のデータ、ベースラインデータ、または新しいデータと組み合わされうる(例えば、胆汁酸に対するRCTの寄与率は、胆汁酸プールサイズと組み合わせることにより、胆汁酸に変換されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の質量を決定し得る)。
【0039】
「過去のデータ」とは、実験の開始前に存在する任意のデータを意味する。
【0040】
「候補治療法」とは、本明細書において概説されるように有効性がスクリーニングされ得る、疾患を治療しうる任意の過程を意味する。候補治療法は、行動療法、運動療法、食事療法を含みうる。候補治療法はまた、医療機器による治療、または医療機器の移植をも含みうる。候補治療法はまた、任意の「候補薬剤」または「候補薬物」(下記参照)による治療をも含みうる。
【0041】
候補治療法は、候補治療法の組合せを含みうる。このような組合せは、2つの異なる候補薬剤でありうる。組合せはまた、候補薬剤および食事療法でもありうる。組合せはまた、運動療法および食事療法でもありうる。組合せはまた、運動療法および食事療法および候補薬剤でもありうる。組合せはまた、運動療法もしくは食事療法またはその両方のような別の候補治療法と併用される候補薬剤または候補薬剤の組合せとの併用でもありうる。従って組合せは、同一の被験体に施行される複数の候補治療法である。
【0042】
候補治療法は、適切な規制機関(例えば、米国食品医薬品局または他国の同等機関)によってヒトでの使用が既に認可されていてもよい。候補治療法は、アテローム生成、動脈硬化、アテローム硬化、または他のコレステロール関連疾患の治療もしくは予防のためのヒトでの使用が既に認可されていてもよい。
【0043】
「候補薬剤」または「候補薬物」とは、本明細書において概説されるように活性がスクリーニングされ得る、任意の化合物、分子、ポリマー、高分子または分子複合体(例えば、抗体および酵素などの生物製剤を含むタンパク質、既知の薬物および薬物候補を含む有機小分子、他の種類の小分子、多糖類、脂肪酸、ワクチン、核酸など)を意味する。候補薬剤は、本発明においてコレステロール代謝および輸送に影響を及ぼす潜在的な治療薬を発見するために評価される。
【0044】
候補薬剤は多数の化学的分類を包含する。1つの実施形態では、候補薬剤は、通常100〜約2,500ダルトンの分子量を有する低分子有機化合物のような有機分子である。好ましくは、100ダルトン以上約2,000ダルトン以下、より好ましくは約1500ダルトン以下、さらにより好ましくは約1000ダルトン以下、さらにより好ましくは500ダルトン以下の分子量を有する低分子有機化合物である。候補薬剤は、タンパク質または他の宿主分子との構造的相互作用、特に水素結合のために必要な官能基を含み、通常、少なくとも1つのアミン基、カルボニル基、ヒドロキシル基またはカルボキシル基、好ましくは少なくとも2つの化学官能基を含む。候補薬剤はしばしば、1つ以上の上記の官能基で置換された環状炭素もしくは複素環構造および/または芳香族もしくは多環芳香族構造を含む。候補薬剤はまた、ペプチド、糖類、脂肪酸、ステロイド、プリン、ピリミジン、誘導体、構造類似体またはそれらの組合せを含む生体分子の中からも見いだされる。
【0045】
候補薬剤は、「既知の薬物」または「既知の薬剤」または「既に認可された薬剤」を含み、このような用語は、米国もしくは他の法的権限においてヒトまたは動物での薬剤としての治療的使用が認可されている薬剤を指す。既知の薬物はまた、例えば、The Merck Indexの第13版(米国の出版物、Whitehouse Station, N.J., USA)(参照によりその全体が本明細書に組み入れられる)において開示される任意の化合物または組成物を含むが、それらに限定されない。
【0046】
候補薬剤は、合成または天然化合物のライブラリーを含む幅広い種類の起源から入手される。例えば、ランダム化オリゴヌクレオチドおよびペプチドの発現および/または合成を含む、幅広い種類の有機化合物ならびに生体分子のランダム合成ならびに指向性合成のために当技術分野においてよく知られている、多数の方法が利用可能である。あるいは、細菌、菌類、植物および動物抽出物の形での天然化合物のライブラリーが利用可能であり、容易に作製される。加えて、天然または合成によって作製されたライブラリーおよび化合物は、従来の化学的、物理的および生化学的方法によって容易に改変される。既知の薬剤は、構造的類似体を作製し、それによってそれらを異なる候補薬剤にするために、アシル化、アルキル化、エステル化、アミド化(amidification)などの、部位指定化学修飾またはランダム化学修飾を受けてもよい。
【0047】
候補薬剤はタンパク質でありうる。本明細書において「タンパク質」とは、少なくとも2つの共有結合したアミノ酸を意味し、タンパク質、ポリペプチド、オリゴペプチドおよびペプチドを含む。タンパク質は、天然のアミノ酸およびペプチド結合、または合成ペプチド模倣薬構造で構成されうる。従って、本明細書において用いられる場合、「アミノ酸」または「ペプチド残基」とは、天然のアミノ酸と合成アミノ酸の両方を意味する。例えば、ホモフェニルアラニン、シトルリン、ノルロイシンは、本発明のためにはアミノ酸と見なされる。「アミノ酸」はまた、プロリンおよびヒドロキシプロリンなどのイミノ酸残基を含む。側鎖は、(R)または(S)立体配置のいずれかでありうる。非天然の側鎖が用いられる場合、例えば、in vivoでの分解を防止または遅延させるために、非アミノ酸置換基が使用されうる。酵素のペプチド阻害剤は具体的な用途であると思われる。
【0048】
候補薬剤は、天然のタンパク質または天然のタンパク質の断片でありうる。従って、例えば、タンパク質を含有する細胞抽出物、またはタンパク質性細胞抽出物のランダム消化物もしくは部位指定消化物が使用されうる。このようにして、原核生物タンパク質および真核生物タンパク質のライブラリーは、本明細書に記載されるシステムにおけるスクリーニングのために作製されうる。この実施形態において特に好ましいのは、細菌、菌類、ウイルス、および哺乳動物のタンパク質のライブラリーであるが、後者が好ましく、ヒトタンパク質は特に好ましい。
【0049】
候補薬剤は、タンパク質の一種である抗体でありうる。「抗体」という用語は、完全長ならびに、当技術分野において知られているような、Fab、Fab2、一本鎖抗体(例えばFv)を含む抗体フラグメント、キメラ抗体、ヒト化抗体およびヒト抗体など、完全な抗体の改変によって作製されるものまたは組換えDNA技術を用いてde novo合成されるもののいずれか、およびそれらの誘導体を含む。
【0050】
候補薬剤は核酸でありうる。「核酸」または「オリゴヌクレオチド」または本明細書における文法的同等物は、ともに共有結合した少なくとも2つのヌクレオチドを意味する。本発明の核酸は通常ホスホジエステル結合を含むが、ある場合には、下記に概説されるように、代替骨格を有しうる核酸類似体が含まれ、例えば、ホスホルアミド(phosphoramide)(Beaucageら、Tetrahedron, 49(10):1925 (1993)およびその参考文献;Letsinger, J. Org. Chem., 35:3800 (1970); Sprinzlら、Eur. J. Biochem., 81:579 (1977); Letsingerら、Nucl. Acids Res., 14:3487 (1986); Sawaiら、Chem. Lett., 805 (1984), Letsingerら、J. Am. Chem. Soc., 110:4470 (1988); およびPauwelsら、Chemica Scripta, 26:141 (1986))、ホスホロチオエート(Magら、Nucleic Acids Res., 19:1437 (1991); および米国特許第5,644,048号)、ホスホロジチオエート(Briuら、J. Am. Chem. Soc., 111:2321 (1989))、O−メチルホスホロアミダイト結合(Eckstein, Oligonucleotides and Analogues: A Practical Approach, Oxford University Press参照)、ならびにペプチド核酸骨格および結合(Egholm, J. Am. Chem. Soc., 114:1895 (1992); Meierら、Chem. Int. Ed. Engl., 31:1008 (1992); Nielsen, Nature, 365:566 (1993); Carlssonら、Nature, 380:207 (1996)参照、そのすべては参照により組み入れられる)を含む。他の類似体核酸は、正の骨格を有するもの(Denpcyら、Proc. Natl. Acad. Sci. USA, 92:6097 (1995));非イオン性骨格を有するもの(米国特許第5,386,023号;同第5,637,684号;同第5,602,240号;同第5,216,141号;および同第4,469,863号;Kiedrowshiら、Angew. Chem. Intl. Ed. English, 30:423 (1991); Letsingerら、J. Am. Chem. Soc., 110:4470 (1988); Letsingerら、Nucleoside & Nucleotide, 13:1597 (1994); ASC Symposium Series 580, “Carbohydrate Modifications in Antisense Research”, 編Y.S. SanghuiおよびP. Dan Cookの2章および3章; Mesmaekerら、Bioorganic & Medicinal Chem. Lett., 4:395 (1994); Jeffsら、J. Biomolecular NMR, 34:17 (1994); Tetrahedron Lett., 37:743 (1996))ならびに、米国特許第5,235,033号および同第5,034,506号およびASC Symposium Series 580, “Carbohydrate Modifications in Antisense Research”, 編Y.S. SanghuiおよびP. Dan Cookの6章および7章に記載されるものを含む非リボース骨格を有するもの、ならびにペプチド核酸を含む。1つ以上の炭素環糖を含む核酸もまた核酸の定義に含まれる(Jenkinsら、Chem. Soc. Rev., (1995) pp. 169-176参照)。いくつかの核酸類似体は、Rawls, C & E News, June 2, 1997, 35ページに記載される。これらの参考文献はすべて、参照により本明細書に明確に組み入れられる。リボース−リン酸骨格のこれらの改変は、標識などのさらなる部分の付加を容易にするために、または生理環境においてこのような分子の安定性および半減期を増加させるために行われうる。さらに、天然の核酸と類似体の混合物が作製され得る。あるいは、異なる核酸類似体の混合物、および天然の核酸と類似体の混合物が作製されうる。核酸は、規定されているように、一本鎖または二本鎖でありえ、または二本鎖もしくは一本鎖配列の両方の部分を含みうる。核酸は、DNA、ゲノムDNAとcDNAの両方、RNAまたはハイブリッドでありえ、その核酸はデオキシリボヌクレオチドとリボヌクレオチドの任意の組合せを含み、ウラシル、アデニン、チミン、シトシン、グアニン、イノシン、キサンチン(xathanine)、ヒポキサンチン(hypoxathanine)、イソシトシン、イソグアニン、4−アセチルシトシン、8−ヒドロキシ−N6−メチルアデノシン、アジリジニルシトシン、シュードイソシトシン、5−(カルボキシヒドロキシルメチル)ウラシル、5−フルオロウラシル、5−ブロモウラシル、5−カルボシキメチルアミノメチル−2−チオウラシル、5−カルボシキメチル−アミノメチルウラシル、ジヒドロウラシル、イノシン、N6−イソペンテニルアデニン、1−メチルアデニン、1−メチルシュードウラシル、1−メチルグアニン、1−メチルイノシン、2,2−ジメチルグアニン、2−メチルアデニン、2−メチルグアニン、3−メチルシトシン、5−メチルシトシン、N6−メチルアデニン、7−メチルグアニン、5−メチルアミノメチルウラシル、5−メトキシアミノメチル−2−チオウラシル、β−D−マンノシルキューオシン、5−メトキシカルボニルメチルウラシル、5−メトキシウラシル、2−メチルチオ−N6−イソペンテニルアデニン、ウラシル−5−オキシ酢酸メチルエステル、ウラシル−5−オキシ酢酸、オキシブトキソシン、シュードウラシル、キューオシン、2−チオシトシン、5−メチル−2−チオウラシル、2−チオウラシル、4−チオウラシル、5−メチルウラシル、N−ウラシル−5−オキシ酢酸メチルエステル、ウラシル−5−オキシ酢酸、シュードウラシル、キューオシン、2−チオシトシン、および2,6−ジアミノプリンなどを含む塩基の任意の組合せを含む。
【0051】
タンパク質について一般的に上述されたように、核酸候補薬剤は、天然の核酸、ランダムおよび/または合成核酸でありうる。例えば、原核生物ゲノムまたは真核生物ゲノムの消化物は、タンパク質について上記に概説されたように使用されうる。加えて、RNA干渉配列(RNAi)は本明細書に含まれる。
【0052】
「被験体」とは、記載されている実験または手順または過程の、生きている対象を意味する。すべての被験体は生体系である。1つの実施形態では、被験体はヒトでありうる。別の実施形態では、被験体はウサギまたは齧歯類または非ヒト霊長類でありうる。さらに、「被験体」という用語は、任意の他の生体系を包含する。
【0053】
「生体系」とは、本明細書において、細胞、細胞株、組織、器官または生物を含む任意の生きている存在を意味する。生物の例は、任意の動物、好ましくは脊椎動物、より好ましくは哺乳動物、最も好ましくはヒトを含む。哺乳動物の例は、非ヒト霊長類、家畜、愛玩動物(例えば、ネコおよびイヌ)、ならびに研究動物(例えば、マウス、ラット、およびヒト)を含む。
【0054】
「生物学的サンプル」は、生体系または被験体から取得される任意のサンプルを包含する。その定義は、血液、組織、および生体系または被験体から採取され得る生物由来の他のサンプルを包含する。好ましくは、生物学的サンプルは最小限の侵襲性または非侵襲性の方法(例えば、採尿、便の採取、採血、針吸引、および最小限のリスク、不快感または労力を必要とする他の方法)によるサンプリングによって取得される。生物学的サンプルはしばしば液体(時に「体液」と呼ばれる)である。液体の生物学的サンプルは、尿、血液、腸液、浮腫液、唾液、涙液、炎症浸出液、滑液、膿腫、蓄膿症または他の感染体液、脳脊髄液、汗、気道内分泌物(喀痰)、精液、糞便、胆汁、腸分泌物などを含むが、それらに限定されない。生物学的サンプルは、それらの取得後、試薬による処理、可溶化、または例えばタンパク質もしくはポリヌクレオチドなど、特定の成分の濃縮などによる任意の方法で処理されたサンプルを含む。「生物学的サンプル」という用語はまた、血清、血漿、他の体液、または組織サンプルなどの臨床サンプルをも包含し、また培養細胞、細胞上清および細胞溶解液をも含む。
【0055】
「同位体含量または同位体パターンまたは同位体含量もしくは同位体パターンの変化速度」は、同位体含量、同位体パターン、同位体含量の変化速度、同位体パターンの変化速度、または分子の同位体分布の他の測定結果を指す。同位体含量または同位体パターンまたは同位体含量の変化速度または同位体パターンの変化速度は、分子もしくは分子集団における同位体のパターンまたは含量または分布を指す。この用語は、幅広い意味および分子特性を含む。同位体含量または同位体パターンは、同位体含量の経時的な変化(例えば、時間の関数としての同位体含量)を含みうる。1つの実施形態では、同位体含量または同位体パターンは、サンプル中での特定の同位体のモルパーセントを表す。別の実施形態では、同位体含量または同位体パターンは、1つ以上の質量アイソトポマーの相対量を表す。別の実施形態では、同位体含量または同位体パターンは、質量アイソトポマーの分布全体を指す場合があり、巨大分子のそれは何百にも達しうる。同位体含量または同位体パターンはまた、高度に標識された単一の分子種(例えば、4つの重水素を有する前駆体)の相対量をも表しうる。同位体含量または同位体パターンは、単一アイソトポマーの超過モル百分率(molar percent excess)を指すことができ、またはそれは特定の同位体の超過原子百分率(atom percent excess)を指すことができる。同位体含量または同位体パターンは、本明細書に記載される本方法の実施の間に行われる質量分析により測定されるものを含む。これらの分析は、特定の質量アイソトポマーの超過モル百分率(MPE)(例えば、コレステロールのM1アイソトポマーのMPE、またはコール酸のM4アイソトポマーのMPE、または血中の2H2OのMPE)の測定を含みうる。これらの分析は、特定の原子同位体の超過原子百分率(APE)(例えば、コレステロール中の13CのAPE)の測定を含みうる。
【0056】
「対象となる分子」とは、本明細書に記載される方法の実施の間に精製もしくは分析のために選択される、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体を意味する。このような対象となる分子は、本明細書に記載される方法を実施する間に被験体において見いだされるかまたは生成される同位体標識生成物である。例えば、RCTの肝臓成分または排出成分の測定は、被験体の肝臓における13C2標識コレステロールの13C2標識コール酸への変換に基づきうる。この場合は、コール酸が対象となる分子であり、それはその13C同位体含量または同位体パターンについて分析される。同様に、RCTの血漿成分の測定は、HDL中の14C2標識コレステロールの、VLDL中の14C2標識コレステロールエステルへの変換に基づきうる。この場合は、VLDLに由来するコレステロールエステルが対象となる分子であり、それはその14C同位体含量または同位体パターンについて分析される。対象となる分子は被験体に投与された同位体標識分子(コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体もしくコレステロール前駆体)と同一であってもよく、またはそれは異なる同位体標識分子、例えば、被験体もしくは微生物のいずれかによる被験体内での代謝性事象により生成されたものであってもよい。
【0057】
対象となる分子は、コレステロールまたはコレステロールエステルを含みうる。対象となる分子はまた、カイロミクロン、TGRL、HDL、IDL、LDL、またはVLDLに由来するコレステロールを含みうる。対象となる分子はまた、カイロミクロン、TGRL、HDL、IDL、LDL、またはVLDLに由来するコレステロールエステルを含みうる。対象となる分子はまた、血液、糞便、胆汁、尿、または任意の他の生物学的サンプル由来の胆汁酸を含みうる。対象となる分子はまた、血液、糞便、胆汁、尿、または任意の他の生物学的サンプル由来の中性ステロールを含みうる。対象となる分子はまた、ケノデオキシコレート、コレート、デオキシコレート、リトコレート、ウルソデオキシコレート、リン脂質、またはビリルビンを含みうる。対象となる分子はまた、消化管微生物によって生成される胆汁酸の代謝産物を含みうる。対象となる分子はまた、消化管微生物によって生成される中性ステロールの代謝産物(例えば、コプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノール)を含みうる。このような微生物代謝産物は糞便内において見いだされ、またはそれらは被験体に再吸収されて、他の生物学的サンプル中に出現しうる。
【0058】
被験体または生物学的サンプル中の対象となる分子の全プールの一部である、同位体標識された対象となる分子は、本発明の方法の実施により生成された生成物である。
【0059】
「モノアイソトピック質量」は、すべて1H、12C、14N、16O、32Sなどを含む分子種の正確な質量を指す。C、H、N、O、P、S、F、Cl、BrおよびIからなるアイソトポログに関して、最も低い質量を有するアイソトポログの同位体組成は一つしかない一義的なものである。なぜなら、これらの元素の最も豊富な同位体もまた最も低い質量を有するからである。モノアイソトピック質量はm0と略され、他の質量アイソトポマーの質量は、それらの質量のm0との差異によって区別される(m1、m2など)。
【0060】
「質量アイソトポマー」または「アイソトポマー」は、同位体組成よりむしろ見掛けの質量に基づいて分類される同位体異性体群を指す。質量アイソトポマーは、アイソトポログとは異なり、異なる同位体組成の分子を含みうる(例えば、CH3NHD、13CH3NH2、CH315NH2は同一の質量アイソトポマーの一部であるが、異なるアイソトポログである)。実務上の用語では、質量アイソトポマーは、質量分析計によって分離されないアイソトポログ群である。四重極質量分析計では、これは通常、質量アイソトポマーは見掛けの質量を共有するアイソトポログ群であるということを意味する。従って、アイソトポログCH3NH2とCH3NHDは見掛けの質量が異なり、異なる質量アイソトポマーとして区別されるが、アイソトポログCH3NHD、CH2DNH2、13CH3NH2およびCH315NH2はすべて同一の見掛けの質量であり、従って同一の質量アイソトポマーである。従って、それぞれの質量アイソトポマーは通常、1つ以上のアイソトポログからなり、1つ以上の正確な質量を有する。すべての個々のアイソトポログは四重極質量分析計によって分離されず、より高い質量分解能を実現する質量分析計を用いても分離されないかもしれないため、質量分析データからの算出は、アイソトポログよりむしろ質量アイソトポマーの存在度で行われなければならないので、アイソトポログと質量アイソトポマーとの区別は実際面で有用である。最も低い質量の質量アイソトポマーはM0で表され;ほとんどの有機分子にとって、これはすべて12C、1H、16O、14Nなどを含む分子種である。他の質量アイソトポマーは、それらの質量のM0との差異によって区別される(M1、M2など)。特定の質量アイソトポマーに関して、分子内の同位体の配置または位置は特定されず、異なりうる(すなわち、「位置アイソトポマー」は区別されない)。
【0061】
「同位体標識」とは、同一の数の陽子を有し、従って同一の元素であるが、異なる数の中性子を有する原子による標識を意味する(例えば、1Hに対する2H)。同位体標識分子は任意の可能性のある同位体によって標識される。同位体は安定同位体(例えば、2H、13C)であってもよく、またはそれらは放射性同位体(例えば、3H、14C)であってもよい。
【0062】
「同位体標識基質」は、生体系または被験体において対象となる分子に取り込まれ得る、任意の同位体標識前駆体分子を含む。同位体標識基質の例は、2H2O、3H2O、2H−グルコース、2H標識アミノ酸、2H標識有機分子、13C標識有機分子、14C標識有機分子、13CO2、14CO2、15N標識有機分子および15NH3を含むが、それらに限定されない。
【0063】
「精製」は、他の類似した化合物の混合物の1つ以上の成分を取り出す方法を指す。例えば、「タンパク質またはペプチドの精製」は、タンパク質またはペプチドの混合物中の1つ以上のタンパク質またはペプチドからタンパク質またはペプチドを取り出すことを指す。
【0064】
「単離」は、化合物の混合物から1つの化合物を分離することを指す。例えば、「タンパク質またはペプチドの単離」は、1つ以上のタンパク質またはペプチドの混合物中の他のすべてのタンパク質またはペプチドから1つの特定のタンパク質またはペプチドを分離することを指す。
【0065】
「前駆体分子」は、特定の分子の合成の間に用いられる代謝前駆体を指す。前駆体分子の例は、アセチルCoA、リボ核酸、デオキシリボ核酸、アミノ酸、グルコース、水などを含む。
【0066】
「標識水」は、本明細書において用いられる場合、同位体を含有する水を指す。標識水の例は、2H2O、3H2O、およびH218Oを含む。本明細書において用いられる場合、「同位体標識水」は「標識水」と同義に用いられる。
【0067】
「分子流速」は、細胞、組織、もしくは生物内での分子の合成速度および/または分解速度を指す。「分子流速」はまた、分子プール内への分子の流入または分子プールからの移動を指し、従って分子プール内へまたは分子プールからの流量と同義である。
【0068】
コレステロール輸送および代謝の測定方法
コレステロール逆輸送(RCT)は、コレステロールが動員され体外へ輸送される生物学的経路である(図1)。RCTの3つの成分:(1)組織、特に肝臓外の組織から血流へのコレステロールの流出(流出成分、図2);(2)血漿画分内でのコレステロールの輸送および分布(血漿成分、図3);ならびに(3)肝臓または腸を介した糞便内への排出(肝臓成分もしくは排出成分、図4)がある。コレステロールは、胆汁酸または遊離コレステロール(ステロール)のいずれかとして胆汁分泌に組み込まれ、その後、腸管腔に分泌され、その一部は体から糞便内に出る。ステロールはまた、腸から腸管内腔に直接放出され、その後一部が糞便内に排出されうる。これらの経路は、コレステロールが体から除去され得る唯一の有効な機序である。機能的観点から、成分#1および#3(すなわち、流出成分および肝臓成分または排出成分)は、それぞれ細胞からのおよび体からのコレステロールの出口であるため、重要なステップである。上述のように、アテローム生成、アテローム硬化ならびに他のコレステロール関連疾患および血管疾患におけるコレステロールの確立された役割のため、RCTは、重要な抗アテローム生成過程および抗アテローム硬化過程と考えられ、心血管系リスクの低下と血漿の高密度リポタンパク質(HDL)画分との臨床相関と同様に、抗アテローム生成特性および抗アテローム硬化特性に対する理由であると一般に信じられている。
【0069】
しかし、HDLレベルは、RCTの分子経路の1つの成分しか反映せず、RCT経路を介したコレステロールの真の流れを必ずしも反映しないことが現在は認識されている。RCT経路の分子詳細は、この数年間でさらに重視されるようになった。分子的理解におけるこれらの最近の進歩の1つの重要な意味は、単独での血漿HDLc(HDL−コレステロール)レベルは、HDLcの変化に関与する根底の機序によって、その経路を介した真の流れを反映するかもしれず、またはしないかもしれないという認識である。例えば、個体におけるHDLcの血漿濃度が、突然変異体ABC(A)−1ヘテロ接合体でのように、組織からABC(A)−1(ATP結合カセットトランスポーター)を介した血漿apoA1含有粒子への流れである場合、HDLcは有用なマーカーである。しかし、別の個体においてHDLcが、そのアクセプターへのHDLcの送達阻害のために蓄積する場合(例えばコレステロールエステル輸送タンパク質活性の低下または肝臓のスカベンジャー受容体−B1[SR−B1]活性の低下による場合)、HDLcレベルはRCTを反映しない。スタチンのような、apoB含有粒子の産生および運命を変化させる治療のRCTに対する影響を考慮した場合、状況は特に複雑であり得る。apoB粒子は逆方向(すなわち、肝臓に戻す)だけでなく、コレステロールを前方に(すなわち、組織に)運ぶこともできるため、個体におけるapoB粒子の実際の運命は、いずれの血漿HDLレベルでもRCTの効率に寄与しうる。従って、HDLc濃度とRCTとの間の既存の解離を増加させる可能性は、効果的なスタチン治療もしくはVLDLおよびLDL粒子の肝臓への回帰を促進する他の治療の背景において、またはコレステロール代謝もしくは脂質代謝の改変に対して行われる事実上任意の治療(例えば、スタチン治療、フィブラート治療など)において生じる。
【0070】
RCT活性とHDLcレベルとの間の違いは、本開示の基礎を説明する。RCTなどの生化学的過程の測定は、生化学的分子の濃度の測定と同じではない。HDLcの濃度の測定は技術的に単純な作業であるが、単独では、必ずしも情報を提供するとは限らない。対象となる過程は血漿中のHDLc濃度ではなく、対象となる過程はコレステロールの体からの除去(すなわち、RCT)である。HDLcの測定、それ自体は、単に実際の過程の代用である。この違いのいくつかの例は、動物モデルならびにヒトについて当技術分野において知られている。アテローム硬化を生じやすいマウスにおけるSR−BI受容体の遺伝子欠失は、HDLからのコレステロールの取り込みが低下することによってRCT過程を低下させ、それによって、血漿HDLコレステロールレベルを著しく増加させる。しかし、より高いHDLレベルにもかかわらず、これらのマウスはより悪化したアテローム硬化を呈する。このHDLコレステロールレベルと心臓保護との間の解離は、HDLの濃度よりも流れの優位性を反映する。同様に、アテローム硬化を生じやすいマウスにおけるタンパク質ABC−A1の遺伝子の過剰発現は、より低いHDLコレステロールレベルをもたらすが、アテローム硬化に対する保護をもたらす。実際、通常のHDLと血管系リスクとの間の関係とは反対に、HDLレベルがより高いほど、より悪化したアテローム硬化が観察された。さらに、突然変異apoA1−ミラノを有するヒトは、低いHDLコレステロールレベルを有するが、著しく低下した心血管系リスクを有し、おそらく、血流中での蓄積なしにRCT経路を介してコレステロールを運ぶapoA1−ミラノの優れた能力を反映している。
【0071】
従って、RCT経路によって組織から血液を介して体外へ輸送されるコレステロールの量を実際に測定しうる方法は、問題となっている過程の直接測定であろう。本開示は、RCT経路に重点を置いて、生体系もしくは被験体によって合成され、輸送され、修飾され、代謝され、分泌され、または別の方法で移動される、コレステロールあるいはコレステロール関連分子あるいはコレステロール関連複合体の量(絶対量、相対量、または割合)の測定を記載する。これらのような方法は、必ずではないが、時に経時実験を含むため、またはデータを速度の形(すなわち、単位時間当たりの量)に返すため、しばしば「キネティック」測定の項目に分類される。本開示では、RCT経路の異なる成分を介するコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の動きを追跡するために、同位体標識が用いられる。同位体標識分子は非標識分子と化学的に同一であり、生化学的に区別できないが、それらは異なる質量を有し、様々な質量分析またはレーザー分光光度法もしくはレーザー分光法などの他の方法によって測定され得る特性を有する。同位体標識分子の出現、希釈、濃縮、もしくは消失を追跡することによって、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の輸送あるいは代謝が測定され得る。
【0072】
コレステロール関連疾患の世界的な影響の増大のため、ならびにコレステロール代謝の複雑さおよびその研究のため、RCT速度を測定するin vivoでの方法が必要とされ、医療ならびに創薬および薬剤開発に対して大きな実用性を有する。候補治療法の同定、選択、評価および開発(例えば、臨床または前臨床用量設定および用量の最適化、有効性の測定)、コレステロール関連疾患の診断、疾患進行または治療への反応の評価を含む被験体の管理、ならびにコレステロール関連疾患の管理、診断もしくは治療に使用するための医療機器または医療用具の設計および試験は、本発明の方法の実施から利益を受けるすべての過程である。臨床試験への登録前の被験体の評価は、本発明の1つの有益な用途である。彼らが候補治療法に反応するか否かを予測するために被験体を評価することは、本発明の別の有益な用途である。本発明は、コレステロール関連疾患のリスクを変える遺伝的要因の同定および研究、ならびに被験体を分類するためおよび治療を推奨するために使用され得る疾患基準(すなわち、疾患状態または前疾患状態を示すリスクファクターの組合せ)の開発に対するさらなる用途を有する。
【0073】
本開示は、in vivoでのコレステロール輸送および代謝の測定方法を提供する。1つの実施形態では、本開示は、さらに具体的には、コレステロールを細胞および体から出す機序である、RCTの測定を対象とする。「コレステロール逆輸送」または「RCT」という用語は、コレステロールが細胞から血流へ、および血流から体外へ移動する全過程を表すために用いられる。RCT過程は、コレステロールの一時的もしくは永続的な代謝または修飾を含み、コレステロールの輸送だけを扱うのではなく、むしろ様々なコレステロール前駆体および派生生成物を扱う。さらに、RCTの間、コレステロールおよびその様々な代謝産物は、HDLサブクラスおよび超低密度リポタンパク質(VLDL)などの様々な担体分子または複合体と関連し、それらの間を輸送される。RCTのいくつかの成分(例えば、胆汁酸)は分泌および再吸収され、他のものは可逆的に輸送または修飾されて平衡状態(すなわち、問題となっている過程の両方向での自由な輸送がある状態)で存在するように、RCT過程は必ずしも一方向性ではない。本開示の文脈では、「RCT」という用語は、コレステロールおよびコレステロール代謝産物またはコレステロール関連分子が生体(すなわち、生体系もしくは被験体)から最終的に除去される過程を表すために用いられる。RCT過程は、「流出成分」、「血漿成分」、および「肝臓成分または排出成分」の3部の過程として特徴づけされうる(図1)。本開示は、3つの成分のいずれも他の成分を測定または評価することなく独立して測定され得るが、全体としてのRCTの測定を対象とする。
【0074】
測定は通常、ヒトを含む哺乳動物被験体において実施される。哺乳動物は、霊長類、家畜、競技動物、ネコおよびイヌなどの愛玩動物、モルモット、ウサギ、ハムスター、マウス、ラット、ヒトなどを含むが、それらに限定されない。
【0075】
I.被験体におけるRCTの流出成分の速度の測定
1つの態様では、RCTの流出成分が被験体において測定されうる。1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体が被験体に投与される。一定期間後、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体を含有する、血漿サンプルなどの1つ以上のサンプルが被験体から取得され、その分子もしくは複合体の同位体含量または同位体パターンが測定される。組織由来の内在性コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の流出による、投与された標識の希釈量がこのデータから算出され、それは実験の間の流出量を直接反映する。さらに、標識分子または複合体の内在性非標識分子もしくは複合体による希釈速度を算出することによって、被験体におけるコレステロール逆輸送の流出成分の速度が測定され得る。この過程は下記の実施例1に例示される。
【0076】
A.同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与
同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、経口、非経口、皮下、血管内(例えば、静脈内もしくは動脈内)、腹腔内または筋肉内を含むがそれらに限定されない様々な経路によって被験体に投与され得る。
【0077】
投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、下記のいずれかでありうるが、それらに限定されない:
・同位体標識コレステロール
・脂質エマルジョンに懸濁された同位体標識コレステロール
・高密度リポタンパク質(HDL)粒子に結合した同位体標識コレステロール
・低密度リポタンパク質(LDL)粒子に結合した同位体標識コレステロール
・超低密度リポタンパク質(VLDL)粒子に結合した同位体標識コレステロール
・中間密度リポタンパク質(IDL)粒子に結合した同位体標識コレステロール
・カイロミクロンに結合した同位体標識コレステロール
・同位体標識コレステロールエステル
・脂質エマルジョンに懸濁された同位体標識コレステロールエステル
・HDL粒子に結合した同位体標識コレステロールエステル
・LDL粒子に結合した同位体標識コレステロールエステル
・VLDL粒子に結合した同位体標識コレステロールエステル
・IDL粒子に結合した同位体標識コレステロールエステル
・カイロミクロンに結合した同位体標識コレステロールエステル。
【0078】
コレステロールまたはコレステロール関連分子またはコレステロール関連複合体を標識するために使用される同位体は、安定同位体(例えば、2H、18O、もしくは13C)であってもよく、またはそれは放射性同位体(例えば、3Hもしくは14C)であってもよい。コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、複数の異なる同位体標識を有しうる。それは、複数の位置で同一の同位体標識によって標識されてもよい。それは、複数の位置で複数の異なる標識によって標識されてもよい。例えば、2Hおよび18Oまたは2Hおよび13Cまたは任意の標識の組合せによって標識することができる。
【0079】
また、同位体標識されたものの代わりに修飾されたコレステロールまたはコレステロール関連分子もしくは複合体を用いることもできる。修飾されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体がその内在性対応物と識別され得る限り、本方法は修飾されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体を用いて実施され得る。修飾されたコレステロール分子の一例は、メチル基によって修飾されているメチルコレステロールである。メチルコレステロールの場合、コレステロールに非常によく似ているが、質量分析、NMRまたはレーザー分光光度法もしくはレーザー分光法などの他の方法(下記参照)によって識別できるコレステロール分子を作製するために、単一のメチル基がコレステロールに付加される。付加的なメチル基を含む対象となる分子の割合の測定は、対象となる分子の同位体含量の測定に代わることができる(下記参照)。同様に、超過モル百分率は、対象となるメチル化分子について表される(例えば、MmethylのMPE)。MPEの算出は下記において議論される。
【0080】
上記に記載された同位体標識分子もしくは複合体、または他の同位体標識分子もしくは複合体の調製方法は、当業者にとって既知である。
【0081】
同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、様々な方法で投与されうる。それらは、連続的、反復的、不連続的に、または他の方法によって投与され得る。1つの実施形態では、脂質エマルジョン中の既知量の同位体標識コレステロールは、一定の速度で、血漿コレステロールについて定常状態レベルに達するのに十分な時間注入される。
【0082】
B.1つ以上の生物学的サンプルの取得
同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の投与後または投与の間に、生物学的サンプルが取得される。生物学的サンプリングの頻度は様々な要因によって異なりうる。このような要因は、生物学的サンプルの性質、サンプリングの容易さおよび安全性、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の生物学的速度定数および代謝回転の反応速度、ならびに被験体に施行される候補治療法の性質を含むが、それらに限定されない。1つの実施形態では、同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の注入後または注入の間に、被験体から複数の生物学的サンプルが採取される。
【0083】
生物学的サンプルの性質は大きく異なりうる。1つの実施形態では、サンプルは尿または糞便である。別の実施形態では、サンプルは血液である。サンプルは、十分な量のコレステロールまたはコレステロール関連分子またはコレステロール関連複合体(対象となる分子)を得るために選択され、その同位体含量または同位体パターンについて分析される。対象となる分子は実験計画によって異なり、上記のI−A項に記載されるように投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の選択に基づいて選択されうる。サンプルは複数の対象となる分子を含んでもよく、単一の対象となる分子を分析するために、複数のサンプルが採取されてもよい。1つの実施形態では、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は脂質エマルジョン中の13C標識コレステロールであり、生物学的サンプルはコレステロールを含有するであろう血液サンプルである。血中のコレステロールの同位体含量または同位体パターンはその後、下記に記載されるように測定されるであろう。
【0084】
続いて、対象となる分子の同位体含量または同位体パターンの測定が行われる。この測定は直接サンプルに対して行われてもよく、またはそれはサンプルを処理した後に行われてもよい。ある場合には、サンプルは、同位体含量または同位体パターンが測定される前に広範に処理されうる。サンプルは、HDLもしくはHDLのサブクラスなど、特定のコレステロール関連分子またはコレステロール関連複合体を単離するために処理され、単離された分子または複合体はその後、質量分析に適した形にさらに処理されうる。
【0085】
コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体を精製、部分精製、または単離するために生物学的サンプルに適用されうる技術のいくつかは、遠心分離、溶媒沈殿、塩析沈殿、またはpHによる沈殿、高圧液体クロマトグラフィー(HPLC)、高速液体クロマトグラフィー(FPLC)、逆相クロマトグラフィー、サイズ排除クロマトグラフィー、薄層クロマトグラフィー、ガスクロマトグラフィー、ゲル電気泳動、限外ろ過、超遠心分離法、アフィニティークロマトグラフィー、キャピラリー電気泳動、選択的タンパク質分解または示差的(differential)タンパク質分解、示差的(differential)化学分解、結晶化、再結晶化、制限タンパク質分解、制限化学的分解、ならびに/あるいは、当業者にとって既知の化学的なおよび/もしくは生化学的なおよび/もしくは高分子の化合物、生体分子または複合体を分離する任意の他の方法を含むが、それらに限定されない。さらに、コレステロールおよび/またはコレステロール関連分子および/またはコレステロール関連複合体を取得、精製、ならびに単離する方法は、例えば、Cell Biology: A Laboratory Notebook (J.E. Cellis編、1998); Current Protocols in Molecular Biology (F.M. Ausubelら編、1987); Short Protocols in Molecular Biology (WileyおよびSons, 1999)、ならびに当技術分野において周知の他の情報源において見いだされうる。
【0086】
精製もしくは部分精製されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、化学的加水分解、熱加水分解、酸加水分解、化学誘導体化(例えば、アシル化、アセチル化)、水性・有機溶媒抽出、化学的乾燥、真空乾燥、および当技術分野において既知の他の技術を含むがそれらに限定されない技術によって、同位体含量または同位体パターンの分析のためにさらに処理されうる。精製もしくは部分精製されたコレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、分析の前に他の分子とコンジュゲートされうる。例えば、コレステロールは、同位体含量または同位体パターンの分析の前に、そのトリメチルシリル誘導体に誘導体化されうる。
【0087】
別の実施形態では、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、より小さい分子を形成するために加水分解または別の方法で分解されうる。加水分解法は、化学的加水分解(酸加水分解など)および生化学的分解を含むがそれらに限定されない、当技術分野において既知の任意の方法でありうる。加水分解または分解は、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の精製および/または単離の前後いずれかに実施されうる。
【0088】
C.コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンの測定
その後、対象となるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンが測定される。同位体含量または同位体パターンは、質量分析、核磁気共鳴(NMR)分光法、レーザー分光光度法、レーザー分光法、液体シンチレーション計数、または当技術分野において既知の他の方法を含むがそれらに限定されない方法によって測定されうる。同位体含量または同位体パターンは直接測定されてもよく、またはコレステロールが上述のように化学的もしくは生化学的に修飾された後に分析されてもよい。
【0089】
コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体における同位体含量または同位体パターンは、ガスクロマトグラフィー質量分析(GC−MS)、同位体比質量分析、GC−同位体比燃焼MS、GC−同位体比熱分解MS、液体クロマトグラフィーMS、エレクトロスプレーイオン化MS、マトリックス支援レーザー脱離飛行時間型MS、フーリエ変換イオンサイクロトロン共鳴MS、サイクロイドMSなどを含むがそれらに限定されない様々な質量分析法によって測定されうる。
【0090】
質量分析計は分子を高速移動する気体イオンに変換し、それはその後、質量電荷比に基づいて分析される。従って、イオンもしくはイオン断片の同位体またはアイソトポログの分布は、複数の分子における同位体含量または同位体パターンを測定するために使用されうる。
【0091】
通常、質量分析計はイオン化装置および質量分析器を含む。多数の異なる種類の質量分析器が当技術分野において知られている。これらは、磁場型分析器、エレクトロスプレーイオン化、四重極、イオントラップ、飛行時間型質量分析器、およびフーリエ変換分析器を含むが、それらに限定されない。
【0092】
質量分析計はまた、多数の異なるイオン化方法を含みうる。これらは、電子衝撃、化学イオン化、および電場イオン化などの気相イオン化源、ならびに、電場脱離、高速原子衝撃、マトリックス支援レーザー脱離/イオン化、および表面増強レーザー脱離/イオン化などの脱離イオン化源を含むが、それらに限定されない。
【0093】
加えて、最初に前駆イオンを分離し、次に気相断片イオンを分離、測定するために、2つ以上の質量分析計が連結されうる(MS/MS)。これらの機器は、分子の一連の初期イオン断片を発生させ、次に初期イオンの二次断片を発生させる。MS/MSフラグメンテーションパターンおよび質量分析によってもたらされる正確な分子質量決定は、分子の化学組成に関する固有の情報を提供する。未知の分子は、1回の質量分析の実行により数分のうちに同定され得る。現在利用可能な化学物質フラグメンテーションパターンのライブラリーは、複雑な混合物の成分をほぼ確実に同定する機会を提供する。このような技術は、対象となるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンを、関連した生物学的サンプルのいかなる処理も必要とせずに(すなわち、直接測定で)分析するために使用されうる。
【0094】
様々なイオン化方法もまた当技術分野において知られている。1つの重要な進歩は、大きな不揮発性の巨大分子をイオン化するための技術の開発であった。この種の技術は、エレクトロスプレーイオン化(ESI)およびマトリックス支援レーザー脱離/イオン化(MALDI)を含んでいる。これらは、MSが液体クロマトグラフィーおよびキャピラリーゾーン電気泳動などの強力なサンプル分離導入技術と組み合わせて利用されることを可能にした。
【0095】
加えて、質量分析計は、ガスクロマトグラフィー(GC)および高速液体クロマトグラフィー(HPLC)などの分離手段と連結されうる。ガスクロマトグラフィー質量分析(GC/MS)では、ガスクロマトグラフィーからのキャピラリーカラムは、任意選択でジェットセパレーターを用いて、質量分析計に直接連結される。このような適用では、ガスクロマトグラフィー(GC)カラムはサンプルガス混合物からサンプル成分を分離し、分離された成分は質量分析計においてイオン化され化学的に分析される。
【0096】
加えて、同位体が放射性同位体である場合、同位体含量または同位体パターンまたは存在度は、液体シンチレーション計数、ガイガー計数、CCDによる検出、フィルムによる検出などを含むがそれらに限定されない、放射性同位体の測定のために当技術分野において既知の技術を用いて測定されうる。
【0097】
通常、本明細書において企図される測定は、幅広い種類の機器によって実施され得る。上記の列挙は非限定的である。
【0098】
本開示では、2つの分類の同位体標識分子が検討される。第一の分類は、被験体に投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体である。第二の分類は、対象となる分子である。対象となる分子とは、その同位体含量または同位体パターンが後に測定される分子である。対象となる分子は生物学的サンプル中に含まれる。対象となる分子はコレステロールまたはコレステロール関連分子またはコレステロール関連複合体でありうる。対象となる分子は被験体の代謝作用によって標識されうる。対象となる分子は、被験体に投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体と同一でありうる。要するに、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は被験体に投与され、対象となる分子の同位体含量または同位体パターンはその後に測定されるものである。
【0099】
通常、本開示から導かれる生物学的サンプル中のコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンは、任意の同位体標識分子を投与する前の、同一分子のベースラインの同位体含量または同位体パターンと比較して表される。選択されたコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体(対象となる分子)に関するベースラインの同位体含量または同位体パターンを測定するため、サンプルは同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与前に採取され得、対象となる分子の同位体含量または同位体パターンはベースラインサンプルで分析され得る。このような測定は、生物体内での対象となる分子の天然の同位体含量または同位体パターンを確立する1つの方法である。多くの場合、ベースラインの同位体含量または同位体パターンは、いずれの種類の標識分子も投与されていない被験体から採取された生物学的サンプル由来の過去の(既存の)データに基づき推定され得る。これは、ある生物が類似の環境履歴を有する被験体の集団の一部である場合、特に当てはまる。さらに、このようなベースラインの同位体含量または同位体パターンは、同位体の既知の平均天然存在度を用いて推定されうる。例えば、天然では、有機炭素中に存在する13Cの天然存在度は1.11%である。このようなアイソトポマー頻度分布の予測方法は当技術分野においてよく知られており、文献に記載されている(下記参照)。
【0100】
実際の同位体含量または同位体パターンは、上記に記載されたように得られたデータから算出されうる。これらの算出は、利用可能な過去のデータまたはベースラインデータの量、実施者の好み、目的とする測定の精度、分析に使用される機器の種類、および他の要因に応じて、様々な形式を取り得る。算出の例を下記に示す。
【0101】
1.相対的および絶対的な質量アイソトポマー存在度の測定
質量分析計は、サンプル中の異なる質量の分子または原子の相対量を測定する。これらの量は、時に存在度と呼ばれる。測定された質量スペクトルピークの高さ、あるいはピーク下面積は、元の(ゼロ質量アイソトープ(zero mass isotope))アイソトポマーに対する比として表されうる。本開示のためのこのようなデータの記載において、サンプル中のアイソトポマーの存在度に対する相対値および絶対値を提供する任意の算出方法を使用できることが認識される。1つの実施形態では、異なる質量アイソトポマーの相対存在度がGC/MSによって測定され、所定のアイソトポマーの超過モル百分率が算出される。別の実施形態では、異なる同位体の相対存在度が、GC燃焼同位体比質量分析(GCC−IRMS)、またはGC熱分解同位体比質量分析(GCP−IRMS)によって原子レベルで測定され、所定のアイソトポマーの超過原子百分率が算出される。
【0102】
2.同位体含量または同位体パターンの算出
a.超過モル百分率(MPE)
同位体含量または同位体パターンは、上記のI−C−1項に記載されるように収集された存在度データから算出されうる。1つの実施形態では、同位体含量または同位体パターンは超過モル百分率(MPE)として表される。MPEを決定するために、実施者はまず、対象となる分子のアイソトポマーの存在度の割合を決定する(アイソトポマーは、対象となる分子の性質および被験体に投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の性質に基づいて選択される)。これは、GC/MSに由来するような存在度データから、質量アイソトポマーMxの存在度の割合を決定するための一般的な形式である、下記の方程式を用いて算出され得る。すなわち、
【数1】

【0103】
であり、式中、0〜nは、存在量が生じる、最も低い質量の(M0)質量アイソトポマーに対する見掛けの質量の範囲である。
【0104】
存在度の割合を決定したら、それをベースライン、過去のベースライン、理論上のベースライン、または(上述のようにして得られる)他のこのような参照値と比較することにより、MPEを決定する。これは下記の方程式を用いて算出される。すなわち、
【数2】

【0105】
であり、式中、下付きのeは富化(enriched)を指し、bはベースライン(baseline)すなわち天然の存在量を指す。
【0106】
MPEを決定したら、新たに合成された分子の割合または内在性分子による希釈の程度が決定され得る。両方の場合において、MPEは、最大限可能な超過モル百分率を示す値と比較される。対象となる分子が同位体標識前駆体の代謝によって生成される場合(例えば、2H4−コレステロールから2H4−コール酸の生成)、前駆体のMPEが測定され、最大限可能なMPEの算出に直接またはその基盤として使用されうる。最大限可能なMPEはまた、過去のデータ、投与される同位体標識の量に基づく計算、被験体の性質(例えば、体重、身体組成)を考慮に入れた同様の計算、純粋に理論上の計算、ならびに他の概算、測定、および遡及的データ分析の組合せからも決定されうる。最大限可能なMPEはまた、完全に標識された対象となる分子を含有することが知られている別の生物学的サンプルにおけるMPEを測定することによっても決定されうる。標識の希釈の場合には、最大限可能なMPEは、投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体のMPEに基づく。
【0107】
出願者は同位体標識の取り込みおよびアイソトポマー分布の分野において十分な経験を有し、同位体含量または同位体パターンの算出および分析に関する多数の技術および算出方法を開発している。これらは質量アイソトポマー分布解析(MIDA)を含み、詳細には米国特許第5,338,686号、同第5,910,403号、および同第6,010,846号に広範に記載され、それらは参照により全文が本明細書に組み入れられる。MIDAの変形形態および他の関連技術はさらに、HellersteinおよびNeese (1999)、ならびに Chinkesら(1996)、ならびにKelleherおよびMasterson (1992)、ならびに米国特許出願第10/279,399号を含む、当業者にとって既知の多数の異なる情報源に記載され、それらすべては参照によりその全文が本明細書に組み入れられる。
【0108】
上記の参考文献に加えて、その方法を実行する計算ソフトウェアは、University of California, BerkeleyのMarc Hellerstein教授から公的に入手可能である。
【0109】
b.超過原子百分率(APE)
同位体含量または同位体パターンは、上記に記載されるように収集された存在度データから算出されうる。1つの実施形態では、同位体含量または同位体パターンは超過原子百分率(APE)として表される。APEを決定するために、実施者はまず、対象となる分子中の対象となる同位体の存在度の割合を決定する(対象となる同位体は、対象となる分子の性質および被験体に投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の性質に基づいて選択される)。これは、GCC−IR−MSまたはGCP−IR−MSに由来するような存在度データから、同位体Ixの存在度の割合を決定するための一般的な形式である、下記の方程式を用いて算出され得る。すなわち、
【数3】

【0110】
であり、式中、0〜nは、存在量が測定される選択された原子の可能性のある同位体の範囲である。
【0111】
存在度の割合を決定したら、それをベースライン、過去のベースライン、理論上のベースライン、または(上述のようにして得られる)他のこのような参照値と比較して、超過原子百分率(APE)を決定する。これは下記の方程式を用いて算出される。すなわち、
【数4】

【0112】
であり、式中、下付きのeは富化(enriched)を指し、bはベースライン(baseline)すなわち天然の存在量を指す。
【0113】
APEを決定したら、新たに合成された分子の割合または内在性分子による希釈の程度が決定され得る。これは上述のように実施されるが、理論上の最大APEの場合にはさらなる計算を必要としうる。このような計算は当業者にとって公知である。
【0114】
3.同位体含量または同位体パターンの種類
本開示では、同位体含量または同位体パターンはしばしば、MPEまたはAPEとして表される。超過モル百分率は時にEMXと書かれ、(ベースラインサンプル、過去のベースラインデータ、または予測されるベースライン値と比較した分析されている分子の考えられる質量すべてに対する)所定の質量の超過モル百分率を指す。投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体および対象となる分子の多数の組合せが、本開示において検討される。可能性のある方法の範囲の説明を目的とする非限定的な計画は下記のとおりである。
【0115】
計画1:13C2−コレステロール(天然の存在分子において主要な12C原子の代わりに2原子の13Cを含有するコレステロールと定義される)を被験体に投与し、その後、血中コレステロールをGC/MSにより分析することによって、コレステロールの同位体含量または同位体パターンが測定されうる。このような場合、ベースラインまたは同様のデータと組み合わせて、EM2(他の天然のアイソトポログに加えて、2原子の13Cで標識されたコレステロールを表す)が決定されてもよく、これは同位体含量または同位体パターンの関連測定値である。あるいは、同一サンプル由来のコレステロールは、13CのAPEを測定するために、ガスクロマトグラフィー/熱分解/同位体比質量分析によって分析されてもよく、それもまた同位体含量または同位体パターンの関連測定値である。
【0116】
計画2:2H4−コレステロールを被験体に投与し、その後、血中コレステロールをGC/MSにより分析することによって、コレステロールの同位体含量または同位体パターンが測定されうる。このような場合、ベースラインまたは同様のデータと組み合わせて、EM4(他の天然のアイソトポログに加えて、4原子の2Hで標識されたコレステロールを表す)が決定されてもよく、これは同位体含量または同位体パターンの関連測定値である。あるいは、同一サンプル由来のコレステロールは、2HのAPEを測定するために、ガスクロマトグラフィー/熱分解/同位体比質量分析によって分析されてもよく、それもまた同位体含量または同位体パターンの関連測定値である。
【0117】
計画3:2H4−コレステロールを被験体に投与し、その後、血中コレステロールエステルをGC/MSにより分析することによって、コレステロールの同位体含量または同位体パターンが測定されうる。このような場合、ベースラインまたは同様のデータと組み合わせて、EM4(他の天然のアイソトポログに加えて、4つの2H原子で標識されたコレステロールエステルを表す)が決定されてもよく、これは同位体含量または同位体パターンの関連測定値である。あるいは、同一サンプル由来のコレステロールエステルは、2HのAPEを測定するために、ガスクロマトグラフィー/熱分解/同位体比質量分析によって分析されてもよく、それもまた同位体含量または同位体パターンの関連測定値である。
【0118】
D.同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の希釈速度の算出
生物学的サンプルにおいて測定される対象となるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンは、被験体に投与された同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンと比較されうる。この比較は、標識されていない内在性の対象となる分子による希釈の算出を可能にする。希釈方程式は当技術分野において既知であり、例えば、上記のHellersteinら(1992)によって記載されている。希釈速度またはRaはその後、RCTの流出成分に相当する、組織コレステロールの血中リポタンパク質への分子流速を決定するために使用される。
【数5】

【0119】
1つの実施形態では、脂質エマルジョンに懸濁された安定同位体標識コレステロールを、血漿コレステロール富化の定常状態レベルに達するのに十分な時間注入する。注入の間、血漿サンプルを定期的に採取し、血漿サンプル中のコレステロールの同位体含量または同位体パターンを上述のように測定する。同位体含量または同位体パターンの経時的な変化は、同位体含量または同位体パターンの定常状態レベルならびに血漿コレステロールの半減期を決定するために使用される。この場合、血漿コレステロールの希釈速度は、上記の方程式を用いて直接決定されうる。希釈速度はコレステロール流出速度と同一であり、研究中の被験体におけるRCTの流出(Ra)成分の速度を表す。
【0120】
本開示の他の実施形態、特に、対象となるコレステロールまたはコレステロール関連分子またはコレステロール関連複合体の定常状態富化が達成されない実施形態では、RCTの流出成分の算出はより複雑である。しかし、血漿中の標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の出現が数学的に(時間の関数としての注入に由来する血清中での量で)記述され得る限り、RCTの流出成分は本開示の方法を用いて、当技術分野においてよく知られている方程式および数学的手法の使用によって測定され得る。
【0121】
E.体内の代謝回転の速いコレステロールプールのプールサイズの算出
代謝回転の速いプールサイズは、本明細書に記載される方法によって、流出モデルから導かれる方程式を用いて算出され得る。すなわち、
【数6】

【0122】
II.被験体におけるRCTの肝臓成分または排出成分の分子流速の測定
別の態様では、本開示はRCTの肝臓成分または排出成分の測定を対象とする。RCTの肝臓成分または排出成分では、コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、胆汁酸に変換されその後腸管内腔に分泌される、または直接中性ステロールとして分泌される(胆汁中性ステロールは胆汁コレステロールを含む)。排泄物中の胆汁酸もしくは中性ステロール、または両方に対するRCTの寄与が測定されうる。
【0123】
A.1種以上の同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与
安定同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、上述のように投与される。任意の投与方法、投与経路、または任意の量の安定同位体標識が、上述のように使用され得る。
【0124】
B.1つ以上の生物学的サンプルの取得
同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の投与後または投与と投与の間に、生物学的サンプルが取得される。RCTの肝臓成分または排出成分を測定する場合、サンプルは好ましくは糞便胆汁酸および糞便中性ステロールを含有する。生物学的サンプルの数、それらの頻度、およびそれらの時期は様々な要因によって変更しうる。このような要因は、生物学的サンプルの性質、サンプリングの容易さおよび安全性、対象となるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の生物学的速度定数または代謝挙動、ならびに被験体に施行される候補治療法の性質を含むが、それらに限定されない。サンプルは1つだけでもよい。それは同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の投与の間に採取されてもよく、または投与後に採取されてもよい。投与後に採取される場合、サンプルは投与後直ちに採取されてもよく、または投与後サンプリングの前に一定期間が経っていてもよい。1つの実施形態では、糞便、尿、および血液を含む、複数の生物学的サンプルが被験体から採取されうる。別の実施形態では、血液の単一の生物学的サンプルが取得されうる。生物学的サンプルは、上述のように広範に処理されうる。1つの実施形態では、胆汁酸および胆汁中性ステロールは生物学的サンプルから単離され、質量分析のために誘導体化されうる。
【0125】
C.胆汁酸および中性ステロールの同位体含量または同位体パターンの測定
胆汁酸および中性ステロールの同位体含量または同位体パターンが測定され、胆汁酸および中性ステロールのAPEまたはMPEを決定するために、投与前の胆汁酸もしくは中性ステロールの同位体含量または同位体パターンと比較されうる。このAPEまたはMPEはその後、胆汁酸もしくは中性ステロールに対する最大限可能なAPEまたはMPEと比較される(この最大値は、被験体において適切な期間後、胆汁酸もしくは中性ステロールに変換されている同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンを測定することによって決定されうる)。それはまた、過去のデータから算出されてもよく、または文献に由来してもよい。対象となる胆汁酸もしくは中性ステロールに対して観察されたAPEまたはMPEを、同一の胆汁酸もしくは胆汁中性ステロールの最大限可能なAPEまたはMPEで割ると、RCTに由来する胆汁酸または胆汁中性ステロールの割合を生じる。同位体標識コレステロールもしくはコレステロール関連分子の中性ステロールへの輸送または変換もまた算出される。このように、RCTの肝臓成分または排出成分(図1)が測定され得る。
【0126】
さらに、生物学的サンプルが糞便である場合、コレステロール自体の同位体含量または同位体パターンが測定されうる。
【0127】
糞便コレステロールは、RCTによって体から除去されるコレステロールの重要な部分に相当する。上述のように、糞便コレステロールの同位体含量または同位体パターンは、生物学的サンプルが糞便である場合に測定され得る。一旦分泌されると、腸管腔のコレステロールの一部は消化管から再吸収され、循環コレステロールの血漿プールに再度加わる。腸内コレステロールと血漿中の循環コレステロールとの混合は、排出コレステロールの同位体含量または同位体パターンが糞便以外のいずれの生物学的サンプルにおいても正確に直接測定できないことを意味する。この制限を克服するために、代わりに、腸に特異的なコレステロールの代謝産物の同位体含量または同位体パターンが非糞便生物学的サンプルから測定され得る。胆汁コレステロールは、消化管微生物によって、コプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノールを含む多数の代謝産物に変換される。これらのコレステロール代謝産物もまた再吸収され、全身に分布し、血液や尿を含むがそれらに限定されない他の組織および体液に向かう。1つの実施形態では、これらのコレステロール代謝産物の同位体含量または同位体パターンは尿において測定される。別の実施形態では、これらのコレステロール代謝産物の同位体含量または同位体パターンは血液において測定される。このようなコレステロール代謝産物の同位体含量または同位体パターンは、胆汁コレステロールにおいて見いだされるものと同一であり、このような測定は、糞便中の胆汁コレステロールの同位体含量または同位体パターンの直接測定に代わり得る。別の実施形態では、腸に特異的なコレステロール代謝産物および胆汁酸の同位体含量または同位体パターンの両方が、単一の尿サンプルから測定される。
【0128】
同位体含量または同位体パターン、合成速度または変換速度、およびMPEまたはAPE値は、上述のように決定される。
【0129】
D.胆汁酸プールサイズの測定
総胆汁酸量(胆汁酸プールサイズ)は、RCTの肝臓成分または排出成分の測定と同時、測定前または測定後に測定されうる。これは、実施者が異なる胆汁酸プールサイズを有する異なる被験体間で結果を比較することを可能にする目的を果たし、胆汁酸に変換された対象となる同位体標識コレステロールまたはコレステロール関連分子の絶対質量の決定を可能にする。この絶対質量は、投与された同位体標識コレステロールまたはコレステロール関連分子に由来する胆汁酸の割合(上述のように決定される)に胆汁酸プールサイズを乗じた積である。
【0130】
胆汁酸プールサイズは、例えば希釈法によって測定され、そこでは、既知量の同位体標識胆汁酸が被験体に投与され、一定期間後、被験体における胆汁酸の同位体含量または同位体パターンが単一のサンプルまたは複数のサンプルから測定される。同位体標識胆汁酸の希釈量(すなわち、問題となっている胆汁酸に対するAPEもしくはMPEの減少)またはAPEもしくはMPEの減少速度を示す曲線からの逆外挿(back-extrapolation)は、被験体における胆汁酸の全質量を算出するために用いられる。
【0131】
1.同位体標識胆汁酸の投与
1種以上の同位体標識胆汁酸が被験体に投与されうる。胆汁酸プールサイズの測定をRCTの肝臓成分または排出成分の測定と同時に行う場合、同位体標識胆汁酸は、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体とは異なる形で標識される。例えば、胆汁酸は4つの重水素(2H)原子で標識され、コレステロールは2つの13C原子で標識される。胆汁酸およびコレステロールまたはコレステロール関連分子またはコレステロール関連複合体が異なる同位体で標識される限り、任意の数の同位体が使用されうる。あるいは、胆汁酸は同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体と同一の同位体で標識され得るが、コレステロールまたはコレステロール前駆体の投与に使用される方法と識別可能な方法で投与される(例えば、異なる時間、パルス、停止対連続、および当業者にとって周知の他の識別可能な特性)。
【0132】
適切な同位体標識胆汁酸は、コール酸、ケノデオキシコール酸、デオキシコール酸、およびリトコール酸を含む。1つの実施形態では、標識胆汁酸はコール酸またはケノデオキシコール酸でありうる。胆汁酸の標識に使用されうる同位体は、2H、13C、または18Oを含むが、それらに限定されない。
【0133】
同位体標識胆汁酸は、同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体と同時に、またはそれとは別に投与されうる。同位体標識胆汁酸は、適切な担体中、既定の容量および同位体含量または同位体パターンで投与される。適切な担体は、食塩溶液、トリグリセリドエマルジョンおよびイントラリピド(intralipid)を含む。標識胆汁酸の被験体への投与は、上述のようなあらゆる経路によって行われうる。1つの実施形態では、胆汁酸は経口投与される。
【0134】
2.生物学的サンプルの取得
一定期間後、胆汁酸を含有する生物学的サンプルが取得される。同位体標識胆汁酸の投与と生物学的サンプルの採取との間の期間は、投与経路および投与方法、被験体の性質(例えば、被験体の動物種または病状)、同位体標識胆汁酸の選択、ならびに当業者にとって既知の他の要因に応じて変更しうる。生物学的サンプルは、血液、糞便、尿、または任意の他の種類の生物学的サンプルでありうる。生物学的サンプルは、他の同位体含量または同位体パターンの測定のため、例えばRCTの肝臓成分もしくは排出成分の測定(上記のII−B項参照)などのために採取されたものと同一のサンプルであってもよい。
【0135】
採取されたら、サンプルは処理または部分的に処理されてもよく、胆汁酸は上述のように精製、単離、または部分精製されうる。一般的に、このような操作は当技術分野において知られている。
【0136】
3.胆汁酸の同位体含量または同位体パターンの測定
生物学的サンプル中の胆汁酸の同位体含量または同位体パターンは、上述のように測定され、算出される。対象となる胆汁酸は、被験体に投与される同位体標識胆汁酸の性質に基づいて決定される。例えば、被験体が既知量および既知濃度の2H4−コール酸を投与される場合、対象となる適切な胆汁酸はコール酸であり、M4アイソトポマーのMPEが決定される。あるいは、2HのAPEが決定されてもよい。
【0137】
4.胆汁酸プールサイズの算出
被験体における胆汁酸のプールサイズは、下記の方程式を用いて決定されうる。すなわち、
【数7】

【0138】
であり、式中、質量(g)admは被験体に投与された同位体標識胆汁酸のグラム表示での質量であり、MPEadmは投与された安定同位体標識胆汁酸の超過モル百分率であり、MPEsampleは生物学的サンプル中の同一の胆汁酸アイソトポマーのピークまたは最大の超過モル百分率である。
【0139】
この方程式の代替形式は、
【数8】

【0140】
であり、式中、質量(g)admは被験体に投与された同位体標識胆汁酸のグラム表示での質量であり、APEadmは投与された同位体標識胆汁酸中の同位体標識胆汁酸を標識するために使用された同位体の超過原子百分率であり、APEsampleは生物学的サンプル中の同一の胆汁酸内の同一の同位体のピークまたは最大の超過原子百分率である。
【0141】
あるいは、血流中の同位体標識胆汁酸の同位体富化のピークは、当技術分野において周知の方法によって、標識減衰曲線の形から推定され得る。体内の胆汁酸のプールサイズはその後、希釈法によって算出され得る。
【0142】
E.胆汁酸、中性ステロールおよびコレステロールに対するde novoコレステロール合成の寄与の測定
任意選択で、RCTの肝臓成分または排出成分の測定と同時に、胆汁酸、中性ステロールおよびコレステロールに対するde novo合成コレステロールの寄与が測定されうる。RCTの肝臓成分または排出成分の一部では、コレステロールおよび/またはコレステロール関連分子および/またはコレステロール関連複合体は、胆汁酸に変換され、または中性ステロールとして分泌され、その過程の測定は上記のII−A〜II−C項に記載される。しかし、いくらかの胆汁酸および中性ステロールは、他の組織から除去された既存のコレステロールに由来するのではなく、むしろRCTの測定期間に肝臓または他の組織においてde novo合成されたコレステロールに由来する。de novoコレステロール合成はまた、本明細書に記載されるような同位体に基づく方法によって測定され得る過程である。de novoコレステロール合成の測定およびその胆汁酸に対する寄与の測定は、候補治療法が疾患に影響を及ぼす方法の理解に関連し、個体におけるRCT流に関して補足的または補助的な情報を提供しうる。RCTの肝臓成分または排出成分および胆汁酸もしくは中性ステロールに対するde novoコレステロール合成の寄与の被験体での同時測定は、RCTの肝臓成分または排出成分の測定を改善する。RCTの肝臓成分または排出成分に由来する胆汁酸および中性ステロールは、上記のII−A〜II−C項に記載されたように測定される。de novoコレステロール合成に由来する胆汁酸は、下記に記載されるように測定される。残りの胆汁酸は、既存の、すなわち実験の開始時に既に存在している胆汁酸に由来する。
【0143】
de novoコレステロール合成の測定およびその胆汁酸、中性ステロールまたはコレステロールに対する寄与の測定は、1種以上の同位体標識コレステロール前駆体の投与によって測定される。1種以上の同位体標識コレステロール前駆体の投与間もしくは投与後の、一定期間後、胆汁酸、中性ステロールまたはコレステロールを含有する1つ以上の生物学的サンプルが採取される。これらのサンプル中の胆汁酸、コレステロール、中性ステロール、もしくはコレステロール代謝産物の同位体含量または同位体パターンは上述のように測定され、結果として生じるデータは新たに合成されたコレステロールに由来する胆汁酸の割合または質量を算出するために使用される。
【0144】
1.同位体標識コレステロール前駆体の投与
1種以上の同位体標識コレステロール前駆体の投与方法は、同位体標識コレステロール前駆体の吸収特性およびそれが標的とする特定の生合成プールにより異なりうる。前駆体は、上記において以前に企図された任意の経路を介して、または当技術分野において既知の他の経路によって投与されうる。
【0145】
1つの実施形態では、投与方法は、生合成プール内および/または少なくとも一時的な期間このようなプールを供給する貯蔵部に、定常状態レベルの前駆体を生じるものである。血管内投与または経口投与経路は、このような前駆体を被験体に投与するために一般的に使用される。任意で徐放性基質組成物とともに使用される場合、皮下投与または筋肉内投与などの他の投与経路もまた適切である。注射用組成物は通常、滅菌した医薬品賦形剤で調製され、それらは当業者によく知られている。
【0146】
本明細書において議論されるように、投与は連続的に(例えばサンプリング時までおよび/もしくはそれを含んで)または不連続的に(長期間の単回投与もしくは反復投与のいずれかとして)行われ得る。不連続投与が行われる場合、個々の投与時間は同一であり得、または異なり得る。
【0147】
同位体標識前駆体の例は、米国特許出願第11/064197号(参照によりその全文が本明細書に組み入れられる)、特に「precursor molecules (isotope-labeled substrates)」と題されたIV−B−1−a−2項、および「Method for measuring in vivo synthesis of biopolymers」と題された米国特許第5,338,686号(参照によりその全文が本明細書に組み入れられる)において詳細に議論される。同位体標識コレステロール前駆体は、被験体に投与された場合、de novo合成コレステロールへの同位体の取り込みをもたらす安定同位体標識分子でありうる。同位体標識コレステロール前駆体は、同位体標識前駆体に由来するコレステロール、中性ステロールまたは胆汁酸分子が、RCTの肝臓成分もしくは排出成分の測定(上記のII−A〜II−C項)のために投与された同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体に由来するものとは同位体的に異なり、また胆汁酸プールサイズの測定(上記のII−D項)のために投与された同位体標識胆汁酸とも同位体的に異なるように選択される。あるいは、同様の識別が行われることを可能にするために、同位体標識コレステロール前駆体の投与の時期および投与経路は変更されうる。1つの実施形態では、同位体標識コレステロール前駆体は重水素標識水(2H2O)である。別の実施形態では、同位体標識コレステロール前駆体はH218Oである。
【0148】
2.1つ以上の生物学的サンプルの取得
一定期間後、胆汁酸、胆汁中性ステロールまたはコレステロールを含有する1つ以上の生物学的サンプルが取得されうる。同位体標識コレステロール前駆体の投与と生物学的サンプルの採取との間の期間は、投与経路および投与方法、被験体の性質、同位体標識コレステロール前駆体の選択、ならびに当業者にとって既知の他の要因に応じて変更しうる。1つ以上の生物学的サンプルは、血液、糞便、尿、または任意の他の種類のサンプルでありうる。1つ以上の生物学的サンプルは、RCTの肝臓成分もしくは排出成分の測定(上記のII−B項参照)のため、または胆汁酸プールサイズの測定(上記のII−D項参照)のためなどの、他の同位体含量あるいは同位体パターンの測定のために採取されたものと同一のサンプルでありうる。
【0149】
採取されたら、サンプルは処理または部分的に処理されてもよく、胆汁酸は上述のように精製、単離、または部分精製されうる。一般的に、このような操作は当技術分野において知られている。
【0150】
3.胆汁酸もしくは中性ステロールの同位体含量または同位体パターンの測定
対象となる分子(胆汁酸もしくはコレステロールもしくは他のコレステロール関連分子もしくはコレステロール関連複合体)の同位体含量または同位体パターンは、上述のように測定され、算出される。胆汁酸に対するde novoコレステロール合成の寄与は、胆汁酸の同位体含量または同位体パターンの測定によって測定される。中性ステロールに対するde novoコレステロール合成の寄与は、中性ステロールの同位体含量または同位体パターンの測定によって測定される。1つの実施形態では、両方が測定される。
【0151】
本開示の1つの態様では、胆汁酸および腸管微生物の胆汁コレステロールに対する作用に由来するコレステロール代謝産物の同位体含量または同位体パターンが、尿および血液において測定される。上述のように、非糞便生物学的サンプル中のコレステロールは、糞便コレステロールの同位体含量を測定するために直接分析されることはできない。しかし、遊離コレステロールは、消化管微生物によってコプロスタノール、コプロスタノン、コレスタノール、コレスタノンおよびエピコプロスタノールを含む多数の代謝産物に変換される。これらもまた再吸収され、他の組織および血液または尿を含む体液中に出現する。これらの代謝産物は腸コレステロールからしか生じないため、腸コレステロールを反映する同位体含量または同位体パターンを有する。従って、尿中のこれらのコレステロール代謝産物の同位体含量または同位体パターンの測定は、胆汁コレステロールもしくは他の中性ステロールの同位体含量または同位体パターンの測定方法に相当する。
【0152】
4.胆汁酸および中性ステロールに対するde novoコレステロール合成の寄与の算出
胆汁酸もしくは中性ステロールもしくは胆汁コレステロール代謝産物の同位体含量または同位体パターンを、測定されたもしくは既知の同位体標識コレステロール前駆体の濃度と比較することにより、新たに合成された中性ステロールの割合、または新たに合成されたコレステロールに由来する胆汁酸の割合を決定しうる。割合の算出は、上述のように、または米国特許出願第11/064197号(参照によりその全文が本明細書に組み入れられる)および「Method for measuring in vivo synthesis of biopolymers」と題された米国特許第5,338,686号(参照によりその全文が本明細書に組み入れられる)に既述されたように行われる。このような計算はまた、当業者にとって既知の多数の出版物に広く記載されている。
【0153】
F.RCTの肝臓成分または排出成分の活性の算出
RCTの肝臓成分または排出成分の活性(すなわち、コレステロール関連分子もしくはコレステロール関連複合体を含む投与されたコレステロール、または血中コレステロールの、対象となる排出ステロール生成物への変換速度または分泌速度;分泌される、コレステロール関連分子もしくはコレステロール関連複合体を含むコレステロール、または血中コレステロールの質量;あるいはRCTに由来する胆汁酸および/または中性ステロールの割合)は、単離された胆汁酸もしくは中性ステロールの同位体含量または同位体パターンを用いて算出されうる。胆汁酸の同位体含量または同位体パターンは、被験体に投与された同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の総量と比較されうる(すなわち、投与された標識の対象となる生成物中への同位体回収)。胆汁酸プールサイズのデータが利用できる場合、投与された標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の胆汁酸中への回収は、胆汁酸プールの質量を乗じて、RCTの肝臓成分または排出成分により輸送された質量を与える。利用可能な場合には、異なる標識コレステロール前駆体に由来する胆汁酸の同位体含量または同位体パターンは、同様の方法で、胆汁酸合成に対するde novo合成コレステロール(DNC)の寄与を算出するために使用され得る。RCTおよびDNCからの糞便中性ステロールに対する寄与は、同様に算出される。
【0154】
III.RCTの血漿成分の測定
RCTの血漿成分は様々な代謝および輸送ステップを含む(図3)。RCTの血漿成分の測定は、同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与、およびそれに続く異なるコレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体の同位体含量または同位体パターンの測定によって行われる。この「異なる」コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は、投与された分子のin vivo変換産物である;すなわち、それはin vivoで生成される。このようにしてRCTの特定の成分の活性または速度が測定され得る。例えば、コレステロールのコレステロールエステルへの変換(LCAT活性、図3)は、同位体標識コレステロールの投与、およびコレステロールエステルの同位体含量または同位体パターンの測定によって測定され得る。同様にコレステロールエステルのHDLからLDLまたはVLDLへの輸送(CETP活性、図3)は、HDLと複合した同位体標識コレステロールエステルの投与、およびLDLもしくはVLDL中のコレステロールエステルの同位体含量または同位体パターンの測定によって測定され得る。血漿RCTの複数のステップの合計は、例えば、HDLと複合した同位体標識コレステロールの投与、およびその後のLDLもしくはVLDL由来のコレステロールエステルの同位体含量または同位体パターンの測定によって測定され得る(すなわち、LCAT活性およびCETP活性の合計の同時測定)。
【0155】
RCTの血漿成分では、様々な種類のコレステロールまたはコレステロール関連分子またはコレステロール関連複合体が、異なる種類のコレステロールまたはコレステロール関連分子またはコレステロール関連複合体に変換される。RCTの血漿成分を測定するために、ある種類が投与され、別の種類(対象となる分子)が測定される。
【0156】
1.同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の投与
同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体は上述のように投与される。任意の投与方法、投与経路、または任意の同位体標識の量が、上述のように使用されうる。1つの実施形態では、投与経路は静脈内である。標識分子または複合体の選択は、RCTの血漿成分のどの部分を測定したいかによって行われる。
【0157】
2.1つ以上の生物学的サンプルの取得
一定期間後、生物学的サンプルが取得される。取得される生物学的サンプルの性質および時期は、RCTの血漿成分のどの部分を測定しているかによって決定される。好ましい実施形態では、生物学的サンプルは血液サンプルである。複数の生物学的サンプルが取得されうる。
【0158】
3.対象となる分子の同位体含量または同位体パターンの測定
同位体含量または同位体パターンは、上述のように対象となる分子について測定される。対象となる分子は投与された同位体標識分子または複合体のin vivo変換産物である。
【0159】
4.RCTの血漿成分の速度の算出
標準的な前駆体−生成物の関係は、投与される同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体と下流の対象となる分子との間にも存在しうる。このような関係は当技術分野においてよく知られている。前駆体プール同位体含量または同位体パターンは、投与された標識の量に基づいて推定されるか、または過去のデータもしくは他のデータの使用によって決定されるかのいずれかであり、あるいはそれは直接測定される。投与された同位体標識コレステロールまたはコレステロール関連分子またはコレステロール関連複合体の、対象となるコレステロールまたはコレステロール関連分子またはコレステロール関連複合体に対する寄与率は、上述のように決定される。
【0160】
IV.要約:
A.希釈法およびプラトーの原則の使用による、組織から血液へのコレステロール流出/動員速度の算出
注入されたトレーサーの希釈は、その中に注入される(またはそれと迅速に連絡している)プールの出現(Ra、流出、代謝回転)速度を示し、同位体プラトーが実現され実証され得る場合、確実に行われる。代謝研究では、この多数の一般的な例が存在する(例えば、Raグルコース、FA、グリセロール、アミノ酸)。しかし、このアプローチは、いくつかの理由から以前にはコレステロールに対して使用されたことがなかった。第一に、複雑な調節性のコレステロール流出系(輸送体、血漿アクセプター、ドッキングタンパク質など)の発見以前には、Raコレステロールを測定する生理学的な論理的根拠がなかった。第二に、コレステロールは生理食塩水に難溶性であるため、持続注入によって投与することが容易ではない。さらに、血漿コレステロール特異的活性または富化においてプラトーに達するために必要とされる時間もまた不明であり、数日または数週間かかるかもしれないと思われていた。
【0161】
重要な発見は、ヒトおよび実験動物における血漿コレステロール富化におけるプラトーの観察であった。プラトーの達成(下記および図5参照)は、機能的に分離した、測定可能な代謝回転の速いプールの存在を支持し、末梢組織から血液と連絡しているこの代謝回転の速いプール(図4)へのコレステロールのRaまたは流出/動員速度の算出を可能にする。これは方法論上主要な発見である。
【0162】
別の重要な発見は、流出/動員(Ra)および排出効率を測定するために、標識コレステロールはHDL複合体または他のリポタンパク質関連粒子の形で投与される必要はなく、遊離コレステロールの形で投与され得ることである(下記および図5参照)。
【0163】
流出速度(Ra)は、1時間当たりに、大きな細胞内貯蔵プールから代謝回転の速いプールに入る分子数、すなわち貯蔵プールに出入りする動員された遊離コレステロール(「フラッシュ速度(flush-rate)」)を表す。これは、それ自体で重要な新しいRCTの測定基準であり(図1および3〜7)、末梢組織全体にわたる流入/流出への糞便ステロール中への標識回収の修正をも可能にする(下記参照)。
【0164】
そのデータはまた、コレステロールを用いた組織の食餌負荷による調節を実証する(図7)。Raおよびプールサイズはともに、ヒトにおいて妥当ではあるが過度ではない個人差を示し(例えば、多くの調節性生理的パラメータと一致する、約20%の標準偏差(図6A))、それが改変可能なパラメータであることを示唆する。また、プールサイズ(Ra/kとして算出され得る)も約5〜10gであり、Schwartzのデータ(6g(Schwartzら、J Clin Invest))と一致する。
【0165】
B.末梢組織を超える流入/流出に対する糞便ステロール中への標識コレステロール排出効率の補正
投与された血漿コレステロールの糞便中への標識回収は、排出効率および血漿コレステロールから糞便ステロール中への流速を示す(RCTの部分2、図1参照)。しかし、この測定は、血漿コレステロール代謝回転(組織からおよび組織への流出/流入)の変化によって混乱させられる可能性がある。投与された標識が個体において代謝回転の遅い組織プールに迅速に出入りして交換される場合(すなわち、流出/流入速度が大きい場合)、例えば、血漿中の標識は組織中に失われ、非標識コレステロールに置換されるため、糞便ステロール中に回収されないであろう(図9A)。これは小さい回収速度として解釈されるであろう。しかし、この状況は、実際には抗アテローム硬化リスクに関して良いこと(組織からのより高いコレステロール動員速度またはフラッシュ速度(flush-rate))であるかもしれず、個体における包括的RCT過程の効率に対して不利に作用しないはずである。従って、標識された血漿コレステロール排出の任意の機能的指標は、好ましくは組織全体にわたる流出/流入へと修正すべきである(図9B)。これらの考慮はまた、コレステロール標識を細胞中に投与する方法(例えば、ex vivoで標識されたマクロファージ)にも当てはまる。
【0166】
C.「包括的RCT」パラメータの算出
本明細書において開示されるように、流出/動員速度を糞便ステロール中への標識回収効率と組み合わせることによって、「包括的RCT」パラメータが測定され得る(図9B〜C、図10〜13)。この包括的RCT測定基準は、ヒト被験体を含む生体において組織から糞便までのコレステロール流の総合的な測定を提供する。
【0167】
包括的RCT流は、最終的に糞便ステロールとして排出される組織からのコレステロール流出を表す。これは、糞便ステロールとして回収される血漿コレステロール分子の割合を乗じた、1日当たりに血漿プールに入るコレステロール分子数として直感的に理解され得る。この測定基準が組織から血流を介して体外へのコレステロール流速−包括的RCTの定義を表すことは、当業者に理解され得る。
【0168】
加えて、このパラメータは、生物全身での包括的RCT流に対する潜在的な治療薬の効果を解析するために広く使用された(下記の実施例参照)。
【0169】
D.RCTを増加させる治療薬の作用部位を分析するための、包括的RCTパラメータのRCTの2つの部分への分割
本明細書において開示されるように、RCTを増加させる治療薬の作用部位を分析するために、包括的RCTパラメータを2つの成分(流出/動員および排出、図9Cおよび図10〜13)に分割することが有用であることも発見された。薬物または症状によってRCTのどちらの特徴が変化するかを知ることは、創薬または被験体研究において非常に有用であり得る。この実施例が提供される(図10〜13および下記参照)。
【0170】
IV.さらなる実施形態
本明細書に記載される方法は、実施者の好みに応じて様々な方法で実施されうる。これらの実施形態の一部は下記において議論されるが、それらは限定することを意図しない。
【0171】
A.RCTの流出成分の測定
本発明の1つの実施形態では、RCTの流出成分は、ヒトもしくは実験動物モデルにおいて脂質エマルジョン中の13C2標識コレステロールの定速での静脈内注入によって測定され、血中総コレステロールの同位体含量または同位体パターンは、同位体プラトーを解析する必要に応じて、または簡易には約12〜18時間、約1〜2時間毎に測定される。血中総コレステロールまたは血漿遊離コレステロールまたはリポタンパク質結合タンパク質が精製され、同位体含量または同位体パターンがGC/C−IR/MSもしくは他の当技術分野において既知の方法によって測定され、その後13Cの超過原子百分率として表される。流出速度はその後上述のように算出される。
【0172】
本明細書において開示されるように、いくつかの重要な発見が、ヒトを含む生体の細胞からのコレステロール流出速度の測定を可能にする。すなわち、(1)希釈法による流量の測定は、「プラトーの原則」が利用できる場合に最適に行われる。この原則は、基本的には、トレーサーの持続注入の間の同位体プラトー到達は、単に到達した同位体富化または比放射能から内在性プールの代謝回転(出現速度、流量)の算出を可能にするということを述べる。血漿コレステロールが、このアプローチによる流量の算出を可能にするために妥当な期間にわたって同位体プラトーを実現するかどうかは、以前には知られていなかった。本明細書において開示されるように、この状況はヒトと動物被験体との両方において実際に当てはまる(図5および下記参照)。(2)血漿コレステロールプールの流出速度または出現速度は、流量およびプールサイズに関する今までの間接的な発見と一致する範囲内(ヒトでは約10mg/kg/hr、図6A)であることが発見された。また(3)流出速度は、予期されるように組織コレステロール負荷によって影響を受ける(図7および下記参照)。
【0173】
本発明の別の実施形態では、血漿リポタンパク質の特定のサブクラス(例えば、小型もしくは大型HDL粒子)中へのRCTの流出成分が、ヒトまたは実験動物モデルにおいて脂質エマルジョン中の13C2標識コレステロールの定速での静脈内注入によって測定される。対象となる血漿リポタンパク質粒子中のコレステロールの同位体含量または同位体パターンは、約12〜18時間、約1〜2時間毎に測定される。遊離コレステロールが精製され、同位体含量または同位体パターンがGCC−IR−MSもしくは他の当技術分野において既知の方法によって測定され、その後13Cの超過原子百分率として表される。血漿リポタンパク質の特定のサブクラス中への流出速度は、その後上述のように算出される。
【0174】
B.RCTの肝臓成分または排出成分の測定
本発明の別の実施形態では、RCTの肝臓成分または排出成分は、ヒトにおいて脂質エマルジョン中の13C2標識コレステロールを静脈内経路で投与することによって測定される。尿または糞便の生物学的サンプルは、ボーラス投与の前、およびその後28日までの期間毎日採取される。コール酸およびデオキシコール酸、ならびに中性ステロールが尿または糞便サンプルから精製され、その後GCC−IRMSまたは同位体含量もしくは同位体パターンを検出するための他の当技術分野において既知の方法によって分析される(図8A)。同位体含量または同位体パターンは13Cの超過原子百分率(APE)として表される。13C2標識コレステロールの投与前に測定されるコール酸の同位体含量または同位体パターンはベースライン値として用いられ、最大限可能なAPEは被験体に投与される13C2標識コレステロールの量ならびに被験体の体重および身体組成に基づいて推定される。胆汁酸として回収される投与された13C2標識コレステロールの割合、投与された13C2標識コレステロールの胆汁酸または中性ステロールへの総変換速度、および血漿コレステロールに由来する胆汁酸の割合はその後、上述のように算出される(図8B)。
【0175】
C.胆汁酸プールサイズの測定を含むRCTの肝臓成分または排出成分の測定
本発明のさらに別の実施形態では、RCTの肝臓成分または排出成分は、例えばヒトにおいて脂質エマルジョン中の13C2標識コレステロールの静脈内ボーラスを投与することによって測定される。加えて、既知量の2H4−コール酸が経口投与される。尿の生物学的サンプルは、ボーラス投与の前、およびその後28日までの期間毎日採取される。血液の生物学的サンプルは、標識投与前(0日目)および標識投与後2、4、7、14日目に採取される。コール酸は標識投与後0〜48時間の間に採取された血液サンプルから精製され、コール酸の2H同位体含量または同位体パターンはGC/MSもしくは他の当技術分野において既知の方法によって測定され、M4イオンの超過モル百分率として表される。コレステロールはすべての血液サンプルから精製され、13C同位体含量または同位体パターンはGCC−IRMSもしくは他の当技術分野において既知の方法によって測定され、13CのAPEとして表される。コール酸は尿から精製され、13C同位体含量または同位体パターンはGCC−IRMSもしくは他の当技術分野において既知の方法によって測定され、13CのAPEとして表される。血中コール酸の2H同位体含量または同位体パターンは、胆汁酸プールサイズを算出するために用いられる。胆汁酸として回収される投与された13C2標識コレステロールの割合、投与された13C2標識コレステロールの胆汁酸への総変換速度、および血漿コレステロールに由来する胆汁酸の割合は、ベースライン値として用いられる0日目の尿中コール酸の13C同位体含量または同位体パターン、および尿中コール酸について最大限可能な13CのAPEを決定するために用いられる血中コレステロールの13C同位体含量または同位体パターンとともに、尿中コール酸の13C同位体含量または同位体パターンを用いて決定される。これらの値はその後、質量排出速度(これは当技術分野において既知の簡単な方法によって直接測定される)と組み合わされることにより、実験期間中の胆汁酸および胆汁ステロールへの血中コレステロール変換速度または輸送速度が算出される。これは下記の単位を有する質量変換速度(流量)として表されうる。
【数9】

【0176】
この量はRCTの肝臓成分または排出成分を介した流量を表す。
【0177】
D.胆汁酸プールサイズの測定ならびにde novoコレステロール合成およびその胆汁酸への寄与の定量を含むRCTの肝臓成分または排出成分の測定
さらに別の実施形態では、RCTの肝臓成分または排出成分は、上記のIV−C項に記載されるように測定される。加えて、好ましい実施形態では、被験体は約70%の重水の複数回経口投与を受ける。13CのAPEおよびM1のMPEは、尿中コール酸に対して測定される。13CのAPEおよびM1のMPEは、尿中胆汁中性ステロール代謝産物に対して測定される。血液中の重水の濃度もまた血液サンプルから測定されうる。胆汁酸および中性ステロールに対するde novo合成コレステロールの寄与はその後、M1 MPE、0日目のM1 MPE(ベースラインとして)、および血液中の重水(同位体標識コレステロール前駆体)の濃度に基づいて算出される最大限可能なM1 MPEを用いて決定される。これらの算出は上述のように行われる。
【0178】
この実験に由来するデータは、RCTの肝臓成分もしくは排出成分に由来する胆汁酸および中性ステロールの質量または割合、de novo合成コレステロールに由来する胆汁酸および中性ステロールの質量または割合、ならびに、研究の開始前に被験体に存在していた、もしくは研究の開始前に被験体に存在する胆汁酸および中性ステロールに由来する胆汁酸および中性ステロールの質量または割合を算出するために使用され得る。
【0179】
この実験に由来するデータはまた、組織から出るすべてのコレステロールは組織中でのコレステロールのde novo合成によって定常状態で平衡が保たれなければならないという原則に基づき、組織からのRCT速度の補足的な証拠としても使用され得る。従って、末梢組織からのコレステロールの流出および/または体からのコレステロールの排出の証拠は、コレステロールのde novo合成速度の増加をもたらすと期待されうる(図14)。
【0180】
(当技術分野において既知の技術を用いて)排出速度が決定された場合、その後、RCTまたはDNCのいずれかに由来する胆汁酸および中性ステロールの排出速度が同様に算出され得る。
【0181】
E.RCTの流出成分および肝臓成分または排出成分の同時測定
さらに別の実施形態では、RCTの流出成分および肝臓成分または排出成分は同時に測定される。この場合には、被験体に投与される13C2標識コレステロールは、12〜18時間の持続静脈内注入として投与される。血液サンプルは、RCTの流出成分を測定するために注入の間1〜2時間毎に採取される。RCTの肝臓成分または排出成分の測定のための他の要素は、上述のように行われる(図10〜13)。
【0182】
F.RCTの血漿成分の測定
本発明のさらに別の好ましい実施形態では、RCTの血漿成分の一部(LCAT/CETP媒介性の成分)が測定される。HDLと複合した13C2−コレステロールは静脈内ボーラスとして被験体に投与される。血液サンプルは、ボーラス投与前、ボーラス投与後24時間まで2時間ごとに、およびより低い頻度でその後さらに3日後まで採取される。HDL、VLDLおよびLDLが血液サンプルから単離され、HDLコレステロール、LDLコレステロールエステル、およびVLDLコレステロールエステルの同位体含量または同位体パターンがGCC−IRMSによって測定される。コレステロールのコレステロールエステルへの変換およびコレステロールエステルのHDLからLDLまたはVLDLへの輸送はこの方法によって測定される。血漿RCTのLCAT成分はまた、同様にHDLコレステロールエステルの同位体含量または同位体パターンの測定によって特異的に測定されうる。
【0183】
G.動物におけるコレステロール輸送および代謝
上記の実施形態は、動物において上記にヒトのために記載されたような方法を用いて実施され得る。1つの実施形態では、動物はサルなどの霊長類である。別の実施形態では、動物は、ウサギ、モルモットまたはハムスターである。さらに別の実施形態では、動物はラットまたはマウスなどの齧歯類である。
【0184】
H.組合せ
上記の方法は、異なる同位体または同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体、同位体標識胆汁酸もしくは同位体標識コレステロール前駆体を用いて、様々な形に組み合わされうる。このような標識分子の様々な組合せが使用されうる。あるいは、様々な投与経路および投与方法、生物学的サンプリングの種類および時期、サンプル処理の方法、ならびに同位体含量分析の方法、データの算出方法、データの解析方法、ならびにデータの解釈方法が上記において企図され、実施者の要求に合うように組み合わされてもよく、それらは当技術分野の技術の範囲内である。
【0185】
V.本発明の生成物
本発明の実施を通じて、多数の生成物が生じる。特に、同位体標識成分を含有する対象となる分子が生じる。このような生成物は多くの形をとる。
【0186】
A.生物学的サンプル
本発明の実施は、対象となる分子を含有する生物学的サンプルの採取を伴う。対象となる分子の一部は安定同位体標識される。生成物は、対象となる分子のプール(例えば、1ミリグラムのデオキシコール酸)を含有し、そのうちのいくらかは同位体標識されている生物学的サンプルである。
【0187】
B.生物学的サンプルの一部
生成物はまた、本発明の方法の実施によって取得される生物学的サンプルに由来する、(分析のために)精製、単離、部分精製された、または誘導体化もしくは修飾された対象となる分子のプール(例えば、ヒトの尿から単離された500マイクログラムのコプロスタノール)でありうる。生成物は、対象となる分子を濃縮するため、または分析を妨害しうる不要な分子を除去するために調製された、生物学的サンプルの画分(例えば、血液のリポタンパク質画分)でありうる。
【0188】
C.対象となる標識分子
本発明によって生じる生成物はまた、特定の同位体標識分子を含む。このような分子の非限定的なリストは図15および16に示され、それらは様々な対象となる分子を図解し、13Cに関する標識位置を示す。本明細書に記載される実施形態は他の同位体によって標識されるものを含む様々な対象となる同位体標識分子を生じうるが、これらの特定の分子は、本発明の実施の間の13C2標識コレステロールの投与に由来する。
【0189】
本発明の使用
本発明の方法は、様々な目的のために使用されうる。例えば、本方法は、被験体においてRCTの成分の速度を測定するために使用されうる。次に、その速度は、アテローム生成および/もしくはアテローム硬化または冠状動脈性心臓病、末梢血管疾患および脳血管疾患を含む他のコレステロール関連疾患に対する、様々な候補治療法の効果を評価するために使用されうる。
【0190】
1つの態様では、本方法は、RCTに対する候補治療法の効果を決定するために使用されうる。候補治療法を被験体に施行した後、候補治療法の施行前後での被験体におけるRCTの1つ以上の成分の速度が比較されうる。被験体はアテローム硬化を有しても、有さなくてもよい。候補治療法の効果は、候補治療法の施行前後に測定される速度の変化(例えば、増加、減少、または差異なし)によって決定される。このような効果はまた、被験体の1群に候補治療法を施行し、他の群にプラセボ治療を施行するかまたは治療を施行せずに、2群でのRCTを比較することによっても測定され得る。同様に、候補治療法は1群に施行され、この群の流出成分はコレステロール流出に関する過去のデータと比較されてもよい。当業者にとって既知の他の種類の前臨床試験または臨床試験計画は、本発明の方法の実施の際に使用され得る。
【0191】
本発明の別の態様では、本方法は、創薬、薬剤開発および認可(DDA)計画において使用される。RCTに対する効果は、生体系が候補治療法または候補治療法の組合せを受けた後で観察される。作成され分析されたデータはDDAの方針決定過程を容易にする;すなわち、それは、(例えば、RCTデータが有望であると思われる場合)候補治療法のさらなる開発を続ける、または、例えば、RCTデータが好ましくないと思われる場合、試みを停止するという決断において方針決定に有用な情報を提供する。この方法により、提案された分子標的は、例えば、コレステロール輸送、および特にRCTに対する阻害または促進によって、それらの活性の変化の効果について評価され得る。コレステロール輸送、およびRCTにおける提案された分子標的の機能的重要性ならびに役割は、それによってヒトおよび実験動物において効率的に評価され得る。
【0192】
本発明のさらに別の態様では、本方法は、用量設定および/または用量の最適化に使用される。候補治療法は、様々な用量または投与計画にわたって被験体(動物もしくはヒト)に施行され、その後、候補治療法に対するRCTの用量反応に基づいて最適な用量が選択されうる。本方法はさらに、いずれの用量が、異なる種類の被験体、例えば、既にスタチン治療もしくはフィブラート治療を受けている被験体、またはRCTに対して有益な効果を持つために異なる用量の候補治療法を必要としうる、コレステロール代謝に遺伝的欠損を有する被験体に適しているかを決定するために使用されうる。
【0193】
本発明のさらに別の態様では、本方法は、処方開発のために使用される。候補治療法は様々な賦形剤中に処方されてもよく、または様々な経路で投与されうる。RCTに対する効果はその後、いずれの賦形剤または経路が最適であるかを決定するために使用される。例えば、候補治療法は、1日2回投与される場合、または食事時間に投与される場合、RCTの調節においてより効果的であることが見いだされるかもしれない。候補治療法はまた、徐放性製剤で与えられる場合により効果的であることが見いだされるかもしれず、または、迅速に吸収される単回投与で与えられる場合により効果的であることが見いだされるかもしれず、または、特定の賦形剤もしくは特定の賦形剤の比率によって処方される場合により効果的であることが見いだされるかもしれない。
【0194】
本発明のさらに別の態様では、本方法は、候補治療法の評価のための(例えば、臨床試験において)、または候補治療法に反応する彼らの能力について、被験体の選択を可能にする。コレステロール関連疾患の原因の範囲を考慮すると、特定の患者だけが所定の候補治療法に反応しうる可能性がある。この場合、本方法は、被験体が臨床試験に適しているか否かを決定するために使用され得る。例えば、高レベルの血漿HDLをも有する高コレステロール血症の被験体は、RCT治療に対して有利に反応しないかもしれない。このような被験体は臨床試験から除外されうる。同様に、被験体を治療するために使用されている候補治療法(すなわち、ヒトでの使用が認可されている候補治療法−候補治療法のサブクラス)に関して、本発明の方法は、臨床医が特定の被験体または被験体に対する特定の候補治療法の妥当性を決定することを可能にする。
【0195】
本発明のさらに別の態様では、本方法は、当業者が1群の候補治療法(例えば、同一のリード化合物に由来する複数の候補治療法、もしくは部分的に開発されている複数の候補治療法、もしくは同一の化合物ライブラリー由来の複数の候補治療法)から最適な候補治療法を同定、選択、および/または特性化することを可能にする。同定、選択、および/または特性化された時点で、当業者は、本発明の方法によって作成された情報に基づいて、最適な候補治療法をさらに開発もしくは評価すること、または製薬会社もしくはバイオ企業などの他の企業に候補治療法の使用を許諾することを決定しうる。
【0196】
さらに別の態様では、本発明の方法によって作成されたデータは、1つ以上のコレステロール関連疾患の根本的な分子病態論または原因の理解に関連しうる。別の態様では、本発明の方法によって作成されたデータは、対象となるコレステロール関連疾患の発生、進行、重症度、病理学、攻撃性、悪性度、活動性、障害、死亡率、罹患率、疾患の下位分類、または根本的な病原性もしくは病理学的特性の基本的な特徴を解明しうる。
【0197】
さらに別の態様では、本発明の方法によって作成されたデータは、対象となるコレステロール関連疾患の予後、生存率、罹患率、死亡率、病期、治療効果、症状、障害または他の臨床学的要因の基本的な特徴の解明を提供しうる。
【0198】
別の態様では、本方法は、RCTを含むコレステロール代謝および輸送に対する食餌変更の効果を評価するために使用されうる。上述のものと同様に、その効果は、食餌変更の前後に測定されるRCTの1つ以上の成分の速度における変化(例えば、増加、減少、または差異なし)によって決定される。
【0199】
別の態様では、本方法は、コレステロール代謝および輸送に対する運動の効果を評価するために使用されうる。
【0200】
別の態様では、候補薬剤の投与、食餌変更、および/または運動などの候補治療法の組合せが本発明の方法の使用によって評価されることにより、RCTの1つ以上の成分の速度に対してこのような候補治療法の組合せを評価しうる。
【0201】
さらなる態様では、本発明は、本発明の方法を実施するためのキットを提供する。キットは、様々な同位体濃度および事前に測定された容量で、同位体標識コレステロールもしくはコレステロール関連分子もしくはコレステロール関連複合体、同位体標識胆汁酸、または同位体標識コレステロール前駆体、またはそれらの組合せなどの成分を含むように構成されうる。キットは、キット成分の使用説明書およびコレステロール希釈の算出方法の説明書とともに包装されうる。
【0202】
様々な同位体標識成分の投与のための用具(例えば、計量カップ、針、注射器、ピペット、IVチューブ)などの他のキット構成部品は、任意選択でキット内に提供されうる。同様に、被験体からサンプルを取得するための器具(例えば、試料カップ、針、注射器)もまた、任意選択で提供されうる。
【0203】
下記の実施例は、本発明の方法がヒトおよび動物においてコレステロール逆輸送の様々な成分を測定するために使用されうることを示すために提供される。当業者は、特定の実施形態が説明され、記載されているが、それらが本発明の限定を意図していないことを認識するであろう。
【実施例】
【0204】
実施例1
ヒトにおけるRCTの流出成分の測定
序論
RCTの流出成分は、組織および生物全身からのコレステロールの除去の第一段階である。
【0205】
方法
6人の健康なヒトボランティアに200mgの100%13C2−コレステロールを16.66mg/時間の速度で12時間静脈内投与した(図17A)。注入の間に6〜8回、各被験者から20〜40mlの血液を採取した。6人の被験者のうち5人については注入の直前に血液を採取した。当技術分野において既知の方法を用いた水性・有機溶媒抽出によって血清総コレステロールを単離した。その後、塩化アセチルを用いてコレステロールをそのアセチル誘導体に誘導体化し、石油エーテル中に抽出し、硫酸ナトリウムを用いて、窒素下で乾燥させ、トルエン中に再調製した。続いてそれを燃焼モードで稼動するMAT 253 Thermo-Finnigan IRMSに連結したAgilent model 6890ガスクロマトグラフに注入した。各サンプルのAPEを決定するために、データを既知の13C APEを有する一連の標準と比較した。
【0206】
図5は、3人の被験者に関する注入時間の関数としてのAPEデータを示す。3人の被験者すべてにおいて、血清総コレステロールの13C APEはプラトーに向かって上昇しているのが見て取れる。プラトー値は、標識コレステロールの内在性コレステロール流出による希釈を算出するために使用され得る定常状態富化の値に相当する。すべての被験者が実験の終わりまでに定常状態富化に達するとは限らないため、プラトーは利用可能なデータを下記のような指数曲線にフィッティングすることによって決定され、
【数10】

【0207】
式中、「a」はプラトー値である。
【0208】
内在性コレステロールによる希釈速度(すなわち、内在性コレステロールの出現速度)は下記の(および上述のような)方程式を用いて算出された。
【数11】

【0209】
例えば、被験者3は0.00138%のプラトー13C APE値を有し、16.66mg/時間の速度でコレステロールを投与された。注入されたコレステロールは27個の炭素のうち2個が標識されたので、測定された13C APEに対する倍率は27/2である(これは概念的には13C APEのコレステロールM2 MPEへの変換と考えることができる。このような倍率は当技術分野において知られている)。希釈速度方程式はその結果、下記のようになる:
【数12】

【0210】
結果および意義
コレステロール流出速度は、6人の被験者すべてに対して、記載したように測定した:
被験者ID 流出速度
001 891mg/hr
002 640mg/hr
003 647mg/hr
004 878mg/hr
005 979mg/hr
006 959mg/hr
これらの速度は各被験体でのRCTの第1の成分を表す。
さらに15人の被験者を研究し、プラトーフィットへの上昇から算出されるkおよびRaの両方についての測定の個人差を実証した(図6A)。
【0211】
この実験は、RCTの流出成分がヒトにおいて測定され得ることを説明する。その技術は正確であり、比較的迅速である。RCTの流出成分の測定は、RCTに対する様々な候補治療法の作用を評価するため、またはアテローム生成、アテローム硬化、もしくは動脈硬化の予防もしくは治療に対する様々な候補治療法の有用性を評価するために使用されうる。例えば、薬剤の投与前後で被験体におけるRCTの流出成分を比較することができる。被験体はアテローム硬化を有しても有しなくてもよい。候補治療法の効果は、候補治療法の施行前後に測定した場合のRCTの流出成分の変化(例えば、増加、減少、または差異なし)によって決定されるであろう。このような差異はまた、被験体の1群に候補治療法を施行し、他の群にプラセボ治療を施行するかまたは治療を施行せずに、2群でのRCTの流出成分を比較することによっても測定され得る。同様に、候補治療法を1群に施行し、この群の流出成分をコレステロール流出に関する過去のデータと比較してもよい。
【0212】
この方法によって特定された候補治療法は、重要な商業的価値を有する。
【0213】
実施例2
ヒトにおけるRCTの血漿成分の測定;コレステロールエステルの生成
序論
コレステロールの代謝および様々なキャリア分子間でのその輸送はRCTの重要な成分である。製薬産業にとって主要な現在の分子標的はCETPである(図1参照)。同様に、LCATの阻害はRCT経路を介するコレステロールの動きを有利に調節しうるため、LCATの活性の調節は、新規の治療法を開発するための合理的な標的である。本発明は、in vivoでのLCAT作用、CETP作用、または両方の作用の測定方法を含む、RCTの血漿成分の測定のための手段を提供する。
【0214】
方法
2人の健康なボランティアに脂質エマルジョンに懸濁された100mgまたは200mgの13C2−コレステロールの静脈内ボーラスを投与した。標識の投与後最初の24時間に3〜4回、ならびにその後、標識投与後約5日目および10日目に2回、20〜40mlの血液サンプルを採取した。各血液サンプルから、遠心分離とそれに続くメタノール/クロロホルム抽出およびその後の薄層クロマトグラフィー(TLC)よってコレステロールを単離した。同じ技術によるが、異なるTLC法を用いて、コレステロールエステルを単離した。コレステロールとコレステロールエステルはともに、上述のようにそれらの塩化アセチル誘導体に変換された。各サンプル由来のコレステロールおよびコレステロールエステルに対する13C APEを、上述のようにGCC−IRMSによって測定した。
【0215】
結果および意義
両被験者について、コレステロールおよびコレステロールエステルの13C APEを時間に対してプロットした(データは示していない)。コレステロールからコレステロールエステルへの変換は12時間の間に起こる。これらのデータは、in vivoでのLCATの活性を直接示し、RCTの血漿成分のこの部分が迅速に起こることを示す。RCTの流出成分と同様に、RCTの血漿成分の一部または全体の測定は、特に候補治療法の開発という背景において、in vivoでの候補治療法活性および薬効について有益な情報を与えうる。
【0216】
この実験は、RCTの血漿成分がヒトにおいて測定され得ることを説明する。RCTの血漿成分の測定は、CETP阻害剤、LCAT阻害剤、もしくは他のこのような候補治療法を含む、RCTまたはコレステロール輸送に対する様々な候補治療法の作用を評価するために使用されうる。RCTの他の成分と同様に、RCTの血漿成分を調節できる候補治療法の特定は、重要な商業的価値を有するであろう。
【0217】
実施例3
ラットにおけるRCTの流出成分の測定
序論
RCTの流出成分はRCTの最初の成分であり、候補治療法の標的となりうるプロセスである。あらゆる候補治療法は、開発プロセスの一環として動物で試験されなければならない。実施例1は、流出成分がヒトにおいて測定されうることを実証した。本実施例は、ラットにおいて実施された同一の実験を示す。
【0218】
方法
方法は、わずか1.2mgの13C2−コレステロールが静脈内注入によって投与され(100μg/時間)、わずか100μlの血液が各時点で採取されたこと以外は、上記の実施例1において記載されたものと同一である。さらに4つの動物群:標準的なラットの食餌を与えたラット;高コレステロール食を与えたラット;コール酸を加えた高コレステロール食を与えたラット;およびコール酸を加えた高コレステロール食を14日間与え、その後通常食に4日間戻したラットが研究された。この場合、疾患の動物モデルは食餌誘導性高コレステロール血症であり、血漿コレステロールを増加させることに対するコール酸の効果に続いて、食餌の切り替えによる比較的迅速な正常コレステロールレベルへの回復が起こる。図7は、血漿中へのコレステロールの流出に対するコレステロール/コール酸摂食(コレステロール負荷)の効果、およびその後の通常食への回復(コレステロール除荷)の効果を示す。
【0219】
結果および意義
図7は、各処理群についての平均流出速度を示す。コレステロール/コール酸摂食動物は最も高い流出速度を有し、コレステロール負荷食のコレステロール代謝への影響を補償するためにRCTの流出成分がアップレギュレートされうることを示唆する。通常食への回復では、Raはより低くなるがまだ正常化されず、それはラットからの持続性のコレステロール流出を示唆し、コレステロール/コール酸食が組織にコレステロールを負荷し、これがいまだに除去されているという見解と一致する。ここでのデータは、前臨床(齧歯類)モデルにおける介入試験を実証することに成功した。
【0220】
実施例4
ラットにおけるコレステロール排出RCTの測定;コレステロールの胆汁中への輸送およびコレステロールの胆汁酸への変換の測定
序論
RCTの肝臓成分は、それがRCTの最後の成分に相当し、コレステロールが実際に体から出る点であるため、RCTの研究にとって有意義である。理想的には、RCTの肝臓成分の測定は、特に、中性ステロール(例えば、RCTまたは肝臓でのde novoコレステロール合成に由来する胆汁コレステロール)ならびに胆汁酸(例えば、RCTコレステロールまたは肝臓でのde novo合成コレステロールに由来するデオキシコレート)をはじめとする胆汁のすべての成分の供給源および合成速度の決定を可能にする。
【0221】
方法
標識投与および生物学的サンプリング
あらゆる安定同位体標識の投与前(「0日目」と呼ばれる)に、血液および糞便サンプルを採取する。
【0222】
体内水分が約5%過剰な重水素の同位体含量に達するように、ラットに100%重水のIPボーラスを投与した。その後、体内水分の重水素の定常状態レベルを維持するために、ラットに飲料水中8%過剰な重水を与えた。重水に由来する重水素の肝臓でのde novo合成コレステロールへの取り込みは、de novo合成コレステロールに由来する胆汁コレステロールまたは胆汁酸の割合の測定を可能にする(図11B)。
【0223】
また、重水ボーラスと同時に、ラットに脂質エマルジョン中の1.2mgの13C2−コレステロールの静脈内ボーラスをも投与した。
【0224】
ボーラス投与後6日間にわたり血液サンプルを毎日採取した。ボーラス投与後6日間にわたり糞便サンプルを毎日採取した。
【0225】
ステロール排出速度の測定
当技術分野において既知の技術を用いて、毎日排出される各胆汁成分(コレステロール、コプロスタノール、およびデオキシコール酸)の質量を測定した。あるいは、質量値はまた、過去のデータから、または対象となるラットの系統が以前に同様の条件下で研究されている場合には文献からも取得される。
【0226】
同位体含量または同位体パターン測定:de novoコレステロールの寄与の測定
様々な同位体含量または同位体パターン測定が行われた。1日目〜6日目に採取した血液サンプルでの2H2Oの濃度は、血漿を炭化カルシウムと反応させ、その結果生じたアセチレンガスをMonitor series 3000サイクロイド質量分析計を用いて分析することにより測定された。このデータは、対象となる分子の最大限可能なMPEの算出根拠を提供する。
【0227】
コレステロール、コプロスタノール、およびデオキシコレートは、1日目〜6日目の糞便サンプルから、以下のようにして精製した:糞便を一晩水酸化ナトリウム溶液中でインキュベーションし、中性ステロールを単離するためにヘキサン抽出を行い、残りの水相を塩酸で中和し、その後胆汁酸を単離するために酢酸エチルで抽出した。その後、コレステロール、コプロスタノール、およびデオキシコール酸のM1同位体のMPEをGC/MSによって測定した。血漿重水濃度と組み合わせた場合、これらの測定結果は、肝臓でのde novo合成コレステロールに由来する対象となる各分子の割合(図14)およびRCTの他の測定基準と組織コレステロールバランスとの相関の決定を可能にする。
【0228】
同位体含量または同位体パターン測定:肝臓RCTの寄与の測定
様々な同位体含量または同位体パターン測定が行われた。0日目〜6日目に採取した血液サンプルからコレステロールを精製し、GCC−IRMSによって上述のように13C APEについて分析した。0日目の測定は、上述のような13C APE算出のためのベースライン測定を提供する。血中コレステロールの13C APEは、糞便コレステロール、コプロスタノール、またはデオキシコレートにおいて予期され得る最大限可能なAPEを算出するために使用される。
【0229】
0日目〜6日目に採取した糞便サンプルからコプロスタノール、コレステロール、およびデオキシコレートを精製した。それらの分子をその後、GCC−IRMSにより13C APEについて分析した。血中コレステロールの13C APEと組み合わせた場合、これらの測定結果は、RCTに由来するそれぞれの対象となる分子の割合の決定を可能にする。
【0230】
寄与率の算出
de novo合成コレステロールについては、最大限可能なM1アイソトポマーのMPEは、血漿中の過剰な重水の量に、MIDAの計算により決定されるスカラー係数を乗じることによって、または過去のデータによって決定される。観察された糞便コレステロール、コプロスタノール、およびデオキシコール酸のMPE EM1富化をこの最大限可能な値で割ることによって、肝臓でのde novo合成コレステロールに由来するそれぞれの割合を得る。
【0231】
RCTについては、糞便コレステロール、コプロスタノール、およびデオキシコール酸で観察される13C APEを、適切なサンプリング期間(サンプル採取の頻度に基づいて決定される)にわたって平均された血漿コレステロールで観察される13C APEで割ることによって、RCTに由来する各分子の割合を得る。この場合には、平均期間は24時間であった。例えば、2日目の糞便サンプル由来の糞便コレステロール、コプロスタノール、およびデオキシコール酸の13C APEを、2日目および1日目の血中コレステロールの13C APE値の平均で割った。この時間の平均化は、寄与率を算出するために使用される最大限可能なAPEが、サンプリングされた対象となる分子が合成されていた期間全体にわたる血中コレステロール濃度を反映することを確実にする。理論的には、ラットの場合、理想的な平均期間は、2つの糞粒の含量(生物学的サンプルサイズ)が排出されるためにかかる期間にわたって平均化される。しかし、当業者は、(図8の3日目以降から観察されるように)血中コレステロールの13C APEがサンプリング頻度ごとに定常状態に近づいていく場合、平均化の重要性は低下することを理解し得る。これらの状況では、単一サンプルからの血中コレステロールの実際の13C APEが最大値として使用され得る。
【0232】
結果および意義
対象となる各分子(コレステロール、コプロスタノール、およびデオキシコール酸)に対するそれぞれのコレステロール供給源(RCTまたはde novo合成)の寄与率に、各分子の排出速度を乗じることにより、それぞれの供給源から1日当たりに排出される質量を得た。
【0233】
本発明の方法は、候補治療法の発見および開発のために幅広い前臨床用途を有する。胆汁排出に対するde novo合成およびRCTの寄与を理解することは、このような分析にとって不可欠であり、単にいずれかまたはすべての胆汁成分の分泌速度を測定するだけでは不十分である。例えば、胆汁の排出速度を増加させた治療は、RCTの増加によってそのような結果をもたらしたのかもしれないが、それはまた肝臓でのde novoコレステロール合成の増加によるのかもしれず、その場合、その治療は、RCTの増加(すなわち、RCTを介した体からのコレステロールの除去の増加)およびアテローム硬化のリスクまたは発生率の減少に有効ではないだろう。あるいは、胆汁分泌速度を増加させるが、RCTが実質的に減少するようなレベルまで肝臓でのコレステロール合成が増加することによってそのような結果がもたらされる候補治療法は、望ましくない作用機序であり、まったく治療しないよりも事実上有害であるかもしれない。本発明の方法は、RCTを増加させる候補治療法と、胆汁分泌を増加させるが実質的にRCTを減少させる候補治療法との識別を可能にする。本発明の方法はまた、至適用量を特定するためにも使用され得る。
【0234】
RCTの肝臓成分または排出成分の測定はまた、様々な動物モデルにおいて候補治療法の効果を評価するためにも使用されうる。例えば、薬剤の投与前後でのRCTの肝臓部分が比較され得る。候補治療法の効果は、候補治療法の施行前後に測定した場合の肝臓RCTの変化(例えば、増加、減少、または差異なし)によって決定されるであろう。RCT関連作用に関する、用量範囲または有効量、用量反応曲線の性質、および候補治療法の作用機序の他の指標もまた、この方法で測定され得る。
【0235】
別の変形形態では、本方法は、RCTの肝臓成分に対する食餌変更の効果を評価するために使用されうる。上述のものと同様に、その効果は、食餌変更の前後に測定した場合の肝臓RCTの変化(例えば、増加、減少、または差異なし)によって決定される。
【0236】
このような差異はまた、動物の1群に候補治療法を施行し、他の群にプラセボ治療を施行するかまたは治療を施行せずに、2群でのRCTの肝臓成分を比較することによっても測定され得る。
【0237】
実施例5
ラットにおける「包括的コレステロールRCT」パラメータの測定
実施例1において概説されたアプローチの改良は、血漿コレステロールのRaを算出すること、およびその測定結果を実施例4に記載された投与コレステロールの排出速度と組み合わせることを含む。
【0238】
方法
血漿コレステロールの糞便中への回収は、糞便中性ステロール中に排出された投与標識コレステロールの割合と定義される。それは、注入後1〜4日目の回収された標識の割合(%)として表される。それは、糞便中性ステロール中の13C富化の割合(%)(中性ステロール排出(mg/日)を投与された13Cコレステロールの全mgで割ったもの)から算出される。
【数13】

【0239】
糞便中に排出される胆汁酸中への血漿コレステロールの回収について、同じ計算が行われる。ラットを一般的な試験用のコレステロール降下薬であるコレスチラミン、エゼチミブ、LXRアゴニスト(TO−901317)で処理した。コレステロールのRaは記載されたように算出され、投与されたコレステロールの糞便ステロールまたは胆汁酸中への回収は記載されたように算出される。
【0240】
結果および意義
図11に示されるのは、コレスチラミンで処理された、中性ステロール(図11A)および胆汁酸(図11B)中へのRCT流で観察される変化である。コレスチラミンは胆汁酸吸収を選択的に阻害するが、中性ステロール吸収を阻害しないことが知られている。これは、中性ステロールで観察されるものより大きな血漿コレステロールの糞便胆汁酸中への流量の増加に反映されている。
【0241】
図12に示されるのは、RCTに対するエゼチミブの効果である。中性ステロールへの血漿流量の増加は、肝臓から胆汁および腸内に分泌された内在性コレステロールの再吸収を含む腸のコレステロール吸収を阻害する、エゼチミブの既知の作用機序と一致する。
【0242】
図10に示されるのは、血漿コレステロールの中性ステロール中への排出およびRCTの包括的パラメータに対するLXRアゴニストの効果である。LXRアゴニストはマウスモデルにおいてアテローム硬化に拮抗することが示されている。観察されるRCTの増加はこの効果と一致する。遺伝子発現との相関(図10B)はまた、測定されるRCT流との相関によって創薬および薬剤開発の治療標的の有効性を確認する戦略を支持する。
【0243】
これらの結果は、RCTに対する薬剤介入の効果を記述することの有効性を実証し、その経路における活性の改善を評価または特定するために、それらがどのように使用されうるかを説明する。
【0244】
実施例6
ヒトにおけるRCTの肝臓成分の測定;胆汁酸のde novo合成、胆汁酸プールサイズの測定、血漿コレステロールから胆汁酸への変換の測定
序論
RCTの肝臓成分または排出成分はRCTの研究に有意義であり、コレステロールが実際に体から出るときのRCTの成分に相当する。ヒトにおいてRCTの肝臓成分または排出成分を測定することは様々な目的を果たすことができ、そのいくつかは上述されている。RCTの肝臓部分または排出部分の測定によるヒト被験体での候補治療法の評価は、本発明の例示的な用途である。臨床試験を正当化し、計画し、もしくは中止するため、または候補治療法の開発の継続もしくは認可に関する規制当局への申請を支持するためのこのようなデータの使用もまた、本発明の例示的な用途である。
【0245】
理想的には、RCTの肝臓成分または排出成分の測定は、特に、中性ステロール(例えば、RCTまたは肝臓でのde novoコレステロール合成に由来する胆汁コレステロール)ならびに胆汁酸(例えば、RCTコレステロールまたは肝臓でのde novo合成コレステロールに由来するデオキシコレート)をはじめとする胆汁のすべての成分の供給源および合成速度の決定を可能にする。
【0246】
方法
標識投与および生物学的サンプリング
いずれの安定同位体標識の投与前(「0日目」と呼ばれる)にも、ヒト被験体およびラットにおいて血液、糞便、ならびに尿サンプルを採取した。
【0247】
体内水分が約1%過剰な重水素の富化に達するように、被験体に重水の複数回投与を行った。また、被験体に13C2−コレステロールの静脈内ボーラスを投与し、50mgの2H4−コール酸を経口投与した。重水に由来する重水素の肝臓でのde novo合成コレステロールへの取り込みは、de novo合成コレステロールに由来する胆汁コレステロールまたは胆汁酸の割合の測定を可能にする。13Cの胆汁酸および胆汁コレステロール中への出現は、血中コレステロール(すなわち、RCT)に由来するこれらの分子の割合の測定を可能にする。2H4−コール酸の希釈は、胆汁酸プールサイズの測定を可能にする。
【0248】
複数の生物学的サンプルが採取された。ラットでは標識投与後7日目まで毎日、ヒトでは4、7および14日目に糞便を採取した。血液は定期的に10日目まで採取された(1〜2ml)。尿はヒトでは定期的に10日目まで採取された(少なくとも50mlのサンプル)。
【0249】
異なる被験体は異なる標識分子を投与されてもよく、異なる生物学的サンプリング計画を受けてもよい。被験体または被験体群からのデータは、被験体集団(例えば、健康な成人、高コレステロール血症の人など)におけるRCTの全体像を形成するために、他の同様の被験体からのデータと組み合わされうる。1つの実施形態では、すべての測定結果は、異なる薬物治療計画を受けたラットにおいて作成される。
【0250】
同位体含量または同位体パターン測定:de novoコレステロールの寄与の測定、胆汁成分に対するDNCの寄与率の算出
0日目〜7日目に採取した血液サンプルでの2H2Oの濃度を、血漿を炭化カルシウムと反応させ、その結果生じたアセチレンガスをMonitor series 3000サイクロイド質量分析計を用いて分析することにより測定した。このデータは、de novo合成コレステロールの最大限可能なMPEの算出根拠を提供する。
【0251】
コレステロールおよびコール酸を4日目〜7日目の糞便サンプルから精製し、コール酸を4日目〜7日目の尿サンプルから精製した。これらの分子を(上述のように)さらに処理し、その後、GC/MSによって分析する。M1 MPEは、ベースラインについては過去の参照値を用いて、上述のように算出された。最大限可能なMPEは、重水とコレステロール合成との間の関係に関する過去のデータを用いて、血液中で測定された体内水分の値から算出された。
【0252】
de novo合成肝臓コレステロールに由来する尿中コール酸、糞便コール酸、または糞便コレステロールの割合は、対象となる各分子で観察されるM1 MPEを、血中重水素値から算出される最大限可能なM1 MPEで割ることによって算出された。
【0253】
同位体含量または同位体パターン測定:肝臓RCTの寄与の測定、胆汁成分に対するRCTの寄与率の算出
RCTについては、RCTに由来する各分子の割合を得る1つの方法として、尿中コール酸で観察される13C APEを、適切なサンプリング期間(サンプル採取の頻度に基づいて決定される)にわたって平均された血漿コレステロールで観察される13C APEで割る。ヒトの場合には、血漿コレステロールの13C APEは、過去のデータから、サンプルを採取した期間中は約0.02で一定であることが知られている。2人の健康な被験者由来の2つのサンプル(2週目および3週目)からのデータが図12に示される。その計算は、被験者1では約81%の胆汁酸がRCTに由来し、被験者2では51%の胆汁酸がRCTに由来することを示す。これらの差異は、RCTにおいて臨床的に意義のある差異であり、より少ないコレステロールを胆汁中に排出する被験者2でのアテローム生成またはアテローム硬化のリスクを示唆しうる。
【0254】
同位体含量または同位体パターン測定:胆汁酸プールサイズの決定のための測定、胆汁酸プールサイズの算出
10日の研究期間中に採取された血液サンプルからコール酸を単離した。その後、コール酸を精製し、GC/MSによって分析し、ベースライン値として過去のデータを用いてM4イオンのMPEを決定した。その後、コール酸の希釈を、投与したコール酸の量に基づいて算出した。胆汁酸プールサイズは、当技術分野において既知の方程式、具体的には、Measurement of parameters of cholic acid kinetics in plasma using a microscale stable isotope dilution technique: application to rodents and humans, Hulzebos et al, J. of Lipid Research, volume 42, 2001, pp 1923-1929に見られるものを用いて算出された。
【0255】
胆汁ステロールの代用としての尿中ステロールの使用
尿由来の胆汁酸および尿由来の胆汁コレステロールへの腸管微生物の作用に由来するコレステロールの代謝産物の同位体含量または同位体パターンを測定した。この場合、胆汁コレステロールおよび胆汁酸の同位体含量または同位体パターンは尿サンプルから測定され得る。この技術の詳細は、上記のII−C項に記載されている。標識水を投与された被験体での糞便コプロスタノールおよび尿中コプロスタノールの2H同位体含量または同位体パターン測定結果は、その2つが平衡状態にあることを示す。尿中コプロスタノールの同位体含量または同位体パターンを測定することによって、糞便中の胆汁コレステロールの同位体含量を決定した。様々な処理計画は、研究されたとおりに、ラットでのde novoコレステロール合成を変化させた(図14)。
【0256】
実施例7
ヒトにおける「包括的コレステロールRCT」パラメータの測定
実施例6において概説されたアプローチの改良は、血漿コレステロールのRaを算出すること、およびその測定結果を実施例4および5に記載された投与コレステロールの排出速度と組み合わせることを含む。
【0257】
方法
同位体は実施例6に記載されるように投与される。経口投与シトスタノールは1日3回投与され、その糞便サンプル中への回収は、当技術分野において既知の方法を用いて絶対的な糞便中性ステロールおよび胆汁酸排出速度を決定するために用いられた。
【0258】
結果
研究された7人の被験者に対するRCTが示され、被験者間の個人差が示される。さらに、低い血漿HDLコレステロール濃度(<40mg/dl)および高い血漿HDLコレステロール濃度(>60mg/dl)を有する被験者が特定される。最も低いRCT値は最も低いHDLを有する被験者で見られ(図13Aおよび13Bにおいて*で示される)、最も高いRCT値は最も高いHDLを有する被験者で見られる(#で示される)。
【0259】
この実験は、中性ステロールおよび胆汁酸中へのRCT流がヒトにおいて効果的に測定され得ることを示す。さらに、血漿HDLレベルはRCT流パラメータ、特に包括的RCT流パラメータと関連しうることを示唆する。
【図面の簡単な説明】
【0260】
【図1】図1は、RCT経路およびコレステロールの全身プールを図解する。略語;「RBC」は赤血球である。末梢組織中の大きな代謝回転の遅いコレステロールプール、ならびに血漿、RBCおよび肝臓遊離コレステロールを含む代謝回転の速いコレステロールプールの存在が示されている。代謝回転の速いプールに投与された標識コレステロールは、組織と交換され得、または糞便ステロールの形で排出され得る。
【図2】図2は、認識されているRCT経路の分子要素を図解する(A.Tall, Journal of Clinical Investigation, 2001から)。
【図3】図3は、RCT経路の2つの成分または部分である流出/動員および排出を説明する。
【図4A】図4Aは、プラトーの原則、および同位体希釈による分子流速または分子出現速度(Ra)の測定のためのモデルを図解する。
【図4B】図4Bは、コレステロールのRaを測定するためのプラトーの原則の適用、およびRaコレステロールを測定するためのプロトコルを説明する。
【図5】図5は、3人のヒト被験体についての13C2−コレステロール注入時間に対する13C APEを示す。プラトーへの指数近似のための曲線フィッティングおよびフィッティングパラメータはそれぞれのグラフ上に含まれる。
【図6A】図6Aは、ヒト被験体において測定されたコレステロール流出/動員速度、すなわちRaコレステロールの代表値を示す。
【図6B】図6Bは、Raコレステロールの反復測定に対する被験体内再現性を示す。
【図7】図7は、様々な食餌を与えられたラットにおけるコレステロールの流出速度を示す。コレステロール/コール酸摂食により増加した血漿コレステロールRaの変化は、通常食に戻した4日後も持続する。
【図8A】図8Aは、投与された標識コレステロールの糞便ステロール中への排出効率の測定プロトコルを説明する。
【図8B】図8Bは、投与された標識コレステロールの排出効率に対する、7日間のラットのLXRアゴニストによる処理の効果を示す。
【図9A】図9Aは、Raが個体において増加した場合、アーチファクトとして排出効率が低下するため、投与された標識コレステロールの排出効率を、組織での流出/流入(Raコレステロール)に対して修正することの必要性を図解する。
【図9B】図9Bは、組織からの血液を介した糞便内へのコレステロールの流れを示す、包括的RCTパラメータの算出の基礎を説明する。
【図9C】図9Cは、組織から血液への流れ(流出/動員)および血液から糞便への流れ(排出)を包含する、測定される包括的RCT過程を図解する。
【図10A】図10Aは、LXRアゴニスト(TO−901317)を投与されたラットでの、RCTの成分および中性ステロール中へのRCTの「包括的パラメータ」の算出を示す。ラットにLXRアゴニストを7日間投与し、RCT流を測定した。A)Raコレステロール。B)血漿コレステロールの胆汁酸中への排出。C)2つの成分の積(有意な増加が観察された)。
【図10B】図10Bは、LXR誘導性遺伝子発現と包括的RCT流との間の関係を示す。
【図11A】図11Aは、コレスチラミンを投与されたラットでの、RCTの成分および中性ステロール中へのRCTの「包括的パラメータ」の算出を示す。ラットに胆汁酸結合物質であるコレスチラミンを7日間投与し、RCT流を測定した。A)Raコレステロール。B)血漿コレステロールの中性ステロール中への排出。C)2つの成分の積(有意な効果は観察されなかった)。
【図11B】図11Bは、コレスチラミンを投与されたラットでの、RCTの成分および胆汁酸中へのRCTの「包括的パラメータ」の算出を示す。ラットに胆汁酸結合物質(コレスチラミン)を7日間投与し、RCT流を測定した。A)Raコレステロール。B)血漿コレステロールの胆汁酸への排出。C)2つの成分の積(有意な増加が観察された)。
【図12】図12Aは、エゼチミブを投与されたラットでの、RCTの成分および中性ステロール中へのRCTの「包括的パラメータ」の算出を示す。ラットにエゼチミブを7日間投与し、その後RCT流を測定した。A)Raコレステロール。B)血漿コレステロールの中世ステロールへの排出。C)2つの成分の積(有意な増加が観察された)。
【図13A】図13Aは、包括的RCTおよびRCTの2つの成分を含む、ヒト被験体で測定された糞便中性ステロール中へのRCTパラメータを示す。被験体での低濃度または高濃度のHDLコレステロールとの関係が示される。
【図13B】図13Bは、包括的RCTおよびRCTの2つの成分を含む、ヒト被験体で測定された糞便胆汁酸中へのRCTパラメータを示す。被験体での低濃度または高濃度のHDLコレステロールとの関係が示される。
【図13C】図13Cは、ヒト被験体での糞便中性ステロールおよび胆汁酸中への包括的RCTの平均値を示す。
【図14】図14は、ラットにおいて測定されたde novoコレステロール合成速度、ならびにde novoコレステロール合成速度に対する薬物および食餌の効果を示す。
【図15】図15は、同位体標識コレステロール誘導体(コレステロールを含む)およびコレステロールエステルの非限定的なリストを示し、それらの構造および標識が各分子に付加されうる位置を詳述する。
【図16】図16は、同位体標識胆汁酸および胆汁酸代謝産物の非限定的なリストを示し、それらの構造および標識が各分子に付加されうる位置を詳述する。
【図17A】図17Aは、ヒトでの流出/動員(Ra)の測定プロトコルを図解する。
【図17B】図17Bは、ヒトでのコレステロール排出効率の測定プロトコルを図解する。
【特許請求の範囲】
【請求項1】
生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定する方法であって、以下のステップ:
(a)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子を、既知または測定可能な速度で生体系に投与するステップ;
(b)1種以上の同位体標識コレステロール分子、胆汁酸または該生体系からの排出中性ステロールを含むサンプルを該生体系から取得するステップ;
(c)該同位体標識コレステロール分子、胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(d)該同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子から該コレステロール分子、胆汁酸または排出中性ステロールへの取り込み速度または移動速度を算出することにより、該生体系でのRCTの肝臓成分または排出成分の分子流速を測定するステップ
を含む、上記方法。
【請求項2】
前記サンプルが、糞便、尿または血液サンプルである、請求項1に記載の方法。
【請求項3】
前記サンプルが糞便サンプルであり、かつ標識中性ステロールおよび胆汁酸の同位体含量を測定する、請求項2に記載の方法。
【請求項4】
前記同位体標識コレステロール分子または同位体標識コレステロール関連分子の同位体標識が、2H、3H、13C、14Cまたは18Oである、請求項1に記載の方法。
【請求項5】
前記生体系がヒトまたは齧歯類である、請求項1に記載の方法。
【請求項6】
脂質エマルジョン中の13C2標識コレステロールを前記生体系に静脈内投与する、請求項1に記載の方法。
【請求項7】
以下のステップ:
(i)既知量の同位体標識胆汁酸を前記生体系に投与するステップ;
(ii)一定時間後に該生体系での胆汁酸の同位体含量または同位体含量の変化速度を測定するステップ;および
(iii)同位体標識胆汁酸の希釈量を測定することにより、該生体系中の胆汁酸の総量を測定するステップ
により、該生体系中の胆汁酸の総量を測定するステップをさらに含む、請求項1に記載の方法。
【請求項8】
前記標識胆汁酸が、コール酸、ケノデオキシコール酸、デオキシコール酸およびリトコール酸より選択される、請求項7に記載の方法。
【請求項9】
前記同位体標識胆汁酸の同位体標識が、2H、3H、13C、14Cまたは18Oである、請求項8に記載の方法。
【請求項10】
脂質エマルジョン中の13C2標識コレステロールまたは2H4−コール酸を前記生体系に投与する、請求項9に記載の方法。
【請求項11】
以下のステップ:
(i)所定の標識濃度を有する同位体標識コレステロール前駆体を前記生体系に投与するステップ;
(ii)標識胆汁酸、排出中性ステロールまたは血中コレステロールを含む生物学的サンプルを該生体系から取得するステップ;
(iii)該標識胆汁酸、排出中性ステロールまたは血中コレステロールの同位体含量もしくは同位体パターン、または同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該胆汁酸、中性ステロールまたはコレステロールの同位体含量もしくは同位体パターン、または同位体含量もしくは同位体パターンの変化速度を、安定な同位体標識コレステロール前駆体の標識濃度と比較することにより、新規に合成されたコレステロールに由来するコレステロール、中性ステロールまたは胆汁酸の割合を測定し、それにより該胆汁酸、中性ステロールまたはコレステロールに対するde novoコレステロール合成の寄与を測定するステップ
を含む、胆汁酸に対するde novoコレステロール合成の寄与を測定するステップをさらに含む、請求項1に記載の方法。
【請求項12】
前記同位体標識コレステロール前駆体が重水素化水である、請求項11に記載の方法。
【請求項13】
前記サンプルが糞便であり、かつ単位時間当たりに被験体から排出される中性ステロールおよび胆汁酸の総含量を、該被験体に経口的に投与された、糞便中に検出される内部標準との比較により測定する、請求項1に記載の方法。
【請求項14】
前記内部標準がシトスタノールである、請求項13に記載の方法。
【請求項15】
生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定する方法であって、以下のステップ:
(a)安定同位体標識コレステロール分子または安定同位体標識コレステロール関連分子を該生体系に投与するステップ;
(b)該同位体標識コレステロール分子または同位体標識コレステロール関連分子のin vivo変換産物を含むサンプルを該生体系から取得するステップ;
(c)該in vivo変換産物の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(d)該同位体標識コレステロール分子または同位体標識コレステロール関連分子の希釈速度を算出することにより、該生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ
を含む、上記方法。
【請求項16】
前記サンプルが、糞便、尿または血液サンプルである、請求項15に記載の方法。
【請求項17】
前記同位体標識コレステロール分子または同位体標識コレステロール関連分子の同位体標識が、2H、3H、13C、14Cまたは18Oである、請求項15に記載の方法。
【請求項18】
前記生体系がヒトまたは齧歯類である、請求項15に記載の方法。
【請求項19】
HDLとの複合体中の13C2標識コレステロールを前記生体系に投与する、請求項15に記載の方法。
【請求項20】
前記サンプルが、HDL、VLDLおよびLDLを含む血液サンプルであり、かつHDLコレステロール、LDLコレステロールエステルおよびVLDLコレステロールエステルの同位体含量をGCC−IRMSにより測定する、請求項19に記載の方法。
【請求項21】
生体系での血中コレステロールの出現速度、またはコレステロール組織流出速度を測定する方法であって、以下のステップ:
(a)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子を、既知または測定可能な速度で該生体系に静脈内投与するステップであって、該投与速度は該生体系体内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分であること;
(b)該標識遊離コレステロール分子を含むサンプルを、該生体系から取得するステップ;
(c)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;
(d)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、該同位体標識コレステロール分子または同位体標識コレステロール関連分子の投与速度と比較することにより、該生体系での血中コレステロールの出現速度を算出するステップ
を含む、上記方法。
【請求項22】
前記生体系がヒトまたは齧歯類である、請求項21に記載の方法。
【請求項23】
前記生体系での血中コレステロールの出現速度を、プラトーの原則(plateau principle)に従い同位体希釈により、同位体プラトーの存在の確立により、同位体プラトー値の推定により、または同位体プラトー値の外挿により算出する、請求項21に記載の方法。
【請求項24】
生体系でのコレステロール流速を算出する方法であって、以下のステップ:
(a)以下のステップ:
(i)脂質エマルジョン中の13C、2Hまたは18O標識コレステロールを、該生体系体内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分な投与速度で該生体系に静脈内投与するステップ;
(ii)標識遊離コレステロール分子を含むサンプルを該生体系から取得するステップ;
(iii)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、13C、2Hまたは18O標識コレステロールの投与速度と比較することにより、該生体系での血中コレステロールの出現速度を算出するステップ
により、血中コレステロールの出現速度を測定するステップ;
(b)以下のステップ:
(i)同位体標識コレステロール分子または同位体標識コレステロール関連分子を該生体系に投与するステップ;
(ii)1種以上の同位体標識胆汁酸または該生体系からの排出中性ステロールを含むサンプルを該生体系から取得するステップ;
(iii)同位体標識胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該同位体標識コレステロール関連分子の該胆汁酸もしくは排出中性ステロールへの取り込み速度または移動速度を算出することにより、該生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の回収割合を測定するステップ
により、コレステロール逆輸送(RCT)の肝臓部分(hepatic arm)または排出部分(excretory arm)の回収割合を測定するステップ;および
(c)ステップ(a)(iii)からの血中コレステロールの出現速度に、ステップ(b)(iv)からのRCTの肝臓部分または排出部分の回収割合を乗じることにより、該生体系でのコレステロール流速を算出するステップ
を含む、上記方法。
【請求項25】
前記生体系がヒトである、請求項24に記載の方法。
【請求項26】
生体系でのアテローム硬化のリスクおよび進行速度に対する候補薬剤および/または食餌変更の効果を評価する方法であって、以下のステップ:
(a)請求項24に記載の方法により該生体系でのコレステロール流速を算出するステップ;
(b)候補薬剤を該生体系に投与し、かつ/または該生体系の食餌を変更するステップ;
(c)請求項24に記載の方法により該生体系でのコレステロール流速を算出するステップ;
(d)ステップ(a)とステップ(c)とのコレステロール流速の差異を比較することにより、アテローム硬化に対する該候補薬物および/または食餌変更の効果を評価するステップ
を含む、上記方法。
【請求項27】
生体系でのアテローム硬化のリスクおよび進行速度に対する候補薬剤および/または食餌変更の効果を評価する方法であって、以下のステップ:
(a)請求項1に記載の方法により生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定するステップ;
(b)候補薬剤を該生体系に投与し、かつ/または該生体系の食餌を変更するステップ;
(c)請求項1に記載の方法により該生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定するステップ;および
(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する該候補薬物および/または食餌変更の効果を評価するステップ
を含む、上記方法。
【請求項28】
生体系でのアテローム硬化のリスクおよび進行速度に対する候補薬剤および/または食餌変更の効果を評価する方法であって、以下のステップ:
(a)請求項12に記載の方法により生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ;
(b)候補薬剤を該生体系に投与し、かつ/または該生体系の食餌を変更するステップ;
(c)請求項12に記載の方法により該生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ;および
(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する該候補薬物および/または食餌変更の効果を評価するステップ
を含む、上記方法。
【請求項29】
生体系でのアテローム硬化のリスクおよび進行速度に対する候補薬剤および/または食餌変更の効果を評価する方法であって、以下のステップ:
(a)請求項21に記載の方法により該生体系でのコレステロールの出現速度を測定するステップ;
(b)候補薬剤を該生体系に投与し、かつ/または該生体系の食餌を変更するステップ;
(c)請求項21に記載の方法により生体系でのコレステロールの出現速度を測定するステップ;および
(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する該候補薬物および/または食餌変更の効果を評価するステップ
を含む、上記方法。
【請求項30】
糞便ステロール中の標識コレステロール回収を組織全体にわたるコレステロールの流出/流入速度について修正する方法であって、以下のステップ:
(a)以下のステップ:
(i)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子を、既知または測定可能な速度で生体系に投与するステップ;
(ii)1種以上の同位体標識コレステロール分子、胆汁酸または該生体系からの排出中性ステロールを含むサンプルを該生体系から取得するステップ;
(iii)該同位体標識コレステロール分子、胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子から該コレステロール分子、胆汁酸または排出中性ステロールへの取り込み速度または移動速度を算出することにより、該生体系でのRCTの肝臓成分または排出成分の分子流速を測定するステップ
によりRCTの肝臓部分(hepatic arm)または排出部分(excretory arm)の回収割合を測定するステップ;
(b)以下のステップ:
(i)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子を、既知または測定可能な速度で該生体系に静脈内投与するステップであって、該投与速度は該生体系体内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分であること;
(ii)標識遊離コレステロール分子を含むサンプルを該生体系から取得するステップ;
(iii)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、該同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子の投与速度と比較することにより、該生体系での血中コレステロールの出現速度を算出するステップ
により、血中コレステロールの出現速度を測定するステップ;および
(c)ステップ(b)からのコレステロールの出現速度にステップ(a)の回収割合を乗じることにより、糞便ステロール中の標識コレステロール回収を組織全体にわたるコレステロールの流出/流入速度について修正するステップ
を含む、上記方法。
【請求項31】
生体系でのRCT流速を算出するためのキットであって、以下のもの:
(a)1種以上の同位体標識HDL粒子、同位体標識コレステロール分子、同位体標識コレステロール前駆体、または同位体標識胆汁酸;および
(b)キットの使用説明書
を含み、生体系のコレステロール流速の算出のために用いられる、上記キット。
【請求項32】
同位体標識HDL粒子または標識胆汁酸の投与のための用具をさらに含む、請求項31に記載のキット。
【請求項33】
前記生体系からの生物学的サンプル回収のための器具をさらに含む、請求項31に記載のキット。
【請求項1】
生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定する方法であって、以下のステップ:
(a)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子を、既知または測定可能な速度で生体系に投与するステップ;
(b)1種以上の同位体標識コレステロール分子、胆汁酸または該生体系からの排出中性ステロールを含むサンプルを該生体系から取得するステップ;
(c)該同位体標識コレステロール分子、胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(d)該同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子から該コレステロール分子、胆汁酸または排出中性ステロールへの取り込み速度または移動速度を算出することにより、該生体系でのRCTの肝臓成分または排出成分の分子流速を測定するステップ
を含む、上記方法。
【請求項2】
前記サンプルが、糞便、尿または血液サンプルである、請求項1に記載の方法。
【請求項3】
前記サンプルが糞便サンプルであり、かつ標識中性ステロールおよび胆汁酸の同位体含量を測定する、請求項2に記載の方法。
【請求項4】
前記同位体標識コレステロール分子または同位体標識コレステロール関連分子の同位体標識が、2H、3H、13C、14Cまたは18Oである、請求項1に記載の方法。
【請求項5】
前記生体系がヒトまたは齧歯類である、請求項1に記載の方法。
【請求項6】
脂質エマルジョン中の13C2標識コレステロールを前記生体系に静脈内投与する、請求項1に記載の方法。
【請求項7】
以下のステップ:
(i)既知量の同位体標識胆汁酸を前記生体系に投与するステップ;
(ii)一定時間後に該生体系での胆汁酸の同位体含量または同位体含量の変化速度を測定するステップ;および
(iii)同位体標識胆汁酸の希釈量を測定することにより、該生体系中の胆汁酸の総量を測定するステップ
により、該生体系中の胆汁酸の総量を測定するステップをさらに含む、請求項1に記載の方法。
【請求項8】
前記標識胆汁酸が、コール酸、ケノデオキシコール酸、デオキシコール酸およびリトコール酸より選択される、請求項7に記載の方法。
【請求項9】
前記同位体標識胆汁酸の同位体標識が、2H、3H、13C、14Cまたは18Oである、請求項8に記載の方法。
【請求項10】
脂質エマルジョン中の13C2標識コレステロールまたは2H4−コール酸を前記生体系に投与する、請求項9に記載の方法。
【請求項11】
以下のステップ:
(i)所定の標識濃度を有する同位体標識コレステロール前駆体を前記生体系に投与するステップ;
(ii)標識胆汁酸、排出中性ステロールまたは血中コレステロールを含む生物学的サンプルを該生体系から取得するステップ;
(iii)該標識胆汁酸、排出中性ステロールまたは血中コレステロールの同位体含量もしくは同位体パターン、または同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該胆汁酸、中性ステロールまたはコレステロールの同位体含量もしくは同位体パターン、または同位体含量もしくは同位体パターンの変化速度を、安定な同位体標識コレステロール前駆体の標識濃度と比較することにより、新規に合成されたコレステロールに由来するコレステロール、中性ステロールまたは胆汁酸の割合を測定し、それにより該胆汁酸、中性ステロールまたはコレステロールに対するde novoコレステロール合成の寄与を測定するステップ
を含む、胆汁酸に対するde novoコレステロール合成の寄与を測定するステップをさらに含む、請求項1に記載の方法。
【請求項12】
前記同位体標識コレステロール前駆体が重水素化水である、請求項11に記載の方法。
【請求項13】
前記サンプルが糞便であり、かつ単位時間当たりに被験体から排出される中性ステロールおよび胆汁酸の総含量を、該被験体に経口的に投与された、糞便中に検出される内部標準との比較により測定する、請求項1に記載の方法。
【請求項14】
前記内部標準がシトスタノールである、請求項13に記載の方法。
【請求項15】
生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定する方法であって、以下のステップ:
(a)安定同位体標識コレステロール分子または安定同位体標識コレステロール関連分子を該生体系に投与するステップ;
(b)該同位体標識コレステロール分子または同位体標識コレステロール関連分子のin vivo変換産物を含むサンプルを該生体系から取得するステップ;
(c)該in vivo変換産物の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(d)該同位体標識コレステロール分子または同位体標識コレステロール関連分子の希釈速度を算出することにより、該生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ
を含む、上記方法。
【請求項16】
前記サンプルが、糞便、尿または血液サンプルである、請求項15に記載の方法。
【請求項17】
前記同位体標識コレステロール分子または同位体標識コレステロール関連分子の同位体標識が、2H、3H、13C、14Cまたは18Oである、請求項15に記載の方法。
【請求項18】
前記生体系がヒトまたは齧歯類である、請求項15に記載の方法。
【請求項19】
HDLとの複合体中の13C2標識コレステロールを前記生体系に投与する、請求項15に記載の方法。
【請求項20】
前記サンプルが、HDL、VLDLおよびLDLを含む血液サンプルであり、かつHDLコレステロール、LDLコレステロールエステルおよびVLDLコレステロールエステルの同位体含量をGCC−IRMSにより測定する、請求項19に記載の方法。
【請求項21】
生体系での血中コレステロールの出現速度、またはコレステロール組織流出速度を測定する方法であって、以下のステップ:
(a)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子を、既知または測定可能な速度で該生体系に静脈内投与するステップであって、該投与速度は該生体系体内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分であること;
(b)該標識遊離コレステロール分子を含むサンプルを、該生体系から取得するステップ;
(c)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;
(d)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、該同位体標識コレステロール分子または同位体標識コレステロール関連分子の投与速度と比較することにより、該生体系での血中コレステロールの出現速度を算出するステップ
を含む、上記方法。
【請求項22】
前記生体系がヒトまたは齧歯類である、請求項21に記載の方法。
【請求項23】
前記生体系での血中コレステロールの出現速度を、プラトーの原則(plateau principle)に従い同位体希釈により、同位体プラトーの存在の確立により、同位体プラトー値の推定により、または同位体プラトー値の外挿により算出する、請求項21に記載の方法。
【請求項24】
生体系でのコレステロール流速を算出する方法であって、以下のステップ:
(a)以下のステップ:
(i)脂質エマルジョン中の13C、2Hまたは18O標識コレステロールを、該生体系体内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分な投与速度で該生体系に静脈内投与するステップ;
(ii)標識遊離コレステロール分子を含むサンプルを該生体系から取得するステップ;
(iii)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、13C、2Hまたは18O標識コレステロールの投与速度と比較することにより、該生体系での血中コレステロールの出現速度を算出するステップ
により、血中コレステロールの出現速度を測定するステップ;
(b)以下のステップ:
(i)同位体標識コレステロール分子または同位体標識コレステロール関連分子を該生体系に投与するステップ;
(ii)1種以上の同位体標識胆汁酸または該生体系からの排出中性ステロールを含むサンプルを該生体系から取得するステップ;
(iii)同位体標識胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該同位体標識コレステロール関連分子の該胆汁酸もしくは排出中性ステロールへの取り込み速度または移動速度を算出することにより、該生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の回収割合を測定するステップ
により、コレステロール逆輸送(RCT)の肝臓部分(hepatic arm)または排出部分(excretory arm)の回収割合を測定するステップ;および
(c)ステップ(a)(iii)からの血中コレステロールの出現速度に、ステップ(b)(iv)からのRCTの肝臓部分または排出部分の回収割合を乗じることにより、該生体系でのコレステロール流速を算出するステップ
を含む、上記方法。
【請求項25】
前記生体系がヒトである、請求項24に記載の方法。
【請求項26】
生体系でのアテローム硬化のリスクおよび進行速度に対する候補薬剤および/または食餌変更の効果を評価する方法であって、以下のステップ:
(a)請求項24に記載の方法により該生体系でのコレステロール流速を算出するステップ;
(b)候補薬剤を該生体系に投与し、かつ/または該生体系の食餌を変更するステップ;
(c)請求項24に記載の方法により該生体系でのコレステロール流速を算出するステップ;
(d)ステップ(a)とステップ(c)とのコレステロール流速の差異を比較することにより、アテローム硬化に対する該候補薬物および/または食餌変更の効果を評価するステップ
を含む、上記方法。
【請求項27】
生体系でのアテローム硬化のリスクおよび進行速度に対する候補薬剤および/または食餌変更の効果を評価する方法であって、以下のステップ:
(a)請求項1に記載の方法により生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定するステップ;
(b)候補薬剤を該生体系に投与し、かつ/または該生体系の食餌を変更するステップ;
(c)請求項1に記載の方法により該生体系でのコレステロール逆輸送(RCT)の肝臓成分または排出成分の分子流速を測定するステップ;および
(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する該候補薬物および/または食餌変更の効果を評価するステップ
を含む、上記方法。
【請求項28】
生体系でのアテローム硬化のリスクおよび進行速度に対する候補薬剤および/または食餌変更の効果を評価する方法であって、以下のステップ:
(a)請求項12に記載の方法により生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ;
(b)候補薬剤を該生体系に投与し、かつ/または該生体系の食餌を変更するステップ;
(c)請求項12に記載の方法により該生体系でのコレステロール逆輸送(RCT)の血漿成分の分子流速を測定するステップ;および
(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する該候補薬物および/または食餌変更の効果を評価するステップ
を含む、上記方法。
【請求項29】
生体系でのアテローム硬化のリスクおよび進行速度に対する候補薬剤および/または食餌変更の効果を評価する方法であって、以下のステップ:
(a)請求項21に記載の方法により該生体系でのコレステロールの出現速度を測定するステップ;
(b)候補薬剤を該生体系に投与し、かつ/または該生体系の食餌を変更するステップ;
(c)請求項21に記載の方法により生体系でのコレステロールの出現速度を測定するステップ;および
(d)ステップ(a)とステップ(c)との分子流速の差異を比較することにより、アテローム硬化に対する該候補薬物および/または食餌変更の効果を評価するステップ
を含む、上記方法。
【請求項30】
糞便ステロール中の標識コレステロール回収を組織全体にわたるコレステロールの流出/流入速度について修正する方法であって、以下のステップ:
(a)以下のステップ:
(i)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子を、既知または測定可能な速度で生体系に投与するステップ;
(ii)1種以上の同位体標識コレステロール分子、胆汁酸または該生体系からの排出中性ステロールを含むサンプルを該生体系から取得するステップ;
(iii)該同位体標識コレステロール分子、胆汁酸または排出中性ステロールの同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子から該コレステロール分子、胆汁酸または排出中性ステロールへの取り込み速度または移動速度を算出することにより、該生体系でのRCTの肝臓成分または排出成分の分子流速を測定するステップ
によりRCTの肝臓部分(hepatic arm)または排出部分(excretory arm)の回収割合を測定するステップ;
(b)以下のステップ:
(i)同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子を、既知または測定可能な速度で該生体系に静脈内投与するステップであって、該投与速度は該生体系体内で検出可能なレベルの標識遊離コレステロールの蓄積を生じるのに十分であること;
(ii)標識遊離コレステロール分子を含むサンプルを該生体系から取得するステップ;
(iii)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を測定するステップ;および
(iv)該標識遊離コレステロール分子の同位体含量、同位体パターン、同位体含量もしくは同位体パターンの変化速度を、該同位体標識コレステロール分子もしくは同位体標識コレステロール関連分子の投与速度と比較することにより、該生体系での血中コレステロールの出現速度を算出するステップ
により、血中コレステロールの出現速度を測定するステップ;および
(c)ステップ(b)からのコレステロールの出現速度にステップ(a)の回収割合を乗じることにより、糞便ステロール中の標識コレステロール回収を組織全体にわたるコレステロールの流出/流入速度について修正するステップ
を含む、上記方法。
【請求項31】
生体系でのRCT流速を算出するためのキットであって、以下のもの:
(a)1種以上の同位体標識HDL粒子、同位体標識コレステロール分子、同位体標識コレステロール前駆体、または同位体標識胆汁酸;および
(b)キットの使用説明書
を含み、生体系のコレステロール流速の算出のために用いられる、上記キット。
【請求項32】
同位体標識HDL粒子または標識胆汁酸の投与のための用具をさらに含む、請求項31に記載のキット。
【請求項33】
前記生体系からの生物学的サンプル回収のための器具をさらに含む、請求項31に記載のキット。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図7】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図10A】


【図10B】


【図11A】


【図11B】


【図12】


【図13A】


【図13B】


【図13C】


【図14】


【図15】


【図16】


【図17A】


【図17B】




【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図7】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図10A】


【図10B】


【図11A】


【図11B】


【図12】


【図13A】


【図13B】


【図13C】


【図14】


【図15】


【図16】


【図17A】


【図17B】


【公表番号】特表2008−542688(P2008−542688A)
【公表日】平成20年11月27日(2008.11.27)
【国際特許分類】
【出願番号】特願2008−510210(P2008−510210)
【出願日】平成18年5月3日(2006.5.3)
【国際出願番号】PCT/US2006/017167
【国際公開番号】WO2006/119438
【国際公開日】平成18年11月9日(2006.11.9)
【出願人】(592130699)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【Fターム(参考)】
【公表日】平成20年11月27日(2008.11.27)
【国際特許分類】
【出願日】平成18年5月3日(2006.5.3)
【国際出願番号】PCT/US2006/017167
【国際公開番号】WO2006/119438
【国際公開日】平成18年11月9日(2006.11.9)
【出願人】(592130699)ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【Fターム(参考)】
[ Back to top ]

