コンフォーマルレーザ治療手順を用いてサンプルの少なくとも一部分の情報をモニタ及び取得し、電磁放射を放射する方法及びシステム
【課題】治療深度を正確に制御して誘導することができるレーザ焼灼システムを提供する。
【解決手段】サンプルの少なくとも一部分に関する情報を取得する方法及びシステムを提供できる。例えば、サンプルの一部分に温度変化を引き起こすことができる。少なくとも一つの電磁放射をサンプルの部分の近傍または内部の部位に送出することができる。複数の深度における部位の変形を、(i)部位からもたらされる少なくとも一つの第2の電磁放射の位相、及び/又は(ii)第2の電磁放射の位相及び/又は振幅の変化のレート、の関数として特定することができる。他の代表的な実施の形態では、サンプルの温度分布を制御する方法及びシステムを提供できる。例えば、電磁放射をサンプルの部位に特定の波長で照射することができる。電磁放射を部位に照射している際、電磁放射の特定の波長を変更することによって温度分布を制御することができる。
【解決手段】サンプルの少なくとも一部分に関する情報を取得する方法及びシステムを提供できる。例えば、サンプルの一部分に温度変化を引き起こすことができる。少なくとも一つの電磁放射をサンプルの部分の近傍または内部の部位に送出することができる。複数の深度における部位の変形を、(i)部位からもたらされる少なくとも一つの第2の電磁放射の位相、及び/又は(ii)第2の電磁放射の位相及び/又は振幅の変化のレート、の関数として特定することができる。他の代表的な実施の形態では、サンプルの温度分布を制御する方法及びシステムを提供できる。例えば、電磁放射をサンプルの部位に特定の波長で照射することができる。電磁放射を部位に照射している際、電磁放射の特定の波長を変更することによって温度分布を制御することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、少なくとも一つのファイバの少なくとも二つの部位の少なくとも一つを制御する装置に関するものであり、具体的には、複数のチャネルを含むことができる装置に関する。
【背景技術】
【0002】
(関連出願の相互参照)
【0003】
本出願は、2006年2月1日出願の米国特許出願第60/764,622号、および2006年6月1日出願の米国特許出願第60/810,868号、に基づき優先度の利益を主張するものであり、これらの全ての開示内容を本明細書の一部として援用する。
(連邦政府により支援された研究に関する声明)
【0004】
本発明は、DAMD(米国陸軍省共同協定)により米国政府助成契約第17−02−2−0006号として支援を受けた。それ故、米国連邦政府は本発明に一定の権利を有するものである。
【発明の概要】
【発明が解決しようとする課題】
【0005】
病変組織のアブレーション即ち熱破壊のためにレーザを使用することは周知であり、しばしば、付随的な損傷を最小限にとどめながら正確な局所効果が期待できるという主な理由から、その使用が推奨されている。しかしながら、実際にはレーザ治療は特定の臨床応用、例えば初期上皮癌やその前駆体の治療には完璧とは言い難いものであった。これらの用途におけるレーザ治療の問題点の一つは、治療深度を正確に制御して誘導することができないことであり、その結果、不完全な治療による病気の再発或いは過剰な治療による合併症の発症をもたらした。
【0006】
上皮癌:診断と治療
罹患率と転移に伴う死亡率を劇的に減少させる可能性があるとして、初期癌の特定および治療方法と技術が広く探求されてきた。上皮癌と前駆病変はしばしば巣状をなし、広い範囲に渡り不均一に分布することがある、高感度診断が特に要求される。診断は、10億個以上にも及びうる細胞で構成されたフィールドにおいて単一細胞大のスケールで行なう必要がある。
【0007】
上皮癌はまた治療にも課題を突きつけるものである。これらの癌は面上に形成されるため、上皮性病変への接近手段には屡侵襲が最軽微なカテーテルまたは内視鏡が用いられる。しかしながら、治療上の課題は下層或いは周囲の組織に損傷を与えることなく総合的にその全病巣を殺し、切除し或いは焼灼させることにある。病変の深度並びに正常な上皮組織層の厚みまでも大幅に変化しうるため、これは特に大きな課題である。さらに、上皮組織は非常に柔軟であり、治療器具により著しく圧迫される可能性がある。この結果、一定の深度の組織に影響を与えるように設計した治療法は、再発を齎す過少治療か或いは著しい合併症を誘発する過剰治療の危険性を伴っている。
バレット食道
【0008】
下記の文献1に記載されているように、バレット食道(BE)は、主にこの病気の流行、罹病率の急増、および高度異形性とバレット腺癌などが陰惨な予後が予想されることから重要である。(下記の文献2および3に記載されているように)、最新の有力説によれば、逆流阻止治療に加えて管理された方法でBEを広範囲に破壊すれば、鱗状再生を齎す。また連続的な逆流管理はBEの再発を防止する。課題は、食道壁の下層組織を残して病変粘膜を広範囲に除去することにある。不完全な治療は、下層病変を遮蔽する鱗状過剰再生を齎すものである。過剰な積極的治療は、食道壁の狭窄または穿孔を齎すことがある。以下は、BEのスクリーニングおよび治療に関わる情報である。
【0009】
BEの管理において食道スクリーニングのためのアプローチがいくつか研究されている。ブラシ細胞診(下記の文献4と5に記載)および(下記文献6および7に記載)17p(p53)遺伝子の欠失および/または突然変異のような生物学的マーカの使用は内視鏡検査とは無関係に行なうことができるが、病気の空間マッピングを得ることはできない。高倍率ビデオ内視鏡検査法(文献8に記載)、蛍光分光法(文献9に記載)および光散乱分光法(文献10に記載)はそれぞれポイント診断を約束するものであるが、表面下微細構造に関する情報提供は不十分であり、また、広視野スクリーニングに対しては動作確認がされていない。高分解能内視鏡超音波検査法および色素内視鏡検査法(それぞれ下記文献11および12に記載)は両方とも広範囲に適用できるが、低感度および選択度に難点がある。
【0010】
光コヒーレンストモグラフィー(OCT)のシステム、方法および技術(下記文献13および14に記載)が開発されている。2004年9月8日出願の国際特許出願PCT/US2004/029148、2004年7月9日出願の米国特許出願NS.10/501,276、及び下記文献15−17に記載の、腸上皮化生、異形成および腺癌に特化した信頼できる正確なOCT診断基準が開発されている。下記文献18−20に記載のように、例えばOCT技術の進歩により、(時間領域と反対の)波長領域のOCT信号の収集によって優れた画像品質を保持しながら撮像速度を桁違いに改善できることが実証されている。このような代表的な第2世代の撮像技術の一つとして、例えば、2005年11月2日出願の米国特許出願NS.11/266、779、および下記文献21に記載されているように、光周波数領域撮像(OFDI)が開発されている。OFDIの方法、技術およびシステムを用いて、光源波長を変化させながら組織サンプルと参照光との間の干渉をスペクトル分解して検出することにより、組織内における高分解能照準を行なうことができる(例えば、下記文献22を参照)。下記文献23に記載のように、現在、OFDIの方法、技術およびシステムでは、(例えば10μm)3ボクセルを略毎秒4000万のレートで捕捉することができ、近い将来撮像速度はこの2倍以上になる見通しである。さらに、下記文献24に記載されているように、撮像フローには位相感知OFDIの方法、技術およびシステムが用いられている。
管理可能な治療
【0011】
(異形成がある場合およびない場合の)SIMの治療に対して、光動力学療法(PDT)(下記文献25に記載)、レーザ治療法(532nmおよび1064nm)(下記文献26に記載)、多極型電気凝固法(下記文献27に記載)、アルゴンプラズマ凝固法(下記文献28に記載)、内視鏡粘膜切除法(下記文献29に記載)、高周波アブレーション法(下記文献30に記載)および液体窒素を用いた冷凍アブレーション法(下記文献31に記載)を含む内腔治療法の評価が行なわれてきた。これらの技術は各々成功しているように見えるが、ほとんどの研究では狭窄或いは穿孔に至る持続性のSIM或いは過深度アブレーションに帰結する可能性のある非一様な治療法であることが論じられている。100名を超す患者の調査によれば、PDT(光動力学療法)の単一治療に対する狭窄率は30%であり、複数治療では50%となりうる(下記文献32に記載)。過誤に対する代表的な原因は完全には解明されていないが、これらの装置が手持ち、手動照準用であることによる操作者に依存する特性、治療を必要とする表面面積が広い、および治療のために施術者が決定する可視エンドポイントに固有の選択等が原因として関与している可能性がある(下記文献3と30とに記載)。さらに、患者内部並びに患者間で粘膜層の厚さに大きなバラツキが存在することがあり、食道の軟組織が顕著に圧縮されていることも直接観察されている。しかしながら、従前の測定法は層の厚さ或いは食道壁の圧縮率を考慮したものではない。
【0012】
従って、上述の欠陥を克服する必要がある。
【課題を解決するための手段】
【0013】
上述の問題および/または欠陥、さらにその他の欠陥に対処する、および/または克服するため、コンフォーマルレーザ治療手順を用いてサンプルの少なくとも一部分の情報をモニタし、電磁放射を放射し、サンプルの少なくとも一つの特徴に関する情報を取得する、代表的な実施の形態の方法及びシステムを提供することができる。
【0014】
上述の欠陥は、本発明の代表的な実施の形態を用いて対処できる。本発明の代表的な一実施の形態では、サンプルの少なくとも一部分に関する情報を取得する方法及びシステムを提供する。例えば、サンプルの一部分に温度変化を引き起こすことができる。少なくとも一つの電磁放射を前記サンプルの部分の近傍または内部の部位に送出することができる。複数の深度における前記部位の変形を、(i)前記部位からもたらされる少なくとも一つの第2の電磁放射の位相、及び/又は(ii)前記第2の電磁放射の前記位相及び/又は振幅の変化のレート、の関数として特定することができる。
【0015】
前記第2の電磁放射に関する干渉信号を生成し、前記干渉信号を用いて、前記第2の電磁放射の前記位相を決定することができる。前記干渉信号は、前記第2の電磁放射の波長の関数として測定できる。前記第1の電磁放射は、時間とともに変化する波長を有することができる。前記温度変化は、レーザ構成部を用いて引き起してもよい。前記サンプルの少なくとも一つの変化した部分と変化しない部分との間の境界を前記変形に関する情報の関数として画定することができる。前記サンプルは生物構造体でもよく、前記変化した部分は変性した部分、損傷した部分、及び/又は、破壊された部分であってもよい。さらに、前記少なくとも一つの第2の電磁放射に関する干渉信号を生成することができ、前記干渉信号を用いて、前記第2の電磁放射の振幅を決定することができる。前記干渉信号は前記第2の電磁放射の波長の関数として測定することができる。
【0016】
本発明の他の代表的な実施の形態では、サンプルの温度分布を制御する方法及びシステムを提供する。例えば、前記電磁放射を前記サンプルの部位に特定の波長で照射することができる。前記電磁放射を前記部位に照射している際、前記電磁放射の前記特定の波長を変更することによって前記温度分布を制御することができる。
【0017】
特に特定の波長を変更することによって、サンプルの少なくとも一部分において損傷の分布を変化させることができる。前記温度分布はさらに、前記電磁放射の出力を変更することによって制御することができる。前記特定の波長は、(1)略1.35μmから1.5μm、及び/又は(ii)略1.7μmから2.2μmの範囲で変更することができる。前記温度分布はほぼ、水による前記電磁放射の吸収によるものであってもよい。前記電磁放射は、ツリウムレーザ増幅器構成部、及び/又は、エルビウムレーザ増幅器によって提供することができる。前記特定の波長を変更するレート(rate:速度)は、略毎秒10nmより多くすることができる。前記特定の波長は、非無作為に変更してもよい。
【0018】
本発明のさらに他の代表的な実施の形態では、複数のチャネルは各々、複数の電磁放射の少なくとも一つの特定の放射を、サンプルの解剖学的構造体の内部にあるサンプルに送出することを容易にし、複数の電磁放射は、サンプルの異なる領域に送出される。複数の領域の各々の中心は、ほぼ直線の上に位置してもよい。直線は、複数の放射の走査方向に対して略平行であってもよい。
【0019】
本発明のこれらの目的、特徴及び利点、又はその他の目的、特徴及び利点は、添付の特許請求の範囲とともに、本発明の実施の形態の詳細な説明を読むことにより明らかになる。
【0020】
本発明のさらなる目的、特徴、利点は、本発明の実施の形態を例示的に示す添付の図面を参照して以下の詳細な説明から明らかになる。図面を通して、例示の実施の形態の同様の機能、構成要素、部品などには、特に明記しない限り、同様の番号と記号を付している。さらに、本発明を図面を参照して以下、例示の実施の形態に関連して詳細に説明する。記載の実施の形態は、添付の特許請求の範囲に画定される本発明の範囲と趣旨を逸脱せずに改変及び修正可能である。
【発明を実施するための形態】
【0021】
治療を制御し局所化する本発明の代表的な実施の形態のシステムおよび方法は、従来の空間走査レーザビームにより伝達される熱励起をベースにすることができる。例えば、下記文献33に記載されているように、組織に吸収されたレーザエネルギーは、光化学プロセスあるいは相転移プロセスを経ることなく、実質的にあるいは完全に熱に変換されて温度を上昇させることができる。下記文献34に記載されているように、曝露時間が約10msを超える場合、温度が60−70度を超すと一般に時間とは無関係にタンパク質の非可逆変性および細胞死が起こりうる。エネルギーは吸収されると熱拡散により空間的に再分配される。下記文献35には、1983年に、加熱体積の特性熱拡散時間より短時間のレーザ曝露を用いると空間的に制限されたマイクロサージェリー効果(選択的光熱分解)が齎されるという代表的なコンセプトが記載されている。相対的に大きなレーザビーム径(>1mm)および1450nm近傍のレーザ波長に対して、生物組織に対するこの特性熱拡散時間は1秒のオーダーでよい。文献33および34に記載されているように、これらの条件下では温度上昇はレーザの出力密度Pd、吸収係数μaおよび曝露期間tにより以下のように決定される:
【数1】

ここでρは組織密度、cは熱容量及びrは1/e2半径のWのガウスレーザビームの中心からの半径方向距離を表す。この近似では、レーザ光が組織へ伝播する際の散乱を無視しているが、散乱を明示的に含むモデルは、(1)式からの偏差が上述の条件下で10%未満である(下記文献36に記載)。
【0022】
上述の吸収係数は波長に依存するため、(1)式はレーザパラメータPa、tおよび波長を用いて熱傷深度を制御し、下層組織の付随的な損傷を最小化できることを示している。吸収は、組織と病変の状態により密度が大きく変化する、広範囲の発色団により律則されるため、スペクトルの可視部における動作が課題となっている。これと比べて、生体組織の1.45μm近傍の吸収スペクトルは水により大きく律則されるため、組織範囲にわたり略一定である。さらに、例えば波長を1375nm〜1430nmの小幅な範囲で変化させることにより、吸収長を2mm〜300μmの範囲で選択することができる。この代表的な範囲は、上皮性病変の特性深度とよく整合している。
代表的なモニタリング
【0023】
レーザ治療のモニタリングに対して幾つかの試みがなされてきた。これらには、アブレーション時に発生する過渡音の解析(下記文献37に記載)、組織の反射率の変化の解析(下記文献38と39に記載)、プラークと血管壁とを識別すための蛍光分光分析(下記文献40に記載)、骨と神経組織を識別するためのプラズマ分光分析(下記文献41に記載)、および緑内障手術における制御された強膜穿孔のためのレーザ光プローブ先端のキャビテーション気泡力学の解析(文献42に記載)が含まれる。文献38および39に記載の反射率に基づいた手順を除くと、これらのそれぞれの方法では、モニタリング信号は熱傷ゾーンが特定の組織種別の境界を越えて遷移した時にはじめて発生している。熱傷深度、即ち損傷組織の隣接する生組織との空間的関連を決定する手段はなにも存在しない。ある程度の空間分解能は、組織に吸収されないレーザ光の一部をモニタすることにより達成されている。針を用いて光ファイバを挿入することにより、被加熱体を取り囲む異なる視点からこの光を集めることができ、また温度依存性散乱の変化を測定することができる(下記文献43に記載)。また、アブレーションレーザ照射により生じる組織の物理的除去及び散乱変化の可視化のために、さらに直接的な手法である高分解能、原位置撮像が実演されている(下記文献44に記載)。
【0024】
本発明の代表的な実施の形態のモニタリングシステム、方法および技術は、熱傷に対する既知の組織応答に関する情報を活用してもよい。これらの代表的な応答は、以下に限定されるものではないが、レーザ加熱により発生し、45℃以上の温度範囲で観察できる微視的変形(下記文献33に記載)、散乱の変化(下記文献36,38および45に記載)、複屈折の変化(下記文献46に記載)、および血流の変化(文献47に記載)などが含まれる。本発明の代表的な実施の形態の方法および技術の代表的な態様では、これらの熱応答は高空間分解能を用いて検出することが可能であり、また微視的組織構造に沿った断面画像フォーマットで表現することができる。
代表的なコンフォーマルレーザ治療法
【0025】
本発明の代表的な実施の形態によると、スクリーニングおよび正確に誘導したレーザ治療を実行可能なシステム、装置および方法を提供できる。総合的なスクリーニングと総合的な治療に好適な特性長さスケールは明らかであるため、これらの目的を別々に実行することができる。一例として、(例えば第1のステップとして実行する可能性のある)スクリーニングには、細胞サイズのスケールの分解能をもつ総合的な撮像技術を利用してもよい。この代表的な手順は、続く治療のための領域を特定するために用いることができる。このスクリーニング手順の後、内視鏡プローブをこうして特定した領域に再び導き、全ての病気を治療しながらも付随的な損傷を最小化するようにリアルタイムに誘導してもよい。この結果、例えば合併症の危険を低減させながら治療の有効性を増進させることにより、バレット食道患者の管理を改善することができる。
【0026】
以上は上皮癌の治療について説明したが、本発明の代表的な実施の形態のシステム、技術および方法は、これに限定するものではないが、例えば、皮膚科学の用途を含む如何なるレーザ治療法にも適用可能である。本発明の代表的な実施の形態が対処しうる上皮癌および前癌病変は、これらに限るものではないが、喉頭癌、頚部癌、卵巣癌、膀胱癌、口腔癌および肺癌を含むことができる。さらに、本発明の代表的な実施の形態は、光力学療法、高周波アブレーションおよび低温治療のモニタリングの分野に適用して、治療を深度と空間的範囲にわたり制御を行うことができる。
代表的な広視野スクリーニング
【0027】
効果的なスクリーニング手順を達成するためには、広い表面領域を総合的に検査し、厳密な診断基準を適用して、特定の病変領域を同定することが好ましい。下記の文献15−17に記載されているように、腸上皮化生、異形成および腺癌に特化した様々なOCT用診断基準が開発され動作確認がなされている。例えば、下記の文献16に記載のように、121名の患者から採取した288検体で、SIMを診断するための感度と選択性は(他の全ての上部消化管組織に対して)、それぞれ97%と92%であった。しかしながら、最近まで、代表的なOCT技術は広い粘膜表面の範囲を撮像するためには遅すぎるものであった。以下に考察するように、(現在は)これらの技術はこの時間問題を解決し、生体における総合的食道撮像の予備的実演が行なえるまでに進歩している。
光周波数領域撮像(OFDI)
【0028】
上述したように、文献21には、OCT技術の代用としてのOFDI技術の開発が記載されている。(下記文献22と23で考察している)OFDIの光源および検出原理は有用なものであるが、コントラスト、分解能および断面画像の表示はOCTのそれと略同等或いは類似である。OFDIの利点の一つは、OFDIはより高い検出感度を有するため、これにより画像品質を犠牲にすることなく、画像収集速度を大幅に高速化できる。下記文献24に記載されているように、これらの予備的研究に用いたシステムは内視鏡撮像用に特別に設計したものであって、収集速度は毎秒10,000depth−走査(A−ライン)、組織の軸方向分解能は8μm、およびレンジング深度3.5mmである。この代表的なシステムの撮像速度は、データをコンピュータのバスを経由して伝送し、ハードドライブに記憶する速度のみに制限される。
代表的なバルーンカテーテル
【0029】
総合的な食道撮像用に、図1Aおよび1Bに示すバルーン被覆を用いた食道管腔内でセンタリングを行なうことができる、本発明の代表的な実施の形態のOFDIカテーテルを提供することができる。この代表的なカテーテルは回転可能であり、また光ファイバの内部コア2010をプルバックすることができるプローブスキャナ2000を含んでもよい。この内部コア2010は、透明被覆2020内に包囲することができる。バルーン2040は、このカテーテルの遠端にあり、膨張すると撮像光学系のセンタリングを行なうようにしてもよい。撮像用ビーム2030は食道表面2050上に集光することができる。この撮像用ビーム2030を走査して、総合的な撮像を行なうようにしてもよい。バルーン2040は膨張時の径が1.8cmであり、また、再配置を行なうことなく長さ4.5cmにわたり長手方向に撮像を行なうことができる。カテーテルの光コア2010は、光ファイバ、光ビームを拡大するためのスペーサ、集光のための屈折率分布型レンズ、およびカテーテルの長軸に対して垂直にビームを導く直角プリズムを含むことができる。小型円筒型レンズは自社製であってプリズムの裏面に配置した。このレンズはプラスチック製被覆により生じる非点収差を補償するものであって、組織表面上に回析限界ビーム(直径30μm)を生成した。使用に際しては、この代表的なカテーテルを毎秒約4回転の速度で回転し、円形断面当り2500の軸方向走査を収集できる。この代表的なOFDIシステムはエンコーダ信号を記録して、カテーテルの回転およびプルバックを正確に追跡することができる。この情報は、3次元データセットを再構築する場合に用いられる。
豚の食道の予備撮像
【0030】
2匹の50kgの豚に食道撮像技術を実施した。20GBの全データセットを個別に図面に表示しないが、情報の内容を図2A−2Cに示す。例えば、図2Aの斜視図において、画像2100は撮像した食道全体の3Dレンダリングを表している。図2Bの正面図において、画像2110は、撮像した食道の一つの横断面図である。図2Cにおいて、画像2120は、この食道の少なくとも一部分の拡大断面の画像を表す。分解能10μmx20μmx30μm(r、θ、z)のサンプリングにより、マッピングおよび方向付け用に立体的に表現した図2Aの用画像2100、或いは図2Bの画像2110として食道壁全体を可視化した高分解能断面図を表示可能な、総合的な微視データセットを生成できる。図2Cの画像2120の拡大図は、粘膜層の構造を描写している。
人体食道の予備撮像
【0031】
代表的な単一回転画像2150を図3に示す。そこには、患者のSIMの顕著な特徴(不規則な表面を有する無秩序な上皮構造;大きな上皮線の存在)が見られる。この患者は以前にBEと診断されており、PDTに先立って撮像を行った。
【0032】
これらの予備的研究により、a)生体の総合的なOFDI微視的な撮像が可能であること、b)食道壁全体の構造が可視化可能であること、およびc)バルーンセンタリングプローブを用いて被検者のSIM診断に重要な特徴を検出できることが実証できた。
レーザ熱傷のモニタリング
【0033】
加熱に応答して、組織のタンパク質およびコラーゲンが変性して微視的変形が生じ(下記文献33に記載)、散乱が増加し(下記文献36,38および45に記載)、複屈折が減少し(下記文献46に記載)、かつ血流が減少する(下記文献47に記載)。以下に、本発明の代表的な実施の形態による代表的なOFDIを用いた、これらの変化をモニタリングする方法を説明する。各々の代表的な実証において、新鮮な豚の食道サンプルおよび十二指腸サンプル(SIMの代用品として)を、顕微鏡用カバーガラスが上皮表面の上となるようにマウントして、バルーンカテーテルのおおよその圧力と熱伝導率とをシミュレートできるようにした。
【0034】
図4に、レーザ照射時にOFDI信号を収集する本発明の代表的な実施の形態の装置およびその使用例を示す。例えば、治療用光2200はコリメータを介して送出する。撮像用光2220は第2のコリメータを介して送出する。この治療用ビーム2200と撮像用ビーム2230とは、バッキング2280上に配置され、薄いガラスカバースリップ2260で覆われた組織2270に重なって到達する。この組織は、モータ駆動の併進ステージ2290により併進移動する。撮像用ビームはレンズ2250により焦点を結ぶ。ビームの重なりを示す上面図2250が示されている。熱励起には、コリメート高出力ガウスレーザビーム(例えば径=1.1mm;波長1450nm;出力400mW)を用いることができる。図4に示すように、このOFDIサンプリングビームは、例えば

強度直径23μmで、組織表面に焦点を結び、レーザスポットに重なるように位置合わせされる。データ収集の間、このサンプルは固定位置に保持され、かつ/またはモータ駆動のステージを用いて併進移動するようにしてもよい。
代表的な微視的変形
【0035】
組織にレーザエネルギーが蓄積されるにつれて生じる温度上昇はタンパク質およびコラーゲンを変性させる。これらの変化は、位相検出OFDIを用いて測定可能な微視的変形として現れることができる。以下のデータはこの可能性を実証するものである。
【0036】
固定スポット―この代表的実験では、サンプルを固定位置に保持した。1450nmレーザをスイッチオンにして、所定の時間400mWの一定出力を保持している間、約10kHzの速度で連続的にOFDI深度走査を取得し、次いでスイッチがオフした。3つの異なるレーザ曝露時間に対する代表的なデータを図5のグラフに「Mモード」画像として示す。これらの図で垂直軸2300a、2300b、2300cは組織内の深度を表し、水平軸2310a、2310b、2310cは時間を表し、また、測定した位相シフトの大きさをカラー参照テーブル2320(赤色=正位相シフト、青色=負位相シフト)を用いて表す。各位相シフト画像の上部の赤色水平ライン2330a、2330b、2330cは、レーザがオンとなった区間を表している。初期レーザ曝露において、負位相シフトの下方領域を覆う正位相シフトの表面領域が観測された。レーザ照射を続けるに従って、正から負へ遷移する位相の深度は漸次深くなり、また位相シフトの重なりの大きさが減少した。レーザがオフとなった後では測定可能な位相シフトは検出されなかった。タンパク質変性は、局所的な微細構造の変化と干渉信号中の位相シフトとして検出される局所的変形という病巣を引き起こす。レーザ曝露を続けるに従い、アクティブな変性ゾーンは伝播して深度を深め、下部組織は完全に変性する。位相シフトの方向が反転する深度に応じて、アクティブな変性の焦点中心が特定される。
【0037】
これらの結果を実証するために、レーザ曝露の後に組織切片を取得し、ニトロブルーテトラゾリウム塩化物(NBTC)染色剤を用いてレーザ損傷の広がりを評価した。易熱性酵素である乳酸脱水素酵素(LDH)に対するNBTC染色が陽性であればLDHの活性喪失が熱性細胞損傷に対して急速に現れ、細胞致死率との相関が示される(下記文献48および49に記載)。それ故、レーザ損傷深度として非染色組織と染色組織との境界の深度を選択した。対応する位相シフトデータおよび組織像を2340a、2340b、2340cに示す。事前の知見によれば、熱変性組織と生組織との境界は、OFDIを用いて測定した位相シフトの変曲点と一致する。定量的には、位相シフトの深度導関数をそれぞれのAラインに対して決定し、損傷深度をこの導関数の負の最大値のポイントとして定義した。このようにして決定した深度を、図5に各Mモードに隣接する垂直ラインとして示した。組織形態計測と良好に一致していることがわかる。
【0038】
併進スポット―広い上皮表面領域のレーザ治療は、治療用レーザビームとOFDIビームとが同時に走査されるように治療用レーザビームを既存のOFDIカテーテルに加えることにより容易に行なうことができる。事前の撮像研究では、サイズが30μmのOFDIビームを用いて総合的な食道撮像を行なった。連続して回転走査する際に径が1mmを超えるレーザビームを正確に位置合わせすることができなくてはならない。走査中にモニタリングのシミュレーションを行なうため、コンピュータ制御併進ステージ2290(図4参照)を制御して、サンプル速度を、それぞれスイッチを切り替えることにより1.8mm/秒から0.9mm/秒までとできるようにした。
【0039】
レーザ照射を行なわないで得られたOFDI強度画像2400を図6Aに示す。それぞれ図6B、6Cおよび6Dに示す画像2410,2420および2430では、1450nmレーザ出力は約400mWであった。曝露期間におけるサンプルの併進により、サンプル表面を横断するレーザ損傷のラインが生じた。熱エネルギーの蓄積は曝露時間に比例するため(式1参照)、レーザ損傷深度はこのラインに沿い、併進速度に逆数として変化する。高速併進と低速併進の領域で、このラインに直交する向きで得た組織切片は、レーザ損傷深度がそれぞれ0.41mmおよび0.69mmであることを示した。図6Bの画像2410に相当する位相シフトデータを、図6Cに画像2420として示す。組織形態計測とほぼ一致しているため、位相シフトデータにより決定した損傷深度(最大の負の導関数)は、高速及び低速領域でそれぞれ0.40mmおよび0.67mmとすることができる。
スペックル非相関
【0040】
スペックルはコヒーレント照明を用いた撮像の際に通常観られる現象であり、微細構造とは相関がないと考えられる強弱の強度を有する粒状パターンとして現れる。組織中でスペックルは、一般にサンプル内の異なる経路を経由して伝播したフォトン間の干渉により生じる。組織内の散乱が移動している場合には、それが微視的なスケールであっても、スペックルのパターンの急激な変動として現れることがある。それ故、スペックルパターンの時間的な展開を測定することによって、サンプル内の微視的な動きを洞察することができる。この代表的な技術は生体組織の生体力学特性の研究(下記文献50に記載)、および熱励起の研究(下記文献51に記載)のために開発された。これらのコンセプトをOFDIを用いたレーザ組織相互作用の深度分解モニタリングへ拡張することが検討されている。
【0041】
レーザ曝露時の組織のOFDI画像を観察することによって、この代表的な技術の可能性が示される。レーザ曝露を行なわない場合、OFDIで観察されたスペックルパターンは画像の深度方向および直交方向で一定であった。レーザ照射下では、このスペックルパターンがレーザビームの局所的領域で高速で変動することが観察された。低速運動の観察では、スペックル変動が組織表面の近傍で開始し、時間とともに下部に伝播することが観察された。これらの観察結果を定量化するために、図6Bの画像2410のそれぞれの深度ポイントに対してスペックル非相関のレートを決定した。特に、OFDI強度信号の時間的自己相関関数の深度依存性幅を決定した。次いで、スペックル非相関画像を、グレースケール参照テーブルを用いて自己相関幅を表示して生成された。図6Dの画像2430は、それぞれ図6Bおよび図6Cの画像2410、2420に対応するスペックル非相関画像である。非相関2431レート(図6Dの矢印で指示された黒い帯)のピーク深度は、サンプルの併進速度と組織像に示されたレーザ損傷深度とに連動して変化することを観察できる。食道と十二指腸のサンプル両方から得られたこの調査結果の一貫性は、ピーク非相関レートの深度がレーザ損傷の深度を決定するための定量化可能な測定基準となりうることを確認できる。
複屈折
【0042】
屈折率が非等方性の場合、光を物質中を伝播する際に偏光状態が変化しうる。この効果を複屈折という。多くの組織、特に筋肉とコラーゲンは強い複屈折を示すがこれらは加熱および変性により失われる(文献46に記載)。複屈折損失の測定により熱傷深度を定量化する偏光検出OCT(PS−OCT)技術、方法およびシステムが開示されている(以下の文献52、53参照)。PS−OCTでは、2つの検出器チャネルをサンプルから戻ってきた直交偏光状態の光を受光するように構成できる。複屈折サンプルは偏光状態に深度依存回転を誘発し、各チャネルで検出されたサンプル光の割合に変化をもたらす。2つのチャネルの比を断面画像にグレースケールで表示すると、複屈折が特徴的な横縞模様として観測される。
【0043】
例えば、図27に示すように、図4の装置は改変して、サンプルが静止して支持し、かつ1450nmレーザスポットを中心に固定した状態で、OFDIビームが組織の表面を繰り返し横断して走査するように、検流計式スキャナを具備することができる。図27に示すように、治療用光は、治療用ビーム2510が、バッキング2560の上に配置され、カバースリップ2540で覆われた組織2550に入射するように設けた第1のコリメータ2500を介して送出される。撮像用光は、撮像用ビーム2580を生成する第2のコリメータ2570により供給され、ガルボミラー2520により導かれてレンズ2530を経由する。この装置/システムは、皮膚科学における用途に適用可能な代表的な実施の形態の治療モニタリングシステムとなりうる。レーザ照射時に食道および十二指腸組織のOFDI画像、即ち映像を収集した。
【0044】
図7A−7Dはその代表的なデータを表す。レーザ照射前に収集されたフレームでは、強度画像2450(図7A参照)で層状食道構造を観察することができ、また、対応する偏光画像2470には特徴的な複屈折横縞が観察される(図7C参照)。レーザ曝露中に収集されたフレームでは、1.1mmレーザスポット2460内で上皮散乱強度が劇的に増加し(図7B参照)、対応する偏光画像2480では複屈折横縞が消失している(図7D参照)。低速の偏光運動画像を精査すると、複屈折が減少するゾーンが表面の近傍で始まり下部方向へ伝播することが観察できる。これらの観察結果は概ね変性組織の下部方向伝播ゾーンと一致する。複屈折のパーセント損失の計量により、レーザ熱損傷のモニタリングの定量的測定基準が得られる。
散乱
【0045】
熱的に誘発された組織の微視的構造の変化は、光の散乱を変化させる。OFDIにおける信号は散乱によって生じるものであって、小さな変化を広いダイナミックレンジにわたり検出できるため、組織に熱誘発された変化をモニタするために散乱の測定を利用した。図7Bの画像2460において観測された散乱の変化は、十二指腸および食道の両サンプルにおける事前測定を表す。あるケースでは、上皮内部の散乱の顕著な変化および粘膜筋層および筋固有層の下部組織における相対的に小さな変化が認められた。例えば、レーザ損傷用の定量的測定基準として可能性のある2組を散乱の測定結果から得ることができた。深度分解散乱強度の変化および深度積分散乱強度の変化である。
血流
【0046】
レーザ治療は血管および毛細血管を変化させて血流を減少させる(下記文献54に記載)。食道粘膜は非常に血管に富んでいるため、血流の変化をモニタリングすることによってレーザ治療をモニタリングするためのさらなる方法を提供することができる。豚を用いた最近の研究で収集した図8の画像2490は、豚の食道の血管を表す。この代表的な画像2490は、管状の画像データを開いて、あたかも食道が長手方向に開放されており平坦にピン止めされているかのように表示したものである。強度データは組織の内部へ深度方向に積分したものである。この種類の大規模な可視化は血管を描くには便利な方法であるが、血流の測定にはさらに高感度で定量的な方法/技術/システムを用いることが可能である。組織内の血流を可視化し定量化するためのドップラーOCTが動作確認されており(下記の文献55および56に記載)、レーザ治療後の血流を評価するための装置として研究されている(下記文献57に記載)。OFDIを用いたドップラー測定が報告されており、生体内での構造と血流を同時に測定する可能性が研究されている(下記文献24に記載)。
【0047】
図9の代表的な画像2590の断面図を生きた豚の食道で取得し、強度をグレースケールで、またドップラー信号をこれに重畳してカラーで表示している。表示を簡単にするため、このデータの座標(r、θ)をデカルト座標(垂直、水平)に写像している。この結果は、2匹の豚の複数部位における我々の観測結果を表している。さらに、ドップラー画像の時系列において、我々は拍動流を明確に測定した。
【0048】
【表1】

【0049】
予備的研究によると、提案した測定法は相補的である。:また、位相シフトおよびスペックル非相関はレーザ照射中にのみ使用できるのであるが、さらに高感度かつ高空間分解能を提供しうるものである。複屈折、散乱および血流の変化は持続的であり、レーザ治療後のフォローアップ撮像に適用可能である。
代表的な制御方法
【0050】
効果的なコンフォーマルレーザ治療には、レーザ熱傷のモニタリングに加えて、治療された組織の体積にわたり正確な制御を行ってもよい。治療深度を制御するための一つの代表的アプローチは、付随的な損傷を最小限に止めかつレーザ波長、出力および曝露時間を操作して熱傷深度を制御するために、熱閉鎖した条件の範囲で操作を行なうものである。(食道面に沿った)左右面では、熱傷はラスター走査、空間平行化ビームの使用により制御が可能である。辺縁部を明確に画定した直径が1.3mmの平頂ビームは、ラスター操作により広い上皮範囲の治療を可能とするとともに空間制御を可能とする。代表的なレーザ制御パラメータを以下に式1を用いて説明する。式1の温度分布は、通常弱散乱の範囲でのみ適用されるものである。
波長
【0051】
式1の温度分布から、μaは明らかにレーザ損傷の深さ方向の制御の最適なパラメータでありうる。μaは、外部から制御可能な代表的なパラメータというよりもサンプルの特性を表すが、本発明において我々は深度制御を達成するためにμaの波長依存性を利用した。本発明では、水吸収域にあるさらに長い波長の吸収係数を目標とした。上皮組織において含水比は略一定であるので、レーザ波長を少し変化させることにより熱傷深度を厳密に制御することができる。1.45μm近くの水吸収帯の近傍で、吸収波長は狭いスペクトル幅(1375nmから1430nm)を持ち0.3mmから2mm以上まで変化する(図10のグラフ2595参照)。これらの波長は、上皮疾病の治療に適した特徴波長スケールとよく合致する。水吸収帯1450nm近辺で動作可能な波長可変型レーザを使用して、波長を変化させることによって、治療を制御することができる。
出力及び暴露時間
【0052】
式1を精査すると、吸収係数は、例えば、振幅の制御など、温度分布の指数的深度破壊の制御以上の制御を行なうものであることがわかる。振幅項もまたエネルギー密度と曝露時間に依存するため、これらの変数は吸収係数の変化があっても振幅の正規化に用いることができる。
手順時間
【0053】
新たに提案する治療法の評価では、好適な手順時間を推定し、この推定値を競合する手法、および医療環境と患者の容認に固有の制約と合わせて評価することが重要であろう。PDTは現在内視鏡検査環境でBEの治療に用いられており、20分台の手順時間を要する。
代表的なコンフォーマルレーザ治療技術では、手順遂行時間は2At/(π r v)で見積もってもよい。ここにAtは治療面積、rはレーザスポット半径、およびvはレーザスポット走査速度である。食道治療長60mmに対して食道直径は20mmであった。
【0054】
本発明の代表的な実施の形態によれば、レーザ励起制御が可能な複合システムを提供することができる。一つの代表的な実施の形態では、この代表的なシステムは、周辺組織への付随的な損傷を最小限にして上皮性病変を総合的に治療できるコンフォーマルレーザ治療のために、内視鏡検査で用いることができる。
代表的なシステムの設計
【0055】
本発明の代表的な実施の形態によれば、モニタリングと制御とを結合して上皮疾病のコンフォーマルレーザ治療を行なうためのシステムを提供することができる。レーザビームは容易に形成して空間的に走査できるため、また(食道表面に沿った)横断面の辺縁部はそれほど重要ではないため、精密なレーザ治療の制御を達成するための第1の課題は、レーザ損傷深度を制限しかつ調整することである。上述のモデル化と分析に基づけば、レーザ波長と出力および走査速度を利用して、横方向の損傷範囲を大きく変えることなく医療上重要な領域にわたりレーザ損傷深度を変化させることが可能である。
代表的な治療用レーザ装置
【0056】
おおよそ1375nmから1430nmの範囲のレーザ波長の吸収長は2mm超から0.3mm未満の範囲にある。半導体レーザはこのスペクトル領域で動作することができる。このようなレーザはコンパクトでありかつ使用環境に対して安定しているため、医療用として効果的に使用される。しかしながら、この特定波長領域に好適な物質は、標準的なものではない。本発明の代表的な実施の形態の方法の初期試験フェーズに用いるより安価な代替品は、固体レーザ物質、四価クロムドープYAG (Cr4+:YAG) を用いて提供できる。例えば、この物質は1340nm−1570nmのスペクトル領域で波長を変化することができる(下記文献58および59に記載)。近赤外線スペクトル領域で動作する波長可変型固体レーザの代表的な設計および構造は、下記の文献60−65に記載されている。レーザ共振器の外部の電気機械式シャッターを用いて、この代表的レーザをオン/オフすることができる。
代表的な卓上型システム
【0057】
図4及び図27のシステムに類似した本発明の代表的な実施の形態の卓上型光学システムについて説明する。例えば、OFDIサンプリングビームは〜25μmまでの径でサンプル上に集光してもよい。焦点の軸位置は標準的なz−走査技術を用いて決定することができ、OFDI断面画像中に登録してもよい。続いて、OFDI画像ウインドウ内でサンプルの軸位置を決定することによって、全サンプルに対する焦点位置を確実に固定するようにしてもよい。データは、相互に固定した2つのビームを用いて、サンプルをレーザビーム軸に垂直に併進移動させながら収集してもよい。
レーザおよびOFDIビームの代表的な位置決めおよび登録方法
【0058】
本発明の代表的な実施の形態によれば、OFDIビームとレーザスポットの中心との間のオフセットはモニタリングに重要な意味を持たない。OFDIデータを様々なオフセットに対して収集し(図4に描かれているように)、熱傷の最大深度を示すオフセットを決定するようにしてもよい。次いで、このオフセットを後続の全ての研究段階で用い、また以下のように登録してもよい。サンプルを固定している(併進移動を行なわない)間、サンプルの表面に、小さな、低出力、短時間上皮熱傷を誘発してもよい。図7に示すように、上皮散乱の増加はOFDIで容易に観測でき、レーザビームのプロファイルに従って空間的に局所化される。図4には描かれていないが、OFDIビームは2次元走査を行なう2個の検流計により集束レンズへ中継することができる。この検流計を用いて、サンプルのOFDI正面画像を生成してもよい。上皮熱傷は増大した散乱の円として出現する。次いで、(図4に図式的に示されているように)この検流計の位置決めをして固定することによって、OFDIビームを所要のオフセットで位置あわせすることができる。
代表的な波長スケーリング
【0059】
この実験の一つの目的は、レーザ損傷深度の医療に関連する変動を実現するための、本発明の代表的な波長変動と出力の正規化の技術並びに方法を試験することにある。レーザ波長は、スポットサイズと走査速度を一定に保ちながら約1375nmから1405nmまで2nmステップで変化させてもよい。それぞれの波長に対して、式1における積

(Pd μa)を一定に保持されるようにレーザ出力が調節してもよい。これは、損傷深度が約0.25から1.5mmの範囲で幅が一定の線となる。
代表的な走査速度スケーリング
【0060】
治療深度に影響を与える本発明の代表的な一実施の形態は、走査速度のスケーリングを含んでもよい。例えば、治療用ビーム走査速度は1mm/秒から5mm/秒まで変化させることができる。走査速度が遅くなると、加熱する時間が与えられるため、加熱する組織の範囲がより深くなり、治療する部位もより深くなる。
レーザおよびOFDIビームの代表的な位置決めおよび登録
【0061】
正確な治療モニタリングを確実にするために、OFDIサンプリングビームとレーザスポットと間の空間配置を制御することができる。
代表的な内視鏡プローブの設計
【0062】
図11に示すように、本発明の代表的実施の形態の一つは、総合的な立体撮像および同時レーザ治療用の内視鏡用プローブを含むことができる。例えば、2つのビーム中継用光学系2640aと2640bを用いて、その一方が撮像用光2640bを搬送し、他の一方が治療用光2640aを搬送するようにしてもよい。これらの中継光学系は、第1の透明な被覆2600内部に収容されたハウジング2630内部に配設する。(上述したように)バルーン軸出し(centration)機構2620を用いて、光学プローブ2630と組織表面2610との距離を一定に保つようにしてもよい。レーザ光とOFDIビームとは独立の光ファイバ2641aと2641bとを通して伝達してもよい。それぞれのファイバは独自の中継光学系を有して、別々に制御可能なスポットサイズを生成してもよい。本発明の更なる代表的な実施の形態では、重複スポットを生じるように設計された中継光学系を含むことができる。光ファイバおよび遠端光学系は巻線ドライブシャフト内に収容し、かつバルーン被覆と同一のバルーンセンタリングプローブの内部に配置してもよい。
【0063】
長手方向の走査は、ドライブシャフトの近端に取り付けたコンピュータ制御の併進移動ステージを用いて行なうことができる。この代表的な装置は、われわれの以前の研究でプルバック食道撮像に用いることができる装置と同じである。図13に示す代表的な回転カプラ2900を用いた自動回転と同様に、ドライブシャフトの手動回転も可能としてもよい。本発明の代表的な一実施の形態では、内視鏡システムは広い視野にわたり病気をスクリーニングし、レーザ−組織相互のモニタリングを行ない、またレーザ治療を正確に制御する。このような実施の形態の応用例の一つは、上皮癌およびそれらの前駆体の特定と治療である。さらに進んだ代表的な実施の形態では、システムはスクリーニング、モニタリングおよび制御を直接に結びつけられるというよりも、手順とソフトウェアーモジュールを統合することができる。
【0064】
さらに他の代表的な実施の形態では、治療のプラニングを容易にするため、システムを用いて食道下部全体の高分解能、3次元マップを生成するようにしてもよい。その後、使用結果は図14に示すように3つの部位からなる「生体」断面画像を用いて表示してもよい。画像の右の部位2700は治療用レーザ照射直前の組織であり、画像の中央2730は治療ゾーンを指示するマーカ2740で示されたレーザ照射位置であり、画像の左の部位2710は治療後の組織である。3つのビームは連続的に走査されるため、画像が更新されるに連れて組織は右から左へ移動して現れるようにしてもよい。ユーザ(内視鏡操作者)は、治療を開始/停止させ、また治療深度を深めるまたは浅くするために制御サーボを走査してもよい。事前に未治療組織2700を見ながら治療済ゾーン2710を検査することにより、ユーザはレーザ治療の領域を誘導して所望の標的と一致させることができる。
【0065】
図12に、本発明の代表的な実施の形態の、センタリングバルーンを用いた撮像、モニタリングおよびレーザ治療用内視鏡プローブを示す。この代表的なプローブは回転して食道を円周方向に走査することができ、長手方向に低速で併進移動して、治療部位を画定してもよい。このプローブは、例えば、レーザ照射に先行して組織を撮像するための第1のチャネル2800c、治療のための第2のチャネル2800bおよびモニタリングのための第3のチャネル2800a、と3つ以上の光チャネルを含んでもよい。それぞれの光ファイバは独立して、バルーンを通して食道壁上に横断方向に撮像されるようにしてもよい。この結果として現れる出力ビームが、時計方向に回転すると未処置組織のサンプルを得るように撮像用ビームが処置ビームに十分に先行するように位置決めされる。モニタリングビームは、レーザスポット内に収まるように配置してもよい。3つのビームの初期の位置決めに続いて、これらの光学系をエポキシ樹脂で接着し、その配置を固定してもよい。
代表的な回転ジャンクション
【0066】
OFDIシステムにこの3チャネルカテーテルを接続することができる、本発明の代表的な実施の形態の回転カプラを図13に示す。このカプラは、2つの同心スプールで中継できるため、「時計バネ」回転ジャンクションと呼ぶ。例えば、内側スプール2900が一方向に回転するに従って、光ファイバは外側スプール2910から内側スプール2900上に巻き取られる。回転方向を反転させると、このファイバは内側スプールから巻き戻すことができる。リボン状の光ファイバを使用して、リボンの幅に合ったギャップが形成された2枚の平行プレート2920によって、巻取りが平坦に行なわれて、縺れないようにする。このプレートは反転となる前に、例えば100回転まで回転できるように十分な大きさを有してもよい。1mmのレーザスポットでは、長さが6cmの食道の部位を完全に治療する場合には60回転で行なうようにしてもよい。プレート径が10cm未満のものを使用できる。3つの光学チャネルを収納するだけでなく、本発明の本実施の形態の装置およびシステムではエアーギャップカプラから生じる損失および背面反射を回避できる。
代表的な高速データ収集および処理
【0067】
本発明のさらなる実施の形態のシステムおよび装置では、例えば高速撮像システムを使用することができる。代表的なデジタル収集および処理システムでは、リアルタイムでOFDI信号の収集、処理および記憶のためにVME−バスのハードウェアをベースに用いることができる。このような代表的なシステムおよび装置の代表的な部品には、シングルボードコンピュータに搭載された高速デジタイザとRAID記憶アレーに接続された光ファイバを有するVME筐体を含んでもよい。この代表的なシステムおよび装置はホストプロセッサ(例えばパーソナルコンピュータ)経由で制御できる。アナログOFDI信号はフィールド−プログラマブル−ゲート−アレー(FPGA)プロセッサ集積回路を搭載した広帯域レシーバー(例えば、12ビット、210MS/毎秒)を用いてデジタル化してもよい。OFDIシステムの2つの偏光チャネルに対して生データ速度は800MB/秒であるため、収集ボードに搭載されたプロセッサの処理能力が重要である。このFPGAプロセッサは、それぞれの偏光チャネルの信号を周波数領域から反射率対深度を表す1024素子アレー(一Aライン)に変換するように構成、またはプログラムすることができる。このデータは、後続の処理のため、および最終データをハードディスクのRAIDアレーへ転送することに先立って2つのチャネルを結合するために、シングルボードコンピュータへ渡される。最終的なデータ記憶速度は、例えば400MB/秒でもよい。データを複数のハードディスクにストライプすることにより、このデータ速度を連続的に持続できる。
【0068】
本発明による代表的な実施の形態の処理装置のソフトウェアによりこの代表的なシステムをユーザが制御することができ、またリアルタイムでダウンサンプル速度で画像の表示を行なうことができる。例えば、代表的なシステムは、全データ速度であるバーストモード、及び半データ速度である連続モードの、2つの代表的なモードで使用できる。代表的な内視鏡システムおよび装置は上述の部品およびソフトウェアを搭載することができる。さらに、位相シフト、複屈折、スペックルおよびドップラー信号のリアルタイムの演算を容易にするために、FPGAプロセッサおよびシングルボードプロセッサの両方をプログラムするさらなる手順(例えばソフトウェア)を提供できる。Vertex4 Pro FPGAとquadG4シングルボードコンピュータとを結合した演算能力は、モニタリング信号をリアルタイムで表示するために十分である。
代表的なレーザ
【0069】
式1を用いれば、走査速度を一定に保ちながらレーザ出力を4倍に増加させてスポットサイズを2倍にして組織内の温度分布を一定に保つことができる。一定のスポットサイズで速度を2倍にするには2倍のレーザ出力を使用することとなる。本発明の一代表的な実施の形態のレーザ装置は、単一エミッター半導体レーザダイオードを利用することができる。従来のデバイスは、波長制御用の回折格子を含む単式外部キャビティ設計を用いて、このスペクトル領域にわたり3Wを超えるレーザ出力を得ている。このレーザ出力および波長は、ポテンショメータからのアナログ信号に基づいてOFDIシステムのホスト処理装置経由で制御してもよい。このポテンショメータは、ユーザ(例えば内視鏡操作者)がレーザ損傷深度を増加或いは減少させるために使用できるハンドヘルドダイアルで構成してもよい。
代表的なユーザインターフェイス
【0070】
本発明の代表的な実施の形態のシステムおよび方法は、操作者に組織の断面画像を含むユーザインターフェイスを提供することができる。この画像は連続的に更新してもよく、モニタリング手順で決定した通りにレーザ治療のゾーンの指定とともに治療済みおよび次に来る未治療組織像を含んでもよい。このユーザインターフェイスはホスト収集装置上でプログラムされてもよく、FPGAプロセッサ並びにシングルボードコンピュータからの演算結果を使用することができる。画像およびレーザパラメータはRAIDアレーにアーカイブ保管してもよい。
【0071】
本発明のさらなる一代表的な実施の形態では、撮像システム/装置100は、図15のブロック図に示すように、光学スイッチ115を用いて3−ファイバプローブに接続できる。この代表的なプローブは、例えば図12を参照して説明したもののように、2つの撮像用ファイバと1つの治療用ファイバとを含むことができる。スイッチ115は、再治療画像と例えば治療時画像を取得するために使用することができる2つの撮像ファイバ120aと120bの一方から他方へと撮像用光を交互に投入する。治療用光源105は、治療用ファイバ125cに直接に投入してもよい。これらのファイバはカテーテル130に接続することができる。カテーテル130は、例えば、図12に示した代表的なカテーテルでもよい。撮像システム100からの信号は、光スイッチ115の状態を制御することができる。
【0072】
さらに、図16に示す本発明のその他の代表的な実施の形態では、代表的な撮像システム/装置200は、図12に示すもののような代表的な3ポートカテーテルに、2つの撮像ファイバ220aと220bの両方に光を結合することができる光学スプリッタ215経由で結合することができる。この代表的な撮像システムは、それぞれからの画像信号を経路長エンコーディング技術を用いて分離することができる。異なる経路長を作るため、光学遅延部材235を1つのファイバ220bの中あるいは複数のファイバの中に配置してもよい。治療用光源205は、カテーテルの治療用ファイバ225cに直接或いは間接的に投入することができる。
【0073】
さらに図17に示す本発明によるその他の代表的な撮像システム/装置800において、光は単一の波長分割マルチプレクサ810を用いて治療用光源805に結合してもよい。結合した光は、単一ファイバ型回転カプラに連結して、次いで図21に示すカテーテルなどの代表的な単一ファイバカテーテルに接続してもよい。
【0074】
さらに、図18に示す本発明のさらなる代表的な実施の形態の撮像システム/装置900では、単一モードファイバ901からの撮像システム900の光をデュアルファイバ911の単一モードコアに結合し、かつマルチモードファイバ906からの治療用ビームをデュアルクラッドファイバ911に結合するクラッディングモードカプラを用いて、光を治療用ビーム905と結合してもよい。
【0075】
図19に、3つの出力ファイバ405a、405b、405cを有する例えば図15および図16に概要を示したものなどのシステム400と、例えば図12に示したものなどの3ポートカテーテル415との、図13に示したもののようなマルチチャネル回転カプラ410経由の代表的な接続を示す。
【0076】
図20に、撮像用光と治療用光の両方を含む単一ファイバ305を単一チャネル回転カプラ310に結合した、本発明の代表的なシステム300の概略を示す。例えば、この光は回転カプラ310の後で、撮像用光を第1のファイバ332上へ分離しまた治療用光を第2のファイバ331上に分離する波長分割マルチプレクサ(WDM)330により分割される。撮像用光は、2つの撮像ポート336aと336bを受ける光スプリッタ335を用いてさらに分離してもよい。ファイバ331、336a、336bは図12に示すもののような設計の3ポートカテーテル325に接続することができる。カテーテル部分320は内視鏡を挿入できるように柔軟であり、またWDM330とスプリッタ335とを含む部分は保護のために硬質チューブ315の内部に収容されている。
【0077】
図21は、単一撮像用ビーム1125および単一モードファイバ1101からの独立した治療用ビーム1120を生成することができる本発明の代表的な実施の形態の遠端光学系の側面図である。例えば、撮像用および治療用の両光を含むファイバからの光は、最初に第1のGRINレンズ1100により集束する。次いでこの光は、治療用ビーム1120を生成するために治療用光波長を上方に誘導し、かつ撮像用光の波長を第2のGRINレンズ1110へ伝達する波長分割マルチプレクサプリズム1105を通過する。この第2のGRINレンズ1110は、撮像用光を交互に集束させて、撮像用ビーム1125を上方へ誘導する最終プリズム1115へ誘導する。プリズム1105及び1115の角度は、ビームが装置から適当な距離で重なり合うように設定される。
【0078】
図22は、本発明の代表的な実施の形態の3ポートカテーテルの側面図及び正面図である。この代表的なカテーテルは、ハウジング1040内のV字溝1020に含まれた3組の集束光学系1035に接続された3つのファイバ1005を有することができる。集束光学系はビームを集束させることができる。マイクロプリズム1025は、透明被覆1000により生じた非点収差を補正する円筒型レンズ1030を通してこの光ビームを上方へ再び誘導することができる。バルーン1010による軸出し機構を用いて、管腔組織1015内に光学系1035の心出しを維持してもよい。端面図にはモニタ用ビーム1050c、治療用ビーム1050bおよび撮像前用ビーム1050aが見られる。ハウジング1040は、図13に示されているものなどのマルチチャネル回転カプラによる回転に適応できるものである。
【0079】
図23は、撮像用ビームの回転を実現するためにマイクロモータ1260を利用する本発明の代表的な実施の形態のカテーテルの側面図である。例えば、このモータ1260は透明被覆1235に包まれている。モータシャフトの回転は、プリズム1220を回転することができる。撮像用光は、ファイバ1210を経由して遠端光学系に結合することができる。この遠端光学系では、光は集束光学系1215により集束し、反射器1225によりプリズム1220上へ反射される。プリズム1220の回転により撮像用ビームは円周方向に掃引される。モータ電気接続1205は、ファイバ1210と同じ管腔を通して行なうことができる。治療用光はファイバ1200上の遠端光学系に結合される。この治療用光は集束光学系1250を用いて集光され、プリズム1245によって内側被覆1235に対して固定回転角度で横方向に誘導される。このようにして、撮像用ビームは固定した治療用スポットの中を通って掃引を行なう。治療用スポットの併進移動は、外側被覆1240内で内側被覆1235の全体を回転させることにより実行する。この代表的な回転は、図13に示すカプラなどのマルチチャネル回転カプラを使用して行なうことができる。カテーテルは光コア1230の軸出し用のバルーン1255を使用できる。
【0080】
図24は、低出力波長可変光源600と、これに続く光出力を増幅する広帯域ブースタ増幅器605を用いて波長を変化させることができる、本発明の代表的な実施の形態のレーザ治療用光源のブロック図である。
【0081】
図25は、波長並びに偏光が異なる複数のレーザダイオード500a、500b500c、500dを組み込んだ代表的な実施の形態のレーザ治療用ビーム源およびその装置を実現するための代表的な手順のブロック図および機能図である。例えば、この光は偏光マルチプレクサ505a、505bおよび波長分割マルチプレクサ510により単一モードファイバ515へ結合できる。必要な場合は、この光をマルチモードファイバ520に結合させることができる。高速モードスクランブラ525を用いて、マルチモードファイバからの横モードパターン出力を高速でスクランブルすることができる。単一モードファイバへ光を出力するその他の光源用装置にも、光をマルチモードファイバに結合させる同様の設計を用いることができる。
【0082】
図26に、本発明の代表的な実施の形態の治療用光源およびその使用法を示す。例えば、複数の波長701a−gを有するレーザダイオードバー700を使用することができる。各導波路は、レンズ装置705、回折格子710および部分反射エンドミラー715を通して自由空間レーザキャビティーに結合できる。回折格子が波長を分散するため、各導波路で形成されたレーザは異なる波長のレーザ光となる。このため、導波路701a−gのそれぞれへの駆動電流を調節することにより、レーザ出力720およびスペクトル形状を調節できる。
【0083】
図28に示すように、本発明の更なる代表的実施の形態では、撮像およびモニタリング信号の検出を容易にするために、音響―光周波数シフタを使用して単一OFDIシステムを変調することができる。例えば、波長掃引レーザ光源3000は第1のスプリッタ3020により分離され、サンプルアーム経路および参照アーム経路を作る。サンプルアーム経路は第2のスプリッタ3030によりさらに分離される。このスプリッタの第1の出力は第1の周波数シフタ3061へ導かれ、第2の出力は第2の周波数シフタ3060へ導かれる。各周波数シフタは別々の周波数で駆動できる。第1の周波数シフタ3061からの光は、光サーキュレータ3071を通して、図13に示すような3ファイバ回転カプラ3110の撮像ファイバ3072に結合できる。第2の周波数シフタ3060からの光は、サーキュレータ3070を通して、同じ回転カプラのモニタリングファイバ3073に結合してもよい。
【0084】
独立した治療用レーザ3010を第3の治療用ファイバに結合できる。撮像ファイバ3072およびモニタリングファイバ3073に戻ってきた光は、光混合部3080で再結合し、次いで第2の混合部3090でレファレンスアーム光と混合し、その出力は一連の検出器3100に導かれる。周波数シフタにより、撮像用光に起因する干渉信号およびモニタリング光に起因する干渉信号は異なるキャリア周波数でエンコードされ、また従来の周波数領域技術により分離できる。
【0085】
図29Aは、サンプルの少なくとも一部分に関する情報を取得する、本発明の代表的な実施の形態の方法のフロー図である。例えば、ステップ3100において、サンプルの一部に温度変化が生じる。ステップ3110において、少なくとも一つの第1の電磁放射をサンプルの一部の近傍あるいは内部の部位に送出する。ステップ3120において、その部位の変形を複数の深度における(i)その部位から齎される少なくとも一つの第2の電磁放射の位相、および/または(ii)位相の変化レートおよび/または第2の電磁放射の振幅の関数として特定できる。
【0086】
図29Bは、サンプル中の温度分布を制御する本発明の他の代表的実施の形態の方法のフロー図である。例えば、ステップ3130において、特定波長の電磁放射をサンプルの部位に照射することができる。温度分布は、ステップ3140でその部位に電磁放射を照射する際にその特定波長を変更することにより制御できる。
【0087】
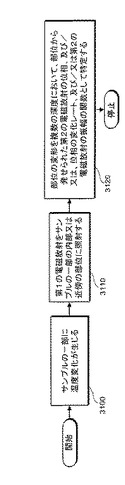
図29Cは、生体構造の少なくとも一部分にレーザ照射を行なうための本発明のさらに別の代表的な実施の形態の方法のフロー図である。例えば、ステップ3150ではレーザ放射ビームを当該部分に照射することができる。ここで、ビームの断面積は最大でもこの少なくとも一つの部分の全面積の略10分の1である。ステップ3160において、このビームを、(I)所定のパターンに基づく、(II)レーザ放射の波長を変調しながら、および/または(III)レーザ放射の照射深度をモニタしながら、その部位に照射することができる。
代表的な参考文献
【0088】
1.Devesa SS, Blot WJ and Fraumeni JF, Jr.、Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer(米国における食道及び胃部上皮性悪性腫瘍発生率の増加パターン、癌),1,998;83:2049−2053.
2. Barr H, Stone N and Rembacken B.、Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer(バレット食道の内視鏡治療)、Gut 2005;54:875−884.
3. Johnston MH.Technology insight: ablative techniques for Barrett’s esophagus − current and emerging trends.(技術的所見:バレット食道の切除技術−現在及び今後のトレンド)Nature Clinical Practice、Gastroenterology & Hepatology2005;2:323−330.
4. FaIk GW, Chittajallu R, Goldblum JR, Biscotti CV, Geisinger KR, Petras RE, Birgisson S, Rice TW and Richter JE.、Surveillance of patients with Barrett’s esophagus for dysplasia and cancer with balloon cytology.(バルーン細胞診によるバレット患者の異形成および癌調査)、Gastroenterology 1997;112: 1787−1797.
5. Spechler SJ.「バレット食道:この急増する問題を無視すべきか?」、Gastroenterology 1997;112:2138−2142.
6. Kubba AK, Poole NA and Watson A.assessment in management of Barrett’s esophagus(バレット食道管理におけるp53評価の役割)、Dig Dis Sci 1999;44:659−667.
7. Reid BJ.、neoplastic progression in Barrett’s esophagus(バレット食道におけるp53および腫瘍の進行)、Am J Gastroenterol 2001;96:1321−1323.
8. Sharma P, Weston AP, Topalovski M, Cherian R, Bhattacharyya A, Sampラインr RE.、Magnification chromoendoscopy for the detection of intestinal metaplasia and dysplasia in Barrett’s oesophagus(バレット食道における腸上皮化成および異形成検出のための拡大色素内視鏡検査法)、GUT 2003;52: 24−27.
9. Kuipers EJ and Haringsma J.、Diagnostic and therapeutic endoscopy. Journal of Surgical Oncology(診断および治療用内視鏡検査法)、Journal of Surgical Oncology、 2005;92:203−209.
10. Georgakoudi I, Jacobson BC, Van Dam J, Backman V, Wallace MB, Muller MG, Zhang Q, Badizadegan K, Sun D, Thomas GA,Perelman LT and FeId MS.、Fluorescence, reflectance, and light−scattering spectroscopy for evaluating dysplasia in patients with Barrett’s esophagus(バレット食道患者の異形成評価のための蛍光、反射率、および光散乱スペクトロスコピー)、Gastroenterology 2001;120: 1620−1629.
11. Adrain AL, Ter HC, Cassidy MJ, Schiano TD, Liu JB and Miller LS.、High− resolution endoluminal sonography is a sensitive modality for the identification of Barrett’s metaplasia(高分解能内腔超音波検査はバレット化成の特定に高感度なモダリティーである)、Gastrointest Endosc 1997;46: 147−151.
12. Canto MI.、Vital staining and Barrett’s esophagus(生体染色およびバレット食道)、Gastrointest Endosc 1999;49:S12−16.
13. Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang W, Hee MR,Flotte T, Gregory K, Puliafito CA and Fujimoto JG.、Optical coherence tomography(光コヒーレンストモグラフィー)、Science 1991;254: 1178−1181.
14. Tearney GJ, Brezinski ME, Bouma BE, Boppart SA, Pitvis C, Southern JF and Fujimoto JG.、In vivo endoscopic optical biopsy with optical coherence tomography(光コヒーレンストモグラフィーを用いた生体内内視鏡光生検)、Science 1997;276:2037−2039.
15. Evans JA, Poneros JM, Bouma BE, Bressner J, Halpern EF, Shishkov M,Lauwers GY, Mino−Kenudson M, Nishioka NS and Tearney GJ.、Optical Coherence Tomography to Identify Intramucosal Carcinoma and High Grade Dysplasia in Barrett’s Esophagus「バレット食道における粘膜内癌および高度異形成特定用光コヒーレンストモグラフィー」、Clinical Gastroenterology and Hepatology、 2005;4:38−43.
16. Poneros JM, Brand S, Bouma BE, Tearney GJ, Compton CC and Nishioka NS.、Diagnosis of Specialized Intestinal Metaplasia by Optical Coherence Tomography(光コヒーレンストモグラフィーによる特殊腸上皮化成の診断)、Clinical Gastroenterology and Hepatology 2005;4:38−43.
17. Brand S, Poneros JM, Bouma BE, Tearney GJ, Compton CC and Nishioka NS.、Optical Coherent Tomography in the Gastrointestinal Tract. Endoscopy(胃腸管における光コヒーレンストモグラフィー、内視鏡) 2000;32:796− 803.
18. de Boer JF, Cense B, Park BH, Pierce MC, Tearney GJ and Bouma BE.、Improved signal−to−noise ratio in spectral−domain compared with time−domain optical coherence tomography(時間領域光コヒーレンストモグラフィーに比較して信号対雑音比が改善されるスペクトル領域光コヒーレンストモグラフィー)、Optics Letters 2003;28:2067−2069.
19. Choma MA, Sarunic MV, Changhuei Y and Izatt JA.、Sensitivity advantage of swept source and Fourier domain optical coherence tomography(掃引型光源およびフーリエ領域光コヒーレンストモグラフィーの検出感度の利点)、Optics Express 2003;I I :2183−2189.
20. Leitgeb R, Hitzenberger CK and Fercher AF.、Performance of Fourier domain vs. time domain optical coherence tomography(フーリエ領域対時間領域光コヒーレンストモグラフィーの性能比較)、Optics Express 2003;I I :889−894.
21. Yun SH, Tearney GJ, de Boer JF, Iftimia N and Bouma BE.、High−speed optical frequency−domain imaging(高速光周波数領域撮像)、Optics Express 2003; 11 :2953−2963.
22. Yun SH, Boudoux C, Tearney GJ and Bouma BE.、High−speed wavelength−swept semiconductor laser with a polygon−scanner−based wavelength filter(ポリゴン走査型波長フィルターを有する高速波長掃引型半導体レーザ)、Optics Letters 2003;28: 1981−1983.
23. Oh WY, Yun SH, Tearney GJ and Bouma BE.、115 kHz tuning repetition rate ultrahigh−speed wavelength−swept semiconductor laser(115kHz共振繰返速度の超高速波長掃引型半導体レーザ)、Optics Letters 2005;30:3159− 3161.
24. Vakoc BJ, Yun SH, de Boer JF, Teamey GJ and Bouma BE.、Phase−resolved optical frequency domain imaging(位相分解光周波数領域撮像)、Optics Express 2005;13:5483−5493.
25. Brown SB, Brown EA and Walker I.、The present and future role of photodynamic therapy in cancer treatment(癌治療における光力学療法の現在および未来の役割)、Lancet Oncol 2004;5:497−508.
26. van den Boogert J, van Hillegersberg R, Siersema PD, de Bruin RW and Tilanus HW.、Endoscopic ablation therapy for Barrett’s esophagus with high−grade dysplasia: a review(高度異形成バレット食道の内視鏡アブレーション治療:検討)、Am J Gastroenterol 1999;94: 1153−1160.
27. Sampラインr RE, Fennerty B and Garewal HS.、Reversal of Barrett’s esophagus with acid suppression and multipolar electrocoagulation: preliminary results(酸抑制および多極電気凝固法によるバレット食道の好転:中間結果)、Gastrointest Endosc 1996;44:532−535.
28. Sampラインr RE.、Endoscopic ablative therapy for Barrett’s esophagus(バレット食道の内視鏡アブレーション治療法)、Gastrointest Endosc、2004;59:66−69.
29. Soetikno RM, Gotoda T, Nakanishi Y and Soehendra N.、Endoscopic mucosal resection(内視鏡的粘膜切除術)、Gastrointest Endosc 2003;57:567−579.
30. Ganz RA, Utley DS, Stern RA, Jackson J, Batts KP and Termin P.、Complete ablation of esophageal epithelium with a balloon−based bipolar electrode: a phased evaluation in the porcine and in the human esophagus(バルーン型2電極を用いた食道上皮の完全アブレーション:豚及びヒト食道における位相化評価)、Gastrointest Endosc 2004;60:1002−1010.
31. Mark H. Johnston, Brooks D. Cash, Cathy A. Dykes, Halisha S. Mays and Lavonne R. Johnston、Cryoablation of Dysplasia in Barrett’s Esophagus (BE) and Early Stage Esophageal Cancer「バレット食道(BE)における異形成および初期食道癌のクライオアブレーション術」、Gastrointest Endosc 2006 ;63: AB223.
32. Overholt BF, Panjehpour M and Haydek JM.、Photodynamic therapy for Barrett’s esophagus「バレット食道の光力学的治療法:100名の患者の追跡調査」、Gastrointest Endosc 1999;49:1−7.
33. Vogel A and Venugopalan V.、Mechanisms of pulsed laser ablation of biological tissues(生体組織のパルスレーザアブレーションのメカニズム)、Chemical Reviews 2003;103:2079−2079.
34. McKenzie AL.、Physics of thermal processes in laser−tissue interactions(レーザ−組織相互作用における熱過程の物理)、Physics in Medicine & Biology 1990;35: 1 175−1209.
35. Anderson RR and Parrish JA.、Selective photothermolysis: precise microsurgery by selective absorption of pulsed radiation(選択性光熱分解:パルス化放射の選択吸収を用いた精密マイクロサージェリー)、Science 1983;220:524−527.
36. Jacques SL.、Role of tissue optics and pulse duration on tissue effects during high− 出力 laser irradiation(高出力レーザ照射時間における組織効果に対する組織光学とパルス時間の役割)、Applied Optics、 1993;32:2447−2454.
37. Nahen K and Vogel A.、Investigations on acoustic on−line monitoring of IR laser ablation of burned skin(熱傷皮膚のIRレーザアブレーションの音響オンラインモニタリングの研究)、Lasers in Surgery & Medicine 1999;25:69−78.
38. Jerath MR, Kaisig D, Rylander HG, 3rd and Welch AJ.、Calibrated real−time control of lesion size based on reflectance images(校正手法を用いた反射率画像に基づく病変サイズのリアルタイム制御法)、Applied Optics 1993;32:1200−1209.
39. Jerath MR, Gardner CM, Rylander HG, 3rd and Welch AJ.、Dynamic optical property changes: implications for reflectance feedback control of photocoagulation(動力学的光学特性の変化:光凝固の反射率フィードバック制御に対する影響)、Journal of Photochemistry & Photobiology B − Biology 1992;16: 113−126.
40. Deckelbaum LI.、Coronary laser angioplasty(冠状動脈レーザ造影法)、Lasers in Surgery & Medicine 1994;14: 101−110.
41. Kim BM, Feit MD, Rubenchik AM, Mammini BM and Da Silva LB.、Optical feedback signal for ultra short laser pulse ablation of tissue(組織の超短レーザパルスアブレーションに対する光フィードバック信号)、Applied Surface Science 1998;127−129:857−862.
42. Brinkmann R, Hansen C, Mohrenstecher D, Scheu M and Birngruber R.、Analysis of cavitation dynamics during pulsed laser tissue ablation by optical on−line monitoring(光オンラインモニタリングによるパルス化レーザ組織アブレーション時間におけるキャビテーション力学の分析)、Selected Topics in Quantum Electronics, IEEE Journal of 1996;2:826.
43. Whelan WM, Davidson SRH, Chin LCL and Vitkin IA.、A Novel Strategy For Monitoring Laser Thermal Therapy Based on Changes in Optothermal Properties of Heated Tissues(加熱組織の光熱特性変化に基づいたレーザ熱治療法のモニタリングのための新方策)、International Journal of Thermophysics 2005;26:233−241.
44. Boppart SA, Herrmann J, Pitris C, Stamper DL, Brezinski ME and Fujimoto JG.、High−resolution optical coherence tomography−guided laser ablation of surgical tissue(高分解能光コヒーレンストモグラフィーによる誘導を用いた手術組織のレーザアブレーション術)、Journal of Surgical Research 1999;82:275−284.
45. Thomsen SL, Jacques SL and Flock ST.、Microscopic correlates of macroscopic optical property changes during thermal coagulation of myocardium(心筋の熱凝固期間における巨視光学特性の変化の微視要因)、Proceedings of the SPIE 1990;1202:2−1 1 .
46. Maitland DJ and Walsh JT, Jr、Quantitative measurements of linear birefringence during heating of native collagen(天然コラーゲンの加熱期間における線形複屈折の定量測定法)、Lasers Surg Med 1997;20:310−318.
47. Kimel S, Svaasand LO, Hammer−Wilson M, Schell MJ, Milner TE, Nelson JS and Berns MW.、Differential vascular response to laser photothermolysis(血管のレーザ光熱分解に対する微分応答)、Journal of Investigative 皮膚科学 1994;103:693−700.
48. Khan MH, Sink RK, Manstein D, Eimerl D and Anderson RR.、Intradermally focused infrared laser pulses: Thermal effects at defined tissue depths(皮膚内集束赤外レーザ:規定の組織深度における熱効果)、Lasers in Surgery and Medicine 2005;36:270−280.
49. Neumann RA, Knobler RM, Pieczkowski F and Gebhart W.、Enzyme histochemical analysis of cell viability after argon laser−induced coagulation necrosis of the skin(皮膚のアルゴンレーザ誘発凝固壊死後の細胞生存率の酵素を用いた組織化学的分析法)、Journal of the American Academy of Dermatology、1991;25:991−998.
50. Nadkarni S, HeIg T, Bouma BE, Chan RC, Minsky MS, Chau AH, Motz J, Houser SL and Tearney GJ.、Characterization of atherosclerotic plaques by laser speckle analysis(レーザスペックル分析による動脈硬化性プラークの特性解析法)、Circulation 2005; 112:885−892.
51. Zimnyakov DA, Agafonov DN, Sviridov AP, Omel’chenko AI, Kuznetsova LV and Bagratashvili VN.、Speckle−contrast monitoring of tissue thermal modification(組織の熱変化のスペックルコントラストモニタリング)、Appl Opt 2002;41 :5989−5996.
52. Pierce MC, Sheridan RL, Park BH, Cense B and de Boer JF.、Collagen denaturation can be quantified in burned human skin using polarization−sensitive optical coherence tomography(熱傷ヒト皮膚のコラーゲンの変性は偏光検出光コヒーレンストモグラフィーを用いて定量化できる)、Burns 2004;30:511−517.
53. de Boer JF, Milner TE, van Gemert MJC and Nelson JS.、Two−dimensional birefringence imaging in biological tissue using polarization sensitive optical coherence tomography(偏光検出光コヒーレンストモグラフィーを用いた生体組織の2次元複屈折撮像法)、Optics Letters 1997;22:934−936.
54. Morelli JG, Tan OT, Garden J, Margolis R, Seki Y, Boll J, Carney JM, Anderson RR, Furumoto H and Parrish JA.、Tunable dye laser (577 nm) treatment of port wine stains(ポートワイン母斑の共振色素レーザ(577nm)を用いた治療術)、Lasers Surg Med 1986;6:94−99.
55. Chen ZP, Milner TE, Dave D and Nelson JS.、Optical Doppler tomographic imaging of fluid flow velocity in highly scattering media(強散乱媒体中の流体流速の光ドップラートモグラフィーによる撮像法)、Optics Letters 1997;22:64−66.
56. Izatt JA, Kulkarni MD, Yazdanfar S, Barton JK and Welch AJ.、In vivo bidirectional color Doppler flow imaging of picoliter blood volumes using optical coherence tomography(光コヒーレンストモグラフィーを用いたピコリッター血液量の生体内二方向カラードップラーフロー撮像法)、Optics Letters 1997;22:1439.
57. Barton JK, Welch AJ and Izatt JA.、Investigating pulsed dye laser−blood vessel interaction with color Doppler optical coherence tomography(カラードップラー光コヒーレンストモグラフィーを用いたパルス色素レーザ−血管相互作用の研究)、Optics Express 1998;3:251−256.
58. French PMW, Rizvi NH, Taylor JR and Shestakov AV.、Continuous−wave mode− locked Cr4+:YAG laser(連続波、モード同期Cr4+:YAGレーザ)、Optics Letters 1993;18:39−41.
59. Sennaroglu A, Pollock CR and Nathel H.、Efficient continuous−wave chromium− doped YAG laser(高効率連続波、クロムドープYAGレーザ)、Journal of the Optical Society of America B 1995;12:930−937.
60. Bouma B, Gouveia−Neto A, Izatt JA, Russell J, Sierra R, Keller U and Fujimoto JG.、Hybrid mode locking of a flash−lamp−pumped Ti:A12O3 laser(フラッシュランプポンプ型Ti:A12O3レーザのハイブリッドモード同期法)、Optics Letters 1994;19: 1858−1860.
61. Bouma B, Tearney GJ, Boppart SA, Hee MR, Brezinski ME and Fujimoto JG.、High−resolution optical coherence tomographic imaging using a mode−locked Ti:A12O3 laser source(モード同期Ti:A12O3光源を用いた高分解能光コヒーレンストモグラフィー撮像法)、Optics Letters 1995;20: 1486−1488.
62. Bouma BE and Fujimoto JG.、Compact Kerr−lens mode−locked resonators(小型カーレンズモード同期共振器)、Optics Letters、 1996;21 : 134−136.
63. Bouma BE, Nelson LE, Tearney GJ, Jones DJ, Brezinski ME and Fujimoto JG.、Optical coherence tomographic imaging of human tissue at 1.55 μm and 1.81 μm using Er and Tm−doped fiber sources(Er及びTmドープファイバ光源を用いたヒト組織の1.55μmおよび1.81μmにおける光コヒーレンストモグラフィー撮像法)、Journal of Biomedical Optics 1998;3:76−79.
64. Bouma BE, Ramaswamy−Paye M and Fujimoto JG.、Compact resonator designs for mode−locked solid−state lasers(モード同期固体レーザのための小型共振器の設計)、Applied Physics B (Lasers and Optics)1997;65:213−220.
65. Bouma BE, Tearney GJ, Bilinsky IP, Golubovic B and Fujimoto JG.、Self−phase− modulated Kerr−lens mode−locked Cπ forsterite laser source for optical coherence tomography(自己位相変調カーレンズ、モード同期型Cπフォルステライトレーザ光源)、Optics Letters 1996;21 :1839−1841.
【0089】
前述の説明は単に本発明の原理を例示したに過ぎない。本明細書の説明を考慮して、記載された実施の形態に種々の変更や改変を加えることは、当業者にとって明白である。
実際に、本発明の代表的な実施の形態による装置、システム、および方法は、どのようなOCTシステム、OFDIシステム、スペクトル領域OCT(SD−OCT)システム、または他の画像化システム、例えば、2004年9月8日出願の国際特許出願第PCT/US2004/029148号、2005年11月2日出願の米国特許出願第11/266,779号、および2004年7月9日出願の米国特許出願第10/501,276号に記載されているものに対しても使用および/または実施可能であり、これらの開示の全てを本明細書の一部として援用する。従って、当業者にとっては、本明細書に明確に提示又は説明されていなくとも、本発明の原理を具現化する数多くのシステム、装置、及び方法に工夫を凝らすことが可能であり、これは本発明の趣旨と範囲内に含まれることが理解されるであろう。さらに、上述の明細書に前記の先行技術の知識が明示的に援用されていない範囲においても、その全体を明示的に本明細書に援用する。本明細書で引用した上述の全ての文献は、その全体を本明細書の一部として援用する。
【図面の簡単な説明】
【0090】
【図1A】図1Aは、本発明の代表的な実施の形態のOFDIバルーンカテーテルの概略図である。
【図1B】図1Bは、図1Aに示したOFDIバルーンカテーテルの写真である。
【図2】図2Aは、本発明の代表的な実施の形態のOFDIバルーンカテーテルを用いて得られた、豚の食道の代表的な斜視画像である。図2Bは、図2Aに示した豚の食道の代表的な上面画像である。図2Cは、図2Aに示した豚の食道の代表的な側面画像である。
【図3】図3は、本発明の代表的な実施の形態のBE技術を用いて被験者から取得した代表的なOFDI画像である。
【図4】図4は、本発明の代表胃的な実施の形態の、組織を治療及びモニタリングする代表的な装置及びその使用法の概略図である。
【図5】図5は、図4に示した代表的な装置を使用して得られた、複数の代表的なM−モードOFDI位相画像と対応する組織像のセットである。
【図6】図6Aは、本発明の代表的な実施の形態の、併進するサンプルについて得られたOFDIデータに関連する代表的な画像である。図6Bは、本発明の代表的な実施の形態の、併進するサンプルについて得られたOFDIデータに関連する代表的な画像である。図6Cは、本発明の代表的な実施の形態の、併進するサンプルについて得られたOFDIデータに関連する代表的な画像である。図6Dは、本発明の代表的な実施の形態の、併進するサンプルについて得られたOFDIデータに関連する代表的な画像である。
【図7】図7Aは、本発明の代表的な実施の形態を用いて得られた、代表的なレーザ治療前のOFDI画像である。図7Bは、本発明の代表的な実施の形態を用いて得られた、代表的なレーザ治療前の複屈折画像である。図7Cは、本発明の代表的な実施の形態を用いて得られた、代表的なレーザ治療後のOFDI画像である。図7Dは、本発明の代表的な実施の形態を用いて得られた、代表的なレーザ治療後の複屈折画像である。
【図8】図8は、本発明の代表的な実施の形態を用いて得ることができる、豚の食道の生体から得た総合的なデータセットから抽出した代表的な血管マップの画像である。
【図9】本発明の代表的な実施の形態を用いて得た、代表的な豚の食道の生体ドップラー血流画像である。
【図10】本発明の代表的な実施の形態を用いて得た、水の吸収係数と対応する貫通深度を波長の関数としたグラフである。
【図11】本発明の他の代表的な実施の形態の2ビームカテーテルプローブの概略図である。
【図12】本発明のさらに他の代表的な実施の形態の3ビームカテーテルプローブの略側面図及び正面図である。
【図13】本発明の代表的な実施の形態の時計バネマルチチャネル光学回転ジャンクションの斜視図である。
【図14】本発明の代表的な実施の形態を用いて得たユーザにフィードバックを行うことができる画像の概念レンダリングである。
【図15】本発明のさらなる代表的な実施の形態の、光学スイッチを統合したOFDIシステムのサンプルアームのブロック図である。
【図16】本発明のさらなる代表的な実施の形態の、光学スプリッタを統合したOFDIシステムのサンプルアームのブロック図である。
【図17】本発明のさらなる代表的な実施の形態の、単一波長分割マルチプレクサを統合したOFDIシステムのサンプルアームのブロック図である。
【図18】本発明のさらなる代表的な実施の形態の、クラッディングモードカプラおよびデュアルクラッドファイバを統合したOFDIシステムのサンプルアームのブロック図である。
【図19】本発明の代表的な実施の形態の、3ポート回転カプラおよびカテーテルのブロック図である。
【図20】本発明の他の代表的な実施の形態の、治療用光を続けてデマルチプレクスして、撮像光をスプリットすることができる、単一ファイバ回転カプラのブロック図である。
【図21】本発明の代表的な実施の形態の、2ビームインラインカテーテルプローブの概略及び使用図である。
【図22】本発明の代表的な実施の形態の、3ビームカテーテルプローブとバルーンカテーテルの正面図及び側面図である。
【図23】本発明の代表的な実施の形態の、低速回転可能な治療用ビームと高速走査撮像用ビームを生成可能なマイクロモータをベースとした構成部の側面図である。
【図24】本発明の代表的な実施の形態の、広帯域ブースタ増幅器が続く低出力波長可変光源を統合した治療用光源のブロック図である。
【図25】本発明の他の代表的な実施の形態の、波長及び偏光の異なる複数のレーザダイオード(LD)を統合した治療用光源のブロック図である。
【図26】本の代表的な実施の形態の、レーザダイオードバーを統合した波長可変治療用光源とこれによって生成したものを示す図である。
【図27】OFDIビームを組織の表面にわたって繰り返し走査することができる検流計式スキャナを含む他の代表的な実施の形態のシステムとその使用法を示す側面図である。
【図28】音響光周波数シフタによる撮像信号とモニタリング信号を検出するために使用可能な本発明のさらなる代表的な実施の形態のOFDIシステムの概略図である。
【図29A】本発明の代表的な実施の形態のサンプルの少なくとも一部分に関する情報を取得する方法のフロー図である。
【図29B】本発明の他の代表的な実施の形態のサンプルの温度分布を制御する方法のフロー図である。
【図29C】本発明のさらに他の代表的な実施の形態の生物構造の少なくとも一部分にレーザ放射を照射する方法のフロー図である。
【技術分野】
【0001】
本発明は、少なくとも一つのファイバの少なくとも二つの部位の少なくとも一つを制御する装置に関するものであり、具体的には、複数のチャネルを含むことができる装置に関する。
【背景技術】
【0002】
(関連出願の相互参照)
【0003】
本出願は、2006年2月1日出願の米国特許出願第60/764,622号、および2006年6月1日出願の米国特許出願第60/810,868号、に基づき優先度の利益を主張するものであり、これらの全ての開示内容を本明細書の一部として援用する。
(連邦政府により支援された研究に関する声明)
【0004】
本発明は、DAMD(米国陸軍省共同協定)により米国政府助成契約第17−02−2−0006号として支援を受けた。それ故、米国連邦政府は本発明に一定の権利を有するものである。
【発明の概要】
【発明が解決しようとする課題】
【0005】
病変組織のアブレーション即ち熱破壊のためにレーザを使用することは周知であり、しばしば、付随的な損傷を最小限にとどめながら正確な局所効果が期待できるという主な理由から、その使用が推奨されている。しかしながら、実際にはレーザ治療は特定の臨床応用、例えば初期上皮癌やその前駆体の治療には完璧とは言い難いものであった。これらの用途におけるレーザ治療の問題点の一つは、治療深度を正確に制御して誘導することができないことであり、その結果、不完全な治療による病気の再発或いは過剰な治療による合併症の発症をもたらした。
【0006】
上皮癌:診断と治療
罹患率と転移に伴う死亡率を劇的に減少させる可能性があるとして、初期癌の特定および治療方法と技術が広く探求されてきた。上皮癌と前駆病変はしばしば巣状をなし、広い範囲に渡り不均一に分布することがある、高感度診断が特に要求される。診断は、10億個以上にも及びうる細胞で構成されたフィールドにおいて単一細胞大のスケールで行なう必要がある。
【0007】
上皮癌はまた治療にも課題を突きつけるものである。これらの癌は面上に形成されるため、上皮性病変への接近手段には屡侵襲が最軽微なカテーテルまたは内視鏡が用いられる。しかしながら、治療上の課題は下層或いは周囲の組織に損傷を与えることなく総合的にその全病巣を殺し、切除し或いは焼灼させることにある。病変の深度並びに正常な上皮組織層の厚みまでも大幅に変化しうるため、これは特に大きな課題である。さらに、上皮組織は非常に柔軟であり、治療器具により著しく圧迫される可能性がある。この結果、一定の深度の組織に影響を与えるように設計した治療法は、再発を齎す過少治療か或いは著しい合併症を誘発する過剰治療の危険性を伴っている。
バレット食道
【0008】
下記の文献1に記載されているように、バレット食道(BE)は、主にこの病気の流行、罹病率の急増、および高度異形性とバレット腺癌などが陰惨な予後が予想されることから重要である。(下記の文献2および3に記載されているように)、最新の有力説によれば、逆流阻止治療に加えて管理された方法でBEを広範囲に破壊すれば、鱗状再生を齎す。また連続的な逆流管理はBEの再発を防止する。課題は、食道壁の下層組織を残して病変粘膜を広範囲に除去することにある。不完全な治療は、下層病変を遮蔽する鱗状過剰再生を齎すものである。過剰な積極的治療は、食道壁の狭窄または穿孔を齎すことがある。以下は、BEのスクリーニングおよび治療に関わる情報である。
【0009】
BEの管理において食道スクリーニングのためのアプローチがいくつか研究されている。ブラシ細胞診(下記の文献4と5に記載)および(下記文献6および7に記載)17p(p53)遺伝子の欠失および/または突然変異のような生物学的マーカの使用は内視鏡検査とは無関係に行なうことができるが、病気の空間マッピングを得ることはできない。高倍率ビデオ内視鏡検査法(文献8に記載)、蛍光分光法(文献9に記載)および光散乱分光法(文献10に記載)はそれぞれポイント診断を約束するものであるが、表面下微細構造に関する情報提供は不十分であり、また、広視野スクリーニングに対しては動作確認がされていない。高分解能内視鏡超音波検査法および色素内視鏡検査法(それぞれ下記文献11および12に記載)は両方とも広範囲に適用できるが、低感度および選択度に難点がある。
【0010】
光コヒーレンストモグラフィー(OCT)のシステム、方法および技術(下記文献13および14に記載)が開発されている。2004年9月8日出願の国際特許出願PCT/US2004/029148、2004年7月9日出願の米国特許出願NS.10/501,276、及び下記文献15−17に記載の、腸上皮化生、異形成および腺癌に特化した信頼できる正確なOCT診断基準が開発されている。下記文献18−20に記載のように、例えばOCT技術の進歩により、(時間領域と反対の)波長領域のOCT信号の収集によって優れた画像品質を保持しながら撮像速度を桁違いに改善できることが実証されている。このような代表的な第2世代の撮像技術の一つとして、例えば、2005年11月2日出願の米国特許出願NS.11/266、779、および下記文献21に記載されているように、光周波数領域撮像(OFDI)が開発されている。OFDIの方法、技術およびシステムを用いて、光源波長を変化させながら組織サンプルと参照光との間の干渉をスペクトル分解して検出することにより、組織内における高分解能照準を行なうことができる(例えば、下記文献22を参照)。下記文献23に記載のように、現在、OFDIの方法、技術およびシステムでは、(例えば10μm)3ボクセルを略毎秒4000万のレートで捕捉することができ、近い将来撮像速度はこの2倍以上になる見通しである。さらに、下記文献24に記載されているように、撮像フローには位相感知OFDIの方法、技術およびシステムが用いられている。
管理可能な治療
【0011】
(異形成がある場合およびない場合の)SIMの治療に対して、光動力学療法(PDT)(下記文献25に記載)、レーザ治療法(532nmおよび1064nm)(下記文献26に記載)、多極型電気凝固法(下記文献27に記載)、アルゴンプラズマ凝固法(下記文献28に記載)、内視鏡粘膜切除法(下記文献29に記載)、高周波アブレーション法(下記文献30に記載)および液体窒素を用いた冷凍アブレーション法(下記文献31に記載)を含む内腔治療法の評価が行なわれてきた。これらの技術は各々成功しているように見えるが、ほとんどの研究では狭窄或いは穿孔に至る持続性のSIM或いは過深度アブレーションに帰結する可能性のある非一様な治療法であることが論じられている。100名を超す患者の調査によれば、PDT(光動力学療法)の単一治療に対する狭窄率は30%であり、複数治療では50%となりうる(下記文献32に記載)。過誤に対する代表的な原因は完全には解明されていないが、これらの装置が手持ち、手動照準用であることによる操作者に依存する特性、治療を必要とする表面面積が広い、および治療のために施術者が決定する可視エンドポイントに固有の選択等が原因として関与している可能性がある(下記文献3と30とに記載)。さらに、患者内部並びに患者間で粘膜層の厚さに大きなバラツキが存在することがあり、食道の軟組織が顕著に圧縮されていることも直接観察されている。しかしながら、従前の測定法は層の厚さ或いは食道壁の圧縮率を考慮したものではない。
【0012】
従って、上述の欠陥を克服する必要がある。
【課題を解決するための手段】
【0013】
上述の問題および/または欠陥、さらにその他の欠陥に対処する、および/または克服するため、コンフォーマルレーザ治療手順を用いてサンプルの少なくとも一部分の情報をモニタし、電磁放射を放射し、サンプルの少なくとも一つの特徴に関する情報を取得する、代表的な実施の形態の方法及びシステムを提供することができる。
【0014】
上述の欠陥は、本発明の代表的な実施の形態を用いて対処できる。本発明の代表的な一実施の形態では、サンプルの少なくとも一部分に関する情報を取得する方法及びシステムを提供する。例えば、サンプルの一部分に温度変化を引き起こすことができる。少なくとも一つの電磁放射を前記サンプルの部分の近傍または内部の部位に送出することができる。複数の深度における前記部位の変形を、(i)前記部位からもたらされる少なくとも一つの第2の電磁放射の位相、及び/又は(ii)前記第2の電磁放射の前記位相及び/又は振幅の変化のレート、の関数として特定することができる。
【0015】
前記第2の電磁放射に関する干渉信号を生成し、前記干渉信号を用いて、前記第2の電磁放射の前記位相を決定することができる。前記干渉信号は、前記第2の電磁放射の波長の関数として測定できる。前記第1の電磁放射は、時間とともに変化する波長を有することができる。前記温度変化は、レーザ構成部を用いて引き起してもよい。前記サンプルの少なくとも一つの変化した部分と変化しない部分との間の境界を前記変形に関する情報の関数として画定することができる。前記サンプルは生物構造体でもよく、前記変化した部分は変性した部分、損傷した部分、及び/又は、破壊された部分であってもよい。さらに、前記少なくとも一つの第2の電磁放射に関する干渉信号を生成することができ、前記干渉信号を用いて、前記第2の電磁放射の振幅を決定することができる。前記干渉信号は前記第2の電磁放射の波長の関数として測定することができる。
【0016】
本発明の他の代表的な実施の形態では、サンプルの温度分布を制御する方法及びシステムを提供する。例えば、前記電磁放射を前記サンプルの部位に特定の波長で照射することができる。前記電磁放射を前記部位に照射している際、前記電磁放射の前記特定の波長を変更することによって前記温度分布を制御することができる。
【0017】
特に特定の波長を変更することによって、サンプルの少なくとも一部分において損傷の分布を変化させることができる。前記温度分布はさらに、前記電磁放射の出力を変更することによって制御することができる。前記特定の波長は、(1)略1.35μmから1.5μm、及び/又は(ii)略1.7μmから2.2μmの範囲で変更することができる。前記温度分布はほぼ、水による前記電磁放射の吸収によるものであってもよい。前記電磁放射は、ツリウムレーザ増幅器構成部、及び/又は、エルビウムレーザ増幅器によって提供することができる。前記特定の波長を変更するレート(rate:速度)は、略毎秒10nmより多くすることができる。前記特定の波長は、非無作為に変更してもよい。
【0018】
本発明のさらに他の代表的な実施の形態では、複数のチャネルは各々、複数の電磁放射の少なくとも一つの特定の放射を、サンプルの解剖学的構造体の内部にあるサンプルに送出することを容易にし、複数の電磁放射は、サンプルの異なる領域に送出される。複数の領域の各々の中心は、ほぼ直線の上に位置してもよい。直線は、複数の放射の走査方向に対して略平行であってもよい。
【0019】
本発明のこれらの目的、特徴及び利点、又はその他の目的、特徴及び利点は、添付の特許請求の範囲とともに、本発明の実施の形態の詳細な説明を読むことにより明らかになる。
【0020】
本発明のさらなる目的、特徴、利点は、本発明の実施の形態を例示的に示す添付の図面を参照して以下の詳細な説明から明らかになる。図面を通して、例示の実施の形態の同様の機能、構成要素、部品などには、特に明記しない限り、同様の番号と記号を付している。さらに、本発明を図面を参照して以下、例示の実施の形態に関連して詳細に説明する。記載の実施の形態は、添付の特許請求の範囲に画定される本発明の範囲と趣旨を逸脱せずに改変及び修正可能である。
【発明を実施するための形態】
【0021】
治療を制御し局所化する本発明の代表的な実施の形態のシステムおよび方法は、従来の空間走査レーザビームにより伝達される熱励起をベースにすることができる。例えば、下記文献33に記載されているように、組織に吸収されたレーザエネルギーは、光化学プロセスあるいは相転移プロセスを経ることなく、実質的にあるいは完全に熱に変換されて温度を上昇させることができる。下記文献34に記載されているように、曝露時間が約10msを超える場合、温度が60−70度を超すと一般に時間とは無関係にタンパク質の非可逆変性および細胞死が起こりうる。エネルギーは吸収されると熱拡散により空間的に再分配される。下記文献35には、1983年に、加熱体積の特性熱拡散時間より短時間のレーザ曝露を用いると空間的に制限されたマイクロサージェリー効果(選択的光熱分解)が齎されるという代表的なコンセプトが記載されている。相対的に大きなレーザビーム径(>1mm)および1450nm近傍のレーザ波長に対して、生物組織に対するこの特性熱拡散時間は1秒のオーダーでよい。文献33および34に記載されているように、これらの条件下では温度上昇はレーザの出力密度Pd、吸収係数μaおよび曝露期間tにより以下のように決定される:
【数1】

ここでρは組織密度、cは熱容量及びrは1/e2半径のWのガウスレーザビームの中心からの半径方向距離を表す。この近似では、レーザ光が組織へ伝播する際の散乱を無視しているが、散乱を明示的に含むモデルは、(1)式からの偏差が上述の条件下で10%未満である(下記文献36に記載)。
【0022】
上述の吸収係数は波長に依存するため、(1)式はレーザパラメータPa、tおよび波長を用いて熱傷深度を制御し、下層組織の付随的な損傷を最小化できることを示している。吸収は、組織と病変の状態により密度が大きく変化する、広範囲の発色団により律則されるため、スペクトルの可視部における動作が課題となっている。これと比べて、生体組織の1.45μm近傍の吸収スペクトルは水により大きく律則されるため、組織範囲にわたり略一定である。さらに、例えば波長を1375nm〜1430nmの小幅な範囲で変化させることにより、吸収長を2mm〜300μmの範囲で選択することができる。この代表的な範囲は、上皮性病変の特性深度とよく整合している。
代表的なモニタリング
【0023】
レーザ治療のモニタリングに対して幾つかの試みがなされてきた。これらには、アブレーション時に発生する過渡音の解析(下記文献37に記載)、組織の反射率の変化の解析(下記文献38と39に記載)、プラークと血管壁とを識別すための蛍光分光分析(下記文献40に記載)、骨と神経組織を識別するためのプラズマ分光分析(下記文献41に記載)、および緑内障手術における制御された強膜穿孔のためのレーザ光プローブ先端のキャビテーション気泡力学の解析(文献42に記載)が含まれる。文献38および39に記載の反射率に基づいた手順を除くと、これらのそれぞれの方法では、モニタリング信号は熱傷ゾーンが特定の組織種別の境界を越えて遷移した時にはじめて発生している。熱傷深度、即ち損傷組織の隣接する生組織との空間的関連を決定する手段はなにも存在しない。ある程度の空間分解能は、組織に吸収されないレーザ光の一部をモニタすることにより達成されている。針を用いて光ファイバを挿入することにより、被加熱体を取り囲む異なる視点からこの光を集めることができ、また温度依存性散乱の変化を測定することができる(下記文献43に記載)。また、アブレーションレーザ照射により生じる組織の物理的除去及び散乱変化の可視化のために、さらに直接的な手法である高分解能、原位置撮像が実演されている(下記文献44に記載)。
【0024】
本発明の代表的な実施の形態のモニタリングシステム、方法および技術は、熱傷に対する既知の組織応答に関する情報を活用してもよい。これらの代表的な応答は、以下に限定されるものではないが、レーザ加熱により発生し、45℃以上の温度範囲で観察できる微視的変形(下記文献33に記載)、散乱の変化(下記文献36,38および45に記載)、複屈折の変化(下記文献46に記載)、および血流の変化(文献47に記載)などが含まれる。本発明の代表的な実施の形態の方法および技術の代表的な態様では、これらの熱応答は高空間分解能を用いて検出することが可能であり、また微視的組織構造に沿った断面画像フォーマットで表現することができる。
代表的なコンフォーマルレーザ治療法
【0025】
本発明の代表的な実施の形態によると、スクリーニングおよび正確に誘導したレーザ治療を実行可能なシステム、装置および方法を提供できる。総合的なスクリーニングと総合的な治療に好適な特性長さスケールは明らかであるため、これらの目的を別々に実行することができる。一例として、(例えば第1のステップとして実行する可能性のある)スクリーニングには、細胞サイズのスケールの分解能をもつ総合的な撮像技術を利用してもよい。この代表的な手順は、続く治療のための領域を特定するために用いることができる。このスクリーニング手順の後、内視鏡プローブをこうして特定した領域に再び導き、全ての病気を治療しながらも付随的な損傷を最小化するようにリアルタイムに誘導してもよい。この結果、例えば合併症の危険を低減させながら治療の有効性を増進させることにより、バレット食道患者の管理を改善することができる。
【0026】
以上は上皮癌の治療について説明したが、本発明の代表的な実施の形態のシステム、技術および方法は、これに限定するものではないが、例えば、皮膚科学の用途を含む如何なるレーザ治療法にも適用可能である。本発明の代表的な実施の形態が対処しうる上皮癌および前癌病変は、これらに限るものではないが、喉頭癌、頚部癌、卵巣癌、膀胱癌、口腔癌および肺癌を含むことができる。さらに、本発明の代表的な実施の形態は、光力学療法、高周波アブレーションおよび低温治療のモニタリングの分野に適用して、治療を深度と空間的範囲にわたり制御を行うことができる。
代表的な広視野スクリーニング
【0027】
効果的なスクリーニング手順を達成するためには、広い表面領域を総合的に検査し、厳密な診断基準を適用して、特定の病変領域を同定することが好ましい。下記の文献15−17に記載されているように、腸上皮化生、異形成および腺癌に特化した様々なOCT用診断基準が開発され動作確認がなされている。例えば、下記の文献16に記載のように、121名の患者から採取した288検体で、SIMを診断するための感度と選択性は(他の全ての上部消化管組織に対して)、それぞれ97%と92%であった。しかしながら、最近まで、代表的なOCT技術は広い粘膜表面の範囲を撮像するためには遅すぎるものであった。以下に考察するように、(現在は)これらの技術はこの時間問題を解決し、生体における総合的食道撮像の予備的実演が行なえるまでに進歩している。
光周波数領域撮像(OFDI)
【0028】
上述したように、文献21には、OCT技術の代用としてのOFDI技術の開発が記載されている。(下記文献22と23で考察している)OFDIの光源および検出原理は有用なものであるが、コントラスト、分解能および断面画像の表示はOCTのそれと略同等或いは類似である。OFDIの利点の一つは、OFDIはより高い検出感度を有するため、これにより画像品質を犠牲にすることなく、画像収集速度を大幅に高速化できる。下記文献24に記載されているように、これらの予備的研究に用いたシステムは内視鏡撮像用に特別に設計したものであって、収集速度は毎秒10,000depth−走査(A−ライン)、組織の軸方向分解能は8μm、およびレンジング深度3.5mmである。この代表的なシステムの撮像速度は、データをコンピュータのバスを経由して伝送し、ハードドライブに記憶する速度のみに制限される。
代表的なバルーンカテーテル
【0029】
総合的な食道撮像用に、図1Aおよび1Bに示すバルーン被覆を用いた食道管腔内でセンタリングを行なうことができる、本発明の代表的な実施の形態のOFDIカテーテルを提供することができる。この代表的なカテーテルは回転可能であり、また光ファイバの内部コア2010をプルバックすることができるプローブスキャナ2000を含んでもよい。この内部コア2010は、透明被覆2020内に包囲することができる。バルーン2040は、このカテーテルの遠端にあり、膨張すると撮像光学系のセンタリングを行なうようにしてもよい。撮像用ビーム2030は食道表面2050上に集光することができる。この撮像用ビーム2030を走査して、総合的な撮像を行なうようにしてもよい。バルーン2040は膨張時の径が1.8cmであり、また、再配置を行なうことなく長さ4.5cmにわたり長手方向に撮像を行なうことができる。カテーテルの光コア2010は、光ファイバ、光ビームを拡大するためのスペーサ、集光のための屈折率分布型レンズ、およびカテーテルの長軸に対して垂直にビームを導く直角プリズムを含むことができる。小型円筒型レンズは自社製であってプリズムの裏面に配置した。このレンズはプラスチック製被覆により生じる非点収差を補償するものであって、組織表面上に回析限界ビーム(直径30μm)を生成した。使用に際しては、この代表的なカテーテルを毎秒約4回転の速度で回転し、円形断面当り2500の軸方向走査を収集できる。この代表的なOFDIシステムはエンコーダ信号を記録して、カテーテルの回転およびプルバックを正確に追跡することができる。この情報は、3次元データセットを再構築する場合に用いられる。
豚の食道の予備撮像
【0030】
2匹の50kgの豚に食道撮像技術を実施した。20GBの全データセットを個別に図面に表示しないが、情報の内容を図2A−2Cに示す。例えば、図2Aの斜視図において、画像2100は撮像した食道全体の3Dレンダリングを表している。図2Bの正面図において、画像2110は、撮像した食道の一つの横断面図である。図2Cにおいて、画像2120は、この食道の少なくとも一部分の拡大断面の画像を表す。分解能10μmx20μmx30μm(r、θ、z)のサンプリングにより、マッピングおよび方向付け用に立体的に表現した図2Aの用画像2100、或いは図2Bの画像2110として食道壁全体を可視化した高分解能断面図を表示可能な、総合的な微視データセットを生成できる。図2Cの画像2120の拡大図は、粘膜層の構造を描写している。
人体食道の予備撮像
【0031】
代表的な単一回転画像2150を図3に示す。そこには、患者のSIMの顕著な特徴(不規則な表面を有する無秩序な上皮構造;大きな上皮線の存在)が見られる。この患者は以前にBEと診断されており、PDTに先立って撮像を行った。
【0032】
これらの予備的研究により、a)生体の総合的なOFDI微視的な撮像が可能であること、b)食道壁全体の構造が可視化可能であること、およびc)バルーンセンタリングプローブを用いて被検者のSIM診断に重要な特徴を検出できることが実証できた。
レーザ熱傷のモニタリング
【0033】
加熱に応答して、組織のタンパク質およびコラーゲンが変性して微視的変形が生じ(下記文献33に記載)、散乱が増加し(下記文献36,38および45に記載)、複屈折が減少し(下記文献46に記載)、かつ血流が減少する(下記文献47に記載)。以下に、本発明の代表的な実施の形態による代表的なOFDIを用いた、これらの変化をモニタリングする方法を説明する。各々の代表的な実証において、新鮮な豚の食道サンプルおよび十二指腸サンプル(SIMの代用品として)を、顕微鏡用カバーガラスが上皮表面の上となるようにマウントして、バルーンカテーテルのおおよその圧力と熱伝導率とをシミュレートできるようにした。
【0034】
図4に、レーザ照射時にOFDI信号を収集する本発明の代表的な実施の形態の装置およびその使用例を示す。例えば、治療用光2200はコリメータを介して送出する。撮像用光2220は第2のコリメータを介して送出する。この治療用ビーム2200と撮像用ビーム2230とは、バッキング2280上に配置され、薄いガラスカバースリップ2260で覆われた組織2270に重なって到達する。この組織は、モータ駆動の併進ステージ2290により併進移動する。撮像用ビームはレンズ2250により焦点を結ぶ。ビームの重なりを示す上面図2250が示されている。熱励起には、コリメート高出力ガウスレーザビーム(例えば径=1.1mm;波長1450nm;出力400mW)を用いることができる。図4に示すように、このOFDIサンプリングビームは、例えば

強度直径23μmで、組織表面に焦点を結び、レーザスポットに重なるように位置合わせされる。データ収集の間、このサンプルは固定位置に保持され、かつ/またはモータ駆動のステージを用いて併進移動するようにしてもよい。
代表的な微視的変形
【0035】
組織にレーザエネルギーが蓄積されるにつれて生じる温度上昇はタンパク質およびコラーゲンを変性させる。これらの変化は、位相検出OFDIを用いて測定可能な微視的変形として現れることができる。以下のデータはこの可能性を実証するものである。
【0036】
固定スポット―この代表的実験では、サンプルを固定位置に保持した。1450nmレーザをスイッチオンにして、所定の時間400mWの一定出力を保持している間、約10kHzの速度で連続的にOFDI深度走査を取得し、次いでスイッチがオフした。3つの異なるレーザ曝露時間に対する代表的なデータを図5のグラフに「Mモード」画像として示す。これらの図で垂直軸2300a、2300b、2300cは組織内の深度を表し、水平軸2310a、2310b、2310cは時間を表し、また、測定した位相シフトの大きさをカラー参照テーブル2320(赤色=正位相シフト、青色=負位相シフト)を用いて表す。各位相シフト画像の上部の赤色水平ライン2330a、2330b、2330cは、レーザがオンとなった区間を表している。初期レーザ曝露において、負位相シフトの下方領域を覆う正位相シフトの表面領域が観測された。レーザ照射を続けるに従って、正から負へ遷移する位相の深度は漸次深くなり、また位相シフトの重なりの大きさが減少した。レーザがオフとなった後では測定可能な位相シフトは検出されなかった。タンパク質変性は、局所的な微細構造の変化と干渉信号中の位相シフトとして検出される局所的変形という病巣を引き起こす。レーザ曝露を続けるに従い、アクティブな変性ゾーンは伝播して深度を深め、下部組織は完全に変性する。位相シフトの方向が反転する深度に応じて、アクティブな変性の焦点中心が特定される。
【0037】
これらの結果を実証するために、レーザ曝露の後に組織切片を取得し、ニトロブルーテトラゾリウム塩化物(NBTC)染色剤を用いてレーザ損傷の広がりを評価した。易熱性酵素である乳酸脱水素酵素(LDH)に対するNBTC染色が陽性であればLDHの活性喪失が熱性細胞損傷に対して急速に現れ、細胞致死率との相関が示される(下記文献48および49に記載)。それ故、レーザ損傷深度として非染色組織と染色組織との境界の深度を選択した。対応する位相シフトデータおよび組織像を2340a、2340b、2340cに示す。事前の知見によれば、熱変性組織と生組織との境界は、OFDIを用いて測定した位相シフトの変曲点と一致する。定量的には、位相シフトの深度導関数をそれぞれのAラインに対して決定し、損傷深度をこの導関数の負の最大値のポイントとして定義した。このようにして決定した深度を、図5に各Mモードに隣接する垂直ラインとして示した。組織形態計測と良好に一致していることがわかる。
【0038】
併進スポット―広い上皮表面領域のレーザ治療は、治療用レーザビームとOFDIビームとが同時に走査されるように治療用レーザビームを既存のOFDIカテーテルに加えることにより容易に行なうことができる。事前の撮像研究では、サイズが30μmのOFDIビームを用いて総合的な食道撮像を行なった。連続して回転走査する際に径が1mmを超えるレーザビームを正確に位置合わせすることができなくてはならない。走査中にモニタリングのシミュレーションを行なうため、コンピュータ制御併進ステージ2290(図4参照)を制御して、サンプル速度を、それぞれスイッチを切り替えることにより1.8mm/秒から0.9mm/秒までとできるようにした。
【0039】
レーザ照射を行なわないで得られたOFDI強度画像2400を図6Aに示す。それぞれ図6B、6Cおよび6Dに示す画像2410,2420および2430では、1450nmレーザ出力は約400mWであった。曝露期間におけるサンプルの併進により、サンプル表面を横断するレーザ損傷のラインが生じた。熱エネルギーの蓄積は曝露時間に比例するため(式1参照)、レーザ損傷深度はこのラインに沿い、併進速度に逆数として変化する。高速併進と低速併進の領域で、このラインに直交する向きで得た組織切片は、レーザ損傷深度がそれぞれ0.41mmおよび0.69mmであることを示した。図6Bの画像2410に相当する位相シフトデータを、図6Cに画像2420として示す。組織形態計測とほぼ一致しているため、位相シフトデータにより決定した損傷深度(最大の負の導関数)は、高速及び低速領域でそれぞれ0.40mmおよび0.67mmとすることができる。
スペックル非相関
【0040】
スペックルはコヒーレント照明を用いた撮像の際に通常観られる現象であり、微細構造とは相関がないと考えられる強弱の強度を有する粒状パターンとして現れる。組織中でスペックルは、一般にサンプル内の異なる経路を経由して伝播したフォトン間の干渉により生じる。組織内の散乱が移動している場合には、それが微視的なスケールであっても、スペックルのパターンの急激な変動として現れることがある。それ故、スペックルパターンの時間的な展開を測定することによって、サンプル内の微視的な動きを洞察することができる。この代表的な技術は生体組織の生体力学特性の研究(下記文献50に記載)、および熱励起の研究(下記文献51に記載)のために開発された。これらのコンセプトをOFDIを用いたレーザ組織相互作用の深度分解モニタリングへ拡張することが検討されている。
【0041】
レーザ曝露時の組織のOFDI画像を観察することによって、この代表的な技術の可能性が示される。レーザ曝露を行なわない場合、OFDIで観察されたスペックルパターンは画像の深度方向および直交方向で一定であった。レーザ照射下では、このスペックルパターンがレーザビームの局所的領域で高速で変動することが観察された。低速運動の観察では、スペックル変動が組織表面の近傍で開始し、時間とともに下部に伝播することが観察された。これらの観察結果を定量化するために、図6Bの画像2410のそれぞれの深度ポイントに対してスペックル非相関のレートを決定した。特に、OFDI強度信号の時間的自己相関関数の深度依存性幅を決定した。次いで、スペックル非相関画像を、グレースケール参照テーブルを用いて自己相関幅を表示して生成された。図6Dの画像2430は、それぞれ図6Bおよび図6Cの画像2410、2420に対応するスペックル非相関画像である。非相関2431レート(図6Dの矢印で指示された黒い帯)のピーク深度は、サンプルの併進速度と組織像に示されたレーザ損傷深度とに連動して変化することを観察できる。食道と十二指腸のサンプル両方から得られたこの調査結果の一貫性は、ピーク非相関レートの深度がレーザ損傷の深度を決定するための定量化可能な測定基準となりうることを確認できる。
複屈折
【0042】
屈折率が非等方性の場合、光を物質中を伝播する際に偏光状態が変化しうる。この効果を複屈折という。多くの組織、特に筋肉とコラーゲンは強い複屈折を示すがこれらは加熱および変性により失われる(文献46に記載)。複屈折損失の測定により熱傷深度を定量化する偏光検出OCT(PS−OCT)技術、方法およびシステムが開示されている(以下の文献52、53参照)。PS−OCTでは、2つの検出器チャネルをサンプルから戻ってきた直交偏光状態の光を受光するように構成できる。複屈折サンプルは偏光状態に深度依存回転を誘発し、各チャネルで検出されたサンプル光の割合に変化をもたらす。2つのチャネルの比を断面画像にグレースケールで表示すると、複屈折が特徴的な横縞模様として観測される。
【0043】
例えば、図27に示すように、図4の装置は改変して、サンプルが静止して支持し、かつ1450nmレーザスポットを中心に固定した状態で、OFDIビームが組織の表面を繰り返し横断して走査するように、検流計式スキャナを具備することができる。図27に示すように、治療用光は、治療用ビーム2510が、バッキング2560の上に配置され、カバースリップ2540で覆われた組織2550に入射するように設けた第1のコリメータ2500を介して送出される。撮像用光は、撮像用ビーム2580を生成する第2のコリメータ2570により供給され、ガルボミラー2520により導かれてレンズ2530を経由する。この装置/システムは、皮膚科学における用途に適用可能な代表的な実施の形態の治療モニタリングシステムとなりうる。レーザ照射時に食道および十二指腸組織のOFDI画像、即ち映像を収集した。
【0044】
図7A−7Dはその代表的なデータを表す。レーザ照射前に収集されたフレームでは、強度画像2450(図7A参照)で層状食道構造を観察することができ、また、対応する偏光画像2470には特徴的な複屈折横縞が観察される(図7C参照)。レーザ曝露中に収集されたフレームでは、1.1mmレーザスポット2460内で上皮散乱強度が劇的に増加し(図7B参照)、対応する偏光画像2480では複屈折横縞が消失している(図7D参照)。低速の偏光運動画像を精査すると、複屈折が減少するゾーンが表面の近傍で始まり下部方向へ伝播することが観察できる。これらの観察結果は概ね変性組織の下部方向伝播ゾーンと一致する。複屈折のパーセント損失の計量により、レーザ熱損傷のモニタリングの定量的測定基準が得られる。
散乱
【0045】
熱的に誘発された組織の微視的構造の変化は、光の散乱を変化させる。OFDIにおける信号は散乱によって生じるものであって、小さな変化を広いダイナミックレンジにわたり検出できるため、組織に熱誘発された変化をモニタするために散乱の測定を利用した。図7Bの画像2460において観測された散乱の変化は、十二指腸および食道の両サンプルにおける事前測定を表す。あるケースでは、上皮内部の散乱の顕著な変化および粘膜筋層および筋固有層の下部組織における相対的に小さな変化が認められた。例えば、レーザ損傷用の定量的測定基準として可能性のある2組を散乱の測定結果から得ることができた。深度分解散乱強度の変化および深度積分散乱強度の変化である。
血流
【0046】
レーザ治療は血管および毛細血管を変化させて血流を減少させる(下記文献54に記載)。食道粘膜は非常に血管に富んでいるため、血流の変化をモニタリングすることによってレーザ治療をモニタリングするためのさらなる方法を提供することができる。豚を用いた最近の研究で収集した図8の画像2490は、豚の食道の血管を表す。この代表的な画像2490は、管状の画像データを開いて、あたかも食道が長手方向に開放されており平坦にピン止めされているかのように表示したものである。強度データは組織の内部へ深度方向に積分したものである。この種類の大規模な可視化は血管を描くには便利な方法であるが、血流の測定にはさらに高感度で定量的な方法/技術/システムを用いることが可能である。組織内の血流を可視化し定量化するためのドップラーOCTが動作確認されており(下記の文献55および56に記載)、レーザ治療後の血流を評価するための装置として研究されている(下記文献57に記載)。OFDIを用いたドップラー測定が報告されており、生体内での構造と血流を同時に測定する可能性が研究されている(下記文献24に記載)。
【0047】
図9の代表的な画像2590の断面図を生きた豚の食道で取得し、強度をグレースケールで、またドップラー信号をこれに重畳してカラーで表示している。表示を簡単にするため、このデータの座標(r、θ)をデカルト座標(垂直、水平)に写像している。この結果は、2匹の豚の複数部位における我々の観測結果を表している。さらに、ドップラー画像の時系列において、我々は拍動流を明確に測定した。
【0048】
【表1】

【0049】
予備的研究によると、提案した測定法は相補的である。:また、位相シフトおよびスペックル非相関はレーザ照射中にのみ使用できるのであるが、さらに高感度かつ高空間分解能を提供しうるものである。複屈折、散乱および血流の変化は持続的であり、レーザ治療後のフォローアップ撮像に適用可能である。
代表的な制御方法
【0050】
効果的なコンフォーマルレーザ治療には、レーザ熱傷のモニタリングに加えて、治療された組織の体積にわたり正確な制御を行ってもよい。治療深度を制御するための一つの代表的アプローチは、付随的な損傷を最小限に止めかつレーザ波長、出力および曝露時間を操作して熱傷深度を制御するために、熱閉鎖した条件の範囲で操作を行なうものである。(食道面に沿った)左右面では、熱傷はラスター走査、空間平行化ビームの使用により制御が可能である。辺縁部を明確に画定した直径が1.3mmの平頂ビームは、ラスター操作により広い上皮範囲の治療を可能とするとともに空間制御を可能とする。代表的なレーザ制御パラメータを以下に式1を用いて説明する。式1の温度分布は、通常弱散乱の範囲でのみ適用されるものである。
波長
【0051】
式1の温度分布から、μaは明らかにレーザ損傷の深さ方向の制御の最適なパラメータでありうる。μaは、外部から制御可能な代表的なパラメータというよりもサンプルの特性を表すが、本発明において我々は深度制御を達成するためにμaの波長依存性を利用した。本発明では、水吸収域にあるさらに長い波長の吸収係数を目標とした。上皮組織において含水比は略一定であるので、レーザ波長を少し変化させることにより熱傷深度を厳密に制御することができる。1.45μm近くの水吸収帯の近傍で、吸収波長は狭いスペクトル幅(1375nmから1430nm)を持ち0.3mmから2mm以上まで変化する(図10のグラフ2595参照)。これらの波長は、上皮疾病の治療に適した特徴波長スケールとよく合致する。水吸収帯1450nm近辺で動作可能な波長可変型レーザを使用して、波長を変化させることによって、治療を制御することができる。
出力及び暴露時間
【0052】
式1を精査すると、吸収係数は、例えば、振幅の制御など、温度分布の指数的深度破壊の制御以上の制御を行なうものであることがわかる。振幅項もまたエネルギー密度と曝露時間に依存するため、これらの変数は吸収係数の変化があっても振幅の正規化に用いることができる。
手順時間
【0053】
新たに提案する治療法の評価では、好適な手順時間を推定し、この推定値を競合する手法、および医療環境と患者の容認に固有の制約と合わせて評価することが重要であろう。PDTは現在内視鏡検査環境でBEの治療に用いられており、20分台の手順時間を要する。
代表的なコンフォーマルレーザ治療技術では、手順遂行時間は2At/(π r v)で見積もってもよい。ここにAtは治療面積、rはレーザスポット半径、およびvはレーザスポット走査速度である。食道治療長60mmに対して食道直径は20mmであった。
【0054】
本発明の代表的な実施の形態によれば、レーザ励起制御が可能な複合システムを提供することができる。一つの代表的な実施の形態では、この代表的なシステムは、周辺組織への付随的な損傷を最小限にして上皮性病変を総合的に治療できるコンフォーマルレーザ治療のために、内視鏡検査で用いることができる。
代表的なシステムの設計
【0055】
本発明の代表的な実施の形態によれば、モニタリングと制御とを結合して上皮疾病のコンフォーマルレーザ治療を行なうためのシステムを提供することができる。レーザビームは容易に形成して空間的に走査できるため、また(食道表面に沿った)横断面の辺縁部はそれほど重要ではないため、精密なレーザ治療の制御を達成するための第1の課題は、レーザ損傷深度を制限しかつ調整することである。上述のモデル化と分析に基づけば、レーザ波長と出力および走査速度を利用して、横方向の損傷範囲を大きく変えることなく医療上重要な領域にわたりレーザ損傷深度を変化させることが可能である。
代表的な治療用レーザ装置
【0056】
おおよそ1375nmから1430nmの範囲のレーザ波長の吸収長は2mm超から0.3mm未満の範囲にある。半導体レーザはこのスペクトル領域で動作することができる。このようなレーザはコンパクトでありかつ使用環境に対して安定しているため、医療用として効果的に使用される。しかしながら、この特定波長領域に好適な物質は、標準的なものではない。本発明の代表的な実施の形態の方法の初期試験フェーズに用いるより安価な代替品は、固体レーザ物質、四価クロムドープYAG (Cr4+:YAG) を用いて提供できる。例えば、この物質は1340nm−1570nmのスペクトル領域で波長を変化することができる(下記文献58および59に記載)。近赤外線スペクトル領域で動作する波長可変型固体レーザの代表的な設計および構造は、下記の文献60−65に記載されている。レーザ共振器の外部の電気機械式シャッターを用いて、この代表的レーザをオン/オフすることができる。
代表的な卓上型システム
【0057】
図4及び図27のシステムに類似した本発明の代表的な実施の形態の卓上型光学システムについて説明する。例えば、OFDIサンプリングビームは〜25μmまでの径でサンプル上に集光してもよい。焦点の軸位置は標準的なz−走査技術を用いて決定することができ、OFDI断面画像中に登録してもよい。続いて、OFDI画像ウインドウ内でサンプルの軸位置を決定することによって、全サンプルに対する焦点位置を確実に固定するようにしてもよい。データは、相互に固定した2つのビームを用いて、サンプルをレーザビーム軸に垂直に併進移動させながら収集してもよい。
レーザおよびOFDIビームの代表的な位置決めおよび登録方法
【0058】
本発明の代表的な実施の形態によれば、OFDIビームとレーザスポットの中心との間のオフセットはモニタリングに重要な意味を持たない。OFDIデータを様々なオフセットに対して収集し(図4に描かれているように)、熱傷の最大深度を示すオフセットを決定するようにしてもよい。次いで、このオフセットを後続の全ての研究段階で用い、また以下のように登録してもよい。サンプルを固定している(併進移動を行なわない)間、サンプルの表面に、小さな、低出力、短時間上皮熱傷を誘発してもよい。図7に示すように、上皮散乱の増加はOFDIで容易に観測でき、レーザビームのプロファイルに従って空間的に局所化される。図4には描かれていないが、OFDIビームは2次元走査を行なう2個の検流計により集束レンズへ中継することができる。この検流計を用いて、サンプルのOFDI正面画像を生成してもよい。上皮熱傷は増大した散乱の円として出現する。次いで、(図4に図式的に示されているように)この検流計の位置決めをして固定することによって、OFDIビームを所要のオフセットで位置あわせすることができる。
代表的な波長スケーリング
【0059】
この実験の一つの目的は、レーザ損傷深度の医療に関連する変動を実現するための、本発明の代表的な波長変動と出力の正規化の技術並びに方法を試験することにある。レーザ波長は、スポットサイズと走査速度を一定に保ちながら約1375nmから1405nmまで2nmステップで変化させてもよい。それぞれの波長に対して、式1における積

(Pd μa)を一定に保持されるようにレーザ出力が調節してもよい。これは、損傷深度が約0.25から1.5mmの範囲で幅が一定の線となる。
代表的な走査速度スケーリング
【0060】
治療深度に影響を与える本発明の代表的な一実施の形態は、走査速度のスケーリングを含んでもよい。例えば、治療用ビーム走査速度は1mm/秒から5mm/秒まで変化させることができる。走査速度が遅くなると、加熱する時間が与えられるため、加熱する組織の範囲がより深くなり、治療する部位もより深くなる。
レーザおよびOFDIビームの代表的な位置決めおよび登録
【0061】
正確な治療モニタリングを確実にするために、OFDIサンプリングビームとレーザスポットと間の空間配置を制御することができる。
代表的な内視鏡プローブの設計
【0062】
図11に示すように、本発明の代表的実施の形態の一つは、総合的な立体撮像および同時レーザ治療用の内視鏡用プローブを含むことができる。例えば、2つのビーム中継用光学系2640aと2640bを用いて、その一方が撮像用光2640bを搬送し、他の一方が治療用光2640aを搬送するようにしてもよい。これらの中継光学系は、第1の透明な被覆2600内部に収容されたハウジング2630内部に配設する。(上述したように)バルーン軸出し(centration)機構2620を用いて、光学プローブ2630と組織表面2610との距離を一定に保つようにしてもよい。レーザ光とOFDIビームとは独立の光ファイバ2641aと2641bとを通して伝達してもよい。それぞれのファイバは独自の中継光学系を有して、別々に制御可能なスポットサイズを生成してもよい。本発明の更なる代表的な実施の形態では、重複スポットを生じるように設計された中継光学系を含むことができる。光ファイバおよび遠端光学系は巻線ドライブシャフト内に収容し、かつバルーン被覆と同一のバルーンセンタリングプローブの内部に配置してもよい。
【0063】
長手方向の走査は、ドライブシャフトの近端に取り付けたコンピュータ制御の併進移動ステージを用いて行なうことができる。この代表的な装置は、われわれの以前の研究でプルバック食道撮像に用いることができる装置と同じである。図13に示す代表的な回転カプラ2900を用いた自動回転と同様に、ドライブシャフトの手動回転も可能としてもよい。本発明の代表的な一実施の形態では、内視鏡システムは広い視野にわたり病気をスクリーニングし、レーザ−組織相互のモニタリングを行ない、またレーザ治療を正確に制御する。このような実施の形態の応用例の一つは、上皮癌およびそれらの前駆体の特定と治療である。さらに進んだ代表的な実施の形態では、システムはスクリーニング、モニタリングおよび制御を直接に結びつけられるというよりも、手順とソフトウェアーモジュールを統合することができる。
【0064】
さらに他の代表的な実施の形態では、治療のプラニングを容易にするため、システムを用いて食道下部全体の高分解能、3次元マップを生成するようにしてもよい。その後、使用結果は図14に示すように3つの部位からなる「生体」断面画像を用いて表示してもよい。画像の右の部位2700は治療用レーザ照射直前の組織であり、画像の中央2730は治療ゾーンを指示するマーカ2740で示されたレーザ照射位置であり、画像の左の部位2710は治療後の組織である。3つのビームは連続的に走査されるため、画像が更新されるに連れて組織は右から左へ移動して現れるようにしてもよい。ユーザ(内視鏡操作者)は、治療を開始/停止させ、また治療深度を深めるまたは浅くするために制御サーボを走査してもよい。事前に未治療組織2700を見ながら治療済ゾーン2710を検査することにより、ユーザはレーザ治療の領域を誘導して所望の標的と一致させることができる。
【0065】
図12に、本発明の代表的な実施の形態の、センタリングバルーンを用いた撮像、モニタリングおよびレーザ治療用内視鏡プローブを示す。この代表的なプローブは回転して食道を円周方向に走査することができ、長手方向に低速で併進移動して、治療部位を画定してもよい。このプローブは、例えば、レーザ照射に先行して組織を撮像するための第1のチャネル2800c、治療のための第2のチャネル2800bおよびモニタリングのための第3のチャネル2800a、と3つ以上の光チャネルを含んでもよい。それぞれの光ファイバは独立して、バルーンを通して食道壁上に横断方向に撮像されるようにしてもよい。この結果として現れる出力ビームが、時計方向に回転すると未処置組織のサンプルを得るように撮像用ビームが処置ビームに十分に先行するように位置決めされる。モニタリングビームは、レーザスポット内に収まるように配置してもよい。3つのビームの初期の位置決めに続いて、これらの光学系をエポキシ樹脂で接着し、その配置を固定してもよい。
代表的な回転ジャンクション
【0066】
OFDIシステムにこの3チャネルカテーテルを接続することができる、本発明の代表的な実施の形態の回転カプラを図13に示す。このカプラは、2つの同心スプールで中継できるため、「時計バネ」回転ジャンクションと呼ぶ。例えば、内側スプール2900が一方向に回転するに従って、光ファイバは外側スプール2910から内側スプール2900上に巻き取られる。回転方向を反転させると、このファイバは内側スプールから巻き戻すことができる。リボン状の光ファイバを使用して、リボンの幅に合ったギャップが形成された2枚の平行プレート2920によって、巻取りが平坦に行なわれて、縺れないようにする。このプレートは反転となる前に、例えば100回転まで回転できるように十分な大きさを有してもよい。1mmのレーザスポットでは、長さが6cmの食道の部位を完全に治療する場合には60回転で行なうようにしてもよい。プレート径が10cm未満のものを使用できる。3つの光学チャネルを収納するだけでなく、本発明の本実施の形態の装置およびシステムではエアーギャップカプラから生じる損失および背面反射を回避できる。
代表的な高速データ収集および処理
【0067】
本発明のさらなる実施の形態のシステムおよび装置では、例えば高速撮像システムを使用することができる。代表的なデジタル収集および処理システムでは、リアルタイムでOFDI信号の収集、処理および記憶のためにVME−バスのハードウェアをベースに用いることができる。このような代表的なシステムおよび装置の代表的な部品には、シングルボードコンピュータに搭載された高速デジタイザとRAID記憶アレーに接続された光ファイバを有するVME筐体を含んでもよい。この代表的なシステムおよび装置はホストプロセッサ(例えばパーソナルコンピュータ)経由で制御できる。アナログOFDI信号はフィールド−プログラマブル−ゲート−アレー(FPGA)プロセッサ集積回路を搭載した広帯域レシーバー(例えば、12ビット、210MS/毎秒)を用いてデジタル化してもよい。OFDIシステムの2つの偏光チャネルに対して生データ速度は800MB/秒であるため、収集ボードに搭載されたプロセッサの処理能力が重要である。このFPGAプロセッサは、それぞれの偏光チャネルの信号を周波数領域から反射率対深度を表す1024素子アレー(一Aライン)に変換するように構成、またはプログラムすることができる。このデータは、後続の処理のため、および最終データをハードディスクのRAIDアレーへ転送することに先立って2つのチャネルを結合するために、シングルボードコンピュータへ渡される。最終的なデータ記憶速度は、例えば400MB/秒でもよい。データを複数のハードディスクにストライプすることにより、このデータ速度を連続的に持続できる。
【0068】
本発明による代表的な実施の形態の処理装置のソフトウェアによりこの代表的なシステムをユーザが制御することができ、またリアルタイムでダウンサンプル速度で画像の表示を行なうことができる。例えば、代表的なシステムは、全データ速度であるバーストモード、及び半データ速度である連続モードの、2つの代表的なモードで使用できる。代表的な内視鏡システムおよび装置は上述の部品およびソフトウェアを搭載することができる。さらに、位相シフト、複屈折、スペックルおよびドップラー信号のリアルタイムの演算を容易にするために、FPGAプロセッサおよびシングルボードプロセッサの両方をプログラムするさらなる手順(例えばソフトウェア)を提供できる。Vertex4 Pro FPGAとquadG4シングルボードコンピュータとを結合した演算能力は、モニタリング信号をリアルタイムで表示するために十分である。
代表的なレーザ
【0069】
式1を用いれば、走査速度を一定に保ちながらレーザ出力を4倍に増加させてスポットサイズを2倍にして組織内の温度分布を一定に保つことができる。一定のスポットサイズで速度を2倍にするには2倍のレーザ出力を使用することとなる。本発明の一代表的な実施の形態のレーザ装置は、単一エミッター半導体レーザダイオードを利用することができる。従来のデバイスは、波長制御用の回折格子を含む単式外部キャビティ設計を用いて、このスペクトル領域にわたり3Wを超えるレーザ出力を得ている。このレーザ出力および波長は、ポテンショメータからのアナログ信号に基づいてOFDIシステムのホスト処理装置経由で制御してもよい。このポテンショメータは、ユーザ(例えば内視鏡操作者)がレーザ損傷深度を増加或いは減少させるために使用できるハンドヘルドダイアルで構成してもよい。
代表的なユーザインターフェイス
【0070】
本発明の代表的な実施の形態のシステムおよび方法は、操作者に組織の断面画像を含むユーザインターフェイスを提供することができる。この画像は連続的に更新してもよく、モニタリング手順で決定した通りにレーザ治療のゾーンの指定とともに治療済みおよび次に来る未治療組織像を含んでもよい。このユーザインターフェイスはホスト収集装置上でプログラムされてもよく、FPGAプロセッサ並びにシングルボードコンピュータからの演算結果を使用することができる。画像およびレーザパラメータはRAIDアレーにアーカイブ保管してもよい。
【0071】
本発明のさらなる一代表的な実施の形態では、撮像システム/装置100は、図15のブロック図に示すように、光学スイッチ115を用いて3−ファイバプローブに接続できる。この代表的なプローブは、例えば図12を参照して説明したもののように、2つの撮像用ファイバと1つの治療用ファイバとを含むことができる。スイッチ115は、再治療画像と例えば治療時画像を取得するために使用することができる2つの撮像ファイバ120aと120bの一方から他方へと撮像用光を交互に投入する。治療用光源105は、治療用ファイバ125cに直接に投入してもよい。これらのファイバはカテーテル130に接続することができる。カテーテル130は、例えば、図12に示した代表的なカテーテルでもよい。撮像システム100からの信号は、光スイッチ115の状態を制御することができる。
【0072】
さらに、図16に示す本発明のその他の代表的な実施の形態では、代表的な撮像システム/装置200は、図12に示すもののような代表的な3ポートカテーテルに、2つの撮像ファイバ220aと220bの両方に光を結合することができる光学スプリッタ215経由で結合することができる。この代表的な撮像システムは、それぞれからの画像信号を経路長エンコーディング技術を用いて分離することができる。異なる経路長を作るため、光学遅延部材235を1つのファイバ220bの中あるいは複数のファイバの中に配置してもよい。治療用光源205は、カテーテルの治療用ファイバ225cに直接或いは間接的に投入することができる。
【0073】
さらに図17に示す本発明によるその他の代表的な撮像システム/装置800において、光は単一の波長分割マルチプレクサ810を用いて治療用光源805に結合してもよい。結合した光は、単一ファイバ型回転カプラに連結して、次いで図21に示すカテーテルなどの代表的な単一ファイバカテーテルに接続してもよい。
【0074】
さらに、図18に示す本発明のさらなる代表的な実施の形態の撮像システム/装置900では、単一モードファイバ901からの撮像システム900の光をデュアルファイバ911の単一モードコアに結合し、かつマルチモードファイバ906からの治療用ビームをデュアルクラッドファイバ911に結合するクラッディングモードカプラを用いて、光を治療用ビーム905と結合してもよい。
【0075】
図19に、3つの出力ファイバ405a、405b、405cを有する例えば図15および図16に概要を示したものなどのシステム400と、例えば図12に示したものなどの3ポートカテーテル415との、図13に示したもののようなマルチチャネル回転カプラ410経由の代表的な接続を示す。
【0076】
図20に、撮像用光と治療用光の両方を含む単一ファイバ305を単一チャネル回転カプラ310に結合した、本発明の代表的なシステム300の概略を示す。例えば、この光は回転カプラ310の後で、撮像用光を第1のファイバ332上へ分離しまた治療用光を第2のファイバ331上に分離する波長分割マルチプレクサ(WDM)330により分割される。撮像用光は、2つの撮像ポート336aと336bを受ける光スプリッタ335を用いてさらに分離してもよい。ファイバ331、336a、336bは図12に示すもののような設計の3ポートカテーテル325に接続することができる。カテーテル部分320は内視鏡を挿入できるように柔軟であり、またWDM330とスプリッタ335とを含む部分は保護のために硬質チューブ315の内部に収容されている。
【0077】
図21は、単一撮像用ビーム1125および単一モードファイバ1101からの独立した治療用ビーム1120を生成することができる本発明の代表的な実施の形態の遠端光学系の側面図である。例えば、撮像用および治療用の両光を含むファイバからの光は、最初に第1のGRINレンズ1100により集束する。次いでこの光は、治療用ビーム1120を生成するために治療用光波長を上方に誘導し、かつ撮像用光の波長を第2のGRINレンズ1110へ伝達する波長分割マルチプレクサプリズム1105を通過する。この第2のGRINレンズ1110は、撮像用光を交互に集束させて、撮像用ビーム1125を上方へ誘導する最終プリズム1115へ誘導する。プリズム1105及び1115の角度は、ビームが装置から適当な距離で重なり合うように設定される。
【0078】
図22は、本発明の代表的な実施の形態の3ポートカテーテルの側面図及び正面図である。この代表的なカテーテルは、ハウジング1040内のV字溝1020に含まれた3組の集束光学系1035に接続された3つのファイバ1005を有することができる。集束光学系はビームを集束させることができる。マイクロプリズム1025は、透明被覆1000により生じた非点収差を補正する円筒型レンズ1030を通してこの光ビームを上方へ再び誘導することができる。バルーン1010による軸出し機構を用いて、管腔組織1015内に光学系1035の心出しを維持してもよい。端面図にはモニタ用ビーム1050c、治療用ビーム1050bおよび撮像前用ビーム1050aが見られる。ハウジング1040は、図13に示されているものなどのマルチチャネル回転カプラによる回転に適応できるものである。
【0079】
図23は、撮像用ビームの回転を実現するためにマイクロモータ1260を利用する本発明の代表的な実施の形態のカテーテルの側面図である。例えば、このモータ1260は透明被覆1235に包まれている。モータシャフトの回転は、プリズム1220を回転することができる。撮像用光は、ファイバ1210を経由して遠端光学系に結合することができる。この遠端光学系では、光は集束光学系1215により集束し、反射器1225によりプリズム1220上へ反射される。プリズム1220の回転により撮像用ビームは円周方向に掃引される。モータ電気接続1205は、ファイバ1210と同じ管腔を通して行なうことができる。治療用光はファイバ1200上の遠端光学系に結合される。この治療用光は集束光学系1250を用いて集光され、プリズム1245によって内側被覆1235に対して固定回転角度で横方向に誘導される。このようにして、撮像用ビームは固定した治療用スポットの中を通って掃引を行なう。治療用スポットの併進移動は、外側被覆1240内で内側被覆1235の全体を回転させることにより実行する。この代表的な回転は、図13に示すカプラなどのマルチチャネル回転カプラを使用して行なうことができる。カテーテルは光コア1230の軸出し用のバルーン1255を使用できる。
【0080】
図24は、低出力波長可変光源600と、これに続く光出力を増幅する広帯域ブースタ増幅器605を用いて波長を変化させることができる、本発明の代表的な実施の形態のレーザ治療用光源のブロック図である。
【0081】
図25は、波長並びに偏光が異なる複数のレーザダイオード500a、500b500c、500dを組み込んだ代表的な実施の形態のレーザ治療用ビーム源およびその装置を実現するための代表的な手順のブロック図および機能図である。例えば、この光は偏光マルチプレクサ505a、505bおよび波長分割マルチプレクサ510により単一モードファイバ515へ結合できる。必要な場合は、この光をマルチモードファイバ520に結合させることができる。高速モードスクランブラ525を用いて、マルチモードファイバからの横モードパターン出力を高速でスクランブルすることができる。単一モードファイバへ光を出力するその他の光源用装置にも、光をマルチモードファイバに結合させる同様の設計を用いることができる。
【0082】
図26に、本発明の代表的な実施の形態の治療用光源およびその使用法を示す。例えば、複数の波長701a−gを有するレーザダイオードバー700を使用することができる。各導波路は、レンズ装置705、回折格子710および部分反射エンドミラー715を通して自由空間レーザキャビティーに結合できる。回折格子が波長を分散するため、各導波路で形成されたレーザは異なる波長のレーザ光となる。このため、導波路701a−gのそれぞれへの駆動電流を調節することにより、レーザ出力720およびスペクトル形状を調節できる。
【0083】
図28に示すように、本発明の更なる代表的実施の形態では、撮像およびモニタリング信号の検出を容易にするために、音響―光周波数シフタを使用して単一OFDIシステムを変調することができる。例えば、波長掃引レーザ光源3000は第1のスプリッタ3020により分離され、サンプルアーム経路および参照アーム経路を作る。サンプルアーム経路は第2のスプリッタ3030によりさらに分離される。このスプリッタの第1の出力は第1の周波数シフタ3061へ導かれ、第2の出力は第2の周波数シフタ3060へ導かれる。各周波数シフタは別々の周波数で駆動できる。第1の周波数シフタ3061からの光は、光サーキュレータ3071を通して、図13に示すような3ファイバ回転カプラ3110の撮像ファイバ3072に結合できる。第2の周波数シフタ3060からの光は、サーキュレータ3070を通して、同じ回転カプラのモニタリングファイバ3073に結合してもよい。
【0084】
独立した治療用レーザ3010を第3の治療用ファイバに結合できる。撮像ファイバ3072およびモニタリングファイバ3073に戻ってきた光は、光混合部3080で再結合し、次いで第2の混合部3090でレファレンスアーム光と混合し、その出力は一連の検出器3100に導かれる。周波数シフタにより、撮像用光に起因する干渉信号およびモニタリング光に起因する干渉信号は異なるキャリア周波数でエンコードされ、また従来の周波数領域技術により分離できる。
【0085】
図29Aは、サンプルの少なくとも一部分に関する情報を取得する、本発明の代表的な実施の形態の方法のフロー図である。例えば、ステップ3100において、サンプルの一部に温度変化が生じる。ステップ3110において、少なくとも一つの第1の電磁放射をサンプルの一部の近傍あるいは内部の部位に送出する。ステップ3120において、その部位の変形を複数の深度における(i)その部位から齎される少なくとも一つの第2の電磁放射の位相、および/または(ii)位相の変化レートおよび/または第2の電磁放射の振幅の関数として特定できる。
【0086】
図29Bは、サンプル中の温度分布を制御する本発明の他の代表的実施の形態の方法のフロー図である。例えば、ステップ3130において、特定波長の電磁放射をサンプルの部位に照射することができる。温度分布は、ステップ3140でその部位に電磁放射を照射する際にその特定波長を変更することにより制御できる。
【0087】
図29Cは、生体構造の少なくとも一部分にレーザ照射を行なうための本発明のさらに別の代表的な実施の形態の方法のフロー図である。例えば、ステップ3150ではレーザ放射ビームを当該部分に照射することができる。ここで、ビームの断面積は最大でもこの少なくとも一つの部分の全面積の略10分の1である。ステップ3160において、このビームを、(I)所定のパターンに基づく、(II)レーザ放射の波長を変調しながら、および/または(III)レーザ放射の照射深度をモニタしながら、その部位に照射することができる。
代表的な参考文献
【0088】
1.Devesa SS, Blot WJ and Fraumeni JF, Jr.、Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer(米国における食道及び胃部上皮性悪性腫瘍発生率の増加パターン、癌),1,998;83:2049−2053.
2. Barr H, Stone N and Rembacken B.、Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer(バレット食道の内視鏡治療)、Gut 2005;54:875−884.
3. Johnston MH.Technology insight: ablative techniques for Barrett’s esophagus − current and emerging trends.(技術的所見:バレット食道の切除技術−現在及び今後のトレンド)Nature Clinical Practice、Gastroenterology & Hepatology2005;2:323−330.
4. FaIk GW, Chittajallu R, Goldblum JR, Biscotti CV, Geisinger KR, Petras RE, Birgisson S, Rice TW and Richter JE.、Surveillance of patients with Barrett’s esophagus for dysplasia and cancer with balloon cytology.(バルーン細胞診によるバレット患者の異形成および癌調査)、Gastroenterology 1997;112: 1787−1797.
5. Spechler SJ.「バレット食道:この急増する問題を無視すべきか?」、Gastroenterology 1997;112:2138−2142.
6. Kubba AK, Poole NA and Watson A.assessment in management of Barrett’s esophagus(バレット食道管理におけるp53評価の役割)、Dig Dis Sci 1999;44:659−667.
7. Reid BJ.、neoplastic progression in Barrett’s esophagus(バレット食道におけるp53および腫瘍の進行)、Am J Gastroenterol 2001;96:1321−1323.
8. Sharma P, Weston AP, Topalovski M, Cherian R, Bhattacharyya A, Sampラインr RE.、Magnification chromoendoscopy for the detection of intestinal metaplasia and dysplasia in Barrett’s oesophagus(バレット食道における腸上皮化成および異形成検出のための拡大色素内視鏡検査法)、GUT 2003;52: 24−27.
9. Kuipers EJ and Haringsma J.、Diagnostic and therapeutic endoscopy. Journal of Surgical Oncology(診断および治療用内視鏡検査法)、Journal of Surgical Oncology、 2005;92:203−209.
10. Georgakoudi I, Jacobson BC, Van Dam J, Backman V, Wallace MB, Muller MG, Zhang Q, Badizadegan K, Sun D, Thomas GA,Perelman LT and FeId MS.、Fluorescence, reflectance, and light−scattering spectroscopy for evaluating dysplasia in patients with Barrett’s esophagus(バレット食道患者の異形成評価のための蛍光、反射率、および光散乱スペクトロスコピー)、Gastroenterology 2001;120: 1620−1629.
11. Adrain AL, Ter HC, Cassidy MJ, Schiano TD, Liu JB and Miller LS.、High− resolution endoluminal sonography is a sensitive modality for the identification of Barrett’s metaplasia(高分解能内腔超音波検査はバレット化成の特定に高感度なモダリティーである)、Gastrointest Endosc 1997;46: 147−151.
12. Canto MI.、Vital staining and Barrett’s esophagus(生体染色およびバレット食道)、Gastrointest Endosc 1999;49:S12−16.
13. Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang W, Hee MR,Flotte T, Gregory K, Puliafito CA and Fujimoto JG.、Optical coherence tomography(光コヒーレンストモグラフィー)、Science 1991;254: 1178−1181.
14. Tearney GJ, Brezinski ME, Bouma BE, Boppart SA, Pitvis C, Southern JF and Fujimoto JG.、In vivo endoscopic optical biopsy with optical coherence tomography(光コヒーレンストモグラフィーを用いた生体内内視鏡光生検)、Science 1997;276:2037−2039.
15. Evans JA, Poneros JM, Bouma BE, Bressner J, Halpern EF, Shishkov M,Lauwers GY, Mino−Kenudson M, Nishioka NS and Tearney GJ.、Optical Coherence Tomography to Identify Intramucosal Carcinoma and High Grade Dysplasia in Barrett’s Esophagus「バレット食道における粘膜内癌および高度異形成特定用光コヒーレンストモグラフィー」、Clinical Gastroenterology and Hepatology、 2005;4:38−43.
16. Poneros JM, Brand S, Bouma BE, Tearney GJ, Compton CC and Nishioka NS.、Diagnosis of Specialized Intestinal Metaplasia by Optical Coherence Tomography(光コヒーレンストモグラフィーによる特殊腸上皮化成の診断)、Clinical Gastroenterology and Hepatology 2005;4:38−43.
17. Brand S, Poneros JM, Bouma BE, Tearney GJ, Compton CC and Nishioka NS.、Optical Coherent Tomography in the Gastrointestinal Tract. Endoscopy(胃腸管における光コヒーレンストモグラフィー、内視鏡) 2000;32:796− 803.
18. de Boer JF, Cense B, Park BH, Pierce MC, Tearney GJ and Bouma BE.、Improved signal−to−noise ratio in spectral−domain compared with time−domain optical coherence tomography(時間領域光コヒーレンストモグラフィーに比較して信号対雑音比が改善されるスペクトル領域光コヒーレンストモグラフィー)、Optics Letters 2003;28:2067−2069.
19. Choma MA, Sarunic MV, Changhuei Y and Izatt JA.、Sensitivity advantage of swept source and Fourier domain optical coherence tomography(掃引型光源およびフーリエ領域光コヒーレンストモグラフィーの検出感度の利点)、Optics Express 2003;I I :2183−2189.
20. Leitgeb R, Hitzenberger CK and Fercher AF.、Performance of Fourier domain vs. time domain optical coherence tomography(フーリエ領域対時間領域光コヒーレンストモグラフィーの性能比較)、Optics Express 2003;I I :889−894.
21. Yun SH, Tearney GJ, de Boer JF, Iftimia N and Bouma BE.、High−speed optical frequency−domain imaging(高速光周波数領域撮像)、Optics Express 2003; 11 :2953−2963.
22. Yun SH, Boudoux C, Tearney GJ and Bouma BE.、High−speed wavelength−swept semiconductor laser with a polygon−scanner−based wavelength filter(ポリゴン走査型波長フィルターを有する高速波長掃引型半導体レーザ)、Optics Letters 2003;28: 1981−1983.
23. Oh WY, Yun SH, Tearney GJ and Bouma BE.、115 kHz tuning repetition rate ultrahigh−speed wavelength−swept semiconductor laser(115kHz共振繰返速度の超高速波長掃引型半導体レーザ)、Optics Letters 2005;30:3159− 3161.
24. Vakoc BJ, Yun SH, de Boer JF, Teamey GJ and Bouma BE.、Phase−resolved optical frequency domain imaging(位相分解光周波数領域撮像)、Optics Express 2005;13:5483−5493.
25. Brown SB, Brown EA and Walker I.、The present and future role of photodynamic therapy in cancer treatment(癌治療における光力学療法の現在および未来の役割)、Lancet Oncol 2004;5:497−508.
26. van den Boogert J, van Hillegersberg R, Siersema PD, de Bruin RW and Tilanus HW.、Endoscopic ablation therapy for Barrett’s esophagus with high−grade dysplasia: a review(高度異形成バレット食道の内視鏡アブレーション治療:検討)、Am J Gastroenterol 1999;94: 1153−1160.
27. Sampラインr RE, Fennerty B and Garewal HS.、Reversal of Barrett’s esophagus with acid suppression and multipolar electrocoagulation: preliminary results(酸抑制および多極電気凝固法によるバレット食道の好転:中間結果)、Gastrointest Endosc 1996;44:532−535.
28. Sampラインr RE.、Endoscopic ablative therapy for Barrett’s esophagus(バレット食道の内視鏡アブレーション治療法)、Gastrointest Endosc、2004;59:66−69.
29. Soetikno RM, Gotoda T, Nakanishi Y and Soehendra N.、Endoscopic mucosal resection(内視鏡的粘膜切除術)、Gastrointest Endosc 2003;57:567−579.
30. Ganz RA, Utley DS, Stern RA, Jackson J, Batts KP and Termin P.、Complete ablation of esophageal epithelium with a balloon−based bipolar electrode: a phased evaluation in the porcine and in the human esophagus(バルーン型2電極を用いた食道上皮の完全アブレーション:豚及びヒト食道における位相化評価)、Gastrointest Endosc 2004;60:1002−1010.
31. Mark H. Johnston, Brooks D. Cash, Cathy A. Dykes, Halisha S. Mays and Lavonne R. Johnston、Cryoablation of Dysplasia in Barrett’s Esophagus (BE) and Early Stage Esophageal Cancer「バレット食道(BE)における異形成および初期食道癌のクライオアブレーション術」、Gastrointest Endosc 2006 ;63: AB223.
32. Overholt BF, Panjehpour M and Haydek JM.、Photodynamic therapy for Barrett’s esophagus「バレット食道の光力学的治療法:100名の患者の追跡調査」、Gastrointest Endosc 1999;49:1−7.
33. Vogel A and Venugopalan V.、Mechanisms of pulsed laser ablation of biological tissues(生体組織のパルスレーザアブレーションのメカニズム)、Chemical Reviews 2003;103:2079−2079.
34. McKenzie AL.、Physics of thermal processes in laser−tissue interactions(レーザ−組織相互作用における熱過程の物理)、Physics in Medicine & Biology 1990;35: 1 175−1209.
35. Anderson RR and Parrish JA.、Selective photothermolysis: precise microsurgery by selective absorption of pulsed radiation(選択性光熱分解:パルス化放射の選択吸収を用いた精密マイクロサージェリー)、Science 1983;220:524−527.
36. Jacques SL.、Role of tissue optics and pulse duration on tissue effects during high− 出力 laser irradiation(高出力レーザ照射時間における組織効果に対する組織光学とパルス時間の役割)、Applied Optics、 1993;32:2447−2454.
37. Nahen K and Vogel A.、Investigations on acoustic on−line monitoring of IR laser ablation of burned skin(熱傷皮膚のIRレーザアブレーションの音響オンラインモニタリングの研究)、Lasers in Surgery & Medicine 1999;25:69−78.
38. Jerath MR, Kaisig D, Rylander HG, 3rd and Welch AJ.、Calibrated real−time control of lesion size based on reflectance images(校正手法を用いた反射率画像に基づく病変サイズのリアルタイム制御法)、Applied Optics 1993;32:1200−1209.
39. Jerath MR, Gardner CM, Rylander HG, 3rd and Welch AJ.、Dynamic optical property changes: implications for reflectance feedback control of photocoagulation(動力学的光学特性の変化:光凝固の反射率フィードバック制御に対する影響)、Journal of Photochemistry & Photobiology B − Biology 1992;16: 113−126.
40. Deckelbaum LI.、Coronary laser angioplasty(冠状動脈レーザ造影法)、Lasers in Surgery & Medicine 1994;14: 101−110.
41. Kim BM, Feit MD, Rubenchik AM, Mammini BM and Da Silva LB.、Optical feedback signal for ultra short laser pulse ablation of tissue(組織の超短レーザパルスアブレーションに対する光フィードバック信号)、Applied Surface Science 1998;127−129:857−862.
42. Brinkmann R, Hansen C, Mohrenstecher D, Scheu M and Birngruber R.、Analysis of cavitation dynamics during pulsed laser tissue ablation by optical on−line monitoring(光オンラインモニタリングによるパルス化レーザ組織アブレーション時間におけるキャビテーション力学の分析)、Selected Topics in Quantum Electronics, IEEE Journal of 1996;2:826.
43. Whelan WM, Davidson SRH, Chin LCL and Vitkin IA.、A Novel Strategy For Monitoring Laser Thermal Therapy Based on Changes in Optothermal Properties of Heated Tissues(加熱組織の光熱特性変化に基づいたレーザ熱治療法のモニタリングのための新方策)、International Journal of Thermophysics 2005;26:233−241.
44. Boppart SA, Herrmann J, Pitris C, Stamper DL, Brezinski ME and Fujimoto JG.、High−resolution optical coherence tomography−guided laser ablation of surgical tissue(高分解能光コヒーレンストモグラフィーによる誘導を用いた手術組織のレーザアブレーション術)、Journal of Surgical Research 1999;82:275−284.
45. Thomsen SL, Jacques SL and Flock ST.、Microscopic correlates of macroscopic optical property changes during thermal coagulation of myocardium(心筋の熱凝固期間における巨視光学特性の変化の微視要因)、Proceedings of the SPIE 1990;1202:2−1 1 .
46. Maitland DJ and Walsh JT, Jr、Quantitative measurements of linear birefringence during heating of native collagen(天然コラーゲンの加熱期間における線形複屈折の定量測定法)、Lasers Surg Med 1997;20:310−318.
47. Kimel S, Svaasand LO, Hammer−Wilson M, Schell MJ, Milner TE, Nelson JS and Berns MW.、Differential vascular response to laser photothermolysis(血管のレーザ光熱分解に対する微分応答)、Journal of Investigative 皮膚科学 1994;103:693−700.
48. Khan MH, Sink RK, Manstein D, Eimerl D and Anderson RR.、Intradermally focused infrared laser pulses: Thermal effects at defined tissue depths(皮膚内集束赤外レーザ:規定の組織深度における熱効果)、Lasers in Surgery and Medicine 2005;36:270−280.
49. Neumann RA, Knobler RM, Pieczkowski F and Gebhart W.、Enzyme histochemical analysis of cell viability after argon laser−induced coagulation necrosis of the skin(皮膚のアルゴンレーザ誘発凝固壊死後の細胞生存率の酵素を用いた組織化学的分析法)、Journal of the American Academy of Dermatology、1991;25:991−998.
50. Nadkarni S, HeIg T, Bouma BE, Chan RC, Minsky MS, Chau AH, Motz J, Houser SL and Tearney GJ.、Characterization of atherosclerotic plaques by laser speckle analysis(レーザスペックル分析による動脈硬化性プラークの特性解析法)、Circulation 2005; 112:885−892.
51. Zimnyakov DA, Agafonov DN, Sviridov AP, Omel’chenko AI, Kuznetsova LV and Bagratashvili VN.、Speckle−contrast monitoring of tissue thermal modification(組織の熱変化のスペックルコントラストモニタリング)、Appl Opt 2002;41 :5989−5996.
52. Pierce MC, Sheridan RL, Park BH, Cense B and de Boer JF.、Collagen denaturation can be quantified in burned human skin using polarization−sensitive optical coherence tomography(熱傷ヒト皮膚のコラーゲンの変性は偏光検出光コヒーレンストモグラフィーを用いて定量化できる)、Burns 2004;30:511−517.
53. de Boer JF, Milner TE, van Gemert MJC and Nelson JS.、Two−dimensional birefringence imaging in biological tissue using polarization sensitive optical coherence tomography(偏光検出光コヒーレンストモグラフィーを用いた生体組織の2次元複屈折撮像法)、Optics Letters 1997;22:934−936.
54. Morelli JG, Tan OT, Garden J, Margolis R, Seki Y, Boll J, Carney JM, Anderson RR, Furumoto H and Parrish JA.、Tunable dye laser (577 nm) treatment of port wine stains(ポートワイン母斑の共振色素レーザ(577nm)を用いた治療術)、Lasers Surg Med 1986;6:94−99.
55. Chen ZP, Milner TE, Dave D and Nelson JS.、Optical Doppler tomographic imaging of fluid flow velocity in highly scattering media(強散乱媒体中の流体流速の光ドップラートモグラフィーによる撮像法)、Optics Letters 1997;22:64−66.
56. Izatt JA, Kulkarni MD, Yazdanfar S, Barton JK and Welch AJ.、In vivo bidirectional color Doppler flow imaging of picoliter blood volumes using optical coherence tomography(光コヒーレンストモグラフィーを用いたピコリッター血液量の生体内二方向カラードップラーフロー撮像法)、Optics Letters 1997;22:1439.
57. Barton JK, Welch AJ and Izatt JA.、Investigating pulsed dye laser−blood vessel interaction with color Doppler optical coherence tomography(カラードップラー光コヒーレンストモグラフィーを用いたパルス色素レーザ−血管相互作用の研究)、Optics Express 1998;3:251−256.
58. French PMW, Rizvi NH, Taylor JR and Shestakov AV.、Continuous−wave mode− locked Cr4+:YAG laser(連続波、モード同期Cr4+:YAGレーザ)、Optics Letters 1993;18:39−41.
59. Sennaroglu A, Pollock CR and Nathel H.、Efficient continuous−wave chromium− doped YAG laser(高効率連続波、クロムドープYAGレーザ)、Journal of the Optical Society of America B 1995;12:930−937.
60. Bouma B, Gouveia−Neto A, Izatt JA, Russell J, Sierra R, Keller U and Fujimoto JG.、Hybrid mode locking of a flash−lamp−pumped Ti:A12O3 laser(フラッシュランプポンプ型Ti:A12O3レーザのハイブリッドモード同期法)、Optics Letters 1994;19: 1858−1860.
61. Bouma B, Tearney GJ, Boppart SA, Hee MR, Brezinski ME and Fujimoto JG.、High−resolution optical coherence tomographic imaging using a mode−locked Ti:A12O3 laser source(モード同期Ti:A12O3光源を用いた高分解能光コヒーレンストモグラフィー撮像法)、Optics Letters 1995;20: 1486−1488.
62. Bouma BE and Fujimoto JG.、Compact Kerr−lens mode−locked resonators(小型カーレンズモード同期共振器)、Optics Letters、 1996;21 : 134−136.
63. Bouma BE, Nelson LE, Tearney GJ, Jones DJ, Brezinski ME and Fujimoto JG.、Optical coherence tomographic imaging of human tissue at 1.55 μm and 1.81 μm using Er and Tm−doped fiber sources(Er及びTmドープファイバ光源を用いたヒト組織の1.55μmおよび1.81μmにおける光コヒーレンストモグラフィー撮像法)、Journal of Biomedical Optics 1998;3:76−79.
64. Bouma BE, Ramaswamy−Paye M and Fujimoto JG.、Compact resonator designs for mode−locked solid−state lasers(モード同期固体レーザのための小型共振器の設計)、Applied Physics B (Lasers and Optics)1997;65:213−220.
65. Bouma BE, Tearney GJ, Bilinsky IP, Golubovic B and Fujimoto JG.、Self−phase− modulated Kerr−lens mode−locked Cπ forsterite laser source for optical coherence tomography(自己位相変調カーレンズ、モード同期型Cπフォルステライトレーザ光源)、Optics Letters 1996;21 :1839−1841.
【0089】
前述の説明は単に本発明の原理を例示したに過ぎない。本明細書の説明を考慮して、記載された実施の形態に種々の変更や改変を加えることは、当業者にとって明白である。
実際に、本発明の代表的な実施の形態による装置、システム、および方法は、どのようなOCTシステム、OFDIシステム、スペクトル領域OCT(SD−OCT)システム、または他の画像化システム、例えば、2004年9月8日出願の国際特許出願第PCT/US2004/029148号、2005年11月2日出願の米国特許出願第11/266,779号、および2004年7月9日出願の米国特許出願第10/501,276号に記載されているものに対しても使用および/または実施可能であり、これらの開示の全てを本明細書の一部として援用する。従って、当業者にとっては、本明細書に明確に提示又は説明されていなくとも、本発明の原理を具現化する数多くのシステム、装置、及び方法に工夫を凝らすことが可能であり、これは本発明の趣旨と範囲内に含まれることが理解されるであろう。さらに、上述の明細書に前記の先行技術の知識が明示的に援用されていない範囲においても、その全体を明示的に本明細書に援用する。本明細書で引用した上述の全ての文献は、その全体を本明細書の一部として援用する。
【図面の簡単な説明】
【0090】
【図1A】図1Aは、本発明の代表的な実施の形態のOFDIバルーンカテーテルの概略図である。
【図1B】図1Bは、図1Aに示したOFDIバルーンカテーテルの写真である。
【図2】図2Aは、本発明の代表的な実施の形態のOFDIバルーンカテーテルを用いて得られた、豚の食道の代表的な斜視画像である。図2Bは、図2Aに示した豚の食道の代表的な上面画像である。図2Cは、図2Aに示した豚の食道の代表的な側面画像である。
【図3】図3は、本発明の代表的な実施の形態のBE技術を用いて被験者から取得した代表的なOFDI画像である。
【図4】図4は、本発明の代表胃的な実施の形態の、組織を治療及びモニタリングする代表的な装置及びその使用法の概略図である。
【図5】図5は、図4に示した代表的な装置を使用して得られた、複数の代表的なM−モードOFDI位相画像と対応する組織像のセットである。
【図6】図6Aは、本発明の代表的な実施の形態の、併進するサンプルについて得られたOFDIデータに関連する代表的な画像である。図6Bは、本発明の代表的な実施の形態の、併進するサンプルについて得られたOFDIデータに関連する代表的な画像である。図6Cは、本発明の代表的な実施の形態の、併進するサンプルについて得られたOFDIデータに関連する代表的な画像である。図6Dは、本発明の代表的な実施の形態の、併進するサンプルについて得られたOFDIデータに関連する代表的な画像である。
【図7】図7Aは、本発明の代表的な実施の形態を用いて得られた、代表的なレーザ治療前のOFDI画像である。図7Bは、本発明の代表的な実施の形態を用いて得られた、代表的なレーザ治療前の複屈折画像である。図7Cは、本発明の代表的な実施の形態を用いて得られた、代表的なレーザ治療後のOFDI画像である。図7Dは、本発明の代表的な実施の形態を用いて得られた、代表的なレーザ治療後の複屈折画像である。
【図8】図8は、本発明の代表的な実施の形態を用いて得ることができる、豚の食道の生体から得た総合的なデータセットから抽出した代表的な血管マップの画像である。
【図9】本発明の代表的な実施の形態を用いて得た、代表的な豚の食道の生体ドップラー血流画像である。
【図10】本発明の代表的な実施の形態を用いて得た、水の吸収係数と対応する貫通深度を波長の関数としたグラフである。
【図11】本発明の他の代表的な実施の形態の2ビームカテーテルプローブの概略図である。
【図12】本発明のさらに他の代表的な実施の形態の3ビームカテーテルプローブの略側面図及び正面図である。
【図13】本発明の代表的な実施の形態の時計バネマルチチャネル光学回転ジャンクションの斜視図である。
【図14】本発明の代表的な実施の形態を用いて得たユーザにフィードバックを行うことができる画像の概念レンダリングである。
【図15】本発明のさらなる代表的な実施の形態の、光学スイッチを統合したOFDIシステムのサンプルアームのブロック図である。
【図16】本発明のさらなる代表的な実施の形態の、光学スプリッタを統合したOFDIシステムのサンプルアームのブロック図である。
【図17】本発明のさらなる代表的な実施の形態の、単一波長分割マルチプレクサを統合したOFDIシステムのサンプルアームのブロック図である。
【図18】本発明のさらなる代表的な実施の形態の、クラッディングモードカプラおよびデュアルクラッドファイバを統合したOFDIシステムのサンプルアームのブロック図である。
【図19】本発明の代表的な実施の形態の、3ポート回転カプラおよびカテーテルのブロック図である。
【図20】本発明の他の代表的な実施の形態の、治療用光を続けてデマルチプレクスして、撮像光をスプリットすることができる、単一ファイバ回転カプラのブロック図である。
【図21】本発明の代表的な実施の形態の、2ビームインラインカテーテルプローブの概略及び使用図である。
【図22】本発明の代表的な実施の形態の、3ビームカテーテルプローブとバルーンカテーテルの正面図及び側面図である。
【図23】本発明の代表的な実施の形態の、低速回転可能な治療用ビームと高速走査撮像用ビームを生成可能なマイクロモータをベースとした構成部の側面図である。
【図24】本発明の代表的な実施の形態の、広帯域ブースタ増幅器が続く低出力波長可変光源を統合した治療用光源のブロック図である。
【図25】本発明の他の代表的な実施の形態の、波長及び偏光の異なる複数のレーザダイオード(LD)を統合した治療用光源のブロック図である。
【図26】本の代表的な実施の形態の、レーザダイオードバーを統合した波長可変治療用光源とこれによって生成したものを示す図である。
【図27】OFDIビームを組織の表面にわたって繰り返し走査することができる検流計式スキャナを含む他の代表的な実施の形態のシステムとその使用法を示す側面図である。
【図28】音響光周波数シフタによる撮像信号とモニタリング信号を検出するために使用可能な本発明のさらなる代表的な実施の形態のOFDIシステムの概略図である。
【図29A】本発明の代表的な実施の形態のサンプルの少なくとも一部分に関する情報を取得する方法のフロー図である。
【図29B】本発明の他の代表的な実施の形態のサンプルの温度分布を制御する方法のフロー図である。
【図29C】本発明のさらに他の代表的な実施の形態の生物構造の少なくとも一部分にレーザ放射を照射する方法のフロー図である。
【特許請求の範囲】
【請求項1】
サンプルの少なくとも一部分に関する情報を取得する処理であって、
前記サンプルの前記少なくとも一部分に温度変化を引き起こすステップと、
少なくとも一つの電磁放射を前記サンプルの前記少なくとも一部分の近傍または内部の部位に送出するステップと、
複数の深度における前記部位の変形を、(i)前記部位からもたらされる少なくとも一つの第2の電磁放射の位相、又は(ii)前記少なくとも一つの第2の電磁放射の前記位相又は振幅の少なくとも一つの変化のレート、の少なくとも一つの関数として特定するステップと、を含む処理。
【請求項2】
さらに、前記少なくとも一つの第2の電磁放射に関する干渉信号を生成するステップと、
前記干渉信号を用いて、前記少なくとも一つの第2の電磁放射の前記位相を決定するステップと、を含む、請求項1記載の処理。
【請求項3】
さらに、前記干渉信号を前記少なくとも一つの第2の電磁放射の波長の関数として測定するステップを含む、請求項2記載の処理。
【請求項4】
前記少なくとも一つの第1の電磁放射が、時間とともに変化する波長を有する、請求項1記載の処理。
【請求項5】
前記温度変化は、レーザ構成部を用いて引き起こす、請求項1記載の処理。
【請求項6】
さらに、前記サンプルの少なくとも一つの変化した部分と変化しない部分との間の境界を前記変形に関する情報の関数として画定する、請求項1記載の処理。
【請求項7】
前記サンプルは生物構造体であって、
前記少なくとも一つの変化した部分は変性した部分、損傷した部分、破壊された部分の少なくとも一つである、請求項6記載の処理。
【請求項8】
さらに、前記少なくとも一つの第2の電磁放射に関する干渉信号を生成するステップと、
前記干渉信号を用いて前記少なくとも一つの第2の電磁放射の振幅を決定するステップと、を含む、請求項1記載の処理。
【請求項9】
さらに、前記干渉信号を前記少なくとも一つの第2の電磁放射の波長の関数として測定するステップを含む、請求項8記載の処理
【請求項10】
第1の電磁放射は前記サンプルの前記部位に特定の波長で送出され、
前記少なくとも一つの第1の電磁放射を送出している間、前記サンプルの温度分布を、前記電磁放射の前記特定の波長を変更することによって制御するステップを含む、請求項1記載の処理。
【請求項11】
前記温度変化を引き起こすステップは、電磁放射のレーザ放射のビームを前記部位に適用するステップを含み、
前記ビームの断面積は最大で、前記部位の全体の面積の略10分の1であり、さらに、
(i)所定のパターンに基づく、(ii)前記レーザ放射の波長を変調しながら、又は、(iii)前記レーザ放射を適用する深度をモニタしながら、の少なくとも一つで、前記ビームを前記少なくとも一部分に適用するステップを含む、請求項1記載の処理。
【請求項12】
サンプルの温度分布を制御する処理であって、
(a)電磁放射を特定の波長で前記サンプルの部位に照射するステップと、
(b)前記ステップ(a)の間に、前記電磁放射の前記特定の波長を変更することによって、前記温度分布を制御するステップと、を含む処理。
【請求項13】
さらに、(c)ステップ(a)に先だって、前記サンプルの前記部位の近傍又は内部にある、前記サンプルの少なくとも一部分に温度変化を引き起こすステップと、
(d)複数の深度における前記少なくとも一部分の変形を、(i)前記少なくとも一部分からもたらされる少なくとも一つの電磁放射の位相、又は(ii)前記少なくとも一つのさらなる電磁放射の前記位相又は振幅の少なくとも一つの変化のレート、の少なくとも一つの関数として特定するステップと、を含む、請求項12記載の処理。
【請求項14】
前記ステップ(b)は、前記電磁放射のレーザ放射のビームを前記部位に適用するステップを含み、
前記ビームの断面積は最大で、前記部位の全体の面積の略10分の1であり、さらに、(e)(i)所定のパターンに基づく、(ii)前記レーザ放射の波長を変調しながら、又は、(iii)前記レーザ放射を適用する深度をモニタしながら、の少なくとも一つで、前記ビームを前記少なくとも一部分に適用するステップを含む、請求項12記載の処理。
【請求項15】
前記特定の波長を変更すると、前記サンプルの少なくとも一部分の損傷の分布が変化する、請求項12記載の処理。
【請求項16】
前記温度分布をさらに、前記電磁放射の出力を変更することによって制御する、請求項12記載の処理。
【請求項17】
前記特定の波長を、(1)略1.35μmから1.5μm、又は(ii)略1.7μmから2.2μmの範囲で変更する、請求項12記載の処理。
【請求項18】
前記温度分布はほぼ、水による前記電磁放射の吸収によるものである、請求項12記載の処理。
【請求項19】
前記電磁放射は、ツリウムレーザ増幅器構成部又はエルビウムレーザ増幅器の少なくとも一つによって提供される、請求項12記載の処理。
【請求項20】
前記特定の波長を変更するレートは略毎秒10nmより多い、請求項12記載の処理。
【請求項21】
前記特定の波長は、非無作為に変更する、請求項12記載の処理。
【請求項22】
サンプルの少なくとも一部分に関する情報を取得するシステムであって、
前記サンプルの前記少なくとも一部分に温度変化を引き起こすように構成された第1の構成部と、
少なくとも一つの電磁放射を前記サンプルの前記少なくとも一部分の近傍または内部の部位に送出する第2の構成部と、
複数の深度における前記部位の変形を、(i)前記部位からもたらされる少なくとも一つの第2の電磁放射の位相、又は(ii)前記少なくとも一つの第2の電磁放射の前記位相又は振幅の少なくとも一つの変化のレート、の少なくとも一つの関数として特定する第3の構成部と、を含むシステム。
【請求項1】
サンプルの少なくとも一部分に関する情報を取得する処理であって、
前記サンプルの前記少なくとも一部分に温度変化を引き起こすステップと、
少なくとも一つの電磁放射を前記サンプルの前記少なくとも一部分の近傍または内部の部位に送出するステップと、
複数の深度における前記部位の変形を、(i)前記部位からもたらされる少なくとも一つの第2の電磁放射の位相、又は(ii)前記少なくとも一つの第2の電磁放射の前記位相又は振幅の少なくとも一つの変化のレート、の少なくとも一つの関数として特定するステップと、を含む処理。
【請求項2】
さらに、前記少なくとも一つの第2の電磁放射に関する干渉信号を生成するステップと、
前記干渉信号を用いて、前記少なくとも一つの第2の電磁放射の前記位相を決定するステップと、を含む、請求項1記載の処理。
【請求項3】
さらに、前記干渉信号を前記少なくとも一つの第2の電磁放射の波長の関数として測定するステップを含む、請求項2記載の処理。
【請求項4】
前記少なくとも一つの第1の電磁放射が、時間とともに変化する波長を有する、請求項1記載の処理。
【請求項5】
前記温度変化は、レーザ構成部を用いて引き起こす、請求項1記載の処理。
【請求項6】
さらに、前記サンプルの少なくとも一つの変化した部分と変化しない部分との間の境界を前記変形に関する情報の関数として画定する、請求項1記載の処理。
【請求項7】
前記サンプルは生物構造体であって、
前記少なくとも一つの変化した部分は変性した部分、損傷した部分、破壊された部分の少なくとも一つである、請求項6記載の処理。
【請求項8】
さらに、前記少なくとも一つの第2の電磁放射に関する干渉信号を生成するステップと、
前記干渉信号を用いて前記少なくとも一つの第2の電磁放射の振幅を決定するステップと、を含む、請求項1記載の処理。
【請求項9】
さらに、前記干渉信号を前記少なくとも一つの第2の電磁放射の波長の関数として測定するステップを含む、請求項8記載の処理
【請求項10】
第1の電磁放射は前記サンプルの前記部位に特定の波長で送出され、
前記少なくとも一つの第1の電磁放射を送出している間、前記サンプルの温度分布を、前記電磁放射の前記特定の波長を変更することによって制御するステップを含む、請求項1記載の処理。
【請求項11】
前記温度変化を引き起こすステップは、電磁放射のレーザ放射のビームを前記部位に適用するステップを含み、
前記ビームの断面積は最大で、前記部位の全体の面積の略10分の1であり、さらに、
(i)所定のパターンに基づく、(ii)前記レーザ放射の波長を変調しながら、又は、(iii)前記レーザ放射を適用する深度をモニタしながら、の少なくとも一つで、前記ビームを前記少なくとも一部分に適用するステップを含む、請求項1記載の処理。
【請求項12】
サンプルの温度分布を制御する処理であって、
(a)電磁放射を特定の波長で前記サンプルの部位に照射するステップと、
(b)前記ステップ(a)の間に、前記電磁放射の前記特定の波長を変更することによって、前記温度分布を制御するステップと、を含む処理。
【請求項13】
さらに、(c)ステップ(a)に先だって、前記サンプルの前記部位の近傍又は内部にある、前記サンプルの少なくとも一部分に温度変化を引き起こすステップと、
(d)複数の深度における前記少なくとも一部分の変形を、(i)前記少なくとも一部分からもたらされる少なくとも一つの電磁放射の位相、又は(ii)前記少なくとも一つのさらなる電磁放射の前記位相又は振幅の少なくとも一つの変化のレート、の少なくとも一つの関数として特定するステップと、を含む、請求項12記載の処理。
【請求項14】
前記ステップ(b)は、前記電磁放射のレーザ放射のビームを前記部位に適用するステップを含み、
前記ビームの断面積は最大で、前記部位の全体の面積の略10分の1であり、さらに、(e)(i)所定のパターンに基づく、(ii)前記レーザ放射の波長を変調しながら、又は、(iii)前記レーザ放射を適用する深度をモニタしながら、の少なくとも一つで、前記ビームを前記少なくとも一部分に適用するステップを含む、請求項12記載の処理。
【請求項15】
前記特定の波長を変更すると、前記サンプルの少なくとも一部分の損傷の分布が変化する、請求項12記載の処理。
【請求項16】
前記温度分布をさらに、前記電磁放射の出力を変更することによって制御する、請求項12記載の処理。
【請求項17】
前記特定の波長を、(1)略1.35μmから1.5μm、又は(ii)略1.7μmから2.2μmの範囲で変更する、請求項12記載の処理。
【請求項18】
前記温度分布はほぼ、水による前記電磁放射の吸収によるものである、請求項12記載の処理。
【請求項19】
前記電磁放射は、ツリウムレーザ増幅器構成部又はエルビウムレーザ増幅器の少なくとも一つによって提供される、請求項12記載の処理。
【請求項20】
前記特定の波長を変更するレートは略毎秒10nmより多い、請求項12記載の処理。
【請求項21】
前記特定の波長は、非無作為に変更する、請求項12記載の処理。
【請求項22】
サンプルの少なくとも一部分に関する情報を取得するシステムであって、
前記サンプルの前記少なくとも一部分に温度変化を引き起こすように構成された第1の構成部と、
少なくとも一つの電磁放射を前記サンプルの前記少なくとも一部分の近傍または内部の部位に送出する第2の構成部と、
複数の深度における前記部位の変形を、(i)前記部位からもたらされる少なくとも一つの第2の電磁放射の位相、又は(ii)前記少なくとも一つの第2の電磁放射の前記位相又は振幅の少なくとも一つの変化のレート、の少なくとも一つの関数として特定する第3の構成部と、を含むシステム。
【図1A】


【図1B】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29A】


【図29B】


【図29C】




【図1B】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29A】


【図29B】


【図29C】


【公開番号】特開2012−236078(P2012−236078A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−181098(P2012−181098)
【出願日】平成24年8月17日(2012.8.17)
【分割の表示】特願2008−553501(P2008−553501)の分割
【原出願日】平成19年2月1日(2007.2.1)
【出願人】(592017633)ザ ジェネラル ホスピタル コーポレイション (177)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成24年8月17日(2012.8.17)
【分割の表示】特願2008−553501(P2008−553501)の分割
【原出願日】平成19年2月1日(2007.2.1)
【出願人】(592017633)ザ ジェネラル ホスピタル コーポレイション (177)
【Fターム(参考)】
[ Back to top ]

