コードされた多重粒子での比較ゲノムハイブリダイゼーション
【課題】コードされた多重粒子での比較ゲノムハイブリダイゼーションの提供。
【解決手段】本明細書で開示されるのは、a)ゲノムDNA試料を提供するステップと、b)粒子混合物を提供するステップであって、混合物は異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、混合物は複数の異なるゲノム遺伝子座に対するプローブを集合的に含むステップと、c)ハイブリダイゼーション条件下で粒子混合物の一部分に試料を接触させるステップと、d)検出可能な標識をモニタリングすることにより混合物のそれぞれの一部分中の粒子に対する試料のハイブリダイゼーションを評価するステップであって、モニタリングからのシグナルは検討する各ゲノム遺伝子座のコピー数を示すステップとを含む、ゲノムDNAの評価方法に関する。
【解決手段】本明細書で開示されるのは、a)ゲノムDNA試料を提供するステップと、b)粒子混合物を提供するステップであって、混合物は異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、混合物は複数の異なるゲノム遺伝子座に対するプローブを集合的に含むステップと、c)ハイブリダイゼーション条件下で粒子混合物の一部分に試料を接触させるステップと、d)検出可能な標識をモニタリングすることにより混合物のそれぞれの一部分中の粒子に対する試料のハイブリダイゼーションを評価するステップであって、モニタリングからのシグナルは検討する各ゲノム遺伝子座のコピー数を示すステップとを含む、ゲノムDNAの評価方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の引用)
本願は、2005年12月23日に出願された米国出願第60/753,584号、2005年12月23日に出願された米国出願第60/753,822号、2006年2月3日に出願された米国出願第60/765,311号、および2006年2月3日に出願された米国出願第60/765,355号に対する優先権を主張する。これらの各々の内容は、本明細書中に参考として援用される。
【背景技術】
【0002】
(背景)
比較ゲノムハイブリダイゼーション(CGH)は、ゲノム量を評価する方法である。CGHは、例えば、先天性異常、遺伝性疾患および癌を分析するのに使用することができる。
【発明の概要】
【課題を解決するための手段】
【0003】
(要旨)
本発明者らは、複数の試料を同時に評価するため、コードされた粒子を用いてゲノム量を評価する方法を発見した。いくつかの実施形態では、ゲノム量の差は、例えば、分析用DNAおよび参照DNAを単一の混合物に合わせることなく、未知の試料からのDNAおよび参照DNAを同時に評価して検出することができる。分析用DNAおよび参照DNAは、互いに別個のままである。複数の試料を、例えば、単一の標識により評価することができる。いくつかの他の実施形態では、単一の検出標識を使用して、分析用DNAおよび参照DNAを同一の混合物中で比較してゲノム量の差を検出する。分析用DNAおよび参照DNAは、例えば、異なる直接または間接標識を有することができる。該方法はまた、遺伝子発現分析のように、他の核酸、例えば、mRNAを評価するのに使用することもできる。
【0004】
1つの態様では、本開示は、ゲノムDNAの評価方法を特徴とする。該方法は、異なる粒子セットからの粒子を含む混合物を使用する。混合物が複数の異なるゲノム遺伝子座に対するプローブを集合的に含むように、各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有する。該方法は、ゲノムDNA試料および粒子混合物を提供すること、ハイブリダイゼーション条件下で粒子混合物の一部に試料を接触させること、検出可能な標識をモニタリングして、混合物のそれぞれの一部分の粒子と試料のハイブリダイゼーションを評価することを含むことができる。モニタリングからのシグナルは、検討する各ゲノム遺伝子座のコピー数を示す。
【0005】
1つを超える核酸試料(例えば、ゲノムDNAを含む試料)が提供され得る。例えば、各核酸試料を、該方法により評価することができる。試料は、別々のコンパートメントで評価することができる。いくつかの実施形態では、1つを超えるDNA試料を、同一のコンパートメントで評価することができる。
【0006】
いくつかの実施形態では、検出可能な標識は分光法により検出することができる。例示的な検出可能な標識は、フィコエリトリンまたは他の蛍光分子を含有することができる。
【0007】
いくつかの実施形態では、核酸ハイブリダイゼーションプローブは、クローン化核酸を含む、またはクローン化核酸から得られる。例えば、核酸ハイブリダイゼーションプローブは、細菌人工染色体(BAC)由来の核酸を含有することができる。BAC核酸は、ヒトゲノムDNAまたはヒト以外(例えば、マウス、ラット、ウサギ、モルモット、ハムスター、ヤギ、ウシ、イヌ、ネコ、ウマ、鳥、爬虫類、ヒト以外の霊長類(例えば、サルまたはヒヒ)、またはハエ)のゲノムDNAのセグメントを含有することができる。
【0008】
いくつかの実施形態では、核酸ハイブリダイゼーションプローブは、特定の染色体遺伝子座に特異的な1つまたは複数のオリゴヌクレオチド(例えば、オリゴヌクレオチドのコレクション)を含有することができる。例えば、プローブは、互いに50、20、5、2、1、または0.5メガ塩基対内にある配列に対し特異的であってよい。
【0009】
いくつかの実施形態では、少なくとも2、5、10、20、50、100、または200個の異なる粒子セットを使用して、例えば、異なる遺伝子座の各個数を評価することができる。いくつかの実施形態では、1個の粒子セットのコードされた粒子すべてが、同一のコードを有することができる。他の実施形態では、各粒子は固有のコードを有し、どの粒子がどの粒子セットにあるか、またはどのプローブが各粒子に結合されるかを示す情報が保存される。
【0010】
いくつかの実施形態では、複数の試料のうち少なくとも1つの試料は、検討する各ゲノム遺伝子座のコピー数がわかっている参照試料であってよい。該方法は、参照試料のモニタリングからのシグナルを他の試料からのシグナルと比較して、該試料の検討する各ゲノム遺伝子座のコピー数を判定することを含み得る。
【0011】
1つを超えるDNA試料が提供されるいくつかの実施形態では、各試料を第1の間接標識で標識することができ、各試料を第2の間接標識で標識された参照DNAと合わせることができる。参照DNAは、検討する各ゲノム遺伝子座のコピー数がわかっている参照源由来のゲノムDNAとすることができる。例えば、第1の間接標識はフルオレセインとすることができ、第2の間接標識はビオチンとすることができる。
【0012】
いくつかの実施形態では、評価は、(i)試料の第1の一部分(portion)に、単一の標識、および第1の間接標識を結合する薬剤を含む第1部分(moiety)を合わせること、ならびに(ii)試料の第2の一部分に、単一の標識、および第2の間接標識を結合する薬剤を含む第2部分を結合することを含み得る。例えば、第1部分は、ストレプトアビジンまたはアビジンおよび検出可能な標識(例えば、フィコエリトリン)を含み得、第2部分は、抗フルオレセイン抗体またはこの機能部分および検出可能な標識(例えば、フィコエリトリン)を含み得る。いくつかの実施形態では、各ゲノム試料の異なる粒子セットの各々からの少なくとも5、10、20、30、50、70、または100個の粒子が評価される。
【0013】
1つを超える試料が提供される場合、1つを超える試料はそれぞれ、マルチコンパートメントデバイスの異なるコンパートメント中にあってよい。いくつかの実施形態では、各試料は、マルチウェルプレートの異なるウェル中にあってよい。マルチウェルプレートは、96ウェル、384ウェル、または1024ウェルのアッセイプレートであってよい。
【0014】
該方法は、例えば、複数の異なる染色体遺伝子座においてヘテロ接合性を検出するのに使用することができ、染色体増幅が検出でき、ヘテロ接合性の欠損が検出でき、染色体遺伝子座のヘテロ接合性欠失が検出でき、染色体遺伝子座のホモ接合性欠失が検出できる。
【0015】
いくつかの実施形態では、粒子は、例えば、ハイブリダイゼーション後、ポリメラーゼに接触しない。いくつかの実施形態では、粒子は、例えば、ハイブリダイゼーション後、いずれの酵素にも接触しない。
【0016】
いくつかの実施形態では、ゲノムDNA試料は非標識であってもよい。該方法は、標識プローブをゲノム試料にハイブリダイズすることをさらに含むことができ、ゲノム遺伝子が試料に存在する場合、試料核酸鎖との標識プローブのハイブリダイゼーション、および粒子に結合した核酸ハイブリダイゼーションプローブとの試料核酸鎖のハイブリダイゼーションにより形成された複合体により標識プローブが粒子に固定化されるように、粒子に結合した核酸ハイブリダイゼーションプローブごとに、1つの標識プローブが同一のゲノム遺伝子座の遺伝的関連部位にハイブリダイズする。いくつかの実施形態では、標識プローブは、粒子に結合した核酸プローブとのゲノムDNA試料のハイブリダイズと同時にハイブリダイズすることができる。いくつかの実施形態では、標識プローブは、粒子に結合した核酸プローブとのゲノムDNA試料のハイブリダイズの後でハイブリダイズすることができる。
【0017】
いくつかの実施形態では、該方法は、1つのソースからのゲノムDNAを間接標識で標識してゲノムDNA試料を提供することをさらに含み得る。
【0018】
いくつかの実施形態では、例えば単一の検出可能な標識が使用される場合、該方法は、1つのソース由来のゲノムDNAを単一の標識で標識してゲノムDNA試料を提供することをさらに含み得る。該方法のいくつかの実施形態では、ゲノムDNA試料のすべてを、単一の標識で標識することができる。
【0019】
いくつかの実施形態では、未知のゲノム量を有するゲノムDNA試料のすべてを、同一の間接標識で標識することができる。いくつかの実施形態では、ゲノムDNA試料の大部分を、同一の間接標識で標識することができる。
【0020】
いくつかの実施形態では、該方法は、ハイブリダイゼーションを評価する前に粒子を攪拌することをさらに含み得る。
【0021】
例えば、粒子は、ホログラフ的にコードすることができ、または単一の検出標識のスペクトルとは分離可能なスペクトルを有する蛍光色素によりコードすることができる。該方法のいくつかの実施形態では、粒子は磁性を有し得る。例えば、粒子は常磁性ビーズである。
【0022】
別の態様では、本開示は、単一の検出可能な部分および1つの粒子混合物を用いるゲノムDNAの評価方法を提供する。混合物は、(複数の異なるゲノム遺伝子座に対するプローブを混合物が集合的に含むように、各粒子セットが、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有する)異なる粒子セットからの粒子を含む。該方法は、少なくとも1つの参照DNA試料および複数のゲノムDNA試料を提供することを含む。各試料は、同一の検出可能な部分で標識される。該方法はまた、ハイブリダイゼーション条件下で粒子混合物の一部に試料をそれぞれ接触させること、および検出可能な部分をモニタリングして、混合物のそれぞれの一部分の粒子と各試料のハイブリダイゼーションを評価することも含む。例えば、各試料は、別々の容器で粒子混合物と接触する。モニタリングからのシグナルは、検討する各ゲノム遺伝子座のコピー数を示すことができる。該方法は、本明細書に記載された他の特徴を含み得る。
【0023】
別の態様では、本開示は、単一の検出可能な部分および1つの粒子混合物を用いる核酸の評価方法を特徴とする。混合物は、(複数の異なるゲノム遺伝子座に対するプローブを混合物が集合的に含むように、各粒子セットが、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有する)異なる粒子セットからの粒子を含む。該方法は、第1の間接標識で標識された少なくとも1つの参照核酸試料、および複数のテスト核酸試料を提供することを含み得る。各試料は、第2の間接標識で標識される。該方法は、ハイブリダイゼーション条件下で粒子混合物の一部に各テスト試料および参照試料を接触させる(各テスト試料は、別々の容器で粒子混合物および参照試料に接触する)こと、各テスト試料の第1の一部分に、単一の標識、および第1の間接標識を結合する薬剤を含む第1部分を結合すること、各テスト試料の第2の一部分に、単一の標識、および第2の間接標識を結合する薬剤を含む第2部分を結合すること、試料の第1の一部分における単一の標識、および試料の第2の一部分における単一の標識をモニタリングして、各テスト試料を評価することを含み得る。モニタリングからのシグナルは、各標的のコピー数を示すことができる。該方法は、テスト試料ごとに、第1の一部分における単一の標識からのシグナルを、第2の一部分における単一の標識からのシグナルと比較して、参照試料に対するテスト試料中のプローブコピー数の指標を得ることを含み得る。該方法は、本明細書に記載された他の特徴を含み得る。
【0024】
別の態様では、本開示は、複数の異なるゲノム遺伝子座に対するプローブを混合物が集合的に含むように、各粒子セットが、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有することができる、異なる粒子セットからの粒子を含有する粒子混合物を提供する。
【0025】
いくつかの実施形態では、遺伝子座の少なくともいくつかに対するプローブは、細菌人工染色体DNAを含有することができる。いくつかの実施形態では、遺伝子座の少なくともいくつかに対するプローブは、超音波処理した細菌人工染色体DNAを含有することができる。いくつかの実施形態では、遺伝子座の少なくともいくつかに対するプローブは、合成オリゴヌクレオチドのコレクションを含有することができる。
【0026】
いくつかの実施形態では、粒子混合物は、少なくとも2つの試料からのハイブリダイズしたDNAを含む粒子をさらに含み得る。各試料はゲノムDNAを含み、各試料は異なる間接標識で標識することができる。いくつかの実施形態では、粒子混合物は、検出可能な標識で標識される単一の試料からのハイブリダイズしたDNA、または1つを超える試料(例えば、第1試料および第2試料)からのハイブリダイズしたDNAをさらに含み得る。
【0027】
別の態様では、本開示は、複数のコンパートメントを有するマルチコンパートメントプレートを特徴とする。少なくとも複数のウェルのそれぞれは、本明細書に記載されたもののいずれかのような1つの粒子混合物、および試料または参照ゲノム核酸を含有することができる。試料および参照核酸は別々の容器中にあってよい。いくつかの実施形態では、試料および参照核酸は、同一の標識で検出することができる。
【0028】
別の態様では、本開示は、第1の間接標識で標識された参照ゲノムDNA(または他の参照核酸)試料と、第2の間接標識でゲノムDNA(または他の核酸)試料を標識するための試薬とを含むキットを特徴とする。キットはまた、単一の標識、および第1の間接標識を結合する1つの薬剤を含む第1部分、単一の標識、および第2の間接標識を結合する1つの薬剤を含む第2部分、および本明細書に記載されたもののいずれかのような粒子混合物の1つまたは複数を含むこともできる。キットはまた、場合により、単一の標識の検出法および/またはキットを用いるアッセイの実施に関する説明書を含むこともできる。
【0029】
本明細書に記載された1つまたは複数の成分を含むキットも開示される。キットは、方法、例えば、本明細書に記載された方法のための成分を使用するための説明書を含む材料をさらに含むことができる。キットは、1つまたは複数のクローン化もしくは合成核酸配列(細菌人工染色体(BACS)または合成オリゴヌクレオチドの1つもしくは複数のコレクション、または個々のオリゴヌクレオチドなど)、1つまたは複数のマイクロウェルプレート、および/または、例えば、本明細書に記載されたような1つまたは複数の粒子セット、または1つの粒子混合物を含むことができる。
【0030】
ビーズなどの粒子は、ゲノム量を評価するための特に堅固なシステムを提供する。粒子ベースの方法は、液相速度に近いまたは液相速度でのハイブリダイゼーションを含むため、均一性が向上する。粒子は、特定の粒子に関する多くのデータ点を得ることを容易にする。例えば、小粒子(例えば、直径が最大数ミクロンの粒子)では、同一のプローブを有する少なくとも10、50、または100粒子が、個別に分析され得る。大粒子は、各粒子の目立たない位置から複数のデータ点を得ることを可能にすることができる。大粒子では、多くのデータ点を得るのに必要な粒子は少ない場合が多い。統計は、同一のプローブ量を有する粒子集団に関する中央値または平均値シグナルを判定するのに適用することができる。
【0031】
本明細書に記載された方法は、レシオメトリックアッセイに使用することができる。レシオメトリックアプローチは、複数のアッセイを競合的におよび同時に実施することでアッセイ精度の多くの潜在的誤差を訂正する。例えば、インキュベーション条件または捕捉分子もしくは標識試薬の濃度におけるいかなる変動も、正規化により訂正される。競合または非競合レシオメトリックアッセイは、例えば、比較ゲノム量または比較遺伝子発現に使用することができる。
【0032】
本明細書に引用された特許、特許出願、および参考文献はすべて、参照により本書に組み込まれる。
例えば、本願発明は以下の項目を提供する。
(項目1)
ゲノムDNAの評価方法であって、
ゲノムDNA試料を提供することと、
粒子混合物を提供することであって、該混合物は、異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、該混合物は、複数の異なるゲノム遺伝子座に対するプローブを集合的に含むことと、
ハイブリダイゼーション条件下で該粒子混合物の一部分に該試料を接触させることと、
検出可能な標識をモニタリングすることにより該混合物のそれぞれの一部分中の粒子に対する該試料のハイブリダイゼーションを評価することであって、ここで、該モニタリングからのシグナルは、検討する各ゲノム遺伝子座のコピー数を示すことと
を含む方法。
(項目2)
単一の検出可能な標識が使用される、項目1に記載の方法。
(項目3)
1種類を超えるDNA試料が提供され、該DNA試料のそれぞれが前記方法により評価される、項目1に記載の方法。
(項目4)
粒子セットのコードされた粒子がすべて同一のコードを有する、項目1に記載の方法。
(項目5)
前記検出可能な標識が分光法により検出できる、項目1に記載の方法。
(項目6)
前記検出可能な標識がフィコエリトリンを含む、項目5に記載の方法。
(項目7)
前記核酸ハイブリダイゼーションプローブがクローン化核酸を含む、項目1に記載の方法。
(項目8)
前記核酸ハイブリダイゼーションプローブがBAC核酸を含む、項目7に記載の方法。
(項目9)
前記BAC核酸がヒトゲノムDNAセグメントを含む、項目7に記載の方法。
(項目10)
前記BAC核酸がヒト以外のゲノムDNAセグメントを含む、項目7に記載の方法。
(項目11)
前記核酸ハイブリダイゼーションプローブが、特定の染色体遺伝子座に特異的なオリゴヌクレオチドのコレクションを含む、項目1に記載の方法。
(項目12)
少なくとも20個の異なる粒子セットが、少なくとも20個の異なるゲノム遺伝子座を評価するのに使用される、項目1に記載の方法。
(項目13)
複数の試料のうち少なくとも1つの試料が、検討する各ゲノム遺伝子座を既知のコピー数で有する参照試料であり、前記方法が、該参照試料のモニタリングからのシグナルを他の試料からのシグナルと比較して、該試料の検討する各ゲノム遺伝子座のコピー数を判定することを含む、項目3に記載の方法。
(項目14)
各試料が第1の間接標識で標識され、および各試料が第2の間接標識で標識された参照DNAと合わせられる、項目3に記載の方法。
(項目15)
前記参照DNAが、検討する各ゲノム遺伝子座を既知のコピー数で有する参照源からのゲノムDNAである、項目14に記載の方法。
(項目16)
前記第1の間接標識がフルオレセインであり、前記第2の間接標識がビオチンである、項目14に記載の方法。
(項目17)
前記評価することが、(i)前記試料の第1の一部分に、単一の標識、および第1の間接標識を結合する薬剤を含む第1部分を結合することと、(ii)該試料の第2の一部分に、単一の標識、および第2の間接標識を結合する薬剤を含む第2部分を結合することとを含む、項目1に記載の方法。
(項目18)
前記第1部分が、ストレプトアビジンおよびフィコエリトリンを含み、前記第2部分が、抗フルオレセインおよびフィコエリトリンを含む、項目17に記載の方法。
(項目19)
各試料が、マルチコンパートメントデバイスの異なるコンパートメントである、項目1に記載の方法。
(項目20)
各試料が、マルチウェルプレートの異なるウェルである、項目19に記載の方法。
(項目21)
少なくとも100個の粒子が、各ゲノム試料の異なる粒子セットの各々から評価される、項目1に記載の方法。
(項目22)
複数の異なる染色体遺伝子座でのヘテロ接合性が検出できる、項目1に記載の方法。
(項目23)
染色体増幅が検出できる、項目1に記載の方法。
(項目24)
染色体のヘテロ接合性欠失が検出できる、項目1に記載の方法。
(項目25)
染色体のホモ接合性欠失が検出できる、項目1に記載の方法。
(項目26)
ハイブリダイゼーション条件下での接触後、前記粒子がポリメラーゼに接触しない、項目1に記載の方法。
(項目27)
ハイブリダイゼーション条件下での接触後、前記粒子が酵素に接触しない、項目1に記載の方法。
(項目28)
前記ゲノムDNA試料が標識されておらず、前記方法が、標識プローブを該ゲノム試料にハイブリダイズすることをさらに含み、ここで、前記ゲノム遺伝子座が該試料に存在する場合、試料核酸鎖への該標識プローブのハイブリダイゼーションおよび該粒子に結合した該核酸ハイブリダイゼーションプローブに対する該試料核酸鎖のハイブリダイゼーションにより形成された複合体によって該標識プローブが該粒子に固定化されるように、粒子に結合した核酸ハイブリダイゼーションプローブの各々について、1つの標識プローブが同一のゲノム遺伝子座の遺伝的連鎖部位にハイブリダイズする、項目1に記載の方法。
(項目29)
前記標識プローブが、前記粒子に結合した前記核酸プローブに対して前記ゲノムDNA試料がハイブリダイズするのと同時にハイブリダイズされる、項目28に記載の方法。
(項目30)
前記標識プローブが、前記粒子に結合した前記核酸プローブに対して前記ゲノムDNA試料がハイブリダイズした後にハイブリダイズされる、項目28に記載の方法。
(項目31)
1つのソースからのゲノムDNAを間接標識で標識してゲノムDNA試料を提供することをさらに含む、項目1に記載の方法。
(項目32)
1つのソースからのゲノムDNAを前記単一の標識で標識してゲノムDNA試料を提供することをさらに含む、項目2に記載の方法。
(項目33)
前記ゲノムDNA試料のすべてが前記単一の標識で標識される、項目2に記載の方法。
(項目34)
未知のゲノム含量を有するゲノムDNA試料のすべてが同一の間接標識で標識される、項目1に記載の方法。
(項目35)
ゲノムDNA試料の大部分が同一の間接標識で標識される、項目1に記載の方法。
(項目36)
ハイブリダイゼーションを評価する前に前記粒子を攪拌することを含む、項目1に記載の方法。
(項目37)
前記粒子が、ホログラフ的にコードされるか、または前記単一の検出標識のスペクトルと分離可能なスペクトルを有する蛍光色素によりコードされる、項目2に記載の方法。
(項目38)
前記粒子が常磁性ビーズである、項目1に記載の方法。
(項目39)
単一の検出可能な部分を用いるゲノムDNAの評価方法であって、
少なくとも1つの参照DNA試料、および各試料が同一の検出可能な部分で標識されている複数のゲノムDNA試料を提供することと、
粒子混合物を提供することであって、該混合物は、異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、該混合物は、複数の異なるゲノム遺伝子座に対するプローブを集合的に含むことと、
ハイブリダイゼーション条件下で該粒子混合物の一部分に該試料のそれぞれを接触させることであって、各試料は別々の容器において該粒子混合物に接触することと、
該検出可能な部分をモニタリングすることにより該混合物のそれぞれの一部分中の粒子に対する各試料のハイブリダイゼーションを評価することであって、ここで、該モニタリングからのシグナルは、検討する各ゲノム遺伝子座のコピー数を示すことと
と
を含む方法。
(項目40)
単一の検出可能な標識を用いる核酸の評価方法であって、
第1の間接標識で標識された少なくとも1つの参照核酸試料、および各テスト試料が第2の間接標識で標識される複数のテスト核酸試料を提供することと、
粒子混合物を提供することであって、該混合物は、異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子、および特定の標的に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、該混合物は、複数の異なる標的に対するプローブを集合的に含むことと、
ハイブリダイゼーション条件下で該粒子混合物の一部分に該テスト試料の各々および参照試料を接触させることであって、ここで、各テスト試料は、別々の容器中で該粒子混合物および該参照試料に接触することと、
各テスト試料の第1の一部分に、該単一の標識、および該第1の間接標識を結合する薬剤を含む第1部分を結合することと、
各テスト試料の第2の一部分に、該単一の標識、および該第2の間接標識を結合する薬剤を含む第2部分を結合することと、
該試料の該第1の一部分における該単一の標識をモニタリングし、該試料の該第2の一部分における該単一の標識をモニタリングすることにより各テスト試料を評価することであって、ここで、該モニタリングからのシグナルは、各標的のコピー数を示すことと、
各テスト試料について、該第1の一部分における該単一の標識からのシグナルを、該第2の一部分における該単一の標識からのシグナルと比較して、該参照試料に対する該テスト試料中のプローブのコピー数の指標を得ることと
を含む方法。
(項目41)
粒子混合物であって、該粒子混合物は、異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、該混合物は、複数の異なるゲノム遺伝子座に対するプローブを集合的に含む、混合物。
(項目42)
前記遺伝子座のうちの少なくともいくつかに対するプローブが、細菌人工染色体DNAを含む、項目41に記載の粒子混合物。
(項目43)
前記遺伝子座のうちの少なくともいくつかに対するプローブが、超音波処理した細菌人工染色体DNAを含む、項目41に記載の粒子混合物。
(項目44)
前記遺伝子座のうちの少なくともいくつかに対するプローブが、合成オリゴヌクレオチドのコレクションを含む、項目41に記載の粒子混合物。
(項目45)
少なくとも2つの試料からのハイブリダイズしたDNAをさらに含み、ここで、各試料がゲノムDNAを含み、各試料が異なる間接標識で標識される、項目41に記載の粒子混合物。
(項目46)
検出可能な標識で標識された、単一の試料からのハイブリダイズしたDNAをさらに含む、項目41に記載の粒子混合物。
(項目47)
複数のウェルを有するマルチウェルプレートであって、該ウェルのうちの少なくとも複数のウェルの各々が、
項目41に記載の粒子混合物と、
試料または参照ゲノムDNAであって、ここで該試料および参照DNAが別々の容器中にあり、同一の標識で検出できる、試料または参照ゲノムDNAと
を含む、マルチウェルプレート。
(項目48)
キットであって、
第1の間接標識で標識された参照ゲノムDNA試料と、
第2の間接標識でゲノムDNA試料を標識するための試薬と、
単一の標識、および該第1の間接標識を結合する薬剤を含む第1部分と、
単一の標識、および該第2の間接標識を結合する薬剤を含む第2部分と、
項目41に記載の粒子混合物と
を含む、キット。
【図面の簡単な説明】
【0033】
【図1】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図2】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図3】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図4】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図5】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図6】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図7】図7は、図1から6に記載された例示のアッセイの工程フローチャートである。
【図8】図8は、例示的実施形態に従って実施された参照アッセイの結果を示す。
【図9】図9は、例示的実施形態に従って実施された参照アッセイの結果を示す。
【図10】図10は、例示的実施形態に従って実施された参照アッセイの結果を示す。
【図11】図11は、発現RNAに関する二重の間接標識−単回ハイブリダイゼーションを用いる例示的アッセイからの結果を示す。
【図12】図12は、参照およびテスト試料が同一のウェル中にない、1つの実施形態に従って実施された単色(単一標識)アッセイからの結果を示す直線グラフである。
【発明を実施するための形態】
【0034】
(詳細な説明)
多重核酸アッセイは、効率的および経済的な設計特性により大幅に容易になる。本明細書に記載の通り、単一標識の検出は、大型多重アッセイを実施するのに使用することができる。該アッセイは、異なる粒子セットからの小粒子の混合物を利用する。各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座またはRNAなど特定の標的に対する1つの核酸ハイブリダイゼーションプローブを含有する。異なるセットからの粒子は、複数の異なる標的に対するプローブを集合的に含む混合物を提供するのに併用することができる。
【0035】
1つの例では、粒子混合物は、少なくとも2つの一部分、AおよびBに分けられる。テスト試料ゲノムDNAは、第1部分で標識され、標識された一部分Aにハイブリダイズされる。参照DNA(典型的には参照試料からのゲノムDNA)は、第1部分または異なる部分(すなわち、第2部分)と同じであり得る部分により標識される。参照DNAは、一部分Bにハイブリダイズされる。一部分Aおよび一部分Bからのシグナルが測定され、次いで比較される。参照DNAおよび試料DNAが同一の部分により標識される場合、これらは異なる容器において処理される。両ハイブリダイゼーション反応物は、部分が直接標識である、または直接標識に結合している場合(例えば、ハイブリダイゼーションの前後に)部分を検出するように設定された装置を用いて、わずかな操作で評価することができる。
【0036】
使用される部分は、間接標識(間接標識として使用される色素など)、直接標識(例えばフルオロフォアなどの色素など)、または特異的結合ペアのメンバーであってよい。検出は、例えば、特異的結合ペアの標識された第2メンバーを用いる2次検出により、直接的または間接的であり得る。
【0037】
第2の例では、テストおよび参照試料ゲノムDNAは、それぞれが異なる間接標識により標識される。間接標識は、典型的には特異的結合ペアの第1メンバーである。試料は互いに混合され、粒子混合物の同一の部分にハイブリダイズされる。インキュベーションおよび洗浄後、該部分は、2つの特異的結合ペアの対応する第2メンバーと共にインキュベーションするため、少なくとも2つの容器に分けられる。2つの特異的結合ペアのこれらの第2メンバーは、検出に使用される第3の標識、および必要に応じて第4の標識に結合することができる。一般に、検出標識および2つの間接標識は、すべて互いに区別できる。例えば、1つまたは複数の標識が蛍光標識である場合、これらは、分光により区別できるように異なる励起および/または発光スペクトルを有する。
【0038】
例えば、ビオチンはテスト試料に対する間接標識として使用することができ、カルボキシフルオレセインは参照試料に対する間接標識として使用することができる。故に、第1容器では、蛍光標識されたストレプトアビジン(ビオチンに結合する)が添加およびインキュベートされ、ならびに第2容器では、蛍光標識された抗フルオレセイン(カルボキシフルオレセインに結合する)が添加およびインキュベートされる。LUMINEX xMAP(商標)システムでは検出に好ましい蛍光標識は、フィコエリトリンである。結合した蛍光標識産物(テストおよび参照試料由来の)と共にインキュベートされた粒子混合物はそれぞれ、次いで単色検出システムを用いて順次読み取られ、シグナルが比較された。
【0039】
これらの例は、単一検出により比較またはレシオメトリック情報を得る方法を例証する。例示的適用では、多数の異なる粒子試料は、単一のマルチウェルプレートにおいて、異なる標的、例えば、異なるゲノム遺伝子座に対するプローブを有する粒子混合物を用いて処理することができる。粒子混合物は、プレートの各ウェルに入れる。各試料はウェルの1つに入れる。この様式では、複数の試料は、同時におよびロボットの助けにより処理することができる。次いで、混合物中の異なる粒子タイプに対するハイブリダイゼーションを検出するため、各試料は器具(フローサイトメーターなど)を用いて評価することができる。
【0040】
いくつかの実施形態では、テストおよび参照試料は、2つの異なる直接または間接標識により標識される。標識が、直接標識(例えば、シアニン3およびシアニン5などの蛍光色素)の場合、次いで試料は混合され、1つの粒子セットにハイブリダイズされ、2つの標識を区別できる器具により検出することができる。標識が間接標識(すなわち、ビオチンおよびフルオレセインなどの特異的結合ペアの第1メンバー)の場合、次いで特異的結合ペアの各第2メンバー(例えば、ストレプトアビジンおよび抗フルオレセイン)は、シアニン3およびシアニン5など固有の検出標識により標識することができ、2つの標識を区別できる器具により検出することができる。
【0041】
粒子
核酸量、例えば、ゲノム量を評価するのに、様々な異なるタイプの粒子を使用することができる。粒子は、いかなる形(例えば、円筒形、球形など)、大きさ、組成、または生理化学的特性であってよい。粒子の大きさまたは組成は、例えば、粒子孔径を有するフィルター上でまたはいくつかの他の物理的特性、例えば、磁性により、粒子を液体から分離できるように選択することができる。
【0042】
粒子は、一般に多重アッセイに適している。例えば、各粒子は、固有のコード、特に、ゲノムDNAに特異的な核酸プローブ以外のコードを含む。コードは、埋め込まれるか(例えば、粒子内部に)さもなければハイブリダイゼーションおよび分析を通じて安定な形で粒子に結合される。粒子を同定し、故にこれに固定化された捕捉プローブを同定するため、コードは、蛍光特性、色、形、大きさ、光発光、量子ドット発光などによる、ホログラフィックコード化など、任意の検出可能な手段により提供することができる。いくつかの実施形態では、コードは、核酸により提供されるもの以外である。
【0043】
例えば、粒子は、光学、化学、物理、または電子タグを用いてコードされ得る。このようなコード化技術の例は、光学バーコード蛍光色素、または他の手段である。
【0044】
1つの例示的プラットフォームは、特異的捕捉プローブが固定化された粒子セットの各メンバーを同定する手段として、ポリマー粒子に含浸した蛍光色素の混合物を利用する。別の例示的プラットフォームは、円筒形ガラス粒子を同定するのにホログラフィックバーコードを用いる。例えば、Chandlerら(5,981,180)は、異なる粒子タイプが、ポリマー粒子に含浸した2つを超える蛍光色素の様々な割合の混合物によりコードされる、粒子ベースのシステムを記載する。Soini(5,028,545)は、粒子の同定に時間分解蛍光を使用する、粒子ベースの多重アッセイシステムを記載する。Fulwyler(4,499,052)は、色および/または大きさにより区別された粒子を用いる例示的方法を記載する。US2004−0179267、2004−0132205、2004−1030786、2004−0130761、2004−0126875、2004−0125424、2004−0075907は、ホログラフィックバーコードによりコードされた例示的粒子を記載する。
【0045】
US6,916,661は、粒子に対するコードを提供する色素を有するナノ粒子に関連したポリマー微粒子を記載する。ポリマー微粒子は、直径1ミリメートル未満、例えば、直径約0.1から約1,000マイクロメートル、例えば、3〜25μmまたは約6〜12μmの範囲の大きさを有してよい。ナノ粒子は、例えば、直径約1ナノメートル(nm)から約100,000nm、例えば、約10〜1,000nmまたは200〜500nmの直径を有してよい。
【0046】
複数のゲノム遺伝子座を調べるための粒子混合物は、異なる粒子セットからの粒子を結合して調製することができる。各粒子セットは、特定の遺伝子座に特異的な同一のコードおよび核酸プローブ量を有する多数の粒子を含有することができる。例えば、異なる粒子要素の数は、10〜3000、10〜500、20〜200、50〜2000、50〜500、または50〜200、または75〜300の範囲であってよい。各粒子セットは、個別に調製することができ、次いで粒子セットの一部分は、粒子混合物を提供するため他の粒子セットの一部分に結合される。
【0047】
粒子混合物の一部分がDNA試料の分析に使用される場合、特定の遺伝子座に特異的ないくつかの粒子(例えば、少なくとも10、20、30、50、80、もしくは100個の粒子、または1〜5個の粒子であっても)が、この個々の試料に関するハイブリダイゼーション反応において存在するように、粒子セットの各一部分は多数の粒子を含む。粒子は、プローブへの比較的迅速な結合を促進するため液体試料内で浮遊状態で攪拌することができる。
【0048】
粒子は、粒子とのハイブリダイゼーションの程度を判定するために分析される。例えば、ゲノムDNAに関連した標識が検出される。粒子は、粒子コードを読み取り、各特定の粒子に関連したシグナルを判定することができる装置を用いて個別に評価することができる。
【0049】
核酸プローブ
粒子は、一般に、適用に応じて、1つの特定の染色体遺伝子座または遺伝子に特異的なプローブを有する。例えば、プローブは、クローン化DNA(例えば、BACまたは酵母人工染色体または他のソースのクローン化DNA)、増幅DNA、またはオリゴヌクレオチドから調製することができる。一般に、判定可能な配列の任意の核酸源を使用することができる。プローブは、粒子に固定化される(例えば、多孔性粒子では表面、または内部および/もしくは外部表面)。
【0050】
ある染色体プローブは、合成オリゴヌクレオチドの混合物を含む。別の例示的タイプの染色体プローブは、断片化BAC DNAとして固定化することができるBACのクローン化DNAから得られる。
【0051】
一般に、特定の粒子に結合され得るプローブは、断片の混合物であってよい。例えば、断片はランダムに重複する配列を含み、この大部分は600から2,000塩基対の間の長さを有する。それぞれが約60から150塩基対の間の長さを有し、重複または隣接する配列を有する合成オリゴヌクレオチド配列の混合物は、プローブとして調製することができる。オリゴヌクレオチド混合物は、確定的組成を有し、費用効率の高い方法で調製することができる。
【0052】
プローブは、特定の粒子と共有結合することができる。例えば、US6,048,695は、プローブを結合する例示的方法を記載する。特定の粒子セットに対するプローブが、1つまたは複数の化学合成オリゴヌクレオチドである場合、オリゴヌクレオチドは、粒子上の基と反応できる化学基(例えば、アミン)により合成することができる。プローブはまた、例えば、プラスミド、コスミド、および人工染色体などの他のソースから得ることもできる。例えば、細菌人工染色体(BAC)は超音波処理され得、次いでこれを粒子と共有結合させる架橋剤と反応され得る。例えば、1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩(EDCまたはEDAC化学)は、超音波処理したBAC DNAなどの核酸プローブを粒子に結合するのに使用することができる。
【0053】
一般に、プローブを粒子セットに結合する場合、セット中のすべての粒子は同一の「コード」を有する。故に検出器は、特定の結合したプローブとのハイブリダイゼーションに関するシグナルを、セット中のすべての粒子に関する「コード」と関連づけるであろう。しかし、同一の特定のプローブに関する2つを超える「コード」を使用することも可能である。ソフトウェア(または手動計算であっても)は、次いで2つの「コード」に関するシグナルを特定のプローブと関連づけるのに使用することができる。極端には、各粒子は固有のシリアル番号、すなわち自身のコードを有する。データベースが、どの粒子コードが特定のプローブにより修飾されるかを追跡する限り、検出器からのデータは、シグナルをプローブとのハイブリダイゼーションと関連づけるのに使用することができる。
【0054】
標識
試料標識。例えば、分析用のゲノムDNAなどの試料DNAを標識するには、様々な方法を用いることができる。標識は、少なくともいくつかの修飾ヌクレオチド、例えば、ビオチン、ジゴキシゲニン、フルオレセイン、またはシアニン修飾ヌクレオチドを含むヌクレオチドによる重合により導入することができる。いくつかの実施形態では、標識は、ランダムプライミングおよび重合により導入される。他の例には、ニックトランスレーション(Roche Applied Science社、インディアナポリス IN;Invitrogen社、カールスバッド CA)および化学標識(Kreatech ULS社、アムステルダム NL)が挙げられる。一般に、ゲノムDNA試料の標識に適した任意の標識方法が使用され得る。
【0055】
共有参照。多くの実施形態では、方法は、既知の参照試料と未知の実験試料との間のシグナル比を評価する。例えば、2つの間接標識(ビオチンおよびフルオレセイン)は、2つの試料の競合ハイブリダイゼーションを可能にするのに使用される。ハイブリダイゼーション後、試料は2つの(または2つを超える)一部分に分けられ、各一部分は個別に評価される。評価結果は、2つの間接標識レベルの比を得るのに使用することができる。このアプローチは、競合ハイブリダイゼーションを用いてアッセイ間の任意の変動を正規化するという利点を有する。参照および実験試料はいずれも、同一の粒子と混合した同一の容器において同時にアッセイされる。
【0056】
並行参照。いくつかの実施形態では、既知および未知の試料を別々の状態に保つことも可能である。競合ハイブリダイゼーションは使用されない。この場合、参照試料は1つの容器においてアッセイされ、少なくとも1つの実験試料は、別の容器においてアッセイされる。例えば、容器はマルチウェルプレートの異なるウェルであってよい。複数の実験試料が使用される場合、それぞれは、異なる容器、例えばマルチウェルプレートの異なるウェルにおいて評価することができる。各プローブに関する実験試料シグナル対参照試料シグナルの比は、競合アッセイと同じ方法で得ることができる。
【0057】
このアプローチが利用される場合、単一の参照試料を、いくつかのまたは多くの実験試料間で共有することができる。1日あたり複数の試料を必要とする実験では、複数の重複する標準試料の標識を回避することで試薬費用および労力の節約となり得る。また、別の分析用の異なる一部分を得るのに試料を操作する必要がない。各試料は1回のみ評価することができる。
【0058】
非共有結合標識。さらに別の実施形態では、各試料の個別の共有結合標識化が回避される。例えば、非標識ゲノムDNA試料が、コードされた粒子に固定化された捕捉プローブにハイブリダイズされる。前記捕捉プローブは、上述のようなBAC DNAまたはオリゴヌクレオチド混合物を含む。予め標識されたレポーター配列も、捕捉プローブの配列に隣接するが重複しない配列においてプローブ−試料複合体にハイブリダイズされる。これらの標識されたレポーター配列は、同じまたは異なるハイブリダイゼーション反応においてハイブリダイズすることができる。この方法では、標識されたレポーター配列は、アッセイ時に各試料を個別標識することに比べて、アッセイあたりの費用を低減しつつ、大規模環境で大量に作製することができる。
【0059】
検出
ハイブリダイゼーションの程度を示すシグナルは、粒子ごとに、1つまたは複数の検出可能な標識からのシグナルを評価して検出することができる。粒子は、典型的には個別に評価される。例えば、粒子は、フローサイトメーターに通すことができる。例示的フローサイトメーターには、Coulter Elite−ESPフローサイトメーター、またはBeckman Coulter,Inc.社(フラートン CA)から入手可能なFACScan(商標)フローサイトメーター、およびCytomation,Inc.社、フォートコリンズ、コロラド州から入手可能なMOFLO(商標)フローサイトメーターが挙げられる。フローサイトメトリーに加えて、微粒子を分離および分類する機器として遠心分離機を使用してもよい。適切なシステムは、米国特許第5,926,387号に記載されているシステムである。フローサイトメトリーおよび遠心分離に加えて、微粒子を分離および分類する機器としてフリーフロー電気泳動装置を使用してもよい。適切なシステムは、米国特許第4,310,408号に記載されているシステムである。粒子を、表面に置いて走査または画像化してもよい。
【0060】
例示的適用
本明細書に記載されたゲノム評価方法は、診断学および法医学を含む、様々な適用を有する。例えば、該方法は、成人、生殖細胞、胎盤細胞、または胎児細胞のゲノム量を判定するのに使用することができる。細胞は、任意の種由来であってよいが、典型的には2倍体種または高い倍数性を有する種由来である。例えば、細胞は植物(例えば、作物)または動物(例えば、ヒトまたは家畜)由来であってよい。
【0061】
ヒトの医学的用途に関し、該方法は、患者からの試料、例えば、生検、血液試料、羊水試料、または頬スワブからの試料を評価するのに使用することができる。特に、患者は、癌のリクスがあるまたは癌を有する患者であってよい。試料は、腫瘍近くのまたは腫瘍由来の組織からの試料であってよい。例えば、該方法は、癌腫もしくは肉腫由来、または肺、乳房、甲状腺、リンパ系、胃腸、尿生殖路の腫瘍、腺癌(例えば、結腸癌、腎細胞癌、前立腺癌および/または精巣腫瘍)、肺の非小細胞癌、小腸癌および食堂癌由来の細胞のゲノム量を評価するのに使用することができる。癌において変化した多くの染色体遺伝子座が知られている。例えばDutrillauxら、Cancer Genet. Cytogenet.49:203〜217頁(1990年)、US5,670,314(肺癌)、US5,635,351(神経膠腫)、およびUS6,110,673を参照されたい。該方法は、血液細胞(例えば、BもしくはT細胞)、または白血病もしくはリンパ腫由来の細胞のゲノム量を評価するのに使用することができる。
【0062】
本明細書に記載された方法は、他の核酸、例えば、ゲノムDNA以外のDNA、mRNA、または他のRNAに適応することもできる。
【0063】
本発明のいくつかの態様は、以下の非限定例によりさらに例証される。
【実施例】
【0064】
(実施例1)
この例示的レシオメトリックアッセイでは、粒子を、単一の標識により同時に複数の試料について評価するのに使用する。例えば、異なる試料は、2つの別々のマイクロプレートウェルなど、別々の容器に入れる。1つまたは複数の対照試薬は、2試料間の結果を正規化するのに各容器において使用する。
【0065】
単一標識の読み出しシステムを用いる例示的マルチ結合アッセイを以下に記載する。多重マルチ結合アッセイを、例えば、2つの試料IおよびIIにより実施する。アッセイは、追加試料にまで広げることができる。各試料を、試料Iではビオチン、試料IIではジニトロフェノール(DNP)など、1つの間接標識で標識する。両試料からの特定の分析物は、それぞれの粒子タイプ上の核酸プローブとの結合をめぐって競合する。インキュベーションおよび洗浄後、粒子セットを、2つの特異的第2標識と共に別々にインキュベーションするため、2つの容器に分ける。第1容器では、蛍光標識されたストレプトアビジンを添加およびインキュベートし、ならびに第2容器では、蛍光標識された抗DNPを添加およびインキュベートする。LUMINEX xMAP(商標)システムに関しては、蛍光標識ラベルはフィコエリトリンが好ましい。結合した蛍光標識産物IおよびIIと共にインキュベートした各粒子セットの粒子を、粒子コードをフィコエリトリンシグナルと関連づける単色検出システムにより順次評価する。
【0066】
図1に関して、アッセイビーズ1は、この表面に固定化された捕捉分子2を有する。この図では、捕捉分子は、この例の目的のため直鎖状核酸配列として概略的に示されるが、捕捉分子は、クローン化DNAまたはオリゴヌクレオチドなどの特異的結合ペアの任意の核酸メンバーであってよい。アッセイビーズは、第1の液体アッセイ緩衝液3において懸濁される。
【0067】
図2では、2つの標識された試料が図1のビーズ懸濁液に添加される。この例では、試料は、遺伝子発現アッセイまたは比較ゲノムハイブリダイゼーションアッセイにおいて見出されるような核酸配列として概略的に示されるが、この方法は、特異的結合アッセイの任意のタイプにより功を奏するであろう。この図では、第1試料からの分子5は、第1の間接標識B(この例ではビオチン)で標識され、第2試料からの分子4は、第2の間接標識D(この例ではジニトロフェノール[DNP])で標識される。この例では、「B」標識された分子5の2倍の「D」標識された分子4が存在する。試料分子は、ビーズに固定化された結合ペア相補体との結合をめぐって競合するであろう。
【0068】
図3は、インキュベーション、およびビーズ上の捕捉分子との試料分子の特異的結合後の、図1からのビーズおよび間接標識された試料分子を示す。標識された試料分子4および5は、捕捉分子2上での結合をめぐって競合し、結合が起きた場合、結合複合体6を形成した。各ビーズでの特異的結合イベントの数は、相補的な試料分子の濃度にほぼ比例する。この例では、「B」標識された試料分子5に比べて2倍の「D」標識された試料分子4が各ビーズで捕捉される。
【0069】
図4では、捕捉された間接標識分析物7および8を有するビーズ複合体9は、洗浄され、第2の緩衝液12で再懸濁される。洗浄は、ビーズに特異的結合されなかった任意の試料分子を除去する。ビーズはまた、アリコートAおよびBに分けて示される。これは、典型的には、攪拌により緩衝液でビーズを懸濁し、次いでビーズ−緩衝液の懸濁液容量の約半分を第2マイクロプレートウェルなどの第2容器にピペッティングして行われる。2つのアリコートは、ビーズ複合体9とほぼ同じ量および濃度を有する。
【0070】
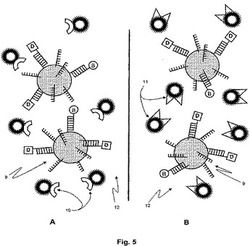
図5では、試料分子上の間接標識に相補的な異なる蛍光標識分子結合体10および11が、各アリコートに添加される。アリコートAでは、蛍光標識10(フィコエリトリンまたはシアニンまたは他のフルオロフォアなど)に結合したストレプトアビジンが添加される。蛍光標識は、下流の蛍光ビーズ読み取りシステムに適合するように選択される。アリコートBでは、同じ蛍光標識11に結合した抗DNPが添加される。ストレプトアビジンおよび抗DNPは、例示的なビオチンおよびDNP間接標識に相補的であることから、この例ではこれらが使用されるが、いずれの高親和性特異的結合ペアも使用することができる。
【0071】
図6では、蛍光標識されたビーズ結合体13および14は、図5に示された混合物のインキュベーション後に生じ、続いて洗浄、および第3の緩衝液15におけるビーズ複合体の再懸濁が行われた。各アリコートは、アッセイ試料の1つにおける分析物濃度にほぼ比例した各アリコートのビーズ上の蛍光標識集団を有する、蛍光標識されたビーズ複合体を含有する。各アリコートは、現在、各ビーズにおける蛍光標識密度に比例したシグナルを生成する、単一標識の蛍光ビーズ読み取りシステム(LUMINEX xMAP(商標)システムなど)により個別に読み取ることができる。
【0072】
図7は、図1〜6に記載されたアッセイ例の工程フローチャートである。第1試料16は、第1間接標識17(この場合はビオチン)と共にインキュベートされ18、第1間接標識された試料19を生成する。別に、第2試料20は、第2間接標識(DNP)21と共にインキュベートされ22、第2間接標識された試料23を生成する。間接標識を有するこれら2つの試料、19および23は、次いでコードされたビーズセット24により競合的方法でインキュベートされる25。ビーズセットは、例えば、各ビーズタイプに固定化された異なる捕捉分子を有する、コードされたLUMINEXビーズのセット(LUMINEX用語ではビーズ「領域」)であってよい。競合的インキュベーション25の後、ビーズは洗浄され、洗浄緩衝液34により再懸濁され26、再懸濁されたビーズは2つのアリコート27および28に分けられる。
【0073】
間接標識のそれぞれに対する蛍光標識された特異的相補体が、次いで各アリコートに別々に添加される。この例では、ストレプトアビジン−フィコエリトリン29が、第1間接ビーズアリコート27と共にインキュベートされる31。ストレプトアビジンは、ビーズ複合体のビオチン間接標識と特異的に結合する。別に、抗DNP−フィコエリトリン30が、第2ビーズアリコート28と共にインキュベートされる32。抗DNPは、ビーズ複合体のDNP間接標識と特異的に結合する。次に、および2つのアリコートを別々の状態にしたまま、余分な蛍光結合体が洗浄緩衝液35および36で洗い流される31および32。最後に、それぞれ蛍光標識されたビーズアリコートが、この例ではLUMINEX xMAP 100(商標)またはxMAP 200(商標)機器を用いて別々に読み取られる33。
【0074】
(実施例2)
図8から10は、例示的参照アッセイの結果を示す。図8は、間接標識としてのビオチンおよびフルオレセインにより、LUMINEX(登録商標)プラットフォームで行われた10の5乗のBAC−CGHアッセイの特異度および感度を示す。アミノ酸表面に対するカルボキシル化ビーズ表面を最初に修飾し、次いで1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩(EDCまたはEDAC化学)を用いてBAC断片の5’末端をビーズに固定化することで、まず、5つのBACそれぞれからの断片化DNAを5セットのLUMINEXビーズに固定化した。次いで、それぞれが異なるLUMINEXビーズIDすなわち「領域」を有する、6つのビーズセットを、1つの多重ビーズセットにプールした。これらのステップを以下に詳述する。
【0075】
BACプローブ、基準、および試料。細菌人工染色体(BAC)DNAは、捕捉プローブをコードされたビーズに固定化させるのに使用した。5つの異なるヒトBAC(すべてHealth Research Division、Roswell Park Cancer Institute(バッファロー、NY)により提供された)を、次の実験:RP11−289D12(15q11.2);RP11−524F11(17p11.2);RP11−1398P12(4q16.3);RP11−476−C20(22q11.21);RP5−59D14(17p13.3)において固定化捕捉分子として使用した。これらのBACは、染色体遺伝子座を括弧で示したRoswell Parkクローン#によりリストされる。
【0076】
これらのBACは、実験における基準として使用した。5つのBACのプールを、ビオチン標識ヌクレオチドおよび非標識ヌクレオチドによるKlenowランダムプライマー標識を用いて、陽性試料を酵素標識するのに使用した。さらに、陰性対照としてCot−1 DNA(Invitrogen社 15279−011、カールスバッド CA)を、コードされたビーズに固定化した。
【0077】
BACプローブの調製およびビーズへの固定化 BAC DNAは、LUMINEX社(オースチン TX)製のLUMINEX xMAP(商標)ビーズに固定化した。xMAP(商標)ビーズは、表面のカルボキシル基により官能化されたポリスチレンから成る。これらのビーズは、常磁性バージョンおよび非磁性バージョンの両方で提供される。常磁性ビーズは、洗浄ステップでは溶液からのビーズの分離を促進するが、洗浄がフィルターカラムまたはプレート(例えばHTS 0.45μm、カタログMSHVN4510、Millipore社、ビレリカ MA)で実施される場合、非磁性ビーズについても同じプロトコルが機能する。
【0078】
BACおよび対照プローブの磁性LUMINEXビーズへの固定化プロトコルは、以下の通りである。
【0079】
4,9−ジオキサ−1,12−ドデカンジアミンおよびエチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩(EDC)との反応によるカルボキシル化ビーズのアミノ転換
1.LUMINEXスタンドード輸送/保管用バイアルから6つのビーズ領域(24、46、47、56、68および79)250μl(2.5×106ビーズ)を、シリコン処理した200μlピペットチップを用いて6つの別々の1.5mlエッペンドルフチューブに分注した。
【0080】
2.750μlの0.1M 2−(N−モルホリン)−エタンスルホン酸(MES)0.15M NaCl pH6.0を各チューブに添加した。各チューブをボルテックスし超音波処理した。
【0081】
3.サマリウム磁石ディスク磁石を10分間バイアルの側に接触させて各チューブの電磁ビーズをペレット化した。電磁ビーズの攪乱を避けながら液体900μlを慎重に除去した。
【0082】
4.各チューブでMESにより容量を合計80μlに調整した。10μlの4,9−ジオキサ−1,12−ドデカンジアミン(50μl/ml MESで)および10μlのEDC(MES中50mg/ml)を各チューブに添加した。
【0083】
5.ビーズを再懸濁するため各チューブをボルテックスし超音波処理した。
【0084】
6.チューブ回転機で120分間室温にてインキュベートした。
【0085】
7.PBS 900μlをビーズに添加し、ボルテックスし超音波処理した。
【0086】
8.5分間、磁石を用いて電磁ビーズをペレット化した。メスピペットで液体1,000μlを除去し、1,000μlのリン酸緩衝生理食塩水(PBS)を添加した。各チューブをボルテックスし超音波処理してビーズを再懸濁した。
【0087】
9.ビーズ3×の各チューブを、磁石でペレット化して洗浄し、液体を取り除き、洗浄緩衝液(1×PBS 0.01% BSA 0.01% Tween 20)を添加し、超音波処理しボルテックスした。最終的な緩衝液添加は、保存のための250μl 1×PBS 0.01% BSAであった。
【0088】
BACおよび対照DNAのビーズとのEDC結合
1.6つのビーズ領域それぞれの0.5×106アミノビーズ(50μl)を1.5mlエッペンドルフチューブに等分し、ボルテックスし超音波処理した。
【0089】
2.5.0μlのBAC DNAまたはCot−1 DNA(超音波処理により断片化した)(名目濃度50ng/μl)を各チューブに添加し、簡単にボルテックスした。5μlの溶解したてのEDC(dH2O中10mg/ml)を添加した。直ちにボルテックスし、次いで暗所で30分間室温にてインキュベートした。EDC添加を繰り返し、ボルテックスし、30分間インキュベートした。700μlの0.2% Tween 20をdH2Oに添加しボルテックスした。
【0090】
3.磁石を用いて電磁ビーズを5分間ペレット化した。上清を除去した。ビーズをdH2O中900μl 0.05% Tween 20において再懸濁し、ボルテックスし超音波処理した。100℃で5分間加熱し、表面に結合した二本鎖DNAを変性させた。このステップをもう1回繰り返した。
【0091】
多重ビーズミックスの調製
1.固定化したBACおよびCot−1対照プローブを有するビーズの6チューブそれぞれをボルテックスし超音波処理した。各ビーズチューブからのアリコートを推定ビーズ収量2,500ビーズ/μlを有する新たなチューブに等分した。
【0092】
2.多重ビーズミックスビーズを磁石で10分間ペレット化した。200μlの加温したAMBION(登録商標)Slide Hybridization Buffer #2(Ambion社、オースチン TX)を添加した。10μlのアリコートで使用されたビーズミックスは、各アリコートの各領域の約2,500ビーズと20回ハイブリダイズするのに十分であった。
【0093】
実証アッセイでは、試料DNAは、多重ビーズの調製に使用した同一のBAC DNA断片をプールして調製した。二本鎖であるBAC DNAは、変性後、自体と特異的にハイブリダイズし、既知の濃度の試料により標準曲線を作成できるようにする。8つの濃度のそれぞれの希釈物(6.25ng/mlから2倍ずつ希釈)を基準として使用した。これらのDNA希釈物はそれぞれ、2つのアリコートに分け、2つのアリコートはそれぞれ、間接標識試料を作製するためフルオレセインまたはビオチンで標識した。
【0094】
標識は、標準のシアニン色素標識ヌクレオチドの代わりにビオチン標識およびフルオレセイン標識ヌクレオチドを使用する、標準的BioPrime(商標)BACプラナーマイクロアレイランダムプライマー標識キット(Invitrogen、カールスバッド CA)を使用して実施した。詳細は以下の通りである。
【0095】
1.5つのBACのそれぞれのアリコートを単一のチューブに等分し、ボルテックスした。2μgの各プールをマイクロフュージチューブに添加した。容量を脱イオンH2Oで50μlに調整した。
【0096】
2.キットからの2.5×ランダムプライマーミックス40μlを2つの標識反応物それぞれに添加した。2秒間ボルテックスし、10秒間遠心分離した。
【0097】
3.DNAをヒートブロックで5分間、100℃で変性させた。氷スラリーで5分間スナップ冷却し、10秒間遠心分離した。
【0098】
4.ビオチンマスターミックス(6つの反応物に十分な)を作製した。
【0099】
16μlのSpectral Labeling Buffer(EDTAおよびトリス緩衝液中の非標識dNTPヌクレオチドミックス、Spectral Genomics社、ヒューストン TX)
10μlのビオチンdCTP
6.5μlのKlenow(Invitrogen社、カールスバッド CA)
合計32.5μl
5.マスターミックス10μlを各チューブに添加し、10秒間遠心分離し、それぞれを37℃で2時間インキュベートした。
【0100】
6.各反応物から3μlを除去し、アガロースゲルで電気泳動を行い標識した産物が約100bp長であることを確認した。
【0101】
7.8μlのEDTAをdH2Oに添加し(pH8.0)、70℃で10分間インキュベートした。標識した試料を氷上に置いた。
【0102】
8.90μlのSpectral Genomics Hybridization Buffer(ヒトCot−1 DNAおよび剪断したサケの精巣)を添加し、38.8μlの5M NaClを添加し、ボルテックスした。260μlのイソプロパノールを添加し、ボルテックスし遠心分離した。
【0103】
9.室温で20分間インキュベートした。フルスピードで20分間遠心分離した。必要とされるまで4℃で保存した。
【0104】
10.使用前に、標識したBACを室温まで加温し、10分間遠心分離した。
【0105】
11.上清を除去し、70%エタノール 30% d.1,000μlを添加した。さらに3分間遠心分離し、ペレットを残して全液体を除去した。
【0106】
12.10分間、または目視で乾燥するまで空気乾燥した。
【0107】
13.脱イオンH2O 20μlをペレットに添加し、室温で10分間インキュベートした。標識したDNAの推定濃度:2μg/20μl(100ng/μl)。
【0108】
上述のプロトコルを、ステップ4の第2のフルオレセインマスターミックスでは、ビオチンヌクレオチドに代えてフルオレセインヌクレオチドにより繰り返した。これら2つの操作の産物は、ビオチン標識したBACプールおよびフルオレセイン標識したBACプールであった。これらは、プローブに使用したのと同じBACの標識プールを含んでいた。これは、固定化されたプローブと完全に一致する陽性ハイブリダイゼーション相補体であろう。例えば、患者または他の被験者由来のゲノムDNAなど、細胞から調製した核酸試料では、同じ手順を使用することができる。
【0109】
8対の直接標識した試料を、次いでLUMINEX多重ビーズセットにそれぞれハイブリダイズした。8対を、図8の図の横軸に並んだ表記ごとに、上昇するフルオレセイン標識した試料濃度を、低下するビオチン標識した試料濃度と混合してまとめた。以下に詳述の通り、ハイブリダイゼーションは50℃で2時間実施し、続いて3回のストリンジェント洗浄を50℃で実施した。ストリンジェント洗浄緩衝液は、順に、2×SSC+50%脱イオンホルムアミド、2×SSC+0.1% Igepal、および0.2×SSCであった。
【0110】
ハイブリダイゼーションおよび検出
1.標識した試料の4つの希釈シリーズを1.5mlのマイクロ遠心分離チューブにおいて作製した。同じ標識希釈物の逆数ペアを混合して以下の8試料を形成した。
【0111】
試料# 5BACプール、フルオレセイン 5BACプール、ビオチン
1 0.039ng + 6.25ng
2 0.078ng + 3.12ng
3 0.156ng + 1.56ng
4 0.31ng + 0.78ng
5 0.78ng + 0.31ng
6 1.56ng + 0.156ng
7 3.12ng + 0.078ng
8 6.25ng + 0.039ng
2.標識した試料の容量をSpeedVac(商標)(Kendro Laboratory Products社、ThermoElectron Corp社、アッシュビル NC)で凍結乾燥(dry down)した。上記のように調製した加温した多重ビーズミックス10μlを添加した。ピペットで混合し、ヒーターブロックで98℃にて2分間変性させた。
【0112】
3.マイクロチューブをアルミホイルで覆った50ml遠心分離チューブの内部でインキュベートしてハイブリダイズし、50℃のオーブンの回転ラックに2時間置いた。
【0113】
4.ハイブリダイゼーション後、1mlの0.2×SSCを各試料チューブに添加し、ボルテックスした。
【0114】
5.各チューブの内容物を96ウェルPCRプレートの2ウェルに移し、ハイブリダイズした各ビーズセットを1組の500μlアリコートに分けた。
【0115】
6.プレートウェルのビーズを磁石で10分間ペレット化し、500μlの上清をビーズの減少を避けるため慎重に除去した。
【0116】
7.8μg/mlのPJ31Sストレプトアビジン−フィコエリトリン(Prozyme社、サンリアンドロ CA)100μlを各ペアの1つのウェルに添加し、100μlの8μg/ml抗フルオレセイン−フィコエリトリン(Invitrogen社、A−21250)を各ペアの他のウェルに添加した。次いで、プレートを、NCS(商標)Shaker Incubator(PerkinElmer社、ボストン MA)において室温で950RPMにて30分間攪拌しながらインキュベートし、続いてビーズを1×PBS+0.01% Tween 20緩衝液で洗浄した。
【0117】
8.各プレートウェルのビーズを磁石で10分間ペレット化し、100μlの上清をビーズの減少を避けるため慎重に除去した。100μlのトリス−NaCl−Tween 20 緩衝液を添加し、ビーズを再懸濁するため再ピペッティングにより混合した。
【0118】
9.試料をLUMINEX 100(商標)分析器で読み取り、各ウェルの各ビーズ領域の蛍光強度中央値を記録した。
【0119】
ステップ(7〜9)で上に詳述した通り、間接標識を用いた2つの試料の競合ハイブリダイゼーションアッセイの終了後、多重アッセイしたビーズセットを再び分けた。一方のアリコートは、4μg/mlの抗フルオレセイン−フィコエリトリンで二次標識し、他方は、4μg/mlの抗ストレプトアビジン−フィコエリトリンで二次標識した。これらの二次標識ビーズセットのそれぞれを、次いでLUMINEX xMAP 200(商標)システムで別々に読み取った。
【0120】
この結果を図8に示す。各BACからのシグナルは、別々のデータトレースとして示され、およびフルオレセイン標識した試料は、ビオチン標識したものとは別個に示される。それぞれは、約160:1の濃度範囲にわたるシグナルに対する線形濃度反応を示す。最大のフルオレセイン標識シグナルは、最も低いビオチン標識シグナルに干渉することはないようであり、この反対も同様である。また、COT−1が固定化したビーズからのシグナルは、特異的結合イベントからの最も低いシグナルよりも低い。こうしたシグナルは、全条件下のフルスケールの2%未満であった。これは、2つの間接標識は、これらの濃度範囲では実質的な干渉または交差反応性を示さないことを実証する。
【0121】
図9は、異なる様式でフォーマットされた図8からのデータを示す。これは、示差的遺伝子発現マイクロアレイ解析でしばしば使用されるタイプの、「同一対同一」散布図である。両軸のスケールは、ビオチンおよびフルオレセイン標識したBAC試料それぞれの正規化濃度である。理想的なまたは完全なアッセイでは、各データ点は対角線上にあるであろう。それぞれの競合アッセイした間接標識試料からのシグナルは、濃度が同じであるため、同じとなろう。実際のデータは対角線付近に密集し、理想との偏差はわずか1.5倍であり、典型的に少ない。標準CGH(または同様に遺伝子発現)アッセイは、通常、生物学的有意性を示す閾値として2:1の示差的シグナルを用いる。
【0122】
(実施例3)
図10は、間接標識ゲノムDNA試料に関する、上述した同一の多重ビーズセットを用いた、10の5乗のCGHアッセイの結果を示す。ゲノムDNA試料(ヒトゲノムDNA:男性;Promega Corporation社、マジソン WI)を2つのアリコートに分けた。一方のアリコートをフルオレセインで間接標識し、他方は、上述のBioPrime(商標)を用いてビオチンで間接標識して2つの間接標識試料を作製した。2つの間接標識試料を次いで混合し、多重ビーズセットに対して共に競合アッセイした。間接標識による競合アッセイ後、ビーズセットを分け、一方のアリコートを抗フルオレセイン−フィコエリトリンで二次標識し、他方はストレプトアビジン−フィコエリトリンで二次標識した。これらの二次標識ビーズセットのそれぞれを、次いでLUMINEX xMAP 200(商標)システムで読み取った。結果のデータは、再び、図10の「同一対同一」散布図としてフォーマットする。図9に示した意図的に構築された希釈シリーズと同様、ゲノムDNAの分割した試料からのデータは、図の対角線にピタリと一致する。
【0123】
(実施例4)
本発明の別の態様を説明する例示的アッセイでは、合成の70−merアミン修飾オリゴヌクレオチドプローブ(Operon Biotechnologies社、ハンツビル AL)をLuminex多重ビーズに固定化し、参照およびテスト試料が同じウェルにない場合は単色アッセイを実施した。この実験は17個の異なるプローブを利用した。このうち4個は、下の表に詳述の通り、XおよびY染色体上の遺伝子座を表す5つのオリゴヌクレオチドをプールまたは組み合わせたセットであった。この多重プローブセットにより、男性および女性のDNAを区別する実証アッセイを実施した。
【0124】
【表1−1】

【表1−2】

【表1−3】

多重オリゴビーズミックスを作製するため、アミン修飾オリゴヌクレオチドプローブを、コードされたLuminex zMap微小球またはビーズに結合するプロトコルは以下の通りであった。
【0125】
1.−20℃の、乾燥EDC(1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩)粉末(Pierce Biotechnlogy社、ロックフォード
IL)の新鮮な1アリコートを室温に戻す。
【0126】
2.70−merのC−6アミン修飾オリゴヌクレオチドを、dH2Oで100μM(100ピコモル/μL)まで再懸濁する。
【0127】
3.貯蔵xMAP微小球を光学ボルテックス(light vortex)および超音波処理により約20秒間再懸濁する。
【0128】
4.貯蔵微小球(100μL)の1,250,000ビーズを、1.5ml Seal−Riteマイクロフュージチューブ(USA Scientific社、オカラ FL)に移す。
【0129】
5.貯蔵微小球を、マイクロ遠心分離により≧8000×gで3〜5分間(固体ペレットの形成に十分な時間)ペレット化する。
【0130】
6.上清を除去し、ペレット化した微小球を50μLの0.1M MES緩衝液、pH4.5で約20秒間(チューブにペレットまたはスメアリングが目で確認できなくなるのに十分な時間)、超音波処理により再懸濁する。
【0131】
7.100μMのアミンオリゴヌクレオチド1:4(3μLのdH2O中1μL)を、最終濃度25μM(25ピコモル/μL)に希釈する。
【0132】
8.捕捉オリゴ(25ピコモル)1.0μLを添加し、超音波処理により約20秒間混合する。
【0133】
9.dH2O中10mg/mL EDCの新鮮溶液を調製する。(注:第2のEDC添加に再使用するためEDC粉末を乾燥剤に戻す)。
【0134】
10.反応ごとに1つずつ、新鮮な10mg/mLのEDC 25μLを微小球(25μgまたは≒[0.47μg/μL]final)に添加し、超音波処理により約20秒間混合する。
【0135】
11.(微小球の沈降を減少するため)15分を目印に超音波処理しながら、暗所で室温にて30分間インキュベートする。
【0136】
12.dH2O中10mg/mL EDCの新鮮溶液を調製する。(注:EDC粉末のアリコートは今や捨てるべきである。本発明者は、結合エピソードごとにEDC粉末の新鮮なアリコートを用いることを推奨する)。
【0137】
13.反応ごとに1つずつ、新鮮な10mg/mLのEDC 25μLを微小球に添加し、超音波処理により約20秒間混合する。
【0138】
14.15分を目印に超音波処理しながら、暗所で室温にて30分間インキュベートする。
【0139】
15.0.02% Tween−20 1.0mLを結合した微小球に添加し、ボルテックスおよび超音波処理により混合する。
【0140】
16.結合した微小球を、マイクロ遠心分離により≧8000×gで3〜5分間ペレット化する。
【0141】
17.上清を除去し、結合した微小球を1.0mLの0.1% SDS緩衝液でボルテックスおよび超音波処理により再懸濁する。
【0142】
18.結合した微小球を、マイクロ遠心分離により≧8000×gで6〜10分間ペレット化する。
【0143】
19.上清を除去し、結合した微小球を10mMのトリス、1mMのEDTA 100μL、pH8.0でボルテックスおよび超音波処理により約20秒間再懸濁する。
【0144】
100%の回収と想定すると、得られるオリゴ結合ビーズ濃度は、約12,500微小球/μLである。
【0145】
同じ性別の名目上正常ないくつかの個体からプールした、標準的な正常ゲノムDNA(Promega社、マジソン WI)を、このアッセイではテスト試料として使用した。男性のDNAはテスト試料として使用し、女性のDNAは参照に使用した。各試料2μgの標識は、ビオチン標識試料を提供するため、キットのシアニンヌクレオチドがビオチンヌクレオチドへ代わったこと以外、上記の実施例4の通りInvitrogen社製BioPrimeキットおよびSpectral Genomics社製試薬により実施した。
【0146】
多重実証アッセイは、以下のプロトコルにより96ウェルマイクロプレートの4ウェルを利用して、2組の両試料によりLuminex xMAPビーズで実施した。
【0147】
1.試料ごとに、1.0μgのビオチン標識ヒトゲノムDNAをMatrix社(ハドソン NH)製ポリプロピレン96ウェルV底ポリプロピレンマイクロプレートの1ウェルに添加する。
【0148】
2.10.0μgのCot 1 DNAおよび10.0μgのサケ精子(Invitrogen社、カールスバッド CA)を、ハイブリダイズするV底プレートの各ウェルに添加する。ビオチンDNAはないが核酸ブロッカーを含有する陰性対照ウェルを含める(Cot 1 DNAおよびサケ精子)。これは、ビーズのブランクを判定するのに使用する。
【0149】
3.プレートを、30〜120分間またはウェルの底が透明になるまでSpeedVacで凍結乾燥する。
【0150】
4.Spectral Genomics Hyb II Bufferを手で温めて沈殿物を溶解し、1.5mLチューブで緩衝液3/4を滅菌蒸留H2O 1/4に添加して希釈する。
【0151】
5.適量の多重オリゴビーズミックスを、結果が、(7.5μL/ウェルに十分な)〜300の各ビーズコード/ウェルとなるよう、希釈したSpectral Genomics Hyb II Bufferに添加する。上下にピペッティングして混合する。
【0152】
6.ハイブリダイゼーション緩衝液の7.5μLの多重オリゴビーズミックスを、ハイブリダイズするV底プレートの各ウェルに分注する。上下にピペッティングして混合する。
【0153】
7.Matrixシングルストリッププレートキャップでウェルを蓋し、Bio−Rad社(ハーキュリーズ CA)製プレートカバーでプレートを密封する。
【0154】
8.プレートの試料を、96ウェルのサーマルサイクラーで100℃にて2分間変性させ、次いで加熱蓋なしで2分間で50℃に冷却する。
【0155】
9.プレートをPerkinElmer NCSマイクロプレートインキュベーターに入れ、50℃および1150rpm振盪にて一晩インキュベートする。
【0156】
10.ハイブリダイゼーション後、2×SSC、50%ホルムアミド(Spectral Genomics Stringency Wash、使用前に50℃に加熱)100μLを各反応物に添加し、プレートをPerkinElmer NCSプレートインキュベーターで20分間、50℃および1150rpm振盪にてインキュベートする。
【0157】
11.均一な真空濾過のため、Millipore 0.45m HTフィルタープレートのすべてのウェルを、30μLの0.2×SSCで湿らせる。
【0158】
12.洗浄のため、Matrix V底プレートからの容量をMilliporeフィルタープレートに移す。
【0159】
13.Millipore真空マニホールドを用いて真空を静かに適用して液体を除去し、フィルタープレートの底をペパータオルで軽く押さえて乾かす。
【0160】
14.2×SSC、0.1% Igepal(Spectral Genomics Stringency Wash、使用前に50℃に加熱)100μLを各反応物に添加し、トップをアルミホイルで(緩く)覆い、プレートをPerkinElmer NCSマイクロプレートインキュベーターで20分間、50℃および1150rpm振盪にてインキュベートする。
【0161】
15.真空マニホールドを用いて真空を静かに適用して液体を除去し、フィルタープレートの底をペパータオルで軽く押さえて乾かす。
【0162】
16.100μLの0.2×SSC(Spectral Genomics Stringency Wash、使用前に50℃に加熱)を各反応物に添加し、トップをアルミホイルで(緩く)覆い、プレートをPerkinElmer NCSミキサーで10分間、50℃および1150rpm振盪にてインキュベートする。
【0163】
17.真空マニホールドを用いて真空を静かに適用して液体を除去し、フィルタープレートの底をペパータオルで軽く押さえて乾かす。
【0164】
18.100μLの1×PBS、0.1% BSA、0.05% Tweenを、4.0μg/mLのPhycoLink(商標)ストレプトアビジン−R−PE(Prozyme Lot PJ13S)と共に各反応物に添加する。トップをアルミホイルで(緩く)覆い、プレートをPerkinElmer NCSミキサーで30分間、25℃および1050rpm振盪にてインキュベートする。
【0165】
19.真空マニホールドを用いて真空を静かに適用して液体を除去し、フィルタープレートの底をペパータオルで軽く押さえて乾かす。
【0166】
20.100μLの1×PBS、0.01% Tween 20を各反応物に添加し、フィルタープレートに真空を適用し、軽く押さえて乾かす。
【0167】
21.100μLの1×PBS、0.01% Tween 20を各反応物に添加する。フィルタープレートを、PerkinElmer NCSマイクロプレートインキュベーターで少なくとも1分間、1050rpmで振盪する。
【0168】
22.ビーズ領域ごとの蛍光シグナル中央値および50という最少ビーズカウント設定を用いて、Luminex 200機器により試料を読み取る。
【0169】
実証アッセイの結果を図12に示す。女性試料のシグナル対男性試料のシグナルの比は縦軸上にあり、オリゴヌクレオチドプローブの識別は横軸上にある。各試料の2つの複製物に関するシグナルを平均化した。XおよびYの性特異的染色体プローブは、単一線を上下に1.2超過するシグナル比を生じたのに対し、非性特異的プローブはすべて、上下1.2未満の比を生じた。
【0170】
(実施例5)
多重示差的遺伝子発現は、一般に、2つのフルオロフォアアッセイにより、プリントマイクロアレイで実施される。このタイプのアッセイでは、2つのRNA試料(参照およびテストする試料)が、標識されたヌクレオチドの存在下で逆転写酵素によりcDNAに酵素的に転換される。cDNA産物は、故に蛍光標識されたヌクレオチド画分を有し、これにより光学的に検出することができる。各試料は、2つの異なるフルオロフォア(典型的にはシアニン3およびシアニン5)により別々に標識され、標識された試料はプールされ、マイクロアレイに競合的にハイブリダイズされる。蛍光走査装置で検出された、マイクロアレイの各要素での2つの色素の比は、故にそれぞれの試料のアッセイされたRNA配列それぞれの相対濃度を示す。
【0171】
このタイプのアッセイは、本技術の1つの態様に従って、単一のフルオロフォア読み出しにより常磁性Luminex xMAP(商標)ビーズで実施される。38個の遺伝子を示すオリゴヌクレオチド(「オリゴ」)プローブは、Operon社(ハンツビル AL)から入手した。これらのオリゴプローブは、5’末端にアミノ基を有する70−mer長のプローブであった。各オリゴ配列を、一般的なEDAC結合化学を用いて、特定のxMAPビーズIDコードまたは領域を有するxMAPビーズ1セットに固定化した。陰性対照に加えて、示された38個の遺伝子は、NRP2、CARD14、IGFALS、TSSC3、PSEN2、IGFBP4、TP53BP2、GAPD、PRODH、TNFRSF7、RAB6KIFL、ILF1、BCL2L2、DNASE1L3、PPP1R15A、PIG11、HSPD1、CDH1、IGFBP5、IRF1、TNFRSF10C、TNFRSF17、LTA、DFFB、IL16、PTPN13、IL3、TNFSF18、CCNG1、CCND1、TUCAN、RIPK3、CASP6、IL2、TNFAIP2、IL24、K−ALPHA−1、およびTRIPであった。39のビーズタイプを、次いで多重ビーズセットにプールし、このセットからのアリコートを96ウェルマイクロプレートのウェルに入れ、以下に記載の通り遺伝子発現を実施した。
【0172】
本技術を実証する目的のため、単一の参照RNA試料を使用した(Universal
Human Reference RNA Stratagene社、ラホーヤ CA)。単一試料を2つに分けた。故に、示差的アッセイの予想結果は、各遺伝子につき1:1比である。これは、遺伝子発現プラットフォームで行われる一般的な評価である。本技術の1つの態様に従い、RNAの一方のアリコートは、間接標識であるビオチンで標識し、他方はフルオレセインで標識した。これら2つの間接標識した試料を、次いでプールし、予め調製した多重ビーズセットと混合し、同時にハイブリダイズできるようにした。
【0173】
ハイブリダイゼーション後、アッセイしたビーズセットを2つのアリコートに分けた。ストレプトアビジン−フィコエリトリンレポーター試薬(ビオチン標識試料に特異的)を添加し、一方のアリコートと共にインキュベートし、および抗フルオレセイン−フィコエリトリン(抗フルオレセイン標識試料に特異的)を添加し、他方のアリコートと共にインキュベートした。フィコエリトリンは、xMAP(商標)機器における好ましいレポーターフルオロフォアである。常磁性ビーズのアリコートを、次いでプレート磁石によりマイクロプレートウェルの壁に引き寄せ、ピペットで液体試薬を取り除き、および標識したビーズを洗浄緩衝液で再懸濁した。ビーズの2つのアリコートを、次いでLuminex xMAP 200(商標)機器で順次読み取った。
【0174】
得られたシグナルデータを、図11に示したように散布図にプロットした。すべてのデータが同一線に位置した場合、これは、1:1の比および1.0の相関値R2に相当するであろう。この実証アッセイでは、相関計数は0.96であった。この値は、2色素検出を用いる典型的なプリントマイクロアレイ(典型的には0.92から0.96の間のR2値を生じる)により生じる値と比べて進歩である。
【0175】
他の実施形態は、本特許請求の範囲内である。
【技術分野】
【0001】
(関連出願の引用)
本願は、2005年12月23日に出願された米国出願第60/753,584号、2005年12月23日に出願された米国出願第60/753,822号、2006年2月3日に出願された米国出願第60/765,311号、および2006年2月3日に出願された米国出願第60/765,355号に対する優先権を主張する。これらの各々の内容は、本明細書中に参考として援用される。
【背景技術】
【0002】
(背景)
比較ゲノムハイブリダイゼーション(CGH)は、ゲノム量を評価する方法である。CGHは、例えば、先天性異常、遺伝性疾患および癌を分析するのに使用することができる。
【発明の概要】
【課題を解決するための手段】
【0003】
(要旨)
本発明者らは、複数の試料を同時に評価するため、コードされた粒子を用いてゲノム量を評価する方法を発見した。いくつかの実施形態では、ゲノム量の差は、例えば、分析用DNAおよび参照DNAを単一の混合物に合わせることなく、未知の試料からのDNAおよび参照DNAを同時に評価して検出することができる。分析用DNAおよび参照DNAは、互いに別個のままである。複数の試料を、例えば、単一の標識により評価することができる。いくつかの他の実施形態では、単一の検出標識を使用して、分析用DNAおよび参照DNAを同一の混合物中で比較してゲノム量の差を検出する。分析用DNAおよび参照DNAは、例えば、異なる直接または間接標識を有することができる。該方法はまた、遺伝子発現分析のように、他の核酸、例えば、mRNAを評価するのに使用することもできる。
【0004】
1つの態様では、本開示は、ゲノムDNAの評価方法を特徴とする。該方法は、異なる粒子セットからの粒子を含む混合物を使用する。混合物が複数の異なるゲノム遺伝子座に対するプローブを集合的に含むように、各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有する。該方法は、ゲノムDNA試料および粒子混合物を提供すること、ハイブリダイゼーション条件下で粒子混合物の一部に試料を接触させること、検出可能な標識をモニタリングして、混合物のそれぞれの一部分の粒子と試料のハイブリダイゼーションを評価することを含むことができる。モニタリングからのシグナルは、検討する各ゲノム遺伝子座のコピー数を示す。
【0005】
1つを超える核酸試料(例えば、ゲノムDNAを含む試料)が提供され得る。例えば、各核酸試料を、該方法により評価することができる。試料は、別々のコンパートメントで評価することができる。いくつかの実施形態では、1つを超えるDNA試料を、同一のコンパートメントで評価することができる。
【0006】
いくつかの実施形態では、検出可能な標識は分光法により検出することができる。例示的な検出可能な標識は、フィコエリトリンまたは他の蛍光分子を含有することができる。
【0007】
いくつかの実施形態では、核酸ハイブリダイゼーションプローブは、クローン化核酸を含む、またはクローン化核酸から得られる。例えば、核酸ハイブリダイゼーションプローブは、細菌人工染色体(BAC)由来の核酸を含有することができる。BAC核酸は、ヒトゲノムDNAまたはヒト以外(例えば、マウス、ラット、ウサギ、モルモット、ハムスター、ヤギ、ウシ、イヌ、ネコ、ウマ、鳥、爬虫類、ヒト以外の霊長類(例えば、サルまたはヒヒ)、またはハエ)のゲノムDNAのセグメントを含有することができる。
【0008】
いくつかの実施形態では、核酸ハイブリダイゼーションプローブは、特定の染色体遺伝子座に特異的な1つまたは複数のオリゴヌクレオチド(例えば、オリゴヌクレオチドのコレクション)を含有することができる。例えば、プローブは、互いに50、20、5、2、1、または0.5メガ塩基対内にある配列に対し特異的であってよい。
【0009】
いくつかの実施形態では、少なくとも2、5、10、20、50、100、または200個の異なる粒子セットを使用して、例えば、異なる遺伝子座の各個数を評価することができる。いくつかの実施形態では、1個の粒子セットのコードされた粒子すべてが、同一のコードを有することができる。他の実施形態では、各粒子は固有のコードを有し、どの粒子がどの粒子セットにあるか、またはどのプローブが各粒子に結合されるかを示す情報が保存される。
【0010】
いくつかの実施形態では、複数の試料のうち少なくとも1つの試料は、検討する各ゲノム遺伝子座のコピー数がわかっている参照試料であってよい。該方法は、参照試料のモニタリングからのシグナルを他の試料からのシグナルと比較して、該試料の検討する各ゲノム遺伝子座のコピー数を判定することを含み得る。
【0011】
1つを超えるDNA試料が提供されるいくつかの実施形態では、各試料を第1の間接標識で標識することができ、各試料を第2の間接標識で標識された参照DNAと合わせることができる。参照DNAは、検討する各ゲノム遺伝子座のコピー数がわかっている参照源由来のゲノムDNAとすることができる。例えば、第1の間接標識はフルオレセインとすることができ、第2の間接標識はビオチンとすることができる。
【0012】
いくつかの実施形態では、評価は、(i)試料の第1の一部分(portion)に、単一の標識、および第1の間接標識を結合する薬剤を含む第1部分(moiety)を合わせること、ならびに(ii)試料の第2の一部分に、単一の標識、および第2の間接標識を結合する薬剤を含む第2部分を結合することを含み得る。例えば、第1部分は、ストレプトアビジンまたはアビジンおよび検出可能な標識(例えば、フィコエリトリン)を含み得、第2部分は、抗フルオレセイン抗体またはこの機能部分および検出可能な標識(例えば、フィコエリトリン)を含み得る。いくつかの実施形態では、各ゲノム試料の異なる粒子セットの各々からの少なくとも5、10、20、30、50、70、または100個の粒子が評価される。
【0013】
1つを超える試料が提供される場合、1つを超える試料はそれぞれ、マルチコンパートメントデバイスの異なるコンパートメント中にあってよい。いくつかの実施形態では、各試料は、マルチウェルプレートの異なるウェル中にあってよい。マルチウェルプレートは、96ウェル、384ウェル、または1024ウェルのアッセイプレートであってよい。
【0014】
該方法は、例えば、複数の異なる染色体遺伝子座においてヘテロ接合性を検出するのに使用することができ、染色体増幅が検出でき、ヘテロ接合性の欠損が検出でき、染色体遺伝子座のヘテロ接合性欠失が検出でき、染色体遺伝子座のホモ接合性欠失が検出できる。
【0015】
いくつかの実施形態では、粒子は、例えば、ハイブリダイゼーション後、ポリメラーゼに接触しない。いくつかの実施形態では、粒子は、例えば、ハイブリダイゼーション後、いずれの酵素にも接触しない。
【0016】
いくつかの実施形態では、ゲノムDNA試料は非標識であってもよい。該方法は、標識プローブをゲノム試料にハイブリダイズすることをさらに含むことができ、ゲノム遺伝子が試料に存在する場合、試料核酸鎖との標識プローブのハイブリダイゼーション、および粒子に結合した核酸ハイブリダイゼーションプローブとの試料核酸鎖のハイブリダイゼーションにより形成された複合体により標識プローブが粒子に固定化されるように、粒子に結合した核酸ハイブリダイゼーションプローブごとに、1つの標識プローブが同一のゲノム遺伝子座の遺伝的関連部位にハイブリダイズする。いくつかの実施形態では、標識プローブは、粒子に結合した核酸プローブとのゲノムDNA試料のハイブリダイズと同時にハイブリダイズすることができる。いくつかの実施形態では、標識プローブは、粒子に結合した核酸プローブとのゲノムDNA試料のハイブリダイズの後でハイブリダイズすることができる。
【0017】
いくつかの実施形態では、該方法は、1つのソースからのゲノムDNAを間接標識で標識してゲノムDNA試料を提供することをさらに含み得る。
【0018】
いくつかの実施形態では、例えば単一の検出可能な標識が使用される場合、該方法は、1つのソース由来のゲノムDNAを単一の標識で標識してゲノムDNA試料を提供することをさらに含み得る。該方法のいくつかの実施形態では、ゲノムDNA試料のすべてを、単一の標識で標識することができる。
【0019】
いくつかの実施形態では、未知のゲノム量を有するゲノムDNA試料のすべてを、同一の間接標識で標識することができる。いくつかの実施形態では、ゲノムDNA試料の大部分を、同一の間接標識で標識することができる。
【0020】
いくつかの実施形態では、該方法は、ハイブリダイゼーションを評価する前に粒子を攪拌することをさらに含み得る。
【0021】
例えば、粒子は、ホログラフ的にコードすることができ、または単一の検出標識のスペクトルとは分離可能なスペクトルを有する蛍光色素によりコードすることができる。該方法のいくつかの実施形態では、粒子は磁性を有し得る。例えば、粒子は常磁性ビーズである。
【0022】
別の態様では、本開示は、単一の検出可能な部分および1つの粒子混合物を用いるゲノムDNAの評価方法を提供する。混合物は、(複数の異なるゲノム遺伝子座に対するプローブを混合物が集合的に含むように、各粒子セットが、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有する)異なる粒子セットからの粒子を含む。該方法は、少なくとも1つの参照DNA試料および複数のゲノムDNA試料を提供することを含む。各試料は、同一の検出可能な部分で標識される。該方法はまた、ハイブリダイゼーション条件下で粒子混合物の一部に試料をそれぞれ接触させること、および検出可能な部分をモニタリングして、混合物のそれぞれの一部分の粒子と各試料のハイブリダイゼーションを評価することも含む。例えば、各試料は、別々の容器で粒子混合物と接触する。モニタリングからのシグナルは、検討する各ゲノム遺伝子座のコピー数を示すことができる。該方法は、本明細書に記載された他の特徴を含み得る。
【0023】
別の態様では、本開示は、単一の検出可能な部分および1つの粒子混合物を用いる核酸の評価方法を特徴とする。混合物は、(複数の異なるゲノム遺伝子座に対するプローブを混合物が集合的に含むように、各粒子セットが、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有する)異なる粒子セットからの粒子を含む。該方法は、第1の間接標識で標識された少なくとも1つの参照核酸試料、および複数のテスト核酸試料を提供することを含み得る。各試料は、第2の間接標識で標識される。該方法は、ハイブリダイゼーション条件下で粒子混合物の一部に各テスト試料および参照試料を接触させる(各テスト試料は、別々の容器で粒子混合物および参照試料に接触する)こと、各テスト試料の第1の一部分に、単一の標識、および第1の間接標識を結合する薬剤を含む第1部分を結合すること、各テスト試料の第2の一部分に、単一の標識、および第2の間接標識を結合する薬剤を含む第2部分を結合すること、試料の第1の一部分における単一の標識、および試料の第2の一部分における単一の標識をモニタリングして、各テスト試料を評価することを含み得る。モニタリングからのシグナルは、各標的のコピー数を示すことができる。該方法は、テスト試料ごとに、第1の一部分における単一の標識からのシグナルを、第2の一部分における単一の標識からのシグナルと比較して、参照試料に対するテスト試料中のプローブコピー数の指標を得ることを含み得る。該方法は、本明細書に記載された他の特徴を含み得る。
【0024】
別の態様では、本開示は、複数の異なるゲノム遺伝子座に対するプローブを混合物が集合的に含むように、各粒子セットが、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有することができる、異なる粒子セットからの粒子を含有する粒子混合物を提供する。
【0025】
いくつかの実施形態では、遺伝子座の少なくともいくつかに対するプローブは、細菌人工染色体DNAを含有することができる。いくつかの実施形態では、遺伝子座の少なくともいくつかに対するプローブは、超音波処理した細菌人工染色体DNAを含有することができる。いくつかの実施形態では、遺伝子座の少なくともいくつかに対するプローブは、合成オリゴヌクレオチドのコレクションを含有することができる。
【0026】
いくつかの実施形態では、粒子混合物は、少なくとも2つの試料からのハイブリダイズしたDNAを含む粒子をさらに含み得る。各試料はゲノムDNAを含み、各試料は異なる間接標識で標識することができる。いくつかの実施形態では、粒子混合物は、検出可能な標識で標識される単一の試料からのハイブリダイズしたDNA、または1つを超える試料(例えば、第1試料および第2試料)からのハイブリダイズしたDNAをさらに含み得る。
【0027】
別の態様では、本開示は、複数のコンパートメントを有するマルチコンパートメントプレートを特徴とする。少なくとも複数のウェルのそれぞれは、本明細書に記載されたもののいずれかのような1つの粒子混合物、および試料または参照ゲノム核酸を含有することができる。試料および参照核酸は別々の容器中にあってよい。いくつかの実施形態では、試料および参照核酸は、同一の標識で検出することができる。
【0028】
別の態様では、本開示は、第1の間接標識で標識された参照ゲノムDNA(または他の参照核酸)試料と、第2の間接標識でゲノムDNA(または他の核酸)試料を標識するための試薬とを含むキットを特徴とする。キットはまた、単一の標識、および第1の間接標識を結合する1つの薬剤を含む第1部分、単一の標識、および第2の間接標識を結合する1つの薬剤を含む第2部分、および本明細書に記載されたもののいずれかのような粒子混合物の1つまたは複数を含むこともできる。キットはまた、場合により、単一の標識の検出法および/またはキットを用いるアッセイの実施に関する説明書を含むこともできる。
【0029】
本明細書に記載された1つまたは複数の成分を含むキットも開示される。キットは、方法、例えば、本明細書に記載された方法のための成分を使用するための説明書を含む材料をさらに含むことができる。キットは、1つまたは複数のクローン化もしくは合成核酸配列(細菌人工染色体(BACS)または合成オリゴヌクレオチドの1つもしくは複数のコレクション、または個々のオリゴヌクレオチドなど)、1つまたは複数のマイクロウェルプレート、および/または、例えば、本明細書に記載されたような1つまたは複数の粒子セット、または1つの粒子混合物を含むことができる。
【0030】
ビーズなどの粒子は、ゲノム量を評価するための特に堅固なシステムを提供する。粒子ベースの方法は、液相速度に近いまたは液相速度でのハイブリダイゼーションを含むため、均一性が向上する。粒子は、特定の粒子に関する多くのデータ点を得ることを容易にする。例えば、小粒子(例えば、直径が最大数ミクロンの粒子)では、同一のプローブを有する少なくとも10、50、または100粒子が、個別に分析され得る。大粒子は、各粒子の目立たない位置から複数のデータ点を得ることを可能にすることができる。大粒子では、多くのデータ点を得るのに必要な粒子は少ない場合が多い。統計は、同一のプローブ量を有する粒子集団に関する中央値または平均値シグナルを判定するのに適用することができる。
【0031】
本明細書に記載された方法は、レシオメトリックアッセイに使用することができる。レシオメトリックアプローチは、複数のアッセイを競合的におよび同時に実施することでアッセイ精度の多くの潜在的誤差を訂正する。例えば、インキュベーション条件または捕捉分子もしくは標識試薬の濃度におけるいかなる変動も、正規化により訂正される。競合または非競合レシオメトリックアッセイは、例えば、比較ゲノム量または比較遺伝子発現に使用することができる。
【0032】
本明細書に引用された特許、特許出願、および参考文献はすべて、参照により本書に組み込まれる。
例えば、本願発明は以下の項目を提供する。
(項目1)
ゲノムDNAの評価方法であって、
ゲノムDNA試料を提供することと、
粒子混合物を提供することであって、該混合物は、異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、該混合物は、複数の異なるゲノム遺伝子座に対するプローブを集合的に含むことと、
ハイブリダイゼーション条件下で該粒子混合物の一部分に該試料を接触させることと、
検出可能な標識をモニタリングすることにより該混合物のそれぞれの一部分中の粒子に対する該試料のハイブリダイゼーションを評価することであって、ここで、該モニタリングからのシグナルは、検討する各ゲノム遺伝子座のコピー数を示すことと
を含む方法。
(項目2)
単一の検出可能な標識が使用される、項目1に記載の方法。
(項目3)
1種類を超えるDNA試料が提供され、該DNA試料のそれぞれが前記方法により評価される、項目1に記載の方法。
(項目4)
粒子セットのコードされた粒子がすべて同一のコードを有する、項目1に記載の方法。
(項目5)
前記検出可能な標識が分光法により検出できる、項目1に記載の方法。
(項目6)
前記検出可能な標識がフィコエリトリンを含む、項目5に記載の方法。
(項目7)
前記核酸ハイブリダイゼーションプローブがクローン化核酸を含む、項目1に記載の方法。
(項目8)
前記核酸ハイブリダイゼーションプローブがBAC核酸を含む、項目7に記載の方法。
(項目9)
前記BAC核酸がヒトゲノムDNAセグメントを含む、項目7に記載の方法。
(項目10)
前記BAC核酸がヒト以外のゲノムDNAセグメントを含む、項目7に記載の方法。
(項目11)
前記核酸ハイブリダイゼーションプローブが、特定の染色体遺伝子座に特異的なオリゴヌクレオチドのコレクションを含む、項目1に記載の方法。
(項目12)
少なくとも20個の異なる粒子セットが、少なくとも20個の異なるゲノム遺伝子座を評価するのに使用される、項目1に記載の方法。
(項目13)
複数の試料のうち少なくとも1つの試料が、検討する各ゲノム遺伝子座を既知のコピー数で有する参照試料であり、前記方法が、該参照試料のモニタリングからのシグナルを他の試料からのシグナルと比較して、該試料の検討する各ゲノム遺伝子座のコピー数を判定することを含む、項目3に記載の方法。
(項目14)
各試料が第1の間接標識で標識され、および各試料が第2の間接標識で標識された参照DNAと合わせられる、項目3に記載の方法。
(項目15)
前記参照DNAが、検討する各ゲノム遺伝子座を既知のコピー数で有する参照源からのゲノムDNAである、項目14に記載の方法。
(項目16)
前記第1の間接標識がフルオレセインであり、前記第2の間接標識がビオチンである、項目14に記載の方法。
(項目17)
前記評価することが、(i)前記試料の第1の一部分に、単一の標識、および第1の間接標識を結合する薬剤を含む第1部分を結合することと、(ii)該試料の第2の一部分に、単一の標識、および第2の間接標識を結合する薬剤を含む第2部分を結合することとを含む、項目1に記載の方法。
(項目18)
前記第1部分が、ストレプトアビジンおよびフィコエリトリンを含み、前記第2部分が、抗フルオレセインおよびフィコエリトリンを含む、項目17に記載の方法。
(項目19)
各試料が、マルチコンパートメントデバイスの異なるコンパートメントである、項目1に記載の方法。
(項目20)
各試料が、マルチウェルプレートの異なるウェルである、項目19に記載の方法。
(項目21)
少なくとも100個の粒子が、各ゲノム試料の異なる粒子セットの各々から評価される、項目1に記載の方法。
(項目22)
複数の異なる染色体遺伝子座でのヘテロ接合性が検出できる、項目1に記載の方法。
(項目23)
染色体増幅が検出できる、項目1に記載の方法。
(項目24)
染色体のヘテロ接合性欠失が検出できる、項目1に記載の方法。
(項目25)
染色体のホモ接合性欠失が検出できる、項目1に記載の方法。
(項目26)
ハイブリダイゼーション条件下での接触後、前記粒子がポリメラーゼに接触しない、項目1に記載の方法。
(項目27)
ハイブリダイゼーション条件下での接触後、前記粒子が酵素に接触しない、項目1に記載の方法。
(項目28)
前記ゲノムDNA試料が標識されておらず、前記方法が、標識プローブを該ゲノム試料にハイブリダイズすることをさらに含み、ここで、前記ゲノム遺伝子座が該試料に存在する場合、試料核酸鎖への該標識プローブのハイブリダイゼーションおよび該粒子に結合した該核酸ハイブリダイゼーションプローブに対する該試料核酸鎖のハイブリダイゼーションにより形成された複合体によって該標識プローブが該粒子に固定化されるように、粒子に結合した核酸ハイブリダイゼーションプローブの各々について、1つの標識プローブが同一のゲノム遺伝子座の遺伝的連鎖部位にハイブリダイズする、項目1に記載の方法。
(項目29)
前記標識プローブが、前記粒子に結合した前記核酸プローブに対して前記ゲノムDNA試料がハイブリダイズするのと同時にハイブリダイズされる、項目28に記載の方法。
(項目30)
前記標識プローブが、前記粒子に結合した前記核酸プローブに対して前記ゲノムDNA試料がハイブリダイズした後にハイブリダイズされる、項目28に記載の方法。
(項目31)
1つのソースからのゲノムDNAを間接標識で標識してゲノムDNA試料を提供することをさらに含む、項目1に記載の方法。
(項目32)
1つのソースからのゲノムDNAを前記単一の標識で標識してゲノムDNA試料を提供することをさらに含む、項目2に記載の方法。
(項目33)
前記ゲノムDNA試料のすべてが前記単一の標識で標識される、項目2に記載の方法。
(項目34)
未知のゲノム含量を有するゲノムDNA試料のすべてが同一の間接標識で標識される、項目1に記載の方法。
(項目35)
ゲノムDNA試料の大部分が同一の間接標識で標識される、項目1に記載の方法。
(項目36)
ハイブリダイゼーションを評価する前に前記粒子を攪拌することを含む、項目1に記載の方法。
(項目37)
前記粒子が、ホログラフ的にコードされるか、または前記単一の検出標識のスペクトルと分離可能なスペクトルを有する蛍光色素によりコードされる、項目2に記載の方法。
(項目38)
前記粒子が常磁性ビーズである、項目1に記載の方法。
(項目39)
単一の検出可能な部分を用いるゲノムDNAの評価方法であって、
少なくとも1つの参照DNA試料、および各試料が同一の検出可能な部分で標識されている複数のゲノムDNA試料を提供することと、
粒子混合物を提供することであって、該混合物は、異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、該混合物は、複数の異なるゲノム遺伝子座に対するプローブを集合的に含むことと、
ハイブリダイゼーション条件下で該粒子混合物の一部分に該試料のそれぞれを接触させることであって、各試料は別々の容器において該粒子混合物に接触することと、
該検出可能な部分をモニタリングすることにより該混合物のそれぞれの一部分中の粒子に対する各試料のハイブリダイゼーションを評価することであって、ここで、該モニタリングからのシグナルは、検討する各ゲノム遺伝子座のコピー数を示すことと
と
を含む方法。
(項目40)
単一の検出可能な標識を用いる核酸の評価方法であって、
第1の間接標識で標識された少なくとも1つの参照核酸試料、および各テスト試料が第2の間接標識で標識される複数のテスト核酸試料を提供することと、
粒子混合物を提供することであって、該混合物は、異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子、および特定の標的に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、該混合物は、複数の異なる標的に対するプローブを集合的に含むことと、
ハイブリダイゼーション条件下で該粒子混合物の一部分に該テスト試料の各々および参照試料を接触させることであって、ここで、各テスト試料は、別々の容器中で該粒子混合物および該参照試料に接触することと、
各テスト試料の第1の一部分に、該単一の標識、および該第1の間接標識を結合する薬剤を含む第1部分を結合することと、
各テスト試料の第2の一部分に、該単一の標識、および該第2の間接標識を結合する薬剤を含む第2部分を結合することと、
該試料の該第1の一部分における該単一の標識をモニタリングし、該試料の該第2の一部分における該単一の標識をモニタリングすることにより各テスト試料を評価することであって、ここで、該モニタリングからのシグナルは、各標的のコピー数を示すことと、
各テスト試料について、該第1の一部分における該単一の標識からのシグナルを、該第2の一部分における該単一の標識からのシグナルと比較して、該参照試料に対する該テスト試料中のプローブのコピー数の指標を得ることと
を含む方法。
(項目41)
粒子混合物であって、該粒子混合物は、異なる粒子セットからの粒子を含み、ここで、各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座に対する1つの核酸ハイブリダイゼーションプローブを含有し、その結果、該混合物は、複数の異なるゲノム遺伝子座に対するプローブを集合的に含む、混合物。
(項目42)
前記遺伝子座のうちの少なくともいくつかに対するプローブが、細菌人工染色体DNAを含む、項目41に記載の粒子混合物。
(項目43)
前記遺伝子座のうちの少なくともいくつかに対するプローブが、超音波処理した細菌人工染色体DNAを含む、項目41に記載の粒子混合物。
(項目44)
前記遺伝子座のうちの少なくともいくつかに対するプローブが、合成オリゴヌクレオチドのコレクションを含む、項目41に記載の粒子混合物。
(項目45)
少なくとも2つの試料からのハイブリダイズしたDNAをさらに含み、ここで、各試料がゲノムDNAを含み、各試料が異なる間接標識で標識される、項目41に記載の粒子混合物。
(項目46)
検出可能な標識で標識された、単一の試料からのハイブリダイズしたDNAをさらに含む、項目41に記載の粒子混合物。
(項目47)
複数のウェルを有するマルチウェルプレートであって、該ウェルのうちの少なくとも複数のウェルの各々が、
項目41に記載の粒子混合物と、
試料または参照ゲノムDNAであって、ここで該試料および参照DNAが別々の容器中にあり、同一の標識で検出できる、試料または参照ゲノムDNAと
を含む、マルチウェルプレート。
(項目48)
キットであって、
第1の間接標識で標識された参照ゲノムDNA試料と、
第2の間接標識でゲノムDNA試料を標識するための試薬と、
単一の標識、および該第1の間接標識を結合する薬剤を含む第1部分と、
単一の標識、および該第2の間接標識を結合する薬剤を含む第2部分と、
項目41に記載の粒子混合物と
を含む、キット。
【図面の簡単な説明】
【0033】
【図1】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図2】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図3】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図4】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図5】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図6】図1〜6は、1つの例に従ってアッセイビーズに固定化された捕捉分子との一連の特異的結合相互作用の概略図である。
【図7】図7は、図1から6に記載された例示のアッセイの工程フローチャートである。
【図8】図8は、例示的実施形態に従って実施された参照アッセイの結果を示す。
【図9】図9は、例示的実施形態に従って実施された参照アッセイの結果を示す。
【図10】図10は、例示的実施形態に従って実施された参照アッセイの結果を示す。
【図11】図11は、発現RNAに関する二重の間接標識−単回ハイブリダイゼーションを用いる例示的アッセイからの結果を示す。
【図12】図12は、参照およびテスト試料が同一のウェル中にない、1つの実施形態に従って実施された単色(単一標識)アッセイからの結果を示す直線グラフである。
【発明を実施するための形態】
【0034】
(詳細な説明)
多重核酸アッセイは、効率的および経済的な設計特性により大幅に容易になる。本明細書に記載の通り、単一標識の検出は、大型多重アッセイを実施するのに使用することができる。該アッセイは、異なる粒子セットからの小粒子の混合物を利用する。各粒子セットは、多数のコードされた粒子、および特定のゲノム遺伝子座またはRNAなど特定の標的に対する1つの核酸ハイブリダイゼーションプローブを含有する。異なるセットからの粒子は、複数の異なる標的に対するプローブを集合的に含む混合物を提供するのに併用することができる。
【0035】
1つの例では、粒子混合物は、少なくとも2つの一部分、AおよびBに分けられる。テスト試料ゲノムDNAは、第1部分で標識され、標識された一部分Aにハイブリダイズされる。参照DNA(典型的には参照試料からのゲノムDNA)は、第1部分または異なる部分(すなわち、第2部分)と同じであり得る部分により標識される。参照DNAは、一部分Bにハイブリダイズされる。一部分Aおよび一部分Bからのシグナルが測定され、次いで比較される。参照DNAおよび試料DNAが同一の部分により標識される場合、これらは異なる容器において処理される。両ハイブリダイゼーション反応物は、部分が直接標識である、または直接標識に結合している場合(例えば、ハイブリダイゼーションの前後に)部分を検出するように設定された装置を用いて、わずかな操作で評価することができる。
【0036】
使用される部分は、間接標識(間接標識として使用される色素など)、直接標識(例えばフルオロフォアなどの色素など)、または特異的結合ペアのメンバーであってよい。検出は、例えば、特異的結合ペアの標識された第2メンバーを用いる2次検出により、直接的または間接的であり得る。
【0037】
第2の例では、テストおよび参照試料ゲノムDNAは、それぞれが異なる間接標識により標識される。間接標識は、典型的には特異的結合ペアの第1メンバーである。試料は互いに混合され、粒子混合物の同一の部分にハイブリダイズされる。インキュベーションおよび洗浄後、該部分は、2つの特異的結合ペアの対応する第2メンバーと共にインキュベーションするため、少なくとも2つの容器に分けられる。2つの特異的結合ペアのこれらの第2メンバーは、検出に使用される第3の標識、および必要に応じて第4の標識に結合することができる。一般に、検出標識および2つの間接標識は、すべて互いに区別できる。例えば、1つまたは複数の標識が蛍光標識である場合、これらは、分光により区別できるように異なる励起および/または発光スペクトルを有する。
【0038】
例えば、ビオチンはテスト試料に対する間接標識として使用することができ、カルボキシフルオレセインは参照試料に対する間接標識として使用することができる。故に、第1容器では、蛍光標識されたストレプトアビジン(ビオチンに結合する)が添加およびインキュベートされ、ならびに第2容器では、蛍光標識された抗フルオレセイン(カルボキシフルオレセインに結合する)が添加およびインキュベートされる。LUMINEX xMAP(商標)システムでは検出に好ましい蛍光標識は、フィコエリトリンである。結合した蛍光標識産物(テストおよび参照試料由来の)と共にインキュベートされた粒子混合物はそれぞれ、次いで単色検出システムを用いて順次読み取られ、シグナルが比較された。
【0039】
これらの例は、単一検出により比較またはレシオメトリック情報を得る方法を例証する。例示的適用では、多数の異なる粒子試料は、単一のマルチウェルプレートにおいて、異なる標的、例えば、異なるゲノム遺伝子座に対するプローブを有する粒子混合物を用いて処理することができる。粒子混合物は、プレートの各ウェルに入れる。各試料はウェルの1つに入れる。この様式では、複数の試料は、同時におよびロボットの助けにより処理することができる。次いで、混合物中の異なる粒子タイプに対するハイブリダイゼーションを検出するため、各試料は器具(フローサイトメーターなど)を用いて評価することができる。
【0040】
いくつかの実施形態では、テストおよび参照試料は、2つの異なる直接または間接標識により標識される。標識が、直接標識(例えば、シアニン3およびシアニン5などの蛍光色素)の場合、次いで試料は混合され、1つの粒子セットにハイブリダイズされ、2つの標識を区別できる器具により検出することができる。標識が間接標識(すなわち、ビオチンおよびフルオレセインなどの特異的結合ペアの第1メンバー)の場合、次いで特異的結合ペアの各第2メンバー(例えば、ストレプトアビジンおよび抗フルオレセイン)は、シアニン3およびシアニン5など固有の検出標識により標識することができ、2つの標識を区別できる器具により検出することができる。
【0041】
粒子
核酸量、例えば、ゲノム量を評価するのに、様々な異なるタイプの粒子を使用することができる。粒子は、いかなる形(例えば、円筒形、球形など)、大きさ、組成、または生理化学的特性であってよい。粒子の大きさまたは組成は、例えば、粒子孔径を有するフィルター上でまたはいくつかの他の物理的特性、例えば、磁性により、粒子を液体から分離できるように選択することができる。
【0042】
粒子は、一般に多重アッセイに適している。例えば、各粒子は、固有のコード、特に、ゲノムDNAに特異的な核酸プローブ以外のコードを含む。コードは、埋め込まれるか(例えば、粒子内部に)さもなければハイブリダイゼーションおよび分析を通じて安定な形で粒子に結合される。粒子を同定し、故にこれに固定化された捕捉プローブを同定するため、コードは、蛍光特性、色、形、大きさ、光発光、量子ドット発光などによる、ホログラフィックコード化など、任意の検出可能な手段により提供することができる。いくつかの実施形態では、コードは、核酸により提供されるもの以外である。
【0043】
例えば、粒子は、光学、化学、物理、または電子タグを用いてコードされ得る。このようなコード化技術の例は、光学バーコード蛍光色素、または他の手段である。
【0044】
1つの例示的プラットフォームは、特異的捕捉プローブが固定化された粒子セットの各メンバーを同定する手段として、ポリマー粒子に含浸した蛍光色素の混合物を利用する。別の例示的プラットフォームは、円筒形ガラス粒子を同定するのにホログラフィックバーコードを用いる。例えば、Chandlerら(5,981,180)は、異なる粒子タイプが、ポリマー粒子に含浸した2つを超える蛍光色素の様々な割合の混合物によりコードされる、粒子ベースのシステムを記載する。Soini(5,028,545)は、粒子の同定に時間分解蛍光を使用する、粒子ベースの多重アッセイシステムを記載する。Fulwyler(4,499,052)は、色および/または大きさにより区別された粒子を用いる例示的方法を記載する。US2004−0179267、2004−0132205、2004−1030786、2004−0130761、2004−0126875、2004−0125424、2004−0075907は、ホログラフィックバーコードによりコードされた例示的粒子を記載する。
【0045】
US6,916,661は、粒子に対するコードを提供する色素を有するナノ粒子に関連したポリマー微粒子を記載する。ポリマー微粒子は、直径1ミリメートル未満、例えば、直径約0.1から約1,000マイクロメートル、例えば、3〜25μmまたは約6〜12μmの範囲の大きさを有してよい。ナノ粒子は、例えば、直径約1ナノメートル(nm)から約100,000nm、例えば、約10〜1,000nmまたは200〜500nmの直径を有してよい。
【0046】
複数のゲノム遺伝子座を調べるための粒子混合物は、異なる粒子セットからの粒子を結合して調製することができる。各粒子セットは、特定の遺伝子座に特異的な同一のコードおよび核酸プローブ量を有する多数の粒子を含有することができる。例えば、異なる粒子要素の数は、10〜3000、10〜500、20〜200、50〜2000、50〜500、または50〜200、または75〜300の範囲であってよい。各粒子セットは、個別に調製することができ、次いで粒子セットの一部分は、粒子混合物を提供するため他の粒子セットの一部分に結合される。
【0047】
粒子混合物の一部分がDNA試料の分析に使用される場合、特定の遺伝子座に特異的ないくつかの粒子(例えば、少なくとも10、20、30、50、80、もしくは100個の粒子、または1〜5個の粒子であっても)が、この個々の試料に関するハイブリダイゼーション反応において存在するように、粒子セットの各一部分は多数の粒子を含む。粒子は、プローブへの比較的迅速な結合を促進するため液体試料内で浮遊状態で攪拌することができる。
【0048】
粒子は、粒子とのハイブリダイゼーションの程度を判定するために分析される。例えば、ゲノムDNAに関連した標識が検出される。粒子は、粒子コードを読み取り、各特定の粒子に関連したシグナルを判定することができる装置を用いて個別に評価することができる。
【0049】
核酸プローブ
粒子は、一般に、適用に応じて、1つの特定の染色体遺伝子座または遺伝子に特異的なプローブを有する。例えば、プローブは、クローン化DNA(例えば、BACまたは酵母人工染色体または他のソースのクローン化DNA)、増幅DNA、またはオリゴヌクレオチドから調製することができる。一般に、判定可能な配列の任意の核酸源を使用することができる。プローブは、粒子に固定化される(例えば、多孔性粒子では表面、または内部および/もしくは外部表面)。
【0050】
ある染色体プローブは、合成オリゴヌクレオチドの混合物を含む。別の例示的タイプの染色体プローブは、断片化BAC DNAとして固定化することができるBACのクローン化DNAから得られる。
【0051】
一般に、特定の粒子に結合され得るプローブは、断片の混合物であってよい。例えば、断片はランダムに重複する配列を含み、この大部分は600から2,000塩基対の間の長さを有する。それぞれが約60から150塩基対の間の長さを有し、重複または隣接する配列を有する合成オリゴヌクレオチド配列の混合物は、プローブとして調製することができる。オリゴヌクレオチド混合物は、確定的組成を有し、費用効率の高い方法で調製することができる。
【0052】
プローブは、特定の粒子と共有結合することができる。例えば、US6,048,695は、プローブを結合する例示的方法を記載する。特定の粒子セットに対するプローブが、1つまたは複数の化学合成オリゴヌクレオチドである場合、オリゴヌクレオチドは、粒子上の基と反応できる化学基(例えば、アミン)により合成することができる。プローブはまた、例えば、プラスミド、コスミド、および人工染色体などの他のソースから得ることもできる。例えば、細菌人工染色体(BAC)は超音波処理され得、次いでこれを粒子と共有結合させる架橋剤と反応され得る。例えば、1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩(EDCまたはEDAC化学)は、超音波処理したBAC DNAなどの核酸プローブを粒子に結合するのに使用することができる。
【0053】
一般に、プローブを粒子セットに結合する場合、セット中のすべての粒子は同一の「コード」を有する。故に検出器は、特定の結合したプローブとのハイブリダイゼーションに関するシグナルを、セット中のすべての粒子に関する「コード」と関連づけるであろう。しかし、同一の特定のプローブに関する2つを超える「コード」を使用することも可能である。ソフトウェア(または手動計算であっても)は、次いで2つの「コード」に関するシグナルを特定のプローブと関連づけるのに使用することができる。極端には、各粒子は固有のシリアル番号、すなわち自身のコードを有する。データベースが、どの粒子コードが特定のプローブにより修飾されるかを追跡する限り、検出器からのデータは、シグナルをプローブとのハイブリダイゼーションと関連づけるのに使用することができる。
【0054】
標識
試料標識。例えば、分析用のゲノムDNAなどの試料DNAを標識するには、様々な方法を用いることができる。標識は、少なくともいくつかの修飾ヌクレオチド、例えば、ビオチン、ジゴキシゲニン、フルオレセイン、またはシアニン修飾ヌクレオチドを含むヌクレオチドによる重合により導入することができる。いくつかの実施形態では、標識は、ランダムプライミングおよび重合により導入される。他の例には、ニックトランスレーション(Roche Applied Science社、インディアナポリス IN;Invitrogen社、カールスバッド CA)および化学標識(Kreatech ULS社、アムステルダム NL)が挙げられる。一般に、ゲノムDNA試料の標識に適した任意の標識方法が使用され得る。
【0055】
共有参照。多くの実施形態では、方法は、既知の参照試料と未知の実験試料との間のシグナル比を評価する。例えば、2つの間接標識(ビオチンおよびフルオレセイン)は、2つの試料の競合ハイブリダイゼーションを可能にするのに使用される。ハイブリダイゼーション後、試料は2つの(または2つを超える)一部分に分けられ、各一部分は個別に評価される。評価結果は、2つの間接標識レベルの比を得るのに使用することができる。このアプローチは、競合ハイブリダイゼーションを用いてアッセイ間の任意の変動を正規化するという利点を有する。参照および実験試料はいずれも、同一の粒子と混合した同一の容器において同時にアッセイされる。
【0056】
並行参照。いくつかの実施形態では、既知および未知の試料を別々の状態に保つことも可能である。競合ハイブリダイゼーションは使用されない。この場合、参照試料は1つの容器においてアッセイされ、少なくとも1つの実験試料は、別の容器においてアッセイされる。例えば、容器はマルチウェルプレートの異なるウェルであってよい。複数の実験試料が使用される場合、それぞれは、異なる容器、例えばマルチウェルプレートの異なるウェルにおいて評価することができる。各プローブに関する実験試料シグナル対参照試料シグナルの比は、競合アッセイと同じ方法で得ることができる。
【0057】
このアプローチが利用される場合、単一の参照試料を、いくつかのまたは多くの実験試料間で共有することができる。1日あたり複数の試料を必要とする実験では、複数の重複する標準試料の標識を回避することで試薬費用および労力の節約となり得る。また、別の分析用の異なる一部分を得るのに試料を操作する必要がない。各試料は1回のみ評価することができる。
【0058】
非共有結合標識。さらに別の実施形態では、各試料の個別の共有結合標識化が回避される。例えば、非標識ゲノムDNA試料が、コードされた粒子に固定化された捕捉プローブにハイブリダイズされる。前記捕捉プローブは、上述のようなBAC DNAまたはオリゴヌクレオチド混合物を含む。予め標識されたレポーター配列も、捕捉プローブの配列に隣接するが重複しない配列においてプローブ−試料複合体にハイブリダイズされる。これらの標識されたレポーター配列は、同じまたは異なるハイブリダイゼーション反応においてハイブリダイズすることができる。この方法では、標識されたレポーター配列は、アッセイ時に各試料を個別標識することに比べて、アッセイあたりの費用を低減しつつ、大規模環境で大量に作製することができる。
【0059】
検出
ハイブリダイゼーションの程度を示すシグナルは、粒子ごとに、1つまたは複数の検出可能な標識からのシグナルを評価して検出することができる。粒子は、典型的には個別に評価される。例えば、粒子は、フローサイトメーターに通すことができる。例示的フローサイトメーターには、Coulter Elite−ESPフローサイトメーター、またはBeckman Coulter,Inc.社(フラートン CA)から入手可能なFACScan(商標)フローサイトメーター、およびCytomation,Inc.社、フォートコリンズ、コロラド州から入手可能なMOFLO(商標)フローサイトメーターが挙げられる。フローサイトメトリーに加えて、微粒子を分離および分類する機器として遠心分離機を使用してもよい。適切なシステムは、米国特許第5,926,387号に記載されているシステムである。フローサイトメトリーおよび遠心分離に加えて、微粒子を分離および分類する機器としてフリーフロー電気泳動装置を使用してもよい。適切なシステムは、米国特許第4,310,408号に記載されているシステムである。粒子を、表面に置いて走査または画像化してもよい。
【0060】
例示的適用
本明細書に記載されたゲノム評価方法は、診断学および法医学を含む、様々な適用を有する。例えば、該方法は、成人、生殖細胞、胎盤細胞、または胎児細胞のゲノム量を判定するのに使用することができる。細胞は、任意の種由来であってよいが、典型的には2倍体種または高い倍数性を有する種由来である。例えば、細胞は植物(例えば、作物)または動物(例えば、ヒトまたは家畜)由来であってよい。
【0061】
ヒトの医学的用途に関し、該方法は、患者からの試料、例えば、生検、血液試料、羊水試料、または頬スワブからの試料を評価するのに使用することができる。特に、患者は、癌のリクスがあるまたは癌を有する患者であってよい。試料は、腫瘍近くのまたは腫瘍由来の組織からの試料であってよい。例えば、該方法は、癌腫もしくは肉腫由来、または肺、乳房、甲状腺、リンパ系、胃腸、尿生殖路の腫瘍、腺癌(例えば、結腸癌、腎細胞癌、前立腺癌および/または精巣腫瘍)、肺の非小細胞癌、小腸癌および食堂癌由来の細胞のゲノム量を評価するのに使用することができる。癌において変化した多くの染色体遺伝子座が知られている。例えばDutrillauxら、Cancer Genet. Cytogenet.49:203〜217頁(1990年)、US5,670,314(肺癌)、US5,635,351(神経膠腫)、およびUS6,110,673を参照されたい。該方法は、血液細胞(例えば、BもしくはT細胞)、または白血病もしくはリンパ腫由来の細胞のゲノム量を評価するのに使用することができる。
【0062】
本明細書に記載された方法は、他の核酸、例えば、ゲノムDNA以外のDNA、mRNA、または他のRNAに適応することもできる。
【0063】
本発明のいくつかの態様は、以下の非限定例によりさらに例証される。
【実施例】
【0064】
(実施例1)
この例示的レシオメトリックアッセイでは、粒子を、単一の標識により同時に複数の試料について評価するのに使用する。例えば、異なる試料は、2つの別々のマイクロプレートウェルなど、別々の容器に入れる。1つまたは複数の対照試薬は、2試料間の結果を正規化するのに各容器において使用する。
【0065】
単一標識の読み出しシステムを用いる例示的マルチ結合アッセイを以下に記載する。多重マルチ結合アッセイを、例えば、2つの試料IおよびIIにより実施する。アッセイは、追加試料にまで広げることができる。各試料を、試料Iではビオチン、試料IIではジニトロフェノール(DNP)など、1つの間接標識で標識する。両試料からの特定の分析物は、それぞれの粒子タイプ上の核酸プローブとの結合をめぐって競合する。インキュベーションおよび洗浄後、粒子セットを、2つの特異的第2標識と共に別々にインキュベーションするため、2つの容器に分ける。第1容器では、蛍光標識されたストレプトアビジンを添加およびインキュベートし、ならびに第2容器では、蛍光標識された抗DNPを添加およびインキュベートする。LUMINEX xMAP(商標)システムに関しては、蛍光標識ラベルはフィコエリトリンが好ましい。結合した蛍光標識産物IおよびIIと共にインキュベートした各粒子セットの粒子を、粒子コードをフィコエリトリンシグナルと関連づける単色検出システムにより順次評価する。
【0066】
図1に関して、アッセイビーズ1は、この表面に固定化された捕捉分子2を有する。この図では、捕捉分子は、この例の目的のため直鎖状核酸配列として概略的に示されるが、捕捉分子は、クローン化DNAまたはオリゴヌクレオチドなどの特異的結合ペアの任意の核酸メンバーであってよい。アッセイビーズは、第1の液体アッセイ緩衝液3において懸濁される。
【0067】
図2では、2つの標識された試料が図1のビーズ懸濁液に添加される。この例では、試料は、遺伝子発現アッセイまたは比較ゲノムハイブリダイゼーションアッセイにおいて見出されるような核酸配列として概略的に示されるが、この方法は、特異的結合アッセイの任意のタイプにより功を奏するであろう。この図では、第1試料からの分子5は、第1の間接標識B(この例ではビオチン)で標識され、第2試料からの分子4は、第2の間接標識D(この例ではジニトロフェノール[DNP])で標識される。この例では、「B」標識された分子5の2倍の「D」標識された分子4が存在する。試料分子は、ビーズに固定化された結合ペア相補体との結合をめぐって競合するであろう。
【0068】
図3は、インキュベーション、およびビーズ上の捕捉分子との試料分子の特異的結合後の、図1からのビーズおよび間接標識された試料分子を示す。標識された試料分子4および5は、捕捉分子2上での結合をめぐって競合し、結合が起きた場合、結合複合体6を形成した。各ビーズでの特異的結合イベントの数は、相補的な試料分子の濃度にほぼ比例する。この例では、「B」標識された試料分子5に比べて2倍の「D」標識された試料分子4が各ビーズで捕捉される。
【0069】
図4では、捕捉された間接標識分析物7および8を有するビーズ複合体9は、洗浄され、第2の緩衝液12で再懸濁される。洗浄は、ビーズに特異的結合されなかった任意の試料分子を除去する。ビーズはまた、アリコートAおよびBに分けて示される。これは、典型的には、攪拌により緩衝液でビーズを懸濁し、次いでビーズ−緩衝液の懸濁液容量の約半分を第2マイクロプレートウェルなどの第2容器にピペッティングして行われる。2つのアリコートは、ビーズ複合体9とほぼ同じ量および濃度を有する。
【0070】
図5では、試料分子上の間接標識に相補的な異なる蛍光標識分子結合体10および11が、各アリコートに添加される。アリコートAでは、蛍光標識10(フィコエリトリンまたはシアニンまたは他のフルオロフォアなど)に結合したストレプトアビジンが添加される。蛍光標識は、下流の蛍光ビーズ読み取りシステムに適合するように選択される。アリコートBでは、同じ蛍光標識11に結合した抗DNPが添加される。ストレプトアビジンおよび抗DNPは、例示的なビオチンおよびDNP間接標識に相補的であることから、この例ではこれらが使用されるが、いずれの高親和性特異的結合ペアも使用することができる。
【0071】
図6では、蛍光標識されたビーズ結合体13および14は、図5に示された混合物のインキュベーション後に生じ、続いて洗浄、および第3の緩衝液15におけるビーズ複合体の再懸濁が行われた。各アリコートは、アッセイ試料の1つにおける分析物濃度にほぼ比例した各アリコートのビーズ上の蛍光標識集団を有する、蛍光標識されたビーズ複合体を含有する。各アリコートは、現在、各ビーズにおける蛍光標識密度に比例したシグナルを生成する、単一標識の蛍光ビーズ読み取りシステム(LUMINEX xMAP(商標)システムなど)により個別に読み取ることができる。
【0072】
図7は、図1〜6に記載されたアッセイ例の工程フローチャートである。第1試料16は、第1間接標識17(この場合はビオチン)と共にインキュベートされ18、第1間接標識された試料19を生成する。別に、第2試料20は、第2間接標識(DNP)21と共にインキュベートされ22、第2間接標識された試料23を生成する。間接標識を有するこれら2つの試料、19および23は、次いでコードされたビーズセット24により競合的方法でインキュベートされる25。ビーズセットは、例えば、各ビーズタイプに固定化された異なる捕捉分子を有する、コードされたLUMINEXビーズのセット(LUMINEX用語ではビーズ「領域」)であってよい。競合的インキュベーション25の後、ビーズは洗浄され、洗浄緩衝液34により再懸濁され26、再懸濁されたビーズは2つのアリコート27および28に分けられる。
【0073】
間接標識のそれぞれに対する蛍光標識された特異的相補体が、次いで各アリコートに別々に添加される。この例では、ストレプトアビジン−フィコエリトリン29が、第1間接ビーズアリコート27と共にインキュベートされる31。ストレプトアビジンは、ビーズ複合体のビオチン間接標識と特異的に結合する。別に、抗DNP−フィコエリトリン30が、第2ビーズアリコート28と共にインキュベートされる32。抗DNPは、ビーズ複合体のDNP間接標識と特異的に結合する。次に、および2つのアリコートを別々の状態にしたまま、余分な蛍光結合体が洗浄緩衝液35および36で洗い流される31および32。最後に、それぞれ蛍光標識されたビーズアリコートが、この例ではLUMINEX xMAP 100(商標)またはxMAP 200(商標)機器を用いて別々に読み取られる33。
【0074】
(実施例2)
図8から10は、例示的参照アッセイの結果を示す。図8は、間接標識としてのビオチンおよびフルオレセインにより、LUMINEX(登録商標)プラットフォームで行われた10の5乗のBAC−CGHアッセイの特異度および感度を示す。アミノ酸表面に対するカルボキシル化ビーズ表面を最初に修飾し、次いで1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩(EDCまたはEDAC化学)を用いてBAC断片の5’末端をビーズに固定化することで、まず、5つのBACそれぞれからの断片化DNAを5セットのLUMINEXビーズに固定化した。次いで、それぞれが異なるLUMINEXビーズIDすなわち「領域」を有する、6つのビーズセットを、1つの多重ビーズセットにプールした。これらのステップを以下に詳述する。
【0075】
BACプローブ、基準、および試料。細菌人工染色体(BAC)DNAは、捕捉プローブをコードされたビーズに固定化させるのに使用した。5つの異なるヒトBAC(すべてHealth Research Division、Roswell Park Cancer Institute(バッファロー、NY)により提供された)を、次の実験:RP11−289D12(15q11.2);RP11−524F11(17p11.2);RP11−1398P12(4q16.3);RP11−476−C20(22q11.21);RP5−59D14(17p13.3)において固定化捕捉分子として使用した。これらのBACは、染色体遺伝子座を括弧で示したRoswell Parkクローン#によりリストされる。
【0076】
これらのBACは、実験における基準として使用した。5つのBACのプールを、ビオチン標識ヌクレオチドおよび非標識ヌクレオチドによるKlenowランダムプライマー標識を用いて、陽性試料を酵素標識するのに使用した。さらに、陰性対照としてCot−1 DNA(Invitrogen社 15279−011、カールスバッド CA)を、コードされたビーズに固定化した。
【0077】
BACプローブの調製およびビーズへの固定化 BAC DNAは、LUMINEX社(オースチン TX)製のLUMINEX xMAP(商標)ビーズに固定化した。xMAP(商標)ビーズは、表面のカルボキシル基により官能化されたポリスチレンから成る。これらのビーズは、常磁性バージョンおよび非磁性バージョンの両方で提供される。常磁性ビーズは、洗浄ステップでは溶液からのビーズの分離を促進するが、洗浄がフィルターカラムまたはプレート(例えばHTS 0.45μm、カタログMSHVN4510、Millipore社、ビレリカ MA)で実施される場合、非磁性ビーズについても同じプロトコルが機能する。
【0078】
BACおよび対照プローブの磁性LUMINEXビーズへの固定化プロトコルは、以下の通りである。
【0079】
4,9−ジオキサ−1,12−ドデカンジアミンおよびエチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩(EDC)との反応によるカルボキシル化ビーズのアミノ転換
1.LUMINEXスタンドード輸送/保管用バイアルから6つのビーズ領域(24、46、47、56、68および79)250μl(2.5×106ビーズ)を、シリコン処理した200μlピペットチップを用いて6つの別々の1.5mlエッペンドルフチューブに分注した。
【0080】
2.750μlの0.1M 2−(N−モルホリン)−エタンスルホン酸(MES)0.15M NaCl pH6.0を各チューブに添加した。各チューブをボルテックスし超音波処理した。
【0081】
3.サマリウム磁石ディスク磁石を10分間バイアルの側に接触させて各チューブの電磁ビーズをペレット化した。電磁ビーズの攪乱を避けながら液体900μlを慎重に除去した。
【0082】
4.各チューブでMESにより容量を合計80μlに調整した。10μlの4,9−ジオキサ−1,12−ドデカンジアミン(50μl/ml MESで)および10μlのEDC(MES中50mg/ml)を各チューブに添加した。
【0083】
5.ビーズを再懸濁するため各チューブをボルテックスし超音波処理した。
【0084】
6.チューブ回転機で120分間室温にてインキュベートした。
【0085】
7.PBS 900μlをビーズに添加し、ボルテックスし超音波処理した。
【0086】
8.5分間、磁石を用いて電磁ビーズをペレット化した。メスピペットで液体1,000μlを除去し、1,000μlのリン酸緩衝生理食塩水(PBS)を添加した。各チューブをボルテックスし超音波処理してビーズを再懸濁した。
【0087】
9.ビーズ3×の各チューブを、磁石でペレット化して洗浄し、液体を取り除き、洗浄緩衝液(1×PBS 0.01% BSA 0.01% Tween 20)を添加し、超音波処理しボルテックスした。最終的な緩衝液添加は、保存のための250μl 1×PBS 0.01% BSAであった。
【0088】
BACおよび対照DNAのビーズとのEDC結合
1.6つのビーズ領域それぞれの0.5×106アミノビーズ(50μl)を1.5mlエッペンドルフチューブに等分し、ボルテックスし超音波処理した。
【0089】
2.5.0μlのBAC DNAまたはCot−1 DNA(超音波処理により断片化した)(名目濃度50ng/μl)を各チューブに添加し、簡単にボルテックスした。5μlの溶解したてのEDC(dH2O中10mg/ml)を添加した。直ちにボルテックスし、次いで暗所で30分間室温にてインキュベートした。EDC添加を繰り返し、ボルテックスし、30分間インキュベートした。700μlの0.2% Tween 20をdH2Oに添加しボルテックスした。
【0090】
3.磁石を用いて電磁ビーズを5分間ペレット化した。上清を除去した。ビーズをdH2O中900μl 0.05% Tween 20において再懸濁し、ボルテックスし超音波処理した。100℃で5分間加熱し、表面に結合した二本鎖DNAを変性させた。このステップをもう1回繰り返した。
【0091】
多重ビーズミックスの調製
1.固定化したBACおよびCot−1対照プローブを有するビーズの6チューブそれぞれをボルテックスし超音波処理した。各ビーズチューブからのアリコートを推定ビーズ収量2,500ビーズ/μlを有する新たなチューブに等分した。
【0092】
2.多重ビーズミックスビーズを磁石で10分間ペレット化した。200μlの加温したAMBION(登録商標)Slide Hybridization Buffer #2(Ambion社、オースチン TX)を添加した。10μlのアリコートで使用されたビーズミックスは、各アリコートの各領域の約2,500ビーズと20回ハイブリダイズするのに十分であった。
【0093】
実証アッセイでは、試料DNAは、多重ビーズの調製に使用した同一のBAC DNA断片をプールして調製した。二本鎖であるBAC DNAは、変性後、自体と特異的にハイブリダイズし、既知の濃度の試料により標準曲線を作成できるようにする。8つの濃度のそれぞれの希釈物(6.25ng/mlから2倍ずつ希釈)を基準として使用した。これらのDNA希釈物はそれぞれ、2つのアリコートに分け、2つのアリコートはそれぞれ、間接標識試料を作製するためフルオレセインまたはビオチンで標識した。
【0094】
標識は、標準のシアニン色素標識ヌクレオチドの代わりにビオチン標識およびフルオレセイン標識ヌクレオチドを使用する、標準的BioPrime(商標)BACプラナーマイクロアレイランダムプライマー標識キット(Invitrogen、カールスバッド CA)を使用して実施した。詳細は以下の通りである。
【0095】
1.5つのBACのそれぞれのアリコートを単一のチューブに等分し、ボルテックスした。2μgの各プールをマイクロフュージチューブに添加した。容量を脱イオンH2Oで50μlに調整した。
【0096】
2.キットからの2.5×ランダムプライマーミックス40μlを2つの標識反応物それぞれに添加した。2秒間ボルテックスし、10秒間遠心分離した。
【0097】
3.DNAをヒートブロックで5分間、100℃で変性させた。氷スラリーで5分間スナップ冷却し、10秒間遠心分離した。
【0098】
4.ビオチンマスターミックス(6つの反応物に十分な)を作製した。
【0099】
16μlのSpectral Labeling Buffer(EDTAおよびトリス緩衝液中の非標識dNTPヌクレオチドミックス、Spectral Genomics社、ヒューストン TX)
10μlのビオチンdCTP
6.5μlのKlenow(Invitrogen社、カールスバッド CA)
合計32.5μl
5.マスターミックス10μlを各チューブに添加し、10秒間遠心分離し、それぞれを37℃で2時間インキュベートした。
【0100】
6.各反応物から3μlを除去し、アガロースゲルで電気泳動を行い標識した産物が約100bp長であることを確認した。
【0101】
7.8μlのEDTAをdH2Oに添加し(pH8.0)、70℃で10分間インキュベートした。標識した試料を氷上に置いた。
【0102】
8.90μlのSpectral Genomics Hybridization Buffer(ヒトCot−1 DNAおよび剪断したサケの精巣)を添加し、38.8μlの5M NaClを添加し、ボルテックスした。260μlのイソプロパノールを添加し、ボルテックスし遠心分離した。
【0103】
9.室温で20分間インキュベートした。フルスピードで20分間遠心分離した。必要とされるまで4℃で保存した。
【0104】
10.使用前に、標識したBACを室温まで加温し、10分間遠心分離した。
【0105】
11.上清を除去し、70%エタノール 30% d.1,000μlを添加した。さらに3分間遠心分離し、ペレットを残して全液体を除去した。
【0106】
12.10分間、または目視で乾燥するまで空気乾燥した。
【0107】
13.脱イオンH2O 20μlをペレットに添加し、室温で10分間インキュベートした。標識したDNAの推定濃度:2μg/20μl(100ng/μl)。
【0108】
上述のプロトコルを、ステップ4の第2のフルオレセインマスターミックスでは、ビオチンヌクレオチドに代えてフルオレセインヌクレオチドにより繰り返した。これら2つの操作の産物は、ビオチン標識したBACプールおよびフルオレセイン標識したBACプールであった。これらは、プローブに使用したのと同じBACの標識プールを含んでいた。これは、固定化されたプローブと完全に一致する陽性ハイブリダイゼーション相補体であろう。例えば、患者または他の被験者由来のゲノムDNAなど、細胞から調製した核酸試料では、同じ手順を使用することができる。
【0109】
8対の直接標識した試料を、次いでLUMINEX多重ビーズセットにそれぞれハイブリダイズした。8対を、図8の図の横軸に並んだ表記ごとに、上昇するフルオレセイン標識した試料濃度を、低下するビオチン標識した試料濃度と混合してまとめた。以下に詳述の通り、ハイブリダイゼーションは50℃で2時間実施し、続いて3回のストリンジェント洗浄を50℃で実施した。ストリンジェント洗浄緩衝液は、順に、2×SSC+50%脱イオンホルムアミド、2×SSC+0.1% Igepal、および0.2×SSCであった。
【0110】
ハイブリダイゼーションおよび検出
1.標識した試料の4つの希釈シリーズを1.5mlのマイクロ遠心分離チューブにおいて作製した。同じ標識希釈物の逆数ペアを混合して以下の8試料を形成した。
【0111】
試料# 5BACプール、フルオレセイン 5BACプール、ビオチン
1 0.039ng + 6.25ng
2 0.078ng + 3.12ng
3 0.156ng + 1.56ng
4 0.31ng + 0.78ng
5 0.78ng + 0.31ng
6 1.56ng + 0.156ng
7 3.12ng + 0.078ng
8 6.25ng + 0.039ng
2.標識した試料の容量をSpeedVac(商標)(Kendro Laboratory Products社、ThermoElectron Corp社、アッシュビル NC)で凍結乾燥(dry down)した。上記のように調製した加温した多重ビーズミックス10μlを添加した。ピペットで混合し、ヒーターブロックで98℃にて2分間変性させた。
【0112】
3.マイクロチューブをアルミホイルで覆った50ml遠心分離チューブの内部でインキュベートしてハイブリダイズし、50℃のオーブンの回転ラックに2時間置いた。
【0113】
4.ハイブリダイゼーション後、1mlの0.2×SSCを各試料チューブに添加し、ボルテックスした。
【0114】
5.各チューブの内容物を96ウェルPCRプレートの2ウェルに移し、ハイブリダイズした各ビーズセットを1組の500μlアリコートに分けた。
【0115】
6.プレートウェルのビーズを磁石で10分間ペレット化し、500μlの上清をビーズの減少を避けるため慎重に除去した。
【0116】
7.8μg/mlのPJ31Sストレプトアビジン−フィコエリトリン(Prozyme社、サンリアンドロ CA)100μlを各ペアの1つのウェルに添加し、100μlの8μg/ml抗フルオレセイン−フィコエリトリン(Invitrogen社、A−21250)を各ペアの他のウェルに添加した。次いで、プレートを、NCS(商標)Shaker Incubator(PerkinElmer社、ボストン MA)において室温で950RPMにて30分間攪拌しながらインキュベートし、続いてビーズを1×PBS+0.01% Tween 20緩衝液で洗浄した。
【0117】
8.各プレートウェルのビーズを磁石で10分間ペレット化し、100μlの上清をビーズの減少を避けるため慎重に除去した。100μlのトリス−NaCl−Tween 20 緩衝液を添加し、ビーズを再懸濁するため再ピペッティングにより混合した。
【0118】
9.試料をLUMINEX 100(商標)分析器で読み取り、各ウェルの各ビーズ領域の蛍光強度中央値を記録した。
【0119】
ステップ(7〜9)で上に詳述した通り、間接標識を用いた2つの試料の競合ハイブリダイゼーションアッセイの終了後、多重アッセイしたビーズセットを再び分けた。一方のアリコートは、4μg/mlの抗フルオレセイン−フィコエリトリンで二次標識し、他方は、4μg/mlの抗ストレプトアビジン−フィコエリトリンで二次標識した。これらの二次標識ビーズセットのそれぞれを、次いでLUMINEX xMAP 200(商標)システムで別々に読み取った。
【0120】
この結果を図8に示す。各BACからのシグナルは、別々のデータトレースとして示され、およびフルオレセイン標識した試料は、ビオチン標識したものとは別個に示される。それぞれは、約160:1の濃度範囲にわたるシグナルに対する線形濃度反応を示す。最大のフルオレセイン標識シグナルは、最も低いビオチン標識シグナルに干渉することはないようであり、この反対も同様である。また、COT−1が固定化したビーズからのシグナルは、特異的結合イベントからの最も低いシグナルよりも低い。こうしたシグナルは、全条件下のフルスケールの2%未満であった。これは、2つの間接標識は、これらの濃度範囲では実質的な干渉または交差反応性を示さないことを実証する。
【0121】
図9は、異なる様式でフォーマットされた図8からのデータを示す。これは、示差的遺伝子発現マイクロアレイ解析でしばしば使用されるタイプの、「同一対同一」散布図である。両軸のスケールは、ビオチンおよびフルオレセイン標識したBAC試料それぞれの正規化濃度である。理想的なまたは完全なアッセイでは、各データ点は対角線上にあるであろう。それぞれの競合アッセイした間接標識試料からのシグナルは、濃度が同じであるため、同じとなろう。実際のデータは対角線付近に密集し、理想との偏差はわずか1.5倍であり、典型的に少ない。標準CGH(または同様に遺伝子発現)アッセイは、通常、生物学的有意性を示す閾値として2:1の示差的シグナルを用いる。
【0122】
(実施例3)
図10は、間接標識ゲノムDNA試料に関する、上述した同一の多重ビーズセットを用いた、10の5乗のCGHアッセイの結果を示す。ゲノムDNA試料(ヒトゲノムDNA:男性;Promega Corporation社、マジソン WI)を2つのアリコートに分けた。一方のアリコートをフルオレセインで間接標識し、他方は、上述のBioPrime(商標)を用いてビオチンで間接標識して2つの間接標識試料を作製した。2つの間接標識試料を次いで混合し、多重ビーズセットに対して共に競合アッセイした。間接標識による競合アッセイ後、ビーズセットを分け、一方のアリコートを抗フルオレセイン−フィコエリトリンで二次標識し、他方はストレプトアビジン−フィコエリトリンで二次標識した。これらの二次標識ビーズセットのそれぞれを、次いでLUMINEX xMAP 200(商標)システムで読み取った。結果のデータは、再び、図10の「同一対同一」散布図としてフォーマットする。図9に示した意図的に構築された希釈シリーズと同様、ゲノムDNAの分割した試料からのデータは、図の対角線にピタリと一致する。
【0123】
(実施例4)
本発明の別の態様を説明する例示的アッセイでは、合成の70−merアミン修飾オリゴヌクレオチドプローブ(Operon Biotechnologies社、ハンツビル AL)をLuminex多重ビーズに固定化し、参照およびテスト試料が同じウェルにない場合は単色アッセイを実施した。この実験は17個の異なるプローブを利用した。このうち4個は、下の表に詳述の通り、XおよびY染色体上の遺伝子座を表す5つのオリゴヌクレオチドをプールまたは組み合わせたセットであった。この多重プローブセットにより、男性および女性のDNAを区別する実証アッセイを実施した。
【0124】
【表1−1】

【表1−2】

【表1−3】

多重オリゴビーズミックスを作製するため、アミン修飾オリゴヌクレオチドプローブを、コードされたLuminex zMap微小球またはビーズに結合するプロトコルは以下の通りであった。
【0125】
1.−20℃の、乾燥EDC(1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩)粉末(Pierce Biotechnlogy社、ロックフォード
IL)の新鮮な1アリコートを室温に戻す。
【0126】
2.70−merのC−6アミン修飾オリゴヌクレオチドを、dH2Oで100μM(100ピコモル/μL)まで再懸濁する。
【0127】
3.貯蔵xMAP微小球を光学ボルテックス(light vortex)および超音波処理により約20秒間再懸濁する。
【0128】
4.貯蔵微小球(100μL)の1,250,000ビーズを、1.5ml Seal−Riteマイクロフュージチューブ(USA Scientific社、オカラ FL)に移す。
【0129】
5.貯蔵微小球を、マイクロ遠心分離により≧8000×gで3〜5分間(固体ペレットの形成に十分な時間)ペレット化する。
【0130】
6.上清を除去し、ペレット化した微小球を50μLの0.1M MES緩衝液、pH4.5で約20秒間(チューブにペレットまたはスメアリングが目で確認できなくなるのに十分な時間)、超音波処理により再懸濁する。
【0131】
7.100μMのアミンオリゴヌクレオチド1:4(3μLのdH2O中1μL)を、最終濃度25μM(25ピコモル/μL)に希釈する。
【0132】
8.捕捉オリゴ(25ピコモル)1.0μLを添加し、超音波処理により約20秒間混合する。
【0133】
9.dH2O中10mg/mL EDCの新鮮溶液を調製する。(注:第2のEDC添加に再使用するためEDC粉末を乾燥剤に戻す)。
【0134】
10.反応ごとに1つずつ、新鮮な10mg/mLのEDC 25μLを微小球(25μgまたは≒[0.47μg/μL]final)に添加し、超音波処理により約20秒間混合する。
【0135】
11.(微小球の沈降を減少するため)15分を目印に超音波処理しながら、暗所で室温にて30分間インキュベートする。
【0136】
12.dH2O中10mg/mL EDCの新鮮溶液を調製する。(注:EDC粉末のアリコートは今や捨てるべきである。本発明者は、結合エピソードごとにEDC粉末の新鮮なアリコートを用いることを推奨する)。
【0137】
13.反応ごとに1つずつ、新鮮な10mg/mLのEDC 25μLを微小球に添加し、超音波処理により約20秒間混合する。
【0138】
14.15分を目印に超音波処理しながら、暗所で室温にて30分間インキュベートする。
【0139】
15.0.02% Tween−20 1.0mLを結合した微小球に添加し、ボルテックスおよび超音波処理により混合する。
【0140】
16.結合した微小球を、マイクロ遠心分離により≧8000×gで3〜5分間ペレット化する。
【0141】
17.上清を除去し、結合した微小球を1.0mLの0.1% SDS緩衝液でボルテックスおよび超音波処理により再懸濁する。
【0142】
18.結合した微小球を、マイクロ遠心分離により≧8000×gで6〜10分間ペレット化する。
【0143】
19.上清を除去し、結合した微小球を10mMのトリス、1mMのEDTA 100μL、pH8.0でボルテックスおよび超音波処理により約20秒間再懸濁する。
【0144】
100%の回収と想定すると、得られるオリゴ結合ビーズ濃度は、約12,500微小球/μLである。
【0145】
同じ性別の名目上正常ないくつかの個体からプールした、標準的な正常ゲノムDNA(Promega社、マジソン WI)を、このアッセイではテスト試料として使用した。男性のDNAはテスト試料として使用し、女性のDNAは参照に使用した。各試料2μgの標識は、ビオチン標識試料を提供するため、キットのシアニンヌクレオチドがビオチンヌクレオチドへ代わったこと以外、上記の実施例4の通りInvitrogen社製BioPrimeキットおよびSpectral Genomics社製試薬により実施した。
【0146】
多重実証アッセイは、以下のプロトコルにより96ウェルマイクロプレートの4ウェルを利用して、2組の両試料によりLuminex xMAPビーズで実施した。
【0147】
1.試料ごとに、1.0μgのビオチン標識ヒトゲノムDNAをMatrix社(ハドソン NH)製ポリプロピレン96ウェルV底ポリプロピレンマイクロプレートの1ウェルに添加する。
【0148】
2.10.0μgのCot 1 DNAおよび10.0μgのサケ精子(Invitrogen社、カールスバッド CA)を、ハイブリダイズするV底プレートの各ウェルに添加する。ビオチンDNAはないが核酸ブロッカーを含有する陰性対照ウェルを含める(Cot 1 DNAおよびサケ精子)。これは、ビーズのブランクを判定するのに使用する。
【0149】
3.プレートを、30〜120分間またはウェルの底が透明になるまでSpeedVacで凍結乾燥する。
【0150】
4.Spectral Genomics Hyb II Bufferを手で温めて沈殿物を溶解し、1.5mLチューブで緩衝液3/4を滅菌蒸留H2O 1/4に添加して希釈する。
【0151】
5.適量の多重オリゴビーズミックスを、結果が、(7.5μL/ウェルに十分な)〜300の各ビーズコード/ウェルとなるよう、希釈したSpectral Genomics Hyb II Bufferに添加する。上下にピペッティングして混合する。
【0152】
6.ハイブリダイゼーション緩衝液の7.5μLの多重オリゴビーズミックスを、ハイブリダイズするV底プレートの各ウェルに分注する。上下にピペッティングして混合する。
【0153】
7.Matrixシングルストリッププレートキャップでウェルを蓋し、Bio−Rad社(ハーキュリーズ CA)製プレートカバーでプレートを密封する。
【0154】
8.プレートの試料を、96ウェルのサーマルサイクラーで100℃にて2分間変性させ、次いで加熱蓋なしで2分間で50℃に冷却する。
【0155】
9.プレートをPerkinElmer NCSマイクロプレートインキュベーターに入れ、50℃および1150rpm振盪にて一晩インキュベートする。
【0156】
10.ハイブリダイゼーション後、2×SSC、50%ホルムアミド(Spectral Genomics Stringency Wash、使用前に50℃に加熱)100μLを各反応物に添加し、プレートをPerkinElmer NCSプレートインキュベーターで20分間、50℃および1150rpm振盪にてインキュベートする。
【0157】
11.均一な真空濾過のため、Millipore 0.45m HTフィルタープレートのすべてのウェルを、30μLの0.2×SSCで湿らせる。
【0158】
12.洗浄のため、Matrix V底プレートからの容量をMilliporeフィルタープレートに移す。
【0159】
13.Millipore真空マニホールドを用いて真空を静かに適用して液体を除去し、フィルタープレートの底をペパータオルで軽く押さえて乾かす。
【0160】
14.2×SSC、0.1% Igepal(Spectral Genomics Stringency Wash、使用前に50℃に加熱)100μLを各反応物に添加し、トップをアルミホイルで(緩く)覆い、プレートをPerkinElmer NCSマイクロプレートインキュベーターで20分間、50℃および1150rpm振盪にてインキュベートする。
【0161】
15.真空マニホールドを用いて真空を静かに適用して液体を除去し、フィルタープレートの底をペパータオルで軽く押さえて乾かす。
【0162】
16.100μLの0.2×SSC(Spectral Genomics Stringency Wash、使用前に50℃に加熱)を各反応物に添加し、トップをアルミホイルで(緩く)覆い、プレートをPerkinElmer NCSミキサーで10分間、50℃および1150rpm振盪にてインキュベートする。
【0163】
17.真空マニホールドを用いて真空を静かに適用して液体を除去し、フィルタープレートの底をペパータオルで軽く押さえて乾かす。
【0164】
18.100μLの1×PBS、0.1% BSA、0.05% Tweenを、4.0μg/mLのPhycoLink(商標)ストレプトアビジン−R−PE(Prozyme Lot PJ13S)と共に各反応物に添加する。トップをアルミホイルで(緩く)覆い、プレートをPerkinElmer NCSミキサーで30分間、25℃および1050rpm振盪にてインキュベートする。
【0165】
19.真空マニホールドを用いて真空を静かに適用して液体を除去し、フィルタープレートの底をペパータオルで軽く押さえて乾かす。
【0166】
20.100μLの1×PBS、0.01% Tween 20を各反応物に添加し、フィルタープレートに真空を適用し、軽く押さえて乾かす。
【0167】
21.100μLの1×PBS、0.01% Tween 20を各反応物に添加する。フィルタープレートを、PerkinElmer NCSマイクロプレートインキュベーターで少なくとも1分間、1050rpmで振盪する。
【0168】
22.ビーズ領域ごとの蛍光シグナル中央値および50という最少ビーズカウント設定を用いて、Luminex 200機器により試料を読み取る。
【0169】
実証アッセイの結果を図12に示す。女性試料のシグナル対男性試料のシグナルの比は縦軸上にあり、オリゴヌクレオチドプローブの識別は横軸上にある。各試料の2つの複製物に関するシグナルを平均化した。XおよびYの性特異的染色体プローブは、単一線を上下に1.2超過するシグナル比を生じたのに対し、非性特異的プローブはすべて、上下1.2未満の比を生じた。
【0170】
(実施例5)
多重示差的遺伝子発現は、一般に、2つのフルオロフォアアッセイにより、プリントマイクロアレイで実施される。このタイプのアッセイでは、2つのRNA試料(参照およびテストする試料)が、標識されたヌクレオチドの存在下で逆転写酵素によりcDNAに酵素的に転換される。cDNA産物は、故に蛍光標識されたヌクレオチド画分を有し、これにより光学的に検出することができる。各試料は、2つの異なるフルオロフォア(典型的にはシアニン3およびシアニン5)により別々に標識され、標識された試料はプールされ、マイクロアレイに競合的にハイブリダイズされる。蛍光走査装置で検出された、マイクロアレイの各要素での2つの色素の比は、故にそれぞれの試料のアッセイされたRNA配列それぞれの相対濃度を示す。
【0171】
このタイプのアッセイは、本技術の1つの態様に従って、単一のフルオロフォア読み出しにより常磁性Luminex xMAP(商標)ビーズで実施される。38個の遺伝子を示すオリゴヌクレオチド(「オリゴ」)プローブは、Operon社(ハンツビル AL)から入手した。これらのオリゴプローブは、5’末端にアミノ基を有する70−mer長のプローブであった。各オリゴ配列を、一般的なEDAC結合化学を用いて、特定のxMAPビーズIDコードまたは領域を有するxMAPビーズ1セットに固定化した。陰性対照に加えて、示された38個の遺伝子は、NRP2、CARD14、IGFALS、TSSC3、PSEN2、IGFBP4、TP53BP2、GAPD、PRODH、TNFRSF7、RAB6KIFL、ILF1、BCL2L2、DNASE1L3、PPP1R15A、PIG11、HSPD1、CDH1、IGFBP5、IRF1、TNFRSF10C、TNFRSF17、LTA、DFFB、IL16、PTPN13、IL3、TNFSF18、CCNG1、CCND1、TUCAN、RIPK3、CASP6、IL2、TNFAIP2、IL24、K−ALPHA−1、およびTRIPであった。39のビーズタイプを、次いで多重ビーズセットにプールし、このセットからのアリコートを96ウェルマイクロプレートのウェルに入れ、以下に記載の通り遺伝子発現を実施した。
【0172】
本技術を実証する目的のため、単一の参照RNA試料を使用した(Universal
Human Reference RNA Stratagene社、ラホーヤ CA)。単一試料を2つに分けた。故に、示差的アッセイの予想結果は、各遺伝子につき1:1比である。これは、遺伝子発現プラットフォームで行われる一般的な評価である。本技術の1つの態様に従い、RNAの一方のアリコートは、間接標識であるビオチンで標識し、他方はフルオレセインで標識した。これら2つの間接標識した試料を、次いでプールし、予め調製した多重ビーズセットと混合し、同時にハイブリダイズできるようにした。
【0173】
ハイブリダイゼーション後、アッセイしたビーズセットを2つのアリコートに分けた。ストレプトアビジン−フィコエリトリンレポーター試薬(ビオチン標識試料に特異的)を添加し、一方のアリコートと共にインキュベートし、および抗フルオレセイン−フィコエリトリン(抗フルオレセイン標識試料に特異的)を添加し、他方のアリコートと共にインキュベートした。フィコエリトリンは、xMAP(商標)機器における好ましいレポーターフルオロフォアである。常磁性ビーズのアリコートを、次いでプレート磁石によりマイクロプレートウェルの壁に引き寄せ、ピペットで液体試薬を取り除き、および標識したビーズを洗浄緩衝液で再懸濁した。ビーズの2つのアリコートを、次いでLuminex xMAP 200(商標)機器で順次読み取った。
【0174】
得られたシグナルデータを、図11に示したように散布図にプロットした。すべてのデータが同一線に位置した場合、これは、1:1の比および1.0の相関値R2に相当するであろう。この実証アッセイでは、相関計数は0.96であった。この値は、2色素検出を用いる典型的なプリントマイクロアレイ(典型的には0.92から0.96の間のR2値を生じる)により生じる値と比べて進歩である。
【0175】
他の実施形態は、本特許請求の範囲内である。
【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−254099(P2012−254099A)
【公開日】平成24年12月27日(2012.12.27)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−219508(P2012−219508)
【出願日】平成24年10月1日(2012.10.1)
【分割の表示】特願2008−547548(P2008−547548)の分割
【原出願日】平成18年12月22日(2006.12.22)
【出願人】(507191854)パーキンエルマー エルエーエス, インコーポレイテッド (3)
【Fターム(参考)】
【公開日】平成24年12月27日(2012.12.27)
【国際特許分類】
【出願番号】特願2012−219508(P2012−219508)
【出願日】平成24年10月1日(2012.10.1)
【分割の表示】特願2008−547548(P2008−547548)の分割
【原出願日】平成18年12月22日(2006.12.22)
【出願人】(507191854)パーキンエルマー エルエーエス, インコーポレイテッド (3)
【Fターム(参考)】
[ Back to top ]

