サイトカイン発現細胞ワクチンの組み合わせ
【課題】癌を有する患者への投与に基づく、改善された方法及び組成物の提供。
【解決手段】サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療の組み合わせの癌を有する患者への投与に基づく、改善された方法及び組成物を提供し、ここで、上記組み合わせの投与は、単独療法としての上記サイトカイン発現細胞ワクチン或いは癌治療剤又は治療に比べて亢進した治療的有効性を生じる。
【解決手段】サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療の組み合わせの癌を有する患者への投与に基づく、改善された方法及び組成物を提供し、ここで、上記組み合わせの投与は、単独療法としての上記サイトカイン発現細胞ワクチン或いは癌治療剤又は治療に比べて亢進した治療的有効性を生じる。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2003年4月2日に出願された米国特許出願第10/404,662号の一部継続出願である。上記出願のすべては参考文献として本明細書中に援用されている。
【0002】
本発明は、標的癌抗原に対する個体の免疫応答を変更する方法に関する。より特別には、本発明は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を含む組成物並びにサイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を含むサイトカイン発現細胞ワクチンの組み合わせを癌患者に投与する方法に関する。
【背景技術】
【0003】
免疫系は、広く多様な癌の発病において重要な役割を演じる。癌が進行するとき、免疫系が十分に応答できないか又は適切に応答できずに癌細胞を増殖させると広く信じられている。現在のところ、化学療法、手術、放射線療法及び細胞治療を含む癌の標準的な医学的治療は、有効性及び毒性の両方に関して明らかに制限されている。これまで、これらのアプローチは癌のタイプ、患者の一般的な健康状態、診断時における病気のステージなどに依存して様々な程度の成功を経験してきた。標準的な医学的治療と癌への免疫応答の特別な操作を組み合わせる改善された戦略は、有効性を高めそして毒性を低下させるための手段を提供するかもしれない。
【0004】
抗腫瘍性免疫を増強するためのワクチンとしての自己の癌細胞の使用は、しばらくの間探求された(Biolobic Therapy of Cancer, Devita et al.(編) J. Lippincot Co., pp87-199, 1991中のOettgen et al., "The History of Cancer Immunotherapy")。しかしながら、多くの癌の弱い免疫原性、MHC分子のダウンレギュレーション、適切な共刺激分子の発現及び癌細胞による免疫抑制性サイトカイン分泌の欠如によって、そのようなワクチンに対する応答は長期間の有効性は生じなかった。例えば、Armstrong TD and Jaffee EM, Surg Oncol Clin N Am. 11(3):681-96, 2002及びBodey B et al., Anticancer Res 20(4):2665-76,2000を参照のこと。
【0005】
多数のサイトカインが腫瘍に対する免疫応答の制御に役割を果たすことが示された。例えば、米国特許第5,098,702号は、現存の腫瘍と戦うために、相乗的有効量のTNF、IL-2及びIFN-ベータの組み合わせを使用することを記載する。米国特許第5,078,996号、同第5,637,483号、及び同第5,904,920号は、腫瘍の治療のためのGM-CSFの使用を記載する。しかしながら、癌治療のためのサイトカインの直接投与は、実際的なものではない。なぜなら、それらはしばしば全身的に毒性があるからである(例えば、Asher et al., J. Immunol. 146: 3227-3234, 1991及びHavell et al., J. Exp. Med. 167: 1067-1085, 1988を参照のこと)。
【0006】
このアプローチの拡大は、接種部位において局所的にサイトカインを発現する、遺伝的に修飾された腫瘍細胞の使用を含む。IL-4、IL-2、TNF-アルファ、G-CSF、IL-7、IL-6及びGM-CSFを含む多様な免疫調節サイトカインを使用する腫瘍モデルにおいて活性が示され、それは、Golumbeck PT et al., Science 254:13-716, 1991: Gansbacher B et al., J. Exp. Med. 172:1217-1224, 1990: Fearon ER et al., Cell 60: 397-403, 1990: Gansbacher B et al., Cancer Res. 50 7820-25, 1990;Teng M et al., PNAS 88:3535-3539, 1991; Columbo MP et al., J. Exp. Med. 174: 1291-1298, 1991 Aoki et al., Proc. Natl. Acad. Sci USA 89(9): 3850-4, 1992: Porgador A et al., Nat Immun. 13(2-3):113-30, 1994: Dranoff G et al., PNAS 90: 3539-3543, 1993: Lee CT et al., Human Gene Therapy 8:187-193, 1997: Nagai E et al., Cancer Immunol. Immonther. 47:2-80, 1998 及びChang A et al., Human Gene Therapy 11:839-850, 2000にそれぞれ記載されている。
【0007】
GM-CSFを発現する自己の又は同種異系の細胞ワクチン(GVAX(登録商標))を採用する、前立腺がん、メラノーマ、肺癌、膵臓癌、腎臓癌、及び多発性骨髄腫の治療のための臨床試験が開始した(Dummer R., Curr Opin Investig Drugs 2(6): 844-8, 2001; Simons J et al., Cancer Res. 15;59(20): 5160-8, 1999; Soiffer R et al., PNAS 95:13141-13146, 1998; Simons J et al., Cancer Res. 15; 57:1537-1546, 1997; Jaffee E et al., J. Clin Oncl. 19:145-156, 2001;及びSalgia R et al., J. Clin Oncol. 21:624-630,2003)。
【0008】
他のアプローチにおいても、B7-1のような共刺激分子又は同種異種間の組織適合性抗原を産生するように、自己の腫瘍細胞が遺伝的に改変された(Salvadori et al., Hum. Gene Ther. 6:1299-1306, 1995及びPlaksin et al., Int. J. Cancer 59:796-801, 1994)。遺伝的に改変された腫瘍細胞の使用がいくつかの形態の癌の治療に成功した一方、現在使用されている治療法よりも、より強力/有効であり、副作用の少ない改善された治療計画が依然として必要とされている。
【発明の概要】
【課題を解決するための手段】
【0009】
本発明は、哺乳動物、典型的にはヒト、における癌の治療のための改善された組成物並びにサイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤を含むサイトカイン発現細胞ワクチンの組み合わせを癌を有する対象に投与することによる治療方法を提供する。
【0010】
サイトカイン発現細胞ワクチンの組み合わせの投与は、サイトカイン発現細胞ワクチン又は追加の癌治療剤単独の投与に比べて治療的有効性及び/又はワクチン力価を向上させる。
【0011】
本発明の1の側面において、サイトカイン発現細胞ワクチンは、GM-CSFを発現する。
【0012】
本発明の他の側面において、サイトカイン発現細胞ワクチンの組み合わせは、自己の細胞、同種異系の細胞、又はバイスタンダー細胞(bystander cell)を含む。
【0013】
本発明のさらなる側面においては、自己の、同種異系の、又はバイスタンダー細胞の集団は、有効量のサイトカイン、例えばGM-CSFを産生するように遺伝的に修飾される。
【0014】
少なくとも1つの追加の癌治療剤は、抗CTLA4抗体、抗4-1BB抗体、インターフェロン−アルファ、ドセタキセル、パクリタキセル、COX-2阻害剤、腫瘍細胞ワクチンの細胞表面上に発現されたCD40リガンド又は抗CD40抗体、腫瘍細胞ワクチンの細胞表面上に発現されたOX40リガンド又は抗OX40抗体、CpCオリゴヌクレオチド及び熱ショックタンパク質(HSP)からなる群から選ばれる。
【0015】
自己の、同種異系の、又はバイスタンダー細胞の同一の又は異なる集団は、有効量の少なくとも1つの追加の癌治療剤を産生するように遺伝的に修飾される。
【0016】
自己の、同種異系の、又はバイスタンダー細胞の集団は、対象への投与の前に放射線照射によって増殖不能とさせられる。
【0017】
本発明のなおさらなる側面においては、少なくとも1つの追加の癌治療剤が、(例えば、抗CTLA4抗体、抗4-1BB抗体、抗CD40抗体及び抗OX40抗体などの)抗体のような化合物として、ドセタキセル、パクリタキセルなどの伝統的な化学療法剤として、又はワクチン細胞上に発現された細胞表面分子として投与される。
【0018】
サイトカイン発現細胞ワクチンは、典型的には皮下又は腫瘍内に投与される。少なくとも1つの追加の癌治療剤は、上記組み合わせのサイトカイン発現細胞ワクチン成分の投与の前に、同時に、又はその後に投与されることができる。
【0019】
本発明は、さらに、本明細書の記載に従う使用のためのサイトカイン発現細胞ワクチンの組み合わせを含む組成物及びキットを提供する。
【図面の簡単な説明】
【0020】
【図1A】図1Aは、基本的な予防モデルにおけるGM-CSF分泌腫瘍細胞ワクチン接種後の腫瘍を有さない生存期間を示す、C57Bl/6マウスにおける試験の結果を図示する。このモデルにおいては、マウスに放射線照射した1×106個の腫瘍細胞を(皮下に:SC)ワクチン接種した。7日後、マウスに1×106個のB16F10腫瘍細胞でチャレンジ(SC)し、腫瘍の増殖及び生存について追跡した。B16F10/Ad−nullは、E1欠失アデノウイルスベクターで形質導入した、導入遺伝子を発現しないB16F10腫瘍細胞である。B16F10/Ad-gen.mGMは、E1欠失アデノウイルスベクターで形質導入した、ゲノムDNAから450ngのGM-CSF/1×106個の細胞/24時間を発現するB16F10クローンである。AAV#81は、アデノウイルスで形質導入したGM-CSFを発現するB16F10クローンである。AAV#81は平均して500ngのGM-CSF/24時間/1×106個の細胞を発現する。
【図1B】図1Bは、治療モデルにおけるGM-CSF分泌腫瘍細胞ワクチン接種後の腫瘍を有さない生存期間を示す、C57Bl/6マウスにおける試験の結果を図示する。このモデルにおいては、マウスに5×104個のB16F10腫瘍細胞でチャレンジし(SC)、3日後に放射線照射した1×106個の腫瘍細胞で治療した。B16F10/Ad−nullは、E1欠失アデノウイルスベクターで形質導入した、導入遺伝子を発現しないB16F10腫瘍細胞である。マウスを腫瘍の増殖及び生存について追跡した。B16F10/Ad-gen.mGMは、E1欠失アデノウイルスベクターで形質導入した、ゲノムDNAから450ngのGM-CSF/1×106個の細胞/24時間を発現するB16F10クローンである。AAV#81は、アデノウイルスで形質導入した、GM-CSFを発現するB16F10クローンである。AAV#81は平均して500ngのGM-CSF/24時間/1×106個の細胞を発現する。
【図2A】図2Aは、第0日にC57Bl6マウスに1×105個のB16F10腫瘍細胞でチャレンジした、B16F10メラノーマモデルにおける試験を図示したものである。1日後、マウスに1×106個の放射線照射したB16F10細胞又はGM-CSF分泌B16F10細胞をワクチン接種した。接種の1日及び3日後に、マウスに150μg及び100μgの抗CTLA-4抗体(マウス抗マウスCTLA4抗体である9D9、又はハムスター抗マウス抗CTLA4抗体である9H10)をそれぞれ注射した。いくつかの場合には、マウスには3×106個の放射線照射した細胞を最後の抗CTLA-4治療の2日後に2回目に注射した。そして、マウスを皮下腫瘍の進行についてモニターし、免疫学的にモニタリングし、そして第21日に屠殺した。
【図2B】図2Bは、図2Aで示した治療計画に類似の計画を用いた、B16F10モデルにおけるB16F10細胞又はGM-CSF分泌B16F10(dB16gmtd)細胞及びハムスター(9H10)又はマウス(9D9)抗CTLA-4抗体の組み合わせによる治療の結果を図示したものである。C57Bl6マウスに1×105個のB16F10腫瘍細胞でチャレンジした。1日後、マウスに3×106個の放射線照射したB16F10細胞又はGM-CSF分泌B16F10(dB16gmtd)細胞をワクチン接種した。接種の1日及び3日後に、マウスに150μg及び100μgの抗CTLA-4抗体(9D9又は9H10;図2A)をそれぞれ注射した。マウスには3×106個の放射線照射した細胞を最後の抗CTLA-4治療の2日後に2回目に注射した(第7日)。そして、マウスを皮下腫瘍の発生について1週間に2回モニターした。
【図2C】図2Cは、C57Bl6マウスに1×105個のB16F10メラノーマ腫瘍細胞でチャレンジした試験の結果を図示する。1日後、マウスに1×106個又は3×106個の放射線照射したGM-CSF分泌B16F10(それぞれ、150ngのGM-CSF/1×106細胞/24時間を産生するdB16gmtd150、及び450ngのGM-CSF/1×106細胞/24時間を産生するdB16gmtd450)メラノーマ腫瘍細胞をワクチン接種した。接種の1日及び3日後に、マウスに150μg及び100μgのマウス抗CTLA-4モノクローナル抗体(抗CTLA-4 9D9)をそれぞれ注射した。マウスには3×106個の放射線照射した細胞を最後の抗CTLA-4治療の2日後に2回目に注射し、そして生存期間を基礎とした。
【図2D】図2Dは、GM-CSF分泌レベルが150ng/106細胞/24時間(低レベル)である、図2Aに記載した試験の結果を図示したものを提供する。
【図2E】図2Eは、GM-CSF分泌レベルが450ng/106細胞/24時間(高レベル)である、図2Aに記載したような試験の結果を図示したものを提供する。
【図3】図3は、C57Bl6マウスにGM-CSF分泌マウス前立腺癌細胞で2週ごとに全部で5回ワクチン接種した試験の結果を図示する。マウスに、マウス抗CTLA-4 9D9抗体又はアイソタイプ対照抗体を、最初のワクチン接種後のみ(1)又は第1、3及び5回目のワクチン接種後に1ヶ月の間隔で3回(3)、注射した。最後のワクチン接種の2週間後、前立腺特異的腫瘍抗原(PTSA)‐特異的細胞内IFN-ガンマ発現についてのフローサイトメトリーによって、脾細胞を分析した。各バーの上の数字は、未処置マウスに比較した各治療群からのPTSA特異的IFN-ガンマ+CD8+T細胞の増加倍率を表す。NP-1は非特異的なペプチド対照である。
【図4A】図4Aは、4-1BBモノクローナル抗体と組み合わせたGVAX(登録商標)の効果を評価したB16F10メラノーマモデルにおける試験の結果を図示する。上記試験においては、第0日に、C57Bl6マウスに1×105個のB16F10腫瘍細胞でチャレンジした。3日後、放射線照射した3×106個のB16F10細胞又はGM-CSF分泌B16F10細胞を、マウスにワクチン接種した。ワクチン接種の3日後、マウスに150μgの4-1BBモノクローナル抗体を腹腔内注射した。マウスを第21日に屠殺し、免疫学的にモニタリングした。図4Aは、腫瘍を有さないマウスのパーセンテージを図示する。
【図4B】図4Bは、4-1BBモノクローナル抗体と組み合わせたGVAX(登録商標)の効果を評価したB16F10メラノーマモデルにおける試験の結果を図示する。上記試験においては、第0日に、C57Bl6マウスに1×105個のB16F10腫瘍細胞でチャレンジした。3日後、放射線照射した3×106個のB16F10細胞又はGM-CSF分泌B16F10細胞を、マウスにワクチン接種した。ワクチン接種の3日後、マウスに150μgの4-1BBモノクローナル抗体を腹腔内注射した。マウスを第21日に屠殺し、免疫学的にモニタリングした。図4Aは、チャレンジの後80日間までの生存パーセンテージを図示する。
【図5A】図5Aは、インターフェロン‐アルファを用いるインビトロの試験の結果を図示する。
【図5B】図5Bは、インターフェロン‐アルファを用いるインビトロの試験の結果を図示する。
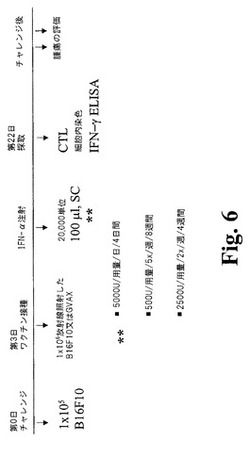
【図6】図6は、GVAX(登録商標)とインターフェロン‐アルファの組み合わせの効果をマウスB16F10腫瘍モデルにおいて評価した、試験計画を図示する。
【図7A】図7Aは、マウスをB16F10細胞又はGM-CSF分泌B16F10(dB16gmtd)細胞の組み合わせで治療したインターフェロン‐アルファを用いるインビボの試験の結果を図示する。図7Aに示す結果は、第0日に105個のB16F10メラノーマ細胞を腫瘍チャレンジとして、同系のC57/B6マウスの背側に皮下注射した試験から得られたものである。第3日に、放射線照射したB16.GM(106)を細胞ワクチンとして腹側部位に皮下注射した。第7日に、IFN-アルファ注射を開始した。IFN−アルファ注射を100μl中、2500単位を一週間に2回で4週間、皮下に局部的腫瘍チャレンジ部位に与えた。送達された総IFN-アルファ用量は、20,000単位であった。腫瘍の確立を、3〜4日ごとに触診によって判定した。悪性腫瘍を有するマウス又は腫瘍サイズが150mm2のマウスを屠殺した。示すデータは、試験ごとに10匹のマウスを用いる試験からの、示した時点での生存パーセンテージとしてあらわす。B16.GMの生存に対する有効性は40%であり、B16.GM+IFN-アルファでは、p=0.08で有意にB16.GM単独療法よりも40%高かった。
【図7B】図7Bは、マウスをB16F10細胞又はGM-CSF分泌B16F10(dB16gmtd)細胞の組み合わせで治療したインターフェロン‐アルファを用いるインビボの試験の結果を図示する。図7Bに示す結果は、第0日に105個のB16F10メラノーマ細胞を腫瘍チャレンジとして、同系のC57/B6マウスの背側に皮下注射した試験から得られたものである。第3日に、放射線照射したB16.GM(106)を細胞ワクチンとして腹側部位に皮下注射した。第7日に、IFN-アルファ注射を開始した。IFN−アルファ注射を100μl中、2500単位を一週間に2回で4週間、皮下に局部的接種部位に与えた。送達された総IFN-アルファ用量は、20,000単位であった。腫瘍の確立を、3〜4日ごとに触診によって判定した。悪性腫瘍を有するマウス又は腫瘍サイズが150mm2のマウスを屠殺した。示すデータは、試験ごとに10匹のマウスを用いる試験からの、示した時点での生存パーセンテージとしてあらわす。B16.GMの生存に対する有効性は10%であり、B16.GM+IFN-アルファでは、p=0.08で有意にB16.GM単独療法よりも40%高かった。
【図8A】図8Aは、第5、9及び13日に投与されたドセタキセル(総用量18mg/kg)の3回の静脈内注射の効果を、生存したマウスのパーセンテージに関して評価した、B16F10メラノーマモデルにおける試験結果を図示する。
【図8B】図8Bは、図8C及びDに示すデータを作るために実施した試験を図示する。上記試験を、B16F10メラノーマモデルにおいて実施し、1サイクルのタキソテレ投与と組み合わせた1サイクルのGM-CSF分泌腫瘍細胞ワクチン投与の有効性を、3サイクルのワクチン+3サイクルのタキソテレに比較した。
【図8C】図8Cは、ドセタキセル(総用量18mg/kg)と組み合わせて第5、9及び13日に投与したサイトカイン発現細胞ワクチンの効果を評価した、(図8Bに記載のとおりに実施した)B16F10メラノーマモデルにおける試験結果を図示する。生存したマウスのパーセンテージを図8Cに示す。
【図8D】図8Dは、ドセタキセル(総用量18mg/kg)と組み合わせて第5、9及び13日に投与したサイトカイン発現細胞ワクチンの効果を評価した、(図8Bに記載のとおりに実施した)B16F10メラノーマモデルにおける試験結果を図示する。生存期間の中央値を図8Dに示す。隔週でのワクチン接種(全部で3回のワクチン接種:3サイクル)の間に投与したドセタキセルは、3回のB16-GMワクチン接種単独に比べて、腫瘍を有するB16マウスの生存期間の中央値を31日から52日に増加させた。1サイクルのワクチン+ドセタキセルが投与された場合の試験結果は、生存期間の中央値を24日(ワクチンのみ)から45日(1サイクルのワクチン+ドセタキセル)に増加させた。
【図9】図9A及び9Bは、セレブレックス(セレコキシブ:第7日に開始して飼料中で50mg/kg/日)と組み合わせたサイトカイン発現細胞ワクチンの効果を評価した、B16F10メラノーマモデルにおける試験結果を図示する。第0日に、1×105個の生きたB16F10細胞で背側位置にマウスにチャレンジし、そして第3日に1×106個の放射線照射したdB16gmtd細胞を腹側位置にチャレンジした。結果は、GM-CSF分泌腫瘍細胞ワクチン接種の10日前に投与したセレブレックスが、ワクチンの能力を顕著に増加させ、長期の生存を生じた。
【図10】図10は、GVAX(登録商標)とCD40Lの組み合わせの効果をマウスB16F10モデルにおいて評価した試験計画を図示する。
【図11A】図11Aは、B16F10モデルにおける、B16F10及びアデノウイルスにより発現されたCD40リガンドの組み合わせによる治療結果を図示する。表4に示すとおり、第0日に、1×105個の生きたB16F10マウスメラノーマ細胞でチャレンジし、そして第3日のチャレンジ後に、マウスに1×106個のB16-GMで腹側にワクチン接種し、続いてさらなる放射線照射したワクチン細胞を、図4に示すように第3日、第4日、第5日、及び第7日に投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。
【図11B】図11Bは、B16F10モデルにおける、B16F10及び抗CD40抗体の組み合わせによる治療の結果を図示する。C57B16マウスに、1×105個の生きたB16F10マウスメラノーマ細胞で背側にチャレンジした。チャレンジ後の第3日に、マウスに1×106個のB16-GMで腹側にワクチン接種した。100μgの抗CD40抗体を、第0日及び2日、又は第2日および4日(図11B)に投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。
【図11C】図11Cは、B16F10モデルにおける、B16F10及び抗CD40抗体の組み合わせによる治療の結果を図示する。C57B16マウスに、1×105個の生きたB16F10マウスメラノーマ細胞で背側にチャレンジした。チャレンジ後の第3日に、マウスに1×106個のB16-GMで腹側にワクチン接種した。100μgの抗CD40抗体を、第4および6日、第7日および9日、又は第10日および12日(図11C)に投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。
【発明を実施するための形態】
【0021】
本発明は、癌の治療のための改善された細胞ワクチンに相当し、本明細書に記載の組成物及び方法は、治療を受ける患者のために改善された治療結果を協同して生み出す少なくとも2つの成分を含む。
【0022】
定義
本明細書中で使用される「免疫応答を制御すること」、又は「免疫応答を調節すること」という用語は、免疫系の細胞のいかなる変更又は免疫応答に関与する細胞の活性のいかなる変更も意味する。そのような制御又は調節は、多様な種類の細胞の数の増加又は減少、これらの細胞における活性の増加又は減少、或いは免疫系内で起こりうるいかなる他の変化も含む。免疫応答に関与する細胞は、Tリンパ細胞、Bリンパ細胞、ナチュラルキラー(NK)細胞、マクロファージ、好酸球、マスト細胞、樹状細胞及び好中球を含むがこれらに限られない。いくつかの場合には、免疫応答を「制御すること」又は「調節すること」は、免疫応答が刺激され又は亢進されること、そして他の場合には、免疫応答を「制御すること」又は「調節すること」は、免疫系の抑制を意味する。免疫系の刺激は、記憶応答及び/又は後の抗原チャレンジに対する将来の防御を含むことができる。
【0023】
本明細書中で使用される「癌治療剤」、「追加の癌治療剤又は治療」などは、GVAX(登録商標)のようなサイトカイン発現細胞ワクチンとともに使用された場合に抗癌応答を刺激する、いかなる分子又は治療もさす。1つの側面において、追加の癌治療剤は組換え腫瘍細胞によって発現され、そして免疫調節分子、すなわち、第二のサイトカインであることができる。他の側面においては、追加の癌治療剤は、薬剤として許容可能な賦形剤中で提供される、タンパク質或いは抗体又はタキソテレのような標準的な化学療法剤などの他の化合物の形態で投与される。さらに他の側面においては、癌治療剤は、放射線照射などの、癌の治療において伝統的に使用された標準的な治療である。さらなる側面においては、追加の癌治療剤は、典型的には癌の治療において考慮されないが、サイトカイン発現細胞ワクチンと併用して患者に投与された場合、治療される患者のために改善された治療結果を生じる、剤又は治療である。
【0024】
本明細書中で使用される「サイトカイン」は、免疫系の細胞に効果を及ぼすか/影響する生物学的分子の一般的なクラスを意味する。この定義は、局所的に作用するか又は血中を循環することができ、そして本発明の組成物又は方法において使用される場合、癌への個体の免疫応答を制御又は調節する働きをする生物学的分子を含むがこれらに限定されない。本発明を実施するために使用される例示的なサイトカインは、IFN-アルファ、IFN‐ベータ、及びIFN-ガンマ、(IL-1〜IL-29、特にIL-2、IL-7、IL-12、IL-15及びIL-18などの)インターロイキン、(TNF‐アルファ及びTNF-ベータなどの)腫瘍壊死因子、エリスロポエチン(EPO)、MIP3a、ICAM、マクロファージコロニー刺激因子(M-CSF)、顆粒球コロニー刺激因子(G-CSF)及び顆粒球マクロファージコロニー刺激因子(GM-CSF)を含むが、これらに限られない。
【0025】
本明細書中で使用される「サイトカイン発現細胞ワクチン」という用語は、サイトカイン、例えばGM-CSFを発現するように遺伝的に修飾されており、そして癌治療計画の一部分として患者に投与される細胞集団を含む組成物をさす。そのような「サイトカイン発現細胞ワクチン」の細胞は、サイトカインがその細胞によって発現されるように、発現及び制御要素に作動可能に連結されている、サイトカインをコードするDNA配列を含む。「サイトカイン発現細胞ワクチン」の細胞は、典型的には腫瘍細胞であり、治療を受けている患者にとって自己の又は同種異系のものであることができ、そして、その患者から得られた腫瘍細胞と混合される「バイスタンダー細胞」であることができる。GM-CSFを発現する「サイトカイン発現細胞ワクチン」は、本明細書中で「GVAX(登録商標)」と称されることができる。
【0026】
組換えDNA構築物又はベクターに関して本明細書中で使用される「作動可能に連結された」という用語は、組換えDNA構築物又はベクターのヌクレオチド成分が選択されたコード配列の作動的制御のためにお互いに直接的に連結していることを意味する。一般に、「作動可能に連結された」DNA配列は、隣接しており、分泌リーダーの場合には隣接しているが、リーディングフレームにおいてはいくつかの配列、例えばエンハンサーは隣接する必要はない。
【0027】
本明細書中で使用されるように、「遺伝子」又は「コード配列」という用語は、適切な制御配列に作動可能に連結されたとき、インビトロ又はインビボにおいて、転写され(DNA)そしてポリペプチドに翻訳される(mRNA)、核酸配列を意味する。「遺伝子」は、典型的にはコード配列+該遺伝子に付随するいずれかの非コード配列(例えば、制御配列)を含み、したがって、該コード領域の前及び後の領域、例えば、5’非翻訳(5’UTR)又は「リーダー」配列及び3’UTR又は「トレーラー」配列、並びに個体のコード部分(エキソン)の間の介在配列(イントロン)を含むか又は含まないことができる。対照的に、「コード配列」は非コードDNAを含まない。
【0028】
本明細書において、「遺伝子修飾された」及び「遺伝的に修飾された」という用語は、核酸配列が細胞又は細胞集団中へ導入された、細胞又は細胞集団に関連して使用される。核酸配列は、細胞に対して異種性であることができ、又は細胞内にすでに存在する核酸配列の追加のコピー又は改善された変形であることができる。細胞は、物理的又は化学的方法によって、或いは組換えウイルスの使用によって遺伝的に修飾されることができる。リン酸カルシウム、エレクトロポーレーション及び圧力を介する遺伝物質の細胞内への移動のような物理的及び化学的方法がしばしば用いられる。哺乳動物細胞内への遺伝子の有効な送達において有用ないくつかの組換えウイルスベクターは、例えば、レトロウイルスベクター、アデノウイルスベクター、アデノウイルス関連ベクター(AAV)、ヘルペスウイルスベクター、ポックスウイルスベクターを含む。さらに、例えば、リポソーム、受容体を介する送達、リン酸カルシウムトランスフェクション、エレクトロポーレーション、粒子衝撃(遺伝子銃)、又は圧力を介する送達によって送達された裸のDNAも、核酸配列を細胞又は細胞集団内へ導入するために採用されることができ、それらを「遺伝子修飾された」又は「遺伝的に修飾された」ものとする。
【0029】
本明細書中で使用されるとおり、「腫瘍」及び「癌」という用語は、増殖制御の喪失及び通常は細胞の大きなクローンの形成を示す細胞をさす。腫瘍又は癌細胞は、一般に接触阻害を失い、そして侵襲性であり、及び/又は転移能を有する。
【0030】
本明細書中において、「腫瘍細胞由来の抗原」及び「腫瘍抗原」及び「腫瘍細胞抗原」という用語は交換可能に使用されることができ、免疫応答を誘発することのできる腫瘍細胞に由来するか又は該細胞によって発現される、いずれかのタンパク質、炭水化物又は他の成分をさす。その定義は、すべての腫瘍関連抗原を発現する腫瘍細胞全体、腫瘍細胞断片、腫瘍細胞から取られた細胞膜、細胞表面から精製されたタンパク質又は腫瘍細胞の膜、或いは腫瘍細胞の細胞表面に結合している独特の炭化水素部分を含むが、これらに限定されない。その定義は、その細胞にアクセスするために特別な処理を必要とする細胞の表面に由来する抗原も含む。
【0031】
本明細書中で使用される「全身的な免疫応答」という用語は、局在化されない、しかしその個体全体に影響を与える免疫応答を意味する。
【0032】
本明細書中で使用される「遺伝子治療」という用語は、ウイルス又は非ウイルスベクターを通じて組換え遺伝物質を含む組成物をエキソビボ又はインビボで送達することにより、癌を治療又は予防することを意味する。
【0033】
本明細書中で使用される「エキソビボ」の送達は、ヒトの体の外から、遺伝物質を含む組成物を細胞、組織、オルガノイド、器官、などの内に導入し、続いて、そのような導入された組成物を含む細胞、組織、オルガノイド、器官などを、製剤、投与部位又は経路に限定されずに、同じ(自己の)又は異なる(同種異系の)ヒトに投与することを意味する。
【0034】
「不活性化細胞」、「非分裂細胞」及び「非複製細胞」という用語は、本明細書中で交換可能に使用されることができ、例えば、放射線照射により処理され、増殖不能とされた細胞をさす。そのような処理により、有糸分裂を行うことができないが、サイトカイン又は他の癌治療剤のようなタンパク質を発現する能力を保持する細胞が生じる。典型的には、約3500ラドの最小用量の照射で十分であるが、約30,000ラドまでの用量が許容可能である。有効用量は、非制限的に5000〜10000ラドを含む。マイトマイシンCによる処理のような、細胞を不活性化する多数の方法が本分野において知られている。細胞を細胞分裂不能とするが細胞のタンパク質発現能力を保持することを可能とする、いかなる不活性化方法も、本発明の範囲内に含まれる。
【0035】
本明細書において使用されるとおり、個体又は細胞の「治療」は、個体又は細胞の自然の過程を変更する試みにおいて使用されるいずれかのタイプの介入である。治療は、例えば、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療の投与を含むがこれに限定されず、そして、予防的に或いは一次的な又はフォローアップ治療計画の一部分として診断に続いて実施されることができる。
【0036】
本明細書中で使用される「投与すること」という用語は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を含む組成物を、癌患者に物理的に導入することをさす。いかなるそしてすべての導入方法は本発明により考慮され、該方法は、いかなる特別な導入手段にも依存せず、そのように解釈されるべきでない。導入手段は、当業者に周知であり、その例が本明細書中に提供される。
【0037】
本明細書中で使用される「同時投与」という用語は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療の組み合わせが同じ患者に投与される過程を意味する。サイトカイン発現細胞ワクチン及び追加の癌治療剤は、同時に、本質的に同時に、又は連続的に投与されることができる。投与が連続的に行われる場合、サイトカイン発現細胞ワクチンは、所定の追加の癌治療剤又は治療の前又は後に投与されることができる。サイトカイン発現細胞ワクチン及び追加の癌治療剤又は治療は、同じビヒクルによって投与される必要はなく、細胞ワクチン及び追加の剤又は治療は、1回以上の回数で、及び組み合わせの各成分の投与回数は同じでも異なってもよい。さらに、サイトカイン発現細胞ワクチン及び追加の癌治療剤又は治療は、同じ部位に投与される必要はない。
【0038】
本明細書中で使用される「治療的有効量」又は「治療的に有効な組み合わせ」は、刺激又は抑制することのいずれかによって、個体の全身性の免疫応答を調節するのに十分な、サイトカイン発現細胞ワクチンの量又は用量と追加の剤又は治療の量又は用量をあわせたものをさす。所定の治療的に有効な組み合わせにおけるサイトカイン発現細胞ワクチンの量は、異なる個体、異なる腫瘍のタイプによって異なることができ、そして、該組み合わせに含まれる1つ以上の追加の剤又は治療に依存するであろう。「治療的有効量」は、「改善された治療成績」の結果のような当業者によって日常的に採用される手順を用いて決定される。
【0039】
本明細書において使用されるとおり、癌に関する「改善された治療成績」及び「亢進された治療的有効性」は、癌細胞又は固形癌の増殖の緩徐化又は減少、或いは癌細胞総数又は癌による負担全体の減少をさす。「改善された治療成績」又は「亢進された治療的有効性」は、したがって、腫瘍の進行する時間の増加、平均余命の増加、又は生活の質の向上を含む臨床的に許容可能な基準による患者の状態の改善があることを意味する。
【0040】
本明細書中で使用される「確立された腫瘍の逆行」は、既存の腫瘍の抑制、退行、部分的又は完全な消失を意味する。該定義は、既存の腫瘍のサイズ、成長速度、出現又は細胞成分のいかなる減少も含むことを意味する。
【0041】
本明細書中で示される「個体」、「対象」という用語は、脊椎動物、好ましくは哺乳動物、そして典型的にはヒトをさす。
【0042】
一般的な技術
本発明の実施には、特記されない限り、分子生物学、微生物学、細胞生物学、生化学及び免疫学の慣用技術を採用し、そしてこれらは当業者の知識の範囲内にある。そのような技術は、それぞれが特別に参考文献として本明細書中に援用されている、「Molecular Cloning: A Laboratory Manual」、second edition(Sambrook et al., 1989);「Current Protocols in Molecular Biology」(F.M.Ausubel et al., eds., 1987);「Animal Cell Culture」(R.I.Freshney ed., 1987)などの文献中に完全に説明されている。
【0043】
癌標的
本発明の方法及び組成物は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を癌患者に同時投与することによって、癌の治療への改善された治療的アプローチを提供する。本明細書中で使用される「癌」は、腫瘍中に局在化された癌、並びに例えば、局所的な腫瘍から浸潤によって広がる癌細胞(すなわち、転移)のような腫瘍中に局在化されない癌を含む。本発明は、非制限的に膀胱、乳房、結腸、腎臓、肝臓、肺、卵巣、頚部、膵臓、直腸、前立腺、胃、表皮の癌;リンパ系又は骨髄系の造血系の腫瘍;繊維肉腫又は横紋筋肉腫などの間葉由来の腫瘍;メラノーマ、テラトカルシノーマ、ニューロブラストーマ、グリオーマ、アデノカルシノーマ及び非小細胞肺癌などの他の腫瘍タイプを含むいかなる形態の癌の治療においても有用性を見出す。
【0044】
サイトカイン及び癌治療剤をコードする核酸配列の細胞への導入
本発明の1つの側面において、第一のプロモーターに作動可能に連結されたサイトカインをコードする核酸配列(すなわち、組換えDNA構築物又はベクター)が単独で、又は第二のプロモーターに作動可能に連結された癌治療剤をコードする核酸配列とともに細胞又は細胞集団に導入される。細胞又は細胞集団、典型的には腫瘍細胞、へのいかなる導入方法も、本発明により考慮され、該方法はいずれの特別な導入手段にも依存せず、そしてそのように解釈されるべきでない。サイトカインをコードする核酸配列は、癌治療剤をコードする核酸配列と同じ又は異なる細胞集団へ導入されることができる。
【0045】
当業者により理解されるとおり、「ベクター」は、プラスミド、ウイルス又は他の媒体のようなDNA分子であって、1つ以上の異種性の又は組換えのDNA配列、例えばサイトカイン又は追加の癌治療剤を機能的プロモーターのコントロール下でコードする核酸配列を含み、そしていくつかの場合にはベクターとして機能することのできるエンハンサーをさらに含む。好適なウイルスベクターは、レトロウイルス、レンチウイルス、アデノウイルス(AV)、アデノ関連ウイルス(AAV)、シミアンウイルス40(SV-40)、ウシパピローマウイルス、エプシュタイン−バールウイルス、ヘルペスウイルス、ワクシニアウイルス、マウス白血病ウイルス、マウス肉腫ウイルス、マウス乳癌ウイルス、及びラウス肉腫ウイルスを非制限的に含む。非ウイルスベクターもまた、本発明の範囲に含まれる。
【0046】
真核腫瘍細胞、又は特別には、ヒトのような哺乳動物の腫瘍細胞などの動物腫瘍細胞への核酸の導入に適した、好適なベクターが採用されることができる。好ましくは、ベクターは腫瘍細胞と適合性であり、例えば、サイトカイン又は癌治療剤のためのコード配列を発現させ、そして腫瘍細胞中で安定に、又は比較的安定に維持されることができる。望ましくは、ベクターは複製開始点を含み、そしてベクターは、ベクターがそれによって同定されそして選択される、「マーカー」又は「選択的マーカー」機能をも含んでも、含まなくてもよい。いかなる選択的マーカーが使用可能であっても、そのような発現ベクター中で使用される選択的マーカーは、一般に当業者に知られており、適切な選択的マーカーの選択は宿主細胞に依存するであろう。抗生物質又は他のトキシンに対する耐性を与えるタンパク質をコードする選択的マーカー遺伝子の例は、アンピシリン、メトトレキセート、テトラサイクリン、ネオマイシン(Southern and Berg, J., 1982)、マイコフェノール酸(Mulligan and Berg, 1980)、ピューロマイシン、ゼオマイシン、ヒグロマイシン(Sugden et al., 1985)又はG418を含む。
【0047】
本発明の方法を実施するにあたって、サイトカイン又は追加の癌治療剤をコードする核酸配列を含むベクターがインビトロで細胞、好ましくは腫瘍細胞に移され、それは、エレクトロポーレーション、リポソームとの膜融合、リポフェクタミン処理、DNA-被覆微粒子銃による高速銃、リン酸カルシウム−DNA沈殿とのインキュベーション、DEAE−デキストランを介するトランスフェクション、修飾されたウイルス核酸による感染、単一の細胞への直接のマイクロインジェクションなどを非制限的に含む多数の方法のいずれかを使用する。本明細書に特別に参考文献として援用されているAusubel, et al., 1992及びSambrook, et al, 1989,に記載されたような組換えDNA技術を用いて天然のタンパク質の修飾された形態をクローニング及び発現させる方法は、一般的に当業者に知られている。
【0048】
「組換えの」というベクター又は他のDNA配列への言及は、典型的には自然から単離された形態又は自然に見出される形態として作動可能に連結されていないDNA配列の作動可能な連結を認めるだけのことである。「プロモーター」は、RNAポリメラーゼの結合を指示し、それによってRNA合成を促進するDNA配列である。「エンハンサー」は、隣接する遺伝子の転写を刺激又は阻害するシス作用性の要素である。転写を阻害するエンハンサーは「サイレンサー」とも呼ばれる。エンハンサーは、コード配列からそして転写領域の下流の位置から数キロ塩基対(kb)以下の距離にわたって、どちらの方向にも機能することができる(すなわち、コード配列に作動可能に連結されている)。制御(発現/調節)配列が転写、そして適宜、核酸配列の翻訳を制御する場合、制御(発現/調節)配列は、核酸コード配列に作動可能に連結されている。したがって、発現/調節配列は、プロモーター、エンハンサー、転写終結区、コード配列の前の開始コドン(すなわち、ATG)、イントロンのためのスプライシングシグナル及び停止コドンを含むことができる。
【0049】
本発明の細胞ワクチンの製造のための組換えベクターは、ベクターが導入された腫瘍細胞中でサイトカイン又は癌治療剤のためのコード配列が適切に転写されそして翻訳されるように、すべての適切な転写、翻訳及びプロセシングシグナル(例えば、スプライシング及びポリアデニル化シグナル)を提供する。宿主細胞中での適切な発現を確実にするためのそのようなシグナルの操作は、当業者の能力の範囲内にある。サイトカイン及び癌治療剤のためのコード配列は、それ自身の天然のプロモーター或いはサイトメガロウイルス(CMV)即時早期(cytomegalovirus (CMV) immediate early)プロモーター/エンハンサー、ラウス肉腫ウイルス長端末反復(Rous sarcoma virus long terminal repeat(RSV-LTR))又はSV-40プロモーターなどの構成的プロモーターを含む非天然の(すなわち、異種性の)プロモーターの制御の下にある(すなわち、作動可能に連結されている)ことができる。
【0050】
或いは、組織特異的プロモーター(特別な種類の組織において優先的に活性化され、その組織において遺伝子産物を発現するプロモーター)が、ベクター中で使用されることができる。そのようなプロモーターは、非制限的に、肝臓特異的プロモーター(Ill CR et al., Blood Coagul Fibrinolysis 8 Suppl 2: S23-30, 1997)及びEF-1アルファプロモーター(それぞれが特別に参考文献として本明細書中に援用されている、Kim DW et al., Gene. 91(2):217-23, 1990, Guo ZS et al., Gene Ther. 3(9):802-10, 1996;米国特許第5,266,491号及び同第5,225,348号)を含む。誘導可能なプロモーターも、本明細書に記載の方法の実施において有用性を見出し、それらは、記載されたtet‐オン又はtet-オフシステム中のtet応答配列(TRE)を含むプロモーター(Clon Tech and BASF)、一定の金属塩を加えることによってアップレギュレーションされることのできるメタロチオネインプロモーター、及びラパマイシン誘導性プロモーター(Rivera et al., 1996, Nature Med, 2(9):1028-1032; Ye et al., 2000, Science 283: 88-91; Sawyer TK et al., 2002, Mini Rev Med Chem. 2(5):475-88)などのプロモーターである。本発明の実施において使用される多数の好適な組織特異的又は制御可能なベクター及びプロモーターは、当業者に知られており、多くが商業的に入手可能である。
【0051】
本発明の実施に使用される例示的なベクター系は、本明細書中に特別に参考文献として援用された、米国特許第5,637,483号に記載のレトロウイルスMFGベクターを含む。他の有用なレトロウイルスベクターは、それぞれが特別に参考文献として本明細書中に援用されている、米国特許第5,637,483号(特に、実施例12)、同第6,506,604号、同第5,955,331号及び米国特許出願第09/612808号に記載された、pLJ、pEm、及び[アルファ]SGCを含む。
【0052】
本発明の実施に使用されるさらなる例示的ベクター系は、本明細書中に特別に参考文献として援用された、米国特許第6,428,953号、同第5,665,577号及び同第5,981,276号、及びPCT国際特許出願公開第WO00/72686号に記載の第2、第3及び第4世代のレンチウイルスベクターを含む。
【0053】
本発明の実施に使用されるさらなる例示的ベクター系は、例えば、それぞれが本明細書中に特別に参考文献として援用された、米国特許第5,872,005号及びPCT国際特許出願公開第WO00/72686号に記載のアデノウイルスベクターを含む。
【0054】
本発明の実施において好ましいなおさらなる例示的ベクター系は、例えば、それぞれが本明細書中に特別に参考文献として援用された、PCT国際特許出願公開第WO98/46728号、同第WO00/72686号、Samulski et al., Virol. 63:3822-3828(1989)及び米国特許第5436146号、同第5753500号、同第6037177号、同第6040183号及び同第6093570号に記載された組換えアデノ関連ベクター(rAAV)系である。
【0055】
サイトカイン
サイトカイン及びサイトカインの組み合わせは、免疫系の刺激において重要な役割を果たすことが示されている。「サイトカイン」という用語は、宿主中に存在する腫瘍への免疫応答を亢進又は修飾する(糖たんぱく質のような修飾タンパク質を含む)いかなる免疫賦活タンパク質もさすものとして当業者に理解されている。サイトカインは、典型的には、免疫系の細胞の活性を活性化又は亢進することによって、免疫応答を亢進又は修飾し、それ自身は宿主に対して免疫原性でない。
【0056】
本明細書中に示された結果から、多様なサイトカインが本発明における用途を見出すであろう。本発明の実施において使用される例示的なサイトカインは、非制限的に、IFN-アルファ、IFN-ベータ、及びIFN-ガンマ、インターロイキン(例えば、IL-1〜IL-29、特に、IL-2、IL-7、IL-12、IL-15及びIL-18)、腫瘍壊死因子(例えば、TNF-アルファ及びTNF-ベータ)、エリスロポエチン(EPO)、MIP3a、マクロファージコロニー刺激因子(M-CSF)、顆粒球コロニー刺激因子(G-CSF)並びに顆粒球‐マクロファージコロニー刺激因子(GM-CSF)を含む。サイトカインはいずれの供給源からのものでもよいが、サイトカインはマウス又はヒト由来(天然のヒト又はマウスサイトカイン)或いは、サイトカインがヒトの形態のサイトカインに実質的に相同の配列を有し、そして免疫系に対して類似の活性を示す限り、そのようなサイトカインの配列変異体であることが最適である。そこから、相同性の形態が免疫系に対して同じ又は類似の活性を示す限り、ヒトの形態のIFN-アルファ、IFN-ベータ、及びIFN-ガンマ、IL-1〜IL-29、TNF-アルファ、TNF-ベータ、EPO、MIP3a、ICAM、M-CSF、G-CSF並びにGM-CSFに実質的に相同であるサイトカインは、本発明の実施において有用であると結論される。いずれかの特別なサイトカインに実質的に類似するが、タンパク配列における比較的小さな変化を有するタンパク質は、本発明における用途を見出す。タンパク配列における小さな変更は、タンパク質分子の機能的活性を妨害せず、そしてしたがって、本発明におけるサイトカインのように機能するが、現在知られた又は天然の配列とはわずかに異なる、タンパク質を作ることができることはよく知られている。
【0057】
変異体配列
天然のヒト又はマウスサイトカインの相同体及び変異体並びに追加の癌治療剤は、本発明の範囲内に含まれる。本明細書中で使用されるとおり、「配列の同一性」という用語は、2つ以上の整列された配列間の核酸又はアミノ酸配列の同一性を意味し、典型的には、パーセンテージ(「%」)で表される。「相同性%」という用語は、本明細書において「同一性%」又は「配列同一性%」という用語と交換可能に使用され、配列の整列プログラムを用いて整列化された場合の、2つ以上の整列された配列間の核酸又はアミノ酸配列の同一性のレベルをさす。例えば、本明細書中で使用されるとおり、80%の相同性は、定義されたアルゴリズムにより決定された80%配列同一性と同じことを意味し、そしてしたがって、ある配列の相同体は、本明細書中に記載のとおり、典型的にその配列の長さにわたって80%超の配列同一性を有する。配列同一性の好ましいレベルは、天然のサイトカイン又は癌治療剤のアミノ酸配列又は核酸配列に対する80、85、88、89、90、91、92、93、94、95、96、97、98、又は99%以上の配列同一性を含むが、これらに限られない。
【0058】
2つの配列間の同一性の程度を決定するために使用されることのできる例示的なコンピュータープログラムは、そのすべてがインターネット上で公的に利用可能なBLASTN、BLASTX、TBLASTX、BLASTP、及びTBLASTNなどの一揃いのBLASTプログラムを含むが、これらに限られない。本明細書中に特別に参考文献として援用されている、Altschul, S.F. et al. Mol. Biol. 215:403-410, 1990及びAltschul, S.F. et al., Nucleic Acids Res. 25:3389-3402, 1997も参照のこと。配列の調査は、ある核酸配列をGenBank DNA Sequence及び他の公的なデータベース中の核酸配列に対して評価する場合、典型的には、BLASTNプログラムを用いて実施される。BLASTXプログラムは、すべてのリーディングフレームにおいて翻訳された核酸配列を、GenBank Protein Sequences 及び他の公的なデータベース中のアミノ酸配列に対して調査するのに好適である。配列同一性の決定において、BLASTN及びBLASTX(すなわち、バージョン2.2.5)は両方とも11.0のギャップ開始ペナルティ(open gap penalty)、及び1.0のギャップ延長ペナルティ(extended gap penalty)を用いて実行され、そしてBLOSUM-62マトリックスを利用する(上記のAltschul, et al, 1997を参照のこと)。2つ以上の配列間の「同一性%」を決定するための選ばれた配列の好ましい整列化は、例えば、10.0のギャップ開始ペナルティ、0.1のギャップ延長ペナルティ、及びBLOSUM30類似性マトリックスを含む、デフォルトパラメータを用いて実行されるMacVector バージョン6.5中のCLUSTAL-Wプログラムを用いて実施される。
【0059】
中度〜高度にストリンジェントなハイブリダイゼーション条件及び洗浄条件下で、2つの配列が相互に特異的にハイブリダイズする場合、核酸配列は、参照核酸配列に対して「選択的にハイブリダイズ可能」であると考えられる。ハイブリダイゼーション条件は、核酸結合複合体又はプローブの融点(Tm)に基づく。例えば、典型的に、「最大ストリンジェンシー」は約TM-5℃(プローブのTmより5℃低い)、「高ストリンジェンシー」はTmよりも約5〜10℃低く、「中ストリンジェンシー」はプローブのTmよりも約10〜20℃低く、そして「低ストリンジェンシー」はTmよりも約20〜25℃低い温度で起こる。機能的には、最大ストリンジェンシー条件はハイブリダイゼーションプローブと厳密に同一又は厳密に近く同一な配列を同定するために使用されることができるが、高ストリンジェンシー条件は、プローブと約80%以上の配列同一性を有する配列を同定するために使用される。高ストリンジェンシー条件の例は、約42℃において、50%ホルムアミド、5×SSC、5×Denhardt溶液、0.5%SDS及び100μg/ml変性キャリアーDNA中でハイブリダイゼーション、続いて室温において2×SSC及び0.5%SDSで二回洗浄し、そして42℃において0.1×SSC及び0.5%SDSでさらに二回洗浄することを含む。中及び高ストリンジェンシーハイブリダイゼーション条件は、当業者に周知である。例えば、(本明細書中に特別に参考文献として援用されている)Sambrook, et al., 1989, Chapters 9 及び 11、そしてAusubel, F. M. et al., 1993, を参照のこと。
【0060】
1つ以上の追加の剤又は治療
本明細書中に記載のとおり、本発明は、サイトカイン発現細胞ワクチン(例えば、GM-CSF;GVAX(登録商標))及び少なくとも1つの追加の癌治療剤又は治療を患者に同時投与することによって、癌(例えば、標的癌抗原)に対する個体の免疫応答を改善する方法を目的とする。本発明の実施において使用される癌治療剤又は治療は、接着分子又はアクセサリー分子、他の生物学的応答調節物質、化学療法剤、放射線療法並びにそれらの組み合わせを含むがこれらに限られない。
【0061】
癌治療剤
本発明の実施態様は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤の組み合わせの投与を含む。本発明の実施において使用される癌治療剤は、表1A及び1Bに列挙されたものを含む。これらは、アルキル化剤、アルカロイド、抗代謝剤、抗腫瘍抗体、ニトロソ尿素、ホルモンアゴニスト/アンタゴニスト及びアナログ、免疫調節剤、光増感剤、酵素などを含む、癌治療剤の主要な各クラスからの剤を含むがこれらに限定されない。いくつかの好ましい実施態様において、癌治療剤は、サイトカイン又は共刺激分子である。他の好ましい実施態様においては、癌治療剤は例えば、CpG(細菌のDNAを擬態するCGジヌクレオチド);HSP(熱ショックタンパク質);COX-2阻害剤;抗4-1BBmAb;IL-2、IL-18;抗CTLA−4モノクローナル抗体;抗CD40又は膜/可溶性CD40リガンド;インターフェロンアルファ(IFN-アルファ);イレッサ:抗−上皮細胞成長因子R(EGF-R);或いは抗VEGF Rである。好ましい癌治療剤は、5−フルオロウラシル、シスプラチン、ドキソルビシン、エストラムスチン、エトポシド、ミトキサントロン、ドセタキセル(TAXOTERE(商標))、パクリタキセル(TAXOL(商標))、及びレトロ‐ガットレスアデノ、IL-15、ケモ‐タキソテレ、及びエラストムスチン(+ステロイド)を含むがこれらに限られない。
【0062】
【表1】

【0063】
【表2】

【0064】
【表3】

【0065】
【表4】

【0066】
細胞ワクチンの組み合わせ
顆粒球−マクロファージコロニー刺激因子(GM-CSF)は、線維芽細胞、内皮細胞、T細胞及びマクロファージにより産生されるサイトカインである。このサイトカインは、顆粒球及びマクロファージ系の造血細胞の増殖を誘導することが示されている。さらに、それは、免疫系の主要抗原提示細胞(APC)である樹状細胞の抗原プロセシング及び抗原提示機能を活性化する。動物モデル実験の結果は、GM-CSFを産生する腫瘍細胞(すなわち、GVAX(登録商標))が親である非形質導入腫瘍細胞に対する免疫応答を誘発できることを断定的に示した。
【0067】
癌の治療のために続いて患者に再投与されるサイトカイン、例えばGM-CSFを発現するように遺伝的に修飾された自己の又は同種異系の癌細胞が、本明細書中に特別に参考文献として援用されている米国特許第5,637,483号、同第5,904,920号及び同第6,350,445号に記載されている。膵臓癌の治療のための、遺伝的に修飾されたGM-CSF発現腫瘍細胞又は「サイトカイン‐発現細胞ワクチン」の形態が、本明細書に特別に参考文献として援用されている米国特許第6,033,674号及び同第5,985,290号に記載されている。普遍的な免疫調節性サイトカイン発現バイスタンダー細胞系は、本明細書に特別に参考文献として援用されている米国特許第6,464,973号に記載されている。GM-CSFを発現する自己の又は同種異系の細胞ワクチン(GVAX(登録商標))を使用する臨床試験が、前立腺癌、メラノーマ、肺癌、膵臓癌、腎臓癌、及び多発性骨髄腫の治療のために行われ、これらの試験の多くが現在進行中であるが、GM-CSFに対する免疫応答単独で急速に成長する悪性度を遅くするか又は根絶するのに十分に強力であるか否かについての疑問はいまだ解決されないままである。
【0068】
本発明は、哺乳動物、好ましくはヒトの患者において癌への免疫応答を刺激する改善された方法を提供する。望ましくは、該方法は癌への全身性の免疫応答、すなわち、T細胞の応答及び/又はB細胞の応答を発生させる。該方法は、患者にサイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を投与することを含み、ここで、該細胞ワクチンは1つ又はさまざまな癌抗原を発現する細胞を含み、該癌抗原は、治療中の患者において見出される癌の抗原のうちの一つであることができる。細胞は、放射線照射などによって増殖不能とさせられる。該組成物の投与によって、癌への免疫応答が誘発され、又は亢進される。1つのアプローチにおいて、サイトカイン発現細胞ワクチンの組み合わせは、サイトカイン及び少なくとも1つの追加の癌治療剤を発現するように修飾された単一の細胞集団を含む。他のアプローチにおいては、ワクチンはそれぞれがワクチンの成分を一つ発現するように修飾された2つ以上の細胞集団を含む。さらに他のアプローチにおいては、サイトカイン発現細胞ワクチンの組み合わせは、少なくとも1つの追加のがん治療剤又は治療とともに投与されるサイトカインを発現するように修飾された細胞集団を含む。
【0069】
一般に、本発明の実施において使用されるためのサイトカイン発現細胞ワクチンの組み合わせは、自己の腫瘍細胞、同種異系の腫瘍細胞及び腫瘍細胞株(すなわち、バイスタンダー細胞)から成る群から選ばれる腫瘍細胞を含む。
【0070】
いくつかの実施態様においては、サイトカイン発現細胞ワクチンの組み合わせの細胞は、投与の前に凍結保存される。本発明の1つの側面においては、サイトカイン発現細胞ワクチンの組み合わせの細胞は、それらが由来する(自己の)同じ個体に投与される。本発明の他の側面においては、サイトカイン発現細胞ワクチンの組み合わせの細胞及び腫瘍は、異なる個体(同種異系の又はバイスタンダー)から誘導される。好ましいアプローチにおいては、治療される腫瘍は、膀胱、乳房、結腸、腎臓、肝臓、肺、卵巣、頚部、膵臓、直腸、前立腺、胃、表皮の癌;リンパ系又は骨髄系の造血系の腫瘍;繊維肉腫又は横紋筋肉腫のような間葉由来の腫瘍;メラノーマ、テラトカルシノーマ、神経芽細胞腫、グリオーマ、アデノカルシノーマ及び非小細胞肺癌からなる群から選ばれる。
【0071】
本発明の1つの側面において、サイトカイン発現細胞ワクチンの組み合わせの細胞は、サイトカインの発現のための1つのタイプの遺伝子修飾された細胞及び1つ以上の追加の癌治療剤の発現のための他の異なるタイプの細胞の遺伝子修飾された細胞を含む。例えば、一つのアプローチにおいては、サイトカイン発現細胞ワクチン(すなわち、GVAX(登録商標))は、同種異系の又はバイスタンダー細胞株として提供される一方、1つ以上の追加の癌治療剤は自己の細胞によって発現される。他のアプローチにおいては、1つ以上の追加の癌治療剤は、自己の又はバイスタンダー細胞株によって発現されるが、サイトカイン(すなわち、GM-CSF)は自己の細胞によって発現される。
【0072】
先の研究において、多様なサイトカインによって形質導入されたマウス腫瘍細胞を直接比較したところ、GM-CSFを分泌する腫瘍細胞が全体として最高の腫瘍に対する防御を誘発したことが実証された。1つの好ましい実施態様において、本発明のサイトカイン発現細胞ワクチンによって発現されたサイトカインは、GM-CSF(本明細書中では一般に「GVAX(登録商標)と称される)である。GM-CSFのための好ましいコード配列は、Huebner K. et al., Science 230(4731):1282-5,1985に記載のゲノム配列である。或いは、GM-CSFのcDNA形態も本発明の実施において有用性を見出す(Cantrell et al., Proc. Natl. Acad. Sci., 82, 6250-6254, 1985)。
【0073】
投与の前に、本発明のサイトカイン発現細胞ワクチンの組み合わせの細胞は、増殖不能とさせられる。細胞の増殖能力を失わせる方法が数多く知られている一方、放射線照射が好ましい方法である。好ましくは、サイトカイン発現細胞ワクチンの組み合わせは約50〜約200ラド/分、より好ましくは約120〜約140ラド/分で、患者の投与前に照射される。最も重要なのは、実質的に100%の細胞の増殖、さらなる増殖を阻害するのに十分な総放射線量で、細胞が照射されることである。したがって、細胞は約10,000〜20,000ラド、最適には約15,000ラドの総量を照射されることが望ましい。
【0074】
自己の
本発明のワクチン中での自己のサイトカイン発現細胞の使用は、利益を提供し、それは各患者の腫瘍が、他の患者由来の形態学的に類似した、MHC適合性の腫瘍細胞に見出されるものとは異なることのできる、独特の腫瘍抗原の組を発現するためである。例えば、Kawakami et al.J. Immunol., 148, 638-643(1992); Darrow et al., J. Immunol., 142, 3329-3335(1989);及びHom et al., J. Immunother., 10, 153-164(1991)を参照のこと。対照的に、MHC-適合性の腫瘍細胞は、ワクチン製造のためにその腫瘍のサンプルを得るための手術を患者が受ける必要がないという利点を提供する。
【0075】
1つの好ましい側面において、本発明は、以下のステップを実施することによって癌を治療する方法を含む:(a)腫瘍を有する哺乳動物、好ましくはヒトから腫瘍細胞を得て;(b)非修飾腫瘍細胞に比べて、サイトカインを産生し又は細胞によって天然に産生されるサイトカインのレベルを増加させ、そして少なくとも1つの追加の癌治療剤を産生することができるように、該腫瘍細胞を修飾し;(c)該修飾された腫瘍細胞を増殖不能とし;そして、(d)該修飾された腫瘍細胞を、その腫瘍細胞が得られた哺乳動物に、又はその腫瘍細胞が得られた哺乳動物と同じMHCタイプを有する哺乳動物に再投与すること。投与された腫瘍細胞は、宿主の自己の、又は宿主に対してMHC適合性のものである。
【0076】
同じ自己の腫瘍細胞がサイトカイン及び癌治療剤の両方を発現することができ、又はサイトカイン及び1つ以上の癌治療剤は異なる自己の腫瘍細胞集団によって発現されることができる。本発明の1つの側面において、自己の腫瘍細胞は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結されたサイトカインをコードする核酸配列を含むベクターを導入することによって修飾される。他の側面においては、同じ自己の腫瘍細胞が、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結された少なくとも1つの追加の癌治療剤をコードする核酸配列を含むベクターを導入することによって修飾される。さらなる側面においては、第二の自己の腫瘍細胞が、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結された少なくとも1つの追加の癌治療剤をコードする核酸配列を含むベクターを導入することによって修飾される。サイトカイン及び追加の癌治療剤をコードする核酸配列は、同じ又は異なるベクターを用いて同じ又は異なる自己の腫瘍細胞に導入されることができる。サイトカイン又は癌治療剤をコードする核酸配列は、プロモーターに作動可能に連結された選択的マーカー配列をさらに含んでも含まなくてもよい。
【0077】
同種異系の
Jaffee et al., Seminars in Oncology, 22, 81-91(1995)に記載のとおり、研究者らは腫瘍ワクチンとしての自己の細胞及びMHC-適合性細胞の代替物を探索した。初期の腫瘍ワクチン戦略は、腫瘍細胞の接種が、それらのMHCクラスI及びII分子によって抗原提示細胞(APC)として機能しそして腫瘍抗原を提示し、そして直接的に免疫系のT細胞部門を活性化するという理解に基づいていた。Huang et al(Science, 264, 961-965, 1994)の結果は、腫瘍細胞の接種よりも宿主の専門のAPCが、GM-CSFのようなサイトカインを分泌して骨髄由来のAPCが腫瘍領域に補充されるようにすることによって免疫細胞のT細胞部門の準備を整えることを示している。骨髄由来のAPCは、プロセシングのために腫瘍のすべての細胞タンパク質を取り込み、そしてそのMICクラスI及びII分子上に抗原ペプチドを提示し、それによって、免疫系のCD4+及びCD8+T細胞部門の両方の準備を整え、結果として癌に特異的な全身性の抗腫瘍免疫応答が起こる。これらの結果は、癌に対する免疫応答を誘発するためには、自己の又はMHC適合性腫瘍細胞を使用することは必要でも最適でもないかも知れず、そして(遺伝的に非類似の同じ種の個体からの)同種異系のMHC遺伝子の転移が腫瘍免疫性を亢進することができることを示唆する。より特別には、上記のJaffee et al及び上記のHuang et al中で考察されているとおり、一定の場合には、同種異系のMHCクラスI分子を発現する腫瘍の拒絶は、非修飾の親腫瘍によるその後のチャレンジに対する全身性の免疫応答を亢進させる。
【0078】
本明細書に記載のとおり、「腫瘍細胞株」は、最初に腫瘍に由来する細胞を含む。そのような細胞は、典型的には形質転換されている(すなわち、培養中で不確定の増殖を示す)。
【0079】
1つの好ましい側面において、本発明は、以下のステップを実施することによる癌の治療方法を提供する:(a)腫瘍細胞株を得て;(b)該腫瘍細胞株を修飾して、非修飾の腫瘍細胞株に比べて増加したレベルのサイトカイン単独又はサイトカインと少なくとも1つの追加の癌治療剤の組み合わせを産生することができるようにし;(c)修飾された腫瘍細胞株を増殖不能とし;そして(d)該腫瘍細胞株が得られたのと同じタイプの腫瘍である少なくとも1つの腫瘍を有する宿主、又は該腫瘍細胞株と宿主の腫瘍が少なくとも1つの共通の抗原を発現する宿主に該腫瘍細胞株を投与すること。投与された腫瘍細胞株は、同種異系であり、宿主に対してMHC適合性でない。そのような同種異系の株は、よく特徴づけされた細胞の患者への投与が可能であるように、それらが前もって調製され、特徴づけされ、既知の数のサイトカイン発現細胞を含むバイアル中に等量ずつ分けられ、そして保存されることができるという利益を提供する。遺伝子修飾された同種異系の細胞の生産方法は、例えば、本明細書中に特別に参考文献として援用されているPCT国際特許出願公開第WO00/72686A1号に記載されている。
【0080】
遺伝子修飾された同種異系の細胞を含むサイトカイン発現細胞ワクチンを調製するための1つのアプローチにおいて、サイトカイン及び治療剤をコードする核酸配列が、同種異系の(すなわち、治療される個体以外の個体からの)腫瘍細胞株である細胞株に導入される。他のアプローチにおいては、サイトカイン及び治療剤をコードする核酸配列が、別の(すなわち、異なる)同種異系の腫瘍細胞株に導入される。細胞又は細胞集団は、治療される腫瘍又は癌と同じタイプの腫瘍細胞株からのものであることができる。腫瘍及び/又は腫瘍細胞株は、膀胱、乳房、結腸、腎臓、肝臓、肺、卵巣、頚部、膵臓、直腸、前立腺、胃、表皮の癌;リンパ系又は骨髄系の造血系の腫瘍;繊維肉腫又は横紋筋肉腫のような間葉由来の腫瘍;メラノーマ、テラトカルシノーマ、神経芽細胞腫、グリオーマ、アデノカルシノーマ及び非小細胞肺癌を含む他の腫瘍を含むが、これらに限られないいずれかの形態であることもできる。
【0081】
本発明の1つの側面において、同種異系の腫瘍細胞は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結されたサイトカインをコードする核酸配列を含むベクターを導入することによって修飾される。他の側面において、同じ同種異系の腫瘍細胞又は第二の同種異系の腫瘍細胞は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結された少なくとも1つの追加の癌治療剤をコードする核酸配列を含むベクターを導入することによって修飾される。サイトカイン及び追加の癌治療剤をコードする核酸配列は、同じ又は異なるベクターを用いて、同じ又は異なる同種異系の腫瘍細胞中に導入されることができる。サイトカイン又は癌治療剤をコードする核酸配列は、プロモーターに作動可能に連結された選択的マーカー配列をさらに含んでも含まなくてもよい。
【0082】
望ましくは、同種異系の細胞株は、200〜1000ng/106細胞/24時間の範囲内のGM-CSFを発現する。好ましくは、普遍的なバイスタンダー細胞株は、少なくとも約200ngGM-CSF/106細胞/24時間を発現する。
【0083】
本発明の実施においては、1つ以上の同種異系の細胞株が自己の癌抗原、例えば、(同種異系の細胞株組成物をともに含む)自己の腫瘍細胞とともにインキュベートされ、そして同種異系の細胞株組成物が患者に投与される。典型的には、癌抗原は、治療される癌の細胞、すなわち、自己の癌細胞によって(上に)提供される。そのような場合、組成物は放射線照射によって増殖不能とさせられ、ここで、該同種異系の細胞及び癌細胞は組織培養プレート中に蒔かれ、上記で詳述したCs供給源を用いて室温において放射線照射される。ある投与における同種異系の細胞の自己の癌細胞に対する比率は、その組み合わせによって変化するであろう。
【0084】
同種異系の細胞株組成物を患者に導入するためには、いかなる好適な投与経路も使用可能であり、好ましくは、該組成物は皮下に又は腫瘍内に投与される。
【0085】
本発明の実施における同種異系の細胞株の使用は、サイトカイン発現同種異系細胞株及び(同じ又は異なる細胞株によって発現された)少なくとも1つの追加の癌治療剤を、自己の癌抗原とともに癌患者に投与し、免疫調節性サイトカインのパラクリン産生を介して、腫瘍に対する有効な免疫応答を生じるという治療的利益を提供する。これは、各患者について自己の腫瘍細胞を培養しそして形質導入する必要性を取り除き、多様で非効率的な形質導入効率の問題を除去する。
【0086】
バイスタンダー
1つのさらなる側面において、本発明は、普遍的な免疫調節性サイトカイン発現バイスタンダー細胞株及び少なくとも1つの追加の癌治療剤を発現するバイスタンダー細胞株を提供する。同じ普遍的なバイスタンダー細胞株がサイトカイン及び癌治療剤の両方を発現することができるか、又はそれぞれは異なる普遍的なバイスタンダー細胞株によって発現されることができる。普遍的なバイスタンダー細胞株は、天然に主要組織適合性クラスI(MHC-I)抗原及び主要組織適合性クラスII(MHC-II)抗原を欠いている細胞、又はMHC-I及びMHC-II抗原を欠くように修飾された細胞のいずれかを含む。本発明の1つの側面において、普遍的なバイスタンダー細胞株は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結されたサイトカインをコードする核酸配列を含むベクターを導入することによって修飾される。他の側面においては、同じ普遍的なバイスタンダー細胞株又は第二の普遍的なバイスタンダー細胞株は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結された少なくとも1つの追加の癌治療剤をコードする核酸配列を含むベクターを導入することによって修飾される。サイトカイン及び追加の癌治療剤をコードする核酸配列は、同じ又は異なるベクターを用いて同じ又は異なる普遍的なバイスタンダー細胞株へ導入されることができる。いくつかの場合には、バイスタンダーアプローチは、自己の又は同種異系のアプローチと組み合わせられる。例えば、サイトカインをコードする自己の、又は同種異系の又はバイスタンダー細胞株は、1つ以上の癌治療剤をコードする自己の、同種異系の又はバイスタンダー細胞株と組み合わせられることができる。サイトカイン又は癌治療剤をコードする核酸配列は、プロモーターに作動可能に連結された選択的マーカー配列をさらに含んでも含まなくてもよい。抗腫瘍免疫応答を刺激するサイトカイン及び癌治療剤の組み合わせは、本発明の実施において有用性を見出す。普遍的なバイスタンダー細胞株は、ディファインド培地、すなわち、血清を含まない、好ましくは懸濁液としての培地中で増殖することが好ましい。
【0087】
好ましい普遍的なバイスタンダー細胞株の例は、K562(ATCC CCL-243;Lozzio et al., Blood 45(3): 321-334(1975);Klein et al., Int. J. Cancer 18:421-431(1976))である。ヒトバイスタンダー細胞株の詳細な説明は、例えば、米国特許第6,464,973号及びPCT国際特許出願公開第WO9938954号中に記載されている。望ましくは、普遍的なバイスタンダー細胞株は、サイトカイン、例えばGM-CSFを200〜1000ng/106細胞/24時間の範囲内で発現する。好ましくは、普遍的なバイスタンダー細胞株は、少なくとも約200ngのGM-CSF/106細胞/24時間を発現する。
【0088】
本発明の実施において、1つ以上の普遍的なバイスタンダー細胞株が、自己の癌抗原、例えば、(普遍的なバイスタンダー細胞株組成物をともに含む)自己の腫瘍細胞とともにインキュベートされ、そして普遍的なバイスタンダー細胞株組成物が患者に投与される。普遍的なバイスタンダー細胞株組成物を患者に導入するためには、いかなる好適な投与経路も使用可能である。好ましくは、該組成物は皮下に又は腫瘍内に投与される。
【0089】
典型的には、癌抗原は、治療される癌の細胞、すなわち、自己の癌細胞によって(上に)提供される。そのような場合、組成物は放射線照射によって増殖不能とさせられ、ここで、バイスタンダー細胞及び癌細胞は組織培養プレート中に蒔かれ、上記で詳述したCs供給源を用いて室温において放射線照射される。
【0090】
ある投与におけるバイスタンダー細胞の自己の癌細胞に対する比率は、その組み合わせによって変化するであろう。GM-CSF産生バイスタンダー細胞に関しては、或る投与におけるバイスタンダー細胞の自己の癌細胞に対する比率は、少なくとも36ngのGM-CSF/106細胞/24時間が産生されるようなものでなければならない。一般に、GM-CSFの濃度がこれよりも低い場合、治療効果は低下する。GM-CSFの閾値に加えて、バイスタンダー細胞の自己の癌細胞に対する比率は1:1以下でなくてはならない。バイスタンダー細胞対腫瘍細胞又は腫瘍抗原の好適な比率は、本分野における日常的な方法を使用して決定されることができる。
【0091】
本発明の実施におけるバイスタンダー細胞株の使用は、サイトカイン発現バイスタンダー細胞株及び(同じ又は異なる細胞株によって発現された)少なくとも1つの追加の癌治療剤を、自己の癌抗原とともに癌患者に投与し、免疫調節性サイトカインのパラクリン産生を介して、腫瘍に対する有効な免疫応答を生じるという治療的利益を提供する。これは、各患者について自己の腫瘍細胞を培養しそして形質導入する必要性を取り除き、多様で非効率的な形質導入効率の問題を除去する。
【0092】
動物モデルにおける組み合わせの評価
B16F10メラノーマモデル
1つのアプローチにおいて、サイトカイン発現細胞ワクチンの組み合わせの有効性が、治療的設定において同系のB16F10メラノーマ腫瘍モデルにおける動物試験を実施することによって評価される。例えば、Griswold DP Jr., Cancer Chemother Rep 2; 3(1): 315-24, 1972及びBerkelhammer J et al., Cancer Res 42(8): 3157-63, 1982を参照のこと。マウスメラノーマ細胞株B16は、詳細に明らかにされた細胞株であって、同系のC57BL6マウスにおいて弱い免疫原性を有し、したがって、C57BL6マウスにおいて容易に腫瘍を形成する。さらに、腫瘍並びに抗原特異的な免疫応答をモニターすることのできるこのモデルにおいて、いくつかの腫瘍関連抗原が同定された。さらに、いくつかのマウス特異的試薬は商業的に入手可能であり、さまざまなワクチン戦略において腫瘍に対する免疫応答をモニターするために使用される。B16F10メラノーマ腫瘍モデルにおける典型的な研究は、統計学的に有意な結果を得るために、1群あたり少なくとも6匹、そして一般に10〜15匹のマウスを使用する。統計学的な有意性は、スチューデントのT検定を用いて評価される。
【0093】
C57BL/6マウスに放射線照射されたGM-CSF分泌B16F10腫瘍細胞を接種すると、強力で持続性、且つ特異的な抗腫瘍免疫性を刺激し、それは続いて野生型B16F10細胞でチャレンジしたほとんどのマウスにおける腫瘍の増殖を予防した。しかしながら、GM-CSF産生腫瘍細胞ワクチンが既存の腫瘍負荷を有するマウスに投与された場合、この防御の有効性はより低い。B16F10メラノーマ腫瘍モデルを用いる試験の実施においては、雌性C57BL/6マウスはTaconicから入手され、そして各実験の開始時に6〜8週齢である。典型的な実験においては、マウスは、1×105のB16BF10細胞を第0日に背側/前側の位置に皮下注射される。第3日に、マウスは、腹側/後側の位置に1〜3×106の放射線照射された(5000ラド)B16F10又はサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))を接種される。腫瘍の進行及び生存に関してマウスを追跡した。14〜21日後、マウスを屠殺し、マウスの肺を回収し、表面の腫瘍転移を計数し、そして肺重量を測定することによって、かれらの腫瘍負荷を評価した。他のB16F10メラノーマ腫瘍モデルは、B16F10腫瘍細胞の皮下注射を含む。
【0094】
B16F10メラノーマ腫瘍モデルにおける典型的なインビボの試験は、以下の群を採用する:HBSS単独(陰性対照);放射線照射されたB16F10/HBSS(対照);サイトカイン発現細胞ワクチン(GVAX(登録商標))/HBSS(細胞ワクチン単独療法対照);追加のがん治療剤又は治療(治療剤/治療単独療法対照);腫瘍抗原の供給源とともに追加の癌治療剤又は治療;サイトカイン発現細胞ワクチン+癌治療剤又は治療。
【0095】
C57BL6マウスにおける同系のB16メラノーマモデルの実験は、非形質導入B16細胞が完全に無効であった一方、GM-CSFを発現するように遺伝的に修飾されたB16細胞によって免疫性が誘発されたことを示した。GM-CSFを分泌するように操作された、放射線照射されたB16F10メラノーマ細胞のC57BL6マウスへの接種は、非形質導入B16F10でチャレンジされた大多数のマウスにおいて腫瘍の形成を予防する、強力で持続的、且つ腫瘍特異的な免疫性を刺激することが示された(予防モデル;図1A)。しかしながら、放射線照射されたGM-CSF産生腫瘍細胞が、最近確立された表皮の腫瘍を有するマウスに投与された場合(治療モデル;図1B)、防御的な抗腫瘍免疫性の有効性はより低い。動物モデル実験の結果は、GM-CSF産生腫瘍細胞が、それらがB16F10のような非免疫原性の腫瘍細胞であっても、親である非形質転換腫瘍細胞に対する免疫応答を誘発することができることを確信的に示した。
【0096】
先の実験は、HBSS又は放射線照射されたB16F10単独では、チャレンジされたマウスを腫瘍の形成から保護できないことを実証した。GM-CSF発現細胞ワクチン(GVAX(登録商標))は単独で、チャレンジされたマウスの30〜50%を保護することが示された。サイトカイン発現細胞ワクチン+少なくとも1つの追加の癌治療剤又は治療の組み合わせは、腫瘍に対する保護の有効性を増大させることが期待される。保護の程度は、追加の癌治療剤及びサイトカイン発現細胞ワクチンの発現レベル、治療(すなわち、剤の用量及び放射線照射の頻度及び強度)のレベル、並びにサイトカイン発現細胞ワクチン、例えば、GVAX(登録商標)の投与のタイミングに対する(例えば、トランスフェクトされた細胞又はたんぱく質若しくは化学物質のような)追加の癌治療剤の投与の相対的なタイミング及び経路に依存する。
【0097】
免疫学的モニタリング
腫瘍並びに抗原特異的な免疫応答をモニターすることを可能とする、いくつかの腫瘍関連抗原が同定された。例えば、腫瘍抗原特異的なT細胞は、インビトロにおける抗原再刺激に続くIFNガンマの放出によって同定されることができる(Hu, H-M. et al., Cancer Research, 2002, 62: 3914-3919)。腫瘍抗原特異的なT細胞を同定するために使用される新たな方法の他の例は、抗腫瘍免疫応答に関与することが示された特別なペプチドを負荷されることが報告された、MHCテトラマー(Beckman Coulter, Immunomics)としても知られる可溶性のMHC I分子の開発である。B16F10メラノーマ腫瘍モデル内の例は、gp100、Trp2、Trp−1及びチロシナーゼを含むがこれらに限定されない。類似するメラノーマ関連抗原がヒトにおいて同定された。そのようなツールは、臨床的に翻訳されることのできる情報を提供する。
【0098】
B16.OVAモデル
B16.ova及びB16.GM.ova腫瘍は、B16細胞又は膜に結合したオボアルブミンを発現するように修飾されたGM-CSFを発現するB16細胞である。オボアルブミンは、チャレンジに使用される腫瘍細胞上並びにワクチン細胞上の腫瘍関連抗原の代理として作用する。オボアルブミン特異的T細胞は、GM-CSF(B16.GM−ova)を単独で又は他の癌治療剤とともに発現する細胞の存在下又は非存在下において、「腫瘍特異的」T細胞応答を追跡するために使用される。オボアルブミン特異的なT細胞のT細胞受容体を特異的に認識する抗体が、これらの「腫瘍特異的」T細胞を追跡するために使用される。この抗体は、様々なワクチン接種計画に続く、これらの腫瘍特異的T細胞の増殖及びそれらの活性化状態をモニターするために使用されることができる。1つの例示的な実験的アプローチにおいては、オボアルブミン特異的T細胞を第2日に養子移植されたマウスは、B16F10.ovaで第0日にチャレンジされ、第3日にB16G10.GM-ovaを接種され、そしてタキソテレのような少なくとも1つの追加の癌治療剤(6mg/kg)で第5及び第9日に治療され、続いて、ワクチン接種後のさまざまな時点においてOVA特異的T細胞をモニターされる。
【0099】
RIP-Tag自然発症膵島細胞癌モデル
RIP-Tag自然発症膵島細胞癌モデルは、ラットインスリンプロモーター(RIP)下でシミアンウイルス40(SV-40)抗原を発現し、そして膵臓島細胞におけるSV-40癌遺伝子Aの発現の結果として島細胞癌を発生させるように、遺伝的に修飾されたトランスジェニックマウスを使用する。このモデルにおいて、腫瘍の発生はこれらのマウスにおいて13.5週にわたって起こる一連の詳細に明らかにされたステージを通じて進行する。RIP−Tagマウスは、固形癌形成の前の血管新生のスイッチを含む、多数のステップの経路において膵島細胞腺腫及び島細胞癌を発生させる。正常な島細胞の100%がTag癌遺伝子を発現するが、3〜4週齢になるまで異形成の症状を示さない。島細胞の50%の過形成細胞は、10週齢までに現れはじめる。固形癌は12〜3週後に出現し、これは、時々、高い脈管構造及び拡張した易出血性の血管に特徴を有する侵襲性の癌に発達する大きな腺腫へと進行する(Bergers G et al., Science, 1999 Apr 30:284(5415):808-12)。RIP-Tag自然発症膵臓島細胞癌モデルは、サイトカイン発現細胞ワクチンの組み合わせの有効性を評価するために使用されることができる。
【0100】
インビボモデルにおける組み合わせの有効性についてのアッセイ
腫瘍のチャレンジ後、腫瘍の負荷を様々な時点で評価した。典型的には、5日間のインビトロの細胞全体の刺激によってCTL活性について脾細胞を評価する。標的細胞は51Crで標識され、脾臓エフェクターCTLとともにインキュベートされ、そして上清への51Crの放出を標的細胞のCTL溶解の指標とする。第3日にインビトロで刺激されたCTLの上清はCTLによるIFN−ガンマ産生について試験される。すなわち、ウエルはIFN-ガンマ特異的な被覆抗体で被覆され、そして上清がウエルに加えられ、IFN-ガンマ特異的検出抗体を用いてIFN-ガンマが検出される。IFN-ガンマは、細胞特異的IFN-ガンマ産生を測定するためのフローサイトメトリーによっても検出されることができる。
【0101】
有効な抗腫瘍免疫応答の他の指標は、インビトロでの再刺激によるTNF-アルファ、IL-2、及びIFN-ガンマのようなエフェクターサイトカインの産生である。サイトカインレベルは、放射線照射されたGM-CSF発現細胞によってインビトロで48時間再刺激された脾細胞又は流入リンパ節(dLN)細胞からの上清中で測定された。
【0102】
腫瘍特異的T細胞応答をモニターするために使用されるさらなる方法は、細胞内サイトカイン染色(ICS)を介する。ICSは、腫瘍特異的T細胞応答をモニターするため、及び抗原特異的T細胞の非常に低い出現頻度を確認するために使用されることができる。しばしば2〜7日間のインビトロ刺激を必要とするCTL及びサイトカイン放出アッセイとは異なり、ICSは新たに単離された、切除後5時間以内のリンパ細胞において実施されるため、それはインビボにおける腫瘍抗原特異的T細胞の出現頻度を推定するために使用されることができる。これは、異なる腫瘍ワクチン戦略の効力を比較するための強力な技術を提供する。ICSは、多様なメラノーマワクチン戦略に続いて、gp100及びTrp2のようなメラノーマ関連抗原へのT細胞応答をモニターするために使用されてきた。そのようなT細胞は、MHC-Iに結合した腫瘍特異的ペプチドによる刺激に続く、細胞内IFN-ガンマ発現の誘発によって確認されることができる。
【0103】
腫瘍モデルのXenogenイメージング
いくつかの研究において、腫瘍を有するマウスのインビボでのルミネッセンスがB16F10−ルシフェラーゼ(Xenogen Inc.)を注射されたマウスをモニタリングすることによってモニターされる。すなわち、Balb/c nu/nuマウスが、5×104又は2×105個のB16F10−luc細胞を第0日に尾静脈を介して注射される。過剰のルシフェリン基質を1.5mg/gマウス体重で腹腔内注射することによって、マウスは必要に応じて腫瘍の負荷についてモニターされる。典型的な分析においては、基質の注射の20分後、マウスは麻酔され、そしてXenogenIVISイメージングシステム(Xenogen Inc.)ルミネッセンス感受性CCDカメラによってインビボのルミネッセンスについて背側又は腹側位置でモニターされる。データが集められ、そしてLiving Image 2.11 ソフトウエアによって分析される。
【0104】
サイトカイン発現細胞ワクチンの組み合わせ
本発明は、サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+少なくとも1つの追加の癌治療剤又は治療の組み合わせを目的とする。上記剤又は治療は、化学療法剤、癌抗原に対する免疫応答を調節する剤、放射線照射などであることができる。本発明の例示的な実施態様は、サイトカイン発現細胞ワクチン+1つ以上の以下の:抗CTLA-4モノクローナル抗体;抗4-1BBmAb;抗-CD40又は膜/可溶性CD40L;インターフェロンアルファ(IFN-アルファ);IL-2又はIL-18;HSP(熱ショックタンパク質);CpG(細菌DNAを擬態するジヌクレオチド);抗-OX-40又は可溶性/膜結合OX-40リガンド;COX-2阻害剤;イレッサ;イミキモド;ジュバイミュン(Juvaimmune);抗-上皮細胞成長因子R(EGF-R);抗VEGF R又はTRAILを含むが、これらに限られない。例示的な組み合わせは、以下においてさらに詳述される。
【0105】
サイトカイン発現細胞ワクチンと組み合わせられる共刺激分子
自然の免疫応答においては、MHCクラスII分子によって樹状細胞(DC)上に提示されるペプチド抗原と反応性であるCD4+ヘルパーT(Th)細胞は、CD8+CTL免疫の誘発に必要とされるDCの成熟を推進することができる。CTL応答の適切な誘発、拡大及び維持は、CD4+T細胞、DC及びCD8+T細胞の間の相互作用を通じて達成される。そのメカニズムが本発明の部分ではない一方、細胞はDCにより発現されたCD40と相互作用してDCを成熟させるCD40Lのアップレギュレーションを通じてかなりの程度まで機能する。成熟した又は活性化されたDCによって発現されるCD80/CD86は、CD8+T細胞上のCD28共刺激性受容体と相互作用することによってCTL誘発をもたらすことができる。CTLの維持及び完全な拡大のためには、DCにより発現された4-1BBリガンドとCTL上のその受容体4-1BBとの相互作用も重要である。DCの活性化は、例えば、アゴニストである抗CD40抗体或いはLPS(TLR4リガンド)又はオリゴデオキシヌクレオチドを含むCpG-モチーフ(TLR9リガンド)のようなトル様受容体(TLR)のリガンドによって引き起こされることができる。
【0106】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+抗CTLA-4モノクローナル抗体
休止期のT細胞上に低レベルで発現され、T細胞活性化によって誘導されるCTLA4分子は、IL-2産生、IL-2R発現をブロックするネガティブシグナルをT細胞へ伝達し、そして細胞周期の停止を誘発する。CTLA4は、CD28を介する及びCD28を介さないT細胞の活性化の両方を制御し、正常な免疫の恒常性において重要な役割を有する(Bour-Jordan et al., Nature Immunol. 4: 182-188, 2003)。動物モデルにおいては、抗CTLA-4抗体は、免疫原性の腫瘍における腫瘍拒絶を誘発し、抗腫瘍抗体接種と併用することによって最小限に免疫原性の腫瘍の拒絶も誘発することができる。臨床試験は、転移性メラノーマ及びホルモン治療抵抗性前立腺がん(HRPC)の患者の治療のための、ヒトCTLA−4に結合する完全なヒト抗体を用いて開始された。
【0107】
先の報告は、抗CTLA‐4モノクローナル抗体(抗‐CTLA4mAb)又はGM-CSF分泌腫瘍細胞ワクチンのどちらかがB16メラノーマのような非免疫原性腫瘍のための単独療法として使用された場合、マウスの部分的な保護しか提供できないことを示している。本明細書中に示された結果は、GM-CSF分泌B16腫瘍細胞及び抗CTLA‐4の組み合わせが相乗的に作用し、防御性の高い抗腫瘍免疫応答を生じることを実証している。臨床試験においてこれら2つの剤の最大の相乗効果を達成するためには、前臨床試験において可能な治療計画を注意深く評価することが必要である。現在進行中の臨床試験において、GM-CSF分泌腫瘍細胞ワクチン(GVAX(登録商標))又はヒト抗CTLA4mAbは、数ヶ月にわたって繰り返し患者に投与される。本明細書中に記載された試験においては、組み合わせの有効性が、抗CTLA‐4mAb及びGM-CSF分泌腫瘍細胞ワクチンの両方の繰り返し投与に続く前臨床試験において評価された。実施例1は、B7/CTLA-4相互作用をブロックする、ハムスター抗マウス抗CTLA4(9H10)抗体及びマウス抗マウス抗CTLA-4mAb(9D9)が、サイトカイン発現細胞ワクチン(GM-CSF分泌B16F10腫瘍細胞;B16‐GM)を接種されるか又はされないB16メラノーマ腫瘍モデルにおいてテストされた結果を詳解する(図2A)。マウスにおける最初の前臨床試験は、ハムスター抗マウス抗CTLA4(9H10)抗体を使用し、この試験では、抗ハムスター抗体の発生により、抗CTLA4mAbの繰り返し投与を除外した。したがって、マウス抗マウス抗CTLA-4mAb、9D9が産生された。9D9抗CTLA4mAbは、B16F10腫瘍チャレンジからC57Bl/6マウスを防御する単独療法としては有効でなかった。対照的に、B16‐GM+抗CTLA4抗体、9D9で治療したマウスの80%は防御され、9D9が生理活性を有することを実証し、さらに、抗CTLA‐4及び(GVAX(登録商標)のような)GM-CSF分泌腫瘍細胞ワクチンが有効な抗癌併用療法であるという概念を支持している(図2B〜2E)。
【0108】
これらの結果は、本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が抗CTLA‐抗体とともに癌患者に投与されることができ、結果としていずれかの単独療法に比べても治療的有効性が亢進し、そして生存が延長されることを実証している。
【0109】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+抗4-1BBmAb
4-1BBとしても知られるCD137は、TNFRスーパーファミリーの一員(Kwon BS et al., Cell Immunol. 121(2):414-22, 1989;Kwon BS et al., Proc Natl Acad Sci USA. 86(6):1963-7,1989)である。CD137は、TCR複合体を介する活性化のおよそ4〜6日後に、活性化されたT細胞上にモノマー、ダイマー、及びテトラマーとして発現される。CD137とそのリガンドである4-1BBLとの相互作用は、増殖、IFN-gを含むサイトカインの産生、CTLの発生及び活性化後細胞死(AICD)の阻害へ導く共刺激シグナルを送達することが報告されている。4-1BBは、活性化されたT細胞上に、活性化の2〜3日後を発現のピークとして発現される。4-1BBのためのリガンド(4-1BBL)は、活性化されたAPC上に発現される。いくつかの研究が、抗4-1BBモノクローナル抗体の投与がCTL応答を増加させ及び/又はインビボにおいて確立された腫瘍を根絶することができることを実証した。Shuford et al. J. Exp. Med.;1997及びMelero et al., Nature medicine:1997を参照のこと。
【0110】
4-1BBリガンドは米国特許第5,674,704号に記載され;4-1BBリガンドポリペプチド及び4-1BBリガンドに結合する細胞表面受容体は米国特許第6,355,779号に記載され;4-1BBの細胞外ドメインに特異的に結合するモノクローナル抗体(mAb)は、米国特許第6,210,669号及び同第5,928,893号に記載され;ヒト4-1BBに特異的なヒト化抗体は米国特許第6,458,934号に記載され;そして、4-1BBに結合するアゴニストのmAbを投与することによりT細胞の増殖を促進する方法は、米国特許第6,303,121号に記載され、それぞれは参考文献として特別に本明細書中に援用されている。
【0111】
実施例2で詳解されているとおり、サイトカイン発現細胞ワクチン/4-1BBの組み合わせが、B16F10腫瘍モデルにおいて評価され、そして結果は、チャレンジ後の80日まで、上記組み合わせが腫瘍を有さないマウスの数(図4A)及び生存(図4B)を両方とも増加させたことを示す。これらの結果は、本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、抗4-1BB抗体とともに癌患者に投与され、結果としていずれの単独療法に比べても治療的有効性が亢進されたことを実証している。
【0112】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+1つ以上の追加のサイトカイン
本発明の1つの側面において、癌の治療のために、サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が少なくとも1つの追加のサイトカインとともに患者に投与される。例示的なサイトカインは、IL-2〜IL-29、r‐IFN、TNF‐アルファ、CD2、MIP3a及びICAMを含むがこれらに限られない。
【0113】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+インターフェロン‐アルファ
インターフェロンは、ウイルス感染を妨害する因子として1957年に同定された。タイプI(IFN‐α及びIFN‐β)は、ウイルス感染の初期相の間に産生される。タイプIIは(IFN‐γ)は、細胞免疫応答の発生に重要である。IFN‐アルファは、細胞毒性効果(アポトーシス)を介して腫瘍細胞に対して直接的な抗増殖効果を有することが示された。IFN‐アルファは、微小環境を変化させることによって抗原特異的免疫を調節することが知られており、それはTh1リンパ細胞の増殖に有利である。IFN‐αは、クローン増殖及びCD8+T細胞の生存を促進することによって、CTLの生成にとって重要である。
【0114】
IFN‐アルファは、リンパ腫、(ヘアリーセル)白血病、カポシ肉腫、及びメラノーマの臨床的治療に関して承認されている。IFN-アルファの癌治療における有効性は、免疫に依存する及び依存しないメカニズムの両方により生じる。例えば、IFN-アルファは、MHCクラスI分子のアップレギュレーション及び樹状細胞の活性化/分化の促進を含む免疫調節効果をあらわすことがインビトロで示された。さらに、IFN‐アルファは、Th1リンパ細胞及び腫瘍抗原特異的CTLの発生を促進し、そして、インビトロ及びインビボの両方において活性化CD8+T細胞のための生存因子として作用する。免疫に依存しない過程は、抗増殖活性及び/又はアポトーシス促進活性を含むことができる。これらの性質のすべては、有効な抗腫瘍応答の発生のために決定的であろう。
【0115】
腫瘍の血管新生を標的とする治療戦略は、癌治療の強力な選択肢として最近出現した。臨床的証拠は、IFN-アルファが、抗血管新生過程によって腫瘍の増殖を阻害することもできることを示唆する。IFN-アルファ及びGM-CSF分泌腫瘍細胞ワクチンの組み合わせが、(実施例3に記載のとおりに)B16F10メラノーママウスモデルにおいて調査された。
【0116】
サイトカイン発現細胞ワクチン(GM-CSF分泌B16F10腫瘍細胞:B16-GM)とIFN-αの組み合わせの効果を調査するために試験が行われた。単独療法として与えられた組換えマウスIFN-α(rmIFN‐アルファ)は、腫瘍チャレンジ部位に皮下投与された場合、16F10腫瘍細胞でチャレンジされたマウスの30%までを保護したが、離れた部位に投与した場合には保護しなかった。同様に、B16‐GM単独を受容した動物の30〜40%は、チャレンジ後も腫瘍を有さなかった。対照的に、IFN‐アルファ及びB16.GMの組み合わせの投与では、70〜80%が腫瘍を有さず、生存した(実施例3)。さらに、IFN‐アルファは、接種部位に投与されることもでき、ワクチンの効力を10%(ワクチンのみ)から50〜60%(ワクチン+IFN‐アルファ)まで増加させた。まとめると、上記結果は、GM-CSF分泌細胞ワクチンと組み合わせられたIFN‐アルファは、B16F10モデルにおける腫瘍の増殖を顕著に遅らせることができることを実証しており、上記組み合わせが癌の治療のための有効な戦略を代表することを示唆している。
【0117】
本発明の1つの好ましい実施態様においては、追加の癌治療剤は、GM-CSF発現細胞ワクチンとともに投与されるインターフェロン‐アルファである。本発明の実施においては、インターフェロン‐アルファは、タンパク質の形態或いは自己の、同種異系の、又はバイスタンダーインターフェロン‐アルファ発現細胞株の形態で投与されることができる。
【0118】
サイトカイン発現性細胞ワクチン(例えば、GVAX(登録商標))+IL-2
先の研究は、IL-2をコードする遺伝子の腫瘍細胞へのトランスフェクションが、腫瘍に対するMHCクラスI拘束性細胞溶解性Tリンパ細胞(CTL)応答をインビボで刺激することを示し、それは、IL-2がインビボで腫瘍に対する免疫応答性を亢進する役割を果たすことができることを示唆する(Frost et al., PCT国際特許出願公開第WO92/05262号;Fearon et al., Cell 1990 Feb 9;60(3):397-403)。本発明の実施において使用するための例示的なIL-2配列は、例えば、本明細書中に参考文献として特別に援用されている、GenBank 受入番号 NMIL04, NM 000586において見出されることができる。本明細書中に参考文献として特別に援用されているPCT国際特許出願公開第WO00/72686号に記載のとおり、B16メラノーマモデルにおける先の研究は、IL-2及びGM-CSFを両方とも発現する細胞が、全身的な免疫性を生じ、そして生存を促進することを示した。
【0119】
サイトカイン発現細胞ワクチン/IL-2の組み合わせの有効性は、(例えば、PCT国際特許出願公開第WO00/72686号に記載のとおり)B16F10腫瘍モデルにおいて先に評価された。本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、IL-2タンパク質とともに、或いは、自己の、同種異系の、又はバイスタンダーIL-2発現細胞株とともに癌患者に投与される。
【0120】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+化学療法剤
本発明の実施態様は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の伝統的癌治療剤の組み合わせの投与を含む。本発明の実施において使用される伝統的な癌治療剤は、表1A及び1Bに列挙されたものを含む。これらは、主要な癌治療剤の各クラスからの剤を含み、以下の:アルキル化剤、アルカロイド、抗代謝剤、抗腫瘍性抗生物質、ニトロソ尿素、ホルモンアゴニスト/アンタゴニスト及びアナログ、免疫調節剤、光増感剤、酵素などを含むがこれらに限られない。
【0121】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+ドセタキセル(タキソテレ(商標))
ドセタキセルは、乳癌、前立腺癌、卵巣癌及び他の固形癌に対して治療的有効性を示した半合成のタキサンである。ドセタキセルの殺腫瘍活性は、主にその微小管脱重合をブロックし、したがってG2-M停止及びアポトーシスを誘発する能力に起因する。しかしながら、増加する証拠は、ドセタキセルがマクロファージ及びリンホカインにより活性化されたキラー活性の増強並びに前炎症性サイトカインの産生などの免疫調節活性も有することを示唆する。これらの性質は、ドセタキセルを他の癌免疫療法と組み合わせる興味深い化学療法剤とする。当業者は、パクリタキセル(タキソール(商標))が、ドセタキセル(タキソテレ(商標))の代わりに使用されることができることを理解するであろう。
【0122】
ドセタキセル及びGM-CSF分泌B16F10腫瘍細胞(B16-GM)ワクチンの組み合わせが、B16メラノーマモデルにおいて評価された(実施例4)。要約すると、結果は、GM-CSF分泌細胞ワクチンと組み合わせられたドセタキセルが、B16F10モデルにおける腫瘍の増殖を顕著に遅らせ、この組み合わせが癌の化学療法及び免疫療法を組み合わせるための新たな戦略を代表することを示唆している。本発明の実施においては、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、ドセタキセルとともに癌患者に投与される。
【0123】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+COX-2阻害剤
(PGHシンターゼ又はプロスタグランジンエンドパーオキサイドシンターゼとしても知られる)シクロオキシゲナーゼ(COX)は、プロスタグランジン(PG)の生合成を触媒する主要酵素である。酵素COX-1及びCOX-2の2つの異なるアイソフォームを発現する2つの遺伝子があり、類似のタンパク質一次構造(60%相同)を有し、そして本質的に同じ反応を触媒する。プロスタグランジンは、腎機能、血管運動の緊張、血小板凝集、及び血液凝固、免疫細胞の分化、傷の治癒、神経の成長、骨代謝、排卵、並びに分娩の開始のような多岐にわたる正常の過程に関与する。COX-2は、主に炎症細胞及び免疫細胞(好中球、マクロファージ、マスト細胞など)中で主に見出される誘導性アイソフォームである。前炎症性サイトカイン及び成長因子がCOX-2を誘導し、これは、COX-2が炎症及び細胞増殖の制御において重要な役割を果たすことを示唆する。COX-2は、ヒト結腸癌細胞中で強力に発現され、おそらく腫瘍細胞のアポトーシス(プログラムされた細胞死)を引き起こすことによって結腸腫瘍の進行を遅らせると考えられる。例えば、Vane JR et al., Annu Rev Pharmacol Toxicol, 1998, 38;, 97-120;Cryer B and Feldman M., Am J Med, 1998 May, 104:5, 413-21; S. Dubinett et al., Clinical Cancer Research; 2003;及びU. Yamashita et al., J. Immunology; 2000を参照のこと。疫学試験並びに初期の臨床試験も、COX-2阻害剤の投与が癌の発生のリスクを低下させることができることを示唆する。今日まで、FDAは、患者における家族性大腸ポリープ症(FAP)の治療のための選択的COX-2阻害剤、セレコキシブ(CELEBREX(登録商標))の使用を許可してきた。さらに、多くのネズミモデルは、COX-2阻害剤が多くの異なる腫瘍において腫瘍の形成を減少させることを実証した。COX-2阻害剤は、腫瘍の血管新生を阻害することによって腫瘍の形成を減少させることができる。マウスCOX-1は、ヒトCOX-1に対して92%相同であり、マウスCOX-2はヒトCOX-2に対して91%相同である。
【0124】
サイトカイン発現細胞ワクチン+選択的COX-2阻害剤がワクチン接種又は剤のいずれか単独よりもより大きな保護に導いたか否かを試験するために、B16F10モデルにおいて、COX-2阻害剤であるセレブレックス(Celebrex)とB16-GMの組み合わせが評価された(実施例5)。予備的な結果は、セレブレックスのみではB16F10腫瘍のサイズ及び全生存期間に対して単独の剤として効果を及ぼさないことを示している。しかしながら、GM-CSF発現細胞ワクチンと組み合わせた場合、生存数及び腫瘍を有さない動物の数における顕著な増加が観察された(図9A及びB)。結果は、有効性のためにはサイトカイン発現細胞ワクチンの接種前にCOX-2阻害剤が投与されなくてはならないことを示している。B16F10モデルにおいては、セレブレックスが接種の少なくとも3日前までに投与された場合には有効性は最大であったが、セレブレックスが接種の日に投与された場合には増強は観察されなかった。さらなる試験においては、データは単独療法としてのセレブレックスはCT26腫瘍のサイズ及びBALB/Cマウスの全生存期間に対して顕著な効果を有することも実証している(実施例5)。
【0125】
結果は、サイトカイン発現細胞ワクチン(すなわち、GVAX(登録商標))及びCOX-2阻害剤の組み合わせが、個々の剤による治療よりも全体としてのより大きな保護に導くことを示唆している。本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチンがCOX-2阻害剤とともに使用される。
【0126】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+抗CD-40又は膜/可溶性CD40L
CD40LはCD40に結合する。CD40はB細胞及び樹状細胞上で発現される。CD40は、B細胞の増殖、B細胞分化及びB細胞の生存において中心的役割を果たす。CD40を介する情報伝達は、FASにより誘発されたアポトーシスからB細胞を救済する。それはまた、Igアイソタイプスイッチングを受けさせ、そしてCD80(B7又はB7.1)を発現するようにB細胞を誘導する。特定の樹状細胞(DC)を含む抗原提示細胞(APC)は、共刺激シグナル及び細胞の免疫応答の発生に関与するサイトカインを提供することによって、直接的なT細胞の活性化及び分化に中心的役割を果たす。線維芽細胞、内皮細胞、T細胞及びマクロファージによって産生されるサイトカインである、顆粒球マクロファージコロニー刺激因子(GM-CSF)は、DCのプロセッシング及び抗原提示機能を活性化する。GM-CSF(B16-GM)を発現するように形質導入された、放射線照射されたB16F10メラノーマ細胞は、最近確立された皮下のB16F10腫瘍に対する防御免疫を部分的に獲得した。膜結合CD40リガンド(CD40L)及び抗CD40モノクローナル抗体は、DCを活性化することが示された。腫瘍壊死因子受容体(TNF-R)ファミリーの一員であるCD40は、B細胞、DC、及び活性化された単球を含む抗原提示細胞(APC)上に発現された表面受容体である。CD40のための自然のリガンドはCD40Lである。CD40LはCD40を発現するB細胞及びDCの抗原提示機能を亢進し、その結果、エフェクターT細胞の発生に決定的な役割を果たすIL-12が産生される。
【0127】
実施例6は、抗CD40又は膜結合型CD40リガンド(CD40L)とサイトカイン発現細胞ワクチンの組み合わせを評価するためのインビボの試験を詳解する(図10及び11)。実験結果は、CD40Lを発現するようにアデノウイルスによって形質導入されたB16F10細胞がB16-GMと併用して与えられ、B16-GMの接種の4日後に投与された場合、B16F10メラノーマでチャレンジされたマウスの生存期間を顕著に増加させたことを示す。B16-GMと同日に投与されたCD40Lは、病気を悪化させることが示された。B16-GM及び抗CD-40の組み合わせの有効性をさらに実証するために、接種後の異なる時点で投与された抗CD40モノクローナル抗体で動物が治療された。CD40Lについて得られた結果と類似して、接種との関係における抗CD40投与のタイミングは、有効性にとって決定的なものであった。データは、DCを標的とすることは、GM-CSF分泌細胞ワクチンによる接種の効力を増加させることができることを示している。
【0128】
(実施例6においてさらに説明されるように)サイトカイン発現細胞ワクチン/CD40L及び抗CD40の組み合わせの有効性が、B16F10腫瘍モデルにおいて評価された。本発明の実施においては、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、自己の、同種異系の又はバイスタンダー細胞によって発現された抗CD40抗体又はCD40リガンドとともに癌患者に投与され、その結果、いずれの単独療法に比べても治療的有効性が亢進された。
【0129】
サイトカイン発現細胞ワクチン(例えば、GVAX)+抗OX40mAb又は膜/可溶性OX40L
TNFRスーパーファミリーの一員であるOX40(CD134)は、活性化されたCD4+T細胞上に発現される。CD4T細胞表面上の架橋OX40は、有糸分裂を促進する濃度未満のCon A、抗CD3、PHA及びPMAまでT細胞の増殖を促進する、強力な共刺激シグナルを発生させる。抗原特異的T細胞応答もOX40を介する共刺激によって促進されることができる。インビボでのOX40の関与は、スーパー抗原又は可溶性タンパク質抗原に対する応答であるそれらの増殖後に起こる末梢でのCD4+T細胞の除去を阻害し、そしてOX40ノックアウトマウスはインビボでの免疫化に続いて正常レベルの抗原特異的記憶T細胞を産生することができない。したがって、OX40の関与は、インビボでの免疫化に続く記憶T細胞の発生及び維持に重要であるらしい。GM-CSFを産生する腫瘍細胞及びOX40受容体(OX40R)を介する刺激の組み合わせは、個々による治療よりも、癌に対する亢進された治療効果を提供するはずである。
【0130】
サイトカイン発現細胞ワクチン/OX40L又は抗OX40の組み合わせの臨床的有効性を最適化するためには、(実施例7及びGri, G. et al., J. Immunol. 2003, Jan 1; 170(1):99-106にさらに記載されるように)同系の腫瘍モデルにおいて、多くの治療計画が評価される。本発明の実施においては、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、抗OX40抗体と組み合わせて、或いは自己の、同種異系の、又はバイスタンダーOX40L-発現細胞株として癌患者に投与される。
【0131】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+抗血管新生剤
腫瘍の発生には、新たな血管の形成を活性化する、「腫瘍血管新生因子」と呼ばれる可溶性のメディエーターが必要であることは一般に受け入れられている。血管内皮細胞成長因子(VEGF)及び新たなプロテアーゼの発見は、腫瘍血管新生に関与する化合物の同定に導き、そして、抗血管新生化合物の使用を含む新たな治療的戦略の設計を可能とした。
【0132】
1つの側面において、本発明は、抗血管新生化合物を含む、サイトカイン発現細胞ワクチンの組み合わせを提供する。好ましい抗血管新生化合物は、エンドスタチン、アンギオスタチン、血小板因子‐4、プロラクチンの16-kD断片、sFlt-1(fms様チロシンキナーゼ1受容体の可溶性断片)、sKDR(キナーゼ挿入ドメイン受容体の可溶性断片)、VEGF-Trap(VEGF受容体1及びVEGF受容体2からのドメインからなるハイブリッド可溶性受容体)、sVEGFR3(VEGFRの可溶性細胞外形態)、抗上皮細胞成長因子R(EGF-R)、TRAIL(腫瘍壊死因子関連アポトーシス誘導リガンド)、トロンボスポンディン、インターフェロンアルファ及び色素上皮由来因子(PEDF)、並びにこれらの化合物の発現/産生に導く情報伝達経路に関与する因子を含む。
【0133】
本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、タンパク質の形態で送達される抗血管新生剤とともに、或いは自己の、同種異系の、又はバイスタンダー抗血管新生剤発現細胞株として癌患者に投与される。
【0134】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+HSP(熱ショックタンパク質)
最近の証拠は、熱ショックタンパク質(HSP)が、交差提示と呼ばれるメカニズムを通してMHC I分子上に提示されることのできる自己ペプチドの広い配列に関連することを示唆する。さらに、HSPは前炎症性サイトカインを刺激する特異的受容体相互作用及び共刺激分子のアップレギュレーションを通して専門のAPCを活性化することができる。その結果、腫瘍由来のHSPは、腫瘍特異的免疫応答を強力に刺激する。
【0135】
サイトカイン発現細胞ワクチン/HSPの組み合わせの有効性が(実施例8に記載されたように)B16F10腫瘍モデルにおいて評価された。本発明の実施において使用される例示的HSP配列は、例えば、本明細書に参考文献として特別に援用されている、GenBank受入番号No.AX194370号において見出されることができる。
【0136】
本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、HSPと組み合わせて、或いは自己の、同種異系の、又はバイスタンダーHSP発現細胞株として癌患者に投与される。
【0137】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+CpG
哺乳動物のDNAは低い頻度でCGを含み、そして存在する場合でさえ、シトシンの5位がメチル化されているため、哺乳動物の免疫系によって認識されない。対照的に、細菌DNAは、脊椎動物の免疫系によって認識される非メチル化CG-ジヌクレオチドを多数含む。CpG ODNは、自然免疫応答及び適応免疫応答の両方の機能を亢進する強力な免疫刺激性の性質をあらわすことが示された。細菌DNA及び多くのウイルスDNA中にごく普通にある非メチル化シトシン-ホスホロチオエート-グアニン(CpG)モチーフは、B細胞、DC、単球、及びNK細胞を活性化して強力なアジュバント効果を有する多様なサイトカインを産生する。CpGオリゴは、Th1サイトカイン産生、樹状細胞及びマクロファージなどの抗原提示細胞の活性化の刺激の促進を容易化し、そしてIFN-アルファ産生の増加を誘発し、それによって多様な抗癌免疫効果を促進することが知られている。腫瘍特異的CTL及びThエピトープの両方を含む35アミノ酸長の合成ペプチドとCpGアジュバントの組み合わせは、ヒトパピローマウイルスにより引きおこされるマウス腫瘍に対する治療的免疫性を誘発することができる有効性の高いワクチン製剤であることが証明された(Kim et al., Cancer Res. 62(24):7234-40. 2002)。
【0138】
サイトカイン発現細胞ワクチン+CpGがいずれか一方の剤単独による接種よりも大きな防御に導くか否かを試験するためにB16F10モデルにおいて、合成されたCpGモチーフがB16-GMとの組み合わせで評価された。予備的な結果は、IP投与されたあるCpGがGM-CSFで抗原刺激されたT細胞の効果を亢進することができ、そして、B16-GM接種の前に投与されたあるCpGは、接種後に投与された場合よりもより大きな相乗的効果を有することを示している。
【0139】
結果は、サイトカイン発現細胞ワクチン(すなわち、GVAX(登録商標))及びCpGの組み合わせが、個々の治療よりもより大きな全体的防御に導きうることを示唆している。本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、CpGジヌクレオチドと組み合わせて癌患者に投与される。
【0140】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+ジュバイミュン(Juvaimmune)
陽イオン性脂質-DNA複合体(JuvImmune)は、免疫活性化及びインターフェロン放出の強力な引き金である。JuvImmune によって誘発された免疫応答は、マウス、ラット、ウサギ、ネコ、イヌ、ヤギ、及びサルを含む多様な哺乳動物において上手く実証された。病気に特異的な抗原を含むか又は含まない、脂質及び非コードDNAの相乗的な組み合わせは、強力な免疫刺激を提供し、これが実質的なTh1を介する応答(IFN-アルファ、IFN-ガンマ及びIL-12の産生)を活性化する。GVAX(登録商標)などのサイトカイン発現細胞ワクチン及びJuvImmuneは、癌の治療において有用性を見出す。
【0141】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+イミキモド
3Mファーマシューティカルズによって開発された新規合成分子であるイミキモドは、樹状細胞(DC)及びマクロファージの機能を調節する最良の薬理学的作用物質の一つである。イミキモドは性器いぼの局所療法として評価され、そして基底細胞癌の局所療法としても臨床試験において有効性が示された。イミキモドは、DC、マクロファージ、及び他の細胞による免疫応答を、トル様受容体7(TLR-7)の結合を介して活性化することによって調節し、そしてIFN-アルファ、IL-1、IL-6、IL-8、IL-10、IL-12、TNF-アルファ及びGM-CSFを含むサイトカインの合成を誘導することが示されている。イミキモド及びGVAX(登録商標)のようなサイトカイン発現細胞ワクチンの組み合わせは、癌の治療において有用性を見出すことができる。
【0142】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+イレッサ
イレッサは非小細胞肺癌(NSCLC)の患者のための第3段階の化学療法として臨床的に認められている。それは、増殖、血管新生、転移及びアポトーシスに対する抵抗性に関与する下流へのシグナル伝達を妨害し、それにより細胞死へ導く、EGF受容体TKの細胞内リン酸化を阻害する低分子である。イレッサの抗血管新生活性は、腫瘍の成長を遅くし/阻害し、それはサイトカイン発現細胞ワクチンにより誘発された腫瘍特異的免疫応答が残りの腫瘍を破壊することを可能とするであろう。イレッサ及びGVAX(登録商標)などのサイトカイン発現細胞ワクチンは癌の治療において有用性を見出すことができる。
【0143】
サイトカイン発現細胞ワクチンの患者への送達
本発明は癌の治療方法を提供し、ここで、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療が癌患者に投与される。望ましくは、該方法は癌に対する全身性の免疫応答、すなわち、T細胞応答及び/又はB細胞応答を起こさせる。
【0144】
本明細書中に記載された方法の好ましい側面においては、サイトカイン発現細胞ワクチンの組み合わせが癌患者に投与され、ここで、サイトカイン発現細胞ワクチンは、哺乳動物、好ましくはヒトの腫瘍細胞を含み、そしてサイトカイン発現細胞ワクチン中の細胞は、放射線照射などによって増殖不能とされる。サイトカイン発現細胞ワクチンの組み合わせの投与は、サイトカイン発現細胞ワクチン又は癌治療剤又は治療である上記組み合わせの構成成分単独の投与後の同じ癌に対する免疫応答に比べて癌への亢進した免疫応答を生じる。言い換えれば、上記のサイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療の併用投与は、サイトカイン発現細胞ワクチン単独の投与或いは癌治療剤又は治療の単独投与に比べて亢進した治療的有効性を生じる。
【0145】
サイトカイン発現細胞ワクチンの組み合わせは、いかなる好適な経路によって投与されてもよい。好ましくは、該組み合わせは皮下又は腫瘍内に投与される。局所的又は全身的送達は、筋肉内、静脈内、門脈内、肝臓内、腹腔内、皮下、又は皮内投与を含む非経口的導入による該組み合わせの体腔内への投与を含む投与によって達成されることができる。腫瘍が中枢神経系内にある場合には、流入領域リンパ節中の未処置のT細胞を免疫刺激するために、組成物は末梢に投与される。活性化された腫瘍特異的T細胞は、中枢神経系内のそれらの標的を発見するために、血液/脳関門を通ることができる。
【0146】
1つの例示的な好ましい実施態様においては、サイトカイン発現細胞ワクチンはGVAX(登録商標)であり、ここで、発現されるサイトカインはGM-CSFであり、そして少なくとも1つの追加の癌治療剤又は治療は、CTLA4に対する抗体;4-1BBに対する抗体;インターフェロンアルファ; COX-2阻害剤;IL-2又はIL-18;ドセタキセル;CD40に対する抗体又は膜結合/可溶性CD40リガンド;OX-40に対する抗体又は可溶性/膜結合OX-40リガンド;HSP(熱ショックタンパク質);CpGジヌクレオチド;イレッサ;イミキモド;ジュバイミュン(Juvaimmune);抗-上皮細胞成長因子R(EGF-R);抗VEGF R;VEGF-トラップ又はTRAILからなる群から選ばれる。
【0147】
当業者に理解されるであろうとおり、最適な治療計画は変化するであろう。結果として、有効性を高めるために各成分の用量及び投与の相対的なタイミングが最適化されるべきか又は投与の追加のサイクルが処方されるかを決定するために、癌患者の状態並びにサイトカイン発現細胞ワクチンの組み合わせの投与の前、その間、及びその後での患者の一般的健康状態について患者が評価されることは理解されるであろう。そのような評価は、典型的には、以下の「モニタリング方法」と題したセクションにおいてさらに記載されるような、伝統的な癌化学療法を評価するために当業者によって採用される試験を用いて実施される。
【0148】
追加の癌治療剤又は治療に依存して、サイトカイン発現細胞ワクチンは追加の癌治療剤又は治療の投与の前、それと同時に、又はその後で患者に投与される。例えば、抗CD40抗体又はCD40Lの場合、GM-CSF発現細胞ワクチンは、抗CD40抗体又はCD40Lの投与の前に患者に投与される。
【0149】
化学療法剤の送達
本発明のいくつかの側面においては、サイトカイン発現細胞ワクチンの組み合わせは化学療法剤を含む。本発明のこの側面において重要な考慮点は、薬剤として許容可能な担体中での癌治療剤の有効な送達である。
【0150】
本発明のこの側面により、癌治療剤(すなわち、化学療法剤)並びに対応する送達経路及びタイミングの選択は、以下のうちの1つ以上の点で有利である:(i)治療される特別なタイプの癌の治療における確立された使用;(ii)選択された剤の、サイトカイン発現細胞ワクチンとともに投与された場合に改善された治療結果を生じる可能性;及び(iii)癌細胞への十分に局在化された剤の露出を達成するのに有効な投与様式による剤の送達。
【0151】
典型的には、癌治療剤は癌療法において確立された用途を有する経路及び治療計画を用いて投与される。上記のとおり、最適経路は癌治療剤によって異なる。局所的又は全身的な送達は、エアロゾルの吸入又はガス注入、或いは、筋肉内、静脈内、門脈内、肝臓内、腹腔内、皮下、又は皮内投与を含む腸管外導入によって体腔内へ投与されることによって達成されることができる。しかしながら、好ましい経路は典型的に、遅い静脈内輸注(IVドリップ)、経口投与及び局所的な注射を含む。腫瘍が中枢神経系内にある場合、組成物はいかなる経路を介しても末梢中へ投与されなくてはならない。注射可能な溶液、薬物放出カプセル、インプラントなどの多様な剤型として又はリポソーム若しくはマイクロカプセルのような担体とともに容易に投与される。
【0152】
腸管外投与は、緩衝化された好適な水溶液及び食塩水又はグルコースを使用する等張な形態で調製された希釈液を用いて達成される。そのような水溶液は静脈内、筋肉内、皮下及び腹腔内投与に適している。(例えば、"Remington's Pharmaceutical Sciences", 15th Edition, pages 1035-1038及び1570-1580を参照のこと。)滅菌注射溶液は、化学療法剤を多様な他の成分とともに必要量の好適な溶媒に含ませ、そして滅菌ろ過することによって調製される。滅菌注射溶液中で使用するための滅菌粉末は、真空乾燥、又は凍結乾燥、又は他の手段で調製されることができ、活性化学療法剤+先に滅菌された溶液から調製された追加の所望の成分の粉末を生じる。
【0153】
例えば、経口投与された場合、癌治療剤は不活性の希釈剤又は食用の担体と併合され、又はハード又はソフトシェルゼラチンカプセル中に封入され、錠剤に圧縮され、食品中に直接取り込まれるか、賦形剤とともに取り込まれ、そして摂取できる錠剤、バッカル錠、トローチ、カプセル、エリキシル、懸濁液、シロップ、ウエファース、などの形態で使用されることができる。癌治療剤の好適な量は、特別な治療剤に特異的であり、そして一般に当業者に知られている。
【0154】
多数の癌治療剤のために推奨される用量及び剤型は、確立されており、そしてMedical Economics Company, Inc., Oradell, N.J.から発行されたPhysicians Desk Referenceのような慣用の供給源から得られることができる。典型的には、既知の癌治療剤のための送達の最適経路は、例えば、臨床試験において確立している手順及び分析によって決定された。
【0155】
本発明が1つ以上の癌治療剤の投与及びサイトカイン発現細胞ワクチンの投与を含む、癌の治療のための治療計画を考慮することは理解されるであろう。そのような治療計画は、放射線療法などの追加の癌治療、さらなる化学療法及び/又は免疫療法の前に、それと同時に、又はそれに続いて投与されることができる。
【0156】
本発明は、サイトカイン発現細胞ワクチンとともに投与された場合、1つ以上の癌治療剤又は治療の用量が、サイトカイン発現細胞ワクチンの投与を含まない治療計画に比べて減少されることができるという利点を提供する。
【0157】
治療のモニタリング
当業者は、本発明の組み合わせ治療を投与することによる、治療結果及び/又は全身性の免疫応答をモニターする手段を知っている。特別には、治療結果は腫瘍の成長の減弱及び/又は腫瘍の退行及び/又は腫瘍特異的マーカーレベルをモニターすることによって評価されることができる。治療に対する応答である腫瘍の成長の減弱又は腫瘍の退行は、腫瘍の数、腫瘍の重量又はサイズ、或いは転移の減少/阻止などを含む、当業者に知られたいくつかのエンドポイントを用いてモニターされることができる。
【0158】
上記で引用されたすべての文献及び特許参考文献は、参考文献として本明細書中に特別に援用されている。
【実施例】
【0159】
サイトカイン発現細胞ワクチン+抗CTLA-4モノクローナル抗体
(GVAX(登録商標)などの)サイトカイン発現細胞と組み合わせた抗CTLA4mAb(9D9)が抗癌有効性を高めることができるかを判定するために、B16F10モデルを使用してインビボの試験を実施した。1つの実験においては、C57B16マウスに1×105個のB16F10腫瘍細胞で第0日にチャレンジした。1日後、3×106個の放射線照射したB16F10又はGM-CSF分泌B16F10(dB16gmtd)細胞をマウスに接種した。接種の1日後及び3日後に、マウスに150μg又は100μgの抗CTLA-4抗体(9D9又は9H10)をそれぞれ注射した。マウスは、抗CTLA-4治療の2日後に二回目の3×106個の放射線照射したB16F10又はGM-CSF分泌B16F10(dB16gmtd)細胞を受容した(図2A)。そして、マウスを、皮下の腫瘍の発生についてモニターした。2つの抗CTLA-4mAb、9D9(マウス抗CTLA4)及び9H10(ハムスター抗CTLA4)を、B16メラノーマ腫瘍モデルにおいて試験し(図2A.)、そして同様の有効性を有することを示した。ハムスター抗CTLA4抗体に対する免疫反応により、マウスの抗体をその後の試験において使用した。
【0160】
9D9抗CTLA-4mAbを、サイトカイン発現細胞ワクチン(GM-CSF分泌B16F10腫瘍細胞;B16-GM)を接種する又は接種しないB16メラノーマ腫瘍モデルにおいて試験した。結果は、単独療法としての9D9抗CTLA-4mAbがC57Bl/6マウスをB16F10腫瘍チャレンジから防御するのに有効でなかったことを示す。対照的に、B16-GM+9D9で治療したマウスの80%は防御され、9D9抗CTLA4mAbが生物学的に活性であることを実証し、さらに抗CTLA-4及びGVAX(登録商標)ワクチンが有効な抗癌併用療法であるという考えを支持する(図2B)。
【0161】
α-CTLA-4抗体による治療と組み合わせたGM-CSF分泌ワクチンの反復接種後の免疫応答
マウスにおける他の試験を、α-CTLA-4 9D9モノクローナル抗体による治療と組み合わせたGM-CSF分泌ワクチンの反復接種に対する免疫応答を評価するために用いた。この試験においては、腫瘍を有さないC57Bl/6雄性マウスに、自然発生的なマウス前立腺癌由来の、100ngのGM-CSF/106細胞/24時間を分泌する放射線照射されたmGM-CSF分泌腫瘍細胞3×106個を5回接種するか、又は非形質導入マウス前立腺癌細胞を隔週のスケジュールで接種した。選択された治療群には、抗CTLA-4 9D9又はマウスIgG2bアイソタイプ抗体対照を1番目、3番目、及び5番目の接種後の1日及び4日後にIP注射した(各100μg)。2、4、6、8、10及び13週目に、免疫学的及び安全性のエンドポイントのためにマウスを剖検した。最後の接種の2週間後、前立腺癌特異的抗原(PTSA)−特異的細胞内IFN-ガンマの発現について、フローサイトメトリーによって脾細胞を分析した。
【0162】
免疫応答を腫瘍抗原特異的T細胞の増加として測定した。そのようなT細胞は、MHC Iに結合した腫瘍特異的ペプチドによる刺激後の細胞内IFN-ガンマ発現の誘発によって確認することができる。前立腺癌特異的抗原は、ヒト前立腺癌とマウス前立腺癌細胞の両方に共通して特異的なエピトープである。細胞内サイトカイン染色(ICS)は、腫瘍特異的T細胞応答をモニターし、そして抗原特異的T細胞の非常に低い出現頻度を同定するために使用されることができる。ICSは新たに単離された切除後5時間以内のリンパ細胞において実施され、しばしば5〜7日のインビトロの刺激を必要とする細胞溶解性のアッセイとは異なり、インビボにおける腫瘍抗原特異的T細胞の出現頻度を推定するために使用可能である。これは、異なる腫瘍ワクチン戦略の効力を比較する手段を提供する。この試験においては、ICSは、CTLA-4 9D9同時治療を伴うか又は伴わないマウス前立腺癌細胞‐GMワクチンによる接種後の上記の、前立腺癌特異的抗原へのT細胞応答をモニターするために使用した。結果を図3に示す。各バーの上の数字は、各治療群からのPTSA特異的IFN-ガンマ+CD8+T細胞の未処置マウスに比べた増加倍率を表す。NP-1は非特異的ペプチド対照である。
【0163】
抗CTLA-4の非存在下でGM-CSF分泌腫瘍細胞の接種を複数回受けたマウスにおける抗原特異的T細胞の出現頻度は、非免疫化対照に比べて、10〜16倍の増加を検出した。同様に、最初の接種の後にだけ、抗CTLA-4を単回注射すると、未処置マウスに比べて前立腺癌抗原(PTSA)特異的T細胞応答が10倍増加した。しかしながら、最も衝撃的な応答は、最初、3番目、及び5番目の接種後の抗CTLA-4の注射を受けたマウスにおいて観察された。この群においては、PTSA特異的T細胞応答における36倍の増加が検出された。これらのデータは、抗CTLAの反復注射(すなわち、CTLA-4遮断)と組み合わせたGM-CSF分泌腫瘍細胞ワクチンの複数回接種が強力な腫瘍特異的T細胞応答を誘発することを実証している。B16メラノーマモデルにおけるGM-CSF分泌ワクチン及び抗CTLA-4抗体の組み合わせの相乗効果は、該組み合わせの潜在的な臨床的利益を示唆する。
【0164】
GM-CSF分泌ワクチン及び抗CTLA-4抗体の組み合わせによる抗腫瘍免疫応答の誘発の潜在的な有用性に関しては、インビトロの再刺激によるTNF-アルファ、IL-2、及びIFN-ガンマなどのエフェクターサイトカインの産生がさらに示唆される。そのようなサイトカインの放出は、しばしば、抗腫瘍免疫を誘発するように設計された免疫治療戦略後の腫瘍特異的免疫応答のための代理のマーカーとして使用される。放射線照射されたGM-CSF分泌腫瘍細胞で48時間インビトロで再刺激された脾細胞からの上清中においてサイトカインレベルが測定された場合、TNF-アルファ、IFN-ガンマ、IL-5及びIL-2の産生が2週間目までに検出された(データは示さない)。
【0165】
実施例2
サイトカイン発現細胞ワクチン(GVAX(登録商標))+抗4-1BBmAb
サイトカイン発現細胞ワクチン(GVAX(登録商標))と組み合わせた抗4-1BBモノクローナル抗体が抗癌有効性を高めることができるかを決定するために、B16F10モデルを用いてインビボの試験を実施した。
【0166】
第0日に、1×105個の生きたB16F10(体積0.5mlを背部に皮下注射)でマウスにチャレンジした。第3日に、(以下の表2に示すように)1×106個の放射線照射したワクチン細胞でマウスに接種し、その後、第6日に150μgの抗4-1BBmAbを注射した(体積0.5mlを腹腔内注射)。
【0167】
【表5】

【0168】
いかなる明白な異常についても毎日マウスを評価し、そして皮下の腫瘍が直径15〜20mmのサイズに達したか、又は皮膚を通して潰瘍化した場合には動物を安楽死させた。第21日に、脾臓及び血液を採集し、抗腫瘍CTL、サイトカイン放出(ELISA)及び細胞内FACSの分析に使用した。
【0169】
結果は、GVAX(登録商標)及び抗4-1BB抗体の組み合わせが、腫瘍を有さないマウスの数(図4A)及び生存(図4B)の両方をGVAX(登録商標)単独投与に比べてチャレンジ後80日まで、亢進したことを示した。
【0170】
実施例3
サイトカイン発現細胞ワクチン(GVAX(登録商標))+インターフェロン‐アルファ
インビトロの試験は、IFN-アルファが腫瘍細胞の増殖を阻害し、アポトーシスを用量依存的に誘発することを示した。図5Aに示す結果は、96穴プレート中で3連で72時間、マウス腫瘍細胞株を組換えマウスIFN-アルファ(rmIFN-α)と共培養した試験からのものである。細胞を3Hチミジンでパルスし、放射活性の取り込みによって増殖を測定した。個々の腫瘍細胞株は、rmIFN-αと共培養した場合、異なるレベルの阻害を表した。IFN-αの抗増殖性効果は、試験した他の細胞株と比べてB16F10細胞株で最も明らかであった。図5Bに示す結果は、96穴プレート中で3連で72時間、マウス腫瘍細胞株をrmIFN-αと共培養した後、細胞をトリプシン処理し、アネキシンV及び7-AADで染色し、そしてフローサイトメトリーによってアポトーシスを分析した試験からのものである。個々の腫瘍細胞株は、rmIFN-αと共培養した場合、異なるレベルのアポトーシスを表した。CT26は、試験した細胞株の中で、IFN-アルファのプロアポトーシス効果に対して最も感受性であった。
【0171】
メラノーマ(B16F10)、腎細胞癌(renca)、結腸癌(CT26)、乳癌(4T1)、肺癌(LLC)及び繊維肉腫(3T3)を含む多様な腫瘍において抗増殖効果が観察された。5000U/mlのIFN-アルファとのインキュベーションは、ほとんどの腫瘍において増殖を20〜40%阻害した。しかしながら、同じ用量のIFN-アルファは、80%超、B16F10メラノーマ細胞を阻害した。プロアポトーシス活性も、試験したすべての腫瘍細胞において観察された。アポトーシスが5倍増加したCT26を除いて、すべての腫瘍においてアポトーシスの増加は対照よりも1.5〜2.5高い範囲であった。IFN-アルファは、タンパク質(組換えマウスIFN-アルファ:R+D Systems)の形態、又はIFN-アルファのコード配列を含むベクターで細胞を形質移入することによって調製された、IFN-アルファを産生する細胞株として提供する。本発明の実施において使用するための例示的なインターフェロン‐アルファ配列は、例えば、本明細書中に参考文献として特別に援用されている、Genbank受入番号NM1FNA1、NM1FNA2において見出されることができる。
【0172】
サイトカイン発現細胞ワクチン(GVAX(登録商標))と組み合わせたインターフェロン‐アルファが抗癌有効性を高めることができるかを判定するために、インビボの試験も実施した。例示的な試験を模式的に示したものを図6に提供する。1つの例示的なプロトコールにおいて、C57B16マウスに1×105個のB16F10腫瘍細胞でチャレンジした。3日後、マウスに1×106個の放射線照射したB16F10又はGM-CSF分泌B16F10(B16.GM)細胞を接種した。接種の4日後、IFN-アルファ投与を開始した。IFN-アルファ(2500単位/日;2回/週)を腫瘍チャレンジ部位(図7A)又は接種部位(図7B)に皮下注射した。腫瘍の確立を触診によって3〜4日ごとに判定した。悪性腫瘍又は150mm2のサイズの腫瘍を有するマウスを屠殺した。示したデータは、表示された時点における生存率として表した、10匹のマウス/試験からのものである。B16.GMの生存に対する有効性は40%であり、B16.GM+IFN-アルファは、p=0.08の有意性をもってB16.GM単独療法よりも40%高かった。B16.GMの生存に対する有効性は10%であり、B16.GM+IFN-アルファはp=0.08の有意性をもってB16.GM単独療法よりも40%高かった。
【0173】
要約すると、これらのデータは、原発腫瘍の切除後に、切除された腫瘍のごく近傍に投与された局所的なIFN-アルファ治療が腫瘍を静的に保つのに有効であることを示唆する。さらに、IFN-アルファはワクチン部位においてワクチンとともに投与されることができる。したがって、GM-CSF分泌全細胞ワクチンと組み合わせたIFN-アルファは、B16F10腫瘍モデルの生存を上昇させ、そして腫瘍免疫療法のための新しい臨床的組み合わせを代表する。
【0174】
実施例4
サイトカイン発現細胞ワクチン(GVAX(登録商標))+ドセタキセル(タキソテレ(商標))
ドセタキセル及びGM-CSF分泌B16F10腫瘍細胞(B16-GM)ワクチンの組み合わせを、B16メラノーマモデルにおいて評価した。第5、9、及び13日におけるドセタキセルの3回のIV注射(全部で18mg/kg)は、生存期間の中央値が24日であって、B16腫瘍の増殖を阻害する単独療法としては無効であった(図8A及び8B)。腫瘍チャレンジの3日後にB16-GMを接種したマウスも生存期間の中央値が24日であった。対照的に、同じ治療計画を用いるドセタキセルとB16-GMの組み合わせは、腫瘍の増殖を顕著に遅らせ、そして生存期間の中央値を45日まで増加させた(図8C及び8D)。1週おきのB16-GM接種の間のドセタキセルの投与は、B16-GMの複数回の接種のみに比べて、B16腫瘍を有するマウスの生存期間の中央値を31日から52日に増加させた。これらの効果は、複数回のB16-GM接種+複数回のドセタキセルの治療計画を用いても観察された(表3)。
【0175】
【表6】

【0176】
さらに、膜結合オボアルブミンを発現するB16腫瘍細胞を使用して、ドセタキセルの投与がオボアルブミン特異的TCRトランスジェニックT細胞(OT-1;データは示さない)の生存を延長させることが実証され、ここで、オボアルブミンは抗原特異的T細胞の追跡を可能とする腫瘍抗原のモデルとして使用される。これらのデータは、ドセタキセルの投与が、腫瘍特異的エフェクターT細胞の生存を促進することによって、GM-CSF分泌腫瘍細胞ワクチンの効力を高めることが可能であることを示唆する。
【0177】
実施例5
サイトカイン発現細胞ワクチン(GVAX(登録商標))+COX-2阻害剤
サイトカイン発現細胞ワクチン+Celebrexがどちらか一方の剤単独の接種よりもより大きな保護を与えるかを試験するために、COX-2阻害剤であるセレコキシブ(CELEBREX(登録商標))の組み合わせを、B16-GMとの組み合わせでB16F10モデルにおいて評価した。予備的な結果は、Celebrex単独ではB16F10腫瘍のサイズ及び全生存期間に対して効果を有さないことを示した。しかしながら、GM-CSF発現細胞ワクチンと組み合わせると、生存数及び腫瘍を有さない動物の数に顕著な増加が観察された。結果は、有効性のためには、Celebrexがサイトカイン発現細胞ワクチン接種の少なくとも3日前に投与されなくてはならないことを示す(図9A及びB)。Celebrexが接種の日に投与される場合、サイトカイン発現細胞ワクチンが単独で投与される場合に観察されたのに対して、さらなる有効性が観察された。さらなる試験において、我々は単独療法としてのCelebrexはCT26腫瘍のサイズ及びBALB/Cマウスの全生存期間に対して顕著な効果を有することを実証した。
【0178】
実施例6
サイトカイン発現細胞ワクチン(GVAX(登録商標))+CD40L
抗CD40及びCD40Lを含むサイトカイン発現細胞ワクチンの組み合わせの効力並びにそのような組み合わせの有効性を最適化するためのパラメーターを評価するために、多様なインビボの試験を実施した。臨床試験を設計するのに考慮すべき因子は、組み合わせの構成成分の投与の相対的タイミング、各構成成分の用量、投与の経路及び頻度を含むがこれらに限られない。サイトカイン発現細胞ワクチン(GVAX(登録商標))と組み合わせた抗CD40又はCD40Lが、サイトカイン発現細胞ワクチン単独の抗癌有効性を高めることができるかを判定するためにインビボの試験を実施した(図10)。1つの例示的な実験において、Ad-NULL(導入遺伝子を発現しないE-1欠失アデノウイルス)、Ad-GVAX(登録商標)(Ad-GM-CSF)及びAd-CD40Lワクチンを調製し、そして本明細書中に参考文献として特別に援用されたPCT国際特許出願公開第WO00/72686号に記載されたような標準的手順によって腫瘍細胞に形質導入した。そのような実験の実施において、いずれかの分離した細胞集団をAd-GM-CSF及びAd-CD40Lのそれぞれで形質導入するか又は同じ細胞集団を両方のベクターで形質導入した。別々の細胞集団を個々のベクターで形質導入した場合には、細胞集団を混合し、そして以下に記載するように同時に又は異なる時に投与することができる。1の実験においては、第0日に第1群〜第11群のマウスに1×105個の生きたB16F10マウスメラノーマ細胞でチャレンジした(背側部位の皮下に体積0.5ml)。チャレンジ後の第3日にマウスの腹側に1×106個のB16-GMでワクチン接種し、その後、さらに放射線照射したワクチン細胞を第3日(第5群)、第4日(第6及び7群)、第5日(第8群及び9群)及び第7日(第10群及び第11群)を以下の表4に示すとおりに投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。図11に示す結果は、CD40をコードするアデノウイルスベクターで形質導入したB16F10細胞がCD40Lを発現し、そしてB16-GMとともに投与された場合、特にAd-CD40Lで形質導入した細胞を接種の4日後に投与した場合には、B16F10メラノーマでチャレンジしたマウスの生存を顕著に増加させることを実証している。CD40LがB16-GMと同日に投与された場合、病気は悪化した。
【0179】
【表7】

【0180】
B16-GMと抗CD40の組み合わせの有効性をさらに実証するために、接種後の異なる時点で投与されるCD40モノクローナル抗体で動物を治療した。この実験においては、第0日にマウスに1×105個の生きたB16F10マウスメラノーマ細胞でチャレンジした(背側に体積0.5mlを皮下投与)。チャレンジ後の第3日に、マウスに1×106個のB16-GMを腹側に接種した。抗CD40抗体を第0日及び第2日、又は第2日及び第4日(図11B);第4日及び第6日、第7日および第9日、又は第10日及び第12日(図11C)に投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。
【0181】
結果は、膜結合CD40Lまたは抗CD40モノクローナル抗体のいずれかとB16-GMワクチンの組み合わせが、B16-GMメラノーマモデルにおいてB16F10ワクチン発現GM-CSFの有効性を顕著に亢進することを実証している。B16メラノーマモデル試験からの結果は、CD40L及び抗CD40投与のタイミングが有効性に対して決定的なものであることをさらに示した(図11A〜11C)。
【0182】
実施例7
サイトカイン発現細胞ワクチン(GVAX(登録商標))+OX40/OX40L
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))及び抗OX40又は膜結合/可溶性OX40Lの有効性をB16F10メラノーマ腫瘍モデルを用い、以下の表5に示す例示的な試験計画を用いて評価する。
【0183】
【表8】

【0184】
治療プロトコールを最適化するためには、以下の表6に概説する多数の変数が重要である。
【0185】
【表9】

【0186】
公表された文献及び多様な実験結果に基づいて、OX40を介する防御は、腫瘍固有の免疫原性に依存して20〜60%の範囲である(Weinberg, A et al., J. Immunol., 164: 2160-2169, 2000)。GVAX(登録商標)及びOX40の組み合わせによって付与された防御は、GVAX(登録商標)に対するタイミング、投与経路並びに抗OX40またはOX40L:Ig融合タンパク質及びGVAX(登録商標)の相対的な用量などのいくつかの因子に依存する。
【0187】
実施例8
サイトカイン発現細胞ワクチン(GVAX(登録商標))+Hsp70
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))及びHsp70の有効性を、B16F10メラノーマ腫瘍モデルを用いて評価する。例示的な試験設計は以下のものである。
【0188】
【表10】

【0189】
治療プロトコールを最適化するためには、以下の表8に概説する多数の変数が重要である。
【0190】
【表11】

【0191】
GVAX(登録商標)及びHsp70の組み合わせによって付与された腫瘍に対する防御は、GVAX(登録商標)に対するHSP投与のタイミング、投与経路及びhsp70の用量に対するGVAX(登録商標)の相対的な用量などのいくつかの因子に依存する。
【技術分野】
【0001】
本出願は、2003年4月2日に出願された米国特許出願第10/404,662号の一部継続出願である。上記出願のすべては参考文献として本明細書中に援用されている。
【0002】
本発明は、標的癌抗原に対する個体の免疫応答を変更する方法に関する。より特別には、本発明は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を含む組成物並びにサイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を含むサイトカイン発現細胞ワクチンの組み合わせを癌患者に投与する方法に関する。
【背景技術】
【0003】
免疫系は、広く多様な癌の発病において重要な役割を演じる。癌が進行するとき、免疫系が十分に応答できないか又は適切に応答できずに癌細胞を増殖させると広く信じられている。現在のところ、化学療法、手術、放射線療法及び細胞治療を含む癌の標準的な医学的治療は、有効性及び毒性の両方に関して明らかに制限されている。これまで、これらのアプローチは癌のタイプ、患者の一般的な健康状態、診断時における病気のステージなどに依存して様々な程度の成功を経験してきた。標準的な医学的治療と癌への免疫応答の特別な操作を組み合わせる改善された戦略は、有効性を高めそして毒性を低下させるための手段を提供するかもしれない。
【0004】
抗腫瘍性免疫を増強するためのワクチンとしての自己の癌細胞の使用は、しばらくの間探求された(Biolobic Therapy of Cancer, Devita et al.(編) J. Lippincot Co., pp87-199, 1991中のOettgen et al., "The History of Cancer Immunotherapy")。しかしながら、多くの癌の弱い免疫原性、MHC分子のダウンレギュレーション、適切な共刺激分子の発現及び癌細胞による免疫抑制性サイトカイン分泌の欠如によって、そのようなワクチンに対する応答は長期間の有効性は生じなかった。例えば、Armstrong TD and Jaffee EM, Surg Oncol Clin N Am. 11(3):681-96, 2002及びBodey B et al., Anticancer Res 20(4):2665-76,2000を参照のこと。
【0005】
多数のサイトカインが腫瘍に対する免疫応答の制御に役割を果たすことが示された。例えば、米国特許第5,098,702号は、現存の腫瘍と戦うために、相乗的有効量のTNF、IL-2及びIFN-ベータの組み合わせを使用することを記載する。米国特許第5,078,996号、同第5,637,483号、及び同第5,904,920号は、腫瘍の治療のためのGM-CSFの使用を記載する。しかしながら、癌治療のためのサイトカインの直接投与は、実際的なものではない。なぜなら、それらはしばしば全身的に毒性があるからである(例えば、Asher et al., J. Immunol. 146: 3227-3234, 1991及びHavell et al., J. Exp. Med. 167: 1067-1085, 1988を参照のこと)。
【0006】
このアプローチの拡大は、接種部位において局所的にサイトカインを発現する、遺伝的に修飾された腫瘍細胞の使用を含む。IL-4、IL-2、TNF-アルファ、G-CSF、IL-7、IL-6及びGM-CSFを含む多様な免疫調節サイトカインを使用する腫瘍モデルにおいて活性が示され、それは、Golumbeck PT et al., Science 254:13-716, 1991: Gansbacher B et al., J. Exp. Med. 172:1217-1224, 1990: Fearon ER et al., Cell 60: 397-403, 1990: Gansbacher B et al., Cancer Res. 50 7820-25, 1990;Teng M et al., PNAS 88:3535-3539, 1991; Columbo MP et al., J. Exp. Med. 174: 1291-1298, 1991 Aoki et al., Proc. Natl. Acad. Sci USA 89(9): 3850-4, 1992: Porgador A et al., Nat Immun. 13(2-3):113-30, 1994: Dranoff G et al., PNAS 90: 3539-3543, 1993: Lee CT et al., Human Gene Therapy 8:187-193, 1997: Nagai E et al., Cancer Immunol. Immonther. 47:2-80, 1998 及びChang A et al., Human Gene Therapy 11:839-850, 2000にそれぞれ記載されている。
【0007】
GM-CSFを発現する自己の又は同種異系の細胞ワクチン(GVAX(登録商標))を採用する、前立腺がん、メラノーマ、肺癌、膵臓癌、腎臓癌、及び多発性骨髄腫の治療のための臨床試験が開始した(Dummer R., Curr Opin Investig Drugs 2(6): 844-8, 2001; Simons J et al., Cancer Res. 15;59(20): 5160-8, 1999; Soiffer R et al., PNAS 95:13141-13146, 1998; Simons J et al., Cancer Res. 15; 57:1537-1546, 1997; Jaffee E et al., J. Clin Oncl. 19:145-156, 2001;及びSalgia R et al., J. Clin Oncol. 21:624-630,2003)。
【0008】
他のアプローチにおいても、B7-1のような共刺激分子又は同種異種間の組織適合性抗原を産生するように、自己の腫瘍細胞が遺伝的に改変された(Salvadori et al., Hum. Gene Ther. 6:1299-1306, 1995及びPlaksin et al., Int. J. Cancer 59:796-801, 1994)。遺伝的に改変された腫瘍細胞の使用がいくつかの形態の癌の治療に成功した一方、現在使用されている治療法よりも、より強力/有効であり、副作用の少ない改善された治療計画が依然として必要とされている。
【発明の概要】
【課題を解決するための手段】
【0009】
本発明は、哺乳動物、典型的にはヒト、における癌の治療のための改善された組成物並びにサイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤を含むサイトカイン発現細胞ワクチンの組み合わせを癌を有する対象に投与することによる治療方法を提供する。
【0010】
サイトカイン発現細胞ワクチンの組み合わせの投与は、サイトカイン発現細胞ワクチン又は追加の癌治療剤単独の投与に比べて治療的有効性及び/又はワクチン力価を向上させる。
【0011】
本発明の1の側面において、サイトカイン発現細胞ワクチンは、GM-CSFを発現する。
【0012】
本発明の他の側面において、サイトカイン発現細胞ワクチンの組み合わせは、自己の細胞、同種異系の細胞、又はバイスタンダー細胞(bystander cell)を含む。
【0013】
本発明のさらなる側面においては、自己の、同種異系の、又はバイスタンダー細胞の集団は、有効量のサイトカイン、例えばGM-CSFを産生するように遺伝的に修飾される。
【0014】
少なくとも1つの追加の癌治療剤は、抗CTLA4抗体、抗4-1BB抗体、インターフェロン−アルファ、ドセタキセル、パクリタキセル、COX-2阻害剤、腫瘍細胞ワクチンの細胞表面上に発現されたCD40リガンド又は抗CD40抗体、腫瘍細胞ワクチンの細胞表面上に発現されたOX40リガンド又は抗OX40抗体、CpCオリゴヌクレオチド及び熱ショックタンパク質(HSP)からなる群から選ばれる。
【0015】
自己の、同種異系の、又はバイスタンダー細胞の同一の又は異なる集団は、有効量の少なくとも1つの追加の癌治療剤を産生するように遺伝的に修飾される。
【0016】
自己の、同種異系の、又はバイスタンダー細胞の集団は、対象への投与の前に放射線照射によって増殖不能とさせられる。
【0017】
本発明のなおさらなる側面においては、少なくとも1つの追加の癌治療剤が、(例えば、抗CTLA4抗体、抗4-1BB抗体、抗CD40抗体及び抗OX40抗体などの)抗体のような化合物として、ドセタキセル、パクリタキセルなどの伝統的な化学療法剤として、又はワクチン細胞上に発現された細胞表面分子として投与される。
【0018】
サイトカイン発現細胞ワクチンは、典型的には皮下又は腫瘍内に投与される。少なくとも1つの追加の癌治療剤は、上記組み合わせのサイトカイン発現細胞ワクチン成分の投与の前に、同時に、又はその後に投与されることができる。
【0019】
本発明は、さらに、本明細書の記載に従う使用のためのサイトカイン発現細胞ワクチンの組み合わせを含む組成物及びキットを提供する。
【図面の簡単な説明】
【0020】
【図1A】図1Aは、基本的な予防モデルにおけるGM-CSF分泌腫瘍細胞ワクチン接種後の腫瘍を有さない生存期間を示す、C57Bl/6マウスにおける試験の結果を図示する。このモデルにおいては、マウスに放射線照射した1×106個の腫瘍細胞を(皮下に:SC)ワクチン接種した。7日後、マウスに1×106個のB16F10腫瘍細胞でチャレンジ(SC)し、腫瘍の増殖及び生存について追跡した。B16F10/Ad−nullは、E1欠失アデノウイルスベクターで形質導入した、導入遺伝子を発現しないB16F10腫瘍細胞である。B16F10/Ad-gen.mGMは、E1欠失アデノウイルスベクターで形質導入した、ゲノムDNAから450ngのGM-CSF/1×106個の細胞/24時間を発現するB16F10クローンである。AAV#81は、アデノウイルスで形質導入したGM-CSFを発現するB16F10クローンである。AAV#81は平均して500ngのGM-CSF/24時間/1×106個の細胞を発現する。
【図1B】図1Bは、治療モデルにおけるGM-CSF分泌腫瘍細胞ワクチン接種後の腫瘍を有さない生存期間を示す、C57Bl/6マウスにおける試験の結果を図示する。このモデルにおいては、マウスに5×104個のB16F10腫瘍細胞でチャレンジし(SC)、3日後に放射線照射した1×106個の腫瘍細胞で治療した。B16F10/Ad−nullは、E1欠失アデノウイルスベクターで形質導入した、導入遺伝子を発現しないB16F10腫瘍細胞である。マウスを腫瘍の増殖及び生存について追跡した。B16F10/Ad-gen.mGMは、E1欠失アデノウイルスベクターで形質導入した、ゲノムDNAから450ngのGM-CSF/1×106個の細胞/24時間を発現するB16F10クローンである。AAV#81は、アデノウイルスで形質導入した、GM-CSFを発現するB16F10クローンである。AAV#81は平均して500ngのGM-CSF/24時間/1×106個の細胞を発現する。
【図2A】図2Aは、第0日にC57Bl6マウスに1×105個のB16F10腫瘍細胞でチャレンジした、B16F10メラノーマモデルにおける試験を図示したものである。1日後、マウスに1×106個の放射線照射したB16F10細胞又はGM-CSF分泌B16F10細胞をワクチン接種した。接種の1日及び3日後に、マウスに150μg及び100μgの抗CTLA-4抗体(マウス抗マウスCTLA4抗体である9D9、又はハムスター抗マウス抗CTLA4抗体である9H10)をそれぞれ注射した。いくつかの場合には、マウスには3×106個の放射線照射した細胞を最後の抗CTLA-4治療の2日後に2回目に注射した。そして、マウスを皮下腫瘍の進行についてモニターし、免疫学的にモニタリングし、そして第21日に屠殺した。
【図2B】図2Bは、図2Aで示した治療計画に類似の計画を用いた、B16F10モデルにおけるB16F10細胞又はGM-CSF分泌B16F10(dB16gmtd)細胞及びハムスター(9H10)又はマウス(9D9)抗CTLA-4抗体の組み合わせによる治療の結果を図示したものである。C57Bl6マウスに1×105個のB16F10腫瘍細胞でチャレンジした。1日後、マウスに3×106個の放射線照射したB16F10細胞又はGM-CSF分泌B16F10(dB16gmtd)細胞をワクチン接種した。接種の1日及び3日後に、マウスに150μg及び100μgの抗CTLA-4抗体(9D9又は9H10;図2A)をそれぞれ注射した。マウスには3×106個の放射線照射した細胞を最後の抗CTLA-4治療の2日後に2回目に注射した(第7日)。そして、マウスを皮下腫瘍の発生について1週間に2回モニターした。
【図2C】図2Cは、C57Bl6マウスに1×105個のB16F10メラノーマ腫瘍細胞でチャレンジした試験の結果を図示する。1日後、マウスに1×106個又は3×106個の放射線照射したGM-CSF分泌B16F10(それぞれ、150ngのGM-CSF/1×106細胞/24時間を産生するdB16gmtd150、及び450ngのGM-CSF/1×106細胞/24時間を産生するdB16gmtd450)メラノーマ腫瘍細胞をワクチン接種した。接種の1日及び3日後に、マウスに150μg及び100μgのマウス抗CTLA-4モノクローナル抗体(抗CTLA-4 9D9)をそれぞれ注射した。マウスには3×106個の放射線照射した細胞を最後の抗CTLA-4治療の2日後に2回目に注射し、そして生存期間を基礎とした。
【図2D】図2Dは、GM-CSF分泌レベルが150ng/106細胞/24時間(低レベル)である、図2Aに記載した試験の結果を図示したものを提供する。
【図2E】図2Eは、GM-CSF分泌レベルが450ng/106細胞/24時間(高レベル)である、図2Aに記載したような試験の結果を図示したものを提供する。
【図3】図3は、C57Bl6マウスにGM-CSF分泌マウス前立腺癌細胞で2週ごとに全部で5回ワクチン接種した試験の結果を図示する。マウスに、マウス抗CTLA-4 9D9抗体又はアイソタイプ対照抗体を、最初のワクチン接種後のみ(1)又は第1、3及び5回目のワクチン接種後に1ヶ月の間隔で3回(3)、注射した。最後のワクチン接種の2週間後、前立腺特異的腫瘍抗原(PTSA)‐特異的細胞内IFN-ガンマ発現についてのフローサイトメトリーによって、脾細胞を分析した。各バーの上の数字は、未処置マウスに比較した各治療群からのPTSA特異的IFN-ガンマ+CD8+T細胞の増加倍率を表す。NP-1は非特異的なペプチド対照である。
【図4A】図4Aは、4-1BBモノクローナル抗体と組み合わせたGVAX(登録商標)の効果を評価したB16F10メラノーマモデルにおける試験の結果を図示する。上記試験においては、第0日に、C57Bl6マウスに1×105個のB16F10腫瘍細胞でチャレンジした。3日後、放射線照射した3×106個のB16F10細胞又はGM-CSF分泌B16F10細胞を、マウスにワクチン接種した。ワクチン接種の3日後、マウスに150μgの4-1BBモノクローナル抗体を腹腔内注射した。マウスを第21日に屠殺し、免疫学的にモニタリングした。図4Aは、腫瘍を有さないマウスのパーセンテージを図示する。
【図4B】図4Bは、4-1BBモノクローナル抗体と組み合わせたGVAX(登録商標)の効果を評価したB16F10メラノーマモデルにおける試験の結果を図示する。上記試験においては、第0日に、C57Bl6マウスに1×105個のB16F10腫瘍細胞でチャレンジした。3日後、放射線照射した3×106個のB16F10細胞又はGM-CSF分泌B16F10細胞を、マウスにワクチン接種した。ワクチン接種の3日後、マウスに150μgの4-1BBモノクローナル抗体を腹腔内注射した。マウスを第21日に屠殺し、免疫学的にモニタリングした。図4Aは、チャレンジの後80日間までの生存パーセンテージを図示する。
【図5A】図5Aは、インターフェロン‐アルファを用いるインビトロの試験の結果を図示する。
【図5B】図5Bは、インターフェロン‐アルファを用いるインビトロの試験の結果を図示する。
【図6】図6は、GVAX(登録商標)とインターフェロン‐アルファの組み合わせの効果をマウスB16F10腫瘍モデルにおいて評価した、試験計画を図示する。
【図7A】図7Aは、マウスをB16F10細胞又はGM-CSF分泌B16F10(dB16gmtd)細胞の組み合わせで治療したインターフェロン‐アルファを用いるインビボの試験の結果を図示する。図7Aに示す結果は、第0日に105個のB16F10メラノーマ細胞を腫瘍チャレンジとして、同系のC57/B6マウスの背側に皮下注射した試験から得られたものである。第3日に、放射線照射したB16.GM(106)を細胞ワクチンとして腹側部位に皮下注射した。第7日に、IFN-アルファ注射を開始した。IFN−アルファ注射を100μl中、2500単位を一週間に2回で4週間、皮下に局部的腫瘍チャレンジ部位に与えた。送達された総IFN-アルファ用量は、20,000単位であった。腫瘍の確立を、3〜4日ごとに触診によって判定した。悪性腫瘍を有するマウス又は腫瘍サイズが150mm2のマウスを屠殺した。示すデータは、試験ごとに10匹のマウスを用いる試験からの、示した時点での生存パーセンテージとしてあらわす。B16.GMの生存に対する有効性は40%であり、B16.GM+IFN-アルファでは、p=0.08で有意にB16.GM単独療法よりも40%高かった。
【図7B】図7Bは、マウスをB16F10細胞又はGM-CSF分泌B16F10(dB16gmtd)細胞の組み合わせで治療したインターフェロン‐アルファを用いるインビボの試験の結果を図示する。図7Bに示す結果は、第0日に105個のB16F10メラノーマ細胞を腫瘍チャレンジとして、同系のC57/B6マウスの背側に皮下注射した試験から得られたものである。第3日に、放射線照射したB16.GM(106)を細胞ワクチンとして腹側部位に皮下注射した。第7日に、IFN-アルファ注射を開始した。IFN−アルファ注射を100μl中、2500単位を一週間に2回で4週間、皮下に局部的接種部位に与えた。送達された総IFN-アルファ用量は、20,000単位であった。腫瘍の確立を、3〜4日ごとに触診によって判定した。悪性腫瘍を有するマウス又は腫瘍サイズが150mm2のマウスを屠殺した。示すデータは、試験ごとに10匹のマウスを用いる試験からの、示した時点での生存パーセンテージとしてあらわす。B16.GMの生存に対する有効性は10%であり、B16.GM+IFN-アルファでは、p=0.08で有意にB16.GM単独療法よりも40%高かった。
【図8A】図8Aは、第5、9及び13日に投与されたドセタキセル(総用量18mg/kg)の3回の静脈内注射の効果を、生存したマウスのパーセンテージに関して評価した、B16F10メラノーマモデルにおける試験結果を図示する。
【図8B】図8Bは、図8C及びDに示すデータを作るために実施した試験を図示する。上記試験を、B16F10メラノーマモデルにおいて実施し、1サイクルのタキソテレ投与と組み合わせた1サイクルのGM-CSF分泌腫瘍細胞ワクチン投与の有効性を、3サイクルのワクチン+3サイクルのタキソテレに比較した。
【図8C】図8Cは、ドセタキセル(総用量18mg/kg)と組み合わせて第5、9及び13日に投与したサイトカイン発現細胞ワクチンの効果を評価した、(図8Bに記載のとおりに実施した)B16F10メラノーマモデルにおける試験結果を図示する。生存したマウスのパーセンテージを図8Cに示す。
【図8D】図8Dは、ドセタキセル(総用量18mg/kg)と組み合わせて第5、9及び13日に投与したサイトカイン発現細胞ワクチンの効果を評価した、(図8Bに記載のとおりに実施した)B16F10メラノーマモデルにおける試験結果を図示する。生存期間の中央値を図8Dに示す。隔週でのワクチン接種(全部で3回のワクチン接種:3サイクル)の間に投与したドセタキセルは、3回のB16-GMワクチン接種単独に比べて、腫瘍を有するB16マウスの生存期間の中央値を31日から52日に増加させた。1サイクルのワクチン+ドセタキセルが投与された場合の試験結果は、生存期間の中央値を24日(ワクチンのみ)から45日(1サイクルのワクチン+ドセタキセル)に増加させた。
【図9】図9A及び9Bは、セレブレックス(セレコキシブ:第7日に開始して飼料中で50mg/kg/日)と組み合わせたサイトカイン発現細胞ワクチンの効果を評価した、B16F10メラノーマモデルにおける試験結果を図示する。第0日に、1×105個の生きたB16F10細胞で背側位置にマウスにチャレンジし、そして第3日に1×106個の放射線照射したdB16gmtd細胞を腹側位置にチャレンジした。結果は、GM-CSF分泌腫瘍細胞ワクチン接種の10日前に投与したセレブレックスが、ワクチンの能力を顕著に増加させ、長期の生存を生じた。
【図10】図10は、GVAX(登録商標)とCD40Lの組み合わせの効果をマウスB16F10モデルにおいて評価した試験計画を図示する。
【図11A】図11Aは、B16F10モデルにおける、B16F10及びアデノウイルスにより発現されたCD40リガンドの組み合わせによる治療結果を図示する。表4に示すとおり、第0日に、1×105個の生きたB16F10マウスメラノーマ細胞でチャレンジし、そして第3日のチャレンジ後に、マウスに1×106個のB16-GMで腹側にワクチン接種し、続いてさらなる放射線照射したワクチン細胞を、図4に示すように第3日、第4日、第5日、及び第7日に投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。
【図11B】図11Bは、B16F10モデルにおける、B16F10及び抗CD40抗体の組み合わせによる治療の結果を図示する。C57B16マウスに、1×105個の生きたB16F10マウスメラノーマ細胞で背側にチャレンジした。チャレンジ後の第3日に、マウスに1×106個のB16-GMで腹側にワクチン接種した。100μgの抗CD40抗体を、第0日及び2日、又は第2日および4日(図11B)に投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。
【図11C】図11Cは、B16F10モデルにおける、B16F10及び抗CD40抗体の組み合わせによる治療の結果を図示する。C57B16マウスに、1×105個の生きたB16F10マウスメラノーマ細胞で背側にチャレンジした。チャレンジ後の第3日に、マウスに1×106個のB16-GMで腹側にワクチン接種した。100μgの抗CD40抗体を、第4および6日、第7日および9日、又は第10日および12日(図11C)に投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。
【発明を実施するための形態】
【0021】
本発明は、癌の治療のための改善された細胞ワクチンに相当し、本明細書に記載の組成物及び方法は、治療を受ける患者のために改善された治療結果を協同して生み出す少なくとも2つの成分を含む。
【0022】
定義
本明細書中で使用される「免疫応答を制御すること」、又は「免疫応答を調節すること」という用語は、免疫系の細胞のいかなる変更又は免疫応答に関与する細胞の活性のいかなる変更も意味する。そのような制御又は調節は、多様な種類の細胞の数の増加又は減少、これらの細胞における活性の増加又は減少、或いは免疫系内で起こりうるいかなる他の変化も含む。免疫応答に関与する細胞は、Tリンパ細胞、Bリンパ細胞、ナチュラルキラー(NK)細胞、マクロファージ、好酸球、マスト細胞、樹状細胞及び好中球を含むがこれらに限られない。いくつかの場合には、免疫応答を「制御すること」又は「調節すること」は、免疫応答が刺激され又は亢進されること、そして他の場合には、免疫応答を「制御すること」又は「調節すること」は、免疫系の抑制を意味する。免疫系の刺激は、記憶応答及び/又は後の抗原チャレンジに対する将来の防御を含むことができる。
【0023】
本明細書中で使用される「癌治療剤」、「追加の癌治療剤又は治療」などは、GVAX(登録商標)のようなサイトカイン発現細胞ワクチンとともに使用された場合に抗癌応答を刺激する、いかなる分子又は治療もさす。1つの側面において、追加の癌治療剤は組換え腫瘍細胞によって発現され、そして免疫調節分子、すなわち、第二のサイトカインであることができる。他の側面においては、追加の癌治療剤は、薬剤として許容可能な賦形剤中で提供される、タンパク質或いは抗体又はタキソテレのような標準的な化学療法剤などの他の化合物の形態で投与される。さらに他の側面においては、癌治療剤は、放射線照射などの、癌の治療において伝統的に使用された標準的な治療である。さらなる側面においては、追加の癌治療剤は、典型的には癌の治療において考慮されないが、サイトカイン発現細胞ワクチンと併用して患者に投与された場合、治療される患者のために改善された治療結果を生じる、剤又は治療である。
【0024】
本明細書中で使用される「サイトカイン」は、免疫系の細胞に効果を及ぼすか/影響する生物学的分子の一般的なクラスを意味する。この定義は、局所的に作用するか又は血中を循環することができ、そして本発明の組成物又は方法において使用される場合、癌への個体の免疫応答を制御又は調節する働きをする生物学的分子を含むがこれらに限定されない。本発明を実施するために使用される例示的なサイトカインは、IFN-アルファ、IFN‐ベータ、及びIFN-ガンマ、(IL-1〜IL-29、特にIL-2、IL-7、IL-12、IL-15及びIL-18などの)インターロイキン、(TNF‐アルファ及びTNF-ベータなどの)腫瘍壊死因子、エリスロポエチン(EPO)、MIP3a、ICAM、マクロファージコロニー刺激因子(M-CSF)、顆粒球コロニー刺激因子(G-CSF)及び顆粒球マクロファージコロニー刺激因子(GM-CSF)を含むが、これらに限られない。
【0025】
本明細書中で使用される「サイトカイン発現細胞ワクチン」という用語は、サイトカイン、例えばGM-CSFを発現するように遺伝的に修飾されており、そして癌治療計画の一部分として患者に投与される細胞集団を含む組成物をさす。そのような「サイトカイン発現細胞ワクチン」の細胞は、サイトカインがその細胞によって発現されるように、発現及び制御要素に作動可能に連結されている、サイトカインをコードするDNA配列を含む。「サイトカイン発現細胞ワクチン」の細胞は、典型的には腫瘍細胞であり、治療を受けている患者にとって自己の又は同種異系のものであることができ、そして、その患者から得られた腫瘍細胞と混合される「バイスタンダー細胞」であることができる。GM-CSFを発現する「サイトカイン発現細胞ワクチン」は、本明細書中で「GVAX(登録商標)」と称されることができる。
【0026】
組換えDNA構築物又はベクターに関して本明細書中で使用される「作動可能に連結された」という用語は、組換えDNA構築物又はベクターのヌクレオチド成分が選択されたコード配列の作動的制御のためにお互いに直接的に連結していることを意味する。一般に、「作動可能に連結された」DNA配列は、隣接しており、分泌リーダーの場合には隣接しているが、リーディングフレームにおいてはいくつかの配列、例えばエンハンサーは隣接する必要はない。
【0027】
本明細書中で使用されるように、「遺伝子」又は「コード配列」という用語は、適切な制御配列に作動可能に連結されたとき、インビトロ又はインビボにおいて、転写され(DNA)そしてポリペプチドに翻訳される(mRNA)、核酸配列を意味する。「遺伝子」は、典型的にはコード配列+該遺伝子に付随するいずれかの非コード配列(例えば、制御配列)を含み、したがって、該コード領域の前及び後の領域、例えば、5’非翻訳(5’UTR)又は「リーダー」配列及び3’UTR又は「トレーラー」配列、並びに個体のコード部分(エキソン)の間の介在配列(イントロン)を含むか又は含まないことができる。対照的に、「コード配列」は非コードDNAを含まない。
【0028】
本明細書において、「遺伝子修飾された」及び「遺伝的に修飾された」という用語は、核酸配列が細胞又は細胞集団中へ導入された、細胞又は細胞集団に関連して使用される。核酸配列は、細胞に対して異種性であることができ、又は細胞内にすでに存在する核酸配列の追加のコピー又は改善された変形であることができる。細胞は、物理的又は化学的方法によって、或いは組換えウイルスの使用によって遺伝的に修飾されることができる。リン酸カルシウム、エレクトロポーレーション及び圧力を介する遺伝物質の細胞内への移動のような物理的及び化学的方法がしばしば用いられる。哺乳動物細胞内への遺伝子の有効な送達において有用ないくつかの組換えウイルスベクターは、例えば、レトロウイルスベクター、アデノウイルスベクター、アデノウイルス関連ベクター(AAV)、ヘルペスウイルスベクター、ポックスウイルスベクターを含む。さらに、例えば、リポソーム、受容体を介する送達、リン酸カルシウムトランスフェクション、エレクトロポーレーション、粒子衝撃(遺伝子銃)、又は圧力を介する送達によって送達された裸のDNAも、核酸配列を細胞又は細胞集団内へ導入するために採用されることができ、それらを「遺伝子修飾された」又は「遺伝的に修飾された」ものとする。
【0029】
本明細書中で使用されるとおり、「腫瘍」及び「癌」という用語は、増殖制御の喪失及び通常は細胞の大きなクローンの形成を示す細胞をさす。腫瘍又は癌細胞は、一般に接触阻害を失い、そして侵襲性であり、及び/又は転移能を有する。
【0030】
本明細書中において、「腫瘍細胞由来の抗原」及び「腫瘍抗原」及び「腫瘍細胞抗原」という用語は交換可能に使用されることができ、免疫応答を誘発することのできる腫瘍細胞に由来するか又は該細胞によって発現される、いずれかのタンパク質、炭水化物又は他の成分をさす。その定義は、すべての腫瘍関連抗原を発現する腫瘍細胞全体、腫瘍細胞断片、腫瘍細胞から取られた細胞膜、細胞表面から精製されたタンパク質又は腫瘍細胞の膜、或いは腫瘍細胞の細胞表面に結合している独特の炭化水素部分を含むが、これらに限定されない。その定義は、その細胞にアクセスするために特別な処理を必要とする細胞の表面に由来する抗原も含む。
【0031】
本明細書中で使用される「全身的な免疫応答」という用語は、局在化されない、しかしその個体全体に影響を与える免疫応答を意味する。
【0032】
本明細書中で使用される「遺伝子治療」という用語は、ウイルス又は非ウイルスベクターを通じて組換え遺伝物質を含む組成物をエキソビボ又はインビボで送達することにより、癌を治療又は予防することを意味する。
【0033】
本明細書中で使用される「エキソビボ」の送達は、ヒトの体の外から、遺伝物質を含む組成物を細胞、組織、オルガノイド、器官、などの内に導入し、続いて、そのような導入された組成物を含む細胞、組織、オルガノイド、器官などを、製剤、投与部位又は経路に限定されずに、同じ(自己の)又は異なる(同種異系の)ヒトに投与することを意味する。
【0034】
「不活性化細胞」、「非分裂細胞」及び「非複製細胞」という用語は、本明細書中で交換可能に使用されることができ、例えば、放射線照射により処理され、増殖不能とされた細胞をさす。そのような処理により、有糸分裂を行うことができないが、サイトカイン又は他の癌治療剤のようなタンパク質を発現する能力を保持する細胞が生じる。典型的には、約3500ラドの最小用量の照射で十分であるが、約30,000ラドまでの用量が許容可能である。有効用量は、非制限的に5000〜10000ラドを含む。マイトマイシンCによる処理のような、細胞を不活性化する多数の方法が本分野において知られている。細胞を細胞分裂不能とするが細胞のタンパク質発現能力を保持することを可能とする、いかなる不活性化方法も、本発明の範囲内に含まれる。
【0035】
本明細書において使用されるとおり、個体又は細胞の「治療」は、個体又は細胞の自然の過程を変更する試みにおいて使用されるいずれかのタイプの介入である。治療は、例えば、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療の投与を含むがこれに限定されず、そして、予防的に或いは一次的な又はフォローアップ治療計画の一部分として診断に続いて実施されることができる。
【0036】
本明細書中で使用される「投与すること」という用語は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を含む組成物を、癌患者に物理的に導入することをさす。いかなるそしてすべての導入方法は本発明により考慮され、該方法は、いかなる特別な導入手段にも依存せず、そのように解釈されるべきでない。導入手段は、当業者に周知であり、その例が本明細書中に提供される。
【0037】
本明細書中で使用される「同時投与」という用語は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療の組み合わせが同じ患者に投与される過程を意味する。サイトカイン発現細胞ワクチン及び追加の癌治療剤は、同時に、本質的に同時に、又は連続的に投与されることができる。投与が連続的に行われる場合、サイトカイン発現細胞ワクチンは、所定の追加の癌治療剤又は治療の前又は後に投与されることができる。サイトカイン発現細胞ワクチン及び追加の癌治療剤又は治療は、同じビヒクルによって投与される必要はなく、細胞ワクチン及び追加の剤又は治療は、1回以上の回数で、及び組み合わせの各成分の投与回数は同じでも異なってもよい。さらに、サイトカイン発現細胞ワクチン及び追加の癌治療剤又は治療は、同じ部位に投与される必要はない。
【0038】
本明細書中で使用される「治療的有効量」又は「治療的に有効な組み合わせ」は、刺激又は抑制することのいずれかによって、個体の全身性の免疫応答を調節するのに十分な、サイトカイン発現細胞ワクチンの量又は用量と追加の剤又は治療の量又は用量をあわせたものをさす。所定の治療的に有効な組み合わせにおけるサイトカイン発現細胞ワクチンの量は、異なる個体、異なる腫瘍のタイプによって異なることができ、そして、該組み合わせに含まれる1つ以上の追加の剤又は治療に依存するであろう。「治療的有効量」は、「改善された治療成績」の結果のような当業者によって日常的に採用される手順を用いて決定される。
【0039】
本明細書において使用されるとおり、癌に関する「改善された治療成績」及び「亢進された治療的有効性」は、癌細胞又は固形癌の増殖の緩徐化又は減少、或いは癌細胞総数又は癌による負担全体の減少をさす。「改善された治療成績」又は「亢進された治療的有効性」は、したがって、腫瘍の進行する時間の増加、平均余命の増加、又は生活の質の向上を含む臨床的に許容可能な基準による患者の状態の改善があることを意味する。
【0040】
本明細書中で使用される「確立された腫瘍の逆行」は、既存の腫瘍の抑制、退行、部分的又は完全な消失を意味する。該定義は、既存の腫瘍のサイズ、成長速度、出現又は細胞成分のいかなる減少も含むことを意味する。
【0041】
本明細書中で示される「個体」、「対象」という用語は、脊椎動物、好ましくは哺乳動物、そして典型的にはヒトをさす。
【0042】
一般的な技術
本発明の実施には、特記されない限り、分子生物学、微生物学、細胞生物学、生化学及び免疫学の慣用技術を採用し、そしてこれらは当業者の知識の範囲内にある。そのような技術は、それぞれが特別に参考文献として本明細書中に援用されている、「Molecular Cloning: A Laboratory Manual」、second edition(Sambrook et al., 1989);「Current Protocols in Molecular Biology」(F.M.Ausubel et al., eds., 1987);「Animal Cell Culture」(R.I.Freshney ed., 1987)などの文献中に完全に説明されている。
【0043】
癌標的
本発明の方法及び組成物は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を癌患者に同時投与することによって、癌の治療への改善された治療的アプローチを提供する。本明細書中で使用される「癌」は、腫瘍中に局在化された癌、並びに例えば、局所的な腫瘍から浸潤によって広がる癌細胞(すなわち、転移)のような腫瘍中に局在化されない癌を含む。本発明は、非制限的に膀胱、乳房、結腸、腎臓、肝臓、肺、卵巣、頚部、膵臓、直腸、前立腺、胃、表皮の癌;リンパ系又は骨髄系の造血系の腫瘍;繊維肉腫又は横紋筋肉腫などの間葉由来の腫瘍;メラノーマ、テラトカルシノーマ、ニューロブラストーマ、グリオーマ、アデノカルシノーマ及び非小細胞肺癌などの他の腫瘍タイプを含むいかなる形態の癌の治療においても有用性を見出す。
【0044】
サイトカイン及び癌治療剤をコードする核酸配列の細胞への導入
本発明の1つの側面において、第一のプロモーターに作動可能に連結されたサイトカインをコードする核酸配列(すなわち、組換えDNA構築物又はベクター)が単独で、又は第二のプロモーターに作動可能に連結された癌治療剤をコードする核酸配列とともに細胞又は細胞集団に導入される。細胞又は細胞集団、典型的には腫瘍細胞、へのいかなる導入方法も、本発明により考慮され、該方法はいずれの特別な導入手段にも依存せず、そしてそのように解釈されるべきでない。サイトカインをコードする核酸配列は、癌治療剤をコードする核酸配列と同じ又は異なる細胞集団へ導入されることができる。
【0045】
当業者により理解されるとおり、「ベクター」は、プラスミド、ウイルス又は他の媒体のようなDNA分子であって、1つ以上の異種性の又は組換えのDNA配列、例えばサイトカイン又は追加の癌治療剤を機能的プロモーターのコントロール下でコードする核酸配列を含み、そしていくつかの場合にはベクターとして機能することのできるエンハンサーをさらに含む。好適なウイルスベクターは、レトロウイルス、レンチウイルス、アデノウイルス(AV)、アデノ関連ウイルス(AAV)、シミアンウイルス40(SV-40)、ウシパピローマウイルス、エプシュタイン−バールウイルス、ヘルペスウイルス、ワクシニアウイルス、マウス白血病ウイルス、マウス肉腫ウイルス、マウス乳癌ウイルス、及びラウス肉腫ウイルスを非制限的に含む。非ウイルスベクターもまた、本発明の範囲に含まれる。
【0046】
真核腫瘍細胞、又は特別には、ヒトのような哺乳動物の腫瘍細胞などの動物腫瘍細胞への核酸の導入に適した、好適なベクターが採用されることができる。好ましくは、ベクターは腫瘍細胞と適合性であり、例えば、サイトカイン又は癌治療剤のためのコード配列を発現させ、そして腫瘍細胞中で安定に、又は比較的安定に維持されることができる。望ましくは、ベクターは複製開始点を含み、そしてベクターは、ベクターがそれによって同定されそして選択される、「マーカー」又は「選択的マーカー」機能をも含んでも、含まなくてもよい。いかなる選択的マーカーが使用可能であっても、そのような発現ベクター中で使用される選択的マーカーは、一般に当業者に知られており、適切な選択的マーカーの選択は宿主細胞に依存するであろう。抗生物質又は他のトキシンに対する耐性を与えるタンパク質をコードする選択的マーカー遺伝子の例は、アンピシリン、メトトレキセート、テトラサイクリン、ネオマイシン(Southern and Berg, J., 1982)、マイコフェノール酸(Mulligan and Berg, 1980)、ピューロマイシン、ゼオマイシン、ヒグロマイシン(Sugden et al., 1985)又はG418を含む。
【0047】
本発明の方法を実施するにあたって、サイトカイン又は追加の癌治療剤をコードする核酸配列を含むベクターがインビトロで細胞、好ましくは腫瘍細胞に移され、それは、エレクトロポーレーション、リポソームとの膜融合、リポフェクタミン処理、DNA-被覆微粒子銃による高速銃、リン酸カルシウム−DNA沈殿とのインキュベーション、DEAE−デキストランを介するトランスフェクション、修飾されたウイルス核酸による感染、単一の細胞への直接のマイクロインジェクションなどを非制限的に含む多数の方法のいずれかを使用する。本明細書に特別に参考文献として援用されているAusubel, et al., 1992及びSambrook, et al, 1989,に記載されたような組換えDNA技術を用いて天然のタンパク質の修飾された形態をクローニング及び発現させる方法は、一般的に当業者に知られている。
【0048】
「組換えの」というベクター又は他のDNA配列への言及は、典型的には自然から単離された形態又は自然に見出される形態として作動可能に連結されていないDNA配列の作動可能な連結を認めるだけのことである。「プロモーター」は、RNAポリメラーゼの結合を指示し、それによってRNA合成を促進するDNA配列である。「エンハンサー」は、隣接する遺伝子の転写を刺激又は阻害するシス作用性の要素である。転写を阻害するエンハンサーは「サイレンサー」とも呼ばれる。エンハンサーは、コード配列からそして転写領域の下流の位置から数キロ塩基対(kb)以下の距離にわたって、どちらの方向にも機能することができる(すなわち、コード配列に作動可能に連結されている)。制御(発現/調節)配列が転写、そして適宜、核酸配列の翻訳を制御する場合、制御(発現/調節)配列は、核酸コード配列に作動可能に連結されている。したがって、発現/調節配列は、プロモーター、エンハンサー、転写終結区、コード配列の前の開始コドン(すなわち、ATG)、イントロンのためのスプライシングシグナル及び停止コドンを含むことができる。
【0049】
本発明の細胞ワクチンの製造のための組換えベクターは、ベクターが導入された腫瘍細胞中でサイトカイン又は癌治療剤のためのコード配列が適切に転写されそして翻訳されるように、すべての適切な転写、翻訳及びプロセシングシグナル(例えば、スプライシング及びポリアデニル化シグナル)を提供する。宿主細胞中での適切な発現を確実にするためのそのようなシグナルの操作は、当業者の能力の範囲内にある。サイトカイン及び癌治療剤のためのコード配列は、それ自身の天然のプロモーター或いはサイトメガロウイルス(CMV)即時早期(cytomegalovirus (CMV) immediate early)プロモーター/エンハンサー、ラウス肉腫ウイルス長端末反復(Rous sarcoma virus long terminal repeat(RSV-LTR))又はSV-40プロモーターなどの構成的プロモーターを含む非天然の(すなわち、異種性の)プロモーターの制御の下にある(すなわち、作動可能に連結されている)ことができる。
【0050】
或いは、組織特異的プロモーター(特別な種類の組織において優先的に活性化され、その組織において遺伝子産物を発現するプロモーター)が、ベクター中で使用されることができる。そのようなプロモーターは、非制限的に、肝臓特異的プロモーター(Ill CR et al., Blood Coagul Fibrinolysis 8 Suppl 2: S23-30, 1997)及びEF-1アルファプロモーター(それぞれが特別に参考文献として本明細書中に援用されている、Kim DW et al., Gene. 91(2):217-23, 1990, Guo ZS et al., Gene Ther. 3(9):802-10, 1996;米国特許第5,266,491号及び同第5,225,348号)を含む。誘導可能なプロモーターも、本明細書に記載の方法の実施において有用性を見出し、それらは、記載されたtet‐オン又はtet-オフシステム中のtet応答配列(TRE)を含むプロモーター(Clon Tech and BASF)、一定の金属塩を加えることによってアップレギュレーションされることのできるメタロチオネインプロモーター、及びラパマイシン誘導性プロモーター(Rivera et al., 1996, Nature Med, 2(9):1028-1032; Ye et al., 2000, Science 283: 88-91; Sawyer TK et al., 2002, Mini Rev Med Chem. 2(5):475-88)などのプロモーターである。本発明の実施において使用される多数の好適な組織特異的又は制御可能なベクター及びプロモーターは、当業者に知られており、多くが商業的に入手可能である。
【0051】
本発明の実施に使用される例示的なベクター系は、本明細書中に特別に参考文献として援用された、米国特許第5,637,483号に記載のレトロウイルスMFGベクターを含む。他の有用なレトロウイルスベクターは、それぞれが特別に参考文献として本明細書中に援用されている、米国特許第5,637,483号(特に、実施例12)、同第6,506,604号、同第5,955,331号及び米国特許出願第09/612808号に記載された、pLJ、pEm、及び[アルファ]SGCを含む。
【0052】
本発明の実施に使用されるさらなる例示的ベクター系は、本明細書中に特別に参考文献として援用された、米国特許第6,428,953号、同第5,665,577号及び同第5,981,276号、及びPCT国際特許出願公開第WO00/72686号に記載の第2、第3及び第4世代のレンチウイルスベクターを含む。
【0053】
本発明の実施に使用されるさらなる例示的ベクター系は、例えば、それぞれが本明細書中に特別に参考文献として援用された、米国特許第5,872,005号及びPCT国際特許出願公開第WO00/72686号に記載のアデノウイルスベクターを含む。
【0054】
本発明の実施において好ましいなおさらなる例示的ベクター系は、例えば、それぞれが本明細書中に特別に参考文献として援用された、PCT国際特許出願公開第WO98/46728号、同第WO00/72686号、Samulski et al., Virol. 63:3822-3828(1989)及び米国特許第5436146号、同第5753500号、同第6037177号、同第6040183号及び同第6093570号に記載された組換えアデノ関連ベクター(rAAV)系である。
【0055】
サイトカイン
サイトカイン及びサイトカインの組み合わせは、免疫系の刺激において重要な役割を果たすことが示されている。「サイトカイン」という用語は、宿主中に存在する腫瘍への免疫応答を亢進又は修飾する(糖たんぱく質のような修飾タンパク質を含む)いかなる免疫賦活タンパク質もさすものとして当業者に理解されている。サイトカインは、典型的には、免疫系の細胞の活性を活性化又は亢進することによって、免疫応答を亢進又は修飾し、それ自身は宿主に対して免疫原性でない。
【0056】
本明細書中に示された結果から、多様なサイトカインが本発明における用途を見出すであろう。本発明の実施において使用される例示的なサイトカインは、非制限的に、IFN-アルファ、IFN-ベータ、及びIFN-ガンマ、インターロイキン(例えば、IL-1〜IL-29、特に、IL-2、IL-7、IL-12、IL-15及びIL-18)、腫瘍壊死因子(例えば、TNF-アルファ及びTNF-ベータ)、エリスロポエチン(EPO)、MIP3a、マクロファージコロニー刺激因子(M-CSF)、顆粒球コロニー刺激因子(G-CSF)並びに顆粒球‐マクロファージコロニー刺激因子(GM-CSF)を含む。サイトカインはいずれの供給源からのものでもよいが、サイトカインはマウス又はヒト由来(天然のヒト又はマウスサイトカイン)或いは、サイトカインがヒトの形態のサイトカインに実質的に相同の配列を有し、そして免疫系に対して類似の活性を示す限り、そのようなサイトカインの配列変異体であることが最適である。そこから、相同性の形態が免疫系に対して同じ又は類似の活性を示す限り、ヒトの形態のIFN-アルファ、IFN-ベータ、及びIFN-ガンマ、IL-1〜IL-29、TNF-アルファ、TNF-ベータ、EPO、MIP3a、ICAM、M-CSF、G-CSF並びにGM-CSFに実質的に相同であるサイトカインは、本発明の実施において有用であると結論される。いずれかの特別なサイトカインに実質的に類似するが、タンパク配列における比較的小さな変化を有するタンパク質は、本発明における用途を見出す。タンパク配列における小さな変更は、タンパク質分子の機能的活性を妨害せず、そしてしたがって、本発明におけるサイトカインのように機能するが、現在知られた又は天然の配列とはわずかに異なる、タンパク質を作ることができることはよく知られている。
【0057】
変異体配列
天然のヒト又はマウスサイトカインの相同体及び変異体並びに追加の癌治療剤は、本発明の範囲内に含まれる。本明細書中で使用されるとおり、「配列の同一性」という用語は、2つ以上の整列された配列間の核酸又はアミノ酸配列の同一性を意味し、典型的には、パーセンテージ(「%」)で表される。「相同性%」という用語は、本明細書において「同一性%」又は「配列同一性%」という用語と交換可能に使用され、配列の整列プログラムを用いて整列化された場合の、2つ以上の整列された配列間の核酸又はアミノ酸配列の同一性のレベルをさす。例えば、本明細書中で使用されるとおり、80%の相同性は、定義されたアルゴリズムにより決定された80%配列同一性と同じことを意味し、そしてしたがって、ある配列の相同体は、本明細書中に記載のとおり、典型的にその配列の長さにわたって80%超の配列同一性を有する。配列同一性の好ましいレベルは、天然のサイトカイン又は癌治療剤のアミノ酸配列又は核酸配列に対する80、85、88、89、90、91、92、93、94、95、96、97、98、又は99%以上の配列同一性を含むが、これらに限られない。
【0058】
2つの配列間の同一性の程度を決定するために使用されることのできる例示的なコンピュータープログラムは、そのすべてがインターネット上で公的に利用可能なBLASTN、BLASTX、TBLASTX、BLASTP、及びTBLASTNなどの一揃いのBLASTプログラムを含むが、これらに限られない。本明細書中に特別に参考文献として援用されている、Altschul, S.F. et al. Mol. Biol. 215:403-410, 1990及びAltschul, S.F. et al., Nucleic Acids Res. 25:3389-3402, 1997も参照のこと。配列の調査は、ある核酸配列をGenBank DNA Sequence及び他の公的なデータベース中の核酸配列に対して評価する場合、典型的には、BLASTNプログラムを用いて実施される。BLASTXプログラムは、すべてのリーディングフレームにおいて翻訳された核酸配列を、GenBank Protein Sequences 及び他の公的なデータベース中のアミノ酸配列に対して調査するのに好適である。配列同一性の決定において、BLASTN及びBLASTX(すなわち、バージョン2.2.5)は両方とも11.0のギャップ開始ペナルティ(open gap penalty)、及び1.0のギャップ延長ペナルティ(extended gap penalty)を用いて実行され、そしてBLOSUM-62マトリックスを利用する(上記のAltschul, et al, 1997を参照のこと)。2つ以上の配列間の「同一性%」を決定するための選ばれた配列の好ましい整列化は、例えば、10.0のギャップ開始ペナルティ、0.1のギャップ延長ペナルティ、及びBLOSUM30類似性マトリックスを含む、デフォルトパラメータを用いて実行されるMacVector バージョン6.5中のCLUSTAL-Wプログラムを用いて実施される。
【0059】
中度〜高度にストリンジェントなハイブリダイゼーション条件及び洗浄条件下で、2つの配列が相互に特異的にハイブリダイズする場合、核酸配列は、参照核酸配列に対して「選択的にハイブリダイズ可能」であると考えられる。ハイブリダイゼーション条件は、核酸結合複合体又はプローブの融点(Tm)に基づく。例えば、典型的に、「最大ストリンジェンシー」は約TM-5℃(プローブのTmより5℃低い)、「高ストリンジェンシー」はTmよりも約5〜10℃低く、「中ストリンジェンシー」はプローブのTmよりも約10〜20℃低く、そして「低ストリンジェンシー」はTmよりも約20〜25℃低い温度で起こる。機能的には、最大ストリンジェンシー条件はハイブリダイゼーションプローブと厳密に同一又は厳密に近く同一な配列を同定するために使用されることができるが、高ストリンジェンシー条件は、プローブと約80%以上の配列同一性を有する配列を同定するために使用される。高ストリンジェンシー条件の例は、約42℃において、50%ホルムアミド、5×SSC、5×Denhardt溶液、0.5%SDS及び100μg/ml変性キャリアーDNA中でハイブリダイゼーション、続いて室温において2×SSC及び0.5%SDSで二回洗浄し、そして42℃において0.1×SSC及び0.5%SDSでさらに二回洗浄することを含む。中及び高ストリンジェンシーハイブリダイゼーション条件は、当業者に周知である。例えば、(本明細書中に特別に参考文献として援用されている)Sambrook, et al., 1989, Chapters 9 及び 11、そしてAusubel, F. M. et al., 1993, を参照のこと。
【0060】
1つ以上の追加の剤又は治療
本明細書中に記載のとおり、本発明は、サイトカイン発現細胞ワクチン(例えば、GM-CSF;GVAX(登録商標))及び少なくとも1つの追加の癌治療剤又は治療を患者に同時投与することによって、癌(例えば、標的癌抗原)に対する個体の免疫応答を改善する方法を目的とする。本発明の実施において使用される癌治療剤又は治療は、接着分子又はアクセサリー分子、他の生物学的応答調節物質、化学療法剤、放射線療法並びにそれらの組み合わせを含むがこれらに限られない。
【0061】
癌治療剤
本発明の実施態様は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤の組み合わせの投与を含む。本発明の実施において使用される癌治療剤は、表1A及び1Bに列挙されたものを含む。これらは、アルキル化剤、アルカロイド、抗代謝剤、抗腫瘍抗体、ニトロソ尿素、ホルモンアゴニスト/アンタゴニスト及びアナログ、免疫調節剤、光増感剤、酵素などを含む、癌治療剤の主要な各クラスからの剤を含むがこれらに限定されない。いくつかの好ましい実施態様において、癌治療剤は、サイトカイン又は共刺激分子である。他の好ましい実施態様においては、癌治療剤は例えば、CpG(細菌のDNAを擬態するCGジヌクレオチド);HSP(熱ショックタンパク質);COX-2阻害剤;抗4-1BBmAb;IL-2、IL-18;抗CTLA−4モノクローナル抗体;抗CD40又は膜/可溶性CD40リガンド;インターフェロンアルファ(IFN-アルファ);イレッサ:抗−上皮細胞成長因子R(EGF-R);或いは抗VEGF Rである。好ましい癌治療剤は、5−フルオロウラシル、シスプラチン、ドキソルビシン、エストラムスチン、エトポシド、ミトキサントロン、ドセタキセル(TAXOTERE(商標))、パクリタキセル(TAXOL(商標))、及びレトロ‐ガットレスアデノ、IL-15、ケモ‐タキソテレ、及びエラストムスチン(+ステロイド)を含むがこれらに限られない。
【0062】
【表1】

【0063】
【表2】

【0064】
【表3】

【0065】
【表4】

【0066】
細胞ワクチンの組み合わせ
顆粒球−マクロファージコロニー刺激因子(GM-CSF)は、線維芽細胞、内皮細胞、T細胞及びマクロファージにより産生されるサイトカインである。このサイトカインは、顆粒球及びマクロファージ系の造血細胞の増殖を誘導することが示されている。さらに、それは、免疫系の主要抗原提示細胞(APC)である樹状細胞の抗原プロセシング及び抗原提示機能を活性化する。動物モデル実験の結果は、GM-CSFを産生する腫瘍細胞(すなわち、GVAX(登録商標))が親である非形質導入腫瘍細胞に対する免疫応答を誘発できることを断定的に示した。
【0067】
癌の治療のために続いて患者に再投与されるサイトカイン、例えばGM-CSFを発現するように遺伝的に修飾された自己の又は同種異系の癌細胞が、本明細書中に特別に参考文献として援用されている米国特許第5,637,483号、同第5,904,920号及び同第6,350,445号に記載されている。膵臓癌の治療のための、遺伝的に修飾されたGM-CSF発現腫瘍細胞又は「サイトカイン‐発現細胞ワクチン」の形態が、本明細書に特別に参考文献として援用されている米国特許第6,033,674号及び同第5,985,290号に記載されている。普遍的な免疫調節性サイトカイン発現バイスタンダー細胞系は、本明細書に特別に参考文献として援用されている米国特許第6,464,973号に記載されている。GM-CSFを発現する自己の又は同種異系の細胞ワクチン(GVAX(登録商標))を使用する臨床試験が、前立腺癌、メラノーマ、肺癌、膵臓癌、腎臓癌、及び多発性骨髄腫の治療のために行われ、これらの試験の多くが現在進行中であるが、GM-CSFに対する免疫応答単独で急速に成長する悪性度を遅くするか又は根絶するのに十分に強力であるか否かについての疑問はいまだ解決されないままである。
【0068】
本発明は、哺乳動物、好ましくはヒトの患者において癌への免疫応答を刺激する改善された方法を提供する。望ましくは、該方法は癌への全身性の免疫応答、すなわち、T細胞の応答及び/又はB細胞の応答を発生させる。該方法は、患者にサイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療を投与することを含み、ここで、該細胞ワクチンは1つ又はさまざまな癌抗原を発現する細胞を含み、該癌抗原は、治療中の患者において見出される癌の抗原のうちの一つであることができる。細胞は、放射線照射などによって増殖不能とさせられる。該組成物の投与によって、癌への免疫応答が誘発され、又は亢進される。1つのアプローチにおいて、サイトカイン発現細胞ワクチンの組み合わせは、サイトカイン及び少なくとも1つの追加の癌治療剤を発現するように修飾された単一の細胞集団を含む。他のアプローチにおいては、ワクチンはそれぞれがワクチンの成分を一つ発現するように修飾された2つ以上の細胞集団を含む。さらに他のアプローチにおいては、サイトカイン発現細胞ワクチンの組み合わせは、少なくとも1つの追加のがん治療剤又は治療とともに投与されるサイトカインを発現するように修飾された細胞集団を含む。
【0069】
一般に、本発明の実施において使用されるためのサイトカイン発現細胞ワクチンの組み合わせは、自己の腫瘍細胞、同種異系の腫瘍細胞及び腫瘍細胞株(すなわち、バイスタンダー細胞)から成る群から選ばれる腫瘍細胞を含む。
【0070】
いくつかの実施態様においては、サイトカイン発現細胞ワクチンの組み合わせの細胞は、投与の前に凍結保存される。本発明の1つの側面においては、サイトカイン発現細胞ワクチンの組み合わせの細胞は、それらが由来する(自己の)同じ個体に投与される。本発明の他の側面においては、サイトカイン発現細胞ワクチンの組み合わせの細胞及び腫瘍は、異なる個体(同種異系の又はバイスタンダー)から誘導される。好ましいアプローチにおいては、治療される腫瘍は、膀胱、乳房、結腸、腎臓、肝臓、肺、卵巣、頚部、膵臓、直腸、前立腺、胃、表皮の癌;リンパ系又は骨髄系の造血系の腫瘍;繊維肉腫又は横紋筋肉腫のような間葉由来の腫瘍;メラノーマ、テラトカルシノーマ、神経芽細胞腫、グリオーマ、アデノカルシノーマ及び非小細胞肺癌からなる群から選ばれる。
【0071】
本発明の1つの側面において、サイトカイン発現細胞ワクチンの組み合わせの細胞は、サイトカインの発現のための1つのタイプの遺伝子修飾された細胞及び1つ以上の追加の癌治療剤の発現のための他の異なるタイプの細胞の遺伝子修飾された細胞を含む。例えば、一つのアプローチにおいては、サイトカイン発現細胞ワクチン(すなわち、GVAX(登録商標))は、同種異系の又はバイスタンダー細胞株として提供される一方、1つ以上の追加の癌治療剤は自己の細胞によって発現される。他のアプローチにおいては、1つ以上の追加の癌治療剤は、自己の又はバイスタンダー細胞株によって発現されるが、サイトカイン(すなわち、GM-CSF)は自己の細胞によって発現される。
【0072】
先の研究において、多様なサイトカインによって形質導入されたマウス腫瘍細胞を直接比較したところ、GM-CSFを分泌する腫瘍細胞が全体として最高の腫瘍に対する防御を誘発したことが実証された。1つの好ましい実施態様において、本発明のサイトカイン発現細胞ワクチンによって発現されたサイトカインは、GM-CSF(本明細書中では一般に「GVAX(登録商標)と称される)である。GM-CSFのための好ましいコード配列は、Huebner K. et al., Science 230(4731):1282-5,1985に記載のゲノム配列である。或いは、GM-CSFのcDNA形態も本発明の実施において有用性を見出す(Cantrell et al., Proc. Natl. Acad. Sci., 82, 6250-6254, 1985)。
【0073】
投与の前に、本発明のサイトカイン発現細胞ワクチンの組み合わせの細胞は、増殖不能とさせられる。細胞の増殖能力を失わせる方法が数多く知られている一方、放射線照射が好ましい方法である。好ましくは、サイトカイン発現細胞ワクチンの組み合わせは約50〜約200ラド/分、より好ましくは約120〜約140ラド/分で、患者の投与前に照射される。最も重要なのは、実質的に100%の細胞の増殖、さらなる増殖を阻害するのに十分な総放射線量で、細胞が照射されることである。したがって、細胞は約10,000〜20,000ラド、最適には約15,000ラドの総量を照射されることが望ましい。
【0074】
自己の
本発明のワクチン中での自己のサイトカイン発現細胞の使用は、利益を提供し、それは各患者の腫瘍が、他の患者由来の形態学的に類似した、MHC適合性の腫瘍細胞に見出されるものとは異なることのできる、独特の腫瘍抗原の組を発現するためである。例えば、Kawakami et al.J. Immunol., 148, 638-643(1992); Darrow et al., J. Immunol., 142, 3329-3335(1989);及びHom et al., J. Immunother., 10, 153-164(1991)を参照のこと。対照的に、MHC-適合性の腫瘍細胞は、ワクチン製造のためにその腫瘍のサンプルを得るための手術を患者が受ける必要がないという利点を提供する。
【0075】
1つの好ましい側面において、本発明は、以下のステップを実施することによって癌を治療する方法を含む:(a)腫瘍を有する哺乳動物、好ましくはヒトから腫瘍細胞を得て;(b)非修飾腫瘍細胞に比べて、サイトカインを産生し又は細胞によって天然に産生されるサイトカインのレベルを増加させ、そして少なくとも1つの追加の癌治療剤を産生することができるように、該腫瘍細胞を修飾し;(c)該修飾された腫瘍細胞を増殖不能とし;そして、(d)該修飾された腫瘍細胞を、その腫瘍細胞が得られた哺乳動物に、又はその腫瘍細胞が得られた哺乳動物と同じMHCタイプを有する哺乳動物に再投与すること。投与された腫瘍細胞は、宿主の自己の、又は宿主に対してMHC適合性のものである。
【0076】
同じ自己の腫瘍細胞がサイトカイン及び癌治療剤の両方を発現することができ、又はサイトカイン及び1つ以上の癌治療剤は異なる自己の腫瘍細胞集団によって発現されることができる。本発明の1つの側面において、自己の腫瘍細胞は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結されたサイトカインをコードする核酸配列を含むベクターを導入することによって修飾される。他の側面においては、同じ自己の腫瘍細胞が、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結された少なくとも1つの追加の癌治療剤をコードする核酸配列を含むベクターを導入することによって修飾される。さらなる側面においては、第二の自己の腫瘍細胞が、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結された少なくとも1つの追加の癌治療剤をコードする核酸配列を含むベクターを導入することによって修飾される。サイトカイン及び追加の癌治療剤をコードする核酸配列は、同じ又は異なるベクターを用いて同じ又は異なる自己の腫瘍細胞に導入されることができる。サイトカイン又は癌治療剤をコードする核酸配列は、プロモーターに作動可能に連結された選択的マーカー配列をさらに含んでも含まなくてもよい。
【0077】
同種異系の
Jaffee et al., Seminars in Oncology, 22, 81-91(1995)に記載のとおり、研究者らは腫瘍ワクチンとしての自己の細胞及びMHC-適合性細胞の代替物を探索した。初期の腫瘍ワクチン戦略は、腫瘍細胞の接種が、それらのMHCクラスI及びII分子によって抗原提示細胞(APC)として機能しそして腫瘍抗原を提示し、そして直接的に免疫系のT細胞部門を活性化するという理解に基づいていた。Huang et al(Science, 264, 961-965, 1994)の結果は、腫瘍細胞の接種よりも宿主の専門のAPCが、GM-CSFのようなサイトカインを分泌して骨髄由来のAPCが腫瘍領域に補充されるようにすることによって免疫細胞のT細胞部門の準備を整えることを示している。骨髄由来のAPCは、プロセシングのために腫瘍のすべての細胞タンパク質を取り込み、そしてそのMICクラスI及びII分子上に抗原ペプチドを提示し、それによって、免疫系のCD4+及びCD8+T細胞部門の両方の準備を整え、結果として癌に特異的な全身性の抗腫瘍免疫応答が起こる。これらの結果は、癌に対する免疫応答を誘発するためには、自己の又はMHC適合性腫瘍細胞を使用することは必要でも最適でもないかも知れず、そして(遺伝的に非類似の同じ種の個体からの)同種異系のMHC遺伝子の転移が腫瘍免疫性を亢進することができることを示唆する。より特別には、上記のJaffee et al及び上記のHuang et al中で考察されているとおり、一定の場合には、同種異系のMHCクラスI分子を発現する腫瘍の拒絶は、非修飾の親腫瘍によるその後のチャレンジに対する全身性の免疫応答を亢進させる。
【0078】
本明細書に記載のとおり、「腫瘍細胞株」は、最初に腫瘍に由来する細胞を含む。そのような細胞は、典型的には形質転換されている(すなわち、培養中で不確定の増殖を示す)。
【0079】
1つの好ましい側面において、本発明は、以下のステップを実施することによる癌の治療方法を提供する:(a)腫瘍細胞株を得て;(b)該腫瘍細胞株を修飾して、非修飾の腫瘍細胞株に比べて増加したレベルのサイトカイン単独又はサイトカインと少なくとも1つの追加の癌治療剤の組み合わせを産生することができるようにし;(c)修飾された腫瘍細胞株を増殖不能とし;そして(d)該腫瘍細胞株が得られたのと同じタイプの腫瘍である少なくとも1つの腫瘍を有する宿主、又は該腫瘍細胞株と宿主の腫瘍が少なくとも1つの共通の抗原を発現する宿主に該腫瘍細胞株を投与すること。投与された腫瘍細胞株は、同種異系であり、宿主に対してMHC適合性でない。そのような同種異系の株は、よく特徴づけされた細胞の患者への投与が可能であるように、それらが前もって調製され、特徴づけされ、既知の数のサイトカイン発現細胞を含むバイアル中に等量ずつ分けられ、そして保存されることができるという利益を提供する。遺伝子修飾された同種異系の細胞の生産方法は、例えば、本明細書中に特別に参考文献として援用されているPCT国際特許出願公開第WO00/72686A1号に記載されている。
【0080】
遺伝子修飾された同種異系の細胞を含むサイトカイン発現細胞ワクチンを調製するための1つのアプローチにおいて、サイトカイン及び治療剤をコードする核酸配列が、同種異系の(すなわち、治療される個体以外の個体からの)腫瘍細胞株である細胞株に導入される。他のアプローチにおいては、サイトカイン及び治療剤をコードする核酸配列が、別の(すなわち、異なる)同種異系の腫瘍細胞株に導入される。細胞又は細胞集団は、治療される腫瘍又は癌と同じタイプの腫瘍細胞株からのものであることができる。腫瘍及び/又は腫瘍細胞株は、膀胱、乳房、結腸、腎臓、肝臓、肺、卵巣、頚部、膵臓、直腸、前立腺、胃、表皮の癌;リンパ系又は骨髄系の造血系の腫瘍;繊維肉腫又は横紋筋肉腫のような間葉由来の腫瘍;メラノーマ、テラトカルシノーマ、神経芽細胞腫、グリオーマ、アデノカルシノーマ及び非小細胞肺癌を含む他の腫瘍を含むが、これらに限られないいずれかの形態であることもできる。
【0081】
本発明の1つの側面において、同種異系の腫瘍細胞は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結されたサイトカインをコードする核酸配列を含むベクターを導入することによって修飾される。他の側面において、同じ同種異系の腫瘍細胞又は第二の同種異系の腫瘍細胞は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結された少なくとも1つの追加の癌治療剤をコードする核酸配列を含むベクターを導入することによって修飾される。サイトカイン及び追加の癌治療剤をコードする核酸配列は、同じ又は異なるベクターを用いて、同じ又は異なる同種異系の腫瘍細胞中に導入されることができる。サイトカイン又は癌治療剤をコードする核酸配列は、プロモーターに作動可能に連結された選択的マーカー配列をさらに含んでも含まなくてもよい。
【0082】
望ましくは、同種異系の細胞株は、200〜1000ng/106細胞/24時間の範囲内のGM-CSFを発現する。好ましくは、普遍的なバイスタンダー細胞株は、少なくとも約200ngGM-CSF/106細胞/24時間を発現する。
【0083】
本発明の実施においては、1つ以上の同種異系の細胞株が自己の癌抗原、例えば、(同種異系の細胞株組成物をともに含む)自己の腫瘍細胞とともにインキュベートされ、そして同種異系の細胞株組成物が患者に投与される。典型的には、癌抗原は、治療される癌の細胞、すなわち、自己の癌細胞によって(上に)提供される。そのような場合、組成物は放射線照射によって増殖不能とさせられ、ここで、該同種異系の細胞及び癌細胞は組織培養プレート中に蒔かれ、上記で詳述したCs供給源を用いて室温において放射線照射される。ある投与における同種異系の細胞の自己の癌細胞に対する比率は、その組み合わせによって変化するであろう。
【0084】
同種異系の細胞株組成物を患者に導入するためには、いかなる好適な投与経路も使用可能であり、好ましくは、該組成物は皮下に又は腫瘍内に投与される。
【0085】
本発明の実施における同種異系の細胞株の使用は、サイトカイン発現同種異系細胞株及び(同じ又は異なる細胞株によって発現された)少なくとも1つの追加の癌治療剤を、自己の癌抗原とともに癌患者に投与し、免疫調節性サイトカインのパラクリン産生を介して、腫瘍に対する有効な免疫応答を生じるという治療的利益を提供する。これは、各患者について自己の腫瘍細胞を培養しそして形質導入する必要性を取り除き、多様で非効率的な形質導入効率の問題を除去する。
【0086】
バイスタンダー
1つのさらなる側面において、本発明は、普遍的な免疫調節性サイトカイン発現バイスタンダー細胞株及び少なくとも1つの追加の癌治療剤を発現するバイスタンダー細胞株を提供する。同じ普遍的なバイスタンダー細胞株がサイトカイン及び癌治療剤の両方を発現することができるか、又はそれぞれは異なる普遍的なバイスタンダー細胞株によって発現されることができる。普遍的なバイスタンダー細胞株は、天然に主要組織適合性クラスI(MHC-I)抗原及び主要組織適合性クラスII(MHC-II)抗原を欠いている細胞、又はMHC-I及びMHC-II抗原を欠くように修飾された細胞のいずれかを含む。本発明の1つの側面において、普遍的なバイスタンダー細胞株は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結されたサイトカインをコードする核酸配列を含むベクターを導入することによって修飾される。他の側面においては、同じ普遍的なバイスタンダー細胞株又は第二の普遍的なバイスタンダー細胞株は、プロモーター及びその発現に必要な発現/調節配列に作動可能に連結された少なくとも1つの追加の癌治療剤をコードする核酸配列を含むベクターを導入することによって修飾される。サイトカイン及び追加の癌治療剤をコードする核酸配列は、同じ又は異なるベクターを用いて同じ又は異なる普遍的なバイスタンダー細胞株へ導入されることができる。いくつかの場合には、バイスタンダーアプローチは、自己の又は同種異系のアプローチと組み合わせられる。例えば、サイトカインをコードする自己の、又は同種異系の又はバイスタンダー細胞株は、1つ以上の癌治療剤をコードする自己の、同種異系の又はバイスタンダー細胞株と組み合わせられることができる。サイトカイン又は癌治療剤をコードする核酸配列は、プロモーターに作動可能に連結された選択的マーカー配列をさらに含んでも含まなくてもよい。抗腫瘍免疫応答を刺激するサイトカイン及び癌治療剤の組み合わせは、本発明の実施において有用性を見出す。普遍的なバイスタンダー細胞株は、ディファインド培地、すなわち、血清を含まない、好ましくは懸濁液としての培地中で増殖することが好ましい。
【0087】
好ましい普遍的なバイスタンダー細胞株の例は、K562(ATCC CCL-243;Lozzio et al., Blood 45(3): 321-334(1975);Klein et al., Int. J. Cancer 18:421-431(1976))である。ヒトバイスタンダー細胞株の詳細な説明は、例えば、米国特許第6,464,973号及びPCT国際特許出願公開第WO9938954号中に記載されている。望ましくは、普遍的なバイスタンダー細胞株は、サイトカイン、例えばGM-CSFを200〜1000ng/106細胞/24時間の範囲内で発現する。好ましくは、普遍的なバイスタンダー細胞株は、少なくとも約200ngのGM-CSF/106細胞/24時間を発現する。
【0088】
本発明の実施において、1つ以上の普遍的なバイスタンダー細胞株が、自己の癌抗原、例えば、(普遍的なバイスタンダー細胞株組成物をともに含む)自己の腫瘍細胞とともにインキュベートされ、そして普遍的なバイスタンダー細胞株組成物が患者に投与される。普遍的なバイスタンダー細胞株組成物を患者に導入するためには、いかなる好適な投与経路も使用可能である。好ましくは、該組成物は皮下に又は腫瘍内に投与される。
【0089】
典型的には、癌抗原は、治療される癌の細胞、すなわち、自己の癌細胞によって(上に)提供される。そのような場合、組成物は放射線照射によって増殖不能とさせられ、ここで、バイスタンダー細胞及び癌細胞は組織培養プレート中に蒔かれ、上記で詳述したCs供給源を用いて室温において放射線照射される。
【0090】
ある投与におけるバイスタンダー細胞の自己の癌細胞に対する比率は、その組み合わせによって変化するであろう。GM-CSF産生バイスタンダー細胞に関しては、或る投与におけるバイスタンダー細胞の自己の癌細胞に対する比率は、少なくとも36ngのGM-CSF/106細胞/24時間が産生されるようなものでなければならない。一般に、GM-CSFの濃度がこれよりも低い場合、治療効果は低下する。GM-CSFの閾値に加えて、バイスタンダー細胞の自己の癌細胞に対する比率は1:1以下でなくてはならない。バイスタンダー細胞対腫瘍細胞又は腫瘍抗原の好適な比率は、本分野における日常的な方法を使用して決定されることができる。
【0091】
本発明の実施におけるバイスタンダー細胞株の使用は、サイトカイン発現バイスタンダー細胞株及び(同じ又は異なる細胞株によって発現された)少なくとも1つの追加の癌治療剤を、自己の癌抗原とともに癌患者に投与し、免疫調節性サイトカインのパラクリン産生を介して、腫瘍に対する有効な免疫応答を生じるという治療的利益を提供する。これは、各患者について自己の腫瘍細胞を培養しそして形質導入する必要性を取り除き、多様で非効率的な形質導入効率の問題を除去する。
【0092】
動物モデルにおける組み合わせの評価
B16F10メラノーマモデル
1つのアプローチにおいて、サイトカイン発現細胞ワクチンの組み合わせの有効性が、治療的設定において同系のB16F10メラノーマ腫瘍モデルにおける動物試験を実施することによって評価される。例えば、Griswold DP Jr., Cancer Chemother Rep 2; 3(1): 315-24, 1972及びBerkelhammer J et al., Cancer Res 42(8): 3157-63, 1982を参照のこと。マウスメラノーマ細胞株B16は、詳細に明らかにされた細胞株であって、同系のC57BL6マウスにおいて弱い免疫原性を有し、したがって、C57BL6マウスにおいて容易に腫瘍を形成する。さらに、腫瘍並びに抗原特異的な免疫応答をモニターすることのできるこのモデルにおいて、いくつかの腫瘍関連抗原が同定された。さらに、いくつかのマウス特異的試薬は商業的に入手可能であり、さまざまなワクチン戦略において腫瘍に対する免疫応答をモニターするために使用される。B16F10メラノーマ腫瘍モデルにおける典型的な研究は、統計学的に有意な結果を得るために、1群あたり少なくとも6匹、そして一般に10〜15匹のマウスを使用する。統計学的な有意性は、スチューデントのT検定を用いて評価される。
【0093】
C57BL/6マウスに放射線照射されたGM-CSF分泌B16F10腫瘍細胞を接種すると、強力で持続性、且つ特異的な抗腫瘍免疫性を刺激し、それは続いて野生型B16F10細胞でチャレンジしたほとんどのマウスにおける腫瘍の増殖を予防した。しかしながら、GM-CSF産生腫瘍細胞ワクチンが既存の腫瘍負荷を有するマウスに投与された場合、この防御の有効性はより低い。B16F10メラノーマ腫瘍モデルを用いる試験の実施においては、雌性C57BL/6マウスはTaconicから入手され、そして各実験の開始時に6〜8週齢である。典型的な実験においては、マウスは、1×105のB16BF10細胞を第0日に背側/前側の位置に皮下注射される。第3日に、マウスは、腹側/後側の位置に1〜3×106の放射線照射された(5000ラド)B16F10又はサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))を接種される。腫瘍の進行及び生存に関してマウスを追跡した。14〜21日後、マウスを屠殺し、マウスの肺を回収し、表面の腫瘍転移を計数し、そして肺重量を測定することによって、かれらの腫瘍負荷を評価した。他のB16F10メラノーマ腫瘍モデルは、B16F10腫瘍細胞の皮下注射を含む。
【0094】
B16F10メラノーマ腫瘍モデルにおける典型的なインビボの試験は、以下の群を採用する:HBSS単独(陰性対照);放射線照射されたB16F10/HBSS(対照);サイトカイン発現細胞ワクチン(GVAX(登録商標))/HBSS(細胞ワクチン単独療法対照);追加のがん治療剤又は治療(治療剤/治療単独療法対照);腫瘍抗原の供給源とともに追加の癌治療剤又は治療;サイトカイン発現細胞ワクチン+癌治療剤又は治療。
【0095】
C57BL6マウスにおける同系のB16メラノーマモデルの実験は、非形質導入B16細胞が完全に無効であった一方、GM-CSFを発現するように遺伝的に修飾されたB16細胞によって免疫性が誘発されたことを示した。GM-CSFを分泌するように操作された、放射線照射されたB16F10メラノーマ細胞のC57BL6マウスへの接種は、非形質導入B16F10でチャレンジされた大多数のマウスにおいて腫瘍の形成を予防する、強力で持続的、且つ腫瘍特異的な免疫性を刺激することが示された(予防モデル;図1A)。しかしながら、放射線照射されたGM-CSF産生腫瘍細胞が、最近確立された表皮の腫瘍を有するマウスに投与された場合(治療モデル;図1B)、防御的な抗腫瘍免疫性の有効性はより低い。動物モデル実験の結果は、GM-CSF産生腫瘍細胞が、それらがB16F10のような非免疫原性の腫瘍細胞であっても、親である非形質転換腫瘍細胞に対する免疫応答を誘発することができることを確信的に示した。
【0096】
先の実験は、HBSS又は放射線照射されたB16F10単独では、チャレンジされたマウスを腫瘍の形成から保護できないことを実証した。GM-CSF発現細胞ワクチン(GVAX(登録商標))は単独で、チャレンジされたマウスの30〜50%を保護することが示された。サイトカイン発現細胞ワクチン+少なくとも1つの追加の癌治療剤又は治療の組み合わせは、腫瘍に対する保護の有効性を増大させることが期待される。保護の程度は、追加の癌治療剤及びサイトカイン発現細胞ワクチンの発現レベル、治療(すなわち、剤の用量及び放射線照射の頻度及び強度)のレベル、並びにサイトカイン発現細胞ワクチン、例えば、GVAX(登録商標)の投与のタイミングに対する(例えば、トランスフェクトされた細胞又はたんぱく質若しくは化学物質のような)追加の癌治療剤の投与の相対的なタイミング及び経路に依存する。
【0097】
免疫学的モニタリング
腫瘍並びに抗原特異的な免疫応答をモニターすることを可能とする、いくつかの腫瘍関連抗原が同定された。例えば、腫瘍抗原特異的なT細胞は、インビトロにおける抗原再刺激に続くIFNガンマの放出によって同定されることができる(Hu, H-M. et al., Cancer Research, 2002, 62: 3914-3919)。腫瘍抗原特異的なT細胞を同定するために使用される新たな方法の他の例は、抗腫瘍免疫応答に関与することが示された特別なペプチドを負荷されることが報告された、MHCテトラマー(Beckman Coulter, Immunomics)としても知られる可溶性のMHC I分子の開発である。B16F10メラノーマ腫瘍モデル内の例は、gp100、Trp2、Trp−1及びチロシナーゼを含むがこれらに限定されない。類似するメラノーマ関連抗原がヒトにおいて同定された。そのようなツールは、臨床的に翻訳されることのできる情報を提供する。
【0098】
B16.OVAモデル
B16.ova及びB16.GM.ova腫瘍は、B16細胞又は膜に結合したオボアルブミンを発現するように修飾されたGM-CSFを発現するB16細胞である。オボアルブミンは、チャレンジに使用される腫瘍細胞上並びにワクチン細胞上の腫瘍関連抗原の代理として作用する。オボアルブミン特異的T細胞は、GM-CSF(B16.GM−ova)を単独で又は他の癌治療剤とともに発現する細胞の存在下又は非存在下において、「腫瘍特異的」T細胞応答を追跡するために使用される。オボアルブミン特異的なT細胞のT細胞受容体を特異的に認識する抗体が、これらの「腫瘍特異的」T細胞を追跡するために使用される。この抗体は、様々なワクチン接種計画に続く、これらの腫瘍特異的T細胞の増殖及びそれらの活性化状態をモニターするために使用されることができる。1つの例示的な実験的アプローチにおいては、オボアルブミン特異的T細胞を第2日に養子移植されたマウスは、B16F10.ovaで第0日にチャレンジされ、第3日にB16G10.GM-ovaを接種され、そしてタキソテレのような少なくとも1つの追加の癌治療剤(6mg/kg)で第5及び第9日に治療され、続いて、ワクチン接種後のさまざまな時点においてOVA特異的T細胞をモニターされる。
【0099】
RIP-Tag自然発症膵島細胞癌モデル
RIP-Tag自然発症膵島細胞癌モデルは、ラットインスリンプロモーター(RIP)下でシミアンウイルス40(SV-40)抗原を発現し、そして膵臓島細胞におけるSV-40癌遺伝子Aの発現の結果として島細胞癌を発生させるように、遺伝的に修飾されたトランスジェニックマウスを使用する。このモデルにおいて、腫瘍の発生はこれらのマウスにおいて13.5週にわたって起こる一連の詳細に明らかにされたステージを通じて進行する。RIP−Tagマウスは、固形癌形成の前の血管新生のスイッチを含む、多数のステップの経路において膵島細胞腺腫及び島細胞癌を発生させる。正常な島細胞の100%がTag癌遺伝子を発現するが、3〜4週齢になるまで異形成の症状を示さない。島細胞の50%の過形成細胞は、10週齢までに現れはじめる。固形癌は12〜3週後に出現し、これは、時々、高い脈管構造及び拡張した易出血性の血管に特徴を有する侵襲性の癌に発達する大きな腺腫へと進行する(Bergers G et al., Science, 1999 Apr 30:284(5415):808-12)。RIP-Tag自然発症膵臓島細胞癌モデルは、サイトカイン発現細胞ワクチンの組み合わせの有効性を評価するために使用されることができる。
【0100】
インビボモデルにおける組み合わせの有効性についてのアッセイ
腫瘍のチャレンジ後、腫瘍の負荷を様々な時点で評価した。典型的には、5日間のインビトロの細胞全体の刺激によってCTL活性について脾細胞を評価する。標的細胞は51Crで標識され、脾臓エフェクターCTLとともにインキュベートされ、そして上清への51Crの放出を標的細胞のCTL溶解の指標とする。第3日にインビトロで刺激されたCTLの上清はCTLによるIFN−ガンマ産生について試験される。すなわち、ウエルはIFN-ガンマ特異的な被覆抗体で被覆され、そして上清がウエルに加えられ、IFN-ガンマ特異的検出抗体を用いてIFN-ガンマが検出される。IFN-ガンマは、細胞特異的IFN-ガンマ産生を測定するためのフローサイトメトリーによっても検出されることができる。
【0101】
有効な抗腫瘍免疫応答の他の指標は、インビトロでの再刺激によるTNF-アルファ、IL-2、及びIFN-ガンマのようなエフェクターサイトカインの産生である。サイトカインレベルは、放射線照射されたGM-CSF発現細胞によってインビトロで48時間再刺激された脾細胞又は流入リンパ節(dLN)細胞からの上清中で測定された。
【0102】
腫瘍特異的T細胞応答をモニターするために使用されるさらなる方法は、細胞内サイトカイン染色(ICS)を介する。ICSは、腫瘍特異的T細胞応答をモニターするため、及び抗原特異的T細胞の非常に低い出現頻度を確認するために使用されることができる。しばしば2〜7日間のインビトロ刺激を必要とするCTL及びサイトカイン放出アッセイとは異なり、ICSは新たに単離された、切除後5時間以内のリンパ細胞において実施されるため、それはインビボにおける腫瘍抗原特異的T細胞の出現頻度を推定するために使用されることができる。これは、異なる腫瘍ワクチン戦略の効力を比較するための強力な技術を提供する。ICSは、多様なメラノーマワクチン戦略に続いて、gp100及びTrp2のようなメラノーマ関連抗原へのT細胞応答をモニターするために使用されてきた。そのようなT細胞は、MHC-Iに結合した腫瘍特異的ペプチドによる刺激に続く、細胞内IFN-ガンマ発現の誘発によって確認されることができる。
【0103】
腫瘍モデルのXenogenイメージング
いくつかの研究において、腫瘍を有するマウスのインビボでのルミネッセンスがB16F10−ルシフェラーゼ(Xenogen Inc.)を注射されたマウスをモニタリングすることによってモニターされる。すなわち、Balb/c nu/nuマウスが、5×104又は2×105個のB16F10−luc細胞を第0日に尾静脈を介して注射される。過剰のルシフェリン基質を1.5mg/gマウス体重で腹腔内注射することによって、マウスは必要に応じて腫瘍の負荷についてモニターされる。典型的な分析においては、基質の注射の20分後、マウスは麻酔され、そしてXenogenIVISイメージングシステム(Xenogen Inc.)ルミネッセンス感受性CCDカメラによってインビボのルミネッセンスについて背側又は腹側位置でモニターされる。データが集められ、そしてLiving Image 2.11 ソフトウエアによって分析される。
【0104】
サイトカイン発現細胞ワクチンの組み合わせ
本発明は、サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+少なくとも1つの追加の癌治療剤又は治療の組み合わせを目的とする。上記剤又は治療は、化学療法剤、癌抗原に対する免疫応答を調節する剤、放射線照射などであることができる。本発明の例示的な実施態様は、サイトカイン発現細胞ワクチン+1つ以上の以下の:抗CTLA-4モノクローナル抗体;抗4-1BBmAb;抗-CD40又は膜/可溶性CD40L;インターフェロンアルファ(IFN-アルファ);IL-2又はIL-18;HSP(熱ショックタンパク質);CpG(細菌DNAを擬態するジヌクレオチド);抗-OX-40又は可溶性/膜結合OX-40リガンド;COX-2阻害剤;イレッサ;イミキモド;ジュバイミュン(Juvaimmune);抗-上皮細胞成長因子R(EGF-R);抗VEGF R又はTRAILを含むが、これらに限られない。例示的な組み合わせは、以下においてさらに詳述される。
【0105】
サイトカイン発現細胞ワクチンと組み合わせられる共刺激分子
自然の免疫応答においては、MHCクラスII分子によって樹状細胞(DC)上に提示されるペプチド抗原と反応性であるCD4+ヘルパーT(Th)細胞は、CD8+CTL免疫の誘発に必要とされるDCの成熟を推進することができる。CTL応答の適切な誘発、拡大及び維持は、CD4+T細胞、DC及びCD8+T細胞の間の相互作用を通じて達成される。そのメカニズムが本発明の部分ではない一方、細胞はDCにより発現されたCD40と相互作用してDCを成熟させるCD40Lのアップレギュレーションを通じてかなりの程度まで機能する。成熟した又は活性化されたDCによって発現されるCD80/CD86は、CD8+T細胞上のCD28共刺激性受容体と相互作用することによってCTL誘発をもたらすことができる。CTLの維持及び完全な拡大のためには、DCにより発現された4-1BBリガンドとCTL上のその受容体4-1BBとの相互作用も重要である。DCの活性化は、例えば、アゴニストである抗CD40抗体或いはLPS(TLR4リガンド)又はオリゴデオキシヌクレオチドを含むCpG-モチーフ(TLR9リガンド)のようなトル様受容体(TLR)のリガンドによって引き起こされることができる。
【0106】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+抗CTLA-4モノクローナル抗体
休止期のT細胞上に低レベルで発現され、T細胞活性化によって誘導されるCTLA4分子は、IL-2産生、IL-2R発現をブロックするネガティブシグナルをT細胞へ伝達し、そして細胞周期の停止を誘発する。CTLA4は、CD28を介する及びCD28を介さないT細胞の活性化の両方を制御し、正常な免疫の恒常性において重要な役割を有する(Bour-Jordan et al., Nature Immunol. 4: 182-188, 2003)。動物モデルにおいては、抗CTLA-4抗体は、免疫原性の腫瘍における腫瘍拒絶を誘発し、抗腫瘍抗体接種と併用することによって最小限に免疫原性の腫瘍の拒絶も誘発することができる。臨床試験は、転移性メラノーマ及びホルモン治療抵抗性前立腺がん(HRPC)の患者の治療のための、ヒトCTLA−4に結合する完全なヒト抗体を用いて開始された。
【0107】
先の報告は、抗CTLA‐4モノクローナル抗体(抗‐CTLA4mAb)又はGM-CSF分泌腫瘍細胞ワクチンのどちらかがB16メラノーマのような非免疫原性腫瘍のための単独療法として使用された場合、マウスの部分的な保護しか提供できないことを示している。本明細書中に示された結果は、GM-CSF分泌B16腫瘍細胞及び抗CTLA‐4の組み合わせが相乗的に作用し、防御性の高い抗腫瘍免疫応答を生じることを実証している。臨床試験においてこれら2つの剤の最大の相乗効果を達成するためには、前臨床試験において可能な治療計画を注意深く評価することが必要である。現在進行中の臨床試験において、GM-CSF分泌腫瘍細胞ワクチン(GVAX(登録商標))又はヒト抗CTLA4mAbは、数ヶ月にわたって繰り返し患者に投与される。本明細書中に記載された試験においては、組み合わせの有効性が、抗CTLA‐4mAb及びGM-CSF分泌腫瘍細胞ワクチンの両方の繰り返し投与に続く前臨床試験において評価された。実施例1は、B7/CTLA-4相互作用をブロックする、ハムスター抗マウス抗CTLA4(9H10)抗体及びマウス抗マウス抗CTLA-4mAb(9D9)が、サイトカイン発現細胞ワクチン(GM-CSF分泌B16F10腫瘍細胞;B16‐GM)を接種されるか又はされないB16メラノーマ腫瘍モデルにおいてテストされた結果を詳解する(図2A)。マウスにおける最初の前臨床試験は、ハムスター抗マウス抗CTLA4(9H10)抗体を使用し、この試験では、抗ハムスター抗体の発生により、抗CTLA4mAbの繰り返し投与を除外した。したがって、マウス抗マウス抗CTLA-4mAb、9D9が産生された。9D9抗CTLA4mAbは、B16F10腫瘍チャレンジからC57Bl/6マウスを防御する単独療法としては有効でなかった。対照的に、B16‐GM+抗CTLA4抗体、9D9で治療したマウスの80%は防御され、9D9が生理活性を有することを実証し、さらに、抗CTLA‐4及び(GVAX(登録商標)のような)GM-CSF分泌腫瘍細胞ワクチンが有効な抗癌併用療法であるという概念を支持している(図2B〜2E)。
【0108】
これらの結果は、本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が抗CTLA‐抗体とともに癌患者に投与されることができ、結果としていずれかの単独療法に比べても治療的有効性が亢進し、そして生存が延長されることを実証している。
【0109】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+抗4-1BBmAb
4-1BBとしても知られるCD137は、TNFRスーパーファミリーの一員(Kwon BS et al., Cell Immunol. 121(2):414-22, 1989;Kwon BS et al., Proc Natl Acad Sci USA. 86(6):1963-7,1989)である。CD137は、TCR複合体を介する活性化のおよそ4〜6日後に、活性化されたT細胞上にモノマー、ダイマー、及びテトラマーとして発現される。CD137とそのリガンドである4-1BBLとの相互作用は、増殖、IFN-gを含むサイトカインの産生、CTLの発生及び活性化後細胞死(AICD)の阻害へ導く共刺激シグナルを送達することが報告されている。4-1BBは、活性化されたT細胞上に、活性化の2〜3日後を発現のピークとして発現される。4-1BBのためのリガンド(4-1BBL)は、活性化されたAPC上に発現される。いくつかの研究が、抗4-1BBモノクローナル抗体の投与がCTL応答を増加させ及び/又はインビボにおいて確立された腫瘍を根絶することができることを実証した。Shuford et al. J. Exp. Med.;1997及びMelero et al., Nature medicine:1997を参照のこと。
【0110】
4-1BBリガンドは米国特許第5,674,704号に記載され;4-1BBリガンドポリペプチド及び4-1BBリガンドに結合する細胞表面受容体は米国特許第6,355,779号に記載され;4-1BBの細胞外ドメインに特異的に結合するモノクローナル抗体(mAb)は、米国特許第6,210,669号及び同第5,928,893号に記載され;ヒト4-1BBに特異的なヒト化抗体は米国特許第6,458,934号に記載され;そして、4-1BBに結合するアゴニストのmAbを投与することによりT細胞の増殖を促進する方法は、米国特許第6,303,121号に記載され、それぞれは参考文献として特別に本明細書中に援用されている。
【0111】
実施例2で詳解されているとおり、サイトカイン発現細胞ワクチン/4-1BBの組み合わせが、B16F10腫瘍モデルにおいて評価され、そして結果は、チャレンジ後の80日まで、上記組み合わせが腫瘍を有さないマウスの数(図4A)及び生存(図4B)を両方とも増加させたことを示す。これらの結果は、本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、抗4-1BB抗体とともに癌患者に投与され、結果としていずれの単独療法に比べても治療的有効性が亢進されたことを実証している。
【0112】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+1つ以上の追加のサイトカイン
本発明の1つの側面において、癌の治療のために、サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が少なくとも1つの追加のサイトカインとともに患者に投与される。例示的なサイトカインは、IL-2〜IL-29、r‐IFN、TNF‐アルファ、CD2、MIP3a及びICAMを含むがこれらに限られない。
【0113】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+インターフェロン‐アルファ
インターフェロンは、ウイルス感染を妨害する因子として1957年に同定された。タイプI(IFN‐α及びIFN‐β)は、ウイルス感染の初期相の間に産生される。タイプIIは(IFN‐γ)は、細胞免疫応答の発生に重要である。IFN‐アルファは、細胞毒性効果(アポトーシス)を介して腫瘍細胞に対して直接的な抗増殖効果を有することが示された。IFN‐アルファは、微小環境を変化させることによって抗原特異的免疫を調節することが知られており、それはTh1リンパ細胞の増殖に有利である。IFN‐αは、クローン増殖及びCD8+T細胞の生存を促進することによって、CTLの生成にとって重要である。
【0114】
IFN‐アルファは、リンパ腫、(ヘアリーセル)白血病、カポシ肉腫、及びメラノーマの臨床的治療に関して承認されている。IFN-アルファの癌治療における有効性は、免疫に依存する及び依存しないメカニズムの両方により生じる。例えば、IFN-アルファは、MHCクラスI分子のアップレギュレーション及び樹状細胞の活性化/分化の促進を含む免疫調節効果をあらわすことがインビトロで示された。さらに、IFN‐アルファは、Th1リンパ細胞及び腫瘍抗原特異的CTLの発生を促進し、そして、インビトロ及びインビボの両方において活性化CD8+T細胞のための生存因子として作用する。免疫に依存しない過程は、抗増殖活性及び/又はアポトーシス促進活性を含むことができる。これらの性質のすべては、有効な抗腫瘍応答の発生のために決定的であろう。
【0115】
腫瘍の血管新生を標的とする治療戦略は、癌治療の強力な選択肢として最近出現した。臨床的証拠は、IFN-アルファが、抗血管新生過程によって腫瘍の増殖を阻害することもできることを示唆する。IFN-アルファ及びGM-CSF分泌腫瘍細胞ワクチンの組み合わせが、(実施例3に記載のとおりに)B16F10メラノーママウスモデルにおいて調査された。
【0116】
サイトカイン発現細胞ワクチン(GM-CSF分泌B16F10腫瘍細胞:B16-GM)とIFN-αの組み合わせの効果を調査するために試験が行われた。単独療法として与えられた組換えマウスIFN-α(rmIFN‐アルファ)は、腫瘍チャレンジ部位に皮下投与された場合、16F10腫瘍細胞でチャレンジされたマウスの30%までを保護したが、離れた部位に投与した場合には保護しなかった。同様に、B16‐GM単独を受容した動物の30〜40%は、チャレンジ後も腫瘍を有さなかった。対照的に、IFN‐アルファ及びB16.GMの組み合わせの投与では、70〜80%が腫瘍を有さず、生存した(実施例3)。さらに、IFN‐アルファは、接種部位に投与されることもでき、ワクチンの効力を10%(ワクチンのみ)から50〜60%(ワクチン+IFN‐アルファ)まで増加させた。まとめると、上記結果は、GM-CSF分泌細胞ワクチンと組み合わせられたIFN‐アルファは、B16F10モデルにおける腫瘍の増殖を顕著に遅らせることができることを実証しており、上記組み合わせが癌の治療のための有効な戦略を代表することを示唆している。
【0117】
本発明の1つの好ましい実施態様においては、追加の癌治療剤は、GM-CSF発現細胞ワクチンとともに投与されるインターフェロン‐アルファである。本発明の実施においては、インターフェロン‐アルファは、タンパク質の形態或いは自己の、同種異系の、又はバイスタンダーインターフェロン‐アルファ発現細胞株の形態で投与されることができる。
【0118】
サイトカイン発現性細胞ワクチン(例えば、GVAX(登録商標))+IL-2
先の研究は、IL-2をコードする遺伝子の腫瘍細胞へのトランスフェクションが、腫瘍に対するMHCクラスI拘束性細胞溶解性Tリンパ細胞(CTL)応答をインビボで刺激することを示し、それは、IL-2がインビボで腫瘍に対する免疫応答性を亢進する役割を果たすことができることを示唆する(Frost et al., PCT国際特許出願公開第WO92/05262号;Fearon et al., Cell 1990 Feb 9;60(3):397-403)。本発明の実施において使用するための例示的なIL-2配列は、例えば、本明細書中に参考文献として特別に援用されている、GenBank 受入番号 NMIL04, NM 000586において見出されることができる。本明細書中に参考文献として特別に援用されているPCT国際特許出願公開第WO00/72686号に記載のとおり、B16メラノーマモデルにおける先の研究は、IL-2及びGM-CSFを両方とも発現する細胞が、全身的な免疫性を生じ、そして生存を促進することを示した。
【0119】
サイトカイン発現細胞ワクチン/IL-2の組み合わせの有効性は、(例えば、PCT国際特許出願公開第WO00/72686号に記載のとおり)B16F10腫瘍モデルにおいて先に評価された。本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、IL-2タンパク質とともに、或いは、自己の、同種異系の、又はバイスタンダーIL-2発現細胞株とともに癌患者に投与される。
【0120】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+化学療法剤
本発明の実施態様は、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の伝統的癌治療剤の組み合わせの投与を含む。本発明の実施において使用される伝統的な癌治療剤は、表1A及び1Bに列挙されたものを含む。これらは、主要な癌治療剤の各クラスからの剤を含み、以下の:アルキル化剤、アルカロイド、抗代謝剤、抗腫瘍性抗生物質、ニトロソ尿素、ホルモンアゴニスト/アンタゴニスト及びアナログ、免疫調節剤、光増感剤、酵素などを含むがこれらに限られない。
【0121】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+ドセタキセル(タキソテレ(商標))
ドセタキセルは、乳癌、前立腺癌、卵巣癌及び他の固形癌に対して治療的有効性を示した半合成のタキサンである。ドセタキセルの殺腫瘍活性は、主にその微小管脱重合をブロックし、したがってG2-M停止及びアポトーシスを誘発する能力に起因する。しかしながら、増加する証拠は、ドセタキセルがマクロファージ及びリンホカインにより活性化されたキラー活性の増強並びに前炎症性サイトカインの産生などの免疫調節活性も有することを示唆する。これらの性質は、ドセタキセルを他の癌免疫療法と組み合わせる興味深い化学療法剤とする。当業者は、パクリタキセル(タキソール(商標))が、ドセタキセル(タキソテレ(商標))の代わりに使用されることができることを理解するであろう。
【0122】
ドセタキセル及びGM-CSF分泌B16F10腫瘍細胞(B16-GM)ワクチンの組み合わせが、B16メラノーマモデルにおいて評価された(実施例4)。要約すると、結果は、GM-CSF分泌細胞ワクチンと組み合わせられたドセタキセルが、B16F10モデルにおける腫瘍の増殖を顕著に遅らせ、この組み合わせが癌の化学療法及び免疫療法を組み合わせるための新たな戦略を代表することを示唆している。本発明の実施においては、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、ドセタキセルとともに癌患者に投与される。
【0123】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+COX-2阻害剤
(PGHシンターゼ又はプロスタグランジンエンドパーオキサイドシンターゼとしても知られる)シクロオキシゲナーゼ(COX)は、プロスタグランジン(PG)の生合成を触媒する主要酵素である。酵素COX-1及びCOX-2の2つの異なるアイソフォームを発現する2つの遺伝子があり、類似のタンパク質一次構造(60%相同)を有し、そして本質的に同じ反応を触媒する。プロスタグランジンは、腎機能、血管運動の緊張、血小板凝集、及び血液凝固、免疫細胞の分化、傷の治癒、神経の成長、骨代謝、排卵、並びに分娩の開始のような多岐にわたる正常の過程に関与する。COX-2は、主に炎症細胞及び免疫細胞(好中球、マクロファージ、マスト細胞など)中で主に見出される誘導性アイソフォームである。前炎症性サイトカイン及び成長因子がCOX-2を誘導し、これは、COX-2が炎症及び細胞増殖の制御において重要な役割を果たすことを示唆する。COX-2は、ヒト結腸癌細胞中で強力に発現され、おそらく腫瘍細胞のアポトーシス(プログラムされた細胞死)を引き起こすことによって結腸腫瘍の進行を遅らせると考えられる。例えば、Vane JR et al., Annu Rev Pharmacol Toxicol, 1998, 38;, 97-120;Cryer B and Feldman M., Am J Med, 1998 May, 104:5, 413-21; S. Dubinett et al., Clinical Cancer Research; 2003;及びU. Yamashita et al., J. Immunology; 2000を参照のこと。疫学試験並びに初期の臨床試験も、COX-2阻害剤の投与が癌の発生のリスクを低下させることができることを示唆する。今日まで、FDAは、患者における家族性大腸ポリープ症(FAP)の治療のための選択的COX-2阻害剤、セレコキシブ(CELEBREX(登録商標))の使用を許可してきた。さらに、多くのネズミモデルは、COX-2阻害剤が多くの異なる腫瘍において腫瘍の形成を減少させることを実証した。COX-2阻害剤は、腫瘍の血管新生を阻害することによって腫瘍の形成を減少させることができる。マウスCOX-1は、ヒトCOX-1に対して92%相同であり、マウスCOX-2はヒトCOX-2に対して91%相同である。
【0124】
サイトカイン発現細胞ワクチン+選択的COX-2阻害剤がワクチン接種又は剤のいずれか単独よりもより大きな保護に導いたか否かを試験するために、B16F10モデルにおいて、COX-2阻害剤であるセレブレックス(Celebrex)とB16-GMの組み合わせが評価された(実施例5)。予備的な結果は、セレブレックスのみではB16F10腫瘍のサイズ及び全生存期間に対して単独の剤として効果を及ぼさないことを示している。しかしながら、GM-CSF発現細胞ワクチンと組み合わせた場合、生存数及び腫瘍を有さない動物の数における顕著な増加が観察された(図9A及びB)。結果は、有効性のためにはサイトカイン発現細胞ワクチンの接種前にCOX-2阻害剤が投与されなくてはならないことを示している。B16F10モデルにおいては、セレブレックスが接種の少なくとも3日前までに投与された場合には有効性は最大であったが、セレブレックスが接種の日に投与された場合には増強は観察されなかった。さらなる試験においては、データは単独療法としてのセレブレックスはCT26腫瘍のサイズ及びBALB/Cマウスの全生存期間に対して顕著な効果を有することも実証している(実施例5)。
【0125】
結果は、サイトカイン発現細胞ワクチン(すなわち、GVAX(登録商標))及びCOX-2阻害剤の組み合わせが、個々の剤による治療よりも全体としてのより大きな保護に導くことを示唆している。本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチンがCOX-2阻害剤とともに使用される。
【0126】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+抗CD-40又は膜/可溶性CD40L
CD40LはCD40に結合する。CD40はB細胞及び樹状細胞上で発現される。CD40は、B細胞の増殖、B細胞分化及びB細胞の生存において中心的役割を果たす。CD40を介する情報伝達は、FASにより誘発されたアポトーシスからB細胞を救済する。それはまた、Igアイソタイプスイッチングを受けさせ、そしてCD80(B7又はB7.1)を発現するようにB細胞を誘導する。特定の樹状細胞(DC)を含む抗原提示細胞(APC)は、共刺激シグナル及び細胞の免疫応答の発生に関与するサイトカインを提供することによって、直接的なT細胞の活性化及び分化に中心的役割を果たす。線維芽細胞、内皮細胞、T細胞及びマクロファージによって産生されるサイトカインである、顆粒球マクロファージコロニー刺激因子(GM-CSF)は、DCのプロセッシング及び抗原提示機能を活性化する。GM-CSF(B16-GM)を発現するように形質導入された、放射線照射されたB16F10メラノーマ細胞は、最近確立された皮下のB16F10腫瘍に対する防御免疫を部分的に獲得した。膜結合CD40リガンド(CD40L)及び抗CD40モノクローナル抗体は、DCを活性化することが示された。腫瘍壊死因子受容体(TNF-R)ファミリーの一員であるCD40は、B細胞、DC、及び活性化された単球を含む抗原提示細胞(APC)上に発現された表面受容体である。CD40のための自然のリガンドはCD40Lである。CD40LはCD40を発現するB細胞及びDCの抗原提示機能を亢進し、その結果、エフェクターT細胞の発生に決定的な役割を果たすIL-12が産生される。
【0127】
実施例6は、抗CD40又は膜結合型CD40リガンド(CD40L)とサイトカイン発現細胞ワクチンの組み合わせを評価するためのインビボの試験を詳解する(図10及び11)。実験結果は、CD40Lを発現するようにアデノウイルスによって形質導入されたB16F10細胞がB16-GMと併用して与えられ、B16-GMの接種の4日後に投与された場合、B16F10メラノーマでチャレンジされたマウスの生存期間を顕著に増加させたことを示す。B16-GMと同日に投与されたCD40Lは、病気を悪化させることが示された。B16-GM及び抗CD-40の組み合わせの有効性をさらに実証するために、接種後の異なる時点で投与された抗CD40モノクローナル抗体で動物が治療された。CD40Lについて得られた結果と類似して、接種との関係における抗CD40投与のタイミングは、有効性にとって決定的なものであった。データは、DCを標的とすることは、GM-CSF分泌細胞ワクチンによる接種の効力を増加させることができることを示している。
【0128】
(実施例6においてさらに説明されるように)サイトカイン発現細胞ワクチン/CD40L及び抗CD40の組み合わせの有効性が、B16F10腫瘍モデルにおいて評価された。本発明の実施においては、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、自己の、同種異系の又はバイスタンダー細胞によって発現された抗CD40抗体又はCD40リガンドとともに癌患者に投与され、その結果、いずれの単独療法に比べても治療的有効性が亢進された。
【0129】
サイトカイン発現細胞ワクチン(例えば、GVAX)+抗OX40mAb又は膜/可溶性OX40L
TNFRスーパーファミリーの一員であるOX40(CD134)は、活性化されたCD4+T細胞上に発現される。CD4T細胞表面上の架橋OX40は、有糸分裂を促進する濃度未満のCon A、抗CD3、PHA及びPMAまでT細胞の増殖を促進する、強力な共刺激シグナルを発生させる。抗原特異的T細胞応答もOX40を介する共刺激によって促進されることができる。インビボでのOX40の関与は、スーパー抗原又は可溶性タンパク質抗原に対する応答であるそれらの増殖後に起こる末梢でのCD4+T細胞の除去を阻害し、そしてOX40ノックアウトマウスはインビボでの免疫化に続いて正常レベルの抗原特異的記憶T細胞を産生することができない。したがって、OX40の関与は、インビボでの免疫化に続く記憶T細胞の発生及び維持に重要であるらしい。GM-CSFを産生する腫瘍細胞及びOX40受容体(OX40R)を介する刺激の組み合わせは、個々による治療よりも、癌に対する亢進された治療効果を提供するはずである。
【0130】
サイトカイン発現細胞ワクチン/OX40L又は抗OX40の組み合わせの臨床的有効性を最適化するためには、(実施例7及びGri, G. et al., J. Immunol. 2003, Jan 1; 170(1):99-106にさらに記載されるように)同系の腫瘍モデルにおいて、多くの治療計画が評価される。本発明の実施においては、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、抗OX40抗体と組み合わせて、或いは自己の、同種異系の、又はバイスタンダーOX40L-発現細胞株として癌患者に投与される。
【0131】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+抗血管新生剤
腫瘍の発生には、新たな血管の形成を活性化する、「腫瘍血管新生因子」と呼ばれる可溶性のメディエーターが必要であることは一般に受け入れられている。血管内皮細胞成長因子(VEGF)及び新たなプロテアーゼの発見は、腫瘍血管新生に関与する化合物の同定に導き、そして、抗血管新生化合物の使用を含む新たな治療的戦略の設計を可能とした。
【0132】
1つの側面において、本発明は、抗血管新生化合物を含む、サイトカイン発現細胞ワクチンの組み合わせを提供する。好ましい抗血管新生化合物は、エンドスタチン、アンギオスタチン、血小板因子‐4、プロラクチンの16-kD断片、sFlt-1(fms様チロシンキナーゼ1受容体の可溶性断片)、sKDR(キナーゼ挿入ドメイン受容体の可溶性断片)、VEGF-Trap(VEGF受容体1及びVEGF受容体2からのドメインからなるハイブリッド可溶性受容体)、sVEGFR3(VEGFRの可溶性細胞外形態)、抗上皮細胞成長因子R(EGF-R)、TRAIL(腫瘍壊死因子関連アポトーシス誘導リガンド)、トロンボスポンディン、インターフェロンアルファ及び色素上皮由来因子(PEDF)、並びにこれらの化合物の発現/産生に導く情報伝達経路に関与する因子を含む。
【0133】
本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、タンパク質の形態で送達される抗血管新生剤とともに、或いは自己の、同種異系の、又はバイスタンダー抗血管新生剤発現細胞株として癌患者に投与される。
【0134】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+HSP(熱ショックタンパク質)
最近の証拠は、熱ショックタンパク質(HSP)が、交差提示と呼ばれるメカニズムを通してMHC I分子上に提示されることのできる自己ペプチドの広い配列に関連することを示唆する。さらに、HSPは前炎症性サイトカインを刺激する特異的受容体相互作用及び共刺激分子のアップレギュレーションを通して専門のAPCを活性化することができる。その結果、腫瘍由来のHSPは、腫瘍特異的免疫応答を強力に刺激する。
【0135】
サイトカイン発現細胞ワクチン/HSPの組み合わせの有効性が(実施例8に記載されたように)B16F10腫瘍モデルにおいて評価された。本発明の実施において使用される例示的HSP配列は、例えば、本明細書に参考文献として特別に援用されている、GenBank受入番号No.AX194370号において見出されることができる。
【0136】
本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、HSPと組み合わせて、或いは自己の、同種異系の、又はバイスタンダーHSP発現細胞株として癌患者に投与される。
【0137】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+CpG
哺乳動物のDNAは低い頻度でCGを含み、そして存在する場合でさえ、シトシンの5位がメチル化されているため、哺乳動物の免疫系によって認識されない。対照的に、細菌DNAは、脊椎動物の免疫系によって認識される非メチル化CG-ジヌクレオチドを多数含む。CpG ODNは、自然免疫応答及び適応免疫応答の両方の機能を亢進する強力な免疫刺激性の性質をあらわすことが示された。細菌DNA及び多くのウイルスDNA中にごく普通にある非メチル化シトシン-ホスホロチオエート-グアニン(CpG)モチーフは、B細胞、DC、単球、及びNK細胞を活性化して強力なアジュバント効果を有する多様なサイトカインを産生する。CpGオリゴは、Th1サイトカイン産生、樹状細胞及びマクロファージなどの抗原提示細胞の活性化の刺激の促進を容易化し、そしてIFN-アルファ産生の増加を誘発し、それによって多様な抗癌免疫効果を促進することが知られている。腫瘍特異的CTL及びThエピトープの両方を含む35アミノ酸長の合成ペプチドとCpGアジュバントの組み合わせは、ヒトパピローマウイルスにより引きおこされるマウス腫瘍に対する治療的免疫性を誘発することができる有効性の高いワクチン製剤であることが証明された(Kim et al., Cancer Res. 62(24):7234-40. 2002)。
【0138】
サイトカイン発現細胞ワクチン+CpGがいずれか一方の剤単独による接種よりも大きな防御に導くか否かを試験するためにB16F10モデルにおいて、合成されたCpGモチーフがB16-GMとの組み合わせで評価された。予備的な結果は、IP投与されたあるCpGがGM-CSFで抗原刺激されたT細胞の効果を亢進することができ、そして、B16-GM接種の前に投与されたあるCpGは、接種後に投与された場合よりもより大きな相乗的効果を有することを示している。
【0139】
結果は、サイトカイン発現細胞ワクチン(すなわち、GVAX(登録商標))及びCpGの組み合わせが、個々の治療よりもより大きな全体的防御に導きうることを示唆している。本発明の実施において、自己の、同種異系の、又はバイスタンダーサイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))が、CpGジヌクレオチドと組み合わせて癌患者に投与される。
【0140】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+ジュバイミュン(Juvaimmune)
陽イオン性脂質-DNA複合体(JuvImmune)は、免疫活性化及びインターフェロン放出の強力な引き金である。JuvImmune によって誘発された免疫応答は、マウス、ラット、ウサギ、ネコ、イヌ、ヤギ、及びサルを含む多様な哺乳動物において上手く実証された。病気に特異的な抗原を含むか又は含まない、脂質及び非コードDNAの相乗的な組み合わせは、強力な免疫刺激を提供し、これが実質的なTh1を介する応答(IFN-アルファ、IFN-ガンマ及びIL-12の産生)を活性化する。GVAX(登録商標)などのサイトカイン発現細胞ワクチン及びJuvImmuneは、癌の治療において有用性を見出す。
【0141】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+イミキモド
3Mファーマシューティカルズによって開発された新規合成分子であるイミキモドは、樹状細胞(DC)及びマクロファージの機能を調節する最良の薬理学的作用物質の一つである。イミキモドは性器いぼの局所療法として評価され、そして基底細胞癌の局所療法としても臨床試験において有効性が示された。イミキモドは、DC、マクロファージ、及び他の細胞による免疫応答を、トル様受容体7(TLR-7)の結合を介して活性化することによって調節し、そしてIFN-アルファ、IL-1、IL-6、IL-8、IL-10、IL-12、TNF-アルファ及びGM-CSFを含むサイトカインの合成を誘導することが示されている。イミキモド及びGVAX(登録商標)のようなサイトカイン発現細胞ワクチンの組み合わせは、癌の治療において有用性を見出すことができる。
【0142】
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))+イレッサ
イレッサは非小細胞肺癌(NSCLC)の患者のための第3段階の化学療法として臨床的に認められている。それは、増殖、血管新生、転移及びアポトーシスに対する抵抗性に関与する下流へのシグナル伝達を妨害し、それにより細胞死へ導く、EGF受容体TKの細胞内リン酸化を阻害する低分子である。イレッサの抗血管新生活性は、腫瘍の成長を遅くし/阻害し、それはサイトカイン発現細胞ワクチンにより誘発された腫瘍特異的免疫応答が残りの腫瘍を破壊することを可能とするであろう。イレッサ及びGVAX(登録商標)などのサイトカイン発現細胞ワクチンは癌の治療において有用性を見出すことができる。
【0143】
サイトカイン発現細胞ワクチンの患者への送達
本発明は癌の治療方法を提供し、ここで、サイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療が癌患者に投与される。望ましくは、該方法は癌に対する全身性の免疫応答、すなわち、T細胞応答及び/又はB細胞応答を起こさせる。
【0144】
本明細書中に記載された方法の好ましい側面においては、サイトカイン発現細胞ワクチンの組み合わせが癌患者に投与され、ここで、サイトカイン発現細胞ワクチンは、哺乳動物、好ましくはヒトの腫瘍細胞を含み、そしてサイトカイン発現細胞ワクチン中の細胞は、放射線照射などによって増殖不能とされる。サイトカイン発現細胞ワクチンの組み合わせの投与は、サイトカイン発現細胞ワクチン又は癌治療剤又は治療である上記組み合わせの構成成分単独の投与後の同じ癌に対する免疫応答に比べて癌への亢進した免疫応答を生じる。言い換えれば、上記のサイトカイン発現細胞ワクチン及び少なくとも1つの追加の癌治療剤又は治療の併用投与は、サイトカイン発現細胞ワクチン単独の投与或いは癌治療剤又は治療の単独投与に比べて亢進した治療的有効性を生じる。
【0145】
サイトカイン発現細胞ワクチンの組み合わせは、いかなる好適な経路によって投与されてもよい。好ましくは、該組み合わせは皮下又は腫瘍内に投与される。局所的又は全身的送達は、筋肉内、静脈内、門脈内、肝臓内、腹腔内、皮下、又は皮内投与を含む非経口的導入による該組み合わせの体腔内への投与を含む投与によって達成されることができる。腫瘍が中枢神経系内にある場合には、流入領域リンパ節中の未処置のT細胞を免疫刺激するために、組成物は末梢に投与される。活性化された腫瘍特異的T細胞は、中枢神経系内のそれらの標的を発見するために、血液/脳関門を通ることができる。
【0146】
1つの例示的な好ましい実施態様においては、サイトカイン発現細胞ワクチンはGVAX(登録商標)であり、ここで、発現されるサイトカインはGM-CSFであり、そして少なくとも1つの追加の癌治療剤又は治療は、CTLA4に対する抗体;4-1BBに対する抗体;インターフェロンアルファ; COX-2阻害剤;IL-2又はIL-18;ドセタキセル;CD40に対する抗体又は膜結合/可溶性CD40リガンド;OX-40に対する抗体又は可溶性/膜結合OX-40リガンド;HSP(熱ショックタンパク質);CpGジヌクレオチド;イレッサ;イミキモド;ジュバイミュン(Juvaimmune);抗-上皮細胞成長因子R(EGF-R);抗VEGF R;VEGF-トラップ又はTRAILからなる群から選ばれる。
【0147】
当業者に理解されるであろうとおり、最適な治療計画は変化するであろう。結果として、有効性を高めるために各成分の用量及び投与の相対的なタイミングが最適化されるべきか又は投与の追加のサイクルが処方されるかを決定するために、癌患者の状態並びにサイトカイン発現細胞ワクチンの組み合わせの投与の前、その間、及びその後での患者の一般的健康状態について患者が評価されることは理解されるであろう。そのような評価は、典型的には、以下の「モニタリング方法」と題したセクションにおいてさらに記載されるような、伝統的な癌化学療法を評価するために当業者によって採用される試験を用いて実施される。
【0148】
追加の癌治療剤又は治療に依存して、サイトカイン発現細胞ワクチンは追加の癌治療剤又は治療の投与の前、それと同時に、又はその後で患者に投与される。例えば、抗CD40抗体又はCD40Lの場合、GM-CSF発現細胞ワクチンは、抗CD40抗体又はCD40Lの投与の前に患者に投与される。
【0149】
化学療法剤の送達
本発明のいくつかの側面においては、サイトカイン発現細胞ワクチンの組み合わせは化学療法剤を含む。本発明のこの側面において重要な考慮点は、薬剤として許容可能な担体中での癌治療剤の有効な送達である。
【0150】
本発明のこの側面により、癌治療剤(すなわち、化学療法剤)並びに対応する送達経路及びタイミングの選択は、以下のうちの1つ以上の点で有利である:(i)治療される特別なタイプの癌の治療における確立された使用;(ii)選択された剤の、サイトカイン発現細胞ワクチンとともに投与された場合に改善された治療結果を生じる可能性;及び(iii)癌細胞への十分に局在化された剤の露出を達成するのに有効な投与様式による剤の送達。
【0151】
典型的には、癌治療剤は癌療法において確立された用途を有する経路及び治療計画を用いて投与される。上記のとおり、最適経路は癌治療剤によって異なる。局所的又は全身的な送達は、エアロゾルの吸入又はガス注入、或いは、筋肉内、静脈内、門脈内、肝臓内、腹腔内、皮下、又は皮内投与を含む腸管外導入によって体腔内へ投与されることによって達成されることができる。しかしながら、好ましい経路は典型的に、遅い静脈内輸注(IVドリップ)、経口投与及び局所的な注射を含む。腫瘍が中枢神経系内にある場合、組成物はいかなる経路を介しても末梢中へ投与されなくてはならない。注射可能な溶液、薬物放出カプセル、インプラントなどの多様な剤型として又はリポソーム若しくはマイクロカプセルのような担体とともに容易に投与される。
【0152】
腸管外投与は、緩衝化された好適な水溶液及び食塩水又はグルコースを使用する等張な形態で調製された希釈液を用いて達成される。そのような水溶液は静脈内、筋肉内、皮下及び腹腔内投与に適している。(例えば、"Remington's Pharmaceutical Sciences", 15th Edition, pages 1035-1038及び1570-1580を参照のこと。)滅菌注射溶液は、化学療法剤を多様な他の成分とともに必要量の好適な溶媒に含ませ、そして滅菌ろ過することによって調製される。滅菌注射溶液中で使用するための滅菌粉末は、真空乾燥、又は凍結乾燥、又は他の手段で調製されることができ、活性化学療法剤+先に滅菌された溶液から調製された追加の所望の成分の粉末を生じる。
【0153】
例えば、経口投与された場合、癌治療剤は不活性の希釈剤又は食用の担体と併合され、又はハード又はソフトシェルゼラチンカプセル中に封入され、錠剤に圧縮され、食品中に直接取り込まれるか、賦形剤とともに取り込まれ、そして摂取できる錠剤、バッカル錠、トローチ、カプセル、エリキシル、懸濁液、シロップ、ウエファース、などの形態で使用されることができる。癌治療剤の好適な量は、特別な治療剤に特異的であり、そして一般に当業者に知られている。
【0154】
多数の癌治療剤のために推奨される用量及び剤型は、確立されており、そしてMedical Economics Company, Inc., Oradell, N.J.から発行されたPhysicians Desk Referenceのような慣用の供給源から得られることができる。典型的には、既知の癌治療剤のための送達の最適経路は、例えば、臨床試験において確立している手順及び分析によって決定された。
【0155】
本発明が1つ以上の癌治療剤の投与及びサイトカイン発現細胞ワクチンの投与を含む、癌の治療のための治療計画を考慮することは理解されるであろう。そのような治療計画は、放射線療法などの追加の癌治療、さらなる化学療法及び/又は免疫療法の前に、それと同時に、又はそれに続いて投与されることができる。
【0156】
本発明は、サイトカイン発現細胞ワクチンとともに投与された場合、1つ以上の癌治療剤又は治療の用量が、サイトカイン発現細胞ワクチンの投与を含まない治療計画に比べて減少されることができるという利点を提供する。
【0157】
治療のモニタリング
当業者は、本発明の組み合わせ治療を投与することによる、治療結果及び/又は全身性の免疫応答をモニターする手段を知っている。特別には、治療結果は腫瘍の成長の減弱及び/又は腫瘍の退行及び/又は腫瘍特異的マーカーレベルをモニターすることによって評価されることができる。治療に対する応答である腫瘍の成長の減弱又は腫瘍の退行は、腫瘍の数、腫瘍の重量又はサイズ、或いは転移の減少/阻止などを含む、当業者に知られたいくつかのエンドポイントを用いてモニターされることができる。
【0158】
上記で引用されたすべての文献及び特許参考文献は、参考文献として本明細書中に特別に援用されている。
【実施例】
【0159】
サイトカイン発現細胞ワクチン+抗CTLA-4モノクローナル抗体
(GVAX(登録商標)などの)サイトカイン発現細胞と組み合わせた抗CTLA4mAb(9D9)が抗癌有効性を高めることができるかを判定するために、B16F10モデルを使用してインビボの試験を実施した。1つの実験においては、C57B16マウスに1×105個のB16F10腫瘍細胞で第0日にチャレンジした。1日後、3×106個の放射線照射したB16F10又はGM-CSF分泌B16F10(dB16gmtd)細胞をマウスに接種した。接種の1日後及び3日後に、マウスに150μg又は100μgの抗CTLA-4抗体(9D9又は9H10)をそれぞれ注射した。マウスは、抗CTLA-4治療の2日後に二回目の3×106個の放射線照射したB16F10又はGM-CSF分泌B16F10(dB16gmtd)細胞を受容した(図2A)。そして、マウスを、皮下の腫瘍の発生についてモニターした。2つの抗CTLA-4mAb、9D9(マウス抗CTLA4)及び9H10(ハムスター抗CTLA4)を、B16メラノーマ腫瘍モデルにおいて試験し(図2A.)、そして同様の有効性を有することを示した。ハムスター抗CTLA4抗体に対する免疫反応により、マウスの抗体をその後の試験において使用した。
【0160】
9D9抗CTLA-4mAbを、サイトカイン発現細胞ワクチン(GM-CSF分泌B16F10腫瘍細胞;B16-GM)を接種する又は接種しないB16メラノーマ腫瘍モデルにおいて試験した。結果は、単独療法としての9D9抗CTLA-4mAbがC57Bl/6マウスをB16F10腫瘍チャレンジから防御するのに有効でなかったことを示す。対照的に、B16-GM+9D9で治療したマウスの80%は防御され、9D9抗CTLA4mAbが生物学的に活性であることを実証し、さらに抗CTLA-4及びGVAX(登録商標)ワクチンが有効な抗癌併用療法であるという考えを支持する(図2B)。
【0161】
α-CTLA-4抗体による治療と組み合わせたGM-CSF分泌ワクチンの反復接種後の免疫応答
マウスにおける他の試験を、α-CTLA-4 9D9モノクローナル抗体による治療と組み合わせたGM-CSF分泌ワクチンの反復接種に対する免疫応答を評価するために用いた。この試験においては、腫瘍を有さないC57Bl/6雄性マウスに、自然発生的なマウス前立腺癌由来の、100ngのGM-CSF/106細胞/24時間を分泌する放射線照射されたmGM-CSF分泌腫瘍細胞3×106個を5回接種するか、又は非形質導入マウス前立腺癌細胞を隔週のスケジュールで接種した。選択された治療群には、抗CTLA-4 9D9又はマウスIgG2bアイソタイプ抗体対照を1番目、3番目、及び5番目の接種後の1日及び4日後にIP注射した(各100μg)。2、4、6、8、10及び13週目に、免疫学的及び安全性のエンドポイントのためにマウスを剖検した。最後の接種の2週間後、前立腺癌特異的抗原(PTSA)−特異的細胞内IFN-ガンマの発現について、フローサイトメトリーによって脾細胞を分析した。
【0162】
免疫応答を腫瘍抗原特異的T細胞の増加として測定した。そのようなT細胞は、MHC Iに結合した腫瘍特異的ペプチドによる刺激後の細胞内IFN-ガンマ発現の誘発によって確認することができる。前立腺癌特異的抗原は、ヒト前立腺癌とマウス前立腺癌細胞の両方に共通して特異的なエピトープである。細胞内サイトカイン染色(ICS)は、腫瘍特異的T細胞応答をモニターし、そして抗原特異的T細胞の非常に低い出現頻度を同定するために使用されることができる。ICSは新たに単離された切除後5時間以内のリンパ細胞において実施され、しばしば5〜7日のインビトロの刺激を必要とする細胞溶解性のアッセイとは異なり、インビボにおける腫瘍抗原特異的T細胞の出現頻度を推定するために使用可能である。これは、異なる腫瘍ワクチン戦略の効力を比較する手段を提供する。この試験においては、ICSは、CTLA-4 9D9同時治療を伴うか又は伴わないマウス前立腺癌細胞‐GMワクチンによる接種後の上記の、前立腺癌特異的抗原へのT細胞応答をモニターするために使用した。結果を図3に示す。各バーの上の数字は、各治療群からのPTSA特異的IFN-ガンマ+CD8+T細胞の未処置マウスに比べた増加倍率を表す。NP-1は非特異的ペプチド対照である。
【0163】
抗CTLA-4の非存在下でGM-CSF分泌腫瘍細胞の接種を複数回受けたマウスにおける抗原特異的T細胞の出現頻度は、非免疫化対照に比べて、10〜16倍の増加を検出した。同様に、最初の接種の後にだけ、抗CTLA-4を単回注射すると、未処置マウスに比べて前立腺癌抗原(PTSA)特異的T細胞応答が10倍増加した。しかしながら、最も衝撃的な応答は、最初、3番目、及び5番目の接種後の抗CTLA-4の注射を受けたマウスにおいて観察された。この群においては、PTSA特異的T細胞応答における36倍の増加が検出された。これらのデータは、抗CTLAの反復注射(すなわち、CTLA-4遮断)と組み合わせたGM-CSF分泌腫瘍細胞ワクチンの複数回接種が強力な腫瘍特異的T細胞応答を誘発することを実証している。B16メラノーマモデルにおけるGM-CSF分泌ワクチン及び抗CTLA-4抗体の組み合わせの相乗効果は、該組み合わせの潜在的な臨床的利益を示唆する。
【0164】
GM-CSF分泌ワクチン及び抗CTLA-4抗体の組み合わせによる抗腫瘍免疫応答の誘発の潜在的な有用性に関しては、インビトロの再刺激によるTNF-アルファ、IL-2、及びIFN-ガンマなどのエフェクターサイトカインの産生がさらに示唆される。そのようなサイトカインの放出は、しばしば、抗腫瘍免疫を誘発するように設計された免疫治療戦略後の腫瘍特異的免疫応答のための代理のマーカーとして使用される。放射線照射されたGM-CSF分泌腫瘍細胞で48時間インビトロで再刺激された脾細胞からの上清中においてサイトカインレベルが測定された場合、TNF-アルファ、IFN-ガンマ、IL-5及びIL-2の産生が2週間目までに検出された(データは示さない)。
【0165】
実施例2
サイトカイン発現細胞ワクチン(GVAX(登録商標))+抗4-1BBmAb
サイトカイン発現細胞ワクチン(GVAX(登録商標))と組み合わせた抗4-1BBモノクローナル抗体が抗癌有効性を高めることができるかを決定するために、B16F10モデルを用いてインビボの試験を実施した。
【0166】
第0日に、1×105個の生きたB16F10(体積0.5mlを背部に皮下注射)でマウスにチャレンジした。第3日に、(以下の表2に示すように)1×106個の放射線照射したワクチン細胞でマウスに接種し、その後、第6日に150μgの抗4-1BBmAbを注射した(体積0.5mlを腹腔内注射)。
【0167】
【表5】

【0168】
いかなる明白な異常についても毎日マウスを評価し、そして皮下の腫瘍が直径15〜20mmのサイズに達したか、又は皮膚を通して潰瘍化した場合には動物を安楽死させた。第21日に、脾臓及び血液を採集し、抗腫瘍CTL、サイトカイン放出(ELISA)及び細胞内FACSの分析に使用した。
【0169】
結果は、GVAX(登録商標)及び抗4-1BB抗体の組み合わせが、腫瘍を有さないマウスの数(図4A)及び生存(図4B)の両方をGVAX(登録商標)単独投与に比べてチャレンジ後80日まで、亢進したことを示した。
【0170】
実施例3
サイトカイン発現細胞ワクチン(GVAX(登録商標))+インターフェロン‐アルファ
インビトロの試験は、IFN-アルファが腫瘍細胞の増殖を阻害し、アポトーシスを用量依存的に誘発することを示した。図5Aに示す結果は、96穴プレート中で3連で72時間、マウス腫瘍細胞株を組換えマウスIFN-アルファ(rmIFN-α)と共培養した試験からのものである。細胞を3Hチミジンでパルスし、放射活性の取り込みによって増殖を測定した。個々の腫瘍細胞株は、rmIFN-αと共培養した場合、異なるレベルの阻害を表した。IFN-αの抗増殖性効果は、試験した他の細胞株と比べてB16F10細胞株で最も明らかであった。図5Bに示す結果は、96穴プレート中で3連で72時間、マウス腫瘍細胞株をrmIFN-αと共培養した後、細胞をトリプシン処理し、アネキシンV及び7-AADで染色し、そしてフローサイトメトリーによってアポトーシスを分析した試験からのものである。個々の腫瘍細胞株は、rmIFN-αと共培養した場合、異なるレベルのアポトーシスを表した。CT26は、試験した細胞株の中で、IFN-アルファのプロアポトーシス効果に対して最も感受性であった。
【0171】
メラノーマ(B16F10)、腎細胞癌(renca)、結腸癌(CT26)、乳癌(4T1)、肺癌(LLC)及び繊維肉腫(3T3)を含む多様な腫瘍において抗増殖効果が観察された。5000U/mlのIFN-アルファとのインキュベーションは、ほとんどの腫瘍において増殖を20〜40%阻害した。しかしながら、同じ用量のIFN-アルファは、80%超、B16F10メラノーマ細胞を阻害した。プロアポトーシス活性も、試験したすべての腫瘍細胞において観察された。アポトーシスが5倍増加したCT26を除いて、すべての腫瘍においてアポトーシスの増加は対照よりも1.5〜2.5高い範囲であった。IFN-アルファは、タンパク質(組換えマウスIFN-アルファ:R+D Systems)の形態、又はIFN-アルファのコード配列を含むベクターで細胞を形質移入することによって調製された、IFN-アルファを産生する細胞株として提供する。本発明の実施において使用するための例示的なインターフェロン‐アルファ配列は、例えば、本明細書中に参考文献として特別に援用されている、Genbank受入番号NM1FNA1、NM1FNA2において見出されることができる。
【0172】
サイトカイン発現細胞ワクチン(GVAX(登録商標))と組み合わせたインターフェロン‐アルファが抗癌有効性を高めることができるかを判定するために、インビボの試験も実施した。例示的な試験を模式的に示したものを図6に提供する。1つの例示的なプロトコールにおいて、C57B16マウスに1×105個のB16F10腫瘍細胞でチャレンジした。3日後、マウスに1×106個の放射線照射したB16F10又はGM-CSF分泌B16F10(B16.GM)細胞を接種した。接種の4日後、IFN-アルファ投与を開始した。IFN-アルファ(2500単位/日;2回/週)を腫瘍チャレンジ部位(図7A)又は接種部位(図7B)に皮下注射した。腫瘍の確立を触診によって3〜4日ごとに判定した。悪性腫瘍又は150mm2のサイズの腫瘍を有するマウスを屠殺した。示したデータは、表示された時点における生存率として表した、10匹のマウス/試験からのものである。B16.GMの生存に対する有効性は40%であり、B16.GM+IFN-アルファは、p=0.08の有意性をもってB16.GM単独療法よりも40%高かった。B16.GMの生存に対する有効性は10%であり、B16.GM+IFN-アルファはp=0.08の有意性をもってB16.GM単独療法よりも40%高かった。
【0173】
要約すると、これらのデータは、原発腫瘍の切除後に、切除された腫瘍のごく近傍に投与された局所的なIFN-アルファ治療が腫瘍を静的に保つのに有効であることを示唆する。さらに、IFN-アルファはワクチン部位においてワクチンとともに投与されることができる。したがって、GM-CSF分泌全細胞ワクチンと組み合わせたIFN-アルファは、B16F10腫瘍モデルの生存を上昇させ、そして腫瘍免疫療法のための新しい臨床的組み合わせを代表する。
【0174】
実施例4
サイトカイン発現細胞ワクチン(GVAX(登録商標))+ドセタキセル(タキソテレ(商標))
ドセタキセル及びGM-CSF分泌B16F10腫瘍細胞(B16-GM)ワクチンの組み合わせを、B16メラノーマモデルにおいて評価した。第5、9、及び13日におけるドセタキセルの3回のIV注射(全部で18mg/kg)は、生存期間の中央値が24日であって、B16腫瘍の増殖を阻害する単独療法としては無効であった(図8A及び8B)。腫瘍チャレンジの3日後にB16-GMを接種したマウスも生存期間の中央値が24日であった。対照的に、同じ治療計画を用いるドセタキセルとB16-GMの組み合わせは、腫瘍の増殖を顕著に遅らせ、そして生存期間の中央値を45日まで増加させた(図8C及び8D)。1週おきのB16-GM接種の間のドセタキセルの投与は、B16-GMの複数回の接種のみに比べて、B16腫瘍を有するマウスの生存期間の中央値を31日から52日に増加させた。これらの効果は、複数回のB16-GM接種+複数回のドセタキセルの治療計画を用いても観察された(表3)。
【0175】
【表6】

【0176】
さらに、膜結合オボアルブミンを発現するB16腫瘍細胞を使用して、ドセタキセルの投与がオボアルブミン特異的TCRトランスジェニックT細胞(OT-1;データは示さない)の生存を延長させることが実証され、ここで、オボアルブミンは抗原特異的T細胞の追跡を可能とする腫瘍抗原のモデルとして使用される。これらのデータは、ドセタキセルの投与が、腫瘍特異的エフェクターT細胞の生存を促進することによって、GM-CSF分泌腫瘍細胞ワクチンの効力を高めることが可能であることを示唆する。
【0177】
実施例5
サイトカイン発現細胞ワクチン(GVAX(登録商標))+COX-2阻害剤
サイトカイン発現細胞ワクチン+Celebrexがどちらか一方の剤単独の接種よりもより大きな保護を与えるかを試験するために、COX-2阻害剤であるセレコキシブ(CELEBREX(登録商標))の組み合わせを、B16-GMとの組み合わせでB16F10モデルにおいて評価した。予備的な結果は、Celebrex単独ではB16F10腫瘍のサイズ及び全生存期間に対して効果を有さないことを示した。しかしながら、GM-CSF発現細胞ワクチンと組み合わせると、生存数及び腫瘍を有さない動物の数に顕著な増加が観察された。結果は、有効性のためには、Celebrexがサイトカイン発現細胞ワクチン接種の少なくとも3日前に投与されなくてはならないことを示す(図9A及びB)。Celebrexが接種の日に投与される場合、サイトカイン発現細胞ワクチンが単独で投与される場合に観察されたのに対して、さらなる有効性が観察された。さらなる試験において、我々は単独療法としてのCelebrexはCT26腫瘍のサイズ及びBALB/Cマウスの全生存期間に対して顕著な効果を有することを実証した。
【0178】
実施例6
サイトカイン発現細胞ワクチン(GVAX(登録商標))+CD40L
抗CD40及びCD40Lを含むサイトカイン発現細胞ワクチンの組み合わせの効力並びにそのような組み合わせの有効性を最適化するためのパラメーターを評価するために、多様なインビボの試験を実施した。臨床試験を設計するのに考慮すべき因子は、組み合わせの構成成分の投与の相対的タイミング、各構成成分の用量、投与の経路及び頻度を含むがこれらに限られない。サイトカイン発現細胞ワクチン(GVAX(登録商標))と組み合わせた抗CD40又はCD40Lが、サイトカイン発現細胞ワクチン単独の抗癌有効性を高めることができるかを判定するためにインビボの試験を実施した(図10)。1つの例示的な実験において、Ad-NULL(導入遺伝子を発現しないE-1欠失アデノウイルス)、Ad-GVAX(登録商標)(Ad-GM-CSF)及びAd-CD40Lワクチンを調製し、そして本明細書中に参考文献として特別に援用されたPCT国際特許出願公開第WO00/72686号に記載されたような標準的手順によって腫瘍細胞に形質導入した。そのような実験の実施において、いずれかの分離した細胞集団をAd-GM-CSF及びAd-CD40Lのそれぞれで形質導入するか又は同じ細胞集団を両方のベクターで形質導入した。別々の細胞集団を個々のベクターで形質導入した場合には、細胞集団を混合し、そして以下に記載するように同時に又は異なる時に投与することができる。1の実験においては、第0日に第1群〜第11群のマウスに1×105個の生きたB16F10マウスメラノーマ細胞でチャレンジした(背側部位の皮下に体積0.5ml)。チャレンジ後の第3日にマウスの腹側に1×106個のB16-GMでワクチン接種し、その後、さらに放射線照射したワクチン細胞を第3日(第5群)、第4日(第6及び7群)、第5日(第8群及び9群)及び第7日(第10群及び第11群)を以下の表4に示すとおりに投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。図11に示す結果は、CD40をコードするアデノウイルスベクターで形質導入したB16F10細胞がCD40Lを発現し、そしてB16-GMとともに投与された場合、特にAd-CD40Lで形質導入した細胞を接種の4日後に投与した場合には、B16F10メラノーマでチャレンジしたマウスの生存を顕著に増加させることを実証している。CD40LがB16-GMと同日に投与された場合、病気は悪化した。
【0179】
【表7】

【0180】
B16-GMと抗CD40の組み合わせの有効性をさらに実証するために、接種後の異なる時点で投与されるCD40モノクローナル抗体で動物を治療した。この実験においては、第0日にマウスに1×105個の生きたB16F10マウスメラノーマ細胞でチャレンジした(背側に体積0.5mlを皮下投与)。チャレンジ後の第3日に、マウスに1×106個のB16-GMを腹側に接種した。抗CD40抗体を第0日及び第2日、又は第2日及び第4日(図11B);第4日及び第6日、第7日および第9日、又は第10日及び第12日(図11C)に投与した。3ヶ月の間3〜4日ごとに腫瘍負荷についてマウスをモニターし(n=10)、そして第18日に屠殺し、免疫学的アッセイのために脾臓及び血液を採取した。
【0181】
結果は、膜結合CD40Lまたは抗CD40モノクローナル抗体のいずれかとB16-GMワクチンの組み合わせが、B16-GMメラノーマモデルにおいてB16F10ワクチン発現GM-CSFの有効性を顕著に亢進することを実証している。B16メラノーマモデル試験からの結果は、CD40L及び抗CD40投与のタイミングが有効性に対して決定的なものであることをさらに示した(図11A〜11C)。
【0182】
実施例7
サイトカイン発現細胞ワクチン(GVAX(登録商標))+OX40/OX40L
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))及び抗OX40又は膜結合/可溶性OX40Lの有効性をB16F10メラノーマ腫瘍モデルを用い、以下の表5に示す例示的な試験計画を用いて評価する。
【0183】
【表8】

【0184】
治療プロトコールを最適化するためには、以下の表6に概説する多数の変数が重要である。
【0185】
【表9】

【0186】
公表された文献及び多様な実験結果に基づいて、OX40を介する防御は、腫瘍固有の免疫原性に依存して20〜60%の範囲である(Weinberg, A et al., J. Immunol., 164: 2160-2169, 2000)。GVAX(登録商標)及びOX40の組み合わせによって付与された防御は、GVAX(登録商標)に対するタイミング、投与経路並びに抗OX40またはOX40L:Ig融合タンパク質及びGVAX(登録商標)の相対的な用量などのいくつかの因子に依存する。
【0187】
実施例8
サイトカイン発現細胞ワクチン(GVAX(登録商標))+Hsp70
サイトカイン発現細胞ワクチン(例えば、GVAX(登録商標))及びHsp70の有効性を、B16F10メラノーマ腫瘍モデルを用いて評価する。例示的な試験設計は以下のものである。
【0188】
【表10】

【0189】
治療プロトコールを最適化するためには、以下の表8に概説する多数の変数が重要である。
【0190】
【表11】

【0191】
GVAX(登録商標)及びHsp70の組み合わせによって付与された腫瘍に対する防御は、GVAX(登録商標)に対するHSP投与のタイミング、投与経路及びhsp70の用量に対するGVAX(登録商標)の相対的な用量などのいくつかの因子に依存する。
【特許請求の範囲】
【請求項1】
癌治療のための改善された方法であって、以下のステップ:
サイトカイン発現細胞ワクチン及び以下の:抗CTLA4抗体、抗4-1BB抗体、インターフェロン‐アルファ、ドセタキセル、パクリタキセル、COX-2阻害剤、抗CD40抗体又はCD40リガンド、抗OX40抗体又はOX40リガンド及び熱ショックタンパク質(HSP)から成る群から選ばれる少なくとも1つの追加の癌治療剤を癌を有する対象に投与し、ここで、上記組み合わせの上記対象への投与が、上記サイトカイン発現細胞ワクチン又は上記少なくとも1つの追加の癌治療剤単独の投与に比べて亢進された治療的有効性を生じる、
を含む、前記方法。
【請求項2】
上記サイトカイン発現細胞ワクチンがGM-CSFを発現する、請求項1に記載の方法。
【請求項3】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対して自己のものである、請求項2に記載の方法。
【請求項4】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対して同種異系のものである、請求項2に記載の方法。
【請求項5】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対してバイスタンダー細胞である、請求項2に記載の方法。
【請求項6】
前記サイトカイン発現細胞ワクチンの該細胞が放射線照射によって増殖不能とされる、請求項2に記載の方法。
【請求項7】
上記哺乳動物がヒトである、請求項2に記載の方法。
【請求項8】
上記癌が前立腺癌である、請求項2に記載の方法。
【請求項9】
上記癌が非小細胞肺癌である、請求項2に記載の方法。
【請求項10】
上記同種異系の細胞が、前立腺癌株、非小細胞肺癌株及び膵臓癌株からなる群から選ばれる腫瘍細胞株である、請求項4に記載の方法。
【請求項11】
前記少なくとも1つの追加の癌治療剤が、抗CTLA4抗体を含む、請求項2に記載の方法。
【請求項12】
前記少なくとも1つの追加の癌治療剤が、抗4-1BB抗体を含む、請求項2に記載の方法。
【請求項13】
前記少なくとも1つの追加の癌治療剤が、インターフェロン‐アルファを含む、請求項2に記載の方法。
【請求項14】
前記少なくとも1つの追加の癌治療剤が、ドセタキセル又はパクリタキセルを含む、請求項2に記載の方法。
【請求項15】
前記少なくとも1つの追加の癌治療剤がドセタキセルを含む、請求項14に記載の方法。
【請求項16】
前記少なくとも1つの追加の癌治療剤がCOX-2阻害剤を含む、請求項2に記載の方法。
【請求項17】
前記COX-2阻害剤がセレコキシブである、請求項16に記載の方法。
【請求項18】
前記少なくとも1つの追加の癌治療剤が抗CD40抗体又はCD40リガンドを含む、請求項2に記載の方法。
【請求項19】
前記少なくとも1つの追加の癌治療剤が細胞によって発現され、該細胞が自己の、同種異系の又はバイスタンダー細胞である、請求項2に記載の方法。
【請求項20】
前記自己の、同種異系の又はバイスタンダー細胞が放射線照射によって増殖不能とされる、請求項19に記載の方法。
【請求項21】
前記自己の、同種異系の又はバイスタンダー細胞がインターフェロン‐アルファを発現する、請求項20に記載の方法。
【請求項22】
前記自己の、同種異系の又はバイスタンダー細胞がCD40リガンドを発現する、請求項20に記載の方法。
【請求項23】
前記サイトカイン発現細胞ワクチンが皮下に投与される、請求項2に記載の方法。
【請求項24】
前記サイトカイン発現細胞ワクチンが腫瘍内に投与される、請求項2に記載の方法。
【請求項25】
前記COX-2阻害剤が上記GM-CSF発現細胞ワクチンの前に投与される、請求項16に記載の方法。
【請求項26】
前記抗CD40抗体が上記GM-CSF発現細胞ワクチンの後に投与される、請求項18に記載の方法。
【請求項27】
前記CD40リガンドが上記GM-CSF発現細胞ワクチンの後に投与される、請求項18に記載の方法。
【請求項28】
癌治療のための改善された組成物であって、以下の:
癌を有する対象への投与のためのGM-CSF発現細胞ワクチン及び以下の:抗CTLA4抗体、抗4-1BB抗体、インターフェロン‐アルファ、ドセタキセル、セレコキシブ、抗CD40抗体及びCD40リガンドから成る群から選ばれる少なくとも1つの追加の癌治療剤を含み、ここで、上記組み合わせの投与が、上記GM-CSF発現細胞ワクチン又は上記少なくとも1つの追加の癌治療剤単独の投与に比べて亢進された治療的有効性を生じる、前記組成物。
【請求項29】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対して自己のものである、請求項28に記載の組成物。
【請求項30】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対して同種異系のものである、請求項28に記載の組成物。
【請求項31】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対してバイスタンダー細胞である、請求項28に記載の組成物。
【請求項32】
上記自己の、同種異系の又はバイスタンダー細胞が放射線照射によって増殖不能とされる、請求項28に記載の組成物。
【請求項33】
上記同種異系の細胞が、前立腺癌株、非小細胞肺癌株及び膵臓癌株からなる群から選ばれる腫瘍細胞株である、請求項30に記載の組成物。
【請求項34】
前記少なくとも1つの追加の癌治療剤が、抗CTLA4抗体である、請求項28に記載の組成物。
【請求項35】
前記少なくとも1つの追加の癌治療剤が、抗4-1BB抗体である、請求項28に記載の組成物。
【請求項36】
前記少なくとも1つの追加の癌治療剤が、インターフェロン‐アルファである、請求項28に記載の組成物。
【請求項37】
前記少なくとも1つの追加の癌治療剤が、ドセタキセルである、請求項28に記載の組成物。
【請求項38】
前記少なくとも1つの追加の癌治療剤が、セレコキシブである、請求項28に記載の組成物。
【請求項39】
前記少なくとも1つの追加の癌治療剤が抗CD40抗体又はCD40リガンドである、請求項28に記載の組成物。
【請求項40】
前記少なくとも1つの追加の癌治療剤が細胞によって発現され、該細胞が自己の、同種異系の又はバイスタンダー細胞である、請求項28に記載の組成物。
【請求項41】
上記自己の、同種異系の又はバイスタンダー細胞が放射線照射によって増殖不能とされる、請求項40に記載の組成物。
【請求項42】
上記自己の、同種異系の又はバイスタンダー細胞がインターフェロン‐アルファを発現する、請求項41に記載の組成物。
【請求項43】
上記自己の、同種異系の又はバイスタンダー細胞がCD40リガンドを発現する、請求項41に記載の組成物。
【請求項1】
癌治療のための改善された方法であって、以下のステップ:
サイトカイン発現細胞ワクチン及び以下の:抗CTLA4抗体、抗4-1BB抗体、インターフェロン‐アルファ、ドセタキセル、パクリタキセル、COX-2阻害剤、抗CD40抗体又はCD40リガンド、抗OX40抗体又はOX40リガンド及び熱ショックタンパク質(HSP)から成る群から選ばれる少なくとも1つの追加の癌治療剤を癌を有する対象に投与し、ここで、上記組み合わせの上記対象への投与が、上記サイトカイン発現細胞ワクチン又は上記少なくとも1つの追加の癌治療剤単独の投与に比べて亢進された治療的有効性を生じる、
を含む、前記方法。
【請求項2】
上記サイトカイン発現細胞ワクチンがGM-CSFを発現する、請求項1に記載の方法。
【請求項3】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対して自己のものである、請求項2に記載の方法。
【請求項4】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対して同種異系のものである、請求項2に記載の方法。
【請求項5】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対してバイスタンダー細胞である、請求項2に記載の方法。
【請求項6】
前記サイトカイン発現細胞ワクチンの該細胞が放射線照射によって増殖不能とされる、請求項2に記載の方法。
【請求項7】
上記哺乳動物がヒトである、請求項2に記載の方法。
【請求項8】
上記癌が前立腺癌である、請求項2に記載の方法。
【請求項9】
上記癌が非小細胞肺癌である、請求項2に記載の方法。
【請求項10】
上記同種異系の細胞が、前立腺癌株、非小細胞肺癌株及び膵臓癌株からなる群から選ばれる腫瘍細胞株である、請求項4に記載の方法。
【請求項11】
前記少なくとも1つの追加の癌治療剤が、抗CTLA4抗体を含む、請求項2に記載の方法。
【請求項12】
前記少なくとも1つの追加の癌治療剤が、抗4-1BB抗体を含む、請求項2に記載の方法。
【請求項13】
前記少なくとも1つの追加の癌治療剤が、インターフェロン‐アルファを含む、請求項2に記載の方法。
【請求項14】
前記少なくとも1つの追加の癌治療剤が、ドセタキセル又はパクリタキセルを含む、請求項2に記載の方法。
【請求項15】
前記少なくとも1つの追加の癌治療剤がドセタキセルを含む、請求項14に記載の方法。
【請求項16】
前記少なくとも1つの追加の癌治療剤がCOX-2阻害剤を含む、請求項2に記載の方法。
【請求項17】
前記COX-2阻害剤がセレコキシブである、請求項16に記載の方法。
【請求項18】
前記少なくとも1つの追加の癌治療剤が抗CD40抗体又はCD40リガンドを含む、請求項2に記載の方法。
【請求項19】
前記少なくとも1つの追加の癌治療剤が細胞によって発現され、該細胞が自己の、同種異系の又はバイスタンダー細胞である、請求項2に記載の方法。
【請求項20】
前記自己の、同種異系の又はバイスタンダー細胞が放射線照射によって増殖不能とされる、請求項19に記載の方法。
【請求項21】
前記自己の、同種異系の又はバイスタンダー細胞がインターフェロン‐アルファを発現する、請求項20に記載の方法。
【請求項22】
前記自己の、同種異系の又はバイスタンダー細胞がCD40リガンドを発現する、請求項20に記載の方法。
【請求項23】
前記サイトカイン発現細胞ワクチンが皮下に投与される、請求項2に記載の方法。
【請求項24】
前記サイトカイン発現細胞ワクチンが腫瘍内に投与される、請求項2に記載の方法。
【請求項25】
前記COX-2阻害剤が上記GM-CSF発現細胞ワクチンの前に投与される、請求項16に記載の方法。
【請求項26】
前記抗CD40抗体が上記GM-CSF発現細胞ワクチンの後に投与される、請求項18に記載の方法。
【請求項27】
前記CD40リガンドが上記GM-CSF発現細胞ワクチンの後に投与される、請求項18に記載の方法。
【請求項28】
癌治療のための改善された組成物であって、以下の:
癌を有する対象への投与のためのGM-CSF発現細胞ワクチン及び以下の:抗CTLA4抗体、抗4-1BB抗体、インターフェロン‐アルファ、ドセタキセル、セレコキシブ、抗CD40抗体及びCD40リガンドから成る群から選ばれる少なくとも1つの追加の癌治療剤を含み、ここで、上記組み合わせの投与が、上記GM-CSF発現細胞ワクチン又は上記少なくとも1つの追加の癌治療剤単独の投与に比べて亢進された治療的有効性を生じる、前記組成物。
【請求項29】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対して自己のものである、請求項28に記載の組成物。
【請求項30】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対して同種異系のものである、請求項28に記載の組成物。
【請求項31】
前記サイトカイン発現細胞ワクチンの該細胞が上記対象に対してバイスタンダー細胞である、請求項28に記載の組成物。
【請求項32】
上記自己の、同種異系の又はバイスタンダー細胞が放射線照射によって増殖不能とされる、請求項28に記載の組成物。
【請求項33】
上記同種異系の細胞が、前立腺癌株、非小細胞肺癌株及び膵臓癌株からなる群から選ばれる腫瘍細胞株である、請求項30に記載の組成物。
【請求項34】
前記少なくとも1つの追加の癌治療剤が、抗CTLA4抗体である、請求項28に記載の組成物。
【請求項35】
前記少なくとも1つの追加の癌治療剤が、抗4-1BB抗体である、請求項28に記載の組成物。
【請求項36】
前記少なくとも1つの追加の癌治療剤が、インターフェロン‐アルファである、請求項28に記載の組成物。
【請求項37】
前記少なくとも1つの追加の癌治療剤が、ドセタキセルである、請求項28に記載の組成物。
【請求項38】
前記少なくとも1つの追加の癌治療剤が、セレコキシブである、請求項28に記載の組成物。
【請求項39】
前記少なくとも1つの追加の癌治療剤が抗CD40抗体又はCD40リガンドである、請求項28に記載の組成物。
【請求項40】
前記少なくとも1つの追加の癌治療剤が細胞によって発現され、該細胞が自己の、同種異系の又はバイスタンダー細胞である、請求項28に記載の組成物。
【請求項41】
上記自己の、同種異系の又はバイスタンダー細胞が放射線照射によって増殖不能とされる、請求項40に記載の組成物。
【請求項42】
上記自己の、同種異系の又はバイスタンダー細胞がインターフェロン‐アルファを発現する、請求項41に記載の組成物。
【請求項43】
上記自己の、同種異系の又はバイスタンダー細胞がCD40リガンドを発現する、請求項41に記載の組成物。
【図1A】


【図1B】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3】


【図4A】


【図4B】


【図5A】


【図5B】


【図6】


【図7A】


【図7B】


【図8A】


【図8B】


【図8C】


【図8D】


【図9】


【図10】


【図11A】


【図11B】


【図11C】




【図1B】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3】


【図4A】


【図4B】


【図5A】


【図5B】


【図6】


【図7A】


【図7B】


【図8A】


【図8B】


【図8C】


【図8D】


【図9】


【図10】


【図11A】


【図11B】


【図11C】


【公開番号】特開2011−252006(P2011−252006A)
【公開日】平成23年12月15日(2011.12.15)
【国際特許分類】
【出願番号】特願2011−175553(P2011−175553)
【出願日】平成23年8月11日(2011.8.11)
【分割の表示】特願2006−507483(P2006−507483)の分割
【原出願日】平成16年3月24日(2004.3.24)
【出願人】(597078983)セル ジェネシス インコーポレイテッド (21)
【Fターム(参考)】
【公開日】平成23年12月15日(2011.12.15)
【国際特許分類】
【出願日】平成23年8月11日(2011.8.11)
【分割の表示】特願2006−507483(P2006−507483)の分割
【原出願日】平成16年3月24日(2004.3.24)
【出願人】(597078983)セル ジェネシス インコーポレイテッド (21)
【Fターム(参考)】
[ Back to top ]

