サンプル中のγ−ヒドロキシ酪酸(GHB)の濃度決定に適した方法、組成物およびキット
本発明は、サンプル中のγ−ヒドロキシ酪酸(GHB)の濃度を決定するための方法および組成物、並びに前記方法を行うのに適したキットに関する。本発明は、さらに、マイクロタイタープレートまたはオートアナライザーにおける用途への前記方法の使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はサンプル中のγ−ヒドロキシ酪酸(GHB)の濃度を決定するための方法および組成物、並びに前記方法を行うのに適したキットに関する。本発明は、さらに、マイクロタイタープレートまたはオートアナライザー(臨床検査室でしばしば使用されるランダムアクセス分析用装置)における用途への前記方法の使用に関する。
【背景技術】
【0002】
γ−ヒドロキシ酪酸(4−ヒドロキシブタン酸、C4H8O3、通常、GHBと略される)は内因性物質であり、また、多くの国において非合法的な治療薬物であって、中枢神経系、つる植物、肉牛、小さな柑橘果実、およびほとんどすべての他の生物に少量見出される自然発生物質である。該物質は現在、米国で規制されており、ジャズファーマシューティカルがキシレム(Xyrem)という名称で販売している。
【0003】
医療機関において、GHBは一般的な麻酔薬として使用され、不眠症、臨床的鬱病、ナルコレプシー、およびアルコール依存症のような症状の治療ならびに運動能力を改善するため使用されている。
【0004】
イタリアでは、GHBは、アルコバー(Alcover)(ATCN07BB)という商標名で、急性アルコール離脱用および長期間解毒媒体用としてアルコール依存症治療(3回以上の分配投与で50〜100mg/kg/日)に使用されている。米国では、GHBは、キシレムという商標名で、ナルコレプシー患者の脱力発作回数を減らすための用途としての使用が食品医薬品局(FDA)に認可されている。
【0005】
GHBがナトリウム塩またはカリウム塩の形態で用いられる場合には、有意量の過剰ナトリウムまたはカリウムが消費されることから、心不全、高血圧、または腎機能低下している者に考慮される。食品とともに摂取される場合には、GHBナトリウム塩のバイオアベイラビリティーはかなり低下するため、薬を服用する前には食後少なくとも2時間待つよう指示される。その鎮静作用は強力であるため、患者はGHBナトリウム塩を摂取した後、少なくとも6時間は運転や重機を操作するべきではない。
【0006】
臨床試験におけるキシレムの副作用としては、頭痛、吐き気、咽頭炎、めまい、眠気、嘔吐、尿失禁、精神錯乱、呼吸困難、感覚麻痺、知覚障害、震え、目眩、および視力低下を含む。
【0007】
また、γ−ヒドロキシ酪酸(GHB)は、米国や他の国で薬物性昏睡の主要な原因となる違法化学物質である。実際、米国において、GHBの過剰摂取の数は、現在、MDMA(エクスタシー)の過剰摂取の数を越えている。GHBは1960年代に米国医学会により禁止されたが、血液脳関門を自由に通過し、意識を低下させ、その結果興奮する作用を有し、また、毒性を有することから、多くの人の間で良く知られている。これらの使用は、科学的研究により証明されているわけではなく、死に至る危険性もあるが、睡眠補助薬、抗鬱剤および減量製品としてインターネットで過大に宣伝されている。GHBは、1980年代後半にステロイドが規制されたとき、ステロイドの代替品として最初に始まり、緊急治療室での業務、愛する者を失った者の命に対する喪失感、中毒の家族/友達に対する恐怖感によって生じる多様な医療悪夢へと拡大した。しかし、それは未だ警察官、医療/検視従事者、および親にとって不可解なことである。
【0008】
非医学的に、中枢神経系(CNS)抑制剤としても作用するGHBは、乱用薬物として使用される。それは、リキッドエクスタシーやリキッドエックスを含む多くの俗称を有する。GHBは、低用量で興奮状態、運動や音楽の楽しさの増加、性欲の増加、および社交性の増加を生じうる。GHBは、より高用量で吐き気、目眩、眠気、動揺、視覚障害、呼吸困難、記憶喪失、意識不明、および死を誘発する。GHBの効果は、大量投与した場合またはアルコールと併用した場合、1.5〜3時間以上継続する。
【0009】
一般的に、娯楽で使用される投与量は500mg〜3000mgであり、濃度が1g/mlの場合(いつもとは限らない)、液体の約0.5〜3mlに相当する。レクリエーションドラッグとして使用されるとき、GHBは純正液体、または標準濃度1g/mlの一般的なGHB塩水溶液でありうることから、医学用途に合法的に販売されている薬物やキシレムの2倍の強さである。
【0010】
水および/またはアルコール飲料に溶解したGHB塩は、GHBの濃度がわからず、摂取されたGHBの実際の投与量を正確に判断するのが困難となりうることから、きわめて危険である。レクリエーションドラッグとして販売されているGHBは標準化されていないので、違法市場で購入されるGHB溶液の有効濃度を確認することは不可能である。GHBナトリウムは1mlの水に1g以上の溶解し、GHBナトリウム溶液は純粋なGHB溶液よりも実際に強力でありうる。GHBカリウム、GHBカルシウム、およびGHBマグネシウムのような他の塩の形態も報告されているが、前記ナトリウム塩が最も一般的なものである。
【0011】
化学物質の中には、胃中および血流中に循環している時にGHBに変換されるものがある。GBLまたはγ−ブチロラクトンはそのようなプロドラッグの一つである。他のプロドラッグとしては1,4−ブタンジオール(1,4−B)を含む。これらは、前駆体に関する追加的な毒性を有しうる。1,4−BおよびGBLは、例えば、ペンキ除去剤やワニス用希釈剤として産業上利用するとき、他のより有害な溶液と混合されうるが、通常、純正液体である。
【0012】
GHBは密造され、米国において使用されているGHBのほとんどは、米国内で不法に製造されている。いくつかの他の国において睡眠障害に処方薬として利用されている一方、その使用に伴う危険性により、GHBは1990年にFDAにより(米国内で)禁止された。しかしながら、2002年7月17日に、GHBはナルコレプシーとしばしば併発するカタプレキシーの治療に認可された。
【0013】
GHBは40年以上前に有望な麻酔薬としてフランスで初めて合成されたが、その望ましくない副作用によって米国医学会により禁止された。各国が前記問題を認識し始めており、GHBの合法的な使用は減少している。GHBは1987年にナルコレプシー/カタプレキシーとして知られている睡眠障害合併症治療用に研究されるオーファンドラッグとして再び使用され始めた。ほぼ同時に、ステロイドユーザーに(深い睡眠状態において)成長ホルモンの体内生産が増大しうると言われていた。しかしながら、過剰摂取者の数が増えたため、1990年11月に店頭に並べられなくなった。不運にも、レクリエーションドラッグおよびレイプドラッグとして認識され、一般に危険なものとなった。GHBそれ自体の規制が強化された結果、その「アナログ」または体内においてGHBに変換されうる化学的関連物が次第に普及していった。
【0014】
GHBの作用は未だ完全には解明されていない。GHBは、明らかに少なくとも2つの側面の作用を有しており、GABAB受容体と同様、最近の特徴付けられた、適切に命名された「GHB受容体」を刺激する。GHBが、仮に実際の神経伝達物質であれば、GABAB受容体に対し比較的弱い親和性を有しているので、GHB受容体で作用するのに十分な濃度に達しうる。しかしながら、レクリエーションでの使用中、GHBは基礎レベルに対して脳内できわめて高濃度に達し、GABAB受容体にも作用しうる。GABAB受容体におけるGHBの作用はおそらくその鎮痛作用に関与しうる。GHBによるGABAB受容体の刺激は、ドパミン放出を阻害し、(バクロフェンのような他のGABABアゴニストのような)天然の鎮静神経ステロイド放出の原因となる。動物では、GHBの前記鎮静作用はGABABアンタゴニスト(遮断薬)によりブロックされうる。
【0015】
GHBにより誘発された行動的な影響におけるGHB受容体の関連性は、よく議論されている。信じがたいが、GHB作用の高親和性部位と同様に、大脳皮質を含む脳の多くの領域において密に発現されるとき、GHB受容体は重要でない。GHB受容体における研究は限られている。しかしながら、興奮性神経伝達物質であるグルタミン酸塩の放出の原因となることが解っている。trans−4−ヒドロキシクロトン酸および4−(p−クロロベンジル)−GHBのようなGABAB受容体ではなく、GHB受容体を選択的に活性化する薬物は、動物の痙攣の原因となり、応答に適するGHBを産出しない。
【0016】
GHB受容体の活性化はGHBの追加的な性質を説明するものではない;GHB受容体の選択的なアゴニストであり、GABABを活性化しない選択的GABABアゴニストおよびGHBアナログを利用した調査では、GHB受容体およびGABAB受容体の両方がドパミン放出に重要であり、結果的に乱用傾向となることが示唆された。前記受容体の両方ではなく、一方のみを活性化する化合物は、急性のドパミン放出を誘起し、またはGHB自体による典型的な乱用の可能性をもたらすようには思われない。
【0017】
一般的に、高用量のGHBは、GABAB受容体を介して鎮静作用を示し、一方、低用量はGHB受容体の活性化を介して興奮作用を示す。これは、睡眠剤としてGBHを服用する個体が、GHBによりもたらされた深い睡眠の数時間後に突然目覚めてしまう際に経験する、いわゆる「リバウンド」効果とも呼ばれる、鎮静とGHB中毒による典型的な興奮との奇異性の混乱を説明しうる。これは、系中において、GABAB受容体機能を刺激するための閾値以下の代謝により、GHBの濃度は低下し、その後の覚醒状態をもたらすGHB受容体を刺激するためである。
【0018】
低用量におけるGHBの脳での鎮静効果は、抑制を抑えることにより高揚感または興奮状態を生み出す。前記用量が増加された場合には、深昏睡に陥る。心拍数も抑えられ、またはゆっくりとなる。神経系における効果はミオクローヌスと呼ばれる筋収縮の痙攣をもたらし、発作のようになる。GHBの主な鎮静効果と組み合わさると、混乱、記憶喪失、嘔吐、および不規則な呼吸等の他の効果により危険である。GHBと併用する他の薬物、特にアルコールは、前記鎮静効果を弱め、致命的な結果の可能性を増加しうる。低用量におけるGHBの所望の効果は魅力的に聞こえるが、(誤った)高用量の結果は死でありうる。GHBの用量反応性はかなり急であり、わずかな用量増加が症状および危険を劇的に増加する原因となることを意味する。様々な効果には、ティースプーン1杯で十分であり、それ以上は過剰投与になる。GHBを他の化学物質と混合したときに生じる結果に気づくこともまた重要である。例えば、GHBをアルコールまたは他の抑制剤と混合することは、結果的により死に至りやすくなる。前記効果は4時間続き、突然に消失する。
【0019】
前記薬物は、さらに最近、アルコールおよび薬物「ロヒプノール」と同様の方法で、デートレイプドラッグとしてメディアで言及されている。GHB自体は、石鹸のようなものであり、塩味があるが、溶液に希釈するとほとんど味はなく、したがって、飲料に混ぜたときに気づきにくい。さらに、摂取後のGHBの同定は、体液内に存在する時間が短く困難である。今までのところ、様々な方法:体液または毛髪、および飲料中のγ−ヒドロキシ酪酸(GHB)のスクリーニング方法が開発されている。
【0020】
Kintzらは、例えば、ガスクロマトグラフィー(GC)/質量分析(MS)により毛髪中のGHBの検査方法を開示した。該方法は毛髪サンプルを塩化メチレンで洗浄し、次いでGHB−d6の存在下、NaOH(0.01 N)中で一晩インキュベーションし、中和し、酸性条件下で酢酸エチルに抽出することにより、洗浄する必要がある(J. Forensic Sci.,2003,Jan;48(1):195−200)。同様の方法は、Shenらによっても開発されており(Fa Yi Xue Za Zhi;2006 Feb;22(1):48−51)、毛髪中のGHBをGC/MS分析している。両方の方法は、GC/MS検査方法は時間がかかり、複雑であるという不都合を有しているだけでなく、規則的な成長に対応するものをサンプルとするため、早くとも事象が断定された後、1か月は毛髪を収集しうる。したがって、リアルタイムおよび現場での検査は不可能である。
【0021】
今まで、血中および尿中におけるGHBの測定方法は、GC−MS、LC/LC−MS、HPLC、HPLC−MS、またはキャピラリー電気泳動法(CE)のようなクロマトグラフィー法にほとんど限られていた。
【0022】
血中および尿サンプル中のGHBの検出する検査方法は、例えば、Kankaanpaaらにより開発された(Forensic Sci Int.2007 Aug 6;170(2−3):133−8)。この方法もまた、数回の抽出、酸性化および遠心分離工程後、GC/MS分析を用いる。同様の方法(いくつかの条件および/または調製工程を伴うGC/MS方法)はLiuら(Fa Yi Xue Za Zhi;2007 Apr;23(2):120−2,129)、Paulら(J Anal Toxicol.2007 Jul−Aug;30(6):375−9)、Ferraraら(J Farm Biomed Anal.1993 JUN;11(6):483−7)、Villainら(J Chromatogr B Analyt Technol Biomed Life Sci.2003 Jul 15;792(1):83−7)、McCuskerら(J Anal Toxicol.1999 Sept;23(5):301−5)、Elianら(Forensic Sci Int.2000 Apr 10;109(3):183−7)、およびBlanchetら(J Chromatogr B Analyt Technol Biomed Life Sci.2002 Apr 5;769(2):221−6)により提供されている。
【0023】
ガスクロマトグラフィー(GC)法はまた、飲料(beverage)および/またはドリンク中GHBの検出に一般的に使用されている(例えば、Liuら、Fa Yi Xue Za Zhi,2007 Apr;23(2):120−2,129)。
【0024】
GHB成分のさらなる検査方法は、GHBが、酸性溶液中で、水酸化ナトリウム存在下でヒドロキシルアミン塩酸塩と反応するGBLに変換され、ヒドロキサメートを形成する点に特徴を有する、ドリンクおよび尿中のGHBを素早くスクリーニングするカラーテストを含む。ヒドロキサメートは酸性条件において塩化第二鉄と反応したとき、紫色の錯体が形成された(Zhang et al.;Fa Yi Xue Za Zhi,2006 Dec;22(6):424−7)。
【0025】
さらに、間接UV検出を用いたキャピラリー電気泳動(CE)およびエレクトロスプレーイオン化イオントラップ分光分析を用いた確認によって、ヒト尿中のGHBを決定する方法が当該技術分野で知られている(Baldacci et al.,J Chromatogr A,2003 Mar 21;990(1)−2:99−110)。該分析は間接UV吸収検出を用いた液体抽出およびキャピラリーゾーン電気泳動(CZE)に基づいている。同時に用いられる電解液には、ニコチン酸(4mM)(間接検出用の化合物)、スペルミン(3mM)(電気浸透の逆転)、およびヒスチジン(pH6.2にするために添加される)が含まれる。40cmの効果的な長さの50ミクロンIDキャピラリー、内部標準としての1−オクタンスルホン酸、214nmの溶液検出および2.4mS/cmの導電性を有する希釈尿を有している場合、GHB濃度=2μg/mlが検出されうる。
【0026】
加えて、GHB検出のアッセイに基づく酵素はBravoらにより開発され、サンプル中のGHB成分はラルストニア・ユートロファ(Ralstonia eutropha)由来のGHBデヒドロゲナーゼを使用する2工程の検査方法において決定される。この方法は少なくとも2つの連続した工程からなり、第1工程は、前記サンプルをGHBオキシドレダクターゼおよび酸化型補因子と接触させ、酸化型補因子の還元を行うものであり、第2工程は第2のオキシドレダクターゼおよび色原体または染料とを前記サンプルおよび前記還元型補因子と接触させ、検出可能な化合物の形態にするものである(Bravo et al.,J Forensic Sci,Mar.2004,Vol.49,No.2:379−87)。この方法はさらに、US 6,703,216 B2で特許されている。
【発明の概要】
【0027】
最先端ですでに知られているすべての方法は、大規模な装置、および/またはきわめて熟練した職員、および/または実施するのに長時間を要する。資格のない研究者によっても行われうる、新規、簡単、および迅速な方法に対する要望は、大規模な装置を必要とせず、また、緊急の検査に適する、極めて早い方法である。
【0028】
したがって、本発明は、簡単に行うことができ、大規模で効果な装置を必要としない、マイクロタイタープレートリーダーまたはオートアナライザーのどちらかに利用できるGHBの決定方法を提供することを目的とする。また、本発明の方法を実施するのに適したキットおよび組成物を提供することを目的とする。
【0029】
前記方法は臨床化学検査器に容易に適用可能であり、標準クロマトグラフィー法と良好な相関を示す利点をさらに有する。また、サンプル中に高レベルまたは低レベルのどちらであってもGHB決定が可能である。
【0030】
驚くべきことに、GHBをコハク酸セミアルデヒド(SSA)に変換しうる酵素および還元される酸化型補因子を含むサンプルをインキュベーションし、前記還元された補因子の量を測定することで、サンプル中のGHB成分を検出することが可能であることがわかった。前記還元型補因子測定量はサンプル中のGHB濃度と直接関連しうる。
【0031】
したがって、本発明は、(a)EDTAと共にシュウ酸を含む混合緩衝液を加えて希釈されたサンプルと酸化型補因子を還元することによりγ−ヒドロキシ酪酸(GHB)をコハク酸セミアルデヒド(SSA)へ変換可能な酵素とをインキュベーションする工程、(b)還元型補因子の量を測定する工程、および(c)前記還元型補因子の測定量と前記サンプル中のGHBの濃度とを関連づける工程、を含む、サンプル中のGHBの濃度の決定方法を提供する。
【0032】
本発明は、さらに(a)GHBをコハク酸セミアルデヒドへ変換可能な酵素、および(b)酸化型補因子を成分として含むGHBサンプル分析用組成物を提供する。
【0033】
さらに、本発明は、本発明の方法を行うのに適したキットを提供する。
【0034】
本発明は、また、マイクロタイタープレートまたはオートアナライザー(電解質、酵素、乱用薬物、治療薬物、腫瘍マーカー、ホルモン、心臓マーカーのような臨床化学パラメータの臨床検査にしばしば使用されるランダムアクセス分析)を用いる本発明の方法の使用に関する。
【図面の簡単な説明】
【0035】
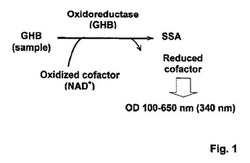
【図1】図1はサンプル(例えば、血清、尿、飲料)中のGHB濃度の決定原理を示す。
【図2】図2はGHB−DHの動態に関するマイクロプレート分析を示す。
【図3】図3はオートアナライザー(臨床化学分析)に用いられた2つのアッセイフォーマットを示す。
【図4】図4はコーンT30分析器で行われた2つの試薬による分析を示す。
【図5】図5は臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)におけるGHB検量線を示す。
【図6】図6は尿サンプル用の前記方法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)においての一連のアッセイ(添加回収率実験)の結果を示す。
【図7】図7は血清サンプル用の前記方法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分)において行われる一連のアッセイ(添加回収率実験)の結果を示す。
【図8】図8は、本発明の酵素法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)またはイオンクロマトグラフィー(IC)法のいずれかで行われる一連のアッセイの結果を示す。
【図9】図9は臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)において行われる一連のアッセイの結果を示す。
【図10A】図10は本発明の酵素法(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)でそれぞれ測定された10人の健常ドナーの血清および尿中のGHBの内因性レベルをそれぞれ示す。
【図10B】図10は本発明の酵素法(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)でそれぞれ測定された10人の健常ドナーの血清および尿中のGHBの内因性レベルをそれぞれ示す。
【図11】図11は中毒患者(n=9)から採取した尿サンプル中のGHBの内因性レベルと、GHB濃度を示す健常ドナー(n=10)から採取した尿サンプル中のGHBの内因性レベルとの比較を示す。
【発明を実施するための形態】
【0036】
本発明の前記方法において、前記サンプルは任意の体液、およびアルコール含有飲料を含む任意の飲料または任意の食用エキスから採取されうる。前記サンプルが体液から採取される場合、限定されないが、前記サンプルは、血液、血清、血漿、リンパ液、細胞もしくは組織誘導抽出物、骨髄液、唾液、眼球液、精液、脳抽出物、髄液、関節液、胸腺液、腹水または精製物質、および羊水からなる群から選択されることが好ましく、血液、血清または血漿、およびスポット尿であることが最も好ましい。可能な血漿サンプルはEDTA、クエン酸塩、およびヘパリン血漿を含む。前記サンプルが飲料または飲料様製品から採取される場合、前記サンプルは、制限されないが、ビール、ワイン、蒸留酒のようなアルコール含有飲料およびカクテルやアルコポップのようなアルコール含有混合飲料、レモンソーダ、炭酸ミネラルウォーター、コカコーラ(登録商標)、ジンジャーエール(登録商標)、ビターレモン(登録商標)、トニックウォーター(登録商標)またはスプライト(登録商標)、フルーツジュースのような炭酸またはソーダ飲料のようなノンアルコール飲料からなる群から選択されることが好ましい。本発明の趣旨において、バターミルク、ミルク、ヨーグルト飲料、ヨーグルト、およびクリームのような飲料様食品から前記サンプルを採取することも可能である。さらに可能なサンプルは、紅茶、紅茶含有製品、ココア、およびココア含有製品のほか、コーヒー、コーヒー代替品、および他のコーヒー含有製品である。
【0037】
本発明の趣旨において、GHBはGHB由来のものまたはそのアナログでありうる。さらに、「GHB」との語は、限定されないが、「γ−ヒドロキシ酪酸」、「γ−ヒドロキシ酪酸エステル」、「4−ヒドロキシ酪酸」、「オキシ酪酸」、「γ−ヒドロキシ酪酸ナトリウム(gamma−hydroxy sodium butyrate)」、「γ−ヒドロキシ酪酸ナトリウム(gamma−hydroxy butyrate sodium)」、「γ−ヒドロキシ酪酸分解生成物」、「γ−ヒドロキシ酪酸モノナトリウム塩」、「4−ヒドロキシブタン酸」、「4−ヒドロキシブタン酸エステル」、「4−ヒドロキシ酪酸ナトリウム」、「4−ヒドロキシ酪酸モノナトリウム塩」、「4−ヒドロキシ酪酸ナトリウム塩」、「ナトリウム γ−オキシ酪酸」などの語を含み、同じ意味で用いられうる。さらに、以下の語および商品名により表される物質が含まれる:「4HB」、「4−03−00−00774 (バイルシュタインハンドブック参照)」、「4−OHB」、「502−85−2」、「52352−27−9」、「591−81−1」、「AIDS−156012」、「AIDS 156012」、「BRN 1720582」、「C00989」、「CHEBI:30830」、「DEA No.2100」、「EB 27」、「Gam−OH」、「γ−OH」、「LMFA01050006」、「NSC84223」、「ソムサナイト(Somsanite)」、「WY 3478」、「WY−3478」、「ナトリウム オキシベート(sodium oxybate)」など。さらに、本発明の方法によって検出可能な、GHBに構造的に関連したGHBアナログ、それらの塩および同位体が含まれ、同一またはきわめて類似の薬剤効果を示し、この際、本発明の請求項1に記載の酵素の基質として使用されうる。前記GBH塩は、前述したGHBまたはこれらのアナログ、およびGBHに変換しうる前駆物質または前駆体(例えば、エーテルまたはアミド)、並びに、非限定のGHBに構造的に関連する「γ−ブチロラクトン」、「1,4−ブタンオール」、その他の化合物を含有するGHB前駆体等であり、同一または同様の薬剤効果を(直接的にまたは代謝の後に)示し、また、本発明により提供される方法により直接的にまたは段階的に検出されうる。「GBL」、「γ−ブチロラクトン」、「4−ヒドロキシ酪酸ラクトン」、「1,4−ブタノリド」、「4−ブチロラクトン」等の語は同じ意味で用いられ、「ジヒドロ−2(3H)−フラノン」を意味する。「前駆体」との語は、GHBを化学的に、または体内で代謝後に生成しうる化合物に関する。
【0038】
本発明の趣旨において、5μM(〜0.5mg/L)〜100000μM(〜10g/L)、好ましくは25〜50000μM、より好ましくは50〜20000μMのレベルで決定されうる。尿サンプルを検査する場合において、治療レベルの検査および100μMの切り捨てが、内因性並びに/または治療レベルおよびに毒性を示しうる陽性レベルとの間を区別するために好ましく使用される場合には、測定されうるGHB濃度は、好ましくは0〜2000μM、より好ましくは20〜500μM、さらに好ましくは30〜150μM、最も好ましくは100μMである。血漿または血清サンプルを検査する場合には、測定されうるGHBの濃度は、好ましくは0〜1000μM、より好ましくは10〜500μM、さらに好ましくは20〜100μMであり、50μMの切り捨てが、内因性並びに/または治療レベルおよび毒性を示しうる陽性レベルとの間を区別するために好ましく使用されている。直接分析において過度に高い濃度のサンプルは当業者公知の手段により希釈されうる。
【0039】
本発明の方法に使用される酵素は、GHBをコハク酸セミアルデヒド(SSA)に変換し、酸化型補酵素を還元できる任意の酵素でありうる。そのような酵素の例としては、オキシドレダクターゼが挙げられる。本発明において「オキシドレダクターゼ」との語は、1つの分子(還元剤であり、水素受容体または電子供与体とも呼ばれる)からもう1つ(酸化剤であり、水素供与体または電子受容体とも呼ばれる)への電子移動を触媒しうる任意の酵素を含む。特に、好ましいオキシドレダクターゼは、デヒドロゲナーゼおよびレダクターゼを含み、GHBデヒドロゲナーゼ(GHB−DH)、SSA−レダクターゼ、グルクロン酸レダクターゼ、およびアルデヒドレダクターゼが最も好ましい。1以上の酵素の混合物は、前記したように、本発明の前記方法においても使用されうる。
【0040】
本発明の方法に適した酵素は、天然由来のものまたは組み換えたもののいずれかでありうるが、好ましくは合成的に製造された遺伝子構築物(プラスミド)である。本発明において、前記組み換え酵素の調製は、当該技術分野において公知の、任意の方法が使用されうる。これらの方法は、限定されるものではないが、天然の出発原料に基づく化合物の合成および全合成システムによる調製を含む。
【0041】
本発明において、前記酵素の二つの異なる製造方法が好ましい。以下、本発明において好ましい方法が、単離に始まり、クローニング、GHB−DHの配列決定(遺伝子構築物の調製)という、酵素GHB−DHを製造方法を例として概説される:GHB−DHの単離、クローニング、および配列決定は、ラルストニア・ユートロファ(Ralstonia eutropha)、シュードモナス・プチダ(Pseudomonas putida)、および/またはボルデテラ・パラペルツッシス(Bordetella parapertussis)から行われる。GHB−DHの上流および下流のプライマーは、前記遺伝子を増幅するために使用されうる。GHB−DHは、その後、組み換え標識His融合タンパク質として生産され、His結合電磁ビーズまたはスーパーフローカラムを使用して精製される。コードされた遺伝子配列はpQE−30UAベクター中にクローン化され、組み換えGHB−DHは、図に示されるように、発現し精製されうる。
【0042】
1.大腸菌における発現
ラルストニア・ユートロファ(Ralstonia eutropha)、シュードモナス・プチダ(Pseudomonas putida)、および/またはボルデテラ・パラペルツッシス(Bordetella parapertussis)からの構築物が、出発原料として使用される。この方法によると、GHB−DH発現の最適化は3種類可能である:(1)大腸菌株(M15、BL−21およびXL1−ブルーMRF’)、(2)インダクタ濃度(IPTG)、および(3)インダクション用のインキュベーション温度(18℃〜37℃)。ラルストニア・ユートロファ、シュードモナス・プチダおよび/またはボルデテラ・パラペルツッシスからの配列を含むpQE−30UAベクターの構築物は、例えば、lac リプレッサーヘルパープラスミドpREP4を利用し、および利用しないで、XL1−ブルー中で形質転換される。正確な組み換えタンパクの発現は、抗His標識抗体を用いたSDS−PAGEおよびウエスタンブロットにより確認される。同時に、小スケールのIMACは、XL1−ブルー発現からGHB−DH凝集体の可溶化が行われる。その後、前記プラスミドは、選択された発現株のセットに再形質転換(retransform)される。
【0043】
2.ピキア・パストリス(Pichia pastoris)における発現
標的組み換えタンパクに対するα係数分泌シグナルを含むベクターpPICZalphaが、成長培地に付与される。目的の遺伝子の複数の複製物は、単一細胞中に統合されうる。多くの複製物は、ゼオシン濃度の増加により選択されうる。天然構築物からの前記GHB−DH配列(上記参照)は、His標識でラベルされていないベクターpPICZalpha A中に再クローン化される。ピキア・パストリスにおける形質転換は化学的方法で行われ、ゼオシン耐性により選択される。
【0044】
本発明における補因子は、酵素にしっかりと結合され、これが触媒活性に必要とされる非タンパク化学物質として理解されうる。それらは「ヘルパー」分子およびイオンとしてそれぞれ理解され、それぞれ生化学的変換を補助する。本発明において酸化型補因子は、本発明の方法において還元能を有する任意の補因子である。
【0045】
本発明の方法において使用される補因子は、限定されないが、ニコチンアミド補因子、フラビン補因子、キノン補因子およびオキソ酸を含み、この際、ニコチンアミド補因子は、限定されないが、ニコチンアミドアデニンジヌクレオチド(NAD)、ニコチンアミドアデニンジヌクレオチドリン酸(NADP)、ニコチンアミド1、N6−エテノアデニンジヌクレオチドリン酸を含む。フラビン補因子はフラビン基またはその活性部分を含む補因子を含む。本発明においてフラビン補因子の例は、限定されないが、リボフラビン、イソアロキサジン、フラビンモノヌクレオチド(FMN)およびフラビンアデニンジヌクレオチド(FAD)である。本発明において、キノン補因子は、キノン基を含む補因子として理解されうる。キノン補因子の例は、限定されないが、ピロロキノリンキニン(PQQ)である。オキソ酸の例は、限定されないが、α−ケトグルタル酸である。本発明の方法において使用されうる補因子のアナログもまた、本発明の技術的範囲に含まれる。
【0046】
特に好ましい補因子は、ニコチンアミドアデニンジヌクレオチド(NAD+)およびニコチンアミドアデニンジヌクレオチドリン酸(NADP)である。
【0047】
本発明において、NAD+は2つのリボース環からなり、一方はその1’位の炭素原子にアデニンが結合され、もう一方はこの位置にニコチンアミドが結合される。これらの2つの糖ヘテロ環部位は5’位の炭素を介して2つのリン酸基の架橋により共に結合している。NAD(P)+において、前記アデニンに結合しているリボース環は、2’位にさらにリン酸基を有している。前記補因子のアナログは、限定されないが、ニコチンアミドアデニンジヌクレオチド(NAD+)であり、ニコチンアミドアデニンジヌクレオチドリン酸(NADP)は、例えば、3−アセチルピリジン−NADH、3−アセチルピリジン NADPH、3−ピリジンアルデヒド−NADH、3−ピリジンアルデヒド−NAPDH、チオニコチンアミド−NADHおよびチオニコチンアミド−NADPHであり、本発明の方法においても使用されうる。さらに、1以上の補因子およびそれらのアナログの混合物は、それぞれ、前記されているように、本発明の方法において使用されうる。
【0048】
本発明の方法において、NAD+は0.001〜1000mM、好ましくは0.01〜100mM、より好ましくは0.1〜10mM、最も好ましくは2mMの濃度での濃度で使用される。
【0049】
本発明の方法において、前記補因子NAD(P)+は電子受容体として使用され、したがって、NAD(P)+はNAD(P)Hに還元される。本発明の方法は、様々な異なる方法、例えばマイクロタイタープレートまたはオートアナライザーにおいて一般的に行われうる。これに関連して、前記マイクロタイター(またはマイクロプレート)は小さな試験管として使用される小さな管状「ウェル」を有するフラットプレートである。マイクロプレートのそれぞれのウェルは、通常、数μL〜数百μLの液体を保持する。マイクロプレートは人間の手によってではなく、ロボットにより扱われうる。ロボットは、これらのプレートに液体サンプルを吸引もしくは分配する液体ハンドラーであり、または装置間でそれらを移動させる「プレート運送屋」でありうる。前記プレートのウェルに置き換える行為は、後に特別なマイクロタイタープレートリーダーにより検知される。好ましくは、強力なランプはマイクロタイターウェルを経て光を送り、マイクロプレートウェルに含まれる反応生成物に吸収または放出された光は、検知器により定量化される。本発明において適当な検知モードの例は、吸光度、蛍光強度、発光、時間分解蛍光および蛍光偏光であり、特に吸光度が好ましい。
【0050】
本発明において、オートアナライザーは、特別な流体操作およびフロー法を使用する自動分析器である。本発明において、利用可能な自動分析器の例は、セグメントフローアナライザー、フローインジェクションアナライザーまたは透析装置モジュールを有するオートアナライザーである。本発明において、具体的なオートアナライザーは、限定されないが、エアロセット(Aeroset)、アルション 300(Alcyon 300)、アボット(Abbott)社製のC8000/16000およびCi 8200/16200、シンクロンCx5(Synchron Cx5)、シンクロンCx4(Synchron Cx4)シンクロンCx7(Synchron Cx7)、シンクロンLx20(Synchron Lx20)およびベックマン(Beckman)社製のUniCell DxC800、サーモ(Thermo)社製のコーン(Kone)T20、T20 XT、T30およびT60、オリンパス社製のリプライアナライザー(Reply Analyzer)、AU 400,AU 600、AU 800、AU 640およびAU 2700/5400、オルト社製のビトロスフュージョン5.1(Vitros Fusion 5.1)およびビトロス340(Vitros 340)、ロシュ社製のコバスミラ(Cobas Mira)、ヒタチ704(Hitachi 704)、ヒタチ717(Hitachi 717)、ヒタチ911(Hitachi 911)、ヒタチ902(Hitachi 902)、ヒタチ912(Hitachi 912)、ヒタチ917(Hitachi 917)、コバスインテグラ400/700/800(Cobas Integra 400/700/800)、モジュラーP800(Modular P 800)、コバスC501(Cobas C501)、コバスC111(Cobas C111)、モジュラーD2400(Modular D2400)、コバスBIO(Cobas BIO)、コバスファラ(Cobas FARA)およびコバス6000(Cobas 6000)、シーメンズ(バイエル)社製のアドヴィア1200(Advia 1200)、アドヴィア1650(Advia 1650)、アドヴィア1800(Advia 1800)およびアドヴィア2400(Advia 2400)、シーメンズ(ダデ)社製のディメンションRxL(Dimension RxL)、ディメンションXpandプラス(Dimension Xpand plus)、ディメンションヴィスタ3000T(Dimension Vista 3000T)およびディメンションヴィスタ1500(Dimension Vista 1500)、エービーエックス(ABX)社製のペントラ60(Pentra 60)およびペントラ120(Pentra 120)、イーライテック(ELITech)社製のセレクトラE/XL(Selectra E/XL)、ランドックス(Randox)社製のRXデイトナ(RX Daytona)およびRXイモラ(RX Imola)、テクニコン(Technicon)社製のRA500、RA1000およびRA XTでありうる。本発明においてオートアナライザーは「臨床化学分析器」とも呼ばれる。
【0051】
サンプル中のGHB濃度の決定のため、還元型補因子の量を測定しなければならない。還元型補因子の量を測定しうる検知モードは、吸光度、蛍光強度、発光、時間分解蛍光、および蛍光偏光であり、特に吸光度が好ましい。前記サンプルの吸光度は好ましくは分光光度計を用いて測定される。本発明において分光光度計は色またはより特別な波長の光における強度を測定しうる光度計(光強度を測定する装置)である。本発明において多くの種類の分光光度計が用いられる。これらを分類するために利用されるもっとも重要な特徴は、作用する波長、利用できる測定技術、スペクトルの取得方法、測定のために設計された強度変化の源である。分光光度計の他の重要な特徴はスペクトルバンド幅および線形範囲を含む。通常、2つの異なる種の分光光度計(シングルビームおよびダブルビーム分光光度計)が本発明において使用されうる。ダブルビーム分光光度計は二つの異なる光路における光の強度の比率を測定し、前記シングルビーム分光光度計は絶対光度を測定する。比率の測定は簡易、かつ、一般的により安定であるが、シングルビーム装置は、例えば、より大きなダイナミックレンジを有しうる等の利点がある。
【0052】
本発明の方法によって処理された前記サンプルの光学密度は1〜1000nm、好ましくは100〜650nm、より好ましくは280〜450nm、最も好ましくは340nmで測定されうる。
【0053】
本発明の方法を実施する場合、特に制限されないが、pH、バッファー、イオン強度、1以上の塩の存否および濃度、変化および補因子の存否および濃度、任意の試薬、温度、持続時間(インキュベーション時間)、および反応容積を含む1以上のパラメータが個々に選択されうる。前記パラメータは所望の結果を得るために適宜組み合わせて選択されうる。
【0054】
前記反応混合物のpHは、pH2〜pH13、好ましくはpH8〜pH12から選択され、最も好ましくはpH10である。本発明の方法に適したpHを得るために、好ましくは分析試薬中にバッファーが含まれる。使用可能なバッファーは酢酸塩、ビシン(bicine)、フタル酸塩、ホウ酸塩、トリクロロ酢酸塩、スルホサリチル酸塩、リン酸塩、酒石酸塩、クエン酸塩、コハク酸塩、マレイン酸、2,2−ビス(ヒドロキシメチル)−2,2’,2”−ニトリロトリエタノール、3,3−ジメチルグルタル酸、3−N−モルホリノプロパンスルホン酸(MOPS)、マロン酸、1,3−ビストリス(ヒドロキシメチル)メチルアミノプロパン(ビス−TRIS)、トリス(ヒドロキシメチル)アミノメタン(TRIS)、トリス(ヒドロキシメチル)アミノメタン−マレイン酸(トリス−マレイン酸エステル)、トリス(ヒドロキシメチル)アミノメタン−マロン酸(トリス−マロン酸塩)、3−N−(トリスヒドロキシメチル)メチルアミノ−2−ヒドロキシプロパンヒドロキシプロパン硫酸(TAPSO)、2−(トリス(ヒドロキシメチル)メチルアミノ)エタンスルホン酸(TES)、1,4−ピペラジンビス(エタンスルホン酸)(PIPES)、4−モルホリノエタンスルホン酸(MES)、N−2−ヒドロキシエチルピペラジン−N’−2−エタンスルホン酸(HEPES)、硫酸塩、アミノ酸(例えば、グリシン)、2−アミノ−2−メチル−1,3−プロパンジオール(AMPD)、イミダゾール、トリエタノールアミン、N,N−ビス(2−ヒドロキシエチル)−2−アミノエタンスルホン酸(BES)、N−シクロヘキシル−2−アミノエタンスルホン酸(CHES)、トリス−HClおよび当業者に公知の他の物を含む。最も好ましくはAMPDバッファーである。
【0055】
本発明の方法によると、前記サンプルのインキュベーションは、0℃〜100℃、好ましくは18℃〜70℃、より好ましくは28℃〜50℃、さらに好ましくは35℃〜40℃、最も好ましくは37℃の温度で行われる。
【0056】
本発明の方法によると、前記サンプルのインキュベーション時間は、1秒〜数日、好ましくは10秒〜24時間、より好ましくは30秒〜5時間、さらに好ましくは1分〜60分であり、3分〜12分もまた好ましく、5分〜8分が最も好ましい。
【0057】
本発明の方法において使用される前記酵素の濃度は、リットル毎のユニットとして0.1〜10000μg/mL、好ましくは1〜1000μg/mLの範囲から選択され、より好ましくは10〜100μg/mL、さらに好ましくは30〜80μg/mL、最も好ましくは60μg/mLでありうる。
【0058】
本発明の方法によると、前記反応容積は1μL〜100mL、好ましくは50μL〜10mL、より好ましくは100μL〜1mLから選択され、最も好ましくは250μLでありうる。
【0059】
本発明の技術的範囲において、追加の反応剤が前記方法に含まれうる。そのような反応剤は、本発明の方法により、GHBの前駆体を検知可能な化合物に変換できる反応剤を含みうる。エステルをGHBに変換するには、エステラーゼが添加されていてもよく、GHBエステル、GBLのような内部エステル等が、GHBに変換されうる。アミラーゼは、アミド化形態のGHBをGHBに上記と同様に変換するために添加されうる。
【0060】
本発明の方法において、任意に含まれる物質は、限定されないが、ポリビニルピロリドン、ポリビニルアルコール、アラビアゴム、ゼラチン、アルギン、カラギーナン、カゼイン、アルブミン、メチルセルロース、保護されていないポリエチレングリコール、末端保護されたポリエチレングリコール、多糖類(例えば、スクロース)、他の天然および合成高分子材料、並びにこれらの組み合わせ等の高分子試薬;単糖類(例えば、グルコース)およびグリセロール等の非高分子試薬を含む群から選択されうる。また、試薬は安定化剤およびバイオサイドを含んでいてもよい。
【0061】
さらに、本発明の方法において、その他の任意の成分として、例えば、ウシ血清アルブミンのようなタンパク質、マルトース、グルコース、スクロース、トレハロース、グリセロールなどのような糖類、ポリエチレングリコールおよび当該技術分野において公知の化合物のような高分子化合物、例えば、ナトリウム、マグネシウム、カリウム、カルシウムおよび当該技術分野において公知の金属のような金属イオンが含まれていてもよい。任意成分として金属イオンが使用される場合、これらの金属イオンは酵素活性剤および/または安定化剤として働きうる。さらなる任意成分はエチレンジアミン四酢酸(EDTA)のようなキレート化合物である。好ましくは、前記糖類は0.1〜50%(w/v)、好ましくは0.15〜20%(w/v)、より好ましくは1〜5%(w/v)の濃度で使用される。タンパク質は、0.001〜50%(w/v)、好ましくは0.0015〜20%(w/v)、より好ましくは0.01〜2%(w/v)の濃度の溶液で使用される。金属イオンは、0.001〜1000mM、好ましくは0.1〜100mM、最も好ましくは0.15〜80mMの金属イオン濃度の溶液で使用される。EDTAは、0.001〜50mM、好ましくは0.01〜2mM、さらに好ましくは0.1〜1.5mM、最も好ましくは0.8mMの濃度の溶液で使用される。
【0062】
また、上述工程に追加の工程が行われうる。前記追加の工程は、限定されないが、例えば、シングル検査の実施に応じて行われるサンプル除タンパク質または加熱のような特別な処置;形質転換細菌培地の強力な溶解性、天然および変性状態におけるNi2+充填カラムによる発現タンパクの溶出、並びに/または前記溶出タンパク質へのプロテイナーゼ阻害剤および/もしくは防腐剤(例えば、NaN3)の添加によって、−発現融合タンパク質の完全性およびタンパク質のコンタミネーションは、SDS−PAGE法、または形成した封入体を溶解して、リフォールドする評価方法により評価されうる−酵素精製の再現性の最適化;GHB−DH非存在下でNAD+を含むサンプルのプレインキュベート、サンプルの希釈、EDTAと混合された乳酸脱水素酵素(例えば、シュウ酸)を含む糖分解酵素阻害剤の添加、またはサンプルを加熱不活化により、サンプル中のGBH依存性酵素または非酵素的なNADHの形成の最小化;亜硝酸および亜硝酸ナトリウム塩のようなヘモグロビン抑制剤の添加;トリス−HCl、CAPS,CAPSO、および/またはAMPのようなアルカリのpHにするために好適なバッファーの添加からなる群から選択されうる。本発明において、上述されたすべての追加的な工程は、本発明の方法に単独でまたは適宜組み合わせて実施されうる。
【0063】
本発明はまた、上述の方法の実施に適したキットに関する。本発明の方法の実施に適したキットは、少なくともGHBをコハク酸のセミアルデヒド(SSA)変換できる酵素および酸化型補因子を含む。前記キットはまた、限定されないが、全て上記で詳細に記載された、バッファー物質、GHB前駆体を検出可能な形態に変換できる追加の試薬、前記分析能力を改善するための物質、タンパク質、糖類、高分子化合物、金属イオン、およびキレート化合物を含んでいてもよい。
【0064】
本発明はまた、少なくともGHBをコハク酸セミアルデヒド(SSA)に変換できる酵素および酸化型補因子を含む、GHBのサンプルの分析に適した組成物に関する。前記組成物に含まれる酵素は、好ましくはオキシドレダクターゼであり、より好ましくはデヒドロゲナーゼであり、最も好ましくはGHBデヒドロゲナーゼ(GHB−DH)である。また、詳細に上述されているような化合物および試薬が前記組成物に追加的に含まれていてもよい。前記組成物に含まれる酸化型補因子は、好ましくはNAD+である。
【0065】
本発明はまた、マイクロタイタープレートまたはオートアナライザーにおける用途への前記方法の使用に関する。
【0066】
図のリスト
本発明は、限定されないが、さらに以下の図によって説明される。図は典型的な特徴を表すものであり、例示目的のみのものであることが理解される。
【0067】
図1はサンプル(例えば、血清、尿、飲料)中のGHB濃度の決定原理を示す。該分析において、オキシドレダクターゼ(GHBデヒドロゲナーゼ、GHB−DH;EC 1.1.1.61)は、NAD+を補因子として用いて、GHBをコハク酸セミアルデヒドへ酸化する。薬物(GHB)濃度と酵素活性とは直接に関連している。該反応は前記酵素を添加することにより開始され、GHB−DH活性は340nmでNAD+のNADHへの変換能を測定することで分光学的に決定される。
【0068】
図2はGHB−DHの動態に関するマイクロプレート分析を示す。GHB濃度の作用の反応容積に対する添加されたGHB濃度との関係におけるGHB−DH活性をマイクロプレート分析において5分間測定した。該分析において用いられたGHB濃度を右側に示す(mMで表す)。
【0069】
図3はオートアナライザー(臨床化学分析)に用いられた2つのアッセイフォーマットを示す。2つのフォーマットは、コーンT30分析器で行われた1つの試薬による分析を記載する。該試薬をオートアナライザーに設置する前に、緩衝液、阻害剤、補因子、および酵素を含む試薬混合物を、図に示されるRa、Rb、およびRc、またはRa’およびRb’を混合して調製しなければならない。その後、該試薬を前記サンプルまたは較正器と接触させ、指示された時間オートアナライザー内でインキュベートし、その後測定した。略称:OxA(シュウ酸);Cal(較正器)。
【0070】
図4はコーンT30分析器で行われた2つの試薬による分析を示す。試薬混合物R1をオートアナライザーに設置する前に、緩衝液および阻害剤を含む試薬R1a、並びに補因子を含む試薬R1bを、図に示されるようにR1aおよびRbを混合して調製しなければならない。そして、前記試薬R1a:R1bを、GHB−DHを含む試薬R2を加える前に前記サンプルまたは較正器と2分間接触させる。最終反応混合物インキュベートし、オートアナライザーでさらに6分間測定した。略称:OxA(シュウ酸);Cal(較正器);Con L(〜150μM GHBを含む尿コントロール);Con H(〜800μM GHBを含む尿コントロール)。
【0071】
図5は臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)におけるGHB検量線を示す。ΔODはインキュベーション時間2〜8分の340nmにおける光学密度の差である。
【0072】
図6は尿サンプル用の前記方法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)においての一連のアッセイ(添加回収率実験)の結果を示す。この実験において、健常ドナー(n=5)の尿は、GHBに対して0、100、500、および1000μMで添加された。パーセント(%)添加回収率は、添加サンプル中の予測GHB濃度(E)に対する実測GHB濃度(O)の%値(O/E)として計算された。
【0073】
図7は血清サンプル用の前記方法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分)において行われる一連のアッセイ(添加回収率実験)の結果を示す。この実験において、健常ドナー(n=6)からの血清は、GHBに対して0、150、および800μMで添加された。パーセント(%)添加回収率は、添加サンプル中の予測GHB濃度(E)に対する実測GHB濃度(O)の%値(O/E)として計算された。
【0074】
図8は、本発明の酵素法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)またはイオンクロマトグラフィー(IC)法のいずれかで行われる一連のアッセイの結果を示す。中毒患者(それぞれ、n=3)から採取したGHB陽性血清および尿サンプルが、2つの試薬による手順を使用する酵素法において分析され、測定結果を、イオンクロマトグラフィーに基づく確立した参照方法で得られた結果と比較した(Jordiら:ヒト血清および尿中のギ酸、グリコール酸塩、γ−ヒドロキシ酪酸を、その他の内因性有機酸とともに決定する方法、2003年、スイス、バーゼルおよびムッテンツの産業科および化学科の工業高校における卒業研究;Jordiら:イオンクロマトグラフィーを用いたGHB決定、2003年、スイス、バーゼルの国際TDM学会会議でのポスター)。
【0075】
図9は臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)において行われる一連のアッセイの結果を示す。中毒患者(n=9)から採取したGHBの陽性尿サンプルの濃度は、本発明の酵素法により決定され、図8において規定されたIC参照法に関連付けられた。初期濃度が2000μMより大きな尿サンプル(〜200mg/L)は0.9%NaCl溶液で5〜100倍に希釈され、再分析された。測定されたGHB濃度はmg/Lで示される。
【0076】
図10は本発明の酵素法(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)でそれぞれ測定された10人の健常ドナーの血清および尿中のGHBの内因性レベルをそれぞれ示す。
【0077】
図11は中毒患者(n=9)から採取した尿サンプル中のGHBの内因性レベルと、GHB濃度を示す健常ドナー(n=10)から採取した尿サンプル中のGHBの内因性レベルとの比較を示す。すべてのサンプルは本発明の酵素法(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)で測定された。測定されたGHB濃度はμMで与えられる。2000μMより高い初期濃度の患者のサンプルは0.9%NaCl溶液で5〜100倍に希釈し、再分析した。
【技術分野】
【0001】
本発明はサンプル中のγ−ヒドロキシ酪酸(GHB)の濃度を決定するための方法および組成物、並びに前記方法を行うのに適したキットに関する。本発明は、さらに、マイクロタイタープレートまたはオートアナライザー(臨床検査室でしばしば使用されるランダムアクセス分析用装置)における用途への前記方法の使用に関する。
【背景技術】
【0002】
γ−ヒドロキシ酪酸(4−ヒドロキシブタン酸、C4H8O3、通常、GHBと略される)は内因性物質であり、また、多くの国において非合法的な治療薬物であって、中枢神経系、つる植物、肉牛、小さな柑橘果実、およびほとんどすべての他の生物に少量見出される自然発生物質である。該物質は現在、米国で規制されており、ジャズファーマシューティカルがキシレム(Xyrem)という名称で販売している。
【0003】
医療機関において、GHBは一般的な麻酔薬として使用され、不眠症、臨床的鬱病、ナルコレプシー、およびアルコール依存症のような症状の治療ならびに運動能力を改善するため使用されている。
【0004】
イタリアでは、GHBは、アルコバー(Alcover)(ATCN07BB)という商標名で、急性アルコール離脱用および長期間解毒媒体用としてアルコール依存症治療(3回以上の分配投与で50〜100mg/kg/日)に使用されている。米国では、GHBは、キシレムという商標名で、ナルコレプシー患者の脱力発作回数を減らすための用途としての使用が食品医薬品局(FDA)に認可されている。
【0005】
GHBがナトリウム塩またはカリウム塩の形態で用いられる場合には、有意量の過剰ナトリウムまたはカリウムが消費されることから、心不全、高血圧、または腎機能低下している者に考慮される。食品とともに摂取される場合には、GHBナトリウム塩のバイオアベイラビリティーはかなり低下するため、薬を服用する前には食後少なくとも2時間待つよう指示される。その鎮静作用は強力であるため、患者はGHBナトリウム塩を摂取した後、少なくとも6時間は運転や重機を操作するべきではない。
【0006】
臨床試験におけるキシレムの副作用としては、頭痛、吐き気、咽頭炎、めまい、眠気、嘔吐、尿失禁、精神錯乱、呼吸困難、感覚麻痺、知覚障害、震え、目眩、および視力低下を含む。
【0007】
また、γ−ヒドロキシ酪酸(GHB)は、米国や他の国で薬物性昏睡の主要な原因となる違法化学物質である。実際、米国において、GHBの過剰摂取の数は、現在、MDMA(エクスタシー)の過剰摂取の数を越えている。GHBは1960年代に米国医学会により禁止されたが、血液脳関門を自由に通過し、意識を低下させ、その結果興奮する作用を有し、また、毒性を有することから、多くの人の間で良く知られている。これらの使用は、科学的研究により証明されているわけではなく、死に至る危険性もあるが、睡眠補助薬、抗鬱剤および減量製品としてインターネットで過大に宣伝されている。GHBは、1980年代後半にステロイドが規制されたとき、ステロイドの代替品として最初に始まり、緊急治療室での業務、愛する者を失った者の命に対する喪失感、中毒の家族/友達に対する恐怖感によって生じる多様な医療悪夢へと拡大した。しかし、それは未だ警察官、医療/検視従事者、および親にとって不可解なことである。
【0008】
非医学的に、中枢神経系(CNS)抑制剤としても作用するGHBは、乱用薬物として使用される。それは、リキッドエクスタシーやリキッドエックスを含む多くの俗称を有する。GHBは、低用量で興奮状態、運動や音楽の楽しさの増加、性欲の増加、および社交性の増加を生じうる。GHBは、より高用量で吐き気、目眩、眠気、動揺、視覚障害、呼吸困難、記憶喪失、意識不明、および死を誘発する。GHBの効果は、大量投与した場合またはアルコールと併用した場合、1.5〜3時間以上継続する。
【0009】
一般的に、娯楽で使用される投与量は500mg〜3000mgであり、濃度が1g/mlの場合(いつもとは限らない)、液体の約0.5〜3mlに相当する。レクリエーションドラッグとして使用されるとき、GHBは純正液体、または標準濃度1g/mlの一般的なGHB塩水溶液でありうることから、医学用途に合法的に販売されている薬物やキシレムの2倍の強さである。
【0010】
水および/またはアルコール飲料に溶解したGHB塩は、GHBの濃度がわからず、摂取されたGHBの実際の投与量を正確に判断するのが困難となりうることから、きわめて危険である。レクリエーションドラッグとして販売されているGHBは標準化されていないので、違法市場で購入されるGHB溶液の有効濃度を確認することは不可能である。GHBナトリウムは1mlの水に1g以上の溶解し、GHBナトリウム溶液は純粋なGHB溶液よりも実際に強力でありうる。GHBカリウム、GHBカルシウム、およびGHBマグネシウムのような他の塩の形態も報告されているが、前記ナトリウム塩が最も一般的なものである。
【0011】
化学物質の中には、胃中および血流中に循環している時にGHBに変換されるものがある。GBLまたはγ−ブチロラクトンはそのようなプロドラッグの一つである。他のプロドラッグとしては1,4−ブタンジオール(1,4−B)を含む。これらは、前駆体に関する追加的な毒性を有しうる。1,4−BおよびGBLは、例えば、ペンキ除去剤やワニス用希釈剤として産業上利用するとき、他のより有害な溶液と混合されうるが、通常、純正液体である。
【0012】
GHBは密造され、米国において使用されているGHBのほとんどは、米国内で不法に製造されている。いくつかの他の国において睡眠障害に処方薬として利用されている一方、その使用に伴う危険性により、GHBは1990年にFDAにより(米国内で)禁止された。しかしながら、2002年7月17日に、GHBはナルコレプシーとしばしば併発するカタプレキシーの治療に認可された。
【0013】
GHBは40年以上前に有望な麻酔薬としてフランスで初めて合成されたが、その望ましくない副作用によって米国医学会により禁止された。各国が前記問題を認識し始めており、GHBの合法的な使用は減少している。GHBは1987年にナルコレプシー/カタプレキシーとして知られている睡眠障害合併症治療用に研究されるオーファンドラッグとして再び使用され始めた。ほぼ同時に、ステロイドユーザーに(深い睡眠状態において)成長ホルモンの体内生産が増大しうると言われていた。しかしながら、過剰摂取者の数が増えたため、1990年11月に店頭に並べられなくなった。不運にも、レクリエーションドラッグおよびレイプドラッグとして認識され、一般に危険なものとなった。GHBそれ自体の規制が強化された結果、その「アナログ」または体内においてGHBに変換されうる化学的関連物が次第に普及していった。
【0014】
GHBの作用は未だ完全には解明されていない。GHBは、明らかに少なくとも2つの側面の作用を有しており、GABAB受容体と同様、最近の特徴付けられた、適切に命名された「GHB受容体」を刺激する。GHBが、仮に実際の神経伝達物質であれば、GABAB受容体に対し比較的弱い親和性を有しているので、GHB受容体で作用するのに十分な濃度に達しうる。しかしながら、レクリエーションでの使用中、GHBは基礎レベルに対して脳内できわめて高濃度に達し、GABAB受容体にも作用しうる。GABAB受容体におけるGHBの作用はおそらくその鎮痛作用に関与しうる。GHBによるGABAB受容体の刺激は、ドパミン放出を阻害し、(バクロフェンのような他のGABABアゴニストのような)天然の鎮静神経ステロイド放出の原因となる。動物では、GHBの前記鎮静作用はGABABアンタゴニスト(遮断薬)によりブロックされうる。
【0015】
GHBにより誘発された行動的な影響におけるGHB受容体の関連性は、よく議論されている。信じがたいが、GHB作用の高親和性部位と同様に、大脳皮質を含む脳の多くの領域において密に発現されるとき、GHB受容体は重要でない。GHB受容体における研究は限られている。しかしながら、興奮性神経伝達物質であるグルタミン酸塩の放出の原因となることが解っている。trans−4−ヒドロキシクロトン酸および4−(p−クロロベンジル)−GHBのようなGABAB受容体ではなく、GHB受容体を選択的に活性化する薬物は、動物の痙攣の原因となり、応答に適するGHBを産出しない。
【0016】
GHB受容体の活性化はGHBの追加的な性質を説明するものではない;GHB受容体の選択的なアゴニストであり、GABABを活性化しない選択的GABABアゴニストおよびGHBアナログを利用した調査では、GHB受容体およびGABAB受容体の両方がドパミン放出に重要であり、結果的に乱用傾向となることが示唆された。前記受容体の両方ではなく、一方のみを活性化する化合物は、急性のドパミン放出を誘起し、またはGHB自体による典型的な乱用の可能性をもたらすようには思われない。
【0017】
一般的に、高用量のGHBは、GABAB受容体を介して鎮静作用を示し、一方、低用量はGHB受容体の活性化を介して興奮作用を示す。これは、睡眠剤としてGBHを服用する個体が、GHBによりもたらされた深い睡眠の数時間後に突然目覚めてしまう際に経験する、いわゆる「リバウンド」効果とも呼ばれる、鎮静とGHB中毒による典型的な興奮との奇異性の混乱を説明しうる。これは、系中において、GABAB受容体機能を刺激するための閾値以下の代謝により、GHBの濃度は低下し、その後の覚醒状態をもたらすGHB受容体を刺激するためである。
【0018】
低用量におけるGHBの脳での鎮静効果は、抑制を抑えることにより高揚感または興奮状態を生み出す。前記用量が増加された場合には、深昏睡に陥る。心拍数も抑えられ、またはゆっくりとなる。神経系における効果はミオクローヌスと呼ばれる筋収縮の痙攣をもたらし、発作のようになる。GHBの主な鎮静効果と組み合わさると、混乱、記憶喪失、嘔吐、および不規則な呼吸等の他の効果により危険である。GHBと併用する他の薬物、特にアルコールは、前記鎮静効果を弱め、致命的な結果の可能性を増加しうる。低用量におけるGHBの所望の効果は魅力的に聞こえるが、(誤った)高用量の結果は死でありうる。GHBの用量反応性はかなり急であり、わずかな用量増加が症状および危険を劇的に増加する原因となることを意味する。様々な効果には、ティースプーン1杯で十分であり、それ以上は過剰投与になる。GHBを他の化学物質と混合したときに生じる結果に気づくこともまた重要である。例えば、GHBをアルコールまたは他の抑制剤と混合することは、結果的により死に至りやすくなる。前記効果は4時間続き、突然に消失する。
【0019】
前記薬物は、さらに最近、アルコールおよび薬物「ロヒプノール」と同様の方法で、デートレイプドラッグとしてメディアで言及されている。GHB自体は、石鹸のようなものであり、塩味があるが、溶液に希釈するとほとんど味はなく、したがって、飲料に混ぜたときに気づきにくい。さらに、摂取後のGHBの同定は、体液内に存在する時間が短く困難である。今までのところ、様々な方法:体液または毛髪、および飲料中のγ−ヒドロキシ酪酸(GHB)のスクリーニング方法が開発されている。
【0020】
Kintzらは、例えば、ガスクロマトグラフィー(GC)/質量分析(MS)により毛髪中のGHBの検査方法を開示した。該方法は毛髪サンプルを塩化メチレンで洗浄し、次いでGHB−d6の存在下、NaOH(0.01 N)中で一晩インキュベーションし、中和し、酸性条件下で酢酸エチルに抽出することにより、洗浄する必要がある(J. Forensic Sci.,2003,Jan;48(1):195−200)。同様の方法は、Shenらによっても開発されており(Fa Yi Xue Za Zhi;2006 Feb;22(1):48−51)、毛髪中のGHBをGC/MS分析している。両方の方法は、GC/MS検査方法は時間がかかり、複雑であるという不都合を有しているだけでなく、規則的な成長に対応するものをサンプルとするため、早くとも事象が断定された後、1か月は毛髪を収集しうる。したがって、リアルタイムおよび現場での検査は不可能である。
【0021】
今まで、血中および尿中におけるGHBの測定方法は、GC−MS、LC/LC−MS、HPLC、HPLC−MS、またはキャピラリー電気泳動法(CE)のようなクロマトグラフィー法にほとんど限られていた。
【0022】
血中および尿サンプル中のGHBの検出する検査方法は、例えば、Kankaanpaaらにより開発された(Forensic Sci Int.2007 Aug 6;170(2−3):133−8)。この方法もまた、数回の抽出、酸性化および遠心分離工程後、GC/MS分析を用いる。同様の方法(いくつかの条件および/または調製工程を伴うGC/MS方法)はLiuら(Fa Yi Xue Za Zhi;2007 Apr;23(2):120−2,129)、Paulら(J Anal Toxicol.2007 Jul−Aug;30(6):375−9)、Ferraraら(J Farm Biomed Anal.1993 JUN;11(6):483−7)、Villainら(J Chromatogr B Analyt Technol Biomed Life Sci.2003 Jul 15;792(1):83−7)、McCuskerら(J Anal Toxicol.1999 Sept;23(5):301−5)、Elianら(Forensic Sci Int.2000 Apr 10;109(3):183−7)、およびBlanchetら(J Chromatogr B Analyt Technol Biomed Life Sci.2002 Apr 5;769(2):221−6)により提供されている。
【0023】
ガスクロマトグラフィー(GC)法はまた、飲料(beverage)および/またはドリンク中GHBの検出に一般的に使用されている(例えば、Liuら、Fa Yi Xue Za Zhi,2007 Apr;23(2):120−2,129)。
【0024】
GHB成分のさらなる検査方法は、GHBが、酸性溶液中で、水酸化ナトリウム存在下でヒドロキシルアミン塩酸塩と反応するGBLに変換され、ヒドロキサメートを形成する点に特徴を有する、ドリンクおよび尿中のGHBを素早くスクリーニングするカラーテストを含む。ヒドロキサメートは酸性条件において塩化第二鉄と反応したとき、紫色の錯体が形成された(Zhang et al.;Fa Yi Xue Za Zhi,2006 Dec;22(6):424−7)。
【0025】
さらに、間接UV検出を用いたキャピラリー電気泳動(CE)およびエレクトロスプレーイオン化イオントラップ分光分析を用いた確認によって、ヒト尿中のGHBを決定する方法が当該技術分野で知られている(Baldacci et al.,J Chromatogr A,2003 Mar 21;990(1)−2:99−110)。該分析は間接UV吸収検出を用いた液体抽出およびキャピラリーゾーン電気泳動(CZE)に基づいている。同時に用いられる電解液には、ニコチン酸(4mM)(間接検出用の化合物)、スペルミン(3mM)(電気浸透の逆転)、およびヒスチジン(pH6.2にするために添加される)が含まれる。40cmの効果的な長さの50ミクロンIDキャピラリー、内部標準としての1−オクタンスルホン酸、214nmの溶液検出および2.4mS/cmの導電性を有する希釈尿を有している場合、GHB濃度=2μg/mlが検出されうる。
【0026】
加えて、GHB検出のアッセイに基づく酵素はBravoらにより開発され、サンプル中のGHB成分はラルストニア・ユートロファ(Ralstonia eutropha)由来のGHBデヒドロゲナーゼを使用する2工程の検査方法において決定される。この方法は少なくとも2つの連続した工程からなり、第1工程は、前記サンプルをGHBオキシドレダクターゼおよび酸化型補因子と接触させ、酸化型補因子の還元を行うものであり、第2工程は第2のオキシドレダクターゼおよび色原体または染料とを前記サンプルおよび前記還元型補因子と接触させ、検出可能な化合物の形態にするものである(Bravo et al.,J Forensic Sci,Mar.2004,Vol.49,No.2:379−87)。この方法はさらに、US 6,703,216 B2で特許されている。
【発明の概要】
【0027】
最先端ですでに知られているすべての方法は、大規模な装置、および/またはきわめて熟練した職員、および/または実施するのに長時間を要する。資格のない研究者によっても行われうる、新規、簡単、および迅速な方法に対する要望は、大規模な装置を必要とせず、また、緊急の検査に適する、極めて早い方法である。
【0028】
したがって、本発明は、簡単に行うことができ、大規模で効果な装置を必要としない、マイクロタイタープレートリーダーまたはオートアナライザーのどちらかに利用できるGHBの決定方法を提供することを目的とする。また、本発明の方法を実施するのに適したキットおよび組成物を提供することを目的とする。
【0029】
前記方法は臨床化学検査器に容易に適用可能であり、標準クロマトグラフィー法と良好な相関を示す利点をさらに有する。また、サンプル中に高レベルまたは低レベルのどちらであってもGHB決定が可能である。
【0030】
驚くべきことに、GHBをコハク酸セミアルデヒド(SSA)に変換しうる酵素および還元される酸化型補因子を含むサンプルをインキュベーションし、前記還元された補因子の量を測定することで、サンプル中のGHB成分を検出することが可能であることがわかった。前記還元型補因子測定量はサンプル中のGHB濃度と直接関連しうる。
【0031】
したがって、本発明は、(a)EDTAと共にシュウ酸を含む混合緩衝液を加えて希釈されたサンプルと酸化型補因子を還元することによりγ−ヒドロキシ酪酸(GHB)をコハク酸セミアルデヒド(SSA)へ変換可能な酵素とをインキュベーションする工程、(b)還元型補因子の量を測定する工程、および(c)前記還元型補因子の測定量と前記サンプル中のGHBの濃度とを関連づける工程、を含む、サンプル中のGHBの濃度の決定方法を提供する。
【0032】
本発明は、さらに(a)GHBをコハク酸セミアルデヒドへ変換可能な酵素、および(b)酸化型補因子を成分として含むGHBサンプル分析用組成物を提供する。
【0033】
さらに、本発明は、本発明の方法を行うのに適したキットを提供する。
【0034】
本発明は、また、マイクロタイタープレートまたはオートアナライザー(電解質、酵素、乱用薬物、治療薬物、腫瘍マーカー、ホルモン、心臓マーカーのような臨床化学パラメータの臨床検査にしばしば使用されるランダムアクセス分析)を用いる本発明の方法の使用に関する。
【図面の簡単な説明】
【0035】
【図1】図1はサンプル(例えば、血清、尿、飲料)中のGHB濃度の決定原理を示す。
【図2】図2はGHB−DHの動態に関するマイクロプレート分析を示す。
【図3】図3はオートアナライザー(臨床化学分析)に用いられた2つのアッセイフォーマットを示す。
【図4】図4はコーンT30分析器で行われた2つの試薬による分析を示す。
【図5】図5は臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)におけるGHB検量線を示す。
【図6】図6は尿サンプル用の前記方法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)においての一連のアッセイ(添加回収率実験)の結果を示す。
【図7】図7は血清サンプル用の前記方法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分)において行われる一連のアッセイ(添加回収率実験)の結果を示す。
【図8】図8は、本発明の酵素法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)またはイオンクロマトグラフィー(IC)法のいずれかで行われる一連のアッセイの結果を示す。
【図9】図9は臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)において行われる一連のアッセイの結果を示す。
【図10A】図10は本発明の酵素法(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)でそれぞれ測定された10人の健常ドナーの血清および尿中のGHBの内因性レベルをそれぞれ示す。
【図10B】図10は本発明の酵素法(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)でそれぞれ測定された10人の健常ドナーの血清および尿中のGHBの内因性レベルをそれぞれ示す。
【図11】図11は中毒患者(n=9)から採取した尿サンプル中のGHBの内因性レベルと、GHB濃度を示す健常ドナー(n=10)から採取した尿サンプル中のGHBの内因性レベルとの比較を示す。
【発明を実施するための形態】
【0036】
本発明の前記方法において、前記サンプルは任意の体液、およびアルコール含有飲料を含む任意の飲料または任意の食用エキスから採取されうる。前記サンプルが体液から採取される場合、限定されないが、前記サンプルは、血液、血清、血漿、リンパ液、細胞もしくは組織誘導抽出物、骨髄液、唾液、眼球液、精液、脳抽出物、髄液、関節液、胸腺液、腹水または精製物質、および羊水からなる群から選択されることが好ましく、血液、血清または血漿、およびスポット尿であることが最も好ましい。可能な血漿サンプルはEDTA、クエン酸塩、およびヘパリン血漿を含む。前記サンプルが飲料または飲料様製品から採取される場合、前記サンプルは、制限されないが、ビール、ワイン、蒸留酒のようなアルコール含有飲料およびカクテルやアルコポップのようなアルコール含有混合飲料、レモンソーダ、炭酸ミネラルウォーター、コカコーラ(登録商標)、ジンジャーエール(登録商標)、ビターレモン(登録商標)、トニックウォーター(登録商標)またはスプライト(登録商標)、フルーツジュースのような炭酸またはソーダ飲料のようなノンアルコール飲料からなる群から選択されることが好ましい。本発明の趣旨において、バターミルク、ミルク、ヨーグルト飲料、ヨーグルト、およびクリームのような飲料様食品から前記サンプルを採取することも可能である。さらに可能なサンプルは、紅茶、紅茶含有製品、ココア、およびココア含有製品のほか、コーヒー、コーヒー代替品、および他のコーヒー含有製品である。
【0037】
本発明の趣旨において、GHBはGHB由来のものまたはそのアナログでありうる。さらに、「GHB」との語は、限定されないが、「γ−ヒドロキシ酪酸」、「γ−ヒドロキシ酪酸エステル」、「4−ヒドロキシ酪酸」、「オキシ酪酸」、「γ−ヒドロキシ酪酸ナトリウム(gamma−hydroxy sodium butyrate)」、「γ−ヒドロキシ酪酸ナトリウム(gamma−hydroxy butyrate sodium)」、「γ−ヒドロキシ酪酸分解生成物」、「γ−ヒドロキシ酪酸モノナトリウム塩」、「4−ヒドロキシブタン酸」、「4−ヒドロキシブタン酸エステル」、「4−ヒドロキシ酪酸ナトリウム」、「4−ヒドロキシ酪酸モノナトリウム塩」、「4−ヒドロキシ酪酸ナトリウム塩」、「ナトリウム γ−オキシ酪酸」などの語を含み、同じ意味で用いられうる。さらに、以下の語および商品名により表される物質が含まれる:「4HB」、「4−03−00−00774 (バイルシュタインハンドブック参照)」、「4−OHB」、「502−85−2」、「52352−27−9」、「591−81−1」、「AIDS−156012」、「AIDS 156012」、「BRN 1720582」、「C00989」、「CHEBI:30830」、「DEA No.2100」、「EB 27」、「Gam−OH」、「γ−OH」、「LMFA01050006」、「NSC84223」、「ソムサナイト(Somsanite)」、「WY 3478」、「WY−3478」、「ナトリウム オキシベート(sodium oxybate)」など。さらに、本発明の方法によって検出可能な、GHBに構造的に関連したGHBアナログ、それらの塩および同位体が含まれ、同一またはきわめて類似の薬剤効果を示し、この際、本発明の請求項1に記載の酵素の基質として使用されうる。前記GBH塩は、前述したGHBまたはこれらのアナログ、およびGBHに変換しうる前駆物質または前駆体(例えば、エーテルまたはアミド)、並びに、非限定のGHBに構造的に関連する「γ−ブチロラクトン」、「1,4−ブタンオール」、その他の化合物を含有するGHB前駆体等であり、同一または同様の薬剤効果を(直接的にまたは代謝の後に)示し、また、本発明により提供される方法により直接的にまたは段階的に検出されうる。「GBL」、「γ−ブチロラクトン」、「4−ヒドロキシ酪酸ラクトン」、「1,4−ブタノリド」、「4−ブチロラクトン」等の語は同じ意味で用いられ、「ジヒドロ−2(3H)−フラノン」を意味する。「前駆体」との語は、GHBを化学的に、または体内で代謝後に生成しうる化合物に関する。
【0038】
本発明の趣旨において、5μM(〜0.5mg/L)〜100000μM(〜10g/L)、好ましくは25〜50000μM、より好ましくは50〜20000μMのレベルで決定されうる。尿サンプルを検査する場合において、治療レベルの検査および100μMの切り捨てが、内因性並びに/または治療レベルおよびに毒性を示しうる陽性レベルとの間を区別するために好ましく使用される場合には、測定されうるGHB濃度は、好ましくは0〜2000μM、より好ましくは20〜500μM、さらに好ましくは30〜150μM、最も好ましくは100μMである。血漿または血清サンプルを検査する場合には、測定されうるGHBの濃度は、好ましくは0〜1000μM、より好ましくは10〜500μM、さらに好ましくは20〜100μMであり、50μMの切り捨てが、内因性並びに/または治療レベルおよび毒性を示しうる陽性レベルとの間を区別するために好ましく使用されている。直接分析において過度に高い濃度のサンプルは当業者公知の手段により希釈されうる。
【0039】
本発明の方法に使用される酵素は、GHBをコハク酸セミアルデヒド(SSA)に変換し、酸化型補酵素を還元できる任意の酵素でありうる。そのような酵素の例としては、オキシドレダクターゼが挙げられる。本発明において「オキシドレダクターゼ」との語は、1つの分子(還元剤であり、水素受容体または電子供与体とも呼ばれる)からもう1つ(酸化剤であり、水素供与体または電子受容体とも呼ばれる)への電子移動を触媒しうる任意の酵素を含む。特に、好ましいオキシドレダクターゼは、デヒドロゲナーゼおよびレダクターゼを含み、GHBデヒドロゲナーゼ(GHB−DH)、SSA−レダクターゼ、グルクロン酸レダクターゼ、およびアルデヒドレダクターゼが最も好ましい。1以上の酵素の混合物は、前記したように、本発明の前記方法においても使用されうる。
【0040】
本発明の方法に適した酵素は、天然由来のものまたは組み換えたもののいずれかでありうるが、好ましくは合成的に製造された遺伝子構築物(プラスミド)である。本発明において、前記組み換え酵素の調製は、当該技術分野において公知の、任意の方法が使用されうる。これらの方法は、限定されるものではないが、天然の出発原料に基づく化合物の合成および全合成システムによる調製を含む。
【0041】
本発明において、前記酵素の二つの異なる製造方法が好ましい。以下、本発明において好ましい方法が、単離に始まり、クローニング、GHB−DHの配列決定(遺伝子構築物の調製)という、酵素GHB−DHを製造方法を例として概説される:GHB−DHの単離、クローニング、および配列決定は、ラルストニア・ユートロファ(Ralstonia eutropha)、シュードモナス・プチダ(Pseudomonas putida)、および/またはボルデテラ・パラペルツッシス(Bordetella parapertussis)から行われる。GHB−DHの上流および下流のプライマーは、前記遺伝子を増幅するために使用されうる。GHB−DHは、その後、組み換え標識His融合タンパク質として生産され、His結合電磁ビーズまたはスーパーフローカラムを使用して精製される。コードされた遺伝子配列はpQE−30UAベクター中にクローン化され、組み換えGHB−DHは、図に示されるように、発現し精製されうる。
【0042】
1.大腸菌における発現
ラルストニア・ユートロファ(Ralstonia eutropha)、シュードモナス・プチダ(Pseudomonas putida)、および/またはボルデテラ・パラペルツッシス(Bordetella parapertussis)からの構築物が、出発原料として使用される。この方法によると、GHB−DH発現の最適化は3種類可能である:(1)大腸菌株(M15、BL−21およびXL1−ブルーMRF’)、(2)インダクタ濃度(IPTG)、および(3)インダクション用のインキュベーション温度(18℃〜37℃)。ラルストニア・ユートロファ、シュードモナス・プチダおよび/またはボルデテラ・パラペルツッシスからの配列を含むpQE−30UAベクターの構築物は、例えば、lac リプレッサーヘルパープラスミドpREP4を利用し、および利用しないで、XL1−ブルー中で形質転換される。正確な組み換えタンパクの発現は、抗His標識抗体を用いたSDS−PAGEおよびウエスタンブロットにより確認される。同時に、小スケールのIMACは、XL1−ブルー発現からGHB−DH凝集体の可溶化が行われる。その後、前記プラスミドは、選択された発現株のセットに再形質転換(retransform)される。
【0043】
2.ピキア・パストリス(Pichia pastoris)における発現
標的組み換えタンパクに対するα係数分泌シグナルを含むベクターpPICZalphaが、成長培地に付与される。目的の遺伝子の複数の複製物は、単一細胞中に統合されうる。多くの複製物は、ゼオシン濃度の増加により選択されうる。天然構築物からの前記GHB−DH配列(上記参照)は、His標識でラベルされていないベクターpPICZalpha A中に再クローン化される。ピキア・パストリスにおける形質転換は化学的方法で行われ、ゼオシン耐性により選択される。
【0044】
本発明における補因子は、酵素にしっかりと結合され、これが触媒活性に必要とされる非タンパク化学物質として理解されうる。それらは「ヘルパー」分子およびイオンとしてそれぞれ理解され、それぞれ生化学的変換を補助する。本発明において酸化型補因子は、本発明の方法において還元能を有する任意の補因子である。
【0045】
本発明の方法において使用される補因子は、限定されないが、ニコチンアミド補因子、フラビン補因子、キノン補因子およびオキソ酸を含み、この際、ニコチンアミド補因子は、限定されないが、ニコチンアミドアデニンジヌクレオチド(NAD)、ニコチンアミドアデニンジヌクレオチドリン酸(NADP)、ニコチンアミド1、N6−エテノアデニンジヌクレオチドリン酸を含む。フラビン補因子はフラビン基またはその活性部分を含む補因子を含む。本発明においてフラビン補因子の例は、限定されないが、リボフラビン、イソアロキサジン、フラビンモノヌクレオチド(FMN)およびフラビンアデニンジヌクレオチド(FAD)である。本発明において、キノン補因子は、キノン基を含む補因子として理解されうる。キノン補因子の例は、限定されないが、ピロロキノリンキニン(PQQ)である。オキソ酸の例は、限定されないが、α−ケトグルタル酸である。本発明の方法において使用されうる補因子のアナログもまた、本発明の技術的範囲に含まれる。
【0046】
特に好ましい補因子は、ニコチンアミドアデニンジヌクレオチド(NAD+)およびニコチンアミドアデニンジヌクレオチドリン酸(NADP)である。
【0047】
本発明において、NAD+は2つのリボース環からなり、一方はその1’位の炭素原子にアデニンが結合され、もう一方はこの位置にニコチンアミドが結合される。これらの2つの糖ヘテロ環部位は5’位の炭素を介して2つのリン酸基の架橋により共に結合している。NAD(P)+において、前記アデニンに結合しているリボース環は、2’位にさらにリン酸基を有している。前記補因子のアナログは、限定されないが、ニコチンアミドアデニンジヌクレオチド(NAD+)であり、ニコチンアミドアデニンジヌクレオチドリン酸(NADP)は、例えば、3−アセチルピリジン−NADH、3−アセチルピリジン NADPH、3−ピリジンアルデヒド−NADH、3−ピリジンアルデヒド−NAPDH、チオニコチンアミド−NADHおよびチオニコチンアミド−NADPHであり、本発明の方法においても使用されうる。さらに、1以上の補因子およびそれらのアナログの混合物は、それぞれ、前記されているように、本発明の方法において使用されうる。
【0048】
本発明の方法において、NAD+は0.001〜1000mM、好ましくは0.01〜100mM、より好ましくは0.1〜10mM、最も好ましくは2mMの濃度での濃度で使用される。
【0049】
本発明の方法において、前記補因子NAD(P)+は電子受容体として使用され、したがって、NAD(P)+はNAD(P)Hに還元される。本発明の方法は、様々な異なる方法、例えばマイクロタイタープレートまたはオートアナライザーにおいて一般的に行われうる。これに関連して、前記マイクロタイター(またはマイクロプレート)は小さな試験管として使用される小さな管状「ウェル」を有するフラットプレートである。マイクロプレートのそれぞれのウェルは、通常、数μL〜数百μLの液体を保持する。マイクロプレートは人間の手によってではなく、ロボットにより扱われうる。ロボットは、これらのプレートに液体サンプルを吸引もしくは分配する液体ハンドラーであり、または装置間でそれらを移動させる「プレート運送屋」でありうる。前記プレートのウェルに置き換える行為は、後に特別なマイクロタイタープレートリーダーにより検知される。好ましくは、強力なランプはマイクロタイターウェルを経て光を送り、マイクロプレートウェルに含まれる反応生成物に吸収または放出された光は、検知器により定量化される。本発明において適当な検知モードの例は、吸光度、蛍光強度、発光、時間分解蛍光および蛍光偏光であり、特に吸光度が好ましい。
【0050】
本発明において、オートアナライザーは、特別な流体操作およびフロー法を使用する自動分析器である。本発明において、利用可能な自動分析器の例は、セグメントフローアナライザー、フローインジェクションアナライザーまたは透析装置モジュールを有するオートアナライザーである。本発明において、具体的なオートアナライザーは、限定されないが、エアロセット(Aeroset)、アルション 300(Alcyon 300)、アボット(Abbott)社製のC8000/16000およびCi 8200/16200、シンクロンCx5(Synchron Cx5)、シンクロンCx4(Synchron Cx4)シンクロンCx7(Synchron Cx7)、シンクロンLx20(Synchron Lx20)およびベックマン(Beckman)社製のUniCell DxC800、サーモ(Thermo)社製のコーン(Kone)T20、T20 XT、T30およびT60、オリンパス社製のリプライアナライザー(Reply Analyzer)、AU 400,AU 600、AU 800、AU 640およびAU 2700/5400、オルト社製のビトロスフュージョン5.1(Vitros Fusion 5.1)およびビトロス340(Vitros 340)、ロシュ社製のコバスミラ(Cobas Mira)、ヒタチ704(Hitachi 704)、ヒタチ717(Hitachi 717)、ヒタチ911(Hitachi 911)、ヒタチ902(Hitachi 902)、ヒタチ912(Hitachi 912)、ヒタチ917(Hitachi 917)、コバスインテグラ400/700/800(Cobas Integra 400/700/800)、モジュラーP800(Modular P 800)、コバスC501(Cobas C501)、コバスC111(Cobas C111)、モジュラーD2400(Modular D2400)、コバスBIO(Cobas BIO)、コバスファラ(Cobas FARA)およびコバス6000(Cobas 6000)、シーメンズ(バイエル)社製のアドヴィア1200(Advia 1200)、アドヴィア1650(Advia 1650)、アドヴィア1800(Advia 1800)およびアドヴィア2400(Advia 2400)、シーメンズ(ダデ)社製のディメンションRxL(Dimension RxL)、ディメンションXpandプラス(Dimension Xpand plus)、ディメンションヴィスタ3000T(Dimension Vista 3000T)およびディメンションヴィスタ1500(Dimension Vista 1500)、エービーエックス(ABX)社製のペントラ60(Pentra 60)およびペントラ120(Pentra 120)、イーライテック(ELITech)社製のセレクトラE/XL(Selectra E/XL)、ランドックス(Randox)社製のRXデイトナ(RX Daytona)およびRXイモラ(RX Imola)、テクニコン(Technicon)社製のRA500、RA1000およびRA XTでありうる。本発明においてオートアナライザーは「臨床化学分析器」とも呼ばれる。
【0051】
サンプル中のGHB濃度の決定のため、還元型補因子の量を測定しなければならない。還元型補因子の量を測定しうる検知モードは、吸光度、蛍光強度、発光、時間分解蛍光、および蛍光偏光であり、特に吸光度が好ましい。前記サンプルの吸光度は好ましくは分光光度計を用いて測定される。本発明において分光光度計は色またはより特別な波長の光における強度を測定しうる光度計(光強度を測定する装置)である。本発明において多くの種類の分光光度計が用いられる。これらを分類するために利用されるもっとも重要な特徴は、作用する波長、利用できる測定技術、スペクトルの取得方法、測定のために設計された強度変化の源である。分光光度計の他の重要な特徴はスペクトルバンド幅および線形範囲を含む。通常、2つの異なる種の分光光度計(シングルビームおよびダブルビーム分光光度計)が本発明において使用されうる。ダブルビーム分光光度計は二つの異なる光路における光の強度の比率を測定し、前記シングルビーム分光光度計は絶対光度を測定する。比率の測定は簡易、かつ、一般的により安定であるが、シングルビーム装置は、例えば、より大きなダイナミックレンジを有しうる等の利点がある。
【0052】
本発明の方法によって処理された前記サンプルの光学密度は1〜1000nm、好ましくは100〜650nm、より好ましくは280〜450nm、最も好ましくは340nmで測定されうる。
【0053】
本発明の方法を実施する場合、特に制限されないが、pH、バッファー、イオン強度、1以上の塩の存否および濃度、変化および補因子の存否および濃度、任意の試薬、温度、持続時間(インキュベーション時間)、および反応容積を含む1以上のパラメータが個々に選択されうる。前記パラメータは所望の結果を得るために適宜組み合わせて選択されうる。
【0054】
前記反応混合物のpHは、pH2〜pH13、好ましくはpH8〜pH12から選択され、最も好ましくはpH10である。本発明の方法に適したpHを得るために、好ましくは分析試薬中にバッファーが含まれる。使用可能なバッファーは酢酸塩、ビシン(bicine)、フタル酸塩、ホウ酸塩、トリクロロ酢酸塩、スルホサリチル酸塩、リン酸塩、酒石酸塩、クエン酸塩、コハク酸塩、マレイン酸、2,2−ビス(ヒドロキシメチル)−2,2’,2”−ニトリロトリエタノール、3,3−ジメチルグルタル酸、3−N−モルホリノプロパンスルホン酸(MOPS)、マロン酸、1,3−ビストリス(ヒドロキシメチル)メチルアミノプロパン(ビス−TRIS)、トリス(ヒドロキシメチル)アミノメタン(TRIS)、トリス(ヒドロキシメチル)アミノメタン−マレイン酸(トリス−マレイン酸エステル)、トリス(ヒドロキシメチル)アミノメタン−マロン酸(トリス−マロン酸塩)、3−N−(トリスヒドロキシメチル)メチルアミノ−2−ヒドロキシプロパンヒドロキシプロパン硫酸(TAPSO)、2−(トリス(ヒドロキシメチル)メチルアミノ)エタンスルホン酸(TES)、1,4−ピペラジンビス(エタンスルホン酸)(PIPES)、4−モルホリノエタンスルホン酸(MES)、N−2−ヒドロキシエチルピペラジン−N’−2−エタンスルホン酸(HEPES)、硫酸塩、アミノ酸(例えば、グリシン)、2−アミノ−2−メチル−1,3−プロパンジオール(AMPD)、イミダゾール、トリエタノールアミン、N,N−ビス(2−ヒドロキシエチル)−2−アミノエタンスルホン酸(BES)、N−シクロヘキシル−2−アミノエタンスルホン酸(CHES)、トリス−HClおよび当業者に公知の他の物を含む。最も好ましくはAMPDバッファーである。
【0055】
本発明の方法によると、前記サンプルのインキュベーションは、0℃〜100℃、好ましくは18℃〜70℃、より好ましくは28℃〜50℃、さらに好ましくは35℃〜40℃、最も好ましくは37℃の温度で行われる。
【0056】
本発明の方法によると、前記サンプルのインキュベーション時間は、1秒〜数日、好ましくは10秒〜24時間、より好ましくは30秒〜5時間、さらに好ましくは1分〜60分であり、3分〜12分もまた好ましく、5分〜8分が最も好ましい。
【0057】
本発明の方法において使用される前記酵素の濃度は、リットル毎のユニットとして0.1〜10000μg/mL、好ましくは1〜1000μg/mLの範囲から選択され、より好ましくは10〜100μg/mL、さらに好ましくは30〜80μg/mL、最も好ましくは60μg/mLでありうる。
【0058】
本発明の方法によると、前記反応容積は1μL〜100mL、好ましくは50μL〜10mL、より好ましくは100μL〜1mLから選択され、最も好ましくは250μLでありうる。
【0059】
本発明の技術的範囲において、追加の反応剤が前記方法に含まれうる。そのような反応剤は、本発明の方法により、GHBの前駆体を検知可能な化合物に変換できる反応剤を含みうる。エステルをGHBに変換するには、エステラーゼが添加されていてもよく、GHBエステル、GBLのような内部エステル等が、GHBに変換されうる。アミラーゼは、アミド化形態のGHBをGHBに上記と同様に変換するために添加されうる。
【0060】
本発明の方法において、任意に含まれる物質は、限定されないが、ポリビニルピロリドン、ポリビニルアルコール、アラビアゴム、ゼラチン、アルギン、カラギーナン、カゼイン、アルブミン、メチルセルロース、保護されていないポリエチレングリコール、末端保護されたポリエチレングリコール、多糖類(例えば、スクロース)、他の天然および合成高分子材料、並びにこれらの組み合わせ等の高分子試薬;単糖類(例えば、グルコース)およびグリセロール等の非高分子試薬を含む群から選択されうる。また、試薬は安定化剤およびバイオサイドを含んでいてもよい。
【0061】
さらに、本発明の方法において、その他の任意の成分として、例えば、ウシ血清アルブミンのようなタンパク質、マルトース、グルコース、スクロース、トレハロース、グリセロールなどのような糖類、ポリエチレングリコールおよび当該技術分野において公知の化合物のような高分子化合物、例えば、ナトリウム、マグネシウム、カリウム、カルシウムおよび当該技術分野において公知の金属のような金属イオンが含まれていてもよい。任意成分として金属イオンが使用される場合、これらの金属イオンは酵素活性剤および/または安定化剤として働きうる。さらなる任意成分はエチレンジアミン四酢酸(EDTA)のようなキレート化合物である。好ましくは、前記糖類は0.1〜50%(w/v)、好ましくは0.15〜20%(w/v)、より好ましくは1〜5%(w/v)の濃度で使用される。タンパク質は、0.001〜50%(w/v)、好ましくは0.0015〜20%(w/v)、より好ましくは0.01〜2%(w/v)の濃度の溶液で使用される。金属イオンは、0.001〜1000mM、好ましくは0.1〜100mM、最も好ましくは0.15〜80mMの金属イオン濃度の溶液で使用される。EDTAは、0.001〜50mM、好ましくは0.01〜2mM、さらに好ましくは0.1〜1.5mM、最も好ましくは0.8mMの濃度の溶液で使用される。
【0062】
また、上述工程に追加の工程が行われうる。前記追加の工程は、限定されないが、例えば、シングル検査の実施に応じて行われるサンプル除タンパク質または加熱のような特別な処置;形質転換細菌培地の強力な溶解性、天然および変性状態におけるNi2+充填カラムによる発現タンパクの溶出、並びに/または前記溶出タンパク質へのプロテイナーゼ阻害剤および/もしくは防腐剤(例えば、NaN3)の添加によって、−発現融合タンパク質の完全性およびタンパク質のコンタミネーションは、SDS−PAGE法、または形成した封入体を溶解して、リフォールドする評価方法により評価されうる−酵素精製の再現性の最適化;GHB−DH非存在下でNAD+を含むサンプルのプレインキュベート、サンプルの希釈、EDTAと混合された乳酸脱水素酵素(例えば、シュウ酸)を含む糖分解酵素阻害剤の添加、またはサンプルを加熱不活化により、サンプル中のGBH依存性酵素または非酵素的なNADHの形成の最小化;亜硝酸および亜硝酸ナトリウム塩のようなヘモグロビン抑制剤の添加;トリス−HCl、CAPS,CAPSO、および/またはAMPのようなアルカリのpHにするために好適なバッファーの添加からなる群から選択されうる。本発明において、上述されたすべての追加的な工程は、本発明の方法に単独でまたは適宜組み合わせて実施されうる。
【0063】
本発明はまた、上述の方法の実施に適したキットに関する。本発明の方法の実施に適したキットは、少なくともGHBをコハク酸のセミアルデヒド(SSA)変換できる酵素および酸化型補因子を含む。前記キットはまた、限定されないが、全て上記で詳細に記載された、バッファー物質、GHB前駆体を検出可能な形態に変換できる追加の試薬、前記分析能力を改善するための物質、タンパク質、糖類、高分子化合物、金属イオン、およびキレート化合物を含んでいてもよい。
【0064】
本発明はまた、少なくともGHBをコハク酸セミアルデヒド(SSA)に変換できる酵素および酸化型補因子を含む、GHBのサンプルの分析に適した組成物に関する。前記組成物に含まれる酵素は、好ましくはオキシドレダクターゼであり、より好ましくはデヒドロゲナーゼであり、最も好ましくはGHBデヒドロゲナーゼ(GHB−DH)である。また、詳細に上述されているような化合物および試薬が前記組成物に追加的に含まれていてもよい。前記組成物に含まれる酸化型補因子は、好ましくはNAD+である。
【0065】
本発明はまた、マイクロタイタープレートまたはオートアナライザーにおける用途への前記方法の使用に関する。
【0066】
図のリスト
本発明は、限定されないが、さらに以下の図によって説明される。図は典型的な特徴を表すものであり、例示目的のみのものであることが理解される。
【0067】
図1はサンプル(例えば、血清、尿、飲料)中のGHB濃度の決定原理を示す。該分析において、オキシドレダクターゼ(GHBデヒドロゲナーゼ、GHB−DH;EC 1.1.1.61)は、NAD+を補因子として用いて、GHBをコハク酸セミアルデヒドへ酸化する。薬物(GHB)濃度と酵素活性とは直接に関連している。該反応は前記酵素を添加することにより開始され、GHB−DH活性は340nmでNAD+のNADHへの変換能を測定することで分光学的に決定される。
【0068】
図2はGHB−DHの動態に関するマイクロプレート分析を示す。GHB濃度の作用の反応容積に対する添加されたGHB濃度との関係におけるGHB−DH活性をマイクロプレート分析において5分間測定した。該分析において用いられたGHB濃度を右側に示す(mMで表す)。
【0069】
図3はオートアナライザー(臨床化学分析)に用いられた2つのアッセイフォーマットを示す。2つのフォーマットは、コーンT30分析器で行われた1つの試薬による分析を記載する。該試薬をオートアナライザーに設置する前に、緩衝液、阻害剤、補因子、および酵素を含む試薬混合物を、図に示されるRa、Rb、およびRc、またはRa’およびRb’を混合して調製しなければならない。その後、該試薬を前記サンプルまたは較正器と接触させ、指示された時間オートアナライザー内でインキュベートし、その後測定した。略称:OxA(シュウ酸);Cal(較正器)。
【0070】
図4はコーンT30分析器で行われた2つの試薬による分析を示す。試薬混合物R1をオートアナライザーに設置する前に、緩衝液および阻害剤を含む試薬R1a、並びに補因子を含む試薬R1bを、図に示されるようにR1aおよびRbを混合して調製しなければならない。そして、前記試薬R1a:R1bを、GHB−DHを含む試薬R2を加える前に前記サンプルまたは較正器と2分間接触させる。最終反応混合物インキュベートし、オートアナライザーでさらに6分間測定した。略称:OxA(シュウ酸);Cal(較正器);Con L(〜150μM GHBを含む尿コントロール);Con H(〜800μM GHBを含む尿コントロール)。
【0071】
図5は臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)におけるGHB検量線を示す。ΔODはインキュベーション時間2〜8分の340nmにおける光学密度の差である。
【0072】
図6は尿サンプル用の前記方法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)においての一連のアッセイ(添加回収率実験)の結果を示す。この実験において、健常ドナー(n=5)の尿は、GHBに対して0、100、500、および1000μMで添加された。パーセント(%)添加回収率は、添加サンプル中の予測GHB濃度(E)に対する実測GHB濃度(O)の%値(O/E)として計算された。
【0073】
図7は血清サンプル用の前記方法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分)において行われる一連のアッセイ(添加回収率実験)の結果を示す。この実験において、健常ドナー(n=6)からの血清は、GHBに対して0、150、および800μMで添加された。パーセント(%)添加回収率は、添加サンプル中の予測GHB濃度(E)に対する実測GHB濃度(O)の%値(O/E)として計算された。
【0074】
図8は、本発明の酵素法の精度を実証するための、臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)またはイオンクロマトグラフィー(IC)法のいずれかで行われる一連のアッセイの結果を示す。中毒患者(それぞれ、n=3)から採取したGHB陽性血清および尿サンプルが、2つの試薬による手順を使用する酵素法において分析され、測定結果を、イオンクロマトグラフィーに基づく確立した参照方法で得られた結果と比較した(Jordiら:ヒト血清および尿中のギ酸、グリコール酸塩、γ−ヒドロキシ酪酸を、その他の内因性有機酸とともに決定する方法、2003年、スイス、バーゼルおよびムッテンツの産業科および化学科の工業高校における卒業研究;Jordiら:イオンクロマトグラフィーを用いたGHB決定、2003年、スイス、バーゼルの国際TDM学会会議でのポスター)。
【0075】
図9は臨床化学分析器(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)において行われる一連のアッセイの結果を示す。中毒患者(n=9)から採取したGHBの陽性尿サンプルの濃度は、本発明の酵素法により決定され、図8において規定されたIC参照法に関連付けられた。初期濃度が2000μMより大きな尿サンプル(〜200mg/L)は0.9%NaCl溶液で5〜100倍に希釈され、再分析された。測定されたGHB濃度はmg/Lで示される。
【0076】
図10は本発明の酵素法(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)でそれぞれ測定された10人の健常ドナーの血清および尿中のGHBの内因性レベルをそれぞれ示す。
【0077】
図11は中毒患者(n=9)から採取した尿サンプル中のGHBの内因性レベルと、GHB濃度を示す健常ドナー(n=10)から採取した尿サンプル中のGHBの内因性レベルとの比較を示す。すべてのサンプルは本発明の酵素法(コーン T30、サーモ社製;2つの試薬によるアッセイフォーマット;インキュベーション総合時間は8分である)で測定された。測定されたGHB濃度はμMで与えられる。2000μMより高い初期濃度の患者のサンプルは0.9%NaCl溶液で5〜100倍に希釈し、再分析した。
【特許請求の範囲】
【請求項1】
(a)EDTAと共にシュウ酸を含む混合緩衝液を加えて希釈されたサンプルと酸化型補因子を還元することによりγ−ヒドロキシ酪酸(GHB)をコハク酸セミアルデヒド(SSA)へ変換可能な酵素とをインキュベーションする工程、
(b)還元型補因子の量を測定する工程、および
(c)前記還元型補因子の測定量と前記サンプル中のGHBの濃度とを関連づける工程、を含む、サンプル中のGHBの濃度の決定方法。
【請求項2】
工程(a)における前記酵素がオキシドレダクターゼである、請求項1に記載の方法。
【請求項3】
前記酵素がGHBデヒドロゲナーゼ、SSAレダクターゼ、グルクロン酸レダクターゼおよび/またはアルデヒドレダクターゼである、請求項2に記載の方法。
【請求項4】
前記酵素が合成的に製造された遺伝子構築物から得られる、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記酸化型補因子がNAD+である、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記還元型補因子の測定波長が100nm〜650nmである、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記還元型補因子の測定波長が340nmである、請求項6に記載の方法。
【請求項8】
前記サンプルのインキュベーション温度が28〜50℃である、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
前記サンプルのインキュベーション温度が37℃である、請求項8に記載の方法。
【請求項10】
前記インキュベーション時間が1〜60分である、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
前記インキュベーション時間が8分である、請求項10に記載の方法。
【請求項12】
前記反応ボリュームのpH値が8〜12である、請求項1〜11のいずれか1項に記載の方法。
【請求項13】
前記pH値が10である、請求項12に記載の方法。
【請求項14】
(a)GHBをコハク酸セミアルデヒド(SSA)へ変換可能な酵素、
(b)酸化型補因子、ならびに
(c)1〜100mM、好ましくは10mMのシュウ酸、および0.1〜1.5mM、好ましくは0.8mMのEDTAを含む緩衝液、
を成分として含むGHBサンプル分析用組成物。
【請求項15】
前記酵素がGHBデヒドロゲナーゼである、請求項14に記載の組成物。
【請求項16】
前記酸化型補因子が0.1〜10mM、好ましくは2mMのNAD+である、請求項14または15に記載の組成物。
【請求項17】
請求項1〜13のいずれか1項に記載の方法を行うのに適したキット。
【請求項18】
請求項14〜16のいずれか1項に記載の組成物を含む、請求項17に記載のキット。
【請求項19】
マイクロタイタープレートにおける用途への請求項1〜13のいずれか1項に記載の方法の使用。
【請求項20】
オートアナライザーにおける用途への請求項1〜13のいずれか1項に記載の方法の使用。
【請求項1】
(a)EDTAと共にシュウ酸を含む混合緩衝液を加えて希釈されたサンプルと酸化型補因子を還元することによりγ−ヒドロキシ酪酸(GHB)をコハク酸セミアルデヒド(SSA)へ変換可能な酵素とをインキュベーションする工程、
(b)還元型補因子の量を測定する工程、および
(c)前記還元型補因子の測定量と前記サンプル中のGHBの濃度とを関連づける工程、を含む、サンプル中のGHBの濃度の決定方法。
【請求項2】
工程(a)における前記酵素がオキシドレダクターゼである、請求項1に記載の方法。
【請求項3】
前記酵素がGHBデヒドロゲナーゼ、SSAレダクターゼ、グルクロン酸レダクターゼおよび/またはアルデヒドレダクターゼである、請求項2に記載の方法。
【請求項4】
前記酵素が合成的に製造された遺伝子構築物から得られる、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記酸化型補因子がNAD+である、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記還元型補因子の測定波長が100nm〜650nmである、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記還元型補因子の測定波長が340nmである、請求項6に記載の方法。
【請求項8】
前記サンプルのインキュベーション温度が28〜50℃である、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
前記サンプルのインキュベーション温度が37℃である、請求項8に記載の方法。
【請求項10】
前記インキュベーション時間が1〜60分である、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
前記インキュベーション時間が8分である、請求項10に記載の方法。
【請求項12】
前記反応ボリュームのpH値が8〜12である、請求項1〜11のいずれか1項に記載の方法。
【請求項13】
前記pH値が10である、請求項12に記載の方法。
【請求項14】
(a)GHBをコハク酸セミアルデヒド(SSA)へ変換可能な酵素、
(b)酸化型補因子、ならびに
(c)1〜100mM、好ましくは10mMのシュウ酸、および0.1〜1.5mM、好ましくは0.8mMのEDTAを含む緩衝液、
を成分として含むGHBサンプル分析用組成物。
【請求項15】
前記酵素がGHBデヒドロゲナーゼである、請求項14に記載の組成物。
【請求項16】
前記酸化型補因子が0.1〜10mM、好ましくは2mMのNAD+である、請求項14または15に記載の組成物。
【請求項17】
請求項1〜13のいずれか1項に記載の方法を行うのに適したキット。
【請求項18】
請求項14〜16のいずれか1項に記載の組成物を含む、請求項17に記載のキット。
【請求項19】
マイクロタイタープレートにおける用途への請求項1〜13のいずれか1項に記載の方法の使用。
【請求項20】
オートアナライザーにおける用途への請求項1〜13のいずれか1項に記載の方法の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10A】


【図10B】


【図11】


【公表番号】特表2012−525127(P2012−525127A)
【公表日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願番号】特願2012−507692(P2012−507692)
【出願日】平成22年4月23日(2010.4.23)
【国際出願番号】PCT/EP2010/055436
【国際公開番号】WO2010/124999
【国際公開日】平成22年11月4日(2010.11.4)
【出願人】(511261271)ブールマン ラボラトリーズ アクチェンゲゼルシャフト (1)
【Fターム(参考)】
【公表日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願日】平成22年4月23日(2010.4.23)
【国際出願番号】PCT/EP2010/055436
【国際公開番号】WO2010/124999
【国際公開日】平成22年11月4日(2010.11.4)
【出願人】(511261271)ブールマン ラボラトリーズ アクチェンゲゼルシャフト (1)
【Fターム(参考)】
[ Back to top ]

