シクラメンの花器官形成関連転写因子をコードする遺伝子
【課題】シクラメンの花器官形成関連転写因子および転写因子をコードする遺伝子を提供する。
【解決手段】CpMADS1、CpMADS2、CpMADS3と命名した、シクラメンのMADS遺伝子をコードする3種類のシクラメンの花器官形成を制御する転写因子の遺伝子。シクラメンのMADSボックス転写因子の機能を抑制することによってシクラメンの花の形態が改変された植物体を得ることができる。それゆえ、各種農業や園芸、アグリビジネス、さらには農産物を加工する産業や食品産業等に利用可能であり、しかも非常に有用である。
【解決手段】CpMADS1、CpMADS2、CpMADS3と命名した、シクラメンのMADS遺伝子をコードする3種類のシクラメンの花器官形成を制御する転写因子の遺伝子。シクラメンのMADSボックス転写因子の機能を抑制することによってシクラメンの花の形態が改変された植物体を得ることができる。それゆえ、各種農業や園芸、アグリビジネス、さらには農産物を加工する産業や食品産業等に利用可能であり、しかも非常に有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、シクラメンの花器官形成関連転写因子をコードする遺伝子に関する。
【背景技術】
【0002】
花の形態は園芸植物の観賞性における重要な要素の一つである。花の発生は、花序分裂組織から花原基として分化するところから始まり、花原基に含まれる花芽分裂組織から、がく片、花びら、雄しべ、雌しべの4種類の花器官が分化する。その後、分化した花器官を含む複合器官として成熟した花が形成される。八重咲きと呼ばれる花は、花弁の内側の雄しべや雌しべが並んでいる場所に、雄しべや雌しべの形態が改変されて花弁に変化したものが形成されて、花弁数が増加して花弁だけで花が構成されているように見える状態を指す。このような植物は、新規な園芸植物の創出に利用できる等、農業上の有用性が高い。
【0003】
このような高等植物における花の形態の発生は一般にABCモデルによって説明されており、このモデルはMADSボックスファミリーに属するA、B、Cのクラスの遺伝子の転写制御を介して花の形態が変化すると考えられている(酒井一、花 の形 態形 成の分子遺伝学、新版「植物の形 を決める分子機構」(秀潤社)150-163 (2000))。MADSボックスファミリー遺伝子 は、MADSボックスと呼ばれる保存性領域を含む転写因子をコードする遺伝子 で、30以上の遺伝子 からなる遺伝子 ファミリーを形 成している。例えばAPETALA1(AP1)、APETALA(AP2)などのAクラス遺伝子、APETALA3(AP3)、PISTILLATA(PI)などのBクラス遺伝子、そしてAGAMOUS(AG)のCクラス遺伝子など転写因子が挙げられ、これらの変異体で花の形態の変化が確認されている。
【0004】
これまで、植物の花弁の形態や数の改変は、一般に植物の品種を掛け合わせる交配育種や自然界で発生する突然変異により行われている。しかし、従来の交配育種では、目的とする形態を有する植物を生産するためには、長い年月と、熟練者の経験が必要であり、また突然変異は目的とする形態の発生が制御できないため、簡易かつ確実に花器官の形態を改変する方法が求められている。
【0005】
近年、遺伝子工学的に花の形態を改変する方法として、任意の転写因子を転写抑制因子に転換するペプチドを利用する方法が知られている(例えば、特許文献1〜7)。種々の転写因子と上記ペプチドとを融合させた融合タンパク質(キメラタンパク質)をコードする遺伝子を植物体内に導入することより、転写因子が転写抑制因子に転換され、該転写因子が転写を促進する標的遺伝子の発現が抑制された植物体を生産することが可能で、具体的には、上記のMADSボックスファミリー遺伝子であるシロイヌナズナのAP3遺伝子やAG遺伝子の発現を、それぞれの遺伝子のプロモーター領域に結合するリプレッサーを用いて抑制し、雄性不稔体の生産方法や花弁数を増加させる方法を確立している(特許文献8〜9)。
【0006】
しかしながら、シロイヌナズナのAG遺伝子のキメラリプレッサーを導入したトレニアでは、花弁数の増加は認められていないなど、使用する転写因子の植物起源と、目的とする植物種によっては、機能しないことがある(非特許文献1)。
【0007】
一方、シクラメンは冬を代表する鉢花として国内出荷数の上位を占める重要な花卉園芸植物であるが、前記した遺伝子工学的手法によって花の形態を改変するには、シクラメンの花器官形成に関与する転写因子遺伝子の取得が重要である。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2001−269177公報
【特許文献2】特開2001−269178公報
【特許文献3】特開2001−292776公報
【特許文献4】特開2001−292777公報
【特許文献5】特開2001−269176公報
【特許文献6】特開2001−269179公報
【特許文献7】国際公開第03/055903号パンフレット
【特許文献8】特開2005−192483公報
【特許文献9】特開2006−42729公報
【非特許文献】
【0009】
【非特許文献1】Plant Biotechnology,2008年,25巻,P45-53
【発明の概要】
【発明が解決しようとする課題】
【0010】
シクラメンの花器官形成に関与する転写因子は知られていないのが現状で、本発明は、シクラメンの花器官形成関連転写因子をコードする遺伝子を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者は、上記課題を解決するため鋭意研究を行った結果、シクラメンの花器官形成を制御する転写因子をコードする遺伝子を同定することに成功し、本発明を完成するに至った。
【0012】
すなわち、本発明は、以下を包含する。
[1](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号2のアミノ酸配列
(b)配列番号2のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号1の塩基配列からなるDNA
(d)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号1の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0013】
[2](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号4のアミノ酸配列
(b)配列番号4のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号3の塩基配列からなるDNA
(d)配列番号3の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号3の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0014】
[3](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号6のアミノ酸配列
(b)配列番号6のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号5の塩基配列からなるDNA
(d)配列番号5の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号5の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0015】
[4](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号8のアミノ酸配列
(b)配列番号8のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号7の塩基配列からなるDNA
(d)配列番号7の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号7の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0016】
[5](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号10のアミノ酸配列
(b)配列番号10のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号9の塩基配列からなるDNA
(d)配列番号9の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号9の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0017】
[6](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号12のアミノ酸配列
(b)配列番号12のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号11の塩基配列からなるDNA
(d)配列番号11の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号11の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0018】
[7](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号14のアミノ酸配列
(b)配列番号14のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号13の塩基配列からなるDNA
(d)配列番号13の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号13の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0019】
[8](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号16のアミノ酸配列
(b)配列番号16のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号15の塩基配列からなるDNA
(d)配列番号15の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号15の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0020】
[9]前記転写因子をコードする請求項1、2、3、4、5、6、7又は8記載のDNAと転写因子を転写抑制因子に転換する機能性ペプチドをコードする配列番号17のDNAとを融合させたキメラ遺伝子
【0021】
[10]前記[9]記載の遺伝子を含む発現ベクター。
【0022】
[11]前記[10]記載の発現ベクターを含む形質転換シクラメン植物。
【発明の効果】
【0023】
本発明により、シクラメンの花器官形成関連転写因子をコードする遺伝子が提供される。本発明の遺伝子は、シクラメンの花器官の形態を変化させる分子育種に使用できる点で有用である。
【図面の簡単な説明】
【0024】
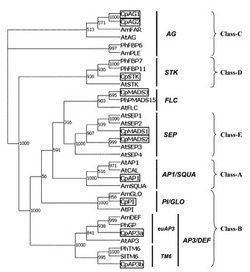
【図1】シクラメンMADS−ボックス転写因子遺伝子の系統樹
【発明を実施するための形態】
【0025】
以下、本発明を詳細に説明する。なお、本発明はこれに限定されるものではない。
シクラメン植物の花器官の形態に関与する転写因子としては、シクラメンのMADSボックスファミリーに属する転写因子を挙げることができる。
【0026】
本発明で用いられる転写因子の代表的な一例としては、シクラメンのAP1タンパク質、AP3aタンパク質、AP3bタンパク質、PIタンパク質、STKタンパク質、MADS1タンパク質、MADS2タンパク質またはMADS3タンパク質を挙げることができる。AP1タンパク質は、配列番号2に示されるアミノ酸配列を有するタンパク質である。AP3aタンパク質は、配列番号4に示されるアミノ酸配列を有するタンパク質である。AP3bタンパク質は、配列番号6に示されるアミノ酸配列を有するタンパク質である。PIタンパク質配列番号8に示されるアミノ酸配列を有するタンパク質である。STKタンパク質配列番号10に示されるアミノ酸配列を有するタンパク質である。MADS1タンパク質配列番号12に示されるアミノ酸配列を有するタンパク質である。MADS2タンパク質配列番号14に示されるアミノ酸配列を有するタンパク質である。MADS3タンパク質は、配列番号16に示されるアミノ酸配列を有するタンパク質である。
【0027】
ただし、上記転写因子は、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14および配列番号16に示されるアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入、及び/又は付加されたアミノ酸配列からなるタンパク質であっても、下記転写抑制転換ペプチドとのキメラタンパク質として植物に導入したときにシクラメン植物の花器官の形態を改変しうるものであれば本発明にて用いることができる。
【0028】
なお、上記の配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14および配列番号16に示されるアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入、及び/又は付加されたアミノ酸配列における「1個又は数個」の範囲は特に限定されないが、例えば、1から20個、好ましくは1から10個、より好ましくは1から7個、さらに好ましくは1個から5個、特に好ましくは1個から3個を意味する。
【0029】
本発明で用いられるキメラタンパク質を生産する際には、後述するように、公知の遺伝子組換え技術を好適に用いることができる。そこで、本発明にかかる植物体の生産方法には、上記転写因子をコードする遺伝子が好適に用いることができる。
【0030】
例えば、転写因子としてシクラメンのAP1タンパク質を用いる場合には、このAP1タンパク質をコードする遺伝子(説明の便宜上、CpAP1遺伝子と称する)を挙げることができる。CpAP1遺伝子の具体的な一例としては、配列番号1に示される塩基配列をオープンリーディングフレーム(ORF)として含むポリヌクレオチドを挙げることができる。また、例えば、転写因子としてシクラメンのAP3aタンパク質を用いる場合には、このAP3aタンパク質をコードする遺伝子(説明の便宜上、CpAP3a遺伝子と称する)を挙げることができる。CpAP3a遺伝子の具体的な一例としては、配列番号3に示される塩基配列をオープンリーディングフレーム(ORF)として含むポリヌクレオチドを挙げることができる。
【0031】
もちろん、本発明で用いられる転写因子をコードするDNAとしては、上記の例に限定されるものではなく、配列番号1、3、5、7、9、11、13または15に示される塩基配列と相同性を有するDNAであってもよい。具体的には、例えば、配列番号1、3、5、7、9、11、13または15に示される塩基配列と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ、転写抑制転換ペプチドとのキメラタンパク質として植物に導入したときに植物の花の形態を改変しうるタンパク質をコードするDNA等を挙げることができる。なお、ここでストリンジェントな条件でハイブリダイズするとは、好ましくは60℃で2×SSC洗浄条件下で結合することを意味し、より好ましくは60℃で0.1×SSC洗浄条件下で結合することを意味する。また、配列番号2、4、6、8、10、12、14または16に記載のアミノ酸配列と90%以上の同一性を有するアミノ酸配列をコードするDNA等を挙げることができる。
【0032】
上記ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual,2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。通常、温度が高いほど、塩濃度が低いほどストリンジェンシーは高くなる(非特異DNAはハイブリダイズしがたくなる)。
【0033】
上記転写因子をコードするDNAをシクラメンから取得する方法は特に限定されるものではなく、従来公知の方法により、多くの植物から単離することができる。例えば、既知の転写因子の塩基配列に基づき作製したプライマー対を用いることができる。このプライマー対を用いて、植物のcDNA又はゲノミックDNAを鋳型としてPCRを行うこと等により上記DNAを得ることができる。また、上記転写因子をコードするDNAは、従来公知の方法により化学合成して得ることもできる。
【0034】
シクラメン植物の花器官の形態形成に関与する転写因子の機能を抑制する方法は特に限定されるものではなく、転写抑制因子を植物に導入して内在性の転写因子の活性を抑制する方法や、遺伝子破壊やRNA干渉(RNAi)などにより転写因子をコードする遺伝子の発現を抑制する方法が例示されるが、この中では、上記転写因子と、任意の転写因子を転写抑制因子に転換する機能性ペプチドとを融合させたキメラタンパク質を、植物体で生産させることが好ましい。これによって得られる植物体では、上記転写因子の機能が抑制されるため、花器官が形態変化したシクラメン植物体を生産することができる。つまり、上記転写因子は、シクラメンの花器官の形態形成、に不可欠なものであるため、上記転写因子が転写抑制因子に転換されることにより、花器官の形態形成に異常が引き起こされる。
【0035】
なお、本方法においては、上記転写因子が標的とする遺伝子は特定される必要がない。結果として、花器官の形態が改変されることから、上記標的遺伝子は、花器官の形成過程において、花器官の形態に影響を与える機能を有する遺伝子であることが推定されるが、その機能や構造の特定がされていなくても、本方法においては、その転写抑制を有効に行うことができる。
【0036】
本発明で用いられる、任意の転写因子を転写抑制因子に転換する機能性ペプチド(説明の便宜上、転写抑制転換ペプチドと称する)としては、特に限定されるものではなく、転写因子と融合させたキメラタンパク質を形成させることにより、当該転写因子の機能を抑制することができるペプチドであればよい。具体的には、例えば、本発明者によって見出された転写抑制転換ペプチド(特許文献1〜7)を挙げることができ、好ましくは配列番号17記載のLDLDLELRLGFAペプチドがよい。各種転写抑制転換ペプチドは、上記で説明した転写因子と融合してキメラタンパク質とすることにより、当該転写因子を転写抑制因子とすることができる。
【0037】
したがって、本発明では、上記転写抑制転換ペプチドをコードするポリヌクレオチドを用いて、転写因子をコードするDNAとのキメラDNAを得れば、キメラタンパク質を生産させることができる。具体的には、上記転写抑制転換ペプチドをコードするポリヌクレオチド(説明の便宜上、転写抑制転換ポリヌクレオチドと称する)と上記転写因子をコードするDNAとを連結することによりキメラDNAを構築して、植物細胞に導入する。これによりキメラタンパク質を生産させることができる。
【0038】
上記転写抑制転換ポリヌクレオチドの具体的な塩基配列は特に限定されるものではなく、遺伝暗号に基づいて、上記転写抑制転換ペプチドのアミノ酸配列に対応する塩基配列を含んでいればよい。また、必要に応じて、上記転写抑制転換ポリヌクレオチドは、転写因子DNAと連結するための連結部位となる塩基配列を含んでいてもよい。さらに、上記転写抑制転換ポリヌクレオチドのアミノ酸読み枠と転写因子DNAの読み枠とが一致しないような場合に、これらを一致させるための付加的な塩基配列を含んでいてもよい。
【0039】
本発明で用いられるキメラタンパク質は、転写因子をコードするDNAと転写抑制転換ポリヌクレオチドとを連結した上記キメラDNAから得ることができる。したがって、上記キメラタンパク質は、上記転写因子と、上記転写抑制転換ペプチドとが含まれていればよく、その構成は特に限定されるものではない。例えば、転写因子と転写抑制転換ペプチドとの間をつなぐためのリンカー機能を有するポリペプチドや、HisやMyc、Flag等のようにキメラタンパク質をエピトープ標識するためのポリペプチド等、各種の付加的なポリペプチドが含まれていてもよい。さらに上記キメラタンパク質には、必要に応じて、ポリペプチド以外の構造、例えば、糖鎖やイソプレノイド基等が含まれていてもよい。なお、キメラタンパク質において、転写因子と転写抑制転換ペプチドの順番は特に制限されず、いずれをアミノ末端側にしてもよい。
【0040】
本発明にかかる植物体の生産方法は、上記で説明したキメラタンパク質を植物体で生産させ、シクラメン植物の花器官の形態を改変する過程を含んでいれば特に限定されるものではないが、本発明にかかる植物体の生産方法を具体的な工程で示せば、例えば、発現ベクター構築工程、形質転換工程、選抜工程等の工程を含む生産方法として挙げることができる。このうち、本発明では、少なくとも形質転換工程が含まれていればよい。
【0041】
本発明において行われる発現ベクター構築工程は、上記で説明した転写因子をコードするDNAと、転写抑制転換ポリヌクレオチドと、プロモーターとを含む組換え発現ベクターを構築する工程であれば特に限定されるものではない。
【0042】
上記プロモーターは、植物体内で遺伝子を発現させることが可能なプロモーターであれば特に限定されるものではなく、公知のプロモーターを好適に用いることができる。かかるプロモーターとしては、例えば、カリフラワーモザイクウイルス35Sプロモーター(CaMV35S)、アクチンプロモーター、ノパリン合成酵素のプロモーター、タバコのPR1a遺伝子プロモーター、トマトのリブロース1,5−二リン酸カルボキシラーゼ・オキシダーゼ小サブユニットプロモーター等を挙げることができる。また、花器官特異的に発現するプロモーター等を挙げることができる。上記プロモーターは、転写因子をコードするDNAと転写抑制転換ポリヌクレオチドとを連結したキメラDNAを発現しうるように連結され、ベクター内に導入されていればよく、組換え発現ベクターとしての具体的な構造は特に限定されるものではない。
【0043】
ターミネーターは転写終結部位としての機能を有していれば特に限定されるものではなく、公知のものであってもよい。例えば、具体的には、ノパリン合成酵素遺伝子の転写終結領域(Nosターミネーター)、カリフラワーモザイクウイルス35Sの転写終結領域(CaMV35Sターミネーター)等を好ましく用いることができる。
【0044】
上記選別マーカーとしては、例えば薬剤耐性遺伝子を用いることができる。かかる薬剤耐性遺伝子の具体的な一例としては、例えば、ハイグロマイシン、ブレオマイシン、カナマイシン、ゲンタマイシン、クロラムフェニコール等に対する薬剤耐性遺伝子を挙げることができる。これにより、上記抗生物質を含む培地中で生育する植物体を選択することによって、形質転換された植物体を容易に選別することができる。
【0045】
上記組換え発現ベクターの構築方法についても特に限定されるものではなく、適宜選択された母体となるベクターに、上記プロモーター、転写因子をコードするDNA、および転写抑制転換ポリヌクレオチド、並びに必要に応じて上記他のDNAセグメントを所定の順序となるように導入すればよい。例えば、転写因子をコードするDNAと転写抑制転換ポリヌクレオチドとを連結してキメラDNAを構築し、次に、このキメラDNAとプロモーターと(必要に応じてターミネーター等)とを連結して発現カセットを構築し、これをベクターに導入すればよい。
【0046】
本発明において行われる形質転換工程は、上記で説明した組換え発現ベクターを植物細胞に導入して、キメラタンパク質を生産させるようになっていればよい。
上記組換え発現ベクターを植物細胞に導入する方法(形質転換方法)は特に限定されるものではなく、植物細胞に応じた適切な従来公知の方法を用いることができる。具体的には、例えば、アグロバクテリウムを用いる方法や直接植物細胞に導入する方法を用いることができる。組換え発現ベクターを直接植物細胞に導入する方法としては、例えば、マイクロインジェクション法、エレクトロポレーション法(電気穿孔法)、ポリエチレングリコール法、パーティクルガン法、プロトプラスト融合法、リン酸カルシウム法等を用いることができる。
【0047】
上記組換え発現ベクターが導入される植物細胞としては、例えば、花、葉、根等の植物器官における各組織の細胞、カルス、不定胚、懸濁培養細胞等を挙げることができる。
本発明において「花器官の形態形成」が改変されているとは、花器官の形態に関する形質が改変されていれば、特に限定されるものではない。花器官の形態としては、例えば、花柄の長さ、花びらの形状、花びらの模様、花びらの色、がくの形状、さやの形状、雄しべの形状、雌しべの形状等を挙げることができ、果実の形態も含まれ。また、花器官の形態形成が改変されるとは、単独の形態が改変される場合と、複数の形態が同時に改変される場合を含む。
【0048】
本発明における植物体とは、成育した植物個体、植物細胞、植物組織、カルス、種子の少なくとも何れかが含まれる。つまり、本発明では、最終的に植物個体まで成育させることができる状態のものであれば、全て植物体と見なす。また、上記植物細胞には、種々の形態の植物細胞が含まれる。かかる植物細胞としては、例えば、懸濁培養細胞、プロトプラスト、葉の切片等が含まれる。これらの植物細胞を増殖・分化させることにより植物体を得ることができる。なお、植物細胞からの植物体の再生は、植物細胞の種類に応じて、従来公知の方法を用いて行うことができる。したがって、本発明にかかる植物体の生産方法では、植物細胞から植物体を再生させる再生工程が含まれていてもよい。
【0049】
ここで、本発明にかかる花器官の形態が改変された植物体はシクラメン属に含まれるものであれば特に限定されるものではない。
以下に、本発明の実施例の例示により具体的に説明するが、本発明の範囲はこれらに限定されるものではない。以下の実験操作の手順は特に記述しない限り、「モレキュラー クローニング(Molecular Cloning) 第2版」(J.Sambrookら、Cold Spring Habor Laboratory press,1989年)に記載されている方法に従った。
【実施例】
【0050】
以下、実施例により本発明をさらに具体的に説明する。但し、本発明はこれら実施例にその技術的範囲が限定されるものではない。
【0051】
[実施例1]
(1)シクラメンのmRNAの調製
シクラメン(品種:フレグランスミニ)の蕾4gを液体窒素存在下で凍結後、凍結した花弁を乳棒乳鉢を用いて粉砕した。この粉砕物に2×CTAB溶液(すなわち2%臭化セチルトリメチルアンモニウムと0.1M Tris-HCl(pH9.5)と20mM EDTAと1.4M NaClと4% β−メルカプトエタノールとの混合物)40mlを加えた。得られた混合物を撹拌した後、65℃で10分間インキュベートした。次にインキュベートした該混合物をクロロフォルム抽出に2回かけた。得られたクロロフォルム抽出液にイソプロパノールを加えて核酸を析出させた。核酸よりなる沈澱を8000g、4℃で15分間遠心分離を行い、核酸をを回収した。その核酸をTE(10mM Tris(pH8.0)と1mM EDTAの混合物)4mlに溶解し、得られた溶液に10M 塩化リチウム溶液1mlを加えた。得られた混合液を氷上に2時間置いた後、19000g、4℃で10分間遠心分離すると、RNAが沈澱した。そのRNAを分け取り、蒸留水に溶解し、さらにそのRNA溶液をフェノール抽出およびエタノール沈殿することによりRNAを精製した。さらに、これで得られた全RNAの精製品から、mRNAの単離をmRNA精製キット(タカラバイオ社製、Oligotex−Mag mRNA purification Kit)により行うと、シクラメンのmRNAを約6μg得た。
【0052】
[実施例2]
(2)MADSボックス転写因子クローニング用cDNA断片の作製
シクラメンのMADSボックス転写因子のcDNA断片クローニング用のプローブをRT−PCR(Reverse Transcriptase-Polymerase Chain Reaction)を用いて作製するために、まずプライマーの設計を行った。そのために、シロイヌナズナを含めた花卉類のAG遺伝子をもとにアライメントを作成した。
下記に示す塩基配列を有する5種類のオリゴヌクレオチドをプライマーNo.1、No.2、No.3、No.4、No.5 として化学合成により作製した。
No.1(プライマー配列:配列番号18 )
5’-GCICWTGARMTNTCNRTNYTNTGYGATGC-3’
No.2(プライマー配列:配列番号19 )
5’-GCGGATCCRTTYTGYTCYTGDATIGCYTTYTC-3’
No.3(プライマー配列:配列番号20 )
5’-ATGGSIMGIGGIAARATISARAT-3’
No.4(プライマー配列:配列番号21 )
5’-GGIMGIGGIAARATIGARATIAARMGIAT-3’
No.5(プライマー配列:配列番号22 )
5’-GTNCARYTNAARRMGNATNGARAAYAAGAT-3’
但し、上記の2つの塩基配列においてk=gまたはt;w=aまたはt;r=gまたはa;y=tまたはc;m= aまたはcを意味する。
【0053】
なお、上記の5種類のオリゴヌクレオチドの作製はDNA合成装置(Model 391、アプライドバイオシステムズ社製)を用いてオリゴヌクレオチドを合成し、さらにその合成品をイオン交換HPLCで精製することにより行った。
【0054】
次に上記(1)で得た全RNA1μgをテンプレートとして、逆転転写反応液(10mM Tris‐HCl(pH8.3)、50mM KCl、5mM MgCl2、1mMのdNTP(dATP、dGTP、dCTP、dTTP)混合物、2.5μM オリゴ(dT)Oligo(dT)12-18 primer、ライフテックオリエンタル社製)、RNA阻害剤(RNase Inhibitor、タカラバイオ社製 20単位および逆転写酵素(AMV Reverse Transcriptase XL タカラバイオ社製 5単位)20μlを調製し、逆転写反応を行った。逆転写反応は30℃ 10分間、50℃ 30分間、99℃ 5分間、4℃ 5分間インキュベートする条件で行った。
【0055】
更にプライマーNo.1、No.2、各0.15μMをプライマーとし、上記で得られた逆転写反応液を含むPCR法用の増幅反応液を調整し、DNAの増幅反応を行った。ここで使用される増幅反応液は、PCRキット(タカラバイオ社製、LA PCR Kit Ver.2.1)により調製した。
PCR法によるDNAの上記の増幅反応は、PCR反応装置(BioRad社製、iCyceサーマルサイクラー )を用いて、変性を94℃、30秒間、アニーリングを55℃、1分間、また伸張を68℃、30秒間行う3つの反応操作を30回繰り返すことによって実施した。
【0056】
同様にプライマーNo.3と市販のUniversal Primer A Mix (SMART RACE cDNA Amplification Kit, Clontech/Takara Bio Inc.)
No.X(プライマー配列:配列番号23 )
5’-CTAATACGACTCACTATAGGGC-3’
各0.15μMをプライマーとし、DNAの増幅反応を行った。
同様にプライマーNo.4とNo.X、各0.15μMをプライマーとし、DNAの増幅反応を行った。
同様にプライマーNo.5とNo.X、各0.15μMをプライマーとし、DNAの増幅反応を行った。
上記のようにして増幅された数種類のシクラメンのMADSボックスのcDNAの一部をプローブDNAとして以下のクローニングに用いた。
【0057】
[実施例3]
(3)3’RACE および5’RACE (Rapid amplification of cDNA ends)法によるシクラメンのMADSボックス cDNAのクローニング
(i)シクラメンのAP1のcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.6(配列番号24に示す) AP1F2
5’-GGGAAGGGTGGAAATGAAGAGGATTG-3’
プライマーNo.7(配列番号25に示す) AP1R2
5’-GCCCTCAAGCGGCAAAGCATCCAA-3’
【0058】
次に、3’RACE System for Rapid Amplification of cDNA Ends(Invitrogen社製)および上記のプライマーNo.6として構築された合成オリゴヌクレオチドの各10pmolをプライマーとして用いて、上記(1)で得たmRNA0.1μgからシクラメンのAP1cDNA下流域の増幅を行った。上記した3’RACE法におけるシクラメンcDNAの増幅反応は、PCR反応装置(BioRad社製、iCyceサーマルサイクラー)を用いて、変性を94℃で30秒間行い、アニーリングを52℃で1分間行い、また伸張を72℃で1分間行う3つの反応操作を35回繰り返すことによって実施した。
【0059】
次に、5’RACE System for Rapid Amplification of cDNA Ends(Invitrogen社製)および上記のプライマーNo.7として構築された2種類の合成オリゴヌクレオチドの各10pmolをプライマーとして用いて、上記(1)で得たmRNA0.1μgからシクラメンのAP1cDNA上流域の増幅を行った。上記した5’RACE法におけるシクラメンcDNAの増幅反応は、PCR反応装置(BioRad社製、iCyceサーマルサイクラー)を用いて、変性を94℃で30秒間行い、アニーリングを52℃で1分間行い、また伸張を72℃で1分間行う3つの反応操作を35回繰り返すことによって実施した。
【0060】
上記で得られた増幅反応産物をTAベクターpT7Blue Vector(Navagen社製)のTAサイトに連結した。得られた連結ベクターを大腸菌DH5αに形質転換することにより、増幅反応産物であるDNAを保持する形質転換された大腸菌を得た。
上記のDNA断片がクローニングされた大腸菌をそれぞれ複数個選抜し、この大腸菌が保持するプラスミドDNAの塩基配列解析を行った。この塩基配列の決定は、プラスミド精製キット(QIAfilter Plasmid Midi Kit(QIAGEN社製))およびDNAシークエンス受託サービス(ファスマック社)を利用し、行った。
【0061】
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているAP1遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのAP1遺伝子をコードするcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpAP1と命名した。
【0062】
上記で決定されたCpAP1cDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社製)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpAP1cDNAは246個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【0063】
(ii)シクラメンのPIのcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.8(配列番号26に示す) PIF
5’-AAGGAGATCTCGGTCTTGTGTGATGC-3’
プライマーNo.9(配列番号27に示す) PIR
5’-GGAGAAAGGCATCTGAGGCTGGTACT-3’
【0064】
上記(i)記載の方法と同様の方法で、シクラメンのPIの増幅断片を得た。
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているPI遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのPI遺伝子をコードするcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpPIと命名した。
【0065】
上記で決定されたCpPIcDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社製)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpPIcDNAは206個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【0066】
(iii)シクラメンのAP3のcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.10(配列番号28に示す) AP3aF
5’-CTGCATAGGGAGATTCGGCAAAGGAT-3’
プライマーNo.11(配列番号29に示す) AP3aR
5’-AGAAATCCCGGCTCTGAGTTGAATGT-3’
プライマーNo.12(配列番号30に示す) AP3bF
5’-TCACCATGAGAAAATGCAAGAGCAGA-3’
プライマーNo.13(配列番号31に示す) AP3bR
5’-CGTTTATTAAGCGAGGCGAAGGTCAT-3’
【0067】
上記(i)記載の方法と同様の方法で、シクラメンのAP3の増幅断片を2種類得た。
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているAP3遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのAP3遺伝子をコードする2種類のcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpAP3a、CpAP3bと命名した。
【0068】
上記で決定されたCpAP3a およびCpAP3bのcDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社製)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpAP3acDNAは226個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。CpAP3bcDNAは225個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【0069】
(iv)シクラメンのSTKのcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.14(配列番号32に示す) STKF
5’-CAACCGCCAGGTCACTTTTTGTAAGA-3’
プライマーNo.15(配列番号33に示す) STKR
5’-GACGGTCCTTCCTCCATTAGGTTGAG-3’
【0070】
上記(i)記載の方法と同様の方法で、シクラメンのSTKの増幅断片を得た。
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているSTK遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのSTK遺伝子をコードするcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpSTKと命名した。
【0071】
上記で決定されたCpSTKcDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社製)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpSTKcDNAは222個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【0072】
(v)シクラメンのMADSのcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。
なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.16(配列番号34に示す) MADS1F
5’-TAACAATGCAGGAAGAGAGATGGAGCA-3’
プライマーNo.17(配列番号35に示す) MADS1R
5’-GATCAAGCCATTCCCATTTTGATCTTG-3’
プライマーNo.18(配列番号36に示す) MADS2F
5’-CACAATACATGCTGGATCAGCTCACTG-3’
プライマーNo.19(配列番号37に示す) MADS2R
5’-AATGCATCACACGTTTGTTCAGGTTTC-3’
プライマーNo.20(配列番号38に示す) MADS3F
5’-GCTACAAAAGCAGCTGTGTGGCAGTG-3’
プライマーNo.21(配列番号39に示す) MADS3R
5’-CCGCAAGTTAACAGCAGCGTACAACA-3’
【0073】
上記(i)記載の方法と同様の方法で、シクラメンのMADSの増幅断片を3種類得た。
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているMADS遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのMADS遺伝子をコードする3種類のcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpMADS1、CpMADS2、CpMADS3と命名した。
【0074】
上記で決定されたCpMADS1、CpMADS2およびCpMADS3のcDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpMADS1cDNAは245個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。CpMADS2cDNAは247個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。CpMADS3cDNAは189個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【産業上の利用可能性】
【0075】
本発明では、シクラメンのMADSボックス転写因子の機能を抑制することによってシクラメンの花の形態が改変された植物体を得ることができる。それゆえ、本発明は、各種農業や園芸、アグリビジネス、さらには農産物を加工する産業や食品産業等に利用可能であり、しかも非常に有用であると考えられる。
【技術分野】
【0001】
本発明は、シクラメンの花器官形成関連転写因子をコードする遺伝子に関する。
【背景技術】
【0002】
花の形態は園芸植物の観賞性における重要な要素の一つである。花の発生は、花序分裂組織から花原基として分化するところから始まり、花原基に含まれる花芽分裂組織から、がく片、花びら、雄しべ、雌しべの4種類の花器官が分化する。その後、分化した花器官を含む複合器官として成熟した花が形成される。八重咲きと呼ばれる花は、花弁の内側の雄しべや雌しべが並んでいる場所に、雄しべや雌しべの形態が改変されて花弁に変化したものが形成されて、花弁数が増加して花弁だけで花が構成されているように見える状態を指す。このような植物は、新規な園芸植物の創出に利用できる等、農業上の有用性が高い。
【0003】
このような高等植物における花の形態の発生は一般にABCモデルによって説明されており、このモデルはMADSボックスファミリーに属するA、B、Cのクラスの遺伝子の転写制御を介して花の形態が変化すると考えられている(酒井一、花 の形 態形 成の分子遺伝学、新版「植物の形 を決める分子機構」(秀潤社)150-163 (2000))。MADSボックスファミリー遺伝子 は、MADSボックスと呼ばれる保存性領域を含む転写因子をコードする遺伝子 で、30以上の遺伝子 からなる遺伝子 ファミリーを形 成している。例えばAPETALA1(AP1)、APETALA(AP2)などのAクラス遺伝子、APETALA3(AP3)、PISTILLATA(PI)などのBクラス遺伝子、そしてAGAMOUS(AG)のCクラス遺伝子など転写因子が挙げられ、これらの変異体で花の形態の変化が確認されている。
【0004】
これまで、植物の花弁の形態や数の改変は、一般に植物の品種を掛け合わせる交配育種や自然界で発生する突然変異により行われている。しかし、従来の交配育種では、目的とする形態を有する植物を生産するためには、長い年月と、熟練者の経験が必要であり、また突然変異は目的とする形態の発生が制御できないため、簡易かつ確実に花器官の形態を改変する方法が求められている。
【0005】
近年、遺伝子工学的に花の形態を改変する方法として、任意の転写因子を転写抑制因子に転換するペプチドを利用する方法が知られている(例えば、特許文献1〜7)。種々の転写因子と上記ペプチドとを融合させた融合タンパク質(キメラタンパク質)をコードする遺伝子を植物体内に導入することより、転写因子が転写抑制因子に転換され、該転写因子が転写を促進する標的遺伝子の発現が抑制された植物体を生産することが可能で、具体的には、上記のMADSボックスファミリー遺伝子であるシロイヌナズナのAP3遺伝子やAG遺伝子の発現を、それぞれの遺伝子のプロモーター領域に結合するリプレッサーを用いて抑制し、雄性不稔体の生産方法や花弁数を増加させる方法を確立している(特許文献8〜9)。
【0006】
しかしながら、シロイヌナズナのAG遺伝子のキメラリプレッサーを導入したトレニアでは、花弁数の増加は認められていないなど、使用する転写因子の植物起源と、目的とする植物種によっては、機能しないことがある(非特許文献1)。
【0007】
一方、シクラメンは冬を代表する鉢花として国内出荷数の上位を占める重要な花卉園芸植物であるが、前記した遺伝子工学的手法によって花の形態を改変するには、シクラメンの花器官形成に関与する転写因子遺伝子の取得が重要である。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2001−269177公報
【特許文献2】特開2001−269178公報
【特許文献3】特開2001−292776公報
【特許文献4】特開2001−292777公報
【特許文献5】特開2001−269176公報
【特許文献6】特開2001−269179公報
【特許文献7】国際公開第03/055903号パンフレット
【特許文献8】特開2005−192483公報
【特許文献9】特開2006−42729公報
【非特許文献】
【0009】
【非特許文献1】Plant Biotechnology,2008年,25巻,P45-53
【発明の概要】
【発明が解決しようとする課題】
【0010】
シクラメンの花器官形成に関与する転写因子は知られていないのが現状で、本発明は、シクラメンの花器官形成関連転写因子をコードする遺伝子を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者は、上記課題を解決するため鋭意研究を行った結果、シクラメンの花器官形成を制御する転写因子をコードする遺伝子を同定することに成功し、本発明を完成するに至った。
【0012】
すなわち、本発明は、以下を包含する。
[1](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号2のアミノ酸配列
(b)配列番号2のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号1の塩基配列からなるDNA
(d)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号1の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0013】
[2](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号4のアミノ酸配列
(b)配列番号4のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号3の塩基配列からなるDNA
(d)配列番号3の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号3の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0014】
[3](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号6のアミノ酸配列
(b)配列番号6のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号5の塩基配列からなるDNA
(d)配列番号5の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号5の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0015】
[4](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号8のアミノ酸配列
(b)配列番号8のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号7の塩基配列からなるDNA
(d)配列番号7の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号7の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0016】
[5](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号10のアミノ酸配列
(b)配列番号10のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号9の塩基配列からなるDNA
(d)配列番号9の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号9の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0017】
[6](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号12のアミノ酸配列
(b)配列番号12のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号11の塩基配列からなるDNA
(d)配列番号11の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号11の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0018】
[7](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号14のアミノ酸配列
(b)配列番号14のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号13の塩基配列からなるDNA
(d)配列番号13の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号13の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0019】
[8](a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号16のアミノ酸配列
(b)配列番号16のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号15の塩基配列からなるDNA
(d)配列番号15の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号15の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【0020】
[9]前記転写因子をコードする請求項1、2、3、4、5、6、7又は8記載のDNAと転写因子を転写抑制因子に転換する機能性ペプチドをコードする配列番号17のDNAとを融合させたキメラ遺伝子
【0021】
[10]前記[9]記載の遺伝子を含む発現ベクター。
【0022】
[11]前記[10]記載の発現ベクターを含む形質転換シクラメン植物。
【発明の効果】
【0023】
本発明により、シクラメンの花器官形成関連転写因子をコードする遺伝子が提供される。本発明の遺伝子は、シクラメンの花器官の形態を変化させる分子育種に使用できる点で有用である。
【図面の簡単な説明】
【0024】
【図1】シクラメンMADS−ボックス転写因子遺伝子の系統樹
【発明を実施するための形態】
【0025】
以下、本発明を詳細に説明する。なお、本発明はこれに限定されるものではない。
シクラメン植物の花器官の形態に関与する転写因子としては、シクラメンのMADSボックスファミリーに属する転写因子を挙げることができる。
【0026】
本発明で用いられる転写因子の代表的な一例としては、シクラメンのAP1タンパク質、AP3aタンパク質、AP3bタンパク質、PIタンパク質、STKタンパク質、MADS1タンパク質、MADS2タンパク質またはMADS3タンパク質を挙げることができる。AP1タンパク質は、配列番号2に示されるアミノ酸配列を有するタンパク質である。AP3aタンパク質は、配列番号4に示されるアミノ酸配列を有するタンパク質である。AP3bタンパク質は、配列番号6に示されるアミノ酸配列を有するタンパク質である。PIタンパク質配列番号8に示されるアミノ酸配列を有するタンパク質である。STKタンパク質配列番号10に示されるアミノ酸配列を有するタンパク質である。MADS1タンパク質配列番号12に示されるアミノ酸配列を有するタンパク質である。MADS2タンパク質配列番号14に示されるアミノ酸配列を有するタンパク質である。MADS3タンパク質は、配列番号16に示されるアミノ酸配列を有するタンパク質である。
【0027】
ただし、上記転写因子は、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14および配列番号16に示されるアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入、及び/又は付加されたアミノ酸配列からなるタンパク質であっても、下記転写抑制転換ペプチドとのキメラタンパク質として植物に導入したときにシクラメン植物の花器官の形態を改変しうるものであれば本発明にて用いることができる。
【0028】
なお、上記の配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14および配列番号16に示されるアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入、及び/又は付加されたアミノ酸配列における「1個又は数個」の範囲は特に限定されないが、例えば、1から20個、好ましくは1から10個、より好ましくは1から7個、さらに好ましくは1個から5個、特に好ましくは1個から3個を意味する。
【0029】
本発明で用いられるキメラタンパク質を生産する際には、後述するように、公知の遺伝子組換え技術を好適に用いることができる。そこで、本発明にかかる植物体の生産方法には、上記転写因子をコードする遺伝子が好適に用いることができる。
【0030】
例えば、転写因子としてシクラメンのAP1タンパク質を用いる場合には、このAP1タンパク質をコードする遺伝子(説明の便宜上、CpAP1遺伝子と称する)を挙げることができる。CpAP1遺伝子の具体的な一例としては、配列番号1に示される塩基配列をオープンリーディングフレーム(ORF)として含むポリヌクレオチドを挙げることができる。また、例えば、転写因子としてシクラメンのAP3aタンパク質を用いる場合には、このAP3aタンパク質をコードする遺伝子(説明の便宜上、CpAP3a遺伝子と称する)を挙げることができる。CpAP3a遺伝子の具体的な一例としては、配列番号3に示される塩基配列をオープンリーディングフレーム(ORF)として含むポリヌクレオチドを挙げることができる。
【0031】
もちろん、本発明で用いられる転写因子をコードするDNAとしては、上記の例に限定されるものではなく、配列番号1、3、5、7、9、11、13または15に示される塩基配列と相同性を有するDNAであってもよい。具体的には、例えば、配列番号1、3、5、7、9、11、13または15に示される塩基配列と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ、転写抑制転換ペプチドとのキメラタンパク質として植物に導入したときに植物の花の形態を改変しうるタンパク質をコードするDNA等を挙げることができる。なお、ここでストリンジェントな条件でハイブリダイズするとは、好ましくは60℃で2×SSC洗浄条件下で結合することを意味し、より好ましくは60℃で0.1×SSC洗浄条件下で結合することを意味する。また、配列番号2、4、6、8、10、12、14または16に記載のアミノ酸配列と90%以上の同一性を有するアミノ酸配列をコードするDNA等を挙げることができる。
【0032】
上記ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual,2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。通常、温度が高いほど、塩濃度が低いほどストリンジェンシーは高くなる(非特異DNAはハイブリダイズしがたくなる)。
【0033】
上記転写因子をコードするDNAをシクラメンから取得する方法は特に限定されるものではなく、従来公知の方法により、多くの植物から単離することができる。例えば、既知の転写因子の塩基配列に基づき作製したプライマー対を用いることができる。このプライマー対を用いて、植物のcDNA又はゲノミックDNAを鋳型としてPCRを行うこと等により上記DNAを得ることができる。また、上記転写因子をコードするDNAは、従来公知の方法により化学合成して得ることもできる。
【0034】
シクラメン植物の花器官の形態形成に関与する転写因子の機能を抑制する方法は特に限定されるものではなく、転写抑制因子を植物に導入して内在性の転写因子の活性を抑制する方法や、遺伝子破壊やRNA干渉(RNAi)などにより転写因子をコードする遺伝子の発現を抑制する方法が例示されるが、この中では、上記転写因子と、任意の転写因子を転写抑制因子に転換する機能性ペプチドとを融合させたキメラタンパク質を、植物体で生産させることが好ましい。これによって得られる植物体では、上記転写因子の機能が抑制されるため、花器官が形態変化したシクラメン植物体を生産することができる。つまり、上記転写因子は、シクラメンの花器官の形態形成、に不可欠なものであるため、上記転写因子が転写抑制因子に転換されることにより、花器官の形態形成に異常が引き起こされる。
【0035】
なお、本方法においては、上記転写因子が標的とする遺伝子は特定される必要がない。結果として、花器官の形態が改変されることから、上記標的遺伝子は、花器官の形成過程において、花器官の形態に影響を与える機能を有する遺伝子であることが推定されるが、その機能や構造の特定がされていなくても、本方法においては、その転写抑制を有効に行うことができる。
【0036】
本発明で用いられる、任意の転写因子を転写抑制因子に転換する機能性ペプチド(説明の便宜上、転写抑制転換ペプチドと称する)としては、特に限定されるものではなく、転写因子と融合させたキメラタンパク質を形成させることにより、当該転写因子の機能を抑制することができるペプチドであればよい。具体的には、例えば、本発明者によって見出された転写抑制転換ペプチド(特許文献1〜7)を挙げることができ、好ましくは配列番号17記載のLDLDLELRLGFAペプチドがよい。各種転写抑制転換ペプチドは、上記で説明した転写因子と融合してキメラタンパク質とすることにより、当該転写因子を転写抑制因子とすることができる。
【0037】
したがって、本発明では、上記転写抑制転換ペプチドをコードするポリヌクレオチドを用いて、転写因子をコードするDNAとのキメラDNAを得れば、キメラタンパク質を生産させることができる。具体的には、上記転写抑制転換ペプチドをコードするポリヌクレオチド(説明の便宜上、転写抑制転換ポリヌクレオチドと称する)と上記転写因子をコードするDNAとを連結することによりキメラDNAを構築して、植物細胞に導入する。これによりキメラタンパク質を生産させることができる。
【0038】
上記転写抑制転換ポリヌクレオチドの具体的な塩基配列は特に限定されるものではなく、遺伝暗号に基づいて、上記転写抑制転換ペプチドのアミノ酸配列に対応する塩基配列を含んでいればよい。また、必要に応じて、上記転写抑制転換ポリヌクレオチドは、転写因子DNAと連結するための連結部位となる塩基配列を含んでいてもよい。さらに、上記転写抑制転換ポリヌクレオチドのアミノ酸読み枠と転写因子DNAの読み枠とが一致しないような場合に、これらを一致させるための付加的な塩基配列を含んでいてもよい。
【0039】
本発明で用いられるキメラタンパク質は、転写因子をコードするDNAと転写抑制転換ポリヌクレオチドとを連結した上記キメラDNAから得ることができる。したがって、上記キメラタンパク質は、上記転写因子と、上記転写抑制転換ペプチドとが含まれていればよく、その構成は特に限定されるものではない。例えば、転写因子と転写抑制転換ペプチドとの間をつなぐためのリンカー機能を有するポリペプチドや、HisやMyc、Flag等のようにキメラタンパク質をエピトープ標識するためのポリペプチド等、各種の付加的なポリペプチドが含まれていてもよい。さらに上記キメラタンパク質には、必要に応じて、ポリペプチド以外の構造、例えば、糖鎖やイソプレノイド基等が含まれていてもよい。なお、キメラタンパク質において、転写因子と転写抑制転換ペプチドの順番は特に制限されず、いずれをアミノ末端側にしてもよい。
【0040】
本発明にかかる植物体の生産方法は、上記で説明したキメラタンパク質を植物体で生産させ、シクラメン植物の花器官の形態を改変する過程を含んでいれば特に限定されるものではないが、本発明にかかる植物体の生産方法を具体的な工程で示せば、例えば、発現ベクター構築工程、形質転換工程、選抜工程等の工程を含む生産方法として挙げることができる。このうち、本発明では、少なくとも形質転換工程が含まれていればよい。
【0041】
本発明において行われる発現ベクター構築工程は、上記で説明した転写因子をコードするDNAと、転写抑制転換ポリヌクレオチドと、プロモーターとを含む組換え発現ベクターを構築する工程であれば特に限定されるものではない。
【0042】
上記プロモーターは、植物体内で遺伝子を発現させることが可能なプロモーターであれば特に限定されるものではなく、公知のプロモーターを好適に用いることができる。かかるプロモーターとしては、例えば、カリフラワーモザイクウイルス35Sプロモーター(CaMV35S)、アクチンプロモーター、ノパリン合成酵素のプロモーター、タバコのPR1a遺伝子プロモーター、トマトのリブロース1,5−二リン酸カルボキシラーゼ・オキシダーゼ小サブユニットプロモーター等を挙げることができる。また、花器官特異的に発現するプロモーター等を挙げることができる。上記プロモーターは、転写因子をコードするDNAと転写抑制転換ポリヌクレオチドとを連結したキメラDNAを発現しうるように連結され、ベクター内に導入されていればよく、組換え発現ベクターとしての具体的な構造は特に限定されるものではない。
【0043】
ターミネーターは転写終結部位としての機能を有していれば特に限定されるものではなく、公知のものであってもよい。例えば、具体的には、ノパリン合成酵素遺伝子の転写終結領域(Nosターミネーター)、カリフラワーモザイクウイルス35Sの転写終結領域(CaMV35Sターミネーター)等を好ましく用いることができる。
【0044】
上記選別マーカーとしては、例えば薬剤耐性遺伝子を用いることができる。かかる薬剤耐性遺伝子の具体的な一例としては、例えば、ハイグロマイシン、ブレオマイシン、カナマイシン、ゲンタマイシン、クロラムフェニコール等に対する薬剤耐性遺伝子を挙げることができる。これにより、上記抗生物質を含む培地中で生育する植物体を選択することによって、形質転換された植物体を容易に選別することができる。
【0045】
上記組換え発現ベクターの構築方法についても特に限定されるものではなく、適宜選択された母体となるベクターに、上記プロモーター、転写因子をコードするDNA、および転写抑制転換ポリヌクレオチド、並びに必要に応じて上記他のDNAセグメントを所定の順序となるように導入すればよい。例えば、転写因子をコードするDNAと転写抑制転換ポリヌクレオチドとを連結してキメラDNAを構築し、次に、このキメラDNAとプロモーターと(必要に応じてターミネーター等)とを連結して発現カセットを構築し、これをベクターに導入すればよい。
【0046】
本発明において行われる形質転換工程は、上記で説明した組換え発現ベクターを植物細胞に導入して、キメラタンパク質を生産させるようになっていればよい。
上記組換え発現ベクターを植物細胞に導入する方法(形質転換方法)は特に限定されるものではなく、植物細胞に応じた適切な従来公知の方法を用いることができる。具体的には、例えば、アグロバクテリウムを用いる方法や直接植物細胞に導入する方法を用いることができる。組換え発現ベクターを直接植物細胞に導入する方法としては、例えば、マイクロインジェクション法、エレクトロポレーション法(電気穿孔法)、ポリエチレングリコール法、パーティクルガン法、プロトプラスト融合法、リン酸カルシウム法等を用いることができる。
【0047】
上記組換え発現ベクターが導入される植物細胞としては、例えば、花、葉、根等の植物器官における各組織の細胞、カルス、不定胚、懸濁培養細胞等を挙げることができる。
本発明において「花器官の形態形成」が改変されているとは、花器官の形態に関する形質が改変されていれば、特に限定されるものではない。花器官の形態としては、例えば、花柄の長さ、花びらの形状、花びらの模様、花びらの色、がくの形状、さやの形状、雄しべの形状、雌しべの形状等を挙げることができ、果実の形態も含まれ。また、花器官の形態形成が改変されるとは、単独の形態が改変される場合と、複数の形態が同時に改変される場合を含む。
【0048】
本発明における植物体とは、成育した植物個体、植物細胞、植物組織、カルス、種子の少なくとも何れかが含まれる。つまり、本発明では、最終的に植物個体まで成育させることができる状態のものであれば、全て植物体と見なす。また、上記植物細胞には、種々の形態の植物細胞が含まれる。かかる植物細胞としては、例えば、懸濁培養細胞、プロトプラスト、葉の切片等が含まれる。これらの植物細胞を増殖・分化させることにより植物体を得ることができる。なお、植物細胞からの植物体の再生は、植物細胞の種類に応じて、従来公知の方法を用いて行うことができる。したがって、本発明にかかる植物体の生産方法では、植物細胞から植物体を再生させる再生工程が含まれていてもよい。
【0049】
ここで、本発明にかかる花器官の形態が改変された植物体はシクラメン属に含まれるものであれば特に限定されるものではない。
以下に、本発明の実施例の例示により具体的に説明するが、本発明の範囲はこれらに限定されるものではない。以下の実験操作の手順は特に記述しない限り、「モレキュラー クローニング(Molecular Cloning) 第2版」(J.Sambrookら、Cold Spring Habor Laboratory press,1989年)に記載されている方法に従った。
【実施例】
【0050】
以下、実施例により本発明をさらに具体的に説明する。但し、本発明はこれら実施例にその技術的範囲が限定されるものではない。
【0051】
[実施例1]
(1)シクラメンのmRNAの調製
シクラメン(品種:フレグランスミニ)の蕾4gを液体窒素存在下で凍結後、凍結した花弁を乳棒乳鉢を用いて粉砕した。この粉砕物に2×CTAB溶液(すなわち2%臭化セチルトリメチルアンモニウムと0.1M Tris-HCl(pH9.5)と20mM EDTAと1.4M NaClと4% β−メルカプトエタノールとの混合物)40mlを加えた。得られた混合物を撹拌した後、65℃で10分間インキュベートした。次にインキュベートした該混合物をクロロフォルム抽出に2回かけた。得られたクロロフォルム抽出液にイソプロパノールを加えて核酸を析出させた。核酸よりなる沈澱を8000g、4℃で15分間遠心分離を行い、核酸をを回収した。その核酸をTE(10mM Tris(pH8.0)と1mM EDTAの混合物)4mlに溶解し、得られた溶液に10M 塩化リチウム溶液1mlを加えた。得られた混合液を氷上に2時間置いた後、19000g、4℃で10分間遠心分離すると、RNAが沈澱した。そのRNAを分け取り、蒸留水に溶解し、さらにそのRNA溶液をフェノール抽出およびエタノール沈殿することによりRNAを精製した。さらに、これで得られた全RNAの精製品から、mRNAの単離をmRNA精製キット(タカラバイオ社製、Oligotex−Mag mRNA purification Kit)により行うと、シクラメンのmRNAを約6μg得た。
【0052】
[実施例2]
(2)MADSボックス転写因子クローニング用cDNA断片の作製
シクラメンのMADSボックス転写因子のcDNA断片クローニング用のプローブをRT−PCR(Reverse Transcriptase-Polymerase Chain Reaction)を用いて作製するために、まずプライマーの設計を行った。そのために、シロイヌナズナを含めた花卉類のAG遺伝子をもとにアライメントを作成した。
下記に示す塩基配列を有する5種類のオリゴヌクレオチドをプライマーNo.1、No.2、No.3、No.4、No.5 として化学合成により作製した。
No.1(プライマー配列:配列番号18 )
5’-GCICWTGARMTNTCNRTNYTNTGYGATGC-3’
No.2(プライマー配列:配列番号19 )
5’-GCGGATCCRTTYTGYTCYTGDATIGCYTTYTC-3’
No.3(プライマー配列:配列番号20 )
5’-ATGGSIMGIGGIAARATISARAT-3’
No.4(プライマー配列:配列番号21 )
5’-GGIMGIGGIAARATIGARATIAARMGIAT-3’
No.5(プライマー配列:配列番号22 )
5’-GTNCARYTNAARRMGNATNGARAAYAAGAT-3’
但し、上記の2つの塩基配列においてk=gまたはt;w=aまたはt;r=gまたはa;y=tまたはc;m= aまたはcを意味する。
【0053】
なお、上記の5種類のオリゴヌクレオチドの作製はDNA合成装置(Model 391、アプライドバイオシステムズ社製)を用いてオリゴヌクレオチドを合成し、さらにその合成品をイオン交換HPLCで精製することにより行った。
【0054】
次に上記(1)で得た全RNA1μgをテンプレートとして、逆転転写反応液(10mM Tris‐HCl(pH8.3)、50mM KCl、5mM MgCl2、1mMのdNTP(dATP、dGTP、dCTP、dTTP)混合物、2.5μM オリゴ(dT)Oligo(dT)12-18 primer、ライフテックオリエンタル社製)、RNA阻害剤(RNase Inhibitor、タカラバイオ社製 20単位および逆転写酵素(AMV Reverse Transcriptase XL タカラバイオ社製 5単位)20μlを調製し、逆転写反応を行った。逆転写反応は30℃ 10分間、50℃ 30分間、99℃ 5分間、4℃ 5分間インキュベートする条件で行った。
【0055】
更にプライマーNo.1、No.2、各0.15μMをプライマーとし、上記で得られた逆転写反応液を含むPCR法用の増幅反応液を調整し、DNAの増幅反応を行った。ここで使用される増幅反応液は、PCRキット(タカラバイオ社製、LA PCR Kit Ver.2.1)により調製した。
PCR法によるDNAの上記の増幅反応は、PCR反応装置(BioRad社製、iCyceサーマルサイクラー )を用いて、変性を94℃、30秒間、アニーリングを55℃、1分間、また伸張を68℃、30秒間行う3つの反応操作を30回繰り返すことによって実施した。
【0056】
同様にプライマーNo.3と市販のUniversal Primer A Mix (SMART RACE cDNA Amplification Kit, Clontech/Takara Bio Inc.)
No.X(プライマー配列:配列番号23 )
5’-CTAATACGACTCACTATAGGGC-3’
各0.15μMをプライマーとし、DNAの増幅反応を行った。
同様にプライマーNo.4とNo.X、各0.15μMをプライマーとし、DNAの増幅反応を行った。
同様にプライマーNo.5とNo.X、各0.15μMをプライマーとし、DNAの増幅反応を行った。
上記のようにして増幅された数種類のシクラメンのMADSボックスのcDNAの一部をプローブDNAとして以下のクローニングに用いた。
【0057】
[実施例3]
(3)3’RACE および5’RACE (Rapid amplification of cDNA ends)法によるシクラメンのMADSボックス cDNAのクローニング
(i)シクラメンのAP1のcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.6(配列番号24に示す) AP1F2
5’-GGGAAGGGTGGAAATGAAGAGGATTG-3’
プライマーNo.7(配列番号25に示す) AP1R2
5’-GCCCTCAAGCGGCAAAGCATCCAA-3’
【0058】
次に、3’RACE System for Rapid Amplification of cDNA Ends(Invitrogen社製)および上記のプライマーNo.6として構築された合成オリゴヌクレオチドの各10pmolをプライマーとして用いて、上記(1)で得たmRNA0.1μgからシクラメンのAP1cDNA下流域の増幅を行った。上記した3’RACE法におけるシクラメンcDNAの増幅反応は、PCR反応装置(BioRad社製、iCyceサーマルサイクラー)を用いて、変性を94℃で30秒間行い、アニーリングを52℃で1分間行い、また伸張を72℃で1分間行う3つの反応操作を35回繰り返すことによって実施した。
【0059】
次に、5’RACE System for Rapid Amplification of cDNA Ends(Invitrogen社製)および上記のプライマーNo.7として構築された2種類の合成オリゴヌクレオチドの各10pmolをプライマーとして用いて、上記(1)で得たmRNA0.1μgからシクラメンのAP1cDNA上流域の増幅を行った。上記した5’RACE法におけるシクラメンcDNAの増幅反応は、PCR反応装置(BioRad社製、iCyceサーマルサイクラー)を用いて、変性を94℃で30秒間行い、アニーリングを52℃で1分間行い、また伸張を72℃で1分間行う3つの反応操作を35回繰り返すことによって実施した。
【0060】
上記で得られた増幅反応産物をTAベクターpT7Blue Vector(Navagen社製)のTAサイトに連結した。得られた連結ベクターを大腸菌DH5αに形質転換することにより、増幅反応産物であるDNAを保持する形質転換された大腸菌を得た。
上記のDNA断片がクローニングされた大腸菌をそれぞれ複数個選抜し、この大腸菌が保持するプラスミドDNAの塩基配列解析を行った。この塩基配列の決定は、プラスミド精製キット(QIAfilter Plasmid Midi Kit(QIAGEN社製))およびDNAシークエンス受託サービス(ファスマック社)を利用し、行った。
【0061】
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているAP1遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのAP1遺伝子をコードするcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpAP1と命名した。
【0062】
上記で決定されたCpAP1cDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社製)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpAP1cDNAは246個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【0063】
(ii)シクラメンのPIのcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.8(配列番号26に示す) PIF
5’-AAGGAGATCTCGGTCTTGTGTGATGC-3’
プライマーNo.9(配列番号27に示す) PIR
5’-GGAGAAAGGCATCTGAGGCTGGTACT-3’
【0064】
上記(i)記載の方法と同様の方法で、シクラメンのPIの増幅断片を得た。
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているPI遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのPI遺伝子をコードするcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpPIと命名した。
【0065】
上記で決定されたCpPIcDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社製)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpPIcDNAは206個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【0066】
(iii)シクラメンのAP3のcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.10(配列番号28に示す) AP3aF
5’-CTGCATAGGGAGATTCGGCAAAGGAT-3’
プライマーNo.11(配列番号29に示す) AP3aR
5’-AGAAATCCCGGCTCTGAGTTGAATGT-3’
プライマーNo.12(配列番号30に示す) AP3bF
5’-TCACCATGAGAAAATGCAAGAGCAGA-3’
プライマーNo.13(配列番号31に示す) AP3bR
5’-CGTTTATTAAGCGAGGCGAAGGTCAT-3’
【0067】
上記(i)記載の方法と同様の方法で、シクラメンのAP3の増幅断片を2種類得た。
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているAP3遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのAP3遺伝子をコードする2種類のcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpAP3a、CpAP3bと命名した。
【0068】
上記で決定されたCpAP3a およびCpAP3bのcDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社製)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpAP3acDNAは226個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。CpAP3bcDNAは225個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【0069】
(iv)シクラメンのSTKのcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.14(配列番号32に示す) STKF
5’-CAACCGCCAGGTCACTTTTTGTAAGA-3’
プライマーNo.15(配列番号33に示す) STKR
5’-GACGGTCCTTCCTCCATTAGGTTGAG-3’
【0070】
上記(i)記載の方法と同様の方法で、シクラメンのSTKの増幅断片を得た。
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているSTK遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのSTK遺伝子をコードするcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpSTKと命名した。
【0071】
上記で決定されたCpSTKcDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社製)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpSTKcDNAは222個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【0072】
(v)シクラメンのMADSのcDNAを増幅するために、プライマーの設計を行った。
すなわち、下記に示す塩基配列を有する2種類のオリゴヌクレオチドをプライマーとして設計し、化学合成により作製した。
なお、上記のプライマーのオリゴヌクレオチドの作製はDNA合成サービス(北海道システムサイエンス社)を利用した。
プライマーNo.16(配列番号34に示す) MADS1F
5’-TAACAATGCAGGAAGAGAGATGGAGCA-3’
プライマーNo.17(配列番号35に示す) MADS1R
5’-GATCAAGCCATTCCCATTTTGATCTTG-3’
プライマーNo.18(配列番号36に示す) MADS2F
5’-CACAATACATGCTGGATCAGCTCACTG-3’
プライマーNo.19(配列番号37に示す) MADS2R
5’-AATGCATCACACGTTTGTTCAGGTTTC-3’
プライマーNo.20(配列番号38に示す) MADS3F
5’-GCTACAAAAGCAGCTGTGTGGCAGTG-3’
プライマーNo.21(配列番号39に示す) MADS3R
5’-CCGCAAGTTAACAGCAGCGTACAACA-3’
【0073】
上記(i)記載の方法と同様の方法で、シクラメンのMADSの増幅断片を3種類得た。
その結果、前記の増幅反応産物のDNA断片はすべてポリAシグナルを含むcDNAであることが確認された。決定された塩基配列より予想されるアミノ酸配列をこれまで明らかにされているMADS遺伝子のアミノ酸配列と比較することにより、上記の増幅反応産物であるcDNA断片はシクラメンのMADS遺伝子をコードする3種類のcDNAの一部領域を含むDNA断片である事を確認した。上記のcDNA断片の遺伝子をそれぞれCpMADS1、CpMADS2、CpMADS3と命名した。
【0074】
上記で決定されたCpMADS1、CpMADS2およびCpMADS3のcDNAの5’側上流域および3’側下流域の塩基配列を結合するために、ソフトウエアGenetyx(ゼネティクス社)を用い、塩基配列Alignmentファイルをソフトウェアの初期設定条件で作成することによって、個の塩基よりなる一つのcDNAとしての塩基配列を得た。CpMADS1cDNAは245個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。CpMADS2cDNAは247個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。CpMADS3cDNAは189個の塩基よりなる単一のオープンリーディングフレーム(ORF)のDNA配列を含む。
【産業上の利用可能性】
【0075】
本発明では、シクラメンのMADSボックス転写因子の機能を抑制することによってシクラメンの花の形態が改変された植物体を得ることができる。それゆえ、本発明は、各種農業や園芸、アグリビジネス、さらには農産物を加工する産業や食品産業等に利用可能であり、しかも非常に有用であると考えられる。
【特許請求の範囲】
【請求項1】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号2のアミノ酸配列
(b)配列番号2のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号1の塩基配列からなるDNA
(d)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号1の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項2】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号4のアミノ酸配列
(b)配列番号4のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号3の塩基配列からなるDNA
(d)配列番号3の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号3の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項3】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号6のアミノ酸配列
(b)配列番号6のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号5の塩基配列からなるDNA
(d)配列番号5の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号5の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項4】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号8のアミノ酸配列
(b)配列番号8のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号7の塩基配列からなるDNA
(d)配列番号7の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号7の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項5】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号10のアミノ酸配列
(b)配列番号10のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号9の塩基配列からなるDNA
(d)配列番号9の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号9の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項6】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号12のアミノ酸配列
(b)配列番号12のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号11の塩基配列からなるDNA
(d)配列番号11の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号11の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項7】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号14のアミノ酸配列
(b)配列番号14のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号13の塩基配列からなるDNA
(d)配列番号13の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号13の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項8】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号16のアミノ酸配列
(b)配列番号16のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号15の塩基配列からなるDNA
(d)配列番号15の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号15の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項9】
前記転写因子をコードする請求項1、2、3、4、5、6、7又は8記載のDNAと転写因子を転写抑制因子に転換する機能性ペプチドをコードする配列番号17のDNAとを融合させたキメラ遺伝子
【請求項10】
請求項9記載の遺伝子を含む発現ベクター。
【請求項11】
請求項10記載の発現ベクターを含む形質転換シクラメン植物。
【請求項1】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号2のアミノ酸配列
(b)配列番号2のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号1の塩基配列からなるDNA
(d)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号1の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項2】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号4のアミノ酸配列
(b)配列番号4のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号3の塩基配列からなるDNA
(d)配列番号3の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号3の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項3】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号6のアミノ酸配列
(b)配列番号6のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号5の塩基配列からなるDNA
(d)配列番号5の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号5の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項4】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号8のアミノ酸配列
(b)配列番号8のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号7の塩基配列からなるDNA
(d)配列番号7の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号7の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項5】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号10のアミノ酸配列
(b)配列番号10のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号9の塩基配列からなるDNA
(d)配列番号9の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号9の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項6】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号12のアミノ酸配列
(b)配列番号12のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号11の塩基配列からなるDNA
(d)配列番号11の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号11の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項7】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号14のアミノ酸配列
(b)配列番号14のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号13の塩基配列からなるDNA
(d)配列番号13の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号13の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項8】
以下の(a)、(b)、(c)、(d)又は(e)のアミノ酸配列を含むシクラメンの花器官形成関連転写因子をコードする遺伝子。
(a)配列番号16のアミノ酸配列
(b)配列番号16のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、シクラメンの花器官形成に関与し、かつ転写因子活性を有するアミノ酸配列
(c)配列番号15の塩基配列からなるDNA
(d)配列番号15の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列からなり、シクラメンの花器官形成に関与する転写因子をコードするDNA
(e)配列番号15の塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつシクラメンの花器官形成に関与する転写因子をコードするDNA
【請求項9】
前記転写因子をコードする請求項1、2、3、4、5、6、7又は8記載のDNAと転写因子を転写抑制因子に転換する機能性ペプチドをコードする配列番号17のDNAとを融合させたキメラ遺伝子
【請求項10】
請求項9記載の遺伝子を含む発現ベクター。
【請求項11】
請求項10記載の発現ベクターを含む形質転換シクラメン植物。
【図1】




【公開番号】特開2012−200165(P2012−200165A)
【公開日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願番号】特願2011−65829(P2011−65829)
【出願日】平成23年3月24日(2011.3.24)
【出願人】(000242002)北興化学工業株式会社 (182)
【Fターム(参考)】
【公開日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願日】平成23年3月24日(2011.3.24)
【出願人】(000242002)北興化学工業株式会社 (182)
【Fターム(参考)】
[ Back to top ]

