シクロスポリンを含有する液晶乳化型医薬組成物
【課題】
塗布時、塗布後の感触に優れ、シクロスポリンの経皮吸収性を高めることにより、低濃度で薬効が発揮される皮膚外用医薬組成物の提供。
【解決手段】
シクロスポリン、親水性非イオン界面活性剤、親油性非イオン界面活性剤、油分、室温で油分に溶解しない脂肪酸、室温で油分に溶解しない固形高級アルコール及び室温で油分と混和しない水溶性多価アルコールを含有する液晶乳化型の医薬組成物。
塗布時、塗布後の感触に優れ、シクロスポリンの経皮吸収性を高めることにより、低濃度で薬効が発揮される皮膚外用医薬組成物の提供。
【解決手段】
シクロスポリン、親水性非イオン界面活性剤、親油性非イオン界面活性剤、油分、室温で油分に溶解しない脂肪酸、室温で油分に溶解しない固形高級アルコール及び室温で油分と混和しない水溶性多価アルコールを含有する液晶乳化型の医薬組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はシクロスポリンの経皮吸収性に優れ、低濃度でありながらアレルギー性疾患や自己免疫疾患等の各種皮膚疾患に対して優れた治療効果を有する皮膚外用の医薬組成物に関する。
【背景技術】
【0002】
シクロスポリンは、腎臓、肝臓、心臓、肺、膵臓等の臓器移植における拒絶反応の抑制、骨髄移植における拒絶反応及び移植片対宿主病の抑制、ベーチェット病、重症の再生不良性貧血、ネフローゼ症候群に対して経口剤や注射剤として使用されているだけでなく、重症の乾癬に対しても経口剤が使用されている。
【0003】
また、アトピー性皮膚炎などのアレルギー性疾患や自己免疫疾患などの各種皮膚疾患についても有効であることが知られている。
【0004】
シクロスポリンは上述したように薬効に非常に優れているが、シクロスポリンの経口剤及び注射剤は腎機能障害等の全身性の副作用の発生頻度が非常に高かったり、他剤との薬物相互作用が多かったりして、使用を制限しなければならない場合があった。
【0005】
乾癬やアトピー性皮膚炎のようなアレルギー性疾患や自己免疫疾患等の各種皮膚疾患については、疾患部位である皮膚に直接シクロスポリン製剤を塗布することにより、治療効果を発揮することができる。このように局所治療を行うことにより、疾患部位における薬物濃度上昇による薬効の増強と全身性の副作用の発生頻度の低減が期待できる。
【0006】
このような背景から、乾癬やアトピー性皮膚炎などの疾患部位に直接シクロスポリン製剤を塗布して経皮吸収させる治療方法が試みられ、上述したような副作用の少ない有効な外用剤の開発が望まれている。しかし、シクロスポリンの分子量は1200余りと非常に大きいため、一般的な外用剤では経皮吸収させることが困難であり、疾患部位において薬効を発揮させることは困難であった。
【0007】
シクロスポリンを経皮吸収させようとする試みとして、シクロスポリンを高濃度で含有する外用剤がある。つまり、シクロスポリンを溶解させるための有機溶剤、25℃で液状を示す全炭素数が8以上の一価アルコールの脂肪酸エステル及び/又は25℃で液状を示すアルカノールアミン、25℃で固体状を示す油性物質及び界面活性剤からなる外用薬剤(特許文献1)、有機液体、固体状油性物質及び界面活性剤を含有する外用剤(特許文献2)、常温で液状のポリカルボン酸ポリアルキルエステル、I.O.B.が0〜0.25の常温で液状の油分及び界面活性剤を含有する水中油型乳化組成物(特許文献3)、プロピレングリコールをベースにオレイルアルコールを含有したゲル又は軟膏剤(特許文献4)、自発乳化エマルション(特許文献5)、コロイド状形態の医薬製剤(特許文献6)が提案されている。これらの外用剤はシクロスポリンを高濃度で含有するので、シクロスポリンに伴う副作用が懸念されるだけでなく、油分または水溶性多価アルコールの配合比率が高いため感触が悪い、界面活性剤の配合比率が高いため皮膚刺激性が懸念される製剤である。
【0008】
一方、ラウロリルサルコシンを吸収促進剤として用いることにより、シクロスポリンの含有量を低下させた軟膏剤が提案されている(特許文献7)。しかし、基剤として、軟膏基剤または油分を非常に高い配合比率で調製しているため、使用感の悪い製剤である。
【0009】
皮膚外用の医薬組成物は、塗布時、塗布後の感触が良いことも重要な要素の一つであるから、いずれの外用剤についても医薬品として満足できるものではない。
【特許文献1】特開平5−310591号公報
【特許文献2】特開平7−188046号公報
【特許文献3】特開平7−278007号公報
【特許文献4】特開平8−133979号公報
【特許文献5】特開平10−7584号公報
【特許文献6】特表2005−516931号公報
【特許文献7】特開平7−25784号公報
【発明の開示】
【発明が解決しようとする課題】
【0010】
シクロスポリンの経皮吸収性を高めることにより、低濃度で薬効が発揮される皮膚外用の医薬組成物を提供することである。また、塗布時、塗布後の感触に優れた皮膚外用の医薬組成物を提供することである。
【課題を解決するための手段】
【0011】
本発明者らは、シクロスポリンを含有する皮膚外用の医薬組成物に適した組成を鋭意研究した結果、液晶乳化型の医薬組成物とすることにより、シクロスポリンの含有量が少ないにもかかわらず、薬効が十分発揮される皮膚外用の医薬組成物の組成を得ることに成功した。
【0012】
また、液晶乳化型の医薬組成物とすることにより、シクロスポリンを含有していても塗布時、塗布後の感触に優れた皮膚外用の医薬組成物を得ることに成功した。
【0013】
すなわち、本発明はシクロスポリン、非イオン界面活性剤を含有する液晶乳化型の医薬組成物を提供する。
さらに、本発明の液晶乳化型の医薬組成物を構成する油相成分として、油分、油分に溶解しない脂肪酸及び油分に溶解しない固形高級アルコールを含有することが好ましい。
また、本発明の液晶乳化型の医薬組成物を構成する水相成分としては油分と混和しない水溶性多価アルコールを含有することが好ましい。
【0014】
本発明の液晶乳化型の医薬組成物は、油相成分の構成に特徴を有する。すなわち構成成分のうち、脂肪酸及び固形高級アルコールは、油分である液状の油成分に溶解しないことが求められる。従って、液状の油成分の極性は比較的低いものが望ましい。液状の油成分の極性が高くなると、脂肪酸及び高級アルコールが均一に溶解し、液晶構造を形成しにくくなる。
【0015】
脂肪酸及び固形高級アルコールが、油分である液状の油成分に溶解しない構成にすることにより、脂肪酸及び固形高級アルコールが、非イオン界面活性剤とともに界面付近に配向状態を作りやすくなる。この状態に、両イオン性の特定のアミノ酸を添加すると、さらに界面の安定化が図られ、液晶乳化型の医薬組成物がより製剤的に安定状態を維持した存在が可能になる。
【0016】
本発明において、液晶乳化型の医薬組成物とは顕微鏡(対物レンズ:40倍、接眼レンズ:10倍)で観察した結果、明確な乳化粒子を認めず、簡易偏向フィルターを装着した顕微鏡(対物レンズ:4〜40倍、接眼レンズ:10倍)で観察した結果、光学異方性による屈折光を認める組成物をいう。
【0017】
有効成分として含まれるシクロスポリンは公知の化合物であり、シクロスポリンA、シクロスポリンB、シクロスポリンC、シクロスポリンD、シクロスポリンHが知られており、本発明ではいずれも用いることができるが、シクロスポリンAが好ましい。これらのシクロスポリンは、Alexis、MP Biomedicals, Inc.、LKT Labs, Inc、Toronto Research Chemicals Inc,などから試薬として購入することができる。本発明の医薬組成物中に含有されるシクロスポリンの量は適用される皮膚疾患に治療上有効な量であれば特に限定されないが、含有量は本発明により得られる医薬組成物全量に対し、0.01〜1重量%、好ましくは0.05〜0.75重量%、より好ましくは0.05〜0.5重量%である。
【0018】
本発明に用いることができる界面活性剤は非イオン界面活性剤であり、親水性非イオン界面活性剤及び親油性非イオン界面活性剤を組み合わせて使用することが好ましい。
【0019】
親油性非イオン界面活性剤としては、HLB値が2.0〜7.0のものが好ましく、具体的にはモノステアリン酸グリセリン、モノステアリン酸ソルビタン、モノオレイン酸ジグリセリル、モノステアリン酸ジグリセリル、モノステアリン酸テトラグリセリル、ポリオキシエチレンベヘニルエーテルなどを挙げることができ、好ましくはモノステアリン酸グリセリン、モノステアリン酸ジグリセリル、モノステアリン酸テトラグリセリルであり、さらに好ましくはモノステアリン酸グリセリン、モノステアリン酸テトラグリセリルである。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.1〜5重量%、好ましくは0.5〜4重量%である。0.1重量%より少ない場合には液晶構造を維持することができず、5%重量を越えると皮膚刺激性が発生しやすくなる。
【0020】
親水性非イオン界面活性剤としては、HLB値が10.0〜18.0のものが好ましく、具体的にはポリオキシエチレン(20)ポリオキシプロピレン(4)セチルエーテル、ポリオキシエチレンセチルエーテル、ステアリン酸ポリオキシル25、ポリオキシエチレン硬化ヒマシ油60などを挙げることができ、好ましくはポリオキシエチレン(20)ポリオキシプロピレン(4)セチルエーテル、ポリオキシエチレン硬化ヒマシ油60である。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.1〜5重量%、好ましくは0.5〜4重量%である。0.1重量%より少ない場合には液晶構造を維持することができず、5%重量を越えると皮膚刺激性が発生しやすくなる。
【0021】
本発明に用いることができる油相成分としては、一般に外用製剤、化粧品に用いられるものであれば特に限定されないが、少なくとも油分、油分に溶解しない脂肪酸及び油分に溶解しない固形高級アルコールの組合せで用いることが好ましい。
【0022】
本発明に用いることができる油分としては、炭化水素、脂肪酸エステル、トリグリセリド、液状高級アルコールを挙げることができる。炭化水素としては、スクワラン、流動パラフィンなどを挙げることができ、脂肪酸エステルとしては、ミリスチン酸オクチルドデシル、ミリスチン酸イソプロピル、セバシン酸ジエチルなどを挙げることができ、トリグリセリドとしては、トリイソオクタン酸グリセリン、中鎖脂肪酸トリグリセリドなどを挙げることができる。液状高級アルコールは、室温で液状である高級アルコールをいい、具体的にはオクチルドデカノール、ヘキシルデカノールなどを挙げることができるが、好ましくは、スクワラン、トリイソオクタン酸グリセリン、オクチルドデカノールである。脂肪酸及び固形高級アルコールを溶解する油分を用いると、液晶構造を維持することが困難なため、脂肪酸及び固形高級アルコールを室温で溶解しない油分を選択する必要がある。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.5〜10重量%、好ましくは1〜9重量%である。
【0023】
本発明において、「油分に溶解しない」とは、室温において、脂肪酸または固形高級アルコールが所望の油分に溶解しない、または所望の配合量において脂肪酸または固形高級アルコールが所望の油分に対して飽和溶解度以上存在するため、油分と脂肪酸または固形高級アルコールが溶解しない状態にあることをいう。
また、本発明において室温とは、1〜30℃をいう。
【0024】
本発明に用いることができる油分に溶解しない脂肪酸としては、室温で固形の脂肪酸が好ましく、炭素数が16から22の飽和・直鎖型脂肪酸がより好ましい。具体的には、パルミチン酸、ステアリン酸、ベヘン酸などを挙げることができ、好ましくはベヘン酸である。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.1〜1重量%である。
【0025】
本発明に用いることができる油分に溶解しない固形高級アルコールとは、室温で固形状の高級アルコールをいい、具体的には炭素数が16から22の飽和・直鎖型の固形高級アルコールが好ましく、セタノール、セトステアリルアルコール、ステアリルアルコール、ベヘニルアルコールなどを挙げることができ、好ましくはセトステアリルアルコール、ベヘニルアルコールである。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.1〜10重量%、好ましくは0.5〜6重量%である。
【0026】
本発明に用いることができる水相成分としては、一般に外用製剤、化粧品に用いられるものであれば特に限定されないが、少なくとも油分と混和しない水溶性多価アルコールを用いることが好ましい。
【0027】
本発明に用いることができる油分と混和しない水溶性多価アルコールとしては、1,3-ブチレングリコール、グリセリン、プロピレングリコール、ジプロピレングリコールなどを挙げることができ、好ましくは、1,3-ブチレングリコール、グリセリンである。これらは単独又は2種以上の組み合わせで用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、1〜50重量%、好ましくは5〜50重量%である。
【0028】
本発明において、「油分と混和しない」とは、室温において、水溶性多価アルコールが所望の油分に混和しない状態にあることをいう。
【0029】
液晶構造の安定化のために、乳化安定剤を配合することもできる。乳化安定剤としては、L-アルギニン、グリシン、N-アシル-L-グルタミン酸ナトリウムなどを挙げることができ、L-アルギニンが好ましい。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.01〜5重量%、好ましくは0.05〜0.5重量%である。
【0030】
本発明の医薬組成物は構造粘性を有するため増粘剤等は配合しなくてもよいが、必要に応じてカルボキシビニルポリマー等の水溶性高分子やベントナイト等の粘度鉱物等の増粘剤を配合することにより目的とする粘度に調製することができる。
【0031】
さらに必要に応じて、クエン酸、クエン酸ナトリウムなどのpH調節剤、色素、香料、顔料、保存剤、抗酸化剤、安定化剤、紫外線吸収剤等は本目的を構成する範囲内で適宜配合することができる。
【0032】
本発明の医薬組成物ではシクロスポリンが溶解剤に溶解した状態で存在する。シクロスポリンの溶解剤としては、所要量のシクロスポリンを溶解させることができる溶解剤であれば油相成分、水相成分を問わず用いることができるが、α=10〜75(αは有機性・無機性のバランスを表すtan αを意味する)である溶解剤が好ましく、ヘキシルデカノール、オクチルドデカノール、1,3-ブチレングリコールがより好ましい。
【0033】
好ましい態様としては、本発明の液晶乳化型医薬組成物は、組成物全体の重量を基準として、0.01〜1重量%のシクロスポリン、0.1〜5重量%の親水性非イオン界面活性剤、0.1〜5重量%の親油性非イオン界面活性剤、0.5〜10重量%の油分、0.1〜1重量%の油分に溶解しない脂肪酸、0.1〜6重量%の油分に溶解しない固形高級アルコール、および1〜50重量%の油分と混和しない水溶性多価アルコールを含んでなる。
【0034】
さらに好ましい態様としては、本発明の液晶乳化型医薬組成物は、組成物全体の重量を基準として、0.05〜1重量%のシクロスポリン、0.5〜5重量%のモノステアリン酸グリセリン、0.5〜5重量%のポリオキシエチレン硬化ヒマシ油60、1〜10重量%のスクワラン、0.1〜1重量%のベヘン酸、0.5〜6重量%のセトステアリルアルコール、および1〜50重量%のグリセリンおよび/または1,3-ブチレングリコールを含んでなる。
【0035】
本発明の液晶乳化型の医薬組成物の製造方法は特に制限されるものではないが、油分、油分に溶解しない脂肪酸、油分に溶解しない固形高級アルコール、親油性非イオン界面活性剤、親水性非イオン性界面活性剤等を含有する油相並びに油分と混和しない水溶性多価アルコール、アミノ酸、pH調節剤、水等を含有する水相を調製して、油相中に水相を加える方法により乳化する行程で目的とする液晶乳化型の医薬組成物を調製することができる。なお、シクロスポリンはあらかじめ油分または油分と混和しない水溶性多価アルコールに溶解させたものを用いる。また、乳化を行う際の水相は全量を一度に用いてもよいし、一部を用いて乳化して濃縮乳化物(コンクベース)を形成させた後に、残りの水相を数段階に分けてコンクベースと混和させて希釈してもよい。水相を数段階に分けるときは、水相成分を全て溶解させた後に一定量を小分けして乳化をさせてもよいし、例えばアミノ酸はコンクベース作成時の水相のみ添加する等コンクベース作成段階と希釈段階で異なる組成の水相成分としてもよい。
【0036】
本発明の油相を調製する際の諸条件は適宜選定されるが、油分、油分に溶解しない脂肪酸、油分に溶解しない固形高級アルコール、親油性非イオン界面活性剤及び親水性非イオン界面活性剤を均一に混合溶解させるには各成分を60〜90℃、好ましくは65〜85℃で混合溶解させることが望ましい。温度が低すぎると油相を均一に混合溶解することが困難となる場合があり、温度が高すぎると各成分が変質する恐れがある。
【0037】
また、本発明の水相を調製する際の諸条件は適宜選定されるが、油分と混和しない水溶性多価アルコール、アミノ酸、pH調節剤、保存剤、安定化剤等から適宜選択される水相成分を水に均一に混合溶解させるにはこれらを室温〜90℃、好ましくは室温〜80℃で混合溶解させることが望ましい。
【0038】
次に、濃縮乳化物(コンクベース)の調製は油相を撹拌処理しながら水相を油相に徐々に添加するものである。コンクベースを調製する際の温度は油相及び水相の種類等によって適宜選定されるが、通常、撹拌開始時は50℃〜90℃、撹拌終了時は室温である。温度が低すぎると乳化が困難となる場合がある。
【0039】
本発明の第二次工程の水相を調製する際の諸条件は適宜選定されるが、保存剤、pH調節剤及び安定化剤を水に溶解させる。これらの成分を均一に混合溶解させるには室温〜90℃、好ましくは室温〜80℃で混合溶解させることが望ましい。この水相及びコンクベースを室温で均一に混合し、さらに撹拌及び脱気を実施し、目的の液晶乳化型の医薬組成物を得ることができる。水相の添加に際しては、加温の必要はなく、室温で実施できる。
【0040】
本発明の医薬組成物は、通常の医薬外用剤を製造する際に使用する乳化機を用いて製造することができるが、必要に応じてマントンガウリン乳化機、マイクロフルイダイザーなどの強力な撹拌機を用いて製造してもよい。
【0041】
本発明の医薬組成物の投与に当たっては、医薬組成物を直接的に一日数回例えば1〜3回患部に塗布するか、あるはパッチ、プラスター、パップ等の形態に加工し、これを同様に1日数回患部に適用することができる。適用回数は該当する疾患の重篤度により適宜増減することができる。本発明の医薬組成物は、アトピー性皮膚炎や乾癬などのシクロスポリンが治療に有効である皮膚疾患に使用することが可能である。
【発明の効果】
【0042】
本発明により、シクロスポリンの含有量が少ないにもかかわらず、薬効が十分発揮できる外皮用の医薬組成物が提供される。また、塗布時、塗布後の感触に優れた皮膚外用の医薬組成物を提供される。
【発明を実施するための最良の形態】
【0043】
以下に実施例及び試験例を挙げて本発明をさらに詳しく説明するが、本発明はこれらにより限定されるものではない。
【実施例】
【0044】
[実施例1] 液晶乳化型組成物の調製
下記の表1に示した組成比率のスクワラン、ベヘン酸、セトステアリルアルコール、モ
ノステアリン酸グリセリン、ポリオキシエチレン(20)ポリオキシプロピレン(4)セチルエーテ
ルを85℃で溶解させた(油相)。また、シクロスポリンAを1,3-ブチレングリコールに60℃で溶解させた(主薬相)。さらに、pH調節剤、L-アルギニンを水に85℃で溶解させた(水相)。油相に主薬相を加え、さらに水相を加えて撹拌した(コンクベース)。
【0045】
また別に、1,3-ブチレングリコール、pH調節剤及び水を室温で加え溶解させた(後添水相)。コンクベースに後添水相を室温で加え、撹拌及び脱気を実施して、目的とする製剤を得た。
【0046】
[実施例2〜実施例10および比較例1]
実施例1と同様に操作して表1に示した組成比率で製剤を調製した。
【0047】
【表1】

【0048】
[比較例2]
プロトピック(登録商標)軟膏0.1%;タクロリムス水和物1.02mg含有軟膏剤(アステラス製薬社製)
【0049】
[試験例1] 乳化状態及び乳化粒子径
実施例1〜実施例10の製剤少量をスライドグラス上にとり、カバーグラスを被せた後,顕微鏡観察(対物レンズ:40倍,接眼レンズ:10倍)を実施した。また、必要に応じて、簡易偏光フィルターを用いて光学異方性の有無についても観察した(対物レンズ:4〜40倍,接眼レンズ:10倍)。
【0050】
<評価基準>
A:明確な乳化粒子を認めず,光学異方性による屈折光を認める.
B:1μm以下の乳化粒子のみ
C:1〜5μmの乳化粒子のみ
D:1〜5μmの乳化粒子が主で数〜数十μmの粒子も含む
E:その他
【0051】
【表2】

【0052】
実施例の各組成物はいずれも明確な粒子を認めず、光学異方性による屈折光を認め、液晶乳化型組成物であることを確認した。
【0053】
[試験例2] 製剤の安定性試験
実施例6の製剤を表3に示した条件下で3週間保存し、結晶の析出の有無を顕微鏡(対物レンズ:40倍,接眼レンズ:10倍)で、製剤の分離の有無を目視で確認した。
結果を表3に示したが、いずれの条件で保存しても、結晶が析出することなく、安定な製剤であることを確認した。
【0054】
【表3】

【0055】
[試験例3] 主薬安定性試験
実施例6の製剤を表4に示した条件下で3週間保管したときのシクロスポリンAの含量を測定した。シクロスポリンAの含量の測定方法は、製剤約0.6gにテトラデカノフェノン溶液及びアセトニトリルを加えて撹拌した後、遠心分離して得られた上澄みの一部を試料溶液とした。これを逆相高速液体クロマトグラフ法(検出波長;210nm、移動相;水:アセトニトリル混液=2:3)により各試料中に含まれるシクロスポリンAの含量を測定し、初期値に対するシクロスポリンAの残存率(%)を求めた。
結果を表4に示したが、いずれの条件で保存しても、シクロスポリンAが安定な製剤であることを確認した。
【0056】
【表4】

【0057】
[試験例4] 薬理試験
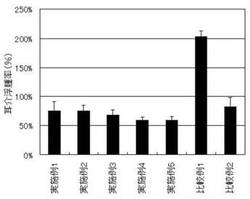
実施例1〜実施例5、比較例1および比較例2の製剤について、薬理試験を実施した。 腹部を剃毛したマウスの腹部に3%塩化ピクリル・エタノール溶液0.1mLを塗布した(感作)。その6日後に1%塩化ピクリル・アセトン溶液0.02mLを右耳に塗布して誘発を行った。誘発1時間後に各製剤(10mg)を右耳の耳介に塗布して、誘発24時間後に左右の耳介をパンチで打ち抜き、打ち抜いた耳介の重量を測定し、下記計算式を用いて浮腫率を算出した。
【0058】
【数1】

【0059】
結果を図1に示したが、実施例の各組成物はプラセボである比較例1の組成物と比較して耳介浮腫率は著しく強く、市販製剤である比較例2と比較しても同等かやや強い結果であったので、実施例の各組成物は優れた薬理作用を有することがわかる。
【0060】
[試験例5] 皮膚累積刺激試験
実施例6の組成物について、雄ウサギを用いた皮膚累積刺激性試験を実施した。
ウサギの健常皮膚(2.5cm×2.5cm)に製剤(100mg)を塗布し、塗布後6時間経過した後に製剤は脱脂綿を用いて微温湯でふき取った。塗布後約23時間後に皮膚反応の観察を行った。この操作を7日間連続して行い、各日の評点を表5に示した。
皮膚反応の評価は、Draize, J.H. (Appraisal of the safety of chemicals in foods, drugs and cosmetics, The Association of Food and Drug Officials of the United States, Topeka, Kansas, 46-59, 1965)の判定基準に従った。
結果を表5に示したが弱い刺激物と判定され、外用剤として使用するのに支障はない。
【0061】
【表5】

【図面の簡単な説明】
【0062】
【図1】薬理試験の結果を示す図である。
【技術分野】
【0001】
本発明はシクロスポリンの経皮吸収性に優れ、低濃度でありながらアレルギー性疾患や自己免疫疾患等の各種皮膚疾患に対して優れた治療効果を有する皮膚外用の医薬組成物に関する。
【背景技術】
【0002】
シクロスポリンは、腎臓、肝臓、心臓、肺、膵臓等の臓器移植における拒絶反応の抑制、骨髄移植における拒絶反応及び移植片対宿主病の抑制、ベーチェット病、重症の再生不良性貧血、ネフローゼ症候群に対して経口剤や注射剤として使用されているだけでなく、重症の乾癬に対しても経口剤が使用されている。
【0003】
また、アトピー性皮膚炎などのアレルギー性疾患や自己免疫疾患などの各種皮膚疾患についても有効であることが知られている。
【0004】
シクロスポリンは上述したように薬効に非常に優れているが、シクロスポリンの経口剤及び注射剤は腎機能障害等の全身性の副作用の発生頻度が非常に高かったり、他剤との薬物相互作用が多かったりして、使用を制限しなければならない場合があった。
【0005】
乾癬やアトピー性皮膚炎のようなアレルギー性疾患や自己免疫疾患等の各種皮膚疾患については、疾患部位である皮膚に直接シクロスポリン製剤を塗布することにより、治療効果を発揮することができる。このように局所治療を行うことにより、疾患部位における薬物濃度上昇による薬効の増強と全身性の副作用の発生頻度の低減が期待できる。
【0006】
このような背景から、乾癬やアトピー性皮膚炎などの疾患部位に直接シクロスポリン製剤を塗布して経皮吸収させる治療方法が試みられ、上述したような副作用の少ない有効な外用剤の開発が望まれている。しかし、シクロスポリンの分子量は1200余りと非常に大きいため、一般的な外用剤では経皮吸収させることが困難であり、疾患部位において薬効を発揮させることは困難であった。
【0007】
シクロスポリンを経皮吸収させようとする試みとして、シクロスポリンを高濃度で含有する外用剤がある。つまり、シクロスポリンを溶解させるための有機溶剤、25℃で液状を示す全炭素数が8以上の一価アルコールの脂肪酸エステル及び/又は25℃で液状を示すアルカノールアミン、25℃で固体状を示す油性物質及び界面活性剤からなる外用薬剤(特許文献1)、有機液体、固体状油性物質及び界面活性剤を含有する外用剤(特許文献2)、常温で液状のポリカルボン酸ポリアルキルエステル、I.O.B.が0〜0.25の常温で液状の油分及び界面活性剤を含有する水中油型乳化組成物(特許文献3)、プロピレングリコールをベースにオレイルアルコールを含有したゲル又は軟膏剤(特許文献4)、自発乳化エマルション(特許文献5)、コロイド状形態の医薬製剤(特許文献6)が提案されている。これらの外用剤はシクロスポリンを高濃度で含有するので、シクロスポリンに伴う副作用が懸念されるだけでなく、油分または水溶性多価アルコールの配合比率が高いため感触が悪い、界面活性剤の配合比率が高いため皮膚刺激性が懸念される製剤である。
【0008】
一方、ラウロリルサルコシンを吸収促進剤として用いることにより、シクロスポリンの含有量を低下させた軟膏剤が提案されている(特許文献7)。しかし、基剤として、軟膏基剤または油分を非常に高い配合比率で調製しているため、使用感の悪い製剤である。
【0009】
皮膚外用の医薬組成物は、塗布時、塗布後の感触が良いことも重要な要素の一つであるから、いずれの外用剤についても医薬品として満足できるものではない。
【特許文献1】特開平5−310591号公報
【特許文献2】特開平7−188046号公報
【特許文献3】特開平7−278007号公報
【特許文献4】特開平8−133979号公報
【特許文献5】特開平10−7584号公報
【特許文献6】特表2005−516931号公報
【特許文献7】特開平7−25784号公報
【発明の開示】
【発明が解決しようとする課題】
【0010】
シクロスポリンの経皮吸収性を高めることにより、低濃度で薬効が発揮される皮膚外用の医薬組成物を提供することである。また、塗布時、塗布後の感触に優れた皮膚外用の医薬組成物を提供することである。
【課題を解決するための手段】
【0011】
本発明者らは、シクロスポリンを含有する皮膚外用の医薬組成物に適した組成を鋭意研究した結果、液晶乳化型の医薬組成物とすることにより、シクロスポリンの含有量が少ないにもかかわらず、薬効が十分発揮される皮膚外用の医薬組成物の組成を得ることに成功した。
【0012】
また、液晶乳化型の医薬組成物とすることにより、シクロスポリンを含有していても塗布時、塗布後の感触に優れた皮膚外用の医薬組成物を得ることに成功した。
【0013】
すなわち、本発明はシクロスポリン、非イオン界面活性剤を含有する液晶乳化型の医薬組成物を提供する。
さらに、本発明の液晶乳化型の医薬組成物を構成する油相成分として、油分、油分に溶解しない脂肪酸及び油分に溶解しない固形高級アルコールを含有することが好ましい。
また、本発明の液晶乳化型の医薬組成物を構成する水相成分としては油分と混和しない水溶性多価アルコールを含有することが好ましい。
【0014】
本発明の液晶乳化型の医薬組成物は、油相成分の構成に特徴を有する。すなわち構成成分のうち、脂肪酸及び固形高級アルコールは、油分である液状の油成分に溶解しないことが求められる。従って、液状の油成分の極性は比較的低いものが望ましい。液状の油成分の極性が高くなると、脂肪酸及び高級アルコールが均一に溶解し、液晶構造を形成しにくくなる。
【0015】
脂肪酸及び固形高級アルコールが、油分である液状の油成分に溶解しない構成にすることにより、脂肪酸及び固形高級アルコールが、非イオン界面活性剤とともに界面付近に配向状態を作りやすくなる。この状態に、両イオン性の特定のアミノ酸を添加すると、さらに界面の安定化が図られ、液晶乳化型の医薬組成物がより製剤的に安定状態を維持した存在が可能になる。
【0016】
本発明において、液晶乳化型の医薬組成物とは顕微鏡(対物レンズ:40倍、接眼レンズ:10倍)で観察した結果、明確な乳化粒子を認めず、簡易偏向フィルターを装着した顕微鏡(対物レンズ:4〜40倍、接眼レンズ:10倍)で観察した結果、光学異方性による屈折光を認める組成物をいう。
【0017】
有効成分として含まれるシクロスポリンは公知の化合物であり、シクロスポリンA、シクロスポリンB、シクロスポリンC、シクロスポリンD、シクロスポリンHが知られており、本発明ではいずれも用いることができるが、シクロスポリンAが好ましい。これらのシクロスポリンは、Alexis、MP Biomedicals, Inc.、LKT Labs, Inc、Toronto Research Chemicals Inc,などから試薬として購入することができる。本発明の医薬組成物中に含有されるシクロスポリンの量は適用される皮膚疾患に治療上有効な量であれば特に限定されないが、含有量は本発明により得られる医薬組成物全量に対し、0.01〜1重量%、好ましくは0.05〜0.75重量%、より好ましくは0.05〜0.5重量%である。
【0018】
本発明に用いることができる界面活性剤は非イオン界面活性剤であり、親水性非イオン界面活性剤及び親油性非イオン界面活性剤を組み合わせて使用することが好ましい。
【0019】
親油性非イオン界面活性剤としては、HLB値が2.0〜7.0のものが好ましく、具体的にはモノステアリン酸グリセリン、モノステアリン酸ソルビタン、モノオレイン酸ジグリセリル、モノステアリン酸ジグリセリル、モノステアリン酸テトラグリセリル、ポリオキシエチレンベヘニルエーテルなどを挙げることができ、好ましくはモノステアリン酸グリセリン、モノステアリン酸ジグリセリル、モノステアリン酸テトラグリセリルであり、さらに好ましくはモノステアリン酸グリセリン、モノステアリン酸テトラグリセリルである。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.1〜5重量%、好ましくは0.5〜4重量%である。0.1重量%より少ない場合には液晶構造を維持することができず、5%重量を越えると皮膚刺激性が発生しやすくなる。
【0020】
親水性非イオン界面活性剤としては、HLB値が10.0〜18.0のものが好ましく、具体的にはポリオキシエチレン(20)ポリオキシプロピレン(4)セチルエーテル、ポリオキシエチレンセチルエーテル、ステアリン酸ポリオキシル25、ポリオキシエチレン硬化ヒマシ油60などを挙げることができ、好ましくはポリオキシエチレン(20)ポリオキシプロピレン(4)セチルエーテル、ポリオキシエチレン硬化ヒマシ油60である。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.1〜5重量%、好ましくは0.5〜4重量%である。0.1重量%より少ない場合には液晶構造を維持することができず、5%重量を越えると皮膚刺激性が発生しやすくなる。
【0021】
本発明に用いることができる油相成分としては、一般に外用製剤、化粧品に用いられるものであれば特に限定されないが、少なくとも油分、油分に溶解しない脂肪酸及び油分に溶解しない固形高級アルコールの組合せで用いることが好ましい。
【0022】
本発明に用いることができる油分としては、炭化水素、脂肪酸エステル、トリグリセリド、液状高級アルコールを挙げることができる。炭化水素としては、スクワラン、流動パラフィンなどを挙げることができ、脂肪酸エステルとしては、ミリスチン酸オクチルドデシル、ミリスチン酸イソプロピル、セバシン酸ジエチルなどを挙げることができ、トリグリセリドとしては、トリイソオクタン酸グリセリン、中鎖脂肪酸トリグリセリドなどを挙げることができる。液状高級アルコールは、室温で液状である高級アルコールをいい、具体的にはオクチルドデカノール、ヘキシルデカノールなどを挙げることができるが、好ましくは、スクワラン、トリイソオクタン酸グリセリン、オクチルドデカノールである。脂肪酸及び固形高級アルコールを溶解する油分を用いると、液晶構造を維持することが困難なため、脂肪酸及び固形高級アルコールを室温で溶解しない油分を選択する必要がある。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.5〜10重量%、好ましくは1〜9重量%である。
【0023】
本発明において、「油分に溶解しない」とは、室温において、脂肪酸または固形高級アルコールが所望の油分に溶解しない、または所望の配合量において脂肪酸または固形高級アルコールが所望の油分に対して飽和溶解度以上存在するため、油分と脂肪酸または固形高級アルコールが溶解しない状態にあることをいう。
また、本発明において室温とは、1〜30℃をいう。
【0024】
本発明に用いることができる油分に溶解しない脂肪酸としては、室温で固形の脂肪酸が好ましく、炭素数が16から22の飽和・直鎖型脂肪酸がより好ましい。具体的には、パルミチン酸、ステアリン酸、ベヘン酸などを挙げることができ、好ましくはベヘン酸である。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.1〜1重量%である。
【0025】
本発明に用いることができる油分に溶解しない固形高級アルコールとは、室温で固形状の高級アルコールをいい、具体的には炭素数が16から22の飽和・直鎖型の固形高級アルコールが好ましく、セタノール、セトステアリルアルコール、ステアリルアルコール、ベヘニルアルコールなどを挙げることができ、好ましくはセトステアリルアルコール、ベヘニルアルコールである。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.1〜10重量%、好ましくは0.5〜6重量%である。
【0026】
本発明に用いることができる水相成分としては、一般に外用製剤、化粧品に用いられるものであれば特に限定されないが、少なくとも油分と混和しない水溶性多価アルコールを用いることが好ましい。
【0027】
本発明に用いることができる油分と混和しない水溶性多価アルコールとしては、1,3-ブチレングリコール、グリセリン、プロピレングリコール、ジプロピレングリコールなどを挙げることができ、好ましくは、1,3-ブチレングリコール、グリセリンである。これらは単独又は2種以上の組み合わせで用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、1〜50重量%、好ましくは5〜50重量%である。
【0028】
本発明において、「油分と混和しない」とは、室温において、水溶性多価アルコールが所望の油分に混和しない状態にあることをいう。
【0029】
液晶構造の安定化のために、乳化安定剤を配合することもできる。乳化安定剤としては、L-アルギニン、グリシン、N-アシル-L-グルタミン酸ナトリウムなどを挙げることができ、L-アルギニンが好ましい。これらは単独又は2種以上を組み合わせて用いることができ、その配合量は本発明により得られる医薬組成物全量に対し、0.01〜5重量%、好ましくは0.05〜0.5重量%である。
【0030】
本発明の医薬組成物は構造粘性を有するため増粘剤等は配合しなくてもよいが、必要に応じてカルボキシビニルポリマー等の水溶性高分子やベントナイト等の粘度鉱物等の増粘剤を配合することにより目的とする粘度に調製することができる。
【0031】
さらに必要に応じて、クエン酸、クエン酸ナトリウムなどのpH調節剤、色素、香料、顔料、保存剤、抗酸化剤、安定化剤、紫外線吸収剤等は本目的を構成する範囲内で適宜配合することができる。
【0032】
本発明の医薬組成物ではシクロスポリンが溶解剤に溶解した状態で存在する。シクロスポリンの溶解剤としては、所要量のシクロスポリンを溶解させることができる溶解剤であれば油相成分、水相成分を問わず用いることができるが、α=10〜75(αは有機性・無機性のバランスを表すtan αを意味する)である溶解剤が好ましく、ヘキシルデカノール、オクチルドデカノール、1,3-ブチレングリコールがより好ましい。
【0033】
好ましい態様としては、本発明の液晶乳化型医薬組成物は、組成物全体の重量を基準として、0.01〜1重量%のシクロスポリン、0.1〜5重量%の親水性非イオン界面活性剤、0.1〜5重量%の親油性非イオン界面活性剤、0.5〜10重量%の油分、0.1〜1重量%の油分に溶解しない脂肪酸、0.1〜6重量%の油分に溶解しない固形高級アルコール、および1〜50重量%の油分と混和しない水溶性多価アルコールを含んでなる。
【0034】
さらに好ましい態様としては、本発明の液晶乳化型医薬組成物は、組成物全体の重量を基準として、0.05〜1重量%のシクロスポリン、0.5〜5重量%のモノステアリン酸グリセリン、0.5〜5重量%のポリオキシエチレン硬化ヒマシ油60、1〜10重量%のスクワラン、0.1〜1重量%のベヘン酸、0.5〜6重量%のセトステアリルアルコール、および1〜50重量%のグリセリンおよび/または1,3-ブチレングリコールを含んでなる。
【0035】
本発明の液晶乳化型の医薬組成物の製造方法は特に制限されるものではないが、油分、油分に溶解しない脂肪酸、油分に溶解しない固形高級アルコール、親油性非イオン界面活性剤、親水性非イオン性界面活性剤等を含有する油相並びに油分と混和しない水溶性多価アルコール、アミノ酸、pH調節剤、水等を含有する水相を調製して、油相中に水相を加える方法により乳化する行程で目的とする液晶乳化型の医薬組成物を調製することができる。なお、シクロスポリンはあらかじめ油分または油分と混和しない水溶性多価アルコールに溶解させたものを用いる。また、乳化を行う際の水相は全量を一度に用いてもよいし、一部を用いて乳化して濃縮乳化物(コンクベース)を形成させた後に、残りの水相を数段階に分けてコンクベースと混和させて希釈してもよい。水相を数段階に分けるときは、水相成分を全て溶解させた後に一定量を小分けして乳化をさせてもよいし、例えばアミノ酸はコンクベース作成時の水相のみ添加する等コンクベース作成段階と希釈段階で異なる組成の水相成分としてもよい。
【0036】
本発明の油相を調製する際の諸条件は適宜選定されるが、油分、油分に溶解しない脂肪酸、油分に溶解しない固形高級アルコール、親油性非イオン界面活性剤及び親水性非イオン界面活性剤を均一に混合溶解させるには各成分を60〜90℃、好ましくは65〜85℃で混合溶解させることが望ましい。温度が低すぎると油相を均一に混合溶解することが困難となる場合があり、温度が高すぎると各成分が変質する恐れがある。
【0037】
また、本発明の水相を調製する際の諸条件は適宜選定されるが、油分と混和しない水溶性多価アルコール、アミノ酸、pH調節剤、保存剤、安定化剤等から適宜選択される水相成分を水に均一に混合溶解させるにはこれらを室温〜90℃、好ましくは室温〜80℃で混合溶解させることが望ましい。
【0038】
次に、濃縮乳化物(コンクベース)の調製は油相を撹拌処理しながら水相を油相に徐々に添加するものである。コンクベースを調製する際の温度は油相及び水相の種類等によって適宜選定されるが、通常、撹拌開始時は50℃〜90℃、撹拌終了時は室温である。温度が低すぎると乳化が困難となる場合がある。
【0039】
本発明の第二次工程の水相を調製する際の諸条件は適宜選定されるが、保存剤、pH調節剤及び安定化剤を水に溶解させる。これらの成分を均一に混合溶解させるには室温〜90℃、好ましくは室温〜80℃で混合溶解させることが望ましい。この水相及びコンクベースを室温で均一に混合し、さらに撹拌及び脱気を実施し、目的の液晶乳化型の医薬組成物を得ることができる。水相の添加に際しては、加温の必要はなく、室温で実施できる。
【0040】
本発明の医薬組成物は、通常の医薬外用剤を製造する際に使用する乳化機を用いて製造することができるが、必要に応じてマントンガウリン乳化機、マイクロフルイダイザーなどの強力な撹拌機を用いて製造してもよい。
【0041】
本発明の医薬組成物の投与に当たっては、医薬組成物を直接的に一日数回例えば1〜3回患部に塗布するか、あるはパッチ、プラスター、パップ等の形態に加工し、これを同様に1日数回患部に適用することができる。適用回数は該当する疾患の重篤度により適宜増減することができる。本発明の医薬組成物は、アトピー性皮膚炎や乾癬などのシクロスポリンが治療に有効である皮膚疾患に使用することが可能である。
【発明の効果】
【0042】
本発明により、シクロスポリンの含有量が少ないにもかかわらず、薬効が十分発揮できる外皮用の医薬組成物が提供される。また、塗布時、塗布後の感触に優れた皮膚外用の医薬組成物を提供される。
【発明を実施するための最良の形態】
【0043】
以下に実施例及び試験例を挙げて本発明をさらに詳しく説明するが、本発明はこれらにより限定されるものではない。
【実施例】
【0044】
[実施例1] 液晶乳化型組成物の調製
下記の表1に示した組成比率のスクワラン、ベヘン酸、セトステアリルアルコール、モ
ノステアリン酸グリセリン、ポリオキシエチレン(20)ポリオキシプロピレン(4)セチルエーテ
ルを85℃で溶解させた(油相)。また、シクロスポリンAを1,3-ブチレングリコールに60℃で溶解させた(主薬相)。さらに、pH調節剤、L-アルギニンを水に85℃で溶解させた(水相)。油相に主薬相を加え、さらに水相を加えて撹拌した(コンクベース)。
【0045】
また別に、1,3-ブチレングリコール、pH調節剤及び水を室温で加え溶解させた(後添水相)。コンクベースに後添水相を室温で加え、撹拌及び脱気を実施して、目的とする製剤を得た。
【0046】
[実施例2〜実施例10および比較例1]
実施例1と同様に操作して表1に示した組成比率で製剤を調製した。
【0047】
【表1】

【0048】
[比較例2]
プロトピック(登録商標)軟膏0.1%;タクロリムス水和物1.02mg含有軟膏剤(アステラス製薬社製)
【0049】
[試験例1] 乳化状態及び乳化粒子径
実施例1〜実施例10の製剤少量をスライドグラス上にとり、カバーグラスを被せた後,顕微鏡観察(対物レンズ:40倍,接眼レンズ:10倍)を実施した。また、必要に応じて、簡易偏光フィルターを用いて光学異方性の有無についても観察した(対物レンズ:4〜40倍,接眼レンズ:10倍)。
【0050】
<評価基準>
A:明確な乳化粒子を認めず,光学異方性による屈折光を認める.
B:1μm以下の乳化粒子のみ
C:1〜5μmの乳化粒子のみ
D:1〜5μmの乳化粒子が主で数〜数十μmの粒子も含む
E:その他
【0051】
【表2】

【0052】
実施例の各組成物はいずれも明確な粒子を認めず、光学異方性による屈折光を認め、液晶乳化型組成物であることを確認した。
【0053】
[試験例2] 製剤の安定性試験
実施例6の製剤を表3に示した条件下で3週間保存し、結晶の析出の有無を顕微鏡(対物レンズ:40倍,接眼レンズ:10倍)で、製剤の分離の有無を目視で確認した。
結果を表3に示したが、いずれの条件で保存しても、結晶が析出することなく、安定な製剤であることを確認した。
【0054】
【表3】

【0055】
[試験例3] 主薬安定性試験
実施例6の製剤を表4に示した条件下で3週間保管したときのシクロスポリンAの含量を測定した。シクロスポリンAの含量の測定方法は、製剤約0.6gにテトラデカノフェノン溶液及びアセトニトリルを加えて撹拌した後、遠心分離して得られた上澄みの一部を試料溶液とした。これを逆相高速液体クロマトグラフ法(検出波長;210nm、移動相;水:アセトニトリル混液=2:3)により各試料中に含まれるシクロスポリンAの含量を測定し、初期値に対するシクロスポリンAの残存率(%)を求めた。
結果を表4に示したが、いずれの条件で保存しても、シクロスポリンAが安定な製剤であることを確認した。
【0056】
【表4】

【0057】
[試験例4] 薬理試験
実施例1〜実施例5、比較例1および比較例2の製剤について、薬理試験を実施した。 腹部を剃毛したマウスの腹部に3%塩化ピクリル・エタノール溶液0.1mLを塗布した(感作)。その6日後に1%塩化ピクリル・アセトン溶液0.02mLを右耳に塗布して誘発を行った。誘発1時間後に各製剤(10mg)を右耳の耳介に塗布して、誘発24時間後に左右の耳介をパンチで打ち抜き、打ち抜いた耳介の重量を測定し、下記計算式を用いて浮腫率を算出した。
【0058】
【数1】

【0059】
結果を図1に示したが、実施例の各組成物はプラセボである比較例1の組成物と比較して耳介浮腫率は著しく強く、市販製剤である比較例2と比較しても同等かやや強い結果であったので、実施例の各組成物は優れた薬理作用を有することがわかる。
【0060】
[試験例5] 皮膚累積刺激試験
実施例6の組成物について、雄ウサギを用いた皮膚累積刺激性試験を実施した。
ウサギの健常皮膚(2.5cm×2.5cm)に製剤(100mg)を塗布し、塗布後6時間経過した後に製剤は脱脂綿を用いて微温湯でふき取った。塗布後約23時間後に皮膚反応の観察を行った。この操作を7日間連続して行い、各日の評点を表5に示した。
皮膚反応の評価は、Draize, J.H. (Appraisal of the safety of chemicals in foods, drugs and cosmetics, The Association of Food and Drug Officials of the United States, Topeka, Kansas, 46-59, 1965)の判定基準に従った。
結果を表5に示したが弱い刺激物と判定され、外用剤として使用するのに支障はない。
【0061】
【表5】

【図面の簡単な説明】
【0062】
【図1】薬理試験の結果を示す図である。
【特許請求の範囲】
【請求項1】
シクロスポリン、非イオン界面活性剤を含有する液晶乳化型の医薬組成物。
【請求項2】
シクロスポリンの含有量が0.01から1重量%である請求項1に記載の医薬組成物。
【請求項3】
非イオン界面活性剤として、親水性非イオン界面活性剤及び親油性非イオン界面活性剤を含有する請求項1または2のいずれかに記載の医薬組成物。
【請求項4】
液晶乳化型の医薬組成物を構成する油相成分として、油分、油分に溶解しない脂肪酸及び油分に溶解しない固形高級アルコールを含有する請求項1ないし3のいずれか1項に記載の医薬組成物。
【請求項5】
液晶乳化型の医薬組成物を構成する水相成分として、油分と混和しない水溶性多価アルコールを含有する請求項1ないし4のいずれか1項に記載の医薬組成物。
【請求項6】
油分に溶解しない脂肪酸が炭素数16から22で飽和・直鎖型脂肪酸である請求項4に記載の液晶乳化型組成物。
【請求項7】
油分に溶解しない固形高級アルコールが炭素数16から22で飽和・直鎖型アルコールである請求項4に記載の液晶乳化型組成物。
【請求項8】
油分と混和しない水溶性多価アルコールがグリセリン、プロピレングリコール、ジプロピレングリコールおよび1,3-ブチレングリコールから選ばれる請求項5に記載の医薬組成物。
【請求項1】
シクロスポリン、非イオン界面活性剤を含有する液晶乳化型の医薬組成物。
【請求項2】
シクロスポリンの含有量が0.01から1重量%である請求項1に記載の医薬組成物。
【請求項3】
非イオン界面活性剤として、親水性非イオン界面活性剤及び親油性非イオン界面活性剤を含有する請求項1または2のいずれかに記載の医薬組成物。
【請求項4】
液晶乳化型の医薬組成物を構成する油相成分として、油分、油分に溶解しない脂肪酸及び油分に溶解しない固形高級アルコールを含有する請求項1ないし3のいずれか1項に記載の医薬組成物。
【請求項5】
液晶乳化型の医薬組成物を構成する水相成分として、油分と混和しない水溶性多価アルコールを含有する請求項1ないし4のいずれか1項に記載の医薬組成物。
【請求項6】
油分に溶解しない脂肪酸が炭素数16から22で飽和・直鎖型脂肪酸である請求項4に記載の液晶乳化型組成物。
【請求項7】
油分に溶解しない固形高級アルコールが炭素数16から22で飽和・直鎖型アルコールである請求項4に記載の液晶乳化型組成物。
【請求項8】
油分と混和しない水溶性多価アルコールがグリセリン、プロピレングリコール、ジプロピレングリコールおよび1,3-ブチレングリコールから選ばれる請求項5に記載の医薬組成物。
【図1】




【公開番号】特開2007−269795(P2007−269795A)
【公開日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願番号】特願2007−60987(P2007−60987)
【出願日】平成19年3月9日(2007.3.9)
【出願人】(000113908)マルホ株式会社 (12)
【Fターム(参考)】
【公開日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願日】平成19年3月9日(2007.3.9)
【出願人】(000113908)マルホ株式会社 (12)
【Fターム(参考)】
[ Back to top ]

