シクロスポリン類似体の代謝体
シクロスポリン類似体ISA247の単離された代謝体を開示し、また、それらのin vitroの調製方法も開示する。該代謝体は、ISA247の化学修飾を含み、該修飾とは、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、ならびに分子内環化、リン酸化、硫酸化、グルクロニド形成およびグリコシル化からなる群より選択される少なくとも1種の反応である。調製方法には半合成法が含まれ、その場合ISA247の代謝体は動物肝臓細胞のミクロソーム抽出物から生成されるか、または微生物を用いた培養から生成され、また、調製方法には完全合成法が含まれ、そのようなものとしては、親化合物の化学修飾もしくは有機合成法を用いた代謝体の単離がある。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本出願は、2004年12月17日に出願の米国仮特許出願第60/637,392号の利益を主張する。前記出願の全開示を参照により本明細書に組み入れるものとする。
【0002】
本発明は、シクロスポリンAの誘導体であるISA247またはISATX247の単離された代謝体に関する。また本発明は、ISA247の単離された代謝体を調製し、分析する方法に関する。
【背景技術】
【0003】
シクロスポリンは、強力な免疫抑制活性を有する環状ポリペプチド群に属するメンバーである。これらの化合物の少なくとも一部(例えば、シクロスポリンAなど)は、トリポクラジウム・インフラタム・ガムス(Tolypocladium inflatum Gams)種によって二次代謝産物として産生される。シクロスポリンは、免疫抑制剤として、体液性免疫反応および細胞介在性免疫反応、例えば同種移植片拒絶、遅延型過敏症、実験的アレルギー性脳脊髄炎、フロイントアジュバント関節炎および移植片対宿主拒絶反応などを抑制することが証明されている。これは、臓器移植における臓器拒絶反応の予防;関節リウマチの治療;および乾癬の治療に用いられる。
【0004】
多数のシクロスポリンファミリーの化合物が知られているが、医療分野では、シクロスポリンAが恐らく最も広く使用されている。シクロスポリンAの免疫抑制効果は、T細胞介在性活性化現象の阻害と関係がある。免疫抑制は、広く存在しているシクロフィリンと呼ばれる細胞内タンパク質にシクロスポリンが結合することによって起こる。この複合体は、次に、酵素カルシニューリンのカルシウムおよびカルモジュリン依存性セリン・スレオニンホスファターゼ活性を阻害する。カルシニューリンの阻害は、T細胞活性化中のサイトカイン遺伝子(IL-2、IFN-γ、IL-4およびGM-CSF)の誘導に必要な、NFATp/cおよびNF-κBなどの転写因子の活性化を妨げる。
【0005】
またシクロスポリンは、in vitroにおけるヘルパーT細胞によるリンホカイン生成を阻害し、胸腺の成熟CD8細胞およびCD4細胞の成長を停止させる。シクロスポリンに関する別のin vitro特性としては、IL-2生産Tリンパ球および細胞傷害性Tリンパ球の阻害、活性化T細胞により放出されるIL-2の阻害、同種抗原および外因性リンホカインに応答する休止Tリンパ球の阻害、IL-1生産の阻害、およびIL-2生産Tリンパ球のマイトジェン活性化の阻害がある。
【0006】
シクロスポリンには有益な免疫抑制作用、抗炎症用および駆虫作用があるものの、シクロスポリンAの治療に伴う多数の副作用がある。これらの作用には、いくつか例を挙げると、腎毒性、肝毒性、白内障発生、多毛症、パラセシス(parathesis)および歯肉増殖症が含まれる。これらのうち腎毒性は、シクロスポリン投与に起因する、より深刻な用量依存性副作用の1つである。即効型のシクロスポリンA医薬品(例えば、ネオーラル(Neoral、登録商標)およびサンディミュン(Sandimmune、登録商標)では、それらが血流中へ速やかに放出され、その速やかな放出の結果、濃度が高まることにより腎毒性およびその他の毒性副作用が起こり得る。シクロスポリンAが腎損傷を起こす正確な機序は知られていないが、腎臓中の血管収縮物質の濃度上昇が糸球体輸入細動脈の血管収縮を引き起こすといわれている。これは、腎虚血、糸球体濾過率の低下を招き、長期間にわたる場合、間質性線維症を引き起こす可能性がある。
【0007】
従って、天然に存在する化合物のシクロスポリンAに匹敵する薬理学的効果を有するが、毒性副作用は低減された免疫抑制剤が求められている。
【0008】
シクロスポリンが最初に発見されて以来、種々の天然シクロスポリンが単離され同定されてきた。さらに、自然には存在しない多くのシクロスポリンが一部合成手段または完全合成手段によって、および改変された細胞培養技術を適用することによって調製されてきた。従って、シクロスポリンを構成している群は相当数あり、例えば、天然シクロスポリンA〜Z;各種の非天然シクロスポリン誘導体;ジヒドロシクロスポリンおよびイソシクロスポリンをはじめとする人工または合成シクロスポリン;誘導化シクロスポリン(例えば、MeBmt残基の3’-O-原子をアシル化してもよいし、3位のサルコシル残基にさらに置換基を導入してもよい);MeBmt残基が異性体の形態で存在するシクロスポリン(例えば、MeBmt残基の6’位および7’位を横切る立体配置がトランス型よりもむしろシス型であるもの);ならびにペプチド配列内の特定の位置に変異アミノ酸が挿入されているシクロスポリンが挙げられる。
【0009】
1位に修飾アミノ酸を含んでいるシクロスポリン類似体は、WO 99/18120およびWO 03/033527に記載されている(これは、本出願の譲受人に譲渡されており、また参照によりその全体を本明細書に組み入れるものとする)。これらの出願には、「ISATX247」または「ISA247」または「ISA」として知られるシクロスポリン誘導体が記載されている。この類似体は、アミノ酸1残基の修飾を除けば、構造的にシクロスポリンAと同一である。出願人らはこれまでに、ISA247のシス異性体およびトランス異性体からなる特定の混合物(主としてトランスISA247で構成されている混合物を含む)が、天然で既に公知のシクロスポリンに勝る高い効力と低毒性の組み合わせを示すことを見出している。ISA247の一部のアルキル化誘導体、アリール化誘導体および重水素化誘導体も記載されている。
【0010】
またシクロスポリンAの代謝体が研究されてきており、一部の例では、親医薬品の効力と同等の優れた効力を持つことが確認されている。さらに、代謝体を認識する抗体の産生に代謝体が使用されている。これらの抗体は、患者血液中の医薬品の量のモニタリングに用いることができる(薬剤治療管理またはTDM)。代謝体を特異的に認識する抗体は、代謝体との結合によりこれらのTDM試験を実施するのに役立ち得る。抗体が代謝体に特異的に結合しない場合には、患者血液中の医薬品の量が誤って多く算出される恐れがある。従って、当技術分野では、ISA247の代謝体の同定および単離と、これらの代謝体の調製方法および使用方法が求められている。
【0011】
参考文献
【特許文献1】米国特許第6,605,593号
【特許文献2】米国特許第6,613,739号
【特許文献3】US 2003/0212249
【特許文献4】国際公開WO 99/18120
【特許文献5】国際公開WO 03/033527
【特許文献6】国際公開WO 2003/033526
【特許文献7】国際公開WO 2003/033527
【非特許文献1】Brown, H.C.ら, J. Am. Chem. Soc. vol 110, p 1535 (1988)
【非特許文献2】Christiansら, "Cyclosporine Metabolism in Transplant Patients" Pharmac. Ther. vol 57, pp 291-345 (1993)
【非特許文献3】Eberle M.K.およびF. Nuninger, "Synthesis of the main metabolite (OL-17) of cyclosporin A," J. Org. Chem. Vol. 57, No. 9, pp. 2689-2691 (1992)
【非特許文献4】Hartman, N. R.およびI. Jardine, "Mass Spectrometric Analysis of Cyclosporine Metabolites," Biomed. Environ. Mass Spectrom. Vol. 13, pp. 361-372 (1986)
【非特許文献5】Huら, J. Org. Chem. vol 63, p 8843 (1998)
【非特許文献6】Johnson, R.A.,およびSharpless, K.B; Catalytic Asymmetric Synthesis: I. Ojima編; VCH Publishers: New York; 1993; p. 103
【非特許文献7】Keown, P.A., "Molecular and Clinical Therapeutics of Cyclosporine in Transplantation," Immunosuppression in Transplantation (Blackwell Science, Maiden MA, 1999), pp. 1-12
【非特許文献8】Marshall, J. A. Chem Rev. vol 96, p 31 (1996)
【非特許文献9】Barrett, A.G.M.ら, J. Org. Chem. vol 56, p 5243 (1991)
【非特許文献10】Sharpless, K.B.ら, J. Org. Chem. vol 57, p 2768 (1992)
【非特許文献11】Wenger, R.M., "Synthesis of Cyclosporine and Analogs: Structural Requirements for Immunosuppressive Activity," Angew Chem Int. Ed. Engl. Vol. 24, No. 2, pp. 77-138. (1985)
【発明の開示】
【0012】
本発明は、シクロスポリン類似体ISA247の代謝体の同定および単離に関する。また本発明は、シクロスポリン類似体ISA247の代謝体の調製方法および使用方法も提供する。かかる代謝体は、有用な免疫抑制活性を有していると考えられ、かつ親化合物よりも低い毒性または同等の毒性を示し得る。またかかる代謝体は、薬剤治療管理のためのアッセイの開発に役立つ可能性がある。
【0013】
本発明の実施形態では、ISA247の代謝体は、以下の式:
【化1】

【0014】
[式中、
各R2は独立に-Hまたは-CH3であり;
各R10は独立に-H、-OH、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORaまたは-NRcC(O)N(RaRb)であり;
R5、R6、R7、R8およびR9は独立に、-H、-OH、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORaまたは-NRcC(O)N(RaRb)であるか;またはR6とR7が一緒になって-O-であるか;またはR5とR6が一緒になって、もしくはR7とR8が一緒になって独立に-O-であるか;またはR8とR9が一緒になって-O-であるか;またはR5が、それが結合する炭素と一緒になって、-C(=O)Ra、-CO2Ra、-CH2ORa、-CH2OC(O)Ra、-CH(ORa)2、-C(O)N(RaRb)、-C(=NRb)Ra、-C(=NORb)Ra、もしくは-C(=NNRb)Raであり;ただし、R5とR6、R6とR7、またはR7とR8のうち1ペアが炭素間結合していて、かつ残りのすべてが-Hであることはなく;かつ
Ra、RbおよびRcはそれぞれ独立に-Hであるか、または脂肪族、脂環族、ベンジルもしくはアリールで置換されていてもよく、あるいは-N(RaRb)が一緒になって任意的な置換複素環基であるか、または-CH(ORa)2が一緒になって環状アセタール基である]
により表される単離された化合物、ならびに製薬上許容されるその塩および溶媒和物を包含する。
【0015】
各種の実施形態では、本化合物は、以下の式:
【化2】

【0016】
[式中、
各R2は独立に-Hまたは-CH3であり;
各R10は独立に-H、-OH、-F、-Cl、-Br、-I、-ORa、-OC(O)Ra、-OSO2Ra、-OSO3Ra、-OPO2RaRbまたは-OPO3RaRbであり;
R5、R6、R7、R8およびR9は独立に、-H、-OH、-F、-Cl、-Br、-I、-ORa、-OC(O)Ra、-OSO2Ra、-OSO3Ra、-OPO2RaRbもしくは-OPO3RaRbであるか;またはR6とR7が一緒になって-O-であるか;またはR5とR6が一緒になって、もしくはR7とR8が一緒になって独立に-O-であるか;またはR8とR9が一緒になって-O-であるか;またはR5が、それに結合する炭素と一緒になって-C(=O)Ra、-CO2Ra、-CH2ORa、-CH2OC(O)Ra、-CH(ORa)2、-C(O)N(RaRb)、-C(=NRb)Ra、-C(=NORb)Raまたは-C(=NNRb)Raであり;ただし、R5とR6、R6とR7、またはR7とR8のうち1ペアが炭素間結合していて、かつ残りのすべてが-Hであることはなく;かつ、
Ra、RbおよびRcはそれぞれ独立に-Hであるか、または脂肪族、脂環族、ベンジルもしくはアリールで置換されていてもよく、あるいは-N(RaRb)が一緒になって任意的な置換複素環基であるか、または-CH(ORa)2が一緒になって環状アセタール基である]
により表される。
【0017】
特定の実施形態では、本化合物は、以下の式:
【化3】

【0018】
[式中、
R1は以下のもの:
【化4】

【0019】

【0020】
からなる群より選択され、
各R2は独立に、-CH3および-Hからなる群より選択され;
各R3は独立に、-CH2CH(CH3)2および-CH2C(CH3)2OHからなる群より選択され;かつ
各R4は独立に、-CH(CH3)2および-C(CH3)2OHからなる群より選択される]
により表される。
【0021】
本発明の各種実施形態には、シクロ{{(E)-および(Z)-(2S,3R,4R)-3-ヒドロキシ-4-メチル-2- (メチルアミノ)-6,8-ノナジエノイル}-L-2-アミノブチリル-N-メチル-グリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル-L-アラニル-D-アラニル-N-メチル-L-ロイシル-N-メチル-L-ロイシル-N-メチル-L-バリル}(ISA247)の単離された代謝体ならびにその製薬上許容される塩および溶媒和物であって、ISA247と比較して、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、分子内環化、リン酸化、硫酸化、グルクロニド形成およびグリコシル化からなる群より選択される少なくとも1個の化学修飾を含む代謝体ならびにその塩および溶媒和物が含まれる。
【0022】
具体的な実施形態では、本発明は、化学修飾が、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、および分子内環化からなる群より選択される、親化合物ISA247の少なくとも1個の化学修飾を提供する。
【0023】
本発明の特定の実施形態には、化学修飾が、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、および分子内環化からなる群より選択される、親化合物の少なくとも1個の化学修飾を含む、シクロ{{(E)-および(Z)-(2S,3R,4R)-3-ヒドロキシ-4-メチル-2-(メチルアミノ)-6,8-ノナジエノイル}-L-2-アミノブチリル-N-メチル-グリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル-L-アラニル-D-アラニル-N-メチル-L-ロイシル-N-メチル-L-ロイシル-N-メチル-L-バリル}(ISA247)の代謝体が含まれる。
【0024】
各種の実施形態では、単離された代謝体は、以下のもの:アミノ酸1の側鎖でのエポキシド;アミノ酸1の側鎖でのジオール;アミノ酸1の側鎖中の環状エーテル;アミノ酸1、3、4、6、9、10、または11での脱メチル化アミノ窒素;アミノ酸4、6、9、または10の側鎖のγ炭素での-OH;およびアミノ酸5または11の側鎖のβ炭素での-OHからなる群より選択される、少なくとも1個の化学修飾を含む。各種の実施形態では、単離された代謝体は、2個以上の前記化学修飾を含む。特定の実施形態では、単離された代謝体は、IM1-e-1、IM1-e-2、IM1-e-3、IM1-d-1、IM1-d-2、IM1-d-3、IM1-d-4、IM1-c-1およびIM1-c-2からなる群より選択することができる。
【0025】
特定の実施形態では、ISA247と比較して、単離された代謝体は、以下のもの:少なくとも2個の-OH基;少なくとも2個の脱メチル化アミノ酸窒素;少なくとも1個の-OH基および少なくとも1個の脱メチル化アミノ酸窒素;少なくとも1個のジオール基および少なくとも1個の-OH基;少なくとも1個のジオール基および少なくとも1個の脱メチル化アミノ酸窒素;少なくとも1個の環状エーテルおよび少なくとも1個の-OH基;少なくとも1個の環状エーテルおよび少なくとも1個の脱メチル化アミノ酸窒素;少なくとも1個の-OH基およびリン酸、硫酸、グルクロニドまたはグリコシル化残基;ならびに、少なくとも1個のジオールおよびリン酸、硫酸、グルクロニドまたはグリコシル化残基からなる群より選択される化学修飾を含む。実施形態としては、エポキシド、ジオールおよび環化を含む、ISA247のアミノ酸1での代謝体が挙げられる。さらなる実施形態としては、ISA247化合物が、(1)少なくとも1個のメチルロイシンアミノ酸で、例えば、アミノ酸4、6、9または10で;(2)バリン残基5で;または(3)メチルバリン残基11で水酸化されている代謝体が挙げられる。さらなる実施形態としては、ISA247のアミド結合の少なくとも1個のメチル化窒素が脱メチル化されている代謝体が挙げられる。またさらなる実施形態としては、ISA247のアミノ酸1、3、4、6、9、10および11のアミド結合の少なくとも1個の窒素が脱メチル化されている代謝体が挙げられる。ISA247の具体的な代謝体としては、IM1-d-1、IM1-d-2、IM1-d-3、IM1-d-4、IM9、IM1-c-1、IM1-c-2、IM4n、IM6、IM46、IM69、IM49、IM1-e-1、IM1-e-2、およびIM1-e-3が挙げられる。
【0026】
さらなる実施形態としては、別のアミノ酸残基での少なくとも1個の水酸化または少なくとも1個のN-脱メチル化と組み合わせた、ISA247のアミノ酸1でのジオールまたは環化を有する代謝体が挙げられる。さらに、実施形態としては、別のアミノ酸残基での少なくとも1個の水酸化および少なくとも1個のN-脱メチル化と組み合わせた、ISA247のアミノ酸1でのジオールまたは環化を有する代謝体が挙げられる。
【0027】
各種の実施形態では、ISA247の代謝体は、薬剤投与後に体液から単離するか、あるいは、半合成的に(すなわち、動物肝臓細胞のミクロソームホモジネートから、もしくは微生物の培養物から)生成するか、または完全合成的に、例えば、有機合成の当技術分野で公知の反応を用いて親化合物を化学修飾させることによって生成することができる。
【0028】
従って、本発明の一部の実施形態は、in vitroでISA247の代謝体を調製する方法であって、以下のステップ:(a)哺乳動物細胞(例えば、哺乳動物肝臓細胞)をホモジナイズしてホモジネートを形成させる(例えば、それらの形質膜を破裂させて肝臓細胞の内容物を放出させる)ステップと;(b)前記ホモジネートを遠心分離して、少なくとも1種の薬物代謝酵素(例えばシトクロムP450)を含むミクロソームペレットを形成させるステップと;(c)ISA247、前記ミクロソームペレット、エネルギー源、および電子供与分子を含有する反応混合物を、ISA247の少なくとも1種の代謝体の生成をもたらす条件下で調製するステップとを含む方法を提供する。さらなる実施形態では、本方法は、霊長類、ラット、イヌおよびウサギからなる群より選択されるか、または一部の実施形態では、イヌまたはウサギから選択される、哺乳動物の肝臓細胞を利用することができる。電子供与分子は、例えばNADHまたはNADPHであってもよい。エネルギー源は、例えば、グルコース-6-リン酸およびイソクエン酸からなる群より選択することができる。特定の実施形態では、本反応混合物は、グルコース-6-リン酸デヒドロゲナーゼおよびイソクエン酸デヒドロゲナーゼからなる群より選択される酵素をさらに含んでいる。
【0029】
さらなる実施形態では、本発明は、高速液体クロマトグラフィーを用いて、ISA247の代謝体を単離する方法を提供する。さらなる実施形態では、クロマトグラフィーカラムは、n-オクタデシル、n-オクチル、n-ブチル、ジフェニルおよびシアノプロピルのカラムであって、その長さは約150〜250mm、直径は約0.1〜4.6mmの範囲であり、流速が約500〜2,000μL/分であってもよい。またさらに、本発明の実施形態は、代謝体を質量分析によって同定することができることを提供する。
【0030】
また本発明の実施形態は、ISA247の水酸化代謝体を生成する方法であって、以下のステップ:(a)ISA247の1-アミノ酸のβアルコールを保護して保護されたISA247化合物を形成させるステップと;(b)前記の保護されたISA247化合物をハロゲン化剤を用いて4、6、または9-アミノ酸残基のうち少なくとも1つの側鎖のγ炭素でハロゲン化し、それによりハロゲン化生成物を形成させるステップと;(c)ステップ(b)のハロゲン化生成物をアセテート試薬の存在下で加熱してアセテート部分を有するアセテート含有生成物を形成させるステップと;(d)トランスエステル化を行って、ステップ(c)のアセテート含有生成物のアセテート部分をアルコール部分に交換するステップとを含み、それによりISA247の水酸化代謝体を形成させる方法を提供する。具体的な実施形態では、ハロゲン化剤は、例えばN-ブロモスクシンイミド(NBS)であり、アセテート試薬は、例えばテトラブチルアンモニウムアセテートである。
【0031】
各種の実施形態としては、前記方法によって生成される、ISA247の単離された水酸化代謝体が挙げられる。具体的な単離された水酸化代謝体は、IM9、IM4、IM6、IM46、IM69およびIM49からなる群から選択することができる。
【0032】
本発明の実施形態は、in vitroでISA247のエポキシド代謝体を生成する方法であって、単離されたISA247の1-アミノ酸残基の側鎖のアルケン部分を酸化剤を用いて(例えば、Prilezhaev反応を用いて)酸化し、それによりISA247のエポキシド代謝体を形成させるステップを含む方法を提供する。酸化剤は、例えば、m-クロロ過安息香酸(MCPBA)、過酢酸、トリフルオロ過酢酸、過安息香酸、3,5-ジニトロ過安息香酸、過酸化水素、過酸化アルキル、および酸素などであってもよい。
【0033】
各種の実施形態としては、前記方法により調製される、ISA247の単離されたエポキシド代謝体が挙げられる。具体的な単離されたエポキシド代謝体としては、IM1-e-1、IM1-e-2およびIM1-e-3が挙げられる。
【0034】
本発明のさらなる実施形態は、ISA247の代謝体を含有しているジオールを生成する方法であって、以下のステップ:(a)β-OH基を保護するステップと;(b) ISA247のアミノ酸1残基の側鎖のアルケン成分を酸化剤で処理し、アルケン成分をモノエポキシドに変換させるステップと;(c)エポキシドからジオールを含有しているISA247の代謝体を形成するステップと;(d)β-OH基を塩基を用いて脱保護するステップとを含む方法を提供する。
【0035】
本発明のさらなる実施形態としては、ISA247のジオール含有代謝体を生成する方法であって、以下のステップ:(a)ISA247の1-アミノ酸の側鎖のアルケン部分を(例えばPrilezhaev反応として)酸化剤で処理してISA247のエポキシド代謝体を形成させるステップと;(b)ISA247の単離されたエポキシド代謝体から、ISA247の単離されたジオール代謝体を形成させるステップとを含む方法が挙げられる。酸化剤の代表的な例としては、m-クロロ過安息香酸(MCPBA)、過酢酸、トリフルオロ過酢酸、過安息香酸、3,5-ジニトロ過安息香酸、過酸化水素、過酸化アルキル、および酸素が挙げられる。別の実施形態では、ISA247のジオール含有代謝体をエポキシドから形成するステップ(b)は、ステップ(a)のエポキシドを、水を使用する求核攻撃(例えば加水分解)に供することを含む。水による求核攻撃は、酸および塩基(例えば、過塩素酸、アルカリ水、Nafion-H、ギ酸等)からなる群より選択される試薬により触媒され得る。特定の実施形態では、ステップ(b)の加水分解は、過塩素酸もしくはNafion-Hにより触媒される加水分解;ジメチルスルホキシド中でのアルカリ加水分解;およびミクロソームエポキシドヒドロラーゼにより触媒される加水分解から選択される。
【0036】
各種の実施形態としては、前記方法によって調製される、ISA247の単離されたジオール代謝体が挙げられる。具体的な単離されたジオール代謝体としては、IM1-d-1、IM1-d-2、IM1-d-3およびIM1-d-4が挙げられる。
【0037】
またさらなる実施形態では、本発明は、ISA247のジオール含有代謝体を生成する方法であって、四酸化オスミウムおよびアルカリ性過マンガン酸カリウムもしくは過酸化水素、またはt-ブチルヒドロペルオキシドもしくは過酸化水素/ギ酸、またはモノ過コハク酸(monopersuccinic acid)を用いて、ISA247から直接的にジオール代謝体を形成させるステップを含む方法を提供する。典型的な実施形態では、ISA247を、四酸化オスミウム、アルカリ性過マンガン酸カリウム、過酸化水素、モノ過コハク酸およびt-ブチルヒドロペルオキシドからなる群より選択される試薬と反応させることにより、ISA247のジオール代謝体を形成させる。典型的には、ISA247を、触媒作用を有する量の四酸化オスミウムと反応させることができる。一部の実施形態では、ISA247を、過酸化水素/ギ酸およびモノ過コハク酸からなる群より選択される試薬と反応させることができる。
【0038】
一部の実施形態では、ISA247のジオール代謝体を生成する方法は、(a)ISA247を、ヨウ素/安息香酸銀および酢酸銀からなる群より選択される試薬で処理し、ISA247のジエステルを形成させるステップと;(b)ISA247のジエステルを加水分解し、それによりISA247のジオール代謝体を形成させるステップとを含む。
【0039】
各種の実施形態としては、前記方法によって調製される、ISA247の単離されたジオール代謝体が挙げられる。具体的な単離されたジオール代謝体としては、IM1-d-1およびIM1-d-2が挙げられる。
【0040】
一部の実施形態では、ISA247のジオール代謝体を生成する方法は、(a)ISA247を、四酢酸鉛および酢酸タリウムからなる群より選択される試薬と反応させ、ISA247のジオールビスアセテートを形成させるステップと;(b)ISA247のジオールビスアセテートを加水分解し、それによりISA247のジオール代謝体を形成させるステップとを含む。
【0041】
各種の実施形態としては、前記方法によって調製される、ISA247の単離されたジオール代謝体が挙げられる。具体的な単離されたジオール代謝体としては、IM1-d-1およびIM1-d-2が挙げられる。
【0042】
さらなる実施形態では、代謝体ジオールは、ハロアリルホウ素化反応(haloallylboration)などの有機金属成分により利用されやすいビニルエポキシドから調製される。また、かかるビニルエポキシドは、Sharplessの二水酸化プロトコルにより取得することができる。
【0043】
本発明の特定の実施形態としては、製薬上許容される担体と、本発明の単離された化合物または代謝体のいずれかとを含む医薬組成物が挙げられる。
【発明を実施するための最良の形態】
【0044】
本発明は、シクロスポリン類似体ISA247の代謝体を明らかにする。また本発明は、シクロスポリン類似体ISA247の代謝体の調製方法を提供する。かかる代謝体は免疫抑制活性を有している。これらはまた、抗体の産生をはじめとする、薬剤治療管理のアッセイを開発するのに有用である。
【0045】
シクロスポリンAは、トリポクラジウム・インフラタム・ガムス(Tolypocladium inflatum Gams)種の浸漬培養で生成される、中性で高親油性の環状ウンデカペプチドである。この臨床コードはOL 27-400であり、サンディミュン(登録商標)の商品名の免疫抑制剤の有効成分である。
【0046】
シクロスポリンAは、最近(1983年にCarruthersによって)「シクロスポリン」と名称変更された。本出願では、特定の化合物シクロスポリンAを表すのに省略形の「CsA」を用い、また「シクロスポリン」という用語は、シクロスポリン類似体をはじめとする、免疫抑制活性を有する環状ペプチドを含む免疫抑制剤の一般群を意味するものとする。従って、「シクロスポリン」という用語は、通常、シクロスポリンA〜Z(修飾体および類似体を含む)のいずれかを意味する。特に、用語シクロスポリンは、化合物CsAおよびISA247を含んでいる。
【0047】
CsAおよびその代謝体の構造と命名法
図1にシクロスポリンAの構造を示す。N.R. HartmanおよびI. Jardineによって、"Mass Spectrometric Analysis of Cyclosporine Metabolites," Biomed. Environ. Mass Spectrom. Vol. 13, pp. 361-372 (1986)に記載されている通り、シクロスポリンAは、そのほとんど全体が疎水性アミノ酸からなる環状ウンデカペプチドである。これらのアミノ酸の大半は、タンパク質では通常発見されない。図1は、この分子の環状ペプチド環を含む11個のアミノ酸残基を明らかにしている。CsA分子は、サルコシン残基(Sarまたはメチル化グリシン残基MeGly)、D-およびL-アラニン(Ala)の各残基、α-アミノ酪酸残基(Abu)、バリン(Val)残基、N-メチルバリン(MeVal)残基、4個のN-メチルロイシン(MeLeu)残基、および9個の炭素を含有しているアルケン、すなわち(4R)-4-[(E)-2-ブテニル]-4,N-ジメチル-L-スレオニン(MeBmt)と呼ばれるシクロスポリンに特有のβ-水酸化アミノ酸を含んでいる。
【0048】
本明細書では、これらのアミノ酸残基には、(4R)-4-[(E)-2-ブテニル]-4,N-ジメチル-L-スレオニン(MeBmt)から始まり、隣接しているMeValで終了するように、連続番号1〜11を付けている(図1では、MeBmtから開始して右回りに番号を付けている)。
【0049】
CsAの各アミノ酸は、位置8のアラニン残基を除き、S-立体配置(アミノ酸のL-異性体)を有している。前記アラニン残基は、R-立体配置(アラニンのD-異性体)をとる。これらのアミン窒素原子で、7個のアミノ酸がメチル化されている(これらは、残基1、3、4、6、9、10および11である)。シクロスポリンAの構造が発見された時、10個のアミノ酸2〜11は知られていたが、β-水酸化アミノ酸MeBmtは知られていなかった。
【0050】
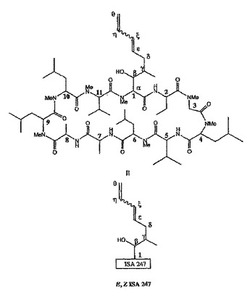
ISA247(またはISATX247もしくはISA)の構造を図2に示す。本明細書では、ISA247および記載の代謝体中のアミノ酸残基の位置には、図1のCsAと同じように番号を付けている。図1と比較すると、CsAとISA247は、アミノ酸残基1の側鎖を除けば同一であるということがわかる。これらのシクロスポリンの共通の構造は、ISA247のE(トランス)異性体およびZ(シス)異性体を描いた、図3および図4に示した囲み枠によっても表示される。この場合、数字の1は、表示した側鎖が結合しているアミノ酸残基1を示す。このアミノ酸1の構造は、図41および図42に、ならびに表5に同様に記載している。
【0051】
アミノ酸の側鎖構造を本明細書で明確に示す場合、その側鎖の炭素は、当技術分野で通常知られているようにギリシャ文字で表示する場合がある。例えば、アミノ酸のカルボニル基に隣接している炭素は通常α炭素と表示され、ペプチド環から離れる方向の炭素原子の特定のために、ギリシャ文字のアルファベットが順次付けられる。図1および図2にこの命名法の例を示す。例えばCsAの場合、MeBmt側鎖のβ炭素はヒドロキシル基に結合しており、側鎖のε炭素とζ炭素との間には二重結合がある。
【0052】
CsA構造に関するさらなる詳しい情報は、P. A. Keownにより、 Immunosuppression in Transplantation (Blackwell Science, Malden MA, 1999), pp. 1-12の章表題 "Molecular and Clinical Therapeutics of Cyclosporine in Transplantation"に記載されている。Keownによれば、固体状態でのX線回折と非水系溶液での核磁気共鳴研究を行ったところ、CsA分子が2種類の構造モチーフにより特性決定されることが紹介されている。残基MeBmt(位置1)〜残基MeLeu(位置6)は、水素結合により安定化されている逆並行βシートを含んでおり、一方、残基Ala(位置7)〜残基MeVal(位置11)は、残基9と残基10の間のペプチド結合がシス立体配置にあるループを形成している。免疫抑制剤シクロスポリンは、2種類の制御ドメインを有する。残基1、2、9、10および11が受容体結合ドメインを表し、一方、残基4〜8がエフェクタードメインとして機能する。また、R.M. WengerによるAngew Chem Int. Ed. Engl. Vol. 24, No. 2, pp. 77-138 (1985)の文献タイトル"Synthesis of Cyclosporine and Analogs: Structural Requirements for Immunosuppressive Activity" によると、免疫抑制に必須のアミノ酸は、位置1、2、3および11のMeBmt、Abu、SarおよびMeValである。
【0053】
CsAの環状ウンデカペプチド構造は、解明されているすべての代謝体中に保存されている(Copeland, 1990)。これらの環状ペプチドの生体内変化に関与している反応は、ほとんどの場合、水酸化、エポキシド形成、N-脱メチル化、および分子内環化である。多重水酸化(multiple hydroxylation)は同一分子中の異なる部位で起こり得るが、「水酸化」という用語は一水酸化(monohydroxylation)を意味する。また二水酸化は、アルケンのエポキシドへの酸化と、その後のジオール形成により起こり得る。N-脱メチル化は、環状ペプチド環中のアミノ酸残基に隣接して連結しているアミド結合のメチル化窒素で起きる。CsAの代謝体は、アルデヒド誘導体およびカルボン酸誘導体を含む。CsAのカルボン酸代謝体が形成されると、毒性をもたらす可能性がある。上述の反応の組み合わせもまた起こり得る。
【0054】
同様な命名法が必ずしも用いられているとは限らないが、多くの異なる研究者がCsA代謝体について記載している。この状況を明確にするため、図5にCsAの公知の代謝体の表を作成した。図5に関し、シクロスポリンAの代謝体は、接頭語「CsA-Am」により識別される。この場合、表示の「CsA」部分は、その化合物がシクロスポリンAの代謝体であることを意味し、「Am」の記号の部分は、代謝による修飾が起こるアミノ酸位置を示す。それに続く記号は、代謝反応の性質を明示する。この命名法を使用すると、以下のISA247代謝体の記載に関してより明確に理解されるであろう。
【0055】
ISA247およびその代謝体の構造と命名法
本発明者らは、これまで、「ISA」、「ISA247」または「ISATX247」と呼ぶシクロスポリンA類似体について記載してきた(米国特許第6,605,593号および同第6,613,739号を参照されたい)。上述の通り、この類似体は、アミノ酸1残基の修飾を除けば、構造的にはシクロスポリンAと同じである。本発明者らは、ISA247のシス異性体(Z異性体としても知られる)およびトランス異性体(E異性体としても知られる)の特定の混合物が、天然であって現在公知のシクロスポリン類に勝る高い効力と低毒性の組み合わせがあることを明らかにした。さらに本発明者らは、主としてトランス異性体からなる、シス異性体とトランス異性体の混合物が、天然であって現在公知のシクロスポリン類に勝る低毒性と高い効力を有することを見出した。
【0056】
ISA247の化学名は、シクロ-{{(E)-および(Z)-(2S,3R,4R)-3-ヒドロキシ-4-メチル-2-(メチルアミノ)-6,8-ノナジエノイル}-L-2-アミノブチリル-N-メチル-グリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル-L-アラニル-D-アラニル-N-メチル-L-ロイシル-N-メチル-L-ロイシル-N-メチル-L-バリル}である。その実験式はC63H111N11O12であり、約1214.85の分子量をもつ。「ISA」、「ISA247」および「ISATX247」という用語は、この薬理学的活性化合物に付与された流通名である。
【0057】
ISA247の構造は、主として核磁気共鳴(NMR)分光法により確認されている。1Hおよび13Cの両スペクトルを、1次元および2次元NMR実験系列を使用し、ISA247のピークをシクロスポリンAに関する公知のNMR帰属と比較することにより帰属した。ISA247の(E)異性体および(Z)異性体の絶対的な帰属は、核オーバーハウザー効果(NOE)実験により確認した。裏付けとなるさらなる証拠は、質量スペクトル分析および赤外スペクトルにより得た。質量スペクトル分析では分子量が確認され、赤外スペクトルでは、シクロスポリンAに非常に似ていることが判明した。後者の結果は、この2つの化合物間には構造上の密接な類似性があることから予期されたものである。しかし、ISA247は、その1-アミノ酸残基の側鎖にCsA中には存在しない共役ジエンを含有している。ISA247は、CsAと同じく、そのアミノ酸1側鎖のε炭素とζ炭素の間に炭素-炭素二重結合を有してはいるが、ISA247はCsAとは異なり、さらにη炭素とθ炭素の間に炭素-炭素二重結合を有している。
【0058】
CsAとISA247の構造間には類似性があることから、記載したISA247の代謝体に関する命名法は、CsA代謝体に対して展開した命名スキームに基づいている。本明細書で特定された代謝体は、ISA247代謝体がシクロスポリン「A」の「A」の代わりに「ISA」の接頭語「I」が前につく以外は、同様のパターンに従う。また、CsA代謝体の修飾アミノ酸の識別には文字「AM」を用いているが、ISAの代謝体には「IM」を用いる。例えば、アミノ酸9のγ炭素で一水酸化されているCsA代謝体は、CsA-Am9またはAM9として識別される。アミノ酸9のγ炭素で一水酸化されているISA247代謝体は、IM9として識別される。4位のMeLeuの窒素が脱メチル化されているCsA代謝体は、CsA-Am4nまたはAM4nとして識別される。4位のMeLeuの窒素が脱メチル化されているISA247代謝体は、IM4nとして識別される(ISAの代謝体(Metabolite)、アミノ酸4でのn-脱メチル化)。
【0059】
ISA247はアミノ酸1に1,3-ジエンを有するので、数種類のジオール代謝体は、CsAから形成することができず、ISA247から形成することができる。これらのジオール代謝体に関する命名法は、上述した基準と同様にする。例えば、構造が解明されている最初のジオール代謝体は、IM1-d-1である(ISAの代謝体(Metabolite)、アミノ酸1-ジオール(diol)-試験した1番目の構造)。
【0060】
CsAと同様に、ISA247はin vivoで代謝され、代謝体が形成され得る。これらの代謝体は、血流により運ばれ、尿および/または胆汁を介して排泄され得る。従って、ISA247代謝体は、薬剤投与後に、動物の全血、胆汁および尿をはじめとする体液から単離することができる。またISA247代謝体は、生体内変換を介して微生物により生成することもできる。さらにISA247代謝体は、哺乳動物のミクロソーム系を用いて調製することができる。またISA247代謝体は化学的に合成することもできる。代謝体は、質量分析連結型のクロマトグラフ法によって、また核磁気共鳴(NMR)技術によって単離し特性決定することができる。
【0061】
さらなる実施形態では、本発明は、本発明の代謝体を特異的に認識する抗体を提供する。特に、所定の代謝体は認識するが、シクロスポリン、ISA247または他の代謝体とは交差反応しない抗体が意図される。抗体は、ポリクローナル抗体、モノクローナル抗体、多重特異的抗体、ヒト抗体、ヒト化抗体、霊長類化抗体、キメラ抗体、単鎖抗体、エピトープ結合フラグメント(例えばFab、Fab'およびF(ab')2)等であってもよい。本発明の代謝体は、抗体調製またはスクリーニングに使用することができる。さらに、ポリクローナル抗体混合物(抗血清など)がシクロスポリン、ISA247または不都合な代謝体と交差反応する場合は、混合物を免疫的選択または免疫吸着により処理して交差反応性抗体を除去することができる。例えば、免疫的選択では、目的の代謝体が固定化されているカラムに混合物を通過させることができる。次いで、カラムへ結合している抗体を溶出させ、回収することができる。反対に、免疫吸着では、混合物が交差反応する化合物を固定化し、不都合な抗体を吸着するために用いることができる。抗体の調製方法は当技術分野で公知である(例えば、Harlow and Lane, "Antibodies. A Laboratory Manual", Cold Spring Harbor Laboratory, New York, 1988を参照されたい)。これらの抗体は、例えば、薬剤治療管理において有用である。
【0062】
定義
本明細書では「代謝体」とは、哺乳動物においてISA247の代謝により生成されるISA247の誘導体を意味し、これはさらに化学的に修飾することができる。本明細書に記載したISA247の単離された代謝体は、ISA247を哺乳動物へ投与した後、単離することによって;ISA247、CsAまたは別のシクロスポリン誘導体を本明細書に記載のように化学修飾することによって;ISA247、CsAまたは別のシクロスポリン誘導体を酵素を用いてin vitroで反応させることによって;ISA247、CsAまたは別のシクロスポリン誘導体を微生物変換することによって;あるいはこれらのステップの2つ以上を任意の順序で組み合わせることによって調製することができる。例えば、ISA247を哺乳動物に投与し、その哺乳動物から単離されたISA247の代謝体を化学的に修飾し、さらなる代謝体を形成させることができる。あるいは、ISA247を、本明細書に記載したミクロソーム調製物とin vitroで反応させて代謝体を形成させ、これを化学的に修飾し、さらなる代謝体を形成させることができる。
【0063】
本明細書では、「化学的に修飾する」とは、化合物が基準構造と比較した場合に少なくとも1つの化学的な構造上の差異を有することを意味する。化学修飾は、本明細書に記載の任意の合成法、酵素法または代謝過程によってもたらすことができる。
【0064】
本明細書では、好適な保護基(例えば、ISA247の1-アミノ酸残基のβ-アルコールを保護し、保護されたISA247化合物を形成させる保護基)、ならびに保護および脱保護の条件は、当技術分野で公知であり、例えば、GreeneおよびWuts, "Protective Groups in Organic Synthesis", John Wiley & Sons (1991)に記載されている(その全開示は、参照により本明細書に組み入れるものとする)。好適なヒドロキシル保護基の具体的な例としては、置換メチルエーテル類(例えばメトキシメチル、ベンジルオキシメチル)、置換エチルエーテル類(例えばエトキシメチル、エトキシエチル)、ベンジルエーテル類(ベンジル、ニトロベンジル、ハロベンジル)、シリルエーテル類(例えばトリメチルシリル)、エステル等が挙げられるが、これらに限定されるものではない。
【0065】
本明細書では、「ハロゲン化剤」とは、-Hまたは他の基をハロゲンで置換することができる、当技術分野で公知の化合物である。例えば、各種の実施形態では、ハロゲン化剤は、臭素、塩素、N-クロロスクシンイミド、N-ブロモスクシンイミド等であってもよく、特にN-ブロモスクシンイミドである。
【0066】
本明細書では、Prilezhaev反応とは、アルケンと過酸との反応によるエポキシドの形成を意味する。例えば、N. Prilezhaev, Ber. 42, 4811 (1909); D. Swern, Chem. Rev. 45, 16 (1949); Org. React. 7, 378 (1953); H. O. House, Modern Synthetic Reactions (W. A. Benjamin, Menlo Park, California, 第2版, 1972) pp 302-319; D. I. Metelitra, Russ. Chem. Rev. 41, 807 (1972);およびD. Schnurgfeil, Z. Chem. 20, 445 (1980)を参照されたい。なおこれらの引用文献の全開示は参照により本明細書に組み入れるものとする。
【0067】
本明細書では、「薬剤代謝酵素」とは、in vivoまたはin vitroにおいて、CsA、ISA247またはその代謝体を化学的に修飾することができる酵素である。一般には、薬剤代謝酵素は、動物または微生物(例えば哺乳動物)から、例えば、哺乳動物細胞(例えば肝臓細胞)をホモジナイズし、薬剤代謝酵素を含有するミクロソーム調製物を生成することにより得ることができる。特定の実施形態では、薬剤代謝酵素としては、酵素のシトクロムP450ファミリーの1種または複数のメンバーが挙げられる。
【0068】
本明細書では、「エネルギー源」には、薬剤代謝酵素によって使用され、ISA247を化学的に修飾してISA247の代謝体を生成するエネルギーを提供することができる、1種または複数の化合物が含まれる。例えば、エネルギー源は、炭水化物、例えば、特定の実施形態では、グルコース-6-リン酸、イソクエン酸等であってもよい。ミクロソーム調製物において、エネルギー源の消化を促進する酵素としては、例えば、グルコース-6-リン酸デヒドロゲナーゼ、イソクエン酸デヒドロゲナーゼ等を挙げることができる。
【0069】
本明細書では、「電子供与分子」は、ISA247を化学的に修飾し、ISA247の代謝体を生成するための酸化還元反応系電子源として薬剤代謝酵素によって使用され得る化合物である。例えば典型的な電子供与分子としては、ニコチンアミドアデニンジヌクレオチド(NADH)およびニコチンアミドアデニンジヌクレオチドホスフェート(NADPH)が挙げられる。
【0070】
本明細書では、「単離された」とは、化合物(例えば、記載したISA247の代謝体)が生物系(例えば、哺乳動物、微生物細胞培養物の細胞等)から単離されることを意味する。一般には、単離された化合物はまた、例えば、クロマトグラフィーによる分離、結晶、親和性精製または当技術分野で公知の他の手段によって精製される。例えば、特定の実施形態では、記載したISA247代謝体を高圧液体クロマトグラフィーによって精製することができる。
【0071】
本明細書では、「N-脱メチル化」とは、アミノ酸窒素からメチル基を除去することを意味する。「アミノ酸窒素」は、アミノ酸側鎖中の窒素ではなく、アミノ酸主鎖中の窒素である。
【0072】
本明細書では、「グルクロニド形成」とは、グリコシド結合を介してグルクロン酸をISA247または他のISA247代謝体に結合させることによりグルクロニドISA247代謝体を形成することを意味する。
【0073】
本明細書では、「グリコシル化」とは、糖がISA247代謝体のヒドロキシル基に結合し、グリコシル化ISA247代謝体を形成することを意味する。糖(またはグリコシル化残基)は、例えば、二糖類、オリゴ糖類、多糖類等をはじめとする、1種または複数の糖を有していてもよい。グリコシル化残基に含まれている典型的な糖は、グルコース、マンノースおよびN-アセチルグルコサミンである。
【0074】
本明細書では、脂肪族基は、直鎖状、分枝状、または環状の非芳香族炭化水素であって、これは完全に飽和されていてもよく、あるいは1個または複数の不飽和単位を含有していてもよい。アルキル基は、飽和脂肪族基である。一般には、直鎖状または分枝状脂肪族基は、1個〜約10個、好ましくは1〜約4個の炭素原子を有しており、環状脂肪族基は、3個〜約10個、好ましくは3個〜約8個の炭素原子を有している。脂肪族基は、好ましくは直鎖状または分枝状アルキル基であって、例えばメチル、エチル、n-プロピル、イソプロピル、n-ブチル、sec-ブチル、tert-ブチル、ペンチル、ヘキシル、ペンチルまたはオクチルであるか、あるいは3個〜約8個の炭素原子を持つシクロアルキル基である。また、C1-C4の直鎖状または分枝状のアルキル基またはアルコキシ基、あるいはC3-C8の環状アルキル基またはアルコキシ基(好ましくは、C1-C4の直鎖状または分枝状のアルキル基またはアルコキシ基)は「低級アルキル」基または「低級アルコキシ」基とも呼ばれ;-F、-Cl、-Br、または-Iにより置換されているかかる基は、「低級ハロアルキル」基または「低級ハロアルコキシ」基であり;「低級ヒドロキシアルキル」は、-OHにより置換されている低級アルキルである。
【0075】
本明細書では、「アルキレン基」は、-(CH2)n-(式中、nは1〜10、好ましくは1〜4の整数である)で表される連結アルキル鎖である。
【0076】
本明細書では、「アリール」という用語は、例えばフェニル、ビフェニルなどのC6-C14の炭素環式芳香族基を意味する。またアリール基には、炭素環式芳香族環が別のアリール環、シクロアルキル環または脂環式環に縮合されている縮合多環式芳香族環系、例えばナフチル基、ピレニル基、アントラシル基なども含まれる。
【0077】
本明細書では、「ヘテロアリール」という用語は、1個または複数のO、SまたはNヘテロ原子を有する5〜14員のヘテロアリール基を意味する。ヘテロアリール基の例としては、イミダゾリル、イソイミダゾリル、チエニル、フラニル、フルオレニル、ピリジル、ピリミジル、ピラニル、ピラゾリル、ピロリル、ピラジニル、チアゾリル(thiazoyl)、イソチアゾリル、オキサゾリル、イソオキサゾリル、1,2,3-トリアゾリル(trizaolyl)、1,2,4-トリアゾリル、イミダゾリル、チエニル、ピリミジニル、キナゾリニル、インドリル、テトラゾリル等が挙げられる。またヘテロアリール基には、炭素環式芳香族環またはヘテロアリール環が1個または複数の他のヘテロアリール環に縮合している、縮合多環式芳香族環系が含まれる。例としては、ベンゾチエニル、ベンゾフラニル、インドリル、キノリニル、ベンゾチアゾリル、ベンゾイソチアゾイル、ベンゾオキサゾリル、ベンゾイソオキサゾリル、ベンゾイミダゾリル、キノリニル、イソキノリニルおよびイソインドリルが挙げられる。
【0078】
本明細書では、非芳香族複素環基は、環中にN、OまたはSなどの1個または複数のヘテロ原子を含んでいる、非芳香族炭素環である。環は、5員、6員、7員、または8員であってもよい。例としては、オキサゾリニル、チアゾリニル、オキサゾリジニル、チアゾリジニル、テトラヒドロフラニル、テトラヒドロチオフェニル、モルホリノ、チオモルホリノ、ピロリジニル、ピペラジニル、ピペリジニル、チアゾリジニル、環状糖類(例えば、ピラノース形およびフラノース形のグルコース、マンノース、ガラクトース、アロース、アルトロース、グロース、イドース、タロースなど)等が挙げられる。
【0079】
アルキル基、シクロアルキル基、脂肪族基、脂環式基、複素環基、ベンジル基、アリール基またはヘテロアリール基中の置換可能な原子に対する好適な任意の置換基は、記載したISA427代謝体の薬理活性を実質的に阻害しない置換基である。「置換可能な原子」とは、置換基と1つもしくは複数の対応する共有結合もしくはイオン結合を形成し得る、1個もしくは複数の原子価または電荷を持つ原子である。例えば、利用可能な1個の原子価を持つ炭素原子(例えば-C(-H)=)は、アルキル基に1個の単結合を形成する(例えば-C(-アルキル)=)ことができ、利用可能な2個の原子価を持つ炭素原子(例えば-C(H2)-)は、1個または2個の置換基に1個または2個の単結合を形成する(例えば-C(アルキル)(H)-、-C(アルキル)(Br))-)か、あるいは1個の置換基に二重結合を形成する(例えば-C(=O)-)ことができる。本明細書で検討した置換基には、安定した化合物を形成するこれらの置換のみが含まれる。
【0080】
例えば、置換可能な炭素原子に対する好適な任意の置換基(例えば、R5〜R10によって表される置換基)としては、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-SRa、-C(S)Ra、-OC(S)Ra、-C(S)ORa、-C(O)SRa、-C(S)SRa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(0)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORa、-NRcC(O)N(RaRb)、-C(NRc)-N(RaRb)、-NRd-C(NRc)-N(RaRb)、-NRaN(RaRb)、-CRc=CRaRb、-C≡CRa、=O、=S、=CRaRb、=NRa、=NORa、=NNRa、任意に置換されていてもよいアルキル基、任意に置換されていてもよいシクロアルキル基、任意に置換されていてもよい脂肪族基、任意に置換されていてもよい脂環式基、任意に置換されていてもよい複素環基、任意に置換されていてもよいベンジル基、任意に置換されていてもよいアリール基、および任意に置換されていてもよいヘテロアリール基が挙げられ、この場合、Ra〜Rdは、それぞれ独立に-Hであるか、または任意に置換されていてもよい脂肪族基、任意に置換されていてもよい脂環式基、任意に置換されていてもよい複素環基、任意に置換されていてもよいベンジル基、任意に置換されていてもよいアリール基、もしくは任意に置換されていてもよいヘテロアリール基であるか、あるいは、-N(RaRb)が一緒になって、任意に置換されていてもよい複素環基である。
【0081】
別の原子に対して2つの共有結合を有している窒素原子(例えば、記載したISA247代謝体のアミノ酸残基1〜11中のアミノ酸窒素)に対する好適な置換基としては、例えば、任意に置換されていてもよいアルキル基、任意に置換されていてもよいシクロアルキル基、任意に置換されていてもよい脂肪族基、任意に置換されていてもよい脂環式基、任意に置換されていてもよい複素環基、任意に置換されていてもよいベンジル基、任意に置換されていてもよいアリール基、任意に置換されていてもよいヘテロアリール基、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-SRa、-S(O)Ra、-SO2Ra、-SO3Ra、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORa、-NRcC(O)N(RaRb)等が挙げられる。
【0082】
窒素含有ヘテロアリールまたは非芳香族複素環は、酸素により置換して窒素酸化物を(例えば、ピリジル窒素酸化物、ピペリジル窒素酸化物の中などに)形成させることができる。例えば、各種の実施形態では、窒素含有の複素環基またはヘテロアリール基中の環窒素原子を置換して窒素酸化物を形成させることができる。
【0083】
本明細書では、「製薬上許容される」という用語は、物質(例えば、組成物、担体、希釈剤、試薬、塩など)が哺乳動物体内へ、または哺乳動物表面に投与可能であることを意味する。
【0084】
また、本発明には、記載したISA247代謝体の製薬上許容される塩も含まれる。これらの代謝体は、好適な有機塩基または無機塩基と反応して塩基付加塩を形成可能な、1種または複数の十分な酸性プロトンを有していてもよい。化合物が酸素、窒素または硫黄原子に結合されている水素原子を持つと述べられている場合、前記化合物には、この水素原子を好適な有機塩基または無機塩基と反応させて塩基付加塩を形成させたその塩も含まれることが意図される。塩基付加塩としては、無機塩基から誘導されたもの、例えば、アンモニウムまたはアルカリもしくはアルカリ土類金属の水酸化物、炭酸塩、重炭酸塩など、ならびに有機塩基から誘導されるもの、例えば、アルコキシド、アルキルアミド、アルキルアミンおよびアリールアミンなどが挙げられる。従って、本発明の塩を調製するのに有用なかかる塩基としては、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、炭酸カリウムなどが挙げられる。
【0085】
例えば、製薬上許容される塩としては、記載したISA247代謝体を、1当量の好適な塩基と反応させて1価の塩を形成することにより形成されたもの(すなわち、この化合物は、製薬上許容される対カチオン(例えば1価のカチオン)によって平衡化されている1個の負電荷を有している)、あるいは2当量の好適な塩基と反応させて2価の塩を形成することにより形成されたもの(例えば、この化合物は、2個の製薬上許容される対カチオン(例えば、2個の製薬上許容される1価のカチオンまたは1個の製薬上許容される2価のカチオン)によって平衡化されている2個の電子負電荷を有している)を挙げることができる。「製薬上許容される」とは、カチオンが被験体への投与に好適であることを意味する。例としては、Li+、Na+、K+、Mg2+、Ca2+およびNR4+が挙げられる。この場合、各Rは、独立に、水素、任意に置換されていてもよい脂肪族基(例えばヒドロキシアルキル基、アミノアルキル基もしくはアンモニウムアルキル基)、または任意に置換されていてもよいアリール基であるか、あるいは、2個のR基が一緒になって、任意に置換されていてもよい非芳香族複素環(芳香族環に縮合されていてもよい)を形成する。通常、製薬上許容されるカチオンは、Li+、Na+、K+、NH3(C2H5OH)+またはN(CH3)3(C2H5OH)+である。
【0086】
十分な塩基性基(例えばアミンなど)を有する記載したISA247代謝体の製薬上許容される塩は、記載したISA247代謝体を有機酸または無機酸と反応させ、酸付加塩を形成させることによって形成することができる。塩基性基を有する化合物からの酸付加塩の形成に一般に用いられる酸としては、無機酸(例えば、塩酸、臭化水素酸、ヨウ化水素酸、硫酸、リン酸など)、および有機酸(例えば、p-トルエンスルホン酸、メタンスルホン酸、シュウ酸、p-ブロモフェニルスルホン酸、炭酸、コハク酸、クエン酸、安息香酸、酢酸など)を挙げることができる。かかる塩の例としては、硫酸塩、ピロ硫酸塩、重硫酸塩、亜硫酸塩、亜硫酸水素塩、リン酸塩、一水素リン酸塩、二水素リン酸塩、メタリン酸塩、ピロリン酸塩、塩化物、臭化物、ヨウ化物、酢酸塩、プロピオン酸塩、デカン酸塩、カプリル酸塩、アクリル酸塩、ギ酸塩、イソ酪酸塩、カプロン酸塩、ヘプタン酸塩、プロピオール酸塩、シュウ酸塩、マロン酸塩、コハク酸塩、スベリン酸塩、セバシン酸塩、フマル酸塩、マレイン酸塩、ブチン-1,4-ジオエートおよびヘキシン-1,6-ジオエート、安息香酸塩、クロロ安息香酸塩、安息香酸メチル、ジニトロ安息香酸塩、ヒドロキシ安息香酸塩、メトキシ安息香酸塩、フタル酸塩、スルホン酸塩、キシレンスルホン酸塩、酢酸フェニル、フェニルプロピオン酸塩、フェニル酪酸塩、クエン酸塩、乳酸塩、γ-ヒドロキシ酪酸塩、グリコール酸塩、酒石酸塩、メタンスルホン酸塩、プロパンスルホン酸塩、ナフタレン-1-スルホン酸塩、ナフタレン-2-スルホン酸塩、マンデル酸塩などが挙げられる。
【0087】
また、製薬上許容される溶媒和物も含まれる。本明細書では、「溶媒和物」という用語は、非共有結合の分子間力によって結合されている、化学量論的量または非化学量論的量の溶媒(例えば水、有機溶媒)をさらに含んでいる、本発明の化合物またはその塩を意味する。
【0088】
また、記載したISA247代謝体を含んでいる医薬用組成物も含まれる。「医薬組成物」は、被験体へ投与する医薬組成物の一部分として許容可能な医薬用担体と一緒に、記載したISA247代謝体を含む。投与する化合物の剤形は、選択される投与経路(例えば、経口投与、静注、非経口投与もしくは局所投与、溶液剤、エマルジョン剤、カプセル剤、クリーム剤、軟膏等)によって変わる。好適な医薬用担体は、本化合物と相互に作用しない不活性成分を含有していてもよい。標準的な医薬製剤技術については、例えば、Remington's Pharmaceutical Sciences (Mack Publishing Company, Easton, Pa)に記載されている技術などを用いることができる。非経口投与に好適な医薬用担体としては、例えば、滅菌水、生理食塩水、静菌性生理食塩水(約0.9%mg/mlベンジルアルコール含有生理食塩水)、リン酸緩衝生理食塩水、ハンクス溶液、リンゲル乳酸塩等が挙げられる。組成物のカプセル化方法(例えば、硬性ゼラチンまたはシクロデキストラン(cyclodextrasn)のコーティングの場合など)は当技術分野で公知である(Bakerら, "Controlled Release of Biological Active Agents", John Wiley and Sons, 1986)。
【0089】
特定の記載したISA247代謝体は、異なる立体異性体(例えば、ジアステレオマーおよびエナンチオマー)として取得可能であること、また、本発明は、記載した化合物のすべての異性体形態およびラセミ混合物、ならびに、純粋な異性体およびその混合物(ラセミ混合物を含む)で被験体を治療する方法を含んでいることも理解されよう。立体異性体は、クロマトグラフィーなどの任意の好適な方法を用いて分離および単離することができる。
【0090】
ヒト全血、尿または胆汁からのISA247代謝体の同定および単離
これらの液体に対して有機抽出法を使用し、代謝体をメタノールで抽出、乾燥、再調製し、質量分析連結型のクロマトグラフィー技術を用いて同定した。
【0091】
ISA247代謝体の化学合成
ISA247の代謝体は、化学合成により調製することができる。シクロスポリンAの一水酸化代謝体CsA-Am1は、既に"Synthesis of the main metabolite (OL-17) of cyclosporin A," J. Org. Chem. Vol. 57, No. 9, pp. 2689-2691 (1992)に報告されているように、M.K. EberleおよびF. Nuningerによって合成されている。Eberleらは、シクロスポリンAがヒトおよび動物内でシクロスポリンに代謝され、それによって(1-アミノ酸残基の側鎖上にある)元のアリルメチル基が対応するアリルアルコールに酸化されることを記載している。Eberleらは、アミノ酸1残基のβ-アルコールを保護し、次いで、アセチルシクロスポリンA(アセチルCsA)をN-ブロモスクシンイミド(NBS)で処理することによるアリル臭素化の条件に、得られたアセチルCsAを供することにより、「in vitroでこの代謝経路を再現することを試みた」。次いで、そのステップから得られた生成物をテトラブチルアンモニウムアセテートの存在下で加熱した。これは、臭化物がアセテートにより交換されるように作用する。最後に、ナトリウムメトキシドの存在下で、アセテートのトランスエステル化をメタノール中で行ない、アセテート基をアルコール官能基に交換することにより、この合成を終えた。報告によれば、このシクロスポリンAからOL-17代謝体への変換は、その後の逆相カラムクロマトグラフィーから収率が28%であることが確認された。
【0092】
同様の合成経路を用いて、IM4、IM6およびIM9などのISA247代謝体を生成することができる。さらに述べれば、ペンダントメチル基などのアルキル炭素が水酸化されているすべての代謝体を生成することができる。例えば、水酸化は、ISA247のアミノ酸1残基の側鎖内のγ-CH3で起こり得る。従って、側鎖のβ-γ-CH3炭素にわたって1,2ジオールが生じる。
【0093】
別の実施形態では、代謝体IM4、IM6およびIM9は、(1) 親化合物ISA247のアミノ酸1残基のβ-アルコールを保護して、保護されたISA247の化合物を形成させるステップと、(2) 保護されたISA247をN-ブロモスクシンイミド(NBS)などのハロゲン化剤で処理し、4、6、または9-アミノ酸残基の側鎖のγ炭素でハロゲン化されている(一実施形態では、臭素化されている)、保護されたISA247を形成させるステップと、(3) 前ステップの生成物を、テトラブチルアンモニウムアセテートなどの置換試薬の存在下で加熱し、アセテート含有生成物を形成させるステップと、(4) 前ステップのアセテート含有生成物のアセテート部分をアルコール部分に交換するトランスエステル化を行ない、水酸化代謝体を形成させるステップにより合成することができる。ISA247のアミノ酸1残基以外の残基の側鎖に関する一水酸化の一般的な化学的概念は、上述のCsAのアミノ酸1残基の側鎖に関する一水酸化の概念と同じであってもよい。しかし、ISA247中には存在するがCsAには存在しない共役ジエン系のことを考慮すると、ISA247のアミノ酸1残基で水酸化される代謝体を取得するには、実質的に異なる合成手法を用いなければならないと考えられる。
【0094】
別の実施形態では、ISA247代謝体の化学合成に向けて、ISA247のアミノ酸1の側鎖のアルケン部分を直接的に、またはエポキシド中間体を経由して、ジオールに変換することができる。例えば、アルケンからエポキシドへの変換は、化学文献で公知である。Prilezhaev反応を用いる一実施形態では、オレフィンを好適な酸化剤で処理すると、オレフィンの炭素-炭素二重結合にわたって酸素が付加され、その結果エポキシドが形成され得る。この反応で使用可能な一般的な酸化剤は過酸であり、本発明の一実施形態では、m-クロロ過安息香酸(MCPBA)が好ましい試薬である。他の過酸、例えば、過酢酸、トリフルオロ過酢酸、過安息香酸および3,5-ジニトロ過安息香酸などもまた使用可能である。また本発明のアルケン含有シクロスポリンを過酸化水素、アルキルパーオキシドまたは酸素で処理することによっても、エポキシドを形成することができると考えられる。
【0095】
次いで、本発明のエポキシド含有代謝体は、水による求核攻撃を受けて、1,2-ジオールを形成することができる。この反応は、酸または塩基のいずれかによって触媒され得る。本発明の一実施形態では、過塩素酸が好ましい試薬であるが、Nafion-Hまたはギ酸など他の酸触媒もまた効果的であり得る。別の実施形態では、エポキシド代謝体のジメチルスルホキシド中でのアルカリ加水分解は、塩基性条件下で実施することができる。さらに別の方法としては、酵素ミクロソームエポキシドヒドロラーゼにより触媒されるエポキシド加水分解が意図される。この方法には、反応によって、反応生成物にある程度の立体選択性が取り入れられ得るという点で特に利点がある。
【0096】
あるいは、アルケンは、多数の異なる試薬により1,2-ジオールに直接変換することができる。四酸化オスミウムおよびアルカリ性過マンガン酸カリウムによりsyn付加が生じ得る。同様に、過酸化水素またはt-ブチルヒドロペルオキシドなどの試薬によっても、四酸化オスミウム触媒の存在下でsyn付加が生じ得る。反対に、anti付加は、例えば、過酸化水素およびギ酸、またはモノ過コハク酸での処理を介して可能である。アルケンをヨウ素および安息香酸銀または酢酸銀で処理すると中間体のジエステルが得られ、これは容易に加水分解され1,2-ジオールを得ることができる。同様に、四酢酸鉛または酢酸タリウムで酸化すると、加水分解可能なジオールのビスアセテートが得られる。従って、オレフィン類から1,2-ジオールへの直接変換に、多数の方法を用いることができるということが当業者には理解されよう。
【0097】
アルケンを1,2-ジオールに変換する前述の合成方法は、ISA247のジオール代謝体の合成的調製に有用であると考えられる。ISA247のアミノ酸1残基の側鎖の共役ジエン部分のアルケンは、直接的に、またはエポキシドなどの中間体を経由て、ジオールに化学的に変換することができる。次いで、得られた化合物を、他の技術によって生成した(例えば、ウサギまたはイヌのミクロソーム系により生成した)代謝体と比較し、マッチさせることができる。ISA247から形成したエポキシド中間体は薬理活性を持っていることが予想され、従って、有望な治療薬として関心が高まる可能性があると本発明者らは考えている。
【0098】
ISA247は、構造的にアミノ酸1の化学組成内だけがシクロスポリンAと異なるため、シクロスポリンAの特定の代謝体は、ISA247代謝体合成の中間体として使用することができる。例えば、AM4n(アミノ酸4残基のN-脱メチル化)およびAM9(アミノ酸9残基の側鎖上の水酸化)などのシクロスポリンA代謝体は、シクロスポリンAをISA247に変換する同一化学工程によって、類似のISA247代謝体に変換することができる。
【0099】
哺乳動物ミクロソーム系によるISA247代謝体の調製
シクロスポリンAおよびISA247は、ヒトおよび他の動物由来のミクロソーム系により広く代謝されている(Christians, 1993)。ヒト肝臓ミクロソーム調製物においては、シクロスポリンからその代謝体への変換は、NADPH依存性である。この代謝は、一酸化炭素、ケトコナゾール、シメチジンおよびSKF525Aによって阻害することができる。これらの阻害剤は特定のシトクロムP-450阻害剤であることが知られていることから、シクロスポリンの代謝は、シトクロムP-450系のモノオキシゲナーゼ機能により仲介されていることが示唆された。また本発明者らは、ISA247もシトクロムP-450酵素系により代謝されていることをすでに明らかにしている。
【0100】
ミクロソーム系は当技術分野で周知であり、適切な組織(これには、ウサギ、イヌ、ブタ、ウシ、ヒツジ、霊長類、ラット、マウスなどの哺乳動物の肝臓、腎臓、胃腸組織等から得た組織が含まれ得る)をホモジナイズし、100,000×gで遠心分離することにより調製され、ミクロソームペレットが得られる。これは、再調製すると、in vivoにおけるISA247の代謝の再現に使用することができる。代謝体がミクロソーム調製物中に生成された場合、HPLC/MSもしくはNMRまたは他の技術を用いて、ISA247代謝体を単離し分析することができる。
【0101】
微生物を用いた生体内変換法によるISA247代謝体の調製
本発明の実施形態では、ISA247の代謝体は、微生物の培養物および生体内変換を利用して調製することができる。特定の微生物がヒトシトクロムP-450系の活性を再現する能力を持つことから、生体内変換を用いて、ヒトでのISA247代謝体に対応するISA247の代謝体を生成させることができる。
【0102】
生体内変換法で有用と思われる具体的な微生物としては、アクチノプラネス属の種(Actinoplanes sp.)(例えばATCC No. 53771、American Type Culture Collection Manassas, VA USAから入手可能)、ストレプトマイセス・グリセウス(Streptomyces griseus)(例えばATCC 13273)、サッカロポリスポラ・エリスレア(Saccharopolyspora erythraea)(例えばATCC No. 11635)、およびストレプトマイセス・セトニ(Streptomyces setonii)(例えばATCC No. 39116)が挙げられる。他の有用な微生物としては、アミコラータ・オートトロフィカ(Amycolata autotrophica)(例えばATCC No. 35204、プセウドノカルジア・オートトロフィカ(Pseudonocardia autotrophica)としても知られる)、ストレプトマイセス・カリフォルニカ(Streptomyces californica)(例えばATCC No. 15436)、サッカロポリソラ・ヒルステ(Saccharopolysora hirsute)(例えばATCC No. 20501)、ストレプトマイセス・ラバンデュラエ(Streptomyces lavandulae)(例えばATCC 55209)、ストレトマイセス・オーレオファシエンス(Stretomyces aureofaciens)(例えばATCC 10762)、ストレプトマイセス・リモサス(Streptomyces rimosus)(例えばATCC 28893、ペニシリウム・エクスパンサム(Penicillium expansum)しても知られる)、バチルス・サブチリス(Bacillus subtillis)(例えばATCC 55060)、およびノカルジア・アステロイド(Nocardia asteroids)(例えばATCC 3318、ノカルジア・ファルシニカ(Nocardia farcinica)としても知られる)を挙げることができる。各種の実施形態では、有用な微生物としては、クルブラリア・ルナータ(Curvularia lunata)(例えば、ATCC 12017またはUAMH 9191、University of Alberta Microfungal Collection and Herbarium, Edmonton, Alberta, Canadaから入手可能)、クンニングアメラ・エチヌラータ var. エレガンス(Cunninghamella echinulata var. elegans)(例えばUAMH 7370、 ATCC 36112)、クルブラリア・エチヌラータ var. ブラケスレーナ(Curvularia echinulata var. blakesleena)(例えばUAMH 8718、 ATCC 8688a)、クンニングアメラ・エチヌラータ var. エレガンス(Cunninghamella echinulata var. elegans)(例えばUAMH 7369、 ATCC 26269)、ボーバリア・バシアナ(Beauvaria bassiana)(例えばUAMH 8717、 ATCC 7159)、アクチノマイセス属(Actinomycetes)(例えばATCC 53828)、アクチノプラネス属(Actinoplanes)(例えばATCC 53771)、クンニングアメラ・エチヌラータ(Cunninghamella echinulata)(例えばUAMH 4144、 ATCC 36190)、クンニングアメラ・エチヌラータ(例えばUAMH 7368、 ATCC 9246)、クンニングアメラ・ベニエーレ(エチヌラータ)(Cunninghamella bainiere (echinulata))(例えばUAMH 4145、ATCC 9244)、およびサッカロポリスポラ・エリスレ(Saccharopolyspora erythrae)(例えばATCC 11635)を挙げることができる。
【0103】
本発明者らの知る限りにおいては、恐らく、これらの化合物が親油性であるこという理由から、慣用の生体内変換法では、シクロスポリンおよびISA247の代謝体の生成は成功していない。いかなる理論にも束縛されるものではないが、ISA247などの疎水性化合物は、フィルター、カラム、ならびにこの培養および工程の実施で使用する他の器具の表面に付着する傾向があること、また生成物代謝体(例えばISA247)は、その薬剤を培地に無菌的に添加する際に使用するフィルターの表面に付着する傾向があることが考えられる。
【0104】
本発明の実施形態では、ISA247の代謝体(CsAおよびISA247の代謝体を含む)は、薬剤と少なくとも1種の界面活性剤の混合物を調製するステップと、微生物の増殖培地に前記の薬剤・界面活性剤の混合物を直接加えるステップにより生成することができる。界面活性剤は滅菌していてもよい。本発明者らは、このステップに従った場合、生体内変換がより生産性の高いものになることを確認した。この方法の特定の実施形態では、界面活性剤はTweenである。
【0105】
好適な界面活性剤は、微生物増殖環境へ入れる前に、オートクレーブにかけることができる。好適な界面活性剤は生体適合性の界面活性剤であり、ポリエチレングリコールなどの非イオン性界面活性剤、例えば、PEG 300、PEG 400、PEG 600(BASF製のLutrol(登録商標) E 300、Lutrol(登録商標) E 400、Lutrol(登録商標) E 600、Lutrol(登録商標) F 127、およびLutrol(登録商標) F 68としても知られる);カプリロカプロイルマクロゴール-8グリセリド(例えば、Labrasol(登録商標)(Gatte Fosse, Cedex France));ポリオキシエチレンソルビタン脂肪酸エステル(例えば、Tween(登録商標) 20、Tween(登録商標) 21、Tween(登録商標) 40、Tween(登録商標) 80、Tween(登録商標) 80K、Tween(登録商標) 81、およびTween(登録商標) 85 (ICI Americas Inc., Bridgewater NJ、Aldrich Chemical Company Inc., Milwaukee Wis.から入手可能));グリセリン(BDH Fine Chemicals, Toronto Ont.);ヒマシ油(Wiler Fine Chemicals Ltd, London Ont.);ミリスチン酸イソプロピル(Wiler Fine Chemicals Ltd, London Ont.);Cremaphor EL(Sigma Chemical, St Louis MO);ならびにポロキサマー(例えば、Pluronics(登録商標) F127およびPluronics(登録商標) L108(BASF))が挙げられるが、これらに限定されるものではない。他の使用可能な界面活性剤としては、滑剤または乳化剤として作用し得るもの、例えば、チロキサポール(ホルムアルデヒドおよびオキシランとの4-(1,1,3,3-テトラメチルブチル)フェノールポリマー);ポリエトキシ化ヒマシ油(例えば、BASF製のCremaphor A25、Cremaphor A6、Cremaphor EL、Cremaphor ELP、Cremaphor RH、およびRhone Poulenc Co製のAlkamuls EL620);ポリエトキシ化硬化ヒマシ油(例えばHCO-40);ならびにポリエチレン9ヒマシ油が挙げられる。
【0106】
他の使用可能な界面活性剤としては、ポリソルベート20、ポリソルベート60およびポリソルベート80;Cremaphor Rh;ポロキサマー;Pluonics L10、L31、L35、L42、L43、L44、L61、L62、L63、L72、L81、L101、L121、L122;PEG 20アーモンドグリセリド;PEG 20コーングリセリドなどが挙げられる。また好適な界面活性剤としては、以下のものが挙げられる:アルキルグルコシド;アルキルマルトシド(alkylmaltosides);アルキルチオグルコシド;ラウリルマクロゴールグリセリド;ポリオキシエチレンアルキルエーテル;ポリオキシエチレンアルキルフェノール;ポリエチレングリコール脂肪酸エステル;ポリエチレングリコールグリセリン脂肪酸エステル;ポリオキシエチレンポリオキシプロピレンブロックコポリマー;ポリグリセリン脂肪酸エステル;ポリオキシエチレングリセリド;ポリオキシエチレンステロール;ポリオキシエチレン植物油;ポリオキシエチレン水素化植物油;ポリオキシエチレンアルキルエーテル;ポリエチレングリコール脂肪酸エステル;ポリエチレングリコールグリセリン脂肪酸エステル;ポリオキシエチレンソルビタン脂肪酸エステル;ポリオキシエチレンポリオキシプロピレンブロックコポリマー;ポリグリセリン脂肪酸エステル;ポリオキシエチレングリセリド;ポリオキシエチレン植物油;ポリオキシエチレン水素化植物油;以下のものなどのポリオール類の反応混合物:PEG-10ラウリン酸塩、PEG-12ラウリン酸塩、PEG-20ラウリン酸塩、PEG-32ラウリン酸塩、PEG-32 ジラウリン酸塩、PEG-12オレイン酸塩、PEG-15オレイン酸塩、PEG-20オレイン酸塩、PEG-20ジオレイン酸塩、PEG-32オレイン酸塩、PEG-200のオレイン酸塩、PEG-400オレイン酸塩、PEG-15ステアリン酸塩、PEG-32 ジステアリン酸塩、PEG-40ステアリン酸塩、PEG-100ステアリン酸塩、PEG-20ジラウリン酸塩、PEG-25トリオレイン酸グリセリン、PEG-32ジオレイン酸塩、PEG-20ラウリン酸グリセリン、PEG-30ラウリン酸グリセリン、PEG-20ステアリン酸グリセリン、PEG-20オレイン酸グリセリン、PEG-30オレイン酸グリセリン、P
EG-30ラウリン酸グリセリン、PEG-40ラウリン酸グリセリン、PEG-40パーム核油、PEG-50硬化ヒマシ油、PEG-40ヒマシ油、PEG-35ヒマシ油、PEG-60ヒマシ油、PEG-40硬化ヒマシ油、PEG-60硬化ヒマシ油、PEG-60トウモロコシ油、PEG-6カプリン酸/カプリル酸グリセリド、PEG-8カプリン酸/カプリル酸グリセリド、ポリグリセリル-10ラウレート、PEG-30コレステロール、PEG-25フィトステロール、PEG-30大豆ステロール、PEG-20トリオレイン酸塩、PEG-40オレイン酸ソルビタン、PEG-80ラウリン酸ソルビタン、ポリソルベート20、ポリソルベート80、POE-9ラウリルエーテル、POE-23ラウリルエーテル、POE-10オレイルエーテル、POE-20オレイルエーテル、POE-20ステアリルエーテル、トコフェリルPEG-100コハク酸、PEG-24コレステロール、ポリグリセリル-10オレエート、スクロースモノステアレート、スクロースモノラウレート、スクロースモノパルミテート、PEG 10-100ノニルフェノールシリーズ、PEG 15-100オクチルフェノールシリーズ、ポロキサマー;PEG-35ヒマシ油、PEG-40硬化ヒマシ油、PEG-60トウモロコシ油、PEG-25トリオレイン酸グリセリン、PEG-6カプリン酸/カプリル酸グリセリド、PEG-8カプリン酸/カプリル酸グリセリド、ポリソルベート20、ポリソルベート80、トコフェリルPEG-1000コハク酸、およびPEG-24コレステロール、ポロキサマー。さらに油、例えばアーモンド油;ババスー油;ルリヂサ油;ブラックカラント種子油;キャノーラ油;ヤシ油;トウモロコシ油;綿実油;月見草油;ブドウ種子油;ラッカセイ油;からし油;オリーブ油;パーム油;パーム核油;落花生油;菜種油;サフラワー油;ゴマ油;鮫肝油;大豆油;ひまわり油;硬化ヒマシ油;水素化ヤシ油;水素化パーム油;水素化大豆油;水素化植物油;水素化綿実油およびヒマシ油;部分的水素化大豆油;大豆油;トリカプロン酸グリセリン;トリカプリル酸グリセリン;トリカプリン酸グリセリン;トリウンデカン酸グリセリン;トリラウリン酸グリセリン;トリオレイン酸グリセリン;トリリノール酸グリセリン;トリリノレン酸グレイセリン;トリカプリル酸/
カプリン酸グリセリン;トリカプリル酸/カプリン酸/ラウリン酸グリセンリン;トリカプリル酸/カプリン酸/リノール酸グリセリン;トリカプリル酸/カプリン酸/ステアリン酸グリセリン;飽和ポリグリコール化(polyglycolized)グリセリド;リノール酸グリセリド;カプリル/カプリングリセリドを用いることができる。さらに、界面活性剤および/または油および/またはアルコールの混合物を用いてもよい。
【0107】
本発明の特定の実施形態では、親化合物は、活発に増殖している微生物培養物へ添加する前に、エタノールなどのアルカノールおよび好適な非イオン性界面活性剤と混合する。親化合物をアルコールと混合する場合には、アルコールはエタノールであってもよい。追加の好適なアルコールとしては、メタノール、および当技術分野で周知の他の好適なアルコールが挙げられる。
【0108】
増殖培地中に微生物を含む生物反応混合物に、親化合物・界面活性剤混合物を添加した後、親化合物が代謝され得る時間および条件下で生物反応を進行させる。所望の時間を経た後、代謝体を生物反応混合物から抽出し、精製により(例えば、高圧液体クロマトグラフィーおよび質量スペクトル分析(HPLC-MS)などのクロマトグラフィーにより)分離する。また核磁気共鳴分析法を用いて、個別の代謝体が互いに単離されたことを確認し、その構造を確認することができる。
【0109】
本発明の一部の実施形態では、エタノール中のISA247をグリセリンと混合し、次いで、サッカロポリスポラ・エリセレア(Saccharopolyspora erytheraea) ATCC 11635を含有している生物変換系に添加する。別の実施形態では、ISA247を生物変換系へ添加する前に、PEG 400をエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、ヒマシ油をエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、ミリスチン酸イソプロピルをエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、Cremaphorをエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、Labrasol(登録商標)をエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、Tween 40をエタノール中のISA247と混合する。
【0110】
ISA247代謝体の分析および解明
ISA247の代謝体は、質量分析連結型(HPLC-MSまたはLC-MS/MS)の高速液体クロマトグラフィー(HPLC)を用いて、それらの化学的特性およびそれらの動力学的パラメータにより分離した。
【0111】
本発明者らは、質量分析連結型の液体クロマトグラフィー技術を用いて、ISA247代謝体を分析する定性的手法および定量的手法を開発した。これらの方法では、in vitroおよびin vivoで生成したISA247代謝体の単離、および特性決定が可能であるとともに、薬物動態研究の一部として、全血または他の体液におけるISA247代謝体の定量的モニタリングに都合が良い。
【0112】
分析物の同定は、高圧液体クロマトグラフィー(HPLC)データから取得した保持時間、およびエレクトロスプレーイオン化(ESI)質量スペクトルデータから取得した構造特異的イオンフラグメント情報に基づいて実施する。図6は、SCIEXTM三連四重極型質量分析計を用いた、MRMモード(Multiple Reaction Monitoring mode)におけるLCMSトレースである。
【0113】
図6のHPLC-MRMスキャンは、ヒト全血から単離された典型的なISA247の代謝プロファイルを表しており、これは、肝臓ミクロソームまたは生物変換の供給源から調製したISA247抽出物で確認されたLC-MSフラグメンテーションプロファイルと一致している。図6のMRMスキャンでは、少なくとも4つの異なるジオールピーク(Diol(1)、Diol(2)、Diol(3)およびDiol(4))を示す1271/1113範囲の4つのピーク、IMXnX(2)、IMXnX(4)およびIMXnX(6)と標識した1239/1115範囲の3つの小型ピーク、IMX(1)、IM9、IM4およびIMX(2)と標識した1253/1225範囲の4つのピーク、IM4nおよびIMXn(2)と標識した1223/1099範囲の2つのピーク、ならびに代謝されていない標準品により特定されるISA247に関する1237/1113の大型ピークが明らかになっている。さらにいくつかのピークが示されているが、標識はしていない。
【0114】
さらに、変換されたISA247のHPLC精製物質の構造を、以下の一般的条件を用いた核磁気共鳴(NMR)技術を使用して解明した。1Dおよび2D NMRスペクトルは、25〜27℃で、Varian Inova 800および/または500MHz、ならびに/またはVarian Mercuryplus 400MHz分光計においてベンゼン-d6で記録した。基準として、ベンゼンシグナルを、1H-NMRではδ7.15ppmに、13C-NMRではδ128.06ppmに設定した。ベンゼンd6の試料濃度は0.5〜1mg/〜0.7mlで用いた。得られたスペクトルは、ACD/Labs (Advanced Chemistry Development Inc., Toronto, Canada)の2D NMRプロセッサーソフトウェアを用いて解析した。
【0115】
アミノ酸1での変換:ジオール、環化体およびエポキシド
図6に示す通り、ヒト全血から単離された代謝体は、一連の主要な代謝体ピークが、約6.5〜8分の保持時間で、かつ1271/1113m/zの親イオン/フラグメントイオン対で起こることが明らかである。これは、1237m/zの親ISA247の質量に34質量単位が加わっていることを示唆している。さらに、フラグメントイオンが1113m/zの質量を有するので、代謝体を構成する化学修飾がアミノ酸1残基に局所的であると結論を下すこともできる。この情報から、この修飾は、ε炭素位置とθ炭素位置の間のアミノ酸1のジエン領域でのジオール形成である可能性が高いと仮定することができた。
【0116】
ジオール代謝体は、さらに構造解析用のHPLCから単離することができる。材料の供給源に応じて、化学合成由来であるか、あるいは生物変換、ミクロソームまたは血液もしくは尿から単離されたものであるかにより、HPLCで見えるピークが異なる可能性があることに注意することが重要である。例えば、化学合成では、ジオール構造のRおよびSの両ジアステレオマーとして存在するジオールが生成され得るが、一方、酵素代謝では、ジオール構造の1つのジアステレオマーは形成されるが、もう一方のジアステレオマーは形成されない。酵素は、一配向にある基質を好適とし、それ以外は好適としない場合があり、従って、酵素では、一方のジアステレオマーが生成され、もう一方のジアステレオマーは生成されない場合がある。ジオール代謝体のジアステレオマーは、HPLCで異なるピークとして現れる可能性がある。というのは、それらが異なる化学的性質を有していて、カラムを通過する際、異なった移動が生じる可能性があるからである。従って、異なる手段によって(例えば、化学合成および生物変換によって)生成される代謝体のHPLCトレースは、異なるピークを有している場合がある。このため、図6に示したHPLCは、ヒト全血から単離したものではない代謝体の代表的なHPLCトレースではない可能性があることに注意することが重要である。さらに、ジオールで使用している命名法(すなわち、IM1-d-1)は、図6に示すHPLCピークに必ずしも対応していないことに注意することも重要である。この命名法は、表1に示した通り、それらの構造に照らし合わせて考えるべきである。
【0117】
化学合成、生物変換によって生成されたか、または血液もしくは尿から単離され、かつHPLC-MSを用いて単離された、ISA247のジオール代謝体構造のさらなる解明に、1H-NMR技術および2D NMR技術を用いた。図8は、IM1-d-1化合物をHPLC精製した生成物(ここで、前記生成物は、上述の微生物による生物変換方法により調製したものである(KI-2とも表示))から得られた1H-NMRスペクトルを、ISA247のE異性体およびZ異性体の1H-NMRスペクトルと比較して示す。これらの3種類のスペクトルを比較すると、約δ6〜7ppmのジエン領域におけるIM1-ジオール-1、すなわちIM1-d-1の1H-NMRでの変化が明らかであり、これはaa-1側鎖変換を示している。アミドNHプロトンおよびN-メチルプロトン領域は、この代謝体が2種類の主生成物と微量の混入物との混合物であって、4種類のNHシグナルと7種類のN-メチルシグナルがそれぞれの主生成物から生じていると想定されることを示している。この想定は、アミドプロトンシグナルを利用した相関スペクトルにより立証された。IM1-d-1の2D TOCSYスペクトルから、関連のαプロトンおよび側鎖メチル基とのアミドNHプロトン交差ピーク相関が得られた(図9)。このNMR分析によって、このジオール画分(KI-2)は主として2種類のジアステレオマーの1:1混合物からなり、アミノ酸1(aa-1)のη炭素での立体化学に違いがあることがわかった。このトランス二重結合立体配置は、Jεζ=15.0Hzを有する両ジアステレオマーのカップリング定数から決定された。提案されるIM1-d-1構造を図10に示す。
【0118】
図10は、IM1-d-1の構造が、トランスISA247のアミノ酸1(aa-1)側鎖のη位およびθ位でのジオールであることを示す。η位はキラル中心であることから、図10に示す通り、IM1-d-1化合物は、アミノ酸1のη炭素の立体配置で相違のある、2種類のジアステレオマーとして存在し得る。これらの2種類のジアステレオマーは、各ジアステレオマーが特定の物理化学特性を持つ異なる化学物質であることから、異なるNMRスペクトルを提供する。
【0119】
驚いたことに、NMR研究によれば、50:50のシス:トランスISA247の出発材料から(この場合、この代謝体は、生物変換法を用いて調製する(真菌を使用、KI-2試料))、図10に示したIM1-d-1ジアステレオマーの混合物が1:1のジアステレオマー比にて、トランス構造で生じることが明らかになった。しかし、主としてトランスISA247の出発材料を化学合成によって調製し(KI-2A試料)、HPLC-MSを用いて単離し、NMRを用いて試験した場合、3:2の比でIM1-d-1のジアステレオマーの混合物が生じる。IM1-d-1は、図42および図43に示すように、トランスISA247から形成される代謝体である。KI-2A NMRスペクトルで検出された異性体比の相違により、各ジアステレオマーのプロトン化学シフト帰属が得られるようになったが、図10に示すような構造の1つをNMRによる比率決定に帰属させることはできなかった。この矛盾は、これらの代謝体が、天然酵素(肝臓由来または真菌類由来のもの)を使用して生成されたか、あるいは実験室で化学反応を使用して生成されたかによって、1つのジアステレオマー代謝体が別の代謝体よりも優先的に生成される可能性があることを示唆している。例えば、化学合成中に、化学中間体の配向は、1つの異性体が別の異性体よりも富んでいるジアステレオマー混合物を生成し得る。あるいは、生物変換法では、複数のジアステレオマー代謝体が生成され、それらのジアステレオマーの1つが、さらにIM1-d-1とは異なる別の代謝体へと優先的に処理される可能性があり、これが、HPLCにおける対応ピークに存在する生成物の比率に食い違いを起こす。あるいは、化学法または生物変換法では、ジアステレオマーが生成され、これがIM1-d-1化合物とは異なる、別の代謝体へとさらに処理され、これがHPLCを用いた特定のピークに存在する生成物の比率に食い違いを起こす。表1は、上記のNMR分析に基づいた、IM1-d-1の化学シフト帰属を示す。この表には、NMRにより特定された1つの化合物が記載されているが、この試料中には2つ以上の化合物が認められた。第2の化合物に関する化学シフト情報は、表1には示していない。しかし、図43に、2種類の最終的なジオールジアステレオマー(IM1-d-1)を示している。
【表1】

【0120】
研究対象の第2のジオール(試料KI-3A)(すなわち、IM1-d-2)は、化学的に変換したISA247(シス:トランス=5:95)からHPLC精製を用いて単離し、1H-NMRおよび2D TOCSYにより解析してその構造を決定した。図11に、トランスISA247の1H-NMRスペクトルと比較した、IM1-d-2の1H-NMRスペクトルを示す。これらの1H-NMRスペクトルの比較では、δ6〜7ppmの間のジエンプロトンの欠如が示されており、このことはaa-1の側鎖での変換を示唆している。また、通常領域における4つのアミドNH 2重線と7つのN-メチル1重線についての所見では、環状ペプチド構造が完全であることが示唆された。図12は、ジオールの2D COSYおよびTOCSYスペクトルを示す。これらのスペクトルは、大部分のプロトンを直接的に帰属することができる、シグナルの結合性を提供する(ただし、変化が認められたaa-1側鎖のプロトンは除く)。δ3.8〜6.2ppmのαプロトン領域のCOSYスペクトルの拡大は、交差ピーク相関を示す実線を付けて、図13に示す。これはまた、一部の追加のプロトンの帰属を加えた図14に示す拡大1D 1H-NMRスペクトルでも明らかである。
【0121】
このCOSYスペクトルは、この領域に以下の4つの交差ピーク相関があることを示した:
δ5.55、4.29および4.16ppmでのシグナルに対するδ5.80ppmでのシグナル
δ4.16および4.02ppmでのシグナルに対するδ5.55ppmでのシグナル
δ4.26ppmでの1-βのシグナルに対するδ5.24ppmでの1-αのシグナル
δ4.16でのシグナルに対するδ4.29でのシグナル。
【0122】
δ5.80および5.55ppmで観測されたシグナルは、オレフィンプロトン(-CH=CH-)のものを示し、δ4.29、4.16および4.02ppmのシグナルは、アルコール炭素(>CH-OH)に結合しているプロトンのものを示す。δ4.29でのシグナルと4.16ppmでのシグナルの間のカップリング関係、ならびにこれらのシグナルとδ5.80ppmでのオレフィンプロトンシグナルの間のカップリング関係は、δ4.29ppmでのシグナルおよびδ4.16ppmでのシグナルが、二重結合(-C=CH-)に結合している第1級アルコール(HO-CH2-)のメチレンプロトンのものであり、アリルアルコール構造(HO-CH2-CH=CH2)につながることを示唆している。さらに、δ4.02ppmでのシグナルとδ5.55ppmでの他のオレフィンプロトンとのカップリングから、これらのプロトンに関する以下の全体構造が示唆された。
【化5】

【0123】
また上記の構造は、長距離相関、すなわち、δ5.55ppmでのプロトンとδ4.16ppmでのプロトンの間のCOSYスペクトルで観測された4つの結合カップリング(4J)結合性と一致する。
【0124】
二重結合立体配置は、図15の二重結合プロトンの拡大1Dスペクトルで示した通り、観測された15.2Hzのカップリング定数からトランスとして帰属された。δ4.29および4.16ppmでのメチレンプロトン、ならびにδ5.55ppmでの別の二重結合プロトンとのカップリングに基づく、δ5.80ppmでのシグナルの分裂パターン(2重線および3重線)は、提案した構造と一致している。δ5.55ppmでの二重結合プロトンに関して観測された2重線および2重線シグナルが若干広範に出現したのは、δ4.16ppmでのシグナルとの4Jの存在によって説明することができる。
【0125】
COSYスペクトルから、さらにaa-1側鎖プロトンの残りの以下のシグナル結合性が得られた:δ2.28ppmでの1-γに対するδ4.26ppmでの1-β;δ1.88ppmでの1-δ1、δ1.59ppmでの1-δ2、およびδ1.45ppmでの1-γCH2に対するδ2.28ppmでの1-γ;δ1.88ppmでの1-δ1、δ1.59ppmでの1-δ2に対するδ4.02ppmでの1-ε。これらの相関は、図16の部分的に拡大したCOSYスペクトルに示している。上記のスペクトル知見から、IM1-d-2構造が図17に示した通りであることが示唆された。
【0126】
図17は、2種類のジアステレオマー形態のIM1-d-2構造を示す。当業者は、図17に示した構造が、aa-1でトランス二重結合立体配置にあり、かつ、図42に機構的に説明したように、ε位での協奏的水攻撃によるエポキシド(IM1-e-2)開環によって形成された、二重結合移動生成物(IM1-d-2)であることに気づくであろう。従って、本化合物は、図17に示したいずれかのジアステレオマーの形態で存在し得る。しかし、上述したIM1-d-1構造とは異なり、この化合物には比較的明瞭なNMRスペクトルが現れた。従って、この構造は図17に示したジアステレオマーのうちの1つであると考えられる。図18は、IM1-d-2のアミノ酸1構造を、各炭素に結合しているプロトンに関する化学シフト帰属とともに示す。収集したIM1-d-2のスペクトルデータを、化学シフト帰属とともに表2に示す。
【表2】

【0127】

【0128】

【0129】
第3のジオール代謝体であるIM1-d-3(試料KI-3)は、ISA247(シス:トランス=50:50)の微生物変換とHPLC精製により得られた。図19に、IM1-d-1化合物と比較したIM1-d-3化合物(試料KI-3)の1H-NMRスペクトルを、トランスISA247(E-ISA247)およびシスISA247(Z-ISA247)と共に示す。図19に示したNMRスペクトルを比較することにより、aa-1側鎖変換を示す、δ6〜7ppmのジエン領域におけるIM1-d-3(試料KI-3)の1H-NMRスペクトルの変化が明らかになった。また質量試験の情報でも、ジオール形成を伴った、アミノ酸1側鎖での変化が示された。スペクトルの比較は、IM1-d-3とIM1-d-1が構造的に異なることを示したが、これらの質量試験の変化は、IM1-d-1代謝体から得られた変化と同様であった。
【0130】
スペクトルのアミドNHプロトンおよびN-メチルプロトン領域は、試料KI-3が1種類の主生成物と数種類の微量混入物との混合物であることを示唆している。従って、NMR分析は、主として2D TOCSYスペクトルから得られた交差ピーク相関によって、KI-3(IM1-d-3)の主要生成物に特化させた(図20を参照されたい)。アミドNHプロトン領域での2D TOCSYスペクトルは、主要アミドNHプロトンが、ISA247およびその代謝体で典型的に観測されるような、aa-2、aa-5、aa-7およびaa-8のものであり、かつ、2-γCH3、7-βCH3および8-βCH3などの特性シグナルへの2D相関の観測により同定可能であることを表していた。アミドプロトン相関の拡大TOCSYスペクトルは、一部のシフト帰属を含めて、図21および図22に示す。この主要代謝体の大部分のアミノ酸側鎖プロトンの化学シフトは、TOCSYスペクトル相関に基づいて同様に帰属された。4つのアミドプロトンおよび7つのN-メチル基1重線の存在、ならびにISA247および他の代謝体のものに類似のシグナル結合性パターンから、親ISA247の環状環構造が完全であることが示唆された。
【0131】
2D TOCSYスペクトルのαプロトン領域に関する詳しい実験から、恐らくアミノ酸1側鎖プロトンのδ55.86〜5.62〜4.62〜3.72〜3.60ppmでの1組の相関シグナル(図24を参照)が明らかにされた。またこれを、この領域の拡大1Dスペクトルに示した(図23を参照されたい)。δ5.86(9-αとオーバーラップ)および5.62ppmでのプロトンシグナルは、オレフィンプロトン(-CH=CH-)を明確に示し;δ5.62でのプロトンシグナルは、第2級アルコールプロトン(>CH-OH)を明確に示し;δ3.72および3.60ppmでのプロトンシグナルは、第1級アルコールプロトン(-CH2-OH)を明確に示している。IM1-d-3のδ5.62ppmでのプロトンはより低磁場にシフトされているが、図24の実線により描かれたこれらのプロトン相関は、代謝体IM1-d-1(KI-2またはKI-2A)で観測されたものに似ている。従って、代謝体IM1-d-3に関するNMRスペクトルおよび質量情報は、アミノ酸1のジオール形成に一致している。
【0132】
推定される二重結合のカウンタープロトンは9-αとオーバーラップしており、解析には利用不可能であるけれども、δ5.62ppmでのシグナルの一次解析(図25を参照)は、9.6Hzのカップリング定数を持つ三重線を示した。これは、シス立体配置の二重結合を示している。δ3.72および3.60ppmでの化学シフトは、構造上の基(-CH2-OH)が二重結合に直接的に結合していないことを示した。従って、これらの所見に基づいて、図26の構造が試料KI-3(代謝体IM1-d-3)の主要生成物であると考える。IM1-d-3ジオールは、図26に示す通り、aa-1のキラルη位で相違している、2種類のジアステレオマーとして存在し得る。図26に示した構造のη位の立体化学は測定されていない。しかし、別の試料KI-4A(シス:トランスの比が1:1のISA247から調製した化学的合成試料)を試験したところ、試料KI-4AのNMR分析(示さず)からは、KI-4A試料の主成分が、aa-1のη位での立体化学で相互に異なっている、KI-3試料の主成分のジアステレオマーであることがわかった。KI-4A試料は、KI-3試料に関する図19〜25に示したものとは異なるNMRスペクトルを表した。これらの構造の同定は可能であって、各ジアステレオマーを単離し研究することは可能であったが、1つの試料または他の試料にそれらのジアステレオマー構造の1つを決定的に帰属させることはできなかった。aa-1のη位でのR異性体またはS異性体のいずれがKI-4A試料またはKI-3試料に属しているかを決定することはできなかった。
【0133】
図26は、IM1-d-3が、aa-1のη炭素にキラル中心を持つシス立体配置のジオールであること、従って、2種類のジアステレオマー(KI-3およびKI-4A)として存在することを示唆している。IM1-d-3中の二重結合がシス立体配座にあり、かつIM1-d-1中の二重結合がトランス立体配座にあることを除けば、IM1-d-3はIM1-d-1と同じジオールである。この違いは、図6に示したHPLCスキャンにおいて、IM1-d-1代謝体とIM1-d-3代謝体を区別する。IM1-d-3の化学シフト帰属を表3に示す。
【表3】

【0134】

【0135】
単離する4番目のジオールはIM1-d-4(試料KI-8A)であった。微量の混入物を含む試料KI-8Aが、ISA247(シス:トランス=5:95)の化学変換から、試料KI-2A(IM1-d-1)およびKI-3A(IM1-d-2)に加えて得られた。HPLCにより単離されたIM1-d-4(試料KI-8A)をNMR分析したところ、予想通りにaa-1の側鎖での変換を意味する、δ6〜7ppmのジエンプロトンの欠如が明らかとなった。通常領域内の4つのアミドNH 2重線および7つのN-メチル1重線の観測からは、環状ペプチド構造が完全であることが示唆された。図27は、IM1-d-4(試料KI-8A)、トランスISA247またはE-ISA247の1H-NMRスペクトルの比較である。
【0136】
微量混入物をスペクトルで目視し得るが、IM1-d-4が試料KI-8の主成分であると思われる。さらに、図28Aおよび図28Bに示した2D COSYおよびTOCSYスペクトルの解析からは、aa-1側鎖の変換によるスペクトルのαプロトン領域で観測される少数のピークを除き、大部分のプロトンに関するシフト帰属が得られた。この比較からは、aa-1の側鎖での変換を意味する、δ6〜7ppm間のジエンプロトンの欠如が明らかである。αプロトン領域の拡大2D COSYスペクトルは、図29に示した通り、1-αおよび1-βの交差ピーク結合性と、帰属されていないプロトン(恐らくaa-1側鎖プロトン)を示している。図30に、この領域の拡大1Dスペクトルを、COSYスペクトルから得られた一部のピーク帰属とピーク相関を含めて示す。δ6.00(ddd)、5.44(dt)、5.15(dt)、4.28(m)および3.73ppm(m)でのシグナルの結合性(それぞれ1つのプロトンとして積分した)は、これらのプロトンが、aa-1の側鎖プロトンのように構造的に関連していることを示した。これらのうち、認識できる分裂パターンを提示したδ6.00(ddd)、5.44(dt)および5.15ppm(dt)でのシグナルを拡大し、図31に示した。
【0137】
δ6.00ppmの化学シフトは、このプロトンが、J=17.2Hzでδ5.44ppmでのプロトンに、またJ=10.6Hzでδ5.15ppmでのプロトンに結合しているオレフィンプロトンであり、その両方が、1.8Hzのカップリング定数で相互に結合しており、かつ、E-ISA247およびZのスペクトルで明らかなように、末端二重結合ジェミナルプロトンを示すことを意味した。通常領域における4つのアミドNH 2重線および7つのN-メチル1重線についての観測からは、環状ペプチド構造が完全であることが示唆された。
【0138】
IM1-d-4の全体構造を図32に図示している。aa-1のε炭素およびζ炭素が共にキラル中心であることに留意されたい。従って、図32に示した構造は、4種類の立体配置をとり得る。図32に示した構造を持つ化合物の正確な立体配置は決定されなかった。しかし、微量混入物が、主要化合物のaa-1側鎖のε炭素およびζ炭素で立体異性体を含み得ることが示唆されている。
【0139】
IM1-d-4の化学シフト帰属を表4に示す。
【表4】

【0140】

【0141】

【0142】
環化代謝体のIM1-c-1(試料KI-5)は、ISA247(シス:トランス=1:1)の生物変換とHPLC精製から得られた。E-ISA247およびZ-ISA247の1H-NMRスペクトルと比較したこの代謝体(試料KI-5)の1H-NMRを図33に示す。NMR分析から、試料がジアステレオ異性体の混合物ではなく、単一の化合物を含有することが明らかになった。このことは、スペクトルのアミドNHおよびN-メチルプロトン領域:4つのアミドNHプロトンおよび7つのN-メチル1重線シグナルから明白である。図33で明らかなように、スペクトルにおけるISA化合物から代謝体への大きな変化は、ジエン領域(δ6〜7ppm)のプロトンの欠如である。
【0143】
これらのオレフィンプロトンシグナルは、アミノ酸1側鎖から生じていて、ISA247分子に特有であり、通常、δ6〜7ppmの間で観測される。従って、この領域からこれらのピークが欠如したことにより、アミノ酸1側鎖に構造的な変換があることが示唆された。図34に、δ3.9〜6.0ppmのアミノ酸αプロトン領域の代謝体拡大スペクトルを、ピークの最上部に記載した特定のαプロトンおよび1-βプロトンに関するシフト帰属とともに示す。これらの帰属および他の帰属は、図36に示す、2Dスペクトルから取得され、アミノ酸1側鎖プロトンを除き、他のすべてのアミノ酸側鎖およびN-メチルプロトンが説明されている。従って、図34のδ5.75(積分により1Hに対応)、δ4.35(1H)およびδ3.94(2Hs)での未帰属のシグナルがアミノ酸1側鎖プロトンであるとの結論が出された。
【0144】
δ5.75ppmでのピークに関する詳細な試験によると、図35に示す通り、これは、δ5.77および5.74ppmで共鳴している2種類のプロトンからなっており、それはまた、相互に結合されていることが明らかとなった。化学シフトおよびカップリング定数(15.8Hz)により、トランス構造を有するオレフィン(-CH=CH-)基が示唆された。図36の2Dスペクトルは、δ5.75ppmでのシグナルが、δ3.94および4.35ppmでのピーク(これらの両ピークは、順次、シグナル結合性を示す)と相関していることを示した。さらに、δ3.94ppmでの多重線シグナルから2つのプロトンが説明され、δ4.35でのシグナルから1つのプロトンが説明された。従って、これらのピーク(δ5.77、5.74、4.35および3.9ppm)のシグナル結合性の説明に、構造基(-CH-CH=CH=CH2-)が提案された。
【0145】
δ4.35および3.94ppmでのシグナルの化学シフトは、これらのプロトンが、次の構造:(-O-CH-CH=CH-CH2-O-)を有する酸素原子に隣接する炭素に結合されていることをさらに示唆している。図37に示した拡大DQF-COSYスペクトルからは、δ5.77ppmでのシグナルがδ4.35ppmでのシグナルと結合しており、δ5.74ppmでのシグナルがδ3.94ppmでのシグナルと結合していることが示唆された。このNMR分析を、図38に示すように、IM1-c-1の構造に明瞭に記載した質量情報と組み合わせた。
【0146】
側鎖のε位の立体化学は、ROESYスペクトルから推定された(図39を参照されたい)。aa-1側鎖プロトンに関するROESYスペクトルの詳しい試験から、以下のROE相関が明らかになった:
(1)δ4.35(1-ε)−δ2.30(1-δ2)
(2)δ4.25(1-β)−δ1.26(1-γCH3)
(3)δ2.49(1-γ)−δ2.30(1-δ2)
(4)δ1.35(1-δ)−δ1.26(1-γCH3)。
【0147】
これらの観測に基づいて、IM1-c-1のaa-1側鎖構造が解明された(図40)。当業者には、aa-1のε炭素がキラル中心であり、従って、ε炭素が、図40に示すようにR立体配置をとるか、またはS立体配置をとり得る(図示せず)ことは理解されよう。ROESYスペクトルの分析によれば、IM1-c-1ピークから単離された代謝体は、主としてR立体配置にある。しかし、図40に示す代謝体は、同様にS立体配置でも存在し得る。
【0148】
いかなる理論にも束縛されるものではないが、ISA247の代謝体のこの構造解析(アミノ酸1残基での代謝から生じたもの)に基づいて、図41の反応スキームを作成した。この反応スキームは、シスISA247またはトランスISA247から開始し得る。ISA247(1)の代謝の第1のステップは、エポキシ化反応である。ISA247がエポキシ化されると、構造2、3および6としてそれぞれ、図41に示した立体配座IM1-e-1、IM1-e-2またはIM1-e-3で存在し得るエポキシドが生じる。これらのエポキシドはHPLCにより特定されておらず、また単離されていない。これらのエポキシドは非常に反応的であると考えられる。これらは、ISA247と、上述の変換生成物の間の反応における中間体または遷移状態であり得る。
【0149】
いかなる理論にも束縛されるものではないが、エポキシドが形成された場合、水がエポキシドを攻撃し、ジオールを形成することができると考えられる。図42は、トランスISA247からのISA247ジオールおよび環状aa-1代謝体の形成について提案される反応機構を示す。図42では、反応スキーム1(「1」と表示した矢印を参照)において、水がIM1-e-1エポキシドのε位またはζ位を攻撃可能な場合、エポキシドは開環され、IM1-d-4代謝体を形成することができる。IM1-d-4代謝体はε炭素およびζ炭素に新しい2個のキラル中心を有しており、その結果、IM1-d-4代謝体は、図42に示す4種類のジアステレオマーの形態で存在し得ることに留意されたい。水がトランスエポキシドのη位またはθ位を攻撃する場合には、エポキシドIM1-e-2が開環され、IM1-d-1代謝体を形成する。IM1-d-1代謝体のη炭素はキラル中心であることに留意されたい。従って、IM1-d-1代謝体は、図42に示すいずれかのジアステレオマーとして存在し得る。エポキシド開環が二重結合移動を伴って生じ、続いて、IM1-e-2エポキシドのε位で水による攻撃(2と表示した矢印を参照)が起こった場合、図42に示すIM1-d-2構造が形成される。IM1-d-2のε炭素はキラル中心であることに留意されたい。従って、IM1-d-2代謝体は、図42に示すように、いずれかのジアステレオマー異性体として存在し得る。一方、IM1-e-2エポキシドのβ炭素のヒドロキシル基がIM1-e-2エポキシドのε炭素を攻撃する場合、環状代謝体IM1-c-1が形成される。再度、ε炭素がキラル中心であり、IM1-c-1代謝体が図42に示したいずれかのジアステレオマーとして存在し得ることに留意されたい。
【0150】
同様に、中間体エポキシドから進行するジオール形成は、シスISA247から出発することが可能である。図43は、トランス-エポキシドIM1-e-2(IM1-e-2トランス)(この場合、IM1-e-2は、エポキシドであるアミノ酸1代謝体(同定された第2のエポキシド)を示す)のエポキシド開環について提案される反応スキームを示す。また図43は、1,2-ジオールを形成するためのシス-エポキシドIM1-e-2(IM1-e-2シス)のエポキシド開環に関する反応スキームを示す。図42および図43に示すように、IM1-e-2トランスからの反応により、IM1-d-1代謝体が生じる。一方、IM1-d-3は、図43に示すように、IM1-e-2シスから形成される。IM1-d-1およびIM1-d-3は共にη炭素にキラル中心があり、従って、いずれかのジアステレオマーとして存在し得ることに留意されたい。
【0151】
ISA247のアミノ酸1側鎖は共役ジエン系を含み、CsAと比較した場合に炭素が1個伸長していることから、ISA247化合物では、CsAの場合よりも多くのジオールおよびエポキシドの立体配置が代謝体として形成される。ISA247分子のアミノ酸1残基の末端炭素はアルケン官能基の一部であるので、CsA-Am1と類似したISA247代謝体はない(この場合、アミノ酸1側鎖のθ炭素は一水酸化される)。
【0152】
図57は、E-ISA247からのIM-1、IM-1-アセタール、IM1-アルデヒドおよびIM1-カルボン酸の形成を示す典型的な反応スキームである。理論に束縛されるものではないが、E-ISA247は、上述のようにη、θアルケンでエポキシ化され、IM1-e-2が形成されると考えられる。エポキシドは開環され、カチオン性中間体が形成され得る。これは、結合移動または1,2-水素化物シフトを受けた後、IM-1-アルデヒドが形成され得る。このアルデヒドは、還元させてアルコールIM-1を形成させるか、酸化させてIM-1-カルボン酸を形成させるか、または、H2O添加によりIM1-アセタールを形成させることができる。
【0153】
表5には、アミノ酸1での修飾を示すISA247代謝体のリストを示す。表5は完全なリストではない。例えば、アミノ酸1代謝体には、5員環、6員環、7員環または8員環が含まれる可能性がある。
【表5】

【0154】

【0155】

【0156】
水酸化代謝体
図6のLCMSスキャンは、1253/1129m/zの親イオン/フラグメントイオン対での4つのピークを示す。図6で8.5分のクロマトグラフィー保持時間を有している主要ピーク1253/1129イオン対は、アミノ酸1以外のアミノ酸の側鎖における水酸化を表している。これは、アミノ酸1以外のアミノ酸のIMX型または水酸化型代謝体と一致している。CsAとISA247のHPLC保持時間が同一であることと、1253/1129m/zのイオン対ピークおよびCsA-Am9標準のHPLC保持時間はまた区別不能であることを考慮すると、この代謝体はIM9であると考えられる。
【0157】
試料KI-7Cは、ISA247(シス:トランス=1:1)の微生物変換から得られ、HPLCにより精製した。図44Aに、KI-7C、ISA247のE異性体およびZ異性体の1D 1H-NMRスペクトルを示す。この比較は、δ6〜7ppmの間のaa-1のジエンプロトンがこの試料では影響されていないことを示しており、これは、aa-1が変換されていないことを示唆している。また、この試料がZ異性体およびE異性体の混合物であることも明らかになった。E異性体およびZ異性体から生じている、2組の4つのアミドNHシグナルおよび7つのN-メチルシグナルは、対応する化学シフト領域で観測された。このことから、この試料(KI-7C)では、ペプチド環が完全であることが示唆された。大部分のアミノ酸プロトンは、2D技術により帰属された(TOCSYおよびDQF-COSY、データは示さず)。側鎖メチル基プロトンへの結合性を欠いていた唯一のアミノ酸は、aa-9であった。従って、水酸化の質量分析結果と組み合わせると、以下の構造:
【化6】

【0158】
を有するaa-9側鎖変換が示唆された。
【0159】
上記観測を、1H-検出HMQC(異種核多量子相関)およびHMBC(異種核多重結合相関)技術(データは示さず)でさらに確認したところ、両メチルプロトンは、単結合および二重結合〜三重結合を介してそれぞれ適切な炭素と相関していた。下記は、前述の異核相関技術から得られた、HMBC相関およびメチルプロトンの化学シフトおよびアミノ酸9(aa-9)側鎖の対応する炭素を示す。従って、KI-7CのNMR分析からは、試料KI-7CがIM9であることが証明された。
【化7】

【0160】
図44Bは、IM9の構造(アミノ酸9残基の水酸化)を示す。ISA247のIM9代謝体のアミノ酸1側鎖は、シスまたはトランス構造のいずれかで存在し得ることに留意されたい。表6は、試料KI-7C(IM9代謝体)の1H-NMRに基づいた化学シフト帰属を示す。
【表6】

【0161】

【0162】

【0163】
IM4と表示した、図6のLCMSスキャンで1253/1129m/zの親イオン/フラグメントイオン対による第2のHPLCピークに対応する物質(試料KI-6)は、ISA247(シス:トランス=1:1)の微生物変換から単離され、1H-NMRを用いて解析された。この代謝体の質量情報がIM9に類似していることから、KI-6もまたIMX型代謝体であることが示唆された。KI-6の1H-NMRスペクトルからは、この代謝体が2種類の化合物の混合物であることが示された。また、アミドNHプロトン(δ7.5〜8.7ppm)、ジエン(δ6.0〜7.0ppm)およびN-メチル領域(δ2.5〜4.0ppm)についてさらに詳しい試験を行ったところ、この代謝体がaa-1でのE異性体およびZ異性体の混合物であって、EとZの比が3:2であることが明らかになった。興味深いことには、出発材料は、ISA247のE異性体とZ異性体の比が1:1であった。これにより、ISA247のE異性体およびZ異性体のこの代謝体への代謝率に差がある可能性があると言える。
【0164】
ISAのジエン構造に関する特有のシグナルと7対のN-メチル基の存在から、aa-1の側鎖が完全であって、N-脱メチル化が起こらなかったことが示唆された。図45は、代謝体(KI-6と表示)の1H-NMRと、E-ISA247およびZ-ISA247の1H-NMRスペクトルの比較である。ジエンおよびアミノ酸プロトン領域におけるNMRスペクトルの比較では、図45の矢印により示したように、δ5.58ppmでのシグナル(これは、Z-ISA247およびE-ISA247のNMRスペクトルでaa-4αプロトンに対応する)が存在しないか、スペクトル中の別の位置にシフトしていることが明瞭にわかった。この観測からは、構造修飾がaa-4のα位付近で起こったことが示唆された。さらに、側鎖メチルプロトン領域(δ0.5〜1.5ppm)のNMR比較では、図46で矢印により示したように、新しいメチル基シグナルの出現があった。図46に示すように、これらのピークの拡大から、δ1.33および1.30ppm、ならびにδ1.29および1.26ppmでの2組の1重線メチルシグナルがあることが明らかになった。2:3のピーク強度比は、δ1.33および1.30ppmでのメチルシグナルはZ異性体のものであり、δ1.29および1.26ppmでのシグナルはE異性体のものであることを示唆している。図47は、拡大したKI-6の新しいメチルシグナルを示す。図46で示した領域のISA247 EおよびZのメチル基ピークの帰属からは、aa-4側鎖からのメチル基、4-CH3(δ1)および(δ2)が、対応する領域のKI-6スペクトルに不在であることが示された。これは、図47の新しいメチルピークがaa-4側鎖に属することを示唆している。メチル基は、E-ISA247およびZ-ISA247のケースのように、γCHプロトンに結合されているので、aa-4側鎖の各メチル基は、通常、2重線として現れる。さらに、KI-6試料に関する質量研究では、アミノ酸1以外のアミノ酸の水酸化が示唆された。従って、aa-4のδメチル基について観測された1重線シグナルは、図49に示したaa-4のγ位におけるISAの酸化的変換により生じたものと結論した。また、2D TOCSYスペクトル(図48)からも、これらのメチル基に関するシグナル結合性の不在をもたらす、上記修飾が確認された
。これは、KI-4であるIM4(アミノ酸4のγ-水酸化)と一致している。IM4の構造を図50に示す。
【0165】
この研究については単離および分析はされていないが、上述のIM9およびIM4に類似した水酸化代謝体もまた、アミノ酸10(IM10)のγCHで、アミノ酸6(IM6)のγCHで、およびアミノ酸5(IM5)のβCHでも生じる可能性がある。これらの水酸化代謝体の一部は、図6に示すHPLCで同定したが、NMRによる検討はしていない。例えば、IMX(2)は、未確認のアミノ酸での水酸化代謝体である。
【0166】
N-脱メチル化代謝体
1223/1099m/zの親イオン/フラグメントイオン対により単離した代謝体(試料KI-1)を1H-NMRで分析した。代謝体の1223/1099m/zの親イオン/フラグメント対は、それがN-脱メチル化代謝体であることを示した。代謝体KI-1の1H-NMRスペクトルからは、E異性体およびZ異性体両方のaa-1側鎖のジエンプロトンピークの存在(aa-1側鎖が完全であることを示す)によって明らかなように、代謝体が、比が約1:1のEおよびZ異性体の混合物であることが明らかになった。またスペクトルから、図51で矢印により示す通り、δ2.5ppmでの1対のN-メチルピークの欠如が明らかになった。代謝体の1H-NMRスペクトルをE-ISA247およびZ-ISA247のものと比較したところ、この領域に対応するシグナルの欠如が、アミノ酸4のN-メチル基(各異性体由来のもの)のものであることが示唆された。従って、この代謝体についてアミノ酸4のN-脱メチル化が示唆された。
【0167】
この代謝体のaa-4αプロトンのシグナルもまた、δ5.56および5.59ppmにそれぞれ共鳴する、ISA247 EおよびIDS247 Zのaa-4αプロトンのシグナルからシフトしており、それはこのスペクトルでは簡単にその位置を確認できなかった。さらに、両異性体のaa-4からの2つのNHプロトンがこの領域で帰属された場合、δ7〜δ8.7ppm間のアミドNHプロトン領域が、10の代わりに、両異性体から生じる8つのアミドNHプロトンを示すのみであった。従って、これは、aa-4のアミドNHプロトンがより高いフィールドで共鳴していることを示唆している。
【0168】
2D TOCSYスペクトルの分析では、δ4.7ppmでのシグナルに相関している、δ5.2ppmでの2組のシグナルが明らかになった。拡大スペクトル(図52)により、これらのシグナル:δ5.26ppmと4.76ppm、およびδ5.23ppmと4.72ppmの明瞭な相関が得られた。2組のピークは、別のアミノ酸プロトン:すなわち、aa-11プロトンによるδ5.2ppmでのシグナル、ならびにaa-5、aa-7およびaa-8αプロトンによるδ4.7ppmでのシグナルとオーバーラップしている。しかし、aa-5、aa-7、aa-8およびaa-11の化学シフト帰属により、これらのアミノ酸から生じているδ5.2およびδ4.7ppmでのシグナルの可能性が除外された。従って、δ4.72と5.23ppmおよびδ4.76と5.26ppmの交差ピーク結合性は、両異性体のaa-4のアミドNHおよびαプロトンから生じたものと考えられる。この観測に基づいて、また1H-15N HSQC(示さず)によって確認したところ、δ5.26ppmおよび5.23ppmのシグナルは、NHプロトンに帰属され、δ4.76ppmおよびδ4.72ppmのシグナルは、aa-4のαプロトンに帰属された。図53に、IM4nとしての代謝体KI-1の提案される構造を示す。
【0169】
ISA247の代謝体の製造には化学合成法を用いることができる。これらの代謝体の化学合成は、通常、次のステップ:(1) シクロスポリンAまたはISA247の1アミノ酸側鎖のβ-OHの保護;(2) エポキシ化;(3) ジオール形成、および(4)脱保護に従う。β-OHの保護は、エポキシド代謝体とジオール代謝体の形成には望ましいかもしれないが、環状代謝体の形成には適合しない。β-OHでの考えられる保護基としては、アセチル、トリメチルシリル、安息香酸エステル、置換安息香酸エステル、エーテルおよびシリルエーテルが挙げられる。特定の反応条件下では、アセテート保護基は、脱離および加水分解などの不適切な副反応を起こす傾向にある。安息香酸エステル、エーテルおよびシリルエーテルは、多くの場合、これらの同じ反応条件下でのかかる副反応に耐性があることから、アセテートの代わりにこれらの保護基を用いると有利なことが多い。
【0170】
保護されたCsAまたはISA247は、塩基条件下でエポキシドを形成することができる。図54は、シャープレス法を用いた合成経路を説明する(R. A. Johnson, K.B. Sharpless. Catalytic Asymmetric Synthesis: I. Ojima編; VCH Publishers: New York; 1993; p. 103; K.B. Sharplessら, J. Org. Chem. 1992, 57, 2768)。図54に示したように、アリルアルコール部分により保護されたCsA化合物は、シャープレスエポキシ化を受けることができる。酸化、ウィッティヒ反応およびエポキシド開環を含む一連の反応によってジオール代謝体が得られる(WO 2003/033526およびUS 2003/0212249を参照されたい)。あるいは、AD-mix-β/AD-mix-αなどの市販試薬を用いるシャープレス二水酸化(K.B. Sharplessら, J. Am. Chem. Soc. 1992, 114, 7570)をジオール代謝体の合成で用いることができる。代表的な実施例を図54に示す。
【0171】
図55に、化学的合成法を用いて、特定のsynおよびantiジオールの合成を導くことができることを示す。例えば、図55では、シスアルコキシアリルボロン酸エステル試薬を用いてIM1-d-4のsynジオールを形成することができる。IM1-d-4のantiジオールは、トランス-シリルアリルボロン酸エステルの試薬を用いる場合に形成することができる(H.C. Brownら, J. Am. Chem. Soc. 1988, 110, 1535, Marshall, J.A. Chem. Rev. 1996, 96, 31, Barrett, A.G.M.ら, J. Org. Chem. 1991, 56, 5243を参照されたい)。
【0172】
図56は、クロロアリルホウ素化法を用いたエポキシド(およびジオール)の形成を説明する。図56は、ジオールに変換することができるシスエポキシドを形成させる、HuらのJ. Org. Chem. 1998, 63, 8843に記載された方法(またWO 2003/033526およびUS 2003/0212249も参照されたい)を使用する、ジアルキル(クロロアリル)ボラン試薬の使用を示す。
【0173】
5員環形成を示す、上述の環状アミノ酸1代謝体以外に、6員環、7員環または8員環を含む、さらなる環状アミノ酸1代謝体が考えられる。例えば、図42では、IM1-e-2エポキシド代謝体のβ-OHが、水の存在下でそれ自体のε炭素を攻撃する場合の環状代謝体の形成を説明している。IM1-e-2エポキシド代謝体のβ-OHがそれ自体のζ炭素を攻撃した場合は、6員環構造を持つ環状代謝体が形成される。IM1-e-2エポキシド代謝体のβ-OHがそれ自体のθ炭素を攻撃した場合は、8員環構造を持つ環状代謝体ができる。同様に、IM1-e-2エポキシド代謝体のβ-OHがそれ自体のη炭素を攻撃した場合は、7員環構造を持つ環状代謝体ができる。
【0174】
また、上述のIM4nに類似の脱メチル化代謝体は、aa-1、aa-3、aa-6、aa-9、aa-10およびaa-11でのメチル化窒素でも生じ得る。これらの代謝体のうちの一部は、図6のHPLCスキャンで同定可能である。例えば、IMXn(2)は、ISA247環中の未確認アミノ酸(「X」と表す)での脱メチル化代謝体である。
【0175】
上述の代謝体の他に、水酸化、N-脱メチル化、ジオール形成または環化の組み合わせで代謝体を生成する、代謝ステップの組み合わせが存在し得る。多重水酸化およびN-脱メチル化を有する代謝体が存在し得る。例えば、IM-1-d-1は、4位におけるMeLeuの窒素の脱メチル化によりさらに代謝され、IM1-d-1-4nを生成し得る。別の例としては、IM1-d-2-4nまたはIM1-d-3-4n、あるいはIM1-d-4-4n、IM1-c-l-4nまたはIM1-c-2-4nが挙げられる。ジオール形成または環化と組み合わせる脱メチル化は、N-脱メチル化を受けやすいISA247分子上の任意のアミノ酸であってもよい。例えば、ISA247の代謝体には、アミノ酸1、3、4、6、9、10または11における少なくとも1つのN-脱メチル化と組み合わせた、アミノ酸1で形成されたジオール(IM1-d-1、IM1-d-2、IM1-d-3またはIM1-d-4)が含まれる。またISA247の代謝体は、水酸化を受けやすいISA247分子上の任意のアミノ酸における少なくとも1つの水酸化と組み合わせた、アミノ酸1で形成されたジオールも含み得る。例えば、ISA247の代謝体は、アミノ酸4、6、9、10、または11における少なくとも1つの水酸化と組み合わせた、アミノ酸1で形成されたジオール(IM1-d-1、IM1-d-2、IM1-d-3またはIM1-d-4)を含んでいる。ISA247の代謝体は、アミノ酸1、3、4、6、9、10または11における少なくとも1つのN-脱メチル化、あるいはアミノ酸4、6、9、10または11における少なくとも1つの水酸化と組み合わせた、アミノ酸における環化(IM1-c-1またはIM1-c-2)を含んでいてもよい。代謝体は、多重水酸化(例えば、IM46、IM69またはIM49)、あるいは多重N-脱メチル化(例えばIM4n9nまたはIM4n3n)を含んでいてもよい。多重代謝体は、図6のHPLCスキャン中に存在している。例えば、IMXnX(2)は、ISA247環上の未確認位置でN-脱メチル化され、かつ水酸化されている代謝体を表す。これらの多重水酸化および/または多重N-脱メチル化は、aa-1でのジオール形成、またはaa-1での環化と組み合わせても起こり得る。
【0176】
上述のフェーズI代謝体の他に、さらにフェーズII代謝体が生じる可能性がある。これらのフェーズII代謝体はグルクロニド、糖(例えばグリコシル化由来のもの)、リン酸、硫酸等などの基を含んでいてもよく、これらはISA247またはISA247代謝体分子上の任意のヒドロキシル基で生じ得る。フェーズII代謝体のこのリストは完全ではないこと、また、多数のさらなるフェーズII代謝体がこの明細書により意図されることは、当業者には理解されよう。
【実施例】
【0177】
実施例1:全血からのISA247代謝体の調製
ヒトにISA247を投与した後、全血を採取した。tertブチルメチルエーテル(またはメチルtertブチルエーテル、MTBE)を用いて全血からISA247およびその代謝体を抽出し、乾燥させ、メタノール中に再調製した。MTBE(cat. No. 7001-2; Caledon)2mLを全血200μLに加え、10分間振盪し、卓上遠心分離機で2分間遠心した。上部のMTBE層を除去し、真空下で濃縮した。残渣をメタノール200μL中に再調製した。同様に、胆汁抽出物および尿抽出物について実施することができる。
【0178】
実施例2:ISA247代謝体の化学合成
OAc-E-ISA247のモノエポキシドの調製
E-ISA247のジオール代謝体を調製するため、図42に示したようにエポキシドを形成させた。以下のステップを実施した。CHCl3(3mL)中のOAc-E-ISA247(125mg、0.1mmol)の撹拌冷却(0℃)溶液に、重炭酸カリウム(10mg)を添加した。これに、CHCl3(2mL)に溶解したm-クロロ過安息香酸(23mg、0.1mmol、77%)溶液を添加した。この反応混合物を室温まで温め、18時間撹拌を継続した。反応生成物をジクロロメタン(25mL)で抽出した。有機層を飽和NaHCO3溶液とブラインで洗浄した。乾燥(Na2SO4)させ、溶媒を除去することにより、白色固体(110mg)が得られた。MS (m/z): 1295 (M + Na+)。この生成物はエポキシドの混合物であった。同じ工程は、OAc-Z-ISA247またはISA247の異性体混合物で用いることができるが、図42に示した通り、その生成物の立体化学は異なる。
【0179】
OAc-E-ISA247のエポキシドからジオール混合物への開裂:
上述の生成物(110mg)を、アセトン-水-88%HCO2H(15mL、64.5:33:2.5)の撹拌・氷冷混合物に添加し、室温で72時間撹拌した。反応混合物を酢酸エチル(25mL)で抽出することにより処理し、有機抽出物を飽和NaHCO3溶液およびブラインで洗浄した。乾燥(Na2SO4)させ、溶媒を除去することにより白色固体(110mg)を得た。MS (m/z):1313 (M + Na+)。生成物はOAc-E-ISA247ジオールの混合物であった。
【0180】
ジオールの脱保護:
OAc-E-ISA247ジオール(110mg)の混合物をMeOH(10mL)中に溶解し、水(4mL)を加え、その後、固体の炭酸カリウム(110mg)を加えた。反応混合物を36時間室温で撹拌し、次いで、酢酸エチル(25mL)で抽出した。併せた有機抽出物をブラインで洗浄し、乾燥させた(NaSO4)。溶媒の除去により固体(110mg)が得られた。MS (m/z) 1271 (M + Na+)。PHLCを用いた精製を行ったところ、化合物IM1-d-1、IM1-d-2およびIM1-d-4が得られた。
【0181】
実施例3:E-ISA247のエポキシ化(環状代謝体の調製):
酸性環境において、環状化合物を形成した。CHCl3(3mL)に溶解したE-ISA247(250mg、0.2mmol)の撹拌・冷却(0℃)溶液に、CHCl3(2mL)中のm-クロロ過安息香酸(51mg、0.23mmol、77%)溶液を加え、室温で48時間撹拌した。反応混合物を0℃まで冷却し、Me2S(600uL)を添加することにより過剰のm-CPBAを破壊した。反応生成物をジクロロメタン(25mL)で抽出し、有機層を飽和NaHCO3溶液およびブラインで洗浄した。乾燥(NaSO4)させ、溶媒を除去することにより固体(230mg)が得られた。IM1-c-1およびIM1-c-2の混合物中に存在していた環状化合物を分取HPLCを用いて単離した。
【0182】
実施例4:E-ISA247のエポキシ化(末端エポキシドの調製)
CHCL3(3mL)に溶解したE-ISA247(200mg、0.17mmol)の撹拌・冷却(0℃)溶液に、固体KHCO3(20mg、0.2mmol)を添加した。次いで、CHCl3(2mL)に溶解したm-クロロ過安息香酸(45mg、0.2mmol)溶液を加えた。室温にて4.5時間、撹拌を継続した。次いで、反応混合物を氷中で冷却し、Me2S(500uL)を加えた。上述のように処理とHPLC単離を行うことにより、末端エポキシドIM1-e-1が得られた。
【0183】
実施例5:イヌ肝臓ミクロソーム調製物によるISA247代謝体生成
イヌミクロソームの調製
以下の方法でイヌ肝臓ミクロソームを調製した:肝臓を切除した後、1.15%の塩化カリウム(KCl)でフラッシングし;小型断片(約25g)にダイスカットし、冷却した粉砕バッファー(0.1Mのリン酸緩衝液 pH 7.4;4℃;肝臓とバッファーとの比率は1:1)中で大きな塊が崩壊するまで破砕した。Polytron Homogenizerを利用し(15,000rpmで3〜5分間)、肝臓組織を含んでいるホモジネートを形成させた。粒状物質から上清をデカントした後、上清を100,000×gで90分間遠心分離にかけ、ミクロソームペレットを得た。ミクロソームペレットのタンパク質含有量は、Lowryタンパク質アッセイを用いて測定した。このミクロソーム調製物のタンパク質濃度は約23.2mg/mLであった。酵素の失活を避けるため、ミクロソームを-80℃の4.0mLまたは6.0mLアリコートで保存し、凍結融解サイクルを回避した。
【0184】
上述のようにして調製したイヌ肝臓ミクロソーム6mL容量を、以下の成分を段階的に加えながら、257mLのエルレンマイヤーフラスコ中でインキュベートした:リン酸緩衝液(pH 7.4に調整)6.0mLに、NADP 57.3mg、グルコース-6-リン酸 254mg、およびNADPH 23.0mgを加えたもの。次いで、5.0mMのMgCl 2.0mL、およびグルコース-6-リン酸デヒドロゲナーゼ6.0mL(10単位/mL、CALBIOCHEM(San Diege, CA)から購入可能、カタログ番号346774)をこの溶液に加えた。最後に、リン酸緩衝液(pH7.4)を10mL加えた。このフラスコを、環境制御インキュベータ/振盪機において、250rpmで2時間37℃にてインキュベートした。2時間後、2MのHCl 500μLを加えることによりこの反応を停止させた。
【0185】
次いで、この方法により生成された代謝体を有機溶媒で抽出し、さらに、高圧液体クロマトグラフィー(HPLC)を用いて分離した。さらに、エレクトロスプレー質量分析(MS)およびNMRにより代謝体を特性決定した。
【0186】
実施例6A:生物変換によるISA247代謝体の生成
生物変換系は微生物を利用し、微生物当量のヒトシトクロムP450ミクロソーム酵素と微生物の活発な増殖に好適な培地を含む。親化合物(水に難溶性である)は、生物変換系へ添加する前に、エタノールおよび界面活性剤と混合した。この実施例では、エタノールに溶解したISA247をTween40と混合し、次いで、サッカロポリスポラ・エリテレア(Saccharopolyspora erytheraea)ATCC 11635を含む生物変換系に加えた。
【0187】
生物変換実験は、15斜面のサッカロポリスポラ・エリテレアで開始した。これらの斜面は、脱イオン水に溶解し、NaOHでpH7.0に調整し、100℃で30分間滅菌した、100mLのATCC培地196(1斜面当たり約6.0mL)から調製した。サッカロポリスポラ・エリテレアを接種した後、これらの斜面を28℃で3週間培養した。
【0188】
次いで、これらの斜面から得たコロニーをフェーズI培地に移した。フェーズI培地は、10g/Lのデキストリン、1g/Lのグルコース、3g/Lのビーフエキス、10g/Lの酵母エキス、5g/Lの硫酸マグネシウム、および400mg/Lのリン酸カリウムで調製した。これらの成分は、1リットル以下の脱イオン水中で混合し、NaOHでpH7.0に調整した。次いで、50mLのアリコートをバッフル付き250mL培養フラスコに移し、100℃で30分間滅菌した。フェーズI培養を開始するため、サッカロポリスポラ・エリスレアを含む寒天斜面へ5mlの培地を分けた。細胞を斜面表面からかき取り、細胞懸濁液を調製した。各フラスコへの接種には、この懸濁液2.5mLを用いた。27℃のLabline Incubatorにこのフラスコを入れ、3日間(72時間)250rpmで振盪した。
【0189】
3300rpmで5分間、フェーズIフラスコの内容物を遠心分離にかけて、上清をデカントしてペレットを取得することにより、サッカロポリスポラ・エリスレアをフェーズI培地からフェーズII培地に移した。ペレットにフェーズII培地5mLを加え、試験管をボルテックスし、次いで、3300rpmで4分間遠心分離にかけた。再度、上清をデカントした。ペレットをフェーズII培地中に再懸濁した。その結果生じた懸濁液をバッフル付き培養フラスコ中のフェーズII培地50mLに加えた。
【0190】
フェーズII培地は、10g/Lグルコース、1g/Lの酵母エキス、1g/Lのビーフエキス、および3-N-モルホリノプロパンスルホン酸(MOPS)バッファー11.6g/Lを含んでいた。これらの成分を脱イオン水中で混合し、5MのNaOHでpH7.0に調整した。50mLのアリコートをバッフル付き培養フラスコ(250mL)に分注し、100℃で30分間オートクレーブにかけた。また、Tween 40もオートクレーブにかけた。
【0191】
ISA247(4mg)を0.1mlのエタノール(95%)中に溶解し、次いで、0.4mlのTween(登録商標)40(ポリオキシエチレンソルビタンモノパルミテート; カタログ番号P1504. Sigma-Aldrich(St. Louis, MO))と混合した。次いで、この親化合物・界面活性剤混合物を、サッカロポリスポラ・エリスレアを含むフェーズII培地に加えた。ゼロ時間の試料を取得し、それを凍結した。次いで、各フラスコに栓をし、27℃のInnova Incubatorに入れ、170rpmで振盪しながら120時間インキュベートした。
【0192】
フェーズII培地から第2の試料を得た。ゼロ時間試料と第2の試料を、tert-ブチル-メチルエーテル(カタログ番7001-2; Caledon)を用いて抽出した。抽出した代謝体をメタノール(HPLC等級)中に再調製し、下記のLC-MSにより分析した。
【0193】
図59は、ATCC 11635により(すなわち、ATCC 11635の代謝の多様性により)生成され得る、代謝体の量と種類を例示している棒グラフである。
【0194】
実施例6B:生物変換によるISA247代謝体生成
前述の生物変換実施例に基づいたさらなる実験において、ISA247からのISA247代謝体の生成について、カルバラリア・ルナータ(Curvularia lunata) (UAMH 9191, ATCC 12017)、カニングハメラ・エキヌラタ var. エレガンス(Cunninghamella echinulata var. elegans) (UAMH 7370, ATCC 36112))、カーブラリア・エキヌラタ var. ブラケスレエナ(UAMH 8718, ATCC 8688a)、カニングハメラ・エキヌラタ var. エレガンス(Curvularia echinulata var. blakesleena)(UAMH 7369, ATCC 26269)、ボーヴァリア・バシアナ(Beauvaria bassiana) (UAMH 8717, ATCC 7159)、アクチノマイセス属(Actinomycetes)(ATCC 53828)、アクチノプラネス属(Actinoplanes)(ATCC 53771)、カニングハメラ・エキヌラタ(UAMH 4144, ATCC 36190)、カニングハメラ・エキヌラタ(UAMH 7368, ATCC 9246)、カニングハメラ・ベニエレ(エキヌラタ)(Cunninghamella bainiere (echinulata))(UAMH 4145, ATCC 9244)、およびサッカロポリスポラ・エリスレ(Saccharopolyspora erythrae) (ATCC 11635)をはじめとする、種々の微生物を評価した。
【0195】
代謝体変換率(開始ISA24に対して生成された公知のISA247代謝体の総量)について、ならびに代謝多様性(生成された異なるISA247代謝体の数)について、これらの微生物をスクリーニングした。さらに、(高脂溶性ISA247の吸収を高めるための)ジメチルスルホキシド(DMSO)およびTween40を含む送達アジュバントを、公知のアジュバントであるグリセリンと比較して試験した。試料を培地から取得し、下記のヒト標準ISA247代謝体プロファイルに対してLC-MSにより分析した。表7には、確認されたイオン質量、対応する定量可能なISA247代謝体、およびおおよその保持時間を挙げている。計量したイオン質量には、1223、1237、1239、1253、1255、1267および1271が含まれていた。
【表7】

【0196】
表8は、96時間生物変換した後の総変換および代謝多様性に基づいて試験した微生物を分類している。チェックマークは、定量可能な量の代謝体が生成されたことを示す。
【表8】

【0197】

【0198】
実施例7:ISA247代謝体の分析に関するLC/MS手順
この実施例では、ISA247代謝体をin vitroで生成し、高圧液体クロマトグラフィー(HPLC)を用いて分離し、エレクトロスプレー質量分析を用いて特性決定した。
【0199】
液体クロマトグラフィー(LC)条件
液体クロマトグラフィー(LCまたはHPLC)については、Perisorb RP-8 (Upchurch Scientific cat# C-601)を充填したguard カラム2×20mm(Upchurch Scientific cat# C-130B)を備えた、逆相Waters Symmetry C8、2.1×50mm、3.5μm分析カラム(Waters cat# WAT 200624)を用いた。LCプログラムで利用した溶媒比率と流速は、表9に記載している。
【表9】

【0200】
質量分析(MS)条件
質量分析においては、Applied Biosystems / MDS Sciex API3000 (Analyst software v 1.2)装置を用いた。実行時間は15分、注入容量は5μLであり、Guardカラム温度および分析カラム温度は60℃であった。手動設定は以下のとおりであった:Turbo Ion Sprayは8000、Turbo Ion Spray horizontal settingはプラス4であり、Turbo Ion Spray lateral setteingは10であった。Sciex装置は、表10に示したパラメータに設定した。
【表10】

【0201】
表11にはイオンおよびイオン特異的機器設定を示す。
【表11】

【0202】
実施例8:ISA247代謝体の免疫抑制活性の測定
カルシニューリン活性は、Frumanらによって既に記載されている方法(A Proc Natl Acad Sci USA, 1992)および米国特許第6,605,593号に記載の方法を変更して用い、分析した。全血溶解物は、オカダ酸、1型および2型ホスファターゼ阻害剤の存在下で、32Pで標識した19個のアミノ酸ペプチド基質を脱リン酸化する能力について評価する。過剰添加したISA247の存在下および不在下で実施したアッセイとともに、バックグラウンドのホスファターゼ2C活性(CsAおよびオカダ酸耐性活性)を測定し、各試料から差し引いた。残存しているホスファターゼ活性がカルシニューリン活性として得られる。
【0203】
図58Aは、添加した代謝体濃度(ng/mL)に対するカルシニューリン阻害(%)を示すグラフである。ISA247代謝体IM1-ジオール-1、IM9、IM4n、IM1cおよびIM1による濃度関数としてのカルシニューリン阻害は、図58Aを図58B(これは、トランスISA247、シスISA247およびCsAの濃度に対するカルシニューリン阻害を示す)と対比して確認することができる通り、トランスISA247、シスISA247およびCsAに匹敵する。表12は、トランスISA247およびCsAと比較した、IM1、IM1-ジオール-1、IM4nおよびIM9のEmaxおよびEC50を示す。
【表12】

【0204】
本出願で引用したすべての刊行物、特許および特許出願は、各々の個別の刊行物、特許出願または特許の明細書が参照によってその全開示が具体的にかつ個々に組み入れられたのと同程度まで、その全開示を参照により本明細書に組み入れるものとする。
【0205】
本明細書中の反応機構は、化学的であるか酵素的であるかにかかわらず、理論的なものであって、本明細書に記載された工程を明確にし例示するために提供するものである。これらの機構は正しいと考えてはいるが、当業者は、さらなる証拠によってこれらの機構に変更が生じる可能性があることは理解するであろう。従って、本出願人らは、本明細書に記載した実施形態がこれらの理論的機構により限定されることを意図するものではない。
【0206】
上述の本発明の典型的な実施形態に関する多くの変更が当業者によって容易に行われる。従って、本発明には、添付した特許請求の範囲内にある全ての構造および方法が含まれるものとして解釈すべきである。
【図面の簡単な説明】
【0207】
【図1】図1は、CsAの構造の説明図である。
【図2】図2は、ISA247の構造の説明図である。
【図3】図3は、ISA247のE(トランス)異性体の説明図である。
【図4】図4は、ISA247のZ(シス)異性体の説明図である。
【図5】図5は、公知のCsA代謝体を示した表である。
【図6】図6は、ISA247投与後のヒト全血中に存在する代謝体のHPLC-MRMスキャンである。
【図7】図7は、単離されたISA247代謝体の混合標準物のHPLC-MRMスキャンである。
【図8】図8は、試料KI-2から得た、E-ISA247、Z-ISA247およびIM1-d-1の1H-NMRスペクトルを示す。
【図9】図9は、試料KI-2から得た、IM1-d-1の2D TOCSYスペクトルである。
【図10】図10は、IM1-d-1の構造を示す。
【図11】図11は、試料KI-3Aから得た、E-ISA247およびIM1-d-2の1H-NMRスペクトルを示す。
【図12】図12は、試料KI-3Aから得た、IM1-d-2の2D COSYおよびTOCSYスペクトルを示す。
【図13】図13は、試料KI-3Aから得た、IM1-d-2の拡大2D COSYスペクトル(3.8〜6.2ppm)を示す。
【図14】図14は、試料KI-3Aから得た、IM1-d-2の拡大1H-NMRスペクトル(3.8〜6.2ppm)を示す。
【図15】図15は、シグナルの分裂パターンを表す、IM1-d-2(試料KI-3A)の二重結合プロトンの拡大1H-NMRスペクトルを示す。
【図16】図16は、aa-1側鎖プロトンの相関を示す、IM1-d-2(試料KI-3A)の拡大2D COSYスペクトルを示す。
【図17】図17は、IM1-d-2のaa-1側鎖のε位でのRおよびSエピマーの構造を示す。
【図18】図18は、IM1-d-2のアミノ酸1構造とそのプロトン化学シフトを示す。
【図19】図19は、IM1-d-1、IM1-d-3、E-ISA247およびZ-ISA247の1H-NMRスペクトルを示す。
【図20】図20は、IM1-d-3(試料KI-3)の2D TOCSYスペクトルを示す。
【図21】図21は、IM1-d-3(試料KI-3)の拡大TOCSYスペクトルにおいて、対応するαプロトンに相関を示すアミドプロトンを示す。
【図22】図22は、IM1-d-3(試料KI-3)の拡大TOCSYスペクトルにおいて、対応する側鎖メチルプロトンに相関を示すアミドプロトンを示す。
【図23】図23は、3.5〜6.1ppmの間のIM1-d-3(試料KI-3)の拡大1H-NMRスペクトルと一部のTOCSY相関を示す。
【図24】図24は、3.4〜6.3ppmの間のIM1-d-3(試料KI-3)の拡大2D TOCSYスペクトルを、交差ピーク相関と共に示す。
【図25】図25は、IM1-d-3(試料KI-3)の拡大1H-NMRスペクトルを、δ5.62ppmでのシグナル分析を含めて示す。
【図26】図26は、IM1-d-3のaa-1側鎖のη位でのR異性体とS異性体の構造を示す。
【図27】図27は、IM1-d-4(試料KI-8A)およびE-ISA247の1H-NMRスペクトルを示す。
【図28A】図28Aは、IM1-d-4(試料KI-8A)の2D COSYスペクトルを示す。
【図28B】図28Bは、IM1-d-4(試料KI-8A)の2D TOCSYスペクトルを示す。
【図29】図29は、3.5〜6.2ppmの間のIM1-d-4(試料KI-8A)の拡大2D COSYスペクトルを、相関と共に示す。
【図30】図30は、COSY相関を含めた、3.7〜6.2ppmの間のIM1-d-4(試料KI-8A)の拡大1H-NMRスペクトルと一部のプロトン帰属である。
【図31】図31は、IM1-d-4(試料KI-8A)に関する、δ〜6.00、5.44および5.15ppmでの1H-NMRシグナルの一次分析である。
【図32】図32は、IM1-d-4の構造を示す。
【図33】図33は、E-ISA247、Z-ISA247およびIM1-c-1(試料KI-5)についての1H-NMRスペクトルの比較である。
【図34】図34は、αプロトン領域でのIM1-c-1(試料KI-5)の拡大1H-NMRスペクトルを示す。
【図35】図35は、図34で示した、IM1-c-1(試料KI-5)のδ〜5.75ppmでのシグナルの分析を示す。
【図36】図36は、αプロトン領域でのIM1-c-1(試料KI-5)の拡大2D TOCSYスペクトルを示す。
【図37】図37は、IM1-c-1(試料KI-5)の一部を拡大したDQF-COSYスペクトルである。
【図38】図38は、IM1-c-1の構造を示す。
【図39】図39は、IM1-c-1(試料KI-5)の2D ROESYスペクトルである。
【図40】図40は、ROE相関を示す、IM1-c-1のアミノ酸1側鎖に関する構造の説明図である。
【図41】図41は、ISA247のアミノ酸1代謝体の形成を説明する典型的な反応スキームである。
【図42A】図42Aは、トランスISA247からのISA247のアミノ酸1代謝体の形成を説明する典型的な反応スキームである。
【図42B】図42Bは、シスISA247からのISA247のアミノ酸1代謝体の形成を説明する典型的な反応スキームである。
【図43】図43は、トランスISA247からのIM1-d-1の形成、およびシスISA247からのIM1-d-3の形成を説明する典型的な反応スキームである。
【図44A】図44Aは、KI-7C、E-ISA247およびZ-ISA247の1H-NMRスペクトルの比較である。
【図44B】図44Bは、IM9の構造を示す。
【図45】図45は、IM4(試料KI-6)、E-ISA247およびZ-ISA247の1H-NMRスペクトルの比較である。
【図46】図46は、0.5〜1.5ppmの間のIM4(試料KI-6)、E-ISA247およびZ-ISA247の拡大1H-NMRスペクトルの比較である。
【図47】図47はIM4の新規のメチルシグナルを示す拡大1H-NMRである。
【図48】図48は、IM4(試料KI-6)の2D TOCSYスペクトルである。
【図49】図49は、IM4を形成するためのアミノ酸4γ位の変換を示すスキームである。
【図50】図50は、IM4の構造を示す。
【図51】図51は、IM4n(試料KI-1)、E-ISA247およびZ-ISA247の1H-NMRスペクトルの比較である。
【図52】図52は、IM4n(試料KI-1)の拡大2D TOCSYスペクトルである。
【図53】図53は、IM4nの構造を示す。
【図54】図54は、シャープレス法を用いる化学反応スキームを示す。
【図55】図55は、特定のsyn-またはanti-ジオールの合成を誘導する化学的合成法を示す。
【図56】図56は、クロロアリルホウ素化(chloroallylboration)を用いる化学的合成法を示す。
【図57】図57は、E-ISA247からのIM-1、IM-1-アセタール、IM1-アルデヒドおよびIM1-カルボン酸の形成を示す典型的な反応スキームである。
【図58A】図58Aは、ISA247代謝体のIM1-ジオール-1、IM9、IM4n、IM1-cおよびIM1の代謝体濃度(ng/mL)に対するカルシニューリン阻害(%)を示すグラフである。
【図58B】図58Bは、トランスISA247、シスISA247およびCsAの濃度(ng/mL)に対するカルシニューリン阻害(%)を示すグラフである。
【図59】図59は、ISA247代謝体生成におけるATCC 11635の典型的な代謝多様性プロファイルを示す棒グラフである。示した変換は、lmg/mLのシクロスポリンA標準と比較したパーセントである。
【技術分野】
【0001】
関連出願の相互参照
本出願は、2004年12月17日に出願の米国仮特許出願第60/637,392号の利益を主張する。前記出願の全開示を参照により本明細書に組み入れるものとする。
【0002】
本発明は、シクロスポリンAの誘導体であるISA247またはISATX247の単離された代謝体に関する。また本発明は、ISA247の単離された代謝体を調製し、分析する方法に関する。
【背景技術】
【0003】
シクロスポリンは、強力な免疫抑制活性を有する環状ポリペプチド群に属するメンバーである。これらの化合物の少なくとも一部(例えば、シクロスポリンAなど)は、トリポクラジウム・インフラタム・ガムス(Tolypocladium inflatum Gams)種によって二次代謝産物として産生される。シクロスポリンは、免疫抑制剤として、体液性免疫反応および細胞介在性免疫反応、例えば同種移植片拒絶、遅延型過敏症、実験的アレルギー性脳脊髄炎、フロイントアジュバント関節炎および移植片対宿主拒絶反応などを抑制することが証明されている。これは、臓器移植における臓器拒絶反応の予防;関節リウマチの治療;および乾癬の治療に用いられる。
【0004】
多数のシクロスポリンファミリーの化合物が知られているが、医療分野では、シクロスポリンAが恐らく最も広く使用されている。シクロスポリンAの免疫抑制効果は、T細胞介在性活性化現象の阻害と関係がある。免疫抑制は、広く存在しているシクロフィリンと呼ばれる細胞内タンパク質にシクロスポリンが結合することによって起こる。この複合体は、次に、酵素カルシニューリンのカルシウムおよびカルモジュリン依存性セリン・スレオニンホスファターゼ活性を阻害する。カルシニューリンの阻害は、T細胞活性化中のサイトカイン遺伝子(IL-2、IFN-γ、IL-4およびGM-CSF)の誘導に必要な、NFATp/cおよびNF-κBなどの転写因子の活性化を妨げる。
【0005】
またシクロスポリンは、in vitroにおけるヘルパーT細胞によるリンホカイン生成を阻害し、胸腺の成熟CD8細胞およびCD4細胞の成長を停止させる。シクロスポリンに関する別のin vitro特性としては、IL-2生産Tリンパ球および細胞傷害性Tリンパ球の阻害、活性化T細胞により放出されるIL-2の阻害、同種抗原および外因性リンホカインに応答する休止Tリンパ球の阻害、IL-1生産の阻害、およびIL-2生産Tリンパ球のマイトジェン活性化の阻害がある。
【0006】
シクロスポリンには有益な免疫抑制作用、抗炎症用および駆虫作用があるものの、シクロスポリンAの治療に伴う多数の副作用がある。これらの作用には、いくつか例を挙げると、腎毒性、肝毒性、白内障発生、多毛症、パラセシス(parathesis)および歯肉増殖症が含まれる。これらのうち腎毒性は、シクロスポリン投与に起因する、より深刻な用量依存性副作用の1つである。即効型のシクロスポリンA医薬品(例えば、ネオーラル(Neoral、登録商標)およびサンディミュン(Sandimmune、登録商標)では、それらが血流中へ速やかに放出され、その速やかな放出の結果、濃度が高まることにより腎毒性およびその他の毒性副作用が起こり得る。シクロスポリンAが腎損傷を起こす正確な機序は知られていないが、腎臓中の血管収縮物質の濃度上昇が糸球体輸入細動脈の血管収縮を引き起こすといわれている。これは、腎虚血、糸球体濾過率の低下を招き、長期間にわたる場合、間質性線維症を引き起こす可能性がある。
【0007】
従って、天然に存在する化合物のシクロスポリンAに匹敵する薬理学的効果を有するが、毒性副作用は低減された免疫抑制剤が求められている。
【0008】
シクロスポリンが最初に発見されて以来、種々の天然シクロスポリンが単離され同定されてきた。さらに、自然には存在しない多くのシクロスポリンが一部合成手段または完全合成手段によって、および改変された細胞培養技術を適用することによって調製されてきた。従って、シクロスポリンを構成している群は相当数あり、例えば、天然シクロスポリンA〜Z;各種の非天然シクロスポリン誘導体;ジヒドロシクロスポリンおよびイソシクロスポリンをはじめとする人工または合成シクロスポリン;誘導化シクロスポリン(例えば、MeBmt残基の3’-O-原子をアシル化してもよいし、3位のサルコシル残基にさらに置換基を導入してもよい);MeBmt残基が異性体の形態で存在するシクロスポリン(例えば、MeBmt残基の6’位および7’位を横切る立体配置がトランス型よりもむしろシス型であるもの);ならびにペプチド配列内の特定の位置に変異アミノ酸が挿入されているシクロスポリンが挙げられる。
【0009】
1位に修飾アミノ酸を含んでいるシクロスポリン類似体は、WO 99/18120およびWO 03/033527に記載されている(これは、本出願の譲受人に譲渡されており、また参照によりその全体を本明細書に組み入れるものとする)。これらの出願には、「ISATX247」または「ISA247」または「ISA」として知られるシクロスポリン誘導体が記載されている。この類似体は、アミノ酸1残基の修飾を除けば、構造的にシクロスポリンAと同一である。出願人らはこれまでに、ISA247のシス異性体およびトランス異性体からなる特定の混合物(主としてトランスISA247で構成されている混合物を含む)が、天然で既に公知のシクロスポリンに勝る高い効力と低毒性の組み合わせを示すことを見出している。ISA247の一部のアルキル化誘導体、アリール化誘導体および重水素化誘導体も記載されている。
【0010】
またシクロスポリンAの代謝体が研究されてきており、一部の例では、親医薬品の効力と同等の優れた効力を持つことが確認されている。さらに、代謝体を認識する抗体の産生に代謝体が使用されている。これらの抗体は、患者血液中の医薬品の量のモニタリングに用いることができる(薬剤治療管理またはTDM)。代謝体を特異的に認識する抗体は、代謝体との結合によりこれらのTDM試験を実施するのに役立ち得る。抗体が代謝体に特異的に結合しない場合には、患者血液中の医薬品の量が誤って多く算出される恐れがある。従って、当技術分野では、ISA247の代謝体の同定および単離と、これらの代謝体の調製方法および使用方法が求められている。
【0011】
参考文献
【特許文献1】米国特許第6,605,593号
【特許文献2】米国特許第6,613,739号
【特許文献3】US 2003/0212249
【特許文献4】国際公開WO 99/18120
【特許文献5】国際公開WO 03/033527
【特許文献6】国際公開WO 2003/033526
【特許文献7】国際公開WO 2003/033527
【非特許文献1】Brown, H.C.ら, J. Am. Chem. Soc. vol 110, p 1535 (1988)
【非特許文献2】Christiansら, "Cyclosporine Metabolism in Transplant Patients" Pharmac. Ther. vol 57, pp 291-345 (1993)
【非特許文献3】Eberle M.K.およびF. Nuninger, "Synthesis of the main metabolite (OL-17) of cyclosporin A," J. Org. Chem. Vol. 57, No. 9, pp. 2689-2691 (1992)
【非特許文献4】Hartman, N. R.およびI. Jardine, "Mass Spectrometric Analysis of Cyclosporine Metabolites," Biomed. Environ. Mass Spectrom. Vol. 13, pp. 361-372 (1986)
【非特許文献5】Huら, J. Org. Chem. vol 63, p 8843 (1998)
【非特許文献6】Johnson, R.A.,およびSharpless, K.B; Catalytic Asymmetric Synthesis: I. Ojima編; VCH Publishers: New York; 1993; p. 103
【非特許文献7】Keown, P.A., "Molecular and Clinical Therapeutics of Cyclosporine in Transplantation," Immunosuppression in Transplantation (Blackwell Science, Maiden MA, 1999), pp. 1-12
【非特許文献8】Marshall, J. A. Chem Rev. vol 96, p 31 (1996)
【非特許文献9】Barrett, A.G.M.ら, J. Org. Chem. vol 56, p 5243 (1991)
【非特許文献10】Sharpless, K.B.ら, J. Org. Chem. vol 57, p 2768 (1992)
【非特許文献11】Wenger, R.M., "Synthesis of Cyclosporine and Analogs: Structural Requirements for Immunosuppressive Activity," Angew Chem Int. Ed. Engl. Vol. 24, No. 2, pp. 77-138. (1985)
【発明の開示】
【0012】
本発明は、シクロスポリン類似体ISA247の代謝体の同定および単離に関する。また本発明は、シクロスポリン類似体ISA247の代謝体の調製方法および使用方法も提供する。かかる代謝体は、有用な免疫抑制活性を有していると考えられ、かつ親化合物よりも低い毒性または同等の毒性を示し得る。またかかる代謝体は、薬剤治療管理のためのアッセイの開発に役立つ可能性がある。
【0013】
本発明の実施形態では、ISA247の代謝体は、以下の式:
【化1】

【0014】
[式中、
各R2は独立に-Hまたは-CH3であり;
各R10は独立に-H、-OH、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORaまたは-NRcC(O)N(RaRb)であり;
R5、R6、R7、R8およびR9は独立に、-H、-OH、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORaまたは-NRcC(O)N(RaRb)であるか;またはR6とR7が一緒になって-O-であるか;またはR5とR6が一緒になって、もしくはR7とR8が一緒になって独立に-O-であるか;またはR8とR9が一緒になって-O-であるか;またはR5が、それが結合する炭素と一緒になって、-C(=O)Ra、-CO2Ra、-CH2ORa、-CH2OC(O)Ra、-CH(ORa)2、-C(O)N(RaRb)、-C(=NRb)Ra、-C(=NORb)Ra、もしくは-C(=NNRb)Raであり;ただし、R5とR6、R6とR7、またはR7とR8のうち1ペアが炭素間結合していて、かつ残りのすべてが-Hであることはなく;かつ
Ra、RbおよびRcはそれぞれ独立に-Hであるか、または脂肪族、脂環族、ベンジルもしくはアリールで置換されていてもよく、あるいは-N(RaRb)が一緒になって任意的な置換複素環基であるか、または-CH(ORa)2が一緒になって環状アセタール基である]
により表される単離された化合物、ならびに製薬上許容されるその塩および溶媒和物を包含する。
【0015】
各種の実施形態では、本化合物は、以下の式:
【化2】

【0016】
[式中、
各R2は独立に-Hまたは-CH3であり;
各R10は独立に-H、-OH、-F、-Cl、-Br、-I、-ORa、-OC(O)Ra、-OSO2Ra、-OSO3Ra、-OPO2RaRbまたは-OPO3RaRbであり;
R5、R6、R7、R8およびR9は独立に、-H、-OH、-F、-Cl、-Br、-I、-ORa、-OC(O)Ra、-OSO2Ra、-OSO3Ra、-OPO2RaRbもしくは-OPO3RaRbであるか;またはR6とR7が一緒になって-O-であるか;またはR5とR6が一緒になって、もしくはR7とR8が一緒になって独立に-O-であるか;またはR8とR9が一緒になって-O-であるか;またはR5が、それに結合する炭素と一緒になって-C(=O)Ra、-CO2Ra、-CH2ORa、-CH2OC(O)Ra、-CH(ORa)2、-C(O)N(RaRb)、-C(=NRb)Ra、-C(=NORb)Raまたは-C(=NNRb)Raであり;ただし、R5とR6、R6とR7、またはR7とR8のうち1ペアが炭素間結合していて、かつ残りのすべてが-Hであることはなく;かつ、
Ra、RbおよびRcはそれぞれ独立に-Hであるか、または脂肪族、脂環族、ベンジルもしくはアリールで置換されていてもよく、あるいは-N(RaRb)が一緒になって任意的な置換複素環基であるか、または-CH(ORa)2が一緒になって環状アセタール基である]
により表される。
【0017】
特定の実施形態では、本化合物は、以下の式:
【化3】

【0018】
[式中、
R1は以下のもの:
【化4】

【0019】

【0020】
からなる群より選択され、
各R2は独立に、-CH3および-Hからなる群より選択され;
各R3は独立に、-CH2CH(CH3)2および-CH2C(CH3)2OHからなる群より選択され;かつ
各R4は独立に、-CH(CH3)2および-C(CH3)2OHからなる群より選択される]
により表される。
【0021】
本発明の各種実施形態には、シクロ{{(E)-および(Z)-(2S,3R,4R)-3-ヒドロキシ-4-メチル-2- (メチルアミノ)-6,8-ノナジエノイル}-L-2-アミノブチリル-N-メチル-グリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル-L-アラニル-D-アラニル-N-メチル-L-ロイシル-N-メチル-L-ロイシル-N-メチル-L-バリル}(ISA247)の単離された代謝体ならびにその製薬上許容される塩および溶媒和物であって、ISA247と比較して、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、分子内環化、リン酸化、硫酸化、グルクロニド形成およびグリコシル化からなる群より選択される少なくとも1個の化学修飾を含む代謝体ならびにその塩および溶媒和物が含まれる。
【0022】
具体的な実施形態では、本発明は、化学修飾が、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、および分子内環化からなる群より選択される、親化合物ISA247の少なくとも1個の化学修飾を提供する。
【0023】
本発明の特定の実施形態には、化学修飾が、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、および分子内環化からなる群より選択される、親化合物の少なくとも1個の化学修飾を含む、シクロ{{(E)-および(Z)-(2S,3R,4R)-3-ヒドロキシ-4-メチル-2-(メチルアミノ)-6,8-ノナジエノイル}-L-2-アミノブチリル-N-メチル-グリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル-L-アラニル-D-アラニル-N-メチル-L-ロイシル-N-メチル-L-ロイシル-N-メチル-L-バリル}(ISA247)の代謝体が含まれる。
【0024】
各種の実施形態では、単離された代謝体は、以下のもの:アミノ酸1の側鎖でのエポキシド;アミノ酸1の側鎖でのジオール;アミノ酸1の側鎖中の環状エーテル;アミノ酸1、3、4、6、9、10、または11での脱メチル化アミノ窒素;アミノ酸4、6、9、または10の側鎖のγ炭素での-OH;およびアミノ酸5または11の側鎖のβ炭素での-OHからなる群より選択される、少なくとも1個の化学修飾を含む。各種の実施形態では、単離された代謝体は、2個以上の前記化学修飾を含む。特定の実施形態では、単離された代謝体は、IM1-e-1、IM1-e-2、IM1-e-3、IM1-d-1、IM1-d-2、IM1-d-3、IM1-d-4、IM1-c-1およびIM1-c-2からなる群より選択することができる。
【0025】
特定の実施形態では、ISA247と比較して、単離された代謝体は、以下のもの:少なくとも2個の-OH基;少なくとも2個の脱メチル化アミノ酸窒素;少なくとも1個の-OH基および少なくとも1個の脱メチル化アミノ酸窒素;少なくとも1個のジオール基および少なくとも1個の-OH基;少なくとも1個のジオール基および少なくとも1個の脱メチル化アミノ酸窒素;少なくとも1個の環状エーテルおよび少なくとも1個の-OH基;少なくとも1個の環状エーテルおよび少なくとも1個の脱メチル化アミノ酸窒素;少なくとも1個の-OH基およびリン酸、硫酸、グルクロニドまたはグリコシル化残基;ならびに、少なくとも1個のジオールおよびリン酸、硫酸、グルクロニドまたはグリコシル化残基からなる群より選択される化学修飾を含む。実施形態としては、エポキシド、ジオールおよび環化を含む、ISA247のアミノ酸1での代謝体が挙げられる。さらなる実施形態としては、ISA247化合物が、(1)少なくとも1個のメチルロイシンアミノ酸で、例えば、アミノ酸4、6、9または10で;(2)バリン残基5で;または(3)メチルバリン残基11で水酸化されている代謝体が挙げられる。さらなる実施形態としては、ISA247のアミド結合の少なくとも1個のメチル化窒素が脱メチル化されている代謝体が挙げられる。またさらなる実施形態としては、ISA247のアミノ酸1、3、4、6、9、10および11のアミド結合の少なくとも1個の窒素が脱メチル化されている代謝体が挙げられる。ISA247の具体的な代謝体としては、IM1-d-1、IM1-d-2、IM1-d-3、IM1-d-4、IM9、IM1-c-1、IM1-c-2、IM4n、IM6、IM46、IM69、IM49、IM1-e-1、IM1-e-2、およびIM1-e-3が挙げられる。
【0026】
さらなる実施形態としては、別のアミノ酸残基での少なくとも1個の水酸化または少なくとも1個のN-脱メチル化と組み合わせた、ISA247のアミノ酸1でのジオールまたは環化を有する代謝体が挙げられる。さらに、実施形態としては、別のアミノ酸残基での少なくとも1個の水酸化および少なくとも1個のN-脱メチル化と組み合わせた、ISA247のアミノ酸1でのジオールまたは環化を有する代謝体が挙げられる。
【0027】
各種の実施形態では、ISA247の代謝体は、薬剤投与後に体液から単離するか、あるいは、半合成的に(すなわち、動物肝臓細胞のミクロソームホモジネートから、もしくは微生物の培養物から)生成するか、または完全合成的に、例えば、有機合成の当技術分野で公知の反応を用いて親化合物を化学修飾させることによって生成することができる。
【0028】
従って、本発明の一部の実施形態は、in vitroでISA247の代謝体を調製する方法であって、以下のステップ:(a)哺乳動物細胞(例えば、哺乳動物肝臓細胞)をホモジナイズしてホモジネートを形成させる(例えば、それらの形質膜を破裂させて肝臓細胞の内容物を放出させる)ステップと;(b)前記ホモジネートを遠心分離して、少なくとも1種の薬物代謝酵素(例えばシトクロムP450)を含むミクロソームペレットを形成させるステップと;(c)ISA247、前記ミクロソームペレット、エネルギー源、および電子供与分子を含有する反応混合物を、ISA247の少なくとも1種の代謝体の生成をもたらす条件下で調製するステップとを含む方法を提供する。さらなる実施形態では、本方法は、霊長類、ラット、イヌおよびウサギからなる群より選択されるか、または一部の実施形態では、イヌまたはウサギから選択される、哺乳動物の肝臓細胞を利用することができる。電子供与分子は、例えばNADHまたはNADPHであってもよい。エネルギー源は、例えば、グルコース-6-リン酸およびイソクエン酸からなる群より選択することができる。特定の実施形態では、本反応混合物は、グルコース-6-リン酸デヒドロゲナーゼおよびイソクエン酸デヒドロゲナーゼからなる群より選択される酵素をさらに含んでいる。
【0029】
さらなる実施形態では、本発明は、高速液体クロマトグラフィーを用いて、ISA247の代謝体を単離する方法を提供する。さらなる実施形態では、クロマトグラフィーカラムは、n-オクタデシル、n-オクチル、n-ブチル、ジフェニルおよびシアノプロピルのカラムであって、その長さは約150〜250mm、直径は約0.1〜4.6mmの範囲であり、流速が約500〜2,000μL/分であってもよい。またさらに、本発明の実施形態は、代謝体を質量分析によって同定することができることを提供する。
【0030】
また本発明の実施形態は、ISA247の水酸化代謝体を生成する方法であって、以下のステップ:(a)ISA247の1-アミノ酸のβアルコールを保護して保護されたISA247化合物を形成させるステップと;(b)前記の保護されたISA247化合物をハロゲン化剤を用いて4、6、または9-アミノ酸残基のうち少なくとも1つの側鎖のγ炭素でハロゲン化し、それによりハロゲン化生成物を形成させるステップと;(c)ステップ(b)のハロゲン化生成物をアセテート試薬の存在下で加熱してアセテート部分を有するアセテート含有生成物を形成させるステップと;(d)トランスエステル化を行って、ステップ(c)のアセテート含有生成物のアセテート部分をアルコール部分に交換するステップとを含み、それによりISA247の水酸化代謝体を形成させる方法を提供する。具体的な実施形態では、ハロゲン化剤は、例えばN-ブロモスクシンイミド(NBS)であり、アセテート試薬は、例えばテトラブチルアンモニウムアセテートである。
【0031】
各種の実施形態としては、前記方法によって生成される、ISA247の単離された水酸化代謝体が挙げられる。具体的な単離された水酸化代謝体は、IM9、IM4、IM6、IM46、IM69およびIM49からなる群から選択することができる。
【0032】
本発明の実施形態は、in vitroでISA247のエポキシド代謝体を生成する方法であって、単離されたISA247の1-アミノ酸残基の側鎖のアルケン部分を酸化剤を用いて(例えば、Prilezhaev反応を用いて)酸化し、それによりISA247のエポキシド代謝体を形成させるステップを含む方法を提供する。酸化剤は、例えば、m-クロロ過安息香酸(MCPBA)、過酢酸、トリフルオロ過酢酸、過安息香酸、3,5-ジニトロ過安息香酸、過酸化水素、過酸化アルキル、および酸素などであってもよい。
【0033】
各種の実施形態としては、前記方法により調製される、ISA247の単離されたエポキシド代謝体が挙げられる。具体的な単離されたエポキシド代謝体としては、IM1-e-1、IM1-e-2およびIM1-e-3が挙げられる。
【0034】
本発明のさらなる実施形態は、ISA247の代謝体を含有しているジオールを生成する方法であって、以下のステップ:(a)β-OH基を保護するステップと;(b) ISA247のアミノ酸1残基の側鎖のアルケン成分を酸化剤で処理し、アルケン成分をモノエポキシドに変換させるステップと;(c)エポキシドからジオールを含有しているISA247の代謝体を形成するステップと;(d)β-OH基を塩基を用いて脱保護するステップとを含む方法を提供する。
【0035】
本発明のさらなる実施形態としては、ISA247のジオール含有代謝体を生成する方法であって、以下のステップ:(a)ISA247の1-アミノ酸の側鎖のアルケン部分を(例えばPrilezhaev反応として)酸化剤で処理してISA247のエポキシド代謝体を形成させるステップと;(b)ISA247の単離されたエポキシド代謝体から、ISA247の単離されたジオール代謝体を形成させるステップとを含む方法が挙げられる。酸化剤の代表的な例としては、m-クロロ過安息香酸(MCPBA)、過酢酸、トリフルオロ過酢酸、過安息香酸、3,5-ジニトロ過安息香酸、過酸化水素、過酸化アルキル、および酸素が挙げられる。別の実施形態では、ISA247のジオール含有代謝体をエポキシドから形成するステップ(b)は、ステップ(a)のエポキシドを、水を使用する求核攻撃(例えば加水分解)に供することを含む。水による求核攻撃は、酸および塩基(例えば、過塩素酸、アルカリ水、Nafion-H、ギ酸等)からなる群より選択される試薬により触媒され得る。特定の実施形態では、ステップ(b)の加水分解は、過塩素酸もしくはNafion-Hにより触媒される加水分解;ジメチルスルホキシド中でのアルカリ加水分解;およびミクロソームエポキシドヒドロラーゼにより触媒される加水分解から選択される。
【0036】
各種の実施形態としては、前記方法によって調製される、ISA247の単離されたジオール代謝体が挙げられる。具体的な単離されたジオール代謝体としては、IM1-d-1、IM1-d-2、IM1-d-3およびIM1-d-4が挙げられる。
【0037】
またさらなる実施形態では、本発明は、ISA247のジオール含有代謝体を生成する方法であって、四酸化オスミウムおよびアルカリ性過マンガン酸カリウムもしくは過酸化水素、またはt-ブチルヒドロペルオキシドもしくは過酸化水素/ギ酸、またはモノ過コハク酸(monopersuccinic acid)を用いて、ISA247から直接的にジオール代謝体を形成させるステップを含む方法を提供する。典型的な実施形態では、ISA247を、四酸化オスミウム、アルカリ性過マンガン酸カリウム、過酸化水素、モノ過コハク酸およびt-ブチルヒドロペルオキシドからなる群より選択される試薬と反応させることにより、ISA247のジオール代謝体を形成させる。典型的には、ISA247を、触媒作用を有する量の四酸化オスミウムと反応させることができる。一部の実施形態では、ISA247を、過酸化水素/ギ酸およびモノ過コハク酸からなる群より選択される試薬と反応させることができる。
【0038】
一部の実施形態では、ISA247のジオール代謝体を生成する方法は、(a)ISA247を、ヨウ素/安息香酸銀および酢酸銀からなる群より選択される試薬で処理し、ISA247のジエステルを形成させるステップと;(b)ISA247のジエステルを加水分解し、それによりISA247のジオール代謝体を形成させるステップとを含む。
【0039】
各種の実施形態としては、前記方法によって調製される、ISA247の単離されたジオール代謝体が挙げられる。具体的な単離されたジオール代謝体としては、IM1-d-1およびIM1-d-2が挙げられる。
【0040】
一部の実施形態では、ISA247のジオール代謝体を生成する方法は、(a)ISA247を、四酢酸鉛および酢酸タリウムからなる群より選択される試薬と反応させ、ISA247のジオールビスアセテートを形成させるステップと;(b)ISA247のジオールビスアセテートを加水分解し、それによりISA247のジオール代謝体を形成させるステップとを含む。
【0041】
各種の実施形態としては、前記方法によって調製される、ISA247の単離されたジオール代謝体が挙げられる。具体的な単離されたジオール代謝体としては、IM1-d-1およびIM1-d-2が挙げられる。
【0042】
さらなる実施形態では、代謝体ジオールは、ハロアリルホウ素化反応(haloallylboration)などの有機金属成分により利用されやすいビニルエポキシドから調製される。また、かかるビニルエポキシドは、Sharplessの二水酸化プロトコルにより取得することができる。
【0043】
本発明の特定の実施形態としては、製薬上許容される担体と、本発明の単離された化合物または代謝体のいずれかとを含む医薬組成物が挙げられる。
【発明を実施するための最良の形態】
【0044】
本発明は、シクロスポリン類似体ISA247の代謝体を明らかにする。また本発明は、シクロスポリン類似体ISA247の代謝体の調製方法を提供する。かかる代謝体は免疫抑制活性を有している。これらはまた、抗体の産生をはじめとする、薬剤治療管理のアッセイを開発するのに有用である。
【0045】
シクロスポリンAは、トリポクラジウム・インフラタム・ガムス(Tolypocladium inflatum Gams)種の浸漬培養で生成される、中性で高親油性の環状ウンデカペプチドである。この臨床コードはOL 27-400であり、サンディミュン(登録商標)の商品名の免疫抑制剤の有効成分である。
【0046】
シクロスポリンAは、最近(1983年にCarruthersによって)「シクロスポリン」と名称変更された。本出願では、特定の化合物シクロスポリンAを表すのに省略形の「CsA」を用い、また「シクロスポリン」という用語は、シクロスポリン類似体をはじめとする、免疫抑制活性を有する環状ペプチドを含む免疫抑制剤の一般群を意味するものとする。従って、「シクロスポリン」という用語は、通常、シクロスポリンA〜Z(修飾体および類似体を含む)のいずれかを意味する。特に、用語シクロスポリンは、化合物CsAおよびISA247を含んでいる。
【0047】
CsAおよびその代謝体の構造と命名法
図1にシクロスポリンAの構造を示す。N.R. HartmanおよびI. Jardineによって、"Mass Spectrometric Analysis of Cyclosporine Metabolites," Biomed. Environ. Mass Spectrom. Vol. 13, pp. 361-372 (1986)に記載されている通り、シクロスポリンAは、そのほとんど全体が疎水性アミノ酸からなる環状ウンデカペプチドである。これらのアミノ酸の大半は、タンパク質では通常発見されない。図1は、この分子の環状ペプチド環を含む11個のアミノ酸残基を明らかにしている。CsA分子は、サルコシン残基(Sarまたはメチル化グリシン残基MeGly)、D-およびL-アラニン(Ala)の各残基、α-アミノ酪酸残基(Abu)、バリン(Val)残基、N-メチルバリン(MeVal)残基、4個のN-メチルロイシン(MeLeu)残基、および9個の炭素を含有しているアルケン、すなわち(4R)-4-[(E)-2-ブテニル]-4,N-ジメチル-L-スレオニン(MeBmt)と呼ばれるシクロスポリンに特有のβ-水酸化アミノ酸を含んでいる。
【0048】
本明細書では、これらのアミノ酸残基には、(4R)-4-[(E)-2-ブテニル]-4,N-ジメチル-L-スレオニン(MeBmt)から始まり、隣接しているMeValで終了するように、連続番号1〜11を付けている(図1では、MeBmtから開始して右回りに番号を付けている)。
【0049】
CsAの各アミノ酸は、位置8のアラニン残基を除き、S-立体配置(アミノ酸のL-異性体)を有している。前記アラニン残基は、R-立体配置(アラニンのD-異性体)をとる。これらのアミン窒素原子で、7個のアミノ酸がメチル化されている(これらは、残基1、3、4、6、9、10および11である)。シクロスポリンAの構造が発見された時、10個のアミノ酸2〜11は知られていたが、β-水酸化アミノ酸MeBmtは知られていなかった。
【0050】
ISA247(またはISATX247もしくはISA)の構造を図2に示す。本明細書では、ISA247および記載の代謝体中のアミノ酸残基の位置には、図1のCsAと同じように番号を付けている。図1と比較すると、CsAとISA247は、アミノ酸残基1の側鎖を除けば同一であるということがわかる。これらのシクロスポリンの共通の構造は、ISA247のE(トランス)異性体およびZ(シス)異性体を描いた、図3および図4に示した囲み枠によっても表示される。この場合、数字の1は、表示した側鎖が結合しているアミノ酸残基1を示す。このアミノ酸1の構造は、図41および図42に、ならびに表5に同様に記載している。
【0051】
アミノ酸の側鎖構造を本明細書で明確に示す場合、その側鎖の炭素は、当技術分野で通常知られているようにギリシャ文字で表示する場合がある。例えば、アミノ酸のカルボニル基に隣接している炭素は通常α炭素と表示され、ペプチド環から離れる方向の炭素原子の特定のために、ギリシャ文字のアルファベットが順次付けられる。図1および図2にこの命名法の例を示す。例えばCsAの場合、MeBmt側鎖のβ炭素はヒドロキシル基に結合しており、側鎖のε炭素とζ炭素との間には二重結合がある。
【0052】
CsA構造に関するさらなる詳しい情報は、P. A. Keownにより、 Immunosuppression in Transplantation (Blackwell Science, Malden MA, 1999), pp. 1-12の章表題 "Molecular and Clinical Therapeutics of Cyclosporine in Transplantation"に記載されている。Keownによれば、固体状態でのX線回折と非水系溶液での核磁気共鳴研究を行ったところ、CsA分子が2種類の構造モチーフにより特性決定されることが紹介されている。残基MeBmt(位置1)〜残基MeLeu(位置6)は、水素結合により安定化されている逆並行βシートを含んでおり、一方、残基Ala(位置7)〜残基MeVal(位置11)は、残基9と残基10の間のペプチド結合がシス立体配置にあるループを形成している。免疫抑制剤シクロスポリンは、2種類の制御ドメインを有する。残基1、2、9、10および11が受容体結合ドメインを表し、一方、残基4〜8がエフェクタードメインとして機能する。また、R.M. WengerによるAngew Chem Int. Ed. Engl. Vol. 24, No. 2, pp. 77-138 (1985)の文献タイトル"Synthesis of Cyclosporine and Analogs: Structural Requirements for Immunosuppressive Activity" によると、免疫抑制に必須のアミノ酸は、位置1、2、3および11のMeBmt、Abu、SarおよびMeValである。
【0053】
CsAの環状ウンデカペプチド構造は、解明されているすべての代謝体中に保存されている(Copeland, 1990)。これらの環状ペプチドの生体内変化に関与している反応は、ほとんどの場合、水酸化、エポキシド形成、N-脱メチル化、および分子内環化である。多重水酸化(multiple hydroxylation)は同一分子中の異なる部位で起こり得るが、「水酸化」という用語は一水酸化(monohydroxylation)を意味する。また二水酸化は、アルケンのエポキシドへの酸化と、その後のジオール形成により起こり得る。N-脱メチル化は、環状ペプチド環中のアミノ酸残基に隣接して連結しているアミド結合のメチル化窒素で起きる。CsAの代謝体は、アルデヒド誘導体およびカルボン酸誘導体を含む。CsAのカルボン酸代謝体が形成されると、毒性をもたらす可能性がある。上述の反応の組み合わせもまた起こり得る。
【0054】
同様な命名法が必ずしも用いられているとは限らないが、多くの異なる研究者がCsA代謝体について記載している。この状況を明確にするため、図5にCsAの公知の代謝体の表を作成した。図5に関し、シクロスポリンAの代謝体は、接頭語「CsA-Am」により識別される。この場合、表示の「CsA」部分は、その化合物がシクロスポリンAの代謝体であることを意味し、「Am」の記号の部分は、代謝による修飾が起こるアミノ酸位置を示す。それに続く記号は、代謝反応の性質を明示する。この命名法を使用すると、以下のISA247代謝体の記載に関してより明確に理解されるであろう。
【0055】
ISA247およびその代謝体の構造と命名法
本発明者らは、これまで、「ISA」、「ISA247」または「ISATX247」と呼ぶシクロスポリンA類似体について記載してきた(米国特許第6,605,593号および同第6,613,739号を参照されたい)。上述の通り、この類似体は、アミノ酸1残基の修飾を除けば、構造的にはシクロスポリンAと同じである。本発明者らは、ISA247のシス異性体(Z異性体としても知られる)およびトランス異性体(E異性体としても知られる)の特定の混合物が、天然であって現在公知のシクロスポリン類に勝る高い効力と低毒性の組み合わせがあることを明らかにした。さらに本発明者らは、主としてトランス異性体からなる、シス異性体とトランス異性体の混合物が、天然であって現在公知のシクロスポリン類に勝る低毒性と高い効力を有することを見出した。
【0056】
ISA247の化学名は、シクロ-{{(E)-および(Z)-(2S,3R,4R)-3-ヒドロキシ-4-メチル-2-(メチルアミノ)-6,8-ノナジエノイル}-L-2-アミノブチリル-N-メチル-グリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル-L-アラニル-D-アラニル-N-メチル-L-ロイシル-N-メチル-L-ロイシル-N-メチル-L-バリル}である。その実験式はC63H111N11O12であり、約1214.85の分子量をもつ。「ISA」、「ISA247」および「ISATX247」という用語は、この薬理学的活性化合物に付与された流通名である。
【0057】
ISA247の構造は、主として核磁気共鳴(NMR)分光法により確認されている。1Hおよび13Cの両スペクトルを、1次元および2次元NMR実験系列を使用し、ISA247のピークをシクロスポリンAに関する公知のNMR帰属と比較することにより帰属した。ISA247の(E)異性体および(Z)異性体の絶対的な帰属は、核オーバーハウザー効果(NOE)実験により確認した。裏付けとなるさらなる証拠は、質量スペクトル分析および赤外スペクトルにより得た。質量スペクトル分析では分子量が確認され、赤外スペクトルでは、シクロスポリンAに非常に似ていることが判明した。後者の結果は、この2つの化合物間には構造上の密接な類似性があることから予期されたものである。しかし、ISA247は、その1-アミノ酸残基の側鎖にCsA中には存在しない共役ジエンを含有している。ISA247は、CsAと同じく、そのアミノ酸1側鎖のε炭素とζ炭素の間に炭素-炭素二重結合を有してはいるが、ISA247はCsAとは異なり、さらにη炭素とθ炭素の間に炭素-炭素二重結合を有している。
【0058】
CsAとISA247の構造間には類似性があることから、記載したISA247の代謝体に関する命名法は、CsA代謝体に対して展開した命名スキームに基づいている。本明細書で特定された代謝体は、ISA247代謝体がシクロスポリン「A」の「A」の代わりに「ISA」の接頭語「I」が前につく以外は、同様のパターンに従う。また、CsA代謝体の修飾アミノ酸の識別には文字「AM」を用いているが、ISAの代謝体には「IM」を用いる。例えば、アミノ酸9のγ炭素で一水酸化されているCsA代謝体は、CsA-Am9またはAM9として識別される。アミノ酸9のγ炭素で一水酸化されているISA247代謝体は、IM9として識別される。4位のMeLeuの窒素が脱メチル化されているCsA代謝体は、CsA-Am4nまたはAM4nとして識別される。4位のMeLeuの窒素が脱メチル化されているISA247代謝体は、IM4nとして識別される(ISAの代謝体(Metabolite)、アミノ酸4でのn-脱メチル化)。
【0059】
ISA247はアミノ酸1に1,3-ジエンを有するので、数種類のジオール代謝体は、CsAから形成することができず、ISA247から形成することができる。これらのジオール代謝体に関する命名法は、上述した基準と同様にする。例えば、構造が解明されている最初のジオール代謝体は、IM1-d-1である(ISAの代謝体(Metabolite)、アミノ酸1-ジオール(diol)-試験した1番目の構造)。
【0060】
CsAと同様に、ISA247はin vivoで代謝され、代謝体が形成され得る。これらの代謝体は、血流により運ばれ、尿および/または胆汁を介して排泄され得る。従って、ISA247代謝体は、薬剤投与後に、動物の全血、胆汁および尿をはじめとする体液から単離することができる。またISA247代謝体は、生体内変換を介して微生物により生成することもできる。さらにISA247代謝体は、哺乳動物のミクロソーム系を用いて調製することができる。またISA247代謝体は化学的に合成することもできる。代謝体は、質量分析連結型のクロマトグラフ法によって、また核磁気共鳴(NMR)技術によって単離し特性決定することができる。
【0061】
さらなる実施形態では、本発明は、本発明の代謝体を特異的に認識する抗体を提供する。特に、所定の代謝体は認識するが、シクロスポリン、ISA247または他の代謝体とは交差反応しない抗体が意図される。抗体は、ポリクローナル抗体、モノクローナル抗体、多重特異的抗体、ヒト抗体、ヒト化抗体、霊長類化抗体、キメラ抗体、単鎖抗体、エピトープ結合フラグメント(例えばFab、Fab'およびF(ab')2)等であってもよい。本発明の代謝体は、抗体調製またはスクリーニングに使用することができる。さらに、ポリクローナル抗体混合物(抗血清など)がシクロスポリン、ISA247または不都合な代謝体と交差反応する場合は、混合物を免疫的選択または免疫吸着により処理して交差反応性抗体を除去することができる。例えば、免疫的選択では、目的の代謝体が固定化されているカラムに混合物を通過させることができる。次いで、カラムへ結合している抗体を溶出させ、回収することができる。反対に、免疫吸着では、混合物が交差反応する化合物を固定化し、不都合な抗体を吸着するために用いることができる。抗体の調製方法は当技術分野で公知である(例えば、Harlow and Lane, "Antibodies. A Laboratory Manual", Cold Spring Harbor Laboratory, New York, 1988を参照されたい)。これらの抗体は、例えば、薬剤治療管理において有用である。
【0062】
定義
本明細書では「代謝体」とは、哺乳動物においてISA247の代謝により生成されるISA247の誘導体を意味し、これはさらに化学的に修飾することができる。本明細書に記載したISA247の単離された代謝体は、ISA247を哺乳動物へ投与した後、単離することによって;ISA247、CsAまたは別のシクロスポリン誘導体を本明細書に記載のように化学修飾することによって;ISA247、CsAまたは別のシクロスポリン誘導体を酵素を用いてin vitroで反応させることによって;ISA247、CsAまたは別のシクロスポリン誘導体を微生物変換することによって;あるいはこれらのステップの2つ以上を任意の順序で組み合わせることによって調製することができる。例えば、ISA247を哺乳動物に投与し、その哺乳動物から単離されたISA247の代謝体を化学的に修飾し、さらなる代謝体を形成させることができる。あるいは、ISA247を、本明細書に記載したミクロソーム調製物とin vitroで反応させて代謝体を形成させ、これを化学的に修飾し、さらなる代謝体を形成させることができる。
【0063】
本明細書では、「化学的に修飾する」とは、化合物が基準構造と比較した場合に少なくとも1つの化学的な構造上の差異を有することを意味する。化学修飾は、本明細書に記載の任意の合成法、酵素法または代謝過程によってもたらすことができる。
【0064】
本明細書では、好適な保護基(例えば、ISA247の1-アミノ酸残基のβ-アルコールを保護し、保護されたISA247化合物を形成させる保護基)、ならびに保護および脱保護の条件は、当技術分野で公知であり、例えば、GreeneおよびWuts, "Protective Groups in Organic Synthesis", John Wiley & Sons (1991)に記載されている(その全開示は、参照により本明細書に組み入れるものとする)。好適なヒドロキシル保護基の具体的な例としては、置換メチルエーテル類(例えばメトキシメチル、ベンジルオキシメチル)、置換エチルエーテル類(例えばエトキシメチル、エトキシエチル)、ベンジルエーテル類(ベンジル、ニトロベンジル、ハロベンジル)、シリルエーテル類(例えばトリメチルシリル)、エステル等が挙げられるが、これらに限定されるものではない。
【0065】
本明細書では、「ハロゲン化剤」とは、-Hまたは他の基をハロゲンで置換することができる、当技術分野で公知の化合物である。例えば、各種の実施形態では、ハロゲン化剤は、臭素、塩素、N-クロロスクシンイミド、N-ブロモスクシンイミド等であってもよく、特にN-ブロモスクシンイミドである。
【0066】
本明細書では、Prilezhaev反応とは、アルケンと過酸との反応によるエポキシドの形成を意味する。例えば、N. Prilezhaev, Ber. 42, 4811 (1909); D. Swern, Chem. Rev. 45, 16 (1949); Org. React. 7, 378 (1953); H. O. House, Modern Synthetic Reactions (W. A. Benjamin, Menlo Park, California, 第2版, 1972) pp 302-319; D. I. Metelitra, Russ. Chem. Rev. 41, 807 (1972);およびD. Schnurgfeil, Z. Chem. 20, 445 (1980)を参照されたい。なおこれらの引用文献の全開示は参照により本明細書に組み入れるものとする。
【0067】
本明細書では、「薬剤代謝酵素」とは、in vivoまたはin vitroにおいて、CsA、ISA247またはその代謝体を化学的に修飾することができる酵素である。一般には、薬剤代謝酵素は、動物または微生物(例えば哺乳動物)から、例えば、哺乳動物細胞(例えば肝臓細胞)をホモジナイズし、薬剤代謝酵素を含有するミクロソーム調製物を生成することにより得ることができる。特定の実施形態では、薬剤代謝酵素としては、酵素のシトクロムP450ファミリーの1種または複数のメンバーが挙げられる。
【0068】
本明細書では、「エネルギー源」には、薬剤代謝酵素によって使用され、ISA247を化学的に修飾してISA247の代謝体を生成するエネルギーを提供することができる、1種または複数の化合物が含まれる。例えば、エネルギー源は、炭水化物、例えば、特定の実施形態では、グルコース-6-リン酸、イソクエン酸等であってもよい。ミクロソーム調製物において、エネルギー源の消化を促進する酵素としては、例えば、グルコース-6-リン酸デヒドロゲナーゼ、イソクエン酸デヒドロゲナーゼ等を挙げることができる。
【0069】
本明細書では、「電子供与分子」は、ISA247を化学的に修飾し、ISA247の代謝体を生成するための酸化還元反応系電子源として薬剤代謝酵素によって使用され得る化合物である。例えば典型的な電子供与分子としては、ニコチンアミドアデニンジヌクレオチド(NADH)およびニコチンアミドアデニンジヌクレオチドホスフェート(NADPH)が挙げられる。
【0070】
本明細書では、「単離された」とは、化合物(例えば、記載したISA247の代謝体)が生物系(例えば、哺乳動物、微生物細胞培養物の細胞等)から単離されることを意味する。一般には、単離された化合物はまた、例えば、クロマトグラフィーによる分離、結晶、親和性精製または当技術分野で公知の他の手段によって精製される。例えば、特定の実施形態では、記載したISA247代謝体を高圧液体クロマトグラフィーによって精製することができる。
【0071】
本明細書では、「N-脱メチル化」とは、アミノ酸窒素からメチル基を除去することを意味する。「アミノ酸窒素」は、アミノ酸側鎖中の窒素ではなく、アミノ酸主鎖中の窒素である。
【0072】
本明細書では、「グルクロニド形成」とは、グリコシド結合を介してグルクロン酸をISA247または他のISA247代謝体に結合させることによりグルクロニドISA247代謝体を形成することを意味する。
【0073】
本明細書では、「グリコシル化」とは、糖がISA247代謝体のヒドロキシル基に結合し、グリコシル化ISA247代謝体を形成することを意味する。糖(またはグリコシル化残基)は、例えば、二糖類、オリゴ糖類、多糖類等をはじめとする、1種または複数の糖を有していてもよい。グリコシル化残基に含まれている典型的な糖は、グルコース、マンノースおよびN-アセチルグルコサミンである。
【0074】
本明細書では、脂肪族基は、直鎖状、分枝状、または環状の非芳香族炭化水素であって、これは完全に飽和されていてもよく、あるいは1個または複数の不飽和単位を含有していてもよい。アルキル基は、飽和脂肪族基である。一般には、直鎖状または分枝状脂肪族基は、1個〜約10個、好ましくは1〜約4個の炭素原子を有しており、環状脂肪族基は、3個〜約10個、好ましくは3個〜約8個の炭素原子を有している。脂肪族基は、好ましくは直鎖状または分枝状アルキル基であって、例えばメチル、エチル、n-プロピル、イソプロピル、n-ブチル、sec-ブチル、tert-ブチル、ペンチル、ヘキシル、ペンチルまたはオクチルであるか、あるいは3個〜約8個の炭素原子を持つシクロアルキル基である。また、C1-C4の直鎖状または分枝状のアルキル基またはアルコキシ基、あるいはC3-C8の環状アルキル基またはアルコキシ基(好ましくは、C1-C4の直鎖状または分枝状のアルキル基またはアルコキシ基)は「低級アルキル」基または「低級アルコキシ」基とも呼ばれ;-F、-Cl、-Br、または-Iにより置換されているかかる基は、「低級ハロアルキル」基または「低級ハロアルコキシ」基であり;「低級ヒドロキシアルキル」は、-OHにより置換されている低級アルキルである。
【0075】
本明細書では、「アルキレン基」は、-(CH2)n-(式中、nは1〜10、好ましくは1〜4の整数である)で表される連結アルキル鎖である。
【0076】
本明細書では、「アリール」という用語は、例えばフェニル、ビフェニルなどのC6-C14の炭素環式芳香族基を意味する。またアリール基には、炭素環式芳香族環が別のアリール環、シクロアルキル環または脂環式環に縮合されている縮合多環式芳香族環系、例えばナフチル基、ピレニル基、アントラシル基なども含まれる。
【0077】
本明細書では、「ヘテロアリール」という用語は、1個または複数のO、SまたはNヘテロ原子を有する5〜14員のヘテロアリール基を意味する。ヘテロアリール基の例としては、イミダゾリル、イソイミダゾリル、チエニル、フラニル、フルオレニル、ピリジル、ピリミジル、ピラニル、ピラゾリル、ピロリル、ピラジニル、チアゾリル(thiazoyl)、イソチアゾリル、オキサゾリル、イソオキサゾリル、1,2,3-トリアゾリル(trizaolyl)、1,2,4-トリアゾリル、イミダゾリル、チエニル、ピリミジニル、キナゾリニル、インドリル、テトラゾリル等が挙げられる。またヘテロアリール基には、炭素環式芳香族環またはヘテロアリール環が1個または複数の他のヘテロアリール環に縮合している、縮合多環式芳香族環系が含まれる。例としては、ベンゾチエニル、ベンゾフラニル、インドリル、キノリニル、ベンゾチアゾリル、ベンゾイソチアゾイル、ベンゾオキサゾリル、ベンゾイソオキサゾリル、ベンゾイミダゾリル、キノリニル、イソキノリニルおよびイソインドリルが挙げられる。
【0078】
本明細書では、非芳香族複素環基は、環中にN、OまたはSなどの1個または複数のヘテロ原子を含んでいる、非芳香族炭素環である。環は、5員、6員、7員、または8員であってもよい。例としては、オキサゾリニル、チアゾリニル、オキサゾリジニル、チアゾリジニル、テトラヒドロフラニル、テトラヒドロチオフェニル、モルホリノ、チオモルホリノ、ピロリジニル、ピペラジニル、ピペリジニル、チアゾリジニル、環状糖類(例えば、ピラノース形およびフラノース形のグルコース、マンノース、ガラクトース、アロース、アルトロース、グロース、イドース、タロースなど)等が挙げられる。
【0079】
アルキル基、シクロアルキル基、脂肪族基、脂環式基、複素環基、ベンジル基、アリール基またはヘテロアリール基中の置換可能な原子に対する好適な任意の置換基は、記載したISA427代謝体の薬理活性を実質的に阻害しない置換基である。「置換可能な原子」とは、置換基と1つもしくは複数の対応する共有結合もしくはイオン結合を形成し得る、1個もしくは複数の原子価または電荷を持つ原子である。例えば、利用可能な1個の原子価を持つ炭素原子(例えば-C(-H)=)は、アルキル基に1個の単結合を形成する(例えば-C(-アルキル)=)ことができ、利用可能な2個の原子価を持つ炭素原子(例えば-C(H2)-)は、1個または2個の置換基に1個または2個の単結合を形成する(例えば-C(アルキル)(H)-、-C(アルキル)(Br))-)か、あるいは1個の置換基に二重結合を形成する(例えば-C(=O)-)ことができる。本明細書で検討した置換基には、安定した化合物を形成するこれらの置換のみが含まれる。
【0080】
例えば、置換可能な炭素原子に対する好適な任意の置換基(例えば、R5〜R10によって表される置換基)としては、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-SRa、-C(S)Ra、-OC(S)Ra、-C(S)ORa、-C(O)SRa、-C(S)SRa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(0)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORa、-NRcC(O)N(RaRb)、-C(NRc)-N(RaRb)、-NRd-C(NRc)-N(RaRb)、-NRaN(RaRb)、-CRc=CRaRb、-C≡CRa、=O、=S、=CRaRb、=NRa、=NORa、=NNRa、任意に置換されていてもよいアルキル基、任意に置換されていてもよいシクロアルキル基、任意に置換されていてもよい脂肪族基、任意に置換されていてもよい脂環式基、任意に置換されていてもよい複素環基、任意に置換されていてもよいベンジル基、任意に置換されていてもよいアリール基、および任意に置換されていてもよいヘテロアリール基が挙げられ、この場合、Ra〜Rdは、それぞれ独立に-Hであるか、または任意に置換されていてもよい脂肪族基、任意に置換されていてもよい脂環式基、任意に置換されていてもよい複素環基、任意に置換されていてもよいベンジル基、任意に置換されていてもよいアリール基、もしくは任意に置換されていてもよいヘテロアリール基であるか、あるいは、-N(RaRb)が一緒になって、任意に置換されていてもよい複素環基である。
【0081】
別の原子に対して2つの共有結合を有している窒素原子(例えば、記載したISA247代謝体のアミノ酸残基1〜11中のアミノ酸窒素)に対する好適な置換基としては、例えば、任意に置換されていてもよいアルキル基、任意に置換されていてもよいシクロアルキル基、任意に置換されていてもよい脂肪族基、任意に置換されていてもよい脂環式基、任意に置換されていてもよい複素環基、任意に置換されていてもよいベンジル基、任意に置換されていてもよいアリール基、任意に置換されていてもよいヘテロアリール基、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-SRa、-S(O)Ra、-SO2Ra、-SO3Ra、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORa、-NRcC(O)N(RaRb)等が挙げられる。
【0082】
窒素含有ヘテロアリールまたは非芳香族複素環は、酸素により置換して窒素酸化物を(例えば、ピリジル窒素酸化物、ピペリジル窒素酸化物の中などに)形成させることができる。例えば、各種の実施形態では、窒素含有の複素環基またはヘテロアリール基中の環窒素原子を置換して窒素酸化物を形成させることができる。
【0083】
本明細書では、「製薬上許容される」という用語は、物質(例えば、組成物、担体、希釈剤、試薬、塩など)が哺乳動物体内へ、または哺乳動物表面に投与可能であることを意味する。
【0084】
また、本発明には、記載したISA247代謝体の製薬上許容される塩も含まれる。これらの代謝体は、好適な有機塩基または無機塩基と反応して塩基付加塩を形成可能な、1種または複数の十分な酸性プロトンを有していてもよい。化合物が酸素、窒素または硫黄原子に結合されている水素原子を持つと述べられている場合、前記化合物には、この水素原子を好適な有機塩基または無機塩基と反応させて塩基付加塩を形成させたその塩も含まれることが意図される。塩基付加塩としては、無機塩基から誘導されたもの、例えば、アンモニウムまたはアルカリもしくはアルカリ土類金属の水酸化物、炭酸塩、重炭酸塩など、ならびに有機塩基から誘導されるもの、例えば、アルコキシド、アルキルアミド、アルキルアミンおよびアリールアミンなどが挙げられる。従って、本発明の塩を調製するのに有用なかかる塩基としては、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、炭酸カリウムなどが挙げられる。
【0085】
例えば、製薬上許容される塩としては、記載したISA247代謝体を、1当量の好適な塩基と反応させて1価の塩を形成することにより形成されたもの(すなわち、この化合物は、製薬上許容される対カチオン(例えば1価のカチオン)によって平衡化されている1個の負電荷を有している)、あるいは2当量の好適な塩基と反応させて2価の塩を形成することにより形成されたもの(例えば、この化合物は、2個の製薬上許容される対カチオン(例えば、2個の製薬上許容される1価のカチオンまたは1個の製薬上許容される2価のカチオン)によって平衡化されている2個の電子負電荷を有している)を挙げることができる。「製薬上許容される」とは、カチオンが被験体への投与に好適であることを意味する。例としては、Li+、Na+、K+、Mg2+、Ca2+およびNR4+が挙げられる。この場合、各Rは、独立に、水素、任意に置換されていてもよい脂肪族基(例えばヒドロキシアルキル基、アミノアルキル基もしくはアンモニウムアルキル基)、または任意に置換されていてもよいアリール基であるか、あるいは、2個のR基が一緒になって、任意に置換されていてもよい非芳香族複素環(芳香族環に縮合されていてもよい)を形成する。通常、製薬上許容されるカチオンは、Li+、Na+、K+、NH3(C2H5OH)+またはN(CH3)3(C2H5OH)+である。
【0086】
十分な塩基性基(例えばアミンなど)を有する記載したISA247代謝体の製薬上許容される塩は、記載したISA247代謝体を有機酸または無機酸と反応させ、酸付加塩を形成させることによって形成することができる。塩基性基を有する化合物からの酸付加塩の形成に一般に用いられる酸としては、無機酸(例えば、塩酸、臭化水素酸、ヨウ化水素酸、硫酸、リン酸など)、および有機酸(例えば、p-トルエンスルホン酸、メタンスルホン酸、シュウ酸、p-ブロモフェニルスルホン酸、炭酸、コハク酸、クエン酸、安息香酸、酢酸など)を挙げることができる。かかる塩の例としては、硫酸塩、ピロ硫酸塩、重硫酸塩、亜硫酸塩、亜硫酸水素塩、リン酸塩、一水素リン酸塩、二水素リン酸塩、メタリン酸塩、ピロリン酸塩、塩化物、臭化物、ヨウ化物、酢酸塩、プロピオン酸塩、デカン酸塩、カプリル酸塩、アクリル酸塩、ギ酸塩、イソ酪酸塩、カプロン酸塩、ヘプタン酸塩、プロピオール酸塩、シュウ酸塩、マロン酸塩、コハク酸塩、スベリン酸塩、セバシン酸塩、フマル酸塩、マレイン酸塩、ブチン-1,4-ジオエートおよびヘキシン-1,6-ジオエート、安息香酸塩、クロロ安息香酸塩、安息香酸メチル、ジニトロ安息香酸塩、ヒドロキシ安息香酸塩、メトキシ安息香酸塩、フタル酸塩、スルホン酸塩、キシレンスルホン酸塩、酢酸フェニル、フェニルプロピオン酸塩、フェニル酪酸塩、クエン酸塩、乳酸塩、γ-ヒドロキシ酪酸塩、グリコール酸塩、酒石酸塩、メタンスルホン酸塩、プロパンスルホン酸塩、ナフタレン-1-スルホン酸塩、ナフタレン-2-スルホン酸塩、マンデル酸塩などが挙げられる。
【0087】
また、製薬上許容される溶媒和物も含まれる。本明細書では、「溶媒和物」という用語は、非共有結合の分子間力によって結合されている、化学量論的量または非化学量論的量の溶媒(例えば水、有機溶媒)をさらに含んでいる、本発明の化合物またはその塩を意味する。
【0088】
また、記載したISA247代謝体を含んでいる医薬用組成物も含まれる。「医薬組成物」は、被験体へ投与する医薬組成物の一部分として許容可能な医薬用担体と一緒に、記載したISA247代謝体を含む。投与する化合物の剤形は、選択される投与経路(例えば、経口投与、静注、非経口投与もしくは局所投与、溶液剤、エマルジョン剤、カプセル剤、クリーム剤、軟膏等)によって変わる。好適な医薬用担体は、本化合物と相互に作用しない不活性成分を含有していてもよい。標準的な医薬製剤技術については、例えば、Remington's Pharmaceutical Sciences (Mack Publishing Company, Easton, Pa)に記載されている技術などを用いることができる。非経口投与に好適な医薬用担体としては、例えば、滅菌水、生理食塩水、静菌性生理食塩水(約0.9%mg/mlベンジルアルコール含有生理食塩水)、リン酸緩衝生理食塩水、ハンクス溶液、リンゲル乳酸塩等が挙げられる。組成物のカプセル化方法(例えば、硬性ゼラチンまたはシクロデキストラン(cyclodextrasn)のコーティングの場合など)は当技術分野で公知である(Bakerら, "Controlled Release of Biological Active Agents", John Wiley and Sons, 1986)。
【0089】
特定の記載したISA247代謝体は、異なる立体異性体(例えば、ジアステレオマーおよびエナンチオマー)として取得可能であること、また、本発明は、記載した化合物のすべての異性体形態およびラセミ混合物、ならびに、純粋な異性体およびその混合物(ラセミ混合物を含む)で被験体を治療する方法を含んでいることも理解されよう。立体異性体は、クロマトグラフィーなどの任意の好適な方法を用いて分離および単離することができる。
【0090】
ヒト全血、尿または胆汁からのISA247代謝体の同定および単離
これらの液体に対して有機抽出法を使用し、代謝体をメタノールで抽出、乾燥、再調製し、質量分析連結型のクロマトグラフィー技術を用いて同定した。
【0091】
ISA247代謝体の化学合成
ISA247の代謝体は、化学合成により調製することができる。シクロスポリンAの一水酸化代謝体CsA-Am1は、既に"Synthesis of the main metabolite (OL-17) of cyclosporin A," J. Org. Chem. Vol. 57, No. 9, pp. 2689-2691 (1992)に報告されているように、M.K. EberleおよびF. Nuningerによって合成されている。Eberleらは、シクロスポリンAがヒトおよび動物内でシクロスポリンに代謝され、それによって(1-アミノ酸残基の側鎖上にある)元のアリルメチル基が対応するアリルアルコールに酸化されることを記載している。Eberleらは、アミノ酸1残基のβ-アルコールを保護し、次いで、アセチルシクロスポリンA(アセチルCsA)をN-ブロモスクシンイミド(NBS)で処理することによるアリル臭素化の条件に、得られたアセチルCsAを供することにより、「in vitroでこの代謝経路を再現することを試みた」。次いで、そのステップから得られた生成物をテトラブチルアンモニウムアセテートの存在下で加熱した。これは、臭化物がアセテートにより交換されるように作用する。最後に、ナトリウムメトキシドの存在下で、アセテートのトランスエステル化をメタノール中で行ない、アセテート基をアルコール官能基に交換することにより、この合成を終えた。報告によれば、このシクロスポリンAからOL-17代謝体への変換は、その後の逆相カラムクロマトグラフィーから収率が28%であることが確認された。
【0092】
同様の合成経路を用いて、IM4、IM6およびIM9などのISA247代謝体を生成することができる。さらに述べれば、ペンダントメチル基などのアルキル炭素が水酸化されているすべての代謝体を生成することができる。例えば、水酸化は、ISA247のアミノ酸1残基の側鎖内のγ-CH3で起こり得る。従って、側鎖のβ-γ-CH3炭素にわたって1,2ジオールが生じる。
【0093】
別の実施形態では、代謝体IM4、IM6およびIM9は、(1) 親化合物ISA247のアミノ酸1残基のβ-アルコールを保護して、保護されたISA247の化合物を形成させるステップと、(2) 保護されたISA247をN-ブロモスクシンイミド(NBS)などのハロゲン化剤で処理し、4、6、または9-アミノ酸残基の側鎖のγ炭素でハロゲン化されている(一実施形態では、臭素化されている)、保護されたISA247を形成させるステップと、(3) 前ステップの生成物を、テトラブチルアンモニウムアセテートなどの置換試薬の存在下で加熱し、アセテート含有生成物を形成させるステップと、(4) 前ステップのアセテート含有生成物のアセテート部分をアルコール部分に交換するトランスエステル化を行ない、水酸化代謝体を形成させるステップにより合成することができる。ISA247のアミノ酸1残基以外の残基の側鎖に関する一水酸化の一般的な化学的概念は、上述のCsAのアミノ酸1残基の側鎖に関する一水酸化の概念と同じであってもよい。しかし、ISA247中には存在するがCsAには存在しない共役ジエン系のことを考慮すると、ISA247のアミノ酸1残基で水酸化される代謝体を取得するには、実質的に異なる合成手法を用いなければならないと考えられる。
【0094】
別の実施形態では、ISA247代謝体の化学合成に向けて、ISA247のアミノ酸1の側鎖のアルケン部分を直接的に、またはエポキシド中間体を経由して、ジオールに変換することができる。例えば、アルケンからエポキシドへの変換は、化学文献で公知である。Prilezhaev反応を用いる一実施形態では、オレフィンを好適な酸化剤で処理すると、オレフィンの炭素-炭素二重結合にわたって酸素が付加され、その結果エポキシドが形成され得る。この反応で使用可能な一般的な酸化剤は過酸であり、本発明の一実施形態では、m-クロロ過安息香酸(MCPBA)が好ましい試薬である。他の過酸、例えば、過酢酸、トリフルオロ過酢酸、過安息香酸および3,5-ジニトロ過安息香酸などもまた使用可能である。また本発明のアルケン含有シクロスポリンを過酸化水素、アルキルパーオキシドまたは酸素で処理することによっても、エポキシドを形成することができると考えられる。
【0095】
次いで、本発明のエポキシド含有代謝体は、水による求核攻撃を受けて、1,2-ジオールを形成することができる。この反応は、酸または塩基のいずれかによって触媒され得る。本発明の一実施形態では、過塩素酸が好ましい試薬であるが、Nafion-Hまたはギ酸など他の酸触媒もまた効果的であり得る。別の実施形態では、エポキシド代謝体のジメチルスルホキシド中でのアルカリ加水分解は、塩基性条件下で実施することができる。さらに別の方法としては、酵素ミクロソームエポキシドヒドロラーゼにより触媒されるエポキシド加水分解が意図される。この方法には、反応によって、反応生成物にある程度の立体選択性が取り入れられ得るという点で特に利点がある。
【0096】
あるいは、アルケンは、多数の異なる試薬により1,2-ジオールに直接変換することができる。四酸化オスミウムおよびアルカリ性過マンガン酸カリウムによりsyn付加が生じ得る。同様に、過酸化水素またはt-ブチルヒドロペルオキシドなどの試薬によっても、四酸化オスミウム触媒の存在下でsyn付加が生じ得る。反対に、anti付加は、例えば、過酸化水素およびギ酸、またはモノ過コハク酸での処理を介して可能である。アルケンをヨウ素および安息香酸銀または酢酸銀で処理すると中間体のジエステルが得られ、これは容易に加水分解され1,2-ジオールを得ることができる。同様に、四酢酸鉛または酢酸タリウムで酸化すると、加水分解可能なジオールのビスアセテートが得られる。従って、オレフィン類から1,2-ジオールへの直接変換に、多数の方法を用いることができるということが当業者には理解されよう。
【0097】
アルケンを1,2-ジオールに変換する前述の合成方法は、ISA247のジオール代謝体の合成的調製に有用であると考えられる。ISA247のアミノ酸1残基の側鎖の共役ジエン部分のアルケンは、直接的に、またはエポキシドなどの中間体を経由て、ジオールに化学的に変換することができる。次いで、得られた化合物を、他の技術によって生成した(例えば、ウサギまたはイヌのミクロソーム系により生成した)代謝体と比較し、マッチさせることができる。ISA247から形成したエポキシド中間体は薬理活性を持っていることが予想され、従って、有望な治療薬として関心が高まる可能性があると本発明者らは考えている。
【0098】
ISA247は、構造的にアミノ酸1の化学組成内だけがシクロスポリンAと異なるため、シクロスポリンAの特定の代謝体は、ISA247代謝体合成の中間体として使用することができる。例えば、AM4n(アミノ酸4残基のN-脱メチル化)およびAM9(アミノ酸9残基の側鎖上の水酸化)などのシクロスポリンA代謝体は、シクロスポリンAをISA247に変換する同一化学工程によって、類似のISA247代謝体に変換することができる。
【0099】
哺乳動物ミクロソーム系によるISA247代謝体の調製
シクロスポリンAおよびISA247は、ヒトおよび他の動物由来のミクロソーム系により広く代謝されている(Christians, 1993)。ヒト肝臓ミクロソーム調製物においては、シクロスポリンからその代謝体への変換は、NADPH依存性である。この代謝は、一酸化炭素、ケトコナゾール、シメチジンおよびSKF525Aによって阻害することができる。これらの阻害剤は特定のシトクロムP-450阻害剤であることが知られていることから、シクロスポリンの代謝は、シトクロムP-450系のモノオキシゲナーゼ機能により仲介されていることが示唆された。また本発明者らは、ISA247もシトクロムP-450酵素系により代謝されていることをすでに明らかにしている。
【0100】
ミクロソーム系は当技術分野で周知であり、適切な組織(これには、ウサギ、イヌ、ブタ、ウシ、ヒツジ、霊長類、ラット、マウスなどの哺乳動物の肝臓、腎臓、胃腸組織等から得た組織が含まれ得る)をホモジナイズし、100,000×gで遠心分離することにより調製され、ミクロソームペレットが得られる。これは、再調製すると、in vivoにおけるISA247の代謝の再現に使用することができる。代謝体がミクロソーム調製物中に生成された場合、HPLC/MSもしくはNMRまたは他の技術を用いて、ISA247代謝体を単離し分析することができる。
【0101】
微生物を用いた生体内変換法によるISA247代謝体の調製
本発明の実施形態では、ISA247の代謝体は、微生物の培養物および生体内変換を利用して調製することができる。特定の微生物がヒトシトクロムP-450系の活性を再現する能力を持つことから、生体内変換を用いて、ヒトでのISA247代謝体に対応するISA247の代謝体を生成させることができる。
【0102】
生体内変換法で有用と思われる具体的な微生物としては、アクチノプラネス属の種(Actinoplanes sp.)(例えばATCC No. 53771、American Type Culture Collection Manassas, VA USAから入手可能)、ストレプトマイセス・グリセウス(Streptomyces griseus)(例えばATCC 13273)、サッカロポリスポラ・エリスレア(Saccharopolyspora erythraea)(例えばATCC No. 11635)、およびストレプトマイセス・セトニ(Streptomyces setonii)(例えばATCC No. 39116)が挙げられる。他の有用な微生物としては、アミコラータ・オートトロフィカ(Amycolata autotrophica)(例えばATCC No. 35204、プセウドノカルジア・オートトロフィカ(Pseudonocardia autotrophica)としても知られる)、ストレプトマイセス・カリフォルニカ(Streptomyces californica)(例えばATCC No. 15436)、サッカロポリソラ・ヒルステ(Saccharopolysora hirsute)(例えばATCC No. 20501)、ストレプトマイセス・ラバンデュラエ(Streptomyces lavandulae)(例えばATCC 55209)、ストレトマイセス・オーレオファシエンス(Stretomyces aureofaciens)(例えばATCC 10762)、ストレプトマイセス・リモサス(Streptomyces rimosus)(例えばATCC 28893、ペニシリウム・エクスパンサム(Penicillium expansum)しても知られる)、バチルス・サブチリス(Bacillus subtillis)(例えばATCC 55060)、およびノカルジア・アステロイド(Nocardia asteroids)(例えばATCC 3318、ノカルジア・ファルシニカ(Nocardia farcinica)としても知られる)を挙げることができる。各種の実施形態では、有用な微生物としては、クルブラリア・ルナータ(Curvularia lunata)(例えば、ATCC 12017またはUAMH 9191、University of Alberta Microfungal Collection and Herbarium, Edmonton, Alberta, Canadaから入手可能)、クンニングアメラ・エチヌラータ var. エレガンス(Cunninghamella echinulata var. elegans)(例えばUAMH 7370、 ATCC 36112)、クルブラリア・エチヌラータ var. ブラケスレーナ(Curvularia echinulata var. blakesleena)(例えばUAMH 8718、 ATCC 8688a)、クンニングアメラ・エチヌラータ var. エレガンス(Cunninghamella echinulata var. elegans)(例えばUAMH 7369、 ATCC 26269)、ボーバリア・バシアナ(Beauvaria bassiana)(例えばUAMH 8717、 ATCC 7159)、アクチノマイセス属(Actinomycetes)(例えばATCC 53828)、アクチノプラネス属(Actinoplanes)(例えばATCC 53771)、クンニングアメラ・エチヌラータ(Cunninghamella echinulata)(例えばUAMH 4144、 ATCC 36190)、クンニングアメラ・エチヌラータ(例えばUAMH 7368、 ATCC 9246)、クンニングアメラ・ベニエーレ(エチヌラータ)(Cunninghamella bainiere (echinulata))(例えばUAMH 4145、ATCC 9244)、およびサッカロポリスポラ・エリスレ(Saccharopolyspora erythrae)(例えばATCC 11635)を挙げることができる。
【0103】
本発明者らの知る限りにおいては、恐らく、これらの化合物が親油性であるこという理由から、慣用の生体内変換法では、シクロスポリンおよびISA247の代謝体の生成は成功していない。いかなる理論にも束縛されるものではないが、ISA247などの疎水性化合物は、フィルター、カラム、ならびにこの培養および工程の実施で使用する他の器具の表面に付着する傾向があること、また生成物代謝体(例えばISA247)は、その薬剤を培地に無菌的に添加する際に使用するフィルターの表面に付着する傾向があることが考えられる。
【0104】
本発明の実施形態では、ISA247の代謝体(CsAおよびISA247の代謝体を含む)は、薬剤と少なくとも1種の界面活性剤の混合物を調製するステップと、微生物の増殖培地に前記の薬剤・界面活性剤の混合物を直接加えるステップにより生成することができる。界面活性剤は滅菌していてもよい。本発明者らは、このステップに従った場合、生体内変換がより生産性の高いものになることを確認した。この方法の特定の実施形態では、界面活性剤はTweenである。
【0105】
好適な界面活性剤は、微生物増殖環境へ入れる前に、オートクレーブにかけることができる。好適な界面活性剤は生体適合性の界面活性剤であり、ポリエチレングリコールなどの非イオン性界面活性剤、例えば、PEG 300、PEG 400、PEG 600(BASF製のLutrol(登録商標) E 300、Lutrol(登録商標) E 400、Lutrol(登録商標) E 600、Lutrol(登録商標) F 127、およびLutrol(登録商標) F 68としても知られる);カプリロカプロイルマクロゴール-8グリセリド(例えば、Labrasol(登録商標)(Gatte Fosse, Cedex France));ポリオキシエチレンソルビタン脂肪酸エステル(例えば、Tween(登録商標) 20、Tween(登録商標) 21、Tween(登録商標) 40、Tween(登録商標) 80、Tween(登録商標) 80K、Tween(登録商標) 81、およびTween(登録商標) 85 (ICI Americas Inc., Bridgewater NJ、Aldrich Chemical Company Inc., Milwaukee Wis.から入手可能));グリセリン(BDH Fine Chemicals, Toronto Ont.);ヒマシ油(Wiler Fine Chemicals Ltd, London Ont.);ミリスチン酸イソプロピル(Wiler Fine Chemicals Ltd, London Ont.);Cremaphor EL(Sigma Chemical, St Louis MO);ならびにポロキサマー(例えば、Pluronics(登録商標) F127およびPluronics(登録商標) L108(BASF))が挙げられるが、これらに限定されるものではない。他の使用可能な界面活性剤としては、滑剤または乳化剤として作用し得るもの、例えば、チロキサポール(ホルムアルデヒドおよびオキシランとの4-(1,1,3,3-テトラメチルブチル)フェノールポリマー);ポリエトキシ化ヒマシ油(例えば、BASF製のCremaphor A25、Cremaphor A6、Cremaphor EL、Cremaphor ELP、Cremaphor RH、およびRhone Poulenc Co製のAlkamuls EL620);ポリエトキシ化硬化ヒマシ油(例えばHCO-40);ならびにポリエチレン9ヒマシ油が挙げられる。
【0106】
他の使用可能な界面活性剤としては、ポリソルベート20、ポリソルベート60およびポリソルベート80;Cremaphor Rh;ポロキサマー;Pluonics L10、L31、L35、L42、L43、L44、L61、L62、L63、L72、L81、L101、L121、L122;PEG 20アーモンドグリセリド;PEG 20コーングリセリドなどが挙げられる。また好適な界面活性剤としては、以下のものが挙げられる:アルキルグルコシド;アルキルマルトシド(alkylmaltosides);アルキルチオグルコシド;ラウリルマクロゴールグリセリド;ポリオキシエチレンアルキルエーテル;ポリオキシエチレンアルキルフェノール;ポリエチレングリコール脂肪酸エステル;ポリエチレングリコールグリセリン脂肪酸エステル;ポリオキシエチレンポリオキシプロピレンブロックコポリマー;ポリグリセリン脂肪酸エステル;ポリオキシエチレングリセリド;ポリオキシエチレンステロール;ポリオキシエチレン植物油;ポリオキシエチレン水素化植物油;ポリオキシエチレンアルキルエーテル;ポリエチレングリコール脂肪酸エステル;ポリエチレングリコールグリセリン脂肪酸エステル;ポリオキシエチレンソルビタン脂肪酸エステル;ポリオキシエチレンポリオキシプロピレンブロックコポリマー;ポリグリセリン脂肪酸エステル;ポリオキシエチレングリセリド;ポリオキシエチレン植物油;ポリオキシエチレン水素化植物油;以下のものなどのポリオール類の反応混合物:PEG-10ラウリン酸塩、PEG-12ラウリン酸塩、PEG-20ラウリン酸塩、PEG-32ラウリン酸塩、PEG-32 ジラウリン酸塩、PEG-12オレイン酸塩、PEG-15オレイン酸塩、PEG-20オレイン酸塩、PEG-20ジオレイン酸塩、PEG-32オレイン酸塩、PEG-200のオレイン酸塩、PEG-400オレイン酸塩、PEG-15ステアリン酸塩、PEG-32 ジステアリン酸塩、PEG-40ステアリン酸塩、PEG-100ステアリン酸塩、PEG-20ジラウリン酸塩、PEG-25トリオレイン酸グリセリン、PEG-32ジオレイン酸塩、PEG-20ラウリン酸グリセリン、PEG-30ラウリン酸グリセリン、PEG-20ステアリン酸グリセリン、PEG-20オレイン酸グリセリン、PEG-30オレイン酸グリセリン、P
EG-30ラウリン酸グリセリン、PEG-40ラウリン酸グリセリン、PEG-40パーム核油、PEG-50硬化ヒマシ油、PEG-40ヒマシ油、PEG-35ヒマシ油、PEG-60ヒマシ油、PEG-40硬化ヒマシ油、PEG-60硬化ヒマシ油、PEG-60トウモロコシ油、PEG-6カプリン酸/カプリル酸グリセリド、PEG-8カプリン酸/カプリル酸グリセリド、ポリグリセリル-10ラウレート、PEG-30コレステロール、PEG-25フィトステロール、PEG-30大豆ステロール、PEG-20トリオレイン酸塩、PEG-40オレイン酸ソルビタン、PEG-80ラウリン酸ソルビタン、ポリソルベート20、ポリソルベート80、POE-9ラウリルエーテル、POE-23ラウリルエーテル、POE-10オレイルエーテル、POE-20オレイルエーテル、POE-20ステアリルエーテル、トコフェリルPEG-100コハク酸、PEG-24コレステロール、ポリグリセリル-10オレエート、スクロースモノステアレート、スクロースモノラウレート、スクロースモノパルミテート、PEG 10-100ノニルフェノールシリーズ、PEG 15-100オクチルフェノールシリーズ、ポロキサマー;PEG-35ヒマシ油、PEG-40硬化ヒマシ油、PEG-60トウモロコシ油、PEG-25トリオレイン酸グリセリン、PEG-6カプリン酸/カプリル酸グリセリド、PEG-8カプリン酸/カプリル酸グリセリド、ポリソルベート20、ポリソルベート80、トコフェリルPEG-1000コハク酸、およびPEG-24コレステロール、ポロキサマー。さらに油、例えばアーモンド油;ババスー油;ルリヂサ油;ブラックカラント種子油;キャノーラ油;ヤシ油;トウモロコシ油;綿実油;月見草油;ブドウ種子油;ラッカセイ油;からし油;オリーブ油;パーム油;パーム核油;落花生油;菜種油;サフラワー油;ゴマ油;鮫肝油;大豆油;ひまわり油;硬化ヒマシ油;水素化ヤシ油;水素化パーム油;水素化大豆油;水素化植物油;水素化綿実油およびヒマシ油;部分的水素化大豆油;大豆油;トリカプロン酸グリセリン;トリカプリル酸グリセリン;トリカプリン酸グリセリン;トリウンデカン酸グリセリン;トリラウリン酸グリセリン;トリオレイン酸グリセリン;トリリノール酸グリセリン;トリリノレン酸グレイセリン;トリカプリル酸/
カプリン酸グリセリン;トリカプリル酸/カプリン酸/ラウリン酸グリセンリン;トリカプリル酸/カプリン酸/リノール酸グリセリン;トリカプリル酸/カプリン酸/ステアリン酸グリセリン;飽和ポリグリコール化(polyglycolized)グリセリド;リノール酸グリセリド;カプリル/カプリングリセリドを用いることができる。さらに、界面活性剤および/または油および/またはアルコールの混合物を用いてもよい。
【0107】
本発明の特定の実施形態では、親化合物は、活発に増殖している微生物培養物へ添加する前に、エタノールなどのアルカノールおよび好適な非イオン性界面活性剤と混合する。親化合物をアルコールと混合する場合には、アルコールはエタノールであってもよい。追加の好適なアルコールとしては、メタノール、および当技術分野で周知の他の好適なアルコールが挙げられる。
【0108】
増殖培地中に微生物を含む生物反応混合物に、親化合物・界面活性剤混合物を添加した後、親化合物が代謝され得る時間および条件下で生物反応を進行させる。所望の時間を経た後、代謝体を生物反応混合物から抽出し、精製により(例えば、高圧液体クロマトグラフィーおよび質量スペクトル分析(HPLC-MS)などのクロマトグラフィーにより)分離する。また核磁気共鳴分析法を用いて、個別の代謝体が互いに単離されたことを確認し、その構造を確認することができる。
【0109】
本発明の一部の実施形態では、エタノール中のISA247をグリセリンと混合し、次いで、サッカロポリスポラ・エリセレア(Saccharopolyspora erytheraea) ATCC 11635を含有している生物変換系に添加する。別の実施形態では、ISA247を生物変換系へ添加する前に、PEG 400をエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、ヒマシ油をエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、ミリスチン酸イソプロピルをエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、Cremaphorをエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、Labrasol(登録商標)をエタノール中のISA247と混合する。別の実施形態では、ISA247を生物変換系へ添加する前に、Tween 40をエタノール中のISA247と混合する。
【0110】
ISA247代謝体の分析および解明
ISA247の代謝体は、質量分析連結型(HPLC-MSまたはLC-MS/MS)の高速液体クロマトグラフィー(HPLC)を用いて、それらの化学的特性およびそれらの動力学的パラメータにより分離した。
【0111】
本発明者らは、質量分析連結型の液体クロマトグラフィー技術を用いて、ISA247代謝体を分析する定性的手法および定量的手法を開発した。これらの方法では、in vitroおよびin vivoで生成したISA247代謝体の単離、および特性決定が可能であるとともに、薬物動態研究の一部として、全血または他の体液におけるISA247代謝体の定量的モニタリングに都合が良い。
【0112】
分析物の同定は、高圧液体クロマトグラフィー(HPLC)データから取得した保持時間、およびエレクトロスプレーイオン化(ESI)質量スペクトルデータから取得した構造特異的イオンフラグメント情報に基づいて実施する。図6は、SCIEXTM三連四重極型質量分析計を用いた、MRMモード(Multiple Reaction Monitoring mode)におけるLCMSトレースである。
【0113】
図6のHPLC-MRMスキャンは、ヒト全血から単離された典型的なISA247の代謝プロファイルを表しており、これは、肝臓ミクロソームまたは生物変換の供給源から調製したISA247抽出物で確認されたLC-MSフラグメンテーションプロファイルと一致している。図6のMRMスキャンでは、少なくとも4つの異なるジオールピーク(Diol(1)、Diol(2)、Diol(3)およびDiol(4))を示す1271/1113範囲の4つのピーク、IMXnX(2)、IMXnX(4)およびIMXnX(6)と標識した1239/1115範囲の3つの小型ピーク、IMX(1)、IM9、IM4およびIMX(2)と標識した1253/1225範囲の4つのピーク、IM4nおよびIMXn(2)と標識した1223/1099範囲の2つのピーク、ならびに代謝されていない標準品により特定されるISA247に関する1237/1113の大型ピークが明らかになっている。さらにいくつかのピークが示されているが、標識はしていない。
【0114】
さらに、変換されたISA247のHPLC精製物質の構造を、以下の一般的条件を用いた核磁気共鳴(NMR)技術を使用して解明した。1Dおよび2D NMRスペクトルは、25〜27℃で、Varian Inova 800および/または500MHz、ならびに/またはVarian Mercuryplus 400MHz分光計においてベンゼン-d6で記録した。基準として、ベンゼンシグナルを、1H-NMRではδ7.15ppmに、13C-NMRではδ128.06ppmに設定した。ベンゼンd6の試料濃度は0.5〜1mg/〜0.7mlで用いた。得られたスペクトルは、ACD/Labs (Advanced Chemistry Development Inc., Toronto, Canada)の2D NMRプロセッサーソフトウェアを用いて解析した。
【0115】
アミノ酸1での変換:ジオール、環化体およびエポキシド
図6に示す通り、ヒト全血から単離された代謝体は、一連の主要な代謝体ピークが、約6.5〜8分の保持時間で、かつ1271/1113m/zの親イオン/フラグメントイオン対で起こることが明らかである。これは、1237m/zの親ISA247の質量に34質量単位が加わっていることを示唆している。さらに、フラグメントイオンが1113m/zの質量を有するので、代謝体を構成する化学修飾がアミノ酸1残基に局所的であると結論を下すこともできる。この情報から、この修飾は、ε炭素位置とθ炭素位置の間のアミノ酸1のジエン領域でのジオール形成である可能性が高いと仮定することができた。
【0116】
ジオール代謝体は、さらに構造解析用のHPLCから単離することができる。材料の供給源に応じて、化学合成由来であるか、あるいは生物変換、ミクロソームまたは血液もしくは尿から単離されたものであるかにより、HPLCで見えるピークが異なる可能性があることに注意することが重要である。例えば、化学合成では、ジオール構造のRおよびSの両ジアステレオマーとして存在するジオールが生成され得るが、一方、酵素代謝では、ジオール構造の1つのジアステレオマーは形成されるが、もう一方のジアステレオマーは形成されない。酵素は、一配向にある基質を好適とし、それ以外は好適としない場合があり、従って、酵素では、一方のジアステレオマーが生成され、もう一方のジアステレオマーは生成されない場合がある。ジオール代謝体のジアステレオマーは、HPLCで異なるピークとして現れる可能性がある。というのは、それらが異なる化学的性質を有していて、カラムを通過する際、異なった移動が生じる可能性があるからである。従って、異なる手段によって(例えば、化学合成および生物変換によって)生成される代謝体のHPLCトレースは、異なるピークを有している場合がある。このため、図6に示したHPLCは、ヒト全血から単離したものではない代謝体の代表的なHPLCトレースではない可能性があることに注意することが重要である。さらに、ジオールで使用している命名法(すなわち、IM1-d-1)は、図6に示すHPLCピークに必ずしも対応していないことに注意することも重要である。この命名法は、表1に示した通り、それらの構造に照らし合わせて考えるべきである。
【0117】
化学合成、生物変換によって生成されたか、または血液もしくは尿から単離され、かつHPLC-MSを用いて単離された、ISA247のジオール代謝体構造のさらなる解明に、1H-NMR技術および2D NMR技術を用いた。図8は、IM1-d-1化合物をHPLC精製した生成物(ここで、前記生成物は、上述の微生物による生物変換方法により調製したものである(KI-2とも表示))から得られた1H-NMRスペクトルを、ISA247のE異性体およびZ異性体の1H-NMRスペクトルと比較して示す。これらの3種類のスペクトルを比較すると、約δ6〜7ppmのジエン領域におけるIM1-ジオール-1、すなわちIM1-d-1の1H-NMRでの変化が明らかであり、これはaa-1側鎖変換を示している。アミドNHプロトンおよびN-メチルプロトン領域は、この代謝体が2種類の主生成物と微量の混入物との混合物であって、4種類のNHシグナルと7種類のN-メチルシグナルがそれぞれの主生成物から生じていると想定されることを示している。この想定は、アミドプロトンシグナルを利用した相関スペクトルにより立証された。IM1-d-1の2D TOCSYスペクトルから、関連のαプロトンおよび側鎖メチル基とのアミドNHプロトン交差ピーク相関が得られた(図9)。このNMR分析によって、このジオール画分(KI-2)は主として2種類のジアステレオマーの1:1混合物からなり、アミノ酸1(aa-1)のη炭素での立体化学に違いがあることがわかった。このトランス二重結合立体配置は、Jεζ=15.0Hzを有する両ジアステレオマーのカップリング定数から決定された。提案されるIM1-d-1構造を図10に示す。
【0118】
図10は、IM1-d-1の構造が、トランスISA247のアミノ酸1(aa-1)側鎖のη位およびθ位でのジオールであることを示す。η位はキラル中心であることから、図10に示す通り、IM1-d-1化合物は、アミノ酸1のη炭素の立体配置で相違のある、2種類のジアステレオマーとして存在し得る。これらの2種類のジアステレオマーは、各ジアステレオマーが特定の物理化学特性を持つ異なる化学物質であることから、異なるNMRスペクトルを提供する。
【0119】
驚いたことに、NMR研究によれば、50:50のシス:トランスISA247の出発材料から(この場合、この代謝体は、生物変換法を用いて調製する(真菌を使用、KI-2試料))、図10に示したIM1-d-1ジアステレオマーの混合物が1:1のジアステレオマー比にて、トランス構造で生じることが明らかになった。しかし、主としてトランスISA247の出発材料を化学合成によって調製し(KI-2A試料)、HPLC-MSを用いて単離し、NMRを用いて試験した場合、3:2の比でIM1-d-1のジアステレオマーの混合物が生じる。IM1-d-1は、図42および図43に示すように、トランスISA247から形成される代謝体である。KI-2A NMRスペクトルで検出された異性体比の相違により、各ジアステレオマーのプロトン化学シフト帰属が得られるようになったが、図10に示すような構造の1つをNMRによる比率決定に帰属させることはできなかった。この矛盾は、これらの代謝体が、天然酵素(肝臓由来または真菌類由来のもの)を使用して生成されたか、あるいは実験室で化学反応を使用して生成されたかによって、1つのジアステレオマー代謝体が別の代謝体よりも優先的に生成される可能性があることを示唆している。例えば、化学合成中に、化学中間体の配向は、1つの異性体が別の異性体よりも富んでいるジアステレオマー混合物を生成し得る。あるいは、生物変換法では、複数のジアステレオマー代謝体が生成され、それらのジアステレオマーの1つが、さらにIM1-d-1とは異なる別の代謝体へと優先的に処理される可能性があり、これが、HPLCにおける対応ピークに存在する生成物の比率に食い違いを起こす。あるいは、化学法または生物変換法では、ジアステレオマーが生成され、これがIM1-d-1化合物とは異なる、別の代謝体へとさらに処理され、これがHPLCを用いた特定のピークに存在する生成物の比率に食い違いを起こす。表1は、上記のNMR分析に基づいた、IM1-d-1の化学シフト帰属を示す。この表には、NMRにより特定された1つの化合物が記載されているが、この試料中には2つ以上の化合物が認められた。第2の化合物に関する化学シフト情報は、表1には示していない。しかし、図43に、2種類の最終的なジオールジアステレオマー(IM1-d-1)を示している。
【表1】

【0120】
研究対象の第2のジオール(試料KI-3A)(すなわち、IM1-d-2)は、化学的に変換したISA247(シス:トランス=5:95)からHPLC精製を用いて単離し、1H-NMRおよび2D TOCSYにより解析してその構造を決定した。図11に、トランスISA247の1H-NMRスペクトルと比較した、IM1-d-2の1H-NMRスペクトルを示す。これらの1H-NMRスペクトルの比較では、δ6〜7ppmの間のジエンプロトンの欠如が示されており、このことはaa-1の側鎖での変換を示唆している。また、通常領域における4つのアミドNH 2重線と7つのN-メチル1重線についての所見では、環状ペプチド構造が完全であることが示唆された。図12は、ジオールの2D COSYおよびTOCSYスペクトルを示す。これらのスペクトルは、大部分のプロトンを直接的に帰属することができる、シグナルの結合性を提供する(ただし、変化が認められたaa-1側鎖のプロトンは除く)。δ3.8〜6.2ppmのαプロトン領域のCOSYスペクトルの拡大は、交差ピーク相関を示す実線を付けて、図13に示す。これはまた、一部の追加のプロトンの帰属を加えた図14に示す拡大1D 1H-NMRスペクトルでも明らかである。
【0121】
このCOSYスペクトルは、この領域に以下の4つの交差ピーク相関があることを示した:
δ5.55、4.29および4.16ppmでのシグナルに対するδ5.80ppmでのシグナル
δ4.16および4.02ppmでのシグナルに対するδ5.55ppmでのシグナル
δ4.26ppmでの1-βのシグナルに対するδ5.24ppmでの1-αのシグナル
δ4.16でのシグナルに対するδ4.29でのシグナル。
【0122】
δ5.80および5.55ppmで観測されたシグナルは、オレフィンプロトン(-CH=CH-)のものを示し、δ4.29、4.16および4.02ppmのシグナルは、アルコール炭素(>CH-OH)に結合しているプロトンのものを示す。δ4.29でのシグナルと4.16ppmでのシグナルの間のカップリング関係、ならびにこれらのシグナルとδ5.80ppmでのオレフィンプロトンシグナルの間のカップリング関係は、δ4.29ppmでのシグナルおよびδ4.16ppmでのシグナルが、二重結合(-C=CH-)に結合している第1級アルコール(HO-CH2-)のメチレンプロトンのものであり、アリルアルコール構造(HO-CH2-CH=CH2)につながることを示唆している。さらに、δ4.02ppmでのシグナルとδ5.55ppmでの他のオレフィンプロトンとのカップリングから、これらのプロトンに関する以下の全体構造が示唆された。
【化5】

【0123】
また上記の構造は、長距離相関、すなわち、δ5.55ppmでのプロトンとδ4.16ppmでのプロトンの間のCOSYスペクトルで観測された4つの結合カップリング(4J)結合性と一致する。
【0124】
二重結合立体配置は、図15の二重結合プロトンの拡大1Dスペクトルで示した通り、観測された15.2Hzのカップリング定数からトランスとして帰属された。δ4.29および4.16ppmでのメチレンプロトン、ならびにδ5.55ppmでの別の二重結合プロトンとのカップリングに基づく、δ5.80ppmでのシグナルの分裂パターン(2重線および3重線)は、提案した構造と一致している。δ5.55ppmでの二重結合プロトンに関して観測された2重線および2重線シグナルが若干広範に出現したのは、δ4.16ppmでのシグナルとの4Jの存在によって説明することができる。
【0125】
COSYスペクトルから、さらにaa-1側鎖プロトンの残りの以下のシグナル結合性が得られた:δ2.28ppmでの1-γに対するδ4.26ppmでの1-β;δ1.88ppmでの1-δ1、δ1.59ppmでの1-δ2、およびδ1.45ppmでの1-γCH2に対するδ2.28ppmでの1-γ;δ1.88ppmでの1-δ1、δ1.59ppmでの1-δ2に対するδ4.02ppmでの1-ε。これらの相関は、図16の部分的に拡大したCOSYスペクトルに示している。上記のスペクトル知見から、IM1-d-2構造が図17に示した通りであることが示唆された。
【0126】
図17は、2種類のジアステレオマー形態のIM1-d-2構造を示す。当業者は、図17に示した構造が、aa-1でトランス二重結合立体配置にあり、かつ、図42に機構的に説明したように、ε位での協奏的水攻撃によるエポキシド(IM1-e-2)開環によって形成された、二重結合移動生成物(IM1-d-2)であることに気づくであろう。従って、本化合物は、図17に示したいずれかのジアステレオマーの形態で存在し得る。しかし、上述したIM1-d-1構造とは異なり、この化合物には比較的明瞭なNMRスペクトルが現れた。従って、この構造は図17に示したジアステレオマーのうちの1つであると考えられる。図18は、IM1-d-2のアミノ酸1構造を、各炭素に結合しているプロトンに関する化学シフト帰属とともに示す。収集したIM1-d-2のスペクトルデータを、化学シフト帰属とともに表2に示す。
【表2】

【0127】

【0128】

【0129】
第3のジオール代謝体であるIM1-d-3(試料KI-3)は、ISA247(シス:トランス=50:50)の微生物変換とHPLC精製により得られた。図19に、IM1-d-1化合物と比較したIM1-d-3化合物(試料KI-3)の1H-NMRスペクトルを、トランスISA247(E-ISA247)およびシスISA247(Z-ISA247)と共に示す。図19に示したNMRスペクトルを比較することにより、aa-1側鎖変換を示す、δ6〜7ppmのジエン領域におけるIM1-d-3(試料KI-3)の1H-NMRスペクトルの変化が明らかになった。また質量試験の情報でも、ジオール形成を伴った、アミノ酸1側鎖での変化が示された。スペクトルの比較は、IM1-d-3とIM1-d-1が構造的に異なることを示したが、これらの質量試験の変化は、IM1-d-1代謝体から得られた変化と同様であった。
【0130】
スペクトルのアミドNHプロトンおよびN-メチルプロトン領域は、試料KI-3が1種類の主生成物と数種類の微量混入物との混合物であることを示唆している。従って、NMR分析は、主として2D TOCSYスペクトルから得られた交差ピーク相関によって、KI-3(IM1-d-3)の主要生成物に特化させた(図20を参照されたい)。アミドNHプロトン領域での2D TOCSYスペクトルは、主要アミドNHプロトンが、ISA247およびその代謝体で典型的に観測されるような、aa-2、aa-5、aa-7およびaa-8のものであり、かつ、2-γCH3、7-βCH3および8-βCH3などの特性シグナルへの2D相関の観測により同定可能であることを表していた。アミドプロトン相関の拡大TOCSYスペクトルは、一部のシフト帰属を含めて、図21および図22に示す。この主要代謝体の大部分のアミノ酸側鎖プロトンの化学シフトは、TOCSYスペクトル相関に基づいて同様に帰属された。4つのアミドプロトンおよび7つのN-メチル基1重線の存在、ならびにISA247および他の代謝体のものに類似のシグナル結合性パターンから、親ISA247の環状環構造が完全であることが示唆された。
【0131】
2D TOCSYスペクトルのαプロトン領域に関する詳しい実験から、恐らくアミノ酸1側鎖プロトンのδ55.86〜5.62〜4.62〜3.72〜3.60ppmでの1組の相関シグナル(図24を参照)が明らかにされた。またこれを、この領域の拡大1Dスペクトルに示した(図23を参照されたい)。δ5.86(9-αとオーバーラップ)および5.62ppmでのプロトンシグナルは、オレフィンプロトン(-CH=CH-)を明確に示し;δ5.62でのプロトンシグナルは、第2級アルコールプロトン(>CH-OH)を明確に示し;δ3.72および3.60ppmでのプロトンシグナルは、第1級アルコールプロトン(-CH2-OH)を明確に示している。IM1-d-3のδ5.62ppmでのプロトンはより低磁場にシフトされているが、図24の実線により描かれたこれらのプロトン相関は、代謝体IM1-d-1(KI-2またはKI-2A)で観測されたものに似ている。従って、代謝体IM1-d-3に関するNMRスペクトルおよび質量情報は、アミノ酸1のジオール形成に一致している。
【0132】
推定される二重結合のカウンタープロトンは9-αとオーバーラップしており、解析には利用不可能であるけれども、δ5.62ppmでのシグナルの一次解析(図25を参照)は、9.6Hzのカップリング定数を持つ三重線を示した。これは、シス立体配置の二重結合を示している。δ3.72および3.60ppmでの化学シフトは、構造上の基(-CH2-OH)が二重結合に直接的に結合していないことを示した。従って、これらの所見に基づいて、図26の構造が試料KI-3(代謝体IM1-d-3)の主要生成物であると考える。IM1-d-3ジオールは、図26に示す通り、aa-1のキラルη位で相違している、2種類のジアステレオマーとして存在し得る。図26に示した構造のη位の立体化学は測定されていない。しかし、別の試料KI-4A(シス:トランスの比が1:1のISA247から調製した化学的合成試料)を試験したところ、試料KI-4AのNMR分析(示さず)からは、KI-4A試料の主成分が、aa-1のη位での立体化学で相互に異なっている、KI-3試料の主成分のジアステレオマーであることがわかった。KI-4A試料は、KI-3試料に関する図19〜25に示したものとは異なるNMRスペクトルを表した。これらの構造の同定は可能であって、各ジアステレオマーを単離し研究することは可能であったが、1つの試料または他の試料にそれらのジアステレオマー構造の1つを決定的に帰属させることはできなかった。aa-1のη位でのR異性体またはS異性体のいずれがKI-4A試料またはKI-3試料に属しているかを決定することはできなかった。
【0133】
図26は、IM1-d-3が、aa-1のη炭素にキラル中心を持つシス立体配置のジオールであること、従って、2種類のジアステレオマー(KI-3およびKI-4A)として存在することを示唆している。IM1-d-3中の二重結合がシス立体配座にあり、かつIM1-d-1中の二重結合がトランス立体配座にあることを除けば、IM1-d-3はIM1-d-1と同じジオールである。この違いは、図6に示したHPLCスキャンにおいて、IM1-d-1代謝体とIM1-d-3代謝体を区別する。IM1-d-3の化学シフト帰属を表3に示す。
【表3】

【0134】

【0135】
単離する4番目のジオールはIM1-d-4(試料KI-8A)であった。微量の混入物を含む試料KI-8Aが、ISA247(シス:トランス=5:95)の化学変換から、試料KI-2A(IM1-d-1)およびKI-3A(IM1-d-2)に加えて得られた。HPLCにより単離されたIM1-d-4(試料KI-8A)をNMR分析したところ、予想通りにaa-1の側鎖での変換を意味する、δ6〜7ppmのジエンプロトンの欠如が明らかとなった。通常領域内の4つのアミドNH 2重線および7つのN-メチル1重線の観測からは、環状ペプチド構造が完全であることが示唆された。図27は、IM1-d-4(試料KI-8A)、トランスISA247またはE-ISA247の1H-NMRスペクトルの比較である。
【0136】
微量混入物をスペクトルで目視し得るが、IM1-d-4が試料KI-8の主成分であると思われる。さらに、図28Aおよび図28Bに示した2D COSYおよびTOCSYスペクトルの解析からは、aa-1側鎖の変換によるスペクトルのαプロトン領域で観測される少数のピークを除き、大部分のプロトンに関するシフト帰属が得られた。この比較からは、aa-1の側鎖での変換を意味する、δ6〜7ppm間のジエンプロトンの欠如が明らかである。αプロトン領域の拡大2D COSYスペクトルは、図29に示した通り、1-αおよび1-βの交差ピーク結合性と、帰属されていないプロトン(恐らくaa-1側鎖プロトン)を示している。図30に、この領域の拡大1Dスペクトルを、COSYスペクトルから得られた一部のピーク帰属とピーク相関を含めて示す。δ6.00(ddd)、5.44(dt)、5.15(dt)、4.28(m)および3.73ppm(m)でのシグナルの結合性(それぞれ1つのプロトンとして積分した)は、これらのプロトンが、aa-1の側鎖プロトンのように構造的に関連していることを示した。これらのうち、認識できる分裂パターンを提示したδ6.00(ddd)、5.44(dt)および5.15ppm(dt)でのシグナルを拡大し、図31に示した。
【0137】
δ6.00ppmの化学シフトは、このプロトンが、J=17.2Hzでδ5.44ppmでのプロトンに、またJ=10.6Hzでδ5.15ppmでのプロトンに結合しているオレフィンプロトンであり、その両方が、1.8Hzのカップリング定数で相互に結合しており、かつ、E-ISA247およびZのスペクトルで明らかなように、末端二重結合ジェミナルプロトンを示すことを意味した。通常領域における4つのアミドNH 2重線および7つのN-メチル1重線についての観測からは、環状ペプチド構造が完全であることが示唆された。
【0138】
IM1-d-4の全体構造を図32に図示している。aa-1のε炭素およびζ炭素が共にキラル中心であることに留意されたい。従って、図32に示した構造は、4種類の立体配置をとり得る。図32に示した構造を持つ化合物の正確な立体配置は決定されなかった。しかし、微量混入物が、主要化合物のaa-1側鎖のε炭素およびζ炭素で立体異性体を含み得ることが示唆されている。
【0139】
IM1-d-4の化学シフト帰属を表4に示す。
【表4】

【0140】

【0141】

【0142】
環化代謝体のIM1-c-1(試料KI-5)は、ISA247(シス:トランス=1:1)の生物変換とHPLC精製から得られた。E-ISA247およびZ-ISA247の1H-NMRスペクトルと比較したこの代謝体(試料KI-5)の1H-NMRを図33に示す。NMR分析から、試料がジアステレオ異性体の混合物ではなく、単一の化合物を含有することが明らかになった。このことは、スペクトルのアミドNHおよびN-メチルプロトン領域:4つのアミドNHプロトンおよび7つのN-メチル1重線シグナルから明白である。図33で明らかなように、スペクトルにおけるISA化合物から代謝体への大きな変化は、ジエン領域(δ6〜7ppm)のプロトンの欠如である。
【0143】
これらのオレフィンプロトンシグナルは、アミノ酸1側鎖から生じていて、ISA247分子に特有であり、通常、δ6〜7ppmの間で観測される。従って、この領域からこれらのピークが欠如したことにより、アミノ酸1側鎖に構造的な変換があることが示唆された。図34に、δ3.9〜6.0ppmのアミノ酸αプロトン領域の代謝体拡大スペクトルを、ピークの最上部に記載した特定のαプロトンおよび1-βプロトンに関するシフト帰属とともに示す。これらの帰属および他の帰属は、図36に示す、2Dスペクトルから取得され、アミノ酸1側鎖プロトンを除き、他のすべてのアミノ酸側鎖およびN-メチルプロトンが説明されている。従って、図34のδ5.75(積分により1Hに対応)、δ4.35(1H)およびδ3.94(2Hs)での未帰属のシグナルがアミノ酸1側鎖プロトンであるとの結論が出された。
【0144】
δ5.75ppmでのピークに関する詳細な試験によると、図35に示す通り、これは、δ5.77および5.74ppmで共鳴している2種類のプロトンからなっており、それはまた、相互に結合されていることが明らかとなった。化学シフトおよびカップリング定数(15.8Hz)により、トランス構造を有するオレフィン(-CH=CH-)基が示唆された。図36の2Dスペクトルは、δ5.75ppmでのシグナルが、δ3.94および4.35ppmでのピーク(これらの両ピークは、順次、シグナル結合性を示す)と相関していることを示した。さらに、δ3.94ppmでの多重線シグナルから2つのプロトンが説明され、δ4.35でのシグナルから1つのプロトンが説明された。従って、これらのピーク(δ5.77、5.74、4.35および3.9ppm)のシグナル結合性の説明に、構造基(-CH-CH=CH=CH2-)が提案された。
【0145】
δ4.35および3.94ppmでのシグナルの化学シフトは、これらのプロトンが、次の構造:(-O-CH-CH=CH-CH2-O-)を有する酸素原子に隣接する炭素に結合されていることをさらに示唆している。図37に示した拡大DQF-COSYスペクトルからは、δ5.77ppmでのシグナルがδ4.35ppmでのシグナルと結合しており、δ5.74ppmでのシグナルがδ3.94ppmでのシグナルと結合していることが示唆された。このNMR分析を、図38に示すように、IM1-c-1の構造に明瞭に記載した質量情報と組み合わせた。
【0146】
側鎖のε位の立体化学は、ROESYスペクトルから推定された(図39を参照されたい)。aa-1側鎖プロトンに関するROESYスペクトルの詳しい試験から、以下のROE相関が明らかになった:
(1)δ4.35(1-ε)−δ2.30(1-δ2)
(2)δ4.25(1-β)−δ1.26(1-γCH3)
(3)δ2.49(1-γ)−δ2.30(1-δ2)
(4)δ1.35(1-δ)−δ1.26(1-γCH3)。
【0147】
これらの観測に基づいて、IM1-c-1のaa-1側鎖構造が解明された(図40)。当業者には、aa-1のε炭素がキラル中心であり、従って、ε炭素が、図40に示すようにR立体配置をとるか、またはS立体配置をとり得る(図示せず)ことは理解されよう。ROESYスペクトルの分析によれば、IM1-c-1ピークから単離された代謝体は、主としてR立体配置にある。しかし、図40に示す代謝体は、同様にS立体配置でも存在し得る。
【0148】
いかなる理論にも束縛されるものではないが、ISA247の代謝体のこの構造解析(アミノ酸1残基での代謝から生じたもの)に基づいて、図41の反応スキームを作成した。この反応スキームは、シスISA247またはトランスISA247から開始し得る。ISA247(1)の代謝の第1のステップは、エポキシ化反応である。ISA247がエポキシ化されると、構造2、3および6としてそれぞれ、図41に示した立体配座IM1-e-1、IM1-e-2またはIM1-e-3で存在し得るエポキシドが生じる。これらのエポキシドはHPLCにより特定されておらず、また単離されていない。これらのエポキシドは非常に反応的であると考えられる。これらは、ISA247と、上述の変換生成物の間の反応における中間体または遷移状態であり得る。
【0149】
いかなる理論にも束縛されるものではないが、エポキシドが形成された場合、水がエポキシドを攻撃し、ジオールを形成することができると考えられる。図42は、トランスISA247からのISA247ジオールおよび環状aa-1代謝体の形成について提案される反応機構を示す。図42では、反応スキーム1(「1」と表示した矢印を参照)において、水がIM1-e-1エポキシドのε位またはζ位を攻撃可能な場合、エポキシドは開環され、IM1-d-4代謝体を形成することができる。IM1-d-4代謝体はε炭素およびζ炭素に新しい2個のキラル中心を有しており、その結果、IM1-d-4代謝体は、図42に示す4種類のジアステレオマーの形態で存在し得ることに留意されたい。水がトランスエポキシドのη位またはθ位を攻撃する場合には、エポキシドIM1-e-2が開環され、IM1-d-1代謝体を形成する。IM1-d-1代謝体のη炭素はキラル中心であることに留意されたい。従って、IM1-d-1代謝体は、図42に示すいずれかのジアステレオマーとして存在し得る。エポキシド開環が二重結合移動を伴って生じ、続いて、IM1-e-2エポキシドのε位で水による攻撃(2と表示した矢印を参照)が起こった場合、図42に示すIM1-d-2構造が形成される。IM1-d-2のε炭素はキラル中心であることに留意されたい。従って、IM1-d-2代謝体は、図42に示すように、いずれかのジアステレオマー異性体として存在し得る。一方、IM1-e-2エポキシドのβ炭素のヒドロキシル基がIM1-e-2エポキシドのε炭素を攻撃する場合、環状代謝体IM1-c-1が形成される。再度、ε炭素がキラル中心であり、IM1-c-1代謝体が図42に示したいずれかのジアステレオマーとして存在し得ることに留意されたい。
【0150】
同様に、中間体エポキシドから進行するジオール形成は、シスISA247から出発することが可能である。図43は、トランス-エポキシドIM1-e-2(IM1-e-2トランス)(この場合、IM1-e-2は、エポキシドであるアミノ酸1代謝体(同定された第2のエポキシド)を示す)のエポキシド開環について提案される反応スキームを示す。また図43は、1,2-ジオールを形成するためのシス-エポキシドIM1-e-2(IM1-e-2シス)のエポキシド開環に関する反応スキームを示す。図42および図43に示すように、IM1-e-2トランスからの反応により、IM1-d-1代謝体が生じる。一方、IM1-d-3は、図43に示すように、IM1-e-2シスから形成される。IM1-d-1およびIM1-d-3は共にη炭素にキラル中心があり、従って、いずれかのジアステレオマーとして存在し得ることに留意されたい。
【0151】
ISA247のアミノ酸1側鎖は共役ジエン系を含み、CsAと比較した場合に炭素が1個伸長していることから、ISA247化合物では、CsAの場合よりも多くのジオールおよびエポキシドの立体配置が代謝体として形成される。ISA247分子のアミノ酸1残基の末端炭素はアルケン官能基の一部であるので、CsA-Am1と類似したISA247代謝体はない(この場合、アミノ酸1側鎖のθ炭素は一水酸化される)。
【0152】
図57は、E-ISA247からのIM-1、IM-1-アセタール、IM1-アルデヒドおよびIM1-カルボン酸の形成を示す典型的な反応スキームである。理論に束縛されるものではないが、E-ISA247は、上述のようにη、θアルケンでエポキシ化され、IM1-e-2が形成されると考えられる。エポキシドは開環され、カチオン性中間体が形成され得る。これは、結合移動または1,2-水素化物シフトを受けた後、IM-1-アルデヒドが形成され得る。このアルデヒドは、還元させてアルコールIM-1を形成させるか、酸化させてIM-1-カルボン酸を形成させるか、または、H2O添加によりIM1-アセタールを形成させることができる。
【0153】
表5には、アミノ酸1での修飾を示すISA247代謝体のリストを示す。表5は完全なリストではない。例えば、アミノ酸1代謝体には、5員環、6員環、7員環または8員環が含まれる可能性がある。
【表5】

【0154】

【0155】

【0156】
水酸化代謝体
図6のLCMSスキャンは、1253/1129m/zの親イオン/フラグメントイオン対での4つのピークを示す。図6で8.5分のクロマトグラフィー保持時間を有している主要ピーク1253/1129イオン対は、アミノ酸1以外のアミノ酸の側鎖における水酸化を表している。これは、アミノ酸1以外のアミノ酸のIMX型または水酸化型代謝体と一致している。CsAとISA247のHPLC保持時間が同一であることと、1253/1129m/zのイオン対ピークおよびCsA-Am9標準のHPLC保持時間はまた区別不能であることを考慮すると、この代謝体はIM9であると考えられる。
【0157】
試料KI-7Cは、ISA247(シス:トランス=1:1)の微生物変換から得られ、HPLCにより精製した。図44Aに、KI-7C、ISA247のE異性体およびZ異性体の1D 1H-NMRスペクトルを示す。この比較は、δ6〜7ppmの間のaa-1のジエンプロトンがこの試料では影響されていないことを示しており、これは、aa-1が変換されていないことを示唆している。また、この試料がZ異性体およびE異性体の混合物であることも明らかになった。E異性体およびZ異性体から生じている、2組の4つのアミドNHシグナルおよび7つのN-メチルシグナルは、対応する化学シフト領域で観測された。このことから、この試料(KI-7C)では、ペプチド環が完全であることが示唆された。大部分のアミノ酸プロトンは、2D技術により帰属された(TOCSYおよびDQF-COSY、データは示さず)。側鎖メチル基プロトンへの結合性を欠いていた唯一のアミノ酸は、aa-9であった。従って、水酸化の質量分析結果と組み合わせると、以下の構造:
【化6】

【0158】
を有するaa-9側鎖変換が示唆された。
【0159】
上記観測を、1H-検出HMQC(異種核多量子相関)およびHMBC(異種核多重結合相関)技術(データは示さず)でさらに確認したところ、両メチルプロトンは、単結合および二重結合〜三重結合を介してそれぞれ適切な炭素と相関していた。下記は、前述の異核相関技術から得られた、HMBC相関およびメチルプロトンの化学シフトおよびアミノ酸9(aa-9)側鎖の対応する炭素を示す。従って、KI-7CのNMR分析からは、試料KI-7CがIM9であることが証明された。
【化7】

【0160】
図44Bは、IM9の構造(アミノ酸9残基の水酸化)を示す。ISA247のIM9代謝体のアミノ酸1側鎖は、シスまたはトランス構造のいずれかで存在し得ることに留意されたい。表6は、試料KI-7C(IM9代謝体)の1H-NMRに基づいた化学シフト帰属を示す。
【表6】

【0161】

【0162】

【0163】
IM4と表示した、図6のLCMSスキャンで1253/1129m/zの親イオン/フラグメントイオン対による第2のHPLCピークに対応する物質(試料KI-6)は、ISA247(シス:トランス=1:1)の微生物変換から単離され、1H-NMRを用いて解析された。この代謝体の質量情報がIM9に類似していることから、KI-6もまたIMX型代謝体であることが示唆された。KI-6の1H-NMRスペクトルからは、この代謝体が2種類の化合物の混合物であることが示された。また、アミドNHプロトン(δ7.5〜8.7ppm)、ジエン(δ6.0〜7.0ppm)およびN-メチル領域(δ2.5〜4.0ppm)についてさらに詳しい試験を行ったところ、この代謝体がaa-1でのE異性体およびZ異性体の混合物であって、EとZの比が3:2であることが明らかになった。興味深いことには、出発材料は、ISA247のE異性体とZ異性体の比が1:1であった。これにより、ISA247のE異性体およびZ異性体のこの代謝体への代謝率に差がある可能性があると言える。
【0164】
ISAのジエン構造に関する特有のシグナルと7対のN-メチル基の存在から、aa-1の側鎖が完全であって、N-脱メチル化が起こらなかったことが示唆された。図45は、代謝体(KI-6と表示)の1H-NMRと、E-ISA247およびZ-ISA247の1H-NMRスペクトルの比較である。ジエンおよびアミノ酸プロトン領域におけるNMRスペクトルの比較では、図45の矢印により示したように、δ5.58ppmでのシグナル(これは、Z-ISA247およびE-ISA247のNMRスペクトルでaa-4αプロトンに対応する)が存在しないか、スペクトル中の別の位置にシフトしていることが明瞭にわかった。この観測からは、構造修飾がaa-4のα位付近で起こったことが示唆された。さらに、側鎖メチルプロトン領域(δ0.5〜1.5ppm)のNMR比較では、図46で矢印により示したように、新しいメチル基シグナルの出現があった。図46に示すように、これらのピークの拡大から、δ1.33および1.30ppm、ならびにδ1.29および1.26ppmでの2組の1重線メチルシグナルがあることが明らかになった。2:3のピーク強度比は、δ1.33および1.30ppmでのメチルシグナルはZ異性体のものであり、δ1.29および1.26ppmでのシグナルはE異性体のものであることを示唆している。図47は、拡大したKI-6の新しいメチルシグナルを示す。図46で示した領域のISA247 EおよびZのメチル基ピークの帰属からは、aa-4側鎖からのメチル基、4-CH3(δ1)および(δ2)が、対応する領域のKI-6スペクトルに不在であることが示された。これは、図47の新しいメチルピークがaa-4側鎖に属することを示唆している。メチル基は、E-ISA247およびZ-ISA247のケースのように、γCHプロトンに結合されているので、aa-4側鎖の各メチル基は、通常、2重線として現れる。さらに、KI-6試料に関する質量研究では、アミノ酸1以外のアミノ酸の水酸化が示唆された。従って、aa-4のδメチル基について観測された1重線シグナルは、図49に示したaa-4のγ位におけるISAの酸化的変換により生じたものと結論した。また、2D TOCSYスペクトル(図48)からも、これらのメチル基に関するシグナル結合性の不在をもたらす、上記修飾が確認された
。これは、KI-4であるIM4(アミノ酸4のγ-水酸化)と一致している。IM4の構造を図50に示す。
【0165】
この研究については単離および分析はされていないが、上述のIM9およびIM4に類似した水酸化代謝体もまた、アミノ酸10(IM10)のγCHで、アミノ酸6(IM6)のγCHで、およびアミノ酸5(IM5)のβCHでも生じる可能性がある。これらの水酸化代謝体の一部は、図6に示すHPLCで同定したが、NMRによる検討はしていない。例えば、IMX(2)は、未確認のアミノ酸での水酸化代謝体である。
【0166】
N-脱メチル化代謝体
1223/1099m/zの親イオン/フラグメントイオン対により単離した代謝体(試料KI-1)を1H-NMRで分析した。代謝体の1223/1099m/zの親イオン/フラグメント対は、それがN-脱メチル化代謝体であることを示した。代謝体KI-1の1H-NMRスペクトルからは、E異性体およびZ異性体両方のaa-1側鎖のジエンプロトンピークの存在(aa-1側鎖が完全であることを示す)によって明らかなように、代謝体が、比が約1:1のEおよびZ異性体の混合物であることが明らかになった。またスペクトルから、図51で矢印により示す通り、δ2.5ppmでの1対のN-メチルピークの欠如が明らかになった。代謝体の1H-NMRスペクトルをE-ISA247およびZ-ISA247のものと比較したところ、この領域に対応するシグナルの欠如が、アミノ酸4のN-メチル基(各異性体由来のもの)のものであることが示唆された。従って、この代謝体についてアミノ酸4のN-脱メチル化が示唆された。
【0167】
この代謝体のaa-4αプロトンのシグナルもまた、δ5.56および5.59ppmにそれぞれ共鳴する、ISA247 EおよびIDS247 Zのaa-4αプロトンのシグナルからシフトしており、それはこのスペクトルでは簡単にその位置を確認できなかった。さらに、両異性体のaa-4からの2つのNHプロトンがこの領域で帰属された場合、δ7〜δ8.7ppm間のアミドNHプロトン領域が、10の代わりに、両異性体から生じる8つのアミドNHプロトンを示すのみであった。従って、これは、aa-4のアミドNHプロトンがより高いフィールドで共鳴していることを示唆している。
【0168】
2D TOCSYスペクトルの分析では、δ4.7ppmでのシグナルに相関している、δ5.2ppmでの2組のシグナルが明らかになった。拡大スペクトル(図52)により、これらのシグナル:δ5.26ppmと4.76ppm、およびδ5.23ppmと4.72ppmの明瞭な相関が得られた。2組のピークは、別のアミノ酸プロトン:すなわち、aa-11プロトンによるδ5.2ppmでのシグナル、ならびにaa-5、aa-7およびaa-8αプロトンによるδ4.7ppmでのシグナルとオーバーラップしている。しかし、aa-5、aa-7、aa-8およびaa-11の化学シフト帰属により、これらのアミノ酸から生じているδ5.2およびδ4.7ppmでのシグナルの可能性が除外された。従って、δ4.72と5.23ppmおよびδ4.76と5.26ppmの交差ピーク結合性は、両異性体のaa-4のアミドNHおよびαプロトンから生じたものと考えられる。この観測に基づいて、また1H-15N HSQC(示さず)によって確認したところ、δ5.26ppmおよび5.23ppmのシグナルは、NHプロトンに帰属され、δ4.76ppmおよびδ4.72ppmのシグナルは、aa-4のαプロトンに帰属された。図53に、IM4nとしての代謝体KI-1の提案される構造を示す。
【0169】
ISA247の代謝体の製造には化学合成法を用いることができる。これらの代謝体の化学合成は、通常、次のステップ:(1) シクロスポリンAまたはISA247の1アミノ酸側鎖のβ-OHの保護;(2) エポキシ化;(3) ジオール形成、および(4)脱保護に従う。β-OHの保護は、エポキシド代謝体とジオール代謝体の形成には望ましいかもしれないが、環状代謝体の形成には適合しない。β-OHでの考えられる保護基としては、アセチル、トリメチルシリル、安息香酸エステル、置換安息香酸エステル、エーテルおよびシリルエーテルが挙げられる。特定の反応条件下では、アセテート保護基は、脱離および加水分解などの不適切な副反応を起こす傾向にある。安息香酸エステル、エーテルおよびシリルエーテルは、多くの場合、これらの同じ反応条件下でのかかる副反応に耐性があることから、アセテートの代わりにこれらの保護基を用いると有利なことが多い。
【0170】
保護されたCsAまたはISA247は、塩基条件下でエポキシドを形成することができる。図54は、シャープレス法を用いた合成経路を説明する(R. A. Johnson, K.B. Sharpless. Catalytic Asymmetric Synthesis: I. Ojima編; VCH Publishers: New York; 1993; p. 103; K.B. Sharplessら, J. Org. Chem. 1992, 57, 2768)。図54に示したように、アリルアルコール部分により保護されたCsA化合物は、シャープレスエポキシ化を受けることができる。酸化、ウィッティヒ反応およびエポキシド開環を含む一連の反応によってジオール代謝体が得られる(WO 2003/033526およびUS 2003/0212249を参照されたい)。あるいは、AD-mix-β/AD-mix-αなどの市販試薬を用いるシャープレス二水酸化(K.B. Sharplessら, J. Am. Chem. Soc. 1992, 114, 7570)をジオール代謝体の合成で用いることができる。代表的な実施例を図54に示す。
【0171】
図55に、化学的合成法を用いて、特定のsynおよびantiジオールの合成を導くことができることを示す。例えば、図55では、シスアルコキシアリルボロン酸エステル試薬を用いてIM1-d-4のsynジオールを形成することができる。IM1-d-4のantiジオールは、トランス-シリルアリルボロン酸エステルの試薬を用いる場合に形成することができる(H.C. Brownら, J. Am. Chem. Soc. 1988, 110, 1535, Marshall, J.A. Chem. Rev. 1996, 96, 31, Barrett, A.G.M.ら, J. Org. Chem. 1991, 56, 5243を参照されたい)。
【0172】
図56は、クロロアリルホウ素化法を用いたエポキシド(およびジオール)の形成を説明する。図56は、ジオールに変換することができるシスエポキシドを形成させる、HuらのJ. Org. Chem. 1998, 63, 8843に記載された方法(またWO 2003/033526およびUS 2003/0212249も参照されたい)を使用する、ジアルキル(クロロアリル)ボラン試薬の使用を示す。
【0173】
5員環形成を示す、上述の環状アミノ酸1代謝体以外に、6員環、7員環または8員環を含む、さらなる環状アミノ酸1代謝体が考えられる。例えば、図42では、IM1-e-2エポキシド代謝体のβ-OHが、水の存在下でそれ自体のε炭素を攻撃する場合の環状代謝体の形成を説明している。IM1-e-2エポキシド代謝体のβ-OHがそれ自体のζ炭素を攻撃した場合は、6員環構造を持つ環状代謝体が形成される。IM1-e-2エポキシド代謝体のβ-OHがそれ自体のθ炭素を攻撃した場合は、8員環構造を持つ環状代謝体ができる。同様に、IM1-e-2エポキシド代謝体のβ-OHがそれ自体のη炭素を攻撃した場合は、7員環構造を持つ環状代謝体ができる。
【0174】
また、上述のIM4nに類似の脱メチル化代謝体は、aa-1、aa-3、aa-6、aa-9、aa-10およびaa-11でのメチル化窒素でも生じ得る。これらの代謝体のうちの一部は、図6のHPLCスキャンで同定可能である。例えば、IMXn(2)は、ISA247環中の未確認アミノ酸(「X」と表す)での脱メチル化代謝体である。
【0175】
上述の代謝体の他に、水酸化、N-脱メチル化、ジオール形成または環化の組み合わせで代謝体を生成する、代謝ステップの組み合わせが存在し得る。多重水酸化およびN-脱メチル化を有する代謝体が存在し得る。例えば、IM-1-d-1は、4位におけるMeLeuの窒素の脱メチル化によりさらに代謝され、IM1-d-1-4nを生成し得る。別の例としては、IM1-d-2-4nまたはIM1-d-3-4n、あるいはIM1-d-4-4n、IM1-c-l-4nまたはIM1-c-2-4nが挙げられる。ジオール形成または環化と組み合わせる脱メチル化は、N-脱メチル化を受けやすいISA247分子上の任意のアミノ酸であってもよい。例えば、ISA247の代謝体には、アミノ酸1、3、4、6、9、10または11における少なくとも1つのN-脱メチル化と組み合わせた、アミノ酸1で形成されたジオール(IM1-d-1、IM1-d-2、IM1-d-3またはIM1-d-4)が含まれる。またISA247の代謝体は、水酸化を受けやすいISA247分子上の任意のアミノ酸における少なくとも1つの水酸化と組み合わせた、アミノ酸1で形成されたジオールも含み得る。例えば、ISA247の代謝体は、アミノ酸4、6、9、10、または11における少なくとも1つの水酸化と組み合わせた、アミノ酸1で形成されたジオール(IM1-d-1、IM1-d-2、IM1-d-3またはIM1-d-4)を含んでいる。ISA247の代謝体は、アミノ酸1、3、4、6、9、10または11における少なくとも1つのN-脱メチル化、あるいはアミノ酸4、6、9、10または11における少なくとも1つの水酸化と組み合わせた、アミノ酸における環化(IM1-c-1またはIM1-c-2)を含んでいてもよい。代謝体は、多重水酸化(例えば、IM46、IM69またはIM49)、あるいは多重N-脱メチル化(例えばIM4n9nまたはIM4n3n)を含んでいてもよい。多重代謝体は、図6のHPLCスキャン中に存在している。例えば、IMXnX(2)は、ISA247環上の未確認位置でN-脱メチル化され、かつ水酸化されている代謝体を表す。これらの多重水酸化および/または多重N-脱メチル化は、aa-1でのジオール形成、またはaa-1での環化と組み合わせても起こり得る。
【0176】
上述のフェーズI代謝体の他に、さらにフェーズII代謝体が生じる可能性がある。これらのフェーズII代謝体はグルクロニド、糖(例えばグリコシル化由来のもの)、リン酸、硫酸等などの基を含んでいてもよく、これらはISA247またはISA247代謝体分子上の任意のヒドロキシル基で生じ得る。フェーズII代謝体のこのリストは完全ではないこと、また、多数のさらなるフェーズII代謝体がこの明細書により意図されることは、当業者には理解されよう。
【実施例】
【0177】
実施例1:全血からのISA247代謝体の調製
ヒトにISA247を投与した後、全血を採取した。tertブチルメチルエーテル(またはメチルtertブチルエーテル、MTBE)を用いて全血からISA247およびその代謝体を抽出し、乾燥させ、メタノール中に再調製した。MTBE(cat. No. 7001-2; Caledon)2mLを全血200μLに加え、10分間振盪し、卓上遠心分離機で2分間遠心した。上部のMTBE層を除去し、真空下で濃縮した。残渣をメタノール200μL中に再調製した。同様に、胆汁抽出物および尿抽出物について実施することができる。
【0178】
実施例2:ISA247代謝体の化学合成
OAc-E-ISA247のモノエポキシドの調製
E-ISA247のジオール代謝体を調製するため、図42に示したようにエポキシドを形成させた。以下のステップを実施した。CHCl3(3mL)中のOAc-E-ISA247(125mg、0.1mmol)の撹拌冷却(0℃)溶液に、重炭酸カリウム(10mg)を添加した。これに、CHCl3(2mL)に溶解したm-クロロ過安息香酸(23mg、0.1mmol、77%)溶液を添加した。この反応混合物を室温まで温め、18時間撹拌を継続した。反応生成物をジクロロメタン(25mL)で抽出した。有機層を飽和NaHCO3溶液とブラインで洗浄した。乾燥(Na2SO4)させ、溶媒を除去することにより、白色固体(110mg)が得られた。MS (m/z): 1295 (M + Na+)。この生成物はエポキシドの混合物であった。同じ工程は、OAc-Z-ISA247またはISA247の異性体混合物で用いることができるが、図42に示した通り、その生成物の立体化学は異なる。
【0179】
OAc-E-ISA247のエポキシドからジオール混合物への開裂:
上述の生成物(110mg)を、アセトン-水-88%HCO2H(15mL、64.5:33:2.5)の撹拌・氷冷混合物に添加し、室温で72時間撹拌した。反応混合物を酢酸エチル(25mL)で抽出することにより処理し、有機抽出物を飽和NaHCO3溶液およびブラインで洗浄した。乾燥(Na2SO4)させ、溶媒を除去することにより白色固体(110mg)を得た。MS (m/z):1313 (M + Na+)。生成物はOAc-E-ISA247ジオールの混合物であった。
【0180】
ジオールの脱保護:
OAc-E-ISA247ジオール(110mg)の混合物をMeOH(10mL)中に溶解し、水(4mL)を加え、その後、固体の炭酸カリウム(110mg)を加えた。反応混合物を36時間室温で撹拌し、次いで、酢酸エチル(25mL)で抽出した。併せた有機抽出物をブラインで洗浄し、乾燥させた(NaSO4)。溶媒の除去により固体(110mg)が得られた。MS (m/z) 1271 (M + Na+)。PHLCを用いた精製を行ったところ、化合物IM1-d-1、IM1-d-2およびIM1-d-4が得られた。
【0181】
実施例3:E-ISA247のエポキシ化(環状代謝体の調製):
酸性環境において、環状化合物を形成した。CHCl3(3mL)に溶解したE-ISA247(250mg、0.2mmol)の撹拌・冷却(0℃)溶液に、CHCl3(2mL)中のm-クロロ過安息香酸(51mg、0.23mmol、77%)溶液を加え、室温で48時間撹拌した。反応混合物を0℃まで冷却し、Me2S(600uL)を添加することにより過剰のm-CPBAを破壊した。反応生成物をジクロロメタン(25mL)で抽出し、有機層を飽和NaHCO3溶液およびブラインで洗浄した。乾燥(NaSO4)させ、溶媒を除去することにより固体(230mg)が得られた。IM1-c-1およびIM1-c-2の混合物中に存在していた環状化合物を分取HPLCを用いて単離した。
【0182】
実施例4:E-ISA247のエポキシ化(末端エポキシドの調製)
CHCL3(3mL)に溶解したE-ISA247(200mg、0.17mmol)の撹拌・冷却(0℃)溶液に、固体KHCO3(20mg、0.2mmol)を添加した。次いで、CHCl3(2mL)に溶解したm-クロロ過安息香酸(45mg、0.2mmol)溶液を加えた。室温にて4.5時間、撹拌を継続した。次いで、反応混合物を氷中で冷却し、Me2S(500uL)を加えた。上述のように処理とHPLC単離を行うことにより、末端エポキシドIM1-e-1が得られた。
【0183】
実施例5:イヌ肝臓ミクロソーム調製物によるISA247代謝体生成
イヌミクロソームの調製
以下の方法でイヌ肝臓ミクロソームを調製した:肝臓を切除した後、1.15%の塩化カリウム(KCl)でフラッシングし;小型断片(約25g)にダイスカットし、冷却した粉砕バッファー(0.1Mのリン酸緩衝液 pH 7.4;4℃;肝臓とバッファーとの比率は1:1)中で大きな塊が崩壊するまで破砕した。Polytron Homogenizerを利用し(15,000rpmで3〜5分間)、肝臓組織を含んでいるホモジネートを形成させた。粒状物質から上清をデカントした後、上清を100,000×gで90分間遠心分離にかけ、ミクロソームペレットを得た。ミクロソームペレットのタンパク質含有量は、Lowryタンパク質アッセイを用いて測定した。このミクロソーム調製物のタンパク質濃度は約23.2mg/mLであった。酵素の失活を避けるため、ミクロソームを-80℃の4.0mLまたは6.0mLアリコートで保存し、凍結融解サイクルを回避した。
【0184】
上述のようにして調製したイヌ肝臓ミクロソーム6mL容量を、以下の成分を段階的に加えながら、257mLのエルレンマイヤーフラスコ中でインキュベートした:リン酸緩衝液(pH 7.4に調整)6.0mLに、NADP 57.3mg、グルコース-6-リン酸 254mg、およびNADPH 23.0mgを加えたもの。次いで、5.0mMのMgCl 2.0mL、およびグルコース-6-リン酸デヒドロゲナーゼ6.0mL(10単位/mL、CALBIOCHEM(San Diege, CA)から購入可能、カタログ番号346774)をこの溶液に加えた。最後に、リン酸緩衝液(pH7.4)を10mL加えた。このフラスコを、環境制御インキュベータ/振盪機において、250rpmで2時間37℃にてインキュベートした。2時間後、2MのHCl 500μLを加えることによりこの反応を停止させた。
【0185】
次いで、この方法により生成された代謝体を有機溶媒で抽出し、さらに、高圧液体クロマトグラフィー(HPLC)を用いて分離した。さらに、エレクトロスプレー質量分析(MS)およびNMRにより代謝体を特性決定した。
【0186】
実施例6A:生物変換によるISA247代謝体の生成
生物変換系は微生物を利用し、微生物当量のヒトシトクロムP450ミクロソーム酵素と微生物の活発な増殖に好適な培地を含む。親化合物(水に難溶性である)は、生物変換系へ添加する前に、エタノールおよび界面活性剤と混合した。この実施例では、エタノールに溶解したISA247をTween40と混合し、次いで、サッカロポリスポラ・エリテレア(Saccharopolyspora erytheraea)ATCC 11635を含む生物変換系に加えた。
【0187】
生物変換実験は、15斜面のサッカロポリスポラ・エリテレアで開始した。これらの斜面は、脱イオン水に溶解し、NaOHでpH7.0に調整し、100℃で30分間滅菌した、100mLのATCC培地196(1斜面当たり約6.0mL)から調製した。サッカロポリスポラ・エリテレアを接種した後、これらの斜面を28℃で3週間培養した。
【0188】
次いで、これらの斜面から得たコロニーをフェーズI培地に移した。フェーズI培地は、10g/Lのデキストリン、1g/Lのグルコース、3g/Lのビーフエキス、10g/Lの酵母エキス、5g/Lの硫酸マグネシウム、および400mg/Lのリン酸カリウムで調製した。これらの成分は、1リットル以下の脱イオン水中で混合し、NaOHでpH7.0に調整した。次いで、50mLのアリコートをバッフル付き250mL培養フラスコに移し、100℃で30分間滅菌した。フェーズI培養を開始するため、サッカロポリスポラ・エリスレアを含む寒天斜面へ5mlの培地を分けた。細胞を斜面表面からかき取り、細胞懸濁液を調製した。各フラスコへの接種には、この懸濁液2.5mLを用いた。27℃のLabline Incubatorにこのフラスコを入れ、3日間(72時間)250rpmで振盪した。
【0189】
3300rpmで5分間、フェーズIフラスコの内容物を遠心分離にかけて、上清をデカントしてペレットを取得することにより、サッカロポリスポラ・エリスレアをフェーズI培地からフェーズII培地に移した。ペレットにフェーズII培地5mLを加え、試験管をボルテックスし、次いで、3300rpmで4分間遠心分離にかけた。再度、上清をデカントした。ペレットをフェーズII培地中に再懸濁した。その結果生じた懸濁液をバッフル付き培養フラスコ中のフェーズII培地50mLに加えた。
【0190】
フェーズII培地は、10g/Lグルコース、1g/Lの酵母エキス、1g/Lのビーフエキス、および3-N-モルホリノプロパンスルホン酸(MOPS)バッファー11.6g/Lを含んでいた。これらの成分を脱イオン水中で混合し、5MのNaOHでpH7.0に調整した。50mLのアリコートをバッフル付き培養フラスコ(250mL)に分注し、100℃で30分間オートクレーブにかけた。また、Tween 40もオートクレーブにかけた。
【0191】
ISA247(4mg)を0.1mlのエタノール(95%)中に溶解し、次いで、0.4mlのTween(登録商標)40(ポリオキシエチレンソルビタンモノパルミテート; カタログ番号P1504. Sigma-Aldrich(St. Louis, MO))と混合した。次いで、この親化合物・界面活性剤混合物を、サッカロポリスポラ・エリスレアを含むフェーズII培地に加えた。ゼロ時間の試料を取得し、それを凍結した。次いで、各フラスコに栓をし、27℃のInnova Incubatorに入れ、170rpmで振盪しながら120時間インキュベートした。
【0192】
フェーズII培地から第2の試料を得た。ゼロ時間試料と第2の試料を、tert-ブチル-メチルエーテル(カタログ番7001-2; Caledon)を用いて抽出した。抽出した代謝体をメタノール(HPLC等級)中に再調製し、下記のLC-MSにより分析した。
【0193】
図59は、ATCC 11635により(すなわち、ATCC 11635の代謝の多様性により)生成され得る、代謝体の量と種類を例示している棒グラフである。
【0194】
実施例6B:生物変換によるISA247代謝体生成
前述の生物変換実施例に基づいたさらなる実験において、ISA247からのISA247代謝体の生成について、カルバラリア・ルナータ(Curvularia lunata) (UAMH 9191, ATCC 12017)、カニングハメラ・エキヌラタ var. エレガンス(Cunninghamella echinulata var. elegans) (UAMH 7370, ATCC 36112))、カーブラリア・エキヌラタ var. ブラケスレエナ(UAMH 8718, ATCC 8688a)、カニングハメラ・エキヌラタ var. エレガンス(Curvularia echinulata var. blakesleena)(UAMH 7369, ATCC 26269)、ボーヴァリア・バシアナ(Beauvaria bassiana) (UAMH 8717, ATCC 7159)、アクチノマイセス属(Actinomycetes)(ATCC 53828)、アクチノプラネス属(Actinoplanes)(ATCC 53771)、カニングハメラ・エキヌラタ(UAMH 4144, ATCC 36190)、カニングハメラ・エキヌラタ(UAMH 7368, ATCC 9246)、カニングハメラ・ベニエレ(エキヌラタ)(Cunninghamella bainiere (echinulata))(UAMH 4145, ATCC 9244)、およびサッカロポリスポラ・エリスレ(Saccharopolyspora erythrae) (ATCC 11635)をはじめとする、種々の微生物を評価した。
【0195】
代謝体変換率(開始ISA24に対して生成された公知のISA247代謝体の総量)について、ならびに代謝多様性(生成された異なるISA247代謝体の数)について、これらの微生物をスクリーニングした。さらに、(高脂溶性ISA247の吸収を高めるための)ジメチルスルホキシド(DMSO)およびTween40を含む送達アジュバントを、公知のアジュバントであるグリセリンと比較して試験した。試料を培地から取得し、下記のヒト標準ISA247代謝体プロファイルに対してLC-MSにより分析した。表7には、確認されたイオン質量、対応する定量可能なISA247代謝体、およびおおよその保持時間を挙げている。計量したイオン質量には、1223、1237、1239、1253、1255、1267および1271が含まれていた。
【表7】

【0196】
表8は、96時間生物変換した後の総変換および代謝多様性に基づいて試験した微生物を分類している。チェックマークは、定量可能な量の代謝体が生成されたことを示す。
【表8】

【0197】

【0198】
実施例7:ISA247代謝体の分析に関するLC/MS手順
この実施例では、ISA247代謝体をin vitroで生成し、高圧液体クロマトグラフィー(HPLC)を用いて分離し、エレクトロスプレー質量分析を用いて特性決定した。
【0199】
液体クロマトグラフィー(LC)条件
液体クロマトグラフィー(LCまたはHPLC)については、Perisorb RP-8 (Upchurch Scientific cat# C-601)を充填したguard カラム2×20mm(Upchurch Scientific cat# C-130B)を備えた、逆相Waters Symmetry C8、2.1×50mm、3.5μm分析カラム(Waters cat# WAT 200624)を用いた。LCプログラムで利用した溶媒比率と流速は、表9に記載している。
【表9】

【0200】
質量分析(MS)条件
質量分析においては、Applied Biosystems / MDS Sciex API3000 (Analyst software v 1.2)装置を用いた。実行時間は15分、注入容量は5μLであり、Guardカラム温度および分析カラム温度は60℃であった。手動設定は以下のとおりであった:Turbo Ion Sprayは8000、Turbo Ion Spray horizontal settingはプラス4であり、Turbo Ion Spray lateral setteingは10であった。Sciex装置は、表10に示したパラメータに設定した。
【表10】

【0201】
表11にはイオンおよびイオン特異的機器設定を示す。
【表11】

【0202】
実施例8:ISA247代謝体の免疫抑制活性の測定
カルシニューリン活性は、Frumanらによって既に記載されている方法(A Proc Natl Acad Sci USA, 1992)および米国特許第6,605,593号に記載の方法を変更して用い、分析した。全血溶解物は、オカダ酸、1型および2型ホスファターゼ阻害剤の存在下で、32Pで標識した19個のアミノ酸ペプチド基質を脱リン酸化する能力について評価する。過剰添加したISA247の存在下および不在下で実施したアッセイとともに、バックグラウンドのホスファターゼ2C活性(CsAおよびオカダ酸耐性活性)を測定し、各試料から差し引いた。残存しているホスファターゼ活性がカルシニューリン活性として得られる。
【0203】
図58Aは、添加した代謝体濃度(ng/mL)に対するカルシニューリン阻害(%)を示すグラフである。ISA247代謝体IM1-ジオール-1、IM9、IM4n、IM1cおよびIM1による濃度関数としてのカルシニューリン阻害は、図58Aを図58B(これは、トランスISA247、シスISA247およびCsAの濃度に対するカルシニューリン阻害を示す)と対比して確認することができる通り、トランスISA247、シスISA247およびCsAに匹敵する。表12は、トランスISA247およびCsAと比較した、IM1、IM1-ジオール-1、IM4nおよびIM9のEmaxおよびEC50を示す。
【表12】

【0204】
本出願で引用したすべての刊行物、特許および特許出願は、各々の個別の刊行物、特許出願または特許の明細書が参照によってその全開示が具体的にかつ個々に組み入れられたのと同程度まで、その全開示を参照により本明細書に組み入れるものとする。
【0205】
本明細書中の反応機構は、化学的であるか酵素的であるかにかかわらず、理論的なものであって、本明細書に記載された工程を明確にし例示するために提供するものである。これらの機構は正しいと考えてはいるが、当業者は、さらなる証拠によってこれらの機構に変更が生じる可能性があることは理解するであろう。従って、本出願人らは、本明細書に記載した実施形態がこれらの理論的機構により限定されることを意図するものではない。
【0206】
上述の本発明の典型的な実施形態に関する多くの変更が当業者によって容易に行われる。従って、本発明には、添付した特許請求の範囲内にある全ての構造および方法が含まれるものとして解釈すべきである。
【図面の簡単な説明】
【0207】
【図1】図1は、CsAの構造の説明図である。
【図2】図2は、ISA247の構造の説明図である。
【図3】図3は、ISA247のE(トランス)異性体の説明図である。
【図4】図4は、ISA247のZ(シス)異性体の説明図である。
【図5】図5は、公知のCsA代謝体を示した表である。
【図6】図6は、ISA247投与後のヒト全血中に存在する代謝体のHPLC-MRMスキャンである。
【図7】図7は、単離されたISA247代謝体の混合標準物のHPLC-MRMスキャンである。
【図8】図8は、試料KI-2から得た、E-ISA247、Z-ISA247およびIM1-d-1の1H-NMRスペクトルを示す。
【図9】図9は、試料KI-2から得た、IM1-d-1の2D TOCSYスペクトルである。
【図10】図10は、IM1-d-1の構造を示す。
【図11】図11は、試料KI-3Aから得た、E-ISA247およびIM1-d-2の1H-NMRスペクトルを示す。
【図12】図12は、試料KI-3Aから得た、IM1-d-2の2D COSYおよびTOCSYスペクトルを示す。
【図13】図13は、試料KI-3Aから得た、IM1-d-2の拡大2D COSYスペクトル(3.8〜6.2ppm)を示す。
【図14】図14は、試料KI-3Aから得た、IM1-d-2の拡大1H-NMRスペクトル(3.8〜6.2ppm)を示す。
【図15】図15は、シグナルの分裂パターンを表す、IM1-d-2(試料KI-3A)の二重結合プロトンの拡大1H-NMRスペクトルを示す。
【図16】図16は、aa-1側鎖プロトンの相関を示す、IM1-d-2(試料KI-3A)の拡大2D COSYスペクトルを示す。
【図17】図17は、IM1-d-2のaa-1側鎖のε位でのRおよびSエピマーの構造を示す。
【図18】図18は、IM1-d-2のアミノ酸1構造とそのプロトン化学シフトを示す。
【図19】図19は、IM1-d-1、IM1-d-3、E-ISA247およびZ-ISA247の1H-NMRスペクトルを示す。
【図20】図20は、IM1-d-3(試料KI-3)の2D TOCSYスペクトルを示す。
【図21】図21は、IM1-d-3(試料KI-3)の拡大TOCSYスペクトルにおいて、対応するαプロトンに相関を示すアミドプロトンを示す。
【図22】図22は、IM1-d-3(試料KI-3)の拡大TOCSYスペクトルにおいて、対応する側鎖メチルプロトンに相関を示すアミドプロトンを示す。
【図23】図23は、3.5〜6.1ppmの間のIM1-d-3(試料KI-3)の拡大1H-NMRスペクトルと一部のTOCSY相関を示す。
【図24】図24は、3.4〜6.3ppmの間のIM1-d-3(試料KI-3)の拡大2D TOCSYスペクトルを、交差ピーク相関と共に示す。
【図25】図25は、IM1-d-3(試料KI-3)の拡大1H-NMRスペクトルを、δ5.62ppmでのシグナル分析を含めて示す。
【図26】図26は、IM1-d-3のaa-1側鎖のη位でのR異性体とS異性体の構造を示す。
【図27】図27は、IM1-d-4(試料KI-8A)およびE-ISA247の1H-NMRスペクトルを示す。
【図28A】図28Aは、IM1-d-4(試料KI-8A)の2D COSYスペクトルを示す。
【図28B】図28Bは、IM1-d-4(試料KI-8A)の2D TOCSYスペクトルを示す。
【図29】図29は、3.5〜6.2ppmの間のIM1-d-4(試料KI-8A)の拡大2D COSYスペクトルを、相関と共に示す。
【図30】図30は、COSY相関を含めた、3.7〜6.2ppmの間のIM1-d-4(試料KI-8A)の拡大1H-NMRスペクトルと一部のプロトン帰属である。
【図31】図31は、IM1-d-4(試料KI-8A)に関する、δ〜6.00、5.44および5.15ppmでの1H-NMRシグナルの一次分析である。
【図32】図32は、IM1-d-4の構造を示す。
【図33】図33は、E-ISA247、Z-ISA247およびIM1-c-1(試料KI-5)についての1H-NMRスペクトルの比較である。
【図34】図34は、αプロトン領域でのIM1-c-1(試料KI-5)の拡大1H-NMRスペクトルを示す。
【図35】図35は、図34で示した、IM1-c-1(試料KI-5)のδ〜5.75ppmでのシグナルの分析を示す。
【図36】図36は、αプロトン領域でのIM1-c-1(試料KI-5)の拡大2D TOCSYスペクトルを示す。
【図37】図37は、IM1-c-1(試料KI-5)の一部を拡大したDQF-COSYスペクトルである。
【図38】図38は、IM1-c-1の構造を示す。
【図39】図39は、IM1-c-1(試料KI-5)の2D ROESYスペクトルである。
【図40】図40は、ROE相関を示す、IM1-c-1のアミノ酸1側鎖に関する構造の説明図である。
【図41】図41は、ISA247のアミノ酸1代謝体の形成を説明する典型的な反応スキームである。
【図42A】図42Aは、トランスISA247からのISA247のアミノ酸1代謝体の形成を説明する典型的な反応スキームである。
【図42B】図42Bは、シスISA247からのISA247のアミノ酸1代謝体の形成を説明する典型的な反応スキームである。
【図43】図43は、トランスISA247からのIM1-d-1の形成、およびシスISA247からのIM1-d-3の形成を説明する典型的な反応スキームである。
【図44A】図44Aは、KI-7C、E-ISA247およびZ-ISA247の1H-NMRスペクトルの比較である。
【図44B】図44Bは、IM9の構造を示す。
【図45】図45は、IM4(試料KI-6)、E-ISA247およびZ-ISA247の1H-NMRスペクトルの比較である。
【図46】図46は、0.5〜1.5ppmの間のIM4(試料KI-6)、E-ISA247およびZ-ISA247の拡大1H-NMRスペクトルの比較である。
【図47】図47はIM4の新規のメチルシグナルを示す拡大1H-NMRである。
【図48】図48は、IM4(試料KI-6)の2D TOCSYスペクトルである。
【図49】図49は、IM4を形成するためのアミノ酸4γ位の変換を示すスキームである。
【図50】図50は、IM4の構造を示す。
【図51】図51は、IM4n(試料KI-1)、E-ISA247およびZ-ISA247の1H-NMRスペクトルの比較である。
【図52】図52は、IM4n(試料KI-1)の拡大2D TOCSYスペクトルである。
【図53】図53は、IM4nの構造を示す。
【図54】図54は、シャープレス法を用いる化学反応スキームを示す。
【図55】図55は、特定のsyn-またはanti-ジオールの合成を誘導する化学的合成法を示す。
【図56】図56は、クロロアリルホウ素化(chloroallylboration)を用いる化学的合成法を示す。
【図57】図57は、E-ISA247からのIM-1、IM-1-アセタール、IM1-アルデヒドおよびIM1-カルボン酸の形成を示す典型的な反応スキームである。
【図58A】図58Aは、ISA247代謝体のIM1-ジオール-1、IM9、IM4n、IM1-cおよびIM1の代謝体濃度(ng/mL)に対するカルシニューリン阻害(%)を示すグラフである。
【図58B】図58Bは、トランスISA247、シスISA247およびCsAの濃度(ng/mL)に対するカルシニューリン阻害(%)を示すグラフである。
【図59】図59は、ISA247代謝体生成におけるATCC 11635の典型的な代謝多様性プロファイルを示す棒グラフである。示した変換は、lmg/mLのシクロスポリンA標準と比較したパーセントである。
【特許請求の範囲】
【請求項1】
以下の式:
【化1】

[式中、
各R2は独立に-Hまたは-CH3であり;
各R10は独立に-H、-OH、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORaまたは-NRcC(O)N(RaRb)であり;
R5、R6、R7、R8およびR9は独立に、-H、-OH、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORaまたは-NRcC(O)N(RaRb)であるか;またはR6とR7が一緒になって-O-であるか;またはR5とR6が一緒になって、もしくはR7とR8が一緒になって独立に-O-であるか;またはR8とR9が一緒になって-O-であるか;またはR5が、それが結合する炭素と一緒になって、-C(=O)Ra、-CO2Ra、-CH2ORa、-CH2OC(O)Ra、-CH(ORa)2、-C(O)N(RaRb)、-C(=NRb)Ra、-C(=NORb)Ra、もしくは-C(=NNRb)Raであり;ただし、R5とR6、R6とR7、またはR7とR8のうち1ペアが炭素間結合していて、かつ残りのすべてが-Hであることはなく;かつ
Ra、RbおよびRcはそれぞれ独立に-Hであるかまたは脂肪族、脂環族、ベンジルもしくはアリールで置換されていてもよく、あるいは-N(RaRb)が一緒になって任意的な置換複素環基であるかまたは-CH(ORa)2が一緒になって環状アセタール基である]
により表される単離された化合物、ならびに製薬上許容されるその塩および溶媒和物。
【請求項2】
以下の式:
【化2】

[式中、
各R2は独立に-Hまたは-CH3であり;
各R10は独立に-H、-OH、-F、-Cl、-Br、-I、-ORa、-OC(O)Ra、-OSO2Ra、-OSO3Ra、-OPO2RaRbまたは-OPO3RaRbであり;
R5、R6、R7、R8およびR9は独立に、-H、-OH、-F、-Cl、-Br、-I、-ORa、-OC(O)Ra、-OSO2Ra、-OSO3Ra、-OPO2RaRbもしくは-OPO3RaRbであるか;またはR6とR7が一緒になって-O-であるか;またはR5とR6が一緒になって、もしくはR7とR8が一緒になって独立に-O-であるか;またはR8とR9が一緒になって-O-であるか;またはR5が、それに結合する炭素と一緒になって-C(=O)Ra、-CO2Ra、-CH2ORa、-CH2OC(O)Ra、-CH(ORa)2、-C(O)N(RaRb)、-C(=NRb)Ra、-C(=NORb)Raまたは-C(=NNRb)Raであり;ただし、R5とR6、R6とR7、またはR7とR8のうち1ペアが炭素間結合しており、かつ残りのすべてが-Hであることはなく;かつ
Ra、RbおよびRcはそれぞれ独立に-Hであるかまたは脂肪族、脂環族、ベンジルもしくはアリールで置換されていてもよく、あるいは-N(RaRb)が一緒になって任意的な置換複素環基であるかまたは-CH(ORa)2が一緒になって環状アセタール基である]
により表される、請求項1に記載の単離された化合物。
【請求項3】
以下の式:
【化3】

[式中、
R1は以下のもの:
【化4】


からなる群より選択され、
各R2は独立に、-CH3および-Hからなる群より選択され;
各R3は独立に、-CH2CH(CH3)2および-CH2C(CH3)2OHからなる群より選択され;かつ
各R4は独立に、-CH(CH3)2および-C(CH3)2OHからなる群より選択される]
により表される、請求項1に記載の単離された化合物。
【請求項4】
シクロ{{(E)-および(Z)-(2S,3R,4R)-3-ヒドロキシ-4-メチル-2- (メチルアミノ)-6,8-ノナジエノイル}-L-2-アミノブチリル-N-メチル-グリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル-L-アラニル-D-アラニル-N-メチル-L-ロイシル-N-メチル-L-ロイシル-N-メチル-L-バリル}(ISA247)の単離された代謝体ならびにその製薬上許容される塩および溶媒和物であって、ISA247と比較して、該単離された代謝体が、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、分子内環化、リン酸化、硫酸化、グルクロニド形成およびグリコシル化からなる群より選択される少なくとも1個の化学修飾を含む、上記代謝体ならびにその塩および溶媒和物。
【請求項5】
以下のもの:
アミノ酸1の側鎖でのエポキシド;
アミノ酸1の側鎖でのジオール;
アミノ酸1の側鎖中の環状エーテル;
アミノ酸1、3、4、6、9、10、または11での脱メチル化アミノ窒素;
アミノ酸4、6、9、または10の側鎖のγ炭素での-OH;および
アミノ酸5または11の側鎖のβ炭素での-OH
からなる群より選択される少なくとも1個の化学修飾を含む、請求項4に記載の単離された代謝体。
【請求項6】
IM1-e-1、IM1-e-2、IM1-e-3、IM1-d-1、IM1-d-2、IM1-d-3、IM1-d-4、IM1-c-1およびIM1-c-2からなる群より選択される、請求項4に記載の単離された代謝体。
【請求項7】
ISA247と比較して、以下のもの:
少なくとも2個の-OH基;
少なくとも2個の脱メチル化アミノ酸窒素;
少なくとも1個の-OH基および少なくとも1個の脱メチル化アミノ酸窒素;
少なくとも1個のジオール基および少なくとも1個の-OH基;
少なくとも1個のジオール基および少なくとも1個の脱メチル化アミノ酸窒素;
少なくとも1個の環状エーテルおよび少なくとも1個の-OH基;
少なくとも1個の環状エーテルおよび少なくとも1個の脱メチル化アミノ酸窒素;
少なくとも1個の-OH基およびリン酸、硫酸、グルクロニドまたはグリコシル化残基;ならびに
少なくとも1個のジオールおよびリン酸、硫酸、グルクロニドまたはグリコシル化残基
からなる群より選択される化学修飾を含む、請求項4に記載の単離された代謝体。
【請求項8】
in vitroでISA247の代謝体を調製する方法であって、以下のステップ:
(a) 哺乳動物細胞をホモジナイズしてホモジネートを形成させるステップ;
(b) 該ホモジネートを遠心分離して、少なくとも1種の薬物代謝酵素を含むミクロソームペレットを形成させるステップ;および
(c) ISA247、該ミクロソームペレット、エネルギー源、および電子供与分子を含有する反応混合物を、ISA247の少なくとも1種の代謝体の生成をもたらす条件下で調製するステップ
を含む、上記方法。
【請求項9】
前記哺乳動物細胞が、霊長類、ラット、イヌおよびウサギからなる群より選択される哺乳動物の肝臓細胞である、請求項8に記載の方法。
【請求項10】
前記薬物代謝酵素がシトクロムP-450酵素である、請求項8に記載の方法。
【請求項11】
前記電子供与分子が、NADHおよびNADPHからなる群より選択される、請求項8に記載の方法。
【請求項12】
前記エネルギー源が、グルコース-6-リン酸およびイソクエン酸からなる群より選択される、請求項8に記載の方法。
【請求項13】
前記反応混合物が、グルコース-6-リン酸デヒドロゲナーゼおよびイソクエン酸デヒドロゲナーゼからなる群より選択される酵素をさらに含有する、請求項12に記載の方法。
【請求項14】
高速液体クロマトグラフィーを用いて前記ISA247代謝体を単離するステップをさらに含む、請求項8に記載の方法。
【請求項15】
ISA247の水酸化代謝体を生成する方法であって、以下のステップ:
(a) ISA247の1-アミノ酸のβ-アルコールを保護して保護されたISA247化合物を形成させるステップ;
(b) 該保護されたISA247化合物をハロゲン化剤を用いて4、6、または9-アミノ酸残基のうち少なくとも1つの側鎖のγ炭素でハロゲン化し、それによりハロゲン化生成物を形成させるステップ;
(c) ステップ(b)のハロゲン化生成物をアセテート試薬の存在下で加熱してアセテート部分を有するアセテート含有生成物を形成させるステップ;および
(d) トランスエステル化を行って、ステップ(c)のアセテート含有生成物のアセテート部分をアルコール部分に交換するステップ
を含み、それによりISA247の水酸化代謝体を形成させる、上記方法。
【請求項16】
前記ハロゲン化剤がN-ブロモスクシンイミド(NBS)であり、かつ前記アセテート試薬がテトラブチルアンモニウムアセテートである、請求項15に記載の方法。
【請求項17】
請求項15に記載の方法により生成されるISA247の単離された水酸化代謝体。
【請求項18】
IM9、IM4、IM6、IM46、IM69およびIM49からなる群より選択される水酸化代謝体である、請求項17に記載の単離された水酸化代謝体。
【請求項19】
in vitroでISA247のエポキシド代謝体を生成する方法であって、単離されたISA247の1-アミノ酸残基の側鎖のアルケン部分を酸化剤を用いて酸化し、それによりISA247のエポキシド代謝体を形成させるステップを含む、上記方法。
【請求項20】
前記酸化ステップがPrilezhaev反応である、請求項19に記載の方法。
【請求項21】
前記酸化剤が、m-クロロ過安息香酸(MCPBA)、過酢酸、トリフルオロ過酢酸、過安息香酸、3,5-ジニトロ過安息香酸、過酸化水素、過酸化アルキル、および酸素からなる群より選択される、請求項19に記載の方法。
【請求項22】
請求項19に記載の方法により調製されるISA247の単離されたエポキシド代謝体。
【請求項23】
IM1-e-1、IM1-e-2およびIM1-e-3からなる群より選択される、請求項22に記載の単離されたエポキシド代謝体。
【請求項24】
in vitroでISA247のジオール代謝体を生成する方法であって、以下のステップ:
(a) ISA247の1-アミノ酸の側鎖のアルケン部分を酸化剤で処理してISA247のエポキシド代謝体を形成させるステップ;および
(b) 該ISA247の単離されたエポキシド代謝体からISA247の単離されたジオール代謝体を形成させるステップ
を含む、上記方法。
【請求項25】
ステップ(a)がPrilezhaev反応である、請求項24に記載の方法。
【請求項26】
前記酸化剤が、m-クロロ過安息香酸(MCPBA)、過酢酸、トリフルオロ過酢酸、過安息香酸、3,5-ジニトロ過安息香酸、過酸化水素、過酸化アルキル、および酸素からなる群より選択される、請求項24に記載の方法。
【請求項27】
ステップ(b)が前記ISA247のエポキシド代謝体を加水分解することを含む、請求項24に記載の方法。
【請求項28】
ステップ(b)での前記加水分解が、酸または塩基により触媒される、請求項27に記載の方法。
【請求項29】
ステップ(b)が、以下:
過塩素酸もしくはNafion-Hにより触媒される加水分解;
ジメチルスルホキシド中でのアルカリ加水分解;または
ミクロソームエポキシドヒドロラーゼにより触媒される加水分解
を含む、請求項27に記載の方法。
【請求項30】
請求項24に記載の方法により調製される、ISA247の単離されたジオール代謝体。
【請求項31】
IM1-d-1、IM1-d-2、IM1-d-3およびIM1-d-4からなる群より選択される、請求項30に記載の単離されたジオール代謝体。
【請求項32】
ISA247のジオール代謝体を生成する方法であって、単離されたISA247を、四酸化オスミウム、アルカリ性過マンガン酸カリウム、過酸化水素、モノ過コハク酸(monopersuccinic acid)およびt-ブチルヒドロペルオキシドからなる群より選択される試薬と反応させることにより、ISA247のジオール代謝体を形成させるステップを含む、上記方法。
【請求項33】
ISA247を、触媒作用を有する量の四酸化オスミウムと反応させる、請求項32に記載の方法。
【請求項34】
ISA247を、過酸化水素/ギ酸およびモノ過コハク酸(monopersuccinic acid)からなる群より選択される試薬と反応させる、請求項32に記載の方法。
【請求項35】
ISA247のジオール代謝体を生成する方法であって、以下のステップ:
(a) ISA247を、ヨウ素/安息香酸銀および酢酸銀からなる群より選択される試薬で処理し、ISA247のジエステルを形成させるステップ;および
(b) 該ISA247のジエステルを加水分解するステップ
を含み、それによりISA247のジオール代謝体を形成させる、上記方法。
【請求項36】
請求項35に記載の方法により調製される、ISA247の単離されたジオール代謝体。
【請求項37】
IM1-d-1およびIM1-d-2からなる群より選択される、請求項36に記載の単離されたジオール代謝体。
【請求項38】
ISA247のジオール代謝体を生成する方法であって、以下のステップ:
(a) ISA247を、四酢酸鉛および酢酸タリウムからなる群より選択される試薬と反応させ、ISA247のジオールビスアセテートを形成させるステップ;および
(b) 該ISA247のジオールビスアセテートを加水分解するステップ
を含み、それによりISA247のジオール代謝体を形成させる、上記方法。
【請求項39】
請求項38に記載の方法により調製される、ISA247の単離されたジオール代謝体。
【請求項40】
IM1-d-1およびIM1-d-2からなる群より選択される、請求項39に記載の単離されたジオール代謝体。
【請求項41】
製薬上許容される担体と、請求項1に記載の単離された化合物とを含む、医薬組成物。
【請求項42】
製薬上許容される担体と、請求項2に記載の単離された代謝体とを含む、医薬組成物。
【請求項1】
以下の式:
【化1】

[式中、
各R2は独立に-Hまたは-CH3であり;
各R10は独立に-H、-OH、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORaまたは-NRcC(O)N(RaRb)であり;
R5、R6、R7、R8およびR9は独立に、-H、-OH、-F、-Cl、-Br、-I、-CN、-NO2、-ORa、-C(O)Ra、-OC(O)Ra、-C(O)ORa、-S(O)Ra、-SO2Ra、-SO3Ra、-OSO2Ra、-OSO3Ra、-PO2RaRb、-OPO2RaRb、-PO3RaRb、-OPO3RaRb、-N(RaRb)、-C(O)N(RaRb)、-C(O)NRaNRbSO2Rc、-C(O)NRaSO2Rc、-C(O)NRaCN、-SO2N(RaRb)、-SO2N(RaRb)、-NRcC(O)Ra、-NRcC(O)ORaまたは-NRcC(O)N(RaRb)であるか;またはR6とR7が一緒になって-O-であるか;またはR5とR6が一緒になって、もしくはR7とR8が一緒になって独立に-O-であるか;またはR8とR9が一緒になって-O-であるか;またはR5が、それが結合する炭素と一緒になって、-C(=O)Ra、-CO2Ra、-CH2ORa、-CH2OC(O)Ra、-CH(ORa)2、-C(O)N(RaRb)、-C(=NRb)Ra、-C(=NORb)Ra、もしくは-C(=NNRb)Raであり;ただし、R5とR6、R6とR7、またはR7とR8のうち1ペアが炭素間結合していて、かつ残りのすべてが-Hであることはなく;かつ
Ra、RbおよびRcはそれぞれ独立に-Hであるかまたは脂肪族、脂環族、ベンジルもしくはアリールで置換されていてもよく、あるいは-N(RaRb)が一緒になって任意的な置換複素環基であるかまたは-CH(ORa)2が一緒になって環状アセタール基である]
により表される単離された化合物、ならびに製薬上許容されるその塩および溶媒和物。
【請求項2】
以下の式:
【化2】

[式中、
各R2は独立に-Hまたは-CH3であり;
各R10は独立に-H、-OH、-F、-Cl、-Br、-I、-ORa、-OC(O)Ra、-OSO2Ra、-OSO3Ra、-OPO2RaRbまたは-OPO3RaRbであり;
R5、R6、R7、R8およびR9は独立に、-H、-OH、-F、-Cl、-Br、-I、-ORa、-OC(O)Ra、-OSO2Ra、-OSO3Ra、-OPO2RaRbもしくは-OPO3RaRbであるか;またはR6とR7が一緒になって-O-であるか;またはR5とR6が一緒になって、もしくはR7とR8が一緒になって独立に-O-であるか;またはR8とR9が一緒になって-O-であるか;またはR5が、それに結合する炭素と一緒になって-C(=O)Ra、-CO2Ra、-CH2ORa、-CH2OC(O)Ra、-CH(ORa)2、-C(O)N(RaRb)、-C(=NRb)Ra、-C(=NORb)Raまたは-C(=NNRb)Raであり;ただし、R5とR6、R6とR7、またはR7とR8のうち1ペアが炭素間結合しており、かつ残りのすべてが-Hであることはなく;かつ
Ra、RbおよびRcはそれぞれ独立に-Hであるかまたは脂肪族、脂環族、ベンジルもしくはアリールで置換されていてもよく、あるいは-N(RaRb)が一緒になって任意的な置換複素環基であるかまたは-CH(ORa)2が一緒になって環状アセタール基である]
により表される、請求項1に記載の単離された化合物。
【請求項3】
以下の式:
【化3】

[式中、
R1は以下のもの:
【化4】


からなる群より選択され、
各R2は独立に、-CH3および-Hからなる群より選択され;
各R3は独立に、-CH2CH(CH3)2および-CH2C(CH3)2OHからなる群より選択され;かつ
各R4は独立に、-CH(CH3)2および-C(CH3)2OHからなる群より選択される]
により表される、請求項1に記載の単離された化合物。
【請求項4】
シクロ{{(E)-および(Z)-(2S,3R,4R)-3-ヒドロキシ-4-メチル-2- (メチルアミノ)-6,8-ノナジエノイル}-L-2-アミノブチリル-N-メチル-グリシル-N-メチル-L-ロイシル-L-バリル-N-メチル-L-ロイシル-L-アラニル-D-アラニル-N-メチル-L-ロイシル-N-メチル-L-ロイシル-N-メチル-L-バリル}(ISA247)の単離された代謝体ならびにその製薬上許容される塩および溶媒和物であって、ISA247と比較して、該単離された代謝体が、水酸化、N-脱メチル化、ジオール形成、エポキシド形成、分子内環化、リン酸化、硫酸化、グルクロニド形成およびグリコシル化からなる群より選択される少なくとも1個の化学修飾を含む、上記代謝体ならびにその塩および溶媒和物。
【請求項5】
以下のもの:
アミノ酸1の側鎖でのエポキシド;
アミノ酸1の側鎖でのジオール;
アミノ酸1の側鎖中の環状エーテル;
アミノ酸1、3、4、6、9、10、または11での脱メチル化アミノ窒素;
アミノ酸4、6、9、または10の側鎖のγ炭素での-OH;および
アミノ酸5または11の側鎖のβ炭素での-OH
からなる群より選択される少なくとも1個の化学修飾を含む、請求項4に記載の単離された代謝体。
【請求項6】
IM1-e-1、IM1-e-2、IM1-e-3、IM1-d-1、IM1-d-2、IM1-d-3、IM1-d-4、IM1-c-1およびIM1-c-2からなる群より選択される、請求項4に記載の単離された代謝体。
【請求項7】
ISA247と比較して、以下のもの:
少なくとも2個の-OH基;
少なくとも2個の脱メチル化アミノ酸窒素;
少なくとも1個の-OH基および少なくとも1個の脱メチル化アミノ酸窒素;
少なくとも1個のジオール基および少なくとも1個の-OH基;
少なくとも1個のジオール基および少なくとも1個の脱メチル化アミノ酸窒素;
少なくとも1個の環状エーテルおよび少なくとも1個の-OH基;
少なくとも1個の環状エーテルおよび少なくとも1個の脱メチル化アミノ酸窒素;
少なくとも1個の-OH基およびリン酸、硫酸、グルクロニドまたはグリコシル化残基;ならびに
少なくとも1個のジオールおよびリン酸、硫酸、グルクロニドまたはグリコシル化残基
からなる群より選択される化学修飾を含む、請求項4に記載の単離された代謝体。
【請求項8】
in vitroでISA247の代謝体を調製する方法であって、以下のステップ:
(a) 哺乳動物細胞をホモジナイズしてホモジネートを形成させるステップ;
(b) 該ホモジネートを遠心分離して、少なくとも1種の薬物代謝酵素を含むミクロソームペレットを形成させるステップ;および
(c) ISA247、該ミクロソームペレット、エネルギー源、および電子供与分子を含有する反応混合物を、ISA247の少なくとも1種の代謝体の生成をもたらす条件下で調製するステップ
を含む、上記方法。
【請求項9】
前記哺乳動物細胞が、霊長類、ラット、イヌおよびウサギからなる群より選択される哺乳動物の肝臓細胞である、請求項8に記載の方法。
【請求項10】
前記薬物代謝酵素がシトクロムP-450酵素である、請求項8に記載の方法。
【請求項11】
前記電子供与分子が、NADHおよびNADPHからなる群より選択される、請求項8に記載の方法。
【請求項12】
前記エネルギー源が、グルコース-6-リン酸およびイソクエン酸からなる群より選択される、請求項8に記載の方法。
【請求項13】
前記反応混合物が、グルコース-6-リン酸デヒドロゲナーゼおよびイソクエン酸デヒドロゲナーゼからなる群より選択される酵素をさらに含有する、請求項12に記載の方法。
【請求項14】
高速液体クロマトグラフィーを用いて前記ISA247代謝体を単離するステップをさらに含む、請求項8に記載の方法。
【請求項15】
ISA247の水酸化代謝体を生成する方法であって、以下のステップ:
(a) ISA247の1-アミノ酸のβ-アルコールを保護して保護されたISA247化合物を形成させるステップ;
(b) 該保護されたISA247化合物をハロゲン化剤を用いて4、6、または9-アミノ酸残基のうち少なくとも1つの側鎖のγ炭素でハロゲン化し、それによりハロゲン化生成物を形成させるステップ;
(c) ステップ(b)のハロゲン化生成物をアセテート試薬の存在下で加熱してアセテート部分を有するアセテート含有生成物を形成させるステップ;および
(d) トランスエステル化を行って、ステップ(c)のアセテート含有生成物のアセテート部分をアルコール部分に交換するステップ
を含み、それによりISA247の水酸化代謝体を形成させる、上記方法。
【請求項16】
前記ハロゲン化剤がN-ブロモスクシンイミド(NBS)であり、かつ前記アセテート試薬がテトラブチルアンモニウムアセテートである、請求項15に記載の方法。
【請求項17】
請求項15に記載の方法により生成されるISA247の単離された水酸化代謝体。
【請求項18】
IM9、IM4、IM6、IM46、IM69およびIM49からなる群より選択される水酸化代謝体である、請求項17に記載の単離された水酸化代謝体。
【請求項19】
in vitroでISA247のエポキシド代謝体を生成する方法であって、単離されたISA247の1-アミノ酸残基の側鎖のアルケン部分を酸化剤を用いて酸化し、それによりISA247のエポキシド代謝体を形成させるステップを含む、上記方法。
【請求項20】
前記酸化ステップがPrilezhaev反応である、請求項19に記載の方法。
【請求項21】
前記酸化剤が、m-クロロ過安息香酸(MCPBA)、過酢酸、トリフルオロ過酢酸、過安息香酸、3,5-ジニトロ過安息香酸、過酸化水素、過酸化アルキル、および酸素からなる群より選択される、請求項19に記載の方法。
【請求項22】
請求項19に記載の方法により調製されるISA247の単離されたエポキシド代謝体。
【請求項23】
IM1-e-1、IM1-e-2およびIM1-e-3からなる群より選択される、請求項22に記載の単離されたエポキシド代謝体。
【請求項24】
in vitroでISA247のジオール代謝体を生成する方法であって、以下のステップ:
(a) ISA247の1-アミノ酸の側鎖のアルケン部分を酸化剤で処理してISA247のエポキシド代謝体を形成させるステップ;および
(b) 該ISA247の単離されたエポキシド代謝体からISA247の単離されたジオール代謝体を形成させるステップ
を含む、上記方法。
【請求項25】
ステップ(a)がPrilezhaev反応である、請求項24に記載の方法。
【請求項26】
前記酸化剤が、m-クロロ過安息香酸(MCPBA)、過酢酸、トリフルオロ過酢酸、過安息香酸、3,5-ジニトロ過安息香酸、過酸化水素、過酸化アルキル、および酸素からなる群より選択される、請求項24に記載の方法。
【請求項27】
ステップ(b)が前記ISA247のエポキシド代謝体を加水分解することを含む、請求項24に記載の方法。
【請求項28】
ステップ(b)での前記加水分解が、酸または塩基により触媒される、請求項27に記載の方法。
【請求項29】
ステップ(b)が、以下:
過塩素酸もしくはNafion-Hにより触媒される加水分解;
ジメチルスルホキシド中でのアルカリ加水分解;または
ミクロソームエポキシドヒドロラーゼにより触媒される加水分解
を含む、請求項27に記載の方法。
【請求項30】
請求項24に記載の方法により調製される、ISA247の単離されたジオール代謝体。
【請求項31】
IM1-d-1、IM1-d-2、IM1-d-3およびIM1-d-4からなる群より選択される、請求項30に記載の単離されたジオール代謝体。
【請求項32】
ISA247のジオール代謝体を生成する方法であって、単離されたISA247を、四酸化オスミウム、アルカリ性過マンガン酸カリウム、過酸化水素、モノ過コハク酸(monopersuccinic acid)およびt-ブチルヒドロペルオキシドからなる群より選択される試薬と反応させることにより、ISA247のジオール代謝体を形成させるステップを含む、上記方法。
【請求項33】
ISA247を、触媒作用を有する量の四酸化オスミウムと反応させる、請求項32に記載の方法。
【請求項34】
ISA247を、過酸化水素/ギ酸およびモノ過コハク酸(monopersuccinic acid)からなる群より選択される試薬と反応させる、請求項32に記載の方法。
【請求項35】
ISA247のジオール代謝体を生成する方法であって、以下のステップ:
(a) ISA247を、ヨウ素/安息香酸銀および酢酸銀からなる群より選択される試薬で処理し、ISA247のジエステルを形成させるステップ;および
(b) 該ISA247のジエステルを加水分解するステップ
を含み、それによりISA247のジオール代謝体を形成させる、上記方法。
【請求項36】
請求項35に記載の方法により調製される、ISA247の単離されたジオール代謝体。
【請求項37】
IM1-d-1およびIM1-d-2からなる群より選択される、請求項36に記載の単離されたジオール代謝体。
【請求項38】
ISA247のジオール代謝体を生成する方法であって、以下のステップ:
(a) ISA247を、四酢酸鉛および酢酸タリウムからなる群より選択される試薬と反応させ、ISA247のジオールビスアセテートを形成させるステップ;および
(b) 該ISA247のジオールビスアセテートを加水分解するステップ
を含み、それによりISA247のジオール代謝体を形成させる、上記方法。
【請求項39】
請求項38に記載の方法により調製される、ISA247の単離されたジオール代謝体。
【請求項40】
IM1-d-1およびIM1-d-2からなる群より選択される、請求項39に記載の単離されたジオール代謝体。
【請求項41】
製薬上許容される担体と、請求項1に記載の単離された化合物とを含む、医薬組成物。
【請求項42】
製薬上許容される担体と、請求項2に記載の単離された代謝体とを含む、医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28A】


【図28B】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42A】


【図42B】


【図43】


【図44A】


【図44B】


【図45】


【図46】


【図47】


【図48】


【図49】


【図50】


【図51】


【図52】


【図53】


【図54】


【図55】


【図56】


【図57】


【図58A】


【図58B】


【図59】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28A】


【図28B】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42A】


【図42B】


【図43】


【図44A】


【図44B】


【図45】


【図46】


【図47】


【図48】


【図49】


【図50】


【図51】


【図52】


【図53】


【図54】


【図55】


【図56】


【図57】


【図58A】


【図58B】


【図59】


【公表番号】特表2008−524122(P2008−524122A)
【公表日】平成20年7月10日(2008.7.10)
【国際特許分類】
【出願番号】特願2007−545805(P2007−545805)
【出願日】平成17年12月19日(2005.12.19)
【国際出願番号】PCT/CA2005/001926
【国際公開番号】WO2006/063470
【国際公開日】平成18年6月22日(2006.6.22)
【出願人】(507201197)イソテクニカ インコーポレーテッド (1)
【Fターム(参考)】
【公表日】平成20年7月10日(2008.7.10)
【国際特許分類】
【出願日】平成17年12月19日(2005.12.19)
【国際出願番号】PCT/CA2005/001926
【国際公開番号】WO2006/063470
【国際公開日】平成18年6月22日(2006.6.22)
【出願人】(507201197)イソテクニカ インコーポレーテッド (1)
【Fターム(参考)】
[ Back to top ]

