シクロプロピルアミド誘導体からなる固体形態
この開示は、4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミドの少なくとも1つの固体形態に関する。この開示はまた、本明細書中に述べられている少なくとも1つの固体形態を含んでなる少なくとも1つの医薬組成物、その固体形態を使用する方法、及びそれから成っている医薬組成物、及びその固体形態を製造する方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
この開示は、少なくとも1つの4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミドの固体形態に関する。この開示はまた、本明細書中で述べられている少なくとも1つの固体形態を含む少なくとも1つの医薬組成物、それから成る固体形態及び医薬組成物の使用方法及び固体形態を製造する方法に関する。
【背景技術】
【0002】
薬物製剤を製剤化する際には、活性な薬物物質が、取り扱い、処理が好都合であることが可能な形であることが望ましい。このことは商業上実行可能な製造方法を得るという視点のみならず、その後、活性な薬物物質を含む医薬組成物を製造する視点からも重要である。更に、薬物組成物を製造する際は、信頼でき、再現性があり、かつ一定の薬物血漿濃度プロフィールが患者に投与した後に提供されることが望ましい。
【0003】
活性成分の化学的安定性、固体状態安定性、及びシェルフライフもまた、望ましいファクターである。薬物物質、及びそれを含有する組成物は、好ましくは、活性成分の物理化学的特性(例えば、その化学組成物、濃度、吸湿性及び溶解性)において大幅な変化を示すことなく、相当な期間にわたって有効に貯蔵されることが可能であるべきである。更に、可能な限り化学的に純粋である形態の薬物物質が提供されることが望ましい。
【0004】
また、ある場合には、例えば、取り扱いが容易であること、適切な医薬製剤の調製が容易であること、及びより信頼性のある溶解性プロフィールなどの具体的な望ましい特性を利用可能にしうる、薬物の有利な固体形態(複数を含む)が提供されることが望ましい。
【0005】
例えば、安定性、溶解性、処理可能性、及び生物学的利用性などの1つ又は複数の有利な物理特性を有する、4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミドの固体形態(複数を含む)の必要性が存在している。
【図面の簡単な説明】
【0006】
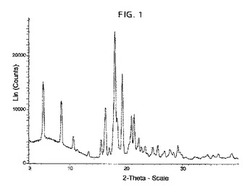
【図1】化合物IのフォームIの粉末X線回折(XRPD)パターンを示す。
【図2】化合物IのフォームIの示差走査熱量計(DSC)サーモグラムを示す。
【図3】化合物IのフォームIの熱重量分析(TGA)サーモグラムを示す。
【図4】化合物IのフォームIの動的水蒸気収着(DVS)等温線プロットを示す。
【図5】化合物IのフォームIの13C交差分極マジック角スピニング(CPMAS)固体核磁気共鳴(SS−NMR)スペクトルを示す。
【図6】化合物IのフォームIのフーリエ変換赤外(FT−IR)スペクトル(上側)及びFTラマンスペクトル(下側)を示す。
【発明の概要】
【課題を解決するための手段】
【0007】
本明細書中の実施形態は、下記:
【化1】

に示される、化学名:4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミド及び化学構造(I)によって説明される、“化合物I(Compound I)”の固体形態に関する。
【0008】
本明細書中に述べられている更なる実施形態は、本明細書に述べられている少なくとも1つの固体形態を含む少なくとも1つの医薬組成物、本明細書中に述べられている固体形態及び医薬組成物の使用方法、及び固体形態を製造する方法に関する。
【0009】
1つの実施形態は、実質的に結晶性である化合物Iの固体形態を提供する。用語“実質的に結晶性の(substantially crystalline)”は、重量ベースで20%より高い、30%より高い、40%より高い、50%より高い、60%より高い、70%より高い、80%より高い、90%より高い、95%より高い、97%より高い、98%より高い、又は99%より高い結晶化度であることを含んでいる。
【0010】
別の実施形態は、部分的に結晶性である化合物Iの固体形態を提供する。用語“部分的結晶性(partially crystalline)”は、重量で20%より低い、10%より低い、又は5%より低い結晶化度であることを含んでいる。結晶化度の程度(%)は、種々の手法[例えば、XRPD、SS−NMRスペクトロスコピー、FT−IRスペクトロスコピー、FT−ラマンスペクトロスコピー、DSC熱分析、TGA分析、微量熱量測定(microcalorimetry)、及びDVS分析を含むがこれらに限定されない]を用いて、当業者によって決定することができる。
【0011】
更に別の実施形態では、実質的に純粋である化合物Iの固体形態が提供される。特定の実施形態では、用語“実質的に純粋である(substantially pure)”は、化合物I以外の化学化合物に対して重量ベースで、50%を超えて化学的に純粋である、60%を超えて化学的に純粋である、70%を超えて化学的に純粋である、80%を超えて化学的に純粋である、90%を超えて化学的に純粋である、95%を超えて化学的に純粋である、98%を超えて化学的に純粋である、又は99%を超えて化学的に純粋である化合物Iの固体形態の試料を含んでいる。化学的純度の程度(%)は、種々の手法[例えば、NMRスペクトロスコピー、高性能液体クロマトグラフィー(HPLC)、質量分析法(MS)、及び元素分析(例えば、燃焼分析)を含むがこれらに限定されない]を用いて、当業者によって決定されうる。特定の実施形態では、用語“実質的に純粋である(substantially pure)”は、選択された固体形態以外の固体形態(例えば、他の結晶形態又は非晶形態)に対して重量ベースで、50%を超えて物理的に純粋である、60%を超えて物理的に純粋である、70%を超えて物理的に純粋である、80%を超えて物理的に純粋である、90%を超えて物理的に純粋である、95%を超えて物理的に純粋である、98%を超えて物理的に純粋である、又は99%を超えて物理的に純粋である固体形態の選択された固体形態の試料を含んでいる。物理的純度の程度(%)は、種々の手法[例えば、XRPD、SS−NMRスペクトロスコピー、FT−IRスペクトロスコピー、FT−ラマンスペクトロスコピー、DSC熱分析、TGA分析、微量熱量測定、及びDVS分析を含むがこれらに限定されない]を用いて、当業者によって決定されうる。
【0012】
更に別の実施形態は、化合物IのフォームIである固体形態を提供する。代表的な形態I物質のXRPDパターン、DSCサーモグラム、TGAサーモグラム、DVS等温線プロット、SS−NMRスペクトル、FT−IRスペクトル、及びFT−ラマンスペクトルが、図1〜6に示されている。特定の実施形態では、化合物Iの形態Iは、実質的に結晶性である。他の特定の実施形態では、化合物Iの形態Iは、実質的に純粋である。更に他の特定の実施形態では、化合物Iの形態Iは、実質的に結晶性であり、かつ実質的に純粋である。
【0013】
その上更に別の実施形態は、表1に実質的に明確にされているピークを含んでなるXRPDパターンを有する化合物Iの形態Iに関する。
【0014】
測定条件(使用する機器、試料調製又は機械など)によって1つ若しくは複数の測定エラーがあるXRPDパターンが得られうることは当技術分野で知られている。特に、XRPDパターンの強度は、測定条件及び試料調製によって変動しうるということが一般に知られている。例えば、XRPDの技術分野の当業者は、ピークの相対強度は、試験されている試料の配向方向、及び使用される機器のタイプ及び設定によって変化しうることを理解している。当業者はまた、反射の位置が、試料が回折計の中で置かれている正確な高さによって、そして回折計のゼロキャリブレーションによって影響されうることを理解している。試料の表面の平面度もまた少しの影響を与えうる。それ故、当技術分野の当業者であれば、本明細書中で供されている回折パターンデータは、絶対的なものであると解釈されるべきではなく、そして本明細書中に開示されているものと実質的に同一であるXRPDパターンを提供している結晶形態であればいかなるものでもこの開示の範囲内に入るものと理解するであろう。更に当技術分野の当業者は、XRPDの2θ値は、合理的な範囲[例えば、±0.1°2θ〜±0.2°2θの範囲内]によって変化しうることを理解する。XRPDの原理については、例えば、Giacovazzo, C. et al. (1995), Fundamentals
of Crystallography, Oxford University Press; Jenkins, R. and Snyder, R. L. (1996), Introduction to X-Ray Powder Diffractometry, John Wiley & Sons, New York; 及び Klug, H. P. & Alexander, L. E. (1974), X-ray Diffraction Procedures, John Wiley and Sons, New Yorkなどの文献中に記載されている。
【0015】
更なる実施形態は、図1に示されているXRPDパターンを本質的に有している化合物IのフォームIに関する。
【0016】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0017】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の1個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0018】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の2個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0019】
別の実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の3個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0020】
更に別の実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の4個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0021】
また更に別の実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の5個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0022】
なおまた更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の6個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0023】
なおまた更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の7個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0024】
更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の8個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0025】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の9個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0026】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の10個の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0027】
別の実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θから選択される少なくとも1個のピークを含むXRPDパターンを有する。
【0028】
更なる実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θから選択される少なくとも2個のピークを含むXRPDパターンを有する。
【0029】
一実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約18.0°2θにおけるピークを含むXRPDパターンを有する。
【0030】
更なる実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約16.3及び約19.3°2θにおけるピークを含むXRPDパターンを有する。
【0031】
別の実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約18.0及び約19.3°2θにおけるピークを含むXRPDパターンを有する。
【0032】
更に別の実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5及び約18.0°2θにおけるピークを含むXRPDパターンを有する。
【0033】
また更に別の実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、約18.0及び約19.3°2θにおけるピークを含むXRPDパターンを有する。
【0034】
また更なる実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、約16.3、約18.0及び約19.3°2θにおけるピークを含むXRPDパターンを有する。
【0035】
なおまた更なる実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、約16.3、約18.0、19.3、約20.9、及び約21.4°2θにおけるピークを含むXRPDパターンを有する。
【0036】
別の実施形態は、図2に示されているDSCサーモグラムを本質的に有している化合物IのフォームIに関する。
【0037】
DSCの立ち上がり及びピーク温度、並びにエネルギー値は、例えば、試料の純度及び試料サイズによって変化しえ、そして機器パラメーター、特に温度スキャン速度(temperature scan rate)によって変化しうることは周知である。それ故、提供されているDSCデータは絶対値として理解されるべきではない。当技術分野の当業者であれば、示差走査熱量計の機器パラメーターを、本明細書で供されるデータと同程度のデータが標準方法、例えば、Hoehne, G. W. H. et al (1996), Differential Scanning Calorimetry, Springer, Berlin中に記載されている方法によって収集できるように設定することができる。
【0038】
別の実施形態では、化合物IのフォームIは、約133.5℃の立ち上がり温度を持つ吸熱事象を含んでなるDSCサーモグラムを有している。
【0039】
更に別の実施形態では、化合物IのフォームIは、約135.3℃のピーク温度を持つ吸熱事象を含んでなるDSCサーモグラムを有している。
【0040】
また更に別の実施形態では、化合物IのフォームIは、約20℃と約130℃の間で顕
著な吸熱事象を示さないDSCサーモグラムを有している。
【0041】
更なる実施形態は、図3に示されているTGAサーモグラムを本質的に有している化合物IのフォームIに関する。
【0042】
TGAトレースは、例えば、試料サイズによって、そして機器パラメーター、殊に、温度スキャン速度によって変化しうることは周知である。それ故、提供されているTGAデータは、絶対的な値であると受け取るべきではない。
【0043】
一実施態様では、化合物IのフォームIは、約20℃〜約100℃に加熱したときに、試料の総重量の約1%未満(例えば、約0.75%未満、約0.5%未満、約0.25%未満、又は約0%)の重量減少を含んでなるTGAサーモグラムを有する。
【0044】
更なる実施形態では、化合物IのフォームIは、約100℃〜約160℃に加熱したときに、試料の総重量の約1%未満(例えば、約0.75%未満、約0.5%未満、約0.25%未満、又は約0%)の重量減少を含んでなるTGAサーモグラムを有する。
【0045】
別の実施形態では、化合物IのフォームIは、実質量の溶媒(例えば、水、酢酸エチル(EtOAc)、及び/又はアセトニトリル(ACN))を含有していない。特定の実施形態では、化合物IのフォームIは、重量ベースで、約3%未満、約2%未満、約1%未満、約0.75%未満、約0.5%未満、約0.25%未満、又は約0.1%未満の溶媒(例えば、水、EtOAc、及び/又はACN)を含む。
【0046】
更に別の実施形態では、化合物IのフォームIは溶媒和化していない。
【0047】
更に別の実施形態では、化合物IのフォームIは無水物である。
【0048】
また更なる実施形態は、図4に示されているDVS等温線プロットを本質的に有している化合物IのフォームIに関する。
【0049】
DVS等温線プロットは、例えば、試料の純度及び試料サイズによって、そして機器パラメーター、殊に実験の間に使用される平衡基準設定によって変化しうることは周知である。それ故、提供されているDVSデータは、絶対的な値であると受け取るべきではないということは当技術分野の当業者であれば理解できる。
【0050】
その上また更なる実施形態では、化合物IのフォームIは、約周囲温度で約0%相対湿度(RH)〜約90%RHに上昇させたとき、試料の総質量の約3%未満(例えば、約2.5%未満、約2%未満、約1.5%未満、又は1%未満)の質量増加を含んでなるDVS等温線プロットを有する。
【0051】
その上また更なる実施形態では、化合物IのフォームIは、約周囲温度で約0%RH〜約90%RHに上昇させたとき、試料の総質量の約1.2%と約1.6%の間(例えば、約1.4%)の質量増加を含んでなるDVS等温線プロットを有する。
【0052】
更にその上また更なる実施形態では、化合物IのフォームIは、約周囲温度で約0%RH〜約70%RHに上昇させたとき、試料の総質量の約2%未満(例えば、約1.5%未満、約1%未満、又は約0.5%未満)の質量増加を含んでなるDVS等温線プロットを有する。
【0053】
また更なる実施形態は、図5に示されているCP−MAS SS−NMRスペクトルを本質的に有している化合物IのフォームIに関する。
【0054】
更なる実施形態では、化合物IのフォームIは、次のppm値:約171.06;約144.17;約131.76;約127.53;約60.47;約54.52;約52.92;約51.56;約50.78;約45.95;約45.04;約40.79;約28.50;約24.58;約23.71;約18.13;約15.75;約15.29;約14.37;約13.67;及び約13.11ppmのうちで任意の1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個又はそれより多くの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0055】
また更なる実施形態では、化合物IのフォームIは、約171.1ppm、約144.2ppm、及び約131.8ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0056】
またなお更なる実施形態では、化合物IのフォームIは、約60.5ppm及び約40.8ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0057】
なお更なる実施形態では、化合物IのフォームIは、約28.5ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0058】
またなお更なる実施形態では、化合物IのフォームIは、約18.1ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0059】
更に別の実施形態では、化合物IのフォームIは、約14.4ppm、約13.7ppm、及び約13.1ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0060】
別の実施形態は、図6(上側のスペクトル)に示されているFT−IRスペクトルを本質的に有している化合物IのフォームIに関する。
【0061】
別の実施形態では、化合物IのフォームIは、約3378.97cm-1でピークを示すFT−IRスペクトルを有する。
【0062】
更に別の実施形態では、化合物IのフォームIは、約3171.70cm-1でピークを示すFT−IRスペクトルを有する。
【0063】
また更に別の実施形態では、化合物IのフォームIは、約2939.02cm-1でピークを示すFT−IRスペクトルを有する。
【0064】
またなお更なる実施形態では、化合物IのフォームIは、約2808.65cm-1でピークを示すFT−IRスペクトルを有する。
【0065】
更に別の実施形態では、化合物IのフォームIは、約1646.80cm-1でピークを示すFT−IRスペクトルを有する。
【0066】
更に別の実施形態では、化合物IのフォームIは、約1607.63cm-1でピークを示すFT−IRスペクトルを有する。
【0067】
なお更なる実施形態では、化合物IのフォームIは、約1567.34cm-1でピークを示すFT−IRスペクトルを有する。
【0068】
なお更なる実施形態では、化合物IのフォームIは、約1414.45cm-1でピークを示すFT−IRスペクトルを有する。
【0069】
なお更なる実施形態では、化合物IのフォームIは、約1234.13cm-1でピークを示すFT−IRスペクトルを有する。
【0070】
またなお更なる実施形態では、化合物IのフォームIは、約1055.18cm-1でピークを示すFT−IRスペクトルを有する。
【0071】
一実施形態では、化合物IのフォームIは、約798.42cm-1でピークを示すFT−IRスペクトルを有する。
【0072】
別の実施態様は、図6(下側のスペクトル)に示されているFT−ラマンスペクトルを本質的に有している化合物IのフォームIに関する。
【0073】
更なる実施形態では、化合物IのフォームIは、約3070.22cm-1でピークを示すFT−ラマンスペクトルを有する。
【0074】
また更なる実施形態では、化合物IのフォームIは、約3006.28cm-1でピークを示すFT−ラマンスペクトルを有する。
【0075】
またなお更なる実施形態では、化合物IのフォームIは、約2940.36cm-1でピークを示すFT−ラマンスペクトルを有する。
【0076】
またなお更なる実施形態では、化合物IのフォームIは、約2867.12cm-1でピークを示すFT−ラマンスペクトルを有する。
【0077】
更に別の実施形態では、化合物IのフォームIは、約2808.64cm-1でピークを示すFT−ラマンスペクトルを有する。
【0078】
更に別の実施形態では、化合物IのフォームIは、約2767.97cm-1でピークを示すFT−ラマンスペクトルを有する。
【0079】
また更に別の実施形態では、化合物IのフォームIは、約1614.44cm-1でピークを示すFT−ラマンスペクトルを有する。
【0080】
また更なる実施形態では、化合物IのフォームIは、約1562.48cm-1でピークを示すFT−ラマンスペクトルを有する。
【0081】
また更なる実施形態では、化合物IのフォームIは、約1219.17cm-1でピークを示すFT−ラマンスペクトルを有する。
【0082】
またなお更なる実施形態では、化合物IのフォームIは、約1144.15cm-1でピークを示すFT−ラマンスペクトルを有する。
【0083】
またなお更なる実施形態では、化合物IのフォームIは、約867.54cm-1でピークを示すFT−ラマンスペクトルを有する。
【0084】
また更になお更なる実施形態では、化合物IのフォームIは、約834cm-1でピークを示すFT−ラマンスペクトルを有する。
【0085】
また更になお更なる実施形態では、化合物IのフォームIは、約803.77cm-1でピークを示すFT−ラマンスペクトルを有する。
【0086】
一実施形態では、本明細書中で提供される固体形態は1つ又は複数の有利な特性を有する。例えば、いくつかの実施形態では、式IのフォームIは、例えば、融点が高いこと、溶媒(例えば、水)含量が実質的にないこと、加熱しても重量減少がほとんどないか、又はないこと、及び/又は吸湿性が低いことなどの有利な特性を示す。いくつかの実施形態では、こうした特性は好都合にも、化合物Iの製造、貯蔵、製剤化、及び/又は送達を容易にする。
【0087】
本明細書中で提供されるある種の固体形態は、安定性に関して有利な特性を提供する。本明細書中で使用される、用語“安定性(stability)”とは、化学的安定性及び固体状態安定性を含んでいる。
【0088】
化学的安定性は、単離物質として、及び/又は製薬学的に許容される担体、希釈剤又は補助剤と混和して提供される固体製剤の一部分として(例えば、錠剤、カプセル剤などの経口投与剤形中)、通常の貯蔵条件のもとで、わずかな程度の化学的劣化又は分解で固体形態を貯蔵する能力を含む。
【0089】
固体状態安定性は、単離物質として、及び/又は製薬学的に許容される担体、希釈剤又は補助剤(例えば、錠剤、カプセル剤などの経口投与剤形中)と混和して提供される製剤の一部分として、通常の貯蔵条件のもとで、わずかな程度の固体状態変換(例えば、結晶化、再結晶、固体状態相転移、水和、脱水、溶媒和作用、及び/又は脱溶媒和)で固体形態を貯蔵する能力を含む。
【0090】
“通常の貯蔵条件(normal storage conditions)”の一例としては、長期間(例えば、6ヶ月より長いか、あるいは6ヶ月間)にわたり、−80℃と50℃の間の温度(例えば、0℃と40℃の間の温度、又は約15℃と約30℃の間の温度のような約室温)であること、0.1と2バールの間の圧力(例えば、大気圧)であること、5%と95%の間(例えば、10%〜60%RH)の相対湿度(“RHs”)であること、及び/又は460ルクスのUV/可視光に曝されることが含まれる。こうした条件のもとで、本明細書で提供される固体形態は、適切な場合に、化学的劣化/分解あるいは固体状態変換が15%未満、10%未満、又は5%未満であるということが判明しうる。当業者であれば、上記に言及した温度、圧力、及びRHの上限及び下限は、通常の貯蔵条件の両極端を表しており、そしてこうした極端のある種の組み合わせについては、通常の貯蔵(例えば、50℃の温度、及び0.1バールの圧力)時には体験する可能性がないということを理解するであろう。
【0091】
固体形態の調製方法
更なる実施形態は、本明細書中で提供されている固体形態を調製する方法を提供する。そのもとで固体形態が調製されうる別の条件は、本明細書中に提供されている情報を、当技術分野で知られている手法及び方法と組み合わせて使用して当業者によって決定することができる。実験温度及び時間は、単離すべき固体形態、溶液中の化合物の濃度、及び使用する溶媒系に左右される。結晶化は、標準的手法[例えば、固体形態の結晶を用いてシーディングするか、それともしない]によって開始及び/又は実施しうる。
【0092】
本明細書中のある実施形態は、化合物IのフォームIを調製する方法に関する。ある実施形態では、フォームIは、化合物Iを1つ又は複数の適切な溶媒中に溶解させ、そしてフォームIを単離することを含んでなる方法によって調製される。ある実施形態では、フォームIは、化合物Iを1つ又は複数の適切な溶媒中に懸濁させ、そしてフォームIを単離することを含んでなる方法によって調製される。ある実施形態では、この懸濁は周囲温度で行なわれる。ある実施形態では、この懸濁は約3日間行なわれる。ある実施形態では、単離された化合物IのフォームIは、空気乾燥される。ある実施形態では、本明細書中で提供される方法のための出発化合物I成分は、化合物Iの非晶質固体形態である。ある実施形態では、適切な溶媒は、EtOAc又はACN又はその混合物から選択される。
【0093】
ある実施形態では、化合物IのフォームIを調製する方法で使用する適切な溶媒は、極性非プロトン性溶媒類(例えば、DMSO、DMF);アセタート類(例えば、C1-6−アルキルアセタート、酢酸エチル、酢酸イソプロピル);アルコール類(例えば、低級アルキルアルコール、直鎖状又は分岐鎖状C1-6−アルキルアルコール、メタノール、エタノール、イソプロパノール、1−プロパノール);炭化水素類(例えば、脂肪族及び芳香族炭化水素、C6-12−脂肪族炭化水素、C6-10−芳香族炭化水素、n−ヘプタン);エーテル類(例えば、ジアルキルエーテル、ジ−C1-6−アルキルエーテル、ジエチルエーテル);ケトン類(例えば、ジアルキルケトン、ジ−C1-6−アルキルケトン、アセトン、メチルイソブチルケトン);ニトリル類(例えば、アセトニトリル);塩素化溶媒類(例えば、塩素化アルカン、塩素化メタン、塩素化エタン、ジクロロメタン);水性溶媒類(例えば、水又は水を含有する溶媒);及びその混合物から選択されうる。
【0094】
本明細書中で提供される固体形態は、本明細書中で述べられている方法と同様、及び/又は本明細書中の実施例に従って調製することができ、そしてこうした類似な方法によって調製された固体形態は、本明細書中で開示されているのと本質的に同じXRPD特性を示しうるということは当業者が理解しているところである。データ間の比較(例えば、2つのXRPDパターン)の一部として使用する際に、用語“本質的に(essentially)”とは、関連するデータから、例えば、実験エラー及び試料間の変動を斟酌して、それらが同じ固体形態に該当することが当業者にとって明瞭であるときに、そうした例を含んでいる。
【0095】
固体形態の使用方法
一実施形態では、本明細書中で述べられている化合物Iから成る少なくとも1つの固体形態は、少なくとも1つのヒスタミンH3受容体をモジュレートするために使用することができる。本明細書中で使用される際には、用語“モジュレートする(modulate)”、“モジュレートする(modulates)”、“モジュレートすること(modulating)”、又は“モジュレーション(modulation)”とは、例えば、少なくとも1つのヒスタミンH3受容体を活性化すること(例えば、アゴニスト活性)、又は阻害すること(例えば、アンタゴニスト及びインバースアゴニスト活性)を意味する。一実施形態では、本明細書中で述べられている少なくとも1つの固体形態を、少なくとも1つのヒスタミンH3受容体のインバースアゴニストとして使用することができる。別の実施形態では、本明細書中で述べられている少なくとも1つの固体形態を、少なくとも1つのヒスタミンH3受容体のアンタゴニストとして使用することができる。別の実施形態では、本明細書中で述べられている少なくとも1つの固体形態を、少なくとも1つのヒスタミンH3受容体のアンタゴニストとして使用することができる。更に別の実施形態では、本明細書中で述べられている少なくとも1つの固体形態を、少なくとも1つのヒスタミンH3受容体のアンタゴニストとして使用することができる。
【0096】
本明細書中で述べられている少なくとも1つの固体形態は、ヒスタミンH3受容体をモジュレートすることが有益である、1つ若しくは複数の広範囲の状態又は障害を処置するのに使用することができる。本明細書中で述べられている少なくとも1つの固体形態は、例えば、中枢神経系、末梢神経系、心血管系、肺系、胃腸系、又は内分泌系の中で少なくとも1つの疾患を処置するのに有用でありうる。
【0097】
別の実施形態では、少なくとも1つのヒスタミンH3受容体の機能をモジュレートすることが有益である障害の処置方法であって、治療的に有効な量の化合物IのフォームIをそうした処置を必要とする温血動物に投与することを含んでなる、上記方法を提供する。
【0098】
一実施形態は、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の処置のための薬剤の製造における、化合物IのフォームIの使用に関する。
【0099】
別の実施形態は、統合失調症、ナルコレプシー、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の処置のための薬剤の製造における化合物IのフォームIに使用に関する。
【0100】
更なる実施形態は、そうした治療を必要とする温血動物における、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の治療方法であって、その方法が治療的に有効な量の化合物IのフォームIを動物に投与することを含んでなる、上記方法に関する。
【0101】
また更なる実施形態は、そうした治療を必要とする温血動物における、統合失調症、ナルコレプシー、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の処置方法であって、その方法が治療的に有効な量の化合物IのフォームIを動物に投与することを含んでなる、上記方法に関する。
【0102】
更なる実施形態は、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の処置方法であって、その方法によって、医学的に、かつ薬理学的に有効な量の化合物IのフォームIを相した処置を必要とする対象に投与する、上記方法に関する。
【0103】
化合物IのフォームIは、少なくとも1つの自己免疫障害を処置するために有用でありうる。
【0104】
例示的な自己免疫障害には、例えば、関節炎、皮膚移植、臓器移植及び同様な外科的ニーズ、膠原病、種々のアレルギー、腫瘍及びウイルス性疾患(viruses)が含まれるが、これらに限定されない。
【0105】
化合物IのフォームIは、少なくとも1つの精神障害を処置するために有用でありうる。
【0106】
例示的な精神障害には、一例を示せば、例えば統合失調感情障害、妄想性障害、一時的精神病性障害、共有精神病性障害、及び全身身体状態による精神病性障害(Psychotic Disorder(s) Due to a General Medical Condition)などの精神病性障害及び統合失調症障害;認知症及び他の認知障害;例えば、広所恐怖症を伴わないパニック障害、広所恐怖症を伴うパニック障害、パニック障害の既往歴のない広所恐怖症、特定の恐怖症、社会恐怖症、強迫性障害、ストレス関連性障害、心的外傷後ストレス障害、急性ストレス障害、全般性不安障害及び全身身体状態による全般性不安障害などの不安障害;気分障害、例えば、a)うつ病性障害[例えば、大うつ病性障害(うつ病、大うつ病、気分安定(mood stabilization)及び/又はアパチー(apathy)、及び気分変調性障害(dysthymic disorder)を含む)などを含むが、これらに限定されない]、b)例えば、双極性I型(これは、躁病、うつ病又は混合性エピソードを伴うものを含むが、これらに限定されない)、双極性II型などの、双極性うつ病及び/又は双極性躁病(Bipolar mania)及び双極性障害の維持(Bipolar Maintenance)、c)気分循環性障害(Cyclothymiac's Disorder(s))、及びd)全身身体状態による気分障害;例えば、日中過眠、ナルコレプシー、睡気過多、及び睡眠時無呼吸などの睡眠障害;例えば、精神遅滞、ダウン症候群、学習障害、運動機能障害、意思疎通障害、広汎性発達障害、注意力欠損及び破壊的行動障害、乳児又は小児期早期の哺育及び摂食障害、チック障害、並びに排泄障害を含むが、これらに限定されない、通例、乳児期、小児期又は青年期に最初に診断される障害;例えば、薬物依存(substance Dependence)、薬物乱用、薬物中毒、薬物離脱(substance withdrawal)、アルコール関連障害、アンフェタミン(又はアンフェタミン様)関連障害、カフェイン関連障害、大麻関連障害、コカイン関連障害、幻覚剤関連障害、吸入剤関連障害、ニコチン関連障害、オピオイド関連障害、フェンシクリジン(又はフェンシクリジン様)関連障害、及び鎮静剤、催眠薬又は抗不安薬関連障害を含むがこれらに限定されない薬物関連障害;注意力欠損及び破壊的行動障害;例えば、肥満などの摂食障害;例えば、強迫性人格障害を含むがこれに限定されない人格障害;衝動調節障害;例えば、トゥレット障害、慢性運動性又は音声チック障害を含むが、これらに限定されないチック障害;及び一過性チック障害が含まれるがこれらには限定されない。上記の精神障害の少なくとも一つは、例えば、米国精神医学会:精神障害の診断と統計の手引き,第4版,改訂版,ワシントン,DC,米国精神医学会,2000年(American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, Text Revision, Washington, DC, American Psychiatric Association, 2000)中に定義されている。
【0107】
化合物IのフォームIは、i)肥満又は体重過多(例えば体重減少の促進及び体重減少の維持)、摂食障害(例えば、過食、拒食症、過食症及び強迫)、及び/又は渇望(薬物、タバコ、アルコール、食欲をそそるあらゆる主要栄養素又は非必須食品に対する)の処置;ii)体重増加(例えば、薬物誘発性又は禁煙後)の防止;及び/又はiii)食欲及び/又は満腹の調節に有用でありうる。本明細書中で述べられている少なくとも1つの固体形態は、食欲及び体重を減らし、及び/又は体重減少を維持し、そしてリバウンドを防止することによって肥満の治療に適切でありうる。本明細書中で述べられている少なくとも1つの固体形態は、薬物誘発による体重増加、例えば抗精神病剤(神経弛緩薬)処置によって引き起こされる体重増加;及び/又は禁煙に伴う体重増加を防止又は後退させるのに使用しうる。
【0108】
化合物IのフォームIは、少なくとも1つの神経変性障害を処置するのに有用でありうる。
【0109】
例示的な、神経変性障害には、例えば、認知障害又は認知欠損をもつ兆候に関連する状態:例えば、認知症;以下を含む、初老期認知症(早期発症型アルツハイマー病);老人性認知症(アルツハイマー型認知症);アルツハイマー病(AD);家族性アルツハイマー病;初期のアルツハイマー病;軽度から中等度のアルツハイマー型認知症;アルツハイマー病の疾患進行の遅延;アルツハイマー病に関連する神経変性症、軽度認知機能障害(MCI);健忘型軽度認知機能障害(aMCI);加齢関連性記憶障害(AAMI);レビー小体型認知症;血管性認知症(VD);HIV−認知症;AIDS認知症症候群;AIDS−神経合併症(AIDS - Neurological Complications);前頭側頭型認知症(FTD);前頭側頭型認知症・パーキンソン型(Frontotemporal dementia Parkinson's Type)(FTDP);ボクサー認知症;感染因子又は代謝障害による認知症;変性起源による認知症(dementia of degenerative origin);多種梗塞性認知症(dementia-Multi-Infarct);記憶欠損;パーキンソン病における認知症;多発性硬化症における認知症;化学療法に関連する認知欠損;統合失調症の認知欠損(CDS);統合失調症を含む統合失調感情障害;加齢関連認知低下(ARCD);認知症ではない認知障害(Cognitive Impairment No Dementia)(CIND);脳卒中又は脳虚血から生じる認知欠損;先天性及び/又は発育障害;進行性核上性麻痺(PSP);筋萎縮性側策硬化症(ALS);大脳皮質基底核変性症(CBD);外傷性脳損傷(TBI);脳炎後遺症性パーキンソン症候群;ピック病;ニーマン・ピック病;ダウン症候群;ハンチントン病;クロイツフェルト・ヤコブ病;プリオン病;多発性硬化症(MS);運動ニューロン疾患(MND);パーキンソン病(PD);β−アミロイド血管症;脳アミロイド血管症;トリヌクレオチド反復配列障害(Trinucleotide Repeat Disorders);脊髄性筋萎縮症;運動失調症;フリードリッヒ運動失調症;運動失調及び小脳又は脊髄小脳変性症;視神経脊髄炎;多系統萎縮症;伝達性海綿状脳症;注意欠陥障害(ADD);注意欠陥多動性障害(ADHD);急性躁病を含む双極性障害、双極性うつ病、双極性障害維持を含む双極性障害(BD);うつ病、大うつ病、気分障害(安定化)、気分変調症及びアパチーを含む大うつ病性障害(MDD);ギラン−バレー症候群(GBS);及び慢性炎症性脱髄性多発神経炎(CIDP)が含まれるが、これらに限定されない。
【0110】
化合物IのフォームIは、例えば、多発性硬化症(MS)(これには、例えば、再発寛解型多発性硬化症(RRMS)、二次性進行型多発性硬化症(SPMS)、及び一次性進行型多発性硬化症(PPMS)が含まれるが、これらには限定されない);パーキンソン病;多系統萎縮症(MSA);大脳皮質基底核変性症;進行性核上性麻痺;ギラン−バレー症候群(GBS);並びに慢性炎症性脱髄性多発神経炎(CIDP)を含む[但し、これらに限定されることはない]少なくとも1つの神経炎症性障害を処置するのに有用でありうる。
【0111】
化合物IのフォームIは、少なくとも1つの注意欠陥及び破壊的行動障害を処置するのに有用でありうる。
【0112】
例示的な注意欠陥及び破壊的行動障害には、例えば、注意欠陥障害(ADD)、注意欠陥多動性障害(ADHD)、及び感情障害が含まれるが、これらに限定されることはない。
【0113】
化合物IのフォームIは、例えば、広範囲にわたる疼痛、限局性の疼痛、侵害受容性疼痛、炎症性疼痛、中枢痛、中枢及び末梢神経障害性疼痛、糖尿病性神経障害疼痛、中枢及び末梢神経原性疼痛、中枢及び末梢神経痛、下背部痛、術後痛、内臓痛、並びに骨盤痛;異痛;有痛性感覚脱失;カウザルギー;異常感覚;線維筋痛症;痛覚過敏;知覚過敏症;ヒペルパチー;虚血性疼痛;坐骨疼痛;熱傷誘発疼痛(Burn-induced pain);間質性膀胱炎(但し、これに限定されない)を含む膀胱炎に関連する疼痛;多発性硬化症に関連する疼痛;関節炎に関連する疼痛;骨関節炎に関連する疼痛;関節リウマチに関連する疼痛;膵炎に関連する疼痛;乾癬に関連する疼痛;線維筋痛に関連する疼痛;IBSに関連する疼痛;癌に関連する疼痛;並びに下肢静止不能症候群を含む[但し、これらに限定されない]急性又は慢性疼痛障害を含む疼痛を処置するのに有用でありうる。
【0114】
化合物IのフォームIは、少なくとも1つの下記の障害を処置するのに有用でありうる:自閉症、失読症、ジェットラッグ、運動過剰症(Hyperkinesias)、筋失調症、激しい怒りの爆発(Rage outbursts)、筋ジストロフィー、神経線維腫症、脊髄損傷、脳性まひ、狼瘡の神経性後遺症及びポリオ後症候群。
【0115】
化合物IのフォームIは、少なくとも1つの自己免疫障害、精神障害、肥満障害、摂食障害、渇望障害、神経変性障害、神経炎症性障害、注意欠陥及び破壊的行動障害、及び/又は上記に述べられている疼痛障害を処置する薬剤の製造のために使用することができる。
【0116】
化合物IのフォームIは、統合失調症の認知欠損、ナルコレプシー、日中過眠、注意欠陥多動性障害、肥満、疼痛及びアルツハイマー病から選択される少なくとも1つの障害を処置する薬剤を製造するために使用されうる。
【0117】
化合物IのフォームIは、統合失調症の認知欠損、ナルコレプシー、注意欠陥多動性障害、肥満、疼痛及びアルツハイマー病から選択される少なくとも1つの障害を処置する薬剤を製造するために使用されうる。
【0118】
化合物IのフォームIは、統合失調症の認知欠損、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛及びアルツハイマー病から選択される少なくとも1つの障害を処置するために使用されうる。
【0119】
化合物IのフォームIは、統合失調症の認知欠損、ナルコレプシー、肥満、注意欠陥多動性障害、疼痛、及びアルツハイマー病から選択される少なくとも1つの障害を処置するために使用されうる。
【0120】
化合物IのフォームIは、統合失調症の認知欠損及びアルツハイマー病から選択される少なくとも1つの障害を処置するために使用されうる。
【0121】
別の局面は、温血動物における少なくとも1つの自己免疫障害、精神障害、肥満障害、摂食障害、渇望障害、神経変性障害、神経炎症性障害、注意欠陥及び破壊的行動障害、及び/又は疼痛障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0122】
更に別の局面は、温血動物における少なくとも1つの統合失調症の認知欠損、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、及びアルツハイマー病から選択される障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0123】
更に別の局面は、温血動物における少なくとも1つの統合失調症の認知欠損、ナルコレプシー、肥満、注意欠陥多動性障害、疼痛、及びアルツハイマー病から選択される障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0124】
更に別の局面は、温血動物における統合失調症の認知欠損を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0125】
更に別の局面は、温血動物における肥満を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0126】
更に別の局面は、温血動物におけるナルコレプシーを処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0127】
更に別の局面は、温血動物における日中過眠を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0128】
更に別の局面は、温血動物におけるアルツハイマー病を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0129】
また更に別の局面は、温血動物における注意欠陥多動性障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0130】
更にまた別の局面は、温血動物における疼痛障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0131】
一実施態様では、温血動物は、例えば、ヒト及び、例えばイヌ、ネコ及びウマなどの飼育動物を含むが、これらに限定はされない哺乳動物種である。一実施態様では、温血動物はヒトである。
【0132】
別の局面は、治療における化合物IのフォームIの使用を提供する。
【0133】
別の実施形態は、治療に使用する薬剤の製造における化合物IのフォームIの使用を提供する。
【0134】
本明細書中で使用される際は、用語“治療(therapy)”は、それとは反対の明確な指示がない限り、“予防(prophylaxis)”も含む。
【0135】
更に別の実施形態では、化合物IのフォームI、又は化合物IのフォームIを含んでなる医薬組成物又は製剤は、以下から選択される少なくとも1つの別の医薬的に活性な化合物と共に、同時に、併行して、順次に、又は別々に投与することができる:
【0136】
(i)抗うつ剤、例えば、アゴメラチン、アミトリプチリン、アモキサピン、ブプロピオン、シタロプラム、クロミプラミン、デシプラミン、ドキセピン、ドロキセチン、エルザソナン、エスシタロプラム、フルボキサミン、フルオキセチン、ゲピロン、イミプラミン、イプサピロン、マプロチリン、ノルトリプチリン、ネファゾドン、パロキセチン、フェネルジン、プロトリプチリン、ラメルテオン、レボキセチン、ロバルゾタン、セルトラリン、シブトラミン、チオニソキセチン、トラニルシプロミン(tranylcypromaine)、トラゾドン、トリミプラミン、ベンラファキシン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0137】
(ii)非定型抗精神病薬、例えば、クエチアピン及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0138】
(iii)抗精神病剤、例えば、アミスルプリド、アリピプラゾール、アセナピン、ベンゾイソキシジル(benzisoxidil)、ビフェプルノクス、カルバマゼピン、クロザピン、クロルプロマジン、デベンザピン、ジバルプロエクス、デュロキセチン、エスゾピクロン、ハロペリドール、イロペリドン、ラモトリギン(lamotrigine)、ロクサピン、メソリダジン、オランザピン、パリペリドン、ペルラピン、ペルフェナジン、フェノチアジン、フェニルブチルピペリジン、ピモジド、プロクロルペラジン、リスペリドン、セルチンドール、スルピリド、スプロクロン、スリクロン、チオリダジン、トリフルオペラジン、トリメトジン、バルプロエート(valproate)、バルプロ酸(valproic acid)、ゾピクロン、ゾテピン、ジプラシドン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0139】
(iv)抗不安剤、例えば、アルネスピロン、アザピロン、ベンゾジアゼピン、バルビツレート酸系、例えば、アジナゾラム、アルプラゾラム、バレゼパム、ベンタゼパム、ブロマゼパム、ブロチゾラム、ブスピロン、クロナゼパム、クロラゼペート、クロルジアゼポキシド、シプラゼパム、ジアゼパム、ジフェンヒドラミン、エスタゾラム、フェノバム、フルニトラゼパム、フルラゼパム、ホサゼパム、ロラゼパム、ロルメタゼパム、メプロバメート、ミダゾラム、ニトラゼパム、オキサゼパム、プラゼパム、クアゼパム、レクラゼパム、トラカゾレート、トレピパム、テマゼパム、トリアゾラム、ウルダゼパム、ゾラゼパム、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0140】
(v)抗痙攣剤、例えば、カルバマゼピン、クロナゼパム、エトスクシミド、フェルバメート、フォスフェニトイン、ガバペンチン、ラコサミド、ラモトリギン(lamotrogine)、レベチラセタム、オキシカルバゼピン(oxcarbazepine)、フェノバルビタール、フェニトイン、プレガバリン(pregabaline)、ルフィナマイド、トピラメート、バルプロエート、ビガバトリン(vigabatrine)、ゾニサミド、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0141】
(vi)アルツハイマー病治療剤、例えば、ドネペジル、リバスチグミン、ガランタミン、メマンチン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0142】
(vii)パーキンソン病治療剤、例えば、レボドパ、アポモルフィン、ブロモクリプチン、カベルゴリン、プラミペキソール、ロピニロール、及びロチゴチンなどのドーパミンアゴニスト、セレギリン(selegeline)及びラザジリンなどのMAO−B阻害剤、トルカポン、及びエンタカポンなどの他のドーパミン作動薬、A−2阻害剤、ドーパミン再取り込み阻害剤、NMDAアンタゴニスト、ニコチンアゴニスト、及びニューロンの一酸化窒素シンターゼの阻害剤、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0143】
(viii)片頭痛治療剤、例えば、アルモトリプタン、アマンタジン、ブロモクリプチン、ブタルビタール、カベルゴリン、ジクロラールフェナゾン、ジヒドロエルゴタミン、エレトリプタン、フロバトリプタン、リスリド、ナラトリプタン、ペルゴリド、ピゾチフェン(pizotiphen)、プラミペキソール、リザトリプタン、ロピニロール、スマトリプタン、ゾルミトリプタン、ゾミトリプタン(zomitriptan)、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0144】
(ix)脳卒中治療剤、一例を述べれば、例えば、アクティベース及びデスモテプラーゼとの血栓溶解療法、アブシキシマブ、シチコリン、クロピドグレル、エプチフィバチド、ミノサイクリン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0145】
(x)尿失禁治療剤、例えば、ダラフェナシン、ファルボキセート(falvoxate)、オキシブチニン、プロピベリン、ロバルゾタン、ソリフェナシン、トルテロジン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0146】
(xi)神経障害性疼痛治療剤、リドカイン、カプサイシン、及びガバペンチン、プレガバリンなどの抗痙攣剤、及びデュロキセチン、ベンラファキシン、アミトリプチリン、クロミプラミンなどの抗うつ剤、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0147】
(xii)侵害受容性疼痛治療剤、例えば、パラセタモール、NSAIDS及びコキシブ系、例えば、セレコキシブ、エトリコキシブ、ルミラコキシブ、バルデコキシブ、パレコキシブ、ジクロフェナク、ロキソプロフェン、ナプロキセン、ケトプロフェン、イブプロフェン、ナブメトン、メロキシカム、ピロキシカム、及びオピオイド、例えば、モルフィン、オキシコドン、ブプレノルフィン、トラマドール、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0148】
(xiii)不眠治療剤、例えば、アゴメラチン、アロバルビタール、アロニミド、アモバルビタール、ベンゾクタミン、ブタバルビタール、カプリド、クロラール、クロペリドン、クロレタート、デキスクラモール、エトクロルビノール、エトミデート、グルテチミド、ハラゼパム、ヒドロキシジン、メクロカロン、メラトニン、メフォバルビタール、メタカロン、ミダフルル、ニソバマート(nisobamate)、ペントバルビタール、フェノバルビタール、プロポフォール、ラメルテオン、ロレタミド、トリクロホス、セコバルビタール、ザレプロン、ゾルピデム、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0149】
(xiv)気分安定剤、例えば、カルバマゼピン、ジバルプロエクス、ガバペンチン、ラモトリギン(lamotrigine)、リチウム、オランザピン、クエチアピン、バルプロエート、バルプロ酸、ベラパミル、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0150】
(xv)肥満治療剤、例えばエネルギー消費、グリコリシス(glycolysis)、グルコネオジェネシス(gluconeogenesis)、グルコジェノリシス(glucogenolysis)、脂肪分解、脂質生成、脂肪吸収、脂肪貯蔵、脂肪排泄、空腹及び/又は満腹及び/又は渇望機構、食欲/刺激、食物摂取、及びGI運動性に影響を及ぼす抗肥満剤;超低カロリー食(VLCD);及び低カロリー食(LCD)など;
【0151】
(xvi)肥満関連障害を処置する際に有用な治療剤、例えば、ビグアニド剤、インスリン(合成インスリン類似体)及び経口血糖降下剤(これらは、食後血糖調節薬(prandial
glucose regulators)と、α−グルコシダーゼ阻害剤に分けられる)、例えば、PPARα及び/又はγアゴニストなどのPPAR調節剤;スルホニル尿素;例えば、HMG−CoA還元酵素(3−ヒドロキシ−3−メチルグルタリル補酵素A還元酵素)阻害剤などのコレステロール低下剤;回腸胆汁酸輸送系の阻害剤(IBAT阻害剤);胆汁酸結合樹脂;例えば、コレスチポール、コレスチラミン、又はコレスタゲル(cholestagel)などの胆汁酸封鎖剤;CETP(コレステロールエステル転送タンパク質)阻害剤;コレステロール吸収アンタゴニスト;MTP(ミクロソーム転送タンパク質)阻害剤;遅延放出及び組み合わせ物(combination products)を含むニコチン酸誘導体;フィトステロール化合物;プロブコール;抗凝固剤;オメガ−3脂肪酸;例えば、シブトラミン、フェンテルミン、オーリスタット、ブプロピオン、エフェドリン及びサイロキシンなどの抗肥満治療剤、;例えば、アンギオテンシン変換酵素(ACE)阻害剤、アンギオテンシンII受容体アンタゴニスト、アドレナリン遮断剤、αアドレナリン遮断剤、βアドレナリン遮断剤、混合型アルファ/ベータアドレナリン遮断剤、アドレナリン刺激剤、カルシウムチャネル遮断剤、AT−1遮断剤、塩類利尿剤、利尿剤及び血管拡張剤などの降圧剤;メラニン濃縮ホルモン(MCH)モジュレーター;NPY受容体モジュレーター;オレキシン受容体モジュレーター;ホスホイノシチド依存性プロテインキナーゼ(PDK)モジュレーター;例えば、LXR、FXR、RXR、GR、ERRα,β、PPARα,β,γ及びRORαなどの核内受容体のモジュレーター;例えば、選択的セロトニン再取り込み阻害剤(SSRI)、ノルアドレナリン再取り込み阻害剤(NARI)、ノルアドレナリン−セロトニン再取り込み阻害剤(SNRI)、モノアミンオキシダーゼ阻害剤(MAOI)、三環式抗うつ剤(TCA)、ノルアドレナリン作動性・特異的セロトニン作動性抗うつ剤(NaSSA)などのモノアミン伝達調節剤;セロトニン受容体モジュレーター;レプチン/レプチン受容体モジュレーター;グレリン/グレリン受容体モジュレーター;DPP−IV阻害剤;並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)、代謝物(複数を含む)及びその製薬学的に許容される塩(複数を含む)、溶媒和物(複数を含む)、及びプロドラッグ(複数を含む)など。
【0152】
(xvii)ADHDを処置する薬剤、例えば、アンフェタミン、メタンフェタミン、デキストロアンフェタミン、アトモキセチン、メチルフェニデート、デキサメチルフェニデート、モダフィニル、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)など;及び
【0153】
(xviii)薬物乱用障害、依存症及び離脱症状を処置するのに用いられる薬剤、例えば、ニコチン補充療法(すなわち、ガム、パッチ及びスプレー式点鼻剤);ニコチン性受容体アゴニスト、部分アゴニスト及びアンタゴニスト、(例えばバレニクリン);アコンプロセート(acomprosate)、ブプロピオン、クロニジン、ジスルフィラム、メサドン、ナロキソン、ナルトレキソン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)など。
【0154】
本明細書中の述べられている少なくとも1つの固体形態と組み合わせて使用されるときには、前述の別の医薬的に活性な成分を、例えば、Physicians’ Desk Reference(PDR;例えば、64th ed. 2010)に指示されている量で、あるいは承認されている投薬量範囲で、及び/又は公表されている参考資料中に記載されている投薬量で、あるいは、そうでない場合は当技術分野の当業者によって決定されている量で使用することができる。
【0155】
本明細書中で述べられている固体形態は、処置される状態に適したあらゆる手段によって投与することができ、これは送達される本明細書中に述べられている固体形態の量に左右されうる。本明細書中に述べられている固体形態(複数を含む)は、例えば、経口的、筋肉内、皮下的、局所的、鼻腔内、硬膜外、腹腔内、胸腔内(intrathoracially)、静脈内、髄腔内、脳室内、及び関節内注入(これらに限定されない)を含む任意のルートによって医薬組成物の形で投与することができる。一実施形態では、投与ルートは経口的である。
【0156】
本明細書中で述べられている固体形態の“有効な量(effective amount)”は、当技術分野の当業者によって決定することができる。例えば、投与される固体形態の量は、処置される患者によって変動し、1日あたり約100ng/kg(体重)〜100mg/kg(体重)(例えば、1日あたり10pg/kg〜10mg/kg)変動しうる。特定の実施形態では、有効な量には、単回投与、又は個々の分割投与量の形で、約0.05〜約300mg/kg/日(例えば、約200mg/kg/日未満)の哺乳類に対する投薬量の例示が含まれる。特定の実施形態では、成人のヒトに対する例示的な投薬量は、1日あたり約1〜100mg/kg(体重)(例えば、1日あたり15mg/kg(体重))であり、これは、単回投与、又は個々の分割投与量(例えば、1日あたり1〜4回)の形で投与することができる。
【0157】
投与量は、この開示及び当技術分野の知識を基準にして当業者であれば、容易に確定することができる。すなわち、当業者であれば、組成物中の、本明細書中で提供された方法で投与される固体形態及び所望の添加剤、ビヒクル、及び/又は担体の量を容易に決定することができる。しかしながら、特定の対象に対する特定の投与レベル及び投与頻度は変化しえ、通例、例えば、本明細書中で述べられている固体形態(複数を含む)の溶解性及び/又は生物学的利用性;対象の種、年齢、体重、全般的健康状態、性別、及び食事;投与形式及び時間;排出速度;薬物の組み合わせ;及び具体的な状態の重篤度を含む、種々の要因に左右されうる。
【0158】
固体形態を含む医薬組成物
一局面では、化合物IのフォームI及び少なくとも1つの製薬学的に許容される担体及び/又は希釈剤を含んでなる医薬組成物を提供する。
【0159】
一実施形態は、温血動物における本明細書中に述べられている少なくとも1つの障害を処置する方法であって、そうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIと、少なくとも1つの製薬学的に許容される担体及び/又は希釈剤を含む医薬組成物を投与することを含んでなる、上記方法を提供する。
【0160】
一実施形態は、温血動物における統合失調症の認知欠損、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、及びアルツハイマー病から選択される少なくとも1つの障害を処置する方法であって、そうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIと、少なくとも1つの製薬学的に許容される担体及び/又は希釈剤を含む医薬組成物を投与することを含んでなる、上記方法を提供する。
【0161】
一実施形態は、温血動物における統合失調症の認知欠損、ナルコレプシー、肥満、注意欠陥多動性障害、及びアルツハイマー病から選択される少なくとも1つの障害を処置する方法であって、そうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIと、少なくとも1つの製薬学的に許容される担体及び/又は希釈剤を含む医薬組成物を投与することを含んでなる、上記方法を提供する。
【0162】
許容される固体医薬組成物には、例えば、粉末剤、錠剤、分散性顆粒剤、カプセル剤、カシェ剤、及び坐剤が含まれるが、これらに限定されない。固体の医薬組成物、製薬学的に許容される担体には、例えば、少なくとも1つの固体、少なくとも1つの液体、及びその混合物が含まれるが、それらに限定されない。固体の担体はまた、希釈剤、矯味矯臭剤、可溶化剤、滑沢剤、懸濁剤、結合剤、カプセル封入材料、及び/又は錠剤崩壊剤でありうる。適切な担体には、例えば、炭酸マグネシウム;ステアリン酸マグネシウム;タルク;乳糖;糖類;ペクチン;デキストリン;デンプン;トラガカント;メチルセルロース;カルボキシメチルセルロースナトリウム;低融点ワックス;カカオ脂;及びその混合物が含まれるが、それらに限定されない。適切な担体の例は、当業者に知られており、また、例えば、Remington: The Science and Practice of Pharmacy(Lippincott Williams & Wilkins, 20th ed. 2000)中に記載されている。
【0163】
粉末剤は、例えば、微細固体を化合物IのフォームIと混和することによって調製することができる。錠剤は、例えば、適切な比率で化合物IのフォームIを、必要な結合特性を有している製薬学的に許容される担体と混和し、そして所望の形及びサイズに圧縮することによって調製することができる。坐剤は、例えば、化合物IのフォームIを、直腸温度で液体であるが直腸温度未満の温度では固体である、少なくとも1つの適切な無刺激性の賦形剤と混和することによって調製することができ、この場合、無刺激性の賦形剤をまず融解させ、そして化合物IのフォームIをその中に分散させる。次いで融解した均一な混合物を好都合なサイズの金型に注ぎ、そして冷却し、固体化する。無刺激性の賦形剤を例示すると、例えば、カカオ脂;グリセロゼラチン;水素化植物油;種々の分子量のポリエチレングリコールの混合物;及びポリエチレングリコールの脂肪酸エステルが挙げられるが、これらに限定されない。
【0164】
許容される液体医薬組成物には、懸濁液が含まれる。経口投与のための水性懸濁液は、本明細書中で述べられている少なくとも1つの微細固体形態を、例えば、天然・合成ガム、レジン、メチルセルロース、及びカルボキシメチルセルロースナトリウムなどの粘性物質と一緒に水中に分散させることによって調製することができる。
【0165】
一実施形態では、本明細書中で述べられている医薬組成物は、約0.05%と約99%(重量)[パーセントはすべて、重量基準で全組成物をベースとしている]の間の化合物IのフォームIを含む。別の実施形態では、医薬組成物は、約0.10%〜約50%(重量)[パーセントはすべて、重量基準で全組成物をベースとしている]の化合物IのフォームIを含む。
【0166】
別の実施形態は、治療のための化合物IのフォームIと製薬学的に許容される担体/希釈剤を含んでなる医薬組成物を提供する。
【0167】
更に、前記に論じられたいずれかの状態に使用するための、化合物IのフォームIと、製薬学的に許容される担体とを共に含んでなる医薬組成物が提供される。
【発明を実施するための形態】
【0168】
実施例
本発明は下記の実施例中で更に明確にされる。この実施例は説明のみの目的で示されているということが理解されるべきである。前記論議及び実施例から、当技術分野の当業者であれば、本発明の本質的な特徴を確認することができ、そしてその趣旨及び範囲から逸脱することなく、本発明を種々の使用及び条件に適合するように種々の修正及び改変をすることができる。その結果として、本発明は、以下に述べられている例示的な実施例によっては限定されることはなく、本明細書に添付されている請求項によって定義されている。
【0169】
温度はすべて、摂氏(℃)単位であり、補正されていない。
【0170】
別途記載のない限り、実施例化合物を製造する際に使用される市販試薬を更なる精製はせずに受理したまま使用した。
【0171】
別途記載のない限り、実施例化合物を製造する際に使用される溶媒は、市販の無水グレードであり、更に乾燥又は精製することはせずに使用した。
【0172】
出発物質はすべて、別途記載のない限り、商業上入手可能である。
【0173】
以下の略語が本明細書中で使用されうる:ACN:アセトニトリル;aq:水性の;br:ブロード;Bu:ブチル;calcd:計算値;Celite(登録商標):珪藻土ろ過剤のブランド、セライトコーポレーション(Celite Corporation)(登録トレーダー);CP−MAS SS−NMR:交差分極マジック角スピニング固体核磁気共鳴;d:二重線;dd:二重線の二重線;ddd:二重線の二重線の二重線;dddd:二重線の二重線の二重線の二重線;DABCO:1,4−ジアザビシクロ[2.2.2]オクタン;DCE:ジクロロエタン;DCM:ジクロロメタン;DIPEA:N−エチル−N−イソプロピルプロパン−2−アミン;DME:ジメチルエーテル;DMEA:ジメチルエチルアミン;DMF:N,N−ジメチルホルムアミド;DMSO:ジメチルスルホキシド;dq:四重線の二重線;DSC:示差走査熱量測定法;dt:三重線の二重線;DVS:動的水蒸気収着;EDC:1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩;ESI:エレクトロスプレーイオン源;EtOAc:酢酸エチル;EtOH:エタノール;Et:エチル;FT−IR:フーリエ変換赤外;FT−Raman:フーリエ変換ラマン;g:グラム;h:時間(複数を含む);1H NMR:プロトン核磁気共鳴;HBTU:O−ベンゾトリアゾール−N,N,N’,N’−テトラメチル−ウロニウム−ヘキサフルオロ−ホスファート;HCl:塩酸;HOBT:N−ヒドロキシベンゾトリアゾール;HPLC:高圧液体クロマトグラフィー;HRMS:高分解能質量分析法;iPrOH:イソプロパノール;L:リットル;m:多重線;M:モル(の);mL:ミリリットル;Me:メチル;MeOH:メタノール;mg:ミリグラム;MgSO4:無水硫酸マグネシウム(乾燥剤);MHz:メガヘルツ;min:分(複数を含む);mmol:ミリモル;mol:モル;MPLC:中圧液体クロマトグラフィー;MS:質量分析;MTBE:メチルtert−ブチルエーテル;NaHCO3:重炭酸ナトリウム;NH4Cl:塩化アンモニウム;Pd/C:パラジウム・炭素;ppm:百万分率;q:四重線;quin:五重線;rt:室温;s:一重線;sat;飽和した;t:三重線;TEA:トリエチルアミン;tBuOH:tert−ブタノール;td:二重線の三重線;TFA:トリフルオロ酢酸;TGA=熱重量分析;THF:テトラヒドロフラン;UV=紫外;XRPD=粉末X線回折;及び接頭語n−、s−、i−、t−及びtert−は、それらの通例の意味を有する:ノルマル、セカンダリー、イソ、及びターシャリー。
【0174】
実施例1:化合物Iの合成(第一ルート)
4−((トランス)−2−((R)−4−シクロブチル−2−メチルピペラジン−1−カルボニル)シクロプロピル)ベンズアミド,異性体1
【化2】

注:*は、単一異性体(絶対立体化学未定)を示す。
【0175】
実施例2(138mg,0.40mmol)を、MettlerToledo Minigram超臨界液体クロマトグラフィー機器(MettlerToledo Minigram Supercritical Fluid Chromatography instrument)によって、次の条件:ChiralPak AD-H,10×250mm,5μm粒径,10.0mL/分,移動相:55% iPrOH(0.1%DMEAを含む),超臨界CO2,レギュレーター 100バールに設定,カラム温度 35℃に設定,UV 215nmを用いて分離すると、57.8mgの異性体1(41.9%)及び56.5mgの異性体2(41.0%)が固体として提供された。この生成物を、ChiralPak AD-H,10×250mm,5μm粒径を用いアイソクラティック法(移動相:55%EtOH(0.1%DMEAを含む),超臨界CO2)を用いてキラルSFC(UV検出)によって分析すると、エナンチオマー純度99%、Rt 1.92分(異性体1)及び3.46分(異性体2)が得られた。
異性体1: 1H NMR (400 MHz, CD3OD) δ ppm 1.26 (br. s., 1H) 1.38 (br. s., 3H) 1.59 (ddd, J= 9.57, 4.69, 4.49 Hz, 1H) 1.65-1.77 (m, 3 H) 1.77-1.98 (m, 3H) 1.98-2.09 (m, 2H) 2.22 -2.31 (m, 1H) 2.43 (br. s., 1H) 2.63-2.74 (m, 2H) 2.84 (d, J=11.33 Hz, 1H) 2.96 (t, J= 12.89 Hz, 0.5H), 3.36 (t, J=12.30 Hz, 0.5H) 4.04 (d, J =12.11 Hz, 0.5H) 4.31 (d, J= 12.11 Hz, 0.5H) 4.38 (br. s., 0.5H) 4.65 (br. s., 0.5H) 7.25 (d, J=8.20 Hz, 2H), 7.80 (d, J=8.20 Hz, 2H);
HRMS m/z 計算値(C20H28N3O2)342.21760 [M+H]+,実測値 342.21771;
[α]D+156.3°(c 2.20,MeOH)。
【0176】
実施例2
4−(トランス−2−((R)−4−シクロブチル−2−メチルピペラジン−1−カルボニル)シクロプロピル)ベンズアミド,ジアステレオマー混合物
【化3】

中間体AをDCE(13.0mL)中に溶解した。TEA(0.958mL,6.87mmol)を加え、引き続いてシクロブタノン(193mg,2.75mmol)及びトリアセトキシ水素化ホウ素ナトリウム(437mg,2.06mmol)を添加した。この反応混合物を終夜撹拌し、そして飽和NaHCO3で洗浄した。有機層をMgSO4上で乾燥し、ろ過し、そして減圧下で濃縮した。この粗製物を、XBridge Prep C18 OBD,30×50mm,5μm,Waters逆相カラム(Waters reverse phase column)でショート高pHシャローグラジエント法(short high pH shallow gradient method)[移動相:20〜40%B;A:H2O(10mM NH4CO3及び0.375% NH4OH v/vを含む),B:CH3CN,10分稼動)]を用いる分取HPLC MSによって精製すると、159mgの実施例2(33.9%)が固体(ジアステレオマー混合物)として提供された。
1H NMR (400 MHz, CD3OD) δ ppm 1.27 (d, J=7.03 Hz, 2H) 1.39 (br. s., 2H ) 1.59 (ddd, J=9.18, 5.27, 4.30 Hz, 1H) 1.65-1.78 (m, 3H) 1.78-1.98 (m, 3H) 1.98-2.10 (m, 2 H) 2.20-2.34 (m, 1H) 2.42 (br. s., 1H) 2.62-2.77 (m, 2H) 2.78-2.90 (m, 1H) 2.90-3.05 (m, 1H) 3.94-4.10 (m, 1H) 4.23-4.35 (m, 1H) 7.25 (d, J=8.59 Hz, 2H) 7.80 (d, J=8.20 Hz, 2H);
HRMS m/z 計算値(C20H28N3O2) 342.21760 [M+H]+,実測値 342.21804。
【0177】
実施例3:化合物Iの合成(第二ルート)
4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミド
【化4】

中間体N(10.0g,48.7mmoles)を、2−MeTHF(200mL)にtジャケット(ジャケット(jacket)温度)=25℃で混和した。1,1’−カルボニルジイミダゾール(11.0g,53.6mmoles,82.1%w/w)を1回で加えた。この反応スラリーをゆっくりtジャケット=85℃に加熱し、そしておよそ5時間後、反応スラリーをt反応混合物(反応混合物(reaction mixture)温度)=25℃に冷却した。中間体O(13.8g,58.5mmoles)及びTEA(7.55mL,53.6mmoles)を反応スラリーに加えた。この反応スラリーをtジャケット=70℃で3時間加熱した。試料を、Chromolith Performance RP-18e,4.6×100mmによってグラジエント法[移動相 20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動]を用いてHPLCによって分析すると、この時点で完全な変換を示した。この反応スラリーをtジャケット=40℃に冷却した。ブライン(90mL)中の1M Na2CO3を加えた。水相を分離し、そして有機相をブライン(2L)で洗浄した。有機相中の表題化合物の分析評価を1H NMRによって決定し、そして有機相の量を10相対容量(15.4gの表題化合物)に調整した。有機相をtジャケット=15℃に冷却し、そしてH2O中の10%H3PO4(pH2.5まで加えた,110mL)で抽出した。下の水相を回収し、残存する有機相をH2O中の10%H3PO4(50mL)で再び抽出した。水相を集め、これを5M KOHを用いて塩基性にしpH>12とし、そしてMeTHFで2回(200mL,50mL)抽出した。有機相を集め、これをブライン(50mL)で抽出し、そしてろ過して無機塩を除去した。有機相中の表題化合物の分析評価を1H NMRによって決定し、そして有機相の量を6相対容量(14.4gの表題化合物,86mL)に減少させた。tジャケット=55℃で開始して、結晶化を行なった。tジャケット=40℃に冷却した後、ヘプタン(21.6mL)及びシード(128mgの表題化合物)を加えた。この混合物をエイジング(aging)の後、tジャケット=20℃に冷却し、ヘプタン(64.8mL)の2回目の添加を行った。生成物はろ別し、そしてMeTHF/ヘプタンで2回(2*30mL)洗浄した。真空下にて40℃で乾燥すると、12.6gの表題化合物(35.2mmoles,98.7%w/w,75%収率)が得られた。
1H-NMR (DMSO-d6): δ 7.91 (br s, 1H), 7.78 (d, J=8.4 Hz, 2H), 7.30 (br s, 1H), 7.25 (d, J=8.0 Hz, 2H), 4.54 及び 4.36 (br s, 1H), 4.17 及び 4.01 (d, J=12.2 Hz, 1H), 3.20 及び 2.80 (t, J=11.9 Hz, 1H), 2.74 (d, J=11.4 Hz, 1H), 2.67-2.55 (m, 2H), 2.33 (br s, 2H), 1.99-1.88 (m, 2H), 1.88-1.53 (m, 6H), 1.48-1.37 (m, 1H), 1.27 (br s, 3H), 1.12 (br s, 1H);
LC-MS (ESI): m/z 342 (M+1)。
Rt 1.68分[Xbridge C18,3.0×50mm,2.5μm 粒径による分析方法(移動相:5〜90%B;A:H2O(0.1%ギ酸を含む),B:CH3CN,8.6分稼動)を用いた]。生成物のLC純度をUV−検出(250nm)付きAtlantis T3カラム(3.0×150mm,3.0μm 粒径)によって、グラジエント法[移動相 2〜50%B;A:H2O(0.03%TFAを含む),B:CH3CN(0.03%TFAを含む),30分稼動]を用いて解析すると、12.06分で純度99.48面積%が得られた。この生成物を、ChiralPak AD-H,10×250mm,5μm粒径を用いアイソクラティック法[移動相:55%EtOH(0.1%DMEAを含む),超臨界CO2]を用いてキラルSFC(UV検出)によって分析すると、エナンチオマー純度>99%ee,Rt 1.98分が得られた。
【0178】
実施例4:化合物Iの合成(第三ルート)
4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミド
【化5】

N2を泡状の形でEtOH(125mL)及びH2O(30mL)中の中間体P(6.09g,18.83mmol)に入れ、これにヒドリド(ジメチル亜ホスフィン酸−kP)[水素ビス(ジメチルホスフィニト−kP]白金(II){(Hydrido(dimethylphosphinous acid-kP)[hydrogen bis(dimethylphosphnito-kP]platinum (II))}(0.050g,0.12mmol)を加えた。反応物を20時間加熱・還流した。この反応混合物を更に24時間加熱し、濃縮・乾燥し、そしてETOAcとH2Oの間で分配した。水相をETOAcで3回抽出し、有機層を集め、これをブラインで洗浄し、Na2SO4上で乾燥し、ろ過し、そして濃縮した。この粗製物を、CH2Cl2及びMeOH 2〜10%[黒っぽい可視バンドが溶出するまで4%でプラトー(plateau)の状態にする(with a plateau at 4% until elution of visible dark band)]のグラジエントで溶出し、引き続いてアセトン/ヘプタン30〜100 %のグラジエントで2回目の精製を行なうシリカゲルを用いるフラッシュクロマトグラフィーによって精製すると、3.65gの実施例4(56.8%収率)が固体として得られた。
1H NMR (400 MHz, メタノール-d4) δ ppm 1.24 (br. s., 1H) 1.36 (br. s., 3H) 1.52-1.60 (m, 1H) 1.63-1.74 (m, 3H) 1.74-1.84 (m, 1H) 1.84-1.95 (m, 2H) 1.95-2.05 (m,
2H) 2.24 (br. s., 1H) 2.40 (br. s., 1H) 2.60-2.72 (m, 2H) 2.82 (d, J= 12.50 Hz,
1H) 2.94 及び 3.36 (t, J=12.11 Hz, 1H) 4.01 及び 4.28 (d, J=13.28 Hz, 1H) 4.35 及び 4.62 (br. s., 1H) 7.22 (d, J=8.20 Hz, 2H) 7.77 (d, J=8.59 Hz, 2H)。
この生成物をZorbax SB C18,4.6×30mm,1.8μm 粒径,MS m/z 342.3 [M+H]+(ESI),Rt 0.584分によるゾルバクス(Zorbax)グラジエント法[移動相:5〜95%B;A:H2O(0.05%TFAを含む),B:CH3CN,4.5分稼動]を用いる分析HPLC MSによって分析した。この生成物を、ChiralPak AD-H,10×250mm,5μm粒径を用いアイソクラティック法[移動相:55%EtOH(0.1%DMEAを含む),超臨界CO2]を用いてキラルSFC(UV検出)によって分析すると、エナンチオマー純度>99%,Rt 1.98分が得られた。この表題化合物は上記の実施例1の“異性体1”に該当する。
HRMS m/z 計算値 C20H27N3O2 342.2176 [M+H]+,実測値 342.2176。
【0179】
実施例5:化合物IのフォームIの製造
化合物IのフォームIを製造する第一手段では、20mgの非晶形態の化合物I(前出の合成ルートのうちの実施例1、2又は4によって製造される)を容器に加えた。この容器に100μlのEtOAcを加え、懸濁液を得た。この結果生じたスラリーを周囲温度で3日間撹拌した。次いで固体結晶性物質を単離し、そして空気乾燥した。
化合物IのフォームIを製造する第二手段では、20mgの非晶形態の化合物I(前出の合成ルートのうちの1つによって製造される)を容器に加えた。この容器に100μlのACNを加え、懸濁液を得た。この結果生じたスラリーを周囲温度で3日間撹拌した。次いで固体結晶性物質を単離し、そして空気乾燥した。
【0180】
実施例6:化合物IのフォームIの分析
実施例5によって得られた固体物質をXRPDによって分析した。選択されたピークが表1に与えられている。代表的なXRPDパターンが図1に示されている。このXRPDパターンによれば、この固体物質は結晶性の化合物IのフォームIであることが確認された。
【0181】
【表1】

【0182】
実施例5によって得られた固体物質を熱分析手法(thermal techniques)によって分析した、DSC分析によって、フォームIは、図2に示されているように、約133.5℃で溶融の吸熱開始、そして約135.3℃でピークを有する高溶融固体であることが示されている。TGAによって、化合物IのフォームIは、約20℃〜約100℃に加熱すると、約0.25%の質量損失を示し、そして、約100℃〜約160℃に加熱すると、更に約0.25%の質量損失を示すことが明らかにされた。熱分析によって、化合物IのフォームIは、実質的量の溶媒又は水を含まないことが明らかにされた。代表的なDSCサーモグラムが図2に示されている。代表的なTGAサーモグラムが図3に示されている。
【0183】
実施例5によって得られた固体物質は、DVS手法によって分析された。DVS等温線分析(isothermic DVS analysis)は、約0%RHと約90%RHの間で、化合物IのフォームIの試料を増加させることによってほぼ周囲温度で行なわれた。このDVS分析によって、化合物IのフォームIが、約0%RHと約90%RHの間で、質量基準で2%未満(約1.2%〜約1.4%)の水を吸着することが明らかと成った。DVS分析によって、フォームIは実質的に非吸湿性であることが明らかとなった。代表的なDVS等温線プロットが図4に示されている。
【0184】
実施例5によって得られた固体物質は、SS−NMRによって分析された。スペクトルは、下記のppm値でピークを示した:171.0624;144.1716;131.7559;127.5291;60.4671;54.5210;52.9234;51.5593;50.7770;45.9523;45.0427;40.7924;28.5029;24.5826;23.7109;18.1318;15.7476;15.2935;14.3726;13.6745;及び13.1087。代表的なSS−NMRスペクトルが図5に示されている。
【0185】
実施例5によって得られた固体物質は、FT−IR及びFTラマンスペクトロスコピーによって分析された。代表的なFT−IRスペクトル(上側)及びFTラマンスペクトル(下側)が図6に示されている。
【0186】
実施例7:機器及び手法
XRPD分析
XRPD分析は、Bruker AXS Inc.(商標)(Madison, Wisconsin)から商業的に入手可能である、ブルカーD8ディフラクトメータ(Bruker D8 diffractometer)を用いて行なわれた。XRPDスペクトルは、シリコン単結晶ウエハーマウント(a single silicon
crystal wafer mount)(例えば、ブルカーシリコンゼロバックグラウンドX線回折試料ホルダー:Bruker silicon zero background X-ray diffraction sample holder)上に分析のためのこの対象物の試料(およそ20mg)を据え付け、そして顕微鏡用スライドを用いて試料を広げて薄層状にすることによって得られた。試料を毎分30回転で回転させ(計数統計を向上させるため)、そして銅製の長い微小焦点管(copper long-fine focus
tube)を、1.5406オングストローム(すなわち、約1.54オングストローム)の波長で、40kV及び40mAにおいて作動させて発生するX線を照射した。この試料をシータ・シータ・モード(theta-theta mode)で2°〜40°2θの範囲にわたって、0.02°2θ増加につき(連続的スキャンモード)1秒間曝露した。稼働時間は31分41秒であった。
【0187】
DSC分析
DSCを、TA Instruments model Q1000を用いて行なった。試料(およそ2mg)を計量しアルミニウムサンプルパン(aluminium sample pan)に入れ、そしてDSCに移した。この機器を50mL/分で窒素を用いてパージし、そしてデータを10℃/分の動的加熱速度(dynamic heating rate)を用いて25℃〜300℃で回収した。
【0188】
DSC分析を、TA INSTRUMENTS(登録商標)(New Castle, Delaware)から商業的に入手可能であるQ SERIES(商標)Q1000 DSC熱量計を用いて標準的な方法に従って調製した試料によって行なった。この機器を、50mL/分で窒素を用いてパージし、そしてデータを10℃/分の動的加熱速度を用いて25℃〜300℃で回収した。熱的データを、標準的なソフトウェア、例えば、TA INSTRUMENTS(登録商標)からのUniversal v.4.5Aを用いて分析した。
【0189】
DVS分析
DVS分析を標準的な機器、例えば、Surface Measurement Systems, Ltd.(商標)(Alperton, London, UK)から商業的に入手可能であるDVS機器を用いて、標準的な方法に従って調製した試料によって行なった。周囲温度で維持される試料は、約0%RH〜約90%RHでサイクルさせた。水蒸気収着及び脱着を示している質量の変化率を記録した。
【0190】
SS−NMR分析
分析のためのおよそ100mgの物質(例えば、薬物物質又は製剤物)を、Kel−Fキャップ(Kel-F cap)で密封された4mm二酸化ジルコニウムローターに詰め込んだ。13C交差分極マジック角スピニングスペルクトルの決定の場合には通例、ローターを5〜9kHzで回転させ(化学シフト異方性を除去するため)、そして13Cスペクトルを水素に起源する交差分極を用いて記録した(感度を向上させ、そして実験時間を減少させるため)。磁化移動のコンタクト時間は通例、2ミリ秒であり、そしてインターパルス(inter-pulse)遅延(核緩和を考慮して)は通例、5秒であった。シグナル平均化(Signal averaging)が、すべての主要ピークがノイズから解消されることを可能にするのに十分にスキャン記録して使用された。結晶性の薬物物質の場合の通例の実験時間は約1時間であった。
【0191】
FT−IR及びFT−ラマン分析
FT−IR/ATRスペクトルをDTGS KBr検出器を備えたThermo Nicolet Nexus 870を用いて400〜4000cm−1の範囲にわたって[分解能:4cm−1及びスキャン数:64回で]回収した。ATRで使用した結晶はダイアモンドである。
【0192】
【表2】

【0193】
FT−ラマンスペクトルは、InGaAs検出器を備えたThermo Nicolet Nexus 870によって100〜3700cm−1の範囲にわたって[分解能:8cm−1及びスキャン数:64回で]回収した。データ取得及び分析は、Thermo Nicolet software Omnic softwareを用いて行なわれた。
【0194】
【表3】

【0195】
中間体A
4−(トランス−2−((R)−2−メチルピペラジン−1−カルボニル)シクロプロピル)ベンズアミド
【化6】

中間体B(849mg,2.19mmol)をDCM(10.0mL)中に溶解した。TFA(5.00mL)を加え、そしてこの反応混合物を30分間室温で撹拌した。揮発性物質を減圧下で蒸発させると黄色ガムが得られた。この粗製物は、精製することはせずに次の工程で使用した。
1H NMR (400 MHz, CD3OD) δ ppm 1.33 (d, J=7.03 Hz, 3H) 1.37-1.52 (m, 3 H) 1.65 (br. s., 1H) 2.26-2.39 (m, 1H) 2.51 (br. s., 1H) 3.11 (br. s., 1H) 3.21-3.45 (m, 4H) 7.27 (d, J=8.20 Hz, 2H) 7.81 (d, J=8.20 Hz, 2 H)。
【0196】
中間体B
(R)−tert−ブチル−4−(トランス−2−(4−カルバモイルフェニル)シクロプロパンカルボニル)−3−メチルピペラジン−1−カルボキシラート
【化7】

中間体C(450mg,2.19mmol)を、DMF(20mL)中に溶解した。DIPEA(1.149mL,6.58mmol)を加え、引き続いてHOBT(444mg,3.29mmol)、EDC(631mg,3.29mmol)及び中間体D(527mg,2.63mmol)を添加した。この反応混合物を室温で2日間撹拌し、減圧下で濃縮し、EtOAcに再び溶解し、1M HCl及び飽和NaHCO3で洗浄し、MgSO4上で乾燥し、ろ過し、そして減圧下で濃縮すると、中間体Bが固体として得られた。粗生成物は更に精製することはせずに次の工程で使用した。
MS m/z 388.34 [M+H]+(ESI)。
【0197】
中間体C
トランス−2−(4−カルバモイルフェニル)シクロプロパンカルボン酸
【化8】

中間体E(3.4g,18.16mmol)を、t−BuOH(90mL)中に溶解した。粉砕KOH(5.10g,90.81mmol)を加え、この反応混合物を、終夜70℃に加熱し、室温に冷却し、そして減圧下で濃縮した。残留物をH2Oに再び溶解し、そしてEtOAcで洗浄した。水相を1M HClを用いて酸性にし、pH4〜5にした。沈殿物をろ過し、そして真空下にて乾燥すると、3.06g(82%)の中間体Cが固体として得られた。この生成物は、更に精製することはせずに次の工程で使用した。
1H NMR (400 MHz, CD3OD) δ ppm 1.42 (ddd, J=8.50, 6.35, 4.69 Hz, 1H) 1.55-1.62 (m, 1H) 1.91 (ddd, J=8.50, 5.37, 4.10 Hz, 1H) 2.52 (ddd, J=9.18, 6.25, 4.10 Hz, 1H) 7.20-7.26 (m, 2H) 7.76-7.83 (m, 2H);
MS m/z 206.22 [M+H]+ (ES+)。
【0198】
中間体D
(R)−tert−ブチル 3−メチルピペラジン−1−カルボキシラート
【化9】

(R)−2−メチルピペラジン(5.025g,50.2mmol)をDCM(100mL)中に溶解した。DCM(50mL)中のboc無水物(boc anhydride)(5.47g,25.1mmol)の溶液を0℃で滴下した。この反応混合物を室温で1時間撹拌した。この溶液をろ過し、そして減圧下で濃縮した。H2O(100mL)を残留物に加え、これを再びろ過した。ろ液をK2CO3で飽和させ、そしてEt2O(3×150mL)で抽出した。有機層を集め、これを無水Na2SO4上で乾燥し、ろ過し、そして減圧下で濃縮すると、5.04g(50%)の中間体Dが固体として提供された。
1H NMR (300 MHz, CDCl3) δ ppm 1.03 (d, J =6.3 Hz, 3H) 1.45 (s, 9H) 1.56 (s, 1H)
2.30-2.46 (m, 1H) 2.65-2.72 (m, 1H) 2.74-2.76 (m, 2H) 2.93-2.95 (m, 1H) 3.93 (br s, 2H)。
中間体Dはまた、Lanzhou Boc Chemical Co.から商業的に入手可能である。
【0199】
中間体E(第一方法)
トランス−2−(4−シアノフェニル)シクロプロパンカルボン酸
【化10】

中間体H(11.2g,64.7mmol)をアセトン(100mL)中に溶解した。この溶液を−10℃に冷却した。ジョーンズ試薬(65mL)を30分間にわたって加えた。添加が完結した後、この反応物を室温に暖め、次いで2−プロパノール(100mL)を加えることによってクエンチした。この結果生じた混合物をEtOAc(200mL)で希釈した。MgSO4を加え、そして撹拌を更に30分間継続した。この混合物を、ろ過し、そしてろ液を減圧下で濃縮した。残留物をEtOAc(200mL)中に再び溶解し、H2O(2×75mL)で洗浄し、MgSO4上で乾燥し、ろ過し、そして減圧下で濃縮した。粗製物をEtOAc(20mL)でトリチュレーションすることによって精製すると、5.2g(43%)の中間体Eが固体として得られた。
1H NMR (400 MHz, DMSO-d6) δ ppm 1.39-1.46 (m, 1H) 1.47-1.55 (m, 1H) 1.90-1.98 (m, 1H) 2.45-2.55 (m, 1H) 7.38 (d, J=8.2 Hz, 2H) 7.73 (d, J=8.2 Hz, 2H)。
ジョーンズ試薬の製造:ジョーンズ試薬は、23mLの濃H2SO4中に26.7gのCrO3を溶解し、そしてこの混合物を水で100mLに希釈することによって製造された。
【0200】
中間体E(第二方法)
トランス−2−(4−シアノフェニル)シクロプロパンカルボン酸
【化11】

中間体F(11.6g,47.7mmol)をMeOH(55mL)中に溶解した。H2O(30mL)中のNaOH(5.7g,143.1mmol)の溶液を加え、そしてこの結果生じた混合物を70℃で4時間加熱した。室温に冷却した後、この混合物をその3分の1の量に濃縮し、50mLの0.5M NaOHを添加することによって希釈した。この結果生じた混合物をMTBE(2×25mL)で洗浄した。水層を分離し、そして濃HClを添加することによってpH1まで酸性にした。酸性にした水相をEtOAc(2×50mL)で抽出した。有機抽出物を集め、これをMgSO4上で乾燥し、ろ過し、そして蒸発・乾固した。この粗製物をフラッシュクロマトグラフィー(シリカ,DCM:MeOH 99:1〜90:10)によって精製すると、3.1g(36.4%)の中間体Eが固体として得られた。
1H NMR (400 MHz, CDCl3) δ ppm 1.37-1.46 (m, 1H) 1.47-1.55 (m, 1H) 1.87-1.98 (m,
1H) 2.43-2.49 (m, 1H) 7.38 (d, J=8 Hz, 2H) 7.74 (d, J=8 Hz, 2H) 12.43 (s, 1H)。
【0201】
中間体F
トランス−tert−ブチル 2−(4−シアノフェニル)シクロプロパンカルボキシラート
【化12】

トリメチルスルホキソニウムヨージド(37.9g,172.4mmol)を、窒素下にてDMSO(450mL)中に溶解した。ナトリウム tert−ブトキシド(16.5g,172.4mmol)を加え、そしてその結果生じた混合物を室温で2時間撹拌した。中間体G(20g,86.2mmol)を加え、そしてこの反応混合物を室温で16時間撹拌した。この反応混合物をMTBE(500mL)及びブライン(300mL)を連続して添加することによって希釈した。有機層を分離し、MgSO4上で乾燥し、ろ過し、そして蒸発・乾固した。粗生成物を、フラッシュクロマトグラフィー(シリカ,ヘプタン/EtOAc 95:5〜90:10)によって精製すると、11.6g(54%)の中間体Fが固体として得られた。
1H NMR (400 MHz, CDCl3) δ ppm 1.29-1.23 (m, 1H) 1.49 (s, 9H) 1.57-1.69 (m, 1H) 1.83-1.96 (m, 1H) 2.40-2.53 (m, 1H) 7.18 (d, J=8 Hz, 2H) 7.57 (d, J=8 Hz, 2H)。
【0202】
中間体G
(E)−tert−ブチル 3−(4−シアノフェニル)アクリラート
【化13】

磁気撹拌棒、温度計、添加漏斗及び窒素流入口を備えた火炎乾燥三つ口丸底フラスコにNaH(3.96g,94.7mmol)及び無水THF(120mL)を入れた。無水THF(20mL)に溶解したtert−ブチルジエチルホスホノアセタート(Tertbutyldiethylphosphono acetate)(23.2mL,94.7mmol)を30分間にわたって添加漏斗を介して滴下した。添加が完結した後、この反応混合物を室温で更に30分間撹拌した。無水THF(20mL)中に溶解した4−シアノベンズアルデヒド(11.3g,86.1mmol)の溶液を、30分間にわたって添加漏斗を介してこの反応混合物に滴下した。添加の終了後、この反応混合物を室温で1時間撹拌し、次いでMTBE(200mL)及び飽和NH4Cl(150mL)で希釈した。有機層を分離し、25mLのH2O及び25mLの飽和NH4Clで洗浄し、MgSO4上で乾燥し、ろ過し、そして蒸発・乾固すると、20.0g(100%)の中間体Gが固体として得られた。
1H NMR (400 MHz, CDCl3) δ ppm 1.56 (s, 9H) 6.47 (d, J=16 Hz, 1H) 7.58 (d, J=16 Hz, 1H) 7.61 (d, J=8 Hz, 2H) 7.68 (d, J=8 Hz, 2H)。
【0203】
中間体H
トランス−4−(2−(ヒドロキシメチル)シクロプロピル)ベンゾニトリル
【化14】

丸底フラスコに、中間体I(10.0g,44mmol)、ジメチルアセトアミド(125mL)、ヘキサシアノ鉄(II)酸カリウム三水和物(potassium hexacyanferrate (II) trihydrate)(24.2g,22mmol)、酢酸パラジウム(II)(palladium (II) acetate)(1.3g,2.2mmol)、DABCO(1.3g,4.4mmol)、及び炭酸ナトリウム(12.2g,44mmol)を入れた。この結果生じた混合物を、窒素下にて17時間、150℃に加熱した。この反応混合物を室温に冷却し、そしてシリカゲルパッドに通してろ過した。このパッドをEtOAc(200mL)で洗浄した。集められたろ液及び洗浄液を追加のEtOAc(200mL)で希釈し、ブライン(3×100mL)で洗浄し、MgSO4上で乾燥し、ろ過し、そして減圧下で濃縮した。この粗製物をカラムクロマトグラフィー(シリカ,DCM/MeOH 99:1)によって精製すると、10.5g(55%)の中間体Hが得られた。
1H NMR (400 MHz, CDCl3) δ ppm□ 1.00-1.15 (m, 2H) 1.47 -1.58 (m, 1H) 1.88-1.94 (m, 1H) 3.56-3.76 (m, 2H) 7.15 (d, J=8.5 Hz, 2H) 7.55 (d, J= 8.5 Hz, 2H)。
【0204】
中間体I
トランス−2−(4−ブロモフェニル)シクロプロピル)メタノール
【化15】

ヘキサン中のジエチル亜鉛(1.1M,695mL,765mmol)の溶液を、窒素下にて450mLのDCMを含んでいる火炎乾燥三つ口丸底フラスコに加えた。この結果生じた溶液を0〜5℃に冷却した。TFA(59mL,765mmol)を冷却したジエチル亜鉛溶液にゆっくり加えた。添加が完結した後、この結果生じた混合物を20分間撹拌した。50mLのDCM中のCH2I2(62mL,765mmol)の溶液をこの混合物に加えた。更に20分の撹拌後、450mLのDCM中の3−(4−ブロモフェニル)プロパ−2−エン−1−オール(81.6g,382.9mmol)の溶液を加えた。添加の完結後、この反応混合物を室温に暖め、そして2時間撹拌した。過剰の試薬を500mLの1M HClをゆっくり添加することによってクエンチした。上部の水層を分離し、そして200mLのDCMで抽出した。有機抽出物を集め、これを500mLの飽和NH4ClとNH4OH(9:1v/v)の混合物で洗浄し、MgSO4上で乾燥し、ろ過し、そして減圧下で濃縮した。粗製物を、フラッシュカラムクロマトグラフィー(シリカ,ヘプタン/EtOAc 10:1)によって精製すると、76.1g(87.5%)の中間体Iが固体として得られた。
1H NMR (400 MHz, CDCl3) δ ppm 0.90-1.00 (m, 2H) 1.36-1.48 (m, 1H) 1.75-1.85 (m,
1H) 3.62 (t, J=6 Hz, 2H) 6.95 (d, J=8.5 Hz, 2H) 7.38 (d, J=8.5 Hz, 2H)。
【0205】
中間体J
(R)−1−(4−ブロモ−フェニル)−2−クロロ−エタノール
【化16】

ジメチルスルフィドボラン(2.0kg,24.8moles,94%w/w)を、tジャケット(ジャケット温度)=20℃でトルエン(8L)中に混ぜ入れた。トルエン溶液として、(R)−(+)−メチル−CBS−オキサザボロリジン(2.6kg,2.74moles,1M)を加えた。この充填容器をトルエン(0.5L)でリンスし、そしてtジャケットを45℃に設定した。Jiangyan Keyan Fine Chemical Co. Ltdから商業的に入手可能である1−(4−ブロモ−フェニル)−2−クロロ−エタノン(7.84kg,33.6moles)を、別々の容器中で2−MeTHF(75L)中に溶解し、そして第一の容器中ではtインナー(内部(インナー:inner)温度)を40℃より高くして、2−MeTHF溶液を3時間にわたって加えた。後者の容器は2−MeTHF(2L)でリンスし、そしてそれをこの反応混合物に加え、これはtジャケット=45℃で1時間撹拌したままにした。試料を次のグラジエント法(移動相 20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動)を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。この反応混合物をtジャケット=10℃に冷却し、その後MeOH(36L)でゆっくりクエンチした。MeOHの1回目の分のリットルを30分間にわたって加え、そして残りを更に30分間にわたって加えた。MeOHを真空下にてtジャケット=50℃で留去した。残っている有機溶液をtジャケット=20℃に冷却し、H2O中の1M HCl(7L 濃HCl
+73L H2O)で洗浄し、そして真空下にてtジャケット=50℃でおよそ40Lまで濃縮した。2−MeTHF溶液中の得られた中間体Jは、10℃で20時間保管するか、あるいは次の合成工程で直ちに使用することができる。
【0206】
中間体K
(R)−2−(4−ブロモ−フェニル)−オキシラン
【化17】

Aliquat(登録商標)175(メチルトリブチルアンモニウムクロリド)(1.12kg,4.75moles)を、tジャケット=20℃で2−MeTHFの溶液(33.6moles,40L)としての中間体Jに加えた。H2O(2L)で希釈したNaOH(5.1kg,57.4moles,45%w/w)を20分にわたって加えた。この反応混合物をtジャケット=20℃で2時間撹拌したままにした。試料を次のグラジエント法[移動相 20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。水相を分離し、そして有機相をH2O(2×25L)で洗浄した。2−MeTHF(25L)を加え、そして有機相を真空下にてtジャケット=50℃でおよそ30Lまで濃縮した。2−MeTHF溶液中の得られた中間体Kは、5℃で140時間保管するか、あるいは次の合成工程で直ちに使用することができる。
【0207】
中間体L
(1S,2S)−2−(4−ブロモ−フェニル)−シクロプロパンカルボン酸
【化18】

トリエチルホスホノアセタート(Triethyl phosphonoacetate)(10.5L,51.9moles,98%w/w)を、tジャケット=−20℃で2−MeTHF(14L)中に溶解した。ヘキサン中のヘキシルリチウム(21L,48.3moles,2.3M)を、tインナー(内部温度)を0℃未満に維持する速度で加えた。充填容器を2−MeTHF(3L)でリンスし、そしてこの反応溶液をtジャケット=10℃で撹拌したままにした。2−MeTHF溶液(33.6moles,30L)としての中間体Kを20分にわたって加えた。この充填容器を2−MeTHF(2L)でリンスし、そしてこの反応溶液を、tジャケット=65℃で少なくとも16時間(但し、最後の3時間はtジャケット=75℃にした)撹拌したままにした。試料を次のグラジエント法[移動相20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、中間体(1S,2S)−2−(4−ブロモ−フェニル)−シクロプロパンカルボン酸エチルエステルへの完全な変換を示した。この反応溶液を、tジャケット=20℃に冷却した。H2O(12L)で希釈したNaOH(7.6kg,85.5moles,45%w/w)を20分にわたって加えた。得られた反応溶液をtジャケット=60℃で少なくとも2時間撹拌したままにした
。試料を次のグラジエント法[移動相 20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。この反応溶液を、tジャケット=20℃に冷却し、水相を分離し、そして有機相をH2O(37L)で抽出した。水相を集め、これをH2O(12.5L)中に希釈したH3PO4(9L,131moles,85%w/w)を用いて酸性にし、pH<3.5にした。希釈したH3PO4(水性)のうち17Lだけが、pH<3.5に達するのに使用された。この酸性の水相を2−MeTHF(2×15L)で抽出した。2−MeTHF(2L)でのリンス液を含めて集められた有機相を、真空下にてtジャケット=50℃でおよそ11Lまで濃縮した。この2−MeTHF溶液をtジャケット=35℃で、EtOH(14.5L)で希釈し、そしてH2O(16L)を20分にわたって加えた。この反応溶液を、tジャケット=28℃に冷却した。シード(16g,0.066moles)を加え、そしてこの溶液をtジャケット=28℃で2時間撹拌した。この反応混合物を6時間にわたってtジャケット=0℃に冷却し、そして少なくとも1時間撹拌したままにした。追加のH2O(8L)を40分にわたって加え、そしてこの生成物をろ別し、そして冷却したH2O(10L)で洗浄した。真空下にて40℃で乾燥すると、6.18kgの中間体L(21.5moles,84%w/w)が得られ、収率は7.84kgの1−(4−ブロモ−フェニル)−2−クロロ−エタノン(33.6moles)からの4工程にわたって64%であった。
【0208】
中間体Lの再結晶:中間体Lの2バッチ(6.18+7.04kg)を、EtOH(52L)に混ぜ入れ、tジャケット=70℃で加熱した。H2O(52L)を加えた。この反応溶液を、2.5時間にわたってtジャケット=30℃に冷却した。H2O(16L)を20分間にわたって加え、そして再結晶体を3時間にわたってtジャケット=20℃に冷却した。この生成物をろ別し、そしてH2O(8L)とEtOH(2L)の混合物で洗浄した。真空下にて40℃で乾燥すると、10.0kgの中間体L(41.5moles,88%w/w)が得られ、これをtジャケット=60℃でトルエン(39L)とイソオクタン(57L)中で再溶解した。透明な溶液が得られた。この反応溶液を、tジャケット=45℃に冷却し、そして1時間撹拌したままにし、次いで2時間にわたってtジャケット=20℃に冷却した。この生成物をろ別し、そしてトルエン(4L)とイソオクタン(36L)の混合物で2回に分けて洗浄した。真空下にて40℃で乾燥すると、7.4kgの中間体L(29.8moles,97%w/w)が得られ、収率は、7.84+7.93kgの1−(4−ブロモ−フェニル)−2−クロロ−エタノン(67.5moles)からの4工程にわたって44%であった。
1H-NMR (DMSO-d6): δ 12.36 (s, 1H), 7.44 (d, 2H, J=8 Hz), 7.13 (d, 2H, J=8 Hz), 2.39 (m, 1H), 1.81 (m, 1H), 1.43 (m, 1H), 1.33 (m, 1H);
13C-NMR (DMSO-d6): δ 173.76, 139.88, 131.20, 128.24, 119.14, 24.73, 24.31, 16.78;
LC-MS (ES): m/z 239 (M-1 (Br79)) 及び 241 (M-1 (Br81))。
Rt=5.03分[Xbridge C18,3.0×50mm,2.5μm 粒径による分析方法(移動相:5〜90%B;A:H2O(0.1%ギ酸を含む),B:CH3CN,8.6分稼動)]。この生成物を、Kromosil 3-Amycoat,150×4.6mm,3μm 粒径によって、アイソクラティック法(移動相:EtOH/イソヘキサン/TFA(15/85/0.1v/v/v))を用いてUV検出付きキラルカラムによって分析すると、エナンチオマー純度98.9%ee、Rt=5.29分(異性体1)及び5.97分(異性体2)が得られた。
【0209】
中間体M
(1S,2S)−2−(4−シアノ−フェニル)−シクロプロパンカルボン酸
【化19】

中間体L(3.7kg,14.9moles,97%w/w)及び亜鉛末(98%+,<10μm)(99g,1.51moles)を、DMF(13.5L)と混和し、そしてこのスラリーをtジャケット=20℃で撹拌した。この混合物を不活性化し、0.1〜0.2バールのN2圧にした。ビス(トリ−t−ブチルホスフィン)パラジウム(0)(27.5g,0.054moles)をこのスラリーに加え、そしてこの容器を不活性化し、0.1〜0.2バールのN2圧にした。この混合物をtジャケット=45℃に加熱し、Zn(CN)2(1.0kg,8.52moles)を1回でこの懸濁液に加え、そしてこの系を不活性化し、0.1〜0.2バールのN2圧にした(注:シアン化物塩は毒性が高い)。この結果生じた混合物をtジャケット=75℃に加熱し、そして少なくとも2時間撹拌した。試料を次のグラジエント法[移動相20〜95%B;A:5%CH3CN(0.05%ギ酸を含むH2O中),B:95%CH3CN(0.05%ギ酸を含むH2O中),8分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。この反応混合物をtジャケット=20℃に冷却した。チオール官能化シリカ(Silicycle社,SiliaBond Thiol)(1.07kg,28%w/w)を加え、そして容器を不活性化した。この反応混合物を、tジャケット=20℃で少なくとも36時間撹拌した。このスカベンジャーを活性炭又はその等価物(ポールフィルター:pall-filter)を含むフィルターを介してろ別した。この容器とフィルターシステムを2−MeTHF(53L)で洗浄した。ろ液及び洗浄液を集め、そそしてtジャケット=5℃で撹拌した。淡黄色液体が生じた。H2O(16.4L)中のNaCl(3.5kg)を内部温度が15℃未満に留まっているような速度で15分間にわたって加えた。この結果生じた反応混合物を、tジャケット=45℃に加熱し、そして水相を分離した。有機相をH2O中のNaHSO4×H2O(2×(2.87kg+16.4L))、及びH2O中のNaCl(3.5kg+16.4L)で洗浄した。有機相をtジャケット=10℃に冷却し、そしてH2O(41L)中に希釈したNaOH(1.54kg,19.3moles,50%w/w)を45分間にわたって加えた。この結果生じた反応混合物を、tジャケット=30℃に加熱し、そして有機相を分離した。水相を、tジャケット=20℃で撹拌し、そしてpHを、内部温度が25℃未満に維持される速度でH2O(5.3L)中に希釈したH3PO4(0.90kg,7.81moles,85%w/w)を加えて6.5に調整した。2−MeTHF及びH2Oを、真空下にて、蒸留の前の量の85〜90%の量、およそ8Lまで留去した。この反応混合物をtジャケット=0℃に冷却し、そしてH2O(8.2L)中に希釈したH3PO4(1.17kg,10.1moles,85%w/w)を、pH=4まで加えることを継続した。このスラリーを、tジャケット=10℃で終夜撹拌したままにした。この生成物をろ別し、H2O(2×4L)で洗浄した。真空下にて40℃で乾燥すると、中間体M(2.24kg,11.2moles,93.2%w/w)が収率75%で得られた。
1H-NMR (DMSO-d6): δ 12.45 (s, 1H), 7.72 (d, 2H, J=8 Hz), 7.37 (d, 2H, J=8 Hz), 2.50 (m, 1H), 1.94 (m, 1H), 1.50 (m, 1H), 1.42 (m, 1H);
13C-NMR (DMSO-d6): δ 173.51, 146.68, 132.27, 126.93, 118.97, 108.85, 25.16, 25.04, 17.44;
LC-MS (ESI): m/z 186 (M-1)。
Rt=3.63分[Xbridge C18,3.0×50mm,2.5μm 粒径による分析方法(移動相:5〜90%B;A:H2O(0.1%ギ酸を含む),B:CH3CN,8.6分稼動)]。
【0210】
中間体N
(1S,2S)−2−(4−カルバモイル−フェニル)−シクロプロパンカルボン酸
【化20】

中間体M(4.46kg,22.0moles,92.5%w/w)を、tジャケット=30℃でH2O(40L)中に混ぜ入れた。H2O(6L)中に希釈したNaOH(2.25kg,28.1moles,50%w/w)を、tインナー(内部(inner)温度)が35℃未満に留まるような速度で加えた。充填容器を、H2O(1L)でリンスした。pHが≧12でない場合には、更にNaOHを前と同じ濃度で加えた。過酸化水素(4.89kg,50.3moles,35%w/w)を、tインナーを35℃未満に維持するような速度で加えた。充填容器をH2O(1L)でリンスし、そしてこの反応スラリーを0.5〜1.0時間撹拌したままにした。試料を次のグラジエント法[移動相20〜95%B;A:5%CH3CN(0.05%ギ酸を含むH2O中),B:95%CH3CN(0.05%ギ酸を含むH2O中),8分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。この反応混合物をtジャケット=0℃に冷却し、少なくとも0.5時間撹拌したままにして温度を達しさせた。中間体Nのナトリウム塩をろ別し、そして冷却したH2O(2×7L)で洗浄した。この固体を、H2O(35L)中に希釈したNaHSO4×H2O(2.76kg,20.0moles)を含むフィルター上でスラリー洗浄した。スラリーをtジャケット=0℃で1時間撹拌し続けた。pHが<3.7でない場合には、H2O中のNaHSO4×H2Oを用いて調整した。この生成物をろ別し、冷却したH2O(3×14L)で洗浄した。真空下にて40℃で乾燥すると、4.0kgの中間体N(18.2moles,93.4%w/w)が得られた(収率83%)。
1H-NMR (DMSO-d6): δ 12.40 (s, 1H), 7.94 (s, 1H), 7.79 (d, 2H, J=8 Hz), 7.32 (s,
1H), 7.23 (d, 2H, J=8 Hz), 2.44 (m, 1H), 1.88 (m, 1H), 1.47 (m, 1H), 1.39 (m, 1H);
13C-NMR (DMSO-d6): δ 173.83, 167.67, 143.94, 132.17, 127.68, 125.73, 25.21, 24.67, 17.11;
LC-MS (ESI): m/z 206 (M+1)。
Rt=2.13分[Xbridge C18,3.0×50mm,2.5μm 粒径による分析方法(移動相:5〜90%B;A:H2O(0.1%ギ酸を含む),B:CH3CN,8.6分稼動)]。この生成物を、Kromosil 3-Amycoat,150×4.6mm,3μm 粒径によって、アイソクラティック法(移動相:EtOH/イソヘキサン/TFA(15/85/0.1v/v/v))を用いてUV検出付きキラルカラムによって分析すると、エナンチオマー純度>99%ee、Rt=13.40分(異性体1)及び22.22分(異性体2)が得られた。
【0211】
中間体O
(R)−1−シクロブチル−3−メチルピペラジン・2HCl
【化21】

Lanzhou Boc Chemical Co.から商業的に入手可能である(R)−Boc−2−メチルピペラジン(350g,1.71moles,98%w/w)を、tジャケット=20℃でEtOH(2.75L)中に溶解した。酢酸(1.37L)を1回で加え、引き続いてシクロブタノン(184g,2.57moles)を添加した。充填容器をEtOH(250mL)でリンスし、そして淡黄色溶液を、tジャケット=20℃で1時間撹拌したままにした。NaBH(OAc)3(497g,2.48moles,95%w/w)を、90分にわたって20回に分けて加えた。EtOH(340mL)をリンスするために使用した。この反応混合物を2時間撹拌したままにした。試料を、グラジエント法(60℃(2分),次いで25℃/分(8分間)、次いで260℃(2分))で、HP−5MSカラム(長さ 25m,ID 0.32mm,フィルム 0.52μm)を用いてGCによって分析した。ガスとしてヘリウム(He)を用い、フロント注入口温度=200℃、及び検出器温度=300℃であった。更にこの反応を1時間以内に完結するためにNaBH(OAc)3(30g,0.14moles)を加えた。この反応混合物をtジャケット=0℃に冷却し、その後5M NaOH(5.5L)でクエンチした。EtOHを真空下にてtジャケット=50℃で留去した。このH2O相をtジャケット=20℃において、トルエン(5.5L)で抽出した。有機相は、(R)−Boc−2−メチルピペラジン(300g,1.47moles,98%w/w)から開始し、第二のバッチと組み合わされた。有機相を集め、これを真空下にてtジャケット=50℃でおよそ2Lまで濃縮した。得られた中間体を含むトルエン溶液を数日間5℃で保管した。トルエン溶液を、tジャケット=10℃で2−プロパノール(2L)で希釈し、そして2−プロパノール(2L)中に希釈した、2−プロパノール(1.06L,6.36moles,6M)中のHClを30分にわたって加えた。この反応溶液を、tジャケット=48℃に加熱した。2−プロパノール(2L)中に希釈した、2−プロパノール(2.12L,12.72moles,6M)中のHClをtインナー(内部温度)=46℃で2時間にわたって加えた。この反応溶液を、tジャケット=48℃で更に3時間維持し、その後1時間にわたってtジャケット=0℃に冷却した。シード混合物(中間体O(0.2g,0.89mmoles)を含む0.4Lの反応溶液)を加えた。この反応混合物を、tジャケット=0℃で終夜撹拌したままにし、そしてこの生成物をろ別した。真空下にて40℃で乾燥すると、620gの中間体O(2.63moles,96.3%w/w)が収率83%で得られた。
1H-NMR (DMSO-d6): δ 12.46 (s, 1H), 10.13 (s, 2H), 3.35-3.74 (m, 6H), 3.09 (m, 1H), 2.92 (m, 1H), 2.39 (m, 2H), 2.16 (m, 2H), 1.72 (m, 2H), 1.32 (d, 3H, J=6.4 Hz);
13C-NMR (DMSO-d6): δ 58.50, 49.62, 48.13, 44.30, 24.48, 24.38, 15.25, 13.26。
【0212】
中間体P
4−((1S,2S)−2−((R)−4−シクロブチル−2−メチルピペラジン−1−カルボニル)シクロプロピル)ベンゾニトリル
【化22】

Arを泡立たせながら、NMP(100mL)中の中間体Q(8.5g,22.53mmol)の溶液に、亜鉛(0.737g,11.26mmol)、シアン化亜鉛(1.984g,16.90mmol)及びジクロロ[1,1’−ビス(ジ−t−ブチルホスフィノ)フェロセン]パラジウム(II)(0.335g,0.45mmol)を加えた。これを100℃で20時間加熱した。一部の出発物質は依然として存在していたので、加熱を更に24時間継続し、次いでこの反応物を冷却し、そして高真空下にて濃縮した。この物質を、EtOAc中に加え、そしてセライトろ過した。ろ液を濃縮し、2つの同重量の部分に分割し、それぞれの部分を、EtOAc/ヘプタン50〜100%のグラジエントで溶離する、120gのシリカゲルカラムによって精製すると、6.10g(84%)の中間体Pが提供された。この生成物をX-Bridge C18,2.1×30mm,5μm 粒径を使用して、高pHグラジエント法[移動相:5〜95%B;A:H2O(10mM NH4CO3及び0.375% NH4OH v/vを含む),B:CH3CN,2.25分稼動]を用いる分析HPLC MSによって分析した。
MS m/z 324.39 [M+H]+ (ESI), Rt 1.76分。
【0213】
中間体Q
((1S,2S)−2−(4−ブロモフェニル)シクロプロピル)((R)−4−シクロブチル−2−メチルピペラジン−1−イル)メタノン
【化23】

DMF(120mL)中の中間体R(第二方法)(5.87g,24.34mmol)の溶液に、0℃で、N,N−ジイソプロピルエチルアミン(21.20mL,121.72mmol)、1−ヒドロキシベンゾトリアゾール(4.93g,36.52mmol)、N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド塩酸塩(7g,36.52mmol)を加え、引き続いて中間体O(5.53g,24.34mmol)を添加した。次いで反応物を15時間撹拌し、この反応物を濃縮し、そして残留物をEtOAc中に加え、そして飽和NaHCO3溶液で洗浄した。水相をEtOAcで2回抽出し、そして有機物を集め、これをブラインで洗浄し、MgSO4上で乾燥し、ろ過し、そして濃縮した。この結果生じた油状物を、イスココンパニオン装置(ISCO Companion instrument)を用いて120g Redisepカラムを使用し、EtOAc/ヘプタン 20〜100%のグラジエントを用いる順相クロマトグラフィーによって精製すると、8.50g(93%)の中間体Qが放置するとゆっくり固体化する透明なガラス状物として提供された。1H-NMR (400 MHz, メタノール-d4) δ ppm 1.27 (br. s., 3H) 1.38 (br. s., 1H) 1.48-1.58 (m, 1H) 1.64-1.77 (m, 3H) 1.77-1.87 (m, 1H) 1.87-1.99 (m, 2H) 1.98-2.09 (m, 2H) 2.14-2.22 (m, 1H) 2.34 (br. s., 1H) 2.63-2.76 (m, 2H) 2.85 (dddd, J=11.43, 3.61, 1.95, 1.76 Hz, 1H) 2.90-3.01 (m, 1H) 3.40 (br. s., 1H) 4.03 (d, J=11.33 Hz, 1H) 4.31 (d, J=11.72 Hz, 1H) 4.39 (br. s., 1H) 4.64 (br. s., 1H) 7.09 (d, J=8.20 Hz, 2H) 7.41 (d, J=8.59 Hz, 2H)。
この生成物をX-Bridge C18,2.1×30mm,5μm 粒径を使用して、高pHグラジエント法[移動相:5〜95%B;A:H2O(10mM NH4CO3及び0.375% NH4OH v/vを含む),B:CH3CN,2.25分稼動]を用いる分析HPLC MSによって分析した。
MS m/z 277.31 [M+H]+ (ESI), Rt 2.10 分。
【0214】
中間体R
(1S,2S)−2−(4−ブロモ−フェニル)−シクロプロパンカルボン酸
【化24】

400mlのEtOH中の(トランス)−2−(4−ブロモフェニル)シクロプロパンカルボン酸[WO 2009/024823の82ページに記載されている方法に従って製造することができる](6.52g,27.04mmol)の撹拌溶液に、100mlのEtOH中、その後に25mlのH2O中に溶解した(R)−(+)−1−(1−ナフチル)エチルアミン(4.63g,4.37mL,27.04mmol)の溶液を加えた。これを室温で約4時間撹拌した。固形物をろ過によって回収し、そして40mlの冷却したEtOH/H2O(20/1)で洗浄すると、遊離の酸1.86gに相当する3.18グラムの塩が白色固形物(58%回収)として提供された。これを2N NaOH中に加え、そしてEtOAcで5回抽出した。水相をロータリーエバポレーターにセットし、残留しているEtOAcを除去した。この結果生じた透明な溶液をエルレンマイアーフラスコに移し、氷浴中で冷却し、そして撹拌しながら濃HClを滴下して、pH4にした。この結果生じた固形物をろ過により回収すると、1.63gの中間体Rが提供された。この生成物を、ChiralPak AD-H,10×250mm,5μm粒径を用いアイソクラティック法(移動相:25%MeOH(0.1%DMEAを含む),超臨界CO2)を用いてキラルSFC(UV検出)によって分析すると、エナンチオマー純度>95%、Rt 3.88分(異性体1)及び4.79分(異性体2)が得られた。
1H NMR (400 MHz, CDCl3) δ ppm 1.37 (ddd, J=8.20, 6.64, 4.69 Hz, 1H), 1.67 (ddd,
J=9.28, 5.08, 4.79 Hz, 1H), 1.87 (ddd, J=8.50, 4.69, 4.39 Hz, 1H), 2.48-2.63 (m, 1H), 6.87-7.06 (m, 2H), 7.37-7.46 (m, 2H)。
【技術分野】
【0001】
この開示は、少なくとも1つの4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミドの固体形態に関する。この開示はまた、本明細書中で述べられている少なくとも1つの固体形態を含む少なくとも1つの医薬組成物、それから成る固体形態及び医薬組成物の使用方法及び固体形態を製造する方法に関する。
【背景技術】
【0002】
薬物製剤を製剤化する際には、活性な薬物物質が、取り扱い、処理が好都合であることが可能な形であることが望ましい。このことは商業上実行可能な製造方法を得るという視点のみならず、その後、活性な薬物物質を含む医薬組成物を製造する視点からも重要である。更に、薬物組成物を製造する際は、信頼でき、再現性があり、かつ一定の薬物血漿濃度プロフィールが患者に投与した後に提供されることが望ましい。
【0003】
活性成分の化学的安定性、固体状態安定性、及びシェルフライフもまた、望ましいファクターである。薬物物質、及びそれを含有する組成物は、好ましくは、活性成分の物理化学的特性(例えば、その化学組成物、濃度、吸湿性及び溶解性)において大幅な変化を示すことなく、相当な期間にわたって有効に貯蔵されることが可能であるべきである。更に、可能な限り化学的に純粋である形態の薬物物質が提供されることが望ましい。
【0004】
また、ある場合には、例えば、取り扱いが容易であること、適切な医薬製剤の調製が容易であること、及びより信頼性のある溶解性プロフィールなどの具体的な望ましい特性を利用可能にしうる、薬物の有利な固体形態(複数を含む)が提供されることが望ましい。
【0005】
例えば、安定性、溶解性、処理可能性、及び生物学的利用性などの1つ又は複数の有利な物理特性を有する、4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミドの固体形態(複数を含む)の必要性が存在している。
【図面の簡単な説明】
【0006】
【図1】化合物IのフォームIの粉末X線回折(XRPD)パターンを示す。
【図2】化合物IのフォームIの示差走査熱量計(DSC)サーモグラムを示す。
【図3】化合物IのフォームIの熱重量分析(TGA)サーモグラムを示す。
【図4】化合物IのフォームIの動的水蒸気収着(DVS)等温線プロットを示す。
【図5】化合物IのフォームIの13C交差分極マジック角スピニング(CPMAS)固体核磁気共鳴(SS−NMR)スペクトルを示す。
【図6】化合物IのフォームIのフーリエ変換赤外(FT−IR)スペクトル(上側)及びFTラマンスペクトル(下側)を示す。
【発明の概要】
【課題を解決するための手段】
【0007】
本明細書中の実施形態は、下記:
【化1】

に示される、化学名:4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミド及び化学構造(I)によって説明される、“化合物I(Compound I)”の固体形態に関する。
【0008】
本明細書中に述べられている更なる実施形態は、本明細書に述べられている少なくとも1つの固体形態を含む少なくとも1つの医薬組成物、本明細書中に述べられている固体形態及び医薬組成物の使用方法、及び固体形態を製造する方法に関する。
【0009】
1つの実施形態は、実質的に結晶性である化合物Iの固体形態を提供する。用語“実質的に結晶性の(substantially crystalline)”は、重量ベースで20%より高い、30%より高い、40%より高い、50%より高い、60%より高い、70%より高い、80%より高い、90%より高い、95%より高い、97%より高い、98%より高い、又は99%より高い結晶化度であることを含んでいる。
【0010】
別の実施形態は、部分的に結晶性である化合物Iの固体形態を提供する。用語“部分的結晶性(partially crystalline)”は、重量で20%より低い、10%より低い、又は5%より低い結晶化度であることを含んでいる。結晶化度の程度(%)は、種々の手法[例えば、XRPD、SS−NMRスペクトロスコピー、FT−IRスペクトロスコピー、FT−ラマンスペクトロスコピー、DSC熱分析、TGA分析、微量熱量測定(microcalorimetry)、及びDVS分析を含むがこれらに限定されない]を用いて、当業者によって決定することができる。
【0011】
更に別の実施形態では、実質的に純粋である化合物Iの固体形態が提供される。特定の実施形態では、用語“実質的に純粋である(substantially pure)”は、化合物I以外の化学化合物に対して重量ベースで、50%を超えて化学的に純粋である、60%を超えて化学的に純粋である、70%を超えて化学的に純粋である、80%を超えて化学的に純粋である、90%を超えて化学的に純粋である、95%を超えて化学的に純粋である、98%を超えて化学的に純粋である、又は99%を超えて化学的に純粋である化合物Iの固体形態の試料を含んでいる。化学的純度の程度(%)は、種々の手法[例えば、NMRスペクトロスコピー、高性能液体クロマトグラフィー(HPLC)、質量分析法(MS)、及び元素分析(例えば、燃焼分析)を含むがこれらに限定されない]を用いて、当業者によって決定されうる。特定の実施形態では、用語“実質的に純粋である(substantially pure)”は、選択された固体形態以外の固体形態(例えば、他の結晶形態又は非晶形態)に対して重量ベースで、50%を超えて物理的に純粋である、60%を超えて物理的に純粋である、70%を超えて物理的に純粋である、80%を超えて物理的に純粋である、90%を超えて物理的に純粋である、95%を超えて物理的に純粋である、98%を超えて物理的に純粋である、又は99%を超えて物理的に純粋である固体形態の選択された固体形態の試料を含んでいる。物理的純度の程度(%)は、種々の手法[例えば、XRPD、SS−NMRスペクトロスコピー、FT−IRスペクトロスコピー、FT−ラマンスペクトロスコピー、DSC熱分析、TGA分析、微量熱量測定、及びDVS分析を含むがこれらに限定されない]を用いて、当業者によって決定されうる。
【0012】
更に別の実施形態は、化合物IのフォームIである固体形態を提供する。代表的な形態I物質のXRPDパターン、DSCサーモグラム、TGAサーモグラム、DVS等温線プロット、SS−NMRスペクトル、FT−IRスペクトル、及びFT−ラマンスペクトルが、図1〜6に示されている。特定の実施形態では、化合物Iの形態Iは、実質的に結晶性である。他の特定の実施形態では、化合物Iの形態Iは、実質的に純粋である。更に他の特定の実施形態では、化合物Iの形態Iは、実質的に結晶性であり、かつ実質的に純粋である。
【0013】
その上更に別の実施形態は、表1に実質的に明確にされているピークを含んでなるXRPDパターンを有する化合物Iの形態Iに関する。
【0014】
測定条件(使用する機器、試料調製又は機械など)によって1つ若しくは複数の測定エラーがあるXRPDパターンが得られうることは当技術分野で知られている。特に、XRPDパターンの強度は、測定条件及び試料調製によって変動しうるということが一般に知られている。例えば、XRPDの技術分野の当業者は、ピークの相対強度は、試験されている試料の配向方向、及び使用される機器のタイプ及び設定によって変化しうることを理解している。当業者はまた、反射の位置が、試料が回折計の中で置かれている正確な高さによって、そして回折計のゼロキャリブレーションによって影響されうることを理解している。試料の表面の平面度もまた少しの影響を与えうる。それ故、当技術分野の当業者であれば、本明細書中で供されている回折パターンデータは、絶対的なものであると解釈されるべきではなく、そして本明細書中に開示されているものと実質的に同一であるXRPDパターンを提供している結晶形態であればいかなるものでもこの開示の範囲内に入るものと理解するであろう。更に当技術分野の当業者は、XRPDの2θ値は、合理的な範囲[例えば、±0.1°2θ〜±0.2°2θの範囲内]によって変化しうることを理解する。XRPDの原理については、例えば、Giacovazzo, C. et al. (1995), Fundamentals
of Crystallography, Oxford University Press; Jenkins, R. and Snyder, R. L. (1996), Introduction to X-Ray Powder Diffractometry, John Wiley & Sons, New York; 及び Klug, H. P. & Alexander, L. E. (1974), X-ray Diffraction Procedures, John Wiley and Sons, New Yorkなどの文献中に記載されている。
【0015】
更なる実施形態は、図1に示されているXRPDパターンを本質的に有している化合物IのフォームIに関する。
【0016】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0017】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の1個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0018】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の2個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0019】
別の実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の3個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0020】
更に別の実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の4個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0021】
また更に別の実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の5個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0022】
なおまた更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の6個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0023】
なおまた更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の7個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0024】
更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の8個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0025】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのうちで任意の9個のピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0026】
また更なる実施形態は、約1.54オングストロームの波長を有する放射線を用いて測定したときに、次の10個の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのピークを含む、XRPDパターンを有する化合物IのフォームIに関する。
【0027】
別の実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θから選択される少なくとも1個のピークを含むXRPDパターンを有する。
【0028】
更なる実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θから選択される少なくとも2個のピークを含むXRPDパターンを有する。
【0029】
一実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約18.0°2θにおけるピークを含むXRPDパターンを有する。
【0030】
更なる実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約16.3及び約19.3°2θにおけるピークを含むXRPDパターンを有する。
【0031】
別の実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約18.0及び約19.3°2θにおけるピークを含むXRPDパターンを有する。
【0032】
更に別の実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5及び約18.0°2θにおけるピークを含むXRPDパターンを有する。
【0033】
また更に別の実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、約18.0及び約19.3°2θにおけるピークを含むXRPDパターンを有する。
【0034】
また更なる実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、約16.3、約18.0及び約19.3°2θにおけるピークを含むXRPDパターンを有する。
【0035】
なおまた更なる実施形態では、化合物IのフォームIは、約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、約16.3、約18.0、19.3、約20.9、及び約21.4°2θにおけるピークを含むXRPDパターンを有する。
【0036】
別の実施形態は、図2に示されているDSCサーモグラムを本質的に有している化合物IのフォームIに関する。
【0037】
DSCの立ち上がり及びピーク温度、並びにエネルギー値は、例えば、試料の純度及び試料サイズによって変化しえ、そして機器パラメーター、特に温度スキャン速度(temperature scan rate)によって変化しうることは周知である。それ故、提供されているDSCデータは絶対値として理解されるべきではない。当技術分野の当業者であれば、示差走査熱量計の機器パラメーターを、本明細書で供されるデータと同程度のデータが標準方法、例えば、Hoehne, G. W. H. et al (1996), Differential Scanning Calorimetry, Springer, Berlin中に記載されている方法によって収集できるように設定することができる。
【0038】
別の実施形態では、化合物IのフォームIは、約133.5℃の立ち上がり温度を持つ吸熱事象を含んでなるDSCサーモグラムを有している。
【0039】
更に別の実施形態では、化合物IのフォームIは、約135.3℃のピーク温度を持つ吸熱事象を含んでなるDSCサーモグラムを有している。
【0040】
また更に別の実施形態では、化合物IのフォームIは、約20℃と約130℃の間で顕
著な吸熱事象を示さないDSCサーモグラムを有している。
【0041】
更なる実施形態は、図3に示されているTGAサーモグラムを本質的に有している化合物IのフォームIに関する。
【0042】
TGAトレースは、例えば、試料サイズによって、そして機器パラメーター、殊に、温度スキャン速度によって変化しうることは周知である。それ故、提供されているTGAデータは、絶対的な値であると受け取るべきではない。
【0043】
一実施態様では、化合物IのフォームIは、約20℃〜約100℃に加熱したときに、試料の総重量の約1%未満(例えば、約0.75%未満、約0.5%未満、約0.25%未満、又は約0%)の重量減少を含んでなるTGAサーモグラムを有する。
【0044】
更なる実施形態では、化合物IのフォームIは、約100℃〜約160℃に加熱したときに、試料の総重量の約1%未満(例えば、約0.75%未満、約0.5%未満、約0.25%未満、又は約0%)の重量減少を含んでなるTGAサーモグラムを有する。
【0045】
別の実施形態では、化合物IのフォームIは、実質量の溶媒(例えば、水、酢酸エチル(EtOAc)、及び/又はアセトニトリル(ACN))を含有していない。特定の実施形態では、化合物IのフォームIは、重量ベースで、約3%未満、約2%未満、約1%未満、約0.75%未満、約0.5%未満、約0.25%未満、又は約0.1%未満の溶媒(例えば、水、EtOAc、及び/又はACN)を含む。
【0046】
更に別の実施形態では、化合物IのフォームIは溶媒和化していない。
【0047】
更に別の実施形態では、化合物IのフォームIは無水物である。
【0048】
また更なる実施形態は、図4に示されているDVS等温線プロットを本質的に有している化合物IのフォームIに関する。
【0049】
DVS等温線プロットは、例えば、試料の純度及び試料サイズによって、そして機器パラメーター、殊に実験の間に使用される平衡基準設定によって変化しうることは周知である。それ故、提供されているDVSデータは、絶対的な値であると受け取るべきではないということは当技術分野の当業者であれば理解できる。
【0050】
その上また更なる実施形態では、化合物IのフォームIは、約周囲温度で約0%相対湿度(RH)〜約90%RHに上昇させたとき、試料の総質量の約3%未満(例えば、約2.5%未満、約2%未満、約1.5%未満、又は1%未満)の質量増加を含んでなるDVS等温線プロットを有する。
【0051】
その上また更なる実施形態では、化合物IのフォームIは、約周囲温度で約0%RH〜約90%RHに上昇させたとき、試料の総質量の約1.2%と約1.6%の間(例えば、約1.4%)の質量増加を含んでなるDVS等温線プロットを有する。
【0052】
更にその上また更なる実施形態では、化合物IのフォームIは、約周囲温度で約0%RH〜約70%RHに上昇させたとき、試料の総質量の約2%未満(例えば、約1.5%未満、約1%未満、又は約0.5%未満)の質量増加を含んでなるDVS等温線プロットを有する。
【0053】
また更なる実施形態は、図5に示されているCP−MAS SS−NMRスペクトルを本質的に有している化合物IのフォームIに関する。
【0054】
更なる実施形態では、化合物IのフォームIは、次のppm値:約171.06;約144.17;約131.76;約127.53;約60.47;約54.52;約52.92;約51.56;約50.78;約45.95;約45.04;約40.79;約28.50;約24.58;約23.71;約18.13;約15.75;約15.29;約14.37;約13.67;及び約13.11ppmのうちで任意の1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個又はそれより多くの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0055】
また更なる実施形態では、化合物IのフォームIは、約171.1ppm、約144.2ppm、及び約131.8ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0056】
またなお更なる実施形態では、化合物IのフォームIは、約60.5ppm及び約40.8ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0057】
なお更なる実施形態では、化合物IのフォームIは、約28.5ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0058】
またなお更なる実施形態では、化合物IのフォームIは、約18.1ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0059】
更に別の実施形態では、化合物IのフォームIは、約14.4ppm、約13.7ppm、及び約13.1ppmの位置でピークを示すCP−MAS SS−NMRスペクトルを有している。
【0060】
別の実施形態は、図6(上側のスペクトル)に示されているFT−IRスペクトルを本質的に有している化合物IのフォームIに関する。
【0061】
別の実施形態では、化合物IのフォームIは、約3378.97cm-1でピークを示すFT−IRスペクトルを有する。
【0062】
更に別の実施形態では、化合物IのフォームIは、約3171.70cm-1でピークを示すFT−IRスペクトルを有する。
【0063】
また更に別の実施形態では、化合物IのフォームIは、約2939.02cm-1でピークを示すFT−IRスペクトルを有する。
【0064】
またなお更なる実施形態では、化合物IのフォームIは、約2808.65cm-1でピークを示すFT−IRスペクトルを有する。
【0065】
更に別の実施形態では、化合物IのフォームIは、約1646.80cm-1でピークを示すFT−IRスペクトルを有する。
【0066】
更に別の実施形態では、化合物IのフォームIは、約1607.63cm-1でピークを示すFT−IRスペクトルを有する。
【0067】
なお更なる実施形態では、化合物IのフォームIは、約1567.34cm-1でピークを示すFT−IRスペクトルを有する。
【0068】
なお更なる実施形態では、化合物IのフォームIは、約1414.45cm-1でピークを示すFT−IRスペクトルを有する。
【0069】
なお更なる実施形態では、化合物IのフォームIは、約1234.13cm-1でピークを示すFT−IRスペクトルを有する。
【0070】
またなお更なる実施形態では、化合物IのフォームIは、約1055.18cm-1でピークを示すFT−IRスペクトルを有する。
【0071】
一実施形態では、化合物IのフォームIは、約798.42cm-1でピークを示すFT−IRスペクトルを有する。
【0072】
別の実施態様は、図6(下側のスペクトル)に示されているFT−ラマンスペクトルを本質的に有している化合物IのフォームIに関する。
【0073】
更なる実施形態では、化合物IのフォームIは、約3070.22cm-1でピークを示すFT−ラマンスペクトルを有する。
【0074】
また更なる実施形態では、化合物IのフォームIは、約3006.28cm-1でピークを示すFT−ラマンスペクトルを有する。
【0075】
またなお更なる実施形態では、化合物IのフォームIは、約2940.36cm-1でピークを示すFT−ラマンスペクトルを有する。
【0076】
またなお更なる実施形態では、化合物IのフォームIは、約2867.12cm-1でピークを示すFT−ラマンスペクトルを有する。
【0077】
更に別の実施形態では、化合物IのフォームIは、約2808.64cm-1でピークを示すFT−ラマンスペクトルを有する。
【0078】
更に別の実施形態では、化合物IのフォームIは、約2767.97cm-1でピークを示すFT−ラマンスペクトルを有する。
【0079】
また更に別の実施形態では、化合物IのフォームIは、約1614.44cm-1でピークを示すFT−ラマンスペクトルを有する。
【0080】
また更なる実施形態では、化合物IのフォームIは、約1562.48cm-1でピークを示すFT−ラマンスペクトルを有する。
【0081】
また更なる実施形態では、化合物IのフォームIは、約1219.17cm-1でピークを示すFT−ラマンスペクトルを有する。
【0082】
またなお更なる実施形態では、化合物IのフォームIは、約1144.15cm-1でピークを示すFT−ラマンスペクトルを有する。
【0083】
またなお更なる実施形態では、化合物IのフォームIは、約867.54cm-1でピークを示すFT−ラマンスペクトルを有する。
【0084】
また更になお更なる実施形態では、化合物IのフォームIは、約834cm-1でピークを示すFT−ラマンスペクトルを有する。
【0085】
また更になお更なる実施形態では、化合物IのフォームIは、約803.77cm-1でピークを示すFT−ラマンスペクトルを有する。
【0086】
一実施形態では、本明細書中で提供される固体形態は1つ又は複数の有利な特性を有する。例えば、いくつかの実施形態では、式IのフォームIは、例えば、融点が高いこと、溶媒(例えば、水)含量が実質的にないこと、加熱しても重量減少がほとんどないか、又はないこと、及び/又は吸湿性が低いことなどの有利な特性を示す。いくつかの実施形態では、こうした特性は好都合にも、化合物Iの製造、貯蔵、製剤化、及び/又は送達を容易にする。
【0087】
本明細書中で提供されるある種の固体形態は、安定性に関して有利な特性を提供する。本明細書中で使用される、用語“安定性(stability)”とは、化学的安定性及び固体状態安定性を含んでいる。
【0088】
化学的安定性は、単離物質として、及び/又は製薬学的に許容される担体、希釈剤又は補助剤と混和して提供される固体製剤の一部分として(例えば、錠剤、カプセル剤などの経口投与剤形中)、通常の貯蔵条件のもとで、わずかな程度の化学的劣化又は分解で固体形態を貯蔵する能力を含む。
【0089】
固体状態安定性は、単離物質として、及び/又は製薬学的に許容される担体、希釈剤又は補助剤(例えば、錠剤、カプセル剤などの経口投与剤形中)と混和して提供される製剤の一部分として、通常の貯蔵条件のもとで、わずかな程度の固体状態変換(例えば、結晶化、再結晶、固体状態相転移、水和、脱水、溶媒和作用、及び/又は脱溶媒和)で固体形態を貯蔵する能力を含む。
【0090】
“通常の貯蔵条件(normal storage conditions)”の一例としては、長期間(例えば、6ヶ月より長いか、あるいは6ヶ月間)にわたり、−80℃と50℃の間の温度(例えば、0℃と40℃の間の温度、又は約15℃と約30℃の間の温度のような約室温)であること、0.1と2バールの間の圧力(例えば、大気圧)であること、5%と95%の間(例えば、10%〜60%RH)の相対湿度(“RHs”)であること、及び/又は460ルクスのUV/可視光に曝されることが含まれる。こうした条件のもとで、本明細書で提供される固体形態は、適切な場合に、化学的劣化/分解あるいは固体状態変換が15%未満、10%未満、又は5%未満であるということが判明しうる。当業者であれば、上記に言及した温度、圧力、及びRHの上限及び下限は、通常の貯蔵条件の両極端を表しており、そしてこうした極端のある種の組み合わせについては、通常の貯蔵(例えば、50℃の温度、及び0.1バールの圧力)時には体験する可能性がないということを理解するであろう。
【0091】
固体形態の調製方法
更なる実施形態は、本明細書中で提供されている固体形態を調製する方法を提供する。そのもとで固体形態が調製されうる別の条件は、本明細書中に提供されている情報を、当技術分野で知られている手法及び方法と組み合わせて使用して当業者によって決定することができる。実験温度及び時間は、単離すべき固体形態、溶液中の化合物の濃度、及び使用する溶媒系に左右される。結晶化は、標準的手法[例えば、固体形態の結晶を用いてシーディングするか、それともしない]によって開始及び/又は実施しうる。
【0092】
本明細書中のある実施形態は、化合物IのフォームIを調製する方法に関する。ある実施形態では、フォームIは、化合物Iを1つ又は複数の適切な溶媒中に溶解させ、そしてフォームIを単離することを含んでなる方法によって調製される。ある実施形態では、フォームIは、化合物Iを1つ又は複数の適切な溶媒中に懸濁させ、そしてフォームIを単離することを含んでなる方法によって調製される。ある実施形態では、この懸濁は周囲温度で行なわれる。ある実施形態では、この懸濁は約3日間行なわれる。ある実施形態では、単離された化合物IのフォームIは、空気乾燥される。ある実施形態では、本明細書中で提供される方法のための出発化合物I成分は、化合物Iの非晶質固体形態である。ある実施形態では、適切な溶媒は、EtOAc又はACN又はその混合物から選択される。
【0093】
ある実施形態では、化合物IのフォームIを調製する方法で使用する適切な溶媒は、極性非プロトン性溶媒類(例えば、DMSO、DMF);アセタート類(例えば、C1-6−アルキルアセタート、酢酸エチル、酢酸イソプロピル);アルコール類(例えば、低級アルキルアルコール、直鎖状又は分岐鎖状C1-6−アルキルアルコール、メタノール、エタノール、イソプロパノール、1−プロパノール);炭化水素類(例えば、脂肪族及び芳香族炭化水素、C6-12−脂肪族炭化水素、C6-10−芳香族炭化水素、n−ヘプタン);エーテル類(例えば、ジアルキルエーテル、ジ−C1-6−アルキルエーテル、ジエチルエーテル);ケトン類(例えば、ジアルキルケトン、ジ−C1-6−アルキルケトン、アセトン、メチルイソブチルケトン);ニトリル類(例えば、アセトニトリル);塩素化溶媒類(例えば、塩素化アルカン、塩素化メタン、塩素化エタン、ジクロロメタン);水性溶媒類(例えば、水又は水を含有する溶媒);及びその混合物から選択されうる。
【0094】
本明細書中で提供される固体形態は、本明細書中で述べられている方法と同様、及び/又は本明細書中の実施例に従って調製することができ、そしてこうした類似な方法によって調製された固体形態は、本明細書中で開示されているのと本質的に同じXRPD特性を示しうるということは当業者が理解しているところである。データ間の比較(例えば、2つのXRPDパターン)の一部として使用する際に、用語“本質的に(essentially)”とは、関連するデータから、例えば、実験エラー及び試料間の変動を斟酌して、それらが同じ固体形態に該当することが当業者にとって明瞭であるときに、そうした例を含んでいる。
【0095】
固体形態の使用方法
一実施形態では、本明細書中で述べられている化合物Iから成る少なくとも1つの固体形態は、少なくとも1つのヒスタミンH3受容体をモジュレートするために使用することができる。本明細書中で使用される際には、用語“モジュレートする(modulate)”、“モジュレートする(modulates)”、“モジュレートすること(modulating)”、又は“モジュレーション(modulation)”とは、例えば、少なくとも1つのヒスタミンH3受容体を活性化すること(例えば、アゴニスト活性)、又は阻害すること(例えば、アンタゴニスト及びインバースアゴニスト活性)を意味する。一実施形態では、本明細書中で述べられている少なくとも1つの固体形態を、少なくとも1つのヒスタミンH3受容体のインバースアゴニストとして使用することができる。別の実施形態では、本明細書中で述べられている少なくとも1つの固体形態を、少なくとも1つのヒスタミンH3受容体のアンタゴニストとして使用することができる。別の実施形態では、本明細書中で述べられている少なくとも1つの固体形態を、少なくとも1つのヒスタミンH3受容体のアンタゴニストとして使用することができる。更に別の実施形態では、本明細書中で述べられている少なくとも1つの固体形態を、少なくとも1つのヒスタミンH3受容体のアンタゴニストとして使用することができる。
【0096】
本明細書中で述べられている少なくとも1つの固体形態は、ヒスタミンH3受容体をモジュレートすることが有益である、1つ若しくは複数の広範囲の状態又は障害を処置するのに使用することができる。本明細書中で述べられている少なくとも1つの固体形態は、例えば、中枢神経系、末梢神経系、心血管系、肺系、胃腸系、又は内分泌系の中で少なくとも1つの疾患を処置するのに有用でありうる。
【0097】
別の実施形態では、少なくとも1つのヒスタミンH3受容体の機能をモジュレートすることが有益である障害の処置方法であって、治療的に有効な量の化合物IのフォームIをそうした処置を必要とする温血動物に投与することを含んでなる、上記方法を提供する。
【0098】
一実施形態は、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の処置のための薬剤の製造における、化合物IのフォームIの使用に関する。
【0099】
別の実施形態は、統合失調症、ナルコレプシー、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の処置のための薬剤の製造における化合物IのフォームIに使用に関する。
【0100】
更なる実施形態は、そうした治療を必要とする温血動物における、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の治療方法であって、その方法が治療的に有効な量の化合物IのフォームIを動物に投与することを含んでなる、上記方法に関する。
【0101】
また更なる実施形態は、そうした治療を必要とする温血動物における、統合失調症、ナルコレプシー、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の処置方法であって、その方法が治療的に有効な量の化合物IのフォームIを動物に投与することを含んでなる、上記方法に関する。
【0102】
更なる実施形態は、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される少なくとも1つの障害の処置方法であって、その方法によって、医学的に、かつ薬理学的に有効な量の化合物IのフォームIを相した処置を必要とする対象に投与する、上記方法に関する。
【0103】
化合物IのフォームIは、少なくとも1つの自己免疫障害を処置するために有用でありうる。
【0104】
例示的な自己免疫障害には、例えば、関節炎、皮膚移植、臓器移植及び同様な外科的ニーズ、膠原病、種々のアレルギー、腫瘍及びウイルス性疾患(viruses)が含まれるが、これらに限定されない。
【0105】
化合物IのフォームIは、少なくとも1つの精神障害を処置するために有用でありうる。
【0106】
例示的な精神障害には、一例を示せば、例えば統合失調感情障害、妄想性障害、一時的精神病性障害、共有精神病性障害、及び全身身体状態による精神病性障害(Psychotic Disorder(s) Due to a General Medical Condition)などの精神病性障害及び統合失調症障害;認知症及び他の認知障害;例えば、広所恐怖症を伴わないパニック障害、広所恐怖症を伴うパニック障害、パニック障害の既往歴のない広所恐怖症、特定の恐怖症、社会恐怖症、強迫性障害、ストレス関連性障害、心的外傷後ストレス障害、急性ストレス障害、全般性不安障害及び全身身体状態による全般性不安障害などの不安障害;気分障害、例えば、a)うつ病性障害[例えば、大うつ病性障害(うつ病、大うつ病、気分安定(mood stabilization)及び/又はアパチー(apathy)、及び気分変調性障害(dysthymic disorder)を含む)などを含むが、これらに限定されない]、b)例えば、双極性I型(これは、躁病、うつ病又は混合性エピソードを伴うものを含むが、これらに限定されない)、双極性II型などの、双極性うつ病及び/又は双極性躁病(Bipolar mania)及び双極性障害の維持(Bipolar Maintenance)、c)気分循環性障害(Cyclothymiac's Disorder(s))、及びd)全身身体状態による気分障害;例えば、日中過眠、ナルコレプシー、睡気過多、及び睡眠時無呼吸などの睡眠障害;例えば、精神遅滞、ダウン症候群、学習障害、運動機能障害、意思疎通障害、広汎性発達障害、注意力欠損及び破壊的行動障害、乳児又は小児期早期の哺育及び摂食障害、チック障害、並びに排泄障害を含むが、これらに限定されない、通例、乳児期、小児期又は青年期に最初に診断される障害;例えば、薬物依存(substance Dependence)、薬物乱用、薬物中毒、薬物離脱(substance withdrawal)、アルコール関連障害、アンフェタミン(又はアンフェタミン様)関連障害、カフェイン関連障害、大麻関連障害、コカイン関連障害、幻覚剤関連障害、吸入剤関連障害、ニコチン関連障害、オピオイド関連障害、フェンシクリジン(又はフェンシクリジン様)関連障害、及び鎮静剤、催眠薬又は抗不安薬関連障害を含むがこれらに限定されない薬物関連障害;注意力欠損及び破壊的行動障害;例えば、肥満などの摂食障害;例えば、強迫性人格障害を含むがこれに限定されない人格障害;衝動調節障害;例えば、トゥレット障害、慢性運動性又は音声チック障害を含むが、これらに限定されないチック障害;及び一過性チック障害が含まれるがこれらには限定されない。上記の精神障害の少なくとも一つは、例えば、米国精神医学会:精神障害の診断と統計の手引き,第4版,改訂版,ワシントン,DC,米国精神医学会,2000年(American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, Text Revision, Washington, DC, American Psychiatric Association, 2000)中に定義されている。
【0107】
化合物IのフォームIは、i)肥満又は体重過多(例えば体重減少の促進及び体重減少の維持)、摂食障害(例えば、過食、拒食症、過食症及び強迫)、及び/又は渇望(薬物、タバコ、アルコール、食欲をそそるあらゆる主要栄養素又は非必須食品に対する)の処置;ii)体重増加(例えば、薬物誘発性又は禁煙後)の防止;及び/又はiii)食欲及び/又は満腹の調節に有用でありうる。本明細書中で述べられている少なくとも1つの固体形態は、食欲及び体重を減らし、及び/又は体重減少を維持し、そしてリバウンドを防止することによって肥満の治療に適切でありうる。本明細書中で述べられている少なくとも1つの固体形態は、薬物誘発による体重増加、例えば抗精神病剤(神経弛緩薬)処置によって引き起こされる体重増加;及び/又は禁煙に伴う体重増加を防止又は後退させるのに使用しうる。
【0108】
化合物IのフォームIは、少なくとも1つの神経変性障害を処置するのに有用でありうる。
【0109】
例示的な、神経変性障害には、例えば、認知障害又は認知欠損をもつ兆候に関連する状態:例えば、認知症;以下を含む、初老期認知症(早期発症型アルツハイマー病);老人性認知症(アルツハイマー型認知症);アルツハイマー病(AD);家族性アルツハイマー病;初期のアルツハイマー病;軽度から中等度のアルツハイマー型認知症;アルツハイマー病の疾患進行の遅延;アルツハイマー病に関連する神経変性症、軽度認知機能障害(MCI);健忘型軽度認知機能障害(aMCI);加齢関連性記憶障害(AAMI);レビー小体型認知症;血管性認知症(VD);HIV−認知症;AIDS認知症症候群;AIDS−神経合併症(AIDS - Neurological Complications);前頭側頭型認知症(FTD);前頭側頭型認知症・パーキンソン型(Frontotemporal dementia Parkinson's Type)(FTDP);ボクサー認知症;感染因子又は代謝障害による認知症;変性起源による認知症(dementia of degenerative origin);多種梗塞性認知症(dementia-Multi-Infarct);記憶欠損;パーキンソン病における認知症;多発性硬化症における認知症;化学療法に関連する認知欠損;統合失調症の認知欠損(CDS);統合失調症を含む統合失調感情障害;加齢関連認知低下(ARCD);認知症ではない認知障害(Cognitive Impairment No Dementia)(CIND);脳卒中又は脳虚血から生じる認知欠損;先天性及び/又は発育障害;進行性核上性麻痺(PSP);筋萎縮性側策硬化症(ALS);大脳皮質基底核変性症(CBD);外傷性脳損傷(TBI);脳炎後遺症性パーキンソン症候群;ピック病;ニーマン・ピック病;ダウン症候群;ハンチントン病;クロイツフェルト・ヤコブ病;プリオン病;多発性硬化症(MS);運動ニューロン疾患(MND);パーキンソン病(PD);β−アミロイド血管症;脳アミロイド血管症;トリヌクレオチド反復配列障害(Trinucleotide Repeat Disorders);脊髄性筋萎縮症;運動失調症;フリードリッヒ運動失調症;運動失調及び小脳又は脊髄小脳変性症;視神経脊髄炎;多系統萎縮症;伝達性海綿状脳症;注意欠陥障害(ADD);注意欠陥多動性障害(ADHD);急性躁病を含む双極性障害、双極性うつ病、双極性障害維持を含む双極性障害(BD);うつ病、大うつ病、気分障害(安定化)、気分変調症及びアパチーを含む大うつ病性障害(MDD);ギラン−バレー症候群(GBS);及び慢性炎症性脱髄性多発神経炎(CIDP)が含まれるが、これらに限定されない。
【0110】
化合物IのフォームIは、例えば、多発性硬化症(MS)(これには、例えば、再発寛解型多発性硬化症(RRMS)、二次性進行型多発性硬化症(SPMS)、及び一次性進行型多発性硬化症(PPMS)が含まれるが、これらには限定されない);パーキンソン病;多系統萎縮症(MSA);大脳皮質基底核変性症;進行性核上性麻痺;ギラン−バレー症候群(GBS);並びに慢性炎症性脱髄性多発神経炎(CIDP)を含む[但し、これらに限定されることはない]少なくとも1つの神経炎症性障害を処置するのに有用でありうる。
【0111】
化合物IのフォームIは、少なくとも1つの注意欠陥及び破壊的行動障害を処置するのに有用でありうる。
【0112】
例示的な注意欠陥及び破壊的行動障害には、例えば、注意欠陥障害(ADD)、注意欠陥多動性障害(ADHD)、及び感情障害が含まれるが、これらに限定されることはない。
【0113】
化合物IのフォームIは、例えば、広範囲にわたる疼痛、限局性の疼痛、侵害受容性疼痛、炎症性疼痛、中枢痛、中枢及び末梢神経障害性疼痛、糖尿病性神経障害疼痛、中枢及び末梢神経原性疼痛、中枢及び末梢神経痛、下背部痛、術後痛、内臓痛、並びに骨盤痛;異痛;有痛性感覚脱失;カウザルギー;異常感覚;線維筋痛症;痛覚過敏;知覚過敏症;ヒペルパチー;虚血性疼痛;坐骨疼痛;熱傷誘発疼痛(Burn-induced pain);間質性膀胱炎(但し、これに限定されない)を含む膀胱炎に関連する疼痛;多発性硬化症に関連する疼痛;関節炎に関連する疼痛;骨関節炎に関連する疼痛;関節リウマチに関連する疼痛;膵炎に関連する疼痛;乾癬に関連する疼痛;線維筋痛に関連する疼痛;IBSに関連する疼痛;癌に関連する疼痛;並びに下肢静止不能症候群を含む[但し、これらに限定されない]急性又は慢性疼痛障害を含む疼痛を処置するのに有用でありうる。
【0114】
化合物IのフォームIは、少なくとも1つの下記の障害を処置するのに有用でありうる:自閉症、失読症、ジェットラッグ、運動過剰症(Hyperkinesias)、筋失調症、激しい怒りの爆発(Rage outbursts)、筋ジストロフィー、神経線維腫症、脊髄損傷、脳性まひ、狼瘡の神経性後遺症及びポリオ後症候群。
【0115】
化合物IのフォームIは、少なくとも1つの自己免疫障害、精神障害、肥満障害、摂食障害、渇望障害、神経変性障害、神経炎症性障害、注意欠陥及び破壊的行動障害、及び/又は上記に述べられている疼痛障害を処置する薬剤の製造のために使用することができる。
【0116】
化合物IのフォームIは、統合失調症の認知欠損、ナルコレプシー、日中過眠、注意欠陥多動性障害、肥満、疼痛及びアルツハイマー病から選択される少なくとも1つの障害を処置する薬剤を製造するために使用されうる。
【0117】
化合物IのフォームIは、統合失調症の認知欠損、ナルコレプシー、注意欠陥多動性障害、肥満、疼痛及びアルツハイマー病から選択される少なくとも1つの障害を処置する薬剤を製造するために使用されうる。
【0118】
化合物IのフォームIは、統合失調症の認知欠損、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛及びアルツハイマー病から選択される少なくとも1つの障害を処置するために使用されうる。
【0119】
化合物IのフォームIは、統合失調症の認知欠損、ナルコレプシー、肥満、注意欠陥多動性障害、疼痛、及びアルツハイマー病から選択される少なくとも1つの障害を処置するために使用されうる。
【0120】
化合物IのフォームIは、統合失調症の認知欠損及びアルツハイマー病から選択される少なくとも1つの障害を処置するために使用されうる。
【0121】
別の局面は、温血動物における少なくとも1つの自己免疫障害、精神障害、肥満障害、摂食障害、渇望障害、神経変性障害、神経炎症性障害、注意欠陥及び破壊的行動障害、及び/又は疼痛障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0122】
更に別の局面は、温血動物における少なくとも1つの統合失調症の認知欠損、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、及びアルツハイマー病から選択される障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0123】
更に別の局面は、温血動物における少なくとも1つの統合失調症の認知欠損、ナルコレプシー、肥満、注意欠陥多動性障害、疼痛、及びアルツハイマー病から選択される障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0124】
更に別の局面は、温血動物における統合失調症の認知欠損を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0125】
更に別の局面は、温血動物における肥満を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0126】
更に別の局面は、温血動物におけるナルコレプシーを処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0127】
更に別の局面は、温血動物における日中過眠を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0128】
更に別の局面は、温血動物におけるアルツハイマー病を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0129】
また更に別の局面は、温血動物における注意欠陥多動性障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0130】
更にまた別の局面は、温血動物における疼痛障害を処置する方法であって、こうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIを投与することを含んでなる、上記方法を提供する。
【0131】
一実施態様では、温血動物は、例えば、ヒト及び、例えばイヌ、ネコ及びウマなどの飼育動物を含むが、これらに限定はされない哺乳動物種である。一実施態様では、温血動物はヒトである。
【0132】
別の局面は、治療における化合物IのフォームIの使用を提供する。
【0133】
別の実施形態は、治療に使用する薬剤の製造における化合物IのフォームIの使用を提供する。
【0134】
本明細書中で使用される際は、用語“治療(therapy)”は、それとは反対の明確な指示がない限り、“予防(prophylaxis)”も含む。
【0135】
更に別の実施形態では、化合物IのフォームI、又は化合物IのフォームIを含んでなる医薬組成物又は製剤は、以下から選択される少なくとも1つの別の医薬的に活性な化合物と共に、同時に、併行して、順次に、又は別々に投与することができる:
【0136】
(i)抗うつ剤、例えば、アゴメラチン、アミトリプチリン、アモキサピン、ブプロピオン、シタロプラム、クロミプラミン、デシプラミン、ドキセピン、ドロキセチン、エルザソナン、エスシタロプラム、フルボキサミン、フルオキセチン、ゲピロン、イミプラミン、イプサピロン、マプロチリン、ノルトリプチリン、ネファゾドン、パロキセチン、フェネルジン、プロトリプチリン、ラメルテオン、レボキセチン、ロバルゾタン、セルトラリン、シブトラミン、チオニソキセチン、トラニルシプロミン(tranylcypromaine)、トラゾドン、トリミプラミン、ベンラファキシン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0137】
(ii)非定型抗精神病薬、例えば、クエチアピン及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0138】
(iii)抗精神病剤、例えば、アミスルプリド、アリピプラゾール、アセナピン、ベンゾイソキシジル(benzisoxidil)、ビフェプルノクス、カルバマゼピン、クロザピン、クロルプロマジン、デベンザピン、ジバルプロエクス、デュロキセチン、エスゾピクロン、ハロペリドール、イロペリドン、ラモトリギン(lamotrigine)、ロクサピン、メソリダジン、オランザピン、パリペリドン、ペルラピン、ペルフェナジン、フェノチアジン、フェニルブチルピペリジン、ピモジド、プロクロルペラジン、リスペリドン、セルチンドール、スルピリド、スプロクロン、スリクロン、チオリダジン、トリフルオペラジン、トリメトジン、バルプロエート(valproate)、バルプロ酸(valproic acid)、ゾピクロン、ゾテピン、ジプラシドン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0139】
(iv)抗不安剤、例えば、アルネスピロン、アザピロン、ベンゾジアゼピン、バルビツレート酸系、例えば、アジナゾラム、アルプラゾラム、バレゼパム、ベンタゼパム、ブロマゼパム、ブロチゾラム、ブスピロン、クロナゼパム、クロラゼペート、クロルジアゼポキシド、シプラゼパム、ジアゼパム、ジフェンヒドラミン、エスタゾラム、フェノバム、フルニトラゼパム、フルラゼパム、ホサゼパム、ロラゼパム、ロルメタゼパム、メプロバメート、ミダゾラム、ニトラゼパム、オキサゼパム、プラゼパム、クアゼパム、レクラゼパム、トラカゾレート、トレピパム、テマゼパム、トリアゾラム、ウルダゼパム、ゾラゼパム、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0140】
(v)抗痙攣剤、例えば、カルバマゼピン、クロナゼパム、エトスクシミド、フェルバメート、フォスフェニトイン、ガバペンチン、ラコサミド、ラモトリギン(lamotrogine)、レベチラセタム、オキシカルバゼピン(oxcarbazepine)、フェノバルビタール、フェニトイン、プレガバリン(pregabaline)、ルフィナマイド、トピラメート、バルプロエート、ビガバトリン(vigabatrine)、ゾニサミド、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0141】
(vi)アルツハイマー病治療剤、例えば、ドネペジル、リバスチグミン、ガランタミン、メマンチン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0142】
(vii)パーキンソン病治療剤、例えば、レボドパ、アポモルフィン、ブロモクリプチン、カベルゴリン、プラミペキソール、ロピニロール、及びロチゴチンなどのドーパミンアゴニスト、セレギリン(selegeline)及びラザジリンなどのMAO−B阻害剤、トルカポン、及びエンタカポンなどの他のドーパミン作動薬、A−2阻害剤、ドーパミン再取り込み阻害剤、NMDAアンタゴニスト、ニコチンアゴニスト、及びニューロンの一酸化窒素シンターゼの阻害剤、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0143】
(viii)片頭痛治療剤、例えば、アルモトリプタン、アマンタジン、ブロモクリプチン、ブタルビタール、カベルゴリン、ジクロラールフェナゾン、ジヒドロエルゴタミン、エレトリプタン、フロバトリプタン、リスリド、ナラトリプタン、ペルゴリド、ピゾチフェン(pizotiphen)、プラミペキソール、リザトリプタン、ロピニロール、スマトリプタン、ゾルミトリプタン、ゾミトリプタン(zomitriptan)、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0144】
(ix)脳卒中治療剤、一例を述べれば、例えば、アクティベース及びデスモテプラーゼとの血栓溶解療法、アブシキシマブ、シチコリン、クロピドグレル、エプチフィバチド、ミノサイクリン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0145】
(x)尿失禁治療剤、例えば、ダラフェナシン、ファルボキセート(falvoxate)、オキシブチニン、プロピベリン、ロバルゾタン、ソリフェナシン、トルテロジン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0146】
(xi)神経障害性疼痛治療剤、リドカイン、カプサイシン、及びガバペンチン、プレガバリンなどの抗痙攣剤、及びデュロキセチン、ベンラファキシン、アミトリプチリン、クロミプラミンなどの抗うつ剤、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0147】
(xii)侵害受容性疼痛治療剤、例えば、パラセタモール、NSAIDS及びコキシブ系、例えば、セレコキシブ、エトリコキシブ、ルミラコキシブ、バルデコキシブ、パレコキシブ、ジクロフェナク、ロキソプロフェン、ナプロキセン、ケトプロフェン、イブプロフェン、ナブメトン、メロキシカム、ピロキシカム、及びオピオイド、例えば、モルフィン、オキシコドン、ブプレノルフィン、トラマドール、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0148】
(xiii)不眠治療剤、例えば、アゴメラチン、アロバルビタール、アロニミド、アモバルビタール、ベンゾクタミン、ブタバルビタール、カプリド、クロラール、クロペリドン、クロレタート、デキスクラモール、エトクロルビノール、エトミデート、グルテチミド、ハラゼパム、ヒドロキシジン、メクロカロン、メラトニン、メフォバルビタール、メタカロン、ミダフルル、ニソバマート(nisobamate)、ペントバルビタール、フェノバルビタール、プロポフォール、ラメルテオン、ロレタミド、トリクロホス、セコバルビタール、ザレプロン、ゾルピデム、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む);
【0149】
(xiv)気分安定剤、例えば、カルバマゼピン、ジバルプロエクス、ガバペンチン、ラモトリギン(lamotrigine)、リチウム、オランザピン、クエチアピン、バルプロエート、バルプロ酸、ベラパミル、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)を含む;
【0150】
(xv)肥満治療剤、例えばエネルギー消費、グリコリシス(glycolysis)、グルコネオジェネシス(gluconeogenesis)、グルコジェノリシス(glucogenolysis)、脂肪分解、脂質生成、脂肪吸収、脂肪貯蔵、脂肪排泄、空腹及び/又は満腹及び/又は渇望機構、食欲/刺激、食物摂取、及びGI運動性に影響を及ぼす抗肥満剤;超低カロリー食(VLCD);及び低カロリー食(LCD)など;
【0151】
(xvi)肥満関連障害を処置する際に有用な治療剤、例えば、ビグアニド剤、インスリン(合成インスリン類似体)及び経口血糖降下剤(これらは、食後血糖調節薬(prandial
glucose regulators)と、α−グルコシダーゼ阻害剤に分けられる)、例えば、PPARα及び/又はγアゴニストなどのPPAR調節剤;スルホニル尿素;例えば、HMG−CoA還元酵素(3−ヒドロキシ−3−メチルグルタリル補酵素A還元酵素)阻害剤などのコレステロール低下剤;回腸胆汁酸輸送系の阻害剤(IBAT阻害剤);胆汁酸結合樹脂;例えば、コレスチポール、コレスチラミン、又はコレスタゲル(cholestagel)などの胆汁酸封鎖剤;CETP(コレステロールエステル転送タンパク質)阻害剤;コレステロール吸収アンタゴニスト;MTP(ミクロソーム転送タンパク質)阻害剤;遅延放出及び組み合わせ物(combination products)を含むニコチン酸誘導体;フィトステロール化合物;プロブコール;抗凝固剤;オメガ−3脂肪酸;例えば、シブトラミン、フェンテルミン、オーリスタット、ブプロピオン、エフェドリン及びサイロキシンなどの抗肥満治療剤、;例えば、アンギオテンシン変換酵素(ACE)阻害剤、アンギオテンシンII受容体アンタゴニスト、アドレナリン遮断剤、αアドレナリン遮断剤、βアドレナリン遮断剤、混合型アルファ/ベータアドレナリン遮断剤、アドレナリン刺激剤、カルシウムチャネル遮断剤、AT−1遮断剤、塩類利尿剤、利尿剤及び血管拡張剤などの降圧剤;メラニン濃縮ホルモン(MCH)モジュレーター;NPY受容体モジュレーター;オレキシン受容体モジュレーター;ホスホイノシチド依存性プロテインキナーゼ(PDK)モジュレーター;例えば、LXR、FXR、RXR、GR、ERRα,β、PPARα,β,γ及びRORαなどの核内受容体のモジュレーター;例えば、選択的セロトニン再取り込み阻害剤(SSRI)、ノルアドレナリン再取り込み阻害剤(NARI)、ノルアドレナリン−セロトニン再取り込み阻害剤(SNRI)、モノアミンオキシダーゼ阻害剤(MAOI)、三環式抗うつ剤(TCA)、ノルアドレナリン作動性・特異的セロトニン作動性抗うつ剤(NaSSA)などのモノアミン伝達調節剤;セロトニン受容体モジュレーター;レプチン/レプチン受容体モジュレーター;グレリン/グレリン受容体モジュレーター;DPP−IV阻害剤;並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)、代謝物(複数を含む)及びその製薬学的に許容される塩(複数を含む)、溶媒和物(複数を含む)、及びプロドラッグ(複数を含む)など。
【0152】
(xvii)ADHDを処置する薬剤、例えば、アンフェタミン、メタンフェタミン、デキストロアンフェタミン、アトモキセチン、メチルフェニデート、デキサメチルフェニデート、モダフィニル、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)など;及び
【0153】
(xviii)薬物乱用障害、依存症及び離脱症状を処置するのに用いられる薬剤、例えば、ニコチン補充療法(すなわち、ガム、パッチ及びスプレー式点鼻剤);ニコチン性受容体アゴニスト、部分アゴニスト及びアンタゴニスト、(例えばバレニクリン);アコンプロセート(acomprosate)、ブプロピオン、クロニジン、ジスルフィラム、メサドン、ナロキソン、ナルトレキソン、並びにそれらの同等物及びその医薬的に活性な異性体(複数を含む)及び代謝物(複数を含む)など。
【0154】
本明細書中の述べられている少なくとも1つの固体形態と組み合わせて使用されるときには、前述の別の医薬的に活性な成分を、例えば、Physicians’ Desk Reference(PDR;例えば、64th ed. 2010)に指示されている量で、あるいは承認されている投薬量範囲で、及び/又は公表されている参考資料中に記載されている投薬量で、あるいは、そうでない場合は当技術分野の当業者によって決定されている量で使用することができる。
【0155】
本明細書中で述べられている固体形態は、処置される状態に適したあらゆる手段によって投与することができ、これは送達される本明細書中に述べられている固体形態の量に左右されうる。本明細書中に述べられている固体形態(複数を含む)は、例えば、経口的、筋肉内、皮下的、局所的、鼻腔内、硬膜外、腹腔内、胸腔内(intrathoracially)、静脈内、髄腔内、脳室内、及び関節内注入(これらに限定されない)を含む任意のルートによって医薬組成物の形で投与することができる。一実施形態では、投与ルートは経口的である。
【0156】
本明細書中で述べられている固体形態の“有効な量(effective amount)”は、当技術分野の当業者によって決定することができる。例えば、投与される固体形態の量は、処置される患者によって変動し、1日あたり約100ng/kg(体重)〜100mg/kg(体重)(例えば、1日あたり10pg/kg〜10mg/kg)変動しうる。特定の実施形態では、有効な量には、単回投与、又は個々の分割投与量の形で、約0.05〜約300mg/kg/日(例えば、約200mg/kg/日未満)の哺乳類に対する投薬量の例示が含まれる。特定の実施形態では、成人のヒトに対する例示的な投薬量は、1日あたり約1〜100mg/kg(体重)(例えば、1日あたり15mg/kg(体重))であり、これは、単回投与、又は個々の分割投与量(例えば、1日あたり1〜4回)の形で投与することができる。
【0157】
投与量は、この開示及び当技術分野の知識を基準にして当業者であれば、容易に確定することができる。すなわち、当業者であれば、組成物中の、本明細書中で提供された方法で投与される固体形態及び所望の添加剤、ビヒクル、及び/又は担体の量を容易に決定することができる。しかしながら、特定の対象に対する特定の投与レベル及び投与頻度は変化しえ、通例、例えば、本明細書中で述べられている固体形態(複数を含む)の溶解性及び/又は生物学的利用性;対象の種、年齢、体重、全般的健康状態、性別、及び食事;投与形式及び時間;排出速度;薬物の組み合わせ;及び具体的な状態の重篤度を含む、種々の要因に左右されうる。
【0158】
固体形態を含む医薬組成物
一局面では、化合物IのフォームI及び少なくとも1つの製薬学的に許容される担体及び/又は希釈剤を含んでなる医薬組成物を提供する。
【0159】
一実施形態は、温血動物における本明細書中に述べられている少なくとも1つの障害を処置する方法であって、そうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIと、少なくとも1つの製薬学的に許容される担体及び/又は希釈剤を含む医薬組成物を投与することを含んでなる、上記方法を提供する。
【0160】
一実施形態は、温血動物における統合失調症の認知欠損、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、及びアルツハイマー病から選択される少なくとも1つの障害を処置する方法であって、そうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIと、少なくとも1つの製薬学的に許容される担体及び/又は希釈剤を含む医薬組成物を投与することを含んでなる、上記方法を提供する。
【0161】
一実施形態は、温血動物における統合失調症の認知欠損、ナルコレプシー、肥満、注意欠陥多動性障害、及びアルツハイマー病から選択される少なくとも1つの障害を処置する方法であって、そうした処置を必要とする前記動物に、治療的に有効な量の化合物IのフォームIと、少なくとも1つの製薬学的に許容される担体及び/又は希釈剤を含む医薬組成物を投与することを含んでなる、上記方法を提供する。
【0162】
許容される固体医薬組成物には、例えば、粉末剤、錠剤、分散性顆粒剤、カプセル剤、カシェ剤、及び坐剤が含まれるが、これらに限定されない。固体の医薬組成物、製薬学的に許容される担体には、例えば、少なくとも1つの固体、少なくとも1つの液体、及びその混合物が含まれるが、それらに限定されない。固体の担体はまた、希釈剤、矯味矯臭剤、可溶化剤、滑沢剤、懸濁剤、結合剤、カプセル封入材料、及び/又は錠剤崩壊剤でありうる。適切な担体には、例えば、炭酸マグネシウム;ステアリン酸マグネシウム;タルク;乳糖;糖類;ペクチン;デキストリン;デンプン;トラガカント;メチルセルロース;カルボキシメチルセルロースナトリウム;低融点ワックス;カカオ脂;及びその混合物が含まれるが、それらに限定されない。適切な担体の例は、当業者に知られており、また、例えば、Remington: The Science and Practice of Pharmacy(Lippincott Williams & Wilkins, 20th ed. 2000)中に記載されている。
【0163】
粉末剤は、例えば、微細固体を化合物IのフォームIと混和することによって調製することができる。錠剤は、例えば、適切な比率で化合物IのフォームIを、必要な結合特性を有している製薬学的に許容される担体と混和し、そして所望の形及びサイズに圧縮することによって調製することができる。坐剤は、例えば、化合物IのフォームIを、直腸温度で液体であるが直腸温度未満の温度では固体である、少なくとも1つの適切な無刺激性の賦形剤と混和することによって調製することができ、この場合、無刺激性の賦形剤をまず融解させ、そして化合物IのフォームIをその中に分散させる。次いで融解した均一な混合物を好都合なサイズの金型に注ぎ、そして冷却し、固体化する。無刺激性の賦形剤を例示すると、例えば、カカオ脂;グリセロゼラチン;水素化植物油;種々の分子量のポリエチレングリコールの混合物;及びポリエチレングリコールの脂肪酸エステルが挙げられるが、これらに限定されない。
【0164】
許容される液体医薬組成物には、懸濁液が含まれる。経口投与のための水性懸濁液は、本明細書中で述べられている少なくとも1つの微細固体形態を、例えば、天然・合成ガム、レジン、メチルセルロース、及びカルボキシメチルセルロースナトリウムなどの粘性物質と一緒に水中に分散させることによって調製することができる。
【0165】
一実施形態では、本明細書中で述べられている医薬組成物は、約0.05%と約99%(重量)[パーセントはすべて、重量基準で全組成物をベースとしている]の間の化合物IのフォームIを含む。別の実施形態では、医薬組成物は、約0.10%〜約50%(重量)[パーセントはすべて、重量基準で全組成物をベースとしている]の化合物IのフォームIを含む。
【0166】
別の実施形態は、治療のための化合物IのフォームIと製薬学的に許容される担体/希釈剤を含んでなる医薬組成物を提供する。
【0167】
更に、前記に論じられたいずれかの状態に使用するための、化合物IのフォームIと、製薬学的に許容される担体とを共に含んでなる医薬組成物が提供される。
【発明を実施するための形態】
【0168】
実施例
本発明は下記の実施例中で更に明確にされる。この実施例は説明のみの目的で示されているということが理解されるべきである。前記論議及び実施例から、当技術分野の当業者であれば、本発明の本質的な特徴を確認することができ、そしてその趣旨及び範囲から逸脱することなく、本発明を種々の使用及び条件に適合するように種々の修正及び改変をすることができる。その結果として、本発明は、以下に述べられている例示的な実施例によっては限定されることはなく、本明細書に添付されている請求項によって定義されている。
【0169】
温度はすべて、摂氏(℃)単位であり、補正されていない。
【0170】
別途記載のない限り、実施例化合物を製造する際に使用される市販試薬を更なる精製はせずに受理したまま使用した。
【0171】
別途記載のない限り、実施例化合物を製造する際に使用される溶媒は、市販の無水グレードであり、更に乾燥又は精製することはせずに使用した。
【0172】
出発物質はすべて、別途記載のない限り、商業上入手可能である。
【0173】
以下の略語が本明細書中で使用されうる:ACN:アセトニトリル;aq:水性の;br:ブロード;Bu:ブチル;calcd:計算値;Celite(登録商標):珪藻土ろ過剤のブランド、セライトコーポレーション(Celite Corporation)(登録トレーダー);CP−MAS SS−NMR:交差分極マジック角スピニング固体核磁気共鳴;d:二重線;dd:二重線の二重線;ddd:二重線の二重線の二重線;dddd:二重線の二重線の二重線の二重線;DABCO:1,4−ジアザビシクロ[2.2.2]オクタン;DCE:ジクロロエタン;DCM:ジクロロメタン;DIPEA:N−エチル−N−イソプロピルプロパン−2−アミン;DME:ジメチルエーテル;DMEA:ジメチルエチルアミン;DMF:N,N−ジメチルホルムアミド;DMSO:ジメチルスルホキシド;dq:四重線の二重線;DSC:示差走査熱量測定法;dt:三重線の二重線;DVS:動的水蒸気収着;EDC:1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩;ESI:エレクトロスプレーイオン源;EtOAc:酢酸エチル;EtOH:エタノール;Et:エチル;FT−IR:フーリエ変換赤外;FT−Raman:フーリエ変換ラマン;g:グラム;h:時間(複数を含む);1H NMR:プロトン核磁気共鳴;HBTU:O−ベンゾトリアゾール−N,N,N’,N’−テトラメチル−ウロニウム−ヘキサフルオロ−ホスファート;HCl:塩酸;HOBT:N−ヒドロキシベンゾトリアゾール;HPLC:高圧液体クロマトグラフィー;HRMS:高分解能質量分析法;iPrOH:イソプロパノール;L:リットル;m:多重線;M:モル(の);mL:ミリリットル;Me:メチル;MeOH:メタノール;mg:ミリグラム;MgSO4:無水硫酸マグネシウム(乾燥剤);MHz:メガヘルツ;min:分(複数を含む);mmol:ミリモル;mol:モル;MPLC:中圧液体クロマトグラフィー;MS:質量分析;MTBE:メチルtert−ブチルエーテル;NaHCO3:重炭酸ナトリウム;NH4Cl:塩化アンモニウム;Pd/C:パラジウム・炭素;ppm:百万分率;q:四重線;quin:五重線;rt:室温;s:一重線;sat;飽和した;t:三重線;TEA:トリエチルアミン;tBuOH:tert−ブタノール;td:二重線の三重線;TFA:トリフルオロ酢酸;TGA=熱重量分析;THF:テトラヒドロフラン;UV=紫外;XRPD=粉末X線回折;及び接頭語n−、s−、i−、t−及びtert−は、それらの通例の意味を有する:ノルマル、セカンダリー、イソ、及びターシャリー。
【0174】
実施例1:化合物Iの合成(第一ルート)
4−((トランス)−2−((R)−4−シクロブチル−2−メチルピペラジン−1−カルボニル)シクロプロピル)ベンズアミド,異性体1
【化2】

注:*は、単一異性体(絶対立体化学未定)を示す。
【0175】
実施例2(138mg,0.40mmol)を、MettlerToledo Minigram超臨界液体クロマトグラフィー機器(MettlerToledo Minigram Supercritical Fluid Chromatography instrument)によって、次の条件:ChiralPak AD-H,10×250mm,5μm粒径,10.0mL/分,移動相:55% iPrOH(0.1%DMEAを含む),超臨界CO2,レギュレーター 100バールに設定,カラム温度 35℃に設定,UV 215nmを用いて分離すると、57.8mgの異性体1(41.9%)及び56.5mgの異性体2(41.0%)が固体として提供された。この生成物を、ChiralPak AD-H,10×250mm,5μm粒径を用いアイソクラティック法(移動相:55%EtOH(0.1%DMEAを含む),超臨界CO2)を用いてキラルSFC(UV検出)によって分析すると、エナンチオマー純度99%、Rt 1.92分(異性体1)及び3.46分(異性体2)が得られた。
異性体1: 1H NMR (400 MHz, CD3OD) δ ppm 1.26 (br. s., 1H) 1.38 (br. s., 3H) 1.59 (ddd, J= 9.57, 4.69, 4.49 Hz, 1H) 1.65-1.77 (m, 3 H) 1.77-1.98 (m, 3H) 1.98-2.09 (m, 2H) 2.22 -2.31 (m, 1H) 2.43 (br. s., 1H) 2.63-2.74 (m, 2H) 2.84 (d, J=11.33 Hz, 1H) 2.96 (t, J= 12.89 Hz, 0.5H), 3.36 (t, J=12.30 Hz, 0.5H) 4.04 (d, J =12.11 Hz, 0.5H) 4.31 (d, J= 12.11 Hz, 0.5H) 4.38 (br. s., 0.5H) 4.65 (br. s., 0.5H) 7.25 (d, J=8.20 Hz, 2H), 7.80 (d, J=8.20 Hz, 2H);
HRMS m/z 計算値(C20H28N3O2)342.21760 [M+H]+,実測値 342.21771;
[α]D+156.3°(c 2.20,MeOH)。
【0176】
実施例2
4−(トランス−2−((R)−4−シクロブチル−2−メチルピペラジン−1−カルボニル)シクロプロピル)ベンズアミド,ジアステレオマー混合物
【化3】

中間体AをDCE(13.0mL)中に溶解した。TEA(0.958mL,6.87mmol)を加え、引き続いてシクロブタノン(193mg,2.75mmol)及びトリアセトキシ水素化ホウ素ナトリウム(437mg,2.06mmol)を添加した。この反応混合物を終夜撹拌し、そして飽和NaHCO3で洗浄した。有機層をMgSO4上で乾燥し、ろ過し、そして減圧下で濃縮した。この粗製物を、XBridge Prep C18 OBD,30×50mm,5μm,Waters逆相カラム(Waters reverse phase column)でショート高pHシャローグラジエント法(short high pH shallow gradient method)[移動相:20〜40%B;A:H2O(10mM NH4CO3及び0.375% NH4OH v/vを含む),B:CH3CN,10分稼動)]を用いる分取HPLC MSによって精製すると、159mgの実施例2(33.9%)が固体(ジアステレオマー混合物)として提供された。
1H NMR (400 MHz, CD3OD) δ ppm 1.27 (d, J=7.03 Hz, 2H) 1.39 (br. s., 2H ) 1.59 (ddd, J=9.18, 5.27, 4.30 Hz, 1H) 1.65-1.78 (m, 3H) 1.78-1.98 (m, 3H) 1.98-2.10 (m, 2 H) 2.20-2.34 (m, 1H) 2.42 (br. s., 1H) 2.62-2.77 (m, 2H) 2.78-2.90 (m, 1H) 2.90-3.05 (m, 1H) 3.94-4.10 (m, 1H) 4.23-4.35 (m, 1H) 7.25 (d, J=8.59 Hz, 2H) 7.80 (d, J=8.20 Hz, 2H);
HRMS m/z 計算値(C20H28N3O2) 342.21760 [M+H]+,実測値 342.21804。
【0177】
実施例3:化合物Iの合成(第二ルート)
4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミド
【化4】

中間体N(10.0g,48.7mmoles)を、2−MeTHF(200mL)にtジャケット(ジャケット(jacket)温度)=25℃で混和した。1,1’−カルボニルジイミダゾール(11.0g,53.6mmoles,82.1%w/w)を1回で加えた。この反応スラリーをゆっくりtジャケット=85℃に加熱し、そしておよそ5時間後、反応スラリーをt反応混合物(反応混合物(reaction mixture)温度)=25℃に冷却した。中間体O(13.8g,58.5mmoles)及びTEA(7.55mL,53.6mmoles)を反応スラリーに加えた。この反応スラリーをtジャケット=70℃で3時間加熱した。試料を、Chromolith Performance RP-18e,4.6×100mmによってグラジエント法[移動相 20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動]を用いてHPLCによって分析すると、この時点で完全な変換を示した。この反応スラリーをtジャケット=40℃に冷却した。ブライン(90mL)中の1M Na2CO3を加えた。水相を分離し、そして有機相をブライン(2L)で洗浄した。有機相中の表題化合物の分析評価を1H NMRによって決定し、そして有機相の量を10相対容量(15.4gの表題化合物)に調整した。有機相をtジャケット=15℃に冷却し、そしてH2O中の10%H3PO4(pH2.5まで加えた,110mL)で抽出した。下の水相を回収し、残存する有機相をH2O中の10%H3PO4(50mL)で再び抽出した。水相を集め、これを5M KOHを用いて塩基性にしpH>12とし、そしてMeTHFで2回(200mL,50mL)抽出した。有機相を集め、これをブライン(50mL)で抽出し、そしてろ過して無機塩を除去した。有機相中の表題化合物の分析評価を1H NMRによって決定し、そして有機相の量を6相対容量(14.4gの表題化合物,86mL)に減少させた。tジャケット=55℃で開始して、結晶化を行なった。tジャケット=40℃に冷却した後、ヘプタン(21.6mL)及びシード(128mgの表題化合物)を加えた。この混合物をエイジング(aging)の後、tジャケット=20℃に冷却し、ヘプタン(64.8mL)の2回目の添加を行った。生成物はろ別し、そしてMeTHF/ヘプタンで2回(2*30mL)洗浄した。真空下にて40℃で乾燥すると、12.6gの表題化合物(35.2mmoles,98.7%w/w,75%収率)が得られた。
1H-NMR (DMSO-d6): δ 7.91 (br s, 1H), 7.78 (d, J=8.4 Hz, 2H), 7.30 (br s, 1H), 7.25 (d, J=8.0 Hz, 2H), 4.54 及び 4.36 (br s, 1H), 4.17 及び 4.01 (d, J=12.2 Hz, 1H), 3.20 及び 2.80 (t, J=11.9 Hz, 1H), 2.74 (d, J=11.4 Hz, 1H), 2.67-2.55 (m, 2H), 2.33 (br s, 2H), 1.99-1.88 (m, 2H), 1.88-1.53 (m, 6H), 1.48-1.37 (m, 1H), 1.27 (br s, 3H), 1.12 (br s, 1H);
LC-MS (ESI): m/z 342 (M+1)。
Rt 1.68分[Xbridge C18,3.0×50mm,2.5μm 粒径による分析方法(移動相:5〜90%B;A:H2O(0.1%ギ酸を含む),B:CH3CN,8.6分稼動)を用いた]。生成物のLC純度をUV−検出(250nm)付きAtlantis T3カラム(3.0×150mm,3.0μm 粒径)によって、グラジエント法[移動相 2〜50%B;A:H2O(0.03%TFAを含む),B:CH3CN(0.03%TFAを含む),30分稼動]を用いて解析すると、12.06分で純度99.48面積%が得られた。この生成物を、ChiralPak AD-H,10×250mm,5μm粒径を用いアイソクラティック法[移動相:55%EtOH(0.1%DMEAを含む),超臨界CO2]を用いてキラルSFC(UV検出)によって分析すると、エナンチオマー純度>99%ee,Rt 1.98分が得られた。
【0178】
実施例4:化合物Iの合成(第三ルート)
4−{(1S,2S)−2−[((R)−4−シクロブチル−2−メチルピペラジン−1−イル)カルボニル]−シクロプロピル}−ベンズアミド
【化5】

N2を泡状の形でEtOH(125mL)及びH2O(30mL)中の中間体P(6.09g,18.83mmol)に入れ、これにヒドリド(ジメチル亜ホスフィン酸−kP)[水素ビス(ジメチルホスフィニト−kP]白金(II){(Hydrido(dimethylphosphinous acid-kP)[hydrogen bis(dimethylphosphnito-kP]platinum (II))}(0.050g,0.12mmol)を加えた。反応物を20時間加熱・還流した。この反応混合物を更に24時間加熱し、濃縮・乾燥し、そしてETOAcとH2Oの間で分配した。水相をETOAcで3回抽出し、有機層を集め、これをブラインで洗浄し、Na2SO4上で乾燥し、ろ過し、そして濃縮した。この粗製物を、CH2Cl2及びMeOH 2〜10%[黒っぽい可視バンドが溶出するまで4%でプラトー(plateau)の状態にする(with a plateau at 4% until elution of visible dark band)]のグラジエントで溶出し、引き続いてアセトン/ヘプタン30〜100 %のグラジエントで2回目の精製を行なうシリカゲルを用いるフラッシュクロマトグラフィーによって精製すると、3.65gの実施例4(56.8%収率)が固体として得られた。
1H NMR (400 MHz, メタノール-d4) δ ppm 1.24 (br. s., 1H) 1.36 (br. s., 3H) 1.52-1.60 (m, 1H) 1.63-1.74 (m, 3H) 1.74-1.84 (m, 1H) 1.84-1.95 (m, 2H) 1.95-2.05 (m,
2H) 2.24 (br. s., 1H) 2.40 (br. s., 1H) 2.60-2.72 (m, 2H) 2.82 (d, J= 12.50 Hz,
1H) 2.94 及び 3.36 (t, J=12.11 Hz, 1H) 4.01 及び 4.28 (d, J=13.28 Hz, 1H) 4.35 及び 4.62 (br. s., 1H) 7.22 (d, J=8.20 Hz, 2H) 7.77 (d, J=8.59 Hz, 2H)。
この生成物をZorbax SB C18,4.6×30mm,1.8μm 粒径,MS m/z 342.3 [M+H]+(ESI),Rt 0.584分によるゾルバクス(Zorbax)グラジエント法[移動相:5〜95%B;A:H2O(0.05%TFAを含む),B:CH3CN,4.5分稼動]を用いる分析HPLC MSによって分析した。この生成物を、ChiralPak AD-H,10×250mm,5μm粒径を用いアイソクラティック法[移動相:55%EtOH(0.1%DMEAを含む),超臨界CO2]を用いてキラルSFC(UV検出)によって分析すると、エナンチオマー純度>99%,Rt 1.98分が得られた。この表題化合物は上記の実施例1の“異性体1”に該当する。
HRMS m/z 計算値 C20H27N3O2 342.2176 [M+H]+,実測値 342.2176。
【0179】
実施例5:化合物IのフォームIの製造
化合物IのフォームIを製造する第一手段では、20mgの非晶形態の化合物I(前出の合成ルートのうちの実施例1、2又は4によって製造される)を容器に加えた。この容器に100μlのEtOAcを加え、懸濁液を得た。この結果生じたスラリーを周囲温度で3日間撹拌した。次いで固体結晶性物質を単離し、そして空気乾燥した。
化合物IのフォームIを製造する第二手段では、20mgの非晶形態の化合物I(前出の合成ルートのうちの1つによって製造される)を容器に加えた。この容器に100μlのACNを加え、懸濁液を得た。この結果生じたスラリーを周囲温度で3日間撹拌した。次いで固体結晶性物質を単離し、そして空気乾燥した。
【0180】
実施例6:化合物IのフォームIの分析
実施例5によって得られた固体物質をXRPDによって分析した。選択されたピークが表1に与えられている。代表的なXRPDパターンが図1に示されている。このXRPDパターンによれば、この固体物質は結晶性の化合物IのフォームIであることが確認された。
【0181】
【表1】

【0182】
実施例5によって得られた固体物質を熱分析手法(thermal techniques)によって分析した、DSC分析によって、フォームIは、図2に示されているように、約133.5℃で溶融の吸熱開始、そして約135.3℃でピークを有する高溶融固体であることが示されている。TGAによって、化合物IのフォームIは、約20℃〜約100℃に加熱すると、約0.25%の質量損失を示し、そして、約100℃〜約160℃に加熱すると、更に約0.25%の質量損失を示すことが明らかにされた。熱分析によって、化合物IのフォームIは、実質的量の溶媒又は水を含まないことが明らかにされた。代表的なDSCサーモグラムが図2に示されている。代表的なTGAサーモグラムが図3に示されている。
【0183】
実施例5によって得られた固体物質は、DVS手法によって分析された。DVS等温線分析(isothermic DVS analysis)は、約0%RHと約90%RHの間で、化合物IのフォームIの試料を増加させることによってほぼ周囲温度で行なわれた。このDVS分析によって、化合物IのフォームIが、約0%RHと約90%RHの間で、質量基準で2%未満(約1.2%〜約1.4%)の水を吸着することが明らかと成った。DVS分析によって、フォームIは実質的に非吸湿性であることが明らかとなった。代表的なDVS等温線プロットが図4に示されている。
【0184】
実施例5によって得られた固体物質は、SS−NMRによって分析された。スペクトルは、下記のppm値でピークを示した:171.0624;144.1716;131.7559;127.5291;60.4671;54.5210;52.9234;51.5593;50.7770;45.9523;45.0427;40.7924;28.5029;24.5826;23.7109;18.1318;15.7476;15.2935;14.3726;13.6745;及び13.1087。代表的なSS−NMRスペクトルが図5に示されている。
【0185】
実施例5によって得られた固体物質は、FT−IR及びFTラマンスペクトロスコピーによって分析された。代表的なFT−IRスペクトル(上側)及びFTラマンスペクトル(下側)が図6に示されている。
【0186】
実施例7:機器及び手法
XRPD分析
XRPD分析は、Bruker AXS Inc.(商標)(Madison, Wisconsin)から商業的に入手可能である、ブルカーD8ディフラクトメータ(Bruker D8 diffractometer)を用いて行なわれた。XRPDスペクトルは、シリコン単結晶ウエハーマウント(a single silicon
crystal wafer mount)(例えば、ブルカーシリコンゼロバックグラウンドX線回折試料ホルダー:Bruker silicon zero background X-ray diffraction sample holder)上に分析のためのこの対象物の試料(およそ20mg)を据え付け、そして顕微鏡用スライドを用いて試料を広げて薄層状にすることによって得られた。試料を毎分30回転で回転させ(計数統計を向上させるため)、そして銅製の長い微小焦点管(copper long-fine focus
tube)を、1.5406オングストローム(すなわち、約1.54オングストローム)の波長で、40kV及び40mAにおいて作動させて発生するX線を照射した。この試料をシータ・シータ・モード(theta-theta mode)で2°〜40°2θの範囲にわたって、0.02°2θ増加につき(連続的スキャンモード)1秒間曝露した。稼働時間は31分41秒であった。
【0187】
DSC分析
DSCを、TA Instruments model Q1000を用いて行なった。試料(およそ2mg)を計量しアルミニウムサンプルパン(aluminium sample pan)に入れ、そしてDSCに移した。この機器を50mL/分で窒素を用いてパージし、そしてデータを10℃/分の動的加熱速度(dynamic heating rate)を用いて25℃〜300℃で回収した。
【0188】
DSC分析を、TA INSTRUMENTS(登録商標)(New Castle, Delaware)から商業的に入手可能であるQ SERIES(商標)Q1000 DSC熱量計を用いて標準的な方法に従って調製した試料によって行なった。この機器を、50mL/分で窒素を用いてパージし、そしてデータを10℃/分の動的加熱速度を用いて25℃〜300℃で回収した。熱的データを、標準的なソフトウェア、例えば、TA INSTRUMENTS(登録商標)からのUniversal v.4.5Aを用いて分析した。
【0189】
DVS分析
DVS分析を標準的な機器、例えば、Surface Measurement Systems, Ltd.(商標)(Alperton, London, UK)から商業的に入手可能であるDVS機器を用いて、標準的な方法に従って調製した試料によって行なった。周囲温度で維持される試料は、約0%RH〜約90%RHでサイクルさせた。水蒸気収着及び脱着を示している質量の変化率を記録した。
【0190】
SS−NMR分析
分析のためのおよそ100mgの物質(例えば、薬物物質又は製剤物)を、Kel−Fキャップ(Kel-F cap)で密封された4mm二酸化ジルコニウムローターに詰め込んだ。13C交差分極マジック角スピニングスペルクトルの決定の場合には通例、ローターを5〜9kHzで回転させ(化学シフト異方性を除去するため)、そして13Cスペクトルを水素に起源する交差分極を用いて記録した(感度を向上させ、そして実験時間を減少させるため)。磁化移動のコンタクト時間は通例、2ミリ秒であり、そしてインターパルス(inter-pulse)遅延(核緩和を考慮して)は通例、5秒であった。シグナル平均化(Signal averaging)が、すべての主要ピークがノイズから解消されることを可能にするのに十分にスキャン記録して使用された。結晶性の薬物物質の場合の通例の実験時間は約1時間であった。
【0191】
FT−IR及びFT−ラマン分析
FT−IR/ATRスペクトルをDTGS KBr検出器を備えたThermo Nicolet Nexus 870を用いて400〜4000cm−1の範囲にわたって[分解能:4cm−1及びスキャン数:64回で]回収した。ATRで使用した結晶はダイアモンドである。
【0192】
【表2】

【0193】
FT−ラマンスペクトルは、InGaAs検出器を備えたThermo Nicolet Nexus 870によって100〜3700cm−1の範囲にわたって[分解能:8cm−1及びスキャン数:64回で]回収した。データ取得及び分析は、Thermo Nicolet software Omnic softwareを用いて行なわれた。
【0194】
【表3】

【0195】
中間体A
4−(トランス−2−((R)−2−メチルピペラジン−1−カルボニル)シクロプロピル)ベンズアミド
【化6】

中間体B(849mg,2.19mmol)をDCM(10.0mL)中に溶解した。TFA(5.00mL)を加え、そしてこの反応混合物を30分間室温で撹拌した。揮発性物質を減圧下で蒸発させると黄色ガムが得られた。この粗製物は、精製することはせずに次の工程で使用した。
1H NMR (400 MHz, CD3OD) δ ppm 1.33 (d, J=7.03 Hz, 3H) 1.37-1.52 (m, 3 H) 1.65 (br. s., 1H) 2.26-2.39 (m, 1H) 2.51 (br. s., 1H) 3.11 (br. s., 1H) 3.21-3.45 (m, 4H) 7.27 (d, J=8.20 Hz, 2H) 7.81 (d, J=8.20 Hz, 2 H)。
【0196】
中間体B
(R)−tert−ブチル−4−(トランス−2−(4−カルバモイルフェニル)シクロプロパンカルボニル)−3−メチルピペラジン−1−カルボキシラート
【化7】

中間体C(450mg,2.19mmol)を、DMF(20mL)中に溶解した。DIPEA(1.149mL,6.58mmol)を加え、引き続いてHOBT(444mg,3.29mmol)、EDC(631mg,3.29mmol)及び中間体D(527mg,2.63mmol)を添加した。この反応混合物を室温で2日間撹拌し、減圧下で濃縮し、EtOAcに再び溶解し、1M HCl及び飽和NaHCO3で洗浄し、MgSO4上で乾燥し、ろ過し、そして減圧下で濃縮すると、中間体Bが固体として得られた。粗生成物は更に精製することはせずに次の工程で使用した。
MS m/z 388.34 [M+H]+(ESI)。
【0197】
中間体C
トランス−2−(4−カルバモイルフェニル)シクロプロパンカルボン酸
【化8】

中間体E(3.4g,18.16mmol)を、t−BuOH(90mL)中に溶解した。粉砕KOH(5.10g,90.81mmol)を加え、この反応混合物を、終夜70℃に加熱し、室温に冷却し、そして減圧下で濃縮した。残留物をH2Oに再び溶解し、そしてEtOAcで洗浄した。水相を1M HClを用いて酸性にし、pH4〜5にした。沈殿物をろ過し、そして真空下にて乾燥すると、3.06g(82%)の中間体Cが固体として得られた。この生成物は、更に精製することはせずに次の工程で使用した。
1H NMR (400 MHz, CD3OD) δ ppm 1.42 (ddd, J=8.50, 6.35, 4.69 Hz, 1H) 1.55-1.62 (m, 1H) 1.91 (ddd, J=8.50, 5.37, 4.10 Hz, 1H) 2.52 (ddd, J=9.18, 6.25, 4.10 Hz, 1H) 7.20-7.26 (m, 2H) 7.76-7.83 (m, 2H);
MS m/z 206.22 [M+H]+ (ES+)。
【0198】
中間体D
(R)−tert−ブチル 3−メチルピペラジン−1−カルボキシラート
【化9】

(R)−2−メチルピペラジン(5.025g,50.2mmol)をDCM(100mL)中に溶解した。DCM(50mL)中のboc無水物(boc anhydride)(5.47g,25.1mmol)の溶液を0℃で滴下した。この反応混合物を室温で1時間撹拌した。この溶液をろ過し、そして減圧下で濃縮した。H2O(100mL)を残留物に加え、これを再びろ過した。ろ液をK2CO3で飽和させ、そしてEt2O(3×150mL)で抽出した。有機層を集め、これを無水Na2SO4上で乾燥し、ろ過し、そして減圧下で濃縮すると、5.04g(50%)の中間体Dが固体として提供された。
1H NMR (300 MHz, CDCl3) δ ppm 1.03 (d, J =6.3 Hz, 3H) 1.45 (s, 9H) 1.56 (s, 1H)
2.30-2.46 (m, 1H) 2.65-2.72 (m, 1H) 2.74-2.76 (m, 2H) 2.93-2.95 (m, 1H) 3.93 (br s, 2H)。
中間体Dはまた、Lanzhou Boc Chemical Co.から商業的に入手可能である。
【0199】
中間体E(第一方法)
トランス−2−(4−シアノフェニル)シクロプロパンカルボン酸
【化10】

中間体H(11.2g,64.7mmol)をアセトン(100mL)中に溶解した。この溶液を−10℃に冷却した。ジョーンズ試薬(65mL)を30分間にわたって加えた。添加が完結した後、この反応物を室温に暖め、次いで2−プロパノール(100mL)を加えることによってクエンチした。この結果生じた混合物をEtOAc(200mL)で希釈した。MgSO4を加え、そして撹拌を更に30分間継続した。この混合物を、ろ過し、そしてろ液を減圧下で濃縮した。残留物をEtOAc(200mL)中に再び溶解し、H2O(2×75mL)で洗浄し、MgSO4上で乾燥し、ろ過し、そして減圧下で濃縮した。粗製物をEtOAc(20mL)でトリチュレーションすることによって精製すると、5.2g(43%)の中間体Eが固体として得られた。
1H NMR (400 MHz, DMSO-d6) δ ppm 1.39-1.46 (m, 1H) 1.47-1.55 (m, 1H) 1.90-1.98 (m, 1H) 2.45-2.55 (m, 1H) 7.38 (d, J=8.2 Hz, 2H) 7.73 (d, J=8.2 Hz, 2H)。
ジョーンズ試薬の製造:ジョーンズ試薬は、23mLの濃H2SO4中に26.7gのCrO3を溶解し、そしてこの混合物を水で100mLに希釈することによって製造された。
【0200】
中間体E(第二方法)
トランス−2−(4−シアノフェニル)シクロプロパンカルボン酸
【化11】

中間体F(11.6g,47.7mmol)をMeOH(55mL)中に溶解した。H2O(30mL)中のNaOH(5.7g,143.1mmol)の溶液を加え、そしてこの結果生じた混合物を70℃で4時間加熱した。室温に冷却した後、この混合物をその3分の1の量に濃縮し、50mLの0.5M NaOHを添加することによって希釈した。この結果生じた混合物をMTBE(2×25mL)で洗浄した。水層を分離し、そして濃HClを添加することによってpH1まで酸性にした。酸性にした水相をEtOAc(2×50mL)で抽出した。有機抽出物を集め、これをMgSO4上で乾燥し、ろ過し、そして蒸発・乾固した。この粗製物をフラッシュクロマトグラフィー(シリカ,DCM:MeOH 99:1〜90:10)によって精製すると、3.1g(36.4%)の中間体Eが固体として得られた。
1H NMR (400 MHz, CDCl3) δ ppm 1.37-1.46 (m, 1H) 1.47-1.55 (m, 1H) 1.87-1.98 (m,
1H) 2.43-2.49 (m, 1H) 7.38 (d, J=8 Hz, 2H) 7.74 (d, J=8 Hz, 2H) 12.43 (s, 1H)。
【0201】
中間体F
トランス−tert−ブチル 2−(4−シアノフェニル)シクロプロパンカルボキシラート
【化12】

トリメチルスルホキソニウムヨージド(37.9g,172.4mmol)を、窒素下にてDMSO(450mL)中に溶解した。ナトリウム tert−ブトキシド(16.5g,172.4mmol)を加え、そしてその結果生じた混合物を室温で2時間撹拌した。中間体G(20g,86.2mmol)を加え、そしてこの反応混合物を室温で16時間撹拌した。この反応混合物をMTBE(500mL)及びブライン(300mL)を連続して添加することによって希釈した。有機層を分離し、MgSO4上で乾燥し、ろ過し、そして蒸発・乾固した。粗生成物を、フラッシュクロマトグラフィー(シリカ,ヘプタン/EtOAc 95:5〜90:10)によって精製すると、11.6g(54%)の中間体Fが固体として得られた。
1H NMR (400 MHz, CDCl3) δ ppm 1.29-1.23 (m, 1H) 1.49 (s, 9H) 1.57-1.69 (m, 1H) 1.83-1.96 (m, 1H) 2.40-2.53 (m, 1H) 7.18 (d, J=8 Hz, 2H) 7.57 (d, J=8 Hz, 2H)。
【0202】
中間体G
(E)−tert−ブチル 3−(4−シアノフェニル)アクリラート
【化13】

磁気撹拌棒、温度計、添加漏斗及び窒素流入口を備えた火炎乾燥三つ口丸底フラスコにNaH(3.96g,94.7mmol)及び無水THF(120mL)を入れた。無水THF(20mL)に溶解したtert−ブチルジエチルホスホノアセタート(Tertbutyldiethylphosphono acetate)(23.2mL,94.7mmol)を30分間にわたって添加漏斗を介して滴下した。添加が完結した後、この反応混合物を室温で更に30分間撹拌した。無水THF(20mL)中に溶解した4−シアノベンズアルデヒド(11.3g,86.1mmol)の溶液を、30分間にわたって添加漏斗を介してこの反応混合物に滴下した。添加の終了後、この反応混合物を室温で1時間撹拌し、次いでMTBE(200mL)及び飽和NH4Cl(150mL)で希釈した。有機層を分離し、25mLのH2O及び25mLの飽和NH4Clで洗浄し、MgSO4上で乾燥し、ろ過し、そして蒸発・乾固すると、20.0g(100%)の中間体Gが固体として得られた。
1H NMR (400 MHz, CDCl3) δ ppm 1.56 (s, 9H) 6.47 (d, J=16 Hz, 1H) 7.58 (d, J=16 Hz, 1H) 7.61 (d, J=8 Hz, 2H) 7.68 (d, J=8 Hz, 2H)。
【0203】
中間体H
トランス−4−(2−(ヒドロキシメチル)シクロプロピル)ベンゾニトリル
【化14】

丸底フラスコに、中間体I(10.0g,44mmol)、ジメチルアセトアミド(125mL)、ヘキサシアノ鉄(II)酸カリウム三水和物(potassium hexacyanferrate (II) trihydrate)(24.2g,22mmol)、酢酸パラジウム(II)(palladium (II) acetate)(1.3g,2.2mmol)、DABCO(1.3g,4.4mmol)、及び炭酸ナトリウム(12.2g,44mmol)を入れた。この結果生じた混合物を、窒素下にて17時間、150℃に加熱した。この反応混合物を室温に冷却し、そしてシリカゲルパッドに通してろ過した。このパッドをEtOAc(200mL)で洗浄した。集められたろ液及び洗浄液を追加のEtOAc(200mL)で希釈し、ブライン(3×100mL)で洗浄し、MgSO4上で乾燥し、ろ過し、そして減圧下で濃縮した。この粗製物をカラムクロマトグラフィー(シリカ,DCM/MeOH 99:1)によって精製すると、10.5g(55%)の中間体Hが得られた。
1H NMR (400 MHz, CDCl3) δ ppm□ 1.00-1.15 (m, 2H) 1.47 -1.58 (m, 1H) 1.88-1.94 (m, 1H) 3.56-3.76 (m, 2H) 7.15 (d, J=8.5 Hz, 2H) 7.55 (d, J= 8.5 Hz, 2H)。
【0204】
中間体I
トランス−2−(4−ブロモフェニル)シクロプロピル)メタノール
【化15】

ヘキサン中のジエチル亜鉛(1.1M,695mL,765mmol)の溶液を、窒素下にて450mLのDCMを含んでいる火炎乾燥三つ口丸底フラスコに加えた。この結果生じた溶液を0〜5℃に冷却した。TFA(59mL,765mmol)を冷却したジエチル亜鉛溶液にゆっくり加えた。添加が完結した後、この結果生じた混合物を20分間撹拌した。50mLのDCM中のCH2I2(62mL,765mmol)の溶液をこの混合物に加えた。更に20分の撹拌後、450mLのDCM中の3−(4−ブロモフェニル)プロパ−2−エン−1−オール(81.6g,382.9mmol)の溶液を加えた。添加の完結後、この反応混合物を室温に暖め、そして2時間撹拌した。過剰の試薬を500mLの1M HClをゆっくり添加することによってクエンチした。上部の水層を分離し、そして200mLのDCMで抽出した。有機抽出物を集め、これを500mLの飽和NH4ClとNH4OH(9:1v/v)の混合物で洗浄し、MgSO4上で乾燥し、ろ過し、そして減圧下で濃縮した。粗製物を、フラッシュカラムクロマトグラフィー(シリカ,ヘプタン/EtOAc 10:1)によって精製すると、76.1g(87.5%)の中間体Iが固体として得られた。
1H NMR (400 MHz, CDCl3) δ ppm 0.90-1.00 (m, 2H) 1.36-1.48 (m, 1H) 1.75-1.85 (m,
1H) 3.62 (t, J=6 Hz, 2H) 6.95 (d, J=8.5 Hz, 2H) 7.38 (d, J=8.5 Hz, 2H)。
【0205】
中間体J
(R)−1−(4−ブロモ−フェニル)−2−クロロ−エタノール
【化16】

ジメチルスルフィドボラン(2.0kg,24.8moles,94%w/w)を、tジャケット(ジャケット温度)=20℃でトルエン(8L)中に混ぜ入れた。トルエン溶液として、(R)−(+)−メチル−CBS−オキサザボロリジン(2.6kg,2.74moles,1M)を加えた。この充填容器をトルエン(0.5L)でリンスし、そしてtジャケットを45℃に設定した。Jiangyan Keyan Fine Chemical Co. Ltdから商業的に入手可能である1−(4−ブロモ−フェニル)−2−クロロ−エタノン(7.84kg,33.6moles)を、別々の容器中で2−MeTHF(75L)中に溶解し、そして第一の容器中ではtインナー(内部(インナー:inner)温度)を40℃より高くして、2−MeTHF溶液を3時間にわたって加えた。後者の容器は2−MeTHF(2L)でリンスし、そしてそれをこの反応混合物に加え、これはtジャケット=45℃で1時間撹拌したままにした。試料を次のグラジエント法(移動相 20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動)を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。この反応混合物をtジャケット=10℃に冷却し、その後MeOH(36L)でゆっくりクエンチした。MeOHの1回目の分のリットルを30分間にわたって加え、そして残りを更に30分間にわたって加えた。MeOHを真空下にてtジャケット=50℃で留去した。残っている有機溶液をtジャケット=20℃に冷却し、H2O中の1M HCl(7L 濃HCl
+73L H2O)で洗浄し、そして真空下にてtジャケット=50℃でおよそ40Lまで濃縮した。2−MeTHF溶液中の得られた中間体Jは、10℃で20時間保管するか、あるいは次の合成工程で直ちに使用することができる。
【0206】
中間体K
(R)−2−(4−ブロモ−フェニル)−オキシラン
【化17】

Aliquat(登録商標)175(メチルトリブチルアンモニウムクロリド)(1.12kg,4.75moles)を、tジャケット=20℃で2−MeTHFの溶液(33.6moles,40L)としての中間体Jに加えた。H2O(2L)で希釈したNaOH(5.1kg,57.4moles,45%w/w)を20分にわたって加えた。この反応混合物をtジャケット=20℃で2時間撹拌したままにした。試料を次のグラジエント法[移動相 20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。水相を分離し、そして有機相をH2O(2×25L)で洗浄した。2−MeTHF(25L)を加え、そして有機相を真空下にてtジャケット=50℃でおよそ30Lまで濃縮した。2−MeTHF溶液中の得られた中間体Kは、5℃で140時間保管するか、あるいは次の合成工程で直ちに使用することができる。
【0207】
中間体L
(1S,2S)−2−(4−ブロモ−フェニル)−シクロプロパンカルボン酸
【化18】

トリエチルホスホノアセタート(Triethyl phosphonoacetate)(10.5L,51.9moles,98%w/w)を、tジャケット=−20℃で2−MeTHF(14L)中に溶解した。ヘキサン中のヘキシルリチウム(21L,48.3moles,2.3M)を、tインナー(内部温度)を0℃未満に維持する速度で加えた。充填容器を2−MeTHF(3L)でリンスし、そしてこの反応溶液をtジャケット=10℃で撹拌したままにした。2−MeTHF溶液(33.6moles,30L)としての中間体Kを20分にわたって加えた。この充填容器を2−MeTHF(2L)でリンスし、そしてこの反応溶液を、tジャケット=65℃で少なくとも16時間(但し、最後の3時間はtジャケット=75℃にした)撹拌したままにした。試料を次のグラジエント法[移動相20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、中間体(1S,2S)−2−(4−ブロモ−フェニル)−シクロプロパンカルボン酸エチルエステルへの完全な変換を示した。この反応溶液を、tジャケット=20℃に冷却した。H2O(12L)で希釈したNaOH(7.6kg,85.5moles,45%w/w)を20分にわたって加えた。得られた反応溶液をtジャケット=60℃で少なくとも2時間撹拌したままにした
。試料を次のグラジエント法[移動相 20〜95%B;A:5%CH3CN(0.1%TFAを含むH2O中),B:95%CH3CN(0.085%TFAを含むH2O中),10分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。この反応溶液を、tジャケット=20℃に冷却し、水相を分離し、そして有機相をH2O(37L)で抽出した。水相を集め、これをH2O(12.5L)中に希釈したH3PO4(9L,131moles,85%w/w)を用いて酸性にし、pH<3.5にした。希釈したH3PO4(水性)のうち17Lだけが、pH<3.5に達するのに使用された。この酸性の水相を2−MeTHF(2×15L)で抽出した。2−MeTHF(2L)でのリンス液を含めて集められた有機相を、真空下にてtジャケット=50℃でおよそ11Lまで濃縮した。この2−MeTHF溶液をtジャケット=35℃で、EtOH(14.5L)で希釈し、そしてH2O(16L)を20分にわたって加えた。この反応溶液を、tジャケット=28℃に冷却した。シード(16g,0.066moles)を加え、そしてこの溶液をtジャケット=28℃で2時間撹拌した。この反応混合物を6時間にわたってtジャケット=0℃に冷却し、そして少なくとも1時間撹拌したままにした。追加のH2O(8L)を40分にわたって加え、そしてこの生成物をろ別し、そして冷却したH2O(10L)で洗浄した。真空下にて40℃で乾燥すると、6.18kgの中間体L(21.5moles,84%w/w)が得られ、収率は7.84kgの1−(4−ブロモ−フェニル)−2−クロロ−エタノン(33.6moles)からの4工程にわたって64%であった。
【0208】
中間体Lの再結晶:中間体Lの2バッチ(6.18+7.04kg)を、EtOH(52L)に混ぜ入れ、tジャケット=70℃で加熱した。H2O(52L)を加えた。この反応溶液を、2.5時間にわたってtジャケット=30℃に冷却した。H2O(16L)を20分間にわたって加え、そして再結晶体を3時間にわたってtジャケット=20℃に冷却した。この生成物をろ別し、そしてH2O(8L)とEtOH(2L)の混合物で洗浄した。真空下にて40℃で乾燥すると、10.0kgの中間体L(41.5moles,88%w/w)が得られ、これをtジャケット=60℃でトルエン(39L)とイソオクタン(57L)中で再溶解した。透明な溶液が得られた。この反応溶液を、tジャケット=45℃に冷却し、そして1時間撹拌したままにし、次いで2時間にわたってtジャケット=20℃に冷却した。この生成物をろ別し、そしてトルエン(4L)とイソオクタン(36L)の混合物で2回に分けて洗浄した。真空下にて40℃で乾燥すると、7.4kgの中間体L(29.8moles,97%w/w)が得られ、収率は、7.84+7.93kgの1−(4−ブロモ−フェニル)−2−クロロ−エタノン(67.5moles)からの4工程にわたって44%であった。
1H-NMR (DMSO-d6): δ 12.36 (s, 1H), 7.44 (d, 2H, J=8 Hz), 7.13 (d, 2H, J=8 Hz), 2.39 (m, 1H), 1.81 (m, 1H), 1.43 (m, 1H), 1.33 (m, 1H);
13C-NMR (DMSO-d6): δ 173.76, 139.88, 131.20, 128.24, 119.14, 24.73, 24.31, 16.78;
LC-MS (ES): m/z 239 (M-1 (Br79)) 及び 241 (M-1 (Br81))。
Rt=5.03分[Xbridge C18,3.0×50mm,2.5μm 粒径による分析方法(移動相:5〜90%B;A:H2O(0.1%ギ酸を含む),B:CH3CN,8.6分稼動)]。この生成物を、Kromosil 3-Amycoat,150×4.6mm,3μm 粒径によって、アイソクラティック法(移動相:EtOH/イソヘキサン/TFA(15/85/0.1v/v/v))を用いてUV検出付きキラルカラムによって分析すると、エナンチオマー純度98.9%ee、Rt=5.29分(異性体1)及び5.97分(異性体2)が得られた。
【0209】
中間体M
(1S,2S)−2−(4−シアノ−フェニル)−シクロプロパンカルボン酸
【化19】

中間体L(3.7kg,14.9moles,97%w/w)及び亜鉛末(98%+,<10μm)(99g,1.51moles)を、DMF(13.5L)と混和し、そしてこのスラリーをtジャケット=20℃で撹拌した。この混合物を不活性化し、0.1〜0.2バールのN2圧にした。ビス(トリ−t−ブチルホスフィン)パラジウム(0)(27.5g,0.054moles)をこのスラリーに加え、そしてこの容器を不活性化し、0.1〜0.2バールのN2圧にした。この混合物をtジャケット=45℃に加熱し、Zn(CN)2(1.0kg,8.52moles)を1回でこの懸濁液に加え、そしてこの系を不活性化し、0.1〜0.2バールのN2圧にした(注:シアン化物塩は毒性が高い)。この結果生じた混合物をtジャケット=75℃に加熱し、そして少なくとも2時間撹拌した。試料を次のグラジエント法[移動相20〜95%B;A:5%CH3CN(0.05%ギ酸を含むH2O中),B:95%CH3CN(0.05%ギ酸を含むH2O中),8分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。この反応混合物をtジャケット=20℃に冷却した。チオール官能化シリカ(Silicycle社,SiliaBond Thiol)(1.07kg,28%w/w)を加え、そして容器を不活性化した。この反応混合物を、tジャケット=20℃で少なくとも36時間撹拌した。このスカベンジャーを活性炭又はその等価物(ポールフィルター:pall-filter)を含むフィルターを介してろ別した。この容器とフィルターシステムを2−MeTHF(53L)で洗浄した。ろ液及び洗浄液を集め、そそしてtジャケット=5℃で撹拌した。淡黄色液体が生じた。H2O(16.4L)中のNaCl(3.5kg)を内部温度が15℃未満に留まっているような速度で15分間にわたって加えた。この結果生じた反応混合物を、tジャケット=45℃に加熱し、そして水相を分離した。有機相をH2O中のNaHSO4×H2O(2×(2.87kg+16.4L))、及びH2O中のNaCl(3.5kg+16.4L)で洗浄した。有機相をtジャケット=10℃に冷却し、そしてH2O(41L)中に希釈したNaOH(1.54kg,19.3moles,50%w/w)を45分間にわたって加えた。この結果生じた反応混合物を、tジャケット=30℃に加熱し、そして有機相を分離した。水相を、tジャケット=20℃で撹拌し、そしてpHを、内部温度が25℃未満に維持される速度でH2O(5.3L)中に希釈したH3PO4(0.90kg,7.81moles,85%w/w)を加えて6.5に調整した。2−MeTHF及びH2Oを、真空下にて、蒸留の前の量の85〜90%の量、およそ8Lまで留去した。この反応混合物をtジャケット=0℃に冷却し、そしてH2O(8.2L)中に希釈したH3PO4(1.17kg,10.1moles,85%w/w)を、pH=4まで加えることを継続した。このスラリーを、tジャケット=10℃で終夜撹拌したままにした。この生成物をろ別し、H2O(2×4L)で洗浄した。真空下にて40℃で乾燥すると、中間体M(2.24kg,11.2moles,93.2%w/w)が収率75%で得られた。
1H-NMR (DMSO-d6): δ 12.45 (s, 1H), 7.72 (d, 2H, J=8 Hz), 7.37 (d, 2H, J=8 Hz), 2.50 (m, 1H), 1.94 (m, 1H), 1.50 (m, 1H), 1.42 (m, 1H);
13C-NMR (DMSO-d6): δ 173.51, 146.68, 132.27, 126.93, 118.97, 108.85, 25.16, 25.04, 17.44;
LC-MS (ESI): m/z 186 (M-1)。
Rt=3.63分[Xbridge C18,3.0×50mm,2.5μm 粒径による分析方法(移動相:5〜90%B;A:H2O(0.1%ギ酸を含む),B:CH3CN,8.6分稼動)]。
【0210】
中間体N
(1S,2S)−2−(4−カルバモイル−フェニル)−シクロプロパンカルボン酸
【化20】

中間体M(4.46kg,22.0moles,92.5%w/w)を、tジャケット=30℃でH2O(40L)中に混ぜ入れた。H2O(6L)中に希釈したNaOH(2.25kg,28.1moles,50%w/w)を、tインナー(内部(inner)温度)が35℃未満に留まるような速度で加えた。充填容器を、H2O(1L)でリンスした。pHが≧12でない場合には、更にNaOHを前と同じ濃度で加えた。過酸化水素(4.89kg,50.3moles,35%w/w)を、tインナーを35℃未満に維持するような速度で加えた。充填容器をH2O(1L)でリンスし、そしてこの反応スラリーを0.5〜1.0時間撹拌したままにした。試料を次のグラジエント法[移動相20〜95%B;A:5%CH3CN(0.05%ギ酸を含むH2O中),B:95%CH3CN(0.05%ギ酸を含むH2O中),8分稼動]を用い、Chromolith Performance RP-18e,4.6×100mmによるHPLCによって分析すると、この時点で完全な変換を示した。この反応混合物をtジャケット=0℃に冷却し、少なくとも0.5時間撹拌したままにして温度を達しさせた。中間体Nのナトリウム塩をろ別し、そして冷却したH2O(2×7L)で洗浄した。この固体を、H2O(35L)中に希釈したNaHSO4×H2O(2.76kg,20.0moles)を含むフィルター上でスラリー洗浄した。スラリーをtジャケット=0℃で1時間撹拌し続けた。pHが<3.7でない場合には、H2O中のNaHSO4×H2Oを用いて調整した。この生成物をろ別し、冷却したH2O(3×14L)で洗浄した。真空下にて40℃で乾燥すると、4.0kgの中間体N(18.2moles,93.4%w/w)が得られた(収率83%)。
1H-NMR (DMSO-d6): δ 12.40 (s, 1H), 7.94 (s, 1H), 7.79 (d, 2H, J=8 Hz), 7.32 (s,
1H), 7.23 (d, 2H, J=8 Hz), 2.44 (m, 1H), 1.88 (m, 1H), 1.47 (m, 1H), 1.39 (m, 1H);
13C-NMR (DMSO-d6): δ 173.83, 167.67, 143.94, 132.17, 127.68, 125.73, 25.21, 24.67, 17.11;
LC-MS (ESI): m/z 206 (M+1)。
Rt=2.13分[Xbridge C18,3.0×50mm,2.5μm 粒径による分析方法(移動相:5〜90%B;A:H2O(0.1%ギ酸を含む),B:CH3CN,8.6分稼動)]。この生成物を、Kromosil 3-Amycoat,150×4.6mm,3μm 粒径によって、アイソクラティック法(移動相:EtOH/イソヘキサン/TFA(15/85/0.1v/v/v))を用いてUV検出付きキラルカラムによって分析すると、エナンチオマー純度>99%ee、Rt=13.40分(異性体1)及び22.22分(異性体2)が得られた。
【0211】
中間体O
(R)−1−シクロブチル−3−メチルピペラジン・2HCl
【化21】

Lanzhou Boc Chemical Co.から商業的に入手可能である(R)−Boc−2−メチルピペラジン(350g,1.71moles,98%w/w)を、tジャケット=20℃でEtOH(2.75L)中に溶解した。酢酸(1.37L)を1回で加え、引き続いてシクロブタノン(184g,2.57moles)を添加した。充填容器をEtOH(250mL)でリンスし、そして淡黄色溶液を、tジャケット=20℃で1時間撹拌したままにした。NaBH(OAc)3(497g,2.48moles,95%w/w)を、90分にわたって20回に分けて加えた。EtOH(340mL)をリンスするために使用した。この反応混合物を2時間撹拌したままにした。試料を、グラジエント法(60℃(2分),次いで25℃/分(8分間)、次いで260℃(2分))で、HP−5MSカラム(長さ 25m,ID 0.32mm,フィルム 0.52μm)を用いてGCによって分析した。ガスとしてヘリウム(He)を用い、フロント注入口温度=200℃、及び検出器温度=300℃であった。更にこの反応を1時間以内に完結するためにNaBH(OAc)3(30g,0.14moles)を加えた。この反応混合物をtジャケット=0℃に冷却し、その後5M NaOH(5.5L)でクエンチした。EtOHを真空下にてtジャケット=50℃で留去した。このH2O相をtジャケット=20℃において、トルエン(5.5L)で抽出した。有機相は、(R)−Boc−2−メチルピペラジン(300g,1.47moles,98%w/w)から開始し、第二のバッチと組み合わされた。有機相を集め、これを真空下にてtジャケット=50℃でおよそ2Lまで濃縮した。得られた中間体を含むトルエン溶液を数日間5℃で保管した。トルエン溶液を、tジャケット=10℃で2−プロパノール(2L)で希釈し、そして2−プロパノール(2L)中に希釈した、2−プロパノール(1.06L,6.36moles,6M)中のHClを30分にわたって加えた。この反応溶液を、tジャケット=48℃に加熱した。2−プロパノール(2L)中に希釈した、2−プロパノール(2.12L,12.72moles,6M)中のHClをtインナー(内部温度)=46℃で2時間にわたって加えた。この反応溶液を、tジャケット=48℃で更に3時間維持し、その後1時間にわたってtジャケット=0℃に冷却した。シード混合物(中間体O(0.2g,0.89mmoles)を含む0.4Lの反応溶液)を加えた。この反応混合物を、tジャケット=0℃で終夜撹拌したままにし、そしてこの生成物をろ別した。真空下にて40℃で乾燥すると、620gの中間体O(2.63moles,96.3%w/w)が収率83%で得られた。
1H-NMR (DMSO-d6): δ 12.46 (s, 1H), 10.13 (s, 2H), 3.35-3.74 (m, 6H), 3.09 (m, 1H), 2.92 (m, 1H), 2.39 (m, 2H), 2.16 (m, 2H), 1.72 (m, 2H), 1.32 (d, 3H, J=6.4 Hz);
13C-NMR (DMSO-d6): δ 58.50, 49.62, 48.13, 44.30, 24.48, 24.38, 15.25, 13.26。
【0212】
中間体P
4−((1S,2S)−2−((R)−4−シクロブチル−2−メチルピペラジン−1−カルボニル)シクロプロピル)ベンゾニトリル
【化22】

Arを泡立たせながら、NMP(100mL)中の中間体Q(8.5g,22.53mmol)の溶液に、亜鉛(0.737g,11.26mmol)、シアン化亜鉛(1.984g,16.90mmol)及びジクロロ[1,1’−ビス(ジ−t−ブチルホスフィノ)フェロセン]パラジウム(II)(0.335g,0.45mmol)を加えた。これを100℃で20時間加熱した。一部の出発物質は依然として存在していたので、加熱を更に24時間継続し、次いでこの反応物を冷却し、そして高真空下にて濃縮した。この物質を、EtOAc中に加え、そしてセライトろ過した。ろ液を濃縮し、2つの同重量の部分に分割し、それぞれの部分を、EtOAc/ヘプタン50〜100%のグラジエントで溶離する、120gのシリカゲルカラムによって精製すると、6.10g(84%)の中間体Pが提供された。この生成物をX-Bridge C18,2.1×30mm,5μm 粒径を使用して、高pHグラジエント法[移動相:5〜95%B;A:H2O(10mM NH4CO3及び0.375% NH4OH v/vを含む),B:CH3CN,2.25分稼動]を用いる分析HPLC MSによって分析した。
MS m/z 324.39 [M+H]+ (ESI), Rt 1.76分。
【0213】
中間体Q
((1S,2S)−2−(4−ブロモフェニル)シクロプロピル)((R)−4−シクロブチル−2−メチルピペラジン−1−イル)メタノン
【化23】

DMF(120mL)中の中間体R(第二方法)(5.87g,24.34mmol)の溶液に、0℃で、N,N−ジイソプロピルエチルアミン(21.20mL,121.72mmol)、1−ヒドロキシベンゾトリアゾール(4.93g,36.52mmol)、N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド塩酸塩(7g,36.52mmol)を加え、引き続いて中間体O(5.53g,24.34mmol)を添加した。次いで反応物を15時間撹拌し、この反応物を濃縮し、そして残留物をEtOAc中に加え、そして飽和NaHCO3溶液で洗浄した。水相をEtOAcで2回抽出し、そして有機物を集め、これをブラインで洗浄し、MgSO4上で乾燥し、ろ過し、そして濃縮した。この結果生じた油状物を、イスココンパニオン装置(ISCO Companion instrument)を用いて120g Redisepカラムを使用し、EtOAc/ヘプタン 20〜100%のグラジエントを用いる順相クロマトグラフィーによって精製すると、8.50g(93%)の中間体Qが放置するとゆっくり固体化する透明なガラス状物として提供された。1H-NMR (400 MHz, メタノール-d4) δ ppm 1.27 (br. s., 3H) 1.38 (br. s., 1H) 1.48-1.58 (m, 1H) 1.64-1.77 (m, 3H) 1.77-1.87 (m, 1H) 1.87-1.99 (m, 2H) 1.98-2.09 (m, 2H) 2.14-2.22 (m, 1H) 2.34 (br. s., 1H) 2.63-2.76 (m, 2H) 2.85 (dddd, J=11.43, 3.61, 1.95, 1.76 Hz, 1H) 2.90-3.01 (m, 1H) 3.40 (br. s., 1H) 4.03 (d, J=11.33 Hz, 1H) 4.31 (d, J=11.72 Hz, 1H) 4.39 (br. s., 1H) 4.64 (br. s., 1H) 7.09 (d, J=8.20 Hz, 2H) 7.41 (d, J=8.59 Hz, 2H)。
この生成物をX-Bridge C18,2.1×30mm,5μm 粒径を使用して、高pHグラジエント法[移動相:5〜95%B;A:H2O(10mM NH4CO3及び0.375% NH4OH v/vを含む),B:CH3CN,2.25分稼動]を用いる分析HPLC MSによって分析した。
MS m/z 277.31 [M+H]+ (ESI), Rt 2.10 分。
【0214】
中間体R
(1S,2S)−2−(4−ブロモ−フェニル)−シクロプロパンカルボン酸
【化24】

400mlのEtOH中の(トランス)−2−(4−ブロモフェニル)シクロプロパンカルボン酸[WO 2009/024823の82ページに記載されている方法に従って製造することができる](6.52g,27.04mmol)の撹拌溶液に、100mlのEtOH中、その後に25mlのH2O中に溶解した(R)−(+)−1−(1−ナフチル)エチルアミン(4.63g,4.37mL,27.04mmol)の溶液を加えた。これを室温で約4時間撹拌した。固形物をろ過によって回収し、そして40mlの冷却したEtOH/H2O(20/1)で洗浄すると、遊離の酸1.86gに相当する3.18グラムの塩が白色固形物(58%回収)として提供された。これを2N NaOH中に加え、そしてEtOAcで5回抽出した。水相をロータリーエバポレーターにセットし、残留しているEtOAcを除去した。この結果生じた透明な溶液をエルレンマイアーフラスコに移し、氷浴中で冷却し、そして撹拌しながら濃HClを滴下して、pH4にした。この結果生じた固形物をろ過により回収すると、1.63gの中間体Rが提供された。この生成物を、ChiralPak AD-H,10×250mm,5μm粒径を用いアイソクラティック法(移動相:25%MeOH(0.1%DMEAを含む),超臨界CO2)を用いてキラルSFC(UV検出)によって分析すると、エナンチオマー純度>95%、Rt 3.88分(異性体1)及び4.79分(異性体2)が得られた。
1H NMR (400 MHz, CDCl3) δ ppm 1.37 (ddd, J=8.20, 6.64, 4.69 Hz, 1H), 1.67 (ddd,
J=9.28, 5.08, 4.79 Hz, 1H), 1.87 (ddd, J=8.50, 4.69, 4.39 Hz, 1H), 2.48-2.63 (m, 1H), 6.87-7.06 (m, 2H), 7.37-7.46 (m, 2H)。
【特許請求の範囲】
【請求項1】
式I:
【化1】

のフォームIを含んでなる固体形態。
【請求項2】
約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θから選択される少なくとも1個のピークを含んでなるXRPDパターンを有する、請求項1に記載の固体形態。
【請求項3】
約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θから選択される少なくとも2個のピークを含んでなるXRPDパターンを有する、請求項1に記載の固体形態
【請求項4】
約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θにおけるピークを含んでなるXRPDパターンを有する、請求項1に記載の固体形態
【請求項5】
パターンが約16.3及び約19.3°2θにおけるピークを更に含んでなる、請求項2〜4のいずれか1項に記載の固体形態。
【請求項6】
パターンが約20.9、及び約21.4°2θにおけるピークを更に含んでなる、請求項2〜5のいずれか1項に記載の固体形態。
【請求項7】
約1.54オングストロームの波長の放射線を用いて測定したときに、次の10個の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのピークを含んでなるXRPDパターンを有する、請求項1に記載の固体形態。
【請求項8】
本質的に図1に示されているXRPDパターンを有する、請求項1に記載の固体形態。
【請求項9】
本質的に図2に示されているDSCサーモグラムを有する、請求項1〜8のいずれか1項に記載の固体形態。
【請求項10】
約133.5℃において吸熱を含んでなるDSCサーモグラムを有している、請求項1〜8のいずれか1項に記載の固体形態。
【請求項11】
本質的に図3に示されているTGAサーモグラムを有する、請求項1〜10のいずれか1項に記載の固体形態。
【請求項12】
約20℃〜約100℃において約1%未満の質量減少を含んでなるTGAサーモグラムを有する、請求項1〜10のいずれか1項に記載の固体形態。
【請求項13】
質量減少が約0.5%未満である、請求項12に記載の固体形態。
【請求項14】
質量減少が約0.25%である、請求項12又は13に記載の固体形態。
【請求項15】
実質的に結晶性である、請求項1〜14のいずれか1項に記載の固体形態。
【請求項16】
実質的に純粋である、請求項1〜14のいずれか1項に記載の固体形態。
【請求項17】
実質的に結晶性であり、かつ実質的に純粋である、請求項1〜14のいずれか1項に記載の固体形態。
【請求項18】
請求項1〜17のいずれか1項に記載の固体形態を、製薬学的に許容される担体又は希釈剤と混和して含んでなる、医薬組成物。
【請求項19】
薬剤として使用するための請求項18に記載の医薬組成物。
【請求項20】
薬剤として使用するための請求項1〜17のいずれか1項に記載の固体形態。
【請求項21】
統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される障害を処置するための薬剤の製造における使用のための、請求項1〜17のいずれか1項に記載の固体形態。
【請求項22】
温血動物における、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される障害の治療方法であって、そうした治療を必要とする上記動物に治療的に有効な量の請求項1〜17のいずれか1項に記載の固体形態を投与することを含んでなる、上記方法。
【請求項23】
温血動物における、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される障害の治療方法であって、そうした治療を必要とする上記動物に請求項18に記載の医薬組成物を投与することを含んでなる、上記方法。
【請求項24】
統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損の処置における使用のための請求項1〜17のいずれか1項に記載の固体形態。
【請求項25】
統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損の処置における使用のための請求項18に記載の医薬組成物。
【請求項1】
式I:
【化1】

のフォームIを含んでなる固体形態。
【請求項2】
約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θから選択される少なくとも1個のピークを含んでなるXRPDパターンを有する、請求項1に記載の固体形態。
【請求項3】
約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θから選択される少なくとも2個のピークを含んでなるXRPDパターンを有する、請求項1に記載の固体形態
【請求項4】
約1.54オングストロームの波長を有する放射線を用いて測定したときに、約5.3、約8.5、及び約18.0°2θにおけるピークを含んでなるXRPDパターンを有する、請求項1に記載の固体形態
【請求項5】
パターンが約16.3及び約19.3°2θにおけるピークを更に含んでなる、請求項2〜4のいずれか1項に記載の固体形態。
【請求項6】
パターンが約20.9、及び約21.4°2θにおけるピークを更に含んでなる、請求項2〜5のいずれか1項に記載の固体形態。
【請求項7】
約1.54オングストロームの波長の放射線を用いて測定したときに、次の10個の位置:約5.3、約8.5、約10.6、約15.5、約16.3、約18.0、約18.4、約19.3、約20.9、約21.4°2θのピークを含んでなるXRPDパターンを有する、請求項1に記載の固体形態。
【請求項8】
本質的に図1に示されているXRPDパターンを有する、請求項1に記載の固体形態。
【請求項9】
本質的に図2に示されているDSCサーモグラムを有する、請求項1〜8のいずれか1項に記載の固体形態。
【請求項10】
約133.5℃において吸熱を含んでなるDSCサーモグラムを有している、請求項1〜8のいずれか1項に記載の固体形態。
【請求項11】
本質的に図3に示されているTGAサーモグラムを有する、請求項1〜10のいずれか1項に記載の固体形態。
【請求項12】
約20℃〜約100℃において約1%未満の質量減少を含んでなるTGAサーモグラムを有する、請求項1〜10のいずれか1項に記載の固体形態。
【請求項13】
質量減少が約0.5%未満である、請求項12に記載の固体形態。
【請求項14】
質量減少が約0.25%である、請求項12又は13に記載の固体形態。
【請求項15】
実質的に結晶性である、請求項1〜14のいずれか1項に記載の固体形態。
【請求項16】
実質的に純粋である、請求項1〜14のいずれか1項に記載の固体形態。
【請求項17】
実質的に結晶性であり、かつ実質的に純粋である、請求項1〜14のいずれか1項に記載の固体形態。
【請求項18】
請求項1〜17のいずれか1項に記載の固体形態を、製薬学的に許容される担体又は希釈剤と混和して含んでなる、医薬組成物。
【請求項19】
薬剤として使用するための請求項18に記載の医薬組成物。
【請求項20】
薬剤として使用するための請求項1〜17のいずれか1項に記載の固体形態。
【請求項21】
統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される障害を処置するための薬剤の製造における使用のための、請求項1〜17のいずれか1項に記載の固体形態。
【請求項22】
温血動物における、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される障害の治療方法であって、そうした治療を必要とする上記動物に治療的に有効な量の請求項1〜17のいずれか1項に記載の固体形態を投与することを含んでなる、上記方法。
【請求項23】
温血動物における、統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損から選択される障害の治療方法であって、そうした治療を必要とする上記動物に請求項18に記載の医薬組成物を投与することを含んでなる、上記方法。
【請求項24】
統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損の処置における使用のための請求項1〜17のいずれか1項に記載の固体形態。
【請求項25】
統合失調症、ナルコレプシー、日中過眠、肥満、注意欠陥多動性障害、疼痛、アルツハイマー病、認知欠損、及び統合失調症関連の認知欠損の処置における使用のための請求項18に記載の医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2013−520412(P2013−520412A)
【公表日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願番号】特願2012−553848(P2012−553848)
【出願日】平成23年2月17日(2011.2.17)
【国際出願番号】PCT/SE2011/050170
【国際公開番号】WO2011/102793
【国際公開日】平成23年8月25日(2011.8.25)
【出願人】(391008951)アストラゼネカ・アクチエボラーグ (625)
【氏名又は名称原語表記】ASTRAZENECA AKTIEBOLAG
【Fターム(参考)】
【公表日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願日】平成23年2月17日(2011.2.17)
【国際出願番号】PCT/SE2011/050170
【国際公開番号】WO2011/102793
【国際公開日】平成23年8月25日(2011.8.25)
【出願人】(391008951)アストラゼネカ・アクチエボラーグ (625)
【氏名又は名称原語表記】ASTRAZENECA AKTIEBOLAG
【Fターム(参考)】
[ Back to top ]

