シュードモナス・アエルギノーザ感染を診断するための組成物
【課題】本発明は、シュードモナス・アエルギノーザ感染を診断するための組成物を提供することを目的とする。
【解決手段】課題を解決するために、PcrV抗原を含む、PcrV特異的抗体/抗原複合体を検出することでシュードモナス・アエルギノーザ感染を診断するための組成物を提供する。
【解決手段】課題を解決するために、PcrV抗原を含む、PcrV特異的抗体/抗原複合体を検出することでシュードモナス・アエルギノーザ感染を診断するための組成物を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照 本出願は、1998年11月25日出願の米国出願番号第60/109,952号、並びに1999年3月30日出願の米国出願番号第60/126,794号に対して優先権を主張し、これらは両方とも参照して明細書の記載の一部とする。
【0002】
連邦政府後援の研究開発に関する記述 本発明は、以下の機関により与えられた米国政府支援によりなされた。NIH/NIADA許可番号R01 A131665−08、K04 AI01289−04およびR01 HL59239−02。米国は本発明に一定の権利を有する。
【背景技術】
【0003】
シュードモナス・アエルギノーザ(Pseudomonas aeruginosa)は、重病の個体において致命的な急性肺感染を引き起こすことのできる日和見細菌病原体である(1)。細菌の肺上皮傷害能は、III型媒介分泌および転位機構を介して、真核細胞に直接注入される毒素の発現と関連している(2、3)。
【0004】
P.アエルギノーザ(P.aeruginosa)III型分泌および転位装置によりコード化されるタンパク質は、エルシニア(Yersinia)Yopレギュロンのメンバーと高レベルのアミノ酸同一性を示す(4−6)。グラム陰性細菌に発見された全III型系の中で、唯一、P.アエルギノーザが、エルシニアV抗原であるPcrVに相同性を有する(III型系の概観については6参照)。分泌および転位装置に相同なタンパク質は、植物および動物の両方の病原性細菌によりコード化される。これらの生物は、サルモネラ・チフス菌(Salmonella typhimurium)、シゲラ・フレクスナー(Shigella flexneri)、腸病原性大腸菌(E.coli)、クラミジア(Chlamydia)種などのヒト病原体、およびキサントモナス・カンペストリス(Xanthamonas campestris)、シュードモナス・シリンゲ(Pseudomonas syringae)、エルシニア・アミロボーラ(Erwinia amylovora)およびラルストニア・ソラナセアラム(Ralstonia solanacearum)などの植物病原体を含む。しかし、唯一、P.アエルギノーザおよびエルシニアが、V抗原をコード化する。
【0005】
ヤール(Yahr)等、1997は、PcrVをコード化するオペロンの配列を開示し、この配列をLcrVタンパク質と比較している。それゆえに、PcrVのアミノ酸配列は既知であり、GenBankの寄託番号AF010149で入手できる。
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、シュードモナスV抗原は、致命的な肺感染から動物を守るために使用できるという我々の観察から発展させた方法および組成物を含む。
【課題を解決するための手段】
【0007】
1つの実施態様において、本発明は、患者(patient、患者または患蓄)に有効量のPcrV抗原を接種することを含む、シュードモナス感染を抑制する方法である。別の実施態様において、PcrVをコード化するDNAを、遺伝子ワクチンとして使用する。
【0008】
1つの好ましい実施態様において、抗原は、組換えタンパク質として発現され、危険にさらされている患者を免疫化するために使用する。
【0009】
好ましくは、患者は、感染から完全に守られる。
【0010】
別の実施態様において、PcrVをコード化するDNA(pcrVと呼ぶ)またはDNA断片は、P.アエルギノーザ感染を検出するために診断的に使用することができる。
【0011】
別の実施態様において、組換えタンパク質(rPcrV)は、患者から抗体を検出するために診断的に使用する。PcrVに対する患者の抗体応答は、予後に関連し得る。それ故、この実施態様において、組換えタンパク質は、患者の抗体力価を測定することにより、予後の指標として使用する。
【0012】
本発明はまた、個体を、有効量のPcrV抑制剤、特にPcrV抗体、抗体誘導体もしくは断片、または抗体擬似体と接触させることにより、個体のシュードモナス感染を抑制する方法を提供する。PcrV抗体、抗体誘導体および抗体断片もまた提供される。
【0013】
本発明の目的は、シュードモナス感染に対して患者を能動および受動免疫化することである。
【0014】
本発明の別の目的は、P.アエルギノーザ感染を診断的に検出することである。
【0015】
本発明の別の目的は、シュードモナス患者から抗体を診断的に検出することである。
【0016】
本発明の別の目的、特徴および利点は、明細書、特許請求の範囲および図面を概観した後、当業者には明らかとなろう。
【発明の効果】
【0017】
本発明によれば、PcrVに対してワクチン接種することにより、攻撃された動物の生存が保証されるだけでなく、細菌により引き起こされる肺炎症および損傷も減少する。また、有効量のPcrV抗原を用いて患者を免疫化することにより、シュードモナス感染を緩和または抑制することができる。また、PcrVに対するヒトまたはヒト化モノクローナルまたはポリクローナル抗体を投与し、P.アエルギノーザによる感染を予防または治療することができる。また、PcrVタンパク質をコード化するDNA、またはこのDNAの相補体を使用して、P.アエルギノーザ感染を診断的に検出することができる。また、タンパク質または抗原は、患者の抗体を検出するために診断的に使用することもでき、したがって、患者の感染状態を予測できる。また、PcrV抗体または抗体断片を治療に使用することができる。
【図面の簡単な説明】
【0018】
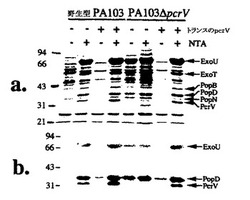
【図1】図1Aおよび1Bは、PA103ΔpcrVの表現型分析を示す、染色ゲル(図1A)およびウエスタンブロット(図1B)である。
【図2】図2Aおよび2Bは、P.アエルギノーザ親および変異株の生存および肺損傷を示す、グラフ(図2A)および棒グラフのセット(図2B)である。
【図3】図3Aおよび3Bは、生存、肺損傷、および細菌コロニー形成に対する免疫化の効果を示す、グラフ(図3A)および棒グラフのセット(図3B)である。
【図4】図4は、PcrV、ExoU、PopDに特異的なポリクローナル抗体または非免疫化動物由来の対照IgGを受動投与した後、5×105CFU/マウスのPA103株で攻撃して生存した動物数のグラフである。
【図5】図5は、異なる細菌性抗原に対するIgGおよび細菌攻撃の併用投与による、肺損傷からの生存および保護を示す、グラフ(図5A)および棒グラフのセット(図5B)である。肺損傷の一方向性分散分析は、p=0.026、および肺浮腫では、p<0.0005。
【発明を実施するための形態】
【0019】
我々は、本明細書で、PcrVは、III型分泌産物の発現に対して新規な調節効果を有し、III型毒素の転位に関与し、P.アエルギノーザ感染により誘導される肺損傷から守る最初の抗原であることを開示する。抗PcrV IgGを気腔に滴下注入する前に、PcrVに対してワクチン接種することにより、攻撃された動物の生存が保証されただけでなく、細菌により引き起こされる肺炎症および損傷も減少した。
【0020】
LcrV、またはV抗原は、Yopエフェクタータンパク質の分泌および転位を調節し、エルシニア感染に対するホストサイトカイン応答を変化させることにより、病理発生に細胞外的役割を果たしている、多機能性タンパク質である(7−11)。この危険な病原因子の唯一の既知の相同体は、PcrVと呼ばれる、P.アエルギノーザによりコード化される細胞外タンパク質である。
【0021】
本発明の1つの実施態様は、有効量のPcrV抗原を用いて患者を免疫化することにより、シュードモナス感染を緩和または抑制する方法である。ここで「有効量」とは、抗原で処置されていない対照被検者または動物と比較して、シュードモナス感染のいくらかの緩和または抑制が示されるに有効な量のPcrV抗原を意味する。
【0022】
ここで「緩和」とは、感染が、非免疫化動物と比較して、少なくとも50%抑制されることを意味する。好ましくは、感染は完全に予防される。感染の定量評価は、好ましくは、血流または胸水中の細菌量の検査および/または肺損傷パラメーターの検査を含む。例えば、血流または胸水中での細菌の非存在は、感染の予防を示す。肺損傷パラメータ−の減少は、感染の緩和を示す。
【0023】
感染は、痰、血液または胸水中の細菌容量の減少、浸潤物のサイズの減少、酸素付加改善、機械的換気時間の長さの減少、熱降下、および白血球数の減少を含む、いくつかの他の臨床指標により定量的に評価できる。
【0024】
ここで「PcrV抗原」とは、感染を予防または緩和する免疫応答を引き出すのに必要なPcrVタンパク質の一部または断片を意味する。現在、我々は、全長PcrVタンパク質を、保護を誘導するための抗原として使用している。しかし、当業者は、分子上での保護エピトープの位置を決めることができる。例えば、我々は、モノクローナル抗体を産生し、それらを、組織培養中において細胞毒性を予防する抗体についてスクリーニングする。細胞毒性を予防する抗体を、急性肺感染モデルで、感染に対する受動保護について試験する。モノクローナル抗体は、一般に、小領域のアミノ酸を認識し、アミノ酸が隣接している場合、エピトープは、6−9という少ないアミノ酸として特定され得る。エピトープを特定するために、感染および細胞毒性から守るモノクローナル抗体を、段々と小さい形の組換えPcrVに対する結合について試験する。(ここで「組換えPcrV」または「rPcrV」とは、非天然ホストに配置しておいたPcrV遺伝子から産生されたタンパク質を意味する。)これにより領域が局限する。この時点で、我々は、エピトープを特定するために、化学的にアミノ酸伸展を合成する。これらの化学合成したエピトープは、担体分子に結合させることができ、免疫化に使用して保護が達成されたかを決定することができる。別法として、我々は、PcrVの異なるクローンを作成し、組換えタンパク質を産生および精製し、これらの抗原を、免疫化実験および攻撃実験で試験できる。
【0025】
PcrVを用いて行なったマッピング研究に基づき、我々は、エピトープは、アミノ酸113ないし245の間に存在すると予測する。
【0026】
PcrV抗原は、我々が使用した方法、すなわちノバゲン(Novagen)から市販で入手可能なpet16bと呼ばれる細菌性発現プラスミドにより、最も容易に得られ得る。pcrV遺伝子は、初めて、オペロンの一部として、P.アエルギノーザ染色体からクローン化された。コード領域を増幅し、2つの異なるベクターに挿入した。1つのベクターは、図1で示すように、P.アエルギノーザからの発現用である。これは、PcrV発現が、細菌の残りの輸送および中毒装置と協調的に調節されるように、適切なプロモーター配列を含むように我々が修飾した、ハーバート・シュバイツァーからのベクター(参考文献19)である。第二のプラスミドであるpET16bは、大腸菌からの発現および精製目的用である。
【0027】
この系の利点は、P.アエルギノーザタンパク質の汚染を心配する必要がなく、タンパク質は非常に大量に産生され、そして1段階精製プロセスであるということである。この状況において、PcrVコード領域を増幅し、pET16bベクター上に提供されたヒスチジン標識を有するフレーム内でクローン化する。PcrVのアミノ末端に融合した複数のヒスチジン残基により、ニッケル−NTAカラムを使用したアフィニティークロマトグラフィーが可能となる。それ故、好ましいPcrV抗原は、組換えバージョンの天然PcrVタンパク質である。
【0028】
別の実施態様において、PcrVに対するヒトまたはヒト化モノクローナルまたはポリクローナル抗体を投与し、P.アエルギノーザによる感染を予防または治療する。P.アエルギノーザ感染にさらされる危険性の高い患者において、抗体を、感染の予防のために投与できる。さらに、抗体は、感染を治療するために、感染の開始後に、投与してもよい。この場合、抗体は、単独で、または抗生物質と組合せて投与できる。抗生物質と共に抗体を投与することにより、より短いクールまたは低用量の抗生物質の投与が可能となり得、よって、抗生物質耐性生物の出現の危険性が減少する。
【0029】
我々は、仮定上の少なくとも3つの型の患者を想定する。(1)重度の損傷または熱傷にさらされる危険性のある健康な個体(消防士、軍人、警官)を、永続する保護を与える方法(注射または鼻腔内のいずれか)によりワクチンで免疫化する。ブースターは、損傷後に病院の許可を得て投与する(筋肉内注射)。(2)機械的換気を受けている患者。(3)嚢胞性繊維症と遺伝子診断された患者。
【0030】
免疫化は、全身的にまたは鼻腔内に実施し得る。これらの個体の免疫化は、好ましくは、他の小児期疾患の普通のワクチン接種法中に開始する。我々は、おそらく5および10歳頃でのブースター用量により保護の永続を予測する。
【0031】
別の実施態様において、P.アエルギノーザ感染を診断的に検出するために、PcrVタンパク質をコード化するDNA、またはこのDNAの相補体を使用する。GenBankAF010149でPcrV抗原のDNA配列が得られる。PcrVのコード領域は、ヌクレオチド626−1510である。また、このコード領域の断片またはこの断片の相補体の使用を選択してもよい。成功するプローブは、PcrV DNAに特異的にハイブリッド化し、他の領域にはハイブリッド化しないものである。
【0032】
好ましくは、抗原配列内で少なくとも40個連続したヌクレオチドのハイブリッド形成プローブ、または配列内で少なくとも25個連続したヌクレオチドの2つのプライマーを使用する。当業者は、多くの標準的な型の核酸診断技術が適切であることを理解し、例えば、患者の痰から抽出されたDNAまたはRNAに対する一本鎖40ヌクレオチドプローブのハイブリッド形成がある。別の例では、患者の痰を、細菌性DNAまたはRNA源として使用し、それぞれ、PCRまたはRT−PCR反応の鋳型として使用する。
【0033】
また、個体から得られたサンプルを、PcrVに特異的な抗体と接触させ、対照サンプルと比較して増強した抗体結合を、個体のシュードモナス・アエルギノーザ感染と相関させることにより、個体におけるシュードモナス・アエルギノーザ感染を決定する。
【0034】
追加の実施態様において、PcrVをコード化するDNAを、標準的な分子生物学的方法を使用して、遺伝子ワクチンとして使用する。例えば、当業者には公知の技術について、以下の参考文献を概観し得る。デイビス・エイチ・エル(Davis,H.L.)等、「B型肝炎のDNAワクチン:チンパンジーにおける免疫原性の証拠および他のワクチンとの比較」、Proc.Natl.Acad.Sci.93:7213−7218、1996;バリー・エム・エー(Barry,M.A.)等、「発現−ライブラリー免疫化を使用したマイコプラズマ感染からの保護」、Nature 377:632−635、1995;キシアング・ゼット・キュー(Xiang,Z.Q.)等、「狂犬病ウイルスの核酸ワクチンに対する免疫応答」、Virology 209:569−579、1995。ここで「有効量」の遺伝子ワクチンとは、シュードモナス感染またはシュードモナス感染症状を緩和または排除するに有効な量のワクチンを意味する。
【0035】
タンパク質または抗原は、患者の抗体を検出するために診断的に使用することもでき、したがって、患者の感染状態を予測できる。好ましくは、シュードモナス感染が疑われる個体から得られたサンプルを、PcrVタンパク質またはその断片と接触させ、タンパク質/抗体結合を検出する。その後、(対照サンプルと比較して)増強した抗体結合を、個体のシュードモナス・アエルギノーザ感染と相関させる。
【0036】
また、PcrV抗体または抗体断片を治療に使用することもできる。抗体がヒト使用に安全であるとなれば、(a)それを全身投与でき、また(b)予防処置または治療法として肺に投与できる。ヒトでPcrV抗体を使用するために、抗体は好ましくは「ヒト化」する。一般に、モノクローナル抗体が得られれば、重鎖および軽鎖可変領域をクローン化する。これらのクローン化した断片は、その後、ヒト抗体骨格(定常領域)に挿入する。このようにして、我々は、結合特異性を提供することに加えて、抗体のクラス(IgG、IgA等)を調節できる。
【0037】
本発明での使用において、PcrV抗体は、モノクローナル抗体でもポリクローナルでもよい。抗体は、特に治療適用のために、ヒトまたはヒト化され得る。抗体断片または誘導体、例えばFab、F(ab')2またはFvも使用してよい。例えば、フストン(Huston)等(Int.Rev.Immunol.10:195−217、1993)に記載のような単鎖抗体は、本明細書に記載の方法にも用途を見出し得る。ここで「有効量」のPcrV抗体または抗体断片とは、シュードモナス感染または感染症状を緩和または排除するに十分な量を意味する。
【0038】
PcrV抗体および抗体断片に加えて、小分子ペプチド擬似体または非ペプチド擬似体を、おそらくPcrVの作用を妨害することによる、シュードモナス感染の抑制または調節におけるPcrV抗体の作用を擬似するように設計できる。かかる小分子擬似体を設計する方法は公知である(例えば、リプカ(Ripka)およびリッチ(Rich)、Curr.Opin.Chem.Biol.2:441−452、1998;フアング(Huang)等、Biopolymers 42:367−382、1997;アル−オベイジ(al−Obeidi)等、Mol.Biotechnol.9:205−223、1998参照)。PcrV抗体に基づき設計した小分子抑制剤を、PcrV−PcrV抗体結合相互作用を妨害する能力についてスクリーニングした。かかるアッセイで活性を示す候補小分子を、例えば、インビトロスクリーニングアッセイを含む、当分野で公知の方法により最適化し得、本明細書に記載の方法のいずれかにより、または当分野で公知のように、シュードモナス感染の抑制または調節についてインビボアッセイでさらに精製し得る。かかる小分子のPcrV作用抑制剤は、シュードモナス感染の抑制または調節において本法に有用である。
【0039】
本発明の別の態様において、PcrVタンパク質は、ホスト細胞、特にヒト細胞、より特定すると、ヒト上皮細胞またはマクロファージに存在し得るPcrVレセプターを同定するために使用し得る。PcrVレセプターの同定により、組合せライブラリーなどの小分子ライブラリーを、PcrV結合を妨害する候補についてスクリーニングすることが可能となる。かかる分子は、シュードモナス感染を抑制または調節する方法にも有用である。
【0040】
レセプター同定における我々の最初の試みは、プルダウン実験でPcrVを使用することである。PcrVを、グルタチオンS−トランスフェラーゼ(GST)に融合させ、可溶化細胞抽出物のアフィニティークロマトグラフィーのカラムマトリックスに付着させる。PcrVに特異的に結合しているタンパク質を溶出し、同定のためにアミノ末端シークエンスにかけた。平行実験で、PcrVを、酵母二重ハイブリッド分析にかける。この場合、PcrVは、Gal4のDNA結合ドメインを有するフレーム内に融合させる。クローンが得られれば、適切な酵母ホスト株に形質転換する。Gal4PcrV作成物を含む酵母株を、Gal4活性化ドメインを有するフレーム内にクローン化したHela細胞cDNAバンクを用いて形質転換する。ヒスチジンを利用し、βガラクトシダーゼ(PcrVと相互作用するタンパク質)を産生する能力を補完した二重形質転換体を、遺伝学的におよびヌクレオチド配列レベルで分析する。レセプターが細胞糖脂質である場合、我々は、糖脂質を、薄層クロマトグラフィーにより分離し、その後、放射標識細菌でプローブする、オーバーレイ技術を利用する。特異的成分への結合は、オートラジオグラフィーにより監視する。同じように、上皮およびマクロファージタンパク質を、SDS−PAGEにより分離し、ニトロセルロースにブロットし、放射標識細菌または標識PcrVをのせる。ここでも、細菌が結合したタンパク質成分を、その後、オートラジオグラフィーにより同定する。
【0041】
シュードモナス種は、動物界およびさらには植物界内の広範囲のホストを感染することが知られている。当業者には明らかなように、本明細書で開示した組成物および方法は、シュードモナス種による感染から生じた疾患または状態の抑制または調節において、広範囲の生物に使用し得る。本発明の組成物および方法は、特にシュードモナス・アエルギノーザへの適用について記載するが、本明細書に教示した方法を他の種に適用することは当業者の能力の十分範囲内である。
【実施例1】
【0042】
1.細胞毒性におけるPcrVの役割
III型媒介調節/分泌におけるPcrVの役割を決定するために、我々は、PcrVの非極性対立遺伝子を作成し、この作成物を使用して、P.アエルギノーザPA103株(インビトロで細胞毒性が高く(3)、インビボで肺上皮傷害を引き起こす(12、13)株である)の野生型対立遺伝子を置換した。細胞毒性および肺損傷は、特異的な細胞毒ExoUの産生に起因する(3)。
【0043】
PA103ΔpcrVは、ExoU細胞毒(3)、PcrV(5)、および毒素の転位に必要なタンパク質PopD(14)を含む、P.アエルギノーザIII型系により分泌されるいくつかの細胞外産物の発現により特徴づけられた。濃縮培養上清のSDS−ポリアクリルアミドゲル電気泳動により、親株PA103は、カルシウムキレート剤であるニトリロトリ酢酸(NTA)を含む培地中での増殖により、III型タンパク質の産生および分泌が誘導されることが示された(図1)。PcrVをコード化する発現クローンが、親株においてトランスで提供される場合、NTAの存在または非存在に応答する細胞外タンパク質産生は正常である。PA103ΔpcrVは、カルシウム盲目表現型を示し、細胞外タンパク質産生は、NTAの存在および非存在の両方で強く誘導される。これらの結果は、分泌系は、完全に機能しているが、調節は解除されていることを示唆する。この調節の解除された表現型は、細胞外Yopsを産生できず、カルシウムの存在または非存在にかかわらず37℃で増殖し、ほんの一部しかYopsの誘導を示さない、LcrV欠損株で報告されたカルシウム非依存性表現型と対照的である(7)。PA103ΔpcrVを、野生型PcrVを発現するクローンで補完することにより、NTA誘導に応答した、正常な細胞外タンパク質産生調節が回復した。
【0044】
P.アエルギノーザ病理発生に対するPcrVの寄与を試験するために、2つの感染モデルを使用した。インビトロモデルにおいて、親および数個の変異誘導体株を、CHO細胞感染アッセイで、細胞毒性を引き起こす能力について比較した(3)。この実験の陰性対照は、III型病原性決定要因の転位が欠損していることが以前に示されたPA103popD::Ω(14)、およびExoUが産生されないために、細胞毒性のないPA103ΔexoUを含んだ(3、15)。
【0045】
3時間感染後、CHO細胞は、野生型およびPcrVを発現するプラスミド作成物で補完したΔpcrV株で、トリパンブルーを除外できなかった。CHO細胞を、陰性対照株またはPA103ΔpcrVで感染させた場合、染色は起こらなかった(データは示していない)。これらの結果により、PcrV発現は細胞毒性に必要であることが示唆される。精製組換えPcrVは、外因的に組織培養細胞に加えた場合、細胞毒性ではなかった。転位に必要なIII型タンパク質の分泌は、pcrVの欠失により影響を受けなかったので(図1AおよびB)、PA103ΔpcrVには、ExoU転位が欠損しているようである。
【0046】
図1Aおよび1Bは、PA103ΔpcrVの表現型分析を示す、染色ゲル(図1A)およびウエスタンブロット(図1B)である。トランスのPcrVを発現するプラスミドを含む、または含まない、親およびΔpcrV誘導体を、P.アエルギノーザのIII型分泌の誘導物質、ニトリロトリ酢酸(NTA)の非存在下または存在下で増殖させた。細胞外タンパク質プロフィル(図1A)を、クーマシーブルーで染色したSDS−ポリアクリルアミドゲル(10%)上で分析した。P.アエルギノーザコード化III型タンパク質の移動は左に示し、分子量マーカーの移動は右に示す。図1Bは、結合したIgGを検出するために、ExoU、PcrV、およびPopDに特異的な抗体および125I−プロテインAを使用した重複ゲルのウエスタンブロットである。
【0047】
野生型および変異P.アエルギノーザ株は、低および高攻撃用量の細菌を使用して、急性肺感染モデルで試験した。生存測定により、PcrVおよびPopDが、致命的感染の誘導に必要であることが示された(図2A)。3つの独立した肺損傷測定を利用した実験において(肺の気腔から血流への標識アルブミンの流入、肺の気腔から胸水への標識アルブミンの流入、および肺浮腫を測定する湿潤/乾燥比)、PA103ΔpcrV、ベクター対照株(PA103ΔpcrVpUCP18)、およびPA103popD::Ωにより引き起こされる損傷度は、非感染対照動物と全く異ならなかった(図2B)。PA103ΔpcrVをトランスのpcrVで補完することにより、肺損傷レベルは、親株PA103で測定されたものに戻った。合わせると、これらのデータにより、PcrV発現は、急性肺感染モデルにおけるP.アエルギノーザの病原性に必要であり、PcrVの機能の一部は、III型エフェクタータンパク質を真核細胞に転位する能力に関連があるようである。
【0048】
図2Aおよび2Bは、P.アエルギノーザ親および変異株の生存および肺損傷を示す、グラフ(図2A)および棒グラフのセット(図2B)である。図2Aに関して、マウスを、5×105cfuの示された各株で攻撃し、生存を1週間監視した。図2Bに関して、肺損傷を、肺の気腔から血液への(肺上皮損傷)、胸水への(胸水)標識アルブミンの流入により、または湿潤/乾燥比(肺浮腫)の測定により評価した。2つの細菌感染用量を使用し、黒棒および縞棒により表した。対照ないし試験群での有意差(*p<0.001)を、一方向性分散分析およびダネット(Dunnet)複数比較試験により決定した。以下の略称を使用した。PA103、親野生型株;ΔpcrV、PA103ΔpcrV;ΔpcrVpUCPpcrV、PcrVを発現するプラスミドで補完したPA103ΔpcrV;ΔpcrVpUCP、ベクター対照を有するPA103ΔpcrV;popD::Ω、転位欠損株であるPA103popD::Ω。
【実施例2】
【0049】
2.PcrVを用いた免疫化
PcrVを用いた免疫化により致命的な肺感染から動物が守られるかを決定するために、組換えPcrV(rPcrV)またはExoU(rExoU)を、ヒスチジン標識融合タンパク質として精製し、抗原として使用した。マウスを免疫化し、その後、気腔を介して、致死量のPA103株で攻撃した。生存を測定すると、両方のワクチンがマウスを保護した(図3A)。肺損傷を評価すると、PcrVワクチン接種を受けた動物のみにおいて、上皮傷害および肺浮腫が有意に低かった(図3B)。PcrVワクチンで免疫化した動物は、その肺における細菌が有意に低く、このことは、シュードモナスV抗原の遮断により、肺からの細菌の迅速な除去が促進され、重度の上皮損傷から動物が守られることを示唆する(図3B)。
【0050】
図3Aおよび3Bは、生存、肺損傷、および細菌コロニー化に対する免疫化の効果を示す、グラフ(図3A)および棒グラフのセット(図3B)である。図3Aに関して、マウスを、示されたように免疫化し(PcrV、n=10;ExoU、n=5;対照、n=10)、5×105CFU/動物のPA103株で攻撃した。生存動物の比率を、1週間決定した。Mantel−Cox log rank検定によりp<0.05。図3Bに関して、PA103の設置4時間後の、ワクチン接種動物の肺損傷評価および細菌コロニー形成。肺上皮損傷、肺浮腫、および細菌負荷;PcrV、n=9;ExoU、n=4;および対照、n=8。肺の細菌の最終数は、Y軸×104CFUの数として示される。ダネット複数比較試験により決定、肺損傷(p<0.01)、肺浮腫(p<0.05)、および細菌数(p<0.05)の有意差(*)。肺損傷における一方向性分散分析、p=0.0005;肺浮腫、p=0.0437;細菌負荷、p=0.0075。
【0051】
治療介入が可能であるかを決定するために、5×105CFU/マウスの濃度のPA103を気腔滴下する1時間前に、マウスを、免疫前のウサギIgG、またはrPcrV、rExoU、またはrPopDに特異的なウサギIgGを用いて受動免疫化した。rPcrVに対する抗体により、致命的感染に対する完全な保護が提供された(図4)。抗rExoU IgGにより部分的生存が提供され、これは、対照IgGの投与とは有意に異なっていたが、全ての生存動物が試験中に重病であるようであった。生存は、別のIII型転位タンパク質PopDに対する抗体の受動移動により向上しなかった。これらの結果から、我々は、PcrVに対する抗体は、急性肺感染モデルで高度に保護的であり、PcrVは、細菌表面上にさらされ得るか、または抗体−抗原相互作用に利用可能な可溶形であり得ると結論する。
【0052】
図4は、5×105CFU/マウスのPA103株で攻撃して生存した動物数のグラフである。動物を、免疫IgG100μgまたは非免疫化ウサギ由来の対照IgG(rPcrV、免疫前の血清)で前処置した。各群についてN=10;Mantel−Cox log rank検定により、抗PcrVおよび抗ExoU IgG調製物での処理において、*p<0.05対対照群。
【0053】
PcrVが、中和を受け易い場合、抗rPcrV IgGと細菌種菌の併用投与により、肺損傷および致死から完全に守られる。IgG調製物を、細菌を肺に滴下注入する前に、種菌(致死種菌よりも10倍高い用量)と混合し、生存を測定した。唯一、抗rPcrV IgGのみが、この極度な感染から保護した(図5A)。肺損傷は、正常致死量である5×105細菌で感染させた動物で測定した。肺の気腔からの標識アルブミンの流出は、抗rPcrV IgGの同時投与後、非感染対照よりも僅か3%高かった(図5B)。肺から胸水への標識タンパク質の流出減少は、抗PcrVを種菌と共に含めた場合、非感染対照と同じであった。珍しいことに、湿潤/乾燥比により測定した肺浮腫は、抗rPcrVまたは抗rPopDの添加により有意に減少した(図5B)。従って、細菌と抗rPcrV IgGの併用投与は、ワクチン接種よりも、全ての肺損傷パラメーターを規格化する上で、さらにより効果的であった。これらのデータは、PcrVが抗体媒介中和を受け易いことを支持し、肺損傷の臨床関連減少を文書で裏付け;PcrVに対する抗体は、シュードモナス・アエルギノーザにより引き起こされる重度の院内肺炎の治療における治療薬として使用し得る。
【0054】
図5は、IgGおよび細菌攻撃の併用投与による肺損傷からの生存および保護を示す、グラフ(図5A)および棒グラフのセット(図5B)である。IgG(5μg)を、5×106(生存アッセイ用、1群あたりn=10)または5×105(肺損傷測定用、1群あたりn=4〜6動物)のP.アエルギノーザPA103株と混合した。この混合物を、肺に滴下注入し、生存(図5A)または肺損傷(図5B)を評価した。生存では、Mantel−Cox log rank検定による抗PcrVにおいて*p<0.05対対照IgG;肺上皮損傷および肺浮腫では、ダネット複数比較試験により、*p<0.05対対照IgG。肺損傷における一方向性分散分析、p=0.026、および肺浮腫、p<0.0005。
【0055】
急性P.アエルギノーザ感染では、III型媒介中毒の実効効果は、上皮を超えて細菌の播種を促進し、胸水、脾臓、肝臓、および血流の感染をもたらし得ることである。急性換気装置関連肺炎からの、または熱傷感染からの、P.アエルギノーザによる血液由来感染の結果、活発な抗生物質処置にもかかわらず、死亡率は40−80%であり得る(16)。PcrVは、P.アエルギノーザのIII型転位複合体の成分であるに違いない。なぜなら、このタンパク質の産生が欠損している変異体は、転位に必要なIII型エフェクターおよびタンパク質を産生および分泌できるにもかかわらず、CHO細胞を中毒させることができないか、または肺上皮損傷を引き起こすことができないからである。PopD(これもまた転位に必要である)と異なり、PcrVは、抗体媒介中和を受け易く、これは、抗体は急性感染の有用な治療剤であり得ることを示唆する。
【実施例3】
【0056】
3.実施例1および2の方法
PcrVの非極性挿入物の作成および補完
pcrGVHpopBDおよびフランキング配列をコード化する5.0kbのEcoRI−NsiI制限断片を、対立遺伝子置換ベクターpNOT19にクローン化した(17)。2つのNotI部位(1つはpcrG内で、1つはpopB内)を、スカルプター(Sculptor)変異誘発系(アマシャム)を使用して、挿入配列から除去した。内部SstI制限断片を、pcrVから欠失させ、残基17−221をインフレーム欠失させた(pNOTΔpcrV)。プラスミドの組込みを選択するために、テトラサイクリン耐性(TcΩ)をコード化する遺伝子を、ベクターのHindIII部位にクローン化した(pNOTΩΔpcrV)。MOBカセット(17)を、NotI断片として加えた。部分二倍体の選択、プラスミド配列の分解能、および対立遺伝子置換の確認を、前記した通り行なった(18)。シャトルプラスミド(pUCP、19)を使用して、pcrV欠失を補完したクローンを作成した。PcrVのコード配列を増幅し、ExoSプロモーター領域の制御下でクローン化した(20)。ExoSの転写は、P.アエルギノーザにおけるIII型分泌および転位を調節するオペロンと協調的に調節されている(2)。ヌクレオチド配列は、部位特異的変異、PCR増幅、またはインフレーム欠失を含む、各DNA作成物について確認した。
【0057】
分泌産物のSDS−PAGEおよびウエスタンブロット分析
P.アエルギノーザを、誘導(+NTA)または非誘導条件下(−NTA)で、III型分泌産物を発現させるために増殖した(18)。培養物を、540nmでの光学密度測定に基づき収集し、上清画分を、硫酸アンモニウムの飽和溶液を最終濃度が55%となるように添加して濃縮した。SDS−ポリアクリルアミドゲル(11%)の各レーンに、3μlの20倍濃縮した上清をのせ、クーマシーブルーで染色した。同一のゲルを、ExoU、PopD、およびPcrVを特異的に認識する、ウサギ抗血清のカクテルを使用して、前記の通り(3−5)ウエスタンブロット分析にかけた。125Iで標識したプロテインAを、第二試薬として使用して、結合したIgGを同定した。
【0058】
感染モデルおよび肺損傷評価
チャイニーズハムスター卵巣細胞(CHO)を、細胞毒性およびIII型転位を測定するために設計した、インビトロ感染モデルに使用した(21)。簡潔には、細菌種菌を、血清を含まない組織培養培地で調製した。血清含有培地中で繁殖させたCHO細胞を洗浄し、5:1の感染多重度で、様々なP.アエルギノーザ株で感染させた。培養物を、組織培養条件下(37℃、5%CO2)で3時間インキュベートし、洗浄し、トリパンブルーで染色した。色素への透過性は、位相差写真から決定した。ExoUを発現する親株PA103での感染により、インキュベートの3時間後、単層の約80%がトリパンブルー染色され、インキュベートの4−5時間後、単層は完全に破壊される。マウス感染および肺損傷の評価は、前記した通りに行なった(16)。簡潔には、雄で8−12週令の病原体のないBALB/cマウスを、シモンセン(Simonsen)研究所(ギルロイ、カリフォルニア)から購入し、柵のある状態に飼った。マウスを、簡潔には、吸入メトファン(メトキシフルラン、ピットマン−ムーア(Pitman−Moore)、マンデライン(Mundelein)、イリノイ)で麻酔し、約30°の角度で、仰臥位に配置した。15μlの細菌性種菌を、中咽頭を介して気管に挿入した修飾24ゲージ動物栄養補給針(ポッパー・アンド・サンズ・インコーポレイテッド(Popper&Sons,Inc.)、ニューハイドパーク、ニューヨーク)を使用して、左葉にゆっくりと滴下注入した。肺損傷評価を測定する場合、5%マウスアルブミンと共に、リンガーラクテート1ml中、0.5μCiの131I標識ヒト血清アルブミン(メルク−フロスト(Frosst)、ケベック、カナダ)、0.05μgの無水エバンスブルーを滴下注入液に加えた。感染の4時間後、マウスを麻酔し、血液を頚動脈穿刺により集め、正中胸骨切開を行なった。肺、胸水、気管、中咽頭、胃、および肝臓を収集し、放射活性を測定した。滴下注入した肺に残り、循環または胸水に侵入した、放射活性アルブミンの比率を、血液量(体重×0.07)に、終末血液サンプルで測定された計数(1mlあたり)を掛けることにより計算した。肺の湿潤/乾燥比は、1mlの水を肺に加え、混合物をホモジナイズすることにより決定した。ホモジネートは、前以て秤量したアルミニウム皿に置き、80℃のオーブンで3日間一定重量になるまで乾燥させた。肺ホモジネートは、連続希釈し、細菌を定量評価するためにヒツジ血液寒天上に置いた。
【0059】
PcrV、PopD、およびExoUに対するウサギ抗血清の産生
rPcrV、rPopD、およびrExoUは、pET16bにおいてヒスチジン標識融合タンパク質として産生し、前記した通りニッケルクロマトグラフィーにより精製した(22)。ウサギに、フロイント完全アジュバント中で乳化した300μgの組換えタンパク質を皮内注射(10部位)し、フロイント不完全アジュバント中の抗原をブースター投与し、7日間間隔で周期的に採血した。受動免疫化するために、IgG画分を、プロテインAカラムクロマトグラフィー(ピアスケミカルズ、ロックフォード、イリノイ)を使用して単離した。マウスに、5×105CFUのPA103株で攻撃する1時間前に、100μgのIgG(腹腔内注射)を注射した。rPcrVおよびrExoUを用いて能動免疫化するために、エンドトキシンを、1%トリトンX−114での抽出により、タンパク質調製物から除去した(23)。抽出後、トリトンX−114を、セファクリルS−200クロマトグラフィーにより除去した。全ワクチン調製物が、リムルスアメーバ様細胞ライセートアッセイ(バイオウィッタカー(BioWhittaker)、ウォーカースヴィレ(Walkersville)、メリーランド)の使用により決定されたように、40μgの組換えタンパク質あたり、1ng以下のエンドトキシンを含んだ。BALB/cマウスに、フロイント完全アジュバント中、10μgの組換えタンパク質を皮下注射した。30日目に、マウスを、フロイントの不完全アジュバント中、追加の10μgの抗原をブースター投与した。51日目に、マウスを、その左肺へのP.アエルギノーザの滴下注入により攻撃した。
【0060】
4.モノクローナル抗体の合成
マウスを、フロイントの完全アジュバント中、10μgの精製、LPS非含有、組換えPcrVを用いて免疫化し、2週間後に、フロイントの不完全アジュバント中で乳化した、同量の抗原を用いてブースター投与した。免疫化は皮下で行なった。フロイントの不完全アジュバント中のPcrVのブースター用量の1週間後に、脾臓をマウスから収集した。
【0061】
単一の脾臓を、血清を含有しない組織培養培地5mlに置き、片に切断し、穏やかにホモジナイズした。組織の大片を、ホモジネートおよび上清から沈降させ、単一細胞懸濁液を取り出し、1200rpmで10分間遠心分離にかけた。ペレット化した細胞を、10ml溶液に再懸濁し、赤血球を5分間溶解し、引き続き、10mlのウシ胎児血清を敷いた。物質を、1200rpmで8分間遠心分離し、上清を廃棄し、細胞を30mlの培地に懸濁した。脾臓細胞およびミエローマ細胞(P3×63Ag8.653)を、1200rpmで10分間の遠心分離により収集し、各ペレットを、別々に、10mlの組織培養培地に懸濁した。108脾臓細胞および2×107ミエローマ細胞を混合し、1200rpmで6分間の遠心分離により一緒にペレット化させた。上清を吸引により取り出し、1mlの35%ポリエチレングリコール(PEG)を加えた。細胞をこの溶液に穏やかに懸濁し、1000rpmで3分間遠心分離した。いくつかの実験では、遠心分離は省いた。
【0062】
PEG添加から正確に8分後、25mlの培地を加え、細胞を穏やかに再懸濁した。5分間の1200rpmでの遠心分離段階の後、細胞ペレットを、30%ならし培地および70%完全培地(血清含有)中1mlあたり1×106の密度で懸濁した。細胞を37℃で一晩インキュベートした。次の日、細胞を遠心分離により収集し、200mlの30%ならし培地およびヒポキサンチン、アミノプテリンおよびチミジン(HAT)を含む70%完全培地中に懸濁した。
【0063】
1ウェルあたり、約0.2mlのこの細胞懸濁液を、10個の96ウェルプレート(96ウェルプレートあたり12ml)に加えた。残りの細胞の密度は、1mlあたり2.5×105に調整し、細胞を96ウェル型式で培養した。プレートを、単一のコロニーについて顕微鏡でスクリーニングし、その後、上清を、抗原として組換えPcrVを使用して、酵素結合免疫吸着検定法により抗体産生について試験した。PcrVに反応性の抗体を産生するクローンを、より大きな培養皿に継代培養し、その後、アイソタイプを決定した。
【0064】
抗体の結合は、ウェルを覆膜する抗原(ヒスチジン標識タンパク質)として組換えPcrVを使用して、酵素結合免疫吸着検定法で試験した。モノクローナル抗体は、ヒスチジン標識を有さない天然PcrVを含むP.アエルギノーザ上清を使用して、ウエスタンブロット反応でも試験した。
【0065】
参考文献
1.ウィーナー−クロニッシュ・ジェイ・ピー(Wiener−Kronish,J.P.)、サワ・ティー(Sawa,T.)、クラハシ・ケー(Kurahashi,K.)、オーハラ・エム(Ohara,M.)、およびグロッパー・エム・エー(Gropper,M.A.)、「細菌性肺炎に関連した肺浮腫」、肺浮腫(マタイ・エム・エー(Matthay,M.A.)およびイングバー・ディー・エイチ(Ingbar,D.H.)編)pp.247−267(マーセル・デッカー・インコーポレイテッド(Marcel Dekker,Inc.)、ニューヨーク、1998)
2.フランク・ディー・ダブリュー(Frank,D.W.)、「シュードモナス・アエルギノーザの細胞外酵素Sレギュロン」、Mol.Microbiol.26:621−629(1997)
3.フィンク−バーバンコン・ヴィー(Finck−Barbancon,V.)等、「シュードモナス・アエルギノーザによるExoU発現は、急性細胞毒性および上皮損傷と相関する」、Mol.Microbiol.25:547−557(1997)
4.ヤー・ティー・エル(Yahr,T.L.)、ゴランソン・ジェイ(Goranson,J.)およびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザの細胞外酵素は、III型経路により分泌される」、Mol.Microbiol.22:991−1003(1996)。
5.ヤー・ティー・エル、メンデ−ミュエラー・エル・エム(Mende−Mueller,L.M.)、フリーズ・エム・ビー(Friese,M.B.)、およびフランク・ディー・ダブリュー、「シュードモナスアエルギノーザ細胞外酵素SレギュロンのIII型分泌産物の同定」、J.Bacteriol.179:7165−7168(1997)。
6.ウエック・シー・ジェイ(Hueck,C.J.)、「動物および植物の細菌病原体におけるIII型タンパク質分泌系」、Microbiol.Mol.Biol.Rev.62:379−433(1998)
7.スクルジペック・イー(Skrzypek,E.)およびストラレイ・エス・シー(Straley,S.C.)、「V抗原の分泌に対する、lcrVの欠失の異なる効果、低Ca2+応答の調節、およびエルシニア・ペスティスの病原性」、J.Bacteriol.177:2530−2542(1995)
8.ナカジマ・アール(Nakajima,R.)およびブルベーカー・アール・アール(Brubaker,R.R.)、「エルシニア・ペスティスの病原性ないしγインターフェロンおよび腫瘍壊死因子αの抑制の関連」、Infect.Immun.61:23−31(1993)
9.ナカジマ・アール、モティン・ヴィー・エル(Motin,V.L.)およびブルベーカー・アール・アール、「タンパク質A−V抗原融合ペプチドによるマウスのサイトカインの抑制および能動免疫による合成の回復」、Infect.Immun.63:3021−3029(1995)
10.ネディアルコフ・ワイ・エー(Nedialkov,Y.A.)、モティン・ヴィー・エルおよびブルベーカー・アール・アール、「エルシニア・ペスティスV抗原−ポリヒスチジン融合ペプチドにより媒介されるリポ多糖に対する耐性:インターロイキン−10の増幅」、Infect.Immun.63:1196−1203(1997)
11.ニレス・エム・エル(Nilles,M.L.)、フィールズ・ケー・エー(Fields,K.A.)、およびストラレイ・エス・シー、「エルシニア・ペスティスのV抗原は、YopBおよびLcrGに対する効果を介して、Yopベクター標的化並びにYop分泌を調節する」、J.Bacteriol.180:3410−3420(1998)
12.クドー・アイ(Kudoh,I.)、ウィーナー−クロニッシュ・ジェイ・ピー、ハシモト・エス(Hashimoto,S.)、ピテット・ジェイ・−エフ(Pittet,J.−F.)、およびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザ株の細胞外産物分泌は、肺胞上皮損傷の重度に影響を及ぼす」、Am.J.Physiol.267:L551−L556(1994)
13.アポダカ・ジー(Apodaca,G.)等、「シュードモナス・アエルギノーザ誘導MDCK細胞損傷の特徴づけ:グリコシル化欠損ホスト細胞は、細菌殺滅に耐性である」、Infect.Immun.63:1541−1551(1995)
14.ヤール・ティー・エル(Yahr,T.L.)、バリス・エー・ジェイ(Vallis,A.J.)、ハンコック・エム・ケー(Hancock,M.K.)、バービエリ・ジェイ・ティー(Barbieri,J.T.)、およびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザIII型系により分泌される新規アデニル酸シクラーゼであるExoY」、Proc.Natl.Acad.Sci.USA、印刷中(1998)
15.フィンク−バーバンコン・ヴィー(Finck−Barbancon,V.)、ヤール・ティー・エル、およびフランク・ディー・ダブリュー、「ExoU細胞毒の効率的分泌に必要なシャペロンSpcUの同定および特徴づけ」、J.Bacteriol.印刷中(1998)
16.サワ・ティー(Sawa,T.)、コリー・ディー・ビー(Corry,D.B.)、グロッパー・エム・エー、オーハラ・エム、クラハシ・ケーおよびウィーナー−クロニッシュ・ジェイ・ピー、「IL−10は、シュードモナス・アエルギノーザ肺炎における肺損傷および生存を改善する」、J.Immunol.159:2858−2866(1997)
17.シュバイツァー・エイチ・ピー(Schweizer,H.P.)、「新規ColE1型ベクターおよび携帯型oriTおよび対抗選択可能な枯草菌sacBマーカーを含むファミリカセットを使用した、シュードモナス・アエルギノーザの対立遺伝子交換」、Mol.Microbiol.6:1195−1204(1992)
18.フランク・ディー・ダブリュー、ナイアー・ジー(Nair,G.)、およびシュバイツァー・エイチ・ピー、「シュードモナス・アエルギノーザ細胞外酵素Sトランス調節座位の染色体挿入変異の作成および特徴づけ」、Infect.Immun.62:554−563(1994)。
19.シュバイツァー・エイチ・ピー、「pUC18/19から得られるエセリシア(Escherichia)−シュードモナスシャトルベクター」、Gene 97:109−112(1991)
20.ヤール・ティー・エル、ホベイ・エー・ケー(Hovey,A.K.)、クリッヒ・エス・エム(Kulich,S.M.)、およびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザ細胞外酵素S構造遺伝子の転写分析」、J.Bacteriol.177:1169−1178(1995)
21.バリス・エー・ジェイ(Vallis,A.J.)、ヤール・ティー・エル、バービエリ・ジェイ・ティー(Barbieri,J.T.)、およびフランク・ディー・ダブリュー、「組織培養条件に応答したシュードモナス・アエルギノーザによるExoS産生の調節」、Infect.Immun.提出
22.ヤール・ティー・エル、バービエリ・ジェイ・ティーおよびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザ由来の細胞外酵素Sの53ないし49kDa形の遺伝子関係」、J.Bacteriol.178:1412−1419(1996)
23.アイジ・ワイ(Aidi,Y.)およびパブスト・エム・ジェイ(Pabst,M.J.)、「トリトンX−114を使用した相分離によるタンパク質溶液からのエンドトキシンの除去」、J.Immunol.Methods 132:191−195(1990)
【技術分野】
【0001】
関連出願の相互参照 本出願は、1998年11月25日出願の米国出願番号第60/109,952号、並びに1999年3月30日出願の米国出願番号第60/126,794号に対して優先権を主張し、これらは両方とも参照して明細書の記載の一部とする。
【0002】
連邦政府後援の研究開発に関する記述 本発明は、以下の機関により与えられた米国政府支援によりなされた。NIH/NIADA許可番号R01 A131665−08、K04 AI01289−04およびR01 HL59239−02。米国は本発明に一定の権利を有する。
【背景技術】
【0003】
シュードモナス・アエルギノーザ(Pseudomonas aeruginosa)は、重病の個体において致命的な急性肺感染を引き起こすことのできる日和見細菌病原体である(1)。細菌の肺上皮傷害能は、III型媒介分泌および転位機構を介して、真核細胞に直接注入される毒素の発現と関連している(2、3)。
【0004】
P.アエルギノーザ(P.aeruginosa)III型分泌および転位装置によりコード化されるタンパク質は、エルシニア(Yersinia)Yopレギュロンのメンバーと高レベルのアミノ酸同一性を示す(4−6)。グラム陰性細菌に発見された全III型系の中で、唯一、P.アエルギノーザが、エルシニアV抗原であるPcrVに相同性を有する(III型系の概観については6参照)。分泌および転位装置に相同なタンパク質は、植物および動物の両方の病原性細菌によりコード化される。これらの生物は、サルモネラ・チフス菌(Salmonella typhimurium)、シゲラ・フレクスナー(Shigella flexneri)、腸病原性大腸菌(E.coli)、クラミジア(Chlamydia)種などのヒト病原体、およびキサントモナス・カンペストリス(Xanthamonas campestris)、シュードモナス・シリンゲ(Pseudomonas syringae)、エルシニア・アミロボーラ(Erwinia amylovora)およびラルストニア・ソラナセアラム(Ralstonia solanacearum)などの植物病原体を含む。しかし、唯一、P.アエルギノーザおよびエルシニアが、V抗原をコード化する。
【0005】
ヤール(Yahr)等、1997は、PcrVをコード化するオペロンの配列を開示し、この配列をLcrVタンパク質と比較している。それゆえに、PcrVのアミノ酸配列は既知であり、GenBankの寄託番号AF010149で入手できる。
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、シュードモナスV抗原は、致命的な肺感染から動物を守るために使用できるという我々の観察から発展させた方法および組成物を含む。
【課題を解決するための手段】
【0007】
1つの実施態様において、本発明は、患者(patient、患者または患蓄)に有効量のPcrV抗原を接種することを含む、シュードモナス感染を抑制する方法である。別の実施態様において、PcrVをコード化するDNAを、遺伝子ワクチンとして使用する。
【0008】
1つの好ましい実施態様において、抗原は、組換えタンパク質として発現され、危険にさらされている患者を免疫化するために使用する。
【0009】
好ましくは、患者は、感染から完全に守られる。
【0010】
別の実施態様において、PcrVをコード化するDNA(pcrVと呼ぶ)またはDNA断片は、P.アエルギノーザ感染を検出するために診断的に使用することができる。
【0011】
別の実施態様において、組換えタンパク質(rPcrV)は、患者から抗体を検出するために診断的に使用する。PcrVに対する患者の抗体応答は、予後に関連し得る。それ故、この実施態様において、組換えタンパク質は、患者の抗体力価を測定することにより、予後の指標として使用する。
【0012】
本発明はまた、個体を、有効量のPcrV抑制剤、特にPcrV抗体、抗体誘導体もしくは断片、または抗体擬似体と接触させることにより、個体のシュードモナス感染を抑制する方法を提供する。PcrV抗体、抗体誘導体および抗体断片もまた提供される。
【0013】
本発明の目的は、シュードモナス感染に対して患者を能動および受動免疫化することである。
【0014】
本発明の別の目的は、P.アエルギノーザ感染を診断的に検出することである。
【0015】
本発明の別の目的は、シュードモナス患者から抗体を診断的に検出することである。
【0016】
本発明の別の目的、特徴および利点は、明細書、特許請求の範囲および図面を概観した後、当業者には明らかとなろう。
【発明の効果】
【0017】
本発明によれば、PcrVに対してワクチン接種することにより、攻撃された動物の生存が保証されるだけでなく、細菌により引き起こされる肺炎症および損傷も減少する。また、有効量のPcrV抗原を用いて患者を免疫化することにより、シュードモナス感染を緩和または抑制することができる。また、PcrVに対するヒトまたはヒト化モノクローナルまたはポリクローナル抗体を投与し、P.アエルギノーザによる感染を予防または治療することができる。また、PcrVタンパク質をコード化するDNA、またはこのDNAの相補体を使用して、P.アエルギノーザ感染を診断的に検出することができる。また、タンパク質または抗原は、患者の抗体を検出するために診断的に使用することもでき、したがって、患者の感染状態を予測できる。また、PcrV抗体または抗体断片を治療に使用することができる。
【図面の簡単な説明】
【0018】
【図1】図1Aおよび1Bは、PA103ΔpcrVの表現型分析を示す、染色ゲル(図1A)およびウエスタンブロット(図1B)である。
【図2】図2Aおよび2Bは、P.アエルギノーザ親および変異株の生存および肺損傷を示す、グラフ(図2A)および棒グラフのセット(図2B)である。
【図3】図3Aおよび3Bは、生存、肺損傷、および細菌コロニー形成に対する免疫化の効果を示す、グラフ(図3A)および棒グラフのセット(図3B)である。
【図4】図4は、PcrV、ExoU、PopDに特異的なポリクローナル抗体または非免疫化動物由来の対照IgGを受動投与した後、5×105CFU/マウスのPA103株で攻撃して生存した動物数のグラフである。
【図5】図5は、異なる細菌性抗原に対するIgGおよび細菌攻撃の併用投与による、肺損傷からの生存および保護を示す、グラフ(図5A)および棒グラフのセット(図5B)である。肺損傷の一方向性分散分析は、p=0.026、および肺浮腫では、p<0.0005。
【発明を実施するための形態】
【0019】
我々は、本明細書で、PcrVは、III型分泌産物の発現に対して新規な調節効果を有し、III型毒素の転位に関与し、P.アエルギノーザ感染により誘導される肺損傷から守る最初の抗原であることを開示する。抗PcrV IgGを気腔に滴下注入する前に、PcrVに対してワクチン接種することにより、攻撃された動物の生存が保証されただけでなく、細菌により引き起こされる肺炎症および損傷も減少した。
【0020】
LcrV、またはV抗原は、Yopエフェクタータンパク質の分泌および転位を調節し、エルシニア感染に対するホストサイトカイン応答を変化させることにより、病理発生に細胞外的役割を果たしている、多機能性タンパク質である(7−11)。この危険な病原因子の唯一の既知の相同体は、PcrVと呼ばれる、P.アエルギノーザによりコード化される細胞外タンパク質である。
【0021】
本発明の1つの実施態様は、有効量のPcrV抗原を用いて患者を免疫化することにより、シュードモナス感染を緩和または抑制する方法である。ここで「有効量」とは、抗原で処置されていない対照被検者または動物と比較して、シュードモナス感染のいくらかの緩和または抑制が示されるに有効な量のPcrV抗原を意味する。
【0022】
ここで「緩和」とは、感染が、非免疫化動物と比較して、少なくとも50%抑制されることを意味する。好ましくは、感染は完全に予防される。感染の定量評価は、好ましくは、血流または胸水中の細菌量の検査および/または肺損傷パラメーターの検査を含む。例えば、血流または胸水中での細菌の非存在は、感染の予防を示す。肺損傷パラメータ−の減少は、感染の緩和を示す。
【0023】
感染は、痰、血液または胸水中の細菌容量の減少、浸潤物のサイズの減少、酸素付加改善、機械的換気時間の長さの減少、熱降下、および白血球数の減少を含む、いくつかの他の臨床指標により定量的に評価できる。
【0024】
ここで「PcrV抗原」とは、感染を予防または緩和する免疫応答を引き出すのに必要なPcrVタンパク質の一部または断片を意味する。現在、我々は、全長PcrVタンパク質を、保護を誘導するための抗原として使用している。しかし、当業者は、分子上での保護エピトープの位置を決めることができる。例えば、我々は、モノクローナル抗体を産生し、それらを、組織培養中において細胞毒性を予防する抗体についてスクリーニングする。細胞毒性を予防する抗体を、急性肺感染モデルで、感染に対する受動保護について試験する。モノクローナル抗体は、一般に、小領域のアミノ酸を認識し、アミノ酸が隣接している場合、エピトープは、6−9という少ないアミノ酸として特定され得る。エピトープを特定するために、感染および細胞毒性から守るモノクローナル抗体を、段々と小さい形の組換えPcrVに対する結合について試験する。(ここで「組換えPcrV」または「rPcrV」とは、非天然ホストに配置しておいたPcrV遺伝子から産生されたタンパク質を意味する。)これにより領域が局限する。この時点で、我々は、エピトープを特定するために、化学的にアミノ酸伸展を合成する。これらの化学合成したエピトープは、担体分子に結合させることができ、免疫化に使用して保護が達成されたかを決定することができる。別法として、我々は、PcrVの異なるクローンを作成し、組換えタンパク質を産生および精製し、これらの抗原を、免疫化実験および攻撃実験で試験できる。
【0025】
PcrVを用いて行なったマッピング研究に基づき、我々は、エピトープは、アミノ酸113ないし245の間に存在すると予測する。
【0026】
PcrV抗原は、我々が使用した方法、すなわちノバゲン(Novagen)から市販で入手可能なpet16bと呼ばれる細菌性発現プラスミドにより、最も容易に得られ得る。pcrV遺伝子は、初めて、オペロンの一部として、P.アエルギノーザ染色体からクローン化された。コード領域を増幅し、2つの異なるベクターに挿入した。1つのベクターは、図1で示すように、P.アエルギノーザからの発現用である。これは、PcrV発現が、細菌の残りの輸送および中毒装置と協調的に調節されるように、適切なプロモーター配列を含むように我々が修飾した、ハーバート・シュバイツァーからのベクター(参考文献19)である。第二のプラスミドであるpET16bは、大腸菌からの発現および精製目的用である。
【0027】
この系の利点は、P.アエルギノーザタンパク質の汚染を心配する必要がなく、タンパク質は非常に大量に産生され、そして1段階精製プロセスであるということである。この状況において、PcrVコード領域を増幅し、pET16bベクター上に提供されたヒスチジン標識を有するフレーム内でクローン化する。PcrVのアミノ末端に融合した複数のヒスチジン残基により、ニッケル−NTAカラムを使用したアフィニティークロマトグラフィーが可能となる。それ故、好ましいPcrV抗原は、組換えバージョンの天然PcrVタンパク質である。
【0028】
別の実施態様において、PcrVに対するヒトまたはヒト化モノクローナルまたはポリクローナル抗体を投与し、P.アエルギノーザによる感染を予防または治療する。P.アエルギノーザ感染にさらされる危険性の高い患者において、抗体を、感染の予防のために投与できる。さらに、抗体は、感染を治療するために、感染の開始後に、投与してもよい。この場合、抗体は、単独で、または抗生物質と組合せて投与できる。抗生物質と共に抗体を投与することにより、より短いクールまたは低用量の抗生物質の投与が可能となり得、よって、抗生物質耐性生物の出現の危険性が減少する。
【0029】
我々は、仮定上の少なくとも3つの型の患者を想定する。(1)重度の損傷または熱傷にさらされる危険性のある健康な個体(消防士、軍人、警官)を、永続する保護を与える方法(注射または鼻腔内のいずれか)によりワクチンで免疫化する。ブースターは、損傷後に病院の許可を得て投与する(筋肉内注射)。(2)機械的換気を受けている患者。(3)嚢胞性繊維症と遺伝子診断された患者。
【0030】
免疫化は、全身的にまたは鼻腔内に実施し得る。これらの個体の免疫化は、好ましくは、他の小児期疾患の普通のワクチン接種法中に開始する。我々は、おそらく5および10歳頃でのブースター用量により保護の永続を予測する。
【0031】
別の実施態様において、P.アエルギノーザ感染を診断的に検出するために、PcrVタンパク質をコード化するDNA、またはこのDNAの相補体を使用する。GenBankAF010149でPcrV抗原のDNA配列が得られる。PcrVのコード領域は、ヌクレオチド626−1510である。また、このコード領域の断片またはこの断片の相補体の使用を選択してもよい。成功するプローブは、PcrV DNAに特異的にハイブリッド化し、他の領域にはハイブリッド化しないものである。
【0032】
好ましくは、抗原配列内で少なくとも40個連続したヌクレオチドのハイブリッド形成プローブ、または配列内で少なくとも25個連続したヌクレオチドの2つのプライマーを使用する。当業者は、多くの標準的な型の核酸診断技術が適切であることを理解し、例えば、患者の痰から抽出されたDNAまたはRNAに対する一本鎖40ヌクレオチドプローブのハイブリッド形成がある。別の例では、患者の痰を、細菌性DNAまたはRNA源として使用し、それぞれ、PCRまたはRT−PCR反応の鋳型として使用する。
【0033】
また、個体から得られたサンプルを、PcrVに特異的な抗体と接触させ、対照サンプルと比較して増強した抗体結合を、個体のシュードモナス・アエルギノーザ感染と相関させることにより、個体におけるシュードモナス・アエルギノーザ感染を決定する。
【0034】
追加の実施態様において、PcrVをコード化するDNAを、標準的な分子生物学的方法を使用して、遺伝子ワクチンとして使用する。例えば、当業者には公知の技術について、以下の参考文献を概観し得る。デイビス・エイチ・エル(Davis,H.L.)等、「B型肝炎のDNAワクチン:チンパンジーにおける免疫原性の証拠および他のワクチンとの比較」、Proc.Natl.Acad.Sci.93:7213−7218、1996;バリー・エム・エー(Barry,M.A.)等、「発現−ライブラリー免疫化を使用したマイコプラズマ感染からの保護」、Nature 377:632−635、1995;キシアング・ゼット・キュー(Xiang,Z.Q.)等、「狂犬病ウイルスの核酸ワクチンに対する免疫応答」、Virology 209:569−579、1995。ここで「有効量」の遺伝子ワクチンとは、シュードモナス感染またはシュードモナス感染症状を緩和または排除するに有効な量のワクチンを意味する。
【0035】
タンパク質または抗原は、患者の抗体を検出するために診断的に使用することもでき、したがって、患者の感染状態を予測できる。好ましくは、シュードモナス感染が疑われる個体から得られたサンプルを、PcrVタンパク質またはその断片と接触させ、タンパク質/抗体結合を検出する。その後、(対照サンプルと比較して)増強した抗体結合を、個体のシュードモナス・アエルギノーザ感染と相関させる。
【0036】
また、PcrV抗体または抗体断片を治療に使用することもできる。抗体がヒト使用に安全であるとなれば、(a)それを全身投与でき、また(b)予防処置または治療法として肺に投与できる。ヒトでPcrV抗体を使用するために、抗体は好ましくは「ヒト化」する。一般に、モノクローナル抗体が得られれば、重鎖および軽鎖可変領域をクローン化する。これらのクローン化した断片は、その後、ヒト抗体骨格(定常領域)に挿入する。このようにして、我々は、結合特異性を提供することに加えて、抗体のクラス(IgG、IgA等)を調節できる。
【0037】
本発明での使用において、PcrV抗体は、モノクローナル抗体でもポリクローナルでもよい。抗体は、特に治療適用のために、ヒトまたはヒト化され得る。抗体断片または誘導体、例えばFab、F(ab')2またはFvも使用してよい。例えば、フストン(Huston)等(Int.Rev.Immunol.10:195−217、1993)に記載のような単鎖抗体は、本明細書に記載の方法にも用途を見出し得る。ここで「有効量」のPcrV抗体または抗体断片とは、シュードモナス感染または感染症状を緩和または排除するに十分な量を意味する。
【0038】
PcrV抗体および抗体断片に加えて、小分子ペプチド擬似体または非ペプチド擬似体を、おそらくPcrVの作用を妨害することによる、シュードモナス感染の抑制または調節におけるPcrV抗体の作用を擬似するように設計できる。かかる小分子擬似体を設計する方法は公知である(例えば、リプカ(Ripka)およびリッチ(Rich)、Curr.Opin.Chem.Biol.2:441−452、1998;フアング(Huang)等、Biopolymers 42:367−382、1997;アル−オベイジ(al−Obeidi)等、Mol.Biotechnol.9:205−223、1998参照)。PcrV抗体に基づき設計した小分子抑制剤を、PcrV−PcrV抗体結合相互作用を妨害する能力についてスクリーニングした。かかるアッセイで活性を示す候補小分子を、例えば、インビトロスクリーニングアッセイを含む、当分野で公知の方法により最適化し得、本明細書に記載の方法のいずれかにより、または当分野で公知のように、シュードモナス感染の抑制または調節についてインビボアッセイでさらに精製し得る。かかる小分子のPcrV作用抑制剤は、シュードモナス感染の抑制または調節において本法に有用である。
【0039】
本発明の別の態様において、PcrVタンパク質は、ホスト細胞、特にヒト細胞、より特定すると、ヒト上皮細胞またはマクロファージに存在し得るPcrVレセプターを同定するために使用し得る。PcrVレセプターの同定により、組合せライブラリーなどの小分子ライブラリーを、PcrV結合を妨害する候補についてスクリーニングすることが可能となる。かかる分子は、シュードモナス感染を抑制または調節する方法にも有用である。
【0040】
レセプター同定における我々の最初の試みは、プルダウン実験でPcrVを使用することである。PcrVを、グルタチオンS−トランスフェラーゼ(GST)に融合させ、可溶化細胞抽出物のアフィニティークロマトグラフィーのカラムマトリックスに付着させる。PcrVに特異的に結合しているタンパク質を溶出し、同定のためにアミノ末端シークエンスにかけた。平行実験で、PcrVを、酵母二重ハイブリッド分析にかける。この場合、PcrVは、Gal4のDNA結合ドメインを有するフレーム内に融合させる。クローンが得られれば、適切な酵母ホスト株に形質転換する。Gal4PcrV作成物を含む酵母株を、Gal4活性化ドメインを有するフレーム内にクローン化したHela細胞cDNAバンクを用いて形質転換する。ヒスチジンを利用し、βガラクトシダーゼ(PcrVと相互作用するタンパク質)を産生する能力を補完した二重形質転換体を、遺伝学的におよびヌクレオチド配列レベルで分析する。レセプターが細胞糖脂質である場合、我々は、糖脂質を、薄層クロマトグラフィーにより分離し、その後、放射標識細菌でプローブする、オーバーレイ技術を利用する。特異的成分への結合は、オートラジオグラフィーにより監視する。同じように、上皮およびマクロファージタンパク質を、SDS−PAGEにより分離し、ニトロセルロースにブロットし、放射標識細菌または標識PcrVをのせる。ここでも、細菌が結合したタンパク質成分を、その後、オートラジオグラフィーにより同定する。
【0041】
シュードモナス種は、動物界およびさらには植物界内の広範囲のホストを感染することが知られている。当業者には明らかなように、本明細書で開示した組成物および方法は、シュードモナス種による感染から生じた疾患または状態の抑制または調節において、広範囲の生物に使用し得る。本発明の組成物および方法は、特にシュードモナス・アエルギノーザへの適用について記載するが、本明細書に教示した方法を他の種に適用することは当業者の能力の十分範囲内である。
【実施例1】
【0042】
1.細胞毒性におけるPcrVの役割
III型媒介調節/分泌におけるPcrVの役割を決定するために、我々は、PcrVの非極性対立遺伝子を作成し、この作成物を使用して、P.アエルギノーザPA103株(インビトロで細胞毒性が高く(3)、インビボで肺上皮傷害を引き起こす(12、13)株である)の野生型対立遺伝子を置換した。細胞毒性および肺損傷は、特異的な細胞毒ExoUの産生に起因する(3)。
【0043】
PA103ΔpcrVは、ExoU細胞毒(3)、PcrV(5)、および毒素の転位に必要なタンパク質PopD(14)を含む、P.アエルギノーザIII型系により分泌されるいくつかの細胞外産物の発現により特徴づけられた。濃縮培養上清のSDS−ポリアクリルアミドゲル電気泳動により、親株PA103は、カルシウムキレート剤であるニトリロトリ酢酸(NTA)を含む培地中での増殖により、III型タンパク質の産生および分泌が誘導されることが示された(図1)。PcrVをコード化する発現クローンが、親株においてトランスで提供される場合、NTAの存在または非存在に応答する細胞外タンパク質産生は正常である。PA103ΔpcrVは、カルシウム盲目表現型を示し、細胞外タンパク質産生は、NTAの存在および非存在の両方で強く誘導される。これらの結果は、分泌系は、完全に機能しているが、調節は解除されていることを示唆する。この調節の解除された表現型は、細胞外Yopsを産生できず、カルシウムの存在または非存在にかかわらず37℃で増殖し、ほんの一部しかYopsの誘導を示さない、LcrV欠損株で報告されたカルシウム非依存性表現型と対照的である(7)。PA103ΔpcrVを、野生型PcrVを発現するクローンで補完することにより、NTA誘導に応答した、正常な細胞外タンパク質産生調節が回復した。
【0044】
P.アエルギノーザ病理発生に対するPcrVの寄与を試験するために、2つの感染モデルを使用した。インビトロモデルにおいて、親および数個の変異誘導体株を、CHO細胞感染アッセイで、細胞毒性を引き起こす能力について比較した(3)。この実験の陰性対照は、III型病原性決定要因の転位が欠損していることが以前に示されたPA103popD::Ω(14)、およびExoUが産生されないために、細胞毒性のないPA103ΔexoUを含んだ(3、15)。
【0045】
3時間感染後、CHO細胞は、野生型およびPcrVを発現するプラスミド作成物で補完したΔpcrV株で、トリパンブルーを除外できなかった。CHO細胞を、陰性対照株またはPA103ΔpcrVで感染させた場合、染色は起こらなかった(データは示していない)。これらの結果により、PcrV発現は細胞毒性に必要であることが示唆される。精製組換えPcrVは、外因的に組織培養細胞に加えた場合、細胞毒性ではなかった。転位に必要なIII型タンパク質の分泌は、pcrVの欠失により影響を受けなかったので(図1AおよびB)、PA103ΔpcrVには、ExoU転位が欠損しているようである。
【0046】
図1Aおよび1Bは、PA103ΔpcrVの表現型分析を示す、染色ゲル(図1A)およびウエスタンブロット(図1B)である。トランスのPcrVを発現するプラスミドを含む、または含まない、親およびΔpcrV誘導体を、P.アエルギノーザのIII型分泌の誘導物質、ニトリロトリ酢酸(NTA)の非存在下または存在下で増殖させた。細胞外タンパク質プロフィル(図1A)を、クーマシーブルーで染色したSDS−ポリアクリルアミドゲル(10%)上で分析した。P.アエルギノーザコード化III型タンパク質の移動は左に示し、分子量マーカーの移動は右に示す。図1Bは、結合したIgGを検出するために、ExoU、PcrV、およびPopDに特異的な抗体および125I−プロテインAを使用した重複ゲルのウエスタンブロットである。
【0047】
野生型および変異P.アエルギノーザ株は、低および高攻撃用量の細菌を使用して、急性肺感染モデルで試験した。生存測定により、PcrVおよびPopDが、致命的感染の誘導に必要であることが示された(図2A)。3つの独立した肺損傷測定を利用した実験において(肺の気腔から血流への標識アルブミンの流入、肺の気腔から胸水への標識アルブミンの流入、および肺浮腫を測定する湿潤/乾燥比)、PA103ΔpcrV、ベクター対照株(PA103ΔpcrVpUCP18)、およびPA103popD::Ωにより引き起こされる損傷度は、非感染対照動物と全く異ならなかった(図2B)。PA103ΔpcrVをトランスのpcrVで補完することにより、肺損傷レベルは、親株PA103で測定されたものに戻った。合わせると、これらのデータにより、PcrV発現は、急性肺感染モデルにおけるP.アエルギノーザの病原性に必要であり、PcrVの機能の一部は、III型エフェクタータンパク質を真核細胞に転位する能力に関連があるようである。
【0048】
図2Aおよび2Bは、P.アエルギノーザ親および変異株の生存および肺損傷を示す、グラフ(図2A)および棒グラフのセット(図2B)である。図2Aに関して、マウスを、5×105cfuの示された各株で攻撃し、生存を1週間監視した。図2Bに関して、肺損傷を、肺の気腔から血液への(肺上皮損傷)、胸水への(胸水)標識アルブミンの流入により、または湿潤/乾燥比(肺浮腫)の測定により評価した。2つの細菌感染用量を使用し、黒棒および縞棒により表した。対照ないし試験群での有意差(*p<0.001)を、一方向性分散分析およびダネット(Dunnet)複数比較試験により決定した。以下の略称を使用した。PA103、親野生型株;ΔpcrV、PA103ΔpcrV;ΔpcrVpUCPpcrV、PcrVを発現するプラスミドで補完したPA103ΔpcrV;ΔpcrVpUCP、ベクター対照を有するPA103ΔpcrV;popD::Ω、転位欠損株であるPA103popD::Ω。
【実施例2】
【0049】
2.PcrVを用いた免疫化
PcrVを用いた免疫化により致命的な肺感染から動物が守られるかを決定するために、組換えPcrV(rPcrV)またはExoU(rExoU)を、ヒスチジン標識融合タンパク質として精製し、抗原として使用した。マウスを免疫化し、その後、気腔を介して、致死量のPA103株で攻撃した。生存を測定すると、両方のワクチンがマウスを保護した(図3A)。肺損傷を評価すると、PcrVワクチン接種を受けた動物のみにおいて、上皮傷害および肺浮腫が有意に低かった(図3B)。PcrVワクチンで免疫化した動物は、その肺における細菌が有意に低く、このことは、シュードモナスV抗原の遮断により、肺からの細菌の迅速な除去が促進され、重度の上皮損傷から動物が守られることを示唆する(図3B)。
【0050】
図3Aおよび3Bは、生存、肺損傷、および細菌コロニー化に対する免疫化の効果を示す、グラフ(図3A)および棒グラフのセット(図3B)である。図3Aに関して、マウスを、示されたように免疫化し(PcrV、n=10;ExoU、n=5;対照、n=10)、5×105CFU/動物のPA103株で攻撃した。生存動物の比率を、1週間決定した。Mantel−Cox log rank検定によりp<0.05。図3Bに関して、PA103の設置4時間後の、ワクチン接種動物の肺損傷評価および細菌コロニー形成。肺上皮損傷、肺浮腫、および細菌負荷;PcrV、n=9;ExoU、n=4;および対照、n=8。肺の細菌の最終数は、Y軸×104CFUの数として示される。ダネット複数比較試験により決定、肺損傷(p<0.01)、肺浮腫(p<0.05)、および細菌数(p<0.05)の有意差(*)。肺損傷における一方向性分散分析、p=0.0005;肺浮腫、p=0.0437;細菌負荷、p=0.0075。
【0051】
治療介入が可能であるかを決定するために、5×105CFU/マウスの濃度のPA103を気腔滴下する1時間前に、マウスを、免疫前のウサギIgG、またはrPcrV、rExoU、またはrPopDに特異的なウサギIgGを用いて受動免疫化した。rPcrVに対する抗体により、致命的感染に対する完全な保護が提供された(図4)。抗rExoU IgGにより部分的生存が提供され、これは、対照IgGの投与とは有意に異なっていたが、全ての生存動物が試験中に重病であるようであった。生存は、別のIII型転位タンパク質PopDに対する抗体の受動移動により向上しなかった。これらの結果から、我々は、PcrVに対する抗体は、急性肺感染モデルで高度に保護的であり、PcrVは、細菌表面上にさらされ得るか、または抗体−抗原相互作用に利用可能な可溶形であり得ると結論する。
【0052】
図4は、5×105CFU/マウスのPA103株で攻撃して生存した動物数のグラフである。動物を、免疫IgG100μgまたは非免疫化ウサギ由来の対照IgG(rPcrV、免疫前の血清)で前処置した。各群についてN=10;Mantel−Cox log rank検定により、抗PcrVおよび抗ExoU IgG調製物での処理において、*p<0.05対対照群。
【0053】
PcrVが、中和を受け易い場合、抗rPcrV IgGと細菌種菌の併用投与により、肺損傷および致死から完全に守られる。IgG調製物を、細菌を肺に滴下注入する前に、種菌(致死種菌よりも10倍高い用量)と混合し、生存を測定した。唯一、抗rPcrV IgGのみが、この極度な感染から保護した(図5A)。肺損傷は、正常致死量である5×105細菌で感染させた動物で測定した。肺の気腔からの標識アルブミンの流出は、抗rPcrV IgGの同時投与後、非感染対照よりも僅か3%高かった(図5B)。肺から胸水への標識タンパク質の流出減少は、抗PcrVを種菌と共に含めた場合、非感染対照と同じであった。珍しいことに、湿潤/乾燥比により測定した肺浮腫は、抗rPcrVまたは抗rPopDの添加により有意に減少した(図5B)。従って、細菌と抗rPcrV IgGの併用投与は、ワクチン接種よりも、全ての肺損傷パラメーターを規格化する上で、さらにより効果的であった。これらのデータは、PcrVが抗体媒介中和を受け易いことを支持し、肺損傷の臨床関連減少を文書で裏付け;PcrVに対する抗体は、シュードモナス・アエルギノーザにより引き起こされる重度の院内肺炎の治療における治療薬として使用し得る。
【0054】
図5は、IgGおよび細菌攻撃の併用投与による肺損傷からの生存および保護を示す、グラフ(図5A)および棒グラフのセット(図5B)である。IgG(5μg)を、5×106(生存アッセイ用、1群あたりn=10)または5×105(肺損傷測定用、1群あたりn=4〜6動物)のP.アエルギノーザPA103株と混合した。この混合物を、肺に滴下注入し、生存(図5A)または肺損傷(図5B)を評価した。生存では、Mantel−Cox log rank検定による抗PcrVにおいて*p<0.05対対照IgG;肺上皮損傷および肺浮腫では、ダネット複数比較試験により、*p<0.05対対照IgG。肺損傷における一方向性分散分析、p=0.026、および肺浮腫、p<0.0005。
【0055】
急性P.アエルギノーザ感染では、III型媒介中毒の実効効果は、上皮を超えて細菌の播種を促進し、胸水、脾臓、肝臓、および血流の感染をもたらし得ることである。急性換気装置関連肺炎からの、または熱傷感染からの、P.アエルギノーザによる血液由来感染の結果、活発な抗生物質処置にもかかわらず、死亡率は40−80%であり得る(16)。PcrVは、P.アエルギノーザのIII型転位複合体の成分であるに違いない。なぜなら、このタンパク質の産生が欠損している変異体は、転位に必要なIII型エフェクターおよびタンパク質を産生および分泌できるにもかかわらず、CHO細胞を中毒させることができないか、または肺上皮損傷を引き起こすことができないからである。PopD(これもまた転位に必要である)と異なり、PcrVは、抗体媒介中和を受け易く、これは、抗体は急性感染の有用な治療剤であり得ることを示唆する。
【実施例3】
【0056】
3.実施例1および2の方法
PcrVの非極性挿入物の作成および補完
pcrGVHpopBDおよびフランキング配列をコード化する5.0kbのEcoRI−NsiI制限断片を、対立遺伝子置換ベクターpNOT19にクローン化した(17)。2つのNotI部位(1つはpcrG内で、1つはpopB内)を、スカルプター(Sculptor)変異誘発系(アマシャム)を使用して、挿入配列から除去した。内部SstI制限断片を、pcrVから欠失させ、残基17−221をインフレーム欠失させた(pNOTΔpcrV)。プラスミドの組込みを選択するために、テトラサイクリン耐性(TcΩ)をコード化する遺伝子を、ベクターのHindIII部位にクローン化した(pNOTΩΔpcrV)。MOBカセット(17)を、NotI断片として加えた。部分二倍体の選択、プラスミド配列の分解能、および対立遺伝子置換の確認を、前記した通り行なった(18)。シャトルプラスミド(pUCP、19)を使用して、pcrV欠失を補完したクローンを作成した。PcrVのコード配列を増幅し、ExoSプロモーター領域の制御下でクローン化した(20)。ExoSの転写は、P.アエルギノーザにおけるIII型分泌および転位を調節するオペロンと協調的に調節されている(2)。ヌクレオチド配列は、部位特異的変異、PCR増幅、またはインフレーム欠失を含む、各DNA作成物について確認した。
【0057】
分泌産物のSDS−PAGEおよびウエスタンブロット分析
P.アエルギノーザを、誘導(+NTA)または非誘導条件下(−NTA)で、III型分泌産物を発現させるために増殖した(18)。培養物を、540nmでの光学密度測定に基づき収集し、上清画分を、硫酸アンモニウムの飽和溶液を最終濃度が55%となるように添加して濃縮した。SDS−ポリアクリルアミドゲル(11%)の各レーンに、3μlの20倍濃縮した上清をのせ、クーマシーブルーで染色した。同一のゲルを、ExoU、PopD、およびPcrVを特異的に認識する、ウサギ抗血清のカクテルを使用して、前記の通り(3−5)ウエスタンブロット分析にかけた。125Iで標識したプロテインAを、第二試薬として使用して、結合したIgGを同定した。
【0058】
感染モデルおよび肺損傷評価
チャイニーズハムスター卵巣細胞(CHO)を、細胞毒性およびIII型転位を測定するために設計した、インビトロ感染モデルに使用した(21)。簡潔には、細菌種菌を、血清を含まない組織培養培地で調製した。血清含有培地中で繁殖させたCHO細胞を洗浄し、5:1の感染多重度で、様々なP.アエルギノーザ株で感染させた。培養物を、組織培養条件下(37℃、5%CO2)で3時間インキュベートし、洗浄し、トリパンブルーで染色した。色素への透過性は、位相差写真から決定した。ExoUを発現する親株PA103での感染により、インキュベートの3時間後、単層の約80%がトリパンブルー染色され、インキュベートの4−5時間後、単層は完全に破壊される。マウス感染および肺損傷の評価は、前記した通りに行なった(16)。簡潔には、雄で8−12週令の病原体のないBALB/cマウスを、シモンセン(Simonsen)研究所(ギルロイ、カリフォルニア)から購入し、柵のある状態に飼った。マウスを、簡潔には、吸入メトファン(メトキシフルラン、ピットマン−ムーア(Pitman−Moore)、マンデライン(Mundelein)、イリノイ)で麻酔し、約30°の角度で、仰臥位に配置した。15μlの細菌性種菌を、中咽頭を介して気管に挿入した修飾24ゲージ動物栄養補給針(ポッパー・アンド・サンズ・インコーポレイテッド(Popper&Sons,Inc.)、ニューハイドパーク、ニューヨーク)を使用して、左葉にゆっくりと滴下注入した。肺損傷評価を測定する場合、5%マウスアルブミンと共に、リンガーラクテート1ml中、0.5μCiの131I標識ヒト血清アルブミン(メルク−フロスト(Frosst)、ケベック、カナダ)、0.05μgの無水エバンスブルーを滴下注入液に加えた。感染の4時間後、マウスを麻酔し、血液を頚動脈穿刺により集め、正中胸骨切開を行なった。肺、胸水、気管、中咽頭、胃、および肝臓を収集し、放射活性を測定した。滴下注入した肺に残り、循環または胸水に侵入した、放射活性アルブミンの比率を、血液量(体重×0.07)に、終末血液サンプルで測定された計数(1mlあたり)を掛けることにより計算した。肺の湿潤/乾燥比は、1mlの水を肺に加え、混合物をホモジナイズすることにより決定した。ホモジネートは、前以て秤量したアルミニウム皿に置き、80℃のオーブンで3日間一定重量になるまで乾燥させた。肺ホモジネートは、連続希釈し、細菌を定量評価するためにヒツジ血液寒天上に置いた。
【0059】
PcrV、PopD、およびExoUに対するウサギ抗血清の産生
rPcrV、rPopD、およびrExoUは、pET16bにおいてヒスチジン標識融合タンパク質として産生し、前記した通りニッケルクロマトグラフィーにより精製した(22)。ウサギに、フロイント完全アジュバント中で乳化した300μgの組換えタンパク質を皮内注射(10部位)し、フロイント不完全アジュバント中の抗原をブースター投与し、7日間間隔で周期的に採血した。受動免疫化するために、IgG画分を、プロテインAカラムクロマトグラフィー(ピアスケミカルズ、ロックフォード、イリノイ)を使用して単離した。マウスに、5×105CFUのPA103株で攻撃する1時間前に、100μgのIgG(腹腔内注射)を注射した。rPcrVおよびrExoUを用いて能動免疫化するために、エンドトキシンを、1%トリトンX−114での抽出により、タンパク質調製物から除去した(23)。抽出後、トリトンX−114を、セファクリルS−200クロマトグラフィーにより除去した。全ワクチン調製物が、リムルスアメーバ様細胞ライセートアッセイ(バイオウィッタカー(BioWhittaker)、ウォーカースヴィレ(Walkersville)、メリーランド)の使用により決定されたように、40μgの組換えタンパク質あたり、1ng以下のエンドトキシンを含んだ。BALB/cマウスに、フロイント完全アジュバント中、10μgの組換えタンパク質を皮下注射した。30日目に、マウスを、フロイントの不完全アジュバント中、追加の10μgの抗原をブースター投与した。51日目に、マウスを、その左肺へのP.アエルギノーザの滴下注入により攻撃した。
【0060】
4.モノクローナル抗体の合成
マウスを、フロイントの完全アジュバント中、10μgの精製、LPS非含有、組換えPcrVを用いて免疫化し、2週間後に、フロイントの不完全アジュバント中で乳化した、同量の抗原を用いてブースター投与した。免疫化は皮下で行なった。フロイントの不完全アジュバント中のPcrVのブースター用量の1週間後に、脾臓をマウスから収集した。
【0061】
単一の脾臓を、血清を含有しない組織培養培地5mlに置き、片に切断し、穏やかにホモジナイズした。組織の大片を、ホモジネートおよび上清から沈降させ、単一細胞懸濁液を取り出し、1200rpmで10分間遠心分離にかけた。ペレット化した細胞を、10ml溶液に再懸濁し、赤血球を5分間溶解し、引き続き、10mlのウシ胎児血清を敷いた。物質を、1200rpmで8分間遠心分離し、上清を廃棄し、細胞を30mlの培地に懸濁した。脾臓細胞およびミエローマ細胞(P3×63Ag8.653)を、1200rpmで10分間の遠心分離により収集し、各ペレットを、別々に、10mlの組織培養培地に懸濁した。108脾臓細胞および2×107ミエローマ細胞を混合し、1200rpmで6分間の遠心分離により一緒にペレット化させた。上清を吸引により取り出し、1mlの35%ポリエチレングリコール(PEG)を加えた。細胞をこの溶液に穏やかに懸濁し、1000rpmで3分間遠心分離した。いくつかの実験では、遠心分離は省いた。
【0062】
PEG添加から正確に8分後、25mlの培地を加え、細胞を穏やかに再懸濁した。5分間の1200rpmでの遠心分離段階の後、細胞ペレットを、30%ならし培地および70%完全培地(血清含有)中1mlあたり1×106の密度で懸濁した。細胞を37℃で一晩インキュベートした。次の日、細胞を遠心分離により収集し、200mlの30%ならし培地およびヒポキサンチン、アミノプテリンおよびチミジン(HAT)を含む70%完全培地中に懸濁した。
【0063】
1ウェルあたり、約0.2mlのこの細胞懸濁液を、10個の96ウェルプレート(96ウェルプレートあたり12ml)に加えた。残りの細胞の密度は、1mlあたり2.5×105に調整し、細胞を96ウェル型式で培養した。プレートを、単一のコロニーについて顕微鏡でスクリーニングし、その後、上清を、抗原として組換えPcrVを使用して、酵素結合免疫吸着検定法により抗体産生について試験した。PcrVに反応性の抗体を産生するクローンを、より大きな培養皿に継代培養し、その後、アイソタイプを決定した。
【0064】
抗体の結合は、ウェルを覆膜する抗原(ヒスチジン標識タンパク質)として組換えPcrVを使用して、酵素結合免疫吸着検定法で試験した。モノクローナル抗体は、ヒスチジン標識を有さない天然PcrVを含むP.アエルギノーザ上清を使用して、ウエスタンブロット反応でも試験した。
【0065】
参考文献
1.ウィーナー−クロニッシュ・ジェイ・ピー(Wiener−Kronish,J.P.)、サワ・ティー(Sawa,T.)、クラハシ・ケー(Kurahashi,K.)、オーハラ・エム(Ohara,M.)、およびグロッパー・エム・エー(Gropper,M.A.)、「細菌性肺炎に関連した肺浮腫」、肺浮腫(マタイ・エム・エー(Matthay,M.A.)およびイングバー・ディー・エイチ(Ingbar,D.H.)編)pp.247−267(マーセル・デッカー・インコーポレイテッド(Marcel Dekker,Inc.)、ニューヨーク、1998)
2.フランク・ディー・ダブリュー(Frank,D.W.)、「シュードモナス・アエルギノーザの細胞外酵素Sレギュロン」、Mol.Microbiol.26:621−629(1997)
3.フィンク−バーバンコン・ヴィー(Finck−Barbancon,V.)等、「シュードモナス・アエルギノーザによるExoU発現は、急性細胞毒性および上皮損傷と相関する」、Mol.Microbiol.25:547−557(1997)
4.ヤー・ティー・エル(Yahr,T.L.)、ゴランソン・ジェイ(Goranson,J.)およびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザの細胞外酵素は、III型経路により分泌される」、Mol.Microbiol.22:991−1003(1996)。
5.ヤー・ティー・エル、メンデ−ミュエラー・エル・エム(Mende−Mueller,L.M.)、フリーズ・エム・ビー(Friese,M.B.)、およびフランク・ディー・ダブリュー、「シュードモナスアエルギノーザ細胞外酵素SレギュロンのIII型分泌産物の同定」、J.Bacteriol.179:7165−7168(1997)。
6.ウエック・シー・ジェイ(Hueck,C.J.)、「動物および植物の細菌病原体におけるIII型タンパク質分泌系」、Microbiol.Mol.Biol.Rev.62:379−433(1998)
7.スクルジペック・イー(Skrzypek,E.)およびストラレイ・エス・シー(Straley,S.C.)、「V抗原の分泌に対する、lcrVの欠失の異なる効果、低Ca2+応答の調節、およびエルシニア・ペスティスの病原性」、J.Bacteriol.177:2530−2542(1995)
8.ナカジマ・アール(Nakajima,R.)およびブルベーカー・アール・アール(Brubaker,R.R.)、「エルシニア・ペスティスの病原性ないしγインターフェロンおよび腫瘍壊死因子αの抑制の関連」、Infect.Immun.61:23−31(1993)
9.ナカジマ・アール、モティン・ヴィー・エル(Motin,V.L.)およびブルベーカー・アール・アール、「タンパク質A−V抗原融合ペプチドによるマウスのサイトカインの抑制および能動免疫による合成の回復」、Infect.Immun.63:3021−3029(1995)
10.ネディアルコフ・ワイ・エー(Nedialkov,Y.A.)、モティン・ヴィー・エルおよびブルベーカー・アール・アール、「エルシニア・ペスティスV抗原−ポリヒスチジン融合ペプチドにより媒介されるリポ多糖に対する耐性:インターロイキン−10の増幅」、Infect.Immun.63:1196−1203(1997)
11.ニレス・エム・エル(Nilles,M.L.)、フィールズ・ケー・エー(Fields,K.A.)、およびストラレイ・エス・シー、「エルシニア・ペスティスのV抗原は、YopBおよびLcrGに対する効果を介して、Yopベクター標的化並びにYop分泌を調節する」、J.Bacteriol.180:3410−3420(1998)
12.クドー・アイ(Kudoh,I.)、ウィーナー−クロニッシュ・ジェイ・ピー、ハシモト・エス(Hashimoto,S.)、ピテット・ジェイ・−エフ(Pittet,J.−F.)、およびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザ株の細胞外産物分泌は、肺胞上皮損傷の重度に影響を及ぼす」、Am.J.Physiol.267:L551−L556(1994)
13.アポダカ・ジー(Apodaca,G.)等、「シュードモナス・アエルギノーザ誘導MDCK細胞損傷の特徴づけ:グリコシル化欠損ホスト細胞は、細菌殺滅に耐性である」、Infect.Immun.63:1541−1551(1995)
14.ヤール・ティー・エル(Yahr,T.L.)、バリス・エー・ジェイ(Vallis,A.J.)、ハンコック・エム・ケー(Hancock,M.K.)、バービエリ・ジェイ・ティー(Barbieri,J.T.)、およびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザIII型系により分泌される新規アデニル酸シクラーゼであるExoY」、Proc.Natl.Acad.Sci.USA、印刷中(1998)
15.フィンク−バーバンコン・ヴィー(Finck−Barbancon,V.)、ヤール・ティー・エル、およびフランク・ディー・ダブリュー、「ExoU細胞毒の効率的分泌に必要なシャペロンSpcUの同定および特徴づけ」、J.Bacteriol.印刷中(1998)
16.サワ・ティー(Sawa,T.)、コリー・ディー・ビー(Corry,D.B.)、グロッパー・エム・エー、オーハラ・エム、クラハシ・ケーおよびウィーナー−クロニッシュ・ジェイ・ピー、「IL−10は、シュードモナス・アエルギノーザ肺炎における肺損傷および生存を改善する」、J.Immunol.159:2858−2866(1997)
17.シュバイツァー・エイチ・ピー(Schweizer,H.P.)、「新規ColE1型ベクターおよび携帯型oriTおよび対抗選択可能な枯草菌sacBマーカーを含むファミリカセットを使用した、シュードモナス・アエルギノーザの対立遺伝子交換」、Mol.Microbiol.6:1195−1204(1992)
18.フランク・ディー・ダブリュー、ナイアー・ジー(Nair,G.)、およびシュバイツァー・エイチ・ピー、「シュードモナス・アエルギノーザ細胞外酵素Sトランス調節座位の染色体挿入変異の作成および特徴づけ」、Infect.Immun.62:554−563(1994)。
19.シュバイツァー・エイチ・ピー、「pUC18/19から得られるエセリシア(Escherichia)−シュードモナスシャトルベクター」、Gene 97:109−112(1991)
20.ヤール・ティー・エル、ホベイ・エー・ケー(Hovey,A.K.)、クリッヒ・エス・エム(Kulich,S.M.)、およびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザ細胞外酵素S構造遺伝子の転写分析」、J.Bacteriol.177:1169−1178(1995)
21.バリス・エー・ジェイ(Vallis,A.J.)、ヤール・ティー・エル、バービエリ・ジェイ・ティー(Barbieri,J.T.)、およびフランク・ディー・ダブリュー、「組織培養条件に応答したシュードモナス・アエルギノーザによるExoS産生の調節」、Infect.Immun.提出
22.ヤール・ティー・エル、バービエリ・ジェイ・ティーおよびフランク・ディー・ダブリュー、「シュードモナス・アエルギノーザ由来の細胞外酵素Sの53ないし49kDa形の遺伝子関係」、J.Bacteriol.178:1412−1419(1996)
23.アイジ・ワイ(Aidi,Y.)およびパブスト・エム・ジェイ(Pabst,M.J.)、「トリトンX−114を使用した相分離によるタンパク質溶液からのエンドトキシンの除去」、J.Immunol.Methods 132:191−195(1990)
【特許請求の範囲】
【請求項1】
有効量のPcrV抗原を含む、シュードモナス・アエルギノーザ感染を抑制する組成物であって、前記PcrV抗原が、PcrVタンパク質のエピトープを含んでV抗原に特異的な免疫応答を誘導できるPcrVタンパク質の断片であり、かつ、前記PcrVタンパク質のエピトープがPcrVタンパク質のアミノ酸配列中の6〜9のアミノ酸からなる、組成物。
【請求項2】
有効量のPcrV抗原を含む、シュードモナス・アエルギノーザ感染を抑制する組成物であって、前記PcrV抗原がPcrVをコード化するDNAを含む遺伝子ワクチンであり、前記DNAが、PcrVタンパク質のエピトープを含んでV抗原に特異的な免疫応答を誘導できるPcrVタンパク質の断片をコード化し、かつ、前記PcrVタンパク質のエピトープがPcrVタンパク質のアミノ酸配列中の6〜9のアミノ酸からなる、組成物。
【請求項3】
PcrV抗原のDNA配列内で少なくとも40個連続したヌクレオチドからなる、PcrVコード化核酸に特異的にハイブリッド化するが、他の核酸にはハイブリッド化しない、ヌクレオチドプローブを含む、シュードモナス・アエルギノーザ感染を診断するための組成物。
【請求項4】
シュードモナス・アエルギノーザ感染を診断するための組成物であって、pcrV遺伝子を増幅するように設計された、PcrV抗原のDNA配列内で少なくとも25個連続したヌクレオチドからなる、ヌクレオチドプライマーを含み、該プライマーは、シュードモナス・アエルギノーザ感染を増幅産物の存在と相関させるために、ポリメラーゼ連鎖反応によってpcrV遺伝子が存在すればこれを増幅しうる、シュードモナス・アエルギノーザ感染を診断するための組成物。
【請求項5】
PcrV抗原を含む、PcrV特異的抗体/抗原複合体を検出することでシュードモナス・アエルギノーザ感染を診断するための組成物。
【請求項6】
PcrV抗原をコード化する有効量の遺伝子ワクチンを含む、シュードモナス・アエルギノーザ感染を抑制する組成物であって、前記遺伝子ワクチンが、PcrVタンパク質のエピトープを含んでV抗原に特異的な免疫応答を誘導できるPcrVタンパク質の断片をコード化し、かつ、前記PcrVタンパク質のエピトープがPcrVタンパク質のアミノ酸配列中の6〜9のアミノ酸からなる、組成物。
【請求項1】
有効量のPcrV抗原を含む、シュードモナス・アエルギノーザ感染を抑制する組成物であって、前記PcrV抗原が、PcrVタンパク質のエピトープを含んでV抗原に特異的な免疫応答を誘導できるPcrVタンパク質の断片であり、かつ、前記PcrVタンパク質のエピトープがPcrVタンパク質のアミノ酸配列中の6〜9のアミノ酸からなる、組成物。
【請求項2】
有効量のPcrV抗原を含む、シュードモナス・アエルギノーザ感染を抑制する組成物であって、前記PcrV抗原がPcrVをコード化するDNAを含む遺伝子ワクチンであり、前記DNAが、PcrVタンパク質のエピトープを含んでV抗原に特異的な免疫応答を誘導できるPcrVタンパク質の断片をコード化し、かつ、前記PcrVタンパク質のエピトープがPcrVタンパク質のアミノ酸配列中の6〜9のアミノ酸からなる、組成物。
【請求項3】
PcrV抗原のDNA配列内で少なくとも40個連続したヌクレオチドからなる、PcrVコード化核酸に特異的にハイブリッド化するが、他の核酸にはハイブリッド化しない、ヌクレオチドプローブを含む、シュードモナス・アエルギノーザ感染を診断するための組成物。
【請求項4】
シュードモナス・アエルギノーザ感染を診断するための組成物であって、pcrV遺伝子を増幅するように設計された、PcrV抗原のDNA配列内で少なくとも25個連続したヌクレオチドからなる、ヌクレオチドプライマーを含み、該プライマーは、シュードモナス・アエルギノーザ感染を増幅産物の存在と相関させるために、ポリメラーゼ連鎖反応によってpcrV遺伝子が存在すればこれを増幅しうる、シュードモナス・アエルギノーザ感染を診断するための組成物。
【請求項5】
PcrV抗原を含む、PcrV特異的抗体/抗原複合体を検出することでシュードモナス・アエルギノーザ感染を診断するための組成物。
【請求項6】
PcrV抗原をコード化する有効量の遺伝子ワクチンを含む、シュードモナス・アエルギノーザ感染を抑制する組成物であって、前記遺伝子ワクチンが、PcrVタンパク質のエピトープを含んでV抗原に特異的な免疫応答を誘導できるPcrVタンパク質の断片をコード化し、かつ、前記PcrVタンパク質のエピトープがPcrVタンパク質のアミノ酸配列中の6〜9のアミノ酸からなる、組成物。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−68672(P2011−68672A)
【公開日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願番号】特願2010−273433(P2010−273433)
【出願日】平成22年12月8日(2010.12.8)
【分割の表示】特願2000−586362(P2000−586362)の分割
【原出願日】平成11年11月23日(1999.11.23)
【出願人】(500345401)エムシーダブリユー リサーチ フオンデーシヨン インコーポレーテツド (6)
【Fターム(参考)】
【公開日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願日】平成22年12月8日(2010.12.8)
【分割の表示】特願2000−586362(P2000−586362)の分割
【原出願日】平成11年11月23日(1999.11.23)
【出願人】(500345401)エムシーダブリユー リサーチ フオンデーシヨン インコーポレーテツド (6)
【Fターム(参考)】
[ Back to top ]

