ショック治療用血液浄化器及びショック治療用血液浄化装置
【課題】血液中に存在する様々なメディエーター類、具体的には、HMGB1、トロンビン、LPSを網羅的に、かつ効率よく除去するショック治療用血液浄化器を提供する。
【解決手段】血液の導入口及び導出口を備えた容器120と、該容器中に収容された、ヒト・トロンボモジュリンの一部又は全部を含むペプチドが吸着した基材、及び抗酸化剤と、を備えるショック治療用血液浄化器120であって、前記基材及び抗酸化剤が前記容器に収容された状態で放射線が照射されており、血液を流通させたときに、該血液中に存在するHMGB1、トロンビン及びLPSをそれぞれ少なくとも70%除去する、ショック治療用血液浄化器。
【解決手段】血液の導入口及び導出口を備えた容器120と、該容器中に収容された、ヒト・トロンボモジュリンの一部又は全部を含むペプチドが吸着した基材、及び抗酸化剤と、を備えるショック治療用血液浄化器120であって、前記基材及び抗酸化剤が前記容器に収容された状態で放射線が照射されており、血液を流通させたときに、該血液中に存在するHMGB1、トロンビン及びLPSをそれぞれ少なくとも70%除去する、ショック治療用血液浄化器。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ショック治療用血液浄化器及びショック治療用血液浄化装置に関する。
【背景技術】
【0002】
ショックは急性の末梢循環不全とほぼ同義であり、特に微小循環障害により惹起された重要実質臓器の急性機能不全を中核とした疾患概念である。ショックは外傷や救急医療、あるいは感染症や外科・麻酔医療に際しては決してまれな疾患ではなく、本邦では敗血症によるショック死だけでも年間1万人の死者にのぼっている。その他の原因によるショック(出血性ショック、アナフィラキシーショック、外傷性ショックなど)を含めると、実質数は約10万人を超える死者であろうと予測される。ショックは種々の基礎疾患に続発合併するが、基盤となる病態生理は、血圧低下、組織低灌流、組織呼吸失調により、組織や臓器の恒常性が損なわれた病態である。現在のショック治療の中心は、血圧の維持管理と代謝の是正に向けられているが、なおかつ死亡率が50〜70%にものぼるという難治性の疾患である。
【0003】
上述のように、ショックは“急性の末梢循環不全”という単純な定義であるが、実際の病態生理は複雑である。一言でいえば、臓器・組織レベルでは、循環不全とそれに基づく低酸素血症である。低酸素血症の結果、代謝不全によるアポトーシス、代謝性アシドーシスを引き起こしている。すなわち循環動態の低下によりもたらされた代謝障害である。そのためこれまでのショックの治療は、主として循環動態、血圧の維持管理とアシドーシス対策に向けられてきた。しかし、ショックという病態の座は微小循環系にあることが判明してきた。微小循環領域で、微小血栓や後細動脈の拡張に基づくシャント形成のため、血流が“空回り”状態、あるいは閉塞状態となって、結果として循環不全に陥っている。そのため、あらゆる投与経路(経口、静注等)をもってしても、それらの治療薬が、最も必要とされる当該部位にまで到達しえず、薬物もまた“空回り”の状態になっている。この点が現行のショック治療の大きな盲点である。
【0004】
ごく最近、生体(組織)の障害や侵襲に対して生体が応答して放出する因子類(HMGB1など)がショックやSIRS(Systemic Inflammatory Response Syndrome)、播種性血管内凝固症候群(Disseminated Intravascular Cogagulation;DIC)などの発生病理に深く関与することが判明してきたが、これらの進歩を入れた治療が遅れている。
【0005】
HMGB1(High Mobility Group Box Protein 1)は、真核細胞内に存在する非ヒストン性のDNA結合タンパクであり、本来細胞内でDNAに結合して転写の促進や細胞の増殖などの機能に関与する細胞内タンパクの一つである。侵襲に際し、壊死細胞、あるいは活性化マクロファージ・樹状細胞から細胞外に放出されると、受容体RAGE,TLR−2,TLR−4を介し、周辺細胞を活性化して、止血、自然免疫、修復反応を誘導する。しかし最近、HMGB1が全身化するとショックの強力なメディエーターとして作用するという報告がなされた。(非特許文献1参照)。すなわち、マウスにリポポリサッカライド(LPS)を投与すると8〜24時間後に血清中のHMGB1濃度が顕著に上昇しマウスは死に至る。精製したHMGB1自体をLPSと同時にマウスに投与した場合も相乗的に作用して致死活性を示すことから、HMGB1がエンドトキシンショックの重要なメディエーターとなることが示された。ヒトにおいても、敗血症患者血中でHMGB1濃度が顕著に上昇し、特に死亡例において高いことが示された。このため、患者血液中に存在するLPSやHMGB1の除去あるいは分解により、エンドキシンショック患者を救命できる可能性が示唆されている。
【0006】
従来、これらに対して、LPSの吸着材(特許文献1)やHMGB1の吸着材(特許文献2)を用いた血液浄化法が開示されている。
【0007】
他方、トロンボモジュリン(TM)は多くの器官(肺、肝臓及び腎臓など)の内皮細胞の膜表面に存在する糖タンパク質である。活性化タンパク質C(APC)は、トロンビンにより媒介されるタンパク質C(PC)の裂開(トロンビン共同因子としてTMを必要とする現象)によって生じる(非特許文献2、3)。トロンビンがin vivoでTMと複合体を形成するとき、PCの活性化が1000倍に強化され(非特許文献4)、更にPCが内皮細胞PCレセプタ(ECPCR)と結合しているときには20倍強化されることが報告されている(非特許文献5)。このように形成されるAPCは因子Va及びVIIIaを不活性化することによって抗凝固効果を発揮し、それにより凝固カスケードが制御される。そして最近、APCはPAR−1(Protease Acivated Receptor−1)やEPCR(Endothelial Protein C Receptor)を介して、抗炎症、抗アポトーシス機能、細胞保護効果を発揮することがわかった。すなわち、血管内皮細胞上のTMは、トロンビン(T)・TM・PC・EPCR/PAR−1システムとして循環器内部を、炎症と凝固から守り、聖域化している。
【0008】
また最近、TMがそのN末端にHMGB1を吸着し、中和した後、分解して、細胞外に遊離してくるHMGB1を局所に封じ込め、侵襲反応の全身化を防ぐ活性を持つことが明らかとなった(非特許文献6)。さらに、そのN末端にLPSも吸着することが開示されている(非特許文献7)。
【0009】
以上の背景により、可溶化した遺伝子組み換えトロンボモジュリン(商品名:リコモジュリン)が開発され、本邦でDICの臨床薬として使用されている。この薬剤の効果は高く、多くのDIC患者を救命しつつあるが、更に高い効果を得るためには、投与量を増やさなければならない問題があった。
【0010】
一方、TMを基材に固定した血液浄化装置については、基材にプロテインCを活性化させる生理活性物質が存在した状態で放射線照射され、プロテインC活性化能を持つ改質基材(特許文献3)が開示されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特許第3817808号公報
【特許文献2】国際公開第01/074420号
【特許文献3】特開2006−271809号公報
【非特許文献】
【0012】
【非特許文献1】“Science”,285巻,p.248−251,1999年
【非特許文献2】“J.Biol.Chem.”,257巻,p.7944−7947,1982年
【非特許文献3】“Proc.Natl.Acad.Sci.USA”,78巻,p.2249−2252,1981年
【非特許文献4】“J.Biol.Chem.”,278巻,p.46750−46759,2003年
【非特許文献5】“Esmon,Crit.Care Med.”,32巻,p.S298−301,2004年
【非特許文献6】“J.Clin.Invest.”,115巻,p.1267,2005年
【非特許文献7】“Blood”,112巻,p.3661−3670,2008年
【発明の概要】
【発明が解決しようとする課題】
【0013】
特許文献1及び2に記載された血液浄化法は、単一のメディエーターを標的として、これを除去することをストラテジーとしている。しかしながら、ごく最近の進歩で、ショックの病態は、炎症、凝固、免疫などの各システムが騒乱・不全に陥り、生体諸細胞がアポトーシスに向かっている複雑で、カタストロフィクな病態であること、それは複合したメディエーター類の作用で発症していることが判明しており、これらの因子を網羅的に除去できる血液浄化法や血液浄化装置の開発が必要である。
【0014】
特許文献3に記載された血液浄化装置は、良好な抗血栓性を有するとされているものの、ショックの病態の改善に重要な血液中に存在するHMGB1やトロンビン、LPSの除去に関する記載は全くない。
【0015】
したがって、ショックの病態の血液中に存在する様々なメディエーター類を網羅的に除去する、具体的には、血液中に存在するHMGB1、トロンビン、LPSを効率よく除去するショック治療用血液処理装置はいまだ開示されていなかった。
【0016】
そこで本発明は、血液中に存在する様々なメディエーター類、具体的には、HMGB1、トロンビン、LPSを網羅的に、かつ効率よく除去するショック治療用血液浄化器及びショック治療用血液浄化装置を提供することを目的とする。
【課題を解決するための手段】
【0017】
本発明は、「血液の導入口及び導出口を備えた容器」と、該容器中に収容された、「ヒト・トロンボモジュリンの一部又は全部を含むペプチドが吸着した基材」及び「抗酸化剤」と、を備えるショック治療用血液浄化器であって、前記基材及び抗酸化剤が前記容器に収容された状態で放射線が照射されており、血液を流通させたときに、該血液中に存在するHMGB1、トロンビン及びLPSをそれぞれ少なくとも70%除去する、ショック治療用血液浄化器を提供する。
【0018】
本発明のショック治療用血液浄化器は、上述の構成を有することにより、血液中に存在するHMGB1、トロンビン及びLPSを網羅的に、かつ効率よく除去することができる。
【0019】
上記血液は、ショック状態の生体から取り出したものであることが好ましい。ショック状態の生体では、種々のメディエーター類、特にHMGB1、トロンビン及びLPSが血液中に増加しているため、本発明のショック治療用血液浄化器によって血液中のHMGB1、トロンビン及びLPSを網羅的に除去することによる効果はより一層高いものとなる。
【0020】
上記ショック状態は、急性の末梢循環不全の状態とすることができる。また、上記急性の末梢循環不全は、敗血症性ショック、エンドトキシンショック、心原性ショック、出血性ショック、アナフィラキシーショック及び外傷性ショックからなる群から選択されるものとすることができる。
【0021】
本発明はまた、上記ショック治療用血液浄化器と、被検体から取り出した血液を脱血側回路を通して前記ショック治療用血液浄化器に送液し、前記ショック治療用血液浄化器を通過した血液を返血側回路を通して前記被検体に返血する血液回路と、前記血液回路内の血液を送液させる血液ポンプと、前記血液ポンプを駆動して前記血液回路内の血液の流れを制御する制御部と、を備える、ショック治療用血液浄化装置を提供する。
【0022】
本発明のショック治療用血液浄化装置は、上述の構成を有することから、ショックの病態の血液中に存在する複数のメディエーターを体外循環処理によって効率よく除くことができる。したがって、単一のメディエーターを標的としていた従来法と比較して、重症化したショックにおける救命効果を向上することができる。
【発明の効果】
【0023】
本発明により、血液中に存在する様々なメディエーター類、具体的には、血液中に存在するHMGB1、トロンビン及びLPSを網羅的に、かつ効率よく除去するショック治療用血液浄化器及びショック治療用血液浄化装置の提供が可能となる。
【図面の簡単な説明】
【0024】
【図1】第一の実施形態に係る血液浄化器の模式断面図である。
【図2】第二の実施形態に係る血液浄化器の模式断面図である。
【図3】本発明の実施形態に係る血液浄化装置の概略図である。
【発明を実施するための形態】
【0025】
以下、場合により図面を参照しつつ本発明の好適な実施形態について詳細に説明する。なお、図面中、同一又は相当部分には同一符号を付し、重複する説明は省略する。また、図面の寸法比率は図示の比率に限られるものではない。
【0026】
本発明は以下のような構成を有する;
血液の導入口及び導出口を備えた容器と、
該容器中に収容された、ヒト・トロンボモジュリンの一部又は全部を含むペプチドが吸着した基材、及び抗酸化剤と、を備えるショック治療用血液浄化器であって、
前記基材及び抗酸化剤が前記容器に収容された状態で放射線が照射されており、
血液を流通させたときに、該血液中に存在するHMGB1、トロンビン及びLPSをそれぞれ少なくとも70%除去する、ショック治療用血液浄化器。
【0027】
本発明におけるショックとは、急性の末梢循環不全と定義され、特に微小循環障害により惹起された重要実質臓器の急性機能不全を中核とした疾患概念をいう。基盤となる病態生理は、血圧低下、組織低灌流、組織呼吸失調により、組織や臓器の恒常性が損なわれた病態である。例示すると、敗血症性ショック、エンドトキシンショック、心原性ショック、出血性ショック、アナフィラキシーショック、外傷性ショックなどが挙げられる。
【0028】
本発明の血液浄化器におけるヒト・トロンボモジュリンとしては、例えば、ヒト肺組織から精製したトロンボモジュリンをその一例として挙げることができる。このトロンボモジュリンの取得方法及び精製方法については、例えば、N.L.Esmonらの方法(J.Biol.Chem.,257巻,p.859,1982年)に従って作成したDIP−トロンビン(diisopropylphosphoro−thrombin)を固定化したカラムに、ヒト肺組織から得た細胞抽出物を通液し、カラムに結合した成分を溶出したフラクションを回収し、各フラクションのプロテインC活性化能を指標としてトロンボモジュリンを含むフラクションを得ることができる。また、特開昭64−6219に記載された方法を用いることもできる。
【0029】
さらに、ヒト・トロンボモジュリンとしては、遺伝子工学的手法によって得たものでもよい。例えば、遺伝子データベースに登録されたヒト・トロンボモジュリンの塩基配列に基づいてプローブを作成し、ヒトcDNAライブラリー等のスクリーニングによってヒト・トロンボモジュリン遺伝子を得ることができる。これを本技術分野において汎用されている遺伝子組換え技術により、適切なベクター−宿主系(例えば、プラスミド−大腸菌系)を用いて形質転換し、ヒト・トロンボモジュリン遺伝子を有する組換え体を得ることができる。続いて、この組換え体を適切な条件下で培養することにより、ヒト・トロンボモジュリン遺伝子を発現させ、発現したヒト・トロンボモジュリンタンパク質を適切な方法によって精製することによって得たヒト・トロンボモジュリンを用いることができる。このような遺伝子工学的手法については、Molecular Cloning A Laboratory Manual(J.Smabrookら著,Cold Spring Harbor Laboratory出版)に記載された方法を適宜組合わせて用いることができる。
【0030】
本発明の血液浄化器におけるヒト・トロンボモジュリンとしては、ヒト・トロンボモジュリン分子をそのまま用いてもよいし、ヒト・トロンボモジュリンの構造の一部分の構造を有するペプチド、又は該ペプチドを含む構造を有するペプチドを用いてもよい。なお、ヒト・トロンボモジュリンの構造の一部分の構造を有するペプチドとは、血液中に存在するHMGB1、トロンビン及びLPSに対して分解、結合、吸着、不活性化等の作用をもたらすペプチドを意味する。
【0031】
本発明の血液浄化器における基材の形状は、液相で血液との接触頻度を高くするため、表面積が大きいことが望ましい。例を挙げると、ビーズ状、チップ状、中空糸状、平膜状、糸状、スポンジ状等いずれの形状であっても良い。これらの中でも取扱い性の点でビーズ状、中空糸状、糸状、スポンジ状が好ましく用いられる。また、体液循環時の体液の流通の観点から中空糸状又はビーズ状が最も好ましく用いられる。
【0032】
基材の材質としては、上記の形状に成型でき、血液への溶出量が少なく、血球にダメージを与えにくいものであれば特に制限はなく各種のものを用いることができる。例えば、ポリエステル、ポリオレフィン、ポリアクリロニトリル、ポリアミド、ポリスチレン、ポリアルキル(メタ)アクリレート、ポリ塩化ビニル、ポリクロロプレン、ポリウレタン、ポリビニルアルコール、ポリビニルアセテート、ポリブタジエン、ブタジエン−アクリロニトリル共重合体、スチレン−ブタジエン共重合体、エチレン−ビニルアルコール共重合体、セルロースジアセテート、エチルセルロース等が挙げられる。好ましくはポリスルホン、ポリエーテルスルホンで、特に好ましくはポリスルホンである。
【0033】
本発明の血液浄化器は、前述のヒト・トロンボモジュリンの一部又は全部を含むペプチド(以下、「トロンボモジュリンペプチド」という。)が吸着した基材と、抗酸化剤と、が充填された容器に放射線を照射することにより製造される。例えば、トロンボモジュリンペプチドが吸着した基材を抗酸化剤が充填された容器に収容し、該基材及び抗酸化剤が該容器に収容された状態で、放射線を照射することにより製造される。
【0034】
トロンボモジュリンペプチドが吸着した基材は、トロンボモジュリンペプチドを含む溶液に基材を浸漬するか、又は上記溶液を基材に通液する等により得ることができる。これにより、トロンボモジュリンペプチドが基材表面に物理吸着、化学吸着等したものが得られる。
【0035】
放射線照射によって発生するラジカル反応により、トロンボモジュリンペプチドと基材に化学結合が形成される。このため、トロンボモジュリンペプチドを基材に吸着させただけでも、放射線照射によってトロンボモジュリンペプチドを基材に固定化することができる。つまり、放射線照射によって、滅菌とトロンボモジュリンペプチドの基材への固定化を同時に行うことも可能である。
【0036】
本発明者らは、血液浄化器の製造にあたり、抗酸化剤の存在下でトロンボモジュリンペプチドが吸着した基材に放射線を照射することによって、抗酸化剤の非存在下で放射線を照射した場合に比べて、血液中に存在するHMGB1、トロンビン及びLPSの除去効率が著しく上昇することを見出した。この作用機序は明らかではないが、放射線照射時のラジカル発生及びラジカル反応の進行において、抗酸化剤がラジカルの発生を抑制するか、又は発生したラジカルを消去することによって、ラジカル反応の進行を抑え、基材間又は基材とトロンボモジュリンペプチド間の結合形成が完全には進行せず、半架橋状態となるため、血液中に存在するHMGB1、トロンビン及びLPS等とトロンボモジュリンペプチドとの相互作用が生じ易くなることが一因であると考えられる。
【0037】
本発明の血液浄化器における抗酸化剤とは、酸化防止効果を持った物質のことをいい、放射線照射時に発生する酸素ラジカルによる、基材、容器及びトロンボモジュリンペプチドの酸化劣化を抑制する効果が高くなる利点も得られる。抗酸化剤を例示すると、ピロ亜硫酸ナトリウム、亜硫酸ナトリウム、亜硫酸水素ナトリウム、アセトンソジウムバイサルファイト、ソジウムホルムアルデヒドスルホキシレート、ソジウムハイドロサルファイト、アスコルビン酸が挙げられる。以上例示した中では、ピロ亜硫酸ナトリウム、アセトンソジウムバイサルファイト、ソジウムホルムアルデヒドスルホキシレート、ソジウムハイドロサルファイト、アスコルビン酸が毒性、取扱い性などの点から好ましく、特にピロ亜硫酸ナトリウムが好ましい。
【0038】
抗酸化剤は、酸化劣化を抑制する効果及びラジカル反応の進行を抑える効果の観点から、トロンボモジュリンペプチドを吸着した基材の単位表面積に対して、0.0001〜10000mol/cm2となるように添加することが好ましく、0.001〜1000mol/cm2となるように添加することがより好ましい。
【0039】
抗酸化剤は、抗酸化剤溶液であってもよい。本発明の血液浄化器における容器に抗酸化剤溶液を充填させる方法は、抗酸化剤を適当な溶媒に溶解して容器と接触させる方法、例えば、水又は生理的塩溶液に抗酸化剤を溶解させて容器に充填又は含浸させる方法、グリセリン、アルコール等の溶剤に抗酸化剤を溶かして容器に充填又は含浸させる方法等が用いられる。容器に抗酸化剤溶液が含浸し、酸素により容器が変化を受けるのを抑制できる状態になっていることが必要である。溶液状態にして抗酸化剤を用いる場合、抗酸化剤の濃度は、容器の材質、抗酸化剤の種類及び滅菌の条件によって最適な濃度が決定されるべきであるが、好ましくは0.001質量%から1質量%、より好ましいのは0.005質量%から0.5質量%の濃度である。
【0040】
放射線の種類としては、α線、β線、γ線、X線、紫外線、電子線などが用いられるが、基材への透過性が良いことからγ線が好んで用いられる。
【0041】
放射線の照射線量としては、基材の材質や形状にも依存するが、5kGy以上、多くの基材は15kGy以上の放射線を照射することで、滅菌することができる。また一方で、放射線照射線量が高くなると、トロンボモジュリンペプチドの変性が起こり、100kGyを越える線量を照射すると、活性化能の低下が顕著になる。放射線照射線量は5kGy以上100kGy未満が好ましく、さらには15kGy以上80kGy以下、さらに好ましくは20kGy以上50kGy以下である。なお線量の測定は線量計にて測定することができる。
【0042】
本発明の血液浄化器における容器は、内部に血液を導入するための入口(導入口)と該血液を外部に排出するための出口(導出口)とを備え、トロンボモジュリンペプチドが吸着した基材を収納できるものであれば特に制限はないが、容器の容量は、体外循環に用いる場合10mLから1000mL程度が適当である。本発明においては、血球成分を含む血液を直接血液浄化器に流通させ、浄化する。これにより血球成分に吸着したHMGB1、トロンビン、LPSも除去できるため、好ましい。また、血液浄化器への血液の流通は、臨床上の必要に応じ、あるいは設備の装置状況に応じて、連続的に行っても良いし、また断続的に行っても良い。
【0043】
本発明の血液浄化器は、血液中に存在するHMGB1、トロンビン、LPSを網羅的に、効率よく除去することができることを特徴とする。なお、本明細書において、「除去」とは、血液浄化器を流通する前後の血液において、血液中のメディエーター類の存在そのものが消失することに加え、存在そのものは消失しないが不活性化していることも含むものとする。
【0044】
本発明の血液浄化器による、HMGB1、トロンビン又はLPSの除去率は、それぞれ70%以上である。より好ましくはそれぞれ80%以上、さらに好ましくはそれぞれ90%以上である。なお、「除去率」とは、血液浄化器を流通する前の血液中におけるHMGB1、トロンビン又はLPSの存在量と、血液浄化器を流通した後の血液中におけるHMGB1、トロンビン又はLPSの存在量とから算出される。具体的には、血液浄化器を流通する前の血液中におけるHMGB1、トロンビン又はLPSの存在量に対する、「除去」されたHMGB1、トロンビン又はLPS量の割合を意味する。
【0045】
本発明の血液浄化器は、血液よりHMGB1、トロンビン、LPSを効率よく除去することができることから、本発明の血液浄化器にHMGB1、トロンビン、LPSを含むショック患者の血液を体外循環の方法で流通させることにより、患者の治療を有効に行うことができる。
【0046】
図1は、本発明の第一の実施形態に係る血液浄化器の模式断面図である。血液浄化器100は、容器10の内部に複数のビーズ状基材1が装填されている。ビーズ状基材1の表面には、トロンボモジュリンペプチドが固定されている。容器10の両端部には、血液の導入口及び導出口となる、ヘッダーキャップ41a、41bが設けられている。
【0047】
ヘッダーキャップ41aの血液の導入口より矢印Fの方向から血液浄化器100の内部に流入した血液が、ビーズ状基材1に固定されたトロンボモジュリンペプチドと接することにより、血液中に存在するHMGB1、トロンビン及びLPSは、分解、結合、吸着、不活性化等の作用を受ける。これにより、ヘッダーキャップ41bの血液の導出口から流出した際には血液中からHMGB1、トロンビン及びLPSが除去されている。
【0048】
図2は、本発明の第二の実施形態に係る血液浄化器の模式断面図である。血液浄化器110は、容器20の長手方向に沿って、複数の中空糸状基材2からなる中空糸束が装填されている。当該中空糸束は、封止樹脂30a、30bによって、容器20の両端部に固定されている。中空糸状基材2の内側には、トロンボモジュリンペプチドが固定化されている。
【0049】
中空糸状基材2の端面は開口しており、この開口部から、血液が矢印Fの方向から中空糸状基材2の内部へ流入することができる。そして、中空糸状基材2の内部を通過した血液は、他方の開口部から流出することができる。容器20の両端部には、表面に中空糸状基材2の開口部を有する封止樹脂30a、30bの端面に対向して、血液の導入口及び導出口となる、ヘッダーキャップ40a、40bが設けられている。
【0050】
中空糸状基材2の内部へと導入された血液中に存在するHMGB1、トロンビン及びLPSは、中空糸状基材2の内部でトロンボモジュリンペプチドと接することにより、分解、結合、吸着、不活性化等の作用を受ける。これにより、他方の開口部から流出した際には血液中からHMGB1、トロンビン及びLPSが除去されている。
【0051】
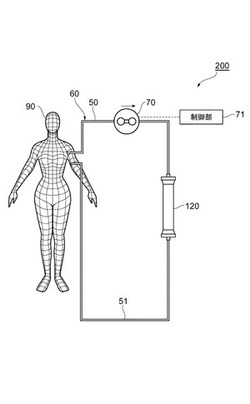
本発明はまた、上述した血液浄化器と、被検体から取り出した血液を脱血側回路を通して前記ショック治療用血液浄化器に送液し、前記ショック治療用血液浄化器を流通した血液を返血側回路を通して前記被検体に返血する血液回路と、前記血液回路内の血液を送液させる血液ポンプと、前記血液ポンプを駆動して前記血液回路内の血液の流れを制御する制御部と、を備える、ショック治療用血液浄化装置に関する。
【0052】
図3は、本発明の一実施形態に係る血液浄化装置の概略図である。血液浄化装置200は、脱血側回路50及び返血側回路51を有する血液回路60と、本発明の血液浄化器120と、血液ポンプ70と、制御部71と、を備えている。
【0053】
血液浄化装置200の制御部71は、血液ポンプ70及び図示しない各種バルブに有線、又は無線によって接続されており、血液ポンプ70を駆動制御、又は各種バルブを開閉制御することで、血液の流量を制御する。
【0054】
次に、血液浄化装置200の作動方法について説明する。血液処理時には、制御部71により血液ポンプ70が制御され、被検体90から採取された血液が所定流量で脱血側回路50から血液浄化器120を流通して返血側回路51に送液される。血液浄化器120を流通するときに、血液中に存在するHMGB1、トロンビン及びLPSが除去される。
【0055】
本発明の血液浄化器は高い効率で血液中に存在するHMGB1、トロンビン及びLPSを除去することができるため、血液を血液浄化器120に1回流通させるだけで充分な除去効果が得られるものであるが、更に除去効率を高めるために、返血側回路51と脱血側回路50とを接続する循環回路を更に備えていてもよい。この循環回路によって、返血側回路51に送液された血液を、再度脱血側回路50に循環させ、再度血液浄化器120に流通させることができる。これにより、血液を血液浄化器120に2回(又は3回以上)流通させることとなり、血液中に存在するHMGB1、トロンビン及びLPSをより高い効率で除去することができる。この場合、循環回路に循環回路内の血液を脱血側回路50に循環させる循環ポンプを備え、制御部71で循環ポンプを駆動制御、及び各種バルブを開閉制御することで、血液の流量及び経路を制御する。
【実施例】
【0056】
以下、本発明を実施例により更に具体的に説明するが本発明の範囲はこれらの実施例に限定されるものではない。
【0057】
〔実施例1〕
(1.ポリスルホン/ポリビニルピロリドン混合中空糸膜充填カラムの作成)
ポリスルホン樹脂(アモコ・エンジニアリング・ポリマーズ社製、P−1700)18重量部、ポリビニルピロリドン(アイ・エス・ピー社製、K−92)4重量部、ジメチルアセトアミド(以下、DMAC)78重量部、からなる均一な紡糸原液を作成した。DMAC濃度54重量%の中空内液とともにスリット幅50μmの環状口金から吐出し、80cm下方に設けた60℃の水中に浸漬し68.5m/分の速度で巻き取った。中空糸膜厚を45μm、内径を185μmに合わせるように紡糸原液、中空内液の吐出量を調製した。9500mmフィラメント巻き取ったところで、ロープを300mmに切断し、束の切断面上方から80℃の熱水シャワーを2時間かけて洗浄することにより膜中の残溶剤を除去した。この膜をさらに87℃の熱風で7時間乾燥することにより含水量が1%未満の中空糸膜を得た。
【0058】
中空糸膜を50本束ね、直径約7mm、長さ5cmのプラスチック管ミニカラムケースに挿入した。中空糸膜の両末端を、中空糸膜中空部を閉塞しないようにウレタン系ポッティング剤で固定し、カラムを作成した。該カラムの中空糸内表面積は75cm2である。中空糸膜ミニカラムの両側に、内径1mm、外径2mm、長さ50cmのシリコーンチューブを接続した。ミニカラムの中空糸膜内側及び外側を注射用蒸留水60mLで1mL/minの流速で洗浄し、さらにリン酸緩衝生理食塩水10mLを1mL/minの流速で洗浄し、ポリスルホン/ポリビニルピロリドン混合中空糸膜充填カラムを作成した。
【0059】
(2.ミニカラムへのトロンボモジュリンペプチドの固定化)
トロンボモジュリンペプチドとして、特開平1−6219号公報の記載に従い、遺伝子工学的手法によって得たヒト・トロンボモジュリンを用いた。1.で作成したポリスルホン/ポリビニルピロリドン混合中空糸膜充填カラムにヒト・トロンボモジュリン200μg/mLを含むリン酸緩衝生理食塩水1mLを1mL/minの速度で流し、ヒト・トロンボモジュリン溶液に置換した。置換後、前記ヒト・トロンボモジュリン溶液2mLを1mL/minの速度で30分間灌流させた。灌流後、回路を外し、モジュール両端に栓をした状態で37℃にて20時間静置し、ヒト・トロンボモジュリンを中空糸内部に吸着させた。吸着後のカラムに回路を取り付け、リン酸緩衝生理食塩水5mLで1mL/minの速度で洗浄した。洗浄後のカラムに抗酸化剤溶液としてピロ亜硫酸ナトリウム600ppm、炭酸ナトリウム300ppmを含む水溶液5mLを1mL/minの速度で流し、抗酸化剤溶液に置換した。置換後、回路を外し、モジュール両端に栓をした状態で照射線量25kGyのγ線を照射し、ポリビニルピロリドン混合中空糸膜にトロンボモジュリンペプチドを固定化した血液浄化器を作成した。
【0060】
(3.血液浄化器の除去能評価)
採血直後の健常人血液6mLにLPSを20pg/mL、HMGB1を50ng/mL、ヘパリン0.8unit/mLになるようにそれぞれ加え、37℃に加温した。2.で作成した血液浄化器に37℃に加温した前記血液3mLを1mL/minの速度で30分間循環した。なお、血液浄化器内及び回路内には、はじめは充填液が充填してあるので、循環開始後の最初の100μLは廃棄した後、循環した。対照として、血液浄化器を使用せず回路のみで同様に血液3mLを1mL/minの速度で30分間循環した。30分循環後の血液に3.8%クエン酸ナトリウム1/10容量を加え、血液凝固反応を抑制し、4℃に冷却後、遠心分離(3000rpm、10min)した。少血小板血漿(Platelet−Poor Plasma;以下、「PPP」という。)を分離した。PPPは測定まで−70℃で凍結して保管した。
【0061】
分離したPPPを用いてHMGB1濃度、トロンビン活性値、LPS濃度を測定し、循環前後の除去率を算出した。HMGB1濃度は、PPPを電気泳動し、酵素標識抗体を用いたウエスタンブロット法によって測定した。トロンビン活性値は、SensoLyte 520 Thrombin Activity Assay Kit *Fluorimetric* (ANASPEC社製)を用いて測定した。LPS濃度は、国際公開第2009/116633号の記載に従い、エンドトキシン散乱測光法(ESP法)を用いて測定した。
HMGB1、トロンビン、LPSの除去率(%)は、以下の式により算出した。
除去率(%)=[(Csham−Ctrue)/Csham]×100
Csham:回路のみを循環した血液中の濃度又は活性値
Ctrue:血液浄化器と回路を循環した血液中の濃度又は活性値
結果は、HMGB1除去率が85%、トロンビン除去率が96%、LPS除去率が90%と効率的な除去が可能であった。
【0062】
〔実施例2〕
抗酸化剤溶液としてピロ亜硫酸ナトリウム600ppm、炭酸ナトリウム300ppmを含む水溶液の代わりにアスコルビン酸2000ppmを含むリン酸緩衝生理食塩水を使用したこと以外は、実施例1と同様な操作で血液浄化器を作成し、除去能を評価した。その結果、HMGB1除去率が92%、トロンビン除去率が95%、LPS除去率が83%と効率的な除去が可能であった。
【0063】
〔比較例1〕
ヒト・トロンボモジュリンを用いないこと以外は、実施例1と同様な操作で血液浄化器を作成し、除去能を評価した。HMGB1除去率が10%、トロンビン除去率が20%、LPS除去率が5%と除去能は低下した。
【0064】
〔比較例2〕
抗酸化剤溶液の代わりにリン酸緩衝生理食塩水を使用したこと以外は、実施例1と同様な操作で血液浄化器を作成し、除去能を評価した。HMGB1除去率が40%、トロンビン除去率が50%、LPS除去率が50%と除去能は低下した。
【符号の説明】
【0065】
1…ビーズ状基材、2…中空糸状基材、10,20…容器、30a,30b…封止樹脂、F…血液の流れ方向、40a,41a,40b,41b…ヘッダーキャップ、50…脱血側回路、51…返血側回路、60…血液回路、70…血液ポンプ、71…制御部、90…被検体、100,110,120…血液浄化器、200…血液浄化装置。
【技術分野】
【0001】
本発明は、ショック治療用血液浄化器及びショック治療用血液浄化装置に関する。
【背景技術】
【0002】
ショックは急性の末梢循環不全とほぼ同義であり、特に微小循環障害により惹起された重要実質臓器の急性機能不全を中核とした疾患概念である。ショックは外傷や救急医療、あるいは感染症や外科・麻酔医療に際しては決してまれな疾患ではなく、本邦では敗血症によるショック死だけでも年間1万人の死者にのぼっている。その他の原因によるショック(出血性ショック、アナフィラキシーショック、外傷性ショックなど)を含めると、実質数は約10万人を超える死者であろうと予測される。ショックは種々の基礎疾患に続発合併するが、基盤となる病態生理は、血圧低下、組織低灌流、組織呼吸失調により、組織や臓器の恒常性が損なわれた病態である。現在のショック治療の中心は、血圧の維持管理と代謝の是正に向けられているが、なおかつ死亡率が50〜70%にものぼるという難治性の疾患である。
【0003】
上述のように、ショックは“急性の末梢循環不全”という単純な定義であるが、実際の病態生理は複雑である。一言でいえば、臓器・組織レベルでは、循環不全とそれに基づく低酸素血症である。低酸素血症の結果、代謝不全によるアポトーシス、代謝性アシドーシスを引き起こしている。すなわち循環動態の低下によりもたらされた代謝障害である。そのためこれまでのショックの治療は、主として循環動態、血圧の維持管理とアシドーシス対策に向けられてきた。しかし、ショックという病態の座は微小循環系にあることが判明してきた。微小循環領域で、微小血栓や後細動脈の拡張に基づくシャント形成のため、血流が“空回り”状態、あるいは閉塞状態となって、結果として循環不全に陥っている。そのため、あらゆる投与経路(経口、静注等)をもってしても、それらの治療薬が、最も必要とされる当該部位にまで到達しえず、薬物もまた“空回り”の状態になっている。この点が現行のショック治療の大きな盲点である。
【0004】
ごく最近、生体(組織)の障害や侵襲に対して生体が応答して放出する因子類(HMGB1など)がショックやSIRS(Systemic Inflammatory Response Syndrome)、播種性血管内凝固症候群(Disseminated Intravascular Cogagulation;DIC)などの発生病理に深く関与することが判明してきたが、これらの進歩を入れた治療が遅れている。
【0005】
HMGB1(High Mobility Group Box Protein 1)は、真核細胞内に存在する非ヒストン性のDNA結合タンパクであり、本来細胞内でDNAに結合して転写の促進や細胞の増殖などの機能に関与する細胞内タンパクの一つである。侵襲に際し、壊死細胞、あるいは活性化マクロファージ・樹状細胞から細胞外に放出されると、受容体RAGE,TLR−2,TLR−4を介し、周辺細胞を活性化して、止血、自然免疫、修復反応を誘導する。しかし最近、HMGB1が全身化するとショックの強力なメディエーターとして作用するという報告がなされた。(非特許文献1参照)。すなわち、マウスにリポポリサッカライド(LPS)を投与すると8〜24時間後に血清中のHMGB1濃度が顕著に上昇しマウスは死に至る。精製したHMGB1自体をLPSと同時にマウスに投与した場合も相乗的に作用して致死活性を示すことから、HMGB1がエンドトキシンショックの重要なメディエーターとなることが示された。ヒトにおいても、敗血症患者血中でHMGB1濃度が顕著に上昇し、特に死亡例において高いことが示された。このため、患者血液中に存在するLPSやHMGB1の除去あるいは分解により、エンドキシンショック患者を救命できる可能性が示唆されている。
【0006】
従来、これらに対して、LPSの吸着材(特許文献1)やHMGB1の吸着材(特許文献2)を用いた血液浄化法が開示されている。
【0007】
他方、トロンボモジュリン(TM)は多くの器官(肺、肝臓及び腎臓など)の内皮細胞の膜表面に存在する糖タンパク質である。活性化タンパク質C(APC)は、トロンビンにより媒介されるタンパク質C(PC)の裂開(トロンビン共同因子としてTMを必要とする現象)によって生じる(非特許文献2、3)。トロンビンがin vivoでTMと複合体を形成するとき、PCの活性化が1000倍に強化され(非特許文献4)、更にPCが内皮細胞PCレセプタ(ECPCR)と結合しているときには20倍強化されることが報告されている(非特許文献5)。このように形成されるAPCは因子Va及びVIIIaを不活性化することによって抗凝固効果を発揮し、それにより凝固カスケードが制御される。そして最近、APCはPAR−1(Protease Acivated Receptor−1)やEPCR(Endothelial Protein C Receptor)を介して、抗炎症、抗アポトーシス機能、細胞保護効果を発揮することがわかった。すなわち、血管内皮細胞上のTMは、トロンビン(T)・TM・PC・EPCR/PAR−1システムとして循環器内部を、炎症と凝固から守り、聖域化している。
【0008】
また最近、TMがそのN末端にHMGB1を吸着し、中和した後、分解して、細胞外に遊離してくるHMGB1を局所に封じ込め、侵襲反応の全身化を防ぐ活性を持つことが明らかとなった(非特許文献6)。さらに、そのN末端にLPSも吸着することが開示されている(非特許文献7)。
【0009】
以上の背景により、可溶化した遺伝子組み換えトロンボモジュリン(商品名:リコモジュリン)が開発され、本邦でDICの臨床薬として使用されている。この薬剤の効果は高く、多くのDIC患者を救命しつつあるが、更に高い効果を得るためには、投与量を増やさなければならない問題があった。
【0010】
一方、TMを基材に固定した血液浄化装置については、基材にプロテインCを活性化させる生理活性物質が存在した状態で放射線照射され、プロテインC活性化能を持つ改質基材(特許文献3)が開示されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特許第3817808号公報
【特許文献2】国際公開第01/074420号
【特許文献3】特開2006−271809号公報
【非特許文献】
【0012】
【非特許文献1】“Science”,285巻,p.248−251,1999年
【非特許文献2】“J.Biol.Chem.”,257巻,p.7944−7947,1982年
【非特許文献3】“Proc.Natl.Acad.Sci.USA”,78巻,p.2249−2252,1981年
【非特許文献4】“J.Biol.Chem.”,278巻,p.46750−46759,2003年
【非特許文献5】“Esmon,Crit.Care Med.”,32巻,p.S298−301,2004年
【非特許文献6】“J.Clin.Invest.”,115巻,p.1267,2005年
【非特許文献7】“Blood”,112巻,p.3661−3670,2008年
【発明の概要】
【発明が解決しようとする課題】
【0013】
特許文献1及び2に記載された血液浄化法は、単一のメディエーターを標的として、これを除去することをストラテジーとしている。しかしながら、ごく最近の進歩で、ショックの病態は、炎症、凝固、免疫などの各システムが騒乱・不全に陥り、生体諸細胞がアポトーシスに向かっている複雑で、カタストロフィクな病態であること、それは複合したメディエーター類の作用で発症していることが判明しており、これらの因子を網羅的に除去できる血液浄化法や血液浄化装置の開発が必要である。
【0014】
特許文献3に記載された血液浄化装置は、良好な抗血栓性を有するとされているものの、ショックの病態の改善に重要な血液中に存在するHMGB1やトロンビン、LPSの除去に関する記載は全くない。
【0015】
したがって、ショックの病態の血液中に存在する様々なメディエーター類を網羅的に除去する、具体的には、血液中に存在するHMGB1、トロンビン、LPSを効率よく除去するショック治療用血液処理装置はいまだ開示されていなかった。
【0016】
そこで本発明は、血液中に存在する様々なメディエーター類、具体的には、HMGB1、トロンビン、LPSを網羅的に、かつ効率よく除去するショック治療用血液浄化器及びショック治療用血液浄化装置を提供することを目的とする。
【課題を解決するための手段】
【0017】
本発明は、「血液の導入口及び導出口を備えた容器」と、該容器中に収容された、「ヒト・トロンボモジュリンの一部又は全部を含むペプチドが吸着した基材」及び「抗酸化剤」と、を備えるショック治療用血液浄化器であって、前記基材及び抗酸化剤が前記容器に収容された状態で放射線が照射されており、血液を流通させたときに、該血液中に存在するHMGB1、トロンビン及びLPSをそれぞれ少なくとも70%除去する、ショック治療用血液浄化器を提供する。
【0018】
本発明のショック治療用血液浄化器は、上述の構成を有することにより、血液中に存在するHMGB1、トロンビン及びLPSを網羅的に、かつ効率よく除去することができる。
【0019】
上記血液は、ショック状態の生体から取り出したものであることが好ましい。ショック状態の生体では、種々のメディエーター類、特にHMGB1、トロンビン及びLPSが血液中に増加しているため、本発明のショック治療用血液浄化器によって血液中のHMGB1、トロンビン及びLPSを網羅的に除去することによる効果はより一層高いものとなる。
【0020】
上記ショック状態は、急性の末梢循環不全の状態とすることができる。また、上記急性の末梢循環不全は、敗血症性ショック、エンドトキシンショック、心原性ショック、出血性ショック、アナフィラキシーショック及び外傷性ショックからなる群から選択されるものとすることができる。
【0021】
本発明はまた、上記ショック治療用血液浄化器と、被検体から取り出した血液を脱血側回路を通して前記ショック治療用血液浄化器に送液し、前記ショック治療用血液浄化器を通過した血液を返血側回路を通して前記被検体に返血する血液回路と、前記血液回路内の血液を送液させる血液ポンプと、前記血液ポンプを駆動して前記血液回路内の血液の流れを制御する制御部と、を備える、ショック治療用血液浄化装置を提供する。
【0022】
本発明のショック治療用血液浄化装置は、上述の構成を有することから、ショックの病態の血液中に存在する複数のメディエーターを体外循環処理によって効率よく除くことができる。したがって、単一のメディエーターを標的としていた従来法と比較して、重症化したショックにおける救命効果を向上することができる。
【発明の効果】
【0023】
本発明により、血液中に存在する様々なメディエーター類、具体的には、血液中に存在するHMGB1、トロンビン及びLPSを網羅的に、かつ効率よく除去するショック治療用血液浄化器及びショック治療用血液浄化装置の提供が可能となる。
【図面の簡単な説明】
【0024】
【図1】第一の実施形態に係る血液浄化器の模式断面図である。
【図2】第二の実施形態に係る血液浄化器の模式断面図である。
【図3】本発明の実施形態に係る血液浄化装置の概略図である。
【発明を実施するための形態】
【0025】
以下、場合により図面を参照しつつ本発明の好適な実施形態について詳細に説明する。なお、図面中、同一又は相当部分には同一符号を付し、重複する説明は省略する。また、図面の寸法比率は図示の比率に限られるものではない。
【0026】
本発明は以下のような構成を有する;
血液の導入口及び導出口を備えた容器と、
該容器中に収容された、ヒト・トロンボモジュリンの一部又は全部を含むペプチドが吸着した基材、及び抗酸化剤と、を備えるショック治療用血液浄化器であって、
前記基材及び抗酸化剤が前記容器に収容された状態で放射線が照射されており、
血液を流通させたときに、該血液中に存在するHMGB1、トロンビン及びLPSをそれぞれ少なくとも70%除去する、ショック治療用血液浄化器。
【0027】
本発明におけるショックとは、急性の末梢循環不全と定義され、特に微小循環障害により惹起された重要実質臓器の急性機能不全を中核とした疾患概念をいう。基盤となる病態生理は、血圧低下、組織低灌流、組織呼吸失調により、組織や臓器の恒常性が損なわれた病態である。例示すると、敗血症性ショック、エンドトキシンショック、心原性ショック、出血性ショック、アナフィラキシーショック、外傷性ショックなどが挙げられる。
【0028】
本発明の血液浄化器におけるヒト・トロンボモジュリンとしては、例えば、ヒト肺組織から精製したトロンボモジュリンをその一例として挙げることができる。このトロンボモジュリンの取得方法及び精製方法については、例えば、N.L.Esmonらの方法(J.Biol.Chem.,257巻,p.859,1982年)に従って作成したDIP−トロンビン(diisopropylphosphoro−thrombin)を固定化したカラムに、ヒト肺組織から得た細胞抽出物を通液し、カラムに結合した成分を溶出したフラクションを回収し、各フラクションのプロテインC活性化能を指標としてトロンボモジュリンを含むフラクションを得ることができる。また、特開昭64−6219に記載された方法を用いることもできる。
【0029】
さらに、ヒト・トロンボモジュリンとしては、遺伝子工学的手法によって得たものでもよい。例えば、遺伝子データベースに登録されたヒト・トロンボモジュリンの塩基配列に基づいてプローブを作成し、ヒトcDNAライブラリー等のスクリーニングによってヒト・トロンボモジュリン遺伝子を得ることができる。これを本技術分野において汎用されている遺伝子組換え技術により、適切なベクター−宿主系(例えば、プラスミド−大腸菌系)を用いて形質転換し、ヒト・トロンボモジュリン遺伝子を有する組換え体を得ることができる。続いて、この組換え体を適切な条件下で培養することにより、ヒト・トロンボモジュリン遺伝子を発現させ、発現したヒト・トロンボモジュリンタンパク質を適切な方法によって精製することによって得たヒト・トロンボモジュリンを用いることができる。このような遺伝子工学的手法については、Molecular Cloning A Laboratory Manual(J.Smabrookら著,Cold Spring Harbor Laboratory出版)に記載された方法を適宜組合わせて用いることができる。
【0030】
本発明の血液浄化器におけるヒト・トロンボモジュリンとしては、ヒト・トロンボモジュリン分子をそのまま用いてもよいし、ヒト・トロンボモジュリンの構造の一部分の構造を有するペプチド、又は該ペプチドを含む構造を有するペプチドを用いてもよい。なお、ヒト・トロンボモジュリンの構造の一部分の構造を有するペプチドとは、血液中に存在するHMGB1、トロンビン及びLPSに対して分解、結合、吸着、不活性化等の作用をもたらすペプチドを意味する。
【0031】
本発明の血液浄化器における基材の形状は、液相で血液との接触頻度を高くするため、表面積が大きいことが望ましい。例を挙げると、ビーズ状、チップ状、中空糸状、平膜状、糸状、スポンジ状等いずれの形状であっても良い。これらの中でも取扱い性の点でビーズ状、中空糸状、糸状、スポンジ状が好ましく用いられる。また、体液循環時の体液の流通の観点から中空糸状又はビーズ状が最も好ましく用いられる。
【0032】
基材の材質としては、上記の形状に成型でき、血液への溶出量が少なく、血球にダメージを与えにくいものであれば特に制限はなく各種のものを用いることができる。例えば、ポリエステル、ポリオレフィン、ポリアクリロニトリル、ポリアミド、ポリスチレン、ポリアルキル(メタ)アクリレート、ポリ塩化ビニル、ポリクロロプレン、ポリウレタン、ポリビニルアルコール、ポリビニルアセテート、ポリブタジエン、ブタジエン−アクリロニトリル共重合体、スチレン−ブタジエン共重合体、エチレン−ビニルアルコール共重合体、セルロースジアセテート、エチルセルロース等が挙げられる。好ましくはポリスルホン、ポリエーテルスルホンで、特に好ましくはポリスルホンである。
【0033】
本発明の血液浄化器は、前述のヒト・トロンボモジュリンの一部又は全部を含むペプチド(以下、「トロンボモジュリンペプチド」という。)が吸着した基材と、抗酸化剤と、が充填された容器に放射線を照射することにより製造される。例えば、トロンボモジュリンペプチドが吸着した基材を抗酸化剤が充填された容器に収容し、該基材及び抗酸化剤が該容器に収容された状態で、放射線を照射することにより製造される。
【0034】
トロンボモジュリンペプチドが吸着した基材は、トロンボモジュリンペプチドを含む溶液に基材を浸漬するか、又は上記溶液を基材に通液する等により得ることができる。これにより、トロンボモジュリンペプチドが基材表面に物理吸着、化学吸着等したものが得られる。
【0035】
放射線照射によって発生するラジカル反応により、トロンボモジュリンペプチドと基材に化学結合が形成される。このため、トロンボモジュリンペプチドを基材に吸着させただけでも、放射線照射によってトロンボモジュリンペプチドを基材に固定化することができる。つまり、放射線照射によって、滅菌とトロンボモジュリンペプチドの基材への固定化を同時に行うことも可能である。
【0036】
本発明者らは、血液浄化器の製造にあたり、抗酸化剤の存在下でトロンボモジュリンペプチドが吸着した基材に放射線を照射することによって、抗酸化剤の非存在下で放射線を照射した場合に比べて、血液中に存在するHMGB1、トロンビン及びLPSの除去効率が著しく上昇することを見出した。この作用機序は明らかではないが、放射線照射時のラジカル発生及びラジカル反応の進行において、抗酸化剤がラジカルの発生を抑制するか、又は発生したラジカルを消去することによって、ラジカル反応の進行を抑え、基材間又は基材とトロンボモジュリンペプチド間の結合形成が完全には進行せず、半架橋状態となるため、血液中に存在するHMGB1、トロンビン及びLPS等とトロンボモジュリンペプチドとの相互作用が生じ易くなることが一因であると考えられる。
【0037】
本発明の血液浄化器における抗酸化剤とは、酸化防止効果を持った物質のことをいい、放射線照射時に発生する酸素ラジカルによる、基材、容器及びトロンボモジュリンペプチドの酸化劣化を抑制する効果が高くなる利点も得られる。抗酸化剤を例示すると、ピロ亜硫酸ナトリウム、亜硫酸ナトリウム、亜硫酸水素ナトリウム、アセトンソジウムバイサルファイト、ソジウムホルムアルデヒドスルホキシレート、ソジウムハイドロサルファイト、アスコルビン酸が挙げられる。以上例示した中では、ピロ亜硫酸ナトリウム、アセトンソジウムバイサルファイト、ソジウムホルムアルデヒドスルホキシレート、ソジウムハイドロサルファイト、アスコルビン酸が毒性、取扱い性などの点から好ましく、特にピロ亜硫酸ナトリウムが好ましい。
【0038】
抗酸化剤は、酸化劣化を抑制する効果及びラジカル反応の進行を抑える効果の観点から、トロンボモジュリンペプチドを吸着した基材の単位表面積に対して、0.0001〜10000mol/cm2となるように添加することが好ましく、0.001〜1000mol/cm2となるように添加することがより好ましい。
【0039】
抗酸化剤は、抗酸化剤溶液であってもよい。本発明の血液浄化器における容器に抗酸化剤溶液を充填させる方法は、抗酸化剤を適当な溶媒に溶解して容器と接触させる方法、例えば、水又は生理的塩溶液に抗酸化剤を溶解させて容器に充填又は含浸させる方法、グリセリン、アルコール等の溶剤に抗酸化剤を溶かして容器に充填又は含浸させる方法等が用いられる。容器に抗酸化剤溶液が含浸し、酸素により容器が変化を受けるのを抑制できる状態になっていることが必要である。溶液状態にして抗酸化剤を用いる場合、抗酸化剤の濃度は、容器の材質、抗酸化剤の種類及び滅菌の条件によって最適な濃度が決定されるべきであるが、好ましくは0.001質量%から1質量%、より好ましいのは0.005質量%から0.5質量%の濃度である。
【0040】
放射線の種類としては、α線、β線、γ線、X線、紫外線、電子線などが用いられるが、基材への透過性が良いことからγ線が好んで用いられる。
【0041】
放射線の照射線量としては、基材の材質や形状にも依存するが、5kGy以上、多くの基材は15kGy以上の放射線を照射することで、滅菌することができる。また一方で、放射線照射線量が高くなると、トロンボモジュリンペプチドの変性が起こり、100kGyを越える線量を照射すると、活性化能の低下が顕著になる。放射線照射線量は5kGy以上100kGy未満が好ましく、さらには15kGy以上80kGy以下、さらに好ましくは20kGy以上50kGy以下である。なお線量の測定は線量計にて測定することができる。
【0042】
本発明の血液浄化器における容器は、内部に血液を導入するための入口(導入口)と該血液を外部に排出するための出口(導出口)とを備え、トロンボモジュリンペプチドが吸着した基材を収納できるものであれば特に制限はないが、容器の容量は、体外循環に用いる場合10mLから1000mL程度が適当である。本発明においては、血球成分を含む血液を直接血液浄化器に流通させ、浄化する。これにより血球成分に吸着したHMGB1、トロンビン、LPSも除去できるため、好ましい。また、血液浄化器への血液の流通は、臨床上の必要に応じ、あるいは設備の装置状況に応じて、連続的に行っても良いし、また断続的に行っても良い。
【0043】
本発明の血液浄化器は、血液中に存在するHMGB1、トロンビン、LPSを網羅的に、効率よく除去することができることを特徴とする。なお、本明細書において、「除去」とは、血液浄化器を流通する前後の血液において、血液中のメディエーター類の存在そのものが消失することに加え、存在そのものは消失しないが不活性化していることも含むものとする。
【0044】
本発明の血液浄化器による、HMGB1、トロンビン又はLPSの除去率は、それぞれ70%以上である。より好ましくはそれぞれ80%以上、さらに好ましくはそれぞれ90%以上である。なお、「除去率」とは、血液浄化器を流通する前の血液中におけるHMGB1、トロンビン又はLPSの存在量と、血液浄化器を流通した後の血液中におけるHMGB1、トロンビン又はLPSの存在量とから算出される。具体的には、血液浄化器を流通する前の血液中におけるHMGB1、トロンビン又はLPSの存在量に対する、「除去」されたHMGB1、トロンビン又はLPS量の割合を意味する。
【0045】
本発明の血液浄化器は、血液よりHMGB1、トロンビン、LPSを効率よく除去することができることから、本発明の血液浄化器にHMGB1、トロンビン、LPSを含むショック患者の血液を体外循環の方法で流通させることにより、患者の治療を有効に行うことができる。
【0046】
図1は、本発明の第一の実施形態に係る血液浄化器の模式断面図である。血液浄化器100は、容器10の内部に複数のビーズ状基材1が装填されている。ビーズ状基材1の表面には、トロンボモジュリンペプチドが固定されている。容器10の両端部には、血液の導入口及び導出口となる、ヘッダーキャップ41a、41bが設けられている。
【0047】
ヘッダーキャップ41aの血液の導入口より矢印Fの方向から血液浄化器100の内部に流入した血液が、ビーズ状基材1に固定されたトロンボモジュリンペプチドと接することにより、血液中に存在するHMGB1、トロンビン及びLPSは、分解、結合、吸着、不活性化等の作用を受ける。これにより、ヘッダーキャップ41bの血液の導出口から流出した際には血液中からHMGB1、トロンビン及びLPSが除去されている。
【0048】
図2は、本発明の第二の実施形態に係る血液浄化器の模式断面図である。血液浄化器110は、容器20の長手方向に沿って、複数の中空糸状基材2からなる中空糸束が装填されている。当該中空糸束は、封止樹脂30a、30bによって、容器20の両端部に固定されている。中空糸状基材2の内側には、トロンボモジュリンペプチドが固定化されている。
【0049】
中空糸状基材2の端面は開口しており、この開口部から、血液が矢印Fの方向から中空糸状基材2の内部へ流入することができる。そして、中空糸状基材2の内部を通過した血液は、他方の開口部から流出することができる。容器20の両端部には、表面に中空糸状基材2の開口部を有する封止樹脂30a、30bの端面に対向して、血液の導入口及び導出口となる、ヘッダーキャップ40a、40bが設けられている。
【0050】
中空糸状基材2の内部へと導入された血液中に存在するHMGB1、トロンビン及びLPSは、中空糸状基材2の内部でトロンボモジュリンペプチドと接することにより、分解、結合、吸着、不活性化等の作用を受ける。これにより、他方の開口部から流出した際には血液中からHMGB1、トロンビン及びLPSが除去されている。
【0051】
本発明はまた、上述した血液浄化器と、被検体から取り出した血液を脱血側回路を通して前記ショック治療用血液浄化器に送液し、前記ショック治療用血液浄化器を流通した血液を返血側回路を通して前記被検体に返血する血液回路と、前記血液回路内の血液を送液させる血液ポンプと、前記血液ポンプを駆動して前記血液回路内の血液の流れを制御する制御部と、を備える、ショック治療用血液浄化装置に関する。
【0052】
図3は、本発明の一実施形態に係る血液浄化装置の概略図である。血液浄化装置200は、脱血側回路50及び返血側回路51を有する血液回路60と、本発明の血液浄化器120と、血液ポンプ70と、制御部71と、を備えている。
【0053】
血液浄化装置200の制御部71は、血液ポンプ70及び図示しない各種バルブに有線、又は無線によって接続されており、血液ポンプ70を駆動制御、又は各種バルブを開閉制御することで、血液の流量を制御する。
【0054】
次に、血液浄化装置200の作動方法について説明する。血液処理時には、制御部71により血液ポンプ70が制御され、被検体90から採取された血液が所定流量で脱血側回路50から血液浄化器120を流通して返血側回路51に送液される。血液浄化器120を流通するときに、血液中に存在するHMGB1、トロンビン及びLPSが除去される。
【0055】
本発明の血液浄化器は高い効率で血液中に存在するHMGB1、トロンビン及びLPSを除去することができるため、血液を血液浄化器120に1回流通させるだけで充分な除去効果が得られるものであるが、更に除去効率を高めるために、返血側回路51と脱血側回路50とを接続する循環回路を更に備えていてもよい。この循環回路によって、返血側回路51に送液された血液を、再度脱血側回路50に循環させ、再度血液浄化器120に流通させることができる。これにより、血液を血液浄化器120に2回(又は3回以上)流通させることとなり、血液中に存在するHMGB1、トロンビン及びLPSをより高い効率で除去することができる。この場合、循環回路に循環回路内の血液を脱血側回路50に循環させる循環ポンプを備え、制御部71で循環ポンプを駆動制御、及び各種バルブを開閉制御することで、血液の流量及び経路を制御する。
【実施例】
【0056】
以下、本発明を実施例により更に具体的に説明するが本発明の範囲はこれらの実施例に限定されるものではない。
【0057】
〔実施例1〕
(1.ポリスルホン/ポリビニルピロリドン混合中空糸膜充填カラムの作成)
ポリスルホン樹脂(アモコ・エンジニアリング・ポリマーズ社製、P−1700)18重量部、ポリビニルピロリドン(アイ・エス・ピー社製、K−92)4重量部、ジメチルアセトアミド(以下、DMAC)78重量部、からなる均一な紡糸原液を作成した。DMAC濃度54重量%の中空内液とともにスリット幅50μmの環状口金から吐出し、80cm下方に設けた60℃の水中に浸漬し68.5m/分の速度で巻き取った。中空糸膜厚を45μm、内径を185μmに合わせるように紡糸原液、中空内液の吐出量を調製した。9500mmフィラメント巻き取ったところで、ロープを300mmに切断し、束の切断面上方から80℃の熱水シャワーを2時間かけて洗浄することにより膜中の残溶剤を除去した。この膜をさらに87℃の熱風で7時間乾燥することにより含水量が1%未満の中空糸膜を得た。
【0058】
中空糸膜を50本束ね、直径約7mm、長さ5cmのプラスチック管ミニカラムケースに挿入した。中空糸膜の両末端を、中空糸膜中空部を閉塞しないようにウレタン系ポッティング剤で固定し、カラムを作成した。該カラムの中空糸内表面積は75cm2である。中空糸膜ミニカラムの両側に、内径1mm、外径2mm、長さ50cmのシリコーンチューブを接続した。ミニカラムの中空糸膜内側及び外側を注射用蒸留水60mLで1mL/minの流速で洗浄し、さらにリン酸緩衝生理食塩水10mLを1mL/minの流速で洗浄し、ポリスルホン/ポリビニルピロリドン混合中空糸膜充填カラムを作成した。
【0059】
(2.ミニカラムへのトロンボモジュリンペプチドの固定化)
トロンボモジュリンペプチドとして、特開平1−6219号公報の記載に従い、遺伝子工学的手法によって得たヒト・トロンボモジュリンを用いた。1.で作成したポリスルホン/ポリビニルピロリドン混合中空糸膜充填カラムにヒト・トロンボモジュリン200μg/mLを含むリン酸緩衝生理食塩水1mLを1mL/minの速度で流し、ヒト・トロンボモジュリン溶液に置換した。置換後、前記ヒト・トロンボモジュリン溶液2mLを1mL/minの速度で30分間灌流させた。灌流後、回路を外し、モジュール両端に栓をした状態で37℃にて20時間静置し、ヒト・トロンボモジュリンを中空糸内部に吸着させた。吸着後のカラムに回路を取り付け、リン酸緩衝生理食塩水5mLで1mL/minの速度で洗浄した。洗浄後のカラムに抗酸化剤溶液としてピロ亜硫酸ナトリウム600ppm、炭酸ナトリウム300ppmを含む水溶液5mLを1mL/minの速度で流し、抗酸化剤溶液に置換した。置換後、回路を外し、モジュール両端に栓をした状態で照射線量25kGyのγ線を照射し、ポリビニルピロリドン混合中空糸膜にトロンボモジュリンペプチドを固定化した血液浄化器を作成した。
【0060】
(3.血液浄化器の除去能評価)
採血直後の健常人血液6mLにLPSを20pg/mL、HMGB1を50ng/mL、ヘパリン0.8unit/mLになるようにそれぞれ加え、37℃に加温した。2.で作成した血液浄化器に37℃に加温した前記血液3mLを1mL/minの速度で30分間循環した。なお、血液浄化器内及び回路内には、はじめは充填液が充填してあるので、循環開始後の最初の100μLは廃棄した後、循環した。対照として、血液浄化器を使用せず回路のみで同様に血液3mLを1mL/minの速度で30分間循環した。30分循環後の血液に3.8%クエン酸ナトリウム1/10容量を加え、血液凝固反応を抑制し、4℃に冷却後、遠心分離(3000rpm、10min)した。少血小板血漿(Platelet−Poor Plasma;以下、「PPP」という。)を分離した。PPPは測定まで−70℃で凍結して保管した。
【0061】
分離したPPPを用いてHMGB1濃度、トロンビン活性値、LPS濃度を測定し、循環前後の除去率を算出した。HMGB1濃度は、PPPを電気泳動し、酵素標識抗体を用いたウエスタンブロット法によって測定した。トロンビン活性値は、SensoLyte 520 Thrombin Activity Assay Kit *Fluorimetric* (ANASPEC社製)を用いて測定した。LPS濃度は、国際公開第2009/116633号の記載に従い、エンドトキシン散乱測光法(ESP法)を用いて測定した。
HMGB1、トロンビン、LPSの除去率(%)は、以下の式により算出した。
除去率(%)=[(Csham−Ctrue)/Csham]×100
Csham:回路のみを循環した血液中の濃度又は活性値
Ctrue:血液浄化器と回路を循環した血液中の濃度又は活性値
結果は、HMGB1除去率が85%、トロンビン除去率が96%、LPS除去率が90%と効率的な除去が可能であった。
【0062】
〔実施例2〕
抗酸化剤溶液としてピロ亜硫酸ナトリウム600ppm、炭酸ナトリウム300ppmを含む水溶液の代わりにアスコルビン酸2000ppmを含むリン酸緩衝生理食塩水を使用したこと以外は、実施例1と同様な操作で血液浄化器を作成し、除去能を評価した。その結果、HMGB1除去率が92%、トロンビン除去率が95%、LPS除去率が83%と効率的な除去が可能であった。
【0063】
〔比較例1〕
ヒト・トロンボモジュリンを用いないこと以外は、実施例1と同様な操作で血液浄化器を作成し、除去能を評価した。HMGB1除去率が10%、トロンビン除去率が20%、LPS除去率が5%と除去能は低下した。
【0064】
〔比較例2〕
抗酸化剤溶液の代わりにリン酸緩衝生理食塩水を使用したこと以外は、実施例1と同様な操作で血液浄化器を作成し、除去能を評価した。HMGB1除去率が40%、トロンビン除去率が50%、LPS除去率が50%と除去能は低下した。
【符号の説明】
【0065】
1…ビーズ状基材、2…中空糸状基材、10,20…容器、30a,30b…封止樹脂、F…血液の流れ方向、40a,41a,40b,41b…ヘッダーキャップ、50…脱血側回路、51…返血側回路、60…血液回路、70…血液ポンプ、71…制御部、90…被検体、100,110,120…血液浄化器、200…血液浄化装置。
【特許請求の範囲】
【請求項1】
血液の導入口及び導出口を備えた容器と、
該容器中に収容された、ヒト・トロンボモジュリンの一部又は全部を含むペプチドが吸着した基材、及び抗酸化剤と、を備えるショック治療用血液浄化器であって、
前記基材及び抗酸化剤が前記容器に収容された状態で放射線が照射されており、
血液を流通させたときに、該血液中に存在するHMGB1、トロンビン及びLPSをそれぞれ少なくとも70%除去する、ショック治療用血液浄化器。
【請求項2】
前記血液が、ショック状態の生体から取り出したものである、請求項1に記載のショック治療用血液浄化器。
【請求項3】
前記ショック状態が、急性の末梢循環不全の状態である、請求項2に記載のショック治療用血液浄化器。
【請求項4】
前記急性の末梢循環不全が、敗血症性ショック、エンドトキシンショック、心原性ショック、出血性ショック、アナフィラキシーショック及び外傷性ショックからなる群から選択される、請求項3に記載のショック治療用血液浄化器。
【請求項5】
請求項1〜4のいずれか一項に記載のショック治療用血液浄化器と、
被検体から取り出した血液を脱血側回路を通して前記ショック治療用血液浄化器に送液し、前記ショック治療用血液浄化器を通過した血液を返血側回路を通して前記被検体に返血する血液回路と、
前記血液回路内の血液を送液させる血液ポンプと、
前記血液ポンプを駆動して前記血液回路内の血液の流れを制御する制御部と、を備える、ショック治療用血液浄化装置。
【請求項1】
血液の導入口及び導出口を備えた容器と、
該容器中に収容された、ヒト・トロンボモジュリンの一部又は全部を含むペプチドが吸着した基材、及び抗酸化剤と、を備えるショック治療用血液浄化器であって、
前記基材及び抗酸化剤が前記容器に収容された状態で放射線が照射されており、
血液を流通させたときに、該血液中に存在するHMGB1、トロンビン及びLPSをそれぞれ少なくとも70%除去する、ショック治療用血液浄化器。
【請求項2】
前記血液が、ショック状態の生体から取り出したものである、請求項1に記載のショック治療用血液浄化器。
【請求項3】
前記ショック状態が、急性の末梢循環不全の状態である、請求項2に記載のショック治療用血液浄化器。
【請求項4】
前記急性の末梢循環不全が、敗血症性ショック、エンドトキシンショック、心原性ショック、出血性ショック、アナフィラキシーショック及び外傷性ショックからなる群から選択される、請求項3に記載のショック治療用血液浄化器。
【請求項5】
請求項1〜4のいずれか一項に記載のショック治療用血液浄化器と、
被検体から取り出した血液を脱血側回路を通して前記ショック治療用血液浄化器に送液し、前記ショック治療用血液浄化器を通過した血液を返血側回路を通して前記被検体に返血する血液回路と、
前記血液回路内の血液を送液させる血液ポンプと、
前記血液ポンプを駆動して前記血液回路内の血液の流れを制御する制御部と、を備える、ショック治療用血液浄化装置。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−45314(P2012−45314A)
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2010−192523(P2010−192523)
【出願日】平成22年8月30日(2010.8.30)
【出願人】(505115854)株式会社ビーエムティーハイブリッド (6)
【Fターム(参考)】
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成22年8月30日(2010.8.30)
【出願人】(505115854)株式会社ビーエムティーハイブリッド (6)
【Fターム(参考)】
[ Back to top ]

