シルクタンパク質コーティング
本発明は、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法に関する。本発明は更に、上記方法により入手可能なコーティングされた不活性材料又は自然発生的な材料に、及びその使用に関する。本発明は、上記コーティングされた材料を含む製品にも関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法に関する。本発明は更に、上記方法により入手可能なコーティングされた不活性材料又は自然発生的な材料に、及びその使用に関する。本発明は、上記コーティングされた材料を含む製品にも関する。
【背景技術】
【0002】
スパイダーシルクは、特別な物理特性を示すタンパク質ポリマーである。様々なタイプのスパイダーシルクの中でも、ドラグラインが最も広く研究されている。ドラグラインシルクは円網を張るクモにより、それらの網の縦糸及び横糸を構築するのに、並びに命綱として利用されている。これらの目的のために、高い引張強度及び弾性が要求される。かかる特性の組み合わせにより、ほとんどの他の既知の材料よりも大きい靭性が得られる。例えばニワオニグモ(Araneus diadematus)のドラグラインシルクは、鋼(1.3GPa)及びアラミド繊維の引張強度とほぼ同等の1.9GPaと高い引張強度を示す。
【0003】
大腸菌におけるスパイダーシルクタンパク質の組換えによる生成のための系が過去に開発されている(特許文献1、特許文献2)。例として、特許文献1(特許文献3に対する優先権を主張している)に言及される。この発現系では、単一構成要素(=モジュール)を自由に変えることができ、そのため具体的な事例の要件に適合させることができる。このタイプのモジュールは、非特許文献1にも開示される。更なるモジュールは特許文献4に記載される。スパイダーシルクタンパク質を糸に加工することができることは自然と知られている。クモは様々なタイプのタンパク質を用いて、シルク糸及びクモの巣を形成するエキスパートである。スパイダーシルクタンパク質を糸へと変形させる技術的プロセスが、例えば特許文献5で説明されている。
【0004】
合成材料又は無機材料、例えば合成繊維又は無機繊維は、何十年にわたり産業的に重要なものとなっている。これらの中でも、例えばアラミド糸ケブラーは、等重量ベースで鋼の5倍の強度があり、同時に軽量である。また該アラミド糸ケブラーは、低い導電率を示し、非常に高い耐薬品性を有する、すなわち不活性である。一方で、この条件は例えば防護服に望ましい。しかしながら他方では、アラミド糸は製造後に改良を加えるのが非常に困難である。効率良くアラミド糸を染色する、又はアラミド糸の表面に分子を接着させるのはほぼ不可能である。またアラミド糸は可湿性を僅かしか有しない。このことは、他の不活性な合成材料又は無機材料でも当てはまる、すなわち該他の不活性な合成材料又は無機材料は、高い耐薬品性を有し、可湿性を僅かしか有さず、穏やかな条件下で、すなわち低温下でかつ毒性溶媒を用いずに重合後に改良を加えることができない。一般的なコーティングは不活性な合成材料又は無機材料、例えば不活性な合成繊維又は無機繊維の表面に十分に密着せず、また一般的なコーティングはあまり耐久性を有さず、又は厳しい条件、すなわち高温及び/若しくは毒性溶媒下で塗布しなければならない。
【0005】
このため、好ましくは低温下でかつ毒性溶媒を用いずに製造後に不活性な合成材料又は無機材料、例えば不活性な合成糸又は無機糸に改良を加える新規の好適な方法が必要とされている。
【0006】
本発明者らは驚くべきことに、コーティング材としてのシルクポリペプチドの使用が最も穏やかな条件下での効率性の高いコーティングを提供し、特定用途に合わせたシルクでコーティングされた不活性な合成材料又は無機材料の製造を可能にすることを見出している。今日までは、(たとえ可能であったとしても)プラズマ処理のような非常に厳しい条件が不活性な合成材料又は無機材料、例えば不活性な合成繊維又は無機繊維に変更を加えるのに必要であった。またシルクポリペプチドを用いることで利用可能となる不活性な合成材料又は無機材料をコーティングする方法は存在せず、より重要なことには、これまで完全に不可能であると思われてきたために、既存の不活性な合成繊維又は無機繊維を純粋なシルクの層でコーティングすることについて考える人はいなかった。
【0007】
本発明のコーティングにより、穏やかな条件下で、すなわち低温下でかつ毒性溶媒を用いずに、分子を不活性な合成材料又は無機材料に接着させることが可能になる。例えば医療技術では、医薬品等の作用物質を非破壊条件下でシルクに覆われた不活性材料に効率的に連結させることができる。
【0008】
加えて、不活性な合成材料又は無機材料は幾つかの制限を示す。ほとんどの不活性な合成材料又は無機材料、例えばアラミド繊維又は炭素繊維等の不活性な合成繊維は、例えば昆虫シルク等の天然繊維と比較すると表面の感触が望ましくない。これは、ほとんどの不活性な合成材料又は無機材料がザラザラしており(harsh)、粗く脆弱であり、そのため触り心地が良くないことを意味する。他方で、昆虫シルク繊維は不活性な合成繊維又は無機繊維の特質を共有しておらず、はるかに高価であることが多い。
【0009】
したがって、改善された表面の感触、すなわち改善された触感を有する新規の不活性な合成材料又は無機材料が必要とされている。
【0010】
本発明者らは驚くべきことに、シルクでコーティングされた不活性な合成材料又は無機材料、例えばシルクでコーティングされたアラミド繊維又は炭素繊維は、不活性な合成材料又は無機材料の利点と、天然材料の利点とを兼ね揃えることを見出している。シルクでコーティングされた不活性な合成材料又は無機材料は改善された表面の感触(触感)を有し、このことがこれらの材料の触り心地をより良くしている。この効果はシルク表面によりもたらされる光沢により達成され、該シルク表面はアラミド繊維の無光沢の外観、又は炭素繊維の黒色の表面よりも魅力的である。例として、ケブラー布は粗く不快な表面の感触により皮膚の付近での又は皮膚での適用にとって最適レベルに到達しない。しかしながらシルクでコーティングされたケブラー布は快適である。
【0011】
また、産業は、新規の大幅に改善された物理的、化学的及び生物学的な特性及び機能性を示すように、綿又は羊毛等の自然発生的な材料を改良しようと常に試みている。さらに、繊維産業では、綿又は羊毛等の自然発生的な材料に、通気性及び着用の快適性を保持しながら、改善された強度、弾性、曲げ剛性及び/又は運動に対する抵抗性を与えることが望まれる。
【0012】
本発明者らは驚くべきことに、シルクポリペプチドの使用により、上述の所望の特性を有するコーティングされた自然発生的な材料の製造を可能にする効率性の高いコーティング反応がもたらされることを見出している。
【0013】
シルクポリペプチドを用いる本発明のコーティング反応により、分子を自然発生的な材料に効率的に接着させ、具体的な用途に合わせた材料、例えばコーティングされた繊維製品、衣類、並びにUV遮断性、抗微生物性及び自浄性を与える活性の高い表面を有する履物用の繊維製品を製造することも可能になる。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】国際公開第2006/008163号
【特許文献2】国際公開第2006/002827号
【特許文献3】米国仮出願第60/590,196号
【特許文献4】国際公開第2007/025719号
【特許文献5】国際公開第2007/031301号
【非特許文献】
【0015】
【非特許文献1】Hummerich, D., Helsen, C.W., Oschmann, J., Rudolph, R. &Scheibel, T. (2004): "Primarystructure elements of dragline silks and their contribution to proteinsolubility and assembly, Biochemistry 43, 13604-13612"
【発明の概要】
【0016】
第1の態様では、本発明は、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法であって、
i)少なくとも2つの同一の反復単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
ii)不活性材料又は自然発生的な材料上に該溶液を塗布することにより該不活性材料又は該自然発生的な材料を該シルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含む、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法を提供する。
【0017】
第2の態様では、本発明は、第1の態様の方法により入手可能なコーティングされた不活性材料又は自然発生的な材料を提供する。
【0018】
第3の態様では、本発明は、第2の態様のコーティングされた材料を含む製品を提供する。
【0019】
第4の態様では、本発明は、第2の態様のコーティングされた不活性材料又は自然発生的な材料の使用に関する。
【0020】
第5の態様では、本発明は、不活性材料を染色するためのシルクポリペプチドの使用に関する。この発明の概要は必ずしも本発明の特徴を全て記載しているわけではない。
【0021】
本発明を以下で詳細に説明する前に、本発明は本明細書に記載の特定の方法論、プロトコル及び試薬に限定されない(なぜなら、これらの方法論、プロトコル及び試薬は変化し得るものであるためである)ことを理解するべきである。本明細書で用いられる専門用語は特定の実施の形態を説明するためのものにすぎず、本発明の範囲を限定することは意図されず、該範囲は添付の特許請求の範囲でのみ限定されることも理解すべきである。本明細書で他に特に規定されない限り、本明細書で用いられる技術用語及び科学用語は全て、当業者が一般的に理解するものと同じ意味を有する。
【0022】
好ましくは、本明細書で用いられる用語は、"A multilingual glossary ofbiotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W, Nagel, B. and Kolbl, H.編(1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland)で記載されるように定義される。
【0023】
幾つかの文献が本明細書の本文全体を通して引用されている。本明細書で引用される文献(全ての特許、特許出願、科学刊行物、製造業者の仕様書、取扱説明書、GenBankアクセッション番号配列寄託書等を含む)の各々が、上記又は下記に関わらず、その全体が参照により本明細書に援用される。本発明が先行発明のためにかかる開示に先行する権利がないことの承認として解釈されるものは本明細書には存在しない。
【0024】
以下で本発明の要素を説明する。これらの要素を特定の実施の形態とともに挙げるが、付加的な実施の形態を作成するために任意の様式で及び任意の数で該要素を組み合わせることができることを理解すべきである。様々に記載された実施例及び好ましい実施の形態は、本発明を明示的に記載された実施の形態のみに限定するものとは解釈されるべきではない。本記載は明示的に記載された実施の形態を任意の数の開示された及び/又は好ましい要素と組み合わせる実施の形態を支持及び包含するものと理解されるべきである。さらに、本願において記載されたあらゆる要素の任意の並べ替え及び組み合わせは、文脈上他の意味を示していない限り、本願の記載により開示されているとみなすものとする。
【0025】
本明細書及び添付の特許請求の範囲を通じて、文脈上他の意味に解する必要がある場合を除き、「含む(comprise)」という言葉、及びその変化形(variations such as "comprises"and "comprising")は、記載の整数若しくは工程、又は整数若しくは工程の群の包含の意図はあるが、任意の他の整数若しくは工程、又は整数若しくは工程の群の排除の意図はないと理解される。
【0026】
本明細書及び添付の特許請求の範囲に使用される場合、単数形(the singular forms "a","an", and "the")は、他に文脈上明確に示されていない限り複数の対象を含む。
【0027】
2つ以上のポリペプチドにおける残基は、該残基がポリペプチド構造において類似の位置を占める場合、互いに「対応する」といわれる。2つ以上のポリペプチドにおける類似の位置は、アミノ酸配列又は構造類似性に基づきポリペプチド配列をアラインメントすることにより決定することができることが当該技術分野で既知である。かかるアラインメントツールは当業者にとって既知であり、例えばワールドワイドウェブ上で入手することができる(例えば、標準的な設定、好ましくはAlignでは、EMBOSS:needle、行列:Blosum62、ギャップ開始(Gap Open)10.0、ギャップ伸長(Gap Extend)0.5を用いるClustalW(www.ebi.ac.uk/clustalw)又はAlign(http://www.ebi.ac.uk/emboss/align/index.html))。
【0028】
本発明との関連では、「不活性材料」という用語は、高い耐薬品性を有し、僅かに可湿性であるか、若しくは可湿性ではなく、及び/又は穏やかな条件下で、すなわち低温下でかつ毒性溶媒を用いずに重合後に改良を加えることができない材料を表す。
【0029】
「合成材料」という用語は、本発明との関連で使用される場合、自然において発生するものに対して、人間が製造する又はそうでなければ作り出す材料を表す。「合成」という言葉は、本発明との関連では、人工的に組み立てられることも意味する。
【0030】
「無機材料」という用語は、本発明との関連で使用される場合、主要素として炭化水素(カーボネート、シアニド及びシアネートを除く)を含有しない材料、つまり植物又は動物以外の、すなわち生体起源ではないものを表す。
【0031】
「自然発生的な材料」という用語は、本発明との関連で使用される場合、自然に存在する材料を表すが、該自然発生的な材料は改良を加えることが材料のポリマー骨格を著しく変えない限り、例えば漂白、洗浄、伸張、回転等により改良を加え、更には処理することができる。
【0032】
本発明との関連では、「コーティング」という用語は、コーティング対象の不活性材料又は自然発生的な材料に塗布される被覆を表す。好ましくは、上記「コーティング」は不活性材料又は自然発生的な材料を完全に覆う又は取り囲む。「コーティング」は1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さを有するのが好ましい。
【0033】
他に示されていない限り、「ポリペプチド」及び「タンパク質」という用語は、本明細書で区別なく使用され、長さ又は翻訳後修飾に関わらず、アミノ酸の任意のペプチド結合した鎖を意味する。
【0034】
本発明との関連では、「シルクポリペプチド」という用語は、組換え(例えば微生物、昆虫、植物又は哺乳動物の)発現系(すなわちその自然環境から切り離された系)で発現されるシルクポリペプチド若しくはシルクタンパク質(組換えシルクポリペプチド又は組換えシルクタンパク質)、又は天然供給源(例えばクモ、カイコ、イガイ又はハエの幼虫)から採取されるシルクポリペプチド又はタンパク質を表す(他に示されていない限り、これら2つの用語は本明細書で使用される場合、区別されないことに留意する)。好ましくは、「シルクポリペプチド」は単離又は精製される。特に、「精製シルクポリペプチド」又は「単離シルクポリペプチド」は該タンパク質が単離又は誘導される細胞源又は組織源由来の細胞材料又は他の夾雑タンパク質を含まない又は実質的に含まない。「細胞材料を実質的に含まない」シルクポリペプチドという語句は、組換えによる産生の元となる細胞の細胞成分から切り離されたシルクポリペプチドの調製物を含む。このため、細胞材料を実質的に含まないシルクポリペプチドは、約30%、20%、10%、5%又は1%(乾燥重量により)未満の夾雑タンパク質を有するシルクポリペプチドの調製物を含む。
【0035】
「シルクポリペプチド」は本発明との関連で使用される場合、少なくとも50%、60%、65%、70%、75%、80%、85%、90%、好ましくは少なくとも95%、最も好ましくは100%の1つの同一の反復単位の多重コピー(例えばA2、Q6又はC16(ここで2、6又は16は反復単位の数を表す))、又は2つ以上の異なる反復単位の多重コピー(例えば(AQ)24又は(AQ)12C16)を含む又はこれからなるアミノ酸配列を有するポリペプチドを更に表す。シルクポリペプチドは上記タンパク質の検出又は精製を容易にする人工タグ(例えばT7タグ)を付加することにより更に改変することができる。
【0036】
「反復単位」及び「繰り返し単位」という用語は本発明との関連では区別なく使用され得る。
【0037】
本発明との関連では、「シルクポリペプチド」という用語は、自然発生的なシルクポリペプチドのアミノ酸配列の同一コピー又は自然発生的なシルクポリペプチドのアミノ酸配列の変異体の同一コピー又は両方の組み合わせを含む又はこれからなる少なくとも2つの同一の反復単位を含む又はこれからなるシルクポリペプチドも表す。
【0038】
本発明との関連では、「反復単位」は、アミノ酸配列において、自然発生的なシルクポリペプチド(例えばMaSpI、ADF−3、ADF−4又はFlag)内で反復して発生する少なくとも1つのペプチドモチーフ(例えばAAAAAA(配列番号13)又はGPGQQ(配列番号4))を含む若しくはこれからなる領域(すなわち同一のアミノ酸配列)、又はそれと実質的に類似のアミノ酸配列(すなわち変動アミノ酸配列)に対応する領域を表す。この点で、「実質的に類似の」は、好ましくはそれぞれの参照となる自然発生的なアミノ酸配列の全長にわたる少なくとも50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は更には99.9%のアミノ酸同一性の程度を意味する。自然発生的なシルクポリペプチド内の対応するアミノ酸配列と「実質的に類似の」アミノ酸配列を有する「反復単位」(すなわち野生型反復単位)はその機能特性に関しても類似している。例えば「実質的に類似の反復単位」を含むシルクポリペプチドは依然としてケブラー、羊毛等の合成材料又は自然発生的な材料上にコーティングを形成する能力を有する。好ましくは、「実質的に類似の反復単位」を含むシルクポリペプチドは、各参照(野生型)反復単位を含むシルクポリペプチドを用いて形成することができるのと同様に、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さのコーティングを形成することが可能である。「実質的に類似の反復単位」を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)反復単位を含むシルクポリペプチドで作られたコーティングと比較して類似の(similar)表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。「実質的に類似の反復単位」を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)反復単位を含むシルクポリペプチドで作られたコーティングと類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いて、コーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0039】
自然発生的なシルクポリペプチドのアミノ酸配列と「同一の」アミノ酸配列を有する「反復単位」は例えば、MaSp I(配列番号43)、MaSp II(配列番号44)、ADF−3(配列番号1)及び/又はADF−4(配列番号2)の1つ又は複数のペプチドモチーフに対応するシルクポリペプチドの一部であり得る。自然発生的なシルクポリペプチドのアミノ酸配列と「実質的に類似の」アミノ酸配列を有する「反復単位」は例えば、MaSpI(配列番号43)、MaSpII(配列番号44)、ADF−3(配列番号1)及び/又はADF−4(配列番号2)の1つ又は複数のペプチドモチーフに対応するが、特定のアミノ酸位置に1つ又は複数のアミノ酸置換を有するシルクポリペプチドの一部であり得る。
【0040】
「反復単位」は、一般的に自然発生的なシルクポリペプチドのカルボキシル末端に存在すると考えられている非反復的な親水性アミノ酸ドメインを含まない。
【0041】
本発明による「反復単位」は、3個〜200個又は5個〜150個のアミノ酸長、好ましくは10個〜100個又は15個〜80個のアミノ酸長、より好ましくは18個〜60個又は20個〜40個のアミノ酸長のアミノ酸配列を更に表す。例えば、本発明による反復単位は、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個、80個、81個、82個、83個、84個、85個、86個、87個、88個、89個、90個、91個、92個、93個、94個、95個、96個、97個、98個、99個、100個、105個、110個、115個、120個、125個、130個、135個、140個、145個、150個、155個、160個、165個、170個、175個、180個、185個、190個、195個又は200個のアミノ酸長を有し得る。最も好ましくは、本発明による反復単位は、3個、4個、5個、6個、7個、8個、9個、10個、12個、15個、18個、20個、24個、27個、28個、30個、34個、35個又は39個のアミノ酸からなる。
【0042】
第1の態様では、本発明は、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法であって、
i)少なくとも2つの同一の反復単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
ii)不活性材料又は自然発生的な材料上に該溶液を塗布することにより該不活性材料又は該自然発生的な材料を該シルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含む、これから本質的になる、又はこれからなる、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法を提供する。
【0043】
本発明者らは驚くべきことに、シルクポリペプチドが、厳しい反応条件(すなわち高温の適用及び/又は毒性溶媒の使用)を用いることなく、穏やかな反応条件(すなわち低温及び毒性溶媒の不使用)を用いることにより、合成不活性材料又は無機不活性材料(例えばケブラー等のポリアラミド、ポリテトラフルオロエチレン(テフロン登録商標)又は炭素)等の既存の不活性材料に安定して付着することを見出している。上述の方法によるシルクポリペプチドでコーティングされた不活性材料は、コーティングされていない不活性材料と比較して改善された表面の感触(すなわち改善された触感及び/又は平滑表面)を有し、このことが上記材料の人による触り心地をよくしていることも本発明者らにとっては驚くべきことであった。本発明者らは更に驚くべきことに、上述の方法によるシルクポリペプチドでコーティングされた自然発生的な材料が、通気性及び着用の快適性を保持しながら、改善された強度、弾性、曲げ剛性、改善された表面の感触(すなわち改善された触感)及び/又は運動に対する抵抗性を有することを見出している。
【0044】
好ましくは、本発明の方法ではディップコーティング、スプレーコーティング及び/又はパディングを用いて該溶液を塗布する。
【0045】
「ディップコーティング」は、(i)不活性材料又は自然発生的な材料を、コーティング材として少なくとも1つのシルクポリペプチド溶液の入ったタンクに浸漬し、(ii)少なくとも1つのシルクポリペプチドの入ったタンク内で、例えば0.1秒〜10分の期間、不活性材料又は自然発生的な材料をインキュベートし、(iii)コーティングされた不活性材料又は自然発生的な材料を溶液から取り出し、(iv)タンクを排水することを意味する。それから、コーティングされた不活性材料又は自然発生的な材料を、(v)例えば加熱チャンバ、放射又はファンを用いて、強制乾燥、ベーキングにより(室温で又は高温で)乾燥することができる。ディップコーティングにより、例えばスピンコーティング手法と同様に薄膜でコーティングされた不活性材料又は自然発生的な材料が作り出される。スピンコーティングは均一な薄膜を不活性材料又は自然発生的な材料に塗布するのに使用される手法である。要するに、過剰量の溶液を上記材料上に配置し、それから遠心力によりシルクポリペプチドを展開させるために、該材料を一定速度、好ましくは1m/分〜10m/秒で回転させる。スピンコーティングに用いられる機械はスピンコーター、又は単にスピナーと呼ばれる。ディップコーティングの方法は実施例Vで例示されるとともに、図1で説明される。
【0046】
「スプレーコーティング」は、(i)少なくとも1つのシルクポリペプチドを含む溶液をスプレー缶又は噴霧装置に移し、(ii)不活性材料又は自然発生的な材料上に少なくとも1つのシルクポリペプチドを含む溶液を均一に分配させ、(iii)例えば加熱チャンバ、放射又はファンを用いて、強制乾燥、ベーキングによりコーティングを(室温で又は高温で)乾燥することを意味する。スプレーコーティングの方法は実施例VIで記載されるとともに、図1で説明される。
【0047】
「パディング」は、(i)不活性材料又は自然発生的な材料を、コーティング材として少なくとも1つのシルクポリペプチドを含有する溶液に浸漬し又は漬け込み、(ii)少なくとも1つのシルクポリペプチドを有する溶液中で、例えば0.1秒〜10分の期間、不活性材料又は自然発生的な材料をインキュベートし、(iii)コーティングされた不活性材料又は自然発生的な材料を溶液から取り出し、(iv)コーティングされた不活性材料又は自然発生的な材料を1対のローラーに通し、余分なシルクポリペプチド(溶液)を搾り出すことを意味する。それから、コーティングされた不活性材料又は自然発生的な材料を、(v)例えば加熱チャンバ、放射又はファンを用いて、強制乾燥、ベーキングにより(室温で又は高温で)乾燥することができる。
【0048】
本発明の方法に使用されるシルクポリペプチドは好ましくは、6個〜1500個のアミノ酸、又は200個〜1300個のアミノ酸、最も好ましくは250個〜1200個のアミノ酸、又は500個〜1000個のアミノ酸からなる。
【0049】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位、又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位を含む、本質的にこれからなる又はこれからなる。例えば、本発明の方法に使用されるシルクポリペプチドは、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位を含み得る又はこれからなり得る。最も好ましくは、シルクポリペプチドは、4個、8個、12個、16個、24個、32個又は48個の反復単位を含む。上述のように、本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位である。このため、本発明の方法に使用されるシルクポリペプチドは、1つの同一の反復単位の多重コピー(例えばA2又はC16(ここで2又は6は反復単位の数を表す))、又は2つ以上の異なる反復単位の多重コピー(例えば(AQ)24又は(QAQ)8)を含み得る。例えば、本発明の方法に使用されるシルクポリペプチドに含まれ得る80個の反復単位のうち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個が、同一の反復単位であり得る。
【0050】
本発明の方法に使用されるシルクポリペプチドは、当業者に既知の任意のシルクポリペプチドのアミノ酸配列を含み得る又はこれからなり得る。本発明の方法に使用されるシルクポリペプチドは、節足動物シルクポリペプチド、好ましくはスパイダーシルクポリペプチド、又は昆虫シルクポリペプチドのアミノ酸配列を含む又はこれからなるのが好ましい。また本発明の方法に使用されるシルクポリペプチドは、イガイシルクポリペプチドのアミノ酸配列を含み得る又はこれからなり得る。
【0051】
スパイダーシルクポリペプチドは、大瓶状腺(major ampullate gland)ポリペプチド(MaSp)、例えばドラグラインスパイダーシルクポリペプチド、小瓶状腺(minor ampullate gland)ポリペプチド(MiSp)、鞭毛状ポリペプチド、凝集スパイダーシルクポリペプチド、房状スパイダーシルクポリペプチド、又は梨状スパイダーシルクポリペプチドのアミノ酸配列を含む又はこれからなることが好ましい。最も好ましくは、スパイダーシルクポリペプチドは、ドラグラインスパイダーシルクポリペプチド又は鞭毛状スパイダーシルクポリペプチドのアミノ酸配列を含む又はこれからなる。概してコガネグモ科及びコガネグモ上科(Araneoids)の円網を張るクモのドラグラインポリペプチド又は鞭毛状ポリペプチドのドラグラインポリペプチド又は鞭毛状ポリペプチドのアミノ酸配列を選択するのが好ましい。
【0052】
昆虫のシルクポリペプチドは、鱗翅目の昆虫のシルクポリペプチドのアミノ酸配列を含む又はこれからなることが好ましい。より好ましくは、昆虫のシルクポリペプチドは、カイコガ科の、最も好ましくはカイコのシルクポリペプチドのアミノ酸配列を含む又はこれからなる。
【0053】
好ましくは、上述のシルクポリペプチドは組換えにより生成される、すなわち組換え型のシルクポリペプチドである。例えば本発明の方法に使用されるシルクポリペプチドは組換え型のスパイダーシルクポリペプチド(ドラグラインスパイダーシルクポリペプチド若しくは鞭毛状スパイダーシルクポリペプチド等)、組換え型の昆虫シルクポリペプチド、又は組換え型のイガイシルクポリペプチドである。
【0054】
本発明との関連では、「溶液」という用語は、シルクポリペプチドと溶媒とを含有し、コーティングに適した任意の液体混合物を意味する。
【0055】
本発明の方法で提供される溶液は、少なくとも一種類のシルクポリペプチドを含む。好ましくは、本発明の方法で提供される溶液は、2種類、3種類、4種類、5種類、6種類、7種類、8種類、9種類又は10種類の異なるシルクポリペプチド、最も好ましくは2種類の異なるシルクポリペプチドを含む。例えば、該溶液はそのアミノ酸配列が互いに異なる2種類のドラグラインスパイダーシルクポリペプチドを含むことができる。本発明の方法で提供される溶液は、その天然起源が互いに異なるドラグラインスパイダーシルクポリペプチド及び鞭毛状スパイダーシルクポリペプチドも含むことができる。ドラグラインスパイダーシルクポリペプチドは大瓶状腺由来であり、鞭毛状ポリペプチドは鞭状腺由来である。
【0056】
本発明の方法に使用されるシルクポリペプチド反復単位は、当業者に既知の自然発生的なシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる任意の領域のアミノ酸配列を含み得る又はこれからなり得る。好ましくは、本発明の方法に使用されるシルクポリペプチドの反復単位は、節足動物シルクポリペプチド内で、より好ましくはスパイダーシルクポリペプチド又は昆虫シルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなる。また本発明の方法に使用されるシルクポリペプチドの反復単位は、イガイシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含み得る又はこれからなり得る。
【0057】
スパイダーシルクの反復単位は、自然発生的な大瓶状腺ポリペプチド(MaSp)、例えばドラグラインスパイダーシルクポリペプチド、小瓶状腺ポリペプチド(MiSp)、鞭毛状ポリペプチド、凝集スパイダーシルクポリペプチド、房状スパイダーシルクポリペプチド、又は梨状スパイダーシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなるのが好ましい。最も好ましくは、反復単位は自然発生的なドラグラインスパイダーシルクポリペプチド又は鞭毛状スパイダーシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなる。
【0058】
昆虫シルクの反復単位は、鱗翅目の昆虫の自然発生的なシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなるのが好ましい。より好ましくは、昆虫シルクの反復単位は、カイコガ科の昆虫、最も好ましくはカイコガ(Bombyx mori)の自然発生的な昆虫シルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなる。
【0059】
「コンセンサス配列」という用語は本発明との関連で使用する場合、或る特定の位置における発生頻度が高いアミノ酸(例えば「G」)を含有し、更に決定されていない他のアミノ酸をプレースホルダー「X」に置き換えたアミノ酸配列を表す。
【0060】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、各々が、
i)GPGXX(配列番号3)(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してA、S、G、Y、P及びQから選択される任意のアミノ酸である)、
ii)GGX(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してY、P、R、S、A、T、N及びQから選択され、より好ましくはそれぞれの場合で独立してY、P及びQから選択される任意のアミノ酸である)、
iii)Ax(ここでxは5〜10の整数である)
からなる群から選択されるコンセンサス配列を少なくとも1つ、好ましくは1つ含む、少なくとも2つの同一の反復単位を含む、これから本質的になる、又はこれからなる。
【0061】
本発明の方法に使用されるシルクポリペプチドが、各々がGGRPSDTYG(配列番号18)及びGGRPSSSYG(配列番号19)からなる群から選択されるアミノ酸配列を少なくとも1つ、好ましくは1つ含む少なくとも2つの同一の反復単位を含む、又はこれからなることも好ましい。
【0062】
反復(ペプチド)モチーフGPGXX(配列番号3)及びGGX、すなわち高グリシンモチーフは、シルクポリペプチドに、このため上記モチーフを含有するシルクタンパク質から形成される糸に柔軟性を与える。詳細には、反復GPGXX(配列番号3)モチーフはβ−ターンらせん構造を形成し、シルクポリペプチドに弾性を付与する。大瓶状腺シルク及び鞭毛状シルクは両方ともGPGXX(配列番号3)モチーフを有する。反復GGXモチーフは1つのターン当たり3つのアミノ酸を有するヘリックス構造に関連し、ほとんどのスパイダーシルクで見られる。GGXモチーフはシルクに付加的な弾性を与えることができる。反復ポリアラニンAx(ペプチド)モチーフはシルクポリペプチドに強度を与える結晶性β−シート構造を形成する(国際公開第03/057727号)。GGRPSDTYG(配列番号18)及びGGRPSSSYG(配列番号19)(ペプチド)モチーフは、レジリン(国際公開第08/155304号)から選択されている。レジリンはほとんどの節足動物(節足動物門)で見られる弾性タンパク質である。レジリンは角皮の特定領域に位置しており、低剛性及び高強度を与える(Elvin et al., Nature(437): 999-1002, 2005)。
【0063】
このため本発明の好ましい実施の形態では、シルクポリペプチドは、各々がGPGAS(配列番号5)、GPGSG(配列番号6)、GPGGY(配列番号7)、GPGGP(配列番号8)、GPGGA(配列番号9)、GPGQQ(配列番号4)、GPGGG(配列番号10)、GPGQG(配列番号40)及びGPGGS(配列番号11)からなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ又は9つ)、好ましくは1つ含む反復単位を含む、又はこれからなる。本発明の別の好ましい実施の形態では、シルクポリペプチドは、各々がGGY、GGP、GGA、GGR、GGS、GGT、GGN及びGGQからなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1つ、2つ、3つ、4つ、5つ、8つ、7つ又は8つ)、好ましくは1つ含む反復単位を含む、又はこれからなる。本発明の更に好ましい実施の形態では、シルクポリペプチドは、各々がAAAAA(配列番号12)、AAAAAA(配列番号13)、AAAAAAA(配列番号14)、AAAAAAAA(配列番号15)、AAAAAAAAA(配列番号16)及びAAAAAAAAAA(配列番号17)からなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1つ、2つ、3つ、4つ、5つ又は6つ)、好ましくは1つ含む反復単位を含む、又はこれからなる。
【0064】
本発明の別の好ましい実施の形態では、シルクポリペプチドは、各々がGPGAS(配列番号5)、GPGSG(配列番号6)、GPGGY(配列番号7)、GPGGP(配列番号8)、GPGGA(配列番号9)、GPGQQ(配列番号4)、GPGGG(配列番号10)、GPGQG(配列番号40)、GPGGS(配列番号11)、GGY、GGP、GGA、GGR、GGS、GGT、GGN、GGQ、AAAAA(配列番号12)、AAAAAA(配列番号13)、AAAAAAA(配列番号14)、AAAAAAAA(配列番号15)、AAAAAAAAA(配列番号16)、AAAAAAAAAA(配列番号17)、GGRPSDTYG(配列番号18)、及びGGRPSSSYG(配列番号19)からなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個又は25個)、好ましくは1つ含む反復単位を含む、又はこれからなる。
【0065】
最も好ましくは、本発明の方法に使用されるシルクポリペプチドは、
(i)アミノ酸配列として、好ましくはこの順番でGPGAS(配列番号5)、AAAAAA(配列番号13)、GGY及びGPGSG(配列番号6)、
(ii)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGGY(配列番号7)、GPGGY(配列番号7)及びGPGGP(配列番号8)、
(iii)アミノ酸配列として、GPGQQ(配列番号4)、GPGQQ(配列番号4)、GPGQQ(配列番号4)及びGPGQQ(配列番号4)、
(iv)アミノ酸配列として、好ましくはこの順番でGPGGA(配列番号9)、GGP、GPGGA(配列番号9)、GGP、GPGGA(配列番号9)及びGGP、
(v)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGQG(配列番号40)及びGGR、
(vi)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGGG(配列番号10)、GGR、GGN及びGGR、
(vii)アミノ酸配列として、好ましくはこの順番でGGA、GGA、GGA、GGS、GGA及びGGS、並びに/又は
(viii)アミノ酸配列として、好ましくはこの順番でGPGGA(配列番号9)、GPGGY(配列番号7)、GPGGS(配列番号11)、GPGGY(配列番号7)、GPGGS(配列番号11)及びGPGGY(配列番号7)
を含むか又はこれからなる反復単位を含む、これから本質的になる、又はこれからなる。
【0066】
上述のシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位であることに留意すべきである。
【0067】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位、又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(各々が、
i)GPGXX(配列番号3)(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してA、S、G、Y、P及びQから選択される任意のアミノ酸である)、
ii)GGX(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してY、P、R、S、A、T、N及びQから選択され、より好ましくはそれぞれの場合で独立してY、P及びQから選択される任意のアミノ酸である)、及び
iii)Ax(ここでxは5〜10の整数である)
からなる群から選択されるコンセンサス配列を少なくとも1つ、好ましくは1つ含む)を含む、これから本質的になる、又はこれからなる。上述のように、本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位である。
【0068】
本発明の方法に使用されるシルクポリペプチドが、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位(各々がGGRPSDTYG(配列番号18)及びGGRPSSSYG(配列番号19)からなる群から選択されるアミノ酸配列を少なくとも1つ、好ましくは1つ含む)を含む、又はこれからなることも好ましい。
【0069】
このため、本発明の方法に使用されるシルクポリペプチドは好ましくは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(各々がGPGAS(配列番号5)、GPGSG(配列番号6)、GPGGY(配列番号7)、GPGGP(配列番号8)、GPGGA(配列番号9)、GPGQQ(配列番号4)、GPGQG(配列番号40)、GPGGG(配列番号10)、GPGGS(配列番号11)、GGY、GGP、GGA、GGR、GGS、GGT、GGN、GGQ、AAAAA(配列番号12)、AAAAAA(配列番号13)、AAAAAAA(配列番号14)、AAAAAAAA(配列番号15)、AAAAAAAAA(配列番号16)、AAAAAAAAAA(配列番号17)、GGRPSDTYG(配列番号18)、及びGGRPSSSYG(配列番号19)からなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個又は25個)、好ましくは1つ含む)を含む、又はこれからなる。
【0070】
最も好ましくは、本発明の方法に使用されるシルクポリペプチドは、
(i)アミノ酸配列として、好ましくはこの順番でGPGAS(配列番号5)、AAAAAA(配列番号13)、GGY及びGPGSG(配列番号6)を含む又はこれからなる反復単位、
(ii)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGGY(配列番号7)、GPGGY(配列番号7)及びGPGGP(配列番号8)を含む又はこれからなる反復単位、
(iii)アミノ酸配列として、GPGQQ(配列番号4)、GPGQQ(配列番号4)、GPGQQ(配列番号4)及びGPGQQ(配列番号4)を含む又はこれからなる反復単位、
(iv)アミノ酸配列として、好ましくはこの順番でGPGGA(配列番号9)、GGP、GPGGA(配列番号9)、GGP、GPGGA(配列番号9)及びGGPを含む又はこれからなる反復単位、
(v)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGQG(配列番号40)及びGGRを含む又はこれからなる反復単位、
(vi)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGGG(配列番号10)、GGR、GGN及びGGRを含む又はこれからなる反復単位、
(vii)アミノ酸配列として、好ましくはこの順番でGGA、GGA、GGA、GGS、GGA及びGGSを含む又はこれからなる反復単位、並びに/又は
(viii)アミノ酸配列として、好ましくはこの順番でGPGGA(配列番号9)、GPGGY(配列番号7)、GPGGS(配列番号11)、GPGGY(配列番号7)、GPGGS(配列番号11)及びGPGGY(配列番号7)を含む又はこれからなる反復単位
を含む、これから本質的になる、又はこれからなる。
【0071】
上述のシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位であることに留意すべきである。
【0072】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、
(i)反復単位として(GPGXX)n(配列番号3)(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してA、S、G、Y、P及びQから選択され、nは2、3、4、5、6、7、8又は9である)、
ii)反復単位として(GGX)n(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してY、P、R、S、A、T、N及びQから選択され、より好ましくはそれぞれの場合で独立してY、P及びQから選択される任意のアミノ酸であり、nは2、3、4、5、6、7又は8である)、及び/又は
iii)反復単位として(Ax)n(ここでxは5〜10の整数であり、nは2、3、4、5、6、7、8、9又は10である)
を含む、これから本質的になる、又はこれからなる。上述のように、本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つは同一の反復単位である。
【0073】
反復単位は独立して、モジュールA(配列番号20)、モジュールC(配列番号21)、モジュールQ(配列番号22)、モジュールK(配列番号23)、モジュールsp(配列番号24)、モジュールS(配列番号25)、モジュールR(配列番号26)、モジュールX(配列番号27)若しくはモジュールY(配列番号28)、又はその変異体(すなわちモジュールA変異体、モジュールC変異体、モジュールQ変異体、モジュールK変異体、モジュールsp変異体、モジュールS変異体、モジュールR変異体、モジュールX変異体又はモジュールY変異体)から選択されるのが好ましい。モジュールA(配列番号20)及びモジュールQ(配列番号22)はニワオニグモのADF−3のアミノ酸配列をベースにしている。モジュールC(配列番号21)はニワオニグモのADF−4のアミノ酸配列をベースにしている。モジュールK(配列番号23)、モジュールsp(配列番号24)、モジュールX(配列番号27)及びモジュールY(配列番号28)はアメリカジョロウグモの鞭毛状タンパク質FLAGのアミノ酸配列をベースにしている(国際公開第2006/008163号)。モジュールS(配列番号25)及びモジュールR(配列番号26)はレジリン(節足動物門)をベースにしている(国際公開第2008/155304号)。
【0074】
このため本発明の好ましい実施の形態では、シルクポリペプチドの反復単位は、モジュールA:GPYGPGASAAAAAAGGYGPGSGQQ(配列番号20)、モジュールC:GSSAAAAAAAASGPGGYGPENQGPSGPGGYGPGGP(配列番号21)、モジュールQ:GPGQQGPGQQGPGQQGPGQQ(配列番号22)、モジュールK:GPGGAGGPYGPGGAGGPYGPGGAGGPY(配列番号23)、モジュールsp:GGTTIIEDLDITIDGADGPITISEELTI(配列番号24)、モジュールS:PGSSAAAAAAAASGPGQGQGQGQGQGGRPSDTYG(配列番号25)、モジュールR:SAAAAAAAAGPGGGNGGRPSDTYGAPGGGNGGRPSSSYG(配列番号26)、モジュールX:GGAGGAGGAGGSGGAGGS(配列番号27)若しくはモジュールY:GPGGAGPGGYGPGGSGPGGYGPGGSGPGGY(配列番号28)、又はそれらの変異体からなる。
【0075】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(独立して、モジュールA(配列番号20)、モジュールC(配列番号21)、モジュールQ(配列番号22)、モジュールK(配列番号23)、モジュールsp(配列番号24)、モジュールS(配列番号25)、モジュールR(配列番号26)、モジュールX(配列番号27)若しくはモジュールY(配列番号28)、又はその変異体(すなわちモジュールA変異体、モジュールC変異体、モジュールQ変異体、モジュールK変異体、モジュールsp変異体、モジュールS変異体、モジュールR変異体、モジュールX変異体又はモジュールY変異体)から選択される)を含む、これから本質的になる、又はこれからなる。本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位(モジュール)であることに留意すべきである。
【0076】
このため、本発明の方法に使用されるシルクポリペプチドは、(i)モジュールAからなる反復単位(複数も可)及び/若しくはモジュールA変異体からなる反復単位(複数も可)、(ii)モジュールCからなる反復単位(複数も可)及び/若しくはモジュールC変異体からなる反復単位(複数も可)、(iii)モジュールQからなる反復単位(複数も可)及び/若しくはモジュールQ変異体からなる反復単位(複数も可)、(iv)(a)モジュールAからなる反復単位(複数も可)及びモジュールQからなる反復単位(複数も可)、(b)モジュールAからなる反復単位(複数も可)及びモジュールQ変異体からなる反復単位(複数も可)、(c)モジュールA変異体からなる反復単位(複数も可)及びモジュールQからなる反復単位(複数も可)、(d)モジュールA変異体からなる反復単位(複数も可)及びモジュールQ変異体からなる反復単位(複数も可)、(v)(a)モジュールAからなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(b)モジュールAからなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(c)モジュールA変異体からなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(d)モジュールA変異体からなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(vi)(a)モジュールCからなる反復単位(複数も可)及びモジュールQからなる反復単位(複数も可)、(b)モジュールCからなる反復単位(複数も可)及びモジュールQ変異体からなる反復単位(複数も可)、(c)モジュールC変異体からなる反復単位(複数も可)及びモジュールQからなる反復単位(複数も可)、(d)モジュールC変異体からなる反復単位(複数も可)及びモジュールQ変異体からなる反復単位(複数も可)、又は(vii)(a)モジュールAからなる反復単位(複数も可)、モジュールQからなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(b)モジュールAからなる反復単位(複数も可)、モジュールQからなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(c)モジュールAからなる反復単位(複数も可)、モジュールQ変異体からなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(d)モジュールA変異体からなる反復単位(複数も可)、モジュールQからなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(e)モジュールAからなる反復単位(複数も可)、モジュールQ変異体からなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(f)モジュールA変異体からなる反復単位(複数も可)、モジュールQ変異体からなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(g)モジュールA変異体からなる反復単位(複数も可)、モジュールQからなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(h)モジュールA変異体からなる反復単位(複数も可)、モジュールQ変異体からなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)を含む、これから本質的になる、又はこれからなるのが好ましい。
【0077】
本発明の方法に使用されるシルクポリペプチドは少なくとも2つの同一の反復単位を含む又はこれからなるという条件で、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX、モジュールY、又はその変異体(すなわちモジュールA変異体、モジュールC変異体、モジュールQ変異体、モジュールK変異体、モジュールsp変異体、モジュールS変異体、モジュールR変異体、モジュールX変異体又はモジュールY変異体)を各々の任意の組み合わせ及び任意の数で互いに組み合わせることもできる、すなわち例えば、モジュール(反復単位)Aをモジュール(反復単位)Qと組み合わせることができ(すなわち組み合わせAQ)、モジュール(反復単位)Cをモジュール(反復単位)Qと組み合わせることができ(すなわち組み合わせCQ)、モジュール(反復単位)Qをモジュール(反復単位)A及びモジュール(反復単位)Qと組み合わせることができ(すなわち組み合わせQAQ)、モジュール(反復単位)Aをモジュール(反復単位)A及びモジュール(反復単位)Qと組み合わせることができる(すなわち組み合わせAAQ)。例えば、本発明の方法に使用されるシルクポリペプチドは、An、(AA)n、(AQ)n、(QA)n、Qn、(QQ)n、(QAQ)n、(AQA)n、Cn、(CC)n、(CCC)n、(CQ)n、(QC)n、(QCQ)n、(CQC)n、(AA)nQn、(QQ)nAn、(AAA)nQn、(QQQ)nAn、(AQQ)n、(QQA)n、Kn、spn、Sn、Rn、Xn、Yn、(Ksp)n、(spK)n、(XY)n、(YX)n、(XX)n、(YY)n、(XXX)n、(YYY)n、(AX)n、(XA)n、(CX)n、(XC)n、(QX)n、(XQ)n、(YQ)n、(QY)n、(SS)n、(SR)n、(RS)n又は(RR)n(ここでnは少なくとも2、好ましくは4、8、9、10、12、16、20、24又は32である)を含み得る又はこれからなり得る。シルクポリペプチドが(AQ)12からなる場合、シルクポリペプチドには、モジュール(反復単位)Aが12回存在し、モジュール(反復単位)Qも12回存在し、そのためシルクポリペプチドは24個のモジュール(反復単位)からなることに留意する。(AQ)12からなるシルクポリペプチドのモジュール(繰り返し単位)の配置は以下のとおりである:AQAQAQAQAQAQAQAQAQAQAQAQ。さらに、シルクポリペプチドのモジュール(繰り返し単位)のシルクポリペプチドが(QAQ)8からなる場合、シルクポリペプチドには、モジュール(繰り返し単位)Aが8回存在し、モジュール(反復単位)Qが16回存在し、そのためシルクポリペプチドは24個のモジュール(反復単位)からなることに留意する。(QAQ)8からなるシルクポリペプチドのモジュール(繰り返し単位)の配置は以下のとおりである:QAQQAQQAQQAQQAQQAQQAQQAQ。
【0078】
本発明の方法に使用されるシルクポリペプチドはまた、(A*Q)n、(AQ*)n、(A*Q*)n、(Q*A)n、(QA*)n、(Q*A*)n、(QAQ*)n、(QA*Q)n、(Q*AQ)n、(QA*Q*)n、(Q*A*Q)n、(Q*AQ*)n、(Q*A*Q*)n、(AQA*)n、(AQ*A)n、(A*QA)n、(AQ*A*)n、(A*Q*A)n、(A*QA*)n、(A*Q*A*)n(ここでnは少なくとも2、好ましくは4、8、9、10、12、16、20、24又は32であり、*はモジュール変異体、すなわちモジュールA変異体又はモジュールQ変異体を示す)を含み得る又はこれからなり得る。
【0079】
「互いに組み合わせた」又は「互いに連結した」という用語は、本発明との関連では、複数のモジュール(反復単位)が互いに直接組み合わされている若しくは連結されていることを意味し得る、又は本発明との関連では、複数のモジュール(反復単位)が1つ又は複数のスペーサーアミノ酸を介して互いに組み合わされている若しくは連結されていることを意味し得る。好ましい実施の形態では、シルクポリペプチドに含まれるモジュール(反復単位)が互いに直接組み合わされている若しくは連結されている。他の好ましい実施の形態では、シルクポリペプチドに含まれるモジュール(反復単位)が、1個〜25個又は1個〜20個のスペーサーアミノ酸を介して、より好ましくは1個〜15個又は1個〜10個のスペーサーアミノ酸を介して、最も好ましくは1個〜5個のスペーサーアミノ酸を介して、すなわち1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個又は25個のスペーサーアミノ酸を介して互いに組み合わされている又は連結されている。上記スペーサーアミノ酸はタンパク質において自然発生的な任意のアミノ酸であり得る。好ましくは、上記スペーサーアミノ酸はプロリンではない。スペーサーアミノ酸(複数も可)は荷電基を含有するのが好ましい。好ましくは、荷電基を含有するスペーサーアミノ酸(複数も可)は独立して、アスパラギン酸、グルタミン酸、ヒスチジン及びリジンからなる群から選択される。上記スペーサーアミノ酸は、シルクポリペプチドのケブラー又は羊毛等の不活性材料又は自然発生的な材料をコーティング、好ましくは均一にコーティングする能力に負の影響を与えないアミノ酸とする。さらに、上記スペーサーアミノ酸は、立体障害を引き起こさないアミノ酸、例えばリジン及びシステイン等のサイズが小さいアミノ酸とする。
【0080】
より好ましい実施の形態では、シルクポリペプチドは、互いに直接組み合わせられるモジュール、及び1個〜25個又は1個〜20個のスペーサーアミノ酸を介して、より好ましくは1個〜15個又は1個〜10個のスペーサーアミノ酸を介して、最も好ましくは1個〜5個のスペーサーアミノ酸を介して、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個又は25個のスペーサーアミノ酸を介して互いに組み合わせられるモジュールを含む。
【0081】
モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体は参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYとは異なり、該変異体はそれらからアミノ酸配列における最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個又は15個のアミノ酸変化(すなわち置換、付加、挿入、欠失、N末端切断及び/又はC末端切断)により誘導される。代替的に又は付加的に、このようなモジュール変異体は、変異体の誘導元である参照(野生型)モジュールに対する或る特定の程度の配列同一性を特徴とし得る。このため、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体は、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYに対する少なくとも50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は更には99.9%の配列同一性を有する。好ましくは配列同一性は、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの少なくとも10個、15個、18個、20個、24個、27個、28個、30個、34個、35個又はそれ以上のアミノ酸の連続ストレッチにわたる、好ましくは全長にわたるものである。
【0082】
配列同一性は、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの全長にわたって少なくとも80%、全長にわたって少なくとも85%、全長にわたって少なくとも90%、全長にわたって少なくとも95%、全長にわたって少なくとも98%、又は全長にわたって少なくとも99%であるのが特に好ましい。配列同一性は、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX若しくはモジュールYのうちの少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも80%、少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも85%、少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも90%、少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも95%、少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも98%、又は少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも99%であるのが特に好ましい。
【0083】
モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個又は15個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0084】
さらに、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片は、変異体又は断片の元となるアミノ酸配列に対する修飾が、シルクポリペプチドのケブラー又は羊毛等の不活性材料又は自然発生的な材料をコーティングする、好ましくは均一にコーティングする能力に負の影響を与えない場合にのみ、本発明との関連内においてモジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片とみなされる。好ましくは、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片を含むシルクポリペプチドは、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYを含むシルクポリペプチドを用いて形成可能であるように、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さのコーティングを形成することが可能である。モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYを含むシルクポリペプチドで作られたコーティングと比較して類似の表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片を含むシルクポリペプチドで作られたコーティングが、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYを含むシルクポリペプチドで作られたコーティングと類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いてコーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0085】
このため本発明の好ましい実施の形態では、反復単位は独立して、モジュールAC(配列番号29)、モジュールAK(配列番号30)、モジュールCC(配列番号31)、モジュールCK1(配列番号32)、モジュールCK2(配列番号33)又はモジュールCKC(配列番号34)から選択される。モジュールAC(配列番号29)、モジュールAK(配列番号30)、モジュールCC(配列番号31)、モジュールCK1(配列番号32)、モジュールCK2(配列番号33)及びモジュールCKC(配列番号34)は、ニワオニグモのADF−3のアミノ酸配列をベースとするモジュールA、及びニワオニグモのADF−4のアミノ酸配列をベースとするモジュールCの変異体である(国際公開第2007/025719号)。モジュールAC(配列番号29)では、21位のアミノ酸S(セリン)がアミノ酸C(システイン)に置き換えられており、モジュールAK(配列番号30)では、21位のアミノ酸Sがアミノ酸K(リジン)に置き換えられており、モジュールCC(配列番号31)では、25位のアミノ酸Sがアミノ酸Cに置き換えられており、モジュールCK1(配列番号32)では、25位のアミノ酸Sがアミノ酸Kに置き換えられており、モジュールCK2(配列番号33)では、20位のアミノ酸E(グルタミン酸)がアミノ酸Kに置き換えられており、モジュールCKC(配列番号34)では、20位のアミノ酸Eがアミノ酸Kに置き換えられており、25位のアミノ酸Sがアミノ酸Cに置き換えられている(国際公開第2007/025719号)。
【0086】
好ましくは、本発明の方法に使用されるシルクポリペプチドにおける反復単位は、モジュールAC:GPYGPGASAAAAAAGGYGPGCGQQ(配列番号29)、モジュールAK:GPYGPGASAAAAAAGGYGPGKGQQ(配列番号30)、モジュールCC:GSSAAAAAAAASGPGGYGPENQGPCGPGGYGPGGP(配列番号31)、モジュールCK1:GSSAAAAAAAASGPGGYGPENQGPKGPGGYGPGGP(配列番号32)、モジュールCK2:GSSAAAAAAAASGPGGYGPKNQGPSGPGGYGPGGP(配列番号33)、又はモジュールCKC:GSSAAAAAAAASGPGGYGPKNQGPCGPGGYGPGGP(配列番号34)からなる。
【0087】
本発明の方法に使用されるシルクポリペプチドが、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(独立して、モジュールAC(配列番号29)、モジュールAK(配列番号30)、モジュールCC(配列番号31)、モジュールCK1(配列番号32)、モジュールCK2(配列番号33)又はモジュールCKC(配列番号34)から選択される)を含む、これから本質的になる、又はこれからなることも好ましい。本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位(モジュール)であることに留意すべきである。
【0088】
例えば、本発明の方法に使用されるシルクポリペプチドは、モジュールCC4、モジュールCC8、モジュールCC16、モジュールCC32、モジュールAC5、モジュールAC8又はモジュールAC10を含み得る又はこれからなり得る。
【0089】
本発明の方法に使用されるシルクポリペプチドは少なくとも2つの同一の反復単位を含む又はこれからなるという条件で、モジュールAK、モジュールCC、モジュールCK1、モジュールCK2及びモジュールCKCを互いに組み合わせることもできる、すなわち例えば、モジュール(反復単位)AKをモジュール(反復単位)CCと組み合わせることができ(すなわち組み合わせAKCC)、モジュール(反復単位)CK1をモジュール(反復単位)CK2及びモジュール(反復単位)CKCと組み合わせることができる(すなわち組み合わせCK1CK2CKC)。このため、本発明の方法に使用されるシルクポリペプチドはまた、モジュール(AK)n、モジュール(CC)n、モジュール(CK1)n、モジュール(CK2)n、モジュール(CKC)n、モジュール(AKAC)n、モジュール(CCCC)n、モジュール(CK1CK2)n、モジュール(CK2CK1)n、モジュール(CK1CK2CK1)n、モジュール(CK2CK1CK2)n、モジュール(CK1CK2CKC)n、モジュール(CKCCK2CKC)n又はモジュール(CKCCK2CK1)n(ここでnは少なくとも2、好ましくは4、5、6、7、8、10、12、16又は20である)を含み得る又はこれからなり得る。「互いに組み合わせた」という用語は上で定義される。
【0090】
本発明の方法に使用されるシルクポリペプチドは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(独立して、モジュールA(配列番号20)若しくはその変異体、モジュールC(配列番号21)若しくはその変異体、モジュールQ(配列番号22)若しくはその変異体、モジュールK(配列番号23)若しくはその変異体、モジュールsp(配列番号24)若しくはその変異体、モジュールS(配列番号25)若しくはその変異体、モジュールR(配列番号26)若しくはその変異体、モジュールX(配列番号27)若しくはその変異体、モジュールY(配列番号28)若しくはその変異体、モジュールAC(配列番号29)、モジュールAK(配列番号30)、モジュールCC(配列番号31)、モジュールCK1(配列番号32)、モジュールCK2(配列番号33)、又はモジュールCKC(配列番号34)から選択される)を含む、これから本質的になる、又はこれからなるのが更に好ましい。この場合も、本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位(モジュール)であることに留意すべきである。
【0091】
本発明の方法に使用されるシルクポリペプチドは少なくとも2つの同一の反復単位を含む又はこれからなるという条件で、モジュールAK、モジュールCC、モジュールCK1、モジュールCK2及びモジュールCKCを、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYと互いに組み合わせることもできる、すなわち例えば、モジュール(反復単位)AKをモジュール(反復単位)Cと組み合わせることができ(すなわち組み合わせAKC)、又はモジュール(反復単位)CCをモジュール(反復単位)Cと組み合わせることができる(すなわち組み合わせCCC)。このため、本発明の方法に使用されるシルクポリペプチドはまた、モジュール(AQAK)n、モジュール(QAK)n、モジュール(QAKQ)n、モジュール(AKQA)n、モジュール(AKQAK)n、モジュール(CCC)n、モジュール(CCCC)n、モジュール(CCCCC)n、モジュール(CCCCC)n、モジュール(CCQ)n、モジュール(QCC)n、モジュール(QCCQ)n、モジュール(CCQC)n、モジュール(CQCC)n、モジュール(CCQCC)n、モジュール(CCK1)n、モジュール(CK1C)n、モジュール(CK1CC)n、モジュール(CCK1C)n、モジュール(CKCCKCC)n、モジュール(CCKCCKC)n、モジュール(CKCQ)n、モジュール(QCKC)n、モジュール(QCKCQ)n、モジュール(AKCK1Q)n、モジュール(QCK2AK)n、又はモジュール(CK1CK2C)n(ここでnは少なくとも2、好ましくは4、5、6、7、8、10、12、16又は20である)を含み得る又はこれからなり得る。「互いに組み合わせた」という用語は上で定義される。
【0092】
例えば、本発明の方法に使用されるシルクポリペプチドは、モジュールC16CC、モジュールCCC16、モジュールC8CCC8、モジュールC8CC8、モジュールCC8C8、モジュールC4CC8C4、モジュールCC4C8CC4、モジュールCC(AQ)24又はモジュール(AQ)24CCを含む又はこれからなる。
【0093】
本発明の方法に使用されるシルクポリペプチドは、少なくとも1つの非反復(NR)単位、すなわち1個、2個、3個、4個、5個、6個又はそれ以上のNR単位、好ましくは1個のNR単位を更に含むことができる。本発明との関連では、「非反復(NR)単位」という用語は、明らかな反復パターンを示さない、自然発生的なシルクポリペプチドに存在するアミノ酸の領域(非反復単位又はNR単位)を表す。好ましくは、非反復単位のアミノ酸配列は、自然発生的なドラグラインポリペプチド、好ましくはADF−3(配列番号1)若しくはADF−4(配列番号2)の非反復アミノ酸配列に、又はそれと実質的に類似のアミノ酸配列に相当する。
【0094】
非反復単位のアミノ酸配列は、自然発生的なドラグラインポリペプチド、好ましくはADF−3(配列番号1)若しくはADF−4(配列番号2)の非反復カルボキシ末端アミノ酸配列に、又はそれと実質的に類似のアミノ酸配列に相当するのが特に好ましい。より好ましくは、非反復単位のアミノ酸配列は、アミノ酸513〜アミノ酸636を含むADF−3(配列番号1)若しくはアミノ酸302〜アミノ酸410を含むADF−4(配列番号2)の非反復カルボキシ末端アミノ酸配列に、又はそれと実質的に類似のアミノ酸配列に相当する。
【0095】
この関連で「実質的に類似の」は、好ましくは20個、30個、40個、50個、60個、70個、80個又はそれ以上のアミノ酸にわたる、より好ましくは自然発生的なドラグラインポリペプチド、好ましくはADF−3(配列番号1)又はADF−4(配列番号2)の各参照非反復(カルボキシ末端)アミノ酸配列の全長にわたる少なくとも50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は更には99.9%のアミノ酸同一性の程度を意味する。
【0096】
自然発生的なドラグラインポリペプチド(すなわち野生型非反復(カルボキシ末端)単位)内の、好ましくはADF−3(配列番号1)又はADF−4(配列番号2)内の対応する非反復(カルボキシ末端)アミノ酸配列と「実質的に類似の」アミノ酸配列を有する「非反復単位」は、その機能特性に関しても類似している。例えば「実質的に類似の非反復単位」を含むシルクポリペプチドは依然として、ケブラー又は羊毛等の合成材料又は自然発生的な材料上にコーティングを形成する能力を有する。好ましくは、「実質的に類似の非反復単位」を含むシルクポリペプチドは、各参照(野生型)非反復(カルボキシ末端)単位を含むシルクポリペプチドを用いて形成することができるのと同様に、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さのコーティングを形成することが可能である。「実質的に類似の非反復単位」を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)非反復(カルボキシ末端)単位を含むシルクポリペプチドで作られたコーティングと比較して類似の(similar)表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。「実質的に類似の反復単位」を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)非反復(カルボキシ末端)単位を含むシルクポリペプチドで作られたコーティングに類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いて、コーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0097】
最も好ましくは、非反復(NR)単位は、NR3(配列番号41)若しくはその変異体、又はNR4(配列番号42)若しくはその変異体である。NR3(配列番号41)単位はニワオニグモのADF−3のアミノ酸配列をベースとしており、NR4(配列番号42)単位はニワオニグモのADF−4のアミノ酸配列をベースとしている(国際公開第2006/008163号)。
【0098】
NR3単位又はNR4単位の変異体は、参照NR3(配列番号41)単位又はNR4(配列番号42)単位とは異なり、該変異体はそれらからアミノ酸配列における最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、25個又は30個のアミノ酸変化(すなわち置換(exchanges)、挿入、欠失、N末端切断及び/又はC末端切断)により誘導される。代替的に又は付加的に、このようなNR3単位又はNR4単位の変異体は、変異体の誘導元である参照NR3単位又はNR4単位に対する或る特定の程度の配列同一性を特徴とし得る。このため、NR3単位又はNR4単位の変異体は、各参照NR3単位又はNR4単位に対する少なくとも50%、55%、60%、65%、70%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は更には99.9%の配列同一性を有する。好ましくは配列同一性は、各参照NR3単位又はNR4単位の少なくとも10個、20個、30個、40個、50個、60個、70個、80個、90個又はそれ以上のアミノ酸の連続ストレッチにわたる、好ましくは全長にわたるものである。
【0099】
配列同一性は各参照NR3単位又はNR4単位の全長にわたって少なくとも80%、全長にわたって少なくとも85%、全長にわたって少なくとも90%、全長にわたって少なくとも95%、全長にわたって少なくとも98%、又は全長にわたって少なくとも99%であるのが特に好ましい。配列同一性は各参照NR3単位若しくはNR4単位のうちの少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも80%、少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも85%、少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも90%、少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも95%、少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも98%、又は少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも99%であるのが更に特に好ましい。
【0100】
NR3単位又はNR4単位の断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、30個、35個、40個、45個、50個、55個又は60個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0101】
さらに、NR3単位又はNR4単位の変異体又は断片は、変異体又は断片の元となるアミノ酸配列に対する修飾が、シルクポリペプチドのケブラー又は綿等の不活性材料又は自然発生的な材料をコーティングする、好ましくは均一にコーティングする能力に負の影響を与えない場合にのみ、本発明との関連内においてNR3単位又はNR4単位の変異体又は断片とみなされる。好ましくは、NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドは、各参照NR3単位又はNR4単位を含むシルクポリペプチドを用いて形成することができるのと同様に、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5.0μmの厚さのコーティングを形成することが可能である。NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドで作られたコーティングは、各参照NR3単位又はNR4単位を含むシルクポリペプチドで作られたコーティングと比較して類似の表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドで作られたコーティングは、各参照NR3単位又はNR4単位を含むシルクポリペプチドで作られたコーティングに類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いて、コーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0102】
代替的には、NR3単位又はNR4単位の変異体又は断片が依然として、それが含まれるシルクポリペプチドの重合を可能にするか、及び/又は可溶性を増大させるかを試験することができる。当業者は、NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドが、各参照NR3単位又はNR4単位を含むシルクポリペプチドのように上述の機能特性を有するかを容易に評価することができる。好適なアッセイは当業者にとって既知である。例えば、NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドの重合、及び各参照NR3単位又はNR4単位を含むシルクポリペプチドの重合を、ネイティブゲル電気泳動により容易に可視化することができる。NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドの可溶性、及び各参照NR3単位又はNR4単位を含むシルクポリペプチドの可溶性を、水溶液中の上記シルクポリペプチドの飽和により単純に試験することができる。最終的に結果を互いに比較することができる。
【0103】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、ADF−3(配列番号1)又はその変異体、ADF−4(配列番号2)又はその変異体、MaSp I(配列番号43)又はその変異体、MaSp II(配列番号44)又はその変異体、(C)m、(C)mNRz、NRz(C)m、(AQ)n、(AQ)nNRz、NRz(AQ)n、(QAQ)o、NRz(QAQ)o、(QAQ)oNRz、Yp、Xp及びKp(ここで、mは8〜48(すなわち8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47又は48)の整数であり、nは6〜24(すなわち6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23又は24)の整数であり、oは8〜16(すなわち8、9、10、11、12、13、14、15又は16)の整数であり、pは8〜16(すなわち8、9、10、11、12、13、14、15又は16)の整数であり、zは1〜3(すなわち1、2又は3)の整数であり、NRは非反復単位を表す)からなる群から選択される。上述の式は以下のうちの1つにより定義される。
(i)式(C)mでは、配列番号21によるアミノ酸配列で表される、数「m」のCモジュール、すなわち8個〜48個のCモジュールが互いに組み合わせられ、
(ii)式(C)mNRzでは、配列番号21によるアミノ酸配列で表される、数「m」のCモジュール、すなわち8個〜48個のCモジュールが互いに組み合わせられ、上記Cモジュールはさらに、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4と組み合わせられ、
(iii)式NRz(C)mでは、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4が存在し(z=1)、又は互いに組み合わせられ(z=2又は3)、上記非反復(NR)単位(複数も可)はさらに、配列番号21によるアミノ酸配列で表される、数「m」のCモジュール、すなわち8個〜48個のCモジュールと組み合わせられ、
(iv)式(AQ)nでは、数「n」のAモジュールとQモジュールとの組み合わせ、すなわち6個〜24個のAモジュールとQモジュールとの組み合わせ(ここでモジュールAは配列番号20によるアミノ酸配列により表され、モジュールQは配列番号22によるアミノ酸配列により表される)が互いに組み合わされ、
(v)式(AQ)nNRzでは、数「n」のAモジュールとQモジュールとの組み合わせ、すなわち6個〜24個のAモジュールとQモジュールとの組み合わせ(ここでモジュールAは配列番号20によるアミノ酸配列により表され、モジュールQは配列番号22によるアミノ酸配列により表される)が互いに組み合わされ、上記AモジュールとQモジュールとの組み合わせはさらに、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4と組み合わせられ、
(vi)式NRz(AQ)nでは、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4が存在し(z=1)、又は互いに組み合わせられ(z=2又は3)、上記非反復(NR)単位(複数も可)はさらに、数「n」のAモジュールとQモジュールとの組み合わせ、すなわち6個〜24個のAモジュールとQモジュールとの組み合わせ(ここでモジュールAは配列番号20によるアミノ酸配列により表され、モジュールQは配列番号22によるアミノ酸配列により表される)と組み合わせられ、
(vii)式(QAQ)oでは、数「o」のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ、すなわち8個〜16個のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ(ここでモジュールQは配列番号22によるアミノ酸配列で表され、モジュールAは配列番号20によるアミノ酸配列で表される)が互いに組み合わされ、
(viii)式(QAQ)oNRzでは、数「o」のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ、すなわち8個〜16個のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ(ここでモジュールQは配列番号22によるアミノ酸配列で表され、モジュールAは配列番号20によるアミノ酸配列で表される)が互いに組み合わされ、上記Qモジュールと、Aモジュールと、Qモジュールとの組み合わせはさらに、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4と組み合わせられ、
(ix)式NRz(QAQ)oでは、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4が存在し(z=1)、又は互いに組み合わせられ(z=2又は3)、上記非反復(NR)単位(複数も可)はさらに、数「o」のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ、すなわち8個〜16個のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ(ここでモジュールQは配列番号22によるアミノ酸配列で表され、モジュールAは配列番号20によるアミノ酸配列で表される)と組み合わせられ、
(x)式Ypでは、配列番号28によるアミノ酸配列で表される、数「p」のYモジュール、すなわち8個〜16個のYモジュールが互いに組み合わされ、
(xi)式Xpでは、配列番号27によるアミノ酸配列で表される、数「p」のXモジュール、すなわち8個〜16個のXモジュールが互いに組み合わされ、
(xii)式Kpでは、配列番号23によるアミノ酸配列で表される、数「p」のKモジュール、すなわち8個〜16個のKモジュールが互いに組み合わされる。
【0104】
最も好ましくは、本発明の方法に使用されるシルクポリペプチドは、C16NR4、C32NR4、(AQ)12、(AQ)24、(AQ)12NR3、(AQ)24NR3、C16、C32、Y8、Y16、X8、X16、K8又はK16である。
【0105】
ADF−3、ADF−4、MaSp I又はMaSp IIの変異体は、参照(野生型)ADF−3(配列番号1)、ADF−4(配列番号2)、MaSp I(配列番号43)、又はMaSp II(配列番号44)のポリペプチドとは異なり、該変異体はそれらからアミノ酸配列における最大150個(最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、110個、120個、130個、140個又は150個)のアミノ酸変化(すなわち置換、挿入、欠失、N末端切断及び/又はC末端切断)により誘導される。代替的に又は付加的に、このような変異体は、変異体の誘導元である参照(野生型)ポリペプチドに対する或る特定の程度の配列同一性を特徴とし得る。このため、ADF−3、ADF−4、MaSp I又はMaSp IIの変異体は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドに対する少なくとも50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は更には99.9%の配列同一性を有する。好ましくは配列同一性は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドの少なくとも20個、25個、30個、35個、40個、50個、60個、70個、80個、90個、100個、120個、150個、180個、200個、250個、300個、350個、400個又はそれ以上のアミノ酸の連続ストレッチにわたる、好ましくは全長にわたるものである。
【0106】
配列同一性は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドの全長にわたって少なくとも80%、全長にわたって少なくとも85%、全長にわたって少なくとも90%、全長にわたって少なくとも95%、全長にわたって少なくとも98%、又は全長にわたって少なくとも99%であるのが特に好ましい。配列同一性は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドのうちの少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも80%、少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも85%、少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも90%、少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも95%、少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも98%、又は少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも99%であるのが更に特に好ましい。
【0107】
ADF−3(配列番号1)ポリペプチドの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、120個、150個、170個、200個、220個、250個、270個、300個、320個、350個、370個、400個、420個、450個、470個、500個、520個、550個、570個、600個又は610個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0108】
ADF−4(配列番号2)ポリペプチドの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、120個、150個、170個、200個、220個、250個、270個、300個、320個、330個、340個、350個、360個、370個、380個又は390個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0109】
MaSp 1(配列番号43)ポリペプチドの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、150個、200個、250個、300個、350個、400個、450個、500個、550個、600個、620個、640個、660個、670個、680個又は690個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0110】
MaSp 11(配列番号44)ポリペプチドの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、150個、200個、250個、300個、350個、400個、450個、500個、520個、540個、560個又は570個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0111】
さらに、ADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片は、変異体又は断片の元となるアミノ酸配列に対する修飾が、ポリペプチドのケブラー又は綿等の不活性材料又は自然発生的な材料をコーティングする、好ましくは均一にコーティングする能力に負の影響を与えない場合にのみ、本発明との関連内においてADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片とみなされる。好ましくは、ADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドを用いて形成することができるのと同様に、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さのコーティングを形成することが可能である。ADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片で作られたコーティングは、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドで作られたコーティングと比較して類似の表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。ADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片で作られたコーティングは、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドで作られたコーティングに類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いて、コーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0112】
別の実施の形態では、シルクポリペプチドは、
(i)アミノ酸配列GCGGGGGGSGGGG(配列番号35)からなるTAGCYS1、
(ii)アミノ酸配列GCGGGGGG(配列番号36)からなるTAGCYS2、
(iii)アミノ酸配列GCGGSGGGGSGGGG(配列番号37)からなるTAGCYS3、
(iv)アミノ酸配列GKGGGGGGSGGGG(配列番号38)からなるTAGLYS1、及び
(v)アミノ酸配列GKGGGGGG(配列番号39)からなるTAGLYS2
からなる群から選択されるアミノ末端及び/又はカルボキシ末端TAGを含む。
【0113】
これらのTAGは、システイン及び/又はリジンを含有し、下記のように、シルクポリペプチドと不活性材料とを共有結合的に連結するのに、又は物質とシルクポリペプチドとを連結するのに使用することができる。
【0114】
最も好ましくは、本発明の方法に使用されるシルクポリペプチドは、TAGCYS1C16、C16TAGCYS1、TAGCYS1C16TAGCYS1、TAGCYS2C16、C16TAGCYS2、TAGCYS2C16TAGCYS2、TAGCYS3C16、C16TAGCYS3、TAGCYS3C16TAGCYS3、TAGLYS1C16、C16TAGLYS1、TAGLYS1C16TAGLYS1、TAGLYS2C16、C16TAGLYS2、又はTAGLYS2C16TAGLYS2を含む又はこれからなる。
【0115】
好ましくは、本発明の方法で提供される溶液中のシルクポリペプチドの濃度は、0.1wt%/vol〜30wt%/volの範囲、好ましくは1wt%/vol〜10wt%/volの範囲、最も好ましくは2wt%/vol〜8wt%/vol又は4wt%/vol〜6wt%/volの範囲である。このため例えば、本発明の方法で提供される溶液中のシルクポリペプチドの濃度は、0.1wt%/vol、0.4wt%/vol、0.
.6wt%/vol、0.8wt%/vol、1.0wt%/vol、1.2wt%/vol、1.4wt%/vol、1.6wt%/vol、1.8wt%/vol、2.0wt%/vol、2.2wt%/vol、2.4wt%/vol、2.6wt%/vol、2.8wt%/vol、3.0wt%/vol、3.5wt%/vol、4.0wt%/vol、4.5wt%/vol、5.0wt%/vol、5.5wt%/vol、6.0wt%/vol、6.5wt%/vol、7.0wt%/vol、7.5wt%/vol、8.0wt%/vol、9.0wt%/vol、10.0wt%/vol、12.0wt%/vol、15.0wt%/vol、18.0wt%/vol、20.0wt%/vol、25.0wt%/vol又は30.0wt%/volである。
【0116】
好ましくは、本発明の方法で提供される溶媒は、ファンデルワールス力を不安定化する溶媒(van der Waals forces destabilisingsolvent)、ギ酸、水溶液、好ましくはH2O若しくは緩衝水溶液(例えばトリス緩衝水溶液)、又はそれらの混合物である。最も好ましくは、ファンデルワールス力を不安定化する溶媒は、ヘキサフルオロイソプロパノール(HFIP)、トリクロロ酢酸(Trichloroacetic acid)(TCA)、トリフルオロ酢酸(Trifluoroacetic acid)(TFA)及び臭化リチウム(LiBr)からなる群から選択される。水はその良好な入手可能性及び非毒性のために最も好ましい。これらの溶媒中に、シルクポリペプチドが溶解又は懸濁化する。本発明に関連して「懸濁液」という用語は、液体中での固体粒子の分散液を表す。粒径が約100nmである場合、懸濁液はコロイド状である。
【0117】
本発明の方法でコーティングされる不活性材料又は自然発生的な材料は、繊維、繊維を含む糸、繊維を含む撚糸、繊維を含む織布、及び繊維を含む不織布からなる群から選択されるのが好ましい。
【0118】
織布のコーティングはより実用的であり、費やされる時間がより短く、かつコーティング材の必要量がより小さい。繊維のコーティング、及び続く布地の製織はより複雑であるとともに、より費用がかかるが、再現性がより高く価値がより高い。シルクポリペプチドC16による綿織布のコーティングを実施例IVで例示する。図4は、未処理の製織済みの布地と、コーティングされた製織済みの布地との比較を示す。
【0119】
不活性材料が不活性合成材料又は不活性無機材料であるのが好ましい。好ましくは、不活性材料は、
(i)ポリエステル(Diolen、Trevira)、ポリアミド(PA、例えばナイロン又はPerlon)、ポリアラミド(例えばケブラー、Twaron又はNomex)、ポリテトラフルオロエチレン(PTFE、例えばテフロン登録商標)、ポリエチレン(PE、例えばDyneema)、ポリプロピレン(PP)、ポリウレタン(PU、例えばLycra)、シリコーン、ポリウレタンとポリエチレングリコールとの混合物(エラスタン)、超高分子量ポリエチレン(UHMWPE)及び高性能ポリエチレン(HPPE)からなる群から選択される不活性合成材料、又は
(ii)ガラス、炭素、セラミック、金属、(金属)合金、サファイア、ダイアモンド及び半導体からなる群から選択される不活性無機材料
である。
【0120】
本発明者らは驚くべきことに、コーティング材としてのシルクポリペプチドの使用が最も穏やかな条件下での効率性の高いコーティングを提供し、特定用途に合わせたシルクでコーティングされた不活性な無機材料の製造を可能とすることを見出している。今日までは、(たとえ可能であったとしても)プラズマ処理のような非常に厳しい条件が不活性無機材料、例えば不活性無機繊維に変更を加えるのに必要であった。
【0121】
不活性合成材料であるポリエステル、ポリアミド(PA)及びポリアラミドは重縮合材料(例えば重縮合繊維)である。すなわち上記材料は重縮合反応により生成される。重縮合反応により、モノマー分子同士が連結し、水又は類似の物質を放出することでポリマーが形成される。不活性合成材料であるポリテトラフルオロエチレン(PTFE)、ポリエチレン(PE)及びポリプロピレン(PP)は重合材料(例えば重合繊維)である。すなわち上記材料は重合反応により生成される。重合反応は、化学反応においてモノマー分子同士を反応させ、三次元ネットワーク又はポリマー鎖を形成するプロセスである。不活性合成材料ポリウレタン(PU)及びポリウレタンとポリエチレングリコールとの混合物は重付加材料(例えば重付加繊維)である。すなわち上記材料は重付加反応により作製される。重付加反応では、多くのモノマー同士がいかなる原子又は分子をも失うことなく、結合の転位により結合する。このことは形成中に分子(通常は水)が失われる縮合反応により形成される縮合ポリマーとは対照的である。
【0122】
不活性無機材料としての金属は、白金(Pt)、クロム(Cr)、銀(Ag)、金(Au)及びそれらの組成物/合金からなる群から選択されるのが好ましい。好ましくは、無機材料は半導体であり、鉄(Fe)、銅(Cu)、ゲルマニウム(Ge)、ケイ素(Si)、 セレン(Se)、テルル(Te)及びそれらの組成物/合金からなる群から選択される。(金属)合金は鋼であるのが更に好ましい。
【0123】
好ましくは、自然発生的な材料は、絹、綿、セルロース、亜麻、羊毛、麻、竹、ゴム、本物の毛(例えば人毛又は獣毛)又は人工毛等の毛、及び人の皮膚又は動物の皮膚等の皮膚からなる群から選択される。本物の毛(例えば人毛)又は人工毛は、ヘアーエクステンション、ウィッグ(periwigs)、ヘアーピース(hair pieces)又はかつら用の毛であり得る。本物の毛(例えば人毛)又は人工毛はウィッグ、ヘアーピース又はかつらの一部であってもよい。
【0124】
本発明の方法が、毛、特に本物の毛(例えば人毛又は獣毛)、又は皮膚(例えば人又は動物の皮膚)等の自然発生的な材料のシルクポリペプチドによるコーティングに関する限りにおいて、上記方法は美容上の目的のためのもの、例えば毛の粗さを低減するためのもの、並びに/又は毛の輝きを改善するためのもの、又は皮膚の湿潤性及び/若しくは柔軟性を改善するためのものであるのが好ましい。
【0125】
このため例えばポリアラミド繊維、ポリアラミド糸、ポリテトラフルオロエチレン繊維、ポリテトラフルオロエチレン糸、炭素繊維、炭素糸、ガラス繊維、ガラス糸、ナイロン繊維、ナイロン糸、綿繊維、綿糸、綿織布、綿の不織布、羊毛織布、又は羊毛の不織布を本発明の方法においてシルクポリペプチドでコーティングすることができる。
【0126】
シルクポリペプチドによるコーティングのための不活性基材又は自然発生的な基材の選択は、コーティングされた不活性材料又は自然発生的な材料の続く用途によって様々である。例えば、表面の感触が改善された不活性合成材料の糸(例えばポリアラミド糸)が望まれる場合、まず不活性合成材料の繊維(例えばポリアラミド繊維)をシルクポリペプチドでコーティングし、続いて上記繊維から糸を作製する必要はない。加えて、シルクポリペプチドによる織布の直接コーティングにより、既にシルクポリペプチドでコーティングされた繊維から作製した織布と比較して同程度ではあるが、異なるコーティングパターンがもたらされる。これは、織布コーティングでは、隙間にシルクポリペプチドを充填することができるのに対して、既にシルクポリペプチドでコーティングされた繊維から作製した織布では、隙間にはシルクポリペプチドコーティングが含まれていないことを意味する。したがって、隙間が充填された織布材料のコーティングが望まれる場合、本発明のコーティング方法のための基材として織布を使用することが有益である。
【0127】
例として、本発明の方法は、
i)反復単位としてのC16からなるシルクポリペプチドと、溶媒としてH2Oとを含む溶液を準備する工程と、
ii)不活性合成材料としてのポリアラミド(ケブラー)繊維上に溶液を塗布することより該ポリアラミド繊維を反復単位としてのC16からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含むことができる。
【0128】
本発明の方法は、
i)反復単位としてのC16からなるシルクポリペプチドを含む水溶液を準備する工程と、
ii)該溶液を不活性合成材料としてのポリテトラフルオロエチレン(テフロン登録商標)糸上に塗布することにより該ポリテトラフルオロエチレン糸を反復単位としてのC16からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含むことができる。
【0129】
本発明の方法は、
i)反復単位としての(AQ)24NR3からなるシルクポリペプチドと、溶媒としてギ酸とを含む溶液を準備する工程と、
ii)該溶液を不活性合成材料としてのポリテトラフルオロエチレン(テフロン登録商標)糸上に塗布することにより該ポリテトラフルオロエチレン糸を反復単位としての(AQ)24NR3からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含むことができる。
【0130】
本発明の方法は、
i)反復単位としてのC16からなるシルクポリペプチドと、溶媒としてヘキサフルオロイソプロパノール(HFIP)とを含む溶液を準備する工程と、
ii)自然発生的な材料としての亜麻繊維上に溶液を塗布することにより該亜麻繊維を反復単位としてのC16からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含むこともできる。
【0131】
加えて、本発明の方法は、
i)反復単位としてのC32からなるシルクポリペプチドを含む水溶液を準備する工程と、
ii)該溶液を自然発生的な材料としての羊毛織布上に塗布することにより該羊毛織布を反復単位としてのC32からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含むことができる。
【0132】
上述の例に関しては、C16はモジュールCの16個の反復単位を意味し、C32はモジュールCの16個又は32個の反復単位を意味する。
【0133】
好ましくは、コーティングにおけるシルクポリペプチドは、不活性材料と、又は自然発生的な材料と共有結合的に及び/又は非共有結合的に連結している。「共有結合的な連結」という用語は、結合対の各原子が1つの電子を提供し、化学結合において電子対を形成するタイプの化学的な連結を意味する。シルクポリペプチドは、
(a)シルクポリペプチドのシステイン残基、リジン残基、アミノ末端、カルボキシ末端、アミノ末端TAG若しくはカルボキシ末端TAGを介して、及び/又は
(b)架橋を介して
不活性材料又は自然発生的な材料と共有結合的に連結するのが好ましい。
【0134】
本発明の方法において、シルクポリペプチドは、アミド結合又はジスルフィド結合の形成を介して自然発生的な材料(例えば羊毛又は亜麻)と共有結合的に連結することができる。「アミド結合」(アミド連結)という用語は、1つの分子のカルボキシル基が他の分子のアミン基と反応し、それにより水分子(H2O)が放出される際に2つの分子(例えばポリペプチド)間で形成される化学結合を表す。「ジスルフィド結合」(ジスルフィド連結)という用語は、通常システイン残基の2つのチオール基のカップリングにより誘導される化学結合を表す。該連結はSS−結合又はジスルフィド架橋とも呼ばれる。
【0135】
このため例えば、本発明の方法に使用されるシルクポリペプチド(例えばC16を含むシルクポリペプチド)は、アミド結合を形成することによりそのアミノ末端を介して又はそのカルボキシ末端を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することができる。シルクポリペプチドは、ジスルフィド結合を形成することによりそのアミノ末端TAG(例えばTAGCYS1C16)を介して又はそのカルボキシ末端TAG(例えばC16TAGCYS1)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することもできる。加えて、シルクポリペプチド(例えばAKQ4)は、アミド結合を形成することによりそのリジン残基(例えばシルクポリペプチドAKQ4の反復単位AKにおけるリジン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することができる。さらに、シルクポリペプチドは、ジスルフィド結合を形成することによりそのシステイン残基(例えばシルクポリペプチドACQ4の反復単位ACにおけるシステイン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することができる。
【0136】
(a)で言及されるようなシルクポリペプチドと自然発生的な材料との共有結合的な連結の組み合わせも好ましい。このため例えば、シルクポリペプチド(例えばC16TAGCYS1)は、(i)ジスルフィド結合を形成することによりそのシステイン残基(例えばシルクポリペプチドC16TAGCYS1のカルボキシ末端TAGCYS1におけるシステイン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と、及び(ii)アミド結合を形成することによりそのアミノ末端(例えばシルクポリペプチドC16TAGCYS1のC16のアミノ末端)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することができる。シルクポリペプチド(例えばAC4TAGLYS1)は、(i)アミド結合を形成することによりそのリジン残基(例えばシルクポリペプチドAC4TAGLYS1のカルボキシ末端TAGLYS1におけるリジン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と、及び(ii)ジスルフィド結合を形成することによりそのシステイン残基(例えばシルクポリペプチドAC4TAGLYS1の反復単位ACにおけるシステイン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することもできる。
【0137】
シルクポリペプチドは不活性材料又は自然発生的な材料と非共有結合的に連結することもできる。「非共有結合的な連結」という用語は、電子対の共有を伴わないが、電磁相互作用、疎水性相互作用又はファンデルワールス相互作用のより分散したバリエーションを伴うタイプの連結(相互作用)を意味する。
【0138】
シルクポリペプチドは、イオン(静電)連結(相互作用)を介して又は疎水性連結(相互作用)を介して不活性材料(例えばポリエステル、ポリアラミド又はポリテトラフルオロエチレン)、又は自然発生的な材料(例えば羊毛、亜麻又は綿)と非共有結合的に連結するのが特に好ましい。「疎水性連結」(疎水性相互作用)という用語は、炭化水素が水性媒体中で分子間凝集体を形成する傾向に依存する連結(相互作用)を表す。「イオン(静電)連結」(イオン(静電)相互作用)という用語は、1つの原子が電子を失って陽イオンを形成し、他の原子が電子を得て陰イオンを形成する非共有結合(イオン(静電)結合)を表す。
【0139】
シルクポリペプチドC16によるアラミド(ケブラー)繊維のコーティングを実施例Iで説明する。シルクポリペプチドC16でコーティングされたアラミドフィラメントを図2に示す。
【0140】
不活性材料又は自然発生的な材料をシルクポリペプチド層でコーティングすることができるという予期せぬ発見が、様々な用途に関する新たな機会を与える。一般的にタンパク質は特に不活性材料の存在下で非特異的に凝集する傾向があることは周知の事実である。ヘモグロビン、BSA又はシトクロムCのような標準タンパク質は単に凝集し、このためこれらが表面に全体的に(at all)固着する場合に平坦ではない表面が生じる。驚くべきことに、シルクポリペプチド(例えばスパイダーシルクポリペプチド)は、特にポリアラミド又は炭素材料(例えばポリアラミド又は炭素糸)のような剛性であり、かつ粗い不活性合成材料上で平坦でかつ平滑な表面層を形成する。光学的利点及び触感的利点とは別に、シルクポリペプチドコーティングは、更なる改良、またこれによりコーティングされた不活性材料又は自然発生的な材料に関する新たな範囲の用途の可能性をもたらす。
【0141】
このため、本発明の好ましい実施の形態では、シルクポリペプチドは、シルクポリペプチドと共有結合的に及び/又は非共有結合的に連結する、少なくとも1つの物質、すなわち1個、2個、3個、4個、5個、6個又はそれ以上の物質、好ましくは1個又は2個の物質を更に含む。
【0142】
好ましくは、該物質は本発明の方法の工程i)の前に、工程i)の後に、及び/又は工程ii)の後にシルクポリペプチドと共有結合的に及び/又は非共有結合的に連結する。
【0143】
該物質とシルクポリペプチドとのカップリング/連結を、不活性材料又は自然発生的な材料上へのシルクポリペプチドの塗布の前に(すなわち本発明の方法の工程i)の前に又は工程i)の後に)行うか、塗布の後に(すなわち本発明の方法の工程ii)の後に)行うか、又は複数回(すなわち本発明の方法の工程i)の前と、工程i)の後と、工程ii)の後とで;工程i)の前と、工程ii)の後とで;工程i)の前と、工程i)の後とで;又は工程i)の後と、工程ii)の後とで)行うかは、接着させる物質、接着のタイプ及びコーティングされた材料の所望の用途に依存する。シルクポリペプチドの複数回のカップリングは、様々な材料がシルクポリペプチドとカップリングする場合に有益である。
【0144】
物質の非共有結合的な連結は本発明の方法の工程ii)の後に行うのが好ましい。大量の共有結合的に連結した物質を有するコーティングされた製品が望まれる場合、物質の連結は数回、例えば工程i)の後と、工程ii)の後とで行うのが好ましい。好ましくは、該物質が、
(a)該シルクポリペプチドのシステイン残基、リジン残基、該アミノ末端、該カルボキシ末端、該アミノ末端TAG若しくは該カルボキシ末端TAGを介して、及び/又は
(b)架橋を介して
シルクポリペプチドと共有結合的に連結する。
【0145】
該物質は本発明のプロセスにおいて架橋を介してシルクポリペプチドと共有結合的に連結することができる。「架橋」という用語は、共有結合により2つの分子を化学的に結び付けるプロセスを表す。架橋試薬又はカップリング試薬は、ポリペプチド上に又は他の分子上に特定の官能基に対する反応性末端(第1級アミン、スルフヒドリル等)を含有する。好ましくは、本発明の方法に使用される架橋試薬又はカップリング試薬は、1−エチル−3−(3−ジメチルアミノプロピル)−カルボジイミド塩酸塩(EDC)又はグルタルアルデヒドである。
【0146】
したがって例えば、本発明の方法に使用される該物質(例えば酵素、抗体又は抗体断片)は、アミド結合を形成することによりシルクポリペプチドのアミノ末端を介して又はカルボキシ末端を介してシルクポリペプチド(例えばC16を含むシルクポリペプチド)と共有結合的に連結することができる。該物質(例えば酵素又は抗体)は、ジスルフィド結合を形成することによりシルクポリペプチドのアミノ末端TAG(例えばTAGCYS1C16)を介して又はカルボキシ末端TAG(例えばC16TAGCYS1)を介してシルクポリペプチドと共有結合的に連結することもできる。加えて、該物質(例えば酵素又は抗体)は、アミド結合を形成することによりシルクポリペプチドのリジン残基(例えばシルクポリペプチドAKQ4の反復単位AKにおけるリジン残基)を介してシルクポリペプチド(例えばAKQ4)と共有結合的に連結することができる。さらに、該物質(例えば酵素又は抗体)は、ジスルフィド結合を形成することによりシルクポリペプチドのシステイン残基(例えばシルクポリペプチドACQ4の反復単位ACにおけるシステイン残基)を介してシルクポリペプチド(例えばACQ4)と共有結合的に連結することができる。
【0147】
(a)で言及されるような該物質とシルクポリペプチドとの共有結合的な連結の組み合わせも好ましい。このため例えば、該物質(例えば酵素又は抗体)は、アミド結合を形成することによりシルクポリペプチドの(i)アミノ末端を介して、及び(ii)カルボキシ末端を介してシルクポリペプチド(例えばC16を含むシルクポリペプチド)と共有結合的に連結することができる。該物質(例えば酵素又は抗体)は、(i)ジスルフィド結合を形成することによりシルクポリペプチドのシステイン残基(例えばシルクポリペプチドC16TAGCYS1のカルボキシ末端TAGCYS1におけるシステイン残基)を介してシルクポリペプチド(例えばC16TAGCYS1)と、及び(ii)アミド結合を形成することによりシルクポリペプチドのアミノ末端(例えばシルクポリペプチドC16TAGCYS1のC16のアミノ末端)を介してシルクポリペプチド(例えばC16TAGCYS1)と共有結合的に連結することもできる。該物質(例えば酵素又は抗体)は、(i)アミド結合を形成することによりシルクポリペプチドのリジン残基(例えばシルクポリペプチドAC4TAGLYS1のカルボキシ末端TAGLYS1におけるリジン残基)を介してシルクポリペプチド(例えばAC4TAGLYS1)と、及び(ii)ジスルフィド結合を形成することによりシルクポリペプチドのシステイン残基(例えばシルクポリペプチドAC4TAGLYS1の反復単位ACにおけるシステイン残基)を介してシルクポリペプチド(例えばAC4TAGLYS1)と共有結合的に連結することもできる。
【0148】
上述のように、該物質(例えば色素又は酵素)は本発明のプロセスにおいて架橋を介してシルクポリペプチドと共有結合的に連結することができる。好ましくは、本発明の方法に使用される架橋試薬又はカップリング試薬は、1−エチル−3−(3−ジメチルアミノプロピル)−カルボジイミド塩酸塩(EDC)又はグルタルアルデヒドである。酵素β−ガラクトシダーゼ及びフルオレセイン色素と、シルクポリペプチドC16でコーティングされたポリアラミド繊維との架橋を実施例IIで説明する。
【0149】
好ましくは、共有結合的に連結/カップリングする物質は、ポリペプチド、脂質、色素、共役金属、活性炭、及び作用物質からなる群から選択される。最も好ましくは、
(i)ポリペプチドが酵素、好ましくはβ−ガラクトシダーゼ、抗体、ホルモン、好ましくはインスリン、又は抗原であり、
(ii)脂質がコレステロール、ステロイド、ワックス、又はオイルであり、
(iii)色素が合成色素、好ましくはアゾ化合物、無機色素、好ましくは金属塩、又は有機色素、好ましくはフルオレセイン色素若しくはローダミン色素であり、
(iv)共役金属がナノゴールド(商標)であり、
(v)活性炭が粉末活性炭(PAC)、粒状活性炭(GAC)及び押出成形活性炭(EAC)からなる群から選択され、
(vi)作用物質が医薬品、止血剤、成長刺激剤、抗炎症剤、防汚剤(anti-fouling)、抗微生物剤、抗細菌剤、抗真菌剤、農薬及びUV保護剤からなる群から選択される。
【0150】
組み込まれる物質は限定されるものではないが、固体、半固体又は液体であり得る。該物質はシルクポリペプチドと非共有結合的に連結することもできる。該物質がイオン(静電)連結(相互作用)を介して、疎水性連結(相互作用)を介して又は付着を介してシルクポリペプチドと非共有結合的に連結するのが特に好ましい。
【0151】
好ましくは、非共有結合的に連結/カップリングする物質は、ポリペプチド、脂質、色素、共役金属、活性炭、金属塩、及び作用物質からなる群から選択される。最も好ましくは、
(i)ポリペプチドが酵素、好ましくはβ−ガラクトシダーゼ、抗体、ホルモン、好ましくはインスリン、又は抗原であり、
(ii)脂質がコレステロール、ステロイド、ワックス、又はオイルであり、
(iii)色素が合成色素、好ましくはアゾ化合物、無機色素、好ましくは金属塩、又は有機色素、好ましくはフルオレセイン色素若しくはローダミン色素であり、
(iv)共役金属がナノゴールド(商標)であり、
(v)活性炭が粉末活性炭(PAC)、粒状活性炭(GAC)及び押出成形活性炭(EAC)からなる群から選択され、
(vi)金属塩が銅、コバルト、ニッケル又は銀からなる群から選択されるカチオンであり、
(vii)作用物質が医薬品、止血剤、成長刺激剤、抗炎症剤、防汚剤、抗微生物剤、抗細菌剤、抗真菌剤、農薬及びUV保護剤からなる群から選択される。
【0152】
塩化銅又は塩化コバルトのいずれかと、シルクポリペプチドC16でコーティングされたアラミド繊維との非共有結合的な連結を実施例IIIで説明する。
【0153】
非共有結合的なカップリングは、或る特定期間にわたり該物質の規定の放出を行わせるための金属塩又は作用物質のコーティングへの導入に好適である。これは、幾つかの目的、すなわち医薬技術におけるポリアラミド糸コーティングで必要とされる。現在ではこれにより、コーティングされた不活性な合成材料又は無機材料、例えばポリアラミド糸又は布地からの塩又は作用物質の制御放出を達成することが初めて可能となる。不活性な合成材料又は無機材料、例えばポリアラミド糸又は布地をかかる便利な方法で改良を加えることができることは全く予見不可能であった。
【0154】
他の用途、例えば撥水性布地の製造には、物質とシルクポリペプチドとの共有結合的な連結がより好適である。降雨中、組み込まれた物質はシルクでコーティングされた不活性合成材料、不活性無機材料又は自然発生的な材料から洗い流されることはないものとする。加えて、殺菌効果又は発散防止効果を有する布地の製造には、物質、例えば銀又は静菌性化合物と、シルクでコーティングされた不活性合成材料、不活性無機材料又は自然発生的な材料とを共有結合的に連結することも好まれる。
【0155】
本発明の方法の工程ii)を、4℃〜80℃、好ましくは4℃〜40℃の温度で行うのが好ましい。例えば、本発明の方法の工程ii)を、4℃、8℃、10℃、12℃、15℃、18℃、20℃、21℃、22℃、23℃、24℃、25℃、28℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃又は80℃で行うことができる。最も好ましくは、本発明の方法の工程ii)を20℃〜25℃で行う。
【0156】
本発明者らは驚くべきことに、不活性材料又は自然発生的な材料を、穏やかな反応条件、すなわち4℃〜80℃の温度等の穏やかな温度下でコーティングすることができることを見出している。コーティングされた製品は改善された触感特性及び光学特性を有する。好ましくは、該方法は、
iii)少なくとも2つの同一の反復単位及び任意選択的に少なくとも1つの非反復(NR)単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
iv)不活性材料又は自然発生的な材料上に該溶液を塗布することにより2回目として該不活性材料又は該自然発生的な材料をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)の該シルクポリペプチドが工程(i)の該シルクポリペプチドと同一である又は異なる。このため例えば、本発明の好ましい実施の形態では、該方法は、
iii)シルクポリペプチドC16と、溶媒としてギ酸とを含む溶液を準備する工程と、
iv)ポリアラミド繊維上に該溶液を塗布することにより2回目として該ポリアラミド繊維をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)のシルクポリペプチドC16は工程(i)のシルクポリペプチドC16と同一である。本発明の別の好ましい実施の形態では、該方法は、
iii)シルクポリペプチド(AQ)24NR4と、溶媒としてヘキサフルオロイソプロパノール(HFIP)とを含む溶液を準備する工程と、
iv)ポリテトラフルオロエチレン糸上に該溶液を塗布することにより2回目としてポリテトラフルオロエチレン糸をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)のシルクポリペプチド(AQ)24NR4は工程(i)のシルクポリペプチドC16とは異なる。本発明の更に好ましい実施の形態では、該方法は、
iii)シルクポリペプチドC16を含む水溶液を準備する工程と、
iv)ポリアラミド繊維上に該溶液を塗布することにより2回目としてポリアラミド繊維をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)のシルクポリペプチドC16は工程(i)のシルクポリペプチドC16と同一である。
【0157】
本発明の方法の工程(iii)及び工程(iv)は、様々な厚さ及び多重層のコーティングされた不活性材料又は自然発生的な材料を得るために数回、好ましくは3回〜10回、すなわち3回、4回、5回、6回、7回、8回、9回又は10回繰り返すのが好ましい。
【0158】
好ましくは、不活性材料又は自然発生的な材料のコーティングは、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、より好ましくは0.8μm〜8μm、最も好ましくは1.0μm〜5.0μm、すなわち1.0μm、1.1μm、1.2μm、1.3μm、1.4μm、1.5μm、1.6μm、1.7μm、1.8μm、1.9μm、2.0μm、2.1μm、2.2μm、2.3μm、2.4μm、2.5μm、2.6μm、2.7μm、2.8μm、2.9μm、3.0μm、3.1μm、3.2μm、3.3μm、3.4μm、3.5μm、3.6μm、3.7μm、3.8μm、3.9μm、4.0μm、4.1μm、4.2μm、4.3μm、4.4μm、4.5μm、4.6μm、4.7μm、4.8μm、4.9μm又は5.0μmの厚さを有する。
【0159】
コーティングされた不活性材料又は自然発生的な材料は、3層、4層、5層、6層、7層、8層、9層又は10層の異なる又は同一のシルクポリペプチド、好ましくは異なるシルクポリペプチドを含むのが好ましい。
【0160】
このため例えば本発明の好ましい実施の形態では、該方法は、
i)シルクポリペプチドC16を含む水溶液を準備する工程と、
ii)ポリアラミド糸上に溶液を塗布することによりポリアラミド糸をシルクポリペプチドC16でコーティングする、塗布することによりコーティングする工程と、
iii)シルクポリペプチド(AQ)24NR4を含む水溶液を準備する工程と、
iv)ポリアラミド糸上に溶液を塗布することにより2回目としてポリアラミド糸をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含み、工程(iii)のシルクポリペプチド(AQ)24NR4は工程(i)のシルクポリペプチドC16とは異なり、ポリアラミド糸のコーティングは2つの異なる層(すなわち第1の層:シルクポリペプチドC16及び第2の層:シルクポリペプチド(AQ)24NR4)を有し、0.05μmの厚さを有する。
【0161】
本発明の方法は工程ii)、工程iii)、及び/又は工程iv)の後に、可視光、紫外線若しくは耐水性、摩耗、機械的応力、酸及び/又は塩基に対する保護を与える染色/仕上げ加工により、コーティングされた又は非処理材料に事後改良を加える工程を含むのが更に好ましい。
【0162】
第2の態様では、本発明は、第1の態様の方法により入手可能なコーティングされた不活性材料又は自然発生的な材料を提供する。
【0163】
第3の態様では、本発明は、
(i)繊維、
(ii)(i)の繊維を含む糸、又は
(iii)(i)の繊維を含む撚糸、織布若しくは不織布
等の第2の態様のコーティングされた不活性材料又は自然発生的な材料を含む製品を提供する。
【0164】
第4の態様では、本発明は、或る特定の期間にわたる、好ましくは6時間から最大8日間にわたる、より好ましくは24時間から最大5日間にわたる、最も好ましくは12時間、24時間、48時間、72時間、96時間若しくは120時間にわたる少なくとも1つの物質、すなわち1個、2個、3個、4個、5個、6個若しくはそれ以上の物質、好ましくは1個若しくは2個の物質の制御放出のための、又は防護服若しくは撥水性の服の製造のための第2の態様のコーティングされた不活性材料又は自然発生的な材料の使用に関する。
【0165】
第5の態様では、本発明は、不活性材料を染色するためのシルクポリペプチドの使用に関する。不活性材料は合成不活性材料又は無機不活性材料であるのが好ましい。好ましくは、不活性材料が、
(i)ポリエステル、ポリアミド(PA)、ポリアラミド、ポリテトラフルオロエチレン(PTFE)、ポリエチレン(PE)、ポリプロピレン(PP)、ポリウレタン(PU)、シリコーン、ポリウレタンとポリエチレングリコールとの混合物(エラスタン)、超高分子量ポリエチレン(UHMWPE)、及び高性能ポリエチレン(HPPE)からなる群から選択される合成不活性材料、又は
(ii)ガラス、炭素、セラミック、金属、サファイア、ダイアモンド及び半導体からなる群から選択される無機不活性材料
である。
【0166】
更なる態様では、本発明は、アレルギー、発疹、湿疹皮膚炎、疱疹、皮膚感染症、乾癬、座瘡、日焼け及び疣贅からなる群から選択される皮膚疾患の治療又は予防のためのシルクポリペプチドに関する。好ましくは、皮膚疾患の予防は保湿効果及びUV線に対する保護に関する。
【0167】
別の態様では、本発明は、アレルギー、発疹、湿疹皮膚炎、疱疹、皮膚感染症、乾癬、座瘡、日焼け及び疣贅からなる群から選択される皮膚疾患の治療又は予防のための薬物の製造のためのシルクポリペプチドの使用に関する。好ましくは、皮膚疾患の予防は保湿効果及びUV線に対する保護に関する。
【0168】
添付の図面及び以下の実施例は本発明を単に説明するものであり、添付の特許請求の範囲により示されるような本発明の範囲を限定するものとは決して解釈されないものとする。
【図面の簡単な説明】
【0169】
【図1】糸をシルクポリペプチドでコーティングする技術プロセスを示す図である。図1によると、シルクポリペプチドをスプレーコーティングにより又はディップコーティングにより糸上に塗布することができる。
【図2】スパイダーシルクでコーティングされたアラミド(ケブラー)フィラメントの電子顕微鏡写真を示す図である。図2は、スパイダーシルクコーティングがアラミド(ケブラー)フィラメント全体にわたって均一に分布していることを示す。
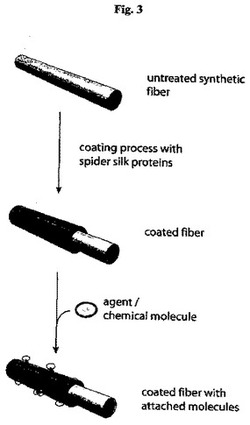
【図3】分子をスパイダーシルクコーティングに共有結合的に接着させる技術プロセスを示す図である。図3は、スパイダーシルクポリペプチドによる未処理の不活性合成繊維のコーティングと、その後の作用物質又は化学分子によるコーティングされた不活性合成繊維のコーティングとを示す。
【図4】未処理の製織済みの布地及びコーティングされた製織済みの布地の異なる倍率での電子顕微鏡写真を示す図である。
【図5】金色に脱色した欧州人の毛(A、B)のスパイダーシルクポリペプチドC16(3%)によるコーティング前(A)及びコーティング後(B)の、並びに脱色したことのない(virgin)欧州人の毛(C、D)のAQ24NR3(0.85%)によるコーティング前(C)及びコーティング後(D)のレーザー走査顕微鏡画像(レーザー強度倍率50×)を示す図である。図5A及び図5Bに示される四方形はコーティングの前後での同じセクションの毛サンプルの比較を可能にするために毛サンプル上の特定の特徴的なスポットを指定したものである。
【図6】C16(3%)によるコーティング前(A)及びコーティング後(B)のナイロン(PA)繊維のレーザー走査顕微鏡画像(レーザー強度倍率150×)を示す図である。
【図7】蛍光(EpiVax)及びCy5フィルター下での蛍光画像(Proxima−Imager)を示す図である。図7Aでは、Cy5を用いた又は用いないAQ24NR3のウェスタンブロット分析を示す。Cy5で標識化したAQ24NR3でコーティングされた人毛を図7B及び図7Cに示す。
【図8】未処理の人の皮膚(図8A)及びシルクタンパク質でのコーティング後の人の皮膚(図8B)を示す図である。シルクタンパク質によるコーティング後、皮膚の疎水性が大幅に低減し、これにより水滴の濡れ挙動が極めて大きくなる。図中の英語図1thread 糸spray スプレーbath 溶液槽coated thread コーティングされた糸 図2Spider Silk Coating スパイダーシルクコーティングKevlar ケブラーKevlar Filament ケブラーフィラメントCoated Kevlar Filament コーティングされたケブラーフィラメント 図3untreated synthetic fiber 未処理の合成繊維coating process with spider silk proteins スパイダーシルクタンパク質によるコーティングプロセスcoated fiber コーティングされた繊維agent/chemical molecule 作用物質/化学的分子coated fiber with attached molecules 接着した分子を有するコーティングされた繊 図4untreated 未処理coated fabric コーティングされた繊維
【発明を実施するための形態】
【実施例】
【0170】
コーティング反応を行うために、本発明者らは例示的に、ニワオニグモ(European gardencross spider Araneus diadematus)由来のドラグラインシルクタンパク質ADF−3及びADF−4から誘導される合成シルクポリペプチドC16、C32、C16NR4、(AQ)24及び(AQ)24NR3を設計した。これらのタンパク質は、ADF−3及びADF−4、並びにそれらの変異体が効率的な集合挙動を示すというこれまでの観察結果に基づき選択された。
【0171】
実施例I:スパイダーシルクポリペプチドC16によるアラミド繊維のコーティング
単一のアラミド(ケブラー)繊維を、室温(25℃)で2wt%/volのスパイダーシルクポリペプチドC16を含有するHFIP(ヘキサフルオロイソプロパノール)溶液中で5秒間インキュベートした。溶媒を蒸発させた後、スパイダーシルクポリペプチドC16がアラミド繊維の周りに透明な膜を形成した。電子顕微鏡検査により測定された膜の厚さは3μmであった(図2を参照されたい)。
【0172】
同じ結果を、ギ酸及び水等の他の溶媒を用いて得ることができる。同様の実験を、ナイロン繊維、ガラス繊維、炭素繊維、セルロース繊維、PTFE(テフロン登録商標)繊維、エラスタン(スパンデックス)繊維及び人毛を用いて行った。したがって記載の方法を用いて全ての試験繊維をコーティングすることができた。
【0173】
コーティングされた繊維の化学安定性を試験するために、スパイダーシルクポリペプチドC16コーティングを、8Mの尿素、6Mの塩酸グアニジン及び6Mのチオシアン酸グアニジン中で24時間インキュベートした。1Mのリン酸カリウム又は100%メタノールで処理したスパイダーシルクポリペプチドC16コーティングはチオシアン酸グアニジン中にだけ溶解することができた。スパイダーシルクポリペプチドC16コーティングのこの顕著な化学安定性は天然のドラグラインシルクの化学安定性と、及び組換えにより作製した集合化したADF−4の化学安定性と同程度である。これまでの研究から、集合化した構造体の集合性及び安定性をシルクタンパク質のアミノ酸配列と直接相関させることができた。このため、スパイダーシルクコーティングの特性は、対応するシルク遺伝子の操作を介してシルクタンパク質の一次構造を変えることにより直接修飾することができる。
【0174】
実施例II:物質とアラミド繊維上にコーティングしたシルクポリペプチドC16との化学架橋を介した共有結合的なカップリング
繊維の多くの用途には繊維表面上の特定の官能基の存在が必要とされる。スパイダーシルクコーティングに続いて物質を用いて改良を加えることができることを実証するために、原理の証明として、発色団フルオレセインと酵素β−ガラクトシダーゼとを、アラミド繊維上にコーティングしたシルクポリペプチドC16と化学的にカップリングさせた(図3を参照されたい)。カップリングは、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を用いてスパイダーシルクポリペプチドC16の表面に曝されたカルボキシル基を活性化することにより達成された。スパイダーシルクポリペプチドC16でコーティングされたアラミド繊維をエチレンジアミンとともに更にインキュベートし、アミドを形成させた。続いてエチレンジアミンの残りの遊離アミノ基をイソチオシアン酸フルオレセインとカップリングさせ、それにより安定したチオ尿素誘導体の形成を介したフルオレセインの効率的な共有結合的な連結がもたらされた。
【0175】
同様に、β−ガラクトシダーゼとEDCにより活性化されたC16膜とのインキュベーションにより、シルクポリペプチドC16のカルボキシル基と、β−ガラクトシダーゼの酵素表面でアクセス可能であった第1級アミン(例えばリジン残基由来)との間でアミド結合が形成された。かかる改良を加えた繊維を繰り返し洗浄した後でも、β−ガラクトシダーゼの活性を、基質として5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトピラノシド(X−Gal)を用いて検出することができた。
【0176】
実施例III:物質とアラミド繊維上にコーティングしたシルクポリペプチドC16との非共有結合的なカップリング
物質とスパイダーシルクポリペプチドC16でコーティングされたアラミド繊維との上述の共有結合的なカップリングに加えて、非共有結合的なカップリングも行った。単一のアラミド繊維を2wt%/volのスパイダーシルクポリペプチドC16と塩化銅又は塩化コバルトとを含有するギ酸中で室温(25℃)で5秒間インキュベートした。溶液槽から取り出し、溶媒を蒸発させた後、塩化コバルト又は塩化銅がスパイダーシルクポリペプチドC16でコーティングされたアラミド繊維の周りに色の付いた膜を形成した。
【0177】
実施例IV:スパイダーシルクポリペプチドC16による綿織布のコーティング
単繊維だけではなく、製織済みの布地もスパイダーシルクによるコーティングに好適なテンプレートである。綿の製織済みの布地及び綿繊維を2wt%/volのスパイダーシルクポリペプチドC16溶液中で別々にインキュベートした。乾燥した後、綿織布及び綿繊維は同程度のコーティング挙動を示した(図4を参照されたい)。
【0178】
このため既製の布地の直接コーティングにより、既にシルクでコーティングされた繊維で作られた布地と比較して同程度であるが、異なるコーティングパターンがもたらされる。例えば布地のコーティングにより、隙間をコーティングすることができるが、布地のコーティングでなければスパイダーシルクコーティングによって繊維及び交差箇所だけしかコーティングされ(engulfed)ず、隙間はコーティングされない。これは製織前の繊維のコーティング又は製織済みの布地の処理のいずれによっても、様々な用途に好適なむらなくコーティングされた材料がもたらされることを示している。
【0179】
実施例V:スパイダーシルクポリペプチドC16によるアラミド糸のディップコーティング
スパイダーシルクポリペプチドC16によるアラミド糸のディップコーティングを行うために、スパイダーシルクポリペプチドC16を水溶液(10mMのトリス、pH7.5)に溶解した。水溶液中のシルクポリペプチドC16の濃度は2wt%/volであった。ディップコーティング手法(図1も参照されたい)には、以下のものが含まれていた。
i)浸漬:アラミド糸を5m/sの一定速度でスパイダーシルクポリペプチドC16溶液中に浸漬し、
ii)インキュベーション:基材をコーティング溶液中で2分間インキュベートし、コーティング材を基材に付着させ、
iii)引き揚げ:アラミド糸から余分な基材を5m/sの一定速度で取り除き、
iv)後処理:コーティングを室温(25℃)で乾燥した。
【0180】
実施例VI:スパイダーシルクポリペプチドC16によるアラミド糸のスプレーコーティング
スパイダーシルクポリペプチドC16によるアラミド糸のスプレーコーティングを行うために、スパイダーシルクポリペプチドC16を水溶液(10mMのトリス、pH7.5)に溶解した。水溶液中のシルクポリペプチドC16の濃度は2wt%/volであった。スプレーコーティング手法(図1も参照されたい)には、以下のものが含まれていた。
i)準備:スパイダーシルクポリペプチドC16溶液をスプレー缶又は噴霧装置に移し、
ii)コーティング:シルクポリペプチドC16溶液をスプレー缶によりアラミド糸上に均一に分配させ、
iii)後処理:コーティングを室温(25℃)で乾燥した。
【0181】
実施例VII:スパイダーシルクポリペプチドC16によるアラミド糸のパディング
スパイダーシルクポリペプチドC16をギ酸中に溶解した。ギ酸中のシルクポリペプチドC16の濃度は10mg/mlであった。異なるタイプの糸(テフロン登録商標(Goodfellow、繊維径:0.0211mm)、セルロース(Goodfellow、繊維径:0.015mm)、原綿、ケブラー(Goodfellow、繊維径:0.017mm)、エラスタン(スパンデックス)、未処理の人毛及び処理済みの(フケを含まない)人毛)をディップコーティング方法に従ってコーティングした。スパンデックス及び原綿糸は脱イオンH2Oで洗浄し、乾燥した後にコーティングした。糸をスパイダーシルクポリペプチドC16/ギ酸溶液中で5秒間インキュベートし、コーティング材を基材に付着させた。コーティングを室温(25℃)で乾燥した。
【0182】
実施例VIII:スパイダーシルクポリペプチドC16によるナイロン糸のコーティング
スパイダーシルクポリペプチドC16を水溶液(10mMのトリス、pH7.5)に溶解した。ギ酸中のシルクポリペプチドC16の濃度は1wt%/volであった。ナイロン糸(Goodfellow、繊維径:0.01mm)をコーティング溶液中で5秒間インキュベートし、コーティング材を基材に付着させた。コーティングを室温(25℃)で乾燥した。
【0183】
実施例IX:様々なスパイダーシルクタンパク質による材料のコーティング
材料(コーティングされたスライドガラス、特にシリコンマトリクス(Sciences Services,Munich, Germany)を有するコーティング材でコーティングされたスライドガラス)をコーティングするために様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32を使用した。様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32によるスライドガラスのコーティングは、コーティングされたスライドガラス、特にシリコンマトリクスでコーティングされたスライドガラスとともに例示的に示されている。様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32による、コーティングされたスライドガラス、特にシリコンマトリクスでコーティングされたスライドガラスのコーティングの結果は、様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32による他のスライドガラス(コーティングされていない、特にシリコンマトリクスを有するコーティング材ではコーティングされていない)のコーティングの結果と類似している。トリス緩衝水溶液中のC16、AQ24NR3及びC16NR4の最終タンパク質濃度はそれぞれ、3%、0.5%及び2.1%であった。ディップコーティング方法を使用した。上記方法には以下の工程が含まれていた:溶液中への60秒のディッピング、溶液から取り出して30秒の乾燥、溶液中への材料の30回の再浸、及び精製水(Milli−Q)によるすすぎ。AQ24、C8及びC32を2%の濃度でギ酸中に溶解した。スピンコーティング方法を1000rpmで1分間使用した。それから材料(コーティングされたスライドガラス、特にシリコンマトリクスを有するコーティング材でコーティングされたスライドガラス)の表面を小さい針を用いて削った。コーティングされた材料と非コーティング(raw)材料との高さの差異をレーザー走査顕微鏡(VK 9700 Keyence, NeuIsenburg, Germany)を用いて様々なスポットで分析した。
【0184】
表1は、材料(スライドガラス)を様々なスパイダーシルクタンパク質で均質にコーティングすることができたことを示している。コーティングの厚さはタンパク質の性質(親水性及び電荷)、溶媒の湿潤性及びコーティング方法によって変わる。
【0185】
【表1】

「**」:高度に均質なコーティング 「*」 :均質なコーティング
表1の英語
Spider silk protein:スパイダーシルクタンパク質
coating:コーティング
Coating thickness:コーティングの厚さ
Homogeneity:均質性
yes:あり
【0186】
実施例X:様々な溶媒を用いるスパイダーシルクポリペプチドC16による材料のコーティング
様々な溶媒(100mMのトリス、pH8;トリフルオロ酢酸;ギ酸;ヘキサフルオロイソプロパノール)を、C16を溶解し、材料(コーティングされたスライドガラス、特にシリコンマトリクス(Sciences Services, Munich, Germany)を有するコーティング材でコーティングされたスライドガラス)をコーティングするために使用した。様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32によるスライドガラスのコーティングは、コーティングされたスライドガラス、特にシリコンマトリクスでコーティングされたスライドガラスとともに例示的に示されている。様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32による、コーティングされたスライドガラス、特にシリコンマトリクスでコーティングされたスライドガラスのコーティングの結果は、様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32による他のスライドガラス(コーティングされていない、特にシリコンマトリクスを有するコーティング材ではコーティングされていない)のコーティングの結果と類似している。コーティングには、水溶液(トリス(100mM、pH8))を使用した。上記溶液中のC16の最終タンパク質濃度は3%であった。ディップコーティング方法を使用した。上記方法には以下の工程が含まれていた:溶液中への60秒のディッピング、溶液から取り出して30秒の乾燥、溶液中への材料の30回の再浸、及びミリポア水によるすすぎ。またC16を1%の最終濃度でトリフルオロ酢酸、ギ酸及びヘキサフルオロイソプロパノール中に直接溶解した。スピンコーティング方法を1000rpmで1分間使用した。それからコーティングされた材料(コーティングされたスライドガラス、特にシリコンマトリクスを有するコーティング材でコーティングされたスライドガラス)の表面を小さい針を用いて削った。コーティングされた材料と非コーティング材料との高さの差異をレーザー走査顕微鏡(VK 9700 Keyence, Neu-Isenburg, Germany)を用いて様々なスポットで分析した。
【0187】
表2は、材料(スライドガラス)をC16でコーティングすることができたことを示している。厚さはタンパク質の性質、溶媒の湿潤性及びコーティング方法によって変わる。
【0188】
【表2】

**:高度に均質なコーティング *:均質なコーティング
表中英語
Solvent:溶媒
Coating:コーティング
Coating thickness:コーティングの厚さ
Homogeneity:均質性
溶媒名上から順次:100mMのトリス、pH8、トリフルオロ酢酸、ギ酸、ヘキサフルオロイソプロパノール
【0189】
実施例XI:C16による自然発生的な材料のコーティング
C16及びAQ24NR3を用いて、人毛、綿(「Obergarn」繊維)、ゴム、羊毛及びセルロース(Good fellow、d=0.015mm、Huntington, GreatBritain)等の様々な自然発生的な材料(有機材料)をコーティングした。金色に脱色した欧州人の毛を3%のタンパク質濃度でC16のトリス緩衝水溶液(100mM、pH8)を用いてドロップコーティングし(drop-coated)、その後乾燥して(until drying)、精製水(Milli Q)ですすいだ。脱色したことのない欧州人の毛を0.85%のタンパク質濃度で精製水(Milli Q)に溶解したAQ24NR3の溶液を用いてドロップコーティングし、その後乾燥した。綿、ゴム、羊毛及びセルロースを、1.35%のタンパク質濃度でC16のトリス緩衝水溶液(100mM、pH8)を用いてコーティングした。ディップコーティング方法を使用した。上記方法には以下の工程が含まれていた:溶液中への120秒のディッピング、溶液から取り出して120秒の乾燥、溶液中への材料の10回の再浸、及び精製水(Milli Q)によるすすぎ。それぞれのコーティングされた繊維(コーティング)をコーティングされていない参照繊維(参照)と比較した。人毛、綿、羊毛及びセルロースのコーティングされた繊維とコーティングされてない繊維の半径を比較して、コーティングの厚さを定量化した。コーティングをレーザー走査顕微鏡(VK 9700 Keyence, Neu-Isenburg, Germany)を用いて様々なスポットで分析した。結果を表3にまとめる。
【0190】
【表3】

Ra@:計算による中間の高さ **:高度に均質なコーティング
*:均質なコーティング X:僅かに均質なコーティング
表中英語
Material:材料
Coating:コーティング
radius References:半径(参照)
Radius Coating:半径(コーティング)
Coating thickness:コーティングの厚さ
Roughness Ra@:粗度
Coating:コーティング
Reference:参照
Homogeneity:均質性
Treated Hair:処理した毛
Virgin Hair:脱色したことのない毛
Cotton:綿
Rubber:ゴム
Wool:羊毛
Cellulose:セルロース
Yes:あり
【0191】
表3は、様々な自然発生的な材料(有機材料)のコーティングを示している。これらの材料はコーティング後に厚さの増大を示した。処理した毛及び脱色したことのない毛は粗度の低減を示した。綿繊維は撚り合わされ、より大きい繊維を形成した。そのため単繊維を画像化し、直径の差異を推測することは困難であった。繊維は長さ全体にわたって一定の直径を有していなかったため、厚さを正確に推測することはできなかったが、コーティングははっきりと見て取れた。羊毛はC16で均質にコーティングすることができた。セルロースはC16でコーティングすることができた。セルロースの特質のために、この実験では該コーティング方法による均質なコーティングを検出することはできなかった。セルロースはおおよそ平滑な繊維ではないため、均質とするにはコーティングの厚さが十分ではなかった。しかしながら、コーティングサイクルの回数の増大により、コーティングの均質性を増大させることができる。
【0192】
図5におけるレーザー走査画像は、ヘアケラチン繊維のコーティングの差異を示している。脱色した毛及び脱色したことのない毛の両方で、コーティングの際にキューティクルが消失し、繊維表面がより均質になった。粗度がコーティングの厚さに伴い低減した。コーティング材の添加により毛繊維が平滑になった。光反射はレーザー強度として測定することができた。参照となる脱色した毛では、全長にわたる平均値は13198であり、コーティングされた毛では、(16384のグレイステップ(grey steps)に対して)平均値は約13632であった。参照となる脱色したことのない毛では、平均値は約13517であったが、コーティングされた毛の平均値は13746であった。レーザー強度はグレイステップで特定する。最小値は0の値を示し、最大値は16384の値を示す。値が高くなると、サンプル/材料の反射/輝度が高くなる。脱色した毛及び脱色したことのない毛の場合、コーティングされた毛の値はそれぞれ参照と比較して高かった。コーティングは繊維の輝度を高めた。
【0193】
実施例XII:スパイダーシルクポリペプチドC16による無機不活性材料のコーティング
C16を用いて、ガラス(スライドガラス、Roth; Karlsruhe,Germany)、炭素(炭素繊維プレート、R&G GmbH)及び金属(金属プレート)等の様々な無機不活性材料をコーティングした。スライドガラスでは,C16をギ酸中に直接溶解した(最終タンパク質濃度1%)。スピンコーティング方法を1000rpmで1分間使用した。炭素及び金属プレートでは、コーティングをC16の水溶液(100mMのトリス、pH8)を用いて行った。最終濃度は1.35%であった。炭素プレートでのディップコーティング方法には以下の工程が含まれていた:溶液中への120秒のディッピング、溶液から取り出して120秒の乾燥、溶液中への材料の10回の再浸、及びミリポア水によるすすぎ。金属プレートでのディップコーティング方法には以下の工程が含まれていた:溶液中への120秒のディッピング、溶液から取り出して120秒の乾燥、溶液中への材料の1000回の再浸、及び精製水(Milli Q)によるすすぎ。それからコーティングされた材料(金属プレート、炭素プレート)の表面を小さい針を用いて削った。コーティングされた材料(金属プレート、炭素プレート)の表面をレーザー走査顕微鏡(VK 9700 Keyence, Neu-Isenburg, Germany)を用いて様々なスポットで分析した。コーティングされた材料とコーティングされてない材料とを比較した。コーティング材料と非コーティング材料との間の高さの差異により、コーティングの厚さを推測した。コーティングは基材表面を平滑にした。結果を表4にまとめる。
【0194】
【表4】

Ra:計算による中間の高さ Rq:二次高さ平均 *:均質なコーティング
X:僅かに均質なコーティング
表中英語
Inorganic inert material:無機不活性材料
Coating:コーティング
Coating thickness:コーティングの厚さ
Roughness:粗度
Reference:参照
Homogeneity:均質性
Carbon fiber plate:炭素繊維プレート
Yes:あり
【0195】
表4は、無機材料上のC16コーティングの厚さを示している。ガラス、炭素及び金属をコーティングすることができた。ガラスの場合、均質なコーティングを検出することができた。コーティングされたガラスはコーティングされていないガラス(参照)と比較して粗度の低減を示した。
【0196】
実施例XIII:スパイダーシルクポリペプチドC16による合成不活性材料のコーティング
C16を用いて、ポリエステル(PET、Syngarn繊維)、ポリアミド(PA、Goodfellow、d=0.01mm)、ポリテトラフルオロエチレン(PTFE、Good Fellow、d=0.0211mm)、ポリプロピレン(PP、Good Fellow製のプレート)、超高分子量ポリエチレン(UHMW PE、GoodFellow製のプレート)、エラスタン及びポリアラミド等の様々な合成不活性材料をコーティングした。ポリエステル、ポリアミド、PTFE、ポリプロピレン、UHMWポリエチレンのコーティングはC16の水溶液(100mMのトリス、pH8)を用いて行った。最終タンパク質濃度は1.35%であった。ディップコーティング方法を使用した。上記方法には以下の工程が含まれていた:溶液中への60秒のディッピング、溶液から取り出して30秒の乾燥、溶液中へのサンプルの30回の再浸、及びミリポア水によるすすぎ。エラスタン及びポリアラミドを14%の最終タンパク質濃度でC16のトリス緩衝溶液(100mM、pH8)を用いてコーティングした。繊維を溶液中に3回ディッピングし、ミリポア水ですすいだ。各材料をコーティングされていない参照と比較した。PE、PA、PTFE、エラスタン及びポリアラミドは繊維の形態であった。コーティングの厚さを推測するために、繊維の半径を比較することができる。繊維の全長にわたるコーティングの厚さを推測することは不可能であった。このため、繊維をレーザー走査顕微鏡(VK 9700 Keyence, Neu-Isenburg, Germany)を用いて様々なスポットで分析した。結果を表5にまとめる。
【0197】
【表5】

表中英語
Synthetic inert material:合成不活性材料
Coating:コーティング
Radius ref:半径(参照)
Radius coated:半径(コーティング)
Coating thickness:コーティングの厚さ
Homogeneity:均質性
Yes:あり
【0198】
表5は合成不活性材料上のC16コーティングの厚さを示している。全ての材料をコーティングすることができた。PET、PA、PTFE、エラスタン及びポリアラミドの場合、コーティングされていない参照と比較したコーティングされた合成不活性材料の厚さの増大が検出された。PTFE繊維の場合、コーティングは僅かに均質であった。4.3μmというコーティングの厚さの値は平均である。PP及びUHMW PEプレートでは、コーティングをはっきりと検出することができた。エラスタンは撚り合わされた多くの繊維からなる。このため、測定した厚さの値は撚り合わされた幾つかの繊維上のコーティングの厚さを表す。ポリアミド(PA)繊維の平滑表面のコーティングでは、均質性の低い表面が生じた。これはポリアミド(PA、ナイロン)繊維のレーザー走査顕微鏡画像(図6)によって示される。C16によるコーティング前(図6A)及びコーティング後(図6B)の繊維が示される。コーティングは繊維全体にわたって検出可能であった。コーティング後、繊維表面の均質性は低かった(図6B)。
【0199】
実施例XIV:Cy5蛍光タグと架橋したAQ24NR3による人毛のコーティング
AQ24NR3(タンパク質濃度4mg/ml)のチオシアン酸グアニジン溶液(5M)を調製し、pH8で100mMのトリス緩衝液に対して透析し、1mg/mlのタンパク質溶液を得た(このタンパク質によるコーティングを図7Bに示す)。更なる実験で、AQ24NR3(タンパク質濃度2mg/ml)の5M尿素溶液を調製し、pH8で100mMのトリス緩衝液に対して透析した(このタンパク質によるコーティングを図7Cに示す)。タンパク質溶液をAmersham(商標)Cy(商標)5 Maleimide Mono−Reactive Dye(GE Healthcare、カタログ番号PA25031)で標識化した。蛍光タグによるバイオコンジュゲーション(bioconjugation)をシステインのスルフヒドリル基(1分子あたり1つ)を用いて行った。ジスルフィド結合を低減するのに使用する18mg/mlのTCEPのトリス溶液(10μL、トリス(2−カルボキシエチル)ホスフィン)(pH7)をタンパク質溶液に添加した。タンパク質溶液を室温(RT)で10分間インキュベートした。Cy5−マレイミド(GE Healthcare)の色素溶液を50μLの無水ジメチルホルムアミド(Dimethylformamide)(DMF)と混合し、そのうち40μLをタンパク質溶液に添加した。溶液を室温で2時間及び4℃で終夜インキュベートした。タンパク質溶液(3μg)をウェスタンブロット分析に直接使用した。
【0200】
未処理の人毛をタンパク質溶液中に10分間入れ、純水(milli Q)ですすいだ(図7B)。インド人の毛先を標的化したタンパク質溶液中に10分間入れ、それから空気乾燥した(図7C)。毛及びゲルを、Epi−Vex光とCy5フィルターを有するProximaを用いて画像化した(図7A)。ウェスタンブロットゲル上で、標識化したAQ24NR3タンパク質と標識化していないAQ24NR3タンパク質とを比較した。標識化したタンパク質だけをCy5フィルター下で検出することができる。結果として、蛍光標識化したタンパク質が発光し、標識化していないものは見ることができなかった。タンパク質は蛍光色素と共有結合した。溶液中のシルクを、様々なアドレス可能なアミノ基を用いて化学的に修飾することができる。Cy5で標識化したAQ24NR3タンパク質を用いて、コーティング特質及び蛍光特質を変えることなく毛等の様々な基材をコーティングすることができる。毛のコーティングはCy5フィルター下で見ることができる(図7)。
【0201】
全体的な結論として、実験により、本発明の方法が合成不活性材料、無機不活性材料及び自然発生的な材料のコーティングを可能にすることが例示的に示される。コーティングの均質性はシルクの化学的性質(親水性及び電荷)、材料の化学的性質、材料の形状、選択される溶媒及びコーティング方法によって変わる。化学的に修飾されたシルクタンパク質を様々な基材上にコーティングすることもできる。
【0202】
実施例XV:AQ24NR3によるインド人の毛及び脱色したことのない人毛のコーティング
実験により、欧州人の脱色したことのない毛(一度も化学物質で処理していない)及びインド人の毛(化学物質で処理し、エクステンションに使用する)に対するタンパク質コーティングの効果が示される。タンパク質AQ24NR3を毛の処理のために様々なタンパク質濃度で使用した。0.2%タンパク質溶液では、AQ24NR3を5Mの尿素に溶解し、純水(Milli Q)に対して透析した。0.6%及び0.85%タンパク質溶液では、AQ24NR3を任意の透析工程を用いずに純水(Milli Q)に直接溶解した。欧州人の脱色したことのない毛又はインド人の毛を上述のタンパク質溶液中に約10分間入れ、それから空気乾燥した。欧州人の脱色したことのない毛又はインド人の毛上の全く同じスポット(粘着テープ(adhesive strip)及び油性マーカーで印を付ける)を、上述のタンパク質溶液による処理の前後でレーザー走査顕微鏡(VK 9700 Keyence, Neu Isenburg, Germany)を用いて分析した。結果を表6〜表9に示す。分析をKeyenceのVKアナライザを用いて行った。
【0203】
【表6】

表中英語
表6.Thickness coating on Indian hair:インド人の毛上のコーティングの厚さ
Conditioner concentration:コンディショナーの濃度
Radius untreated hair:未処理の毛の半径
Radius treated hair:処理した毛の半径
Coating thickness:コーティングの厚さ
表7.Average surfeace roughness(Ra) of indian hair:インド人の毛の平均表面粗度(Ra)
Conditioner concentration::コンディショナーの濃度
Ra untreated hair:未処理の毛のRa
Ra treated hair:処理した毛のRa
Roughness reduction:粗度の低減
表8.Thickness coating on European virgin hair:欧州人の脱色したことのない毛上のコーティングの厚さ
Conditioner concentration:コンディショナーの濃度
Radius untreated hair:未処理の毛の半径
Radius treated hair:処理した毛の半径
Coating thickness:コーティングの厚さ
表9.Average surface roughness(Ra) of European virgin hair:欧州人の脱色したことのない毛の平均表面粗度(Ra)
Conditioner concentration:コンディショナーの濃度
Ra untreated hair:未処理の毛のRa
Ra treated hair:処理した毛のRa
Roughness reduction:粗度の低減
【0204】
タンパク質溶液の濃度の増大(すなわち0.2%から0.85%への)により、コーティングされた毛の半径の増大がもたらされた。毛表面の粗度がコーティングの厚さの増大に伴い低減した。加えて、毛表面の平滑性がコーティングの厚さの増大に伴い増大した。
【0205】
実施例XVI:スパイダーシルクタンパク質C16による人の皮膚のコーティング
未処理の人の皮膚(図8A)及びシルクタンパク質によるコーティング後の人の皮膚(図8B)。水滴(明確にするために染色した)は通常、無傷の皮膚の疎水性の性質により人の皮膚を湿らせることはない。シルクタンパク質によるコーティング後、皮膚の疎水性が大幅に低減し、水滴の極めて高い濡れ挙動がもたらされる。
【0206】
詳細には、スパイダーシルクタンパク質C16(1mg/ml)の尿素溶液(5%)を調製した。ラウリル硫酸ナトリウム無含有石鹸で手の皮膚を洗浄し、続いて空気乾燥した後、40μlのタンパク質−尿素溶液(B)及び40μlの尿素(5%)対照溶液(タンパク質なし)(A)を規定の皮膚領域上に塗布した(図8を参照されたい)。シルクコーティングにより、間断ない不可視膜が生じ、これにより皮膚の親水性が増大し、皮膚の保護がもたらされる。乾燥後、40μlの純水を皮膚上に塗布した(図8)。シルクでコーティングされた皮膚の親水性の増大により、水を皮膚に即座に浸透させることが可能であったが(図8B)、図8Aでは水滴はコーティングされていない皮膚に浸透しなかった。図8B(シルクでコーティングされた皮膚)は、はっきりした水滴を示す図8A(コーティングされていない皮膚)に比して広領域にわたり広がる水滴を示す。コーティング不可視膜の保護特性は、水/石鹸による洗浄と乾燥とのサイクルに数回耐えた。
【技術分野】
【0001】
本発明は、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法に関する。本発明は更に、上記方法により入手可能なコーティングされた不活性材料又は自然発生的な材料に、及びその使用に関する。本発明は、上記コーティングされた材料を含む製品にも関する。
【背景技術】
【0002】
スパイダーシルクは、特別な物理特性を示すタンパク質ポリマーである。様々なタイプのスパイダーシルクの中でも、ドラグラインが最も広く研究されている。ドラグラインシルクは円網を張るクモにより、それらの網の縦糸及び横糸を構築するのに、並びに命綱として利用されている。これらの目的のために、高い引張強度及び弾性が要求される。かかる特性の組み合わせにより、ほとんどの他の既知の材料よりも大きい靭性が得られる。例えばニワオニグモ(Araneus diadematus)のドラグラインシルクは、鋼(1.3GPa)及びアラミド繊維の引張強度とほぼ同等の1.9GPaと高い引張強度を示す。
【0003】
大腸菌におけるスパイダーシルクタンパク質の組換えによる生成のための系が過去に開発されている(特許文献1、特許文献2)。例として、特許文献1(特許文献3に対する優先権を主張している)に言及される。この発現系では、単一構成要素(=モジュール)を自由に変えることができ、そのため具体的な事例の要件に適合させることができる。このタイプのモジュールは、非特許文献1にも開示される。更なるモジュールは特許文献4に記載される。スパイダーシルクタンパク質を糸に加工することができることは自然と知られている。クモは様々なタイプのタンパク質を用いて、シルク糸及びクモの巣を形成するエキスパートである。スパイダーシルクタンパク質を糸へと変形させる技術的プロセスが、例えば特許文献5で説明されている。
【0004】
合成材料又は無機材料、例えば合成繊維又は無機繊維は、何十年にわたり産業的に重要なものとなっている。これらの中でも、例えばアラミド糸ケブラーは、等重量ベースで鋼の5倍の強度があり、同時に軽量である。また該アラミド糸ケブラーは、低い導電率を示し、非常に高い耐薬品性を有する、すなわち不活性である。一方で、この条件は例えば防護服に望ましい。しかしながら他方では、アラミド糸は製造後に改良を加えるのが非常に困難である。効率良くアラミド糸を染色する、又はアラミド糸の表面に分子を接着させるのはほぼ不可能である。またアラミド糸は可湿性を僅かしか有しない。このことは、他の不活性な合成材料又は無機材料でも当てはまる、すなわち該他の不活性な合成材料又は無機材料は、高い耐薬品性を有し、可湿性を僅かしか有さず、穏やかな条件下で、すなわち低温下でかつ毒性溶媒を用いずに重合後に改良を加えることができない。一般的なコーティングは不活性な合成材料又は無機材料、例えば不活性な合成繊維又は無機繊維の表面に十分に密着せず、また一般的なコーティングはあまり耐久性を有さず、又は厳しい条件、すなわち高温及び/若しくは毒性溶媒下で塗布しなければならない。
【0005】
このため、好ましくは低温下でかつ毒性溶媒を用いずに製造後に不活性な合成材料又は無機材料、例えば不活性な合成糸又は無機糸に改良を加える新規の好適な方法が必要とされている。
【0006】
本発明者らは驚くべきことに、コーティング材としてのシルクポリペプチドの使用が最も穏やかな条件下での効率性の高いコーティングを提供し、特定用途に合わせたシルクでコーティングされた不活性な合成材料又は無機材料の製造を可能にすることを見出している。今日までは、(たとえ可能であったとしても)プラズマ処理のような非常に厳しい条件が不活性な合成材料又は無機材料、例えば不活性な合成繊維又は無機繊維に変更を加えるのに必要であった。またシルクポリペプチドを用いることで利用可能となる不活性な合成材料又は無機材料をコーティングする方法は存在せず、より重要なことには、これまで完全に不可能であると思われてきたために、既存の不活性な合成繊維又は無機繊維を純粋なシルクの層でコーティングすることについて考える人はいなかった。
【0007】
本発明のコーティングにより、穏やかな条件下で、すなわち低温下でかつ毒性溶媒を用いずに、分子を不活性な合成材料又は無機材料に接着させることが可能になる。例えば医療技術では、医薬品等の作用物質を非破壊条件下でシルクに覆われた不活性材料に効率的に連結させることができる。
【0008】
加えて、不活性な合成材料又は無機材料は幾つかの制限を示す。ほとんどの不活性な合成材料又は無機材料、例えばアラミド繊維又は炭素繊維等の不活性な合成繊維は、例えば昆虫シルク等の天然繊維と比較すると表面の感触が望ましくない。これは、ほとんどの不活性な合成材料又は無機材料がザラザラしており(harsh)、粗く脆弱であり、そのため触り心地が良くないことを意味する。他方で、昆虫シルク繊維は不活性な合成繊維又は無機繊維の特質を共有しておらず、はるかに高価であることが多い。
【0009】
したがって、改善された表面の感触、すなわち改善された触感を有する新規の不活性な合成材料又は無機材料が必要とされている。
【0010】
本発明者らは驚くべきことに、シルクでコーティングされた不活性な合成材料又は無機材料、例えばシルクでコーティングされたアラミド繊維又は炭素繊維は、不活性な合成材料又は無機材料の利点と、天然材料の利点とを兼ね揃えることを見出している。シルクでコーティングされた不活性な合成材料又は無機材料は改善された表面の感触(触感)を有し、このことがこれらの材料の触り心地をより良くしている。この効果はシルク表面によりもたらされる光沢により達成され、該シルク表面はアラミド繊維の無光沢の外観、又は炭素繊維の黒色の表面よりも魅力的である。例として、ケブラー布は粗く不快な表面の感触により皮膚の付近での又は皮膚での適用にとって最適レベルに到達しない。しかしながらシルクでコーティングされたケブラー布は快適である。
【0011】
また、産業は、新規の大幅に改善された物理的、化学的及び生物学的な特性及び機能性を示すように、綿又は羊毛等の自然発生的な材料を改良しようと常に試みている。さらに、繊維産業では、綿又は羊毛等の自然発生的な材料に、通気性及び着用の快適性を保持しながら、改善された強度、弾性、曲げ剛性及び/又は運動に対する抵抗性を与えることが望まれる。
【0012】
本発明者らは驚くべきことに、シルクポリペプチドの使用により、上述の所望の特性を有するコーティングされた自然発生的な材料の製造を可能にする効率性の高いコーティング反応がもたらされることを見出している。
【0013】
シルクポリペプチドを用いる本発明のコーティング反応により、分子を自然発生的な材料に効率的に接着させ、具体的な用途に合わせた材料、例えばコーティングされた繊維製品、衣類、並びにUV遮断性、抗微生物性及び自浄性を与える活性の高い表面を有する履物用の繊維製品を製造することも可能になる。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】国際公開第2006/008163号
【特許文献2】国際公開第2006/002827号
【特許文献3】米国仮出願第60/590,196号
【特許文献4】国際公開第2007/025719号
【特許文献5】国際公開第2007/031301号
【非特許文献】
【0015】
【非特許文献1】Hummerich, D., Helsen, C.W., Oschmann, J., Rudolph, R. &Scheibel, T. (2004): "Primarystructure elements of dragline silks and their contribution to proteinsolubility and assembly, Biochemistry 43, 13604-13612"
【発明の概要】
【0016】
第1の態様では、本発明は、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法であって、
i)少なくとも2つの同一の反復単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
ii)不活性材料又は自然発生的な材料上に該溶液を塗布することにより該不活性材料又は該自然発生的な材料を該シルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含む、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法を提供する。
【0017】
第2の態様では、本発明は、第1の態様の方法により入手可能なコーティングされた不活性材料又は自然発生的な材料を提供する。
【0018】
第3の態様では、本発明は、第2の態様のコーティングされた材料を含む製品を提供する。
【0019】
第4の態様では、本発明は、第2の態様のコーティングされた不活性材料又は自然発生的な材料の使用に関する。
【0020】
第5の態様では、本発明は、不活性材料を染色するためのシルクポリペプチドの使用に関する。この発明の概要は必ずしも本発明の特徴を全て記載しているわけではない。
【0021】
本発明を以下で詳細に説明する前に、本発明は本明細書に記載の特定の方法論、プロトコル及び試薬に限定されない(なぜなら、これらの方法論、プロトコル及び試薬は変化し得るものであるためである)ことを理解するべきである。本明細書で用いられる専門用語は特定の実施の形態を説明するためのものにすぎず、本発明の範囲を限定することは意図されず、該範囲は添付の特許請求の範囲でのみ限定されることも理解すべきである。本明細書で他に特に規定されない限り、本明細書で用いられる技術用語及び科学用語は全て、当業者が一般的に理解するものと同じ意味を有する。
【0022】
好ましくは、本明細書で用いられる用語は、"A multilingual glossary ofbiotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W, Nagel, B. and Kolbl, H.編(1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland)で記載されるように定義される。
【0023】
幾つかの文献が本明細書の本文全体を通して引用されている。本明細書で引用される文献(全ての特許、特許出願、科学刊行物、製造業者の仕様書、取扱説明書、GenBankアクセッション番号配列寄託書等を含む)の各々が、上記又は下記に関わらず、その全体が参照により本明細書に援用される。本発明が先行発明のためにかかる開示に先行する権利がないことの承認として解釈されるものは本明細書には存在しない。
【0024】
以下で本発明の要素を説明する。これらの要素を特定の実施の形態とともに挙げるが、付加的な実施の形態を作成するために任意の様式で及び任意の数で該要素を組み合わせることができることを理解すべきである。様々に記載された実施例及び好ましい実施の形態は、本発明を明示的に記載された実施の形態のみに限定するものとは解釈されるべきではない。本記載は明示的に記載された実施の形態を任意の数の開示された及び/又は好ましい要素と組み合わせる実施の形態を支持及び包含するものと理解されるべきである。さらに、本願において記載されたあらゆる要素の任意の並べ替え及び組み合わせは、文脈上他の意味を示していない限り、本願の記載により開示されているとみなすものとする。
【0025】
本明細書及び添付の特許請求の範囲を通じて、文脈上他の意味に解する必要がある場合を除き、「含む(comprise)」という言葉、及びその変化形(variations such as "comprises"and "comprising")は、記載の整数若しくは工程、又は整数若しくは工程の群の包含の意図はあるが、任意の他の整数若しくは工程、又は整数若しくは工程の群の排除の意図はないと理解される。
【0026】
本明細書及び添付の特許請求の範囲に使用される場合、単数形(the singular forms "a","an", and "the")は、他に文脈上明確に示されていない限り複数の対象を含む。
【0027】
2つ以上のポリペプチドにおける残基は、該残基がポリペプチド構造において類似の位置を占める場合、互いに「対応する」といわれる。2つ以上のポリペプチドにおける類似の位置は、アミノ酸配列又は構造類似性に基づきポリペプチド配列をアラインメントすることにより決定することができることが当該技術分野で既知である。かかるアラインメントツールは当業者にとって既知であり、例えばワールドワイドウェブ上で入手することができる(例えば、標準的な設定、好ましくはAlignでは、EMBOSS:needle、行列:Blosum62、ギャップ開始(Gap Open)10.0、ギャップ伸長(Gap Extend)0.5を用いるClustalW(www.ebi.ac.uk/clustalw)又はAlign(http://www.ebi.ac.uk/emboss/align/index.html))。
【0028】
本発明との関連では、「不活性材料」という用語は、高い耐薬品性を有し、僅かに可湿性であるか、若しくは可湿性ではなく、及び/又は穏やかな条件下で、すなわち低温下でかつ毒性溶媒を用いずに重合後に改良を加えることができない材料を表す。
【0029】
「合成材料」という用語は、本発明との関連で使用される場合、自然において発生するものに対して、人間が製造する又はそうでなければ作り出す材料を表す。「合成」という言葉は、本発明との関連では、人工的に組み立てられることも意味する。
【0030】
「無機材料」という用語は、本発明との関連で使用される場合、主要素として炭化水素(カーボネート、シアニド及びシアネートを除く)を含有しない材料、つまり植物又は動物以外の、すなわち生体起源ではないものを表す。
【0031】
「自然発生的な材料」という用語は、本発明との関連で使用される場合、自然に存在する材料を表すが、該自然発生的な材料は改良を加えることが材料のポリマー骨格を著しく変えない限り、例えば漂白、洗浄、伸張、回転等により改良を加え、更には処理することができる。
【0032】
本発明との関連では、「コーティング」という用語は、コーティング対象の不活性材料又は自然発生的な材料に塗布される被覆を表す。好ましくは、上記「コーティング」は不活性材料又は自然発生的な材料を完全に覆う又は取り囲む。「コーティング」は1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さを有するのが好ましい。
【0033】
他に示されていない限り、「ポリペプチド」及び「タンパク質」という用語は、本明細書で区別なく使用され、長さ又は翻訳後修飾に関わらず、アミノ酸の任意のペプチド結合した鎖を意味する。
【0034】
本発明との関連では、「シルクポリペプチド」という用語は、組換え(例えば微生物、昆虫、植物又は哺乳動物の)発現系(すなわちその自然環境から切り離された系)で発現されるシルクポリペプチド若しくはシルクタンパク質(組換えシルクポリペプチド又は組換えシルクタンパク質)、又は天然供給源(例えばクモ、カイコ、イガイ又はハエの幼虫)から採取されるシルクポリペプチド又はタンパク質を表す(他に示されていない限り、これら2つの用語は本明細書で使用される場合、区別されないことに留意する)。好ましくは、「シルクポリペプチド」は単離又は精製される。特に、「精製シルクポリペプチド」又は「単離シルクポリペプチド」は該タンパク質が単離又は誘導される細胞源又は組織源由来の細胞材料又は他の夾雑タンパク質を含まない又は実質的に含まない。「細胞材料を実質的に含まない」シルクポリペプチドという語句は、組換えによる産生の元となる細胞の細胞成分から切り離されたシルクポリペプチドの調製物を含む。このため、細胞材料を実質的に含まないシルクポリペプチドは、約30%、20%、10%、5%又は1%(乾燥重量により)未満の夾雑タンパク質を有するシルクポリペプチドの調製物を含む。
【0035】
「シルクポリペプチド」は本発明との関連で使用される場合、少なくとも50%、60%、65%、70%、75%、80%、85%、90%、好ましくは少なくとも95%、最も好ましくは100%の1つの同一の反復単位の多重コピー(例えばA2、Q6又はC16(ここで2、6又は16は反復単位の数を表す))、又は2つ以上の異なる反復単位の多重コピー(例えば(AQ)24又は(AQ)12C16)を含む又はこれからなるアミノ酸配列を有するポリペプチドを更に表す。シルクポリペプチドは上記タンパク質の検出又は精製を容易にする人工タグ(例えばT7タグ)を付加することにより更に改変することができる。
【0036】
「反復単位」及び「繰り返し単位」という用語は本発明との関連では区別なく使用され得る。
【0037】
本発明との関連では、「シルクポリペプチド」という用語は、自然発生的なシルクポリペプチドのアミノ酸配列の同一コピー又は自然発生的なシルクポリペプチドのアミノ酸配列の変異体の同一コピー又は両方の組み合わせを含む又はこれからなる少なくとも2つの同一の反復単位を含む又はこれからなるシルクポリペプチドも表す。
【0038】
本発明との関連では、「反復単位」は、アミノ酸配列において、自然発生的なシルクポリペプチド(例えばMaSpI、ADF−3、ADF−4又はFlag)内で反復して発生する少なくとも1つのペプチドモチーフ(例えばAAAAAA(配列番号13)又はGPGQQ(配列番号4))を含む若しくはこれからなる領域(すなわち同一のアミノ酸配列)、又はそれと実質的に類似のアミノ酸配列(すなわち変動アミノ酸配列)に対応する領域を表す。この点で、「実質的に類似の」は、好ましくはそれぞれの参照となる自然発生的なアミノ酸配列の全長にわたる少なくとも50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は更には99.9%のアミノ酸同一性の程度を意味する。自然発生的なシルクポリペプチド内の対応するアミノ酸配列と「実質的に類似の」アミノ酸配列を有する「反復単位」(すなわち野生型反復単位)はその機能特性に関しても類似している。例えば「実質的に類似の反復単位」を含むシルクポリペプチドは依然としてケブラー、羊毛等の合成材料又は自然発生的な材料上にコーティングを形成する能力を有する。好ましくは、「実質的に類似の反復単位」を含むシルクポリペプチドは、各参照(野生型)反復単位を含むシルクポリペプチドを用いて形成することができるのと同様に、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さのコーティングを形成することが可能である。「実質的に類似の反復単位」を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)反復単位を含むシルクポリペプチドで作られたコーティングと比較して類似の(similar)表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。「実質的に類似の反復単位」を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)反復単位を含むシルクポリペプチドで作られたコーティングと類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いて、コーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0039】
自然発生的なシルクポリペプチドのアミノ酸配列と「同一の」アミノ酸配列を有する「反復単位」は例えば、MaSp I(配列番号43)、MaSp II(配列番号44)、ADF−3(配列番号1)及び/又はADF−4(配列番号2)の1つ又は複数のペプチドモチーフに対応するシルクポリペプチドの一部であり得る。自然発生的なシルクポリペプチドのアミノ酸配列と「実質的に類似の」アミノ酸配列を有する「反復単位」は例えば、MaSpI(配列番号43)、MaSpII(配列番号44)、ADF−3(配列番号1)及び/又はADF−4(配列番号2)の1つ又は複数のペプチドモチーフに対応するが、特定のアミノ酸位置に1つ又は複数のアミノ酸置換を有するシルクポリペプチドの一部であり得る。
【0040】
「反復単位」は、一般的に自然発生的なシルクポリペプチドのカルボキシル末端に存在すると考えられている非反復的な親水性アミノ酸ドメインを含まない。
【0041】
本発明による「反復単位」は、3個〜200個又は5個〜150個のアミノ酸長、好ましくは10個〜100個又は15個〜80個のアミノ酸長、より好ましくは18個〜60個又は20個〜40個のアミノ酸長のアミノ酸配列を更に表す。例えば、本発明による反復単位は、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個、80個、81個、82個、83個、84個、85個、86個、87個、88個、89個、90個、91個、92個、93個、94個、95個、96個、97個、98個、99個、100個、105個、110個、115個、120個、125個、130個、135個、140個、145個、150個、155個、160個、165個、170個、175個、180個、185個、190個、195個又は200個のアミノ酸長を有し得る。最も好ましくは、本発明による反復単位は、3個、4個、5個、6個、7個、8個、9個、10個、12個、15個、18個、20個、24個、27個、28個、30個、34個、35個又は39個のアミノ酸からなる。
【0042】
第1の態様では、本発明は、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法であって、
i)少なくとも2つの同一の反復単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
ii)不活性材料又は自然発生的な材料上に該溶液を塗布することにより該不活性材料又は該自然発生的な材料を該シルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含む、これから本質的になる、又はこれからなる、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法を提供する。
【0043】
本発明者らは驚くべきことに、シルクポリペプチドが、厳しい反応条件(すなわち高温の適用及び/又は毒性溶媒の使用)を用いることなく、穏やかな反応条件(すなわち低温及び毒性溶媒の不使用)を用いることにより、合成不活性材料又は無機不活性材料(例えばケブラー等のポリアラミド、ポリテトラフルオロエチレン(テフロン登録商標)又は炭素)等の既存の不活性材料に安定して付着することを見出している。上述の方法によるシルクポリペプチドでコーティングされた不活性材料は、コーティングされていない不活性材料と比較して改善された表面の感触(すなわち改善された触感及び/又は平滑表面)を有し、このことが上記材料の人による触り心地をよくしていることも本発明者らにとっては驚くべきことであった。本発明者らは更に驚くべきことに、上述の方法によるシルクポリペプチドでコーティングされた自然発生的な材料が、通気性及び着用の快適性を保持しながら、改善された強度、弾性、曲げ剛性、改善された表面の感触(すなわち改善された触感)及び/又は運動に対する抵抗性を有することを見出している。
【0044】
好ましくは、本発明の方法ではディップコーティング、スプレーコーティング及び/又はパディングを用いて該溶液を塗布する。
【0045】
「ディップコーティング」は、(i)不活性材料又は自然発生的な材料を、コーティング材として少なくとも1つのシルクポリペプチド溶液の入ったタンクに浸漬し、(ii)少なくとも1つのシルクポリペプチドの入ったタンク内で、例えば0.1秒〜10分の期間、不活性材料又は自然発生的な材料をインキュベートし、(iii)コーティングされた不活性材料又は自然発生的な材料を溶液から取り出し、(iv)タンクを排水することを意味する。それから、コーティングされた不活性材料又は自然発生的な材料を、(v)例えば加熱チャンバ、放射又はファンを用いて、強制乾燥、ベーキングにより(室温で又は高温で)乾燥することができる。ディップコーティングにより、例えばスピンコーティング手法と同様に薄膜でコーティングされた不活性材料又は自然発生的な材料が作り出される。スピンコーティングは均一な薄膜を不活性材料又は自然発生的な材料に塗布するのに使用される手法である。要するに、過剰量の溶液を上記材料上に配置し、それから遠心力によりシルクポリペプチドを展開させるために、該材料を一定速度、好ましくは1m/分〜10m/秒で回転させる。スピンコーティングに用いられる機械はスピンコーター、又は単にスピナーと呼ばれる。ディップコーティングの方法は実施例Vで例示されるとともに、図1で説明される。
【0046】
「スプレーコーティング」は、(i)少なくとも1つのシルクポリペプチドを含む溶液をスプレー缶又は噴霧装置に移し、(ii)不活性材料又は自然発生的な材料上に少なくとも1つのシルクポリペプチドを含む溶液を均一に分配させ、(iii)例えば加熱チャンバ、放射又はファンを用いて、強制乾燥、ベーキングによりコーティングを(室温で又は高温で)乾燥することを意味する。スプレーコーティングの方法は実施例VIで記載されるとともに、図1で説明される。
【0047】
「パディング」は、(i)不活性材料又は自然発生的な材料を、コーティング材として少なくとも1つのシルクポリペプチドを含有する溶液に浸漬し又は漬け込み、(ii)少なくとも1つのシルクポリペプチドを有する溶液中で、例えば0.1秒〜10分の期間、不活性材料又は自然発生的な材料をインキュベートし、(iii)コーティングされた不活性材料又は自然発生的な材料を溶液から取り出し、(iv)コーティングされた不活性材料又は自然発生的な材料を1対のローラーに通し、余分なシルクポリペプチド(溶液)を搾り出すことを意味する。それから、コーティングされた不活性材料又は自然発生的な材料を、(v)例えば加熱チャンバ、放射又はファンを用いて、強制乾燥、ベーキングにより(室温で又は高温で)乾燥することができる。
【0048】
本発明の方法に使用されるシルクポリペプチドは好ましくは、6個〜1500個のアミノ酸、又は200個〜1300個のアミノ酸、最も好ましくは250個〜1200個のアミノ酸、又は500個〜1000個のアミノ酸からなる。
【0049】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位、又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位を含む、本質的にこれからなる又はこれからなる。例えば、本発明の方法に使用されるシルクポリペプチドは、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位を含み得る又はこれからなり得る。最も好ましくは、シルクポリペプチドは、4個、8個、12個、16個、24個、32個又は48個の反復単位を含む。上述のように、本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位である。このため、本発明の方法に使用されるシルクポリペプチドは、1つの同一の反復単位の多重コピー(例えばA2又はC16(ここで2又は6は反復単位の数を表す))、又は2つ以上の異なる反復単位の多重コピー(例えば(AQ)24又は(QAQ)8)を含み得る。例えば、本発明の方法に使用されるシルクポリペプチドに含まれ得る80個の反復単位のうち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個が、同一の反復単位であり得る。
【0050】
本発明の方法に使用されるシルクポリペプチドは、当業者に既知の任意のシルクポリペプチドのアミノ酸配列を含み得る又はこれからなり得る。本発明の方法に使用されるシルクポリペプチドは、節足動物シルクポリペプチド、好ましくはスパイダーシルクポリペプチド、又は昆虫シルクポリペプチドのアミノ酸配列を含む又はこれからなるのが好ましい。また本発明の方法に使用されるシルクポリペプチドは、イガイシルクポリペプチドのアミノ酸配列を含み得る又はこれからなり得る。
【0051】
スパイダーシルクポリペプチドは、大瓶状腺(major ampullate gland)ポリペプチド(MaSp)、例えばドラグラインスパイダーシルクポリペプチド、小瓶状腺(minor ampullate gland)ポリペプチド(MiSp)、鞭毛状ポリペプチド、凝集スパイダーシルクポリペプチド、房状スパイダーシルクポリペプチド、又は梨状スパイダーシルクポリペプチドのアミノ酸配列を含む又はこれからなることが好ましい。最も好ましくは、スパイダーシルクポリペプチドは、ドラグラインスパイダーシルクポリペプチド又は鞭毛状スパイダーシルクポリペプチドのアミノ酸配列を含む又はこれからなる。概してコガネグモ科及びコガネグモ上科(Araneoids)の円網を張るクモのドラグラインポリペプチド又は鞭毛状ポリペプチドのドラグラインポリペプチド又は鞭毛状ポリペプチドのアミノ酸配列を選択するのが好ましい。
【0052】
昆虫のシルクポリペプチドは、鱗翅目の昆虫のシルクポリペプチドのアミノ酸配列を含む又はこれからなることが好ましい。より好ましくは、昆虫のシルクポリペプチドは、カイコガ科の、最も好ましくはカイコのシルクポリペプチドのアミノ酸配列を含む又はこれからなる。
【0053】
好ましくは、上述のシルクポリペプチドは組換えにより生成される、すなわち組換え型のシルクポリペプチドである。例えば本発明の方法に使用されるシルクポリペプチドは組換え型のスパイダーシルクポリペプチド(ドラグラインスパイダーシルクポリペプチド若しくは鞭毛状スパイダーシルクポリペプチド等)、組換え型の昆虫シルクポリペプチド、又は組換え型のイガイシルクポリペプチドである。
【0054】
本発明との関連では、「溶液」という用語は、シルクポリペプチドと溶媒とを含有し、コーティングに適した任意の液体混合物を意味する。
【0055】
本発明の方法で提供される溶液は、少なくとも一種類のシルクポリペプチドを含む。好ましくは、本発明の方法で提供される溶液は、2種類、3種類、4種類、5種類、6種類、7種類、8種類、9種類又は10種類の異なるシルクポリペプチド、最も好ましくは2種類の異なるシルクポリペプチドを含む。例えば、該溶液はそのアミノ酸配列が互いに異なる2種類のドラグラインスパイダーシルクポリペプチドを含むことができる。本発明の方法で提供される溶液は、その天然起源が互いに異なるドラグラインスパイダーシルクポリペプチド及び鞭毛状スパイダーシルクポリペプチドも含むことができる。ドラグラインスパイダーシルクポリペプチドは大瓶状腺由来であり、鞭毛状ポリペプチドは鞭状腺由来である。
【0056】
本発明の方法に使用されるシルクポリペプチド反復単位は、当業者に既知の自然発生的なシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる任意の領域のアミノ酸配列を含み得る又はこれからなり得る。好ましくは、本発明の方法に使用されるシルクポリペプチドの反復単位は、節足動物シルクポリペプチド内で、より好ましくはスパイダーシルクポリペプチド又は昆虫シルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなる。また本発明の方法に使用されるシルクポリペプチドの反復単位は、イガイシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含み得る又はこれからなり得る。
【0057】
スパイダーシルクの反復単位は、自然発生的な大瓶状腺ポリペプチド(MaSp)、例えばドラグラインスパイダーシルクポリペプチド、小瓶状腺ポリペプチド(MiSp)、鞭毛状ポリペプチド、凝集スパイダーシルクポリペプチド、房状スパイダーシルクポリペプチド、又は梨状スパイダーシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなるのが好ましい。最も好ましくは、反復単位は自然発生的なドラグラインスパイダーシルクポリペプチド又は鞭毛状スパイダーシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなる。
【0058】
昆虫シルクの反復単位は、鱗翅目の昆虫の自然発生的なシルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなるのが好ましい。より好ましくは、昆虫シルクの反復単位は、カイコガ科の昆虫、最も好ましくはカイコガ(Bombyx mori)の自然発生的な昆虫シルクポリペプチド内で繰り返し生じる少なくとも1つのペプチドモチーフを含む又はこれからなる領域のアミノ酸配列を含む又はこれからなる。
【0059】
「コンセンサス配列」という用語は本発明との関連で使用する場合、或る特定の位置における発生頻度が高いアミノ酸(例えば「G」)を含有し、更に決定されていない他のアミノ酸をプレースホルダー「X」に置き換えたアミノ酸配列を表す。
【0060】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、各々が、
i)GPGXX(配列番号3)(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してA、S、G、Y、P及びQから選択される任意のアミノ酸である)、
ii)GGX(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してY、P、R、S、A、T、N及びQから選択され、より好ましくはそれぞれの場合で独立してY、P及びQから選択される任意のアミノ酸である)、
iii)Ax(ここでxは5〜10の整数である)
からなる群から選択されるコンセンサス配列を少なくとも1つ、好ましくは1つ含む、少なくとも2つの同一の反復単位を含む、これから本質的になる、又はこれからなる。
【0061】
本発明の方法に使用されるシルクポリペプチドが、各々がGGRPSDTYG(配列番号18)及びGGRPSSSYG(配列番号19)からなる群から選択されるアミノ酸配列を少なくとも1つ、好ましくは1つ含む少なくとも2つの同一の反復単位を含む、又はこれからなることも好ましい。
【0062】
反復(ペプチド)モチーフGPGXX(配列番号3)及びGGX、すなわち高グリシンモチーフは、シルクポリペプチドに、このため上記モチーフを含有するシルクタンパク質から形成される糸に柔軟性を与える。詳細には、反復GPGXX(配列番号3)モチーフはβ−ターンらせん構造を形成し、シルクポリペプチドに弾性を付与する。大瓶状腺シルク及び鞭毛状シルクは両方ともGPGXX(配列番号3)モチーフを有する。反復GGXモチーフは1つのターン当たり3つのアミノ酸を有するヘリックス構造に関連し、ほとんどのスパイダーシルクで見られる。GGXモチーフはシルクに付加的な弾性を与えることができる。反復ポリアラニンAx(ペプチド)モチーフはシルクポリペプチドに強度を与える結晶性β−シート構造を形成する(国際公開第03/057727号)。GGRPSDTYG(配列番号18)及びGGRPSSSYG(配列番号19)(ペプチド)モチーフは、レジリン(国際公開第08/155304号)から選択されている。レジリンはほとんどの節足動物(節足動物門)で見られる弾性タンパク質である。レジリンは角皮の特定領域に位置しており、低剛性及び高強度を与える(Elvin et al., Nature(437): 999-1002, 2005)。
【0063】
このため本発明の好ましい実施の形態では、シルクポリペプチドは、各々がGPGAS(配列番号5)、GPGSG(配列番号6)、GPGGY(配列番号7)、GPGGP(配列番号8)、GPGGA(配列番号9)、GPGQQ(配列番号4)、GPGGG(配列番号10)、GPGQG(配列番号40)及びGPGGS(配列番号11)からなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ又は9つ)、好ましくは1つ含む反復単位を含む、又はこれからなる。本発明の別の好ましい実施の形態では、シルクポリペプチドは、各々がGGY、GGP、GGA、GGR、GGS、GGT、GGN及びGGQからなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1つ、2つ、3つ、4つ、5つ、8つ、7つ又は8つ)、好ましくは1つ含む反復単位を含む、又はこれからなる。本発明の更に好ましい実施の形態では、シルクポリペプチドは、各々がAAAAA(配列番号12)、AAAAAA(配列番号13)、AAAAAAA(配列番号14)、AAAAAAAA(配列番号15)、AAAAAAAAA(配列番号16)及びAAAAAAAAAA(配列番号17)からなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1つ、2つ、3つ、4つ、5つ又は6つ)、好ましくは1つ含む反復単位を含む、又はこれからなる。
【0064】
本発明の別の好ましい実施の形態では、シルクポリペプチドは、各々がGPGAS(配列番号5)、GPGSG(配列番号6)、GPGGY(配列番号7)、GPGGP(配列番号8)、GPGGA(配列番号9)、GPGQQ(配列番号4)、GPGGG(配列番号10)、GPGQG(配列番号40)、GPGGS(配列番号11)、GGY、GGP、GGA、GGR、GGS、GGT、GGN、GGQ、AAAAA(配列番号12)、AAAAAA(配列番号13)、AAAAAAA(配列番号14)、AAAAAAAA(配列番号15)、AAAAAAAAA(配列番号16)、AAAAAAAAAA(配列番号17)、GGRPSDTYG(配列番号18)、及びGGRPSSSYG(配列番号19)からなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個又は25個)、好ましくは1つ含む反復単位を含む、又はこれからなる。
【0065】
最も好ましくは、本発明の方法に使用されるシルクポリペプチドは、
(i)アミノ酸配列として、好ましくはこの順番でGPGAS(配列番号5)、AAAAAA(配列番号13)、GGY及びGPGSG(配列番号6)、
(ii)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGGY(配列番号7)、GPGGY(配列番号7)及びGPGGP(配列番号8)、
(iii)アミノ酸配列として、GPGQQ(配列番号4)、GPGQQ(配列番号4)、GPGQQ(配列番号4)及びGPGQQ(配列番号4)、
(iv)アミノ酸配列として、好ましくはこの順番でGPGGA(配列番号9)、GGP、GPGGA(配列番号9)、GGP、GPGGA(配列番号9)及びGGP、
(v)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGQG(配列番号40)及びGGR、
(vi)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGGG(配列番号10)、GGR、GGN及びGGR、
(vii)アミノ酸配列として、好ましくはこの順番でGGA、GGA、GGA、GGS、GGA及びGGS、並びに/又は
(viii)アミノ酸配列として、好ましくはこの順番でGPGGA(配列番号9)、GPGGY(配列番号7)、GPGGS(配列番号11)、GPGGY(配列番号7)、GPGGS(配列番号11)及びGPGGY(配列番号7)
を含むか又はこれからなる反復単位を含む、これから本質的になる、又はこれからなる。
【0066】
上述のシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位であることに留意すべきである。
【0067】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位、又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(各々が、
i)GPGXX(配列番号3)(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してA、S、G、Y、P及びQから選択される任意のアミノ酸である)、
ii)GGX(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してY、P、R、S、A、T、N及びQから選択され、より好ましくはそれぞれの場合で独立してY、P及びQから選択される任意のアミノ酸である)、及び
iii)Ax(ここでxは5〜10の整数である)
からなる群から選択されるコンセンサス配列を少なくとも1つ、好ましくは1つ含む)を含む、これから本質的になる、又はこれからなる。上述のように、本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位である。
【0068】
本発明の方法に使用されるシルクポリペプチドが、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位(各々がGGRPSDTYG(配列番号18)及びGGRPSSSYG(配列番号19)からなる群から選択されるアミノ酸配列を少なくとも1つ、好ましくは1つ含む)を含む、又はこれからなることも好ましい。
【0069】
このため、本発明の方法に使用されるシルクポリペプチドは好ましくは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(各々がGPGAS(配列番号5)、GPGSG(配列番号6)、GPGGY(配列番号7)、GPGGP(配列番号8)、GPGGA(配列番号9)、GPGQQ(配列番号4)、GPGQG(配列番号40)、GPGGG(配列番号10)、GPGGS(配列番号11)、GGY、GGP、GGA、GGR、GGS、GGT、GGN、GGQ、AAAAA(配列番号12)、AAAAAA(配列番号13)、AAAAAAA(配列番号14)、AAAAAAAA(配列番号15)、AAAAAAAAA(配列番号16)、AAAAAAAAAA(配列番号17)、GGRPSDTYG(配列番号18)、及びGGRPSSSYG(配列番号19)からなる群から選択されるアミノ酸配列を少なくとも1つ(例えば1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個又は25個)、好ましくは1つ含む)を含む、又はこれからなる。
【0070】
最も好ましくは、本発明の方法に使用されるシルクポリペプチドは、
(i)アミノ酸配列として、好ましくはこの順番でGPGAS(配列番号5)、AAAAAA(配列番号13)、GGY及びGPGSG(配列番号6)を含む又はこれからなる反復単位、
(ii)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGGY(配列番号7)、GPGGY(配列番号7)及びGPGGP(配列番号8)を含む又はこれからなる反復単位、
(iii)アミノ酸配列として、GPGQQ(配列番号4)、GPGQQ(配列番号4)、GPGQQ(配列番号4)及びGPGQQ(配列番号4)を含む又はこれからなる反復単位、
(iv)アミノ酸配列として、好ましくはこの順番でGPGGA(配列番号9)、GGP、GPGGA(配列番号9)、GGP、GPGGA(配列番号9)及びGGPを含む又はこれからなる反復単位、
(v)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGQG(配列番号40)及びGGRを含む又はこれからなる反復単位、
(vi)アミノ酸配列として、好ましくはこの順番でAAAAAAAA(配列番号15)、GPGGG(配列番号10)、GGR、GGN及びGGRを含む又はこれからなる反復単位、
(vii)アミノ酸配列として、好ましくはこの順番でGGA、GGA、GGA、GGS、GGA及びGGSを含む又はこれからなる反復単位、並びに/又は
(viii)アミノ酸配列として、好ましくはこの順番でGPGGA(配列番号9)、GPGGY(配列番号7)、GPGGS(配列番号11)、GPGGY(配列番号7)、GPGGS(配列番号11)及びGPGGY(配列番号7)を含む又はこれからなる反復単位
を含む、これから本質的になる、又はこれからなる。
【0071】
上述のシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位であることに留意すべきである。
【0072】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、
(i)反復単位として(GPGXX)n(配列番号3)(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してA、S、G、Y、P及びQから選択され、nは2、3、4、5、6、7、8又は9である)、
ii)反復単位として(GGX)n(ここでXは任意のアミノ酸であり、好ましくはそれぞれの場合で独立してY、P、R、S、A、T、N及びQから選択され、より好ましくはそれぞれの場合で独立してY、P及びQから選択される任意のアミノ酸であり、nは2、3、4、5、6、7又は8である)、及び/又は
iii)反復単位として(Ax)n(ここでxは5〜10の整数であり、nは2、3、4、5、6、7、8、9又は10である)
を含む、これから本質的になる、又はこれからなる。上述のように、本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つは同一の反復単位である。
【0073】
反復単位は独立して、モジュールA(配列番号20)、モジュールC(配列番号21)、モジュールQ(配列番号22)、モジュールK(配列番号23)、モジュールsp(配列番号24)、モジュールS(配列番号25)、モジュールR(配列番号26)、モジュールX(配列番号27)若しくはモジュールY(配列番号28)、又はその変異体(すなわちモジュールA変異体、モジュールC変異体、モジュールQ変異体、モジュールK変異体、モジュールsp変異体、モジュールS変異体、モジュールR変異体、モジュールX変異体又はモジュールY変異体)から選択されるのが好ましい。モジュールA(配列番号20)及びモジュールQ(配列番号22)はニワオニグモのADF−3のアミノ酸配列をベースにしている。モジュールC(配列番号21)はニワオニグモのADF−4のアミノ酸配列をベースにしている。モジュールK(配列番号23)、モジュールsp(配列番号24)、モジュールX(配列番号27)及びモジュールY(配列番号28)はアメリカジョロウグモの鞭毛状タンパク質FLAGのアミノ酸配列をベースにしている(国際公開第2006/008163号)。モジュールS(配列番号25)及びモジュールR(配列番号26)はレジリン(節足動物門)をベースにしている(国際公開第2008/155304号)。
【0074】
このため本発明の好ましい実施の形態では、シルクポリペプチドの反復単位は、モジュールA:GPYGPGASAAAAAAGGYGPGSGQQ(配列番号20)、モジュールC:GSSAAAAAAAASGPGGYGPENQGPSGPGGYGPGGP(配列番号21)、モジュールQ:GPGQQGPGQQGPGQQGPGQQ(配列番号22)、モジュールK:GPGGAGGPYGPGGAGGPYGPGGAGGPY(配列番号23)、モジュールsp:GGTTIIEDLDITIDGADGPITISEELTI(配列番号24)、モジュールS:PGSSAAAAAAAASGPGQGQGQGQGQGGRPSDTYG(配列番号25)、モジュールR:SAAAAAAAAGPGGGNGGRPSDTYGAPGGGNGGRPSSSYG(配列番号26)、モジュールX:GGAGGAGGAGGSGGAGGS(配列番号27)若しくはモジュールY:GPGGAGPGGYGPGGSGPGGYGPGGSGPGGY(配列番号28)、又はそれらの変異体からなる。
【0075】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、より好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(独立して、モジュールA(配列番号20)、モジュールC(配列番号21)、モジュールQ(配列番号22)、モジュールK(配列番号23)、モジュールsp(配列番号24)、モジュールS(配列番号25)、モジュールR(配列番号26)、モジュールX(配列番号27)若しくはモジュールY(配列番号28)、又はその変異体(すなわちモジュールA変異体、モジュールC変異体、モジュールQ変異体、モジュールK変異体、モジュールsp変異体、モジュールS変異体、モジュールR変異体、モジュールX変異体又はモジュールY変異体)から選択される)を含む、これから本質的になる、又はこれからなる。本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位(モジュール)であることに留意すべきである。
【0076】
このため、本発明の方法に使用されるシルクポリペプチドは、(i)モジュールAからなる反復単位(複数も可)及び/若しくはモジュールA変異体からなる反復単位(複数も可)、(ii)モジュールCからなる反復単位(複数も可)及び/若しくはモジュールC変異体からなる反復単位(複数も可)、(iii)モジュールQからなる反復単位(複数も可)及び/若しくはモジュールQ変異体からなる反復単位(複数も可)、(iv)(a)モジュールAからなる反復単位(複数も可)及びモジュールQからなる反復単位(複数も可)、(b)モジュールAからなる反復単位(複数も可)及びモジュールQ変異体からなる反復単位(複数も可)、(c)モジュールA変異体からなる反復単位(複数も可)及びモジュールQからなる反復単位(複数も可)、(d)モジュールA変異体からなる反復単位(複数も可)及びモジュールQ変異体からなる反復単位(複数も可)、(v)(a)モジュールAからなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(b)モジュールAからなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(c)モジュールA変異体からなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(d)モジュールA変異体からなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(vi)(a)モジュールCからなる反復単位(複数も可)及びモジュールQからなる反復単位(複数も可)、(b)モジュールCからなる反復単位(複数も可)及びモジュールQ変異体からなる反復単位(複数も可)、(c)モジュールC変異体からなる反復単位(複数も可)及びモジュールQからなる反復単位(複数も可)、(d)モジュールC変異体からなる反復単位(複数も可)及びモジュールQ変異体からなる反復単位(複数も可)、又は(vii)(a)モジュールAからなる反復単位(複数も可)、モジュールQからなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(b)モジュールAからなる反復単位(複数も可)、モジュールQからなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(c)モジュールAからなる反復単位(複数も可)、モジュールQ変異体からなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(d)モジュールA変異体からなる反復単位(複数も可)、モジュールQからなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(e)モジュールAからなる反復単位(複数も可)、モジュールQ変異体からなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(f)モジュールA変異体からなる反復単位(複数も可)、モジュールQ変異体からなる反復単位(複数も可)及びモジュールCからなる反復単位(複数も可)、(g)モジュールA変異体からなる反復単位(複数も可)、モジュールQからなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)、(h)モジュールA変異体からなる反復単位(複数も可)、モジュールQ変異体からなる反復単位(複数も可)及びモジュールC変異体からなる反復単位(複数も可)を含む、これから本質的になる、又はこれからなるのが好ましい。
【0077】
本発明の方法に使用されるシルクポリペプチドは少なくとも2つの同一の反復単位を含む又はこれからなるという条件で、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX、モジュールY、又はその変異体(すなわちモジュールA変異体、モジュールC変異体、モジュールQ変異体、モジュールK変異体、モジュールsp変異体、モジュールS変異体、モジュールR変異体、モジュールX変異体又はモジュールY変異体)を各々の任意の組み合わせ及び任意の数で互いに組み合わせることもできる、すなわち例えば、モジュール(反復単位)Aをモジュール(反復単位)Qと組み合わせることができ(すなわち組み合わせAQ)、モジュール(反復単位)Cをモジュール(反復単位)Qと組み合わせることができ(すなわち組み合わせCQ)、モジュール(反復単位)Qをモジュール(反復単位)A及びモジュール(反復単位)Qと組み合わせることができ(すなわち組み合わせQAQ)、モジュール(反復単位)Aをモジュール(反復単位)A及びモジュール(反復単位)Qと組み合わせることができる(すなわち組み合わせAAQ)。例えば、本発明の方法に使用されるシルクポリペプチドは、An、(AA)n、(AQ)n、(QA)n、Qn、(QQ)n、(QAQ)n、(AQA)n、Cn、(CC)n、(CCC)n、(CQ)n、(QC)n、(QCQ)n、(CQC)n、(AA)nQn、(QQ)nAn、(AAA)nQn、(QQQ)nAn、(AQQ)n、(QQA)n、Kn、spn、Sn、Rn、Xn、Yn、(Ksp)n、(spK)n、(XY)n、(YX)n、(XX)n、(YY)n、(XXX)n、(YYY)n、(AX)n、(XA)n、(CX)n、(XC)n、(QX)n、(XQ)n、(YQ)n、(QY)n、(SS)n、(SR)n、(RS)n又は(RR)n(ここでnは少なくとも2、好ましくは4、8、9、10、12、16、20、24又は32である)を含み得る又はこれからなり得る。シルクポリペプチドが(AQ)12からなる場合、シルクポリペプチドには、モジュール(反復単位)Aが12回存在し、モジュール(反復単位)Qも12回存在し、そのためシルクポリペプチドは24個のモジュール(反復単位)からなることに留意する。(AQ)12からなるシルクポリペプチドのモジュール(繰り返し単位)の配置は以下のとおりである:AQAQAQAQAQAQAQAQAQAQAQAQ。さらに、シルクポリペプチドのモジュール(繰り返し単位)のシルクポリペプチドが(QAQ)8からなる場合、シルクポリペプチドには、モジュール(繰り返し単位)Aが8回存在し、モジュール(反復単位)Qが16回存在し、そのためシルクポリペプチドは24個のモジュール(反復単位)からなることに留意する。(QAQ)8からなるシルクポリペプチドのモジュール(繰り返し単位)の配置は以下のとおりである:QAQQAQQAQQAQQAQQAQQAQQAQ。
【0078】
本発明の方法に使用されるシルクポリペプチドはまた、(A*Q)n、(AQ*)n、(A*Q*)n、(Q*A)n、(QA*)n、(Q*A*)n、(QAQ*)n、(QA*Q)n、(Q*AQ)n、(QA*Q*)n、(Q*A*Q)n、(Q*AQ*)n、(Q*A*Q*)n、(AQA*)n、(AQ*A)n、(A*QA)n、(AQ*A*)n、(A*Q*A)n、(A*QA*)n、(A*Q*A*)n(ここでnは少なくとも2、好ましくは4、8、9、10、12、16、20、24又は32であり、*はモジュール変異体、すなわちモジュールA変異体又はモジュールQ変異体を示す)を含み得る又はこれからなり得る。
【0079】
「互いに組み合わせた」又は「互いに連結した」という用語は、本発明との関連では、複数のモジュール(反復単位)が互いに直接組み合わされている若しくは連結されていることを意味し得る、又は本発明との関連では、複数のモジュール(反復単位)が1つ又は複数のスペーサーアミノ酸を介して互いに組み合わされている若しくは連結されていることを意味し得る。好ましい実施の形態では、シルクポリペプチドに含まれるモジュール(反復単位)が互いに直接組み合わされている若しくは連結されている。他の好ましい実施の形態では、シルクポリペプチドに含まれるモジュール(反復単位)が、1個〜25個又は1個〜20個のスペーサーアミノ酸を介して、より好ましくは1個〜15個又は1個〜10個のスペーサーアミノ酸を介して、最も好ましくは1個〜5個のスペーサーアミノ酸を介して、すなわち1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個又は25個のスペーサーアミノ酸を介して互いに組み合わされている又は連結されている。上記スペーサーアミノ酸はタンパク質において自然発生的な任意のアミノ酸であり得る。好ましくは、上記スペーサーアミノ酸はプロリンではない。スペーサーアミノ酸(複数も可)は荷電基を含有するのが好ましい。好ましくは、荷電基を含有するスペーサーアミノ酸(複数も可)は独立して、アスパラギン酸、グルタミン酸、ヒスチジン及びリジンからなる群から選択される。上記スペーサーアミノ酸は、シルクポリペプチドのケブラー又は羊毛等の不活性材料又は自然発生的な材料をコーティング、好ましくは均一にコーティングする能力に負の影響を与えないアミノ酸とする。さらに、上記スペーサーアミノ酸は、立体障害を引き起こさないアミノ酸、例えばリジン及びシステイン等のサイズが小さいアミノ酸とする。
【0080】
より好ましい実施の形態では、シルクポリペプチドは、互いに直接組み合わせられるモジュール、及び1個〜25個又は1個〜20個のスペーサーアミノ酸を介して、より好ましくは1個〜15個又は1個〜10個のスペーサーアミノ酸を介して、最も好ましくは1個〜5個のスペーサーアミノ酸を介して、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個又は25個のスペーサーアミノ酸を介して互いに組み合わせられるモジュールを含む。
【0081】
モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体は参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYとは異なり、該変異体はそれらからアミノ酸配列における最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個又は15個のアミノ酸変化(すなわち置換、付加、挿入、欠失、N末端切断及び/又はC末端切断)により誘導される。代替的に又は付加的に、このようなモジュール変異体は、変異体の誘導元である参照(野生型)モジュールに対する或る特定の程度の配列同一性を特徴とし得る。このため、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体は、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYに対する少なくとも50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は更には99.9%の配列同一性を有する。好ましくは配列同一性は、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの少なくとも10個、15個、18個、20個、24個、27個、28個、30個、34個、35個又はそれ以上のアミノ酸の連続ストレッチにわたる、好ましくは全長にわたるものである。
【0082】
配列同一性は、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの全長にわたって少なくとも80%、全長にわたって少なくとも85%、全長にわたって少なくとも90%、全長にわたって少なくとも95%、全長にわたって少なくとも98%、又は全長にわたって少なくとも99%であるのが特に好ましい。配列同一性は、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX若しくはモジュールYのうちの少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも80%、少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも85%、少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも90%、少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも95%、少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも98%、又は少なくとも10個、15個、18個、20個、24個、28個若しくは30個のアミノ酸の連続ストレッチにわたって少なくとも99%であるのが特に好ましい。
【0083】
モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個又は15個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0084】
さらに、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片は、変異体又は断片の元となるアミノ酸配列に対する修飾が、シルクポリペプチドのケブラー又は羊毛等の不活性材料又は自然発生的な材料をコーティングする、好ましくは均一にコーティングする能力に負の影響を与えない場合にのみ、本発明との関連内においてモジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片とみなされる。好ましくは、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片を含むシルクポリペプチドは、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYを含むシルクポリペプチドを用いて形成可能であるように、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さのコーティングを形成することが可能である。モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYを含むシルクポリペプチドで作られたコーティングと比較して類似の表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYの変異体又は断片を含むシルクポリペプチドで作られたコーティングが、各参照(野生型)モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYを含むシルクポリペプチドで作られたコーティングと類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いてコーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0085】
このため本発明の好ましい実施の形態では、反復単位は独立して、モジュールAC(配列番号29)、モジュールAK(配列番号30)、モジュールCC(配列番号31)、モジュールCK1(配列番号32)、モジュールCK2(配列番号33)又はモジュールCKC(配列番号34)から選択される。モジュールAC(配列番号29)、モジュールAK(配列番号30)、モジュールCC(配列番号31)、モジュールCK1(配列番号32)、モジュールCK2(配列番号33)及びモジュールCKC(配列番号34)は、ニワオニグモのADF−3のアミノ酸配列をベースとするモジュールA、及びニワオニグモのADF−4のアミノ酸配列をベースとするモジュールCの変異体である(国際公開第2007/025719号)。モジュールAC(配列番号29)では、21位のアミノ酸S(セリン)がアミノ酸C(システイン)に置き換えられており、モジュールAK(配列番号30)では、21位のアミノ酸Sがアミノ酸K(リジン)に置き換えられており、モジュールCC(配列番号31)では、25位のアミノ酸Sがアミノ酸Cに置き換えられており、モジュールCK1(配列番号32)では、25位のアミノ酸Sがアミノ酸Kに置き換えられており、モジュールCK2(配列番号33)では、20位のアミノ酸E(グルタミン酸)がアミノ酸Kに置き換えられており、モジュールCKC(配列番号34)では、20位のアミノ酸Eがアミノ酸Kに置き換えられており、25位のアミノ酸Sがアミノ酸Cに置き換えられている(国際公開第2007/025719号)。
【0086】
好ましくは、本発明の方法に使用されるシルクポリペプチドにおける反復単位は、モジュールAC:GPYGPGASAAAAAAGGYGPGCGQQ(配列番号29)、モジュールAK:GPYGPGASAAAAAAGGYGPGKGQQ(配列番号30)、モジュールCC:GSSAAAAAAAASGPGGYGPENQGPCGPGGYGPGGP(配列番号31)、モジュールCK1:GSSAAAAAAAASGPGGYGPENQGPKGPGGYGPGGP(配列番号32)、モジュールCK2:GSSAAAAAAAASGPGGYGPKNQGPSGPGGYGPGGP(配列番号33)、又はモジュールCKC:GSSAAAAAAAASGPGGYGPKNQGPCGPGGYGPGGP(配列番号34)からなる。
【0087】
本発明の方法に使用されるシルクポリペプチドが、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(独立して、モジュールAC(配列番号29)、モジュールAK(配列番号30)、モジュールCC(配列番号31)、モジュールCK1(配列番号32)、モジュールCK2(配列番号33)又はモジュールCKC(配列番号34)から選択される)を含む、これから本質的になる、又はこれからなることも好ましい。本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位(モジュール)であることに留意すべきである。
【0088】
例えば、本発明の方法に使用されるシルクポリペプチドは、モジュールCC4、モジュールCC8、モジュールCC16、モジュールCC32、モジュールAC5、モジュールAC8又はモジュールAC10を含み得る又はこれからなり得る。
【0089】
本発明の方法に使用されるシルクポリペプチドは少なくとも2つの同一の反復単位を含む又はこれからなるという条件で、モジュールAK、モジュールCC、モジュールCK1、モジュールCK2及びモジュールCKCを互いに組み合わせることもできる、すなわち例えば、モジュール(反復単位)AKをモジュール(反復単位)CCと組み合わせることができ(すなわち組み合わせAKCC)、モジュール(反復単位)CK1をモジュール(反復単位)CK2及びモジュール(反復単位)CKCと組み合わせることができる(すなわち組み合わせCK1CK2CKC)。このため、本発明の方法に使用されるシルクポリペプチドはまた、モジュール(AK)n、モジュール(CC)n、モジュール(CK1)n、モジュール(CK2)n、モジュール(CKC)n、モジュール(AKAC)n、モジュール(CCCC)n、モジュール(CK1CK2)n、モジュール(CK2CK1)n、モジュール(CK1CK2CK1)n、モジュール(CK2CK1CK2)n、モジュール(CK1CK2CKC)n、モジュール(CKCCK2CKC)n又はモジュール(CKCCK2CK1)n(ここでnは少なくとも2、好ましくは4、5、6、7、8、10、12、16又は20である)を含み得る又はこれからなり得る。「互いに組み合わせた」という用語は上で定義される。
【0090】
本発明の方法に使用されるシルクポリペプチドは、2個〜80個の反復単位、3個〜80個の反復単位若しくは4個〜60個の反復単位、好ましくは8個〜48個の反復単位又は10個〜40個の反復単位、最も好ましくは16個〜32個の反復単位、すなわち2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、51個、52個、53個、54個、55個、56個、57個、58個、59個、60個、61個、62個、63個、64個、65個、66個、67個、68個、69個、70個、71個、72個、73個、74個、75個、76個、77個、78個、79個又は80個の反復単位(独立して、モジュールA(配列番号20)若しくはその変異体、モジュールC(配列番号21)若しくはその変異体、モジュールQ(配列番号22)若しくはその変異体、モジュールK(配列番号23)若しくはその変異体、モジュールsp(配列番号24)若しくはその変異体、モジュールS(配列番号25)若しくはその変異体、モジュールR(配列番号26)若しくはその変異体、モジュールX(配列番号27)若しくはその変異体、モジュールY(配列番号28)若しくはその変異体、モジュールAC(配列番号29)、モジュールAK(配列番号30)、モジュールCC(配列番号31)、モジュールCK1(配列番号32)、モジュールCK2(配列番号33)、又はモジュールCKC(配列番号34)から選択される)を含む、これから本質的になる、又はこれからなるのが更に好ましい。この場合も、本発明の方法に使用されるシルクポリペプチドに含まれる反復単位のうち少なくとも2つが同一の反復単位(モジュール)であることに留意すべきである。
【0091】
本発明の方法に使用されるシルクポリペプチドは少なくとも2つの同一の反復単位を含む又はこれからなるという条件で、モジュールAK、モジュールCC、モジュールCK1、モジュールCK2及びモジュールCKCを、モジュールA、モジュールC、モジュールQ、モジュールK、モジュールsp、モジュールS、モジュールR、モジュールX又はモジュールYと互いに組み合わせることもできる、すなわち例えば、モジュール(反復単位)AKをモジュール(反復単位)Cと組み合わせることができ(すなわち組み合わせAKC)、又はモジュール(反復単位)CCをモジュール(反復単位)Cと組み合わせることができる(すなわち組み合わせCCC)。このため、本発明の方法に使用されるシルクポリペプチドはまた、モジュール(AQAK)n、モジュール(QAK)n、モジュール(QAKQ)n、モジュール(AKQA)n、モジュール(AKQAK)n、モジュール(CCC)n、モジュール(CCCC)n、モジュール(CCCCC)n、モジュール(CCCCC)n、モジュール(CCQ)n、モジュール(QCC)n、モジュール(QCCQ)n、モジュール(CCQC)n、モジュール(CQCC)n、モジュール(CCQCC)n、モジュール(CCK1)n、モジュール(CK1C)n、モジュール(CK1CC)n、モジュール(CCK1C)n、モジュール(CKCCKCC)n、モジュール(CCKCCKC)n、モジュール(CKCQ)n、モジュール(QCKC)n、モジュール(QCKCQ)n、モジュール(AKCK1Q)n、モジュール(QCK2AK)n、又はモジュール(CK1CK2C)n(ここでnは少なくとも2、好ましくは4、5、6、7、8、10、12、16又は20である)を含み得る又はこれからなり得る。「互いに組み合わせた」という用語は上で定義される。
【0092】
例えば、本発明の方法に使用されるシルクポリペプチドは、モジュールC16CC、モジュールCCC16、モジュールC8CCC8、モジュールC8CC8、モジュールCC8C8、モジュールC4CC8C4、モジュールCC4C8CC4、モジュールCC(AQ)24又はモジュール(AQ)24CCを含む又はこれからなる。
【0093】
本発明の方法に使用されるシルクポリペプチドは、少なくとも1つの非反復(NR)単位、すなわち1個、2個、3個、4個、5個、6個又はそれ以上のNR単位、好ましくは1個のNR単位を更に含むことができる。本発明との関連では、「非反復(NR)単位」という用語は、明らかな反復パターンを示さない、自然発生的なシルクポリペプチドに存在するアミノ酸の領域(非反復単位又はNR単位)を表す。好ましくは、非反復単位のアミノ酸配列は、自然発生的なドラグラインポリペプチド、好ましくはADF−3(配列番号1)若しくはADF−4(配列番号2)の非反復アミノ酸配列に、又はそれと実質的に類似のアミノ酸配列に相当する。
【0094】
非反復単位のアミノ酸配列は、自然発生的なドラグラインポリペプチド、好ましくはADF−3(配列番号1)若しくはADF−4(配列番号2)の非反復カルボキシ末端アミノ酸配列に、又はそれと実質的に類似のアミノ酸配列に相当するのが特に好ましい。より好ましくは、非反復単位のアミノ酸配列は、アミノ酸513〜アミノ酸636を含むADF−3(配列番号1)若しくはアミノ酸302〜アミノ酸410を含むADF−4(配列番号2)の非反復カルボキシ末端アミノ酸配列に、又はそれと実質的に類似のアミノ酸配列に相当する。
【0095】
この関連で「実質的に類似の」は、好ましくは20個、30個、40個、50個、60個、70個、80個又はそれ以上のアミノ酸にわたる、より好ましくは自然発生的なドラグラインポリペプチド、好ましくはADF−3(配列番号1)又はADF−4(配列番号2)の各参照非反復(カルボキシ末端)アミノ酸配列の全長にわたる少なくとも50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は更には99.9%のアミノ酸同一性の程度を意味する。
【0096】
自然発生的なドラグラインポリペプチド(すなわち野生型非反復(カルボキシ末端)単位)内の、好ましくはADF−3(配列番号1)又はADF−4(配列番号2)内の対応する非反復(カルボキシ末端)アミノ酸配列と「実質的に類似の」アミノ酸配列を有する「非反復単位」は、その機能特性に関しても類似している。例えば「実質的に類似の非反復単位」を含むシルクポリペプチドは依然として、ケブラー又は羊毛等の合成材料又は自然発生的な材料上にコーティングを形成する能力を有する。好ましくは、「実質的に類似の非反復単位」を含むシルクポリペプチドは、各参照(野生型)非反復(カルボキシ末端)単位を含むシルクポリペプチドを用いて形成することができるのと同様に、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さのコーティングを形成することが可能である。「実質的に類似の非反復単位」を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)非反復(カルボキシ末端)単位を含むシルクポリペプチドで作られたコーティングと比較して類似の(similar)表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。「実質的に類似の反復単位」を含むシルクポリペプチドで作られたコーティングは、各参照(野生型)非反復(カルボキシ末端)単位を含むシルクポリペプチドで作られたコーティングに類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いて、コーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0097】
最も好ましくは、非反復(NR)単位は、NR3(配列番号41)若しくはその変異体、又はNR4(配列番号42)若しくはその変異体である。NR3(配列番号41)単位はニワオニグモのADF−3のアミノ酸配列をベースとしており、NR4(配列番号42)単位はニワオニグモのADF−4のアミノ酸配列をベースとしている(国際公開第2006/008163号)。
【0098】
NR3単位又はNR4単位の変異体は、参照NR3(配列番号41)単位又はNR4(配列番号42)単位とは異なり、該変異体はそれらからアミノ酸配列における最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、25個又は30個のアミノ酸変化(すなわち置換(exchanges)、挿入、欠失、N末端切断及び/又はC末端切断)により誘導される。代替的に又は付加的に、このようなNR3単位又はNR4単位の変異体は、変異体の誘導元である参照NR3単位又はNR4単位に対する或る特定の程度の配列同一性を特徴とし得る。このため、NR3単位又はNR4単位の変異体は、各参照NR3単位又はNR4単位に対する少なくとも50%、55%、60%、65%、70%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は更には99.9%の配列同一性を有する。好ましくは配列同一性は、各参照NR3単位又はNR4単位の少なくとも10個、20個、30個、40個、50個、60個、70個、80個、90個又はそれ以上のアミノ酸の連続ストレッチにわたる、好ましくは全長にわたるものである。
【0099】
配列同一性は各参照NR3単位又はNR4単位の全長にわたって少なくとも80%、全長にわたって少なくとも85%、全長にわたって少なくとも90%、全長にわたって少なくとも95%、全長にわたって少なくとも98%、又は全長にわたって少なくとも99%であるのが特に好ましい。配列同一性は各参照NR3単位若しくはNR4単位のうちの少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも80%、少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも85%、少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも90%、少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも95%、少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも98%、又は少なくとも20個、30個、40個、50個、60個、70個若しくは80個のアミノ酸の連続ストレッチにわたって少なくとも99%であるのが更に特に好ましい。
【0100】
NR3単位又はNR4単位の断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、30個、35個、40個、45個、50個、55個又は60個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0101】
さらに、NR3単位又はNR4単位の変異体又は断片は、変異体又は断片の元となるアミノ酸配列に対する修飾が、シルクポリペプチドのケブラー又は綿等の不活性材料又は自然発生的な材料をコーティングする、好ましくは均一にコーティングする能力に負の影響を与えない場合にのみ、本発明との関連内においてNR3単位又はNR4単位の変異体又は断片とみなされる。好ましくは、NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドは、各参照NR3単位又はNR4単位を含むシルクポリペプチドを用いて形成することができるのと同様に、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5.0μmの厚さのコーティングを形成することが可能である。NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドで作られたコーティングは、各参照NR3単位又はNR4単位を含むシルクポリペプチドで作られたコーティングと比較して類似の表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドで作られたコーティングは、各参照NR3単位又はNR4単位を含むシルクポリペプチドで作られたコーティングに類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いて、コーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0102】
代替的には、NR3単位又はNR4単位の変異体又は断片が依然として、それが含まれるシルクポリペプチドの重合を可能にするか、及び/又は可溶性を増大させるかを試験することができる。当業者は、NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドが、各参照NR3単位又はNR4単位を含むシルクポリペプチドのように上述の機能特性を有するかを容易に評価することができる。好適なアッセイは当業者にとって既知である。例えば、NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドの重合、及び各参照NR3単位又はNR4単位を含むシルクポリペプチドの重合を、ネイティブゲル電気泳動により容易に可視化することができる。NR3単位又はNR4単位の変異体又は断片を含むシルクポリペプチドの可溶性、及び各参照NR3単位又はNR4単位を含むシルクポリペプチドの可溶性を、水溶液中の上記シルクポリペプチドの飽和により単純に試験することができる。最終的に結果を互いに比較することができる。
【0103】
好ましくは、本発明の方法に使用されるシルクポリペプチドは、ADF−3(配列番号1)又はその変異体、ADF−4(配列番号2)又はその変異体、MaSp I(配列番号43)又はその変異体、MaSp II(配列番号44)又はその変異体、(C)m、(C)mNRz、NRz(C)m、(AQ)n、(AQ)nNRz、NRz(AQ)n、(QAQ)o、NRz(QAQ)o、(QAQ)oNRz、Yp、Xp及びKp(ここで、mは8〜48(すなわち8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47又は48)の整数であり、nは6〜24(すなわち6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23又は24)の整数であり、oは8〜16(すなわち8、9、10、11、12、13、14、15又は16)の整数であり、pは8〜16(すなわち8、9、10、11、12、13、14、15又は16)の整数であり、zは1〜3(すなわち1、2又は3)の整数であり、NRは非反復単位を表す)からなる群から選択される。上述の式は以下のうちの1つにより定義される。
(i)式(C)mでは、配列番号21によるアミノ酸配列で表される、数「m」のCモジュール、すなわち8個〜48個のCモジュールが互いに組み合わせられ、
(ii)式(C)mNRzでは、配列番号21によるアミノ酸配列で表される、数「m」のCモジュール、すなわち8個〜48個のCモジュールが互いに組み合わせられ、上記Cモジュールはさらに、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4と組み合わせられ、
(iii)式NRz(C)mでは、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4が存在し(z=1)、又は互いに組み合わせられ(z=2又は3)、上記非反復(NR)単位(複数も可)はさらに、配列番号21によるアミノ酸配列で表される、数「m」のCモジュール、すなわち8個〜48個のCモジュールと組み合わせられ、
(iv)式(AQ)nでは、数「n」のAモジュールとQモジュールとの組み合わせ、すなわち6個〜24個のAモジュールとQモジュールとの組み合わせ(ここでモジュールAは配列番号20によるアミノ酸配列により表され、モジュールQは配列番号22によるアミノ酸配列により表される)が互いに組み合わされ、
(v)式(AQ)nNRzでは、数「n」のAモジュールとQモジュールとの組み合わせ、すなわち6個〜24個のAモジュールとQモジュールとの組み合わせ(ここでモジュールAは配列番号20によるアミノ酸配列により表され、モジュールQは配列番号22によるアミノ酸配列により表される)が互いに組み合わされ、上記AモジュールとQモジュールとの組み合わせはさらに、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4と組み合わせられ、
(vi)式NRz(AQ)nでは、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4が存在し(z=1)、又は互いに組み合わせられ(z=2又は3)、上記非反復(NR)単位(複数も可)はさらに、数「n」のAモジュールとQモジュールとの組み合わせ、すなわち6個〜24個のAモジュールとQモジュールとの組み合わせ(ここでモジュールAは配列番号20によるアミノ酸配列により表され、モジュールQは配列番号22によるアミノ酸配列により表される)と組み合わせられ、
(vii)式(QAQ)oでは、数「o」のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ、すなわち8個〜16個のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ(ここでモジュールQは配列番号22によるアミノ酸配列で表され、モジュールAは配列番号20によるアミノ酸配列で表される)が互いに組み合わされ、
(viii)式(QAQ)oNRzでは、数「o」のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ、すなわち8個〜16個のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ(ここでモジュールQは配列番号22によるアミノ酸配列で表され、モジュールAは配列番号20によるアミノ酸配列で表される)が互いに組み合わされ、上記Qモジュールと、Aモジュールと、Qモジュールとの組み合わせはさらに、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4と組み合わせられ、
(ix)式NRz(QAQ)oでは、数「z」の非反復(NR)単位、すなわち1個〜3個の非反復(NR)単位、例えば配列番号41によるアミノ酸配列で表される非反復(NR)単位NR3又は配列番号42によるアミノ酸配列で表される非反復(NR)単位NR4が存在し(z=1)、又は互いに組み合わせられ(z=2又は3)、上記非反復(NR)単位(複数も可)はさらに、数「o」のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ、すなわち8個〜16個のQモジュールと、Aモジュールと、Qモジュールとの組み合わせ(ここでモジュールQは配列番号22によるアミノ酸配列で表され、モジュールAは配列番号20によるアミノ酸配列で表される)と組み合わせられ、
(x)式Ypでは、配列番号28によるアミノ酸配列で表される、数「p」のYモジュール、すなわち8個〜16個のYモジュールが互いに組み合わされ、
(xi)式Xpでは、配列番号27によるアミノ酸配列で表される、数「p」のXモジュール、すなわち8個〜16個のXモジュールが互いに組み合わされ、
(xii)式Kpでは、配列番号23によるアミノ酸配列で表される、数「p」のKモジュール、すなわち8個〜16個のKモジュールが互いに組み合わされる。
【0104】
最も好ましくは、本発明の方法に使用されるシルクポリペプチドは、C16NR4、C32NR4、(AQ)12、(AQ)24、(AQ)12NR3、(AQ)24NR3、C16、C32、Y8、Y16、X8、X16、K8又はK16である。
【0105】
ADF−3、ADF−4、MaSp I又はMaSp IIの変異体は、参照(野生型)ADF−3(配列番号1)、ADF−4(配列番号2)、MaSp I(配列番号43)、又はMaSp II(配列番号44)のポリペプチドとは異なり、該変異体はそれらからアミノ酸配列における最大150個(最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、110個、120個、130個、140個又は150個)のアミノ酸変化(すなわち置換、挿入、欠失、N末端切断及び/又はC末端切断)により誘導される。代替的に又は付加的に、このような変異体は、変異体の誘導元である参照(野生型)ポリペプチドに対する或る特定の程度の配列同一性を特徴とし得る。このため、ADF−3、ADF−4、MaSp I又はMaSp IIの変異体は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドに対する少なくとも50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は更には99.9%の配列同一性を有する。好ましくは配列同一性は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドの少なくとも20個、25個、30個、35個、40個、50個、60個、70個、80個、90個、100個、120個、150個、180個、200個、250個、300個、350個、400個又はそれ以上のアミノ酸の連続ストレッチにわたる、好ましくは全長にわたるものである。
【0106】
配列同一性は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドの全長にわたって少なくとも80%、全長にわたって少なくとも85%、全長にわたって少なくとも90%、全長にわたって少なくとも95%、全長にわたって少なくとも98%、又は全長にわたって少なくとも99%であるのが特に好ましい。配列同一性は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドのうちの少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも80%、少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも85%、少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも90%、少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも95%、少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも98%、又は少なくとも20個、30個、50個、100個、150個、200個、250個若しくは300個のアミノ酸の連続ストレッチにわたって少なくとも99%であるのが更に特に好ましい。
【0107】
ADF−3(配列番号1)ポリペプチドの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、120個、150個、170個、200個、220個、250個、270個、300個、320個、350個、370個、400個、420個、450個、470個、500個、520個、550個、570個、600個又は610個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0108】
ADF−4(配列番号2)ポリペプチドの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、120個、150個、170個、200個、220個、250個、270個、300個、320個、330個、340個、350個、360個、370個、380個又は390個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0109】
MaSp 1(配列番号43)ポリペプチドの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、150個、200個、250個、300個、350個、400個、450個、500個、550個、600個、620個、640個、660個、670個、680個又は690個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0110】
MaSp 11(配列番号44)ポリペプチドの断片(又は欠失変異体)は好ましくは、そのN末端に及び/又はそのC末端に最大1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、15個、20個、25個、30個、35個、40個、45個、50個、55個、60個、65個、70個、75個、80個、85個、90個、95個、100個、150個、200個、250個、300個、350個、400個、450個、500個、520個、540個、560個又は570個のアミノ酸の欠失を有する。欠失は内部にあってもよい。
【0111】
さらに、ADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片は、変異体又は断片の元となるアミノ酸配列に対する修飾が、ポリペプチドのケブラー又は綿等の不活性材料又は自然発生的な材料をコーティングする、好ましくは均一にコーティングする能力に負の影響を与えない場合にのみ、本発明との関連内においてADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片とみなされる。好ましくは、ADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片は、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドを用いて形成することができるのと同様に、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、最も好ましくは1.0μm〜5μmの厚さのコーティングを形成することが可能である。ADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片で作られたコーティングは、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドで作られたコーティングと比較して類似の表面構造(表面起伏)、例えば粗度又は多孔性を有するのも好ましい。ADF−3、ADF−4、MaSp I又はMaSp IIの変異体又は断片で作られたコーティングは、各参照(野生型)ADF−3、ADF−4、MaSp I又はMaSp IIのポリペプチドで作られたコーティングに類似の表面構造及び厚さを示すのが特に好ましい。当業者は電子顕微鏡検査を用いて、コーティングの厚さ又は表面構造(表面起伏)を容易に評価することができる。
【0112】
別の実施の形態では、シルクポリペプチドは、
(i)アミノ酸配列GCGGGGGGSGGGG(配列番号35)からなるTAGCYS1、
(ii)アミノ酸配列GCGGGGGG(配列番号36)からなるTAGCYS2、
(iii)アミノ酸配列GCGGSGGGGSGGGG(配列番号37)からなるTAGCYS3、
(iv)アミノ酸配列GKGGGGGGSGGGG(配列番号38)からなるTAGLYS1、及び
(v)アミノ酸配列GKGGGGGG(配列番号39)からなるTAGLYS2
からなる群から選択されるアミノ末端及び/又はカルボキシ末端TAGを含む。
【0113】
これらのTAGは、システイン及び/又はリジンを含有し、下記のように、シルクポリペプチドと不活性材料とを共有結合的に連結するのに、又は物質とシルクポリペプチドとを連結するのに使用することができる。
【0114】
最も好ましくは、本発明の方法に使用されるシルクポリペプチドは、TAGCYS1C16、C16TAGCYS1、TAGCYS1C16TAGCYS1、TAGCYS2C16、C16TAGCYS2、TAGCYS2C16TAGCYS2、TAGCYS3C16、C16TAGCYS3、TAGCYS3C16TAGCYS3、TAGLYS1C16、C16TAGLYS1、TAGLYS1C16TAGLYS1、TAGLYS2C16、C16TAGLYS2、又はTAGLYS2C16TAGLYS2を含む又はこれからなる。
【0115】
好ましくは、本発明の方法で提供される溶液中のシルクポリペプチドの濃度は、0.1wt%/vol〜30wt%/volの範囲、好ましくは1wt%/vol〜10wt%/volの範囲、最も好ましくは2wt%/vol〜8wt%/vol又は4wt%/vol〜6wt%/volの範囲である。このため例えば、本発明の方法で提供される溶液中のシルクポリペプチドの濃度は、0.1wt%/vol、0.4wt%/vol、0.
.6wt%/vol、0.8wt%/vol、1.0wt%/vol、1.2wt%/vol、1.4wt%/vol、1.6wt%/vol、1.8wt%/vol、2.0wt%/vol、2.2wt%/vol、2.4wt%/vol、2.6wt%/vol、2.8wt%/vol、3.0wt%/vol、3.5wt%/vol、4.0wt%/vol、4.5wt%/vol、5.0wt%/vol、5.5wt%/vol、6.0wt%/vol、6.5wt%/vol、7.0wt%/vol、7.5wt%/vol、8.0wt%/vol、9.0wt%/vol、10.0wt%/vol、12.0wt%/vol、15.0wt%/vol、18.0wt%/vol、20.0wt%/vol、25.0wt%/vol又は30.0wt%/volである。
【0116】
好ましくは、本発明の方法で提供される溶媒は、ファンデルワールス力を不安定化する溶媒(van der Waals forces destabilisingsolvent)、ギ酸、水溶液、好ましくはH2O若しくは緩衝水溶液(例えばトリス緩衝水溶液)、又はそれらの混合物である。最も好ましくは、ファンデルワールス力を不安定化する溶媒は、ヘキサフルオロイソプロパノール(HFIP)、トリクロロ酢酸(Trichloroacetic acid)(TCA)、トリフルオロ酢酸(Trifluoroacetic acid)(TFA)及び臭化リチウム(LiBr)からなる群から選択される。水はその良好な入手可能性及び非毒性のために最も好ましい。これらの溶媒中に、シルクポリペプチドが溶解又は懸濁化する。本発明に関連して「懸濁液」という用語は、液体中での固体粒子の分散液を表す。粒径が約100nmである場合、懸濁液はコロイド状である。
【0117】
本発明の方法でコーティングされる不活性材料又は自然発生的な材料は、繊維、繊維を含む糸、繊維を含む撚糸、繊維を含む織布、及び繊維を含む不織布からなる群から選択されるのが好ましい。
【0118】
織布のコーティングはより実用的であり、費やされる時間がより短く、かつコーティング材の必要量がより小さい。繊維のコーティング、及び続く布地の製織はより複雑であるとともに、より費用がかかるが、再現性がより高く価値がより高い。シルクポリペプチドC16による綿織布のコーティングを実施例IVで例示する。図4は、未処理の製織済みの布地と、コーティングされた製織済みの布地との比較を示す。
【0119】
不活性材料が不活性合成材料又は不活性無機材料であるのが好ましい。好ましくは、不活性材料は、
(i)ポリエステル(Diolen、Trevira)、ポリアミド(PA、例えばナイロン又はPerlon)、ポリアラミド(例えばケブラー、Twaron又はNomex)、ポリテトラフルオロエチレン(PTFE、例えばテフロン登録商標)、ポリエチレン(PE、例えばDyneema)、ポリプロピレン(PP)、ポリウレタン(PU、例えばLycra)、シリコーン、ポリウレタンとポリエチレングリコールとの混合物(エラスタン)、超高分子量ポリエチレン(UHMWPE)及び高性能ポリエチレン(HPPE)からなる群から選択される不活性合成材料、又は
(ii)ガラス、炭素、セラミック、金属、(金属)合金、サファイア、ダイアモンド及び半導体からなる群から選択される不活性無機材料
である。
【0120】
本発明者らは驚くべきことに、コーティング材としてのシルクポリペプチドの使用が最も穏やかな条件下での効率性の高いコーティングを提供し、特定用途に合わせたシルクでコーティングされた不活性な無機材料の製造を可能とすることを見出している。今日までは、(たとえ可能であったとしても)プラズマ処理のような非常に厳しい条件が不活性無機材料、例えば不活性無機繊維に変更を加えるのに必要であった。
【0121】
不活性合成材料であるポリエステル、ポリアミド(PA)及びポリアラミドは重縮合材料(例えば重縮合繊維)である。すなわち上記材料は重縮合反応により生成される。重縮合反応により、モノマー分子同士が連結し、水又は類似の物質を放出することでポリマーが形成される。不活性合成材料であるポリテトラフルオロエチレン(PTFE)、ポリエチレン(PE)及びポリプロピレン(PP)は重合材料(例えば重合繊維)である。すなわち上記材料は重合反応により生成される。重合反応は、化学反応においてモノマー分子同士を反応させ、三次元ネットワーク又はポリマー鎖を形成するプロセスである。不活性合成材料ポリウレタン(PU)及びポリウレタンとポリエチレングリコールとの混合物は重付加材料(例えば重付加繊維)である。すなわち上記材料は重付加反応により作製される。重付加反応では、多くのモノマー同士がいかなる原子又は分子をも失うことなく、結合の転位により結合する。このことは形成中に分子(通常は水)が失われる縮合反応により形成される縮合ポリマーとは対照的である。
【0122】
不活性無機材料としての金属は、白金(Pt)、クロム(Cr)、銀(Ag)、金(Au)及びそれらの組成物/合金からなる群から選択されるのが好ましい。好ましくは、無機材料は半導体であり、鉄(Fe)、銅(Cu)、ゲルマニウム(Ge)、ケイ素(Si)、 セレン(Se)、テルル(Te)及びそれらの組成物/合金からなる群から選択される。(金属)合金は鋼であるのが更に好ましい。
【0123】
好ましくは、自然発生的な材料は、絹、綿、セルロース、亜麻、羊毛、麻、竹、ゴム、本物の毛(例えば人毛又は獣毛)又は人工毛等の毛、及び人の皮膚又は動物の皮膚等の皮膚からなる群から選択される。本物の毛(例えば人毛)又は人工毛は、ヘアーエクステンション、ウィッグ(periwigs)、ヘアーピース(hair pieces)又はかつら用の毛であり得る。本物の毛(例えば人毛)又は人工毛はウィッグ、ヘアーピース又はかつらの一部であってもよい。
【0124】
本発明の方法が、毛、特に本物の毛(例えば人毛又は獣毛)、又は皮膚(例えば人又は動物の皮膚)等の自然発生的な材料のシルクポリペプチドによるコーティングに関する限りにおいて、上記方法は美容上の目的のためのもの、例えば毛の粗さを低減するためのもの、並びに/又は毛の輝きを改善するためのもの、又は皮膚の湿潤性及び/若しくは柔軟性を改善するためのものであるのが好ましい。
【0125】
このため例えばポリアラミド繊維、ポリアラミド糸、ポリテトラフルオロエチレン繊維、ポリテトラフルオロエチレン糸、炭素繊維、炭素糸、ガラス繊維、ガラス糸、ナイロン繊維、ナイロン糸、綿繊維、綿糸、綿織布、綿の不織布、羊毛織布、又は羊毛の不織布を本発明の方法においてシルクポリペプチドでコーティングすることができる。
【0126】
シルクポリペプチドによるコーティングのための不活性基材又は自然発生的な基材の選択は、コーティングされた不活性材料又は自然発生的な材料の続く用途によって様々である。例えば、表面の感触が改善された不活性合成材料の糸(例えばポリアラミド糸)が望まれる場合、まず不活性合成材料の繊維(例えばポリアラミド繊維)をシルクポリペプチドでコーティングし、続いて上記繊維から糸を作製する必要はない。加えて、シルクポリペプチドによる織布の直接コーティングにより、既にシルクポリペプチドでコーティングされた繊維から作製した織布と比較して同程度ではあるが、異なるコーティングパターンがもたらされる。これは、織布コーティングでは、隙間にシルクポリペプチドを充填することができるのに対して、既にシルクポリペプチドでコーティングされた繊維から作製した織布では、隙間にはシルクポリペプチドコーティングが含まれていないことを意味する。したがって、隙間が充填された織布材料のコーティングが望まれる場合、本発明のコーティング方法のための基材として織布を使用することが有益である。
【0127】
例として、本発明の方法は、
i)反復単位としてのC16からなるシルクポリペプチドと、溶媒としてH2Oとを含む溶液を準備する工程と、
ii)不活性合成材料としてのポリアラミド(ケブラー)繊維上に溶液を塗布することより該ポリアラミド繊維を反復単位としてのC16からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含むことができる。
【0128】
本発明の方法は、
i)反復単位としてのC16からなるシルクポリペプチドを含む水溶液を準備する工程と、
ii)該溶液を不活性合成材料としてのポリテトラフルオロエチレン(テフロン登録商標)糸上に塗布することにより該ポリテトラフルオロエチレン糸を反復単位としてのC16からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含むことができる。
【0129】
本発明の方法は、
i)反復単位としての(AQ)24NR3からなるシルクポリペプチドと、溶媒としてギ酸とを含む溶液を準備する工程と、
ii)該溶液を不活性合成材料としてのポリテトラフルオロエチレン(テフロン登録商標)糸上に塗布することにより該ポリテトラフルオロエチレン糸を反復単位としての(AQ)24NR3からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含むことができる。
【0130】
本発明の方法は、
i)反復単位としてのC16からなるシルクポリペプチドと、溶媒としてヘキサフルオロイソプロパノール(HFIP)とを含む溶液を準備する工程と、
ii)自然発生的な材料としての亜麻繊維上に溶液を塗布することにより該亜麻繊維を反復単位としてのC16からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含むこともできる。
【0131】
加えて、本発明の方法は、
i)反復単位としてのC32からなるシルクポリペプチドを含む水溶液を準備する工程と、
ii)該溶液を自然発生的な材料としての羊毛織布上に塗布することにより該羊毛織布を反復単位としてのC32からなるシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含むことができる。
【0132】
上述の例に関しては、C16はモジュールCの16個の反復単位を意味し、C32はモジュールCの16個又は32個の反復単位を意味する。
【0133】
好ましくは、コーティングにおけるシルクポリペプチドは、不活性材料と、又は自然発生的な材料と共有結合的に及び/又は非共有結合的に連結している。「共有結合的な連結」という用語は、結合対の各原子が1つの電子を提供し、化学結合において電子対を形成するタイプの化学的な連結を意味する。シルクポリペプチドは、
(a)シルクポリペプチドのシステイン残基、リジン残基、アミノ末端、カルボキシ末端、アミノ末端TAG若しくはカルボキシ末端TAGを介して、及び/又は
(b)架橋を介して
不活性材料又は自然発生的な材料と共有結合的に連結するのが好ましい。
【0134】
本発明の方法において、シルクポリペプチドは、アミド結合又はジスルフィド結合の形成を介して自然発生的な材料(例えば羊毛又は亜麻)と共有結合的に連結することができる。「アミド結合」(アミド連結)という用語は、1つの分子のカルボキシル基が他の分子のアミン基と反応し、それにより水分子(H2O)が放出される際に2つの分子(例えばポリペプチド)間で形成される化学結合を表す。「ジスルフィド結合」(ジスルフィド連結)という用語は、通常システイン残基の2つのチオール基のカップリングにより誘導される化学結合を表す。該連結はSS−結合又はジスルフィド架橋とも呼ばれる。
【0135】
このため例えば、本発明の方法に使用されるシルクポリペプチド(例えばC16を含むシルクポリペプチド)は、アミド結合を形成することによりそのアミノ末端を介して又はそのカルボキシ末端を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することができる。シルクポリペプチドは、ジスルフィド結合を形成することによりそのアミノ末端TAG(例えばTAGCYS1C16)を介して又はそのカルボキシ末端TAG(例えばC16TAGCYS1)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することもできる。加えて、シルクポリペプチド(例えばAKQ4)は、アミド結合を形成することによりそのリジン残基(例えばシルクポリペプチドAKQ4の反復単位AKにおけるリジン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することができる。さらに、シルクポリペプチドは、ジスルフィド結合を形成することによりそのシステイン残基(例えばシルクポリペプチドACQ4の反復単位ACにおけるシステイン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することができる。
【0136】
(a)で言及されるようなシルクポリペプチドと自然発生的な材料との共有結合的な連結の組み合わせも好ましい。このため例えば、シルクポリペプチド(例えばC16TAGCYS1)は、(i)ジスルフィド結合を形成することによりそのシステイン残基(例えばシルクポリペプチドC16TAGCYS1のカルボキシ末端TAGCYS1におけるシステイン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と、及び(ii)アミド結合を形成することによりそのアミノ末端(例えばシルクポリペプチドC16TAGCYS1のC16のアミノ末端)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することができる。シルクポリペプチド(例えばAC4TAGLYS1)は、(i)アミド結合を形成することによりそのリジン残基(例えばシルクポリペプチドAC4TAGLYS1のカルボキシ末端TAGLYS1におけるリジン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と、及び(ii)ジスルフィド結合を形成することによりそのシステイン残基(例えばシルクポリペプチドAC4TAGLYS1の反復単位ACにおけるシステイン残基)を介して自然発生的な材料(例えば亜麻又は羊毛)と共有結合的に連結することもできる。
【0137】
シルクポリペプチドは不活性材料又は自然発生的な材料と非共有結合的に連結することもできる。「非共有結合的な連結」という用語は、電子対の共有を伴わないが、電磁相互作用、疎水性相互作用又はファンデルワールス相互作用のより分散したバリエーションを伴うタイプの連結(相互作用)を意味する。
【0138】
シルクポリペプチドは、イオン(静電)連結(相互作用)を介して又は疎水性連結(相互作用)を介して不活性材料(例えばポリエステル、ポリアラミド又はポリテトラフルオロエチレン)、又は自然発生的な材料(例えば羊毛、亜麻又は綿)と非共有結合的に連結するのが特に好ましい。「疎水性連結」(疎水性相互作用)という用語は、炭化水素が水性媒体中で分子間凝集体を形成する傾向に依存する連結(相互作用)を表す。「イオン(静電)連結」(イオン(静電)相互作用)という用語は、1つの原子が電子を失って陽イオンを形成し、他の原子が電子を得て陰イオンを形成する非共有結合(イオン(静電)結合)を表す。
【0139】
シルクポリペプチドC16によるアラミド(ケブラー)繊維のコーティングを実施例Iで説明する。シルクポリペプチドC16でコーティングされたアラミドフィラメントを図2に示す。
【0140】
不活性材料又は自然発生的な材料をシルクポリペプチド層でコーティングすることができるという予期せぬ発見が、様々な用途に関する新たな機会を与える。一般的にタンパク質は特に不活性材料の存在下で非特異的に凝集する傾向があることは周知の事実である。ヘモグロビン、BSA又はシトクロムCのような標準タンパク質は単に凝集し、このためこれらが表面に全体的に(at all)固着する場合に平坦ではない表面が生じる。驚くべきことに、シルクポリペプチド(例えばスパイダーシルクポリペプチド)は、特にポリアラミド又は炭素材料(例えばポリアラミド又は炭素糸)のような剛性であり、かつ粗い不活性合成材料上で平坦でかつ平滑な表面層を形成する。光学的利点及び触感的利点とは別に、シルクポリペプチドコーティングは、更なる改良、またこれによりコーティングされた不活性材料又は自然発生的な材料に関する新たな範囲の用途の可能性をもたらす。
【0141】
このため、本発明の好ましい実施の形態では、シルクポリペプチドは、シルクポリペプチドと共有結合的に及び/又は非共有結合的に連結する、少なくとも1つの物質、すなわち1個、2個、3個、4個、5個、6個又はそれ以上の物質、好ましくは1個又は2個の物質を更に含む。
【0142】
好ましくは、該物質は本発明の方法の工程i)の前に、工程i)の後に、及び/又は工程ii)の後にシルクポリペプチドと共有結合的に及び/又は非共有結合的に連結する。
【0143】
該物質とシルクポリペプチドとのカップリング/連結を、不活性材料又は自然発生的な材料上へのシルクポリペプチドの塗布の前に(すなわち本発明の方法の工程i)の前に又は工程i)の後に)行うか、塗布の後に(すなわち本発明の方法の工程ii)の後に)行うか、又は複数回(すなわち本発明の方法の工程i)の前と、工程i)の後と、工程ii)の後とで;工程i)の前と、工程ii)の後とで;工程i)の前と、工程i)の後とで;又は工程i)の後と、工程ii)の後とで)行うかは、接着させる物質、接着のタイプ及びコーティングされた材料の所望の用途に依存する。シルクポリペプチドの複数回のカップリングは、様々な材料がシルクポリペプチドとカップリングする場合に有益である。
【0144】
物質の非共有結合的な連結は本発明の方法の工程ii)の後に行うのが好ましい。大量の共有結合的に連結した物質を有するコーティングされた製品が望まれる場合、物質の連結は数回、例えば工程i)の後と、工程ii)の後とで行うのが好ましい。好ましくは、該物質が、
(a)該シルクポリペプチドのシステイン残基、リジン残基、該アミノ末端、該カルボキシ末端、該アミノ末端TAG若しくは該カルボキシ末端TAGを介して、及び/又は
(b)架橋を介して
シルクポリペプチドと共有結合的に連結する。
【0145】
該物質は本発明のプロセスにおいて架橋を介してシルクポリペプチドと共有結合的に連結することができる。「架橋」という用語は、共有結合により2つの分子を化学的に結び付けるプロセスを表す。架橋試薬又はカップリング試薬は、ポリペプチド上に又は他の分子上に特定の官能基に対する反応性末端(第1級アミン、スルフヒドリル等)を含有する。好ましくは、本発明の方法に使用される架橋試薬又はカップリング試薬は、1−エチル−3−(3−ジメチルアミノプロピル)−カルボジイミド塩酸塩(EDC)又はグルタルアルデヒドである。
【0146】
したがって例えば、本発明の方法に使用される該物質(例えば酵素、抗体又は抗体断片)は、アミド結合を形成することによりシルクポリペプチドのアミノ末端を介して又はカルボキシ末端を介してシルクポリペプチド(例えばC16を含むシルクポリペプチド)と共有結合的に連結することができる。該物質(例えば酵素又は抗体)は、ジスルフィド結合を形成することによりシルクポリペプチドのアミノ末端TAG(例えばTAGCYS1C16)を介して又はカルボキシ末端TAG(例えばC16TAGCYS1)を介してシルクポリペプチドと共有結合的に連結することもできる。加えて、該物質(例えば酵素又は抗体)は、アミド結合を形成することによりシルクポリペプチドのリジン残基(例えばシルクポリペプチドAKQ4の反復単位AKにおけるリジン残基)を介してシルクポリペプチド(例えばAKQ4)と共有結合的に連結することができる。さらに、該物質(例えば酵素又は抗体)は、ジスルフィド結合を形成することによりシルクポリペプチドのシステイン残基(例えばシルクポリペプチドACQ4の反復単位ACにおけるシステイン残基)を介してシルクポリペプチド(例えばACQ4)と共有結合的に連結することができる。
【0147】
(a)で言及されるような該物質とシルクポリペプチドとの共有結合的な連結の組み合わせも好ましい。このため例えば、該物質(例えば酵素又は抗体)は、アミド結合を形成することによりシルクポリペプチドの(i)アミノ末端を介して、及び(ii)カルボキシ末端を介してシルクポリペプチド(例えばC16を含むシルクポリペプチド)と共有結合的に連結することができる。該物質(例えば酵素又は抗体)は、(i)ジスルフィド結合を形成することによりシルクポリペプチドのシステイン残基(例えばシルクポリペプチドC16TAGCYS1のカルボキシ末端TAGCYS1におけるシステイン残基)を介してシルクポリペプチド(例えばC16TAGCYS1)と、及び(ii)アミド結合を形成することによりシルクポリペプチドのアミノ末端(例えばシルクポリペプチドC16TAGCYS1のC16のアミノ末端)を介してシルクポリペプチド(例えばC16TAGCYS1)と共有結合的に連結することもできる。該物質(例えば酵素又は抗体)は、(i)アミド結合を形成することによりシルクポリペプチドのリジン残基(例えばシルクポリペプチドAC4TAGLYS1のカルボキシ末端TAGLYS1におけるリジン残基)を介してシルクポリペプチド(例えばAC4TAGLYS1)と、及び(ii)ジスルフィド結合を形成することによりシルクポリペプチドのシステイン残基(例えばシルクポリペプチドAC4TAGLYS1の反復単位ACにおけるシステイン残基)を介してシルクポリペプチド(例えばAC4TAGLYS1)と共有結合的に連結することもできる。
【0148】
上述のように、該物質(例えば色素又は酵素)は本発明のプロセスにおいて架橋を介してシルクポリペプチドと共有結合的に連結することができる。好ましくは、本発明の方法に使用される架橋試薬又はカップリング試薬は、1−エチル−3−(3−ジメチルアミノプロピル)−カルボジイミド塩酸塩(EDC)又はグルタルアルデヒドである。酵素β−ガラクトシダーゼ及びフルオレセイン色素と、シルクポリペプチドC16でコーティングされたポリアラミド繊維との架橋を実施例IIで説明する。
【0149】
好ましくは、共有結合的に連結/カップリングする物質は、ポリペプチド、脂質、色素、共役金属、活性炭、及び作用物質からなる群から選択される。最も好ましくは、
(i)ポリペプチドが酵素、好ましくはβ−ガラクトシダーゼ、抗体、ホルモン、好ましくはインスリン、又は抗原であり、
(ii)脂質がコレステロール、ステロイド、ワックス、又はオイルであり、
(iii)色素が合成色素、好ましくはアゾ化合物、無機色素、好ましくは金属塩、又は有機色素、好ましくはフルオレセイン色素若しくはローダミン色素であり、
(iv)共役金属がナノゴールド(商標)であり、
(v)活性炭が粉末活性炭(PAC)、粒状活性炭(GAC)及び押出成形活性炭(EAC)からなる群から選択され、
(vi)作用物質が医薬品、止血剤、成長刺激剤、抗炎症剤、防汚剤(anti-fouling)、抗微生物剤、抗細菌剤、抗真菌剤、農薬及びUV保護剤からなる群から選択される。
【0150】
組み込まれる物質は限定されるものではないが、固体、半固体又は液体であり得る。該物質はシルクポリペプチドと非共有結合的に連結することもできる。該物質がイオン(静電)連結(相互作用)を介して、疎水性連結(相互作用)を介して又は付着を介してシルクポリペプチドと非共有結合的に連結するのが特に好ましい。
【0151】
好ましくは、非共有結合的に連結/カップリングする物質は、ポリペプチド、脂質、色素、共役金属、活性炭、金属塩、及び作用物質からなる群から選択される。最も好ましくは、
(i)ポリペプチドが酵素、好ましくはβ−ガラクトシダーゼ、抗体、ホルモン、好ましくはインスリン、又は抗原であり、
(ii)脂質がコレステロール、ステロイド、ワックス、又はオイルであり、
(iii)色素が合成色素、好ましくはアゾ化合物、無機色素、好ましくは金属塩、又は有機色素、好ましくはフルオレセイン色素若しくはローダミン色素であり、
(iv)共役金属がナノゴールド(商標)であり、
(v)活性炭が粉末活性炭(PAC)、粒状活性炭(GAC)及び押出成形活性炭(EAC)からなる群から選択され、
(vi)金属塩が銅、コバルト、ニッケル又は銀からなる群から選択されるカチオンであり、
(vii)作用物質が医薬品、止血剤、成長刺激剤、抗炎症剤、防汚剤、抗微生物剤、抗細菌剤、抗真菌剤、農薬及びUV保護剤からなる群から選択される。
【0152】
塩化銅又は塩化コバルトのいずれかと、シルクポリペプチドC16でコーティングされたアラミド繊維との非共有結合的な連結を実施例IIIで説明する。
【0153】
非共有結合的なカップリングは、或る特定期間にわたり該物質の規定の放出を行わせるための金属塩又は作用物質のコーティングへの導入に好適である。これは、幾つかの目的、すなわち医薬技術におけるポリアラミド糸コーティングで必要とされる。現在ではこれにより、コーティングされた不活性な合成材料又は無機材料、例えばポリアラミド糸又は布地からの塩又は作用物質の制御放出を達成することが初めて可能となる。不活性な合成材料又は無機材料、例えばポリアラミド糸又は布地をかかる便利な方法で改良を加えることができることは全く予見不可能であった。
【0154】
他の用途、例えば撥水性布地の製造には、物質とシルクポリペプチドとの共有結合的な連結がより好適である。降雨中、組み込まれた物質はシルクでコーティングされた不活性合成材料、不活性無機材料又は自然発生的な材料から洗い流されることはないものとする。加えて、殺菌効果又は発散防止効果を有する布地の製造には、物質、例えば銀又は静菌性化合物と、シルクでコーティングされた不活性合成材料、不活性無機材料又は自然発生的な材料とを共有結合的に連結することも好まれる。
【0155】
本発明の方法の工程ii)を、4℃〜80℃、好ましくは4℃〜40℃の温度で行うのが好ましい。例えば、本発明の方法の工程ii)を、4℃、8℃、10℃、12℃、15℃、18℃、20℃、21℃、22℃、23℃、24℃、25℃、28℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃又は80℃で行うことができる。最も好ましくは、本発明の方法の工程ii)を20℃〜25℃で行う。
【0156】
本発明者らは驚くべきことに、不活性材料又は自然発生的な材料を、穏やかな反応条件、すなわち4℃〜80℃の温度等の穏やかな温度下でコーティングすることができることを見出している。コーティングされた製品は改善された触感特性及び光学特性を有する。好ましくは、該方法は、
iii)少なくとも2つの同一の反復単位及び任意選択的に少なくとも1つの非反復(NR)単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
iv)不活性材料又は自然発生的な材料上に該溶液を塗布することにより2回目として該不活性材料又は該自然発生的な材料をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)の該シルクポリペプチドが工程(i)の該シルクポリペプチドと同一である又は異なる。このため例えば、本発明の好ましい実施の形態では、該方法は、
iii)シルクポリペプチドC16と、溶媒としてギ酸とを含む溶液を準備する工程と、
iv)ポリアラミド繊維上に該溶液を塗布することにより2回目として該ポリアラミド繊維をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)のシルクポリペプチドC16は工程(i)のシルクポリペプチドC16と同一である。本発明の別の好ましい実施の形態では、該方法は、
iii)シルクポリペプチド(AQ)24NR4と、溶媒としてヘキサフルオロイソプロパノール(HFIP)とを含む溶液を準備する工程と、
iv)ポリテトラフルオロエチレン糸上に該溶液を塗布することにより2回目としてポリテトラフルオロエチレン糸をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)のシルクポリペプチド(AQ)24NR4は工程(i)のシルクポリペプチドC16とは異なる。本発明の更に好ましい実施の形態では、該方法は、
iii)シルクポリペプチドC16を含む水溶液を準備する工程と、
iv)ポリアラミド繊維上に該溶液を塗布することにより2回目としてポリアラミド繊維をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)のシルクポリペプチドC16は工程(i)のシルクポリペプチドC16と同一である。
【0157】
本発明の方法の工程(iii)及び工程(iv)は、様々な厚さ及び多重層のコーティングされた不活性材料又は自然発生的な材料を得るために数回、好ましくは3回〜10回、すなわち3回、4回、5回、6回、7回、8回、9回又は10回繰り返すのが好ましい。
【0158】
好ましくは、不活性材料又は自然発生的な材料のコーティングは、1nm〜50μm、好ましくは40nm〜50μm、より好ましくは0.5μm〜10μm、より好ましくは0.8μm〜8μm、最も好ましくは1.0μm〜5.0μm、すなわち1.0μm、1.1μm、1.2μm、1.3μm、1.4μm、1.5μm、1.6μm、1.7μm、1.8μm、1.9μm、2.0μm、2.1μm、2.2μm、2.3μm、2.4μm、2.5μm、2.6μm、2.7μm、2.8μm、2.9μm、3.0μm、3.1μm、3.2μm、3.3μm、3.4μm、3.5μm、3.6μm、3.7μm、3.8μm、3.9μm、4.0μm、4.1μm、4.2μm、4.3μm、4.4μm、4.5μm、4.6μm、4.7μm、4.8μm、4.9μm又は5.0μmの厚さを有する。
【0159】
コーティングされた不活性材料又は自然発生的な材料は、3層、4層、5層、6層、7層、8層、9層又は10層の異なる又は同一のシルクポリペプチド、好ましくは異なるシルクポリペプチドを含むのが好ましい。
【0160】
このため例えば本発明の好ましい実施の形態では、該方法は、
i)シルクポリペプチドC16を含む水溶液を準備する工程と、
ii)ポリアラミド糸上に溶液を塗布することによりポリアラミド糸をシルクポリペプチドC16でコーティングする、塗布することによりコーティングする工程と、
iii)シルクポリペプチド(AQ)24NR4を含む水溶液を準備する工程と、
iv)ポリアラミド糸上に溶液を塗布することにより2回目としてポリアラミド糸をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含み、工程(iii)のシルクポリペプチド(AQ)24NR4は工程(i)のシルクポリペプチドC16とは異なり、ポリアラミド糸のコーティングは2つの異なる層(すなわち第1の層:シルクポリペプチドC16及び第2の層:シルクポリペプチド(AQ)24NR4)を有し、0.05μmの厚さを有する。
【0161】
本発明の方法は工程ii)、工程iii)、及び/又は工程iv)の後に、可視光、紫外線若しくは耐水性、摩耗、機械的応力、酸及び/又は塩基に対する保護を与える染色/仕上げ加工により、コーティングされた又は非処理材料に事後改良を加える工程を含むのが更に好ましい。
【0162】
第2の態様では、本発明は、第1の態様の方法により入手可能なコーティングされた不活性材料又は自然発生的な材料を提供する。
【0163】
第3の態様では、本発明は、
(i)繊維、
(ii)(i)の繊維を含む糸、又は
(iii)(i)の繊維を含む撚糸、織布若しくは不織布
等の第2の態様のコーティングされた不活性材料又は自然発生的な材料を含む製品を提供する。
【0164】
第4の態様では、本発明は、或る特定の期間にわたる、好ましくは6時間から最大8日間にわたる、より好ましくは24時間から最大5日間にわたる、最も好ましくは12時間、24時間、48時間、72時間、96時間若しくは120時間にわたる少なくとも1つの物質、すなわち1個、2個、3個、4個、5個、6個若しくはそれ以上の物質、好ましくは1個若しくは2個の物質の制御放出のための、又は防護服若しくは撥水性の服の製造のための第2の態様のコーティングされた不活性材料又は自然発生的な材料の使用に関する。
【0165】
第5の態様では、本発明は、不活性材料を染色するためのシルクポリペプチドの使用に関する。不活性材料は合成不活性材料又は無機不活性材料であるのが好ましい。好ましくは、不活性材料が、
(i)ポリエステル、ポリアミド(PA)、ポリアラミド、ポリテトラフルオロエチレン(PTFE)、ポリエチレン(PE)、ポリプロピレン(PP)、ポリウレタン(PU)、シリコーン、ポリウレタンとポリエチレングリコールとの混合物(エラスタン)、超高分子量ポリエチレン(UHMWPE)、及び高性能ポリエチレン(HPPE)からなる群から選択される合成不活性材料、又は
(ii)ガラス、炭素、セラミック、金属、サファイア、ダイアモンド及び半導体からなる群から選択される無機不活性材料
である。
【0166】
更なる態様では、本発明は、アレルギー、発疹、湿疹皮膚炎、疱疹、皮膚感染症、乾癬、座瘡、日焼け及び疣贅からなる群から選択される皮膚疾患の治療又は予防のためのシルクポリペプチドに関する。好ましくは、皮膚疾患の予防は保湿効果及びUV線に対する保護に関する。
【0167】
別の態様では、本発明は、アレルギー、発疹、湿疹皮膚炎、疱疹、皮膚感染症、乾癬、座瘡、日焼け及び疣贅からなる群から選択される皮膚疾患の治療又は予防のための薬物の製造のためのシルクポリペプチドの使用に関する。好ましくは、皮膚疾患の予防は保湿効果及びUV線に対する保護に関する。
【0168】
添付の図面及び以下の実施例は本発明を単に説明するものであり、添付の特許請求の範囲により示されるような本発明の範囲を限定するものとは決して解釈されないものとする。
【図面の簡単な説明】
【0169】
【図1】糸をシルクポリペプチドでコーティングする技術プロセスを示す図である。図1によると、シルクポリペプチドをスプレーコーティングにより又はディップコーティングにより糸上に塗布することができる。
【図2】スパイダーシルクでコーティングされたアラミド(ケブラー)フィラメントの電子顕微鏡写真を示す図である。図2は、スパイダーシルクコーティングがアラミド(ケブラー)フィラメント全体にわたって均一に分布していることを示す。
【図3】分子をスパイダーシルクコーティングに共有結合的に接着させる技術プロセスを示す図である。図3は、スパイダーシルクポリペプチドによる未処理の不活性合成繊維のコーティングと、その後の作用物質又は化学分子によるコーティングされた不活性合成繊維のコーティングとを示す。
【図4】未処理の製織済みの布地及びコーティングされた製織済みの布地の異なる倍率での電子顕微鏡写真を示す図である。
【図5】金色に脱色した欧州人の毛(A、B)のスパイダーシルクポリペプチドC16(3%)によるコーティング前(A)及びコーティング後(B)の、並びに脱色したことのない(virgin)欧州人の毛(C、D)のAQ24NR3(0.85%)によるコーティング前(C)及びコーティング後(D)のレーザー走査顕微鏡画像(レーザー強度倍率50×)を示す図である。図5A及び図5Bに示される四方形はコーティングの前後での同じセクションの毛サンプルの比較を可能にするために毛サンプル上の特定の特徴的なスポットを指定したものである。
【図6】C16(3%)によるコーティング前(A)及びコーティング後(B)のナイロン(PA)繊維のレーザー走査顕微鏡画像(レーザー強度倍率150×)を示す図である。
【図7】蛍光(EpiVax)及びCy5フィルター下での蛍光画像(Proxima−Imager)を示す図である。図7Aでは、Cy5を用いた又は用いないAQ24NR3のウェスタンブロット分析を示す。Cy5で標識化したAQ24NR3でコーティングされた人毛を図7B及び図7Cに示す。
【図8】未処理の人の皮膚(図8A)及びシルクタンパク質でのコーティング後の人の皮膚(図8B)を示す図である。シルクタンパク質によるコーティング後、皮膚の疎水性が大幅に低減し、これにより水滴の濡れ挙動が極めて大きくなる。図中の英語図1thread 糸spray スプレーbath 溶液槽coated thread コーティングされた糸 図2Spider Silk Coating スパイダーシルクコーティングKevlar ケブラーKevlar Filament ケブラーフィラメントCoated Kevlar Filament コーティングされたケブラーフィラメント 図3untreated synthetic fiber 未処理の合成繊維coating process with spider silk proteins スパイダーシルクタンパク質によるコーティングプロセスcoated fiber コーティングされた繊維agent/chemical molecule 作用物質/化学的分子coated fiber with attached molecules 接着した分子を有するコーティングされた繊 図4untreated 未処理coated fabric コーティングされた繊維
【発明を実施するための形態】
【実施例】
【0170】
コーティング反応を行うために、本発明者らは例示的に、ニワオニグモ(European gardencross spider Araneus diadematus)由来のドラグラインシルクタンパク質ADF−3及びADF−4から誘導される合成シルクポリペプチドC16、C32、C16NR4、(AQ)24及び(AQ)24NR3を設計した。これらのタンパク質は、ADF−3及びADF−4、並びにそれらの変異体が効率的な集合挙動を示すというこれまでの観察結果に基づき選択された。
【0171】
実施例I:スパイダーシルクポリペプチドC16によるアラミド繊維のコーティング
単一のアラミド(ケブラー)繊維を、室温(25℃)で2wt%/volのスパイダーシルクポリペプチドC16を含有するHFIP(ヘキサフルオロイソプロパノール)溶液中で5秒間インキュベートした。溶媒を蒸発させた後、スパイダーシルクポリペプチドC16がアラミド繊維の周りに透明な膜を形成した。電子顕微鏡検査により測定された膜の厚さは3μmであった(図2を参照されたい)。
【0172】
同じ結果を、ギ酸及び水等の他の溶媒を用いて得ることができる。同様の実験を、ナイロン繊維、ガラス繊維、炭素繊維、セルロース繊維、PTFE(テフロン登録商標)繊維、エラスタン(スパンデックス)繊維及び人毛を用いて行った。したがって記載の方法を用いて全ての試験繊維をコーティングすることができた。
【0173】
コーティングされた繊維の化学安定性を試験するために、スパイダーシルクポリペプチドC16コーティングを、8Mの尿素、6Mの塩酸グアニジン及び6Mのチオシアン酸グアニジン中で24時間インキュベートした。1Mのリン酸カリウム又は100%メタノールで処理したスパイダーシルクポリペプチドC16コーティングはチオシアン酸グアニジン中にだけ溶解することができた。スパイダーシルクポリペプチドC16コーティングのこの顕著な化学安定性は天然のドラグラインシルクの化学安定性と、及び組換えにより作製した集合化したADF−4の化学安定性と同程度である。これまでの研究から、集合化した構造体の集合性及び安定性をシルクタンパク質のアミノ酸配列と直接相関させることができた。このため、スパイダーシルクコーティングの特性は、対応するシルク遺伝子の操作を介してシルクタンパク質の一次構造を変えることにより直接修飾することができる。
【0174】
実施例II:物質とアラミド繊維上にコーティングしたシルクポリペプチドC16との化学架橋を介した共有結合的なカップリング
繊維の多くの用途には繊維表面上の特定の官能基の存在が必要とされる。スパイダーシルクコーティングに続いて物質を用いて改良を加えることができることを実証するために、原理の証明として、発色団フルオレセインと酵素β−ガラクトシダーゼとを、アラミド繊維上にコーティングしたシルクポリペプチドC16と化学的にカップリングさせた(図3を参照されたい)。カップリングは、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を用いてスパイダーシルクポリペプチドC16の表面に曝されたカルボキシル基を活性化することにより達成された。スパイダーシルクポリペプチドC16でコーティングされたアラミド繊維をエチレンジアミンとともに更にインキュベートし、アミドを形成させた。続いてエチレンジアミンの残りの遊離アミノ基をイソチオシアン酸フルオレセインとカップリングさせ、それにより安定したチオ尿素誘導体の形成を介したフルオレセインの効率的な共有結合的な連結がもたらされた。
【0175】
同様に、β−ガラクトシダーゼとEDCにより活性化されたC16膜とのインキュベーションにより、シルクポリペプチドC16のカルボキシル基と、β−ガラクトシダーゼの酵素表面でアクセス可能であった第1級アミン(例えばリジン残基由来)との間でアミド結合が形成された。かかる改良を加えた繊維を繰り返し洗浄した後でも、β−ガラクトシダーゼの活性を、基質として5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトピラノシド(X−Gal)を用いて検出することができた。
【0176】
実施例III:物質とアラミド繊維上にコーティングしたシルクポリペプチドC16との非共有結合的なカップリング
物質とスパイダーシルクポリペプチドC16でコーティングされたアラミド繊維との上述の共有結合的なカップリングに加えて、非共有結合的なカップリングも行った。単一のアラミド繊維を2wt%/volのスパイダーシルクポリペプチドC16と塩化銅又は塩化コバルトとを含有するギ酸中で室温(25℃)で5秒間インキュベートした。溶液槽から取り出し、溶媒を蒸発させた後、塩化コバルト又は塩化銅がスパイダーシルクポリペプチドC16でコーティングされたアラミド繊維の周りに色の付いた膜を形成した。
【0177】
実施例IV:スパイダーシルクポリペプチドC16による綿織布のコーティング
単繊維だけではなく、製織済みの布地もスパイダーシルクによるコーティングに好適なテンプレートである。綿の製織済みの布地及び綿繊維を2wt%/volのスパイダーシルクポリペプチドC16溶液中で別々にインキュベートした。乾燥した後、綿織布及び綿繊維は同程度のコーティング挙動を示した(図4を参照されたい)。
【0178】
このため既製の布地の直接コーティングにより、既にシルクでコーティングされた繊維で作られた布地と比較して同程度であるが、異なるコーティングパターンがもたらされる。例えば布地のコーティングにより、隙間をコーティングすることができるが、布地のコーティングでなければスパイダーシルクコーティングによって繊維及び交差箇所だけしかコーティングされ(engulfed)ず、隙間はコーティングされない。これは製織前の繊維のコーティング又は製織済みの布地の処理のいずれによっても、様々な用途に好適なむらなくコーティングされた材料がもたらされることを示している。
【0179】
実施例V:スパイダーシルクポリペプチドC16によるアラミド糸のディップコーティング
スパイダーシルクポリペプチドC16によるアラミド糸のディップコーティングを行うために、スパイダーシルクポリペプチドC16を水溶液(10mMのトリス、pH7.5)に溶解した。水溶液中のシルクポリペプチドC16の濃度は2wt%/volであった。ディップコーティング手法(図1も参照されたい)には、以下のものが含まれていた。
i)浸漬:アラミド糸を5m/sの一定速度でスパイダーシルクポリペプチドC16溶液中に浸漬し、
ii)インキュベーション:基材をコーティング溶液中で2分間インキュベートし、コーティング材を基材に付着させ、
iii)引き揚げ:アラミド糸から余分な基材を5m/sの一定速度で取り除き、
iv)後処理:コーティングを室温(25℃)で乾燥した。
【0180】
実施例VI:スパイダーシルクポリペプチドC16によるアラミド糸のスプレーコーティング
スパイダーシルクポリペプチドC16によるアラミド糸のスプレーコーティングを行うために、スパイダーシルクポリペプチドC16を水溶液(10mMのトリス、pH7.5)に溶解した。水溶液中のシルクポリペプチドC16の濃度は2wt%/volであった。スプレーコーティング手法(図1も参照されたい)には、以下のものが含まれていた。
i)準備:スパイダーシルクポリペプチドC16溶液をスプレー缶又は噴霧装置に移し、
ii)コーティング:シルクポリペプチドC16溶液をスプレー缶によりアラミド糸上に均一に分配させ、
iii)後処理:コーティングを室温(25℃)で乾燥した。
【0181】
実施例VII:スパイダーシルクポリペプチドC16によるアラミド糸のパディング
スパイダーシルクポリペプチドC16をギ酸中に溶解した。ギ酸中のシルクポリペプチドC16の濃度は10mg/mlであった。異なるタイプの糸(テフロン登録商標(Goodfellow、繊維径:0.0211mm)、セルロース(Goodfellow、繊維径:0.015mm)、原綿、ケブラー(Goodfellow、繊維径:0.017mm)、エラスタン(スパンデックス)、未処理の人毛及び処理済みの(フケを含まない)人毛)をディップコーティング方法に従ってコーティングした。スパンデックス及び原綿糸は脱イオンH2Oで洗浄し、乾燥した後にコーティングした。糸をスパイダーシルクポリペプチドC16/ギ酸溶液中で5秒間インキュベートし、コーティング材を基材に付着させた。コーティングを室温(25℃)で乾燥した。
【0182】
実施例VIII:スパイダーシルクポリペプチドC16によるナイロン糸のコーティング
スパイダーシルクポリペプチドC16を水溶液(10mMのトリス、pH7.5)に溶解した。ギ酸中のシルクポリペプチドC16の濃度は1wt%/volであった。ナイロン糸(Goodfellow、繊維径:0.01mm)をコーティング溶液中で5秒間インキュベートし、コーティング材を基材に付着させた。コーティングを室温(25℃)で乾燥した。
【0183】
実施例IX:様々なスパイダーシルクタンパク質による材料のコーティング
材料(コーティングされたスライドガラス、特にシリコンマトリクス(Sciences Services,Munich, Germany)を有するコーティング材でコーティングされたスライドガラス)をコーティングするために様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32を使用した。様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32によるスライドガラスのコーティングは、コーティングされたスライドガラス、特にシリコンマトリクスでコーティングされたスライドガラスとともに例示的に示されている。様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32による、コーティングされたスライドガラス、特にシリコンマトリクスでコーティングされたスライドガラスのコーティングの結果は、様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32による他のスライドガラス(コーティングされていない、特にシリコンマトリクスを有するコーティング材ではコーティングされていない)のコーティングの結果と類似している。トリス緩衝水溶液中のC16、AQ24NR3及びC16NR4の最終タンパク質濃度はそれぞれ、3%、0.5%及び2.1%であった。ディップコーティング方法を使用した。上記方法には以下の工程が含まれていた:溶液中への60秒のディッピング、溶液から取り出して30秒の乾燥、溶液中への材料の30回の再浸、及び精製水(Milli−Q)によるすすぎ。AQ24、C8及びC32を2%の濃度でギ酸中に溶解した。スピンコーティング方法を1000rpmで1分間使用した。それから材料(コーティングされたスライドガラス、特にシリコンマトリクスを有するコーティング材でコーティングされたスライドガラス)の表面を小さい針を用いて削った。コーティングされた材料と非コーティング(raw)材料との高さの差異をレーザー走査顕微鏡(VK 9700 Keyence, NeuIsenburg, Germany)を用いて様々なスポットで分析した。
【0184】
表1は、材料(スライドガラス)を様々なスパイダーシルクタンパク質で均質にコーティングすることができたことを示している。コーティングの厚さはタンパク質の性質(親水性及び電荷)、溶媒の湿潤性及びコーティング方法によって変わる。
【0185】
【表1】

「**」:高度に均質なコーティング 「*」 :均質なコーティング
表1の英語
Spider silk protein:スパイダーシルクタンパク質
coating:コーティング
Coating thickness:コーティングの厚さ
Homogeneity:均質性
yes:あり
【0186】
実施例X:様々な溶媒を用いるスパイダーシルクポリペプチドC16による材料のコーティング
様々な溶媒(100mMのトリス、pH8;トリフルオロ酢酸;ギ酸;ヘキサフルオロイソプロパノール)を、C16を溶解し、材料(コーティングされたスライドガラス、特にシリコンマトリクス(Sciences Services, Munich, Germany)を有するコーティング材でコーティングされたスライドガラス)をコーティングするために使用した。様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32によるスライドガラスのコーティングは、コーティングされたスライドガラス、特にシリコンマトリクスでコーティングされたスライドガラスとともに例示的に示されている。様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32による、コーティングされたスライドガラス、特にシリコンマトリクスでコーティングされたスライドガラスのコーティングの結果は、様々なタンパク質C16、AQ24NR3、C16NR4、AQ24、C8及びC32による他のスライドガラス(コーティングされていない、特にシリコンマトリクスを有するコーティング材ではコーティングされていない)のコーティングの結果と類似している。コーティングには、水溶液(トリス(100mM、pH8))を使用した。上記溶液中のC16の最終タンパク質濃度は3%であった。ディップコーティング方法を使用した。上記方法には以下の工程が含まれていた:溶液中への60秒のディッピング、溶液から取り出して30秒の乾燥、溶液中への材料の30回の再浸、及びミリポア水によるすすぎ。またC16を1%の最終濃度でトリフルオロ酢酸、ギ酸及びヘキサフルオロイソプロパノール中に直接溶解した。スピンコーティング方法を1000rpmで1分間使用した。それからコーティングされた材料(コーティングされたスライドガラス、特にシリコンマトリクスを有するコーティング材でコーティングされたスライドガラス)の表面を小さい針を用いて削った。コーティングされた材料と非コーティング材料との高さの差異をレーザー走査顕微鏡(VK 9700 Keyence, Neu-Isenburg, Germany)を用いて様々なスポットで分析した。
【0187】
表2は、材料(スライドガラス)をC16でコーティングすることができたことを示している。厚さはタンパク質の性質、溶媒の湿潤性及びコーティング方法によって変わる。
【0188】
【表2】

**:高度に均質なコーティング *:均質なコーティング
表中英語
Solvent:溶媒
Coating:コーティング
Coating thickness:コーティングの厚さ
Homogeneity:均質性
溶媒名上から順次:100mMのトリス、pH8、トリフルオロ酢酸、ギ酸、ヘキサフルオロイソプロパノール
【0189】
実施例XI:C16による自然発生的な材料のコーティング
C16及びAQ24NR3を用いて、人毛、綿(「Obergarn」繊維)、ゴム、羊毛及びセルロース(Good fellow、d=0.015mm、Huntington, GreatBritain)等の様々な自然発生的な材料(有機材料)をコーティングした。金色に脱色した欧州人の毛を3%のタンパク質濃度でC16のトリス緩衝水溶液(100mM、pH8)を用いてドロップコーティングし(drop-coated)、その後乾燥して(until drying)、精製水(Milli Q)ですすいだ。脱色したことのない欧州人の毛を0.85%のタンパク質濃度で精製水(Milli Q)に溶解したAQ24NR3の溶液を用いてドロップコーティングし、その後乾燥した。綿、ゴム、羊毛及びセルロースを、1.35%のタンパク質濃度でC16のトリス緩衝水溶液(100mM、pH8)を用いてコーティングした。ディップコーティング方法を使用した。上記方法には以下の工程が含まれていた:溶液中への120秒のディッピング、溶液から取り出して120秒の乾燥、溶液中への材料の10回の再浸、及び精製水(Milli Q)によるすすぎ。それぞれのコーティングされた繊維(コーティング)をコーティングされていない参照繊維(参照)と比較した。人毛、綿、羊毛及びセルロースのコーティングされた繊維とコーティングされてない繊維の半径を比較して、コーティングの厚さを定量化した。コーティングをレーザー走査顕微鏡(VK 9700 Keyence, Neu-Isenburg, Germany)を用いて様々なスポットで分析した。結果を表3にまとめる。
【0190】
【表3】

Ra@:計算による中間の高さ **:高度に均質なコーティング
*:均質なコーティング X:僅かに均質なコーティング
表中英語
Material:材料
Coating:コーティング
radius References:半径(参照)
Radius Coating:半径(コーティング)
Coating thickness:コーティングの厚さ
Roughness Ra@:粗度
Coating:コーティング
Reference:参照
Homogeneity:均質性
Treated Hair:処理した毛
Virgin Hair:脱色したことのない毛
Cotton:綿
Rubber:ゴム
Wool:羊毛
Cellulose:セルロース
Yes:あり
【0191】
表3は、様々な自然発生的な材料(有機材料)のコーティングを示している。これらの材料はコーティング後に厚さの増大を示した。処理した毛及び脱色したことのない毛は粗度の低減を示した。綿繊維は撚り合わされ、より大きい繊維を形成した。そのため単繊維を画像化し、直径の差異を推測することは困難であった。繊維は長さ全体にわたって一定の直径を有していなかったため、厚さを正確に推測することはできなかったが、コーティングははっきりと見て取れた。羊毛はC16で均質にコーティングすることができた。セルロースはC16でコーティングすることができた。セルロースの特質のために、この実験では該コーティング方法による均質なコーティングを検出することはできなかった。セルロースはおおよそ平滑な繊維ではないため、均質とするにはコーティングの厚さが十分ではなかった。しかしながら、コーティングサイクルの回数の増大により、コーティングの均質性を増大させることができる。
【0192】
図5におけるレーザー走査画像は、ヘアケラチン繊維のコーティングの差異を示している。脱色した毛及び脱色したことのない毛の両方で、コーティングの際にキューティクルが消失し、繊維表面がより均質になった。粗度がコーティングの厚さに伴い低減した。コーティング材の添加により毛繊維が平滑になった。光反射はレーザー強度として測定することができた。参照となる脱色した毛では、全長にわたる平均値は13198であり、コーティングされた毛では、(16384のグレイステップ(grey steps)に対して)平均値は約13632であった。参照となる脱色したことのない毛では、平均値は約13517であったが、コーティングされた毛の平均値は13746であった。レーザー強度はグレイステップで特定する。最小値は0の値を示し、最大値は16384の値を示す。値が高くなると、サンプル/材料の反射/輝度が高くなる。脱色した毛及び脱色したことのない毛の場合、コーティングされた毛の値はそれぞれ参照と比較して高かった。コーティングは繊維の輝度を高めた。
【0193】
実施例XII:スパイダーシルクポリペプチドC16による無機不活性材料のコーティング
C16を用いて、ガラス(スライドガラス、Roth; Karlsruhe,Germany)、炭素(炭素繊維プレート、R&G GmbH)及び金属(金属プレート)等の様々な無機不活性材料をコーティングした。スライドガラスでは,C16をギ酸中に直接溶解した(最終タンパク質濃度1%)。スピンコーティング方法を1000rpmで1分間使用した。炭素及び金属プレートでは、コーティングをC16の水溶液(100mMのトリス、pH8)を用いて行った。最終濃度は1.35%であった。炭素プレートでのディップコーティング方法には以下の工程が含まれていた:溶液中への120秒のディッピング、溶液から取り出して120秒の乾燥、溶液中への材料の10回の再浸、及びミリポア水によるすすぎ。金属プレートでのディップコーティング方法には以下の工程が含まれていた:溶液中への120秒のディッピング、溶液から取り出して120秒の乾燥、溶液中への材料の1000回の再浸、及び精製水(Milli Q)によるすすぎ。それからコーティングされた材料(金属プレート、炭素プレート)の表面を小さい針を用いて削った。コーティングされた材料(金属プレート、炭素プレート)の表面をレーザー走査顕微鏡(VK 9700 Keyence, Neu-Isenburg, Germany)を用いて様々なスポットで分析した。コーティングされた材料とコーティングされてない材料とを比較した。コーティング材料と非コーティング材料との間の高さの差異により、コーティングの厚さを推測した。コーティングは基材表面を平滑にした。結果を表4にまとめる。
【0194】
【表4】

Ra:計算による中間の高さ Rq:二次高さ平均 *:均質なコーティング
X:僅かに均質なコーティング
表中英語
Inorganic inert material:無機不活性材料
Coating:コーティング
Coating thickness:コーティングの厚さ
Roughness:粗度
Reference:参照
Homogeneity:均質性
Carbon fiber plate:炭素繊維プレート
Yes:あり
【0195】
表4は、無機材料上のC16コーティングの厚さを示している。ガラス、炭素及び金属をコーティングすることができた。ガラスの場合、均質なコーティングを検出することができた。コーティングされたガラスはコーティングされていないガラス(参照)と比較して粗度の低減を示した。
【0196】
実施例XIII:スパイダーシルクポリペプチドC16による合成不活性材料のコーティング
C16を用いて、ポリエステル(PET、Syngarn繊維)、ポリアミド(PA、Goodfellow、d=0.01mm)、ポリテトラフルオロエチレン(PTFE、Good Fellow、d=0.0211mm)、ポリプロピレン(PP、Good Fellow製のプレート)、超高分子量ポリエチレン(UHMW PE、GoodFellow製のプレート)、エラスタン及びポリアラミド等の様々な合成不活性材料をコーティングした。ポリエステル、ポリアミド、PTFE、ポリプロピレン、UHMWポリエチレンのコーティングはC16の水溶液(100mMのトリス、pH8)を用いて行った。最終タンパク質濃度は1.35%であった。ディップコーティング方法を使用した。上記方法には以下の工程が含まれていた:溶液中への60秒のディッピング、溶液から取り出して30秒の乾燥、溶液中へのサンプルの30回の再浸、及びミリポア水によるすすぎ。エラスタン及びポリアラミドを14%の最終タンパク質濃度でC16のトリス緩衝溶液(100mM、pH8)を用いてコーティングした。繊維を溶液中に3回ディッピングし、ミリポア水ですすいだ。各材料をコーティングされていない参照と比較した。PE、PA、PTFE、エラスタン及びポリアラミドは繊維の形態であった。コーティングの厚さを推測するために、繊維の半径を比較することができる。繊維の全長にわたるコーティングの厚さを推測することは不可能であった。このため、繊維をレーザー走査顕微鏡(VK 9700 Keyence, Neu-Isenburg, Germany)を用いて様々なスポットで分析した。結果を表5にまとめる。
【0197】
【表5】

表中英語
Synthetic inert material:合成不活性材料
Coating:コーティング
Radius ref:半径(参照)
Radius coated:半径(コーティング)
Coating thickness:コーティングの厚さ
Homogeneity:均質性
Yes:あり
【0198】
表5は合成不活性材料上のC16コーティングの厚さを示している。全ての材料をコーティングすることができた。PET、PA、PTFE、エラスタン及びポリアラミドの場合、コーティングされていない参照と比較したコーティングされた合成不活性材料の厚さの増大が検出された。PTFE繊維の場合、コーティングは僅かに均質であった。4.3μmというコーティングの厚さの値は平均である。PP及びUHMW PEプレートでは、コーティングをはっきりと検出することができた。エラスタンは撚り合わされた多くの繊維からなる。このため、測定した厚さの値は撚り合わされた幾つかの繊維上のコーティングの厚さを表す。ポリアミド(PA)繊維の平滑表面のコーティングでは、均質性の低い表面が生じた。これはポリアミド(PA、ナイロン)繊維のレーザー走査顕微鏡画像(図6)によって示される。C16によるコーティング前(図6A)及びコーティング後(図6B)の繊維が示される。コーティングは繊維全体にわたって検出可能であった。コーティング後、繊維表面の均質性は低かった(図6B)。
【0199】
実施例XIV:Cy5蛍光タグと架橋したAQ24NR3による人毛のコーティング
AQ24NR3(タンパク質濃度4mg/ml)のチオシアン酸グアニジン溶液(5M)を調製し、pH8で100mMのトリス緩衝液に対して透析し、1mg/mlのタンパク質溶液を得た(このタンパク質によるコーティングを図7Bに示す)。更なる実験で、AQ24NR3(タンパク質濃度2mg/ml)の5M尿素溶液を調製し、pH8で100mMのトリス緩衝液に対して透析した(このタンパク質によるコーティングを図7Cに示す)。タンパク質溶液をAmersham(商標)Cy(商標)5 Maleimide Mono−Reactive Dye(GE Healthcare、カタログ番号PA25031)で標識化した。蛍光タグによるバイオコンジュゲーション(bioconjugation)をシステインのスルフヒドリル基(1分子あたり1つ)を用いて行った。ジスルフィド結合を低減するのに使用する18mg/mlのTCEPのトリス溶液(10μL、トリス(2−カルボキシエチル)ホスフィン)(pH7)をタンパク質溶液に添加した。タンパク質溶液を室温(RT)で10分間インキュベートした。Cy5−マレイミド(GE Healthcare)の色素溶液を50μLの無水ジメチルホルムアミド(Dimethylformamide)(DMF)と混合し、そのうち40μLをタンパク質溶液に添加した。溶液を室温で2時間及び4℃で終夜インキュベートした。タンパク質溶液(3μg)をウェスタンブロット分析に直接使用した。
【0200】
未処理の人毛をタンパク質溶液中に10分間入れ、純水(milli Q)ですすいだ(図7B)。インド人の毛先を標的化したタンパク質溶液中に10分間入れ、それから空気乾燥した(図7C)。毛及びゲルを、Epi−Vex光とCy5フィルターを有するProximaを用いて画像化した(図7A)。ウェスタンブロットゲル上で、標識化したAQ24NR3タンパク質と標識化していないAQ24NR3タンパク質とを比較した。標識化したタンパク質だけをCy5フィルター下で検出することができる。結果として、蛍光標識化したタンパク質が発光し、標識化していないものは見ることができなかった。タンパク質は蛍光色素と共有結合した。溶液中のシルクを、様々なアドレス可能なアミノ基を用いて化学的に修飾することができる。Cy5で標識化したAQ24NR3タンパク質を用いて、コーティング特質及び蛍光特質を変えることなく毛等の様々な基材をコーティングすることができる。毛のコーティングはCy5フィルター下で見ることができる(図7)。
【0201】
全体的な結論として、実験により、本発明の方法が合成不活性材料、無機不活性材料及び自然発生的な材料のコーティングを可能にすることが例示的に示される。コーティングの均質性はシルクの化学的性質(親水性及び電荷)、材料の化学的性質、材料の形状、選択される溶媒及びコーティング方法によって変わる。化学的に修飾されたシルクタンパク質を様々な基材上にコーティングすることもできる。
【0202】
実施例XV:AQ24NR3によるインド人の毛及び脱色したことのない人毛のコーティング
実験により、欧州人の脱色したことのない毛(一度も化学物質で処理していない)及びインド人の毛(化学物質で処理し、エクステンションに使用する)に対するタンパク質コーティングの効果が示される。タンパク質AQ24NR3を毛の処理のために様々なタンパク質濃度で使用した。0.2%タンパク質溶液では、AQ24NR3を5Mの尿素に溶解し、純水(Milli Q)に対して透析した。0.6%及び0.85%タンパク質溶液では、AQ24NR3を任意の透析工程を用いずに純水(Milli Q)に直接溶解した。欧州人の脱色したことのない毛又はインド人の毛を上述のタンパク質溶液中に約10分間入れ、それから空気乾燥した。欧州人の脱色したことのない毛又はインド人の毛上の全く同じスポット(粘着テープ(adhesive strip)及び油性マーカーで印を付ける)を、上述のタンパク質溶液による処理の前後でレーザー走査顕微鏡(VK 9700 Keyence, Neu Isenburg, Germany)を用いて分析した。結果を表6〜表9に示す。分析をKeyenceのVKアナライザを用いて行った。
【0203】
【表6】

表中英語
表6.Thickness coating on Indian hair:インド人の毛上のコーティングの厚さ
Conditioner concentration:コンディショナーの濃度
Radius untreated hair:未処理の毛の半径
Radius treated hair:処理した毛の半径
Coating thickness:コーティングの厚さ
表7.Average surfeace roughness(Ra) of indian hair:インド人の毛の平均表面粗度(Ra)
Conditioner concentration::コンディショナーの濃度
Ra untreated hair:未処理の毛のRa
Ra treated hair:処理した毛のRa
Roughness reduction:粗度の低減
表8.Thickness coating on European virgin hair:欧州人の脱色したことのない毛上のコーティングの厚さ
Conditioner concentration:コンディショナーの濃度
Radius untreated hair:未処理の毛の半径
Radius treated hair:処理した毛の半径
Coating thickness:コーティングの厚さ
表9.Average surface roughness(Ra) of European virgin hair:欧州人の脱色したことのない毛の平均表面粗度(Ra)
Conditioner concentration:コンディショナーの濃度
Ra untreated hair:未処理の毛のRa
Ra treated hair:処理した毛のRa
Roughness reduction:粗度の低減
【0204】
タンパク質溶液の濃度の増大(すなわち0.2%から0.85%への)により、コーティングされた毛の半径の増大がもたらされた。毛表面の粗度がコーティングの厚さの増大に伴い低減した。加えて、毛表面の平滑性がコーティングの厚さの増大に伴い増大した。
【0205】
実施例XVI:スパイダーシルクタンパク質C16による人の皮膚のコーティング
未処理の人の皮膚(図8A)及びシルクタンパク質によるコーティング後の人の皮膚(図8B)。水滴(明確にするために染色した)は通常、無傷の皮膚の疎水性の性質により人の皮膚を湿らせることはない。シルクタンパク質によるコーティング後、皮膚の疎水性が大幅に低減し、水滴の極めて高い濡れ挙動がもたらされる。
【0206】
詳細には、スパイダーシルクタンパク質C16(1mg/ml)の尿素溶液(5%)を調製した。ラウリル硫酸ナトリウム無含有石鹸で手の皮膚を洗浄し、続いて空気乾燥した後、40μlのタンパク質−尿素溶液(B)及び40μlの尿素(5%)対照溶液(タンパク質なし)(A)を規定の皮膚領域上に塗布した(図8を参照されたい)。シルクコーティングにより、間断ない不可視膜が生じ、これにより皮膚の親水性が増大し、皮膚の保護がもたらされる。乾燥後、40μlの純水を皮膚上に塗布した(図8)。シルクでコーティングされた皮膚の親水性の増大により、水を皮膚に即座に浸透させることが可能であったが(図8B)、図8Aでは水滴はコーティングされていない皮膚に浸透しなかった。図8B(シルクでコーティングされた皮膚)は、はっきりした水滴を示す図8A(コーティングされていない皮膚)に比して広領域にわたり広がる水滴を示す。コーティング不可視膜の保護特性は、水/石鹸による洗浄と乾燥とのサイクルに数回耐えた。
【特許請求の範囲】
【請求項1】
不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法であって、
i)少なくとも2つの同一の反復単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
ii)不活性材料又は自然発生的な材料上に該溶液を塗布することにより該不活性材料又は該自然発生的な材料を該シルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含む、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法。
【請求項2】
溶液を、ディップコーティング、スプレーコーティング及び/又はパディングを用いて塗布する、請求項1に記載の方法。
【請求項3】
シルクポリペプチドが、各々が、
i)GPGXX(配列番号3)(ここでXは任意のアミノ酸、又はそれぞれの場合で独立してA、S、G、Y、P及びQから選択される任意のアミノ酸である)、
ii)GGX(ここでXは任意のアミノ酸、又はそれぞれの場合で独立してY、P、R、S、A、T、N及びQから選択される任意のアミノ酸である)、及び
iii)Ax(ここでxは5〜10の整数である)
からなる群から選択されるコンセンサス配列を少なくとも1つ含む少なくとも2つの同一の反復単位を含む、請求項1又は2に記載の方法。
【請求項4】
反復単位が独立して、モジュールA(配列番号20)、モジュールC(配列番号21)、モジュールQ(配列番号22)、モジュールK(配列番号23)、モジュールsp(配列番号24)、モジュールS(配列番号25)、モジュールR(配列番号26)、モジュールX(配列番号27)若しくはモジュールY(配列番号28)、又はその変異体から選択される、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
シルクポリペプチドが少なくとも1つの非反復(NR)単位を更に含む、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
NR単位が、NR3(配列番号41)若しくはその変異体、又はNR4(配列番号42)若しくはその変異体である、請求項5に記載の方法。
【請求項7】
シルクポリペプチドが、ADF−3(配列番号1)又はその変異体、ADF−4(配列番号2)又はその変異体、MaSp I(配列番号43)又はその変異体、MaSp II(配列番号44)又はその変異体、(C)m、(C)mNRz、NRz(C)m、(AQ)n、(AQ)nNRz、NRz(AQ)n、(QAQ)o、NRz(QAQ)o、(QAQ)oNRz、Yp、Xp、及びKp(ここで、mは8〜48の整数であり、nは6〜24の整数であり、oは8〜16の整数であり、pは8〜16の整数であり、zは1〜3の整数であり、NRは非反復単位を表す)からなる群から選択される、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
シルクポリペプチドが、C16NR4、C32NR4、(AQ)12NR3、(AQ)24NR3、(AQ)12、(AQ)24、C16又はC32である、請求項7に記載の方法。
【請求項9】
シルクポリペプチドが、TAGCYS1(配列番号35)、TAGCYS2(配列番号36)、TAGCYS3(配列番号37)、TAGLYS1(配列番号38)及びTAGLYS2(配列番号39)からなる群から選択されるアミノ末端及び/又はカルボキシ末端のTAGを更に含む、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
溶液中の該シルクポリペプチドの濃度が、0.1wt%/vol〜30wt%/volの範囲、又は1wt%/vol〜10wt%/volの範囲である、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
溶媒がファンデルワールス力を不安定化する溶媒、ギ酸、水溶液若しくはH2O、又はそれらの混合物である、請求項1〜10のいずれか一項に記載の方法。
【請求項12】
ファンデルワールス力を不安定化する溶媒が、ヘキサフルオロイソプロパノール(HFIP)、トリクロロ酢酸(TCA)、トリフルオロ酢酸(TFA)及び臭化リチウム(LiBr)からなる群から選択される、請求項11に記載の方法。
【請求項13】
不活性材料又は自然発生的な材料が、繊維、繊維を含む糸、繊維を含む撚糸、繊維を含む織布、及び繊維を含む不織布からなる群から選択される、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
不活性材料が、
(i)ポリエステル、ポリアミド(PA)、ポリアラミド、ポリテトラフルオロエチレン(PTFE)、ポリエチレン(PE)、ポリプロピレン(PP)、ポリウレタン(PU)、シリコーン、ポリウレタンとポリエチレングリコールとの混合物(エラスタン)、超高分子量ポリエチレン(UHMWPE)、及び高性能ポリエチレン(HPPE)からなる群から選択される合成不活性材料、又は
(ii)ガラス、炭素、セラミック、金属、サファイア、ダイアモンド及び半導体からなる群から選択される無機不活性材料
である、請求項1〜13のいずれか一項に記載の方法。
【請求項15】
自然発生的な材料が、絹、綿、亜麻、羊毛、麻、竹、ゴム、人毛及び獣毛からなる群から選択される、請求項1〜13のいずれか一項に記載の方法。
【請求項16】
コーティングにおける該シルクポリペプチドが該不活性材料又は該自然発生的な材料と共有結合的に及び/又は非共有結合的に連結する、請求項1〜15のいずれか一項に記載の方法。
【請求項17】
シルクポリペプチドが、
(a)該シルクポリペプチドのシステイン残基、リジン残基、該アミノ末端、該カルボキシ末端、該アミノ末端TAG若しくは該カルボキシ末端TAGを介して、及び/又は
(b)架橋を介して
該不活性材料又は該自然発生的な材料と共有結合的に連結する、請求項16に記載の方法。
【請求項18】
シルクポリペプチドが、イオン結合又は疎水結合を介して該不活性材料又は該自然発生的な材料と非共有結合的に連結する、請求項16に記載の方法。
【請求項19】
シルクポリペプチドが、該シルクポリペプチドと共有結合的に及び/又は非共有結合的に連結する少なくとも1つの物質を更に含む、請求項1〜18のいずれか一項に記載の方法。
【請求項20】
物質が工程i)の前に、工程i)の後に、及び/又は工程ii)の後に該シルクポリペプチドと共有結合的に及び/又は非共有結合的に連結する、請求項19に記載の方法。
【請求項21】
物質が、
(a)該シルクポリペプチドのシステイン残基、リジン残基、該アミノ末端、該カルボキシ末端、該アミノ末端TAG若しくは該カルボキシ末端TAGを介して、及び/又は
(b)架橋を介して
該シルクポリペプチドと共有結合的に連結する、請求項19又は20に記載の方法。
【請求項22】
共有結合的に連結する物質が、ポリペプチド、脂質、色素、共役金属、活性炭及び作用物質からなる群から選択される、請求項19〜21のいずれか一項に記載の方法。
【請求項23】
(i)ポリペプチドが酵素若しくはβ−ガラクトシダーゼ、抗体、ホルモン若しくはインスリン、又は抗原であり、
(ii)脂質がコレステロール、ステロイド、ワックス、又はオイルであり、
(iii)色素が合成色素若しくはアゾ化合物、無機色素若しくは金属塩、又は有機色素、若しくはフルオレセイン色素若しくはローダミン色素であり、
(iv)共役金属がナノゴールド(商標)であり、
(v)活性炭が粉末活性炭(PAC)、粒状活性炭(GAC)及び押出成形活性炭(EAC)からなる群から選択され、
(vi)作用物質が医薬品、止血剤、成長刺激剤、抗炎症剤、防汚剤、抗微生物剤、抗細菌剤、抗真菌剤、農薬及びUV保護剤からなる群から選択される、
請求項22に記載の方法。
【請求項24】
物質がイオン結合又は疎水結合を介して該シルクポリペプチドと非共有結合的に連結する、請求項19又は20に記載の方法。
【請求項25】
非共有結合的に連結する物質が、ポリペプチド、脂質、色素、共役金属、活性炭、金属塩及び作用物質からなる群から選択される、請求項24に記載の方法。
【請求項26】
(i)ポリペプチドが酵素若しくはβ−ガラクトシダーゼ、抗体、ホルモン若しくはインスリン、又は抗原であり、
(ii)脂質がコレステロール、ステロイド、ワックス、又はオイルであり、
(iii)色素が合成色素若しくはアゾ化合物、無機色素若しくは金属塩、又は有機色素、若しくはフルオレセイン色素若しくはローダミン色素であり、
(iv)共役金属がナノゴールド(商標)であり、
(v)活性炭が粉末活性炭(PAC)、粒状活性炭(GAC)及び押出成形活性炭(EAC)からなる群から選択され、
(vi)金属塩が銅、コバルト、ニッケル又は銀からなる群から選択されるカチオンであり、
(vii)作用物質が医薬品、止血剤、成長刺激剤、抗炎症剤、防汚剤、抗微生物剤、抗細菌剤、抗真菌剤、農薬及びUV保護剤からなる群から選択される、
請求項25に記載の方法。
【請求項27】
工程ii)を4℃〜80℃又は4℃〜40℃の温度で行う、請求項1〜26のいずれか一項に記載の方法。
【請求項28】
工程ii)を20℃〜25℃で行う、請求項27に記載の方法。
【請求項29】
iii)少なくとも2つの同一の反復単位及び任意選択的に少なくとも1つの非反復(NR)単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
iv)不活性材料又は自然発生的な材料上に該溶液を塗布することにより2回目として該不活性材料又は該自然発生的な材料をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)の該シルクポリペプチドが工程(i)の該シルクポリペプチドと同一である又は異なる、請求項1〜28のいずれか一項に記載の方法。
【請求項30】
工程(iii)と工程(iv)とを数回、又は3回〜10回繰り返し、様々な厚さ及び多重層のコーティングされた不活性材料又は自然発生的な材料を得る、請求項29に記載の方法。
【請求項31】
工程ii)、工程iii)、及び/又は工程iv)の後に、可視光、紫外線若しくは耐水性、摩耗、機械的応力、酸及び/又は塩基に対する保護を与える染色/仕上げ加工により、該コーティングされた不活性材料又は自然発生的な材料に事後改良を加える工程を含む、請求項1〜30のいずれか一項に記載の方法。
【請求項32】
請求項1〜31のいずれか一項に記載の方法により入手可能なコーティングされた不活性材料又は自然発生的な材料。
【請求項33】
請求項32に記載のコーティングされた不活性材料又は自然発生的な材料を含む繊維。
【請求項34】
請求項33に記載の繊維を含む糸。
【請求項35】
請求項33に記載の繊維を含む、撚糸、織布又は不織布。
【請求項36】
或る特定の期間にわたる該少なくとも1つの物質の制御放出のための、又は防護服若しくは撥水性の服の製造のための請求項32に記載のコーティングされた不活性材料又は自然発生的な材料の使用。
【請求項37】
不活性材料を染色するためのシルクポリペプチドの使用。
【請求項1】
不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法であって、
i)少なくとも2つの同一の反復単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
ii)不活性材料又は自然発生的な材料上に該溶液を塗布することにより該不活性材料又は該自然発生的な材料を該シルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を含む、不活性材料又は自然発生的な材料をシルクポリペプチドでコーティングする方法。
【請求項2】
溶液を、ディップコーティング、スプレーコーティング及び/又はパディングを用いて塗布する、請求項1に記載の方法。
【請求項3】
シルクポリペプチドが、各々が、
i)GPGXX(配列番号3)(ここでXは任意のアミノ酸、又はそれぞれの場合で独立してA、S、G、Y、P及びQから選択される任意のアミノ酸である)、
ii)GGX(ここでXは任意のアミノ酸、又はそれぞれの場合で独立してY、P、R、S、A、T、N及びQから選択される任意のアミノ酸である)、及び
iii)Ax(ここでxは5〜10の整数である)
からなる群から選択されるコンセンサス配列を少なくとも1つ含む少なくとも2つの同一の反復単位を含む、請求項1又は2に記載の方法。
【請求項4】
反復単位が独立して、モジュールA(配列番号20)、モジュールC(配列番号21)、モジュールQ(配列番号22)、モジュールK(配列番号23)、モジュールsp(配列番号24)、モジュールS(配列番号25)、モジュールR(配列番号26)、モジュールX(配列番号27)若しくはモジュールY(配列番号28)、又はその変異体から選択される、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
シルクポリペプチドが少なくとも1つの非反復(NR)単位を更に含む、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
NR単位が、NR3(配列番号41)若しくはその変異体、又はNR4(配列番号42)若しくはその変異体である、請求項5に記載の方法。
【請求項7】
シルクポリペプチドが、ADF−3(配列番号1)又はその変異体、ADF−4(配列番号2)又はその変異体、MaSp I(配列番号43)又はその変異体、MaSp II(配列番号44)又はその変異体、(C)m、(C)mNRz、NRz(C)m、(AQ)n、(AQ)nNRz、NRz(AQ)n、(QAQ)o、NRz(QAQ)o、(QAQ)oNRz、Yp、Xp、及びKp(ここで、mは8〜48の整数であり、nは6〜24の整数であり、oは8〜16の整数であり、pは8〜16の整数であり、zは1〜3の整数であり、NRは非反復単位を表す)からなる群から選択される、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
シルクポリペプチドが、C16NR4、C32NR4、(AQ)12NR3、(AQ)24NR3、(AQ)12、(AQ)24、C16又はC32である、請求項7に記載の方法。
【請求項9】
シルクポリペプチドが、TAGCYS1(配列番号35)、TAGCYS2(配列番号36)、TAGCYS3(配列番号37)、TAGLYS1(配列番号38)及びTAGLYS2(配列番号39)からなる群から選択されるアミノ末端及び/又はカルボキシ末端のTAGを更に含む、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
溶液中の該シルクポリペプチドの濃度が、0.1wt%/vol〜30wt%/volの範囲、又は1wt%/vol〜10wt%/volの範囲である、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
溶媒がファンデルワールス力を不安定化する溶媒、ギ酸、水溶液若しくはH2O、又はそれらの混合物である、請求項1〜10のいずれか一項に記載の方法。
【請求項12】
ファンデルワールス力を不安定化する溶媒が、ヘキサフルオロイソプロパノール(HFIP)、トリクロロ酢酸(TCA)、トリフルオロ酢酸(TFA)及び臭化リチウム(LiBr)からなる群から選択される、請求項11に記載の方法。
【請求項13】
不活性材料又は自然発生的な材料が、繊維、繊維を含む糸、繊維を含む撚糸、繊維を含む織布、及び繊維を含む不織布からなる群から選択される、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
不活性材料が、
(i)ポリエステル、ポリアミド(PA)、ポリアラミド、ポリテトラフルオロエチレン(PTFE)、ポリエチレン(PE)、ポリプロピレン(PP)、ポリウレタン(PU)、シリコーン、ポリウレタンとポリエチレングリコールとの混合物(エラスタン)、超高分子量ポリエチレン(UHMWPE)、及び高性能ポリエチレン(HPPE)からなる群から選択される合成不活性材料、又は
(ii)ガラス、炭素、セラミック、金属、サファイア、ダイアモンド及び半導体からなる群から選択される無機不活性材料
である、請求項1〜13のいずれか一項に記載の方法。
【請求項15】
自然発生的な材料が、絹、綿、亜麻、羊毛、麻、竹、ゴム、人毛及び獣毛からなる群から選択される、請求項1〜13のいずれか一項に記載の方法。
【請求項16】
コーティングにおける該シルクポリペプチドが該不活性材料又は該自然発生的な材料と共有結合的に及び/又は非共有結合的に連結する、請求項1〜15のいずれか一項に記載の方法。
【請求項17】
シルクポリペプチドが、
(a)該シルクポリペプチドのシステイン残基、リジン残基、該アミノ末端、該カルボキシ末端、該アミノ末端TAG若しくは該カルボキシ末端TAGを介して、及び/又は
(b)架橋を介して
該不活性材料又は該自然発生的な材料と共有結合的に連結する、請求項16に記載の方法。
【請求項18】
シルクポリペプチドが、イオン結合又は疎水結合を介して該不活性材料又は該自然発生的な材料と非共有結合的に連結する、請求項16に記載の方法。
【請求項19】
シルクポリペプチドが、該シルクポリペプチドと共有結合的に及び/又は非共有結合的に連結する少なくとも1つの物質を更に含む、請求項1〜18のいずれか一項に記載の方法。
【請求項20】
物質が工程i)の前に、工程i)の後に、及び/又は工程ii)の後に該シルクポリペプチドと共有結合的に及び/又は非共有結合的に連結する、請求項19に記載の方法。
【請求項21】
物質が、
(a)該シルクポリペプチドのシステイン残基、リジン残基、該アミノ末端、該カルボキシ末端、該アミノ末端TAG若しくは該カルボキシ末端TAGを介して、及び/又は
(b)架橋を介して
該シルクポリペプチドと共有結合的に連結する、請求項19又は20に記載の方法。
【請求項22】
共有結合的に連結する物質が、ポリペプチド、脂質、色素、共役金属、活性炭及び作用物質からなる群から選択される、請求項19〜21のいずれか一項に記載の方法。
【請求項23】
(i)ポリペプチドが酵素若しくはβ−ガラクトシダーゼ、抗体、ホルモン若しくはインスリン、又は抗原であり、
(ii)脂質がコレステロール、ステロイド、ワックス、又はオイルであり、
(iii)色素が合成色素若しくはアゾ化合物、無機色素若しくは金属塩、又は有機色素、若しくはフルオレセイン色素若しくはローダミン色素であり、
(iv)共役金属がナノゴールド(商標)であり、
(v)活性炭が粉末活性炭(PAC)、粒状活性炭(GAC)及び押出成形活性炭(EAC)からなる群から選択され、
(vi)作用物質が医薬品、止血剤、成長刺激剤、抗炎症剤、防汚剤、抗微生物剤、抗細菌剤、抗真菌剤、農薬及びUV保護剤からなる群から選択される、
請求項22に記載の方法。
【請求項24】
物質がイオン結合又は疎水結合を介して該シルクポリペプチドと非共有結合的に連結する、請求項19又は20に記載の方法。
【請求項25】
非共有結合的に連結する物質が、ポリペプチド、脂質、色素、共役金属、活性炭、金属塩及び作用物質からなる群から選択される、請求項24に記載の方法。
【請求項26】
(i)ポリペプチドが酵素若しくはβ−ガラクトシダーゼ、抗体、ホルモン若しくはインスリン、又は抗原であり、
(ii)脂質がコレステロール、ステロイド、ワックス、又はオイルであり、
(iii)色素が合成色素若しくはアゾ化合物、無機色素若しくは金属塩、又は有機色素、若しくはフルオレセイン色素若しくはローダミン色素であり、
(iv)共役金属がナノゴールド(商標)であり、
(v)活性炭が粉末活性炭(PAC)、粒状活性炭(GAC)及び押出成形活性炭(EAC)からなる群から選択され、
(vi)金属塩が銅、コバルト、ニッケル又は銀からなる群から選択されるカチオンであり、
(vii)作用物質が医薬品、止血剤、成長刺激剤、抗炎症剤、防汚剤、抗微生物剤、抗細菌剤、抗真菌剤、農薬及びUV保護剤からなる群から選択される、
請求項25に記載の方法。
【請求項27】
工程ii)を4℃〜80℃又は4℃〜40℃の温度で行う、請求項1〜26のいずれか一項に記載の方法。
【請求項28】
工程ii)を20℃〜25℃で行う、請求項27に記載の方法。
【請求項29】
iii)少なくとも2つの同一の反復単位及び任意選択的に少なくとも1つの非反復(NR)単位を含む少なくとも1つのシルクポリペプチドと溶媒とを含む溶液を準備する工程と、
iv)不活性材料又は自然発生的な材料上に該溶液を塗布することにより2回目として該不活性材料又は該自然発生的な材料をシルクポリペプチドでコーティングする、塗布することによりコーティングする工程と、
を更に含み、工程(iii)の該シルクポリペプチドが工程(i)の該シルクポリペプチドと同一である又は異なる、請求項1〜28のいずれか一項に記載の方法。
【請求項30】
工程(iii)と工程(iv)とを数回、又は3回〜10回繰り返し、様々な厚さ及び多重層のコーティングされた不活性材料又は自然発生的な材料を得る、請求項29に記載の方法。
【請求項31】
工程ii)、工程iii)、及び/又は工程iv)の後に、可視光、紫外線若しくは耐水性、摩耗、機械的応力、酸及び/又は塩基に対する保護を与える染色/仕上げ加工により、該コーティングされた不活性材料又は自然発生的な材料に事後改良を加える工程を含む、請求項1〜30のいずれか一項に記載の方法。
【請求項32】
請求項1〜31のいずれか一項に記載の方法により入手可能なコーティングされた不活性材料又は自然発生的な材料。
【請求項33】
請求項32に記載のコーティングされた不活性材料又は自然発生的な材料を含む繊維。
【請求項34】
請求項33に記載の繊維を含む糸。
【請求項35】
請求項33に記載の繊維を含む、撚糸、織布又は不織布。
【請求項36】
或る特定の期間にわたる該少なくとも1つの物質の制御放出のための、又は防護服若しくは撥水性の服の製造のための請求項32に記載のコーティングされた不活性材料又は自然発生的な材料の使用。
【請求項37】
不活性材料を染色するためのシルクポリペプチドの使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2013−512773(P2013−512773A)
【公表日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2012−542392(P2012−542392)
【出願日】平成22年12月7日(2010.12.7)
【国際出願番号】PCT/EP2010/007440
【国際公開番号】WO2011/069643
【国際公開日】平成23年6月16日(2011.6.16)
【出願人】(512141611)アーエムシルク ゲーエムベーハー (3)
【Fターム(参考)】
【公表日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願日】平成22年12月7日(2010.12.7)
【国際出願番号】PCT/EP2010/007440
【国際公開番号】WO2011/069643
【国際公開日】平成23年6月16日(2011.6.16)
【出願人】(512141611)アーエムシルク ゲーエムベーハー (3)
【Fターム(参考)】
[ Back to top ]

