シンバイオティクスを利用した腸内環境調整方法
【課題】 プレバイオティクスとプロバイオティクスとを組み合わせたシンバイオティクスを利用した腸内環境調整方法を提供すること。
【解決手段】 (A)プレバイオティクスとして、加水分解されたグァーの胚乳部分であって、次の性質を含むもの、(1)プルランを分子量マーカーとして用いた高速液体クロマトグラフィーによるゲルろ過で重量平均分子量が3〜50kDaと算出されるガラクトマンナン、(2)ケルダール法により窒素含量を測定し、係数6.25を乗じて算出されたタンパク質含量が1.0%以下であるものと、(B)プロバイオティクスとして、ビィフィズス菌、乳酸菌、枯草菌、酪酸生成菌、乳酸利用菌、プロピオン酸生成菌の一種または二種以上からなり、さらに水分含量が20%以下であるもの、の両者を含有するシンバイオティクスを経口投与することにより、腸管内で乳酸及び糖類から酪酸を生じさせて腸内環境を整えることを特徴とする腸内環境調整方法によって達成される。
【解決手段】 (A)プレバイオティクスとして、加水分解されたグァーの胚乳部分であって、次の性質を含むもの、(1)プルランを分子量マーカーとして用いた高速液体クロマトグラフィーによるゲルろ過で重量平均分子量が3〜50kDaと算出されるガラクトマンナン、(2)ケルダール法により窒素含量を測定し、係数6.25を乗じて算出されたタンパク質含量が1.0%以下であるものと、(B)プロバイオティクスとして、ビィフィズス菌、乳酸菌、枯草菌、酪酸生成菌、乳酸利用菌、プロピオン酸生成菌の一種または二種以上からなり、さらに水分含量が20%以下であるもの、の両者を含有するシンバイオティクスを経口投与することにより、腸管内で乳酸及び糖類から酪酸を生じさせて腸内環境を整えることを特徴とする腸内環境調整方法によって達成される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、腸内の健康に有用とされるプロバイオティクスを特定のプレバイオティクスを併用することにより、プロバイオティクスの胃酸耐性が向上し、ヒトや動物の大腸に効率よく到達し定着率を向上させる、かつプロバイオティクスの保存安定性を向上させることできるシンバイオティクスおよびこれを添加した飲食品、飼料およびペットフードに関する。さらに詳しくは、分子量が分子量マーカーとしてプルランを用いた高速液体クロマトグラフィーによるゲルろ過で重量平均分子量が3〜50kDaと算出されるガラクトマンナンであるプレバイオティクスとプロバイオティクスを併用するシンバイオティクスおよびこれを添加した飲食品、飼料およびペットフードに関する。
【背景技術】
【0002】
プロバイオティクスとは、消化管内の細菌叢を改善して宿主に有益な作用をもたらし得る有用な微生物を意味している。プロバイオティクス機能を持つ微生物を摂取すると、それらが消化管内の細菌叢に作用し、細菌叢の健常化をはかりながら、疾病の予防・改善を行うことができると言われている。プロバイオティクスを応用した技術開発として、いくつかものが知られている(特許文献1)。
【0003】
また、プレバイオティクスとは、上記プロバイオティクスに含まれる有用な細菌や常在の有用腸内細菌の増殖を助けて、腸内環境の改善を促進する物質のことを意味し、簡単に消化されない物質が多い。例えば、オリゴ糖、食物繊維などは、プレバイオティクスとして働く。オリゴ糖は、乳酸菌、ビフィズス菌などの栄養となり、食物繊維は、腸内細菌をとどめさせて、その増殖を助ける。プレバイオティクスを応用した技術開発として、いくつかのものが知られている(特許文献2)。
上記プロバイオティクスとプレバイオティクスとを組み合わせたものをシンバイオティクスと称しているが、このシンバイオティクスに関する技術開発については、十分に進んでいなかった。
【0004】
【特許文献1】特開2008−109945号公報
【特許文献2】特表2007−537224号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、上記課題に鑑みてなされたものであり、その目的はシンバイオティクスを利用した腸内環境調整方法を提供することである。
【課題を解決するための手段】
【0006】
上記課題を解決するための発明に係る腸内環境調整方法は、(A)プレバイオティクスとして、加水分解されたグァーの胚乳部分であって、次の性質を含むもの、(1)プルランを分子量マーカーとして用いた高速液体クロマトグラフィーによるゲルろ過で重量平均分子量が3〜50kDaと算出されるガラクトマンナン、(2)ケルダール法により窒素含量を測定し、係数6.25を乗じて算出されたタンパク質含量が1.0%以下であるものと、(B)プロバイオティクスとして、ビィフィズス菌、乳酸菌、枯草菌、酪酸生成菌、乳酸利用菌、プロピオン酸生成菌の一種または二種以上からなり、さらに水分含量が20%以下であるもの、の両者を含有するシンバイオティクスを経口投与することにより、腸管内で乳酸及び糖類から酪酸を生じさせて腸内環境を整えることを特徴とする。
本発明において、前記加水分解されたグァーの胚乳部分が、次の性質を含むもの、(3)固形分含量15%水溶液の粘度が、回転式粘度計で回転数60rpm、20℃で測定したときに20mPa・s以下であるもの、であることが好ましい。
また、前記加水分解されたグァーの胚乳部分が、次の性質を含むもの、(4)分解物の固形物含量が1.0%水溶液99gに1.0gのポリオキシエチレン付加型界面活性剤(POE)を添加して測定した曇点が60℃以下であるもの、(5)(A)分解物1質量部に対して、1/5質量部のイソプロピルアルコールを加えてよく湿らせた後、激しくかき混ぜながら水10質量部加えた溶液(溶液(5−1))の粘度がB型粘度計で25℃、No.1ローター、12rpmで測定したときに20mPa・s以下、(B)溶液(5−1)を沸騰水中で10分間加熱し冷却後に同条件で測定した粘度が20mPa・s以下(溶液5−2)、(C)溶液(5−2)1質量部に5%ホウ酸ナトリウム水溶液1/5質量部を添加し、混和、放置したものを動的粘弾性測定装置で、25℃、1Hzでひずみ依存性測定をすると、線形領域で貯蔵弾性率(G‘)>損失弾性率(G’‘)かつ線形領域から非線形領域を示す測定曲線を得るものであることが好ましい。
また、さらにツバキ科植物成分を経口投与することが好ましい。
本発明におけるプロバイオティクスとは、宿主の腸管内で有益な作用を発揮する微生物であり、好ましくは乳酸菌、ビフィズス菌、糖化菌、枯草菌、酪酸生成菌、乳酸利用菌、プロピオン酸生成菌、酵母である。
【0007】
本発明における乳酸菌とは、乳酸桿菌および乳酸球菌であり、好ましくは、Lactobacillus属細菌、Streptococcus属細菌、Enterococcus属細菌、Lactococcus属細菌、Pediococcus属細菌およびLeuconostoc属細菌である。
【0008】
本発明におけるLactobacillus属細菌は、Lactobacillus acidophilus、 L.gasseri、 L.johnsonii、L.delbrueckii、L.delbrueckii subsp.bulgaricus、L.bulgaricus、L.helveticus、L.rhamnosus、L.casei、L.plantarum、L.reuteri、L.salivarius、L.sake、L.salivarius、L.cellobiosusおよびL.brevisが例示できる。
【0009】
本発明におけるStreptococcus属細菌は、Streptococcus thermophilus、S.sanguis、S.mitis、S. pseudopneumoniae、S.pasteuri、S.parasanguinis、S.parasanguinis、S.salivarius、S.vestibularis、S.pasteuri、およびS.oralisが例示できる。
本発明におけるEnterococcus属細菌は、E.malodoratus、E.malodoratus、E.facialisおよびE.faceiumが例示できる。
【0010】
本発明におけるLactococcus属細菌は、Lactococcus lactisおよびLactococcus lactis subsp.cremorisが例示できる。
本発明におけるPediococcus属細菌は、Pediococcus damnosusおよびP.acidilacticiが例示できる。
本発明におけるLeuconostoc属細菌は、L.mesenteroidesおよびL.sakeが例示できる。
【0011】
本発明におけるビィフィズス菌とは、Bifidobacterium属細菌のことを指す。好ましくは、Bifidobacterium bifidum、B.adolescentis、B.longum、B.infantis、B.breve、B.animalis、B.pseudolongum、B.thermophilum、B.boum、B.magunum、B.pullorum、B.catenulatum、B.suis、B.pseudocatenulatum、B.gallinarum、B.dentium、B.ruminantium、B.angulatum、B.merycicum、B.gallicum、B.saeculare、B.inopinatum、B.minimum、B.denticolens、B.subtile、B.coryneforme、B.cuniculi、B.asteroides、B.choerinumおよびB.indicumである。
【0012】
本発明における糖化菌とは、Bacillus mesentericusである。
本発明における枯草菌とは、Bacillus subtilis、好ましくは、Bacillus subtilis var. nattoである。
本発明における酪酸生成菌とは、Clostridium butyricumおよびT−RELP法による細菌解析でClostridium subcluster XIVaに分類される細菌である。
【0013】
本発明におけるT−RELP法による細菌解析でClostridium subcluster XIVaに分類される細菌は、Eubacterium hallii、E.ramulus、E.rectale、E.ventriosumおよびRoseburia intestinalisが例示できる。
【0014】
本発明における乳酸利用菌とは、Megasphaera elsdeniiである。
本発明におけるプロピオン酸生成菌とは、Propionibacterium属細菌のことであり、好ましくは、Propionibacterium freudenreichiiである。
【0015】
本発明におけるガラクトマンナンとは、D−マンノースがβ−(1→4)結合したマンナン鎖を主鎖とし、D−マンノースのO−6位からα−ガラクトシル基が結合した櫛状の分岐構造を有し、分子量マーカーとしてプルランを用いた高速液体クロマトグラフィーによるゲルろ過で測定した重量平均分子量が3〜50kDaと算出される物質を指す。
本発明のガラクトマンナンのマンノース直鎖の鎖長は、30単位〜200単位の範囲内に80%以上分布している。
本発明のガラクトマンナンの5%水溶液の粘度は、ブルックフィールド粘度計を用いて5℃,60rpmで、Lowローターにて測定したときに5〜20mPa・sである。
【0016】
本発明のガラクトマンナンの食物繊維含量は、AOAC 985.29に記載の酵素重量法により測定したときに65%以上である。
本発明のガラクトマンナンは、ガラクトマンナンを含有するマメ科植物種子の胚乳部分をヘミセルラーゼ製剤により酸性域で酵素的に加水分解することで得られた溶液の加水分解反応を停止させ、この溶液を遠心分離処理を行って未反応物を除去し、次いで精製処理、加熱殺菌処理及び冷却処理を行った後、中和処理を行うことによって得ることができる。
【0017】
本発明のガラクトマンナンを含有するマメ科植物とは、グアー(Cyamopsis tetragonolobus)、イナゴマメ(Ceratonia siliqua)、ケンタッキー・コーヒーマメ(Gymnocladus dioica)、ムラサキウマゴヤシ(Medicago sativa)、クローバ(Trifolium pratense)、ダイズサヤ(Glycine hispida)、タラ(Actinidia callosa LINDLEY)、セスバニア(Sesbania bisibinonia)、カシア(Cassia tora Linn)およびフェヌグリーク(Trigonella foenum graecum L)が例示でき、資源の豊富さと味の観点からグアー(Cyamopsis tetragonolobus)、フェヌグリーク(Trigonella foenum graecum L)及びイナゴマメ(Ceratonia siliqua)が好ましく、最も好ましくはグアー(Cyamopsis tetragonolobus)である。
【0018】
本発明のガラクトマンナンを得るときに実施される加水分解反応で用いるヘミセルラーゼ製剤は、ガラクトマンナナーゼ、α−ガラクトシダーゼ及びβ−マンノシダーゼを含有し、それら酵素の比活性の割合が1〜100:1:0〜0.5、もしくはガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼを含有し、それら酵素の比活性の割合が1〜100:1:0〜0.15:0〜0.5、もしくはガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼを含有し、それら酵素の比活性の割合が1〜10:1:0〜0.05:0〜0.5である。ここで、本発明で酵素として用いるβ−ガラクトマンナナーゼの比活性とは、β−ガラクトマンナナーゼがガラクトマンナンであるローカストビーンガムに37℃、pH5.0で作用するとき、反応初期の1分間に1マイクロモルのマンノースに相当する還元力の増加をもたらす試料1g中の酵素量のことを指す。β−ガラクトマンナナーゼの分子量は、SDS−ポリアクリルアミドゲル電気泳動後にクーマシーブルー染色(CBB染色)した結果、20kDa〜60kDaを示すことがよい。当該分子量のより好ましい範囲は30kDa〜50kDaであり、最も好ましい範囲は35kDa〜45kDaである。
【0019】
本発明で酵素として用いるα−ガラクトシダーゼの比活性とは、当該α−ガラクトシダーゼがp−ニトロフェニル−α−ガラクシドに37℃、pH5.5で作用するとき、反応初期の1分間に1マイクロモルのp−ニトロフェニルを遊離する試料1g中の酵素量のことを指す。
本発明で酵素として使用する酸性プロテアーゼの比活性とは、当該酸性プロテアーゼが乳製カゼインに30℃、pH3.0で作用するとき、反応初期の1分間に1マイクログラムのチロシンに相当する非蛋白性のフォリン試液呈色物質の増加をもたらす試料1g中の酵素量のことを指す。
本発明で酵素として使用するβ−マンノシダーゼの比活性とは、当該β−マンノシダーゼがp−ニトロフェニル−β−マンノシドに37℃、pH5.5で作用するとき、反応初期の1分間に1マイクロモルのp−ニトロフェニルを遊離する試料1g中の酵素量のことを指す。
【0020】
本発明のガラクトマンナンを得るときに実施される加水分解反応で用いるヘミセルラーゼ製剤は、Penicillium属細菌、Streptomyces属細菌、Enterococcus属細菌、Vibrio属細菌、Aeromonas属細菌、Bacillus属細菌、Clostridium属細菌、Aspergillus属カビ、Rhizopus属カビ及びTricohderma属酵母の微生物群から選択される少なくとも1種に由来し、例えば、Penicillium属細菌はP.purpurogenam、Enterococcus属細菌はE.caseliflavas、Clostridium属細菌はC.tertium、Aspergillus属カビはA.niger、Rhizopus属カビはR.niveus、Tricohderma属酵母はT.reeseiが、それぞれ例示できる。
【0021】
本発明のガラクトマンナンを得るときに実施される加水分解反応における酸性域は、pH2.0〜pH6.0である。
本発明のガラクトマンナンを得るときに実施される加水分解反応における温度および反応時間は、50℃〜80℃で8時間〜24時間、または60℃〜80℃で3時間〜12時間である。
本発明のガラクトマンナンを得るときに実施される加水分解反応の停止は、特に限定されないが、85℃以上で15分間〜60分間加熱が好ましい。
【0022】
本発明のツバキ科植物成分とは、水、アルコール、酢酸エチル、石油エーテル等の有機溶媒による溶剤抽出、水蒸気蒸留、圧搾、油脂吸着、液化ガス抽出、超臨界抽出、乾留により得られる成分を指す。好ましくは抽出効率の観点から溶剤抽出、最も好ましくは水及び酢酸エチルによる溶剤抽出である。このようにして得られた抽出物は、必要に応じて吸着樹脂、濾過膜等により精製しても問題はない。例えば、茶の場合では酢酸エチルにより抽出して得られたポリフェノール化合物を用いることも可能である。緑茶の場合、生葉又は乾燥葉から(+)−カテキン、(+)−ガロカテキン、(−)−ガロカテキンガレート、(−)−エピカテキン、(−)−エピカテキンガレート、(−)−エピガロカテキン、(−)−エピガロカテキンガレートのポリフェノール化合物が抽出され、これらポリフェノール化合物の1種または2種以上の混合物として用いることができが、好ましくは(−)−ガロカテキンガレート、(−)−エピカテキンガレート、(−)−エピガロカテキンガレートの1種または2種以上の混合物として用いることができる。単独で用いる場合、(+)−カテキン、(+)−ガロカテキン、(−)−ガロカテキンガレート、(−)−エピカテキン、(−)−エピカテキンガレート、(−)−エピガロカテキン又は(−)−エピガロカテキンガレートが好ましく、さらに好ましくは、(−)−エピガロカテキンガレート、(−)−エピカテキンガレート又は(−)−ガロカテキンガレートであり、最も好ましくは、(−)−エピガロカテキンガレートである。
【0023】
実施例1
A.nigerを所定期間培養し、加水分解反応に用いる酵素群をあらかじめ採取しておいた。このようにして採取したA. niger由来の酵素群は、β−ガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼの混合物であった。
次に、水900部に塩酸を加えてpHを4.5に調整した後、その水に上記の酵素群0.2部とグアー豆(Cyamopsis tetragonolobus)の胚乳100部とを添加混合し、55℃〜65℃で24時間酵素を作用させ、酵素的に加水分解した。
次に、反応液を90℃,30分間加熱することにより酵素を失活させ、加水分解反応を停止させた。
【0024】
次に、加水分解物を含む反応液を遠心分離装置(石川島播磨重工業社製、商品名HS−50L)で3000rpm,供給量6m3/hで遠心分離処理し、反応液を未反応物と清澄液とに分離させるとともに、清澄液のみを採取した。
次に、採取した溶液(清澄液)に珪藻土系濾過助剤及び活性炭を添加して60分間攪拌した後、第1濾過手段である濾過装置(昭和製作所社製、商品名202B、濾過圧:250kg/cm2)を用いて濾過する粗精製を行った。その結果、前記溶液中に含まれる不純物をある程度吸着除去した。さらに、粗精製された前記溶液に珪藻土系濾過助剤のみを添加して60分間攪拌した後、第1濾過手段よりも目の細かい第2濾過手段である精密濾過装置(中央製作所社製、商品名FS−50B、流量:300L/h)を用いて濾過する本精製を行った。その結果、前記溶液中に含まれる不純物をほぼ完全に吸着除去し、本発明のガラクトマンナンを含有する無色透明で臭いのない溶液を得た。
【0025】
次に、UHT殺菌装置(日阪製作所社製、商品名FX−05)を用いて、前記溶液をUHT殺菌処理しかつ直ちに強制冷却した。なお、この処理では、入り口温度を140℃に設定し、出口温度を4℃に設定し、殺菌時間を4秒に設定した。
次に、pHが酸性域に保持されていた溶液をNaOHで中和してpH=約7.0にした。
さらに、得られた中性の溶液を遠心式薄膜濃縮装置(アルファ・ラバル社製、商品名CT−6)を用いて固形分として20%になるように所定時間減圧濃縮した。
【0026】
その後、噴霧乾燥装置(大川原化工機社製、商品名OC−35)を用いて90分間噴霧乾燥を行い、本発明のガラクトマンナンの白色粉末70部を得た。
そして、得られた粉末状のガラクトマンナンをサンプルとして下記の測定を行った。具体的には、カラムにG3000PW(東ソー株式会社製)を充填したものを固定相として用い、高速液体クロマトグラフィーを行った。このような測定の結果、マンナン主鎖の糖鎖の80%以上はマンノースの重合度が30〜40単位の範囲内に包含されていた。なお、このとき糖鎖単位の標準試薬として、グルコース重合度が既知の直鎖デキストリン(グルコースの重合度:50,100,150)を用いた。
本実施例のガラクトマンナンの重量平均分子量、食物繊維含量、5%溶液の粘度を測定したところ、重量平均分子量が20kDa、食物繊維含量が82%、粘度が8mPa・sであった。
本実施例のガラクトマンナン0.4gにイソプロピルアルコール0.08mlを加えてよく湿らした後、厳しくかき混ぜながら水4mlを加え、更に均一に分散するまで激しくかき混ぜ、粘度を測定した(均一分散後)。また、この液を沸騰した水浴上で約10分間加熱した後に粘度を測定した(10分加熱冷却後)。粘度計はB型粘度計を用い、ローター番号は No.1、測定温度は25℃および粘度計の回転数は12rpmとした。均一分散後の粘度は7.4mPa・sであり、10分加熱冷却後粘度は7.4mPa・sであった。
【0027】
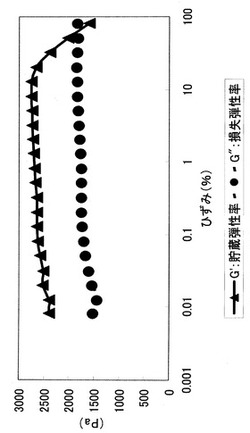
10分加熱冷却後の溶液3.5mlに5%ホウ酸ナトリウム溶液0.7mlを加え、混和して放置し、動的粘弾性の歪依存性測定に供した。尚、試験装置は、動的粘弾性物性計測装置ARES(T.Aインスツルメンツ株式会社製)を用いた。測定温度は25℃、および測定周波数は1.0Hzとした。その結果、図1に示したように、線形領域で貯蔵弾性率(G‘)>損失弾性率(G’‘)かつ線形領域から非線形領域を示す測定曲線が得られた。
【0028】
実施例2
A.nigerを所定期間培養し、加水分解反応に用いる酵素群をあらかじめ採取しておいた。このようにして採取したA.niger由来の酵素群は、β−ガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼの混合物であった。
次に、水900部に塩酸を加えてpHを4.5に調整した後、その水に上記の酵素群0.1部とグアー豆(C.tetragonolobus)の胚乳100部とを添加混合し、70℃〜75℃で8時間酵素を作用させた。この後、実施例1と同様の方法を実施し、本発明のガラクトマンナンの白色粉末70部を得た。
【0029】
得られた粉末状のガラクトマンナンについて、実施例1と同様の測定及び評価を行った。その結果、マンナン主鎖の糖鎖の80%以上は、マンノースの重合度が30〜40単位の範囲内に包含されていた。また、本実施例のガラクトマンナンの重量平均分子量は16kDa、食物繊維含量は76%、5%水溶液の粘度は5mPa・s、であった。
【0030】
本実施例のガラクトマンナン0.4gにイソプロピルアルコール0.08mlを加えてよく湿らした後、厳しくかき混ぜながら水4mlを加え、更に均一に分散するまで激しくかき混ぜ、粘度を測定した(均一分散後)。また、この液を沸騰した水浴上で約10分間加熱した後に粘度を測定した(10分加熱冷却後)。粘度計はB型粘度計を用い、ローター番号は No.1、測定温度は25℃および粘度計の回転数は12rpmとした。均一分散後の粘度は4.9mPa・sであり、10分加熱冷却後粘度は5.1mPa・sであった。
【0031】
10分加熱冷却後の溶液3.5mlに5%ホウ酸ナトリウム溶液0.7mlを加え、混和して放置し、動的粘弾性の歪依存性測定に供した。尚、試験装置は、動的粘弾性物性計測装置ARES(T.Aインスツルメンツ株式会社製)を用いた。測定温度は25℃、および測定周波数は1.0Hzとした。その結果、図2に示したように、線形領域で貯蔵弾性率(G‘)>損失弾性率(G’‘)かつ線形領域から非線形領域を示す測定曲線が得られた。
【0032】
比較例1
A.nigerを所定期間培養し、加水分解反応に用いる酵素群をあらかじめ採取しておいた。このようにして採取したA.niger由来の酵素群は、β−ガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼの混合物であった。
次に、水900部に塩酸を加えてpHを4.5に調整した後、その水に上記の酵素群0.2部とグアー豆(C.tetragonolobus)の胚乳100部とを添加混合し、55℃〜65℃で72時間酵素を作用させ、酵素的に加水分解した。
【0033】
次に、反応液を90℃,30分間加熱することにより酵素を失活させ、加水分解反応を停止させた。
次に、加水分解物を含む反応液を遠心分離装置(石川島播磨重工業社製、商品名HS−50L)で3000rpm,供給量6m3/hで遠心分離処理し、反応液を未反応物と清澄液とに分離させるとともに、清澄液のみを採取した。
次に、採取した溶液(清澄液)に珪藻土系濾過助剤及び活性炭を添加して60分間攪拌した後、第1濾過手段である濾過装置(昭和製作所社製、商品名202B、濾過圧:250kg/cm2)を用いて濾過する粗精製を行った。その結果、前記溶液中に含まれる不純物をある程度吸着除去した。さらに、粗精製された前記溶液に珪藻土系濾過助剤のみを添加して60分間攪拌した後、第1濾過手段よりも目の細かい第2濾過手段である精密濾過装置(中央製作所社製、商品名FS−50B、流量:300L/h)を用いて濾過した。その結果、前記溶液中に含まれる不純物をほぼ完全に吸着除去した。
【0034】
次に、UHT殺菌装置(日阪製作所社製、商品名FX−05)を用いて、前記溶液をUHT殺菌処理しかつ直ちに強制冷却した。なお、この処理では、入り口温度を140℃に設定し、出口温度を4℃に設定し、殺菌時間を4秒に設定した。
次に、pHが酸性域に保持されていた溶液をNaOHで中和してpH=約7.0にした。
さらに、得られた中性の溶液を遠心式薄膜濃縮装置(アルファ・ラバル社製、商品名CT−6)を用いて固形分として20%になるように所定時間減圧濃縮した。濃縮液を陰イオンカラムクロマトグラフィーおよび陽イオンカラムクロマトグラフィー処理し、除タンパク処理した。
その後、噴霧乾燥装置(大川原化工機社製、商品名OC−35)を用いて90分間噴霧乾燥を行い、比較品の白色粉末65部を得た。
【0035】
そして、得られた粉末状のガラクトマンナンをサンプルとして下記の測定を行った。具体的には、カラムにG3000PW(東ソー株式会社製)を充填したものを固定相として用い、高速液体クロマトグラフィーを行った。このような測定の結果、マンナン主鎖の糖鎖の80%以上はマンノースの重合度が30〜40単位の範囲内に包含されていなかった。なお、このとき糖鎖単位の標準試薬として、グルコース重合度が既知の直鎖デキストリン(グルコースの重合度:50,100,150)を用いた。
【0036】
本比較例のガラクトマンナンの重量平均分子量、食物繊維含量、5%溶液の粘度を測定したところ、重量平均分子量が1.5kDa、食物繊維含量が54%、粘度が3mPa・sであった。
【0037】
本比較例のガラクトマンナン0.4gにイソプロピルアルコール0.08mlを加えてよく湿らした後、厳しくかき混ぜながら水4mlを加え、更に均一に分散するまで激しくかき混ぜ、粘度を測定した(均一分散後)。また、この液を沸騰した水浴上で約10分間加熱した後に粘度を測定した(10分加熱冷却後)。粘度計はB型粘度計を用い、ローター番号は No.1、測定温度は25℃および粘度計の回転数は12rpmとした。均一分散後の粘度は2.5mPa・sであり、10分加熱冷却後粘度は2.3mPa・sであった。
10分加熱冷却後の溶液3.5mlに5%ホウ酸ナトリウム溶液0.7mlを加え、混和して放置し、動的粘弾性の歪依存性測定を供しようとしたところ、この溶液はゲル状態を呈しないために、測定することは不可能であった。このことより本発明のガラクトマンナンとは異なる性質のものであった。
【0038】
比較例2
A.nigerを所定期間培養し、加水分解反応に用いる酵素群をあらかじめ採取しておいた。このようにして採取したA.niger由来の酵素群は、β−ガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼの混合物であった。
次に、水900部に塩酸を加えてpHを4.5に調整した後、その水に上記の酵素群0.2部とグアー豆(C.tetragonolobus)の胚乳100部とを添加混合し、55℃〜65℃で3時間酵素を作用させ、酵素的に加水分解した。
【0039】
次に、反応液を90℃,30分間加熱することにより酵素を失活させ、加水分解反応を停止させた。
次に、加水分解物を含む反応液を遠心分離装置(石川島播磨重工業社製、商品名HS−50L)で3000rpm,供給量6m3/hで遠心分離処理し、反応液を未反応物と清澄液とに分離させるとともに、清澄液のみを採取した。
【0040】
次に、採取した溶液(清澄液)に珪藻土系濾過助剤及び活性炭を添加して60分間攪拌した後、第1濾過手段である濾過装置(昭和製作所社製、商品名202B、濾過圧:250kg/cm2)を用いて濾過する粗精製を行った。その結果、前記溶液中に含まれる不純物をある程度吸着除去した。さらに、粗精製された前記溶液に珪藻土系濾過助剤のみを添加して60分間攪拌した後、第1濾過手段よりも目の細かい第2濾過手段である精密濾過装置(中央製作所社製、商品名FS−50B、流量:300L/h)を用いて濾過した。その結果、前記溶液中に含まれる不純物をほぼ完全に吸着除去した。
【0041】
次に、UHT殺菌装置(日阪製作所社製、商品名FX−05)を用いて、前記溶液をUHT殺菌処理しかつ直ちに強制冷却した。なお、この処理では、入り口温度を140℃に設定し、出口温度を4℃に設定し、殺菌時間を4秒に設定した。
次に、pHが酸性域に保持されていた溶液をNaOHで中和してpH=約7.0にした。
さらに、得られた中性の溶液を遠心式薄膜濃縮装置(アルファ・ラバル社製、商品名CT−6)を用いて固形分として20%になるように所定時間減圧濃縮した。濃縮液を陰イオンカラムクロマトグラフィーおよび陽イオンカラムクロマトグラフィー処理し、除タンパク処理した。
【0042】
その後、噴霧乾燥装置(大川原化工機社製、商品名OC−35)を用いて90分間噴霧乾燥を行い、比較品の白色粉末32部を得た。
そして、得られた粉末状のガラクトマンナンをサンプルとして下記の測定を行った。具体的には、カラムにG3000PW(東ソー株式会社製)を充填したものを固定相として用い、高速液体クロマトグラフィーを行った。このような測定の結果、マンナン主鎖の糖鎖の80%以上はマンノースの重合度が30〜40単位の範囲内に包含されていなかった。なお、このとき糖鎖単位の標準試薬として、グルコース重合度が既知の直鎖デキストリン(グルコースの重合度:50,100,150)を用いた。
本比較例のガラクトマンナンの重量平均分子量、食物繊維含量及び5%溶液の粘度を測定したところ、重量平均分子量が83kDa、食物繊維含量が82%、粘度が150mPa・sであった。
本比較例のガラクトマンナン0.4gにイソプロピルアルコール0.08mlを加えてよく湿らした後、厳しくかき混ぜながら水4mlを加え、更に均一に分散するまで激しくかき混ぜ、粘度を測定しようとしたが、この溶液は高粘度を呈し、この条件では粘度測定が不可能であった。よって、以後の測定も実施不可能であった。このことより本発明のガラクトマンナンとは異なる性質のものであった。
【0043】
実施例3
プレバイオティクスとして実施例1で調製したガラクトマンナン(A)10質量部およびプロバイオティクスとして、1.0×108個/gのLactobacillus acidophilus粉末1質量部を混合し、シンバイオティクスLAC−1(SLAC−1)を調製した。
同様に、Aとプロバイオティクスとして、1×108個/gのL.gasseri(2)、L.johnsonii(3)、L.delbrueckii(4)、L.delbrueckii subsp.bulgaricus(5)、L.bulgaricus(6)、L.helveticus(7)、L.rhamnosus(8)、L.casei(9)、L.plantarum(10)、L.reuteri(11)、L.salivarius(12)、L.sake(13)、L.salivarius(14)、L.cellobiosus(15)およびL.brevis(16)を用いて、それぞれシンバイオティクスLAC−2〜16(SLAC−2〜16)を調製した。
【0044】
比較例3
比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)10質量部およびプロバイオティクスとして、1.0×108個/gのLactobacillus acidophilus粉末1質量部を混合し、比較シンバイオティクス−1(CSLAC−1)を調製した。
同様に、Aとプロバイオティクスとして、1×108個/gのL. gasseri(2)、L.johnsonii(3)、L.delbrueckii(4)、L.delbrueckii subsp.bulgaricus(5)、L.bulgaricus(6)、L.helveticus(7)、L.rhamnosus(8)、L.casei(9)、L.plantarum(10)、L.reuteri(11)、L.salivarius(12)、L.sake(13)、L.salivarius(14)、L.cellobiosus(15)およびL.brevis(16)を用いて、それぞれ比較シンバイオティクスLAC−2〜16(CSLAC−2〜16)を調製した。
【0045】
試験例1
男性4名(平均年齢43±5才)より新鮮糞便150gずつを集めた。これらの糞便を一つの3000mLの三角フラスコに注入した。4倍重量のリン酸緩衝液(pH7.0)を添加し、嫌気的に均一に懸濁した。試験管に9.5mLずつ嫌気的に分注した後に、実施例3で調製したSLAC−1〜16、および比較例3で調製したCSLAC−1〜16を、それぞれの試験管に0.5gずつ添加した。各試験管を37℃で24時間嫌気的に培養した。培養後に培養液をろ過し、得られたろ液中の酢酸、プロピオン酸及び酪酸を定量した。定量には、イオン排除高速液体クロマトグラフィー(Waters 製、以下HPLC)を用いた。前処理およびHPLCの条件は、Anim.Sci.Technol.69:571−575(1998)に準拠した。
その結果を表1に示した。
【0046】
【表1】

【0047】
表1に示したように、比較例3で調製した比較シンパイオティクスと比較すると、実施例3で調製したシンバイオティクスは、糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0048】
実施例4
実施例3と同様に、プレバイオティクスとして実施例2で調製したガラクトマンナン(B)100質量部およびプロバイオティクスとして、1.2×108個/gのStreptococcus thermophilus(1)、S.sanguis(2)、S.mitis(3)、S.pseudopneumoniae(4)、S.pasteuri(5)、S.parasanguinis(6)、S.parasanguinis(7)、S.salivarius(8)、S.vestibularis(9)、S.pasteuri(10)、S.oralis(11)1質量部より、それぞれシンバイオティクスS−1〜11(SS−1〜11)を調製した。
【0049】
比較例4
実施例3と同様に、比較プレバイオティクスとして比較例2で調製したガラクトマンナン(CB)100質量部およびプロバイオティクスとして、1.2×108個/gのStreptococcus thermophilus(1)、S.sanguis(2)、S.mitis(3)、S.pseudopneumoniae(4)、S.pasteuri(5)、S.parasanguinis(6)、S.parasanguinis(7)、S.salivarius(8)、S.vestibularis(9)、S.pasteuri(10)、S.oralis(11)1質量部より、それぞれ比較シンバイオティクスS−1〜11(CSS−1〜11)を調製した。
【0050】
試験例2
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例4で調製したSS−1〜11および比較例4で調製したCSS−1〜11で行った。
その結果を表2に示した。
【0051】
【表2】

【0052】
表2に示したように、比較例4で調製した比較シンパイオティクスと比較すると、実施例4で調製したシンバイオティクスは、糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0053】
実施例5
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)200質量部およびプロバイオティクスとして、1.5×107個/gのEnterococcus malodoratus(1)、E. malodoratus(2)、E.facialis(3)およびE.faceium(4)1質量部より、それぞれシンバイオティクスE−1〜11(SE−1〜4)を調製した。
【0054】
比較例5
実施例3と同様に、比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)200質量部およびプロバイオティクスとして、1.5×107個/gのEnterococcus malodoratus(1)、E.malodoratus(2)、E.facialis(3)およびE.faceium(4)1質量部より、それぞれ比較シンバイオティクスE−1〜11(CSE−1〜4)を調製した。
【0055】
試験例3
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を、実施例5で調製したSE−1〜4および比較例5で調製したCSE−1〜4で行った。
その結果を表3に示した。
【0056】
【表3】

【0057】
表3に示したように、比較例5で調製した比較シンパイオティクスと比較して、実施例5で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0058】
実施例6
実施例3と同様に、プレバイオティクスとして実施例2で調製したガラクトマンナン(B)1質量部およびプロバイオティクスとして、1.1×108個/gのLactococcus lactis(1)およびL.lactis subsp.cremoris(2)1質量部より、それぞれシンバイオティクスLC−1および2(SLC−1および2)を調製した。
【0059】
比較例6
実施例3と同様に、比較プレバイオティクスとして比較例2で調製したガラクトマンナン(CB)1質量部およびプロバイオティクスとして、1.1×108個/gのLactococcus lactis(1)およびL.lactis subsp.cremoris(2)1質量部より、それぞれ比較シンバイオティクスLC−1および2(CSLC−1および2)を調製した。
【0060】
試験例4
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例6で調製したSLC−1および2と比較例6で調製したCSLC−1および2で行った。
その結果を表4に示した。
【0061】
【表4】

【0062】
表4に示したように、比較例6で調製した比較シンパイオティクスと比較すると、実施例6で調製したシンバイオティクスは、糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0063】
実施例7
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)500質量部およびプロバイオティクスとして、1.4×108個/gのPediococcus damnosus(1)およびP.acidilactici(2)1質量部より、それぞれシンバイオティクスP−1および2(SP−1および2)を調製した。
【0064】
比較例7
実施例3と同様に比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)500質量部およびプロバイオティクスとして、1.4×108個/gのPediococcus damnosus(1)およびP.acidilactici(2)1質量部より、それぞれ比較シンバイオティクスP−1および2(CSP−1および2)を調製した。
【0065】
試験例5
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例7で調製したSP−1および2と比較例7で調製したCSP−1および2で行った。
その結果を表5に示した。
【0066】
【表5】

【0067】
表5に示したように、比較例6で調製した比較シンパイオティクスと比較して、実施例7で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0068】
実施例8
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)200質量部およびプロバイオティクスとして、1.8×107個/gのLeuconostoc mesenteroides(1)およびL.sake(2)1質量部より、それぞれシンバイオティクスLCN−1および2(SLCN−1および2)を調製した。
【0069】
比較例8
実施例3と同様に比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)200質量部およびプロバイオティクスとして、1.8×107個/gのLeuconostoc mesenteroides(1)およびL.sake(2)1質量部より、それぞれ比較シンバイオティクスLCN−1および2(CSLCN−1および2)を調製した。
【0070】
試験例6
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例8で調製したSLCN−1および2と比較例8で調製したCSLCN−1および2で行った。
その結果を表6に示した。
【0071】
【表6】

【0072】
表6に示したように、比較例8で調製した比較シンパイオティクスと比較すると、実施例8で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0073】
実施例9
実施例3と同様にプレバイオティクスとして実施例1で調製したガラクトマンナン(A)300質量部およびプロバイオティクスとして、1.5×108個/gのBifidobacterium bifidum(1)、B.adolescentis(2)、B.longum(3)、B.infantis(4)、B.breve(4)、B.animalis(5)、B.pseudolongum(6)、B.thermophilum(7)、B.boum(8)、B.magunum(9)、B.pullorum(10)、B.catenulatum(11)、B.suis(12)、B.pseudocatenulatum(13)、B.gallinarum(14)、B.dentium(15)、B.ruminantium(16)、B.angulatum(17)、B.merycicum(18)、B.gallicum(19)、B.saeculare(20)、B.inopinatum(21)、B.minimum(22)、B.denticolens(23)、B.subtile(24)、B.coryneforme(25)、B.cuniculi(26)、B.asteroides(27)、B.choerinum(28)、B.indicum(29)1質量部より、それぞれシンバイオティクスBIF−1〜29(SBIF−1〜29)を調製した。
【0074】
比較例9
実施例3と同様に、比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)300質量部およびプロバイオティクスとして、1.5×108個/gのBifidobacterium bifidum(1)、B.adolescentis(2)、B.longum(3)、B.infantis(4)、B.breve(4)、B.animalis(5)、B.pseudolongum(6)、B.thermophilum(7)、B.boum(8)、B.magunum(9)、B.pullorum(10)、B.catenulatum(11)、B.suis(12)、B.pseudocatenulatum(13)、B.gallinarum(14)、B.dentium(15)、B.ruminantium(16)、B.angulatum(17)、B.merycicum(18)、B.gallicum(19)、B.saeculare(20)、B.inopinatum(21)、B.minimum(22)、B.denticolens(23)、B.subtile(24)、B.coryneforme(25)、B.cuniculi(26)、B.asteroides(27)、B.choerinum(28)、B.indicum(29)1質量部より、それぞれシンバイオティクスBIF−1〜29(CSBIF−1〜29)を調製した。
【0075】
試験例7
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例9で調製したSBIF−1〜29および比較例9で調製したCSBIF−1〜29で行った。
その結果を表7に示した。
【0076】
【表7】

【0077】
表7に示したように、比較例9で調製した比較シンパイオティクスと比較すると、実施例9で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0078】
実施例10
実施例3と同様に、プレバイオティクスとして実施例2で調製したガラクトマンナン(B)500質量部およびプロバイオティクスとして、3.8×106個/gのBacillus subtilis(1)およびB.subtilis var.natto(2)1質量部より、それぞれシンバイオティクスBAC−1および2(SBAC−1および2)を調製した。
【0079】
比較例10
実施例3と同様に、比較プレバイオティクスとして比較例2で調製したガラクトマンナン(CB)500質量部およびプロバイオティクスとして、3.8×106個/gのBacillus subtilis(1)およびB.subtilis var.natto(2)1質量部より、それぞれ比較シンババイオティクスBAC−1および2(CSBAC−1および2)を調製した。
【0080】
試験例8
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例10で調製したSBAC−1および2と比較例10で調製したCSBAC−1および2で行った。
その結果を表8に示した。
【0081】
【表8】

【0082】
表8に示したように、比較例10で調製した比較シンパイオティクスと比較すると、実施例10で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0083】
実施例11
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)1000質量部およびプロバイオティクスとして、2.0×107個/gのClostridium butyricum(1)、Eubacterium hallii(2)、E.ramulus(3)、E.rectale(4)、E.ventriosum(5)およびRoseburia intestinalis(6)1質量部より、それぞれシンバイオティクスBUT−1〜6(SBUT−1〜6)を調製した。
【0084】
比較例11
実施例3と同様に、比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)1000質量部およびプロバイオティクスとして、2.0×107個/gのClostridium butyricum(1)、Eubacterium hallii(2)、E.ramulus(3)、E.rectale(4)、E.ventriosum(5)およびRoseburia intestinalis(6)1質量部より、それぞれ比較シンバイオティクスBUT−1〜6(CSBUT−1〜6)を調製した。
【0085】
試験例9
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例11で調製したSBUT−1〜6および比較例11で調製したCSBUT−1〜6で行った。
その結果を表9に示した。
【0086】
【表9】

【0087】
表9に示したように、比較例11で調製した比較シンパイオティクスと比較すると、実施例11で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0088】
実施例12
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)2000質量部およびプロバイオティクスとして、4.0×107個/gのMegasphaera elsdenii(1)およびPropionibacterium freudenreichii(2)1質量部より、それぞれシンバイオティクスAUB−1および2(SAUB−1および2)を調製した。
【0089】
比較例12
実施例3と同様に、比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)2000質量部およびプロバイオティクスとして、4.0×107個/gのMegasphaera elsdenii(1)およびPropionibacterium freudenreichii(2)1質量部より、それぞれ比較シンバイオティクスAUB−1および2(CSAUB−1および2)を調製した。
【0090】
試験例10
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例12で調製したSAUB−1および2と比較例12で調製したCSAUB−1および2で行った。
その結果を表10に示した。
【0091】
【表10】

【0092】
表10に示したように、比較例12で調製した比較シンパイオティクスと比較すると、実施例12で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0093】
試験例11
乳酸菌として、Lactobacillus属細菌であるLactobacillus acidophilusを用いた実施例3で調製したシンバイオティクスLAC−1(SLAC−1)と比較例3で調製した比較シンパイオティクス−1(CSLAC−1)を、それぞれ1日3gずつ4週間、ローマ−IIIの基準で過敏性腸症候群(IBS)と診断された男性5名、女性5名(平均年齢35±7才)に投与する試験を実施した。試験は、二重盲検、クロスオーバー試験を実施した。ウォッシュアウトは4週間とした。
摂取前と摂取4週間目に、健康関連QOLをSF−36(36−Item Short Form)、胃腸症状をGSRS(Gastrointestinal symptom Rating Scale)、不安・鬱をHADS(Hospital Anxiety and Depression Scale)により、それぞれ評価した。
その結果を表11〜13に示した。
【0094】
【表11】

【0095】
【表12】

【0096】
【表13】

【0097】
表11〜表13に示したように、本実施形態のシンパイオティクスを摂取させることにより、健康関連QOL、胃腸症状および不安・鬱の評価項目が改善され、腸内環境を整えることがわかった。
試験例12
ビフィズス菌として、Bifidobacterium属細菌であるBifidobacterium longumを用いた実施例9で調製したシンバイオティクスBIF−3(SBIF−3)と比較例9で調製した比較シンパイオティクス−3(CBIF−3)を、それぞれ1日5gずつ2週間、ローマ−IIIの基準でIBSと診断された男性4名、女性6名(平均年齢38±7才)に投与する試験を実施した。試験は、二重盲検、クロスオーバー試験を実施した。ウォッシュアウトは4週間とした。
【0098】
摂取前と摂取2週間目に、健康関連QOLをSF−36(36−Item Short Form)、胃腸症状をGSRS(Gastrointestinal symptom Rating Scale)、不安・鬱をHADS(Hospital Anxiety and Depression Scale)により、それぞれ評価した。
その結果を表14〜16に示した。
【0099】
【表14】

【0100】
【表15】

【0101】
【表16】

【0102】
表14〜表16に示したように、本実施形態のシンパイオティクスを摂取させることにより、健康関連QOL、胃腸症状および不安・鬱の評価項目が改善され、腸内環境を整えることがわかった。
実施例11
プレバイオティクスとして実施例1で調製したガラクトマンナン(A)10質量部およびプロバイオティクスとして、1.0×108個/gのLactobacillus acidophilus粉末1質量部、緑茶カテキン類(太陽化学(株)製、サンフェノン)0.01質量部よりシンパイオティクスLACC−1(SLACC−1)を調製した。
同様に、Aと緑茶カテキン類とプロバイオティクスとして、1×108個/gのL.gasseri(2)、L.johnsonii(3)、L.delbrueckii(4)、L.delbrueckii subsp.bulgaricus(5)、L.bulgaricus(6)、L.helveticus(7)、L.rhamnosus(8)、L.casei(9)、L.plantarum(10)、L.reuteri(11)、L.salivarius(12)、L.sake(13)、L.salivarius(14)、L.cellobiosus(15)およびL.brevis(16)を用いて、それぞれシンバイオティクスLAC−2〜16(SLACC−2〜16)を調製した。
【0103】
試験例13
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例4で調製したSLACC−1〜11で行った。
その結果を表17に示した。
【0104】
【表17】

【0105】
表17に示したように、試験例1の表1のSLAC−1〜11より実施例12で調製したSLACC−1〜11では、糞便培養によりさらに酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0106】
試験例14
シンパイオティクスとして実施例3で調製したSLAC−9(実施例1で調製したガラクトマンナンとL.caseiからなるシンパイオティクス)、特表2007−537224号14頁第0100段〜第0101段に記載の方法のうち(a)で調製したコンニャク加水分解物10質量部および1.0×108個/gのL.caseiより調製した比較品A、および市販のパラチニット(和光純薬(株)製、1,6−GPS:49質量%、1,1−GPM:49質量%)10質量部および1.0×108個/gのL.caseiより調製した比較品Bで試験例1と同様に男性4名(平均年齢44±8才)の新鮮糞便を用いた同様の試験を実施した。
その結果を表18に示した。
【0107】
【表18】

【0108】
表18に示したように、SLAC−9は、比較品AおよびBと比較して、糞便培養によりさらに酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0109】
試験例15
シンパイオティクスとして実施例9で調製したSBIF−5(実施例1で調製したガラクトマンナンとB.animalisからなるシンパイオティクス)、特表2007−537224号14頁第0100段〜第0101段に記載の方法のうち(b)で調製したコンニャク加水分解物300質量部および1.5×108個/gのB.animalisより調製した比較品AA、および市販のパラチニット(和光純薬(株)製、1,6−GPS:49質量%、1,1−GPM:49質量%)10質量部および1.0×108個/gのB.animalisより調製した比較品BBで試験例1と同様に男性4名(平均年齢40±6才)の新鮮糞便を用いた同様の試験を実施した。
その結果を表19に示した。
【0110】
【表19】

【0111】
表19に示したように、SBIF−5は、比較品AAおよびBBと比較して、糞便培養によりさらに酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0112】
試験例16
SLAC−9、比較品Aを、それぞれ1日3gずつ4週間、ローマ−IIIの基準で過敏性腸症候群(IBS)と診断された男性6名、女性4名(平均年齢33±2才)に投与する試験を実施した。試験は、二重盲検、クロスオーバー試験を実施した。ウォッシュアウトは4週間とした。
摂取前と摂取4週間目に、健康関連QOLをSF−36(36−Item Short Form)、胃腸症状をGSRS(Gastrointestinal symptom Rating Scale)、不安・鬱をHADS(Hospital Anxiety and Depression Scale)により、それぞれ評価した。
その結果を表20〜22に示した。
【0113】
【表20】

【0114】
【表21】

【0115】
【表22】

【0116】
表20〜表22に示したように、本実施形態のシンパイオティクスを摂取させることにより、健康関連QOL、胃腸症状および不安・鬱の評価項目が有意に改善され、腸内環境を整えることがわかった。しかしながら、比較品Aを摂取した場合は、健康関連QOL、胃腸症状および不安・鬱の評価項目は有意差はなく、改善される傾向であった。
【0117】
試験例17
SBIF−5、比較品BBを、それぞれ1日5gずつ2週間、ローマ−IIIの基準で過敏性腸症候群(IBS)と診断された男性5名、女性3名(平均年齢31±4才)に投与する試験を実施した。試験は、二重盲検、クロスオーバー試験を実施した。ウォッシュアウトは4週間とした。
摂取前と摂取2週間目に、健康関連QOLをSF−36(36−Item Short Form)、胃腸症状をGSRS(Gastrointestinal symptom Rating Scale)、不安・鬱をHADS(Hospital Anxiety and Depression Scale)により、それぞれ評価した。
その結果を表23〜25に示した。
【0118】
【表23】

【0119】
【表24】

【0120】
【表25】

【0121】
表23〜表25に示したように、本実施形態のシンパイオティクスを摂取させることにより、健康関連QOL、胃腸症状および不安・鬱の評価項目が有意に改善され、腸内環境を整えることがわかった。しかしながら、比較品BBを摂取した場合は、健康関連QOL、胃腸症状および不安・鬱の評価項目は有意差はなく、改善される傾向であった。
【0122】
実施例A
脱脂粉乳9.5kg、無塩バター3kg、上白糖10.5kg、実施例1で調製したガラクトマンナン5kg及び水72kgをホモミキサーで混合し、原料ミックスを調製した。
この原料ミックスを50℃まで加温し、80kg/cm2で均質処理した後、プレート式殺菌機で90℃、10分間加熱殺菌し、プレート式熱交換機で42℃まで冷却した。そして、発酵乳製造用のビフィドバクテリウム・ロンガムのスターター4質量%を添加した後、100ml容の容器に充填し、42℃で発酵を行い、乳酸酸度が0.75%になったところで5℃まで冷却して、静置型発酵乳を製造した(実施例A発酵乳)。
【0123】
比較例A
脱脂粉乳9.5kg、無塩バター3kg、上白糖10.5kg、比較例1で調製したガラクトマンナン5kg及び水72kgをホモミキサーで混合し、原料ミックスを調製した。
この原料ミックスを50℃まで加温し、80kg/cm2で均質処理した後、プレート式殺菌機で90℃、10分間加熱殺菌し、プレート式熱交換機で42℃まで冷却した。そして、発酵乳製造用のビフィドバクテリウム・ロンガムのスターター4質量%を添加した後、100ml容の容器に充填し、42℃で発酵を行い、乳酸酸度が0.75%になったところで5℃まで冷却して、静置型発酵乳を製造した(比較例A発酵乳)。
【0124】
比較例B
脱脂粉乳9.5kg、無塩バター3kg、上白糖10.5kg、比較例2で調製したガラクトマンナン5kg及び水72kgをホモミキサーで混合し、原料ミックスを調製した。
この原料ミックスを50℃まで加温し、80kg/cm2で均質処理した後、プレート式殺菌機で90℃、10分間加熱殺菌し、プレート式熱交換機で42℃まで冷却した。そして、発酵乳製造用のビフィドバクテリウム・ロンガムのスターター4質量%を添加した後、100ml容の容器に充填し、42℃で発酵を行い、乳酸酸度が発酵乳100g当たり、0.75%になったところで5℃まで冷却して、静置型発酵乳を製造した(比較例B発酵乳)。
【0125】
試験例A
実施例Aで調製した実施例A発酵乳および比較例Aで調製した比較例A発酵乳を4℃で14日間保存した。保存3、7および14日目に乳酸酸度を測定することで保存中の発酵乳の過発酵を調べた。尚、乳酸酸度は、0.1N水酸化ナトリウム溶液による中和滴定法で測定した。製造直後の乳酸酸度を100として、その上昇率で示した。その結果を表26に示した。
【0126】
【表26】

【0127】
表26に示したように、実施例A発酵乳は保存中に乳酸酸度が上昇せずに過発酵認められなかったが、比較例A発酵乳は保存中に乳酸酸度が上昇し、過発酵が確認された。
【0128】
試験例B
実施例Aで調製した実施例A発酵乳および比較例Bで調製した比較例B発酵乳について、5人のパネラーを用いた官能評価を実施した。尚、評価項目及び評価基準は表27に示した。
【0129】
【表27】

【0130】
表28に示したように実施例A発酵乳は、比較例B発酵乳と比較して、おいしさ、のど越し、風味および総合評価のすべての官能評価項目において優れていることが確認された。
【0131】
【表28】

【発明の効果】
【0132】
本発明によれば、プレバイオティクスとプロバイオティクスとを組み合わせたシンバイオティクスを利用した腸内環境調整方法を提供することができる。
【図面の簡単な説明】
【0133】
【図1】実施例1で得られたガラクトマンナンの歪依存性測定を行った結果を示すグラフである。グラフ中の●はG’‘を意味し、▲はG‘を意味する(図2においても同じ)。
【図2】実施例2で得られたガラクトマンナンの歪依存性測定を行った結果を示すグラフである。
【技術分野】
【0001】
本発明は、腸内の健康に有用とされるプロバイオティクスを特定のプレバイオティクスを併用することにより、プロバイオティクスの胃酸耐性が向上し、ヒトや動物の大腸に効率よく到達し定着率を向上させる、かつプロバイオティクスの保存安定性を向上させることできるシンバイオティクスおよびこれを添加した飲食品、飼料およびペットフードに関する。さらに詳しくは、分子量が分子量マーカーとしてプルランを用いた高速液体クロマトグラフィーによるゲルろ過で重量平均分子量が3〜50kDaと算出されるガラクトマンナンであるプレバイオティクスとプロバイオティクスを併用するシンバイオティクスおよびこれを添加した飲食品、飼料およびペットフードに関する。
【背景技術】
【0002】
プロバイオティクスとは、消化管内の細菌叢を改善して宿主に有益な作用をもたらし得る有用な微生物を意味している。プロバイオティクス機能を持つ微生物を摂取すると、それらが消化管内の細菌叢に作用し、細菌叢の健常化をはかりながら、疾病の予防・改善を行うことができると言われている。プロバイオティクスを応用した技術開発として、いくつかものが知られている(特許文献1)。
【0003】
また、プレバイオティクスとは、上記プロバイオティクスに含まれる有用な細菌や常在の有用腸内細菌の増殖を助けて、腸内環境の改善を促進する物質のことを意味し、簡単に消化されない物質が多い。例えば、オリゴ糖、食物繊維などは、プレバイオティクスとして働く。オリゴ糖は、乳酸菌、ビフィズス菌などの栄養となり、食物繊維は、腸内細菌をとどめさせて、その増殖を助ける。プレバイオティクスを応用した技術開発として、いくつかのものが知られている(特許文献2)。
上記プロバイオティクスとプレバイオティクスとを組み合わせたものをシンバイオティクスと称しているが、このシンバイオティクスに関する技術開発については、十分に進んでいなかった。
【0004】
【特許文献1】特開2008−109945号公報
【特許文献2】特表2007−537224号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、上記課題に鑑みてなされたものであり、その目的はシンバイオティクスを利用した腸内環境調整方法を提供することである。
【課題を解決するための手段】
【0006】
上記課題を解決するための発明に係る腸内環境調整方法は、(A)プレバイオティクスとして、加水分解されたグァーの胚乳部分であって、次の性質を含むもの、(1)プルランを分子量マーカーとして用いた高速液体クロマトグラフィーによるゲルろ過で重量平均分子量が3〜50kDaと算出されるガラクトマンナン、(2)ケルダール法により窒素含量を測定し、係数6.25を乗じて算出されたタンパク質含量が1.0%以下であるものと、(B)プロバイオティクスとして、ビィフィズス菌、乳酸菌、枯草菌、酪酸生成菌、乳酸利用菌、プロピオン酸生成菌の一種または二種以上からなり、さらに水分含量が20%以下であるもの、の両者を含有するシンバイオティクスを経口投与することにより、腸管内で乳酸及び糖類から酪酸を生じさせて腸内環境を整えることを特徴とする。
本発明において、前記加水分解されたグァーの胚乳部分が、次の性質を含むもの、(3)固形分含量15%水溶液の粘度が、回転式粘度計で回転数60rpm、20℃で測定したときに20mPa・s以下であるもの、であることが好ましい。
また、前記加水分解されたグァーの胚乳部分が、次の性質を含むもの、(4)分解物の固形物含量が1.0%水溶液99gに1.0gのポリオキシエチレン付加型界面活性剤(POE)を添加して測定した曇点が60℃以下であるもの、(5)(A)分解物1質量部に対して、1/5質量部のイソプロピルアルコールを加えてよく湿らせた後、激しくかき混ぜながら水10質量部加えた溶液(溶液(5−1))の粘度がB型粘度計で25℃、No.1ローター、12rpmで測定したときに20mPa・s以下、(B)溶液(5−1)を沸騰水中で10分間加熱し冷却後に同条件で測定した粘度が20mPa・s以下(溶液5−2)、(C)溶液(5−2)1質量部に5%ホウ酸ナトリウム水溶液1/5質量部を添加し、混和、放置したものを動的粘弾性測定装置で、25℃、1Hzでひずみ依存性測定をすると、線形領域で貯蔵弾性率(G‘)>損失弾性率(G’‘)かつ線形領域から非線形領域を示す測定曲線を得るものであることが好ましい。
また、さらにツバキ科植物成分を経口投与することが好ましい。
本発明におけるプロバイオティクスとは、宿主の腸管内で有益な作用を発揮する微生物であり、好ましくは乳酸菌、ビフィズス菌、糖化菌、枯草菌、酪酸生成菌、乳酸利用菌、プロピオン酸生成菌、酵母である。
【0007】
本発明における乳酸菌とは、乳酸桿菌および乳酸球菌であり、好ましくは、Lactobacillus属細菌、Streptococcus属細菌、Enterococcus属細菌、Lactococcus属細菌、Pediococcus属細菌およびLeuconostoc属細菌である。
【0008】
本発明におけるLactobacillus属細菌は、Lactobacillus acidophilus、 L.gasseri、 L.johnsonii、L.delbrueckii、L.delbrueckii subsp.bulgaricus、L.bulgaricus、L.helveticus、L.rhamnosus、L.casei、L.plantarum、L.reuteri、L.salivarius、L.sake、L.salivarius、L.cellobiosusおよびL.brevisが例示できる。
【0009】
本発明におけるStreptococcus属細菌は、Streptococcus thermophilus、S.sanguis、S.mitis、S. pseudopneumoniae、S.pasteuri、S.parasanguinis、S.parasanguinis、S.salivarius、S.vestibularis、S.pasteuri、およびS.oralisが例示できる。
本発明におけるEnterococcus属細菌は、E.malodoratus、E.malodoratus、E.facialisおよびE.faceiumが例示できる。
【0010】
本発明におけるLactococcus属細菌は、Lactococcus lactisおよびLactococcus lactis subsp.cremorisが例示できる。
本発明におけるPediococcus属細菌は、Pediococcus damnosusおよびP.acidilacticiが例示できる。
本発明におけるLeuconostoc属細菌は、L.mesenteroidesおよびL.sakeが例示できる。
【0011】
本発明におけるビィフィズス菌とは、Bifidobacterium属細菌のことを指す。好ましくは、Bifidobacterium bifidum、B.adolescentis、B.longum、B.infantis、B.breve、B.animalis、B.pseudolongum、B.thermophilum、B.boum、B.magunum、B.pullorum、B.catenulatum、B.suis、B.pseudocatenulatum、B.gallinarum、B.dentium、B.ruminantium、B.angulatum、B.merycicum、B.gallicum、B.saeculare、B.inopinatum、B.minimum、B.denticolens、B.subtile、B.coryneforme、B.cuniculi、B.asteroides、B.choerinumおよびB.indicumである。
【0012】
本発明における糖化菌とは、Bacillus mesentericusである。
本発明における枯草菌とは、Bacillus subtilis、好ましくは、Bacillus subtilis var. nattoである。
本発明における酪酸生成菌とは、Clostridium butyricumおよびT−RELP法による細菌解析でClostridium subcluster XIVaに分類される細菌である。
【0013】
本発明におけるT−RELP法による細菌解析でClostridium subcluster XIVaに分類される細菌は、Eubacterium hallii、E.ramulus、E.rectale、E.ventriosumおよびRoseburia intestinalisが例示できる。
【0014】
本発明における乳酸利用菌とは、Megasphaera elsdeniiである。
本発明におけるプロピオン酸生成菌とは、Propionibacterium属細菌のことであり、好ましくは、Propionibacterium freudenreichiiである。
【0015】
本発明におけるガラクトマンナンとは、D−マンノースがβ−(1→4)結合したマンナン鎖を主鎖とし、D−マンノースのO−6位からα−ガラクトシル基が結合した櫛状の分岐構造を有し、分子量マーカーとしてプルランを用いた高速液体クロマトグラフィーによるゲルろ過で測定した重量平均分子量が3〜50kDaと算出される物質を指す。
本発明のガラクトマンナンのマンノース直鎖の鎖長は、30単位〜200単位の範囲内に80%以上分布している。
本発明のガラクトマンナンの5%水溶液の粘度は、ブルックフィールド粘度計を用いて5℃,60rpmで、Lowローターにて測定したときに5〜20mPa・sである。
【0016】
本発明のガラクトマンナンの食物繊維含量は、AOAC 985.29に記載の酵素重量法により測定したときに65%以上である。
本発明のガラクトマンナンは、ガラクトマンナンを含有するマメ科植物種子の胚乳部分をヘミセルラーゼ製剤により酸性域で酵素的に加水分解することで得られた溶液の加水分解反応を停止させ、この溶液を遠心分離処理を行って未反応物を除去し、次いで精製処理、加熱殺菌処理及び冷却処理を行った後、中和処理を行うことによって得ることができる。
【0017】
本発明のガラクトマンナンを含有するマメ科植物とは、グアー(Cyamopsis tetragonolobus)、イナゴマメ(Ceratonia siliqua)、ケンタッキー・コーヒーマメ(Gymnocladus dioica)、ムラサキウマゴヤシ(Medicago sativa)、クローバ(Trifolium pratense)、ダイズサヤ(Glycine hispida)、タラ(Actinidia callosa LINDLEY)、セスバニア(Sesbania bisibinonia)、カシア(Cassia tora Linn)およびフェヌグリーク(Trigonella foenum graecum L)が例示でき、資源の豊富さと味の観点からグアー(Cyamopsis tetragonolobus)、フェヌグリーク(Trigonella foenum graecum L)及びイナゴマメ(Ceratonia siliqua)が好ましく、最も好ましくはグアー(Cyamopsis tetragonolobus)である。
【0018】
本発明のガラクトマンナンを得るときに実施される加水分解反応で用いるヘミセルラーゼ製剤は、ガラクトマンナナーゼ、α−ガラクトシダーゼ及びβ−マンノシダーゼを含有し、それら酵素の比活性の割合が1〜100:1:0〜0.5、もしくはガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼを含有し、それら酵素の比活性の割合が1〜100:1:0〜0.15:0〜0.5、もしくはガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼを含有し、それら酵素の比活性の割合が1〜10:1:0〜0.05:0〜0.5である。ここで、本発明で酵素として用いるβ−ガラクトマンナナーゼの比活性とは、β−ガラクトマンナナーゼがガラクトマンナンであるローカストビーンガムに37℃、pH5.0で作用するとき、反応初期の1分間に1マイクロモルのマンノースに相当する還元力の増加をもたらす試料1g中の酵素量のことを指す。β−ガラクトマンナナーゼの分子量は、SDS−ポリアクリルアミドゲル電気泳動後にクーマシーブルー染色(CBB染色)した結果、20kDa〜60kDaを示すことがよい。当該分子量のより好ましい範囲は30kDa〜50kDaであり、最も好ましい範囲は35kDa〜45kDaである。
【0019】
本発明で酵素として用いるα−ガラクトシダーゼの比活性とは、当該α−ガラクトシダーゼがp−ニトロフェニル−α−ガラクシドに37℃、pH5.5で作用するとき、反応初期の1分間に1マイクロモルのp−ニトロフェニルを遊離する試料1g中の酵素量のことを指す。
本発明で酵素として使用する酸性プロテアーゼの比活性とは、当該酸性プロテアーゼが乳製カゼインに30℃、pH3.0で作用するとき、反応初期の1分間に1マイクログラムのチロシンに相当する非蛋白性のフォリン試液呈色物質の増加をもたらす試料1g中の酵素量のことを指す。
本発明で酵素として使用するβ−マンノシダーゼの比活性とは、当該β−マンノシダーゼがp−ニトロフェニル−β−マンノシドに37℃、pH5.5で作用するとき、反応初期の1分間に1マイクロモルのp−ニトロフェニルを遊離する試料1g中の酵素量のことを指す。
【0020】
本発明のガラクトマンナンを得るときに実施される加水分解反応で用いるヘミセルラーゼ製剤は、Penicillium属細菌、Streptomyces属細菌、Enterococcus属細菌、Vibrio属細菌、Aeromonas属細菌、Bacillus属細菌、Clostridium属細菌、Aspergillus属カビ、Rhizopus属カビ及びTricohderma属酵母の微生物群から選択される少なくとも1種に由来し、例えば、Penicillium属細菌はP.purpurogenam、Enterococcus属細菌はE.caseliflavas、Clostridium属細菌はC.tertium、Aspergillus属カビはA.niger、Rhizopus属カビはR.niveus、Tricohderma属酵母はT.reeseiが、それぞれ例示できる。
【0021】
本発明のガラクトマンナンを得るときに実施される加水分解反応における酸性域は、pH2.0〜pH6.0である。
本発明のガラクトマンナンを得るときに実施される加水分解反応における温度および反応時間は、50℃〜80℃で8時間〜24時間、または60℃〜80℃で3時間〜12時間である。
本発明のガラクトマンナンを得るときに実施される加水分解反応の停止は、特に限定されないが、85℃以上で15分間〜60分間加熱が好ましい。
【0022】
本発明のツバキ科植物成分とは、水、アルコール、酢酸エチル、石油エーテル等の有機溶媒による溶剤抽出、水蒸気蒸留、圧搾、油脂吸着、液化ガス抽出、超臨界抽出、乾留により得られる成分を指す。好ましくは抽出効率の観点から溶剤抽出、最も好ましくは水及び酢酸エチルによる溶剤抽出である。このようにして得られた抽出物は、必要に応じて吸着樹脂、濾過膜等により精製しても問題はない。例えば、茶の場合では酢酸エチルにより抽出して得られたポリフェノール化合物を用いることも可能である。緑茶の場合、生葉又は乾燥葉から(+)−カテキン、(+)−ガロカテキン、(−)−ガロカテキンガレート、(−)−エピカテキン、(−)−エピカテキンガレート、(−)−エピガロカテキン、(−)−エピガロカテキンガレートのポリフェノール化合物が抽出され、これらポリフェノール化合物の1種または2種以上の混合物として用いることができが、好ましくは(−)−ガロカテキンガレート、(−)−エピカテキンガレート、(−)−エピガロカテキンガレートの1種または2種以上の混合物として用いることができる。単独で用いる場合、(+)−カテキン、(+)−ガロカテキン、(−)−ガロカテキンガレート、(−)−エピカテキン、(−)−エピカテキンガレート、(−)−エピガロカテキン又は(−)−エピガロカテキンガレートが好ましく、さらに好ましくは、(−)−エピガロカテキンガレート、(−)−エピカテキンガレート又は(−)−ガロカテキンガレートであり、最も好ましくは、(−)−エピガロカテキンガレートである。
【0023】
実施例1
A.nigerを所定期間培養し、加水分解反応に用いる酵素群をあらかじめ採取しておいた。このようにして採取したA. niger由来の酵素群は、β−ガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼの混合物であった。
次に、水900部に塩酸を加えてpHを4.5に調整した後、その水に上記の酵素群0.2部とグアー豆(Cyamopsis tetragonolobus)の胚乳100部とを添加混合し、55℃〜65℃で24時間酵素を作用させ、酵素的に加水分解した。
次に、反応液を90℃,30分間加熱することにより酵素を失活させ、加水分解反応を停止させた。
【0024】
次に、加水分解物を含む反応液を遠心分離装置(石川島播磨重工業社製、商品名HS−50L)で3000rpm,供給量6m3/hで遠心分離処理し、反応液を未反応物と清澄液とに分離させるとともに、清澄液のみを採取した。
次に、採取した溶液(清澄液)に珪藻土系濾過助剤及び活性炭を添加して60分間攪拌した後、第1濾過手段である濾過装置(昭和製作所社製、商品名202B、濾過圧:250kg/cm2)を用いて濾過する粗精製を行った。その結果、前記溶液中に含まれる不純物をある程度吸着除去した。さらに、粗精製された前記溶液に珪藻土系濾過助剤のみを添加して60分間攪拌した後、第1濾過手段よりも目の細かい第2濾過手段である精密濾過装置(中央製作所社製、商品名FS−50B、流量:300L/h)を用いて濾過する本精製を行った。その結果、前記溶液中に含まれる不純物をほぼ完全に吸着除去し、本発明のガラクトマンナンを含有する無色透明で臭いのない溶液を得た。
【0025】
次に、UHT殺菌装置(日阪製作所社製、商品名FX−05)を用いて、前記溶液をUHT殺菌処理しかつ直ちに強制冷却した。なお、この処理では、入り口温度を140℃に設定し、出口温度を4℃に設定し、殺菌時間を4秒に設定した。
次に、pHが酸性域に保持されていた溶液をNaOHで中和してpH=約7.0にした。
さらに、得られた中性の溶液を遠心式薄膜濃縮装置(アルファ・ラバル社製、商品名CT−6)を用いて固形分として20%になるように所定時間減圧濃縮した。
【0026】
その後、噴霧乾燥装置(大川原化工機社製、商品名OC−35)を用いて90分間噴霧乾燥を行い、本発明のガラクトマンナンの白色粉末70部を得た。
そして、得られた粉末状のガラクトマンナンをサンプルとして下記の測定を行った。具体的には、カラムにG3000PW(東ソー株式会社製)を充填したものを固定相として用い、高速液体クロマトグラフィーを行った。このような測定の結果、マンナン主鎖の糖鎖の80%以上はマンノースの重合度が30〜40単位の範囲内に包含されていた。なお、このとき糖鎖単位の標準試薬として、グルコース重合度が既知の直鎖デキストリン(グルコースの重合度:50,100,150)を用いた。
本実施例のガラクトマンナンの重量平均分子量、食物繊維含量、5%溶液の粘度を測定したところ、重量平均分子量が20kDa、食物繊維含量が82%、粘度が8mPa・sであった。
本実施例のガラクトマンナン0.4gにイソプロピルアルコール0.08mlを加えてよく湿らした後、厳しくかき混ぜながら水4mlを加え、更に均一に分散するまで激しくかき混ぜ、粘度を測定した(均一分散後)。また、この液を沸騰した水浴上で約10分間加熱した後に粘度を測定した(10分加熱冷却後)。粘度計はB型粘度計を用い、ローター番号は No.1、測定温度は25℃および粘度計の回転数は12rpmとした。均一分散後の粘度は7.4mPa・sであり、10分加熱冷却後粘度は7.4mPa・sであった。
【0027】
10分加熱冷却後の溶液3.5mlに5%ホウ酸ナトリウム溶液0.7mlを加え、混和して放置し、動的粘弾性の歪依存性測定に供した。尚、試験装置は、動的粘弾性物性計測装置ARES(T.Aインスツルメンツ株式会社製)を用いた。測定温度は25℃、および測定周波数は1.0Hzとした。その結果、図1に示したように、線形領域で貯蔵弾性率(G‘)>損失弾性率(G’‘)かつ線形領域から非線形領域を示す測定曲線が得られた。
【0028】
実施例2
A.nigerを所定期間培養し、加水分解反応に用いる酵素群をあらかじめ採取しておいた。このようにして採取したA.niger由来の酵素群は、β−ガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼの混合物であった。
次に、水900部に塩酸を加えてpHを4.5に調整した後、その水に上記の酵素群0.1部とグアー豆(C.tetragonolobus)の胚乳100部とを添加混合し、70℃〜75℃で8時間酵素を作用させた。この後、実施例1と同様の方法を実施し、本発明のガラクトマンナンの白色粉末70部を得た。
【0029】
得られた粉末状のガラクトマンナンについて、実施例1と同様の測定及び評価を行った。その結果、マンナン主鎖の糖鎖の80%以上は、マンノースの重合度が30〜40単位の範囲内に包含されていた。また、本実施例のガラクトマンナンの重量平均分子量は16kDa、食物繊維含量は76%、5%水溶液の粘度は5mPa・s、であった。
【0030】
本実施例のガラクトマンナン0.4gにイソプロピルアルコール0.08mlを加えてよく湿らした後、厳しくかき混ぜながら水4mlを加え、更に均一に分散するまで激しくかき混ぜ、粘度を測定した(均一分散後)。また、この液を沸騰した水浴上で約10分間加熱した後に粘度を測定した(10分加熱冷却後)。粘度計はB型粘度計を用い、ローター番号は No.1、測定温度は25℃および粘度計の回転数は12rpmとした。均一分散後の粘度は4.9mPa・sであり、10分加熱冷却後粘度は5.1mPa・sであった。
【0031】
10分加熱冷却後の溶液3.5mlに5%ホウ酸ナトリウム溶液0.7mlを加え、混和して放置し、動的粘弾性の歪依存性測定に供した。尚、試験装置は、動的粘弾性物性計測装置ARES(T.Aインスツルメンツ株式会社製)を用いた。測定温度は25℃、および測定周波数は1.0Hzとした。その結果、図2に示したように、線形領域で貯蔵弾性率(G‘)>損失弾性率(G’‘)かつ線形領域から非線形領域を示す測定曲線が得られた。
【0032】
比較例1
A.nigerを所定期間培養し、加水分解反応に用いる酵素群をあらかじめ採取しておいた。このようにして採取したA.niger由来の酵素群は、β−ガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼの混合物であった。
次に、水900部に塩酸を加えてpHを4.5に調整した後、その水に上記の酵素群0.2部とグアー豆(C.tetragonolobus)の胚乳100部とを添加混合し、55℃〜65℃で72時間酵素を作用させ、酵素的に加水分解した。
【0033】
次に、反応液を90℃,30分間加熱することにより酵素を失活させ、加水分解反応を停止させた。
次に、加水分解物を含む反応液を遠心分離装置(石川島播磨重工業社製、商品名HS−50L)で3000rpm,供給量6m3/hで遠心分離処理し、反応液を未反応物と清澄液とに分離させるとともに、清澄液のみを採取した。
次に、採取した溶液(清澄液)に珪藻土系濾過助剤及び活性炭を添加して60分間攪拌した後、第1濾過手段である濾過装置(昭和製作所社製、商品名202B、濾過圧:250kg/cm2)を用いて濾過する粗精製を行った。その結果、前記溶液中に含まれる不純物をある程度吸着除去した。さらに、粗精製された前記溶液に珪藻土系濾過助剤のみを添加して60分間攪拌した後、第1濾過手段よりも目の細かい第2濾過手段である精密濾過装置(中央製作所社製、商品名FS−50B、流量:300L/h)を用いて濾過した。その結果、前記溶液中に含まれる不純物をほぼ完全に吸着除去した。
【0034】
次に、UHT殺菌装置(日阪製作所社製、商品名FX−05)を用いて、前記溶液をUHT殺菌処理しかつ直ちに強制冷却した。なお、この処理では、入り口温度を140℃に設定し、出口温度を4℃に設定し、殺菌時間を4秒に設定した。
次に、pHが酸性域に保持されていた溶液をNaOHで中和してpH=約7.0にした。
さらに、得られた中性の溶液を遠心式薄膜濃縮装置(アルファ・ラバル社製、商品名CT−6)を用いて固形分として20%になるように所定時間減圧濃縮した。濃縮液を陰イオンカラムクロマトグラフィーおよび陽イオンカラムクロマトグラフィー処理し、除タンパク処理した。
その後、噴霧乾燥装置(大川原化工機社製、商品名OC−35)を用いて90分間噴霧乾燥を行い、比較品の白色粉末65部を得た。
【0035】
そして、得られた粉末状のガラクトマンナンをサンプルとして下記の測定を行った。具体的には、カラムにG3000PW(東ソー株式会社製)を充填したものを固定相として用い、高速液体クロマトグラフィーを行った。このような測定の結果、マンナン主鎖の糖鎖の80%以上はマンノースの重合度が30〜40単位の範囲内に包含されていなかった。なお、このとき糖鎖単位の標準試薬として、グルコース重合度が既知の直鎖デキストリン(グルコースの重合度:50,100,150)を用いた。
【0036】
本比較例のガラクトマンナンの重量平均分子量、食物繊維含量、5%溶液の粘度を測定したところ、重量平均分子量が1.5kDa、食物繊維含量が54%、粘度が3mPa・sであった。
【0037】
本比較例のガラクトマンナン0.4gにイソプロピルアルコール0.08mlを加えてよく湿らした後、厳しくかき混ぜながら水4mlを加え、更に均一に分散するまで激しくかき混ぜ、粘度を測定した(均一分散後)。また、この液を沸騰した水浴上で約10分間加熱した後に粘度を測定した(10分加熱冷却後)。粘度計はB型粘度計を用い、ローター番号は No.1、測定温度は25℃および粘度計の回転数は12rpmとした。均一分散後の粘度は2.5mPa・sであり、10分加熱冷却後粘度は2.3mPa・sであった。
10分加熱冷却後の溶液3.5mlに5%ホウ酸ナトリウム溶液0.7mlを加え、混和して放置し、動的粘弾性の歪依存性測定を供しようとしたところ、この溶液はゲル状態を呈しないために、測定することは不可能であった。このことより本発明のガラクトマンナンとは異なる性質のものであった。
【0038】
比較例2
A.nigerを所定期間培養し、加水分解反応に用いる酵素群をあらかじめ採取しておいた。このようにして採取したA.niger由来の酵素群は、β−ガラクトマンナナーゼ、α−ガラクトシダーゼ、酸性プロテアーゼ及びβ−マンノシダーゼの混合物であった。
次に、水900部に塩酸を加えてpHを4.5に調整した後、その水に上記の酵素群0.2部とグアー豆(C.tetragonolobus)の胚乳100部とを添加混合し、55℃〜65℃で3時間酵素を作用させ、酵素的に加水分解した。
【0039】
次に、反応液を90℃,30分間加熱することにより酵素を失活させ、加水分解反応を停止させた。
次に、加水分解物を含む反応液を遠心分離装置(石川島播磨重工業社製、商品名HS−50L)で3000rpm,供給量6m3/hで遠心分離処理し、反応液を未反応物と清澄液とに分離させるとともに、清澄液のみを採取した。
【0040】
次に、採取した溶液(清澄液)に珪藻土系濾過助剤及び活性炭を添加して60分間攪拌した後、第1濾過手段である濾過装置(昭和製作所社製、商品名202B、濾過圧:250kg/cm2)を用いて濾過する粗精製を行った。その結果、前記溶液中に含まれる不純物をある程度吸着除去した。さらに、粗精製された前記溶液に珪藻土系濾過助剤のみを添加して60分間攪拌した後、第1濾過手段よりも目の細かい第2濾過手段である精密濾過装置(中央製作所社製、商品名FS−50B、流量:300L/h)を用いて濾過した。その結果、前記溶液中に含まれる不純物をほぼ完全に吸着除去した。
【0041】
次に、UHT殺菌装置(日阪製作所社製、商品名FX−05)を用いて、前記溶液をUHT殺菌処理しかつ直ちに強制冷却した。なお、この処理では、入り口温度を140℃に設定し、出口温度を4℃に設定し、殺菌時間を4秒に設定した。
次に、pHが酸性域に保持されていた溶液をNaOHで中和してpH=約7.0にした。
さらに、得られた中性の溶液を遠心式薄膜濃縮装置(アルファ・ラバル社製、商品名CT−6)を用いて固形分として20%になるように所定時間減圧濃縮した。濃縮液を陰イオンカラムクロマトグラフィーおよび陽イオンカラムクロマトグラフィー処理し、除タンパク処理した。
【0042】
その後、噴霧乾燥装置(大川原化工機社製、商品名OC−35)を用いて90分間噴霧乾燥を行い、比較品の白色粉末32部を得た。
そして、得られた粉末状のガラクトマンナンをサンプルとして下記の測定を行った。具体的には、カラムにG3000PW(東ソー株式会社製)を充填したものを固定相として用い、高速液体クロマトグラフィーを行った。このような測定の結果、マンナン主鎖の糖鎖の80%以上はマンノースの重合度が30〜40単位の範囲内に包含されていなかった。なお、このとき糖鎖単位の標準試薬として、グルコース重合度が既知の直鎖デキストリン(グルコースの重合度:50,100,150)を用いた。
本比較例のガラクトマンナンの重量平均分子量、食物繊維含量及び5%溶液の粘度を測定したところ、重量平均分子量が83kDa、食物繊維含量が82%、粘度が150mPa・sであった。
本比較例のガラクトマンナン0.4gにイソプロピルアルコール0.08mlを加えてよく湿らした後、厳しくかき混ぜながら水4mlを加え、更に均一に分散するまで激しくかき混ぜ、粘度を測定しようとしたが、この溶液は高粘度を呈し、この条件では粘度測定が不可能であった。よって、以後の測定も実施不可能であった。このことより本発明のガラクトマンナンとは異なる性質のものであった。
【0043】
実施例3
プレバイオティクスとして実施例1で調製したガラクトマンナン(A)10質量部およびプロバイオティクスとして、1.0×108個/gのLactobacillus acidophilus粉末1質量部を混合し、シンバイオティクスLAC−1(SLAC−1)を調製した。
同様に、Aとプロバイオティクスとして、1×108個/gのL.gasseri(2)、L.johnsonii(3)、L.delbrueckii(4)、L.delbrueckii subsp.bulgaricus(5)、L.bulgaricus(6)、L.helveticus(7)、L.rhamnosus(8)、L.casei(9)、L.plantarum(10)、L.reuteri(11)、L.salivarius(12)、L.sake(13)、L.salivarius(14)、L.cellobiosus(15)およびL.brevis(16)を用いて、それぞれシンバイオティクスLAC−2〜16(SLAC−2〜16)を調製した。
【0044】
比較例3
比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)10質量部およびプロバイオティクスとして、1.0×108個/gのLactobacillus acidophilus粉末1質量部を混合し、比較シンバイオティクス−1(CSLAC−1)を調製した。
同様に、Aとプロバイオティクスとして、1×108個/gのL. gasseri(2)、L.johnsonii(3)、L.delbrueckii(4)、L.delbrueckii subsp.bulgaricus(5)、L.bulgaricus(6)、L.helveticus(7)、L.rhamnosus(8)、L.casei(9)、L.plantarum(10)、L.reuteri(11)、L.salivarius(12)、L.sake(13)、L.salivarius(14)、L.cellobiosus(15)およびL.brevis(16)を用いて、それぞれ比較シンバイオティクスLAC−2〜16(CSLAC−2〜16)を調製した。
【0045】
試験例1
男性4名(平均年齢43±5才)より新鮮糞便150gずつを集めた。これらの糞便を一つの3000mLの三角フラスコに注入した。4倍重量のリン酸緩衝液(pH7.0)を添加し、嫌気的に均一に懸濁した。試験管に9.5mLずつ嫌気的に分注した後に、実施例3で調製したSLAC−1〜16、および比較例3で調製したCSLAC−1〜16を、それぞれの試験管に0.5gずつ添加した。各試験管を37℃で24時間嫌気的に培養した。培養後に培養液をろ過し、得られたろ液中の酢酸、プロピオン酸及び酪酸を定量した。定量には、イオン排除高速液体クロマトグラフィー(Waters 製、以下HPLC)を用いた。前処理およびHPLCの条件は、Anim.Sci.Technol.69:571−575(1998)に準拠した。
その結果を表1に示した。
【0046】
【表1】

【0047】
表1に示したように、比較例3で調製した比較シンパイオティクスと比較すると、実施例3で調製したシンバイオティクスは、糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0048】
実施例4
実施例3と同様に、プレバイオティクスとして実施例2で調製したガラクトマンナン(B)100質量部およびプロバイオティクスとして、1.2×108個/gのStreptococcus thermophilus(1)、S.sanguis(2)、S.mitis(3)、S.pseudopneumoniae(4)、S.pasteuri(5)、S.parasanguinis(6)、S.parasanguinis(7)、S.salivarius(8)、S.vestibularis(9)、S.pasteuri(10)、S.oralis(11)1質量部より、それぞれシンバイオティクスS−1〜11(SS−1〜11)を調製した。
【0049】
比較例4
実施例3と同様に、比較プレバイオティクスとして比較例2で調製したガラクトマンナン(CB)100質量部およびプロバイオティクスとして、1.2×108個/gのStreptococcus thermophilus(1)、S.sanguis(2)、S.mitis(3)、S.pseudopneumoniae(4)、S.pasteuri(5)、S.parasanguinis(6)、S.parasanguinis(7)、S.salivarius(8)、S.vestibularis(9)、S.pasteuri(10)、S.oralis(11)1質量部より、それぞれ比較シンバイオティクスS−1〜11(CSS−1〜11)を調製した。
【0050】
試験例2
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例4で調製したSS−1〜11および比較例4で調製したCSS−1〜11で行った。
その結果を表2に示した。
【0051】
【表2】

【0052】
表2に示したように、比較例4で調製した比較シンパイオティクスと比較すると、実施例4で調製したシンバイオティクスは、糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0053】
実施例5
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)200質量部およびプロバイオティクスとして、1.5×107個/gのEnterococcus malodoratus(1)、E. malodoratus(2)、E.facialis(3)およびE.faceium(4)1質量部より、それぞれシンバイオティクスE−1〜11(SE−1〜4)を調製した。
【0054】
比較例5
実施例3と同様に、比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)200質量部およびプロバイオティクスとして、1.5×107個/gのEnterococcus malodoratus(1)、E.malodoratus(2)、E.facialis(3)およびE.faceium(4)1質量部より、それぞれ比較シンバイオティクスE−1〜11(CSE−1〜4)を調製した。
【0055】
試験例3
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を、実施例5で調製したSE−1〜4および比較例5で調製したCSE−1〜4で行った。
その結果を表3に示した。
【0056】
【表3】

【0057】
表3に示したように、比較例5で調製した比較シンパイオティクスと比較して、実施例5で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0058】
実施例6
実施例3と同様に、プレバイオティクスとして実施例2で調製したガラクトマンナン(B)1質量部およびプロバイオティクスとして、1.1×108個/gのLactococcus lactis(1)およびL.lactis subsp.cremoris(2)1質量部より、それぞれシンバイオティクスLC−1および2(SLC−1および2)を調製した。
【0059】
比較例6
実施例3と同様に、比較プレバイオティクスとして比較例2で調製したガラクトマンナン(CB)1質量部およびプロバイオティクスとして、1.1×108個/gのLactococcus lactis(1)およびL.lactis subsp.cremoris(2)1質量部より、それぞれ比較シンバイオティクスLC−1および2(CSLC−1および2)を調製した。
【0060】
試験例4
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例6で調製したSLC−1および2と比較例6で調製したCSLC−1および2で行った。
その結果を表4に示した。
【0061】
【表4】

【0062】
表4に示したように、比較例6で調製した比較シンパイオティクスと比較すると、実施例6で調製したシンバイオティクスは、糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0063】
実施例7
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)500質量部およびプロバイオティクスとして、1.4×108個/gのPediococcus damnosus(1)およびP.acidilactici(2)1質量部より、それぞれシンバイオティクスP−1および2(SP−1および2)を調製した。
【0064】
比較例7
実施例3と同様に比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)500質量部およびプロバイオティクスとして、1.4×108個/gのPediococcus damnosus(1)およびP.acidilactici(2)1質量部より、それぞれ比較シンバイオティクスP−1および2(CSP−1および2)を調製した。
【0065】
試験例5
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例7で調製したSP−1および2と比較例7で調製したCSP−1および2で行った。
その結果を表5に示した。
【0066】
【表5】

【0067】
表5に示したように、比較例6で調製した比較シンパイオティクスと比較して、実施例7で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0068】
実施例8
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)200質量部およびプロバイオティクスとして、1.8×107個/gのLeuconostoc mesenteroides(1)およびL.sake(2)1質量部より、それぞれシンバイオティクスLCN−1および2(SLCN−1および2)を調製した。
【0069】
比較例8
実施例3と同様に比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)200質量部およびプロバイオティクスとして、1.8×107個/gのLeuconostoc mesenteroides(1)およびL.sake(2)1質量部より、それぞれ比較シンバイオティクスLCN−1および2(CSLCN−1および2)を調製した。
【0070】
試験例6
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例8で調製したSLCN−1および2と比較例8で調製したCSLCN−1および2で行った。
その結果を表6に示した。
【0071】
【表6】

【0072】
表6に示したように、比較例8で調製した比較シンパイオティクスと比較すると、実施例8で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0073】
実施例9
実施例3と同様にプレバイオティクスとして実施例1で調製したガラクトマンナン(A)300質量部およびプロバイオティクスとして、1.5×108個/gのBifidobacterium bifidum(1)、B.adolescentis(2)、B.longum(3)、B.infantis(4)、B.breve(4)、B.animalis(5)、B.pseudolongum(6)、B.thermophilum(7)、B.boum(8)、B.magunum(9)、B.pullorum(10)、B.catenulatum(11)、B.suis(12)、B.pseudocatenulatum(13)、B.gallinarum(14)、B.dentium(15)、B.ruminantium(16)、B.angulatum(17)、B.merycicum(18)、B.gallicum(19)、B.saeculare(20)、B.inopinatum(21)、B.minimum(22)、B.denticolens(23)、B.subtile(24)、B.coryneforme(25)、B.cuniculi(26)、B.asteroides(27)、B.choerinum(28)、B.indicum(29)1質量部より、それぞれシンバイオティクスBIF−1〜29(SBIF−1〜29)を調製した。
【0074】
比較例9
実施例3と同様に、比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)300質量部およびプロバイオティクスとして、1.5×108個/gのBifidobacterium bifidum(1)、B.adolescentis(2)、B.longum(3)、B.infantis(4)、B.breve(4)、B.animalis(5)、B.pseudolongum(6)、B.thermophilum(7)、B.boum(8)、B.magunum(9)、B.pullorum(10)、B.catenulatum(11)、B.suis(12)、B.pseudocatenulatum(13)、B.gallinarum(14)、B.dentium(15)、B.ruminantium(16)、B.angulatum(17)、B.merycicum(18)、B.gallicum(19)、B.saeculare(20)、B.inopinatum(21)、B.minimum(22)、B.denticolens(23)、B.subtile(24)、B.coryneforme(25)、B.cuniculi(26)、B.asteroides(27)、B.choerinum(28)、B.indicum(29)1質量部より、それぞれシンバイオティクスBIF−1〜29(CSBIF−1〜29)を調製した。
【0075】
試験例7
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例9で調製したSBIF−1〜29および比較例9で調製したCSBIF−1〜29で行った。
その結果を表7に示した。
【0076】
【表7】

【0077】
表7に示したように、比較例9で調製した比較シンパイオティクスと比較すると、実施例9で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0078】
実施例10
実施例3と同様に、プレバイオティクスとして実施例2で調製したガラクトマンナン(B)500質量部およびプロバイオティクスとして、3.8×106個/gのBacillus subtilis(1)およびB.subtilis var.natto(2)1質量部より、それぞれシンバイオティクスBAC−1および2(SBAC−1および2)を調製した。
【0079】
比較例10
実施例3と同様に、比較プレバイオティクスとして比較例2で調製したガラクトマンナン(CB)500質量部およびプロバイオティクスとして、3.8×106個/gのBacillus subtilis(1)およびB.subtilis var.natto(2)1質量部より、それぞれ比較シンババイオティクスBAC−1および2(CSBAC−1および2)を調製した。
【0080】
試験例8
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例10で調製したSBAC−1および2と比較例10で調製したCSBAC−1および2で行った。
その結果を表8に示した。
【0081】
【表8】

【0082】
表8に示したように、比較例10で調製した比較シンパイオティクスと比較すると、実施例10で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0083】
実施例11
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)1000質量部およびプロバイオティクスとして、2.0×107個/gのClostridium butyricum(1)、Eubacterium hallii(2)、E.ramulus(3)、E.rectale(4)、E.ventriosum(5)およびRoseburia intestinalis(6)1質量部より、それぞれシンバイオティクスBUT−1〜6(SBUT−1〜6)を調製した。
【0084】
比較例11
実施例3と同様に、比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)1000質量部およびプロバイオティクスとして、2.0×107個/gのClostridium butyricum(1)、Eubacterium hallii(2)、E.ramulus(3)、E.rectale(4)、E.ventriosum(5)およびRoseburia intestinalis(6)1質量部より、それぞれ比較シンバイオティクスBUT−1〜6(CSBUT−1〜6)を調製した。
【0085】
試験例9
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例11で調製したSBUT−1〜6および比較例11で調製したCSBUT−1〜6で行った。
その結果を表9に示した。
【0086】
【表9】

【0087】
表9に示したように、比較例11で調製した比較シンパイオティクスと比較すると、実施例11で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0088】
実施例12
実施例3と同様に、プレバイオティクスとして実施例1で調製したガラクトマンナン(A)2000質量部およびプロバイオティクスとして、4.0×107個/gのMegasphaera elsdenii(1)およびPropionibacterium freudenreichii(2)1質量部より、それぞれシンバイオティクスAUB−1および2(SAUB−1および2)を調製した。
【0089】
比較例12
実施例3と同様に、比較プレバイオティクスとして比較例1で調製したガラクトマンナン(CA)2000質量部およびプロバイオティクスとして、4.0×107個/gのMegasphaera elsdenii(1)およびPropionibacterium freudenreichii(2)1質量部より、それぞれ比較シンバイオティクスAUB−1および2(CSAUB−1および2)を調製した。
【0090】
試験例10
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例12で調製したSAUB−1および2と比較例12で調製したCSAUB−1および2で行った。
その結果を表10に示した。
【0091】
【表10】

【0092】
表10に示したように、比較例12で調製した比較シンパイオティクスと比較すると、実施例12で調製したシンバイオティクスは糞便培養により酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0093】
試験例11
乳酸菌として、Lactobacillus属細菌であるLactobacillus acidophilusを用いた実施例3で調製したシンバイオティクスLAC−1(SLAC−1)と比較例3で調製した比較シンパイオティクス−1(CSLAC−1)を、それぞれ1日3gずつ4週間、ローマ−IIIの基準で過敏性腸症候群(IBS)と診断された男性5名、女性5名(平均年齢35±7才)に投与する試験を実施した。試験は、二重盲検、クロスオーバー試験を実施した。ウォッシュアウトは4週間とした。
摂取前と摂取4週間目に、健康関連QOLをSF−36(36−Item Short Form)、胃腸症状をGSRS(Gastrointestinal symptom Rating Scale)、不安・鬱をHADS(Hospital Anxiety and Depression Scale)により、それぞれ評価した。
その結果を表11〜13に示した。
【0094】
【表11】

【0095】
【表12】

【0096】
【表13】

【0097】
表11〜表13に示したように、本実施形態のシンパイオティクスを摂取させることにより、健康関連QOL、胃腸症状および不安・鬱の評価項目が改善され、腸内環境を整えることがわかった。
試験例12
ビフィズス菌として、Bifidobacterium属細菌であるBifidobacterium longumを用いた実施例9で調製したシンバイオティクスBIF−3(SBIF−3)と比較例9で調製した比較シンパイオティクス−3(CBIF−3)を、それぞれ1日5gずつ2週間、ローマ−IIIの基準でIBSと診断された男性4名、女性6名(平均年齢38±7才)に投与する試験を実施した。試験は、二重盲検、クロスオーバー試験を実施した。ウォッシュアウトは4週間とした。
【0098】
摂取前と摂取2週間目に、健康関連QOLをSF−36(36−Item Short Form)、胃腸症状をGSRS(Gastrointestinal symptom Rating Scale)、不安・鬱をHADS(Hospital Anxiety and Depression Scale)により、それぞれ評価した。
その結果を表14〜16に示した。
【0099】
【表14】

【0100】
【表15】

【0101】
【表16】

【0102】
表14〜表16に示したように、本実施形態のシンパイオティクスを摂取させることにより、健康関連QOL、胃腸症状および不安・鬱の評価項目が改善され、腸内環境を整えることがわかった。
実施例11
プレバイオティクスとして実施例1で調製したガラクトマンナン(A)10質量部およびプロバイオティクスとして、1.0×108個/gのLactobacillus acidophilus粉末1質量部、緑茶カテキン類(太陽化学(株)製、サンフェノン)0.01質量部よりシンパイオティクスLACC−1(SLACC−1)を調製した。
同様に、Aと緑茶カテキン類とプロバイオティクスとして、1×108個/gのL.gasseri(2)、L.johnsonii(3)、L.delbrueckii(4)、L.delbrueckii subsp.bulgaricus(5)、L.bulgaricus(6)、L.helveticus(7)、L.rhamnosus(8)、L.casei(9)、L.plantarum(10)、L.reuteri(11)、L.salivarius(12)、L.sake(13)、L.salivarius(14)、L.cellobiosus(15)およびL.brevis(16)を用いて、それぞれシンバイオティクスLAC−2〜16(SLACC−2〜16)を調製した。
【0103】
試験例13
試験例1と同様に、男性4名(平均年齢43±5才)の新鮮糞便を用いた同様の試験を実施例4で調製したSLACC−1〜11で行った。
その結果を表17に示した。
【0104】
【表17】

【0105】
表17に示したように、試験例1の表1のSLAC−1〜11より実施例12で調製したSLACC−1〜11では、糞便培養によりさらに酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0106】
試験例14
シンパイオティクスとして実施例3で調製したSLAC−9(実施例1で調製したガラクトマンナンとL.caseiからなるシンパイオティクス)、特表2007−537224号14頁第0100段〜第0101段に記載の方法のうち(a)で調製したコンニャク加水分解物10質量部および1.0×108個/gのL.caseiより調製した比較品A、および市販のパラチニット(和光純薬(株)製、1,6−GPS:49質量%、1,1−GPM:49質量%)10質量部および1.0×108個/gのL.caseiより調製した比較品Bで試験例1と同様に男性4名(平均年齢44±8才)の新鮮糞便を用いた同様の試験を実施した。
その結果を表18に示した。
【0107】
【表18】

【0108】
表18に示したように、SLAC−9は、比較品AおよびBと比較して、糞便培養によりさらに酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0109】
試験例15
シンパイオティクスとして実施例9で調製したSBIF−5(実施例1で調製したガラクトマンナンとB.animalisからなるシンパイオティクス)、特表2007−537224号14頁第0100段〜第0101段に記載の方法のうち(b)で調製したコンニャク加水分解物300質量部および1.5×108個/gのB.animalisより調製した比較品AA、および市販のパラチニット(和光純薬(株)製、1,6−GPS:49質量%、1,1−GPM:49質量%)10質量部および1.0×108個/gのB.animalisより調製した比較品BBで試験例1と同様に男性4名(平均年齢40±6才)の新鮮糞便を用いた同様の試験を実施した。
その結果を表19に示した。
【0110】
【表19】

【0111】
表19に示したように、SBIF−5は、比較品AAおよびBBと比較して、糞便培養によりさらに酢酸、プロピオン酸および酪酸の産生が増加し、腸内環境が整えられたことが示された。
【0112】
試験例16
SLAC−9、比較品Aを、それぞれ1日3gずつ4週間、ローマ−IIIの基準で過敏性腸症候群(IBS)と診断された男性6名、女性4名(平均年齢33±2才)に投与する試験を実施した。試験は、二重盲検、クロスオーバー試験を実施した。ウォッシュアウトは4週間とした。
摂取前と摂取4週間目に、健康関連QOLをSF−36(36−Item Short Form)、胃腸症状をGSRS(Gastrointestinal symptom Rating Scale)、不安・鬱をHADS(Hospital Anxiety and Depression Scale)により、それぞれ評価した。
その結果を表20〜22に示した。
【0113】
【表20】

【0114】
【表21】

【0115】
【表22】

【0116】
表20〜表22に示したように、本実施形態のシンパイオティクスを摂取させることにより、健康関連QOL、胃腸症状および不安・鬱の評価項目が有意に改善され、腸内環境を整えることがわかった。しかしながら、比較品Aを摂取した場合は、健康関連QOL、胃腸症状および不安・鬱の評価項目は有意差はなく、改善される傾向であった。
【0117】
試験例17
SBIF−5、比較品BBを、それぞれ1日5gずつ2週間、ローマ−IIIの基準で過敏性腸症候群(IBS)と診断された男性5名、女性3名(平均年齢31±4才)に投与する試験を実施した。試験は、二重盲検、クロスオーバー試験を実施した。ウォッシュアウトは4週間とした。
摂取前と摂取2週間目に、健康関連QOLをSF−36(36−Item Short Form)、胃腸症状をGSRS(Gastrointestinal symptom Rating Scale)、不安・鬱をHADS(Hospital Anxiety and Depression Scale)により、それぞれ評価した。
その結果を表23〜25に示した。
【0118】
【表23】

【0119】
【表24】

【0120】
【表25】

【0121】
表23〜表25に示したように、本実施形態のシンパイオティクスを摂取させることにより、健康関連QOL、胃腸症状および不安・鬱の評価項目が有意に改善され、腸内環境を整えることがわかった。しかしながら、比較品BBを摂取した場合は、健康関連QOL、胃腸症状および不安・鬱の評価項目は有意差はなく、改善される傾向であった。
【0122】
実施例A
脱脂粉乳9.5kg、無塩バター3kg、上白糖10.5kg、実施例1で調製したガラクトマンナン5kg及び水72kgをホモミキサーで混合し、原料ミックスを調製した。
この原料ミックスを50℃まで加温し、80kg/cm2で均質処理した後、プレート式殺菌機で90℃、10分間加熱殺菌し、プレート式熱交換機で42℃まで冷却した。そして、発酵乳製造用のビフィドバクテリウム・ロンガムのスターター4質量%を添加した後、100ml容の容器に充填し、42℃で発酵を行い、乳酸酸度が0.75%になったところで5℃まで冷却して、静置型発酵乳を製造した(実施例A発酵乳)。
【0123】
比較例A
脱脂粉乳9.5kg、無塩バター3kg、上白糖10.5kg、比較例1で調製したガラクトマンナン5kg及び水72kgをホモミキサーで混合し、原料ミックスを調製した。
この原料ミックスを50℃まで加温し、80kg/cm2で均質処理した後、プレート式殺菌機で90℃、10分間加熱殺菌し、プレート式熱交換機で42℃まで冷却した。そして、発酵乳製造用のビフィドバクテリウム・ロンガムのスターター4質量%を添加した後、100ml容の容器に充填し、42℃で発酵を行い、乳酸酸度が0.75%になったところで5℃まで冷却して、静置型発酵乳を製造した(比較例A発酵乳)。
【0124】
比較例B
脱脂粉乳9.5kg、無塩バター3kg、上白糖10.5kg、比較例2で調製したガラクトマンナン5kg及び水72kgをホモミキサーで混合し、原料ミックスを調製した。
この原料ミックスを50℃まで加温し、80kg/cm2で均質処理した後、プレート式殺菌機で90℃、10分間加熱殺菌し、プレート式熱交換機で42℃まで冷却した。そして、発酵乳製造用のビフィドバクテリウム・ロンガムのスターター4質量%を添加した後、100ml容の容器に充填し、42℃で発酵を行い、乳酸酸度が発酵乳100g当たり、0.75%になったところで5℃まで冷却して、静置型発酵乳を製造した(比較例B発酵乳)。
【0125】
試験例A
実施例Aで調製した実施例A発酵乳および比較例Aで調製した比較例A発酵乳を4℃で14日間保存した。保存3、7および14日目に乳酸酸度を測定することで保存中の発酵乳の過発酵を調べた。尚、乳酸酸度は、0.1N水酸化ナトリウム溶液による中和滴定法で測定した。製造直後の乳酸酸度を100として、その上昇率で示した。その結果を表26に示した。
【0126】
【表26】

【0127】
表26に示したように、実施例A発酵乳は保存中に乳酸酸度が上昇せずに過発酵認められなかったが、比較例A発酵乳は保存中に乳酸酸度が上昇し、過発酵が確認された。
【0128】
試験例B
実施例Aで調製した実施例A発酵乳および比較例Bで調製した比較例B発酵乳について、5人のパネラーを用いた官能評価を実施した。尚、評価項目及び評価基準は表27に示した。
【0129】
【表27】

【0130】
表28に示したように実施例A発酵乳は、比較例B発酵乳と比較して、おいしさ、のど越し、風味および総合評価のすべての官能評価項目において優れていることが確認された。
【0131】
【表28】

【発明の効果】
【0132】
本発明によれば、プレバイオティクスとプロバイオティクスとを組み合わせたシンバイオティクスを利用した腸内環境調整方法を提供することができる。
【図面の簡単な説明】
【0133】
【図1】実施例1で得られたガラクトマンナンの歪依存性測定を行った結果を示すグラフである。グラフ中の●はG’‘を意味し、▲はG‘を意味する(図2においても同じ)。
【図2】実施例2で得られたガラクトマンナンの歪依存性測定を行った結果を示すグラフである。
【特許請求の範囲】
【請求項1】
(A)プレバイオティクスとして、加水分解されたグァーの胚乳部分であって、次の性質を含むもの、(1)プルランを分子量マーカーとして用いた高速液体クロマトグラフィーによるゲルろ過で重量平均分子量が3〜50kDaと算出されるガラクトマンナン、(2)ケルダール法により窒素含量を測定し、係数6.25を乗じて算出されたタンパク質含量が1.0%以下であるものと、(B)プロバイオティクスとして、ビィフィズス菌、乳酸菌、枯草菌、酪酸生成菌、乳酸利用菌、プロピオン酸生成菌の一種または二種以上からなり、さらに水分含量が20%以下であるもの、の両者を含有するシンバイオティクスを経口投与することにより、腸管内で乳酸及び糖類から酪酸を生じさせて腸内環境を整えることを特徴とする腸内環境調整方法。
【請求項2】
前記加水分解されたグァーの胚乳部分が、次の性質を含むもの、(3)固形分含量15%水溶液の粘度が、回転式粘度計で回転数60rpm、20℃で測定したときに20mPa・s以下であるもの、であることを特徴とする請求項1に記載の腸内環境調整方法。
【請求項3】
前記加水分解されたグァーの胚乳部分が、次の性質を含むもの、(4)分解物の固形物含量が1.0%水溶液99gに1.0gのポリオキシエチレン付加型界面活性剤(POE)を添加して測定した曇点が60℃以下であるもの、であることを特徴とする請求項1又は2に記載の腸内環境調整方法。
【請求項4】
(A)前記加水分解されたグァーの胚乳部分1質量部に対して、1/5質量部のイソプロピルアルコールを加えてよく湿らせた後、激しくかき混ぜながら水10質量部加えた溶液(溶液(1))の粘度がB型粘度計で25℃、No.1ローター、12rpmで測定したときに20mPa・s以下、
(B)溶液(1)を沸騰水中で10分間加熱し冷却後に同条件で測定した粘度が20mPa・s以下(溶液2)、
(C)溶液(2)1質量部に5%ホウ酸ナトリウム水溶液1/5質量部を添加し、混和、放置したものを動的粘弾性測定装置で、25℃、1Hzでひずみ依存性測定をすると、線形領域で貯蔵弾性率(G‘)>損失弾性率(G’‘)かつ線形領域から非線形領域を示す測定曲線を得るものであることを特徴とする請求項1〜3に記載の腸内環境調整方法。
【請求項5】
さらにツバキ科植物成分を経口投与することを特徴とする請求項1〜4のいずれか一つに記載の腸内環境調整方法。
【請求項1】
(A)プレバイオティクスとして、加水分解されたグァーの胚乳部分であって、次の性質を含むもの、(1)プルランを分子量マーカーとして用いた高速液体クロマトグラフィーによるゲルろ過で重量平均分子量が3〜50kDaと算出されるガラクトマンナン、(2)ケルダール法により窒素含量を測定し、係数6.25を乗じて算出されたタンパク質含量が1.0%以下であるものと、(B)プロバイオティクスとして、ビィフィズス菌、乳酸菌、枯草菌、酪酸生成菌、乳酸利用菌、プロピオン酸生成菌の一種または二種以上からなり、さらに水分含量が20%以下であるもの、の両者を含有するシンバイオティクスを経口投与することにより、腸管内で乳酸及び糖類から酪酸を生じさせて腸内環境を整えることを特徴とする腸内環境調整方法。
【請求項2】
前記加水分解されたグァーの胚乳部分が、次の性質を含むもの、(3)固形分含量15%水溶液の粘度が、回転式粘度計で回転数60rpm、20℃で測定したときに20mPa・s以下であるもの、であることを特徴とする請求項1に記載の腸内環境調整方法。
【請求項3】
前記加水分解されたグァーの胚乳部分が、次の性質を含むもの、(4)分解物の固形物含量が1.0%水溶液99gに1.0gのポリオキシエチレン付加型界面活性剤(POE)を添加して測定した曇点が60℃以下であるもの、であることを特徴とする請求項1又は2に記載の腸内環境調整方法。
【請求項4】
(A)前記加水分解されたグァーの胚乳部分1質量部に対して、1/5質量部のイソプロピルアルコールを加えてよく湿らせた後、激しくかき混ぜながら水10質量部加えた溶液(溶液(1))の粘度がB型粘度計で25℃、No.1ローター、12rpmで測定したときに20mPa・s以下、
(B)溶液(1)を沸騰水中で10分間加熱し冷却後に同条件で測定した粘度が20mPa・s以下(溶液2)、
(C)溶液(2)1質量部に5%ホウ酸ナトリウム水溶液1/5質量部を添加し、混和、放置したものを動的粘弾性測定装置で、25℃、1Hzでひずみ依存性測定をすると、線形領域で貯蔵弾性率(G‘)>損失弾性率(G’‘)かつ線形領域から非線形領域を示す測定曲線を得るものであることを特徴とする請求項1〜3に記載の腸内環境調整方法。
【請求項5】
さらにツバキ科植物成分を経口投与することを特徴とする請求項1〜4のいずれか一つに記載の腸内環境調整方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−126457(P2010−126457A)
【公開日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願番号】特願2008−300365(P2008−300365)
【出願日】平成20年11月26日(2008.11.26)
【出願人】(000204181)太陽化学株式会社 (244)
【Fターム(参考)】
【公開日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願日】平成20年11月26日(2008.11.26)
【出願人】(000204181)太陽化学株式会社 (244)
【Fターム(参考)】
[ Back to top ]

