シース流装置及び方法
【解決手段】本発明は、一般的に言えば、流体処理に関し、具体的な態様は、粒子部分(moiety)の検出、選択、捕捉及び/又は選別を行なうための流体処理に関する。シース流装置は、分離装置表面への不要な種の非特異的結合を防ぐとともに、流体サンプルから標的種を単離することができる。細胞、タンパク質及び核酸の体液処理、検出、選別または選択を開示する。本発明は、特に、診断設定、患者の病状解析、治療計画のモニタリング及び/又は調整及び細胞由来生成物の製造に用いられる。
【発明の詳細な説明】
【技術分野】
【0001】
[クロスリファレンス]
本出願は、2009年6月10日に出願された米国仮特許出願No.61/185,919、2010年3月12日に出願された米国仮特許出願No.61/313,625及び2010年6月10日に出願された米国特許出願No.12/813,285に基づく優先権を主張するものであり、前記各出願の内容は、参照することにより、その全体があらゆる目的で本明細書に組み込まれる。
【0002】
本出願は、一般的に言えば流体処理に関するものであり、具体的な態様は、粒子部分(moiety)の検出、選択又は選別を行なうための流体処理に関する。本発明の他の態様は、細胞、タンパク質及び核酸の体液の処理、検出、選別又は選択に関する。他の態様に関しても本明細書中で開示する。
【背景技術】
【0003】
粒子選別法は、懸濁液に含まれる部分(moiety)を標的とする場合に広く用いられているが、汚染という技術的な問題がある。たとえば、複合全血サンプルから比較的希少な細胞を選別することが必要な場合がある。他の細胞型により汚染されていると、標的細胞を濃縮する前処理や不要な非標的細胞を除去する後処理が必要になることがある。
【0004】
さらに、汚染部分(moiety)が、容器の側壁やその他表面に局在化している場合がある。シリコーン系製品等の表面被覆との非特異的結合を最小限に抑える試みも不十分な場合がある。水平な流体流れ平面があり、この平面に沿って懸濁液中の粒子が流れる場合、(密度、粘度、及びその他の特性に応じて)粒子が底に沈む場合がある。この場合、粒子は障壁を形成し、流路を閉塞させてしまう可能性がある。さらに、汚染粒子が、トラップ構造を備えるマイクロ流体装置内で共局在化する可能性もある。特に標的粒子が非常に希少である場合、非特異的結合は、標的種の選別や検出を妨害する可能性がある。
【0005】
粒子選別の特異性を向上させる方法が提案されている。マイクロ流体容量では、標的部分(moiety)の輸送には流体力学が重要となる。従来の流体力学アプローチは、中央のサンプル流の両側に2つの外側流体の流れを形成して、サンプル流を横方向に閉じ込めるものである。フローサイトメトリー及び流体シースの使用を主題にした重要な論文であるP. Crosland-Taylor、“A device for counting small particles suspended in fluid through a tube,” (チューブを流れる流体に懸濁された小さな粒子の計数装置)Nature 171:37-38 (1953) doi: 10.1038/171037b0を参照のこと。
【0006】
一般に、シース流は、特殊な型の層流である。シース流は、流体の流れを囲む外側流「管」として、あるいは、流体の流れを全面的に又は部分的に囲む流体流路として、形成されるが、シース流は、隣接する平行な流体流路に対する層流流体流路を備える。このため、固体表面上の層流平面は、(隣接する平行な流体流路等の)流体「面」上にある場合に、シース流平面として働くと考えられる。過度な乱流は流体の流路を混ぜる(そして、流体層流面層が「シース」として機能しない)結果となるため、シース流は、実質的に乱流が存在しない状態を意味する。このように、シース流の形成には、乱流ではなく、層流が必要である。
【0007】
構造や流体特性に応じて、シース流は、(混ざることなくサンプル流路を囲むことにより)流体力学的に流体サンプルを集める機能がある。あるいは、層(又は流体の流れを不完全に囲むシース)が存在する場合には、層流平面内の流体は、装置壁部の流体延長部として作用する。すなわち、流体サンプルとそれを囲む固体表塩との間の流体障壁として作用する。
【0008】
シース流は、懸濁液の粒子がマイクロ流体回路を妨害又は阻害する可能性があるマイクロ流体において特に有用である。したがって、シース流に着目した流体力学により、サンプル流を高速化して、スループットを向上させることができる。
【0009】
しかしながら、マイクロ流体装置(又はより大きなスケールの流体装置)で有用なシース層流の形成には問題があった。従来のフローサイトメーター等の従来装置では、特殊な構成要素を用いた複雑な計装や非常にきめ細かな製造が必要であった。特別な構造や配置によりマイクロ流体シース流が形成されると考えられているが、マクロ流体スケール及びミクロ流体スケールのいずれにおいても有用であり、特に、標的部分の選別感度を向上でき、表面への非特異的な結合を抑制することができる予測可能なシース流装置を製造することが求められている。
【発明の概要】
【0010】
本発明は、シース流に基づく装置、製造及び計装システム、使用方法、製造方法及び関連する態様を提供する。
【0011】
本発明は、固体表面上に形成される層流の下流側でシース流が得られる、という研究結果に基づくものである。固体表面がなくなっても、層流は基本的には形成された状態で連続するが、流れ平面が隣接する平行な流体流れ平面内で流体流れに当接するように構成された部分では、「シース流」として作用する。本発明の多くの態様や適用は、この知見に基づくものであり、複雑な計装を必要とすることなく、多くの流体工学分野で有益なシース流を容易に形成することができる。
【0012】
具体的な態様において、本発明は、以下に限定されるものではないが、血液及び血液分画、細胞、核酸及びタンパク質、並びに、生体機能で見られる、又は、関与する他の被分析物を含む体液及び生体粒子の処理に関する。本明細書の開示内容を考慮することにより、当業者であれば、他の態様も容易に理解できるであろう。
【図面の簡単な説明】
【0013】
【図1】4枚のコンポーネントプレートを用いてサンプル層流の上と下とにバッファー層流を形成するシース流装置を示す概略図。
【0014】
【図2A】磁気泳動粒子分離を行なうように構成された装置を示す断面側面図。
【図2B】磁気泳動粒子分離を行なうように構成された装置を示す上面図。
【0015】
【図2C】本発明のシース流装置に適した様々な構造の磁気トラップを示す図。
【0016】
【図3A】着脱可能な磁気トラップステーションを示す断面側面図。
【図3B】着脱可能な磁気トラップステーションを示す上面図。
【0017】
【図4】装置内の固体マイクロ流体チャネル面上に血液細胞が非特異的に結合される様子を、シース流が形成されていない状態(左パネル)とシース流を形成後の状態(右パネル)とで比較した画像を示す説明図。
【0018】
【図5A】本発明のシース流装置を用いた場合の、全血からの希少細胞の純度を示すグラフ。
【図5B】本発明のシース流装置を用いた場合の、全血からの希少細胞の回収率を示すグラフ。
【0019】
【図6A】シース流装置の部品を示す分解斜視図。
【0020】
【図6B】図6Aに示すシース流装置を組み立てた状態を画像により示す説明図。
【0021】
【図6C】図6A及び図6Bに示すシース流装置の詳細を示す断面斜視図。
【0022】
【図7A】シース流装置の部品を示す分解斜視図。
【0023】
【図7B】図7Aに示すシース流装置を組み立てた状態を示す斜視図。
【0024】
【図8】さまざまな実施形態においてサンプルを選別する方法を示す処理工程図。
【0025】
【図9A】本発明のシース流装置を用いて臍帯血から単離した造血細胞の純度を示すグラフ。
【図9B】本発明のシース流装置を用いて臍帯血から単離した造血細胞の回収率を示すグラフ。
【発明を実施するための形態】
【0026】
上述したように、本発明は、固体表面上に層流の流路が形成されると、隣接する平行な層流の流路平面に当接するシース流として層流の流路が持続するという研究結果に基づくものである。すなわち、層流の形成に最初に用いられた固体表面がない状態でも、1つ以上の平行流体層流平面に隣接して、流路及び流れ平面内で流体の流れが形成された状態を持続する。一部の実施形態において、サンプル層流の流路は、1つ又は2つのバッファー流路に隣接して形成される。このようにして、シース流が形成されることにより、サンプル流路がシース流装置の内部表面に接触するのを防ぐことができる。
【0027】
図1は、本発明のシース流装置100を示す分解斜視図である。シース流装置100は、4枚の平行なプレート105、110、115及び120を備え、これらの平行なプレートを接合することによりシース流装置100が形成される。サンプル流体は、点線矢印125で示すように、プレート105のアクセスポートを通ってz軸方向に導入される。サンプル流体は、たとえば、プレート115の凹凸面に突き当たって、偏向する。拡孔によって、サンプル流体は固体表面に沿って進むため、層流の流路が形成される。(流体が固体表面の端部を通過した、又は、固体表面との接触が断たれた等により)層流の流路平面内における固体表面がなくなっても、流体の流れは層流として持続する。バッファー流体は、点線矢印130及び135で示すように、プレート120及び105の流入口を通って導入される。バッファーの流れは、各々、同じように、プレート115及び110の表面に突き当たり、サンプル層流に隣接する層流を形成する。これらの層流は、別々の層流の層として持続し、シース流を形成する。すなわち、サンプル層流がバッファー層流によりシースされて、たとえば、シース流装置の内部表面にサンプル流が接触するのを防ぐことができる。
【0028】
したがって、本発明の1つの態様は、(a)シース流平面領域の上流側に位置する第1の層流形成固体表面と、(b)シース流平面領域に平行なサンプル層流領域と、さらに、必要に応じて、(c)第2のシース流平面領域の上流側に位置する第2の層流形成固体表面と、を備えるシース流装置を提供する。
【0029】
図1に示すように、対応シース流平面の上流側に位置する対応固体表面上に1つ以上の平行層流平面を形成するように構成される本発明の装置を用いて、シース流を形成することができる。本明細書に記載される実施形態は、磁気的に標識されたサンプル成分を偏向させて、必要に応じて、捕捉する磁気分離ステーションを備えるシース流装置である。磁気トラップステーションの例は、たとえば、参照することにより、あらゆる目的で本明細書に組み込まれる「標的種を捕捉するためのトラップ型磁気選別システム(Trapping Magnetic Sorting System for Target Species)」という名称の米国特許公報2009/0053799A1に記載されている。シース流装置が非磁気的な力を利用して分離を行なうような実施形態でもよい。非磁気的な力の例としては、音響的な力、光学的な力及び誘電力が挙げられる。
【0030】
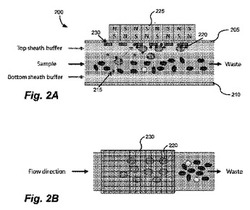
図2A及び図2Bに、磁気泳動粒子分離を行なうように構成された本発明のシース流装置200の断面側面図と上面図とを、それぞれ示す。装置200は、上部プレート205と、下部プレート210と、を備える。標的部分(moiety)(図示した例では細胞)を含有する複合サンプルは、上部流体層と下部流体層との間で層流層を形成する。粒子選択構造体、ここでは、強磁性ニッケル構造体230を上部プレート205の内側表面上に設置することにより、サンプル層流が上部バッファーシース流直接接触するのを防ぐ。一つの実施形態において、生存細胞等、採取した標的種が(有毒な可能性のある)ニッケルに直接接触しないように、所定の物質を被覆する等の方法でニッケル構造体を隔離するようにしてもよい。磁気泳動で選別された選択粒子(図示した例では、磁性粒子215で選択的に標識された細胞であり、磁気選別に応答する細胞)に、制御可能な外力(ここでは、磁力)を印加する。図2Bの上面図に、排出物は、磁気泳動構造により偏向又は捕捉されず、サンプル流体の流れを通過する様子を示す。本実施形態のさらなる態様を以下で説明する。
【0031】
図2Cに、本発明のシース流装置で利用可能な9種類の磁気トラップグリッド又はパターンを示す。これらのグリッド又はパターンは、傾斜磁場(magnetic field gradient:MFG)生成構造として機能する。一つの実施形態において、磁性材料から、磁気トラップグリッド又はパターンを形成するものでもよい。別の実施形態において、高度に局在化した強磁場を磁気トラップグリッド又はパターン内で誘導することにより、サンプル流からバッファーシース流を通して磁気トラップグリッド又はパターン上に、磁性粒子で標識した標的種を引っ張るための外部磁石と共に用いられる材料から、マイクロマシン加工やスクリーン印刷等の方法で、磁気トラップグリッド又はパターンを形成するものでもよい。
【0032】
一般的に言えば、本発明の装置及び関連する方法並びにシステムは、流体層を別々のまま維持するように、実質的に乱流を生じさせることのない、又は、原則として乱流を生じさせることのない個別の流体層流層を形成する。本明細書においてシース層流を説明する際に用いる「実質的に乱流を生じさせることのない」という用語は、乱流が一部生じるかもしれないが、それでもシース流が形成されることを意味する。同様に用いられる「原則として生じさせることのない」という用語は、避けられない乱流が一部生じるかもしれないが、上述したように、所望のシース層流層は形成されることを意味する。
【0033】
一部の態様において、シース流は、(標的部分(moiety)の分離又は検出の対象となる)サンプル流体と固体表面との間に流体障壁を形成して、固体表面に対する隔離障壁として機能させる。たとえば、シース流を用いて、固体表面への非標的部分(moiety)の非特異的結合を抑制する。本発明は、したがって、サンプル流体の成分と装置の固体表面との不要な相互作用を防ぐ手段を提供する。所望の相互作用、たとえば、流体成分の選択的採取には、サンプル流体と固体表面との間の不要な相互作用が伴う。たとえば、本発明の装置を用いて、サンプル流体と、側壁、上面又は底面の固体表面や(上述した)トラップステーション等の固体表面との接触を実質的に防ぐシース流障壁を形成することにより、サンプル流体の層流平面内における非標的部分(moiety)の不要な非特異的結合を防ぐことができる。
【0034】
さらに、シース流を用いて、サンプルの流れを「圧迫する」又は他の方法で横方向に狭くすることにより、サンプル中の細胞の計数等の目的に用いることができるような狭いサンプル流を形成するようにしてもよい。ある実施形態において、シース層流により、検出対象である細胞やその他標的種の大きさに相当する幅を有するサンプル層流の境界を形成する。本明細書の開示内容を考慮することにより、当業者であれば、他の態様も容易に理解できるであろう。
【0035】
用語:
他に規定しない限り、本発明に関連して用いられる科学用語や専門用語は、当業者が一般的に理解している意味で用いられるものとする。
【0036】
一般的な用語:
本出願において、「単数」で表わすものは、特に明記しない限り、「複数」も含むものとする。本出願において、 1つを意味する単語「a」又は「an」は特に明記しない限り「少なくとも1つ」を意味する。あるリストを挙げた後に「のうちの少なくとも1つ」と記載した場合には、リストの中の1つ以上の項目を意味し、リストにあるすべての項目が存在する必要があることを意味するものではない。単語「又は」は、特に明記しない限り「及び/又は」を意味する。多項従属クレームの場合、「又は」という表現は、2つ以上の先行する独立項又は従属項を選択肢として言及するものである。さらに、「備える」「有する」「含む」等を意味する単語「comprising」及びその変化形である「comprises」「comprised」は、非限定的な用語である。また、「(構成)要素」や「成分」を意味する単語である「element」や「component」は、特に明記しない限り、1つのユニットを含む要素や成分と複数のユニットを含む要素や成分との両方を包含する。「当業者(skilled practitioner)」という用語を用いる場合、特に明記しない限り、対象となる内容に関係する分野の通常の技術者を意味する。
【0037】
流体力学に関する用語:
(マイクロ流体工学を含む)流体力学を説明する様々な用語は、通常の専門用語の意味で用いられる。
【0038】
「流体」及び「液体」という用語は、本明細書では同義的に用いられ、「流れ」て、場合に応じて「容器の形状を取る」物質を意味する。状況によっては、「流れ」る気体状物質や固体状物質の場合もある。たとえば、細かい顆粒状物質は「流れ」ることができる。
【0039】
「流体回路」という用語は、本発明のシース流装置内に配置される流体的に相互接続される機能領域の構成を意味する。後に詳述するように、機能領域には、貯留部又は区画及び流体が流れるチャネルが含まれる。チャネルは、たとえば、対隣壁によって2つの区画が直接流体接続される場合に、必要に応じて設けられる。2つの貯留部やチャンバを、たとえば、対隣壁を介して、可逆的に流体接続することができ、対隣壁は、密閉されたものでも開放されたものでもよいし、あるいは、所定の大きさの粒子だけを通過させるような多孔質のものでもよい。当業者であれば、本発明の流体回路を様々に構成可能であることが理解できよう。構成以外にも、本明細書で説明する流れ制御構造要素等、流体回路を統合するために広範囲な選択肢が考えられる。
【0040】
粒子選別に関する用語:
本明細書で時に応じて用いる「部分(moiety)」は「部分(portion)」を意味するが、1つの粒子に言及する時にも用いる。「粒子」は輸送及び特性に関してユニット全体として作用する小さな物体を意味する。「被分析物」という用語は、「部分(moiety)」でも「粒子」でもよく、通常用いられる意味で用いられ、分析過程において、存在するか否かの検出対象又は特性の測定対象となる物質を意味する。
【0041】
生物学及び生化学用語:
核酸やタンパク質等、特定の範疇の分子を議論する場合には、自然に発生する分子の類似型や異性体型等の合成型も含まれる。特に明記しない限り、所望の機能特性が維持されている限り、変性型も同様に包含される。たとえば、CD34細胞表面たんぱく質に選択的なアプタマーには、化学誘導体(たとえば、ペグ化、プロフォーム(pro-form)の形成、酵素やリボゾーム等の別の活性部分(moiety)を用いた誘導体化)が含まれる。
【0042】
「体液」という用語は、流体源を意味し、(以下に限定されるものではないが)羊水、房水、血液および血漿(特に他に明記しない限り、本明細書では、血液は血漿成分を意味する)、耳垢、カウパー腺液、消化粥、間質液、リンパ液、哺乳類の母乳、粘液、胸膜液、膿、唾液、皮脂、精液、血清、汗、涙、尿、膣分泌物、嘔吐物及び(外傷や病変からの)漏出液が含まれる。
【0043】
「選択的結合分子」という用語は、特定の標的部分(moiety)に必ずしも特異的でなくてもよいが、選択的に結合する分子を意味する。結合はランダムに生じるものではない。選択的結合分子は、種々の抗体又は置換体(ポリクロナール、モノクロナール、ペプチボディ、ヒト化、短縮化、類似型やその他当該分野で利用可能なもの)やアプタマー(DNA、RNA又は様々なタンパク質型でもよいし、酵素部分(moiety)や測色部分(moiety)等、別の機能部分(moiety)により変性させたものでもよい)から選択されるものでもよく、特定の生体系に特有のものでもよい。タンパク質は、Hisタグ等の特定のタグを用いて発現させたものでもよく、当業者であれば、適当な種類の選択的結合分子や適当な検出可能な標識を決定することができるであろう。上記の一欄は何ら包括的なものではない。
【0044】
当然のことながら、本発明の実施形態は、生体サンプルや有機サンプルに限定されるものではなく、非生体物質や無機物にも及ぶ。したがって、本明細書で説明する装置や方法を、液体中の広範囲な生体物質や非生体物質のスクリーニング、分析、変性又はその他処理に用いることができる。標的種及び/又は非標的種には、化合物、超分子集合、タンパク質、オルガネラ(細胞小器官)、フラグメント(断片)、ガラス、セラミック等、小さな又は大きな天然起源又は合成した化学物質が含まれる。ある実施形態において、標的種及び/又は非標的種は、任意の分岐度のモノマー、オリゴマー及び/又はポリマーである。これらは、細胞又はウィルス上で発現させたものでもよいし、独立した物質でもよい。また、完全な細胞やウィルス自体でもよい。
【0045】
全般的考察:
本発明の実施及び利用を目的として、全体的な装置の構成、材料、製造システム、計装システム及び用途に関する考察を行なう。実施例を含む所定の実施形態を説明し、理論的実験例に関しても説明する。
【0046】
圧縮性流か非圧縮性流か、粘性流か非粘性流か、定常流か非定常流か、層流か乱流か、ニュートン流体か非ニュートン流体か、亜音速流、遷音速流、超音速流及び極超音速流のいずれか、非相対論的流れか相対論的流れか、磁気流体力学(その他、粒子選別の要件)を含む流体力学の原理を考慮して、本発明の実施又は利用を行なう。この一欄は完全なものではなく、当業者であれば、流体、粒子、装置及び選別方法をすべて組み込むべきであることは理解できよう。
【0047】
したがって、特に、本発明を用いて、血液サンプルから循環腫瘍細胞等の希少細胞を選別すると共に、誤った結果を与える可能性がある非選択的な結合を最小限に抑制することができる。細胞の大きさの粒子に関しては、流体力学的な流れは毎秒数メートルの速度を必要とする、という物理的制約条件が考えられる。この速度ならば、通常の細胞は、数マイクロ秒以内に自分自身の直径と同じ距離を移動できる。
【0048】
さらなる機能を持つように、本発明の装置を構成するようにしてもよい。たとえば、まず細胞を単離した後、in situ(その場)で培養する場合には、本発明の装置をさらにバイオリアクターとして用いることができるように構成するようにしてもよい。さらに、まず細胞を培養して、又は、予め成長させた細胞を用いて、本発明のシース流装置上でタンパク質(又はその他の標的部分(moiety))を得るようにしてもよい。標的タンパク質(又は部分(moiety))を検出可能に標識して流体内に懸濁させて、本発明のシース流装置内で選別するようにしてもよい。本発明を用いて、アプタマーライブラリーからタンパク質用のアプタマーを選択する等、化学物質ライブラリーの選別またはスクリーニングを行なうようにしてもよい。
【0049】
本発明のシース流装置は、従来の流体取扱装置と同様に用いることができる。所望の製造方法やシステム、所望の用途及び(必要に応じて)所望の関連計装を全般的に考慮すればよい。サンプルの大きさや適用要件、流体の流れ方向、流路及び流速の制御手段、(必要に応じて)粒子物質の選択又は選別を行なう手段や必要な計装に伴う適応に関連して、装置形状を考える必要がある。
【0050】
本発明のシース流装置、関連する方法及びシステムは、マクロ流体サンプルとマイクロ流体サンプルの両方に対して、産業上利用可能であり、詳細には後述するように、広範囲な目的に応じて構成及び適合可能である。マイクロ流体装置は、サンプル内のタンパク質精製、希少細胞分離及び希少分子(たとえば、タンパク質やアプタマー)のスクリーニング等の目的に利用可能である。本発明の層流形成面を備えるようにマイクロ流体装置を構成して、本明細書に記載するように、流体層内にシース流を形成するようにしてもよい。たとえば、参照することにより本明細書にすべて組み込まれるQian, X. Lou, Y. Zhang, Y. Xiao, H. T. Soh, "Rapid Generation of Highly Specific Aptamers via Micromagnetic Selection" (マイクロ磁気選別による非常に特異性の高いアプタマーの高速生成)Analytical Chemistry (2009)、 U. Kim and H. T. Soh, "Simultaneous Sorting of Multiple Bacterial Targets Using Integrated Dielectrophoretic-Magnetic Activated Cell Sorter" (集積型誘導泳動磁気活性化セルソーターを用いた複数のバクテリア標的の同時選別)Lab on a Chip (2009)、Y. Liu, J. D. Adams, K. Turner, F.V. Cochran, S. Gambhir, and H.T. Soh, Controlling the Selection Stringency of Phage Display Using a Microfluidic. (マイクロ流体を用いたファージ・ディスプレイの選択厳密性制御) Lab on a Chip (2009)、及び X. Lou, J. Qian, Y. Xiao, L. Viel, A. E. Gerdon, E. T. Lagally, P. Atzberger, T. M.Tarasow, A. J. Heeger, and H. T. Soh, “Micromagnetic Selection of Aptamers in Microfluidic Channels,”(マイクロ流体チャネルにおけるアプタマーのマイクロ磁気選別) Proceedings of the National Academy of Sciences, USA, 106 (9) 2989-2994 (2009)を参照のこと。
【0051】
シース流装置の一般的構成:
本発明のシース流装置は、(本明細書で説明するように、固体表面との接触がなくなっても)1つの流体層が別の流体層に接触すればシース流として持続する層流を固体表面上に形成するという原理に従って構成される。本発明のシース流装置は、平行な層流の流路平面内で隣接する流体と流体接触する上流側に層流を形成することに利用可能な固体表面を有するものであれば、いかなる構成や構造でもよい。
【0052】
一般的に、本発明は、流体サンプル流路と装置表面との間で障壁として作用するシース流を形成するように構成される装置を提供する。この障壁は、サンプル流体と装置表面との相互作用を阻害又は妨害する。たとえば、この障壁は、対象となる流体サンプル部分(moiety)の固体表面への非特異的結合を実質的に防ぐものである。非特異的結合を実質的に防ぐことにより、部分(moiety)の堆積による流路の破壊や選択された希少部分(moiety)の汚染等の悪影響を避けることができる。
【0053】
空間的には、シース流装置を(水平軸に対して)水平方向に配置する場合には、流路は、互いに鉛直方向に配列される(互いに積み重なるように層状に重ねて形成される)。この構成を、図1及び図6Aないし図6Cに示す。図示するように、上部シース流と下部シース流とは、サンプル流面の両側に、平行に隣接するように形成される。流れ平面が水平方向であるのに対して、上部シースは「上面」に下部シースは「底面」に、鉛直方向に積み重なるように形成される。
【0054】
本発明の装置を縦型(水平軸に対して垂直な)で構成することもできる。縦型構成の場合、流路は水平方向に(互いに左右方向に)層状に重ねて形成される。
【0055】
流体回路に応じて、流路は平面内に形成されるものでもよいし、そうでなくてもよい。流路を半円形チャネル、円管又は同様のチャネル構造の形状に構成する場合、流路は(3次元曲面平面形状に関するユークリッド幾何学に従って、交わることなく)実質的に平行になる。
【0056】
所定の状況下では、流体シースとして、実質的に静止した流体「プール」が形成される。厳密に言えば、流体プールは流れていないが、特に粘性の高い液体(たとえば、容器に入れた場合に、容器の形状を取る物質)の場合には、極めてゆっくりではあるが、流体運動特性を示す。このように、(後述する)下部流体層等の「プール」領域を備え、その上に、粘性の低い流体サンプル流が形成されるように、本発明の装置を構成してもよい。
【0057】
サイズ:
本発明の装置は、流体力学及び流体の特性を考量して、任意のサイズにスケーリング可能である。一つの実施形態において、本発明の装置を、マイクロ流体回路に合わせてスケーリングしてもよい。他の実施形態において、本発明の装置を1リットルスケール又は数リットルスケールでの使用に適した構成としてもよい。
【0058】
層流形成領域に関しては、流体特性を考慮して、層流を形成するのに必要な表面積を考える。
【0059】
当業者には自明のことであるが、流体特性には、粘度、粒子状物質の特性(流体力学等)、粒子状物質の濃度、及び、隣接する場内の流体に対する流体の混和性(又は反応性)が含まれる。
【0060】
サイズに関しては、所望の流量/流速を得るための圧力量を、圧縮性流か非圧縮性流か、粘性流か非粘性流か、定常流か非定常流か、層流か乱流か、ニュートン流体か非ニュートン流体か、亜音速流、遷音速流、超音速流及び極超音速流のいずれか、非相対論的流れか相対論的流れか、磁気流体力学及びその他当該分野で周知の方法に従う近似等の流体力学に基づいて、計算することができる。当業者であれば、装置材料を含むシステム全体を考慮して流体力学を考えることができるであろう。
【0061】
シース流装置では、サンプル流平面からシース流平面に標的種を偏向させる方向に、分離力が作用する。一般的に、この方向は、流れ方向に垂直であり、シース流及びサンプル流は、この方向に沿って互いに積み重なる隣接する平行な層を形成する。この方向における装置の寸法(装置の「高さ」)は、比較的小さく、多くの場合、装置の中で最も小さな寸法であり、分離力が作用可能な距離に相当する大きさである。この力は、多くの場合、短距離力であり、この方向における装置の寸法は、多くの場合、約1ミリメートル以下のオーダーである。これに対して、装置の横方向の寸法、すなわち、流れ方向と分離力の方向の両方に垂直な方向の寸法は、比較的大きい。これにより、装置を比較的大きなサイズにスケーリング可能であり、これに応じて、たとえば、マイクロ流体構成において、1時間当たり約数百ミリメートルオーダーに、スループットを増大させることができる。このような装置の横方向の寸法は、たとえば、少なくとも約10センチメートルで、少なくとも約20センチメートルでもよい。具体的な実施形態において、装置の高さは約700マイクロメートルで、横方向の寸法は約20センチメートルである。ここで挙げた寸法は、本明細書の別の部分で詳述するものを含む磁気泳動分離機構と共に用いるのに適した大きさである。
【0062】
後述する実施例は、(実施例に後述するように、一般的には1mm以下の流体チャネル直径を有する)マイクロ流体サイズに関するものである。実施可能な用途に関する制限はさておき、サイズの下限は、主に製造方法によって決まる。たとえば、ナノエレクトロニクス部品が必要な場合には、マイクロリソグラフィー法で各部品を集積させることも考えられる。マイクロ流体用途では、流体の流れに乱流が生じるのを抑制すると共に、所望の流路内で層流を最適化するような比率が必要とされる。本発明のシース流装置を、たとえば、1〜10μl、10〜100μl、100〜1000μl、1000μl〜100mlのサンプル容量に対して利用可能なように構成してもよい。
【0063】
本発明のシース流装置は、流体力学の原理及び所望の用途等、実用を考慮して、実質的にどのような大きさにでもスケーリング可能である。シース流の上流側に層流を形成するための一般的な原理は、マイクロ流体用途用の装置より大きな装置には広く適用可能であり、当業者であれば、スケールアップを可能にする一般的な流体力学の原理を理解できるであろう。たとえば、一部の実施形態において、本発明の装置を、100mlから1リットル、及び、場合によっては数リットルという、より大きなサンプル流量に用いられるように構成するようにしてもよい。
【0064】
流体層の数及び特性:
本明細書で用いられる「流体層」という用語は、実質的に乱流を生じさせることのない個別の流体流路平面を意味する。「流体層」は、固体表面上の層流でもよいし、平行な平面内で隣接する又は当接する流体層に関するシース流でもよい。
【0065】
本発明を、2次元の平面配向ではなく、サンプル流体を全体的に囲むシースを形成する装置に適用することもできる。層流形成面を組み合わせることにより、サンプルを囲む流体層を形成し、3次元の流体力学を容易に実現可能である。このようにして、水平方向と鉛直方向の両方に対して、(装置の流体回路内の)チャネル壁からサンプル流を離すことができる。
【0066】
流体層の数:
一般的態様において、本発明は、少なくとも3つの個別の、順次境界を接する流体層流層を含む装置(及び関連する方法及びシステム)を提供する。層流の流路は、互いに隣接し、互いに平行になるように、順次配置される。各層流の流路は、他の層流の流路と平行で、かつ、流路に対して垂直な方向に層状に重ねて形成される。
【0067】
サンプル層流平面を(たとえば)上層と下層とで挟んだ(後述する実施例のように)3つの層を用いるようにしてもよい。固体支持面なしに層流(シース流)平面を連続させることができる範囲は主に流体力学要件に基づいて決まるが、別の流体層を加えるようにしてもよい。幾何学的構成、チャネル壁組成及び摩擦力等の流体回路の特性を考慮するようにしてもよい。また、流速や流れ力、流れ平面の寸法、各流れ平面層における流体容量、及び、当業者に自明の他の流体力学要件を考慮するようにしてもよい。
【0068】
流体層の厚み:
流体層の数に関連して、各流体層の厚み(又は深さ)も重要である。当業者であれば、装置の構成及び用途に加えて、流体特性により流体層の厚みが決まることが理解されよう。
【0069】
たとえば、シース流装置を磁気泳動用に構成する場合には、シース流を形成する流体層による抵抗よりも大きな磁力をかける必要がある。すなわち、磁気的に標識した標的粒子をサンプルから分離するのに印加する磁力は、流体層を通して、所望の領域(たとえば、上述したトラップステーション)に粒子を引っ張るのに十分な大きさでなければならない。
【0070】
したがって、たとえば、上面にトラップステーションを有し、水平面内で装置の上面に磁力をかける磁気泳動装置を用いる場合には、本発明のシース流装置は、(サンプルの粘性に対して)相対的に粘性が高く、動きがゆっくりの(又は動かない)第1の(たとえば、下部)流体層と、(下部層に対して)相対的に粘性が低いサンプル層と、原則として粘性を持たない上部層とを備えるようにしてもよい。このようにすれば、上部層のシース流により、磁気的に標識された標的粒子が層を通って移動し捕捉されることを妨げることなく、(上面に配置される)磁気トラップステーションにおける非特異的結合を実質的に防ぐことができる。
【0071】
構造要素:
一般的に、本発明のシース流装置は、単純に流体を収容したり貯蔵したりする以上の特定の用途が達成されるように流体を移動させる機能を果たす。
【0072】
構造的な特徴により、流体回路が規定される。本発明のシース流装置は、1つ以上のアクセスポートと、1つ以上の貯留部と、アクセスポート及び貯留部間を流体連結する1つ以上のチャネルと、を備える。他の構造要素に関しても以下で説明する。
【0073】
アクセスポート:
一般的に、全体の構成と材料とに基づき、本発明のシース流装置は、物質の流入及び流出を可能にする少なくとも1つのアクセスポートと、流体を収容する少なくとも1つの貯留部と、を備える。流体(や他の物質の)流入や流出に用いられるアクセスポートを、システム全体の一部として、他の装置や機器と共に作動するように構成してもよい。
【0074】
アクセスポートは、流体供給口や流体流出口を提供し、外部環境に接続されるものでもよい。流体供給の場合には、シリンジやピペットを介して流体が供給されるようにアクセスポートを構成してもよいし、あるいは、自動供給機器により流体が供給されるようにアクセスポートを構成してもよい。図6Bにシリンジに適したアダプターを嵌めたアクセスポートの例を示す。流体流出は、たとえば、排出物の除去を目的としたものでもよいし、懸濁液中の粒子状物質を選択的に捕捉する正の選別スキームの一部として行なわれるものでもよい。チューブスタッド、ホースバーブ接続、Oリング接続やその他の外部接続部等、様々な外部接続部をアクセスポートに用いることができる。
【0075】
外部接続部を用いる代わりに、アクセスポートを、独立に封入された貯留部等、装置の他の部分と流体連結するようにしてもよい。機能的には、流体供給や流体分離(流体流出)と同じ機能を果たす。
【0076】
本発明の装置は、複数の異なる流体を導入する、又は、別々の部分(moiety)を流出させる等、様々な機能のために1つ以上のアクセスポートを備えるものでもよく、各アクセスポートが外部環境や装置の他の部分に接続されるものでもよい。
【0077】
貯留部:
本発明の装置は、さらに、流体を収容し、流体上で所定の機能を果たす少なくとも1つの貯留部を備える。貯留部は、機能的な役割を果たすものでもよいく、この機能を果たすためにさらなる構造要素を備えるものでもよい。たとえば、培養された細胞が必要な場合には、(以下に限定されるものではないが)たとえば、エアレーション装置、ミキサー、温度制御装置等、適当な細胞培養装置を貯留部と一体化させたものでもよい。これらの装置を、本発明のシース流装置の一部として形成してもよいし、(シース流を機器に操作可能に接続した場合に)装置を一時的に取り付けて、関連処理機器の一部としてもよい。機能を果たすシステム内で操作可能なように、貯留部を適合させるようにしてもよい。
【0078】
装置の機能要素:
一定量の供給及び測定用に、あるいは、連続フロー用に、本発明の装置を構成する又は適合させるようにしてもよい。本発明の装置を、(細胞溶解とタンパク質単離等)多重機能用に構成してもよい。本発明の装置を、一段又は多段処理又はアッセイ用に構成してもよいし、試薬貯蔵用に構成してもよい。本発明の装置を、ろ過機能を持つように構成する又は適合させるようにしてもよい。
【0079】
たとえば、本発明のシース流装置が、さらに、たとえば、粒子選別の一形態として、標的部分(moiety)を捕捉する構造を備えるようにしてもよい。たとえば、後述するように、磁気的に結合された標的種の「トラップステーション」として機能する、磁気泳動粒子選別用の強磁気グリッドを備えるようにしてもよい。本発明のシース流装置では、懸濁液からの粒子の分離が特に効果的に実行可能である。たとえば、複合混合物から特定の部分(moiety)を磁気泳動分離させる場合には、先に引用した米国特許公報2009/0053799A1に記載されるような強磁気構造等の適当な磁気泳動トラップ構造を適当な位置に備えるようにしてもよい。上部層上に強磁気トラップステーションを備える例を図6Bに示す。
【0080】
本明細書のあちらこちらに記載するように、様々な粒子選別/検出/分析機能部を備えることができる。
【0081】
シース流流体工学装置内で磁気トラップソーターと統合可能な操作モジュールの例としては、(a)蛍光活性化セルソーター等の追加濃縮モジュール及び洗浄モジュール、(b)サンプル増幅(たとえば、PCR)モジュール等の反応モジュール、制限酵素反応モジュール、核酸シークエンシングモジュール、標的標識モジュール、クロマチン免疫沈降モジュール、架橋モジュール及び細胞培養モジュール、(c)核酸、抗体又は他の特異性が高い結合剤のマイクロアレイ等の検出モジュール及び蛍光分子認識モジュール、及び(d)細胞を溶解させる、ウィルスタンパク膜の破壊又はその他小さな生体の成分を放出させる溶解モジュールが挙げられる。これらのモジュールは、各々、磁気ソーターの前段に備えるようにしてもよいし、又は、後段に備えるようにしてもよい。単一の流体工学システムにおいて、複数の同一種類の又は異なる種類の操作モジュールを磁気ソーターと統合するようにしてもよい。さらに、1つ以上の磁気ソーターを、種々の他の操作モジュールに対して、並列に配置するようにしてもよいし、直列に配置するようにしてもよい。これらの操作モジュールの一部を、サンプル中の標的種を定常状態で保持するような、又は、一般的に所定容量内に閉じ込めるようなトラップとして設計又は構成するようにしてもよい。
【0082】
上述したモジュールの例から明らかなように、集積流体工学装置のモジュールにおいて標的種及び/又は非標的種上で実施可能な操作には、選別、磁性粒子への結合(本明細書では「標識」とも称する)、結合、洗浄、捕捉、増幅、不要な種の除去、沈降、切断、希釈、結紮、シークエンシング、合成、標識(細胞の染色等)、架橋、培養、検出、撮像、定量、溶解等が含まれる。
【0083】
集積流体装置の磁気選別モジュールにおいて実施可能な生化学的操作の具体例としては、プラスミド、アプタマー、タンパク質及びペプチドの合成、精製、及び/又はスクリーニング、酵素活性の評価及びタンパク質と炭水化物の誘導体化が挙げられる。広範囲に及ぶ生化学的及び電気生理学的アッセイを実施可能であり、これには、(1)DNA及びRNAオリゴマーのゲノム解析(シークエンシング、ハイブリダイゼーション)、PCR及び/又はその他の検出及び増幅スキーム、(2)遺伝子発現、(3)酵素活性アッセイ、(4)受容体結合アッセイ、及び(5)ELISAアッセイが含まれる。前述のアッセイは、均一系、ビーズベース、及び表面結合等様々なフォーマットで実施可能である。さらに、本明細書で説明する装置を利用して、特定の酵素又は触媒を用いる生体分子の連続生産、及び、治療薬等、生体系で活性な生体分子又は分子の生産と送達を実施することも可能である。本明細書に記載する流体装置を用いて、ペプチド、タンパク質並びにDNA及びRNAオリゴマーのコンビナトリアル合成を実行することもできる。
【0084】
集積及び流体回路:
機能要素の集積は、様々な方法で実施可能である。一般に、すべての組み合わせで、流れチャネルを介して、アクセスポートと貯留部とを流体的に接続可能である。流れチャネルは、所望の種類の流れに適合するように、また、所望の流体の動きを可能にするような任意の寸法で、形成可能である。
【0085】
流れ制御構造要素は、多種多様な中から選択可能である。これには、バルブ、多孔質膜、ミキサー、ポンプ及びその他従来の流れ制御構造要素が含まれる。in situで凝固して流れを遮断する物質の適応等、従来用いられていない流れ制御を用いることもできる。
【0086】
流体回路の集積に関連して、層流形成面を考慮する必要がある。たとえば、シース流の上流側で層流が形成される場合、シース流は、逆方向適合性(上流側)を持たず、妨害しないようなものでなければならない。
【0087】
熱、太陽光、水等の存在下で非毒性成分の部分(moiety)に分解する高分子材料を用いる等、本発明の装置の全体又は一部を生分解性のものとしてもよい。
【0088】
さらに、在庫管理のために、バーコード、RFID又はその他、装置を識別する手段等で製品識別を行なうようにしてもよい。本発明の装置を、さらに、関連試薬と共にパッケージングするようにしてもよい。たとえば、生物剤と共に用いられるように、本発明の装置を適当な緩衝液(バッファー)、媒体、検出可能な標識部分(moiety)、(流体供給用のシリンジ等の)装置、又はその他の商品と共にパッケージングするようにしてもよい。
【0089】
洗浄又はキャリア流体:
たとえば、(洗浄剤を含有する又は含有しない)水性緩衝液、アルコール(メタノール、エタノール、イソプロピルアルコール等)、有機溶剤(ヘキサン、フッ化炭素、芳香族化合物等)又はこれらの組み合わせと共に用いるように、本発明の装置を構成する又は適合させるようにしてもよい。ある実施形態において、これらの流体は、シース流流体として機能するものでもよい。
【0090】
電気化学/電気活性:
本発明の装置は、1つ以上のプリント基板、互いに噛み合う電極、スパッタ又はスクリーン印刷電極、又はキャパシタンス・アレイを備えるものでもよい。たとえば、高分子材料状に回路基板を予め準備して、本発明のシース流装置の製造に用いるようにしてもよい。これらの構成要素を、トラップステーション及び/又は様々な前処理及び後処理モジュール又はステーションの駆動を指示する関連論理回路で制御するようにしてもよい。
【0091】
粒子捕捉又は選別に力を用いる場合の操作性:
本発明の装置の最も有望な用途の1つは、粒子選別であり、多くの方法で、粒子選別を行なうことができる。磁力、音響的な力、磁気泳動力又は光学的な力等の制御可能な力を用いて、流体に懸濁されている応答粒子を動かすことができる。
【0092】
たとえば、(細胞選別等の)磁気活性化粒子選別を用いるようにしてもよい。実行可能な例としては、選択的結合分子が付着した磁気ビーズを用いることができる。選択的結合分子が所望の標的に結合すると、磁石が付着する。次に、磁力を用いて、また、必要に応じて、強磁性トラップステーションを用いて、所望の標的を捕捉又は選別するようにしてもよい。磁性領域を印刷する、あるいは、(たとえば、特定領域に適用する等)強磁性微粒子を製造原料内に取り込むことにより、シース流装置の材料に強磁性物質を埋め込むようにしてもよい。また、音響的な力、磁気泳動力やその他の力等、当該分野で利用される制御可能な力を用いるようにしてもよい。当業者であれば、本発明のシステムを収容可能な適当な装置構成を理解することができるであろう。
【0093】
光学検出:
光学検出が可能になるように、本発明の装置を構成してもよい。実際に適用する場合には、たとえば、測色であれば、蛍光検出可能な又は発光検出可能なマーカーが望ましい。他の光インターフェースとしては、光ファイバー、表面プラズモン共鳴、減衰全反射やその他の光学インターフェースが挙げられる。
【0094】
他の特徴/特別要件:
(オートクレーブ等他の滅菌法に対する選択された材料の耐久性を考えて、たとえば、酸化エチレンを用いて)本発明の装置を滅菌するようにしてもよい。細胞培養要件に対する表面適合性や、選択された材料や構成にさらなる表面エネルギーを有するものでもよい。本発明の装置は、たとえば、ガス透過性のあるものでもよい。表面への非特異的結合を最小限に抑えるために、ケイ素等で内側を被覆するようにしてもよい。
【0095】
磁気泳動及び磁気トラップの実施形態:
上述の原理に基づいて、シース流と磁場選別の両方を可能にする様々な構造を考えることができる。ある実施形態において、磁場選別は、トラップモードで、外部磁場を印加した後、非標的種と標的種とを順次溶出させる。すなわち、磁性粒子が付着した種を適当な位置に保持すると共に、付着していない種を溶出させる。この最初の溶出ステップが完了後、磁場にとらえられ、溶出されなかった種を、溶出及び回収できるように、何らかの方法で放出させる。
【0096】
一部の実施形態において、MACSシステムのトラップモジュールは、磁性粒子が付着した種及び付着していない種を含むサンプルが流れるチャネルを備える。チャネルの一方側は、外部源から磁場を印加することにより傾斜磁場を発生させる傾斜磁場発生構造を備える。この傾斜磁場は、磁性粒子を磁性粒子が付着した種と共に引き寄せて、捕獲する。サンプルがトラップモジュールを通過後に、印加される磁場を変化させることにより、又は、磁性粒子と磁性粒子が付着した種との間の結合を切断することにより、捕獲された粒子を放出させるようにしてもよい。
【0097】
たとえば、ある実施形態において、流体分離装置は、以下の特性を備えるものでもよい。(a)流体分離装置内にサンプル流を形成するように構成される少なくとも1つのサンプル流入口又はアクセスチャネル、(b)流体分離装置内でサンプル流の周囲にシースを形成する1つ以上の流体の流れを形成するように構成される少なくとも1つのシース流流入チャネル、(c)サンプル流入口及びシース流流入チャネルに流体連結され、サンプル流の流路に沿って配置される選別ステーション、及び(d)外部磁場との相互作用により、線べスステーション内で傾斜磁場を変化させて、サンプル流から磁性粒子を偏向させる及び/又は捕捉する傾斜磁場発生部。
【0098】
選別ステーションが、選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を備えるものでもよい。このような場合、内部空間は、サンプル流の流れ方向と交わる(たとえば、垂直な)第1の横方向寸法と第2の横方向寸法とを備える。種々の実施形態において、第2の横方向寸法(多くの場合、水平面上の幅)は、第1の横方向寸法(多くの場合、鉛直方向の長さ)の少なくとも約2倍以上である。この装置は、少なくとも1つのシース流流入チャネルが、第1の横方向寸法に沿ったサンプル流により互いに分離された2つのシース流を形成するように構成されるものでもよい。
【0099】
さらに、長方形の内部空間を用いる実施形態において、内部空間は、約2ミリメートル以下の距離だけ離れた、あるいは場合によっては、約1ミリメートル以下の距離だけ離れた、実質的に平行かつ実質的に平面状の2つの表面により、部分的に規定される。このような実施形態において、少なくとも1つのシース流流入チャネルは、平行で平面状の2つの表面に接して流れると共に、サンプル流により互いに分離された2つのシース流を形成するように構成される。第1のシース流流入チャネルは、選別ステーションの上流側に位置し、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有するものでもよい。さらに、装置が、選別ステーションの上流側に位置し、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第2のシース流流入チャネルを備えるものでもよい。サンプル流入チャネルは、内部空間の実質的に平行で実質的に平面状の2つの表面に平行な実質的に平面状の表面を有するものでもよい。シース流流入チャネルに平面状の表面を形成する平面構造上にこれらの表面を形成するものでもよい。図1、図2及び図6Aないし図6Cにこのような構造の例を示す。
【0100】
流体分離装置の傾斜磁場発生部は、分離装置上でパターンを形成する複数の強磁性素子を、選別ステーションの近傍に備えるものでもよく、また、複数の強磁性素子の近傍に永久磁石を備えるものでもよい。複数の強磁性素子は、選別ステーションの流体通路内に配置されて、強磁性素子とサンプル流とを流体接触させるものでもよい。強磁性素子がシース流及びサンプル流と直接接触しないように、強磁性素子上に保護層や保護膜を形成することが望ましい。このような層を形成することにより、細胞等のサンプル成分の被毒や汚染等を防ぐことができる。好適な保護層の例としては、酸化ケイ素、窒化ケイ素、又はその他適当な不活性バリア材の薄層(たとえば、10nm〜1μm)が挙げられる。ある実施形態において、強磁性素子は、マイクロパターン化された素子等のニッケル素子を含む。図8Aないし図8Hに例を示す。図示するように、強磁性構造は、平行線、直交グリッド、及び規則的な又は不規則な幾何学形状の長方形アレイ等、系統的なパターンで形成されるものでも、ランダムなパターンで形成されるものでもよい。図示するように、この構造は、規則的又は網目状でもよい。具体的な例では、ニッケル強磁性素子を薄いシリカ保護層で被覆する。種々の実施形態において、傾斜磁場発生部は、一時的に磁性粒子を捕捉し、その後、磁性粒子を放出するように構成される。
【0101】
図2A及び図2Bを参照して上述したように、流れチャネルの下部壁の内側表面上に強磁性構造が形成される。この構造は、傾斜磁場発生(magnetic field gradient:MFG)構造として機能する。外部磁場が、通常、流体媒体の中を流れる磁性粒子を捕捉する駆動力として用いられる。MFG構造は、流れる磁性粒子の捕捉に役立つ局在的に高い傾斜磁場が発生させるように外部磁場を形成してもよい。図2Aに示す実施形態において、交互極性の永久磁石アレイにより外部磁場が与えられる。一般には、1つ以上の永久磁石及び/又は電磁石により外部磁場を発生させることができる。一部の実施形態において、図2Aに示すような磁石群は、個別に又はユニットとして移動可能であり、トラップ領域に印加される磁場を動的に変動させる。
【0102】
ある実施形態において、電磁石を用いて磁場を制御する。他の実施形態において、選別ステーションの近傍に機械的に出入り可能な永久磁石を用いて、磁性粒子を順次捕捉して、その後、放出するのが容易になるように、選別領域内の傾斜磁場を局所的に増大又は減少させるようにしてもよい。電磁石を用いる場合には、処理工程の前半で(磁性粒子の捕捉時)強い傾斜磁場が形成され、処理工程の後半で(磁性粒子の放出時)傾斜磁場が弱められる、あるいは、消失するように、磁場を制御する。
【0103】
一つの実施形態において、装置のトラップ領域は取り外し可能である。別の実施形態において、取り外し可能なトラップ領域は使い捨てである。具体的な実施形態において、トラップ領域、たとえば、ニッケルグリッドを組み込んだプレートが使い捨てであり、トラップ処理後に洗浄を行なって不要物を除去した後、トラップ領域を組み込んだプレートからトラップ領域を「ワンタッチで」取り外せるように切り込み線を形成する外周囲でトラップ領域を規定する。これを、図3Aの側面図と図3Bの上面図とに示す。プレート300は、ニッケルグリッドのトラップ領域310と切り込み線315とを備える。たとえば、吸着カップ装置を用いて、プレート内の切り込み線に沿って破断するのに十分な引っ張り力を印加することにより、プレートから取り外し可能なトラップ領域を引き離すことができる。必要に応じて、磁場を印加して、又は、磁場を印加することなく、取り外し可能なトラップ領域を取り外すことができる。取り外した後、オングリッドで標的細胞を分析及び操作するようにしてもよいし、オフグリッドで標的細胞を分析及び操作するようにしてもよい。
【0104】
図2Aの例に示すように、磁性粒子は、捕捉対象の標的細胞又はその他の種のマーカーに特異的な1つ以上の分子認識成分(たとえば、抗体)により被覆される。したがって、1つ以上の磁性粒子は、これと結合した細胞又はその他の標的種と共に、結合ユニットの形で、トラップモジュール内に流入する。多くの露出結合部分(moiety)を有する大きな標的種(たとえば、哺乳類の細胞)の場合には、複数の磁性粒子が付着することが多い。
【0105】
一部の実施形態において、トラップ領域は、厚みは比較的薄いが、比較的高いスループットを与えるように、かなり幅が広く形成されている。すなわち、チャネルの高さ又は深さは比較的小さいが、チャネル自体の断面積は比較的大きい。流体媒体内のトラップ領域を通って流れる磁性粒子を引き付けるために用いられる磁場の有効距離により、チャネルの薄さを規定するようにしてもよい。一部の実施形態において、したがって、トラップ領域の断面高さは、約2ミリメートル以下であり、場合によっては、約1.5ミリメートル以下、あるいは、約1ミリメートル以下、さらには、約0.8ミリメートル以下である。トラップ領域の内部空間の幅は、スループット要件と製造限界との組み合わせにより決定される。一部の実施形態における幅は1ミリメートル未満であるが、幅を30cm以上とすることもできる。具体的な例では、高さは約0.5〜1ミリメートルで、幅は約15〜25センチメートルである。さらに、複数のシース流トラップ装置を並列に接続することにより、スループットを向上させることができる。一部の実施形態において、1つのサンプル供給部から、複数の並列装置の各々にサンプルが供給される。同様に、1つのバッファー(緩衝液)又はその他のシース流を形成する流体の供給部から、複数の装置に供給される。並列に駆動されるこのような装置の数は、2、3、4、5又はそれ以上でもよい。
【0106】
本発明と共に用いるのに適した流体工学システムの詳細に関しては、引用することによりあらゆる目的で本明細書に組み込まれる、「マイクロ流体磁気泳動装置及びこの装置を用いる方法(Microfluidic magnetophoretic device and methods for using the same)」という名称でSang-Hyun Ohらを発明者として2006年10月18日に出願され、US2008/0124779A1として公開された米国特許出願11/583,989における流れモジュールの説明に記載されている。記載されている詳細としては、たとえば、緩衝液(バッファー)の組成、磁性粒子の特性、外部磁石の特性、MFGを発生させるための強磁性材料、流れ条件、サンプル型、他のモジュールとの統合、流体光学及び磁気素子の制御システム、標的種と磁性粒子との間の結合機構等が挙げられる。一般に、磁気トラップモジュールにおいて印加される外部磁場は、(上述の)米国特許出願11/583,989に記載されるような連続フロー型磁気流ソーターにおいて用いられる磁場と比べて、比較的高い(モジュール全体の構造を考えた場合)。いずれの場合でも、標的種に加えられる磁力は、流動流体に対して(磁性粒子に結合されている)標的種を捕獲して適当な位置に保持することができるように、流体力学的なけん引力よりも十分に大きなものでなければならない。
【0107】
図8に例示する正の選択を行なう典型的な例では、磁気トラップ処理800が以下のように進む。まず、ステップ801で、標的細胞を含有すると考えられる生物試料等のサンプルを、標的細胞の表面マーカーに特異的な捕獲部分(moiety)(たとえば、抗体)で被覆された小さな磁性粒子で、標識する。この標識処理は、マイクロ流体選別装置上で行なうようにしてもよいし、あるいは、マイクロ流体選別装置外で行なうようにしてもよい。標識を行なった後、ステップ803で、同時にバッファー溶液(緩衝溶液)を流しながら、又は、バッファー溶液を流さないで、サンプルを(トラップ領域を含む)選別ステーション内に流入させる。ステップ805に示すように、1つ以上のシース流流入口からバッファーを供給すると共に、サンプルを1つ以上の別の流入口から供給するようにしてもよい。具体的な実施形態において、1つ又は2つのバッファー層流のシース流を形成するようにバッファーを流す。1つのバッファー層流により、選別ステーション近傍の装置の内表面に対する非特異的な結合を防ぐことができる。2つのバッファー層流を用いる場合には、1つのバッファー層流をこの目的で用いる一方で、もう1つのバッファー層流により、装置の他の内表面に対する非特異的な結合を防ぐ。この場合、サンプル層流は、2つのバッファー層流の間に形成される。ステップ807で外部磁場を選別ステーションに加え、ステップ809で流動流体によって与えられる流体力学的けん引力に抗して、磁気的に標識された標的細胞又は他の主を適当な位置に保持する。この一方で、ステップ811で、標識されていない非標的種を連続的に溶出させる。上述したように、磁場は、通常、選別ステーションの近傍に配置される外部磁石により印加される。選別ステーションから大部分又はすべてのサンプル溶液が流出した後、ステップ813で、傾斜磁場を変更する、及び/又は、流体力学的な力を増大させる等、様々な機構のいずれかにより、磁気成分を放出するようにしてもよい。たとえば、チャンバ内の磁場を弱め、消失させ、又は、再配向させると同時に、サンプル流を、(捕獲されている種を放出させるための)放出剤流及び/又はバッファー流に置き換えるようにしてもよい。固定化されていた磁気成分又は磁気成分により捕獲された(精製)種が、最終的にバッファー溶液内で、チャンバから流出する。ステップ815で、構成によってはトラップチャンバのすぐ下流側に配置される、選別チャンバの出口で、標的種を含む精製サンプル成分を採取するようにしてもよい。場合によっては、精製標的種を1つ以上の後処理ステーションに供給する。これで処理フローが終了する。
【0108】
一部の実施形態において、捕獲した標的物質をトラップ領域から直接取り出すようにしてもよい。取り出した物質は、分析したり、細胞生成物の製造に用いたり、その他の目的で処理したりすればよい。たとえば、装置のトラップ領域を、捕獲した物質が付着された状態のままで、装置の残りの部分から剥がせるように、設計してもよい。この場合、傾斜磁場発生領域の周囲に薄肉周縁部又は脆弱領域が形成されるように、装置を設計してもよい。この構成では、トラップ領域を取り外すことにより、サンプルを装置に通過させた後に捕獲された物質を外から取り出すことができる。取り外し処理を容易にするように、タブ、切り欠き、又は隆起部等の機械的構造を備えるように、装置を設計するようにしてもよい。
【0109】
トラップ型磁気分離システムの例を説明する。このシステムでは、各々磁気トラップモジュールを内蔵する流体光学素子が収容されている使い捨ての流体工学チップ又はカートリッジが用いられる。1つの動作モード(正の選択)において、少量の血液等のサンプルをカートリッジの受容ポートに供給して、サンプルを入れたカートリッジを処理/分析機器に挿入する。チップ内の磁気トラップモジュールで、サンプルから磁性粒子及び(存在する場合には)標的種を選別して、濃縮する。このようにしてサンプルを処理後、捕獲した種を放出させて、出力管に採取する。トラップモジュールに印加される外部磁場を弱める又は消失させる、又は、捕獲された種を磁性粒子から放出させる試薬を用いる等、様々な手段で、捕獲した種を放出させることができる。これの代わりに、又は、これと共に、磁性粒子に加えられる流体力学的な力を増大させるようにしてもよい。ある実施形態において、トラップモジュール内にサンプルを流す主な駆動力を与える(シリンジポンプ及び圧力制御装置等の)加圧システムを備えるシステム構成要素が筺体に収容される。当然のことながら、連続式ポンプや空気圧システム等、他の駆動力を用いる構造を採用することもできる。また、バッファーポンプ及び流れ制御モジュールによる制御下で、バッファー貯留部からカートリッジに、バッファー(緩衝液)が供給される。
【0110】
シース流装置製造システム:
一般に、層流形成面を備える構成を実現可能な方法により、本発明の装置及び関連機器を製造することができる。
【0111】
リソグラフィー及びエッチング法を用いて、所望のマイクロ流体の流れを形成するための精密な構造を作るようにしてもよい。コスト削減のために、射出成形により、特定の構成を備える剛体基部を形成するようにしてもよい。基部のみを形成する場合には、チャンバや(液体が流れる)チャネルは開いた状態のまま残される。ラミネート加工、熱処理、音波処理又はレーザー処理を用いて、同様の剛体材料で形成される上部層で密封して(密閉する装置に上部層を接着して)、装置を密閉するようにしてもよい。
【0112】
ガラス、ビニルやその他周知のプラスチックポリマー等の材料を、「ラボオンチップ(lab on a chip)」やその他の装置に用いるようにしてもよい。カートリッジ構造(チャネル、流入口、区画及びその他の流体流路または収容領域)を構成するようにしてもよい。流入及び流出用のポートや加圧流導入/停止用のポート等の相互接続部を、(たとえば)射出成型した構造に取り付ける、又は、射出成型した構造の一部として形成するようにしてもよい。電気的なセンサー、機械的なセンサー、その他様々なセンサー等、他の構成要素も同様に専用の位置に配置するようにしてもよい。
【0113】
本発明のシース流装置製造システムは、流体供給、組立、分離、(バーコード等の)コーディング、滅菌、及び包装用の装置を備える。
【0114】
本発明の製造システムには、食品及び医薬品に関する要件(FDA、FMEA等)、品質管理機構(たとえば、国際標準化機構)、及び特定の目的における品質を保証するために設定された他のレジーム等、様々な政府及び産業界のレジームに準拠するシステムが含まれる。
【0115】
シース流装置計装システム:
本発明の装置及び方法を、ホスト機器と連動して働くように、又は、システム要件を満たすように、適合させる、又は、構成するようにしてもよい。このような適合又は構成の例としては、(以下に示すものに限定されるものではないが)、1つ以上の真空供給、ポンプ及びバルブの自動制御、圧力流、サンプル充填用の注入ループ、温度制御、電気浸透流、容積型ポンプ機能、予想体積流量、遠心力処理、湿度制御及びガス交換制御等が挙げられる。
【0116】
自動計装により流体の流れを制御するようにしてもよいが、装置によっては、手動制御が用いられる。本発明の装置は、たとえば、空気圧又は大気圧を用いて、自動計装と操作可能に結合されている統合ポートを介した流れを形成することができる。
【0117】
捕捉前の処理:
シース流装置において、選別の「上流側」すなわち、選別の前に、さまざまな処理を実施するようにしてもよい。このような処理の例として、標的の標識化、細胞の溶解及びディプリーションが挙げられる。標識化は、後述するように、特異的な結合部分(moiety)を有する磁性粒子をサンプルの標的成分又は非標的成分に結合させることを意味する。溶解は、細胞膜又は細胞壁を破壊して、サンプル内に細胞成分(オルガネラ(細胞小器官)、生体分子等)を放出させることを意味する。ディプリーションは、分離前に、サンプル内の特定の1つ又は複数の成分を除去することを意味する。ディプリーションの例としては、音波等の手段でサンプルから赤血球を除去する処理が挙げられる。オンチップ又はオフチップで実行可能な他の前処理操作には、染色、固定化、又は、細胞内への外来物質の導入を行なうための様々な化学手段が含まれる。
【0118】
多くの場合、サンプルの標的成分又は非標的成分が必要に応じて磁気ビーズで「標識化された」ことを確認する必要がある。この標識化処理は、磁性粒子が捕獲され、流動流体媒体内で固定化されるトラップ/分離段の上流側で(前に)実施される。
【0119】
磁性粒子は、標的種又は非標的種に対して特異的な親和性を有する表面官能基を備えるものでもよい。したがって、磁性粒子は、関連種にさらされると、この種に結合して、複合体を形成する。本発明は、サンプルに含まれる適当な種又は成分への磁性粒子の結合を容易にする機構に関する。
【0120】
必要不可欠ではないが、通常、このような選別前処理は、トラップ領域と流体連結して配置される1つ以上の個別のチャンバ又は貯留部内で実施される。このようなチャンバ又は貯留部は、トラップ領域と同じ装置(チップ)上に備えられるものでもよいし、別の装置又はチップ上に備えられるものでもよい。また、このようなチャンバ又は貯留部は、マイクロ流体に適した寸法でもよいし、必要に応じて、少し大きな寸法でもよい。たとえば、1つ以上の前処理貯留部が、各々、約5ミリリットルの容積を有する。貯留部の容積は、0.5mlから10mlの範囲でもよい。
【0121】
磁気ビーズやサンプル及び結合を容易にするために用いられる試薬は、各々、1つ又は複数の貯留部に供給される。磁性粒子は機能化した形で供給されるものでもよく、この場合には、他の試薬を供給する必要はない。貯留部内で、他の成分に対して磁性粒子を移動させることにより、標識化が容易になる。ある実施形態において、2つの別々のチャンバに順次空気圧を加えることにより、磁性粒子を移動させることができる。別の実施形態において、磁性粒子の放出に関連して後述するような種類の磁気混合機構により、磁性粒子を移動させるようにしてもよい。たとえば、磁場を振動させることにより磁場を移動させる等、混合が容易になるような同様の機構を用いるようにしてもよい。混合機構の他の例としては、超音波攪拌や攪拌が挙げられる。磁性粒子の流体混合を行ない、サンプル種の標識化及び/又は放出を可能にするシステム及び方法の例が、参照することにより本明細書にあらゆる目的で組み込まれる、2009年4月16日出願のPCT特許出願No. PCT/US2009/040866(PCT公報No. WO2009/129415)に詳述されている。
【0122】
捕捉後の処理:
シース流装置において、選別後に様々な処理を実行するようにしてもよい。これらの処理は、選別ステーション内で実施するものでもよいし、選別ステーションの下流側で実施するものでもよい。このような処理には、一般的に、標的種の定量(たとえば、細胞の計数処理)、標的種に関する分子情報の抽出(たとえば、特定のSNPの存在/不存在)、及び/又は、細胞由来生成物の抽出(たとえば、捕捉された幹細胞の分化型)が含まれる。好適な処理の例としては、光学的な方法による標的種の直接的検出、アッセイ、捕捉した細胞又はウィルスの成長、標的種の形質転換(たとえば、捕捉した幹細胞の分化)、発現パターンのプロファイリング及び遺伝的特性評価が挙げられる。発現プロファイル及び/又は遺伝子配列の特性評価を行なうために利用可能な所定のツールとして、mRNAアレイ等のマイクロアレイや、ハイスループット・シークエンシング・ツールがある。詳細に関しては、(上述の)PCT特許出願No. PCT/US2009/040866に記載されている。
【0123】
分離後処理において、トラップステーション内で捕捉された又は選別ステーションで分離された磁性粒子から標的種を放出させる処理が行なわれることが多い。典型的な状態では、捕捉処理終了後、トラップ領域に残っているサンプル種のみが磁性粒子に結合されている。多くの用途において、以降の処理を行なう前に、磁性粒子から捕捉された種を分離させることが重要となる。
【0124】
本明細書に記載する分離後処理では、磁性粒子から結合した種を放出させる機構が用いられる。種々の結合及び放出システムを利用することができる。たとえば、(1)捕獲した種に磁力ビーズを化学的に結合させている結合を消化する、(2)捕獲した種に結合する化学結合又は生化学結合機構と競争する、及び(3)二次抗体との結合を切断するような放出試薬を用いるようにしてもよい。捕捉された標的種を、単に濃縮し、精製し、及び/又は、放出するようにしてもよいし、さらに分析、及び/又は処理を行なってもよい。
【0125】
一部の実施形態において、上述したようにトラップ内で捕捉され、洗浄され、必要に応じて放出された粒子を、サンプルに含まれる標的種に対する1つ以上のマーカー(たとえば、標識化した抗体)にさらすようにしてもよい。検出対象の所定の腫瘍細胞は、たとえば、2種類以上の特異的表面抗原を発現させる。このような腫瘍を検出する際には、2種類以上のマーカーを用いるようにしてもよい。このような抗原の組み合わせは、特定の腫瘍でのみ生じる。1種類以上の標識を十分な長さの時間トラップに流した後、捕獲した粒子/細胞を洗浄するようにしてもよい。その後、粒子/細胞を、トラップから取り出した後で分析するようにしてもよいし、in situで分析するようにしてもよい。たとえば、第1の標識と第2の標識がフルオロフォア(蛍光色素分子)である場合には、トラップの中身をスキャンするために、これらの標識をプローブビームで励起して、第1の標識と第2の標識に特徴的な周波数で放射光を検出するようにしてもよい。ある実施形態において、個々の細胞又は粒子を撮像して、トラップ301の中身の特性評価を行なって、標的腫瘍細胞の存在(又は量)を検出するようにしてもよい。当然のことながら、腫瘍細胞以外の様々な標的成分も検出対象となるが、このような例として、特定のバクテリアやウィルス等の病原体が挙げられる。
【0126】
別の実施形態において、サンプルに含まれる核酸を適当な機構で捕獲するようにしてもよい。このような核酸は、増幅させることなく、たとえば、マイクロアレイを用いて、直接検出及びプロファイリングを行なうようにしてもよい。あるいは、PCR試薬(ヌクレオチド、ポリメラーゼ及びプライマーを含有する適当なバッファー溶液)をトラップに導入して、適当なPCR熱サイクルプログラムを実行するようにしてもよい。適当な増幅レベルになるまで熱サイクルが続けられる。その後、遺伝子型決定や特定の変異株の検出等、増幅された標的核酸の検出をin situで行なうようにしてもよい。あるいは、核酸マイクロアレイ又は電気泳動媒体を含有する別のチャンバ等を用いて、トラップの下流側で検出を行なうようにしてもよい。別の実施形態において、標的配列に対して、適当に標識されたインターカレーション・プローブ又は供与体消光プローブ等を導入して、トラップ内でリアルタイムでPCRを行なうようにしてもよい。プローブを、他のPCR試薬(たとえば、プライマー、ポリメラーゼ及びヌクレオチド)と共に導入するようにしてもよい。in situのリアルタイムPCRは、発現レベルを分析するような分析に適している。一部の実施形態において、リアルタイムPCRの場合でも終点PCRの場合でも、トラップ領域に焦点を合わせた蛍光顕微鏡等の適当な検出装置を用いて、増幅された配列の検出をトラップ内で実施することができる。
【0127】
一部の実施形態において、in situでサンプルから反応チャンバに細胞を捕獲して収容するようにしてもよい。その後、(塩や洗浄剤等の)溶解剤をチャンバに供給する。溶解剤を、溶液プラグで供給し、チャンバ内で拡散させて、固定化した細胞を溶解させるようにしてもよい。これにより、細胞の遺伝物質を抽出して、後段で増幅させることができる。ある実施形態において、溶解剤をPCR試薬と共に供給して、溶解剤により細胞を溶解させて核酸を取り出すのに十分な時間が経過した後に、熱サイクルプログラムを開始して、標的核酸を検出するようにしてもよい。
【0128】
別の実施形態において、核酸試料を、サンプルとして供給し、適当なハイブリダイゼーション配列を含有する磁性粒子に結合させるようにしてもよい。その後、磁性粒子をトラップ内で選別して、固定化する。PCR試薬をチャンバに供給して、すべてのバルブを閉じた後、熱サイクルによりPCRを開始するようにしてもよい。最初の温度逸脱の間に、捕獲された核酸試料を、磁性粒子から放出させることができる。
【0129】
ここで説明する核酸増幅法は、ポリメラーゼ連鎖反応(PCR)であるが、実施形態において、リアルタイム鎖(ストランド)置換増幅(SDA)、ローリングサークル増幅(RCA)及び多重置換増幅(MDA)等、様々な等温核酸増幅法などの非PCR増幅法を用いるようにしてもよい。これらの増幅法は、適当なバルブ及び流路系を備える装置内のチャンバ等のトラップで実施可能である。
【0130】
核酸の抽出と分析とに加えて、捕獲した細胞自体を直接処理生成物として用いることもできるし、さらに処理を行ない、所望の生成物を製造することもできる。たとえば、装置を用いて、細胞由来生成物として、血液または組織から幹細胞を単離することができる。あるいは、捕獲した細胞を成長因子、ケモカインや抗体等の試薬で処理し、所望の細胞由来又は分子由来の生成物を製造するようにしてもよい。装置内で所望の生成物を得るために、多段階の精製及び処理工程を行なうようにしてもよい。
【0131】
本発明の装置及び方法を用いる作業の一例として、特に細胞培養によりタンパク質が発現されるため、自動タンパク質精製工程が挙げられる。タンパク質精製は手動で行なうこともできるが、本発明の装置及び方法を適用することにより、時間と労力の節約になる自動化が可能になり、低コストで高純度の生成物を供給できる。
【0132】
たとえば、ウィルス、バクテリア、昆虫又は哺乳動物の細胞等の生命体内で所望のタンパク質が発現する場合、発現タンパク質を選択的にバッググラウンド物質から単離可能なように、発現タンパク質の設計を行なうようにしてもよい。このような設計としては、たとえば、1つ以上の選択可能なアミノ酸タグを用いて、タンパク質にアミノ酸配列を加えるようにしてもよい。このようなタグの例としてHisタグ、FLAGタグやその他のエピトープタグ(Eタグ)が挙げられる。(たとえば)細胞を、上述したサンプル貯留部の1つに導入すると共に、同じ貯留部又は1つ以上の他の貯留部に磁性粒子及び溶解剤を導入する。磁性粒子は、NTAアガロースや他の樹脂等ニッケルに対する親和性の高い媒体で被覆した磁気ビーズでもよい。空気圧混合、水圧混合、又は磁力混合等、上述した1つ又は複数の方法で、サンプル貯留部間の混合を促進するようにしてもよい。溶解剤により細胞が破壊されて、適当な条件下で、磁性粒子が溶解物内の標的タンパク質に結合する。その後溶解物を磁気分離チャンバに流すと、チャネル表面上にビーズが捕捉される。洗浄用バッファー(緩衝液)を加えて、タグ化されていない非結合タンパク質やその他の細胞フラグメント(断片)を溶出させる。様々な実施形態において、磁気分離チャンバを、磁気的に、又は、その他の手段で攪拌して、さらに、捕獲された粒子の間にくっついた非結合タンパク質を取り除くようにしてもよい。高ストリンジェント洗浄用バッファーを用いて、不要な粒子をさらに溶出させるようにしてもよい。この時点で、チャンバ内には、非常に高い選択性で、標的タンパク質及びこれに結合した磁性粒子のみが残っている。さらに処理を行なう場合には、必要に応じて、少量のビーズ放出剤を用いて、標的タンパク質を放出させるようにしてもよい。最後に、磁性粒子を放出させるようにしてもよい。これら様々な処理は装置内の単一又は使い捨てカートリッジ内で行なわれるので、時間とコストを節約するために、この手順を予めプログラミングして、自動化するようにしてもよい。このような構成により、RNA等、他の核酸関連生成物を、上述のように選択可能にするために標識化して、選択的に捕捉することもできる。
【0133】
一般的な適用:
上述したように、本発明のシース流装置は、広範囲に適用可能である。磁性粒子で標識した様々な種類の標的種の捕獲及び分離に用いることができる。したがって、本発明のシース流流体装置を、たとえば、体液サンプルの調製及び分析、希少分子又は細胞の分離、化学物質ライブラリーのスクリーニング、臨床検査室におけるポイントオブケア(POC)診断、環境試験及びモニタリング、消費者製品及び食物の品質管理等、さまざまな用途に用いることができる。本発明は、学術分野、産業分野及び臨床分野で特に有用である。学術、産業及び臨床分野において、本発明のシース流装置は、特に、試験や特性評価に加えて、細胞株、タンパク質及びmRNAの増幅、遺伝子コード、分子署名プロテオミクス等、その他処理を行なうための細胞株、タンパク質、遺伝物質等の単離に有用である。シース流装置及び方法を、たとえば、血液サンプルからのCTC単離による癌の診断等、病気の早期発見及び診断に用いることができる。臨床分野での用途としては、臨床試験候補を選出するための潜在患者集団のスクリーニング、及び/又は、治療効果の情報及び/又は今後の治療計画を策定するための情報を得るために行なう、既に臨床試験に登録している患者の体液の検査、補助療法や最新補助療法の有効性の測定などがある。具体的な例を、以下で説明する。
【0134】
シース流研究ツール:
本発明のシース流装置を、これに限定されるものではないが、たとえば、分子ライブラリーのスクリーニング等、科学研究に広範囲に用いることができる。たとえば、本発明の装置をアプタマーライブラリーのスクリーニングに用いることができる。具体的には、本発明の装置でタンパク質の生成及び単離を行なった後、同じ1つの装置内で、タンパク質をアプタマーライブラリーと照合する。本明細書で用いる「アプタマー」という用語は、最も広い意味で用いられ、特定の標的分子に結合するオリゴ核酸又はペプチド分子及び模倣分子等の関連合成分子を意味する。本発明のシース流装置を、アプタマーライブラリー、リボゾームライブラリー、ファージ・ディスプレイ、バクテリアペプチド・ディスプレイ、酵母菌ディスプレイ等の分子又は細胞ライブラリー選別を利用するバイオマーカー(生体指標)/創薬プラットフォームに用いることもできる。さらに、本発明のシース流装置を、細胞の計数、分類、増幅、分化等を含む様々な評価を行なう目的で標的細胞を単離するために用いることもできる。
【0135】
シース流生物学的/化学的モニタリング、合成又は分析:
化学物質の危険性モニタリングや、核酸分析(及び、たとえば、ポリメラーゼ連鎖反応を用いた増幅)や、閉鎖環境モニタリング、個人レベルのゲノミクス及び診断、生理環境に供給するのに適したウィルス外被やその他ナノケージ内に包含したアプタマー治療薬の合成やその他の化学物質合成等の化学合成など、特定条件の連続モニタリング等、様々な生物学的又は化学的モニタリング、合成又は分析を目的として、本発明を構成する、又は、適合させるようにしてもよい。家庭用の用途としては、たとえば、pH指示薬、金属指示薬やその他の水質指示薬を用いて、プールや飲料水の水質モニタリングを行なうようにしてもよい。生物医薬品生産工程におけるバイオリアクターのモニタリング等の生産工程管理や食品産業に適するように、本発明の装置を構成する、又は、適合させるようにしてもよい。また、流体制御や分析、ガス制御や分析に適するように、本発明の装置を構成する、又は、適合させるようにしてもよい。たとえば、連続フロー用に本発明の装置を適合させることにより、細胞を選別する速度のモニタリングを行なうことができる。さらに、供給連鎖モニタリング等、生産品質管理に適するように、本発明の装置を構成するようにしてもよい。本発明のシース流装置は、高い選択性で液体サンプルから標的種を捕捉できるため、たとえば、複数種の高度な複合混合物の流体生体サンプルから標的種を高い純度で単離する必要がある治療薬分野等では、多くの従来システムに比べて大きな利点がある。
【0136】
構成:
プレフィル式オンチップキット
本発明の一つの態様は、製造の容易さや使い勝手を考えて、特定の目的に有用な試薬を予め充填した(プレフィル式)シース流装置である。たとえば、生体サンプルの調製に有用な試薬を装置に予め充填する(プレフィルする)ようにしてもよい。この「オンチップキット」型の態様のシース流装置を、上述した様々な用途に適合させることができる。
【0137】
このような「オンチップキット型」の実施形態では、様々な試薬を用いることができ、体液サンプルの調製及び分析、希少分子又は細胞の分離、化学物質ライブラリーのスクリーニング、臨床検査室におけるポイントオブケア(POC)診断、環境試験及びモニタリング、消費者製品及び食物の品質管理等、さまざまな分野で適用可能である。本発明では、このような使用に適したプレフィル型装置を単一で用いることもできるし、複数で用いることもできる。このような構成は特に限定されるものではなく、関係機器や方法を考慮した構成であればよい。
【0138】
使い勝手を考えて、試薬を、所定量の貯蔵部に収容する等、シース流装置内に収容するようにしてもよい。たとえば、細胞を培養して所望のタンパク質を発現させることにより、実質的に精製されたタンパク質製剤を得ることができる。対象となる貯蔵部を細胞の培養に用いる場合には、制御された条件下で流体連結されるアクセスポートを介して適当な試薬を供給するようにしてもよい。たとえば、細胞を溶解させる、細胞を洗浄する、及び、細胞の部分(moiety)に選択的に結合されたビーズを除去するためのバッファーを試薬として用いることができる。また、抗体、アプタマー、及び標的分子に(必ずしも特異的である必要はないが)選択的に結合する他の分子等、選択的結合分子を試薬として用いることもできる。さらに、磁気ビーズ、音波ビーズ、及び、その他同様の機能を与えるビーズ等、選択分子を捕捉できる様々な部分(moiety)を試薬として用いることも可能である。また、複合混合物から特定の核酸を選別するのに適したプライマー等の核酸を試薬として用いることもできる。たとえば、本発明の装置を用いて、装置内部で、ゲノムDNAをスクリーニングしたり、ポリメラーゼ連鎖反応により選択配列を増幅したりすることができる。
【0139】
集積システム:
オンチップキット型の構成を独立して用いることもできるし、本発明のシース流装置を含む集積システムの少なくとも一部として用いることもできる。本発明のシース流装置の「上流側」又は「下流側」に別の処理モジュールやチャンバを加えるようにしてもよい。たとえば、誘導体化や他の反応を行なうための所望の高分子物質やその他の物質を収容する貯蔵部を設ける等、適当な発現後修飾流体回路を設けるようにしてもよい。具体的な例としては、本発明のシース流装置を、培養した細胞からタンパク質を発現させる流体回路を備える構成として、必要に応じて、対象タンパク質を誘導体化できるペグ化モジュール等、発現したたんぱく質を誘導体化するための追加モジュールを備えるようにしてもよい。
【0140】
流体工学装置内で磁気トラップソーターと統合可能な操作モジュールの例としては、(a)蛍光活性化セルソーター等の追加濃縮モジュール及び洗浄モジュール、(b)サンプル増幅(たとえば、PCR)モジュール等の反応モジュール、制限酵素反応モジュール、核酸シークエンシングモジュール、標的標識モジュール、クロマチン免疫沈降モジュール、架橋モジュール及び細胞培養モジュール、(c)核酸、抗体又は他の特異性が高い結合剤のマイクロアレイ等の検出モジュール及び蛍光分子認識モジュール、及び(d)細胞を溶解させる、ウィルスタンパク膜の破壊又はその他小さな生体の成分を放出させる溶解モジュールが挙げられる。これらのモジュールは、各々、磁気ソーターの前段に備えるようにしてもよいし、又は、後段に備えるようにしてもよい。単一の流体工学システムにおいて、複数の同一種類の又は異なる種類の操作モジュールを磁気ソーターと統合するようにしてもよい。さらに、1つ以上の磁気ソーターを、種々の他の操作モジュールに対して、並列に配置するようにしてもよいし、直列に配置するようにしてもよい。これらの操作モジュールの一部を、サンプル中の標的種を定常状態で保持するような、又は、一般的に所定容量内に閉じ込めるようなトラップとして設計又は構成するようにしてもよい。操作モジュールの特性は、所望の反応の種類に応じて決まり、温度管理システム、マイクロミキサー、触媒構造及び検知システムを備えるものでもよい。温度管理システムは、ヒーター、温度センサー、及びマイクロ熱交換器を備えるものでもよい。これらの構成要素をすべて集積して、正確な温度管理を行なうようにしてもよい。このような温度管理は、たとえば、DNA増幅にPCRを用いる際には、極めて重要となる。
【0141】
上述したモジュールの例から明らかなように、集積流体工学装置のモジュールにおいて標的種及び/又は非標的種上で実施可能な操作には、選別、磁性粒子への結合(本明細書では「標識」とも称する)、結合、洗浄、捕捉、増幅、不要な種の除去、沈降、切断、希釈、結紮、シークエンシング、合成、標識(細胞の染色等)、架橋、培養、検出、撮像、定量、溶解等が含まれる。本発明の装置を、1つの同じ装置内で1つ以上の機能を果たすように構成してもよい。
【0142】
集積シース流流体装置の磁気選別モジュールにおいて実施可能な生化学的操作の例としては、プラスミド、アプタマー、タンパク質及びペプチドの合成及び/又はスクリーニング、酵素活性の評価及びタンパク質と炭水化物の誘導体化が挙げられる。広範囲に及ぶ生化学的及び電気生理学的アッセイを実施可能であり、これには、(1)DNA及びRNAオリゴマーのゲノム解析(シークエンシング、ハイブリダイゼーション)、PCR及び/又はその他の検出及び増幅スキーム、(2)遺伝子発現、(3)酵素活性アッセイ、(4)受容体結合アッセイ、及び(5)ELISAアッセイが含まれる。前述のアッセイは、均一系、ビーズベース、及び表面結合等様々なフォーマットで実施可能である。さらに、本明細書で説明する装置を利用して、特定の酵素又は触媒を用いる生体分子の連続生産、及び、治療薬等、生体系で活性な生体分子又は分子の生産と送達を実施することも可能である。本明細書に記載するシース流装置を用いて、マクロ流体容量で従来行なわれているようなペプチド、タンパク質並びにDNA及びRNAオリゴマーのコンビナトリアル合成を実行することもできる。
【0143】
特定の用途:
細胞捕獲及び処理
上述したように、本発明のシース流装置は、様々な生体物質の成分の培養、精製若しくは単離又は様々な生体物質の解析に特に有用である。特定の態様において、細胞溶解、ビーズを用いた置換アッセイ、かん流、ろ過、サンプル調製、走化性、全血分離及び様々な他の処理に適するように、本発明の装置を構成する又は適合させるようにしてもよい。
【0144】
複合生体サンプルから特定の細胞型を単離することは特に有用である。たとえば、生体サンプルは、1つ以上の幹細胞、バクテリア、ヒト細胞、生体膜材料、哺乳類細胞、酵母菌、藻類、原発腫瘍細胞、不死化細胞株、組織又は器官培養、単細胞又は多細胞生命体、カビ、及び、培養物などの、その他サンプルから単離可能な生命体を含むものでもよい。従来、このような複合混合物からの細胞株単離は非常に手間がかかるだけではなく、収率が低い、純度が低い、処理工程が多いことから単離した細胞が死んでしまう等、満足な結果が得られないことが多かった。上述したように、本発明のシース流装置は、細胞選別を行なうための流体回路を備えるだけではなく、特性評価や治療等に用いるために後で増殖や分化を行なうことができる様々な細胞型の単離を可能にするものである。本発明のシース流装置は、ex situ(その場以外)及び/又はin situ(その場)での増殖や分化等、単離後処理にも利用できる。
【0145】
たとえば、標的細胞に選択的な抗体や化学反応基等の結合剤を含有する磁性粒子で細胞を標識化することにより、標的細胞型を単離することができる。サンプルを磁性粒子にさらすと、磁性粒子に結合させた選択的結合剤を介して、標的細胞が選択的に磁性粒子に結合する。本発明のシース流装置の用途として、2種類の細胞型である幹細胞と循環腫瘍細胞(CTC)とを例示する。シース流装置及び方法を幹細胞とCTCとに適用した実施形態の詳細を以下に記載する。
【0146】
幹細胞:
幹細胞処理は、ヒト疾患の様相を変化させて、苦痛を軽減する可能性があるものと医学研究者たちは考えている。自己再生を行なって新しい幹細胞集団を形成するという幹細胞の特性により、拒絶や副作用のリスクなしに、体内の疾患組織や損傷組織の修復及び/又は交換(標的細胞集団に分化させることにより)を実現するという大きな可能性がある。医学研究者たちは、成体幹細胞及び胚性幹細胞技術を用いた、癌、代謝異常、心不全、筋損傷及び神経疾患の治療に期待をかけている。幹細胞治療が有望であると考えられている具体的な疾患には、脳損傷、癌、脊髄損傷、心臓障害、造血、はげ頭、歯の欠損、難聴、失明及び視覚障害、筋委縮性側索硬化症、移植片体宿主拒絶反応、クローン病、神経及び行動の先天性異常、糖尿病、整形外科的障害、傷治療及び不妊症が挙げられる(The Leading Edge of Stem Cell Therapeutics(最先端の幹細胞治療) Singec Iら、Annu. Rev. Med. 58: 313-328, 2007年参照)。
【0147】
幹細胞研究及び/又は治療でカギとなるのは、高純度の生存幹細胞を単離することである。上述したように、本発明のシース流装置及び方法により、たとえば、血液、骨髄、臍帯やその他のソースから特定の幹細胞を選別及び単離することができ、また、必要に応じて、たとえば、シース流装置で単離した細胞をin situ及び/又はex situで培養する等、単離した細胞をさらに処理することも可能である。
【0148】
したがって、本発明の特定の態様は、生体サンプルから幹細胞を単離するように構成されるシース流装置及び方法である。シース流装置内で、たとえば、磁気泳動ビーズ、音波ビーズ、又は、選択された分子(及び細胞)を捕獲可能なその他の部分(moiety)等、選別に適した様々な媒体に選択的結合分子を接続させることができる。一実施形態において、シース流装置は、幹細胞に選択的な部分(moiety)、たとえば、CD34+選択的結合分子、を含有する磁性粒子を用いる。特定の実施形態において、磁性粒子を標的幹細胞に結合させることにより、幹細胞の捕獲と単離を行なうようにしてもよい。また、装置のバッファーシース流によって囲まれたサンプル流にのせて磁性粒子を移動させることにより、シース流を介してサンプル流から採取グリッドに磁性粒子を選択的に引っ張る又は偏向させることができる。
【0149】
採取グリッド上で、又は、採取グリッド外で、単離した幹細胞の特性評価及び/又は処理を行なうことができる。上述したように、本発明のシース流装置は、幹細胞集団を増幅する、及び/又は、幹細胞を分化させるための追加の単離後処理モジュール又は機能を備えるものでもよいたとえば、細胞の捕捉に用いられる磁性粒子からの分離前又は分離後の結合部分(moiety)及び局所環境に応じて、単離後修飾を行なうことができる。当業者には自明のことであるが、このような単離後モジュール及び機能が、さらに、培地、酸素、温度、培地交換等、幹細胞を成長させるためのバイオリアクター機能を備えるものでもよい。
【0150】
具体的な例では、血液から適当な幹細胞を選別して、幹細胞を培養して増殖させるように、本発明のシース流装置を構成するようにしてもよい。選択培地、成長因子及びその他の材料を、本発明のシース流装置に予め充填する(プレフィルする)ようにしてもよい。たとえば、抗体やアプタマー等の造血幹細胞選択試薬を用いるようにしてもよい。このような試薬は、選択的に、たとえば、CD34+幹細胞に結合する。たとえば、CD34+細胞に結合した磁性粒子又は非結合の磁性粒子を適当な位置に保持する一方で、他の物質を洗浄除去する。ビーズ放出試薬、たとえば、市販のビーズ放出試薬を用いて、結合した細胞を放出させる。磁力でビーズを捕獲する一方で、幹細胞を上澄み液に分離することができる。他の種類の幹細胞としては、胚性幹細胞、胎児幹細胞、羊膜幹細胞、成体幹細胞又は人工多能性幹細胞が挙げられる。
【0151】
上述したように、単離した細胞、この例では幹細胞を用いて、シース流装置内で、液体サンプルから分離した幹細胞からの細胞由来生成物を得るようにしてもよい。細胞由来生成物には、たとえば、増殖細胞集団、分化細胞、及び、遺伝子コード情報、RNA、DNA、発がん性情報等、細胞の分子成分の分析により得られた生成物が含まれる。幹細胞の場合、本発明のシース流装置のモジュールを用いて、幹細胞を培養し、幹細胞集団の増殖及び/又は分化をin situで行なうことができる。あるいは、幹細胞を取り出して、別の装置内で増幅及び/又は分化を行なうようにしてもよい。増殖した幹細胞集団を、患者の、たとえば、腫瘍部位や神経組織や筋組織等の組織損傷部位に注入するようにしてもよい。また、幹細胞には、組織を修復する機能や、組織修復を助ける機能もある。腫瘍学において、幹細胞には、腫瘍破壊を助ける機能をある。さらに、癌幹細胞(CSC)は、腫瘍性増殖を妨害すると共にCSCを殺す化学療法を無力化して、癌性増殖を再発させる成分であると考えられている。本発明のシース流装置を用いて、本明細書で記載する他の幹細胞と同様に、CSCの単離、特性評価、及び処理を行なうことができる。
【0152】
本発明のシース流装置を、さらに、組織再生に用いることもできる。たとえば、前述したようにシース流装置を幹細胞増殖に用いる場合、試薬を用いて、単離した幹細胞を、細胞由来生成物の別の例である異なる型の組織関連細胞に分化させるようにしてもよい。本発明のシース流装置を、生体適合性のある骨格とex vivo(生体外)で組織を増殖するために適した試薬と共に構成するようにしてもよい。一つの実施形態において、シース流装置内で単離しin situ(その場)で増殖させた細胞を基にして、移植を目的とした肝臓組織や他の器官の組織の培養を行なうように、シース流装置を構成するようにしてもよい。本発明の装置を幹細胞の選別とin situでの増殖を行なうように構成する場合、さらに、所望の標的組織への幹細胞の分化等、様々な用途にあわせて、予め充填させた(プレフィル)試薬を備えるように装置を構成してもよい。シース流装置自体を生体適合性の材料から形成するようにしてもよく、この場合には、幹細胞増殖組織(又は骨格上の細胞集団)を患者に直接使用又は移植することも可能である。別の例において、本発明のシース流装置を、幹細胞を単離して、角膜移植に適した角膜組織を生成するように構成することもできる。
【0153】
循環腫瘍細胞:
癌による死亡の大部分は、血行性転移拡散及び全身の組織内での腫瘍細胞の増殖に起因するものである。腫瘍由来の生存上皮細胞、循環腫瘍細胞すなわちCTCは、癌患者の末梢血内で同定され、難治性の転移性疾患の原因であると考えられる(Nagrath, S.ら、Isolation of Rare Circulating Tumour Cells in Cancer Patients (癌患者における希少循環腫瘍細胞の単離)Microchip Technology, Nature, Vol 450: 20/27, 1235-1240, 2007参照)。したがって、CTCの研究は、早期転移拡散の生物学(機構)と高い関連性があり、顕性転移のある患者において診断のための強力な情報源となる(Pantel, K.ら、 Detection, Clinical Relevance and Specific Biological Properties of Disseminating Tumour Cells, (播種腫瘍細胞の検出、臨床的関連及び特定の生物学的特性)Nature Reviews, Vol. 8: 329-40, 2008参照)。さらに、癌患者の血液からのCTCの分子解析を行なうことにより、治療過程で腫瘍遺伝子型の変化をモニターすることが可能になる(Detection of Mutations in EGFR in Circulating Lung-Cancer Cells(循環肺癌細胞におけるEGFR変異株の検出)、Maheswaran, S.ら、N Engl J Med, 359:366-77, 2008参照)。単純な採血等により得られた液体サンプルを用いる方法は、非血液癌の検出、特性評価及びモニタリングの情報源として、侵襲的な生検と比べて大きな利点がある。
【0154】
CTC研究及び/又は治療でカギとなるのは、高純度のCTCを単離することである。本発明のシース流装置を用いることにより、固形腫瘍の生検を行なう必要がなく、採血等によって得られた液体サンプルからCTCを選別して、単離することができる。本発明の装置及び方法を用いることにより、分析を目的として、癌のような細胞増殖異常と診断された及び/又はモニタリングされている患者の血液から特定の循環腫瘍細胞を選別することができる。本発明のシース流装置を用いたポイントオブケア(POC)診断は、癌型及び/又は進行等の早期及び正確な診断を行なうための強力なツールである。また、単純な採血等から得た系内CTCの迅速なターンアラウンド分析は、現在および将来の治療計画の策定や、増殖した腫瘍を取り除く外科手術等の補助療法の有効性を比べることができるため、癌患者に有効である。
【0155】
したがって、本発明の一つの態様は、患者の治療計画をモニタリングして、必要に応じて調節する方法であって、(a)一次治療計画を実施中の患者から腫瘍細胞を含むサンプルを採取する工程と、(b)分離法により前記腫瘍細胞をサンプルから分離する工程であって、(i)腫瘍細胞に対する特異親和性を有する磁性粒子を用いてサンプルを標識して、標識サンプルを生成することと、(ii)標識サンプルから磁性粒子を偏向させ、及び/又は、捕捉して、これにより、サンプルから腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、標識サンプルを通すことと、を備え、バッファー溶液のシース内にサンプルを流すことによって、流体装置へのサンプルの非特異的な結合を抑制する工程と、(c)工程(b)でサンプルから分離された腫瘍細胞の特性評価を行なって、患者に対する今後の治療を提案する及び/又は既存の治療の有効性を評価する工程と、を備える。一実施形態において、サンプルは、患者から採取した流体サンプルである。具体的な実施形態において、サンプルは、血液サンプルである。他の実施形態において、腫瘍細胞はCTCである。一つの実施形態において、一次治療計画は化学療法レジメンであり、さらに具体的な実施形態において、今後の治療は異なる化学療法レジメンである。一実施例において、腫瘍細胞の特性評価は、計数であり、別の実施形態において、腫瘍細胞の特性評価は、分子特性評価である。さらに具体的な実施形態において、分子特性評価は、腫瘍細胞内の遺伝子変異である。
【0156】
一実施形態において、患者に対する今後の治療を提案する工程は、一次治療計画の今後の有効性を予測することを備える。別の実施形態において、患者に対する今後の治療を提案する工程は、患者に関して前にはわかっていなかった腫瘍細胞の特徴を考慮した、一次治療計画とは異なる二次治療計画を特定することを備える。別の実施形態において、方法は、さらに、(d)患者に二次治療計画を実施した後で、患者から腫瘍細胞を含むサンプルを採取する工程と、(e)工程(d)で採取されたサンプルと腫瘍細胞に対して(先の段落で説明した)工程(b)及び工程(c)を実施する工程と、を備える。
【0157】
したがって、本発明の方法及び装置を用いて、臨床医は、たとえば、臨床試験に適した候補を選出するための潜在患者集団のスクリーニングを行なうことができる。これにより、対象となる治療計画に対して難治性の反応を示す癌遺伝情報を有するCTCの患者に対して、他の可能な治療を試すことができる。あるいは、特に、難治性の患者を、特定の新しい治療計画のターゲットにすることも可能である。別の例として、患者のCTCの計数分析及び/又は分子成分分析を行なって、この情報から、現在の治療が有効であるか否か、現在の治療を続けるべきか否か、又は、別の若しくは追加の治療を考慮するべきか否かを判定することができる。別の実施形態において、患者のCTCの計数分析及び/又は追加の特性評価分析を行なって、補助療法が有効であったか否かの評価を行なうことができる。具体的な例において、患者のCTC計数から、補助療法が成功し、さらなる治療は現在必要ではないこと、が示唆される。別の具体的な例において、患者のCTC計数から、補助療法が成功したが、以前の患者CTC特性評価と比較したCTCの変異に基づいて、他の治療が必要であること、が示唆される。さらに別の具体的な例において、患者のCTC計数から、補助療法が失敗し、他の補助療法が指示されていること、が示唆される。
【0158】
実施形態:
本発明の一つの実施形態は、流体分離装置であって、(a)流体分離装置内にサンプル流を形成するように構成される少なくとも1つのサンプル流入チャネルと、(b)流体分離装置内でサンプルの流れの周囲にシースを形成する1つ以上の流体の流れを与えることにより、装置に対するサンプルの成分の非特異的結合を抑制するように構成される少なくとも1つのシース流流入チャネルと、(c)サンプル流入チャネルとシース流流入チャネルとに流体連結される選別ステーションであって、サンプル流の流路に沿って配置される選別ステーションと、(d)外部磁場と相互に作用して、選別ステーション内の傾斜磁場を変化させることにより、サンプル流から磁性粒子を偏向させる、及び/又は、捕捉する傾斜磁場発生部と、を備える。一つの実施形態において、磁性粒子は、選別ステーションにより捕捉される。
【0159】
一つの実施形態において、選別ステーションは、選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を有し、内部空間は、サンプル流の流れ方向と交わる第1及び第2の横方向寸法を有し、第2の横方向寸法は、第1の横方向寸法の少なくとも約2倍以上であり、少なくとも1つのシース流流入チャネルは、第1の横方向寸法に沿ったサンプル流により互いに分離された2つのシース流を形成するように構成される。別の実施形態において、選別ステーションは、選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を有し、内部空間は、約2ミリメートル以下の距離だけ離れた、実質的に平行かつ実質的に平面状の2つの表面により、部分的に規定され、少なくとも1つのシース流流入チャネルは、平行で平面状の2つの表面に接して流れると共に、サンプル流により互いに分離された2つのシース流を形成するように構成される。一つの実施形態において、実質的に平行で実質的に平面状の2つの表面は、約1ミリメートル以下の距離だけ離れている。一つの実施形態において、少なくとも1つのシース流流入チャネルは、選別ステーションの上流側に位置し、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第1のシース流流入チャネルを備える。
【0160】
一つの実施形態において、流体分離装置は、さらに、選別ステーションの上流側に位置し、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第2のシース流流入チャネルを備える。一つの実施形態において、少なくとも1つのサンプル流入チャネルは、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する。
【0161】
一つの実施形態において、傾斜磁場発生部は、分離装置上でパターンを形成する複数の強磁性素子を、選別ステーションの近傍に備える。別の実施形態において、傾斜磁場発生部は、複数の強磁性素子の近傍に永久磁石を備える。さらに別の実施形態において、複数の強磁性素子は、選別ステーションの流体通路内に配置されて、強磁性素子とサンプル流とを流体接触させる。強磁性素子は、マイクロパターン化されたニッケル素子を含むものでもよい。一つの実施形態において、傾斜磁場発生部は、一時的に磁性粒子を捕捉し、その後、磁性粒子を放出するように構成される。
【0162】
別の実施形態は、サンプルに含まれる標的種を捕捉する方法であって、(a)流体選別装置の少なくとも第1の流入チャネルに、標的種に対する特異的親和性を有する磁性粒子を含むサンプルを供給する工程と、(b)流体選別装置にシース流を供給し、流体選別装置内でサンプル流の周りにシースを形成する1つ以上のシースの流れを生じさせることにより、装置へのサンプルの非特異的な結合を抑制する工程と、(c)傾斜磁場発生部を磁化して、磁性粒子の少なくとも一部を捕捉して、サンプルから捕捉した磁性粒子を分離する工程と、(d)捕捉した磁性粒子に結合する又は結合した標的種を分析する工程と、を備える。一つの実施形態において、傾斜磁場発生部は、複数の強磁性素子を備える。強磁性素子は、流体装置上でマイクロパターン化された強磁性物質を含有するものでもよい。一つの実施形態において、傾斜磁場発生器を磁化する工程は、永久磁石又は電磁石から外部磁場を傾斜磁場発生器に印加することを備える。
【0163】
方法は、さらに、1)捕捉した磁性粒子に結合する精製された標的種を検出することと、2)流体選別装置内で標的種の核酸を増幅することと、3)流体選別装置内で、少なくとも一部の細胞が標的種を含有するような細胞を溶解することと、4)流体選別装置内で、少なくとも一部の細胞又はウィルスが標的種を含有するような細胞又はウィルスから遺伝物質を分離することと、5)サンプル内に少なくとも50%の標的種を含有する、精製された標的種を回収することと、のいずれかの組み合わせを備えるものでもよい。
【0164】
別の実施形態は、標的種に対する親和性を有する磁性粒子を含有するサンプルに含まれる標的種を精製する方法であって、(a)傾斜磁場発生部を有する流体選別装置にサンプルを流し、サンプルの流れが、実質的にサンプルを含まない液体シースにより包含されるように、又は、液体シース間に挟まれるようにして、少なくとも一部の磁性粒子を捕獲する工程と、(b)傾斜磁場発生部に印加される磁場を消失させる又は弱めることにより、捕獲された磁性粒子を放出させる工程と、(c)傾斜磁場発生部の下流側で、少なくとも一部の磁性粒子を用いて、精製された標的種を採取又は処理する工程と、を備える。
【0165】
別の実施形態は、シース流装置であって、(a)シース流平面領域の上流側に位置する第1の層流形成面と、(b)シース流平面領域に平行であり、サンプルシース流平面領域の上流側に位置するサンプル層流形成面と、必要に応じて、さらに、(c)第2のシース流平面領域の上流側に位置する第2の層流形成面と、を備える。一つの実施形態において、シース流装置は、さらに、粒子トラップステーションを備える。このトラップステーションは、たとえば、磁気トラップステーションでもよい。本明細書のシース流装置は、より大きな流体回路の一部でもよい。
【0166】
別の実施形態は、シース流装置であって、a)シース流平面領域の上流側に位置する第1の層流形成面と、(b)シース流平面領域に平行であり、サンプルシース流平面領域の上流側に位置するサンプル層流形成面と、(c)第2のシース流平面領域の上流側に位置する第2の層流形成面と、を備える。一つの実施形態において、工程(a)、(b)及び(d)の層流形成面は、実質的に乱流を生じさせることのない個別のシース流平面を十分に維持可能である。一つの実施形態において、工程(b)のサンプル層流形成面は、上面と底面とを備え、工程(c)の第2の層流形成面は、サンプル層流形成に用いられる面と反対側の面上に位置する。シース流装置は、水平面に対して実質的に直交するように配置されるものでもよい。シース流装置は、さらに、粒子トラップステーションを備えるものでもおい。一つの実施形態において、粒子トラップステーションは、強磁性成分を備える。シース流装置は、磁気泳動粒子分離に適合させたものでもよい。
【0167】
本発明のシース流装置は、さらに、試薬を収容する少なくとも1つの貯蔵部を備えるものでもよいし、全血からの幹細胞の単離に適合させたものでもよいし、及び/又は、マイクロ流体処理用に構成されるものでもよい。一つの実施形態において、シース流装置は、試薬を収容する貯蔵部を備え、試薬は、バッファ―(緩衝液)、多数の磁気ビーズ、幹細胞増殖剤、アプタマー、タンパク質含有組成物、バクテリア細胞培養物、及びバクテリオファージ集団含有組成物の少なくとも一つを含有する。
【0168】
他の実施形態は、シース流装置内で流体サンプルから標的種を分離する方法であって、(a)標的種に選択的に結合する磁性粒子に結合された試薬を用いて、流体サンプルに含まれる標的種を磁性粒子で予め標識する工程と、(b)シース流装置の平面状の表面に沿ってバッファー層流を形成する工程と、(c)バッファー層流に隣接して流体サンプルの層流を形成する工程と、(d)バッファー層流を介して、流体サンプルの層流から標的種を引き離す工程と、(e)磁気トラップステーションで標的種を捕捉する工程と、を備える。一つの実施形態において、層流は、高さがミクロンオーダーで、幅がミリメートルオーダーである。バッファー層流とサンプル層流とは、長さ方向と幅方向とが一致する領域に沿って隣接する、すなわち、高さ方向に積層される。この方法により標的種を単離する際のスループットを増大させる一つの方法は、層流の高さをミクロン(ミリメートル未満)オーダーに保持する一方で、層流の幅を広くすることである。このためには、複数のシース流装置を並列に運転する、及び/又は、シース流装置内の層流の幅を広くすればよい。一つの実施形態において、方法は、さらに、流体サンプル層流を形成する前に、第1のバッファー層流に隣接して第2のバッファー層流を形成し、第1のバッファー層流と第2のバッファー層流との間に流体サンプル層流を形成する工程を備える。一つの実施形態において、第1及び第2のバッファー層流並びに流体サンプル層流は、実質的に乱流を生じさせることのない個別の流れ平面を十分に維持可能である。別の実施形態において、磁気トラップステーションは、強磁性成分を備える。一つの実施形態において、標的種は、細胞、バクテリア、ウィルス、タンパク質及び核酸のうち少なくとも1つを備える。一つの実施形態において、標的種は循環腫瘍細胞であり、流体サンプルは全血である。
【0169】
他の実施形態は、患者を分析する方法であって、(a)患者から腫瘍細胞を含むサンプルを採取する工程と、(b)分離法により腫瘍細胞をサンプルから分離する工程であって、(i)腫瘍細胞に対する特異親和性を有する磁性粒子を用いてサンプルを標識して、標識サンプルを生成することと、(ii)標識サンプルから磁性粒子を偏向させ、及び/又は、捕捉して、これにより、サンプルから腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、標識サンプルを通すことと、を備え、バッファー溶液のシース内にサンプルを流すことによって、流体装置へのサンプルの非特異的な結合を抑制する工程と、(c)工程(b)でサンプルから分離された腫瘍細胞の特性評価を行なう工程と、を備える。一つの実施形態において、工程(c)の特性評価を行なうことは、状態を診断する、臨床試験のためのスクリーニングを行なう、治療法の有効性を評価する、及び、手術の有効性を査定するための情報を与えることである。別の実施形態において、サンプルは、患者から採取した流体サンプルである。一つの実施形態において、サンプルは、患者の生検により採取されたものではなく、たとえば、サンプルは血液サンプルである。一つの実施形態において、腫瘍細胞は、非血液癌由来の循環腫瘍細胞である。別の実施形態において、特性評価を行なうことは、腫瘍細胞の計数である、及び/又は、腫瘍細胞の分子特性評価を行なうことである。分子特性評価は、たとえば、腫瘍細胞における遺伝子変異である。
【0170】
別の実施形態は、患者の治療計画をモニタリングして、必要に応じて調整する方法であって、(a)一次治療計画を実施中の患者から腫瘍細胞を含むサンプルを採取する工程と、(b)分離法により腫瘍細胞を前記サンプルから分離する工程であって、(i)腫瘍細胞に対する特異親和性を有する磁性粒子を用いてサンプルを標識して、標識サンプルを生成することと、(ii)標識サンプルから磁性粒子を偏向させ、及び/又は、捕捉して、これにより、サンプルから腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、標識サンプルを通すことと、を備え、バッファー溶液のシース内にサンプルを流すことによって、流体装置へのサンプルの非特異的な結合を抑制する工程と、(c)工程(b)でサンプルから分離された腫瘍細胞の特性評価を行なって、患者に対する今後の治療を提案する工程と、を備える。一つの実施形態において、一次治療計画は化学療法レジメンである。一つの実施形態において、今後の治療は異なる化学療法レジメンである。一つの実施形態において、患者に対する今後の治療を提案する工程は、一次治療計画の今後の有効性を予測することを備える。別の実施形態において、患者に対する今後の治療を提案する工程は、患者に関して前にはわかっていなかった腫瘍細胞の特徴を考慮した、一次治療計画とは異なる二次治療計画を特定することを備える。
【0171】
患者の治療計画をモニタリングして、必要に応じて調整する方法は、さらに、(d)患者に二次治療計画を実施した後で、患者から腫瘍細胞を含むサンプルを採取する工程と、(e)工程(d)で採取されたサンプルと腫瘍細胞に対して工程(b)及び工程(c)を実施する工程と、を備える。
【0172】
別の実施形態は、細胞由来生成物を提供する方法であって、(a)標的細胞を含むサンプルを採取する工程と、(b)分離法により標的細胞をサンプルから分離する工程であって、(i)標的細胞に対する特異親和性を有する磁性粒子を用いて標的細胞を標識して、サンプル内に標識細胞集団を生成することと、 (ii)サンプルから標識細胞集団の少なくとも一部を偏向させ、及び/又は、捕捉して、これにより、サンプルから標的細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、サンプルを通すことと、を備え、バッファー溶液のシース内にサンプルを流すことによって、流体装置へのサンプルの非特異的な結合を抑制する工程と、(c)工程(b)でサンプルから分離した標的細胞から細胞由来生成物を得る工程と、を備える。一つの実施形態において、方法は、さらに、工程(b)でサンプルから分離した標的細胞を処理して、細胞由来生成物を生成する工程を備える。一つの実施形態において、標的細胞は幹細胞であり、標的細胞を処理する工程は、幹細胞を処理して、有効な治療薬を得ることを備える。一つの実施形態において、幹細胞を処理して、有効な治療薬を得ることは、標的細胞を分化させて、より特異的な細胞型を生成することを備える。上述した他の方法と同様に、サンプルは、患者から採取した流体サンプルでもよく、たとえば、血液サンプルでもよい。
【0173】
一つの実施形態において、方法は、さらに、工程(b)でサンプルから分離した標的細胞の特性評価を行なう工程を備える。特性評価を行なうことは、標的細胞の計数であってもよく、及び/又は、標的細胞の分子特性評価を行なうことでもよい。分子特性評価は、たとえば、標的細胞における遺伝子変異である。
【0174】
実施例:
以下、実施例及び理論的実験例を説明する。実施例1は、複合血液サンプルから希少細胞を磁気泳動選別する本発明の装置を示す。実施例2は、本発明のオンチップキットの実施例を示す。実施例3ないし7は、サンプル流体の一部が生物製剤又は化学薬品である実施例を示す。実施例8及び9は、本発明の装置を、モニタリング、具体的には、各々、環境プロセス及び生物医薬品製造のモニタリングに用いた実施例を示す。実施例10は、本発明の装置をポイントオブケア(POC)診断に用いた実施例を示す。実施例11は、ヒトの臍帯血サンプルから得た造血前駆細胞(HPC)の濃縮比較を示す。
【0175】
実施例1:全血からの希少細胞の単離及びシース流が形成されない装置との比較
この実施例は、本発明のシース流装置が、磁気泳動トラップステーションへの非標的血液細胞の非特異的結合を実質的に防ぐ流体層を形成する様子を示す。
【0176】
磁力を用いて、106 MNC(単核細胞)及び全血に含まれる非常に希少な標的細胞を濃縮するマイクロ流体分離を行なった。以下、マルチストリームマイクロ磁気分離装置(Multi-stream Micro Magnetic Separator:M−MMS又はMMS)と称する。
【0177】
図6Aに図示し、図6Bに画像として示す装置を用いた。図6Aは、本発明のMMS装置600のシース流部品の一実施例を示す分解斜視図である。これは、装置の個々の部品を互いに組み合わせたときに、どのようにシース流を形成するかを示すための斜視図である。この実施例では、7枚のプレート615、620、625、630、635、640、645が用いられており、各プレートは、アクセスポート及び/又はチャネルを備え、互いに組み合わせてバッファー流とサンプル流とを装置内に導入したときにシース流を形成するように構成される。
【0178】
サンプル流路を示す点線の矢印602のように、サンプル流入ポート601から液体サンプルが導入される。サンプルは、プレート620及び625の同様なポートから、プレート630のチャネル端部を通った後、プレート635の(図では)上面の突き当り領域606(サンプル層流形成面)に流れる。便宜上、サンプル流の矢印602は、互いに組み合わせたときに流れが突き当り領域606で偏向し、プレート630の空隙内に空隙と平行な方向に層流を形成するように図示した。同様に、一方のバッファー流路を示す点線の矢印603のように、バッファー流入ポート604からバッファー溶液が導入される。バッファーは、プレート620の同様なチャネル端部を通った後、プレート625の(図では)上面の突き当り領域605(バッファー層流形成面)に流れる。便宜上、バッファー流の矢印603は、流れが突き当り領域605で偏向し、プレート625の空隙内に空隙と平行な方向に層流を形成するように図示した。さらに同様に、他方のバッファー流路を示す点線の矢印609のように、バッファー流入ポート608からバッファー溶液が導入される。バッファーは、プレート640の同様なチャネル端部を通った後、プレート635の(図では)下面の突き当り領域607(バッファー層流形成面)に流れる。便宜上、バッファー流の矢印609は、流れが突き当り領域607で偏向し、プレート635の空隙内に空隙と平行な方向に層流を形成するように図示した。
【0179】
矢印611は共通の排出流路を示す。流れ602、603及び609は、(互いに組み合わせたときに)プレート620、625、630、635及び640のチャネルの遠位端で合流し、点線の矢印611で示すように、流出ポート610を介して装置から排出される。
【0180】
図6Bに示すように、チャネル上面にニッケルグリッドの薄層がパターン化されている(図2A及び図2Bを参照して上述した。また、図6Bではグリッドパターンは灰色の影として示されている)。ニッケルグリッドは、外部磁石の存在により、強い傾斜磁場を生じ、磁気ビーズで標識した標的検体を捕獲可能なように構成される。標識されていないバックグラウンド細胞は、傾斜磁場の影響を受けないで、排出物として連続的に溶出される。最初は、純粋なシース流のみが上面に接触するため、磁気的に捕獲される標的検体のみが上面に捕獲される一方で、表面への非特異的な結合が最小限に抑えられるため、非常に純度の高いサンプルが得られる。図6Bに、ルアーロック等のサンプル流入口取付具650と、上部及び下部バッファー流入口取付具655及び660と、排出物流出口取付具665と、を示す。これらの取付具により、たとえば、シリンジを用いてサンプルを注入する一方で、専用流路を介して装置600内にバッファーを連続的にポンプで注入することができる。排出物は、たとえば、専用排出流路を介して、真ん中の貯蔵部に除去される。単純に流路を外して新しい装置に再接続するだけで装置を切断することができる。
【0181】
図6Cは、装置600の一部(左上部)の断面Aを示す。図6Cの下部の拡大断面図は、サンプル流路とバッファー流路とを互いに隣接して形成して、シース流装置600の上部内側面と下部内側面とにサンプル流が接しないようにした様子を示す。サンプル層流の上と下とにバッファー層流のシースが形成される様子を断面図の一番右側の部分に示す(点線の矢印は、上部バッファー流、サンプル流及び下部バッファー流の各々の流れ方向を示す)。
【0182】
図7Aは、同様のシース流装置700の各部品を示す分解斜視図である。シース流装置700は、層705、710、715、720、725、730及び735を備え、図示するように、各層を互いに隣接して組み合わせて積層させることにより、装置700を形成する。装置700では、すべての流入口(下部バッファー流入口740、上部バッファー流入口745及びサンプル流入口755)と流出口(排出物流出口750)とが最上部プレート705上に形成されているという点で、装置600と異なる(装置600では、下部バッファー流出口は底部プレートに形成されている)。装置700は、操作の間、平面上に置いておけるため、取扱いが簡便になる。この例では、最上部プレート705は、ニッケルトラップグリッドを備えるガラスであり、層710、720及び730は、たとえば約0.2mmの厚さの接着層であり、層715及び725は、たとえば約0.125mmの厚さのポリカーボネートであり、層735はガラスである。図7Bに、図7Aに示すシース流装置700を組み立てた状態の斜視図を示す。
【0183】
本実施例のシース流装置は、血液の粘度と密度に合うように、下部流体層に50%(w/w)スクロース(ショ糖)を用いた。
【0184】
シース流が形成されるチップと、比較のために、シース流が形成されないチップとに、(磁性粒子を含有しない)全血を同じ流速で注入して、シース流の有効性を調べた。図4(の左側の画像)に示すように、シース流が形成されない場合には、RBC(赤血球)及び他の細胞が、表面に非特異的に付着した。図4(の右側の画像)に示すシース流装置では、表面に非標的細胞がほとんど存在せず、その有効性が立証された。
【0185】
希少細胞を回収するM−MMSの能力を定量する目的で、MCF−7乳癌細胞を、市販のナノサイズ磁性粒子(BD Biosciences社の抗PE磁性粒子)で前標識した。前標識したMCF−7腫瘍細胞を、細胞50個/ml、細胞30個/ml又は細胞10個/mlの割合で全血に混ぜた。結果を図5A及び図5Bに示す。平均純度は、(それぞれ、細胞50個/ml、細胞30個/ml又は細胞10個/mlに対して)69%、58%及び20%であった(図5A)。これは、最初のサンプルの約1×107倍の濃縮に対応する。平均細胞回収率は、(それぞれ、細胞50個/ml、細胞30個/ml又は細胞10個/mlに対して)86%、94%及び92%であった(図5B)。
【0186】
in situ(その場)標識を用いた場合の標的細胞の回収率は約90%であった。また、細胞の純度は、約13%であり、これは、最初のサンプルの約2×106倍の濃縮に対応する。in situの磁気標識の効率が悪いために、前標識選別ほど効率がよくなかったと考えられる。
【0187】
このように、本発明は、層流平面のサンプル流体層に隣接し、かつ、平行な平面におけるシース層流の第1流体層を備え、さらに、必要に応じて、層流平面のサンプル流体の第2層に隣接するシース層流の第2流体層を備える、流体シース流装置を提供する。ここで、シース流は、最初に、固体支持層状に形成される。
【0188】
実施例2:オンチップキット
これは理論的実験例である。所定の流体回路に従って、本発明のシース流装置を製造する。所定の貯蔵部に所望の流体を予め充填する(プレフィルする)自動流体供給機器を用いて、この装置を製造する。貯蔵部を密閉(シール)するが、ここで、プレフィル貯蔵部の一部のシールが所定の張力によって破れて、内部の流体が別の貯蔵部と流体連結されるように構成する。複数の貯蔵部を特定の目的に合わせてプレフィルし、流体回路により、空気力等、適当な力を印加して、流体を所定の領域に流す。流体が貯蔵部から出て、図1及び図2を参照して上述したように所定の流体回路の一部である本発明の装置に流入することにより、本発明のシース流が形成される。一例において、自動機器は、空気ピストンを用いて、装置の流体回路に合わせた所定の時間的パターンで力を印加して、シース流を形成する。
【0189】
実施例3:バイオマーカー検出
これは理論的実験例である。本発明のシース流装置を、個体から採取した体液からバイオマーカーを選別する流体回路を備えるように構成する。バイオマーカーの存在は、特定の病態であることを示す。バイオマーカーは細胞、タンパク質、核酸又はこれらのいずれかの分解生成物から選択される。病態は、癌、神経疾患及び感染症の中から選択される。癌バイオマーカーは、循環腫瘍細胞、タンパク質及び核酸の中から選択される。神経疾患バイオマーカーは、細胞、これに限定されるものではないがAβ(1−42)(アミロイドβペプチド42)タンパク質又はそのフラグメント(断片)若しくはオリゴマーを含むタンパク質、又は、アルツハイマー病、ハンチントン病、筋萎縮性側索硬化症(ALS又はルー・ゲーリック病)、認知症、多発性硬化症及びプリオン病から選択される神経疾患用の他のバイオマーカーから選択される。感染症用のバイオマーカーは、感染性病原体及び二次病原体又は有害な効果のある検出可能なマーカーから選択され、以下に限定されるものではないが、ウィルス、バクテリア、真菌、プリオン及び他の感染性病原体を含む。ウィルスは、たとえば、HIVウィルス、(あらゆる型の)肝炎ウィルス、(あらゆる型の)インフルエンザウィルス、あらゆる型のパピローマウィルス(HPV)、狂犬病ウィルス又はその他のウィルス感染性病原体でもよい。バイオマーカーは、上記の生命体や感染性病原体の一部でもよい。たとえば、バイオマーカーは、ウィルス外被に関係するたんぱく質でもよい。
【0190】
実施例4:アプタマーのスクリーニング
これは理論的実験例である。本発明のシース流装置を、アプタマーを用いて流体サンプルに含まれる希少分子を検出する流体回路を備えるように構成する。アプタマーは、検出可能なマーカーと関連付けられたものでもよい。アプタマーを、アプタマーが標的種に結合する条件下で、流体懸濁液にさらす。アプタマー及び標的種は、本発明のシース流装置の貯蔵部内に設置されるトラップステーション内に捕捉される。非標的物質は、トラップステーションからアプタマー/標的種を取り除くのには不十分な空気力(又は他の力)により流体(たとえば、バッファー)と共に洗浄除去される。この理論的実験例を用いて、たとえば、尿、血液又は他の体液中の物質を検出することができる。たとえば、尿に含まれる微量のコカインやその他の不法に摂取された薬剤を検出することができる。たとえば、参照することによりあらゆる目的で本明細書に組み込まれる、Swensen, J. S.ら、Continuous, real-time monitoring of cocaine in undiluted blood serum via a microfluidic, electrochemical aptamer-based sensor. (マイクロ流体電気化学アプタマーセンサーを用いた不希釈血清中に含まれるコカインの連続的なリアルタイムモニタリング) J. Am. Chem. Soc. doi:10.1021/ja806531z (2009)を参照のこと。
【0191】
実施例5:体液中の被分析物のテスト
これは理論的実験例である。本発明のシース流装置を、薬物に関して、非合法か否かや、その存在や用量を含めた(ヒトや動物等の)個体のモニタリングを行なう流体回路に合わせて、構成する。本発明の装置を、医学的に処方された用量、薬物動態、体や脳の能力向上、非合法(メタンフェタミン、コカイン、マリファナ(カンナビノイド))やグルコース(インスリン)等の内分泌関連物質を検出又はモニタリングするように構成してもよい。たとえば、本発明のシース流装置を、血液や尿等の体液に含まれる医薬品又は医薬品分解又は下流代謝製剤の検出に適した試薬を予め充填した(プレフィルした)貯蔵部(又はチャンバ)を備えるように構成する。シース流装置を、血液(等の)サンプルを貯蔵部に供給した後、適当な試薬をプレフィルした貯蔵部を手動張力等の力を印加して開放するように、構成する。体液と試薬とを結合させることにより、患者への投薬が適切であるか否かを視覚的に検出することができる。
【0192】
実施例6:アプタマーを含む化学物質ライブラリーのスクリーニング
これは理論的実験例である。本発明のシース流装置を、特定の目的に応じて化学物質ライブラリーのスクリーニングを行なう流体回路を備えるように構成する。たとえば、ファージディスプレイを用いることにより、標的タンパク質に対して、アプタマーライブラリーをスクリーニングするようにしてもよい。アプタマー/タンパク質複合体を分析して、結合しているアプタマー及びその結合特性を同定し、濃縮されたアプタマーを再びライブラリーのスクリーニングにかけるようにしてもよい。たとえば、タンパク質部分(moiety)上の特定のエピトープに対する結合親和性又は結合等、特定の特性を有するアプタマー部分(moiety)を選択する反復処理により、このようなスクリーニングを行なうようにしてもよい。この実施例のシース流装置は、所定のタンパク質のファージ・ディスプレイ集団を保持し、必要に応じて培養する貯蔵部と、スクリーニング対象となるアプタマーライブラリーの流入ポート又はアプタマーライブラリーをプレフィルしたチャンバと、を備える。あるいは、所望のタンパク質(又は他の選択用基質)が供給される、アプタマーライブラリーを保持する貯蔵部を備えるものでもよい。アプタマーライブラリーとタンパク質(又は他の基質)とを混合する貯蔵部に力を加えて、結合反応を促進するようにしてもよい。
【0193】
実施例7:ゲノムスクリーニング:DNA分析
これは理論的実験例である。本発明のシース流装置を、マイクロ流体回路を備えるように構成し、核酸選別に用いる。DNAのサンプル又はDNAを含有する細胞を、特定のDNA配列に結合する(さらに、必要に応じて、細胞を溶解して内部のDNAを露出させる)のに適した試薬を供給する貯蔵部及びチャネルと流体連結された装置内にセットする。たとえば、DNAプライマーを用いて、特定の対応DNA配列に結合させる。プライマーを(ゲノムや法医学サンプル等の)対象DNAを含有する貯蔵部に加える。洗浄流体をチャンバに加えて、結合していない部分(moiety)を洗浄除去する。プライマー/DNAを適用試薬にさらして、ポリメラーゼ連鎖反応を複数回実施する。張力を加える自動機器を用いて試薬を適切に混合する。
【0194】
実施例8:環境モニタリング
これは理論的実験例である。本発明のシース流装置を、環境モニタリング又は環境分析に適した材料と流体回路とを備えるように構成する。環境流体サンプルの処理は、(上述した)体液から得られた水性流体処理とかなりの部分が共通するが、(温度、太陽光、塩分や他の環境条件等、極端な条件に耐えさせられた)物質を対象とし、安定した電力が利用できないような現場使用に合うような変更が施されている。たとえば、飲料水のモニタリングを住宅所有者が希望する場合、ある期間にわたって飲料水を採取して、一度に分析する必要がある。あるいは、石油又はガスを含有する特定の地層に関係することが知られている種である、石油やガスの掘削用の指標微生物のモニタリングに本発明のシース流装置を用いることもできる。当業者であれば、このような条件下でのサンプル使用に耐えられる物質を選択することができるであろう。本発明のシース流装置を、さらに、シース流路内の流体の流れに十分な圧力を手動で(手工具や携帯工具)加えるような構成にしてもよい。環境モニタリングには、たとえば、飲料水や環境水(塩水源や淡水源)、土壌(土壌改善等)、PCB又はスーパーファンド用地浄化モニタリング、環境放射線モニタリング、(藻類やオキアミ等の)再生やその他の生態学的な目標、及び、居住環境モニタリング(飲料水やプールの水を含む水、空気及び土壌モニタリング又は分析)が含まれる。水銀、鉛、鉄等の重金属や(試掘用に)金や銀に選択的に結合するアプタマー(又は他の選択的結合分子)を含有するプレフィル型装置を用いるようにしてもよい。また、ヒ素、過度の薬剤環境汚染、MBEや他の有機溶剤等、環境有害物質をモニタリングすることも可能である。大陸棚域等の海洋域の酸性化を、(比色分析片等の)酸性化指標を用いて調べることもできる。
【0195】
実施例9:生物薬剤生産
これは理論的実験例である。本発明のシース流装置を、生物製剤の生産において、生物学的過程のモニタリングに用いることができる。たとえば、様々な段階で別々のバイオリアクターからタンパク質を採取して、タンパク質生産のロット間変動をモニタリングするようにしてもよい。同様に、ワクチン生産のモニタリングも可能である。本発明のシース流装置を用いて、品質保証を目的として、さまざまな生物製剤や生物薬剤のモニタリングを行なうことができる。
【0196】
実施例10:ポイントオブケア(POC)診断
これは理論的実験例である。本発明のシース流装置を、臨床検査室で通常実施される様々なポイントオブケア(POC)血液分析に適するように、構成する。本発明のシース流装置を、患者の血液を1つの貯蔵部に集めた後、張力をかけて、複数の貯蔵部に流して、分割する。個々の貯蔵部に分割された血液サンプルを、染色剤若しくは染料又は抗体等、臨床検査室での試験に用いられる部分(moiety)に各々さらす。あるいは、又は、これに加えて、分割した血液を、肝臓酵素、血糖、甲状腺、タンパク質Cやその他の血液部分(moiety)等、用途により適した別の試薬にさらすようにしてもよい。
【0197】
実施例11:ヒト臍帯血サンプルからの造血前駆細胞(HPC)の濃縮比較
上述の実施例1で説明した、シース流と磁気トラップとを用いる本発明の装置を、シース流を形成することはできないが、磁性粒子で標識した細胞を磁気捕捉する細胞分離用装置である(ドイツ、ベルギッシュ・グラッドバッハ、Miltenyi Biotec社から)市販のMACS(登録商標)細胞分離カラムと、対照比較した。
【0198】
冷凍臍帯血又は2日たった新鮮臍帯血多核細胞(MNC)をろ過して、死んだ細胞を取り除いた。次に、サンプルをMiltenyi CD34マイクロビーズ(ドイツ、ベルギッシュ・グラッドバッハ、Miltenyi Biotec社から市販)で標識した。標識したサンプルを分割して、一部を上述したMiltenyi分離カラムに通し、残りの部分を、実施例1で上述した本発明のシース流磁気分離装置に通した。Miltenyiカラムを通したサンプルの一部を再び別のMiltenyiカラムに通し、Miltenyiカラムを1回通したもの(MACS1x)と2回通したもの(MACS2x)を、本発明のシース流装置を1回通したもの(MMS)と比較した。当業者に周知の標準的な免疫蛍光染色及びFACS分析により、これら3種類の精製サンプルを各々分析した。
【0199】
図9A及び図9Bに、上述の方法で単離したHPCであるMACS1x、MACS2x及びMMSのFACS分析の結果を示す。データは、上述したように、N=6でコンパイルし、エラーバーで標準偏差を示した。図9Aから、MMSで分離したHPCの純度が、MACS1xよりも高く、また、MACS2xよりもわずかに高いが、少なくとも同等であることがわかる。この結果は、従来の非シース流形成装置と比べて、MMS装置の性能向上を示すものである。また、図9Bに、MACS1x、MACS2x及びMMSのHPC回収率を示す。MACS1xの回収率は高いが、その純度はMACS2xやMMSよりも低い(図9A参照)。この結果から、MMSの回収率(及び純度)は、MACS2xと同等であることがわかる。要するに、MMS装置を1回だけ通したものと、従来のMACS装置に2回通したものとが、ほぼ同じ純度と回収率であった。
【0200】
本明細書の記載を参照すれば、当業者には自明のように、本発明は、様々な構成や適用で実施可能であり、上述の実施形態や実施例に何ら限定されるものではない。
【技術分野】
【0001】
[クロスリファレンス]
本出願は、2009年6月10日に出願された米国仮特許出願No.61/185,919、2010年3月12日に出願された米国仮特許出願No.61/313,625及び2010年6月10日に出願された米国特許出願No.12/813,285に基づく優先権を主張するものであり、前記各出願の内容は、参照することにより、その全体があらゆる目的で本明細書に組み込まれる。
【0002】
本出願は、一般的に言えば流体処理に関するものであり、具体的な態様は、粒子部分(moiety)の検出、選択又は選別を行なうための流体処理に関する。本発明の他の態様は、細胞、タンパク質及び核酸の体液の処理、検出、選別又は選択に関する。他の態様に関しても本明細書中で開示する。
【背景技術】
【0003】
粒子選別法は、懸濁液に含まれる部分(moiety)を標的とする場合に広く用いられているが、汚染という技術的な問題がある。たとえば、複合全血サンプルから比較的希少な細胞を選別することが必要な場合がある。他の細胞型により汚染されていると、標的細胞を濃縮する前処理や不要な非標的細胞を除去する後処理が必要になることがある。
【0004】
さらに、汚染部分(moiety)が、容器の側壁やその他表面に局在化している場合がある。シリコーン系製品等の表面被覆との非特異的結合を最小限に抑える試みも不十分な場合がある。水平な流体流れ平面があり、この平面に沿って懸濁液中の粒子が流れる場合、(密度、粘度、及びその他の特性に応じて)粒子が底に沈む場合がある。この場合、粒子は障壁を形成し、流路を閉塞させてしまう可能性がある。さらに、汚染粒子が、トラップ構造を備えるマイクロ流体装置内で共局在化する可能性もある。特に標的粒子が非常に希少である場合、非特異的結合は、標的種の選別や検出を妨害する可能性がある。
【0005】
粒子選別の特異性を向上させる方法が提案されている。マイクロ流体容量では、標的部分(moiety)の輸送には流体力学が重要となる。従来の流体力学アプローチは、中央のサンプル流の両側に2つの外側流体の流れを形成して、サンプル流を横方向に閉じ込めるものである。フローサイトメトリー及び流体シースの使用を主題にした重要な論文であるP. Crosland-Taylor、“A device for counting small particles suspended in fluid through a tube,” (チューブを流れる流体に懸濁された小さな粒子の計数装置)Nature 171:37-38 (1953) doi: 10.1038/171037b0を参照のこと。
【0006】
一般に、シース流は、特殊な型の層流である。シース流は、流体の流れを囲む外側流「管」として、あるいは、流体の流れを全面的に又は部分的に囲む流体流路として、形成されるが、シース流は、隣接する平行な流体流路に対する層流流体流路を備える。このため、固体表面上の層流平面は、(隣接する平行な流体流路等の)流体「面」上にある場合に、シース流平面として働くと考えられる。過度な乱流は流体の流路を混ぜる(そして、流体層流面層が「シース」として機能しない)結果となるため、シース流は、実質的に乱流が存在しない状態を意味する。このように、シース流の形成には、乱流ではなく、層流が必要である。
【0007】
構造や流体特性に応じて、シース流は、(混ざることなくサンプル流路を囲むことにより)流体力学的に流体サンプルを集める機能がある。あるいは、層(又は流体の流れを不完全に囲むシース)が存在する場合には、層流平面内の流体は、装置壁部の流体延長部として作用する。すなわち、流体サンプルとそれを囲む固体表塩との間の流体障壁として作用する。
【0008】
シース流は、懸濁液の粒子がマイクロ流体回路を妨害又は阻害する可能性があるマイクロ流体において特に有用である。したがって、シース流に着目した流体力学により、サンプル流を高速化して、スループットを向上させることができる。
【0009】
しかしながら、マイクロ流体装置(又はより大きなスケールの流体装置)で有用なシース層流の形成には問題があった。従来のフローサイトメーター等の従来装置では、特殊な構成要素を用いた複雑な計装や非常にきめ細かな製造が必要であった。特別な構造や配置によりマイクロ流体シース流が形成されると考えられているが、マクロ流体スケール及びミクロ流体スケールのいずれにおいても有用であり、特に、標的部分の選別感度を向上でき、表面への非特異的な結合を抑制することができる予測可能なシース流装置を製造することが求められている。
【発明の概要】
【0010】
本発明は、シース流に基づく装置、製造及び計装システム、使用方法、製造方法及び関連する態様を提供する。
【0011】
本発明は、固体表面上に形成される層流の下流側でシース流が得られる、という研究結果に基づくものである。固体表面がなくなっても、層流は基本的には形成された状態で連続するが、流れ平面が隣接する平行な流体流れ平面内で流体流れに当接するように構成された部分では、「シース流」として作用する。本発明の多くの態様や適用は、この知見に基づくものであり、複雑な計装を必要とすることなく、多くの流体工学分野で有益なシース流を容易に形成することができる。
【0012】
具体的な態様において、本発明は、以下に限定されるものではないが、血液及び血液分画、細胞、核酸及びタンパク質、並びに、生体機能で見られる、又は、関与する他の被分析物を含む体液及び生体粒子の処理に関する。本明細書の開示内容を考慮することにより、当業者であれば、他の態様も容易に理解できるであろう。
【図面の簡単な説明】
【0013】
【図1】4枚のコンポーネントプレートを用いてサンプル層流の上と下とにバッファー層流を形成するシース流装置を示す概略図。
【0014】
【図2A】磁気泳動粒子分離を行なうように構成された装置を示す断面側面図。
【図2B】磁気泳動粒子分離を行なうように構成された装置を示す上面図。
【0015】
【図2C】本発明のシース流装置に適した様々な構造の磁気トラップを示す図。
【0016】
【図3A】着脱可能な磁気トラップステーションを示す断面側面図。
【図3B】着脱可能な磁気トラップステーションを示す上面図。
【0017】
【図4】装置内の固体マイクロ流体チャネル面上に血液細胞が非特異的に結合される様子を、シース流が形成されていない状態(左パネル)とシース流を形成後の状態(右パネル)とで比較した画像を示す説明図。
【0018】
【図5A】本発明のシース流装置を用いた場合の、全血からの希少細胞の純度を示すグラフ。
【図5B】本発明のシース流装置を用いた場合の、全血からの希少細胞の回収率を示すグラフ。
【0019】
【図6A】シース流装置の部品を示す分解斜視図。
【0020】
【図6B】図6Aに示すシース流装置を組み立てた状態を画像により示す説明図。
【0021】
【図6C】図6A及び図6Bに示すシース流装置の詳細を示す断面斜視図。
【0022】
【図7A】シース流装置の部品を示す分解斜視図。
【0023】
【図7B】図7Aに示すシース流装置を組み立てた状態を示す斜視図。
【0024】
【図8】さまざまな実施形態においてサンプルを選別する方法を示す処理工程図。
【0025】
【図9A】本発明のシース流装置を用いて臍帯血から単離した造血細胞の純度を示すグラフ。
【図9B】本発明のシース流装置を用いて臍帯血から単離した造血細胞の回収率を示すグラフ。
【発明を実施するための形態】
【0026】
上述したように、本発明は、固体表面上に層流の流路が形成されると、隣接する平行な層流の流路平面に当接するシース流として層流の流路が持続するという研究結果に基づくものである。すなわち、層流の形成に最初に用いられた固体表面がない状態でも、1つ以上の平行流体層流平面に隣接して、流路及び流れ平面内で流体の流れが形成された状態を持続する。一部の実施形態において、サンプル層流の流路は、1つ又は2つのバッファー流路に隣接して形成される。このようにして、シース流が形成されることにより、サンプル流路がシース流装置の内部表面に接触するのを防ぐことができる。
【0027】
図1は、本発明のシース流装置100を示す分解斜視図である。シース流装置100は、4枚の平行なプレート105、110、115及び120を備え、これらの平行なプレートを接合することによりシース流装置100が形成される。サンプル流体は、点線矢印125で示すように、プレート105のアクセスポートを通ってz軸方向に導入される。サンプル流体は、たとえば、プレート115の凹凸面に突き当たって、偏向する。拡孔によって、サンプル流体は固体表面に沿って進むため、層流の流路が形成される。(流体が固体表面の端部を通過した、又は、固体表面との接触が断たれた等により)層流の流路平面内における固体表面がなくなっても、流体の流れは層流として持続する。バッファー流体は、点線矢印130及び135で示すように、プレート120及び105の流入口を通って導入される。バッファーの流れは、各々、同じように、プレート115及び110の表面に突き当たり、サンプル層流に隣接する層流を形成する。これらの層流は、別々の層流の層として持続し、シース流を形成する。すなわち、サンプル層流がバッファー層流によりシースされて、たとえば、シース流装置の内部表面にサンプル流が接触するのを防ぐことができる。
【0028】
したがって、本発明の1つの態様は、(a)シース流平面領域の上流側に位置する第1の層流形成固体表面と、(b)シース流平面領域に平行なサンプル層流領域と、さらに、必要に応じて、(c)第2のシース流平面領域の上流側に位置する第2の層流形成固体表面と、を備えるシース流装置を提供する。
【0029】
図1に示すように、対応シース流平面の上流側に位置する対応固体表面上に1つ以上の平行層流平面を形成するように構成される本発明の装置を用いて、シース流を形成することができる。本明細書に記載される実施形態は、磁気的に標識されたサンプル成分を偏向させて、必要に応じて、捕捉する磁気分離ステーションを備えるシース流装置である。磁気トラップステーションの例は、たとえば、参照することにより、あらゆる目的で本明細書に組み込まれる「標的種を捕捉するためのトラップ型磁気選別システム(Trapping Magnetic Sorting System for Target Species)」という名称の米国特許公報2009/0053799A1に記載されている。シース流装置が非磁気的な力を利用して分離を行なうような実施形態でもよい。非磁気的な力の例としては、音響的な力、光学的な力及び誘電力が挙げられる。
【0030】
図2A及び図2Bに、磁気泳動粒子分離を行なうように構成された本発明のシース流装置200の断面側面図と上面図とを、それぞれ示す。装置200は、上部プレート205と、下部プレート210と、を備える。標的部分(moiety)(図示した例では細胞)を含有する複合サンプルは、上部流体層と下部流体層との間で層流層を形成する。粒子選択構造体、ここでは、強磁性ニッケル構造体230を上部プレート205の内側表面上に設置することにより、サンプル層流が上部バッファーシース流直接接触するのを防ぐ。一つの実施形態において、生存細胞等、採取した標的種が(有毒な可能性のある)ニッケルに直接接触しないように、所定の物質を被覆する等の方法でニッケル構造体を隔離するようにしてもよい。磁気泳動で選別された選択粒子(図示した例では、磁性粒子215で選択的に標識された細胞であり、磁気選別に応答する細胞)に、制御可能な外力(ここでは、磁力)を印加する。図2Bの上面図に、排出物は、磁気泳動構造により偏向又は捕捉されず、サンプル流体の流れを通過する様子を示す。本実施形態のさらなる態様を以下で説明する。
【0031】
図2Cに、本発明のシース流装置で利用可能な9種類の磁気トラップグリッド又はパターンを示す。これらのグリッド又はパターンは、傾斜磁場(magnetic field gradient:MFG)生成構造として機能する。一つの実施形態において、磁性材料から、磁気トラップグリッド又はパターンを形成するものでもよい。別の実施形態において、高度に局在化した強磁場を磁気トラップグリッド又はパターン内で誘導することにより、サンプル流からバッファーシース流を通して磁気トラップグリッド又はパターン上に、磁性粒子で標識した標的種を引っ張るための外部磁石と共に用いられる材料から、マイクロマシン加工やスクリーン印刷等の方法で、磁気トラップグリッド又はパターンを形成するものでもよい。
【0032】
一般的に言えば、本発明の装置及び関連する方法並びにシステムは、流体層を別々のまま維持するように、実質的に乱流を生じさせることのない、又は、原則として乱流を生じさせることのない個別の流体層流層を形成する。本明細書においてシース層流を説明する際に用いる「実質的に乱流を生じさせることのない」という用語は、乱流が一部生じるかもしれないが、それでもシース流が形成されることを意味する。同様に用いられる「原則として生じさせることのない」という用語は、避けられない乱流が一部生じるかもしれないが、上述したように、所望のシース層流層は形成されることを意味する。
【0033】
一部の態様において、シース流は、(標的部分(moiety)の分離又は検出の対象となる)サンプル流体と固体表面との間に流体障壁を形成して、固体表面に対する隔離障壁として機能させる。たとえば、シース流を用いて、固体表面への非標的部分(moiety)の非特異的結合を抑制する。本発明は、したがって、サンプル流体の成分と装置の固体表面との不要な相互作用を防ぐ手段を提供する。所望の相互作用、たとえば、流体成分の選択的採取には、サンプル流体と固体表面との間の不要な相互作用が伴う。たとえば、本発明の装置を用いて、サンプル流体と、側壁、上面又は底面の固体表面や(上述した)トラップステーション等の固体表面との接触を実質的に防ぐシース流障壁を形成することにより、サンプル流体の層流平面内における非標的部分(moiety)の不要な非特異的結合を防ぐことができる。
【0034】
さらに、シース流を用いて、サンプルの流れを「圧迫する」又は他の方法で横方向に狭くすることにより、サンプル中の細胞の計数等の目的に用いることができるような狭いサンプル流を形成するようにしてもよい。ある実施形態において、シース層流により、検出対象である細胞やその他標的種の大きさに相当する幅を有するサンプル層流の境界を形成する。本明細書の開示内容を考慮することにより、当業者であれば、他の態様も容易に理解できるであろう。
【0035】
用語:
他に規定しない限り、本発明に関連して用いられる科学用語や専門用語は、当業者が一般的に理解している意味で用いられるものとする。
【0036】
一般的な用語:
本出願において、「単数」で表わすものは、特に明記しない限り、「複数」も含むものとする。本出願において、 1つを意味する単語「a」又は「an」は特に明記しない限り「少なくとも1つ」を意味する。あるリストを挙げた後に「のうちの少なくとも1つ」と記載した場合には、リストの中の1つ以上の項目を意味し、リストにあるすべての項目が存在する必要があることを意味するものではない。単語「又は」は、特に明記しない限り「及び/又は」を意味する。多項従属クレームの場合、「又は」という表現は、2つ以上の先行する独立項又は従属項を選択肢として言及するものである。さらに、「備える」「有する」「含む」等を意味する単語「comprising」及びその変化形である「comprises」「comprised」は、非限定的な用語である。また、「(構成)要素」や「成分」を意味する単語である「element」や「component」は、特に明記しない限り、1つのユニットを含む要素や成分と複数のユニットを含む要素や成分との両方を包含する。「当業者(skilled practitioner)」という用語を用いる場合、特に明記しない限り、対象となる内容に関係する分野の通常の技術者を意味する。
【0037】
流体力学に関する用語:
(マイクロ流体工学を含む)流体力学を説明する様々な用語は、通常の専門用語の意味で用いられる。
【0038】
「流体」及び「液体」という用語は、本明細書では同義的に用いられ、「流れ」て、場合に応じて「容器の形状を取る」物質を意味する。状況によっては、「流れ」る気体状物質や固体状物質の場合もある。たとえば、細かい顆粒状物質は「流れ」ることができる。
【0039】
「流体回路」という用語は、本発明のシース流装置内に配置される流体的に相互接続される機能領域の構成を意味する。後に詳述するように、機能領域には、貯留部又は区画及び流体が流れるチャネルが含まれる。チャネルは、たとえば、対隣壁によって2つの区画が直接流体接続される場合に、必要に応じて設けられる。2つの貯留部やチャンバを、たとえば、対隣壁を介して、可逆的に流体接続することができ、対隣壁は、密閉されたものでも開放されたものでもよいし、あるいは、所定の大きさの粒子だけを通過させるような多孔質のものでもよい。当業者であれば、本発明の流体回路を様々に構成可能であることが理解できよう。構成以外にも、本明細書で説明する流れ制御構造要素等、流体回路を統合するために広範囲な選択肢が考えられる。
【0040】
粒子選別に関する用語:
本明細書で時に応じて用いる「部分(moiety)」は「部分(portion)」を意味するが、1つの粒子に言及する時にも用いる。「粒子」は輸送及び特性に関してユニット全体として作用する小さな物体を意味する。「被分析物」という用語は、「部分(moiety)」でも「粒子」でもよく、通常用いられる意味で用いられ、分析過程において、存在するか否かの検出対象又は特性の測定対象となる物質を意味する。
【0041】
生物学及び生化学用語:
核酸やタンパク質等、特定の範疇の分子を議論する場合には、自然に発生する分子の類似型や異性体型等の合成型も含まれる。特に明記しない限り、所望の機能特性が維持されている限り、変性型も同様に包含される。たとえば、CD34細胞表面たんぱく質に選択的なアプタマーには、化学誘導体(たとえば、ペグ化、プロフォーム(pro-form)の形成、酵素やリボゾーム等の別の活性部分(moiety)を用いた誘導体化)が含まれる。
【0042】
「体液」という用語は、流体源を意味し、(以下に限定されるものではないが)羊水、房水、血液および血漿(特に他に明記しない限り、本明細書では、血液は血漿成分を意味する)、耳垢、カウパー腺液、消化粥、間質液、リンパ液、哺乳類の母乳、粘液、胸膜液、膿、唾液、皮脂、精液、血清、汗、涙、尿、膣分泌物、嘔吐物及び(外傷や病変からの)漏出液が含まれる。
【0043】
「選択的結合分子」という用語は、特定の標的部分(moiety)に必ずしも特異的でなくてもよいが、選択的に結合する分子を意味する。結合はランダムに生じるものではない。選択的結合分子は、種々の抗体又は置換体(ポリクロナール、モノクロナール、ペプチボディ、ヒト化、短縮化、類似型やその他当該分野で利用可能なもの)やアプタマー(DNA、RNA又は様々なタンパク質型でもよいし、酵素部分(moiety)や測色部分(moiety)等、別の機能部分(moiety)により変性させたものでもよい)から選択されるものでもよく、特定の生体系に特有のものでもよい。タンパク質は、Hisタグ等の特定のタグを用いて発現させたものでもよく、当業者であれば、適当な種類の選択的結合分子や適当な検出可能な標識を決定することができるであろう。上記の一欄は何ら包括的なものではない。
【0044】
当然のことながら、本発明の実施形態は、生体サンプルや有機サンプルに限定されるものではなく、非生体物質や無機物にも及ぶ。したがって、本明細書で説明する装置や方法を、液体中の広範囲な生体物質や非生体物質のスクリーニング、分析、変性又はその他処理に用いることができる。標的種及び/又は非標的種には、化合物、超分子集合、タンパク質、オルガネラ(細胞小器官)、フラグメント(断片)、ガラス、セラミック等、小さな又は大きな天然起源又は合成した化学物質が含まれる。ある実施形態において、標的種及び/又は非標的種は、任意の分岐度のモノマー、オリゴマー及び/又はポリマーである。これらは、細胞又はウィルス上で発現させたものでもよいし、独立した物質でもよい。また、完全な細胞やウィルス自体でもよい。
【0045】
全般的考察:
本発明の実施及び利用を目的として、全体的な装置の構成、材料、製造システム、計装システム及び用途に関する考察を行なう。実施例を含む所定の実施形態を説明し、理論的実験例に関しても説明する。
【0046】
圧縮性流か非圧縮性流か、粘性流か非粘性流か、定常流か非定常流か、層流か乱流か、ニュートン流体か非ニュートン流体か、亜音速流、遷音速流、超音速流及び極超音速流のいずれか、非相対論的流れか相対論的流れか、磁気流体力学(その他、粒子選別の要件)を含む流体力学の原理を考慮して、本発明の実施又は利用を行なう。この一欄は完全なものではなく、当業者であれば、流体、粒子、装置及び選別方法をすべて組み込むべきであることは理解できよう。
【0047】
したがって、特に、本発明を用いて、血液サンプルから循環腫瘍細胞等の希少細胞を選別すると共に、誤った結果を与える可能性がある非選択的な結合を最小限に抑制することができる。細胞の大きさの粒子に関しては、流体力学的な流れは毎秒数メートルの速度を必要とする、という物理的制約条件が考えられる。この速度ならば、通常の細胞は、数マイクロ秒以内に自分自身の直径と同じ距離を移動できる。
【0048】
さらなる機能を持つように、本発明の装置を構成するようにしてもよい。たとえば、まず細胞を単離した後、in situ(その場)で培養する場合には、本発明の装置をさらにバイオリアクターとして用いることができるように構成するようにしてもよい。さらに、まず細胞を培養して、又は、予め成長させた細胞を用いて、本発明のシース流装置上でタンパク質(又はその他の標的部分(moiety))を得るようにしてもよい。標的タンパク質(又は部分(moiety))を検出可能に標識して流体内に懸濁させて、本発明のシース流装置内で選別するようにしてもよい。本発明を用いて、アプタマーライブラリーからタンパク質用のアプタマーを選択する等、化学物質ライブラリーの選別またはスクリーニングを行なうようにしてもよい。
【0049】
本発明のシース流装置は、従来の流体取扱装置と同様に用いることができる。所望の製造方法やシステム、所望の用途及び(必要に応じて)所望の関連計装を全般的に考慮すればよい。サンプルの大きさや適用要件、流体の流れ方向、流路及び流速の制御手段、(必要に応じて)粒子物質の選択又は選別を行なう手段や必要な計装に伴う適応に関連して、装置形状を考える必要がある。
【0050】
本発明のシース流装置、関連する方法及びシステムは、マクロ流体サンプルとマイクロ流体サンプルの両方に対して、産業上利用可能であり、詳細には後述するように、広範囲な目的に応じて構成及び適合可能である。マイクロ流体装置は、サンプル内のタンパク質精製、希少細胞分離及び希少分子(たとえば、タンパク質やアプタマー)のスクリーニング等の目的に利用可能である。本発明の層流形成面を備えるようにマイクロ流体装置を構成して、本明細書に記載するように、流体層内にシース流を形成するようにしてもよい。たとえば、参照することにより本明細書にすべて組み込まれるQian, X. Lou, Y. Zhang, Y. Xiao, H. T. Soh, "Rapid Generation of Highly Specific Aptamers via Micromagnetic Selection" (マイクロ磁気選別による非常に特異性の高いアプタマーの高速生成)Analytical Chemistry (2009)、 U. Kim and H. T. Soh, "Simultaneous Sorting of Multiple Bacterial Targets Using Integrated Dielectrophoretic-Magnetic Activated Cell Sorter" (集積型誘導泳動磁気活性化セルソーターを用いた複数のバクテリア標的の同時選別)Lab on a Chip (2009)、Y. Liu, J. D. Adams, K. Turner, F.V. Cochran, S. Gambhir, and H.T. Soh, Controlling the Selection Stringency of Phage Display Using a Microfluidic. (マイクロ流体を用いたファージ・ディスプレイの選択厳密性制御) Lab on a Chip (2009)、及び X. Lou, J. Qian, Y. Xiao, L. Viel, A. E. Gerdon, E. T. Lagally, P. Atzberger, T. M.Tarasow, A. J. Heeger, and H. T. Soh, “Micromagnetic Selection of Aptamers in Microfluidic Channels,”(マイクロ流体チャネルにおけるアプタマーのマイクロ磁気選別) Proceedings of the National Academy of Sciences, USA, 106 (9) 2989-2994 (2009)を参照のこと。
【0051】
シース流装置の一般的構成:
本発明のシース流装置は、(本明細書で説明するように、固体表面との接触がなくなっても)1つの流体層が別の流体層に接触すればシース流として持続する層流を固体表面上に形成するという原理に従って構成される。本発明のシース流装置は、平行な層流の流路平面内で隣接する流体と流体接触する上流側に層流を形成することに利用可能な固体表面を有するものであれば、いかなる構成や構造でもよい。
【0052】
一般的に、本発明は、流体サンプル流路と装置表面との間で障壁として作用するシース流を形成するように構成される装置を提供する。この障壁は、サンプル流体と装置表面との相互作用を阻害又は妨害する。たとえば、この障壁は、対象となる流体サンプル部分(moiety)の固体表面への非特異的結合を実質的に防ぐものである。非特異的結合を実質的に防ぐことにより、部分(moiety)の堆積による流路の破壊や選択された希少部分(moiety)の汚染等の悪影響を避けることができる。
【0053】
空間的には、シース流装置を(水平軸に対して)水平方向に配置する場合には、流路は、互いに鉛直方向に配列される(互いに積み重なるように層状に重ねて形成される)。この構成を、図1及び図6Aないし図6Cに示す。図示するように、上部シース流と下部シース流とは、サンプル流面の両側に、平行に隣接するように形成される。流れ平面が水平方向であるのに対して、上部シースは「上面」に下部シースは「底面」に、鉛直方向に積み重なるように形成される。
【0054】
本発明の装置を縦型(水平軸に対して垂直な)で構成することもできる。縦型構成の場合、流路は水平方向に(互いに左右方向に)層状に重ねて形成される。
【0055】
流体回路に応じて、流路は平面内に形成されるものでもよいし、そうでなくてもよい。流路を半円形チャネル、円管又は同様のチャネル構造の形状に構成する場合、流路は(3次元曲面平面形状に関するユークリッド幾何学に従って、交わることなく)実質的に平行になる。
【0056】
所定の状況下では、流体シースとして、実質的に静止した流体「プール」が形成される。厳密に言えば、流体プールは流れていないが、特に粘性の高い液体(たとえば、容器に入れた場合に、容器の形状を取る物質)の場合には、極めてゆっくりではあるが、流体運動特性を示す。このように、(後述する)下部流体層等の「プール」領域を備え、その上に、粘性の低い流体サンプル流が形成されるように、本発明の装置を構成してもよい。
【0057】
サイズ:
本発明の装置は、流体力学及び流体の特性を考量して、任意のサイズにスケーリング可能である。一つの実施形態において、本発明の装置を、マイクロ流体回路に合わせてスケーリングしてもよい。他の実施形態において、本発明の装置を1リットルスケール又は数リットルスケールでの使用に適した構成としてもよい。
【0058】
層流形成領域に関しては、流体特性を考慮して、層流を形成するのに必要な表面積を考える。
【0059】
当業者には自明のことであるが、流体特性には、粘度、粒子状物質の特性(流体力学等)、粒子状物質の濃度、及び、隣接する場内の流体に対する流体の混和性(又は反応性)が含まれる。
【0060】
サイズに関しては、所望の流量/流速を得るための圧力量を、圧縮性流か非圧縮性流か、粘性流か非粘性流か、定常流か非定常流か、層流か乱流か、ニュートン流体か非ニュートン流体か、亜音速流、遷音速流、超音速流及び極超音速流のいずれか、非相対論的流れか相対論的流れか、磁気流体力学及びその他当該分野で周知の方法に従う近似等の流体力学に基づいて、計算することができる。当業者であれば、装置材料を含むシステム全体を考慮して流体力学を考えることができるであろう。
【0061】
シース流装置では、サンプル流平面からシース流平面に標的種を偏向させる方向に、分離力が作用する。一般的に、この方向は、流れ方向に垂直であり、シース流及びサンプル流は、この方向に沿って互いに積み重なる隣接する平行な層を形成する。この方向における装置の寸法(装置の「高さ」)は、比較的小さく、多くの場合、装置の中で最も小さな寸法であり、分離力が作用可能な距離に相当する大きさである。この力は、多くの場合、短距離力であり、この方向における装置の寸法は、多くの場合、約1ミリメートル以下のオーダーである。これに対して、装置の横方向の寸法、すなわち、流れ方向と分離力の方向の両方に垂直な方向の寸法は、比較的大きい。これにより、装置を比較的大きなサイズにスケーリング可能であり、これに応じて、たとえば、マイクロ流体構成において、1時間当たり約数百ミリメートルオーダーに、スループットを増大させることができる。このような装置の横方向の寸法は、たとえば、少なくとも約10センチメートルで、少なくとも約20センチメートルでもよい。具体的な実施形態において、装置の高さは約700マイクロメートルで、横方向の寸法は約20センチメートルである。ここで挙げた寸法は、本明細書の別の部分で詳述するものを含む磁気泳動分離機構と共に用いるのに適した大きさである。
【0062】
後述する実施例は、(実施例に後述するように、一般的には1mm以下の流体チャネル直径を有する)マイクロ流体サイズに関するものである。実施可能な用途に関する制限はさておき、サイズの下限は、主に製造方法によって決まる。たとえば、ナノエレクトロニクス部品が必要な場合には、マイクロリソグラフィー法で各部品を集積させることも考えられる。マイクロ流体用途では、流体の流れに乱流が生じるのを抑制すると共に、所望の流路内で層流を最適化するような比率が必要とされる。本発明のシース流装置を、たとえば、1〜10μl、10〜100μl、100〜1000μl、1000μl〜100mlのサンプル容量に対して利用可能なように構成してもよい。
【0063】
本発明のシース流装置は、流体力学の原理及び所望の用途等、実用を考慮して、実質的にどのような大きさにでもスケーリング可能である。シース流の上流側に層流を形成するための一般的な原理は、マイクロ流体用途用の装置より大きな装置には広く適用可能であり、当業者であれば、スケールアップを可能にする一般的な流体力学の原理を理解できるであろう。たとえば、一部の実施形態において、本発明の装置を、100mlから1リットル、及び、場合によっては数リットルという、より大きなサンプル流量に用いられるように構成するようにしてもよい。
【0064】
流体層の数及び特性:
本明細書で用いられる「流体層」という用語は、実質的に乱流を生じさせることのない個別の流体流路平面を意味する。「流体層」は、固体表面上の層流でもよいし、平行な平面内で隣接する又は当接する流体層に関するシース流でもよい。
【0065】
本発明を、2次元の平面配向ではなく、サンプル流体を全体的に囲むシースを形成する装置に適用することもできる。層流形成面を組み合わせることにより、サンプルを囲む流体層を形成し、3次元の流体力学を容易に実現可能である。このようにして、水平方向と鉛直方向の両方に対して、(装置の流体回路内の)チャネル壁からサンプル流を離すことができる。
【0066】
流体層の数:
一般的態様において、本発明は、少なくとも3つの個別の、順次境界を接する流体層流層を含む装置(及び関連する方法及びシステム)を提供する。層流の流路は、互いに隣接し、互いに平行になるように、順次配置される。各層流の流路は、他の層流の流路と平行で、かつ、流路に対して垂直な方向に層状に重ねて形成される。
【0067】
サンプル層流平面を(たとえば)上層と下層とで挟んだ(後述する実施例のように)3つの層を用いるようにしてもよい。固体支持面なしに層流(シース流)平面を連続させることができる範囲は主に流体力学要件に基づいて決まるが、別の流体層を加えるようにしてもよい。幾何学的構成、チャネル壁組成及び摩擦力等の流体回路の特性を考慮するようにしてもよい。また、流速や流れ力、流れ平面の寸法、各流れ平面層における流体容量、及び、当業者に自明の他の流体力学要件を考慮するようにしてもよい。
【0068】
流体層の厚み:
流体層の数に関連して、各流体層の厚み(又は深さ)も重要である。当業者であれば、装置の構成及び用途に加えて、流体特性により流体層の厚みが決まることが理解されよう。
【0069】
たとえば、シース流装置を磁気泳動用に構成する場合には、シース流を形成する流体層による抵抗よりも大きな磁力をかける必要がある。すなわち、磁気的に標識した標的粒子をサンプルから分離するのに印加する磁力は、流体層を通して、所望の領域(たとえば、上述したトラップステーション)に粒子を引っ張るのに十分な大きさでなければならない。
【0070】
したがって、たとえば、上面にトラップステーションを有し、水平面内で装置の上面に磁力をかける磁気泳動装置を用いる場合には、本発明のシース流装置は、(サンプルの粘性に対して)相対的に粘性が高く、動きがゆっくりの(又は動かない)第1の(たとえば、下部)流体層と、(下部層に対して)相対的に粘性が低いサンプル層と、原則として粘性を持たない上部層とを備えるようにしてもよい。このようにすれば、上部層のシース流により、磁気的に標識された標的粒子が層を通って移動し捕捉されることを妨げることなく、(上面に配置される)磁気トラップステーションにおける非特異的結合を実質的に防ぐことができる。
【0071】
構造要素:
一般的に、本発明のシース流装置は、単純に流体を収容したり貯蔵したりする以上の特定の用途が達成されるように流体を移動させる機能を果たす。
【0072】
構造的な特徴により、流体回路が規定される。本発明のシース流装置は、1つ以上のアクセスポートと、1つ以上の貯留部と、アクセスポート及び貯留部間を流体連結する1つ以上のチャネルと、を備える。他の構造要素に関しても以下で説明する。
【0073】
アクセスポート:
一般的に、全体の構成と材料とに基づき、本発明のシース流装置は、物質の流入及び流出を可能にする少なくとも1つのアクセスポートと、流体を収容する少なくとも1つの貯留部と、を備える。流体(や他の物質の)流入や流出に用いられるアクセスポートを、システム全体の一部として、他の装置や機器と共に作動するように構成してもよい。
【0074】
アクセスポートは、流体供給口や流体流出口を提供し、外部環境に接続されるものでもよい。流体供給の場合には、シリンジやピペットを介して流体が供給されるようにアクセスポートを構成してもよいし、あるいは、自動供給機器により流体が供給されるようにアクセスポートを構成してもよい。図6Bにシリンジに適したアダプターを嵌めたアクセスポートの例を示す。流体流出は、たとえば、排出物の除去を目的としたものでもよいし、懸濁液中の粒子状物質を選択的に捕捉する正の選別スキームの一部として行なわれるものでもよい。チューブスタッド、ホースバーブ接続、Oリング接続やその他の外部接続部等、様々な外部接続部をアクセスポートに用いることができる。
【0075】
外部接続部を用いる代わりに、アクセスポートを、独立に封入された貯留部等、装置の他の部分と流体連結するようにしてもよい。機能的には、流体供給や流体分離(流体流出)と同じ機能を果たす。
【0076】
本発明の装置は、複数の異なる流体を導入する、又は、別々の部分(moiety)を流出させる等、様々な機能のために1つ以上のアクセスポートを備えるものでもよく、各アクセスポートが外部環境や装置の他の部分に接続されるものでもよい。
【0077】
貯留部:
本発明の装置は、さらに、流体を収容し、流体上で所定の機能を果たす少なくとも1つの貯留部を備える。貯留部は、機能的な役割を果たすものでもよいく、この機能を果たすためにさらなる構造要素を備えるものでもよい。たとえば、培養された細胞が必要な場合には、(以下に限定されるものではないが)たとえば、エアレーション装置、ミキサー、温度制御装置等、適当な細胞培養装置を貯留部と一体化させたものでもよい。これらの装置を、本発明のシース流装置の一部として形成してもよいし、(シース流を機器に操作可能に接続した場合に)装置を一時的に取り付けて、関連処理機器の一部としてもよい。機能を果たすシステム内で操作可能なように、貯留部を適合させるようにしてもよい。
【0078】
装置の機能要素:
一定量の供給及び測定用に、あるいは、連続フロー用に、本発明の装置を構成する又は適合させるようにしてもよい。本発明の装置を、(細胞溶解とタンパク質単離等)多重機能用に構成してもよい。本発明の装置を、一段又は多段処理又はアッセイ用に構成してもよいし、試薬貯蔵用に構成してもよい。本発明の装置を、ろ過機能を持つように構成する又は適合させるようにしてもよい。
【0079】
たとえば、本発明のシース流装置が、さらに、たとえば、粒子選別の一形態として、標的部分(moiety)を捕捉する構造を備えるようにしてもよい。たとえば、後述するように、磁気的に結合された標的種の「トラップステーション」として機能する、磁気泳動粒子選別用の強磁気グリッドを備えるようにしてもよい。本発明のシース流装置では、懸濁液からの粒子の分離が特に効果的に実行可能である。たとえば、複合混合物から特定の部分(moiety)を磁気泳動分離させる場合には、先に引用した米国特許公報2009/0053799A1に記載されるような強磁気構造等の適当な磁気泳動トラップ構造を適当な位置に備えるようにしてもよい。上部層上に強磁気トラップステーションを備える例を図6Bに示す。
【0080】
本明細書のあちらこちらに記載するように、様々な粒子選別/検出/分析機能部を備えることができる。
【0081】
シース流流体工学装置内で磁気トラップソーターと統合可能な操作モジュールの例としては、(a)蛍光活性化セルソーター等の追加濃縮モジュール及び洗浄モジュール、(b)サンプル増幅(たとえば、PCR)モジュール等の反応モジュール、制限酵素反応モジュール、核酸シークエンシングモジュール、標的標識モジュール、クロマチン免疫沈降モジュール、架橋モジュール及び細胞培養モジュール、(c)核酸、抗体又は他の特異性が高い結合剤のマイクロアレイ等の検出モジュール及び蛍光分子認識モジュール、及び(d)細胞を溶解させる、ウィルスタンパク膜の破壊又はその他小さな生体の成分を放出させる溶解モジュールが挙げられる。これらのモジュールは、各々、磁気ソーターの前段に備えるようにしてもよいし、又は、後段に備えるようにしてもよい。単一の流体工学システムにおいて、複数の同一種類の又は異なる種類の操作モジュールを磁気ソーターと統合するようにしてもよい。さらに、1つ以上の磁気ソーターを、種々の他の操作モジュールに対して、並列に配置するようにしてもよいし、直列に配置するようにしてもよい。これらの操作モジュールの一部を、サンプル中の標的種を定常状態で保持するような、又は、一般的に所定容量内に閉じ込めるようなトラップとして設計又は構成するようにしてもよい。
【0082】
上述したモジュールの例から明らかなように、集積流体工学装置のモジュールにおいて標的種及び/又は非標的種上で実施可能な操作には、選別、磁性粒子への結合(本明細書では「標識」とも称する)、結合、洗浄、捕捉、増幅、不要な種の除去、沈降、切断、希釈、結紮、シークエンシング、合成、標識(細胞の染色等)、架橋、培養、検出、撮像、定量、溶解等が含まれる。
【0083】
集積流体装置の磁気選別モジュールにおいて実施可能な生化学的操作の具体例としては、プラスミド、アプタマー、タンパク質及びペプチドの合成、精製、及び/又はスクリーニング、酵素活性の評価及びタンパク質と炭水化物の誘導体化が挙げられる。広範囲に及ぶ生化学的及び電気生理学的アッセイを実施可能であり、これには、(1)DNA及びRNAオリゴマーのゲノム解析(シークエンシング、ハイブリダイゼーション)、PCR及び/又はその他の検出及び増幅スキーム、(2)遺伝子発現、(3)酵素活性アッセイ、(4)受容体結合アッセイ、及び(5)ELISAアッセイが含まれる。前述のアッセイは、均一系、ビーズベース、及び表面結合等様々なフォーマットで実施可能である。さらに、本明細書で説明する装置を利用して、特定の酵素又は触媒を用いる生体分子の連続生産、及び、治療薬等、生体系で活性な生体分子又は分子の生産と送達を実施することも可能である。本明細書に記載する流体装置を用いて、ペプチド、タンパク質並びにDNA及びRNAオリゴマーのコンビナトリアル合成を実行することもできる。
【0084】
集積及び流体回路:
機能要素の集積は、様々な方法で実施可能である。一般に、すべての組み合わせで、流れチャネルを介して、アクセスポートと貯留部とを流体的に接続可能である。流れチャネルは、所望の種類の流れに適合するように、また、所望の流体の動きを可能にするような任意の寸法で、形成可能である。
【0085】
流れ制御構造要素は、多種多様な中から選択可能である。これには、バルブ、多孔質膜、ミキサー、ポンプ及びその他従来の流れ制御構造要素が含まれる。in situで凝固して流れを遮断する物質の適応等、従来用いられていない流れ制御を用いることもできる。
【0086】
流体回路の集積に関連して、層流形成面を考慮する必要がある。たとえば、シース流の上流側で層流が形成される場合、シース流は、逆方向適合性(上流側)を持たず、妨害しないようなものでなければならない。
【0087】
熱、太陽光、水等の存在下で非毒性成分の部分(moiety)に分解する高分子材料を用いる等、本発明の装置の全体又は一部を生分解性のものとしてもよい。
【0088】
さらに、在庫管理のために、バーコード、RFID又はその他、装置を識別する手段等で製品識別を行なうようにしてもよい。本発明の装置を、さらに、関連試薬と共にパッケージングするようにしてもよい。たとえば、生物剤と共に用いられるように、本発明の装置を適当な緩衝液(バッファー)、媒体、検出可能な標識部分(moiety)、(流体供給用のシリンジ等の)装置、又はその他の商品と共にパッケージングするようにしてもよい。
【0089】
洗浄又はキャリア流体:
たとえば、(洗浄剤を含有する又は含有しない)水性緩衝液、アルコール(メタノール、エタノール、イソプロピルアルコール等)、有機溶剤(ヘキサン、フッ化炭素、芳香族化合物等)又はこれらの組み合わせと共に用いるように、本発明の装置を構成する又は適合させるようにしてもよい。ある実施形態において、これらの流体は、シース流流体として機能するものでもよい。
【0090】
電気化学/電気活性:
本発明の装置は、1つ以上のプリント基板、互いに噛み合う電極、スパッタ又はスクリーン印刷電極、又はキャパシタンス・アレイを備えるものでもよい。たとえば、高分子材料状に回路基板を予め準備して、本発明のシース流装置の製造に用いるようにしてもよい。これらの構成要素を、トラップステーション及び/又は様々な前処理及び後処理モジュール又はステーションの駆動を指示する関連論理回路で制御するようにしてもよい。
【0091】
粒子捕捉又は選別に力を用いる場合の操作性:
本発明の装置の最も有望な用途の1つは、粒子選別であり、多くの方法で、粒子選別を行なうことができる。磁力、音響的な力、磁気泳動力又は光学的な力等の制御可能な力を用いて、流体に懸濁されている応答粒子を動かすことができる。
【0092】
たとえば、(細胞選別等の)磁気活性化粒子選別を用いるようにしてもよい。実行可能な例としては、選択的結合分子が付着した磁気ビーズを用いることができる。選択的結合分子が所望の標的に結合すると、磁石が付着する。次に、磁力を用いて、また、必要に応じて、強磁性トラップステーションを用いて、所望の標的を捕捉又は選別するようにしてもよい。磁性領域を印刷する、あるいは、(たとえば、特定領域に適用する等)強磁性微粒子を製造原料内に取り込むことにより、シース流装置の材料に強磁性物質を埋め込むようにしてもよい。また、音響的な力、磁気泳動力やその他の力等、当該分野で利用される制御可能な力を用いるようにしてもよい。当業者であれば、本発明のシステムを収容可能な適当な装置構成を理解することができるであろう。
【0093】
光学検出:
光学検出が可能になるように、本発明の装置を構成してもよい。実際に適用する場合には、たとえば、測色であれば、蛍光検出可能な又は発光検出可能なマーカーが望ましい。他の光インターフェースとしては、光ファイバー、表面プラズモン共鳴、減衰全反射やその他の光学インターフェースが挙げられる。
【0094】
他の特徴/特別要件:
(オートクレーブ等他の滅菌法に対する選択された材料の耐久性を考えて、たとえば、酸化エチレンを用いて)本発明の装置を滅菌するようにしてもよい。細胞培養要件に対する表面適合性や、選択された材料や構成にさらなる表面エネルギーを有するものでもよい。本発明の装置は、たとえば、ガス透過性のあるものでもよい。表面への非特異的結合を最小限に抑えるために、ケイ素等で内側を被覆するようにしてもよい。
【0095】
磁気泳動及び磁気トラップの実施形態:
上述の原理に基づいて、シース流と磁場選別の両方を可能にする様々な構造を考えることができる。ある実施形態において、磁場選別は、トラップモードで、外部磁場を印加した後、非標的種と標的種とを順次溶出させる。すなわち、磁性粒子が付着した種を適当な位置に保持すると共に、付着していない種を溶出させる。この最初の溶出ステップが完了後、磁場にとらえられ、溶出されなかった種を、溶出及び回収できるように、何らかの方法で放出させる。
【0096】
一部の実施形態において、MACSシステムのトラップモジュールは、磁性粒子が付着した種及び付着していない種を含むサンプルが流れるチャネルを備える。チャネルの一方側は、外部源から磁場を印加することにより傾斜磁場を発生させる傾斜磁場発生構造を備える。この傾斜磁場は、磁性粒子を磁性粒子が付着した種と共に引き寄せて、捕獲する。サンプルがトラップモジュールを通過後に、印加される磁場を変化させることにより、又は、磁性粒子と磁性粒子が付着した種との間の結合を切断することにより、捕獲された粒子を放出させるようにしてもよい。
【0097】
たとえば、ある実施形態において、流体分離装置は、以下の特性を備えるものでもよい。(a)流体分離装置内にサンプル流を形成するように構成される少なくとも1つのサンプル流入口又はアクセスチャネル、(b)流体分離装置内でサンプル流の周囲にシースを形成する1つ以上の流体の流れを形成するように構成される少なくとも1つのシース流流入チャネル、(c)サンプル流入口及びシース流流入チャネルに流体連結され、サンプル流の流路に沿って配置される選別ステーション、及び(d)外部磁場との相互作用により、線べスステーション内で傾斜磁場を変化させて、サンプル流から磁性粒子を偏向させる及び/又は捕捉する傾斜磁場発生部。
【0098】
選別ステーションが、選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を備えるものでもよい。このような場合、内部空間は、サンプル流の流れ方向と交わる(たとえば、垂直な)第1の横方向寸法と第2の横方向寸法とを備える。種々の実施形態において、第2の横方向寸法(多くの場合、水平面上の幅)は、第1の横方向寸法(多くの場合、鉛直方向の長さ)の少なくとも約2倍以上である。この装置は、少なくとも1つのシース流流入チャネルが、第1の横方向寸法に沿ったサンプル流により互いに分離された2つのシース流を形成するように構成されるものでもよい。
【0099】
さらに、長方形の内部空間を用いる実施形態において、内部空間は、約2ミリメートル以下の距離だけ離れた、あるいは場合によっては、約1ミリメートル以下の距離だけ離れた、実質的に平行かつ実質的に平面状の2つの表面により、部分的に規定される。このような実施形態において、少なくとも1つのシース流流入チャネルは、平行で平面状の2つの表面に接して流れると共に、サンプル流により互いに分離された2つのシース流を形成するように構成される。第1のシース流流入チャネルは、選別ステーションの上流側に位置し、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有するものでもよい。さらに、装置が、選別ステーションの上流側に位置し、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第2のシース流流入チャネルを備えるものでもよい。サンプル流入チャネルは、内部空間の実質的に平行で実質的に平面状の2つの表面に平行な実質的に平面状の表面を有するものでもよい。シース流流入チャネルに平面状の表面を形成する平面構造上にこれらの表面を形成するものでもよい。図1、図2及び図6Aないし図6Cにこのような構造の例を示す。
【0100】
流体分離装置の傾斜磁場発生部は、分離装置上でパターンを形成する複数の強磁性素子を、選別ステーションの近傍に備えるものでもよく、また、複数の強磁性素子の近傍に永久磁石を備えるものでもよい。複数の強磁性素子は、選別ステーションの流体通路内に配置されて、強磁性素子とサンプル流とを流体接触させるものでもよい。強磁性素子がシース流及びサンプル流と直接接触しないように、強磁性素子上に保護層や保護膜を形成することが望ましい。このような層を形成することにより、細胞等のサンプル成分の被毒や汚染等を防ぐことができる。好適な保護層の例としては、酸化ケイ素、窒化ケイ素、又はその他適当な不活性バリア材の薄層(たとえば、10nm〜1μm)が挙げられる。ある実施形態において、強磁性素子は、マイクロパターン化された素子等のニッケル素子を含む。図8Aないし図8Hに例を示す。図示するように、強磁性構造は、平行線、直交グリッド、及び規則的な又は不規則な幾何学形状の長方形アレイ等、系統的なパターンで形成されるものでも、ランダムなパターンで形成されるものでもよい。図示するように、この構造は、規則的又は網目状でもよい。具体的な例では、ニッケル強磁性素子を薄いシリカ保護層で被覆する。種々の実施形態において、傾斜磁場発生部は、一時的に磁性粒子を捕捉し、その後、磁性粒子を放出するように構成される。
【0101】
図2A及び図2Bを参照して上述したように、流れチャネルの下部壁の内側表面上に強磁性構造が形成される。この構造は、傾斜磁場発生(magnetic field gradient:MFG)構造として機能する。外部磁場が、通常、流体媒体の中を流れる磁性粒子を捕捉する駆動力として用いられる。MFG構造は、流れる磁性粒子の捕捉に役立つ局在的に高い傾斜磁場が発生させるように外部磁場を形成してもよい。図2Aに示す実施形態において、交互極性の永久磁石アレイにより外部磁場が与えられる。一般には、1つ以上の永久磁石及び/又は電磁石により外部磁場を発生させることができる。一部の実施形態において、図2Aに示すような磁石群は、個別に又はユニットとして移動可能であり、トラップ領域に印加される磁場を動的に変動させる。
【0102】
ある実施形態において、電磁石を用いて磁場を制御する。他の実施形態において、選別ステーションの近傍に機械的に出入り可能な永久磁石を用いて、磁性粒子を順次捕捉して、その後、放出するのが容易になるように、選別領域内の傾斜磁場を局所的に増大又は減少させるようにしてもよい。電磁石を用いる場合には、処理工程の前半で(磁性粒子の捕捉時)強い傾斜磁場が形成され、処理工程の後半で(磁性粒子の放出時)傾斜磁場が弱められる、あるいは、消失するように、磁場を制御する。
【0103】
一つの実施形態において、装置のトラップ領域は取り外し可能である。別の実施形態において、取り外し可能なトラップ領域は使い捨てである。具体的な実施形態において、トラップ領域、たとえば、ニッケルグリッドを組み込んだプレートが使い捨てであり、トラップ処理後に洗浄を行なって不要物を除去した後、トラップ領域を組み込んだプレートからトラップ領域を「ワンタッチで」取り外せるように切り込み線を形成する外周囲でトラップ領域を規定する。これを、図3Aの側面図と図3Bの上面図とに示す。プレート300は、ニッケルグリッドのトラップ領域310と切り込み線315とを備える。たとえば、吸着カップ装置を用いて、プレート内の切り込み線に沿って破断するのに十分な引っ張り力を印加することにより、プレートから取り外し可能なトラップ領域を引き離すことができる。必要に応じて、磁場を印加して、又は、磁場を印加することなく、取り外し可能なトラップ領域を取り外すことができる。取り外した後、オングリッドで標的細胞を分析及び操作するようにしてもよいし、オフグリッドで標的細胞を分析及び操作するようにしてもよい。
【0104】
図2Aの例に示すように、磁性粒子は、捕捉対象の標的細胞又はその他の種のマーカーに特異的な1つ以上の分子認識成分(たとえば、抗体)により被覆される。したがって、1つ以上の磁性粒子は、これと結合した細胞又はその他の標的種と共に、結合ユニットの形で、トラップモジュール内に流入する。多くの露出結合部分(moiety)を有する大きな標的種(たとえば、哺乳類の細胞)の場合には、複数の磁性粒子が付着することが多い。
【0105】
一部の実施形態において、トラップ領域は、厚みは比較的薄いが、比較的高いスループットを与えるように、かなり幅が広く形成されている。すなわち、チャネルの高さ又は深さは比較的小さいが、チャネル自体の断面積は比較的大きい。流体媒体内のトラップ領域を通って流れる磁性粒子を引き付けるために用いられる磁場の有効距離により、チャネルの薄さを規定するようにしてもよい。一部の実施形態において、したがって、トラップ領域の断面高さは、約2ミリメートル以下であり、場合によっては、約1.5ミリメートル以下、あるいは、約1ミリメートル以下、さらには、約0.8ミリメートル以下である。トラップ領域の内部空間の幅は、スループット要件と製造限界との組み合わせにより決定される。一部の実施形態における幅は1ミリメートル未満であるが、幅を30cm以上とすることもできる。具体的な例では、高さは約0.5〜1ミリメートルで、幅は約15〜25センチメートルである。さらに、複数のシース流トラップ装置を並列に接続することにより、スループットを向上させることができる。一部の実施形態において、1つのサンプル供給部から、複数の並列装置の各々にサンプルが供給される。同様に、1つのバッファー(緩衝液)又はその他のシース流を形成する流体の供給部から、複数の装置に供給される。並列に駆動されるこのような装置の数は、2、3、4、5又はそれ以上でもよい。
【0106】
本発明と共に用いるのに適した流体工学システムの詳細に関しては、引用することによりあらゆる目的で本明細書に組み込まれる、「マイクロ流体磁気泳動装置及びこの装置を用いる方法(Microfluidic magnetophoretic device and methods for using the same)」という名称でSang-Hyun Ohらを発明者として2006年10月18日に出願され、US2008/0124779A1として公開された米国特許出願11/583,989における流れモジュールの説明に記載されている。記載されている詳細としては、たとえば、緩衝液(バッファー)の組成、磁性粒子の特性、外部磁石の特性、MFGを発生させるための強磁性材料、流れ条件、サンプル型、他のモジュールとの統合、流体光学及び磁気素子の制御システム、標的種と磁性粒子との間の結合機構等が挙げられる。一般に、磁気トラップモジュールにおいて印加される外部磁場は、(上述の)米国特許出願11/583,989に記載されるような連続フロー型磁気流ソーターにおいて用いられる磁場と比べて、比較的高い(モジュール全体の構造を考えた場合)。いずれの場合でも、標的種に加えられる磁力は、流動流体に対して(磁性粒子に結合されている)標的種を捕獲して適当な位置に保持することができるように、流体力学的なけん引力よりも十分に大きなものでなければならない。
【0107】
図8に例示する正の選択を行なう典型的な例では、磁気トラップ処理800が以下のように進む。まず、ステップ801で、標的細胞を含有すると考えられる生物試料等のサンプルを、標的細胞の表面マーカーに特異的な捕獲部分(moiety)(たとえば、抗体)で被覆された小さな磁性粒子で、標識する。この標識処理は、マイクロ流体選別装置上で行なうようにしてもよいし、あるいは、マイクロ流体選別装置外で行なうようにしてもよい。標識を行なった後、ステップ803で、同時にバッファー溶液(緩衝溶液)を流しながら、又は、バッファー溶液を流さないで、サンプルを(トラップ領域を含む)選別ステーション内に流入させる。ステップ805に示すように、1つ以上のシース流流入口からバッファーを供給すると共に、サンプルを1つ以上の別の流入口から供給するようにしてもよい。具体的な実施形態において、1つ又は2つのバッファー層流のシース流を形成するようにバッファーを流す。1つのバッファー層流により、選別ステーション近傍の装置の内表面に対する非特異的な結合を防ぐことができる。2つのバッファー層流を用いる場合には、1つのバッファー層流をこの目的で用いる一方で、もう1つのバッファー層流により、装置の他の内表面に対する非特異的な結合を防ぐ。この場合、サンプル層流は、2つのバッファー層流の間に形成される。ステップ807で外部磁場を選別ステーションに加え、ステップ809で流動流体によって与えられる流体力学的けん引力に抗して、磁気的に標識された標的細胞又は他の主を適当な位置に保持する。この一方で、ステップ811で、標識されていない非標的種を連続的に溶出させる。上述したように、磁場は、通常、選別ステーションの近傍に配置される外部磁石により印加される。選別ステーションから大部分又はすべてのサンプル溶液が流出した後、ステップ813で、傾斜磁場を変更する、及び/又は、流体力学的な力を増大させる等、様々な機構のいずれかにより、磁気成分を放出するようにしてもよい。たとえば、チャンバ内の磁場を弱め、消失させ、又は、再配向させると同時に、サンプル流を、(捕獲されている種を放出させるための)放出剤流及び/又はバッファー流に置き換えるようにしてもよい。固定化されていた磁気成分又は磁気成分により捕獲された(精製)種が、最終的にバッファー溶液内で、チャンバから流出する。ステップ815で、構成によってはトラップチャンバのすぐ下流側に配置される、選別チャンバの出口で、標的種を含む精製サンプル成分を採取するようにしてもよい。場合によっては、精製標的種を1つ以上の後処理ステーションに供給する。これで処理フローが終了する。
【0108】
一部の実施形態において、捕獲した標的物質をトラップ領域から直接取り出すようにしてもよい。取り出した物質は、分析したり、細胞生成物の製造に用いたり、その他の目的で処理したりすればよい。たとえば、装置のトラップ領域を、捕獲した物質が付着された状態のままで、装置の残りの部分から剥がせるように、設計してもよい。この場合、傾斜磁場発生領域の周囲に薄肉周縁部又は脆弱領域が形成されるように、装置を設計してもよい。この構成では、トラップ領域を取り外すことにより、サンプルを装置に通過させた後に捕獲された物質を外から取り出すことができる。取り外し処理を容易にするように、タブ、切り欠き、又は隆起部等の機械的構造を備えるように、装置を設計するようにしてもよい。
【0109】
トラップ型磁気分離システムの例を説明する。このシステムでは、各々磁気トラップモジュールを内蔵する流体光学素子が収容されている使い捨ての流体工学チップ又はカートリッジが用いられる。1つの動作モード(正の選択)において、少量の血液等のサンプルをカートリッジの受容ポートに供給して、サンプルを入れたカートリッジを処理/分析機器に挿入する。チップ内の磁気トラップモジュールで、サンプルから磁性粒子及び(存在する場合には)標的種を選別して、濃縮する。このようにしてサンプルを処理後、捕獲した種を放出させて、出力管に採取する。トラップモジュールに印加される外部磁場を弱める又は消失させる、又は、捕獲された種を磁性粒子から放出させる試薬を用いる等、様々な手段で、捕獲した種を放出させることができる。これの代わりに、又は、これと共に、磁性粒子に加えられる流体力学的な力を増大させるようにしてもよい。ある実施形態において、トラップモジュール内にサンプルを流す主な駆動力を与える(シリンジポンプ及び圧力制御装置等の)加圧システムを備えるシステム構成要素が筺体に収容される。当然のことながら、連続式ポンプや空気圧システム等、他の駆動力を用いる構造を採用することもできる。また、バッファーポンプ及び流れ制御モジュールによる制御下で、バッファー貯留部からカートリッジに、バッファー(緩衝液)が供給される。
【0110】
シース流装置製造システム:
一般に、層流形成面を備える構成を実現可能な方法により、本発明の装置及び関連機器を製造することができる。
【0111】
リソグラフィー及びエッチング法を用いて、所望のマイクロ流体の流れを形成するための精密な構造を作るようにしてもよい。コスト削減のために、射出成形により、特定の構成を備える剛体基部を形成するようにしてもよい。基部のみを形成する場合には、チャンバや(液体が流れる)チャネルは開いた状態のまま残される。ラミネート加工、熱処理、音波処理又はレーザー処理を用いて、同様の剛体材料で形成される上部層で密封して(密閉する装置に上部層を接着して)、装置を密閉するようにしてもよい。
【0112】
ガラス、ビニルやその他周知のプラスチックポリマー等の材料を、「ラボオンチップ(lab on a chip)」やその他の装置に用いるようにしてもよい。カートリッジ構造(チャネル、流入口、区画及びその他の流体流路または収容領域)を構成するようにしてもよい。流入及び流出用のポートや加圧流導入/停止用のポート等の相互接続部を、(たとえば)射出成型した構造に取り付ける、又は、射出成型した構造の一部として形成するようにしてもよい。電気的なセンサー、機械的なセンサー、その他様々なセンサー等、他の構成要素も同様に専用の位置に配置するようにしてもよい。
【0113】
本発明のシース流装置製造システムは、流体供給、組立、分離、(バーコード等の)コーディング、滅菌、及び包装用の装置を備える。
【0114】
本発明の製造システムには、食品及び医薬品に関する要件(FDA、FMEA等)、品質管理機構(たとえば、国際標準化機構)、及び特定の目的における品質を保証するために設定された他のレジーム等、様々な政府及び産業界のレジームに準拠するシステムが含まれる。
【0115】
シース流装置計装システム:
本発明の装置及び方法を、ホスト機器と連動して働くように、又は、システム要件を満たすように、適合させる、又は、構成するようにしてもよい。このような適合又は構成の例としては、(以下に示すものに限定されるものではないが)、1つ以上の真空供給、ポンプ及びバルブの自動制御、圧力流、サンプル充填用の注入ループ、温度制御、電気浸透流、容積型ポンプ機能、予想体積流量、遠心力処理、湿度制御及びガス交換制御等が挙げられる。
【0116】
自動計装により流体の流れを制御するようにしてもよいが、装置によっては、手動制御が用いられる。本発明の装置は、たとえば、空気圧又は大気圧を用いて、自動計装と操作可能に結合されている統合ポートを介した流れを形成することができる。
【0117】
捕捉前の処理:
シース流装置において、選別の「上流側」すなわち、選別の前に、さまざまな処理を実施するようにしてもよい。このような処理の例として、標的の標識化、細胞の溶解及びディプリーションが挙げられる。標識化は、後述するように、特異的な結合部分(moiety)を有する磁性粒子をサンプルの標的成分又は非標的成分に結合させることを意味する。溶解は、細胞膜又は細胞壁を破壊して、サンプル内に細胞成分(オルガネラ(細胞小器官)、生体分子等)を放出させることを意味する。ディプリーションは、分離前に、サンプル内の特定の1つ又は複数の成分を除去することを意味する。ディプリーションの例としては、音波等の手段でサンプルから赤血球を除去する処理が挙げられる。オンチップ又はオフチップで実行可能な他の前処理操作には、染色、固定化、又は、細胞内への外来物質の導入を行なうための様々な化学手段が含まれる。
【0118】
多くの場合、サンプルの標的成分又は非標的成分が必要に応じて磁気ビーズで「標識化された」ことを確認する必要がある。この標識化処理は、磁性粒子が捕獲され、流動流体媒体内で固定化されるトラップ/分離段の上流側で(前に)実施される。
【0119】
磁性粒子は、標的種又は非標的種に対して特異的な親和性を有する表面官能基を備えるものでもよい。したがって、磁性粒子は、関連種にさらされると、この種に結合して、複合体を形成する。本発明は、サンプルに含まれる適当な種又は成分への磁性粒子の結合を容易にする機構に関する。
【0120】
必要不可欠ではないが、通常、このような選別前処理は、トラップ領域と流体連結して配置される1つ以上の個別のチャンバ又は貯留部内で実施される。このようなチャンバ又は貯留部は、トラップ領域と同じ装置(チップ)上に備えられるものでもよいし、別の装置又はチップ上に備えられるものでもよい。また、このようなチャンバ又は貯留部は、マイクロ流体に適した寸法でもよいし、必要に応じて、少し大きな寸法でもよい。たとえば、1つ以上の前処理貯留部が、各々、約5ミリリットルの容積を有する。貯留部の容積は、0.5mlから10mlの範囲でもよい。
【0121】
磁気ビーズやサンプル及び結合を容易にするために用いられる試薬は、各々、1つ又は複数の貯留部に供給される。磁性粒子は機能化した形で供給されるものでもよく、この場合には、他の試薬を供給する必要はない。貯留部内で、他の成分に対して磁性粒子を移動させることにより、標識化が容易になる。ある実施形態において、2つの別々のチャンバに順次空気圧を加えることにより、磁性粒子を移動させることができる。別の実施形態において、磁性粒子の放出に関連して後述するような種類の磁気混合機構により、磁性粒子を移動させるようにしてもよい。たとえば、磁場を振動させることにより磁場を移動させる等、混合が容易になるような同様の機構を用いるようにしてもよい。混合機構の他の例としては、超音波攪拌や攪拌が挙げられる。磁性粒子の流体混合を行ない、サンプル種の標識化及び/又は放出を可能にするシステム及び方法の例が、参照することにより本明細書にあらゆる目的で組み込まれる、2009年4月16日出願のPCT特許出願No. PCT/US2009/040866(PCT公報No. WO2009/129415)に詳述されている。
【0122】
捕捉後の処理:
シース流装置において、選別後に様々な処理を実行するようにしてもよい。これらの処理は、選別ステーション内で実施するものでもよいし、選別ステーションの下流側で実施するものでもよい。このような処理には、一般的に、標的種の定量(たとえば、細胞の計数処理)、標的種に関する分子情報の抽出(たとえば、特定のSNPの存在/不存在)、及び/又は、細胞由来生成物の抽出(たとえば、捕捉された幹細胞の分化型)が含まれる。好適な処理の例としては、光学的な方法による標的種の直接的検出、アッセイ、捕捉した細胞又はウィルスの成長、標的種の形質転換(たとえば、捕捉した幹細胞の分化)、発現パターンのプロファイリング及び遺伝的特性評価が挙げられる。発現プロファイル及び/又は遺伝子配列の特性評価を行なうために利用可能な所定のツールとして、mRNAアレイ等のマイクロアレイや、ハイスループット・シークエンシング・ツールがある。詳細に関しては、(上述の)PCT特許出願No. PCT/US2009/040866に記載されている。
【0123】
分離後処理において、トラップステーション内で捕捉された又は選別ステーションで分離された磁性粒子から標的種を放出させる処理が行なわれることが多い。典型的な状態では、捕捉処理終了後、トラップ領域に残っているサンプル種のみが磁性粒子に結合されている。多くの用途において、以降の処理を行なう前に、磁性粒子から捕捉された種を分離させることが重要となる。
【0124】
本明細書に記載する分離後処理では、磁性粒子から結合した種を放出させる機構が用いられる。種々の結合及び放出システムを利用することができる。たとえば、(1)捕獲した種に磁力ビーズを化学的に結合させている結合を消化する、(2)捕獲した種に結合する化学結合又は生化学結合機構と競争する、及び(3)二次抗体との結合を切断するような放出試薬を用いるようにしてもよい。捕捉された標的種を、単に濃縮し、精製し、及び/又は、放出するようにしてもよいし、さらに分析、及び/又は処理を行なってもよい。
【0125】
一部の実施形態において、上述したようにトラップ内で捕捉され、洗浄され、必要に応じて放出された粒子を、サンプルに含まれる標的種に対する1つ以上のマーカー(たとえば、標識化した抗体)にさらすようにしてもよい。検出対象の所定の腫瘍細胞は、たとえば、2種類以上の特異的表面抗原を発現させる。このような腫瘍を検出する際には、2種類以上のマーカーを用いるようにしてもよい。このような抗原の組み合わせは、特定の腫瘍でのみ生じる。1種類以上の標識を十分な長さの時間トラップに流した後、捕獲した粒子/細胞を洗浄するようにしてもよい。その後、粒子/細胞を、トラップから取り出した後で分析するようにしてもよいし、in situで分析するようにしてもよい。たとえば、第1の標識と第2の標識がフルオロフォア(蛍光色素分子)である場合には、トラップの中身をスキャンするために、これらの標識をプローブビームで励起して、第1の標識と第2の標識に特徴的な周波数で放射光を検出するようにしてもよい。ある実施形態において、個々の細胞又は粒子を撮像して、トラップ301の中身の特性評価を行なって、標的腫瘍細胞の存在(又は量)を検出するようにしてもよい。当然のことながら、腫瘍細胞以外の様々な標的成分も検出対象となるが、このような例として、特定のバクテリアやウィルス等の病原体が挙げられる。
【0126】
別の実施形態において、サンプルに含まれる核酸を適当な機構で捕獲するようにしてもよい。このような核酸は、増幅させることなく、たとえば、マイクロアレイを用いて、直接検出及びプロファイリングを行なうようにしてもよい。あるいは、PCR試薬(ヌクレオチド、ポリメラーゼ及びプライマーを含有する適当なバッファー溶液)をトラップに導入して、適当なPCR熱サイクルプログラムを実行するようにしてもよい。適当な増幅レベルになるまで熱サイクルが続けられる。その後、遺伝子型決定や特定の変異株の検出等、増幅された標的核酸の検出をin situで行なうようにしてもよい。あるいは、核酸マイクロアレイ又は電気泳動媒体を含有する別のチャンバ等を用いて、トラップの下流側で検出を行なうようにしてもよい。別の実施形態において、標的配列に対して、適当に標識されたインターカレーション・プローブ又は供与体消光プローブ等を導入して、トラップ内でリアルタイムでPCRを行なうようにしてもよい。プローブを、他のPCR試薬(たとえば、プライマー、ポリメラーゼ及びヌクレオチド)と共に導入するようにしてもよい。in situのリアルタイムPCRは、発現レベルを分析するような分析に適している。一部の実施形態において、リアルタイムPCRの場合でも終点PCRの場合でも、トラップ領域に焦点を合わせた蛍光顕微鏡等の適当な検出装置を用いて、増幅された配列の検出をトラップ内で実施することができる。
【0127】
一部の実施形態において、in situでサンプルから反応チャンバに細胞を捕獲して収容するようにしてもよい。その後、(塩や洗浄剤等の)溶解剤をチャンバに供給する。溶解剤を、溶液プラグで供給し、チャンバ内で拡散させて、固定化した細胞を溶解させるようにしてもよい。これにより、細胞の遺伝物質を抽出して、後段で増幅させることができる。ある実施形態において、溶解剤をPCR試薬と共に供給して、溶解剤により細胞を溶解させて核酸を取り出すのに十分な時間が経過した後に、熱サイクルプログラムを開始して、標的核酸を検出するようにしてもよい。
【0128】
別の実施形態において、核酸試料を、サンプルとして供給し、適当なハイブリダイゼーション配列を含有する磁性粒子に結合させるようにしてもよい。その後、磁性粒子をトラップ内で選別して、固定化する。PCR試薬をチャンバに供給して、すべてのバルブを閉じた後、熱サイクルによりPCRを開始するようにしてもよい。最初の温度逸脱の間に、捕獲された核酸試料を、磁性粒子から放出させることができる。
【0129】
ここで説明する核酸増幅法は、ポリメラーゼ連鎖反応(PCR)であるが、実施形態において、リアルタイム鎖(ストランド)置換増幅(SDA)、ローリングサークル増幅(RCA)及び多重置換増幅(MDA)等、様々な等温核酸増幅法などの非PCR増幅法を用いるようにしてもよい。これらの増幅法は、適当なバルブ及び流路系を備える装置内のチャンバ等のトラップで実施可能である。
【0130】
核酸の抽出と分析とに加えて、捕獲した細胞自体を直接処理生成物として用いることもできるし、さらに処理を行ない、所望の生成物を製造することもできる。たとえば、装置を用いて、細胞由来生成物として、血液または組織から幹細胞を単離することができる。あるいは、捕獲した細胞を成長因子、ケモカインや抗体等の試薬で処理し、所望の細胞由来又は分子由来の生成物を製造するようにしてもよい。装置内で所望の生成物を得るために、多段階の精製及び処理工程を行なうようにしてもよい。
【0131】
本発明の装置及び方法を用いる作業の一例として、特に細胞培養によりタンパク質が発現されるため、自動タンパク質精製工程が挙げられる。タンパク質精製は手動で行なうこともできるが、本発明の装置及び方法を適用することにより、時間と労力の節約になる自動化が可能になり、低コストで高純度の生成物を供給できる。
【0132】
たとえば、ウィルス、バクテリア、昆虫又は哺乳動物の細胞等の生命体内で所望のタンパク質が発現する場合、発現タンパク質を選択的にバッググラウンド物質から単離可能なように、発現タンパク質の設計を行なうようにしてもよい。このような設計としては、たとえば、1つ以上の選択可能なアミノ酸タグを用いて、タンパク質にアミノ酸配列を加えるようにしてもよい。このようなタグの例としてHisタグ、FLAGタグやその他のエピトープタグ(Eタグ)が挙げられる。(たとえば)細胞を、上述したサンプル貯留部の1つに導入すると共に、同じ貯留部又は1つ以上の他の貯留部に磁性粒子及び溶解剤を導入する。磁性粒子は、NTAアガロースや他の樹脂等ニッケルに対する親和性の高い媒体で被覆した磁気ビーズでもよい。空気圧混合、水圧混合、又は磁力混合等、上述した1つ又は複数の方法で、サンプル貯留部間の混合を促進するようにしてもよい。溶解剤により細胞が破壊されて、適当な条件下で、磁性粒子が溶解物内の標的タンパク質に結合する。その後溶解物を磁気分離チャンバに流すと、チャネル表面上にビーズが捕捉される。洗浄用バッファー(緩衝液)を加えて、タグ化されていない非結合タンパク質やその他の細胞フラグメント(断片)を溶出させる。様々な実施形態において、磁気分離チャンバを、磁気的に、又は、その他の手段で攪拌して、さらに、捕獲された粒子の間にくっついた非結合タンパク質を取り除くようにしてもよい。高ストリンジェント洗浄用バッファーを用いて、不要な粒子をさらに溶出させるようにしてもよい。この時点で、チャンバ内には、非常に高い選択性で、標的タンパク質及びこれに結合した磁性粒子のみが残っている。さらに処理を行なう場合には、必要に応じて、少量のビーズ放出剤を用いて、標的タンパク質を放出させるようにしてもよい。最後に、磁性粒子を放出させるようにしてもよい。これら様々な処理は装置内の単一又は使い捨てカートリッジ内で行なわれるので、時間とコストを節約するために、この手順を予めプログラミングして、自動化するようにしてもよい。このような構成により、RNA等、他の核酸関連生成物を、上述のように選択可能にするために標識化して、選択的に捕捉することもできる。
【0133】
一般的な適用:
上述したように、本発明のシース流装置は、広範囲に適用可能である。磁性粒子で標識した様々な種類の標的種の捕獲及び分離に用いることができる。したがって、本発明のシース流流体装置を、たとえば、体液サンプルの調製及び分析、希少分子又は細胞の分離、化学物質ライブラリーのスクリーニング、臨床検査室におけるポイントオブケア(POC)診断、環境試験及びモニタリング、消費者製品及び食物の品質管理等、さまざまな用途に用いることができる。本発明は、学術分野、産業分野及び臨床分野で特に有用である。学術、産業及び臨床分野において、本発明のシース流装置は、特に、試験や特性評価に加えて、細胞株、タンパク質及びmRNAの増幅、遺伝子コード、分子署名プロテオミクス等、その他処理を行なうための細胞株、タンパク質、遺伝物質等の単離に有用である。シース流装置及び方法を、たとえば、血液サンプルからのCTC単離による癌の診断等、病気の早期発見及び診断に用いることができる。臨床分野での用途としては、臨床試験候補を選出するための潜在患者集団のスクリーニング、及び/又は、治療効果の情報及び/又は今後の治療計画を策定するための情報を得るために行なう、既に臨床試験に登録している患者の体液の検査、補助療法や最新補助療法の有効性の測定などがある。具体的な例を、以下で説明する。
【0134】
シース流研究ツール:
本発明のシース流装置を、これに限定されるものではないが、たとえば、分子ライブラリーのスクリーニング等、科学研究に広範囲に用いることができる。たとえば、本発明の装置をアプタマーライブラリーのスクリーニングに用いることができる。具体的には、本発明の装置でタンパク質の生成及び単離を行なった後、同じ1つの装置内で、タンパク質をアプタマーライブラリーと照合する。本明細書で用いる「アプタマー」という用語は、最も広い意味で用いられ、特定の標的分子に結合するオリゴ核酸又はペプチド分子及び模倣分子等の関連合成分子を意味する。本発明のシース流装置を、アプタマーライブラリー、リボゾームライブラリー、ファージ・ディスプレイ、バクテリアペプチド・ディスプレイ、酵母菌ディスプレイ等の分子又は細胞ライブラリー選別を利用するバイオマーカー(生体指標)/創薬プラットフォームに用いることもできる。さらに、本発明のシース流装置を、細胞の計数、分類、増幅、分化等を含む様々な評価を行なう目的で標的細胞を単離するために用いることもできる。
【0135】
シース流生物学的/化学的モニタリング、合成又は分析:
化学物質の危険性モニタリングや、核酸分析(及び、たとえば、ポリメラーゼ連鎖反応を用いた増幅)や、閉鎖環境モニタリング、個人レベルのゲノミクス及び診断、生理環境に供給するのに適したウィルス外被やその他ナノケージ内に包含したアプタマー治療薬の合成やその他の化学物質合成等の化学合成など、特定条件の連続モニタリング等、様々な生物学的又は化学的モニタリング、合成又は分析を目的として、本発明を構成する、又は、適合させるようにしてもよい。家庭用の用途としては、たとえば、pH指示薬、金属指示薬やその他の水質指示薬を用いて、プールや飲料水の水質モニタリングを行なうようにしてもよい。生物医薬品生産工程におけるバイオリアクターのモニタリング等の生産工程管理や食品産業に適するように、本発明の装置を構成する、又は、適合させるようにしてもよい。また、流体制御や分析、ガス制御や分析に適するように、本発明の装置を構成する、又は、適合させるようにしてもよい。たとえば、連続フロー用に本発明の装置を適合させることにより、細胞を選別する速度のモニタリングを行なうことができる。さらに、供給連鎖モニタリング等、生産品質管理に適するように、本発明の装置を構成するようにしてもよい。本発明のシース流装置は、高い選択性で液体サンプルから標的種を捕捉できるため、たとえば、複数種の高度な複合混合物の流体生体サンプルから標的種を高い純度で単離する必要がある治療薬分野等では、多くの従来システムに比べて大きな利点がある。
【0136】
構成:
プレフィル式オンチップキット
本発明の一つの態様は、製造の容易さや使い勝手を考えて、特定の目的に有用な試薬を予め充填した(プレフィル式)シース流装置である。たとえば、生体サンプルの調製に有用な試薬を装置に予め充填する(プレフィルする)ようにしてもよい。この「オンチップキット」型の態様のシース流装置を、上述した様々な用途に適合させることができる。
【0137】
このような「オンチップキット型」の実施形態では、様々な試薬を用いることができ、体液サンプルの調製及び分析、希少分子又は細胞の分離、化学物質ライブラリーのスクリーニング、臨床検査室におけるポイントオブケア(POC)診断、環境試験及びモニタリング、消費者製品及び食物の品質管理等、さまざまな分野で適用可能である。本発明では、このような使用に適したプレフィル型装置を単一で用いることもできるし、複数で用いることもできる。このような構成は特に限定されるものではなく、関係機器や方法を考慮した構成であればよい。
【0138】
使い勝手を考えて、試薬を、所定量の貯蔵部に収容する等、シース流装置内に収容するようにしてもよい。たとえば、細胞を培養して所望のタンパク質を発現させることにより、実質的に精製されたタンパク質製剤を得ることができる。対象となる貯蔵部を細胞の培養に用いる場合には、制御された条件下で流体連結されるアクセスポートを介して適当な試薬を供給するようにしてもよい。たとえば、細胞を溶解させる、細胞を洗浄する、及び、細胞の部分(moiety)に選択的に結合されたビーズを除去するためのバッファーを試薬として用いることができる。また、抗体、アプタマー、及び標的分子に(必ずしも特異的である必要はないが)選択的に結合する他の分子等、選択的結合分子を試薬として用いることもできる。さらに、磁気ビーズ、音波ビーズ、及び、その他同様の機能を与えるビーズ等、選択分子を捕捉できる様々な部分(moiety)を試薬として用いることも可能である。また、複合混合物から特定の核酸を選別するのに適したプライマー等の核酸を試薬として用いることもできる。たとえば、本発明の装置を用いて、装置内部で、ゲノムDNAをスクリーニングしたり、ポリメラーゼ連鎖反応により選択配列を増幅したりすることができる。
【0139】
集積システム:
オンチップキット型の構成を独立して用いることもできるし、本発明のシース流装置を含む集積システムの少なくとも一部として用いることもできる。本発明のシース流装置の「上流側」又は「下流側」に別の処理モジュールやチャンバを加えるようにしてもよい。たとえば、誘導体化や他の反応を行なうための所望の高分子物質やその他の物質を収容する貯蔵部を設ける等、適当な発現後修飾流体回路を設けるようにしてもよい。具体的な例としては、本発明のシース流装置を、培養した細胞からタンパク質を発現させる流体回路を備える構成として、必要に応じて、対象タンパク質を誘導体化できるペグ化モジュール等、発現したたんぱく質を誘導体化するための追加モジュールを備えるようにしてもよい。
【0140】
流体工学装置内で磁気トラップソーターと統合可能な操作モジュールの例としては、(a)蛍光活性化セルソーター等の追加濃縮モジュール及び洗浄モジュール、(b)サンプル増幅(たとえば、PCR)モジュール等の反応モジュール、制限酵素反応モジュール、核酸シークエンシングモジュール、標的標識モジュール、クロマチン免疫沈降モジュール、架橋モジュール及び細胞培養モジュール、(c)核酸、抗体又は他の特異性が高い結合剤のマイクロアレイ等の検出モジュール及び蛍光分子認識モジュール、及び(d)細胞を溶解させる、ウィルスタンパク膜の破壊又はその他小さな生体の成分を放出させる溶解モジュールが挙げられる。これらのモジュールは、各々、磁気ソーターの前段に備えるようにしてもよいし、又は、後段に備えるようにしてもよい。単一の流体工学システムにおいて、複数の同一種類の又は異なる種類の操作モジュールを磁気ソーターと統合するようにしてもよい。さらに、1つ以上の磁気ソーターを、種々の他の操作モジュールに対して、並列に配置するようにしてもよいし、直列に配置するようにしてもよい。これらの操作モジュールの一部を、サンプル中の標的種を定常状態で保持するような、又は、一般的に所定容量内に閉じ込めるようなトラップとして設計又は構成するようにしてもよい。操作モジュールの特性は、所望の反応の種類に応じて決まり、温度管理システム、マイクロミキサー、触媒構造及び検知システムを備えるものでもよい。温度管理システムは、ヒーター、温度センサー、及びマイクロ熱交換器を備えるものでもよい。これらの構成要素をすべて集積して、正確な温度管理を行なうようにしてもよい。このような温度管理は、たとえば、DNA増幅にPCRを用いる際には、極めて重要となる。
【0141】
上述したモジュールの例から明らかなように、集積流体工学装置のモジュールにおいて標的種及び/又は非標的種上で実施可能な操作には、選別、磁性粒子への結合(本明細書では「標識」とも称する)、結合、洗浄、捕捉、増幅、不要な種の除去、沈降、切断、希釈、結紮、シークエンシング、合成、標識(細胞の染色等)、架橋、培養、検出、撮像、定量、溶解等が含まれる。本発明の装置を、1つの同じ装置内で1つ以上の機能を果たすように構成してもよい。
【0142】
集積シース流流体装置の磁気選別モジュールにおいて実施可能な生化学的操作の例としては、プラスミド、アプタマー、タンパク質及びペプチドの合成及び/又はスクリーニング、酵素活性の評価及びタンパク質と炭水化物の誘導体化が挙げられる。広範囲に及ぶ生化学的及び電気生理学的アッセイを実施可能であり、これには、(1)DNA及びRNAオリゴマーのゲノム解析(シークエンシング、ハイブリダイゼーション)、PCR及び/又はその他の検出及び増幅スキーム、(2)遺伝子発現、(3)酵素活性アッセイ、(4)受容体結合アッセイ、及び(5)ELISAアッセイが含まれる。前述のアッセイは、均一系、ビーズベース、及び表面結合等様々なフォーマットで実施可能である。さらに、本明細書で説明する装置を利用して、特定の酵素又は触媒を用いる生体分子の連続生産、及び、治療薬等、生体系で活性な生体分子又は分子の生産と送達を実施することも可能である。本明細書に記載するシース流装置を用いて、マクロ流体容量で従来行なわれているようなペプチド、タンパク質並びにDNA及びRNAオリゴマーのコンビナトリアル合成を実行することもできる。
【0143】
特定の用途:
細胞捕獲及び処理
上述したように、本発明のシース流装置は、様々な生体物質の成分の培養、精製若しくは単離又は様々な生体物質の解析に特に有用である。特定の態様において、細胞溶解、ビーズを用いた置換アッセイ、かん流、ろ過、サンプル調製、走化性、全血分離及び様々な他の処理に適するように、本発明の装置を構成する又は適合させるようにしてもよい。
【0144】
複合生体サンプルから特定の細胞型を単離することは特に有用である。たとえば、生体サンプルは、1つ以上の幹細胞、バクテリア、ヒト細胞、生体膜材料、哺乳類細胞、酵母菌、藻類、原発腫瘍細胞、不死化細胞株、組織又は器官培養、単細胞又は多細胞生命体、カビ、及び、培養物などの、その他サンプルから単離可能な生命体を含むものでもよい。従来、このような複合混合物からの細胞株単離は非常に手間がかかるだけではなく、収率が低い、純度が低い、処理工程が多いことから単離した細胞が死んでしまう等、満足な結果が得られないことが多かった。上述したように、本発明のシース流装置は、細胞選別を行なうための流体回路を備えるだけではなく、特性評価や治療等に用いるために後で増殖や分化を行なうことができる様々な細胞型の単離を可能にするものである。本発明のシース流装置は、ex situ(その場以外)及び/又はin situ(その場)での増殖や分化等、単離後処理にも利用できる。
【0145】
たとえば、標的細胞に選択的な抗体や化学反応基等の結合剤を含有する磁性粒子で細胞を標識化することにより、標的細胞型を単離することができる。サンプルを磁性粒子にさらすと、磁性粒子に結合させた選択的結合剤を介して、標的細胞が選択的に磁性粒子に結合する。本発明のシース流装置の用途として、2種類の細胞型である幹細胞と循環腫瘍細胞(CTC)とを例示する。シース流装置及び方法を幹細胞とCTCとに適用した実施形態の詳細を以下に記載する。
【0146】
幹細胞:
幹細胞処理は、ヒト疾患の様相を変化させて、苦痛を軽減する可能性があるものと医学研究者たちは考えている。自己再生を行なって新しい幹細胞集団を形成するという幹細胞の特性により、拒絶や副作用のリスクなしに、体内の疾患組織や損傷組織の修復及び/又は交換(標的細胞集団に分化させることにより)を実現するという大きな可能性がある。医学研究者たちは、成体幹細胞及び胚性幹細胞技術を用いた、癌、代謝異常、心不全、筋損傷及び神経疾患の治療に期待をかけている。幹細胞治療が有望であると考えられている具体的な疾患には、脳損傷、癌、脊髄損傷、心臓障害、造血、はげ頭、歯の欠損、難聴、失明及び視覚障害、筋委縮性側索硬化症、移植片体宿主拒絶反応、クローン病、神経及び行動の先天性異常、糖尿病、整形外科的障害、傷治療及び不妊症が挙げられる(The Leading Edge of Stem Cell Therapeutics(最先端の幹細胞治療) Singec Iら、Annu. Rev. Med. 58: 313-328, 2007年参照)。
【0147】
幹細胞研究及び/又は治療でカギとなるのは、高純度の生存幹細胞を単離することである。上述したように、本発明のシース流装置及び方法により、たとえば、血液、骨髄、臍帯やその他のソースから特定の幹細胞を選別及び単離することができ、また、必要に応じて、たとえば、シース流装置で単離した細胞をin situ及び/又はex situで培養する等、単離した細胞をさらに処理することも可能である。
【0148】
したがって、本発明の特定の態様は、生体サンプルから幹細胞を単離するように構成されるシース流装置及び方法である。シース流装置内で、たとえば、磁気泳動ビーズ、音波ビーズ、又は、選択された分子(及び細胞)を捕獲可能なその他の部分(moiety)等、選別に適した様々な媒体に選択的結合分子を接続させることができる。一実施形態において、シース流装置は、幹細胞に選択的な部分(moiety)、たとえば、CD34+選択的結合分子、を含有する磁性粒子を用いる。特定の実施形態において、磁性粒子を標的幹細胞に結合させることにより、幹細胞の捕獲と単離を行なうようにしてもよい。また、装置のバッファーシース流によって囲まれたサンプル流にのせて磁性粒子を移動させることにより、シース流を介してサンプル流から採取グリッドに磁性粒子を選択的に引っ張る又は偏向させることができる。
【0149】
採取グリッド上で、又は、採取グリッド外で、単離した幹細胞の特性評価及び/又は処理を行なうことができる。上述したように、本発明のシース流装置は、幹細胞集団を増幅する、及び/又は、幹細胞を分化させるための追加の単離後処理モジュール又は機能を備えるものでもよいたとえば、細胞の捕捉に用いられる磁性粒子からの分離前又は分離後の結合部分(moiety)及び局所環境に応じて、単離後修飾を行なうことができる。当業者には自明のことであるが、このような単離後モジュール及び機能が、さらに、培地、酸素、温度、培地交換等、幹細胞を成長させるためのバイオリアクター機能を備えるものでもよい。
【0150】
具体的な例では、血液から適当な幹細胞を選別して、幹細胞を培養して増殖させるように、本発明のシース流装置を構成するようにしてもよい。選択培地、成長因子及びその他の材料を、本発明のシース流装置に予め充填する(プレフィルする)ようにしてもよい。たとえば、抗体やアプタマー等の造血幹細胞選択試薬を用いるようにしてもよい。このような試薬は、選択的に、たとえば、CD34+幹細胞に結合する。たとえば、CD34+細胞に結合した磁性粒子又は非結合の磁性粒子を適当な位置に保持する一方で、他の物質を洗浄除去する。ビーズ放出試薬、たとえば、市販のビーズ放出試薬を用いて、結合した細胞を放出させる。磁力でビーズを捕獲する一方で、幹細胞を上澄み液に分離することができる。他の種類の幹細胞としては、胚性幹細胞、胎児幹細胞、羊膜幹細胞、成体幹細胞又は人工多能性幹細胞が挙げられる。
【0151】
上述したように、単離した細胞、この例では幹細胞を用いて、シース流装置内で、液体サンプルから分離した幹細胞からの細胞由来生成物を得るようにしてもよい。細胞由来生成物には、たとえば、増殖細胞集団、分化細胞、及び、遺伝子コード情報、RNA、DNA、発がん性情報等、細胞の分子成分の分析により得られた生成物が含まれる。幹細胞の場合、本発明のシース流装置のモジュールを用いて、幹細胞を培養し、幹細胞集団の増殖及び/又は分化をin situで行なうことができる。あるいは、幹細胞を取り出して、別の装置内で増幅及び/又は分化を行なうようにしてもよい。増殖した幹細胞集団を、患者の、たとえば、腫瘍部位や神経組織や筋組織等の組織損傷部位に注入するようにしてもよい。また、幹細胞には、組織を修復する機能や、組織修復を助ける機能もある。腫瘍学において、幹細胞には、腫瘍破壊を助ける機能をある。さらに、癌幹細胞(CSC)は、腫瘍性増殖を妨害すると共にCSCを殺す化学療法を無力化して、癌性増殖を再発させる成分であると考えられている。本発明のシース流装置を用いて、本明細書で記載する他の幹細胞と同様に、CSCの単離、特性評価、及び処理を行なうことができる。
【0152】
本発明のシース流装置を、さらに、組織再生に用いることもできる。たとえば、前述したようにシース流装置を幹細胞増殖に用いる場合、試薬を用いて、単離した幹細胞を、細胞由来生成物の別の例である異なる型の組織関連細胞に分化させるようにしてもよい。本発明のシース流装置を、生体適合性のある骨格とex vivo(生体外)で組織を増殖するために適した試薬と共に構成するようにしてもよい。一つの実施形態において、シース流装置内で単離しin situ(その場)で増殖させた細胞を基にして、移植を目的とした肝臓組織や他の器官の組織の培養を行なうように、シース流装置を構成するようにしてもよい。本発明の装置を幹細胞の選別とin situでの増殖を行なうように構成する場合、さらに、所望の標的組織への幹細胞の分化等、様々な用途にあわせて、予め充填させた(プレフィル)試薬を備えるように装置を構成してもよい。シース流装置自体を生体適合性の材料から形成するようにしてもよく、この場合には、幹細胞増殖組織(又は骨格上の細胞集団)を患者に直接使用又は移植することも可能である。別の例において、本発明のシース流装置を、幹細胞を単離して、角膜移植に適した角膜組織を生成するように構成することもできる。
【0153】
循環腫瘍細胞:
癌による死亡の大部分は、血行性転移拡散及び全身の組織内での腫瘍細胞の増殖に起因するものである。腫瘍由来の生存上皮細胞、循環腫瘍細胞すなわちCTCは、癌患者の末梢血内で同定され、難治性の転移性疾患の原因であると考えられる(Nagrath, S.ら、Isolation of Rare Circulating Tumour Cells in Cancer Patients (癌患者における希少循環腫瘍細胞の単離)Microchip Technology, Nature, Vol 450: 20/27, 1235-1240, 2007参照)。したがって、CTCの研究は、早期転移拡散の生物学(機構)と高い関連性があり、顕性転移のある患者において診断のための強力な情報源となる(Pantel, K.ら、 Detection, Clinical Relevance and Specific Biological Properties of Disseminating Tumour Cells, (播種腫瘍細胞の検出、臨床的関連及び特定の生物学的特性)Nature Reviews, Vol. 8: 329-40, 2008参照)。さらに、癌患者の血液からのCTCの分子解析を行なうことにより、治療過程で腫瘍遺伝子型の変化をモニターすることが可能になる(Detection of Mutations in EGFR in Circulating Lung-Cancer Cells(循環肺癌細胞におけるEGFR変異株の検出)、Maheswaran, S.ら、N Engl J Med, 359:366-77, 2008参照)。単純な採血等により得られた液体サンプルを用いる方法は、非血液癌の検出、特性評価及びモニタリングの情報源として、侵襲的な生検と比べて大きな利点がある。
【0154】
CTC研究及び/又は治療でカギとなるのは、高純度のCTCを単離することである。本発明のシース流装置を用いることにより、固形腫瘍の生検を行なう必要がなく、採血等によって得られた液体サンプルからCTCを選別して、単離することができる。本発明の装置及び方法を用いることにより、分析を目的として、癌のような細胞増殖異常と診断された及び/又はモニタリングされている患者の血液から特定の循環腫瘍細胞を選別することができる。本発明のシース流装置を用いたポイントオブケア(POC)診断は、癌型及び/又は進行等の早期及び正確な診断を行なうための強力なツールである。また、単純な採血等から得た系内CTCの迅速なターンアラウンド分析は、現在および将来の治療計画の策定や、増殖した腫瘍を取り除く外科手術等の補助療法の有効性を比べることができるため、癌患者に有効である。
【0155】
したがって、本発明の一つの態様は、患者の治療計画をモニタリングして、必要に応じて調節する方法であって、(a)一次治療計画を実施中の患者から腫瘍細胞を含むサンプルを採取する工程と、(b)分離法により前記腫瘍細胞をサンプルから分離する工程であって、(i)腫瘍細胞に対する特異親和性を有する磁性粒子を用いてサンプルを標識して、標識サンプルを生成することと、(ii)標識サンプルから磁性粒子を偏向させ、及び/又は、捕捉して、これにより、サンプルから腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、標識サンプルを通すことと、を備え、バッファー溶液のシース内にサンプルを流すことによって、流体装置へのサンプルの非特異的な結合を抑制する工程と、(c)工程(b)でサンプルから分離された腫瘍細胞の特性評価を行なって、患者に対する今後の治療を提案する及び/又は既存の治療の有効性を評価する工程と、を備える。一実施形態において、サンプルは、患者から採取した流体サンプルである。具体的な実施形態において、サンプルは、血液サンプルである。他の実施形態において、腫瘍細胞はCTCである。一つの実施形態において、一次治療計画は化学療法レジメンであり、さらに具体的な実施形態において、今後の治療は異なる化学療法レジメンである。一実施例において、腫瘍細胞の特性評価は、計数であり、別の実施形態において、腫瘍細胞の特性評価は、分子特性評価である。さらに具体的な実施形態において、分子特性評価は、腫瘍細胞内の遺伝子変異である。
【0156】
一実施形態において、患者に対する今後の治療を提案する工程は、一次治療計画の今後の有効性を予測することを備える。別の実施形態において、患者に対する今後の治療を提案する工程は、患者に関して前にはわかっていなかった腫瘍細胞の特徴を考慮した、一次治療計画とは異なる二次治療計画を特定することを備える。別の実施形態において、方法は、さらに、(d)患者に二次治療計画を実施した後で、患者から腫瘍細胞を含むサンプルを採取する工程と、(e)工程(d)で採取されたサンプルと腫瘍細胞に対して(先の段落で説明した)工程(b)及び工程(c)を実施する工程と、を備える。
【0157】
したがって、本発明の方法及び装置を用いて、臨床医は、たとえば、臨床試験に適した候補を選出するための潜在患者集団のスクリーニングを行なうことができる。これにより、対象となる治療計画に対して難治性の反応を示す癌遺伝情報を有するCTCの患者に対して、他の可能な治療を試すことができる。あるいは、特に、難治性の患者を、特定の新しい治療計画のターゲットにすることも可能である。別の例として、患者のCTCの計数分析及び/又は分子成分分析を行なって、この情報から、現在の治療が有効であるか否か、現在の治療を続けるべきか否か、又は、別の若しくは追加の治療を考慮するべきか否かを判定することができる。別の実施形態において、患者のCTCの計数分析及び/又は追加の特性評価分析を行なって、補助療法が有効であったか否かの評価を行なうことができる。具体的な例において、患者のCTC計数から、補助療法が成功し、さらなる治療は現在必要ではないこと、が示唆される。別の具体的な例において、患者のCTC計数から、補助療法が成功したが、以前の患者CTC特性評価と比較したCTCの変異に基づいて、他の治療が必要であること、が示唆される。さらに別の具体的な例において、患者のCTC計数から、補助療法が失敗し、他の補助療法が指示されていること、が示唆される。
【0158】
実施形態:
本発明の一つの実施形態は、流体分離装置であって、(a)流体分離装置内にサンプル流を形成するように構成される少なくとも1つのサンプル流入チャネルと、(b)流体分離装置内でサンプルの流れの周囲にシースを形成する1つ以上の流体の流れを与えることにより、装置に対するサンプルの成分の非特異的結合を抑制するように構成される少なくとも1つのシース流流入チャネルと、(c)サンプル流入チャネルとシース流流入チャネルとに流体連結される選別ステーションであって、サンプル流の流路に沿って配置される選別ステーションと、(d)外部磁場と相互に作用して、選別ステーション内の傾斜磁場を変化させることにより、サンプル流から磁性粒子を偏向させる、及び/又は、捕捉する傾斜磁場発生部と、を備える。一つの実施形態において、磁性粒子は、選別ステーションにより捕捉される。
【0159】
一つの実施形態において、選別ステーションは、選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を有し、内部空間は、サンプル流の流れ方向と交わる第1及び第2の横方向寸法を有し、第2の横方向寸法は、第1の横方向寸法の少なくとも約2倍以上であり、少なくとも1つのシース流流入チャネルは、第1の横方向寸法に沿ったサンプル流により互いに分離された2つのシース流を形成するように構成される。別の実施形態において、選別ステーションは、選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を有し、内部空間は、約2ミリメートル以下の距離だけ離れた、実質的に平行かつ実質的に平面状の2つの表面により、部分的に規定され、少なくとも1つのシース流流入チャネルは、平行で平面状の2つの表面に接して流れると共に、サンプル流により互いに分離された2つのシース流を形成するように構成される。一つの実施形態において、実質的に平行で実質的に平面状の2つの表面は、約1ミリメートル以下の距離だけ離れている。一つの実施形態において、少なくとも1つのシース流流入チャネルは、選別ステーションの上流側に位置し、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第1のシース流流入チャネルを備える。
【0160】
一つの実施形態において、流体分離装置は、さらに、選別ステーションの上流側に位置し、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第2のシース流流入チャネルを備える。一つの実施形態において、少なくとも1つのサンプル流入チャネルは、内部空間の実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する。
【0161】
一つの実施形態において、傾斜磁場発生部は、分離装置上でパターンを形成する複数の強磁性素子を、選別ステーションの近傍に備える。別の実施形態において、傾斜磁場発生部は、複数の強磁性素子の近傍に永久磁石を備える。さらに別の実施形態において、複数の強磁性素子は、選別ステーションの流体通路内に配置されて、強磁性素子とサンプル流とを流体接触させる。強磁性素子は、マイクロパターン化されたニッケル素子を含むものでもよい。一つの実施形態において、傾斜磁場発生部は、一時的に磁性粒子を捕捉し、その後、磁性粒子を放出するように構成される。
【0162】
別の実施形態は、サンプルに含まれる標的種を捕捉する方法であって、(a)流体選別装置の少なくとも第1の流入チャネルに、標的種に対する特異的親和性を有する磁性粒子を含むサンプルを供給する工程と、(b)流体選別装置にシース流を供給し、流体選別装置内でサンプル流の周りにシースを形成する1つ以上のシースの流れを生じさせることにより、装置へのサンプルの非特異的な結合を抑制する工程と、(c)傾斜磁場発生部を磁化して、磁性粒子の少なくとも一部を捕捉して、サンプルから捕捉した磁性粒子を分離する工程と、(d)捕捉した磁性粒子に結合する又は結合した標的種を分析する工程と、を備える。一つの実施形態において、傾斜磁場発生部は、複数の強磁性素子を備える。強磁性素子は、流体装置上でマイクロパターン化された強磁性物質を含有するものでもよい。一つの実施形態において、傾斜磁場発生器を磁化する工程は、永久磁石又は電磁石から外部磁場を傾斜磁場発生器に印加することを備える。
【0163】
方法は、さらに、1)捕捉した磁性粒子に結合する精製された標的種を検出することと、2)流体選別装置内で標的種の核酸を増幅することと、3)流体選別装置内で、少なくとも一部の細胞が標的種を含有するような細胞を溶解することと、4)流体選別装置内で、少なくとも一部の細胞又はウィルスが標的種を含有するような細胞又はウィルスから遺伝物質を分離することと、5)サンプル内に少なくとも50%の標的種を含有する、精製された標的種を回収することと、のいずれかの組み合わせを備えるものでもよい。
【0164】
別の実施形態は、標的種に対する親和性を有する磁性粒子を含有するサンプルに含まれる標的種を精製する方法であって、(a)傾斜磁場発生部を有する流体選別装置にサンプルを流し、サンプルの流れが、実質的にサンプルを含まない液体シースにより包含されるように、又は、液体シース間に挟まれるようにして、少なくとも一部の磁性粒子を捕獲する工程と、(b)傾斜磁場発生部に印加される磁場を消失させる又は弱めることにより、捕獲された磁性粒子を放出させる工程と、(c)傾斜磁場発生部の下流側で、少なくとも一部の磁性粒子を用いて、精製された標的種を採取又は処理する工程と、を備える。
【0165】
別の実施形態は、シース流装置であって、(a)シース流平面領域の上流側に位置する第1の層流形成面と、(b)シース流平面領域に平行であり、サンプルシース流平面領域の上流側に位置するサンプル層流形成面と、必要に応じて、さらに、(c)第2のシース流平面領域の上流側に位置する第2の層流形成面と、を備える。一つの実施形態において、シース流装置は、さらに、粒子トラップステーションを備える。このトラップステーションは、たとえば、磁気トラップステーションでもよい。本明細書のシース流装置は、より大きな流体回路の一部でもよい。
【0166】
別の実施形態は、シース流装置であって、a)シース流平面領域の上流側に位置する第1の層流形成面と、(b)シース流平面領域に平行であり、サンプルシース流平面領域の上流側に位置するサンプル層流形成面と、(c)第2のシース流平面領域の上流側に位置する第2の層流形成面と、を備える。一つの実施形態において、工程(a)、(b)及び(d)の層流形成面は、実質的に乱流を生じさせることのない個別のシース流平面を十分に維持可能である。一つの実施形態において、工程(b)のサンプル層流形成面は、上面と底面とを備え、工程(c)の第2の層流形成面は、サンプル層流形成に用いられる面と反対側の面上に位置する。シース流装置は、水平面に対して実質的に直交するように配置されるものでもよい。シース流装置は、さらに、粒子トラップステーションを備えるものでもおい。一つの実施形態において、粒子トラップステーションは、強磁性成分を備える。シース流装置は、磁気泳動粒子分離に適合させたものでもよい。
【0167】
本発明のシース流装置は、さらに、試薬を収容する少なくとも1つの貯蔵部を備えるものでもよいし、全血からの幹細胞の単離に適合させたものでもよいし、及び/又は、マイクロ流体処理用に構成されるものでもよい。一つの実施形態において、シース流装置は、試薬を収容する貯蔵部を備え、試薬は、バッファ―(緩衝液)、多数の磁気ビーズ、幹細胞増殖剤、アプタマー、タンパク質含有組成物、バクテリア細胞培養物、及びバクテリオファージ集団含有組成物の少なくとも一つを含有する。
【0168】
他の実施形態は、シース流装置内で流体サンプルから標的種を分離する方法であって、(a)標的種に選択的に結合する磁性粒子に結合された試薬を用いて、流体サンプルに含まれる標的種を磁性粒子で予め標識する工程と、(b)シース流装置の平面状の表面に沿ってバッファー層流を形成する工程と、(c)バッファー層流に隣接して流体サンプルの層流を形成する工程と、(d)バッファー層流を介して、流体サンプルの層流から標的種を引き離す工程と、(e)磁気トラップステーションで標的種を捕捉する工程と、を備える。一つの実施形態において、層流は、高さがミクロンオーダーで、幅がミリメートルオーダーである。バッファー層流とサンプル層流とは、長さ方向と幅方向とが一致する領域に沿って隣接する、すなわち、高さ方向に積層される。この方法により標的種を単離する際のスループットを増大させる一つの方法は、層流の高さをミクロン(ミリメートル未満)オーダーに保持する一方で、層流の幅を広くすることである。このためには、複数のシース流装置を並列に運転する、及び/又は、シース流装置内の層流の幅を広くすればよい。一つの実施形態において、方法は、さらに、流体サンプル層流を形成する前に、第1のバッファー層流に隣接して第2のバッファー層流を形成し、第1のバッファー層流と第2のバッファー層流との間に流体サンプル層流を形成する工程を備える。一つの実施形態において、第1及び第2のバッファー層流並びに流体サンプル層流は、実質的に乱流を生じさせることのない個別の流れ平面を十分に維持可能である。別の実施形態において、磁気トラップステーションは、強磁性成分を備える。一つの実施形態において、標的種は、細胞、バクテリア、ウィルス、タンパク質及び核酸のうち少なくとも1つを備える。一つの実施形態において、標的種は循環腫瘍細胞であり、流体サンプルは全血である。
【0169】
他の実施形態は、患者を分析する方法であって、(a)患者から腫瘍細胞を含むサンプルを採取する工程と、(b)分離法により腫瘍細胞をサンプルから分離する工程であって、(i)腫瘍細胞に対する特異親和性を有する磁性粒子を用いてサンプルを標識して、標識サンプルを生成することと、(ii)標識サンプルから磁性粒子を偏向させ、及び/又は、捕捉して、これにより、サンプルから腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、標識サンプルを通すことと、を備え、バッファー溶液のシース内にサンプルを流すことによって、流体装置へのサンプルの非特異的な結合を抑制する工程と、(c)工程(b)でサンプルから分離された腫瘍細胞の特性評価を行なう工程と、を備える。一つの実施形態において、工程(c)の特性評価を行なうことは、状態を診断する、臨床試験のためのスクリーニングを行なう、治療法の有効性を評価する、及び、手術の有効性を査定するための情報を与えることである。別の実施形態において、サンプルは、患者から採取した流体サンプルである。一つの実施形態において、サンプルは、患者の生検により採取されたものではなく、たとえば、サンプルは血液サンプルである。一つの実施形態において、腫瘍細胞は、非血液癌由来の循環腫瘍細胞である。別の実施形態において、特性評価を行なうことは、腫瘍細胞の計数である、及び/又は、腫瘍細胞の分子特性評価を行なうことである。分子特性評価は、たとえば、腫瘍細胞における遺伝子変異である。
【0170】
別の実施形態は、患者の治療計画をモニタリングして、必要に応じて調整する方法であって、(a)一次治療計画を実施中の患者から腫瘍細胞を含むサンプルを採取する工程と、(b)分離法により腫瘍細胞を前記サンプルから分離する工程であって、(i)腫瘍細胞に対する特異親和性を有する磁性粒子を用いてサンプルを標識して、標識サンプルを生成することと、(ii)標識サンプルから磁性粒子を偏向させ、及び/又は、捕捉して、これにより、サンプルから腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、標識サンプルを通すことと、を備え、バッファー溶液のシース内にサンプルを流すことによって、流体装置へのサンプルの非特異的な結合を抑制する工程と、(c)工程(b)でサンプルから分離された腫瘍細胞の特性評価を行なって、患者に対する今後の治療を提案する工程と、を備える。一つの実施形態において、一次治療計画は化学療法レジメンである。一つの実施形態において、今後の治療は異なる化学療法レジメンである。一つの実施形態において、患者に対する今後の治療を提案する工程は、一次治療計画の今後の有効性を予測することを備える。別の実施形態において、患者に対する今後の治療を提案する工程は、患者に関して前にはわかっていなかった腫瘍細胞の特徴を考慮した、一次治療計画とは異なる二次治療計画を特定することを備える。
【0171】
患者の治療計画をモニタリングして、必要に応じて調整する方法は、さらに、(d)患者に二次治療計画を実施した後で、患者から腫瘍細胞を含むサンプルを採取する工程と、(e)工程(d)で採取されたサンプルと腫瘍細胞に対して工程(b)及び工程(c)を実施する工程と、を備える。
【0172】
別の実施形態は、細胞由来生成物を提供する方法であって、(a)標的細胞を含むサンプルを採取する工程と、(b)分離法により標的細胞をサンプルから分離する工程であって、(i)標的細胞に対する特異親和性を有する磁性粒子を用いて標的細胞を標識して、サンプル内に標識細胞集団を生成することと、 (ii)サンプルから標識細胞集団の少なくとも一部を偏向させ、及び/又は、捕捉して、これにより、サンプルから標的細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、サンプルを通すことと、を備え、バッファー溶液のシース内にサンプルを流すことによって、流体装置へのサンプルの非特異的な結合を抑制する工程と、(c)工程(b)でサンプルから分離した標的細胞から細胞由来生成物を得る工程と、を備える。一つの実施形態において、方法は、さらに、工程(b)でサンプルから分離した標的細胞を処理して、細胞由来生成物を生成する工程を備える。一つの実施形態において、標的細胞は幹細胞であり、標的細胞を処理する工程は、幹細胞を処理して、有効な治療薬を得ることを備える。一つの実施形態において、幹細胞を処理して、有効な治療薬を得ることは、標的細胞を分化させて、より特異的な細胞型を生成することを備える。上述した他の方法と同様に、サンプルは、患者から採取した流体サンプルでもよく、たとえば、血液サンプルでもよい。
【0173】
一つの実施形態において、方法は、さらに、工程(b)でサンプルから分離した標的細胞の特性評価を行なう工程を備える。特性評価を行なうことは、標的細胞の計数であってもよく、及び/又は、標的細胞の分子特性評価を行なうことでもよい。分子特性評価は、たとえば、標的細胞における遺伝子変異である。
【0174】
実施例:
以下、実施例及び理論的実験例を説明する。実施例1は、複合血液サンプルから希少細胞を磁気泳動選別する本発明の装置を示す。実施例2は、本発明のオンチップキットの実施例を示す。実施例3ないし7は、サンプル流体の一部が生物製剤又は化学薬品である実施例を示す。実施例8及び9は、本発明の装置を、モニタリング、具体的には、各々、環境プロセス及び生物医薬品製造のモニタリングに用いた実施例を示す。実施例10は、本発明の装置をポイントオブケア(POC)診断に用いた実施例を示す。実施例11は、ヒトの臍帯血サンプルから得た造血前駆細胞(HPC)の濃縮比較を示す。
【0175】
実施例1:全血からの希少細胞の単離及びシース流が形成されない装置との比較
この実施例は、本発明のシース流装置が、磁気泳動トラップステーションへの非標的血液細胞の非特異的結合を実質的に防ぐ流体層を形成する様子を示す。
【0176】
磁力を用いて、106 MNC(単核細胞)及び全血に含まれる非常に希少な標的細胞を濃縮するマイクロ流体分離を行なった。以下、マルチストリームマイクロ磁気分離装置(Multi-stream Micro Magnetic Separator:M−MMS又はMMS)と称する。
【0177】
図6Aに図示し、図6Bに画像として示す装置を用いた。図6Aは、本発明のMMS装置600のシース流部品の一実施例を示す分解斜視図である。これは、装置の個々の部品を互いに組み合わせたときに、どのようにシース流を形成するかを示すための斜視図である。この実施例では、7枚のプレート615、620、625、630、635、640、645が用いられており、各プレートは、アクセスポート及び/又はチャネルを備え、互いに組み合わせてバッファー流とサンプル流とを装置内に導入したときにシース流を形成するように構成される。
【0178】
サンプル流路を示す点線の矢印602のように、サンプル流入ポート601から液体サンプルが導入される。サンプルは、プレート620及び625の同様なポートから、プレート630のチャネル端部を通った後、プレート635の(図では)上面の突き当り領域606(サンプル層流形成面)に流れる。便宜上、サンプル流の矢印602は、互いに組み合わせたときに流れが突き当り領域606で偏向し、プレート630の空隙内に空隙と平行な方向に層流を形成するように図示した。同様に、一方のバッファー流路を示す点線の矢印603のように、バッファー流入ポート604からバッファー溶液が導入される。バッファーは、プレート620の同様なチャネル端部を通った後、プレート625の(図では)上面の突き当り領域605(バッファー層流形成面)に流れる。便宜上、バッファー流の矢印603は、流れが突き当り領域605で偏向し、プレート625の空隙内に空隙と平行な方向に層流を形成するように図示した。さらに同様に、他方のバッファー流路を示す点線の矢印609のように、バッファー流入ポート608からバッファー溶液が導入される。バッファーは、プレート640の同様なチャネル端部を通った後、プレート635の(図では)下面の突き当り領域607(バッファー層流形成面)に流れる。便宜上、バッファー流の矢印609は、流れが突き当り領域607で偏向し、プレート635の空隙内に空隙と平行な方向に層流を形成するように図示した。
【0179】
矢印611は共通の排出流路を示す。流れ602、603及び609は、(互いに組み合わせたときに)プレート620、625、630、635及び640のチャネルの遠位端で合流し、点線の矢印611で示すように、流出ポート610を介して装置から排出される。
【0180】
図6Bに示すように、チャネル上面にニッケルグリッドの薄層がパターン化されている(図2A及び図2Bを参照して上述した。また、図6Bではグリッドパターンは灰色の影として示されている)。ニッケルグリッドは、外部磁石の存在により、強い傾斜磁場を生じ、磁気ビーズで標識した標的検体を捕獲可能なように構成される。標識されていないバックグラウンド細胞は、傾斜磁場の影響を受けないで、排出物として連続的に溶出される。最初は、純粋なシース流のみが上面に接触するため、磁気的に捕獲される標的検体のみが上面に捕獲される一方で、表面への非特異的な結合が最小限に抑えられるため、非常に純度の高いサンプルが得られる。図6Bに、ルアーロック等のサンプル流入口取付具650と、上部及び下部バッファー流入口取付具655及び660と、排出物流出口取付具665と、を示す。これらの取付具により、たとえば、シリンジを用いてサンプルを注入する一方で、専用流路を介して装置600内にバッファーを連続的にポンプで注入することができる。排出物は、たとえば、専用排出流路を介して、真ん中の貯蔵部に除去される。単純に流路を外して新しい装置に再接続するだけで装置を切断することができる。
【0181】
図6Cは、装置600の一部(左上部)の断面Aを示す。図6Cの下部の拡大断面図は、サンプル流路とバッファー流路とを互いに隣接して形成して、シース流装置600の上部内側面と下部内側面とにサンプル流が接しないようにした様子を示す。サンプル層流の上と下とにバッファー層流のシースが形成される様子を断面図の一番右側の部分に示す(点線の矢印は、上部バッファー流、サンプル流及び下部バッファー流の各々の流れ方向を示す)。
【0182】
図7Aは、同様のシース流装置700の各部品を示す分解斜視図である。シース流装置700は、層705、710、715、720、725、730及び735を備え、図示するように、各層を互いに隣接して組み合わせて積層させることにより、装置700を形成する。装置700では、すべての流入口(下部バッファー流入口740、上部バッファー流入口745及びサンプル流入口755)と流出口(排出物流出口750)とが最上部プレート705上に形成されているという点で、装置600と異なる(装置600では、下部バッファー流出口は底部プレートに形成されている)。装置700は、操作の間、平面上に置いておけるため、取扱いが簡便になる。この例では、最上部プレート705は、ニッケルトラップグリッドを備えるガラスであり、層710、720及び730は、たとえば約0.2mmの厚さの接着層であり、層715及び725は、たとえば約0.125mmの厚さのポリカーボネートであり、層735はガラスである。図7Bに、図7Aに示すシース流装置700を組み立てた状態の斜視図を示す。
【0183】
本実施例のシース流装置は、血液の粘度と密度に合うように、下部流体層に50%(w/w)スクロース(ショ糖)を用いた。
【0184】
シース流が形成されるチップと、比較のために、シース流が形成されないチップとに、(磁性粒子を含有しない)全血を同じ流速で注入して、シース流の有効性を調べた。図4(の左側の画像)に示すように、シース流が形成されない場合には、RBC(赤血球)及び他の細胞が、表面に非特異的に付着した。図4(の右側の画像)に示すシース流装置では、表面に非標的細胞がほとんど存在せず、その有効性が立証された。
【0185】
希少細胞を回収するM−MMSの能力を定量する目的で、MCF−7乳癌細胞を、市販のナノサイズ磁性粒子(BD Biosciences社の抗PE磁性粒子)で前標識した。前標識したMCF−7腫瘍細胞を、細胞50個/ml、細胞30個/ml又は細胞10個/mlの割合で全血に混ぜた。結果を図5A及び図5Bに示す。平均純度は、(それぞれ、細胞50個/ml、細胞30個/ml又は細胞10個/mlに対して)69%、58%及び20%であった(図5A)。これは、最初のサンプルの約1×107倍の濃縮に対応する。平均細胞回収率は、(それぞれ、細胞50個/ml、細胞30個/ml又は細胞10個/mlに対して)86%、94%及び92%であった(図5B)。
【0186】
in situ(その場)標識を用いた場合の標的細胞の回収率は約90%であった。また、細胞の純度は、約13%であり、これは、最初のサンプルの約2×106倍の濃縮に対応する。in situの磁気標識の効率が悪いために、前標識選別ほど効率がよくなかったと考えられる。
【0187】
このように、本発明は、層流平面のサンプル流体層に隣接し、かつ、平行な平面におけるシース層流の第1流体層を備え、さらに、必要に応じて、層流平面のサンプル流体の第2層に隣接するシース層流の第2流体層を備える、流体シース流装置を提供する。ここで、シース流は、最初に、固体支持層状に形成される。
【0188】
実施例2:オンチップキット
これは理論的実験例である。所定の流体回路に従って、本発明のシース流装置を製造する。所定の貯蔵部に所望の流体を予め充填する(プレフィルする)自動流体供給機器を用いて、この装置を製造する。貯蔵部を密閉(シール)するが、ここで、プレフィル貯蔵部の一部のシールが所定の張力によって破れて、内部の流体が別の貯蔵部と流体連結されるように構成する。複数の貯蔵部を特定の目的に合わせてプレフィルし、流体回路により、空気力等、適当な力を印加して、流体を所定の領域に流す。流体が貯蔵部から出て、図1及び図2を参照して上述したように所定の流体回路の一部である本発明の装置に流入することにより、本発明のシース流が形成される。一例において、自動機器は、空気ピストンを用いて、装置の流体回路に合わせた所定の時間的パターンで力を印加して、シース流を形成する。
【0189】
実施例3:バイオマーカー検出
これは理論的実験例である。本発明のシース流装置を、個体から採取した体液からバイオマーカーを選別する流体回路を備えるように構成する。バイオマーカーの存在は、特定の病態であることを示す。バイオマーカーは細胞、タンパク質、核酸又はこれらのいずれかの分解生成物から選択される。病態は、癌、神経疾患及び感染症の中から選択される。癌バイオマーカーは、循環腫瘍細胞、タンパク質及び核酸の中から選択される。神経疾患バイオマーカーは、細胞、これに限定されるものではないがAβ(1−42)(アミロイドβペプチド42)タンパク質又はそのフラグメント(断片)若しくはオリゴマーを含むタンパク質、又は、アルツハイマー病、ハンチントン病、筋萎縮性側索硬化症(ALS又はルー・ゲーリック病)、認知症、多発性硬化症及びプリオン病から選択される神経疾患用の他のバイオマーカーから選択される。感染症用のバイオマーカーは、感染性病原体及び二次病原体又は有害な効果のある検出可能なマーカーから選択され、以下に限定されるものではないが、ウィルス、バクテリア、真菌、プリオン及び他の感染性病原体を含む。ウィルスは、たとえば、HIVウィルス、(あらゆる型の)肝炎ウィルス、(あらゆる型の)インフルエンザウィルス、あらゆる型のパピローマウィルス(HPV)、狂犬病ウィルス又はその他のウィルス感染性病原体でもよい。バイオマーカーは、上記の生命体や感染性病原体の一部でもよい。たとえば、バイオマーカーは、ウィルス外被に関係するたんぱく質でもよい。
【0190】
実施例4:アプタマーのスクリーニング
これは理論的実験例である。本発明のシース流装置を、アプタマーを用いて流体サンプルに含まれる希少分子を検出する流体回路を備えるように構成する。アプタマーは、検出可能なマーカーと関連付けられたものでもよい。アプタマーを、アプタマーが標的種に結合する条件下で、流体懸濁液にさらす。アプタマー及び標的種は、本発明のシース流装置の貯蔵部内に設置されるトラップステーション内に捕捉される。非標的物質は、トラップステーションからアプタマー/標的種を取り除くのには不十分な空気力(又は他の力)により流体(たとえば、バッファー)と共に洗浄除去される。この理論的実験例を用いて、たとえば、尿、血液又は他の体液中の物質を検出することができる。たとえば、尿に含まれる微量のコカインやその他の不法に摂取された薬剤を検出することができる。たとえば、参照することによりあらゆる目的で本明細書に組み込まれる、Swensen, J. S.ら、Continuous, real-time monitoring of cocaine in undiluted blood serum via a microfluidic, electrochemical aptamer-based sensor. (マイクロ流体電気化学アプタマーセンサーを用いた不希釈血清中に含まれるコカインの連続的なリアルタイムモニタリング) J. Am. Chem. Soc. doi:10.1021/ja806531z (2009)を参照のこと。
【0191】
実施例5:体液中の被分析物のテスト
これは理論的実験例である。本発明のシース流装置を、薬物に関して、非合法か否かや、その存在や用量を含めた(ヒトや動物等の)個体のモニタリングを行なう流体回路に合わせて、構成する。本発明の装置を、医学的に処方された用量、薬物動態、体や脳の能力向上、非合法(メタンフェタミン、コカイン、マリファナ(カンナビノイド))やグルコース(インスリン)等の内分泌関連物質を検出又はモニタリングするように構成してもよい。たとえば、本発明のシース流装置を、血液や尿等の体液に含まれる医薬品又は医薬品分解又は下流代謝製剤の検出に適した試薬を予め充填した(プレフィルした)貯蔵部(又はチャンバ)を備えるように構成する。シース流装置を、血液(等の)サンプルを貯蔵部に供給した後、適当な試薬をプレフィルした貯蔵部を手動張力等の力を印加して開放するように、構成する。体液と試薬とを結合させることにより、患者への投薬が適切であるか否かを視覚的に検出することができる。
【0192】
実施例6:アプタマーを含む化学物質ライブラリーのスクリーニング
これは理論的実験例である。本発明のシース流装置を、特定の目的に応じて化学物質ライブラリーのスクリーニングを行なう流体回路を備えるように構成する。たとえば、ファージディスプレイを用いることにより、標的タンパク質に対して、アプタマーライブラリーをスクリーニングするようにしてもよい。アプタマー/タンパク質複合体を分析して、結合しているアプタマー及びその結合特性を同定し、濃縮されたアプタマーを再びライブラリーのスクリーニングにかけるようにしてもよい。たとえば、タンパク質部分(moiety)上の特定のエピトープに対する結合親和性又は結合等、特定の特性を有するアプタマー部分(moiety)を選択する反復処理により、このようなスクリーニングを行なうようにしてもよい。この実施例のシース流装置は、所定のタンパク質のファージ・ディスプレイ集団を保持し、必要に応じて培養する貯蔵部と、スクリーニング対象となるアプタマーライブラリーの流入ポート又はアプタマーライブラリーをプレフィルしたチャンバと、を備える。あるいは、所望のタンパク質(又は他の選択用基質)が供給される、アプタマーライブラリーを保持する貯蔵部を備えるものでもよい。アプタマーライブラリーとタンパク質(又は他の基質)とを混合する貯蔵部に力を加えて、結合反応を促進するようにしてもよい。
【0193】
実施例7:ゲノムスクリーニング:DNA分析
これは理論的実験例である。本発明のシース流装置を、マイクロ流体回路を備えるように構成し、核酸選別に用いる。DNAのサンプル又はDNAを含有する細胞を、特定のDNA配列に結合する(さらに、必要に応じて、細胞を溶解して内部のDNAを露出させる)のに適した試薬を供給する貯蔵部及びチャネルと流体連結された装置内にセットする。たとえば、DNAプライマーを用いて、特定の対応DNA配列に結合させる。プライマーを(ゲノムや法医学サンプル等の)対象DNAを含有する貯蔵部に加える。洗浄流体をチャンバに加えて、結合していない部分(moiety)を洗浄除去する。プライマー/DNAを適用試薬にさらして、ポリメラーゼ連鎖反応を複数回実施する。張力を加える自動機器を用いて試薬を適切に混合する。
【0194】
実施例8:環境モニタリング
これは理論的実験例である。本発明のシース流装置を、環境モニタリング又は環境分析に適した材料と流体回路とを備えるように構成する。環境流体サンプルの処理は、(上述した)体液から得られた水性流体処理とかなりの部分が共通するが、(温度、太陽光、塩分や他の環境条件等、極端な条件に耐えさせられた)物質を対象とし、安定した電力が利用できないような現場使用に合うような変更が施されている。たとえば、飲料水のモニタリングを住宅所有者が希望する場合、ある期間にわたって飲料水を採取して、一度に分析する必要がある。あるいは、石油又はガスを含有する特定の地層に関係することが知られている種である、石油やガスの掘削用の指標微生物のモニタリングに本発明のシース流装置を用いることもできる。当業者であれば、このような条件下でのサンプル使用に耐えられる物質を選択することができるであろう。本発明のシース流装置を、さらに、シース流路内の流体の流れに十分な圧力を手動で(手工具や携帯工具)加えるような構成にしてもよい。環境モニタリングには、たとえば、飲料水や環境水(塩水源や淡水源)、土壌(土壌改善等)、PCB又はスーパーファンド用地浄化モニタリング、環境放射線モニタリング、(藻類やオキアミ等の)再生やその他の生態学的な目標、及び、居住環境モニタリング(飲料水やプールの水を含む水、空気及び土壌モニタリング又は分析)が含まれる。水銀、鉛、鉄等の重金属や(試掘用に)金や銀に選択的に結合するアプタマー(又は他の選択的結合分子)を含有するプレフィル型装置を用いるようにしてもよい。また、ヒ素、過度の薬剤環境汚染、MBEや他の有機溶剤等、環境有害物質をモニタリングすることも可能である。大陸棚域等の海洋域の酸性化を、(比色分析片等の)酸性化指標を用いて調べることもできる。
【0195】
実施例9:生物薬剤生産
これは理論的実験例である。本発明のシース流装置を、生物製剤の生産において、生物学的過程のモニタリングに用いることができる。たとえば、様々な段階で別々のバイオリアクターからタンパク質を採取して、タンパク質生産のロット間変動をモニタリングするようにしてもよい。同様に、ワクチン生産のモニタリングも可能である。本発明のシース流装置を用いて、品質保証を目的として、さまざまな生物製剤や生物薬剤のモニタリングを行なうことができる。
【0196】
実施例10:ポイントオブケア(POC)診断
これは理論的実験例である。本発明のシース流装置を、臨床検査室で通常実施される様々なポイントオブケア(POC)血液分析に適するように、構成する。本発明のシース流装置を、患者の血液を1つの貯蔵部に集めた後、張力をかけて、複数の貯蔵部に流して、分割する。個々の貯蔵部に分割された血液サンプルを、染色剤若しくは染料又は抗体等、臨床検査室での試験に用いられる部分(moiety)に各々さらす。あるいは、又は、これに加えて、分割した血液を、肝臓酵素、血糖、甲状腺、タンパク質Cやその他の血液部分(moiety)等、用途により適した別の試薬にさらすようにしてもよい。
【0197】
実施例11:ヒト臍帯血サンプルからの造血前駆細胞(HPC)の濃縮比較
上述の実施例1で説明した、シース流と磁気トラップとを用いる本発明の装置を、シース流を形成することはできないが、磁性粒子で標識した細胞を磁気捕捉する細胞分離用装置である(ドイツ、ベルギッシュ・グラッドバッハ、Miltenyi Biotec社から)市販のMACS(登録商標)細胞分離カラムと、対照比較した。
【0198】
冷凍臍帯血又は2日たった新鮮臍帯血多核細胞(MNC)をろ過して、死んだ細胞を取り除いた。次に、サンプルをMiltenyi CD34マイクロビーズ(ドイツ、ベルギッシュ・グラッドバッハ、Miltenyi Biotec社から市販)で標識した。標識したサンプルを分割して、一部を上述したMiltenyi分離カラムに通し、残りの部分を、実施例1で上述した本発明のシース流磁気分離装置に通した。Miltenyiカラムを通したサンプルの一部を再び別のMiltenyiカラムに通し、Miltenyiカラムを1回通したもの(MACS1x)と2回通したもの(MACS2x)を、本発明のシース流装置を1回通したもの(MMS)と比較した。当業者に周知の標準的な免疫蛍光染色及びFACS分析により、これら3種類の精製サンプルを各々分析した。
【0199】
図9A及び図9Bに、上述の方法で単離したHPCであるMACS1x、MACS2x及びMMSのFACS分析の結果を示す。データは、上述したように、N=6でコンパイルし、エラーバーで標準偏差を示した。図9Aから、MMSで分離したHPCの純度が、MACS1xよりも高く、また、MACS2xよりもわずかに高いが、少なくとも同等であることがわかる。この結果は、従来の非シース流形成装置と比べて、MMS装置の性能向上を示すものである。また、図9Bに、MACS1x、MACS2x及びMMSのHPC回収率を示す。MACS1xの回収率は高いが、その純度はMACS2xやMMSよりも低い(図9A参照)。この結果から、MMSの回収率(及び純度)は、MACS2xと同等であることがわかる。要するに、MMS装置を1回だけ通したものと、従来のMACS装置に2回通したものとが、ほぼ同じ純度と回収率であった。
【0200】
本明細書の記載を参照すれば、当業者には自明のように、本発明は、様々な構成や適用で実施可能であり、上述の実施形態や実施例に何ら限定されるものではない。
【特許請求の範囲】
【請求項1】
シース流装置であって、
(a)シース流平面領域の上流側に位置する第1の層流形成面と、
(b)前記シース流平面領域に平行であり、サンプルシース流平面領域の上流側に位置するサンプル層流形成面と、
(c)サンプル層流からシース流層流に標的種を偏向させるように構成される粒子移動ステーションと、を備え、
前記サンプル層流形成面により前記サンプル層流が形成され、前記シース流平面領域内に前記シース流層流が形成される
シース流装置。
【請求項2】
請求項1に記載のシース流装置であって、
さらに、
(d)第2のシース流平面領域の上流側に位置する第2の層流形成面を備える
シース流装置。
【請求項3】
請求項2に記載のシース流装置であって、
前記工程(a)、(b)及び(d)の前記層流形成面は、実質的に乱流を生じさせることのない個別のシース流平面を十分に維持可能である
シース流装置。
【請求項4】
請求項3に記載のシース流装置であって、
前記工程(b)の前記サンプル層流形成面は、上面と底面とを備え、
前記工程(d)の前記第2の層流形成面は、前記サンプル層流形成に用いられる面と反対側の面上に位置する
シース流装置。
【請求項5】
請求項4に記載のシース流装置であって、
前記粒子移動ステーションは、磁力、音響的な力、磁気泳動力及び光学的な力のうち少なくとも1つを用いる
シース流装置。
【請求項6】
請求項5に記載のシース流装置であって、
磁気泳動粒子分離に適した
シース流装置。
【請求項7】
請求項6に記載のシース流装置であって、
さらに、試薬を収容する少なくとも1つの貯留部を備える
シース流装置。
【請求項8】
請求項6に記載のシース流装置であって、
前記標的種は幹細胞であり、
前記サンプル層流は全血を含む
シース流装置。
【請求項9】
請求項6に記載のシース流装置であって、
マイクロ流体装置である
シース流装置。
【請求項10】
請求項6に記載のシース流装置であって、
さらに、試薬を収容する貯留部を備え、
前記試薬が、バッファー(緩衝液)、多数の磁気ビーズ、幹細胞増殖剤、アプタマー、タンパク質を含有する組成物、バクテリア細胞培養物及びバクテリオファージ集団を含有する組成物のうち少なくとも1つを含有する
シース流装置。
【請求項11】
シース流装置において流体サンプルから標的種を分離する方法であって、
(a)前記シース流装置の平面に沿ってバッファー・シース層流を形成する工程と、
(b)前記バッファー・シース層流に隣接して流体サンプル層流を形成する工程と、
(c)前記流体サンプル層流から前記バッファー・シース層流内に前記標的種を偏向させる工程と、を備え、
前記バッファー・シース層流と前記流体サンプル層流とが隣接する方法。
【請求項12】
請求項11に記載の方法であって、
さらに、前記流体サンプルの層流に隣接して、第2のバッファー・シース層流を形成する工程を備え、
前記工程(b)は、前記第1のバッファー・シース層流と前記第2のバッファー・シース層流との間に前記流体サンプル層流を形成することを備える
方法。
【請求項13】
請求項12に記載の方法であって、
前記第1のバッファー・シース層流及び前記第2のバッファー・シース層流並びに前記流体サンプル層流を形成することにより、実質的に乱流を生じさせることのない個別の流れ平面を十分に維持可能である方法。
【請求項14】
請求項13に記載の方法であって、
前記流体サンプル層流から前記バッファー・シース層流内に前記標的種を偏向させる工程は、磁力、音響的な力、磁気泳動力及び光学的な力のうち少なくとも1つを用いることを備える 方法。
【請求項15】
請求項14に記載の方法であって、
前記標的種は、細胞、バクテリア、ウィルス、タンパク質及び核酸のうち少なくとも1つを含む方法。
【請求項16】
請求項15に記載の方法であって、
前記標的種は、前記バッファー・シース層流がその上を通過するトラップ・ステーション内に単離される方法。
【請求項17】
請求項16に記載の方法であって、
前記トラップ・ステーションは、磁力を用いて、磁性粒子で選択的に標識された標的種を捕捉する方法。
【請求項18】
請求項17に記載の方法であって、
前記標的種は循環腫瘍細胞であり、前記流体サンプルは全血である方法。
【請求項19】
患者を分析する方法であって、
(a)患者から腫瘍細胞を含むサンプルを採取する工程と、
(b)分離法により前記腫瘍細胞を前記サンプルから分離する工程であって、
(i)前記腫瘍細胞に対する特異親和性を有する磁性粒子を用いて前記サンプルを標識して、標識サンプルを生成することと、
(ii)前記標識サンプルから前記磁性粒子を偏向させ、及び/又は、捕捉して、これにより、前記サンプルから前記腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、前記標識サンプルを通すことと、を備え、バッファー溶液のシース内に前記サンプルを流すことによって、前記流体装置への前記サンプルの非特異的な結合を抑制する工程と、
(c)前記工程(b)で前記サンプルから分離された前記腫瘍細胞の特性評価を行なう工程と
を備える方法。
【請求項20】
請求項19に記載の方法であって、
前記工程(c)の特性評価を行なうことは、状態を診断する、臨床試験のためのスクリーニングを行なう、治療法の有効性を評価する、及び、手術の有効性を査定するための情報を与えることである方法。
【請求項21】
請求項19に記載の方法であって、
前記サンプルは、前記患者から採取した流体サンプルである方法。
【請求項22】
請求項19に記載の方法であって、
前記サンプルは、前記患者の生検により採取されたものではない方法。
【請求項23】
請求項19に記載の方法であって、
前記サンプルは血液サンプルである方法。
【請求項24】
請求項23に記載の方法であって、
前記腫瘍細胞は、非血液癌由来の循環腫瘍細胞である方法。
【請求項25】
請求項19に記載の方法であって、
前記特性評価を行なうことは、前記腫瘍細胞の計数である方法。
【請求項26】
請求項19に記載の方法であって、
前記特性評価を行なうことは、前記腫瘍細胞の分子特性評価を行なうことである方法。
【請求項27】
請求項26に記載の方法であって、
前記分子特性評価は、前記腫瘍細胞における遺伝子変異である方法。
【請求項28】
患者の治療計画をモニタリングして、必要に応じて調整する方法であって、
(a)一次治療計画を実施中の患者から腫瘍細胞を含むサンプルを採取する工程と、
(b)分離法により前記腫瘍細胞を前記サンプルから分離する工程であって、
(i)前記腫瘍細胞に対する特異親和性を有する磁性粒子を用いて前記サンプルを標識して、標識サンプルを生成することと、
(ii)前記標識サンプルから前記磁性粒子を偏向させ、及び/又は、捕捉して、これにより、前記サンプルから前記腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、前記標識サンプルを通すことと、を備え、バッファー溶液のシース内に前記サンプルを流すことによって、前記流体装置への前記サンプルの非特異的な結合を抑制する工程と、
(c)前記工程(b)で前記サンプルから分離された前記腫瘍細胞の特性評価を行なって、前記患者に対する今後の治療を提案する工程と
備える方法。
【請求項29】
請求項28に記載の方法であって、
前記一次治療計画は化学療法レジメンである方法。
【請求項30】
請求項29に記載の方法であって、
前記今後の治療は異なる化学療法レジメンである方法。
【請求項31】
請求項28に記載の方法であって、
前記患者に対する今後の治療を提案する工程は、前記一次治療計画の今後の有効性を予測することを備える方法。
【請求項32】
請求項28に記載の方法であって、
前記患者に対する今後の治療を提案する工程は、前記患者に関して前にはわかっていなかった前記腫瘍細胞の特徴を考慮した、前記一次治療計画とは異なる二次治療計画を特定することを備える方法。
【請求項33】
請求項32に記載の方法であって、
さらに、
(d)前記患者に前記二次治療計画を実施した後で、前記患者から腫瘍細胞を含むサンプルを採取する工程と、
(e)前記工程(d)で採取された前記サンプルと腫瘍細胞に対して前記工程(b)及び前記工程(c)を実施する工程と
を備える方法。
【請求項34】
細胞由来生成物を提供する方法であって、
(a)標的細胞を含むサンプルを採取する工程と、
(b)分離法により前記標的細胞を前記サンプルから分離する工程であって、
(i)前記標的細胞に対する特異親和性を有する磁性粒子を用いて前記標的細胞を標識して、前記サンプル内に標識細胞集団を生成することと、
(ii)前記サンプルから前記標識細胞集団の少なくとも一部を偏向させ、及び/又は、捕捉して、これにより、前記サンプルから前記標的細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、前記サンプルを通すことと、を備え、バッファー溶液のシース内に前記サンプルを流すことによって、前記流体装置への前記サンプルの非特異的な結合を抑制する工程と、
(c)前記工程(b)で前記サンプルから分離した前記標的細胞から細胞由来生成物を得る工程と
を備える方法。
【請求項35】
請求項34に記載の方法であって、
さらに、前記工程(b)で前記サンプルから分離した前記標的細胞を処理して、前記細胞由来生成物を生成する工程を備える方法。
【請求項36】
請求項35に記載の方法であって、
前記標的細胞は幹細胞であり、
前記標的細胞を処理する工程は、前記幹細胞を処理して、有効な治療薬を得ることを備える
方法。
【請求項37】
請求項36に記載の方法であって、
前記幹細胞を処理して、有効な治療薬を得ることは、前記標的細胞を分化させて、より特異的な細胞型を生成することを備える方法。
【請求項38】
請求項34に記載の方法であって、
前記サンプルは、患者から採取した流体サンプルである方法。
【請求項39】
請求項38に記載の方法であって、
前記流体サンプルは、血液サンプルである方法。
【請求項40】
請求項34に記載の方法であって、
さらに、前記工程(b)で前記サンプルから分離した前記標的細胞の特性評価を行なう工程を備える方法。
【請求項41】
請求項40に記載の方法であって、
前記特性評価を行なうことは、前記標的細胞の計数である方法。
【請求項42】
請求項40に記載の方法であって、
前記特性評価を行なうことは、前記標的細胞の分子特性評価を行なうことである方法。
【請求項43】
請求項42に記載の方法であって、
前記分子特性評価は、前記標的細胞の遺伝子配列である方法。
【請求項44】
流体分離装置であって、
(a)前記流体分離装置内にサンプル流を形成するように構成される少なくとも1つのサンプル流入チャネルと、
(b)前記流体分離装置内に1つ以上の流体シースを形成して、前記装置の表面から前記サンプル流を離すことにより、前記装置に対する前記サンプルの成分の非特異的結合を抑制するように構成される少なくとも1つのシース流流入チャネルと、
(c)前記サンプル流入チャネルと前記シース流流入チャネルとに流体連結される選別ステーションであって、前記サンプル流の流路に沿って配置される選別ステーションと、
(d)外部磁場と相互に作用して、前記選別ステーション内の傾斜磁場を変化させることにより、前記サンプル流から磁性粒子を偏向させる、及び/又は、捕捉する傾斜磁場発生部と
を備える流体分離装置。
【請求項45】
請求項44に記載の流体分離装置であって、
前記選別ステーションは、前記選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を有し、
前記内部空間は、前記サンプル流の流れ方向と交わる第1及び第2の横方向寸法を有し、
前記第2の横方向寸法は、前記第1の横方向寸法の少なくとも約2倍以上であり、
前記少なくとも1つのシース流流入チャネルは、前記第1の横方向寸法に沿った前記サンプル流により互いに分離された2つのシース流を形成するように構成される
流体分離装置。
【請求項46】
請求項44に記載の流体分離装置であって、
前記選別ステーションは、前記選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を有し、
前記内部空間は、約2ミリメートル以下の距離だけ離れた、実質的に平行かつ実質的に平面状の2つの表面により、部分的に規定され、
前記少なくとも1つのシース流流入チャネルは、前記平行で平面状の2つの表面に接して流れると共に、前記サンプル流により互いに分離された2つのシース流を形成するように構成される
流体分離装置。
【請求項47】
請求項46に記載の流体分離装置であって、
前記実質的に平行で実質的に平面状の2つの表面は、約1ミリメートル以下の距離だけ離れている流体分離装置。
【請求項48】
請求項46に記載の流体分離装置であって、
前記少なくとも1つのシース流流入チャネルは、前記選別ステーションの上流側に位置し、前記内部空間の前記実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第1のシース流流入チャネルを備える
流体分離装置。
【請求項49】
請求項48に記載の流体分離装置であって、
さらに、前記選別ステーションの上流側に位置し、前記内部空間の前記実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第2のシース流流入チャネルを備える
流体分離装置。
【請求項50】
請求項49に記載の流体分離装置であって、
前記少なくとも1つのサンプル流入チャネルは、前記内部空間の前記実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する流体分離装置。
【請求項1】
シース流装置であって、
(a)シース流平面領域の上流側に位置する第1の層流形成面と、
(b)前記シース流平面領域に平行であり、サンプルシース流平面領域の上流側に位置するサンプル層流形成面と、
(c)サンプル層流からシース流層流に標的種を偏向させるように構成される粒子移動ステーションと、を備え、
前記サンプル層流形成面により前記サンプル層流が形成され、前記シース流平面領域内に前記シース流層流が形成される
シース流装置。
【請求項2】
請求項1に記載のシース流装置であって、
さらに、
(d)第2のシース流平面領域の上流側に位置する第2の層流形成面を備える
シース流装置。
【請求項3】
請求項2に記載のシース流装置であって、
前記工程(a)、(b)及び(d)の前記層流形成面は、実質的に乱流を生じさせることのない個別のシース流平面を十分に維持可能である
シース流装置。
【請求項4】
請求項3に記載のシース流装置であって、
前記工程(b)の前記サンプル層流形成面は、上面と底面とを備え、
前記工程(d)の前記第2の層流形成面は、前記サンプル層流形成に用いられる面と反対側の面上に位置する
シース流装置。
【請求項5】
請求項4に記載のシース流装置であって、
前記粒子移動ステーションは、磁力、音響的な力、磁気泳動力及び光学的な力のうち少なくとも1つを用いる
シース流装置。
【請求項6】
請求項5に記載のシース流装置であって、
磁気泳動粒子分離に適した
シース流装置。
【請求項7】
請求項6に記載のシース流装置であって、
さらに、試薬を収容する少なくとも1つの貯留部を備える
シース流装置。
【請求項8】
請求項6に記載のシース流装置であって、
前記標的種は幹細胞であり、
前記サンプル層流は全血を含む
シース流装置。
【請求項9】
請求項6に記載のシース流装置であって、
マイクロ流体装置である
シース流装置。
【請求項10】
請求項6に記載のシース流装置であって、
さらに、試薬を収容する貯留部を備え、
前記試薬が、バッファー(緩衝液)、多数の磁気ビーズ、幹細胞増殖剤、アプタマー、タンパク質を含有する組成物、バクテリア細胞培養物及びバクテリオファージ集団を含有する組成物のうち少なくとも1つを含有する
シース流装置。
【請求項11】
シース流装置において流体サンプルから標的種を分離する方法であって、
(a)前記シース流装置の平面に沿ってバッファー・シース層流を形成する工程と、
(b)前記バッファー・シース層流に隣接して流体サンプル層流を形成する工程と、
(c)前記流体サンプル層流から前記バッファー・シース層流内に前記標的種を偏向させる工程と、を備え、
前記バッファー・シース層流と前記流体サンプル層流とが隣接する方法。
【請求項12】
請求項11に記載の方法であって、
さらに、前記流体サンプルの層流に隣接して、第2のバッファー・シース層流を形成する工程を備え、
前記工程(b)は、前記第1のバッファー・シース層流と前記第2のバッファー・シース層流との間に前記流体サンプル層流を形成することを備える
方法。
【請求項13】
請求項12に記載の方法であって、
前記第1のバッファー・シース層流及び前記第2のバッファー・シース層流並びに前記流体サンプル層流を形成することにより、実質的に乱流を生じさせることのない個別の流れ平面を十分に維持可能である方法。
【請求項14】
請求項13に記載の方法であって、
前記流体サンプル層流から前記バッファー・シース層流内に前記標的種を偏向させる工程は、磁力、音響的な力、磁気泳動力及び光学的な力のうち少なくとも1つを用いることを備える 方法。
【請求項15】
請求項14に記載の方法であって、
前記標的種は、細胞、バクテリア、ウィルス、タンパク質及び核酸のうち少なくとも1つを含む方法。
【請求項16】
請求項15に記載の方法であって、
前記標的種は、前記バッファー・シース層流がその上を通過するトラップ・ステーション内に単離される方法。
【請求項17】
請求項16に記載の方法であって、
前記トラップ・ステーションは、磁力を用いて、磁性粒子で選択的に標識された標的種を捕捉する方法。
【請求項18】
請求項17に記載の方法であって、
前記標的種は循環腫瘍細胞であり、前記流体サンプルは全血である方法。
【請求項19】
患者を分析する方法であって、
(a)患者から腫瘍細胞を含むサンプルを採取する工程と、
(b)分離法により前記腫瘍細胞を前記サンプルから分離する工程であって、
(i)前記腫瘍細胞に対する特異親和性を有する磁性粒子を用いて前記サンプルを標識して、標識サンプルを生成することと、
(ii)前記標識サンプルから前記磁性粒子を偏向させ、及び/又は、捕捉して、これにより、前記サンプルから前記腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、前記標識サンプルを通すことと、を備え、バッファー溶液のシース内に前記サンプルを流すことによって、前記流体装置への前記サンプルの非特異的な結合を抑制する工程と、
(c)前記工程(b)で前記サンプルから分離された前記腫瘍細胞の特性評価を行なう工程と
を備える方法。
【請求項20】
請求項19に記載の方法であって、
前記工程(c)の特性評価を行なうことは、状態を診断する、臨床試験のためのスクリーニングを行なう、治療法の有効性を評価する、及び、手術の有効性を査定するための情報を与えることである方法。
【請求項21】
請求項19に記載の方法であって、
前記サンプルは、前記患者から採取した流体サンプルである方法。
【請求項22】
請求項19に記載の方法であって、
前記サンプルは、前記患者の生検により採取されたものではない方法。
【請求項23】
請求項19に記載の方法であって、
前記サンプルは血液サンプルである方法。
【請求項24】
請求項23に記載の方法であって、
前記腫瘍細胞は、非血液癌由来の循環腫瘍細胞である方法。
【請求項25】
請求項19に記載の方法であって、
前記特性評価を行なうことは、前記腫瘍細胞の計数である方法。
【請求項26】
請求項19に記載の方法であって、
前記特性評価を行なうことは、前記腫瘍細胞の分子特性評価を行なうことである方法。
【請求項27】
請求項26に記載の方法であって、
前記分子特性評価は、前記腫瘍細胞における遺伝子変異である方法。
【請求項28】
患者の治療計画をモニタリングして、必要に応じて調整する方法であって、
(a)一次治療計画を実施中の患者から腫瘍細胞を含むサンプルを採取する工程と、
(b)分離法により前記腫瘍細胞を前記サンプルから分離する工程であって、
(i)前記腫瘍細胞に対する特異親和性を有する磁性粒子を用いて前記サンプルを標識して、標識サンプルを生成することと、
(ii)前記標識サンプルから前記磁性粒子を偏向させ、及び/又は、捕捉して、これにより、前記サンプルから前記腫瘍細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、前記標識サンプルを通すことと、を備え、バッファー溶液のシース内に前記サンプルを流すことによって、前記流体装置への前記サンプルの非特異的な結合を抑制する工程と、
(c)前記工程(b)で前記サンプルから分離された前記腫瘍細胞の特性評価を行なって、前記患者に対する今後の治療を提案する工程と
備える方法。
【請求項29】
請求項28に記載の方法であって、
前記一次治療計画は化学療法レジメンである方法。
【請求項30】
請求項29に記載の方法であって、
前記今後の治療は異なる化学療法レジメンである方法。
【請求項31】
請求項28に記載の方法であって、
前記患者に対する今後の治療を提案する工程は、前記一次治療計画の今後の有効性を予測することを備える方法。
【請求項32】
請求項28に記載の方法であって、
前記患者に対する今後の治療を提案する工程は、前記患者に関して前にはわかっていなかった前記腫瘍細胞の特徴を考慮した、前記一次治療計画とは異なる二次治療計画を特定することを備える方法。
【請求項33】
請求項32に記載の方法であって、
さらに、
(d)前記患者に前記二次治療計画を実施した後で、前記患者から腫瘍細胞を含むサンプルを採取する工程と、
(e)前記工程(d)で採取された前記サンプルと腫瘍細胞に対して前記工程(b)及び前記工程(c)を実施する工程と
を備える方法。
【請求項34】
細胞由来生成物を提供する方法であって、
(a)標的細胞を含むサンプルを採取する工程と、
(b)分離法により前記標的細胞を前記サンプルから分離する工程であって、
(i)前記標的細胞に対する特異親和性を有する磁性粒子を用いて前記標的細胞を標識して、前記サンプル内に標識細胞集団を生成することと、
(ii)前記サンプルから前記標識細胞集団の少なくとも一部を偏向させ、及び/又は、捕捉して、これにより、前記サンプルから前記標的細胞を分離するのに有効な傾斜磁場を有する選別領域を備える流体装置に、前記サンプルを通すことと、を備え、バッファー溶液のシース内に前記サンプルを流すことによって、前記流体装置への前記サンプルの非特異的な結合を抑制する工程と、
(c)前記工程(b)で前記サンプルから分離した前記標的細胞から細胞由来生成物を得る工程と
を備える方法。
【請求項35】
請求項34に記載の方法であって、
さらに、前記工程(b)で前記サンプルから分離した前記標的細胞を処理して、前記細胞由来生成物を生成する工程を備える方法。
【請求項36】
請求項35に記載の方法であって、
前記標的細胞は幹細胞であり、
前記標的細胞を処理する工程は、前記幹細胞を処理して、有効な治療薬を得ることを備える
方法。
【請求項37】
請求項36に記載の方法であって、
前記幹細胞を処理して、有効な治療薬を得ることは、前記標的細胞を分化させて、より特異的な細胞型を生成することを備える方法。
【請求項38】
請求項34に記載の方法であって、
前記サンプルは、患者から採取した流体サンプルである方法。
【請求項39】
請求項38に記載の方法であって、
前記流体サンプルは、血液サンプルである方法。
【請求項40】
請求項34に記載の方法であって、
さらに、前記工程(b)で前記サンプルから分離した前記標的細胞の特性評価を行なう工程を備える方法。
【請求項41】
請求項40に記載の方法であって、
前記特性評価を行なうことは、前記標的細胞の計数である方法。
【請求項42】
請求項40に記載の方法であって、
前記特性評価を行なうことは、前記標的細胞の分子特性評価を行なうことである方法。
【請求項43】
請求項42に記載の方法であって、
前記分子特性評価は、前記標的細胞の遺伝子配列である方法。
【請求項44】
流体分離装置であって、
(a)前記流体分離装置内にサンプル流を形成するように構成される少なくとも1つのサンプル流入チャネルと、
(b)前記流体分離装置内に1つ以上の流体シースを形成して、前記装置の表面から前記サンプル流を離すことにより、前記装置に対する前記サンプルの成分の非特異的結合を抑制するように構成される少なくとも1つのシース流流入チャネルと、
(c)前記サンプル流入チャネルと前記シース流流入チャネルとに流体連結される選別ステーションであって、前記サンプル流の流路に沿って配置される選別ステーションと、
(d)外部磁場と相互に作用して、前記選別ステーション内の傾斜磁場を変化させることにより、前記サンプル流から磁性粒子を偏向させる、及び/又は、捕捉する傾斜磁場発生部と
を備える流体分離装置。
【請求項45】
請求項44に記載の流体分離装置であって、
前記選別ステーションは、前記選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を有し、
前記内部空間は、前記サンプル流の流れ方向と交わる第1及び第2の横方向寸法を有し、
前記第2の横方向寸法は、前記第1の横方向寸法の少なくとも約2倍以上であり、
前記少なくとも1つのシース流流入チャネルは、前記第1の横方向寸法に沿った前記サンプル流により互いに分離された2つのシース流を形成するように構成される
流体分離装置。
【請求項46】
請求項44に記載の流体分離装置であって、
前記選別ステーションは、前記選別ステーションを通って流れる流体の境界を形成する実質的に長方形の内部空間を有し、
前記内部空間は、約2ミリメートル以下の距離だけ離れた、実質的に平行かつ実質的に平面状の2つの表面により、部分的に規定され、
前記少なくとも1つのシース流流入チャネルは、前記平行で平面状の2つの表面に接して流れると共に、前記サンプル流により互いに分離された2つのシース流を形成するように構成される
流体分離装置。
【請求項47】
請求項46に記載の流体分離装置であって、
前記実質的に平行で実質的に平面状の2つの表面は、約1ミリメートル以下の距離だけ離れている流体分離装置。
【請求項48】
請求項46に記載の流体分離装置であって、
前記少なくとも1つのシース流流入チャネルは、前記選別ステーションの上流側に位置し、前記内部空間の前記実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第1のシース流流入チャネルを備える
流体分離装置。
【請求項49】
請求項48に記載の流体分離装置であって、
さらに、前記選別ステーションの上流側に位置し、前記内部空間の前記実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する第2のシース流流入チャネルを備える
流体分離装置。
【請求項50】
請求項49に記載の流体分離装置であって、
前記少なくとも1つのサンプル流入チャネルは、前記内部空間の前記実質的に平面状の2つの表面に実質的に平行に配置される実質的に平面状の表面を有する流体分離装置。
【図1】


【図2A】


【図2B】


【図2C】


【図3A】


【図3B】


【図4】


【図5A】


【図5B】


【図6A】


【図6B】


【図6C】


【図7A】


【図7B】


【図8】


【図9A】


【図9B】




【図2A】


【図2B】


【図2C】


【図3A】


【図3B】


【図4】


【図5A】


【図5B】


【図6A】


【図6B】


【図6C】


【図7A】


【図7B】


【図8】


【図9A】


【図9B】


【公表番号】特表2012−530246(P2012−530246A)
【公表日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2012−515162(P2012−515162)
【出願日】平成22年6月10日(2010.6.10)
【国際出願番号】PCT/US2010/038229
【国際公開番号】WO2010/144745
【国際公開日】平成22年12月16日(2010.12.16)
【出願人】(510048288)シンベニオ・バイオシステムズ・インコーポレーテッド (2)
【氏名又は名称原語表記】CYNVENIO BIOSYSTEMS INCORPORATED
【Fターム(参考)】
【公表日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成22年6月10日(2010.6.10)
【国際出願番号】PCT/US2010/038229
【国際公開番号】WO2010/144745
【国際公開日】平成22年12月16日(2010.12.16)
【出願人】(510048288)シンベニオ・バイオシステムズ・インコーポレーテッド (2)
【氏名又は名称原語表記】CYNVENIO BIOSYSTEMS INCORPORATED
【Fターム(参考)】
[ Back to top ]

