ジチエノベンゾジチオフェン誘導体からなる有機発光材料、発光部材、有機発光デバイス
【課題】良好な発光特性を示す有機発光材料、それらを用いた発光デバイスの提供。
【解決手段】下式IまたはIIで表されるジチエノベンゾジチオフェン誘導体発光材料。

〔X及びYは、X−Yとして式Iの化合物から脱離する基を表し、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕

【解決手段】下式IまたはIIで表されるジチエノベンゾジチオフェン誘導体発光材料。

〔X及びYは、X−Yとして式Iの化合物から脱離する基を表し、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ジチエノベンゾジチオフェン誘導体からなる新規な有機発光材料、有機発光材料前駆体インクを用いて作製された有機発光部材、有機発光デバイスに関する。
【背景技術】
【0002】
有機発光(蛍光)材料は、金属イオン、特定分子、特定のタンパク質、DNA、細胞、細菌などを特異的に高感度で検出可能であることから、センシング関連分野への利用が検討されている。
また、エレクトロニクス分野においては、色素レーザーや、あるいは電極から発光材料量への電荷の注入による、電流励起による発光を利用した有機エレクトロルミネッセンス素子への利用が検討されている。有機エレクトロルミネッセンス素子に代表されるような、有機エレクトロニクスデバイス分野においては、各種材料をインク化し、印刷法、スピンコート法等のウェットプロセスによる簡便な方法でデバイスを製造できる可能性があり、従来の無機材料を利用したエレクトロニクスデバイスと比べ、製造プロセス温度の低温化と低コスト化が実現できるという利点がある。これにより、一般に耐熱性の低いプラスチック基板上への形成が可能となり、ディスプレイ等のエレクトロニクスデバイスの軽量化や低価格化が実現できるとともに、プラスチック基板のフレキシビリティーを活かした新規な用途など、多様な展開が期待できる。
【0003】
これら有機発光材料は、濃度消光と呼ばれる高濃度条件での大幅な発光強度の低下が知られており、これは隣接分子間におけるエネルギー移動や発光材料が発した蛍光を再び発光材料が吸収してしまうためである。従って、一般的には、発光材料を溶媒や樹脂中に希薄状態に分散あるいは溶解した状態で使用されるが、特に有機エレクトロルミネッセンス素子等の固体素子では、極限濃度である固体状態で使用する必要があるため、固体状態でも発光材料の蛍光強度を高める材料開発が行われている。さらにこのような素子では、素子の寿命を高めるために、材料の耐熱性の向上に関しても精力的に検討されている。
【0004】
これまでに、ペンタセンやテトラセンに代表されるアセン系の有機半導体材料が数多く報告されている(例えば特許文献1の特開平5−5568号公報参照)。このアセン系材料を有機半導体層として利用した有機薄膜トランジスタは、高い電界効果移動度を示すことが知られているが、汎用溶媒に対し極めて溶解性が低いため、薄膜化する際には真空成膜を用いる必要がある。ゆえに、これらアセン系材料は、前述したような塗布法や印刷法などの簡便なプロセスで薄膜を形成できるという有機半導体材料への期待に応えるものではない。
非特許文献1のAdvanced Materials 2009,21,213−216.に記載されているジチエノベンゾジチオフェン誘導体のように、結晶内で分子がπスタックした構造を有する場合、結晶形は針状となりやすく、連続した薄膜状態に製膜できなかったり、単一の結晶中でも電荷輸送特性の異方性が大きくなったり、素子毎の特性のばらつきが大きくなってしまい、実用には適さない。特に結晶の形状を含めた結晶構造は分子構造から予測することは困難であり、現在も更なる材料開発が望まれている。
また、例えば特許文献2の特開2008−56797号公報には、図2(A)の構造を有するポリイミド材料は、高機械的耐久性及び耐熱性のよい蛍光材料であることが記載され、特許文献3の特開2008−303365号公報には、同図(B)の構造を有する蛍光材料は、アモルファス性が高く製膜製に優れたものであることが記載され、特許文献4の特開2010−229215号公報には、同図(C)の構造を有する蛍光材料は溶剤可溶性がある天然物由来のものであることが記載され、特許文献5の特開2009−4351号公報には、同図(D)、(E)又は(F)の構造を有する蛍光材料は青色発光を呈する有機蛍光材料であることが開示されている。
しかし、これらによっても、まだ、蛍光性、耐熱性、印刷等の簡便なプロセスで成膜できる溶解性が充分なものではない。一般的に、嵩高な構造の基を有する化合物は有機溶媒可溶性に優れるがしかし分子同士の凝集性が小さく、また、分子同士の凝集性に優れしたがって高い光電効果を示す化合物は有機溶媒可溶性に劣る傾向があり、両者を同時に満たすのは簡単ではない。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、叙上のような当該分野の現状に鑑み、結晶等の高濃度状態でも蛍光性を有するとともに、高い耐熱性を備えた有機発光材料、および、印刷等の簡便なプロセスで成膜できる溶解性を有し、成膜後は簡単な処理により不溶化し、後工程でのダメージを軽減できると共に、不溶化処理後は良好な発光特性を示す有機発光材料、それらを用いた発光デバイスを提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは鋭意検討した結果、以下の(1)〜(6)の発明により上記課題が解決できることを見出し、本発明を完成するに至った。
(1)下記一般式(I)または(II)で表されるジチエノベンゾジチオフェン誘導体からなることを特徴とする有機発光材料;
【0007】
【化1】

〔上記式中、X及びYは、外部刺激によりXとYが結合してX−Yとして一般式(I)の化合物から脱離する基を表し、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕
【0008】
【化2】

〔上記式中のR1〜R10は前記(I)と同じ基を表す。〕。
【0009】
(2)前記X及びYの一方が水素であり、他方が水酸基、又はエーテル構造、又はエステル構造若しくはチオエステル構造を有する基であることを特徴とする前記(1)項に記載の一般式(I)で表される有機発光材料。
(3)前記一般式(2)のエーテル構造、又はエステル構造若しくはチオエステル構造が、下記一般式(III)〜(IX)のいずれかであることを特徴とする前記(2)項に記載の有機発光材料;
【0010】
【化3】

【0011】
【化4】

【0012】
【化5】

【0013】
【化6】

【0014】
【化7】

【0015】
【化8】

【0016】
【化9】

〔上記式中、R11は置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表す。〕
【0017】
(4)前記(1)項乃至(3)項のいずれかに記載の一般式(I)で表される有機発光材料を含有するインクを用いて、前記一般式(I)で表される化合物からなる構造体を作製した後、エネルギーを付与することにより、前記一般式(II)で表されるジチエノベンゾジチオフェン誘導体に変換する発光波長変換方法。
(5)前記(4)項に記載の方法により製造されたことを特徴とする、一般式(II)からなる発光部材。
(6)一般式(I)または(II)で表される有機発光材料を含有する発光部材を含むことを特徴とする発光デバイス。
【発明の効果】
【0018】
以下の詳細かつ具体的な説明から理解されるように、本発明によれば、結晶等の高濃度状態でも蛍光性を有するとともに、高い耐熱性を備えた有機発光材料、および、印刷等の簡便なプロセスで成膜できる溶解性を有し、成膜後は簡単な処理により不溶化し、後工程でのダメージを軽減できると共に、不溶化処理後は良好な発光特性を示す有機発光材料、それらを用いた発光デバイスが提供されるという極めて優れた効果が発揮される。
【図面の簡単な説明】
【0019】
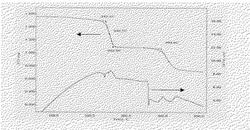
【図1】本発明の(実−1)の有機発光材料の熱分析、TG−DTA測定結果を示すチャートである。
【図2】従来の有機発光材料例を示す図である。
【図3】本発明の(実−4)の有機発光材料の加熱後の吸収スペクトル,蛍光スペクトル示すチャートである。
【図4】実施例で得た化合物(実−1−2)の加熱処理前の吸収スペクトルチャートである
【図5】実施例で得た化合物(実−1−2)、(実−2)の加熱処理前後の蛍光スペクトル、発光スペクトルチャートである。
【図6】実施例で得た化合物(実−9)の加熱処理後の吸収スペクトルチャートである。
【図7】実施例で得た化合物(実−10)の加熱処理後の吸収スペクトルチャートである
【発明を実施するための形態】
【0020】
以下、上記本発明について詳細に説明する。
本発明の有機発光材料の第一の態様は、下記一般式(II)で表されるジチエノベンゾジチオフェン誘導体からなる。
【0021】
【化10】

〔上記式中、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕
【0022】
R1からR10として示される置換もしくは無置換のアルキル基としては、具体的には、メチル基、エチル基、n−プロピル基、i−プロピル基、t−ブチル基、s−ブチル基、n−ブチル基、i−ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基、ウンデシル基、ドデシル基、9−ヘプタデシル基、3,7−ジメチルオクチル基、2−エチルヘキシル基、トリフルオロメチル基、2−シアノエチル基、ベンジル基、4−クロロベンジル基、4−メチルベンジル基、シクロペンチル基、シクロヘキシル基等を一例として挙げることができ、これらはさらに互いに結合して環を形成しても良い。また、アルコキシ基、アルキルチオ基としては上記アルキル基の結合位に酸素原子または硫黄原子を挿入してアルコキシ基、アルキルチオ基としたものが一例として挙げられる。
【0023】
R1からR10として示される置換もしくは無置換のアリール基として具体的には、フェニル、ナフタレン、ビフェニル、ターフェニル、クォーターフェニル、ピレン、フルオレン、9,9−ジメチルフルオレン、アズレン、アントラセン、トリフェニレン、クリセン、9−ベンジリデンフルオレン、5H−ジベンゾ[a,d]シクロヘプテン、[2,2]−パラシクロファン、トリフェニルアミン、チオフェン、ビチオフェン、ターチオフェン、クォーターチオフェン、チエノチオフェン、ベンゾチオフェン、ジチエニルベンゼン、フラン、ベンゾフラン、カルバゾール、ベンゾジチアゾール、ピリジン、キノリン等が一例として挙げられる。これらはさらに上記の置換もしくは無置換のアルキル基、アルコキシ基、チオアルコキシ基、またはフッ素、塩素、ヨウ素および臭素のハロゲン基を置換基として有していてもよい。
【0024】
次に、一般式(II)で表される本発明の有機発光材料の製造法について説明する。
本発明の有機発光材料を合成する方法は特に限定されず、公知の種々の方法により合成することが可能である。本発明の有機発光材料はジチエノベンゾジチオフェン骨格を構築した後、両端の二重結合部位を導入してもよいし、二重結合部位を導入した後、ジチエノベンゾジチオフェン骨格を構築してもよい。
【0025】
ジチエノベンゾジチオフェン骨格を構築した後、両端の二重結合部位を導入する場合、例えばカルボニル化合物とホスホネートを用いたWittig−Horner反応、カルボニル化合物とホスホニウム塩を用いたWittig反応、ビニル置換体とハロゲン化物を用いたHeck反応、ビニルボロン酸誘導体とハロゲン化物を用いた鈴木−宮浦カップリング反応などを用いることができる。
【0026】
特に、Wittig−Horner反応及びWittig反応は、反応操作の簡便さのために有効である。一例として、Wittig−Horner反応を用いた本発明の有機発光材料の製造方法について説明する。
本発明の有機発光材料は、下の反応式(I)に示すように、ホスホン酸エステル化合物及びカルボニル化合物が存在する溶液を、塩基と混合させることによって得られる。
【0027】
【化11】

【0028】
上記カルボニル化合物は、公知の種々の反応により合成することが可能である。
例として下記Vilsmeier反応;
【0029】
【化12】

【0030】
アリールリチウム化合物と、DMF、N−ホルミルモルホリン、N−ホルミルピペリジン、各種酸塩化物、各種酸無水物等をはじめとするホルミル化或いはアシル化試薬との下記反応;
【0031】
【化13】

下記Gatterman反応;
【0032】
【化14】

下記ヒドロキシ化合物の各種酸化反応;
【0033】
【化15】

及び、下記Friedel−Crafts反応
【0034】
【化16】

【0035】
等を一例として挙げることができ、これら反応を用いて所望のカルボニル化合物を合成することができる。
また、上記ホスホン酸エステル化合物についても、公知の種々の反応により合成することが可能であるが、下記Michaelis−Arbuzov反応が特に容易である。
【0036】
【化17】

【0037】
上記反応に使用する塩基はホスホネートカルボアニオンが形成されるものであれば特に限定されず、金属アルコシド、金属ヒドリド、有機リチウム化合物等が挙げられ、例えばカリウムt−ブトキシド、ナトリウムt−ブトキシド、リチウムt−ブトキシド、カリウム2−メチル−2−ブトキシド、ナトリウム2−メチル−2−ブトキシド、ナトリウムメトキシド、ナトリウムエトキシド、カリウムエトキシド、カリウムメトキシド、水素化ナトリウム、水素化カリウム、メチルリチウム、エチルリチウム、プロピルリチウム、n−ブチルリチウム、s−ブチルリチウム、t−ブチルリチウム、フェニルリチウム、リチウムナフチリド、リチウムアミド、リチウムジイソプロピルアミド等を挙げることができる。
反応に用いる塩基の量は、通常ホスホン酸エステル化合物に対して当量使用するだけでよいが、さらに過剰量用いても支障ない。
【0038】
また、二重結合部位を導入した後、ジチエノベンゾジチオフェン骨格を構築する場合には、以下のような方法で合成することができる。
【0039】
【化18】

【0040】
上記のようにして得られた有機発光材料は、反応に使用した触媒、無機塩、未反応原料、副生成物等の不純物を除去して使用される。
精製操作は再結晶、各種クロマトグラフィー法、昇華精製、再沈澱、抽出、ソックスレー抽出、限外濾過、透析等をはじめとする従来公知の方法を使用できる。
不純物の混入は発光特性に悪影響を及ぼすため、可能な限り高純度にすることが望ましい。溶解性に優れた材料では、これら精製方法の制約が少なくなり、結果的に発光特性にも好影響を与える。
【0041】
上記製造方法により得られた一般式(II)で表される本発明の発光材料は、例えばジクロロメタン、テトラヒドロフラン、クロロホルム、トルエン、ジクロロベンゼン及びキシレン等の溶剤に溶解する場合、支持体上に塗布することによって薄膜等の構造体を形成することができる。
【0042】
成膜方法の一例を挙げると、スピンコート法、キャスト法、ディップ法、インクジェッ
ト法、ドクターブレード法、スクリーン印刷法、ディスペンス法等が挙げられ、公知の湿
式成膜方法により薄膜を作製することが可能である。
【0043】
また、キャスト法などによっては平板状結晶や厚膜状態の形態をとることも可能である。作製するデバイスに応じて、上記の中から適した製膜方法あるいは溶媒から、適切な組み合わせが選択される。また当然のことながら、真空蒸着法などのドライプロセスによっても成膜は可能である。
これらの薄膜、厚膜、或いは結晶は、発光部材として機能し、本発光材料を用いて多様な発光デバイスを作製することが可能である。
【0044】
また、本発明の有機発光材料の第二の態様は、下記一般式(I)で表されるジチエノベンゾジチオフェン誘導体からなる。
【0045】
【化19】

〔上記式中、X及びYは、外部刺激によりXとYが結合してX−Yとして一般式(I)の化合物から脱離する基を表し、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕
【0046】
X及びYとしては、一方が水素で、他方が水酸基、エーテル構造、エステル構造、チオエステル構造又はチオエステル構造を有する基の組み合わせが挙げられるが、水素とエステル構造又はチオエステル構造を有する基の組合せが好ましい。中でもカルボン酸エステルと水素、炭酸エステルと水素、キサントゲン酸エステルと水素の組合せが好ましく、特に次の一般式(III)〜(IX)のいずれかと水素の組合せが好ましい。
【0047】
【化20】

【0048】
【化21】

【0049】
【化22】

【0050】
【化23】

【0051】
【化24】

【0052】
【化25】

【0053】
【化26】

上記式中、R11は置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表す。
上記一般式(I)〜(IX)中の、R1〜R11における置換若しくは無置換のアルキル基、置換若しくは無置換のアリール基は前述と同様である。
【0054】
一般式(I)で表されるジチエノベンゾジチオフェン誘導体の合成方法は特に限定されず、公知の種々の方法を採用することができる。手順としては、ジチエノベンゾジチオフェン骨格を構築した後、X及びYで表される脱離ユニットを導入すればよい。
例えば、一般式(I)において、Xがエステル構造を有する基でYが水素の場合、ジチエノベンゾジチオフェン骨格を構築した後、カルボニル化合物へ誘導し、さらにグリニヤール試薬をはじめとする求核試薬との反応によりアルコール体とし、このアルコール体を酸塩化物や酸無水物等と反応させれば、目的とするカルボン酸エステルが得られる。
【0055】
【化27】

【0056】
また、上記アルコール体を、塩基を用いて二硫化炭素と反応させた後、ハロゲン化アルキル等のアルキル化試薬と反応させれば、目的とするキサントゲン酸エステル体を得ることができる。
【0057】
【化28】

【0058】
また、上記アルコール体を、クロロギ酸エステルで処理することにより、炭酸エステル体を得ることができる。
【0059】
【化29】

【0060】
なお、上記カルボニル化合物は、前述のようにVilsmeier反応、アリールリチウム化合物と、DMF、N−ホルミルモルホリン、N−ホルミルピペリジン、各種酸塩化物、各種酸無水物等をはじめとするホルミル化又はアシル化試薬との反応、Gatterman反応、Friedel−Crafts反応により容易に合成することができる。
【0061】
上記のようにして得られた有機発光材料は、反応に使用した触媒、無機塩、未反応原料、副生成物等の不純物を除去して使用される。精製操作は再結晶、各種クロマトグラフィー法、昇華精製、再沈澱、抽出、ソックスレー抽出、限外濾過、透析等をはじめとする従来公知の方法を使用できる。不純物の混入は発光特性に悪影響を及ぼすため、可能な限り高純度にすることが望ましい。溶解性に優れた材料では、これら精製方法の制約が少なくなり、結果的に発光特性にも好影響を与える。
【0062】
前記一般式(II)において、R1及びR2にアリール基を有する場合、溶媒に対する溶解性は極度に低下し、湿式製膜法の適用は困難になる。このような場合、本発明の一般式(I)に示す有機発光材料を用いることができる。
一般式(I)で表されるジチエノベンゾジチオフェン誘導体は、次の式で示すように、外部刺激によりXとYが結合してX−Yとして脱離する結果、新たにアルケン部位が生成し、一般式(II)で表されるジチエノベンゾジチオフェン誘導体へと変換する。
【0063】
【化30】

【0064】
この時、X−Yの組合せが、水素とカルボン酸エステルの場合にはカルボン酸分子が、水素とアルコキシ基の場合にはアルコールが脱離し、X−Yの組合せが水素とキサントゲン酸エステルの場合には、キサントゲン酸部位が脱離した後、さらに分解して、硫化カルボニルとチオール化合物として除去される。X−Yの組合せが水素と炭酸エステルの場合には、炭酸のハーフエステルが脱離し、さらに二酸化炭素とアルコールに分解すると考えられる。
【0065】
脱離成分X−Yとしては、例えば、ギ酸、酢酸、ピルビン酸、プロピオン酸、酪酸、吉草酸、イソ吉草酸、ピバル酸、カプロン酸、ラウリン酸、ステアリン酸、モノクロロ酢酸、モノフルオロ酢酸、ジフルオロ酢酸、2,2−ジフルオロプロピオン酸、トリフルオロ酢酸、3,3,3−トリフルオロプロピオン酸、ペンタフルオロプロピオン酸、シクロプロパンカルボン酸、シクロブタンカルボン酸、シクロヘキサンカルボン酸、安息香酸、p−メトキシ安息香酸、ペンタフルオロ安息香酸、メチルハイドロゲンカーボネート、エチルハイドロゲンカーボネート、イソプロピルハイドロゲンカーボネート、ヘキシルハイドロゲンカーボネート、メタノール、エタノール、プロパノール、ブタノール、ペンタノール、ヘキサノール、ヘプタノール、オクタノール、ノナノール、デカノール、アセト酢酸、3−オキソペンタン酸、3−オキソヘキサン酸、3−オキソヘプタン酸、3−オキソオクタン酸、3−オキソノナン酸、3−オキソデカン酸、4,4−ジメチル−3−オキソペンタン酸、4−メチル−3−オキソペンタン酸、マロン酸メチル、マロン酸エチル、マロン酸プロピル、マロン酸ブチル、マロン酸ペンチル、マロン酸ヘキシル、マロン酸ヘプチル、マロン酸オクチル、マロン酸ノニル、マロン酸デシル、などが一例として挙げられる。
【0066】
上記X−Yの脱離により生成する、一般式(II)で表されるジチエノベンゾジチオフェン誘導体では、脱離前の一般式(I)で表される構造と比べて、共役系が拡大すると共に平面性が得られるため吸収波長が長波長化する。
すなわち、R1及びR2に適宜適したアリール基を導入し、かつアリール基上の置換基を適宜選択することにより、発光波長の調整を容易に行う事が可能であり、このような観点からは、R1及びR2にアリール基を導入することが好ましい。
【0067】
同時にX−Yの脱離前後では溶剤に対する溶解性が劇的に変化する。一般式(I)ではジチエノベンゾジチオフェンユニットの側鎖(R1、R3、R5、X、Y及び、R2、R4、R6、X、Yを含む部位)が分子に良好な溶解性を付与するのに対し、一般式(II)ではそのような効果がなくなり、劇的に溶解性が低下する。
【0068】
上記X−Yの脱離反応を行うための外部刺激としては、熱、光、電磁波等のエネルギーを印加すればよい。反応性及び収率、後処理の観点から、熱エネルギー又は光エネルギーが望ましく、特に熱エネルギーが好ましい。反応の触媒として、酸や塩基等を共存させることも効果的である。
加熱には、ホットプレート上で加熱する方法、オーブン内で加熱する方法、マイクロ波照射による方法、レーザーを用い光を熱に変換して加熱する方法、ホットスタンピング、ヒートローラー等の種々の方法を用いることができるが、特に限定されるものではない。
脱離反応を行うための加熱温度は、室温〜400℃の範囲とすることが可能であるが、50〜300℃の範囲が好ましく、特に100〜280℃の範囲が好ましい。温度が低すぎると十分な変換が行われず所望の特性が得られないし、逆に高すぎると、本発明に係る有機発光材料自体、あるいはデバイスを構成する基板や電極などのその他の部材に熱的なダメージを生じる可能性がある。
加熱時間は、脱離反応の反応性、支持体などのその他の部材の熱伝導性、あるいはデバイス構成によっても異なる。時間が短い程、製造工程のスループットは上がるが、十分な変換が行われず所望の特性が得られない恐れがあり、適宜最適な時間を選択すればよい。
【0069】
本発明の一般式(I)に示される有機発光材料前駆体は、ジクロロメタン、テトラヒドロフラン、クロロホルム、トルエン、メシチレン、安息香酸エチル、ジクロロベンゼン及びキシレン等をはじめとする汎用溶剤への溶解性が高いため、これらの溶剤に溶解させてインク化することができる。さらに該インクを支持体上に付着させた後、溶剤を揮発させることによって薄膜をはじめとする構造体を形成することができる。
【0070】
支持体への付着方法としては、例えばスピンコート法、キャスト法、ディップ法、インクジェット法、ドクターブレード法、スクリーン印刷法、ディスペンス法等の公知の印刷手法が挙げられる。また、これらの手法により、パターニングされた膜や大面積の膜を作製することができ、さらにインク濃度や付着量を変えることにより、膜厚を適宜調整することができる。作製するデバイスに応じて、最適な印刷方法と溶媒の組み合わせを選択すればよい。
【0071】
このようにして得られた本発明の一般式(I)で表される有機発光材料を利用した部材を、加熱処理をはじめとする外部刺激により、一般式(II)で表される有機発光材料へと変換し発光デバイスに用いる事ができる。局所的にエネルギー印加を行って部分的に一般式(I)から一般式(II)へ変換することにより、発光特性の異なる領域のパターニングを行うことも可能である。
さらに、溶解性の高い本発明の一般式(I)で表される有機発光材料が、溶解性の低い一般式(II)で表される有機発光材料へ変換できることは、デバイス作製工程上、非常に有利となる。一般式(II)で表される有機発光材料に変換した後は、さらにその上に絶縁材料、電荷輸送材料、および電極材料等を、ウェットプロセスを用いて構成することが容易になり、後工程によるプロセスダメージを抑えることが可能となる。
これらの薄膜、厚膜、結晶、あるいは高分子分散体等の構造体を用いて多様な有機発光デバイスを作製することが可能である。
【実施例】
【0072】
以下、実施例を挙げて本発明を更に具体的に説明するが、本発明はこれらの実施例によって制限されるものではない。各例中、「部」、「%」は別段の断りない場合、「質量部」、「質量%」を表わす。
【0073】
[実施例1;有機発光材料(実−1)の合成]
下記合成経路により、(実−1)を合成した。
【0074】
【化31】

【0075】
100mLフラスコに、Advanced Materials,2009 21213−216.記載の方法で合成したジチエノベンゾジチオフェンを0.500g(1.653mmol)入れ、アルゴン置換した後、THF30mLを加えた。次いで、−20℃に冷却し、n−BuLiのヘキサン溶液(4.133mmol)を滴下し1時間撹拌した。さらに、−78℃に冷却し、DMF2.5mLを加えて30分撹拌した後、希塩酸を加え、室温に戻した。析出した固体を濾取し、水、メタノール、酢酸エチルで洗浄した。減圧下乾燥し、化合物1を0.392g得た(収率66%)。
次に、25mLフラスコに、上記化合物1を0.100g(0.279mmol)入れ、アルゴン置換した後、THFを2mL加えて0℃に冷却した。この溶液に、ベンジルマグネシウムクロライドの2.0mol/LのTHF溶液を0.56mL(1.116mmol)滴下した後、室温に戻して4時間攪拌した。
次いで、飽和塩化ナトリウム水溶液を加えた後、THFを加え、有機層を飽和食塩水で洗浄した。次いで、溶媒を減圧留去した後、化合物2を含む残渣を、そのまま次の反応に用いた。
100mLフラスコに、上記残渣、及び、N,N−ジメチルアミノピリジン3.4mg(0.028mmol)を入れ、アルゴン置換した後、ピリジン2mL及び塩化ピバロイル0.136mL(1.116mmol)を加え、室温で2日間撹拌した。
次いでTHFを加えた後、この溶液を、飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液の順に用いて洗浄した。次いで溶媒を減圧留去した後、残渣をカラムクロマトグラフィーにより精製し、目的の(実−1)を、無色の結晶として0.174g得た。
得られた(実−1)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。(実−1)の同定データを次に示す。
1H−NMR(CDCl3,TMS)δ/ppm:1.14(18H,s),3.25〜3.38(4H,m),6.26〜6.31(2H,m),7.17(2H,s),7.2〜7.3(10H,m),8.23(2H,s).
IR(KBr)ν/cm−1:1717(νC=O)
【0076】
(実−1)の熱分析
(実−1)のTG−DTA測定(SII社製:TG/DTA200)を行った。結果を図1に示す。5℃/minの速度で昇温したところ、240〜260℃で、ピバル酸の2分子に相当する重量減少(理論減少量28.7%、実測減少量29.7%)が観測された。また、さらに昇温すると362℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、下記化合物(実−1−2)の融点に一致した。
【0077】
【化32】

【0078】
[実施例2;有機発光材料前駆体(実−2)の合成]
【0079】
【化33】

【0080】
100mLフラスコに、実施例1に記載の化合物2(2.790mmol)、及び、N,N−ジメチルアミノピリジン34mg(0.279mmol)を入れ、アルゴン置換した後、ピリジン20mL及び塩化ヘキサノイル1.56mL(11.16mmol)を加えて、室温で一晩撹拌した。次いでトルエンを加え、飽和塩化ナトリウム水溶液で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、残渣をリサイクル分取GPC(日本分析工業社製)により精製し、目的の(実−2)を、無色の結晶として0.44g得た。得られた(実−2)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0081】
(実−2)の熱分析
(実−2)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、150〜240℃で、ヘキサン酸の2分子に相当する重量減少(理論減少量31.5%、実測減少量31.4%)が観測された。また、さらに昇温すると362℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
【0082】
〔実施例3;有機発光材料前駆体(実−3)の合成〕
【0083】
【化34】

【0084】
50mLフラスコに、2−メチル−6−ニトロ無水安息香酸を1.1g(3.30mmol)、N,N−ジメチルアミノピリジンを67mg(0.55mmol)入れ、アルゴンガスで置換した後、トリエチルアミンを0.84mL(6.05mmol)、THFを15mL、3,3,3−トリフルオロプロピオン酸を0.291mL(3.3mmol)加えて、室温で30分間攪拌した。次いで、THF20mLに実施例1に記載の化合物2を600mg(1.1mmol)溶解させた溶液を加えて、室温でさらに24時間攪拌した。次いで反応溶液に飽和塩化アンモニウム水溶液を加え酢酸エチルで4回抽出を行った。
4回の抽出液を併せて、飽和炭酸水素ナトリウム水溶液(50mL)で2回、飽和食塩水(50mL)で2回洗浄し、硫酸ナトリウムで乾燥した。次いで溶媒を減圧留去し、粗生成物として褐色のオイル(収量1.2g)を得た。
これをカラム精製〔固定相:塩基性アルミナ(活性度II)、溶離液:トルエン〕し、黄色の固体(収量350mg)を得た。続いて、リサイクル分取HPLC(日本分析工業社製LC−9104、溶離液:THF)で精製し、黄色の結晶(100mg)を得た。
最後に、この結晶をTHF/MeOHから再結晶することにより、淡黄色の結晶として、目的物である(実−3)を収量60mgで得た。
この結晶の純度をLC/MS(ピーク面積法)により測定したところ、99.9モル%以上であることが確認された。
(実−3)の同定データを次に示す。
1H−NMR(500MHz,CDCl3,TMS)δ/ppm:3.16(q,4H,J=10.3Hz),3.31(dd,2H,J1=7.5Hz,J2=6.3Hz),3.40(dd,2H,J1=6.3Hz,J2=8.0Hz),6.38(t,2H,J=7.5Hz),5.93(t,1H,J=5.2Hz),7.21〜7.25(8H),7.28〜7.31(4H),8.25(s,2H)
【0085】
(実−3)の熱分析
(実−3)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、150〜200℃で、トリフルオロプロピオン酸の2分子に相当する重量減少(理論減少量33.6%、実測減少量32.6%)が観測された。また、さらに昇温すると361℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
【0086】
[実施例4;有機発光材料前駆体(実−4)の合成]
【0087】
【化35】

【0088】
ベンジルマグネシウムクロライドの代りに4−メチルベンジルマグネシウムクロライドを用いた点以外は、実施例1と同様の方法により、化合物3を得た。
次いで、実施例2に記載の化合物2の代わりに、化合物3を用いた点以外は実施例2と同様の方法により、化合物(実−4)を合成した。
【0089】
(実−4)の熱分析
(実−4)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、190〜250℃で、ヘキサン酸2分子に相当する重量減少(理論減少量29.5%、実測減少量30.0%)が観測された。また、さらに昇温すると369℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、下記化合物(実−4−2)の融点に一致した。
【0090】
【化36】

実施例4で得た化合物(実−4)の1wt%クロロホルム溶液をスピンコートし(実−4)を石英基板上に成膜した。このサンプルを230℃、2時間加熱する事により(実−4)の膜を(実−4−2)の膜に変換した。加熱処理後に吸収スペクトルおよび蛍光スペクトルを測定した結果を、図3に示す。加熱処理後の(実−4−2)からは強い発光が観測された。
【0091】
[実施例5;有機発光材料前駆体(実−5)の合成]
【0092】
【化37】

【0093】
実施例2に記載の化合物2の代わりに実施例4に記載の化合物3を用い、塩化ヘキサノイルの代わりにアセチルクロライドを用いた点以外は、実施例2と同様の方法により化合物(実−5)を合成した。
【0094】
(実−5)の熱分析
(実−5)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、200〜230℃で、酢酸2分子に相当する重量減少(理論減少量18.3%、実測減少量17.9%)が観測された。また、さらに昇温すると369℃に吸熱ピークが観測され、前記化合物(実−4−2)に変換されることが確認された。
【0095】
[実施例6;有機発光材料前駆体(実−6)の合成]
【0096】
【化38】

【0097】
25mLフラスコに、マグネシウムを0.855g(35.16mmol)入れ、系内をアルゴン置換し、ジエチルエーテルを2.5mL加えた。次いでヨウ素一粒及び1,2−ジブロモエタン3滴を加えた後、室温で30分撹拌した。この溶液に、4−ヘキシルベンジルクロライド2.470g(11.72mmol)のジエチルエーテル溶液11mLを5時間かけて滴下し、滴下終了後、さらに1時間撹拌した。この溶液をアルゴン置換した200mLフラスコに移し、THF13mL及び塩化亜鉛57mgを加えて1時間撹拌した。この溶液に実施例1に記載の化合物1を0.500g(1.395mmol)加えて、室温で3日間撹拌した。反応溶液を0℃の希塩酸に滴下した後、析出した固体を、水、エタノール、ヘキサンの順に用いて洗浄した。次いで真空乾燥し、ジオール0.820gを得た(収率83%)。
【0098】
続いて、50mLフラスコに、上記ジオールを0.820g入れ、系内をアルゴン置換した。THFを10mL、ピリジンを0.75mL、N,N−ジメチルアミノピリジンを17mg及び無水酢酸を0.44mL加えて、室温で一晩撹拌した。次いでジクロロメタンを加え、溶液を水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を留去した後、リサイクル分取GPCで精製し、目的の(実−6)を無色の結晶として得た。
【0099】
(実−6)の熱分析
(実−6)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、110〜200℃で、酢酸2分子に相当する重量減少(理論減少量15.1%、実測減少量15.1%)が観測された。また、さらに昇温すると272℃及び295℃に相転移及び融点に帰属される吸熱ピークが観測され、下記化合物(実−6−2)に変換されていることが確認された。
【0100】
【化39】

【0101】
〔実施例7〕
実施例6の第一段階の反応で得られたジオールを(実−7)とする。
【0102】
【化40】

【0103】
(実−7)の熱分析
実施例6の第一段階の反応で得られたジオールのTG−DTA測定(SII社製:TG/DTA200)を行った。5℃/minの速度で昇温したところ、200〜270℃で、水2分子に相当する重量減少(理論減少量5.1%、実測減少量4.0%)が観測された。
また、さらに昇温すると272℃及び295℃に吸熱ピークが観測され、前記化合物(実−6−2)に変換されていることが確認された。
【0104】
〔実施例8〕
実施例2で得た化合物(実−2)の1wt%クロロホルム溶液をスピンコートし(実−2)を石英基板上に成膜した。このサンプルを230℃、2時間加熱する事により(実−2)の膜を(実−1−2)の膜に変換した。加熱処理前後で吸収スペクトルおよび蛍光スペクトルを測定した結果を、図4および図5に示す。加熱処理前の(実−2)からは青色の発光が、また加熱処理後の(実−1−2)からは黄緑色の発光が観測された。このときの発光の量子収率は32%および9%であった。
【0105】
〔実施例9:有機発光材料(実−9)の合成〕

1000mlフラスコに、実施例1記載の化合物1を0.700g(1.953mmol)、上記ホスホネート1.902g(6.836mmol)を入れ、アルゴン置換してDMF500mlを加えた。この溶液にt−BuOKのTHF溶液(1mol/L)6.9mLをゆっくりと加え、70℃で3.5時間撹拌した。室温に戻した後、DMFを減圧留去し、残渣を水、メタノール、ヘキサン、酢酸エチルの順に洗浄した。得られた固体を減圧下乾燥し、化合物(実−9)を0.944g得た。収率80%。さらに1E−5 Torrの減圧下で昇華精製を行った。融点386℃。熱分解温度449℃。IR(KBr):945cm−1(−CH=CH− trans)。イオン化ポテンシャル:5.3eV。有機発光材料(実−9)は強い蛍光発光が観測された。有機発光材料(実−9)の吸収スペクトル及び発光スペクトルを図6に示す。
【0106】
〔実施例10:有機発光材料(実−10)の合成〕

上記トリフルオロメチル置換ベンジルホスホネートを用いた以外は実施例9と同様の方法により、有機発光材料(実−10)を合成した。収率88%。さらに1E−5 Torrの減圧下で昇華精製を行った。淡黄色結晶。融点:370℃。熱分解温度:386℃。イオン化ポテンシャル:6.1eV。有機発光材料(実−10)は強い黄色の蛍光発光が観測された。有機発光材料(実−10)の吸収スペクトル及び発光スペクトルを図7に示す。
【0107】
〔実施例11;有機発光材料前駆体(実−11)の合成〕
【0108】
【化41】

【0109】
塩化ヘキサノイルの代りにクロロギ酸アミルを用いた点以外は、実施例2と同様の方法により、化合物(実−11)を合成した。得られた(実−11)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0110】
(実−11)の熱分析
(実−11)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、150〜190℃で炭酸エステル部位の脱離に由来する重量減少(ペンタノールと二酸化炭素のそれぞれ2分子に相当する減少、理論減少量34.3%、実測減少量33.3%)が観測された。また、さらに昇温すると360.3℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
また、実施例8同様に(実−11)を石英基板に成膜し、加熱処理前後の発光スペクトルを測定した所、実施例8と同様の発光スペクトルが観測された。
【0111】
〔実施例12:有機発光材料前駆体(実−12)の合成〕
【0112】
【化42】

【0113】
100mLフラスコに、化合物2を0.500g入れ、系内をアルゴン置換した。次いで、DMF20mL、THF20mLを加え、0℃に冷却した。次いで、水素化ナトリウム(55%パラフィン分散)N,N−ジメチルアミノピリジンを17mg及び無水酢酸を0.44mL加えて、室温0.23gを少しずつ加えた後、室温で0.5時間撹拌した。
この溶液にヨードメタン0.32mLを滴下した後、さらに室温で5時間撹拌した。次いで反応溶液に水を加えた後、トルエンで抽出した。抽出溶液を無水硫酸ナトリウムで乾燥した後、溶媒を減圧留去し、リサイクル分取GPCで精製して目的の(実−12)を無色の結晶として得た。得られた(実−12)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に溶解した。
【0114】
(実−12)の熱分析
(実−12)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、170〜320℃で、メタノール2分子に相当する重量減少(理論減少量11.2%、実測減少量13.9%)が観測された。また、さらに昇温すると362℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
【0115】
〔実施例13;有機発光材料前駆体(実−13)の合成〕
【0116】
【化43】

【0117】
塩化ヘキサノイルの代りにエチルマロニルクロリドを用いた点以外は、実施例2と同様の方法により、化合物(実−13)を合成した。得られた(実−13)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0118】
(実−13)の熱分析
(実−13)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、100〜160℃でエステル部位の脱離に由来する重量減少(酢酸エチルと二酸化炭素のそれぞれ2分子に相当する減少、理論減少量34.3%、実測減少量35.5%)が観測された。またさらに昇温すると362℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
また、実施例8同様に(実−13)を石英基板に成膜し、加熱処理前後の発光スペクトルを測定した所、実施例8と同様の発光スペクトルが観測された。
【0119】
〔実施例14;有機発光材料前駆体(実−14)の合成〕
【0120】
【化44】

【0121】
塩化ヘキサノイルの代りにクロロアセチルクロリドを用いた点以外は、実施例2と同様の方法により、化合物(実−14)を合成した。得られた(実−14)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
(実−14)の同定データを次に示す。
1H−NMR(500MHz,CDCl3,TMS)δ/ppm:3.30−3.34(m,2H,),3.40−3.44(m,2H,),4.03(s,4H,),6.37(t,2H,J=7.4Hz),7.22−7.31(m,12H),8.25(s,2H)
【0122】
(実−14)の熱分析
(実−14)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、140〜192℃でエステル部位の脱離に由来する重量減少(理論減少量27.2%、実測減少量26.6%)が観測された。また、さらに昇温すると363.1℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
また、実施例8同様に(実−14)を石英基板に成膜し、加熱処理前後の発光スペクトルを測定した所、実施例8と同様の発光スペクトルが観測された。
【0123】
〔実施例15;有機発光材料前駆体(実−15)の合成〕
【0124】
【化45】

【0125】
50mLフラスコにジクロロメタン10mL、トリエチルアミン0.35mL、N,N−ジメチルアミノピリジン45mg(0.37mmol)、2−メチル−6−ニトロベンゾイックアンハイドライド、及び4,4,4−トリフルオロブタン酸を入れ、20分間撹拌した。この溶液に実施例1に記載の化合物2(0.37mmol)、及びTHF13mLを加えて20時間撹拌した。次いで、飽和塩化ナトリウム水溶液を加えた後、酢酸エチルで抽出した。次いで抽出溶液を飽和塩化ナトリウム水溶液で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、残渣をリサイクル分取GPC(日本分析工業社製)により精製して、目的の(実−15)を、無色の固体として0.22g得た。得られた(実−15)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0126】
(実−15)の熱分析
(実−15)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、150〜200℃でエステル部位の脱離に由来する重量減少(理論減少量35.9%、実測減少量34.3%)が観測された。また、さらに昇温すると363.0℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
また、実施例8同様に(実−11)を石英基板に成膜し、加熱処理前後の発光スペクトルを測定した所、実施例8と同様の発光スペクトルが観測された。
【0127】
〔実施例16;有機発光材料前駆体(実−16)の合成〕
【0128】
【化46】

【0129】
化合物2の代りに前記化合物(実−7)を用い、4,4,4−トリフルオロブタン酸の代りに2−オキソプロピオン酸を用いた点以外は、実施例15と同様の方法により、化合物(実−16)を合成した。得られた(実−16)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0130】
(実−16)の熱分析
(実−16)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、100〜200℃でエステル部位の脱離に由来する重量減少(理論減少量20.7%、実測減少量21.1%)が観測された。また、さらに昇温すると273℃、300℃に吸熱ピークが観測され、前記化合物(実−6−2)に変換されている事が確認された。
【0131】
〔実施例17;有機発光材料前駆体(実−17)の合成〕
【0132】
【化47】

【0133】
4−ヘキシルベンジルクロライドの代りに4−クロロメチル−4’−メチルビフェニルを用いた点以外は、実施例6と同様の方法によりジオール(実−17)を合成した(収率74%)。得られた(実−17)は、THF、トルエン、等の溶媒に溶解した。
【0134】
(実−17)の熱分析
(実−17)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、200〜300℃で水2分子に相当する重量減少(理論減少量5.0%、実測減少量4.0%)が観測された。また、さらに昇温すると428℃に吸熱ピークが観測され、下記化合物(実−17−2)に変換されていることが確認された。
【0135】
【化48】

【0136】
〔実施例18;有機発光材料前駆体(実−18)の合成〕
【0137】
【化49】

【0138】
化合物2の代りに化合物(実−17)を用いた点以外は、実施例2と同様の方法により化合物(実−18)を無色の固体として得た(収率54%)。得られた(実−18)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0139】
(実−18)の熱分析
(実−18)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、195〜270℃でエステル部位の脱離に由来する重量減少(理論減少量25.3%、実測減少量24.2%)が観測された。また、さらに昇温すると、428℃に吸熱ピークが観測され、前記化合物(実−17−2)に変換されていることが確認された。
【0140】
〔比較例1〕
実施例1に記載の化合物(実−1−2)を、THF、クロロホルム、トルエン、キシレン、メシチレン、ジエチルエーテル、ジクロロメタン、エタノールに加えて溶解性試験を行ったところ、何れの溶媒においても不溶であり、各種印刷法により成膜することが出来なかった。
【先行技術文献】
【特許文献】
【0141】
【特許文献1】特開平5−5568号公報
【特許文献2】特開2008−56797号公報
【特許文献3】特開2008−303365号公報
【特許文献4】特開2010−229215号公報
【特許文献5】特開2009−4351号公報
【非特許文献】
【0142】
【非特許文献1】Advanced Materials 2009,21,213−216.
【技術分野】
【0001】
本発明は、ジチエノベンゾジチオフェン誘導体からなる新規な有機発光材料、有機発光材料前駆体インクを用いて作製された有機発光部材、有機発光デバイスに関する。
【背景技術】
【0002】
有機発光(蛍光)材料は、金属イオン、特定分子、特定のタンパク質、DNA、細胞、細菌などを特異的に高感度で検出可能であることから、センシング関連分野への利用が検討されている。
また、エレクトロニクス分野においては、色素レーザーや、あるいは電極から発光材料量への電荷の注入による、電流励起による発光を利用した有機エレクトロルミネッセンス素子への利用が検討されている。有機エレクトロルミネッセンス素子に代表されるような、有機エレクトロニクスデバイス分野においては、各種材料をインク化し、印刷法、スピンコート法等のウェットプロセスによる簡便な方法でデバイスを製造できる可能性があり、従来の無機材料を利用したエレクトロニクスデバイスと比べ、製造プロセス温度の低温化と低コスト化が実現できるという利点がある。これにより、一般に耐熱性の低いプラスチック基板上への形成が可能となり、ディスプレイ等のエレクトロニクスデバイスの軽量化や低価格化が実現できるとともに、プラスチック基板のフレキシビリティーを活かした新規な用途など、多様な展開が期待できる。
【0003】
これら有機発光材料は、濃度消光と呼ばれる高濃度条件での大幅な発光強度の低下が知られており、これは隣接分子間におけるエネルギー移動や発光材料が発した蛍光を再び発光材料が吸収してしまうためである。従って、一般的には、発光材料を溶媒や樹脂中に希薄状態に分散あるいは溶解した状態で使用されるが、特に有機エレクトロルミネッセンス素子等の固体素子では、極限濃度である固体状態で使用する必要があるため、固体状態でも発光材料の蛍光強度を高める材料開発が行われている。さらにこのような素子では、素子の寿命を高めるために、材料の耐熱性の向上に関しても精力的に検討されている。
【0004】
これまでに、ペンタセンやテトラセンに代表されるアセン系の有機半導体材料が数多く報告されている(例えば特許文献1の特開平5−5568号公報参照)。このアセン系材料を有機半導体層として利用した有機薄膜トランジスタは、高い電界効果移動度を示すことが知られているが、汎用溶媒に対し極めて溶解性が低いため、薄膜化する際には真空成膜を用いる必要がある。ゆえに、これらアセン系材料は、前述したような塗布法や印刷法などの簡便なプロセスで薄膜を形成できるという有機半導体材料への期待に応えるものではない。
非特許文献1のAdvanced Materials 2009,21,213−216.に記載されているジチエノベンゾジチオフェン誘導体のように、結晶内で分子がπスタックした構造を有する場合、結晶形は針状となりやすく、連続した薄膜状態に製膜できなかったり、単一の結晶中でも電荷輸送特性の異方性が大きくなったり、素子毎の特性のばらつきが大きくなってしまい、実用には適さない。特に結晶の形状を含めた結晶構造は分子構造から予測することは困難であり、現在も更なる材料開発が望まれている。
また、例えば特許文献2の特開2008−56797号公報には、図2(A)の構造を有するポリイミド材料は、高機械的耐久性及び耐熱性のよい蛍光材料であることが記載され、特許文献3の特開2008−303365号公報には、同図(B)の構造を有する蛍光材料は、アモルファス性が高く製膜製に優れたものであることが記載され、特許文献4の特開2010−229215号公報には、同図(C)の構造を有する蛍光材料は溶剤可溶性がある天然物由来のものであることが記載され、特許文献5の特開2009−4351号公報には、同図(D)、(E)又は(F)の構造を有する蛍光材料は青色発光を呈する有機蛍光材料であることが開示されている。
しかし、これらによっても、まだ、蛍光性、耐熱性、印刷等の簡便なプロセスで成膜できる溶解性が充分なものではない。一般的に、嵩高な構造の基を有する化合物は有機溶媒可溶性に優れるがしかし分子同士の凝集性が小さく、また、分子同士の凝集性に優れしたがって高い光電効果を示す化合物は有機溶媒可溶性に劣る傾向があり、両者を同時に満たすのは簡単ではない。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、叙上のような当該分野の現状に鑑み、結晶等の高濃度状態でも蛍光性を有するとともに、高い耐熱性を備えた有機発光材料、および、印刷等の簡便なプロセスで成膜できる溶解性を有し、成膜後は簡単な処理により不溶化し、後工程でのダメージを軽減できると共に、不溶化処理後は良好な発光特性を示す有機発光材料、それらを用いた発光デバイスを提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは鋭意検討した結果、以下の(1)〜(6)の発明により上記課題が解決できることを見出し、本発明を完成するに至った。
(1)下記一般式(I)または(II)で表されるジチエノベンゾジチオフェン誘導体からなることを特徴とする有機発光材料;
【0007】
【化1】

〔上記式中、X及びYは、外部刺激によりXとYが結合してX−Yとして一般式(I)の化合物から脱離する基を表し、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕
【0008】
【化2】

〔上記式中のR1〜R10は前記(I)と同じ基を表す。〕。
【0009】
(2)前記X及びYの一方が水素であり、他方が水酸基、又はエーテル構造、又はエステル構造若しくはチオエステル構造を有する基であることを特徴とする前記(1)項に記載の一般式(I)で表される有機発光材料。
(3)前記一般式(2)のエーテル構造、又はエステル構造若しくはチオエステル構造が、下記一般式(III)〜(IX)のいずれかであることを特徴とする前記(2)項に記載の有機発光材料;
【0010】
【化3】

【0011】
【化4】

【0012】
【化5】

【0013】
【化6】

【0014】
【化7】

【0015】
【化8】

【0016】
【化9】

〔上記式中、R11は置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表す。〕
【0017】
(4)前記(1)項乃至(3)項のいずれかに記載の一般式(I)で表される有機発光材料を含有するインクを用いて、前記一般式(I)で表される化合物からなる構造体を作製した後、エネルギーを付与することにより、前記一般式(II)で表されるジチエノベンゾジチオフェン誘導体に変換する発光波長変換方法。
(5)前記(4)項に記載の方法により製造されたことを特徴とする、一般式(II)からなる発光部材。
(6)一般式(I)または(II)で表される有機発光材料を含有する発光部材を含むことを特徴とする発光デバイス。
【発明の効果】
【0018】
以下の詳細かつ具体的な説明から理解されるように、本発明によれば、結晶等の高濃度状態でも蛍光性を有するとともに、高い耐熱性を備えた有機発光材料、および、印刷等の簡便なプロセスで成膜できる溶解性を有し、成膜後は簡単な処理により不溶化し、後工程でのダメージを軽減できると共に、不溶化処理後は良好な発光特性を示す有機発光材料、それらを用いた発光デバイスが提供されるという極めて優れた効果が発揮される。
【図面の簡単な説明】
【0019】
【図1】本発明の(実−1)の有機発光材料の熱分析、TG−DTA測定結果を示すチャートである。
【図2】従来の有機発光材料例を示す図である。
【図3】本発明の(実−4)の有機発光材料の加熱後の吸収スペクトル,蛍光スペクトル示すチャートである。
【図4】実施例で得た化合物(実−1−2)の加熱処理前の吸収スペクトルチャートである
【図5】実施例で得た化合物(実−1−2)、(実−2)の加熱処理前後の蛍光スペクトル、発光スペクトルチャートである。
【図6】実施例で得た化合物(実−9)の加熱処理後の吸収スペクトルチャートである。
【図7】実施例で得た化合物(実−10)の加熱処理後の吸収スペクトルチャートである
【発明を実施するための形態】
【0020】
以下、上記本発明について詳細に説明する。
本発明の有機発光材料の第一の態様は、下記一般式(II)で表されるジチエノベンゾジチオフェン誘導体からなる。
【0021】
【化10】

〔上記式中、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕
【0022】
R1からR10として示される置換もしくは無置換のアルキル基としては、具体的には、メチル基、エチル基、n−プロピル基、i−プロピル基、t−ブチル基、s−ブチル基、n−ブチル基、i−ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基、ウンデシル基、ドデシル基、9−ヘプタデシル基、3,7−ジメチルオクチル基、2−エチルヘキシル基、トリフルオロメチル基、2−シアノエチル基、ベンジル基、4−クロロベンジル基、4−メチルベンジル基、シクロペンチル基、シクロヘキシル基等を一例として挙げることができ、これらはさらに互いに結合して環を形成しても良い。また、アルコキシ基、アルキルチオ基としては上記アルキル基の結合位に酸素原子または硫黄原子を挿入してアルコキシ基、アルキルチオ基としたものが一例として挙げられる。
【0023】
R1からR10として示される置換もしくは無置換のアリール基として具体的には、フェニル、ナフタレン、ビフェニル、ターフェニル、クォーターフェニル、ピレン、フルオレン、9,9−ジメチルフルオレン、アズレン、アントラセン、トリフェニレン、クリセン、9−ベンジリデンフルオレン、5H−ジベンゾ[a,d]シクロヘプテン、[2,2]−パラシクロファン、トリフェニルアミン、チオフェン、ビチオフェン、ターチオフェン、クォーターチオフェン、チエノチオフェン、ベンゾチオフェン、ジチエニルベンゼン、フラン、ベンゾフラン、カルバゾール、ベンゾジチアゾール、ピリジン、キノリン等が一例として挙げられる。これらはさらに上記の置換もしくは無置換のアルキル基、アルコキシ基、チオアルコキシ基、またはフッ素、塩素、ヨウ素および臭素のハロゲン基を置換基として有していてもよい。
【0024】
次に、一般式(II)で表される本発明の有機発光材料の製造法について説明する。
本発明の有機発光材料を合成する方法は特に限定されず、公知の種々の方法により合成することが可能である。本発明の有機発光材料はジチエノベンゾジチオフェン骨格を構築した後、両端の二重結合部位を導入してもよいし、二重結合部位を導入した後、ジチエノベンゾジチオフェン骨格を構築してもよい。
【0025】
ジチエノベンゾジチオフェン骨格を構築した後、両端の二重結合部位を導入する場合、例えばカルボニル化合物とホスホネートを用いたWittig−Horner反応、カルボニル化合物とホスホニウム塩を用いたWittig反応、ビニル置換体とハロゲン化物を用いたHeck反応、ビニルボロン酸誘導体とハロゲン化物を用いた鈴木−宮浦カップリング反応などを用いることができる。
【0026】
特に、Wittig−Horner反応及びWittig反応は、反応操作の簡便さのために有効である。一例として、Wittig−Horner反応を用いた本発明の有機発光材料の製造方法について説明する。
本発明の有機発光材料は、下の反応式(I)に示すように、ホスホン酸エステル化合物及びカルボニル化合物が存在する溶液を、塩基と混合させることによって得られる。
【0027】
【化11】

【0028】
上記カルボニル化合物は、公知の種々の反応により合成することが可能である。
例として下記Vilsmeier反応;
【0029】
【化12】

【0030】
アリールリチウム化合物と、DMF、N−ホルミルモルホリン、N−ホルミルピペリジン、各種酸塩化物、各種酸無水物等をはじめとするホルミル化或いはアシル化試薬との下記反応;
【0031】
【化13】

下記Gatterman反応;
【0032】
【化14】

下記ヒドロキシ化合物の各種酸化反応;
【0033】
【化15】

及び、下記Friedel−Crafts反応
【0034】
【化16】

【0035】
等を一例として挙げることができ、これら反応を用いて所望のカルボニル化合物を合成することができる。
また、上記ホスホン酸エステル化合物についても、公知の種々の反応により合成することが可能であるが、下記Michaelis−Arbuzov反応が特に容易である。
【0036】
【化17】

【0037】
上記反応に使用する塩基はホスホネートカルボアニオンが形成されるものであれば特に限定されず、金属アルコシド、金属ヒドリド、有機リチウム化合物等が挙げられ、例えばカリウムt−ブトキシド、ナトリウムt−ブトキシド、リチウムt−ブトキシド、カリウム2−メチル−2−ブトキシド、ナトリウム2−メチル−2−ブトキシド、ナトリウムメトキシド、ナトリウムエトキシド、カリウムエトキシド、カリウムメトキシド、水素化ナトリウム、水素化カリウム、メチルリチウム、エチルリチウム、プロピルリチウム、n−ブチルリチウム、s−ブチルリチウム、t−ブチルリチウム、フェニルリチウム、リチウムナフチリド、リチウムアミド、リチウムジイソプロピルアミド等を挙げることができる。
反応に用いる塩基の量は、通常ホスホン酸エステル化合物に対して当量使用するだけでよいが、さらに過剰量用いても支障ない。
【0038】
また、二重結合部位を導入した後、ジチエノベンゾジチオフェン骨格を構築する場合には、以下のような方法で合成することができる。
【0039】
【化18】

【0040】
上記のようにして得られた有機発光材料は、反応に使用した触媒、無機塩、未反応原料、副生成物等の不純物を除去して使用される。
精製操作は再結晶、各種クロマトグラフィー法、昇華精製、再沈澱、抽出、ソックスレー抽出、限外濾過、透析等をはじめとする従来公知の方法を使用できる。
不純物の混入は発光特性に悪影響を及ぼすため、可能な限り高純度にすることが望ましい。溶解性に優れた材料では、これら精製方法の制約が少なくなり、結果的に発光特性にも好影響を与える。
【0041】
上記製造方法により得られた一般式(II)で表される本発明の発光材料は、例えばジクロロメタン、テトラヒドロフラン、クロロホルム、トルエン、ジクロロベンゼン及びキシレン等の溶剤に溶解する場合、支持体上に塗布することによって薄膜等の構造体を形成することができる。
【0042】
成膜方法の一例を挙げると、スピンコート法、キャスト法、ディップ法、インクジェッ
ト法、ドクターブレード法、スクリーン印刷法、ディスペンス法等が挙げられ、公知の湿
式成膜方法により薄膜を作製することが可能である。
【0043】
また、キャスト法などによっては平板状結晶や厚膜状態の形態をとることも可能である。作製するデバイスに応じて、上記の中から適した製膜方法あるいは溶媒から、適切な組み合わせが選択される。また当然のことながら、真空蒸着法などのドライプロセスによっても成膜は可能である。
これらの薄膜、厚膜、或いは結晶は、発光部材として機能し、本発光材料を用いて多様な発光デバイスを作製することが可能である。
【0044】
また、本発明の有機発光材料の第二の態様は、下記一般式(I)で表されるジチエノベンゾジチオフェン誘導体からなる。
【0045】
【化19】

〔上記式中、X及びYは、外部刺激によりXとYが結合してX−Yとして一般式(I)の化合物から脱離する基を表し、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕
【0046】
X及びYとしては、一方が水素で、他方が水酸基、エーテル構造、エステル構造、チオエステル構造又はチオエステル構造を有する基の組み合わせが挙げられるが、水素とエステル構造又はチオエステル構造を有する基の組合せが好ましい。中でもカルボン酸エステルと水素、炭酸エステルと水素、キサントゲン酸エステルと水素の組合せが好ましく、特に次の一般式(III)〜(IX)のいずれかと水素の組合せが好ましい。
【0047】
【化20】

【0048】
【化21】

【0049】
【化22】

【0050】
【化23】

【0051】
【化24】

【0052】
【化25】

【0053】
【化26】

上記式中、R11は置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表す。
上記一般式(I)〜(IX)中の、R1〜R11における置換若しくは無置換のアルキル基、置換若しくは無置換のアリール基は前述と同様である。
【0054】
一般式(I)で表されるジチエノベンゾジチオフェン誘導体の合成方法は特に限定されず、公知の種々の方法を採用することができる。手順としては、ジチエノベンゾジチオフェン骨格を構築した後、X及びYで表される脱離ユニットを導入すればよい。
例えば、一般式(I)において、Xがエステル構造を有する基でYが水素の場合、ジチエノベンゾジチオフェン骨格を構築した後、カルボニル化合物へ誘導し、さらにグリニヤール試薬をはじめとする求核試薬との反応によりアルコール体とし、このアルコール体を酸塩化物や酸無水物等と反応させれば、目的とするカルボン酸エステルが得られる。
【0055】
【化27】

【0056】
また、上記アルコール体を、塩基を用いて二硫化炭素と反応させた後、ハロゲン化アルキル等のアルキル化試薬と反応させれば、目的とするキサントゲン酸エステル体を得ることができる。
【0057】
【化28】

【0058】
また、上記アルコール体を、クロロギ酸エステルで処理することにより、炭酸エステル体を得ることができる。
【0059】
【化29】

【0060】
なお、上記カルボニル化合物は、前述のようにVilsmeier反応、アリールリチウム化合物と、DMF、N−ホルミルモルホリン、N−ホルミルピペリジン、各種酸塩化物、各種酸無水物等をはじめとするホルミル化又はアシル化試薬との反応、Gatterman反応、Friedel−Crafts反応により容易に合成することができる。
【0061】
上記のようにして得られた有機発光材料は、反応に使用した触媒、無機塩、未反応原料、副生成物等の不純物を除去して使用される。精製操作は再結晶、各種クロマトグラフィー法、昇華精製、再沈澱、抽出、ソックスレー抽出、限外濾過、透析等をはじめとする従来公知の方法を使用できる。不純物の混入は発光特性に悪影響を及ぼすため、可能な限り高純度にすることが望ましい。溶解性に優れた材料では、これら精製方法の制約が少なくなり、結果的に発光特性にも好影響を与える。
【0062】
前記一般式(II)において、R1及びR2にアリール基を有する場合、溶媒に対する溶解性は極度に低下し、湿式製膜法の適用は困難になる。このような場合、本発明の一般式(I)に示す有機発光材料を用いることができる。
一般式(I)で表されるジチエノベンゾジチオフェン誘導体は、次の式で示すように、外部刺激によりXとYが結合してX−Yとして脱離する結果、新たにアルケン部位が生成し、一般式(II)で表されるジチエノベンゾジチオフェン誘導体へと変換する。
【0063】
【化30】

【0064】
この時、X−Yの組合せが、水素とカルボン酸エステルの場合にはカルボン酸分子が、水素とアルコキシ基の場合にはアルコールが脱離し、X−Yの組合せが水素とキサントゲン酸エステルの場合には、キサントゲン酸部位が脱離した後、さらに分解して、硫化カルボニルとチオール化合物として除去される。X−Yの組合せが水素と炭酸エステルの場合には、炭酸のハーフエステルが脱離し、さらに二酸化炭素とアルコールに分解すると考えられる。
【0065】
脱離成分X−Yとしては、例えば、ギ酸、酢酸、ピルビン酸、プロピオン酸、酪酸、吉草酸、イソ吉草酸、ピバル酸、カプロン酸、ラウリン酸、ステアリン酸、モノクロロ酢酸、モノフルオロ酢酸、ジフルオロ酢酸、2,2−ジフルオロプロピオン酸、トリフルオロ酢酸、3,3,3−トリフルオロプロピオン酸、ペンタフルオロプロピオン酸、シクロプロパンカルボン酸、シクロブタンカルボン酸、シクロヘキサンカルボン酸、安息香酸、p−メトキシ安息香酸、ペンタフルオロ安息香酸、メチルハイドロゲンカーボネート、エチルハイドロゲンカーボネート、イソプロピルハイドロゲンカーボネート、ヘキシルハイドロゲンカーボネート、メタノール、エタノール、プロパノール、ブタノール、ペンタノール、ヘキサノール、ヘプタノール、オクタノール、ノナノール、デカノール、アセト酢酸、3−オキソペンタン酸、3−オキソヘキサン酸、3−オキソヘプタン酸、3−オキソオクタン酸、3−オキソノナン酸、3−オキソデカン酸、4,4−ジメチル−3−オキソペンタン酸、4−メチル−3−オキソペンタン酸、マロン酸メチル、マロン酸エチル、マロン酸プロピル、マロン酸ブチル、マロン酸ペンチル、マロン酸ヘキシル、マロン酸ヘプチル、マロン酸オクチル、マロン酸ノニル、マロン酸デシル、などが一例として挙げられる。
【0066】
上記X−Yの脱離により生成する、一般式(II)で表されるジチエノベンゾジチオフェン誘導体では、脱離前の一般式(I)で表される構造と比べて、共役系が拡大すると共に平面性が得られるため吸収波長が長波長化する。
すなわち、R1及びR2に適宜適したアリール基を導入し、かつアリール基上の置換基を適宜選択することにより、発光波長の調整を容易に行う事が可能であり、このような観点からは、R1及びR2にアリール基を導入することが好ましい。
【0067】
同時にX−Yの脱離前後では溶剤に対する溶解性が劇的に変化する。一般式(I)ではジチエノベンゾジチオフェンユニットの側鎖(R1、R3、R5、X、Y及び、R2、R4、R6、X、Yを含む部位)が分子に良好な溶解性を付与するのに対し、一般式(II)ではそのような効果がなくなり、劇的に溶解性が低下する。
【0068】
上記X−Yの脱離反応を行うための外部刺激としては、熱、光、電磁波等のエネルギーを印加すればよい。反応性及び収率、後処理の観点から、熱エネルギー又は光エネルギーが望ましく、特に熱エネルギーが好ましい。反応の触媒として、酸や塩基等を共存させることも効果的である。
加熱には、ホットプレート上で加熱する方法、オーブン内で加熱する方法、マイクロ波照射による方法、レーザーを用い光を熱に変換して加熱する方法、ホットスタンピング、ヒートローラー等の種々の方法を用いることができるが、特に限定されるものではない。
脱離反応を行うための加熱温度は、室温〜400℃の範囲とすることが可能であるが、50〜300℃の範囲が好ましく、特に100〜280℃の範囲が好ましい。温度が低すぎると十分な変換が行われず所望の特性が得られないし、逆に高すぎると、本発明に係る有機発光材料自体、あるいはデバイスを構成する基板や電極などのその他の部材に熱的なダメージを生じる可能性がある。
加熱時間は、脱離反応の反応性、支持体などのその他の部材の熱伝導性、あるいはデバイス構成によっても異なる。時間が短い程、製造工程のスループットは上がるが、十分な変換が行われず所望の特性が得られない恐れがあり、適宜最適な時間を選択すればよい。
【0069】
本発明の一般式(I)に示される有機発光材料前駆体は、ジクロロメタン、テトラヒドロフラン、クロロホルム、トルエン、メシチレン、安息香酸エチル、ジクロロベンゼン及びキシレン等をはじめとする汎用溶剤への溶解性が高いため、これらの溶剤に溶解させてインク化することができる。さらに該インクを支持体上に付着させた後、溶剤を揮発させることによって薄膜をはじめとする構造体を形成することができる。
【0070】
支持体への付着方法としては、例えばスピンコート法、キャスト法、ディップ法、インクジェット法、ドクターブレード法、スクリーン印刷法、ディスペンス法等の公知の印刷手法が挙げられる。また、これらの手法により、パターニングされた膜や大面積の膜を作製することができ、さらにインク濃度や付着量を変えることにより、膜厚を適宜調整することができる。作製するデバイスに応じて、最適な印刷方法と溶媒の組み合わせを選択すればよい。
【0071】
このようにして得られた本発明の一般式(I)で表される有機発光材料を利用した部材を、加熱処理をはじめとする外部刺激により、一般式(II)で表される有機発光材料へと変換し発光デバイスに用いる事ができる。局所的にエネルギー印加を行って部分的に一般式(I)から一般式(II)へ変換することにより、発光特性の異なる領域のパターニングを行うことも可能である。
さらに、溶解性の高い本発明の一般式(I)で表される有機発光材料が、溶解性の低い一般式(II)で表される有機発光材料へ変換できることは、デバイス作製工程上、非常に有利となる。一般式(II)で表される有機発光材料に変換した後は、さらにその上に絶縁材料、電荷輸送材料、および電極材料等を、ウェットプロセスを用いて構成することが容易になり、後工程によるプロセスダメージを抑えることが可能となる。
これらの薄膜、厚膜、結晶、あるいは高分子分散体等の構造体を用いて多様な有機発光デバイスを作製することが可能である。
【実施例】
【0072】
以下、実施例を挙げて本発明を更に具体的に説明するが、本発明はこれらの実施例によって制限されるものではない。各例中、「部」、「%」は別段の断りない場合、「質量部」、「質量%」を表わす。
【0073】
[実施例1;有機発光材料(実−1)の合成]
下記合成経路により、(実−1)を合成した。
【0074】
【化31】

【0075】
100mLフラスコに、Advanced Materials,2009 21213−216.記載の方法で合成したジチエノベンゾジチオフェンを0.500g(1.653mmol)入れ、アルゴン置換した後、THF30mLを加えた。次いで、−20℃に冷却し、n−BuLiのヘキサン溶液(4.133mmol)を滴下し1時間撹拌した。さらに、−78℃に冷却し、DMF2.5mLを加えて30分撹拌した後、希塩酸を加え、室温に戻した。析出した固体を濾取し、水、メタノール、酢酸エチルで洗浄した。減圧下乾燥し、化合物1を0.392g得た(収率66%)。
次に、25mLフラスコに、上記化合物1を0.100g(0.279mmol)入れ、アルゴン置換した後、THFを2mL加えて0℃に冷却した。この溶液に、ベンジルマグネシウムクロライドの2.0mol/LのTHF溶液を0.56mL(1.116mmol)滴下した後、室温に戻して4時間攪拌した。
次いで、飽和塩化ナトリウム水溶液を加えた後、THFを加え、有機層を飽和食塩水で洗浄した。次いで、溶媒を減圧留去した後、化合物2を含む残渣を、そのまま次の反応に用いた。
100mLフラスコに、上記残渣、及び、N,N−ジメチルアミノピリジン3.4mg(0.028mmol)を入れ、アルゴン置換した後、ピリジン2mL及び塩化ピバロイル0.136mL(1.116mmol)を加え、室温で2日間撹拌した。
次いでTHFを加えた後、この溶液を、飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液の順に用いて洗浄した。次いで溶媒を減圧留去した後、残渣をカラムクロマトグラフィーにより精製し、目的の(実−1)を、無色の結晶として0.174g得た。
得られた(実−1)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。(実−1)の同定データを次に示す。
1H−NMR(CDCl3,TMS)δ/ppm:1.14(18H,s),3.25〜3.38(4H,m),6.26〜6.31(2H,m),7.17(2H,s),7.2〜7.3(10H,m),8.23(2H,s).
IR(KBr)ν/cm−1:1717(νC=O)
【0076】
(実−1)の熱分析
(実−1)のTG−DTA測定(SII社製:TG/DTA200)を行った。結果を図1に示す。5℃/minの速度で昇温したところ、240〜260℃で、ピバル酸の2分子に相当する重量減少(理論減少量28.7%、実測減少量29.7%)が観測された。また、さらに昇温すると362℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、下記化合物(実−1−2)の融点に一致した。
【0077】
【化32】

【0078】
[実施例2;有機発光材料前駆体(実−2)の合成]
【0079】
【化33】

【0080】
100mLフラスコに、実施例1に記載の化合物2(2.790mmol)、及び、N,N−ジメチルアミノピリジン34mg(0.279mmol)を入れ、アルゴン置換した後、ピリジン20mL及び塩化ヘキサノイル1.56mL(11.16mmol)を加えて、室温で一晩撹拌した。次いでトルエンを加え、飽和塩化ナトリウム水溶液で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、残渣をリサイクル分取GPC(日本分析工業社製)により精製し、目的の(実−2)を、無色の結晶として0.44g得た。得られた(実−2)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0081】
(実−2)の熱分析
(実−2)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、150〜240℃で、ヘキサン酸の2分子に相当する重量減少(理論減少量31.5%、実測減少量31.4%)が観測された。また、さらに昇温すると362℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
【0082】
〔実施例3;有機発光材料前駆体(実−3)の合成〕
【0083】
【化34】

【0084】
50mLフラスコに、2−メチル−6−ニトロ無水安息香酸を1.1g(3.30mmol)、N,N−ジメチルアミノピリジンを67mg(0.55mmol)入れ、アルゴンガスで置換した後、トリエチルアミンを0.84mL(6.05mmol)、THFを15mL、3,3,3−トリフルオロプロピオン酸を0.291mL(3.3mmol)加えて、室温で30分間攪拌した。次いで、THF20mLに実施例1に記載の化合物2を600mg(1.1mmol)溶解させた溶液を加えて、室温でさらに24時間攪拌した。次いで反応溶液に飽和塩化アンモニウム水溶液を加え酢酸エチルで4回抽出を行った。
4回の抽出液を併せて、飽和炭酸水素ナトリウム水溶液(50mL)で2回、飽和食塩水(50mL)で2回洗浄し、硫酸ナトリウムで乾燥した。次いで溶媒を減圧留去し、粗生成物として褐色のオイル(収量1.2g)を得た。
これをカラム精製〔固定相:塩基性アルミナ(活性度II)、溶離液:トルエン〕し、黄色の固体(収量350mg)を得た。続いて、リサイクル分取HPLC(日本分析工業社製LC−9104、溶離液:THF)で精製し、黄色の結晶(100mg)を得た。
最後に、この結晶をTHF/MeOHから再結晶することにより、淡黄色の結晶として、目的物である(実−3)を収量60mgで得た。
この結晶の純度をLC/MS(ピーク面積法)により測定したところ、99.9モル%以上であることが確認された。
(実−3)の同定データを次に示す。
1H−NMR(500MHz,CDCl3,TMS)δ/ppm:3.16(q,4H,J=10.3Hz),3.31(dd,2H,J1=7.5Hz,J2=6.3Hz),3.40(dd,2H,J1=6.3Hz,J2=8.0Hz),6.38(t,2H,J=7.5Hz),5.93(t,1H,J=5.2Hz),7.21〜7.25(8H),7.28〜7.31(4H),8.25(s,2H)
【0085】
(実−3)の熱分析
(実−3)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、150〜200℃で、トリフルオロプロピオン酸の2分子に相当する重量減少(理論減少量33.6%、実測減少量32.6%)が観測された。また、さらに昇温すると361℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
【0086】
[実施例4;有機発光材料前駆体(実−4)の合成]
【0087】
【化35】

【0088】
ベンジルマグネシウムクロライドの代りに4−メチルベンジルマグネシウムクロライドを用いた点以外は、実施例1と同様の方法により、化合物3を得た。
次いで、実施例2に記載の化合物2の代わりに、化合物3を用いた点以外は実施例2と同様の方法により、化合物(実−4)を合成した。
【0089】
(実−4)の熱分析
(実−4)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、190〜250℃で、ヘキサン酸2分子に相当する重量減少(理論減少量29.5%、実測減少量30.0%)が観測された。また、さらに昇温すると369℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、下記化合物(実−4−2)の融点に一致した。
【0090】
【化36】

実施例4で得た化合物(実−4)の1wt%クロロホルム溶液をスピンコートし(実−4)を石英基板上に成膜した。このサンプルを230℃、2時間加熱する事により(実−4)の膜を(実−4−2)の膜に変換した。加熱処理後に吸収スペクトルおよび蛍光スペクトルを測定した結果を、図3に示す。加熱処理後の(実−4−2)からは強い発光が観測された。
【0091】
[実施例5;有機発光材料前駆体(実−5)の合成]
【0092】
【化37】

【0093】
実施例2に記載の化合物2の代わりに実施例4に記載の化合物3を用い、塩化ヘキサノイルの代わりにアセチルクロライドを用いた点以外は、実施例2と同様の方法により化合物(実−5)を合成した。
【0094】
(実−5)の熱分析
(実−5)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、200〜230℃で、酢酸2分子に相当する重量減少(理論減少量18.3%、実測減少量17.9%)が観測された。また、さらに昇温すると369℃に吸熱ピークが観測され、前記化合物(実−4−2)に変換されることが確認された。
【0095】
[実施例6;有機発光材料前駆体(実−6)の合成]
【0096】
【化38】

【0097】
25mLフラスコに、マグネシウムを0.855g(35.16mmol)入れ、系内をアルゴン置換し、ジエチルエーテルを2.5mL加えた。次いでヨウ素一粒及び1,2−ジブロモエタン3滴を加えた後、室温で30分撹拌した。この溶液に、4−ヘキシルベンジルクロライド2.470g(11.72mmol)のジエチルエーテル溶液11mLを5時間かけて滴下し、滴下終了後、さらに1時間撹拌した。この溶液をアルゴン置換した200mLフラスコに移し、THF13mL及び塩化亜鉛57mgを加えて1時間撹拌した。この溶液に実施例1に記載の化合物1を0.500g(1.395mmol)加えて、室温で3日間撹拌した。反応溶液を0℃の希塩酸に滴下した後、析出した固体を、水、エタノール、ヘキサンの順に用いて洗浄した。次いで真空乾燥し、ジオール0.820gを得た(収率83%)。
【0098】
続いて、50mLフラスコに、上記ジオールを0.820g入れ、系内をアルゴン置換した。THFを10mL、ピリジンを0.75mL、N,N−ジメチルアミノピリジンを17mg及び無水酢酸を0.44mL加えて、室温で一晩撹拌した。次いでジクロロメタンを加え、溶液を水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を留去した後、リサイクル分取GPCで精製し、目的の(実−6)を無色の結晶として得た。
【0099】
(実−6)の熱分析
(実−6)のTG−DTA測定(SII社製:TG/DTA200)を行った。
5℃/minの速度で昇温したところ、110〜200℃で、酢酸2分子に相当する重量減少(理論減少量15.1%、実測減少量15.1%)が観測された。また、さらに昇温すると272℃及び295℃に相転移及び融点に帰属される吸熱ピークが観測され、下記化合物(実−6−2)に変換されていることが確認された。
【0100】
【化39】

【0101】
〔実施例7〕
実施例6の第一段階の反応で得られたジオールを(実−7)とする。
【0102】
【化40】

【0103】
(実−7)の熱分析
実施例6の第一段階の反応で得られたジオールのTG−DTA測定(SII社製:TG/DTA200)を行った。5℃/minの速度で昇温したところ、200〜270℃で、水2分子に相当する重量減少(理論減少量5.1%、実測減少量4.0%)が観測された。
また、さらに昇温すると272℃及び295℃に吸熱ピークが観測され、前記化合物(実−6−2)に変換されていることが確認された。
【0104】
〔実施例8〕
実施例2で得た化合物(実−2)の1wt%クロロホルム溶液をスピンコートし(実−2)を石英基板上に成膜した。このサンプルを230℃、2時間加熱する事により(実−2)の膜を(実−1−2)の膜に変換した。加熱処理前後で吸収スペクトルおよび蛍光スペクトルを測定した結果を、図4および図5に示す。加熱処理前の(実−2)からは青色の発光が、また加熱処理後の(実−1−2)からは黄緑色の発光が観測された。このときの発光の量子収率は32%および9%であった。
【0105】
〔実施例9:有機発光材料(実−9)の合成〕

1000mlフラスコに、実施例1記載の化合物1を0.700g(1.953mmol)、上記ホスホネート1.902g(6.836mmol)を入れ、アルゴン置換してDMF500mlを加えた。この溶液にt−BuOKのTHF溶液(1mol/L)6.9mLをゆっくりと加え、70℃で3.5時間撹拌した。室温に戻した後、DMFを減圧留去し、残渣を水、メタノール、ヘキサン、酢酸エチルの順に洗浄した。得られた固体を減圧下乾燥し、化合物(実−9)を0.944g得た。収率80%。さらに1E−5 Torrの減圧下で昇華精製を行った。融点386℃。熱分解温度449℃。IR(KBr):945cm−1(−CH=CH− trans)。イオン化ポテンシャル:5.3eV。有機発光材料(実−9)は強い蛍光発光が観測された。有機発光材料(実−9)の吸収スペクトル及び発光スペクトルを図6に示す。
【0106】
〔実施例10:有機発光材料(実−10)の合成〕

上記トリフルオロメチル置換ベンジルホスホネートを用いた以外は実施例9と同様の方法により、有機発光材料(実−10)を合成した。収率88%。さらに1E−5 Torrの減圧下で昇華精製を行った。淡黄色結晶。融点:370℃。熱分解温度:386℃。イオン化ポテンシャル:6.1eV。有機発光材料(実−10)は強い黄色の蛍光発光が観測された。有機発光材料(実−10)の吸収スペクトル及び発光スペクトルを図7に示す。
【0107】
〔実施例11;有機発光材料前駆体(実−11)の合成〕
【0108】
【化41】

【0109】
塩化ヘキサノイルの代りにクロロギ酸アミルを用いた点以外は、実施例2と同様の方法により、化合物(実−11)を合成した。得られた(実−11)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0110】
(実−11)の熱分析
(実−11)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、150〜190℃で炭酸エステル部位の脱離に由来する重量減少(ペンタノールと二酸化炭素のそれぞれ2分子に相当する減少、理論減少量34.3%、実測減少量33.3%)が観測された。また、さらに昇温すると360.3℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
また、実施例8同様に(実−11)を石英基板に成膜し、加熱処理前後の発光スペクトルを測定した所、実施例8と同様の発光スペクトルが観測された。
【0111】
〔実施例12:有機発光材料前駆体(実−12)の合成〕
【0112】
【化42】

【0113】
100mLフラスコに、化合物2を0.500g入れ、系内をアルゴン置換した。次いで、DMF20mL、THF20mLを加え、0℃に冷却した。次いで、水素化ナトリウム(55%パラフィン分散)N,N−ジメチルアミノピリジンを17mg及び無水酢酸を0.44mL加えて、室温0.23gを少しずつ加えた後、室温で0.5時間撹拌した。
この溶液にヨードメタン0.32mLを滴下した後、さらに室温で5時間撹拌した。次いで反応溶液に水を加えた後、トルエンで抽出した。抽出溶液を無水硫酸ナトリウムで乾燥した後、溶媒を減圧留去し、リサイクル分取GPCで精製して目的の(実−12)を無色の結晶として得た。得られた(実−12)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に溶解した。
【0114】
(実−12)の熱分析
(実−12)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、170〜320℃で、メタノール2分子に相当する重量減少(理論減少量11.2%、実測減少量13.9%)が観測された。また、さらに昇温すると362℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
【0115】
〔実施例13;有機発光材料前駆体(実−13)の合成〕
【0116】
【化43】

【0117】
塩化ヘキサノイルの代りにエチルマロニルクロリドを用いた点以外は、実施例2と同様の方法により、化合物(実−13)を合成した。得られた(実−13)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0118】
(実−13)の熱分析
(実−13)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、100〜160℃でエステル部位の脱離に由来する重量減少(酢酸エチルと二酸化炭素のそれぞれ2分子に相当する減少、理論減少量34.3%、実測減少量35.5%)が観測された。またさらに昇温すると362℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
また、実施例8同様に(実−13)を石英基板に成膜し、加熱処理前後の発光スペクトルを測定した所、実施例8と同様の発光スペクトルが観測された。
【0119】
〔実施例14;有機発光材料前駆体(実−14)の合成〕
【0120】
【化44】

【0121】
塩化ヘキサノイルの代りにクロロアセチルクロリドを用いた点以外は、実施例2と同様の方法により、化合物(実−14)を合成した。得られた(実−14)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
(実−14)の同定データを次に示す。
1H−NMR(500MHz,CDCl3,TMS)δ/ppm:3.30−3.34(m,2H,),3.40−3.44(m,2H,),4.03(s,4H,),6.37(t,2H,J=7.4Hz),7.22−7.31(m,12H),8.25(s,2H)
【0122】
(実−14)の熱分析
(実−14)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、140〜192℃でエステル部位の脱離に由来する重量減少(理論減少量27.2%、実測減少量26.6%)が観測された。また、さらに昇温すると363.1℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
また、実施例8同様に(実−14)を石英基板に成膜し、加熱処理前後の発光スペクトルを測定した所、実施例8と同様の発光スペクトルが観測された。
【0123】
〔実施例15;有機発光材料前駆体(実−15)の合成〕
【0124】
【化45】

【0125】
50mLフラスコにジクロロメタン10mL、トリエチルアミン0.35mL、N,N−ジメチルアミノピリジン45mg(0.37mmol)、2−メチル−6−ニトロベンゾイックアンハイドライド、及び4,4,4−トリフルオロブタン酸を入れ、20分間撹拌した。この溶液に実施例1に記載の化合物2(0.37mmol)、及びTHF13mLを加えて20時間撹拌した。次いで、飽和塩化ナトリウム水溶液を加えた後、酢酸エチルで抽出した。次いで抽出溶液を飽和塩化ナトリウム水溶液で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去した後、残渣をリサイクル分取GPC(日本分析工業社製)により精製して、目的の(実−15)を、無色の固体として0.22g得た。得られた(実−15)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0126】
(実−15)の熱分析
(実−15)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、150〜200℃でエステル部位の脱離に由来する重量減少(理論減少量35.9%、実測減少量34.3%)が観測された。また、さらに昇温すると363.0℃に吸熱ピークが観測された。これは特願2009−171441に記載されている、前記化合物(実−1−2)の融点に一致した。
また、実施例8同様に(実−11)を石英基板に成膜し、加熱処理前後の発光スペクトルを測定した所、実施例8と同様の発光スペクトルが観測された。
【0127】
〔実施例16;有機発光材料前駆体(実−16)の合成〕
【0128】
【化46】

【0129】
化合物2の代りに前記化合物(実−7)を用い、4,4,4−トリフルオロブタン酸の代りに2−オキソプロピオン酸を用いた点以外は、実施例15と同様の方法により、化合物(実−16)を合成した。得られた(実−16)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0130】
(実−16)の熱分析
(実−16)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、100〜200℃でエステル部位の脱離に由来する重量減少(理論減少量20.7%、実測減少量21.1%)が観測された。また、さらに昇温すると273℃、300℃に吸熱ピークが観測され、前記化合物(実−6−2)に変換されている事が確認された。
【0131】
〔実施例17;有機発光材料前駆体(実−17)の合成〕
【0132】
【化47】

【0133】
4−ヘキシルベンジルクロライドの代りに4−クロロメチル−4’−メチルビフェニルを用いた点以外は、実施例6と同様の方法によりジオール(実−17)を合成した(収率74%)。得られた(実−17)は、THF、トルエン、等の溶媒に溶解した。
【0134】
(実−17)の熱分析
(実−17)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、200〜300℃で水2分子に相当する重量減少(理論減少量5.0%、実測減少量4.0%)が観測された。また、さらに昇温すると428℃に吸熱ピークが観測され、下記化合物(実−17−2)に変換されていることが確認された。
【0135】
【化48】

【0136】
〔実施例18;有機発光材料前駆体(実−18)の合成〕
【0137】
【化49】

【0138】
化合物2の代りに化合物(実−17)を用いた点以外は、実施例2と同様の方法により化合物(実−18)を無色の固体として得た(収率54%)。得られた(実−18)は、THF、トルエン、クロロホルム、キシレン、ジエチルエーテル、ジクロロメタン等の溶媒に容易に溶解した。
【0139】
(実−18)の熱分析
(実−18)のTG−DTA測定を行った。
5℃/minの速度で昇温したところ、195〜270℃でエステル部位の脱離に由来する重量減少(理論減少量25.3%、実測減少量24.2%)が観測された。また、さらに昇温すると、428℃に吸熱ピークが観測され、前記化合物(実−17−2)に変換されていることが確認された。
【0140】
〔比較例1〕
実施例1に記載の化合物(実−1−2)を、THF、クロロホルム、トルエン、キシレン、メシチレン、ジエチルエーテル、ジクロロメタン、エタノールに加えて溶解性試験を行ったところ、何れの溶媒においても不溶であり、各種印刷法により成膜することが出来なかった。
【先行技術文献】
【特許文献】
【0141】
【特許文献1】特開平5−5568号公報
【特許文献2】特開2008−56797号公報
【特許文献3】特開2008−303365号公報
【特許文献4】特開2010−229215号公報
【特許文献5】特開2009−4351号公報
【非特許文献】
【0142】
【非特許文献1】Advanced Materials 2009,21,213−216.
【特許請求の範囲】
【請求項1】
下記一般式(I)または(II)で表されるジチエノベンゾジチオフェン誘導体からなることを特徴とする有機発光材料。
【化1】

〔上記式中、X及びYは、外部刺激によりXとYが結合してX−Yとして一般式(I)の化合物から脱離する基を表し、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕
【化2】

〔上記式中のR1〜R10は前記(I)と同じ基を表す。〕
【請求項2】
前記X及びYの一方が水素であり、他方が水酸基、又はエーテル構造、又はエステル構造若しくはチオエステル構造を有する基であることを特徴とする、請求項1記載の一般式(I)で表される有機発光材料。
【請求項3】
前記エーテル構造、又はエステル構造若しくはチオエステル構造が、下記一般式(III)〜(IX)のいずれかであることを特徴とする、請求項2記載の有機発光材料。
【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

〔上記式中、R11は置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表す。〕
【請求項4】
請求項1から3記載の一般式(I)で表される有機発光材料を含有するインクを用いて、前記一般式(I)で表される化合物からなる構造体を作製した後、エネルギーを付与する事により、一般式(II)で表されるジチエノベンゾジチオフェン誘導体に変換する発光波長変換方法。
【請求項5】
請求項4記載の方法により製造されたことを特徴とする、一般式(II)からなる発光部材。
【請求項6】
一般式(I)または(II)で表される有機発光材料を含有する発光部材を含むことを特徴とする発光デバイス。
【請求項1】
下記一般式(I)または(II)で表されるジチエノベンゾジチオフェン誘導体からなることを特徴とする有機発光材料。
【化1】

〔上記式中、X及びYは、外部刺激によりXとYが結合してX−Yとして一般式(I)の化合物から脱離する基を表し、R1及びR2はそれぞれ独立に、置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表し、R3〜R10はそれぞれ独立に、水素、置換若しくは無置換のアルキル基、置換若しくは無置換のアルコキシ基、置換若しくは無置換のアルキルチオ基、又は置換若しくは無置換のアリール基を表す。〕
【化2】

〔上記式中のR1〜R10は前記(I)と同じ基を表す。〕
【請求項2】
前記X及びYの一方が水素であり、他方が水酸基、又はエーテル構造、又はエステル構造若しくはチオエステル構造を有する基であることを特徴とする、請求項1記載の一般式(I)で表される有機発光材料。
【請求項3】
前記エーテル構造、又はエステル構造若しくはチオエステル構造が、下記一般式(III)〜(IX)のいずれかであることを特徴とする、請求項2記載の有機発光材料。
【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

〔上記式中、R11は置換若しくは無置換のアルキル基、又は置換若しくは無置換のアリール基を表す。〕
【請求項4】
請求項1から3記載の一般式(I)で表される有機発光材料を含有するインクを用いて、前記一般式(I)で表される化合物からなる構造体を作製した後、エネルギーを付与する事により、一般式(II)で表されるジチエノベンゾジチオフェン誘導体に変換する発光波長変換方法。
【請求項5】
請求項4記載の方法により製造されたことを特徴とする、一般式(II)からなる発光部材。
【請求項6】
一般式(I)または(II)で表される有機発光材料を含有する発光部材を含むことを特徴とする発光デバイス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2013−64063(P2013−64063A)
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願番号】特願2011−203348(P2011−203348)
【出願日】平成23年9月16日(2011.9.16)
【出願人】(000006747)株式会社リコー (37,907)
【Fターム(参考)】
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願日】平成23年9月16日(2011.9.16)
【出願人】(000006747)株式会社リコー (37,907)
【Fターム(参考)】
[ Back to top ]

