ジヒドロエルゴタミンを肺吸入により体循環に送達するためのエアゾール製剤
【課題】乾燥粉末と噴射剤懸濁液を肺エアゾール又は鼻腔スプレー吸入により投与するためのジヒドロエルゴタミン又は医薬的に許容可能なその塩の医薬エアゾール製剤の提供。
【解決手段】偏頭痛等の各種疾患状態及び症状の治療に使用することができる。超臨界流体法により製造され、ジヒドロエルゴタミンからなる粒状粉末薬剤と;(ii)1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であるヒドロフルオロアルカン噴射剤を含み、前記粒状粉末薬剤が10ミクロン以下の平均粒度であり、界面活性剤を含まない、吸入送達用安定医薬エアゾール製剤。本エアゾール製剤は安定性、純度に優れ、特に肺送達に適した吸入可能な粒度の粒子を含む。
【解決手段】偏頭痛等の各種疾患状態及び症状の治療に使用することができる。超臨界流体法により製造され、ジヒドロエルゴタミンからなる粒状粉末薬剤と;(ii)1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であるヒドロフルオロアルカン噴射剤を含み、前記粒状粉末薬剤が10ミクロン以下の平均粒度であり、界面活性剤を含まない、吸入送達用安定医薬エアゾール製剤。本エアゾール製剤は安定性、純度に優れ、特に肺送達に適した吸入可能な粒度の粒子を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はジヒドロエルゴタミン又は医薬的に許容可能なその塩の肺吸入投与用医薬エアゾール製剤に関する。
【背景技術】
【0002】
セロトニンアゴニストの投与は各種疾患状態及び症状の治療に定着しており、限定されないが、急性偏頭痛の治療が挙げられる。最も広く使用されているセロトニンアゴニストはトリプタンであり、スマトリプタン、ゾルミトリプタン、ナラトリプタン、リザトリプタン、エレトリプタン、フロバトリプタン及びアルモトリプタンが挙げられる。これらの化合物はセロトニン5−HT1D/1B受容体と特異的に結合する。比率は劣るが、酒石酸エルゴタミンやジヒドロエルゴタミン等のエルゴットアルカロイドも各種疾患状態及び症状に使用されており、限定されないが、急性偏頭痛の治療が挙げられる。ジヒドロエルゴタミンは慢性連日性頭痛(旧名称:「変容性」偏頭痛)に広く使用されている。エルゴットアルカロイドは5−HT1D、5−HT1A、5−HT2A、5−HT2C、ノルアドレナリンα2A、α2B、及びα、ドーパミンD2L及びD3受容体との結合に関してトリプタンよりも選択性が低い。
【0003】
エルゴットアルカロイドはその潜在的利点にも拘わらずあまり使用されていないが、その一因はこれらの化合物を適切な送達用製剤で安定化しにくい点にある。安定化の問題の結果、エルゴットアルカロイド化合物は送達が安定せず、投薬が安定しない。ジヒドロエルゴタミンは経口及び鼻腔内投与でも使用されている(Migranal(登録商標)−Novartis、US5942251、EP0865789A3、及びBE1006872A)が、筋肉内注射又は静脈内投与により投与することが最も多い(D.H.E.45(登録商標)−Novartis)。最近、単剤及び非ステロイド性鎮痛薬との併用剤としてのジヒドロエルゴタミン製剤が筋肉内自己注射器用に開発された(米国出願20030040537、US6077539、WO005781A3、EP1165044A2、CN1347313T、及びAU0038825A5)。鼻腔内投与による治療用にも単剤又は強力鎮痛薬との併用剤としてのジヒドロエルゴタミンが製剤化されている(US4462983、US5756483、EP0689438A1、AU6428894A1、及びWO9422445A3)。ジヒドロエルゴタミンの舌下投与用スプレー又はエアゾール製剤も開発されている(米国出願20030017994)。酒石酸エルゴタミンは注射、座剤による直腸、及び定量噴霧式吸入器(Medihaler−Ergotamine(登録商標)−3M)による吸入でも投与されているが、経口又は舌下投与が最も一般的である。
【0004】
エルゴタミンとジヒドロエルゴタミンは直腸、経口、舌下及び鼻腔内バイオアベイラビリティーが非常に低く、投与量の2%〜10%しか体循環に到達しない。注射は痛みを伴い、局所炎症を生じ、コンプライアンスを低下させ、IV投与には費用のかかる臨床監督が必要であるため、エルゴットアルカロイドを肺吸入により投与できるならば非常に望ましい。エルゴットアルカロイドを肺吸入すると、肺胞上皮から毛細血管循環に迅速に輸送され、肺におけるエルゴットアルカロイド化合物の代謝機構が相対的に減少するため、その薬剤が標的受容体に到達する前の初回通過代謝が最小になる。肺送達は酒石酸エルゴタミンの場合に92%までのバイオアベイラビリティーに達することが立証されている。肺吸入投与は更に偏頭痛投薬に特有の胃腸障害が回避され、エルゴットアルカロイド化合物の苦味による鼻腔内及び舌下投与時の不味さが最小限になる。肺吸入は注射の侵襲性に伴う投与への抵抗感と臨床監督費用が最小限になる。
【0005】
吸入投与用酒石酸エルゴタミン製剤は最近の多数の文献に記載されており(US646159、US6451287、US6395300、US6395299、US6390291、US6315122、US6179118、US6119853、US6406681)、特に噴射剤を利用した定量噴霧式吸入器(MDI)製剤が記載されている(US5720940、US5683677、US5776434、US5776573、US6153173、US6309624、US6013245、US6200549、US6221339、US6236747、US6251368、US6306369、US6253762、US6149892、US6284287、US5744123、US5916540、US5955439、US5992306、US5849265、US5833950、US5817293、US6143277、US6131566、US5736124、US5696744)。これらの文献の多くは酒石酸エルゴタミンの安定な製剤を製造するために賦形剤又は溶媒を必要とする。1980年代後期に3Mは酒石酸エルゴタミンの肺吸入製剤(Medihaler−Ergotamine(登録商標)−3M)を開発し、認可を受け、販売している。しかし、処方が安定しないという問題と、その結果として投薬が安定しないという問題を避けられず、1990年代には市場から撤退した。
【0006】
酒石酸エルゴタミンを使用したドライパウダー吸入装置による吸入用粉末も記載されている(US6200293、US6120613、US6183782、US6129905、US6309623、US5619984、US4524769、US5740793、US5875766、US6098619、US6012454、US5972388、US5922306)。肺投与用水性エアゾール酒石酸エルゴタミン製剤も記載されている(US5813597)。
【0007】
酒石酸エルゴタミンの肺吸入用エアゾール送達はこれらの多数の文献に記載されているが、ジヒドロエルゴタミンの肺吸入送達については殆ど記載されていない(US4462983)。ジヒドロエルゴタミンを酒石酸エルゴタミンと同様に送達することは自明であると思われるが、ジヒドロエルゴタミンは利用可能なエアゾール送達剤形で安定化することが非常に困難であった。効力と活性を維持するためには、賦形剤の不在下又はジヒドロエルゴタミンの効力を低下させず且つ肺に非毒性の賦形剤の存在下で安定化することが可能な溶液、粉末又は懸濁液としてジヒドロエルゴタミンを製剤化する必要がある。ジヒドロエルゴタミンは非常に劣化し易く、光、酸素及び熱に暴露するか又は酸化もしくは加水分解条件に暴露すると劣化する。ジヒドロエルゴタミンの鼻腔スプレー又は注射送達用水性製剤は溶液中のジヒドロエルゴタミンを安定化するためにカフェイン、デキストラン又はシクロデキストラン等のキレート剤又は錯形成剤が必要である。このような安定化剤は局所炎症を引き起こしたり、急性毒性であるため、肺送達に不適合であることが多い。ジヒドロエルゴタミン溶液の劣化を更に抑制するためには、開放に特殊オープナーを必要とする暗色ガラスバイアルにジヒドロエルゴタミン製剤を密封し、濾過してガラス破片を除去し、使用直前に注射器又はスプレーアプリケーターに移す。あるいは、二相自己注射器フォーマット(ガラスバイアル、シリンジ又はブリスターパッケージ(例えばPozen MT300)内で粉末部分を液体と混合する)等でジヒドロエルゴタミン粉末を注射液と混合することにより使用直前にジヒドロエルゴタミン溶液を調製することができる。このような即席製剤アプローチはジェット又は超音波噴霧による肺送達用溶液を調製するように応用することも想定される。しかし、水溶液から吸入エアゾールを発生するために使用されている公知噴霧方法はいずれも効力と活性に多様な直接変化を生じるに十分な熱及び酸素濃度にジヒドロエルゴタミンを暴露するものである。安定な製剤を獲得又はエアゾール化する際に切り離せないこれらの問題により、ジヒドロエルゴタミンはまだ肺吸入投与に適していない。
【0008】
別のエアゾール送達法は加圧式定量噴霧式吸入器(pMDI)を使用する方法であり、ハロカーボン噴射剤により薬剤の溶液又は懸濁液を小孔に通し、噴射剤液滴の内側の薬剤から構成される微細な吸入可能なミストを発生する。安定なpMDI製剤を製造するためには、薬剤は噴射剤とpMDIバルブ装置の内側で安定であり且つこれらと物理化学的に適合性の溶液又は微粒子懸濁液を形成できなければならない。点鼻液又は注射液について上述した溶液安定性と肺毒性の問題はpMDI製剤にも当てはまり、更に噴射剤適合性の要件が加わり、水やアルコール等の肺適合性であると一般に認められている試薬を使用できない。懸濁液では、約5.8ミクロン未満(肺深部浸透に必要な空気力学的質量中央径)の微粒子が必要であり、粒子は懸濁液中で安定でなければならない。このような粒子は噴射剤に分散できる粉末とするように粉砕、超微粉砕、微粉砕等の摩砕法、又は噴霧乾燥、溶液析出、もしくは凍結乾燥等の多相析出法によりバルク薬剤から製造される。これらの方法は熱又は化学的相互作用により薬剤の物理化学的性質を直接変化させることが多い。ジヒドロエルゴタミンは非常に不安定な化合物であるので、これらの方法は噴射剤に再分散できる粉末を製造するには不適切であるか、あるいは最初は粉末が分散可能であっても、粒度が経時的に増加したり、製剤と接触することによりその化学的組成が経時的に変化することが分かっている。この不安定により効力、活性が変化したり、粒度が増加して3.0ミクロンを上回り、pMDI懸濁液製剤アプローチをジヒドロエルゴタミンエアゾール送達に利用できなくなる。
【0009】
吸入可能なエアゾールを発生する別の方法は薬剤の粉末製剤を使用者の呼気に分散させて肺に吸入するドライパウダー吸入器の使用である。pMDI懸濁液製剤について上述した問題は安定な乾燥粉末製剤の製造にも当てはまる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】米国特許第5942251号明細書
【特許文献2】欧州特許出願公開第0865789号明細書
【特許文献3】ベルギー特許出願公開第1006872号明細書
【特許文献4】米国特許出願公開第2003/0040537号明細書
【特許文献5】米国特許第6077539号明細書
【特許文献6】国際公開第00/005781号
【特許文献7】欧州特許出願公開第1165044号明細書
【特許文献8】中国特許出願公開1347313号明細書
【特許文献9】オーストラリア特許出願公開0038825号明細書
【特許文献10】米国特許第4462983号明細書
【特許文献11】米国特許第5756483号明細書
【特許文献12】欧州特許出願公開第0689438号明細書
【特許文献13】オーストラリア特許出願公開6428894号明細書
【特許文献14】国際公開第94/22445号
【特許文献15】米国特許出願公開第2003/0017994号明細書
【特許文献16】米国特許第646159号明細書
【特許文献17】米国特許第6451287号明細書
【特許文献18】米国特許第6395300号明細書
【特許文献19】米国特許第6395299号明細書
【特許文献20】米国特許第6390291号明細書
【特許文献21】米国特許第6315122号明細書
【特許文献22】米国特許第6179118号明細書
【特許文献23】米国特許第6119853号明細書
【特許文献24】米国特許第6406681号明細書
【特許文献25】米国特許第5720940号明細書
【特許文献26】米国特許第5683677号明細書
【特許文献27】米国特許第5776434号明細書
【特許文献28】米国特許第5776573号明細書
【特許文献29】米国特許第6153173号明細書
【特許文献30】米国特許第6309624号明細書
【特許文献31】米国特許第6013245号明細書
【特許文献32】米国特許第6200549号明細書
【特許文献33】米国特許第6221339号明細書
【特許文献34】米国特許第6236747号明細書
【特許文献35】米国特許第6251368号明細書
【特許文献36】米国特許第6306369号明細書
【特許文献37】米国特許第6253762号明細書
【特許文献38】米国特許第6149892号明細書
【特許文献39】米国特許第6284287号明細書
【特許文献40】米国特許第5744123号明細書
【特許文献41】米国特許第5916540号明細書
【特許文献42】米国特許第5955439号明細書
【特許文献43】米国特許第5992306号明細書
【特許文献44】米国特許第5849265号明細書
【特許文献45】米国特許第5833950号明細書
【特許文献46】米国特許第5817293号明細書
【特許文献47】米国特許第6143277号明細書
【特許文献48】米国特許第6131566号明細書
【特許文献49】米国特許第5736124号明細書
【特許文献50】米国特許第5696744号明細書
【特許文献51】米国特許第6200293号明細書
【特許文献52】米国特許第6120613号明細書
【特許文献53】米国特許第6183782号明細書
【特許文献54】米国特許第6129905号明細書
【特許文献55】米国特許第6309623号明細書
【特許文献56】米国特許第5619984号明細書
【特許文献57】米国特許第4524769号明細書
【特許文献58】米国特許第5740793号明細書
【特許文献59】米国特許第5875766号明細書
【特許文献60】米国特許第6098619号明細書
【特許文献61】米国特許第6012454号明細書
【特許文献62】米国特許第5972388号明細書
【特許文献63】米国特許第5922306号明細書
【特許文献64】米国特許第5813597号明細書
【発明の概要】
【発明が解決しようとする課題】
【0011】
ジヒドロエルゴタミンの吸入送達に適した製剤が当分野に存在していないことは明白である。
【課題を解決するための手段】
【0012】
本発明は肺エアゾール又は鼻腔スプレー吸入により乾燥粉末と噴射剤懸濁液を投与するためのジヒドロエルゴタミン又は医薬的に許容可能なその塩の安定な新規製剤について記載する。このような製剤は限定されないが、偏頭痛等の各種疾患状態及び症状の治療に使用することができる。更に、ジヒドロエルゴタミン又は医薬的に許容可能なその塩の新規製剤の製造方法も記載する。
【図面の簡単な説明】
【0013】
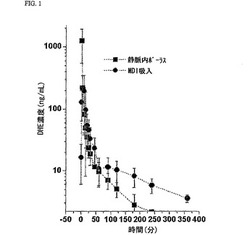
【図1】乾燥粉末により送達したDHE粒子の迅速な吸収を例証する薬物動態データを示す。この試験では、DHE粒子をDPIフォーマット(総用量1mg)と静脈内ボーラス(総用量0.5mg)によりイヌに投与し、イヌ血清中のDHE濃度を所定間隔で測定した。
【発明を実施するための形態】
【0014】
吸入投与される活性化合物は局所、又は全身作用を示すために肺深部に浸透する必要がある。これを達成するためには、活性化合物の粒子は約0.5〜5.8μmの空気力学的質量中央径(MMAD)を越えない粒径でなければならない。この最適粒度範囲の粒子は結晶化段階中には殆ど生成されず、0.5〜5.8μm範囲の粒子を製造するためには二次処理が必要である。このような二次処理としては限定されないが、ジェットミル、超微粉砕及び機械的粉砕による摩砕、多相析出(例えば溶液析出、噴霧乾燥、凍結乾燥)が挙げられる。このような二次処理は大きな熱及び機械的勾配を伴い、活性化合物の効力や活性を直接劣化させたり、位相欠陥や化学的不安定を引き起こし、その後の処理又は保存時に粒子の寸法、形状又は化学的組成を変化させる。これらの二次処理は更に実質的量の自由エネルギーを粒子に付与し、この自由エネルギーは一般に粒子の表面に貯蔵される。粒子により貯蔵されたこの自由エネルギーは凝集力を生じ、この自由エネルギーを低下させるため、粒子を集塊にさせる。凝集プロセスが長引くと、吸入可能な活性化合物粒子が粒状製剤中に存在しなくなったり、凝集相互作用の強度が大きいためにこのような粒子を粒状製剤から生成できなくなる。吸入送達の場合には吸入装置による送達に適した形状で粒子を保存しなければならないのでこのプロセスは悪化する。粒子は比較的長時間保存されるので、凝集プロセスは保存中に増進する可能性がある。粒子の凝集は吸入装置による粒子の再分散を妨げ、肺送達及び鼻腔送達に必要な吸入可能な粒子を生成できなくなる。
【0015】
更に、キャリヤー及び/又は賦形剤の使用等の凝集作用を解消するために使用されている製薬分野の慣用方法の大半は、これらの物質の肺毒物学的プロフィルが望ましくないことから吸入用医薬形態では使用することができない。
【0016】
本発明は乾燥粉末と噴射剤懸濁液を肺エアゾール吸入又は鼻腔スプレー吸入により投与するためのジヒドロエルゴタミン又は医薬的に許容可能なその塩(本明細書ではDHEと言う)の安定な新規製剤について記載する。1態様では、DHEはメシル酸塩として使用される。DHE粉末は超臨界流体法を使用して製造される。超臨界流体法は吸入送達用DHE粒子の製造に有意利点を提供する。重要な点として、超臨界流体法は所望粒度の吸入可能な粒子を1段階で製造し、粒度を低減するために二次処理の必要がない。従って、超臨界流体法により製造された吸入可能な粒子は表面自由エネルギーが低下し、その結果、凝集力が低下し、凝集しにくくなる。製造された粒子は更に均質な粒度分布を示す。更に、製造された粒子は表面が滑らかで結晶構造の再現性があるのでこの点でも凝集しにくくなる。
【0017】
このような超臨界流体法としては、急速膨張法(RES)、溶液強化拡散法(SEDS)、ガス貧溶媒化法(GAS)、超臨界貧溶媒化法(SAS)、ガス飽和溶液析出法(PGSS)、圧縮貧溶媒析出法(PCA)、エアゾール溶媒抽出法(ASES)、又はこれらの任意組み合わせが挙げられる。これらの各超臨界流体法の基礎となる技術は当分野で周知であるので、本明細書では記載しない。1特定態様では、使用する超臨界流体法はPalakodatyらにより米国出願2003 0109421に記載されているようなSEDS法である。
【0018】
超臨界流体法はドライパウダー吸入器(DPI)フォーマットで既定量吐出により直接使用することができる乾燥粒子を製造し、あるいは製造された粒子を定量噴霧式吸入器(MDI)フォーマットで医薬的に許容可能な噴射剤等の懸濁媒体に直接懸濁/分散させることができる。製造された粒子は使用する超臨界流体法と使用条件に応じて結晶質と非晶質の場合がある(例えば、SEDS法は非晶質粒子を製造することが可能である)。上述のように、製造された粒子は慣用方法により製造された粒子に比較して優れた特徴をもち、限定されないが、滑らかで均質な表面、低エネルギー、均質な粒度分布及び高純度が挙げられる。これらの特徴は粒子の物理化学的安定性を増進し、DPIフォーマット又はMDIフォーマットで使用する場合に粒子の分散を促進する。
【0019】
粒度はエアゾール粒子の投与によりDHE粒子を肺に吸入できるように選択する必要がある。1態様では、粒度分布は20ミクロン未満である。代替態様では、粒度分布はカスケードインパクターにより測定したMMAD約0.050ミクロン〜10.000ミクロンであり、更に別の代替態様では、粒度分布はカスケードインパクターにより測定したMMAD約0.400〜3.000ミクロンが好ましい。上記超臨界流体法はこれらの範囲の下端の粒度を生じる。
【0020】
DPIフォーマットでは、当分野で公知の通り、静電的方法、低温測定法、又は慣用方法によりDHE粒子を剤形に定量分配することができる。DHE粒子は単独(ニート)で使用してもよいし、キャリヤーや分散粉末等の1種以上の医薬的に許容可能な賦形剤と併用してもよく、限定されないが、ラクトース、マンノース、マルトース等、又は界面活性剤コーティングが挙げられる。1好適製剤では、付加賦形剤を添加せずにDHE粒子を使用する。当分野で一般に使用されている簡便な剤形の1つはアルミ箔ブリスターパックである。この態様では、DPIで使用するために付加賦形剤を添加せずにDHE粒子をアルミ箔ブリスターパックに定量充填する。典型的1回吐出量は約0.050mg〜2.000mg、又は約0.250mg〜0.500mgとすることができる。当分野で公知の通り、ブリスターパックに穴を開け、静電力、空気力学的力、機械的力、又はその任意組み合わせにより呼気に分散させることができる。1態様では、既定1回吐出量の>25%が吸入により肺に送達され、代替態様では、既定1回吐出量の>50%が吸入により肺に送達され、更に別の代替態様では、既定1回吐出量の>80%が吸入により肺に送達される。DPIフォーマットの送達によるDHE粒子の吸入可能画分(米国薬局方、第601章に従って測定)は25%〜90%であり、ブリスターパック内の残留粒子は既定1回吐出量の5%〜既定1回吐出量の55%である。
【0021】
MDIフォーマットでは、医薬的に許容可能な噴射剤等の懸濁媒体に粒子を直接懸濁/分散させることができる。1特定態様では、懸濁媒体は噴射剤である。噴射剤はDHE粒子の溶媒とならないことが望ましい。適切な噴射剤としては限定されないが、1,1,1,2−テトラフルオロエタン(HFA134a)及び1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパン(HFA227)等のC1−4ヒドロフルオロアルカンが挙げられ、単独又は任意組み合わせで使用することができる。二酸化炭素とアルカン(例えばペンタン、イソペンタン、ブタン、イソブタン、プロパン及びエタン)も噴射剤として使用することができ、又は上記C1−4ヒドロフルオロアルカン噴射剤とブレンドすることができる。ブレンドの場合には、噴射剤は前記二酸化炭素0〜25%とアルカン0〜50%を含有することができる。1態様では、DHE粒子分散系は界面活性剤を添加せずに得られる。代替態様では、DHE粒子分散系は必要に応じて界面活性剤を添加することができ、界面活性剤はDHEに対して質量比0.001〜10とする。典型的界面活性剤としては、オレイン酸塩、ステアリン酸塩、ミリスチン酸塩、アルキルエーテル、アルキルアリールエーテル、ソルビン酸及び吸入送達用化合物製剤化分野の当業者により使用されている他の界面活性剤、又は上記のものの任意組み合わせが挙げられる。特定界面活性剤としては限定されないが、モノオレイン酸ソルビタン(SPAN−80)とミリスチン酸イソプロピルが挙げられる。DHE粒子分散系は更に界面活性剤を使用する場合にその溶解を助長するために少量の極性溶媒を添加することができる。適切な極性化合物としてはC2−6アルコール及びポリオール(例えばエタノール、イソプロパノール、ポリプロピレングリコール及びこれらの任意組み合わせ)が挙げられる。極性化合物は噴射剤に対して質量比0.0001%〜4%で添加することができる。4%を越える量の極性溶媒はDHEと反応したり、DHEを溶解する恐れがある。1特定態様では、極性化合物はエタノールであり、噴射剤に対して質量比0.0001〜1%で使用する。DHE粒子製剤には医薬的に許容可能な噴射剤及び界面活性剤と平衡状態になる量を上回る量の水又はヒドロキシル含有化合物を添加しない。水及びヒドロキシル含有化合物がその平衡点となるように噴射剤と界面活性剤(使用する場合)を使用前に水及びヒドロキシル含有化合物と接触させてもよい。
【0022】
噴射剤/界面活性剤組成に合わせて標準定量バルブ(例えばNeotechnics、Valois、又はBespak製品)及び缶(例えばPressPart又はGemi製品)を適宜使用することができる。1〜数百回の吐出回数を達成するためには2.0ml〜17mlの缶充填容量を使用することができる。充填容量に関係なく特定吐出回数を制限するように場合によりロックアウト機構付き吐出回数カウンターを備えることもできる。噴射剤懸濁液中のDHEの総質量は一般に噴射剤100μl当たりDHE0.100mg〜2.000mgとする。50〜100μlの標準MDI定量バルブを使用すると、1プッシュ0.050μg〜1.000μgが定量噴霧される。吸入同調を最大にするために呼気連動型アクチュエーターを使用することが好ましいが、治療効力を達成するために必須ではない。このようなMDIの吸入可能画分は(米国薬局方、第601章に従って測定した場合に)1回吐出量の25%〜75%である。
【0023】
以下、実施例により本発明の所定態様を例証するが、以下の実施例により本発明を限定するものではない。
【実施例1】
【0024】
乾燥粉末DHEの安定性
Palakadotyら(米国出願20030109421)により記載されているようなSEDS超臨界流体法によりDHE粒子を製造した。製造したDHE粒状粉末をHPLCによりアッセイして純度を測定し、当分野で公知の標準操作条件下にAerosizer計器を使用して空気力学的質量中央径を測定した。表1から明らかなように、製造時にDHE粒子はHPLC純度98.3%及び粒度1.131ミクロン(MMAD)であった。DHE粒状粉末を(i)3ケ月間40℃及び75%相対湿度と、(ii)25℃及び60%相対湿度の標準加速エージング条件下においた。DHE粒子を密閉暗色ガラス容器に入れ、適当な恒温炉に3ケ月間保管した。3ケ月後に純度と粒度を再び上記のように測定した。表1から明らかなように、3ケ月間40℃及び75%相対湿度で静置したサンプルは純度102.0%及び粒度1.091ミクロン(MMAD)であった。同様に、25℃及び60%相対湿度で静置したサンプルは純度101.0%及び粒度1.044ミクロン(MMAD)であった。
【0025】
これらのデータによると、超臨界流体技術を使用して製造したDHE粒状粉末は製造時と3ケ月間加速環境エージング後の再分散性が優れていた。重要な点として、DHE粒子は安定しており、3ケ月間加速環境エージング後でも肺深部浸透に適した吸入可能な粒度範囲(<3.0ミクロン)であった。従来の手段により適切なDHE粒子を製造することは困難であったので、このような結果は全く予想外であった。これらの結果によると、超臨界流体技術を使用して製造したDHE粒状粉末はDPIフォーマットによる肺送達に適している。注目すべき点として、試験したDHE粒状粉末は賦形剤を添加しておらず、従来技術製剤に対して有意な進歩である。上記に試験したものと同一ロット(no.3801087)のDHE粒状粉末を下記のようにMDIフォーマット用製剤例で使用した。
【0026】
【表1】

【実施例2】
【0027】
MDI式肺送達用DHE製剤
上記のように、賦形剤を添加するか又は添加せずにDHE粒子の各種製剤を製造することができるが、(噴射剤以外に)賦形剤を添加せずに製剤を製造することが好ましい。製剤で使用したDHE粒子は実施例1に記載したものと同一ロットから入手した。
【0028】
PressPart製塗装AI缶にBespak BK357バルブとBespak 636アクチュエーターを装着し、1プッシュ総容量が100μlとなるように各製剤をパッケージングした。本発明の教示の例示である製剤を表2に示し、これらの製剤の性能特性を表3に示す。表2に示す製剤は本発明と特許請求の範囲を限定するものではなく、単に本発明の教示を例証するための特定態様の例として記載する。DHE製剤は下記一般方法に記載するように製造した。表2に記載する製剤では非晶質DHE粒子と結晶質DHE粒子に加え、非超臨界流体法により製造した超微粉砕結晶質DHE粒子も使用した。
【0029】
【表2】

【0030】
製剤の微粒子率を測定すると共に、各種製剤に含まれるDHE粒子の空気力学的質量中央径を測定した。微粒子率は米国薬局方第601章に記載の方法及び規格に従い、Andersonカスケードインパクター(28.3LPM)を使用して測定した。表3中、微粒子率は検出器に衝撃を与える直径4.8ミクロン以下のDHE粒子の百分率を示す。これは任意所与製剤で対象の肺に送達される薬剤の量の概数値である。微粒子吐出量はプッシュ段階中に送達される薬剤の実際の量である。MMADは当分野の標準プロトコールを使用してAerosizerにより測定した。表3から明らかなように、DHE製剤の組成は製剤の性能特性に有意影響を与えた。
【0031】
SEDS超臨界流体法により製造したDHE結晶質粒子は一般に同一技術により製造したDHE非晶質粒子よりも優れた結果を示した。SEDSにより製造した結晶質粒子と非晶質粒子(サンプル1,4及び8)はいずれも標準超微粉砕結晶質DHE粒子(サンプル5及び6)に比較して有意に高い性能を示した。例えば、サンプル番号10(SEDSにより製造した結晶質DHEを100%HFA134a+ミリスチン酸イソプロピル0.2mgに分散)は微粒子率44.6%(14.4倍)及び粒度2.2ミクロン(MMAD)であったが、これに対してサンプル番号5(超微粉砕結晶質DHEを100%HFA134a+ミリスチン酸イソプロピル0.2mgに分散)は微粒子率が僅か3.1%であり、粒度は5.7ミクロン(MMAD)であった。この比較は肺吸入送達用DHE粒子の製剤化において従来技術で遭遇する問題、即ち吸入可能なDHE粒子を得にくいという問題を実証するものである。特に好ましい製剤はサンプル2及び18である。サンプル2はSEDSにより製造した結晶質DHEを100%HFA227に分散させ、サンプル18はSEDSにより製造した結晶質DHEを70%HFA227/30%HFA134a混合物に分散させたものである。サンプル2は微粒子率41.2%と粒度MMAD2.3ミクロンを示し、サンプル18は微粒子率47.9%と粒度MMAD1.9ミクロンであった。これらの各製剤はDHEの肺送達に優れた品質を示す。
【0032】
【表3】

【実施例3】
【0033】
DHEの肺送達
DPI又はMDIによる送達では、DHE粒子(DPI態様)又はDHE粒子分散系(MDI態様)の1回吐出量の高比率が(亜区域細気管支を越えて)肺末梢に送達され、肺中枢又は解剖学的死腔に送達される比率は低く、口腔咽頭体腔に送達される比率はほんの僅かである。例えば、表3の微粒子率データは上記各製剤で肺に投与されるDHEの百分率を示す。表3から明らかなように、上記超臨界流体法を使用して製造した結晶質DHEでは、DHE総吐出量の31.7%〜51.8%の比率が肺に送達される。特に、サンプル2及び18は界面活性剤や他の材料を添加せずに(即ち噴射剤しか添加せずに)41.2%と47.9%の送達比率を示す。迅速且つ効率的な毛細血管循環への吸収を生じるような有意量のDHEが肺胞体腔に送達される。1態様では、DHEのピーク血中又は血漿中濃度は5〜10分以内に出現し、迅速な治療作用を生じることができた。このような薬物動態応答は静脈内投与と同等であり、経口投与(30分〜2時間)、舌下(30分〜2時間)、鼻腔内(15分〜30分)及び筋肉内注射(15分〜25分)よりも有意に速い。
【0034】
図1は乾燥粉末により送達したDHE粒子の迅速な吸収を例証する薬物動態データを示す。この試験では、DHE粒子をDPIフォーマット(総用量1mg)と静脈内ボーラス(総用量0.5mg)によりイヌに投与し、イヌ血清中のDHE濃度を所定間隔で測定した。図1から明らかなように、吸入後30秒以内に測定可能な血中DHE濃度が出現し、ピーク濃度は吸入後5〜10分に出現した。更に、血中DHE濃度は静脈内送達に比較して長期間高レベルに維持された。
【0035】
下表4は吸入後のイヌ血清中のDHEのTmaxとF(バイオアベイラビリティー)を示す(n=3)。同表から明らかなように、Tmaxは平均6.7分(標準偏差2.9分)で出現し、DHEのバイオアベイラビリティーは52%(標準偏差27%)であった。これらの結果は吸入経路によるDHEの優れた肺送達とバイオアベイラビリティーを示す。
【0036】
【表4】

【0037】
製剤の製造
以下のプロトコールは表2及び3に記載した製剤の製造方法の概要である。以下の記載は非限定的な例示であり、製剤の他の製造方法も利用できる。
【0038】
HFA227
噴射剤としてHFA227を添加し、界面活性剤を添加しない製剤の場合には、(冷却ジャケット、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルに乾燥DHE粉末を秤量投入する。ケトルを0℃まで冷却し、乾燥窒素ブランケット下においた後、HFA227の使用予定総質量の約50%を充填する。HFA227は500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通して容器にポンプ導入する。ケトルの底の薬剤粉末チャージに衝突するHFA227の力はDHE粉末を噴射剤中に懸濁/分散させるために十分である。ケトル内のHFA227レベルがライトニングミキサーのプロペラの上まできたらミキサーを始動させ、懸濁液を中速で連続撹拌する。HFA227(使用予定総容量の50%)の添加後20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してp227の残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0039】
HFA227+界面活性剤を添加する製剤の場合には、(冷却ジャケット、Silverstone Homogenizer、Lightning Mixer、及び四ツ口カバーを装着し、重量計に載せた)混合ケトルを0℃まで冷却し、乾燥窒素ブランケット下におく。HFA227の使用予定総質量の約20%がケトルに導入されるまで、500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通してHFA227をケトルにポンプ充填する。別に界面活性剤を秤量し、ミキサーで連続撹拌下に容器内のHFA227に添加する。界面活性剤の添加完了後、ホモジナイザーを始動させ、混合物を約20分間音波処理する。更にp227総量の30%を500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通して容器にポンプ導入する。音波処理器を停止し、ライトニングミキサーを始動させる。薬剤粉末を容器に添加し、中速で連続撹拌する。20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してp227の残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0040】
HFA134a
HFA134aを添加する製剤の場合には、(冷却ジャケット、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルに乾燥粉末を秤量投入する。ケトルを−27℃まで冷却し、乾燥窒素で約2000ミリバールに加圧した後、HFA134aの使用予定総質量の約50%を充填する。HFA134aは2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通して容器にポンプ導入する。ケトルの底の薬剤粉末チャージに衝突するHFA134aの力はDHE粒子を噴射剤中に懸濁/分散させるために十分である。ケトル内のHFA134aレベルがライトニングミキサーのプロペラの上まできたらミキサーを始動させ、懸濁液を中速で連続撹拌する。HFA134aの50%の添加完了後20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134aの残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0041】
HFA134a+界面活性剤を添加する製剤の場合には、(冷却ジャケット、Silverstone Homogenizer、Lightning Mixer、及び四ツ口カバーを装着し、重量計に載せた)混合ケトルを−27℃まで冷却し、乾燥窒素ブランケット下におく。HFA134aの使用予定総質量の約20%がケトルに導入されるまで、2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通してHFA134aをケトルにポンプ充填する。別に界面活性剤を秤量し、ミキサーで連続撹拌下に容器内のHFA134aに添加する。界面活性剤の添加完了後、ホモジナイザーを始動させ、混合物を約20分間音波処理する。更にHFA134aの30%を2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通して容器にポンプ導入する。音波処理器を停止し、ライトニングミキサーを始動させる。薬剤粉末を容器に添加し、中速で連続撹拌する。20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134aの残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0042】
HFA227とHFA134aの混合物
HFA227とHFA134aの両方を添加し、界面活性剤を添加しない製剤の場合には、(冷却ジャケット、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルに乾燥粉末を秤量投入する。ケトルを0℃まで冷却し、乾燥窒素で約500ミリバールに加圧した後、HFA227の使用予定総質量の約100%を充填する。HFA227は500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通して容器にポンプ導入する。ケトルの底の薬剤粉末チャージに衝突するp227の力はDHE粒子を噴射剤中に懸濁/分散させるために十分である。ケトル内のHFA227レベルがライトニングミキサーのプロペラの上まできたらミキサーを始動させ、懸濁液を中速で連続撹拌する。HFA227の添加完了後20分間混合後、混合物を缶にポンプ導入し、(HFA134a/HFA227の最終重量比に応じて)所期最終重量の約30%〜50%から70%までを各缶に充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134a質量の100%を加圧下に充填し、100%重量とする。缶を超音波水浴で15分間音波処理し、水試験、吐出試験、秤量チェックし、試験に供する。
【0043】
HFA227とHFA134aの両方と界面活性剤を添加する製剤の場合には、(冷却ジャケット、Silverstone Homogenizer、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルを0℃まで冷却し、乾燥窒素ブランケット下におく。HFA227の使用予定総質量の約100%がケトルに導入されるまで、500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通してHFA227をケトルにポンプ充填する。別に界面活性剤を秤量し、ミキサーで連続撹拌下に容器内のHFA227に添加する。界面活性剤の添加完了後、ホモジナイザーを始動させ、ケトルを−27℃まで冷却しながら混合物を約20〜40分間音波処理する。HFA134a総量の約30%を2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通して容器にポンプ導入する。音波処理器を停止し、ライトニングミキサーを始動させる。薬剤粉末を容器に添加し、中速で連続撹拌する。20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134aの残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0044】
アルコール添加、界面活性剤添加又は不添加
極性化合物(例えばアルコール類)を添加する製剤の場合には、(冷却ジャケット、Silverstone Homogenizer、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルを0℃まで冷却し、乾燥窒素ブランケット下におく。HFA227の使用予定総質量の約100%がケトルに導入されるまで、500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通してHFA227をケトルにポンプ充填する。界面活性剤とアルコールを別に秤量後、界面活性剤が溶けるまで混合する。ミキサーで連続撹拌下に精密定量ポンプを使用して界面活性剤/アルコール溶液を約20分間かけてケトルにポンプ導入する。界面活性剤/アルコール溶液の添加完了後、ホモジナイザーを始動させ、ケトルを−27℃まで冷却しながら混合物を約20〜40分間音波処理する。HFA134a総量の約30%を2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通して容器にポンプ導入する。音波処理器を停止し、ライトニングミキサーを始動させる。薬剤粉末を容器に添加し、中速で連続撹拌する。20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134aの残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。界面活性剤を添加しない特殊な場合には、界面活性剤をアルコールに添加しない点を除いて同一手順に従う。
【0045】
以上の開示に基づき、当業者は他の種々の変形、特徴、又は改良を想到することができる。このような他の変形、特徴及び改良も本発明に含むものとする。引用文献はその開示内容全体を参考資料として本明細書に組込む。
【技術分野】
【0001】
本発明はジヒドロエルゴタミン又は医薬的に許容可能なその塩の肺吸入投与用医薬エアゾール製剤に関する。
【背景技術】
【0002】
セロトニンアゴニストの投与は各種疾患状態及び症状の治療に定着しており、限定されないが、急性偏頭痛の治療が挙げられる。最も広く使用されているセロトニンアゴニストはトリプタンであり、スマトリプタン、ゾルミトリプタン、ナラトリプタン、リザトリプタン、エレトリプタン、フロバトリプタン及びアルモトリプタンが挙げられる。これらの化合物はセロトニン5−HT1D/1B受容体と特異的に結合する。比率は劣るが、酒石酸エルゴタミンやジヒドロエルゴタミン等のエルゴットアルカロイドも各種疾患状態及び症状に使用されており、限定されないが、急性偏頭痛の治療が挙げられる。ジヒドロエルゴタミンは慢性連日性頭痛(旧名称:「変容性」偏頭痛)に広く使用されている。エルゴットアルカロイドは5−HT1D、5−HT1A、5−HT2A、5−HT2C、ノルアドレナリンα2A、α2B、及びα、ドーパミンD2L及びD3受容体との結合に関してトリプタンよりも選択性が低い。
【0003】
エルゴットアルカロイドはその潜在的利点にも拘わらずあまり使用されていないが、その一因はこれらの化合物を適切な送達用製剤で安定化しにくい点にある。安定化の問題の結果、エルゴットアルカロイド化合物は送達が安定せず、投薬が安定しない。ジヒドロエルゴタミンは経口及び鼻腔内投与でも使用されている(Migranal(登録商標)−Novartis、US5942251、EP0865789A3、及びBE1006872A)が、筋肉内注射又は静脈内投与により投与することが最も多い(D.H.E.45(登録商標)−Novartis)。最近、単剤及び非ステロイド性鎮痛薬との併用剤としてのジヒドロエルゴタミン製剤が筋肉内自己注射器用に開発された(米国出願20030040537、US6077539、WO005781A3、EP1165044A2、CN1347313T、及びAU0038825A5)。鼻腔内投与による治療用にも単剤又は強力鎮痛薬との併用剤としてのジヒドロエルゴタミンが製剤化されている(US4462983、US5756483、EP0689438A1、AU6428894A1、及びWO9422445A3)。ジヒドロエルゴタミンの舌下投与用スプレー又はエアゾール製剤も開発されている(米国出願20030017994)。酒石酸エルゴタミンは注射、座剤による直腸、及び定量噴霧式吸入器(Medihaler−Ergotamine(登録商標)−3M)による吸入でも投与されているが、経口又は舌下投与が最も一般的である。
【0004】
エルゴタミンとジヒドロエルゴタミンは直腸、経口、舌下及び鼻腔内バイオアベイラビリティーが非常に低く、投与量の2%〜10%しか体循環に到達しない。注射は痛みを伴い、局所炎症を生じ、コンプライアンスを低下させ、IV投与には費用のかかる臨床監督が必要であるため、エルゴットアルカロイドを肺吸入により投与できるならば非常に望ましい。エルゴットアルカロイドを肺吸入すると、肺胞上皮から毛細血管循環に迅速に輸送され、肺におけるエルゴットアルカロイド化合物の代謝機構が相対的に減少するため、その薬剤が標的受容体に到達する前の初回通過代謝が最小になる。肺送達は酒石酸エルゴタミンの場合に92%までのバイオアベイラビリティーに達することが立証されている。肺吸入投与は更に偏頭痛投薬に特有の胃腸障害が回避され、エルゴットアルカロイド化合物の苦味による鼻腔内及び舌下投与時の不味さが最小限になる。肺吸入は注射の侵襲性に伴う投与への抵抗感と臨床監督費用が最小限になる。
【0005】
吸入投与用酒石酸エルゴタミン製剤は最近の多数の文献に記載されており(US646159、US6451287、US6395300、US6395299、US6390291、US6315122、US6179118、US6119853、US6406681)、特に噴射剤を利用した定量噴霧式吸入器(MDI)製剤が記載されている(US5720940、US5683677、US5776434、US5776573、US6153173、US6309624、US6013245、US6200549、US6221339、US6236747、US6251368、US6306369、US6253762、US6149892、US6284287、US5744123、US5916540、US5955439、US5992306、US5849265、US5833950、US5817293、US6143277、US6131566、US5736124、US5696744)。これらの文献の多くは酒石酸エルゴタミンの安定な製剤を製造するために賦形剤又は溶媒を必要とする。1980年代後期に3Mは酒石酸エルゴタミンの肺吸入製剤(Medihaler−Ergotamine(登録商標)−3M)を開発し、認可を受け、販売している。しかし、処方が安定しないという問題と、その結果として投薬が安定しないという問題を避けられず、1990年代には市場から撤退した。
【0006】
酒石酸エルゴタミンを使用したドライパウダー吸入装置による吸入用粉末も記載されている(US6200293、US6120613、US6183782、US6129905、US6309623、US5619984、US4524769、US5740793、US5875766、US6098619、US6012454、US5972388、US5922306)。肺投与用水性エアゾール酒石酸エルゴタミン製剤も記載されている(US5813597)。
【0007】
酒石酸エルゴタミンの肺吸入用エアゾール送達はこれらの多数の文献に記載されているが、ジヒドロエルゴタミンの肺吸入送達については殆ど記載されていない(US4462983)。ジヒドロエルゴタミンを酒石酸エルゴタミンと同様に送達することは自明であると思われるが、ジヒドロエルゴタミンは利用可能なエアゾール送達剤形で安定化することが非常に困難であった。効力と活性を維持するためには、賦形剤の不在下又はジヒドロエルゴタミンの効力を低下させず且つ肺に非毒性の賦形剤の存在下で安定化することが可能な溶液、粉末又は懸濁液としてジヒドロエルゴタミンを製剤化する必要がある。ジヒドロエルゴタミンは非常に劣化し易く、光、酸素及び熱に暴露するか又は酸化もしくは加水分解条件に暴露すると劣化する。ジヒドロエルゴタミンの鼻腔スプレー又は注射送達用水性製剤は溶液中のジヒドロエルゴタミンを安定化するためにカフェイン、デキストラン又はシクロデキストラン等のキレート剤又は錯形成剤が必要である。このような安定化剤は局所炎症を引き起こしたり、急性毒性であるため、肺送達に不適合であることが多い。ジヒドロエルゴタミン溶液の劣化を更に抑制するためには、開放に特殊オープナーを必要とする暗色ガラスバイアルにジヒドロエルゴタミン製剤を密封し、濾過してガラス破片を除去し、使用直前に注射器又はスプレーアプリケーターに移す。あるいは、二相自己注射器フォーマット(ガラスバイアル、シリンジ又はブリスターパッケージ(例えばPozen MT300)内で粉末部分を液体と混合する)等でジヒドロエルゴタミン粉末を注射液と混合することにより使用直前にジヒドロエルゴタミン溶液を調製することができる。このような即席製剤アプローチはジェット又は超音波噴霧による肺送達用溶液を調製するように応用することも想定される。しかし、水溶液から吸入エアゾールを発生するために使用されている公知噴霧方法はいずれも効力と活性に多様な直接変化を生じるに十分な熱及び酸素濃度にジヒドロエルゴタミンを暴露するものである。安定な製剤を獲得又はエアゾール化する際に切り離せないこれらの問題により、ジヒドロエルゴタミンはまだ肺吸入投与に適していない。
【0008】
別のエアゾール送達法は加圧式定量噴霧式吸入器(pMDI)を使用する方法であり、ハロカーボン噴射剤により薬剤の溶液又は懸濁液を小孔に通し、噴射剤液滴の内側の薬剤から構成される微細な吸入可能なミストを発生する。安定なpMDI製剤を製造するためには、薬剤は噴射剤とpMDIバルブ装置の内側で安定であり且つこれらと物理化学的に適合性の溶液又は微粒子懸濁液を形成できなければならない。点鼻液又は注射液について上述した溶液安定性と肺毒性の問題はpMDI製剤にも当てはまり、更に噴射剤適合性の要件が加わり、水やアルコール等の肺適合性であると一般に認められている試薬を使用できない。懸濁液では、約5.8ミクロン未満(肺深部浸透に必要な空気力学的質量中央径)の微粒子が必要であり、粒子は懸濁液中で安定でなければならない。このような粒子は噴射剤に分散できる粉末とするように粉砕、超微粉砕、微粉砕等の摩砕法、又は噴霧乾燥、溶液析出、もしくは凍結乾燥等の多相析出法によりバルク薬剤から製造される。これらの方法は熱又は化学的相互作用により薬剤の物理化学的性質を直接変化させることが多い。ジヒドロエルゴタミンは非常に不安定な化合物であるので、これらの方法は噴射剤に再分散できる粉末を製造するには不適切であるか、あるいは最初は粉末が分散可能であっても、粒度が経時的に増加したり、製剤と接触することによりその化学的組成が経時的に変化することが分かっている。この不安定により効力、活性が変化したり、粒度が増加して3.0ミクロンを上回り、pMDI懸濁液製剤アプローチをジヒドロエルゴタミンエアゾール送達に利用できなくなる。
【0009】
吸入可能なエアゾールを発生する別の方法は薬剤の粉末製剤を使用者の呼気に分散させて肺に吸入するドライパウダー吸入器の使用である。pMDI懸濁液製剤について上述した問題は安定な乾燥粉末製剤の製造にも当てはまる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】米国特許第5942251号明細書
【特許文献2】欧州特許出願公開第0865789号明細書
【特許文献3】ベルギー特許出願公開第1006872号明細書
【特許文献4】米国特許出願公開第2003/0040537号明細書
【特許文献5】米国特許第6077539号明細書
【特許文献6】国際公開第00/005781号
【特許文献7】欧州特許出願公開第1165044号明細書
【特許文献8】中国特許出願公開1347313号明細書
【特許文献9】オーストラリア特許出願公開0038825号明細書
【特許文献10】米国特許第4462983号明細書
【特許文献11】米国特許第5756483号明細書
【特許文献12】欧州特許出願公開第0689438号明細書
【特許文献13】オーストラリア特許出願公開6428894号明細書
【特許文献14】国際公開第94/22445号
【特許文献15】米国特許出願公開第2003/0017994号明細書
【特許文献16】米国特許第646159号明細書
【特許文献17】米国特許第6451287号明細書
【特許文献18】米国特許第6395300号明細書
【特許文献19】米国特許第6395299号明細書
【特許文献20】米国特許第6390291号明細書
【特許文献21】米国特許第6315122号明細書
【特許文献22】米国特許第6179118号明細書
【特許文献23】米国特許第6119853号明細書
【特許文献24】米国特許第6406681号明細書
【特許文献25】米国特許第5720940号明細書
【特許文献26】米国特許第5683677号明細書
【特許文献27】米国特許第5776434号明細書
【特許文献28】米国特許第5776573号明細書
【特許文献29】米国特許第6153173号明細書
【特許文献30】米国特許第6309624号明細書
【特許文献31】米国特許第6013245号明細書
【特許文献32】米国特許第6200549号明細書
【特許文献33】米国特許第6221339号明細書
【特許文献34】米国特許第6236747号明細書
【特許文献35】米国特許第6251368号明細書
【特許文献36】米国特許第6306369号明細書
【特許文献37】米国特許第6253762号明細書
【特許文献38】米国特許第6149892号明細書
【特許文献39】米国特許第6284287号明細書
【特許文献40】米国特許第5744123号明細書
【特許文献41】米国特許第5916540号明細書
【特許文献42】米国特許第5955439号明細書
【特許文献43】米国特許第5992306号明細書
【特許文献44】米国特許第5849265号明細書
【特許文献45】米国特許第5833950号明細書
【特許文献46】米国特許第5817293号明細書
【特許文献47】米国特許第6143277号明細書
【特許文献48】米国特許第6131566号明細書
【特許文献49】米国特許第5736124号明細書
【特許文献50】米国特許第5696744号明細書
【特許文献51】米国特許第6200293号明細書
【特許文献52】米国特許第6120613号明細書
【特許文献53】米国特許第6183782号明細書
【特許文献54】米国特許第6129905号明細書
【特許文献55】米国特許第6309623号明細書
【特許文献56】米国特許第5619984号明細書
【特許文献57】米国特許第4524769号明細書
【特許文献58】米国特許第5740793号明細書
【特許文献59】米国特許第5875766号明細書
【特許文献60】米国特許第6098619号明細書
【特許文献61】米国特許第6012454号明細書
【特許文献62】米国特許第5972388号明細書
【特許文献63】米国特許第5922306号明細書
【特許文献64】米国特許第5813597号明細書
【発明の概要】
【発明が解決しようとする課題】
【0011】
ジヒドロエルゴタミンの吸入送達に適した製剤が当分野に存在していないことは明白である。
【課題を解決するための手段】
【0012】
本発明は肺エアゾール又は鼻腔スプレー吸入により乾燥粉末と噴射剤懸濁液を投与するためのジヒドロエルゴタミン又は医薬的に許容可能なその塩の安定な新規製剤について記載する。このような製剤は限定されないが、偏頭痛等の各種疾患状態及び症状の治療に使用することができる。更に、ジヒドロエルゴタミン又は医薬的に許容可能なその塩の新規製剤の製造方法も記載する。
【図面の簡単な説明】
【0013】
【図1】乾燥粉末により送達したDHE粒子の迅速な吸収を例証する薬物動態データを示す。この試験では、DHE粒子をDPIフォーマット(総用量1mg)と静脈内ボーラス(総用量0.5mg)によりイヌに投与し、イヌ血清中のDHE濃度を所定間隔で測定した。
【発明を実施するための形態】
【0014】
吸入投与される活性化合物は局所、又は全身作用を示すために肺深部に浸透する必要がある。これを達成するためには、活性化合物の粒子は約0.5〜5.8μmの空気力学的質量中央径(MMAD)を越えない粒径でなければならない。この最適粒度範囲の粒子は結晶化段階中には殆ど生成されず、0.5〜5.8μm範囲の粒子を製造するためには二次処理が必要である。このような二次処理としては限定されないが、ジェットミル、超微粉砕及び機械的粉砕による摩砕、多相析出(例えば溶液析出、噴霧乾燥、凍結乾燥)が挙げられる。このような二次処理は大きな熱及び機械的勾配を伴い、活性化合物の効力や活性を直接劣化させたり、位相欠陥や化学的不安定を引き起こし、その後の処理又は保存時に粒子の寸法、形状又は化学的組成を変化させる。これらの二次処理は更に実質的量の自由エネルギーを粒子に付与し、この自由エネルギーは一般に粒子の表面に貯蔵される。粒子により貯蔵されたこの自由エネルギーは凝集力を生じ、この自由エネルギーを低下させるため、粒子を集塊にさせる。凝集プロセスが長引くと、吸入可能な活性化合物粒子が粒状製剤中に存在しなくなったり、凝集相互作用の強度が大きいためにこのような粒子を粒状製剤から生成できなくなる。吸入送達の場合には吸入装置による送達に適した形状で粒子を保存しなければならないのでこのプロセスは悪化する。粒子は比較的長時間保存されるので、凝集プロセスは保存中に増進する可能性がある。粒子の凝集は吸入装置による粒子の再分散を妨げ、肺送達及び鼻腔送達に必要な吸入可能な粒子を生成できなくなる。
【0015】
更に、キャリヤー及び/又は賦形剤の使用等の凝集作用を解消するために使用されている製薬分野の慣用方法の大半は、これらの物質の肺毒物学的プロフィルが望ましくないことから吸入用医薬形態では使用することができない。
【0016】
本発明は乾燥粉末と噴射剤懸濁液を肺エアゾール吸入又は鼻腔スプレー吸入により投与するためのジヒドロエルゴタミン又は医薬的に許容可能なその塩(本明細書ではDHEと言う)の安定な新規製剤について記載する。1態様では、DHEはメシル酸塩として使用される。DHE粉末は超臨界流体法を使用して製造される。超臨界流体法は吸入送達用DHE粒子の製造に有意利点を提供する。重要な点として、超臨界流体法は所望粒度の吸入可能な粒子を1段階で製造し、粒度を低減するために二次処理の必要がない。従って、超臨界流体法により製造された吸入可能な粒子は表面自由エネルギーが低下し、その結果、凝集力が低下し、凝集しにくくなる。製造された粒子は更に均質な粒度分布を示す。更に、製造された粒子は表面が滑らかで結晶構造の再現性があるのでこの点でも凝集しにくくなる。
【0017】
このような超臨界流体法としては、急速膨張法(RES)、溶液強化拡散法(SEDS)、ガス貧溶媒化法(GAS)、超臨界貧溶媒化法(SAS)、ガス飽和溶液析出法(PGSS)、圧縮貧溶媒析出法(PCA)、エアゾール溶媒抽出法(ASES)、又はこれらの任意組み合わせが挙げられる。これらの各超臨界流体法の基礎となる技術は当分野で周知であるので、本明細書では記載しない。1特定態様では、使用する超臨界流体法はPalakodatyらにより米国出願2003 0109421に記載されているようなSEDS法である。
【0018】
超臨界流体法はドライパウダー吸入器(DPI)フォーマットで既定量吐出により直接使用することができる乾燥粒子を製造し、あるいは製造された粒子を定量噴霧式吸入器(MDI)フォーマットで医薬的に許容可能な噴射剤等の懸濁媒体に直接懸濁/分散させることができる。製造された粒子は使用する超臨界流体法と使用条件に応じて結晶質と非晶質の場合がある(例えば、SEDS法は非晶質粒子を製造することが可能である)。上述のように、製造された粒子は慣用方法により製造された粒子に比較して優れた特徴をもち、限定されないが、滑らかで均質な表面、低エネルギー、均質な粒度分布及び高純度が挙げられる。これらの特徴は粒子の物理化学的安定性を増進し、DPIフォーマット又はMDIフォーマットで使用する場合に粒子の分散を促進する。
【0019】
粒度はエアゾール粒子の投与によりDHE粒子を肺に吸入できるように選択する必要がある。1態様では、粒度分布は20ミクロン未満である。代替態様では、粒度分布はカスケードインパクターにより測定したMMAD約0.050ミクロン〜10.000ミクロンであり、更に別の代替態様では、粒度分布はカスケードインパクターにより測定したMMAD約0.400〜3.000ミクロンが好ましい。上記超臨界流体法はこれらの範囲の下端の粒度を生じる。
【0020】
DPIフォーマットでは、当分野で公知の通り、静電的方法、低温測定法、又は慣用方法によりDHE粒子を剤形に定量分配することができる。DHE粒子は単独(ニート)で使用してもよいし、キャリヤーや分散粉末等の1種以上の医薬的に許容可能な賦形剤と併用してもよく、限定されないが、ラクトース、マンノース、マルトース等、又は界面活性剤コーティングが挙げられる。1好適製剤では、付加賦形剤を添加せずにDHE粒子を使用する。当分野で一般に使用されている簡便な剤形の1つはアルミ箔ブリスターパックである。この態様では、DPIで使用するために付加賦形剤を添加せずにDHE粒子をアルミ箔ブリスターパックに定量充填する。典型的1回吐出量は約0.050mg〜2.000mg、又は約0.250mg〜0.500mgとすることができる。当分野で公知の通り、ブリスターパックに穴を開け、静電力、空気力学的力、機械的力、又はその任意組み合わせにより呼気に分散させることができる。1態様では、既定1回吐出量の>25%が吸入により肺に送達され、代替態様では、既定1回吐出量の>50%が吸入により肺に送達され、更に別の代替態様では、既定1回吐出量の>80%が吸入により肺に送達される。DPIフォーマットの送達によるDHE粒子の吸入可能画分(米国薬局方、第601章に従って測定)は25%〜90%であり、ブリスターパック内の残留粒子は既定1回吐出量の5%〜既定1回吐出量の55%である。
【0021】
MDIフォーマットでは、医薬的に許容可能な噴射剤等の懸濁媒体に粒子を直接懸濁/分散させることができる。1特定態様では、懸濁媒体は噴射剤である。噴射剤はDHE粒子の溶媒とならないことが望ましい。適切な噴射剤としては限定されないが、1,1,1,2−テトラフルオロエタン(HFA134a)及び1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパン(HFA227)等のC1−4ヒドロフルオロアルカンが挙げられ、単独又は任意組み合わせで使用することができる。二酸化炭素とアルカン(例えばペンタン、イソペンタン、ブタン、イソブタン、プロパン及びエタン)も噴射剤として使用することができ、又は上記C1−4ヒドロフルオロアルカン噴射剤とブレンドすることができる。ブレンドの場合には、噴射剤は前記二酸化炭素0〜25%とアルカン0〜50%を含有することができる。1態様では、DHE粒子分散系は界面活性剤を添加せずに得られる。代替態様では、DHE粒子分散系は必要に応じて界面活性剤を添加することができ、界面活性剤はDHEに対して質量比0.001〜10とする。典型的界面活性剤としては、オレイン酸塩、ステアリン酸塩、ミリスチン酸塩、アルキルエーテル、アルキルアリールエーテル、ソルビン酸及び吸入送達用化合物製剤化分野の当業者により使用されている他の界面活性剤、又は上記のものの任意組み合わせが挙げられる。特定界面活性剤としては限定されないが、モノオレイン酸ソルビタン(SPAN−80)とミリスチン酸イソプロピルが挙げられる。DHE粒子分散系は更に界面活性剤を使用する場合にその溶解を助長するために少量の極性溶媒を添加することができる。適切な極性化合物としてはC2−6アルコール及びポリオール(例えばエタノール、イソプロパノール、ポリプロピレングリコール及びこれらの任意組み合わせ)が挙げられる。極性化合物は噴射剤に対して質量比0.0001%〜4%で添加することができる。4%を越える量の極性溶媒はDHEと反応したり、DHEを溶解する恐れがある。1特定態様では、極性化合物はエタノールであり、噴射剤に対して質量比0.0001〜1%で使用する。DHE粒子製剤には医薬的に許容可能な噴射剤及び界面活性剤と平衡状態になる量を上回る量の水又はヒドロキシル含有化合物を添加しない。水及びヒドロキシル含有化合物がその平衡点となるように噴射剤と界面活性剤(使用する場合)を使用前に水及びヒドロキシル含有化合物と接触させてもよい。
【0022】
噴射剤/界面活性剤組成に合わせて標準定量バルブ(例えばNeotechnics、Valois、又はBespak製品)及び缶(例えばPressPart又はGemi製品)を適宜使用することができる。1〜数百回の吐出回数を達成するためには2.0ml〜17mlの缶充填容量を使用することができる。充填容量に関係なく特定吐出回数を制限するように場合によりロックアウト機構付き吐出回数カウンターを備えることもできる。噴射剤懸濁液中のDHEの総質量は一般に噴射剤100μl当たりDHE0.100mg〜2.000mgとする。50〜100μlの標準MDI定量バルブを使用すると、1プッシュ0.050μg〜1.000μgが定量噴霧される。吸入同調を最大にするために呼気連動型アクチュエーターを使用することが好ましいが、治療効力を達成するために必須ではない。このようなMDIの吸入可能画分は(米国薬局方、第601章に従って測定した場合に)1回吐出量の25%〜75%である。
【0023】
以下、実施例により本発明の所定態様を例証するが、以下の実施例により本発明を限定するものではない。
【実施例1】
【0024】
乾燥粉末DHEの安定性
Palakadotyら(米国出願20030109421)により記載されているようなSEDS超臨界流体法によりDHE粒子を製造した。製造したDHE粒状粉末をHPLCによりアッセイして純度を測定し、当分野で公知の標準操作条件下にAerosizer計器を使用して空気力学的質量中央径を測定した。表1から明らかなように、製造時にDHE粒子はHPLC純度98.3%及び粒度1.131ミクロン(MMAD)であった。DHE粒状粉末を(i)3ケ月間40℃及び75%相対湿度と、(ii)25℃及び60%相対湿度の標準加速エージング条件下においた。DHE粒子を密閉暗色ガラス容器に入れ、適当な恒温炉に3ケ月間保管した。3ケ月後に純度と粒度を再び上記のように測定した。表1から明らかなように、3ケ月間40℃及び75%相対湿度で静置したサンプルは純度102.0%及び粒度1.091ミクロン(MMAD)であった。同様に、25℃及び60%相対湿度で静置したサンプルは純度101.0%及び粒度1.044ミクロン(MMAD)であった。
【0025】
これらのデータによると、超臨界流体技術を使用して製造したDHE粒状粉末は製造時と3ケ月間加速環境エージング後の再分散性が優れていた。重要な点として、DHE粒子は安定しており、3ケ月間加速環境エージング後でも肺深部浸透に適した吸入可能な粒度範囲(<3.0ミクロン)であった。従来の手段により適切なDHE粒子を製造することは困難であったので、このような結果は全く予想外であった。これらの結果によると、超臨界流体技術を使用して製造したDHE粒状粉末はDPIフォーマットによる肺送達に適している。注目すべき点として、試験したDHE粒状粉末は賦形剤を添加しておらず、従来技術製剤に対して有意な進歩である。上記に試験したものと同一ロット(no.3801087)のDHE粒状粉末を下記のようにMDIフォーマット用製剤例で使用した。
【0026】
【表1】

【実施例2】
【0027】
MDI式肺送達用DHE製剤
上記のように、賦形剤を添加するか又は添加せずにDHE粒子の各種製剤を製造することができるが、(噴射剤以外に)賦形剤を添加せずに製剤を製造することが好ましい。製剤で使用したDHE粒子は実施例1に記載したものと同一ロットから入手した。
【0028】
PressPart製塗装AI缶にBespak BK357バルブとBespak 636アクチュエーターを装着し、1プッシュ総容量が100μlとなるように各製剤をパッケージングした。本発明の教示の例示である製剤を表2に示し、これらの製剤の性能特性を表3に示す。表2に示す製剤は本発明と特許請求の範囲を限定するものではなく、単に本発明の教示を例証するための特定態様の例として記載する。DHE製剤は下記一般方法に記載するように製造した。表2に記載する製剤では非晶質DHE粒子と結晶質DHE粒子に加え、非超臨界流体法により製造した超微粉砕結晶質DHE粒子も使用した。
【0029】
【表2】

【0030】
製剤の微粒子率を測定すると共に、各種製剤に含まれるDHE粒子の空気力学的質量中央径を測定した。微粒子率は米国薬局方第601章に記載の方法及び規格に従い、Andersonカスケードインパクター(28.3LPM)を使用して測定した。表3中、微粒子率は検出器に衝撃を与える直径4.8ミクロン以下のDHE粒子の百分率を示す。これは任意所与製剤で対象の肺に送達される薬剤の量の概数値である。微粒子吐出量はプッシュ段階中に送達される薬剤の実際の量である。MMADは当分野の標準プロトコールを使用してAerosizerにより測定した。表3から明らかなように、DHE製剤の組成は製剤の性能特性に有意影響を与えた。
【0031】
SEDS超臨界流体法により製造したDHE結晶質粒子は一般に同一技術により製造したDHE非晶質粒子よりも優れた結果を示した。SEDSにより製造した結晶質粒子と非晶質粒子(サンプル1,4及び8)はいずれも標準超微粉砕結晶質DHE粒子(サンプル5及び6)に比較して有意に高い性能を示した。例えば、サンプル番号10(SEDSにより製造した結晶質DHEを100%HFA134a+ミリスチン酸イソプロピル0.2mgに分散)は微粒子率44.6%(14.4倍)及び粒度2.2ミクロン(MMAD)であったが、これに対してサンプル番号5(超微粉砕結晶質DHEを100%HFA134a+ミリスチン酸イソプロピル0.2mgに分散)は微粒子率が僅か3.1%であり、粒度は5.7ミクロン(MMAD)であった。この比較は肺吸入送達用DHE粒子の製剤化において従来技術で遭遇する問題、即ち吸入可能なDHE粒子を得にくいという問題を実証するものである。特に好ましい製剤はサンプル2及び18である。サンプル2はSEDSにより製造した結晶質DHEを100%HFA227に分散させ、サンプル18はSEDSにより製造した結晶質DHEを70%HFA227/30%HFA134a混合物に分散させたものである。サンプル2は微粒子率41.2%と粒度MMAD2.3ミクロンを示し、サンプル18は微粒子率47.9%と粒度MMAD1.9ミクロンであった。これらの各製剤はDHEの肺送達に優れた品質を示す。
【0032】
【表3】

【実施例3】
【0033】
DHEの肺送達
DPI又はMDIによる送達では、DHE粒子(DPI態様)又はDHE粒子分散系(MDI態様)の1回吐出量の高比率が(亜区域細気管支を越えて)肺末梢に送達され、肺中枢又は解剖学的死腔に送達される比率は低く、口腔咽頭体腔に送達される比率はほんの僅かである。例えば、表3の微粒子率データは上記各製剤で肺に投与されるDHEの百分率を示す。表3から明らかなように、上記超臨界流体法を使用して製造した結晶質DHEでは、DHE総吐出量の31.7%〜51.8%の比率が肺に送達される。特に、サンプル2及び18は界面活性剤や他の材料を添加せずに(即ち噴射剤しか添加せずに)41.2%と47.9%の送達比率を示す。迅速且つ効率的な毛細血管循環への吸収を生じるような有意量のDHEが肺胞体腔に送達される。1態様では、DHEのピーク血中又は血漿中濃度は5〜10分以内に出現し、迅速な治療作用を生じることができた。このような薬物動態応答は静脈内投与と同等であり、経口投与(30分〜2時間)、舌下(30分〜2時間)、鼻腔内(15分〜30分)及び筋肉内注射(15分〜25分)よりも有意に速い。
【0034】
図1は乾燥粉末により送達したDHE粒子の迅速な吸収を例証する薬物動態データを示す。この試験では、DHE粒子をDPIフォーマット(総用量1mg)と静脈内ボーラス(総用量0.5mg)によりイヌに投与し、イヌ血清中のDHE濃度を所定間隔で測定した。図1から明らかなように、吸入後30秒以内に測定可能な血中DHE濃度が出現し、ピーク濃度は吸入後5〜10分に出現した。更に、血中DHE濃度は静脈内送達に比較して長期間高レベルに維持された。
【0035】
下表4は吸入後のイヌ血清中のDHEのTmaxとF(バイオアベイラビリティー)を示す(n=3)。同表から明らかなように、Tmaxは平均6.7分(標準偏差2.9分)で出現し、DHEのバイオアベイラビリティーは52%(標準偏差27%)であった。これらの結果は吸入経路によるDHEの優れた肺送達とバイオアベイラビリティーを示す。
【0036】
【表4】

【0037】
製剤の製造
以下のプロトコールは表2及び3に記載した製剤の製造方法の概要である。以下の記載は非限定的な例示であり、製剤の他の製造方法も利用できる。
【0038】
HFA227
噴射剤としてHFA227を添加し、界面活性剤を添加しない製剤の場合には、(冷却ジャケット、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルに乾燥DHE粉末を秤量投入する。ケトルを0℃まで冷却し、乾燥窒素ブランケット下においた後、HFA227の使用予定総質量の約50%を充填する。HFA227は500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通して容器にポンプ導入する。ケトルの底の薬剤粉末チャージに衝突するHFA227の力はDHE粉末を噴射剤中に懸濁/分散させるために十分である。ケトル内のHFA227レベルがライトニングミキサーのプロペラの上まできたらミキサーを始動させ、懸濁液を中速で連続撹拌する。HFA227(使用予定総容量の50%)の添加後20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してp227の残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0039】
HFA227+界面活性剤を添加する製剤の場合には、(冷却ジャケット、Silverstone Homogenizer、Lightning Mixer、及び四ツ口カバーを装着し、重量計に載せた)混合ケトルを0℃まで冷却し、乾燥窒素ブランケット下におく。HFA227の使用予定総質量の約20%がケトルに導入されるまで、500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通してHFA227をケトルにポンプ充填する。別に界面活性剤を秤量し、ミキサーで連続撹拌下に容器内のHFA227に添加する。界面活性剤の添加完了後、ホモジナイザーを始動させ、混合物を約20分間音波処理する。更にp227総量の30%を500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通して容器にポンプ導入する。音波処理器を停止し、ライトニングミキサーを始動させる。薬剤粉末を容器に添加し、中速で連続撹拌する。20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してp227の残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0040】
HFA134a
HFA134aを添加する製剤の場合には、(冷却ジャケット、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルに乾燥粉末を秤量投入する。ケトルを−27℃まで冷却し、乾燥窒素で約2000ミリバールに加圧した後、HFA134aの使用予定総質量の約50%を充填する。HFA134aは2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通して容器にポンプ導入する。ケトルの底の薬剤粉末チャージに衝突するHFA134aの力はDHE粒子を噴射剤中に懸濁/分散させるために十分である。ケトル内のHFA134aレベルがライトニングミキサーのプロペラの上まできたらミキサーを始動させ、懸濁液を中速で連続撹拌する。HFA134aの50%の添加完了後20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134aの残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0041】
HFA134a+界面活性剤を添加する製剤の場合には、(冷却ジャケット、Silverstone Homogenizer、Lightning Mixer、及び四ツ口カバーを装着し、重量計に載せた)混合ケトルを−27℃まで冷却し、乾燥窒素ブランケット下におく。HFA134aの使用予定総質量の約20%がケトルに導入されるまで、2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通してHFA134aをケトルにポンプ充填する。別に界面活性剤を秤量し、ミキサーで連続撹拌下に容器内のHFA134aに添加する。界面活性剤の添加完了後、ホモジナイザーを始動させ、混合物を約20分間音波処理する。更にHFA134aの30%を2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通して容器にポンプ導入する。音波処理器を停止し、ライトニングミキサーを始動させる。薬剤粉末を容器に添加し、中速で連続撹拌する。20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134aの残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0042】
HFA227とHFA134aの混合物
HFA227とHFA134aの両方を添加し、界面活性剤を添加しない製剤の場合には、(冷却ジャケット、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルに乾燥粉末を秤量投入する。ケトルを0℃まで冷却し、乾燥窒素で約500ミリバールに加圧した後、HFA227の使用予定総質量の約100%を充填する。HFA227は500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通して容器にポンプ導入する。ケトルの底の薬剤粉末チャージに衝突するp227の力はDHE粒子を噴射剤中に懸濁/分散させるために十分である。ケトル内のHFA227レベルがライトニングミキサーのプロペラの上まできたらミキサーを始動させ、懸濁液を中速で連続撹拌する。HFA227の添加完了後20分間混合後、混合物を缶にポンプ導入し、(HFA134a/HFA227の最終重量比に応じて)所期最終重量の約30%〜50%から70%までを各缶に充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134a質量の100%を加圧下に充填し、100%重量とする。缶を超音波水浴で15分間音波処理し、水試験、吐出試験、秤量チェックし、試験に供する。
【0043】
HFA227とHFA134aの両方と界面活性剤を添加する製剤の場合には、(冷却ジャケット、Silverstone Homogenizer、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルを0℃まで冷却し、乾燥窒素ブランケット下におく。HFA227の使用予定総質量の約100%がケトルに導入されるまで、500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通してHFA227をケトルにポンプ充填する。別に界面活性剤を秤量し、ミキサーで連続撹拌下に容器内のHFA227に添加する。界面活性剤の添加完了後、ホモジナイザーを始動させ、ケトルを−27℃まで冷却しながら混合物を約20〜40分間音波処理する。HFA134a総量の約30%を2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通して容器にポンプ導入する。音波処理器を停止し、ライトニングミキサーを始動させる。薬剤粉末を容器に添加し、中速で連続撹拌する。20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134aの残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。
【0044】
アルコール添加、界面活性剤添加又は不添加
極性化合物(例えばアルコール類)を添加する製剤の場合には、(冷却ジャケット、Silverstone Homogenizer、Lightning Mixer、及び三ツ口カバーを装着し、重量計に載せた)混合ケトルを0℃まで冷却し、乾燥窒素ブランケット下におく。HFA227の使用予定総質量の約100%がケトルに導入されるまで、500ミリバールの圧力下に温度約0℃でステンレス鋼チューブを通してHFA227をケトルにポンプ充填する。界面活性剤とアルコールを別に秤量後、界面活性剤が溶けるまで混合する。ミキサーで連続撹拌下に精密定量ポンプを使用して界面活性剤/アルコール溶液を約20分間かけてケトルにポンプ導入する。界面活性剤/アルコール溶液の添加完了後、ホモジナイザーを始動させ、ケトルを−27℃まで冷却しながら混合物を約20〜40分間音波処理する。HFA134a総量の約30%を2500ミリバールの圧力下に温度約−27℃でステンレス鋼チューブを通して容器にポンプ導入する。音波処理器を停止し、ライトニングミキサーを始動させる。薬剤粉末を容器に添加し、中速で連続撹拌する。20分間混合後、混合物を缶にポンプ導入し、各缶に約50%重量を充填する。各缶の上端部にバルブをかしめ止めし、弁棒を通してHFA134aの残余を加圧下に充填し、100%重量とする。缶を水試験、吐出試験、秤量チェックし、試験に供する。界面活性剤を添加しない特殊な場合には、界面活性剤をアルコールに添加しない点を除いて同一手順に従う。
【0045】
以上の開示に基づき、当業者は他の種々の変形、特徴、又は改良を想到することができる。このような他の変形、特徴及び改良も本発明に含むものとする。引用文献はその開示内容全体を参考資料として本明細書に組込む。
【特許請求の範囲】
【請求項1】
(i)超臨界流体法により製造され、ジヒドロエルゴタミンからなる粒状粉末薬剤と;(ii)1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であるヒドロフルオロアルカン噴射剤を含み、前記粒状粉末薬剤が10ミクロン以下の平均粒度であり、界面活性剤を含まない、吸入送達用安定医薬エアゾール製剤。
【請求項2】
ジヒドロエルゴタミンがメシル酸塩である請求項1に記載のエアゾール製剤。
【請求項3】
前記超臨界流体法が急速膨張法、溶液強化拡散法、ガス貧溶媒化法、超臨界貧溶媒化法、ガス飽和溶液析出法、圧縮貧溶媒析出法及びエアゾール溶媒抽出法から構成される群から選択される請求項1に記載のエアゾール製剤。
【請求項4】
前記超臨界流体法が溶液強化拡散法である請求項1に記載のエアゾール製剤。
【請求項5】
前記ヒドロフルオロアルカン噴射剤が1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であり、前記混合物が30%以下の1,1,1,2−テトラフルオロエタンを含有する請求項1に記載のエアゾール製剤。
【請求項6】
前記ヒドロフルオロアルカン噴射剤が1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であり、前記混合物が30%以下の1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンを含有する請求項1に記載のエアゾール製剤。
【請求項7】
前記粒状粉末薬剤が10分未満でピーク血液中吸収を示す請求項1に記載のエアゾール製剤。
【請求項8】
粒状粉末薬剤が30%以上の吸入可能画分を有する請求項1に記載のエアゾール製剤。
【請求項9】
粒状粉末薬剤が50%以上の吸入可能画分を有する請求項1に記載のエアゾール製剤。
【請求項10】
定量噴霧式吸入器により投与される請求項1に記載のエアゾール製剤。
【請求項11】
前記粒状粉末薬剤が3ミクロン以下の平均粒度である請求項1に記載のエアゾール製剤。
【請求項12】
(i)超臨界流体法により製造され、ジヒドロエルゴタミンからなる粒状粉末薬剤と;(ii)1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であるヒドロフルオロアルカン噴射剤を含有しており、前記粒状粉末薬剤が10ミクロン以下の平均粒度であり、界面活性剤を含まない、前記薬剤の安定分散物である、吸入送達用医薬エアゾール製剤。
【請求項13】
ジヒドロエルゴタミンがメシル酸塩である請求項12に記載のエアゾール製剤。
【請求項14】
前記超臨界流体法が急速膨張法、溶液強化拡散法、ガス貧溶媒化法、超臨界貧溶媒化法、ガス飽和溶液析出法、圧縮貧溶媒析出法及びエアゾール溶媒抽出法から構成される群から選択される請求項12に記載のエアゾール製剤。
【請求項15】
前記超臨界流体法が溶液強化拡散法である請求項12に記載のエアゾール製剤。
【請求項16】
前記ヒドロフルオロアルカン噴射剤が1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であり、前記混合物が30%以下の1,1,1,2−テトラフルオロエタンを含有する請求項12に記載のエアゾール製剤。
【請求項17】
前記ヒドロフルオロアルカン噴射剤が1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であり、前記混合物が30%以下の1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンを含有する請求項12に記載のエアゾール製剤。
【請求項18】
前記粒状粉末薬剤が10分未満でピーク血液中吸収を示す請求項12に記載のエアゾール製剤。
【請求項19】
粒状粉末薬剤が30%以上の吸入可能画分を有する請求項12に記載のエアゾール製剤。
【請求項20】
粒状粉末薬剤が50%以上の吸入可能画分を有する請求項12に記載のエアゾール製剤。
【請求項21】
定量噴霧式吸入器により投与される請求項12に記載のエアゾール製剤。
【請求項22】
前記粒状粉末薬剤が3ミクロン以下の平均粒度である請求項12に記載のエアゾール製剤。
【請求項1】
(i)超臨界流体法により製造され、ジヒドロエルゴタミンからなる粒状粉末薬剤と;(ii)1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であるヒドロフルオロアルカン噴射剤を含み、前記粒状粉末薬剤が10ミクロン以下の平均粒度であり、界面活性剤を含まない、吸入送達用安定医薬エアゾール製剤。
【請求項2】
ジヒドロエルゴタミンがメシル酸塩である請求項1に記載のエアゾール製剤。
【請求項3】
前記超臨界流体法が急速膨張法、溶液強化拡散法、ガス貧溶媒化法、超臨界貧溶媒化法、ガス飽和溶液析出法、圧縮貧溶媒析出法及びエアゾール溶媒抽出法から構成される群から選択される請求項1に記載のエアゾール製剤。
【請求項4】
前記超臨界流体法が溶液強化拡散法である請求項1に記載のエアゾール製剤。
【請求項5】
前記ヒドロフルオロアルカン噴射剤が1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であり、前記混合物が30%以下の1,1,1,2−テトラフルオロエタンを含有する請求項1に記載のエアゾール製剤。
【請求項6】
前記ヒドロフルオロアルカン噴射剤が1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であり、前記混合物が30%以下の1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンを含有する請求項1に記載のエアゾール製剤。
【請求項7】
前記粒状粉末薬剤が10分未満でピーク血液中吸収を示す請求項1に記載のエアゾール製剤。
【請求項8】
粒状粉末薬剤が30%以上の吸入可能画分を有する請求項1に記載のエアゾール製剤。
【請求項9】
粒状粉末薬剤が50%以上の吸入可能画分を有する請求項1に記載のエアゾール製剤。
【請求項10】
定量噴霧式吸入器により投与される請求項1に記載のエアゾール製剤。
【請求項11】
前記粒状粉末薬剤が3ミクロン以下の平均粒度である請求項1に記載のエアゾール製剤。
【請求項12】
(i)超臨界流体法により製造され、ジヒドロエルゴタミンからなる粒状粉末薬剤と;(ii)1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であるヒドロフルオロアルカン噴射剤を含有しており、前記粒状粉末薬剤が10ミクロン以下の平均粒度であり、界面活性剤を含まない、前記薬剤の安定分散物である、吸入送達用医薬エアゾール製剤。
【請求項13】
ジヒドロエルゴタミンがメシル酸塩である請求項12に記載のエアゾール製剤。
【請求項14】
前記超臨界流体法が急速膨張法、溶液強化拡散法、ガス貧溶媒化法、超臨界貧溶媒化法、ガス飽和溶液析出法、圧縮貧溶媒析出法及びエアゾール溶媒抽出法から構成される群から選択される請求項12に記載のエアゾール製剤。
【請求項15】
前記超臨界流体法が溶液強化拡散法である請求項12に記載のエアゾール製剤。
【請求項16】
前記ヒドロフルオロアルカン噴射剤が1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であり、前記混合物が30%以下の1,1,1,2−テトラフルオロエタンを含有する請求項12に記載のエアゾール製剤。
【請求項17】
前記ヒドロフルオロアルカン噴射剤が1,1,1,2−テトラフルオロエタンと1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンの混合物であり、前記混合物が30%以下の1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパンを含有する請求項12に記載のエアゾール製剤。
【請求項18】
前記粒状粉末薬剤が10分未満でピーク血液中吸収を示す請求項12に記載のエアゾール製剤。
【請求項19】
粒状粉末薬剤が30%以上の吸入可能画分を有する請求項12に記載のエアゾール製剤。
【請求項20】
粒状粉末薬剤が50%以上の吸入可能画分を有する請求項12に記載のエアゾール製剤。
【請求項21】
定量噴霧式吸入器により投与される請求項12に記載のエアゾール製剤。
【請求項22】
前記粒状粉末薬剤が3ミクロン以下の平均粒度である請求項12に記載のエアゾール製剤。
【図1】




【公開番号】特開2012−116841(P2012−116841A)
【公開日】平成24年6月21日(2012.6.21)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−374(P2012−374)
【出願日】平成24年1月5日(2012.1.5)
【分割の表示】特願2006−526324(P2006−526324)の分割
【原出願日】平成16年9月10日(2004.9.10)
【出願人】(506081574)マツプ・フアーマシユーテイカルズ・インコーポレーテツド (2)
【Fターム(参考)】
【公開日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願番号】特願2012−374(P2012−374)
【出願日】平成24年1月5日(2012.1.5)
【分割の表示】特願2006−526324(P2006−526324)の分割
【原出願日】平成16年9月10日(2004.9.10)
【出願人】(506081574)マツプ・フアーマシユーテイカルズ・インコーポレーテツド (2)
【Fターム(参考)】
[ Back to top ]

