ジヒドロキノリノン誘導体
【課題】
認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病、又はアレルギー性鼻炎等の疾患の予防又は治療薬を提供すること。
【解決手段】
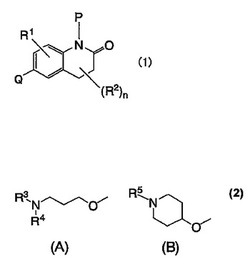
式(1)
【化1】

{式(1)中、Qは、下記式(A)又は(B)で表される基を示す。}
【化2】

で表されるジヒドロキノリノン誘導体、又はその医薬上許容される塩。
認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病、又はアレルギー性鼻炎等の疾患の予防又は治療薬を提供すること。
【解決手段】
式(1)
【化1】

{式(1)中、Qは、下記式(A)又は(B)で表される基を示す。}
【化2】

で表されるジヒドロキノリノン誘導体、又はその医薬上許容される塩。
【発明の詳細な説明】
【背景技術】
【0001】
ヒスタミンは肥満細胞、肺、肝臓、及び胃粘膜などで普段は細胞内の顆粒に貯蔵されており、細胞表面の抗体に抗原が結合するなどの外部刺激を受けて細胞外へ放出される。例えば、肥満細胞が外部から進入した抗原で刺激されると、ヒスタミンは肥満細胞から放出され、血管や平滑筋上に存在するヒスタミンH1(H1)受容体を刺激することによりアレルギー反応を引きおこす。また、胃粘膜上のECL細胞(enterochromaffin−like cell)から放出されたヒスタミンは壁細胞上のヒスタミンH2(H2)受容体を刺激し、胃酸分泌を促進する。これらの事実に基づき、アレルギー疾患治療薬、又は胃潰瘍治療薬としてH1受容体拮抗物質、又はH2受容体拮抗物質の開発が行われ、現在は医薬品として広く使用されている。
【0002】
さらに、ヒスタミンは神経伝達物質として中枢神経及び末梢神経に存在するヒスタミン受容体(ヒスタミンH3(H3)受容体)に作用し、種々の生理機能を発揮することが明らかになった。この受容体は1999年にクローニングされ、その遺伝子配列およびアミノ酸配列が明らかになったが、H1受容体及びH2受容体とのアミノ酸配列相同性は、それぞれ22%、及び21.4%と低いものであった(非特許文献1参照)。H3受容体はシナプス前膜に存在し、ヒスタミンの合成と遊離を制御するオートレセプターとして機能することが示された(非特許文献2参照)。また、H3受容体は、ヒスタミンの放出を制御するとともに、アセチルコリン、セロトニン、ドパミン、ノルアドレナリンといった他の神経伝達物質の放出をも制御することが明らかとなった(非特許文献3参照)。これらの事実は、選択的H3受容体調節物質が神経における神経伝達物質の放出異常に関連した各種疾患の治療薬になりうることを示唆している。
【0003】
実際、合成化合物を用いた動物モデルでの検討結果は、H3受容体拮抗物質、又は逆作動物質が、認知症、アルツハイマー病(非特許文献4及び5参照)、注意欠陥・多動性症(非特許文献6参照)、統合失調症(非特許文献7参照)、てんかん、中枢性痙攣などの治療薬として利用できる可能性を示している。
【0004】
また、H3受容体が摂食行動に関与することが示されており(非特許文献8参照)、H3受容体拮抗物質、又は逆作動物質の適応疾患として摂食障害、肥満、糖尿病、高脂血症などの代謝系疾患も想定される。
【0005】
また、ヒスタミンは脳内の日周リズムを調節し、覚醒と睡眠のバランスを保つ役割があることが示されており(非特許文献9及び10参照)、H3受容体拮抗物質、又は逆作動物質の適応疾患として睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病など睡眠障害に伴う疾患も想定される。
【0006】
さらに、H3受容体は鼻粘膜の交感神経に存在していることが示され、H3受容体拮抗物質とH1受容体拮抗物質の併用により鼻閉が顕著に改善されることが報告されている(非特許文献11参照)。このことは、H3受容体拮抗物質、又は逆作動物質は単独で、又はH1受容体拮抗物質との併用でアレルギー性鼻炎等の治療に有用である可能性を示している。
【0007】
H3受容体拮抗物質、又は逆作動物質については、複数のレビューにまとめられており(非特許文献12〜15参照)、これらを参照することができる。初期にはヒスタミン自身をリード化合物としたイミダゾール系化合物が数多く報告されたが、薬物代謝酵素チトクロムP450(CYP)の阻害作用等の懸念が示され、医薬品として開発されるには至っていない。
【0008】
最近になって、非イミダゾール系のH3受容体拮抗物質あるいは逆作動物質の文献及び特許が数多く報告されている(特許文献1〜10参照)。
【0009】
また、ジヒドロキノリノン構造を有するヒスタミンH3受容体拮抗物質も報告されている(特許文献11参照)。しかし、本発明に開示された構造を有する化合物についての報告はない。また、ジヒドロキノリノン骨格を有する化合物として、低酸素症改善剤、血小板粘着抑制剤、抗不整脈剤が報告されている(特許文献12〜14参照)。しかし、H3受容体への親和性、及びヒスタミン受容体サブタイプへの選択性については何ら開示されていない。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】WO2005097751国際公開公報
【特許文献2】WO2005097778国際公開公報
【特許文献3】WO2005118547国際公開公報
【特許文献4】WO2006014136国際公開公報
【特許文献5】WO2006045416国際公開公報
【特許文献6】WO2006046131国際公開公報
【特許文献7】WO2006059778国際公開公報
【特許文献8】WO2006061193国際公開公報
【特許文献9】WO2006107661国際公開公報
【特許文献10】WO2006103057国際公開公報
【特許文献11】WO2004026837国際公開公報
【特許文献12】特開昭62−135423公開特許広報
【特許文献13】特開昭63−045220公開特許広報
【特許文献14】特開昭63−290821公開特許広報
【非特許文献】
【0011】
【非特許文献1】Lovenberg T.W.ら、Molecular pharmacology, 55, 1101-1107, 1999
【非特許文献2】Arrang J-M.ら、Nature, 302, 832-837, 1983
【非特許文献3】Brown R.E. ら、Progress in Neurobiology, 63, 637-672, 2001
【非特許文献4】Huang Y-W.ら、Behavioural Brain Research, 151, 287-293, 2004
【非特許文献5】Komater V.A.ら、Behavioural Brain Research, 159, 295-300, 2005
【非特許文献6】Passani M.B.ら、Neuroscience and Biobehavioral Reviews, 24, 107-113, 2000
【非特許文献7】Fox G.B.ら、J. Pharmacol. Exp. Ther., 313, 176-190, 2005
【非特許文献8】Hancock A.A. ら、Curr. Opin. Investig. Drug, 4, 1190-1197
【非特許文献9】Huang Z-L.ら、Prog. Natr. Acad. Sci., 103, 4687-4692, 2006
【非特許文献10】Babier A.J.ら、Br. J. Pharmacol., 143, 649-661, 2004
【非特許文献11】McLeod R.L.ら、Am. J. Rhinol., 13, 391-399, 1999
【非特許文献12】Schwartz J.C.ら、Trends in Pharmacol. Sci., 7, 24-28, 1986
【非特許文献13】Passani M.B.ら、Trends in Pharmacol. Sci., 25, 618-625, 2004
【非特許文献14】Leurs R.ら、Nature Drug Discovery, 4, 107-122, 2005
【非特許文献15】Leurs R.ら、Drug Discovery Today, 10, 1613-1627, 2005
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的は、ヒスタミンH3受容体へのヒスタミンの結合に対し強力な阻害作用を有し、ヒスタミンH3受容体に起因する障害、例えば、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病、若しくはアレルギー性鼻炎等の疾患の予防剤又は治療剤を見いだすことにある。
【課題を解決するための手段】
【0013】
本発明者らは上記目的のため鋭意研究を行った結果、ジヒドロキノリノン誘導体が、ヒスタミンH3受容体へのヒスタミンの結合に対して強力な阻害活性を有することを見出し、本発明を完成した。
すなわち、本発明は、
(I)式(1)
【0014】
【化1】

[式(1)中、Qは、下記式(A)又は(B)で表される基を示し、
【0015】
【化2】

R1は、水素原子、ハロゲン原子又はC1〜C6アルキルを示し、
R2は、水素原子又はC1〜C6アルキルを示し、
nは、1又は2を示し
R3及びR4は、同一又は異なって、C1〜C6アルキル又はC3〜C7シクロアルキルを示し、
又はR3及びR4は、隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環(該飽和複素環は1又は2個のC1〜C6アルキルで置換されてもよい。)を形成し、
R5は、C1〜C6アルキル(該C1〜C6アルキルは1又は2個のC3〜C7シクロアルキルで置換されてもよい。)又はC3〜C7シクロアルキル(該C3〜C7シクロアルキルは1又は2個のC1〜C6アルキルで置換されてもよい。)を示し、
Pは、アリール、ヘテロアリール又はヘテロシクリル
{該アリール、ヘテロアリール又はヘテロシクリルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・アミノ、
・C1〜C6アルキルアミノ
・C2〜C12ジアルキルアミノ
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・環中に1つ以上の窒素原子を含み、さらに酸素原子、若しくは硫黄原子を含んでもよい単環式飽和複素環が結合したカルボニル、
・カルバモイル、
・ヘテロアリール、
・ヘテロシクリル(該ヘテロシクリルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ヘテロアリールオキシ(該ヘテロアリールオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す。]
で表されるジヒドロキノリノン誘導体、又はその医薬上許容される塩、
【0016】
(II)式(1)が式(2)で表される、
【0017】
【化3】

(I)に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩、
(III)Pがフェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニル{該フェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・ピロリジン−1−イルカルボニル、
・カルバモイル、
・オキサゾリル、
・モルホリン−4−イル又は2−オキソピロリジン−1−イル、(該モルホリン−4−イル又は2−オキソピロリジン−1−イルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ピリダジニルオキシ(該ピリダジニルオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す、
(I)又は(II)に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩、
(IV)(I)〜(III)のいずれかに記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする医薬、又は
(V)(I)〜(III)のいずれかに記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病、又はアレルギー性鼻炎の予防剤又は治療剤である。
【発明の効果】
【0018】
本発明の化合物が、優れたヒスタミンH3受容体拮抗作用を有することを見出した。
【発明を実施するための形態】
【0019】
本明細書で用いられる用語は、以下に定義される通りである。
【0020】
本発明において、「ハロゲン原子」とは、フッ素原子、塩素原子、臭素原子又はヨウ素原子を示す。
【0021】
「C1〜C6アルキル」とは、炭素数1〜6個の直鎖状又は分枝状のアルキル基を示し、例えば、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチル、tert−ブチル、n−ペンチル、イソペンチル、ネオペンチル又はn−ヘキシル等の基を示す。
【0022】
「C3〜C7シクロアルキル」とは、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル又はシクロヘプチル基を示す。
【0023】
「C1〜C6アルコキシ」とは、炭素数1〜6個の直鎖状又は分枝状のアルコキシ基を示し、例えば、メトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、イソブトキシ、sec−ブトキシ、tert−ブトキシ、n−ペンチルオキシ、イソペンチルオキシ、ネオペンチルオキシ又はn−ヘキシルオキシ等の基を示す。
【0024】
「C2〜C7アルコキシカルボニル」とは、炭素数1〜6個の直鎖状又は分枝状のアルコキシ基が結合したカルボニル基を示し、例えば、メトキシカルボニル、エトキシカルボニル、n−プロポキシカルボニル、イソプロポキシカルボニル、n−ブトキシカルボニル、イソブトキシカルボニル、sec−ブトキシカルボニル、tert−ブトキシカルボニル、n−ペンチルオキシカルボニル、イソペンチルオキシカルボニル、ネオペンチルオキシカルボニル又はn−ヘキシルオキシカルボニル等の基を示す。
【0025】
「C1〜C6アルキルアミノ」とは、炭素数1〜6個の直鎖状又は分枝状のアルキル基で置換されたアミノ基を示し、例えば、メチルアミノ、エチルアミノ、n−プロピルアミノ、イソプロピルアミノ、n−ブチルアミノ、イソブチルアミノ、sec−ブチルアミノ、tert−ブチルアミノ、n−ペンチルアミノ、イソペンチルアミノ、ネオペンチルアミノ又はn−ヘキシルアミノ等の基を示す。
【0026】
「C2〜C12ジアルキルアミノ」とは、2つの炭素数1〜6個の直鎖状又は分枝状のアルキル基で置換されたアミノ基を示し、例えば、ジメチルアミノ、ジエチルアミノ、ジ−n−プロピルアミノ、N,N−イソプロピルメチルアミノ、ジ−n−ブチルアミノ、ジイソブチルアミノ、N,N−sec−ブチルエチルアミノ、N,N−tert−ブチルメチルアミノ、ジ−n−ペンチルアミノ、N,N−イソペンチルメチルアミノ、N,N−ネオペンチルメチルアミノ又はジ−n−ヘキシルアミノ等の基を示す。
【0027】
「C2〜C7アルカノイル」とは、炭素数1〜6個のアルキル基が結合したカルボニル基を示し、例えば、アセチル、プロピオニル、ブチリル、イソブチリル、ピバロイル、ペンタノイル、3−メチルブチリル、4,4−ジメチルペンタノイル又はヘプタノイル等の基を示す。
【0028】
「C4〜C8シクロアルキルカルボニル」とは、シクロプロパンカルボニル、シクロブタンカルボニル、シクロペンタンカルボニル、シクロヘキサンカルボニル又はシクロヘプタンカルボニル基を示す。
【0029】
「C2〜C7アルキルアミノカルボニル」とは、炭素数1〜6個の直鎖状又は分枝状のアルキルアミノ基が結合したカルボニル基を示し、例えば、メチルアミノカルボニル、エチルアミノカルボニル、n−プロピルアミノカルボニル、イソプロピルアミノカルボニル、n−ブチルアミノカルボニル、イソブチルアミノカルボニル、sec−ブチルアミノカルボニル、tert−ブチルアミノカルボニル、n−ペンチルアミノカルボニル、イソペンチルアミノカルボニル、ネオペンチルアミノカルボニル又はn−ヘキシルアミノカルボニル等の基を示す。
【0030】
「C3〜C13ジアルキルアミノカルボニル」とは、炭素数2〜12個のジアルキルアミノ基が結合したカルボニル基を示し、例えば、ジメチルアミノカルボニル、ジエチルアミノカルボニル、ジ−n−プロピルアミノカルボニル、N,N−イソプロピルメチルアミノカルボニル、ジ−n−ブチルアミノカルボニル、ジイソブチルアミノカルボニル、N,N−sec−ブチルエチルアミノカルボニル、N,N−tert−ブチルメチルアミノカルボニル、ジ−n−ペンチルアミノカルボニル、N,N−イソペンチルメチルアミノカルボニル、N,N−ネオペンチルメチルアミノカルボニル又はジ−n−ヘキシルアミノカルボニル等の基を示す。
【0031】
「環中に1つ以上の窒素原子を含み、さらに酸素原子、若しくは硫黄原子を含んでもよい単環式飽和複素環が結合したカルボニル」とは、環中に1つ以上の窒素原子を含み、さらに窒素原子、酸素原子、硫黄原子から選択される1個以上のヘテロ原子を含んでいてもよい、飽和された3〜7員の単環式複素環が結合したカルボニル基を示し、例えば、アジリジン−1−イルカルボニル、アゼチジン−1−イルカルボニル、ピロリジン−1−イルカルボニル、ピペリジン−1−イルカルボニル、アゼパン−1−イルカルボニル、イミダゾリジン−1−イルカルボニル、ピラゾリジン−1−イルカルボニル、ピペラジン−1−イルカルボニル、オキサゾリジン−1−イルカルボニル、モルホリン−1−イルカルボニル又はチオモルホリン−1−イルカルボニル等の基を示す。
【0032】
「隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環」とは、1−アジリジニル、1−アゼチジニル、1−ピロリジニル、ピペリジノ又は1−アゼパニル基を示す。
【0033】
「アリール」とは、炭素原子数6から18個で構成される単環式から4環式の芳香族炭素環式基であり、例えば、フェニル基、ナフチル基、アントリル基、フェナントレニル基、テトラセニル基及びピレニル基が挙げられる。
【0034】
「ヘテロアリール」とは、5員〜6員の単環式又は9員〜10員の双環式の芳香族複素環からなる基を示し、例えば、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、キノリニル、イソキノリニル、キナゾリニル、キノキサリニル、ナフチリジニル、ピロリル、フラニル、チオフェニル、ピラゾリル、イミダゾリル、オキサゾリル、イソオキサゾリル、チアゾリル、イソチアゾリル、トリアゾリル、インドリル、ベンゾフラニル、ベンゾチオフェニル、ベンゾイミダゾリル、インダゾリル、ベンゾオキサゾリル、ベンゾチアゾリル又はベンゾトリアゾリル等の基が挙げられる。さらに詳しくは、2−ピリジル、3−ピリジル、4−ピリジル、ピリダジン−3−イル、ピリダジン−4−イル、ピリミジン−2−イル、ピリミジン−4−イル、ピリミジン−5−イル、ピラジン−2−イル、キノリン−2−イル、キノリン−3−イル、キノリン−4−イル、キノリン−6−イル、キノリン−8−イル、イソキノリン−1−イル、イソキノリン−6−イル、キナゾリン−2−イル、キナゾリン−5−イル、キノキサリン−2−イル、キノキサリン−6−イル、1,5−ナフチリジン−3−イル、1,6−ナフチリジン−8−イル、ピロール−3−イル、フラン−2−イル、フラン−3−イル、チオフェン−2−イル、チオフェン−3−イル、ピラゾール−3−イル、ピラゾール−4−イル、イミダゾール−2−イル、オキサゾール−2−イル、オキサゾール−4−イル、オキサゾール−5−イル、イソオキサゾール−3−イル、チアゾール−2−イル、チアゾール−5−イル、イソチアゾール−4−イル、1,2,4−トリアゾール−3−イル、インドール−2−イル、インドール−3−イル、インドール−5−イル、インドール−7−イル、ベンゾフラン−3−イル、ベンゾチオフェン−3−イル、ベンゾイミダゾール−2−イル、インダゾール−5−イル、ベンゾオキサゾール−2−イル、ベンゾチアゾール−2−イル又はベンゾトリアゾール−4−イル等の基を示す。
【0035】
「ヘテロシクリル」とは、環中に1つ以上の窒素原子、酸素原子、若しくは硫黄原子を含み、環中の一部に不飽和結合を含んでもよい5員〜6員の単環式又は9員〜10員の双環式の飽和複素環からなる基を示し、1又は2個のオキソ基で置換されても良い。例えば、1−ピロリジニル、1−ピペリジニル、1−ピペラジニル、モルホリン−4−イル、チオモルホリン−4−イル、2−オキソピロリジン−1−イル、2,5−ジオキソピロリジン−1−イル、2−テトラヒドロフラニル、3−テトラヒドロフラニル、4−テトラヒドロピラニル、1,4,5,6−テトラヒドロピリダジン−3−イル、2−オキソ−1,2−ジヒドロピリジン−4−イル、インドリン−4−イル、インドリン−6−イル、イソインドリン−4−イル、1,2,3,4−テトラヒドロキノリン−7−イル、1,2,3,4−テトラヒドロイソキノリン−6−イル、2,3−ジヒドロベンゾフラン−5−イル、2,3−ジヒドロベンゾフラン−6−イル、ベンゾ[1,3]ジオキソール−5−イル、2,3−ジヒドロ[1,4]ベンゾジオキシン−5−イル、2,3−ジヒドロ[1,4]ベンゾジオキシン−6−イル又は3,4−ジヒドロ[1,4]ベンゾオキサジン−7−イル等の基を示す。
【0036】
「ヘテロアリールオキシ」とは、上記「ヘテロアリール」が酸素原子を介して結合した基を示し、例えば、ピリジルオキシ、ピリダジニルオキシ、ピリミジニルオキシ、ピラジニルオキシ、キノリニルオキシ、イソキノリニルオキシ、キナゾリニルオキシ、キノキサリニルオキシ、ナフチリジニルオキシ、ピロリルオキシ、フラニルオキシ、チオフェニルオキシ、ピラゾリルオキシ、イミダゾリルオキシ、オキサゾリルオキシ、イソオキサゾリルオキシ、チアゾリルオキシ、イソチアゾリルオキシ、トリアゾリルオキシ、インドリルオキシ、ベンゾフラニルオキシ、ベンゾチオフェニルオキシ、ベンゾイミダゾリルオキシ、インダゾリルオキシ、ベンゾオキサゾリルオキシ、ベンゾチアゾリルオキシ又はベンゾトリアゾリルオキシ等の基が挙げられる。さらに詳しくは、ピリジン−2−イルオキシ、ピリジン−3−イルオキシ、ピリジン−4−イルオキシ、ピリダジン−3−イルオキシ等の基を示す。
【0037】
本願発明の好ましい1つの形態は、
式(2)、
【0038】
【化4】

[式(2)中、Qは、下記式(A)又は(B)で表される基を示し、
【0039】
【化5】

R1は、水素原子、ハロゲン原子又はC1〜C6アルキルを示し、
R3及びR4は、同一又は異なって、C1〜C6アルキル又はC3〜C7シクロアルキルを示し、
又はR3及びR4は、隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環(該飽和複素環は1又は2個のC1〜C6アルキルで置換されてもよい。)を形成し、
R5は、C1〜C6アルキル(該C1〜C6アルキルは1又は2個のC3〜C7シクロアルキルで置換されてもよい。)又はC3〜C7シクロアルキル(該C3〜C7シクロアルキルは1又は2個のC1〜C6アルキルで置換されてもよい。)を示し、
Pは、フェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニイル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニル{該フェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・ピロリジン−1−イルカルボニル、
・カルバモイル、
・オキサゾリル、
・モルホリン−4−イル又は2−オキソピロリジン−1−イル、(該モルホリン−4−イル又は2−オキソピロリジン−1−イルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ピリダジニルオキシ(該ピリダジニルオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す。]
で表されるジヒドロキノリノン誘導体、又はその医薬上許容される塩である。
【0040】
ここで、R1は、好ましくは水素原子である。
式(A)において、R3及びR4は、隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環(該飽和複素環は1又は2個のC1〜C6アルキルで置換されてもよい。)を形成することが好ましい。さらに好ましくは、1−ピロリジニル基(該1−ピロリジニル基は1又は2個のC1〜C6アルキルで置換されてもよい。)である。
Pは、好ましくはフェニル基又はピリジル基{該フェニル基又はピリジル基は
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・ピロリジン−1−イルカルボニル、
・カルバモイル、
・オキサゾリル、
・モルホリン−4−イル又は2−オキソピロリジン−1−イル、(該モルホリン−4−イル又は2−オキソピロリジン−1−イルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ピリダジニルオキシ(該ピリダジニルオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}である。
Pは、より好ましくはフェニル基又はピリジル基{該フェニル基又はピリジル基は
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、又は
・ピロリジン−1−イルカルボニル
より選ばれる同一又は異なる1〜2個の置換基で置換されてもよい。}である。
【0041】
本発明において、医薬上許容される塩とは、例えば、硫酸、塩酸、臭化水素酸、リン酸、硝酸などの無機酸との塩、酢酸、シュウ酸、乳酸、酒石酸、フマル酸、マレイン酸、クエン酸、ベンゼンスルホン酸、メタンスルホン酸、p−トルエンスルホン酸、安息香酸、カンファースルホン酸、エタンスルホン酸、グルコヘプトン酸、グルコン酸、グルタミン酸、グリコール酸、リンゴ酸、マロン酸、マンデル酸、ガラクタル酸、ナフタレン−2−スルホン酸などの有機酸との塩、リチウムイオン、ナトリウムイオン、カリウムイオン、カルシウムイオン、マグネシウムイオン、亜鉛イオン、アルミニウムイオンなどの1種又は複数の金属イオンとの塩、アンモニア、アルギニン、リシン、ピペラジン、コリン、ジエチルアミン、4−フェニルシクロヘキシルアミン、2−アミノエタノール、ベンザチンなどのアミンとの塩が含まれる。
【0042】
本発明の化合物は、各種溶媒和物としても存在し得る。また、医薬としての適用性の面から水和物の場合もある。
【0043】
本発明の化合物は、エナンチオマー、ジアステレオマー、平衡化合物、これらの任意の割合の混合物、ラセミ体等を全て含む。
【0044】
本発明の化合物には、一つ以上の水素原子、炭素原子、窒素原子、酸素原子、硫黄原子が放射性同位元素や安定同位元素と置換された化合物も含まれる。これらの標識化合物は、例えば代謝や薬物動態研究、受容体のリガンドとして生物学的分析等に有用である。
【0045】
本発明の化合物は、一つ又は二つ以上の医薬的に許容される担体、賦形剤又は希釈剤と組み合せて医薬的製剤とすることができる。上記担体、賦形剤及び希釈剤として、例えば水、乳糖、デキストロース、フラクトース、ショ糖、ソルビトール、マンニトール、ポリエチレングリコール、プロピレングリコール、デンプン、ガム、ゼラチン、アルギネート、ケイ酸カルシウム、リン酸カルシウム、セルロース、水シロップ、メチルセルロース、ポリビニルピロリドン、アルキルパラヒドロキシベンゾソルベート、タルク、ステアリン酸マグネシウム、ステアリン酸、グリセリン、ゴマ油、オリーブ油、大豆油等の各種油等が含まれる。
【0046】
また、上記の担体、賦形剤又は希釈剤に必要に応じて一般に使用される増量剤、結合剤、崩壊剤、pH調整剤、溶解剤等の添加剤を混合し、常用の製剤技術によって錠剤、丸剤、カプセル剤、顆粒剤、粉剤、液剤、乳剤、懸濁剤、軟膏剤、注射剤、皮膚貼付剤等の経口又は非経口用医薬として調製することができる。本発明の化合物は、成人患者に対して1回の投与量として0.001〜500mgを1日1回又は数回に分けて経口又は非経口で投与することが可能である。なお、この投与量は治療対象となる疾病の種類、患者の年齢、体重、症状等により適宜増減することが可能である。
【0047】
本発明の化合物における望ましいプロファイルとしては、薬効が優れていること、体内動態が優れていること(経口吸収性が良い・特定の組織に蓄積性を有さない)、物性が優れていること、低毒性であること、等が挙げられる。本発明の好ましい化合物は、優れた脳内移行性を有することが期待される。
【0048】
本発明の化合物は、下記の方法により製造できる。
本発明の化合物は、公知の有機化学的手法によって製造することができ、例えば、下記の反応式による方法に従って製造できる。下記反応式1〜4において、R1、R2、R3、R4、R5、n及びPは前記と同義である。また、R6は、水素原子又は水酸基の保護基として一般的に使用される基(例えばアセチル、ベンゾイル、ベンジル、ベンジルオキシカルボニル、tert−ブトキシカルボニル、メトキシメチル、テトラヒドロピラニル又はtert−ブチルジメチルシリル等の基)を示し、R7及びR8は、水素原子、アルキル基又はシクロアルキル基を示し、また、R7及びR8は、隣接する炭素原子と一緒にシクロアルキルを形成しても良く、X1及びX2は、同一又は異なって、塩素原子、臭素原子、ヨウ素原子等のハロゲン原子又はメタンスルホニルオキシ基、フェニルスルホニルオキシ基、p−トルエンスルホニルオキシ基、トリフルオロメタンスルホニルオキシ基等の有機スルホニルオキシ基等の脱離基を示し、Y1、Y2、Y3及びY4は、同一又は異なって、ハロゲン原子又は有機スルホニルオキシ基等の脱離基、又は水酸基を示し、点線は、単結合又は二重結合を示す。
【0049】
以下、反応式1で示される本発明の化合物の製造方法について説明する。この製造工程は、化合物(2)から本発明の化合物(1−2)を製造するための工程である。
(反応式1)
【0050】
【化6】

【0051】
(工程1)
工程1は、化合物(2)と化合物(3)とをカップリング反応により縮合して化合物(4)を得るための工程である。化合物(2)及び化合物(3)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。
Y1が水酸基である場合、該反応は、一般的なカルボン酸のアミド化の方法により実施でき、例えば、カルボン酸をカルボン酸クロリドやカルボン酸ブロミド等のカルボン酸ハライドに導いた後にアミンと反応させる方法、カルボン酸とクロル炭酸エステル等から得られる混合酸無水物をアミンと反応させる方法、カルボン酸を1−ベンゾトリアゾリルエステルやスクシンイミジルエステル等の活性エステルに導いた後にアミンと反応させる方法、カルボン酸を脱水縮合剤存在下アミンと反応させる方法等が挙げられる。これらの反応は、全て塩基の存在下又は非存在下、溶媒中で行うことができる。本反応で用いられる脱水縮合剤としては、例えば、3−(3−ジメチルアミノプロピル)−1−エチルカルボジイミド塩酸塩、ジシクロヘキシルカルボジイミド、ジフェニルホスホリルアジド、カルボニルジイミダゾール等が挙げられ、必要に応じて1−ヒドロキシベンゾトリアゾール、ヒドロキシスクシンイミド等の活性化剤を用いることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸ナトリウム、炭酸水素ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜120℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0052】
Y1がハロゲン原子である場合、該反応は、塩基の存在下又は非存在下、溶媒中又は無溶媒で化合物(2)と化合物(3)とを反応させることにより実施できる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸水素ナトリウム、水酸化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜120℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0053】
(工程2)
工程2は、化合物(4)の分子内環化反応により化合物(5)を得るための工程である。
Y2が水酸基である場合、該反応は、酸の存在下、溶媒中又は無溶媒で化合物(4)を反応させることにより実施でき、例えば、(Journal of Heterocyclic Chemistry,1991年,28巻,919頁)に記載の方法又はそれに準じた方法に従って実施できる。本反応で用いられる酸としては、例えば、三塩化アルミニウム、二塩化亜鉛、三フッ化ホウ素、四塩化チタン等のルイス酸類;硫酸、リン酸、ポリリン酸等の無機酸類等が挙げられる。本反応で用いられる溶媒としては、例えば、ジエチルエーテル、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン、ニトロベンゼン、クロロベンゼン等の芳香族炭化水素類;クロロホルム、ジクロロメタン、1,2−ジクロロエタン等のハロゲン化炭化水素類;二硫化炭素又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0054】
Y2がハロゲン原子である場合、該反応は、酸の存在下、溶媒中又は無溶媒で化合物(4)を反応させることにより実施でき、例えば、(Journal of American Chemical Society,1973年,95巻,546頁)に記載の方法又はそれに準じた方法に従って実施できる。本反応で用いられる酸としては、例えば、三塩化アルミニウム、二塩化亜鉛、三フッ化ホウ素、四塩化チタン等のルイス酸類;硫酸、リン酸、ポリリン酸等の無機酸類等が挙げられる。本反応で用いられる溶媒としては、例えば、ジエチルエーテル、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン、ニトロベンゼン、クロロベンゼン等の芳香族炭化水素類;クロロホルム、ジクロロメタン、1,2−ジクロロエタン等のハロゲン化炭化水素類;二硫化炭素又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0055】
(工程3)
工程3は、化合物(5)のR6が水酸基の保護基として一般的に使用される基である場合、その脱保護により化合物(6)を得るための工程である。R6が水素原子である場合、本工程は必要ない。該反応は、保護基の種類に応じた一般的な脱保護反応、例えば(T.W.Greene and P.G.M.Wuts著 Protective Groups in Organic Synthesis、第3版、John Wiley and Sons社)に記載の方法又はそれに準じた方法によって実施できる。
【0056】
(工程4a)
工程4aは、化合物(6)と公知の化合物(7)とのカップリング反応により化合物(8)を得るための工程である。該反応は、塩基の存在下、溶媒中又は無溶媒でフェノールとアルキルハライドとを反応させる一般的な方法により実施できる。また、必要に応じて、例えば、ヨウ化カリウム、臭化ナトリウム等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、tert−ブトキシカリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0057】
(工程5a)
工程5aは、化合物(8)と化合物(9)とをカップリング反応により縮合して化合物(10)を得るための工程である。化合物(9)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、塩基の存在下又は非存在下、溶媒中又は無溶媒でアミンとアルキルハライドとを反応させる一般的な方法により実施できる。また、必要に応じて、例えば、ヨウ化カリウム、臭化ナトリウム等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、tert−ブトキシカリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0058】
(工程6a)
工程6aは、化合物(10)と化合物(11)とをクロスカップリング反応により縮合して本発明の化合物(1―2)を得るための工程である。化合物(11)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、触媒及びそのリガンドの存在下溶媒中で反応を行う一般的な方法により実施でき、例えば、(Kunzら,Synlett,2003年,15巻,2428−2439頁)に記載の方法又はそれに準じた方法に従って実施できる。また、本反応は塩基の存在下行うことが好ましい。本反応で用いられる触媒としては、銅、ニッケル及びパラジウム等のクロスカップリング反応に一般的に用いられる遷移金属触媒が挙げられ、より具体的には、銅(0)、ヨウ化銅(I)、塩化銅(I)、酸化銅(I)、臭化銅(I)トリストリフェニルホスフィン錯体、トリフルオロメタンスルホン酸銅(I)ベンゼン錯体、酢酸パラジウム(II)、テトラキス(トリフェニルホスフィン)パラジウム(0)、ビス(トリフェニルホスフィン)パラジウム(II)クロリド、[1,1’−ビス(ジフェニルホスフィノ)フェロセン]パラジウム(II)ジクロリド、トリス(ジベンジリデンアセトン)ジパラジウム(0)、ビス(アセチルアセトナト)ニッケル(II)等が挙げられる。本反応で用いられるリガンドとしては、金属触媒を用いる縮合反応に一般的に用いられるリガンド、例えば、N,N’−ジメチルエチレンジアミン、N,N’−ジメチルシクロヘキサン−1,2−ジアミン、2−アミノピリジン、1,10−フェナンスロリン、2−ヒドロキシベンズアルデヒドオキシム、エチレングリコール、トリフェニルホスフィン、トリ−tert−ブチルホスフィン等が挙げられる。本反応で用いられる塩基としては、例えば、炭酸カリウム、リン酸カリウム、水酸化カリウム、tert−ブトキシカリウム、tert−ブトキシナトリウム、炭酸セシウム、炭酸ナトリウム、炭酸水素ナトリウム、酢酸ナトリウム、ナトリウムメトキシド、テトラブチルアンモニウムヒドロキシド等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、40℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0059】
また、化合物(5)は、反応式2に示す方法に従って製造することもできる。
(反応式2)
【0060】
【化7】

【0061】
(工程7)
工程7は、化合物(12)から化合物(5)を得るための工程である。化合物(12)は、公知化合物であるか、公知化合物から容易に合成できる化合物であり、例えば、(Journalof Heterocyclic Chemistry,1979年,16巻,221頁;Synthesis,1984年、10巻、862頁)等に記載の方法又はそれに準じた方法に従って合成できる。該反応は、溶媒中で化合物(12)を還元反応の条件にて反応させることにより実施でき、例えば、(Journal of American Chemical Society,1944年,66巻,1442頁)に記載の方法又はそれに準じた方法に従って実施できる。本反応で用いられる還元反応の条件としては、例えば、常圧又は加圧下での水素雰囲気下、ラネーニッケル又はパラジウムカーボン等の触媒を加えて反応させる方法、水素化リチウムアルミニウム、水素化ホウ素ナトリウム等の金属水素錯化合物と反応させる方法、酸、例えば酢酸や塩化アンモニウムの存在下、鉄(0)、塩化亜鉛(II)又は塩化スズ(II)と反応させる方法或いはこれらの条件の組み合わせ等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0062】
また、本工程の反応中間体である化合物(13)は、更に分子内環化反応を行うことにより化合物(5)へと変換することができる。該反応は、アニリンとカルボン酸又はエステルとの縮合によりアニリドを得る一般的な方法により実施でき、例えば、カルボン酸をカルボン酸クロリドやカルボン酸ブロミド等のカルボン酸ハライドに導いた後に反応させる方法、カルボン酸をクロル炭酸エステル等から混合酸無水物に導いた後に反応させる方法、カルボン酸を1−ベンゾトリアゾリルエステルやスクシンイミジルエステル等の活性エステルに導いた後に反応させる方法、脱水縮合剤存在下反応させる方法等が挙げられる。これらの反応は、全て酸又は塩基の存在下又は非存在下、溶媒中で又は無溶媒で行うことができる。本反応で用いられる脱水縮合剤としては、例えば、3−(3−ジメチルアミノプロピル)−1−エチルカルボジイミド塩酸塩、ジシクロヘキシルカルボジイミド、ジフェニルホスホリルアジド、カルボニルジイミダゾール等が挙げられ、必要に応じて1−ヒドロキシベンゾトリアゾール、ヒドロキシスクシンイミド等の活性化剤を用いることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸ナトリウム、炭酸水素ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0063】
化合物(13)の点線が二重結合である場合、前述の分子内環化反応に加えて二重結合を単結合へと変換する還元反応を行うことにより、化合物(5)を得ることができる。該反応は、α,β−不飽和エステル又はα,β−不飽和カルボン酸の1,4−還元を行うための一般的な方法により実施でき、例えば、水素雰囲気下パラジウムカーボン、酸化白金、ラネーニッケル等の遷移金属触媒を用いて反応を行う方法、ギ酸やトリエチルシランの存在下遷移金属触媒を用いて反応を行う方法、アルコール等のプロトン性溶媒中で水素化ホウ素ナトリウム等の還元剤を用いて反応を行う方法等が挙げられる。このとき、必要に応じて塩化銅(II)、塩化ニッケル(II)等の遷移金属塩化物を加えることができる。また、必要に応じて、例えば、塩酸、酢酸などの添加物を加えることができる。これらの反応は溶媒中で行うことができる。用いられる溶媒としては、例えば、メタノール、エタノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0064】
また、化合物(10)は、反応式3に示す方法に従って製造することもできる。
(反応式3)
【0065】
【化8】

【0066】
(工程5b)
工程5bは、化合物(9)と化合物(7)とをカップリング反応により縮合して化合物(14)を得るための工程である。該反応は、工程5aと同様の方法により実施できる。
【0067】
(工程4b)
工程4bは、化合物(14)と化合物(6)とをカップリング反応により縮合して化合物(10)を得るための工程である。該反応は、工程4aと同様の方法により実施できる。
【0068】
以下、反応式4で示される本発明の化合物の製造方法について説明する。この製造工程は、化合物(6)から本発明の化合物(1−3)を製造するための工程である。
(反応式4)
【0069】
【化9】

【0070】
(工程8a)
工程8aは、化合物(6)と化合物(15)とをカップリング反応により縮合して化合物(16)を得るための工程である。化合物(15)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。
Y3がハロゲン原子又は有機スルホニルオキシ基等の脱離基である場合、該反応は、塩基の存在下又は非存在下、溶媒中又は無溶媒でフェノールのヒドロキシル基のアルキル化を行う一般的な方法により実施できる。また、必要に応じて、例えば、ヨウ化カリウム、臭化ナトリウム等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン等の有機塩基類;tert−ブトキシカリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム等の無機塩基類が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0071】
Y3が水酸基である場合、該反応としてはミツノブ反応が挙げられ、例えば、トリフェニルホスフィン、トリブチルホスフィン等の有機リン化合物とアゾジカルボン酸ジエチル、アゾジカルボン酸ジイソプロピル、アゾジカルボン酸ジtertブチル等のアゾ化合物とを組み合わせた試薬、或いはシアノメチルトリブチルホスホラン等のリンイリド試薬の存在下溶媒中で行う方法が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0072】
(工程6b)
工程6bは、化合物(16)と化合物(11)とをクロスカップリング反応により縮合して本発明の化合物(1−3)を得るための工程である。該反応は、工程6aと同様の方法により実施できる。
【0073】
以下、反応式5で示される本発明の化合物の製造方法について説明する。この製造工程は、化合物(6)から本発明の化合物(1−3)を製造するための工程である。
(反応式5)
【0074】
【化10】

【0075】
(工程8b)
工程8bは、化合物(6)と化合物(17)とをカップリング反応により縮合して化合物(18)を得るための工程である。化合物(17)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、工程8aと同様の方法により実施できる。
【0076】
(工程6c)
工程6cは、化合物(18)と化合物(11)とをカップリング反応により縮合して化合物(19)を得るための工程である。該反応は、工程6aと同様の方法により実施できる。
【0077】
(工程9)
工程9は、化合物(19)のtert−ブトキシカルボニル基を除去して化合物(20)を得るための工程である。該反応は、一般的なtert−ブトキシカルボニル基の脱保護の方法により実施でき、例えば、強酸存在下溶媒中又は無溶媒で反応させる方法、塩基存在下溶媒中で反応させる方法等、(T.W.Greene and P.G.M.Wuts Protective Groups in Organic Synthesis)に記載されている方法又はそれに準じた方法に従って実施できる。本反応で用いられる酸としては、例えば、塩酸、硫酸、トリフルオロ酢酸、トリフルオロメタンスルホン酸が挙げられる。本反応で用いられる塩基としては、例えば、水酸化ナトリウム、水酸化カリウムが挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
【0078】
(工程10)
工程10は、化合物(20)と化合物(21)とをカップリング反応により縮合して本発明の化合物(1−3)を得るための工程である。化合物(21)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、工程5aと同様の方法により実施できる。
【0079】
また、本発明の化合物(1−3)は、反応式6に示す方法に従って製造することもできる。
(反応式6)
【0080】
【化11】

【0081】
(工程11)
工程11は、化合物(20)と化合物(22)とを還元的縮合反応により縮合して本発明の化合物(1−3)を得るための工程である。該反応は、カルボニル化合物とアミンを縮合させる一般的な還元的アミノ化反応の方法によって実施でき、例えば、酸の存在下又は非存在下、溶媒中又は無溶媒で化合物(20)と化合物(22)の混合物に還元剤を加えて行う方法が挙げられる。また、還元方法として、例えば、パラジウム−炭素、白金、ラネーニッケル、ロジウム−アルミナ等の触媒を用いた水素添加による接触還元の方法を利用することもできる。本反応で用いられる還元剤としては、例えば、水素化ホウ素ナトリウム、トリアセトキシ水素化ホウ素ナトリウム、シアノ水素化ホウ素ナトリウム、ジボラン、水素化リチウムアルミニウム等が挙げられる。本反応で用いられる酸としては、例えば、酢酸、ギ酸等の有機酸類;塩酸、硫酸等の無機酸類;塩化チタン、塩化亜鉛、イッテルビウム(III)トリフラート等のルイス酸類等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
【0082】
以下に実施例及び試験例を示し、本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
【実施例】
【0083】
(実施例1)
4−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号1)の製造
【0084】
(1)(2R)−1−(3−クロロプロピル)−2−メチルピロリジンの製造
【0085】
【化12】

【0086】
(R)−2−メチルピロリジン(18.0g)と1−ブロモ−3−クロロプロパン(100.0g)のアセトン(360mL)溶液に、氷浴下5M水酸化ナトリウム水溶液(50mL)を滴下して加え、80℃にて4時間撹拌した。反応混合物を室温まで放冷し、ジエチルエーテルで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥して減圧下濃縮し、得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:n−ヘキサン/酢酸エチル=4/1〜1/1)及びシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/メタノール=9/1)にて精製して黄色油状の表題化合物(17.8g、52%)を得た。
【0087】
(2)(2R)−6−[3−(2−メチルピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0088】
【化13】

【0089】
6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オン(0.55g)のアセトニトリル(10mL)溶液に、炭酸セシウム(2.0g)及び実施例1−(1)で製造した(2R)−1−(3−クロロプロピル)−2−メチルピロリジン(0.50g)を加え、100℃にて1時間撹拌した。反応混合物に水を加え、酢酸エチルで抽出した。有機層を無水硫酸マグネシウムで乾燥し、減圧下濃縮して得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:n−ヘキサン/酢酸エチル=1/1)で精製した。得られた固体をn−ヘキサンから再結晶して無色粉末の表題化合物(0.33g、37%)を得た。
【0090】
(3)4−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号1)の製造
【0091】
【化14】

【0092】
実施例1−(2)で製造した(2R)−6−[3−(2−メチルピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(0.20g)、4−ヨードベンゾニトリル(0.18g)、rac−trans−N,N’−ジメチルシクロヘキサン−1,2−ジアミン(0.041g)、ヨウ化銅(0.013g)及び炭酸セシウム(0.45g)のN,N−ジメチルホルムアミド(2mL)懸濁液を100℃にて16時間攪拌した。反応混合物に水を加え、クロロホルムで抽出した。有機層を無水硫酸ナトリウムで乾燥して減圧下濃縮した。得られた残渣をプレパラティブTLC(2mm厚*1枚、展開溶媒:クロロホルム/メタノール=9/1)及びNH型プレパラティブTLC(0.25mm厚*2枚、展開溶媒:n−ヘキサン/酢酸エチル=1/1)にて精製して淡褐色非晶質の表題化合物(0.062g,23%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.07 (d, J=6.0 Hz, 3 H), 1.36 - 1.45 (m, 1 H), 1.63 - 2.34 (m, 8 H), 2.75 - 2.85 (m, 2 H), 2.91 - 3.05 (m, 3 H), 3.11 - 3.20 (m, 1 H), 3.93 - 4.01 (m, 2 H), 6.24 (d, J=8.7 Hz, 1 H), 6.59 (dd, J=8.7, 2.8 Hz, 1 H), 6.78 (d, J=3.2 Hz, 1 H), 7.38 (d, J=8.7 Hz, 2 H), 7.76 (d, J=8.7 Hz, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 390(M+H)+
【0093】
実施例1に示した方法と同様の方法で以下の化合物を製造した。
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−フェニル−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号2)
1−(4−メチルフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号3)
1−(4−メトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号4)
1−(4−エトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号5)
1−(4−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号6)
1−(4−クロロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号7)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(トリフルオロメチル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号8)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(トリフルオロメトキシ)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号9)
1−[4−(ヒドロキシメチル)フェニル]−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号10)
1−[4−(メトキシメチル)フェニル]−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号11)
1−{4−[(ジメチルアミノ)メチル]フェニル}−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号12)
N,N−ジメチル−4−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンズアミド(化合物番号13)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(ピロリジン−1−イルカルボニル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号14)
1−(4−アセチルフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号15)
1−[4−(シクロプロピルカルボニル)フェニル]−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号16)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(モルホリン−4−イル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号17)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(2−オキソピロリジン−1−イル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号18)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(1,3−オキサゾール−5−イル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号19)
1−{4−[(6−メチルピリダジン−3−イル)オキシ]フェニル}−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号20)
N,N−ジメチル−3−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンズアミド(化合物番号21)
1−(3−メトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号22)
1−(2−メトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号23)
1−(3−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号24)
1−(2,4−ジメトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号25)
1−(3−フルオロ−5−メトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号26)
1−(3,5−ジフルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号27)
1−(3,4−ジフルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号28)
1−(2,4−ジフルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号29)
1−(4−クロロ−2−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号30)
3−クロロ−5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号31)
2−メチル−5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号32)
2−メトキシ−5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号33)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(ピリジン−2−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号34)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(ピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号35)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(ピリミジン−5−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号36)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号37)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロ−2H−1,6’−ビキノリン−2−オン(化合物番号38)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(1,5−ナフチリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号39)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(1,6−ナフチリジン−8−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号40)
tert−ブチル 5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号41)
tert−ブチル 3−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号42)
1−(2,3−ジヒドロ−1,4−ベンゾジオキシン−6−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号43)
1−(1,3−ベンゾジオキソール−5−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号44)
1−(2,3−ジヒドロ−1−ベンゾフラン−6−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号45)
6−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ピリジン−3−カルボニトリル(化合物番号46)
1−(6−メチルピリジン−3−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号47)
1−(6−メトキシピリジン−3−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号48)
1−(5−クロロピリジン−2−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号49)
5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ピリジン−3−カルボニトリル(化合物番号50)
2−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ピリジン−3−カルボニトリル(化合物番号51)
1−(5−フルオロピリジン−3−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号52)
1−(3−メチルピリジン−2−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号53)
1−(1−メチル−2−オキソ−1,2−ジヒドロピリジン−4−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号54)
6’−メトキシ−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号55)
【0094】
化合物番号2〜55の構造式及び物理化学的測定値を表1に示す。
【0095】
【表1−1】

【0096】
【表1−2】

【0097】
【表1−3】

【0098】
【表1−4】

【0099】
【表1−5】

【0100】
【表1−6】

【0101】
【表1−7】

【0102】
【表1−8】

【0103】
(実施例2)
1−(1H−インドール−5−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号56)の製造
【0104】
【化15】

【0105】
実施例1に示した方法と同様の方法で製造したtert−ブチル 5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号41)(0.050g)のメタノール(0.19mL)溶液に水(0.3mL)及び炭酸カリウム(0.041g)を加え、80℃にて2時間撹拌した。反応混合物を減圧下濃縮し、得られた残渣をNH型プレパラティブTLCで精製(0.25mm厚*3枚、展開溶媒:酢酸エチル)して無色非晶質の表題化合物(0.0090g、2.2%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.4 Hz, 3 H), 1.36 - 1.46 (m, 1 H), 1.59 - 1.82 (m, 2 H), 1.85 - 2.01 (m, 3 H), 2.06 - 2.13 (m, 1 H), 2.14 - 2.21 (m, 1 H), 2.23 - 2.32 (m, 1 H), 2.79 - 2.87 (m, 2 H), 2.91 - 2.99 (m, 1 H), 3.01 - 3.09 (m, 2 H), 3.12 - 3.19 (m, 1 H), 3.90 - 4.01 (m, 2 H), 6.30 (d, J=9.2 Hz, 1 H), 6.50 - 6.56 (m, 2 H), 6.77 (d, J=3.2 Hz, 1 H), 6.95 - 7.01 (m, 1 H), 7.20 - 7.24 (m, 1 H), 7.43 (d, J=8.3 Hz, 1 H), 7.49 (d, J=1.8 Hz, 1 H), 8.46 (br. s., 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 404(M+H)+
【0106】
(実施例3)
1−(1H−インドール−3−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号57)の製造
【0107】
【化16】

【0108】
実施例2と同様の方法により、tert−ブチル 5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号41)の代わりにtert−ブチル 3−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号42)を用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.35 - 1.46 (m, 1 H), 1.62 - 1.82 (m, 2 H), 1.86 - 2.00 (m, 3 H), 2.06 - 2.13 (m, 1 H), 2.13 - 2.21 (m, 1 H), 2.22 - 2.32 (m, 1 H), 2.82 - 2.90 (m, 2 H), 2.90 - 2.99 (m, 1 H), 3.01 - 3.11 (m, 2 H), 3.11 - 3.19 (m, 1 H), 3.92 - 4.01 (m, 2 H), 6.47 - 6.51 (m, 1 H), 6.51 - 6.56 (m, 1 H), 6.80 (d, J=2.8 Hz, 1 H), 7.04 - 7.10 (m, 1 H), 7.16 - 7.24 (m, 2 H), 7.30 (d, J=2.8 Hz, 1 H), 7.38 - 7.44 (m, 1 H), 8.29 (br. s., 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 404(M+H)+
【0109】
(実施例4)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号58)の製造
【0110】
(1)6−(1−シクロブチルピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0111】
【化17】

【0112】
窒素雰囲気下、6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オン(5.00g)とN−シクロブチル−4−ヒドロキシピペリジン(WO2005/108384国際公開公報に記載の方法に従って合成できる)(7.10g)のテトラヒドロフラン(50mL)溶液に、氷冷下ジエチルアゾジカルボキシレート(40%トルエン溶液)(16.7mL)を滴下した。滴下終了後、室温へと昇温し40時間撹拌した。反応混合物を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/メタノール=95/5)にて精製して無色粉末の表題化合物(2.30g、25%)を得た。
【0113】
(2)6−[(1−シクロブチルピペリジン−4−イル)オキシ]−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号58)の製造
【0114】
【化18】

【0115】
実施例4−(1)で合成した6−(1−シクロブチルピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン(0.10g)、3−ブロモイソキノリン(0.10g)、rac−trans−N,N’−ジメチルシクロヘキサン−1,2−ジアミン(0.047g)、ヨウ化銅(0.016g)及び炭酸セシウム(0.22g)のトルエン(1mL)懸濁液を110℃にて3時間攪拌した。反応混合物を室温まで放冷し、クロロホルムを加え、不溶物を濾過して取り除いた。濾液を減圧下濃縮し、得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=4/1〜1/4)及びOH型プレパラティブTLC(1mm厚*2枚、展開溶媒:クロロホルム/メタノール=4/1)にて精製して無色非晶質の表題化合物(0.061g,44%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.54 - 2.24 (m, 12 H), 2.54 - 2.80 (m, 3 H), 2.82 - 2.91 (m, 2 H), 3.04 - 3.12 (m, 2 H), 4.17 - 4.31 (m, 1 H), 6.30 (d, J=8.7 Hz, 1 H), 6.57 (dd, J=8.7, 2.8 Hz, 1 H), 6.83 (d, J=2.8 Hz, 1 H), 7.56 - 7.64 (m, 1 H), 7.74 - 7.81 (m, 1 H), 7.84 (d, J=8.3 Hz, 1 H), 8.10 - 8.22 (m, 2 H), 8.74 (d, J=2.3 Hz, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 428(M+H)+
【0116】
(実施例5)
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号59)の製造
【0117】
【化19】

【0118】
実施例4と同様の方法により、N−シクロブチル−4−ヒドロキシピペリジンの代わりに1−tert−ブチル−4−ヒドロキシピペリジン(Journal of Organic Chemistry,2005年,70巻,1930−1933頁に記載の方法に従って合成できる)を用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.82 - 2.61 (m, 14 H), 2.81 - 3.22 (m, 7 H), 4.09 - 4.43 (m, 1 H), 6.31 (d, J=8.7 Hz, 1 H), 6.57 (dd, J=8.7, 2.8 Hz, 1 H), 6.83 (d, J=2.8 Hz, 1 H), 7.57 - 7.63 (m, 1 H), 7.75 - 7.81 (m, 1 H), 7.84 (d, J=8.3 Hz, 1 H), 8.10 - 8.20 (m, 2 H), 8.74 (d, J=2.3 Hz, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 430(M+H)+
【0119】
(実施例6)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号60)の製造
【0120】
【化20】

【0121】
実施例4と同様の方法により、3−ブロモキノリンの代わりに4−フルオロヨードベンゼンを用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.59 - 2.23 (m, 12 H), 2.49 - 2.87 (m, 5 H), 2.91 - 3.17 (m, 2 H), 4.16 - 4.26 (m, 1 H), 6.24 (d, J=8.7 Hz, 1 H), 6.58 (dd, J=8.7, 2.8 Hz, 1 H), 6.77 (d, J=2.8 Hz, 1 H), 7.12 - 7.22 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 395(M+H)+
【0122】
(実施例6−2)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩(化合物番号60塩酸塩)の製造
【0123】
実施例6で製造した6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号60)(0.90g)の酢酸エチル(10mL)及びエタノール(2mL)の混合溶液に4規定塩酸酢酸エチル溶液(1.14mL)を加え、室温にて3時間撹拌した。反応混合物を減圧下濃縮し、残渣にイソプロパノール(7mL)及びエタノール(2mL)を加えて油浴(110℃)下5分間加熱撹拌し、その後室温まで放冷しながら撹拌した。析出物を濾取し乾燥して無色結晶の表題化合物(0.93g、95%)を得た。
1H NMR (600 MHz, DMSO-d6) δ ppm 1.63 - 1.79 (m, 2 H), 1.81 - 1.92 (m, 1 H), 1.95 - 2.03 (m, 1 H), 2.06 - 2.20 (m, 4 H), 2.28 - 2.41 (m, 2 H), 2.65 - 2.70 (m, 2 H), 2.76 - 2.93 (m, 2 H), 2.99 - 3.02 (m, 2 H), 3.15 - 3.23 (m, 1 H), 3.33 - 3.40 (m, 1 H), 3.54 - 3.74 (m, 1 H), 4.40 - 4.68 (m, 1 H), 6.14 (s, 1 H), 6.67 - 6.77 (m, 1 H), 6.94 - 7.03 (m, 1 H), 7.26 - 7.30 (m, 2 H), 7.32 - 7.37 (m, 2 H), 10.82 - 10.93 (m, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 395(M+H)+
融点 >250℃
【0124】
実施例4〜6に示した方法と同様の方法で以下の化合物を製造した。
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−1−フェニル−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号61)
4−{6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル}ベンゾニトリル(化合物番号62)
3−{6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル}ベンゾニトリル(化合物番号63)
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−1−(5−フルオロピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号64)
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−1−(6−メトキシピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号65)
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号66)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(6−メトキシピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号67)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(3,5−ジフルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号68)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(3−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号69)
1−(4−クロロフェニル)−6−[(1−シクロブチルピペリジン−4−イル)オキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号70)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(5−フルオロピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号71)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−フェニル−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号72)
4−{6−[(1−シクロブチルピペリジン−4−イル)オキシ]−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル}ベンゾニトリル(化合物番号73)
3−{6−[(1−シクロブチルピペリジン−4−イル)オキシ]−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル}ベンゾニトリル(化合物番号74)
【0125】
化合物番号61〜74の構造式及び物理化学的測定値を表2に示す。
【0126】
【表2−1】

【0127】
【表2−2】

【0128】
【表2−3】

【0129】
(実施例7)
1−(4−フルオロフェニル)−6−{[1−(プロパン−2−イル)ピペリジン−4−イル]オキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号75)の製造
【0130】
(1)tert−ブチル 4−(2−オキソ−1,2,3,4−テトラヒドロキノリン−6−イルオキシ)ピペリジン−1−カルボキシレートの製造
【0131】
【化21】

【0132】
6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オン(5.0g)、tert−ブチル 4−(メタンスルホニルオキシ)ピペリジン−1−カルボキシレート(13g)及び炭酸カリウム(5.1g)のN,N−ジメチルホルムアミド(30mL)懸濁液を100℃にて20時間攪拌した。反応混合物を室温まで放冷し、水を加え、クロロホルムで抽出した。有機層を飽和食塩水で洗浄し、減圧下濃縮した。得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/ヘキサン=4/1)にて精製して無色固体の表題化合物(6.9g,65%)を得た。
【0133】
(2)tert−ブチル 4−(1−(4−フルオロフェニル)−2−オキソ−1,2,3,4−テトラヒドロキノリン−6−イルオキシ)ピペリジン−1−カルボキシレートの製造
【0134】
【化22】

【0135】
実施例7−(1)で製造したtert−ブチル 4−(2−オキソ−1,2,3,4−テトラヒドロキノリン−6−イルオキシ)ピペリジン−1−カルボキシレート(3.0g)、1−フルオロ−4−ヨードベンゼン(2.9g)、rac−trans−N,N’−ジメチルシクロヘキサン−1,2−ジアミン(1.2g)、ヨウ化銅(0.41g)及び炭酸セシウム(5.6g)のトルエン(8.0mL)懸濁液を100℃にて4時間攪拌した。反応混合物を室温まで放冷し、トルエンで希釈して不溶物を濾別し、濾液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=7/3〜1/4)にて精製して無色非晶質の表題化合物(3.8g,99%)を得た。
【0136】
(3)1−(4−フルオロフェニル)−6−(ピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩の製造
【0137】
【化23】

【0138】
実施例7−(2)で製造したtert−ブチル 4−(1−(4−フルオロフェニル)−2−オキソ−1,2,3,4−テトラヒドロキノリン−6−イルオキシ)ピペリジン−1−カルボキシレート(6.0g)の酢酸エチル(12mL)及びエタノール(4mL)の混合溶液に、室温にて4M塩酸―酢酸エチル溶液(10mL)を滴下し、16時間攪拌した。反応混合物を減圧下濃縮し、酢酸エチルを加えて室温にて1時間攪拌した。析出物を濾取し乾燥して無色固体の表題化合物(5.1g,99%)を得た。
【0139】
(4)1−(4−フルオロフェニル)−6−{[1−(プロパン−2−イル)ピペリジン−4−イル]オキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号75)の製造
【0140】
【化24】

【0141】
実施例7−(3)で製造した1−(4−フルオロフェニル)−6−(ピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩(0.30g)、炭酸カリウム(0.55g)及び2−ヨードプロパン(0.68g)のN,N−ジメチルホルムアミド(10mL)懸濁液を100℃にて1時間攪拌した。反応混合物を室温まで放冷し、水を加えてクロロホルムで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥して減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)にて精製して無色固体の表題化合物(0.16g,52%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.06 (d, J=6.0 Hz, 6 H), 1.80 (br. s., 2 H), 2.00 (br. s., 2 H), 2.39 (br. s., 2 H), 2.70 - 2.83 (m, 5 H), 2.97 - 3.03 (m, 2 H), 4.16 - 4.25 (m, 1 H), 6.24 (d, J=9.2 Hz, 1 H), 6.58 (dd, J=8.9, 3.0 Hz, 1 H), 6.77 (d, J=2.8 Hz, 1 H), 7.13 - 7.22 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 383(M+H)+
【0142】
(実施例8)
6−{[1−(シクロプロピルメチル)ピペリジン−4−イル]オキシ}−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号76)の製造
【0143】
【化25】

【0144】
実施例7−(3)で製造した1−(4−フルオロフェニル)−6−(ピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩(0.30g)、炭酸カリウム(0.55g)及び(ブロモメチル)シクロプロパン(0.32g)のN,N−ジメチルホルムアミド(10mL)懸濁液を100℃にて6時間攪拌した。反応混合物を室温まで放冷し、水を加え、クロロホルムで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥して減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)及びプレパラティブTLC(2mm厚*1枚、展開溶媒:クロロホルム/メタノール=9/1)にて精製して無色非晶質の表題化合物(0.11g,35%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.07 - 0.14 (m, 2 H), 0.47 - 0.55 (m, 2 H), 0.89 (br. s., 1 H), 1.78 - 1.88 (m, 2 H), 1.97 - 2.06 (m, 2 H), 2.22 - 2.50 (m, 4 H), 2.74 - 2.88 (m, 4 H), 2.96 - 3.02 (m, 2 H), 4.23 (br. s., 1 H), 6.24 (d, J=8.7 Hz, 1 H), 6.57 (dd, J=9.2, 2.8 Hz, 1 H), 6.76 (d, J=2.8 Hz, 1 H), 7.13 - 7.21 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 395(M+H)+
【0145】
(実施例9)
6−[(1−シクロプロピルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号77)の製造
【0146】
【化26】

【0147】
実施例7−(3)で製造した1−(4−フルオロフェニル)−6−(ピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩(0.30g)、トリエチルアミン(0.080g)、[(1−エトキシシクロプロピル)−オキシ]トリメチルシラン(0.69g)、酢酸(0.48g)及びモレキュラーシーブス3A(1.0g)のメタノール(10mL)懸濁液を室温にて1時間攪拌し、シアノ水素化ホウ素ナトリウム(0.25g)加え、同温にて16時間攪拌した。反応混合物を95℃に昇温し、7時間加熱還流した後、室温まで放冷して不溶物を濾別した。濾液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)及びプレパラティブTLC(2mm厚*1枚、展開溶媒:クロロホルム/メタノール=9/1)にて精製して無色非晶質の表題化合物(0.11g,37%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.37 - 0.51 (m, 4 H), 1.57 - 1.68 (m, 1 H), 1.71 - 1.84 (m, 2 H), 1.89 - 2.01 (m, 2 H), 2.42 - 2.55 (m, 2 H), 2.78 - 2.84 (m, 2 H), 2.90 (br. s., 2 H), 2.99 - 3.07 (m, 2 H), 4.19 - 4.28 (m, 1 H), 6.27 (d, J=8.7 Hz, 1 H), 6.57 - 6.63 (m, 1 H), 6.77 - 6.81 (m, 1 H), 7.15 - 7.25 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 381(M+H)+
【0148】
(実施例10)
1−(4−フルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号78)の製造
【0149】
(1)6−(3−クロロプロポキシ)−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0150】
【化27】

【0151】
6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オン(50g)、炭酸セシウム(150g)及び1−ブロモ−3−クロロプロパン(58g)のアセトニトリル(300mL)懸濁液を110℃にて4時間攪拌した。反応混合物を室温まで放冷し、クロロホルムで希釈し、不溶物を濾別して濾液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)にて精製し、得られた固体をエタノールから再結晶して無色固体の表題化合物(42g,68%)を得た。
【0152】
(2)6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0153】
【化28】

【0154】
実施例10−(1)で製造した6−(3−クロロプロポキシ)−3,4−ジヒドロキノリン−2(1H)−オン(10g)及びピロリジン(15g)の2−プロパノール(15mL)溶液を90℃にて2日間攪拌した。反応混合物を室温まで放冷し、水を加え、クロロホルムで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥して減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)にて精製し、得られた固体を酢酸エチルから再結晶して無色固体の表題化合物(7.5g,65%)を得た。
【0155】
(3)1−(4−フルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号78)の製造
【0156】
【化29】

【0157】
実施例10−(2)で製造した6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(0.20g)、1−フルオロ−4−ヨードベンゼン(0.24g)、rac−trans−N,N’−ジメチルシクロヘキサン−1,2−ジアミン(0.10g)、ヨウ化銅(0.035g)及び炭酸セシウム(0.48g)のトルエン(1.0mL)懸濁液を105℃にて60時間攪拌した。反応混合物を室温まで放冷し、クロロホルムで希釈して不溶物を濾別し、濾液を減圧下濃縮した。得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=1/1)にて精製し、得られた固体をジイソプロピルエーテル−酢酸エチル混合溶液から再結晶して無色固体の表題化合物(0.10g,37%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.74 - 1.83 (m, 4 H), 1.92 - 2.02 (m, 2 H), 2.51 (t, J=6.6 Hz, 4 H), 2.57 - 2.63 (m, 2 H), 2.76 - 2.82 (m, 2 H), 2.97 - 3.04 (m, 2 H), 3.94 - 4.01 (m, 2 H), 6.26 (d, J=8.7 Hz, 1 H), 6.58 (dd, J=8.9, 3.0 Hz, 1 H), 6.78 (d, J=2.8 Hz, 1 H), 7.14 - 7.23 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 369(M+H)+
【0158】
実施例10に示した方法と同様の方法で以下の化合物を製造した。
1−(3−フルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号79)
1−(3,5−ジフルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号80)
1−(3,4−ジフルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号81)
1−(4−フルオロフェニル)−6−[3−(ピペリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号82)
6−[3−(ジエチルアミノ)プロポキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号83)
6−{3−[(2R,5R)−2,5−ジメチルピロリジン−1−イル]プロポキシ}−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号84)
【0159】
化合物番号79〜84の構造式及び物理化学的測定値を表3に示す。
【0160】
【表3】

【0161】
(実施例11)
8−クロロ−1−(4−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号85)の製造
【0162】
(1)8−クロロ−6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0163】
【化30】

3−クロロ−N−(2−フルオロ−4−メトキシフェニル)プロパンアミド(1.0g、3−クロロブチリルクロリド及び2−フルオロ−4−メトキシアニリンから合成)及び塩化アルミニウム(5.0g)のn−ヘプタン(2.0mL)懸濁液を110℃にて3日間攪拌した。反応混合物をクロロホルムで希釈し、氷冷下氷水を加え、室温にて2時間攪拌してから有機層と水層を分離した。水層をクロロホルムで抽出し、有機層を併せて無水硫酸マグネシウムで乾燥し、減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=3/2)及びNH型シリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/メタノール=99/1〜9/1)にて精製して淡黄色固体の表題化合物(0.059g,7%)を得た。
【0164】
(2)8−クロロ−1−(4−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号85)の製造
【0165】
【化31】

【0166】
実施例1と同様の方法により、6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オンの代わりに実施例11−(1)で製造した8−クロロ−6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オンを、4−ヨードベンゾニトリルの代わりに4−フルオロヨードベンゼンをそれぞれ用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.11 - 1.28 (m, 3 H), 1.43 - 2.57 (m, 9 H), 2.66 - 2.74 (m, 2 H), 2.90 - 3.14 (m, 3 H), 3.31 (br. s., 1 H), 3.96 - 4.04 (m, 2 H), 6.69 - 6.75 (m, 2 H), 6.99 - 7.05 (m, 2 H), 7.12 - 7.18 (m, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 417(M+H)+
【0167】
(実施例12)
1−(4−フルオロフェニル)−8−メチル−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号86)の製造
【0168】
(1)6−ヒドロキシ−8−メチル−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0169】
【化32】

【0170】
3−クロロ−N−(4−メトキシ−2−メチルフェニル)プロパンアミド(0.50g、3−クロロブチリルクロリド及び4−メトキシ−2−メチルアニリンから合成)及び塩化アルミニウム(1.4g)のn−ヘプタン(4.0mL)懸濁液を110℃にて4日間攪拌した。反応混合物をクロロホルムで希釈し、氷冷下氷水を加え、室温にて1時間攪拌して有機層と水層を分離した。水層を酢酸エチルで抽出し、有機層を併せて無水硫酸マグネシウムで乾燥し、減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/メタノール=10/0〜97/3)にて精製して淡茶色固体の表題化合物(0.166g,39%)を得た。
【0171】
(2)1−(4−フルオロフェニル)−8−メチル−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号86)の製造
【0172】
【化33】

【0173】
実施例1と同様の方法により、6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オンの代わりに実施例12−(1)で製造した6−ヒドロキシ−8−メチル−3,4−ジヒドロキノリン−2(1H)−オンを、4−ヨードベンゾニトリルの代わりに4−フルオロヨードベンゼンをそれぞれ用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.11 - 1.30 (m, 3 H), 1.48 - 2.59 (m, 12 H), 2.64 - 2.71 (m, 2 H), 2.86 - 2.93 (m, 2 H), 3.00 - 3.13 (m, 1 H), 3.22 - 3.41 (m, 1 H), 3.95 - 4.05 (m, 2 H), 6.45 - 6.50 (m, 1 H), 6.60 - 6.66 (m, 1 H), 6.96 - 7.05 (m, 2 H), 7.13 - 7.21 (m, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 397(M+H)+
【0174】
試験例1:H3受容体結合試験
ヒト型H3受容体発現CHO−K1細胞の膜標品(パーキンエルマー社、ES−392−M400UA、タンパク質15μg/200μl)、R(−)−α−メチル[3H]ヒスタミン(アマシャム社、TRK−1017、比活性 1.74TBq/mmol、1nM)、及び試験薬物を、室温にて1時間反応させた。反応終了後に、反応混合物を、0.3%ポリエチレンイミンで処理したガラスフィルター(GF/C)を通して吸引濾過し、ガラスフィルターを、5mM EDTAを含んだ50mM Tris−HCl洗浄液(pH7.4)で5回洗浄した。洗浄後に、ガラスフィルターを乾燥し、シンチレーターを加え、フィルター上の放射活性を液体シンチレーションカウンターで測定した。
10μM R(−)−α−メチルヒスタミンの存在下で反応を実施したときのR(−)−α−メチル[3H]ヒスタミン結合量を非特異的結合度とし、全R(−)−α−メチル[3H]ヒスタミン結合度と非特異的結合度との差を、特異的R(−)−α−メチル[3H]ヒスタミン結合度とした。一定濃度(1nM)のR(−)―α―メチル[3H]ヒスタミンを上述の条件下で様々な濃度の各試験薬物を反応させることにより、阻害曲線を得た。阻害曲線からR(−)−α−メチル[3H]ヒスタミンの結合が50%阻害される試験薬物濃度(IC50)を求めた。実施例化合物のIC50値を表4に示す。
【0175】
【表4】

【0176】
試験例2:[35S]GTP―γ―S結合試験
試験例1で用いたのと同じヒト型H3受容体膜標品(タンパク質7.5μg/200μl)、3μM GDP、10nM R(−)―α―メチルヒスタミン、及び試験化合物を、30℃にて20分間反応させた。反応終了後、さらに[35S]GTP−γ−S(0.2nM)を添加し、引き続き30分間反応を続けた。反応終了後に、反応混合物をガラスフィルター(GF/C)を通して吸引濾過し、ガラスフィルターを100mM 塩化ナトリウム、3mM 塩化マグネシウムを含んだ20mM HEPES洗浄液(pH7.4)で3回洗浄した。洗浄後に、ガラスフィルターを乾燥し、シンチレーターを加え、フィルター上の放射活性を液体シンチレーションカウンターで測定した。
R(−)−α―メチルヒスタミン非存在下で反応を実施したときの[35S]GTP−γ―S結合量を非特異的結合とし、R(−)−α―メチルヒスタミン存在下得られた全結合との差を特異的[35S]GTP−γ―S結合度とした。一定濃度の[35S]GTP−γ−S(0.2nM)とR(−)―α―メチルヒスタミン(10nM)を上述の条件下で様々な濃度の各試験薬物を反応させることにより、阻害曲線を得た。阻害曲線から、[35S]GTP−γ―S結合が50%阻害される試験薬物濃度(IC50)を求めた。その結果、化合物番号6のIC50値は0.28nM、化合物番号12のIC50値は0.21nM、化合物番号13のIC50値は0.62nM、化合物番号58のIC50値は0.40nM、化合物番号60のIC50値は0.23nM、化合物番号69のIC50値は0.20nM、化合物番号71のIC50値は0.26nM、化合物番号72のIC50値は0.16nM、化合物番号73のIC50値は0.23nMであった。
【産業上の利用可能性】
【0177】
本発明により、ヒスタミンH3受容体への強力な結合阻害作用を有し、ヒスタミンH3受容体に起因する障害、例えば、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病若しくはアレルギー性鼻炎等の疾患の予防又は治療に有用な医薬品を提供することが可能となり、医薬品産業の発達に大きく寄与することが考えられる。
【背景技術】
【0001】
ヒスタミンは肥満細胞、肺、肝臓、及び胃粘膜などで普段は細胞内の顆粒に貯蔵されており、細胞表面の抗体に抗原が結合するなどの外部刺激を受けて細胞外へ放出される。例えば、肥満細胞が外部から進入した抗原で刺激されると、ヒスタミンは肥満細胞から放出され、血管や平滑筋上に存在するヒスタミンH1(H1)受容体を刺激することによりアレルギー反応を引きおこす。また、胃粘膜上のECL細胞(enterochromaffin−like cell)から放出されたヒスタミンは壁細胞上のヒスタミンH2(H2)受容体を刺激し、胃酸分泌を促進する。これらの事実に基づき、アレルギー疾患治療薬、又は胃潰瘍治療薬としてH1受容体拮抗物質、又はH2受容体拮抗物質の開発が行われ、現在は医薬品として広く使用されている。
【0002】
さらに、ヒスタミンは神経伝達物質として中枢神経及び末梢神経に存在するヒスタミン受容体(ヒスタミンH3(H3)受容体)に作用し、種々の生理機能を発揮することが明らかになった。この受容体は1999年にクローニングされ、その遺伝子配列およびアミノ酸配列が明らかになったが、H1受容体及びH2受容体とのアミノ酸配列相同性は、それぞれ22%、及び21.4%と低いものであった(非特許文献1参照)。H3受容体はシナプス前膜に存在し、ヒスタミンの合成と遊離を制御するオートレセプターとして機能することが示された(非特許文献2参照)。また、H3受容体は、ヒスタミンの放出を制御するとともに、アセチルコリン、セロトニン、ドパミン、ノルアドレナリンといった他の神経伝達物質の放出をも制御することが明らかとなった(非特許文献3参照)。これらの事実は、選択的H3受容体調節物質が神経における神経伝達物質の放出異常に関連した各種疾患の治療薬になりうることを示唆している。
【0003】
実際、合成化合物を用いた動物モデルでの検討結果は、H3受容体拮抗物質、又は逆作動物質が、認知症、アルツハイマー病(非特許文献4及び5参照)、注意欠陥・多動性症(非特許文献6参照)、統合失調症(非特許文献7参照)、てんかん、中枢性痙攣などの治療薬として利用できる可能性を示している。
【0004】
また、H3受容体が摂食行動に関与することが示されており(非特許文献8参照)、H3受容体拮抗物質、又は逆作動物質の適応疾患として摂食障害、肥満、糖尿病、高脂血症などの代謝系疾患も想定される。
【0005】
また、ヒスタミンは脳内の日周リズムを調節し、覚醒と睡眠のバランスを保つ役割があることが示されており(非特許文献9及び10参照)、H3受容体拮抗物質、又は逆作動物質の適応疾患として睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病など睡眠障害に伴う疾患も想定される。
【0006】
さらに、H3受容体は鼻粘膜の交感神経に存在していることが示され、H3受容体拮抗物質とH1受容体拮抗物質の併用により鼻閉が顕著に改善されることが報告されている(非特許文献11参照)。このことは、H3受容体拮抗物質、又は逆作動物質は単独で、又はH1受容体拮抗物質との併用でアレルギー性鼻炎等の治療に有用である可能性を示している。
【0007】
H3受容体拮抗物質、又は逆作動物質については、複数のレビューにまとめられており(非特許文献12〜15参照)、これらを参照することができる。初期にはヒスタミン自身をリード化合物としたイミダゾール系化合物が数多く報告されたが、薬物代謝酵素チトクロムP450(CYP)の阻害作用等の懸念が示され、医薬品として開発されるには至っていない。
【0008】
最近になって、非イミダゾール系のH3受容体拮抗物質あるいは逆作動物質の文献及び特許が数多く報告されている(特許文献1〜10参照)。
【0009】
また、ジヒドロキノリノン構造を有するヒスタミンH3受容体拮抗物質も報告されている(特許文献11参照)。しかし、本発明に開示された構造を有する化合物についての報告はない。また、ジヒドロキノリノン骨格を有する化合物として、低酸素症改善剤、血小板粘着抑制剤、抗不整脈剤が報告されている(特許文献12〜14参照)。しかし、H3受容体への親和性、及びヒスタミン受容体サブタイプへの選択性については何ら開示されていない。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】WO2005097751国際公開公報
【特許文献2】WO2005097778国際公開公報
【特許文献3】WO2005118547国際公開公報
【特許文献4】WO2006014136国際公開公報
【特許文献5】WO2006045416国際公開公報
【特許文献6】WO2006046131国際公開公報
【特許文献7】WO2006059778国際公開公報
【特許文献8】WO2006061193国際公開公報
【特許文献9】WO2006107661国際公開公報
【特許文献10】WO2006103057国際公開公報
【特許文献11】WO2004026837国際公開公報
【特許文献12】特開昭62−135423公開特許広報
【特許文献13】特開昭63−045220公開特許広報
【特許文献14】特開昭63−290821公開特許広報
【非特許文献】
【0011】
【非特許文献1】Lovenberg T.W.ら、Molecular pharmacology, 55, 1101-1107, 1999
【非特許文献2】Arrang J-M.ら、Nature, 302, 832-837, 1983
【非特許文献3】Brown R.E. ら、Progress in Neurobiology, 63, 637-672, 2001
【非特許文献4】Huang Y-W.ら、Behavioural Brain Research, 151, 287-293, 2004
【非特許文献5】Komater V.A.ら、Behavioural Brain Research, 159, 295-300, 2005
【非特許文献6】Passani M.B.ら、Neuroscience and Biobehavioral Reviews, 24, 107-113, 2000
【非特許文献7】Fox G.B.ら、J. Pharmacol. Exp. Ther., 313, 176-190, 2005
【非特許文献8】Hancock A.A. ら、Curr. Opin. Investig. Drug, 4, 1190-1197
【非特許文献9】Huang Z-L.ら、Prog. Natr. Acad. Sci., 103, 4687-4692, 2006
【非特許文献10】Babier A.J.ら、Br. J. Pharmacol., 143, 649-661, 2004
【非特許文献11】McLeod R.L.ら、Am. J. Rhinol., 13, 391-399, 1999
【非特許文献12】Schwartz J.C.ら、Trends in Pharmacol. Sci., 7, 24-28, 1986
【非特許文献13】Passani M.B.ら、Trends in Pharmacol. Sci., 25, 618-625, 2004
【非特許文献14】Leurs R.ら、Nature Drug Discovery, 4, 107-122, 2005
【非特許文献15】Leurs R.ら、Drug Discovery Today, 10, 1613-1627, 2005
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的は、ヒスタミンH3受容体へのヒスタミンの結合に対し強力な阻害作用を有し、ヒスタミンH3受容体に起因する障害、例えば、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病、若しくはアレルギー性鼻炎等の疾患の予防剤又は治療剤を見いだすことにある。
【課題を解決するための手段】
【0013】
本発明者らは上記目的のため鋭意研究を行った結果、ジヒドロキノリノン誘導体が、ヒスタミンH3受容体へのヒスタミンの結合に対して強力な阻害活性を有することを見出し、本発明を完成した。
すなわち、本発明は、
(I)式(1)
【0014】
【化1】

[式(1)中、Qは、下記式(A)又は(B)で表される基を示し、
【0015】
【化2】

R1は、水素原子、ハロゲン原子又はC1〜C6アルキルを示し、
R2は、水素原子又はC1〜C6アルキルを示し、
nは、1又は2を示し
R3及びR4は、同一又は異なって、C1〜C6アルキル又はC3〜C7シクロアルキルを示し、
又はR3及びR4は、隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環(該飽和複素環は1又は2個のC1〜C6アルキルで置換されてもよい。)を形成し、
R5は、C1〜C6アルキル(該C1〜C6アルキルは1又は2個のC3〜C7シクロアルキルで置換されてもよい。)又はC3〜C7シクロアルキル(該C3〜C7シクロアルキルは1又は2個のC1〜C6アルキルで置換されてもよい。)を示し、
Pは、アリール、ヘテロアリール又はヘテロシクリル
{該アリール、ヘテロアリール又はヘテロシクリルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・アミノ、
・C1〜C6アルキルアミノ
・C2〜C12ジアルキルアミノ
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・環中に1つ以上の窒素原子を含み、さらに酸素原子、若しくは硫黄原子を含んでもよい単環式飽和複素環が結合したカルボニル、
・カルバモイル、
・ヘテロアリール、
・ヘテロシクリル(該ヘテロシクリルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ヘテロアリールオキシ(該ヘテロアリールオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す。]
で表されるジヒドロキノリノン誘導体、又はその医薬上許容される塩、
【0016】
(II)式(1)が式(2)で表される、
【0017】
【化3】

(I)に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩、
(III)Pがフェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニル{該フェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・ピロリジン−1−イルカルボニル、
・カルバモイル、
・オキサゾリル、
・モルホリン−4−イル又は2−オキソピロリジン−1−イル、(該モルホリン−4−イル又は2−オキソピロリジン−1−イルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ピリダジニルオキシ(該ピリダジニルオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す、
(I)又は(II)に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩、
(IV)(I)〜(III)のいずれかに記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする医薬、又は
(V)(I)〜(III)のいずれかに記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病、又はアレルギー性鼻炎の予防剤又は治療剤である。
【発明の効果】
【0018】
本発明の化合物が、優れたヒスタミンH3受容体拮抗作用を有することを見出した。
【発明を実施するための形態】
【0019】
本明細書で用いられる用語は、以下に定義される通りである。
【0020】
本発明において、「ハロゲン原子」とは、フッ素原子、塩素原子、臭素原子又はヨウ素原子を示す。
【0021】
「C1〜C6アルキル」とは、炭素数1〜6個の直鎖状又は分枝状のアルキル基を示し、例えば、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチル、tert−ブチル、n−ペンチル、イソペンチル、ネオペンチル又はn−ヘキシル等の基を示す。
【0022】
「C3〜C7シクロアルキル」とは、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル又はシクロヘプチル基を示す。
【0023】
「C1〜C6アルコキシ」とは、炭素数1〜6個の直鎖状又は分枝状のアルコキシ基を示し、例えば、メトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、イソブトキシ、sec−ブトキシ、tert−ブトキシ、n−ペンチルオキシ、イソペンチルオキシ、ネオペンチルオキシ又はn−ヘキシルオキシ等の基を示す。
【0024】
「C2〜C7アルコキシカルボニル」とは、炭素数1〜6個の直鎖状又は分枝状のアルコキシ基が結合したカルボニル基を示し、例えば、メトキシカルボニル、エトキシカルボニル、n−プロポキシカルボニル、イソプロポキシカルボニル、n−ブトキシカルボニル、イソブトキシカルボニル、sec−ブトキシカルボニル、tert−ブトキシカルボニル、n−ペンチルオキシカルボニル、イソペンチルオキシカルボニル、ネオペンチルオキシカルボニル又はn−ヘキシルオキシカルボニル等の基を示す。
【0025】
「C1〜C6アルキルアミノ」とは、炭素数1〜6個の直鎖状又は分枝状のアルキル基で置換されたアミノ基を示し、例えば、メチルアミノ、エチルアミノ、n−プロピルアミノ、イソプロピルアミノ、n−ブチルアミノ、イソブチルアミノ、sec−ブチルアミノ、tert−ブチルアミノ、n−ペンチルアミノ、イソペンチルアミノ、ネオペンチルアミノ又はn−ヘキシルアミノ等の基を示す。
【0026】
「C2〜C12ジアルキルアミノ」とは、2つの炭素数1〜6個の直鎖状又は分枝状のアルキル基で置換されたアミノ基を示し、例えば、ジメチルアミノ、ジエチルアミノ、ジ−n−プロピルアミノ、N,N−イソプロピルメチルアミノ、ジ−n−ブチルアミノ、ジイソブチルアミノ、N,N−sec−ブチルエチルアミノ、N,N−tert−ブチルメチルアミノ、ジ−n−ペンチルアミノ、N,N−イソペンチルメチルアミノ、N,N−ネオペンチルメチルアミノ又はジ−n−ヘキシルアミノ等の基を示す。
【0027】
「C2〜C7アルカノイル」とは、炭素数1〜6個のアルキル基が結合したカルボニル基を示し、例えば、アセチル、プロピオニル、ブチリル、イソブチリル、ピバロイル、ペンタノイル、3−メチルブチリル、4,4−ジメチルペンタノイル又はヘプタノイル等の基を示す。
【0028】
「C4〜C8シクロアルキルカルボニル」とは、シクロプロパンカルボニル、シクロブタンカルボニル、シクロペンタンカルボニル、シクロヘキサンカルボニル又はシクロヘプタンカルボニル基を示す。
【0029】
「C2〜C7アルキルアミノカルボニル」とは、炭素数1〜6個の直鎖状又は分枝状のアルキルアミノ基が結合したカルボニル基を示し、例えば、メチルアミノカルボニル、エチルアミノカルボニル、n−プロピルアミノカルボニル、イソプロピルアミノカルボニル、n−ブチルアミノカルボニル、イソブチルアミノカルボニル、sec−ブチルアミノカルボニル、tert−ブチルアミノカルボニル、n−ペンチルアミノカルボニル、イソペンチルアミノカルボニル、ネオペンチルアミノカルボニル又はn−ヘキシルアミノカルボニル等の基を示す。
【0030】
「C3〜C13ジアルキルアミノカルボニル」とは、炭素数2〜12個のジアルキルアミノ基が結合したカルボニル基を示し、例えば、ジメチルアミノカルボニル、ジエチルアミノカルボニル、ジ−n−プロピルアミノカルボニル、N,N−イソプロピルメチルアミノカルボニル、ジ−n−ブチルアミノカルボニル、ジイソブチルアミノカルボニル、N,N−sec−ブチルエチルアミノカルボニル、N,N−tert−ブチルメチルアミノカルボニル、ジ−n−ペンチルアミノカルボニル、N,N−イソペンチルメチルアミノカルボニル、N,N−ネオペンチルメチルアミノカルボニル又はジ−n−ヘキシルアミノカルボニル等の基を示す。
【0031】
「環中に1つ以上の窒素原子を含み、さらに酸素原子、若しくは硫黄原子を含んでもよい単環式飽和複素環が結合したカルボニル」とは、環中に1つ以上の窒素原子を含み、さらに窒素原子、酸素原子、硫黄原子から選択される1個以上のヘテロ原子を含んでいてもよい、飽和された3〜7員の単環式複素環が結合したカルボニル基を示し、例えば、アジリジン−1−イルカルボニル、アゼチジン−1−イルカルボニル、ピロリジン−1−イルカルボニル、ピペリジン−1−イルカルボニル、アゼパン−1−イルカルボニル、イミダゾリジン−1−イルカルボニル、ピラゾリジン−1−イルカルボニル、ピペラジン−1−イルカルボニル、オキサゾリジン−1−イルカルボニル、モルホリン−1−イルカルボニル又はチオモルホリン−1−イルカルボニル等の基を示す。
【0032】
「隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環」とは、1−アジリジニル、1−アゼチジニル、1−ピロリジニル、ピペリジノ又は1−アゼパニル基を示す。
【0033】
「アリール」とは、炭素原子数6から18個で構成される単環式から4環式の芳香族炭素環式基であり、例えば、フェニル基、ナフチル基、アントリル基、フェナントレニル基、テトラセニル基及びピレニル基が挙げられる。
【0034】
「ヘテロアリール」とは、5員〜6員の単環式又は9員〜10員の双環式の芳香族複素環からなる基を示し、例えば、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、キノリニル、イソキノリニル、キナゾリニル、キノキサリニル、ナフチリジニル、ピロリル、フラニル、チオフェニル、ピラゾリル、イミダゾリル、オキサゾリル、イソオキサゾリル、チアゾリル、イソチアゾリル、トリアゾリル、インドリル、ベンゾフラニル、ベンゾチオフェニル、ベンゾイミダゾリル、インダゾリル、ベンゾオキサゾリル、ベンゾチアゾリル又はベンゾトリアゾリル等の基が挙げられる。さらに詳しくは、2−ピリジル、3−ピリジル、4−ピリジル、ピリダジン−3−イル、ピリダジン−4−イル、ピリミジン−2−イル、ピリミジン−4−イル、ピリミジン−5−イル、ピラジン−2−イル、キノリン−2−イル、キノリン−3−イル、キノリン−4−イル、キノリン−6−イル、キノリン−8−イル、イソキノリン−1−イル、イソキノリン−6−イル、キナゾリン−2−イル、キナゾリン−5−イル、キノキサリン−2−イル、キノキサリン−6−イル、1,5−ナフチリジン−3−イル、1,6−ナフチリジン−8−イル、ピロール−3−イル、フラン−2−イル、フラン−3−イル、チオフェン−2−イル、チオフェン−3−イル、ピラゾール−3−イル、ピラゾール−4−イル、イミダゾール−2−イル、オキサゾール−2−イル、オキサゾール−4−イル、オキサゾール−5−イル、イソオキサゾール−3−イル、チアゾール−2−イル、チアゾール−5−イル、イソチアゾール−4−イル、1,2,4−トリアゾール−3−イル、インドール−2−イル、インドール−3−イル、インドール−5−イル、インドール−7−イル、ベンゾフラン−3−イル、ベンゾチオフェン−3−イル、ベンゾイミダゾール−2−イル、インダゾール−5−イル、ベンゾオキサゾール−2−イル、ベンゾチアゾール−2−イル又はベンゾトリアゾール−4−イル等の基を示す。
【0035】
「ヘテロシクリル」とは、環中に1つ以上の窒素原子、酸素原子、若しくは硫黄原子を含み、環中の一部に不飽和結合を含んでもよい5員〜6員の単環式又は9員〜10員の双環式の飽和複素環からなる基を示し、1又は2個のオキソ基で置換されても良い。例えば、1−ピロリジニル、1−ピペリジニル、1−ピペラジニル、モルホリン−4−イル、チオモルホリン−4−イル、2−オキソピロリジン−1−イル、2,5−ジオキソピロリジン−1−イル、2−テトラヒドロフラニル、3−テトラヒドロフラニル、4−テトラヒドロピラニル、1,4,5,6−テトラヒドロピリダジン−3−イル、2−オキソ−1,2−ジヒドロピリジン−4−イル、インドリン−4−イル、インドリン−6−イル、イソインドリン−4−イル、1,2,3,4−テトラヒドロキノリン−7−イル、1,2,3,4−テトラヒドロイソキノリン−6−イル、2,3−ジヒドロベンゾフラン−5−イル、2,3−ジヒドロベンゾフラン−6−イル、ベンゾ[1,3]ジオキソール−5−イル、2,3−ジヒドロ[1,4]ベンゾジオキシン−5−イル、2,3−ジヒドロ[1,4]ベンゾジオキシン−6−イル又は3,4−ジヒドロ[1,4]ベンゾオキサジン−7−イル等の基を示す。
【0036】
「ヘテロアリールオキシ」とは、上記「ヘテロアリール」が酸素原子を介して結合した基を示し、例えば、ピリジルオキシ、ピリダジニルオキシ、ピリミジニルオキシ、ピラジニルオキシ、キノリニルオキシ、イソキノリニルオキシ、キナゾリニルオキシ、キノキサリニルオキシ、ナフチリジニルオキシ、ピロリルオキシ、フラニルオキシ、チオフェニルオキシ、ピラゾリルオキシ、イミダゾリルオキシ、オキサゾリルオキシ、イソオキサゾリルオキシ、チアゾリルオキシ、イソチアゾリルオキシ、トリアゾリルオキシ、インドリルオキシ、ベンゾフラニルオキシ、ベンゾチオフェニルオキシ、ベンゾイミダゾリルオキシ、インダゾリルオキシ、ベンゾオキサゾリルオキシ、ベンゾチアゾリルオキシ又はベンゾトリアゾリルオキシ等の基が挙げられる。さらに詳しくは、ピリジン−2−イルオキシ、ピリジン−3−イルオキシ、ピリジン−4−イルオキシ、ピリダジン−3−イルオキシ等の基を示す。
【0037】
本願発明の好ましい1つの形態は、
式(2)、
【0038】
【化4】

[式(2)中、Qは、下記式(A)又は(B)で表される基を示し、
【0039】
【化5】

R1は、水素原子、ハロゲン原子又はC1〜C6アルキルを示し、
R3及びR4は、同一又は異なって、C1〜C6アルキル又はC3〜C7シクロアルキルを示し、
又はR3及びR4は、隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環(該飽和複素環は1又は2個のC1〜C6アルキルで置換されてもよい。)を形成し、
R5は、C1〜C6アルキル(該C1〜C6アルキルは1又は2個のC3〜C7シクロアルキルで置換されてもよい。)又はC3〜C7シクロアルキル(該C3〜C7シクロアルキルは1又は2個のC1〜C6アルキルで置換されてもよい。)を示し、
Pは、フェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニイル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニル{該フェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・ピロリジン−1−イルカルボニル、
・カルバモイル、
・オキサゾリル、
・モルホリン−4−イル又は2−オキソピロリジン−1−イル、(該モルホリン−4−イル又は2−オキソピロリジン−1−イルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ピリダジニルオキシ(該ピリダジニルオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す。]
で表されるジヒドロキノリノン誘導体、又はその医薬上許容される塩である。
【0040】
ここで、R1は、好ましくは水素原子である。
式(A)において、R3及びR4は、隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環(該飽和複素環は1又は2個のC1〜C6アルキルで置換されてもよい。)を形成することが好ましい。さらに好ましくは、1−ピロリジニル基(該1−ピロリジニル基は1又は2個のC1〜C6アルキルで置換されてもよい。)である。
Pは、好ましくはフェニル基又はピリジル基{該フェニル基又はピリジル基は
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・ピロリジン−1−イルカルボニル、
・カルバモイル、
・オキサゾリル、
・モルホリン−4−イル又は2−オキソピロリジン−1−イル、(該モルホリン−4−イル又は2−オキソピロリジン−1−イルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ピリダジニルオキシ(該ピリダジニルオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}である。
Pは、より好ましくはフェニル基又はピリジル基{該フェニル基又はピリジル基は
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、又は
・ピロリジン−1−イルカルボニル
より選ばれる同一又は異なる1〜2個の置換基で置換されてもよい。}である。
【0041】
本発明において、医薬上許容される塩とは、例えば、硫酸、塩酸、臭化水素酸、リン酸、硝酸などの無機酸との塩、酢酸、シュウ酸、乳酸、酒石酸、フマル酸、マレイン酸、クエン酸、ベンゼンスルホン酸、メタンスルホン酸、p−トルエンスルホン酸、安息香酸、カンファースルホン酸、エタンスルホン酸、グルコヘプトン酸、グルコン酸、グルタミン酸、グリコール酸、リンゴ酸、マロン酸、マンデル酸、ガラクタル酸、ナフタレン−2−スルホン酸などの有機酸との塩、リチウムイオン、ナトリウムイオン、カリウムイオン、カルシウムイオン、マグネシウムイオン、亜鉛イオン、アルミニウムイオンなどの1種又は複数の金属イオンとの塩、アンモニア、アルギニン、リシン、ピペラジン、コリン、ジエチルアミン、4−フェニルシクロヘキシルアミン、2−アミノエタノール、ベンザチンなどのアミンとの塩が含まれる。
【0042】
本発明の化合物は、各種溶媒和物としても存在し得る。また、医薬としての適用性の面から水和物の場合もある。
【0043】
本発明の化合物は、エナンチオマー、ジアステレオマー、平衡化合物、これらの任意の割合の混合物、ラセミ体等を全て含む。
【0044】
本発明の化合物には、一つ以上の水素原子、炭素原子、窒素原子、酸素原子、硫黄原子が放射性同位元素や安定同位元素と置換された化合物も含まれる。これらの標識化合物は、例えば代謝や薬物動態研究、受容体のリガンドとして生物学的分析等に有用である。
【0045】
本発明の化合物は、一つ又は二つ以上の医薬的に許容される担体、賦形剤又は希釈剤と組み合せて医薬的製剤とすることができる。上記担体、賦形剤及び希釈剤として、例えば水、乳糖、デキストロース、フラクトース、ショ糖、ソルビトール、マンニトール、ポリエチレングリコール、プロピレングリコール、デンプン、ガム、ゼラチン、アルギネート、ケイ酸カルシウム、リン酸カルシウム、セルロース、水シロップ、メチルセルロース、ポリビニルピロリドン、アルキルパラヒドロキシベンゾソルベート、タルク、ステアリン酸マグネシウム、ステアリン酸、グリセリン、ゴマ油、オリーブ油、大豆油等の各種油等が含まれる。
【0046】
また、上記の担体、賦形剤又は希釈剤に必要に応じて一般に使用される増量剤、結合剤、崩壊剤、pH調整剤、溶解剤等の添加剤を混合し、常用の製剤技術によって錠剤、丸剤、カプセル剤、顆粒剤、粉剤、液剤、乳剤、懸濁剤、軟膏剤、注射剤、皮膚貼付剤等の経口又は非経口用医薬として調製することができる。本発明の化合物は、成人患者に対して1回の投与量として0.001〜500mgを1日1回又は数回に分けて経口又は非経口で投与することが可能である。なお、この投与量は治療対象となる疾病の種類、患者の年齢、体重、症状等により適宜増減することが可能である。
【0047】
本発明の化合物における望ましいプロファイルとしては、薬効が優れていること、体内動態が優れていること(経口吸収性が良い・特定の組織に蓄積性を有さない)、物性が優れていること、低毒性であること、等が挙げられる。本発明の好ましい化合物は、優れた脳内移行性を有することが期待される。
【0048】
本発明の化合物は、下記の方法により製造できる。
本発明の化合物は、公知の有機化学的手法によって製造することができ、例えば、下記の反応式による方法に従って製造できる。下記反応式1〜4において、R1、R2、R3、R4、R5、n及びPは前記と同義である。また、R6は、水素原子又は水酸基の保護基として一般的に使用される基(例えばアセチル、ベンゾイル、ベンジル、ベンジルオキシカルボニル、tert−ブトキシカルボニル、メトキシメチル、テトラヒドロピラニル又はtert−ブチルジメチルシリル等の基)を示し、R7及びR8は、水素原子、アルキル基又はシクロアルキル基を示し、また、R7及びR8は、隣接する炭素原子と一緒にシクロアルキルを形成しても良く、X1及びX2は、同一又は異なって、塩素原子、臭素原子、ヨウ素原子等のハロゲン原子又はメタンスルホニルオキシ基、フェニルスルホニルオキシ基、p−トルエンスルホニルオキシ基、トリフルオロメタンスルホニルオキシ基等の有機スルホニルオキシ基等の脱離基を示し、Y1、Y2、Y3及びY4は、同一又は異なって、ハロゲン原子又は有機スルホニルオキシ基等の脱離基、又は水酸基を示し、点線は、単結合又は二重結合を示す。
【0049】
以下、反応式1で示される本発明の化合物の製造方法について説明する。この製造工程は、化合物(2)から本発明の化合物(1−2)を製造するための工程である。
(反応式1)
【0050】
【化6】

【0051】
(工程1)
工程1は、化合物(2)と化合物(3)とをカップリング反応により縮合して化合物(4)を得るための工程である。化合物(2)及び化合物(3)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。
Y1が水酸基である場合、該反応は、一般的なカルボン酸のアミド化の方法により実施でき、例えば、カルボン酸をカルボン酸クロリドやカルボン酸ブロミド等のカルボン酸ハライドに導いた後にアミンと反応させる方法、カルボン酸とクロル炭酸エステル等から得られる混合酸無水物をアミンと反応させる方法、カルボン酸を1−ベンゾトリアゾリルエステルやスクシンイミジルエステル等の活性エステルに導いた後にアミンと反応させる方法、カルボン酸を脱水縮合剤存在下アミンと反応させる方法等が挙げられる。これらの反応は、全て塩基の存在下又は非存在下、溶媒中で行うことができる。本反応で用いられる脱水縮合剤としては、例えば、3−(3−ジメチルアミノプロピル)−1−エチルカルボジイミド塩酸塩、ジシクロヘキシルカルボジイミド、ジフェニルホスホリルアジド、カルボニルジイミダゾール等が挙げられ、必要に応じて1−ヒドロキシベンゾトリアゾール、ヒドロキシスクシンイミド等の活性化剤を用いることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸ナトリウム、炭酸水素ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜120℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0052】
Y1がハロゲン原子である場合、該反応は、塩基の存在下又は非存在下、溶媒中又は無溶媒で化合物(2)と化合物(3)とを反応させることにより実施できる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸水素ナトリウム、水酸化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜120℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0053】
(工程2)
工程2は、化合物(4)の分子内環化反応により化合物(5)を得るための工程である。
Y2が水酸基である場合、該反応は、酸の存在下、溶媒中又は無溶媒で化合物(4)を反応させることにより実施でき、例えば、(Journal of Heterocyclic Chemistry,1991年,28巻,919頁)に記載の方法又はそれに準じた方法に従って実施できる。本反応で用いられる酸としては、例えば、三塩化アルミニウム、二塩化亜鉛、三フッ化ホウ素、四塩化チタン等のルイス酸類;硫酸、リン酸、ポリリン酸等の無機酸類等が挙げられる。本反応で用いられる溶媒としては、例えば、ジエチルエーテル、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン、ニトロベンゼン、クロロベンゼン等の芳香族炭化水素類;クロロホルム、ジクロロメタン、1,2−ジクロロエタン等のハロゲン化炭化水素類;二硫化炭素又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0054】
Y2がハロゲン原子である場合、該反応は、酸の存在下、溶媒中又は無溶媒で化合物(4)を反応させることにより実施でき、例えば、(Journal of American Chemical Society,1973年,95巻,546頁)に記載の方法又はそれに準じた方法に従って実施できる。本反応で用いられる酸としては、例えば、三塩化アルミニウム、二塩化亜鉛、三フッ化ホウ素、四塩化チタン等のルイス酸類;硫酸、リン酸、ポリリン酸等の無機酸類等が挙げられる。本反応で用いられる溶媒としては、例えば、ジエチルエーテル、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン、ニトロベンゼン、クロロベンゼン等の芳香族炭化水素類;クロロホルム、ジクロロメタン、1,2−ジクロロエタン等のハロゲン化炭化水素類;二硫化炭素又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0055】
(工程3)
工程3は、化合物(5)のR6が水酸基の保護基として一般的に使用される基である場合、その脱保護により化合物(6)を得るための工程である。R6が水素原子である場合、本工程は必要ない。該反応は、保護基の種類に応じた一般的な脱保護反応、例えば(T.W.Greene and P.G.M.Wuts著 Protective Groups in Organic Synthesis、第3版、John Wiley and Sons社)に記載の方法又はそれに準じた方法によって実施できる。
【0056】
(工程4a)
工程4aは、化合物(6)と公知の化合物(7)とのカップリング反応により化合物(8)を得るための工程である。該反応は、塩基の存在下、溶媒中又は無溶媒でフェノールとアルキルハライドとを反応させる一般的な方法により実施できる。また、必要に応じて、例えば、ヨウ化カリウム、臭化ナトリウム等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、tert−ブトキシカリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0057】
(工程5a)
工程5aは、化合物(8)と化合物(9)とをカップリング反応により縮合して化合物(10)を得るための工程である。化合物(9)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、塩基の存在下又は非存在下、溶媒中又は無溶媒でアミンとアルキルハライドとを反応させる一般的な方法により実施できる。また、必要に応じて、例えば、ヨウ化カリウム、臭化ナトリウム等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、tert−ブトキシカリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0058】
(工程6a)
工程6aは、化合物(10)と化合物(11)とをクロスカップリング反応により縮合して本発明の化合物(1―2)を得るための工程である。化合物(11)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、触媒及びそのリガンドの存在下溶媒中で反応を行う一般的な方法により実施でき、例えば、(Kunzら,Synlett,2003年,15巻,2428−2439頁)に記載の方法又はそれに準じた方法に従って実施できる。また、本反応は塩基の存在下行うことが好ましい。本反応で用いられる触媒としては、銅、ニッケル及びパラジウム等のクロスカップリング反応に一般的に用いられる遷移金属触媒が挙げられ、より具体的には、銅(0)、ヨウ化銅(I)、塩化銅(I)、酸化銅(I)、臭化銅(I)トリストリフェニルホスフィン錯体、トリフルオロメタンスルホン酸銅(I)ベンゼン錯体、酢酸パラジウム(II)、テトラキス(トリフェニルホスフィン)パラジウム(0)、ビス(トリフェニルホスフィン)パラジウム(II)クロリド、[1,1’−ビス(ジフェニルホスフィノ)フェロセン]パラジウム(II)ジクロリド、トリス(ジベンジリデンアセトン)ジパラジウム(0)、ビス(アセチルアセトナト)ニッケル(II)等が挙げられる。本反応で用いられるリガンドとしては、金属触媒を用いる縮合反応に一般的に用いられるリガンド、例えば、N,N’−ジメチルエチレンジアミン、N,N’−ジメチルシクロヘキサン−1,2−ジアミン、2−アミノピリジン、1,10−フェナンスロリン、2−ヒドロキシベンズアルデヒドオキシム、エチレングリコール、トリフェニルホスフィン、トリ−tert−ブチルホスフィン等が挙げられる。本反応で用いられる塩基としては、例えば、炭酸カリウム、リン酸カリウム、水酸化カリウム、tert−ブトキシカリウム、tert−ブトキシナトリウム、炭酸セシウム、炭酸ナトリウム、炭酸水素ナトリウム、酢酸ナトリウム、ナトリウムメトキシド、テトラブチルアンモニウムヒドロキシド等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、40℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0059】
また、化合物(5)は、反応式2に示す方法に従って製造することもできる。
(反応式2)
【0060】
【化7】

【0061】
(工程7)
工程7は、化合物(12)から化合物(5)を得るための工程である。化合物(12)は、公知化合物であるか、公知化合物から容易に合成できる化合物であり、例えば、(Journalof Heterocyclic Chemistry,1979年,16巻,221頁;Synthesis,1984年、10巻、862頁)等に記載の方法又はそれに準じた方法に従って合成できる。該反応は、溶媒中で化合物(12)を還元反応の条件にて反応させることにより実施でき、例えば、(Journal of American Chemical Society,1944年,66巻,1442頁)に記載の方法又はそれに準じた方法に従って実施できる。本反応で用いられる還元反応の条件としては、例えば、常圧又は加圧下での水素雰囲気下、ラネーニッケル又はパラジウムカーボン等の触媒を加えて反応させる方法、水素化リチウムアルミニウム、水素化ホウ素ナトリウム等の金属水素錯化合物と反応させる方法、酸、例えば酢酸や塩化アンモニウムの存在下、鉄(0)、塩化亜鉛(II)又は塩化スズ(II)と反応させる方法或いはこれらの条件の組み合わせ等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0062】
また、本工程の反応中間体である化合物(13)は、更に分子内環化反応を行うことにより化合物(5)へと変換することができる。該反応は、アニリンとカルボン酸又はエステルとの縮合によりアニリドを得る一般的な方法により実施でき、例えば、カルボン酸をカルボン酸クロリドやカルボン酸ブロミド等のカルボン酸ハライドに導いた後に反応させる方法、カルボン酸をクロル炭酸エステル等から混合酸無水物に導いた後に反応させる方法、カルボン酸を1−ベンゾトリアゾリルエステルやスクシンイミジルエステル等の活性エステルに導いた後に反応させる方法、脱水縮合剤存在下反応させる方法等が挙げられる。これらの反応は、全て酸又は塩基の存在下又は非存在下、溶媒中で又は無溶媒で行うことができる。本反応で用いられる脱水縮合剤としては、例えば、3−(3−ジメチルアミノプロピル)−1−エチルカルボジイミド塩酸塩、ジシクロヘキシルカルボジイミド、ジフェニルホスホリルアジド、カルボニルジイミダゾール等が挙げられ、必要に応じて1−ヒドロキシベンゾトリアゾール、ヒドロキシスクシンイミド等の活性化剤を用いることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸ナトリウム、炭酸水素ナトリウム等が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0063】
化合物(13)の点線が二重結合である場合、前述の分子内環化反応に加えて二重結合を単結合へと変換する還元反応を行うことにより、化合物(5)を得ることができる。該反応は、α,β−不飽和エステル又はα,β−不飽和カルボン酸の1,4−還元を行うための一般的な方法により実施でき、例えば、水素雰囲気下パラジウムカーボン、酸化白金、ラネーニッケル等の遷移金属触媒を用いて反応を行う方法、ギ酸やトリエチルシランの存在下遷移金属触媒を用いて反応を行う方法、アルコール等のプロトン性溶媒中で水素化ホウ素ナトリウム等の還元剤を用いて反応を行う方法等が挙げられる。このとき、必要に応じて塩化銅(II)、塩化ニッケル(II)等の遷移金属塩化物を加えることができる。また、必要に応じて、例えば、塩酸、酢酸などの添加物を加えることができる。これらの反応は溶媒中で行うことができる。用いられる溶媒としては、例えば、メタノール、エタノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0064】
また、化合物(10)は、反応式3に示す方法に従って製造することもできる。
(反応式3)
【0065】
【化8】

【0066】
(工程5b)
工程5bは、化合物(9)と化合物(7)とをカップリング反応により縮合して化合物(14)を得るための工程である。該反応は、工程5aと同様の方法により実施できる。
【0067】
(工程4b)
工程4bは、化合物(14)と化合物(6)とをカップリング反応により縮合して化合物(10)を得るための工程である。該反応は、工程4aと同様の方法により実施できる。
【0068】
以下、反応式4で示される本発明の化合物の製造方法について説明する。この製造工程は、化合物(6)から本発明の化合物(1−3)を製造するための工程である。
(反応式4)
【0069】
【化9】

【0070】
(工程8a)
工程8aは、化合物(6)と化合物(15)とをカップリング反応により縮合して化合物(16)を得るための工程である。化合物(15)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。
Y3がハロゲン原子又は有機スルホニルオキシ基等の脱離基である場合、該反応は、塩基の存在下又は非存在下、溶媒中又は無溶媒でフェノールのヒドロキシル基のアルキル化を行う一般的な方法により実施できる。また、必要に応じて、例えば、ヨウ化カリウム、臭化ナトリウム等の添加物を加えることができる。本反応で用いられる塩基としては、例えば、ピリジン、トリエチルアミン、ジイソプロピルエチルアミン等の有機塩基類;tert−ブトキシカリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、水酸化ナトリウム、水酸化カリウム、水素化ナトリウム等の無機塩基類が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜200℃、好ましくは、15℃〜150℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0071】
Y3が水酸基である場合、該反応としてはミツノブ反応が挙げられ、例えば、トリフェニルホスフィン、トリブチルホスフィン等の有機リン化合物とアゾジカルボン酸ジエチル、アゾジカルボン酸ジイソプロピル、アゾジカルボン酸ジtertブチル等のアゾ化合物とを組み合わせた試薬、或いはシアノメチルトリブチルホスホラン等のリンイリド試薬の存在下溶媒中で行う方法が挙げられる。本反応で用いられる溶媒としては、例えば、テトラヒドロフラン、1,2−ジメトキシエタン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜100℃であり、反応時間は、通常1〜48時間、好ましくは、1〜16時間である。
【0072】
(工程6b)
工程6bは、化合物(16)と化合物(11)とをクロスカップリング反応により縮合して本発明の化合物(1−3)を得るための工程である。該反応は、工程6aと同様の方法により実施できる。
【0073】
以下、反応式5で示される本発明の化合物の製造方法について説明する。この製造工程は、化合物(6)から本発明の化合物(1−3)を製造するための工程である。
(反応式5)
【0074】
【化10】

【0075】
(工程8b)
工程8bは、化合物(6)と化合物(17)とをカップリング反応により縮合して化合物(18)を得るための工程である。化合物(17)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、工程8aと同様の方法により実施できる。
【0076】
(工程6c)
工程6cは、化合物(18)と化合物(11)とをカップリング反応により縮合して化合物(19)を得るための工程である。該反応は、工程6aと同様の方法により実施できる。
【0077】
(工程9)
工程9は、化合物(19)のtert−ブトキシカルボニル基を除去して化合物(20)を得るための工程である。該反応は、一般的なtert−ブトキシカルボニル基の脱保護の方法により実施でき、例えば、強酸存在下溶媒中又は無溶媒で反応させる方法、塩基存在下溶媒中で反応させる方法等、(T.W.Greene and P.G.M.Wuts Protective Groups in Organic Synthesis)に記載されている方法又はそれに準じた方法に従って実施できる。本反応で用いられる酸としては、例えば、塩酸、硫酸、トリフルオロ酢酸、トリフルオロメタンスルホン酸が挙げられる。本反応で用いられる塩基としては、例えば、水酸化ナトリウム、水酸化カリウムが挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−2−ピロリドン等のアミド類;アセトン、2−ブタノン等のケトン類;ジメチルスルホキシド;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
【0078】
(工程10)
工程10は、化合物(20)と化合物(21)とをカップリング反応により縮合して本発明の化合物(1−3)を得るための工程である。化合物(21)は、公知化合物であるか、公知化合物から容易に合成できる化合物である。該反応は、工程5aと同様の方法により実施できる。
【0079】
また、本発明の化合物(1−3)は、反応式6に示す方法に従って製造することもできる。
(反応式6)
【0080】
【化11】

【0081】
(工程11)
工程11は、化合物(20)と化合物(22)とを還元的縮合反応により縮合して本発明の化合物(1−3)を得るための工程である。該反応は、カルボニル化合物とアミンを縮合させる一般的な還元的アミノ化反応の方法によって実施でき、例えば、酸の存在下又は非存在下、溶媒中又は無溶媒で化合物(20)と化合物(22)の混合物に還元剤を加えて行う方法が挙げられる。また、還元方法として、例えば、パラジウム−炭素、白金、ラネーニッケル、ロジウム−アルミナ等の触媒を用いた水素添加による接触還元の方法を利用することもできる。本反応で用いられる還元剤としては、例えば、水素化ホウ素ナトリウム、トリアセトキシ水素化ホウ素ナトリウム、シアノ水素化ホウ素ナトリウム、ジボラン、水素化リチウムアルミニウム等が挙げられる。本反応で用いられる酸としては、例えば、酢酸、ギ酸等の有機酸類;塩酸、硫酸等の無機酸類;塩化チタン、塩化亜鉛、イッテルビウム(III)トリフラート等のルイス酸類等が挙げられる。本反応で用いられる溶媒としては、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;テトラヒドロフラン、1,4−ジオキサン等のエーテル類;トルエン、ベンゼン等の炭化水素類;クロロホルム、ジクロロメタン等のハロゲン化炭化水素類;アセトニトリル;水又はこれらの混合溶媒が挙げられる。本反応における反応温度は、通常0℃〜150℃、好ましくは、15℃〜40℃であり、反応時間は、通常1〜48時間、好ましくは、1〜12時間である。
【0082】
以下に実施例及び試験例を示し、本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
【実施例】
【0083】
(実施例1)
4−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号1)の製造
【0084】
(1)(2R)−1−(3−クロロプロピル)−2−メチルピロリジンの製造
【0085】
【化12】

【0086】
(R)−2−メチルピロリジン(18.0g)と1−ブロモ−3−クロロプロパン(100.0g)のアセトン(360mL)溶液に、氷浴下5M水酸化ナトリウム水溶液(50mL)を滴下して加え、80℃にて4時間撹拌した。反応混合物を室温まで放冷し、ジエチルエーテルで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥して減圧下濃縮し、得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:n−ヘキサン/酢酸エチル=4/1〜1/1)及びシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/メタノール=9/1)にて精製して黄色油状の表題化合物(17.8g、52%)を得た。
【0087】
(2)(2R)−6−[3−(2−メチルピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0088】
【化13】

【0089】
6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オン(0.55g)のアセトニトリル(10mL)溶液に、炭酸セシウム(2.0g)及び実施例1−(1)で製造した(2R)−1−(3−クロロプロピル)−2−メチルピロリジン(0.50g)を加え、100℃にて1時間撹拌した。反応混合物に水を加え、酢酸エチルで抽出した。有機層を無水硫酸マグネシウムで乾燥し、減圧下濃縮して得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:n−ヘキサン/酢酸エチル=1/1)で精製した。得られた固体をn−ヘキサンから再結晶して無色粉末の表題化合物(0.33g、37%)を得た。
【0090】
(3)4−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号1)の製造
【0091】
【化14】

【0092】
実施例1−(2)で製造した(2R)−6−[3−(2−メチルピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(0.20g)、4−ヨードベンゾニトリル(0.18g)、rac−trans−N,N’−ジメチルシクロヘキサン−1,2−ジアミン(0.041g)、ヨウ化銅(0.013g)及び炭酸セシウム(0.45g)のN,N−ジメチルホルムアミド(2mL)懸濁液を100℃にて16時間攪拌した。反応混合物に水を加え、クロロホルムで抽出した。有機層を無水硫酸ナトリウムで乾燥して減圧下濃縮した。得られた残渣をプレパラティブTLC(2mm厚*1枚、展開溶媒:クロロホルム/メタノール=9/1)及びNH型プレパラティブTLC(0.25mm厚*2枚、展開溶媒:n−ヘキサン/酢酸エチル=1/1)にて精製して淡褐色非晶質の表題化合物(0.062g,23%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.07 (d, J=6.0 Hz, 3 H), 1.36 - 1.45 (m, 1 H), 1.63 - 2.34 (m, 8 H), 2.75 - 2.85 (m, 2 H), 2.91 - 3.05 (m, 3 H), 3.11 - 3.20 (m, 1 H), 3.93 - 4.01 (m, 2 H), 6.24 (d, J=8.7 Hz, 1 H), 6.59 (dd, J=8.7, 2.8 Hz, 1 H), 6.78 (d, J=3.2 Hz, 1 H), 7.38 (d, J=8.7 Hz, 2 H), 7.76 (d, J=8.7 Hz, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 390(M+H)+
【0093】
実施例1に示した方法と同様の方法で以下の化合物を製造した。
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−フェニル−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号2)
1−(4−メチルフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号3)
1−(4−メトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号4)
1−(4−エトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号5)
1−(4−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号6)
1−(4−クロロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号7)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(トリフルオロメチル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号8)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(トリフルオロメトキシ)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号9)
1−[4−(ヒドロキシメチル)フェニル]−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号10)
1−[4−(メトキシメチル)フェニル]−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号11)
1−{4−[(ジメチルアミノ)メチル]フェニル}−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号12)
N,N−ジメチル−4−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンズアミド(化合物番号13)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(ピロリジン−1−イルカルボニル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号14)
1−(4−アセチルフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号15)
1−[4−(シクロプロピルカルボニル)フェニル]−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号16)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(モルホリン−4−イル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号17)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(2−オキソピロリジン−1−イル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号18)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−[4−(1,3−オキサゾール−5−イル)フェニル]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号19)
1−{4−[(6−メチルピリダジン−3−イル)オキシ]フェニル}−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号20)
N,N−ジメチル−3−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンズアミド(化合物番号21)
1−(3−メトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号22)
1−(2−メトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号23)
1−(3−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号24)
1−(2,4−ジメトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号25)
1−(3−フルオロ−5−メトキシフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号26)
1−(3,5−ジフルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号27)
1−(3,4−ジフルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号28)
1−(2,4−ジフルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号29)
1−(4−クロロ−2−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号30)
3−クロロ−5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号31)
2−メチル−5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号32)
2−メトキシ−5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ベンゾニトリル(化合物番号33)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(ピリジン−2−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号34)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(ピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号35)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(ピリミジン−5−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号36)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号37)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロ−2H−1,6’−ビキノリン−2−オン(化合物番号38)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(1,5−ナフチリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号39)
6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−1−(1,6−ナフチリジン−8−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号40)
tert−ブチル 5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号41)
tert−ブチル 3−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号42)
1−(2,3−ジヒドロ−1,4−ベンゾジオキシン−6−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号43)
1−(1,3−ベンゾジオキソール−5−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号44)
1−(2,3−ジヒドロ−1−ベンゾフラン−6−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号45)
6−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ピリジン−3−カルボニトリル(化合物番号46)
1−(6−メチルピリジン−3−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号47)
1−(6−メトキシピリジン−3−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号48)
1−(5−クロロピリジン−2−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号49)
5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ピリジン−3−カルボニトリル(化合物番号50)
2−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]ピリジン−3−カルボニトリル(化合物番号51)
1−(5−フルオロピリジン−3−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号52)
1−(3−メチルピリジン−2−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号53)
1−(1−メチル−2−オキソ−1,2−ジヒドロピリジン−4−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号54)
6’−メトキシ−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号55)
【0094】
化合物番号2〜55の構造式及び物理化学的測定値を表1に示す。
【0095】
【表1−1】

【0096】
【表1−2】

【0097】
【表1−3】

【0098】
【表1−4】

【0099】
【表1−5】

【0100】
【表1−6】

【0101】
【表1−7】

【0102】
【表1−8】

【0103】
(実施例2)
1−(1H−インドール−5−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号56)の製造
【0104】
【化15】

【0105】
実施例1に示した方法と同様の方法で製造したtert−ブチル 5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号41)(0.050g)のメタノール(0.19mL)溶液に水(0.3mL)及び炭酸カリウム(0.041g)を加え、80℃にて2時間撹拌した。反応混合物を減圧下濃縮し、得られた残渣をNH型プレパラティブTLCで精製(0.25mm厚*3枚、展開溶媒:酢酸エチル)して無色非晶質の表題化合物(0.0090g、2.2%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.4 Hz, 3 H), 1.36 - 1.46 (m, 1 H), 1.59 - 1.82 (m, 2 H), 1.85 - 2.01 (m, 3 H), 2.06 - 2.13 (m, 1 H), 2.14 - 2.21 (m, 1 H), 2.23 - 2.32 (m, 1 H), 2.79 - 2.87 (m, 2 H), 2.91 - 2.99 (m, 1 H), 3.01 - 3.09 (m, 2 H), 3.12 - 3.19 (m, 1 H), 3.90 - 4.01 (m, 2 H), 6.30 (d, J=9.2 Hz, 1 H), 6.50 - 6.56 (m, 2 H), 6.77 (d, J=3.2 Hz, 1 H), 6.95 - 7.01 (m, 1 H), 7.20 - 7.24 (m, 1 H), 7.43 (d, J=8.3 Hz, 1 H), 7.49 (d, J=1.8 Hz, 1 H), 8.46 (br. s., 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 404(M+H)+
【0106】
(実施例3)
1−(1H−インドール−3−イル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号57)の製造
【0107】
【化16】

【0108】
実施例2と同様の方法により、tert−ブチル 5−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号41)の代わりにtert−ブチル 3−[6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル]−1H−インドール−1−カルボキシラート(化合物番号42)を用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.08 (d, J=6.0 Hz, 3 H), 1.35 - 1.46 (m, 1 H), 1.62 - 1.82 (m, 2 H), 1.86 - 2.00 (m, 3 H), 2.06 - 2.13 (m, 1 H), 2.13 - 2.21 (m, 1 H), 2.22 - 2.32 (m, 1 H), 2.82 - 2.90 (m, 2 H), 2.90 - 2.99 (m, 1 H), 3.01 - 3.11 (m, 2 H), 3.11 - 3.19 (m, 1 H), 3.92 - 4.01 (m, 2 H), 6.47 - 6.51 (m, 1 H), 6.51 - 6.56 (m, 1 H), 6.80 (d, J=2.8 Hz, 1 H), 7.04 - 7.10 (m, 1 H), 7.16 - 7.24 (m, 2 H), 7.30 (d, J=2.8 Hz, 1 H), 7.38 - 7.44 (m, 1 H), 8.29 (br. s., 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 404(M+H)+
【0109】
(実施例4)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号58)の製造
【0110】
(1)6−(1−シクロブチルピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0111】
【化17】

【0112】
窒素雰囲気下、6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オン(5.00g)とN−シクロブチル−4−ヒドロキシピペリジン(WO2005/108384国際公開公報に記載の方法に従って合成できる)(7.10g)のテトラヒドロフラン(50mL)溶液に、氷冷下ジエチルアゾジカルボキシレート(40%トルエン溶液)(16.7mL)を滴下した。滴下終了後、室温へと昇温し40時間撹拌した。反応混合物を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/メタノール=95/5)にて精製して無色粉末の表題化合物(2.30g、25%)を得た。
【0113】
(2)6−[(1−シクロブチルピペリジン−4−イル)オキシ]−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号58)の製造
【0114】
【化18】

【0115】
実施例4−(1)で合成した6−(1−シクロブチルピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン(0.10g)、3−ブロモイソキノリン(0.10g)、rac−trans−N,N’−ジメチルシクロヘキサン−1,2−ジアミン(0.047g)、ヨウ化銅(0.016g)及び炭酸セシウム(0.22g)のトルエン(1mL)懸濁液を110℃にて3時間攪拌した。反応混合物を室温まで放冷し、クロロホルムを加え、不溶物を濾過して取り除いた。濾液を減圧下濃縮し、得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=4/1〜1/4)及びOH型プレパラティブTLC(1mm厚*2枚、展開溶媒:クロロホルム/メタノール=4/1)にて精製して無色非晶質の表題化合物(0.061g,44%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.54 - 2.24 (m, 12 H), 2.54 - 2.80 (m, 3 H), 2.82 - 2.91 (m, 2 H), 3.04 - 3.12 (m, 2 H), 4.17 - 4.31 (m, 1 H), 6.30 (d, J=8.7 Hz, 1 H), 6.57 (dd, J=8.7, 2.8 Hz, 1 H), 6.83 (d, J=2.8 Hz, 1 H), 7.56 - 7.64 (m, 1 H), 7.74 - 7.81 (m, 1 H), 7.84 (d, J=8.3 Hz, 1 H), 8.10 - 8.22 (m, 2 H), 8.74 (d, J=2.3 Hz, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 428(M+H)+
【0116】
(実施例5)
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−3,4−ジヒドロ−2H−1,3’−ビキノリン−2−オン(化合物番号59)の製造
【0117】
【化19】

【0118】
実施例4と同様の方法により、N−シクロブチル−4−ヒドロキシピペリジンの代わりに1−tert−ブチル−4−ヒドロキシピペリジン(Journal of Organic Chemistry,2005年,70巻,1930−1933頁に記載の方法に従って合成できる)を用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.82 - 2.61 (m, 14 H), 2.81 - 3.22 (m, 7 H), 4.09 - 4.43 (m, 1 H), 6.31 (d, J=8.7 Hz, 1 H), 6.57 (dd, J=8.7, 2.8 Hz, 1 H), 6.83 (d, J=2.8 Hz, 1 H), 7.57 - 7.63 (m, 1 H), 7.75 - 7.81 (m, 1 H), 7.84 (d, J=8.3 Hz, 1 H), 8.10 - 8.20 (m, 2 H), 8.74 (d, J=2.3 Hz, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 430(M+H)+
【0119】
(実施例6)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号60)の製造
【0120】
【化20】

【0121】
実施例4と同様の方法により、3−ブロモキノリンの代わりに4−フルオロヨードベンゼンを用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.59 - 2.23 (m, 12 H), 2.49 - 2.87 (m, 5 H), 2.91 - 3.17 (m, 2 H), 4.16 - 4.26 (m, 1 H), 6.24 (d, J=8.7 Hz, 1 H), 6.58 (dd, J=8.7, 2.8 Hz, 1 H), 6.77 (d, J=2.8 Hz, 1 H), 7.12 - 7.22 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 395(M+H)+
【0122】
(実施例6−2)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩(化合物番号60塩酸塩)の製造
【0123】
実施例6で製造した6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号60)(0.90g)の酢酸エチル(10mL)及びエタノール(2mL)の混合溶液に4規定塩酸酢酸エチル溶液(1.14mL)を加え、室温にて3時間撹拌した。反応混合物を減圧下濃縮し、残渣にイソプロパノール(7mL)及びエタノール(2mL)を加えて油浴(110℃)下5分間加熱撹拌し、その後室温まで放冷しながら撹拌した。析出物を濾取し乾燥して無色結晶の表題化合物(0.93g、95%)を得た。
1H NMR (600 MHz, DMSO-d6) δ ppm 1.63 - 1.79 (m, 2 H), 1.81 - 1.92 (m, 1 H), 1.95 - 2.03 (m, 1 H), 2.06 - 2.20 (m, 4 H), 2.28 - 2.41 (m, 2 H), 2.65 - 2.70 (m, 2 H), 2.76 - 2.93 (m, 2 H), 2.99 - 3.02 (m, 2 H), 3.15 - 3.23 (m, 1 H), 3.33 - 3.40 (m, 1 H), 3.54 - 3.74 (m, 1 H), 4.40 - 4.68 (m, 1 H), 6.14 (s, 1 H), 6.67 - 6.77 (m, 1 H), 6.94 - 7.03 (m, 1 H), 7.26 - 7.30 (m, 2 H), 7.32 - 7.37 (m, 2 H), 10.82 - 10.93 (m, 1 H)
MS (ESI/APCI Dual) (Positive) m/z; 395(M+H)+
融点 >250℃
【0124】
実施例4〜6に示した方法と同様の方法で以下の化合物を製造した。
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−1−フェニル−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号61)
4−{6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル}ベンゾニトリル(化合物番号62)
3−{6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル}ベンゾニトリル(化合物番号63)
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−1−(5−フルオロピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号64)
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−1−(6−メトキシピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号65)
6−[(1−tert−ブチルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号66)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(6−メトキシピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号67)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(3,5−ジフルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号68)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(3−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号69)
1−(4−クロロフェニル)−6−[(1−シクロブチルピペリジン−4−イル)オキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号70)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−(5−フルオロピリジン−3−イル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号71)
6−[(1−シクロブチルピペリジン−4−イル)オキシ]−1−フェニル−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号72)
4−{6−[(1−シクロブチルピペリジン−4−イル)オキシ]−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル}ベンゾニトリル(化合物番号73)
3−{6−[(1−シクロブチルピペリジン−4−イル)オキシ]−2−オキソ−3,4−ジヒドロキノリン−1(2H)−イル}ベンゾニトリル(化合物番号74)
【0125】
化合物番号61〜74の構造式及び物理化学的測定値を表2に示す。
【0126】
【表2−1】

【0127】
【表2−2】

【0128】
【表2−3】

【0129】
(実施例7)
1−(4−フルオロフェニル)−6−{[1−(プロパン−2−イル)ピペリジン−4−イル]オキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号75)の製造
【0130】
(1)tert−ブチル 4−(2−オキソ−1,2,3,4−テトラヒドロキノリン−6−イルオキシ)ピペリジン−1−カルボキシレートの製造
【0131】
【化21】

【0132】
6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オン(5.0g)、tert−ブチル 4−(メタンスルホニルオキシ)ピペリジン−1−カルボキシレート(13g)及び炭酸カリウム(5.1g)のN,N−ジメチルホルムアミド(30mL)懸濁液を100℃にて20時間攪拌した。反応混合物を室温まで放冷し、水を加え、クロロホルムで抽出した。有機層を飽和食塩水で洗浄し、減圧下濃縮した。得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/ヘキサン=4/1)にて精製して無色固体の表題化合物(6.9g,65%)を得た。
【0133】
(2)tert−ブチル 4−(1−(4−フルオロフェニル)−2−オキソ−1,2,3,4−テトラヒドロキノリン−6−イルオキシ)ピペリジン−1−カルボキシレートの製造
【0134】
【化22】

【0135】
実施例7−(1)で製造したtert−ブチル 4−(2−オキソ−1,2,3,4−テトラヒドロキノリン−6−イルオキシ)ピペリジン−1−カルボキシレート(3.0g)、1−フルオロ−4−ヨードベンゼン(2.9g)、rac−trans−N,N’−ジメチルシクロヘキサン−1,2−ジアミン(1.2g)、ヨウ化銅(0.41g)及び炭酸セシウム(5.6g)のトルエン(8.0mL)懸濁液を100℃にて4時間攪拌した。反応混合物を室温まで放冷し、トルエンで希釈して不溶物を濾別し、濾液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=7/3〜1/4)にて精製して無色非晶質の表題化合物(3.8g,99%)を得た。
【0136】
(3)1−(4−フルオロフェニル)−6−(ピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩の製造
【0137】
【化23】

【0138】
実施例7−(2)で製造したtert−ブチル 4−(1−(4−フルオロフェニル)−2−オキソ−1,2,3,4−テトラヒドロキノリン−6−イルオキシ)ピペリジン−1−カルボキシレート(6.0g)の酢酸エチル(12mL)及びエタノール(4mL)の混合溶液に、室温にて4M塩酸―酢酸エチル溶液(10mL)を滴下し、16時間攪拌した。反応混合物を減圧下濃縮し、酢酸エチルを加えて室温にて1時間攪拌した。析出物を濾取し乾燥して無色固体の表題化合物(5.1g,99%)を得た。
【0139】
(4)1−(4−フルオロフェニル)−6−{[1−(プロパン−2−イル)ピペリジン−4−イル]オキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号75)の製造
【0140】
【化24】

【0141】
実施例7−(3)で製造した1−(4−フルオロフェニル)−6−(ピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩(0.30g)、炭酸カリウム(0.55g)及び2−ヨードプロパン(0.68g)のN,N−ジメチルホルムアミド(10mL)懸濁液を100℃にて1時間攪拌した。反応混合物を室温まで放冷し、水を加えてクロロホルムで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥して減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)にて精製して無色固体の表題化合物(0.16g,52%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.06 (d, J=6.0 Hz, 6 H), 1.80 (br. s., 2 H), 2.00 (br. s., 2 H), 2.39 (br. s., 2 H), 2.70 - 2.83 (m, 5 H), 2.97 - 3.03 (m, 2 H), 4.16 - 4.25 (m, 1 H), 6.24 (d, J=9.2 Hz, 1 H), 6.58 (dd, J=8.9, 3.0 Hz, 1 H), 6.77 (d, J=2.8 Hz, 1 H), 7.13 - 7.22 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 383(M+H)+
【0142】
(実施例8)
6−{[1−(シクロプロピルメチル)ピペリジン−4−イル]オキシ}−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号76)の製造
【0143】
【化25】

【0144】
実施例7−(3)で製造した1−(4−フルオロフェニル)−6−(ピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩(0.30g)、炭酸カリウム(0.55g)及び(ブロモメチル)シクロプロパン(0.32g)のN,N−ジメチルホルムアミド(10mL)懸濁液を100℃にて6時間攪拌した。反応混合物を室温まで放冷し、水を加え、クロロホルムで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥して減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)及びプレパラティブTLC(2mm厚*1枚、展開溶媒:クロロホルム/メタノール=9/1)にて精製して無色非晶質の表題化合物(0.11g,35%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.07 - 0.14 (m, 2 H), 0.47 - 0.55 (m, 2 H), 0.89 (br. s., 1 H), 1.78 - 1.88 (m, 2 H), 1.97 - 2.06 (m, 2 H), 2.22 - 2.50 (m, 4 H), 2.74 - 2.88 (m, 4 H), 2.96 - 3.02 (m, 2 H), 4.23 (br. s., 1 H), 6.24 (d, J=8.7 Hz, 1 H), 6.57 (dd, J=9.2, 2.8 Hz, 1 H), 6.76 (d, J=2.8 Hz, 1 H), 7.13 - 7.21 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 395(M+H)+
【0145】
(実施例9)
6−[(1−シクロプロピルピペリジン−4−イル)オキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号77)の製造
【0146】
【化26】

【0147】
実施例7−(3)で製造した1−(4−フルオロフェニル)−6−(ピペリジン−4−イルオキシ)−3,4−ジヒドロキノリン−2(1H)−オン塩酸塩(0.30g)、トリエチルアミン(0.080g)、[(1−エトキシシクロプロピル)−オキシ]トリメチルシラン(0.69g)、酢酸(0.48g)及びモレキュラーシーブス3A(1.0g)のメタノール(10mL)懸濁液を室温にて1時間攪拌し、シアノ水素化ホウ素ナトリウム(0.25g)加え、同温にて16時間攪拌した。反応混合物を95℃に昇温し、7時間加熱還流した後、室温まで放冷して不溶物を濾別した。濾液を減圧下濃縮し、得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)及びプレパラティブTLC(2mm厚*1枚、展開溶媒:クロロホルム/メタノール=9/1)にて精製して無色非晶質の表題化合物(0.11g,37%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.37 - 0.51 (m, 4 H), 1.57 - 1.68 (m, 1 H), 1.71 - 1.84 (m, 2 H), 1.89 - 2.01 (m, 2 H), 2.42 - 2.55 (m, 2 H), 2.78 - 2.84 (m, 2 H), 2.90 (br. s., 2 H), 2.99 - 3.07 (m, 2 H), 4.19 - 4.28 (m, 1 H), 6.27 (d, J=8.7 Hz, 1 H), 6.57 - 6.63 (m, 1 H), 6.77 - 6.81 (m, 1 H), 7.15 - 7.25 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 381(M+H)+
【0148】
(実施例10)
1−(4−フルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号78)の製造
【0149】
(1)6−(3−クロロプロポキシ)−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0150】
【化27】

【0151】
6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オン(50g)、炭酸セシウム(150g)及び1−ブロモ−3−クロロプロパン(58g)のアセトニトリル(300mL)懸濁液を110℃にて4時間攪拌した。反応混合物を室温まで放冷し、クロロホルムで希釈し、不溶物を濾別して濾液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)にて精製し、得られた固体をエタノールから再結晶して無色固体の表題化合物(42g,68%)を得た。
【0152】
(2)6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0153】
【化28】

【0154】
実施例10−(1)で製造した6−(3−クロロプロポキシ)−3,4−ジヒドロキノリン−2(1H)−オン(10g)及びピロリジン(15g)の2−プロパノール(15mL)溶液を90℃にて2日間攪拌した。反応混合物を室温まで放冷し、水を加え、クロロホルムで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥して減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム〜クロロホルム/メタノール=4/1)にて精製し、得られた固体を酢酸エチルから再結晶して無色固体の表題化合物(7.5g,65%)を得た。
【0155】
(3)1−(4−フルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号78)の製造
【0156】
【化29】

【0157】
実施例10−(2)で製造した6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(0.20g)、1−フルオロ−4−ヨードベンゼン(0.24g)、rac−trans−N,N’−ジメチルシクロヘキサン−1,2−ジアミン(0.10g)、ヨウ化銅(0.035g)及び炭酸セシウム(0.48g)のトルエン(1.0mL)懸濁液を105℃にて60時間攪拌した。反応混合物を室温まで放冷し、クロロホルムで希釈して不溶物を濾別し、濾液を減圧下濃縮した。得られた残渣をNH型シリカゲルカラムクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=1/1)にて精製し、得られた固体をジイソプロピルエーテル−酢酸エチル混合溶液から再結晶して無色固体の表題化合物(0.10g,37%)を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.74 - 1.83 (m, 4 H), 1.92 - 2.02 (m, 2 H), 2.51 (t, J=6.6 Hz, 4 H), 2.57 - 2.63 (m, 2 H), 2.76 - 2.82 (m, 2 H), 2.97 - 3.04 (m, 2 H), 3.94 - 4.01 (m, 2 H), 6.26 (d, J=8.7 Hz, 1 H), 6.58 (dd, J=8.9, 3.0 Hz, 1 H), 6.78 (d, J=2.8 Hz, 1 H), 7.14 - 7.23 (m, 4 H)
MS (ESI/APCI Dual) (Positive) m/z; 369(M+H)+
【0158】
実施例10に示した方法と同様の方法で以下の化合物を製造した。
1−(3−フルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号79)
1−(3,5−ジフルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号80)
1−(3,4−ジフルオロフェニル)−6−[3−(ピロリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号81)
1−(4−フルオロフェニル)−6−[3−(ピペリジン−1−イル)プロポキシ]−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号82)
6−[3−(ジエチルアミノ)プロポキシ]−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号83)
6−{3−[(2R,5R)−2,5−ジメチルピロリジン−1−イル]プロポキシ}−1−(4−フルオロフェニル)−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号84)
【0159】
化合物番号79〜84の構造式及び物理化学的測定値を表3に示す。
【0160】
【表3】

【0161】
(実施例11)
8−クロロ−1−(4−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号85)の製造
【0162】
(1)8−クロロ−6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0163】
【化30】

3−クロロ−N−(2−フルオロ−4−メトキシフェニル)プロパンアミド(1.0g、3−クロロブチリルクロリド及び2−フルオロ−4−メトキシアニリンから合成)及び塩化アルミニウム(5.0g)のn−ヘプタン(2.0mL)懸濁液を110℃にて3日間攪拌した。反応混合物をクロロホルムで希釈し、氷冷下氷水を加え、室温にて2時間攪拌してから有機層と水層を分離した。水層をクロロホルムで抽出し、有機層を併せて無水硫酸マグネシウムで乾燥し、減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:ヘキサン/酢酸エチル=3/2)及びNH型シリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/メタノール=99/1〜9/1)にて精製して淡黄色固体の表題化合物(0.059g,7%)を得た。
【0164】
(2)8−クロロ−1−(4−フルオロフェニル)−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号85)の製造
【0165】
【化31】

【0166】
実施例1と同様の方法により、6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オンの代わりに実施例11−(1)で製造した8−クロロ−6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オンを、4−ヨードベンゾニトリルの代わりに4−フルオロヨードベンゼンをそれぞれ用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.11 - 1.28 (m, 3 H), 1.43 - 2.57 (m, 9 H), 2.66 - 2.74 (m, 2 H), 2.90 - 3.14 (m, 3 H), 3.31 (br. s., 1 H), 3.96 - 4.04 (m, 2 H), 6.69 - 6.75 (m, 2 H), 6.99 - 7.05 (m, 2 H), 7.12 - 7.18 (m, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 417(M+H)+
【0167】
(実施例12)
1−(4−フルオロフェニル)−8−メチル−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号86)の製造
【0168】
(1)6−ヒドロキシ−8−メチル−3,4−ジヒドロキノリン−2(1H)−オンの製造
【0169】
【化32】

【0170】
3−クロロ−N−(4−メトキシ−2−メチルフェニル)プロパンアミド(0.50g、3−クロロブチリルクロリド及び4−メトキシ−2−メチルアニリンから合成)及び塩化アルミニウム(1.4g)のn−ヘプタン(4.0mL)懸濁液を110℃にて4日間攪拌した。反応混合物をクロロホルムで希釈し、氷冷下氷水を加え、室温にて1時間攪拌して有機層と水層を分離した。水層を酢酸エチルで抽出し、有機層を併せて無水硫酸マグネシウムで乾燥し、減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(展開溶媒:クロロホルム/メタノール=10/0〜97/3)にて精製して淡茶色固体の表題化合物(0.166g,39%)を得た。
【0171】
(2)1−(4−フルオロフェニル)−8−メチル−6−{3−[(2R)−2−メチルピロリジン−1−イル]プロポキシ}−3,4−ジヒドロキノリン−2(1H)−オン(化合物番号86)の製造
【0172】
【化33】

【0173】
実施例1と同様の方法により、6−ヒドロキシ−3,4−ジヒドロキノリン−2(1H)−オンの代わりに実施例12−(1)で製造した6−ヒドロキシ−8−メチル−3,4−ジヒドロキノリン−2(1H)−オンを、4−ヨードベンゾニトリルの代わりに4−フルオロヨードベンゼンをそれぞれ用いて表題化合物を得た。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.11 - 1.30 (m, 3 H), 1.48 - 2.59 (m, 12 H), 2.64 - 2.71 (m, 2 H), 2.86 - 2.93 (m, 2 H), 3.00 - 3.13 (m, 1 H), 3.22 - 3.41 (m, 1 H), 3.95 - 4.05 (m, 2 H), 6.45 - 6.50 (m, 1 H), 6.60 - 6.66 (m, 1 H), 6.96 - 7.05 (m, 2 H), 7.13 - 7.21 (m, 2 H)
MS (ESI/APCI Dual) (Positive) m/z; 397(M+H)+
【0174】
試験例1:H3受容体結合試験
ヒト型H3受容体発現CHO−K1細胞の膜標品(パーキンエルマー社、ES−392−M400UA、タンパク質15μg/200μl)、R(−)−α−メチル[3H]ヒスタミン(アマシャム社、TRK−1017、比活性 1.74TBq/mmol、1nM)、及び試験薬物を、室温にて1時間反応させた。反応終了後に、反応混合物を、0.3%ポリエチレンイミンで処理したガラスフィルター(GF/C)を通して吸引濾過し、ガラスフィルターを、5mM EDTAを含んだ50mM Tris−HCl洗浄液(pH7.4)で5回洗浄した。洗浄後に、ガラスフィルターを乾燥し、シンチレーターを加え、フィルター上の放射活性を液体シンチレーションカウンターで測定した。
10μM R(−)−α−メチルヒスタミンの存在下で反応を実施したときのR(−)−α−メチル[3H]ヒスタミン結合量を非特異的結合度とし、全R(−)−α−メチル[3H]ヒスタミン結合度と非特異的結合度との差を、特異的R(−)−α−メチル[3H]ヒスタミン結合度とした。一定濃度(1nM)のR(−)―α―メチル[3H]ヒスタミンを上述の条件下で様々な濃度の各試験薬物を反応させることにより、阻害曲線を得た。阻害曲線からR(−)−α−メチル[3H]ヒスタミンの結合が50%阻害される試験薬物濃度(IC50)を求めた。実施例化合物のIC50値を表4に示す。
【0175】
【表4】

【0176】
試験例2:[35S]GTP―γ―S結合試験
試験例1で用いたのと同じヒト型H3受容体膜標品(タンパク質7.5μg/200μl)、3μM GDP、10nM R(−)―α―メチルヒスタミン、及び試験化合物を、30℃にて20分間反応させた。反応終了後、さらに[35S]GTP−γ−S(0.2nM)を添加し、引き続き30分間反応を続けた。反応終了後に、反応混合物をガラスフィルター(GF/C)を通して吸引濾過し、ガラスフィルターを100mM 塩化ナトリウム、3mM 塩化マグネシウムを含んだ20mM HEPES洗浄液(pH7.4)で3回洗浄した。洗浄後に、ガラスフィルターを乾燥し、シンチレーターを加え、フィルター上の放射活性を液体シンチレーションカウンターで測定した。
R(−)−α―メチルヒスタミン非存在下で反応を実施したときの[35S]GTP−γ―S結合量を非特異的結合とし、R(−)−α―メチルヒスタミン存在下得られた全結合との差を特異的[35S]GTP−γ―S結合度とした。一定濃度の[35S]GTP−γ−S(0.2nM)とR(−)―α―メチルヒスタミン(10nM)を上述の条件下で様々な濃度の各試験薬物を反応させることにより、阻害曲線を得た。阻害曲線から、[35S]GTP−γ―S結合が50%阻害される試験薬物濃度(IC50)を求めた。その結果、化合物番号6のIC50値は0.28nM、化合物番号12のIC50値は0.21nM、化合物番号13のIC50値は0.62nM、化合物番号58のIC50値は0.40nM、化合物番号60のIC50値は0.23nM、化合物番号69のIC50値は0.20nM、化合物番号71のIC50値は0.26nM、化合物番号72のIC50値は0.16nM、化合物番号73のIC50値は0.23nMであった。
【産業上の利用可能性】
【0177】
本発明により、ヒスタミンH3受容体への強力な結合阻害作用を有し、ヒスタミンH3受容体に起因する障害、例えば、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病若しくはアレルギー性鼻炎等の疾患の予防又は治療に有用な医薬品を提供することが可能となり、医薬品産業の発達に大きく寄与することが考えられる。
【特許請求の範囲】
【請求項1】
式(1)
【化1】

[式(1)中、Qは、下記式(A)又は(B)で表される基を示し、
【化2】

R1は、水素原子、ハロゲン原子又はC1〜C6アルキルを示し、
R2は、水素原子又はC1〜C6アルキルを示し、
nは、1又は2を示し
R3及びR4は、同一又は異なって、C1〜C6アルキル又はC3〜C7シクロアルキルを示し、
又はR3及びR4は、隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環(該飽和複素環は1又は2個のC1〜C6アルキルで置換されてもよい。)を形成し、
R5は、C1〜C6アルキル(該C1〜C6アルキルは1又は2個のC3〜C7シクロアルキルで置換されてもよい。)又はC3〜C7シクロアルキル(該C3〜C7シクロアルキルは1又は2個のC1〜C6アルキルで置換されてもよい。)を示し、
Pは、アリール、ヘテロアリール又はヘテロシクリル
{該アリール、ヘテロアリール又はヘテロシクリルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・アミノ、
・C1〜C6アルキルアミノ
・C2〜C12ジアルキルアミノ
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・環中に1つ以上の窒素原子を含み、さらに酸素原子、若しくは硫黄原子を含んでもよい単環式飽和複素環が結合したカルボニル、
・カルバモイル、
・ヘテロアリール、
・ヘテロシクリル(該ヘテロシクリルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ヘテロアリールオキシ(該ヘテロアリールオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す。]
で表されるジヒドロキノリノン誘導体、又はその医薬上許容される塩。
【請求項2】
式(1)が式(2)で表される、
【化3】

請求項1に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩。
【請求項3】
Pがフェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニル{該フェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・ピロリジン−1−イルカルボニル、
・カルバモイル、
・オキサゾリル、
・モルホリン−4−イル又は2−オキソピロリジン−1−イル、(該モルホリン−4−イル又は2−オキソピロリジン−1−イルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ピリダジニルオキシ(該ピリダジニルオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す、
請求項1又は2に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩。
【請求項4】
請求項1〜3のいずれか1項に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする医薬。
【請求項5】
請求項1〜3のいずれか1項に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病、若しくはアレルギー性鼻炎の予防剤又は治療剤。
【請求項1】
式(1)
【化1】

[式(1)中、Qは、下記式(A)又は(B)で表される基を示し、
【化2】

R1は、水素原子、ハロゲン原子又はC1〜C6アルキルを示し、
R2は、水素原子又はC1〜C6アルキルを示し、
nは、1又は2を示し
R3及びR4は、同一又は異なって、C1〜C6アルキル又はC3〜C7シクロアルキルを示し、
又はR3及びR4は、隣接する窒素原子と一緒になって互いに結合した3〜7員の飽和複素環(該飽和複素環は1又は2個のC1〜C6アルキルで置換されてもよい。)を形成し、
R5は、C1〜C6アルキル(該C1〜C6アルキルは1又は2個のC3〜C7シクロアルキルで置換されてもよい。)又はC3〜C7シクロアルキル(該C3〜C7シクロアルキルは1又は2個のC1〜C6アルキルで置換されてもよい。)を示し、
Pは、アリール、ヘテロアリール又はヘテロシクリル
{該アリール、ヘテロアリール又はヘテロシクリルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・アミノ、
・C1〜C6アルキルアミノ
・C2〜C12ジアルキルアミノ
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・環中に1つ以上の窒素原子を含み、さらに酸素原子、若しくは硫黄原子を含んでもよい単環式飽和複素環が結合したカルボニル、
・カルバモイル、
・ヘテロアリール、
・ヘテロシクリル(該ヘテロシクリルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ヘテロアリールオキシ(該ヘテロアリールオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す。]
で表されるジヒドロキノリノン誘導体、又はその医薬上許容される塩。
【請求項2】
式(1)が式(2)で表される、
【化3】

請求項1に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩。
【請求項3】
Pがフェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニル{該フェニル、ピリジル、ピリミジニル、キノリニル、ナフチリジル、インドリル、2,3−ジヒドロ[1,4]ベンゾジオキシニル、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロベンゾフラニル又は2−オキソ−1,2−ジヒドロピリジニルは、
・ハロゲン原子、
・C1〜C6アルキル(該C1〜C6アルキルは、1〜3個のハロゲン原子、ヒドロキシ、C1〜C6アルコキシ、又はC2〜C12ジアルキルアミノで置換されてもよい。)、
・C1〜C6アルコキシ(該C1〜C6アルコキシは、1〜3個のハロゲン原子で置換されてもよい。)、
・C2〜C7アルカノイル、
・C4〜C8シクロアルキルカルボニル、
・シアノ、
・C2〜C7アルコキシカルボニル、
・C2〜C7アルキルアミノカルボニル、
・C3〜C13ジアルキルアミノカルボニル、
・ピロリジン−1−イルカルボニル、
・カルバモイル、
・オキサゾリル、
・モルホリン−4−イル又は2−オキソピロリジン−1−イル、(該モルホリン−4−イル又は2−オキソピロリジン−1−イルは、1又は2個のC1〜C6アルキルで置換されてもよい。)、又は、
・ピリダジニルオキシ(該ピリダジニルオキシは、1又は2個のC1〜C6アルキルで置換されてもよい。)
より選ばれる同一又は異なる1〜3の置換基で置換されてもよい。}を示す、
請求項1又は2に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩。
【請求項4】
請求項1〜3のいずれか1項に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする医薬。
【請求項5】
請求項1〜3のいずれか1項に記載のジヒドロキノリノン誘導体、又はその医薬上許容される塩を有効成分として含有することを特徴とする、認知症、アルツハイマー病、注意欠陥・多動性症、統合失調症、てんかん、中枢性痙攣、摂食障害、肥満、糖尿病、高脂血症、睡眠障害、ナルコレプシー、睡眠時無呼吸症候群、概日リズム障害、うつ病、若しくはアレルギー性鼻炎の予防剤又は治療剤。
【公表番号】特表2012−517400(P2012−517400A)
【公表日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願番号】特願2011−533447(P2011−533447)
【出願日】平成22年2月5日(2010.2.5)
【国際出願番号】PCT/JP2010/052114
【国際公開番号】WO2010/090347
【国際公開日】平成22年8月12日(2010.8.12)
【出願人】(000002819)大正製薬株式会社 (437)
【Fターム(参考)】
【公表日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願日】平成22年2月5日(2010.2.5)
【国際出願番号】PCT/JP2010/052114
【国際公開番号】WO2010/090347
【国際公開日】平成22年8月12日(2010.8.12)
【出願人】(000002819)大正製薬株式会社 (437)
【Fターム(参考)】
[ Back to top ]

