ジャガイモ葉巻ウイルスに対して抵抗性を有するジャガ イモ及びその作出方法
【目的】 ジャガイモ葉巻ウイルスに対して抵抗性を有するジャガイモ並びにその作出方法及び当該作出方法に用いる発現プラスミドの提供。
【構成】 ジャガイモ葉巻ウイルスの外被蛋白質をコードする遺伝子を組み込んだ組み換えベクターにより、ジャガイモの細胞を形質転換して、当該形質転換細胞を再分化させることを特徴とするジャガイモ葉巻ウイルスに対して抵抗性を有するジャガイモの作出方法、当該抵抗性ジャガイモ及び上記組み換えベクター。
【構成】 ジャガイモ葉巻ウイルスの外被蛋白質をコードする遺伝子を組み込んだ組み換えベクターにより、ジャガイモの細胞を形質転換して、当該形質転換細胞を再分化させることを特徴とするジャガイモ葉巻ウイルスに対して抵抗性を有するジャガイモの作出方法、当該抵抗性ジャガイモ及び上記組み換えベクター。
【発明の詳細な説明】
【0001】
【産業上の利用分野】本発明は、ジャガイモ葉巻ウイルス (以下「PLRV」と記載する) の外被蛋白質をコードする遺伝子で形質転換することを特徴とするPLRVに対して抵抗性を有するジャガイモの作出方法、当該方法に用いる組換えプラスミド、及び当該方法により作出されたPLRVに対して抵抗性を有するジャガイモに関するものである。
【0002】
【従来の技術】タバコモザイクウイルス (以下「TMV」と記載する) やキュウリモザイクウイルス (以下「CMV」と記載する) 等の植物ウイルスはその感染により農作物に多大な被害を与えるものである。その上、これらのウイルスの防除は一般的に困難であり、当該ウイルスに対して抵抗性を有する、ウイルス耐性植物の作出が産業上期待されている。
【0003】而して、近年ウイルス耐性植物の作出を最終的な目的として、植物ウイルスの外被蛋白質遺伝子cDNAを組み込んだ形質転換植物を作出する試みが進められている。
(1) その最初の例として、TMVの外被蛋白質遺伝子cDNAを組み込んだタバコを用いて、外被蛋白質がTMVの感染・増殖を阻害する作用を有することが明らかにされた(サイエンス (Science), 232, 738-743, 1986: バイロロジー(Virology), 158, 126-132, 1987)。
【0004】以来、CMV(バイオ/テクノロジー (Bio/Technology), 6, 549-557, 1988)、アルファルファ・モザイク・ウイルス(エンボ・ジャーナル (EMBO J.), 6,1845-1851, 1987: バイロロジー (Virology), 159, 299-305, 1987 )、ジャガイモXウイルス (以下「PVX」と記載する) (エンボ・ジャーナル (EMBO J.), 7, 1273-1280, 1988)、タバコ・ストリーク・ウイルス(バイロロジー(Viro-logy), 164, 383-389, 1988 )、タバコ・ラットル・ウイルス(バイロロジー (Virology), 159, 299-305, 1987: バイロロジー (Virology), 167, 649-652,1988)、ダイズ・モザイク・ウイルス(バイオ/テクノロジー (Bio/Technology), 7, 1257-1262, 1989 )について、同様に外被蛋白質遺伝子cDNAを組み込んだタバコが、それらのウイルスの感染・増殖に対して抵抗性を示した。さらに、TMVの外被蛋白質遺伝子cDNAを組み込んだトマトは、野外においてもTMVに対する抵抗性を示すことが報告されている(バイオ/テクノロジー (Bio/Technology), 6, 403-409, 1988)。
【0005】タバコやトマト以外に、PVXの外被蛋白質遺伝子cDNAを組み込んだジャガイモ(バイオ/テクノロジー (Bio/Technology), 7, 273-278, 1989 )及びPVXの外被蛋白質遺伝子cDNAと両者を組み込んだジャガイモ(バイオ/テクノロジー (Bio/Technology), 8, 127-134, 750-754, 1990)においてもウイルスに対する抵抗性が示された。
【0006】(2) PLRVは約6kbの一本鎖RNAゲノムを持つ直径24nmのアブラムシ媒介性の球状ウイルス (CMI/AAB ディスクリプションズ・オブ・プラント・バイラス (Descrip. Plant Virus) No.36)で、ルテオウイルスを代表するウイルスである。なお、本ゲノムは、5'末端にゲノム結合蛋白質 (VPg)を持つことを特徴とする。
【0007】また、PLRVの外被蛋白質をコードする遺伝子の塩基配列はすでに6例報告されている(ジャーナル・オブ・ジェネラル・バイロロジー (J. gen. Virol),70, 783-788, 1037-1051, 1989: ジャーナル・オブ・ジェネラル・バイロロジー(J. gen. Virol), 71, 719-724, 1990: ヌークレイックアシド・リサーチ(Nucleic Acids Res.), 17, 1768, 1989: アーカイブス・オブ・バイロロジー(Arch. Virol. 105, 153-163, 1989: フエブス・レターズ (FEBS LETTERS),245, 51-56, 1989)。そして、当該塩基配列は各々異なることが判明している。
【0008】そして、PLRVの外被蛋白質遺伝子cDNAをジャガイモの細胞に組み込んだ例は、1例報告されている(プラント・モレクラー・バイオロジー(Plant Mol. Biol.), 17, 431-439, 1991)。しかしながら、試験された対象が少なく (4個体) 、ウイルス抵抗性形質転換体の作出効率、ウイルス抵抗性の程度は明らかにされていない。
【0009】
【発明が解決しようとする課題】そこで、本発明が解決しようとする課題は、上記PLRVの外被蛋白質をコードする遺伝子を用いたPLRVに対して抵抗性を有するジャガイモの作出にある。
【0010】
【課題を解決するための手段】本発明者らは、上記課題に鑑み、前記のPLRVとは別に、北海道で葉巻病に侵されたジャガイモの葉よりウイルスを分離して (以下「PLRV−H」と記載する) 、かかるPLRV−Hの遺伝子をcDNAとしてクローニングしたうえで、その外被蛋白質をコードするcDNAを単離し、塩基配列を決定した (1991年4月に日本植物病理学会において発表) 。この結果PLRV−Hの外被蛋白質をコードする遺伝子は、前記のPLRVの外被蛋白質をコードする遺伝子と、その塩基配列が異なることが明らかになった。
【0011】そして、驚くべきことに、かかるPLRV−Hの外被蛋白質をコードする遺伝子由来のcDNAで形質転換したジャガイモ細胞を再分化して得られるジャガイモは、PLRVに対して強い抵抗性を有することを見出し本発明を完成した。すなわち本発明は、(1) 配列番号1に示される塩基配列を有するDNAを組み込んだ組み換えベクターにより、ジャガイモの細胞を形質転換して、当該形質転換細胞を再分化させることを特徴とするジャガイモ葉巻ウイルスに対して抵抗性を有するジャガイモの作出方法、(2) (1) 記載の方法により作出されたジャガイモ、(3) 植物において機能するプロモーター配列、配列番号1に示される塩基配列、及びターミネーター配列を有することを特徴とする (1) 記載の方法において用いる組み換えプラスミドを提供するものである。
【0012】以下、本発明について詳細に説明する。PLRV−Hの外被蛋白質由来のcDNAの塩基配列の決定は、「大島, 松村等, 1991年4月, 日本植物病理学会要旨集」に記載した通り行なうことができる。より具体的かつ詳細には、後記参考例において開示する。次にPLRV−H外被蛋白質発現用プラスミドは以下のようにして調製される。
【0013】クローニングされたPLRV−H外被蛋白質の遺伝子をコードするcDNA断片を制限酵素によって切り出し、リガーゼ反応により、かかる制限酵素断片をそのまま、相補的な開裂末端を有する植物発現用プラスミドに結合することによって調製することが可能である。あるいは、必要に応じて植物発現用プラスミドの制限酵素開裂末端に相補的な配列を有する合成リンカーを上記制限酵素断片に結合させて加工した制限酵素断片をリガーゼ反応を用いて植物発現用プラスミドに結合することによって結合することができる。
【0014】用いられる植物発現用プラスミドは、構造遺伝子挿入部分の上流に植物において機能するプロモーター配列を有し、かつ下流にターミネーター配列を有するものが好ましい。このような植物発現用プラスミドとしては、例えばpBI121 (クローンテック社製) 、 pCaMVCN (ファルマシア製) 等を挙げることができる。このようにして調製された発現用プラスミドを所望のジャガイモの細胞に導入する。当該方法としては、例えばエレクトロポレーションにより行う方法 (Fromm M. et al., Proc. Natl. Acad. Sci. USA, 82, 5824-5828)、アグロバクテリウムを介した方法 (Horsch R. B. et al., Science, 227, 1229-1231, 1985) 、マイクロインジェクションによる方法 (Grossway A. et al., Mol. Gen. Genet,202, 179-185, 1985)等が挙げられる。
【0015】そして、形質転換されたジャガイモの細胞を植物体に分化させる方法としては、リーフディスクからの再分化方法 (M. De Block. Thero. Appl. Genet, 76,767-774, 1988)、チューバーディスクからの再分化方法 (Sheerman S., et al.,Plant Cell Reports, 7, 13-16, 1988)等の既に知られた方法を採ることができる。
【0016】なお、作出の対象となるジャガイモの品種は、特に限定されず、例えば、メークイン、ワセシロ、トヨシロ、農林1号、紅丸、男爵等を広く用いることができる。
【0017】
【実施例】以下、参考例及び実施例を挙げて本発明を具体的に説明する。
<参考例>1. ウイルス核酸の分離PLRVをPhysalis floridanaに接種して、25℃で4週間程度ウイルスを増殖させた後、感染葉を生重の2倍量の0.1M クエン酸緩衝液 ((pH6.0) 0.5%メルカプトエタノールを含む) 中で磨砕した。得られた破砕液に1%(W/V) になるようにドリセラーゼを加え、28℃で2時間攪拌後、クロロホルム:ブタノール混液 (1:1) を加えてさらに攪拌した後、低速遠心分離 (5,000回転、15分間4℃マルサン1OBローター) により植物成分を除去した。上層にpH7.0になるまで0.2 M リン酸2ナトリウム溶液を加えた後、それぞれ終濃度が8%(W/V) 及び0.2M になるようにポリエチレングリコール♯6000及び塩化ナトリウムを加え、室温で1時間攪拌後4℃で1晩静置した。低速遠心分離 (同上) により得られた沈澱を緩衝液で溶解した後、終濃度1%なるようにトリトンX-100 を加え、再度低速遠心分離 (10,000回転、10分間、佐久間製作所6DB6ローター) した上清を高速遠心分離 (27,000回転3時間4℃日立工機RP30-2ローター) した。得られた沈澱を0.1M リン酸緩衝液pH7.0に溶解した後、10−40%(W/V) の蔗糖密度勾配遠心分離 (22,500回転、3時間15℃日立工機RPS27 ローター) を行った。ウイルス分画をISCOフラクショネーター (UA-2モニター) で採取し、高速遠心分離 (36,000回転3時間4℃日立工機RP65ローター) を行い蔗糖を抜いた後、再び0.01M リン酸緩衝液pH7.0に溶解し純化ウイルスとした。
【0018】純化ウイルス溶液にフェノール:クロロホルム (V/V=1:1)を加えて5分間振とうした後、10,000gで5分間遠心分離した。中間変性層がなくなるまでこの操作を繰り返した。水層に1/10量の3M 酢酸ナトリウムと2.5倍量のエタノールを加えて静置し、PLRV−RNAを沈澱させる。10,000gで5分間遠心分離後、得られた沈澱を乾燥させた後滅菌蒸留水に溶解し、PLRV−RNAの精製標品とした。
2. PLRV外被蛋白質遺伝子のcDNAクローニングイギリスで分離されたPLRVstrainlの外被蛋白質遺伝子 (ジャーナル・オブ・ジェネラル・バイロロジー (J. gen. Virol.), 70, 1037-1051, 1989) の塩基配列を参考にして配列番号1に示す塩基配列を有する合成DNAプライマーPLRVp12 と配列番号2に示す塩基配列を有する合成プライマーPLRVp14 を「Applied Biosystems model 380A DNA synthesizer 」で合成した。PLRV−RNAを鋳型に合成プライマーPLRVp12 とアマシャム (Amersham社製) cDNA合成キットを用いてcDNAを合成した。合成したcDNA断片と合成DNAプライマーPLRVp12 及びPLRVp14 を用いてPCR反応を行った。
【0019】PCR反応により増幅されたcDNA断片を制限酵素 SacI (宝酒造社製) で切断後、pUC119 (宝酒造社製) の SacI部位にDNAリガーゼを用いてサブクローニングした。得られた組換えプラスミドをpPLRV25 と命名し、これを用いて大腸菌Escherichia coli MV1184株 (宝酒造社製) を形質転換した。この形質転換体Escherichia coli MV1184/pPLRV25 は、工業技術院微生物工業技術研究所に微生物菌寄第12932号 (FERM P-12932) として寄託されている。
3. DNAシークエンス解析DNAシークエンスはジデオキシヌクレオチド法 (Messing J., Meth. Enzymol., 101, 20-78, 1983) に従い7−デア・ザ・シークエンス・キット (宝酒造社製) を用いて行った。pPLRV25 について「ヌクレイック・アシズ・リサーチ (Nucleic Acids Resarch)、12, 7813-7827, 1985 」に記載されている方法に準じてアルカリ変性を行い、 M13M4プライマー、 M13RVプライマー (宝酒造社製) 及び配列番号3に示す塩基配列を有する PLRVp22プライマー、配列番号4に示す塩基配列を有する PLRVp23プライマーを用いてプラスミド・シークエンスを行った。
【0020】かかるDNAシークエンス解析により決定されたPLRV−Hの外被蛋白質の遺伝子をコードするcDNAの塩基配列を配列番号5に示した。また当該塩基配列より推定されるアミノ酸配列を配列番号6に示した。
【0021】
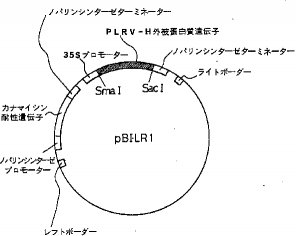
【実施例1】 発現用プラスミドの調製組換えプラスミドpPLRV25、1μg を含むDNA溶液を2ユニットの制限酵素Pma CI (宝酒造社製) と2ユニットの SacI (宝酒造社製) およびそれぞれの制限酵素に添付されている緩衝液を10%(V/V) になるように加え、37℃で2時間反応させて5'上流領域16塩基を含む 644塩基のPLRV−Hの外被蛋白質をコードしているcDNA断片を単離した。次に植物発現ベクターpBI121 (クローンテック社製) 1μg を2ユニットの制限酵素 SmaI (宝酒造社製)、 SacI (宝酒造社製)を用いて上記の方法で切断した。さらに、前記cDNA断片とpBI121の制限断片を2ユニットのT4 DNAリガーゼ (宝酒造社製)存在下、16℃1時間反応させて発現プラスミドを調製し、これをpBILR1と命名した。この発現用プラスミド pBILR1の構築図を図1に示す。これを用いてE. coli HB101株 (フナコシ社製) を形質転換した。
【0022】
【実施例2】 PLRVに対して抵抗性を有するジャガイモの作出(1) 発現用プラスミドpBILR1のアグロバクテリウムへの導入実施例1で得られた発現用プラスミドpBILR1をヘルパープラスミドpRK2013 を保有するE. coli HB101 (クローンテック社製) の存在下で、トリペアレンタル接合によってAgrobacterium tumefaciens LBA4404 (クローンテック社製) に導入した。
【0023】すなわち、前記の組換えプラスミドpBILR1を持つE.coli HB101、ヘルパープラスミドpRK2013 を持つE. coli HB101と腫瘍形成遺伝子が除去された改変非組換えプラスミドpAL4404 を持つA. tumefaciens LBA4404の培養液をそれぞれ等量ずつ混合し、28℃に一晩静置した後、リファンピシン (シグマ社製) (100μg/ml) 、カナマイシン (明治製菓社製) (25μg/ml) 、及びストレプトマイシン (半井化学社製) (300μg/ml) を含む培地上にまき、pBILR1を保有するA. tumefaciensを選択した。
【0024】(2) ジャガイモ細胞への導入及び再分化PLRV外被蛋白質cDNAを植物発現用ベクターに組み込んだ組換えプラスミドのジャガイモへの導入は、チューバーディスク法を用いた。すなわち、バレイショ (品種:メークイン、ワセシロ、トヨシロ、農林1号、紅丸、男爵) の塊茎の皮をむき、1%次亜塩素酸ソーダ溶液で15分間殺菌し、滅菌蒸留水で6回洗浄した。この塊茎から殺菌したコルクボーラーで約1cmの円柱を打ち抜き、2−3mmの厚さのディスクに切り、前記 (1) で調製したpBILR1を保有するA. tumefaciensの培養液中に15分間浸した。この後、MS修正培地 (3%蔗糖、0.1μg/mlインドール酢酸、0.1μg/mlジベレリン、0.1μg/mlアブシジン酸、2μg/mlゼアチンリボシドpH5.9) 上に72時間置床した後、カナマイシン(100μg/ml) とカーベニシリン (シグマ社製(500μg/ml))を含むMS修正培地 (ホルモンは上と同じ) 上に置いて、21℃ (16時間照明、8時間暗期) で培養した。4−6週間後、ディスク表面からカルスが形成され、シュートが誘導された。
【0025】このシュートを切り取り、ホルモンを含まないMS培地 (抗生物質は上と同じ) で培養した。1−2週間後に発根してきた植物体をバーミキュライトの入ったビニールポット (径10cm) に移植して人工気象器で育成した。
(3) 再分化植物体におけるPLRV−Hの外被蛋白質遺伝子導入の確認及びかかる遺伝子の発現の確認■ DNAの解析ポットに移植した上記再分化ジャガイモの葉を採取し、「クローニングとシークエンス植物バイオテクノロジー実験マニュアル:第252-256頁」 (渡辺格監修、杉浦昌弘編集、農村文化社、1989) に記載された方法に従って、当該葉の細胞の全DNAを抽出した。次に、15μg の当該DNAをHindIII (宝酒造社製) で完全に消化し、サザンブロットハイブリダイゼーションを行った。なお、このハイブリダイゼーションは、DNA Labeling kit (ベーリンガー社製) で標識したプラスミドpBILRlをプローブとして行った。ハイブリダイゼーション及び遺伝子の検出には、DIG DNA Luminecent kit (ベーリンガー社製) を用い、その用法に従って行った。このサザンブロット解析の結果を図2に示す。この結果、PLRV外被蛋白質遺伝子が1コピー〜3コピー核DNAに組み込まれていることを確認した。
■ ELISAによるPLRV−H外被蛋白質発現の確認形質転換ジャガイモの葉を生重の5倍量の0.01M PBS T緩衝液 (135mM 塩化ナトリウム、1.5mM リン酸2水素カリウム、 20mM リン酸水素2ナトリウム、2.7mM 塩化カリウム、3.1mM アジ化ソーダ、0.05%(v/v)tween20・pH7.2)で磨砕後、3000g、15分間の低速遠心分離により得られた上清を粗汁液とした。抗PLRV γ−グロブリン (ベーリンガー社製) でコーティングしたマイクロタイタープレートに 200μl の上記粗汁液を加え、4℃で一晩反応させた。反応後、マイクロタイタープレートは、0.01M PBS-T 緩衝液で洗浄し、PLRVエンザイムコンジュゲート (ベーリンガー社製) を加え37℃で3時間反応させた。反応後のマイクロタイタープレートを0.01M PBS-T 緩衝液で洗浄後に、0.1% P−ニトロフェノールフォスフェートを反応基質として37℃で2時間反応させた後、A450 の吸光値をマクイロプレートリーダー (バイオ・ラッド社製モデル2550 EIA reader)で測定した。この結果、いくつかの形質転換バレイショでPLRV−H外被蛋白質が発現していることが明らかになった。
■ ウエスタンブロット法によるPLRV外被蛋白質発現の確認上記■と同様にして、粗汁液 (蛋白質量として70μg ) を、Laemmli (ネイチャー (Nature), 227, 680-685, 1970 )の不連続電気泳動法 (SDS-PAGE、15%分離ゲル、4%濃縮ゲル) を用いて蛋白質を分子量に従って分離した。次に、それら蛋白質をバイオ・ラッド社製トランス・ブロット・セルを用いて、ウエスタン・ブロット用膜ウエストラン (シュライッシャ アンド シュエル社製) 、または、イモブリン (ミリポア社製) に転写した(150ボルト/1〜1.5時間) 。これと抗PLRV γ−グロブリン (0.1μg/ml) を反応させ (37℃/1時間) 、その後TBS-Tween 溶液 (50mM Tris-HCl, pH7.4, 150mM NaCl, 0.05%(W/V))で洗浄した。さらにヤギ抗ラビットパーオキシダーゼ (ザイメッド社製) を、抗PLRVγ−グロブリンと反応 (37℃/1時間) させた。続いて、膜を TBS-Tweenで5回洗った後 (室温/10分) イムノステイン法 (コニカイムノステインキットHRP IS-50B, コニカ社製) を組み合わせ、PLRV−H外被蛋白質の発現の様子を確認した。この結果を参考写真1に示す。その結果、全ての形質転換ジャガイモでPLRV外被蛋白質の発現が確認された。
■ 形質転換ジャガイモのPLRV耐病性の検討ポット移植した形質転換ジャガイモ (実施例1) を1個体から挿し木により5個体に増殖してウイルス接種試験に用いた。すなわちウイルス接種には、PLRVに感染したPhysalis floridana上で一週間飼育したアブラムシ (Myzus persicae) を形質転換バレイショ1個体につき5頭つけて接種した。
【0026】同様にPLRVを接種した非形質転換ジャガイモでは接種後4週間目には病徴が示されたが、形質転換ジャガイモにおいては接種後16週間経過してもなんら病徴は認められなかった。その結果を参考写真2に示す。なお、形質転換体全体に占める、全くの無病徴系統は約70%であり、発病が通常よりも遅い遅延系統は、約30%であった。
【0027】
【発明の効果】本発明によって、PLRVの外被蛋白質をコードする遺伝子で形質転換することを特徴とするPLRVに対して抵抗性を有するジャガイモの作出方法、当該方法に用いる組換えプラスミド、及び当該方法により作出されたPLRVに対して抵抗性を有するジャガイモが提供される。
【0028】
【配列表】
配列番号 : 1配列の長さ : 21配列の型 : 核酸鎖の数 : 一本鎖トポロジー : 直鎖状配列の種類 : 他の核酸 合成DNAプライマー配列 : GAACACTGAAGGAGCTCACTA配列番号 : 2配列の長さ : 32配列の型 : 核酸鎖の数 : 一本鎖トポロジー : 直鎖状配列の種類 : 他の核酸 合成DNAプライマー配列 : GCTGCAGAGCTCTATTTGGGGTTTTGCAAAGC配列番号 : 3配列の長さ : 19配列の型 : 核酸鎖の数 : 一本鎖トポロジー : 直鎖状配列の種類 : 他の核酸 合成DNAプライマー配列 : GTGGTGTACAACAACCAAG配列番号 : 4配列の長さ : 17配列の型 : 核酸鎖の数 : 一本鎖トポロジー : 直鎖状配列の種類 : 他の核酸 合成DNAプライマー配列 : GGGAGTTGGAGTGGGTG配列番号 : 5配列の長さ : 628配列の型 : 核酸鎖の数 : 二本鎖トポロジー : 直鎖状配列の種類 : cDNA起源 : PLRV−H 配列 : ATGAGTACGGTCGTGGTTAAAGGAAATGTCAATGGTGGTGTACAACAACCAAGAAGGCGA 1 60 AGAAGGCAATCCCTTCGCAGGCGCGCTAACAGAGTTCAGCCAGTGGTTATGGTCACGGCC 61 120 CCTGGGCAACCCAGGCGCCGAAGACGTAGAAGAGGAGGCAATCGCCGCTCAAGAAGAACT 121 180 GGAGTTCCCCGAGGACGAGGCTCAAGCGAGACATTCGTGTTTACAAAGGACAACCTCGTG 181 240 GGCAACTCCCAAGGAAGTTTCACCTTCGGGCCGAGTCTATCAGACTGTCCGGCATTCAAG 241 300 GATGGAATACTCAAGGCCTACCATGAGTATAAGATCACAAGCATCTTACTTCAGTTCGTC 301 360 AGCGAGGCCTCTTCCACCTCCTCCGGCTCCATCGCTTATGAGTTGGACCCCCATTGCAAA 361 420 GTATCATCCCTCCAGTCCTACGTCAACAAGTTCCAAATTACGAAGGGCGGCGCCAAAACT 421 480 TATCAAGCGCGGATGATAAACGGGGTAGAATGGCACGATTCTTCTGAGGATCAGTGCCGG 481 540 ATACTGTGGAAGGGAAATGGAAAATCTTCAGA CACCGCAGGATCCTTCAGAGTCACCAT 541 600 CAGGGTGGCTTTGCAAAACCCCAAATAG 601 620配列番号 : 6配列の長さ : 208配列の型 : アミノ酸トポロジー : 直鎖状配列の種類 : ペプチド起源 : PLRV−H
【図面の簡単な説明】
【図1】 PLRV−Hの外被タンパク質遺伝子の発現ベクターpBILRIの構築図。
【図2】 ジャガイモ形質転換体のサザンブロット解析の結果を示す電気泳動図。
【0001】
【産業上の利用分野】本発明は、ジャガイモ葉巻ウイルス (以下「PLRV」と記載する) の外被蛋白質をコードする遺伝子で形質転換することを特徴とするPLRVに対して抵抗性を有するジャガイモの作出方法、当該方法に用いる組換えプラスミド、及び当該方法により作出されたPLRVに対して抵抗性を有するジャガイモに関するものである。
【0002】
【従来の技術】タバコモザイクウイルス (以下「TMV」と記載する) やキュウリモザイクウイルス (以下「CMV」と記載する) 等の植物ウイルスはその感染により農作物に多大な被害を与えるものである。その上、これらのウイルスの防除は一般的に困難であり、当該ウイルスに対して抵抗性を有する、ウイルス耐性植物の作出が産業上期待されている。
【0003】而して、近年ウイルス耐性植物の作出を最終的な目的として、植物ウイルスの外被蛋白質遺伝子cDNAを組み込んだ形質転換植物を作出する試みが進められている。
(1) その最初の例として、TMVの外被蛋白質遺伝子cDNAを組み込んだタバコを用いて、外被蛋白質がTMVの感染・増殖を阻害する作用を有することが明らかにされた(サイエンス (Science), 232, 738-743, 1986: バイロロジー(Virology), 158, 126-132, 1987)。
【0004】以来、CMV(バイオ/テクノロジー (Bio/Technology), 6, 549-557, 1988)、アルファルファ・モザイク・ウイルス(エンボ・ジャーナル (EMBO J.), 6,1845-1851, 1987: バイロロジー (Virology), 159, 299-305, 1987 )、ジャガイモXウイルス (以下「PVX」と記載する) (エンボ・ジャーナル (EMBO J.), 7, 1273-1280, 1988)、タバコ・ストリーク・ウイルス(バイロロジー(Viro-logy), 164, 383-389, 1988 )、タバコ・ラットル・ウイルス(バイロロジー (Virology), 159, 299-305, 1987: バイロロジー (Virology), 167, 649-652,1988)、ダイズ・モザイク・ウイルス(バイオ/テクノロジー (Bio/Technology), 7, 1257-1262, 1989 )について、同様に外被蛋白質遺伝子cDNAを組み込んだタバコが、それらのウイルスの感染・増殖に対して抵抗性を示した。さらに、TMVの外被蛋白質遺伝子cDNAを組み込んだトマトは、野外においてもTMVに対する抵抗性を示すことが報告されている(バイオ/テクノロジー (Bio/Technology), 6, 403-409, 1988)。
【0005】タバコやトマト以外に、PVXの外被蛋白質遺伝子cDNAを組み込んだジャガイモ(バイオ/テクノロジー (Bio/Technology), 7, 273-278, 1989 )及びPVXの外被蛋白質遺伝子cDNAと両者を組み込んだジャガイモ(バイオ/テクノロジー (Bio/Technology), 8, 127-134, 750-754, 1990)においてもウイルスに対する抵抗性が示された。
【0006】(2) PLRVは約6kbの一本鎖RNAゲノムを持つ直径24nmのアブラムシ媒介性の球状ウイルス (CMI/AAB ディスクリプションズ・オブ・プラント・バイラス (Descrip. Plant Virus) No.36)で、ルテオウイルスを代表するウイルスである。なお、本ゲノムは、5'末端にゲノム結合蛋白質 (VPg)を持つことを特徴とする。
【0007】また、PLRVの外被蛋白質をコードする遺伝子の塩基配列はすでに6例報告されている(ジャーナル・オブ・ジェネラル・バイロロジー (J. gen. Virol),70, 783-788, 1037-1051, 1989: ジャーナル・オブ・ジェネラル・バイロロジー(J. gen. Virol), 71, 719-724, 1990: ヌークレイックアシド・リサーチ(Nucleic Acids Res.), 17, 1768, 1989: アーカイブス・オブ・バイロロジー(Arch. Virol. 105, 153-163, 1989: フエブス・レターズ (FEBS LETTERS),245, 51-56, 1989)。そして、当該塩基配列は各々異なることが判明している。
【0008】そして、PLRVの外被蛋白質遺伝子cDNAをジャガイモの細胞に組み込んだ例は、1例報告されている(プラント・モレクラー・バイオロジー(Plant Mol. Biol.), 17, 431-439, 1991)。しかしながら、試験された対象が少なく (4個体) 、ウイルス抵抗性形質転換体の作出効率、ウイルス抵抗性の程度は明らかにされていない。
【0009】
【発明が解決しようとする課題】そこで、本発明が解決しようとする課題は、上記PLRVの外被蛋白質をコードする遺伝子を用いたPLRVに対して抵抗性を有するジャガイモの作出にある。
【0010】
【課題を解決するための手段】本発明者らは、上記課題に鑑み、前記のPLRVとは別に、北海道で葉巻病に侵されたジャガイモの葉よりウイルスを分離して (以下「PLRV−H」と記載する) 、かかるPLRV−Hの遺伝子をcDNAとしてクローニングしたうえで、その外被蛋白質をコードするcDNAを単離し、塩基配列を決定した (1991年4月に日本植物病理学会において発表) 。この結果PLRV−Hの外被蛋白質をコードする遺伝子は、前記のPLRVの外被蛋白質をコードする遺伝子と、その塩基配列が異なることが明らかになった。
【0011】そして、驚くべきことに、かかるPLRV−Hの外被蛋白質をコードする遺伝子由来のcDNAで形質転換したジャガイモ細胞を再分化して得られるジャガイモは、PLRVに対して強い抵抗性を有することを見出し本発明を完成した。すなわち本発明は、(1) 配列番号1に示される塩基配列を有するDNAを組み込んだ組み換えベクターにより、ジャガイモの細胞を形質転換して、当該形質転換細胞を再分化させることを特徴とするジャガイモ葉巻ウイルスに対して抵抗性を有するジャガイモの作出方法、(2) (1) 記載の方法により作出されたジャガイモ、(3) 植物において機能するプロモーター配列、配列番号1に示される塩基配列、及びターミネーター配列を有することを特徴とする (1) 記載の方法において用いる組み換えプラスミドを提供するものである。
【0012】以下、本発明について詳細に説明する。PLRV−Hの外被蛋白質由来のcDNAの塩基配列の決定は、「大島, 松村等, 1991年4月, 日本植物病理学会要旨集」に記載した通り行なうことができる。より具体的かつ詳細には、後記参考例において開示する。次にPLRV−H外被蛋白質発現用プラスミドは以下のようにして調製される。
【0013】クローニングされたPLRV−H外被蛋白質の遺伝子をコードするcDNA断片を制限酵素によって切り出し、リガーゼ反応により、かかる制限酵素断片をそのまま、相補的な開裂末端を有する植物発現用プラスミドに結合することによって調製することが可能である。あるいは、必要に応じて植物発現用プラスミドの制限酵素開裂末端に相補的な配列を有する合成リンカーを上記制限酵素断片に結合させて加工した制限酵素断片をリガーゼ反応を用いて植物発現用プラスミドに結合することによって結合することができる。
【0014】用いられる植物発現用プラスミドは、構造遺伝子挿入部分の上流に植物において機能するプロモーター配列を有し、かつ下流にターミネーター配列を有するものが好ましい。このような植物発現用プラスミドとしては、例えばpBI121 (クローンテック社製) 、 pCaMVCN (ファルマシア製) 等を挙げることができる。このようにして調製された発現用プラスミドを所望のジャガイモの細胞に導入する。当該方法としては、例えばエレクトロポレーションにより行う方法 (Fromm M. et al., Proc. Natl. Acad. Sci. USA, 82, 5824-5828)、アグロバクテリウムを介した方法 (Horsch R. B. et al., Science, 227, 1229-1231, 1985) 、マイクロインジェクションによる方法 (Grossway A. et al., Mol. Gen. Genet,202, 179-185, 1985)等が挙げられる。
【0015】そして、形質転換されたジャガイモの細胞を植物体に分化させる方法としては、リーフディスクからの再分化方法 (M. De Block. Thero. Appl. Genet, 76,767-774, 1988)、チューバーディスクからの再分化方法 (Sheerman S., et al.,Plant Cell Reports, 7, 13-16, 1988)等の既に知られた方法を採ることができる。
【0016】なお、作出の対象となるジャガイモの品種は、特に限定されず、例えば、メークイン、ワセシロ、トヨシロ、農林1号、紅丸、男爵等を広く用いることができる。
【0017】
【実施例】以下、参考例及び実施例を挙げて本発明を具体的に説明する。
<参考例>1. ウイルス核酸の分離PLRVをPhysalis floridanaに接種して、25℃で4週間程度ウイルスを増殖させた後、感染葉を生重の2倍量の0.1M クエン酸緩衝液 ((pH6.0) 0.5%メルカプトエタノールを含む) 中で磨砕した。得られた破砕液に1%(W/V) になるようにドリセラーゼを加え、28℃で2時間攪拌後、クロロホルム:ブタノール混液 (1:1) を加えてさらに攪拌した後、低速遠心分離 (5,000回転、15分間4℃マルサン1OBローター) により植物成分を除去した。上層にpH7.0になるまで0.2 M リン酸2ナトリウム溶液を加えた後、それぞれ終濃度が8%(W/V) 及び0.2M になるようにポリエチレングリコール♯6000及び塩化ナトリウムを加え、室温で1時間攪拌後4℃で1晩静置した。低速遠心分離 (同上) により得られた沈澱を緩衝液で溶解した後、終濃度1%なるようにトリトンX-100 を加え、再度低速遠心分離 (10,000回転、10分間、佐久間製作所6DB6ローター) した上清を高速遠心分離 (27,000回転3時間4℃日立工機RP30-2ローター) した。得られた沈澱を0.1M リン酸緩衝液pH7.0に溶解した後、10−40%(W/V) の蔗糖密度勾配遠心分離 (22,500回転、3時間15℃日立工機RPS27 ローター) を行った。ウイルス分画をISCOフラクショネーター (UA-2モニター) で採取し、高速遠心分離 (36,000回転3時間4℃日立工機RP65ローター) を行い蔗糖を抜いた後、再び0.01M リン酸緩衝液pH7.0に溶解し純化ウイルスとした。
【0018】純化ウイルス溶液にフェノール:クロロホルム (V/V=1:1)を加えて5分間振とうした後、10,000gで5分間遠心分離した。中間変性層がなくなるまでこの操作を繰り返した。水層に1/10量の3M 酢酸ナトリウムと2.5倍量のエタノールを加えて静置し、PLRV−RNAを沈澱させる。10,000gで5分間遠心分離後、得られた沈澱を乾燥させた後滅菌蒸留水に溶解し、PLRV−RNAの精製標品とした。
2. PLRV外被蛋白質遺伝子のcDNAクローニングイギリスで分離されたPLRVstrainlの外被蛋白質遺伝子 (ジャーナル・オブ・ジェネラル・バイロロジー (J. gen. Virol.), 70, 1037-1051, 1989) の塩基配列を参考にして配列番号1に示す塩基配列を有する合成DNAプライマーPLRVp12 と配列番号2に示す塩基配列を有する合成プライマーPLRVp14 を「Applied Biosystems model 380A DNA synthesizer 」で合成した。PLRV−RNAを鋳型に合成プライマーPLRVp12 とアマシャム (Amersham社製) cDNA合成キットを用いてcDNAを合成した。合成したcDNA断片と合成DNAプライマーPLRVp12 及びPLRVp14 を用いてPCR反応を行った。
【0019】PCR反応により増幅されたcDNA断片を制限酵素 SacI (宝酒造社製) で切断後、pUC119 (宝酒造社製) の SacI部位にDNAリガーゼを用いてサブクローニングした。得られた組換えプラスミドをpPLRV25 と命名し、これを用いて大腸菌Escherichia coli MV1184株 (宝酒造社製) を形質転換した。この形質転換体Escherichia coli MV1184/pPLRV25 は、工業技術院微生物工業技術研究所に微生物菌寄第12932号 (FERM P-12932) として寄託されている。
3. DNAシークエンス解析DNAシークエンスはジデオキシヌクレオチド法 (Messing J., Meth. Enzymol., 101, 20-78, 1983) に従い7−デア・ザ・シークエンス・キット (宝酒造社製) を用いて行った。pPLRV25 について「ヌクレイック・アシズ・リサーチ (Nucleic Acids Resarch)、12, 7813-7827, 1985 」に記載されている方法に準じてアルカリ変性を行い、 M13M4プライマー、 M13RVプライマー (宝酒造社製) 及び配列番号3に示す塩基配列を有する PLRVp22プライマー、配列番号4に示す塩基配列を有する PLRVp23プライマーを用いてプラスミド・シークエンスを行った。
【0020】かかるDNAシークエンス解析により決定されたPLRV−Hの外被蛋白質の遺伝子をコードするcDNAの塩基配列を配列番号5に示した。また当該塩基配列より推定されるアミノ酸配列を配列番号6に示した。
【0021】
【実施例1】 発現用プラスミドの調製組換えプラスミドpPLRV25、1μg を含むDNA溶液を2ユニットの制限酵素Pma CI (宝酒造社製) と2ユニットの SacI (宝酒造社製) およびそれぞれの制限酵素に添付されている緩衝液を10%(V/V) になるように加え、37℃で2時間反応させて5'上流領域16塩基を含む 644塩基のPLRV−Hの外被蛋白質をコードしているcDNA断片を単離した。次に植物発現ベクターpBI121 (クローンテック社製) 1μg を2ユニットの制限酵素 SmaI (宝酒造社製)、 SacI (宝酒造社製)を用いて上記の方法で切断した。さらに、前記cDNA断片とpBI121の制限断片を2ユニットのT4 DNAリガーゼ (宝酒造社製)存在下、16℃1時間反応させて発現プラスミドを調製し、これをpBILR1と命名した。この発現用プラスミド pBILR1の構築図を図1に示す。これを用いてE. coli HB101株 (フナコシ社製) を形質転換した。
【0022】
【実施例2】 PLRVに対して抵抗性を有するジャガイモの作出(1) 発現用プラスミドpBILR1のアグロバクテリウムへの導入実施例1で得られた発現用プラスミドpBILR1をヘルパープラスミドpRK2013 を保有するE. coli HB101 (クローンテック社製) の存在下で、トリペアレンタル接合によってAgrobacterium tumefaciens LBA4404 (クローンテック社製) に導入した。
【0023】すなわち、前記の組換えプラスミドpBILR1を持つE.coli HB101、ヘルパープラスミドpRK2013 を持つE. coli HB101と腫瘍形成遺伝子が除去された改変非組換えプラスミドpAL4404 を持つA. tumefaciens LBA4404の培養液をそれぞれ等量ずつ混合し、28℃に一晩静置した後、リファンピシン (シグマ社製) (100μg/ml) 、カナマイシン (明治製菓社製) (25μg/ml) 、及びストレプトマイシン (半井化学社製) (300μg/ml) を含む培地上にまき、pBILR1を保有するA. tumefaciensを選択した。
【0024】(2) ジャガイモ細胞への導入及び再分化PLRV外被蛋白質cDNAを植物発現用ベクターに組み込んだ組換えプラスミドのジャガイモへの導入は、チューバーディスク法を用いた。すなわち、バレイショ (品種:メークイン、ワセシロ、トヨシロ、農林1号、紅丸、男爵) の塊茎の皮をむき、1%次亜塩素酸ソーダ溶液で15分間殺菌し、滅菌蒸留水で6回洗浄した。この塊茎から殺菌したコルクボーラーで約1cmの円柱を打ち抜き、2−3mmの厚さのディスクに切り、前記 (1) で調製したpBILR1を保有するA. tumefaciensの培養液中に15分間浸した。この後、MS修正培地 (3%蔗糖、0.1μg/mlインドール酢酸、0.1μg/mlジベレリン、0.1μg/mlアブシジン酸、2μg/mlゼアチンリボシドpH5.9) 上に72時間置床した後、カナマイシン(100μg/ml) とカーベニシリン (シグマ社製(500μg/ml))を含むMS修正培地 (ホルモンは上と同じ) 上に置いて、21℃ (16時間照明、8時間暗期) で培養した。4−6週間後、ディスク表面からカルスが形成され、シュートが誘導された。
【0025】このシュートを切り取り、ホルモンを含まないMS培地 (抗生物質は上と同じ) で培養した。1−2週間後に発根してきた植物体をバーミキュライトの入ったビニールポット (径10cm) に移植して人工気象器で育成した。
(3) 再分化植物体におけるPLRV−Hの外被蛋白質遺伝子導入の確認及びかかる遺伝子の発現の確認
【0026】同様にPLRVを接種した非形質転換ジャガイモでは接種後4週間目には病徴が示されたが、形質転換ジャガイモにおいては接種後16週間経過してもなんら病徴は認められなかった。その結果を参考写真2に示す。なお、形質転換体全体に占める、全くの無病徴系統は約70%であり、発病が通常よりも遅い遅延系統は、約30%であった。
【0027】
【発明の効果】本発明によって、PLRVの外被蛋白質をコードする遺伝子で形質転換することを特徴とするPLRVに対して抵抗性を有するジャガイモの作出方法、当該方法に用いる組換えプラスミド、及び当該方法により作出されたPLRVに対して抵抗性を有するジャガイモが提供される。
【0028】
【配列表】
配列番号 : 1配列の長さ : 21配列の型 : 核酸鎖の数 : 一本鎖トポロジー : 直鎖状配列の種類 : 他の核酸 合成DNAプライマー配列 : GAACACTGAAGGAGCTCACTA配列番号 : 2配列の長さ : 32配列の型 : 核酸鎖の数 : 一本鎖トポロジー : 直鎖状配列の種類 : 他の核酸 合成DNAプライマー配列 : GCTGCAGAGCTCTATTTGGGGTTTTGCAAAGC配列番号 : 3配列の長さ : 19配列の型 : 核酸鎖の数 : 一本鎖トポロジー : 直鎖状配列の種類 : 他の核酸 合成DNAプライマー配列 : GTGGTGTACAACAACCAAG配列番号 : 4配列の長さ : 17配列の型 : 核酸鎖の数 : 一本鎖トポロジー : 直鎖状配列の種類 : 他の核酸 合成DNAプライマー配列 : GGGAGTTGGAGTGGGTG配列番号 : 5配列の長さ : 628配列の型 : 核酸鎖の数 : 二本鎖トポロジー : 直鎖状配列の種類 : cDNA起源 : PLRV−H 配列 : ATGAGTACGGTCGTGGTTAAAGGAAATGTCAATGGTGGTGTACAACAACCAAGAAGGCGA 1 60 AGAAGGCAATCCCTTCGCAGGCGCGCTAACAGAGTTCAGCCAGTGGTTATGGTCACGGCC 61 120 CCTGGGCAACCCAGGCGCCGAAGACGTAGAAGAGGAGGCAATCGCCGCTCAAGAAGAACT 121 180 GGAGTTCCCCGAGGACGAGGCTCAAGCGAGACATTCGTGTTTACAAAGGACAACCTCGTG 181 240 GGCAACTCCCAAGGAAGTTTCACCTTCGGGCCGAGTCTATCAGACTGTCCGGCATTCAAG 241 300 GATGGAATACTCAAGGCCTACCATGAGTATAAGATCACAAGCATCTTACTTCAGTTCGTC 301 360 AGCGAGGCCTCTTCCACCTCCTCCGGCTCCATCGCTTATGAGTTGGACCCCCATTGCAAA 361 420 GTATCATCCCTCCAGTCCTACGTCAACAAGTTCCAAATTACGAAGGGCGGCGCCAAAACT 421 480 TATCAAGCGCGGATGATAAACGGGGTAGAATGGCACGATTCTTCTGAGGATCAGTGCCGG 481 540 ATACTGTGGAAGGGAAATGGAAAATCTTCAGA CACCGCAGGATCCTTCAGAGTCACCAT 541 600 CAGGGTGGCTTTGCAAAACCCCAAATAG 601 620配列番号 : 6配列の長さ : 208配列の型 : アミノ酸トポロジー : 直鎖状配列の種類 : ペプチド起源 : PLRV−H

【図面の簡単な説明】
【図1】 PLRV−Hの外被タンパク質遺伝子の発現ベクターpBILRIの構築図。
【図2】 ジャガイモ形質転換体のサザンブロット解析の結果を示す電気泳動図。
【特許請求の範囲】
【請求項1】 配列番号1に示される塩基配列を有するDNAを組み込んだ組み換えベクターにより、ジャガイモの細胞を形質転換して、当該形質転換細胞を再分化させることを特徴とするジャガイモ葉巻ウイルスに対して抵抗性を有するジャガイモの作出方法。
【請求項2】 請求項1記載の方法により作出されたジャガイモ。
【請求項3】 植物において機能するプロモーター配列、配列番号1に示される塩基配列、及びターミネーター配列を有することを特徴とする請求項1記載の方法において用いる組み換えプラスミド。
【請求項1】 配列番号1に示される塩基配列を有するDNAを組み込んだ組み換えベクターにより、ジャガイモの細胞を形質転換して、当該形質転換細胞を再分化させることを特徴とするジャガイモ葉巻ウイルスに対して抵抗性を有するジャガイモの作出方法。
【請求項2】 請求項1記載の方法により作出されたジャガイモ。
【請求項3】 植物において機能するプロモーター配列、配列番号1に示される塩基配列、及びターミネーター配列を有することを特徴とする請求項1記載の方法において用いる組み換えプラスミド。
【図1】


【図2】




【図2】


【公開番号】特開平5−304847
【公開日】平成5年(1993)11月19日
【国際特許分類】
【出願番号】特願平4−135561
【出願日】平成4年(1992)4月30日
【出願人】(592113500)株式会社北海道グリーンバイオ研究所 (3)
【公開日】平成5年(1993)11月19日
【国際特許分類】
【出願日】平成4年(1992)4月30日
【出願人】(592113500)株式会社北海道グリーンバイオ研究所 (3)
[ Back to top ]

