ステムループ構造を有する蛍光プローブ
【課題】ステムループ構造を有するプローブにおいて、ステム部位の塩基配列に制限がなく、簡易に調製できる蛍光プローブを提供すること。
【解決手段】式(1)で表されるヌクレオチドを構成単位として含有することを特徴とする蛍光プローブ。Rは蛍光性有機基、Xは蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基、Yは水素原子又は水酸基を表す。

【解決手段】式(1)で表されるヌクレオチドを構成単位として含有することを特徴とする蛍光プローブ。Rは蛍光性有機基、Xは蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基、Yは水素原子又は水酸基を表す。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ステムループ構造を有する蛍光プローブに関する。
【背景技術】
【0002】
ポリヌクレオチドの末端にクエンチャー分子(蛍光消光分子)としてグアニン塩基を配置し、他端に蛍光分子を持つプローブが知られている(非特許文献1及び2)。
【非特許文献1】A.Friederich et al., FEBS Lett., 2007, 581, 1644
【非特許文献2】Y.Saito et al., Chem.Commun., 2007, 4492
【発明の開示】
【発明が解決しようとする課題】
【0003】
非特許文献1に記載されたプローブでは、ポリヌクレオチドの末端にクエンチャー分子としてグアニン塩基を配置する必要があり、ステム部位の塩基配列に制限があるという問題がある。
本発明の目的は、ステムループ構造を有するプローブにおいて、ステム部位の塩基配列に制限がなく、簡易に調製できる蛍光プローブを提供することである。
【課題を解決するための手段】
【0004】
本発明の蛍光プローブの特徴は、ステムループ構造を有するプローブにおいて、
式(1)で表されるヌクレオチドを構成単位として含有する点を要旨とする。
【化1】

Rは蛍光性有機基、Xは蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基、Yは水素原子又は水酸基、Oは酸素原子、Pはリン原子、Cは炭素原子、Hは水素原子、Nは窒素原子を表す。
【発明の効果】
【0005】
本発明の蛍光プローブは、ポリヌクレオチドの末端にクエンチャー分子としてグアニン塩基を配置する必要がないため、ステム部位の塩基配列に制限がない。また、本発明の蛍光プローブは、クエンチャー分子を必要としないため、簡易に調製することができる。また、本発明の蛍光プローブの両末端は、蛍光性分子やクエンチャー分子で修飾する必要がないため、さらに任意の修飾を施したり、基材(チップ)へ固定してマイクロアレイを調製することができる。
【発明を実施するための最良の形態】
【0006】
本発明において、ステムループ構造とは、二重鎖を形成している部分をステム(茎)、折り返しの輪になっている部分をループ(輪)と見立てて呼ばれる構造を意味する(図1参照。)。ステムループ構造は、mRNAの二次構造の一般的な構造の一つである。
また、塩基とは、アデニン(A)、チミン(T)、シトシン(C)、グアニン(G)又はウラシル(U)を意味する。
【0007】
蛍光性有機基(R)としては蛍光を発する有機基であれば制限がないが、ピレン骨格、アントラセン骨格、ペリレン骨格、アクリドン骨格、クマリン骨格、イソクマリン骨格、キサントン骨格、チオキサントン骨格、フェナントレン骨格、ベンゾフェノン骨格、フルオレン骨格又はジフェニルチオエーテル骨格を有する有機基が好ましく、さらに好ましくはピレン骨格、アントラセン骨格、ペリレン骨格、アクリドン骨格、クマリン骨格、イソクマリン骨格、キサントン骨格、チオキサントン骨格又はフェナントレン骨格を有する有機基である。
【0008】
蛍光性有機基(R)には、置換基を有してもよい。置換基を有すると、母骨格の吸収波長を長波長側にシフトさせることができる。シフトする程度(シフト値)は、置換基の種類等によって相違し、このシフト値については「有機化学のスペクトルによる同定法 第5版(R.M.Silverstein著、281頁、1993年東京化学同人発行)」に記載の表が参考となる。
置換基としては、水酸基、炭素数1〜4のアルコキシ基(メトキシ、イソプロポキシ及びブトキシ等)、炭素数1〜4のアシロキシ基(アセトキシ等)、炭素数1〜7のアシル基(アセチル及びベンゾイル等)、ニトロ基及びシアノ基等が挙げられる。
【0009】
ピレン骨格を有する有機基としては、1−ピレニルカルボニルアミノ、1−ピレニルカルボニルオキシ及び1−ピレニル等が挙げられる。
【0010】
アントラセン骨格を有する有機基としては、1−アントリルカルボニルアミノ、2−アントリルカルボニルアミノ、9−アントリルカルボニルアミノ、10−ブトキシ−9−アントリルカルボニルアミノ、1−アントリルカルボニルオキシ、2−アントリルカルボニルオキシ、1−アントリル及び2−アントリル等が挙げられる。
【0011】
ペリレン骨格を有する有機基としては、3−ペリレニルカルボニルアミノ、3−ペリレニルカルボニルオキシ及び3−ペリレニル等が挙げられる。
【0012】
アクリドン骨格を有する有機基としては、10−アクリドニルメチルカルボニルアミノ及び10−アクリドニルメチルカルボニルオキシ等が挙げられる。
【0013】
クマリン骨格を有する有機基としては、3−クマリニルカルボニルアミノ、3−クマリニルカルボニルオキシ、7−メトキシ−3−クマリニルカルボニルアミノ及び7−メトキシ−3−クマリニルカルボニルオキシ等が挙げられる。
【0014】
イソクマリン骨格を有する有機基としては、3−イソクマリニルカルボニルアミノ、3−イソクマリニルカルボニルオキシ、7−メトキシ−3−イソクマリニルカルボニルアミノ及び7−メトキシ−3−イソクマリニルカルボニルオキシ等が挙げられる。
【0015】
キサントン骨格を有する有機基としては、2−キサントニリルカルボニルアミノ、2−キサントニリルカルボニルオキシ、4−キサントニリルカルボニルアミノ、4−キサントニリルカルボニルオキシ、2−キサントニリル、4−キサントニリル、7−メトキシ−2−キサントニリル、2−メトキシ−4−キサントニリル、2−メトキシ−3−キサントニリル及び2,3−ジメトキシ−4−キサントニリル等が挙げられる。
【0016】
チオキサントン骨格を有する有機基としては、2−チオキサントニリルカルボニルアミノ、2−チオキサントニリルカルボニルオキシ、4−チオキサントニリルカルボニルアミノ、4−チオキサントニリルカルボニルオキシ、2−チオキサントニリル、4−チオキサントニリル、7−メトキシ−2−チオキサントニリル、2−メトキシ−4−チオキサントニリル、2−メトキシ−3−チオキサントニリル及び2,3−ジメトキシ−4−チオキサントニリル等が挙げられる。
【0017】
フェナントレン骨格を有する有機基としては、1−フェナントリルカルボニルアミノ、2−フェナントリルカルボニルアミノ、1−フェナントリルカルボニルオキシ、2−フェナントリルカルボニルオキシ、1−フェナントリル及び9−フェナントリル等が挙げられる。
【0018】
ベンゾフェノン骨格を有する有機基としては、4−ベンゾイルフェニルカルボニルアミノ、4−ベンゾイルフェニルカルボニルオキシ及び4−ベンゾイルフェニル等が挙げられる。
【0019】
フルオレン骨格を有する有機基としては、9−フルオレニルカルボニルアミノ、9−フルオレニルカルボニルオキシ及び9−フルオレニル等が挙げられる。
【0020】
ジフェニルチオエーテル骨格を有する有機基としては、4−フェニルチオベンゾイルアミノ及び4−フェニルチオベンゾイルオキシ等が挙げられる。
【0021】
蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基(X)としては、式(1)で表されるヌクレオチド(修飾グアニン)がシトシン(C)とハイブリタイズしたとき、蛍光性有機基が修飾グアニン及びシトシンの塩基対に近づいて蛍光性有機基のπ電子が吸引される状態をとることができれば特に制限はないが、炭素数1〜18のアルキレン基を含んでなることが好ましい。この結合基(X)には、エーテル結合、アミド結合、エステル結合、ウレタン結合及び/又はウレア結合等を含んでもよい。
【0022】
Yが水素原子のときDNAに対応し、一方、Yが水酸基のときRNAに対応する。
【0023】
本発明の蛍光プローブは、式(1)で表されるヌクレオチドを構成単位として含有すれば、その含有位置や含有数に制限はない。
【0024】
式(1)で表されるヌクレオチド単位がステム部位に有すると、本発明の蛍光プローブは、ターゲットポリヌクレオチドとハイブリタイズする前は蛍光を発しないが、ターゲットポリヌクレオチドとハイブリタイズすると蛍光を発することとなる。一方、式(1)で表されるヌクレオチド単位がループ部位に有すると、本発明の蛍光プローブは、ターゲットポリヌクレオチドとハイブリタイズする前は蛍光を発するが、ターゲットポリヌクレオチドとハイブリタイズすると蛍光を発しないこととなる。これらのうち、式(1)で表されるヌクレオチド単位をステム部位に有することが好ましい。
【0025】
式(1)で表されるヌクレオチド単位は、3’末端から2〜10番目の塩基の位置に有することが好ましい。
【0026】
ステム部位の塩基の数は特に制限ないが、4〜10個が好ましい。
【0027】
式(1)で表されるヌクレオチドを構成単位の含有量は特に制限ないが、1個又は少なくとも2個含有することが好ましく、さらに好ましくは1個又は2〜4個含有することである。少なくとも2個有すると、蛍光が長波長側にシフトする蛍光があるため、検出が容易となりやすい。
【0028】
式(1)で表されるヌクレオチドを構成単位として含有する蛍光プローブは、公知の方法で製造することができる。たとえば、特開2008−162916公報に記載された方法により、2’−デオキシグアノシン又はグアノシンの8−炭素をハロゲン化してから、アセチレン化合物をカップリングした後、接触水素還元することにより、式(2)で表される8-置換グアニンを合成する。次いで、8−置換グアニンを原料の一つとして、DNA自動合成機を用い、オリゴヌクレオチドを合成した後、このオリゴヌクレオチドと蛍光性有機基(R)を構成する前駆体とを反応させて本発明の蛍光プローブを製造することができる。
【0029】
なお、式(2)で表される8-置換グアニンと蛍光性有機基(R)を構成する前駆体とを反応させて式(1)で表されるヌクレオチドを製造した後、このヌクレオチドを原料の一つとして、DNA自動合成機を用い、本発明の蛍光プローブを製造してもよい。
【0030】
【化2】

【0031】
Zは反応性置換基(アミノ基及びカルボキシル基等)、Qは反応性置換基(Z)とプリン骨格の8位炭素とを繋ぐ結合基を表し、Y、O、P、C、H及びNは式1と同じ意味である。なお、Qは式(1)のXと同じ基が含まれる。
【0032】
式(2)で表される8-置換グアニンのZがアミノ基の場合、蛍光性有機基(R)を構成する前駆体として、蛍光有機基(R)をもつカルボキシスクシンイミドエステル又は蛍光有機基(R)をもつハロゲン化物等を用いることにより、蛍光有機基(R)がアミド結合又はアミノ結合により結合した蛍光プローブ又は式(1)で表されるヌクレオチドが得られる。
【0033】
蛍光有機基(R)をもつカルボキシスクシンイミドエステルを用いる場合、反応溶媒(たとえば、N,N−ジメチルホルムアミド)やアルカリ触媒(たとえば、炭酸水素ナトリウム)を用いることが好ましい。反応温度は25〜38℃程度である。反応時間は10〜24時間程度である。
【0034】
蛍光有機基(R)をもつハロゲン化物を用いる場合、反応溶媒(たとえば、N,N−ジメチルホルムアミド、アセトン及びトルエン)を用いることが好ましい。反応温度は20〜38℃程度である。反応時間は1〜10時間程度である。
【0035】
蛍光有機基(R)をもつカルボキシスクシンイミドエステルは、公知の方法で得ることができ、たとえば、蛍光有機基(R)を持つカルボン酸(たとえば、1−ピレンカルボン酸、4−オキソ−4−ピレニルブタン酸、3−クマリンカルボン酸、10−アクリドニル酢酸、3−ペリレンカルボン酸、2−アントラセンカルボン酸、1−アントラセンカルボン酸、9−アントラセンカルボン酸、3−キサントンカルボン酸、3−チオキサントンカルボン酸、9−フルオレンカルボン酸及び9−フェナントレンカルボン酸)とN−ヒドロキシスクシンイミドとを反応させることにより得ることができる。
【0036】
蛍光有機基(R)をもつハロゲン化物は、市場から容易に入手できるほか、公知の方法{J.Am.Chem.Soc.(74)4296(1952)、Arch.Pharm.(Weinheim)326、451(1993)、Chem.Pharm.Bull.35(6)2545(1987)、Indian Journal of Chemistry(20)50(1981)、Chemische Berichte(49)2487(1916)、Journal of the Chemical Society(99)2047(1911)、J.Photochem.Photobio.A;Chem(159)173(2003)、第4版実験化学講座21日本化学会編p275、Tetrahedron:Asynmetry,18(8)1003(2007)、Organic Letters,8(6)1189(2006)、Journal of Organometallic Chemistry,691,p1389(2006)、Bull. Chem. Soc. Jpn.,(53)1385(1980)、The Journal of Organic Chemistry(65)3005(2000)、Journal of the American Chemical Society(69)1038(1941)、Organic synthesis, Coll.vol.5,918(1973)、第4版実験化学講座19日本化学会編p422、第4版実験化学講座21日本化学会編p106、第4版実験化学講座20日本化学会編p1、第4版実験化学講座19日本化学会編p422}によって得ることができる。
【0037】
本発明の蛍光プローブは、ポリヌクレオチドの末端にクエンチャー分子としてグアニン塩基を配置する必要がないため、ステム部位の塩基配列に制限がない。したがって、ステム部位及びループ部位を自由に設計できる。
また、本発明の蛍光プローブの両末端は、蛍光性分子やクエンチャー分子で修飾する必要がないため、さらに任意の修飾を施したり、基材(チップ)へ固定してマイクロアレイを調製することができる。たとえば、酵素に対し完全な耐性を持ち、粗抽出液中でのタンパク質結合を検出しうるペプチド核酸(PNA)を本発明の蛍光プローブに応用すると、網羅的なDNA−タンパク質間の結合解析が可能となる。また、各種疾患に対応させたPNAを本発明の蛍光プローブに応用すると、各疾患におけるプロモーター異常・遺伝子発現異常の高速解析を行うことが可能となる。
【実施例】
【0038】
<実施例1>
特開2008−162916号公報の実施例の記載に準じて、2’−デオキシグアノシン5.681g(0.021mol)を蒸留水400mlに懸濁させ、N−ブロモコハク酸イミド4.17g(0.023mol)を加え、約25℃で30分間反応させた後、析出した固体を減圧濾過し、蒸留水で洗浄し、さらにアセトンで洗浄して、淡紫色固体(s1)を得た。
1H−NMR分析及びIR分析により、得られた淡紫色固体(s1)は、8−ブロモ−デオキシグアノシンであることを同定した。
【0039】
淡紫色固体(s1)300mg(0.867mmol)を無水N,N−ジメチルホルムアミド30mlに溶解し、アルゴン雰囲気下、N−ヘキサ−5−イニルトリフルオロアセトアミド498mg(2.581mmol)、ヨウ化銅(I)33mg(0.173mmol)、テトラキストリフェニルホスフィンパラジウム(0)99mg(0.086mmol)及びトリエチルアミン148μL(1.463mmol)を加え、55℃で2時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム/メタノール:体積比7/1)により精製して、白色固体(s2)を得た。
1H−NMR分析及びIR分析により、得られた白色固体(s2)は、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキサ−1−イニル)デオキシグアノシンであることを同定した。
【0040】
白色固体(s2)376mg(0.721mmol)を無水エタノール15mlに溶解し、パラジウムカーボン50mgを加え、系内を水素置換した後、約25℃で14時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム/メタノール:体積比7/1)により精製して、白色固体(s3)を得た。
1H−NMR分析及びIR分析により、得られた白色固体(s3)は、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキシル)デオキシグアノシンであることを同定した。
【0041】
白色固体(s3)195mg(0.422mmol)をアルゴン雰囲気下、無水N,N−ジメチルホルムアミド10mlに溶解し、N,N’−ジメチルホルムアミドジエチルアセタール1ml(5.835mmol)を加えた後、50℃で2時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を減圧留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム/メタノール:体積比7/1)で精製して、白色固体(s4)を得た。
1H−NMR分析及びIR分析により、得られた白色固体(s4)は、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキシル)デオキシグアノシンのプリン骨格の2位のアミノ基をN,N’−ジメチルホルムアミドジエチルアセタールで保護した化合物であることを同定した。
【0042】
アルゴン雰囲気下、白色固体(s4)152mg(0.294mmol)を無水ピリジン10mlに溶解し、4,4’−ジメトキシトリチルクロリド120mg(0.354mmol)、N,N−ジメチルアミノピリジン7.2mg(0.059mmol)を加えた後、約25℃で1時間攪拌した。薄層クロマトグラフィ(TLC)で原料の消失を確認した後、反応溶媒を減圧留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム/メタノール/トリエチルアミン:体積比89/10/1)により精製して、白色固体(s5)を得た。
1H−NMR分析及びIR分析により、得られた白色固体(s5)は、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキシル)デオキシグアノシンのプリン骨格の2位のアミノ基をN,N’−ジメチルホルムアミドジエチルアセタールで保護し、デオキシリボース骨格の5’位の水酸基をジメメトキシトリチル基で保護した化合物であることを同定した。
【0043】
アルゴン雰囲気下、白色固体(s5)52mg(0.059mmol)を無水ジクロロメタン460μlに溶解し、1H−テトラゾール無水アセトニトリル溶液(0.45M)196μl(0.088mmol)及び2−シアノエチル−N,N,N’,N’−テトライソプロピルホスホロジアミダイト28μl(0.089mmol)を加えた後、約25℃で2時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認してから、反応液を分液ロートに移して、飽和重曹水及び蒸留水で洗浄し、有機層を無水硫酸ナトリウムで乾燥した後、反応溶媒を減圧留去した。残渣を無水アセトニトリル1mlに溶解し、コスモナイスフィルターS(溶媒系、ナカライテスク株式会社製)で濾過し、濾液を減圧蒸留して、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキシル)デオキシグアノシンのプリン骨格の2位のアミノ基をN,N’−ジメチルホルムアミドジエチルアセタールで保護し、デオキシリボース骨格の5’位の水酸基をジメメトキシトリチル基で保護し、デオキシリボース骨格の3’位の水酸基を2−シアノエチル−N,N,N’,N’−テトライソプロピルホスホロジアミダイトで保護した化合物(s6)を得た。
【0044】
化合物(s6)を原料の一部として、DNA自動合成機(3400DNA/RNA シンセサイザ、アプライドバイオシステムズ社)を用いて、オリゴヌクレオチド(w1){5'-TGACGAGTATCCAAGATTGAATCwTCA-3’:wは化合物(s6)に対応する。}を合成した。
【0045】
無水ジメチルホルムアミド1mlに、1−ピレンカルボン酸50mg(0.20mmol)を溶解し、水溶性カルボジイミド{1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩}38mg(0.20mmol)及びN−ヒドロキシスクシンイミド28mg(0.24mmol)を加えた後、約25℃で12時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を減圧留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム)で精製して、1−ピレンカルボン酸スクシンイミドエステルを得た。
【0046】
オリゴヌクレオチド(w1)4.2mg(0.5μmol)に、1.0M−炭酸水素ナトリウム水溶液300μlを加えてから、N,N−ジメチルホルムアミド100μlに溶解した後、1−ピレンカルボン酸スクシンイミドエステル2.0mg(5.8μmol)を加えて、37℃で約12時間攪拌して、塩基wのプリン骨格の8位に結合基(X)を介してピレン骨格が結合したオリゴヌクレオチド(w2)を合成した。
【0047】
合成終了後、固相担体から切り出された溶液を0.5mlエッペンドルフチューブに移し替え、37℃で18時間加熱して、脱保護を行った。ついで、約25℃に冷却してから、0.5mlエッペンドルフチューブに超純水19μlを加えた後、遠心分離(15000rpm、約2万G、1分間)して、高速液体クロマトグラフィー(PU−2080−puls、JASCO)で精製した。精製後、凍結乾燥して、本発明の蛍光プローブ(1){5'-TGACGAGTATCCAAGATTGAATCmTCA-3’:mは式(3)で表される化合物に対応する。}を得た。
【0048】
本発明の蛍光プローブ(1)は、MALDI−TOF MASS(AXIMA−LNR、株式会社島津製作所)による質量分析(親ピーク8634.94)、高速液体クロマトグラフィー(FLOW2.0ml/min、AF buffer/CH3CN:3〜20%(45min)、Size10×150mm、CHEMCONBOND 5-ODS-H、図2)及び酵素分解による各ヌクレオチドの含有率の解析の結果から確認した。
【0049】
【化3】

【0050】
以上の化学反応を以下にまとめた。
【化4】

【0051】
なお、TAFはトリフルオロアセチル基を表し、DMTrはジメトキシトリチル基を表し、iPrはイソプロピル基を表す。
【0052】
<実施例2>
無水ジメチルホルムアミド1mlに、4−オキソ−4−ピレニルブタン酸50mg(0.17mmol)を溶解し、水溶性カルボジイミド{1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩}38mg(0.20mmol)及びN−ヒドロキシスクシンイミド23mg(0.20mmol)を加えた後、約25℃で12時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を減圧留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム)で精製して、4−オキソ−4−ピレニルブタン酸スクシンイミドエステルを得た。
【0053】
「1−ピレンカルボン酸スクシンイミドエステル2.0mg(5.8μmol)」を「4−オキソ−4−ピレニルブタン酸スクシンイミドエステル2.0mg、(5.0μmol)」に変更したこと以外、実施例1と同様にして、本発明の蛍光プローブ(2){5'-TGACGAGTATCCAAGATTGAATCnTCA-3’:nは式(4)で表される化合物に対応する。}を得た。
【0054】
本発明の蛍光プローブ(2)は、MALDI−TOF MASS(AXIMA−LNR、株式会社島津製作所)による質量分析(親ピーク8691.00)、高速液体クロマトグラフィー(FLOW2.0ml/min、AF buffer/CH3CN:3〜20%(45min)、Size10×150mm、CHEMCONBOND 5-ODS-H、図3)及び酵素分解による各ヌクレオチドの含有率の解析の結果から確認した。
【0055】
【化5】

【0056】
<実施例3>
化合物(s6)及び1−ピレンカルボン酸スクシンイミドエステルを用いて、実施例1と同様にして、本発明の蛍光プローブ(3){5'-TGACAGGTATCCAAGATTGAACTmTCA-3’:mは式(3)で表される化合物に対応する。}を得た。
【0057】
本発明の蛍光プローブ(3)は、MALDI−TOF MASS(AXIMA−LNR、株式会社島津製作所)による質量分析(親ピーク8634.94)、高速液体クロマトグラフィー(FLOW2.0ml/min、AF buffer/CH3CN:3〜20%(45min)、Size10×150mm、CHEMCONBOND 5-ODS-H)及び酵素分解による各ヌクレオチドの含有率の解析の結果から確認した。
【0058】
<実施例4>
化合物(s6)及び1−ピレンカルボン酸スクシンイミドエステルを用いて、実施例1と同様にして、本発明の蛍光プローブ(4){5'-AGCAGCTGTATCCAAGATTGAAAmCTmCT-3’:mは式(3)で表される化合物に対応する。}を得た。
【0059】
本発明の蛍光プローブ(4)は、MALDI−TOF MASS(AXIMA−LNR、株式会社島津製作所)による質量分析(親ピーク9124.26)、高速液体クロマトグラフィー(FLOW2.0ml/min、AF buffer/CH3CN:3〜20%(45min)、Size10×150mm、CHEMCONBOND 5-ODS-H)及び酵素分解による各ヌクレオチドの含有率の解析の結果から確認した。
【0060】
<蛍光分光分析>
エッペンドルフチューブに、塩化ナトリウム水溶液及びリン酸緩衝溶液(pH7.0)を加え、それぞれの最終濃度が0.1M及び50mMとなるように超純水を加えて濃度調整した後、評価試料(蛍光プローブ)と相補的な塩基配列をもつオリゴデオキシヌクレオチド100μMを最終濃度が2.5μMになるようにして加えてから、攪拌し遠心分離した。評価試料(蛍光プローブ)を70℃で10分間アニーリングを行い、蛍光スペクトルを測定した。
また、相補的な塩基配列をもつオリゴデオキシヌクレオチドを用いなかったこと以外、上記と同様にして蛍光スペクトルを測定した。
【0061】
測定結果を図4〜11に示す。図4〜9から明らかなように、本発明の蛍光プローブは、相補的な塩基配列とハイブリタイズすると蛍光を出すが、相補的な塩基配列とハイブリタイズしないと蛍光を出さないか、一定波長において蛍光を出さなかった。すなわち、ハイブリタイズの有無によって広い波長範囲で蛍光強度が著しく相違した。
また、図10及び11から明らかなように、本発明の蛍光プローブに、式(1)で表されるヌクレオチドを構成単位として2個含むものは、ハイブリタイズの有無によって、長波長側で蛍光強度が著しく相違した。
【図面の簡単な説明】
【0062】
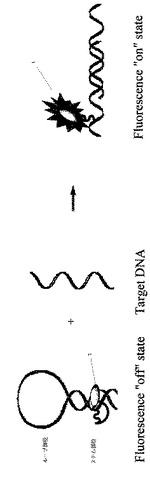
【図1】本発明の蛍光プローブとターゲットDNAとがハイブリタイズする前は蛍光を出さないが、ハイブリタイズすることによって蛍光を発することを模式的に示した概念図である。
【図2】実施例1で得た本発明の蛍光プローブ(1)の高速液体クロマトグラフィーチャートである。
【図3】実施例2で得た本発明の蛍光プローブ(2)の高速液体クロマトグラフィーチャートである。
【図4】実施例で評価した本発明の蛍光プローブ(1)の蛍光スペクトルである(励起光347nm)。
【図5】実施例で評価した本発明の蛍光プローブ(1)の励起スペクトルである(測定波長432nm)。
【図6】実施例で評価した本発明の蛍光プローブ(2)の蛍光スペクトルである(励起光370nm)。
【図7】実施例で評価した本発明の蛍光プローブ(2)の励起スペクトルである(測定波長457nm)。
【図8】実施例で評価した本発明の蛍光プローブ(3)の蛍光スペクトルである(励起光350nm)。
【図9】実施例で評価した本発明の蛍光プローブ(3)の励起スペクトルである(測定波長400nm)。
【図10】実施例で評価した本発明の蛍光プローブ(4)の蛍光スペクトルである(励起光350nm)。
【図11】実施例で評価した本発明の蛍光プローブ(4)の励起スペクトルである(測定波長400nm)。
【符号の説明】
【0063】
1 蛍光性有機基
2 ハイブリタイズしたときの蛍光スペクトル
3 ハイブリタイズしていないときの蛍光スペクトル
4 目的物
【技術分野】
【0001】
本発明は、ステムループ構造を有する蛍光プローブに関する。
【背景技術】
【0002】
ポリヌクレオチドの末端にクエンチャー分子(蛍光消光分子)としてグアニン塩基を配置し、他端に蛍光分子を持つプローブが知られている(非特許文献1及び2)。
【非特許文献1】A.Friederich et al., FEBS Lett., 2007, 581, 1644
【非特許文献2】Y.Saito et al., Chem.Commun., 2007, 4492
【発明の開示】
【発明が解決しようとする課題】
【0003】
非特許文献1に記載されたプローブでは、ポリヌクレオチドの末端にクエンチャー分子としてグアニン塩基を配置する必要があり、ステム部位の塩基配列に制限があるという問題がある。
本発明の目的は、ステムループ構造を有するプローブにおいて、ステム部位の塩基配列に制限がなく、簡易に調製できる蛍光プローブを提供することである。
【課題を解決するための手段】
【0004】
本発明の蛍光プローブの特徴は、ステムループ構造を有するプローブにおいて、
式(1)で表されるヌクレオチドを構成単位として含有する点を要旨とする。
【化1】

Rは蛍光性有機基、Xは蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基、Yは水素原子又は水酸基、Oは酸素原子、Pはリン原子、Cは炭素原子、Hは水素原子、Nは窒素原子を表す。
【発明の効果】
【0005】
本発明の蛍光プローブは、ポリヌクレオチドの末端にクエンチャー分子としてグアニン塩基を配置する必要がないため、ステム部位の塩基配列に制限がない。また、本発明の蛍光プローブは、クエンチャー分子を必要としないため、簡易に調製することができる。また、本発明の蛍光プローブの両末端は、蛍光性分子やクエンチャー分子で修飾する必要がないため、さらに任意の修飾を施したり、基材(チップ)へ固定してマイクロアレイを調製することができる。
【発明を実施するための最良の形態】
【0006】
本発明において、ステムループ構造とは、二重鎖を形成している部分をステム(茎)、折り返しの輪になっている部分をループ(輪)と見立てて呼ばれる構造を意味する(図1参照。)。ステムループ構造は、mRNAの二次構造の一般的な構造の一つである。
また、塩基とは、アデニン(A)、チミン(T)、シトシン(C)、グアニン(G)又はウラシル(U)を意味する。
【0007】
蛍光性有機基(R)としては蛍光を発する有機基であれば制限がないが、ピレン骨格、アントラセン骨格、ペリレン骨格、アクリドン骨格、クマリン骨格、イソクマリン骨格、キサントン骨格、チオキサントン骨格、フェナントレン骨格、ベンゾフェノン骨格、フルオレン骨格又はジフェニルチオエーテル骨格を有する有機基が好ましく、さらに好ましくはピレン骨格、アントラセン骨格、ペリレン骨格、アクリドン骨格、クマリン骨格、イソクマリン骨格、キサントン骨格、チオキサントン骨格又はフェナントレン骨格を有する有機基である。
【0008】
蛍光性有機基(R)には、置換基を有してもよい。置換基を有すると、母骨格の吸収波長を長波長側にシフトさせることができる。シフトする程度(シフト値)は、置換基の種類等によって相違し、このシフト値については「有機化学のスペクトルによる同定法 第5版(R.M.Silverstein著、281頁、1993年東京化学同人発行)」に記載の表が参考となる。
置換基としては、水酸基、炭素数1〜4のアルコキシ基(メトキシ、イソプロポキシ及びブトキシ等)、炭素数1〜4のアシロキシ基(アセトキシ等)、炭素数1〜7のアシル基(アセチル及びベンゾイル等)、ニトロ基及びシアノ基等が挙げられる。
【0009】
ピレン骨格を有する有機基としては、1−ピレニルカルボニルアミノ、1−ピレニルカルボニルオキシ及び1−ピレニル等が挙げられる。
【0010】
アントラセン骨格を有する有機基としては、1−アントリルカルボニルアミノ、2−アントリルカルボニルアミノ、9−アントリルカルボニルアミノ、10−ブトキシ−9−アントリルカルボニルアミノ、1−アントリルカルボニルオキシ、2−アントリルカルボニルオキシ、1−アントリル及び2−アントリル等が挙げられる。
【0011】
ペリレン骨格を有する有機基としては、3−ペリレニルカルボニルアミノ、3−ペリレニルカルボニルオキシ及び3−ペリレニル等が挙げられる。
【0012】
アクリドン骨格を有する有機基としては、10−アクリドニルメチルカルボニルアミノ及び10−アクリドニルメチルカルボニルオキシ等が挙げられる。
【0013】
クマリン骨格を有する有機基としては、3−クマリニルカルボニルアミノ、3−クマリニルカルボニルオキシ、7−メトキシ−3−クマリニルカルボニルアミノ及び7−メトキシ−3−クマリニルカルボニルオキシ等が挙げられる。
【0014】
イソクマリン骨格を有する有機基としては、3−イソクマリニルカルボニルアミノ、3−イソクマリニルカルボニルオキシ、7−メトキシ−3−イソクマリニルカルボニルアミノ及び7−メトキシ−3−イソクマリニルカルボニルオキシ等が挙げられる。
【0015】
キサントン骨格を有する有機基としては、2−キサントニリルカルボニルアミノ、2−キサントニリルカルボニルオキシ、4−キサントニリルカルボニルアミノ、4−キサントニリルカルボニルオキシ、2−キサントニリル、4−キサントニリル、7−メトキシ−2−キサントニリル、2−メトキシ−4−キサントニリル、2−メトキシ−3−キサントニリル及び2,3−ジメトキシ−4−キサントニリル等が挙げられる。
【0016】
チオキサントン骨格を有する有機基としては、2−チオキサントニリルカルボニルアミノ、2−チオキサントニリルカルボニルオキシ、4−チオキサントニリルカルボニルアミノ、4−チオキサントニリルカルボニルオキシ、2−チオキサントニリル、4−チオキサントニリル、7−メトキシ−2−チオキサントニリル、2−メトキシ−4−チオキサントニリル、2−メトキシ−3−チオキサントニリル及び2,3−ジメトキシ−4−チオキサントニリル等が挙げられる。
【0017】
フェナントレン骨格を有する有機基としては、1−フェナントリルカルボニルアミノ、2−フェナントリルカルボニルアミノ、1−フェナントリルカルボニルオキシ、2−フェナントリルカルボニルオキシ、1−フェナントリル及び9−フェナントリル等が挙げられる。
【0018】
ベンゾフェノン骨格を有する有機基としては、4−ベンゾイルフェニルカルボニルアミノ、4−ベンゾイルフェニルカルボニルオキシ及び4−ベンゾイルフェニル等が挙げられる。
【0019】
フルオレン骨格を有する有機基としては、9−フルオレニルカルボニルアミノ、9−フルオレニルカルボニルオキシ及び9−フルオレニル等が挙げられる。
【0020】
ジフェニルチオエーテル骨格を有する有機基としては、4−フェニルチオベンゾイルアミノ及び4−フェニルチオベンゾイルオキシ等が挙げられる。
【0021】
蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基(X)としては、式(1)で表されるヌクレオチド(修飾グアニン)がシトシン(C)とハイブリタイズしたとき、蛍光性有機基が修飾グアニン及びシトシンの塩基対に近づいて蛍光性有機基のπ電子が吸引される状態をとることができれば特に制限はないが、炭素数1〜18のアルキレン基を含んでなることが好ましい。この結合基(X)には、エーテル結合、アミド結合、エステル結合、ウレタン結合及び/又はウレア結合等を含んでもよい。
【0022】
Yが水素原子のときDNAに対応し、一方、Yが水酸基のときRNAに対応する。
【0023】
本発明の蛍光プローブは、式(1)で表されるヌクレオチドを構成単位として含有すれば、その含有位置や含有数に制限はない。
【0024】
式(1)で表されるヌクレオチド単位がステム部位に有すると、本発明の蛍光プローブは、ターゲットポリヌクレオチドとハイブリタイズする前は蛍光を発しないが、ターゲットポリヌクレオチドとハイブリタイズすると蛍光を発することとなる。一方、式(1)で表されるヌクレオチド単位がループ部位に有すると、本発明の蛍光プローブは、ターゲットポリヌクレオチドとハイブリタイズする前は蛍光を発するが、ターゲットポリヌクレオチドとハイブリタイズすると蛍光を発しないこととなる。これらのうち、式(1)で表されるヌクレオチド単位をステム部位に有することが好ましい。
【0025】
式(1)で表されるヌクレオチド単位は、3’末端から2〜10番目の塩基の位置に有することが好ましい。
【0026】
ステム部位の塩基の数は特に制限ないが、4〜10個が好ましい。
【0027】
式(1)で表されるヌクレオチドを構成単位の含有量は特に制限ないが、1個又は少なくとも2個含有することが好ましく、さらに好ましくは1個又は2〜4個含有することである。少なくとも2個有すると、蛍光が長波長側にシフトする蛍光があるため、検出が容易となりやすい。
【0028】
式(1)で表されるヌクレオチドを構成単位として含有する蛍光プローブは、公知の方法で製造することができる。たとえば、特開2008−162916公報に記載された方法により、2’−デオキシグアノシン又はグアノシンの8−炭素をハロゲン化してから、アセチレン化合物をカップリングした後、接触水素還元することにより、式(2)で表される8-置換グアニンを合成する。次いで、8−置換グアニンを原料の一つとして、DNA自動合成機を用い、オリゴヌクレオチドを合成した後、このオリゴヌクレオチドと蛍光性有機基(R)を構成する前駆体とを反応させて本発明の蛍光プローブを製造することができる。
【0029】
なお、式(2)で表される8-置換グアニンと蛍光性有機基(R)を構成する前駆体とを反応させて式(1)で表されるヌクレオチドを製造した後、このヌクレオチドを原料の一つとして、DNA自動合成機を用い、本発明の蛍光プローブを製造してもよい。
【0030】
【化2】

【0031】
Zは反応性置換基(アミノ基及びカルボキシル基等)、Qは反応性置換基(Z)とプリン骨格の8位炭素とを繋ぐ結合基を表し、Y、O、P、C、H及びNは式1と同じ意味である。なお、Qは式(1)のXと同じ基が含まれる。
【0032】
式(2)で表される8-置換グアニンのZがアミノ基の場合、蛍光性有機基(R)を構成する前駆体として、蛍光有機基(R)をもつカルボキシスクシンイミドエステル又は蛍光有機基(R)をもつハロゲン化物等を用いることにより、蛍光有機基(R)がアミド結合又はアミノ結合により結合した蛍光プローブ又は式(1)で表されるヌクレオチドが得られる。
【0033】
蛍光有機基(R)をもつカルボキシスクシンイミドエステルを用いる場合、反応溶媒(たとえば、N,N−ジメチルホルムアミド)やアルカリ触媒(たとえば、炭酸水素ナトリウム)を用いることが好ましい。反応温度は25〜38℃程度である。反応時間は10〜24時間程度である。
【0034】
蛍光有機基(R)をもつハロゲン化物を用いる場合、反応溶媒(たとえば、N,N−ジメチルホルムアミド、アセトン及びトルエン)を用いることが好ましい。反応温度は20〜38℃程度である。反応時間は1〜10時間程度である。
【0035】
蛍光有機基(R)をもつカルボキシスクシンイミドエステルは、公知の方法で得ることができ、たとえば、蛍光有機基(R)を持つカルボン酸(たとえば、1−ピレンカルボン酸、4−オキソ−4−ピレニルブタン酸、3−クマリンカルボン酸、10−アクリドニル酢酸、3−ペリレンカルボン酸、2−アントラセンカルボン酸、1−アントラセンカルボン酸、9−アントラセンカルボン酸、3−キサントンカルボン酸、3−チオキサントンカルボン酸、9−フルオレンカルボン酸及び9−フェナントレンカルボン酸)とN−ヒドロキシスクシンイミドとを反応させることにより得ることができる。
【0036】
蛍光有機基(R)をもつハロゲン化物は、市場から容易に入手できるほか、公知の方法{J.Am.Chem.Soc.(74)4296(1952)、Arch.Pharm.(Weinheim)326、451(1993)、Chem.Pharm.Bull.35(6)2545(1987)、Indian Journal of Chemistry(20)50(1981)、Chemische Berichte(49)2487(1916)、Journal of the Chemical Society(99)2047(1911)、J.Photochem.Photobio.A;Chem(159)173(2003)、第4版実験化学講座21日本化学会編p275、Tetrahedron:Asynmetry,18(8)1003(2007)、Organic Letters,8(6)1189(2006)、Journal of Organometallic Chemistry,691,p1389(2006)、Bull. Chem. Soc. Jpn.,(53)1385(1980)、The Journal of Organic Chemistry(65)3005(2000)、Journal of the American Chemical Society(69)1038(1941)、Organic synthesis, Coll.vol.5,918(1973)、第4版実験化学講座19日本化学会編p422、第4版実験化学講座21日本化学会編p106、第4版実験化学講座20日本化学会編p1、第4版実験化学講座19日本化学会編p422}によって得ることができる。
【0037】
本発明の蛍光プローブは、ポリヌクレオチドの末端にクエンチャー分子としてグアニン塩基を配置する必要がないため、ステム部位の塩基配列に制限がない。したがって、ステム部位及びループ部位を自由に設計できる。
また、本発明の蛍光プローブの両末端は、蛍光性分子やクエンチャー分子で修飾する必要がないため、さらに任意の修飾を施したり、基材(チップ)へ固定してマイクロアレイを調製することができる。たとえば、酵素に対し完全な耐性を持ち、粗抽出液中でのタンパク質結合を検出しうるペプチド核酸(PNA)を本発明の蛍光プローブに応用すると、網羅的なDNA−タンパク質間の結合解析が可能となる。また、各種疾患に対応させたPNAを本発明の蛍光プローブに応用すると、各疾患におけるプロモーター異常・遺伝子発現異常の高速解析を行うことが可能となる。
【実施例】
【0038】
<実施例1>
特開2008−162916号公報の実施例の記載に準じて、2’−デオキシグアノシン5.681g(0.021mol)を蒸留水400mlに懸濁させ、N−ブロモコハク酸イミド4.17g(0.023mol)を加え、約25℃で30分間反応させた後、析出した固体を減圧濾過し、蒸留水で洗浄し、さらにアセトンで洗浄して、淡紫色固体(s1)を得た。
1H−NMR分析及びIR分析により、得られた淡紫色固体(s1)は、8−ブロモ−デオキシグアノシンであることを同定した。
【0039】
淡紫色固体(s1)300mg(0.867mmol)を無水N,N−ジメチルホルムアミド30mlに溶解し、アルゴン雰囲気下、N−ヘキサ−5−イニルトリフルオロアセトアミド498mg(2.581mmol)、ヨウ化銅(I)33mg(0.173mmol)、テトラキストリフェニルホスフィンパラジウム(0)99mg(0.086mmol)及びトリエチルアミン148μL(1.463mmol)を加え、55℃で2時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム/メタノール:体積比7/1)により精製して、白色固体(s2)を得た。
1H−NMR分析及びIR分析により、得られた白色固体(s2)は、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキサ−1−イニル)デオキシグアノシンであることを同定した。
【0040】
白色固体(s2)376mg(0.721mmol)を無水エタノール15mlに溶解し、パラジウムカーボン50mgを加え、系内を水素置換した後、約25℃で14時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム/メタノール:体積比7/1)により精製して、白色固体(s3)を得た。
1H−NMR分析及びIR分析により、得られた白色固体(s3)は、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキシル)デオキシグアノシンであることを同定した。
【0041】
白色固体(s3)195mg(0.422mmol)をアルゴン雰囲気下、無水N,N−ジメチルホルムアミド10mlに溶解し、N,N’−ジメチルホルムアミドジエチルアセタール1ml(5.835mmol)を加えた後、50℃で2時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を減圧留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム/メタノール:体積比7/1)で精製して、白色固体(s4)を得た。
1H−NMR分析及びIR分析により、得られた白色固体(s4)は、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキシル)デオキシグアノシンのプリン骨格の2位のアミノ基をN,N’−ジメチルホルムアミドジエチルアセタールで保護した化合物であることを同定した。
【0042】
アルゴン雰囲気下、白色固体(s4)152mg(0.294mmol)を無水ピリジン10mlに溶解し、4,4’−ジメトキシトリチルクロリド120mg(0.354mmol)、N,N−ジメチルアミノピリジン7.2mg(0.059mmol)を加えた後、約25℃で1時間攪拌した。薄層クロマトグラフィ(TLC)で原料の消失を確認した後、反応溶媒を減圧留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム/メタノール/トリエチルアミン:体積比89/10/1)により精製して、白色固体(s5)を得た。
1H−NMR分析及びIR分析により、得られた白色固体(s5)は、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキシル)デオキシグアノシンのプリン骨格の2位のアミノ基をN,N’−ジメチルホルムアミドジエチルアセタールで保護し、デオキシリボース骨格の5’位の水酸基をジメメトキシトリチル基で保護した化合物であることを同定した。
【0043】
アルゴン雰囲気下、白色固体(s5)52mg(0.059mmol)を無水ジクロロメタン460μlに溶解し、1H−テトラゾール無水アセトニトリル溶液(0.45M)196μl(0.088mmol)及び2−シアノエチル−N,N,N’,N’−テトライソプロピルホスホロジアミダイト28μl(0.089mmol)を加えた後、約25℃で2時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認してから、反応液を分液ロートに移して、飽和重曹水及び蒸留水で洗浄し、有機層を無水硫酸ナトリウムで乾燥した後、反応溶媒を減圧留去した。残渣を無水アセトニトリル1mlに溶解し、コスモナイスフィルターS(溶媒系、ナカライテスク株式会社製)で濾過し、濾液を減圧蒸留して、8−(6−(トリフルオロメチルカルボニルアミノ)ヘキシル)デオキシグアノシンのプリン骨格の2位のアミノ基をN,N’−ジメチルホルムアミドジエチルアセタールで保護し、デオキシリボース骨格の5’位の水酸基をジメメトキシトリチル基で保護し、デオキシリボース骨格の3’位の水酸基を2−シアノエチル−N,N,N’,N’−テトライソプロピルホスホロジアミダイトで保護した化合物(s6)を得た。
【0044】
化合物(s6)を原料の一部として、DNA自動合成機(3400DNA/RNA シンセサイザ、アプライドバイオシステムズ社)を用いて、オリゴヌクレオチド(w1){5'-TGACGAGTATCCAAGATTGAATCwTCA-3’:wは化合物(s6)に対応する。}を合成した。
【0045】
無水ジメチルホルムアミド1mlに、1−ピレンカルボン酸50mg(0.20mmol)を溶解し、水溶性カルボジイミド{1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩}38mg(0.20mmol)及びN−ヒドロキシスクシンイミド28mg(0.24mmol)を加えた後、約25℃で12時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を減圧留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム)で精製して、1−ピレンカルボン酸スクシンイミドエステルを得た。
【0046】
オリゴヌクレオチド(w1)4.2mg(0.5μmol)に、1.0M−炭酸水素ナトリウム水溶液300μlを加えてから、N,N−ジメチルホルムアミド100μlに溶解した後、1−ピレンカルボン酸スクシンイミドエステル2.0mg(5.8μmol)を加えて、37℃で約12時間攪拌して、塩基wのプリン骨格の8位に結合基(X)を介してピレン骨格が結合したオリゴヌクレオチド(w2)を合成した。
【0047】
合成終了後、固相担体から切り出された溶液を0.5mlエッペンドルフチューブに移し替え、37℃で18時間加熱して、脱保護を行った。ついで、約25℃に冷却してから、0.5mlエッペンドルフチューブに超純水19μlを加えた後、遠心分離(15000rpm、約2万G、1分間)して、高速液体クロマトグラフィー(PU−2080−puls、JASCO)で精製した。精製後、凍結乾燥して、本発明の蛍光プローブ(1){5'-TGACGAGTATCCAAGATTGAATCmTCA-3’:mは式(3)で表される化合物に対応する。}を得た。
【0048】
本発明の蛍光プローブ(1)は、MALDI−TOF MASS(AXIMA−LNR、株式会社島津製作所)による質量分析(親ピーク8634.94)、高速液体クロマトグラフィー(FLOW2.0ml/min、AF buffer/CH3CN:3〜20%(45min)、Size10×150mm、CHEMCONBOND 5-ODS-H、図2)及び酵素分解による各ヌクレオチドの含有率の解析の結果から確認した。
【0049】
【化3】

【0050】
以上の化学反応を以下にまとめた。
【化4】

【0051】
なお、TAFはトリフルオロアセチル基を表し、DMTrはジメトキシトリチル基を表し、iPrはイソプロピル基を表す。
【0052】
<実施例2>
無水ジメチルホルムアミド1mlに、4−オキソ−4−ピレニルブタン酸50mg(0.17mmol)を溶解し、水溶性カルボジイミド{1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩}38mg(0.20mmol)及びN−ヒドロキシスクシンイミド23mg(0.20mmol)を加えた後、約25℃で12時間攪拌した。薄層クロマトグラフィー(TLC)で原料の消失を確認した後、反応溶媒を減圧留去し、残渣をカラムクロマトグラフィー(シリカゲル、クロロホルム)で精製して、4−オキソ−4−ピレニルブタン酸スクシンイミドエステルを得た。
【0053】
「1−ピレンカルボン酸スクシンイミドエステル2.0mg(5.8μmol)」を「4−オキソ−4−ピレニルブタン酸スクシンイミドエステル2.0mg、(5.0μmol)」に変更したこと以外、実施例1と同様にして、本発明の蛍光プローブ(2){5'-TGACGAGTATCCAAGATTGAATCnTCA-3’:nは式(4)で表される化合物に対応する。}を得た。
【0054】
本発明の蛍光プローブ(2)は、MALDI−TOF MASS(AXIMA−LNR、株式会社島津製作所)による質量分析(親ピーク8691.00)、高速液体クロマトグラフィー(FLOW2.0ml/min、AF buffer/CH3CN:3〜20%(45min)、Size10×150mm、CHEMCONBOND 5-ODS-H、図3)及び酵素分解による各ヌクレオチドの含有率の解析の結果から確認した。
【0055】
【化5】

【0056】
<実施例3>
化合物(s6)及び1−ピレンカルボン酸スクシンイミドエステルを用いて、実施例1と同様にして、本発明の蛍光プローブ(3){5'-TGACAGGTATCCAAGATTGAACTmTCA-3’:mは式(3)で表される化合物に対応する。}を得た。
【0057】
本発明の蛍光プローブ(3)は、MALDI−TOF MASS(AXIMA−LNR、株式会社島津製作所)による質量分析(親ピーク8634.94)、高速液体クロマトグラフィー(FLOW2.0ml/min、AF buffer/CH3CN:3〜20%(45min)、Size10×150mm、CHEMCONBOND 5-ODS-H)及び酵素分解による各ヌクレオチドの含有率の解析の結果から確認した。
【0058】
<実施例4>
化合物(s6)及び1−ピレンカルボン酸スクシンイミドエステルを用いて、実施例1と同様にして、本発明の蛍光プローブ(4){5'-AGCAGCTGTATCCAAGATTGAAAmCTmCT-3’:mは式(3)で表される化合物に対応する。}を得た。
【0059】
本発明の蛍光プローブ(4)は、MALDI−TOF MASS(AXIMA−LNR、株式会社島津製作所)による質量分析(親ピーク9124.26)、高速液体クロマトグラフィー(FLOW2.0ml/min、AF buffer/CH3CN:3〜20%(45min)、Size10×150mm、CHEMCONBOND 5-ODS-H)及び酵素分解による各ヌクレオチドの含有率の解析の結果から確認した。
【0060】
<蛍光分光分析>
エッペンドルフチューブに、塩化ナトリウム水溶液及びリン酸緩衝溶液(pH7.0)を加え、それぞれの最終濃度が0.1M及び50mMとなるように超純水を加えて濃度調整した後、評価試料(蛍光プローブ)と相補的な塩基配列をもつオリゴデオキシヌクレオチド100μMを最終濃度が2.5μMになるようにして加えてから、攪拌し遠心分離した。評価試料(蛍光プローブ)を70℃で10分間アニーリングを行い、蛍光スペクトルを測定した。
また、相補的な塩基配列をもつオリゴデオキシヌクレオチドを用いなかったこと以外、上記と同様にして蛍光スペクトルを測定した。
【0061】
測定結果を図4〜11に示す。図4〜9から明らかなように、本発明の蛍光プローブは、相補的な塩基配列とハイブリタイズすると蛍光を出すが、相補的な塩基配列とハイブリタイズしないと蛍光を出さないか、一定波長において蛍光を出さなかった。すなわち、ハイブリタイズの有無によって広い波長範囲で蛍光強度が著しく相違した。
また、図10及び11から明らかなように、本発明の蛍光プローブに、式(1)で表されるヌクレオチドを構成単位として2個含むものは、ハイブリタイズの有無によって、長波長側で蛍光強度が著しく相違した。
【図面の簡単な説明】
【0062】
【図1】本発明の蛍光プローブとターゲットDNAとがハイブリタイズする前は蛍光を出さないが、ハイブリタイズすることによって蛍光を発することを模式的に示した概念図である。
【図2】実施例1で得た本発明の蛍光プローブ(1)の高速液体クロマトグラフィーチャートである。
【図3】実施例2で得た本発明の蛍光プローブ(2)の高速液体クロマトグラフィーチャートである。
【図4】実施例で評価した本発明の蛍光プローブ(1)の蛍光スペクトルである(励起光347nm)。
【図5】実施例で評価した本発明の蛍光プローブ(1)の励起スペクトルである(測定波長432nm)。
【図6】実施例で評価した本発明の蛍光プローブ(2)の蛍光スペクトルである(励起光370nm)。
【図7】実施例で評価した本発明の蛍光プローブ(2)の励起スペクトルである(測定波長457nm)。
【図8】実施例で評価した本発明の蛍光プローブ(3)の蛍光スペクトルである(励起光350nm)。
【図9】実施例で評価した本発明の蛍光プローブ(3)の励起スペクトルである(測定波長400nm)。
【図10】実施例で評価した本発明の蛍光プローブ(4)の蛍光スペクトルである(励起光350nm)。
【図11】実施例で評価した本発明の蛍光プローブ(4)の励起スペクトルである(測定波長400nm)。
【符号の説明】
【0063】
1 蛍光性有機基
2 ハイブリタイズしたときの蛍光スペクトル
3 ハイブリタイズしていないときの蛍光スペクトル
4 目的物
【特許請求の範囲】
【請求項1】
ステムループ構造を有するプローブにおいて、
式(1)で表されるヌクレオチドを構成単位として含有することを特徴とする蛍光プローブ。
【化1】

Rは蛍光性有機基、Xは蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基、Yは水素原子又は水酸基、Oは酸素原子、Pはリン原子、Cは炭素原子、Hは水素原子、Nは窒素原子を表す。
【請求項2】
式(1)で表されるヌクレオチド単位をステム部位に有する請求項1に記載の蛍光プローブ。
【請求項3】
式(1)で表されるヌクレオチド単位を3’末端から2〜10番目の塩基の位置に有する請求項1又は2に記載の蛍光プローブ。
【請求項4】
蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基(X)が、炭素数1〜18のアルキレン基を含んでなる請求項1〜3のいずれかに記載の蛍光プローブ。
【請求項5】
蛍光性有機基が、ピレン骨格、アントラセン骨格、ペリレン骨格、アクリドン骨格、クマリン骨格、イソクマリン骨格、キサントン骨格、チオキサントン骨格、フェナントレン骨格、ベンゾフェノン骨格、フルオレン骨格又はジフェニルチオエーテル骨格を有する有機基である請求項1〜4のいずれかに記載の蛍光プローブ。
【請求項6】
ステム部位の塩基の数が4〜10である請求項1〜5のいずれかに記載の蛍光プローブ。
【請求項7】
式(1)で表されるヌクレオチドを構成単位として少なくとも2個含有する請求項1〜6のいずれかに記載の蛍光プローブ。
【請求項8】
請求項1〜7のいずれかに記載の蛍光プローブを基材に固定化してなるマイクロアレイ。
【請求項1】
ステムループ構造を有するプローブにおいて、
式(1)で表されるヌクレオチドを構成単位として含有することを特徴とする蛍光プローブ。
【化1】

Rは蛍光性有機基、Xは蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基、Yは水素原子又は水酸基、Oは酸素原子、Pはリン原子、Cは炭素原子、Hは水素原子、Nは窒素原子を表す。
【請求項2】
式(1)で表されるヌクレオチド単位をステム部位に有する請求項1に記載の蛍光プローブ。
【請求項3】
式(1)で表されるヌクレオチド単位を3’末端から2〜10番目の塩基の位置に有する請求項1又は2に記載の蛍光プローブ。
【請求項4】
蛍光性有機基とプリン骨格の8位炭素とを繋ぐ結合基(X)が、炭素数1〜18のアルキレン基を含んでなる請求項1〜3のいずれかに記載の蛍光プローブ。
【請求項5】
蛍光性有機基が、ピレン骨格、アントラセン骨格、ペリレン骨格、アクリドン骨格、クマリン骨格、イソクマリン骨格、キサントン骨格、チオキサントン骨格、フェナントレン骨格、ベンゾフェノン骨格、フルオレン骨格又はジフェニルチオエーテル骨格を有する有機基である請求項1〜4のいずれかに記載の蛍光プローブ。
【請求項6】
ステム部位の塩基の数が4〜10である請求項1〜5のいずれかに記載の蛍光プローブ。
【請求項7】
式(1)で表されるヌクレオチドを構成単位として少なくとも2個含有する請求項1〜6のいずれかに記載の蛍光プローブ。
【請求項8】
請求項1〜7のいずれかに記載の蛍光プローブを基材に固定化してなるマイクロアレイ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2010−60394(P2010−60394A)
【公開日】平成22年3月18日(2010.3.18)
【国際特許分類】
【出願番号】特願2008−225347(P2008−225347)
【出願日】平成20年9月2日(2008.9.2)
【出願人】(899000057)学校法人日本大学 (650)
【出願人】(507085667)長浜バイオラボラトリー株式会社 (4)
【Fターム(参考)】
【公開日】平成22年3月18日(2010.3.18)
【国際特許分類】
【出願日】平成20年9月2日(2008.9.2)
【出願人】(899000057)学校法人日本大学 (650)
【出願人】(507085667)長浜バイオラボラトリー株式会社 (4)
【Fターム(参考)】
[ Back to top ]

