ステント
【課題】ステントの変形および水膨潤する高分子微粒子の膨潤が起きても、高分子微粒子がほとんど剥離しないステントを提供する。
【解決手段】水膨潤する高分子微粒子が表面に斑点状に化学的に固定されている、ステントである。従来は、表面がハイドロゲルポリマーですべて被覆されているためステントが拡張し変形すると、ステントと膨張したハイドロゲルとの間にひずみが生じ、ハイドロゲルが破壊されステントから剥離する。前記のように水膨潤する高分子微粒子が、表面に斑点状に化学的に固定されている場合、ステントが拡張Bしステントが変形しても、水膨潤した高分子微粒子にひずみは生じず、高分子微粒子の破壊や剥離はほとんど生じない。
【解決手段】水膨潤する高分子微粒子が表面に斑点状に化学的に固定されている、ステントである。従来は、表面がハイドロゲルポリマーですべて被覆されているためステントが拡張し変形すると、ステントと膨張したハイドロゲルとの間にひずみが生じ、ハイドロゲルが破壊されステントから剥離する。前記のように水膨潤する高分子微粒子が、表面に斑点状に化学的に固定されている場合、ステントが拡張Bしステントが変形しても、水膨潤した高分子微粒子にひずみは生じず、高分子微粒子の破壊や剥離はほとんど生じない。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はステントに関し、さらに詳細には、ステントの変形および水膨潤する高分子微粒子の膨潤が起きても、高分子微粒子が剥離しないステントに関する。
【背景技術】
【0002】
心臓疾患等の治療のため、血管内にステントを留置することが行われている。一般的にステントを構成している素材は、ステンレス、コバルト−クロム合金、ニッケル−チタン合金などの金属材料である。ステントは血管内留置後、血栓形成反応、および炎症反応を経て、平滑筋細胞の増殖や、内皮細胞層の形成といった一連の治癒プロセスが進行する。近年、ステント留置による平滑筋細胞の過剰な増殖と血管内再狭窄の防止を目的とした薬剤溶出ステントが開発され、臨床で使用されている。かような薬剤溶出ステントは、その表面が、ポリアクリル酸などのハイドロゲルポリマーで被覆されている構造を有する(例えば、特許文献1参照)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第3372950号明細書
【発明の概要】
【発明が解決しようとする課題】
【0004】
上記特許文献1に記載のステントは、その表面がハイドロゲルポリマーですべて被覆されている。このようなステントにおいては、生理的環境下(特に血管内)でステントの拡張とハイドロゲルポリマーの膨潤とが同時に起きた際、ハイドロゲルポリマー同士がぶつかり合って体積が過剰に増大する。したがって、ステントとハイドロゲルポリマーとの間にひずみが生じ、ハイドロゲルポリマーが剥離し血管内に流出するという問題があった。
【0005】
本発明は、このような従来技術が有する課題に鑑みてなされたものであり、その目的は、ステントの変形および水膨潤する高分子微粒子の膨潤が起きても、高分子微粒子がほとんど剥離しないステントを提供することにある。
【課題を解決するための手段】
【0006】
本発明者らは、上記の課題に鑑み、鋭意研究を積み重ねた。その結果、水膨潤する高分子微粒子を、金属カップリング剤を介してステントの基材の表面に斑点状に化学的に固定させることにより、上記課題が解決できることを見出し、本発明を完成させるに至った。
【0007】
すなわち、本発明は、水膨潤する高分子微粒子が表面に斑点状に化学的に固定されている、ステントである。
【発明の効果】
【0008】
本発明のステントによれば、水膨潤する高分子微粒子が、表面に斑点状に化学的に固定されているため、ステントが拡張しステントが変形しても、水膨潤した高分子微粒子にひずみは生じず、高分子微粒子の破壊や剥離はほとんど生じない。
【0009】
また、本発明のステントは、血小板の粘着が少なく、抗血栓性に優れる。
【図面の簡単な説明】
【0010】
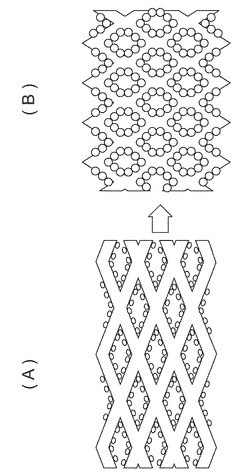
【図1】従来のステントを表す模式図であって、(A)は拡張前のステントの模式図であり、(B)は拡張後のステントの模式図である。
【図2】本発明の一実施形態によるステントを表す模式図であって、(A)は拡張前のステントの模式図であり、(B)は拡張後のステントの模式図である。
【図3】ステントの形状の一例を示す模式図である。
【図4】実施例1で得られたステントを染色し、CCDカメラで観察した際の写真である。
【発明を実施するための形態】
【0011】
本発明のステントは、水膨潤する高分子微粒子が、基材の表面に斑点状に化学的に固定されていることを特徴とする。
【0012】
図1は、表面がハイドロゲルポリマーですべて被覆されている従来のステントを表す模式図であって、(A)は拡張前のステントの模式図であり、(B)は拡張後のステントの模式図である。図1(B)に示すように、ステントが拡張し変形すると、ステントと膨張したハイドロゲルとの間にひずみが生じ、ハイドロゲルが破壊されステントから剥離する。
【0013】
一方、図2は、本発明の一実施形態によるステントを表す模式図であって、(A)は拡張前のステントの模式図であり、(B)は拡張後のステントの模式図である。図2に示す本発明のステントにおいては、その表面に水膨潤する高分子微粒子が斑点状に化学的に固定されている。図2(B)に示すように、高分子微粒子が水膨潤し、さらにステントが拡張しステントが変形しても、高分子微粒子は斑点状に存在しているため、高分子微粒子にひずみは生じず、水膨潤した高分子微粒子の破壊や剥離はほとんど生じない。そして、水膨潤した高分子微粒子同士は非常に少ない面積で接するようになり、ステント表面は水膨潤した高分子微粒子で覆われるようになる。
【0014】
本発明で用いられる水膨潤する高分子微粒子は、好ましくはpHが7以上、より好ましくは血液のようなpH7.3〜7.6の弱アルカリ性条件下でのみ水膨潤するpH応答性水膨潤性高分子微粒子であることが好ましい。
【0015】
また、水膨潤する高分子微粒子が化学的に固定されている本発明のステントは、血小板の粘着が少なく、抗血栓性に優れる。
【0016】
また、本発明のステントは、予め金属カップリング剤がコートされていることから、水膨潤する高分子微粒子の剥離はより発生し難く、耐久性に優れる。
【0017】
以下、本発明のステントの構成について詳細に説明するが、本発明の技術的範囲は下記の形態のみに制限されない。
【0018】
(構成)
[ステントの基材、形状]
本発明のステントの基材は金属であることが好ましい。その具体的な例としては、例えば、ニッケル−チタン合金、コバルト−クロム合金、ステンレス、鉄、チタン、アルミニウム、スズ、亜鉛−タングステン合金などが挙げられる。これらのなかでも、ステントとして実績があるニッケル−チタン合金またはSUS316L等のステンレスが好ましい。
【0019】
ステントの形状も特に制限されない。例えば、図3に示す態様において、ステント1は、弾性線材2からなり、内部に切欠き部を有する略菱形の要素21を基本単位とする。複数の略菱形の要素21が、略菱形の形状がその短軸方向に連続して配置され結合することで環状ユニット22をなしている。環状ユニット22は、隣接する環状ユニットと線状の弾性部材23を介して接続されている。これにより複数の環状ユニット22が一部結合した状態でその軸方向に連続して配置される。ステント1は、このような構成により、両末端部が開口し、該両末端部の間を長手方向に延在する円筒体をなしている。ステント1は、略菱形の切欠き部を有しており、この切欠き部が変形することによって、円筒体の径方向に拡縮可能な構造になっている。
【0020】
ただし、本発明において、ステントの形状は図示した態様に限定されず、両末端部が開口し、該両末端部の間を長手方向に延在する円筒体であって、その側面上に、外側面と内側面とを連通する多数の切欠き部を有し、この切欠き部が変形することによって、円筒体の径方向に拡縮可能な構造を広く含む。
【0021】
ステントを構成する弾性線材の断面形状についても、特に限定されず、例えば矩形、円形、楕円形、矩形以外の多角形等が挙げられる。
【0022】
これらの中でも、本発明で用いられるステントとしては、略円筒形状に形成され、生体内挿入時には中心軸方向に圧縮され、生体内留置時には外方に拡張して圧縮前の形状に復元するいわゆる自己拡張型ステントであることが好ましい。
【0023】
ステントの製造方法は、特に限定されず、ステントの基材および形状に応じて、通常使用される製造方法から適宜選択すればよい。
【0024】
[金属カップリング剤]
本発明のステントは、基材となる金属の上に金属カップリング剤がコートされている。前記金属カップリング剤としては、特に制限されず、具体的な例としては、例えば、N−3−(アクリロキシ−2−ヒドロキシプロピル)−3−アミノプロピルトリエトキシシラン、3−アミノプロピルトリメトキシシラン、3−アミノプロピルトリエトキシシラン、(3−アクリロキシプロピル)ジメチルメトキシシラン、3−アニリノプロピルトリメトキシシラン、ジメチルアミノプロピルトリメトキシシラン、ジエチルアミノプロピルトリメトキシシラン、ジプロピルアミノプロピルトリメトキシシラン、ジブチルアミノプロピルトリメトキシシラン、モノブチルアミノプロピルトリメトキシシラン、ジオクチルアミノプロピルトリメトキシシラン、ジブチルアミノプロピルジメトキシシラン、ジブチルアミノプロピルモノメトキシシラン、ジメチルアミノフェニルトリエトキシシラン、(3−アクリロキシプロピル)メチルジメトキシシラン、(3−アクリロキシプロピル)トリメトキシシラン、3−(N−アリルアミノ)プロピルトリメトキシシラン、アリルジメトキシシラン、アリルトリエトキシシラン、アリルトリメトキシシラン、3−ブテニルトリエトキシシラン、2−(クロロメチル)アリルトリメトキシシラン、メタクリルアミドプロピルトリエトキシシラン、N−(3−メタクリロキシ−2−ヒドロキシプロピル)−3−アミノプロピルトリエトキシシラン、(メタクリロキシジメチル)ジメチルエトキシシラン、メタクリロキシメチルトリエトキシシラン、メタクリロキシメチルトリメトキシシラン、メタクリロキシプロピルジメチルエトキシシラン、メタクリロキシプロピルジメチルメトキシシラン、メタクリロキシプロピルメチルジエトキシシラン、メタクリロキシプロピルメチルジメトキシシラン、メタクリロキシプロピルメチルトリエトキシシラン、メタクリロキシプロピルメチルトリメトキシシラン、メタクリロキシプロピルトリス(メトキシエトキシ)シラン、メトキシジメチルビニルシラン、1−メトキシ−3−(トリメチルシロキシ)ブタジエン、スチリルエチルトリメトキシシラン、ビニルジメチルエトキシシラン、ビニルジフェニルエトキシシラン、ビニルメチルジエトキシシラン、ビニルメチルジメトキシシラン、O−(ビニロキシエチル)−N−(トリエトキシシリルプロピル)ウレタン、ビニルトリエトキシシラン、ビニルトリメトキシシラン、ビニルトリ−t−ブトキシシラン、ビニルトリイソプロポキシシシラン、ビニルトリフェノキシシラン、ビニルトリス(2−メトキシエトキシ)シランなどのシランカップリング剤;イソプロピルトリイソステアロイルチタネート、イソプロピル−n−ドデシルベンゼンスルホニルチタネート、イソプロピルトリス(ジオクチルピロホシフェート)チタネート、テトライソプロピルビス(ジオクチルホスファイト)チタネート、テトライソプロピルビス(ジトリデシルホスファイト)チタネート、テトラ(2,2−ジアリルオキシメチル−1−ブチル)ビス(ジ−トリドデシル)ホスファイトチタネート、ビス(ジオクチルピロホスフェート)オキシアセテートチタネート、ビス(ジオクチルピロホスフェート)エチレンチタネート、イソプロピルトリ(N−アミノエチル−アミノエチル)チタネートなどのチタンカップリング剤などが挙げられる。これらは単独でも、または2種以上組み合わせても用いることができる。
【0025】
これらの中でも、ステントの基材として用いられる金属と水膨潤する高分子微粒子との接着性をより強固にするという観点から、金属と化学結合を形成しうる官能基(例:アルコキシ基)と、高分子微粒子と共有結合を形成しうる官能基(例:アミノ基)とを有するカップリング剤が好ましい。具体的には、N−3−(アクリロキシ−2−ヒドロキシプロピル)−3−アミノプロピルトリエトキシシラン、3−アミノプロピルトリメトキシシラン、3−アミノプロピルトリエトキシシランなどのアミノアルキル基を有するシランカップリング剤がより好ましく、さらに好ましくは、3−アミノプロピルトリメトキシシラン、3−アミノプロピルトリエトキシシランである。
【0026】
[水膨潤する高分子微粒子]
本発明のステントは、その表面に斑点状に水膨潤する高分子微粒子が結合している形態を有する。前記水膨潤する高分子微粒子は、特に限定されず、具体的な例としては、例えば、(メタ)アクリルアミド系単量体等を重合して得られるpH応答性水膨潤性架橋高分子、ポリアクリル酸等の水溶性の単量体を重合・架橋することによって得られる高分子微粒子、高分子多糖を架橋することによって得られる高分子微粒子、アミノ酸の重合体であるポリペプチドを架橋することによって得られる高分子微粒子、水溶性高分子が環状分子を介して架橋したロタキサン構造の高分子微粒子、水溶性高分子が層状粘土化合物を介して架橋した高分子微粒子、カチオン性荷電を持った水溶性高分子とアニオン性荷電を持った水溶性高分子とが静電的に架橋することによって得られる高分子微粒子、相補的な水素結合をする水溶性高分子同士が多点的な水素結合で架橋することによって得られる高分子微粒子などが挙げられる。
【0027】
中でも、前記ステントの表面が親水性となり抗血栓性となること、また、血液中など特定のpH条件下で膨潤するという観点から、水膨潤する高分子微粒子は、(メタ)アクリルアミド系単量体(a1)に由来する構成単位および不飽和カルボン酸(a2)に由来する構成単位を含む共重合体を、架橋剤(a3)により架橋したpH応答性水膨潤性架橋高分子(A)から形成される微粒子であることが好ましい。以下、本発明の好ましい実施形態として、pH応答性水膨潤性架橋高分子(A)を詳細に説明するが、本発明の技術的範囲は下記の形態のみに制限されない。
【0028】
〔pH応答性水膨潤性架橋高分子の単量体成分〕
<(メタ)アクリルアミド系単量体(a1)>
pH応答性水膨潤性架橋高分子(A)の単量体成分である(メタ)アクリルアミド系単量体(a1)は、特に制限されない。具体的な例としては、例えば、(メタ)アクリルアミド、N−メチル(メタ)アクリルアミド、N−エチル(メタ)アクリルアミド、N−n−プロピル(メタ)アクリルアミド、N−イソプロピル(メタ)アクリルアミド、N−n−ブチル(メタ)アクリルアミド、N−イソブチル(メタ)アクリルアミド、N−s−ブチル(メタ)アクリルアミド、N−t−ブチル(メタ)アクリルアミド 、N,N−ジメチル(メタ)アクリルアミド、N−エチル−N−メチル(メタ)アクリルアミド、N,N−ジエチル(メタ)アクリルアミド、N−メチル−N−イソプロピル(メタ)アクリルアミド、N−メチル−N−n−プロピル(メタ)アクリルアミド、N−エチル−N−イソプロピル(メタ)アクリルアミド、N−エチル−N−n−プロピル(メタ)アクリルアミド、N,N−ジ−n−プロピル(メタ)アクリルアミド、ジアセトン(メタ)アクリルアミドなどが挙げられる。これら(メタ)アクリルアミド系単量体(a1)は、単独でもまたは2種以上を組み合わせても用いることができる。なお、本明細書において、(メタ)アクリル酸、(メタ)アクリルアミド等の記載は、アクリル酸およびメタクリル酸またはこれらの各誘導体を意味する。
【0029】
なかでも、整形外科領域等で使用実績があり、生体内において安全性が高い(メタ)アクリルアミドが好ましい。
【0030】
<不飽和カルボン酸(a2)>
前記pH応答性水膨潤性架橋高分子(A)の単量体成分である不飽和カルボン酸(a2)は、特に制限されず、具体的な例としては、例えば、(メタ)アクリル酸、マレイン酸、フマル酸、グルタコン酸、イタコン酸、クロトン酸、ソルビン酸などが挙げられる。また、前記不飽和カルボン酸のナトリウム塩、カリウム塩、アンモニウム塩などの塩も、pH応答性水膨潤性架橋高分子(A)の製造の際に用いることができる。不飽和カルボン酸の塩を共重合に用いた場合は、後述する酸処理を行うことにより、不飽和カルボン酸(a2)の構成単位がpH応答性水膨潤性架橋高分子(A)に導入されうる。これら不飽和カルボン酸(a2)(またはその塩)は、単独でもまたは2種以上を組み合わせても用いることができる。
【0031】
なかでも、pH7以上の中性からアルカリ性領域において膨張性を示すという観点から、(メタ)アクリル酸または(メタ)アクリル酸ナトリウムが好ましい。
【0032】
なお、上記(メタ)アクリルアミド系単量体(a1)に由来する構成単位および不飽和カルボン酸(a2)に由来する構成単位を含む共重合体の形態は、ブロック状でもよいし、ランダム状であってもよい。
【0033】
<架橋剤(a3)>
前記pH応答性水膨潤性架橋高分子(A)に用いられる架橋剤(a3)としては、特に制限されず、例えば、重合性不飽和基を2個以上有する架橋剤(イ)、重合性不飽和基と重合性不飽和基以外の反応性官能基とをそれぞれ1つずつ有する架橋剤(ロ)、重合性不飽和基以外の反応性官能基を2個以上有する架橋剤(ハ)などが挙げられる。これら架橋剤は、単独でもまたは2種以上を組み合わせても用いることができる。
【0034】
前記架橋剤(イ)のみを用いる場合は、(メタ)アクリルアミド系単量体(a1)と不飽和カルボン酸(a2)(またはその塩)との共重合を行う際に、重合系内に架橋剤(イ)を添加して共重合させればよい。前記架橋剤(ハ)のみを用いる場合は、(a1)と(a2)との共重合を行ったあとに架橋剤(ハ)を添加して、例えば加熱による後架橋を行えばよい。前記架橋剤(ロ)のみを用いる場合ならびに前記架橋剤(イ)、(ロ)、および(ハ)の2種以上を用いる場合は、(メタ)アクリルアミド系単量体(a1)と不飽和カルボン酸(a2)との共重合を行う際に重合系内に架橋剤を添加して共重合させ、さらに、例えば加熱による後架橋を行えばよい。
【0035】
重合性不飽和基を2個以上有する架橋剤(イ)の具体例としては、例えば、N,N’−メチレンビスアクリルアミド、N,N’−メチレンビスメタクリルアミド、N,N’−エチレンビスアクリルアミド、N,N’−エチレンビスメタクリルアミド、N,N’−ヘキサメチレンビスアクリルアミド、N,N’−ヘキサメチレンビスメタクリルアミド、N,N’−ベンジリデンビスアクリルアミド、N,N’−ビス(アクリルアミドメチレン)尿素、エチレングリコールジ(メタ)アクリレート、ポリエチレングリコールジ(メタ)アクリレート、プロピレングリコールジ(メタ)アクリレート、グリセリン(ジ又はトリ)アクリレート、トリメチロールプロパントリアクリレート、トリアリルアミン、トリアリルシアヌレート、トリアリルイソシアヌレート、テトラアリロキシエタン、ペンタエリスリトールトリアリルエーテル、(ポリ)エチレングリコールジ(メタ)アクリレート、(ポリ)プロピレングリコールジ(メタ)アクリレート、トリメチルロールプロパントリ(メタ)アクリレート、グリセリントリ(メタ)アクリレート、グリセリンアクリレートメタクリレート、エチレンオキサイド変性トリメチロールプロパントリ(メタ)アクリレート、ペンタエリスリトールヘキサ(メタ)アクリレート、トリアリルシアヌレート、トリアリルイソシアヌレート、トリアリルホスフェート、トリアリルアミン、ポリ(メタ)アリロキシアルカン、(ポリ)エチレングリコールジグリシジルエーテル、グリセロールジグリシジルエーテル、エチレングリコール、ポリエチレングリコール、プロピレングリコール、グリセリン、ペンタエリスリトール、エチレンジアミン、エチレンカーボネート、プロピレンカーボネート、グリシジル(メタ)アクリレート等を挙げることができる。
【0036】
重合性不飽和基と重合性不飽和基以外の反応性官能基とをそれぞれ1つずつ有する架橋剤(ロ)の具体例としては、例えば、ヒドロキシエチル(メタ)アクリレート、N−メチロール(メタ)アクリルアミド、グリシジル(メタ)アクリレート等が挙げられる。
【0037】
重合性不飽和基以外の反応性官能基を2個以上有する架橋剤(ハ)の具体例としては、例えば、多価アルコール(例えば、エチレングリコール、ジエチレングリコール、グリセリン、プロピレングリコール、トリメチロールプロパン等)、アルカノールアミン(例えば、ジエタノールアミン等)、およびポリアミン(例えば、ポリエチレンイミン等)等が挙げられる。
【0038】
これらのうち、重合性不飽和基を2個以上有する架橋剤(イ)が好ましく、N,N’−メチレンビスアクリルアミドがより好ましい。
【0039】
〔pH応答性水膨潤性架橋高分子の製造方法〕
前記pH応答性水膨潤性架橋高分子(A)の製造方法は、特に制限されないが、(メタ)アクリルアミド系単量体(a1)、不飽和カルボン酸(a2)(またはその塩)、および必要に応じて架橋剤(a3)を共重合させ、さらに必要に応じて後架橋を行うことにより製造することが好ましい。
【0040】
共重合の方法は、特に制限されず、例えば、重合開始剤を使用する溶液重合法、乳化重合法、懸濁重合法、逆相懸濁重合法、薄膜重合法、噴霧重合法など従来公知の方法を用いることができる。重合制御の方法としては、断熱重合法、温度制御重合法、等温重合法などが挙げられる。また、重合開始剤により重合を開始させる方法の他に、放射線、電子線、紫外線等を照射して重合を開始させる方法を採用することもできる。好ましくは、重合開始剤を使用した逆相懸濁重合法である。
【0041】
前記逆相懸濁重合を行なう場合の連続相の溶媒としては、n−ヘキサン、n−へプタン、n−オクタン、n−デカン、シクロヘキサン、メチルシクロヘキサン、流動パラフィン等の脂肪族系有機溶媒、トルエン、キシレン等の芳香族系有機溶媒、1,2−ジクロロエタン等のハロゲン系有機溶媒等の有機溶媒が使用できるが、ヘキサン、シクロヘキサン、流動パラフィン等の脂肪族系有機溶媒がより好ましい。なお、前記溶媒は、単独でまたは2種以上を混合して用いることもできる。
【0042】
前記連続相には、分散安定剤を添加することができる。この分散安定剤の種類や使用量を適宜選択することにより、得られるpH応答性水膨潤性高分子微粒子の粒径を制御することができる。
【0043】
前記分散安定剤の例としては、例えば、ポリオキシエチレンラウリルエーテル、ポリオキシエチレンオレイルエーテル、ポリオキシエチレンステアリルエーテル、ソルビタンセスキオレエート、ソルビタントリオレート、ソルビタンモノラウレート、ソルビタンモノオレート、ソルビタンモノパルミテート、ソルビタンモノステアレート、ソルビタントリステアレート、グリセロールモノステアレート、グリセロールモノオレエート、ステアリン酸グリセリル、カプリル酸グリセリル、ステアリン酸ソルビタン、オレイン酸ソルビタン、セスキオレイン酸ソルビタン、ヤシ脂肪酸ソルビタンなどの非イオン系界面活性剤が好適に用いられる。
【0044】
前記分散安定剤は、連続相の溶媒に対して、好ましくは0.04〜20質量%の範囲、より好ましくは1〜12質量%の範囲で用いられる。前記分散安定剤の使用量が0.04質量%未満であると、重合時に得られる重合体が凝集する場合がある。一方、20質量%を超えると、得られた微粒子の粒径のばらつきが大きくなる場合がある。
【0045】
前記逆相懸濁重合法における単量体成分の濃度は、従来公知の範囲であれば特に限定されず、例えば、2〜7質量%が好ましく、3〜5質量%がより好ましい。
【0046】
前記逆相懸濁重合法で用いられる重合開始剤としては、例えば、過硫酸カリウム、過硫酸アンモニウム、過硫酸ナトリウム等の過硫酸塩、メチルエチルケトンパーオキシド、メチルイソブチルケトンパーオキシド、ジ−t−ブチルパーオキシド、t−ブチルクミルパーオキシド、t−ブチルパーオキシアセテート、t−ブチルパーオキシイソブチレート、t−ブチルパーオキシピバレート、過酸化水素等の過酸化物、2,2’−アゾビス〔2−(N−フェニルアミジノ)プロパン〕二塩酸塩、2,2’−アゾビス〔2−(N−アリルアミジノ)プロパン〕二塩酸塩、2,2’−アゾビス{2−〔1−(2−ヒドロキシエチル)−2−イミダゾリン−2−イル〕プロパン}二塩酸塩、2,2’−アゾビス{2−メチル−N−〔1,1−ビス(ヒドロキシメチル)−2−ヒドロキシエチル〕プロピオンアミド}、2,2’−アゾビス〔2−メチル−N−(2−ヒドロキシエチル)−プロピオンアミド〕、4,4’−アゾビス(4−シアノ吉草酸)等のアゾ化合物等が挙げられ、これらは、単独で用いても2種以上を併用してもよい。これらのなかでは、入手が容易で取り扱いが容易であるという観点から、過硫酸塩が好ましく、過硫酸カリウム、過硫酸アンモニウムおよび過硫酸ナトリウムがより好ましい。
【0047】
なお、上記重合開始剤は、亜硫酸ナトリウム、亜硫酸水素ナトリウム、硫酸第一鉄、L−アスコルビン酸、N、N,N’,N’−テトラメチルエチレンジアミン等の還元剤と併用して、レドックス重合開始剤として用いることもできる。
【0048】
重合開始剤の使用量は、単量体の総量100質量部に対して、2〜6質量部が好ましく、3〜5質量部がより好ましい。前記重合開始剤の使用量が2質量部未満の場合、重合反応自体が進行しない可能性がある。一方、6質量部を超えると、得られる重合体の分子量が小さく、また粘性が大きくなるため重合体が凝集する場合がある。
【0049】
必要に応じて、共重合の際に連鎖移動剤を使用してもよい。前記連鎖移動剤の例としては、例えば、チオール類(n−ラウリルメルカプタン、メルカプトエタノール、トリエチレングリコールジメルカプタン等)、チオール酸類(チオグリコール酸、チオリンゴ酸等)、2級アルコール類(イソプロパノ−ル等)、アミン類(ジブチルアミン等)、次亜燐酸塩類(次亜燐酸ナトリウム等)等を挙げることができる。
【0050】
前記逆相懸濁重合法における重合条件は特に制限されず、例えば、重合温度は使用する触媒の種類によって適宜設定することができるが、好ましくは35〜75℃、より好ましくは40〜50℃である。重合温度が35℃未満の場合には、重合反応自体が進行しない可能性がある。一方、重合温度が70℃を超える場合には、分散媒が揮発して単量体成分の分散状態が悪くなる場合がある。重合時間は、好ましくは2時間以上である。
【0051】
重合系内の圧力は、特に限定されるものではなく、常圧(大気圧)下、減圧下、加圧下のいずれであってもよい。また、反応系内の雰囲気も、空気雰囲気であってもよいし、窒素、アルゴンなどの不活性ガス雰囲気下であってもよい。
【0052】
架橋剤(a3)として、上記の重合性不飽和基以外の反応性官能基を2個以上有する架橋剤(ハ)を用いる場合、単量体の重合反応終了後に架橋剤(ハ)を添加して後架橋を行ってもよい。
【0053】
後架橋反応を行う際の反応温度は、使用する架橋剤(a3)の種類等によっても異なるため、一概には決定できないが、通常50〜150℃である。また、反応時間は、通常1〜48時間である。
【0054】
また、共重合を行う際、単量体溶液中に造孔剤を過飽和懸濁させることによって多孔質とすることもできる。この際、単量体溶液には不溶であるが洗浄溶液には可溶である造孔剤を用いることが好ましい。造孔剤の例としては、塩化ナトリウム、塩化カリウム、氷、スクロース、または炭酸水素ナトリウムなどが好ましく挙げられ、より好ましくは塩化ナトリウムである。造孔剤の好ましい濃度は、単量体溶液中、好ましくは5〜50質量%、より好ましくは10〜30質量%の範囲である。
【0055】
このようにして得られるpH応答性水膨潤性高分子微粒子(A)は、必要に応じて、加熱乾燥、解砕等を行うことにより、本発明で用いられるpH応答性水膨潤性高分子微粒子となる。
【0056】
本発明で用いられるpH応答性水膨潤性高分子微粒子の形状は、球状、破砕状、不定形状等特に限定されるものではないが、球状であることが好ましい。
【0057】
前記pH応答性水膨潤性高分子微粒子の乾燥時の平均粒子径は、1〜10μmであることが好ましい。平均粒子径が10μmを超えると、ステントに固定した際、その表面の凹凸が大きくなって、内皮細胞の形成速度や血小板の粘着性にバラツキが出る場合がある。一方、平均粒子径が1μm未満の微粒子は、製造自体が困難な場合がある。
【0058】
上記のようなpH応答性水膨潤性高分子微粒子の形状および平均粒子径は、pH応答性水膨潤性高分子微粒子の製造条件(単量体の種類、共重合時の温度・時間、分散安定剤の量・種類等)により制御されうる。なお、本発明において、乾燥時の平均粒子径は、コールターカウンターを用いて測定した値を採用するものとする。
【0059】
かような構成を有するpH応答性水膨潤性高分子微粒子を、好ましくは0.01質量%以上0.2質量%未満の濃度でヘキサン等の溶媒に分散させた場合、ステント(金属カップリング剤)の表面に斑点状にpH応答性水膨潤性高分子微粒子を被覆することができる。
【0060】
上記のpH応答性水膨潤性高分子微粒子は、好ましくはpHが7以上、特に血液のようなpH7.3〜7.6の弱アルカリ性条件下で水膨潤する。
【0061】
前記水膨潤する高分子微粒子の乾燥時の被覆率は、好ましくは30〜85%、より好ましくは35〜70%、さらに好ましくは35〜50%である。かような範囲であれば、水膨潤する高分子微粒子の破壊や剥離はほとんど生じない。
【0062】
該被覆率は、ステントに固定された水膨潤する高分子微粒子を、例えばメチレンブルーなどの色素を用いて染色し、染色したステントをCCDカメラで撮影し、得た画像を電子ファイルとして取得し、電子ファイル上で画像処理ソフトを用いて染色された領域の面積と染色されていない領域の面積とを測定することによって算出することができる。
【0063】
(製造方法)
次に、本発明のステントの製造方法について説明する。該製造方法は特に制限されないが、(1)ステントの基材の表面を金属カップリング剤で被覆する工程と、(2)前記金属カップリング剤で被覆されたステントの基材に対して、水膨潤する高分子微粒子が0.01質量%以上0.2質量%未満の濃度で分散している分散液を噴霧する工程と、(3)前記分散液が噴霧された前記ステントの基材を加熱乾燥し、前記水膨潤する高分子微粒子の薄膜を形成する工程と、(4)前記水膨潤する高分子微粒子中の官能基と金属カップリング剤の官能基とを化学結合させる縮合剤を含む水溶液を、前記水膨潤する高分子微粒子の薄膜に含浸させた後、加熱乾燥することによって、金属カップリング剤を介して水膨潤する高分子微粒子とステントの基材との間に化学結合を形成させる工程と、を含む製造方法が好ましい。また、必要に応じて、(4)の工程の後に、(5)ステントを酸処理する工程、をさらに含んでもよい。
【0064】
以下、本発明のステントの製造方法について詳細に説明するが、以下の形態のみに制限されるものではない。
【0065】
[(1)ステントの基材の表面を金属カップリング剤で被覆する工程]
本工程では、ステントの基材の表面に金属カップリング剤を被覆する。被覆方法としては、金属カップリング剤中にステントの基材を浸漬させる方法が好ましく用いられる。
【0066】
浸漬時の温度は20〜30℃であることが好ましい。また、浸漬時間は5〜60分であることが好ましく、10〜40分であることがより好ましい。かような浸漬条件であれば、ステントの基材の表面に、ほぼ均一に金属カップリング剤を被覆させることができる。
【0067】
[(2)前記金属カップリング剤で被覆されたステントの基材に対して、水膨潤する高分子微粒子が分散している分散液を噴霧する工程]
本工程では、前記(1)の工程により、表面に金属カップリング剤が被覆されたステントの基材に対して、水膨潤する高分子微粒子が好ましくは0.01質量%以上0.2質量%未満の濃度で分散している分散液を噴霧することにより、水膨潤する高分子微粒子が斑点状にコーティングされた形態のステントを得る。
【0068】
本工程で用いられる分散液中の水膨潤する高分子微粒子の濃度は、好ましくは0.01質量%以上0.2質量%未満であり、より好ましくは0.01〜0.1質量%、さらに好ましくは0.01〜0.05質量%である。前記の濃度が0.01質量%未満の場合、分散液中の水膨潤する高分子微粒子の濃度が低くなりすぎ、ステントの表面に水膨潤する高分子微粒子を被覆すること自体が困難となる場合がある。一方、0.2質量%以上の場合、ステントの表面がすべて水膨潤する高分子微粒子で被覆され、ステントが拡張しステントが変形した際、水膨潤する高分子微粒子の破壊や剥離が生じることがある。
【0069】
分散液に用いられる溶媒は特に制限されず、例えば、水、アセトン、メタノール、ヘキサン等が挙げられる。
【0070】
噴霧方法としては、例えば、スプレー装置を用いて噴霧する方法が用いられる。
【0071】
[(3)前記分散液が噴霧された前記ステントの基材を加熱乾燥し、前記水膨潤する高分子微粒子の薄膜を形成する工程]
前記(2)の工程により、水膨潤する高分子微粒子が斑点状にコーティングされた形態であるステントは、本工程において加熱乾燥され、水膨潤する高分子微粒子の被覆層が形成される形態となる。
【0072】
本工程における乾燥温度は、40〜80℃であることが好ましく、50〜60℃であることがより好ましい。乾燥温度が40℃未満の場合、溶媒が十分に蒸発しない可能性がある。一方、80℃を超える場合、被膜に亀裂・ひびが入る可能性がある。
【0073】
本工程に用いられる乾燥装置は通常用いられる装置でよく、例えば、オーブン、熱風乾燥機等が挙げられる。これらの乾燥装置は、複数個を組み合わせて使用することもできる。
【0074】
[(4)金属カップリング剤を介して水膨潤する高分子微粒子とステントの基材との間に化学結合を形成させる工程]
本工程では、前記水膨潤する高分子微粒子中の官能基と金属カップリング剤の官能基とを化学結合させる縮合剤を含む水溶液を、前記(3)の工程で形成された水膨潤する高分子微粒子の薄膜に含浸させた後、加熱乾燥することによって、金属カップリング剤を介して水膨潤する高分子微粒子とステントの基材との間に化学結合を形成させる。
【0075】
本工程で用いられる縮合剤の溶液の溶媒は水であるが、リン酸緩衝液なども好適に用いられる。例えば、リン酸緩衝液中で反応を行う場合、リン酸緩衝液は、pHの範囲が好ましくは7.4〜7.8となるように調製する。
【0076】
前記縮合剤の具体的な例としては、例えば、N−エチル−N’−(3−ジエチルアミノプロピル)カルボジイミド、N,N’−ジシクロヘキシルカルボジイミド、1−メチル−2−ブロモピリジニウムヨージド、N,N’−カルボニルジイミダゾール、ジフェニルホスホリルアジド、ベンゾトリアゾール−1−イルオキシトリス(ジメチルアミノ)ホスホニウムヘキサフルオロホスフェート(BOP)、4−(4,6−ジメトキシ[1.3.5]トリアジン−2−イル)−4−メチルモルホリニウムクロリド(DMT−MM)、フルオロ−N,N,N’,N’−テトラメチルホルムアミジニウムヘキサフルオロホスフェート(TFFH)等が挙げられる。これら縮合剤は、単独でまたは2種以上混合して用いることができる。
【0077】
前記縮合剤の使用量は、例えば前記水膨潤する高分子微粒子がカルボキシル基を有している場合、前記カルボキシル基の総量1モルに対して1モルであることが好ましい。
【0078】
前記縮合剤を含む水溶液を、水膨潤する高分子微粒子の薄膜に含浸させる際の温度は、好ましくは15〜40℃であり、より好ましくは20〜30℃である。
【0079】
化学結合を形成させる際の加熱温度は、好ましくは40〜80℃であり、より好ましくは40〜60℃である。加熱温度が40℃未満の場合には、化学結合はされるが被膜が十分に乾燥されない可能性がある。一方、加熱温度が80℃を超える場合、被膜に亀裂・ひびが入る可能性がある。
【0080】
化学結合を形成させる際に用いられる加熱装置は、特に限定されず、例えば、オーブンなどの装置が挙げられる。
【0081】
[(5)酸処理する工程]
共重合の際に不飽和カルボン酸(a2)の塩を用いた場合、前記(4)の工程後に酸処理を行い、水膨潤する高分子微粒子のカルボン酸塩の部分をカルボキシル基に変換しておいてもよい。かような処理を行うことにより、本発明で用いられる水膨潤する高分子微粒子が、pH選択的に膨潤・収縮する、pH応答性を有するようになる。酸処理の条件は特に限定されず、例えば、塩酸水溶液などの低pH水溶液中で、好ましくは15〜60℃の温度範囲で、好ましくは1〜24時間処理すればよい。
【0082】
酸処理を行った場合は、酸処理終了後に加熱乾燥を行うことが好ましい。この際、乾燥温度は、好ましくは40〜80℃、より好ましくは40〜60℃の範囲である。乾燥温度が40℃未満の場合には、酸処理はされるが被膜が十分に乾燥されない可能性がある。一方、乾燥温度が80℃を超える場合、被膜に亀裂・ひびが入る可能性がある。
【0083】
本工程に用いられる乾燥装置も、前記(3)の工程と同様に、例えば、オーブン、熱風乾燥機などの通常用いられる装置でよい。これらの乾燥装置は、複数個を組み合わせて使用することもできる。
【0084】
本発明のステントにおいては、前記水膨潤する高分子微粒子がさらに生理活性物質を含んでいてもよい。前記生理活性物質としては、血栓もしくは血栓複合物の融解もしくは代謝を促進する物質、血栓もしくは血栓複合物の増加を抑制する物質、内膜肥厚を抑制する物質、内皮化を促進する物質、および不安定プラークの安定化を促す物質からなる群より選択される少なくとも1種であることが好ましい。
【0085】
血栓もしくは血栓複合物の融解もしくは代謝を促進する物質としては、例えば、ストレプトキナーゼ、プラスミノーゲンアクチベーター、ウロキナーゼ、スタフィノキナーゼ、ルンブロキナーゼ、ナットウキナーゼ、もしくはそれらの類似体等が挙げられる。
【0086】
血栓もしくは血栓複合物の増加を抑制する物質としては、例えば、アセチルサリチル酸、チクロピジン、ジピリダモール、シロスタゾール、ベラプロストNa、リマプロストアルファテクス、イコサペントエン酸エチル、塩酸サルボグレラート、トラピジル、クロピドグレル、プラスグレル及びその類似体に代表される抗血小板薬、もしくはGP IIb/IIIa拮抗剤、ヘパリン、ワルファリンカリウム等の抗凝固薬が挙げられる。
【0087】
内膜肥厚を抑制する物質としては、例えば、抗癌剤、免疫抑制剤、抗生物質、抗リウマチ剤、抗血栓薬、HMG−CoA還元酵素阻害剤、ACE阻害剤、カルシウム拮抗剤、抗高脂血症剤、抗炎症剤、インテグリン阻害薬、抗アレルギー剤、抗酸化剤、GP IIb/IIIa拮抗剤、レチノイド、フラボノイド、カロチノイド、脂質改善薬、DNA合成阻害剤、チロシンキナーゼ阻害剤、抗血小板薬、血管平滑筋増殖抑制薬、生体由来材料、インターフェロン、遺伝子工学により生成される上皮細胞等が挙げられる。
【0088】
内皮化を促進する物質もしくは不安定プラークの安定化を促す物質としては、例えば、抗血栓薬、HMG−CoA還元酵素阻害剤、ACE阻害剤、カルシウム拮抗剤、抗高脂血症剤、抗炎症剤、インテグリン阻害薬、抗アレルギー剤、抗酸化剤、GP IIb/IIIa拮抗剤、レチノイド、フラボノイド、カロチノイド、脂質改善薬、DNA合成阻害剤、チロシンキナーゼ阻害剤、抗血小板薬、生体由来材料、インターフェロンおよび遺伝子工学により生成される上皮細胞等が挙げられる。
【0089】
そして、前記抗癌剤としては、例えば、ビンクリスチン、ビンブラスチン、ビンデシン、イリノテカン、ピラルビシン、パクリタキセル、ドセタキセル、メトトレキサート等が挙げられる。
【0090】
また、前記免疫抑制剤としては、例えば、シロリムス、タクロリムス、アザチオプリン、シクロスポリン、シクロホスファミド、ミコフェノール酸モフェチル、グスペリムス、ミゾリビン等が挙げられる。
【0091】
また、前記抗生物質としては、例えば、マイトマイシン、アドリアマイシン、ドキソルビシン、アクチノマイシン、ダウノルビシン、イダルビシン、ピラルビシン、アクラルビシン、エピルビシン、ペプロマイシン、ジノスタチンスチマラマー等が挙げられる。
【0092】
また、前記抗リウマチ剤としては、例えば、メトトレキサート、チオリンゴ酸ナトリウム、ペニシラミン、ロベンザリット等が挙げられる。
【0093】
また、前記抗血栓薬としては、例えば、ヘパリン、アスピリン、抗トロンビン製剤、チクロピジン、ヒルジン等が挙げられる。
【0094】
また、前記HMG−CoA還元酵素阻害剤としては、例えば、セリバスタチン、セリバスタチンナトリウム、アトルバスタチン、ニスバスタチン、イタバスタチン、フルバスタチン、フルバスタチンナトリウム、シンバスタチン、ロバスタチン、プラバスタチン等が挙げられる。
【0095】
また、前記ACE阻害剤としては、例えば、キナプリル、ペリンドプリルエルブミン、トランドラプリル、シラザプリル、テモカプリル、デラプリル、マレイン酸エナラプリル、リシノプリル、カプトプリル等が挙げられる。
【0096】
また、前記カルシウム拮抗剤としては、例えば、ニフェジピン、ニルバジピン、ジルチアゼム、ベニジピン、ニソルジピン等が挙げられる。
【0097】
また、前記抗高脂血症剤としては、例えば、プロブコールが挙げられる。
【0098】
また、前記抗アレルギー剤としては、例えば、トラニラストが挙げられる。
【0099】
また、前記レチノイドとしては、例えば、オールトランスレチノイン酸が挙げられる。
【0100】
また、前記フラボノイドおよび前記カロチノイドとしては、例えば、カテキン類、特にエピガロカテキンガレート、アントシアニン、プロアントシアニジン、リコピン、β−カロチン等が挙げられる。
【0101】
また、チロシンキナーゼ阻害剤としては、例えば、ゲニステイン、チルフォスチン、アーブスタチン等が挙げられる。
【0102】
また、前記抗炎症剤としては、例えば、サリチル酸、アスピリン、アセトアミノフェン、フェナチセン、インドメタシン、ジクロフェナクナトリウム、ピロキシカム、フェノプロフェンカルシウム、イブプロフェン、マレイン酸クロルフェニラミン、ジフルニサル、デキサメタゾン、プロピオン酸クロベタゾール、酢酸ジフロラゾン、ジフルプレドナート、ジプロピオン酸ベタメタゾン、吉草酸ジフルコルトロン、ブデソニド、フルオシノニド、アムシノニド、ハルシノニド、酪酸ジプロピオン酸ヒドロコルチゾン、フランカルボン酸モメタゾン、酢酸プロピオン酸ベタメタゾン、プロピオン酸デポロドン、吉草酸ベタメタゾン、プロピオン酸ベクロメタゾン、フルオシノロンアセトニド、吉草酸酢酸プレドニゾロン、トリアムシノロンアセトニド、ピバル酸フルメタゾン、酪酸クロベタゾン、酪酸ヒドロコルチゾン、酢酸プレドニゾロン、酢酸メチルプレドニゾロン等が挙げられる。
【0103】
また、前記生体由来材料としては、例えば、EGF(epidermal growth factor)、VEGF(vascular endothelial growth factor)、HGF(hepatocyte growth factor)、PDGF(platelet derived growth factor)、bFGF(basic fibroblast growth factor)等が挙げられる。
【0104】
なお、前記生理活性物質のうち、2種類以上を混合して使用しても良い。
【0105】
上記の生理活性物質を水膨潤する高分子微粒子に含ませる方法も特に制限されず、例えば、水膨潤する高分子微粒子が分散している分散液に生理活性物質を添加し含ませる方法、水膨潤する高分子微粒子の被覆層の上に生理活性物質の溶液または分散液を塗布することにより、水膨潤する高分子微粒子に生理活性物質を含ませる方法などが挙げられる。
【実施例】
【0106】
本発明の効果を、下記の実施例および比較例を用いてさらに詳細に説明する。ただし、本発明の技術的範囲が、下記の実施例のみに制限されるわけではない。
【0107】
(製造例:乾燥時(水膨潤前)の平均粒子径が2.4μmである水膨潤する高分子微粒子の製造)
300mLのビーカーに流動パラフィン150g、およびセスキオレイン酸ソルビタン20.0gを添加し、マグネティックスターラーで攪拌し、逆相懸濁重合の連続相を調製した。窒素気流を30分間通じて、溶存酸素の除去を行った。別途、50mL容量の褐色ガラス瓶にアクリルアミド3.8g、アクリル酸ナトリウム2.2g、N,N−メチレンビスアクリルアミド0.013g、塩化ナトリウム5.4gを秤量し、蒸留水19.9gを添加、マグネティックスターラーで攪拌、溶解しモノマー水溶液を調製した。過硫酸アンモニウム0.27gを2.0gの蒸留水に溶解したものを前記モノマー水溶液に添加した後、前記連続相溶媒に全量加えた。500rpmの回転数で攪拌し、モノマー溶液を連続相溶媒中に分散させた。30分間攪拌した後40℃まで昇温し、N,N,N',N'−テトラメチルエチレンジアミン 500μLを添加した。さらに攪拌を1時間継続した後、ビーカー内容物を3Lのビーカーに移した。ジメチルスルホキシド 1Lを加え、5分間攪拌した後、吸引ろ過を行い、粉状物をろ紙上に回収した。ろ紙上の粉状物をヘキサン1000mLおよびエタノール1000mLで洗浄後、減圧乾燥した。粉状物の回収量は5.8gであった。粉状物をエタノールに分散させ、コールターカウンター(ベックマン・コールター株式会社製、品番:LS−230)にて粒子径を測定して得られた平均粒子径は2.4μmであった。
【0108】
(実施例1:平均粒子径2.4μmのpH応答性水膨潤性高分子微粒子をステンレス製のステントにコーティング(被覆率 70%))
製造例で作製した水膨潤性高分子微粒子2mgを6mLのガラス製サンプル瓶に秤取し、ヘキサンを加えて4gとし、濃度が0.05質量%である微粒子のヘキサン分散液を調製した。図3に示す形状のステント(材質:ステンレスSUS316L)を3−アミノプロピルトリエトキシシラン(KBE903、信越化学工業株式会社製)の2%エタノール溶液の中に室温(23℃)で30分間入れた後、乾燥した。次いで、先に調製した0.05質量%の微粒子のヘキサン分散液を、スプレー装置を用いてステントに噴霧し、70℃のオーブンで48時間、加熱乾燥した。縮合剤 DMT−MM(国産化学株式会社製)30mgを9gのリン酸緩衝生理食塩液に溶解した液に、水膨潤性高分子微粒子を被覆したステントを10秒間浸漬させた後、70℃のオーブンで12時間加熱乾燥し、ステントにシランカップリング剤を介して、水膨潤性高分子微粒子が結合したステントを得た。さらに、このステントを0.1N塩酸に25℃で24時間接触させた後、蒸留水で洗浄し、70℃のオーブンで12時間加熱乾燥することによって、水膨潤性高分子微粒子にpH応答性を付与させた。0.1%メチレンブルー水溶液でステントに固定された水膨潤性高分子微粒子を染色し、染色したステントをCCDカメラで撮影し、得た画像を電子ファイルとして取得し、電子ファイル上で画像処理ソフトを用いて染色された領域の面積と染色されていない領域の面積とを測定して被覆率を算出した。被覆率は70%であった。
【0109】
(実施例2:平均粒子径2.4μmのpH応答性水膨潤性高分子微粒子をステンレス製のステントにコーティング(被覆率 35%))
製造例で作製した水膨潤性高分子微粒子1mgを6mLのガラス製サンプル瓶に秤取し、ヘキサンを加えて4gとし、濃度が0.025質量%である微粒子のヘキサン分散液を調製した。図3に示す形状のステント(材質:ステンレスSUS316L)を3−アミノプロピルトリエトキシシラン(KBE903、信越化学工業株式会社製)の2%エタノール溶液の中に室温(23℃)で30分間入れた後、乾燥した。次いで、先に調製した0.025質量%の微粒子のヘキサン分散液を、スプレー装置を用いてステントに噴霧し、70℃のオーブンで48時間、加熱乾燥した。縮合剤 DMT−MM(国産化学株式会社製)30mgを9gのリン酸緩衝生理食塩液に溶解した液に、水膨潤性高分子微粒子を被覆したステントを10秒間浸漬させた後、70℃のオーブンで12時間加熱乾燥し、ステントにシランカップリング剤を介して、水膨潤性高分子微粒子が結合したステントを得た。さらに、このステントを0.1N塩酸に25℃で24時間接触させた後、蒸留水で洗浄し、70℃のオーブンで12時間加熱乾燥することによって、水膨潤性高分子微粒子にpH応答性を付与させた。水膨潤性高分子微粒子にpH応答性を付与させた。0.1%メチレンブルー水溶液でステントに固定された水膨潤性高分子微粒子を染色し、染色したステントをCCDカメラで撮影し、得た画像を電子ファイルとして取得し、電子ファイル上で画像処理ソフトを用いて染色された領域の面積と染色されていない領域の面積とを測定して被覆率を算出した。被覆率は35%であった。
【0110】
(評価1:バルーン拡張試験)
実施例1で得られたステントをバルーンカテーテルにクリンプし、リン酸緩衝生理食塩液中に5分間漬けた後、バルーンを膨らませ、ステントを拡張した。バルーンを収縮させ、ステントを取り出し、0.1%メチレンブルー水溶液に入れ、ステント表面に被覆された水膨潤性高分子微粒子を染色した。この染色したステントをCCDカメラで撮影した際の写真を図4に示す。図4から明らかなように、実施例1のステントでは、高分子微粒子の剥離片等は全く観察されなかった。
【0111】
(評価2:血小板粘着試験)
人肘静脈より3.8%クエン酸ナトリウム 1/9容を加えて採血した。1200rpmで5分間遠心分離を行い、PRP(多血小板血漿)を分離し、多項目自動血球分析装置(シスメックス株式会社製、品番:Sysmex XE−2100)にて血小板数を測定した。PRPを分離後、さらに3000rpmで10分間遠心分離を行い、PPP(乏血小板血漿)を分離した。PRPをPPPで希釈し、血小板数を105個に調整した。0.2mLの希釈PRPを、実施例1および2で得られたステント、ならびに比較例として、水膨潤する高分子微粒子が固定されていない図3に示す形状のステント(材質:ステンレスSUS316L)に滴下した。室温(23℃)で30分間放置し、リン酸緩衝生理食塩液(PBS)により、2回軽く洗浄した。1質量%グルタールアルデヒド含有PBS溶液中で、4℃で一昼夜固定した。PBSで洗浄後、乾燥した。イオンスパッタリングを行い、走査型電子顕微鏡(SEM)で観察および写真撮影(1000倍、5視野)を行った。その写真から、粘着した血小板の粘着数の算定を行った。結果を下記表1に示す。
【0112】
【表1】

【0113】
上記表1から明らかなように、実施例1および2のステントは、比較例のステントに比べて、血小板を粘着し難いことがわかった。
【符号の説明】
【0114】
1 ステント、
2 弾性線材、
21 略菱形の要素、
22 環状ユニット、
23 線状の弾性部材。
【技術分野】
【0001】
本発明はステントに関し、さらに詳細には、ステントの変形および水膨潤する高分子微粒子の膨潤が起きても、高分子微粒子が剥離しないステントに関する。
【背景技術】
【0002】
心臓疾患等の治療のため、血管内にステントを留置することが行われている。一般的にステントを構成している素材は、ステンレス、コバルト−クロム合金、ニッケル−チタン合金などの金属材料である。ステントは血管内留置後、血栓形成反応、および炎症反応を経て、平滑筋細胞の増殖や、内皮細胞層の形成といった一連の治癒プロセスが進行する。近年、ステント留置による平滑筋細胞の過剰な増殖と血管内再狭窄の防止を目的とした薬剤溶出ステントが開発され、臨床で使用されている。かような薬剤溶出ステントは、その表面が、ポリアクリル酸などのハイドロゲルポリマーで被覆されている構造を有する(例えば、特許文献1参照)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第3372950号明細書
【発明の概要】
【発明が解決しようとする課題】
【0004】
上記特許文献1に記載のステントは、その表面がハイドロゲルポリマーですべて被覆されている。このようなステントにおいては、生理的環境下(特に血管内)でステントの拡張とハイドロゲルポリマーの膨潤とが同時に起きた際、ハイドロゲルポリマー同士がぶつかり合って体積が過剰に増大する。したがって、ステントとハイドロゲルポリマーとの間にひずみが生じ、ハイドロゲルポリマーが剥離し血管内に流出するという問題があった。
【0005】
本発明は、このような従来技術が有する課題に鑑みてなされたものであり、その目的は、ステントの変形および水膨潤する高分子微粒子の膨潤が起きても、高分子微粒子がほとんど剥離しないステントを提供することにある。
【課題を解決するための手段】
【0006】
本発明者らは、上記の課題に鑑み、鋭意研究を積み重ねた。その結果、水膨潤する高分子微粒子を、金属カップリング剤を介してステントの基材の表面に斑点状に化学的に固定させることにより、上記課題が解決できることを見出し、本発明を完成させるに至った。
【0007】
すなわち、本発明は、水膨潤する高分子微粒子が表面に斑点状に化学的に固定されている、ステントである。
【発明の効果】
【0008】
本発明のステントによれば、水膨潤する高分子微粒子が、表面に斑点状に化学的に固定されているため、ステントが拡張しステントが変形しても、水膨潤した高分子微粒子にひずみは生じず、高分子微粒子の破壊や剥離はほとんど生じない。
【0009】
また、本発明のステントは、血小板の粘着が少なく、抗血栓性に優れる。
【図面の簡単な説明】
【0010】
【図1】従来のステントを表す模式図であって、(A)は拡張前のステントの模式図であり、(B)は拡張後のステントの模式図である。
【図2】本発明の一実施形態によるステントを表す模式図であって、(A)は拡張前のステントの模式図であり、(B)は拡張後のステントの模式図である。
【図3】ステントの形状の一例を示す模式図である。
【図4】実施例1で得られたステントを染色し、CCDカメラで観察した際の写真である。
【発明を実施するための形態】
【0011】
本発明のステントは、水膨潤する高分子微粒子が、基材の表面に斑点状に化学的に固定されていることを特徴とする。
【0012】
図1は、表面がハイドロゲルポリマーですべて被覆されている従来のステントを表す模式図であって、(A)は拡張前のステントの模式図であり、(B)は拡張後のステントの模式図である。図1(B)に示すように、ステントが拡張し変形すると、ステントと膨張したハイドロゲルとの間にひずみが生じ、ハイドロゲルが破壊されステントから剥離する。
【0013】
一方、図2は、本発明の一実施形態によるステントを表す模式図であって、(A)は拡張前のステントの模式図であり、(B)は拡張後のステントの模式図である。図2に示す本発明のステントにおいては、その表面に水膨潤する高分子微粒子が斑点状に化学的に固定されている。図2(B)に示すように、高分子微粒子が水膨潤し、さらにステントが拡張しステントが変形しても、高分子微粒子は斑点状に存在しているため、高分子微粒子にひずみは生じず、水膨潤した高分子微粒子の破壊や剥離はほとんど生じない。そして、水膨潤した高分子微粒子同士は非常に少ない面積で接するようになり、ステント表面は水膨潤した高分子微粒子で覆われるようになる。
【0014】
本発明で用いられる水膨潤する高分子微粒子は、好ましくはpHが7以上、より好ましくは血液のようなpH7.3〜7.6の弱アルカリ性条件下でのみ水膨潤するpH応答性水膨潤性高分子微粒子であることが好ましい。
【0015】
また、水膨潤する高分子微粒子が化学的に固定されている本発明のステントは、血小板の粘着が少なく、抗血栓性に優れる。
【0016】
また、本発明のステントは、予め金属カップリング剤がコートされていることから、水膨潤する高分子微粒子の剥離はより発生し難く、耐久性に優れる。
【0017】
以下、本発明のステントの構成について詳細に説明するが、本発明の技術的範囲は下記の形態のみに制限されない。
【0018】
(構成)
[ステントの基材、形状]
本発明のステントの基材は金属であることが好ましい。その具体的な例としては、例えば、ニッケル−チタン合金、コバルト−クロム合金、ステンレス、鉄、チタン、アルミニウム、スズ、亜鉛−タングステン合金などが挙げられる。これらのなかでも、ステントとして実績があるニッケル−チタン合金またはSUS316L等のステンレスが好ましい。
【0019】
ステントの形状も特に制限されない。例えば、図3に示す態様において、ステント1は、弾性線材2からなり、内部に切欠き部を有する略菱形の要素21を基本単位とする。複数の略菱形の要素21が、略菱形の形状がその短軸方向に連続して配置され結合することで環状ユニット22をなしている。環状ユニット22は、隣接する環状ユニットと線状の弾性部材23を介して接続されている。これにより複数の環状ユニット22が一部結合した状態でその軸方向に連続して配置される。ステント1は、このような構成により、両末端部が開口し、該両末端部の間を長手方向に延在する円筒体をなしている。ステント1は、略菱形の切欠き部を有しており、この切欠き部が変形することによって、円筒体の径方向に拡縮可能な構造になっている。
【0020】
ただし、本発明において、ステントの形状は図示した態様に限定されず、両末端部が開口し、該両末端部の間を長手方向に延在する円筒体であって、その側面上に、外側面と内側面とを連通する多数の切欠き部を有し、この切欠き部が変形することによって、円筒体の径方向に拡縮可能な構造を広く含む。
【0021】
ステントを構成する弾性線材の断面形状についても、特に限定されず、例えば矩形、円形、楕円形、矩形以外の多角形等が挙げられる。
【0022】
これらの中でも、本発明で用いられるステントとしては、略円筒形状に形成され、生体内挿入時には中心軸方向に圧縮され、生体内留置時には外方に拡張して圧縮前の形状に復元するいわゆる自己拡張型ステントであることが好ましい。
【0023】
ステントの製造方法は、特に限定されず、ステントの基材および形状に応じて、通常使用される製造方法から適宜選択すればよい。
【0024】
[金属カップリング剤]
本発明のステントは、基材となる金属の上に金属カップリング剤がコートされている。前記金属カップリング剤としては、特に制限されず、具体的な例としては、例えば、N−3−(アクリロキシ−2−ヒドロキシプロピル)−3−アミノプロピルトリエトキシシラン、3−アミノプロピルトリメトキシシラン、3−アミノプロピルトリエトキシシラン、(3−アクリロキシプロピル)ジメチルメトキシシラン、3−アニリノプロピルトリメトキシシラン、ジメチルアミノプロピルトリメトキシシラン、ジエチルアミノプロピルトリメトキシシラン、ジプロピルアミノプロピルトリメトキシシラン、ジブチルアミノプロピルトリメトキシシラン、モノブチルアミノプロピルトリメトキシシラン、ジオクチルアミノプロピルトリメトキシシラン、ジブチルアミノプロピルジメトキシシラン、ジブチルアミノプロピルモノメトキシシラン、ジメチルアミノフェニルトリエトキシシラン、(3−アクリロキシプロピル)メチルジメトキシシラン、(3−アクリロキシプロピル)トリメトキシシラン、3−(N−アリルアミノ)プロピルトリメトキシシラン、アリルジメトキシシラン、アリルトリエトキシシラン、アリルトリメトキシシラン、3−ブテニルトリエトキシシラン、2−(クロロメチル)アリルトリメトキシシラン、メタクリルアミドプロピルトリエトキシシラン、N−(3−メタクリロキシ−2−ヒドロキシプロピル)−3−アミノプロピルトリエトキシシラン、(メタクリロキシジメチル)ジメチルエトキシシラン、メタクリロキシメチルトリエトキシシラン、メタクリロキシメチルトリメトキシシラン、メタクリロキシプロピルジメチルエトキシシラン、メタクリロキシプロピルジメチルメトキシシラン、メタクリロキシプロピルメチルジエトキシシラン、メタクリロキシプロピルメチルジメトキシシラン、メタクリロキシプロピルメチルトリエトキシシラン、メタクリロキシプロピルメチルトリメトキシシラン、メタクリロキシプロピルトリス(メトキシエトキシ)シラン、メトキシジメチルビニルシラン、1−メトキシ−3−(トリメチルシロキシ)ブタジエン、スチリルエチルトリメトキシシラン、ビニルジメチルエトキシシラン、ビニルジフェニルエトキシシラン、ビニルメチルジエトキシシラン、ビニルメチルジメトキシシラン、O−(ビニロキシエチル)−N−(トリエトキシシリルプロピル)ウレタン、ビニルトリエトキシシラン、ビニルトリメトキシシラン、ビニルトリ−t−ブトキシシラン、ビニルトリイソプロポキシシシラン、ビニルトリフェノキシシラン、ビニルトリス(2−メトキシエトキシ)シランなどのシランカップリング剤;イソプロピルトリイソステアロイルチタネート、イソプロピル−n−ドデシルベンゼンスルホニルチタネート、イソプロピルトリス(ジオクチルピロホシフェート)チタネート、テトライソプロピルビス(ジオクチルホスファイト)チタネート、テトライソプロピルビス(ジトリデシルホスファイト)チタネート、テトラ(2,2−ジアリルオキシメチル−1−ブチル)ビス(ジ−トリドデシル)ホスファイトチタネート、ビス(ジオクチルピロホスフェート)オキシアセテートチタネート、ビス(ジオクチルピロホスフェート)エチレンチタネート、イソプロピルトリ(N−アミノエチル−アミノエチル)チタネートなどのチタンカップリング剤などが挙げられる。これらは単独でも、または2種以上組み合わせても用いることができる。
【0025】
これらの中でも、ステントの基材として用いられる金属と水膨潤する高分子微粒子との接着性をより強固にするという観点から、金属と化学結合を形成しうる官能基(例:アルコキシ基)と、高分子微粒子と共有結合を形成しうる官能基(例:アミノ基)とを有するカップリング剤が好ましい。具体的には、N−3−(アクリロキシ−2−ヒドロキシプロピル)−3−アミノプロピルトリエトキシシラン、3−アミノプロピルトリメトキシシラン、3−アミノプロピルトリエトキシシランなどのアミノアルキル基を有するシランカップリング剤がより好ましく、さらに好ましくは、3−アミノプロピルトリメトキシシラン、3−アミノプロピルトリエトキシシランである。
【0026】
[水膨潤する高分子微粒子]
本発明のステントは、その表面に斑点状に水膨潤する高分子微粒子が結合している形態を有する。前記水膨潤する高分子微粒子は、特に限定されず、具体的な例としては、例えば、(メタ)アクリルアミド系単量体等を重合して得られるpH応答性水膨潤性架橋高分子、ポリアクリル酸等の水溶性の単量体を重合・架橋することによって得られる高分子微粒子、高分子多糖を架橋することによって得られる高分子微粒子、アミノ酸の重合体であるポリペプチドを架橋することによって得られる高分子微粒子、水溶性高分子が環状分子を介して架橋したロタキサン構造の高分子微粒子、水溶性高分子が層状粘土化合物を介して架橋した高分子微粒子、カチオン性荷電を持った水溶性高分子とアニオン性荷電を持った水溶性高分子とが静電的に架橋することによって得られる高分子微粒子、相補的な水素結合をする水溶性高分子同士が多点的な水素結合で架橋することによって得られる高分子微粒子などが挙げられる。
【0027】
中でも、前記ステントの表面が親水性となり抗血栓性となること、また、血液中など特定のpH条件下で膨潤するという観点から、水膨潤する高分子微粒子は、(メタ)アクリルアミド系単量体(a1)に由来する構成単位および不飽和カルボン酸(a2)に由来する構成単位を含む共重合体を、架橋剤(a3)により架橋したpH応答性水膨潤性架橋高分子(A)から形成される微粒子であることが好ましい。以下、本発明の好ましい実施形態として、pH応答性水膨潤性架橋高分子(A)を詳細に説明するが、本発明の技術的範囲は下記の形態のみに制限されない。
【0028】
〔pH応答性水膨潤性架橋高分子の単量体成分〕
<(メタ)アクリルアミド系単量体(a1)>
pH応答性水膨潤性架橋高分子(A)の単量体成分である(メタ)アクリルアミド系単量体(a1)は、特に制限されない。具体的な例としては、例えば、(メタ)アクリルアミド、N−メチル(メタ)アクリルアミド、N−エチル(メタ)アクリルアミド、N−n−プロピル(メタ)アクリルアミド、N−イソプロピル(メタ)アクリルアミド、N−n−ブチル(メタ)アクリルアミド、N−イソブチル(メタ)アクリルアミド、N−s−ブチル(メタ)アクリルアミド、N−t−ブチル(メタ)アクリルアミド 、N,N−ジメチル(メタ)アクリルアミド、N−エチル−N−メチル(メタ)アクリルアミド、N,N−ジエチル(メタ)アクリルアミド、N−メチル−N−イソプロピル(メタ)アクリルアミド、N−メチル−N−n−プロピル(メタ)アクリルアミド、N−エチル−N−イソプロピル(メタ)アクリルアミド、N−エチル−N−n−プロピル(メタ)アクリルアミド、N,N−ジ−n−プロピル(メタ)アクリルアミド、ジアセトン(メタ)アクリルアミドなどが挙げられる。これら(メタ)アクリルアミド系単量体(a1)は、単独でもまたは2種以上を組み合わせても用いることができる。なお、本明細書において、(メタ)アクリル酸、(メタ)アクリルアミド等の記載は、アクリル酸およびメタクリル酸またはこれらの各誘導体を意味する。
【0029】
なかでも、整形外科領域等で使用実績があり、生体内において安全性が高い(メタ)アクリルアミドが好ましい。
【0030】
<不飽和カルボン酸(a2)>
前記pH応答性水膨潤性架橋高分子(A)の単量体成分である不飽和カルボン酸(a2)は、特に制限されず、具体的な例としては、例えば、(メタ)アクリル酸、マレイン酸、フマル酸、グルタコン酸、イタコン酸、クロトン酸、ソルビン酸などが挙げられる。また、前記不飽和カルボン酸のナトリウム塩、カリウム塩、アンモニウム塩などの塩も、pH応答性水膨潤性架橋高分子(A)の製造の際に用いることができる。不飽和カルボン酸の塩を共重合に用いた場合は、後述する酸処理を行うことにより、不飽和カルボン酸(a2)の構成単位がpH応答性水膨潤性架橋高分子(A)に導入されうる。これら不飽和カルボン酸(a2)(またはその塩)は、単独でもまたは2種以上を組み合わせても用いることができる。
【0031】
なかでも、pH7以上の中性からアルカリ性領域において膨張性を示すという観点から、(メタ)アクリル酸または(メタ)アクリル酸ナトリウムが好ましい。
【0032】
なお、上記(メタ)アクリルアミド系単量体(a1)に由来する構成単位および不飽和カルボン酸(a2)に由来する構成単位を含む共重合体の形態は、ブロック状でもよいし、ランダム状であってもよい。
【0033】
<架橋剤(a3)>
前記pH応答性水膨潤性架橋高分子(A)に用いられる架橋剤(a3)としては、特に制限されず、例えば、重合性不飽和基を2個以上有する架橋剤(イ)、重合性不飽和基と重合性不飽和基以外の反応性官能基とをそれぞれ1つずつ有する架橋剤(ロ)、重合性不飽和基以外の反応性官能基を2個以上有する架橋剤(ハ)などが挙げられる。これら架橋剤は、単独でもまたは2種以上を組み合わせても用いることができる。
【0034】
前記架橋剤(イ)のみを用いる場合は、(メタ)アクリルアミド系単量体(a1)と不飽和カルボン酸(a2)(またはその塩)との共重合を行う際に、重合系内に架橋剤(イ)を添加して共重合させればよい。前記架橋剤(ハ)のみを用いる場合は、(a1)と(a2)との共重合を行ったあとに架橋剤(ハ)を添加して、例えば加熱による後架橋を行えばよい。前記架橋剤(ロ)のみを用いる場合ならびに前記架橋剤(イ)、(ロ)、および(ハ)の2種以上を用いる場合は、(メタ)アクリルアミド系単量体(a1)と不飽和カルボン酸(a2)との共重合を行う際に重合系内に架橋剤を添加して共重合させ、さらに、例えば加熱による後架橋を行えばよい。
【0035】
重合性不飽和基を2個以上有する架橋剤(イ)の具体例としては、例えば、N,N’−メチレンビスアクリルアミド、N,N’−メチレンビスメタクリルアミド、N,N’−エチレンビスアクリルアミド、N,N’−エチレンビスメタクリルアミド、N,N’−ヘキサメチレンビスアクリルアミド、N,N’−ヘキサメチレンビスメタクリルアミド、N,N’−ベンジリデンビスアクリルアミド、N,N’−ビス(アクリルアミドメチレン)尿素、エチレングリコールジ(メタ)アクリレート、ポリエチレングリコールジ(メタ)アクリレート、プロピレングリコールジ(メタ)アクリレート、グリセリン(ジ又はトリ)アクリレート、トリメチロールプロパントリアクリレート、トリアリルアミン、トリアリルシアヌレート、トリアリルイソシアヌレート、テトラアリロキシエタン、ペンタエリスリトールトリアリルエーテル、(ポリ)エチレングリコールジ(メタ)アクリレート、(ポリ)プロピレングリコールジ(メタ)アクリレート、トリメチルロールプロパントリ(メタ)アクリレート、グリセリントリ(メタ)アクリレート、グリセリンアクリレートメタクリレート、エチレンオキサイド変性トリメチロールプロパントリ(メタ)アクリレート、ペンタエリスリトールヘキサ(メタ)アクリレート、トリアリルシアヌレート、トリアリルイソシアヌレート、トリアリルホスフェート、トリアリルアミン、ポリ(メタ)アリロキシアルカン、(ポリ)エチレングリコールジグリシジルエーテル、グリセロールジグリシジルエーテル、エチレングリコール、ポリエチレングリコール、プロピレングリコール、グリセリン、ペンタエリスリトール、エチレンジアミン、エチレンカーボネート、プロピレンカーボネート、グリシジル(メタ)アクリレート等を挙げることができる。
【0036】
重合性不飽和基と重合性不飽和基以外の反応性官能基とをそれぞれ1つずつ有する架橋剤(ロ)の具体例としては、例えば、ヒドロキシエチル(メタ)アクリレート、N−メチロール(メタ)アクリルアミド、グリシジル(メタ)アクリレート等が挙げられる。
【0037】
重合性不飽和基以外の反応性官能基を2個以上有する架橋剤(ハ)の具体例としては、例えば、多価アルコール(例えば、エチレングリコール、ジエチレングリコール、グリセリン、プロピレングリコール、トリメチロールプロパン等)、アルカノールアミン(例えば、ジエタノールアミン等)、およびポリアミン(例えば、ポリエチレンイミン等)等が挙げられる。
【0038】
これらのうち、重合性不飽和基を2個以上有する架橋剤(イ)が好ましく、N,N’−メチレンビスアクリルアミドがより好ましい。
【0039】
〔pH応答性水膨潤性架橋高分子の製造方法〕
前記pH応答性水膨潤性架橋高分子(A)の製造方法は、特に制限されないが、(メタ)アクリルアミド系単量体(a1)、不飽和カルボン酸(a2)(またはその塩)、および必要に応じて架橋剤(a3)を共重合させ、さらに必要に応じて後架橋を行うことにより製造することが好ましい。
【0040】
共重合の方法は、特に制限されず、例えば、重合開始剤を使用する溶液重合法、乳化重合法、懸濁重合法、逆相懸濁重合法、薄膜重合法、噴霧重合法など従来公知の方法を用いることができる。重合制御の方法としては、断熱重合法、温度制御重合法、等温重合法などが挙げられる。また、重合開始剤により重合を開始させる方法の他に、放射線、電子線、紫外線等を照射して重合を開始させる方法を採用することもできる。好ましくは、重合開始剤を使用した逆相懸濁重合法である。
【0041】
前記逆相懸濁重合を行なう場合の連続相の溶媒としては、n−ヘキサン、n−へプタン、n−オクタン、n−デカン、シクロヘキサン、メチルシクロヘキサン、流動パラフィン等の脂肪族系有機溶媒、トルエン、キシレン等の芳香族系有機溶媒、1,2−ジクロロエタン等のハロゲン系有機溶媒等の有機溶媒が使用できるが、ヘキサン、シクロヘキサン、流動パラフィン等の脂肪族系有機溶媒がより好ましい。なお、前記溶媒は、単独でまたは2種以上を混合して用いることもできる。
【0042】
前記連続相には、分散安定剤を添加することができる。この分散安定剤の種類や使用量を適宜選択することにより、得られるpH応答性水膨潤性高分子微粒子の粒径を制御することができる。
【0043】
前記分散安定剤の例としては、例えば、ポリオキシエチレンラウリルエーテル、ポリオキシエチレンオレイルエーテル、ポリオキシエチレンステアリルエーテル、ソルビタンセスキオレエート、ソルビタントリオレート、ソルビタンモノラウレート、ソルビタンモノオレート、ソルビタンモノパルミテート、ソルビタンモノステアレート、ソルビタントリステアレート、グリセロールモノステアレート、グリセロールモノオレエート、ステアリン酸グリセリル、カプリル酸グリセリル、ステアリン酸ソルビタン、オレイン酸ソルビタン、セスキオレイン酸ソルビタン、ヤシ脂肪酸ソルビタンなどの非イオン系界面活性剤が好適に用いられる。
【0044】
前記分散安定剤は、連続相の溶媒に対して、好ましくは0.04〜20質量%の範囲、より好ましくは1〜12質量%の範囲で用いられる。前記分散安定剤の使用量が0.04質量%未満であると、重合時に得られる重合体が凝集する場合がある。一方、20質量%を超えると、得られた微粒子の粒径のばらつきが大きくなる場合がある。
【0045】
前記逆相懸濁重合法における単量体成分の濃度は、従来公知の範囲であれば特に限定されず、例えば、2〜7質量%が好ましく、3〜5質量%がより好ましい。
【0046】
前記逆相懸濁重合法で用いられる重合開始剤としては、例えば、過硫酸カリウム、過硫酸アンモニウム、過硫酸ナトリウム等の過硫酸塩、メチルエチルケトンパーオキシド、メチルイソブチルケトンパーオキシド、ジ−t−ブチルパーオキシド、t−ブチルクミルパーオキシド、t−ブチルパーオキシアセテート、t−ブチルパーオキシイソブチレート、t−ブチルパーオキシピバレート、過酸化水素等の過酸化物、2,2’−アゾビス〔2−(N−フェニルアミジノ)プロパン〕二塩酸塩、2,2’−アゾビス〔2−(N−アリルアミジノ)プロパン〕二塩酸塩、2,2’−アゾビス{2−〔1−(2−ヒドロキシエチル)−2−イミダゾリン−2−イル〕プロパン}二塩酸塩、2,2’−アゾビス{2−メチル−N−〔1,1−ビス(ヒドロキシメチル)−2−ヒドロキシエチル〕プロピオンアミド}、2,2’−アゾビス〔2−メチル−N−(2−ヒドロキシエチル)−プロピオンアミド〕、4,4’−アゾビス(4−シアノ吉草酸)等のアゾ化合物等が挙げられ、これらは、単独で用いても2種以上を併用してもよい。これらのなかでは、入手が容易で取り扱いが容易であるという観点から、過硫酸塩が好ましく、過硫酸カリウム、過硫酸アンモニウムおよび過硫酸ナトリウムがより好ましい。
【0047】
なお、上記重合開始剤は、亜硫酸ナトリウム、亜硫酸水素ナトリウム、硫酸第一鉄、L−アスコルビン酸、N、N,N’,N’−テトラメチルエチレンジアミン等の還元剤と併用して、レドックス重合開始剤として用いることもできる。
【0048】
重合開始剤の使用量は、単量体の総量100質量部に対して、2〜6質量部が好ましく、3〜5質量部がより好ましい。前記重合開始剤の使用量が2質量部未満の場合、重合反応自体が進行しない可能性がある。一方、6質量部を超えると、得られる重合体の分子量が小さく、また粘性が大きくなるため重合体が凝集する場合がある。
【0049】
必要に応じて、共重合の際に連鎖移動剤を使用してもよい。前記連鎖移動剤の例としては、例えば、チオール類(n−ラウリルメルカプタン、メルカプトエタノール、トリエチレングリコールジメルカプタン等)、チオール酸類(チオグリコール酸、チオリンゴ酸等)、2級アルコール類(イソプロパノ−ル等)、アミン類(ジブチルアミン等)、次亜燐酸塩類(次亜燐酸ナトリウム等)等を挙げることができる。
【0050】
前記逆相懸濁重合法における重合条件は特に制限されず、例えば、重合温度は使用する触媒の種類によって適宜設定することができるが、好ましくは35〜75℃、より好ましくは40〜50℃である。重合温度が35℃未満の場合には、重合反応自体が進行しない可能性がある。一方、重合温度が70℃を超える場合には、分散媒が揮発して単量体成分の分散状態が悪くなる場合がある。重合時間は、好ましくは2時間以上である。
【0051】
重合系内の圧力は、特に限定されるものではなく、常圧(大気圧)下、減圧下、加圧下のいずれであってもよい。また、反応系内の雰囲気も、空気雰囲気であってもよいし、窒素、アルゴンなどの不活性ガス雰囲気下であってもよい。
【0052】
架橋剤(a3)として、上記の重合性不飽和基以外の反応性官能基を2個以上有する架橋剤(ハ)を用いる場合、単量体の重合反応終了後に架橋剤(ハ)を添加して後架橋を行ってもよい。
【0053】
後架橋反応を行う際の反応温度は、使用する架橋剤(a3)の種類等によっても異なるため、一概には決定できないが、通常50〜150℃である。また、反応時間は、通常1〜48時間である。
【0054】
また、共重合を行う際、単量体溶液中に造孔剤を過飽和懸濁させることによって多孔質とすることもできる。この際、単量体溶液には不溶であるが洗浄溶液には可溶である造孔剤を用いることが好ましい。造孔剤の例としては、塩化ナトリウム、塩化カリウム、氷、スクロース、または炭酸水素ナトリウムなどが好ましく挙げられ、より好ましくは塩化ナトリウムである。造孔剤の好ましい濃度は、単量体溶液中、好ましくは5〜50質量%、より好ましくは10〜30質量%の範囲である。
【0055】
このようにして得られるpH応答性水膨潤性高分子微粒子(A)は、必要に応じて、加熱乾燥、解砕等を行うことにより、本発明で用いられるpH応答性水膨潤性高分子微粒子となる。
【0056】
本発明で用いられるpH応答性水膨潤性高分子微粒子の形状は、球状、破砕状、不定形状等特に限定されるものではないが、球状であることが好ましい。
【0057】
前記pH応答性水膨潤性高分子微粒子の乾燥時の平均粒子径は、1〜10μmであることが好ましい。平均粒子径が10μmを超えると、ステントに固定した際、その表面の凹凸が大きくなって、内皮細胞の形成速度や血小板の粘着性にバラツキが出る場合がある。一方、平均粒子径が1μm未満の微粒子は、製造自体が困難な場合がある。
【0058】
上記のようなpH応答性水膨潤性高分子微粒子の形状および平均粒子径は、pH応答性水膨潤性高分子微粒子の製造条件(単量体の種類、共重合時の温度・時間、分散安定剤の量・種類等)により制御されうる。なお、本発明において、乾燥時の平均粒子径は、コールターカウンターを用いて測定した値を採用するものとする。
【0059】
かような構成を有するpH応答性水膨潤性高分子微粒子を、好ましくは0.01質量%以上0.2質量%未満の濃度でヘキサン等の溶媒に分散させた場合、ステント(金属カップリング剤)の表面に斑点状にpH応答性水膨潤性高分子微粒子を被覆することができる。
【0060】
上記のpH応答性水膨潤性高分子微粒子は、好ましくはpHが7以上、特に血液のようなpH7.3〜7.6の弱アルカリ性条件下で水膨潤する。
【0061】
前記水膨潤する高分子微粒子の乾燥時の被覆率は、好ましくは30〜85%、より好ましくは35〜70%、さらに好ましくは35〜50%である。かような範囲であれば、水膨潤する高分子微粒子の破壊や剥離はほとんど生じない。
【0062】
該被覆率は、ステントに固定された水膨潤する高分子微粒子を、例えばメチレンブルーなどの色素を用いて染色し、染色したステントをCCDカメラで撮影し、得た画像を電子ファイルとして取得し、電子ファイル上で画像処理ソフトを用いて染色された領域の面積と染色されていない領域の面積とを測定することによって算出することができる。
【0063】
(製造方法)
次に、本発明のステントの製造方法について説明する。該製造方法は特に制限されないが、(1)ステントの基材の表面を金属カップリング剤で被覆する工程と、(2)前記金属カップリング剤で被覆されたステントの基材に対して、水膨潤する高分子微粒子が0.01質量%以上0.2質量%未満の濃度で分散している分散液を噴霧する工程と、(3)前記分散液が噴霧された前記ステントの基材を加熱乾燥し、前記水膨潤する高分子微粒子の薄膜を形成する工程と、(4)前記水膨潤する高分子微粒子中の官能基と金属カップリング剤の官能基とを化学結合させる縮合剤を含む水溶液を、前記水膨潤する高分子微粒子の薄膜に含浸させた後、加熱乾燥することによって、金属カップリング剤を介して水膨潤する高分子微粒子とステントの基材との間に化学結合を形成させる工程と、を含む製造方法が好ましい。また、必要に応じて、(4)の工程の後に、(5)ステントを酸処理する工程、をさらに含んでもよい。
【0064】
以下、本発明のステントの製造方法について詳細に説明するが、以下の形態のみに制限されるものではない。
【0065】
[(1)ステントの基材の表面を金属カップリング剤で被覆する工程]
本工程では、ステントの基材の表面に金属カップリング剤を被覆する。被覆方法としては、金属カップリング剤中にステントの基材を浸漬させる方法が好ましく用いられる。
【0066】
浸漬時の温度は20〜30℃であることが好ましい。また、浸漬時間は5〜60分であることが好ましく、10〜40分であることがより好ましい。かような浸漬条件であれば、ステントの基材の表面に、ほぼ均一に金属カップリング剤を被覆させることができる。
【0067】
[(2)前記金属カップリング剤で被覆されたステントの基材に対して、水膨潤する高分子微粒子が分散している分散液を噴霧する工程]
本工程では、前記(1)の工程により、表面に金属カップリング剤が被覆されたステントの基材に対して、水膨潤する高分子微粒子が好ましくは0.01質量%以上0.2質量%未満の濃度で分散している分散液を噴霧することにより、水膨潤する高分子微粒子が斑点状にコーティングされた形態のステントを得る。
【0068】
本工程で用いられる分散液中の水膨潤する高分子微粒子の濃度は、好ましくは0.01質量%以上0.2質量%未満であり、より好ましくは0.01〜0.1質量%、さらに好ましくは0.01〜0.05質量%である。前記の濃度が0.01質量%未満の場合、分散液中の水膨潤する高分子微粒子の濃度が低くなりすぎ、ステントの表面に水膨潤する高分子微粒子を被覆すること自体が困難となる場合がある。一方、0.2質量%以上の場合、ステントの表面がすべて水膨潤する高分子微粒子で被覆され、ステントが拡張しステントが変形した際、水膨潤する高分子微粒子の破壊や剥離が生じることがある。
【0069】
分散液に用いられる溶媒は特に制限されず、例えば、水、アセトン、メタノール、ヘキサン等が挙げられる。
【0070】
噴霧方法としては、例えば、スプレー装置を用いて噴霧する方法が用いられる。
【0071】
[(3)前記分散液が噴霧された前記ステントの基材を加熱乾燥し、前記水膨潤する高分子微粒子の薄膜を形成する工程]
前記(2)の工程により、水膨潤する高分子微粒子が斑点状にコーティングされた形態であるステントは、本工程において加熱乾燥され、水膨潤する高分子微粒子の被覆層が形成される形態となる。
【0072】
本工程における乾燥温度は、40〜80℃であることが好ましく、50〜60℃であることがより好ましい。乾燥温度が40℃未満の場合、溶媒が十分に蒸発しない可能性がある。一方、80℃を超える場合、被膜に亀裂・ひびが入る可能性がある。
【0073】
本工程に用いられる乾燥装置は通常用いられる装置でよく、例えば、オーブン、熱風乾燥機等が挙げられる。これらの乾燥装置は、複数個を組み合わせて使用することもできる。
【0074】
[(4)金属カップリング剤を介して水膨潤する高分子微粒子とステントの基材との間に化学結合を形成させる工程]
本工程では、前記水膨潤する高分子微粒子中の官能基と金属カップリング剤の官能基とを化学結合させる縮合剤を含む水溶液を、前記(3)の工程で形成された水膨潤する高分子微粒子の薄膜に含浸させた後、加熱乾燥することによって、金属カップリング剤を介して水膨潤する高分子微粒子とステントの基材との間に化学結合を形成させる。
【0075】
本工程で用いられる縮合剤の溶液の溶媒は水であるが、リン酸緩衝液なども好適に用いられる。例えば、リン酸緩衝液中で反応を行う場合、リン酸緩衝液は、pHの範囲が好ましくは7.4〜7.8となるように調製する。
【0076】
前記縮合剤の具体的な例としては、例えば、N−エチル−N’−(3−ジエチルアミノプロピル)カルボジイミド、N,N’−ジシクロヘキシルカルボジイミド、1−メチル−2−ブロモピリジニウムヨージド、N,N’−カルボニルジイミダゾール、ジフェニルホスホリルアジド、ベンゾトリアゾール−1−イルオキシトリス(ジメチルアミノ)ホスホニウムヘキサフルオロホスフェート(BOP)、4−(4,6−ジメトキシ[1.3.5]トリアジン−2−イル)−4−メチルモルホリニウムクロリド(DMT−MM)、フルオロ−N,N,N’,N’−テトラメチルホルムアミジニウムヘキサフルオロホスフェート(TFFH)等が挙げられる。これら縮合剤は、単独でまたは2種以上混合して用いることができる。
【0077】
前記縮合剤の使用量は、例えば前記水膨潤する高分子微粒子がカルボキシル基を有している場合、前記カルボキシル基の総量1モルに対して1モルであることが好ましい。
【0078】
前記縮合剤を含む水溶液を、水膨潤する高分子微粒子の薄膜に含浸させる際の温度は、好ましくは15〜40℃であり、より好ましくは20〜30℃である。
【0079】
化学結合を形成させる際の加熱温度は、好ましくは40〜80℃であり、より好ましくは40〜60℃である。加熱温度が40℃未満の場合には、化学結合はされるが被膜が十分に乾燥されない可能性がある。一方、加熱温度が80℃を超える場合、被膜に亀裂・ひびが入る可能性がある。
【0080】
化学結合を形成させる際に用いられる加熱装置は、特に限定されず、例えば、オーブンなどの装置が挙げられる。
【0081】
[(5)酸処理する工程]
共重合の際に不飽和カルボン酸(a2)の塩を用いた場合、前記(4)の工程後に酸処理を行い、水膨潤する高分子微粒子のカルボン酸塩の部分をカルボキシル基に変換しておいてもよい。かような処理を行うことにより、本発明で用いられる水膨潤する高分子微粒子が、pH選択的に膨潤・収縮する、pH応答性を有するようになる。酸処理の条件は特に限定されず、例えば、塩酸水溶液などの低pH水溶液中で、好ましくは15〜60℃の温度範囲で、好ましくは1〜24時間処理すればよい。
【0082】
酸処理を行った場合は、酸処理終了後に加熱乾燥を行うことが好ましい。この際、乾燥温度は、好ましくは40〜80℃、より好ましくは40〜60℃の範囲である。乾燥温度が40℃未満の場合には、酸処理はされるが被膜が十分に乾燥されない可能性がある。一方、乾燥温度が80℃を超える場合、被膜に亀裂・ひびが入る可能性がある。
【0083】
本工程に用いられる乾燥装置も、前記(3)の工程と同様に、例えば、オーブン、熱風乾燥機などの通常用いられる装置でよい。これらの乾燥装置は、複数個を組み合わせて使用することもできる。
【0084】
本発明のステントにおいては、前記水膨潤する高分子微粒子がさらに生理活性物質を含んでいてもよい。前記生理活性物質としては、血栓もしくは血栓複合物の融解もしくは代謝を促進する物質、血栓もしくは血栓複合物の増加を抑制する物質、内膜肥厚を抑制する物質、内皮化を促進する物質、および不安定プラークの安定化を促す物質からなる群より選択される少なくとも1種であることが好ましい。
【0085】
血栓もしくは血栓複合物の融解もしくは代謝を促進する物質としては、例えば、ストレプトキナーゼ、プラスミノーゲンアクチベーター、ウロキナーゼ、スタフィノキナーゼ、ルンブロキナーゼ、ナットウキナーゼ、もしくはそれらの類似体等が挙げられる。
【0086】
血栓もしくは血栓複合物の増加を抑制する物質としては、例えば、アセチルサリチル酸、チクロピジン、ジピリダモール、シロスタゾール、ベラプロストNa、リマプロストアルファテクス、イコサペントエン酸エチル、塩酸サルボグレラート、トラピジル、クロピドグレル、プラスグレル及びその類似体に代表される抗血小板薬、もしくはGP IIb/IIIa拮抗剤、ヘパリン、ワルファリンカリウム等の抗凝固薬が挙げられる。
【0087】
内膜肥厚を抑制する物質としては、例えば、抗癌剤、免疫抑制剤、抗生物質、抗リウマチ剤、抗血栓薬、HMG−CoA還元酵素阻害剤、ACE阻害剤、カルシウム拮抗剤、抗高脂血症剤、抗炎症剤、インテグリン阻害薬、抗アレルギー剤、抗酸化剤、GP IIb/IIIa拮抗剤、レチノイド、フラボノイド、カロチノイド、脂質改善薬、DNA合成阻害剤、チロシンキナーゼ阻害剤、抗血小板薬、血管平滑筋増殖抑制薬、生体由来材料、インターフェロン、遺伝子工学により生成される上皮細胞等が挙げられる。
【0088】
内皮化を促進する物質もしくは不安定プラークの安定化を促す物質としては、例えば、抗血栓薬、HMG−CoA還元酵素阻害剤、ACE阻害剤、カルシウム拮抗剤、抗高脂血症剤、抗炎症剤、インテグリン阻害薬、抗アレルギー剤、抗酸化剤、GP IIb/IIIa拮抗剤、レチノイド、フラボノイド、カロチノイド、脂質改善薬、DNA合成阻害剤、チロシンキナーゼ阻害剤、抗血小板薬、生体由来材料、インターフェロンおよび遺伝子工学により生成される上皮細胞等が挙げられる。
【0089】
そして、前記抗癌剤としては、例えば、ビンクリスチン、ビンブラスチン、ビンデシン、イリノテカン、ピラルビシン、パクリタキセル、ドセタキセル、メトトレキサート等が挙げられる。
【0090】
また、前記免疫抑制剤としては、例えば、シロリムス、タクロリムス、アザチオプリン、シクロスポリン、シクロホスファミド、ミコフェノール酸モフェチル、グスペリムス、ミゾリビン等が挙げられる。
【0091】
また、前記抗生物質としては、例えば、マイトマイシン、アドリアマイシン、ドキソルビシン、アクチノマイシン、ダウノルビシン、イダルビシン、ピラルビシン、アクラルビシン、エピルビシン、ペプロマイシン、ジノスタチンスチマラマー等が挙げられる。
【0092】
また、前記抗リウマチ剤としては、例えば、メトトレキサート、チオリンゴ酸ナトリウム、ペニシラミン、ロベンザリット等が挙げられる。
【0093】
また、前記抗血栓薬としては、例えば、ヘパリン、アスピリン、抗トロンビン製剤、チクロピジン、ヒルジン等が挙げられる。
【0094】
また、前記HMG−CoA還元酵素阻害剤としては、例えば、セリバスタチン、セリバスタチンナトリウム、アトルバスタチン、ニスバスタチン、イタバスタチン、フルバスタチン、フルバスタチンナトリウム、シンバスタチン、ロバスタチン、プラバスタチン等が挙げられる。
【0095】
また、前記ACE阻害剤としては、例えば、キナプリル、ペリンドプリルエルブミン、トランドラプリル、シラザプリル、テモカプリル、デラプリル、マレイン酸エナラプリル、リシノプリル、カプトプリル等が挙げられる。
【0096】
また、前記カルシウム拮抗剤としては、例えば、ニフェジピン、ニルバジピン、ジルチアゼム、ベニジピン、ニソルジピン等が挙げられる。
【0097】
また、前記抗高脂血症剤としては、例えば、プロブコールが挙げられる。
【0098】
また、前記抗アレルギー剤としては、例えば、トラニラストが挙げられる。
【0099】
また、前記レチノイドとしては、例えば、オールトランスレチノイン酸が挙げられる。
【0100】
また、前記フラボノイドおよび前記カロチノイドとしては、例えば、カテキン類、特にエピガロカテキンガレート、アントシアニン、プロアントシアニジン、リコピン、β−カロチン等が挙げられる。
【0101】
また、チロシンキナーゼ阻害剤としては、例えば、ゲニステイン、チルフォスチン、アーブスタチン等が挙げられる。
【0102】
また、前記抗炎症剤としては、例えば、サリチル酸、アスピリン、アセトアミノフェン、フェナチセン、インドメタシン、ジクロフェナクナトリウム、ピロキシカム、フェノプロフェンカルシウム、イブプロフェン、マレイン酸クロルフェニラミン、ジフルニサル、デキサメタゾン、プロピオン酸クロベタゾール、酢酸ジフロラゾン、ジフルプレドナート、ジプロピオン酸ベタメタゾン、吉草酸ジフルコルトロン、ブデソニド、フルオシノニド、アムシノニド、ハルシノニド、酪酸ジプロピオン酸ヒドロコルチゾン、フランカルボン酸モメタゾン、酢酸プロピオン酸ベタメタゾン、プロピオン酸デポロドン、吉草酸ベタメタゾン、プロピオン酸ベクロメタゾン、フルオシノロンアセトニド、吉草酸酢酸プレドニゾロン、トリアムシノロンアセトニド、ピバル酸フルメタゾン、酪酸クロベタゾン、酪酸ヒドロコルチゾン、酢酸プレドニゾロン、酢酸メチルプレドニゾロン等が挙げられる。
【0103】
また、前記生体由来材料としては、例えば、EGF(epidermal growth factor)、VEGF(vascular endothelial growth factor)、HGF(hepatocyte growth factor)、PDGF(platelet derived growth factor)、bFGF(basic fibroblast growth factor)等が挙げられる。
【0104】
なお、前記生理活性物質のうち、2種類以上を混合して使用しても良い。
【0105】
上記の生理活性物質を水膨潤する高分子微粒子に含ませる方法も特に制限されず、例えば、水膨潤する高分子微粒子が分散している分散液に生理活性物質を添加し含ませる方法、水膨潤する高分子微粒子の被覆層の上に生理活性物質の溶液または分散液を塗布することにより、水膨潤する高分子微粒子に生理活性物質を含ませる方法などが挙げられる。
【実施例】
【0106】
本発明の効果を、下記の実施例および比較例を用いてさらに詳細に説明する。ただし、本発明の技術的範囲が、下記の実施例のみに制限されるわけではない。
【0107】
(製造例:乾燥時(水膨潤前)の平均粒子径が2.4μmである水膨潤する高分子微粒子の製造)
300mLのビーカーに流動パラフィン150g、およびセスキオレイン酸ソルビタン20.0gを添加し、マグネティックスターラーで攪拌し、逆相懸濁重合の連続相を調製した。窒素気流を30分間通じて、溶存酸素の除去を行った。別途、50mL容量の褐色ガラス瓶にアクリルアミド3.8g、アクリル酸ナトリウム2.2g、N,N−メチレンビスアクリルアミド0.013g、塩化ナトリウム5.4gを秤量し、蒸留水19.9gを添加、マグネティックスターラーで攪拌、溶解しモノマー水溶液を調製した。過硫酸アンモニウム0.27gを2.0gの蒸留水に溶解したものを前記モノマー水溶液に添加した後、前記連続相溶媒に全量加えた。500rpmの回転数で攪拌し、モノマー溶液を連続相溶媒中に分散させた。30分間攪拌した後40℃まで昇温し、N,N,N',N'−テトラメチルエチレンジアミン 500μLを添加した。さらに攪拌を1時間継続した後、ビーカー内容物を3Lのビーカーに移した。ジメチルスルホキシド 1Lを加え、5分間攪拌した後、吸引ろ過を行い、粉状物をろ紙上に回収した。ろ紙上の粉状物をヘキサン1000mLおよびエタノール1000mLで洗浄後、減圧乾燥した。粉状物の回収量は5.8gであった。粉状物をエタノールに分散させ、コールターカウンター(ベックマン・コールター株式会社製、品番:LS−230)にて粒子径を測定して得られた平均粒子径は2.4μmであった。
【0108】
(実施例1:平均粒子径2.4μmのpH応答性水膨潤性高分子微粒子をステンレス製のステントにコーティング(被覆率 70%))
製造例で作製した水膨潤性高分子微粒子2mgを6mLのガラス製サンプル瓶に秤取し、ヘキサンを加えて4gとし、濃度が0.05質量%である微粒子のヘキサン分散液を調製した。図3に示す形状のステント(材質:ステンレスSUS316L)を3−アミノプロピルトリエトキシシラン(KBE903、信越化学工業株式会社製)の2%エタノール溶液の中に室温(23℃)で30分間入れた後、乾燥した。次いで、先に調製した0.05質量%の微粒子のヘキサン分散液を、スプレー装置を用いてステントに噴霧し、70℃のオーブンで48時間、加熱乾燥した。縮合剤 DMT−MM(国産化学株式会社製)30mgを9gのリン酸緩衝生理食塩液に溶解した液に、水膨潤性高分子微粒子を被覆したステントを10秒間浸漬させた後、70℃のオーブンで12時間加熱乾燥し、ステントにシランカップリング剤を介して、水膨潤性高分子微粒子が結合したステントを得た。さらに、このステントを0.1N塩酸に25℃で24時間接触させた後、蒸留水で洗浄し、70℃のオーブンで12時間加熱乾燥することによって、水膨潤性高分子微粒子にpH応答性を付与させた。0.1%メチレンブルー水溶液でステントに固定された水膨潤性高分子微粒子を染色し、染色したステントをCCDカメラで撮影し、得た画像を電子ファイルとして取得し、電子ファイル上で画像処理ソフトを用いて染色された領域の面積と染色されていない領域の面積とを測定して被覆率を算出した。被覆率は70%であった。
【0109】
(実施例2:平均粒子径2.4μmのpH応答性水膨潤性高分子微粒子をステンレス製のステントにコーティング(被覆率 35%))
製造例で作製した水膨潤性高分子微粒子1mgを6mLのガラス製サンプル瓶に秤取し、ヘキサンを加えて4gとし、濃度が0.025質量%である微粒子のヘキサン分散液を調製した。図3に示す形状のステント(材質:ステンレスSUS316L)を3−アミノプロピルトリエトキシシラン(KBE903、信越化学工業株式会社製)の2%エタノール溶液の中に室温(23℃)で30分間入れた後、乾燥した。次いで、先に調製した0.025質量%の微粒子のヘキサン分散液を、スプレー装置を用いてステントに噴霧し、70℃のオーブンで48時間、加熱乾燥した。縮合剤 DMT−MM(国産化学株式会社製)30mgを9gのリン酸緩衝生理食塩液に溶解した液に、水膨潤性高分子微粒子を被覆したステントを10秒間浸漬させた後、70℃のオーブンで12時間加熱乾燥し、ステントにシランカップリング剤を介して、水膨潤性高分子微粒子が結合したステントを得た。さらに、このステントを0.1N塩酸に25℃で24時間接触させた後、蒸留水で洗浄し、70℃のオーブンで12時間加熱乾燥することによって、水膨潤性高分子微粒子にpH応答性を付与させた。水膨潤性高分子微粒子にpH応答性を付与させた。0.1%メチレンブルー水溶液でステントに固定された水膨潤性高分子微粒子を染色し、染色したステントをCCDカメラで撮影し、得た画像を電子ファイルとして取得し、電子ファイル上で画像処理ソフトを用いて染色された領域の面積と染色されていない領域の面積とを測定して被覆率を算出した。被覆率は35%であった。
【0110】
(評価1:バルーン拡張試験)
実施例1で得られたステントをバルーンカテーテルにクリンプし、リン酸緩衝生理食塩液中に5分間漬けた後、バルーンを膨らませ、ステントを拡張した。バルーンを収縮させ、ステントを取り出し、0.1%メチレンブルー水溶液に入れ、ステント表面に被覆された水膨潤性高分子微粒子を染色した。この染色したステントをCCDカメラで撮影した際の写真を図4に示す。図4から明らかなように、実施例1のステントでは、高分子微粒子の剥離片等は全く観察されなかった。
【0111】
(評価2:血小板粘着試験)
人肘静脈より3.8%クエン酸ナトリウム 1/9容を加えて採血した。1200rpmで5分間遠心分離を行い、PRP(多血小板血漿)を分離し、多項目自動血球分析装置(シスメックス株式会社製、品番:Sysmex XE−2100)にて血小板数を測定した。PRPを分離後、さらに3000rpmで10分間遠心分離を行い、PPP(乏血小板血漿)を分離した。PRPをPPPで希釈し、血小板数を105個に調整した。0.2mLの希釈PRPを、実施例1および2で得られたステント、ならびに比較例として、水膨潤する高分子微粒子が固定されていない図3に示す形状のステント(材質:ステンレスSUS316L)に滴下した。室温(23℃)で30分間放置し、リン酸緩衝生理食塩液(PBS)により、2回軽く洗浄した。1質量%グルタールアルデヒド含有PBS溶液中で、4℃で一昼夜固定した。PBSで洗浄後、乾燥した。イオンスパッタリングを行い、走査型電子顕微鏡(SEM)で観察および写真撮影(1000倍、5視野)を行った。その写真から、粘着した血小板の粘着数の算定を行った。結果を下記表1に示す。
【0112】
【表1】

【0113】
上記表1から明らかなように、実施例1および2のステントは、比較例のステントに比べて、血小板を粘着し難いことがわかった。
【符号の説明】
【0114】
1 ステント、
2 弾性線材、
21 略菱形の要素、
22 環状ユニット、
23 線状の弾性部材。
【特許請求の範囲】
【請求項1】
水膨潤する高分子微粒子が表面に斑点状に化学的に固定されている、ステント。
【請求項2】
前記水膨潤する高分子微粒子の乾燥時における被覆率が30〜85%である、請求項1に記載のステント。
【請求項3】
前記水膨潤する高分子微粒子の乾燥時の平均粒子径が1〜10μmである、請求項1または2に記載のステント。
【請求項4】
前記水膨潤する高分子微粒子が、pHが7以上の条件下で水膨潤するpH応答性水膨潤性高分子微粒子である、請求項1〜3のいずれか1項に記載のステント。
【請求項5】
前記pH応答性水膨潤性高分子微粒子が、(メタ)アクリルアミド系単量体(a1)に由来する構成単位および不飽和カルボン酸(a2)に由来する構成単位を含む共重合体を、架橋剤(a3)により架橋したpH応答性水膨潤性架橋高分子(A)から形成される微粒子である、請求項4に記載のステント。
【請求項6】
前記水膨潤する高分子微粒子が、さらに生理活性物質を含む、請求項1〜5のいずれか1項に記載のステント。
【請求項7】
前記生理活性物質が、血栓もしくは血栓複合物の融解もしくは代謝を促進する物質、血栓もしくは血栓複合物の増加を抑制する物質、内膜肥厚を抑制する物質、内皮化を促進する物質、および不安定プラークの安定化を促す物質からなる群より選択される少なくとも1種である、請求項6に記載のステント。
【請求項1】
水膨潤する高分子微粒子が表面に斑点状に化学的に固定されている、ステント。
【請求項2】
前記水膨潤する高分子微粒子の乾燥時における被覆率が30〜85%である、請求項1に記載のステント。
【請求項3】
前記水膨潤する高分子微粒子の乾燥時の平均粒子径が1〜10μmである、請求項1または2に記載のステント。
【請求項4】
前記水膨潤する高分子微粒子が、pHが7以上の条件下で水膨潤するpH応答性水膨潤性高分子微粒子である、請求項1〜3のいずれか1項に記載のステント。
【請求項5】
前記pH応答性水膨潤性高分子微粒子が、(メタ)アクリルアミド系単量体(a1)に由来する構成単位および不飽和カルボン酸(a2)に由来する構成単位を含む共重合体を、架橋剤(a3)により架橋したpH応答性水膨潤性架橋高分子(A)から形成される微粒子である、請求項4に記載のステント。
【請求項6】
前記水膨潤する高分子微粒子が、さらに生理活性物質を含む、請求項1〜5のいずれか1項に記載のステント。
【請求項7】
前記生理活性物質が、血栓もしくは血栓複合物の融解もしくは代謝を促進する物質、血栓もしくは血栓複合物の増加を抑制する物質、内膜肥厚を抑制する物質、内皮化を促進する物質、および不安定プラークの安定化を促す物質からなる群より選択される少なくとも1種である、請求項6に記載のステント。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−235797(P2012−235797A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2009−217285(P2009−217285)
【出願日】平成21年9月18日(2009.9.18)
【出願人】(000109543)テルモ株式会社 (2,232)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成21年9月18日(2009.9.18)
【出願人】(000109543)テルモ株式会社 (2,232)
【Fターム(参考)】
[ Back to top ]

