ストレス測定方法
【課題】 より高感度に生体のストレスを測定する。
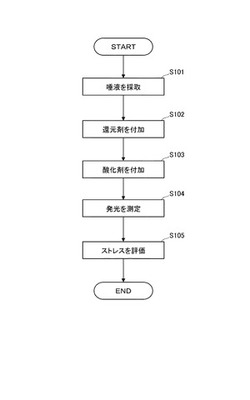
【解決手段】 本発明に係るストレス測定方法は、生体の唾液を採取して唾液サンプルとする唾液採取工程(S101)と、唾液サンプルに還元剤を加える還元剤付加工程(S102)と、唾液サンプルに酸化剤を加える酸化剤付加工程(S103)と、還元剤付加工程において還元剤が加えられ、酸化剤付加工程において酸化剤が加えられた唾液サンプルの化学発光をチオシアン酸イオンの濃度の指標として測定する発光測定工程(S104)と、チオシアン酸イオンの濃度から、所定の基準に基づいて生体のストレスを評価するストレス評価工程(S105)と、を含む。
【解決手段】 本発明に係るストレス測定方法は、生体の唾液を採取して唾液サンプルとする唾液採取工程(S101)と、唾液サンプルに還元剤を加える還元剤付加工程(S102)と、唾液サンプルに酸化剤を加える酸化剤付加工程(S103)と、還元剤付加工程において還元剤が加えられ、酸化剤付加工程において酸化剤が加えられた唾液サンプルの化学発光をチオシアン酸イオンの濃度の指標として測定する発光測定工程(S104)と、チオシアン酸イオンの濃度から、所定の基準に基づいて生体のストレスを評価するストレス評価工程(S105)と、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体のストレスを測定するストレス測定方法に関する。
【背景技術】
【0002】
従来から、健康状態や精神状態の把握、また、その他医療上の目的からストレスの測定や判定が行われている。下記の特許文献1では、簡便かつ容易にストレスの測定を可能とするものとして、唾液中のアミラーゼ活性を指標としてストレスの測定を行なうことが提案されている。
【特許文献1】特開2002−168860号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、唾液中のアミラーゼ活性は、弱いストレッサーに対してはあまり敏感ではないという問題点がある。従って、特許文献1の方法では、弱いストレスを検出することができず、また、ストレスの度合についても正しく測定することができなかった。即ち、特許文献1の方法では、ストレスを十分な感度で検出及び測定することができなかった。
【0004】
本発明は、以上の問題点を解決するためになされたものであり、より高感度に生体のストレスを測定することができるストレス測定方法を提供することを目的とする。
【課題を解決するための手段】
【0005】
本願発明者は、上記目的を達成すべく鋭意研究を重ねた結果、生体へのストレスに応じて、当該生体の唾液中のチオシアン酸イオンの濃度が高い感度で変化することを見出した。即ち、生体へのストレスが大きくなると、当該生体の唾液中のチオシアン酸イオンの濃度が、ストレスに対して高感度で高くなる。この知見に基づいて、本願発明者は本発明を完成するに至った。
【0006】
上記目的を達成するために、本発明に係るストレス測定方法は、生体の唾液を採取して唾液サンプルとする唾液採取工程と、唾液サンプルに含まれるチオシアン酸イオンの濃度を評価する指標物質評価工程と、指標物質評価工程により評価されたチオシアン酸イオンの濃度から、所定の基準に基づいて生体のストレスを評価するストレス評価工程と、を含むストレス測定方法であることを特徴とする。
【0007】
本発明に係るストレス測定方法では、ストレスの測定対象の生体から唾液が採取されて、採取された唾液サンプルに含まれるチオシアン酸イオン(チオシアネートイオン:SCN−)の濃度が評価されて、チオシアン酸イオンの濃度に基づいて生体のストレスが評価される。本発明に係るストレス測定方法によれば、ストレスに対して高い感度を有するチオシアン酸イオンの濃度を指標としてストレスを評価することによって、より高感度に生体のストレスを測定することができる。
【0008】
指標物質評価工程は、唾液サンプルに還元剤を加える還元剤付加工程と、唾液サンプルに酸化剤を加える酸化剤付加工程と、還元剤付加工程において還元剤が加えられ、酸化剤付加工程において酸化剤が加えられた唾液サンプルの化学発光をチオシアン酸イオンの濃度の指標として測定する発光測定工程と、を含むことが望ましい。チオシアン酸イオンは、酸化剤及び還元剤を加えることにより化学発光する。また、チオシアン酸イオンの濃度が多くなると化学発光の発光が強くなるなど、チオシアン酸イオンの濃度に応じて化学発光の発光量が変化する。従って、上記の構成のように、化学発光をチオシアン酸イオンの濃度の指標として測定することにより、本発明によるストレスの評価を行うことが可能となる。即ち、この構成によれば、唾液を採取し、採取した唾液サンプルの発光を計測するという、高感度かつ簡易な方法で生体のストレスを測定することができる。
【0009】
還元剤付加工程において付加する還元剤は、没食子酸を含むことが望ましい。酸化剤付加工程において付加する酸化剤は、過酸化水素を含むことが望ましい。これらの構成によれば、確実に化学発光を生じさせることができるので、本発明を確実に実施することができる。
【0010】
指標物質評価工程は、唾液サンプルに、当該唾液サンプルに含まれるチオシアン酸イオンと反応して発色する試薬を加える試薬付加工程と、発色剤付加工程において試薬が加えられた唾液サンプルの吸光度をチオシアン酸イオンの濃度の指標として測定する吸光度測定工程と、を含むことが望ましい。この構成によれば、チオシアン酸イオンの濃度を確実に評価することができるので、高感度かつ確実に生体のストレスを測定することができる。
【発明の効果】
【0011】
本発明によれば、ストレスに対して高い感度を有するチオシアン酸イオンの濃度を指標としてストレスを評価することによって、より高感度に生体のストレスを測定することができる。
【発明を実施するための最良の形態】
【0012】
以下、図面と共に本発明によるストレス測定方法の好適な実施形態について詳細に説明する。なお、図面の説明においては同一要素には同一符号を付し、重複する説明を省略する。また、図面の寸法比率は、説明のものと必ずしも一致しない。
【0013】
[第1実施形態]
図1は、第1実施形態に係るストレス測定方法に用いられるストレス測定システム10の機能構成図である。ストレス測定システム10は、被験者(生体)から採取された唾液に含まれるチオシアン酸イオンの発光現象を利用して被験者のストレスを測定(判定)するものである。具体的には、本システム10は、唾液サンプル設置部11と、還元剤付加部12と、酸化剤付加部13と、発光測定部14と、ストレス評価部15とを含んで構成されている。
【0014】
唾液サンプル設置部11は、発光測定の対象となる生体の唾液を含む唾液サンプルを設置する設置手段である。唾液サンプルとしては、液状物質の吸収及び保持が可能な吸収材を利用し、この吸収材に生体の唾液を吸収及び保持したものが用いられる。吸収材としては、好ましくはろ紙が用いられる。あるいは、ろ紙以外のもの、例えばスポンジ等を用いることとしても良い。
【0015】
唾液サンプル設置部11に設置された唾液サンプルに対し、測定システム10には、還元剤付加部12、及び酸化剤付加部13が設けられている。還元剤付加部12は、唾液サンプルに還元剤を加える。また、酸化剤付加部13は、唾液サンプルに酸化剤を加える。これらの還元剤及び酸化剤は、唾液サンプルで化学発光を生じさせるために用いられる。還元剤としては例えば、没食子酸を含むものを用いるのが好ましい。また、酸化剤としては例えば、過酸化水素を含むものを用いるのが好ましい。これらの構成によれば、確実に化学発光を生じさせることができるので、本発明を確実に実施することができる。
【0016】
発光測定部14は、唾液サンプル設置部11に対して所定位置に設けられており、唾液サンプル設置部11に設置された唾液サンプルの化学発光を測定する。また、発光測定部14で測定された化学発光データは、ストレス評価部15に入力されている。ストレス評価部15は、測定された化学発光データを参照し、所定の基準に基づいてストレスを評価する。なお、所定の基準とは、化学発光データからストレスの測定を可能とする基準であり、具体的な内容については後述する。
【0017】
図2は、図1に示した実施形態のストレス測定システム10における、具体的装置構成の一例を示す。図2に示す構成例においては、ストレス測定システム10は、シャーレ10aと、還元剤付加用シリンジ10bと、酸化剤付加用シリンジ10cと、光電子増倍管10dと、暗箱10eと、フォトンカウンタ10fと、情報処理装置10gとの各装置を含んで構成されている。
【0018】
シャーレ10aは、唾液サンプル20を設置するためのものであり、唾液サンプル設置部11に相当する。還元剤付加用シリンジ10bは、液体物質を吐出する装置であり、液体の還元剤をシャーレ10aに設置された唾液サンプル20に付加するためのものである。即ち、還元剤付加用シリンジ10bは、図1における還元剤付加部12の機能を実現する。また、酸化剤付加用シリンジ10cも構造は還元剤付加用シリンジ10b同様であり、液体の酸化剤をシャーレ10aに設置された唾液サンプル20に付加するためのものである。即ち、酸化剤付加用シリンジ10cは、図1における酸化剤付加部13の機能を実現する。なお、還元剤付加用シリンジ10b及び酸化剤付加用シリンジ10cは、情報処理装置10gにより、還元剤及び酸化剤の唾液サンプル20に対する吐出の量やタイミングなどが制御される構成とするのが好ましい。
【0019】
光電子増倍管10dは、シャーレ10aに設置された唾液サンプル20の発光、即ち還元剤、酸化剤と唾液サンプル20に含まれるチオシアン酸イオンとの酸化還元反応の結果生じるフォトン(光子)を検出する。暗箱10eは、シャーレ10aでの微弱な発光を検出するために、外部からの光を遮断し、シャーレ10a及び光電子増倍管10dの周囲を暗くするために設けられている。このような構成において、光電子増倍管10dにより検知されたフォトンに対応して出力された検出信号が、計数回路などから構成されたフォトンカウンタ10fによりカウントされる。これにより、シャーレ10aからの化学発光が計測され、化学発光データが取得される。光電子増倍管10d、及びフォトンカウンタ10fは、図1における発光測定部14の機能を実現する。
【0020】
フォトンカウンタ10fにより測定された化学発光データは情報処理装置10gに送信される。情報処理装置10gは、CPU及びメモリなどから構成され、ストレスを評価するための所定の基準を記憶しており、ストレスを評価するための演算などを行う。情報処理装置10gは、受信した化学発光データを参照し、所定の基準に基づいて被験者のストレスを評価する。これにより、情報処理装置10gは、図1におけるストレス評価部15の機能を実現する。また、この情報処理装置10gは、ストレス評価以外の機能、例えば測定システム10の各部の制御機能などを併せて有していても良い。
【0021】
なお、各装置には必要に応じて電源が備えられており、動作に必要な電力が供給される。また、情報処理装置10gに対しては、キーボードやマウスなどの入力装置、CRTディスプレイや液晶ディスプレイなどの表示装置などが、必要に応じて接続される。入力装置は、ストレス測定実行の指示情報や、測定条件の情報などの入力に用いることができる。また、表示装置は、ストレスの測定結果や、測定の実行状況などの表示に用いることができる。
【0022】
次に、図1及び図2に示したストレス測定システム10を用いた本発明によるストレス測定方法について、図3に示すフローチャートを参照しつつ説明する。
【0023】
まず、唾液採取用のチューブ(例えば、サリベット(商品名))を用いて、被験者の口中から唾液を採取する。採取した唾液を、ろ紙やスポンジ等の吸収材に含ませて、唾液サンプル20とする(ステップS101、唾液採取工程)。唾液サンプル20は、シャーレ10a上に設置される。
【0024】
続いて、以下のように唾液サンプルに含まれるチオシアン酸イオンの濃度を評価する(ステップS102〜S104、指標物質評価工程)。まず、還元剤付加用シリンジ10bを用いて、唾液サンプル20に没食子酸等の還元剤を加える(ステップS102、還元剤付加工程)。また、酸化剤付加用シリンジ10cを用いて、唾液サンプル20に過酸化水素等の酸化剤を加える(ステップS103、酸化剤付加工程)。なお、各シリンジ10b、10cには、それぞれ予め必要量の還元剤、酸化剤を入れておくものとする。また、還元剤を唾液サンプル20に加える処理までは、測定対象となる唾液サンプル20からの化学発光はほとんど生じないので、必ずしも暗箱10e内で行う必要はない。
【0025】
還元剤及び酸化剤が加えられた唾液サンプル20では、唾液中に含まれ被験者のストレスに応じた濃度となるチオシアン酸イオンが化学反応をして、化学発光が派生する。このときに起こる化学反応は、酸化剤として過酸化水素(H2O2)を用いたときには、以下の化学式で示される反応となる。
Spx
H2O2 + SCN− → OSCN− + H2O + UCL↑
上記の化学式で、Spxは、唾液中に含まれるペルオキシターゼを示したものであり、触媒の役割を果たしている。また、UCL↑は、微弱化学発光(ultra-weakchemiluminescence)であり、化学反応により化学発光が生じることを示している。また、OSCN−は、化学反応により生じる酸化生成物(抗微生物活性保有物質)を示している。なお、還元剤として用いる没食子酸は、上記の化学式には示されていないが、化学発光の発光量を底上げする役割を果たしていると考えられる。
【0026】
上述したように、唾液中のチオシアン酸イオンは、被験者である生体のストレスと相関を有しており、ストレスが強い場合はチオシアン酸イオンの濃度が高くなる。従って、ストレスの強さに応じて、化学発光の発光量が大きくなる。光電子増倍管10dは、その化学発光によるフォトンを検知する。さらに、フォトンカウンタ10fが、光電子増倍管10dにより検知されたフォトンをカウントし、化学発光を測定する(ステップS104、発光測定工程)。フォトンカウンタ10fは測定された化学発光データを情報処理装置10gに送信する。上記のように、化学発光の発光量がチオシアン酸イオンの濃度の指標値として評価される。
【0027】
次に、情報処理装置10gは、受信した化学発光データを参照し、所定の基準に基づいてストレスを評価する(ステップS105、ストレス評価工程)。ここで、所定の基準としては、例えば、測定された化学発光における所定の発光パラメータの値が予め定められた標準範囲から外れている場合、ストレスがあると評価する基準を用いることが好ましい。具体的には、化学発光の発光量に対し、閾値によって標準範囲を設定し、発光量が閾値を超えている場合にストレスがあるとする構成がある。また、上記の所定の基準を、化学発光の発光量自体を生体のストレスの度合を示す指標値(数値が大きいほどストレスが大きい)とするものとしてもよい。
【0028】
また、ストレス評価の基準で用いることができる発光パラメータとしては、発光量以外にも例えば、発光量の時間変化の微分係数(微分係数が大きい、即ち発光が急激に増加していればストレスがある)などを用いてもよい。即ち、これは、唾液中のチオシアン酸イオンの濃度変化を示す評価値を、ストレス評価に用いるものである。
【0029】
また、ストレスマーカとなる唾液中のチオシアン酸イオン等の成分の量は、通常、個人差があると考えられる。このため、ストレスを測定する生体毎に、予めストレスが無い状態などのデータを取得しておき、そのデータに基づき基準を設定することが好ましい。また、上記の例では、ストレスの有り無しという定性的なストレスの評価について示したが、ストレスを数値化する定量的な基準を設定してもよい。なお、ここで、ストレスが「有る」とはある一定以上のストレスを感じている状態をいう。
【0030】
本実施形態によるストレス測定方法の効果について説明する。本実施形態に係るストレス測定方法によれば、唾液を採取し、採取されたサンプルの発光を計測することにより評価される唾液中のチオシアン酸イオンの濃度に基づいて、生体のストレスを測定することができる。即ち、ストレスに対して高い感度を有するチオシアン酸イオンの濃度を指標としてストレスを評価することによって、より高感度に生体のストレスを測定することができる。また、上記のような簡易な方法で生体のストレスを測定することができる。また、生化学的な分析装置などの特別な装置を必要としないので、測定システムを簡単な構成で低コスト化することができる。また、ストレス測定を行う測定者において、高度な知識や熟練が不要になる。また、化学発光を測定することによるストレス測定では、発光の計測は通常数十秒〜数分程度行えば充分であるので、迅速な測定が可能である。
【0031】
また、化学発光を測定対象とする上記構成では、フォトンカウンティングなどの手法を用いることにより、ごく微量物質による発光まで精度よく測定して、確実にストレス測定を行うことが可能である。また、上述したように、唾液サンプルの生成にろ紙という吸収材を用いることとすれば、唾液を液状のまま取り扱うよりもサンプルの局所濃度が高くなり、化学発光の測定を容易かつ高効率で行うことができる。また、このような唾液サンプルは、サンプルの保存等を行う上でも好適である。
【0032】
このようなストレス測定は、例えば、病院において入院患者に対して1日1回ずつ、例えば起床時に唾液の発光測定を行うなど、被験者の日常的な健康状態や精神状態の把握に利用することができる。また、この他にも様々な目的に対して化学発光測定によるストレス測定を応用することが可能である。例えば、医療上の目的としては、うつ病や極端なストレス状態の測定ならびに神経内科へのサポートへの応用などが挙げられる。また、本測定法で健康状態のモニタリングが可能なことから、健康機器への応用の他、音楽療法、自然療法、アロマセラピーなどの保管代替医療への適用、さらには健康食品の研究開発の支援などに利用することが可能である。
【0033】
また、上記実施形態では、比較的不安定な酸化剤(例えば過酸化水素)を還元剤の後に加えることとしている。これにより、安定した条件で化学発光を起こさせることができ、より確実にストレスを測定することができる。
【0034】
また、唾液サンプルの発光測定においては、測定作業の効率などの観点から、例えば複数の被験者についてそれぞれ唾液の採取を行い、その後に、それらの唾液の分析を一度に行う場合がある。この場合、唾液の採取から発光測定までの間で、唾液サンプルの状態が変化しないように保存を行うことが好ましい。このようなサンプルの保存方法としては、唾液サンプル20を密閉容器に密閉状態で封入して低温で冷却保存しておくことが好ましい。これにより、被験者の唾液の採取から時間を開けて、良好な状態で唾液の化学発光の測定を行うことが可能となる。ただし、唾液の採取後に直ちに発光測定を行っても良い。
【0035】
また、本実施形態においては、シリンジにより還元剤及び酸化剤を唾液サンプル20に加えることとしているが、還元剤及び酸化剤の付加手段としては、シリンジ以外の構成を用いても良い。また、例えば、酸化剤及び還元剤のうちの少なくとも一つを、吸収材に予め含ませておき、唾液を採取した時点で加えられた状態となるようにしてもよい。そのような方法としては、ろ紙にお茶のカテキン等を染み込ませておく方法がある。この場合、より簡便なストレス測定が可能となる。
【0036】
[第2実施形態]
図4に示すフローチャートを参照して、第2実施形態に係るストレス測定方法を説明する。本実施形態に係るストレス測定方法は、被験者(生体)から採取された唾液に含まれるチオシアン酸イオンに基づく吸光度を評価することによって、被験者のストレスを測定するものである。
【0037】
まず、第1実施形態と同様に、唾液採取用のチューブ(例えば、サリベット)を用いて、被験者の口中から唾液を採取する。採取した唾液は、唾液サンプルとしてチューブ等に液体として保持される(ステップS201、唾液採取工程)。
【0038】
続いて、以下のように、唾液サンプルの吸光度を測定することによって唾液サンプルに含まれるチオシアン酸イオンの濃度を評価する(ステップS202〜S203、指標物質評価工程)。まず、唾液サンプルに、チオシアン酸イオンと反応して発色する試薬を加える(ステップS202、試薬付加工程)。上記の試薬としては、例えば、塩酸(HCl)(溶液)と塩化鉄(II)(溶液)との混合物が相当する。試薬を加える量としては、例えば、100μlの唾液サンプルに対して、0.1Mの塩酸800μlと0.1Mの塩化鉄(溶液)100μlとの混合溶液が加えられる。
【0039】
試薬が加えられた唾液サンプルに対して、必要に応じ遠心分離(例えば、1分間1000gで)が行われ、その後、その上澄みの吸光度が測定される(ステップS203、吸光度測定工程)。測定される吸光度は、試薬が加えられたことにより、唾液サンプルに含まれるチオシアン酸イオンからの生成物によるものである。上記の例では、チオシアン酸鉄(III)[Fe(SCN)]2+の吸光度である。吸光度の測定は、例えば、450nmの波長等の特定の波長を対象として行われる。吸光度の測定には、既存の吸光度測定装置を用いることができる。なお、吸光度の測定によってチオシアン酸イオンの濃度を評価する方法については、Anue,T. M., Thomas, E. L. (1977) Accumulation of hypothiocyanite ion duringperoxidase-catalyzed oxidation of thiocyanate ion, Eur. J. Biochem., 80,209-214.等にも記載されている。
【0040】
上述したように、唾液中のチオシアン酸イオンは、被験者である生体のストレスと相関を有しており、ストレスが強い場合はチオシアン酸イオンの濃度が高くなる。従って、ストレスの強さに応じて、吸光度が大きくなる。上記のように、吸光度がチオシアン酸イオンの濃度の指標値として評価される。
【0041】
続いて、測定された吸光度から、所定の基準に基づいてストレスを評価する(ステップS204、ストレス評価工程)。この評価は、例えば、第1実施形態と同様に情報処理装置によって行われることとしてもよい。また、上記の所定の基準は、第1実施形態のものを化学発光の発光量を吸光度に置き換えて適用することができる。
【0042】
なお、上記の測定方法では、口内炎や歯周病等による出血が測定の妨害因子となるので、測定された吸光度に異常値が出現した場合には、酵素抗体法によりヘモグロビン及びミエロペルオシダーゼを測定し、両者の混入が確認できる試料を除いた後、ストレス評価を行うことが望ましい。
【0043】
本実施形態によるストレス測定方法の効果について説明する。本実施形態に係るストレス測定方法によれば、唾液を採取し、採取されたサンプルに試薬を加えて吸光度を計測することにより評価される唾液中のチオシアン酸イオンの濃度に基づいて、生体のストレスを測定することができる。即ち、ストレスに対して高い感度を有するチオシアン酸イオンの濃度を指標としてストレスを評価することによって、より高感度に生体のストレスを測定することができる。また、本実施形態によれば、チオシアン酸イオンの濃度を確実に評価することができるので、確実に生体のストレスを測定することができる。
【0044】
また、本実施形態によれば、以下のような利点がある。唾液原液で測定可能であり、希釈操作を必要としない。クロマトグラフィーを用いる方法等と比較して試薬調整が簡便である。抽出操作等と比較して、測定操作自体が簡便である。生成物であるチオシアン酸鉄(III)[Fe(SCN)]2+が安定しており、反応直後でも1時間後でも測定した吸光度に変化がないため、厳密な測定時間を拘束せずに短時間での測定が可能である。プレートリーダー等、広く普及した機器で測定可能である。96ウェルプレートを使用できるため、多検体測定に適している。
【0045】
なお、上述したように既存の吸光度測定装置を用いて吸光度を測定することができるが、最も簡易にストレスを評価したい場合には、このような装置を用いずに、目視により試薬が加えられたサンプルの色を評価することにより吸光度を測定してストレスの評価を行ってもよい。その場合には、例えば、ストレスの大きさに応じた色見本を予め用意しておき、それとサンプルの色とを比較することでストレスの評価を行ってもよい。
【0046】
[その他の実施形態]
上述した第1及び第2実施形態で説明した方法以外でも、生体の唾液に含まれるチオシアン酸イオンの濃度を評価することができる。当該評価されたチオシアン酸イオンの濃度から、所定の基準に基づいて生体のストレスを評価することができる。以下に、第1及び第2実施形態の方法以外で、生体の唾液に含まれるチオシアン酸イオンの濃度を評価する方法を説明する。
【0047】
(1)銅沈殿による間接測定法
硫酸アンモニウムとエタノールによる抽出において、Cu(II)がアスコルビン酸によってCu(I)に還元される。この還元Cu(I)とチオシアン酸イオン(SCN−)を反応させると、CuSCNとなり沈殿が生成される。この沈殿生成物は、エタノール層と水層との境界で安定する。反応しなかったCu(I)から、反応したCu(I)=SCN−濃度を測定する。なお、この方法は、Indirectdetermination of thiocyanate with ammonium sulfate and ethanol byextraction-flotation of copper.Analyst. 2000 Oct;125(10):1885-8.に、より詳細に記載されている。
【0048】
(2)キャピラリーゾーン電気泳動法
例えば、0.1Mベータアラニン塩酸(pH3.5)をバックとした間接的紫外部吸収測定法によりシリカキャピラリー(64.5cm×75μm)を用いる。検出限界は200nMである。唾液は、例えば20倍精製水により希釈調製してから測定を行う。なお、この方法は、Analysis of thiocyanate in biological fluids by capillary zoneelectrophoresis. JChromatogr A. 2001May 4;916(1-2):273-7. に、より詳細に記載されている。
【0049】
(3)イオンクロマトグラフィー法
例えば、1mMクエン酸溶液を移動層としてセチルメチルアミンでコートされたODSカラムを用いる。チオシアン酸イオンは、他の有機、無機イオンと明確に分離される。なお、この方法は、Determination of thiocyanate in human saliva and urine by ionchromatographyAnalyst. 1992Dec;117(12):1855-8.により詳細に記載されている。
【実施例1】
【0050】
次に、実施例により本発明の内容をより具体的に説明するが、本発明は、以下の実施例に限定されるものではない。
【0051】
[実施例1]
実施例1は、上述した第1実施形態のストレス測定方法の実施例である。本実施例においては、男性23人(平均年齢21.6±標準偏差1.3)、女性23人(平均年齢21.9±標準偏差2.3)の学生をストレスの測定対象の被験者とした。これらの被験者に対して、図5に示すような実験を行った。まず、これらの被験者を、5分間、座った状態(座位:sittingposition)にさせる。その後、30分間クレペリン検査を行わせる。その後、また、30分間、座位をとらせる。
【0052】
クレペリン検査の直前(5分間の座位を取らせた後)、クレペリン検査の直後及び30分後の3度、唾液を採取し、ストレスの測定を行った。ここで、クレペリン検査は、被験者にとって、ストレスの原因となる検査である。
【0053】
図6に示すように、唾液の採取には、綿30aとチューブ30bとからなるサリベット(Salivette(Salstedt, Germany))30を用いた。綿30aを被験者の口内に含ませて、唾液を綿30aに染みこませる。その綿30aをチューブ30bに格納して遠心分離を行うと、綿30aに染みこんだ唾液31が分離される。
【0054】
続いて、図7(a)に示すように、シャーレ10aに設置されたろ紙40上に、200μlの唾液31を滴下する。その後、図7(b)に示すように、ろ紙40上に、3mMの没食子酸(還元剤)1mlを還元剤付加用シリンジ10bから滴下する。その後、図7(c)に示すように、3%(w/v)(0.88M)の過酸化水素(酸化剤)1mlを酸化剤付加用シリンジ10cからから滴下する。その後、図7(d)に示すように生じるろ紙40から生じる化学発光の測定を行った。
【0055】
測定された時間(タイミング)毎の化学発光の発光量を図8のグラフに示す。図8のグラフは、横軸に測定された時間、縦軸に100秒あたりにカウントされたフォトンの数、即ち発光量をとったものである。また、図8に示されるグラフで示される値は、被験者46人の平均値及び標準誤差である。一元配置分散分析(p<0.01)によれば、測定された時間の間の測定値の違いは、統計的に有意なものであった。また、Turkeyの多重比較検定(p<0.05)によれば、クレペリン検査直後の測定値とクレペリン検査前の測定値との間には有意差があった。このように、クレペリン検査によりストレスがかかっている状態には発光量が大きくなっている。即ち、この本実施例は、本発明による方法がクレペリン検査のような高感度のストレス評価が必要とされるストレスでも、正しくストレスの評価を行えることを示している。
【0056】
次に、図9のグラフに上記のストレス測定が行われた時間毎の、(a)ペルオキシターゼ(Spx)(データ数n=40)、(b)チオシアン酸イオン(SCN−)(データ数n=46)及び(c)尿酸(Uric acid)(データ数n=46)の唾液抗酸化成分の濃度を示す。図9のグラフは、横軸に測定された時間、縦軸に濃度をとったものである。また、図9に示されるグラフで示される値は、平均値及び標準誤差である。一元配置分散分析(p<0.001)によれば、測定された時間の間の測定値の違いは、統計的に有意なものであった。また、Turkeyの多重比較検定(**p<0.01、***p<0.001)によれば、クレペリン検査直後の測定値とクレペリン検査前の測定値との間には有意差があった。このように、クレペリン検査によりストレスがかかっている状態には各成分の濃度が大きくなっている。
【0057】
次に、図10に、クレペリン検査直後の化学発光の発光量(縦軸)と、クレペリン検査直後の(a)ペルオキシターゼ(Spx)、(b)チオシアン酸イオン(SCN−)及び(c)尿酸(それぞれ横軸)の濃度との散布図及び回帰直線を示す。化学発光の発光量と、その相関係数は、それぞれ(a)ペルオキシターゼ(Spx)(r=0.618、p<0.0001)、(b)チオシアン酸イオン(SCN−)(r=0.615、p<0.0001)及び(c)尿酸(r=0.490、p<0.0004)となる。これらの結果は、化学発光とこれらの成分とが強い相関を有していることを示している。
【0058】
次に、図11に、10mMのPBS(リン酸バッファー生理食塩水)(pH6.9)の中における、(a)ペルオキシターゼ(Spx)、(b)チオシアン酸イオン(SCN−)及び(c)尿酸の濃度の化学発光に対する影響を示したものである。図11のグラフは、横軸に各成分の濃度、縦軸に発光量をとったものである。また、図11に示されるグラフで示される値は、3回の測定値の平均値及び標準誤差である。上記のデータは、10mMPBS(6.9)中のペルオキシターゼ(Spx)及びチオシアン酸ナトリウム(0.3〜1.5mM)のようなヘモグロビン溶液(1〜30μg/mL)により構成される人工の唾液を用いて測定したものである。
【0059】
また、図12に、10mMのPBS(pH6.9)の中における、(a)ペルオキシターゼ(Spx)及びチオシアン酸イオン(SCN−)の混合物、及び(b)ペルオキシターゼ(Spx)、チオシアン酸イオン(SCN−)及び尿酸の混合物の化学発光に対する影響を示したものである。図12のグラフは、横軸に各成分の(a)チオシアン酸イオン(SCN−)の濃度、(b)尿酸の濃度、縦軸に発光量をとったものである。また、図12に示されるグラフで示される値は、3回の測定値の平均値及び標準誤差である。これらのデータは、化学発光には、チオシアン酸イオン(SCN−)及びペルオキシターゼ(Spx)が大きく影響していることを示している。
【0060】
[実施例2]
実施例2は、上述した第2実施形態のストレス測定方法の実施例である。この方法では、チオシアン酸イオンの基準の吸光度を測定して検量線を作成して、測定した唾液サンプルの吸光度を作成した検量線と比較することにより、ストレスを評価する。
【0061】
まず、チオシアン酸ナトリウム(Sodium Thiocyanate;NaSCN MW:81.07)8.1mgを電子天秤にて秤量し20ml容量三角フラスコに移す。精製水10mlを加えて攪拌し完全に溶解させる(この時点で10mMチオシアン酸ナトリウム溶液となる)。
【0062】
続いて、図13に示すように希釈調整し、0、0.1、0.3、0.5、0.75、1.2mMチオシアン酸ナトリウム溶液を作成し、検量線作成用サンプルとする。続いて、プラスチック50mlチューブに精製水9mlをとり、1mol/l塩酸を1ml加えて攪拌し完全に均一にし0.1mol/l塩酸10mlを作成する。続いて、塩化鉄(III)六水和物(Iron(III) Chloride Hexahydrate;FeCl3・6H2O MW:270.30)0.1gを秤量し、100ml容量三角フラスコに移す。精製水50mlを加えて攪拌し完全に溶解させる(この時点で0.1M塩化鉄(III)六水和物溶液となる)。
【0063】
続いて、プラスチック96ウェルプレートの1ウェルに対して、検量線作成用サンプル(0、0.1、0.3、0.5、0.75、1.2mMチオシアン酸ナトリウム溶液)及びストレスの測定対象の生体の唾液サンプルを50μlずつ入れる。さらに調整済み0.1mol/l塩酸を分注器(例:Multipette plus, eppendorf)で150μlずつ同様に加える。最後に0.1M塩化鉄(III)六水和物溶液を分注器で50μlずつ同様に加える。
【0064】
続いて、サンプル及び試薬が加えられたプラスチック96ウェルプレートをプレートシェイカーにより2〜3秒程度攪拌し、反応を完全なものとする。反応生生物である塩化鉄(II)チオシアン酸(FeSCN2+)の吸光度を450nmにおいてプレートリーダーにより測定する。続いて、吸光度とチオシアン酸ナトリウム溶液の濃度より検量線を作成する。作成される検量線は、例えば、図14に示されるように
y(吸光度)=0.1813x(チオシアン酸ナトリウム)+0.0188
となる。
【0065】
作成した検量線に基づいて、測定された唾液サンプルの吸光度から実際の唾液に含まれるチオシアン酸濃度を計算する。例えば、被験者Aの唾液サンプルを用いたときの450nmにおける吸光度が0.154、被験者Bの唾液サンプルを用いたときの450nm吸光度が0.220であった場合、上記の検量線の式から、
被験者Aのチオシアン酸イオン濃度(nm)=
(0.154−0.0188)/0.1813=0.746(mM)
被験者Bのチオシアン酸イオン濃度(nm)=
(0.220−0.0188)/0.1813=1.110(mM)
と求められた。このように求められたチオシアン酸イオン濃度から、被験者のストレスを評価することができる。
【図面の簡単な説明】
【0066】
【図1】本発明の第1実施形態に係るストレス測定方法に用いられるストレス測定システムの機能構成図である。
【図2】ストレス測定システムにおける、具体的装置構成の一例を示す図である。
【図3】本発明の第1実施形態に係るストレス測定方法の一例を示すフローチャートである。
【図4】本発明の第2実施形態に係るストレス測定方法の一例を示すフローチャートである。
【図5】実施例1における実験方法を示した図である。
【図6】実施例1における唾液の採取方法を示した図である。
【図7】実施例1における化学発光の測定方法を示した図である。
【図8】実施例1における測定された時間と発光量との関係を示したグラフである。
【図9】実施例1における測定された時間と唾液中の各成分との関係を示したグラフである。
【図10】実施例1における唾液中の成分と発光量との関係を示したグラフである。
【図11】実施例1における人工の唾液中の成分と発光量との関係を示したグラフである。
【図12】実施例1における人工の唾液中の各成分と発光量との関係を示したグラフである。
【図13】実施例2における検量線作成用サンプルの作成方法を示した図である。
【図14】実施例2におけるチオシアン酸ナトリウム溶液の濃度と450nmの波長における吸光度との関係及び検量線を示したグラフである。
【符号の説明】
【0067】
10…ストレス測定システム、10a…シャーレ、10b…還元剤付加用シリンジ、10c…酸化剤付加用シリンジ、10d…光電子増倍管、10e…暗箱、10f…フォトンカウンタ、10g…情報処理装置、11…唾液サンプル設置部、12…還元剤付加部、13…酸化剤付加部、14…発光測定部、15…ストレス評価部、20…唾液サンプル、30…サリベット、30a…綿、30b…チューブ、31…唾液、40…ろ紙。
【技術分野】
【0001】
本発明は、生体のストレスを測定するストレス測定方法に関する。
【背景技術】
【0002】
従来から、健康状態や精神状態の把握、また、その他医療上の目的からストレスの測定や判定が行われている。下記の特許文献1では、簡便かつ容易にストレスの測定を可能とするものとして、唾液中のアミラーゼ活性を指標としてストレスの測定を行なうことが提案されている。
【特許文献1】特開2002−168860号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、唾液中のアミラーゼ活性は、弱いストレッサーに対してはあまり敏感ではないという問題点がある。従って、特許文献1の方法では、弱いストレスを検出することができず、また、ストレスの度合についても正しく測定することができなかった。即ち、特許文献1の方法では、ストレスを十分な感度で検出及び測定することができなかった。
【0004】
本発明は、以上の問題点を解決するためになされたものであり、より高感度に生体のストレスを測定することができるストレス測定方法を提供することを目的とする。
【課題を解決するための手段】
【0005】
本願発明者は、上記目的を達成すべく鋭意研究を重ねた結果、生体へのストレスに応じて、当該生体の唾液中のチオシアン酸イオンの濃度が高い感度で変化することを見出した。即ち、生体へのストレスが大きくなると、当該生体の唾液中のチオシアン酸イオンの濃度が、ストレスに対して高感度で高くなる。この知見に基づいて、本願発明者は本発明を完成するに至った。
【0006】
上記目的を達成するために、本発明に係るストレス測定方法は、生体の唾液を採取して唾液サンプルとする唾液採取工程と、唾液サンプルに含まれるチオシアン酸イオンの濃度を評価する指標物質評価工程と、指標物質評価工程により評価されたチオシアン酸イオンの濃度から、所定の基準に基づいて生体のストレスを評価するストレス評価工程と、を含むストレス測定方法であることを特徴とする。
【0007】
本発明に係るストレス測定方法では、ストレスの測定対象の生体から唾液が採取されて、採取された唾液サンプルに含まれるチオシアン酸イオン(チオシアネートイオン:SCN−)の濃度が評価されて、チオシアン酸イオンの濃度に基づいて生体のストレスが評価される。本発明に係るストレス測定方法によれば、ストレスに対して高い感度を有するチオシアン酸イオンの濃度を指標としてストレスを評価することによって、より高感度に生体のストレスを測定することができる。
【0008】
指標物質評価工程は、唾液サンプルに還元剤を加える還元剤付加工程と、唾液サンプルに酸化剤を加える酸化剤付加工程と、還元剤付加工程において還元剤が加えられ、酸化剤付加工程において酸化剤が加えられた唾液サンプルの化学発光をチオシアン酸イオンの濃度の指標として測定する発光測定工程と、を含むことが望ましい。チオシアン酸イオンは、酸化剤及び還元剤を加えることにより化学発光する。また、チオシアン酸イオンの濃度が多くなると化学発光の発光が強くなるなど、チオシアン酸イオンの濃度に応じて化学発光の発光量が変化する。従って、上記の構成のように、化学発光をチオシアン酸イオンの濃度の指標として測定することにより、本発明によるストレスの評価を行うことが可能となる。即ち、この構成によれば、唾液を採取し、採取した唾液サンプルの発光を計測するという、高感度かつ簡易な方法で生体のストレスを測定することができる。
【0009】
還元剤付加工程において付加する還元剤は、没食子酸を含むことが望ましい。酸化剤付加工程において付加する酸化剤は、過酸化水素を含むことが望ましい。これらの構成によれば、確実に化学発光を生じさせることができるので、本発明を確実に実施することができる。
【0010】
指標物質評価工程は、唾液サンプルに、当該唾液サンプルに含まれるチオシアン酸イオンと反応して発色する試薬を加える試薬付加工程と、発色剤付加工程において試薬が加えられた唾液サンプルの吸光度をチオシアン酸イオンの濃度の指標として測定する吸光度測定工程と、を含むことが望ましい。この構成によれば、チオシアン酸イオンの濃度を確実に評価することができるので、高感度かつ確実に生体のストレスを測定することができる。
【発明の効果】
【0011】
本発明によれば、ストレスに対して高い感度を有するチオシアン酸イオンの濃度を指標としてストレスを評価することによって、より高感度に生体のストレスを測定することができる。
【発明を実施するための最良の形態】
【0012】
以下、図面と共に本発明によるストレス測定方法の好適な実施形態について詳細に説明する。なお、図面の説明においては同一要素には同一符号を付し、重複する説明を省略する。また、図面の寸法比率は、説明のものと必ずしも一致しない。
【0013】
[第1実施形態]
図1は、第1実施形態に係るストレス測定方法に用いられるストレス測定システム10の機能構成図である。ストレス測定システム10は、被験者(生体)から採取された唾液に含まれるチオシアン酸イオンの発光現象を利用して被験者のストレスを測定(判定)するものである。具体的には、本システム10は、唾液サンプル設置部11と、還元剤付加部12と、酸化剤付加部13と、発光測定部14と、ストレス評価部15とを含んで構成されている。
【0014】
唾液サンプル設置部11は、発光測定の対象となる生体の唾液を含む唾液サンプルを設置する設置手段である。唾液サンプルとしては、液状物質の吸収及び保持が可能な吸収材を利用し、この吸収材に生体の唾液を吸収及び保持したものが用いられる。吸収材としては、好ましくはろ紙が用いられる。あるいは、ろ紙以外のもの、例えばスポンジ等を用いることとしても良い。
【0015】
唾液サンプル設置部11に設置された唾液サンプルに対し、測定システム10には、還元剤付加部12、及び酸化剤付加部13が設けられている。還元剤付加部12は、唾液サンプルに還元剤を加える。また、酸化剤付加部13は、唾液サンプルに酸化剤を加える。これらの還元剤及び酸化剤は、唾液サンプルで化学発光を生じさせるために用いられる。還元剤としては例えば、没食子酸を含むものを用いるのが好ましい。また、酸化剤としては例えば、過酸化水素を含むものを用いるのが好ましい。これらの構成によれば、確実に化学発光を生じさせることができるので、本発明を確実に実施することができる。
【0016】
発光測定部14は、唾液サンプル設置部11に対して所定位置に設けられており、唾液サンプル設置部11に設置された唾液サンプルの化学発光を測定する。また、発光測定部14で測定された化学発光データは、ストレス評価部15に入力されている。ストレス評価部15は、測定された化学発光データを参照し、所定の基準に基づいてストレスを評価する。なお、所定の基準とは、化学発光データからストレスの測定を可能とする基準であり、具体的な内容については後述する。
【0017】
図2は、図1に示した実施形態のストレス測定システム10における、具体的装置構成の一例を示す。図2に示す構成例においては、ストレス測定システム10は、シャーレ10aと、還元剤付加用シリンジ10bと、酸化剤付加用シリンジ10cと、光電子増倍管10dと、暗箱10eと、フォトンカウンタ10fと、情報処理装置10gとの各装置を含んで構成されている。
【0018】
シャーレ10aは、唾液サンプル20を設置するためのものであり、唾液サンプル設置部11に相当する。還元剤付加用シリンジ10bは、液体物質を吐出する装置であり、液体の還元剤をシャーレ10aに設置された唾液サンプル20に付加するためのものである。即ち、還元剤付加用シリンジ10bは、図1における還元剤付加部12の機能を実現する。また、酸化剤付加用シリンジ10cも構造は還元剤付加用シリンジ10b同様であり、液体の酸化剤をシャーレ10aに設置された唾液サンプル20に付加するためのものである。即ち、酸化剤付加用シリンジ10cは、図1における酸化剤付加部13の機能を実現する。なお、還元剤付加用シリンジ10b及び酸化剤付加用シリンジ10cは、情報処理装置10gにより、還元剤及び酸化剤の唾液サンプル20に対する吐出の量やタイミングなどが制御される構成とするのが好ましい。
【0019】
光電子増倍管10dは、シャーレ10aに設置された唾液サンプル20の発光、即ち還元剤、酸化剤と唾液サンプル20に含まれるチオシアン酸イオンとの酸化還元反応の結果生じるフォトン(光子)を検出する。暗箱10eは、シャーレ10aでの微弱な発光を検出するために、外部からの光を遮断し、シャーレ10a及び光電子増倍管10dの周囲を暗くするために設けられている。このような構成において、光電子増倍管10dにより検知されたフォトンに対応して出力された検出信号が、計数回路などから構成されたフォトンカウンタ10fによりカウントされる。これにより、シャーレ10aからの化学発光が計測され、化学発光データが取得される。光電子増倍管10d、及びフォトンカウンタ10fは、図1における発光測定部14の機能を実現する。
【0020】
フォトンカウンタ10fにより測定された化学発光データは情報処理装置10gに送信される。情報処理装置10gは、CPU及びメモリなどから構成され、ストレスを評価するための所定の基準を記憶しており、ストレスを評価するための演算などを行う。情報処理装置10gは、受信した化学発光データを参照し、所定の基準に基づいて被験者のストレスを評価する。これにより、情報処理装置10gは、図1におけるストレス評価部15の機能を実現する。また、この情報処理装置10gは、ストレス評価以外の機能、例えば測定システム10の各部の制御機能などを併せて有していても良い。
【0021】
なお、各装置には必要に応じて電源が備えられており、動作に必要な電力が供給される。また、情報処理装置10gに対しては、キーボードやマウスなどの入力装置、CRTディスプレイや液晶ディスプレイなどの表示装置などが、必要に応じて接続される。入力装置は、ストレス測定実行の指示情報や、測定条件の情報などの入力に用いることができる。また、表示装置は、ストレスの測定結果や、測定の実行状況などの表示に用いることができる。
【0022】
次に、図1及び図2に示したストレス測定システム10を用いた本発明によるストレス測定方法について、図3に示すフローチャートを参照しつつ説明する。
【0023】
まず、唾液採取用のチューブ(例えば、サリベット(商品名))を用いて、被験者の口中から唾液を採取する。採取した唾液を、ろ紙やスポンジ等の吸収材に含ませて、唾液サンプル20とする(ステップS101、唾液採取工程)。唾液サンプル20は、シャーレ10a上に設置される。
【0024】
続いて、以下のように唾液サンプルに含まれるチオシアン酸イオンの濃度を評価する(ステップS102〜S104、指標物質評価工程)。まず、還元剤付加用シリンジ10bを用いて、唾液サンプル20に没食子酸等の還元剤を加える(ステップS102、還元剤付加工程)。また、酸化剤付加用シリンジ10cを用いて、唾液サンプル20に過酸化水素等の酸化剤を加える(ステップS103、酸化剤付加工程)。なお、各シリンジ10b、10cには、それぞれ予め必要量の還元剤、酸化剤を入れておくものとする。また、還元剤を唾液サンプル20に加える処理までは、測定対象となる唾液サンプル20からの化学発光はほとんど生じないので、必ずしも暗箱10e内で行う必要はない。
【0025】
還元剤及び酸化剤が加えられた唾液サンプル20では、唾液中に含まれ被験者のストレスに応じた濃度となるチオシアン酸イオンが化学反応をして、化学発光が派生する。このときに起こる化学反応は、酸化剤として過酸化水素(H2O2)を用いたときには、以下の化学式で示される反応となる。
Spx
H2O2 + SCN− → OSCN− + H2O + UCL↑
上記の化学式で、Spxは、唾液中に含まれるペルオキシターゼを示したものであり、触媒の役割を果たしている。また、UCL↑は、微弱化学発光(ultra-weakchemiluminescence)であり、化学反応により化学発光が生じることを示している。また、OSCN−は、化学反応により生じる酸化生成物(抗微生物活性保有物質)を示している。なお、還元剤として用いる没食子酸は、上記の化学式には示されていないが、化学発光の発光量を底上げする役割を果たしていると考えられる。
【0026】
上述したように、唾液中のチオシアン酸イオンは、被験者である生体のストレスと相関を有しており、ストレスが強い場合はチオシアン酸イオンの濃度が高くなる。従って、ストレスの強さに応じて、化学発光の発光量が大きくなる。光電子増倍管10dは、その化学発光によるフォトンを検知する。さらに、フォトンカウンタ10fが、光電子増倍管10dにより検知されたフォトンをカウントし、化学発光を測定する(ステップS104、発光測定工程)。フォトンカウンタ10fは測定された化学発光データを情報処理装置10gに送信する。上記のように、化学発光の発光量がチオシアン酸イオンの濃度の指標値として評価される。
【0027】
次に、情報処理装置10gは、受信した化学発光データを参照し、所定の基準に基づいてストレスを評価する(ステップS105、ストレス評価工程)。ここで、所定の基準としては、例えば、測定された化学発光における所定の発光パラメータの値が予め定められた標準範囲から外れている場合、ストレスがあると評価する基準を用いることが好ましい。具体的には、化学発光の発光量に対し、閾値によって標準範囲を設定し、発光量が閾値を超えている場合にストレスがあるとする構成がある。また、上記の所定の基準を、化学発光の発光量自体を生体のストレスの度合を示す指標値(数値が大きいほどストレスが大きい)とするものとしてもよい。
【0028】
また、ストレス評価の基準で用いることができる発光パラメータとしては、発光量以外にも例えば、発光量の時間変化の微分係数(微分係数が大きい、即ち発光が急激に増加していればストレスがある)などを用いてもよい。即ち、これは、唾液中のチオシアン酸イオンの濃度変化を示す評価値を、ストレス評価に用いるものである。
【0029】
また、ストレスマーカとなる唾液中のチオシアン酸イオン等の成分の量は、通常、個人差があると考えられる。このため、ストレスを測定する生体毎に、予めストレスが無い状態などのデータを取得しておき、そのデータに基づき基準を設定することが好ましい。また、上記の例では、ストレスの有り無しという定性的なストレスの評価について示したが、ストレスを数値化する定量的な基準を設定してもよい。なお、ここで、ストレスが「有る」とはある一定以上のストレスを感じている状態をいう。
【0030】
本実施形態によるストレス測定方法の効果について説明する。本実施形態に係るストレス測定方法によれば、唾液を採取し、採取されたサンプルの発光を計測することにより評価される唾液中のチオシアン酸イオンの濃度に基づいて、生体のストレスを測定することができる。即ち、ストレスに対して高い感度を有するチオシアン酸イオンの濃度を指標としてストレスを評価することによって、より高感度に生体のストレスを測定することができる。また、上記のような簡易な方法で生体のストレスを測定することができる。また、生化学的な分析装置などの特別な装置を必要としないので、測定システムを簡単な構成で低コスト化することができる。また、ストレス測定を行う測定者において、高度な知識や熟練が不要になる。また、化学発光を測定することによるストレス測定では、発光の計測は通常数十秒〜数分程度行えば充分であるので、迅速な測定が可能である。
【0031】
また、化学発光を測定対象とする上記構成では、フォトンカウンティングなどの手法を用いることにより、ごく微量物質による発光まで精度よく測定して、確実にストレス測定を行うことが可能である。また、上述したように、唾液サンプルの生成にろ紙という吸収材を用いることとすれば、唾液を液状のまま取り扱うよりもサンプルの局所濃度が高くなり、化学発光の測定を容易かつ高効率で行うことができる。また、このような唾液サンプルは、サンプルの保存等を行う上でも好適である。
【0032】
このようなストレス測定は、例えば、病院において入院患者に対して1日1回ずつ、例えば起床時に唾液の発光測定を行うなど、被験者の日常的な健康状態や精神状態の把握に利用することができる。また、この他にも様々な目的に対して化学発光測定によるストレス測定を応用することが可能である。例えば、医療上の目的としては、うつ病や極端なストレス状態の測定ならびに神経内科へのサポートへの応用などが挙げられる。また、本測定法で健康状態のモニタリングが可能なことから、健康機器への応用の他、音楽療法、自然療法、アロマセラピーなどの保管代替医療への適用、さらには健康食品の研究開発の支援などに利用することが可能である。
【0033】
また、上記実施形態では、比較的不安定な酸化剤(例えば過酸化水素)を還元剤の後に加えることとしている。これにより、安定した条件で化学発光を起こさせることができ、より確実にストレスを測定することができる。
【0034】
また、唾液サンプルの発光測定においては、測定作業の効率などの観点から、例えば複数の被験者についてそれぞれ唾液の採取を行い、その後に、それらの唾液の分析を一度に行う場合がある。この場合、唾液の採取から発光測定までの間で、唾液サンプルの状態が変化しないように保存を行うことが好ましい。このようなサンプルの保存方法としては、唾液サンプル20を密閉容器に密閉状態で封入して低温で冷却保存しておくことが好ましい。これにより、被験者の唾液の採取から時間を開けて、良好な状態で唾液の化学発光の測定を行うことが可能となる。ただし、唾液の採取後に直ちに発光測定を行っても良い。
【0035】
また、本実施形態においては、シリンジにより還元剤及び酸化剤を唾液サンプル20に加えることとしているが、還元剤及び酸化剤の付加手段としては、シリンジ以外の構成を用いても良い。また、例えば、酸化剤及び還元剤のうちの少なくとも一つを、吸収材に予め含ませておき、唾液を採取した時点で加えられた状態となるようにしてもよい。そのような方法としては、ろ紙にお茶のカテキン等を染み込ませておく方法がある。この場合、より簡便なストレス測定が可能となる。
【0036】
[第2実施形態]
図4に示すフローチャートを参照して、第2実施形態に係るストレス測定方法を説明する。本実施形態に係るストレス測定方法は、被験者(生体)から採取された唾液に含まれるチオシアン酸イオンに基づく吸光度を評価することによって、被験者のストレスを測定するものである。
【0037】
まず、第1実施形態と同様に、唾液採取用のチューブ(例えば、サリベット)を用いて、被験者の口中から唾液を採取する。採取した唾液は、唾液サンプルとしてチューブ等に液体として保持される(ステップS201、唾液採取工程)。
【0038】
続いて、以下のように、唾液サンプルの吸光度を測定することによって唾液サンプルに含まれるチオシアン酸イオンの濃度を評価する(ステップS202〜S203、指標物質評価工程)。まず、唾液サンプルに、チオシアン酸イオンと反応して発色する試薬を加える(ステップS202、試薬付加工程)。上記の試薬としては、例えば、塩酸(HCl)(溶液)と塩化鉄(II)(溶液)との混合物が相当する。試薬を加える量としては、例えば、100μlの唾液サンプルに対して、0.1Mの塩酸800μlと0.1Mの塩化鉄(溶液)100μlとの混合溶液が加えられる。
【0039】
試薬が加えられた唾液サンプルに対して、必要に応じ遠心分離(例えば、1分間1000gで)が行われ、その後、その上澄みの吸光度が測定される(ステップS203、吸光度測定工程)。測定される吸光度は、試薬が加えられたことにより、唾液サンプルに含まれるチオシアン酸イオンからの生成物によるものである。上記の例では、チオシアン酸鉄(III)[Fe(SCN)]2+の吸光度である。吸光度の測定は、例えば、450nmの波長等の特定の波長を対象として行われる。吸光度の測定には、既存の吸光度測定装置を用いることができる。なお、吸光度の測定によってチオシアン酸イオンの濃度を評価する方法については、Anue,T. M., Thomas, E. L. (1977) Accumulation of hypothiocyanite ion duringperoxidase-catalyzed oxidation of thiocyanate ion, Eur. J. Biochem., 80,209-214.等にも記載されている。
【0040】
上述したように、唾液中のチオシアン酸イオンは、被験者である生体のストレスと相関を有しており、ストレスが強い場合はチオシアン酸イオンの濃度が高くなる。従って、ストレスの強さに応じて、吸光度が大きくなる。上記のように、吸光度がチオシアン酸イオンの濃度の指標値として評価される。
【0041】
続いて、測定された吸光度から、所定の基準に基づいてストレスを評価する(ステップS204、ストレス評価工程)。この評価は、例えば、第1実施形態と同様に情報処理装置によって行われることとしてもよい。また、上記の所定の基準は、第1実施形態のものを化学発光の発光量を吸光度に置き換えて適用することができる。
【0042】
なお、上記の測定方法では、口内炎や歯周病等による出血が測定の妨害因子となるので、測定された吸光度に異常値が出現した場合には、酵素抗体法によりヘモグロビン及びミエロペルオシダーゼを測定し、両者の混入が確認できる試料を除いた後、ストレス評価を行うことが望ましい。
【0043】
本実施形態によるストレス測定方法の効果について説明する。本実施形態に係るストレス測定方法によれば、唾液を採取し、採取されたサンプルに試薬を加えて吸光度を計測することにより評価される唾液中のチオシアン酸イオンの濃度に基づいて、生体のストレスを測定することができる。即ち、ストレスに対して高い感度を有するチオシアン酸イオンの濃度を指標としてストレスを評価することによって、より高感度に生体のストレスを測定することができる。また、本実施形態によれば、チオシアン酸イオンの濃度を確実に評価することができるので、確実に生体のストレスを測定することができる。
【0044】
また、本実施形態によれば、以下のような利点がある。唾液原液で測定可能であり、希釈操作を必要としない。クロマトグラフィーを用いる方法等と比較して試薬調整が簡便である。抽出操作等と比較して、測定操作自体が簡便である。生成物であるチオシアン酸鉄(III)[Fe(SCN)]2+が安定しており、反応直後でも1時間後でも測定した吸光度に変化がないため、厳密な測定時間を拘束せずに短時間での測定が可能である。プレートリーダー等、広く普及した機器で測定可能である。96ウェルプレートを使用できるため、多検体測定に適している。
【0045】
なお、上述したように既存の吸光度測定装置を用いて吸光度を測定することができるが、最も簡易にストレスを評価したい場合には、このような装置を用いずに、目視により試薬が加えられたサンプルの色を評価することにより吸光度を測定してストレスの評価を行ってもよい。その場合には、例えば、ストレスの大きさに応じた色見本を予め用意しておき、それとサンプルの色とを比較することでストレスの評価を行ってもよい。
【0046】
[その他の実施形態]
上述した第1及び第2実施形態で説明した方法以外でも、生体の唾液に含まれるチオシアン酸イオンの濃度を評価することができる。当該評価されたチオシアン酸イオンの濃度から、所定の基準に基づいて生体のストレスを評価することができる。以下に、第1及び第2実施形態の方法以外で、生体の唾液に含まれるチオシアン酸イオンの濃度を評価する方法を説明する。
【0047】
(1)銅沈殿による間接測定法
硫酸アンモニウムとエタノールによる抽出において、Cu(II)がアスコルビン酸によってCu(I)に還元される。この還元Cu(I)とチオシアン酸イオン(SCN−)を反応させると、CuSCNとなり沈殿が生成される。この沈殿生成物は、エタノール層と水層との境界で安定する。反応しなかったCu(I)から、反応したCu(I)=SCN−濃度を測定する。なお、この方法は、Indirectdetermination of thiocyanate with ammonium sulfate and ethanol byextraction-flotation of copper.Analyst. 2000 Oct;125(10):1885-8.に、より詳細に記載されている。
【0048】
(2)キャピラリーゾーン電気泳動法
例えば、0.1Mベータアラニン塩酸(pH3.5)をバックとした間接的紫外部吸収測定法によりシリカキャピラリー(64.5cm×75μm)を用いる。検出限界は200nMである。唾液は、例えば20倍精製水により希釈調製してから測定を行う。なお、この方法は、Analysis of thiocyanate in biological fluids by capillary zoneelectrophoresis. JChromatogr A. 2001May 4;916(1-2):273-7. に、より詳細に記載されている。
【0049】
(3)イオンクロマトグラフィー法
例えば、1mMクエン酸溶液を移動層としてセチルメチルアミンでコートされたODSカラムを用いる。チオシアン酸イオンは、他の有機、無機イオンと明確に分離される。なお、この方法は、Determination of thiocyanate in human saliva and urine by ionchromatographyAnalyst. 1992Dec;117(12):1855-8.により詳細に記載されている。
【実施例1】
【0050】
次に、実施例により本発明の内容をより具体的に説明するが、本発明は、以下の実施例に限定されるものではない。
【0051】
[実施例1]
実施例1は、上述した第1実施形態のストレス測定方法の実施例である。本実施例においては、男性23人(平均年齢21.6±標準偏差1.3)、女性23人(平均年齢21.9±標準偏差2.3)の学生をストレスの測定対象の被験者とした。これらの被験者に対して、図5に示すような実験を行った。まず、これらの被験者を、5分間、座った状態(座位:sittingposition)にさせる。その後、30分間クレペリン検査を行わせる。その後、また、30分間、座位をとらせる。
【0052】
クレペリン検査の直前(5分間の座位を取らせた後)、クレペリン検査の直後及び30分後の3度、唾液を採取し、ストレスの測定を行った。ここで、クレペリン検査は、被験者にとって、ストレスの原因となる検査である。
【0053】
図6に示すように、唾液の採取には、綿30aとチューブ30bとからなるサリベット(Salivette(Salstedt, Germany))30を用いた。綿30aを被験者の口内に含ませて、唾液を綿30aに染みこませる。その綿30aをチューブ30bに格納して遠心分離を行うと、綿30aに染みこんだ唾液31が分離される。
【0054】
続いて、図7(a)に示すように、シャーレ10aに設置されたろ紙40上に、200μlの唾液31を滴下する。その後、図7(b)に示すように、ろ紙40上に、3mMの没食子酸(還元剤)1mlを還元剤付加用シリンジ10bから滴下する。その後、図7(c)に示すように、3%(w/v)(0.88M)の過酸化水素(酸化剤)1mlを酸化剤付加用シリンジ10cからから滴下する。その後、図7(d)に示すように生じるろ紙40から生じる化学発光の測定を行った。
【0055】
測定された時間(タイミング)毎の化学発光の発光量を図8のグラフに示す。図8のグラフは、横軸に測定された時間、縦軸に100秒あたりにカウントされたフォトンの数、即ち発光量をとったものである。また、図8に示されるグラフで示される値は、被験者46人の平均値及び標準誤差である。一元配置分散分析(p<0.01)によれば、測定された時間の間の測定値の違いは、統計的に有意なものであった。また、Turkeyの多重比較検定(p<0.05)によれば、クレペリン検査直後の測定値とクレペリン検査前の測定値との間には有意差があった。このように、クレペリン検査によりストレスがかかっている状態には発光量が大きくなっている。即ち、この本実施例は、本発明による方法がクレペリン検査のような高感度のストレス評価が必要とされるストレスでも、正しくストレスの評価を行えることを示している。
【0056】
次に、図9のグラフに上記のストレス測定が行われた時間毎の、(a)ペルオキシターゼ(Spx)(データ数n=40)、(b)チオシアン酸イオン(SCN−)(データ数n=46)及び(c)尿酸(Uric acid)(データ数n=46)の唾液抗酸化成分の濃度を示す。図9のグラフは、横軸に測定された時間、縦軸に濃度をとったものである。また、図9に示されるグラフで示される値は、平均値及び標準誤差である。一元配置分散分析(p<0.001)によれば、測定された時間の間の測定値の違いは、統計的に有意なものであった。また、Turkeyの多重比較検定(**p<0.01、***p<0.001)によれば、クレペリン検査直後の測定値とクレペリン検査前の測定値との間には有意差があった。このように、クレペリン検査によりストレスがかかっている状態には各成分の濃度が大きくなっている。
【0057】
次に、図10に、クレペリン検査直後の化学発光の発光量(縦軸)と、クレペリン検査直後の(a)ペルオキシターゼ(Spx)、(b)チオシアン酸イオン(SCN−)及び(c)尿酸(それぞれ横軸)の濃度との散布図及び回帰直線を示す。化学発光の発光量と、その相関係数は、それぞれ(a)ペルオキシターゼ(Spx)(r=0.618、p<0.0001)、(b)チオシアン酸イオン(SCN−)(r=0.615、p<0.0001)及び(c)尿酸(r=0.490、p<0.0004)となる。これらの結果は、化学発光とこれらの成分とが強い相関を有していることを示している。
【0058】
次に、図11に、10mMのPBS(リン酸バッファー生理食塩水)(pH6.9)の中における、(a)ペルオキシターゼ(Spx)、(b)チオシアン酸イオン(SCN−)及び(c)尿酸の濃度の化学発光に対する影響を示したものである。図11のグラフは、横軸に各成分の濃度、縦軸に発光量をとったものである。また、図11に示されるグラフで示される値は、3回の測定値の平均値及び標準誤差である。上記のデータは、10mMPBS(6.9)中のペルオキシターゼ(Spx)及びチオシアン酸ナトリウム(0.3〜1.5mM)のようなヘモグロビン溶液(1〜30μg/mL)により構成される人工の唾液を用いて測定したものである。
【0059】
また、図12に、10mMのPBS(pH6.9)の中における、(a)ペルオキシターゼ(Spx)及びチオシアン酸イオン(SCN−)の混合物、及び(b)ペルオキシターゼ(Spx)、チオシアン酸イオン(SCN−)及び尿酸の混合物の化学発光に対する影響を示したものである。図12のグラフは、横軸に各成分の(a)チオシアン酸イオン(SCN−)の濃度、(b)尿酸の濃度、縦軸に発光量をとったものである。また、図12に示されるグラフで示される値は、3回の測定値の平均値及び標準誤差である。これらのデータは、化学発光には、チオシアン酸イオン(SCN−)及びペルオキシターゼ(Spx)が大きく影響していることを示している。
【0060】
[実施例2]
実施例2は、上述した第2実施形態のストレス測定方法の実施例である。この方法では、チオシアン酸イオンの基準の吸光度を測定して検量線を作成して、測定した唾液サンプルの吸光度を作成した検量線と比較することにより、ストレスを評価する。
【0061】
まず、チオシアン酸ナトリウム(Sodium Thiocyanate;NaSCN MW:81.07)8.1mgを電子天秤にて秤量し20ml容量三角フラスコに移す。精製水10mlを加えて攪拌し完全に溶解させる(この時点で10mMチオシアン酸ナトリウム溶液となる)。
【0062】
続いて、図13に示すように希釈調整し、0、0.1、0.3、0.5、0.75、1.2mMチオシアン酸ナトリウム溶液を作成し、検量線作成用サンプルとする。続いて、プラスチック50mlチューブに精製水9mlをとり、1mol/l塩酸を1ml加えて攪拌し完全に均一にし0.1mol/l塩酸10mlを作成する。続いて、塩化鉄(III)六水和物(Iron(III) Chloride Hexahydrate;FeCl3・6H2O MW:270.30)0.1gを秤量し、100ml容量三角フラスコに移す。精製水50mlを加えて攪拌し完全に溶解させる(この時点で0.1M塩化鉄(III)六水和物溶液となる)。
【0063】
続いて、プラスチック96ウェルプレートの1ウェルに対して、検量線作成用サンプル(0、0.1、0.3、0.5、0.75、1.2mMチオシアン酸ナトリウム溶液)及びストレスの測定対象の生体の唾液サンプルを50μlずつ入れる。さらに調整済み0.1mol/l塩酸を分注器(例:Multipette plus, eppendorf)で150μlずつ同様に加える。最後に0.1M塩化鉄(III)六水和物溶液を分注器で50μlずつ同様に加える。
【0064】
続いて、サンプル及び試薬が加えられたプラスチック96ウェルプレートをプレートシェイカーにより2〜3秒程度攪拌し、反応を完全なものとする。反応生生物である塩化鉄(II)チオシアン酸(FeSCN2+)の吸光度を450nmにおいてプレートリーダーにより測定する。続いて、吸光度とチオシアン酸ナトリウム溶液の濃度より検量線を作成する。作成される検量線は、例えば、図14に示されるように
y(吸光度)=0.1813x(チオシアン酸ナトリウム)+0.0188
となる。
【0065】
作成した検量線に基づいて、測定された唾液サンプルの吸光度から実際の唾液に含まれるチオシアン酸濃度を計算する。例えば、被験者Aの唾液サンプルを用いたときの450nmにおける吸光度が0.154、被験者Bの唾液サンプルを用いたときの450nm吸光度が0.220であった場合、上記の検量線の式から、
被験者Aのチオシアン酸イオン濃度(nm)=
(0.154−0.0188)/0.1813=0.746(mM)
被験者Bのチオシアン酸イオン濃度(nm)=
(0.220−0.0188)/0.1813=1.110(mM)
と求められた。このように求められたチオシアン酸イオン濃度から、被験者のストレスを評価することができる。
【図面の簡単な説明】
【0066】
【図1】本発明の第1実施形態に係るストレス測定方法に用いられるストレス測定システムの機能構成図である。
【図2】ストレス測定システムにおける、具体的装置構成の一例を示す図である。
【図3】本発明の第1実施形態に係るストレス測定方法の一例を示すフローチャートである。
【図4】本発明の第2実施形態に係るストレス測定方法の一例を示すフローチャートである。
【図5】実施例1における実験方法を示した図である。
【図6】実施例1における唾液の採取方法を示した図である。
【図7】実施例1における化学発光の測定方法を示した図である。
【図8】実施例1における測定された時間と発光量との関係を示したグラフである。
【図9】実施例1における測定された時間と唾液中の各成分との関係を示したグラフである。
【図10】実施例1における唾液中の成分と発光量との関係を示したグラフである。
【図11】実施例1における人工の唾液中の成分と発光量との関係を示したグラフである。
【図12】実施例1における人工の唾液中の各成分と発光量との関係を示したグラフである。
【図13】実施例2における検量線作成用サンプルの作成方法を示した図である。
【図14】実施例2におけるチオシアン酸ナトリウム溶液の濃度と450nmの波長における吸光度との関係及び検量線を示したグラフである。
【符号の説明】
【0067】
10…ストレス測定システム、10a…シャーレ、10b…還元剤付加用シリンジ、10c…酸化剤付加用シリンジ、10d…光電子増倍管、10e…暗箱、10f…フォトンカウンタ、10g…情報処理装置、11…唾液サンプル設置部、12…還元剤付加部、13…酸化剤付加部、14…発光測定部、15…ストレス評価部、20…唾液サンプル、30…サリベット、30a…綿、30b…チューブ、31…唾液、40…ろ紙。
【特許請求の範囲】
【請求項1】
生体の唾液を採取して唾液サンプルとする唾液採取工程と、
前記唾液サンプルに含まれるチオシアン酸イオンの濃度を評価する指標物質評価工程と、
前記指標物質評価工程により評価されたチオシアン酸イオンの濃度から、所定の基準に基づいて前記生体のストレスを評価するストレス評価工程と、
を含むストレス測定方法。
【請求項2】
前記指標物質評価工程は、
前記唾液サンプルに還元剤を加える還元剤付加工程と、
前記唾液サンプルに酸化剤を加える酸化剤付加工程と、
前記還元剤付加工程において還元剤が加えられ、前記酸化剤付加工程において酸化剤が加えられた前記唾液サンプルの化学発光を前記チオシアン酸イオンの濃度の指標として測定する発光測定工程と、
を含むことを特徴とする請求項1に記載のストレス測定方法。
【請求項3】
前記還元剤付加工程において付加する還元剤は、没食子酸を含むことを特徴とする請求項2に記載のストレス測定方法。
【請求項4】
前記酸化剤付加工程において付加する酸化剤は、過酸化水素を含むことを特徴とする請求項2又は3に記載のストレス測定方法。
【請求項5】
前記指標物質評価工程は、
前記唾液サンプルに、当該唾液サンプルに含まれるチオシアン酸イオンと反応して発色する試薬を加える試薬付加工程と、
前記発色剤付加工程において試薬が加えられた前記唾液サンプルの吸光度を前記チオシアン酸イオンの濃度の指標として測定する吸光度測定工程と、
を含むことを特徴とする請求項1に記載のストレス測定方法。
【請求項1】
生体の唾液を採取して唾液サンプルとする唾液採取工程と、
前記唾液サンプルに含まれるチオシアン酸イオンの濃度を評価する指標物質評価工程と、
前記指標物質評価工程により評価されたチオシアン酸イオンの濃度から、所定の基準に基づいて前記生体のストレスを評価するストレス評価工程と、
を含むストレス測定方法。
【請求項2】
前記指標物質評価工程は、
前記唾液サンプルに還元剤を加える還元剤付加工程と、
前記唾液サンプルに酸化剤を加える酸化剤付加工程と、
前記還元剤付加工程において還元剤が加えられ、前記酸化剤付加工程において酸化剤が加えられた前記唾液サンプルの化学発光を前記チオシアン酸イオンの濃度の指標として測定する発光測定工程と、
を含むことを特徴とする請求項1に記載のストレス測定方法。
【請求項3】
前記還元剤付加工程において付加する還元剤は、没食子酸を含むことを特徴とする請求項2に記載のストレス測定方法。
【請求項4】
前記酸化剤付加工程において付加する酸化剤は、過酸化水素を含むことを特徴とする請求項2又は3に記載のストレス測定方法。
【請求項5】
前記指標物質評価工程は、
前記唾液サンプルに、当該唾液サンプルに含まれるチオシアン酸イオンと反応して発色する試薬を加える試薬付加工程と、
前記発色剤付加工程において試薬が加えられた前記唾液サンプルの吸光度を前記チオシアン酸イオンの濃度の指標として測定する吸光度測定工程と、
を含むことを特徴とする請求項1に記載のストレス測定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2008−134210(P2008−134210A)
【公開日】平成20年6月12日(2008.6.12)
【国際特許分類】
【出願番号】特願2006−322301(P2006−322301)
【出願日】平成18年11月29日(2006.11.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発行者名 The Psychoneuroimmunology Research Society 刊行物名 13▲th▼ Annual Meeting of The Psychoneuroimmunology Research Society Meeting Programme and Abstract book 発行日 2006年5月31日
【出願人】(000236436)浜松ホトニクス株式会社 (1,479)
【出願人】(506397523)
【Fターム(参考)】
【公開日】平成20年6月12日(2008.6.12)
【国際特許分類】
【出願日】平成18年11月29日(2006.11.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発行者名 The Psychoneuroimmunology Research Society 刊行物名 13▲th▼ Annual Meeting of The Psychoneuroimmunology Research Society Meeting Programme and Abstract book 発行日 2006年5月31日
【出願人】(000236436)浜松ホトニクス株式会社 (1,479)
【出願人】(506397523)

【Fターム(参考)】
[ Back to top ]

