スフェロイド形成促進剤
【課題】簡便にスフェロイド形態に培養可能な促進剤を提供すること。
【解決手段】 粘膜質の体表皮を有する所定の魚類の、表皮から筋肉組織までの部位より採取された体液を用いたことを特徴とするスフェロイド形成促進剤である。特に、ノロゲンゲ、タナカゲンゲ、カレイを用いた体液が好ましい。また、イカやタコの胴部の内面にある体液または肝臓から採取された体液を用いたことを特徴とするスフェロイド形成促進剤である。採取は、圧搾もしくは遠心分離して得られる体液、または、凍結融解によるドリップによることができる。
【解決手段】 粘膜質の体表皮を有する所定の魚類の、表皮から筋肉組織までの部位より採取された体液を用いたことを特徴とするスフェロイド形成促進剤である。特に、ノロゲンゲ、タナカゲンゲ、カレイを用いた体液が好ましい。また、イカやタコの胴部の内面にある体液または肝臓から採取された体液を用いたことを特徴とするスフェロイド形成促進剤である。採取は、圧搾もしくは遠心分離して得られる体液、または、凍結融解によるドリップによることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、スフェロイド形成促進剤に関し、特に、培養液に所定濃度添加するだけで肝臓細胞等を簡便にスフェロイド形態に培養可能な促進剤に関する。
【背景技術】
【0002】
従来、肝臓細胞はその機能を発揮させるために立体的に培養することが重要であることが知られている。このような技術として、中空糸膜上で単層培養する方法や、糖鎖高分子(PVLA)を用いる方法や、培地表面に立体加工を施し、立体的な培養を促進させる技術が知られている。
【0003】
たとえば、小出らの文献(非特許文献1)には、ほ乳類であるマウス肝臓から取り出したプロテオグリカンを利用してスフェロイド培養する技術が開示されている。なお、当技術は、肝臓細胞のスフェロイド培養を目的としているので、原料を、同一生物種の肝臓由来とすることに着眼した技術である。
【0004】
また、特表2008−501724号公報(特許文献1)は、細胞および組織の、成長、発達および分化を促進する組織組成物に関する技術が開示されている。
【0005】
しかしながら、従来の技術では以下の問題点があった。
非特許文献1に開示されるマウス肝臓を利用する技術では、そもそもプロテオグリカンの抽出が極めて困難であり、簡便に素材を得られないという問題点が存在する。また、特許文献1では、請求項4にいくつかの生物種が挙げられているが、どれが簡便に促進できる材料となりうるのか開示されていないという問題点がある。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2008−501724号公報
【非特許文献】
【0007】
【非特許文献1】koideet al 'Continued high albumin production by multicellular spheroids of adultrat hepatocytes formed in the presence of liver-derived proteoglycans ', Biochem.Biophys.Res.Comm.161(1989)385-391
【発明の概要】
【発明が解決しようとする課題】
【0008】
すなわち、解決しようとする問題点は、簡便にスフェロイド形態に培養可能な促進剤を提供することを目的とする。
【課題を解決するための手段】
【0009】
請求項1に記載のスフェロイド形成促進剤は、粘膜質の体表皮を有する所定の魚類の、表皮から筋肉組織までの部位より採取された体液を用いたことを特徴とする。
【0010】
すなわち、請求項1にかかる発明は、簡便にスフェロイド形態に培養可能な促進剤を提供することが可能となる。
【0011】
なお、粘膜質とは、単に滑りがいいというだけでなく、俗にぬるぬるしているという様子を含むものである。表皮から筋肉組織までとは、筋肉組織の外側を意味する(若干の筋肉組織がふくまれていてもよいものとする)。体液は広義であって、当該間隙に存在する物質総てを含む。体液を用いるとは、体液由来と表現することもできる。
【0012】
請求項2に記載のスフェロイド形成促進剤は、請求項1に記載のスフェロイド形成促進剤において、前記体液が、前記部位を圧搾もしくは遠心分離して得られる体液、または、前記部位を凍結融解によるドリップとして得られる体液であることを特徴とする。
【0013】
すなわち、請求項2にかかる発明は、何段階も分離抽出工程を経ることなく、簡便な操作で体液を得ることができる。
【0014】
なお、圧搾には、削ぎ取るまたは掻き取るような操作も含まれるものとする。
【0015】
請求項3に記載のスフェロイド形成促進剤は、請求項1または2に記載のスフェロイド形成促進剤において、魚類がゲンゲ科の魚類であることを特徴とする。
【0016】
すなわち、請求項3にかかる発明は、効率的に促進剤の原料物質を採取可能となる。
【0017】
ゲンゲ科の魚類として、たとえば、ノロゲンゲ、タナカゲンゲを挙げることができる。
【0018】
請求項4に記載のスフェロイド形成促進剤は、頭足類の胴部にある体液または肝臓から採取された体液を用いたことを特徴とする。
【0019】
すなわち、請求項4にかかる発明は、簡便にスフェロイド形態に培養可能な促進剤を提供することが可能となる。
【0020】
なお、頭足類とはイカ類タコ類を示し、胴部とは、いわゆる頭と称される部位であり、胴部にある体液とは、胴部の内側に存在する臓器・器官にある液分をいう。
【0021】
請求項5に記載のスフェロイド形成促進剤は、請求項4に記載のスフェロイド形成促進剤において、前記体液が、圧搾もしくは遠心分離して得られる体液、または、前記部位を凍結融解によるドリップとして得られる体液であることを特徴とする。
【0022】
すなわち、請求項5にかかる発明は、何段階も分離抽出工程を経ることなく、簡便な操作で体液を得ることができる。
【0023】
請求項6に記載のスフェロイド形成促進剤は、請求項1〜5のいずれか一つに記載のスフェロイド形成促進剤において、採取後に脂質を除去した体液を用いたことを特徴とする。
【0024】
すなわち、請求項6にかかる発明は、効率的に促進剤の原料物質を採取可能または促進剤の原料物質の選択肢を広げることが可能となる。ここで、魚類では、沖キス、エイのヒレ部分、頭足類では、胴部内液や肝臓を対象とすることが好ましい。
【発明の効果】
【0025】
本発明によれば、特殊なシャーレ表面加工やコーティングを必要とすることなく、簡便にスフェロイド形態に培養可能な促進剤を提供可能となる。
【図面の簡単な説明】
【0026】
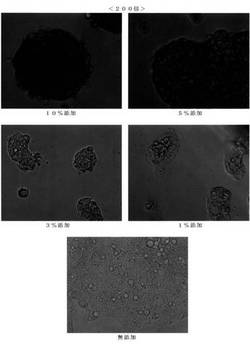
【図1−1】ノロゲンゲの体液を用いた培養結果を示した写真である(倍率40倍)。
【図1−2】ノロゲンゲの体液を用いた培養結果を示した写真である(倍率200倍)。
【図2】ノロゲンゲの体液を用いた培養物の代謝活性を測定したグラフである。
【図3−1】ベランスカレイの皮のドリップを用いた培養結果を示した写真である(倍率40倍)。
【図3−2】ベランスカレイの皮のドリップを用いた培養結果を示した写真である(倍率200倍)。
【図4】タナカゲンゲの皮のドリップを用いた培養結果を示した写真である。
【図5−1】イカの内臓のドリップ(脱脂なし)を用いた培養結果を示した写真である。
【図5−2】イカの内臓のドリップ(脱脂あり)を用いた培養結果を示した写真である。
【図6】イカ(全体)のドリップを用いた培養結果を示した写真である。
【発明を実施するための形態】
【0027】
以下、本発明の実施の形態を図面を参照しながら詳細に説明する。
本発明は、鳥取県にて水揚げされる魚類の新規利用を目的として、魚類由来のプロテオグリカンないしグルコサミノグリカンの抽出方法(本願出願人による特開2007−314458号)の関連研究において発見された知見に基づきなされた発明である。
【0028】
〔実施の形態1:魚類〕
まず、鳥取県で水揚げされる、ノロゲンゲ、ベランスカレイ、タナカゲンゲについて、その表皮体液にスフェロイド形成促進作用があるかを調べ、その後、他の魚種等について検討した。
【0029】
<実験例1:ノロゲンゲ>
まず、ノロゲンゲの魚皮と筋肉の間の間隙物質(粘液部分)をピペットで採取し、0.22μmのメンブランフィルターで濾過した。なお、遠心分離によってもこの体液を採取できることも別途確認した。この濾過液を、細胞培養液DMEM−10%FBSに1wt%〜10wt%添加し、肝臓ガン細胞HepG2細胞を72時間培養した。なお、添加の効果を見るため、無添加のものでも培養をおこなった。
【0030】
培養結果を図1に示す。写真から明らかなように、何れもスフェロイド形態に培養されていた。1wt%添加では、スフェロイド形態とそうでないものが混在する程度であるが、3wt%添加〜10wt%添加では、明瞭なスフェロイド形成が確認できる。特に5wt%と10wt%では、大きな塊として培養されていた。
【0031】
代謝活性を確認するため、72時間培養後の細胞のアルブミン量を測定した。結果を図2に示す。総じて体液添加により代謝活性も良好であることが確認できた。10%添加では、アルブミンは無添加のものに比して量が少なかったが、図1の結果も考慮すると、スフェロイド形成は良好であるので、一定増殖以降は細胞の死滅が進んだものと推定された。
【0032】
以上の結果より、ノロゲンゲの表皮裏の体液は簡便に採取でき、かつ、添加量が多い場合には培養時間の調整が必要ではあるものの1wt%〜10wt%を添加するだけで肝細胞をスフェロイド培養することが可能であることがわかった。好ましくは、3wt%〜5wt%の添加である。
【0033】
<実験例2:ベランスカレイ>
次に、ベランスカレイ(ヒレグロカレイ)の皮を用いて実験をおこなった。ベランスカレイも粘膜質の体表皮を有するが、ノロゲンゲほど豊富には体液がないので、凍結融解による体液採取を試みた。皮25gを剥ぎ取って−40℃に凍結し、2週間後に解凍した。凍結融解時に出てくる液体、すなわちドリップは9.8g得られた。ドリップを遠心分離し、上澄み部分をメンブラン濾過した。濾過液をDMEM−10%FBSに0.5wt%〜10wt%添加し、HepG2細胞を70時間培養した。
【0034】
培養結果を図3に示す。写真から明らかなように、3wt%添加〜10wt%添加では、明瞭なスフェロイド形成が確認できる。以上から、簡便な凍結融解によってもスフェロイド形成促進物質が得られることがわかった。
【0035】
<実験例3:タナカゲンゲ>
次に、タナカゲンゲの皮を用いて実験をおこなった。なお、タナカゲンゲも表皮に特有のヌメリがある。まず、皮(若干の筋肉組織を含む)117gを凍結融解し、ドリップ24.5gを得た。これを遠心分離し、上澄み部分をメンブランフィルターで濾過滅菌をおこなった。濾過液をDMEM−10%FBSに0.3wt%〜10wt%添加し、HepG2細胞を72時間培養した。
【0036】
培養結果を図4に示す。写真から明らかなように、0.3wt%添加〜3wt%添加では、明瞭なスフェロイド形成が確認できる。なお、5wt%以上添加するとスフェロイド化の傾向があるものの細胞死が生じていることを確認した。
【0037】
<実験例4:各種魚類およびマグロ肝臓(脱脂処理なし)>
次に、実験1〜3と同様な表皮性状を有する沖キス(ニギス)の全体、ハタハタの全体、エイ(可食部すなわちヒレ部分の切り身)、タラ(皮のみ。ただし、若干の筋肉組織を含む)を用いて実験をおこなった。また、マグロ(肝臓のみ。すりつぶすことなどせず、そのまま冷凍)を用いて実験をおこなった。実験は、材料それぞれを凍結融解してドリップを取り出し、遠心分離後、上澄み部分をメンブランフィルター滅菌した。この濾過液をDMEM−10%FBSに1wt%、3wt%、5wt%、10wt%添加し、HepG2細胞のスフェロイド化を観察した。
【0038】
表1に結果を示す。
(表1)

△△:スフェロイド微妙であって細胞死を含む状態
△:スフェロイド判定微妙
×:スフェロイドなし
【0039】
上記の表から、粘膜質の体表皮を有する魚であっても、必ずしもスフェロイド形成が効率的に促進される訳ではないことがわかった。また、沖キスやハタハタに関しては、可食部も含む魚全体のドリップを用いたが、実験1〜3の結果、および、エイとタラの結果を見ると、スフェロイド培養に有効なのは、皮部分の粘膜質体液であることがわかる。
【0040】
また、マグロ肝臓に関しては、1wt%の添加の場合を考慮しても、スフェロイド培養は現実的でないことがわかった。これは、ほ乳類であるマウスの肝臓由来のスフェロイド培養が可能である従来技術を考慮すると、単に同様の部位を用いるだけでは、スフェロイド形成が可能であると予見できないことを意味し、むしろ魚類については、スフェロイド形成が困難であることを示唆するものであるといえ、ゲンゲ類、カレイ類では、想定外の促進作用があることが裏付けられた驚くべき結果といえる。
【0041】
<実験例5:各種魚類およびマグロ肝臓(脱脂処理あり)>
次に、実験例5で用いたドリップをエーテル処理して脱脂し遠心分離して脂質部分を除去した液分で実験をおこなった。なお、エーテル分については、臭いが抜けるまで、アスピレーターで揮発させた。3日培養のものと、14日培養のものの結果を、それぞれ、表2および3に示す。
【0042】
(表2) エーテル処理→3日培養

○:スフェロイド明瞭
△△:スフェロイド微妙であって細胞死を含む状態
△:スフェロイド判定微妙
×:スフェロイドなし
【0043】
(表3) エーテル処理→14日培養

○:スフェロイド明瞭
△△:スフェロイド微妙であって細胞死を含む状態
△:スフェロイド判定微妙
×:スフェロイドなし
【0044】
上記の結果から、沖キスは、添加濃度と培養日数に調整が必要なものの、スフェロイド培養が可能であり、エイのヒレ部分は、広範な濃度域にわたってスフェロイド培養が可能であることが分かる。すなわち、魚種によっては脂質除去がスフェロイド化のために有効であることが確認できた。
【0045】
〔実施の形態2:頭足類〕
次に、鳥取県で水揚げされる、イカ・タコの頭足類から得られる体液にスフェロイド形成促進作用があるかを調べた。
【0046】
<実験例6:イカ内臓(脱脂あり/なし)>
イカの内臓(主に肝臓)76gを−40℃に冷凍し、8日後に解凍して3gのドリップを得た。これを遠心分離して固形物を除去した。液体分を二つに分け、一つはそのまま、もう一つはエーテル処理して脱脂し遠心分離して脂質部分を除去した液分で実験をおこなった。なお、後者については、臭いが抜けるまで、アスピレーターでエーテル分を揮発除去した。
【0047】
実施の形態1と同様に、この液分を、細胞培養液DMEM−10%FBSに添加し、肝臓ガン細胞HepG2細胞を72時間培養した。脱脂しない液については、0.1wt%〜1.0wt%の添加、脱脂した液については、0.3wt%〜10wt%の添加で実験をおこなった。
【0048】
それぞれについて、培養結果を図5に示す。脱脂しないものについては、0.3wt〜0.5wt%の添加量でスフェロイド形成が確認され、それ以上では細胞はほとんど細胞死を起こしていた。一方、脱脂した液については、スフェロイド化が0.5wt%〜5wt%で確認された。これから、脂質除去がスフェロイド化のために有効であることがわかった。
【0049】
<実験例7:イカ全体>
次に、イカ(全体)の凍結融解液の効果を確認した。イカ212gから凍結融解により3.2gのドリップを得、遠心分離後上澄みをメンブランフィルター滅菌した。この液を同様に3wt%〜10wt%添加した結果を図6に示す(72時間培養)。10wt%添加では細胞死も同時に起こっており、3wt%〜5wt%の添加でスフェロイド化が生じていることがわかる。
【0050】
<実験例8:タコ>
イカのドリップでスフェロイド化することがわかったので、タコのドリップを検討することとした。タコの胴部(俗に頭と称される)可食部(筋肉および皮)97g並びに肝臓76gを凍結融解して、それぞれ5.3g並びに9.9gのドリップを得た。遠心分離した上澄みをメンブランフィルター滅菌した。このドリップを0.3wt〜10wt%培養液に添加し、HepG2細胞のスフェロイド化を観察した。また、凍結融解させないで胴内から採取できる体液を掻き出し、同様に培養実験をおこなった。
【0051】
結果を表4に示す。
(表4)

○:スフェロイド
△:スフェロイド判定微妙
×:スフェロイドなし
【0052】
タコの場合、胴部の内液並びに肝臓でスフェロイドが確認された。具体的には、胴部の内液で1wt%〜10wt%添加、肝臓ドリップで0.5wt%〜5wt%添加でスフェロイドが確認できた。なお、肝臓由来では10wt%の添加では細胞死が確認された。また、胴部の可食部のみのドリップでは、スフェロイドは明瞭に判別できなかった。
【0053】
以上説明したように、特定の魚類および頭足類の所定体液がスフェロイド形成促進剤として利用できることが確認できた。また、これらの体液は、掻き出しや凍結融解のドリップとして簡便に得られることも確認できた。本発明は、所定の魚類の、表皮から筋肉組織までの部位または魚全体から採取された体液を用いたことを特徴とするスフェロイド形成促進剤ということができ、また、頭足類の胴部にある体液または肝臓から採取された体液を用いたことを特徴とするスフェロイド形成促進剤ということができる。
【産業上の利用可能性】
【0054】
スフェロイド培養技術については、増殖因子の添加、特殊な高分子物質、シャーレの加工などの技術が開発されているが、本発明によれば、特定の魚の体液、ドリップなどの利用により容易にスフェロイドを作成することが可能となる。実験した例から、未利用資源を原料とすることができることが確認された。
【技術分野】
【0001】
本発明は、スフェロイド形成促進剤に関し、特に、培養液に所定濃度添加するだけで肝臓細胞等を簡便にスフェロイド形態に培養可能な促進剤に関する。
【背景技術】
【0002】
従来、肝臓細胞はその機能を発揮させるために立体的に培養することが重要であることが知られている。このような技術として、中空糸膜上で単層培養する方法や、糖鎖高分子(PVLA)を用いる方法や、培地表面に立体加工を施し、立体的な培養を促進させる技術が知られている。
【0003】
たとえば、小出らの文献(非特許文献1)には、ほ乳類であるマウス肝臓から取り出したプロテオグリカンを利用してスフェロイド培養する技術が開示されている。なお、当技術は、肝臓細胞のスフェロイド培養を目的としているので、原料を、同一生物種の肝臓由来とすることに着眼した技術である。
【0004】
また、特表2008−501724号公報(特許文献1)は、細胞および組織の、成長、発達および分化を促進する組織組成物に関する技術が開示されている。
【0005】
しかしながら、従来の技術では以下の問題点があった。
非特許文献1に開示されるマウス肝臓を利用する技術では、そもそもプロテオグリカンの抽出が極めて困難であり、簡便に素材を得られないという問題点が存在する。また、特許文献1では、請求項4にいくつかの生物種が挙げられているが、どれが簡便に促進できる材料となりうるのか開示されていないという問題点がある。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2008−501724号公報
【非特許文献】
【0007】
【非特許文献1】koideet al 'Continued high albumin production by multicellular spheroids of adultrat hepatocytes formed in the presence of liver-derived proteoglycans ', Biochem.Biophys.Res.Comm.161(1989)385-391
【発明の概要】
【発明が解決しようとする課題】
【0008】
すなわち、解決しようとする問題点は、簡便にスフェロイド形態に培養可能な促進剤を提供することを目的とする。
【課題を解決するための手段】
【0009】
請求項1に記載のスフェロイド形成促進剤は、粘膜質の体表皮を有する所定の魚類の、表皮から筋肉組織までの部位より採取された体液を用いたことを特徴とする。
【0010】
すなわち、請求項1にかかる発明は、簡便にスフェロイド形態に培養可能な促進剤を提供することが可能となる。
【0011】
なお、粘膜質とは、単に滑りがいいというだけでなく、俗にぬるぬるしているという様子を含むものである。表皮から筋肉組織までとは、筋肉組織の外側を意味する(若干の筋肉組織がふくまれていてもよいものとする)。体液は広義であって、当該間隙に存在する物質総てを含む。体液を用いるとは、体液由来と表現することもできる。
【0012】
請求項2に記載のスフェロイド形成促進剤は、請求項1に記載のスフェロイド形成促進剤において、前記体液が、前記部位を圧搾もしくは遠心分離して得られる体液、または、前記部位を凍結融解によるドリップとして得られる体液であることを特徴とする。
【0013】
すなわち、請求項2にかかる発明は、何段階も分離抽出工程を経ることなく、簡便な操作で体液を得ることができる。
【0014】
なお、圧搾には、削ぎ取るまたは掻き取るような操作も含まれるものとする。
【0015】
請求項3に記載のスフェロイド形成促進剤は、請求項1または2に記載のスフェロイド形成促進剤において、魚類がゲンゲ科の魚類であることを特徴とする。
【0016】
すなわち、請求項3にかかる発明は、効率的に促進剤の原料物質を採取可能となる。
【0017】
ゲンゲ科の魚類として、たとえば、ノロゲンゲ、タナカゲンゲを挙げることができる。
【0018】
請求項4に記載のスフェロイド形成促進剤は、頭足類の胴部にある体液または肝臓から採取された体液を用いたことを特徴とする。
【0019】
すなわち、請求項4にかかる発明は、簡便にスフェロイド形態に培養可能な促進剤を提供することが可能となる。
【0020】
なお、頭足類とはイカ類タコ類を示し、胴部とは、いわゆる頭と称される部位であり、胴部にある体液とは、胴部の内側に存在する臓器・器官にある液分をいう。
【0021】
請求項5に記載のスフェロイド形成促進剤は、請求項4に記載のスフェロイド形成促進剤において、前記体液が、圧搾もしくは遠心分離して得られる体液、または、前記部位を凍結融解によるドリップとして得られる体液であることを特徴とする。
【0022】
すなわち、請求項5にかかる発明は、何段階も分離抽出工程を経ることなく、簡便な操作で体液を得ることができる。
【0023】
請求項6に記載のスフェロイド形成促進剤は、請求項1〜5のいずれか一つに記載のスフェロイド形成促進剤において、採取後に脂質を除去した体液を用いたことを特徴とする。
【0024】
すなわち、請求項6にかかる発明は、効率的に促進剤の原料物質を採取可能または促進剤の原料物質の選択肢を広げることが可能となる。ここで、魚類では、沖キス、エイのヒレ部分、頭足類では、胴部内液や肝臓を対象とすることが好ましい。
【発明の効果】
【0025】
本発明によれば、特殊なシャーレ表面加工やコーティングを必要とすることなく、簡便にスフェロイド形態に培養可能な促進剤を提供可能となる。
【図面の簡単な説明】
【0026】
【図1−1】ノロゲンゲの体液を用いた培養結果を示した写真である(倍率40倍)。
【図1−2】ノロゲンゲの体液を用いた培養結果を示した写真である(倍率200倍)。
【図2】ノロゲンゲの体液を用いた培養物の代謝活性を測定したグラフである。
【図3−1】ベランスカレイの皮のドリップを用いた培養結果を示した写真である(倍率40倍)。
【図3−2】ベランスカレイの皮のドリップを用いた培養結果を示した写真である(倍率200倍)。
【図4】タナカゲンゲの皮のドリップを用いた培養結果を示した写真である。
【図5−1】イカの内臓のドリップ(脱脂なし)を用いた培養結果を示した写真である。
【図5−2】イカの内臓のドリップ(脱脂あり)を用いた培養結果を示した写真である。
【図6】イカ(全体)のドリップを用いた培養結果を示した写真である。
【発明を実施するための形態】
【0027】
以下、本発明の実施の形態を図面を参照しながら詳細に説明する。
本発明は、鳥取県にて水揚げされる魚類の新規利用を目的として、魚類由来のプロテオグリカンないしグルコサミノグリカンの抽出方法(本願出願人による特開2007−314458号)の関連研究において発見された知見に基づきなされた発明である。
【0028】
〔実施の形態1:魚類〕
まず、鳥取県で水揚げされる、ノロゲンゲ、ベランスカレイ、タナカゲンゲについて、その表皮体液にスフェロイド形成促進作用があるかを調べ、その後、他の魚種等について検討した。
【0029】
<実験例1:ノロゲンゲ>
まず、ノロゲンゲの魚皮と筋肉の間の間隙物質(粘液部分)をピペットで採取し、0.22μmのメンブランフィルターで濾過した。なお、遠心分離によってもこの体液を採取できることも別途確認した。この濾過液を、細胞培養液DMEM−10%FBSに1wt%〜10wt%添加し、肝臓ガン細胞HepG2細胞を72時間培養した。なお、添加の効果を見るため、無添加のものでも培養をおこなった。
【0030】
培養結果を図1に示す。写真から明らかなように、何れもスフェロイド形態に培養されていた。1wt%添加では、スフェロイド形態とそうでないものが混在する程度であるが、3wt%添加〜10wt%添加では、明瞭なスフェロイド形成が確認できる。特に5wt%と10wt%では、大きな塊として培養されていた。
【0031】
代謝活性を確認するため、72時間培養後の細胞のアルブミン量を測定した。結果を図2に示す。総じて体液添加により代謝活性も良好であることが確認できた。10%添加では、アルブミンは無添加のものに比して量が少なかったが、図1の結果も考慮すると、スフェロイド形成は良好であるので、一定増殖以降は細胞の死滅が進んだものと推定された。
【0032】
以上の結果より、ノロゲンゲの表皮裏の体液は簡便に採取でき、かつ、添加量が多い場合には培養時間の調整が必要ではあるものの1wt%〜10wt%を添加するだけで肝細胞をスフェロイド培養することが可能であることがわかった。好ましくは、3wt%〜5wt%の添加である。
【0033】
<実験例2:ベランスカレイ>
次に、ベランスカレイ(ヒレグロカレイ)の皮を用いて実験をおこなった。ベランスカレイも粘膜質の体表皮を有するが、ノロゲンゲほど豊富には体液がないので、凍結融解による体液採取を試みた。皮25gを剥ぎ取って−40℃に凍結し、2週間後に解凍した。凍結融解時に出てくる液体、すなわちドリップは9.8g得られた。ドリップを遠心分離し、上澄み部分をメンブラン濾過した。濾過液をDMEM−10%FBSに0.5wt%〜10wt%添加し、HepG2細胞を70時間培養した。
【0034】
培養結果を図3に示す。写真から明らかなように、3wt%添加〜10wt%添加では、明瞭なスフェロイド形成が確認できる。以上から、簡便な凍結融解によってもスフェロイド形成促進物質が得られることがわかった。
【0035】
<実験例3:タナカゲンゲ>
次に、タナカゲンゲの皮を用いて実験をおこなった。なお、タナカゲンゲも表皮に特有のヌメリがある。まず、皮(若干の筋肉組織を含む)117gを凍結融解し、ドリップ24.5gを得た。これを遠心分離し、上澄み部分をメンブランフィルターで濾過滅菌をおこなった。濾過液をDMEM−10%FBSに0.3wt%〜10wt%添加し、HepG2細胞を72時間培養した。
【0036】
培養結果を図4に示す。写真から明らかなように、0.3wt%添加〜3wt%添加では、明瞭なスフェロイド形成が確認できる。なお、5wt%以上添加するとスフェロイド化の傾向があるものの細胞死が生じていることを確認した。
【0037】
<実験例4:各種魚類およびマグロ肝臓(脱脂処理なし)>
次に、実験1〜3と同様な表皮性状を有する沖キス(ニギス)の全体、ハタハタの全体、エイ(可食部すなわちヒレ部分の切り身)、タラ(皮のみ。ただし、若干の筋肉組織を含む)を用いて実験をおこなった。また、マグロ(肝臓のみ。すりつぶすことなどせず、そのまま冷凍)を用いて実験をおこなった。実験は、材料それぞれを凍結融解してドリップを取り出し、遠心分離後、上澄み部分をメンブランフィルター滅菌した。この濾過液をDMEM−10%FBSに1wt%、3wt%、5wt%、10wt%添加し、HepG2細胞のスフェロイド化を観察した。
【0038】
表1に結果を示す。
(表1)

△△:スフェロイド微妙であって細胞死を含む状態
△:スフェロイド判定微妙
×:スフェロイドなし
【0039】
上記の表から、粘膜質の体表皮を有する魚であっても、必ずしもスフェロイド形成が効率的に促進される訳ではないことがわかった。また、沖キスやハタハタに関しては、可食部も含む魚全体のドリップを用いたが、実験1〜3の結果、および、エイとタラの結果を見ると、スフェロイド培養に有効なのは、皮部分の粘膜質体液であることがわかる。
【0040】
また、マグロ肝臓に関しては、1wt%の添加の場合を考慮しても、スフェロイド培養は現実的でないことがわかった。これは、ほ乳類であるマウスの肝臓由来のスフェロイド培養が可能である従来技術を考慮すると、単に同様の部位を用いるだけでは、スフェロイド形成が可能であると予見できないことを意味し、むしろ魚類については、スフェロイド形成が困難であることを示唆するものであるといえ、ゲンゲ類、カレイ類では、想定外の促進作用があることが裏付けられた驚くべき結果といえる。
【0041】
<実験例5:各種魚類およびマグロ肝臓(脱脂処理あり)>
次に、実験例5で用いたドリップをエーテル処理して脱脂し遠心分離して脂質部分を除去した液分で実験をおこなった。なお、エーテル分については、臭いが抜けるまで、アスピレーターで揮発させた。3日培養のものと、14日培養のものの結果を、それぞれ、表2および3に示す。
【0042】
(表2) エーテル処理→3日培養

○:スフェロイド明瞭
△△:スフェロイド微妙であって細胞死を含む状態
△:スフェロイド判定微妙
×:スフェロイドなし
【0043】
(表3) エーテル処理→14日培養

○:スフェロイド明瞭
△△:スフェロイド微妙であって細胞死を含む状態
△:スフェロイド判定微妙
×:スフェロイドなし
【0044】
上記の結果から、沖キスは、添加濃度と培養日数に調整が必要なものの、スフェロイド培養が可能であり、エイのヒレ部分は、広範な濃度域にわたってスフェロイド培養が可能であることが分かる。すなわち、魚種によっては脂質除去がスフェロイド化のために有効であることが確認できた。
【0045】
〔実施の形態2:頭足類〕
次に、鳥取県で水揚げされる、イカ・タコの頭足類から得られる体液にスフェロイド形成促進作用があるかを調べた。
【0046】
<実験例6:イカ内臓(脱脂あり/なし)>
イカの内臓(主に肝臓)76gを−40℃に冷凍し、8日後に解凍して3gのドリップを得た。これを遠心分離して固形物を除去した。液体分を二つに分け、一つはそのまま、もう一つはエーテル処理して脱脂し遠心分離して脂質部分を除去した液分で実験をおこなった。なお、後者については、臭いが抜けるまで、アスピレーターでエーテル分を揮発除去した。
【0047】
実施の形態1と同様に、この液分を、細胞培養液DMEM−10%FBSに添加し、肝臓ガン細胞HepG2細胞を72時間培養した。脱脂しない液については、0.1wt%〜1.0wt%の添加、脱脂した液については、0.3wt%〜10wt%の添加で実験をおこなった。
【0048】
それぞれについて、培養結果を図5に示す。脱脂しないものについては、0.3wt〜0.5wt%の添加量でスフェロイド形成が確認され、それ以上では細胞はほとんど細胞死を起こしていた。一方、脱脂した液については、スフェロイド化が0.5wt%〜5wt%で確認された。これから、脂質除去がスフェロイド化のために有効であることがわかった。
【0049】
<実験例7:イカ全体>
次に、イカ(全体)の凍結融解液の効果を確認した。イカ212gから凍結融解により3.2gのドリップを得、遠心分離後上澄みをメンブランフィルター滅菌した。この液を同様に3wt%〜10wt%添加した結果を図6に示す(72時間培養)。10wt%添加では細胞死も同時に起こっており、3wt%〜5wt%の添加でスフェロイド化が生じていることがわかる。
【0050】
<実験例8:タコ>
イカのドリップでスフェロイド化することがわかったので、タコのドリップを検討することとした。タコの胴部(俗に頭と称される)可食部(筋肉および皮)97g並びに肝臓76gを凍結融解して、それぞれ5.3g並びに9.9gのドリップを得た。遠心分離した上澄みをメンブランフィルター滅菌した。このドリップを0.3wt〜10wt%培養液に添加し、HepG2細胞のスフェロイド化を観察した。また、凍結融解させないで胴内から採取できる体液を掻き出し、同様に培養実験をおこなった。
【0051】
結果を表4に示す。
(表4)

○:スフェロイド
△:スフェロイド判定微妙
×:スフェロイドなし
【0052】
タコの場合、胴部の内液並びに肝臓でスフェロイドが確認された。具体的には、胴部の内液で1wt%〜10wt%添加、肝臓ドリップで0.5wt%〜5wt%添加でスフェロイドが確認できた。なお、肝臓由来では10wt%の添加では細胞死が確認された。また、胴部の可食部のみのドリップでは、スフェロイドは明瞭に判別できなかった。
【0053】
以上説明したように、特定の魚類および頭足類の所定体液がスフェロイド形成促進剤として利用できることが確認できた。また、これらの体液は、掻き出しや凍結融解のドリップとして簡便に得られることも確認できた。本発明は、所定の魚類の、表皮から筋肉組織までの部位または魚全体から採取された体液を用いたことを特徴とするスフェロイド形成促進剤ということができ、また、頭足類の胴部にある体液または肝臓から採取された体液を用いたことを特徴とするスフェロイド形成促進剤ということができる。
【産業上の利用可能性】
【0054】
スフェロイド培養技術については、増殖因子の添加、特殊な高分子物質、シャーレの加工などの技術が開発されているが、本発明によれば、特定の魚の体液、ドリップなどの利用により容易にスフェロイドを作成することが可能となる。実験した例から、未利用資源を原料とすることができることが確認された。
【特許請求の範囲】
【請求項1】
粘膜質の体表皮を有する所定の魚類の、表皮から筋肉組織までの部位より採取された体液を用いたことを特徴とするスフェロイド形成促進剤。
【請求項2】
前記体液が、前記部位を圧搾もしくは遠心分離して得られる体液、または、前記部位を凍結融解によるドリップとして得られる体液であることを特徴とする請求項1に記載のスフェロイド形成促進剤。
【請求項3】
魚類がゲンゲ科の魚類であることを特徴とする請求項1または2に記載のスフェロイド形成促進剤。
【請求項4】
頭足類の胴部にある体液または肝臓から採取された体液を用いたことを特徴とするスフェロイド形成促進剤。
【請求項5】
前記体液が、圧搾もしくは遠心分離して得られる体液、または、前記部位を凍結融解によるドリップとして得られる体液であることを特徴とする請求項4に記載のスフェロイド形成促進剤。
【請求項6】
採取後に脂質を除去した体液を用いたことを特徴とする請求項1〜5のいずれか一つに記載のスフェロイド形成促進剤。
【請求項1】
粘膜質の体表皮を有する所定の魚類の、表皮から筋肉組織までの部位より採取された体液を用いたことを特徴とするスフェロイド形成促進剤。
【請求項2】
前記体液が、前記部位を圧搾もしくは遠心分離して得られる体液、または、前記部位を凍結融解によるドリップとして得られる体液であることを特徴とする請求項1に記載のスフェロイド形成促進剤。
【請求項3】
魚類がゲンゲ科の魚類であることを特徴とする請求項1または2に記載のスフェロイド形成促進剤。
【請求項4】
頭足類の胴部にある体液または肝臓から採取された体液を用いたことを特徴とするスフェロイド形成促進剤。
【請求項5】
前記体液が、圧搾もしくは遠心分離して得られる体液、または、前記部位を凍結融解によるドリップとして得られる体液であることを特徴とする請求項4に記載のスフェロイド形成促進剤。
【請求項6】
採取後に脂質を除去した体液を用いたことを特徴とする請求項1〜5のいずれか一つに記載のスフェロイド形成促進剤。
【図2】


【図1−1】


【図1−2】


【図3−1】


【図3−2】


【図4】


【図5−1】


【図5−2】


【図6】




【図1−1】


【図1−2】


【図3−1】


【図3−2】


【図4】


【図5−1】


【図5−2】


【図6】


【公開番号】特開2011−62129(P2011−62129A)
【公開日】平成23年3月31日(2011.3.31)
【国際特許分類】
【出願番号】特願2009−215142(P2009−215142)
【出願日】平成21年9月17日(2009.9.17)
【出願人】(307016180)地方独立行政法人鳥取県産業技術センター (32)
【Fターム(参考)】
【公開日】平成23年3月31日(2011.3.31)
【国際特許分類】
【出願日】平成21年9月17日(2009.9.17)
【出願人】(307016180)地方独立行政法人鳥取県産業技術センター (32)
【Fターム(参考)】
[ Back to top ]

