スペクトル情報を使用して、分析対象物の濃度を決定する、非侵襲的方法
分析対象物の濃度を決定する非侵襲的方法は、ラマンスペクトル情報または蛍光スペクトル情報を使用する。高強度帯の光は皮膚組織の一つの側に適用される。高強度の光は皮膚組織に進入し、そしてラマンシグナルまたは蛍光シグナルを生成する。ラマン-生成物質または蛍光-生成物質は、皮膚組織のその他の側の近傍の位置に配置される。ラマン-生成物質または蛍光-生成物質は、一般に、適用される高強度の光の進入の反対側に配置される。ラマンシグナルまたは蛍光シグナルは、回収され、そして、回収されたラマンシグナルを使用して、分析対象物の濃度が決定される。
【発明の詳細な説明】
【技術分野】
【0001】
[0001] 本発明は、一般に、分析対象物の濃度を決定する方法に関連する。さらに具体的にには、本発明は、スペクトル情報(例えば、ラマンまたは蛍光)を使用して、分析対象物の濃度を決定する非侵襲的方法に関するものである。
【背景技術】
【0002】
[0002] 体液中の分析対象物の定量は、特定の生理的異常の診断および維持において非常に重要である。例えば、乳酸塩、コレステロール、およびビリルビンは、特定の個体においては、モニタリングされるべきである。特に、体液中のグルコースレベルを頻繁に検査して、食餌中のグルコースの取り込みを調節しなければならない糖尿病個体においては、体液中のグルコースの測定は重要である。そのような試験の結果を使用して、もしあれば、インスリンまたは他の薬剤を投与する必要があることを決定することができる。
【0003】
[0003] 例えばグルコースの分析対象物濃度の決定は、通常、侵襲的方法により行われる。非侵襲的方法を使用することにより、分析対象物の濃度を決定することが望ましいだろう。
【0004】
[0004] 非侵襲的方法は、異なるタイプのシグナルを使用することを取り入れて、分析対象物の濃度を決定することができる。シグナルの一つのタイプは、ラマンスペクトルシグナルである。しかしながら、ラマンスペクトル情報の使用は、シグナルが非常に弱い傾向があるために、非侵襲的な分析対象物の濃度の決定において、用途が限定されてきた。皮膚から回収されるラマンシグナルが非常に弱いことの原因となる、いくつかの因子がある。一つの因子は、組織に光損傷を引き起こすことなく安全に組織に伝達することができる限られた量の高強度エネルギーである。二番目の因子は、分析的および生理学的に注目するほとんどの分子に特有の、限られたラマン散乱効率である。三番目の因子は、組織に効率的に伝達できるエネルギーの量、および、組織から回収できるラマンスペクトル情報の量を限定する、組織の散乱特性および吸収特性である。
【0005】
[0005] 別のタイプのシグナルは、蛍光シグナルであり、これもラマンシグナルと同様に不都合な点を有する。蛍光シグナルは、実際は、ラマンシグナルよりも一般的である。注目する蛍光分子は、望まれるよりも数が少ない可能性がある。組織の散乱特性および吸収特性が、効率的に組織に伝達することができるエネルギーの量、および、組織から回収できる蛍光スペクトル情報の量を制限する。
【0006】
[0006] 組織の基本的な二つの光学的特性である光学的吸収および組織散乱は、グルコースなどの分析対象物の非侵襲的検出の間に、過渡的である(transient)可能性がある。光学的吸収および組織散乱は、グルコース濃度測定に影響する可能性がある。
【0007】
[0007] より正確に分析対象物の濃度を決定する、ラマンスペクトル情報または蛍光スペクトル情報などの、スペクトル情報を用いる非侵襲的方法の開発が望ましいだろう。
【発明の概要】
【0008】
[0008] 一つの非侵襲的方法によると、分析対象物の濃度は、ラマンスペクトル情報を使用して決定される。高強度で狭帯域の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして、ラマンシグナルを生成する。ラマン-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。高強度の光は、ラマン-生成物質により反射され、それにより皮膚組織を通して皮膚組織の第一の側へと通過する、追加のラマンシグナルが生成される。皮膚組織に進入する高強度の光から生成されるラマンシグナルは、ラマン-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質から生成される追加のラマンシグナルが回収される。回収されたラマンシグナルに由来する情報を使用して、分析対象物の濃度が決定される。
【0009】
[0009] 別の非侵襲的方法によると、ラマンスペクトル情報を使用して診断が決定される。高強度で狭帯域の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして、ラマンシグナルを生成する。ラマン-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。高強度の光は、ラマン-生成物質により反射され、それにより皮膚組織を介して皮膚組織の第一の側へと通過する、追加のラマンシグナルが生成される。皮膚組織に進入する高強度の光から生成されるラマンシグナルは、ラマン-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質から生成される追加のラマンシグナルが回収される。回収されたラマンシグナル由来の情報は、総合診断を行うために使用される。
【0010】
[0010] さらなる非侵襲的方法によると、ラマンスペクトル情報を使用して分析対象物の濃度が決定される。皮膚組織の領域がつままれる。ラマン-生成物質が、つままれた皮膚組織の近傍または周辺に配置される。ラマン-生成物質は、それゆえに、少なくとも一つの開口部を形成する。高強度で狭帯域の光は、少なくとも一つの開口部を通って皮膚組織に適用される。高強度の光は皮膚組織に進入し、そして、ラマンシグナルを生成する。つままれた皮膚組織を通過する高強度の光およびラマンシグナルは、ラマン-生成物質を介してつままれた皮膚組織へと反射されて戻る。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質より生成される追加のラマンシグナルが回収される。回収されたラマンシグナルを使用して分析対象物の濃度が決定される。
【0011】
[0011] 非侵襲的方法によると、分析対象物の濃度は、蛍光スペクトル情報を使用して決定される。高強度で狭帯域の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして蛍光シグナルを生成する。蛍光-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。高強度の光は、蛍光-生成物質により反射され、それにより皮膚組織を通して皮膚組織の第一の側へと通過する、追加の蛍光シグナルが生成される。皮膚組織に進入する高強度の光から生成される蛍光シグナルは、蛍光-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルが回収される。回収された蛍光シグナルに由来する情報を使用して、分析対象物の濃度が決定される。
【0012】
[0012] 別の非侵襲的方法によると、蛍光スペクトル情報を使用した診断が行われる。高強度の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして蛍光シグナルを生成する。蛍光-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。高強度の光は、蛍光-生成物質により反射され、それにより皮膚組織の第一の側へと皮膚組織を通過する、追加の蛍光シグナルが生成される。皮膚組織に進入する高強度の光から生成される蛍光シグナルは、蛍光-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルが回収される。回収された蛍光シグナル由来の情報は、総合診断を行うために使用される。
【0013】
[0013] さらなる非侵襲的方法によると、蛍光スペクトル情報を使用して分析対象物の濃度が決定される。皮膚組織の領域がつままれる。蛍光-生成物質が、つままれた皮膚組織の近傍または周辺に配置される。蛍光-生成物質は、それゆえに、少なくとも一つの開口部を形成する。高強度で狭帯域の光は、少なくとも一つの開口部を通って皮膚組織に適用される。高強度の光は皮膚組織に進入し、そして、蛍光シグナルを生成する。つままれた皮膚組織を通過する高強度の光および蛍光シグナルは、蛍光-生成物質を介してつままれた皮膚組織へと反射されて戻る。皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質より生成される追加の蛍光シグナルが回収される。回収された蛍光シグナルを使用して分析対象物の濃度が決定される。
【図面の簡単な説明】
【0014】
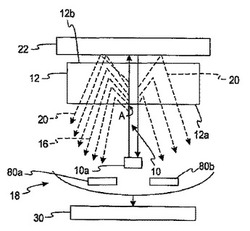
【図1】[0014] 図1は、ひとつの態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図2】[0015] 図2aは、図1の分析対象物の濃度を決定する際に使用される、空間フィルターのさらなる詳細な図解である。 [0016] 図2b、図2cは、一つの態様に従って、可動性空間フィルター(movable spatial filter)の位置を示す。
【図3】[0017] 図3は、別の態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図4】[0018] 図4は、別の態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図5】[0019] 図5aは、さらなる態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。[0020] 図5bは、さらなる態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図6】[0021] 図6aは、別の態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。[0022] 図6bは、図6aの分析対象物の濃度を決定する際に使用される空間フィルター(spatial filter)のさらなる詳細な図解である。
【図7】[0023] 図7は、さらなる態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図8】[0024] 図8は、さらに別の態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図9】[0025] 図9aは、さらなる態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。[0026] 図9bは、さらなる態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【発明を実施するための形態】
【0015】
[0027] 一つの方法において、本発明はラマンスペクトル情報を使用して分析対象物の濃度を決定するための非侵襲的な方法に関するものである。本発明は、スペクトル情報を使用するこれらの方法において、光学的スループット(optical throughput)が増加するように適応される。ラマンスペクトル情報を使用して測定することができる分析対象物には、グルコース、脂質プロフィール(例えば、コレステロール、トリグリセリド、LDL、およびHDL)、微量アルブミン、ヘモグロビンA1C、フルクトース、乳酸塩、またはビリルビンが含まれる。しかしながら本発明は、これらの特定の分析対象物には限定されず、そして、その他の分析対象物の濃度を決定することができることが、意図される。分析対象物は、例えば、全血試料中、血清試料中、血漿試料中、および、ISF(間質液)および尿中などの、その他の体液中に存在してもよい。
【0016】
[0028] 本発明は、非侵襲的な分析対象物(例えばグルコース)の検出の間、過渡的である可能性がある光学的吸収および/または組織散乱に関して補正する方法を提供することを補助する。グルコースなどの分析対象物のラマン信号(signature)を、組織中で起こる光学的吸収および組織散乱に基づいて補正することが可能である。皮膚組織の吸収および組織散乱は、短期間および長期間において変化する可能性がある。例えば、一つの限定的ではない、短期間の状況は、血流の増加、あるいは組織水和の変化であるだろう。一つの限定的ではない、長期間の条件では、個体の皮膚が褐色に焼けたり、またはさらに赤くなるほど焼ける可能性がある。皮膚組織の吸収および組織散乱は、局所化されたヘマトクリット、組織の奇形(例えば、瘢痕または黒色腫)、温度、pH、または皮膚形態などの、その他の短期間および長期間の条件下において、変化する可能性がある。
【0017】
[0029] 一つの方法によると、分析対象物の濃度は、ラマンスペクトル情報を使用して決定される。高強度で狭帯域の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そしてラマンシグナルを生成する。ラマン-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。一般的に、第二の側は第一の側の反対側に配置される。ラマン-生成物質からの高強度の光は反射されて、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成する。皮膚組織に進入する高強度の光から生成されるラマンシグナルは、ラマン-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質より生成される追加のラマンシグナルが、回収される。回収されたラマンシグナルに由来する情報を使用して、分析対象物の濃度が決定される。
【0018】
[0030] 図1を参照すると、一つの方法に従って、ラマン-生成物質および高強度で狭帯域の光の配置を示す図が使用される。高強度の光10は、つままれた皮膚組織または指などの、皮膚組織12に適用される。図1において、高強度の光10は、高強度の光源10aより生じるものとして示される。高強度の光源は、多様な光源であってよい。例えば、高強度の光源は、狭帯域において伝達される単色光源由来であって良い。単色光源の一つの例は、レーザー-ダイオード光源である。発光ダイオードおよび非干渉性(incoherent)ランプなどのその他の光源を使用することができることが意図される。光源は、より明瞭に規定された(すなわち、狭い)帯域の光を提供するために、フィルターを通すことができる。高強度の光が、色素レーザー、気体レーザー、イオンレーザー、または励起レーザーであってもよいこともまた、意図される。
【0019】
[0031] 光源の波長は、変化してもよいが、一般に、約300 nmから約10,000 nmである。光源は、適当なフィルターを伴う、紫外光源、近赤外光源、赤外光源、または可視光源であってもよい。使用されるべき光源は、高強度、狭帯域の光であろう。
【0020】
[0032] 一つの方法において、ラマンスペクトル情報を約300 nmから約12,000 nmの範囲の波長において、回収することができる。しかしながら、組織光学およびラマン効果に特有の、いくつかの波長依存的な特徴は、組織中の分析対象物の非侵襲的決定において、ラマン技術を首尾よく用いる能力に重大な影響を与えることができる。例えば、より低い波長では、組織中の分析対象物からの固有のラマンシグナルは比較的強いが、組織の自己蛍光も比較的強いので、組織中のラマンシグナルの検出を凌駕し、また、困難にする可能性がある。反対に、より高い波長では、組織の自己蛍光および固有のラマンシグナルは、減少する。光源の選択は、注目する分析対象物に関して、注目する波長での、ラマンシグナル力と自己蛍光干渉とのバランスに基づいてなされるだろう。そのため、グルコース分析において、830 nmまたは830 nm付近を中心とした高強度で狭帯域の光源を使用し、そして、ラマンシグナルの強度が組織の自己蛍光に対して最適化される、約830 nmから約1030 nmの範囲の波長におけるラマンスペクトル情報を回収することが望ましい。
【0021】
[0033] グルコースに関連するラマンスペクトル情報を、光源より100 cm-1から10,000 cm-1離れてシフトしたラマン散乱光から回収することができる。約1340 cm-1および約1125 cm-1のラマンシフトでグルコースのピークが最も強くなるため、より特異的には、グルコースに関連するラマンスペクトル情報を、光源より100 cm-1から1,600 cm-1離れてシフトしたラマン散乱光から回収することができる。特に、決定される分析対象物の濃度がグルコースでない場合は、異なる範囲においてラマンスペクトル情報を回収することができることが、意図される。
【0022】
[0034] 一つの特異的な例は、830 nmレーザー-ダイオード源である。商業的に入手可能な830 nmレーザー-ダイオード源の一つの例は、ミシガン州Ann ArborのKaiser Optical Systems, Inc.より販売される、InvictusTM NIR 830 nm ダイオードレーザーである。別の例は、ユタ州Salt Lake CityのProcess Instrumentsより販売される、PI-ECL-830-300ダイオードレーザーである。一つの態様において、レーザー光は、皮膚組織へ、約1mmビーム直径で伝達される。その他のレーザー-ダイオード源を使用することができることが、意図される。
【0023】
[0035] 高強度で狭帯域の光は、より高い分解能のラマンスペクトルを生成するために調節することができる。例えば、高強度で狭帯域の光は、より少ない光を暴露して、より高い分解能のラマンシグナルを得ることをもたらすように、制限されてもよい。高強度で狭帯域の光を調節することにより、ラマンンシグナルの強度および暴露を、注目する分析対象物に応じて最適化することができる。
【0024】
[0036] 高強度の光10は、皮膚組織12の第一の側12aに進入する。分析対象物の濃度の決定に使用することができる皮膚組織の厚さは、変化することができる。皮膚組織は一般に、約1 mmから約5 mmの厚さである。より具体的には、皮膚は一般に、約1 mmから約3 mmの厚さである。高強度の光が皮膚組織に進入する際に、皮膚組織はつままれる可能性がある。
【0025】
[0037] 図1に示されるように、高強度の光10はポイントAにおいて、皮膚組織12に進入する。高強度の光10が皮膚組織12に進入した後、ラマンシグナルが生成され、そして、すべての方向に散乱する。高強度の光の一部分は皮膚に進入することなく皮膚に接触し、そして、すべての方向に散乱する。ラマンシグナルの一部分16は、皮膚組織12に進入した後、集光光学系18へ向かって方向を変えられて戻る。しかしながら、ラマンシグナルのいくらかは皮膚組織12を抜け出て、そして、ラマン-生成物質22を使用して反射されて戻る。ラマン-生成物質22は、集光光学系18に向けてラマンシグナルを反射して戻し、それ以外は、集光光学系18の反対側である、皮膚組織12の奥側12bを抜け出て失われた。つまり、ラマンシグナルの増加した一部分は、集光光学系18へと方向を変えられるであろう。ラマンシグナルの増加した一部分を、鏡などの反射面を使用して方向を変えることができることが意図される。ラマン-生成物質により生成されるラマンシグナルの一部分は斜角で散乱されて、検出されないか、あるいは、検出される前に吸収される可能性もある。
【0026】
[0038] ラマン-生成物質22は皮膚組織12の奥側12bの近傍の位置に配置される。ラマン-生成物質は一般に、適用される高強度の光の進入の反対側に配置される。図1に示される通り、ラマン-生成物質22は図1のポイントAにおける高強度の光10の進入の反対側に配置される。ラマン-生成物質は図1に示されるような一つの反射体、あるいは複数の反射体であってよいことが、意図される。
【0027】
[0039] ラマン-生成物質22もまた、高強度の光10を受け取り、そしてそこから追加のラマンシグナルを生成する。ラマン-生成物質が高強度の光10からラマンシグナルを生成しない範囲で、ラマン-生成物質22は、高強度の光の残存部分を反射して皮膚組織12を通って戻す。ラマンシグナルは皮膚組織内のすべてのポイントから生じ、そして外側に散乱するため、これらのラマンシグナルは、通常、皮膚組織のより大きな容量を覆うであろう。この高強度の光がラマン-生成物質22を介して皮膚組織12へと反射されて戻った後、追加のラマンシグナルが生成される可能性がある。このように、源となる光が皮膚組織を二回通過することにより、光学経路は増加する。光学経路の増加により、結果として生じる分析シグナルもまた、増加する。
【0028】
[0040] ラマン-生成物質22を使用して、光学的吸収の測定を得ることができる。吸収とは、一般に、試料を通過するラマン-生成物質22からのラマンシグナルの全体量に対する比率である。ラマンシグナル全体が積分されることができる場合、分析シグナルは、組織吸収および組織散乱における変化に関して、さらに補正されることが可能である。組織吸収および組織散乱の変化は、例えば、血流の増加、または組織水和(hydration)の変化により、引き起こされる可能性がある。例えば、高強度の光のみを使用するラマン-生成物質からのラマンシグナルの強度は、ラマン生成物質および生体組織を用いる高強度の光を使用するラマンシグナルの強度と比較することができる。これらの強度の比較は組織による光学的吸収のレベルを、決定および定量することができる。光学的吸収のレベルは絶対的基準、あるいは相対的基準においてなされることができる。絶対的基準においてなされる場合、高強度の光は通常、ラマン-生成物質22に接触するときと同様の強度レベルを有するように調節される必要があるであろう。
【0029】
[0041] つまり、要約すると、(a)ラマン-生成物質22は皮膚組織の最初の通過において生成されるラマンシグナルを反射して戻し、それ以外は失われる;(b)ラマン-生成物質22は高強度の光10からラマンシグナルを生成する;そして(c)ラマン-生成物質22はラマンシグナルを生成しなかった光源を反射して、追加のラマンシグナルを生成する可能性を有する皮膚組織へと戻す。これらのラマンシグナルは、図1において一般にラマンシグナル20と示される。
【0030】
[0042] ラマン-生成物質は多様な物質により形成することができる。例えば、ラマン生成物質には、SpectralonTMポリマーライニングなどのポリマー材料が含まれてもよい。SpectralonTMポリマーライニングは、非常に高い拡散反射率を有する熱可塑性樹脂である。SpectralonTMポリマーライニングは、ニューハンプシャー州、North SuttonのLabsphere Inc.を通じて入手可能である。
【0031】
[0043] その他の物質が、その他のポリマー材料を含むラマン-生成物質として使用されてよいことが意図される。例えば、ラマン-生成物質には、ポリスチレン表面またはポリカーボネート表面が含まれてよい。使用されるラマン-生成物質は固有のラマンシグナルを生成する必要がある。
【0032】
[0044] 一つの態様において、ラマン-生成物質は、ラマン-生成物質ではないより厚い素材上の薄いコーティングまたは層であってよい。別の態様において、その素材は全体にラマン-生成物質で形成されてもよい。
【0033】
[0045] 分析対象物(例えばグルコース)の濃度の決定は、分析対象物の量に比例する測定、および、その量の分析対象物がその中に存在するものの容量の測定を必要とする。光学的散乱の測定の実行は、分析対象物の濃度の計算を補正させることができ、光プロ-ブ容量はいくつかの測定の過程を経て変化するだろう。
【0034】
[0046] 一つの方法において、ラマンシグナルを回収する前に、組織におけるラマンシグナルの光学的散乱を測定する空間フィルターが提供される。散乱の量は、生体組織のプローブ容量に影響を及ぼす。空間フィルターの使用は、吸収から散乱を識別し、さらに、固定された厚さの皮膚組織試料における吸収および散乱の相対的変化を近似する。
【0035】
[0047] 一つの方法において、空間フィルターは、皮膚組織から生じるラマンシグナルの一部分を遮断し、そしてラマンシグナルの残りの部分を少なくとも一つの検出器に進ませるように配置される。つまり、空間フィルターは光を一部分において遮断し、そして別の不部分において光を通過させる。図1は、空間フィルター80を示し、それは図2aにおいてさらに詳細が示される。空間フィルター80には、形成される複数の隙間82、84、86が含まれる。空間フィルター80のセクション80a、80bは、ラマンシグナルの一部分を遮断する。光学的散乱が低い場合、ラマンシグナルのわずかな一部分が皮膚組織を通って側面の軌道をとるであろうため、中央の隙間84でのラマンシグナルの強度(I)は、外側の隙間82、86でのラマンシグナルの強度より非常に高いであろう。
【0036】
[0048] 光学的散乱が低い場合、経路の長さに関する補正後の、中央の隙間84を通過するラマン光の強度(Im)に対する、右側の隙間86を通過するラマン光の強度(Ir)の比率は小さいであろう。同様に、光学的散乱が低い場合、経路の長さに関する補正後の、中央の隙間84を通過するラマン光の強度(Im)に対する、左側の隙間82を通過するラマン光の強度(Il)の比率もまた小さいであろう。このように、Ir/ImおよびIl/Imが小さいとき、光学的散乱は低い。組織における散乱が大きいほど、比率Ir/ImおよびIl/Imは大きくなる。図2aの吸収は、一般に強度の和(Ir+Im+Il)で近似されることもまた言及される。
【0037】
[0049] 図2aの装置を使用する場合、組織の散乱特性に影響するように生体組織の状態が変化すると、ラマン-生成物質からのラマンシグナルの空間パターンも続いて変化するであろう。この相対的変化を一連の分析対象物測定に適用することにより、分析対象物シグナルは光プローブ容量に対して正規化され、そしてそのため、計算される分析対象物の濃度の正確性が増加する。
【0038】
[0050] 空間フィルターは調節可能なものであってもよく、その隙間の開口部のサイズは調節されてもよいことが、意図される。これは、吸収される光から、散乱される光を識別するために好都合である可能性がある。例えば、図2bおよび図2cを参照すると、空間フィルター90には、セクション90aおよび90bが含まれる。セクション90a、90bは、概して水平方向に沿って両方向に可動である(矢印A参照)。図2bは、より開いた配置におけるセクション90a、90bが示され、それらの間の距離は、距離D1により示される。図2cは、より閉じた配置におけるセクション90a、90bが示され、それらの間の距離は、距離D2により示される。
【0039】
[0051] 散乱光のより良い決定および特徴づけのため、空間フィルターそのものが可動であってよいこともまた、意図される。例えば、光が試料中を通って伝播する場所を決定するために、および/または、多重散乱された光、または伝達された非散乱光を選択的に測定するために、空間フィルターを動かすことができる。第一のポイントを励起し(excite)、隙間をもつ第二のポイントで測定する場合、経路長についていくつかの考えを有する。経路長についてのより良い考えを有することにより、必要であれば、分析対象物シグナルに関して、組織容量を調節することができ、それにより、結果としてより正確な分析対象物の濃度を得る。
【0040】
[0052] 図1に戻って参照すると、ラマンシグナルが空間フィルター80を通って進行した後、集光光学系18が戻って来たラマンシグナル16、20を回収する。集光光学系は空間フィルターを通過する前にラマンシグナルを回収することができることが意図される。しかしながら、この方法において空間フィルター80は、ラマンシグナルが検出器へと移行する前に配置される必要がある。
【0041】
[0053] 回収されたラマンシグナルは、次に検出器30へと移行する。検出器30は、回収されたラマンシグナルから分析対象物の濃度(例えばグルコース)を決定することを補助する。使用することができる検出器の一つの例は、シリコン検出器である。検出器のその他の例には、拡張型InGaAs検出器、ゲルマニウム検出器、セレン化鉛(PbSe)検出器、または硫化鉛(PbS)検出器が含まれる。その他の検出器を使用して、回収されたラマンシグナルから分析対象物の濃度(例えばグルコース)を決定することを補助することができることが意図される。
【0042】
[0054] 複数の検出器および複数の隙間を使用することができることが意図される。この態様において、複数の隙間および検出器は、直接-画像化配列に近似することができ、散乱および吸収のより正確な測定を提供することができる。
【0043】
[0055] 弱いラマンシグナルを有する分析対象物(例えば生体組織中のグルコース)の定量に関連する、生体組織のラマン吸収および/または散乱特性に関する補正は、いくつかの方法により達成することができる。一つの方法において、較正アルゴリズムは組織の吸収特性および/または散乱特性を取り入れて、分析対象物の濃度の測定値に関して補正する。
【0044】
[0056] 別の方法において、回収回数(collection times)は適当なシグナル対ノイズ比が達せられるように自動的に調節され、より正確な分析対象物測定値を得ることを補助する。例えば、回収回数を増加してシグナルの全体量を増やすことが可能であり、それは、特により小さいシグナルにおいて、一般的により良いシグナルに変換される。
【0045】
[0057] 皮膚組織における光学的吸収および/または散乱に関して補正または評価することにより、グルコースのラマン信号(signature)を、より正確な様式で定量的に決定することができる。つまりこの方法は、定量的、分析的シグナルを、組織の光学的特性の変化に関して補正するための、光学的解決策を提案する。
【0046】
[0058] 集光光学系は図1に示されるものから変化してもよい。図3は、放物面鏡40を含む、図1と類似した図解を示し、放物面鏡の中を高強度の光10が、その中に形成される開口部42を通り抜ける。高強度の光10は組織に進入し、そしてラマンシグナルを生成し、それがすべての方向に散乱する。散乱したラマンシグナル46は、空間フィルターセクション80a、80bの間または周囲を通過した後、放物面鏡40に戻ってくる。ラマンシグナルはさらに放物面鏡により検出器50へと反射され、回収されたラマンシグナルから分析対象物の濃度が決定される。この方法における分析対象物の濃度を、図1および図2に関係して論じられたのと同様の様式で補正することができる。
【0047】
[0059] 別の態様によると、集光光学系は集束レーザー光を組織へと伝達して戻す、その他の湾曲を有する鏡であってよい。あるいは、集光光学系は、ラマンシグナル集光光学系に依存して組織へと並行の光を伝達して返すように形作られた、湾曲を有するその他の鏡であってよい。
【0048】
[0060] 別の態様において、ラマンシグナルの空間分布は、空間画像化に基づく光学的デザインを使用することによっても、達成されることができる。この態様において、空間フィルターは不必要である。その一つの限定的ではない例が図4に示される。図4は、高強度の光源10a、皮膚組織12、およびラマン-生成物質22を示す。ラマンシグナル100は画像化光学系110により回収され、そして次にアレイ検出器112に向けられる。アレイ検出器112は、それぞれがラマンシグナルの一部分を測定する、個々の検出器(画素)のアレイである。一つの方法において、画像化光学系および検出器は、ラマンシグナルを使用して、組織により生じる吸収および散乱の両方に関して補正する。
【0049】
[0061] 別の方法によると、ラマンスペクトル情報を使用して分析対象物の濃度を決定する非侵襲的方法には、皮膚組織の領域をつまむことが含まれる。皮膚組織の領域がつままれる。ラマン-生成物質が、つままれた皮膚組織の近傍または周辺に配置される。ラマン-生成物質は、それゆえに、少なくとも一つの開口部を形成する。高強度で狭帯域の光は、少なくとも一つの開口部を通って皮膚組織に適用される。高強度の光は皮膚組織に進入し、そして、ラマンシグナルを生成する。つままれた皮膚組織を通過する高強度の光およびラマンシグナルは、ラマン-生成物質を介してつままれた皮膚組織へと反射されて戻る。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質より生成される追加のラマンシグナルが回収される。回収されたラマンシグナルを使用して、分析対象物の濃度が決定される。
【0050】
[0062] 図5aに示されるように、ラマン-生成物質170は、つままれた皮膚組織180の近傍または周辺に配置される。つままれた皮膚組織の幅は一般に約1 mmから約2 mmである。ラマン-生成物質170は、少なくとも一つの開口部172を形成し、その中を高強度の光174が少なくとも一つの開口部172を通って適用される。高強度の光174はつままれた皮膚組織180に進入し、そして、ラマンシグナルを生成する。つままれた皮膚組織を通過する高強度の光およびラマンシグナルは、ラマン-生成物質170を介してつままれた皮膚組織へと反射されて戻る。さらに、ラマン-生成物質170は、追加のラマンシグナルを生成する。ラマンシグナルが回収され、そして、回収されたラマンシグナルを使用して分析対象物の濃度が決定される。
【0051】
[0063] ラマンシグナルを、高NA(開口数)光学系またはNAファイバー190を介して回収することができる。高NA(開口数)光学系またはNAファイバー190は、回収されたラマンシグナルを分光計192へと伝達する。回収されたシグナルを、フィルターをもつ単一検出器、CCD(陰極結合検出器)、ダイオードアレイ、または、特異的なシグナルを検出するその他の装置へと伝達することができることが、意図される。例えば図5bに示されるように、ラマンシグナルを、つままれた皮膚組織に進入する高強度の光と同じ側に回収することができることが、意図される。
【0052】
[0064] 分析対象物の濃度の決定に加えて、ラマンスペクトル情報は、その他の方法において使用することができる。例えば、一つの方法において、回収されたラマンシグナルに由来する情報を使用して、総合診断を行うことができる。総合診断には、(a)特定の分析対象物の存在の同定、(b)特定の分子の同定、または(c)組織形態の同定が含まれてもよい。総合診断は、いくつかの有益な応用に関連することができる。例えば、潜在的な癌性皮膚病変は、一つの適用において同定することができる。潜在的な癌性細胞を同定することにより、組織切除を最小にすることができる。別の用途において、癌性細胞のステージを同定することができる。さらなる用途において、癌の光線力学療法の有効性を、追跡することが可能である。本発明の方法を使用して、その他の診断を行うことができることが、意図される。
【0053】
[0065] ラマンシグナルを使用することに加えて、その他のシグナルをその他の方法において使用することができる。別の方法において、分析対象物の濃度を決定するための非侵襲的方法は、蛍光スペクトル情報を使用する。蛍光スペクトル情報を使用して測定することができる分析対象物には、グルコース、脂質プロフィール(例えば、コレステロール、トリグリセリド、LDL、およびHDL)、微量アルブミン、ヘモグロビンA1C、または、ビリルビンが含まれる。しかしながら、本発明はこれらの特定の分析対象物に限定はされず、またその他の分析対象物の濃度を決定することができることが意図される。分析対象物は、例えば、全血試料中、血清試料中、血漿試料中、および、ISF(間質液)および尿中などの、その他の体液中に存在してもよい。
【0054】
[0066] 本発明は、非侵襲的な分析対象物(例えばグルコース)の検出の間に、一過性である(transient)可能性がある、光学的吸収および/または組織散乱に関して補正する方法を提供することを補助する。グルコースなどの分析対象物の蛍光信号(signature)を、組織中で起こる光学的吸収および組織散乱に基づいて補正することが可能である。皮膚組織の吸収および組織散乱は、上述の通り、短期間および長期間において変化する可能性がある。別の方法によると、分析対象物の濃度は蛍光スペクトル情報を使用して決定される。高強度帯の光が、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして、蛍光シグナルを生成する。蛍光-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。蛍光-生成物質からの高強度の光は、反射され、それにより皮膚組織を通して皮膚組織の第一の側へと通過する、追加の蛍光シグナルが生成される。皮膚組織に進入する高強度の光から生成される蛍光シグナルは、蛍光-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルが回収される。回収された蛍光シグナルに由来する情報を使用して、分析対象物の濃度が決定される。
【0055】
[0067] 図6aを参照すると、一つの方法に従って、蛍光-生成物質および高強度帯の光の配置を示すために図解が使用される。高強度の光210は、つままれた皮膚組織または指などの、皮膚組織12に適用される。図6aにおいて、高強度の光210は、高強度の光源210aより生じるように示される。高強度の光210は、狭帯域の光であってもよいが、必ずしも狭帯域の光である必要はない。高強度の光源は、単色光源由来であって良い。発光ダイオード、非干渉性(incoherent)ランプ、色素レーザー、気体レーザー、イオンレーザー、または励起レーザーなどのその他の光源が使用されてもよいことが意図される。
【0056】
[0068] 光源の波長は、変化してもよいが、一般に、300 nmと10,000 nmの間である。一つの方法において、蛍光スペクトル情報を約300 nmから約12,000 nmの範囲の波長において回収することができる。蛍光スペクトル情報を、決定すべき分析対象物の濃度に応じて、異なる範囲において回収することができることが意図される。
【0057】
[0069] 高強度の光210は、皮膚組織12の第一の側12aに進入する。図6aに示されるように、高強度の光210はポイントAにおいて、皮膚組織12に進入する。高強度の光210が皮膚組織12に進入した後、蛍光シグナルが生成され、そして、すべての方向に散乱する可能性がある。高強度の光の一部分は皮膚に進入することなく皮膚に接触し、そして、すべての方向に散乱する可能性がある。蛍光シグナルの一部分216は、皮膚組織12に進入した後、方向を変えられて集光光学系18へ向かって戻る。しかしながら、蛍光シグナルのいくらかは皮膚組織12を抜け出て、そして、蛍光-生成物質222を使用して反射されて戻る。蛍光-生成物質222は、集光光学系18に向けて蛍光シグナルを反射して戻し、それ以外は、集光光学系18の反対側である、皮膚組織12の奥側12bを抜け出なかったであろう。つまり、蛍光シグナルの増加した一部分は、集光光学系18へと方向を変えられるであろう。蛍光シグナルの増加した一部分を、鏡などの反射面を使用して方向を変えることも可能であることが意図される。蛍光-生成物質により生成される蛍光シグナルの一部分は斜角で散乱され、検出されないか、あるいは、検出される前に吸収される可能性もある。
【0058】
[0070] 蛍光-生成物質222は皮膚組織12の奥側12bの近傍の位置に配置される。蛍光-生成物質は一般に、適用される高強度の光の進入の反対側に位置する。図6aに示される通り、蛍光-生成物質222は図6aのポイントAにおける高強度の光210の進入の反対側に配置される。蛍光-生成物質は図6aに示される一つの反射体、あるいは複数の反射体であってよいことが、意図される。
【0059】
[0071] 蛍光-生成物質222もまた、高強度の光210を受け取り、そしてそこから追加の蛍光シグナルを生成する。蛍光-生成物質が高強度の光210から蛍光シグナルを生成しない範囲で、蛍光-生成物質222は、高強度の光の残存部分を反射して皮膚組織12を通って戻す。蛍光シグナルは皮膚組織内のすべてのポイントから生じ、そして外側に散乱するため、これらの蛍光シグナルは、通常、皮膚組織のより大きな容量を覆うであろう。この高強度の光が蛍光-生成物質222を介して反射されて皮膚組織12に戻った後、追加の蛍光シグナルが生成される可能性がある。このように、源となる光が皮膚組織を二回通過することにより、光学経路は増加する。光学経路の増加により、結果として生じる分析シグナルもまた、増加する。
【0060】
[0072] 蛍光-生成物質222を使用して、光学的吸収の測定を得ることができる。吸収は、一般に、試料を通過する蛍光-生成物質222からの蛍光シグナルの全体量に対する比率である。蛍光シグナル全体を積分することができる場合、分析シグナルは、組織吸収および散乱における変化に関して、さらに補正されることが可能である。ラマンシグナル全体を積分することができる場合、次に、分析シグナルは、組織吸収および組織散乱における変化に関して、さらに補正されることが可能である。組織吸収および組織散乱における変化は、例えば、血流の増加、または組織水和における変化により、引き起こされる可能性がある。例えば、高強度の光のみを使用する蛍光-生成物質からの蛍光シグナルの強度は、高強度の光を使用する、蛍光生成物質および生体組織を使用する蛍光シグナルの強度と比較することができる。これらの強度の比較は組織による光学的吸収のレベルを、決定および定量することができる。
【0061】
[0073] つまり、要約すると、 (a)蛍光-生成物質222は最初の皮膚組織の通過において生成される蛍光シグナルを反射して戻し、それ以外は失われる;(b)蛍光-生成物質222は高強度の光210から蛍光シグナルを生成する;そして(c)蛍光-生成物質222は蛍光シグナルを生成しなかった光源を反射して追加の蛍光シグナルを生成する可能性を有する皮膚組織中に戻す。これらの蛍光シグナルは図6aにおいて一般に蛍光シグナル220と指定される。
【0062】
[0074] 蛍光-生成物質は、より短い波長の光が分子を励起し、そして次に分子が蛍光を発し、より長い波長の光を発するという、蛍光の機構に基づいて機能することができる。蛍光-生成物質は、蛍光色素などの多様な物質から形成されることができる。蛍光色素は、近赤外(NIR)色素、IR色素、および可視色素であってよい。NIR蛍光色素のいくつかの例には、シアニン色素からの誘導体(Cy5.5)、または臨床的に認可されたインドシアニンブルー(ICG)が含まれる。これらの色素は、本来、通常は水性なので、典型的にはコーティングとして使用される。色素は、蛍光-生成物質に動員、または、浸透させることができる。同様の様式において機能する蛍光-生成物質として、その他の物質を使用することができることが意図される。
【0063】
[0075] NIRにおいて蛍光を発するその他の物質は、少し異なる方法で機能する。NIRカードにおいて使用される物質は、より長波長の光が第一分子により吸収され、そしてより短波長において蛍光を発する第二分子にエネルギーが移行するという、“光子アップコンバージョン”に基づいて機能する。このプロセスは、励起光が発光よりも低エネルギーなので、アップコンバージョンと言われる。一つの例は、量子ドットの使用である。量子ドットは小さな金属製の物質で、その蛍光はサイズ依存的である。同様の様式で機能するその他の物質を、蛍光-生成物質として使用することができることが、意図される。
【0064】
[0076] 異なる様式、および異なるスペクトルにおいて蛍光を発するその他の物質を、蛍光-生成物質として使用することができることが意図される。使用される蛍光-生成物質は、固有の蛍光シグナルを生成する。
【0065】
[0077] 一つの態様において、蛍光-生成物質は、蛍光-生成物質ではないより厚い素材上の薄いコーティングまたは薄い層であってよい。別の態様において、その素材は全体に蛍光-生成物質で形成されてもよい。
【0066】
[0078] 分析対象物(例えばグルコース)の濃度の決定は、分析対象物の量に比例する測定、および、その量の分析対象物がその中に存在するものの容量の測定を必要とする。光学的散乱の測定の実行は、分析対象物の濃度の計算を補正させることができ、光プロ-ブ容量はいくつかの測定の過程を経て変化するだろう。
【0067】
[0079] 一つの方法において、蛍光シグナルを回収する前に、組織における蛍光シグナルの光学的散乱を測定する空間フィルターが提供される。一つの方法において、空間フィルターは、皮膚組織から生じる蛍光シグナルの一部分を遮断し、そして蛍光シグナルの残りの部分を少なくとも一つの検出器に進ませるように配置される。このように、空間フィルターは光を一部分において遮断し、別の部分において光を通過させる。図6aは、空間フィルター280を示し、それは図6bにおいてさらに詳細に示される。空間フィルター280には、形成される複数の隙間282、284、286が含まれる。空間フィルター280のセクション280a、280bは、蛍光シグナルの一部分を遮断する。光学的散乱が低い場合、蛍光シグナルのわずかな一部分が皮膚組織を通って側面の軌道をとるため、中央の隙間284での蛍光シグナルの強度(I)は、外側の隙間282、286での蛍光シグナルの強度より非常に高いであろう。
【0068】
[0080] 光学的散乱が低い場合、経路の長さに関する補正後の、中央の隙間284を通過する蛍光の強度(Im)に対する、右側の隙間286を通過する蛍光の強度(Ir)の比率は小さいであろう。同様に、光学的散乱が低い場合、経路の長さに関する補正後の、中央の隙間284を通過する蛍光の強度(Im)に対する、左側の隙間282を通過する蛍光の強度(Il)の比率もまた小さいであろう。このように、Ir/ImおよびIl/Imが小さいとき、散乱は低い。組織中の散乱が大きいほど、比率Ir/ImおよびIl/Imは大きくなる。図6bの吸収は、一般に強度の和(Ir+Im+Il)で近似されることもまた言及される。
【0069】
[0081] 図6bの隙間を使用する場合、組織の散乱特性に影響するように生体組織の状態が変化すると、蛍光-生成物質からの蛍光シグナルの空間パターンも続いて変化するであろう。この相対的変化を一連の分析対象物測定に適用することにより、分析対象物シグナルは光プローブ容量に対して正規化され、そしてそのため、計算される分析対象物の濃度の正確性が増加する。
【0070】
[0082] 例えば空間フィルター90について上述されたように、空間フィルターは調節可能なものであってもよく、その隙間の開口部のサイズは調節されてもよいことが、意図される。散乱のより良い決定および配置のため、空間フィルターそのものが可動であってよいこともまた、意図される。
【0071】
[0083] 集光光学系18により、戻って来た蛍光シグナル216、220が回収される。回収された蛍光シグナルは、次に検出器230へと移行する。検出器230は、回収された蛍光シグナルから分析対象物の濃度(例えばグルコース)を決定することを補助する。使用することができる蛍光シグナルの検出器の一つの例は、シリコン検出器である。検出器のその他の例には、拡張型InGaAs検出器、ゲルマニウム検出器、セレン化鉛(PbSe)検出器、または硫化鉛(PbS)検出器が含まれる。その他の検出器を使用して、回収された蛍光シグナルから分析対象物の濃度(例えばグルコース)を決定することを補助することができることが意図される。
【0072】
[0084] 複数の検出器および複数の隙間を使用することができることが、意図される。この態様において、複数の隙間および検出器は、直接-画像化配列に近似することができ、散乱および吸収のより正確な測定を提供する可能性がある。
【0073】
[0085] 弱い蛍光シグナルを有する分析対象物(例えば、生体組織内のグルコース)の定量と関連する、生体組織の蛍光吸収特性および/または散乱特性に関する補正は、いくつかの方法により、達することができる。一つの方法において、較正アルゴリズムは組織の吸収および/または散乱特性を取り入れて、分析対象物の濃度の測定値に関して補正する。
【0074】
[0086] 別の方法において、回収回数は適当なシグナル対ノイズ比が達せられるように自動的に調節され、より正確な分析対象物測定値を得ることを補助する。例えば、回収回数を増加してシグナルの全体量を増やすことが可能であり、それは、特により小さいシグナルにおいて、一般的により良いシグナルに変換される。
【0075】
[0087] 皮膚組織における光学的吸収および/または散乱に関して補正または評価することにより、グルコースの蛍光信号(signature)を、より正確な様式で定量的に決定することができる。このように、この方法は、定量的、分析的シグナルを、組織の光学的特性の変化に関して補正するための、光学的解決策を提案する。
【0076】
[0088] 集光光学系は図6aに示されるものから変化することができる。図7は、放物面鏡240を含む、図6aと類似した図解を示し、放物面鏡の中を高強度の光210が、その中に形成される開口部242を通り抜ける。高強度の光210は組織に進入し、そして蛍光シグナルを生成し、それがすべての方向に散乱する。散乱した蛍光シグナル246は、空間フィルターセクション280a、280bを通過した後、放物面鏡240に戻る。蛍光シグナルはさらに放物面鏡により検出器250へと反射され、回収された蛍光シグナルから分析対象物の濃度が決定される。この方法における分析対象物の濃度を、図6a、図6bに関係して論じられたのと同様の様式で補正することができる。
【0077】
[0089] 別の態様によると、集光光学系は集束レーザー光を組織へと伝達して戻す、湾曲を有するその他の鏡であってよい。あるいは、集光光学系は、蛍光シグナル集光光学系に依存して組織へと並行の光を伝達して返すように形作られた、湾曲を有するその他の鏡であってよい。
【0078】
[0090] 別の態様において、蛍光シグナルの空間分布は、空間画像化に基づく光学的デザインを使用することによっても、達成することができる。この態様において、空間フィルターは不必要である。一つの限定的ではない例が図8に示される。図8は、高強度の光源210a、皮膚組織12、および蛍光-生成物質222を示す。蛍光シグナル300は画像化光学系310により回収され、そして次にアレイ検出器312に向けられる。アレイ検出器312は、それぞれが蛍光シグナルの一部分を測定する、個々の検出器(画素)のアレイである。一つの方法において、画像化光学系および検出器は、蛍光シグナルを使用して、組織により生じる吸収および散乱の両方に関して補正する。
【0079】
[0091] 図9aに示されるように、蛍光-生成物質370は、つままれた皮膚組織380の近傍または周辺に配置される。つままれた皮膚組織の幅は一般に約1 mmから約2 mmである。蛍光生成物質370は、少なくとも一つの開口部372を形成し、その中を高強度の光374が少なくとも一つの開口部372を通って適用される。高強度の光374はつままれた皮膚組織380に進入し、そして、蛍光シグナルを生成する。つままれた皮膚組織を通過する高強度の光および蛍光シグナルは、蛍光生成物質370を介してつままれた皮膚組織へと反射されて戻る。さらに、蛍光生成物質370は、追加の蛍光シグナルを生成する。蛍光シグナルが回収され、そして、回収された蛍光シグナルを使用して分析対象物の濃度が決定される。
【0080】
[0092] 蛍光シグナルを、高NA(開口数)光学系またはNAファイバー390を介して回収することができる。高NA(開口数)光学系またはNAファイバー390は、回収された蛍光シグナルを分光計392へと伝達する。回収されたシグナルを、フィルターをもつ単一検出器、CCD(陰極結合検出器)、ダイオードアレイ、または、特異的なシグナルを検出するその他の装置へと伝達することができることが、意図される。例えば図9bに示されるように、蛍光シグナルを、つままれた皮膚組織に進入する高強度の光と同じ側に回収することができることが、意図される。
【0081】
[0093] 分析対象物の濃度の決定に加えて、蛍光スペクトル情報は、その他の方法において使用することができる。例えば、一つの方法において、回収された蛍光シグナルに由来する情報を使用して、総合診断を行うことができる。総合診断には、(a)特定の分析対象物の存在の同定、(b)特定の分子の同定、または(c)組織形態の同定が含まれてもよい。総合診断は、いくつかの有益な応用に関連することができる。例えば、潜在的な癌性皮膚病変は、一つの適用において同定することができる。潜在的な癌性細胞を同定することにより、組織切除を最小にすることができる。別の用途において、癌性細胞のステージを同定することができる。さらなる用途において、癌の光線力学療法の有効性を、追跡することが可能である。本発明の方法を使用して、その他の診断を行うことができることが、意図される。
【0082】
プロセスA
[0094] 皮膚組織に進入し、そしてラマンシグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、ラマン-生成物質を配置すること;
ラマン-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成すること;
ラマン-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成されるラマンシグナルを反射すること;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルに由来する情報を使用して、分析対象物の濃度を決定すること;
を含む、ラマンスペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【0083】
プロセスB
[0095] 高強度の光が、単色光源より適用される、プロセスAの方法。
【0084】
プロセスC
[0096] 高強度の光が、レーザー-ダイオード光源より適用される、プロセスBの方法。
【0085】
プロセスD
[0097] 高強度の光が、発光ダイオード、zeon-arcランプ、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、プロセスAの方法。
【0086】
プロセスE
[0098] 分析対象物がグルコースである、プロセスAの方法。
【0087】
プロセスF
[0099] 皮膚組織が、約1 mmから約5 mmの厚さである、プロセスAの方法。
【0088】
プロセスG
[0100] ラマン-生成物質が、適用される高強度の光の進入の反対側に配置される、プロセスAの方法。
【0089】
プロセスH
[0101] ラマン-生成物質にポリマー材料が含まれる、プロセスAの方法。
【0090】
プロセスI
[0102] ポリマー材料がポリスチレンまたはポリカーボネートである、プロセスHの方法。
【0091】
プロセスJ
[0103] 分析対象物の濃度を決定することを補助する検出器をさらに含む、プロセスAの方法。
【0092】
プロセスK
[0104] ラマンシグナルが、少なくとも一つの放物面鏡を使用して回収される、プロセスAの方法。
【0093】
プロセスL
[0105] ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスAの方法。
【0094】
プロセスM
[0106] ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスLの方法。
【0095】
プロセスN
[0107] 高強度の光が赤外光である、プロセスAの方法。
【0096】
プロセスO
[0108] 高強度の光が近赤外光である、プロセスAの方法。
【0097】
プロセスP
[0109] 高強度の光が紫外光である、プロセスAの方法。
【0098】
プロセスQ
[0110] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスAの方法。
【0099】
プロセスR
[0111] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスAの方法。
【0100】
プロセスS
[0112] 回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスAの方法。
【0101】
プロセスT
[0113] 皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、プロセスAの方法。
【0102】
プロセスU
[0114] アレイ検出器および画像化光学系をさらに含む、プロセスAの方法。
【0103】
プロセスV
[0115] 皮膚組織に進入し、そしてラマンシグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、ラマン-生成物質を配置すること;
ラマン-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成すること;
ラマン-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成されるラマンシグナルを反射すること;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルに由来する情報を使用して、総合診断を行うこと;
を含む、ラマンスペクトル情報を使用する、診断の非侵襲的方法。
【0104】
プロセスW
[0116] 総合診断を行うことが、特定の分析対象物の存在を同定することを含む、プロセスVの方法。
【0105】
プロセスX
[0117] 総合診断を行うことが、特定の分子を同定することを含む、プロセスVの方法。
【0106】
プロセスY
[0118] 高強度の光が、単色光源より適用される、プロセスVの方法。
【0107】
プロセスZ
[0119] 高強度の光が、レーザー-ダイオード光源より適用される、プロセスYの方法。
【0108】
プロセスAA
[0120] 高強度の光が、発光ダイオード、zeon-arcランプ、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、プロセスVの方法。
【0109】
プロセスBB
[0121] 分析対象物がグルコースである、プロセスVの方法。
【0110】
プロセスCC
[0122] 皮膚組織が、約1 mmから約5 mmの厚さである、プロセスVの方法。
【0111】
プロセスDD
[0123] ラマン-生成物質が、適用される高強度の光の進入の反対側に配置される、プロセスVの方法。
【0112】
プロセスEE
[0124] ラマン-生成物質にポリマー材料が含まれる、プロセスVの方法。
【0113】
プロセスFF
[0125] ポリマー材料がポリスチレンまたはポリカーボネートである、プロセスEEの方法。
【0114】
プロセスGG
[0126] 総合診断を行うことを補助する検出器をさらに含む、プロセスVの方法。
【0115】
プロセスHH
[0127] ラマンシグナルが、少なくとも一つの放物面鏡を使用して回収される、プロセスVの方法。
【0116】
プロセスII
[0128] ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスVの方法。
【0117】
プロセスJJ
[0129] ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスIIの方法。
【0118】
プロセスKK
[0130] 高強度の光が赤外光である、プロセスVの方法。
【0119】
プロセスLL
[0131] 高強度の光が近赤外光である、プロセスVの方法。
【0120】
プロセスMM
[0132] 高強度の光が紫外光である、プロセスVの方法。
【0121】
プロセスNN
[0133] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が総合診断を行うことを補助するのに使用される、プロセスVの方法。
【0122】
プロセスOO
[0134] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が総合診断を行うことを補助するのに使用される、プロセスVの方法。
【0123】
プロセスPP
[0135] 回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスVの方法。
【0124】
プロセスQQ
[0136] 皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、プロセスVの方法。
【0125】
プロセスRR
[0137] アレイ検出器および画像化光学系をさらに含む、プロセスVの方法。
【0126】
プロセスSS
[0138] 皮膚組織の領域をつまむこと;
ラマン-生成物質をつままれた、皮膚組織の近傍または周囲に配置し、ラマン-生成物質が少なくとも一つの開口部を形成すること:
高強度で狭帯域の光を少なくとも一つの開口部を通して皮膚組織に適用し、高強度の光が皮膚組織に進入し、そしてラマンシグナルを生成すること;
つままれた皮膚組織を通過する、高強度の光およびラマンシグナルを反射して、ラマン-生成物質を介してつままれた皮膚組織中に戻すこと;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルを使用して、分析対象物の濃度を決定すること;
を含む、ラマンスペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【0127】
プロセスTT
[0139] ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスSSの方法。
【0128】
プロセスUU
[0140] ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスTTの方法。
【0129】
プロセスVV
[0141] 分析対象物がグルコースである、プロセスSSの方法。
【0130】
プロセスWW
[0142] ラマン-生成物質にポリマー材料が含まれる、プロセスSSの方法。
【0131】
プロセスXX
[0143] 皮膚組織に進入し、そして蛍光シグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、蛍光-生成物質を配置すること;
蛍光-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加の蛍光シグナルを生成すること;
蛍光-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成される蛍光シグナルを反射すること;
皮膚組織に進入する高強度の光から生成される蛍光シグナルおよび蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルに由来する情報を使用して、分析対象物の濃度を決定すること;
を含む、蛍光スペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【0132】
プロセスYY
[0144] 高強度の光が、単色光源より適用される、プロセスXXの方法。
【0133】
プロセスZZ
[0145] 高強度の光が、レーザー-ダイオード光源より適用される、プロセスYYの方法。
【0134】
プロセスAAA
[0146] 高強度の光が、発光ダイオードまたはzeon-arcランプより適用される、プロセスXXの方法。
【0135】
プロセスBBB
[0147] 高強度の光が、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、プロセスXXの方法。
【0136】
プロセスCCC
[0148] 皮膚組織が、約1 mmから約5 mmの厚さである、プロセスXXの方法。
【0137】
プロセスDDD
[0149] 蛍光-生成物質が、適用される高強度の光の進入の反対側に配置される、プロセスXXの方法。
【0138】
プロセスEEE
[0150] 蛍光-生成物質に蛍光色素が含まれる、プロセスXXの方法。
【0139】
プロセスFFF
[0151] 蛍光-生成物質に量子ドットが含まれる、プロセスXXの方法。
【0140】
プロセスGGG
[0152] 分析対象物の濃度を決定することを補助する検出器をさらに含む、プロセスXXの方法。
【0141】
プロセスHHH
[0153] 蛍光シグナルが、少なくとも一つの放物面鏡を使用して回収される、プロセスXXの方法。
【0142】
プロセスIII
[0154] 蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスXXの方法。
【0143】
プロセスJJJ
[0155] 蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスIIIの方法。
【0144】
プロセスKKK
[0156] 高強度の光が赤外光である、プロセスXXの方法。
【0145】
プロセスLLL
[0157] 高強度の光が近赤外光である、プロセスXXの方法。
【0146】
プロセスMMM
[0158] 高強度の光が紫外光である、プロセスXXの方法。
【0147】
プロセスNNN
[0159] 回収された蛍光シグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスXXの方法。
【0148】
プロセスOOO
[0160] 回収された蛍光シグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスXXの方法。
【0149】
プロセスPPP
[0161] 回収された蛍光シグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスXXの方法。
【0150】
プロセスQQQ
[0162] 皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、プロセスXXの方法。
【0151】
プロセスRRR
[0163] アレイ検出器および画像化光学系をさらに含む、プロセスXXの方法。
【0152】
プロセスSSS
[0164] 皮膚組織に進入し、そして蛍光シグナルを生成する高強度の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、蛍光-生成物質を配置すること;
蛍光-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加の蛍光シグナルを生成すること;
蛍光-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成される蛍光シグナルを反射すること;
皮膚組織に進入する高強度の光から生成される蛍光シグナルおよび蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルに由来する情報を使用して、総合診断を行うこと;
を含む、蛍光スペクトル情報を使用する、診断の非侵襲的方法。
【0153】
プロセスTTT
[0165] 総合診断を行うことが、特定の分析対象物の存在を同定することを含む、プロセスSSSの方法。
【0154】
プロセスUUU
[0166] 総合診断を行うことが、特定の分子を同定することを含む、プロセスSSSの方法。
【0155】
プロセスVVV
[0167] 高強度の光が、狭帯域の光である、プロセスSSSの方法。
【0156】
プロセスWWW
[0168] 高強度の光が、レーザー-ダイオード光源より適用される、プロセスSSSの方法。
【0157】
プロセスXXX
[0169] 高強度の光が、発光ダイオードまたはzeon-arcランプより適用される、プロセスSSSの方法。
【0158】
プロセスYYY
[0170] 高強度の光が、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、プロセスSSSの方法。
【0159】
プロセスZZZ
[0171] 皮膚組織が、約1 mmから約5 mmの厚さである、プロセスSSSの方法。
【0160】
プロセスAAAA
[0172] 蛍光-生成物質が、適用される高強度の光の進入の反対側に配置される、プロセスSSSの方法。
【0161】
プロセスBBBB
[0173] 蛍光-生成物質に蛍光色素が含まれる、プロセスSSSの方法。
【0162】
プロセスCCCC
[0174] 蛍光-生成物質に量子ドットが含まれる、プロセスSSSの方法。
【0163】
プロセスDDDD
[0175] 分析対象物の濃度を決定することを補助する検出器をさらに含む、プロセスSSSの方法。
【0164】
プロセスEEEE
[0176] 蛍光シグナルが、少なくとも一つの放物面鏡を使用して回収される、プロセスSSSの方法。
【0165】
プロセスFFFF
[0177] 蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスSSSの方法。
【0166】
プロセスGGGG
[0178] 蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスFFFFの方法。
【0167】
プロセスHHHH
[0179] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスSSSの方法。
【0168】
プロセスIIII
[0180] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスSSSの方法。
【0169】
プロセスJJJJ
[0181] 回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスSSSの方法。
【0170】
プロセスKKKK
[0182] 皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、プロセスSSSの方法。
【0171】
プロセスLLLL
[0183] アレイ検出器および画像化光学系をさらに含む、プロセスSSSの方法。
【0172】
プロセスMMMM
[0184] 皮膚組織の領域をつまむこと;
蛍光-生成物質をつままれた皮膚組織の近傍または周囲に配置し、蛍光-生成物質が少なくとも一つの開口部を形成すること:
高強度で狭帯域の光を少なくとも一つの開口部を通して皮膚組織に適用し、高強度の光が皮膚組織に進入し、そして蛍光シグナルを生成すること;
つままれた皮膚組織を通過する、高強度の光および蛍光シグナルを反射して、蛍光-生成物質を介してつままれた皮膚組織中に戻すこと;
皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルを使用して、分析対象物の濃度を決定すること;
を含む、蛍光スペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【0173】
プロセスNNNN
[0185] 蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスMMMMの方法。
【0174】
プロセスOOOO
[0186] 蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスNNNNの方法。
【0175】
プロセスPPPP
[0187] 分析対象物がグルコースである、プロセスMMMMの方法。
【0176】
[0188] 本発明は、一つあるいはそれ以上の特定の態様に関して記述されているが、本発明の精神と範囲から逸脱することなく、多くの変化をそれに行うことができることを、当業者は認識するだろう。個々のこれらの態様、およびそれらの明白な変更は、添付の請求項により定義される通り、発明の精神と範囲の中に含まれるものと意図される。
【技術分野】
【0001】
[0001] 本発明は、一般に、分析対象物の濃度を決定する方法に関連する。さらに具体的にには、本発明は、スペクトル情報(例えば、ラマンまたは蛍光)を使用して、分析対象物の濃度を決定する非侵襲的方法に関するものである。
【背景技術】
【0002】
[0002] 体液中の分析対象物の定量は、特定の生理的異常の診断および維持において非常に重要である。例えば、乳酸塩、コレステロール、およびビリルビンは、特定の個体においては、モニタリングされるべきである。特に、体液中のグルコースレベルを頻繁に検査して、食餌中のグルコースの取り込みを調節しなければならない糖尿病個体においては、体液中のグルコースの測定は重要である。そのような試験の結果を使用して、もしあれば、インスリンまたは他の薬剤を投与する必要があることを決定することができる。
【0003】
[0003] 例えばグルコースの分析対象物濃度の決定は、通常、侵襲的方法により行われる。非侵襲的方法を使用することにより、分析対象物の濃度を決定することが望ましいだろう。
【0004】
[0004] 非侵襲的方法は、異なるタイプのシグナルを使用することを取り入れて、分析対象物の濃度を決定することができる。シグナルの一つのタイプは、ラマンスペクトルシグナルである。しかしながら、ラマンスペクトル情報の使用は、シグナルが非常に弱い傾向があるために、非侵襲的な分析対象物の濃度の決定において、用途が限定されてきた。皮膚から回収されるラマンシグナルが非常に弱いことの原因となる、いくつかの因子がある。一つの因子は、組織に光損傷を引き起こすことなく安全に組織に伝達することができる限られた量の高強度エネルギーである。二番目の因子は、分析的および生理学的に注目するほとんどの分子に特有の、限られたラマン散乱効率である。三番目の因子は、組織に効率的に伝達できるエネルギーの量、および、組織から回収できるラマンスペクトル情報の量を限定する、組織の散乱特性および吸収特性である。
【0005】
[0005] 別のタイプのシグナルは、蛍光シグナルであり、これもラマンシグナルと同様に不都合な点を有する。蛍光シグナルは、実際は、ラマンシグナルよりも一般的である。注目する蛍光分子は、望まれるよりも数が少ない可能性がある。組織の散乱特性および吸収特性が、効率的に組織に伝達することができるエネルギーの量、および、組織から回収できる蛍光スペクトル情報の量を制限する。
【0006】
[0006] 組織の基本的な二つの光学的特性である光学的吸収および組織散乱は、グルコースなどの分析対象物の非侵襲的検出の間に、過渡的である(transient)可能性がある。光学的吸収および組織散乱は、グルコース濃度測定に影響する可能性がある。
【0007】
[0007] より正確に分析対象物の濃度を決定する、ラマンスペクトル情報または蛍光スペクトル情報などの、スペクトル情報を用いる非侵襲的方法の開発が望ましいだろう。
【発明の概要】
【0008】
[0008] 一つの非侵襲的方法によると、分析対象物の濃度は、ラマンスペクトル情報を使用して決定される。高強度で狭帯域の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして、ラマンシグナルを生成する。ラマン-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。高強度の光は、ラマン-生成物質により反射され、それにより皮膚組織を通して皮膚組織の第一の側へと通過する、追加のラマンシグナルが生成される。皮膚組織に進入する高強度の光から生成されるラマンシグナルは、ラマン-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質から生成される追加のラマンシグナルが回収される。回収されたラマンシグナルに由来する情報を使用して、分析対象物の濃度が決定される。
【0009】
[0009] 別の非侵襲的方法によると、ラマンスペクトル情報を使用して診断が決定される。高強度で狭帯域の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして、ラマンシグナルを生成する。ラマン-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。高強度の光は、ラマン-生成物質により反射され、それにより皮膚組織を介して皮膚組織の第一の側へと通過する、追加のラマンシグナルが生成される。皮膚組織に進入する高強度の光から生成されるラマンシグナルは、ラマン-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質から生成される追加のラマンシグナルが回収される。回収されたラマンシグナル由来の情報は、総合診断を行うために使用される。
【0010】
[0010] さらなる非侵襲的方法によると、ラマンスペクトル情報を使用して分析対象物の濃度が決定される。皮膚組織の領域がつままれる。ラマン-生成物質が、つままれた皮膚組織の近傍または周辺に配置される。ラマン-生成物質は、それゆえに、少なくとも一つの開口部を形成する。高強度で狭帯域の光は、少なくとも一つの開口部を通って皮膚組織に適用される。高強度の光は皮膚組織に進入し、そして、ラマンシグナルを生成する。つままれた皮膚組織を通過する高強度の光およびラマンシグナルは、ラマン-生成物質を介してつままれた皮膚組織へと反射されて戻る。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質より生成される追加のラマンシグナルが回収される。回収されたラマンシグナルを使用して分析対象物の濃度が決定される。
【0011】
[0011] 非侵襲的方法によると、分析対象物の濃度は、蛍光スペクトル情報を使用して決定される。高強度で狭帯域の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして蛍光シグナルを生成する。蛍光-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。高強度の光は、蛍光-生成物質により反射され、それにより皮膚組織を通して皮膚組織の第一の側へと通過する、追加の蛍光シグナルが生成される。皮膚組織に進入する高強度の光から生成される蛍光シグナルは、蛍光-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルが回収される。回収された蛍光シグナルに由来する情報を使用して、分析対象物の濃度が決定される。
【0012】
[0012] 別の非侵襲的方法によると、蛍光スペクトル情報を使用した診断が行われる。高強度の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして蛍光シグナルを生成する。蛍光-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。高強度の光は、蛍光-生成物質により反射され、それにより皮膚組織の第一の側へと皮膚組織を通過する、追加の蛍光シグナルが生成される。皮膚組織に進入する高強度の光から生成される蛍光シグナルは、蛍光-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルが回収される。回収された蛍光シグナル由来の情報は、総合診断を行うために使用される。
【0013】
[0013] さらなる非侵襲的方法によると、蛍光スペクトル情報を使用して分析対象物の濃度が決定される。皮膚組織の領域がつままれる。蛍光-生成物質が、つままれた皮膚組織の近傍または周辺に配置される。蛍光-生成物質は、それゆえに、少なくとも一つの開口部を形成する。高強度で狭帯域の光は、少なくとも一つの開口部を通って皮膚組織に適用される。高強度の光は皮膚組織に進入し、そして、蛍光シグナルを生成する。つままれた皮膚組織を通過する高強度の光および蛍光シグナルは、蛍光-生成物質を介してつままれた皮膚組織へと反射されて戻る。皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質より生成される追加の蛍光シグナルが回収される。回収された蛍光シグナルを使用して分析対象物の濃度が決定される。
【図面の簡単な説明】
【0014】
【図1】[0014] 図1は、ひとつの態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図2】[0015] 図2aは、図1の分析対象物の濃度を決定する際に使用される、空間フィルターのさらなる詳細な図解である。 [0016] 図2b、図2cは、一つの態様に従って、可動性空間フィルター(movable spatial filter)の位置を示す。
【図3】[0017] 図3は、別の態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図4】[0018] 図4は、別の態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図5】[0019] 図5aは、さらなる態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。[0020] 図5bは、さらなる態様に従って、ラマンスペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図6】[0021] 図6aは、別の態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。[0022] 図6bは、図6aの分析対象物の濃度を決定する際に使用される空間フィルター(spatial filter)のさらなる詳細な図解である。
【図7】[0023] 図7は、さらなる態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図8】[0024] 図8は、さらに別の態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【図9】[0025] 図9aは、さらなる態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。[0026] 図9bは、さらなる態様に従って、蛍光スペクトル情報を使用して分析対象物の濃度を決定する際において用いられる図解である。
【発明を実施するための形態】
【0015】
[0027] 一つの方法において、本発明はラマンスペクトル情報を使用して分析対象物の濃度を決定するための非侵襲的な方法に関するものである。本発明は、スペクトル情報を使用するこれらの方法において、光学的スループット(optical throughput)が増加するように適応される。ラマンスペクトル情報を使用して測定することができる分析対象物には、グルコース、脂質プロフィール(例えば、コレステロール、トリグリセリド、LDL、およびHDL)、微量アルブミン、ヘモグロビンA1C、フルクトース、乳酸塩、またはビリルビンが含まれる。しかしながら本発明は、これらの特定の分析対象物には限定されず、そして、その他の分析対象物の濃度を決定することができることが、意図される。分析対象物は、例えば、全血試料中、血清試料中、血漿試料中、および、ISF(間質液)および尿中などの、その他の体液中に存在してもよい。
【0016】
[0028] 本発明は、非侵襲的な分析対象物(例えばグルコース)の検出の間、過渡的である可能性がある光学的吸収および/または組織散乱に関して補正する方法を提供することを補助する。グルコースなどの分析対象物のラマン信号(signature)を、組織中で起こる光学的吸収および組織散乱に基づいて補正することが可能である。皮膚組織の吸収および組織散乱は、短期間および長期間において変化する可能性がある。例えば、一つの限定的ではない、短期間の状況は、血流の増加、あるいは組織水和の変化であるだろう。一つの限定的ではない、長期間の条件では、個体の皮膚が褐色に焼けたり、またはさらに赤くなるほど焼ける可能性がある。皮膚組織の吸収および組織散乱は、局所化されたヘマトクリット、組織の奇形(例えば、瘢痕または黒色腫)、温度、pH、または皮膚形態などの、その他の短期間および長期間の条件下において、変化する可能性がある。
【0017】
[0029] 一つの方法によると、分析対象物の濃度は、ラマンスペクトル情報を使用して決定される。高強度で狭帯域の光は、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そしてラマンシグナルを生成する。ラマン-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。一般的に、第二の側は第一の側の反対側に配置される。ラマン-生成物質からの高強度の光は反射されて、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成する。皮膚組織に進入する高強度の光から生成されるラマンシグナルは、ラマン-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質より生成される追加のラマンシグナルが、回収される。回収されたラマンシグナルに由来する情報を使用して、分析対象物の濃度が決定される。
【0018】
[0030] 図1を参照すると、一つの方法に従って、ラマン-生成物質および高強度で狭帯域の光の配置を示す図が使用される。高強度の光10は、つままれた皮膚組織または指などの、皮膚組織12に適用される。図1において、高強度の光10は、高強度の光源10aより生じるものとして示される。高強度の光源は、多様な光源であってよい。例えば、高強度の光源は、狭帯域において伝達される単色光源由来であって良い。単色光源の一つの例は、レーザー-ダイオード光源である。発光ダイオードおよび非干渉性(incoherent)ランプなどのその他の光源を使用することができることが意図される。光源は、より明瞭に規定された(すなわち、狭い)帯域の光を提供するために、フィルターを通すことができる。高強度の光が、色素レーザー、気体レーザー、イオンレーザー、または励起レーザーであってもよいこともまた、意図される。
【0019】
[0031] 光源の波長は、変化してもよいが、一般に、約300 nmから約10,000 nmである。光源は、適当なフィルターを伴う、紫外光源、近赤外光源、赤外光源、または可視光源であってもよい。使用されるべき光源は、高強度、狭帯域の光であろう。
【0020】
[0032] 一つの方法において、ラマンスペクトル情報を約300 nmから約12,000 nmの範囲の波長において、回収することができる。しかしながら、組織光学およびラマン効果に特有の、いくつかの波長依存的な特徴は、組織中の分析対象物の非侵襲的決定において、ラマン技術を首尾よく用いる能力に重大な影響を与えることができる。例えば、より低い波長では、組織中の分析対象物からの固有のラマンシグナルは比較的強いが、組織の自己蛍光も比較的強いので、組織中のラマンシグナルの検出を凌駕し、また、困難にする可能性がある。反対に、より高い波長では、組織の自己蛍光および固有のラマンシグナルは、減少する。光源の選択は、注目する分析対象物に関して、注目する波長での、ラマンシグナル力と自己蛍光干渉とのバランスに基づいてなされるだろう。そのため、グルコース分析において、830 nmまたは830 nm付近を中心とした高強度で狭帯域の光源を使用し、そして、ラマンシグナルの強度が組織の自己蛍光に対して最適化される、約830 nmから約1030 nmの範囲の波長におけるラマンスペクトル情報を回収することが望ましい。
【0021】
[0033] グルコースに関連するラマンスペクトル情報を、光源より100 cm-1から10,000 cm-1離れてシフトしたラマン散乱光から回収することができる。約1340 cm-1および約1125 cm-1のラマンシフトでグルコースのピークが最も強くなるため、より特異的には、グルコースに関連するラマンスペクトル情報を、光源より100 cm-1から1,600 cm-1離れてシフトしたラマン散乱光から回収することができる。特に、決定される分析対象物の濃度がグルコースでない場合は、異なる範囲においてラマンスペクトル情報を回収することができることが、意図される。
【0022】
[0034] 一つの特異的な例は、830 nmレーザー-ダイオード源である。商業的に入手可能な830 nmレーザー-ダイオード源の一つの例は、ミシガン州Ann ArborのKaiser Optical Systems, Inc.より販売される、InvictusTM NIR 830 nm ダイオードレーザーである。別の例は、ユタ州Salt Lake CityのProcess Instrumentsより販売される、PI-ECL-830-300ダイオードレーザーである。一つの態様において、レーザー光は、皮膚組織へ、約1mmビーム直径で伝達される。その他のレーザー-ダイオード源を使用することができることが、意図される。
【0023】
[0035] 高強度で狭帯域の光は、より高い分解能のラマンスペクトルを生成するために調節することができる。例えば、高強度で狭帯域の光は、より少ない光を暴露して、より高い分解能のラマンシグナルを得ることをもたらすように、制限されてもよい。高強度で狭帯域の光を調節することにより、ラマンンシグナルの強度および暴露を、注目する分析対象物に応じて最適化することができる。
【0024】
[0036] 高強度の光10は、皮膚組織12の第一の側12aに進入する。分析対象物の濃度の決定に使用することができる皮膚組織の厚さは、変化することができる。皮膚組織は一般に、約1 mmから約5 mmの厚さである。より具体的には、皮膚は一般に、約1 mmから約3 mmの厚さである。高強度の光が皮膚組織に進入する際に、皮膚組織はつままれる可能性がある。
【0025】
[0037] 図1に示されるように、高強度の光10はポイントAにおいて、皮膚組織12に進入する。高強度の光10が皮膚組織12に進入した後、ラマンシグナルが生成され、そして、すべての方向に散乱する。高強度の光の一部分は皮膚に進入することなく皮膚に接触し、そして、すべての方向に散乱する。ラマンシグナルの一部分16は、皮膚組織12に進入した後、集光光学系18へ向かって方向を変えられて戻る。しかしながら、ラマンシグナルのいくらかは皮膚組織12を抜け出て、そして、ラマン-生成物質22を使用して反射されて戻る。ラマン-生成物質22は、集光光学系18に向けてラマンシグナルを反射して戻し、それ以外は、集光光学系18の反対側である、皮膚組織12の奥側12bを抜け出て失われた。つまり、ラマンシグナルの増加した一部分は、集光光学系18へと方向を変えられるであろう。ラマンシグナルの増加した一部分を、鏡などの反射面を使用して方向を変えることができることが意図される。ラマン-生成物質により生成されるラマンシグナルの一部分は斜角で散乱されて、検出されないか、あるいは、検出される前に吸収される可能性もある。
【0026】
[0038] ラマン-生成物質22は皮膚組織12の奥側12bの近傍の位置に配置される。ラマン-生成物質は一般に、適用される高強度の光の進入の反対側に配置される。図1に示される通り、ラマン-生成物質22は図1のポイントAにおける高強度の光10の進入の反対側に配置される。ラマン-生成物質は図1に示されるような一つの反射体、あるいは複数の反射体であってよいことが、意図される。
【0027】
[0039] ラマン-生成物質22もまた、高強度の光10を受け取り、そしてそこから追加のラマンシグナルを生成する。ラマン-生成物質が高強度の光10からラマンシグナルを生成しない範囲で、ラマン-生成物質22は、高強度の光の残存部分を反射して皮膚組織12を通って戻す。ラマンシグナルは皮膚組織内のすべてのポイントから生じ、そして外側に散乱するため、これらのラマンシグナルは、通常、皮膚組織のより大きな容量を覆うであろう。この高強度の光がラマン-生成物質22を介して皮膚組織12へと反射されて戻った後、追加のラマンシグナルが生成される可能性がある。このように、源となる光が皮膚組織を二回通過することにより、光学経路は増加する。光学経路の増加により、結果として生じる分析シグナルもまた、増加する。
【0028】
[0040] ラマン-生成物質22を使用して、光学的吸収の測定を得ることができる。吸収とは、一般に、試料を通過するラマン-生成物質22からのラマンシグナルの全体量に対する比率である。ラマンシグナル全体が積分されることができる場合、分析シグナルは、組織吸収および組織散乱における変化に関して、さらに補正されることが可能である。組織吸収および組織散乱の変化は、例えば、血流の増加、または組織水和(hydration)の変化により、引き起こされる可能性がある。例えば、高強度の光のみを使用するラマン-生成物質からのラマンシグナルの強度は、ラマン生成物質および生体組織を用いる高強度の光を使用するラマンシグナルの強度と比較することができる。これらの強度の比較は組織による光学的吸収のレベルを、決定および定量することができる。光学的吸収のレベルは絶対的基準、あるいは相対的基準においてなされることができる。絶対的基準においてなされる場合、高強度の光は通常、ラマン-生成物質22に接触するときと同様の強度レベルを有するように調節される必要があるであろう。
【0029】
[0041] つまり、要約すると、(a)ラマン-生成物質22は皮膚組織の最初の通過において生成されるラマンシグナルを反射して戻し、それ以外は失われる;(b)ラマン-生成物質22は高強度の光10からラマンシグナルを生成する;そして(c)ラマン-生成物質22はラマンシグナルを生成しなかった光源を反射して、追加のラマンシグナルを生成する可能性を有する皮膚組織へと戻す。これらのラマンシグナルは、図1において一般にラマンシグナル20と示される。
【0030】
[0042] ラマン-生成物質は多様な物質により形成することができる。例えば、ラマン生成物質には、SpectralonTMポリマーライニングなどのポリマー材料が含まれてもよい。SpectralonTMポリマーライニングは、非常に高い拡散反射率を有する熱可塑性樹脂である。SpectralonTMポリマーライニングは、ニューハンプシャー州、North SuttonのLabsphere Inc.を通じて入手可能である。
【0031】
[0043] その他の物質が、その他のポリマー材料を含むラマン-生成物質として使用されてよいことが意図される。例えば、ラマン-生成物質には、ポリスチレン表面またはポリカーボネート表面が含まれてよい。使用されるラマン-生成物質は固有のラマンシグナルを生成する必要がある。
【0032】
[0044] 一つの態様において、ラマン-生成物質は、ラマン-生成物質ではないより厚い素材上の薄いコーティングまたは層であってよい。別の態様において、その素材は全体にラマン-生成物質で形成されてもよい。
【0033】
[0045] 分析対象物(例えばグルコース)の濃度の決定は、分析対象物の量に比例する測定、および、その量の分析対象物がその中に存在するものの容量の測定を必要とする。光学的散乱の測定の実行は、分析対象物の濃度の計算を補正させることができ、光プロ-ブ容量はいくつかの測定の過程を経て変化するだろう。
【0034】
[0046] 一つの方法において、ラマンシグナルを回収する前に、組織におけるラマンシグナルの光学的散乱を測定する空間フィルターが提供される。散乱の量は、生体組織のプローブ容量に影響を及ぼす。空間フィルターの使用は、吸収から散乱を識別し、さらに、固定された厚さの皮膚組織試料における吸収および散乱の相対的変化を近似する。
【0035】
[0047] 一つの方法において、空間フィルターは、皮膚組織から生じるラマンシグナルの一部分を遮断し、そしてラマンシグナルの残りの部分を少なくとも一つの検出器に進ませるように配置される。つまり、空間フィルターは光を一部分において遮断し、そして別の不部分において光を通過させる。図1は、空間フィルター80を示し、それは図2aにおいてさらに詳細が示される。空間フィルター80には、形成される複数の隙間82、84、86が含まれる。空間フィルター80のセクション80a、80bは、ラマンシグナルの一部分を遮断する。光学的散乱が低い場合、ラマンシグナルのわずかな一部分が皮膚組織を通って側面の軌道をとるであろうため、中央の隙間84でのラマンシグナルの強度(I)は、外側の隙間82、86でのラマンシグナルの強度より非常に高いであろう。
【0036】
[0048] 光学的散乱が低い場合、経路の長さに関する補正後の、中央の隙間84を通過するラマン光の強度(Im)に対する、右側の隙間86を通過するラマン光の強度(Ir)の比率は小さいであろう。同様に、光学的散乱が低い場合、経路の長さに関する補正後の、中央の隙間84を通過するラマン光の強度(Im)に対する、左側の隙間82を通過するラマン光の強度(Il)の比率もまた小さいであろう。このように、Ir/ImおよびIl/Imが小さいとき、光学的散乱は低い。組織における散乱が大きいほど、比率Ir/ImおよびIl/Imは大きくなる。図2aの吸収は、一般に強度の和(Ir+Im+Il)で近似されることもまた言及される。
【0037】
[0049] 図2aの装置を使用する場合、組織の散乱特性に影響するように生体組織の状態が変化すると、ラマン-生成物質からのラマンシグナルの空間パターンも続いて変化するであろう。この相対的変化を一連の分析対象物測定に適用することにより、分析対象物シグナルは光プローブ容量に対して正規化され、そしてそのため、計算される分析対象物の濃度の正確性が増加する。
【0038】
[0050] 空間フィルターは調節可能なものであってもよく、その隙間の開口部のサイズは調節されてもよいことが、意図される。これは、吸収される光から、散乱される光を識別するために好都合である可能性がある。例えば、図2bおよび図2cを参照すると、空間フィルター90には、セクション90aおよび90bが含まれる。セクション90a、90bは、概して水平方向に沿って両方向に可動である(矢印A参照)。図2bは、より開いた配置におけるセクション90a、90bが示され、それらの間の距離は、距離D1により示される。図2cは、より閉じた配置におけるセクション90a、90bが示され、それらの間の距離は、距離D2により示される。
【0039】
[0051] 散乱光のより良い決定および特徴づけのため、空間フィルターそのものが可動であってよいこともまた、意図される。例えば、光が試料中を通って伝播する場所を決定するために、および/または、多重散乱された光、または伝達された非散乱光を選択的に測定するために、空間フィルターを動かすことができる。第一のポイントを励起し(excite)、隙間をもつ第二のポイントで測定する場合、経路長についていくつかの考えを有する。経路長についてのより良い考えを有することにより、必要であれば、分析対象物シグナルに関して、組織容量を調節することができ、それにより、結果としてより正確な分析対象物の濃度を得る。
【0040】
[0052] 図1に戻って参照すると、ラマンシグナルが空間フィルター80を通って進行した後、集光光学系18が戻って来たラマンシグナル16、20を回収する。集光光学系は空間フィルターを通過する前にラマンシグナルを回収することができることが意図される。しかしながら、この方法において空間フィルター80は、ラマンシグナルが検出器へと移行する前に配置される必要がある。
【0041】
[0053] 回収されたラマンシグナルは、次に検出器30へと移行する。検出器30は、回収されたラマンシグナルから分析対象物の濃度(例えばグルコース)を決定することを補助する。使用することができる検出器の一つの例は、シリコン検出器である。検出器のその他の例には、拡張型InGaAs検出器、ゲルマニウム検出器、セレン化鉛(PbSe)検出器、または硫化鉛(PbS)検出器が含まれる。その他の検出器を使用して、回収されたラマンシグナルから分析対象物の濃度(例えばグルコース)を決定することを補助することができることが意図される。
【0042】
[0054] 複数の検出器および複数の隙間を使用することができることが意図される。この態様において、複数の隙間および検出器は、直接-画像化配列に近似することができ、散乱および吸収のより正確な測定を提供することができる。
【0043】
[0055] 弱いラマンシグナルを有する分析対象物(例えば生体組織中のグルコース)の定量に関連する、生体組織のラマン吸収および/または散乱特性に関する補正は、いくつかの方法により達成することができる。一つの方法において、較正アルゴリズムは組織の吸収特性および/または散乱特性を取り入れて、分析対象物の濃度の測定値に関して補正する。
【0044】
[0056] 別の方法において、回収回数(collection times)は適当なシグナル対ノイズ比が達せられるように自動的に調節され、より正確な分析対象物測定値を得ることを補助する。例えば、回収回数を増加してシグナルの全体量を増やすことが可能であり、それは、特により小さいシグナルにおいて、一般的により良いシグナルに変換される。
【0045】
[0057] 皮膚組織における光学的吸収および/または散乱に関して補正または評価することにより、グルコースのラマン信号(signature)を、より正確な様式で定量的に決定することができる。つまりこの方法は、定量的、分析的シグナルを、組織の光学的特性の変化に関して補正するための、光学的解決策を提案する。
【0046】
[0058] 集光光学系は図1に示されるものから変化してもよい。図3は、放物面鏡40を含む、図1と類似した図解を示し、放物面鏡の中を高強度の光10が、その中に形成される開口部42を通り抜ける。高強度の光10は組織に進入し、そしてラマンシグナルを生成し、それがすべての方向に散乱する。散乱したラマンシグナル46は、空間フィルターセクション80a、80bの間または周囲を通過した後、放物面鏡40に戻ってくる。ラマンシグナルはさらに放物面鏡により検出器50へと反射され、回収されたラマンシグナルから分析対象物の濃度が決定される。この方法における分析対象物の濃度を、図1および図2に関係して論じられたのと同様の様式で補正することができる。
【0047】
[0059] 別の態様によると、集光光学系は集束レーザー光を組織へと伝達して戻す、その他の湾曲を有する鏡であってよい。あるいは、集光光学系は、ラマンシグナル集光光学系に依存して組織へと並行の光を伝達して返すように形作られた、湾曲を有するその他の鏡であってよい。
【0048】
[0060] 別の態様において、ラマンシグナルの空間分布は、空間画像化に基づく光学的デザインを使用することによっても、達成されることができる。この態様において、空間フィルターは不必要である。その一つの限定的ではない例が図4に示される。図4は、高強度の光源10a、皮膚組織12、およびラマン-生成物質22を示す。ラマンシグナル100は画像化光学系110により回収され、そして次にアレイ検出器112に向けられる。アレイ検出器112は、それぞれがラマンシグナルの一部分を測定する、個々の検出器(画素)のアレイである。一つの方法において、画像化光学系および検出器は、ラマンシグナルを使用して、組織により生じる吸収および散乱の両方に関して補正する。
【0049】
[0061] 別の方法によると、ラマンスペクトル情報を使用して分析対象物の濃度を決定する非侵襲的方法には、皮膚組織の領域をつまむことが含まれる。皮膚組織の領域がつままれる。ラマン-生成物質が、つままれた皮膚組織の近傍または周辺に配置される。ラマン-生成物質は、それゆえに、少なくとも一つの開口部を形成する。高強度で狭帯域の光は、少なくとも一つの開口部を通って皮膚組織に適用される。高強度の光は皮膚組織に進入し、そして、ラマンシグナルを生成する。つままれた皮膚組織を通過する高強度の光およびラマンシグナルは、ラマン-生成物質を介してつままれた皮膚組織へと反射されて戻る。皮膚組織に進入する高強度の光から生成されるラマンシグナル、および、ラマン-生成物質より生成される追加のラマンシグナルが回収される。回収されたラマンシグナルを使用して、分析対象物の濃度が決定される。
【0050】
[0062] 図5aに示されるように、ラマン-生成物質170は、つままれた皮膚組織180の近傍または周辺に配置される。つままれた皮膚組織の幅は一般に約1 mmから約2 mmである。ラマン-生成物質170は、少なくとも一つの開口部172を形成し、その中を高強度の光174が少なくとも一つの開口部172を通って適用される。高強度の光174はつままれた皮膚組織180に進入し、そして、ラマンシグナルを生成する。つままれた皮膚組織を通過する高強度の光およびラマンシグナルは、ラマン-生成物質170を介してつままれた皮膚組織へと反射されて戻る。さらに、ラマン-生成物質170は、追加のラマンシグナルを生成する。ラマンシグナルが回収され、そして、回収されたラマンシグナルを使用して分析対象物の濃度が決定される。
【0051】
[0063] ラマンシグナルを、高NA(開口数)光学系またはNAファイバー190を介して回収することができる。高NA(開口数)光学系またはNAファイバー190は、回収されたラマンシグナルを分光計192へと伝達する。回収されたシグナルを、フィルターをもつ単一検出器、CCD(陰極結合検出器)、ダイオードアレイ、または、特異的なシグナルを検出するその他の装置へと伝達することができることが、意図される。例えば図5bに示されるように、ラマンシグナルを、つままれた皮膚組織に進入する高強度の光と同じ側に回収することができることが、意図される。
【0052】
[0064] 分析対象物の濃度の決定に加えて、ラマンスペクトル情報は、その他の方法において使用することができる。例えば、一つの方法において、回収されたラマンシグナルに由来する情報を使用して、総合診断を行うことができる。総合診断には、(a)特定の分析対象物の存在の同定、(b)特定の分子の同定、または(c)組織形態の同定が含まれてもよい。総合診断は、いくつかの有益な応用に関連することができる。例えば、潜在的な癌性皮膚病変は、一つの適用において同定することができる。潜在的な癌性細胞を同定することにより、組織切除を最小にすることができる。別の用途において、癌性細胞のステージを同定することができる。さらなる用途において、癌の光線力学療法の有効性を、追跡することが可能である。本発明の方法を使用して、その他の診断を行うことができることが、意図される。
【0053】
[0065] ラマンシグナルを使用することに加えて、その他のシグナルをその他の方法において使用することができる。別の方法において、分析対象物の濃度を決定するための非侵襲的方法は、蛍光スペクトル情報を使用する。蛍光スペクトル情報を使用して測定することができる分析対象物には、グルコース、脂質プロフィール(例えば、コレステロール、トリグリセリド、LDL、およびHDL)、微量アルブミン、ヘモグロビンA1C、または、ビリルビンが含まれる。しかしながら、本発明はこれらの特定の分析対象物に限定はされず、またその他の分析対象物の濃度を決定することができることが意図される。分析対象物は、例えば、全血試料中、血清試料中、血漿試料中、および、ISF(間質液)および尿中などの、その他の体液中に存在してもよい。
【0054】
[0066] 本発明は、非侵襲的な分析対象物(例えばグルコース)の検出の間に、一過性である(transient)可能性がある、光学的吸収および/または組織散乱に関して補正する方法を提供することを補助する。グルコースなどの分析対象物の蛍光信号(signature)を、組織中で起こる光学的吸収および組織散乱に基づいて補正することが可能である。皮膚組織の吸収および組織散乱は、上述の通り、短期間および長期間において変化する可能性がある。別の方法によると、分析対象物の濃度は蛍光スペクトル情報を使用して決定される。高強度帯の光が、皮膚組織の第一の側に適用される。高強度の光は皮膚組織に進入し、そして、蛍光シグナルを生成する。蛍光-生成物質は、皮膚組織の第二の側の近傍の位置に配置される。第二の側は一般に、第一の側の反対に配置される。蛍光-生成物質からの高強度の光は、反射され、それにより皮膚組織を通して皮膚組織の第一の側へと通過する、追加の蛍光シグナルが生成される。皮膚組織に進入する高強度の光から生成される蛍光シグナルは、蛍光-生成物質を介して皮膚組織の第一の側に向けて反射される。皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルが回収される。回収された蛍光シグナルに由来する情報を使用して、分析対象物の濃度が決定される。
【0055】
[0067] 図6aを参照すると、一つの方法に従って、蛍光-生成物質および高強度帯の光の配置を示すために図解が使用される。高強度の光210は、つままれた皮膚組織または指などの、皮膚組織12に適用される。図6aにおいて、高強度の光210は、高強度の光源210aより生じるように示される。高強度の光210は、狭帯域の光であってもよいが、必ずしも狭帯域の光である必要はない。高強度の光源は、単色光源由来であって良い。発光ダイオード、非干渉性(incoherent)ランプ、色素レーザー、気体レーザー、イオンレーザー、または励起レーザーなどのその他の光源が使用されてもよいことが意図される。
【0056】
[0068] 光源の波長は、変化してもよいが、一般に、300 nmと10,000 nmの間である。一つの方法において、蛍光スペクトル情報を約300 nmから約12,000 nmの範囲の波長において回収することができる。蛍光スペクトル情報を、決定すべき分析対象物の濃度に応じて、異なる範囲において回収することができることが意図される。
【0057】
[0069] 高強度の光210は、皮膚組織12の第一の側12aに進入する。図6aに示されるように、高強度の光210はポイントAにおいて、皮膚組織12に進入する。高強度の光210が皮膚組織12に進入した後、蛍光シグナルが生成され、そして、すべての方向に散乱する可能性がある。高強度の光の一部分は皮膚に進入することなく皮膚に接触し、そして、すべての方向に散乱する可能性がある。蛍光シグナルの一部分216は、皮膚組織12に進入した後、方向を変えられて集光光学系18へ向かって戻る。しかしながら、蛍光シグナルのいくらかは皮膚組織12を抜け出て、そして、蛍光-生成物質222を使用して反射されて戻る。蛍光-生成物質222は、集光光学系18に向けて蛍光シグナルを反射して戻し、それ以外は、集光光学系18の反対側である、皮膚組織12の奥側12bを抜け出なかったであろう。つまり、蛍光シグナルの増加した一部分は、集光光学系18へと方向を変えられるであろう。蛍光シグナルの増加した一部分を、鏡などの反射面を使用して方向を変えることも可能であることが意図される。蛍光-生成物質により生成される蛍光シグナルの一部分は斜角で散乱され、検出されないか、あるいは、検出される前に吸収される可能性もある。
【0058】
[0070] 蛍光-生成物質222は皮膚組織12の奥側12bの近傍の位置に配置される。蛍光-生成物質は一般に、適用される高強度の光の進入の反対側に位置する。図6aに示される通り、蛍光-生成物質222は図6aのポイントAにおける高強度の光210の進入の反対側に配置される。蛍光-生成物質は図6aに示される一つの反射体、あるいは複数の反射体であってよいことが、意図される。
【0059】
[0071] 蛍光-生成物質222もまた、高強度の光210を受け取り、そしてそこから追加の蛍光シグナルを生成する。蛍光-生成物質が高強度の光210から蛍光シグナルを生成しない範囲で、蛍光-生成物質222は、高強度の光の残存部分を反射して皮膚組織12を通って戻す。蛍光シグナルは皮膚組織内のすべてのポイントから生じ、そして外側に散乱するため、これらの蛍光シグナルは、通常、皮膚組織のより大きな容量を覆うであろう。この高強度の光が蛍光-生成物質222を介して反射されて皮膚組織12に戻った後、追加の蛍光シグナルが生成される可能性がある。このように、源となる光が皮膚組織を二回通過することにより、光学経路は増加する。光学経路の増加により、結果として生じる分析シグナルもまた、増加する。
【0060】
[0072] 蛍光-生成物質222を使用して、光学的吸収の測定を得ることができる。吸収は、一般に、試料を通過する蛍光-生成物質222からの蛍光シグナルの全体量に対する比率である。蛍光シグナル全体を積分することができる場合、分析シグナルは、組織吸収および散乱における変化に関して、さらに補正されることが可能である。ラマンシグナル全体を積分することができる場合、次に、分析シグナルは、組織吸収および組織散乱における変化に関して、さらに補正されることが可能である。組織吸収および組織散乱における変化は、例えば、血流の増加、または組織水和における変化により、引き起こされる可能性がある。例えば、高強度の光のみを使用する蛍光-生成物質からの蛍光シグナルの強度は、高強度の光を使用する、蛍光生成物質および生体組織を使用する蛍光シグナルの強度と比較することができる。これらの強度の比較は組織による光学的吸収のレベルを、決定および定量することができる。
【0061】
[0073] つまり、要約すると、 (a)蛍光-生成物質222は最初の皮膚組織の通過において生成される蛍光シグナルを反射して戻し、それ以外は失われる;(b)蛍光-生成物質222は高強度の光210から蛍光シグナルを生成する;そして(c)蛍光-生成物質222は蛍光シグナルを生成しなかった光源を反射して追加の蛍光シグナルを生成する可能性を有する皮膚組織中に戻す。これらの蛍光シグナルは図6aにおいて一般に蛍光シグナル220と指定される。
【0062】
[0074] 蛍光-生成物質は、より短い波長の光が分子を励起し、そして次に分子が蛍光を発し、より長い波長の光を発するという、蛍光の機構に基づいて機能することができる。蛍光-生成物質は、蛍光色素などの多様な物質から形成されることができる。蛍光色素は、近赤外(NIR)色素、IR色素、および可視色素であってよい。NIR蛍光色素のいくつかの例には、シアニン色素からの誘導体(Cy5.5)、または臨床的に認可されたインドシアニンブルー(ICG)が含まれる。これらの色素は、本来、通常は水性なので、典型的にはコーティングとして使用される。色素は、蛍光-生成物質に動員、または、浸透させることができる。同様の様式において機能する蛍光-生成物質として、その他の物質を使用することができることが意図される。
【0063】
[0075] NIRにおいて蛍光を発するその他の物質は、少し異なる方法で機能する。NIRカードにおいて使用される物質は、より長波長の光が第一分子により吸収され、そしてより短波長において蛍光を発する第二分子にエネルギーが移行するという、“光子アップコンバージョン”に基づいて機能する。このプロセスは、励起光が発光よりも低エネルギーなので、アップコンバージョンと言われる。一つの例は、量子ドットの使用である。量子ドットは小さな金属製の物質で、その蛍光はサイズ依存的である。同様の様式で機能するその他の物質を、蛍光-生成物質として使用することができることが、意図される。
【0064】
[0076] 異なる様式、および異なるスペクトルにおいて蛍光を発するその他の物質を、蛍光-生成物質として使用することができることが意図される。使用される蛍光-生成物質は、固有の蛍光シグナルを生成する。
【0065】
[0077] 一つの態様において、蛍光-生成物質は、蛍光-生成物質ではないより厚い素材上の薄いコーティングまたは薄い層であってよい。別の態様において、その素材は全体に蛍光-生成物質で形成されてもよい。
【0066】
[0078] 分析対象物(例えばグルコース)の濃度の決定は、分析対象物の量に比例する測定、および、その量の分析対象物がその中に存在するものの容量の測定を必要とする。光学的散乱の測定の実行は、分析対象物の濃度の計算を補正させることができ、光プロ-ブ容量はいくつかの測定の過程を経て変化するだろう。
【0067】
[0079] 一つの方法において、蛍光シグナルを回収する前に、組織における蛍光シグナルの光学的散乱を測定する空間フィルターが提供される。一つの方法において、空間フィルターは、皮膚組織から生じる蛍光シグナルの一部分を遮断し、そして蛍光シグナルの残りの部分を少なくとも一つの検出器に進ませるように配置される。このように、空間フィルターは光を一部分において遮断し、別の部分において光を通過させる。図6aは、空間フィルター280を示し、それは図6bにおいてさらに詳細に示される。空間フィルター280には、形成される複数の隙間282、284、286が含まれる。空間フィルター280のセクション280a、280bは、蛍光シグナルの一部分を遮断する。光学的散乱が低い場合、蛍光シグナルのわずかな一部分が皮膚組織を通って側面の軌道をとるため、中央の隙間284での蛍光シグナルの強度(I)は、外側の隙間282、286での蛍光シグナルの強度より非常に高いであろう。
【0068】
[0080] 光学的散乱が低い場合、経路の長さに関する補正後の、中央の隙間284を通過する蛍光の強度(Im)に対する、右側の隙間286を通過する蛍光の強度(Ir)の比率は小さいであろう。同様に、光学的散乱が低い場合、経路の長さに関する補正後の、中央の隙間284を通過する蛍光の強度(Im)に対する、左側の隙間282を通過する蛍光の強度(Il)の比率もまた小さいであろう。このように、Ir/ImおよびIl/Imが小さいとき、散乱は低い。組織中の散乱が大きいほど、比率Ir/ImおよびIl/Imは大きくなる。図6bの吸収は、一般に強度の和(Ir+Im+Il)で近似されることもまた言及される。
【0069】
[0081] 図6bの隙間を使用する場合、組織の散乱特性に影響するように生体組織の状態が変化すると、蛍光-生成物質からの蛍光シグナルの空間パターンも続いて変化するであろう。この相対的変化を一連の分析対象物測定に適用することにより、分析対象物シグナルは光プローブ容量に対して正規化され、そしてそのため、計算される分析対象物の濃度の正確性が増加する。
【0070】
[0082] 例えば空間フィルター90について上述されたように、空間フィルターは調節可能なものであってもよく、その隙間の開口部のサイズは調節されてもよいことが、意図される。散乱のより良い決定および配置のため、空間フィルターそのものが可動であってよいこともまた、意図される。
【0071】
[0083] 集光光学系18により、戻って来た蛍光シグナル216、220が回収される。回収された蛍光シグナルは、次に検出器230へと移行する。検出器230は、回収された蛍光シグナルから分析対象物の濃度(例えばグルコース)を決定することを補助する。使用することができる蛍光シグナルの検出器の一つの例は、シリコン検出器である。検出器のその他の例には、拡張型InGaAs検出器、ゲルマニウム検出器、セレン化鉛(PbSe)検出器、または硫化鉛(PbS)検出器が含まれる。その他の検出器を使用して、回収された蛍光シグナルから分析対象物の濃度(例えばグルコース)を決定することを補助することができることが意図される。
【0072】
[0084] 複数の検出器および複数の隙間を使用することができることが、意図される。この態様において、複数の隙間および検出器は、直接-画像化配列に近似することができ、散乱および吸収のより正確な測定を提供する可能性がある。
【0073】
[0085] 弱い蛍光シグナルを有する分析対象物(例えば、生体組織内のグルコース)の定量と関連する、生体組織の蛍光吸収特性および/または散乱特性に関する補正は、いくつかの方法により、達することができる。一つの方法において、較正アルゴリズムは組織の吸収および/または散乱特性を取り入れて、分析対象物の濃度の測定値に関して補正する。
【0074】
[0086] 別の方法において、回収回数は適当なシグナル対ノイズ比が達せられるように自動的に調節され、より正確な分析対象物測定値を得ることを補助する。例えば、回収回数を増加してシグナルの全体量を増やすことが可能であり、それは、特により小さいシグナルにおいて、一般的により良いシグナルに変換される。
【0075】
[0087] 皮膚組織における光学的吸収および/または散乱に関して補正または評価することにより、グルコースの蛍光信号(signature)を、より正確な様式で定量的に決定することができる。このように、この方法は、定量的、分析的シグナルを、組織の光学的特性の変化に関して補正するための、光学的解決策を提案する。
【0076】
[0088] 集光光学系は図6aに示されるものから変化することができる。図7は、放物面鏡240を含む、図6aと類似した図解を示し、放物面鏡の中を高強度の光210が、その中に形成される開口部242を通り抜ける。高強度の光210は組織に進入し、そして蛍光シグナルを生成し、それがすべての方向に散乱する。散乱した蛍光シグナル246は、空間フィルターセクション280a、280bを通過した後、放物面鏡240に戻る。蛍光シグナルはさらに放物面鏡により検出器250へと反射され、回収された蛍光シグナルから分析対象物の濃度が決定される。この方法における分析対象物の濃度を、図6a、図6bに関係して論じられたのと同様の様式で補正することができる。
【0077】
[0089] 別の態様によると、集光光学系は集束レーザー光を組織へと伝達して戻す、湾曲を有するその他の鏡であってよい。あるいは、集光光学系は、蛍光シグナル集光光学系に依存して組織へと並行の光を伝達して返すように形作られた、湾曲を有するその他の鏡であってよい。
【0078】
[0090] 別の態様において、蛍光シグナルの空間分布は、空間画像化に基づく光学的デザインを使用することによっても、達成することができる。この態様において、空間フィルターは不必要である。一つの限定的ではない例が図8に示される。図8は、高強度の光源210a、皮膚組織12、および蛍光-生成物質222を示す。蛍光シグナル300は画像化光学系310により回収され、そして次にアレイ検出器312に向けられる。アレイ検出器312は、それぞれが蛍光シグナルの一部分を測定する、個々の検出器(画素)のアレイである。一つの方法において、画像化光学系および検出器は、蛍光シグナルを使用して、組織により生じる吸収および散乱の両方に関して補正する。
【0079】
[0091] 図9aに示されるように、蛍光-生成物質370は、つままれた皮膚組織380の近傍または周辺に配置される。つままれた皮膚組織の幅は一般に約1 mmから約2 mmである。蛍光生成物質370は、少なくとも一つの開口部372を形成し、その中を高強度の光374が少なくとも一つの開口部372を通って適用される。高強度の光374はつままれた皮膚組織380に進入し、そして、蛍光シグナルを生成する。つままれた皮膚組織を通過する高強度の光および蛍光シグナルは、蛍光生成物質370を介してつままれた皮膚組織へと反射されて戻る。さらに、蛍光生成物質370は、追加の蛍光シグナルを生成する。蛍光シグナルが回収され、そして、回収された蛍光シグナルを使用して分析対象物の濃度が決定される。
【0080】
[0092] 蛍光シグナルを、高NA(開口数)光学系またはNAファイバー390を介して回収することができる。高NA(開口数)光学系またはNAファイバー390は、回収された蛍光シグナルを分光計392へと伝達する。回収されたシグナルを、フィルターをもつ単一検出器、CCD(陰極結合検出器)、ダイオードアレイ、または、特異的なシグナルを検出するその他の装置へと伝達することができることが、意図される。例えば図9bに示されるように、蛍光シグナルを、つままれた皮膚組織に進入する高強度の光と同じ側に回収することができることが、意図される。
【0081】
[0093] 分析対象物の濃度の決定に加えて、蛍光スペクトル情報は、その他の方法において使用することができる。例えば、一つの方法において、回収された蛍光シグナルに由来する情報を使用して、総合診断を行うことができる。総合診断には、(a)特定の分析対象物の存在の同定、(b)特定の分子の同定、または(c)組織形態の同定が含まれてもよい。総合診断は、いくつかの有益な応用に関連することができる。例えば、潜在的な癌性皮膚病変は、一つの適用において同定することができる。潜在的な癌性細胞を同定することにより、組織切除を最小にすることができる。別の用途において、癌性細胞のステージを同定することができる。さらなる用途において、癌の光線力学療法の有効性を、追跡することが可能である。本発明の方法を使用して、その他の診断を行うことができることが、意図される。
【0082】
プロセスA
[0094] 皮膚組織に進入し、そしてラマンシグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、ラマン-生成物質を配置すること;
ラマン-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成すること;
ラマン-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成されるラマンシグナルを反射すること;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルに由来する情報を使用して、分析対象物の濃度を決定すること;
を含む、ラマンスペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【0083】
プロセスB
[0095] 高強度の光が、単色光源より適用される、プロセスAの方法。
【0084】
プロセスC
[0096] 高強度の光が、レーザー-ダイオード光源より適用される、プロセスBの方法。
【0085】
プロセスD
[0097] 高強度の光が、発光ダイオード、zeon-arcランプ、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、プロセスAの方法。
【0086】
プロセスE
[0098] 分析対象物がグルコースである、プロセスAの方法。
【0087】
プロセスF
[0099] 皮膚組織が、約1 mmから約5 mmの厚さである、プロセスAの方法。
【0088】
プロセスG
[0100] ラマン-生成物質が、適用される高強度の光の進入の反対側に配置される、プロセスAの方法。
【0089】
プロセスH
[0101] ラマン-生成物質にポリマー材料が含まれる、プロセスAの方法。
【0090】
プロセスI
[0102] ポリマー材料がポリスチレンまたはポリカーボネートである、プロセスHの方法。
【0091】
プロセスJ
[0103] 分析対象物の濃度を決定することを補助する検出器をさらに含む、プロセスAの方法。
【0092】
プロセスK
[0104] ラマンシグナルが、少なくとも一つの放物面鏡を使用して回収される、プロセスAの方法。
【0093】
プロセスL
[0105] ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスAの方法。
【0094】
プロセスM
[0106] ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスLの方法。
【0095】
プロセスN
[0107] 高強度の光が赤外光である、プロセスAの方法。
【0096】
プロセスO
[0108] 高強度の光が近赤外光である、プロセスAの方法。
【0097】
プロセスP
[0109] 高強度の光が紫外光である、プロセスAの方法。
【0098】
プロセスQ
[0110] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスAの方法。
【0099】
プロセスR
[0111] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスAの方法。
【0100】
プロセスS
[0112] 回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスAの方法。
【0101】
プロセスT
[0113] 皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、プロセスAの方法。
【0102】
プロセスU
[0114] アレイ検出器および画像化光学系をさらに含む、プロセスAの方法。
【0103】
プロセスV
[0115] 皮膚組織に進入し、そしてラマンシグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、ラマン-生成物質を配置すること;
ラマン-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成すること;
ラマン-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成されるラマンシグナルを反射すること;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルに由来する情報を使用して、総合診断を行うこと;
を含む、ラマンスペクトル情報を使用する、診断の非侵襲的方法。
【0104】
プロセスW
[0116] 総合診断を行うことが、特定の分析対象物の存在を同定することを含む、プロセスVの方法。
【0105】
プロセスX
[0117] 総合診断を行うことが、特定の分子を同定することを含む、プロセスVの方法。
【0106】
プロセスY
[0118] 高強度の光が、単色光源より適用される、プロセスVの方法。
【0107】
プロセスZ
[0119] 高強度の光が、レーザー-ダイオード光源より適用される、プロセスYの方法。
【0108】
プロセスAA
[0120] 高強度の光が、発光ダイオード、zeon-arcランプ、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、プロセスVの方法。
【0109】
プロセスBB
[0121] 分析対象物がグルコースである、プロセスVの方法。
【0110】
プロセスCC
[0122] 皮膚組織が、約1 mmから約5 mmの厚さである、プロセスVの方法。
【0111】
プロセスDD
[0123] ラマン-生成物質が、適用される高強度の光の進入の反対側に配置される、プロセスVの方法。
【0112】
プロセスEE
[0124] ラマン-生成物質にポリマー材料が含まれる、プロセスVの方法。
【0113】
プロセスFF
[0125] ポリマー材料がポリスチレンまたはポリカーボネートである、プロセスEEの方法。
【0114】
プロセスGG
[0126] 総合診断を行うことを補助する検出器をさらに含む、プロセスVの方法。
【0115】
プロセスHH
[0127] ラマンシグナルが、少なくとも一つの放物面鏡を使用して回収される、プロセスVの方法。
【0116】
プロセスII
[0128] ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスVの方法。
【0117】
プロセスJJ
[0129] ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスIIの方法。
【0118】
プロセスKK
[0130] 高強度の光が赤外光である、プロセスVの方法。
【0119】
プロセスLL
[0131] 高強度の光が近赤外光である、プロセスVの方法。
【0120】
プロセスMM
[0132] 高強度の光が紫外光である、プロセスVの方法。
【0121】
プロセスNN
[0133] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が総合診断を行うことを補助するのに使用される、プロセスVの方法。
【0122】
プロセスOO
[0134] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が総合診断を行うことを補助するのに使用される、プロセスVの方法。
【0123】
プロセスPP
[0135] 回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスVの方法。
【0124】
プロセスQQ
[0136] 皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、プロセスVの方法。
【0125】
プロセスRR
[0137] アレイ検出器および画像化光学系をさらに含む、プロセスVの方法。
【0126】
プロセスSS
[0138] 皮膚組織の領域をつまむこと;
ラマン-生成物質をつままれた、皮膚組織の近傍または周囲に配置し、ラマン-生成物質が少なくとも一つの開口部を形成すること:
高強度で狭帯域の光を少なくとも一つの開口部を通して皮膚組織に適用し、高強度の光が皮膚組織に進入し、そしてラマンシグナルを生成すること;
つままれた皮膚組織を通過する、高強度の光およびラマンシグナルを反射して、ラマン-生成物質を介してつままれた皮膚組織中に戻すこと;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルを使用して、分析対象物の濃度を決定すること;
を含む、ラマンスペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【0127】
プロセスTT
[0139] ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスSSの方法。
【0128】
プロセスUU
[0140] ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスTTの方法。
【0129】
プロセスVV
[0141] 分析対象物がグルコースである、プロセスSSの方法。
【0130】
プロセスWW
[0142] ラマン-生成物質にポリマー材料が含まれる、プロセスSSの方法。
【0131】
プロセスXX
[0143] 皮膚組織に進入し、そして蛍光シグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、蛍光-生成物質を配置すること;
蛍光-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加の蛍光シグナルを生成すること;
蛍光-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成される蛍光シグナルを反射すること;
皮膚組織に進入する高強度の光から生成される蛍光シグナルおよび蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルに由来する情報を使用して、分析対象物の濃度を決定すること;
を含む、蛍光スペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【0132】
プロセスYY
[0144] 高強度の光が、単色光源より適用される、プロセスXXの方法。
【0133】
プロセスZZ
[0145] 高強度の光が、レーザー-ダイオード光源より適用される、プロセスYYの方法。
【0134】
プロセスAAA
[0146] 高強度の光が、発光ダイオードまたはzeon-arcランプより適用される、プロセスXXの方法。
【0135】
プロセスBBB
[0147] 高強度の光が、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、プロセスXXの方法。
【0136】
プロセスCCC
[0148] 皮膚組織が、約1 mmから約5 mmの厚さである、プロセスXXの方法。
【0137】
プロセスDDD
[0149] 蛍光-生成物質が、適用される高強度の光の進入の反対側に配置される、プロセスXXの方法。
【0138】
プロセスEEE
[0150] 蛍光-生成物質に蛍光色素が含まれる、プロセスXXの方法。
【0139】
プロセスFFF
[0151] 蛍光-生成物質に量子ドットが含まれる、プロセスXXの方法。
【0140】
プロセスGGG
[0152] 分析対象物の濃度を決定することを補助する検出器をさらに含む、プロセスXXの方法。
【0141】
プロセスHHH
[0153] 蛍光シグナルが、少なくとも一つの放物面鏡を使用して回収される、プロセスXXの方法。
【0142】
プロセスIII
[0154] 蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスXXの方法。
【0143】
プロセスJJJ
[0155] 蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスIIIの方法。
【0144】
プロセスKKK
[0156] 高強度の光が赤外光である、プロセスXXの方法。
【0145】
プロセスLLL
[0157] 高強度の光が近赤外光である、プロセスXXの方法。
【0146】
プロセスMMM
[0158] 高強度の光が紫外光である、プロセスXXの方法。
【0147】
プロセスNNN
[0159] 回収された蛍光シグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスXXの方法。
【0148】
プロセスOOO
[0160] 回収された蛍光シグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスXXの方法。
【0149】
プロセスPPP
[0161] 回収された蛍光シグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスXXの方法。
【0150】
プロセスQQQ
[0162] 皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、プロセスXXの方法。
【0151】
プロセスRRR
[0163] アレイ検出器および画像化光学系をさらに含む、プロセスXXの方法。
【0152】
プロセスSSS
[0164] 皮膚組織に進入し、そして蛍光シグナルを生成する高強度の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、蛍光-生成物質を配置すること;
蛍光-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加の蛍光シグナルを生成すること;
蛍光-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成される蛍光シグナルを反射すること;
皮膚組織に進入する高強度の光から生成される蛍光シグナルおよび蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルに由来する情報を使用して、総合診断を行うこと;
を含む、蛍光スペクトル情報を使用する、診断の非侵襲的方法。
【0153】
プロセスTTT
[0165] 総合診断を行うことが、特定の分析対象物の存在を同定することを含む、プロセスSSSの方法。
【0154】
プロセスUUU
[0166] 総合診断を行うことが、特定の分子を同定することを含む、プロセスSSSの方法。
【0155】
プロセスVVV
[0167] 高強度の光が、狭帯域の光である、プロセスSSSの方法。
【0156】
プロセスWWW
[0168] 高強度の光が、レーザー-ダイオード光源より適用される、プロセスSSSの方法。
【0157】
プロセスXXX
[0169] 高強度の光が、発光ダイオードまたはzeon-arcランプより適用される、プロセスSSSの方法。
【0158】
プロセスYYY
[0170] 高強度の光が、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、プロセスSSSの方法。
【0159】
プロセスZZZ
[0171] 皮膚組織が、約1 mmから約5 mmの厚さである、プロセスSSSの方法。
【0160】
プロセスAAAA
[0172] 蛍光-生成物質が、適用される高強度の光の進入の反対側に配置される、プロセスSSSの方法。
【0161】
プロセスBBBB
[0173] 蛍光-生成物質に蛍光色素が含まれる、プロセスSSSの方法。
【0162】
プロセスCCCC
[0174] 蛍光-生成物質に量子ドットが含まれる、プロセスSSSの方法。
【0163】
プロセスDDDD
[0175] 分析対象物の濃度を決定することを補助する検出器をさらに含む、プロセスSSSの方法。
【0164】
プロセスEEEE
[0176] 蛍光シグナルが、少なくとも一つの放物面鏡を使用して回収される、プロセスSSSの方法。
【0165】
プロセスFFFF
[0177] 蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスSSSの方法。
【0166】
プロセスGGGG
[0178] 蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスFFFFの方法。
【0167】
プロセスHHHH
[0179] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスSSSの方法。
【0168】
プロセスIIII
[0180] 回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスSSSの方法。
【0169】
プロセスJJJJ
[0181] 回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、プロセスSSSの方法。
【0170】
プロセスKKKK
[0182] 皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、プロセスSSSの方法。
【0171】
プロセスLLLL
[0183] アレイ検出器および画像化光学系をさらに含む、プロセスSSSの方法。
【0172】
プロセスMMMM
[0184] 皮膚組織の領域をつまむこと;
蛍光-生成物質をつままれた皮膚組織の近傍または周囲に配置し、蛍光-生成物質が少なくとも一つの開口部を形成すること:
高強度で狭帯域の光を少なくとも一つの開口部を通して皮膚組織に適用し、高強度の光が皮膚組織に進入し、そして蛍光シグナルを生成すること;
つままれた皮膚組織を通過する、高強度の光および蛍光シグナルを反射して、蛍光-生成物質を介してつままれた皮膚組織中に戻すこと;
皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルを使用して、分析対象物の濃度を決定すること;
を含む、蛍光スペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【0173】
プロセスNNNN
[0185] 蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、プロセスMMMMの方法。
【0174】
プロセスOOOO
[0186] 蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、プロセスNNNNの方法。
【0175】
プロセスPPPP
[0187] 分析対象物がグルコースである、プロセスMMMMの方法。
【0176】
[0188] 本発明は、一つあるいはそれ以上の特定の態様に関して記述されているが、本発明の精神と範囲から逸脱することなく、多くの変化をそれに行うことができることを、当業者は認識するだろう。個々のこれらの態様、およびそれらの明白な変更は、添付の請求項により定義される通り、発明の精神と範囲の中に含まれるものと意図される。
【特許請求の範囲】
【請求項1】
皮膚組織に進入し、そしてラマンシグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、ラマン-生成物質を配置すること;
ラマン-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成すること;
ラマン-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成されるラマンシグナルを反射すること;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルに由来する情報を使用して、分析対象物の濃度を決定すること;
を含む、ラマンスペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【請求項2】
高強度の光が、単色光源より適用される、請求項1の方法。
【請求項3】
高強度の光が、レーザー-ダイオード光源より適用される、請求項2の方法。
【請求項4】
高強度の光が、発光ダイオード、zeon-arcランプ、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、請求項1の方法。
【請求項5】
分析対象物がグルコースである、請求項1の方法。
【請求項6】
皮膚組織が、約1 mmから約5 mmの厚さである、請求項1の方法。
【請求項7】
ラマン-生成物質が、適用される高強度の光の進入の反対側に配置される、請求項1の方法。
【請求項8】
ラマン-生成物質にポリマー材料が含まれる、請求項1の方法。
【請求項9】
ポリマー材料がポリスチレンまたはポリカーボネートである、請求項8の方法。
【請求項10】
分析対象物の濃度を決定することを補助する検出器をさらに含む、請求項1の方法。
【請求項11】
ラマンシグナルが、少なくとも一つの放物面鏡を使用して回収される、請求項1の方法。
【請求項12】
ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項1の方法。
【請求項13】
ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項12の方法。
【請求項14】
高強度の光が赤外光である、請求項1の方法。
【請求項15】
高強度の光が近赤外光である、請求項1の方法。
【請求項16】
高強度の光が紫外光である、請求項1の方法。
【請求項17】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項1の方法。
【請求項18】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項1の方法。
【請求項19】
回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項1の方法。
【請求項20】
皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、請求項1の方法。
【請求項21】
アレイ検出器および画像化光学系をさらに含む、請求項1の方法。
【請求項22】
皮膚組織に進入し、そしてラマンシグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、ラマン-生成物質を配置すること;
ラマン-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成すること;
ラマン-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成されるラマンシグナルを反射すること;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルに由来する情報を使用して、総合診断を行うこと;
を含む、ラマンスペクトル情報を使用する、診断の非侵襲的方法。
【請求項23】
総合診断を行うことが、特定の分析対象物の存在を同定することを含む、請求項22の方法。
【請求項24】
総合診断を行うことが、特定の分子を同定することを含む、請求項22の方法。
【請求項25】
高強度の光が、単色光源より適用される、請求項22の方法。
【請求項26】
高強度の光が、レーザー-ダイオード光源より適用される、請求項25の方法。
【請求項27】
高強度の光が、発光ダイオード、zeon-arcランプ、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、請求項22の方法。
【請求項28】
分析対象物がグルコースである、請求項22の方法。
【請求項29】
皮膚組織が、約1 mmから約5 mmの厚さである、請求項22の方法。
【請求項30】
ラマン-生成物質が、適用される高強度の光の進入の反対側に配置される、請求項22の方法。
【請求項31】
ラマン-生成物質にポリマー材料が含まれる、請求項22の方法。
【請求項32】
ポリマー材料がポリスチレンまたはポリカーボネートである、請求項31の方法。
【請求項33】
総合診断を行うことを補助する検出器をさらに含む、請求項22の方法。
【請求項34】
ラマンシグナルが、少なくとも一つの放物面鏡を使用して回収される、請求項22の方法。
【請求項35】
ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項22の方法。
【請求項36】
ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項35の方法。
【請求項37】
高強度の光が赤外光である、請求項22の方法。
【請求項38】
高強度の光が近赤外光である、請求項22の方法。
【請求項39】
高強度の光が紫外光である、請求項22の方法。
【請求項40】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が総合診断を行うことを補助するのに使用される、請求項22の方法。
【請求項41】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が総合診断を行うことを補助するのに使用される、請求項22の方法。
【請求項42】
回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項22の方法。
【請求項43】
皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、請求項22の方法。
【請求項44】
アレイ検出器および画像化光学系をさらに含む、請求項22の方法。
【請求項45】
皮膚組織の領域をつまむこと;
ラマン-生成物質を、つままれた皮膚組織の近傍または周囲に配置し、ラマン-生成物質が少なくとも一つの開口部を形成すること:
高強度で狭帯域の光を少なくとも一つの開口部を通して皮膚組織に適用し、高強度の光が皮膚組織に進入し、そしてラマンシグナルを生成すること;
つままれた皮膚組織を通過する、高強度の光およびラマンシグナルを反射して、ラマン-生成物質を介してつままれた皮膚組織中に戻すこと;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルを使用して、分析対象物の濃度を決定すること;
を含む、ラマンスペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【請求項46】
ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項45の方法。
【請求項47】
ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項46の方法。
【請求項48】
分析対象物がグルコースである、請求項45の方法。
【請求項49】
ラマン-生成物質にポリマー材料が含まれる、請求項45の方法。
【請求項50】
皮膚組織に進入し、そして蛍光シグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、蛍光-生成物質を配置すること;
蛍光-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加の蛍光シグナルを生成すること;
蛍光-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成される蛍光シグナルを反射すること;
皮膚組織に進入する高強度の光から生成される蛍光シグナルおよび蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルに由来する情報を使用して、分析対象物の濃度を決定すること;
を含む、蛍光スペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【請求項51】
高強度の光が、単色光源より適用される、請求項50の方法。
【請求項52】
高強度の光が、レーザー-ダイオード光源より適用される、請求項51の方法。
【請求項53】
高強度の光が、発光ダイオードまたはzeon-arcランプより適用される、請求項50の方法。
【請求項54】
高強度の光が、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、請求項50の方法。
【請求項55】
皮膚組織が、約1 mmから約5 mmの厚さである、請求項50の方法。
【請求項56】
蛍光-生成物質が、適用される高強度の光の進入の反対側に配置される、請求項50の方法。
【請求項57】
蛍光-生成物質に蛍光色素が含まれる、請求項50の方法。
【請求項58】
蛍光-生成物質に量子ドットが含まれる、請求項50の方法。
【請求項59】
分析対象物の濃度を決定することを補助する検出器をさらに含む、請求項50の方法。
【請求項60】
蛍光シグナルが、少なくとも一つの放物面鏡を使用して回収される、請求項50の方法。
【請求項61】
蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項50の方法。
【請求項62】
蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項61の方法。
【請求項63】
高強度の光が赤外光である、請求項50の方法。
【請求項64】
高強度の光が近赤外光である、請求項50の方法。
【請求項65】
高強度の光が紫外光である、請求項50の方法。
【請求項66】
回収された蛍光シグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項50の方法。
【請求項67】
回収された蛍光シグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項50の方法。
【請求項68】
回収された蛍光シグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項50の方法。
【請求項69】
皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、請求項50の方法。
【請求項70】
アレイ検出器および画像化光学系をさらに含む、請求項50の方法。
【請求項71】
皮膚組織に進入し、そして蛍光シグナルを生成する高強度の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、蛍光-生成物質を配置すること;
蛍光-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加の蛍光シグナルを生成すること;
蛍光-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成される蛍光シグナルを反射すること;
皮膚組織に進入する高強度の光から生成される蛍光シグナルおよび蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルに由来する情報を使用して、総合診断を行うこと;
を含む、蛍光スペクトル情報を使用する、診断の非侵襲的方法。
【請求項72】
総合診断を行うことが、特定の分析対象物の存在を同定することを含む、請求項71の方法。
【請求項73】
総合診断を行うことが、特定の分子を同定することを含む、請求項71の方法。
【請求項74】
高強度の光が、狭帯域の光である、請求項71の方法。
【請求項75】
高強度の光が、レーザー-ダイオード光源より適用される、請求項71の方法。
【請求項76】
高強度の光が、発光ダイオードまたはzeon-arcランプより適用される、請求項71の方法。
【請求項77】
高強度の光が、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、請求項71の方法。
【請求項78】
皮膚組織が、約1 mmから約5 mmの厚さである、請求項71の方法。
【請求項79】
蛍光-生成物質が、適用される高強度の光の進入の反対側に配置される、請求項71の方法。
【請求項80】
蛍光-生成物質に蛍光色素が含まれる、請求項71の方法。
【請求項81】
蛍光-生成物質に量子ドットが含まれる、請求項71の方法。
【請求項82】
分析対象物の濃度を決定することを補助する検出器をさらに含む、請求項71の方法。
【請求項83】
蛍光シグナルが、少なくとも一つの放物面鏡を使用して回収される、請求項71の方法。
【請求項84】
蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項71の方法。
【請求項85】
蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項84の方法。
【請求項86】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項71の方法。
【請求項87】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項71の方法。
【請求項88】
回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項71の方法。
【請求項89】
皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、請求項71の方法。
【請求項90】
アレイ検出器および画像化光学系をさらに含む、請求項71の方法。
【請求項91】
皮膚組織の領域をつまむこと;
蛍光-生成物質を、つままれた皮膚組織の近傍または周囲に配置し、蛍光-生成物質が少なくとも一つの開口部を形成すること:
高強度で狭帯域の光を少なくとも一つの開口部を通して皮膚組織に適用し、高強度の光が皮膚組織に進入し、そして蛍光シグナルを生成すること;
つままれた皮膚組織を通過する、高強度の光および蛍光シグナルを反射して、蛍光-生成物質を介してつままれた皮膚組織中に戻すこと;
皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルを使用して、分析対象物の濃度を決定すること;
を含む、蛍光スペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【請求項92】
蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項91の方法。
【請求項93】
蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項92の方法。
【請求項94】
分析対象物がグルコースである、請求項91の方法。
【請求項1】
皮膚組織に進入し、そしてラマンシグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、ラマン-生成物質を配置すること;
ラマン-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成すること;
ラマン-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成されるラマンシグナルを反射すること;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルに由来する情報を使用して、分析対象物の濃度を決定すること;
を含む、ラマンスペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【請求項2】
高強度の光が、単色光源より適用される、請求項1の方法。
【請求項3】
高強度の光が、レーザー-ダイオード光源より適用される、請求項2の方法。
【請求項4】
高強度の光が、発光ダイオード、zeon-arcランプ、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、請求項1の方法。
【請求項5】
分析対象物がグルコースである、請求項1の方法。
【請求項6】
皮膚組織が、約1 mmから約5 mmの厚さである、請求項1の方法。
【請求項7】
ラマン-生成物質が、適用される高強度の光の進入の反対側に配置される、請求項1の方法。
【請求項8】
ラマン-生成物質にポリマー材料が含まれる、請求項1の方法。
【請求項9】
ポリマー材料がポリスチレンまたはポリカーボネートである、請求項8の方法。
【請求項10】
分析対象物の濃度を決定することを補助する検出器をさらに含む、請求項1の方法。
【請求項11】
ラマンシグナルが、少なくとも一つの放物面鏡を使用して回収される、請求項1の方法。
【請求項12】
ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項1の方法。
【請求項13】
ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項12の方法。
【請求項14】
高強度の光が赤外光である、請求項1の方法。
【請求項15】
高強度の光が近赤外光である、請求項1の方法。
【請求項16】
高強度の光が紫外光である、請求項1の方法。
【請求項17】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項1の方法。
【請求項18】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項1の方法。
【請求項19】
回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項1の方法。
【請求項20】
皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、請求項1の方法。
【請求項21】
アレイ検出器および画像化光学系をさらに含む、請求項1の方法。
【請求項22】
皮膚組織に進入し、そしてラマンシグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、ラマン-生成物質を配置すること;
ラマン-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加のラマンシグナルを生成すること;
ラマン-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成されるラマンシグナルを反射すること;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルに由来する情報を使用して、総合診断を行うこと;
を含む、ラマンスペクトル情報を使用する、診断の非侵襲的方法。
【請求項23】
総合診断を行うことが、特定の分析対象物の存在を同定することを含む、請求項22の方法。
【請求項24】
総合診断を行うことが、特定の分子を同定することを含む、請求項22の方法。
【請求項25】
高強度の光が、単色光源より適用される、請求項22の方法。
【請求項26】
高強度の光が、レーザー-ダイオード光源より適用される、請求項25の方法。
【請求項27】
高強度の光が、発光ダイオード、zeon-arcランプ、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、請求項22の方法。
【請求項28】
分析対象物がグルコースである、請求項22の方法。
【請求項29】
皮膚組織が、約1 mmから約5 mmの厚さである、請求項22の方法。
【請求項30】
ラマン-生成物質が、適用される高強度の光の進入の反対側に配置される、請求項22の方法。
【請求項31】
ラマン-生成物質にポリマー材料が含まれる、請求項22の方法。
【請求項32】
ポリマー材料がポリスチレンまたはポリカーボネートである、請求項31の方法。
【請求項33】
総合診断を行うことを補助する検出器をさらに含む、請求項22の方法。
【請求項34】
ラマンシグナルが、少なくとも一つの放物面鏡を使用して回収される、請求項22の方法。
【請求項35】
ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項22の方法。
【請求項36】
ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項35の方法。
【請求項37】
高強度の光が赤外光である、請求項22の方法。
【請求項38】
高強度の光が近赤外光である、請求項22の方法。
【請求項39】
高強度の光が紫外光である、請求項22の方法。
【請求項40】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が総合診断を行うことを補助するのに使用される、請求項22の方法。
【請求項41】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が総合診断を行うことを補助するのに使用される、請求項22の方法。
【請求項42】
回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項22の方法。
【請求項43】
皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、請求項22の方法。
【請求項44】
アレイ検出器および画像化光学系をさらに含む、請求項22の方法。
【請求項45】
皮膚組織の領域をつまむこと;
ラマン-生成物質を、つままれた皮膚組織の近傍または周囲に配置し、ラマン-生成物質が少なくとも一つの開口部を形成すること:
高強度で狭帯域の光を少なくとも一つの開口部を通して皮膚組織に適用し、高強度の光が皮膚組織に進入し、そしてラマンシグナルを生成すること;
つままれた皮膚組織を通過する、高強度の光およびラマンシグナルを反射して、ラマン-生成物質を介してつままれた皮膚組織中に戻すこと;
皮膚組織に進入する高強度の光から生成されるラマンシグナルおよびラマン-生成物質から生成される追加のラマンシグナルを回収すること;そして
回収したラマンシグナルを使用して、分析対象物の濃度を決定すること;
を含む、ラマンスペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【請求項46】
ラマンシグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項45の方法。
【請求項47】
ラマンシグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項46の方法。
【請求項48】
分析対象物がグルコースである、請求項45の方法。
【請求項49】
ラマン-生成物質にポリマー材料が含まれる、請求項45の方法。
【請求項50】
皮膚組織に進入し、そして蛍光シグナルを生成する高強度で狭帯域の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、蛍光-生成物質を配置すること;
蛍光-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加の蛍光シグナルを生成すること;
蛍光-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成される蛍光シグナルを反射すること;
皮膚組織に進入する高強度の光から生成される蛍光シグナルおよび蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルに由来する情報を使用して、分析対象物の濃度を決定すること;
を含む、蛍光スペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【請求項51】
高強度の光が、単色光源より適用される、請求項50の方法。
【請求項52】
高強度の光が、レーザー-ダイオード光源より適用される、請求項51の方法。
【請求項53】
高強度の光が、発光ダイオードまたはzeon-arcランプより適用される、請求項50の方法。
【請求項54】
高強度の光が、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、請求項50の方法。
【請求項55】
皮膚組織が、約1 mmから約5 mmの厚さである、請求項50の方法。
【請求項56】
蛍光-生成物質が、適用される高強度の光の進入の反対側に配置される、請求項50の方法。
【請求項57】
蛍光-生成物質に蛍光色素が含まれる、請求項50の方法。
【請求項58】
蛍光-生成物質に量子ドットが含まれる、請求項50の方法。
【請求項59】
分析対象物の濃度を決定することを補助する検出器をさらに含む、請求項50の方法。
【請求項60】
蛍光シグナルが、少なくとも一つの放物面鏡を使用して回収される、請求項50の方法。
【請求項61】
蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項50の方法。
【請求項62】
蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項61の方法。
【請求項63】
高強度の光が赤外光である、請求項50の方法。
【請求項64】
高強度の光が近赤外光である、請求項50の方法。
【請求項65】
高強度の光が紫外光である、請求項50の方法。
【請求項66】
回収された蛍光シグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項50の方法。
【請求項67】
回収された蛍光シグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項50の方法。
【請求項68】
回収された蛍光シグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項50の方法。
【請求項69】
皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、請求項50の方法。
【請求項70】
アレイ検出器および画像化光学系をさらに含む、請求項50の方法。
【請求項71】
皮膚組織に進入し、そして蛍光シグナルを生成する高強度の光を皮膚組織の第一の側に適用すること;
一般には第一の側の反対側に位置する皮膚組織の第二の側の近傍の位置に、蛍光-生成物質を配置すること;
蛍光-生成物質から高強度の光を反射して、それにより皮膚組織を通して皮膚組織の第一の側へと通過する追加の蛍光シグナルを生成すること;
蛍光-生成物質を介して皮膚組織の第一の側へと向けて皮膚組織に進入する高強度の光から生成される蛍光シグナルを反射すること;
皮膚組織に進入する高強度の光から生成される蛍光シグナルおよび蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルに由来する情報を使用して、総合診断を行うこと;
を含む、蛍光スペクトル情報を使用する、診断の非侵襲的方法。
【請求項72】
総合診断を行うことが、特定の分析対象物の存在を同定することを含む、請求項71の方法。
【請求項73】
総合診断を行うことが、特定の分子を同定することを含む、請求項71の方法。
【請求項74】
高強度の光が、狭帯域の光である、請求項71の方法。
【請求項75】
高強度の光が、レーザー-ダイオード光源より適用される、請求項71の方法。
【請求項76】
高強度の光が、発光ダイオードまたはzeon-arcランプより適用される、請求項71の方法。
【請求項77】
高強度の光が、色素レーザー、気体レーザー源、イオンレーザー源、または励起個体レーザー源(pumped solid-state laser source)より適用される、請求項71の方法。
【請求項78】
皮膚組織が、約1 mmから約5 mmの厚さである、請求項71の方法。
【請求項79】
蛍光-生成物質が、適用される高強度の光の進入の反対側に配置される、請求項71の方法。
【請求項80】
蛍光-生成物質に蛍光色素が含まれる、請求項71の方法。
【請求項81】
蛍光-生成物質に量子ドットが含まれる、請求項71の方法。
【請求項82】
分析対象物の濃度を決定することを補助する検出器をさらに含む、請求項71の方法。
【請求項83】
蛍光シグナルが、少なくとも一つの放物面鏡を使用して回収される、請求項71の方法。
【請求項84】
蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項71の方法。
【請求項85】
蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項84の方法。
【請求項86】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱および吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項71の方法。
【請求項87】
回収されたラマンシグナル由来の情報が皮膚組織の光学的散乱のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項71の方法。
【請求項88】
回収されたラマンシグナル由来の情報が皮膚組織の吸収のレベルを決定することを補助し、その情報が分析対象物の濃度を決定することを補助するのに使用される、請求項71の方法。
【請求項89】
皮膚組織の吸収のレベルを決定することを補助するために、空間フィルターを提供することをさらに含む、請求項71の方法。
【請求項90】
アレイ検出器および画像化光学系をさらに含む、請求項71の方法。
【請求項91】
皮膚組織の領域をつまむこと;
蛍光-生成物質を、つままれた皮膚組織の近傍または周囲に配置し、蛍光-生成物質が少なくとも一つの開口部を形成すること:
高強度で狭帯域の光を少なくとも一つの開口部を通して皮膚組織に適用し、高強度の光が皮膚組織に進入し、そして蛍光シグナルを生成すること;
つままれた皮膚組織を通過する、高強度の光および蛍光シグナルを反射して、蛍光-生成物質を介してつままれた皮膚組織中に戻すこと;
皮膚組織に進入する高強度の光から生成される蛍光シグナル、および、蛍光-生成物質から生成される追加の蛍光シグナルを回収すること;そして
回収した蛍光シグナルを使用して、分析対象物の濃度を決定すること;
を含む、蛍光スペクトル情報を使用して、分析対象物の濃度を決定するための非侵襲的方法。
【請求項92】
蛍光シグナルが、約300 nmから約5000 nmの範囲の波長で回収される、請求項91の方法。
【請求項93】
蛍光シグナルが、約830 nmから約1030 nmの範囲の波長で回収される、請求項92の方法。
【請求項94】
分析対象物がグルコースである、請求項91の方法。
【図1】


【図2a】


【図2b】


【図2c】


【図3】


【図4】


【図5a】


【図5b】


【図6a】


【図6b】


【図7】


【図8】


【図9a】


【図9b】




【図2a】


【図2b】


【図2c】


【図3】


【図4】


【図5a】


【図5b】


【図6a】


【図6b】


【図7】


【図8】


【図9a】


【図9b】


【公表番号】特表2010−501252(P2010−501252A)
【公表日】平成22年1月21日(2010.1.21)
【国際特許分類】
【出願番号】特願2009−525575(P2009−525575)
【出願日】平成19年8月17日(2007.8.17)
【国際出願番号】PCT/US2007/018310
【国際公開番号】WO2008/024288
【国際公開日】平成20年2月28日(2008.2.28)
【出願人】(503106111)バイエル・ヘルスケア・エルエルシー (154)
【Fターム(参考)】
【公表日】平成22年1月21日(2010.1.21)
【国際特許分類】
【出願日】平成19年8月17日(2007.8.17)
【国際出願番号】PCT/US2007/018310
【国際公開番号】WO2008/024288
【国際公開日】平成20年2月28日(2008.2.28)
【出願人】(503106111)バイエル・ヘルスケア・エルエルシー (154)
【Fターム(参考)】
[ Back to top ]

