セラミド合成促進剤、化粧料、皮膚外用剤、医薬部外品、医薬品およびセラミド合成促進剤の製造方法
【課題】皮膚中でのセラミドの合成を促進する新しい技術を提供する。
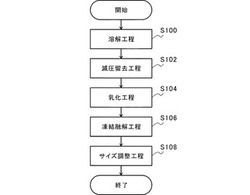
【解決手段】本発明の実施形態の一つであるセラミド合成促進剤は、スフィンゴミエリンを含むリポソームを有する。このリポソームは負電荷を帯びている。かかるリポソームは、例えば、スフィンゴミエリンと負電荷の脂質とを有機溶媒に溶解し、溶解液を生成する溶解工程S100と、溶解液を減圧留去し、脂質薄膜を生成する減圧留去工程S102と、脂質薄膜に水を加えて乳化させ、リポソームを得る乳化工程S104と、を経ることによって得ることができる。
【解決手段】本発明の実施形態の一つであるセラミド合成促進剤は、スフィンゴミエリンを含むリポソームを有する。このリポソームは負電荷を帯びている。かかるリポソームは、例えば、スフィンゴミエリンと負電荷の脂質とを有機溶媒に溶解し、溶解液を生成する溶解工程S100と、溶解液を減圧留去し、脂質薄膜を生成する減圧留去工程S102と、脂質薄膜に水を加えて乳化させ、リポソームを得る乳化工程S104と、を経ることによって得ることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、セラミド合成促進のための技術に関する。本発明は、例えば、化粧料、皮膚外用剤、医薬部外品、医薬品などの分野に好適に適用し得る。
【背景技術】
【0002】
スフィンゴ脂質の1つであるセラミドは、皮膚の最も外側の層である角層中に含まれる脂質の50%以上を占めている。セラミドは、角層の下に位置する顆粒層が生成する層板顆粒に由来し、角層中において水分子と水素結合することで、ラメラ構造(層状構造)を構築し、角層中の水分保持(保湿)機能や、バリア機能に関与している。角層中のセラミドの量が減少すると、皮膚の保湿機能やバリア機能が低下し、乾燥肌、荒れ肌、アトピー性皮膚炎、老人性乾皮症、乾癬等の皮膚疾患を引き起こすと考えられている。
【0003】
一方、近年、細胞内でセラミドの産生を促進することで、アポトーシス、細胞の分化誘導、細胞の増殖抑制等が誘導されることが報告されており、セラミドは、保湿機能やバリア機能に関与するのみならず、アポトーシス、細胞の分化や増殖等を制御する細胞内シグナル伝達物質分子として機能することが分かってきた。したがって、セラミドの産生を促進すれば、炎症性疾患、悪性腫瘍等、細胞の増殖あるいは分化の異常に起因する疾患を低減することができると考えられる。
【0004】
セラミドはスフィンゴミエリンを加水分解することで得られるため、スフィンゴミエリンを皮膚の奥深くまで浸透させることができれば、角層中のセラミド含量や角層より下の層である、表皮の顆粒層、有棘層、基底層中のセラミド含有量を増加させることが可能となる。
【0005】
そこで、スフィンゴミエリンを配合した化粧料が提案されている(例えば、特許文献1)。特許文献1には、開示される化粧料が、有効成分の皮膚浸透性に優れ、皮膚に塗布することにより皮膚細胞機能が活性化し、皮膚の保護および美化に顕著な効果を発揮すると記載されている。しかし、特許文献1にかかる化粧料を皮膚に塗布した際に、スフィンゴミエリンが皮膚の奥深くまで浸透したか否かの記載はなく、また、皮膚中のセラミドの合成量の変化についての記載もない。
【0006】
そこで、リポソーム化したスフィンゴミエリンを含有する化粧料が提案され、この化粧料を皮膚に塗布することで、皮膚中のセラミド含有量を増加させることが可能となる(例えば、特許文献2)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開昭63−211208号公報
【特許文献2】国際公開第2007/145276号
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、皮膚中のセラミドの合成を促進する新しい技術を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明の具現化形態の一例は、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、前記リポソームが負電荷を帯びている、セラミド合成促進剤が含まれる。
【0010】
人の角層は、pH4.5からpH6.5前後と弱酸性であるため、リポソームを負電荷にすれば、リポソームを角層に容易に浸透させることができ、スフィンゴミエリンのリポソームを皮膚の奥深くまで浸透させることが可能となる。セラミドはスフィンゴミエリンを加水分解して得られるため、スフィンゴミエリンを皮膚の奥深くまで浸透させて、角層や、角層より下の層である、表皮の顆粒層、有棘層、基底層でセラミドの合成を促進することができる。
【0011】
上記リポソームの表面が負電荷を帯びていてもよい。
【0012】
角層の細胞と直接接触するのは、リポソームの表面であるため、リポソームの表面が負電荷であれば、リポソームの表面以外が負電荷でなくても、リポソームを角層に容易に浸透させることができる。
【0013】
負電荷の脂質を添加することにより上記リポソームを負電荷にしてもよい。かかる負電荷の脂質を添加する構成により、リポソームを容易に負電荷にすることができる。
【0014】
上記負電荷の脂質は、リン脂質であってもよい。また、上記リン脂質は、ジセチルホスフェイトまたはジパルミトイルホスファチジルグリセロールであってもよい。リポソームを構成するスフィンゴミエリンはリン脂質であるため、負電荷の脂質をリン脂質とすることで、スフィンゴミエリンとの親和性を高めることができ、安定してリポソームを負電荷に帯電させることが可能となる。
【0015】
本発明の具現化形態の他の例は、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームは負電荷を帯びているセラミド合成促進剤を含む化粧料、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームは負電荷を帯びているセラミド合成促進剤を含む皮膚外用剤、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームは負電荷を帯びているセラミド合成促進剤を含む医薬部外品、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームは負電荷を帯びているセラミド合成促進剤を含む医薬品が含まれる。
【0016】
上述したように、リポソームを負電荷にすれば、リポソームを角層に容易に浸透させることができ、スフィンゴミエリンを皮膚の奥深くまで浸透させることが可能となり、表皮でセラミドの合成を促進する作用がある。したがって、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームが負電荷を帯びているセラミド合成促進剤は、皮膚の保湿力が低下している人や、皮膚疾患患者に対する化粧料、皮膚外用剤、医薬部外品、医薬品の有効成分として極めて有望である。
【0017】
本発明の具現化形態の他の例は、スフィンゴミエリンと負電荷の脂質とを有機溶媒に溶解し、溶解液を生成する溶解工程と、溶解液を減圧留去し、脂質薄膜を生成する減圧留去工程と、脂質薄膜に水を加えて乳化させ、リポソームを得る乳化工程と、を有するセラミド合成促進剤の製造方法を含む。
【0018】
特許請求の範囲における各請求項に定義された構成は、本発明の好適な具現化形態の例である。
【図面の簡単な説明】
【0019】
【図1】実施例として紹介するセラミド合成促進剤の製造方法を説明するための説明図である。
【図2】実施例のセラミド合成促進剤の製造方法に用いる脂質の構造式を示す図である。
【図3】SPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lの表面電位を示す図である。
【図4】ヒト3次元培養表皮モデルの構造を説明するための説明図である。
【図5】PBSまたは培地に、それぞれ再分散させた場合のリポソームのサイズの変化を説明するための説明図である。
【図6】ヒト3次元培養表皮モデルの角層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。
【図7】ヒト3次元培養表皮モデルの角層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。
【図8】ヒト3次元培養表皮モデルの基底層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。
【図9】ヒト3次元培養表皮モデルの基底層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。
【発明を実施するための形態】
【0020】
以下に添付図面を参照しながら、本発明の好適な実施形態について詳細に説明する。かかる実施形態に示す寸法、材料、その他具体的な数値などは、発明の理解を容易とするための例示にすぎず、特に断る場合を除き、本発明を限定するものではない。なお、本明細書および図面において、実質的に同一の機能、構成を有する要素については、同一の符号を付することにより重複説明を省略し、また本発明に直接関係のない要素は図示を省略する。
【0021】
<実施例:セラミド合成促進剤の製造方法>
図1は、実施例として紹介するセラミド合成促進剤の製造方法を説明するための説明図である。図1に示すように、本実施例にかかるセラミド合成促進剤の製造方法は、溶解工程S100と、減圧留去工程S102と、乳化工程S104と、凍結融解工程S106と、サイズ調整工程S108とを含む。以下に、各工程の構成を詳細に説明する。
【0022】
(溶解工程S100)
溶解工程S100は、スフィンゴミエリンと負電荷の脂質とを有機溶媒(例えば、クロロホルム)に溶解し溶解液を生成する工程である。溶解工程S100において、負電荷の脂質は、好ましくはリン脂質であり、より好ましくは、ジセチルホスフェイト(Dicetyl phosphate:以下、単にDCPと称する)またはジパルミトイルホスファチジルグリセロール(Dipalmitoyl phosphatidylglycerol:以下、単にDPPGと称する)である。
【0023】
スフィンゴミエリンはリン脂質であるため、負電荷の脂質をリン脂質とすることで、スフィンゴミエリンとの親和性を高めることができ、スフィンゴミエリンでリポソームを作成したときに、安定してリポソームを負電荷に帯電させることが可能となる。
【0024】
(減圧留去工程S102)
減圧留去工程S102は、溶解工程S100で生成された溶解液を減圧留去し、脂質薄膜を生成する工程である。減圧留去工程S102では、溶解工程S100で生成された溶解液をナス型フラスコに入れ、ロータリーエバポレータを用いて、溶解液に含まれる有機溶媒を減圧留去することで脂質薄膜を生成する。
【0025】
(乳化工程S104)
乳化工程S104は、減圧留去工程S102で生成された脂質薄膜に水を加えて乳化させ、リポソームを得る工程である。本実施例の乳化工程S104では、減圧留去工程S102で生成された脂質薄膜にPBS(Phosphate Buffered Saline)(pH7.4)を加えて乳化させ、リポソームを得る。
【0026】
(凍結融解工程S106)
凍結融解工程S106は、乳化工程S104で得られたリポソームを含む溶液を凍結融解する工程である。本実施例の凍結融解工程S106では凍結融解を5回繰り返す。
【0027】
(サイズ調整工程S108)
サイズ調整工程S108は、凍結融解工程S106で凍結融解したリポソームのサイズを調整する工程である。サイズ調整工程S108では、エクストルーダにポアサイズ100から400nmの孔が形成されたポリカーボネート膜をセットし、このポリカーボネート膜に形成された孔に、凍結融解工程S106で凍結融解したリポソームを含む溶液を通過させる。本実施例では、エクストルーダにポアサイズ100nmの孔が形成されたポリカーボネート膜をセットし、凍結融解工程S106で凍結融解したリポソームを含む溶液を5回通過させる。
【0028】
その後、リポソームを含む溶液を、例えば、250000gで15分間、超遠心分離を行い、スフィンゴミエリンのリポソーム(以下、単にスフィンゴミエリンリポソームと称する)を得る。
【0029】
以上説明した、溶解工程S100、減圧留去工程S102、乳化工程S104、凍結融解工程S106、サイズ調整工程S108を経ることによりセラミド合成促進剤を製造することができる。
【0030】
<セラミド合成促進剤の評価>
上記製造方法で製造されたセラミド合成促進剤を評価すべく、セラミド合成促進剤によるセラミド増加量を測定した。以下、実験の手順を詳細に説明する。
【0031】
(スフィンゴミエリンリポソームの調整)
図2は、本実施例のセラミド合成促進剤の製造方法に用いる脂質の構造式を示す図である。上述したセラミド合成促進剤の製造方法を用いて、図2(a)に示すDCPを用いて負電荷に帯電させたスフィンゴミエリンリポソーム(以下、単に、DCP-SPM-Lと称する)と、図2(b)に示すDPPGを用いて負電荷に帯電させたスフィンゴミエリンリポソーム(以下、単に、DPPG-SPM-Lと称する)とを作成した。また、コントロールとして、スフィンゴミエリンのみを用いて作成したスフィンゴミエリンリポソーム(以下、単に、SPM-Lと称する)を作成した。さらに、DCP-SPM-LおよびDPPG-SPM-Lの比較対象として、図2(c)に示すステアリルアミン(Stearyl Amine)を用いて正電荷に帯電させたスフィンゴミエリンリポソーム(以下、単にSA-SPM-Lと称する)を作成した。なお、DCP-SPM-L、DPPG-SPM-L、SA-SPM-Lには、モル比で10%、それぞれの脂質(DCP、DPPG、SA)が含まれている。
【0032】
そして、作成したDCP-SPM-L、DPPG-SPM-L、SPM-LおよびSA-SPM-Lを、それぞれPBS(pH7.4)に再分散させたものと、作成したDCP-SPM-L、DPPG-SPM-L、SPM-LおよびSA-SPM-Lを、それぞれ培地に再分散させたものとを作成した。
【0033】
図3は、SPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lの表面電位を示す図である。図3中、棒グラフに付加したエラーバーは標準偏差(S.D.)を示す。図3に示すように、SPM-Lは、-3.9mV(S.D. 0.39)、SA-SPM-Lは、+12.9mV(S.D. 0.71)、DCP-SPM-Lは、-14.9mV(S.D. 1.59)、DPPG-SPM-Lは、-14.1mV(S.D. 1.12)となった。したがって、SPM-L、DCP-SPM-L およびDPPG-SPM-Lは、表面が負電荷を帯びており、SA-SPM-Lは、表面が正電荷を帯びていることが分かった。
【0034】
(スフィンゴミエリンリポソームの添加)
スフィンゴミエリンリポソームを添加する細胞として、株式会社ジャパン・ティッシュ・エンジニアリング社製のLabCyte EPI-MODELを用いた。LabCyte EPI-MODELは、ヒト正常表皮細胞を重層培養したヒト3次元培養表皮モデルである。
【0035】
図4は、ヒト3次元培養表皮モデルの構造を説明するための説明図である。DCP-SPM-LをPBSに再分散させたもの200μLを、図4に示すヒト3次元培養表皮モデルの角層側から添加し、37℃、5%CO2下で7日間培養を行った。同様に、DPPG-SPM-LをPBSに再分散させたもの200μL、SPM-LをPBSに再分散させたもの200μL、SA-SPM-LをPBSに再分散させたもの200μLを、それぞれヒト3次元培養表皮モデルの角層側から添加し、37℃、5%CO2下で7日間培養を行った。
【0036】
また、DCP-SPM-Lを培地に再分散させたもの1mlを、図4に示すヒト3次元培養表皮モデルのメンブランフィルタ(基底層)側から添加し、37℃、5%CO2下で6時間培養を行った。同様に、DPPG-SPM-Lを培地に再分散させたもの1ml、SPM-Lを培地に再分散させたもの1ml、SA-SPM-Lを培地に再分散させたもの1mlを、それぞれヒト3次元培養表皮モデルの基底層側から添加し、37℃、5%CO2下で6時間培養を行った。
【0037】
その後、リポソームを角層側から添加したヒト3次元培養表皮モデルの培地(この場合、PBS)、および、基底層側から添加したヒト3次元培養表皮モデルの培地を、アスコルビン酸添加角化促進培地に交換し、37℃、5%CO2下で24時間培養を行った。
【0038】
図5は、PBSまたは培地に、それぞれ再分散させた場合のリポソームのサイズの変化を説明するための説明図である。
【0039】
図5(a)に示すように、リポソームをPBSに再分散させ、7日間培養した場合、DCP-SPM-L、DPPG-SPM-L、SPM-LおよびSA-SPM-Lのサイズは多少の増加または減少しているものの、サイズに大きな変化は見られなかった。また、図5(b)に示すように、リポソームを培地に再分散させ、6時間培養した場合、DCP-SPM-L、DPPG-SPM-L、SPM-LおよびSA-SPM-Lのサイズは多少減少しているものの、サイズに大きな変化は見られなかった。
【0040】
以上の結果により、リポソームは、培地中でも安定に存在することが確認された。
【0041】
(セラミドの抽出)
培養後のヒト3次元培養表皮モデルを取り出し、クロロホルム:メタノール(2:1)中で、プローブ型超音波を用いて、表皮組織を破壊し、表皮組織からセラミドを抽出した。そして、フィルタで濾過することによって、表皮組織を除去し、セラミド抽出液を得た。その後、セラミド抽出液をN2気流中で乾固させ、さらにクロロホルム:メタノール(2:1)200μLで再溶解した。これを、サンプルとして以下の実験に用いた。
【0042】
(セラミド含有量の測定)
得られたサンプルを、20μLずつHPTLC(High Performance Thin Layer Chromatography:高性能薄層クロマトグラフィ)プレートにスポットし、クロロホルム:メタノール:酢酸(190:9:1)を展開溶媒として2回展開した。展開後のHPTLCプレートに、10%硫酸銅を含む8%リン酸水溶液を噴霧し、その後、180℃のホットプレートで10分間焼析(加熱)した。
【0043】
そして、ルミノイメージアナライザーシステム(LAS-1000-plus、富士フイルム株式会社製)を用いて、焼析後のHPTLCプレートを撮影し、密度によりセラミド量を定量した。
【0044】
(結果)
図6および図7は、ヒト3次元培養表皮モデルの角層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図であり、図8および図9は、ヒト3次元培養表皮モデルの基底層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。図6から図9中、棒グラフに付加したエラーバーは標準偏差(S.D.)を示す。
【0045】
図6(a)に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、セラミド2の含有量は、SPM-Lの1.08μg/cm2(S.D. 0.07)、SA-SPM-Lの1.13μg/cm2(S.D. 0.17)と比較して、DCP-SPM-Lは1.27μg/cm2(S.D. 0.05)、DPPG-SPM-Lは1.46μg/cm2(S.D. 0.15)となり、セラミド2の含有量が多かった。
【0046】
図6(b)に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、セラミド3の含有量は、SPM-Lの0.03μg/cm2(S.D. 0.03)、SA-SPM-Lの0.04μg/cm2(S.D. 0.01)と比較して、DCP-SPM-Lは0.07μg/cm2(S.D. 0.01)、DPPG-SPM-Lは0.14μg/cm2(S.D. 0.08)となり、セラミド3の含有量が多かった。
【0047】
図7(a)に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、セラミド5の含有量は、SPM-Lの0.37μg/cm2(S.D. 0.02)、SA-SPM-Lの0.41μg/cm2(S.D. 0.07)と比較して、DCP-SPM-Lは0.46μg/cm2(S.D. 0.08)、DPPG-SPM-Lは0.59μg/cm2(S.D. 0.07)となり、セラミド5の含有量が多かった。
【0048】
図7(b)に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、セラミド6の含有量は、SPM-Lの0.88μg/cm2(S.D. 0.06)、SA-SPM-Lの0.86μg/cm2(S.D. 0.19)と比較して、DCP-SPM-Lは1.00μg/cm2(S.D. 0.21)、DPPG-SPM-Lは1.35μg/cm2(S.D. 0.16)となり、セラミド6の含有量が多かった。
【0049】
このように図6および図7に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、SPM-LおよびSA-SPM-Lと比較して、DCP-SPM-LおよびDPPG-SPM-Lの方がセラミド2、セラミド3、セラミド5およびセラミド6の含有量が多かった。特にDPPG-SPM-Lは、セラミド2、セラミド3、セラミド5およびセラミド6の含有量が多かった。
【0050】
以上の実験結果によると、上記製造方法で製造した負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を、角層側から添加した場合、角層を含む表皮組織中のセラミド含有量を増加させる、すなわち、セラミドの合成を促進することができることが分かる。人の角層は、pH4.5からpH6.5前後と弱酸性であるため、リポソームを負電荷にしたことにより、リポソームの角層への分配が変化する、または、リポソームの表皮細胞への親和性が変化することにより、リポソームを角層に容易に浸透させることができ、スフィンゴミエリンのリポソームを皮膚の奥深くまで浸透させることが可能となったと考えられる。
【0051】
図8(a)に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、セラミド2の含有量は、SPM-Lの0.859μg/cm2(S.D. 0.290)、SA-SPM-Lの0.927μg/cm2(S.D. 0.234)と比較して、DCP-SPM-Lは1.010μg/cm2(S.D. 0.335)、DPPG-SPM-Lは1.132μg/cm2(S.D. 0.307)となり、セラミド2の含有量が多かった。
【0052】
図8(b)に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、セラミド3の含有量は、SPM-Lの0.267μg/cm2(S.D. 0.029)、SA-SPM-Lの0.349μg/cm2(S.D. 0.102)と比較して、DCP-SPM-Lは0.476μg/cm2(S.D. 0.072)、DPPG-SPM-Lは0.689μg/cm2(S.D. 0.055)となり、セラミド3の含有量が多かった。
【0053】
図9(a)に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、セラミド5の含有量は、SPM-Lの0.305μg/cm2(S.D. 0.074)、SA-SPM-Lの0.311μg/cm2(S.D. 0.130)と比較して、DCP-SPM-Lは0.437μg/cm2(S.D. 0.059)、DPPG-SPM-Lは0.596μg/cm2(S.D. 0.047)となり、セラミド5の含有量が多かった。
【0054】
図9(b)に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、セラミド6の含有量は、SPM-Lの0.365μg/cm2(S.D. 0.116)、SA-SPM-Lの0.486μg/cm2(S.D. 0.224)と比較して、DCP-SPM-Lは0.709μg/cm2(S.D. 0.176)、DPPG-SPM-Lは0.992μg/cm2(S.D. 0.217)となり、セラミド6の含有量が多かった。
【0055】
このように図8および図9に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、SPM-LおよびSA-SPM-Lと比較して、DCP-SPM-LおよびDPPG-SPM-Lの方がセラミド2、セラミド3、セラミド5およびセラミド6の含有量が多かった。特にDPPG-SPM-Lは、セラミド2、セラミド3、セラミド5およびセラミド6の含有量が多かった。
【0056】
以上の実験結果によると、上記製造方法で製造した負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を、基底層側から添加した場合も、角層側から添加した場合と同様に、角層を含む表皮組織中のセラミド含有量を増加させる、すなわち、セラミドの合成を促進することができることが分かる。
【0057】
したがって、負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を用いることで、スフィンゴミエリンを皮膚の奥深く(角層、顆粒層、有棘層、基底層、真皮)まで浸透させることができ、角層や、角層より下の層である、表皮の顆粒層、有棘層、基底層でセラミドの合成を促進することが可能となる。
【0058】
つまり、負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を皮膚の角層に付与することで、表皮組織におけるセラミドの合成を促進することができ、皮膚の保湿機能やバリア機能を向上させることが可能となる。したがって、本発明の負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を皮膚の角層に付与することで、乾燥肌、荒れ肌、アトピー性皮膚炎、老人性乾皮症、乾癬等の皮膚疾患を予防したり改善したり、または完治させることが可能となる。
【0059】
以上、本実施例にかかるセラミド合成促進剤の製造方法の詳細と、その製造方法により製造されるセラミド合成促進剤の効果を証明する実験結果を示した。上述した実験結果から、本実施例におけるセラミド合成促進剤が驚くべきセラミド合成促進効果を有することが示された。したがって、本実施例におけるセラミド合成促進剤は、例えば、化粧料や、皮膚外用剤、医薬部外品、医薬品等の幅広い応用が可能なものであり、特に、乾燥肌、荒れ肌、アトピー性皮膚炎、老人性乾皮症、乾癬等の皮膚疾患またはそれに近い症状を呈する者に好適な化粧料や、皮膚外用剤、医薬部外品、医薬品に応用が期待できる。
【0060】
本発明によるセラミド合成促進剤は、化粧料においては、皮膚用化粧品・化粧水、化粧液、クリーム、乳液、日焼け、日焼け止め、洗浄料、ひげそり、むだ毛そり、フェイシャルリンス、パック、化粧用油、ボディリンス、マッサージ料、仕上用化粧品・ファンデーション、化粧下地、おしろい、口紅、アイメークアップ、頬化粧料、ボディメークアップ、ボディパウダー、オーデコロン・香水、浴用化粧料、爪化粧料、頭髪用化粧品、整髪料、養毛料、頭皮料、毛髪着色料、洗髪料、ヘアリンス等、また医薬品においては、軟膏剤、外用液剤、薬品吸着剤、絆創膏剤、硬膏剤、散剤、細粒剤、顆粒剤、錠剤、カプセル剤、丸剤、桿剤、ペンシル剤、内容液剤、エキス剤、坐剤、エアゾール、ガス剤、眼科用剤、注射剤等幅広く使用可能である。
【0061】
以上、添付図面を参照しながら本発明の好適な実施例について説明したが、本発明はかかる実施例に限定されないことは言うまでもない。当業者であれば、特許請求の範囲に記載された範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、それらについても当然に本発明の技術的範囲に属するものと了解される。
【0062】
なお、本明細書のセラミドの合成を促進するセラミド合成促進剤の製造方法における各工程は、必ずしもフローチャートとして記載された順序に沿って時系列に処理する必要はなく、並列的に進めることも可能である。
【符号の説明】
【0063】
S100 …溶解工程
S102 …減圧留去工程
S104 …乳化工程
S106 …凍結融解工程
S108 …サイズ調整工程
【技術分野】
【0001】
本発明は、セラミド合成促進のための技術に関する。本発明は、例えば、化粧料、皮膚外用剤、医薬部外品、医薬品などの分野に好適に適用し得る。
【背景技術】
【0002】
スフィンゴ脂質の1つであるセラミドは、皮膚の最も外側の層である角層中に含まれる脂質の50%以上を占めている。セラミドは、角層の下に位置する顆粒層が生成する層板顆粒に由来し、角層中において水分子と水素結合することで、ラメラ構造(層状構造)を構築し、角層中の水分保持(保湿)機能や、バリア機能に関与している。角層中のセラミドの量が減少すると、皮膚の保湿機能やバリア機能が低下し、乾燥肌、荒れ肌、アトピー性皮膚炎、老人性乾皮症、乾癬等の皮膚疾患を引き起こすと考えられている。
【0003】
一方、近年、細胞内でセラミドの産生を促進することで、アポトーシス、細胞の分化誘導、細胞の増殖抑制等が誘導されることが報告されており、セラミドは、保湿機能やバリア機能に関与するのみならず、アポトーシス、細胞の分化や増殖等を制御する細胞内シグナル伝達物質分子として機能することが分かってきた。したがって、セラミドの産生を促進すれば、炎症性疾患、悪性腫瘍等、細胞の増殖あるいは分化の異常に起因する疾患を低減することができると考えられる。
【0004】
セラミドはスフィンゴミエリンを加水分解することで得られるため、スフィンゴミエリンを皮膚の奥深くまで浸透させることができれば、角層中のセラミド含量や角層より下の層である、表皮の顆粒層、有棘層、基底層中のセラミド含有量を増加させることが可能となる。
【0005】
そこで、スフィンゴミエリンを配合した化粧料が提案されている(例えば、特許文献1)。特許文献1には、開示される化粧料が、有効成分の皮膚浸透性に優れ、皮膚に塗布することにより皮膚細胞機能が活性化し、皮膚の保護および美化に顕著な効果を発揮すると記載されている。しかし、特許文献1にかかる化粧料を皮膚に塗布した際に、スフィンゴミエリンが皮膚の奥深くまで浸透したか否かの記載はなく、また、皮膚中のセラミドの合成量の変化についての記載もない。
【0006】
そこで、リポソーム化したスフィンゴミエリンを含有する化粧料が提案され、この化粧料を皮膚に塗布することで、皮膚中のセラミド含有量を増加させることが可能となる(例えば、特許文献2)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開昭63−211208号公報
【特許文献2】国際公開第2007/145276号
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、皮膚中のセラミドの合成を促進する新しい技術を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明の具現化形態の一例は、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、前記リポソームが負電荷を帯びている、セラミド合成促進剤が含まれる。
【0010】
人の角層は、pH4.5からpH6.5前後と弱酸性であるため、リポソームを負電荷にすれば、リポソームを角層に容易に浸透させることができ、スフィンゴミエリンのリポソームを皮膚の奥深くまで浸透させることが可能となる。セラミドはスフィンゴミエリンを加水分解して得られるため、スフィンゴミエリンを皮膚の奥深くまで浸透させて、角層や、角層より下の層である、表皮の顆粒層、有棘層、基底層でセラミドの合成を促進することができる。
【0011】
上記リポソームの表面が負電荷を帯びていてもよい。
【0012】
角層の細胞と直接接触するのは、リポソームの表面であるため、リポソームの表面が負電荷であれば、リポソームの表面以外が負電荷でなくても、リポソームを角層に容易に浸透させることができる。
【0013】
負電荷の脂質を添加することにより上記リポソームを負電荷にしてもよい。かかる負電荷の脂質を添加する構成により、リポソームを容易に負電荷にすることができる。
【0014】
上記負電荷の脂質は、リン脂質であってもよい。また、上記リン脂質は、ジセチルホスフェイトまたはジパルミトイルホスファチジルグリセロールであってもよい。リポソームを構成するスフィンゴミエリンはリン脂質であるため、負電荷の脂質をリン脂質とすることで、スフィンゴミエリンとの親和性を高めることができ、安定してリポソームを負電荷に帯電させることが可能となる。
【0015】
本発明の具現化形態の他の例は、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームは負電荷を帯びているセラミド合成促進剤を含む化粧料、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームは負電荷を帯びているセラミド合成促進剤を含む皮膚外用剤、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームは負電荷を帯びているセラミド合成促進剤を含む医薬部外品、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームは負電荷を帯びているセラミド合成促進剤を含む医薬品が含まれる。
【0016】
上述したように、リポソームを負電荷にすれば、リポソームを角層に容易に浸透させることができ、スフィンゴミエリンを皮膚の奥深くまで浸透させることが可能となり、表皮でセラミドの合成を促進する作用がある。したがって、スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、リポソームが負電荷を帯びているセラミド合成促進剤は、皮膚の保湿力が低下している人や、皮膚疾患患者に対する化粧料、皮膚外用剤、医薬部外品、医薬品の有効成分として極めて有望である。
【0017】
本発明の具現化形態の他の例は、スフィンゴミエリンと負電荷の脂質とを有機溶媒に溶解し、溶解液を生成する溶解工程と、溶解液を減圧留去し、脂質薄膜を生成する減圧留去工程と、脂質薄膜に水を加えて乳化させ、リポソームを得る乳化工程と、を有するセラミド合成促進剤の製造方法を含む。
【0018】
特許請求の範囲における各請求項に定義された構成は、本発明の好適な具現化形態の例である。
【図面の簡単な説明】
【0019】
【図1】実施例として紹介するセラミド合成促進剤の製造方法を説明するための説明図である。
【図2】実施例のセラミド合成促進剤の製造方法に用いる脂質の構造式を示す図である。
【図3】SPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lの表面電位を示す図である。
【図4】ヒト3次元培養表皮モデルの構造を説明するための説明図である。
【図5】PBSまたは培地に、それぞれ再分散させた場合のリポソームのサイズの変化を説明するための説明図である。
【図6】ヒト3次元培養表皮モデルの角層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。
【図7】ヒト3次元培養表皮モデルの角層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。
【図8】ヒト3次元培養表皮モデルの基底層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。
【図9】ヒト3次元培養表皮モデルの基底層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。
【発明を実施するための形態】
【0020】
以下に添付図面を参照しながら、本発明の好適な実施形態について詳細に説明する。かかる実施形態に示す寸法、材料、その他具体的な数値などは、発明の理解を容易とするための例示にすぎず、特に断る場合を除き、本発明を限定するものではない。なお、本明細書および図面において、実質的に同一の機能、構成を有する要素については、同一の符号を付することにより重複説明を省略し、また本発明に直接関係のない要素は図示を省略する。
【0021】
<実施例:セラミド合成促進剤の製造方法>
図1は、実施例として紹介するセラミド合成促進剤の製造方法を説明するための説明図である。図1に示すように、本実施例にかかるセラミド合成促進剤の製造方法は、溶解工程S100と、減圧留去工程S102と、乳化工程S104と、凍結融解工程S106と、サイズ調整工程S108とを含む。以下に、各工程の構成を詳細に説明する。
【0022】
(溶解工程S100)
溶解工程S100は、スフィンゴミエリンと負電荷の脂質とを有機溶媒(例えば、クロロホルム)に溶解し溶解液を生成する工程である。溶解工程S100において、負電荷の脂質は、好ましくはリン脂質であり、より好ましくは、ジセチルホスフェイト(Dicetyl phosphate:以下、単にDCPと称する)またはジパルミトイルホスファチジルグリセロール(Dipalmitoyl phosphatidylglycerol:以下、単にDPPGと称する)である。
【0023】
スフィンゴミエリンはリン脂質であるため、負電荷の脂質をリン脂質とすることで、スフィンゴミエリンとの親和性を高めることができ、スフィンゴミエリンでリポソームを作成したときに、安定してリポソームを負電荷に帯電させることが可能となる。
【0024】
(減圧留去工程S102)
減圧留去工程S102は、溶解工程S100で生成された溶解液を減圧留去し、脂質薄膜を生成する工程である。減圧留去工程S102では、溶解工程S100で生成された溶解液をナス型フラスコに入れ、ロータリーエバポレータを用いて、溶解液に含まれる有機溶媒を減圧留去することで脂質薄膜を生成する。
【0025】
(乳化工程S104)
乳化工程S104は、減圧留去工程S102で生成された脂質薄膜に水を加えて乳化させ、リポソームを得る工程である。本実施例の乳化工程S104では、減圧留去工程S102で生成された脂質薄膜にPBS(Phosphate Buffered Saline)(pH7.4)を加えて乳化させ、リポソームを得る。
【0026】
(凍結融解工程S106)
凍結融解工程S106は、乳化工程S104で得られたリポソームを含む溶液を凍結融解する工程である。本実施例の凍結融解工程S106では凍結融解を5回繰り返す。
【0027】
(サイズ調整工程S108)
サイズ調整工程S108は、凍結融解工程S106で凍結融解したリポソームのサイズを調整する工程である。サイズ調整工程S108では、エクストルーダにポアサイズ100から400nmの孔が形成されたポリカーボネート膜をセットし、このポリカーボネート膜に形成された孔に、凍結融解工程S106で凍結融解したリポソームを含む溶液を通過させる。本実施例では、エクストルーダにポアサイズ100nmの孔が形成されたポリカーボネート膜をセットし、凍結融解工程S106で凍結融解したリポソームを含む溶液を5回通過させる。
【0028】
その後、リポソームを含む溶液を、例えば、250000gで15分間、超遠心分離を行い、スフィンゴミエリンのリポソーム(以下、単にスフィンゴミエリンリポソームと称する)を得る。
【0029】
以上説明した、溶解工程S100、減圧留去工程S102、乳化工程S104、凍結融解工程S106、サイズ調整工程S108を経ることによりセラミド合成促進剤を製造することができる。
【0030】
<セラミド合成促進剤の評価>
上記製造方法で製造されたセラミド合成促進剤を評価すべく、セラミド合成促進剤によるセラミド増加量を測定した。以下、実験の手順を詳細に説明する。
【0031】
(スフィンゴミエリンリポソームの調整)
図2は、本実施例のセラミド合成促進剤の製造方法に用いる脂質の構造式を示す図である。上述したセラミド合成促進剤の製造方法を用いて、図2(a)に示すDCPを用いて負電荷に帯電させたスフィンゴミエリンリポソーム(以下、単に、DCP-SPM-Lと称する)と、図2(b)に示すDPPGを用いて負電荷に帯電させたスフィンゴミエリンリポソーム(以下、単に、DPPG-SPM-Lと称する)とを作成した。また、コントロールとして、スフィンゴミエリンのみを用いて作成したスフィンゴミエリンリポソーム(以下、単に、SPM-Lと称する)を作成した。さらに、DCP-SPM-LおよびDPPG-SPM-Lの比較対象として、図2(c)に示すステアリルアミン(Stearyl Amine)を用いて正電荷に帯電させたスフィンゴミエリンリポソーム(以下、単にSA-SPM-Lと称する)を作成した。なお、DCP-SPM-L、DPPG-SPM-L、SA-SPM-Lには、モル比で10%、それぞれの脂質(DCP、DPPG、SA)が含まれている。
【0032】
そして、作成したDCP-SPM-L、DPPG-SPM-L、SPM-LおよびSA-SPM-Lを、それぞれPBS(pH7.4)に再分散させたものと、作成したDCP-SPM-L、DPPG-SPM-L、SPM-LおよびSA-SPM-Lを、それぞれ培地に再分散させたものとを作成した。
【0033】
図3は、SPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lの表面電位を示す図である。図3中、棒グラフに付加したエラーバーは標準偏差(S.D.)を示す。図3に示すように、SPM-Lは、-3.9mV(S.D. 0.39)、SA-SPM-Lは、+12.9mV(S.D. 0.71)、DCP-SPM-Lは、-14.9mV(S.D. 1.59)、DPPG-SPM-Lは、-14.1mV(S.D. 1.12)となった。したがって、SPM-L、DCP-SPM-L およびDPPG-SPM-Lは、表面が負電荷を帯びており、SA-SPM-Lは、表面が正電荷を帯びていることが分かった。
【0034】
(スフィンゴミエリンリポソームの添加)
スフィンゴミエリンリポソームを添加する細胞として、株式会社ジャパン・ティッシュ・エンジニアリング社製のLabCyte EPI-MODELを用いた。LabCyte EPI-MODELは、ヒト正常表皮細胞を重層培養したヒト3次元培養表皮モデルである。
【0035】
図4は、ヒト3次元培養表皮モデルの構造を説明するための説明図である。DCP-SPM-LをPBSに再分散させたもの200μLを、図4に示すヒト3次元培養表皮モデルの角層側から添加し、37℃、5%CO2下で7日間培養を行った。同様に、DPPG-SPM-LをPBSに再分散させたもの200μL、SPM-LをPBSに再分散させたもの200μL、SA-SPM-LをPBSに再分散させたもの200μLを、それぞれヒト3次元培養表皮モデルの角層側から添加し、37℃、5%CO2下で7日間培養を行った。
【0036】
また、DCP-SPM-Lを培地に再分散させたもの1mlを、図4に示すヒト3次元培養表皮モデルのメンブランフィルタ(基底層)側から添加し、37℃、5%CO2下で6時間培養を行った。同様に、DPPG-SPM-Lを培地に再分散させたもの1ml、SPM-Lを培地に再分散させたもの1ml、SA-SPM-Lを培地に再分散させたもの1mlを、それぞれヒト3次元培養表皮モデルの基底層側から添加し、37℃、5%CO2下で6時間培養を行った。
【0037】
その後、リポソームを角層側から添加したヒト3次元培養表皮モデルの培地(この場合、PBS)、および、基底層側から添加したヒト3次元培養表皮モデルの培地を、アスコルビン酸添加角化促進培地に交換し、37℃、5%CO2下で24時間培養を行った。
【0038】
図5は、PBSまたは培地に、それぞれ再分散させた場合のリポソームのサイズの変化を説明するための説明図である。
【0039】
図5(a)に示すように、リポソームをPBSに再分散させ、7日間培養した場合、DCP-SPM-L、DPPG-SPM-L、SPM-LおよびSA-SPM-Lのサイズは多少の増加または減少しているものの、サイズに大きな変化は見られなかった。また、図5(b)に示すように、リポソームを培地に再分散させ、6時間培養した場合、DCP-SPM-L、DPPG-SPM-L、SPM-LおよびSA-SPM-Lのサイズは多少減少しているものの、サイズに大きな変化は見られなかった。
【0040】
以上の結果により、リポソームは、培地中でも安定に存在することが確認された。
【0041】
(セラミドの抽出)
培養後のヒト3次元培養表皮モデルを取り出し、クロロホルム:メタノール(2:1)中で、プローブ型超音波を用いて、表皮組織を破壊し、表皮組織からセラミドを抽出した。そして、フィルタで濾過することによって、表皮組織を除去し、セラミド抽出液を得た。その後、セラミド抽出液をN2気流中で乾固させ、さらにクロロホルム:メタノール(2:1)200μLで再溶解した。これを、サンプルとして以下の実験に用いた。
【0042】
(セラミド含有量の測定)
得られたサンプルを、20μLずつHPTLC(High Performance Thin Layer Chromatography:高性能薄層クロマトグラフィ)プレートにスポットし、クロロホルム:メタノール:酢酸(190:9:1)を展開溶媒として2回展開した。展開後のHPTLCプレートに、10%硫酸銅を含む8%リン酸水溶液を噴霧し、その後、180℃のホットプレートで10分間焼析(加熱)した。
【0043】
そして、ルミノイメージアナライザーシステム(LAS-1000-plus、富士フイルム株式会社製)を用いて、焼析後のHPTLCプレートを撮影し、密度によりセラミド量を定量した。
【0044】
(結果)
図6および図7は、ヒト3次元培養表皮モデルの角層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図であり、図8および図9は、ヒト3次元培養表皮モデルの基底層側からSPM-L、SA-SPM-L、DCP-SPM-LおよびDPPG-SPM-Lをそれぞれ添加したときのセラミド含有量を示す図である。図6から図9中、棒グラフに付加したエラーバーは標準偏差(S.D.)を示す。
【0045】
図6(a)に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、セラミド2の含有量は、SPM-Lの1.08μg/cm2(S.D. 0.07)、SA-SPM-Lの1.13μg/cm2(S.D. 0.17)と比較して、DCP-SPM-Lは1.27μg/cm2(S.D. 0.05)、DPPG-SPM-Lは1.46μg/cm2(S.D. 0.15)となり、セラミド2の含有量が多かった。
【0046】
図6(b)に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、セラミド3の含有量は、SPM-Lの0.03μg/cm2(S.D. 0.03)、SA-SPM-Lの0.04μg/cm2(S.D. 0.01)と比較して、DCP-SPM-Lは0.07μg/cm2(S.D. 0.01)、DPPG-SPM-Lは0.14μg/cm2(S.D. 0.08)となり、セラミド3の含有量が多かった。
【0047】
図7(a)に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、セラミド5の含有量は、SPM-Lの0.37μg/cm2(S.D. 0.02)、SA-SPM-Lの0.41μg/cm2(S.D. 0.07)と比較して、DCP-SPM-Lは0.46μg/cm2(S.D. 0.08)、DPPG-SPM-Lは0.59μg/cm2(S.D. 0.07)となり、セラミド5の含有量が多かった。
【0048】
図7(b)に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、セラミド6の含有量は、SPM-Lの0.88μg/cm2(S.D. 0.06)、SA-SPM-Lの0.86μg/cm2(S.D. 0.19)と比較して、DCP-SPM-Lは1.00μg/cm2(S.D. 0.21)、DPPG-SPM-Lは1.35μg/cm2(S.D. 0.16)となり、セラミド6の含有量が多かった。
【0049】
このように図6および図7に示すように、ヒト3次元培養表皮モデルの角層側からリポソームを添加した場合、SPM-LおよびSA-SPM-Lと比較して、DCP-SPM-LおよびDPPG-SPM-Lの方がセラミド2、セラミド3、セラミド5およびセラミド6の含有量が多かった。特にDPPG-SPM-Lは、セラミド2、セラミド3、セラミド5およびセラミド6の含有量が多かった。
【0050】
以上の実験結果によると、上記製造方法で製造した負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を、角層側から添加した場合、角層を含む表皮組織中のセラミド含有量を増加させる、すなわち、セラミドの合成を促進することができることが分かる。人の角層は、pH4.5からpH6.5前後と弱酸性であるため、リポソームを負電荷にしたことにより、リポソームの角層への分配が変化する、または、リポソームの表皮細胞への親和性が変化することにより、リポソームを角層に容易に浸透させることができ、スフィンゴミエリンのリポソームを皮膚の奥深くまで浸透させることが可能となったと考えられる。
【0051】
図8(a)に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、セラミド2の含有量は、SPM-Lの0.859μg/cm2(S.D. 0.290)、SA-SPM-Lの0.927μg/cm2(S.D. 0.234)と比較して、DCP-SPM-Lは1.010μg/cm2(S.D. 0.335)、DPPG-SPM-Lは1.132μg/cm2(S.D. 0.307)となり、セラミド2の含有量が多かった。
【0052】
図8(b)に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、セラミド3の含有量は、SPM-Lの0.267μg/cm2(S.D. 0.029)、SA-SPM-Lの0.349μg/cm2(S.D. 0.102)と比較して、DCP-SPM-Lは0.476μg/cm2(S.D. 0.072)、DPPG-SPM-Lは0.689μg/cm2(S.D. 0.055)となり、セラミド3の含有量が多かった。
【0053】
図9(a)に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、セラミド5の含有量は、SPM-Lの0.305μg/cm2(S.D. 0.074)、SA-SPM-Lの0.311μg/cm2(S.D. 0.130)と比較して、DCP-SPM-Lは0.437μg/cm2(S.D. 0.059)、DPPG-SPM-Lは0.596μg/cm2(S.D. 0.047)となり、セラミド5の含有量が多かった。
【0054】
図9(b)に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、セラミド6の含有量は、SPM-Lの0.365μg/cm2(S.D. 0.116)、SA-SPM-Lの0.486μg/cm2(S.D. 0.224)と比較して、DCP-SPM-Lは0.709μg/cm2(S.D. 0.176)、DPPG-SPM-Lは0.992μg/cm2(S.D. 0.217)となり、セラミド6の含有量が多かった。
【0055】
このように図8および図9に示すように、ヒト3次元培養表皮モデルの基底層側からリポソームを添加した場合、SPM-LおよびSA-SPM-Lと比較して、DCP-SPM-LおよびDPPG-SPM-Lの方がセラミド2、セラミド3、セラミド5およびセラミド6の含有量が多かった。特にDPPG-SPM-Lは、セラミド2、セラミド3、セラミド5およびセラミド6の含有量が多かった。
【0056】
以上の実験結果によると、上記製造方法で製造した負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を、基底層側から添加した場合も、角層側から添加した場合と同様に、角層を含む表皮組織中のセラミド含有量を増加させる、すなわち、セラミドの合成を促進することができることが分かる。
【0057】
したがって、負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を用いることで、スフィンゴミエリンを皮膚の奥深く(角層、顆粒層、有棘層、基底層、真皮)まで浸透させることができ、角層や、角層より下の層である、表皮の顆粒層、有棘層、基底層でセラミドの合成を促進することが可能となる。
【0058】
つまり、負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を皮膚の角層に付与することで、表皮組織におけるセラミドの合成を促進することができ、皮膚の保湿機能やバリア機能を向上させることが可能となる。したがって、本発明の負電荷を帯びたスフィンゴミエリンリポソームを含むセラミド合成促進剤を皮膚の角層に付与することで、乾燥肌、荒れ肌、アトピー性皮膚炎、老人性乾皮症、乾癬等の皮膚疾患を予防したり改善したり、または完治させることが可能となる。
【0059】
以上、本実施例にかかるセラミド合成促進剤の製造方法の詳細と、その製造方法により製造されるセラミド合成促進剤の効果を証明する実験結果を示した。上述した実験結果から、本実施例におけるセラミド合成促進剤が驚くべきセラミド合成促進効果を有することが示された。したがって、本実施例におけるセラミド合成促進剤は、例えば、化粧料や、皮膚外用剤、医薬部外品、医薬品等の幅広い応用が可能なものであり、特に、乾燥肌、荒れ肌、アトピー性皮膚炎、老人性乾皮症、乾癬等の皮膚疾患またはそれに近い症状を呈する者に好適な化粧料や、皮膚外用剤、医薬部外品、医薬品に応用が期待できる。
【0060】
本発明によるセラミド合成促進剤は、化粧料においては、皮膚用化粧品・化粧水、化粧液、クリーム、乳液、日焼け、日焼け止め、洗浄料、ひげそり、むだ毛そり、フェイシャルリンス、パック、化粧用油、ボディリンス、マッサージ料、仕上用化粧品・ファンデーション、化粧下地、おしろい、口紅、アイメークアップ、頬化粧料、ボディメークアップ、ボディパウダー、オーデコロン・香水、浴用化粧料、爪化粧料、頭髪用化粧品、整髪料、養毛料、頭皮料、毛髪着色料、洗髪料、ヘアリンス等、また医薬品においては、軟膏剤、外用液剤、薬品吸着剤、絆創膏剤、硬膏剤、散剤、細粒剤、顆粒剤、錠剤、カプセル剤、丸剤、桿剤、ペンシル剤、内容液剤、エキス剤、坐剤、エアゾール、ガス剤、眼科用剤、注射剤等幅広く使用可能である。
【0061】
以上、添付図面を参照しながら本発明の好適な実施例について説明したが、本発明はかかる実施例に限定されないことは言うまでもない。当業者であれば、特許請求の範囲に記載された範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、それらについても当然に本発明の技術的範囲に属するものと了解される。
【0062】
なお、本明細書のセラミドの合成を促進するセラミド合成促進剤の製造方法における各工程は、必ずしもフローチャートとして記載された順序に沿って時系列に処理する必要はなく、並列的に進めることも可能である。
【符号の説明】
【0063】
S100 …溶解工程
S102 …減圧留去工程
S104 …乳化工程
S106 …凍結融解工程
S108 …サイズ調整工程
【特許請求の範囲】
【請求項1】
スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、
前記リポソームは負電荷を帯びていることを特徴とするセラミド合成促進剤。
【請求項2】
前記リポソームの表面が負電荷を帯びていることを特徴とする請求項1に記載のセラミド合成促進剤。
【請求項3】
負電荷の脂質を添加することにより前記リポソームを負電荷にすることを特徴とする請求項2に記載のセラミド合成促進剤。
【請求項4】
前記負電荷の脂質は、リン脂質であることを特徴とする請求項3に記載のセラミド合成促進剤。
【請求項5】
前記リン脂質は、ジセチルホスフェイトまたはジパルミトイルホスファチジルグリセロールであることを特徴とする請求項4に記載のセラミド合成促進剤。
【請求項6】
請求項1から5のいずれか1項に記載のセラミド合成促進剤を含む化粧料。
【請求項7】
請求項1から5のいずれか1項に記載のセラミド合成促進剤を含む皮膚外用剤。
【請求項8】
請求項1から5のいずれか1項に記載のセラミド合成促進剤を含む医薬部外品。
【請求項9】
請求項1から5のいずれか1項に記載のセラミド合成促進剤を含む医薬品。
【請求項10】
スフィンゴミエリンと負電荷の脂質とを有機溶媒に溶解し、溶解液を生成する溶解工程と、
前記溶解液を減圧留去し、脂質薄膜を生成する減圧留去工程と、
前記脂質薄膜に水を加えて乳化させ、リポソームを得る乳化工程と、
を有することを特徴とするセラミド合成促進剤の製造方法。
【請求項1】
スフィンゴミエリンのリポソームを含むセラミド合成促進剤であって、
前記リポソームは負電荷を帯びていることを特徴とするセラミド合成促進剤。
【請求項2】
前記リポソームの表面が負電荷を帯びていることを特徴とする請求項1に記載のセラミド合成促進剤。
【請求項3】
負電荷の脂質を添加することにより前記リポソームを負電荷にすることを特徴とする請求項2に記載のセラミド合成促進剤。
【請求項4】
前記負電荷の脂質は、リン脂質であることを特徴とする請求項3に記載のセラミド合成促進剤。
【請求項5】
前記リン脂質は、ジセチルホスフェイトまたはジパルミトイルホスファチジルグリセロールであることを特徴とする請求項4に記載のセラミド合成促進剤。
【請求項6】
請求項1から5のいずれか1項に記載のセラミド合成促進剤を含む化粧料。
【請求項7】
請求項1から5のいずれか1項に記載のセラミド合成促進剤を含む皮膚外用剤。
【請求項8】
請求項1から5のいずれか1項に記載のセラミド合成促進剤を含む医薬部外品。
【請求項9】
請求項1から5のいずれか1項に記載のセラミド合成促進剤を含む医薬品。
【請求項10】
スフィンゴミエリンと負電荷の脂質とを有機溶媒に溶解し、溶解液を生成する溶解工程と、
前記溶解液を減圧留去し、脂質薄膜を生成する減圧留去工程と、
前記脂質薄膜に水を加えて乳化させ、リポソームを得る乳化工程と、
を有することを特徴とするセラミド合成促進剤の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−25720(P2012−25720A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2010−168915(P2010−168915)
【出願日】平成22年7月28日(2010.7.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 掲載年月日 平成22年2月1日 掲載アドレス http://nenkai.pharm.or.jp/130/pc/ipdfview.asp?i=1291
【出願人】(599047125)株式会社シャローム (5)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願日】平成22年7月28日(2010.7.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 掲載年月日 平成22年2月1日 掲載アドレス http://nenkai.pharm.or.jp/130/pc/ipdfview.asp?i=1291
【出願人】(599047125)株式会社シャローム (5)
【Fターム(参考)】
[ Back to top ]

