セルロースナノファイバーとその製造方法
【課題】酵素処理によるセルロース原料からのセルロースナノファイバーの製造において、特別な装置を必要とせず、温和な条件下で、高結晶性を維持し、素材としての新しい用途が期待できるセルロースナノファイバーを高収率で得る。
【解決手段】CMF(Cellulose microfibril)の凝集体、もしくはCMFそのものの一部に物理的な緩みを生ぜしめ、酵素のセルロース原料への浸透性を向上させると同時に緩みに生じた非晶部分にエンドグルカナーゼを作用させることによって、CMFをフィブリル化し、所望のセルロースナノファイバーを得て、上記課題を解決する。
【解決手段】CMF(Cellulose microfibril)の凝集体、もしくはCMFそのものの一部に物理的な緩みを生ぜしめ、酵素のセルロース原料への浸透性を向上させると同時に緩みに生じた非晶部分にエンドグルカナーゼを作用させることによって、CMFをフィブリル化し、所望のセルロースナノファイバーを得て、上記課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本願発明は、セルロース由来のナノファイバーとその製造方法に関し、セルロースを原料とし、これに、すなわちセルロースミクロフィブリル(Cellulose microfibril:CMF)凝集体および又はCMF自体に酵素作用促進処理を施し、所定酵素の浸透性を確保して、酵素の作用によりセルロースナノファイバーを製造する技術に関するものである。
【背景技術】
【0002】
セルロースは木材等、高等植物を始めとして藻類、酢酸菌等のある種バクテリア、ホヤなどの特定の動物によって生産され、CMFの形態で存在している。CMFの断面形態は生物種によって異なっており、その径も4-20nmと様々である。
【0003】
セルロースを出発原料とする微粒子およびそれらの分散液は、増粘性、乳化安定性、保水性、吸油性、保形性等の特徴を有することから、食品添加剤、錠剤賦形剤、分散剤、保形剤、保水剤、濾過助剤、充填剤、塗料、接着剤用添加剤等として、食品、医薬品、建材、窯業、ゴム・プラスチック等の幅広い分野で使用されている。
【0004】
本願発明に関連する従来技術が以下の文献において開示されている。
【特許文献1】米国特許第3,954,727号明細書
【特許文献2】米国特許第3,141,875号明細書
【特許文献3】特開昭53−127553号公報
【特許文献4】特開平6−10287号公報
【特許文献5】特開平7−310296号公報
【特許文献6】特開2005−270891号公報
【非特許文献1】N. Hayashi, J.Sugiyama, K. Okano, and M. Ishihara, Carbohydrate Research 305 (1) p109-116(1998)
【非特許文献2】セルロース学会編「セルロースの事典」(朝倉書店) p522-531 (2000)
【0005】
セルロースの微細化の方法としては、化学的処理と機械的処理による方法が知られている。化学的処理としてはセルロース原料に硫酸または塩酸等の鉱酸を作用させ加水分解反応を行い、残渣として粉末状セルロースを得る方法が公知であり、例えば120-160℃という高温下、20-45分間希酸で酸加水分解し、残渣として粉末状セルロースを得る方法(特許文献1参照)、2.5規定の塩酸で約15分間酸加水分解し、粉末状セルロースを得る方法(特許文献2参照)、各種濃度の塩酸水溶液で高温処理し、残渣として粉末状セルロースを得る方法(特許文献3参照)等がある。
【0006】
しかしながら、従来技術に係るそれらの製造方法に関しては、高温、耐酸設備を要する上に、酸加水分解反応や中和工程における薬品コストの低減等が望まれていた。
【0007】
また、機械的処理としては、公知の分級および/または粉砕技術が利用されている。例えばガラスやアルミナ等を粉砕媒体として用いた振動ミル粉砕装置によってセルロース繊維懸濁液を湿式粉砕する方法(特許文献4参照)、砥粒板の擦り合せによるせん断力でセルロース繊維を湿式粉砕する方法(特許文献5参照)、セルロースの懸濁液を一対のノズルから高圧でそれぞれ噴射させると共に、その噴射流を互いに衝突させて粉砕する方法(特許文献6参照)等が挙げられる。
【0008】
一方、上記の化学的処理や機械的処理に対して、酵素処理によるセルロースの微細化の試みもなされている。酵素処理による微細化は、上記の化学的処理や機械的処理に比べて、温和な条件下で反応を実行できるという利点がある。セルロースを分解する酵素であるセルラーゼは、セロビオハイドロラーゼ、エンドグルカナーゼ、β-グルコシダーゼといった異なる分解様式の酵素からなる複合酵素系であり、これらの相乗作用によってセルロースはセロビオース等の水溶性物質を経てグルコースにまで解重合される。
【0009】
しかしながら、元来セルロースは結晶性を示すため、酵素が作用し難いという問題がある。セルラーゼの主要構成成分であるセロビオハイドロラーゼは、セルロース分子鎖の端からβ-(1,4)-グルコシド結合を一つおき(セロビオースの単位)に順次加水分解する酵素であり、結晶性セルロースに対しても効率的に作用する。従って、セルロースは主にセロビオースに分解され、本酵素処理によるCMFのフィブリル化、すなわちナノファイバーの生成はごくわずかである(非特許文献1参照)。
【0010】
一方、エンドグルカナーゼを単独で結晶性セルロースに処理させた場合、セルロースに存在する非晶領域に作用し、セルロースの重合度低下が生じるが、ナノファイバーの生成は報告されていない(非特許文献2)。このように、酵素処理による効率的なセルロースナノファイバーの製造技術は未だ確立されていないのが現状である。
【発明の開示】
【発明が解決しようとする課題】
【0011】
本願発明は、酵素処理によるセルロース原料からのセルロースナノファイバーの製造において、簡便で効率的な製造方法を提供することを目的としている。すなわち、特別な装置を必要とせず、温和な条件でセルロースナノファイバーを高収率で得るとともに、該セルロースナノファイバーは高結晶性を維持し、素材としての新しい用途が期待でき、本願発明はその工業的意義が極めて大きいセルロースナノファイバーの製造技術の提供を目的としている。
【課題を解決するための手段】
【0012】
本願発明は、次の工程からなるセルロースナノファイバーの製造方法を実現して、上記従来の課題を解決しようとするものである。
(イ)緩衝液、セルロース、セルロース分解酵素、反応安定剤等からなる反応懸濁液を調製する工程、(ロ)反応懸濁液中のセルロースに酵素作用促進処理をなすことによりCMFの凝集体および/またはCMFにおける結晶領域に配向の乱れを生じさせて前記セルロースに酵素浸透性を確保する工程、(ハ)前記工程(ロ)に次いで、又はこれに併せて酵素浸透性を得たセルロースにセルロース分解酵素が作用してCMFの凝集体を解きほぐし、および/又はCMFを細裂させて所定のセルロースナノファイバーを反応懸濁液中に生成する工程。
【0013】
また、上記のセルロースナノファイバーの製造方法において、前記酵素作用促進処理は
CMFあるいはその凝集体における部分的な物理的破壊処理であり、セルロース分解酵素をこの物理的破壊部分を介して作用させるように構成することがある。すなわち、物理的破壊処理によりセルロースにおいて部分的に結晶性を低下(セルロース分子の配向性低下)せしめ、当該部分における水素結合を開放することになる。
【0014】
さらに、上記セルロースナノファイバーの製造方法において、前記物理的破壊は、CMFあるいはその凝集体の結晶化度を若干低減させる程度のもので構成することがある。
【0015】
また、上記のセルロースナノファイバーの製造方法において、CMFあるいはその凝集体の結晶化度の低減を数%以上に設定することがある。
【0016】
さらにまた、上記いずれかのセルロースナノファイバーの製造方法において、セルロース分解酵素はエンドグルカナーゼで構成することがある。
【0017】
また、上記いずれかのセルロースナノファイバーの製造方法において、前記物理的破壊処理は反応懸濁液中に加えた撹拌子の撹拌によるものとなすことがある。
【0018】
そして、本願発明は、上記いずれか記載のセルロースナノファイバーの製造方法により産出したセルロースナノファイバーを提供して上記従来の課題を解決しようとするものである。
【0019】
セルロースは天然では高等植物等により生産され、CMFという繊維の形で存在している。木材などからほぼCMFのみ(いわゆるパルプ)を残して懸濁液とし、堆積し圧締して乾燥させたものが紙である。また後述のアビセルはパルプに含まれるセルロース以外の成分を酸などでさらに厳密に除去して製造されるもので、CMFの形態は維持されているが、製造・乾燥過程でこれらが絡み合い、複雑な水素結合が形成されて鞠の様に固まっている。これを本願発明では「CMFの凝集体」と呼んでいる。
【0020】
CMFは、生産する起源によってその結晶化度や断面のサイズが異なり、木材やコットンなどの場合は3−6nmと小さく、ホヤの場合は11−15nmと大きなものである。したがって、CMFは、ナノ繊維の範疇にあるともいえるが、アビセルやホヤセルロースをスターラーで撹拌すると、CMFの凝集体や、もともと大きなCMFのある部分の酵素作用促進処理としての物理的破壊が発生し、セルロースにおいて部分的に結晶性が低下(セルロース分子の配向性低下)し、当該部分における水素結合が開放される結果、酵素浸透性が発生するものと考えられる。
【0021】
このことは、エンドグルカナーゼ無添加のセルロース原料の透過電顕観察により確認される。すなわち物理的破壊箇所にエンドグルカナーゼが作用し、凝集していたCMFがほぐれたり、大きなCMFに割れが生じてさらに細いCMFの集合体となる。この現象を指して「CMFのフィブリル化」ということができる。CMFの凝集体がほぐれた場合は、木材やコットン起源の場合、得られるナノファイバーは約3nm径、CMFの起源がホヤの場合は4−6nm径となる。
【0022】
本願発明では、CMFあるいはその凝集体を水に懸濁し、これに撹拌子を入れてスターラーで撹拌しつつ、併せてエンドグルカナーゼを作用させるように構成しているが、エンドグルカナーゼを加えないもので、部分的に物理的破壊が生じていることを透過電顕で確認しており、この段階で結晶化度の低下が見られる。すなわち、物理的破壊(物理的緩みともいえる)を生じさせて、その結果、結晶化度は数〜十数%低下することになる。
【0023】
周知のように、セルロースは、直鎖状のセルロース分子鎖が規則正しく並び、水素結合などで強固な高次構造を成して結晶性を有している。このことは、酵素が作用し難く、難分解性であることの原因となっている。本発明の撹拌条件(物理的破壊処理)により、CMFあるいはその凝集体に酵素の作用し易い部分が生成される。そして、いったん低下した結晶化度は、エンドグルカナーゼの作用により若干増加する。これは撹拌により生じた非晶部分が、エンドグルカナーゼの作用で切れて除かれることにより、結晶領域の割合が高まったためと考えられる。
【0024】
前記物理的破壊処理(物理的緩みの付与ともいえる)とは、CMFあるいはその凝集体を物理的に破壊し、結晶性を低下させることであり、透過電顕の観察から、例えば、CMFがほつれたようになったり、少し小さい凝集体が出来たりしていることから判明する。また、透過電顕では観察できない表面の変化や微細な割れが出来ている可能性が有る。本願発明において「物理的破壊(物理的緩み)」とは以上を併せた概念である。
【0025】
物理的破壊(物理的緩み)を達成する手段としては、超音波処理等も可能である。しかし、本願発明でユニークな点は、この物理的緩みを生じさせつつ、一方で、生成したその緩みにエンドグルカナーゼを作用させてCMFをバラバラにしたり、さらに細いCMFを生成したり、といった反応を同時にできることである。CMFあるいはその凝集体を形成している水素結合は非常に強固なので、酵素処理をなすには、なんらかの酵素作用促進処理を施すことなくしては簡単にほぐれない。そこで、酵素作用促進処理としての物理的破壊(物理的緩み)によりほぐれ酵素浸透性が得られたところにエンドグルカナーゼを作用させることになる。
【0026】
本願発明において、撹拌すなわち、物理的破壊処理はCMF自体あるいはCMFの凝集体を物理的に破壊するが、物理的破壊処理の目的は酵素浸透性の確保にあり、物理的破壊処理自体によってCMF自体あるいはCMFの凝集体をフィブリル化させることが目的ではない。従って、結晶を大規模に壊してしまうほど強い衝撃を与える必要はない。
【0027】
本願発明において、用いるセルロース分解酵素は、セルロースの非晶領域にのみ効率的に作用するエンドグルカナーゼが最適であり、CMFの凝集体のフィブリル化はエンドグルカナーゼ処理で特に顕著に現れる。一方、セロビオハイドロラーゼは、セルロース分子の端からβ-(1,4)-グルコシド結合を一つおきに順次加水分解する性質上、セロビオースが優先的に生成され、効率的にナノファイバーを生産することは難しい。
【0028】
セルロース分解酵素にはβ-(1,4)-グルコシド結合を加水分解するための構造(触媒ドメイン)と、これとは別にセルロース結合モジュール(cellulose binding module: CBM)とよばれる不溶性セルロースに結合するための独立した構造を持っているものと持っていないものが存在することが知られている。CBMが不溶性セルロースに結合することにより、触媒ドメインを基質である不溶性セルロース表面に濃縮させる効果があるため、CBMを有するセルロース分解酵素は、CBMを有していない触媒ドメインのみからなる酵素よりも不溶性セルロースを分解する活性が高いと言われている。
しかしながら本願発明においては、懸濁液中での物理的破壊処理操作により、エンドグルカナーゼとセルロースの接触が十分になされるため、エンドグルカナーゼはCBMの有無にかかわらず用いることができる
【0029】
糖質加水分解酵素(Glycoside Hydrolase: GH)は触媒ドメインの一次構造(酵素のアミノ酸配列)の類似性によって分類されており、エンドグルカナーゼは複数のGHファミリーに分類されている。例えば、セルロース分解菌であるTrichoderma reeseiが有しているエンドグルカナーゼは5つのGHファミリーに分布している。これらの酵素の構造は全く異なっているが、本願発明に用いるエンドグルカナーゼはいずれのGHファミリーに属するものでもよい。
【0030】
本願発明で用いる酵素はセルロースの加水分解反応を触媒するため、水分子の存在は不可欠である。また、反応が効率的に行われるようにするため、酵素と基質(本願発明の場合のセルロース)の接触が十分になされる必要があり、そのためには反応を懸濁液中で行う必要がある。さらに、後述段落0032に示すように、反応系のpHを一定にする必要からも懸濁液中での反応が必須となる。
【0031】
酵素は特定の立体構造をもつタンパク質であり、酵素が反応を触媒するという機能を発揮するためには構造の維持が不可欠である。しかし、酵素の種類や使用条件によっては、酵素の立体構造を長時間維持することが困難になるため、酵素の機能が低下し、期待する酵素反応の速度が低下してしまうことがありえる。
したがって、条件によっては酵素の立体構造を維持することを目的として反応懸濁液に安定剤を添加する場合がある。一般的にウシ血清アルブミン(BSA)やグリセロールが安定剤として広く用いられている。
【0032】
酵素には、最も効率的に働くpH領域があり、それ以外では酵素の働きが低下したり、酵素の立体構造が維持できずに失活してしまうこともある。
したがって、酵素反応を行う際には緩衝液で反応懸濁液のpHを酵素にとって最適のpHに維持することが必須となる。pHを保つための緩衝液にはさまざまな種類があり、目的のpHにするのに適した緩衝液を選ぶことができる。本願発明で用いているエンドグルカナーゼの最適pHは4−6付近のため、酢酸緩衝液を用いるが、代わりにリン酸緩衝液なども利用可能である。
【0033】
前述のようにセルロース分子は直鎖状であり、これらが規則正しく並んで水素結合などにより結晶を形成する。結晶領域では、セルロース分子鎖間の間隔は広くても0.6nmで、セルロース分子は隣接したセルロース分子としっかり結合しているため、酵素はセルロース分子を抱え込むことができず、加水分解反応を起こすことが困難である。
【0034】
また、アビセルの様な二次凝集体は、個々のCMFがさらに絡まり合った状態で乾燥してCMF表面に不規則に水素結合を形成し、塊状になっており、酵素の作用は困難である。前記の物理的破壊処理(物理的緩みの付与)とは、前述のように撹拌子で撹拌することにより部分的に物理的な緩みが生じ、すなわちセルロース分子鎖の配向の乱れた部分(非晶部分)が生じることにより、酵素がセルロース分子を抱え込むこと(酵素浸透性の確保)ができるようにすることである。 このような撹拌による「物理的な緩み」の生成と、その部分の酵素による加水分解が繰り返されることにより、結晶性を有するCMFあるいはアビセルの様な二次凝集体は、CMF自体が解かれる、あるいは、凝集体が分散されることになり、CMFのフィブリル化が実現する。
【0035】
本願発明に係る実験で用いたアビセルは、コットンセルロース・木材パルプを原料としており、その製法上、酸加水分解と乾燥によってCMFが凝集し、数十μm径の塊となっている。 また、ホヤセルロースは塩酸処理により精製したもので、若干のCMFの凝集が残っている。特に、アビセルではCMFがランダムに集合し、凝集部分は不規則に水素結合が形成されているものと考えられる。アビセルの透過電顕観察では、工程終了後は細いフィブリルの集合体になっていることから、凝集部分は、撹拌とエンドグルカナーゼによって、ほぐれてバラバラになるものと推定できる。
【0036】
また、CMF自体にも非晶部分が存在し、その部分が撹拌とエンドグルカナーゼによって破壊・除去され、より短いあるいは細いCMFとして分離されると考えられる。このことは、後述の実施例において、撹拌による微細な破砕は結晶領域にも及んでいること(後記表1において「未処理」よりも「撹拌のみ」で結晶化度が低下している)、さらにこの破砕部分をエンドグルカナーゼが分解除去すること(後記表1において「撹拌のみ」よりも「撹拌+エンドグルカナーゼ」で結晶化度が増加している)により確認している。すなわち、アビセルでもホヤでも、凝集部分のみならず、結晶領域での微細な破砕とその部分のエンドグルカナーゼによる分解によってCMF自体も分解を受けて、より短いあるいは細いCMFとして分離されると考えられる。
【発明の効果】
【0037】
本願発明にあっては、上記構成により、特別な装置を必要とせず、温和な条件で、セルロースナノファイバーを高収率で得ることが出来る。本願発明で得られるセルロースナノファイバーは高結晶性を維持しており、素材としての新しい用途が期待され、その工業的意義は極めて大きい。
【発明を実施するための最良の形態】
【0038】
本願発明は、上記従来の課題を解決のための研究過程において、セルロース原料の懸濁
液をスターラーで撹拌しながら、セルラーゼの成分の一つであるエンドグルカナーゼで処理することが有効であることの知見に端を発するものである。
【0039】
すなわち、スターラーで撹拌することによってCMFの凝集体もしくはCMFそのものの一部に物理的破壊処理による物理的な緩みを生ぜしめ、酵素のセルロース原料への浸透がよくなると同時に、緩みに生じた非晶部分にエンドグルカナーゼを作用させることによってCMFをフィブリル化し、セルロースナノファイバーが生成する。
【0040】
そこで、本願発明の要旨は、セルロースを該CMFに物理的に緩み(酵素作用促進処理)が生じ得て酵素浸透性が確保される条件下でエンドグルカナーゼ処理することにある。
【0041】
なお、「該CMFに物理的に緩みが生じ得る条件下」とは、セルロース原料のCMFの凝集体、もしくはCMFそのものの一部に物理的な緩みが生じることにより、結晶化度が数%から十数%程度低下しうる条件であり、例えばセルロース懸濁液に撹拌子を入れ、スターラーで撹拌することでも実行することができるが、これに限定されるものではない。
【0042】
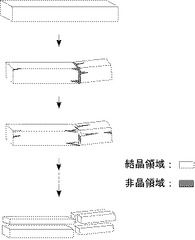
ここで、あらためて、本願発明の上記要旨を図1ないし5に基づいて模式的に整理説明する。
イ.セルロース分子鎖とエンドグルカナーゼの作用について セルロース分子鎖は、図1に示すように、グルコースがβ-(1,4)-グルコシド結合により直鎖状に重合したものである。エンドグルカナーゼはセルロース分子鎖を抱え込んでβ-(1,4)-グルコシド結合を加水分解するとセルロース分子から離れ、新たにセルロース分子鎖を捕まえてβ-(1,4)-グルコシド結合を加水分解する(非プロセッシブ型)。
したがって、図2に示すようにセルロース分子鎖をエンドグルカナーゼで処理するとセルロース分子鎖の断片化が生じる。
ロ.セルロースの構造について(結晶領域と非晶領域)
天然では、図3のように、セルロース分子鎖は何本かが集まった束の形で存在しており、これがCMFと呼ばれ、生物起源によってその幅や長さは異なってくる。CMFではセルロース分子鎖が規則的に並んで水素結合、ファンデルワールス力などにより隣接した分子鎖間が結ばれ、強固な3次元構造を形成している。このように、規則的に分子鎖が並んだ状態(結晶)では、エンドグルカナーゼがセルロース分子を抱え込むことができないため、β-(1,4)-グルコシド結合を加水分解することができない。 一方、外部からの強い力による変形やセルロース分子鎖の長さの不均一性などのため、分子鎖の配列の規則性が低い(配向性が低い)領域(非晶領域)が存在する(図4参照)。
このような領域では水素結合がまばらでセルロース分子鎖が緩んだ状態にあり、エンドグルカナーゼがセルロース分子鎖を抱え込んでβ-(1,4)-グルコシド結合を加水分解することが可能となる。セルロースミクロフィブリルには、結晶領域と非晶領域が混在しており、大きなCMFほど結晶領域の割合が高い(結晶化度が高い)傾向が有る。
ハ.アビセルとホヤセルロースの構造 本願発明の実験例で用いたアビセルは、木材パルプやコットンセルロースを酸加水分解して非晶領域を除き、磨砕、乾燥したもので、乾燥の際にCMFが凝集した状態のものである。
一方、ホヤセルロースはそのセルロースを分離・精製後、酸加水分解して非晶部を除いたもので、CMFの凝集は少なく、ほとんどが結晶領域からなると考えられる。
ニ.撹拌等による物理的破壊とエンドグルカナーゼによる加水分解によるCMFのフィブリル化(図5参照) CMFは結晶化度が高く、エンドグルカナーゼはほとんど作用できない。しかし、CMF懸濁液を撹拌するとCMFと撹拌子、あるいはCMF同士の接触により部分的に物理的破壊が生じる。この部分はセルロース分子鎖の規則的な配向が低下した状態、つまり非晶領域であり、エンドグルカナーゼによる作用で、非晶領域を除去できる。このような物理的な破壊とエンドグルカナーゼによる分解を繰り返すことにより、徐々にミクロフィブリルのフィブリル化(断片化、細分化)が進行する。
【0043】
上記本願発明によれば、既存の製造法と比べ、高結晶性セルロースナノファイバーを特別な装置を必要とせず、温和な条件で効率的に生産することが可能となる。
【0044】
本願発明に係るセルロースナノファイバーは、繊維幅数nmのナノファイバーであり、懸濁状態では優れた粘性を示すことから、各種増粘剤、コーティング剤、保湿剤等の広範な利用価値が期待される。さらに高い結晶化度を有しており、新規な微細繊維材料として期待できる。
【0045】
本願発明はセルロースを原料に撹拌により、そのCMFの凝集体もしくはCMFそのものの一部に物理的な緩みを起こしつつ、エンドグルカナーゼを作用させることにより、高結晶性のセルロースナノファイバーを効率よく得ることを特徴としている。
【0046】
本願発明で使用する原料は、セルロースであれば特に制限はなく、例えば、木材、綿などの高等植物セルロース、微生物が産生するセルロース(例えば、酢酸菌が産生するバクテリアセルロース)、原索動物(ホヤ)のセルロース、海藻が有するセルロース等が含まれる。
【0047】
上記セルロース原料の結晶化度は、最終的に製造されるセルロースナノファイバーの結晶化度に影響する。すなわち高結晶性セルロースを原料とすると、高い結晶化度を有するセルロースナノファイバーを製造することができる。一方、長いフィブリルを有するセルロース原料を用いると、高い粘性を有するセルロースナノファイバー懸濁液を得ることができる。これらのセルロースは、0.1−20重量%程度で用いられる。
【0048】
本願発明において、その用いる酵素、エンドグルカナーゼ(EC3.2.1.4)は、さまざまな微生物、植物、動物に由来し、セルロースなどのβ-(1,4)-グルコシド結合を非プロセッシブ型に加水分解する反応を触媒する。エンドグルカナーゼとしては精製酵素の他、該酵素を含む微生物菌体や培養液などの粗酵素を利用することができるが、セロビオハイドロラーゼの混入は、その結晶性セルロースを効率的に分解する性質上、生成したセルロースナノファイバーを更に分解するため収量低下を招く。したがって、本願発明において用いる酵素にセロビオハイドロラーゼが含まれる場合には、これを極力除去しておくことが望ましい。なおセロビオハイドロラーゼの除去は各種クロマトグラフィー等で達成することができ、セロビオハイドロラーゼが含まれないことは、結晶性セルロース(例えばアビセル)を分解する活性がほとんどないことで確認することができる。
【0049】
上記の反応に係る酵素、エンドグルカナーゼの使用比率は、原料のセルロース1mgに対して0.001-10単位である。なお、酵素活性の単位は、40℃において0.5%のカルボキシメチルセルロースナトリウム塩(置換度0.70)存在下で、1分間に還元糖を1μmol生成する酵素量を1単位と定義する。
【0050】
本願発明の酵素反応は、CMFに物理的な緩みが生じ得る条件下で実施する必要があり、例えば反応懸濁液に撹拌子を入れ、スターラーで撹拌することで実施することができる。pHと温度は使用する酵素の至適範囲内でコントロールすれば良い。反応系にウシ血清アルブミン、グリセロール、メルカプトエタノール等の安定剤を加えることによって、反応系を安定させることができる。反応時間はセルロース原料の種類や反応条件により異なるが、長時間の反応は収量の低下を招くため、数時間から数十時間程度反応させれば十分である。
【0051】
上記反応によりセルロース原料はフィブリル化し、元の結晶性を維持したセルロースナノファイバーを含む反応懸濁液を得ることが出来る。この反応懸濁液中には、少量のセロオリゴ糖が含有されるが、必要に応じて遠心分離やガラスフィルターによる濾過などの分離手段により、セルロースナノファイバーのみを集め、水洗を繰り返すことにより精製セルロースナノファイバーを得ることができる。 このように本願発明は、特別な装置を必要とすることなく,温和な条件でセルロースナノファイバーを高収率で得ることが出来るという優れた特徴を有している。
【発明の実施例】
【0052】
以下、実施例に従って本発明を更に詳細に説明するが、本発明はこれによって限定されるものではない。
実施例1(アビセルを用いたセルロースナノファイバーの製造)エンドグルカナーゼについてマツノザイセンチュウBursaphelenchus
xylophilusより取得したエンドグルカナーゼの遺伝子を酵母で発現させた組換え酵素BxENGと市販酵素であるメイセラーゼ(Meicelase CEPB-10,明治製菓)から調製した酵素EGIIの二種類を用いた。BxENGはGHファミリー45に属する触媒ドメインのみからなるのに対し、EGIIはGHファミリー5に属する触媒ドメインの他に不溶性セルロースに結合するためのセルロース結合モジュール(CBM)を具備している。
【0053】
BxENGの調製
BxENGをコードする遺伝子が導入された発現ベクターにはpGAPZαA(Invitrogen社)を用い、これらを酵母で発現させる際の宿主にはPichia pastoris X-33(Invitrogen社)を用いた。指示書に従いエレクトロポレーション法により酵母へ組換えベクターを導入し、形質転換体を獲得した。形質転換酵母は500mlのYPD液体培地で28℃、96時間振盪培養し、培養終了後、遠心分離して得た上澄液を限外濾過濃縮(分画分子量5,000)した。
【0054】
この濃縮液に20mM酢酸緩衝液(pH3.8)を加えて濃縮を繰り返し、同緩衝液で平衡化した。この処理液を同緩衝液で平衡化したMonoS 10/100カラム(GE Healthcare社製)に通し、吸着させた。次いで、同緩衝液でカラムを洗浄した後、食塩0M-1Mを含む同緩衝液のリニアグラジエントによりエンドグルカナーゼを溶出した。
【0055】
このエンドグルカナーゼを含む画分を集めて濃縮後、食塩0.15Mを含む同緩衝液で平衡化したSephacrylS-200 16/60カラム(GE Healthcare社製)に通し、溶出したエンドグルカナーゼ画分を集めた。こうして得られたエンドグルカナーゼ(BxENG)の総酵素活性は73単位であった。
【0056】
EGIIの調製
メイセラーゼ1.5gを15mMトリス塩酸緩衝液(pH7.5)に溶解し、同緩衝液で平衡化したHiTrap Q HPカラム(GE Healthcare社製)に通し、吸着せずに溶出したエンドグルカナーゼ画分を集めた。この溶出液を限外濾過濃縮(分画分子量5,000)し、さらに蒸留水を加えて濃縮を繰り返した後、凍結乾燥した。
【0057】
この凍結乾燥粉末を硫酸アンモニウム2Mを含む15mMトリス塩酸緩衝液(pH7.0)に溶解し、同緩衝液で平衡化したPhenyl Sepharose HPカラム(GE Healthcare社製)に通し、吸着させた。次いで、同緩衝液でカラムを洗浄した後、硫酸アンモニウム2M-0Mを含む同緩衝液のリニアグラジエントによりエンドグルカナーゼを溶出した。この溶出液を限外濾過濃縮(分画分子量5,000)し、さらに蒸留水を加えて濃縮を繰り返した後、凍結乾燥し50mM酢酸緩衝液(pH4.5)に溶解した。こうして得られたエンドグルカナーゼ(EGII)の総酵素活性は49単位であった。
【0058】
2ml容のテストチューブに50mM酢酸緩衝液(BxENG使用時はpH5.8、EGII使用時はpH4.0に調製)1ml、アビセル(PH101)10mg、各エンドグルカナーゼ0.2単位、ウシ血清アルブミン1mgからなる反応懸濁液を調製し、酵素作用促進処理を施して対象の酵素浸透性を確保した。すなわち、撹拌子(10mm×φ4mm)を加え、スターラーで撹拌しながら(200rpm)40℃で72時間、反応させた。比較対照として、エンドグルカナーゼ無添加の反応懸濁液を調製し、合わせて実施した。
【0059】
反応終了後、残渣を遠心分離により回収し、水洗後、凍結乾燥し、セルロースナノファイバー8.7mg(BxENG使用時)を得た。
透過型電子顕微鏡により形態を観察し、その結果を図6から図8に示す。
アビセルはその製法上酸加水分解処理および乾燥処理によってCMFの凝集が生じ、塊状になっている。これらの図より、撹拌操作のみでエンドグルカナーゼ無添加の場合、凝集した塊のフィブリル化は生じないが(図6参照)、エンドグルカナーゼを添加することにより凝集がほどけ、個々のCMFがバラバラになり、セルロースナノファイバーの生成を確認した(図7および図8参照)。 さらに、エンドグルカナーゼとしてBxENG、EGIIのどちらを用いてもセルロースナノファイバーの生成を確認したことから、エンドグルカナーゼはCBMの有無やGHファミリーの違いに関わらず用いることができることを確認した。
【0060】
実施例2(ホヤセルロースを用いたセルロースナノファイバーの製造)
ホヤセルロースは、ホヤの皮のうをpH4.9の酢酸緩衝液で緩衝化した0.3%亜塩素酸ナトリウム溶液で80℃、2時間処理し、水洗後5%水酸化カリウム溶液に室温で1晩浸せきした後,水洗するという操作を数回繰り返して精製し、ホモジナイザーで粉砕後、凍結乾燥した。この試料を2.5Ν塩酸で1時間煮沸した後水洗し、微結晶セルロースを得た。
【0061】
2ml容のテストチューブに50mM酢酸緩衝液(pH5.8)1ml、ホヤの微結晶セルロース10mg、エンドグルカナーゼ(BxENG)0.2単位、ウシ血清アルブミン1mgからなる反応懸濁液を調製して酵素作用促進処理を施して対象の酵素浸透性を確保した。すなわち、撹拌子(10mm×φ4mm)を加え、スターラーで撹拌しながら(200rpm)40℃で72時間、反応させた。比較対照として、エンドグルカナーゼ無添加のサンプルついても調製し、合わせて実施した。
【0062】
反応終了後、残渣を遠心分離により回収し、水洗後、凍結乾燥し、セルロースナノファイバー9.1mgを得た。
次いで、X線回折により結晶化度を測定し、その結果を次の表1に示す。この表1は、反応条件がホヤセルロースの結晶化度に及ぼす影響を示している。
【0063】
【表1】

【0064】
上記表1に示す通り、撹拌操作によってホヤセルロースの結晶化度は10%程度低下するが、エンドグルカナーゼを反応懸濁液に添加することにより、結晶化度が増加し、高い結晶化度を維持していることが確認できた。
撹拌とエンドグルカナーゼの作用によって生成したセルロースナノファイバーを透過型電子顕微鏡により形態を観察した。図9はその結果を示すものである。本願発明の製造法により、ホヤセルロースのCMFに長軸方向に沿って割れが入り、細いフィブリルが生じていることを観察した。ホヤセルロース由来のセルロースナノファイバーの幅は4-6nmのものが多く生成し、ホヤセルロース本来のCMF(10-15nm)よりも細くなっていることを確認した。一方、そのセルロースナノファイバーの長さは1μm程度であり、懸濁液は高い粘度を呈した。
【図面の簡単な説明】
【0065】
【図1】セルロース分子の模式図である。
【図2】エンドグルカナーゼによるセルロース分子分解の模式図である。
【図3】セルロースミクロフィブリル(結晶領域)の模式図である。
【図4】非晶領域の模式図である。
【図5】物理的破壊処理による破砕とエンドグルカナーゼによる分解を示す模式図である。
【図6】エンドグルカナーゼ無添加で撹拌したアビセルの透過型電子顕微鏡像を示す写真である。
【図7】エンドグルカナーゼ(BxENG)存在下で撹拌したアビセル由来セルロースナノファイバーの透過型電子顕微鏡像を示す写真である。
【図8】エンドグルカナーゼ(EGII)存在下で撹拌したアビセル由来セルロースナノファイバーの透過型電子顕微鏡像を示す写真である。
【図9】エンドグルカナーゼ(BxENG)存在下で撹拌したホヤセルロース由来セルロースナノファイバーの透過型電子顕微鏡像を示す写真である。
【技術分野】
【0001】
本願発明は、セルロース由来のナノファイバーとその製造方法に関し、セルロースを原料とし、これに、すなわちセルロースミクロフィブリル(Cellulose microfibril:CMF)凝集体および又はCMF自体に酵素作用促進処理を施し、所定酵素の浸透性を確保して、酵素の作用によりセルロースナノファイバーを製造する技術に関するものである。
【背景技術】
【0002】
セルロースは木材等、高等植物を始めとして藻類、酢酸菌等のある種バクテリア、ホヤなどの特定の動物によって生産され、CMFの形態で存在している。CMFの断面形態は生物種によって異なっており、その径も4-20nmと様々である。
【0003】
セルロースを出発原料とする微粒子およびそれらの分散液は、増粘性、乳化安定性、保水性、吸油性、保形性等の特徴を有することから、食品添加剤、錠剤賦形剤、分散剤、保形剤、保水剤、濾過助剤、充填剤、塗料、接着剤用添加剤等として、食品、医薬品、建材、窯業、ゴム・プラスチック等の幅広い分野で使用されている。
【0004】
本願発明に関連する従来技術が以下の文献において開示されている。
【特許文献1】米国特許第3,954,727号明細書
【特許文献2】米国特許第3,141,875号明細書
【特許文献3】特開昭53−127553号公報
【特許文献4】特開平6−10287号公報
【特許文献5】特開平7−310296号公報
【特許文献6】特開2005−270891号公報
【非特許文献1】N. Hayashi, J.Sugiyama, K. Okano, and M. Ishihara, Carbohydrate Research 305 (1) p109-116(1998)
【非特許文献2】セルロース学会編「セルロースの事典」(朝倉書店) p522-531 (2000)
【0005】
セルロースの微細化の方法としては、化学的処理と機械的処理による方法が知られている。化学的処理としてはセルロース原料に硫酸または塩酸等の鉱酸を作用させ加水分解反応を行い、残渣として粉末状セルロースを得る方法が公知であり、例えば120-160℃という高温下、20-45分間希酸で酸加水分解し、残渣として粉末状セルロースを得る方法(特許文献1参照)、2.5規定の塩酸で約15分間酸加水分解し、粉末状セルロースを得る方法(特許文献2参照)、各種濃度の塩酸水溶液で高温処理し、残渣として粉末状セルロースを得る方法(特許文献3参照)等がある。
【0006】
しかしながら、従来技術に係るそれらの製造方法に関しては、高温、耐酸設備を要する上に、酸加水分解反応や中和工程における薬品コストの低減等が望まれていた。
【0007】
また、機械的処理としては、公知の分級および/または粉砕技術が利用されている。例えばガラスやアルミナ等を粉砕媒体として用いた振動ミル粉砕装置によってセルロース繊維懸濁液を湿式粉砕する方法(特許文献4参照)、砥粒板の擦り合せによるせん断力でセルロース繊維を湿式粉砕する方法(特許文献5参照)、セルロースの懸濁液を一対のノズルから高圧でそれぞれ噴射させると共に、その噴射流を互いに衝突させて粉砕する方法(特許文献6参照)等が挙げられる。
【0008】
一方、上記の化学的処理や機械的処理に対して、酵素処理によるセルロースの微細化の試みもなされている。酵素処理による微細化は、上記の化学的処理や機械的処理に比べて、温和な条件下で反応を実行できるという利点がある。セルロースを分解する酵素であるセルラーゼは、セロビオハイドロラーゼ、エンドグルカナーゼ、β-グルコシダーゼといった異なる分解様式の酵素からなる複合酵素系であり、これらの相乗作用によってセルロースはセロビオース等の水溶性物質を経てグルコースにまで解重合される。
【0009】
しかしながら、元来セルロースは結晶性を示すため、酵素が作用し難いという問題がある。セルラーゼの主要構成成分であるセロビオハイドロラーゼは、セルロース分子鎖の端からβ-(1,4)-グルコシド結合を一つおき(セロビオースの単位)に順次加水分解する酵素であり、結晶性セルロースに対しても効率的に作用する。従って、セルロースは主にセロビオースに分解され、本酵素処理によるCMFのフィブリル化、すなわちナノファイバーの生成はごくわずかである(非特許文献1参照)。
【0010】
一方、エンドグルカナーゼを単独で結晶性セルロースに処理させた場合、セルロースに存在する非晶領域に作用し、セルロースの重合度低下が生じるが、ナノファイバーの生成は報告されていない(非特許文献2)。このように、酵素処理による効率的なセルロースナノファイバーの製造技術は未だ確立されていないのが現状である。
【発明の開示】
【発明が解決しようとする課題】
【0011】
本願発明は、酵素処理によるセルロース原料からのセルロースナノファイバーの製造において、簡便で効率的な製造方法を提供することを目的としている。すなわち、特別な装置を必要とせず、温和な条件でセルロースナノファイバーを高収率で得るとともに、該セルロースナノファイバーは高結晶性を維持し、素材としての新しい用途が期待でき、本願発明はその工業的意義が極めて大きいセルロースナノファイバーの製造技術の提供を目的としている。
【課題を解決するための手段】
【0012】
本願発明は、次の工程からなるセルロースナノファイバーの製造方法を実現して、上記従来の課題を解決しようとするものである。
(イ)緩衝液、セルロース、セルロース分解酵素、反応安定剤等からなる反応懸濁液を調製する工程、(ロ)反応懸濁液中のセルロースに酵素作用促進処理をなすことによりCMFの凝集体および/またはCMFにおける結晶領域に配向の乱れを生じさせて前記セルロースに酵素浸透性を確保する工程、(ハ)前記工程(ロ)に次いで、又はこれに併せて酵素浸透性を得たセルロースにセルロース分解酵素が作用してCMFの凝集体を解きほぐし、および/又はCMFを細裂させて所定のセルロースナノファイバーを反応懸濁液中に生成する工程。
【0013】
また、上記のセルロースナノファイバーの製造方法において、前記酵素作用促進処理は
CMFあるいはその凝集体における部分的な物理的破壊処理であり、セルロース分解酵素をこの物理的破壊部分を介して作用させるように構成することがある。すなわち、物理的破壊処理によりセルロースにおいて部分的に結晶性を低下(セルロース分子の配向性低下)せしめ、当該部分における水素結合を開放することになる。
【0014】
さらに、上記セルロースナノファイバーの製造方法において、前記物理的破壊は、CMFあるいはその凝集体の結晶化度を若干低減させる程度のもので構成することがある。
【0015】
また、上記のセルロースナノファイバーの製造方法において、CMFあるいはその凝集体の結晶化度の低減を数%以上に設定することがある。
【0016】
さらにまた、上記いずれかのセルロースナノファイバーの製造方法において、セルロース分解酵素はエンドグルカナーゼで構成することがある。
【0017】
また、上記いずれかのセルロースナノファイバーの製造方法において、前記物理的破壊処理は反応懸濁液中に加えた撹拌子の撹拌によるものとなすことがある。
【0018】
そして、本願発明は、上記いずれか記載のセルロースナノファイバーの製造方法により産出したセルロースナノファイバーを提供して上記従来の課題を解決しようとするものである。
【0019】
セルロースは天然では高等植物等により生産され、CMFという繊維の形で存在している。木材などからほぼCMFのみ(いわゆるパルプ)を残して懸濁液とし、堆積し圧締して乾燥させたものが紙である。また後述のアビセルはパルプに含まれるセルロース以外の成分を酸などでさらに厳密に除去して製造されるもので、CMFの形態は維持されているが、製造・乾燥過程でこれらが絡み合い、複雑な水素結合が形成されて鞠の様に固まっている。これを本願発明では「CMFの凝集体」と呼んでいる。
【0020】
CMFは、生産する起源によってその結晶化度や断面のサイズが異なり、木材やコットンなどの場合は3−6nmと小さく、ホヤの場合は11−15nmと大きなものである。したがって、CMFは、ナノ繊維の範疇にあるともいえるが、アビセルやホヤセルロースをスターラーで撹拌すると、CMFの凝集体や、もともと大きなCMFのある部分の酵素作用促進処理としての物理的破壊が発生し、セルロースにおいて部分的に結晶性が低下(セルロース分子の配向性低下)し、当該部分における水素結合が開放される結果、酵素浸透性が発生するものと考えられる。
【0021】
このことは、エンドグルカナーゼ無添加のセルロース原料の透過電顕観察により確認される。すなわち物理的破壊箇所にエンドグルカナーゼが作用し、凝集していたCMFがほぐれたり、大きなCMFに割れが生じてさらに細いCMFの集合体となる。この現象を指して「CMFのフィブリル化」ということができる。CMFの凝集体がほぐれた場合は、木材やコットン起源の場合、得られるナノファイバーは約3nm径、CMFの起源がホヤの場合は4−6nm径となる。
【0022】
本願発明では、CMFあるいはその凝集体を水に懸濁し、これに撹拌子を入れてスターラーで撹拌しつつ、併せてエンドグルカナーゼを作用させるように構成しているが、エンドグルカナーゼを加えないもので、部分的に物理的破壊が生じていることを透過電顕で確認しており、この段階で結晶化度の低下が見られる。すなわち、物理的破壊(物理的緩みともいえる)を生じさせて、その結果、結晶化度は数〜十数%低下することになる。
【0023】
周知のように、セルロースは、直鎖状のセルロース分子鎖が規則正しく並び、水素結合などで強固な高次構造を成して結晶性を有している。このことは、酵素が作用し難く、難分解性であることの原因となっている。本発明の撹拌条件(物理的破壊処理)により、CMFあるいはその凝集体に酵素の作用し易い部分が生成される。そして、いったん低下した結晶化度は、エンドグルカナーゼの作用により若干増加する。これは撹拌により生じた非晶部分が、エンドグルカナーゼの作用で切れて除かれることにより、結晶領域の割合が高まったためと考えられる。
【0024】
前記物理的破壊処理(物理的緩みの付与ともいえる)とは、CMFあるいはその凝集体を物理的に破壊し、結晶性を低下させることであり、透過電顕の観察から、例えば、CMFがほつれたようになったり、少し小さい凝集体が出来たりしていることから判明する。また、透過電顕では観察できない表面の変化や微細な割れが出来ている可能性が有る。本願発明において「物理的破壊(物理的緩み)」とは以上を併せた概念である。
【0025】
物理的破壊(物理的緩み)を達成する手段としては、超音波処理等も可能である。しかし、本願発明でユニークな点は、この物理的緩みを生じさせつつ、一方で、生成したその緩みにエンドグルカナーゼを作用させてCMFをバラバラにしたり、さらに細いCMFを生成したり、といった反応を同時にできることである。CMFあるいはその凝集体を形成している水素結合は非常に強固なので、酵素処理をなすには、なんらかの酵素作用促進処理を施すことなくしては簡単にほぐれない。そこで、酵素作用促進処理としての物理的破壊(物理的緩み)によりほぐれ酵素浸透性が得られたところにエンドグルカナーゼを作用させることになる。
【0026】
本願発明において、撹拌すなわち、物理的破壊処理はCMF自体あるいはCMFの凝集体を物理的に破壊するが、物理的破壊処理の目的は酵素浸透性の確保にあり、物理的破壊処理自体によってCMF自体あるいはCMFの凝集体をフィブリル化させることが目的ではない。従って、結晶を大規模に壊してしまうほど強い衝撃を与える必要はない。
【0027】
本願発明において、用いるセルロース分解酵素は、セルロースの非晶領域にのみ効率的に作用するエンドグルカナーゼが最適であり、CMFの凝集体のフィブリル化はエンドグルカナーゼ処理で特に顕著に現れる。一方、セロビオハイドロラーゼは、セルロース分子の端からβ-(1,4)-グルコシド結合を一つおきに順次加水分解する性質上、セロビオースが優先的に生成され、効率的にナノファイバーを生産することは難しい。
【0028】
セルロース分解酵素にはβ-(1,4)-グルコシド結合を加水分解するための構造(触媒ドメイン)と、これとは別にセルロース結合モジュール(cellulose binding module: CBM)とよばれる不溶性セルロースに結合するための独立した構造を持っているものと持っていないものが存在することが知られている。CBMが不溶性セルロースに結合することにより、触媒ドメインを基質である不溶性セルロース表面に濃縮させる効果があるため、CBMを有するセルロース分解酵素は、CBMを有していない触媒ドメインのみからなる酵素よりも不溶性セルロースを分解する活性が高いと言われている。
しかしながら本願発明においては、懸濁液中での物理的破壊処理操作により、エンドグルカナーゼとセルロースの接触が十分になされるため、エンドグルカナーゼはCBMの有無にかかわらず用いることができる
【0029】
糖質加水分解酵素(Glycoside Hydrolase: GH)は触媒ドメインの一次構造(酵素のアミノ酸配列)の類似性によって分類されており、エンドグルカナーゼは複数のGHファミリーに分類されている。例えば、セルロース分解菌であるTrichoderma reeseiが有しているエンドグルカナーゼは5つのGHファミリーに分布している。これらの酵素の構造は全く異なっているが、本願発明に用いるエンドグルカナーゼはいずれのGHファミリーに属するものでもよい。
【0030】
本願発明で用いる酵素はセルロースの加水分解反応を触媒するため、水分子の存在は不可欠である。また、反応が効率的に行われるようにするため、酵素と基質(本願発明の場合のセルロース)の接触が十分になされる必要があり、そのためには反応を懸濁液中で行う必要がある。さらに、後述段落0032に示すように、反応系のpHを一定にする必要からも懸濁液中での反応が必須となる。
【0031】
酵素は特定の立体構造をもつタンパク質であり、酵素が反応を触媒するという機能を発揮するためには構造の維持が不可欠である。しかし、酵素の種類や使用条件によっては、酵素の立体構造を長時間維持することが困難になるため、酵素の機能が低下し、期待する酵素反応の速度が低下してしまうことがありえる。
したがって、条件によっては酵素の立体構造を維持することを目的として反応懸濁液に安定剤を添加する場合がある。一般的にウシ血清アルブミン(BSA)やグリセロールが安定剤として広く用いられている。
【0032】
酵素には、最も効率的に働くpH領域があり、それ以外では酵素の働きが低下したり、酵素の立体構造が維持できずに失活してしまうこともある。
したがって、酵素反応を行う際には緩衝液で反応懸濁液のpHを酵素にとって最適のpHに維持することが必須となる。pHを保つための緩衝液にはさまざまな種類があり、目的のpHにするのに適した緩衝液を選ぶことができる。本願発明で用いているエンドグルカナーゼの最適pHは4−6付近のため、酢酸緩衝液を用いるが、代わりにリン酸緩衝液なども利用可能である。
【0033】
前述のようにセルロース分子は直鎖状であり、これらが規則正しく並んで水素結合などにより結晶を形成する。結晶領域では、セルロース分子鎖間の間隔は広くても0.6nmで、セルロース分子は隣接したセルロース分子としっかり結合しているため、酵素はセルロース分子を抱え込むことができず、加水分解反応を起こすことが困難である。
【0034】
また、アビセルの様な二次凝集体は、個々のCMFがさらに絡まり合った状態で乾燥してCMF表面に不規則に水素結合を形成し、塊状になっており、酵素の作用は困難である。前記の物理的破壊処理(物理的緩みの付与)とは、前述のように撹拌子で撹拌することにより部分的に物理的な緩みが生じ、すなわちセルロース分子鎖の配向の乱れた部分(非晶部分)が生じることにより、酵素がセルロース分子を抱え込むこと(酵素浸透性の確保)ができるようにすることである。 このような撹拌による「物理的な緩み」の生成と、その部分の酵素による加水分解が繰り返されることにより、結晶性を有するCMFあるいはアビセルの様な二次凝集体は、CMF自体が解かれる、あるいは、凝集体が分散されることになり、CMFのフィブリル化が実現する。
【0035】
本願発明に係る実験で用いたアビセルは、コットンセルロース・木材パルプを原料としており、その製法上、酸加水分解と乾燥によってCMFが凝集し、数十μm径の塊となっている。 また、ホヤセルロースは塩酸処理により精製したもので、若干のCMFの凝集が残っている。特に、アビセルではCMFがランダムに集合し、凝集部分は不規則に水素結合が形成されているものと考えられる。アビセルの透過電顕観察では、工程終了後は細いフィブリルの集合体になっていることから、凝集部分は、撹拌とエンドグルカナーゼによって、ほぐれてバラバラになるものと推定できる。
【0036】
また、CMF自体にも非晶部分が存在し、その部分が撹拌とエンドグルカナーゼによって破壊・除去され、より短いあるいは細いCMFとして分離されると考えられる。このことは、後述の実施例において、撹拌による微細な破砕は結晶領域にも及んでいること(後記表1において「未処理」よりも「撹拌のみ」で結晶化度が低下している)、さらにこの破砕部分をエンドグルカナーゼが分解除去すること(後記表1において「撹拌のみ」よりも「撹拌+エンドグルカナーゼ」で結晶化度が増加している)により確認している。すなわち、アビセルでもホヤでも、凝集部分のみならず、結晶領域での微細な破砕とその部分のエンドグルカナーゼによる分解によってCMF自体も分解を受けて、より短いあるいは細いCMFとして分離されると考えられる。
【発明の効果】
【0037】
本願発明にあっては、上記構成により、特別な装置を必要とせず、温和な条件で、セルロースナノファイバーを高収率で得ることが出来る。本願発明で得られるセルロースナノファイバーは高結晶性を維持しており、素材としての新しい用途が期待され、その工業的意義は極めて大きい。
【発明を実施するための最良の形態】
【0038】
本願発明は、上記従来の課題を解決のための研究過程において、セルロース原料の懸濁
液をスターラーで撹拌しながら、セルラーゼの成分の一つであるエンドグルカナーゼで処理することが有効であることの知見に端を発するものである。
【0039】
すなわち、スターラーで撹拌することによってCMFの凝集体もしくはCMFそのものの一部に物理的破壊処理による物理的な緩みを生ぜしめ、酵素のセルロース原料への浸透がよくなると同時に、緩みに生じた非晶部分にエンドグルカナーゼを作用させることによってCMFをフィブリル化し、セルロースナノファイバーが生成する。
【0040】
そこで、本願発明の要旨は、セルロースを該CMFに物理的に緩み(酵素作用促進処理)が生じ得て酵素浸透性が確保される条件下でエンドグルカナーゼ処理することにある。
【0041】
なお、「該CMFに物理的に緩みが生じ得る条件下」とは、セルロース原料のCMFの凝集体、もしくはCMFそのものの一部に物理的な緩みが生じることにより、結晶化度が数%から十数%程度低下しうる条件であり、例えばセルロース懸濁液に撹拌子を入れ、スターラーで撹拌することでも実行することができるが、これに限定されるものではない。
【0042】
ここで、あらためて、本願発明の上記要旨を図1ないし5に基づいて模式的に整理説明する。
イ.セルロース分子鎖とエンドグルカナーゼの作用について セルロース分子鎖は、図1に示すように、グルコースがβ-(1,4)-グルコシド結合により直鎖状に重合したものである。エンドグルカナーゼはセルロース分子鎖を抱え込んでβ-(1,4)-グルコシド結合を加水分解するとセルロース分子から離れ、新たにセルロース分子鎖を捕まえてβ-(1,4)-グルコシド結合を加水分解する(非プロセッシブ型)。
したがって、図2に示すようにセルロース分子鎖をエンドグルカナーゼで処理するとセルロース分子鎖の断片化が生じる。
ロ.セルロースの構造について(結晶領域と非晶領域)
天然では、図3のように、セルロース分子鎖は何本かが集まった束の形で存在しており、これがCMFと呼ばれ、生物起源によってその幅や長さは異なってくる。CMFではセルロース分子鎖が規則的に並んで水素結合、ファンデルワールス力などにより隣接した分子鎖間が結ばれ、強固な3次元構造を形成している。このように、規則的に分子鎖が並んだ状態(結晶)では、エンドグルカナーゼがセルロース分子を抱え込むことができないため、β-(1,4)-グルコシド結合を加水分解することができない。 一方、外部からの強い力による変形やセルロース分子鎖の長さの不均一性などのため、分子鎖の配列の規則性が低い(配向性が低い)領域(非晶領域)が存在する(図4参照)。
このような領域では水素結合がまばらでセルロース分子鎖が緩んだ状態にあり、エンドグルカナーゼがセルロース分子鎖を抱え込んでβ-(1,4)-グルコシド結合を加水分解することが可能となる。セルロースミクロフィブリルには、結晶領域と非晶領域が混在しており、大きなCMFほど結晶領域の割合が高い(結晶化度が高い)傾向が有る。
ハ.アビセルとホヤセルロースの構造 本願発明の実験例で用いたアビセルは、木材パルプやコットンセルロースを酸加水分解して非晶領域を除き、磨砕、乾燥したもので、乾燥の際にCMFが凝集した状態のものである。
一方、ホヤセルロースはそのセルロースを分離・精製後、酸加水分解して非晶部を除いたもので、CMFの凝集は少なく、ほとんどが結晶領域からなると考えられる。
ニ.撹拌等による物理的破壊とエンドグルカナーゼによる加水分解によるCMFのフィブリル化(図5参照) CMFは結晶化度が高く、エンドグルカナーゼはほとんど作用できない。しかし、CMF懸濁液を撹拌するとCMFと撹拌子、あるいはCMF同士の接触により部分的に物理的破壊が生じる。この部分はセルロース分子鎖の規則的な配向が低下した状態、つまり非晶領域であり、エンドグルカナーゼによる作用で、非晶領域を除去できる。このような物理的な破壊とエンドグルカナーゼによる分解を繰り返すことにより、徐々にミクロフィブリルのフィブリル化(断片化、細分化)が進行する。
【0043】
上記本願発明によれば、既存の製造法と比べ、高結晶性セルロースナノファイバーを特別な装置を必要とせず、温和な条件で効率的に生産することが可能となる。
【0044】
本願発明に係るセルロースナノファイバーは、繊維幅数nmのナノファイバーであり、懸濁状態では優れた粘性を示すことから、各種増粘剤、コーティング剤、保湿剤等の広範な利用価値が期待される。さらに高い結晶化度を有しており、新規な微細繊維材料として期待できる。
【0045】
本願発明はセルロースを原料に撹拌により、そのCMFの凝集体もしくはCMFそのものの一部に物理的な緩みを起こしつつ、エンドグルカナーゼを作用させることにより、高結晶性のセルロースナノファイバーを効率よく得ることを特徴としている。
【0046】
本願発明で使用する原料は、セルロースであれば特に制限はなく、例えば、木材、綿などの高等植物セルロース、微生物が産生するセルロース(例えば、酢酸菌が産生するバクテリアセルロース)、原索動物(ホヤ)のセルロース、海藻が有するセルロース等が含まれる。
【0047】
上記セルロース原料の結晶化度は、最終的に製造されるセルロースナノファイバーの結晶化度に影響する。すなわち高結晶性セルロースを原料とすると、高い結晶化度を有するセルロースナノファイバーを製造することができる。一方、長いフィブリルを有するセルロース原料を用いると、高い粘性を有するセルロースナノファイバー懸濁液を得ることができる。これらのセルロースは、0.1−20重量%程度で用いられる。
【0048】
本願発明において、その用いる酵素、エンドグルカナーゼ(EC3.2.1.4)は、さまざまな微生物、植物、動物に由来し、セルロースなどのβ-(1,4)-グルコシド結合を非プロセッシブ型に加水分解する反応を触媒する。エンドグルカナーゼとしては精製酵素の他、該酵素を含む微生物菌体や培養液などの粗酵素を利用することができるが、セロビオハイドロラーゼの混入は、その結晶性セルロースを効率的に分解する性質上、生成したセルロースナノファイバーを更に分解するため収量低下を招く。したがって、本願発明において用いる酵素にセロビオハイドロラーゼが含まれる場合には、これを極力除去しておくことが望ましい。なおセロビオハイドロラーゼの除去は各種クロマトグラフィー等で達成することができ、セロビオハイドロラーゼが含まれないことは、結晶性セルロース(例えばアビセル)を分解する活性がほとんどないことで確認することができる。
【0049】
上記の反応に係る酵素、エンドグルカナーゼの使用比率は、原料のセルロース1mgに対して0.001-10単位である。なお、酵素活性の単位は、40℃において0.5%のカルボキシメチルセルロースナトリウム塩(置換度0.70)存在下で、1分間に還元糖を1μmol生成する酵素量を1単位と定義する。
【0050】
本願発明の酵素反応は、CMFに物理的な緩みが生じ得る条件下で実施する必要があり、例えば反応懸濁液に撹拌子を入れ、スターラーで撹拌することで実施することができる。pHと温度は使用する酵素の至適範囲内でコントロールすれば良い。反応系にウシ血清アルブミン、グリセロール、メルカプトエタノール等の安定剤を加えることによって、反応系を安定させることができる。反応時間はセルロース原料の種類や反応条件により異なるが、長時間の反応は収量の低下を招くため、数時間から数十時間程度反応させれば十分である。
【0051】
上記反応によりセルロース原料はフィブリル化し、元の結晶性を維持したセルロースナノファイバーを含む反応懸濁液を得ることが出来る。この反応懸濁液中には、少量のセロオリゴ糖が含有されるが、必要に応じて遠心分離やガラスフィルターによる濾過などの分離手段により、セルロースナノファイバーのみを集め、水洗を繰り返すことにより精製セルロースナノファイバーを得ることができる。 このように本願発明は、特別な装置を必要とすることなく,温和な条件でセルロースナノファイバーを高収率で得ることが出来るという優れた特徴を有している。
【発明の実施例】
【0052】
以下、実施例に従って本発明を更に詳細に説明するが、本発明はこれによって限定されるものではない。
実施例1(アビセルを用いたセルロースナノファイバーの製造)エンドグルカナーゼについてマツノザイセンチュウBursaphelenchus
xylophilusより取得したエンドグルカナーゼの遺伝子を酵母で発現させた組換え酵素BxENGと市販酵素であるメイセラーゼ(Meicelase CEPB-10,明治製菓)から調製した酵素EGIIの二種類を用いた。BxENGはGHファミリー45に属する触媒ドメインのみからなるのに対し、EGIIはGHファミリー5に属する触媒ドメインの他に不溶性セルロースに結合するためのセルロース結合モジュール(CBM)を具備している。
【0053】
BxENGの調製
BxENGをコードする遺伝子が導入された発現ベクターにはpGAPZαA(Invitrogen社)を用い、これらを酵母で発現させる際の宿主にはPichia pastoris X-33(Invitrogen社)を用いた。指示書に従いエレクトロポレーション法により酵母へ組換えベクターを導入し、形質転換体を獲得した。形質転換酵母は500mlのYPD液体培地で28℃、96時間振盪培養し、培養終了後、遠心分離して得た上澄液を限外濾過濃縮(分画分子量5,000)した。
【0054】
この濃縮液に20mM酢酸緩衝液(pH3.8)を加えて濃縮を繰り返し、同緩衝液で平衡化した。この処理液を同緩衝液で平衡化したMonoS 10/100カラム(GE Healthcare社製)に通し、吸着させた。次いで、同緩衝液でカラムを洗浄した後、食塩0M-1Mを含む同緩衝液のリニアグラジエントによりエンドグルカナーゼを溶出した。
【0055】
このエンドグルカナーゼを含む画分を集めて濃縮後、食塩0.15Mを含む同緩衝液で平衡化したSephacrylS-200 16/60カラム(GE Healthcare社製)に通し、溶出したエンドグルカナーゼ画分を集めた。こうして得られたエンドグルカナーゼ(BxENG)の総酵素活性は73単位であった。
【0056】
EGIIの調製
メイセラーゼ1.5gを15mMトリス塩酸緩衝液(pH7.5)に溶解し、同緩衝液で平衡化したHiTrap Q HPカラム(GE Healthcare社製)に通し、吸着せずに溶出したエンドグルカナーゼ画分を集めた。この溶出液を限外濾過濃縮(分画分子量5,000)し、さらに蒸留水を加えて濃縮を繰り返した後、凍結乾燥した。
【0057】
この凍結乾燥粉末を硫酸アンモニウム2Mを含む15mMトリス塩酸緩衝液(pH7.0)に溶解し、同緩衝液で平衡化したPhenyl Sepharose HPカラム(GE Healthcare社製)に通し、吸着させた。次いで、同緩衝液でカラムを洗浄した後、硫酸アンモニウム2M-0Mを含む同緩衝液のリニアグラジエントによりエンドグルカナーゼを溶出した。この溶出液を限外濾過濃縮(分画分子量5,000)し、さらに蒸留水を加えて濃縮を繰り返した後、凍結乾燥し50mM酢酸緩衝液(pH4.5)に溶解した。こうして得られたエンドグルカナーゼ(EGII)の総酵素活性は49単位であった。
【0058】
2ml容のテストチューブに50mM酢酸緩衝液(BxENG使用時はpH5.8、EGII使用時はpH4.0に調製)1ml、アビセル(PH101)10mg、各エンドグルカナーゼ0.2単位、ウシ血清アルブミン1mgからなる反応懸濁液を調製し、酵素作用促進処理を施して対象の酵素浸透性を確保した。すなわち、撹拌子(10mm×φ4mm)を加え、スターラーで撹拌しながら(200rpm)40℃で72時間、反応させた。比較対照として、エンドグルカナーゼ無添加の反応懸濁液を調製し、合わせて実施した。
【0059】
反応終了後、残渣を遠心分離により回収し、水洗後、凍結乾燥し、セルロースナノファイバー8.7mg(BxENG使用時)を得た。
透過型電子顕微鏡により形態を観察し、その結果を図6から図8に示す。
アビセルはその製法上酸加水分解処理および乾燥処理によってCMFの凝集が生じ、塊状になっている。これらの図より、撹拌操作のみでエンドグルカナーゼ無添加の場合、凝集した塊のフィブリル化は生じないが(図6参照)、エンドグルカナーゼを添加することにより凝集がほどけ、個々のCMFがバラバラになり、セルロースナノファイバーの生成を確認した(図7および図8参照)。 さらに、エンドグルカナーゼとしてBxENG、EGIIのどちらを用いてもセルロースナノファイバーの生成を確認したことから、エンドグルカナーゼはCBMの有無やGHファミリーの違いに関わらず用いることができることを確認した。
【0060】
実施例2(ホヤセルロースを用いたセルロースナノファイバーの製造)
ホヤセルロースは、ホヤの皮のうをpH4.9の酢酸緩衝液で緩衝化した0.3%亜塩素酸ナトリウム溶液で80℃、2時間処理し、水洗後5%水酸化カリウム溶液に室温で1晩浸せきした後,水洗するという操作を数回繰り返して精製し、ホモジナイザーで粉砕後、凍結乾燥した。この試料を2.5Ν塩酸で1時間煮沸した後水洗し、微結晶セルロースを得た。
【0061】
2ml容のテストチューブに50mM酢酸緩衝液(pH5.8)1ml、ホヤの微結晶セルロース10mg、エンドグルカナーゼ(BxENG)0.2単位、ウシ血清アルブミン1mgからなる反応懸濁液を調製して酵素作用促進処理を施して対象の酵素浸透性を確保した。すなわち、撹拌子(10mm×φ4mm)を加え、スターラーで撹拌しながら(200rpm)40℃で72時間、反応させた。比較対照として、エンドグルカナーゼ無添加のサンプルついても調製し、合わせて実施した。
【0062】
反応終了後、残渣を遠心分離により回収し、水洗後、凍結乾燥し、セルロースナノファイバー9.1mgを得た。
次いで、X線回折により結晶化度を測定し、その結果を次の表1に示す。この表1は、反応条件がホヤセルロースの結晶化度に及ぼす影響を示している。
【0063】
【表1】

【0064】
上記表1に示す通り、撹拌操作によってホヤセルロースの結晶化度は10%程度低下するが、エンドグルカナーゼを反応懸濁液に添加することにより、結晶化度が増加し、高い結晶化度を維持していることが確認できた。
撹拌とエンドグルカナーゼの作用によって生成したセルロースナノファイバーを透過型電子顕微鏡により形態を観察した。図9はその結果を示すものである。本願発明の製造法により、ホヤセルロースのCMFに長軸方向に沿って割れが入り、細いフィブリルが生じていることを観察した。ホヤセルロース由来のセルロースナノファイバーの幅は4-6nmのものが多く生成し、ホヤセルロース本来のCMF(10-15nm)よりも細くなっていることを確認した。一方、そのセルロースナノファイバーの長さは1μm程度であり、懸濁液は高い粘度を呈した。
【図面の簡単な説明】
【0065】
【図1】セルロース分子の模式図である。
【図2】エンドグルカナーゼによるセルロース分子分解の模式図である。
【図3】セルロースミクロフィブリル(結晶領域)の模式図である。
【図4】非晶領域の模式図である。
【図5】物理的破壊処理による破砕とエンドグルカナーゼによる分解を示す模式図である。
【図6】エンドグルカナーゼ無添加で撹拌したアビセルの透過型電子顕微鏡像を示す写真である。
【図7】エンドグルカナーゼ(BxENG)存在下で撹拌したアビセル由来セルロースナノファイバーの透過型電子顕微鏡像を示す写真である。
【図8】エンドグルカナーゼ(EGII)存在下で撹拌したアビセル由来セルロースナノファイバーの透過型電子顕微鏡像を示す写真である。
【図9】エンドグルカナーゼ(BxENG)存在下で撹拌したホヤセルロース由来セルロースナノファイバーの透過型電子顕微鏡像を示す写真である。
【特許請求の範囲】
【請求項1】
次の工程からなるセルロースナノファイバーの製造方法。
(イ) 緩衝液、セルロース、セルロース分解酵素、反応安定剤等からなる反応懸濁液を調製する工程、
(ロ) 反応懸濁液中のセルロースに酵素作用促進処理をなすことによりセルロースミクロフィブリルの凝集体および/またはセルロースミクロフィブリルにおける結晶領域の配向の乱れを生じさせて前記セルロースに酵素浸透性を確保する工程、
(ハ) 前記工程(ロ)に次いで、又はこれに併せて酵素浸透性を得たセルロースにセルロース分解酵素が作用して、セルロースミクロフィブリルの凝集体を解きほぐし、および/又はセルロースミクロフィブリルを細裂させて、所定のセルロースナノファイバーを反応懸濁液中に生成する工程。
【請求項2】
請求項1記載のセルロースナノファイバーの製造方法において、前記酵素作用促進処理は、セルロースミクロフィブリルあるいはその凝集体における部分的な物理的破壊処理であり、セルロース分解酵素をこの物理的破壊部分を介して作用させるようにしたことを特徴とするセルロースナノファイバーの製造方法。
【請求項3】
請求項2記載のセルロースナノファイバーの製造方法において、前記物理的破壊は、セルロースミクロフィブリルあるいはその凝集体の結晶化度を低減させる程度のものであることを特徴とするセルロースナノファイバーの製造方法。
【請求項4】
請求項2記載のセルロースナノファイバーの製造方法において、セルロースミクロフィブリルあるいはその凝集体の結晶化度の低減は数%以上であることを特徴とするセルロースナノファイバーの製造方法。
【請求項5】
請求項1ないし4いずれか記載のセルロースナノファイバーの製造方法において、セルロース分解酵素はエンドグルカナーゼであることを特徴とするセルロースナノファイバーの製造方法。
【請求項6】
請求項2ないし5いずれか記載のセルロースナノファイバーの製造方法において、前記物理的破壊処理は反応懸濁液中に加えた撹拌子の撹拌によるものであることを特徴とするセルロースナノファイバーの製造方法。
【請求項7】
請求項1ないし6いずれか記載のセルロースナノファイバーの製造方法により産出したセルロースナノファイバー。
【請求項1】
次の工程からなるセルロースナノファイバーの製造方法。
(イ) 緩衝液、セルロース、セルロース分解酵素、反応安定剤等からなる反応懸濁液を調製する工程、
(ロ) 反応懸濁液中のセルロースに酵素作用促進処理をなすことによりセルロースミクロフィブリルの凝集体および/またはセルロースミクロフィブリルにおける結晶領域の配向の乱れを生じさせて前記セルロースに酵素浸透性を確保する工程、
(ハ) 前記工程(ロ)に次いで、又はこれに併せて酵素浸透性を得たセルロースにセルロース分解酵素が作用して、セルロースミクロフィブリルの凝集体を解きほぐし、および/又はセルロースミクロフィブリルを細裂させて、所定のセルロースナノファイバーを反応懸濁液中に生成する工程。
【請求項2】
請求項1記載のセルロースナノファイバーの製造方法において、前記酵素作用促進処理は、セルロースミクロフィブリルあるいはその凝集体における部分的な物理的破壊処理であり、セルロース分解酵素をこの物理的破壊部分を介して作用させるようにしたことを特徴とするセルロースナノファイバーの製造方法。
【請求項3】
請求項2記載のセルロースナノファイバーの製造方法において、前記物理的破壊は、セルロースミクロフィブリルあるいはその凝集体の結晶化度を低減させる程度のものであることを特徴とするセルロースナノファイバーの製造方法。
【請求項4】
請求項2記載のセルロースナノファイバーの製造方法において、セルロースミクロフィブリルあるいはその凝集体の結晶化度の低減は数%以上であることを特徴とするセルロースナノファイバーの製造方法。
【請求項5】
請求項1ないし4いずれか記載のセルロースナノファイバーの製造方法において、セルロース分解酵素はエンドグルカナーゼであることを特徴とするセルロースナノファイバーの製造方法。
【請求項6】
請求項2ないし5いずれか記載のセルロースナノファイバーの製造方法において、前記物理的破壊処理は反応懸濁液中に加えた撹拌子の撹拌によるものであることを特徴とするセルロースナノファイバーの製造方法。
【請求項7】
請求項1ないし6いずれか記載のセルロースナノファイバーの製造方法により産出したセルロースナノファイバー。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2008−150719(P2008−150719A)
【公開日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願番号】特願2006−337350(P2006−337350)
【出願日】平成18年12月14日(2006.12.14)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年7月1日 セルロース学会第13回年次大会運営委員会発行の「セルロース学会第13回年次大会 2006Cellulose R&D 講演要旨集」に発表
【出願人】(501186173)独立行政法人森林総合研究所 (91)
【Fターム(参考)】
【公開日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願日】平成18年12月14日(2006.12.14)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年7月1日 セルロース学会第13回年次大会運営委員会発行の「セルロース学会第13回年次大会 2006Cellulose R&D 講演要旨集」に発表
【出願人】(501186173)独立行政法人森林総合研究所 (91)
【Fターム(参考)】
[ Back to top ]

