セルロース系バイオマスからのエタノール製造方法
【課題】セルロース系バイオマスに由来する糖化液から効率的にエタノールを製造する方法を提供する。
【解決手段】ピキア・スティピィティスによるキシロースからエタノールを生成する際の中間代謝物であるグルコース-6-リン酸、フルクトース-1,6-ビスリン酸およびピルビン酸を代謝する酵素であるグルコース-6-リン酸デヒドロゲナーゼ、ケトラーゼ、ピルビン酸デカルボキシラーゼ活性を増強したピキア・スティピティス突然変異株を用い、発酵物質阻害に対する耐性能を付与することでより効率良いアルコール発酵を行うことからなる。
【解決手段】ピキア・スティピィティスによるキシロースからエタノールを生成する際の中間代謝物であるグルコース-6-リン酸、フルクトース-1,6-ビスリン酸およびピルビン酸を代謝する酵素であるグルコース-6-リン酸デヒドロゲナーゼ、ケトラーゼ、ピルビン酸デカルボキシラーゼ活性を増強したピキア・スティピティス突然変異株を用い、発酵物質阻害に対する耐性能を付与することでより効率良いアルコール発酵を行うことからなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、セルロース系バイオマスから微生物発酵を用いてエタノールを製造する方法に関する。
【背景技術】
【0002】
近年、地球温暖化対策などの様々な要因から再生可能エネルギーの技術開発が求められている。セルロース系バイオマスから製造されるバイオエタノールもその再生可能エネルギーの一つである。バイオエタノールは二酸化炭素の排出削減に直結することから自動車用のガソリン燃料への添加剤もしくはガソリン自体の代替燃料として期待されている。
【0003】
セルロース系バイオマスからエタノールを製造する工程は前処理、糖化および発酵の3つに分けられる。セルロース系バイオマスはセルロース、ヘミセルロースおよびリグニンにより構成されている。セルロースとヘミセルロースは多数の糖が結合して形成された多糖であり、多糖から単糖に分解する工程が糖化である。糖化工程によりセルロースからは6炭糖であるグルコースが、ヘミセルロースからはグルコースの他に5炭糖であるキシロースが主に生成される。生成された単糖を含む溶液を糖化液とする。
【0004】
セルロースとヘミセルロースは非常に強固な構造を持っているため、糖化を効率的に行うために前処理が行われる。前処理には高温・高圧処理やアルカリ処理など様々な方法があり、この工程において様々な物質がセルロース系バイオマスから生成される。
【0005】
前処理・糖化工程により生成された糖化液を用いて微生物発酵によりエタノールを製造するのが発酵工程である。エタノールを最も効率良く生産できるとされている酵母サッカロマイセス・セレビシエは6炭糖のグルコースを資化できるが、5炭糖のキシロースを資化することができない。そのため、キシロースからエタノールを生成するにはピキア・スティピティスやキャンディダ・シェハタエなどのキシロースを資化できる酵母が必要になる。
【0006】
ピキア酵母やキャンディダ酵母による糖化液に含まれるキシロースの発酵は前処理工程で生じた物質により阻害される。この発酵阻害を改善する方法は前処理したバイオマスを洗浄することで発酵阻害物質を除去する方法やイオン交換樹脂や活性炭などを用いて発酵阻害物質を除去する方法が報告されている(特許文献1、2)。しかしながら、これらの方法はバイオマス糖化液の製造工程にバイオマスの洗浄工程や発酵阻害物質の除去工程を新たに組み込むことが必要になり、製造工程を複雑化することになる。製造工程の複雑化はエタノールの生成効率の低下と生産コストの上昇を引き起こす。
【0007】
そのため、酵母に発酵阻害物質に対する耐性能を付与することがより効率的であると考えられるが、原材料として用いるセルロース系バイオマスの種類や前処理方法により生成する発酵阻害物質は異なる。従って、使用する糖化液での発酵阻害機構を検証し、その阻害に適した耐性能を酵母に付与することが必要になる。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2005−270056号公報
【特許文献2】特開2010−536376号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明ではセルロース系バイオマスから製造された糖化液における微生物発酵の阻害機構を検証し、得られた知見から発酵阻害に対する対処方法を提示することでセルロース系バイオマスに由来する糖化液から効率的にエタノールを製造する方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者らは前記目的を達成するために鋭意研究を重ねた結果、メラノイジン含有培地およびエリアンサスを原材料とする糖化液における発酵阻害機構を解明し、その阻害機構を基に酵母への改善方法を見出した。本発明は、かかる知見に基づいて完成したものである。
【0011】
細胞内の代謝産物を網羅的に解析するメタボローム解析の結果、ピキア・スティピィティスによるメラノイジン含有培地および糖化液での発酵においてグルコース-6-リン酸およびフルクトース‐1,6-ビスリン酸の顕著な蓄積が見られた。
【0012】
ペントースリン酸経路において、グルコース-6-リン酸はグルコース-6-リン酸デヒドロゲナーゼの働きで6-ホスホグルコノ-1,5-ラクトンに変換され、その変換に付随してNADP+からNADPHが生じる。NADPHはキシロースをキシリトールに変換する働きを持つキシロース還元酵素の補酵素であり、キシロースからのアルコール生産において必須の物質である。そのため、グルコース-6-リン酸の蓄積はNADPHの供給が不足する原因となり、キシロースからのエタノール生産が阻害されることが予想された。メラノイジン含有培地および糖化液においてより効率良くアルコール発酵を行わせるためにはグルコース-6-リン酸デヒドロゲナーゼ活性を増強する必要がある。グルコース-6-リン酸デヒドロゲナーゼ活性の増強方法としては以下に示す3つの方法がある。一つ目はUVもしくはエチルメタンスルホン酸(EMS)による突然変異誘導処理によるグルコース-6-リン酸デヒドロゲナーゼ活性を増強した突然変異株の作成である。二つ目としては高発現ベクターにグルコース-6-リン酸デヒドロゲナーゼをのせて作成したプラスミドを導入したグルコース-6-リン酸デヒドロゲナーゼ高発現形質転換株の作成することである。最後は遺伝子組み換え技術を用いた変異処理による高活性グルコース-6-リン酸デヒドロゲナーゼの作成および酵母細胞への導入する方法である。
【0013】
フルクトース‐1,6-ビスリン酸は解糖系の中間代謝物であり、エタノール生成の中間代謝物である。そのため、フルクトース‐1,6-ビスリン酸が蓄積することはエタノールの生成を阻害する要因となる。フルクトース‐1,6-ビスリン酸はフルクトース‐1,6-ビスリン酸アルドラーゼにより代謝される。フルクトース‐1,6-ビスリン酸の蓄積はフルクトース‐1,6-ビスリン酸アルドラーゼの活性阻害が一因であることが示唆された。より効率良くアルコール発酵を行わせるためにはメラノイジンおよび糖化液に含まれる発酵阻害物質に対する耐性能を酵母に付与することが必要である。酵母細胞への耐性能を付与する方法はUVもしくはEMSによる突然変異誘導処理による糖化液に含まれる阻害物質に対する耐性能を付与した酵母変異株の作成と遺伝子組み換え技術を用いた変異処理により阻害物質に耐性を持つフルクトース‐1,6-ビスリン酸アルドラーゼ変異タンパク質をコードした遺伝子を作製し、酵母細胞へ導入する方法の2つが挙げられる。
【0014】
また、糖化液においては糖からエタノールを生成する経路において働くピルビン酸デカルボキシラーゼ(PDC)の活性が阻害されている事が判明した。糖化液においてより効率良くアルコール発酵を行わせるためには糖化液に含まれる発酵阻害物質に対する耐性能を酵母に付与することが必要である。酵母細胞への耐性能を付与する方法は以下に示す3つの方法が挙げられる。一つ目はUVもしくはEMSによる突然変異誘導処理による糖化液に含まれる阻害物質に対する耐性能を付与した酵母変異株の作成である。二つ目としては糖化液に含まれる阻害物質により阻害されないサッカロマイセス・セレビシエに由来するPDCをのせて作成したプラスミドを導入した形質転換株の作成することである。最後は遺伝子組み換え技術を用いた変異処理による糖化液に含まれる阻害物質により阻害されないPDC変異タンパク質をコードする遺伝子の作成と酵母細胞への導入を行う方法である。
【発明の効果】
【0015】
本発明によりセルロース系バイオマスに由来する糖化液よりエタノールの効率的な製造が可能になる。
【発明を実施するための形態】
【0016】
本発明における発酵阻害物質を含む培地とはメラノイジンを含む培地およびエリアンサスを原材料として製造した糖化液を示す。
【0017】
メラノイジンはグルコースやキシロースなどの還元糖とタンパク質などのアミノ化合物が非酵素的に反応するメイラード反応により生成される最終生成物のことである。メイラード反応は100℃以上の加熱により促進される。バイオマスから糖化液を作成する場合、バイオマスの前処理工程において100℃以上の加熱を行うことがある。そのため、前処理の方法によってはメイラード反応によりメラノイジンが生成されることが予想される。
【0018】
本発明におけるメラノイジン含有培地は還元糖であるキシロースと多数のアミノ化合物を含む酵母エキスとポリペプトンを121℃、1気圧、15分の条件でオートクレーブすることにより作成したものである。そのため、メラノイジン含有培地には最終生成物であるメラノイジン以外にも様々なメイラード反応生成物が含まれていることが予想される。本発明ではメイラード反応により生成された物質を全てメラノイジンと定義する。
【0019】
リグノセルロース系バイオマスの加水分解は、従来から公知の酸加水分解法やアルカリ加水分解法用いることができる。最も好ましいのは、微粉砕されたリグノセルロースを酵素により加水分解するのが良い。粉砕は、リグノセルロース系バイオマスを適切なサイズに粉砕する工程においては、振動式ボールミルあるいはロッドミル,高衝撃力が付加できるミルを用いて100ミクロン以下、好ましくは50ミクロン以下まで微粉砕を行なう。
【0020】
加水分解は、微粉砕された木質系バイオマス原料溶液(5〜30重量%)にセルラーゼ酵素を0.1〜20重量%になるように添加して行わせる。
【0021】
セルロースとヘミセルロースは、グルコースやマンノースなどの6炭糖とキシロース、アラビノースなどの5炭糖で構成されているため、酵素剤は、これらの糖を効率良く生産することが求められる。従って、前記目的を達成するために、複数の酵素剤を用いる場合もある。
【0022】
本発明における糖化液の発酵は特許公開2009−296983明細書に記載された方法に準じて実施する。1次発酵工程はグルコースやマンノースなどの6炭糖を酵母や細菌によってエタノールに変換する。使用する菌は、公知のものを使用できるが、その中でも、サッカロマイセス・セレビシエなどが好ましい。酵母は、エタノール耐性が高いため5%以上の濃度のエタノールを生産することができる。 2次発酵は、1次発酵で得られた発酵液を使用する。本工程では、酵母によってエタノールを生産させる。使用する菌は、ピキア・スティピィティスの発酵阻害耐性能付与株を用いる。発酵阻害耐性能付与株を用いて糖化液でのアルコール発酵を行うことで、エタノールの生産性が向上する。
【実施例1】
【0023】
アンモニア処理エリアンサス糖化液からのエタノール生産
【0024】
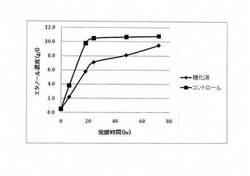
イネ科の多年草であるエリアンサスを原材料として調製された糖化液(アンモニア処理エリアンサス糖化液)におけるサッカロマイセス・セレビシエとピキア・スティピィティスを用いた二段階発酵法によるアルコール生産を行った。一次発酵として、糖化液をサッカロマイセス・セレビシエでアルコール発酵をさせ、グルコースをエタノールに変換した。得られたサッカロマイセス・セレビシエ発酵液に含まれるエタノールをロータリーエバポレーターにより蒸発させ、発酵液中に含まれるエタノールの濃度を1%(w/v)以下にした。二次発酵として、調製された発酵液をピキア・スティピィティスでアルコール発酵させ、キシロースからのアルコール生産を行った。サッカロマイセス・セレビシエによる一次発酵では合成培地(酵母エキス10g/L、ポリペプトン20g/L、グルコース50g/L)でのエタノール生産と同程度のエタノール生産を行った(図1)。しかしながら、ピキア・スティピィティスによる二次発酵では合成培地(酵母エキス10g/L、ポリペプトン20g/L、キシロース25g/L)でのエタノール生産と比較してエタノール生成速度とエタノール最終生成濃度の両方が減少した(図2)。そのため、エリアンサスを原材料とした糖化液にはピキア・スティピィティスによるC5糖の発酵を阻害する物質が含まれていることが判明した。
【実施例2】
【0025】
メラノイジン含有培地からのエタノール生産
【0026】
メラノイジン含有培地におけるピキア・スティピィティスを用いた微生物発酵法によるエタノール生産を行った。メラノイジンは還元糖とタンパク質などのアミノ化合物が非酵素的に反応するメイラード反応による生成物であり、加熱により短時間で進行する。そのため、キシロースを還元糖の供給源とし、酵母エキスとポリペプトンをアミノ化合物の供給源として加熱によりメラノイジンは生成される。酵母エキス10g/L、ポリペプトン20g/L、キシロース70g/Lを含む溶液を121℃、15分の条件でオートクレーブし、得られた反応液をメラノイジン含有培地とした。メラノイジン含有培地における発酵をピキア・スティピィティスSS39-1株で行わせたところ、エタノール生成が顕著に阻害された(図3)。この結果から、メラノイジンはピキア・スティピィティスによるキシロース発酵を阻害する効果を持つことが明らかとなった。
【実施例3】
【0027】
アンモニア処理エリアンサス糖化液からのエタノール生産時のメタボローム解析
【0028】
エリアンサスより調製した糖化液のサッカロマイセス・セレビシエ発酵液からエタノールを除去した。エタノールを除去したサッカロマイセス・セレビシエ発酵液でのピキア・スティピィティス SS39-1株によるアルコール発酵を28℃の条件で行った。発酵を開始してから24時間後に酵母細胞を回収した。回収した細胞はメタノールにより代謝をブロックした。細胞懸濁液1,600mlにクロロホルム1,600mlと水640mlを加え撹拌し、遠心分離(2,300×g, 4℃, 5分)を行った。遠心分離後、水相を限外ろ過チューブ(MILLIPORE,ウルトラフリーMC UFC3 LCC遠心式フィルターユニット5 kDa)に250ml×6本に移し取った。これを遠心分離(9,100×g, 4℃, 120分)し、限外ろ過処理を行った。ろ液を乾固させ、再び50mlのMilli-Q水に溶解してCE-TOFNSによる細胞内代謝物の網羅的な解析(メタボローム解析)に供した。CE-TOFMSによる解析はWO2007/029431号明細書に記載された方法に準じて実施した。また、対照としてろ過滅菌した合成培地(酵母エキス10g/L、ポリペプトン20g/L、キシロース70g/L)で発酵をさせた酵母細胞を用いて同様の処理を行い、CE-TOFMSによる解析に供した。
【0029】
CE-TOFMSにより生体内物質の一斉分析を実施した後、キシロースからエタノールの合成に関与するペントースリン酸経路および解糖系に由来する各代謝物含有量のデータを抽出し、対象との比較を行った。糖化液で発酵させた酵母細胞では合成培地で発酵させたものに比べてグルコース-6-リン酸、リブロース-5-リン酸、セドヘプツロース-7-リン酸、フルクトース-6-リン酸、フルクトース-1,6-ビスリン酸、ジハイドロキシアセトンリン酸、3-ホスホグリセリン、ホスホエノールピルビン酸
およびピルビン酸が多く蓄積していた(表1)。これらの代謝物の中でもグルコース-6-リン酸、フルクトース-1,6-ビスリン酸およびピルビン酸の蓄積が顕著であった。グルコース-6-リン酸、フルクトース-1,6-ビスリン酸およびピルビン酸は何れもキシロースからエタノールの合成過程の中間代謝物であり、蓄積はエタノール合成の直接的な阻害要因となる。グルコース-6-リン酸はグルコース-6-リン酸デヒドロゲナーゼにより6-ホスホグルコノ-1,5-ラクトンに変換される。フルクトース-1,6-ビスリン酸はフルクトース‐1,6-ビスリン酸アルドラーゼによりグリセルアルデヒド-3-リン酸とジヒドロキシアセトンリン酸に分解される。ピルビン酸はピルビン酸デカルボキシラーゼによりアセトアルデヒドに変換される。グルコース-6-リン酸、フルクトース-1,6-ビスリン酸およびピルビン酸は何れもキシロースからエタノールの合成過程の中間代謝物であり、蓄積はエタノール合成の直接的な阻害要因となる。糖化液におけるアルコール発酵阻害の要因は糖化液に含まれる成分によりグルコース-6-リン酸デヒドロゲナーゼ、フルクトース‐1,6-ビスリン酸アルドラーゼとピルビン酸デカルボキシラーゼの活性阻害であることが示唆された。
【0030】
【表1】

【実施例4】
【0031】
メラノイジン含有培地からのエタノール生産時のメタボローム解析
【0032】
合成培地(酵母エキス10g/L、ポリペプトン20g/L、キシロース70g/L)をオートクレーブ(121℃、15分)し、培地中にメラノイジンを生成した。調製したメラノイジン含有培地でのピキア・スティピィティスSS39-1株によるアルコール発酵を28℃の条件で行った。発酵を開始してから24時間後に酵母細胞を回収した。回収した細胞はメタノールにより代謝をブロックした。細胞懸濁液1,600mlにクロロホルム1,600mlと水640mlを加え撹拌し、遠心分離(2,300×g, 4℃, 5分)を行った。遠心分離後、水相を限外ろ過チューブ(MILLIPORE,ウルトラフリーMC UFC3 LCC遠心式フィルターユニット5 kDa)に250ml×6本に移し取った。これを遠心分離(9,100×g, 4℃, 120分)し、限外ろ過処理を行った。ろ液を乾固させ、再び50mlのMilli-Q水に溶解してCE-TOFNSによる測定に供した。CE-TOFMSによる解析はWO2007/029431号明細書に記載された方法に準じて実施した。また、対照としてろ過滅菌した合成培地(酵母エキス10g/L、ポリペプトン20g/L、キシロース70g/L)で発酵をさせた酵母細胞を用いて同様の処理を行い、CE-TOFMSによる解析に供した。
【0033】
CE-TOFMSにより生体内物質の一斉分析を実施した後、キシロースからエタノールの合成に関与するペントースリン酸経路および解糖系に由来する各代謝物含有量のデータを抽出し、対象との比較を行った糖化液で発酵させた酵母細胞では合成培地で発酵させたものに比べてグルコース-6-リン酸、リブロース-5-リン酸、セドヘプツロース-7-リン酸、フルクトース-6-リン酸、フルクトース-1,6-ビスリン酸、ジハイドロキシアセトンリン酸、3-ホスホグリセリンおよびホスホエノールピルビン酸が多く蓄積していた。これらの代謝物の中でもグルコース-6-リン酸とフルクトース-1,6-ビスリン酸の蓄積が顕著であった(表2)。グルコース-6-リン酸とフルクトース-1,6-ビスリン酸の蓄積はメラノイジンによりグルコース-6-リン酸デヒドロゲナーゼとフルクトース‐1,6-ビスリン酸アルドラーゼの活性が阻害されていることを示唆している。
【0034】
【表2】

【図面の簡単な説明】
【0035】
【図1】エリアンサス糖化液およびグルコース(50g/l)を含む発酵培地におけるサッカロマイセス・セレビシエによるエタノール生産の経時的変化
【図2】エタノールを除去したサッカロマイセス・セレビシエ発酵液およびキシロース(25g/l)を含む発酵培地におけるピキア・スティピィティスによるエタノール生産の経時的変化
【図3】メラノイジン含有発酵培地およびキシロース(70g/l)を含む発酵培地におけるピキア・スティピィティスによるエタノール生産の経時的変化
【技術分野】
【0001】
本発明は、セルロース系バイオマスから微生物発酵を用いてエタノールを製造する方法に関する。
【背景技術】
【0002】
近年、地球温暖化対策などの様々な要因から再生可能エネルギーの技術開発が求められている。セルロース系バイオマスから製造されるバイオエタノールもその再生可能エネルギーの一つである。バイオエタノールは二酸化炭素の排出削減に直結することから自動車用のガソリン燃料への添加剤もしくはガソリン自体の代替燃料として期待されている。
【0003】
セルロース系バイオマスからエタノールを製造する工程は前処理、糖化および発酵の3つに分けられる。セルロース系バイオマスはセルロース、ヘミセルロースおよびリグニンにより構成されている。セルロースとヘミセルロースは多数の糖が結合して形成された多糖であり、多糖から単糖に分解する工程が糖化である。糖化工程によりセルロースからは6炭糖であるグルコースが、ヘミセルロースからはグルコースの他に5炭糖であるキシロースが主に生成される。生成された単糖を含む溶液を糖化液とする。
【0004】
セルロースとヘミセルロースは非常に強固な構造を持っているため、糖化を効率的に行うために前処理が行われる。前処理には高温・高圧処理やアルカリ処理など様々な方法があり、この工程において様々な物質がセルロース系バイオマスから生成される。
【0005】
前処理・糖化工程により生成された糖化液を用いて微生物発酵によりエタノールを製造するのが発酵工程である。エタノールを最も効率良く生産できるとされている酵母サッカロマイセス・セレビシエは6炭糖のグルコースを資化できるが、5炭糖のキシロースを資化することができない。そのため、キシロースからエタノールを生成するにはピキア・スティピティスやキャンディダ・シェハタエなどのキシロースを資化できる酵母が必要になる。
【0006】
ピキア酵母やキャンディダ酵母による糖化液に含まれるキシロースの発酵は前処理工程で生じた物質により阻害される。この発酵阻害を改善する方法は前処理したバイオマスを洗浄することで発酵阻害物質を除去する方法やイオン交換樹脂や活性炭などを用いて発酵阻害物質を除去する方法が報告されている(特許文献1、2)。しかしながら、これらの方法はバイオマス糖化液の製造工程にバイオマスの洗浄工程や発酵阻害物質の除去工程を新たに組み込むことが必要になり、製造工程を複雑化することになる。製造工程の複雑化はエタノールの生成効率の低下と生産コストの上昇を引き起こす。
【0007】
そのため、酵母に発酵阻害物質に対する耐性能を付与することがより効率的であると考えられるが、原材料として用いるセルロース系バイオマスの種類や前処理方法により生成する発酵阻害物質は異なる。従って、使用する糖化液での発酵阻害機構を検証し、その阻害に適した耐性能を酵母に付与することが必要になる。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2005−270056号公報
【特許文献2】特開2010−536376号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明ではセルロース系バイオマスから製造された糖化液における微生物発酵の阻害機構を検証し、得られた知見から発酵阻害に対する対処方法を提示することでセルロース系バイオマスに由来する糖化液から効率的にエタノールを製造する方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者らは前記目的を達成するために鋭意研究を重ねた結果、メラノイジン含有培地およびエリアンサスを原材料とする糖化液における発酵阻害機構を解明し、その阻害機構を基に酵母への改善方法を見出した。本発明は、かかる知見に基づいて完成したものである。
【0011】
細胞内の代謝産物を網羅的に解析するメタボローム解析の結果、ピキア・スティピィティスによるメラノイジン含有培地および糖化液での発酵においてグルコース-6-リン酸およびフルクトース‐1,6-ビスリン酸の顕著な蓄積が見られた。
【0012】
ペントースリン酸経路において、グルコース-6-リン酸はグルコース-6-リン酸デヒドロゲナーゼの働きで6-ホスホグルコノ-1,5-ラクトンに変換され、その変換に付随してNADP+からNADPHが生じる。NADPHはキシロースをキシリトールに変換する働きを持つキシロース還元酵素の補酵素であり、キシロースからのアルコール生産において必須の物質である。そのため、グルコース-6-リン酸の蓄積はNADPHの供給が不足する原因となり、キシロースからのエタノール生産が阻害されることが予想された。メラノイジン含有培地および糖化液においてより効率良くアルコール発酵を行わせるためにはグルコース-6-リン酸デヒドロゲナーゼ活性を増強する必要がある。グルコース-6-リン酸デヒドロゲナーゼ活性の増強方法としては以下に示す3つの方法がある。一つ目はUVもしくはエチルメタンスルホン酸(EMS)による突然変異誘導処理によるグルコース-6-リン酸デヒドロゲナーゼ活性を増強した突然変異株の作成である。二つ目としては高発現ベクターにグルコース-6-リン酸デヒドロゲナーゼをのせて作成したプラスミドを導入したグルコース-6-リン酸デヒドロゲナーゼ高発現形質転換株の作成することである。最後は遺伝子組み換え技術を用いた変異処理による高活性グルコース-6-リン酸デヒドロゲナーゼの作成および酵母細胞への導入する方法である。
【0013】
フルクトース‐1,6-ビスリン酸は解糖系の中間代謝物であり、エタノール生成の中間代謝物である。そのため、フルクトース‐1,6-ビスリン酸が蓄積することはエタノールの生成を阻害する要因となる。フルクトース‐1,6-ビスリン酸はフルクトース‐1,6-ビスリン酸アルドラーゼにより代謝される。フルクトース‐1,6-ビスリン酸の蓄積はフルクトース‐1,6-ビスリン酸アルドラーゼの活性阻害が一因であることが示唆された。より効率良くアルコール発酵を行わせるためにはメラノイジンおよび糖化液に含まれる発酵阻害物質に対する耐性能を酵母に付与することが必要である。酵母細胞への耐性能を付与する方法はUVもしくはEMSによる突然変異誘導処理による糖化液に含まれる阻害物質に対する耐性能を付与した酵母変異株の作成と遺伝子組み換え技術を用いた変異処理により阻害物質に耐性を持つフルクトース‐1,6-ビスリン酸アルドラーゼ変異タンパク質をコードした遺伝子を作製し、酵母細胞へ導入する方法の2つが挙げられる。
【0014】
また、糖化液においては糖からエタノールを生成する経路において働くピルビン酸デカルボキシラーゼ(PDC)の活性が阻害されている事が判明した。糖化液においてより効率良くアルコール発酵を行わせるためには糖化液に含まれる発酵阻害物質に対する耐性能を酵母に付与することが必要である。酵母細胞への耐性能を付与する方法は以下に示す3つの方法が挙げられる。一つ目はUVもしくはEMSによる突然変異誘導処理による糖化液に含まれる阻害物質に対する耐性能を付与した酵母変異株の作成である。二つ目としては糖化液に含まれる阻害物質により阻害されないサッカロマイセス・セレビシエに由来するPDCをのせて作成したプラスミドを導入した形質転換株の作成することである。最後は遺伝子組み換え技術を用いた変異処理による糖化液に含まれる阻害物質により阻害されないPDC変異タンパク質をコードする遺伝子の作成と酵母細胞への導入を行う方法である。
【発明の効果】
【0015】
本発明によりセルロース系バイオマスに由来する糖化液よりエタノールの効率的な製造が可能になる。
【発明を実施するための形態】
【0016】
本発明における発酵阻害物質を含む培地とはメラノイジンを含む培地およびエリアンサスを原材料として製造した糖化液を示す。
【0017】
メラノイジンはグルコースやキシロースなどの還元糖とタンパク質などのアミノ化合物が非酵素的に反応するメイラード反応により生成される最終生成物のことである。メイラード反応は100℃以上の加熱により促進される。バイオマスから糖化液を作成する場合、バイオマスの前処理工程において100℃以上の加熱を行うことがある。そのため、前処理の方法によってはメイラード反応によりメラノイジンが生成されることが予想される。
【0018】
本発明におけるメラノイジン含有培地は還元糖であるキシロースと多数のアミノ化合物を含む酵母エキスとポリペプトンを121℃、1気圧、15分の条件でオートクレーブすることにより作成したものである。そのため、メラノイジン含有培地には最終生成物であるメラノイジン以外にも様々なメイラード反応生成物が含まれていることが予想される。本発明ではメイラード反応により生成された物質を全てメラノイジンと定義する。
【0019】
リグノセルロース系バイオマスの加水分解は、従来から公知の酸加水分解法やアルカリ加水分解法用いることができる。最も好ましいのは、微粉砕されたリグノセルロースを酵素により加水分解するのが良い。粉砕は、リグノセルロース系バイオマスを適切なサイズに粉砕する工程においては、振動式ボールミルあるいはロッドミル,高衝撃力が付加できるミルを用いて100ミクロン以下、好ましくは50ミクロン以下まで微粉砕を行なう。
【0020】
加水分解は、微粉砕された木質系バイオマス原料溶液(5〜30重量%)にセルラーゼ酵素を0.1〜20重量%になるように添加して行わせる。
【0021】
セルロースとヘミセルロースは、グルコースやマンノースなどの6炭糖とキシロース、アラビノースなどの5炭糖で構成されているため、酵素剤は、これらの糖を効率良く生産することが求められる。従って、前記目的を達成するために、複数の酵素剤を用いる場合もある。
【0022】
本発明における糖化液の発酵は特許公開2009−296983明細書に記載された方法に準じて実施する。1次発酵工程はグルコースやマンノースなどの6炭糖を酵母や細菌によってエタノールに変換する。使用する菌は、公知のものを使用できるが、その中でも、サッカロマイセス・セレビシエなどが好ましい。酵母は、エタノール耐性が高いため5%以上の濃度のエタノールを生産することができる。 2次発酵は、1次発酵で得られた発酵液を使用する。本工程では、酵母によってエタノールを生産させる。使用する菌は、ピキア・スティピィティスの発酵阻害耐性能付与株を用いる。発酵阻害耐性能付与株を用いて糖化液でのアルコール発酵を行うことで、エタノールの生産性が向上する。
【実施例1】
【0023】
アンモニア処理エリアンサス糖化液からのエタノール生産
【0024】
イネ科の多年草であるエリアンサスを原材料として調製された糖化液(アンモニア処理エリアンサス糖化液)におけるサッカロマイセス・セレビシエとピキア・スティピィティスを用いた二段階発酵法によるアルコール生産を行った。一次発酵として、糖化液をサッカロマイセス・セレビシエでアルコール発酵をさせ、グルコースをエタノールに変換した。得られたサッカロマイセス・セレビシエ発酵液に含まれるエタノールをロータリーエバポレーターにより蒸発させ、発酵液中に含まれるエタノールの濃度を1%(w/v)以下にした。二次発酵として、調製された発酵液をピキア・スティピィティスでアルコール発酵させ、キシロースからのアルコール生産を行った。サッカロマイセス・セレビシエによる一次発酵では合成培地(酵母エキス10g/L、ポリペプトン20g/L、グルコース50g/L)でのエタノール生産と同程度のエタノール生産を行った(図1)。しかしながら、ピキア・スティピィティスによる二次発酵では合成培地(酵母エキス10g/L、ポリペプトン20g/L、キシロース25g/L)でのエタノール生産と比較してエタノール生成速度とエタノール最終生成濃度の両方が減少した(図2)。そのため、エリアンサスを原材料とした糖化液にはピキア・スティピィティスによるC5糖の発酵を阻害する物質が含まれていることが判明した。
【実施例2】
【0025】
メラノイジン含有培地からのエタノール生産
【0026】
メラノイジン含有培地におけるピキア・スティピィティスを用いた微生物発酵法によるエタノール生産を行った。メラノイジンは還元糖とタンパク質などのアミノ化合物が非酵素的に反応するメイラード反応による生成物であり、加熱により短時間で進行する。そのため、キシロースを還元糖の供給源とし、酵母エキスとポリペプトンをアミノ化合物の供給源として加熱によりメラノイジンは生成される。酵母エキス10g/L、ポリペプトン20g/L、キシロース70g/Lを含む溶液を121℃、15分の条件でオートクレーブし、得られた反応液をメラノイジン含有培地とした。メラノイジン含有培地における発酵をピキア・スティピィティスSS39-1株で行わせたところ、エタノール生成が顕著に阻害された(図3)。この結果から、メラノイジンはピキア・スティピィティスによるキシロース発酵を阻害する効果を持つことが明らかとなった。
【実施例3】
【0027】
アンモニア処理エリアンサス糖化液からのエタノール生産時のメタボローム解析
【0028】
エリアンサスより調製した糖化液のサッカロマイセス・セレビシエ発酵液からエタノールを除去した。エタノールを除去したサッカロマイセス・セレビシエ発酵液でのピキア・スティピィティス SS39-1株によるアルコール発酵を28℃の条件で行った。発酵を開始してから24時間後に酵母細胞を回収した。回収した細胞はメタノールにより代謝をブロックした。細胞懸濁液1,600mlにクロロホルム1,600mlと水640mlを加え撹拌し、遠心分離(2,300×g, 4℃, 5分)を行った。遠心分離後、水相を限外ろ過チューブ(MILLIPORE,ウルトラフリーMC UFC3 LCC遠心式フィルターユニット5 kDa)に250ml×6本に移し取った。これを遠心分離(9,100×g, 4℃, 120分)し、限外ろ過処理を行った。ろ液を乾固させ、再び50mlのMilli-Q水に溶解してCE-TOFNSによる細胞内代謝物の網羅的な解析(メタボローム解析)に供した。CE-TOFMSによる解析はWO2007/029431号明細書に記載された方法に準じて実施した。また、対照としてろ過滅菌した合成培地(酵母エキス10g/L、ポリペプトン20g/L、キシロース70g/L)で発酵をさせた酵母細胞を用いて同様の処理を行い、CE-TOFMSによる解析に供した。
【0029】
CE-TOFMSにより生体内物質の一斉分析を実施した後、キシロースからエタノールの合成に関与するペントースリン酸経路および解糖系に由来する各代謝物含有量のデータを抽出し、対象との比較を行った。糖化液で発酵させた酵母細胞では合成培地で発酵させたものに比べてグルコース-6-リン酸、リブロース-5-リン酸、セドヘプツロース-7-リン酸、フルクトース-6-リン酸、フルクトース-1,6-ビスリン酸、ジハイドロキシアセトンリン酸、3-ホスホグリセリン、ホスホエノールピルビン酸
およびピルビン酸が多く蓄積していた(表1)。これらの代謝物の中でもグルコース-6-リン酸、フルクトース-1,6-ビスリン酸およびピルビン酸の蓄積が顕著であった。グルコース-6-リン酸、フルクトース-1,6-ビスリン酸およびピルビン酸は何れもキシロースからエタノールの合成過程の中間代謝物であり、蓄積はエタノール合成の直接的な阻害要因となる。グルコース-6-リン酸はグルコース-6-リン酸デヒドロゲナーゼにより6-ホスホグルコノ-1,5-ラクトンに変換される。フルクトース-1,6-ビスリン酸はフルクトース‐1,6-ビスリン酸アルドラーゼによりグリセルアルデヒド-3-リン酸とジヒドロキシアセトンリン酸に分解される。ピルビン酸はピルビン酸デカルボキシラーゼによりアセトアルデヒドに変換される。グルコース-6-リン酸、フルクトース-1,6-ビスリン酸およびピルビン酸は何れもキシロースからエタノールの合成過程の中間代謝物であり、蓄積はエタノール合成の直接的な阻害要因となる。糖化液におけるアルコール発酵阻害の要因は糖化液に含まれる成分によりグルコース-6-リン酸デヒドロゲナーゼ、フルクトース‐1,6-ビスリン酸アルドラーゼとピルビン酸デカルボキシラーゼの活性阻害であることが示唆された。
【0030】
【表1】

【実施例4】
【0031】
メラノイジン含有培地からのエタノール生産時のメタボローム解析
【0032】
合成培地(酵母エキス10g/L、ポリペプトン20g/L、キシロース70g/L)をオートクレーブ(121℃、15分)し、培地中にメラノイジンを生成した。調製したメラノイジン含有培地でのピキア・スティピィティスSS39-1株によるアルコール発酵を28℃の条件で行った。発酵を開始してから24時間後に酵母細胞を回収した。回収した細胞はメタノールにより代謝をブロックした。細胞懸濁液1,600mlにクロロホルム1,600mlと水640mlを加え撹拌し、遠心分離(2,300×g, 4℃, 5分)を行った。遠心分離後、水相を限外ろ過チューブ(MILLIPORE,ウルトラフリーMC UFC3 LCC遠心式フィルターユニット5 kDa)に250ml×6本に移し取った。これを遠心分離(9,100×g, 4℃, 120分)し、限外ろ過処理を行った。ろ液を乾固させ、再び50mlのMilli-Q水に溶解してCE-TOFNSによる測定に供した。CE-TOFMSによる解析はWO2007/029431号明細書に記載された方法に準じて実施した。また、対照としてろ過滅菌した合成培地(酵母エキス10g/L、ポリペプトン20g/L、キシロース70g/L)で発酵をさせた酵母細胞を用いて同様の処理を行い、CE-TOFMSによる解析に供した。
【0033】
CE-TOFMSにより生体内物質の一斉分析を実施した後、キシロースからエタノールの合成に関与するペントースリン酸経路および解糖系に由来する各代謝物含有量のデータを抽出し、対象との比較を行った糖化液で発酵させた酵母細胞では合成培地で発酵させたものに比べてグルコース-6-リン酸、リブロース-5-リン酸、セドヘプツロース-7-リン酸、フルクトース-6-リン酸、フルクトース-1,6-ビスリン酸、ジハイドロキシアセトンリン酸、3-ホスホグリセリンおよびホスホエノールピルビン酸が多く蓄積していた。これらの代謝物の中でもグルコース-6-リン酸とフルクトース-1,6-ビスリン酸の蓄積が顕著であった(表2)。グルコース-6-リン酸とフルクトース-1,6-ビスリン酸の蓄積はメラノイジンによりグルコース-6-リン酸デヒドロゲナーゼとフルクトース‐1,6-ビスリン酸アルドラーゼの活性が阻害されていることを示唆している。
【0034】
【表2】

【図面の簡単な説明】
【0035】
【図1】エリアンサス糖化液およびグルコース(50g/l)を含む発酵培地におけるサッカロマイセス・セレビシエによるエタノール生産の経時的変化
【図2】エタノールを除去したサッカロマイセス・セレビシエ発酵液およびキシロース(25g/l)を含む発酵培地におけるピキア・スティピィティスによるエタノール生産の経時的変化
【図3】メラノイジン含有発酵培地およびキシロース(70g/l)を含む発酵培地におけるピキア・スティピィティスによるエタノール生産の経時的変化
【特許請求の範囲】
【請求項1】
キシロースを含む培地から酵母を用いてエタノールを製造する方法
【請求項2】
培地が発酵阻害物質を含んでいる、請求項1に記載の方法
【請求項3】
培地がセルロース系バイオマスを原材料とする糖化液である、請求項1に記載の方法
【請求項4】
糖化液が発酵阻害物質を含んでいる、請求項3に記載の方法
【請求項5】
キシロースからエタノールを生産できる酵母を用いてエタノール生産を行う、請求項1に記載の方法。
【請求項6】
セルロース系バイオマスを原材料とする糖化液に含まれる発酵阻害物質によるグルコース‐6-リン酸デヒドロゲナーゼ、フルクトース‐1,6‐ビスリン酸アルドラーゼおよびピルビン酸デカルボキシラーゼの活性阻害に対する耐性能を酵母に付与する方法。
【請求項7】
請求項6に記載の方法により作製した酵母変異株を用いてエタノール生産を行う、請求項1の方法。
【請求項1】
キシロースを含む培地から酵母を用いてエタノールを製造する方法
【請求項2】
培地が発酵阻害物質を含んでいる、請求項1に記載の方法
【請求項3】
培地がセルロース系バイオマスを原材料とする糖化液である、請求項1に記載の方法
【請求項4】
糖化液が発酵阻害物質を含んでいる、請求項3に記載の方法
【請求項5】
キシロースからエタノールを生産できる酵母を用いてエタノール生産を行う、請求項1に記載の方法。
【請求項6】
セルロース系バイオマスを原材料とする糖化液に含まれる発酵阻害物質によるグルコース‐6-リン酸デヒドロゲナーゼ、フルクトース‐1,6‐ビスリン酸アルドラーゼおよびピルビン酸デカルボキシラーゼの活性阻害に対する耐性能を酵母に付与する方法。
【請求項7】
請求項6に記載の方法により作製した酵母変異株を用いてエタノール生産を行う、請求項1の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−170395(P2012−170395A)
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願番号】特願2011−35283(P2011−35283)
【出願日】平成23年2月22日(2011.2.22)
【出願人】(591108178)秋田県 (126)
【Fターム(参考)】
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願日】平成23年2月22日(2011.2.22)
【出願人】(591108178)秋田県 (126)
【Fターム(参考)】
[ Back to top ]

