セレンの定量分析方法
【課題】セレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの定量分析方法において、有機物によるセレン化水素ガス生成の阻害の抑制と、ヨウ化物イオンによる信号出力の妨害の抑制と、6価セレンの4価への還元とを公定法に準じた方法よりも簡易迅速に行ってセレンの定量分析を行う。
【解決手段】水溶性セレンを含む分析用試料を酸性化処理して酸性分析用試料とし、この酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定するセレンの定量分析方法において、分析用試料に対する前処理として、分析用試料に過マンガン酸カリウムを添加して加熱する処理と、分析用試料に塩酸を添加して加熱する処理とを行い、セレン測定における妨害を抑制し、水溶性セレンを含む試料の前処理を簡易迅速化した。
【解決手段】水溶性セレンを含む分析用試料を酸性化処理して酸性分析用試料とし、この酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定するセレンの定量分析方法において、分析用試料に対する前処理として、分析用試料に過マンガン酸カリウムを添加して加熱する処理と、分析用試料に塩酸を添加して加熱する処理とを行い、セレン測定における妨害を抑制し、水溶性セレンを含む試料の前処理を簡易迅速化した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、セレンの定量分析方法に関する。さらに詳述すると、本発明は、水中に溶存しているセレンの濃度の現場分析に好適な定量分析方法に関する。
【背景技術】
【0002】
電気事業では石炭中の微量のセレンに起因して石炭火力発電所の排煙脱硫排水にセレンが検出されることがある。排水中のセレンは4価の亜セレン酸(SeO32−)および6価のセレン酸(SeO42−)の陰イオンとして存在する。
【0003】
排水中セレンの除去には、一般的には鉄を用いた共沈法が用いられる(非特許文献1)。しかしながら、排水中のセレン濃度に対して過剰の鉄を使用するため非常に高いコストを費やし、大量の汚泥が発生することが問題となっている。ここで、排水中のセレン濃度は使用する炭種等によって変動するため、過剰の鉄を使用することなく効率よくセレンを処理するためには、その濃度を継続して監視する必要がある。そのため、排水中のセレンを適切に管理するツールとして、セレン濃度を連続で監視できる簡易な自動測定機(プロセスモニター)が求められている。
【0004】
本願発明者は、先に出願した特許文献1において、排水等の分析用試料に含まれる4価セレンを水素化し、生成したセレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの簡易な定量分析方法を提案した。具体的には、4価セレンを含む分析用試料を酸性化処理して酸性分析用試料とし、この酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定することにより、排水等の分析用試料に含まれる4価セレンを定量的に分析するものである。本願発明者は、この方法の脱硫排水への適用性を評価した結果、排水中の有機物がセレン化水素ガス生成を阻害し、ヨウ化物イオンが信号出力を妨害することがわかった。そこで、分析用試料をJIS法(JIS−K0102.67.3.、非特許文献2参照)に準じた公定法により前処理することで、有機物によるセレン化水素ガス生成の阻害を抑制できるだけでなく、ヨウ化物イオンによる信号出力の妨害を抑制できることも見出した。また、この方法で前処理を行うことによって、分析用試料を酸性化することができ、酸性化処理を省略できることも見出した。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2009−8668号公報
【非特許文献】
【0006】
【非特許文献1】惠藤 良弘、中原 敏次:「現場で役立つ無機排水処理技術」、工業調査会、(2005).
【非特許文献2】日本工業標準調査会、工業排水試験方法、JIS K 0102.67.3、(2008).
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、上記の公定法に準じた前処理法は、分析用試料に硫酸及び硝酸を添加し、加熱して硫酸白煙を発生させる手法であることから、その操作が極めて煩雑であると共に、処理に要する時間も4〜5時間と長時間である。プロセスモニターへの適用を考えた場合、より簡易迅速に前処理を行うことのできる方法の確立が望まれる。
【0008】
そこで、本発明は、セレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの定量分析方法において、有機物によるセレン化水素ガス生成の阻害の抑制と、ヨウ化物イオンによる信号出力の妨害の抑制とを公定法に準じた方法よりも簡易迅速に行ってセレンの定量分析を行うことのできる方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
本願発明者は、上記の公定法に準じた前処理方法に替わる方法について種々検討を行った結果、過マンガン酸カリウム(KMnO4)を分析用試料に添加して加熱することによって、分析用試料に含まれる有機物を簡易迅速に分解処理できることを見出した。ところが、この処理を行うと、分析用試料に含まれる4価セレンが6価セレンに酸化されてしまうこともわかった。
【0010】
ここで、定電位電解式センサにてセレン化水素を測定するためには、セレンが4価の形態で排水中に存在している必要がある。したがって、分析用試料に含まれる4価セレンが6価セレンに酸化された状態のままでは、定電位電解式センサによるセレン化水素の測定ができない。そこで、本願発明者はさらに検討を重ね、分析用試料に塩酸を添加して加熱することで、簡易且つ迅速に分析用試料の6価セレンを4価セレンに還元処理できることを見出した。しかも、この還元処理法によって、過マンガン酸カリウム(KMnO4)を分析用試料に添加して加熱する処理によって発生した6価セレンだけでなく、分析用試料に元々含まれていた6価セレンも還元することができ、分析用試料に含まれる4価セレンと6価セレンの全量を定量分析できることを見出した。つまり、4価セレンのみを含む試料のみならず、4価セレンと6価セレンの両方を含む試料を分析の対象とでき、水溶性の形態で存在するセレン(4価及び6価)の全量を分析できることを見出した。
【0011】
そして、本願発明者は、過マンガン酸カリウム(KMnO4)を分析用試料に添加して加熱する処理と、分析用試料に塩酸を添加して加熱する処理とを行った後に、定電位電解式センサにてヨウ化物イオンを含む分析用試料の分析を実施したところ、定電位電解式センサにてセレンの定量分析を行う際に妨害成分となるはずのヨウ化物イオンの影響を意外にも抑制できることを知見し、本願発明を完成するに至った。
【0012】
即ち、本発明のセレンの定量分析方法は、水溶性セレンを含む分析用試料を酸性化処理して酸性分析用試料とし、この酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定するセレンの定量分析方法において、分析用試料に対する前処理として、分析用試料に過マンガン酸カリウムを添加して加熱する処理と、分析用試料に塩酸を添加し加熱して6価セレンを4価セレンへ還元する処理とを行い、酸性化処理を省略するようにしている。
【発明の効果】
【0013】
本発明によれば、セレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの定量分析方法において、有機物によるセレン化水素ガス生成の阻害の抑制と、ヨウ化物イオンによる信号出力の妨害の抑制とを公定法に準じた方法よりも簡易迅速に行ってセレンの定量分析を行うことが可能となる。また、公定法に準じた方法と比較して、非常に簡易に実施できることから、作業毎の分析ばらつきが出にくく、分析精度も高いものとできる。しかも、分析用試料に塩酸を添加して加熱する処理を行うことにより、分析用試料に含まれる6価セレンを4価セレンに還元するようにしているので、分析用試料に元々含まれている4価セレンと6価セレンの全量を測定することが可能となる。つまり、試料に4価セレンと6価セレンが含まれているときはその全量を測定できるし、試料に4価セレンのみが含まれているときには4価セレンの全量を測定できるし、試料に6価セレンのみが含まれているときには6価セレンの全量を測定できる。また、分析用試料に塩酸を添加して加熱することにより還元処理を行うようにしていることから、分析用試料の酸性化処理を省略することが可能である。
【図面の簡単な説明】
【0014】
【図1】本発明において使用されるシステムの一例を示す図である。
【図2】定電位電解方式でセレン化水素を測定する原理を示す図である。
【図3】定電位電解方式でセレン化水素を測定した際のヨウ化物イオンによる影響を示す図である。
【図4】有機物の分解処理に有効な酸化剤を検討した結果を示す図である。
【図5】有機物の分解処理における過マンガン酸カリウムの添加量の効果を示す図である。
【図6】有機物の分解処理における温度の影響を示す図である。
【図7】6価セレンの還元に対するHCl水溶液の濃度の効果を示す図である。
【図8】6価セレンの還元に対するHCl水溶液の濃度、添加量及び反応温度を示す図である。
【図9】ヨウ化物イオンが添加された標準液に対する本発明の前処理の効果を示す図である。
【図10】本発明の前処理法と公定法の手順を比較する図である。
【発明を実施するための形態】
【0015】
以下、本発明を実施するための形態について、図面に基づいて詳細に説明する。
【0016】
本発明は、特開2009−8668号公報に記載されたセレンの定量分析方法を改良したものである。以下、特開2009−8668号公報に記載されたセレンの定量分析方法の概略を簡単に説明する。
【0017】
特開2009−8668号公報に記載されたセレンの定量分析方法は、水溶性セレンである4価セレンが溶存している分析用試料に塩酸及び硫酸の少なくともいずれか一方を添加して酸性分析用試料を得る工程と、酸性分析用試料に対してテトラヒドロホウ酸ナトリウムを添加し、4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させる工程と、セレン化水素を吸引する工程と、吸引されたセレン化水素を定電位電解式センサで測定して測定値を得る工程と、この測定値に基づいて分析用試料の4価セレン濃度を検量線法により分析する工程とを含み、検量線法に用いる検量線は4価セレン濃度が既知の複数の標準試料から予め求めた4価セレン濃度と定電位電解式センサの測定値との相関に基づいて作成されたものとしている。
【0018】
ここで、セレン化水素を定電位電解式センサで測定する際に、分析用試料に有機物が含まれているとセレン化水素の生成が阻害されてしまう。また、分析用試料にヨウ化物イオンが含まれているとセレン化水素の測定が妨害されてしまう。そこで、特開2009−8668号公報に記載されたセレンの定量分析方法では、酸として硫酸と硝酸を添加し、これを加熱して硫酸白煙を生じさせるJIS法(JIS−K0102.67.3.)に準じた公定法による前処理によって、セレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの定量分析方法における有機物によるセレン化水素ガス生成の阻害を抑制すると共に、ヨウ化物イオンによる信号出力の妨害を抑制するようにしている。
【0019】
しかしながら、公定法に準じた前処理法は、有機物を分解するための硝酸を十分に揮発させなければ、測定時にセレン化水素の生成を阻害してしまう。これを確認するために硫酸白煙を生じさせるものであることから、その操作が極めて煩雑であると共に、作業者への危険性も高いものとなる。また、処理に4〜5時間を要する。したがって、プロセスモニターへの適用は極めて困難である。
【0020】
そこで、本発明では、分析用試料に対する前処理として、分析用試料に過マンガン酸カリウムを添加して加熱する処理と、分析用試料に塩酸を添加して加熱する処理とを行うようにしている。また、分析用試料に塩酸を添加して加熱する処理により、分析用試料を酸性にすることができるので、酸性化処理を省略するようにしている。
【0021】
分析用試料に過マンガン酸カリウムを添加して加熱する処理によって、分析用試料に含まれる有機物を分解することができる。したがって、セレン化水素の生成の阻害要因が排除できる。
【0022】
分析用試料に対する過マンガン酸カリウムの添加量は、分析用試料に含まれる有機物をセレン測定に影響を及ぼさない程度に分解処理できる量であれば特に限定されるものではなく、過剰に添加しても定電位電解式センサによるセレン化水素の測定に影響を与えることはない。具体的には、試料に対し、過マンガン酸カリウムを0.01g/L〜0.24g/Lとなるように添加するのが好適であり、0.06g/L〜0.24g/Lとするのがより好適であり、0.24g/Lとするのがさらに好適である。より具体的には、例えば分析用試料25mLに対し、3重量%の過マンガン酸カリウム水溶液を50〜200μL添加するのが好適であり、100〜200μL添加するのがより好適であり、200μLとするのがさらに好適である。
【0023】
加熱温度については、100℃以上とすることが好適である。加熱温度が低すぎると、過マンガン酸カリウムによる反応が十分に進行せず、有機物の分解が十分に起こらない場合がある。
【0024】
ここで、分析用試料に過マンガン酸カリウムを添加して加熱する処理は、フロー方式で実施することが好適である。これにより、試料の加熱効率が高くなることで測定の再現性が高くなるだけでなく、セレン濃度を連続で監視できる簡易な自動測定機(プロセスモニター)に適用し易くなる。
【0025】
具体的には、細管を用意し、細管内での分析用試料の流量と細管の長さを調整し、細管を加熱することによって、分析用試料が細管を通過する間に、有機物を分解し、ヨウ化物イオンによる妨害を抑制することができる。より具体的には、例えば、6.0m(内径1.0mm)のPTFE製キャピラリーを用い、加熱温度を100℃とし、分析用試料5mLに3重量%の過マンガン酸カリウム水溶液を40μL添加し、流量0.5mL/分とすることで、10分間で反応を完了させることができる。このように、過マンガン酸カリウムはいったん水に溶解させてから分析用試料に添加することで、分析用試料への拡散性が高まるので、フロー方式に用いる際に好適である。ここで、加熱温度を高めすぎると、フロー方式のように細管内に分析用試料を流通させて加熱する場合には、分析用試料が激しく沸騰して析出した固形物等が細管を閉塞する虞があったり、細管内に気泡が生じやすくなって分析用試料の流量制御が難しくなる。したがって、加熱温度は100〜120℃とすることがより好適であり、100℃とすることがさらに好適である。
【0026】
次に、分析用試料に塩酸を添加して加熱する処理を行う。この処理は、分析用試料に過マンガン酸カリウムを添加して加熱する処理によって酸化されて6価セレンとなった分析用試料に元々含まれていた4価セレンを、4価セレンに戻すと共に、分析用試料に元々含まれていた6価セレンを4価セレンに還元するものである。この処理により、分析用試料に元々含まれていた4価セレンと6価セレンが全て4価セレンに変換され、この4価セレンからセレン化水素が生成されて、セレンの定量分析に供される。分析用試料に6価セレンのみが含まれている場合であっても、4価セレンに還元することによって、セレン化水素を生成させて、セレンの定量分析に供することができる。つまり、分析用試料に4価セレンと6価セレンが含まれているときはその全量を分析に供することができ、分析用試料に4価セレンのみが含まれているときには4価セレンの全量を分析に供することができ、分析用試料に6価セレンのみが含まれているときには6価セレンの全量を測定できる。換言すれば、分析用試料に溶解している水溶性セレンの全量を分析に供することができる。したがって、本発明によれば、分析用試料として、4価セレンと6価セレンが含まれる試料、4価セレンのみが含まれる試料、6価セレンのみが含まれる試料を対象とすることができる。
【0027】
分析用試料に対する塩酸の添加量は、分析用試料に含まれる6価セレンの全量を確実に4価セレンに還元できる量であればよいが、分析用試料の酸の規定値が6.7N/Lを超えると、定量分析終了後の酸性分析用試料に4価セレンが未反応のまま残留し易くなるので、分析用試料の酸の規定値が6.7N/L以下となるように塩酸を添加することが好ましい。具体的には、試料に対し、塩酸を4mol/L〜6.7mol/Lとなるように添加するのが好適であり、6.7mol/Lとするのがさらに好適である。より具体的には、例えば分析用試料5mLに対して10〜12mol/Lの塩酸水溶液を5mL以上添加することが好適であり、10mol/Lの塩酸水溶液を10mL添加することが好適である。
【0028】
加熱温度については、100〜120℃の範囲内では、6価セレンの還元に影響を及ぼすことはない。したがって、分析用試料に過マンガン酸カリウムを添加して加熱する処理の際の加熱温度に合わせることで、分析用試料に過マンガン酸カリウムを添加して加熱する処理と、分析用試料に塩酸を添加して加熱する処理とを連続的に行い易くなる。
【0029】
ここで、分析用試料に塩酸を添加して加熱する処理もまた、フロー方式で実施することが好適である。これにより、セレン濃度を連続で監視できる簡易な自動測定機(プロセスモニター)に適用し易くなる。
【0030】
具体的には、上記と同様、細管を用意し、細管内での分析用試料の流量と細管の長さを調整し、細管を加熱することによって、分析用試料が細管を通過する間に、6価セレンの4価セレンへの還元処理を行うことができる。より具体的には、例えば、6.0m(内径1.0mm)のPTFE製キャピラリーを用い、加熱温度を100℃とし、分析用試料5mLに10mol/Lの塩酸水溶液を40μL添加し、流量0.5mL/分とすることで、10分間で反応を完了させることができる。このように、塩酸を水で希釈してから分析用試料に添加することで、分析用試料への拡散性が高まるので、フロー方式に用いる際に好適である。しかも、分析用試料に過マンガン酸カリウムを添加して加熱する処理と同じ加熱温度で処理することができるので、分析用試料をいったん冷却させたりする手間を省くことができる。
【0031】
また、分析用試料に塩酸を添加して加熱する処理を行うことによって、分析用試料の酸の規定値を4N/L〜6.7N/Lにすることができる。したがって、特開2009−8668号公報に記載されたセレンの定量分析方法における分析用試料の酸性化処理を省略することができる。
【0032】
以上、分析用試料に過マンガン酸カリウムを添加して加熱する処理によって、分析用試料に含まれる有機物を分解することができる。また、分析用試料に塩酸を添加して加熱する処理によって、分析用試料に過マンガン酸カリウムを添加して加熱する処理により酸化されて6価セレンの形態となっている分析用試料中の4価セレン、さらには分析用試料に元々含まれていた6価セレンを還元して4価セレンとすることができる。ヨウ化物イオンが定電位電解式センサによるセレン化水素の測定を妨害するのを排除する作用は、分析用試料に過マンガン酸カリウムを添加して加熱する処理により奏されるものと考えられる。したがって、定電位電解式センサによるセレン化水素の測定において分析精度を低下させる要因を排除しつつ、分析用試料に含まれる4価セレンと6価セレンを合わせた総セレン濃度を分析することが可能となる。
【0033】
上記処理により得られた酸性分析用試料中のセレンの定量分析方法は、特開2009−8668号公報に記載されたセレンの定量分析方法と同様の方法で実施することができる。以下、酸性分析用試料中のセレンの定量分析方法について簡単に説明する。
【0034】
上記処理により得られた酸性分析用試料には、テトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定する。
【0035】
テトラヒドロホウ酸ナトリウムの添加速度は、酸性分析用試1Lに対して5〜10g/分以下とすることが好ましい。この場合には、単位時間当たりの水素の発生を抑えながら分析用試料に溶存している4価セレン(亜セレン酸イオン)をセレン化水素に還元することができる。つまり、定電位電解式センサ4によるセレン化水素の測定を妨害することのない水素発生量に抑えることができる。テトラヒドロホウ酸ナトリウムを酸性分析用試料1Lに対して10g/分を超える速度で添加すると、セレン化水素の測定に影響を及ぼす量の水素が発生する虞がある。また、テトラヒドロホウ酸ナトリウムの添加速度の下限値については、定電位電解式センサにより測定されるセレン化水素の単位時間当たりの測定値(定電位電解式センサが出力する信号強度を意味する。以下、測定値を信号強度と呼ぶこともある。)が十分に確保され、定量分析の迅速性が確保される値が適宜選択される。例えば、酸性分析用試料1Lに対して5g/分以上とすることが好ましく、6g/分とすることがより好ましい。テトラヒドロホウ酸ナトリウムの添加について、一例を挙げて具体的に説明すると、濃度が3g/Lのテトラヒドロホウ酸ナトリウム溶液であれば、酸性分析用試料15mLに対して25〜50mL/分とするのが好ましく、30mL/分とすることがより好ましい。この場合には、単位時間当たりの水素の発生が抑えられ、セレン化水素の測定が妨害されない。しかも、セレン化水素の信号強度の十分な確保と定量分析の迅速性が確保される。
【0036】
ここで、テトラヒドロホウ酸ナトリウムは吸湿性が強く、空気中の水分を吸収して徐々に劣化する。したがって、テトラヒドロホウ酸ナトリウムはこれを安定に保持しうる溶媒中に溶解させて用いる。テトラヒドロホウ酸ナトリウムを溶解する溶媒としては、弱アルカリ性の溶媒を用いることが好ましい。酸性の溶媒を用いるとテトラヒドロホウ酸ナトリウムが劣化してしまう虞がある。中性の溶媒を用いた場合にも、テトラヒドロホウ酸ナトリウムが徐々に劣化してしまう虞がある。強アルカリ性の溶媒を用いた場合には、酸性分析用試料2aに添加した際にpHがアルカリ側に変動し易くなり、テトラヒドロホウ酸ナトリウムの還元剤として機能が低下し、分析用試料に溶存している亜セレン酸イオンを十分に還元できなくなる虞がある。即ち、テトラヒドロホウ酸ナトリウムを劣化させることなく、また、酸性分析用試料に添加した際にpHをアルカリ側に変動させてテトラヒドロホウ酸ナトリウムの還元剤としての機能を低下させることのない溶媒を用いればよい。例えば、0.1mol/Lの水酸化ナトリウム溶液が挙げられるが、これに限定されるものではない。
【0037】
尚、テトラヒドロホウ酸ナトリウムは還元剤として広く用いられている化合物であり、安価で入手し易い。また、エチレンジアミン四酢酸を加えることによって、0.1mol/Lの水酸化ナトリウム溶液に溶解させて30日間安定に保存することができる(A. D. Idowu, P. K. Dasgupta, Z. Genfa, and K. Toda: “A Gas-Phase Chemiluminescence -Based Analyzer for Waterborne Arsenic”, Anal. Chem., 78, 7088-7097 (2006))。つまり、使用の簡便性と安定性とを兼ね備えた試薬であり、現場分析に用いる試薬として非常に好適である。
【0038】
テトラヒドロホウ酸ナトリウム溶液の添加は、例えば、分液漏斗やビュレットのように、コック(バルブ)の開度の調節によって添加速度を制御可能なものを用いることもできるし、バルブが開状態の時にのみ一定の速度で添加可能なものを用いることもできる。また、ペリスタルティックポンプのような制御性の高いものを用いることで、より正確な定量分析が可能となる。
【0039】
尚、テトラヒドロホウ酸ナトリウムの添加速度は、テトラヒドロホウ酸ナトリウムを溶解させた溶液のテトラヒドロホウ酸ナトリウム濃度並びに酸性分析用試料に対する添加速度により適宜制御される。つまり、テトラヒドロホウ酸ナトリウム溶液の濃度を高めて酸性分析用試料に添加すれば、酸性分析用試料1Lに対するテトラヒドロホウ酸ナトリウムの添加速度を高めることができる。また、酸性分析用試料に対するテトラヒドロホウ酸ナトリウム溶液の添加速度を高めれば、酸性分析用試料1Lに対するテトラヒドロホウ酸ナトリウムの添加速度を高めることができる。逆に、テトラヒドロホウ酸ナトリウム溶液の濃度を低くして酸性分析用試料に添加すれば、酸性分析用試料1Lに対するテトラヒドロホウ酸ナトリウムの添加速度を低下させることができる。また、酸性分析用試料に対するテトラヒドロホウ酸ナトリウム溶液の添加速度を低下させれば、酸性分析用試料1Lに対するテトラヒドロホウ酸ナトリウムの添加速度を低下させることができる。したがって、テトラヒドロホウ酸ナトリウム溶液の濃度並びに酸性分析用試料に対する添加速度を適宜制御することによって、テトラヒドロホウ酸ナトリウムの添加速度を制御すればよい。
【0040】
酸性分析用試料へのテトラヒドロホウ酸ナトリウムの添加量については、分析用試料に存在していると考えられる4価セレンの全量をセレン化水素に還元しうる量以上の量が適宜選択される。1molのH2SeO3(SeO32−)を還元させてセレン化水素を発生させるためには、3/4molのNaBH4(BH4−)が必要である。したがって、4価セレン1mgに対して最低でも0.38mgのNaBH4が必要である。ここで、分析用試料に存在している4価セレンの全量を確実にセレン化水素に還元するためには、分析用試料に含まれていると考えられる4価セレンの全量に対して過剰量のテトラヒドロホウ酸ナトリウムの量を添加することが好ましい。即ち、分析用試料の4価セレン濃度が1mg/L以下であると仮定した場合には、分析用試料1Lに対して0.38mg〜6.7gのテトラヒドロホウ酸ナトリウムを添加することが好ましく、3.8mg〜3.4gとすることがより好ましく、38mg〜2.0gとすることがさらに好ましい。6.7gを超える量のテトラヒドロホウ酸ナトリウムを添加しても、セレン化水素の測定に影響を及ぼすことは無いが、セレン化水素発生反応には関与しないので、無駄である。
【0041】
また、酸性分析用試料へのテトラヒドロホウ酸ナトリウムの添加開始時から定電位電解式センサによる測定が終了するまでの間は、酸性分析用試料を撹拌し続けることが好ましい。撹拌を十分に行わないと、酸性分析用試料に添加したテトラヒドロホウ酸ナトリウムが十分に拡散せずに酸性分析用試料と不均一に反応しやすくなり、定電位電解式センサによるセレン化水素の信号強度が低下する虞がある。
【0042】
酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加することにより発生したセレン化水素は定電位電解式センサにより吸引されて随時測定され、測定値が出力される。
【0043】
ここで、発生したセレン化水素には、キャリアーガスを供給し、キャリアーガスと共に定電位電解式センサにより吸引することが好適である。キャリアーガスとしては、窒素やアルゴンなどの不活性ガスだけでなく、空気を利用することもできる。このように、空気をキャリアーガスとして利用することで、現場分析の際に容器2に大気中から空気を送り込むことによってキャリアーガスの供給が可能となるので、非常に便利である。
【0044】
キャリアーガスの供給速度は、500〜700mL/分以上とすることが好ましい。この場合には、セレンの定量分析の上限値を高めることができる。ここで、キャリアーガスの供給速度の上限値については、定電位電解式センサのガス吸引能力を大きく超えない値とすることが好ましい。定電位電解式センサのガス吸引能力を大きく超えると、定電位電解式センサのガス吸引機能に負担がかかり、測定ができなくなる虞がある。したがって、キャリアーガスの供給速度は、500〜700mL/分とすることが好ましく、定電位電解式センサ4のガス吸引能力とほぼ同等の供給速度とすることがさらに好ましい。例えば、定電位電解式センサ4のガス吸引能力が500mL/分であれば、キャリアーガスの供給速度は500mL/分に近づけることが好ましい。尚、キャリアーガスの供給速度は、マスフローコントローラーや、ポンプ等により制御することができる。
【0045】
定電位電解式センサは漏洩ガス検知器として市販されている半導体材料ガス検知器である新コスモス電機製PS−7(セレン化水素専用センサユニットCDS−7)が挙げられるが、これに限定されるものではなく、これと機能的に類似するものを用いることができる。
【0046】
ここで、新コスモス電機製PS−7は、ガス吸引機能を有しており、これを利用して容器2内で発生したセレン化水素を吸引する。尚、新コスモス電機製PS−7のガス吸引能力は500mL/分であり、上記分析条件は、この吸引速度に基づいて導出されたものであるが、上記分析条件は、定電位電解式センサのガス吸引速度が400〜600mL/分であっても適用できるものと考えられる。
【0047】
このように、キャリアーガスを使用することによって、セレンの定量分析の精度を高めることができる。また、キャリアーガスを使用しない場合と比較して、非常に低濃度のセレンの定量分析を行うことも可能となる。
【0048】
さらに、新コスモス電機製PS−7は、データ取得がデジタル方式で行われ、データ取得が0.1秒間隔で行われ、フルスケールに対する分解能が0.4%である。このように、アナログ方式で、且つデータ取得間隔や分解能を向上させることによって、セレンの定量分析精度を向上させることができる。
【0049】
定電位電解式センサにより測定された測定値に基づいて、分析用試料の4価セレン濃度を検量線法により分析することができる。
【0050】
検量線法に用いる検量線は、4価セレン濃度が既知の複数の標準試料から予め求めた4価セレン濃度と定電位電解式センサの測定値(セレン化水素の信号強度)との相関に基づいて作成されたものである。さらに具体的に説明すると、4価セレン濃度が既知の複数の標準試料それぞれに対し、テトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定することにより得られた測定値(セレン化水素の信号強度)と4価セレン濃度との関係から、最小二乗法などの公知の手法によりフィッティングして得ることが可能である。
【0051】
そして、検量線法により得られた分析用試料の4価セレン濃度は、分析用試料に含まれる4価セレンと6価セレンの全量を反映する値となる。つまり、本発明により、分析用試料に含まれる総セレン濃度を分析することができる。
【0052】
上述の形態は本発明の好適な形態の一例ではあるがこれに限定されるものではなく本発明の要旨を逸脱しない範囲において種々変形実施可能である。
【実施例】
【0053】
以下に本発明の実施例を説明するが、本発明はこれら実施例に限られるものではない。
【0054】
<1.本実施例において使用した試料>
本実施例では、分析用試料として、石炭火力発電所から排出される4種の排煙脱硫排水A〜Dを入手して使用した。表1に排水A〜Dの化学組成を示す。尚、化学組成は、ICP発光分析装置(ICP−AES、セイコーインスツルメンツ製 SPS5000)及びイオンクロマトグラフィー(IC、ダイオネックス製 DX−320)により測定した。
【0055】
【表1】

【0056】
表1に示されるように、排水Aのセレン濃度は0.11mg/Lであり、排水Bのセレン濃度は0.003mg/Lであり、排水Cのセレン濃度は0.037mg/Lであり、排水Dのセレン濃度は0.031mg/Lであった。排水Bのセレン濃度が低かったことから、以降の実験ではセレン標準液を加えてセレン濃度を0.1mg/Lとした。
【0057】
<2.ヨウ化物イオンの影響の確認>
定電位電解式センサを利用してセレン化水素の測定を行う際に、ヨウ化物イオンが測定結果に与える影響について確認実験を行った。
【0058】
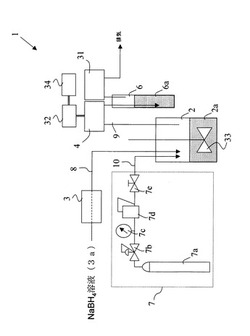
図1に示すセレンの定量分析システムを用いて実験を行った。このシステムは、特開2009−8668に開示されているシステムと同一の構成を有するものである。具体的に説明すると、密閉構造の反応槽(容器)2に酸性分析用試料2aを導入し、還元剤であるテトラヒドロホウ酸ナトリウム水溶液を管体8を介して反応槽2に送液し、攪拌機33で混合してセレン化水素ガスを生成させた。所定濃度のテトラヒドロホウ酸ナトリウム水溶液3aの反応槽2への流量はペリスタルティックポンプ3で制御した。反応槽2で生成したセレン化水素はキャリアーガスである純空気で定電位電解式センサ4に導入した。キャリアーガスはキャリアーガス供給手段7により管体10を介して供給した。キャリアーガス供給手段7は、純空気ボンベ7aと、圧力調整器7bと、圧力計7cと、マスフローコントローラー7dと、ストップバルブ7eにより構成し、マスフローコントローラー7dにより流量を制御した。定電位電解式センサ4として、セレン化水素ガス検知器(新コスモス電機製PS−7)を用い、セレン化水素専用センサユニットであるCDS−7を併用した。この定電位電解式センサは、ガス吸引量が500mL/分であり、反応槽2内で発生したセレン化水素が管体9を介して定電位電解式センサ4により吸引した。また、この定電位電解式センサのセレン化水素の測定範囲は1〜275ppbであり、指示精度はフルスケールに対して10%以内である。測定データはA/Dコンバータ32を介してパーソナルコンピュータ34に収録した。A/Dコンバータ32は、最小データ取得周期が10Hzで、最小分解能がフルスケールに対して0.4%のものを用いた。測定データの解析にはSmart Chrom(ケーワイテクノロジーズ製)を用いた。セレン化水素ガスは毒性が非常に高いので、測定後のセレン化水素ガスを除害槽6に流通させて除害した。セレン化水素の除害には硫酸銅水溶液6aを用いた。除害槽通過後のガスを除害確認用検知器31で測定し、セレン化水素の有無を確認した。除害確認用検知器31には、セレン化水素ガス検知器(新コスモス電機製PS−7)を用いた。
【0059】
ここで、定電位電解方式のセレン化水素ガス検知器の原理を図2に示す。セレン化水素はガス透過性膜を通じて電解液中に拡散吸収される。電解液中に拡散吸収されたセレン化水素は、電解液中で一定の電位で電解されると電流が発生する。定電位電解方式のセレン化水素ガス検知器は、このときの電流を増幅器14で増幅させて測定するものである。電解時には、作用電極11において酸化反応が起こり(化学反応式A)、対極13では還元反応が進行する(化学反応式B)。作用電極11と対極13に流れる電流はセレン化水素濃度に比例する。照合電極12は照合電極用基準電源12aと接続され、照合電極に対する作用電極の電位を規制して電解を行う。
(化学反応式A)作用電極:H2Se+3H2O→H2SeO3+6H++6e−
(化学反応式B)対極:O2+4H++4e−→2H2O
【0060】
0.1mg/Lの4価セレン標準液に対し、ヨウ化物イオンを0.1〜10mg/Lの範囲で標準添加した試料について、セレン化水素の測定を実施した。実験条件は以下の通りとした。即ち、試料に6.0mol/Lの塩酸水溶液10mLを添加して酸性分析用試料2aとし、これにテトラヒドロホウ酸ナトリウム水溶液10mLを流量30mL/分で送液し、セレン化水素ガスを生成させた。生成したセレン化水素ガスは、流量500mL/分のキャリアーガス(純空気)と共に定電位電解式センサ4に導入した。
【0061】
測定結果を図3に示す。試料にヨウ化物イオンを添加すると、信号値が負の値を示した。また、ヨウ化物イオンの濃度を高くする程、負の信号値を示す時間が長くなった。したがって、ヨウ化物イオンは、定電位電解式センサを利用したセレン化水素測定における妨害成分となることが確認された。
【0062】
ここで、別途実験を行い、脱硫排水に塩酸を添加し20分間撹拌した後に試料中のヨウ化物イオンを測定したところ、排水のヨウ化物イオン濃度が低下したことから、脱硫排水中のヨウ化物イオンが塩酸と反応して生成された物質が気化し、これが定電位電解式センサ4によるセレン化水素の測定に負の信号値を与えたものと考えられた。
【0063】
<3.排水に含まれる有機物の分解処理の検討>
定電位電解式センサを利用したセレン化水素測定においては、ヨウ化物イオンのみならず、有機物もまた妨害成分となる。公定法(日本工業標準調査会、工業排水試験方法、JIS K 0102.67.3、(2008).)である硫酸と硝酸を用いた加熱酸分解処理法を用いることで、これらの妨害成分は除去できるが、この公定法は処理に4〜5時間と極めて長い時間を必要とし、処理方法も煩雑で危険を伴う。そこで、排水に含まれる有機物を簡易且つ迅速に分解できる処理方法の検討を行った。
【0064】
有機物の簡易迅速な分解処理法として、KMnO4 、Ce(SO4)2 、NaClOの3種類の酸化剤を用いた方法を検討した。KMnO4については、さらに、硫酸を加えて酸性にした場合と、水酸化ナトリウムを加えてアルカリ性とした場合についても検討した。分解処理は、分析用試料25mLに対して、酸化剤をそれぞれ添加し、120℃のオイルバスで10分間加熱することにより行った。酸化剤は、以下の(1)〜(5)に示すように調整してから分析用試料に添加した。
【0065】
(1)KMnO4
過マンガン酸カリウム(KMnO4)水溶液はKMnO4を蒸留水で3重量%に調製し、ろ過した。この水溶液を所定量添加した。
【0066】
(2)KMnO4+H2SO4
3重量%KMnO4水溶液を50μL、硫酸を3.0mL添加した。尚、この方法は、日本工業標準調査会、工業排水試験方法、JIS K 0102.17・19(2008)に該当するものである。
【0067】
(3)KMnO4+NaOH
3重量%KMnO4水溶液を50μL、100g/L水酸化ナトリウムを0.5mL添加した。尚、この方法は、日本工業標準調査会、工業排水試験方法、JIS K 0102.17・19(2008)に該当するものである。
【0068】
(4)Ce(SO4)2
硫酸セリウム(IV)四水和物(Ce(SO4)2・4H2O)と硫酸セリウム(III)・n水和物(Ce2(SO4)3・nH2O)を6容積%硫酸でそれぞれ3.0mmol/L、6.0mmol/Lに調製した。Ce2(SO4)3は、セリウム(IV)を安定させる目的で添加した。尚、この方法は、以下の文献に記載された方法である(T. Korenaga, X. Zhou, K. Okada, and T. Moriwake, S. Shinoda: “Determination of chemical oxygen demand by a flow-injection method using cerium(IV) sulphate as oxidizing agent”, Anal. Chim. Acta, 272(2), 237-244, (1993). )。
【0069】
(5)NaClO
次亜塩素酸ナトリウム(NaClO)水溶液はNaClO、リン酸緩衝液(pH6.5、NaH2PO4、Na2HPO4)を蒸留水でそれぞれ20mg/L、0.4mol/Lに調製した。尚、この方法は、以下の文献に記載された方法である(鈴木 教太、中山 太一、中村 秀明:「次亜塩素酸を使用した化学的酸素要求量(COD)測定法の開発」日本分析化学会第57年会講演要旨集、J3003、(2008).)。
【0070】
4価セレン標準液(0.1mg/L)、排水A及びBについて、有機物分解処理を行った。また、有機物分解処理を行うと、4価セレンが6価セレンに酸化されることから、これを還元して4価セレンに戻すため、塩酸とKBrによる還元処理を行った後、水素化合物発生ICP−AESにより4価セレン濃度を測定した。そして、各試料の4価セレン濃度に基づいて、(1)〜(5)の有機物分解処理法によるセレン回収率を求めた。
【0071】
結果を図4に示す。KMnO4、KMnO4+H2SO4を用いた有機物分解処理法の場合、標準液、排水A及びBともにセレン回収率が100%となり、有機物分解処理に関しては公定法と遜色のない良好な結果が得られることがわかった。
【0072】
KMnO4+NaOH、Ce(SO4)2を用いた有機物分解処理法の場合、標準液、排水A及びBのいずれにおいてもセレンの回収率が低かった。
【0073】
NaClOを用いた有機物分解処理法の場合、標準液のセレン回収率は100%であったが、排水A及びBではセレン回収率が低かった。
【0074】
ここで、各酸化剤の標準電極電位(E0)を比較してみると、Ce4+が一番高く(1.7V)、次いでMnO4−(1.5V)、ClO−(1.2V)となる。酸化力が弱いNaClOは排水中の有機成分が十分に酸化されないため、有機物が存在しない標準試料ではセレン回収率が高く、排水試料ではセレン回収率が低くなったと考えられた。一方、Ce(SO4)2のように酸化力が強すぎると6価セレンが4価へ還元されにくくなり、標準試料、排水試料ともに低いセレン回収率を示したと考えられた。
【0075】
次に、(1)〜(5)の有機物分解処理法により有機物を分解した後のセレンの形態を確認するため、6価セレンの還元する処理を行わずに水素化合物発生ICP−AESにより4価セレンのみを測定した。
【0076】
その結果、(1)〜(5)の全ての有機物分解処理法において、4価セレンは検出されなかった。このことから、(1)〜(5)の有機物分解処理法により、試料に含まれる4価セレンは6価セレンに酸化されることがわかった。したがって、セレン化水素を生成するためには、有機物分解処理を行った後に必ず6価セレンを4価セレンに還元するための処理を行う必要があることがわかった。尚、6価セレンを4価セレンに還元するための処理を行えば、必然的に元々試料中に含まれる6価セレンをも4価セレンに還元することができることから、還元処理を行うことで、排水試料中の全セレン濃度が測定できることがわかった。
【0077】
以上の結果から、KMnO4またはKMnO4+H2SO4を酸化剤として用い、有機物分解後に6価セレンを還元することで、排水中の全セレン濃度が測定可能であることがわかった。そこで、用いる試薬数及び操作の簡便性に鑑み、KMnO4のみで簡易有機物分解を行うこととした。
【0078】
<4.KMnO4を酸化剤とした有機物分解処理条件の検討>
KMnO4を酸化剤とした有機物分解処理について、KMnO4の添加量と処理温度を検討した。
【0079】
まず、KMnO4の添加量について検討した。4価セレン標準液(0.1mg/L)、排水A及びBに対して、3重量%KMnO4水溶液をそれぞれ0〜200μL添加して有機物分解処理を行った。試料はそれぞれ25mLとし、120℃のオイルバスで10分間加熱した。そして、塩酸とKBrによる還元処理を行った後、水素化合物発生ICP−AESにより4価セレン濃度を測定した。そして、各試料の4価セレン濃度に基づいて、セレン回収率を求めた。
【0080】
結果を図5に示す。標準液、排水A及びBのいずれにおいても、KMnO4水溶液添加量50〜200μLでセレン回収率がほぼ100%となった。KMnO4水溶液10μLでは、排水Bにおいて回収率が80%前後となった。この理由は、排水Bでは比較的有機物量が多く、KMnO4水溶液10μLでは、有機物の全量を分解するに至らなかったためと考えられた。尚、KMnO4水溶液添加量を増加させても回収率が低下しないことから、有機成分量が多い排水にも対応できるように、高濃度のKMnO4水溶液を多めに添加することが好適であることがわかった。以降の実験では、試料25mLに対して、3重量%KMnO4水溶液の添加量を200μL(試料1.0mLに対して8.0μL)とすることとした。
【0081】
次に、処理温度について検討した。尚、この実験では、プロセスモニターにおける前処理の自動化を想定し、フロー方式の加熱反応器を用いた簡易有機物分解処理について検討した。加熱反応器は長さ6.0m(内径1.0mm)のPTFE製キャピラリーを用い。細管内を流れる試料の流量と加熱温度を精密に制御できるものとした。
【0082】
この加熱反応器を用いて、試料5.0mLに3重量%KMnO4水溶液を40μL添加し、流量0.5mL/分(反応時間10分)、加熱温度60〜140℃で有機物分解処理を行った。試料は、4価セレン標準液(0.1mg/L)、排水A及びBとした。有機物分解処理後には、塩酸とKBrによる還元処理を行い、水素化合物発生ICP−AESにより4価セレン濃度を測定した。そして、各試料の4価セレン濃度に基づいて、セレン回収率を求めた。
【0083】
結果を図6に示す。標準液、排水A及びBのいずれにおいても、加熱温度100〜120℃でセレン回収率が100%前後となり、60〜80℃においてはセレン回収率が80%前後となった。この理由は、60〜80℃では加熱温度が低く、KMnO4による反応が十分に進行しなかったためと考えられた。また、140℃において誤差が極めて大きいのは、試料が激しく沸騰し、析出した固形物が加熱反応器中のキャピラリー内で詰まったことが原因であった。
【0084】
以上より、処理温度は100〜120℃が好適であると判断された。但し、温度を高めるにつれて、キャピラリー内に気泡が生じやすくなって、流量が安定しなくなる可能性があることから、以降の実験では100℃で有機物分解処理を行うこととした。
【0085】
<5.6価セレンの簡易還元法の検討>
KMnO4を酸化剤とした有機物分解処理方法により排水中の有機物を分解すると、排水中の4価セレンが酸化されて6価セレンとなる。セレン化水素を生成させて、定電位電解式センサでセレンの定量分析を行う場合、セレンは4価の状態で存在していることが必要である。そこで、有機物分解処理を行った後に、排水中の6価セレンを4価セレンに簡易に還元することのできる処理法について検討した。
【0086】
6価セレンの還元法については、HClで簡易に還元する方法が以下の文献1〜4において報告されている(文献1:J. Pettersson and A. Olin: “The rate of reduction of selenium (VI) to selenium (IV) in hydrochloric acid”, Talanta, 38(4), 413-417, (1991).、文献2:K. Pyrzynska: “Speciation of selenium compounds”, Anal. Sci., 14, 479-483, (1998).、文献3:A. A. Ensafi and M. S. Lemraski: “Highly sensitive spectrophotometric reaction rate method for the determination of selenium based on the catalytic reduction of sulfonazo by sulfide”, Anal. Let., 37(12), 2469-2483, (2004).、文献4:E. M. R. Rodriguez, M. S. Alaejos, and C. D. Romero: “Fluorimetric determination of selenium in biological samples”, Anal. Let., 32(9), 1699-1721, (1999).)。これらの報告では、3.0〜10mol/L HClを添加し、80〜120℃で数十分加熱することで6価セレンを4価に還元可能であると報告されている。本実験においてもこの方法を適用し、簡易有機物分解処理後の試料について、HCl濃度、添加量及び処理温度について検討を行った。
【0087】
まず、HCl濃度について検討した。6価セレン標準液(0.1mg/L)、排水A及びBに対し、KMnO4を酸化剤とした上記の有機物分解処理方法を行った試料25mLに、所定濃度(0〜12mol/L)のHCl水溶液を15mL添加し、120℃のオイルバスで還元処理し、セレン回収率を求めた。
【0088】
結果を図7に示す。標準液、排水A及びBにおいて、HCl濃度0〜6mol/Lではセレン回収率が低く、10mol/Lから回収率が上昇し始めて、12mol/Lで90〜100%の回収率が得られた。従来報告されている還元法では、6.0mol/L前後の濃度で高いセレン回収率が得られているが、本発明のように、KMnO4を酸化剤とした上記の有機物分解処理方法を実施した後に6価セレンの還元を行う場合には、6価セレンの還元に必要なHCl量も多くなると考えられた。
【0089】
次に、この実験結果に基づき、HCl濃度6.0〜12mol/Lで6価セレンを還元させるのに必要なHCl水溶液の添加量と処理温度条件とを検討した。
【0090】
結果を図8に示す。試料5.0mLに対して10〜12mol/LのHCl水溶液を5.0mL以上添加し、100〜120℃で還元することで、セレン回収率がほぼ100%となった。また、HCl濃度6.0mol/Lでは、HCl水溶液の添加量を増やすとセレン回収率も増加するが、10mL添加しても回収率は70%程度に留まった。処理温度が100〜120℃の場合には、大きな差はみられず、HCl水溶液の添加量が6価セレンの還元に大きな影響を与えることがわかった。
【0091】
以上より、6価セレンの還元条件は、試料5.0mLに対して10〜12mol/LのHCl水溶液を5.0mL以上添加し、反応温度は100〜120℃とすることが好適であると判断された。以降の実験では、試料5.0mLに対して10mol/LのHCl水溶液を10mL添加し、反応温度100℃で6価セレンを還元処理することとした。
【0092】
<6.ヨウ化物イオンの影響の除外についての検討>
定電位電解式センサでのセレン化水素の測定の際のヨウ化物イオンによる妨害の問題について、上記の実験から明らかとなった有機物分解処理法の好適な条件と、6価セレン還元のための好適な条件とを用いて分析用試料を前処理することによって、分析用試料に含まれるヨウ化物イオンに対し、何らかの影響が及ぼされるのかを検討した。
【0093】
4価セレン標準液(0.1mg/L)5mLにヨウ化物イオンを0〜500mg/Lの範囲で混合し、有機物分解処理と6価セレンの還元処理とを行った後、定電位電解式センサを用いたセレン化水素の測定を実施した。
【0094】
有機物分解処理は、3重量%KMnO4水溶液を試料に40μL添加し、100℃で10分間加熱することにより行った。
【0095】
6価セレンの還元処理は、10mol/LのHCl水溶液10mLを試料に添加し、100℃で10分間加熱することにより行った。
【0096】
定電位電解式センサを用いたセレン化水素の測定は、3g/Lのテトラヒドロホウ酸ナトリウム水溶液を30mL/分の流速で10mL添加して行った。
【0097】
結果を表2及び図9に示す。表2及び図9から明らかなように、ヨウ化物イオンの多寡によらず、いずれの試料においてもほぼ同等の信号強度をもつピークが得られることが明らかとなった。このことから、意外にも、本発明の前処理を実施することによって、ヨウ化物イオンの影響までも完全に排除してセレン化水素の測定ができることが明らかとなった。また、ヨウ化物イオンが塩酸と反応して定電位電解式センサ4での信号値を負の値にしたことを勘案すると、過マンガン酸カリウムを分析用試料に添加して加熱する処理が、ヨウ化物イオンによる測定の妨害の排除に対して有効に作用しているものと考えられた。
【0098】
【表2】

【0099】
<6.本発明の前処理方法と公定法との比較>
上記実験において検討した前処理法(有機物分解処理法及び6価セレン還元処理法)について、公定法との比較評価を行った。上記実験において検討した前処理法と公定法の手順の比較を図10に示す。公定法との比較には、分析法の正確さを確認する方法として用いられる添加回収試験法により評価した。添加回収試験法は、試料及び既知濃度の標準液を添加した試料を分析し、両者の差を添加した標準液の濃度と比較することで回収率を求めて評価する方法である(Pierce Biotechnology:“Spike-and-recovery and linearity-of-dilution assessment”, TECH TIP #58, (2007).)。
【0100】
排水A〜Dに4価セレン標準液が0.1mg/Lとなるように添加し、公定法及び本発明の前処理を行い、ICP分析を行った。結果を表3に示す。尚、公定法の有機物分解処理は以下の操作手順で行った。試料30mLに(1+1)硫酸1.0mLと硝酸2.0mLを添加し、ホットプレート上(170℃)で硫酸白煙が発生するまで4〜5時間、加熱した。
【0101】
【表3】

【0102】
排水A〜Dのいずれにおいても、公定法及び本発明の前処理法ともに84〜105%の高い回収率が得られたがRSD(相対標準偏差)には差がみられた。即ち、公定法の回収率のRSDは11〜24%であったのに比較して、本発明の前処理法では2.1〜4.3%と低かった。この結果は、公定法の方が実験誤差が生じやすいことを示しており、以下のように考えることができる。即ち、通常、試料中に添加した硝酸の揮発を確認する目的で硫酸白煙の目測が行われるが、硫酸白煙が発生しても十分に加熱されない場合もあり、このような場合には試料中に硝酸が残存して、セレンの水素化効率が低下し、安定した測定値が得られないことがある(Pierce Biotechnology:“Spike-and-recovery and linearity-of-dilution assessment”, TECH TIP #58, (2007).)。また、硫酸白煙発生後、長時間加熱すると、試料中のセレンが揮発する場合があり、測定値に誤差が生じることがある。さらに、公定法は硝酸と硫酸の揮発温度の中間付近(約170℃)の加熱温度で行われるが、同一の加熱器を用いて気圧や室温等が同一の条件で処理を行わないと誤差が大きくなる傾向がある(玉利 祐三:「水素化物生成原子吸光法による生物試料中のセレンの分析−試料溶解法による影響−」、Biomed. Res. Trace. Elements, 10(2), 125-133, (1999).)。
【0103】
これに対し、本発明の前処理方では、処理操作をフロー方式で行うことで実験条件を均一なものとできるため、安定したセレン測定値が得られたものと考えられる。つまり、試料を細管内に流すことで比表面積(表面積/体積)が増加して熱容量が減少し、温度制御が容易になる。また、一連の前処理操作をフロー方式で行うことにより、試料の採取、前処理、定量の自動化が期待できる。
【0104】
以上より、本発明の前処理法は、簡易迅速に行うことができ、しかも、測定値に誤差が生じにくく、公定法よりも優れた処理法であることが明らかとなった。
【技術分野】
【0001】
本発明は、セレンの定量分析方法に関する。さらに詳述すると、本発明は、水中に溶存しているセレンの濃度の現場分析に好適な定量分析方法に関する。
【背景技術】
【0002】
電気事業では石炭中の微量のセレンに起因して石炭火力発電所の排煙脱硫排水にセレンが検出されることがある。排水中のセレンは4価の亜セレン酸(SeO32−)および6価のセレン酸(SeO42−)の陰イオンとして存在する。
【0003】
排水中セレンの除去には、一般的には鉄を用いた共沈法が用いられる(非特許文献1)。しかしながら、排水中のセレン濃度に対して過剰の鉄を使用するため非常に高いコストを費やし、大量の汚泥が発生することが問題となっている。ここで、排水中のセレン濃度は使用する炭種等によって変動するため、過剰の鉄を使用することなく効率よくセレンを処理するためには、その濃度を継続して監視する必要がある。そのため、排水中のセレンを適切に管理するツールとして、セレン濃度を連続で監視できる簡易な自動測定機(プロセスモニター)が求められている。
【0004】
本願発明者は、先に出願した特許文献1において、排水等の分析用試料に含まれる4価セレンを水素化し、生成したセレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの簡易な定量分析方法を提案した。具体的には、4価セレンを含む分析用試料を酸性化処理して酸性分析用試料とし、この酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定することにより、排水等の分析用試料に含まれる4価セレンを定量的に分析するものである。本願発明者は、この方法の脱硫排水への適用性を評価した結果、排水中の有機物がセレン化水素ガス生成を阻害し、ヨウ化物イオンが信号出力を妨害することがわかった。そこで、分析用試料をJIS法(JIS−K0102.67.3.、非特許文献2参照)に準じた公定法により前処理することで、有機物によるセレン化水素ガス生成の阻害を抑制できるだけでなく、ヨウ化物イオンによる信号出力の妨害を抑制できることも見出した。また、この方法で前処理を行うことによって、分析用試料を酸性化することができ、酸性化処理を省略できることも見出した。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2009−8668号公報
【非特許文献】
【0006】
【非特許文献1】惠藤 良弘、中原 敏次:「現場で役立つ無機排水処理技術」、工業調査会、(2005).
【非特許文献2】日本工業標準調査会、工業排水試験方法、JIS K 0102.67.3、(2008).
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、上記の公定法に準じた前処理法は、分析用試料に硫酸及び硝酸を添加し、加熱して硫酸白煙を発生させる手法であることから、その操作が極めて煩雑であると共に、処理に要する時間も4〜5時間と長時間である。プロセスモニターへの適用を考えた場合、より簡易迅速に前処理を行うことのできる方法の確立が望まれる。
【0008】
そこで、本発明は、セレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの定量分析方法において、有機物によるセレン化水素ガス生成の阻害の抑制と、ヨウ化物イオンによる信号出力の妨害の抑制とを公定法に準じた方法よりも簡易迅速に行ってセレンの定量分析を行うことのできる方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
本願発明者は、上記の公定法に準じた前処理方法に替わる方法について種々検討を行った結果、過マンガン酸カリウム(KMnO4)を分析用試料に添加して加熱することによって、分析用試料に含まれる有機物を簡易迅速に分解処理できることを見出した。ところが、この処理を行うと、分析用試料に含まれる4価セレンが6価セレンに酸化されてしまうこともわかった。
【0010】
ここで、定電位電解式センサにてセレン化水素を測定するためには、セレンが4価の形態で排水中に存在している必要がある。したがって、分析用試料に含まれる4価セレンが6価セレンに酸化された状態のままでは、定電位電解式センサによるセレン化水素の測定ができない。そこで、本願発明者はさらに検討を重ね、分析用試料に塩酸を添加して加熱することで、簡易且つ迅速に分析用試料の6価セレンを4価セレンに還元処理できることを見出した。しかも、この還元処理法によって、過マンガン酸カリウム(KMnO4)を分析用試料に添加して加熱する処理によって発生した6価セレンだけでなく、分析用試料に元々含まれていた6価セレンも還元することができ、分析用試料に含まれる4価セレンと6価セレンの全量を定量分析できることを見出した。つまり、4価セレンのみを含む試料のみならず、4価セレンと6価セレンの両方を含む試料を分析の対象とでき、水溶性の形態で存在するセレン(4価及び6価)の全量を分析できることを見出した。
【0011】
そして、本願発明者は、過マンガン酸カリウム(KMnO4)を分析用試料に添加して加熱する処理と、分析用試料に塩酸を添加して加熱する処理とを行った後に、定電位電解式センサにてヨウ化物イオンを含む分析用試料の分析を実施したところ、定電位電解式センサにてセレンの定量分析を行う際に妨害成分となるはずのヨウ化物イオンの影響を意外にも抑制できることを知見し、本願発明を完成するに至った。
【0012】
即ち、本発明のセレンの定量分析方法は、水溶性セレンを含む分析用試料を酸性化処理して酸性分析用試料とし、この酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定するセレンの定量分析方法において、分析用試料に対する前処理として、分析用試料に過マンガン酸カリウムを添加して加熱する処理と、分析用試料に塩酸を添加し加熱して6価セレンを4価セレンへ還元する処理とを行い、酸性化処理を省略するようにしている。
【発明の効果】
【0013】
本発明によれば、セレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの定量分析方法において、有機物によるセレン化水素ガス生成の阻害の抑制と、ヨウ化物イオンによる信号出力の妨害の抑制とを公定法に準じた方法よりも簡易迅速に行ってセレンの定量分析を行うことが可能となる。また、公定法に準じた方法と比較して、非常に簡易に実施できることから、作業毎の分析ばらつきが出にくく、分析精度も高いものとできる。しかも、分析用試料に塩酸を添加して加熱する処理を行うことにより、分析用試料に含まれる6価セレンを4価セレンに還元するようにしているので、分析用試料に元々含まれている4価セレンと6価セレンの全量を測定することが可能となる。つまり、試料に4価セレンと6価セレンが含まれているときはその全量を測定できるし、試料に4価セレンのみが含まれているときには4価セレンの全量を測定できるし、試料に6価セレンのみが含まれているときには6価セレンの全量を測定できる。また、分析用試料に塩酸を添加して加熱することにより還元処理を行うようにしていることから、分析用試料の酸性化処理を省略することが可能である。
【図面の簡単な説明】
【0014】
【図1】本発明において使用されるシステムの一例を示す図である。
【図2】定電位電解方式でセレン化水素を測定する原理を示す図である。
【図3】定電位電解方式でセレン化水素を測定した際のヨウ化物イオンによる影響を示す図である。
【図4】有機物の分解処理に有効な酸化剤を検討した結果を示す図である。
【図5】有機物の分解処理における過マンガン酸カリウムの添加量の効果を示す図である。
【図6】有機物の分解処理における温度の影響を示す図である。
【図7】6価セレンの還元に対するHCl水溶液の濃度の効果を示す図である。
【図8】6価セレンの還元に対するHCl水溶液の濃度、添加量及び反応温度を示す図である。
【図9】ヨウ化物イオンが添加された標準液に対する本発明の前処理の効果を示す図である。
【図10】本発明の前処理法と公定法の手順を比較する図である。
【発明を実施するための形態】
【0015】
以下、本発明を実施するための形態について、図面に基づいて詳細に説明する。
【0016】
本発明は、特開2009−8668号公報に記載されたセレンの定量分析方法を改良したものである。以下、特開2009−8668号公報に記載されたセレンの定量分析方法の概略を簡単に説明する。
【0017】
特開2009−8668号公報に記載されたセレンの定量分析方法は、水溶性セレンである4価セレンが溶存している分析用試料に塩酸及び硫酸の少なくともいずれか一方を添加して酸性分析用試料を得る工程と、酸性分析用試料に対してテトラヒドロホウ酸ナトリウムを添加し、4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させる工程と、セレン化水素を吸引する工程と、吸引されたセレン化水素を定電位電解式センサで測定して測定値を得る工程と、この測定値に基づいて分析用試料の4価セレン濃度を検量線法により分析する工程とを含み、検量線法に用いる検量線は4価セレン濃度が既知の複数の標準試料から予め求めた4価セレン濃度と定電位電解式センサの測定値との相関に基づいて作成されたものとしている。
【0018】
ここで、セレン化水素を定電位電解式センサで測定する際に、分析用試料に有機物が含まれているとセレン化水素の生成が阻害されてしまう。また、分析用試料にヨウ化物イオンが含まれているとセレン化水素の測定が妨害されてしまう。そこで、特開2009−8668号公報に記載されたセレンの定量分析方法では、酸として硫酸と硝酸を添加し、これを加熱して硫酸白煙を生じさせるJIS法(JIS−K0102.67.3.)に準じた公定法による前処理によって、セレン化水素(H2Se)ガスを定電位電解式センサで測定するセレンの定量分析方法における有機物によるセレン化水素ガス生成の阻害を抑制すると共に、ヨウ化物イオンによる信号出力の妨害を抑制するようにしている。
【0019】
しかしながら、公定法に準じた前処理法は、有機物を分解するための硝酸を十分に揮発させなければ、測定時にセレン化水素の生成を阻害してしまう。これを確認するために硫酸白煙を生じさせるものであることから、その操作が極めて煩雑であると共に、作業者への危険性も高いものとなる。また、処理に4〜5時間を要する。したがって、プロセスモニターへの適用は極めて困難である。
【0020】
そこで、本発明では、分析用試料に対する前処理として、分析用試料に過マンガン酸カリウムを添加して加熱する処理と、分析用試料に塩酸を添加して加熱する処理とを行うようにしている。また、分析用試料に塩酸を添加して加熱する処理により、分析用試料を酸性にすることができるので、酸性化処理を省略するようにしている。
【0021】
分析用試料に過マンガン酸カリウムを添加して加熱する処理によって、分析用試料に含まれる有機物を分解することができる。したがって、セレン化水素の生成の阻害要因が排除できる。
【0022】
分析用試料に対する過マンガン酸カリウムの添加量は、分析用試料に含まれる有機物をセレン測定に影響を及ぼさない程度に分解処理できる量であれば特に限定されるものではなく、過剰に添加しても定電位電解式センサによるセレン化水素の測定に影響を与えることはない。具体的には、試料に対し、過マンガン酸カリウムを0.01g/L〜0.24g/Lとなるように添加するのが好適であり、0.06g/L〜0.24g/Lとするのがより好適であり、0.24g/Lとするのがさらに好適である。より具体的には、例えば分析用試料25mLに対し、3重量%の過マンガン酸カリウム水溶液を50〜200μL添加するのが好適であり、100〜200μL添加するのがより好適であり、200μLとするのがさらに好適である。
【0023】
加熱温度については、100℃以上とすることが好適である。加熱温度が低すぎると、過マンガン酸カリウムによる反応が十分に進行せず、有機物の分解が十分に起こらない場合がある。
【0024】
ここで、分析用試料に過マンガン酸カリウムを添加して加熱する処理は、フロー方式で実施することが好適である。これにより、試料の加熱効率が高くなることで測定の再現性が高くなるだけでなく、セレン濃度を連続で監視できる簡易な自動測定機(プロセスモニター)に適用し易くなる。
【0025】
具体的には、細管を用意し、細管内での分析用試料の流量と細管の長さを調整し、細管を加熱することによって、分析用試料が細管を通過する間に、有機物を分解し、ヨウ化物イオンによる妨害を抑制することができる。より具体的には、例えば、6.0m(内径1.0mm)のPTFE製キャピラリーを用い、加熱温度を100℃とし、分析用試料5mLに3重量%の過マンガン酸カリウム水溶液を40μL添加し、流量0.5mL/分とすることで、10分間で反応を完了させることができる。このように、過マンガン酸カリウムはいったん水に溶解させてから分析用試料に添加することで、分析用試料への拡散性が高まるので、フロー方式に用いる際に好適である。ここで、加熱温度を高めすぎると、フロー方式のように細管内に分析用試料を流通させて加熱する場合には、分析用試料が激しく沸騰して析出した固形物等が細管を閉塞する虞があったり、細管内に気泡が生じやすくなって分析用試料の流量制御が難しくなる。したがって、加熱温度は100〜120℃とすることがより好適であり、100℃とすることがさらに好適である。
【0026】
次に、分析用試料に塩酸を添加して加熱する処理を行う。この処理は、分析用試料に過マンガン酸カリウムを添加して加熱する処理によって酸化されて6価セレンとなった分析用試料に元々含まれていた4価セレンを、4価セレンに戻すと共に、分析用試料に元々含まれていた6価セレンを4価セレンに還元するものである。この処理により、分析用試料に元々含まれていた4価セレンと6価セレンが全て4価セレンに変換され、この4価セレンからセレン化水素が生成されて、セレンの定量分析に供される。分析用試料に6価セレンのみが含まれている場合であっても、4価セレンに還元することによって、セレン化水素を生成させて、セレンの定量分析に供することができる。つまり、分析用試料に4価セレンと6価セレンが含まれているときはその全量を分析に供することができ、分析用試料に4価セレンのみが含まれているときには4価セレンの全量を分析に供することができ、分析用試料に6価セレンのみが含まれているときには6価セレンの全量を測定できる。換言すれば、分析用試料に溶解している水溶性セレンの全量を分析に供することができる。したがって、本発明によれば、分析用試料として、4価セレンと6価セレンが含まれる試料、4価セレンのみが含まれる試料、6価セレンのみが含まれる試料を対象とすることができる。
【0027】
分析用試料に対する塩酸の添加量は、分析用試料に含まれる6価セレンの全量を確実に4価セレンに還元できる量であればよいが、分析用試料の酸の規定値が6.7N/Lを超えると、定量分析終了後の酸性分析用試料に4価セレンが未反応のまま残留し易くなるので、分析用試料の酸の規定値が6.7N/L以下となるように塩酸を添加することが好ましい。具体的には、試料に対し、塩酸を4mol/L〜6.7mol/Lとなるように添加するのが好適であり、6.7mol/Lとするのがさらに好適である。より具体的には、例えば分析用試料5mLに対して10〜12mol/Lの塩酸水溶液を5mL以上添加することが好適であり、10mol/Lの塩酸水溶液を10mL添加することが好適である。
【0028】
加熱温度については、100〜120℃の範囲内では、6価セレンの還元に影響を及ぼすことはない。したがって、分析用試料に過マンガン酸カリウムを添加して加熱する処理の際の加熱温度に合わせることで、分析用試料に過マンガン酸カリウムを添加して加熱する処理と、分析用試料に塩酸を添加して加熱する処理とを連続的に行い易くなる。
【0029】
ここで、分析用試料に塩酸を添加して加熱する処理もまた、フロー方式で実施することが好適である。これにより、セレン濃度を連続で監視できる簡易な自動測定機(プロセスモニター)に適用し易くなる。
【0030】
具体的には、上記と同様、細管を用意し、細管内での分析用試料の流量と細管の長さを調整し、細管を加熱することによって、分析用試料が細管を通過する間に、6価セレンの4価セレンへの還元処理を行うことができる。より具体的には、例えば、6.0m(内径1.0mm)のPTFE製キャピラリーを用い、加熱温度を100℃とし、分析用試料5mLに10mol/Lの塩酸水溶液を40μL添加し、流量0.5mL/分とすることで、10分間で反応を完了させることができる。このように、塩酸を水で希釈してから分析用試料に添加することで、分析用試料への拡散性が高まるので、フロー方式に用いる際に好適である。しかも、分析用試料に過マンガン酸カリウムを添加して加熱する処理と同じ加熱温度で処理することができるので、分析用試料をいったん冷却させたりする手間を省くことができる。
【0031】
また、分析用試料に塩酸を添加して加熱する処理を行うことによって、分析用試料の酸の規定値を4N/L〜6.7N/Lにすることができる。したがって、特開2009−8668号公報に記載されたセレンの定量分析方法における分析用試料の酸性化処理を省略することができる。
【0032】
以上、分析用試料に過マンガン酸カリウムを添加して加熱する処理によって、分析用試料に含まれる有機物を分解することができる。また、分析用試料に塩酸を添加して加熱する処理によって、分析用試料に過マンガン酸カリウムを添加して加熱する処理により酸化されて6価セレンの形態となっている分析用試料中の4価セレン、さらには分析用試料に元々含まれていた6価セレンを還元して4価セレンとすることができる。ヨウ化物イオンが定電位電解式センサによるセレン化水素の測定を妨害するのを排除する作用は、分析用試料に過マンガン酸カリウムを添加して加熱する処理により奏されるものと考えられる。したがって、定電位電解式センサによるセレン化水素の測定において分析精度を低下させる要因を排除しつつ、分析用試料に含まれる4価セレンと6価セレンを合わせた総セレン濃度を分析することが可能となる。
【0033】
上記処理により得られた酸性分析用試料中のセレンの定量分析方法は、特開2009−8668号公報に記載されたセレンの定量分析方法と同様の方法で実施することができる。以下、酸性分析用試料中のセレンの定量分析方法について簡単に説明する。
【0034】
上記処理により得られた酸性分析用試料には、テトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定する。
【0035】
テトラヒドロホウ酸ナトリウムの添加速度は、酸性分析用試1Lに対して5〜10g/分以下とすることが好ましい。この場合には、単位時間当たりの水素の発生を抑えながら分析用試料に溶存している4価セレン(亜セレン酸イオン)をセレン化水素に還元することができる。つまり、定電位電解式センサ4によるセレン化水素の測定を妨害することのない水素発生量に抑えることができる。テトラヒドロホウ酸ナトリウムを酸性分析用試料1Lに対して10g/分を超える速度で添加すると、セレン化水素の測定に影響を及ぼす量の水素が発生する虞がある。また、テトラヒドロホウ酸ナトリウムの添加速度の下限値については、定電位電解式センサにより測定されるセレン化水素の単位時間当たりの測定値(定電位電解式センサが出力する信号強度を意味する。以下、測定値を信号強度と呼ぶこともある。)が十分に確保され、定量分析の迅速性が確保される値が適宜選択される。例えば、酸性分析用試料1Lに対して5g/分以上とすることが好ましく、6g/分とすることがより好ましい。テトラヒドロホウ酸ナトリウムの添加について、一例を挙げて具体的に説明すると、濃度が3g/Lのテトラヒドロホウ酸ナトリウム溶液であれば、酸性分析用試料15mLに対して25〜50mL/分とするのが好ましく、30mL/分とすることがより好ましい。この場合には、単位時間当たりの水素の発生が抑えられ、セレン化水素の測定が妨害されない。しかも、セレン化水素の信号強度の十分な確保と定量分析の迅速性が確保される。
【0036】
ここで、テトラヒドロホウ酸ナトリウムは吸湿性が強く、空気中の水分を吸収して徐々に劣化する。したがって、テトラヒドロホウ酸ナトリウムはこれを安定に保持しうる溶媒中に溶解させて用いる。テトラヒドロホウ酸ナトリウムを溶解する溶媒としては、弱アルカリ性の溶媒を用いることが好ましい。酸性の溶媒を用いるとテトラヒドロホウ酸ナトリウムが劣化してしまう虞がある。中性の溶媒を用いた場合にも、テトラヒドロホウ酸ナトリウムが徐々に劣化してしまう虞がある。強アルカリ性の溶媒を用いた場合には、酸性分析用試料2aに添加した際にpHがアルカリ側に変動し易くなり、テトラヒドロホウ酸ナトリウムの還元剤として機能が低下し、分析用試料に溶存している亜セレン酸イオンを十分に還元できなくなる虞がある。即ち、テトラヒドロホウ酸ナトリウムを劣化させることなく、また、酸性分析用試料に添加した際にpHをアルカリ側に変動させてテトラヒドロホウ酸ナトリウムの還元剤としての機能を低下させることのない溶媒を用いればよい。例えば、0.1mol/Lの水酸化ナトリウム溶液が挙げられるが、これに限定されるものではない。
【0037】
尚、テトラヒドロホウ酸ナトリウムは還元剤として広く用いられている化合物であり、安価で入手し易い。また、エチレンジアミン四酢酸を加えることによって、0.1mol/Lの水酸化ナトリウム溶液に溶解させて30日間安定に保存することができる(A. D. Idowu, P. K. Dasgupta, Z. Genfa, and K. Toda: “A Gas-Phase Chemiluminescence -Based Analyzer for Waterborne Arsenic”, Anal. Chem., 78, 7088-7097 (2006))。つまり、使用の簡便性と安定性とを兼ね備えた試薬であり、現場分析に用いる試薬として非常に好適である。
【0038】
テトラヒドロホウ酸ナトリウム溶液の添加は、例えば、分液漏斗やビュレットのように、コック(バルブ)の開度の調節によって添加速度を制御可能なものを用いることもできるし、バルブが開状態の時にのみ一定の速度で添加可能なものを用いることもできる。また、ペリスタルティックポンプのような制御性の高いものを用いることで、より正確な定量分析が可能となる。
【0039】
尚、テトラヒドロホウ酸ナトリウムの添加速度は、テトラヒドロホウ酸ナトリウムを溶解させた溶液のテトラヒドロホウ酸ナトリウム濃度並びに酸性分析用試料に対する添加速度により適宜制御される。つまり、テトラヒドロホウ酸ナトリウム溶液の濃度を高めて酸性分析用試料に添加すれば、酸性分析用試料1Lに対するテトラヒドロホウ酸ナトリウムの添加速度を高めることができる。また、酸性分析用試料に対するテトラヒドロホウ酸ナトリウム溶液の添加速度を高めれば、酸性分析用試料1Lに対するテトラヒドロホウ酸ナトリウムの添加速度を高めることができる。逆に、テトラヒドロホウ酸ナトリウム溶液の濃度を低くして酸性分析用試料に添加すれば、酸性分析用試料1Lに対するテトラヒドロホウ酸ナトリウムの添加速度を低下させることができる。また、酸性分析用試料に対するテトラヒドロホウ酸ナトリウム溶液の添加速度を低下させれば、酸性分析用試料1Lに対するテトラヒドロホウ酸ナトリウムの添加速度を低下させることができる。したがって、テトラヒドロホウ酸ナトリウム溶液の濃度並びに酸性分析用試料に対する添加速度を適宜制御することによって、テトラヒドロホウ酸ナトリウムの添加速度を制御すればよい。
【0040】
酸性分析用試料へのテトラヒドロホウ酸ナトリウムの添加量については、分析用試料に存在していると考えられる4価セレンの全量をセレン化水素に還元しうる量以上の量が適宜選択される。1molのH2SeO3(SeO32−)を還元させてセレン化水素を発生させるためには、3/4molのNaBH4(BH4−)が必要である。したがって、4価セレン1mgに対して最低でも0.38mgのNaBH4が必要である。ここで、分析用試料に存在している4価セレンの全量を確実にセレン化水素に還元するためには、分析用試料に含まれていると考えられる4価セレンの全量に対して過剰量のテトラヒドロホウ酸ナトリウムの量を添加することが好ましい。即ち、分析用試料の4価セレン濃度が1mg/L以下であると仮定した場合には、分析用試料1Lに対して0.38mg〜6.7gのテトラヒドロホウ酸ナトリウムを添加することが好ましく、3.8mg〜3.4gとすることがより好ましく、38mg〜2.0gとすることがさらに好ましい。6.7gを超える量のテトラヒドロホウ酸ナトリウムを添加しても、セレン化水素の測定に影響を及ぼすことは無いが、セレン化水素発生反応には関与しないので、無駄である。
【0041】
また、酸性分析用試料へのテトラヒドロホウ酸ナトリウムの添加開始時から定電位電解式センサによる測定が終了するまでの間は、酸性分析用試料を撹拌し続けることが好ましい。撹拌を十分に行わないと、酸性分析用試料に添加したテトラヒドロホウ酸ナトリウムが十分に拡散せずに酸性分析用試料と不均一に反応しやすくなり、定電位電解式センサによるセレン化水素の信号強度が低下する虞がある。
【0042】
酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加することにより発生したセレン化水素は定電位電解式センサにより吸引されて随時測定され、測定値が出力される。
【0043】
ここで、発生したセレン化水素には、キャリアーガスを供給し、キャリアーガスと共に定電位電解式センサにより吸引することが好適である。キャリアーガスとしては、窒素やアルゴンなどの不活性ガスだけでなく、空気を利用することもできる。このように、空気をキャリアーガスとして利用することで、現場分析の際に容器2に大気中から空気を送り込むことによってキャリアーガスの供給が可能となるので、非常に便利である。
【0044】
キャリアーガスの供給速度は、500〜700mL/分以上とすることが好ましい。この場合には、セレンの定量分析の上限値を高めることができる。ここで、キャリアーガスの供給速度の上限値については、定電位電解式センサのガス吸引能力を大きく超えない値とすることが好ましい。定電位電解式センサのガス吸引能力を大きく超えると、定電位電解式センサのガス吸引機能に負担がかかり、測定ができなくなる虞がある。したがって、キャリアーガスの供給速度は、500〜700mL/分とすることが好ましく、定電位電解式センサ4のガス吸引能力とほぼ同等の供給速度とすることがさらに好ましい。例えば、定電位電解式センサ4のガス吸引能力が500mL/分であれば、キャリアーガスの供給速度は500mL/分に近づけることが好ましい。尚、キャリアーガスの供給速度は、マスフローコントローラーや、ポンプ等により制御することができる。
【0045】
定電位電解式センサは漏洩ガス検知器として市販されている半導体材料ガス検知器である新コスモス電機製PS−7(セレン化水素専用センサユニットCDS−7)が挙げられるが、これに限定されるものではなく、これと機能的に類似するものを用いることができる。
【0046】
ここで、新コスモス電機製PS−7は、ガス吸引機能を有しており、これを利用して容器2内で発生したセレン化水素を吸引する。尚、新コスモス電機製PS−7のガス吸引能力は500mL/分であり、上記分析条件は、この吸引速度に基づいて導出されたものであるが、上記分析条件は、定電位電解式センサのガス吸引速度が400〜600mL/分であっても適用できるものと考えられる。
【0047】
このように、キャリアーガスを使用することによって、セレンの定量分析の精度を高めることができる。また、キャリアーガスを使用しない場合と比較して、非常に低濃度のセレンの定量分析を行うことも可能となる。
【0048】
さらに、新コスモス電機製PS−7は、データ取得がデジタル方式で行われ、データ取得が0.1秒間隔で行われ、フルスケールに対する分解能が0.4%である。このように、アナログ方式で、且つデータ取得間隔や分解能を向上させることによって、セレンの定量分析精度を向上させることができる。
【0049】
定電位電解式センサにより測定された測定値に基づいて、分析用試料の4価セレン濃度を検量線法により分析することができる。
【0050】
検量線法に用いる検量線は、4価セレン濃度が既知の複数の標準試料から予め求めた4価セレン濃度と定電位電解式センサの測定値(セレン化水素の信号強度)との相関に基づいて作成されたものである。さらに具体的に説明すると、4価セレン濃度が既知の複数の標準試料それぞれに対し、テトラヒドロホウ酸ナトリウムを添加して4価セレンとテトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、セレン化水素を定電位電解式センサにて測定することにより得られた測定値(セレン化水素の信号強度)と4価セレン濃度との関係から、最小二乗法などの公知の手法によりフィッティングして得ることが可能である。
【0051】
そして、検量線法により得られた分析用試料の4価セレン濃度は、分析用試料に含まれる4価セレンと6価セレンの全量を反映する値となる。つまり、本発明により、分析用試料に含まれる総セレン濃度を分析することができる。
【0052】
上述の形態は本発明の好適な形態の一例ではあるがこれに限定されるものではなく本発明の要旨を逸脱しない範囲において種々変形実施可能である。
【実施例】
【0053】
以下に本発明の実施例を説明するが、本発明はこれら実施例に限られるものではない。
【0054】
<1.本実施例において使用した試料>
本実施例では、分析用試料として、石炭火力発電所から排出される4種の排煙脱硫排水A〜Dを入手して使用した。表1に排水A〜Dの化学組成を示す。尚、化学組成は、ICP発光分析装置(ICP−AES、セイコーインスツルメンツ製 SPS5000)及びイオンクロマトグラフィー(IC、ダイオネックス製 DX−320)により測定した。
【0055】
【表1】

【0056】
表1に示されるように、排水Aのセレン濃度は0.11mg/Lであり、排水Bのセレン濃度は0.003mg/Lであり、排水Cのセレン濃度は0.037mg/Lであり、排水Dのセレン濃度は0.031mg/Lであった。排水Bのセレン濃度が低かったことから、以降の実験ではセレン標準液を加えてセレン濃度を0.1mg/Lとした。
【0057】
<2.ヨウ化物イオンの影響の確認>
定電位電解式センサを利用してセレン化水素の測定を行う際に、ヨウ化物イオンが測定結果に与える影響について確認実験を行った。
【0058】
図1に示すセレンの定量分析システムを用いて実験を行った。このシステムは、特開2009−8668に開示されているシステムと同一の構成を有するものである。具体的に説明すると、密閉構造の反応槽(容器)2に酸性分析用試料2aを導入し、還元剤であるテトラヒドロホウ酸ナトリウム水溶液を管体8を介して反応槽2に送液し、攪拌機33で混合してセレン化水素ガスを生成させた。所定濃度のテトラヒドロホウ酸ナトリウム水溶液3aの反応槽2への流量はペリスタルティックポンプ3で制御した。反応槽2で生成したセレン化水素はキャリアーガスである純空気で定電位電解式センサ4に導入した。キャリアーガスはキャリアーガス供給手段7により管体10を介して供給した。キャリアーガス供給手段7は、純空気ボンベ7aと、圧力調整器7bと、圧力計7cと、マスフローコントローラー7dと、ストップバルブ7eにより構成し、マスフローコントローラー7dにより流量を制御した。定電位電解式センサ4として、セレン化水素ガス検知器(新コスモス電機製PS−7)を用い、セレン化水素専用センサユニットであるCDS−7を併用した。この定電位電解式センサは、ガス吸引量が500mL/分であり、反応槽2内で発生したセレン化水素が管体9を介して定電位電解式センサ4により吸引した。また、この定電位電解式センサのセレン化水素の測定範囲は1〜275ppbであり、指示精度はフルスケールに対して10%以内である。測定データはA/Dコンバータ32を介してパーソナルコンピュータ34に収録した。A/Dコンバータ32は、最小データ取得周期が10Hzで、最小分解能がフルスケールに対して0.4%のものを用いた。測定データの解析にはSmart Chrom(ケーワイテクノロジーズ製)を用いた。セレン化水素ガスは毒性が非常に高いので、測定後のセレン化水素ガスを除害槽6に流通させて除害した。セレン化水素の除害には硫酸銅水溶液6aを用いた。除害槽通過後のガスを除害確認用検知器31で測定し、セレン化水素の有無を確認した。除害確認用検知器31には、セレン化水素ガス検知器(新コスモス電機製PS−7)を用いた。
【0059】
ここで、定電位電解方式のセレン化水素ガス検知器の原理を図2に示す。セレン化水素はガス透過性膜を通じて電解液中に拡散吸収される。電解液中に拡散吸収されたセレン化水素は、電解液中で一定の電位で電解されると電流が発生する。定電位電解方式のセレン化水素ガス検知器は、このときの電流を増幅器14で増幅させて測定するものである。電解時には、作用電極11において酸化反応が起こり(化学反応式A)、対極13では還元反応が進行する(化学反応式B)。作用電極11と対極13に流れる電流はセレン化水素濃度に比例する。照合電極12は照合電極用基準電源12aと接続され、照合電極に対する作用電極の電位を規制して電解を行う。
(化学反応式A)作用電極:H2Se+3H2O→H2SeO3+6H++6e−
(化学反応式B)対極:O2+4H++4e−→2H2O
【0060】
0.1mg/Lの4価セレン標準液に対し、ヨウ化物イオンを0.1〜10mg/Lの範囲で標準添加した試料について、セレン化水素の測定を実施した。実験条件は以下の通りとした。即ち、試料に6.0mol/Lの塩酸水溶液10mLを添加して酸性分析用試料2aとし、これにテトラヒドロホウ酸ナトリウム水溶液10mLを流量30mL/分で送液し、セレン化水素ガスを生成させた。生成したセレン化水素ガスは、流量500mL/分のキャリアーガス(純空気)と共に定電位電解式センサ4に導入した。
【0061】
測定結果を図3に示す。試料にヨウ化物イオンを添加すると、信号値が負の値を示した。また、ヨウ化物イオンの濃度を高くする程、負の信号値を示す時間が長くなった。したがって、ヨウ化物イオンは、定電位電解式センサを利用したセレン化水素測定における妨害成分となることが確認された。
【0062】
ここで、別途実験を行い、脱硫排水に塩酸を添加し20分間撹拌した後に試料中のヨウ化物イオンを測定したところ、排水のヨウ化物イオン濃度が低下したことから、脱硫排水中のヨウ化物イオンが塩酸と反応して生成された物質が気化し、これが定電位電解式センサ4によるセレン化水素の測定に負の信号値を与えたものと考えられた。
【0063】
<3.排水に含まれる有機物の分解処理の検討>
定電位電解式センサを利用したセレン化水素測定においては、ヨウ化物イオンのみならず、有機物もまた妨害成分となる。公定法(日本工業標準調査会、工業排水試験方法、JIS K 0102.67.3、(2008).)である硫酸と硝酸を用いた加熱酸分解処理法を用いることで、これらの妨害成分は除去できるが、この公定法は処理に4〜5時間と極めて長い時間を必要とし、処理方法も煩雑で危険を伴う。そこで、排水に含まれる有機物を簡易且つ迅速に分解できる処理方法の検討を行った。
【0064】
有機物の簡易迅速な分解処理法として、KMnO4 、Ce(SO4)2 、NaClOの3種類の酸化剤を用いた方法を検討した。KMnO4については、さらに、硫酸を加えて酸性にした場合と、水酸化ナトリウムを加えてアルカリ性とした場合についても検討した。分解処理は、分析用試料25mLに対して、酸化剤をそれぞれ添加し、120℃のオイルバスで10分間加熱することにより行った。酸化剤は、以下の(1)〜(5)に示すように調整してから分析用試料に添加した。
【0065】
(1)KMnO4
過マンガン酸カリウム(KMnO4)水溶液はKMnO4を蒸留水で3重量%に調製し、ろ過した。この水溶液を所定量添加した。
【0066】
(2)KMnO4+H2SO4
3重量%KMnO4水溶液を50μL、硫酸を3.0mL添加した。尚、この方法は、日本工業標準調査会、工業排水試験方法、JIS K 0102.17・19(2008)に該当するものである。
【0067】
(3)KMnO4+NaOH
3重量%KMnO4水溶液を50μL、100g/L水酸化ナトリウムを0.5mL添加した。尚、この方法は、日本工業標準調査会、工業排水試験方法、JIS K 0102.17・19(2008)に該当するものである。
【0068】
(4)Ce(SO4)2
硫酸セリウム(IV)四水和物(Ce(SO4)2・4H2O)と硫酸セリウム(III)・n水和物(Ce2(SO4)3・nH2O)を6容積%硫酸でそれぞれ3.0mmol/L、6.0mmol/Lに調製した。Ce2(SO4)3は、セリウム(IV)を安定させる目的で添加した。尚、この方法は、以下の文献に記載された方法である(T. Korenaga, X. Zhou, K. Okada, and T. Moriwake, S. Shinoda: “Determination of chemical oxygen demand by a flow-injection method using cerium(IV) sulphate as oxidizing agent”, Anal. Chim. Acta, 272(2), 237-244, (1993). )。
【0069】
(5)NaClO
次亜塩素酸ナトリウム(NaClO)水溶液はNaClO、リン酸緩衝液(pH6.5、NaH2PO4、Na2HPO4)を蒸留水でそれぞれ20mg/L、0.4mol/Lに調製した。尚、この方法は、以下の文献に記載された方法である(鈴木 教太、中山 太一、中村 秀明:「次亜塩素酸を使用した化学的酸素要求量(COD)測定法の開発」日本分析化学会第57年会講演要旨集、J3003、(2008).)。
【0070】
4価セレン標準液(0.1mg/L)、排水A及びBについて、有機物分解処理を行った。また、有機物分解処理を行うと、4価セレンが6価セレンに酸化されることから、これを還元して4価セレンに戻すため、塩酸とKBrによる還元処理を行った後、水素化合物発生ICP−AESにより4価セレン濃度を測定した。そして、各試料の4価セレン濃度に基づいて、(1)〜(5)の有機物分解処理法によるセレン回収率を求めた。
【0071】
結果を図4に示す。KMnO4、KMnO4+H2SO4を用いた有機物分解処理法の場合、標準液、排水A及びBともにセレン回収率が100%となり、有機物分解処理に関しては公定法と遜色のない良好な結果が得られることがわかった。
【0072】
KMnO4+NaOH、Ce(SO4)2を用いた有機物分解処理法の場合、標準液、排水A及びBのいずれにおいてもセレンの回収率が低かった。
【0073】
NaClOを用いた有機物分解処理法の場合、標準液のセレン回収率は100%であったが、排水A及びBではセレン回収率が低かった。
【0074】
ここで、各酸化剤の標準電極電位(E0)を比較してみると、Ce4+が一番高く(1.7V)、次いでMnO4−(1.5V)、ClO−(1.2V)となる。酸化力が弱いNaClOは排水中の有機成分が十分に酸化されないため、有機物が存在しない標準試料ではセレン回収率が高く、排水試料ではセレン回収率が低くなったと考えられた。一方、Ce(SO4)2のように酸化力が強すぎると6価セレンが4価へ還元されにくくなり、標準試料、排水試料ともに低いセレン回収率を示したと考えられた。
【0075】
次に、(1)〜(5)の有機物分解処理法により有機物を分解した後のセレンの形態を確認するため、6価セレンの還元する処理を行わずに水素化合物発生ICP−AESにより4価セレンのみを測定した。
【0076】
その結果、(1)〜(5)の全ての有機物分解処理法において、4価セレンは検出されなかった。このことから、(1)〜(5)の有機物分解処理法により、試料に含まれる4価セレンは6価セレンに酸化されることがわかった。したがって、セレン化水素を生成するためには、有機物分解処理を行った後に必ず6価セレンを4価セレンに還元するための処理を行う必要があることがわかった。尚、6価セレンを4価セレンに還元するための処理を行えば、必然的に元々試料中に含まれる6価セレンをも4価セレンに還元することができることから、還元処理を行うことで、排水試料中の全セレン濃度が測定できることがわかった。
【0077】
以上の結果から、KMnO4またはKMnO4+H2SO4を酸化剤として用い、有機物分解後に6価セレンを還元することで、排水中の全セレン濃度が測定可能であることがわかった。そこで、用いる試薬数及び操作の簡便性に鑑み、KMnO4のみで簡易有機物分解を行うこととした。
【0078】
<4.KMnO4を酸化剤とした有機物分解処理条件の検討>
KMnO4を酸化剤とした有機物分解処理について、KMnO4の添加量と処理温度を検討した。
【0079】
まず、KMnO4の添加量について検討した。4価セレン標準液(0.1mg/L)、排水A及びBに対して、3重量%KMnO4水溶液をそれぞれ0〜200μL添加して有機物分解処理を行った。試料はそれぞれ25mLとし、120℃のオイルバスで10分間加熱した。そして、塩酸とKBrによる還元処理を行った後、水素化合物発生ICP−AESにより4価セレン濃度を測定した。そして、各試料の4価セレン濃度に基づいて、セレン回収率を求めた。
【0080】
結果を図5に示す。標準液、排水A及びBのいずれにおいても、KMnO4水溶液添加量50〜200μLでセレン回収率がほぼ100%となった。KMnO4水溶液10μLでは、排水Bにおいて回収率が80%前後となった。この理由は、排水Bでは比較的有機物量が多く、KMnO4水溶液10μLでは、有機物の全量を分解するに至らなかったためと考えられた。尚、KMnO4水溶液添加量を増加させても回収率が低下しないことから、有機成分量が多い排水にも対応できるように、高濃度のKMnO4水溶液を多めに添加することが好適であることがわかった。以降の実験では、試料25mLに対して、3重量%KMnO4水溶液の添加量を200μL(試料1.0mLに対して8.0μL)とすることとした。
【0081】
次に、処理温度について検討した。尚、この実験では、プロセスモニターにおける前処理の自動化を想定し、フロー方式の加熱反応器を用いた簡易有機物分解処理について検討した。加熱反応器は長さ6.0m(内径1.0mm)のPTFE製キャピラリーを用い。細管内を流れる試料の流量と加熱温度を精密に制御できるものとした。
【0082】
この加熱反応器を用いて、試料5.0mLに3重量%KMnO4水溶液を40μL添加し、流量0.5mL/分(反応時間10分)、加熱温度60〜140℃で有機物分解処理を行った。試料は、4価セレン標準液(0.1mg/L)、排水A及びBとした。有機物分解処理後には、塩酸とKBrによる還元処理を行い、水素化合物発生ICP−AESにより4価セレン濃度を測定した。そして、各試料の4価セレン濃度に基づいて、セレン回収率を求めた。
【0083】
結果を図6に示す。標準液、排水A及びBのいずれにおいても、加熱温度100〜120℃でセレン回収率が100%前後となり、60〜80℃においてはセレン回収率が80%前後となった。この理由は、60〜80℃では加熱温度が低く、KMnO4による反応が十分に進行しなかったためと考えられた。また、140℃において誤差が極めて大きいのは、試料が激しく沸騰し、析出した固形物が加熱反応器中のキャピラリー内で詰まったことが原因であった。
【0084】
以上より、処理温度は100〜120℃が好適であると判断された。但し、温度を高めるにつれて、キャピラリー内に気泡が生じやすくなって、流量が安定しなくなる可能性があることから、以降の実験では100℃で有機物分解処理を行うこととした。
【0085】
<5.6価セレンの簡易還元法の検討>
KMnO4を酸化剤とした有機物分解処理方法により排水中の有機物を分解すると、排水中の4価セレンが酸化されて6価セレンとなる。セレン化水素を生成させて、定電位電解式センサでセレンの定量分析を行う場合、セレンは4価の状態で存在していることが必要である。そこで、有機物分解処理を行った後に、排水中の6価セレンを4価セレンに簡易に還元することのできる処理法について検討した。
【0086】
6価セレンの還元法については、HClで簡易に還元する方法が以下の文献1〜4において報告されている(文献1:J. Pettersson and A. Olin: “The rate of reduction of selenium (VI) to selenium (IV) in hydrochloric acid”, Talanta, 38(4), 413-417, (1991).、文献2:K. Pyrzynska: “Speciation of selenium compounds”, Anal. Sci., 14, 479-483, (1998).、文献3:A. A. Ensafi and M. S. Lemraski: “Highly sensitive spectrophotometric reaction rate method for the determination of selenium based on the catalytic reduction of sulfonazo by sulfide”, Anal. Let., 37(12), 2469-2483, (2004).、文献4:E. M. R. Rodriguez, M. S. Alaejos, and C. D. Romero: “Fluorimetric determination of selenium in biological samples”, Anal. Let., 32(9), 1699-1721, (1999).)。これらの報告では、3.0〜10mol/L HClを添加し、80〜120℃で数十分加熱することで6価セレンを4価に還元可能であると報告されている。本実験においてもこの方法を適用し、簡易有機物分解処理後の試料について、HCl濃度、添加量及び処理温度について検討を行った。
【0087】
まず、HCl濃度について検討した。6価セレン標準液(0.1mg/L)、排水A及びBに対し、KMnO4を酸化剤とした上記の有機物分解処理方法を行った試料25mLに、所定濃度(0〜12mol/L)のHCl水溶液を15mL添加し、120℃のオイルバスで還元処理し、セレン回収率を求めた。
【0088】
結果を図7に示す。標準液、排水A及びBにおいて、HCl濃度0〜6mol/Lではセレン回収率が低く、10mol/Lから回収率が上昇し始めて、12mol/Lで90〜100%の回収率が得られた。従来報告されている還元法では、6.0mol/L前後の濃度で高いセレン回収率が得られているが、本発明のように、KMnO4を酸化剤とした上記の有機物分解処理方法を実施した後に6価セレンの還元を行う場合には、6価セレンの還元に必要なHCl量も多くなると考えられた。
【0089】
次に、この実験結果に基づき、HCl濃度6.0〜12mol/Lで6価セレンを還元させるのに必要なHCl水溶液の添加量と処理温度条件とを検討した。
【0090】
結果を図8に示す。試料5.0mLに対して10〜12mol/LのHCl水溶液を5.0mL以上添加し、100〜120℃で還元することで、セレン回収率がほぼ100%となった。また、HCl濃度6.0mol/Lでは、HCl水溶液の添加量を増やすとセレン回収率も増加するが、10mL添加しても回収率は70%程度に留まった。処理温度が100〜120℃の場合には、大きな差はみられず、HCl水溶液の添加量が6価セレンの還元に大きな影響を与えることがわかった。
【0091】
以上より、6価セレンの還元条件は、試料5.0mLに対して10〜12mol/LのHCl水溶液を5.0mL以上添加し、反応温度は100〜120℃とすることが好適であると判断された。以降の実験では、試料5.0mLに対して10mol/LのHCl水溶液を10mL添加し、反応温度100℃で6価セレンを還元処理することとした。
【0092】
<6.ヨウ化物イオンの影響の除外についての検討>
定電位電解式センサでのセレン化水素の測定の際のヨウ化物イオンによる妨害の問題について、上記の実験から明らかとなった有機物分解処理法の好適な条件と、6価セレン還元のための好適な条件とを用いて分析用試料を前処理することによって、分析用試料に含まれるヨウ化物イオンに対し、何らかの影響が及ぼされるのかを検討した。
【0093】
4価セレン標準液(0.1mg/L)5mLにヨウ化物イオンを0〜500mg/Lの範囲で混合し、有機物分解処理と6価セレンの還元処理とを行った後、定電位電解式センサを用いたセレン化水素の測定を実施した。
【0094】
有機物分解処理は、3重量%KMnO4水溶液を試料に40μL添加し、100℃で10分間加熱することにより行った。
【0095】
6価セレンの還元処理は、10mol/LのHCl水溶液10mLを試料に添加し、100℃で10分間加熱することにより行った。
【0096】
定電位電解式センサを用いたセレン化水素の測定は、3g/Lのテトラヒドロホウ酸ナトリウム水溶液を30mL/分の流速で10mL添加して行った。
【0097】
結果を表2及び図9に示す。表2及び図9から明らかなように、ヨウ化物イオンの多寡によらず、いずれの試料においてもほぼ同等の信号強度をもつピークが得られることが明らかとなった。このことから、意外にも、本発明の前処理を実施することによって、ヨウ化物イオンの影響までも完全に排除してセレン化水素の測定ができることが明らかとなった。また、ヨウ化物イオンが塩酸と反応して定電位電解式センサ4での信号値を負の値にしたことを勘案すると、過マンガン酸カリウムを分析用試料に添加して加熱する処理が、ヨウ化物イオンによる測定の妨害の排除に対して有効に作用しているものと考えられた。
【0098】
【表2】

【0099】
<6.本発明の前処理方法と公定法との比較>
上記実験において検討した前処理法(有機物分解処理法及び6価セレン還元処理法)について、公定法との比較評価を行った。上記実験において検討した前処理法と公定法の手順の比較を図10に示す。公定法との比較には、分析法の正確さを確認する方法として用いられる添加回収試験法により評価した。添加回収試験法は、試料及び既知濃度の標準液を添加した試料を分析し、両者の差を添加した標準液の濃度と比較することで回収率を求めて評価する方法である(Pierce Biotechnology:“Spike-and-recovery and linearity-of-dilution assessment”, TECH TIP #58, (2007).)。
【0100】
排水A〜Dに4価セレン標準液が0.1mg/Lとなるように添加し、公定法及び本発明の前処理を行い、ICP分析を行った。結果を表3に示す。尚、公定法の有機物分解処理は以下の操作手順で行った。試料30mLに(1+1)硫酸1.0mLと硝酸2.0mLを添加し、ホットプレート上(170℃)で硫酸白煙が発生するまで4〜5時間、加熱した。
【0101】
【表3】

【0102】
排水A〜Dのいずれにおいても、公定法及び本発明の前処理法ともに84〜105%の高い回収率が得られたがRSD(相対標準偏差)には差がみられた。即ち、公定法の回収率のRSDは11〜24%であったのに比較して、本発明の前処理法では2.1〜4.3%と低かった。この結果は、公定法の方が実験誤差が生じやすいことを示しており、以下のように考えることができる。即ち、通常、試料中に添加した硝酸の揮発を確認する目的で硫酸白煙の目測が行われるが、硫酸白煙が発生しても十分に加熱されない場合もあり、このような場合には試料中に硝酸が残存して、セレンの水素化効率が低下し、安定した測定値が得られないことがある(Pierce Biotechnology:“Spike-and-recovery and linearity-of-dilution assessment”, TECH TIP #58, (2007).)。また、硫酸白煙発生後、長時間加熱すると、試料中のセレンが揮発する場合があり、測定値に誤差が生じることがある。さらに、公定法は硝酸と硫酸の揮発温度の中間付近(約170℃)の加熱温度で行われるが、同一の加熱器を用いて気圧や室温等が同一の条件で処理を行わないと誤差が大きくなる傾向がある(玉利 祐三:「水素化物生成原子吸光法による生物試料中のセレンの分析−試料溶解法による影響−」、Biomed. Res. Trace. Elements, 10(2), 125-133, (1999).)。
【0103】
これに対し、本発明の前処理方では、処理操作をフロー方式で行うことで実験条件を均一なものとできるため、安定したセレン測定値が得られたものと考えられる。つまり、試料を細管内に流すことで比表面積(表面積/体積)が増加して熱容量が減少し、温度制御が容易になる。また、一連の前処理操作をフロー方式で行うことにより、試料の採取、前処理、定量の自動化が期待できる。
【0104】
以上より、本発明の前処理法は、簡易迅速に行うことができ、しかも、測定値に誤差が生じにくく、公定法よりも優れた処理法であることが明らかとなった。
【特許請求の範囲】
【請求項1】
水溶性セレンを含む分析用試料を酸性化処理して酸性分析用試料とし、この酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加して4価セレンと前記テトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、前記セレン化水素を定電位電解式センサにて測定するセレンの定量分析方法において、
前記分析用試料に対する前処理として、前記分析用試料に過マンガン酸カリウムを添加して加熱する処理と、前記分析用試料に塩酸を添加し加熱して6価セレンを4価セレンへ還元する処理とを行い、前記酸性化処理を省略することを特徴とするセレンの定量分析方法。
【請求項1】
水溶性セレンを含む分析用試料を酸性化処理して酸性分析用試料とし、この酸性分析用試料にテトラヒドロホウ酸ナトリウムを添加して4価セレンと前記テトラヒドロホウ酸ナトリウムを反応させてセレン化水素を発生させ、前記セレン化水素を定電位電解式センサにて測定するセレンの定量分析方法において、
前記分析用試料に対する前処理として、前記分析用試料に過マンガン酸カリウムを添加して加熱する処理と、前記分析用試料に塩酸を添加し加熱して6価セレンを4価セレンへ還元する処理とを行い、前記酸性化処理を省略することを特徴とするセレンの定量分析方法。
【図1】


【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図4】




【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図4】


【公開番号】特開2011−2424(P2011−2424A)
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願番号】特願2009−147722(P2009−147722)
【出願日】平成21年6月22日(2009.6.22)
【出願人】(000173809)財団法人電力中央研究所 (1,040)
【Fターム(参考)】
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願日】平成21年6月22日(2009.6.22)
【出願人】(000173809)財団法人電力中央研究所 (1,040)
【Fターム(参考)】
[ Back to top ]

