セロトニン6受容体リガンドの高効率検出のための、HA−5−HT6Rを安定的に発現する細胞株
【課題】5-HT6Rを安定的に発現する細胞株を提供する。
【解決手段】本発明は、セロトニン6受容体リガンドの高効率検出方法に関するもので、HA-5-HT6Rを安定的に発現する細胞株を使用したセロトニン6受容体リガンドの高効率検出方法に関するものである。本発明の細胞株は、HA-5-HT6Rを安定的に発現することにより、HT6Rに選択的に作用するリガンドの検出効率を増加させて、HT6Rと結合するタンパク質研究に有用に使用することができる。したがって、HT6Rが関わる欝病及びアルツハイマー病などの脳疾患及び精神疾患の予防及び診断ならびに治療剤の開発に有用である。
【解決手段】本発明は、セロトニン6受容体リガンドの高効率検出方法に関するもので、HA-5-HT6Rを安定的に発現する細胞株を使用したセロトニン6受容体リガンドの高効率検出方法に関するものである。本発明の細胞株は、HA-5-HT6Rを安定的に発現することにより、HT6Rに選択的に作用するリガンドの検出効率を増加させて、HT6Rと結合するタンパク質研究に有用に使用することができる。したがって、HT6Rが関わる欝病及びアルツハイマー病などの脳疾患及び精神疾患の予防及び診断ならびに治療剤の開発に有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、セロトニン6受容体(5-HT6R)リガンドの高効率検出方法に関するものである。
【背景技術】
【0002】
セロトニン受容体(5-HTR)は、5-HT1Rから5-HT7Rまでそれぞれの亜形を含み、現在まで総15種が知られていて、欝病、精神分裂症、不安症、睡眠障害などの精神疾患、及びアルツハイマー病疾患などに関わっていることが知られている。
【0003】
特に、5-HT6Rは、最近塩基配列が明らかにされた5-HTRで、まだ正確な機序が明かされていないが、退行性脳疾患と精神疾患などに関わっていることが知られている。最近、5-HT6Rの刺激が生化学的、行動学的な側面で抗欝剤のような効果を示すという研究が報告された。また、脳発生(brain development)、記憶と学習(learning and memory)、及びアルツハイマー病に至るまで、脳で発生し得る多くの重要な疾病と密接に関連しているという研究報告が漸次増加している(非特許文献1〜4)。5-HTRを作用点とする薬物としては、すべての5-HTRに非選択的に結合するクロザピンが知られており、5-HT6Rに選択的な薬物としては、SB258585があるが、まだ疾患の治療剤として使用されていない。欝病やアルツハイマー病疾患などに関連して、脳細胞で5-HT6Rの正確な機能及び5-HT6Rが関与した信号伝達機序がほとんど知られていない状況で、その機能及び機序研究と選択的リガンド開発のためには、5-HT6Rを選択的に研究することができるシステムが求められている。
【0004】
以上のことに鑑みて、本発明者等は、HA(血球凝集素)がN末端に連結された5-HT6Rを発現する細胞株を作製して、前記HA-5-HT6Rが細胞表面外に露出していて、前記HA-5-HT6Rが安定的に発現して、前記5-HT6Rの活性が維持されるので、前記細胞株が5-HT6Rに選択的なリガンドの開発のための高効率検出に活用できることを確認することによって本発明を完成した。
【非特許文献1】Grimaldi B等., Naunyn Schmiedebergs Arch Pharmacol., 1999年, 第357(4)巻, 393-400頁
【非特許文献2】Garcia-Alloza M等., Neuropsychopharmacology, 2004年, 第29(2)巻, 410-416頁
【非特許文献3】Lorke D等., BMC Neurosci., 2006年, 第27巻, 7-36頁
【非特許文献4】Greengard等., J Neurosci., 2007年, 第27(15)巻, 4201-4209頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明の目的は、5-HT6Rを安定的に発現する細胞株を提供することである。
【0006】
本発明の他の目的は、前記細胞株を使用した5-HT6Rリガンドの高効率検出方法を提供することである。
【0007】
本発明の他の目的は、前記細胞株を含む5-HT6Rリガンドの高効率検出用組成物を提供することである。
【課題を解決するための手段】
【0008】
前記目的を達成するために、本発明は、N末端にHA(血球凝集素)が連結された5-HT6R遺伝子構築物を含むベクターが宿主細胞に形質導入されて、HA-5-HT6Rを安定的に発現する細胞株を提供する。
【0009】
また、本発明は、
(1)本発明のHA-5-HT6Rを安定的に発現する細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株の5-HT6R活性を測定する工程;及び
(3)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法を提供する。
【0010】
また、本発明は、
(1)本発明のHA-5-HT6Rを安定的に発現する細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株のタンパク質を精製する工程;
(3)前記精製されたタンパク質の5-HT6R活性を測定する工程;及び
(4)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法を提供する。
【0011】
同時に、本発明は、本発明のHA-5-HT6Rを安定的に発現する細胞株を含む、5-HT6Rリガンドの高効率検出用組成物を提供する。
【0012】
以下、本発明で使用した用語を定義する。
【0013】
用語「5-HT6Rリガンド」は、5-HT6Rに結合して活性を調節する物質を意味する。
【0014】
以下、本発明を詳しく説明する。
【0015】
本発明は、N末端にHA(血球凝集素)が連結された5-HT6R遺伝子構築物を含むベクターが宿主細胞に形質導入されて、HA-5-HT6Rを安定的に発現する細胞株を提供する。
【0016】
本発明の具体的な実施例で、HA遺伝子とヒト絨毛膜癌腫細胞株から得た5-HT6R遺伝子が連結された、HA-5-HT6R構築物を含むベクター(図1参照)をヒト胚腎細胞株(HEK293細胞株)に形質導入した。HA-5-HT6R遺伝子を特異的に発現する細胞株をPCR法でスクリーニングした後(図2参照)、前記選別された形質転換細胞株を1〜6世代まで培養した。各世代別に、HA-5-HT6R遺伝子が特異的に発現するかどうかを、PCR法で検証した(図3参照)。そして、本発明の細胞株は、HA-5-HT6Rを安定的に発現することが確認され、前記検証された細胞株を韓国細胞株研究財団に2008年09月12日付けで寄託した(寄託番号:KCLRF-BP-00187)。
【0017】
また、本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株にセロトニン(5-HT)を時間別で処理した後、ERK(細胞外信号調節キナーゼ)のリン酸化が増加したことを確認することで(図4参照)、前記細胞株から発現されたHA-5-HT6Rが細胞内で正常な機能を示すことを確認した。また、前記細胞株から5-HTとEMD386088刺激によってERKのリン酸化が増加し、SB258585によってその効果が減少することを確認した(図5参照)。同時に、本発明のHA-5-HT6Rを安定的に発現する細胞株を、キメラGα15タンパク質を発現させることができるベクターとリポフェクタミンで形質感染させた後、5-HTで刺激した結果、5-HT6Rを発現する細胞株の細胞内カルシウム流入と比較して、HA連結が5-HT6Rの機能を変えないことを確認し(図9及び図10参照)、また前記活性が5-HT濃度依存的であることを確認した(図11参照)。
【0018】
また、本発明の具体的な実施例で、HAに特異的な抗体及び大韓民国公開特許第2008-0004994号で5-HT6Rの結合タンパク質であることが確認されたFynに特異的な抗体を使用して、本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜内部に位置する5-HT6RのN末端に連結されたHAが細胞表面外に位置して(図6参照)、HA-5-HT6Rが細胞膜で観察されることを確認した(図7及び図8参照)。
【0019】
同時に、本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株とHA-5-HT6Rを一時的に発現する細胞株の細胞内カルシウム流入を比較した結果、本発明のHA-5-HT6Rを安定的に発現する細胞株が、HA-5-HT6Rを安定的に発現することで、一時的に発現する細胞株より実験の再現性が優秀であることを確認した(図12参照)。
【0020】
本発明の細胞株は、寄託番号KCLRF-BP-00187で寄託された、HA-5-HT6Rを安定的に発現する細胞株であることを特徴とする。
【0021】
前記HAは、細胞株で5-HT6Rと連結した形態に発現して細胞表面外に位置することを特徴とし、前記HAを使用して細胞表面に発現した5-HT6Rを選択的に確認することができる。
【0022】
前記形質導入は、リポフェクタミン、Dojindo社のHilymax、Fugene、jetPEI、Effectene、及びDreamFectからなる群より選択されるいずれか一つの常用化された形質導入用試薬を使用する方法;リン酸カルシウム、陽電荷性高分子、リポソーム、ナノ粒子、ヌクレオフェクション(nucleofection)、電気穿孔法、熱ショック、マグネットフェクション(magnetofection)を使用する方法;ならびにレトロウイルスを使用する方法からなる群より選択されるいずれか一つを使用して遂行することができる。
【0023】
また、本発明は、
(1)本発明のHA-5-HT6Rを安定的に発現する細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株の5-HT6R活性を測定する工程;及び
(3)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法を提供する。
【0024】
本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜内部に位置する5-HT6RのN末端に連結されたHAが細胞表面外に位置して(図6参照)、HA-5-HT6Rが細胞膜で観察されることを確認した(図7及び図8参照)。
【0025】
また、本発明の具体的な実施例で、HA-5-HT6Rを安定的に発現する細胞株の細胞内カルシウム流入を5-HT6Rを発現する細胞株と比較することで、HA連結が5-HT6Rの機能を変えないこと(図9及び図10参照)及び前記活性が5-HT濃度依存的であることを確認した(図11参照)。
【0026】
同時に、本発明の具体的な実施例で、HA-5-HT6Rを安定的に発現する細胞株とHA-5-HT6Rを一時的に発現する細胞株の細胞内カルシウム流入を比較した結果、本発明のHA-5-HT6Rを安定的に発現する細胞株が、HA-5-HT6Rを安定的に発現することにより、一時的に発現する細胞株より実験の再現性が優秀なことを確認した(図12参照)。
【0027】
したがって、本発明のHA-5-HT6Rを安定的に発現する細胞株は、細胞表面外に位置するHAを使用して細胞表面に発現した5-HT6Rを選択的に確認することができるので、5-HT6Rリガンドの高効率検出に有用に使用することができる。
【0028】
工程(1)の被検化合物は、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子であることが好ましいが、それに限定されるものではない。
【0029】
工程(2)の5-HT6R活性の測定は、これに制限されるものではないが、5-HT6Rによる細胞内カルシウム濃度流入を測定する方法によって行なうことができ、ここで、細胞内カルシウム濃度流入が測定される対象細胞株は、被検化合物処理前にキメラGα15タンパク質を発現することができるベクターとリポフェクタミンで形質感染することができる。
【0030】
また、本発明は、
(1)本発明のHA-5-HT6Rを安定的に発現する細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株のタンパク質を精製する工程;
(3)前記精製されたタンパク質の5-HT6R活性を測定する工程;及び
(4)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法を提供する。
【0031】
本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株を5-HT、EMD386088、及びSB258585で刺激した結果、前記形質転換細胞株が発現したHA-5-HT6Rが、細胞内で正常な機能を示すことを確認した(図4及び図5参照)。
【0032】
また、本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜内部に位置する5-HT6RのN末端に連結されたHAが、細胞表面外に位置して(図6参照)、HA-5-HT6Rが細胞膜で観察されることを確認した(図7及び図8参照)。
【0033】
したがって、本発明のHA-5-HT6Rを安定的に発現する細胞株は、細胞表面外に位置するHA(HA)を使用して細胞表面に発現した5-HT6Rを選択的に確認することができるので、5-HT6Rリガンドの高効率検出に有用に使用することができる。
【0034】
工程(1)の被検化合物は、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子であることが好ましいが、これに限定されるものではない。
【0035】
工程(2)の5-HT6R活性の測定は、これに制限されるものではないが、前記5-HT6Rによってリン酸化されたERKを測定する方法によって行なうことができる。
【0036】
同時に、本発明は本発明のHA-5-HT6Rを安定的に発現する細胞株を含む5-HT6Rリガンドの高効率検出用組成物を提供する。
【0037】
本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜内部に位置する5-HT6RのN末端に連結されたHAが細胞表面外に位置して(図6参照)、HA-5-HT6Rが細胞膜で観察されることを確認した(図7及び図8参照)。
【0038】
また、本発明の具体的な実施例で、HA連結が5-HT6Rの機能を変えないことを確認し(図9及び図10参照)、また、前記活性が5-HT濃度依存的であることを確認した(図11参照)。同時に、本発明の具体的な実施例で、本発明の細胞株がHA-5-HT6Rを安定的に発現することで、一時的に発現する細胞株より実験の再現性が優秀であることを確認した(図12参照)。
【0039】
したがって、本発明のHA-5-HT6Rを安定的に発現する細胞株は、細胞表面外に位置するHA(HA)を使用して細胞表面に発現した5-HT6Rを選択的に確認することができるので、5-HT6Rリガンドの高効率検出用組成物に使用することができる。
【0040】
本発明の細胞株は、寄託番号KCLRF-BP-00187で寄託にされたHA-5-HT6Rを安定的に発現する細胞株であることを特徴とする。
【0041】
前記組成物は、Gα15遺伝子、リポフェクタミン、蛍光性カルシウム標識物、及び洗浄緩衝溶液をさらに含むことができ、前記蛍光性カルシウム標識物では、カルシウム濃度に敏感なフルオ(Fluo)-4/AMとプルロニック(Pluronic)F-127等が使用できる。
【0042】
本発明(1)は、N末端にHA(血球凝集素)が連結された5-HT6R遺伝子構築物を含むベクターが宿主細胞に形質導入されてHA-5-HT6Rを安定的に発現する、細胞株である。
本発明(2)は、寄託番号KCLRF-BP-00187で寄託されたことを特徴とする、本発明(1)の細胞株である。
本発明(3)は、形質導入が、リポフェクタミン、Dojindo社のHilymax、Fugene、jetPEI、Effectene、及びDreamFectからなる群より選択されるいずれか一つの常用化された形質導入用試薬;リン酸カルシウム、陽電荷性高分子、リポソーム、ナノ粒子、ヌクレオフェクション(nucleofection)、電気穿孔法、熱ショック、マグネットフェクション(magnetofection)を使用する方法;ならびにレトロウイルスを使用する方法からなる群より選択されるいずれか一つを使用して遂行されることを特徴とする、本発明(1)の細胞株である。
本発明(4)は、宿主細胞が、HEK293、COS7、CHO-K1、及びCHO-G5Aからなる群より選択されることを特徴とする、本発明(1)の細胞株である。
本発明(5)は、
(1)本発明(1)の細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株の5-HT6R活性を測定する工程;及び
(3)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法である。
本発明(6)は、工程(1)の被検化合物が、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子からなる群より選択されるいずれか一つであることを特徴とする、本発明(5)の高効率検出方法である。
本発明(7)は、5-HT6R活性の測定が、前記5-HT6Rによる細胞内カルシウム濃度流入を測定する方法によって遂行されることを特徴とする、本発明(5)の方法である。
本発明(8)は、細胞内カルシウム濃度流入が測定される対象細胞株は、被検化合物を処理前にGα15タンパク質を発現させることができるベクターとリポフェクタミンで形質感染されることを特徴とする、本発明(7)の方法である。
本発明(9)は、
(1)本発明(1)の細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株のタンパク質を精製する工程;
(3)前記精製されたタンパク質の5-HT6R活性を測定する工程;及び
(4)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法である。
本発明(10)は、工程(1)の被検化合物が、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子からなる群より選択されるいずれか一つであることを特徴とする、本発明(9)の高効率検出方法である。
本発明(11)は、5-HT6R活性の測定が、前記5-HT6Rによってリン酸化されたERKを測定する方法によって行なわれることを特徴とする、本発明(9)の方法である。
本発明(12)は、本発明(1)の細胞株を含む5-HT6Rリガンドの高効率検出用組成物である。
本発明(13)は、細胞株が、寄託番号KCLRF-BP-00187で寄託されたことを特徴とする、本発明(12)の高効率検出用組成物である。
本発明(14)は、組成物が、Gα15タンパク質を発現させることができるベクター、リポフェクタミン、蛍光性カルシウム標識物、及び洗浄緩衝溶液をさらに含むことを特徴とする、本発明(12)の高効率検出用組成物である。
【発明の効果】
【0043】
本発明の細胞株は、HA-5-HT6Rを安定的に発現することによって、5-HT6Rに選択的に作用するリガンドの検出効率を増加させて、5-HT6Rと結合するタンパク質研究に有用に使用することができるので、5-HT6Rが関わる欝病及びアルツハイマー病などの脳疾患及び精神疾患の予防及び診断ならびに治療剤の開発に有用である。
【発明を実施するための最良の形態】
【0044】
以下、本発明を実施例によって詳しく説明する。
【0045】
但し、下記実施例は、本発明を例示するだけのものであって、本発明の内容が下記実施例によって限定されるものではない。
【実施例】
【0046】
実施例1 形質転換細胞株の作製
1-1 野生型細胞株の培養
HEK293細胞株(ATCC CRL1573)を10%牛胎児血清及び1%ペニシリン/ストレプトマイシン(v/v)が含まれたDMEM培地(ダルベッコ修飾イーグル培地)で37℃、5%CO2の加湿条件で培養した。前記培養液は、3〜4日に一回ずつ交換し、細胞は毎週間継代培養した。前記HEK293細胞株を、10cm培養皿に5.0×106程度塗布して12時間培養した。
【0047】
1-2 HA-5-HT6R細胞株の作製
HA-5-HT6R-pcDNA3.1(+)プラスミド(図1;Missouri S&T cDNA Resource Center、米国)をBglII 制限酵素で処理して線形化した後、リポフェクタミン2000(Invitrogen, 米国)と1:3の割合(線形化されたHA-5-HT6R-pcDNA3.1(+)12μg、リポフェクタミン36μl)でOpti-MEM(Invitrogen, 米国)培地に入れて5分間混合して30分後、培養皿に前記混合液を入れて細胞株を形質感染させた。6時間後に培地をDMEM培地に交換し、さらに24時間細胞を培養した後、800μg/mlのG418(Invitrogen, 米国)を添加して形質転換された細胞を選別した。14日間選択培養した後、コロニーを形成した細胞群をそれぞれ24ウェルプレートで継代培養して成長させて、最も早い成長を示した細胞群を選別した結果、HA-5-HT6Rを安定的に発現する細胞株を得た。安定的な細胞株を得た後、漸次にG418濃度を下げて400μg/ml添加された培地で培養した。
【0048】
1-3 5-HT6R細胞株の作製
5-HT6R-pcDNA3.1(+)プラスミド(Missouri S&T cDNA Resource Center, 米国)を使用して、実施例1-2の方法で形質転換された細胞株を得た。
【0049】
実施例2 形質転換細胞株の確認
2-1 形質転換細胞株の選別
実施例1-2で得た形質転換細胞株をコロニー別にDMEM培地で37℃、5%CO2細胞培養器で培養した後、トリゾール試薬(商品名)を使用してRNAを分離した。AMV逆転写酵素を使用してcDNAを作って、配列番号1で記載される正方向プライマー(5'-CCACTCTTCATGCGGGACTTC-3)及び配列番号2で記載される逆方向プライマー(5'-TCAGTTCGTGGGGATGCCAAG-3')を使用して、HA-5-HT6R遺伝子を増幅した。対照群には配列番号3で記載される正方向プライマー(5'-GTCACCAACTGGGACGACATG-3')及び配列番号4で記載される逆方向プライマー(5'-GCCGTCAGGCAGCTCGTAGC-3')を使用して、β-アクチン遺伝子を増幅した。PCR条件は、95℃で4分間予備変性させた後、95℃で1分、60℃で30秒、72℃で30秒間を30回反復して、最後に72℃で10分間反応させた後、4℃に冷却した。
【0050】
その結果、図2に示したようにHA-5-HT6R遺伝子(363bp)を特異的に増幅する細胞株(ライン1)を得た。
【0051】
2-2 HA-5-HT6Rを安定的に発現する形質転換細胞株の検定
実施例2-1の方法で培養した細胞株を3〜4日に一回ずつ培養液を交換し、毎週継代培養して総42日間1(P1)世代ないし6(P6)世代を得て、使用前まで-70℃に保管した。対照群には、野生型細胞株の1世代乃至6世代を使用した。
【0052】
前記方法で得た細胞株から、実施例2-1と同じ方法でRNAを得て、cDNA形成、及びHA-5-HT6R遺伝子を増幅した。対照群にβ-アクチン遺伝子を増幅した。
【0053】
その結果、図3に示したようにP1からP6までHA-5-HT6R遺伝子を特異的に増幅することを確認した。したがって、前記検証された細胞株を韓国細胞株研究財団に2008年09月12日付けで寄託した(寄託番号:KCLRF-BP-00187)。
【0054】
2-3 HA-5-HT6Rを一時的に発現する形質転換細胞株の作製
HA-5-HT6R-pcDNA3.1(+)プラスミドをリポフェクタミン2000と1:3の割合でOpti-MEM培地に入れて5分間混合し、30分後培養皿に前記混合液を入れて細胞株を形質感染させた。6時間後に培地をDMEM培地に交換し、さらに24時間細胞を培養して、HA-5-HT6Rを一時的に発現する形質転換細胞株を作製した。
【0055】
実施例3 HA-5-HT6Rの細胞信号伝達過程の分析
3-1 5-HT6Rの活性剤であるセロトニン(5-HT)に対する反応性の確認
3-1-1 5-HT処理
無血清DMEM培地が含まれた6ウェル培養皿に、実施例2の方法で選別したHA-5-HT6Rを安定的に発現する形質転換細胞株を1×106細胞/ウェルで分注した後、培養した。3時間後、20μ M5-HT(Sigma, 米国)を0〜60分間決められた間隔(0、1、5、15、30、及び60分)で処理した。
【0056】
3-1-2 ウエスタンブロット
5-HT処理時間別に試料を集めて、前記細胞を-20℃に保管してからタンパク質分解酵素抑制剤Complete Mini(Roche Diagnostics GmbH, ドイツ)を含んだ冷たいRIPA溶解緩衝溶液(upstate biotechnology, 米国)と一緒に均質器で粉砕して均質化させた。均質化した試料を13, 000rpmで10分間遠心分離した後、上澄み液と不溶性凝集体を分離した。分離した上澄み液のタンパク質濃度は、Bio-Radタンパク質分析キット(Bio-Rad, 米国)を使用して測定した。また、上澄み液を5×SDS(0.156M Tris-HCl, pH6.8, 2.5%SDS, 37.5%グリセロール, 37.5mM DTT)と1:4で混ぜて100℃で10分間沸かした。沸かした試料を10%SDS-PAGEゲルのウェルにローディングして、125Vで2時間電気泳動して分子量によって分離し、前記タンパク質を20V、400A以下の条件で1時間電気泳動してPVDF膜に移した。タンパク質が移された膜を12時間5%の脱脂乳で遮断して、1次抗体(抗-ERK/p-ERK抗体;Cell signaling, 米国)で4時間処理した後、TBST(Tris緩衝生理食塩水+0.1% tween)で10分間3回洗浄して、2次抗体(抗ウサギ-IgG-HRP;Amersham Bioscience, UK)を1時間処理した。また、TBSTで10分間4回洗浄後、ECL検出キット(Amersham Biosciences, UK)で発光反応を誘発し、Hyperfilm-MP(Amersham Biosciences, UK)に曝露して結合反応を観察した。
【0057】
その結果、図4に示したようにセロトニン(5-HT)刺激によってERKのリン酸化を増加させ、その影響が5分で最大値を示す傾向を確認した。
【0058】
3-2 5-HT6Rの活性剤であるEMD386088と拮抗剤であるSB258585に対する反応性の確認
無血清DMEM培地を含んだ細胞株を6ウェル培養皿に、実施例2の方法で選別した、HA-5-HT6Rを安定的に発現する形質転換細胞株を1×106細胞/ウェルで分注した後、培養した。3時間後、20μM 5-HT、1μM EMD386088(Tocris, 米国)及び10μM SB258585(Tocris, 米国)を5分間決められた間隔でそれぞれ処理した。EMD386088/SB258585の場合、SB258585を30分間前処理した後、EMD386088を処理した。前記化学物質処理によるERKリン酸化を実施例3-1-2のウエスタンブロット方法で確認した。
【0059】
その結果、図5に示したように5-HTとEMD386088刺激によってERKのリン酸化を増加させ、SB258585はその効果を減少させることを確認した。
【0060】
実施例4 HA-5-HT6Rの細胞表面発現の分析
4-1 Fyn過発現の前分析
本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜外部に位置する5-HT6RのN末端に連結されたHAが細胞表面外に位置することを確認するため(図6)、大韓民国公開特許第2008-0004994号で5-HT6Rの結合タンパク質であることが確認されたFynを使用した。
【0061】
具体的に、細胞全体または表面タンパク質分析は、免疫蛍光法を使用して行なった。コーティングされたカバーガラスで育てた実施例2で選別したHA-5-HT6Rを安定的に発現する形質転換細胞株を冷たいPBSで3回洗浄し、PBSに溶解した4%パラホルムアルデヒドを使用して4℃で30分間細胞を固定した後、冷たいPBSで3回洗浄した。以後、抗体を細胞内に投入させて細胞全体を観察するために、20分間PBST(PBS+0.2%Triton X-100)で処理したり、前記PBST処理工程を略して抗体を注入することによって抗体が細胞内部に流入しないようにして細胞表面を分析した。以後1時間5%のBSAで遮断し、1次抗体、抗-HA(1:500;Cell Signaling, 米国)と抗-Fyn(1:500;Cell Signaling, 米国)で6時間反応した後、PBSで10分間3回洗浄し、2次抗体を1時間処理した。PBSで3回洗浄後、CRYSTAL/MOUNT(Biomeda Corp., 米国)でスライド上にカバーガラスを固定させた。抗体に標識された二つの特定タンパク質の細胞内位置を観察するために共焦点レーザー走査顕微鏡LSM510(Zeiss, Gottingen, ドイツ)で映像を分析した。
【0062】
その結果、図7に示したように本発明の形質転換細胞株で安定的に発現するHA-5-HT6Rの宿主細胞であるHEK293細胞株で自主的に発現するFynタンパク質の分布を確認することができた。また、HA抗体が細胞表面膜を透過することができないように処理して使用した時、HA-5-HT6Rが細胞膜で観察された。
【0063】
4-2 Fyn過発現後の分析
無血清DMEM培地を含んだ100mmプレートに、実施例2の方法で選別したHA-5-HT6Rを安定的に発現する形質転換細胞株を1×106細胞/ウェルで分注して培養した後、Fyn-pcDNA3.1(+)とリポフェクタミン2000を1:3の割合でOpti-MEM培地に入れて5分間混合し、30分後に培養皿に前記混合液を入れて細胞株を形質感染させた。6時間後に培地をDMEM培地に交換し、さらに24時間細胞を培養してFynを過発現させた。
【0064】
以後、実施例4-1の方法で細胞全体を観察するために20分間PBST(PBS+0.2% Triton X-100)を添加して細胞全体を観察し、または、この工程を省略することで細胞表面を観察した。
【0065】
その結果、図8に示したようにHA抗体が細胞表面膜を透過することができないように処理した時、Fyn過発現時にも細胞膜でFynは観察されないで、HA-5-HT6Rだけが観察されたことを確認した。
【0066】
実施例5 HA-5-HT6Rの活性の測定
5-1 細胞処理条件
無血清DMEM培地を含んだ100mmプレートに、実施例2の方法で選別したHA-5-HT6Rを安定的に発現する細胞株とHA-5-HT6Rを一時的に発現する細胞株、野生型HEK293細胞株、及び5-HT6Rを発現する細胞株を5×106細胞/ウェルで96ウェルプレート一つを3区域に分けて分注して培養した。24時間後、Gα15タンパク質を発現させることができるベクター(Evi Kostenis, Institute for Pharmaceutical Biology, ドイツ)とリポフェクタミン2000とを1:3の重量比で混合して前記細胞株に形質感染させた後、1%FBSを含んだDMEMで16時間以上培養した。活性の検出の一日前にポリ-L-リジン(0.05mg/ml)で処理した96ウェルプレートに前記形質感染させた細胞を一ウェル当たり5×104の密度で分注した。受容体内在化(internalization)を抑制するために血清枯渇(serum starvation)条件を使用した。前記受容体内在化が細胞質内に内在化すると、分解されたり不活性化されて受容体を下向き調節したりする。
【0067】
5-2 FDSS6000を使用した蛍光カルシウムの測定
細胞基盤HTS器機FDSS6000(Hamamatsu Photonics, 日本)を使用して蛍光カルシウムを測定した。ここで、カルシウム濃度に敏感なフルオ-4/AMと0.001%プルロニックF-127(Sigma, 米国)を蛍光性カルシウム標識物に使用した。細胞を480nmに選択的に曝露して515nmを通過する放出蛍光をCCDカメラで撮ってデータを得た。
【0068】
具体的に、実験当日96ウェルプレートに付着した細胞をHEPES緩衝溶液で3回洗浄し、HEPES緩衝溶液に溶解した4μMフルオ-4/AMと0.001%プルロニックF-127で培養器で1時間反応させた後、HEPES緩衝溶液で再び2回洗浄した後、細胞を480nmに選択的に曝露して515nmを通過する放出蛍光をCCDカメラで撮ってデータを得た。
【0069】
5-3 HA連結の影響の調査
実施例5-1でGα15タンパク質を発現させることができるベクターで形質感染させたHA-5-HT6Rを安定的に発現する細胞株と、5-HT6Rを発現する細胞株に、10μM 5-HTをそれぞれ処理した後、実施例4-2の方法で活性を測定した。陰性対照群には、HAタグのみ入っている空ベクターで形質転換された細胞株を使用した。Fは、480nmでの蛍光強度で、F0は初期値を示す。
【0070】
その結果、図9に示したように、N末端に位置したHA連結が5-HT6Rの機能を変えないことを確認した。また、前記蛍光強度の変化(F/F0)を平均値で示した結果、図10に示したように、HA-5-HT6Rを安定的に発現する細胞株は、0.111±0.003、5-HT6Rを発現する細胞株は、0.105±0.003、及びHAタグのみ入っている空ベクターで形質転換された細胞株は、0.014±0.007(n=4)だった。
【0071】
5-4 5-HT濃度-依存性の活性
実施例5-1でGα15タンパク質を発現させることができるベクターで形質感染させたHA-5-HT6Rを安定的に発現する細胞株に、96ウェルプレートとは別に5-HT6受容体を活性化させる相異した濃度(10-11〜10-5M)の5-HT6受容体活性剤を含んだ1個の96ウェル薬物プレートを準備した。大部分の細胞基盤HTS器機の場合、薬物注入に必要な液体アプリケーションシステムはあるが、液体吸入システムはないので検出しようとする5-HT及び他の活性剤薬物を5倍の高濃度でHEPES緩衝溶液に20μlずつ準備して最終体積である100μl(付着状態培養細胞80+5×5-HT及び他の活性剤薬物)から1/5希釈して測定した。最終的に25秒基準測定、90秒間薬物処理条件下で5-HT6受容体活性剤である5-HTを10-10〜10-5M濃度範囲で蛍光標識染料であるフルオ-4を使用して5-HT6受容体活性に対するCa2+シグナルを%で求めた。480nmで最高比率値の面積を100%にして、5-HTの活性効果を求めた後、細胞に対する濃度-依存性グラフとこれからEC50値を求めた(図11)。ここで、5-HTに対するEC50値は、y/ymax=1/(1+(K1/2/[5-HT]nH)式を使用して求めた(ymaxは最大反応、K1/2はEC50値、nHはHill定数)。
【0072】
5-5 HA-5-HT6Rを安定的に発現する細胞株の確認
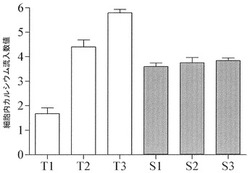
実施例5-1でGα15タンパク質を発現させることができるベクターで形質感染させたHA-5-HT6Rを安定的に発現する細胞株(S1〜S3)と、HA-5-HT6Rを一時的に発現する細胞株(T1〜T3)に、10μM 5-HTをそれぞれ処理した後、実施例4-2の方法で活性を測定し、Integration Ratio Max(Hamamatsu Photonics program, 日本)で細胞内カルシウム流入数値(Integrate ratio max values)を計算した。
【0073】
その結果、図12に示したように本発明のHA-5-HT6Rを安定的に発現する細胞株がHA-5-HT6Rを安定的に発現することにより、一時的に発現する細胞株より実験の再現性が優れていることを確認した。
【図面の簡単な説明】
【0074】
【図1】N末端にHA連結されたヒト5-HT6Rの遺伝子を含むプラスミドの開裂地図を示した図である。
【図2】RT-PCR法でHA-5-HT6Rが形質導入された細胞株を確認した、HA-5-HT6Rが形質導入された細胞株選別結果を示した図である。
【図3】RT-PCR法でHA-5-HT6Rが形質導入された細胞株を確認した、P1からP6まで安定的なHA-5-HT6R発現検定結果を示した図である。
【図4】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株のHA-5-HT6Rの機能を確認した、セロトニン(5-HT)の刺激によるERKのリン酸化結果を示した図である。
【図5】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株のHA-5-HT6Rの機能を確認した、5-HT6Rの活性剤である5-HT及びEMD386088、及び拮抗剤であるSB258585の効果確認結果を示した図である。
【図6】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株の細胞表面でHA-5-HT6Rの発現様相を分析した、5-HT6RのN末端に連結された、細胞表面外に位置したHAを示す模式図結果を示した図である(Total:細胞内部及び表面で発現様相を確認)。
【図7】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株の細胞表面でHA-5-HT6Rの発現様相を分析した、Fyn過発現前のFyn及びHA-5-HT6Rの分布結果を示した図である(Total:細胞内部及び表面で発現様相を確認)。
【図8】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株の細胞表面でHA-5-HT6Rの発現様相を分析した、Fynを過発現させた場合のFyn及びHA-5-HT6Rの分布結果を示した図である(Total:細胞内部及び表面で発現様相を確認)。
【図9】本発明の細胞株が発現したHA-5-HT6Rの機能が、HA連結によって変わらないことを確認した結果(細胞内カルシウム量の変化)を示した図である。
【図10】本発明の細胞株が発現したHA-5-HT6Rの機能が、HA連結によって変わらないことを確認した結果(細胞内カルシウム量の平均)を示した図である。
【図11】本発明の細胞株が発現したHA-5-HT6Rの機能が、HA連結によって変わらないことを確認した結果(HA-5-HT6Rの濃度-依存的活性)を示した図である。
【図12】一時的にまたは安定的にHA-5-HT6Rを発現する細胞株の再現性の差を示した図である。
【技術分野】
【0001】
本発明は、セロトニン6受容体(5-HT6R)リガンドの高効率検出方法に関するものである。
【背景技術】
【0002】
セロトニン受容体(5-HTR)は、5-HT1Rから5-HT7Rまでそれぞれの亜形を含み、現在まで総15種が知られていて、欝病、精神分裂症、不安症、睡眠障害などの精神疾患、及びアルツハイマー病疾患などに関わっていることが知られている。
【0003】
特に、5-HT6Rは、最近塩基配列が明らかにされた5-HTRで、まだ正確な機序が明かされていないが、退行性脳疾患と精神疾患などに関わっていることが知られている。最近、5-HT6Rの刺激が生化学的、行動学的な側面で抗欝剤のような効果を示すという研究が報告された。また、脳発生(brain development)、記憶と学習(learning and memory)、及びアルツハイマー病に至るまで、脳で発生し得る多くの重要な疾病と密接に関連しているという研究報告が漸次増加している(非特許文献1〜4)。5-HTRを作用点とする薬物としては、すべての5-HTRに非選択的に結合するクロザピンが知られており、5-HT6Rに選択的な薬物としては、SB258585があるが、まだ疾患の治療剤として使用されていない。欝病やアルツハイマー病疾患などに関連して、脳細胞で5-HT6Rの正確な機能及び5-HT6Rが関与した信号伝達機序がほとんど知られていない状況で、その機能及び機序研究と選択的リガンド開発のためには、5-HT6Rを選択的に研究することができるシステムが求められている。
【0004】
以上のことに鑑みて、本発明者等は、HA(血球凝集素)がN末端に連結された5-HT6Rを発現する細胞株を作製して、前記HA-5-HT6Rが細胞表面外に露出していて、前記HA-5-HT6Rが安定的に発現して、前記5-HT6Rの活性が維持されるので、前記細胞株が5-HT6Rに選択的なリガンドの開発のための高効率検出に活用できることを確認することによって本発明を完成した。
【非特許文献1】Grimaldi B等., Naunyn Schmiedebergs Arch Pharmacol., 1999年, 第357(4)巻, 393-400頁
【非特許文献2】Garcia-Alloza M等., Neuropsychopharmacology, 2004年, 第29(2)巻, 410-416頁
【非特許文献3】Lorke D等., BMC Neurosci., 2006年, 第27巻, 7-36頁
【非特許文献4】Greengard等., J Neurosci., 2007年, 第27(15)巻, 4201-4209頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明の目的は、5-HT6Rを安定的に発現する細胞株を提供することである。
【0006】
本発明の他の目的は、前記細胞株を使用した5-HT6Rリガンドの高効率検出方法を提供することである。
【0007】
本発明の他の目的は、前記細胞株を含む5-HT6Rリガンドの高効率検出用組成物を提供することである。
【課題を解決するための手段】
【0008】
前記目的を達成するために、本発明は、N末端にHA(血球凝集素)が連結された5-HT6R遺伝子構築物を含むベクターが宿主細胞に形質導入されて、HA-5-HT6Rを安定的に発現する細胞株を提供する。
【0009】
また、本発明は、
(1)本発明のHA-5-HT6Rを安定的に発現する細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株の5-HT6R活性を測定する工程;及び
(3)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法を提供する。
【0010】
また、本発明は、
(1)本発明のHA-5-HT6Rを安定的に発現する細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株のタンパク質を精製する工程;
(3)前記精製されたタンパク質の5-HT6R活性を測定する工程;及び
(4)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法を提供する。
【0011】
同時に、本発明は、本発明のHA-5-HT6Rを安定的に発現する細胞株を含む、5-HT6Rリガンドの高効率検出用組成物を提供する。
【0012】
以下、本発明で使用した用語を定義する。
【0013】
用語「5-HT6Rリガンド」は、5-HT6Rに結合して活性を調節する物質を意味する。
【0014】
以下、本発明を詳しく説明する。
【0015】
本発明は、N末端にHA(血球凝集素)が連結された5-HT6R遺伝子構築物を含むベクターが宿主細胞に形質導入されて、HA-5-HT6Rを安定的に発現する細胞株を提供する。
【0016】
本発明の具体的な実施例で、HA遺伝子とヒト絨毛膜癌腫細胞株から得た5-HT6R遺伝子が連結された、HA-5-HT6R構築物を含むベクター(図1参照)をヒト胚腎細胞株(HEK293細胞株)に形質導入した。HA-5-HT6R遺伝子を特異的に発現する細胞株をPCR法でスクリーニングした後(図2参照)、前記選別された形質転換細胞株を1〜6世代まで培養した。各世代別に、HA-5-HT6R遺伝子が特異的に発現するかどうかを、PCR法で検証した(図3参照)。そして、本発明の細胞株は、HA-5-HT6Rを安定的に発現することが確認され、前記検証された細胞株を韓国細胞株研究財団に2008年09月12日付けで寄託した(寄託番号:KCLRF-BP-00187)。
【0017】
また、本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株にセロトニン(5-HT)を時間別で処理した後、ERK(細胞外信号調節キナーゼ)のリン酸化が増加したことを確認することで(図4参照)、前記細胞株から発現されたHA-5-HT6Rが細胞内で正常な機能を示すことを確認した。また、前記細胞株から5-HTとEMD386088刺激によってERKのリン酸化が増加し、SB258585によってその効果が減少することを確認した(図5参照)。同時に、本発明のHA-5-HT6Rを安定的に発現する細胞株を、キメラGα15タンパク質を発現させることができるベクターとリポフェクタミンで形質感染させた後、5-HTで刺激した結果、5-HT6Rを発現する細胞株の細胞内カルシウム流入と比較して、HA連結が5-HT6Rの機能を変えないことを確認し(図9及び図10参照)、また前記活性が5-HT濃度依存的であることを確認した(図11参照)。
【0018】
また、本発明の具体的な実施例で、HAに特異的な抗体及び大韓民国公開特許第2008-0004994号で5-HT6Rの結合タンパク質であることが確認されたFynに特異的な抗体を使用して、本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜内部に位置する5-HT6RのN末端に連結されたHAが細胞表面外に位置して(図6参照)、HA-5-HT6Rが細胞膜で観察されることを確認した(図7及び図8参照)。
【0019】
同時に、本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株とHA-5-HT6Rを一時的に発現する細胞株の細胞内カルシウム流入を比較した結果、本発明のHA-5-HT6Rを安定的に発現する細胞株が、HA-5-HT6Rを安定的に発現することで、一時的に発現する細胞株より実験の再現性が優秀であることを確認した(図12参照)。
【0020】
本発明の細胞株は、寄託番号KCLRF-BP-00187で寄託された、HA-5-HT6Rを安定的に発現する細胞株であることを特徴とする。
【0021】
前記HAは、細胞株で5-HT6Rと連結した形態に発現して細胞表面外に位置することを特徴とし、前記HAを使用して細胞表面に発現した5-HT6Rを選択的に確認することができる。
【0022】
前記形質導入は、リポフェクタミン、Dojindo社のHilymax、Fugene、jetPEI、Effectene、及びDreamFectからなる群より選択されるいずれか一つの常用化された形質導入用試薬を使用する方法;リン酸カルシウム、陽電荷性高分子、リポソーム、ナノ粒子、ヌクレオフェクション(nucleofection)、電気穿孔法、熱ショック、マグネットフェクション(magnetofection)を使用する方法;ならびにレトロウイルスを使用する方法からなる群より選択されるいずれか一つを使用して遂行することができる。
【0023】
また、本発明は、
(1)本発明のHA-5-HT6Rを安定的に発現する細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株の5-HT6R活性を測定する工程;及び
(3)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法を提供する。
【0024】
本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜内部に位置する5-HT6RのN末端に連結されたHAが細胞表面外に位置して(図6参照)、HA-5-HT6Rが細胞膜で観察されることを確認した(図7及び図8参照)。
【0025】
また、本発明の具体的な実施例で、HA-5-HT6Rを安定的に発現する細胞株の細胞内カルシウム流入を5-HT6Rを発現する細胞株と比較することで、HA連結が5-HT6Rの機能を変えないこと(図9及び図10参照)及び前記活性が5-HT濃度依存的であることを確認した(図11参照)。
【0026】
同時に、本発明の具体的な実施例で、HA-5-HT6Rを安定的に発現する細胞株とHA-5-HT6Rを一時的に発現する細胞株の細胞内カルシウム流入を比較した結果、本発明のHA-5-HT6Rを安定的に発現する細胞株が、HA-5-HT6Rを安定的に発現することにより、一時的に発現する細胞株より実験の再現性が優秀なことを確認した(図12参照)。
【0027】
したがって、本発明のHA-5-HT6Rを安定的に発現する細胞株は、細胞表面外に位置するHAを使用して細胞表面に発現した5-HT6Rを選択的に確認することができるので、5-HT6Rリガンドの高効率検出に有用に使用することができる。
【0028】
工程(1)の被検化合物は、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子であることが好ましいが、それに限定されるものではない。
【0029】
工程(2)の5-HT6R活性の測定は、これに制限されるものではないが、5-HT6Rによる細胞内カルシウム濃度流入を測定する方法によって行なうことができ、ここで、細胞内カルシウム濃度流入が測定される対象細胞株は、被検化合物処理前にキメラGα15タンパク質を発現することができるベクターとリポフェクタミンで形質感染することができる。
【0030】
また、本発明は、
(1)本発明のHA-5-HT6Rを安定的に発現する細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株のタンパク質を精製する工程;
(3)前記精製されたタンパク質の5-HT6R活性を測定する工程;及び
(4)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法を提供する。
【0031】
本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株を5-HT、EMD386088、及びSB258585で刺激した結果、前記形質転換細胞株が発現したHA-5-HT6Rが、細胞内で正常な機能を示すことを確認した(図4及び図5参照)。
【0032】
また、本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜内部に位置する5-HT6RのN末端に連結されたHAが、細胞表面外に位置して(図6参照)、HA-5-HT6Rが細胞膜で観察されることを確認した(図7及び図8参照)。
【0033】
したがって、本発明のHA-5-HT6Rを安定的に発現する細胞株は、細胞表面外に位置するHA(HA)を使用して細胞表面に発現した5-HT6Rを選択的に確認することができるので、5-HT6Rリガンドの高効率検出に有用に使用することができる。
【0034】
工程(1)の被検化合物は、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子であることが好ましいが、これに限定されるものではない。
【0035】
工程(2)の5-HT6R活性の測定は、これに制限されるものではないが、前記5-HT6Rによってリン酸化されたERKを測定する方法によって行なうことができる。
【0036】
同時に、本発明は本発明のHA-5-HT6Rを安定的に発現する細胞株を含む5-HT6Rリガンドの高効率検出用組成物を提供する。
【0037】
本発明の具体的な実施例で、本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜内部に位置する5-HT6RのN末端に連結されたHAが細胞表面外に位置して(図6参照)、HA-5-HT6Rが細胞膜で観察されることを確認した(図7及び図8参照)。
【0038】
また、本発明の具体的な実施例で、HA連結が5-HT6Rの機能を変えないことを確認し(図9及び図10参照)、また、前記活性が5-HT濃度依存的であることを確認した(図11参照)。同時に、本発明の具体的な実施例で、本発明の細胞株がHA-5-HT6Rを安定的に発現することで、一時的に発現する細胞株より実験の再現性が優秀であることを確認した(図12参照)。
【0039】
したがって、本発明のHA-5-HT6Rを安定的に発現する細胞株は、細胞表面外に位置するHA(HA)を使用して細胞表面に発現した5-HT6Rを選択的に確認することができるので、5-HT6Rリガンドの高効率検出用組成物に使用することができる。
【0040】
本発明の細胞株は、寄託番号KCLRF-BP-00187で寄託にされたHA-5-HT6Rを安定的に発現する細胞株であることを特徴とする。
【0041】
前記組成物は、Gα15遺伝子、リポフェクタミン、蛍光性カルシウム標識物、及び洗浄緩衝溶液をさらに含むことができ、前記蛍光性カルシウム標識物では、カルシウム濃度に敏感なフルオ(Fluo)-4/AMとプルロニック(Pluronic)F-127等が使用できる。
【0042】
本発明(1)は、N末端にHA(血球凝集素)が連結された5-HT6R遺伝子構築物を含むベクターが宿主細胞に形質導入されてHA-5-HT6Rを安定的に発現する、細胞株である。
本発明(2)は、寄託番号KCLRF-BP-00187で寄託されたことを特徴とする、本発明(1)の細胞株である。
本発明(3)は、形質導入が、リポフェクタミン、Dojindo社のHilymax、Fugene、jetPEI、Effectene、及びDreamFectからなる群より選択されるいずれか一つの常用化された形質導入用試薬;リン酸カルシウム、陽電荷性高分子、リポソーム、ナノ粒子、ヌクレオフェクション(nucleofection)、電気穿孔法、熱ショック、マグネットフェクション(magnetofection)を使用する方法;ならびにレトロウイルスを使用する方法からなる群より選択されるいずれか一つを使用して遂行されることを特徴とする、本発明(1)の細胞株である。
本発明(4)は、宿主細胞が、HEK293、COS7、CHO-K1、及びCHO-G5Aからなる群より選択されることを特徴とする、本発明(1)の細胞株である。
本発明(5)は、
(1)本発明(1)の細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株の5-HT6R活性を測定する工程;及び
(3)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法である。
本発明(6)は、工程(1)の被検化合物が、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子からなる群より選択されるいずれか一つであることを特徴とする、本発明(5)の高効率検出方法である。
本発明(7)は、5-HT6R活性の測定が、前記5-HT6Rによる細胞内カルシウム濃度流入を測定する方法によって遂行されることを特徴とする、本発明(5)の方法である。
本発明(8)は、細胞内カルシウム濃度流入が測定される対象細胞株は、被検化合物を処理前にGα15タンパク質を発現させることができるベクターとリポフェクタミンで形質感染されることを特徴とする、本発明(7)の方法である。
本発明(9)は、
(1)本発明(1)の細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株のタンパク質を精製する工程;
(3)前記精製されたタンパク質の5-HT6R活性を測定する工程;及び
(4)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法である。
本発明(10)は、工程(1)の被検化合物が、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子からなる群より選択されるいずれか一つであることを特徴とする、本発明(9)の高効率検出方法である。
本発明(11)は、5-HT6R活性の測定が、前記5-HT6Rによってリン酸化されたERKを測定する方法によって行なわれることを特徴とする、本発明(9)の方法である。
本発明(12)は、本発明(1)の細胞株を含む5-HT6Rリガンドの高効率検出用組成物である。
本発明(13)は、細胞株が、寄託番号KCLRF-BP-00187で寄託されたことを特徴とする、本発明(12)の高効率検出用組成物である。
本発明(14)は、組成物が、Gα15タンパク質を発現させることができるベクター、リポフェクタミン、蛍光性カルシウム標識物、及び洗浄緩衝溶液をさらに含むことを特徴とする、本発明(12)の高効率検出用組成物である。
【発明の効果】
【0043】
本発明の細胞株は、HA-5-HT6Rを安定的に発現することによって、5-HT6Rに選択的に作用するリガンドの検出効率を増加させて、5-HT6Rと結合するタンパク質研究に有用に使用することができるので、5-HT6Rが関わる欝病及びアルツハイマー病などの脳疾患及び精神疾患の予防及び診断ならびに治療剤の開発に有用である。
【発明を実施するための最良の形態】
【0044】
以下、本発明を実施例によって詳しく説明する。
【0045】
但し、下記実施例は、本発明を例示するだけのものであって、本発明の内容が下記実施例によって限定されるものではない。
【実施例】
【0046】
実施例1 形質転換細胞株の作製
1-1 野生型細胞株の培養
HEK293細胞株(ATCC CRL1573)を10%牛胎児血清及び1%ペニシリン/ストレプトマイシン(v/v)が含まれたDMEM培地(ダルベッコ修飾イーグル培地)で37℃、5%CO2の加湿条件で培養した。前記培養液は、3〜4日に一回ずつ交換し、細胞は毎週間継代培養した。前記HEK293細胞株を、10cm培養皿に5.0×106程度塗布して12時間培養した。
【0047】
1-2 HA-5-HT6R細胞株の作製
HA-5-HT6R-pcDNA3.1(+)プラスミド(図1;Missouri S&T cDNA Resource Center、米国)をBglII 制限酵素で処理して線形化した後、リポフェクタミン2000(Invitrogen, 米国)と1:3の割合(線形化されたHA-5-HT6R-pcDNA3.1(+)12μg、リポフェクタミン36μl)でOpti-MEM(Invitrogen, 米国)培地に入れて5分間混合して30分後、培養皿に前記混合液を入れて細胞株を形質感染させた。6時間後に培地をDMEM培地に交換し、さらに24時間細胞を培養した後、800μg/mlのG418(Invitrogen, 米国)を添加して形質転換された細胞を選別した。14日間選択培養した後、コロニーを形成した細胞群をそれぞれ24ウェルプレートで継代培養して成長させて、最も早い成長を示した細胞群を選別した結果、HA-5-HT6Rを安定的に発現する細胞株を得た。安定的な細胞株を得た後、漸次にG418濃度を下げて400μg/ml添加された培地で培養した。
【0048】
1-3 5-HT6R細胞株の作製
5-HT6R-pcDNA3.1(+)プラスミド(Missouri S&T cDNA Resource Center, 米国)を使用して、実施例1-2の方法で形質転換された細胞株を得た。
【0049】
実施例2 形質転換細胞株の確認
2-1 形質転換細胞株の選別
実施例1-2で得た形質転換細胞株をコロニー別にDMEM培地で37℃、5%CO2細胞培養器で培養した後、トリゾール試薬(商品名)を使用してRNAを分離した。AMV逆転写酵素を使用してcDNAを作って、配列番号1で記載される正方向プライマー(5'-CCACTCTTCATGCGGGACTTC-3)及び配列番号2で記載される逆方向プライマー(5'-TCAGTTCGTGGGGATGCCAAG-3')を使用して、HA-5-HT6R遺伝子を増幅した。対照群には配列番号3で記載される正方向プライマー(5'-GTCACCAACTGGGACGACATG-3')及び配列番号4で記載される逆方向プライマー(5'-GCCGTCAGGCAGCTCGTAGC-3')を使用して、β-アクチン遺伝子を増幅した。PCR条件は、95℃で4分間予備変性させた後、95℃で1分、60℃で30秒、72℃で30秒間を30回反復して、最後に72℃で10分間反応させた後、4℃に冷却した。
【0050】
その結果、図2に示したようにHA-5-HT6R遺伝子(363bp)を特異的に増幅する細胞株(ライン1)を得た。
【0051】
2-2 HA-5-HT6Rを安定的に発現する形質転換細胞株の検定
実施例2-1の方法で培養した細胞株を3〜4日に一回ずつ培養液を交換し、毎週継代培養して総42日間1(P1)世代ないし6(P6)世代を得て、使用前まで-70℃に保管した。対照群には、野生型細胞株の1世代乃至6世代を使用した。
【0052】
前記方法で得た細胞株から、実施例2-1と同じ方法でRNAを得て、cDNA形成、及びHA-5-HT6R遺伝子を増幅した。対照群にβ-アクチン遺伝子を増幅した。
【0053】
その結果、図3に示したようにP1からP6までHA-5-HT6R遺伝子を特異的に増幅することを確認した。したがって、前記検証された細胞株を韓国細胞株研究財団に2008年09月12日付けで寄託した(寄託番号:KCLRF-BP-00187)。
【0054】
2-3 HA-5-HT6Rを一時的に発現する形質転換細胞株の作製
HA-5-HT6R-pcDNA3.1(+)プラスミドをリポフェクタミン2000と1:3の割合でOpti-MEM培地に入れて5分間混合し、30分後培養皿に前記混合液を入れて細胞株を形質感染させた。6時間後に培地をDMEM培地に交換し、さらに24時間細胞を培養して、HA-5-HT6Rを一時的に発現する形質転換細胞株を作製した。
【0055】
実施例3 HA-5-HT6Rの細胞信号伝達過程の分析
3-1 5-HT6Rの活性剤であるセロトニン(5-HT)に対する反応性の確認
3-1-1 5-HT処理
無血清DMEM培地が含まれた6ウェル培養皿に、実施例2の方法で選別したHA-5-HT6Rを安定的に発現する形質転換細胞株を1×106細胞/ウェルで分注した後、培養した。3時間後、20μ M5-HT(Sigma, 米国)を0〜60分間決められた間隔(0、1、5、15、30、及び60分)で処理した。
【0056】
3-1-2 ウエスタンブロット
5-HT処理時間別に試料を集めて、前記細胞を-20℃に保管してからタンパク質分解酵素抑制剤Complete Mini(Roche Diagnostics GmbH, ドイツ)を含んだ冷たいRIPA溶解緩衝溶液(upstate biotechnology, 米国)と一緒に均質器で粉砕して均質化させた。均質化した試料を13, 000rpmで10分間遠心分離した後、上澄み液と不溶性凝集体を分離した。分離した上澄み液のタンパク質濃度は、Bio-Radタンパク質分析キット(Bio-Rad, 米国)を使用して測定した。また、上澄み液を5×SDS(0.156M Tris-HCl, pH6.8, 2.5%SDS, 37.5%グリセロール, 37.5mM DTT)と1:4で混ぜて100℃で10分間沸かした。沸かした試料を10%SDS-PAGEゲルのウェルにローディングして、125Vで2時間電気泳動して分子量によって分離し、前記タンパク質を20V、400A以下の条件で1時間電気泳動してPVDF膜に移した。タンパク質が移された膜を12時間5%の脱脂乳で遮断して、1次抗体(抗-ERK/p-ERK抗体;Cell signaling, 米国)で4時間処理した後、TBST(Tris緩衝生理食塩水+0.1% tween)で10分間3回洗浄して、2次抗体(抗ウサギ-IgG-HRP;Amersham Bioscience, UK)を1時間処理した。また、TBSTで10分間4回洗浄後、ECL検出キット(Amersham Biosciences, UK)で発光反応を誘発し、Hyperfilm-MP(Amersham Biosciences, UK)に曝露して結合反応を観察した。
【0057】
その結果、図4に示したようにセロトニン(5-HT)刺激によってERKのリン酸化を増加させ、その影響が5分で最大値を示す傾向を確認した。
【0058】
3-2 5-HT6Rの活性剤であるEMD386088と拮抗剤であるSB258585に対する反応性の確認
無血清DMEM培地を含んだ細胞株を6ウェル培養皿に、実施例2の方法で選別した、HA-5-HT6Rを安定的に発現する形質転換細胞株を1×106細胞/ウェルで分注した後、培養した。3時間後、20μM 5-HT、1μM EMD386088(Tocris, 米国)及び10μM SB258585(Tocris, 米国)を5分間決められた間隔でそれぞれ処理した。EMD386088/SB258585の場合、SB258585を30分間前処理した後、EMD386088を処理した。前記化学物質処理によるERKリン酸化を実施例3-1-2のウエスタンブロット方法で確認した。
【0059】
その結果、図5に示したように5-HTとEMD386088刺激によってERKのリン酸化を増加させ、SB258585はその効果を減少させることを確認した。
【0060】
実施例4 HA-5-HT6Rの細胞表面発現の分析
4-1 Fyn過発現の前分析
本発明のHA-5-HT6Rを安定的に発現する細胞株で細胞膜外部に位置する5-HT6RのN末端に連結されたHAが細胞表面外に位置することを確認するため(図6)、大韓民国公開特許第2008-0004994号で5-HT6Rの結合タンパク質であることが確認されたFynを使用した。
【0061】
具体的に、細胞全体または表面タンパク質分析は、免疫蛍光法を使用して行なった。コーティングされたカバーガラスで育てた実施例2で選別したHA-5-HT6Rを安定的に発現する形質転換細胞株を冷たいPBSで3回洗浄し、PBSに溶解した4%パラホルムアルデヒドを使用して4℃で30分間細胞を固定した後、冷たいPBSで3回洗浄した。以後、抗体を細胞内に投入させて細胞全体を観察するために、20分間PBST(PBS+0.2%Triton X-100)で処理したり、前記PBST処理工程を略して抗体を注入することによって抗体が細胞内部に流入しないようにして細胞表面を分析した。以後1時間5%のBSAで遮断し、1次抗体、抗-HA(1:500;Cell Signaling, 米国)と抗-Fyn(1:500;Cell Signaling, 米国)で6時間反応した後、PBSで10分間3回洗浄し、2次抗体を1時間処理した。PBSで3回洗浄後、CRYSTAL/MOUNT(Biomeda Corp., 米国)でスライド上にカバーガラスを固定させた。抗体に標識された二つの特定タンパク質の細胞内位置を観察するために共焦点レーザー走査顕微鏡LSM510(Zeiss, Gottingen, ドイツ)で映像を分析した。
【0062】
その結果、図7に示したように本発明の形質転換細胞株で安定的に発現するHA-5-HT6Rの宿主細胞であるHEK293細胞株で自主的に発現するFynタンパク質の分布を確認することができた。また、HA抗体が細胞表面膜を透過することができないように処理して使用した時、HA-5-HT6Rが細胞膜で観察された。
【0063】
4-2 Fyn過発現後の分析
無血清DMEM培地を含んだ100mmプレートに、実施例2の方法で選別したHA-5-HT6Rを安定的に発現する形質転換細胞株を1×106細胞/ウェルで分注して培養した後、Fyn-pcDNA3.1(+)とリポフェクタミン2000を1:3の割合でOpti-MEM培地に入れて5分間混合し、30分後に培養皿に前記混合液を入れて細胞株を形質感染させた。6時間後に培地をDMEM培地に交換し、さらに24時間細胞を培養してFynを過発現させた。
【0064】
以後、実施例4-1の方法で細胞全体を観察するために20分間PBST(PBS+0.2% Triton X-100)を添加して細胞全体を観察し、または、この工程を省略することで細胞表面を観察した。
【0065】
その結果、図8に示したようにHA抗体が細胞表面膜を透過することができないように処理した時、Fyn過発現時にも細胞膜でFynは観察されないで、HA-5-HT6Rだけが観察されたことを確認した。
【0066】
実施例5 HA-5-HT6Rの活性の測定
5-1 細胞処理条件
無血清DMEM培地を含んだ100mmプレートに、実施例2の方法で選別したHA-5-HT6Rを安定的に発現する細胞株とHA-5-HT6Rを一時的に発現する細胞株、野生型HEK293細胞株、及び5-HT6Rを発現する細胞株を5×106細胞/ウェルで96ウェルプレート一つを3区域に分けて分注して培養した。24時間後、Gα15タンパク質を発現させることができるベクター(Evi Kostenis, Institute for Pharmaceutical Biology, ドイツ)とリポフェクタミン2000とを1:3の重量比で混合して前記細胞株に形質感染させた後、1%FBSを含んだDMEMで16時間以上培養した。活性の検出の一日前にポリ-L-リジン(0.05mg/ml)で処理した96ウェルプレートに前記形質感染させた細胞を一ウェル当たり5×104の密度で分注した。受容体内在化(internalization)を抑制するために血清枯渇(serum starvation)条件を使用した。前記受容体内在化が細胞質内に内在化すると、分解されたり不活性化されて受容体を下向き調節したりする。
【0067】
5-2 FDSS6000を使用した蛍光カルシウムの測定
細胞基盤HTS器機FDSS6000(Hamamatsu Photonics, 日本)を使用して蛍光カルシウムを測定した。ここで、カルシウム濃度に敏感なフルオ-4/AMと0.001%プルロニックF-127(Sigma, 米国)を蛍光性カルシウム標識物に使用した。細胞を480nmに選択的に曝露して515nmを通過する放出蛍光をCCDカメラで撮ってデータを得た。
【0068】
具体的に、実験当日96ウェルプレートに付着した細胞をHEPES緩衝溶液で3回洗浄し、HEPES緩衝溶液に溶解した4μMフルオ-4/AMと0.001%プルロニックF-127で培養器で1時間反応させた後、HEPES緩衝溶液で再び2回洗浄した後、細胞を480nmに選択的に曝露して515nmを通過する放出蛍光をCCDカメラで撮ってデータを得た。
【0069】
5-3 HA連結の影響の調査
実施例5-1でGα15タンパク質を発現させることができるベクターで形質感染させたHA-5-HT6Rを安定的に発現する細胞株と、5-HT6Rを発現する細胞株に、10μM 5-HTをそれぞれ処理した後、実施例4-2の方法で活性を測定した。陰性対照群には、HAタグのみ入っている空ベクターで形質転換された細胞株を使用した。Fは、480nmでの蛍光強度で、F0は初期値を示す。
【0070】
その結果、図9に示したように、N末端に位置したHA連結が5-HT6Rの機能を変えないことを確認した。また、前記蛍光強度の変化(F/F0)を平均値で示した結果、図10に示したように、HA-5-HT6Rを安定的に発現する細胞株は、0.111±0.003、5-HT6Rを発現する細胞株は、0.105±0.003、及びHAタグのみ入っている空ベクターで形質転換された細胞株は、0.014±0.007(n=4)だった。
【0071】
5-4 5-HT濃度-依存性の活性
実施例5-1でGα15タンパク質を発現させることができるベクターで形質感染させたHA-5-HT6Rを安定的に発現する細胞株に、96ウェルプレートとは別に5-HT6受容体を活性化させる相異した濃度(10-11〜10-5M)の5-HT6受容体活性剤を含んだ1個の96ウェル薬物プレートを準備した。大部分の細胞基盤HTS器機の場合、薬物注入に必要な液体アプリケーションシステムはあるが、液体吸入システムはないので検出しようとする5-HT及び他の活性剤薬物を5倍の高濃度でHEPES緩衝溶液に20μlずつ準備して最終体積である100μl(付着状態培養細胞80+5×5-HT及び他の活性剤薬物)から1/5希釈して測定した。最終的に25秒基準測定、90秒間薬物処理条件下で5-HT6受容体活性剤である5-HTを10-10〜10-5M濃度範囲で蛍光標識染料であるフルオ-4を使用して5-HT6受容体活性に対するCa2+シグナルを%で求めた。480nmで最高比率値の面積を100%にして、5-HTの活性効果を求めた後、細胞に対する濃度-依存性グラフとこれからEC50値を求めた(図11)。ここで、5-HTに対するEC50値は、y/ymax=1/(1+(K1/2/[5-HT]nH)式を使用して求めた(ymaxは最大反応、K1/2はEC50値、nHはHill定数)。
【0072】
5-5 HA-5-HT6Rを安定的に発現する細胞株の確認
実施例5-1でGα15タンパク質を発現させることができるベクターで形質感染させたHA-5-HT6Rを安定的に発現する細胞株(S1〜S3)と、HA-5-HT6Rを一時的に発現する細胞株(T1〜T3)に、10μM 5-HTをそれぞれ処理した後、実施例4-2の方法で活性を測定し、Integration Ratio Max(Hamamatsu Photonics program, 日本)で細胞内カルシウム流入数値(Integrate ratio max values)を計算した。
【0073】
その結果、図12に示したように本発明のHA-5-HT6Rを安定的に発現する細胞株がHA-5-HT6Rを安定的に発現することにより、一時的に発現する細胞株より実験の再現性が優れていることを確認した。
【図面の簡単な説明】
【0074】
【図1】N末端にHA連結されたヒト5-HT6Rの遺伝子を含むプラスミドの開裂地図を示した図である。
【図2】RT-PCR法でHA-5-HT6Rが形質導入された細胞株を確認した、HA-5-HT6Rが形質導入された細胞株選別結果を示した図である。
【図3】RT-PCR法でHA-5-HT6Rが形質導入された細胞株を確認した、P1からP6まで安定的なHA-5-HT6R発現検定結果を示した図である。
【図4】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株のHA-5-HT6Rの機能を確認した、セロトニン(5-HT)の刺激によるERKのリン酸化結果を示した図である。
【図5】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株のHA-5-HT6Rの機能を確認した、5-HT6Rの活性剤である5-HT及びEMD386088、及び拮抗剤であるSB258585の効果確認結果を示した図である。
【図6】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株の細胞表面でHA-5-HT6Rの発現様相を分析した、5-HT6RのN末端に連結された、細胞表面外に位置したHAを示す模式図結果を示した図である(Total:細胞内部及び表面で発現様相を確認)。
【図7】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株の細胞表面でHA-5-HT6Rの発現様相を分析した、Fyn過発現前のFyn及びHA-5-HT6Rの分布結果を示した図である(Total:細胞内部及び表面で発現様相を確認)。
【図8】本発明のHA-5-HT6Rが形質導入されたHEK293細胞株の細胞表面でHA-5-HT6Rの発現様相を分析した、Fynを過発現させた場合のFyn及びHA-5-HT6Rの分布結果を示した図である(Total:細胞内部及び表面で発現様相を確認)。
【図9】本発明の細胞株が発現したHA-5-HT6Rの機能が、HA連結によって変わらないことを確認した結果(細胞内カルシウム量の変化)を示した図である。
【図10】本発明の細胞株が発現したHA-5-HT6Rの機能が、HA連結によって変わらないことを確認した結果(細胞内カルシウム量の平均)を示した図である。
【図11】本発明の細胞株が発現したHA-5-HT6Rの機能が、HA連結によって変わらないことを確認した結果(HA-5-HT6Rの濃度-依存的活性)を示した図である。
【図12】一時的にまたは安定的にHA-5-HT6Rを発現する細胞株の再現性の差を示した図である。
【特許請求の範囲】
【請求項1】
N末端にHA(血球凝集素)が連結された5-HT6R遺伝子構築物を含むベクターが宿主細胞に形質導入されてHA-5-HT6Rを安定的に発現する、細胞株。
【請求項2】
寄託番号KCLRF-BP-00187で寄託されたことを特徴とする、請求項1に記載の細胞株。
【請求項3】
形質導入が、リポフェクタミン、Dojindo社のHilymax、Fugene、jetPEI、Effectene、及びDreamFectからなる群より選択されるいずれか一つの常用化された形質導入用試薬;リン酸カルシウム、陽電荷性高分子、リポソーム、ナノ粒子、ヌクレオフェクション(nucleofection)、電気穿孔法、熱ショック、マグネットフェクション(magnetofection)を使用する方法;ならびにレトロウイルスを使用する方法からなる群より選択されるいずれか一つを使用して遂行されることを特徴とする、請求項1に記載の細胞株。
【請求項4】
宿主細胞が、HEK293、COS7、CHO-K1、及びCHO-G5Aからなる群より選択されることを特徴とする、請求項1に記載の細胞株。
【請求項5】
(1)請求項1に記載の細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株の5-HT6R活性を測定する工程;及び
(3)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法。
【請求項6】
工程(1)の被検化合物が、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子からなる群より選択されるいずれか一つであることを特徴とする、請求項5に記載の高効率検出方法。
【請求項7】
5-HT6R活性の測定が、前記5-HT6Rによる細胞内カルシウム濃度流入を測定する方法によって遂行されることを特徴とする、請求項5に記載の方法。
【請求項8】
細胞内カルシウム濃度流入が測定される対象細胞株が、被検化合物を処理前にGα15タンパク質を発現させることができるベクターとリポフェクタミンで形質感染されることを特徴とする、請求項7に記載の方法。
【請求項9】
(1)請求項1に記載の細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株のタンパク質を精製する工程;
(3)前記精製されたタンパク質の5-HT6R活性を測定する工程;及び
(4)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法。
【請求項10】
工程(1)の被検化合物が、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子からなる群より選択されるいずれか一つであることを特徴とする、請求項9に記載の高効率検出方法。
【請求項11】
5-HT6R活性の測定が、前記5-HT6Rによってリン酸化されたERKを測定する方法によって行なわれることを特徴とする、請求項9に記載の方法。
【請求項12】
請求項1に記載の細胞株を含む5-HT6Rリガンドの高効率検出用組成物。
【請求項13】
細胞株が、寄託番号KCLRF-BP-00187で寄託されたことを特徴とする、請求項12に記載の高効率検出用組成物。
【請求項14】
組成物が、Gα15タンパク質を発現させることができるベクター、リポフェクタミン、蛍光性カルシウム標識物、及び洗浄緩衝溶液をさらに含むことを特徴とする、請求項12に記載の高効率検出用組成物。
【請求項1】
N末端にHA(血球凝集素)が連結された5-HT6R遺伝子構築物を含むベクターが宿主細胞に形質導入されてHA-5-HT6Rを安定的に発現する、細胞株。
【請求項2】
寄託番号KCLRF-BP-00187で寄託されたことを特徴とする、請求項1に記載の細胞株。
【請求項3】
形質導入が、リポフェクタミン、Dojindo社のHilymax、Fugene、jetPEI、Effectene、及びDreamFectからなる群より選択されるいずれか一つの常用化された形質導入用試薬;リン酸カルシウム、陽電荷性高分子、リポソーム、ナノ粒子、ヌクレオフェクション(nucleofection)、電気穿孔法、熱ショック、マグネットフェクション(magnetofection)を使用する方法;ならびにレトロウイルスを使用する方法からなる群より選択されるいずれか一つを使用して遂行されることを特徴とする、請求項1に記載の細胞株。
【請求項4】
宿主細胞が、HEK293、COS7、CHO-K1、及びCHO-G5Aからなる群より選択されることを特徴とする、請求項1に記載の細胞株。
【請求項5】
(1)請求項1に記載の細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株の5-HT6R活性を測定する工程;及び
(3)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法。
【請求項6】
工程(1)の被検化合物が、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子からなる群より選択されるいずれか一つであることを特徴とする、請求項5に記載の高効率検出方法。
【請求項7】
5-HT6R活性の測定が、前記5-HT6Rによる細胞内カルシウム濃度流入を測定する方法によって遂行されることを特徴とする、請求項5に記載の方法。
【請求項8】
細胞内カルシウム濃度流入が測定される対象細胞株が、被検化合物を処理前にGα15タンパク質を発現させることができるベクターとリポフェクタミンで形質感染されることを特徴とする、請求項7に記載の方法。
【請求項9】
(1)請求項1に記載の細胞株に被検化合物を処理する工程;
(2)前記処理された細胞株のタンパク質を精製する工程;
(3)前記精製されたタンパク質の5-HT6R活性を測定する工程;及び
(4)未処理の細胞株と比較して、前記細胞株から5-HT6R活性が増加または減少した被検化合物を選別する工程を含む、
5-HT6Rリガンドの高効率検出方法。
【請求項10】
工程(1)の被検化合物が、天然化合物、合成化合物、RNA、DNA、ポリペプチド、酵素、タンパク質、リガンド、抗体、抗原、バクテリアまたは真菌の代謝産物、及び生物活性分子からなる群より選択されるいずれか一つであることを特徴とする、請求項9に記載の高効率検出方法。
【請求項11】
5-HT6R活性の測定が、前記5-HT6Rによってリン酸化されたERKを測定する方法によって行なわれることを特徴とする、請求項9に記載の方法。
【請求項12】
請求項1に記載の細胞株を含む5-HT6Rリガンドの高効率検出用組成物。
【請求項13】
細胞株が、寄託番号KCLRF-BP-00187で寄託されたことを特徴とする、請求項12に記載の高効率検出用組成物。
【請求項14】
組成物が、Gα15タンパク質を発現させることができるベクター、リポフェクタミン、蛍光性カルシウム標識物、及び洗浄緩衝溶液をさらに含むことを特徴とする、請求項12に記載の高効率検出用組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2010−81931(P2010−81931A)
【公開日】平成22年4月15日(2010.4.15)
【国際特許分類】
【出願番号】特願2008−319337(P2008−319337)
【出願日】平成20年12月16日(2008.12.16)
【出願人】(502336265)コリア インスティチュート オブ サイエンス アンド テクノロジー (7)
【Fターム(参考)】
【公開日】平成22年4月15日(2010.4.15)
【国際特許分類】
【出願日】平成20年12月16日(2008.12.16)
【出願人】(502336265)コリア インスティチュート オブ サイエンス アンド テクノロジー (7)
【Fターム(参考)】
[ Back to top ]

