ゼラチンハイドロゲルを用いたヘパリンの徐放
【課題】 局所においてヘパリンあるいは低分子量ヘパリンを長時間にわたって徐放することにより、副作用となる出血傾向を軽減しつつ、病変部において効率よくHGFの産生を促進して、腎臓における線維化を抑制できる組成物を提供すること。
【解決手段】 カチオン化ゼラチンとヘパリンを含む徐放性ゼラチンハイドロゲル組成物が開示される。また、カチオン化ゼラチンとヘパリンとのポリイオンコンプレックスを含む徐放性ゼラチンハイドロゲル組成物も提供される。本発明のハイドロゲル組成物において、好ましくはヘパリンは低分子量ヘパリンである。
【解決手段】 カチオン化ゼラチンとヘパリンを含む徐放性ゼラチンハイドロゲル組成物が開示される。また、カチオン化ゼラチンとヘパリンとのポリイオンコンプレックスを含む徐放性ゼラチンハイドロゲル組成物も提供される。本発明のハイドロゲル組成物において、好ましくはヘパリンは低分子量ヘパリンである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ゼラチンハイドロゲルを用いたヘパリンの徐放用組成物に関する。
【背景技術】
【0002】
腎臓を初めとする種々の臓器において、炎症反応に引き続いて起こってくる組織の線維化は臓器の機能不全を誘発する。最近、進行性糸球体疾患の慢性腎不全に至る過程において、腎間質病変は本疾患の予後と良く相関し、この線維化の抑制は、慢性腎不全への移行を抑制すると示唆されている。また、この線維化を抑制する増殖因子の一つとしてHGFが報告されている(非特許文献1,2)。
【0003】
ヘパリンおよび低分子量ヘパリン(LMWH)は、肺の線維芽細胞において肝細胞増殖因子(HGF)産生を促進すると報告されている(非特許文献3,4)。さらに、腎糸球体に存在するメサンギウム細胞は、HGF産生細胞の一つとして報告されている(非特許文献3)。また、ヘパリンの血液凝固抑制作用は、主に血液凝固因子の一つであるFactor Xaを抑制することに起因し、この酵素については腎炎の増悪因子としても考えられている(非特許文献5,6)。したがって、ヘパリンを投与することにより、慢性腎炎における抗線維化抑制効果が期待できる。
【0004】
しかしながらヘパリンは、投与後、大半が肝臓でヘパリナーゼによって分解され活性の低いウロヘパリンとして排泄されるため、全身投与では十分量標的臓器に到達しない可能性が考えられる。また、ヘパリンを大量に投与すると、出血傾向を誘発するという副作用が生ずる恐れがある。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】HGF as a renotrophic and anti-fibrotic regulator in chronic renal disease. Mizuno S et alFront Biosci. 2008 May 1;13:7072-86. Review.
【非特許文献2】アリストロキア酸中毒性腎症に対するHepatocyte Growth Factor (HGF)の線維化抑制作用の検討 渡辺 裕輔 埼玉医科大学雑誌 2004 31(1):13-22
【非特許文献3】肝細胞増殖因子(HGF)機能と産生制御 合田 榮一 日本薬理学雑誌 2002 119:287-294
【非特許文献4】Stimulation of hepatocyte growth factor production by heparin-derived oligosaccharides. Sakiyama R et al J Biochem. 2007 May;141(5):653-60. Epub 2007 Feb 22.
【非特許文献5】Role of coagulation and fibrinolysis in lung and renal fibrosis. Ruppert C et alHamostaseologie. 2008 Feb;28(1-2):30-2, 34-6. Review.
【非特許文献6】Roles of coagulation pathway and factor Xa in rat mesangioproliferative glomerulonephritis. Nomura K et al Lab Invest. 2007 Feb;87(2):150-60. Epub 2006 Dec 18.
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の目的は、局所においてヘパリンあるいは低分子量ヘパリンを長時間にわたって徐放することにより、副作用となる出血傾向を軽減しつつ、病変部において効率よくHGFの産生を促進して、腎臓における線維化を抑制できる組成物を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、ゼラチンハイドロゲルを用いることにより低分子量ヘパリンを徐放化しうることを見いだした。さらに、低分子量ヘパリンとカチオン化ゼラチンとのポリイオンコンプレックスを形成させた後、これをゼラチンハイドロゲル内に包含させた徐放性ゼラチンハイドロゲル組成物を開発した。
【0008】
すなわち本発明は、カチオン化ゼラチンとヘパリンまたは低分子量ヘパリンを含む徐放性ゼラチンハイドロゲル組成物を提供する。別の態様においては、本発明は、カチオン化ゼラチンとヘパリンまたは低分子量ヘパリンとのポリイオンコンプレックスを含む徐放性ゼラチンハイドロゲル組成物を提供する。
【図面の簡単な説明】
【0009】
【図1】図1はゼラチンのアミノ基導入反応に与えるエチレンジアミン添加量の影響を示す。
【図2】図2は放射ラベルした低分子量ヘパリン−ゼラチンハイドロゲルの生体内における埋込72時間後の残存量を示すグラフである。
【図3】図3は蛍光ラベルした低分子量ヘパリン−ゼラチンハイドロゲルの生体内におけるの徐放効果を示すグラフである。
【図4】図4はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスの見かけの分子サイズである。
【図5】図5はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスのゼータ電位である。
【図6】図6はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスを含むゼラチンハイドロゲルからの低分子量ヘパリン徐放を示す。
【発明を実施するための形態】
【0010】
本発明はヘパリンをゼラチンハイドロゲルとの複合体とし、徐放化することに関する。以下、本発明のゼラチンとヘパリンまたは低分子量ヘパリンの複合体を含有する徐放性ゼラチンハイドロゲルについて説明する。
【0011】
ヘパリンは、動物のあらゆる組織に普遍的に存在するアミノ糖とウロン酸の二糖の繰り返し構造からなる多糖である。分子内に硫酸基をもつため、負の電荷をもっている。ヘパリンは抗血液凝固剤として臨床に使用されている。
【0012】
本発明の徐放性ハイドロゲル組成物において、ヘパリンまたは低分子量ヘパリンとしては、市販の製品の任意のものを用いることができる。一例としては、ダルテパリンナトリウム、パルナパリンナトリウム等が挙げられる。低分子量ヘパリンとは、平均相対分子量が2,000〜10,000、好ましくは3,000〜8,000、より好ましくは4,000〜6,000であるヘパリンをいう。
【0013】
ゼラチンは、動物(牛や豚)の皮膚や骨の主成分であるコラーゲンを酸、アルカリ、あるいは酵素によって処理、変性させて得られるタンパク質である。この処理によって、構成アミノ酸の側鎖が加水分解をうけ、等電点が変化するとともに、ランダムコイル構造をもつゼラチンが得られる。このゼラチンを熱脱水処理や化学処理によって分子間架橋し、水和させることにより、ハイドロゲルが形成できる。
【0014】
本発明においては、ゼラチンにアミノ基を導入してカチオン化したゼラチン誘導体(カチオン化ゼラチン)を用いる。ヘパリンは負の電荷をもつため、カチオン化ゼラチンと静電的に相互作用して、より強く結合することができる。
【0015】
カチオン化ゼラチンのカチオン化の工程は公知の技術を用いることができる。例えば特開2007-182407に記載の方法を採用することができるが、カチオン化の方法は生理条件下でカチオン化する官能基を導入し得る方法であれば特に限定されない。ゼラチンハイドロゲルの有する水酸基あるいはカルボキシル基等に1、2または3級のアミノ基またはアンモニウム基を温和な条件下で導入する方法が好ましい。例えばエチレンジアミン、N,N−ジメチル−1,3−ジアミノプロパン等のアルキルジアミンや、トリメチルアンモニウムアセトヒドラジド、スペルミン、スペルミジンまたはジエチルアミド塩化物等を、種々の縮合剤、例えば1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩、塩化シアヌル、N,N’−カルボジイミダゾール、臭化シアン、ジエポキシ化合物、トシルクロライド、ジエチルトリアミン−N,N,N’,N’’,N’’−ペンタン酸ジ無水物等のジ無水物化合物、トリシルクロリド等を用いて反応させる方法を用いることができる。中でもエチレンジアミンまたはスペルミジンを反応させる方法が簡便且つ汎用性があり好適である。
【0016】
このとき、カチオン化ゼラチンのカチオン化の程度を示す指標として、アミノ基導入率を用いることができる。アミノ基導入率=(カチオン化ゼラチンの一分子あたりのアミノ基の数/カチオン化前のゼラチン一分子あたりのアミノ基の数)/(カチオン化前のゼラチン一分子あたりのカルボキシル基の数)*100(%)であらわされる。このアミノ基導入率は、好適には2%以上60%であり、特に好ましくは30%以上50%以下である。アミノ基導入率がこれらの下限以上であると、ゼラチンハイドロゲルとヘパリンまたは低分子量ヘパリンとの相互作用が強くなるので、徐放性の効果が向上する。一方、アミノ基導入率がこれらの上限を超えると、ゼラチンハイドロゲルのカチオン化が製造工程上困難になる場合がある。
【0017】
ゼラチンハイドロゲルは、架橋することにより水不溶性または水難溶性とする。ゼラチンは生体内で酵素によって分解されるため、ハイドロゲル作製時のゼラチン分子間の架橋度を変化させることによって、ハイドロゲルの分解を、数日から数カ月の範囲でコントロールすることが可能である。このゼラチンハイドロゲルは、すでに医用材料、医薬品添加物、食品などに用いられ、その生体適合性は実証済の材料である。このゼラチンハイドロゲルを用いることで、生物活性をもつタンパク質やプラスミドDNAの徐放化が可能であることが報告されている。この徐放システムでは、薬物はゼラチン分子と相互作用し、ハイドロゲル内に包含固定化されている。ハイドロゲルが分解され、ゼラチンが水可溶化されると、ハイドロゲル内に固定化されている薬物が放出されるという徐放メカニズムである。
【0018】
カチオン化ゼラチンハイドロゲルを製造するためには、公知の技術を用いることができる。例えば特開2007-182407に記載の方法を採用することができる、すなわち、ゼラチンの分子鎖を化学的手法、紫外線照射、あるいは熱により脱水処理することによって水に溶解しにくいように架橋して作製することができる。このとき、架橋の程度の上昇とともに含水ハイドロゲルに対する水の重量比(含水率)は低下する。
【0019】
好ましい態様においては、ゼラチンハイドロゲルは、種々の化学的架橋剤を用いてゼラチンの分子間に化学架橋を形成させることにより不溶化または難溶化することができる。化学的架橋剤としては、例えばグルタルアルデヒド、例えばEDC等の水溶性カルボジイミド、例えばプロピレンオキサイド、ジエポキシ化合物、水酸基、カルボキシル基、アミノ基、チオール基、イミダゾール基などの間に化学結合を作る縮合剤を用いることができる。好ましいものは、グルタルアルデヒドである。また、ゼラチンは、熱脱水処理、紫外線、ガンマ線、電子線照射によって架橋してもよい。さらに、これらの架橋処理を組み合わせて用いてもよい。他にも、塩架橋、静電的相互作用、水素結合、疎水性相互作用などを利用した物理架橋によりハイドロゲルを作製してもよい。
【0020】
ハイドロゲルを調製する際のゼラチンと架橋剤の濃度の好ましい範囲は、溶液中のゼラチンの濃度1〜20w/w%、架橋剤濃度0.01〜1w/w%である。架橋反応条件は特に制限はないが、例えば、0〜40℃、好ましくは25−30℃で、1〜48時間、好ましくは12−24時間で行うことができる。一般に、ゼラチンの濃度および架橋剤の濃度、架橋時間が増大するとともにハイドロゲルの架橋度は増加し、生体吸収性は低くなる。
【0021】
ゼラチンの架橋反応は、熱処理によっても行なうことができる。熱処理による架橋の例は以下のとおりである。ゼラチン水溶液(10重量%程度が好ましい)をプラスチックシャーレに流延し、風乾することによってゼラチンフィルムを得る。そのフイルムを減圧下、好ましくは10mmHg程度で通常110〜160℃、好ましくは120〜150℃、通常1〜48時間、好ましくは6〜24時間放置することによって行なう。また、紫外線によりゼラチンフィルムを架橋する場合は、得られたゼラチンフィルムを殺菌ランプの下において通常室温、好ましくは0〜40℃で放置する。また、ゼラチン水溶液を凍結乾燥することによってスポンジ状成形体を得る。これを同様に、熱処理および紫外線、ガンマ線、電子線によって架橋することができる。あるいは、上述の架橋法を組み合わせて用いることもできる。
【0022】
ゼラチンハイドロゲルの形状(立体構造)は、特に制限はないが、例えば、円柱状、角柱状、シート状、ディスク状、球状、ペースト状などがある。円柱状、角柱状、シート状、ディスク状のものは、埋込片として用いるのに特に適している。
【0023】
本発明におけるカチオン化ゼラチンハイドロゲルは適宜、適当な大きさ及び形に切断後凍結乾燥し滅菌して使用することができる。凍結乾燥は、例えば、ゼラチンハイドロゲルを蒸留水に入れ、液体窒素中で30分以上、又は−80℃で1時間以上凍結させた後に、凍結乾燥機で1〜3日間乾燥させることにより行うことができる。
【0024】
カチオン化ゼラチンハイドロゲルとヘパリンとの複合体は、凍結乾燥したカチオン化ゼラチンハイドロゲルを水、緩衝液、生理食塩水、リンゲル液などの中にヘパリンを含む溶液に含浸させることにより製造することができる。
【0025】
ゼラチンハイドロゲルとヘパリンとの複合体を生体に投与すると、複合体中に取り込まれているヘパリンは、ゼラチンハイドロゲルが生体内で分解されるに従って複合体外部へと徐々に放出される。この放出速度は、使用するゼラチンハイドロゲルの生体における分解および吸収の程度、ならびに複合体内でのヘパリンとゼラチンハイドロゲルとの結合の強さの程度および安定性により決定される。ゼラチンハイドロゲルの生体における分解および吸収の程度は、ハイドロゲル作製時における架橋の程度を調節することにより調節することができる。本発明にしたがえば、ヘパリンの優れた徐放性を有するとともに、十分な材料強度を有するヘパリン徐放材料を提供することができる。
【0026】
本発明の特に好ましい態様においては、ヘパリンとカチオン化ゼラチンのポリイオンコンプレックスを形成させ、これをゼラチンハイドロゲルに取り込ませて複合体を形成する。ポリイオンコンプレックスは、ヘパリンとカチオン化ゼラチンとがイオン結合により結合することにより形成されるコンプレックスである。ポリイオンコンプレックスは、ヘパリンとカチオン化ゼラチンとを、適当な緩衝溶液中で混合し、所定の時間放置することにより形成することができる。得られたポリイオンコンプレックスをゼラチン溶液と混合し、凍結乾燥した後に熱処理することにより、ポリイオンコンプレックス含有ゼラチンハイドロゲルを作製することができる。好ましくは、ハイドロゲルを構成するゼラチンとしては、アニオン性のゼラチン、例えば等電点4〜6をもつゼラチンやカルボキシル基を導入したアニオン化ゼラチンを用いる。このことにより、カチオン性の高い物質が直接生体組織に接することによって起こり得る炎症反応を回避することができる。
【0027】
以下に実施例により本発明をより詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【実施例1】
【0028】
カチオン化ゼラチンの作製
用いたゼラチン(新田ゼラチン株式会社より供与)は、豚皮由来I型コラーゲンを酸処理して得た等電点(pI9)のゼラチン(pI9ゼラチン)と牛骨由来I型コラーゲンをアルカリ処理して得たpI5のゼラチン(pI5ゼラチン)である。コラゲナーゼLは新田ゼラチン株式会社より供与された。低分子量ヘパリン(LMWH)は扶桑薬品工業株式会社より供与されたパルナパリンナトリウム(重量平均分子量5,000)を用いた。エチレンジアミン、1-エチル-3-(3-ジメチルアミノプロピル) カルボジイミド塩酸塩(EDC)、2,4,6-トリニトロベンゼンスルホン酸(TNBS)、1,9-ジメチルメチレンブルー(DMB)、およびドデシル硫酸ナトリウム(SDS)は、ナカライテスク株式会社から購入した。
【0029】
ゼラチンのカチオン化誘導体は、pI9ゼラチンのカルボキシル基へのエチレンジアミンの導入により作製した。pI9ゼラチン(1 g)を24 mlの0.1 Mリン酸緩衝水溶液(PB、pH 5.0)に37 ℃で溶解させた。次に、ゼラチンのカルボキシル基に対して、0.5、1.0、2.0、3.0、5.0、7.0、10、および50倍モル量のエチレンジアミンを加えた。11 Nの塩酸水溶液を用いて、溶液のpHを5.0に調整した。その後、ゼラチンのカルボキシル基に対して、3倍モル量のEDCを添加し、PBを加えることで液量50 ml、ゼラチンの最終濃度が2 wt%とした。37 ℃で4時間攪拌、エチレンジアミン導入反応を行った。反応物を再蒸留水(double distilled water、DDW)で3日間透析した。
【0030】
カチオン化ゼラチンのアミノ基導入率はTNBS法で求めた。pI9ゼラチンとカチオン化ゼラチンを0.2 Mリン酸緩衝生理食塩水溶液(PBS、pH 7.4)に溶解させた(1 mg/ml)。その溶液(100μl)に4 wt%の炭酸水素ナトリウム水溶液(200μl)と0.1 wt%のTNBS水溶液(200μl)を加え、37 ℃、2時間、反応させた。反応後、10 wt%のSDS水溶液(2000μl)と1NのHCl(100μl)を加え、溶液の415 nmにおける吸光度を測定した。この吸光度とβ−アラニンを用いた検量線から、pI9ゼラチンのカルボキシル基当りのアミノ基導入率を算出した。得られたカチオン化ゼラチンは、以下、エチレンジアミンの添加モル量によってE-0.5〜E-50と表した。
【0031】
【表1】

【0032】
図1に、ゼラチンのアミノ基導入反応に与えるエチレンジアミン添加量の影響を示す。エチレンジアミンの添加濃度の増加とともにゼラチンへのアミノ基導入率(ゼラチンのカチオン化度)は増大した。なお、統計分析は、ANOVAを用いた。p値が0.05より低いとき有意差があるとした。
【実施例2】
【0033】
カチオン化ゼラチンハイドロゲルからの低分子量ヘパリンまたはヘパリンの徐放
実施例1で得られたカチオン化ゼラチンをグルタルアルデヒドにより架橋して、E50、E10、E3、E0.5のカチオン化ゼラチンハイドロゲルを作製し、ヘパリンまたは低分子量ヘパリンを含浸させた。ゼラチンハイドロゲルを生体内に埋め込んでインビボにおけるヘパリンまたは低分子量ヘパリンの徐放特性を調べた。
【0034】
低分子量ヘパリンおよびヘパリンの125I ラベル
低分子量ヘパリンまたはヘパリン1mg/mLを30mL(0.1mol/L リン酸緩衝液(pH7.4)で調製)と、チラミン13.8mg (少量のDMSOに溶解)とを混合し、EDC (低分子量ヘパリンの場合5mg, ヘパリンの場合14.3mg)を加え、次にN-ヒドロキシスルホスクシンイミドナトリウム塩(Sulfo-NHS) 33mgを加え、攪拌しながら一晩反応させた。滅菌水に透析(2〜3日)後、凍結乾燥(2〜3日)した。チラミン導入低分子量ヘパリンまたはヘパリンにNaI125を反応させ、PD-10カラム (GEヘルスケア)でゲル濾過し、溶出バッファー3〜4mL付近で現れる高い放射活性を有する画分を放射ラベル化体として使用した。
【0035】
生体内における放射ラベル化体の徐放の確認
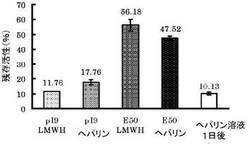
E50もしくはpI9ゼラチンを用いて作製したゼラチンハイドロゲル2mgに放射ラベル化体20μLを4℃にて一晩含浸させた。ネンブタール麻酔下において6週齢のddy マウス背部皮下にゲルを埋め込んだ。なおコントロールとして放射ラベル化体の溶液20μLを100μLにメスアップして背部皮下に投与した。埋込約72時間後においてマウスを安楽死処分し、背部の皮および残存するゲルの放射活性を測定した。埋込直後におけるハイドロゲルの放射活性に対して残存する放射活性の割合を算出した。
【0036】
結果を図2に示す。pI9ゼラチンに含浸させた場合は、徐放開始72時間後には9割弱が放出されてしまうのに対して、E50ゼラチンに含浸させた場合は、含浸72時間後においても、5割前後のヘパリンが残存していた。これは、ゼラチンにアミノ基を導入することにより、強い陰性荷電を持つヘパリンとの相互作用が高まったためと考えられる。
【0037】
蛍光ラベル化 (Cy5.5;GE ヘルスケア)
1mg/mL ヘパリン溶液を0.1mol/L Na2CO3(pH9.3) 溶液で溶解し市販のCy5.5 に1mL添加し室温で30分間放置した。PD-10カラムでゲル濾過を行い溶出バッファー3.5〜4.5mL付近で現れる強い蛍光を発する画分を蛍光ラベルヘパリンとして使用した。
【0038】
生体内における蛍光ラベル化体の徐放の確認
E50もしくはpI9ゼラチンを用いて作製したゼラチンハイドロゲル2mgに蛍光ラベルヘパリン20μLを4℃にて一晩含浸させた。ネンブタール麻酔下において6週齢のddy マウス背部皮下にゲルを埋め込む。なおコントロールとして蛍光ラベル化ヘパリンの溶液20μLを100μLにメスアップして背部皮下に投与した。埋込後、経時的に背部皮下におけるゲルの蛍光強度を観察した(Las 4000;富士フイルム)。
【0039】
結果を図3に示す。pI9ゼラチンに含浸させた場合24時間でほぼ放出してしまうのに対し、E50ゼラチンに含浸させた場合72時間時点でもヘパリンが残存していた。
【0040】
低分子量ヘパリンの抗facter Xa活性
熱架橋より低分子量ヘパリンの抗facter Xa活性が失活しないかどうかを調べた。低分子量ヘパリン水溶液(5mg/mL)を実施例1で得られたカチオン化ゼラチンの水溶液(30mg/mL)またはpI9ゼラチンの水溶液(100 mg/mL)とを等量混合した。さらにこれらの混合液と等量のpI5 ゼラチン水溶液(E50とのポリイオンコンプレックスには100mg/mL、pI9とのポリイオンコンプレックスには200mg/mLの濃度で使用)を混合し、ポリテトラフルオロエチレンモールド(44×44 mm2、深さ8 mm)に37℃で流延した後、液体窒素にて凍結した。凍結乾燥の後、得られた乾燥ハイドロゲル(24×24×2 mm3)を160 ℃で96時間熱脱水処理を行った。この低分子量ヘパリン含有ゼラチンハイドロゲルを5〜10mg程度秤量、秤量したゲルに500μLのPBS(-)を添加し、37℃で溶出開始、溶出開始から1, 2, 4, 8 時間後においてPBS(-)をサンプリングした。溶出開始24時間後においてPBS(-)を回収した後、残っているゲルをコラゲナーゼで分解し、ゲル溶解液をPBS(-)で500μLに合わせた。それぞれの時間ごとに回収された溶液の抗Factor Xa活性から、ゲル中に残存する低分子量ヘパリンの抗Factor Xa活性を求め、熱架橋していない等量の低分子量ヘパリンの活性値と比較した。具体的には、PBS(-)中に溶出してきた低分子量ヘパリンの硫酸基を1,9 ジメチルメチレンブルーで検出することで、溶出量を算出した。次にこの量に相当する抗Factor Xa 活性を低分子量ヘパリン標準液を用いて測定した検量線から算出しその値を100%とし、溶出してきた低分子量ヘパリンの活性比を算出した。なお、抗Factor Xa活性はテストチームヘパリンSを用いた酵素法により測定した。
【0041】
結果を下記の表に示す。最下段の「heatLMWH(160℃ 96hr)は、低分子量ヘパリンを粉末の状態で、熱架橋条件下(160℃, 96時間)においた場合に得られた抗Factor Xa活性を示す。いずれの時間においても加熱によりある程度の抗Factor Xa活性の低下がみられたが、医薬品として用いるのに十分な活性が保持されていることが確認された。
【0042】
【表2】

【実施例3】
【0043】
カチオン化ゼラチンと低分子量ヘパリンのポリイオンコンプレックスを含有するゼラチンハイドロゲル
アミノ基導入率の異なるカチオン化ゼラチン水溶液を異なる濃度で調製した。この水溶液を低分子量ヘパリン水溶液(5 mg/ml)と、37 ℃で同体積にて混合させ、両者のポリイオンコンプレックスを形成させた。カチオン化ゼラチンと低分子量ヘパリンとの混合比は、(カチオン化ゼラチンのモル数)/(低分子量ヘパリンのモル数)をCG/LHモル比で表した。
【0044】
ポリイオンコンプレックスのみかけの分子サイズは、動的光散乱(dynamic light scattering、DLS)(DLS-7000、大塚電子製、検出角度90°、37 ℃)を用いて測定した。測定試料として、カチオン化ゼラチン水溶液(1 mg/ml)および、表2の条件で、カチオン化ゼラチンと低分子量ヘパリン水溶液を同体積で混合して調製したポリイオンコンプレックス水溶液を用いた。
【0045】
ポリイオンコンプレックスのゼータ電位は電気泳動光散乱法(Electrophoretic Light Scattering、ELS)(ELS-8000、大塚電子製) を用いて測定した。測定試料として、溶媒に10 mM PB (pH 7.4)を用いたカチオン化ゼラチン溶液(1 mg/ml)および、表2の条件で、カチオン化ゼラチンと低分子量ヘパリン溶液を同体積で混合して調製したポリイオンコンプレックス溶液を用いて、電場強度100 V/cmで測定した。
【0046】
【表3】

【0047】
図4はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスの見かけの分子サイズである。アミノ基導入率に関係なく、カチオン化ゼラチンの分子サイズは、ほぼ一定であった。一方、ポリイオンコンプレックスの分子サイズは、カチオン化ゼラチンのアミノ基導入率が27.0 %より大きい場合には、アミノ基導入率の増加とともに減少した。これは、アミノ基導入率の増加とともに、負電荷をもつ低分子量ヘパリンとの静電的相互作用が強まり、カチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスがよりコンパクトになったことが理由であると考えられる。
【0048】
図5はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスのゼータ電位である。カチオン化ゼラチンのゼータ電位は、そのアミノ基導入率とともに増大する傾向を示した。一方、ポリイオンコンプレックスのゼータ電位は、アミノ基導入率が4.6-36.0 %の範囲で、その増加とともに高くなる傾向を示した。しかし、アミノ基導入率が36.0 %より大きい場合には、そのゼータ電位は導入率の増加とともに低下した。アミノ基導入率が56.5 %のカチオン化ゼラチンの場合には、ポリイオンコンプレックスは負の電荷をもっていた。
【0049】
ポリイオンコンプレックス含有ゼラチンハイドロゲル作製
20 wt%濃度のpI5ゼラチン水溶液(1 ml)と、カチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックス水溶液(1 ml)を37 ℃で混合した。混合溶液を、ポリテトラフルオロエチレンモールド(44×44 mm2、深さ8 mm)に37℃で流延した後、液体窒素にて凍結した。凍結乾燥の後、得られた乾燥ハイドロゲル(24×24×2 mm3)を160 ℃、24時間の条件で熱脱水処理を行った。
【0050】
ポリイオンコンプレックス含有ゼラチンハイドロゲルからの低分子量ヘパリンの徐放試験
0.2 MのPBS溶液(500μl)に5-7 mgの乾燥重量のハイドロゲルを加えた。1、2、4、 8、24、48、および96時間経過後に、ハイドロゲルを取り出し、新しいPBSに移した。96時間後のハイドロゲルをコラゲナーゼのPBS溶液(1 mg/ml、300μl)に移し、ハイドロゲルを溶解させ、低分子量ヘパリンの全量を回収した。溶液中の低分子量ヘパリンはDMB比色法で定量し(17)、回収された全量ヘパリンを100 %として徐放率を算出した。すなわち、DMB(16 mg)のメタノール溶液(5 ml)と蟻酸ナトリウム(2 g)の蟻酸溶液(2 ml)の混合液をDDWで1000 mlに希釈し、DMB溶液を調製した。DMB溶液(200μl)を回収されたコラゲナーゼPBS溶液(25μl)に加え、溶液の525 nmにおける吸光度を測定した。
【0051】
図6はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスを含むゼラチンハイドロゲルからの低分子量ヘパリン徐放曲線を示す。カチオン化ゼラチンとポリイオンコンプレックスを形成させた場合には、24時間後においても7割強がゲル中に保持されていた。なお、対照として、pI9と複合体を形成させた場合は4割程度が保持されていた。カチオン化ゼラチンのアミノ基導入率に関係なく、低分子量ヘパリンの徐放パターンは大きく変化しなかった。
【技術分野】
【0001】
本発明は、ゼラチンハイドロゲルを用いたヘパリンの徐放用組成物に関する。
【背景技術】
【0002】
腎臓を初めとする種々の臓器において、炎症反応に引き続いて起こってくる組織の線維化は臓器の機能不全を誘発する。最近、進行性糸球体疾患の慢性腎不全に至る過程において、腎間質病変は本疾患の予後と良く相関し、この線維化の抑制は、慢性腎不全への移行を抑制すると示唆されている。また、この線維化を抑制する増殖因子の一つとしてHGFが報告されている(非特許文献1,2)。
【0003】
ヘパリンおよび低分子量ヘパリン(LMWH)は、肺の線維芽細胞において肝細胞増殖因子(HGF)産生を促進すると報告されている(非特許文献3,4)。さらに、腎糸球体に存在するメサンギウム細胞は、HGF産生細胞の一つとして報告されている(非特許文献3)。また、ヘパリンの血液凝固抑制作用は、主に血液凝固因子の一つであるFactor Xaを抑制することに起因し、この酵素については腎炎の増悪因子としても考えられている(非特許文献5,6)。したがって、ヘパリンを投与することにより、慢性腎炎における抗線維化抑制効果が期待できる。
【0004】
しかしながらヘパリンは、投与後、大半が肝臓でヘパリナーゼによって分解され活性の低いウロヘパリンとして排泄されるため、全身投与では十分量標的臓器に到達しない可能性が考えられる。また、ヘパリンを大量に投与すると、出血傾向を誘発するという副作用が生ずる恐れがある。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】HGF as a renotrophic and anti-fibrotic regulator in chronic renal disease. Mizuno S et alFront Biosci. 2008 May 1;13:7072-86. Review.
【非特許文献2】アリストロキア酸中毒性腎症に対するHepatocyte Growth Factor (HGF)の線維化抑制作用の検討 渡辺 裕輔 埼玉医科大学雑誌 2004 31(1):13-22
【非特許文献3】肝細胞増殖因子(HGF)機能と産生制御 合田 榮一 日本薬理学雑誌 2002 119:287-294
【非特許文献4】Stimulation of hepatocyte growth factor production by heparin-derived oligosaccharides. Sakiyama R et al J Biochem. 2007 May;141(5):653-60. Epub 2007 Feb 22.
【非特許文献5】Role of coagulation and fibrinolysis in lung and renal fibrosis. Ruppert C et alHamostaseologie. 2008 Feb;28(1-2):30-2, 34-6. Review.
【非特許文献6】Roles of coagulation pathway and factor Xa in rat mesangioproliferative glomerulonephritis. Nomura K et al Lab Invest. 2007 Feb;87(2):150-60. Epub 2006 Dec 18.
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の目的は、局所においてヘパリンあるいは低分子量ヘパリンを長時間にわたって徐放することにより、副作用となる出血傾向を軽減しつつ、病変部において効率よくHGFの産生を促進して、腎臓における線維化を抑制できる組成物を提供することである。
【課題を解決するための手段】
【0007】
本発明者らは、ゼラチンハイドロゲルを用いることにより低分子量ヘパリンを徐放化しうることを見いだした。さらに、低分子量ヘパリンとカチオン化ゼラチンとのポリイオンコンプレックスを形成させた後、これをゼラチンハイドロゲル内に包含させた徐放性ゼラチンハイドロゲル組成物を開発した。
【0008】
すなわち本発明は、カチオン化ゼラチンとヘパリンまたは低分子量ヘパリンを含む徐放性ゼラチンハイドロゲル組成物を提供する。別の態様においては、本発明は、カチオン化ゼラチンとヘパリンまたは低分子量ヘパリンとのポリイオンコンプレックスを含む徐放性ゼラチンハイドロゲル組成物を提供する。
【図面の簡単な説明】
【0009】
【図1】図1はゼラチンのアミノ基導入反応に与えるエチレンジアミン添加量の影響を示す。
【図2】図2は放射ラベルした低分子量ヘパリン−ゼラチンハイドロゲルの生体内における埋込72時間後の残存量を示すグラフである。
【図3】図3は蛍光ラベルした低分子量ヘパリン−ゼラチンハイドロゲルの生体内におけるの徐放効果を示すグラフである。
【図4】図4はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスの見かけの分子サイズである。
【図5】図5はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスのゼータ電位である。
【図6】図6はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスを含むゼラチンハイドロゲルからの低分子量ヘパリン徐放を示す。
【発明を実施するための形態】
【0010】
本発明はヘパリンをゼラチンハイドロゲルとの複合体とし、徐放化することに関する。以下、本発明のゼラチンとヘパリンまたは低分子量ヘパリンの複合体を含有する徐放性ゼラチンハイドロゲルについて説明する。
【0011】
ヘパリンは、動物のあらゆる組織に普遍的に存在するアミノ糖とウロン酸の二糖の繰り返し構造からなる多糖である。分子内に硫酸基をもつため、負の電荷をもっている。ヘパリンは抗血液凝固剤として臨床に使用されている。
【0012】
本発明の徐放性ハイドロゲル組成物において、ヘパリンまたは低分子量ヘパリンとしては、市販の製品の任意のものを用いることができる。一例としては、ダルテパリンナトリウム、パルナパリンナトリウム等が挙げられる。低分子量ヘパリンとは、平均相対分子量が2,000〜10,000、好ましくは3,000〜8,000、より好ましくは4,000〜6,000であるヘパリンをいう。
【0013】
ゼラチンは、動物(牛や豚)の皮膚や骨の主成分であるコラーゲンを酸、アルカリ、あるいは酵素によって処理、変性させて得られるタンパク質である。この処理によって、構成アミノ酸の側鎖が加水分解をうけ、等電点が変化するとともに、ランダムコイル構造をもつゼラチンが得られる。このゼラチンを熱脱水処理や化学処理によって分子間架橋し、水和させることにより、ハイドロゲルが形成できる。
【0014】
本発明においては、ゼラチンにアミノ基を導入してカチオン化したゼラチン誘導体(カチオン化ゼラチン)を用いる。ヘパリンは負の電荷をもつため、カチオン化ゼラチンと静電的に相互作用して、より強く結合することができる。
【0015】
カチオン化ゼラチンのカチオン化の工程は公知の技術を用いることができる。例えば特開2007-182407に記載の方法を採用することができるが、カチオン化の方法は生理条件下でカチオン化する官能基を導入し得る方法であれば特に限定されない。ゼラチンハイドロゲルの有する水酸基あるいはカルボキシル基等に1、2または3級のアミノ基またはアンモニウム基を温和な条件下で導入する方法が好ましい。例えばエチレンジアミン、N,N−ジメチル−1,3−ジアミノプロパン等のアルキルジアミンや、トリメチルアンモニウムアセトヒドラジド、スペルミン、スペルミジンまたはジエチルアミド塩化物等を、種々の縮合剤、例えば1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩、塩化シアヌル、N,N’−カルボジイミダゾール、臭化シアン、ジエポキシ化合物、トシルクロライド、ジエチルトリアミン−N,N,N’,N’’,N’’−ペンタン酸ジ無水物等のジ無水物化合物、トリシルクロリド等を用いて反応させる方法を用いることができる。中でもエチレンジアミンまたはスペルミジンを反応させる方法が簡便且つ汎用性があり好適である。
【0016】
このとき、カチオン化ゼラチンのカチオン化の程度を示す指標として、アミノ基導入率を用いることができる。アミノ基導入率=(カチオン化ゼラチンの一分子あたりのアミノ基の数/カチオン化前のゼラチン一分子あたりのアミノ基の数)/(カチオン化前のゼラチン一分子あたりのカルボキシル基の数)*100(%)であらわされる。このアミノ基導入率は、好適には2%以上60%であり、特に好ましくは30%以上50%以下である。アミノ基導入率がこれらの下限以上であると、ゼラチンハイドロゲルとヘパリンまたは低分子量ヘパリンとの相互作用が強くなるので、徐放性の効果が向上する。一方、アミノ基導入率がこれらの上限を超えると、ゼラチンハイドロゲルのカチオン化が製造工程上困難になる場合がある。
【0017】
ゼラチンハイドロゲルは、架橋することにより水不溶性または水難溶性とする。ゼラチンは生体内で酵素によって分解されるため、ハイドロゲル作製時のゼラチン分子間の架橋度を変化させることによって、ハイドロゲルの分解を、数日から数カ月の範囲でコントロールすることが可能である。このゼラチンハイドロゲルは、すでに医用材料、医薬品添加物、食品などに用いられ、その生体適合性は実証済の材料である。このゼラチンハイドロゲルを用いることで、生物活性をもつタンパク質やプラスミドDNAの徐放化が可能であることが報告されている。この徐放システムでは、薬物はゼラチン分子と相互作用し、ハイドロゲル内に包含固定化されている。ハイドロゲルが分解され、ゼラチンが水可溶化されると、ハイドロゲル内に固定化されている薬物が放出されるという徐放メカニズムである。
【0018】
カチオン化ゼラチンハイドロゲルを製造するためには、公知の技術を用いることができる。例えば特開2007-182407に記載の方法を採用することができる、すなわち、ゼラチンの分子鎖を化学的手法、紫外線照射、あるいは熱により脱水処理することによって水に溶解しにくいように架橋して作製することができる。このとき、架橋の程度の上昇とともに含水ハイドロゲルに対する水の重量比(含水率)は低下する。
【0019】
好ましい態様においては、ゼラチンハイドロゲルは、種々の化学的架橋剤を用いてゼラチンの分子間に化学架橋を形成させることにより不溶化または難溶化することができる。化学的架橋剤としては、例えばグルタルアルデヒド、例えばEDC等の水溶性カルボジイミド、例えばプロピレンオキサイド、ジエポキシ化合物、水酸基、カルボキシル基、アミノ基、チオール基、イミダゾール基などの間に化学結合を作る縮合剤を用いることができる。好ましいものは、グルタルアルデヒドである。また、ゼラチンは、熱脱水処理、紫外線、ガンマ線、電子線照射によって架橋してもよい。さらに、これらの架橋処理を組み合わせて用いてもよい。他にも、塩架橋、静電的相互作用、水素結合、疎水性相互作用などを利用した物理架橋によりハイドロゲルを作製してもよい。
【0020】
ハイドロゲルを調製する際のゼラチンと架橋剤の濃度の好ましい範囲は、溶液中のゼラチンの濃度1〜20w/w%、架橋剤濃度0.01〜1w/w%である。架橋反応条件は特に制限はないが、例えば、0〜40℃、好ましくは25−30℃で、1〜48時間、好ましくは12−24時間で行うことができる。一般に、ゼラチンの濃度および架橋剤の濃度、架橋時間が増大するとともにハイドロゲルの架橋度は増加し、生体吸収性は低くなる。
【0021】
ゼラチンの架橋反応は、熱処理によっても行なうことができる。熱処理による架橋の例は以下のとおりである。ゼラチン水溶液(10重量%程度が好ましい)をプラスチックシャーレに流延し、風乾することによってゼラチンフィルムを得る。そのフイルムを減圧下、好ましくは10mmHg程度で通常110〜160℃、好ましくは120〜150℃、通常1〜48時間、好ましくは6〜24時間放置することによって行なう。また、紫外線によりゼラチンフィルムを架橋する場合は、得られたゼラチンフィルムを殺菌ランプの下において通常室温、好ましくは0〜40℃で放置する。また、ゼラチン水溶液を凍結乾燥することによってスポンジ状成形体を得る。これを同様に、熱処理および紫外線、ガンマ線、電子線によって架橋することができる。あるいは、上述の架橋法を組み合わせて用いることもできる。
【0022】
ゼラチンハイドロゲルの形状(立体構造)は、特に制限はないが、例えば、円柱状、角柱状、シート状、ディスク状、球状、ペースト状などがある。円柱状、角柱状、シート状、ディスク状のものは、埋込片として用いるのに特に適している。
【0023】
本発明におけるカチオン化ゼラチンハイドロゲルは適宜、適当な大きさ及び形に切断後凍結乾燥し滅菌して使用することができる。凍結乾燥は、例えば、ゼラチンハイドロゲルを蒸留水に入れ、液体窒素中で30分以上、又は−80℃で1時間以上凍結させた後に、凍結乾燥機で1〜3日間乾燥させることにより行うことができる。
【0024】
カチオン化ゼラチンハイドロゲルとヘパリンとの複合体は、凍結乾燥したカチオン化ゼラチンハイドロゲルを水、緩衝液、生理食塩水、リンゲル液などの中にヘパリンを含む溶液に含浸させることにより製造することができる。
【0025】
ゼラチンハイドロゲルとヘパリンとの複合体を生体に投与すると、複合体中に取り込まれているヘパリンは、ゼラチンハイドロゲルが生体内で分解されるに従って複合体外部へと徐々に放出される。この放出速度は、使用するゼラチンハイドロゲルの生体における分解および吸収の程度、ならびに複合体内でのヘパリンとゼラチンハイドロゲルとの結合の強さの程度および安定性により決定される。ゼラチンハイドロゲルの生体における分解および吸収の程度は、ハイドロゲル作製時における架橋の程度を調節することにより調節することができる。本発明にしたがえば、ヘパリンの優れた徐放性を有するとともに、十分な材料強度を有するヘパリン徐放材料を提供することができる。
【0026】
本発明の特に好ましい態様においては、ヘパリンとカチオン化ゼラチンのポリイオンコンプレックスを形成させ、これをゼラチンハイドロゲルに取り込ませて複合体を形成する。ポリイオンコンプレックスは、ヘパリンとカチオン化ゼラチンとがイオン結合により結合することにより形成されるコンプレックスである。ポリイオンコンプレックスは、ヘパリンとカチオン化ゼラチンとを、適当な緩衝溶液中で混合し、所定の時間放置することにより形成することができる。得られたポリイオンコンプレックスをゼラチン溶液と混合し、凍結乾燥した後に熱処理することにより、ポリイオンコンプレックス含有ゼラチンハイドロゲルを作製することができる。好ましくは、ハイドロゲルを構成するゼラチンとしては、アニオン性のゼラチン、例えば等電点4〜6をもつゼラチンやカルボキシル基を導入したアニオン化ゼラチンを用いる。このことにより、カチオン性の高い物質が直接生体組織に接することによって起こり得る炎症反応を回避することができる。
【0027】
以下に実施例により本発明をより詳細に説明するが、本発明はこれらの実施例により限定されるものではない。
【実施例1】
【0028】
カチオン化ゼラチンの作製
用いたゼラチン(新田ゼラチン株式会社より供与)は、豚皮由来I型コラーゲンを酸処理して得た等電点(pI9)のゼラチン(pI9ゼラチン)と牛骨由来I型コラーゲンをアルカリ処理して得たpI5のゼラチン(pI5ゼラチン)である。コラゲナーゼLは新田ゼラチン株式会社より供与された。低分子量ヘパリン(LMWH)は扶桑薬品工業株式会社より供与されたパルナパリンナトリウム(重量平均分子量5,000)を用いた。エチレンジアミン、1-エチル-3-(3-ジメチルアミノプロピル) カルボジイミド塩酸塩(EDC)、2,4,6-トリニトロベンゼンスルホン酸(TNBS)、1,9-ジメチルメチレンブルー(DMB)、およびドデシル硫酸ナトリウム(SDS)は、ナカライテスク株式会社から購入した。
【0029】
ゼラチンのカチオン化誘導体は、pI9ゼラチンのカルボキシル基へのエチレンジアミンの導入により作製した。pI9ゼラチン(1 g)を24 mlの0.1 Mリン酸緩衝水溶液(PB、pH 5.0)に37 ℃で溶解させた。次に、ゼラチンのカルボキシル基に対して、0.5、1.0、2.0、3.0、5.0、7.0、10、および50倍モル量のエチレンジアミンを加えた。11 Nの塩酸水溶液を用いて、溶液のpHを5.0に調整した。その後、ゼラチンのカルボキシル基に対して、3倍モル量のEDCを添加し、PBを加えることで液量50 ml、ゼラチンの最終濃度が2 wt%とした。37 ℃で4時間攪拌、エチレンジアミン導入反応を行った。反応物を再蒸留水(double distilled water、DDW)で3日間透析した。
【0030】
カチオン化ゼラチンのアミノ基導入率はTNBS法で求めた。pI9ゼラチンとカチオン化ゼラチンを0.2 Mリン酸緩衝生理食塩水溶液(PBS、pH 7.4)に溶解させた(1 mg/ml)。その溶液(100μl)に4 wt%の炭酸水素ナトリウム水溶液(200μl)と0.1 wt%のTNBS水溶液(200μl)を加え、37 ℃、2時間、反応させた。反応後、10 wt%のSDS水溶液(2000μl)と1NのHCl(100μl)を加え、溶液の415 nmにおける吸光度を測定した。この吸光度とβ−アラニンを用いた検量線から、pI9ゼラチンのカルボキシル基当りのアミノ基導入率を算出した。得られたカチオン化ゼラチンは、以下、エチレンジアミンの添加モル量によってE-0.5〜E-50と表した。
【0031】
【表1】

【0032】
図1に、ゼラチンのアミノ基導入反応に与えるエチレンジアミン添加量の影響を示す。エチレンジアミンの添加濃度の増加とともにゼラチンへのアミノ基導入率(ゼラチンのカチオン化度)は増大した。なお、統計分析は、ANOVAを用いた。p値が0.05より低いとき有意差があるとした。
【実施例2】
【0033】
カチオン化ゼラチンハイドロゲルからの低分子量ヘパリンまたはヘパリンの徐放
実施例1で得られたカチオン化ゼラチンをグルタルアルデヒドにより架橋して、E50、E10、E3、E0.5のカチオン化ゼラチンハイドロゲルを作製し、ヘパリンまたは低分子量ヘパリンを含浸させた。ゼラチンハイドロゲルを生体内に埋め込んでインビボにおけるヘパリンまたは低分子量ヘパリンの徐放特性を調べた。
【0034】
低分子量ヘパリンおよびヘパリンの125I ラベル
低分子量ヘパリンまたはヘパリン1mg/mLを30mL(0.1mol/L リン酸緩衝液(pH7.4)で調製)と、チラミン13.8mg (少量のDMSOに溶解)とを混合し、EDC (低分子量ヘパリンの場合5mg, ヘパリンの場合14.3mg)を加え、次にN-ヒドロキシスルホスクシンイミドナトリウム塩(Sulfo-NHS) 33mgを加え、攪拌しながら一晩反応させた。滅菌水に透析(2〜3日)後、凍結乾燥(2〜3日)した。チラミン導入低分子量ヘパリンまたはヘパリンにNaI125を反応させ、PD-10カラム (GEヘルスケア)でゲル濾過し、溶出バッファー3〜4mL付近で現れる高い放射活性を有する画分を放射ラベル化体として使用した。
【0035】
生体内における放射ラベル化体の徐放の確認
E50もしくはpI9ゼラチンを用いて作製したゼラチンハイドロゲル2mgに放射ラベル化体20μLを4℃にて一晩含浸させた。ネンブタール麻酔下において6週齢のddy マウス背部皮下にゲルを埋め込んだ。なおコントロールとして放射ラベル化体の溶液20μLを100μLにメスアップして背部皮下に投与した。埋込約72時間後においてマウスを安楽死処分し、背部の皮および残存するゲルの放射活性を測定した。埋込直後におけるハイドロゲルの放射活性に対して残存する放射活性の割合を算出した。
【0036】
結果を図2に示す。pI9ゼラチンに含浸させた場合は、徐放開始72時間後には9割弱が放出されてしまうのに対して、E50ゼラチンに含浸させた場合は、含浸72時間後においても、5割前後のヘパリンが残存していた。これは、ゼラチンにアミノ基を導入することにより、強い陰性荷電を持つヘパリンとの相互作用が高まったためと考えられる。
【0037】
蛍光ラベル化 (Cy5.5;GE ヘルスケア)
1mg/mL ヘパリン溶液を0.1mol/L Na2CO3(pH9.3) 溶液で溶解し市販のCy5.5 に1mL添加し室温で30分間放置した。PD-10カラムでゲル濾過を行い溶出バッファー3.5〜4.5mL付近で現れる強い蛍光を発する画分を蛍光ラベルヘパリンとして使用した。
【0038】
生体内における蛍光ラベル化体の徐放の確認
E50もしくはpI9ゼラチンを用いて作製したゼラチンハイドロゲル2mgに蛍光ラベルヘパリン20μLを4℃にて一晩含浸させた。ネンブタール麻酔下において6週齢のddy マウス背部皮下にゲルを埋め込む。なおコントロールとして蛍光ラベル化ヘパリンの溶液20μLを100μLにメスアップして背部皮下に投与した。埋込後、経時的に背部皮下におけるゲルの蛍光強度を観察した(Las 4000;富士フイルム)。
【0039】
結果を図3に示す。pI9ゼラチンに含浸させた場合24時間でほぼ放出してしまうのに対し、E50ゼラチンに含浸させた場合72時間時点でもヘパリンが残存していた。
【0040】
低分子量ヘパリンの抗facter Xa活性
熱架橋より低分子量ヘパリンの抗facter Xa活性が失活しないかどうかを調べた。低分子量ヘパリン水溶液(5mg/mL)を実施例1で得られたカチオン化ゼラチンの水溶液(30mg/mL)またはpI9ゼラチンの水溶液(100 mg/mL)とを等量混合した。さらにこれらの混合液と等量のpI5 ゼラチン水溶液(E50とのポリイオンコンプレックスには100mg/mL、pI9とのポリイオンコンプレックスには200mg/mLの濃度で使用)を混合し、ポリテトラフルオロエチレンモールド(44×44 mm2、深さ8 mm)に37℃で流延した後、液体窒素にて凍結した。凍結乾燥の後、得られた乾燥ハイドロゲル(24×24×2 mm3)を160 ℃で96時間熱脱水処理を行った。この低分子量ヘパリン含有ゼラチンハイドロゲルを5〜10mg程度秤量、秤量したゲルに500μLのPBS(-)を添加し、37℃で溶出開始、溶出開始から1, 2, 4, 8 時間後においてPBS(-)をサンプリングした。溶出開始24時間後においてPBS(-)を回収した後、残っているゲルをコラゲナーゼで分解し、ゲル溶解液をPBS(-)で500μLに合わせた。それぞれの時間ごとに回収された溶液の抗Factor Xa活性から、ゲル中に残存する低分子量ヘパリンの抗Factor Xa活性を求め、熱架橋していない等量の低分子量ヘパリンの活性値と比較した。具体的には、PBS(-)中に溶出してきた低分子量ヘパリンの硫酸基を1,9 ジメチルメチレンブルーで検出することで、溶出量を算出した。次にこの量に相当する抗Factor Xa 活性を低分子量ヘパリン標準液を用いて測定した検量線から算出しその値を100%とし、溶出してきた低分子量ヘパリンの活性比を算出した。なお、抗Factor Xa活性はテストチームヘパリンSを用いた酵素法により測定した。
【0041】
結果を下記の表に示す。最下段の「heatLMWH(160℃ 96hr)は、低分子量ヘパリンを粉末の状態で、熱架橋条件下(160℃, 96時間)においた場合に得られた抗Factor Xa活性を示す。いずれの時間においても加熱によりある程度の抗Factor Xa活性の低下がみられたが、医薬品として用いるのに十分な活性が保持されていることが確認された。
【0042】
【表2】

【実施例3】
【0043】
カチオン化ゼラチンと低分子量ヘパリンのポリイオンコンプレックスを含有するゼラチンハイドロゲル
アミノ基導入率の異なるカチオン化ゼラチン水溶液を異なる濃度で調製した。この水溶液を低分子量ヘパリン水溶液(5 mg/ml)と、37 ℃で同体積にて混合させ、両者のポリイオンコンプレックスを形成させた。カチオン化ゼラチンと低分子量ヘパリンとの混合比は、(カチオン化ゼラチンのモル数)/(低分子量ヘパリンのモル数)をCG/LHモル比で表した。
【0044】
ポリイオンコンプレックスのみかけの分子サイズは、動的光散乱(dynamic light scattering、DLS)(DLS-7000、大塚電子製、検出角度90°、37 ℃)を用いて測定した。測定試料として、カチオン化ゼラチン水溶液(1 mg/ml)および、表2の条件で、カチオン化ゼラチンと低分子量ヘパリン水溶液を同体積で混合して調製したポリイオンコンプレックス水溶液を用いた。
【0045】
ポリイオンコンプレックスのゼータ電位は電気泳動光散乱法(Electrophoretic Light Scattering、ELS)(ELS-8000、大塚電子製) を用いて測定した。測定試料として、溶媒に10 mM PB (pH 7.4)を用いたカチオン化ゼラチン溶液(1 mg/ml)および、表2の条件で、カチオン化ゼラチンと低分子量ヘパリン溶液を同体積で混合して調製したポリイオンコンプレックス溶液を用いて、電場強度100 V/cmで測定した。
【0046】
【表3】

【0047】
図4はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスの見かけの分子サイズである。アミノ基導入率に関係なく、カチオン化ゼラチンの分子サイズは、ほぼ一定であった。一方、ポリイオンコンプレックスの分子サイズは、カチオン化ゼラチンのアミノ基導入率が27.0 %より大きい場合には、アミノ基導入率の増加とともに減少した。これは、アミノ基導入率の増加とともに、負電荷をもつ低分子量ヘパリンとの静電的相互作用が強まり、カチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスがよりコンパクトになったことが理由であると考えられる。
【0048】
図5はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスのゼータ電位である。カチオン化ゼラチンのゼータ電位は、そのアミノ基導入率とともに増大する傾向を示した。一方、ポリイオンコンプレックスのゼータ電位は、アミノ基導入率が4.6-36.0 %の範囲で、その増加とともに高くなる傾向を示した。しかし、アミノ基導入率が36.0 %より大きい場合には、そのゼータ電位は導入率の増加とともに低下した。アミノ基導入率が56.5 %のカチオン化ゼラチンの場合には、ポリイオンコンプレックスは負の電荷をもっていた。
【0049】
ポリイオンコンプレックス含有ゼラチンハイドロゲル作製
20 wt%濃度のpI5ゼラチン水溶液(1 ml)と、カチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックス水溶液(1 ml)を37 ℃で混合した。混合溶液を、ポリテトラフルオロエチレンモールド(44×44 mm2、深さ8 mm)に37℃で流延した後、液体窒素にて凍結した。凍結乾燥の後、得られた乾燥ハイドロゲル(24×24×2 mm3)を160 ℃、24時間の条件で熱脱水処理を行った。
【0050】
ポリイオンコンプレックス含有ゼラチンハイドロゲルからの低分子量ヘパリンの徐放試験
0.2 MのPBS溶液(500μl)に5-7 mgの乾燥重量のハイドロゲルを加えた。1、2、4、 8、24、48、および96時間経過後に、ハイドロゲルを取り出し、新しいPBSに移した。96時間後のハイドロゲルをコラゲナーゼのPBS溶液(1 mg/ml、300μl)に移し、ハイドロゲルを溶解させ、低分子量ヘパリンの全量を回収した。溶液中の低分子量ヘパリンはDMB比色法で定量し(17)、回収された全量ヘパリンを100 %として徐放率を算出した。すなわち、DMB(16 mg)のメタノール溶液(5 ml)と蟻酸ナトリウム(2 g)の蟻酸溶液(2 ml)の混合液をDDWで1000 mlに希釈し、DMB溶液を調製した。DMB溶液(200μl)を回収されたコラゲナーゼPBS溶液(25μl)に加え、溶液の525 nmにおける吸光度を測定した。
【0051】
図6はカチオン化ゼラチンと低分子量ヘパリンとのポリイオンコンプレックスを含むゼラチンハイドロゲルからの低分子量ヘパリン徐放曲線を示す。カチオン化ゼラチンとポリイオンコンプレックスを形成させた場合には、24時間後においても7割強がゲル中に保持されていた。なお、対照として、pI9と複合体を形成させた場合は4割程度が保持されていた。カチオン化ゼラチンのアミノ基導入率に関係なく、低分子量ヘパリンの徐放パターンは大きく変化しなかった。
【特許請求の範囲】
【請求項1】
カチオン化ゼラチンとヘパリンを含む徐放性ゼラチンハイドロゲル組成物。
【請求項2】
カチオン化ゼラチンとヘパリンとのポリイオンコンプレックスを含む徐放性ゼラチンハイドロゲル組成物。
【請求項3】
ヘパリンが低分子量ヘパリンである、請求項1または2に記載のハイドロゲル組成物。
【請求項1】
カチオン化ゼラチンとヘパリンを含む徐放性ゼラチンハイドロゲル組成物。
【請求項2】
カチオン化ゼラチンとヘパリンとのポリイオンコンプレックスを含む徐放性ゼラチンハイドロゲル組成物。
【請求項3】
ヘパリンが低分子量ヘパリンである、請求項1または2に記載のハイドロゲル組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−75835(P2013−75835A)
【公開日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願番号】特願2011−215184(P2011−215184)
【出願日】平成23年9月29日(2011.9.29)
【出願人】(000238201)扶桑薬品工業株式会社 (42)
【出願人】(599029420)
【Fターム(参考)】
【公開日】平成25年4月25日(2013.4.25)
【国際特許分類】
【出願日】平成23年9月29日(2011.9.29)
【出願人】(000238201)扶桑薬品工業株式会社 (42)
【出願人】(599029420)

【Fターム(参考)】
[ Back to top ]

