ソマトスタチンアンタゴニスト
【課題】ソマトスタチンアンタゴニストの提供。
【解決手段】次式の化合物A1-cyclo[D-Cys-A2-D-Trp-A3-A4-Cys]-A5-Y1またはその医薬的に許容できる塩[式中:A1は、置換されていてもよい芳香族α−アミノ酸であり;A2は、置換されていてもよい芳香族α−アミノ酸であり;A3は、Dab、Dap、LysまたはOrnであり;A4は、β−ヒドロキシバリン、Ser、HserまたはThrであり;A5は、置換されていてもよいD−またはL−芳香族α−アミノ酸であり;Y1は、OH、NH2またはNHR1であり、ここでR1は(C1-6)アルキルであり;式(I)の各アミドペプチド結合およびA1のアミノ基のアミン窒素はメチル基で置換されていてもよく、ただしそのようなメチル基が少なくとも1つある]、およびその使用について提供する。
【解決手段】次式の化合物A1-cyclo[D-Cys-A2-D-Trp-A3-A4-Cys]-A5-Y1またはその医薬的に許容できる塩[式中:A1は、置換されていてもよい芳香族α−アミノ酸であり;A2は、置換されていてもよい芳香族α−アミノ酸であり;A3は、Dab、Dap、LysまたはOrnであり;A4は、β−ヒドロキシバリン、Ser、HserまたはThrであり;A5は、置換されていてもよいD−またはL−芳香族α−アミノ酸であり;Y1は、OH、NH2またはNHR1であり、ここでR1は(C1-6)アルキルであり;式(I)の各アミドペプチド結合およびA1のアミノ基のアミン窒素はメチル基で置換されていてもよく、ただしそのようなメチル基が少なくとも1つある]、およびその使用について提供する。
【発明の詳細な説明】
【背景技術】
【0001】
発明の背景
Brazeauらが発見したテトラデカペプチドであるソマトスタチン(SRIF)は、下垂体、膵臓および消化管などの組織において種々の分泌プロセスに対する有効な抑制作用をもつことが示された。SRIFは、中枢神経系において神経調節物質としても作用する。SRIFがもつこれらの生物学的作用はすべて抑制性であり、一連のGタンパク質結合した受容体により誘発される。受容体について5つの異なるサブタイプが解明されている(sstr1〜sstr5)。これら5つのサブタイプは内因性SRIFリガンドに対して類似の親和性をもつが、種々の組織における分布が異なる。ソマトスタチンはこれら5つの異なる受容体(SSTR)サブタイプに比較的高い親和性で結合し、各サブタイプに対する親和性は等しい。種々の症状および/または疾病の治療には異なるタイプのソマトスタチンサブタイプへの結合が関連する。(”sstr2”)(Raynor, et al., Molecular Pharmacol. 43: 838 (1993); Lloyd, et al., Am. J. Physiol. 268: G102 (1995))、一方、インスリンの抑制はソマトスタチンタイプ−5受容体(”sstr5”)による
(Coy, et al. 197:366-371 (1993))。成長ホルモンの抑制、より具体的にはGH分泌性腺腫(肢端肥大症)およびTSH分泌性腺腫の抑制には、タイプ2と5の活性化が関連する。プロラクチン分泌性腺腫の治療には、タイプ5ではなくタイプ2の活性化が関連する。ソマトスタチン受容体サブタイプの活性化が関連する他の適応症は下記のものである:糖尿病、血管障害、増殖性網膜障害、暁現象および腎障害の治療のためのインスリンおよび/またはグルカゴンの抑制;胃酸分泌の抑制、より具体的には消化性潰瘍、腸皮および膵皮フィステル、過敏性腸症候群、ダンピング症候群、漿液性下痢症候群、エイズ関連下痢、化学療法誘発性下痢、急性または慢性膵炎、および消化管ホルモン分泌性腫瘍の抑制;癌、たとえば肝癌の治療;血管形成の抑制、炎症性障害、たとえば関節炎の治療;網膜障害の治療;慢性同種移植片拒絶反応の抑制;血管形成術;移植血管および消化管の出血防止。目的とする生物学的反応に関与する1種類以上の特定のソマトスタチン受容体サブタイプに対して選択的な類似体を入手することにより、不都合な副作用をもたらす可能性のある他の受容体サブタイプとの相互作用を減らすことが好ましい。
【0002】
有効な低分子SRIFアゴニストの開発により、異なるサブタイプに対する種々のトランケート形リガンドの親和性を識別する方法が見いだされた。Trp8−Lys9配列はこの受容体が認識するリガンド中にしばしば存在すると思われる。Trp8−Lys9配列はβ−折れ曲がりの部分を形成し、これは通常はL−TrpからD−Trpへの置換、主鎖の環化、ジスルフィド橋、またはあらゆる拘束により安定化される。複数の受容体サブタイプが見いだされる前に行われたそのような構造単純化により生じた意図しない結果のひとつは、広域結合親和性の損失であった。その代表例は、オクトレオチド(OCTREOTIDE、登録商標)系列ペプチドにおいてタイプ2親和性は高いが、タイプ1、3、4および5親和性が低いことである。したがって、このタイプの類似体を用いた多くの基礎的な生物学的研究では、1つのタイプ以外のすべてのソマトスタチン受容体が仲介する作用を検出することができなかった。それ以来、一方では生物学的に安定な低分子ペプチドに広域結合性を再導入すること、そして特定の受容体に対する個別の特異性をもつペプチドおよびペプチド模倣体を開発することに向けて、多くの研究が行われた。
【0003】
本発明者らは、各アミノ酸のN−アルキル化によりペプチド主鎖拘束を導入できることを見いだした。この修飾により、当該残基およびその前のアミノ酸が伸長コンホメーションをとるのが大幅に制限される。したがって、潜在的な分子内水素結合部位および同様にタンパク質分解酵素開裂部位がさらにブロックされ、これによりペプチドの薬物動態特性を向上させることができる。市販されているN−メチルアミノ酸はごくわずかであり、それらの合成は冗長である。しかし本発明の他の態様において本発明者らは、MillerおよびScanlanが報告した最近の文献から応用した固相法により、トランケート形ソマトスタチン類似体をあらゆるアミノ酸残基においてN−メチル化する方法を見いだした。
【発明の開示】
【0004】
発明の概要
1態様において本発明は、式(I)の化合物:
A1-cyclo[D-Cys-A2-D-Trp-A3-A4-Cys]-A5-Y1
(I)
またはその医薬的に許容できる塩に関する:
式中:
A1は、置換されていてもよい芳香族α−アミノ酸であり;
A2は、置換されていてもよい芳香族α−アミノ酸であり;
A3は、Dab、Dap、LysまたはOrnであり;
A4は、β−ヒドロキシバリン、Ser、HserまたはThrであり;
A5は、置換されていてもよいD−またはL−芳香族α−アミノ酸であり;
Y1は、OH、NH2またはNHR1であり、ここでR1は(C1-6)アルキルであり;
これらにおいて、置換されていてもよい芳香族α−アミノ酸は、それぞれ独立してハロゲン、NO2、OH、CN、(C1-6)アルキル、(C2-6)アルケニル、(C2-6)アルキニル、(C1-6)アルコキシ、Bzl、O−BzlおよびNR9R10よりなる群から選択される1個以上の置換基で置換されていてもよく、R9およびR10はそれぞれ独立してH、Oまたは(C1-6)アルキルであり;
式(I)の各アミドペプチド結合およびA1のアミノ基のアミン窒素はメチル基で置換されていてもよく、ただしそのようなメチル基が少なくとも1つある。
【0005】
1態様において本発明は、下記の式(I)のペプチドまたはその医薬的に許容できる塩である:
A1が、Cpa、1-Nal、2-Nal、2-Pal、3-Pal、4-Pal、Phe、Tfm、TyrまたはTyr(I)であり;
A2が、2-Pal、3-Pal、4-Pal、Phe、TyrまたはTyr(I)であり;
A5が、Dip、1-Nal、2-Nal、2-Pal、3-Pal、4-Pal、PheまたはD-Trpである。
【0006】
他の態様において本発明は、A1がCpaである上記ペプチド群のペプチドである。
他の態様において本発明は、A3がNMeLysである上記ペプチド群のペプチドである。
【0007】
さらに他の態様において本発明は、ペプチドが次式のものまたはその医薬的に許容できる塩である式(I)のペプチドである:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(NMeDCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NHMe;
Cpa-cyclo(DCys-NMe3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-NMeThr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-NMeCys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-Nme2-Nal-NH2;
Cpa-cyclo(NMeDCys-3-Pal-DTrp-Lys-Thr-Cys)-Dip-NHMe;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Tfm-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;
Nal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;または
3-Pal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【0008】
さらに他の態様において本発明は、ペプチドが次式のものまたはその医薬的に許容できる塩である式(I)のペプチドである:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;
Nal-cyclo(DCys-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;または
3-Pal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【0009】
さらに他の態様において本発明は、ペプチドが次式のものまたはその医薬的に許容できる塩である式(I)のペプチドである:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;または
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【0010】
さらに他の態様において本発明は、ペプチドが次式のものまたはその医薬的に許容できる塩である上記ペプチド群のペプチドである:
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;または
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2。
【0011】
他の形態において本発明は、ソマトスタチンサブタイプ受容体−1、−2、−3、−4および−5のうち1種類以上を結合する方法であって、請求項1に記載の化合物またはその医薬的に許容できる塩を1種類以上のソマトスタチンサブタイプ受容体と接触させる工程を含む方法である。
【0012】
前記形態の1態様において本発明は、ヒト対象または他の動物対象においてソマトスタチンサブタイプ受容体−1、−2、−3、−4および−5のうち1種類以上を結合する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩をその必要がある対象に投与する工程を含む方法である。
【0013】
他の態様において本発明は、細胞からソマトスタチンアンタゴニスト作用を誘発する方法であって、細胞が1種類以上のソマトスタチン受容体を含み、細胞を有効量の請求項1に記載の化合物またはその医薬的に許容できる塩と接触させることを含む方法である。
【0014】
さらに他の態様において本発明は、ヒト対象または他の動物対象においてソマトスタチンアンタゴニスト作用を誘発する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩をその必要がある対象に投与する工程を含む方法を提供する。
【0015】
他の態様において本発明は、ヒトまたは動物対象において成長ホルモンの放出を促進する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与することを含む方法である。
【0016】
他の態様において本発明は、その必要があるヒトまたは動物対象においてインスリンの放出を促進する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与することを含む方法である。
【0017】
他の態様において本発明は、その必要があるヒトまたは動物対象において創傷の治癒を増進する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与することを含む方法である。
【0018】
さらに他の態様において本発明は、その必要があるヒトまたは動物対象において血管形成を促進する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与することを含む方法である。
【0019】
他の態様において本発明は、その必要があるヒトまたは他の動物対象において疾病または症状を処置する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与する工程を含み、その際、疾病または症状が短身(short statue)、悪液質、衰弱、II型糖尿病、循環不良などよりなる群から選択されるものである方法である。
【0020】
他の態様において本発明は、ソマトスタチン受容体を有する細胞をイメージングする方法であって、Tyr(I)を含む有効量の請求項1に記載の化合物またはその医薬的に許容できる塩と細胞を接触させることを含む方法である。
【0021】
詳細な説明
当業者は本明細書の記載に基づいて本発明を最大限に利用できる。したがって以下の具体的な態様は単なる本発明の説明と解釈すべきであり、本発明の全範囲を限定するためのものではない。
【0022】
当業者に周知のように、ソマトスタチンの既知の用途および潜在的な用途は多種多様である。ソマトスタチンおよびその類似体は下記に挙げる疾病および/または症状の処置に有用であることが知られている。ソマトスタチンの多様な用途は下記のようにまとめることができる:クッシング症候群 (参照:Clark, R. V. et al, Clin. Res. 38, p. 943A, 1990);ゴナドトロピン産生腫瘍 (参照:Ambrosi B., et al., Acta Endocr. (Copenh.) 122, 569-576, 1990);副甲状腺機能亢進症(参照:Miller, D., et al., Canad. Med. Ass. J., Vol. 145, pp. 227-228, 1991);ページェット病(参照:Palmieri, G. M. A., et
al., J. of Bone and Mineral Research, 7, (Suppl. 1), p. S240 (Abs. 591), 1992);VIP産生腫瘍 (参照:Koberstein, B., et al., Z. Gastroenterology, 28, 295-301, 1990 および Christensen, C., Acta Chir. Scand. 155, 541-543, 1989);膵島細胞症およびインスリン過剰症(参照:Laron, Z., Israel J. Med. Sci., 26, No. 1, 1-2, 1990;Wilson, D. C., Irish J. Med. Sci., 158, No. 1, 31-32, 1989;および Micic, D., et al., Digestion, 16, Suppl. 1.70. Abs. 193, 1990);ガストリン産生腫瘍 (参照:Bauer, F. E., et al., Europ. J. Pharmacol., 183, 55 1990);ゾリンジャー-エリソン症候群 (参照:Mozell, E., et al., Surg. Gynec. Obstet., 170, 476-484, 1990);エイズその他の症状に関連する分泌過多性下痢 (エイズによるもの:参照:Cello, J. P., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A163 1990;ガストリン放出ペプチド過多によるもの:参照:Alhindawi, R., et al., Can. J. Surg., 33, 139-142, 1990;腸移植片対宿主疾患に伴うもの:参照: Bianco J. A., et al., Transplantation, 49, 1194-1195, 1990;化学療法関連の下痢:参照:Petrelli, N., et al., Proc. Amer. Soc. Clin. Oncol., Vol. 10, P 138, Abstr. No. 417 1991);過敏性腸症候群 (参照:O'Donnell, L. J. D., et al., Aliment. Pharmacol. Therap., Vol. 4., 177-181, 1990);膵炎 (参照:Tulassay, Z., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A238, 1990);クローン病 (参照:Fedorak, R. N., et al., Can. J. Gastroenterology, 3, No. 2, 53-57, 1989);全身性硬化症 (参照:Soudah, H., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A129, 1990);甲状腺癌 (参照:Modigliani, E., et al., Ann., Endocr. (Paris), 50, 483-488, 1989);乾癬 (参照:Camisa, C., et al., Cleveland Clinic J. Med., 57 No. 1, 71-76, 1990);低血圧症 (参照:Hoeldtke, R. D., et al., Arch. Phys. Med. Rehabil., 69, 895-898, 1988 および Kooner, J. S., et al., Brit. J. Clin. Pharmacol., 28, 735P-736P, 1989); パニック発作 (参照:Abelson, J. L., et al., Clin. Psychopharmacol., 10, 128-132, 1990); 硬腫(sclerodoma)(参照:Soudah, H., et al., Clin. Res., Vol. 39, p. 303A, 1991); 小腸閉塞 (参照:Nott, D. M., et al., Brit. J. Surg., Vol. 77, p. A691, 1990); 胃食道逆流症 (参照:Branch, M. S., et al., Gastroenterology, Vol. 100, No. 5, Part 2 Suppl., p. A425, 1991); 十二指腸胃逆流症 (参照:Hasler, W., et al., Gastroenterology, Vol. 100, No. 5, Part 2, Suppl., p. A448, 1991); グレーブズ病 (参照:Chang, T. C., et al., Brit. Med. J., 304, p. 158, 1992); 多嚢胞性卵巣 (参照:Prelevic, G. M., et al., Metabolism Clinical and Experimental, 41, Suppl. 2, pp 76-79, 1992); 上部消化管出血 (参照:Jenkins, S. A., et al., Gut., 33, pp. 404-407, 1992 および Arrigoni, A., et al., American Journal of Gastroenterology, 87, p. 1311, (abs. 275), 1992); 膵仮性嚢胞および腹水 (参照:Hartley, J. E., et al., J. Roy. Soc. Med., 85, pp. 107-108, 1992); 白血病 (参照:Santini, et al., 78, (Suppl. 1), p. 429A (Abs. 1708), 1991); 髄膜腫 (参照:Koper, J. W., et al., J. Clin. Endocr. Metab., 74, pp. 543-547, 1992); ならびに癌悪液質 (参照:Bartlett, D. L., et al., Surg. Forum., 42, pp. 14-16, 1991)。以上の参考文献の内容を本明細書に援用する。
【0023】
本発明のペプチドは、ソマトスタチンの1種類以上の活性に対するアンタゴニストとして有用である。たとえば、本発明のペプチドを用いて対象(たとえばヒト患者などの哺乳動物)における成長ホルモンまたはインスリンの放出を促進することができる。したがってこれらのペプチドは、成長ホルモンまたはインスリンの放出促進が有益となる生理学的状態の処置に有用である。本発明のペプチドは、創傷治癒の増進または血管形成の促進にも使用できる。さらにTyr(I)残基をもつ本発明ペプチドは、ソマトスタチン受容体を含む細胞のイメージングに使用できる。そのような本発明ペプチドは、インビボでソマトスタチン受容体をもつ細胞(たとえば癌細胞)の検出に、またはインビトロでソマトスタチン受容体結合アッセイにおける放射性リガンドとして使用できる。この本発明ペプチドは、放射性同位体で細胞をターゲティングするためのベクターとしても使用できる。
【0024】
同様に本発明の範囲に含まれるのは、成長ホルモンまたはインスリンの放出を促進する必要を伴う疾病または障害を処置する際に使用するための、かつソマトスタチン受容体の検出、たとえば放射線イメージング法に使用するための、前記一般式に含まれるペプチドである。
【0025】
式(I)の化合物またはその医薬的に許容できる塩は、経口、非経口(たとえば筋肉内、腹腔内、静脈内もしくは皮下への注射、または埋込み)、鼻、膣、直腸、舌下または局所投与経路で投与でき、医薬的に許容できるキャリヤーと配合して各投与経路に適切な剤形を得ることができる。
【0026】
経口投与のための固体剤形には、カプセル剤、錠剤、丸剤、散剤および顆粒剤が含まれる。そのような固体剤形においては、有効化合物を少なくとも1種類の医薬的に許容できる不活性キャリヤー、たとえばショ糖、乳糖またはデンプンと混合する。そのような剤形は、常法によりこれらの不活性希釈剤以外の物質、たとえばステアリン酸マグネシウムなどの滑沢剤を含むこともできる。カプセル剤、錠剤および丸剤の場合、これらの剤形は緩衝剤を含むこともできる。錠剤および丸剤はさらに腸溶コーティングを備えたものとして製造できる。
【0027】
経口投与用の液体剤形には、当技術分野で慣用される不活性希釈剤、たとえば水を含有する、医薬的に許容できる乳剤、液剤、懸濁液剤、シロップ剤、エリキシル剤が含まれる。そのような不活性希釈剤のほかに、組成物は佐剤、たとえば湿潤剤、乳化剤および沈殿防止剤、ならびに甘味剤、着香剤および香料を含有することもできる。
【0028】
非経口投与用の本発明製剤には、無菌の水性または非水性の液剤、懸濁液剤または乳剤が含まれる。非水性の溶剤またはビヒクルの例は、プロピレングリコール、ポリエチレングリコール、植物油、たとえばオリーブ油およびトウモロコシ油、ゼラチン、ならびに注射用有機エステル、たとえばオレイン酸エチルである。そのような剤形は、佐剤、たとえば保存剤、湿潤剤、乳化剤および分散剤を含有してもよい。それらは、たとえば細菌捕獲フィルターによる濾過により、殺菌剤を組成物に含有させることにより、組成物の照射により、または組成物の加熱により殺菌できる。それらを無菌固体組成物の形で調製し、使用直前に無菌水または他のいずれかの無菌注射用媒質に溶解することもできる。
【0029】
直腸または膣投与用組成物は好ましくは坐剤であり、これらは有効物質のほかに賦形剤、たとえばカカオ脂または坐剤用ろうを含有することができる。
鼻または舌下投与用組成物も、当技術分野で周知の標準的賦形剤を用いて製造される。
【0030】
本発明組成物中の有効成分の用量は変更できるが、有効成分の用量は適切な剤形が得られるものでなければならない。選択する用量は、目的とする療法効果、投与経路および処置期間に依存する。目的とする療法効果を得るためには、一般に1日当たり25μg/kg〜100mg/kg(体重)のレベルの量を、1回量として、または多数回に分けて、ヒトまたは他の動物、たとえば哺乳動物に投与する。
【0031】
好ましい一般用量範囲は1日当たり250μg/kg〜5.0mg/kg(体重)であり、これを1回量として、または多数回に分けて投与できる。
さらに、式(I)の化合物をたとえば下記の特許に記載される持効性組成物として投与できる。これらの配合物のうち、14日または28日徐放性配合物が好ましい。USP5,672,659には、ペプチドおよびポリエステルを含む持効性組成物が教示されている。USP5,595,760には、ゲル化可能な形のペプチドを含む持効性組成物が教示されている。USP5,821,221には、ペプチドおよびキトサンを含む持効性高分子組成物が教示されている。USP5,916,883には、ペプチドおよびシクロデキストリンを含む持効性組成物が教示されている。国際特許出願PCT/US99/01180(公開番号WO99/38536、1999年8月5日)には、吸収可能な持効性ペプチド組成物が教示されている。以上の特許および出願の内容を本明細書に援用する。
【0032】
即効性または持効性組成物の使用は、目標とする適応症のタイプに依存する。適応症が急性または過急性障害からなる場合、持効性組成物による治療より即効性剤形による治療の方が好ましいであろう。これに対し、予防または長期治療のためには持効性組成物が一般に好ましいであろう。
【0033】
略号
ソマトスタチン受容体サブタイプの命名法はIUPHARの推奨に従う。sstr4は最初にBrunoらがクローニングした受容体を表わし、sstr5は最初にO'Carrollらがクローニングした受容体を表わす。
【0034】
一般アミノ酸の略号はIUPAC-IUBの推奨に従う。さらに本明細書中で用いる特定の略号の定義は下記のとおりである:
Abu = (-アミノ酪酸;
Aib = (-アミノイソ酪酸;
β-Ala = (-アラニン;
Amp = 4-アミノフェニルアラニン;
Ava = 5-アミノ吉草酸;
Cha = シクロヘキシルアラニン;
Cpa = 3-(4-クロフェニル)アラニン;
Dab = 2,4-ジアミノ酪酸;
Dap = 2,3-ジアミノプロピオン酸;
Dip = 3,3'-ジフェニルアラニン;
Gaba = (-アミノ酪酸;
HSer = ホモセリン;
1-Nal = 3-(1-ナフチル)アラニン;
2-Nal = 3-(2-ナフチル)アラニン;
Nle = ノルロイシン;
Nva = ノルバリン;
2-Pal = 3-(2-ピリジル)アラニン;
3-Pal = 3-(3-ピリジル)アラニン;
4-Pal = 3-(4-ピリジル)アラニン;
Tfm = トリフルオロメチル;および
TfmA = 4-トリフルオロメチルフェニルアラニン;
Tyr(I) = ヨウ素化チロシン残基(たとえば3-1-Tyr、5-I-Tyr、3,5-I-Tyr)ヨウ素は放射性同位体、たとえばI125、I127またはI131であってもよい。
【0035】
下記の特定の試薬の略号も本明細書中に用いられる:
DBU = 1,8-ジアザビシクロ[5.4.0]ウンデク-7-エン;
DCM = ジクロロメタン;
DIC = ジイソプロピルカルボジイミド;
DIEA = ジイソプロピルエチルアミン;
DMF = ジメチルホルムアミド;
MTBD = 1,3,4,6,7,8-ヘキサヒドロ-1-メチル-2H-ピリミド[1,2-a]ピリミジン;
o-NBS = 2-ニトロベンゼンスルホニル;
TBTU = O-ベンゾトリアゾール-1-イル-N,N,N',N'-テトラメチルウロニウムテトラフルオロボレート;および
TFA = トリフルオロ酢酸。
【0036】
本明細書においてN−末端アミノ酸(たとえばA1についてのCpa)以外のすべてのアミノ酸の略号が-NH-CH(R)-CO-の構造を表わし、ここでRはアミノ酸の側鎖(たとえばAlaについてのCH3)である。N−末端アミノ酸については、略号は(R1R2)-N-CH (R)-CO-の構造を表わし、ここでRはアミノ酸の側鎖であり、R1およびR2はそれぞれ独立してHまたは本明細書に定義した他のものである。
【0037】
脂肪族アミノ酸は、1つまたは2つの側鎖をもつα−アミノ酸であり、側鎖は独立して炭化水素、たとえば炭素原子1〜6個の直鎖または分枝鎖である。脂肪族アミノ酸の例には、Ala、Aib、Val、Leu、Tle、Ile、Nle、NvaまたはAbuが含まれる。
【0038】
”芳香族α−アミノ酸”が意味するものは、次式のアミノ酸残基である:
【0039】
【化1】

【0040】
式中、Z1は芳香環を含む部分であり、Z2は水素または芳香環を含む部分である。そのような芳香環を含む部分には、ベンゼン環またはピリジン環および下記の構造が含まれるが、それらに限定されない。芳香環は1個以上の置換基Xを含むか、または含まない(Xはそれぞれの場合独立してハロゲン、NO2、CH3、OCH3、CF3またはOHである):
【0041】
【化2】

【0042】
本発明の芳香族α−アミノ酸の他の例は、置換されたHis、たとえばMeHis、His(τ−Me)またはHis(π−Me)である。
本明細書中で用いる”アルキル”は、表示した長さをもつ直鎖または分枝鎖構造いずれのアルキル基も含むものとする。そのようなアルキル基の例は、メチル、エチル、プロピル、イソプロピル、ブチル、sec−ブチル、t−ブチル、ペンチル、イソペンチル、ヘキシル、イソヘキシルなどである。用語C0アルキルが定義に含まれる場合、これは共有単結合を表わすものとする。
【0043】
”低級アルキル”という用語は、炭素原子1〜6個の分枝鎖および直鎖アルキル基の両方を含むものとする。
本明細書中で用いる”アリール”は、各環が最高7員の安定な単環式、二環式または三環式炭素環を含むものとし、その際少なくとも1つの環は芳香環である。アリール基の例には、フェニル、ナフチル、アントラセニル、ビフェニル、テトラヒドロナフチル、インダニル、フェナントレニルなどが含まれる。
【0044】
本明細書中で用いる”ヘテロサイクリル(複素環)”は、安定な5〜7員単環式複素環、または安定な8〜11員二環式複素環、または安定な11〜15員三環式複素環を表わす。これらは飽和または不飽和であり、炭素原子、ならびにN、OおよびSよりなる群から選択される1〜4個の異種原子からなる。前記複素環のいずれかがベンゼン環に縮合した二環式基も含まれる。複素環式環は、安定な構造を形成するいかなる異種原子または炭素原子においても結合できる。そのような複素環式要素には下記のものが含まれるが、これらに限定されない:アゼピニル、ベンゾイミダゾリル、ベンゾイソオキサゾリル、ベンゾフラザニル、ベンゾピラニル、ベンゾチオピラニル、ベンゾフリル、ベンゾチアゾリル、ベンゾチエニル、ベンゾオキサゾリル、クロマニル、シンノリニル、ジヒドロベンゾフリル、ジヒドロベンゾチエニル、ジヒドロベンゾチオピラニル、ジヒドロベンゾチオピラニルスルホン、フリル、イミダゾリジニル、イミダゾリニル、イミダゾリル、インドリニル、インドリル、イソクロマニル、イソインドリニル、イソキノリニル、イソチアゾリジニル、イソチアゾリル、イソチアゾリジニル、モルホリニル、ナフチリジニル、オキサジ
アゾリル、2−オキソアゼピニル、2−オキソピペラジニル、2−オキソピペリジニル、2−オキソピロリジニル、ピペリジル、ピペラジニル、ピリジル、ピリジルN−オキシド、キノキサリニル、テトラヒドロフリル、テトラヒドロイソキノリニル、テトラヒドロイソキノリニル、テトラヒドロ−キノリニル、チアモルホリニル、チアモルホリニルスルホキシド、チアゾリル、チアゾリニル、チエノフリル、チエノチエニル、チエニルなど。
【0045】
”置換された”という用語は、1個以上の当該置換基(たとえばハロ、ヒドロキシ、低級アルキルなど)で置換された当該基(たとえば低級アルキル、アリール、シクロアルキルなど)を含むものとする。置換基はその基のいずれの原子に結合していてもよい。
【0046】
略号”NMe”は”N−メチル−”を表わす。本明細書中で用いるNMeは、関連アミノ酸のアミド窒素がメチル化されていることを示す。たとえば”NmeCpa”は-N(CH3)-CH(R)-CO-(Rは4−クロロフェニル)、”Nme2−Nal”は-N(CH3)-CH(R)-CO-(Rは2−ナフチル)などを表わす。
【0047】
アルコキシという用語は、表示した長さの直鎖または分枝鎖構造のアルコキシ基を含むものとする。そのようなアルコキシ基の例は、メトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、t−ブトキシ、ペントキシ、イソペントキシ、ヘキソキシ、イソヘキソキシなどである。
【0048】
ハロゲンまたはハロという用語は、ハロゲン原子であるフッ素、塩素、臭素およびヨウ素を含むものとする。
アミノ酸残基が光学活性である場合、D−形と特に表示しない限りL−形であるものとする。
【0049】
材料
4−メチルベンゾヒドリルアミン塩酸塩樹脂(0.25または0.5ミリ当量/g)をAdvanced ChemTech Inc.(ケンタッキー州ルイビル)から入手した。Nαt−ブチルオキシカルボニル(Boc)保護されたアミノ酸をBachem Inc.(カリフォルニア州トランス)、Advanced ChemTech Inc.およびSynthetech Inc.(オレゴン州アルバニー)から購入した。アミノ酸の反応性側鎖を下記の1以上の基で遮断した:Cys,4−メチルベンジルオキシカルボニル;Lys,2−クロロベンジルオキシカルボニル;Thr,O−ベンジル;Tyr,O−2,6−ジクロロベンジル。試薬および溶媒はすべてACS等級以上であり、それ以上精製せずに用いられた。
【0050】
ペプチド合成
ペプチド合成は下記の反応経路により概説できる:
【0051】
【化3】

【0052】
式(I)の化合物は、4−メチルベンゾヒドリルアミン官能化1%架橋ポリスチレン樹脂(0.25または0.5ミリ当量/g)上、0.25mmol規模で、Advanced ChemTech(200型)合成装置により、下記のプロトコルを用いて合成でき、この方法で合成された:脱ブロック、40%TFA(2分、20分);DCM洗浄サイクル(3回洗浄);中和、10%DIEA(1分、5分);DMF洗浄サイクル;DCM洗浄サイクル(2回洗浄);2回の結合;1回目は1,3−ジイソプロピルカルボジイミドエステル(3当量)を用いてDCM中で30分間;DCM洗浄(3回洗浄);2回目の結合は予備調製TBTUエステル(3当量)を用いてDMF中で90分間、触媒量のDIEAを使用;DMF洗浄(1回洗浄);DCM洗浄(3回洗浄)。結合反応を定性的にモニターする。
【0053】
Nα−保護
目的とするメチル化部位のアミノ基を脱ブロックした後、樹脂をDCM(20mL)に懸濁した。この懸濁液にコリジン(3当量)およびo−ニトロベンゼンスルホニルクロリド(3当量)を添加し、混合物をAdvanced ChemTech(200型)合成装置で2時間振とうした。次いで樹脂をDCM洗浄(2回洗浄)およびDMF洗浄(3回洗浄)した。保護をニンヒドリン試験により定性的にモニターする。
【0054】
Nα−メチル化
o−ニトロベンゼンスルホンアミド保護した樹脂をDMF(20mL)に懸濁し、これにMTBD(3当量)および4−ニトロベンゼンスルホン酸メチルまたはジメチル硫酸(Cys11について)を添加した。混合物をAdvanced ChemTech(200型)合成装置で0.5時間振とうし、樹脂をDMF洗浄(4回洗浄)した。
【0055】
Nα−Me脱保護
目的残基をメチル化した後、樹脂を再びDMF(20mL)に懸濁した。この懸濁液にDBU(3当量)および2−メルカプトエタノール(3当量)を添加し、混合物をAdvanced ChemTech(200型)合成装置中で0.5時間撹拌した。次いで樹脂をDMF(5回
洗浄)で十分に洗浄した。
【0056】
以上のメチル化法は、ジメチル化誘導体になったD−Cys6(たとえば化合物2および10参照)以外のすべての残基について良好に行われた。しかしD−Cys6をCys6に代えるとモノメチル化ペプチドが得られた。
【0057】
ペプチドの開裂
捕そく剤アニソール(約30%v/v)を含有する無水フッ化水素を用いて0℃で45分間の酸加水分解により、ペプチドを樹脂支持体から開裂させ、同時に側鎖を脱保護した。ペプチドを90%酢酸(約600mL)中でわずかに過剰のI2により環化した(15分間)。次いでアスコルビン酸の添加により過剰のI2を除去した。
【0058】
精製
粗製ペプチドを、C−18結合シリカゲル上、軸圧縮カラム(Dynamax-300Å、5または8μm、21.4×250mm)を用いる調製用RP−HPLCにより精製した。直線勾配溶離系を20mL/分の流速で用いた:A;0.1%TFA、B;80%MeCN中の0.1%TFA、20%B〜50%B、1%/分。分離を分析用RP−HPLCにより215nmでモニターした。生成物含有画分をプールし、真空濃縮し、凍結乾燥した。各ペプチドが酢酸水溶液からの凍結乾燥により一定重量の綿毛状白色粉末として得られた。最終ペプチドの純度を分析用RP−HPLCにより215nmで評価した。Vydac C−18支持体(4.6×250mm、5μm、孔径300Å、Liquid Separations Group)を用いて分析用RP−HPLCを記録した。直線勾配溶離系を1.5mL/分の流速で用いた:HPLC−1、A、0.1%TFA;B、80%MeCN中の0.1%TFA;20%B〜50%B、1%/分;HPLC−2、C、TEAP(0.1M、pH3)中の5%MeCN;D、MeCN中の20%C、10%D〜70%D、1%/分。カラム溶出液を215nmでモニターした。各ペプチドの保持時間および純度をRainin Dynamax HPLC Method Managerにより評価した。各ペプチドは純度>98%をもつことが認められた。HPLC保持時間の結果を表1に示す。
【0059】
【表1−1】

【0060】
【表1−2】

【0061】
アミノ酸分析
ペプチドを真空下に(110℃;20時間)、0.2%の3−(2−アミノエチル)インドール(Pierce)を含有する4Mメタンスルホン酸中で加水分解した。加水分解物について、o−フタリドアルデヒド試薬(Sigma Chemical Co.)で誘導体化した後、一体式ガードカラム付き100×4.6mm、3μmのC18軸圧縮カラム(Microsorb AAAnalysis(商標)O型;Rainin Instrument Co.)を取り付けた自動HPLCシステム(Rainin Instrument Co.)によりアミノ酸分析を行った。誘導体化した第一級アミノ酸を二元勾配により溶離した:緩衝液A;4.5%v/vのメタノールおよび0.5%v/vのテトラヒドロフランを含有する0.10M酢酸ナトリウム(pH7.2)および緩衝液B;メタノール。勾配シーケンス;0分で0%A;16.5分で35%A;30分で90%A;33分で90%Aを、流速1.0mL/分で周囲温度において使用。溶出液を340nmでモニターし、Dynamax HPLC Method Manager(Rainin)により積分する。標準保持時間は下記のとおりであった:Asp、6.6分;Arg、19.9分;Trp、25.4分およびLys、29.5分。表1の各ペプチドが第一級アミノ酸について予想した分析結果を示した。システインは定量されない。
【0062】
質量分析
LaserMat 2000 質量分析計(Thermal Bioanalysis、カリフォルニア州サンホゼ)を使用し、マトリックスとしてのα−シアノ−4−ヒドロキシケイ皮酸および内標準としてのサブスタンスP(1348.7 Da)を用いて、マトリックス支援レーザー脱離/イオン化飛行時間型質量分析によりペプチドを分析した。それぞれの場合、スペクトルは内標準に関する主M−H+イオンピーク、予想した被分析体M−H+イオンピーク、およびマトリックス(< 500 Da)に伴う数ピークからなっていた。結果を表1に示す。
【0063】
SRIFによるGH放出抑制の拮抗
雄ラット成体から下垂体前葉を採集し、これまでに文献記載されているトリプシン/DNase法により分散させた(Murphy, W. A.; Taylor, J.; Moreau, J.-P. および Coy, D. H., Peptide Res. 1989, 2, 128-132)。分散した細胞を、無菌濾過したダルベッコ改変イーグル培地で希釈し(MEM、Gibco Laboratories、ニューヨーク州グランド・アイランド)、これに2.5%のウシ胎仔血清(Gibco)、3%のウマ血清(Gibco)、10%の新鮮ラット血清(氷上に保存、1時間を超えない)(下垂体ドナー由来)、1%のMEM非必須アミノ酸(Gibco)、ゲンタマイシン(10 ng mL-1;Sigma)およびナイスタチン(10,000 U mL-1;Gibco)を補充した。細胞をランダムに約200,000個/ウェルの密度で接種した(Costar cluster 24;Rochester Scientific Co.;ニューヨーク州ロチェスター)。接種した細胞を前記ダルベッコ培地中に、95%空気/5%CO2、37℃の加湿雰囲気で4〜6日間維持した。ホルモン攻撃用に調製する際には、細胞を培地199(Gibco、1mL、3回洗浄)で洗浄した。各用量の本発明化合物(プレート当たり6種類の用量)を、3ウェル内で1nM SRIFの存在下に、1%のBSA(フラクションV;Sigma Chemical Co.)を含有する全体積1mLの培地199中で試験した。すべてのウェルにGHRH(1−29)NH2(1nM)を装入した。GHRH(1−29)NH2(1nM)で刺激した対照群、およびSRIF(1nM)とGHRH(1−29)NH2(1nM)で阻害した対照群を、それぞれの細胞培養プレートに含めた。空気/二酸化炭素雰囲気(95/5%、37℃で3時間)で3時間インキュベートした後、培地を除去し、ホルモン含量をアッセイするまで−20℃に保存した。National Hormone and Pituitary Program (NHHP)(カリフォルニア州トランス)のDr. A. F. Parlowから好意的に提供された成分を用いて、培地中の成長ホルモンを標準二重抗体RIAにより測定した。
【0064】
SRIF(1nM)に対するアンタゴニストのIC50をSigmaplot(Jandel Scientific、カリフォルニア州サン・ラファエル)により計算した。数値を平均IC50(nM)±SEMとして表わし、表2に示す。
【0065】
【表2−1】

【0066】
【表2−2】

【0067】
クローン化ヒトソマトスタチン受容体の機能性発現
ヒトソマトスタチン受容体(hsstr1-5)を含むゲノムクローン(Yamada, Y., et al., Proc. Natl. Acad. Sci. USA. 1992, 89, 251-255;Yasuda, K., et al., J. Biol. Chem. 1992, 267, 20422-20428;Yamada, Y., et al., Mol. Pharmacol. 1992, 42, 2136-2142;Rohrer, L., et al., Proc. Natl. Acad. Sci. USA. 1993, 90, 4196-4200)は、Dr. Graeme I. Bell(シカゴ大学)から好意的に提供された。hsstr1、hsstr2、hsstr3、hsstr4およびhsstr5 cDNAを、それぞれ1.5−kbのPstI−XmnIフラグメント、1.7−kbのBamHI−HindIIIフラグメント、2.0−kbのNcoI−HindIIIフラグメント、1.4−kbのNheI−NdeIフラグメント、および1.2−kbのHindIII−XbaIフラグメントとして単離した。これらはそれぞれ全長受容体の全コード領域を含む。これらのフラグメントを個別に、哺乳動物発現ベクターpCMV5の対応する制限エンドヌクレアーゼ部位において、ヒトサイトメガロウイルス(CMV)プロモーターの下流にサブクローニングし、発現プラスミドpCMV5/hsstr1、pCMV5/hsstr2、pCMV5/hsstr3、pCMV5/hsstr4およびpCMV5/hsstr5を作製した。CHO−K1細胞中へのトランスフェクションのために、哺乳動物細胞ネオマイシン選択マーカーを保有するプラスミドpRSV−neo(American Type Culture Collection、マリーランド州ロックビル)を付加した。
【0068】
受容体発現およびトランスフェクション
リン酸カルシウム法によりトランスフェクションを実施した。10%のウシ胎仔血清を補充したα−最少必須培地(α−MEM;Gibco)にCHO−K1細胞を維持し、リン酸カルシウム沈殿法によりそれぞれの発現プラスミドでトランスフェクションした。発現プラスミドが挿入されたクローンを、500μg mL-1のゲネチシン(G418;Gibco)を補充したα−MEM中で選択した。独立したCHO−K1クローンをガラス環クローニングにより採取し、選択培地での培養により増殖させた。単離クローンから膜を調製し、まず[125I]Tyr11−SRIFおよび[125I]MK−678(sstr2について)との結合についてhsstr発現を評価した。
【0069】
放射性リガンド結合アッセイ
5タイプの受容体について、対応するCHO−K1細胞のホモジェネート(Polytron設定6、15秒)から氷冷トリス−HCl(50mM)中で細胞膜を採取し、遠心した(39000g、10分、2回);中間で新たな緩衝液に再懸濁した。最終ペレットをアッセイのためにトリス−HCl(10mM)に再懸濁する。アリコートの膜を0.05nMの[125I]Tyr11−SRIF(タイプ1、3、4、5)または[125I]MK−678(タイプ2)と共に、BSA(10 mg mL-1)、MgCl2(5 mM)、Trasylol(200 kIU mL-1)、バシトラシン(0.02 mg mL-1)およびフッ化フェニルメタンスルホニル(0.02 mg mL-1)を含有する50mM HEPES(pH7.4)中でインキュベートする(37℃、30分間)。最終アッセイ体積は0.3mLであり、0.3%ポリ(エチレンイミン)に予め浸漬したGF/CフィルターでBrandel迅速濾過モジュールを用いて迅速濾過することによりインキュベーションを終了する。次いでそれぞれの試験管およびフィルターをアリコートの冷緩衝液(5mL、3回)で洗浄する。
【0070】
結合した全放射性リガンドから1.0μM SRIFの存在下で結合したリガンドを差し引いたものとして比結合を定義する。これらのアッセイ系により下記の全放射性リガンド結合値および非特異的結合(nsb)値が一般に得られる:hsstr1、7000cpmの全結合−対3500cpmのnsb;hsstr2、9000cpmの全結合−対1000cpmのnsb;hsstr3、8000cpmの全結合−対1000cpmのnsb;hsstr4、6000cpmの全結合−対3500cpmのnsb;およびhsstr5、7500cpmの全結合−対3500cpmのnsb。結合親和性を5種類の受容体サブタイプそれぞれについてKi値±SEM(nM)として表わし、表2に示す。
【0071】
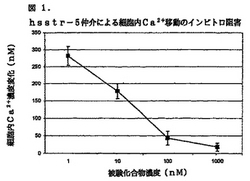
タイプ5仲介による細胞内Ca2+移動
ヒトsst5受容体を発現するCHO−K1細胞を0.3%EDTA/リン酸緩衝化塩類溶液(25℃)中でのインキュベーションにより収穫し、遠心により2回洗浄した。洗浄した細胞を、蛍光Ca2+指示薬Fura-2AM添加のためにハンクス緩衝化塩類溶液(HBSS)に再懸濁した。約106個/mlの細胞懸濁液を、2μMのFura-2AMと共に約25℃で30分間インキュベートした。結合しなかったFura-2AMをHBSS中で2回の遠心により除去し、磁気撹拌機構および温度調節式キュベットホルダーを備えた蛍光分光計(日立F-2000)に最終懸濁液を移した。37℃で平衡化した後、細胞内Ca2+移動の測定のためにソマトスタチンペプチドを添加した。励起および発光波長はそれぞれ340および510nmであった。
【0072】
例示データを図1に示す。これは上記アッセイ法で被験化合物として類似体5を用いて得た結果を表わす。
分子モデリング
Silicon Graphics Indigo2 High Impact 10000 コンピューターにより、SYBYL分子モデリングソフトウェア、バージョン6.6(Tripos Associates Inc.、米国ミズーリ州セントルイス)を用い、Kollman全原子力場法(Weiner, S. J., et al., J. Comp. Chem. 1986, 7, 230-252)で分子モデリングを行った。始化合物Sandostatin/オクトレオチド(Octreotide)の3溶液NMR構造;D-Phe5-c[Cys6-Phe7-D-Trp8-Lys9-Thr10-Cys11]-Thr12-ol(1SOCおよび2SOC)に関するPDBファイルをPDBデータベースから入手した。これらの構造をSYBYL 6.6に輸入し、変更して、類似体9を基礎とするN−メチル化化合物を形成した。Kollman部分原子電荷をモノマー辞書から負荷した。変更残基をアニーリングし、次いで共役勾配アルゴリズムを用いて≦0.01 Kcal molA-1の終rms(final root mean square)勾配に完全エネルギー最小化することにより、構造を最適化した。他のすべての最小化オプションについて、距離依存誘電関数(McCammon, J. A., et al., Biochem. 1979, 18, 927-942)をデフォルト設定と共に用いた。結果を表3に詳述する。
【0073】
【表3】

【0074】
他の態様
本発明をその詳細な記述に関して記載したが、以上の記述は本発明を説明するためのものであり、特許請求の範囲により定められる本発明の範囲を限定するものではないことを理解すべきである。他の態様、利点および変更も本発明に含まれる。
【図面の簡単な説明】
【0075】
【図1】hsstr−5仲介による細胞内Ca2+移動のインビトロ抑制を示すグラフである。
【背景技術】
【0001】
発明の背景
Brazeauらが発見したテトラデカペプチドであるソマトスタチン(SRIF)は、下垂体、膵臓および消化管などの組織において種々の分泌プロセスに対する有効な抑制作用をもつことが示された。SRIFは、中枢神経系において神経調節物質としても作用する。SRIFがもつこれらの生物学的作用はすべて抑制性であり、一連のGタンパク質結合した受容体により誘発される。受容体について5つの異なるサブタイプが解明されている(sstr1〜sstr5)。これら5つのサブタイプは内因性SRIFリガンドに対して類似の親和性をもつが、種々の組織における分布が異なる。ソマトスタチンはこれら5つの異なる受容体(SSTR)サブタイプに比較的高い親和性で結合し、各サブタイプに対する親和性は等しい。種々の症状および/または疾病の治療には異なるタイプのソマトスタチンサブタイプへの結合が関連する。(”sstr2”)(Raynor, et al., Molecular Pharmacol. 43: 838 (1993); Lloyd, et al., Am. J. Physiol. 268: G102 (1995))、一方、インスリンの抑制はソマトスタチンタイプ−5受容体(”sstr5”)による
(Coy, et al. 197:366-371 (1993))。成長ホルモンの抑制、より具体的にはGH分泌性腺腫(肢端肥大症)およびTSH分泌性腺腫の抑制には、タイプ2と5の活性化が関連する。プロラクチン分泌性腺腫の治療には、タイプ5ではなくタイプ2の活性化が関連する。ソマトスタチン受容体サブタイプの活性化が関連する他の適応症は下記のものである:糖尿病、血管障害、増殖性網膜障害、暁現象および腎障害の治療のためのインスリンおよび/またはグルカゴンの抑制;胃酸分泌の抑制、より具体的には消化性潰瘍、腸皮および膵皮フィステル、過敏性腸症候群、ダンピング症候群、漿液性下痢症候群、エイズ関連下痢、化学療法誘発性下痢、急性または慢性膵炎、および消化管ホルモン分泌性腫瘍の抑制;癌、たとえば肝癌の治療;血管形成の抑制、炎症性障害、たとえば関節炎の治療;網膜障害の治療;慢性同種移植片拒絶反応の抑制;血管形成術;移植血管および消化管の出血防止。目的とする生物学的反応に関与する1種類以上の特定のソマトスタチン受容体サブタイプに対して選択的な類似体を入手することにより、不都合な副作用をもたらす可能性のある他の受容体サブタイプとの相互作用を減らすことが好ましい。
【0002】
有効な低分子SRIFアゴニストの開発により、異なるサブタイプに対する種々のトランケート形リガンドの親和性を識別する方法が見いだされた。Trp8−Lys9配列はこの受容体が認識するリガンド中にしばしば存在すると思われる。Trp8−Lys9配列はβ−折れ曲がりの部分を形成し、これは通常はL−TrpからD−Trpへの置換、主鎖の環化、ジスルフィド橋、またはあらゆる拘束により安定化される。複数の受容体サブタイプが見いだされる前に行われたそのような構造単純化により生じた意図しない結果のひとつは、広域結合親和性の損失であった。その代表例は、オクトレオチド(OCTREOTIDE、登録商標)系列ペプチドにおいてタイプ2親和性は高いが、タイプ1、3、4および5親和性が低いことである。したがって、このタイプの類似体を用いた多くの基礎的な生物学的研究では、1つのタイプ以外のすべてのソマトスタチン受容体が仲介する作用を検出することができなかった。それ以来、一方では生物学的に安定な低分子ペプチドに広域結合性を再導入すること、そして特定の受容体に対する個別の特異性をもつペプチドおよびペプチド模倣体を開発することに向けて、多くの研究が行われた。
【0003】
本発明者らは、各アミノ酸のN−アルキル化によりペプチド主鎖拘束を導入できることを見いだした。この修飾により、当該残基およびその前のアミノ酸が伸長コンホメーションをとるのが大幅に制限される。したがって、潜在的な分子内水素結合部位および同様にタンパク質分解酵素開裂部位がさらにブロックされ、これによりペプチドの薬物動態特性を向上させることができる。市販されているN−メチルアミノ酸はごくわずかであり、それらの合成は冗長である。しかし本発明の他の態様において本発明者らは、MillerおよびScanlanが報告した最近の文献から応用した固相法により、トランケート形ソマトスタチン類似体をあらゆるアミノ酸残基においてN−メチル化する方法を見いだした。
【発明の開示】
【0004】
発明の概要
1態様において本発明は、式(I)の化合物:
A1-cyclo[D-Cys-A2-D-Trp-A3-A4-Cys]-A5-Y1
(I)
またはその医薬的に許容できる塩に関する:
式中:
A1は、置換されていてもよい芳香族α−アミノ酸であり;
A2は、置換されていてもよい芳香族α−アミノ酸であり;
A3は、Dab、Dap、LysまたはOrnであり;
A4は、β−ヒドロキシバリン、Ser、HserまたはThrであり;
A5は、置換されていてもよいD−またはL−芳香族α−アミノ酸であり;
Y1は、OH、NH2またはNHR1であり、ここでR1は(C1-6)アルキルであり;
これらにおいて、置換されていてもよい芳香族α−アミノ酸は、それぞれ独立してハロゲン、NO2、OH、CN、(C1-6)アルキル、(C2-6)アルケニル、(C2-6)アルキニル、(C1-6)アルコキシ、Bzl、O−BzlおよびNR9R10よりなる群から選択される1個以上の置換基で置換されていてもよく、R9およびR10はそれぞれ独立してH、Oまたは(C1-6)アルキルであり;
式(I)の各アミドペプチド結合およびA1のアミノ基のアミン窒素はメチル基で置換されていてもよく、ただしそのようなメチル基が少なくとも1つある。
【0005】
1態様において本発明は、下記の式(I)のペプチドまたはその医薬的に許容できる塩である:
A1が、Cpa、1-Nal、2-Nal、2-Pal、3-Pal、4-Pal、Phe、Tfm、TyrまたはTyr(I)であり;
A2が、2-Pal、3-Pal、4-Pal、Phe、TyrまたはTyr(I)であり;
A5が、Dip、1-Nal、2-Nal、2-Pal、3-Pal、4-Pal、PheまたはD-Trpである。
【0006】
他の態様において本発明は、A1がCpaである上記ペプチド群のペプチドである。
他の態様において本発明は、A3がNMeLysである上記ペプチド群のペプチドである。
【0007】
さらに他の態様において本発明は、ペプチドが次式のものまたはその医薬的に許容できる塩である式(I)のペプチドである:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(NMeDCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NHMe;
Cpa-cyclo(DCys-NMe3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-NMeThr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-NMeCys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-Nme2-Nal-NH2;
Cpa-cyclo(NMeDCys-3-Pal-DTrp-Lys-Thr-Cys)-Dip-NHMe;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Tfm-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;
Nal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;または
3-Pal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【0008】
さらに他の態様において本発明は、ペプチドが次式のものまたはその医薬的に許容できる塩である式(I)のペプチドである:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;
Nal-cyclo(DCys-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;または
3-Pal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【0009】
さらに他の態様において本発明は、ペプチドが次式のものまたはその医薬的に許容できる塩である式(I)のペプチドである:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;または
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【0010】
さらに他の態様において本発明は、ペプチドが次式のものまたはその医薬的に許容できる塩である上記ペプチド群のペプチドである:
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;または
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2。
【0011】
他の形態において本発明は、ソマトスタチンサブタイプ受容体−1、−2、−3、−4および−5のうち1種類以上を結合する方法であって、請求項1に記載の化合物またはその医薬的に許容できる塩を1種類以上のソマトスタチンサブタイプ受容体と接触させる工程を含む方法である。
【0012】
前記形態の1態様において本発明は、ヒト対象または他の動物対象においてソマトスタチンサブタイプ受容体−1、−2、−3、−4および−5のうち1種類以上を結合する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩をその必要がある対象に投与する工程を含む方法である。
【0013】
他の態様において本発明は、細胞からソマトスタチンアンタゴニスト作用を誘発する方法であって、細胞が1種類以上のソマトスタチン受容体を含み、細胞を有効量の請求項1に記載の化合物またはその医薬的に許容できる塩と接触させることを含む方法である。
【0014】
さらに他の態様において本発明は、ヒト対象または他の動物対象においてソマトスタチンアンタゴニスト作用を誘発する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩をその必要がある対象に投与する工程を含む方法を提供する。
【0015】
他の態様において本発明は、ヒトまたは動物対象において成長ホルモンの放出を促進する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与することを含む方法である。
【0016】
他の態様において本発明は、その必要があるヒトまたは動物対象においてインスリンの放出を促進する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与することを含む方法である。
【0017】
他の態様において本発明は、その必要があるヒトまたは動物対象において創傷の治癒を増進する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与することを含む方法である。
【0018】
さらに他の態様において本発明は、その必要があるヒトまたは動物対象において血管形成を促進する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与することを含む方法である。
【0019】
他の態様において本発明は、その必要があるヒトまたは他の動物対象において疾病または症状を処置する方法であって、有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を対象に投与する工程を含み、その際、疾病または症状が短身(short statue)、悪液質、衰弱、II型糖尿病、循環不良などよりなる群から選択されるものである方法である。
【0020】
他の態様において本発明は、ソマトスタチン受容体を有する細胞をイメージングする方法であって、Tyr(I)を含む有効量の請求項1に記載の化合物またはその医薬的に許容できる塩と細胞を接触させることを含む方法である。
【0021】
詳細な説明
当業者は本明細書の記載に基づいて本発明を最大限に利用できる。したがって以下の具体的な態様は単なる本発明の説明と解釈すべきであり、本発明の全範囲を限定するためのものではない。
【0022】
当業者に周知のように、ソマトスタチンの既知の用途および潜在的な用途は多種多様である。ソマトスタチンおよびその類似体は下記に挙げる疾病および/または症状の処置に有用であることが知られている。ソマトスタチンの多様な用途は下記のようにまとめることができる:クッシング症候群 (参照:Clark, R. V. et al, Clin. Res. 38, p. 943A, 1990);ゴナドトロピン産生腫瘍 (参照:Ambrosi B., et al., Acta Endocr. (Copenh.) 122, 569-576, 1990);副甲状腺機能亢進症(参照:Miller, D., et al., Canad. Med. Ass. J., Vol. 145, pp. 227-228, 1991);ページェット病(参照:Palmieri, G. M. A., et
al., J. of Bone and Mineral Research, 7, (Suppl. 1), p. S240 (Abs. 591), 1992);VIP産生腫瘍 (参照:Koberstein, B., et al., Z. Gastroenterology, 28, 295-301, 1990 および Christensen, C., Acta Chir. Scand. 155, 541-543, 1989);膵島細胞症およびインスリン過剰症(参照:Laron, Z., Israel J. Med. Sci., 26, No. 1, 1-2, 1990;Wilson, D. C., Irish J. Med. Sci., 158, No. 1, 31-32, 1989;および Micic, D., et al., Digestion, 16, Suppl. 1.70. Abs. 193, 1990);ガストリン産生腫瘍 (参照:Bauer, F. E., et al., Europ. J. Pharmacol., 183, 55 1990);ゾリンジャー-エリソン症候群 (参照:Mozell, E., et al., Surg. Gynec. Obstet., 170, 476-484, 1990);エイズその他の症状に関連する分泌過多性下痢 (エイズによるもの:参照:Cello, J. P., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A163 1990;ガストリン放出ペプチド過多によるもの:参照:Alhindawi, R., et al., Can. J. Surg., 33, 139-142, 1990;腸移植片対宿主疾患に伴うもの:参照: Bianco J. A., et al., Transplantation, 49, 1194-1195, 1990;化学療法関連の下痢:参照:Petrelli, N., et al., Proc. Amer. Soc. Clin. Oncol., Vol. 10, P 138, Abstr. No. 417 1991);過敏性腸症候群 (参照:O'Donnell, L. J. D., et al., Aliment. Pharmacol. Therap., Vol. 4., 177-181, 1990);膵炎 (参照:Tulassay, Z., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A238, 1990);クローン病 (参照:Fedorak, R. N., et al., Can. J. Gastroenterology, 3, No. 2, 53-57, 1989);全身性硬化症 (参照:Soudah, H., et al., Gastroenterology, 98, No. 5, Part 2, Suppl., A129, 1990);甲状腺癌 (参照:Modigliani, E., et al., Ann., Endocr. (Paris), 50, 483-488, 1989);乾癬 (参照:Camisa, C., et al., Cleveland Clinic J. Med., 57 No. 1, 71-76, 1990);低血圧症 (参照:Hoeldtke, R. D., et al., Arch. Phys. Med. Rehabil., 69, 895-898, 1988 および Kooner, J. S., et al., Brit. J. Clin. Pharmacol., 28, 735P-736P, 1989); パニック発作 (参照:Abelson, J. L., et al., Clin. Psychopharmacol., 10, 128-132, 1990); 硬腫(sclerodoma)(参照:Soudah, H., et al., Clin. Res., Vol. 39, p. 303A, 1991); 小腸閉塞 (参照:Nott, D. M., et al., Brit. J. Surg., Vol. 77, p. A691, 1990); 胃食道逆流症 (参照:Branch, M. S., et al., Gastroenterology, Vol. 100, No. 5, Part 2 Suppl., p. A425, 1991); 十二指腸胃逆流症 (参照:Hasler, W., et al., Gastroenterology, Vol. 100, No. 5, Part 2, Suppl., p. A448, 1991); グレーブズ病 (参照:Chang, T. C., et al., Brit. Med. J., 304, p. 158, 1992); 多嚢胞性卵巣 (参照:Prelevic, G. M., et al., Metabolism Clinical and Experimental, 41, Suppl. 2, pp 76-79, 1992); 上部消化管出血 (参照:Jenkins, S. A., et al., Gut., 33, pp. 404-407, 1992 および Arrigoni, A., et al., American Journal of Gastroenterology, 87, p. 1311, (abs. 275), 1992); 膵仮性嚢胞および腹水 (参照:Hartley, J. E., et al., J. Roy. Soc. Med., 85, pp. 107-108, 1992); 白血病 (参照:Santini, et al., 78, (Suppl. 1), p. 429A (Abs. 1708), 1991); 髄膜腫 (参照:Koper, J. W., et al., J. Clin. Endocr. Metab., 74, pp. 543-547, 1992); ならびに癌悪液質 (参照:Bartlett, D. L., et al., Surg. Forum., 42, pp. 14-16, 1991)。以上の参考文献の内容を本明細書に援用する。
【0023】
本発明のペプチドは、ソマトスタチンの1種類以上の活性に対するアンタゴニストとして有用である。たとえば、本発明のペプチドを用いて対象(たとえばヒト患者などの哺乳動物)における成長ホルモンまたはインスリンの放出を促進することができる。したがってこれらのペプチドは、成長ホルモンまたはインスリンの放出促進が有益となる生理学的状態の処置に有用である。本発明のペプチドは、創傷治癒の増進または血管形成の促進にも使用できる。さらにTyr(I)残基をもつ本発明ペプチドは、ソマトスタチン受容体を含む細胞のイメージングに使用できる。そのような本発明ペプチドは、インビボでソマトスタチン受容体をもつ細胞(たとえば癌細胞)の検出に、またはインビトロでソマトスタチン受容体結合アッセイにおける放射性リガンドとして使用できる。この本発明ペプチドは、放射性同位体で細胞をターゲティングするためのベクターとしても使用できる。
【0024】
同様に本発明の範囲に含まれるのは、成長ホルモンまたはインスリンの放出を促進する必要を伴う疾病または障害を処置する際に使用するための、かつソマトスタチン受容体の検出、たとえば放射線イメージング法に使用するための、前記一般式に含まれるペプチドである。
【0025】
式(I)の化合物またはその医薬的に許容できる塩は、経口、非経口(たとえば筋肉内、腹腔内、静脈内もしくは皮下への注射、または埋込み)、鼻、膣、直腸、舌下または局所投与経路で投与でき、医薬的に許容できるキャリヤーと配合して各投与経路に適切な剤形を得ることができる。
【0026】
経口投与のための固体剤形には、カプセル剤、錠剤、丸剤、散剤および顆粒剤が含まれる。そのような固体剤形においては、有効化合物を少なくとも1種類の医薬的に許容できる不活性キャリヤー、たとえばショ糖、乳糖またはデンプンと混合する。そのような剤形は、常法によりこれらの不活性希釈剤以外の物質、たとえばステアリン酸マグネシウムなどの滑沢剤を含むこともできる。カプセル剤、錠剤および丸剤の場合、これらの剤形は緩衝剤を含むこともできる。錠剤および丸剤はさらに腸溶コーティングを備えたものとして製造できる。
【0027】
経口投与用の液体剤形には、当技術分野で慣用される不活性希釈剤、たとえば水を含有する、医薬的に許容できる乳剤、液剤、懸濁液剤、シロップ剤、エリキシル剤が含まれる。そのような不活性希釈剤のほかに、組成物は佐剤、たとえば湿潤剤、乳化剤および沈殿防止剤、ならびに甘味剤、着香剤および香料を含有することもできる。
【0028】
非経口投与用の本発明製剤には、無菌の水性または非水性の液剤、懸濁液剤または乳剤が含まれる。非水性の溶剤またはビヒクルの例は、プロピレングリコール、ポリエチレングリコール、植物油、たとえばオリーブ油およびトウモロコシ油、ゼラチン、ならびに注射用有機エステル、たとえばオレイン酸エチルである。そのような剤形は、佐剤、たとえば保存剤、湿潤剤、乳化剤および分散剤を含有してもよい。それらは、たとえば細菌捕獲フィルターによる濾過により、殺菌剤を組成物に含有させることにより、組成物の照射により、または組成物の加熱により殺菌できる。それらを無菌固体組成物の形で調製し、使用直前に無菌水または他のいずれかの無菌注射用媒質に溶解することもできる。
【0029】
直腸または膣投与用組成物は好ましくは坐剤であり、これらは有効物質のほかに賦形剤、たとえばカカオ脂または坐剤用ろうを含有することができる。
鼻または舌下投与用組成物も、当技術分野で周知の標準的賦形剤を用いて製造される。
【0030】
本発明組成物中の有効成分の用量は変更できるが、有効成分の用量は適切な剤形が得られるものでなければならない。選択する用量は、目的とする療法効果、投与経路および処置期間に依存する。目的とする療法効果を得るためには、一般に1日当たり25μg/kg〜100mg/kg(体重)のレベルの量を、1回量として、または多数回に分けて、ヒトまたは他の動物、たとえば哺乳動物に投与する。
【0031】
好ましい一般用量範囲は1日当たり250μg/kg〜5.0mg/kg(体重)であり、これを1回量として、または多数回に分けて投与できる。
さらに、式(I)の化合物をたとえば下記の特許に記載される持効性組成物として投与できる。これらの配合物のうち、14日または28日徐放性配合物が好ましい。USP5,672,659には、ペプチドおよびポリエステルを含む持効性組成物が教示されている。USP5,595,760には、ゲル化可能な形のペプチドを含む持効性組成物が教示されている。USP5,821,221には、ペプチドおよびキトサンを含む持効性高分子組成物が教示されている。USP5,916,883には、ペプチドおよびシクロデキストリンを含む持効性組成物が教示されている。国際特許出願PCT/US99/01180(公開番号WO99/38536、1999年8月5日)には、吸収可能な持効性ペプチド組成物が教示されている。以上の特許および出願の内容を本明細書に援用する。
【0032】
即効性または持効性組成物の使用は、目標とする適応症のタイプに依存する。適応症が急性または過急性障害からなる場合、持効性組成物による治療より即効性剤形による治療の方が好ましいであろう。これに対し、予防または長期治療のためには持効性組成物が一般に好ましいであろう。
【0033】
略号
ソマトスタチン受容体サブタイプの命名法はIUPHARの推奨に従う。sstr4は最初にBrunoらがクローニングした受容体を表わし、sstr5は最初にO'Carrollらがクローニングした受容体を表わす。
【0034】
一般アミノ酸の略号はIUPAC-IUBの推奨に従う。さらに本明細書中で用いる特定の略号の定義は下記のとおりである:
Abu = (-アミノ酪酸;
Aib = (-アミノイソ酪酸;
β-Ala = (-アラニン;
Amp = 4-アミノフェニルアラニン;
Ava = 5-アミノ吉草酸;
Cha = シクロヘキシルアラニン;
Cpa = 3-(4-クロフェニル)アラニン;
Dab = 2,4-ジアミノ酪酸;
Dap = 2,3-ジアミノプロピオン酸;
Dip = 3,3'-ジフェニルアラニン;
Gaba = (-アミノ酪酸;
HSer = ホモセリン;
1-Nal = 3-(1-ナフチル)アラニン;
2-Nal = 3-(2-ナフチル)アラニン;
Nle = ノルロイシン;
Nva = ノルバリン;
2-Pal = 3-(2-ピリジル)アラニン;
3-Pal = 3-(3-ピリジル)アラニン;
4-Pal = 3-(4-ピリジル)アラニン;
Tfm = トリフルオロメチル;および
TfmA = 4-トリフルオロメチルフェニルアラニン;
Tyr(I) = ヨウ素化チロシン残基(たとえば3-1-Tyr、5-I-Tyr、3,5-I-Tyr)ヨウ素は放射性同位体、たとえばI125、I127またはI131であってもよい。
【0035】
下記の特定の試薬の略号も本明細書中に用いられる:
DBU = 1,8-ジアザビシクロ[5.4.0]ウンデク-7-エン;
DCM = ジクロロメタン;
DIC = ジイソプロピルカルボジイミド;
DIEA = ジイソプロピルエチルアミン;
DMF = ジメチルホルムアミド;
MTBD = 1,3,4,6,7,8-ヘキサヒドロ-1-メチル-2H-ピリミド[1,2-a]ピリミジン;
o-NBS = 2-ニトロベンゼンスルホニル;
TBTU = O-ベンゾトリアゾール-1-イル-N,N,N',N'-テトラメチルウロニウムテトラフルオロボレート;および
TFA = トリフルオロ酢酸。
【0036】
本明細書においてN−末端アミノ酸(たとえばA1についてのCpa)以外のすべてのアミノ酸の略号が-NH-CH(R)-CO-の構造を表わし、ここでRはアミノ酸の側鎖(たとえばAlaについてのCH3)である。N−末端アミノ酸については、略号は(R1R2)-N-CH (R)-CO-の構造を表わし、ここでRはアミノ酸の側鎖であり、R1およびR2はそれぞれ独立してHまたは本明細書に定義した他のものである。
【0037】
脂肪族アミノ酸は、1つまたは2つの側鎖をもつα−アミノ酸であり、側鎖は独立して炭化水素、たとえば炭素原子1〜6個の直鎖または分枝鎖である。脂肪族アミノ酸の例には、Ala、Aib、Val、Leu、Tle、Ile、Nle、NvaまたはAbuが含まれる。
【0038】
”芳香族α−アミノ酸”が意味するものは、次式のアミノ酸残基である:
【0039】
【化1】

【0040】
式中、Z1は芳香環を含む部分であり、Z2は水素または芳香環を含む部分である。そのような芳香環を含む部分には、ベンゼン環またはピリジン環および下記の構造が含まれるが、それらに限定されない。芳香環は1個以上の置換基Xを含むか、または含まない(Xはそれぞれの場合独立してハロゲン、NO2、CH3、OCH3、CF3またはOHである):
【0041】
【化2】

【0042】
本発明の芳香族α−アミノ酸の他の例は、置換されたHis、たとえばMeHis、His(τ−Me)またはHis(π−Me)である。
本明細書中で用いる”アルキル”は、表示した長さをもつ直鎖または分枝鎖構造いずれのアルキル基も含むものとする。そのようなアルキル基の例は、メチル、エチル、プロピル、イソプロピル、ブチル、sec−ブチル、t−ブチル、ペンチル、イソペンチル、ヘキシル、イソヘキシルなどである。用語C0アルキルが定義に含まれる場合、これは共有単結合を表わすものとする。
【0043】
”低級アルキル”という用語は、炭素原子1〜6個の分枝鎖および直鎖アルキル基の両方を含むものとする。
本明細書中で用いる”アリール”は、各環が最高7員の安定な単環式、二環式または三環式炭素環を含むものとし、その際少なくとも1つの環は芳香環である。アリール基の例には、フェニル、ナフチル、アントラセニル、ビフェニル、テトラヒドロナフチル、インダニル、フェナントレニルなどが含まれる。
【0044】
本明細書中で用いる”ヘテロサイクリル(複素環)”は、安定な5〜7員単環式複素環、または安定な8〜11員二環式複素環、または安定な11〜15員三環式複素環を表わす。これらは飽和または不飽和であり、炭素原子、ならびにN、OおよびSよりなる群から選択される1〜4個の異種原子からなる。前記複素環のいずれかがベンゼン環に縮合した二環式基も含まれる。複素環式環は、安定な構造を形成するいかなる異種原子または炭素原子においても結合できる。そのような複素環式要素には下記のものが含まれるが、これらに限定されない:アゼピニル、ベンゾイミダゾリル、ベンゾイソオキサゾリル、ベンゾフラザニル、ベンゾピラニル、ベンゾチオピラニル、ベンゾフリル、ベンゾチアゾリル、ベンゾチエニル、ベンゾオキサゾリル、クロマニル、シンノリニル、ジヒドロベンゾフリル、ジヒドロベンゾチエニル、ジヒドロベンゾチオピラニル、ジヒドロベンゾチオピラニルスルホン、フリル、イミダゾリジニル、イミダゾリニル、イミダゾリル、インドリニル、インドリル、イソクロマニル、イソインドリニル、イソキノリニル、イソチアゾリジニル、イソチアゾリル、イソチアゾリジニル、モルホリニル、ナフチリジニル、オキサジ
アゾリル、2−オキソアゼピニル、2−オキソピペラジニル、2−オキソピペリジニル、2−オキソピロリジニル、ピペリジル、ピペラジニル、ピリジル、ピリジルN−オキシド、キノキサリニル、テトラヒドロフリル、テトラヒドロイソキノリニル、テトラヒドロイソキノリニル、テトラヒドロ−キノリニル、チアモルホリニル、チアモルホリニルスルホキシド、チアゾリル、チアゾリニル、チエノフリル、チエノチエニル、チエニルなど。
【0045】
”置換された”という用語は、1個以上の当該置換基(たとえばハロ、ヒドロキシ、低級アルキルなど)で置換された当該基(たとえば低級アルキル、アリール、シクロアルキルなど)を含むものとする。置換基はその基のいずれの原子に結合していてもよい。
【0046】
略号”NMe”は”N−メチル−”を表わす。本明細書中で用いるNMeは、関連アミノ酸のアミド窒素がメチル化されていることを示す。たとえば”NmeCpa”は-N(CH3)-CH(R)-CO-(Rは4−クロロフェニル)、”Nme2−Nal”は-N(CH3)-CH(R)-CO-(Rは2−ナフチル)などを表わす。
【0047】
アルコキシという用語は、表示した長さの直鎖または分枝鎖構造のアルコキシ基を含むものとする。そのようなアルコキシ基の例は、メトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、t−ブトキシ、ペントキシ、イソペントキシ、ヘキソキシ、イソヘキソキシなどである。
【0048】
ハロゲンまたはハロという用語は、ハロゲン原子であるフッ素、塩素、臭素およびヨウ素を含むものとする。
アミノ酸残基が光学活性である場合、D−形と特に表示しない限りL−形であるものとする。
【0049】
材料
4−メチルベンゾヒドリルアミン塩酸塩樹脂(0.25または0.5ミリ当量/g)をAdvanced ChemTech Inc.(ケンタッキー州ルイビル)から入手した。Nαt−ブチルオキシカルボニル(Boc)保護されたアミノ酸をBachem Inc.(カリフォルニア州トランス)、Advanced ChemTech Inc.およびSynthetech Inc.(オレゴン州アルバニー)から購入した。アミノ酸の反応性側鎖を下記の1以上の基で遮断した:Cys,4−メチルベンジルオキシカルボニル;Lys,2−クロロベンジルオキシカルボニル;Thr,O−ベンジル;Tyr,O−2,6−ジクロロベンジル。試薬および溶媒はすべてACS等級以上であり、それ以上精製せずに用いられた。
【0050】
ペプチド合成
ペプチド合成は下記の反応経路により概説できる:
【0051】
【化3】

【0052】
式(I)の化合物は、4−メチルベンゾヒドリルアミン官能化1%架橋ポリスチレン樹脂(0.25または0.5ミリ当量/g)上、0.25mmol規模で、Advanced ChemTech(200型)合成装置により、下記のプロトコルを用いて合成でき、この方法で合成された:脱ブロック、40%TFA(2分、20分);DCM洗浄サイクル(3回洗浄);中和、10%DIEA(1分、5分);DMF洗浄サイクル;DCM洗浄サイクル(2回洗浄);2回の結合;1回目は1,3−ジイソプロピルカルボジイミドエステル(3当量)を用いてDCM中で30分間;DCM洗浄(3回洗浄);2回目の結合は予備調製TBTUエステル(3当量)を用いてDMF中で90分間、触媒量のDIEAを使用;DMF洗浄(1回洗浄);DCM洗浄(3回洗浄)。結合反応を定性的にモニターする。
【0053】
Nα−保護
目的とするメチル化部位のアミノ基を脱ブロックした後、樹脂をDCM(20mL)に懸濁した。この懸濁液にコリジン(3当量)およびo−ニトロベンゼンスルホニルクロリド(3当量)を添加し、混合物をAdvanced ChemTech(200型)合成装置で2時間振とうした。次いで樹脂をDCM洗浄(2回洗浄)およびDMF洗浄(3回洗浄)した。保護をニンヒドリン試験により定性的にモニターする。
【0054】
Nα−メチル化
o−ニトロベンゼンスルホンアミド保護した樹脂をDMF(20mL)に懸濁し、これにMTBD(3当量)および4−ニトロベンゼンスルホン酸メチルまたはジメチル硫酸(Cys11について)を添加した。混合物をAdvanced ChemTech(200型)合成装置で0.5時間振とうし、樹脂をDMF洗浄(4回洗浄)した。
【0055】
Nα−Me脱保護
目的残基をメチル化した後、樹脂を再びDMF(20mL)に懸濁した。この懸濁液にDBU(3当量)および2−メルカプトエタノール(3当量)を添加し、混合物をAdvanced ChemTech(200型)合成装置中で0.5時間撹拌した。次いで樹脂をDMF(5回
洗浄)で十分に洗浄した。
【0056】
以上のメチル化法は、ジメチル化誘導体になったD−Cys6(たとえば化合物2および10参照)以外のすべての残基について良好に行われた。しかしD−Cys6をCys6に代えるとモノメチル化ペプチドが得られた。
【0057】
ペプチドの開裂
捕そく剤アニソール(約30%v/v)を含有する無水フッ化水素を用いて0℃で45分間の酸加水分解により、ペプチドを樹脂支持体から開裂させ、同時に側鎖を脱保護した。ペプチドを90%酢酸(約600mL)中でわずかに過剰のI2により環化した(15分間)。次いでアスコルビン酸の添加により過剰のI2を除去した。
【0058】
精製
粗製ペプチドを、C−18結合シリカゲル上、軸圧縮カラム(Dynamax-300Å、5または8μm、21.4×250mm)を用いる調製用RP−HPLCにより精製した。直線勾配溶離系を20mL/分の流速で用いた:A;0.1%TFA、B;80%MeCN中の0.1%TFA、20%B〜50%B、1%/分。分離を分析用RP−HPLCにより215nmでモニターした。生成物含有画分をプールし、真空濃縮し、凍結乾燥した。各ペプチドが酢酸水溶液からの凍結乾燥により一定重量の綿毛状白色粉末として得られた。最終ペプチドの純度を分析用RP−HPLCにより215nmで評価した。Vydac C−18支持体(4.6×250mm、5μm、孔径300Å、Liquid Separations Group)を用いて分析用RP−HPLCを記録した。直線勾配溶離系を1.5mL/分の流速で用いた:HPLC−1、A、0.1%TFA;B、80%MeCN中の0.1%TFA;20%B〜50%B、1%/分;HPLC−2、C、TEAP(0.1M、pH3)中の5%MeCN;D、MeCN中の20%C、10%D〜70%D、1%/分。カラム溶出液を215nmでモニターした。各ペプチドの保持時間および純度をRainin Dynamax HPLC Method Managerにより評価した。各ペプチドは純度>98%をもつことが認められた。HPLC保持時間の結果を表1に示す。
【0059】
【表1−1】

【0060】
【表1−2】

【0061】
アミノ酸分析
ペプチドを真空下に(110℃;20時間)、0.2%の3−(2−アミノエチル)インドール(Pierce)を含有する4Mメタンスルホン酸中で加水分解した。加水分解物について、o−フタリドアルデヒド試薬(Sigma Chemical Co.)で誘導体化した後、一体式ガードカラム付き100×4.6mm、3μmのC18軸圧縮カラム(Microsorb AAAnalysis(商標)O型;Rainin Instrument Co.)を取り付けた自動HPLCシステム(Rainin Instrument Co.)によりアミノ酸分析を行った。誘導体化した第一級アミノ酸を二元勾配により溶離した:緩衝液A;4.5%v/vのメタノールおよび0.5%v/vのテトラヒドロフランを含有する0.10M酢酸ナトリウム(pH7.2)および緩衝液B;メタノール。勾配シーケンス;0分で0%A;16.5分で35%A;30分で90%A;33分で90%Aを、流速1.0mL/分で周囲温度において使用。溶出液を340nmでモニターし、Dynamax HPLC Method Manager(Rainin)により積分する。標準保持時間は下記のとおりであった:Asp、6.6分;Arg、19.9分;Trp、25.4分およびLys、29.5分。表1の各ペプチドが第一級アミノ酸について予想した分析結果を示した。システインは定量されない。
【0062】
質量分析
LaserMat 2000 質量分析計(Thermal Bioanalysis、カリフォルニア州サンホゼ)を使用し、マトリックスとしてのα−シアノ−4−ヒドロキシケイ皮酸および内標準としてのサブスタンスP(1348.7 Da)を用いて、マトリックス支援レーザー脱離/イオン化飛行時間型質量分析によりペプチドを分析した。それぞれの場合、スペクトルは内標準に関する主M−H+イオンピーク、予想した被分析体M−H+イオンピーク、およびマトリックス(< 500 Da)に伴う数ピークからなっていた。結果を表1に示す。
【0063】
SRIFによるGH放出抑制の拮抗
雄ラット成体から下垂体前葉を採集し、これまでに文献記載されているトリプシン/DNase法により分散させた(Murphy, W. A.; Taylor, J.; Moreau, J.-P. および Coy, D. H., Peptide Res. 1989, 2, 128-132)。分散した細胞を、無菌濾過したダルベッコ改変イーグル培地で希釈し(MEM、Gibco Laboratories、ニューヨーク州グランド・アイランド)、これに2.5%のウシ胎仔血清(Gibco)、3%のウマ血清(Gibco)、10%の新鮮ラット血清(氷上に保存、1時間を超えない)(下垂体ドナー由来)、1%のMEM非必須アミノ酸(Gibco)、ゲンタマイシン(10 ng mL-1;Sigma)およびナイスタチン(10,000 U mL-1;Gibco)を補充した。細胞をランダムに約200,000個/ウェルの密度で接種した(Costar cluster 24;Rochester Scientific Co.;ニューヨーク州ロチェスター)。接種した細胞を前記ダルベッコ培地中に、95%空気/5%CO2、37℃の加湿雰囲気で4〜6日間維持した。ホルモン攻撃用に調製する際には、細胞を培地199(Gibco、1mL、3回洗浄)で洗浄した。各用量の本発明化合物(プレート当たり6種類の用量)を、3ウェル内で1nM SRIFの存在下に、1%のBSA(フラクションV;Sigma Chemical Co.)を含有する全体積1mLの培地199中で試験した。すべてのウェルにGHRH(1−29)NH2(1nM)を装入した。GHRH(1−29)NH2(1nM)で刺激した対照群、およびSRIF(1nM)とGHRH(1−29)NH2(1nM)で阻害した対照群を、それぞれの細胞培養プレートに含めた。空気/二酸化炭素雰囲気(95/5%、37℃で3時間)で3時間インキュベートした後、培地を除去し、ホルモン含量をアッセイするまで−20℃に保存した。National Hormone and Pituitary Program (NHHP)(カリフォルニア州トランス)のDr. A. F. Parlowから好意的に提供された成分を用いて、培地中の成長ホルモンを標準二重抗体RIAにより測定した。
【0064】
SRIF(1nM)に対するアンタゴニストのIC50をSigmaplot(Jandel Scientific、カリフォルニア州サン・ラファエル)により計算した。数値を平均IC50(nM)±SEMとして表わし、表2に示す。
【0065】
【表2−1】

【0066】
【表2−2】

【0067】
クローン化ヒトソマトスタチン受容体の機能性発現
ヒトソマトスタチン受容体(hsstr1-5)を含むゲノムクローン(Yamada, Y., et al., Proc. Natl. Acad. Sci. USA. 1992, 89, 251-255;Yasuda, K., et al., J. Biol. Chem. 1992, 267, 20422-20428;Yamada, Y., et al., Mol. Pharmacol. 1992, 42, 2136-2142;Rohrer, L., et al., Proc. Natl. Acad. Sci. USA. 1993, 90, 4196-4200)は、Dr. Graeme I. Bell(シカゴ大学)から好意的に提供された。hsstr1、hsstr2、hsstr3、hsstr4およびhsstr5 cDNAを、それぞれ1.5−kbのPstI−XmnIフラグメント、1.7−kbのBamHI−HindIIIフラグメント、2.0−kbのNcoI−HindIIIフラグメント、1.4−kbのNheI−NdeIフラグメント、および1.2−kbのHindIII−XbaIフラグメントとして単離した。これらはそれぞれ全長受容体の全コード領域を含む。これらのフラグメントを個別に、哺乳動物発現ベクターpCMV5の対応する制限エンドヌクレアーゼ部位において、ヒトサイトメガロウイルス(CMV)プロモーターの下流にサブクローニングし、発現プラスミドpCMV5/hsstr1、pCMV5/hsstr2、pCMV5/hsstr3、pCMV5/hsstr4およびpCMV5/hsstr5を作製した。CHO−K1細胞中へのトランスフェクションのために、哺乳動物細胞ネオマイシン選択マーカーを保有するプラスミドpRSV−neo(American Type Culture Collection、マリーランド州ロックビル)を付加した。
【0068】
受容体発現およびトランスフェクション
リン酸カルシウム法によりトランスフェクションを実施した。10%のウシ胎仔血清を補充したα−最少必須培地(α−MEM;Gibco)にCHO−K1細胞を維持し、リン酸カルシウム沈殿法によりそれぞれの発現プラスミドでトランスフェクションした。発現プラスミドが挿入されたクローンを、500μg mL-1のゲネチシン(G418;Gibco)を補充したα−MEM中で選択した。独立したCHO−K1クローンをガラス環クローニングにより採取し、選択培地での培養により増殖させた。単離クローンから膜を調製し、まず[125I]Tyr11−SRIFおよび[125I]MK−678(sstr2について)との結合についてhsstr発現を評価した。
【0069】
放射性リガンド結合アッセイ
5タイプの受容体について、対応するCHO−K1細胞のホモジェネート(Polytron設定6、15秒)から氷冷トリス−HCl(50mM)中で細胞膜を採取し、遠心した(39000g、10分、2回);中間で新たな緩衝液に再懸濁した。最終ペレットをアッセイのためにトリス−HCl(10mM)に再懸濁する。アリコートの膜を0.05nMの[125I]Tyr11−SRIF(タイプ1、3、4、5)または[125I]MK−678(タイプ2)と共に、BSA(10 mg mL-1)、MgCl2(5 mM)、Trasylol(200 kIU mL-1)、バシトラシン(0.02 mg mL-1)およびフッ化フェニルメタンスルホニル(0.02 mg mL-1)を含有する50mM HEPES(pH7.4)中でインキュベートする(37℃、30分間)。最終アッセイ体積は0.3mLであり、0.3%ポリ(エチレンイミン)に予め浸漬したGF/CフィルターでBrandel迅速濾過モジュールを用いて迅速濾過することによりインキュベーションを終了する。次いでそれぞれの試験管およびフィルターをアリコートの冷緩衝液(5mL、3回)で洗浄する。
【0070】
結合した全放射性リガンドから1.0μM SRIFの存在下で結合したリガンドを差し引いたものとして比結合を定義する。これらのアッセイ系により下記の全放射性リガンド結合値および非特異的結合(nsb)値が一般に得られる:hsstr1、7000cpmの全結合−対3500cpmのnsb;hsstr2、9000cpmの全結合−対1000cpmのnsb;hsstr3、8000cpmの全結合−対1000cpmのnsb;hsstr4、6000cpmの全結合−対3500cpmのnsb;およびhsstr5、7500cpmの全結合−対3500cpmのnsb。結合親和性を5種類の受容体サブタイプそれぞれについてKi値±SEM(nM)として表わし、表2に示す。
【0071】
タイプ5仲介による細胞内Ca2+移動
ヒトsst5受容体を発現するCHO−K1細胞を0.3%EDTA/リン酸緩衝化塩類溶液(25℃)中でのインキュベーションにより収穫し、遠心により2回洗浄した。洗浄した細胞を、蛍光Ca2+指示薬Fura-2AM添加のためにハンクス緩衝化塩類溶液(HBSS)に再懸濁した。約106個/mlの細胞懸濁液を、2μMのFura-2AMと共に約25℃で30分間インキュベートした。結合しなかったFura-2AMをHBSS中で2回の遠心により除去し、磁気撹拌機構および温度調節式キュベットホルダーを備えた蛍光分光計(日立F-2000)に最終懸濁液を移した。37℃で平衡化した後、細胞内Ca2+移動の測定のためにソマトスタチンペプチドを添加した。励起および発光波長はそれぞれ340および510nmであった。
【0072】
例示データを図1に示す。これは上記アッセイ法で被験化合物として類似体5を用いて得た結果を表わす。
分子モデリング
Silicon Graphics Indigo2 High Impact 10000 コンピューターにより、SYBYL分子モデリングソフトウェア、バージョン6.6(Tripos Associates Inc.、米国ミズーリ州セントルイス)を用い、Kollman全原子力場法(Weiner, S. J., et al., J. Comp. Chem. 1986, 7, 230-252)で分子モデリングを行った。始化合物Sandostatin/オクトレオチド(Octreotide)の3溶液NMR構造;D-Phe5-c[Cys6-Phe7-D-Trp8-Lys9-Thr10-Cys11]-Thr12-ol(1SOCおよび2SOC)に関するPDBファイルをPDBデータベースから入手した。これらの構造をSYBYL 6.6に輸入し、変更して、類似体9を基礎とするN−メチル化化合物を形成した。Kollman部分原子電荷をモノマー辞書から負荷した。変更残基をアニーリングし、次いで共役勾配アルゴリズムを用いて≦0.01 Kcal molA-1の終rms(final root mean square)勾配に完全エネルギー最小化することにより、構造を最適化した。他のすべての最小化オプションについて、距離依存誘電関数(McCammon, J. A., et al., Biochem. 1979, 18, 927-942)をデフォルト設定と共に用いた。結果を表3に詳述する。
【0073】
【表3】

【0074】
他の態様
本発明をその詳細な記述に関して記載したが、以上の記述は本発明を説明するためのものであり、特許請求の範囲により定められる本発明の範囲を限定するものではないことを理解すべきである。他の態様、利点および変更も本発明に含まれる。
【図面の簡単な説明】
【0075】
【図1】hsstr−5仲介による細胞内Ca2+移動のインビトロ抑制を示すグラフである。
【特許請求の範囲】
【請求項1】
式(I)の化合物:
A1-cyclo{D-Cys-A2-D-Trp-A3-A4-Cys}-A5-Y1
(I)
またはその医薬的に許容できる塩
[式中:
A1は、置換されていてもよい芳香族α−アミノ酸であり;
A2は、置換されていてもよい芳香族α−アミノ酸であり;
A3は、Dab、Dap、LysまたはOrnであり;
A4は、β−ヒドロキシバリン、Ser、HserまたはThrであり;
A5は、置換されていてもよいD−またはL−芳香族α−アミノ酸であり;
Y1は、OH、NH2またはNHR1であり、ここでR1は(C1−6)アルキルであり;
これらにおいて、置換されていてもよい芳香族α−アミノ酸は、それぞれ独立してハロゲン、NO2、OH、CN、(C1−6)アルキル、(C2−6)アルケニル、(C2−6)アルキニル、(C1−6)アルコキシ、Bzl、O−BzlおよびNR9R10よりなる群から選択される1個以上の置換基で置換されていてもよく、R9およびR10はそれぞれ独立してH、Oまたは(C1−6)アルキルであり;
式(I)の各アミドペプチド結合およびA1のアミノ基のアミン窒素はメチル基で置換されていてもよく、ただしそのようなメチル基が少なくとも1つある]。
【請求項2】
A1が、Cpa、1-Nal、2-Nal、2-Pal、3-Pal、4-Pal、Phe、Tfm、TyrまたはTyr(I)であり;
A2が、2-Pal、3-Pal、4-Pal、Phe、TyrまたはTyr(I)であり;
A5が、Dip、1-Nal、2-Nal、2-Pal、3-Pal、4-Pal、PheまたはD-Trpである、
請求項1に記載の化合物またはその医薬的に許容できる塩。
【請求項3】
A1がCpaである、請求項2に記載の化合物。
【請求項4】
A3がNMeLysである、請求項2に記載の化合物。
【請求項5】
化合物が次式のものまたはその医薬的に許容できる塩である、請求項1に記載の化合物:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(NMeDCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NHMe;
Cpa-cyclo(DCys-NMe3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-NMeThr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-NMeCys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-Nme2-Nal-NH2;
Cpa-cyclo(NMeDCys-3-Pal-DTrp-Lys-Thr-Cys)-Dip-NHMe;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Tfm-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;
Nal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;または
3-Pal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【請求項6】
化合物が次式のものまたはその医薬的に許容できる塩である、請求項4に記載の化合物:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;
Nal-cyclo(DCys-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;または
3-Pal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【請求項7】
化合物が次式のものまたはその医薬的に許容できる塩である、請求項5に記載の化合物:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;または
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【請求項8】
化合物が次式のものまたはその医薬的に許容できる塩である、請求項6に記載の化合物:
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;または
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2。
【請求項9】
ソマトスタチンサブタイプ受容体−1、−2、−3、−4および−5のうち1種類以上を結合する方法であって、請求項1に記載の化合物またはその医薬的に許容できる塩を1種類以上のソマトスタチンサブタイプ受容体と接触させる工程を含む方法。
【請求項10】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、ヒト対象または他の動物対象においてソマトスタチンサブタイプ受容体−1、−2、−3、−4および−5のうち1種類以上を結合するための医薬組成物。
【請求項11】
細胞からアンタゴニスト作用を誘発する方法であって、細胞が1種類以上のソマトスタチン受容体を含み、細胞を有効量の請求項1に記載の化合物またはその医薬的に許容できる塩と接触させることを含む方法。
【請求項12】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、ヒトまたは動物対象においてソマトスタチンアンタゴニスト作用を誘発するための医薬組成物。
【請求項13】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、ヒトまたは動物対象において成長ホルモンの放出を促進するための医薬組成物。
【請求項14】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、その必要があるヒトまたは動物対象においてインスリンの放出を促進するための医薬組成物。
【請求項15】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、その必要があるヒトまたは動物対象において創傷の治癒を増進するための医薬組成物。
【請求項16】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、その必要があるヒトまたは動物対象において血管形成を促進するための医薬組成物。
【請求項17】
ソマトスタチン受容体を有する細胞をイメージングする方法であって、Tyr(I)を含む有効量の請求項1に記載の化合物またはその医薬的に許容できる塩と細胞を接触させることを含む方法。
【請求項18】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、その必要があるヒトまたは他の動物対象において、短身、悪液質、衰弱、II型糖尿病および循環不良よりなる群から選択される疾病または症状を治療するための医薬組成物。
【請求項1】
式(I)の化合物:
A1-cyclo{D-Cys-A2-D-Trp-A3-A4-Cys}-A5-Y1
(I)
またはその医薬的に許容できる塩
[式中:
A1は、置換されていてもよい芳香族α−アミノ酸であり;
A2は、置換されていてもよい芳香族α−アミノ酸であり;
A3は、Dab、Dap、LysまたはOrnであり;
A4は、β−ヒドロキシバリン、Ser、HserまたはThrであり;
A5は、置換されていてもよいD−またはL−芳香族α−アミノ酸であり;
Y1は、OH、NH2またはNHR1であり、ここでR1は(C1−6)アルキルであり;
これらにおいて、置換されていてもよい芳香族α−アミノ酸は、それぞれ独立してハロゲン、NO2、OH、CN、(C1−6)アルキル、(C2−6)アルケニル、(C2−6)アルキニル、(C1−6)アルコキシ、Bzl、O−BzlおよびNR9R10よりなる群から選択される1個以上の置換基で置換されていてもよく、R9およびR10はそれぞれ独立してH、Oまたは(C1−6)アルキルであり;
式(I)の各アミドペプチド結合およびA1のアミノ基のアミン窒素はメチル基で置換されていてもよく、ただしそのようなメチル基が少なくとも1つある]。
【請求項2】
A1が、Cpa、1-Nal、2-Nal、2-Pal、3-Pal、4-Pal、Phe、Tfm、TyrまたはTyr(I)であり;
A2が、2-Pal、3-Pal、4-Pal、Phe、TyrまたはTyr(I)であり;
A5が、Dip、1-Nal、2-Nal、2-Pal、3-Pal、4-Pal、PheまたはD-Trpである、
請求項1に記載の化合物またはその医薬的に許容できる塩。
【請求項3】
A1がCpaである、請求項2に記載の化合物。
【請求項4】
A3がNMeLysである、請求項2に記載の化合物。
【請求項5】
化合物が次式のものまたはその医薬的に許容できる塩である、請求項1に記載の化合物:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(NMeDCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NHMe;
Cpa-cyclo(DCys-NMe3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-NMeThr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-NMeCys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-Nme2-Nal-NH2;
Cpa-cyclo(NMeDCys-3-Pal-DTrp-Lys-Thr-Cys)-Dip-NHMe;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Tfm-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;
Nal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;または
3-Pal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【請求項6】
化合物が次式のものまたはその医薬的に許容できる塩である、請求項4に記載の化合物:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;
Nal-cyclo(DCys-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2;または
3-Pal-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【請求項7】
化合物が次式のものまたはその医薬的に許容できる塩である、請求項5に記載の化合物:
NmeCpa-cyclo(DCys-3-Pal-DTrp-Lys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-3-Pal-NMeDTrp-NMeLys-Thr-Cys)-2-Nal-NH2;
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;または
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-DTrp-NH2。
【請求項8】
化合物が次式のものまたはその医薬的に許容できる塩である、請求項6に記載の化合物:
Cpa-cyclo(DCys-3-Pal-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2;または
Cpa-cyclo(DCys-Tyr-DTrp-NMeLys-Thr-Cys)-2-Nal-NH2。
【請求項9】
ソマトスタチンサブタイプ受容体−1、−2、−3、−4および−5のうち1種類以上を結合する方法であって、請求項1に記載の化合物またはその医薬的に許容できる塩を1種類以上のソマトスタチンサブタイプ受容体と接触させる工程を含む方法。
【請求項10】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、ヒト対象または他の動物対象においてソマトスタチンサブタイプ受容体−1、−2、−3、−4および−5のうち1種類以上を結合するための医薬組成物。
【請求項11】
細胞からアンタゴニスト作用を誘発する方法であって、細胞が1種類以上のソマトスタチン受容体を含み、細胞を有効量の請求項1に記載の化合物またはその医薬的に許容できる塩と接触させることを含む方法。
【請求項12】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、ヒトまたは動物対象においてソマトスタチンアンタゴニスト作用を誘発するための医薬組成物。
【請求項13】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、ヒトまたは動物対象において成長ホルモンの放出を促進するための医薬組成物。
【請求項14】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、その必要があるヒトまたは動物対象においてインスリンの放出を促進するための医薬組成物。
【請求項15】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、その必要があるヒトまたは動物対象において創傷の治癒を増進するための医薬組成物。
【請求項16】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、その必要があるヒトまたは動物対象において血管形成を促進するための医薬組成物。
【請求項17】
ソマトスタチン受容体を有する細胞をイメージングする方法であって、Tyr(I)を含む有効量の請求項1に記載の化合物またはその医薬的に許容できる塩と細胞を接触させることを含む方法。
【請求項18】
有効量の請求項1に記載の化合物またはその医薬的に許容できる塩を含む、その必要があるヒトまたは他の動物対象において、短身、悪液質、衰弱、II型糖尿病および循環不良よりなる群から選択される疾病または症状を治療するための医薬組成物。
【図1】




【公開番号】特開2006−342171(P2006−342171A)
【公開日】平成18年12月21日(2006.12.21)
【国際特許分類】
【出願番号】特願2006−185373(P2006−185373)
【出願日】平成18年7月5日(2006.7.5)
【分割の表示】特願2002−571515(P2002−571515)の分割
【原出願日】平成14年3月5日(2002.3.5)
【出願人】(501228417)ジ・アドミニストレーターズ・オブ・ザ・ツーレイン・エデュケイショナル・ファンド (6)
【Fターム(参考)】
【公開日】平成18年12月21日(2006.12.21)
【国際特許分類】
【出願日】平成18年7月5日(2006.7.5)
【分割の表示】特願2002−571515(P2002−571515)の分割
【原出願日】平成14年3月5日(2002.3.5)
【出願人】(501228417)ジ・アドミニストレーターズ・オブ・ザ・ツーレイン・エデュケイショナル・ファンド (6)
【Fターム(参考)】
[ Back to top ]

