タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法
【課題】本発明の目的はタクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させること。
【解決手段】タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法であって、
(a)培養細胞の迅速な成長に好適な第一の栄養培地中で、タクスス・シネンシスのカルス組織由来の細胞を、懸濁細胞培養で培養する工程、
(b)第一の培地とは分離されて、独立した第二の栄養培地中でタキソール及び他のタキサンを生産する工程であって、前記第二の培地は、培養細胞中でのタキソール及びタキサンの生合成に適しており、前記第二の培地はエリシターを含む工程、および、
(c)前記細胞および/または前記細胞培養の前記生産培地からタキソール及び他のタキサンを回収する工程
を含むことを特徴とする方法により上記課題を解決する。
【解決手段】タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法であって、
(a)培養細胞の迅速な成長に好適な第一の栄養培地中で、タクスス・シネンシスのカルス組織由来の細胞を、懸濁細胞培養で培養する工程、
(b)第一の培地とは分離されて、独立した第二の栄養培地中でタキソール及び他のタキサンを生産する工程であって、前記第二の培地は、培養細胞中でのタキソール及びタキサンの生合成に適しており、前記第二の培地はエリシターを含む工程、および、
(c)前記細胞および/または前記細胞培養の前記生産培地からタキソール及び他のタキサンを回収する工程
を含むことを特徴とする方法により上記課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はタクスス属種(Taxus species)の細胞培養によるタキソールおよびタキサンの増強された生産方法に関するものである。
【背景技術】
【0002】
タキソール供給問題と可能な解決策
タキソールは最初はパシフィック・イュー(pacific yew ;北米太平洋岸産のイチイ属の植物)、すなわちタクスス・ブレヴィフォリア(Taxus brevifolia)(非特許文献1)の樹皮から単離されたジテルペノイド・アルカロイドである。
【0003】
タキソールに関心がもたれたのは、米国国立癌研究所(NCI )が大規模なスクリーニング・プログラムにおいて粗樹皮抽出物が抗腫瘍活性を示すことを見いだしたときが始めである。それ以来、臨床的試みでタキソールは難治の卵巣癌や乳癌その他の癌に対して非常に有効であることが確認されている。タキソールはその細胞毒性の機構が基本的に異なるため、即ち、微小管(microtubule )の脱重合の阻止によっているため、化学療法における突破口であるとされている(非特許文献2参照)。
【0004】
タキソール方程式におけるもっとも気持を挫けさせる変数はこれまでのところ供給である。一人の患者を治療するのに樹齢100年のパシフィック・イューを3本から6本必要とするが、これはタキソールの平均収率が乾燥樹皮および針葉の約0.01%と低いからである(非特許文献3)。治療および検査に必要な量のタキソールを生産するには数万本のイチイの伐採を必要とする。これまで世界の供給のすべてが太平洋北西岸の太古の森林に生育するこれらのずんぐりした成長の遅い針葉樹を収穫することにより得られている。不運なことに、イチイは伐採搬出によりほぼ絶滅しかけている。保存論者は、危険にさらされているキタブチフクロウ(Northern spotted owl)その他の野生生物の隠れ家となっている太古の森林に生育する樹木を大規模に犠牲にすることに対して成功裡に反対運動を展開している。パシフィック・イューの本数が減っているので、医療研究は将来のタキソールへの希望を新しい代替供給源にかけている。これまで考慮された3つの供給源は化学合成、半合成および植物細胞培養である。
【0005】
タキソールはこれまで全化学合成ができなかった大きな、複雑な構造をもつ化学分子である。従って、簡単な入手可能な薬品から大規模合成することは来る二、三年間に実行しえるオプションとなることはありそうにない。
【0006】
大規模生産の可能なオプションとしては半合成、即ち、農業的に生産されたタキソール前駆体、バッカチン(baccatin)、に側鎖を化学的に付着させることである。この側鎖の合成について顕著な発展がなされた(非特許文献4)。側鎖をバッカチンに結合する方法も開発された(特許文献1;特許文献2)。しかしながら、タクスス・プランテーションの針葉からバッカチンを農業的に供給することは決してとるに足らないことではなく、現在では先の報告(非特許文献5、0.1 重量%)はバッカチン含有量について最近の報告(非特許文献3、0.03重量%)よりもより楽観的であったことから再評価されつつある。要約すると、化学合成および半合成の世界的な化学療法用途にタキソールを供給する能力は確保されていない。代替生産手段を探求開発する強い理由が存在する。
【0007】
本発明はタキソールや他のタキサンを供給するための植物細胞培養に基づくプロセスの開発に関するものである。
【0008】
植物由来の薬品の供給源としての組織培養
種々の異なる培養方法における植物細胞の分裂、成長および二次的中間代謝物を生産する能力は多数のグループによって十分に証明されている。現在、2つの化合物、シコニン(shikonin)(赤色染料および抗炎症剤)とギンセンゴシド(ginsengoside)(東洋医薬の強壮薬)が日本で組織培養プロセスにより生産されている。他の多くのプロセスは報告によると製品の市販が間近であり、これらにはヴァニリン(vanillin)、ベルベリン(berberine )、ロスマリン酸(rosmarinic acid)が含まれる(非特許文献6)。
【0009】
タキソールに対する植物細胞培養プロセスには多くの利点がある。(i) 細胞培養プロセスは製品の無限、連続的かつ均一供給を保証する。(ii)細胞培養は大きなバイオリアクター内で行い環境条件を操作することによりタキソールの過剰生産を誘発させることができる。(iii) 細胞培養は樹皮や針葉に比べて生産する化合物のスペクトルがより単純であり、分離精製がかなり単純化する。(iv)細胞培養プロセスは農業に基づくプロセスよりも需要の急速な変化に迅速に適応することができる。(v) タキソールを供給する以外にも細胞培養プロセスはタキソールその他の活性誘導体に半合成的に転換することができるバッカチンのようなタキサン前駆体をも生産することができる。
【0010】
無菌大規模植物細胞培養は本来的に高価であり、細胞培養方法が商業的に適切となるのはこれらのコストが迅速な細胞成長と高い中間代謝物生産性によって相殺される場合に限られる。あらゆる植物種および標的中間代謝物は異なっており、異なるアプローチが特定の系ごとに必要となる。本発明はタキソールおよびタキサン生産のための迅速に成長し生産性の高い植物細胞培養を得るための創造的かつ熟練したアプローチに焦点を合わせている。
【0011】
木本植物および針葉樹の組織培養に伴う問題
文献を歴史的に概観すると、草本植物は培養において比較的容易に操作されてきたのに対して、木本植物および針葉樹の培養を達成するのは困難であった。
【0012】
二次的中間代謝物生産裸子植物−および針葉樹培養の成長は一般に低い。例えば、Thuja occidentalisの培養が18日間で約30%だけそれらのバイオマスを増加させたことを見い出した(非特許文献7)。Callitris drummondiiの懸濁培養について21日間でバイオマスの増加が20-50 %であることを報告した(非特許文献8)。裸子植物Cephalotaxus harringtonia の懸濁培養について約10日の倍加時間を報告した(非特許文献9)。非特許文献10によりまとめられたように、とうひ属植物の懸濁培養(Picea abies )用の培地開発に向けて非常に多くの努力がなされた。この集合的仕事により裸子植物の懸濁培養は実際に迅速な成長をすることができるが、一般的原則は適用することができず、異なる細胞系統に対する培地処方は独立に最適化しなければならないことが実証されている。
【0013】
裸子植物培養の二次的中間代謝物の生産性を概観するとこれも草本種に比べて迅速な生合成を誘発するのは困難であることを示している。たとえば、セファロタクスス・ハリントニア(Cephalotaxus harringtonia)の培養ではテルペン・アルカロイドを親植物で見られるレベルのわずか1%ないし3%のレベルで生産した(非特許文献11)。成功したエリシテーション(elicitation )でさえも、親植物で生産されたレベルに近づくことができただけである(約0.04乾燥重量%総アルカロイド)(非特許文献12)。針葉樹Callitris drummondiiの懸濁培養を誘導してポドフィロトキシン(podophyllotoxin )を生産させることができたが、針葉により生産されるレベルのわずか十分の一のレベルだけであった(非特許文献8)。Thuja occidentalisの顕著なレベルのモノテルペン類(10-20mg/L )およびジテルペノイド・デヒドロフェルギノール(diterpenoid dehydroferruginol )(2-8mg/L )を生産する能力は納得のゆくように実証されている(非特許文献7)。しかしながら、これらの結果は成長の遅い(18日間でバイオマスが30%増加)、低細胞密度(1リットル当り5ないし7グラムの乾燥重量)の培養で得られたものである。
【0014】
【非特許文献1】エム.シィー.ワニ,エイチ.エル.テイラー,エム.イー.ウォール,ピー.コゴンおよびエム.ティー.マックフェイル.1971. 植物性抗腫瘍剤.VI.タクスス・ブレビフォリアからのタキソール、新規抗白血病剤および抗腫瘍剤の分離および構造.J.Am.Chem.Soc., 93, 2325-2327.(M.C.Wani, H.L.Taylor, M.E.Wall, P.Coggon and M.T.McPhail. 1971. Plant Antitumor Agents. VI. Isolation and Structure of Taxol, a Novel Antileukemic and Antitumor Agent from Taxus brevitolia. J.Am.Chem.Soc.,93, 2325-2327.)
【非特許文献2】イー.ケイ.ロビンスキー.,エル.エー.カゼナベおよびアール.シィー.ドネハゥワー.1990. タキソール:新規な検査的抗微小管剤.J.Natl.Cancer Inst., 82, 1247-1259. (E.K.Rowinsky, L.A.Cazenave and R.C.Donehower. 1990. Taxol: A Novel Investigational Antimicrotubule Agent. J.Natl.Cancer Inst., 82, 1247-1259. )
【非特許文献3】ケイ.エム.ウィゼラップ,エス.エー.ルック,エム.ダブリュ.スタスコ,ティー.ジェイ.ジオルジおよびジィー.エム.ムシィク.1990. タクスス・ブレビフォリアの樹皮に匹敵する量のタキソールを含む針葉:分析および単離.1990.Journal of Natural Products. 53, 1249-1255.(K.M.Witherup, S.A.Look, M.W.Srasko, T.J.Ghiorzi, G.M.Muschik. 1990. Taxus spp. Neddles Contain Amounts of Taxol Comparable to the Bark of Taxus brevifolia: Analysis and Isolation. Journal of Natural Products. 53, 1249-1255.)
【非特許文献4】ジェイ.エヌ.デニス,エー.コレアおよびエー.イー.グリーン.1991.S−デキストロフェニルグリシンからのタキソールおよびタキソテレ側鎖の直接高効率合成.J.Org.Chem.,56,6939-6942.(J.N.Denis, A.Correa and A.E.Greene. 1991. Direct Highly Efficient Synthesis from S-Dextro Phenylglycine of the Taxol and Taxotere Side Chains. J.Org.Chem.,56,6939-6942. )
【非特許文献5】ジェイ.エヌ.デニス,エー.イー.グリーン,ディー.ジェナード,エフ.ジェリット−ヴォーゲレイン,エル.マンガタルおよびピー.ポーチャー.1988. 天然タキソールへの高効率な実用的アプローチ.J.Am.Chem.Soc.,110,5917-5919. (J.N.Denis,A.E.Greene, D.Guenard, F.Gueritte-Voegelein,L.Mangatal and P.Potier. 1988. Highly Efficient Practical Approach to Natural Taxol. J.Am.Chem.Soc.,110,5917-5919.)
【非特許文献6】ジー.エフ.パイネ,ヴィ.ブリンギ,シィー.プリンスおよびエム.エル.シュラー.1991. 植物細胞および液系における組織培養.Hanser Publishers,Munich.(G.F.Payne, V.Bringi, C.Prince and M.L.Shuler. 1991. Plant Cell and Tissue Culture in Liquid Systems, Hanser Publishers,Munich.)
【非特許文献7】ジェイ.ベルリンおよびエル.ウィッテ.1988.チュージャ オシデンタリスの培養された細胞によるモノおよびジテルペン類の生成.Phytochemistry. 27, 127-132.(J.Berlin and L.Witte. 1988. Formation of Mono- and Diterpenoids by Cultured Cells of Thuja Occidentalis. Phytochemistry. 27,127-132.)
【非特許文献8】ダブリュ.ヴァン ウーデン,エヌ.プラスおよびティー.エム.マリングレ.1990. コニファ カリトリス ドルモンディ由来の細胞懸濁培養によるポドフィロトキシン−B−D−グリコシドの蓄積.Plant Cell Reports. 9, 257-260. (W.van Uden, N.Pras and T.M.Malingre. 1990. The Accumulation of Podophyllotoxin-B-D-glycoside by Cell Suspension Cultures Derived from the Conifer Callitris drummondii. Plant Cell Reports. 9, 257-260.)
【非特許文献9】ピー.ジェイ.ウエストゲート,エー.エイチ.エメリー,ピー.エム.ハセガワおよびピー.エフ.ハインステイン.1991. セファロタクスス・ハリントニア植物細胞培地の成長.Appl.Microbial Biotechn ol. 34, 798-803.(P.J.Westgate, A.H.Emery, P.M.Hasegawa and P.F.Heinstein. 1991. Growth of Cephalotaxus harringtonia Plant Cell Cuiltures. Appl.Microbial Biotechn ol. 34, 798-803. )
【非特許文献10】シー.エイチ.ボーンマン.1983. ピセア アビエスのコチレドナリー ニードルからの生体外での木の再生についての可能性および制約.Physiol.Plants. 57,5-16.(C.H.Bornman. 1983. Possibilities and Constraints in the Regeneration of Trees from Cotyledonary needles of Picea abies in vitro. Physiol.Plants. 57,5-16. )
【非特許文献11】エヌ.イー.デルフェルおよびジェイ.エー.ロスファス.1977. セファロタキサス ハリングトニアのカルス培養中の抗腫瘍アルカノイド類.Phytochemistry. 16,1595-1598. (N.E.Delfel and J.A.Rothfus. 1977. Antitumor Alkaloids in Callus Cultures of Cephalotaxus harringtonia. Phytochemistry. 16,1595-1598. )
【非特許文献12】ピー.エフ.ハインスタイン.1985. 植物細胞懸濁培養における二次天然生産物生成への未来のアプロ濁チ.Journal of Natural Products. 48, 1-9.(P.F.Heinstein. 1985. Future Approaches to the Formation of Secondary Natural Products in Plant Cell Suspension Cultures. Journal of Natural Products. 48, 1-9.)
【非特許文献13】エム.ジャジリ,ビー.エム.ディアロ,エム.エイチ.ヴァンヘーレン−ファストル,エー.ジリ,エー.ジー.ベクおよびジェイ.ホームズ.1991. タククス属種および組織培養におけるタキソールに関するタキサンジテルペン類の検出および半定量的同定のための酵素結合免疫吸着剤分析評価.J.Pharm.Belg.,46, 93-99.(M.Jaziri, B.M.Diallo, M.H.Vanhaelen, R.J.Vanhaelen-Fastre, A.Zhiri, A.G.Becu and J.Homes. 1991. Enzyme-linked Immunosorbent Assay for the Detection and the Semi-Quantitative Determination of Taxane Diterpenoids Related to Taxol in Taxus sp. and Tissue Cultures. J.Pharm.Belg.,46, 93-99.)
【非特許文献14】イー.アール.エム.ウィッケルアメシンヘおよびアール.エヌ.アルテカ.1991.タキソール源としてのタクスス・メディア カルティバ ヒックシの習慣性のカルス培養(要約).Plant Physiol., 96, (Supplement) p.97.(E.R.M.Wickeramesinhe and R.N.Arteca. 1991. Habituated Callus Cultures of Taxus media cultivar Hicksii as a Source fo Taxol(Abstract). Plant Physiol., 96,(Supplement)p.97. )
【非特許文献15】エル.エックス.クーおよびエー.アール.リュー.1991. タクスス・シネンシスにおけるタキソールのHLPC法による決定.Acta Pharmeceutica Sinica, 26, 537-540.(L.X.Xu and A.R.Liu. 1991. Determination of Taxol in Taxus chinensis by HPLC Method. Acta Pharmeceutica Sinica, 26, 537-540.)
【非特許文献16】ユー.エイラート.1987. エリシテーション:「植物の細胞培養および細胞遺伝」における用途の方法論および様相.4 巻,F.Constabel and I.K. Vasil(eds.) Academic Press, New York, pp.153-196.(U.Eilert. 1987. Elicitaion: Methodology and Aspects of Application. In "Cell Culture and Somatic Genetics of Plants," Vol.4, F.Constabel and I.K. Vasil(eds.) Academic Press, New York,pp.153-196. )
【非特許文献17】ジェイ.エベル. 1984. エリシターによる微生物感染または処理に続く植物のフィトアレキシン合成の誘発.Bioregulators: Chemistry and Uses. 257-271.(J.Ebel. 1984. Induction of Phytoalexin Synthesis in Plants Following Microbial Infection or Treatment with Elicitors.Bioregulators: Chemistry and Uses. 257-271.)
【非特許文献18】エー.ジー.ダルヴィルおよびピー.アルベルシェイム.1984. 植物中の微生物感染に対するフィトアレキシンおよびそれらのエリシター−A防御.Ann.Rev.Plant Physiol. 35,243-275.(A.G.Darvill and P.Albersheim. 1984. Phytoalexins and their Elicitors-A Defense Against Microbial Infection in Plants. Ann.Rev.Plant Physiol. 35,243-275. )
【非特許文献19】アール.ジェイ.ロビンスおよびエム.ジェイ.シィー.ローデス.1986. 重合性吸着剤を有するシンコナレジェリアナ培養により生産されたアントラキノンの刺激性.Appl.Microbiol.Biotechnol., 24, 35-41.(R.J.Robins and M.J.C.Rhodes. 1986.The Stimulation of Anthrawuinone Production by Cinchona ledgeriana Cultures with Polymeric Adsorbents. Appl.Microbiol.Biotechnol., 24, 35-41.)
【非特許文献20】エム.アサダおよびエム.エル.シューラー.1989. カタランタス ロゼウスからのアジマリン生産および排出の刺激:本来の位置への吸着、エリシターおよびアルギン酸塩固定化の効果.Appl.Microbiol.Biotechnol.,30,475-481. (M.Asada and M.L.Shuler. 1989. Stimulation of Ajmalicine Production and Excretion from Catharanthus roseus: Effects of adsorption in situ,Elicitors,and Alginate Immobilizaion. Appl.Microbiol. Biotechnol.,30,475-481.)
【非特許文献21】エイチ.ミヤサカ,エム.ナス,ティー.ヤマモト,ワイ.エンドーおよびケイ.ヨネダ.1986. サルビア属ミルティオリーザの細胞懸濁培養におけるフェルギノールおよびクリプトタンシノン生合成の調節.Phytochemistry. 25, 637-640.(H.Miyasaka, M.Nasu, T.Yamamoto, Y.Endo and K.Yoneda. 1986.Regulation of Ferruginol and Cryptotanshinore Biosynthesis in Cell Suspension Culture s of Salvia Miltiorrhiza. Phytochemistry. 25, 637-640.)
【非特許文献22】エム.セイバートおよびピー.ジー.カドカデ.1980. 「生化学の起源としての植物組織培養」における光. E.J.Staba(ed), CRC Press,Boca Raton, Florida, pp.123-141.(M.Seibert and P.G.Kadkade.1980. Light.In 'Plant Tissue Culture as a Source of Biochemicals'. E. J.Staba(ed),CRC Press,Boca Raton, Florida, pp.123-141.)
【非特許文献23】ジェイ.エム.ウィドホルム.1972. 培養植物細胞の生育力を決定するためのフルアレセインジアセテートおよびフェノサフラニンの使用.Stain Technol., 47, 189-194.(J.M.Widholm. 1972. The Use of Fluorescein Diacetate and Phenosafranine for Determining Viability of Cultured Plant Cells. Stain Technol., 47, 189-194.)
【非特許文献24】ケイ.エム.ウィゼラップ,エス.エー.ルック,エム.ダブリュ.スタスコ,ティー.ジィー.マッククロウド,エイチ.ジェイ.イサックおよびジィー.エム.ムシィク.1989. タクスス・ブレビフォリアからのタキソールおよび関連化合物のHPLC分離.J.Liq.Chrom., 12, 2117-2132.(K.M.Witherup, S.A.Look, M.W.Stasko, T.G.McCloud, H.J.Issaq and G.M.Muschik. 1989. HPLC Separation of Taxol and Related Compounds from Taxus brevifolia. J.Liq.Chrom., 12, 2117-2132.)
【非特許文献25】エム.ディー.ビューモントおよびディー.ノル.1987. 培養されたセレリー(アピウム グラベオレンス)細胞の生存率における固定化剤および手順の効果.Biotechnol.Lett.9,377-382.(M.D.Beaumont and D.Knorr. 1987. Effects of immobilizing agents and Procedures on Viability of Cultured Celery (Apium graveolens) Cells. Biotechnol.Lett.9,377-382. )
【特許文献1】米国特許第4,924,011 号明細書
【特許文献2】米国特許第5,015,744 号明細書
【特許文献3】米国特許第5,019,504 号明細書
【発明の開示】
【発明が解決しようとする課題】
【0015】
タキソール生産用細胞培養:従前の努力
裸子植物懸濁培養における迅速な成長および高生産性を達成することが困難であることはタキソール生産についてのこれまでの3編の報告に反映されている。最近タクスス・バッカータ(Taxus baccata)のカルス培養を誘導したが、彼らの免疫吸着アッセイを使用してタキソールを検出することができなかった(非特許文献13)。タクスス・メディア(Taxus media)(cv. hicksii) のカルス培養中に0.009 %の乾燥重量のタキソールが存在することを報告したが(非特許文献14)、倍加時間、細胞密度、報告されたタキソールが生産される時間の尺度は示されていない。
【0016】
タクスス・ブレヴィフォリアの細胞培養によるタキサンおよびタキサン様化合物の生産および回収を記載している(特許文献3)。これらの研究者は2ないし4週間の時間枠内で1ないし3mg/Lのレベルのタキソール生産を報告した。彼らはまた「3-4 週間で5ないし10倍」の細胞マスの増加を報告したが、これは約7ないし12日の倍加時間に相当する。
【課題を解決するための手段】
【0017】
本発明者らはタキソール、タキソール様化合物またはタキサンはすべてのタクスス属の種即ち、ブレヴィフォリア(brevifolia)、 カナデンシス(canadensis)、 カスピダータ(cuspidata )、 バッカータ(baccata )、 グロボーサ(globosa )、 フロリダーナ(floridana )、 ワリキアーナ(wallichiana )、 メディア(media )およびシネンシス(chinensis )から非常に高収率生産することができることを見い出した。特に、本発明者らはタクスス・シネンシス種は迅速に成長することができ、非常に高いレベルのタキソールおよびタキサンを短期間に生産することができることを見い出した。
【0018】
特許文献3に記載の発明を改良して、本発明者らはここに異なるタクスス属種からの細胞培養は迅速かつ効率的に誘導することができると共に、人工栄養培地上にうまく成長させることができ、しかも無傷の植物体におけるのと同じ化学療法的に活性なタキサン・アルカロイドが、細胞培養中に生産されることを発見した。
【0019】
さらに、本発明の方法により従前に報告されたよりもずっと短い時間枠内でタキソールを得ることが可能である。タクスス・シネンシス種では、本発明者らは細胞を操作して他のタクスス属種の組織培養から得られる量をはるかに越える量のタキソールを生産することができた。さらに、タクスス・シネンシス細胞培養の成長速度は特許文献3に記載のタクスス・ブレヴィフォリアに対するものよりも顕著に高く、3ないし6倍である。
【0020】
本発明の目的はタクスス属の種々の種(スペシーズ)からの細胞培養を迅速かつ効率的に誘導することを含む。
【0021】
本発明の目的は迅速な成長、高い細胞密度および高い細胞生存率を促す特別の環境条件を形成することを含む。本発明で達成された成長特性は重要な因子について従前の結果を上回っている。
【0022】
本発明の目的は(a) 栄養の濃度の注意深い操作(生産培地の処方)、(b) 光の使用、(c) 定期的な培地交換のプロトコルの使用、(d) エリシター(elicitors)の使用によりタキソールとタキサンの迅速かつ長期間の生合成および分泌を誘導する能力を含む。
【0023】
本発明の目的は培地処方と環境条件を変えることにより生産されるタキサンのプロフィールを操作する能力を含む。特に、細胞は優勢なタキサン生産物としてタキソールを生産するように馴らされた。さらに、副産物であるセファロマンニン(cephalomannine)の生産が抑制され、それにより高価かつ重要な下流の分離精製問題に対するエレガントな生物学的解決を与えている。
【0024】
本発明の目的はそれ自体薬理作用を示すか、あるいは薬理作用を持つ化合物に修飾または転換することができるタキソール以外の種々のタキサンを生産する能力を含む。
【0025】
本発明の目的はタクスス・シネンシスの細胞培養を誘導して野生の植物体で生産されるレベル(0.003 ないし0.03%乾燥重量、非特許文献15)をはるかに越えるレベルのタキソール(0.32%乾燥重量)を生産するように誘導する能力を含む。
【発明を実施するための最良の形態】
【0026】
植物は長らく製薬および特殊薬品の材料源となってきた。これらの製品は典型的には収穫された植物材料の抽出または化学合成により得られた。タキソールは最近天然物のスクリーニングから出現したもっとも重要で可能性の高い抗ガン剤の一つとなった。
【0027】
本明細書において使用されるように、タキソールおよびタキソール様化合物、またはタキサンという用語はタキサン環を有する化合物を記述するために互換的に使用される。これらの化合物はそれ自体抗新生作用を持っていてもよく、修飾されて生物活性化合物を生じてもよい。
【0028】
本明細書において使用されるように、「カルス」という用語は構造的に未分化であり固体培地上に培養される培養された植物細胞の塊を記述するのに使用される。本明細書において使用されるように、「懸濁培養」という用語は液体栄養培地中に分散された構造的に未分化の細胞を記述するのに使用される。懸濁培養は種々の段階の集合状態にある細胞を含むと了解される。集合体のサイズの範囲は本発明において記載されているサスペンジョンにおいて出会うが、サイズは直径数十ミクロン(単一細胞または集合した数個の細胞)から数千個の細胞からなる直径数ミリメートルの集合体までの範囲である。
【0029】
本発明において有用な植物材料は既知のすべてのタクスス属の種即ち、ブレヴィフォリア(brevifolia)、カナデンシス(canadensis)、カスピダータ(cuspidata )、バッカータ(baccata )、グロボーサ(globosa )、フロリダーナ(floridana )、ワリキアーナ(wallichiana )、メディア(media )およびシネンシス(chinensis )から得られた。特に、本発明者らはタクスス・シネンシスを短かい培養時間で顕著量のタキソールおよびタキサンを生産し、所望の化合物を培地中に連続的に分泌する能力を有するものとして同定した。
【0030】
本発明者らの見出したところによると、特定のタキソールの含有量は植物種によって変動し、同じ種内では組織源と特定の樹木個体によって変動する。高収率のタキソール生産源を選択することは治療用途のタキソールを十分量提供するための重要な第一の工程である。
【0031】
タクスス細胞系統の誘導
タクスス植物材料は全北米からおよび他の大陸からも集めることができる。培養は適当なタクススの組織を成長のために選択することによって誘導される。この植物の樹皮、形成層、針葉、茎、種子、きゅう果(cone)および根を含む任意の部分からの組織をカルスを誘導するのに選択することができる。しかしながら、タキソールの収率を最適にするためには、針葉および植物部分の分裂組織領域が好ましい。最も好ましいのは新しく成長した針葉(例えば1ないし3カ月令)であり、これらは一般に浅緑色により同定することができる。「新しく成長した」(new growth)という用語は広くその年の成長シーズン内の植物の針葉生成を意味するものとして意図されている。
【0032】
培養の汚染を防止するために、組織は培地に導入するに先立って表面滅菌しなければならない。任意の従来の滅菌技術例えば「クロロックス」(Clorox)(Clorox社の所有する漂白剤の商標)処理が効果的であろう。さらに、セフォキシチン(cefoxitin)、ベンレート(benlate)、クロキサシリン(cloxacillin)、アンピシリン(ampicillin)、ゲンタマイシンサルフェート(gentamycin sulfate)、フォスフォマイシン(phosphomycin)のような抗微生物剤を植物材料の表面滅菌に使用してもよい。
【0033】
カルス成長
培養は典型的に成長形態、生産性、生産物プロフィールその他の特徴において変異性を示す。個々の細胞系統は成長培地の構成成分に対する好みが異なるので、多くの異なる成長培地をカルスの誘導および増殖に使用することになるかも知れない。
【0034】
適当な培地組成は培養する種によって変わる。異なる種に対する好ましい培地は第3表にリストされている。例えば、他のものも使用することができるが、タクスス・シネンシス用の2つの好ましい成長栄養培地はAとDである。これらの培地は第2表にリストされた成分を含有しているのが好ましい。例えば、培地Aを使用するときは、成長ホルモンまたは調節剤が培地中に1ppbないし10ppm、好ましくは2ppbないし1ppm、の量で導入される。培地Dを使用するときは、成長ホルモンまたは調節剤が培地中に1ppbないし10ppmのレベルの範囲、好ましくは2ppbないし2ppm、で導入される。他の培地成分の量は第2表に示されている濃度の10分の1ないし3倍であるが、第2表に示すレベルで導入するのが好ましい。
【0035】
懸濁成長
タクスス懸濁培養は他の植物細胞培養と同様に迅速な成長速度および高細胞密度の能力を有する。しかしながら、最適条件は細胞系統ごとに変動するため、与えられた細胞系統に対する迅速な最適化に導く方法を考慮する必要がある。
【0036】
種々のタクスス属種の初期培養は第3表にリストされているマクロおよびミクロ栄養、有機塩および成長ホルモンを含有する培地に移すことにより継代培養する。量は一般に次の範囲である。すなわち、第2表に示す各培地成分の10分の1の濃度から3倍の濃度までである。好ましいレベルは第2表にリストされているものである。
【0037】
液体培養は空気に曝され、好ましくは振とうその他により穏やかに動かして空気を培地に導入するか、あるいは管を通して空気を培養器に導入してもよい。培養は適当な成長条件下20℃ないし26℃に維持される。pHは約3ないし7、好ましくは4ないし6であってもよい。培養は完全な暗黒から種々の期間の完全な明光(狭いバンドおよび/または広いスペクトル)の間の範囲の光条件下で成長することができる。露光下の培養において総タキソール生産が最も高いので、これが好ましい。典型的な光強度条件は約100ないし約3,000フート燭光(foot candle power )の範囲である。
【0038】
懸濁培養は継代培養から1ないし8週間維持されるが、その後培養の成長は減少する。培養物は成長培地を例えば濾過により除去することにより収穫される。収穫された培養物は秤量し、例えば凍結乾燥により乾燥し、微粉末に粉砕し、従来の溶媒抽出技術を使用してタキソールを抽出することができる。
【0039】
倍加時間はバイオマスの経時的増加をモニタすることにより、あるいは単に継代培養中に成長指数をモニタすることにより測定されている。最大乾燥重量密度15-24グラム/リットルが達成された。種々のタクスス属種懸濁培養の成長特性が実施例4に詳述されている。
【0040】
分析方法
細胞および培地からのタキソールとタキサンの抽出・回収方法は従来の技法に従って行われ、実施例5に詳細に述べる。イムノアッセイ(ELISA)技法は主に市販キット中のハワイ・バイオテクノロジー社により供給されたプロトコルに従った。強力液体クロマトグラフィー法は実施例5に詳述するように既存のプロトコルを少し変えた。本発明において使用した条件下では、解像度のよいタキサンのピークが得られ、精確な検出と定量ができた。非タキサン成分が一緒に溶離する可能性があるため、タキサンと思われるピークごとにスペクトルの純度をダイオードアレイにより検査してからピーク領域を統合した。タキサン標準品の滞留時間を実施例5にリストする、サンプル・クロマトグラムを第4図及び図5に含めた。
【0041】
生産培地条件
本明細書において使用されるように、「栄養培地」という用語は植物細胞カルスおよび懸濁培養の培養に適した培地を記述するのに使用される。「栄養培地」という用語は一般的であり「成長培地」と「生産培地」の双方を含む。「成長培地」という用語は培養細胞の迅速な成長に有利な栄養培地を記述するのに使用される。「生産培地」という用語は培養細胞のタキソールおよびタキサンの生合成に有利な栄養培地を指称する。成長は生産培地で起きることがあり得るとともに、生産が成長培地で起きることがあり得るし、単一の栄養培地中で最適の成長と生産が起きることがあり得ることが了解される。
【0042】
栄養培地の一定のクラスの添加物は本発明において特殊な名称で指称されており、本明細書中に定義されている。本明細書中において使用されているように、「抗褐変剤」(anti-browning agents)という用語は細胞培養の間に色素が形成されるのを防止するために栄養培地に添加される成分を指称する。これらの色素には一般に細胞の成長、生存率および生産物の形成に有害な効果を有すると観察されているフェノール化合物およびそれらの関連化合物が含まれる。本明細書中に使用されているように、「生合成前駆体」という用語は栄養培地へ添加された化合物であって細胞により代謝・導入されてタキソールおよびタキサンになるものを記述するのに使用される。本明細書中に使用されているように、「代謝阻害剤」(metabolic inhibitor)という用語は栄養培地に添加された化合物であって特定の生合成経路を妨害するものを指称する。例えば、代謝阻害剤はタキソールと初期の生合成前駆体について競争する異なる経路を阻止することによりタキソール生合成を高めるのに使用することができる。本明細書中において使用されるように、スチムレータ(刺激剤)またはアクチベータ(活性化剤)という用語は栄養培地に添加された化合物であって特定の生合成経路、例えばタキソール生合成に導く生合成経路を刺激または活性化するものを記述するのに使用される。上述の添加物の作用の機構は完全には分かっていないことが了解される。
【0043】
懸濁培養において二次的中間代謝物の形成が成長と同時に起きるならば、この中間代謝物は成長関連と呼ばれ、単一の培地処方で良好な成長と高レベルの生産を達成するのに十分であることがある。他の多くの系では、迅速な成長と高い生産物形成が同時には起きないことが見出されている。そのような場合は、成長期と生産期が分離されており、各期用の培地が独立に開発されている(Payneらにより再調査された、非特許文献6)。タクスス・シネンシスにおけるタキソールとタキサンの生産の場合、成長と迅速な生産物形成は分離されており、独立の培地がそれぞれについて開発されていた。しかしながら、単一の成長/生産培地をこの培養のために処方してもよいことが了解される。本発明において開発された生産培地は総タキソールおよびタキサン形成を増加させるだけでなく細胞生合成をタキソール生産に振り向ける。さらに、セファロマンニンのような阻害的副産物の生産が樹皮組織と比べて最小限である。本発明において開発された生産培地は、また、細胞の長期生存率および生合成を促進し、さらに高レベルの生産物を細胞外培地中に分泌させる。これらの特徴は効率的な商業規模のタキソール生産方法の操作に非常に重要である。
【0044】
他のものも使用することができるが、種々の種に対する好適な生産培地を第5表に示す。例えば、他のものを使用することができるが、タクスス・シネンシス用の好適な生産培地はBおよびCである。これらの培地は第2表にリストされた成分を含有しているのが好ましい。これらの培地は主要および微量無機塩類、有機物および成長ホルモンもしくは成長調整物質を含有しているのが好ましい。量は一般に以下の、第2表に示す各培地成分の濃度の10分の1ないし3倍の範囲内である。しかしながら、好適なレベルは第2表に示すものである。
【0045】
培地Bを使用する場合、成長調整物質は培地中に0.1ppmないし20ppm、好ましくは1ppmないし10ppmの量で導入される。培地Cを使用するときは、成長調製物質は0.1ppmないし5ppmのレベルの範囲で導入するのが好ましい。
【0046】
この培地に他の従来の塩組成物(例えば有機物、ビタミン、アミノ酸、前駆体、アクチベータ、および阻害剤)の置換、種々の成分、成長調整物質の追加または削除、あるいは割合の変更のような修飾をすることができることが了解される。
【0047】
非揮発性の溶解された栄養物質以外に、気体状成分、主として酸素、二酸化炭素、エチレン(植物ホルモン)が成長および生産物形成に重要な役割を果たしている。2つのパラメータが重要である。成長とタキソール形成に有利な溶存ガス濃度は明らかに重要である。それは該濃度がリアクタの操作条件を規定しているからである。さらに、消費または生産速度をリアクタ設計に取り入れて最適の特定濃度が維持できるようにする必要がある。
【0048】
呼吸における重要性以外に、酸素は二次的生合成速度に劇的な影響を及ぼすことができる。二次的生合成経路の酸素要求工程に対する高飽和定数は細胞がリアクタ内で高酸素レベルに曝されることを要求することがある。高成長速度を維持する際のCO2補給の重要性が文献に示されている。エチレン、植物ホルモン、は二次的代謝を含めて植物成長および発生のすべての局面において多面発現的役割を果たす(例えば、非特許文献6参照)。
【0049】
エリシター
細胞培養中のタキソールおよび他の関連タキサンの収率を改善するために、本発明者らは数多くのアプローチを行った。生産性を高めるのに使用されたこれらのアプローチの一つはいわゆるエリシターを使用することである。本明細書において使用されるように、エリシターという用語は生物学的由来および非生物由来の化合物であって植物または植物細胞培養に適用されたときに二次的中間代謝物生産の増加を引き起こすものに対して使用される(非特許文献16; 非特許文献17; および非特許文献18)。多くの異なる化合物が由来の特質と細胞代謝への作用のモードとに応じてエリシターとして作用することができる。本発明においては、本発明者らは2種類の主要なエリシター類:1)通常、選ばれたグループの真菌、バクテリア、酵母からの細胞壁の抽出物または濾過物並びにそれらの精製フラクションを含む生物エリシター類、2)化学ストレス剤および生物由来の若干の化合物を含む非生物エリシター類を使用した(第1表にリストしたエリシター類参照)。
【0050】
真菌のエリシター類の使用およびタクスス・ブレヴィフォリアの懸濁によるタキソールの生産のために選ばれた化合物を報告している(特許文献3)。しかしながら、エリシター処理によるタキソール蓄積のレベルの増加は特に記されていない。
【0051】
一般に、エリシテーション(細胞培養中にタキサンが蓄積することおよび培地中へそれを分泌すること)が起きる程度はエリシターごとに、かつ種ごとに異なるものの、いずれの種類のエリシター類もともに有効である。最高の生産増加はグルタミン酸キトサン、リケナン、フェルラ酸および安息香酸を用いて達成された。キトサンとリケナンは微生物の細胞壁由来の複合多糖類である。キトサンは単独で使用すると培地に不溶性であり、毒性があり永久的な細胞障害を引き起こす。他方、グルタミン酸キトサンは培地に容易に溶解し、細胞の生存率に影響しない。フェルラ酸と安息香酸は生物由来の合成された薬品であり、一般に生物学的系において抗酸化剤として使用される。
【0052】
エリシター類は溶存ガスと多くの仕方で相互作用する。酸素要求性はエリシテーションをすると変わることがある。負傷反応としての呼吸速度の増加は植物細胞培養において普通に観察される。重要なのは、エリシター類はエチレンを介してそれらの作用を媒介する。そのような場合、微生物エリシター標品をエチレンと置き換えて、多分このエリシター標品中の他の微生物成分と結びついた毒性を予防することが望ましいことがある。
【0053】
エリシターおよび代謝ストレス剤は、本発明に従い、エリシター特異性および濃度、時機および継続時間を培養時間と培地成分の関数として算定することによりタキソールの生産および組織培養中への分泌を最大にするために使用することもできる。
【0054】
生産性を向上させるための迅速な培地交換
実施例7.3 に記載したように、使用済み培地の除去および新しい培地の補充を3日おきに行うと総タキサンおよびタキソールの生産が顕著に向上するのに寄与するとともに、細胞外生産物の量の増加にも寄与する。
【0055】
培地交換の刺激効果はin situでの生産物の除去によっていたことが考えられ、フィードバック阻害および生産物の分解を防止するものと思われる。in situでの生産物の除去による二次的中間代謝物の生産および懸濁培養への分泌に対するそのような積極的効果は、就中、非特許文献19ならびに非特許文献20により報告されている。使用済み培地を定期的に除去すると上述の利点が取り入れられ、さらに培地から他の非タキサン系阻害成分(フェノール化合物のような)を除去することにより二次的生合成の抑制解除に役立つことがある。
【0056】
新しい培地を活発な生合成を行いつつある細胞に補充すると枯渇した必須栄養物質を提供することにより生産を向上することもある。例えば、サルヴィア・ミルチオリザ(Salvia miltiorhiza)の定常期の細胞を刺激してジテルペン中間代謝物であるクリプトタンシノンとフェルギノールを生産させることができたが(非特許文献21)、これは単に培地にスクロースを添加することによって行われた。推測では、定常期における炭素の制限により生合成が停止したものと思われる。本発明において使用する定期的培地交換プロトコルは上述のファクターの何れの結果としても有益であると考えられる。
【0057】
交換される培地の量、交換の頻度、および補充される培地の組成は変えることができるものと了解される。
【0058】
定期的培地交換により生合成および分泌を刺激することができることは連続、半連続またはフェッド−バッチ(fed-batch)モードの効率的な商業的プロセスの設計および操作に対する重要な示唆を与える。
【0059】
光
高等植物にとって光は無傷の植物および細胞培養のいずれにおいても二次的代謝における有力なファクターである。光の強度と波長はともに重要である(非特許文献22)。例えば、フラボノイドおよびアントシアニン生合成は通常高強度連続光により促進されるが、暗所培養体は他の中間代謝物にとって好ましいことがある。培養された細胞の緑化または光合成能力の向上も生産物形成または生産物スペクトルを増加させる。本発明者らの研究は広いバンドの光源および特定の狭いバンドの光源の使用を含む。実施例7.3 に示すように、露光するとタキソールの蓄積が増えるとともに培地中への分泌が増加する。タキソール生産に対する光の刺激効果はタキサンの生合成に対する特異な制御機構が存在することを示唆する。光受容体の性質と光誘導促進の成果学的特徴は未だ明らかでない。
【0060】
プロセス操作のモード
植物細胞培養プロセスに対する操作のモードは栄養物質、細胞および生産物が時間に関して添加または除去される仕方をいう(非特許文献6)。すべての栄養物質が最初に供給され、細胞と生産物を含む培養内容物が培養期間末に収穫されるときは操作のモードは「一段階バッチプロセス」と呼ばれる。バッチ方法が2つの連続する期、成長期と生産期、に分割されこれら2つの期の間で培地が交換されるときは、操作のモードは「二段階バッチプロセス」と呼ばれる。
【0061】
「フェッド−バッチ」操作では、個々の培地添加物と栄養物質は一段階または二段階バッチ培養の間中、定期的または連続的に供給される。
【0062】
バッチ培養の内容物の全部ではないが実質的部分が収穫され、連続的細胞成長および生産のための新しい培地が添加されると、このプロセスは「反復的ドロー・アンド・フィル(引き出しおよび充填)操作」に似るため「半連続的プロセス」と呼ばれる。
【0063】
新しい培地を連続的に供給し、溢れた培地を連続的に除去すると、このプロセスは「連続的」と呼ばれる。細胞がリアクタ内に保持されると、このプロセスは「潅流モード」と呼ばれる。細胞が連続的に溢れた培地とともに除去されると、この連続的プロセスは「ケモスタット」と呼ばれる。
【0064】
これらの種々のプロセス操作のモードは上述のタキソール生産系と適合性を有するものと了解される。
【0065】
実施例
以下の実施例は、本発明を実施する上で用いられる材料と方法をさらに記載したものである。これらの実施例は、本発明を説明するためのものであって、いかなる場合においても本発明を限定するものではない。
【実施例1】
【0066】
カルス誘導
タクスス属植物材料のサンプルを、多数の野生植物および培養植物から採取した。これらの試料を研究室に到着した時に処理するか、もしくは使用するまで4℃で保存した。
【0067】
最初に材料を希釈石鹸溶液で洗浄し、水ですすぎを行った後、クロロックス(Clorox)溶液(1%次亜塩素酸塩、pH7)に10分間浸して表面の滅菌を行った。滅菌条件下、材料を滅菌水を用いて3回すすいだ。次に、100mg/L のアスコルビン酸を含む1%ポリビニルピロリドン(PVP )溶液中で針葉(needles )を切断した。そして、切断端とともに針葉を培地E(第2表参照)に置いた。1枚あたり30ないし40の外植片(explants)を含む培地プレートを、24±1℃、暗所でインキュベートした。これらのプレートの観察を毎日実施し、微生物による汚染が生じているかどうかを調べた。汚染が認められた場合、汚染されていない針葉を新しい培地Eのプレートに移しかえた。培養20日目までに実質的なカルス形成が観察された。カルスを外植体から分離し、第3表に示す種々のカルス成長培地に置いた。例えば、タクスス・シネンシスのカルスは培地D(第2表参照)に移した。この誘導方法は、たいへん効率が良く、低い汚染率で高頻度のカルス誘導が得られ、誘導処理した外植体のうち90%以上にカルスが認められた。同様の方法をうまく用いて、タクスス・ブレビフォーリア、タクスス・カナデンシス、タクスス・カスピダータ、タクスス・バッカータ、タクスス・グロボーサ、タクスス・フロリダーナ、タクスス・ワリチアーナ、タクスス・メディア、およびタクスス・シネンシスの培養を誘導した。
【実施例2】
【0068】
カルスの増殖
カルスを外植片から除去するとともに、除去したカルスを24±1℃、暗所で培養した。10日毎にカルスの健康な部分を新しい培地に移した。この移植頻度は、褐変を抑えることおよびカルスの維持期間を延ばすことにとってたいへん重要であることがわかった。種々のカルスにとって好ましい成長培地および維持培地を第3表にまとめた。
【実施例3】
【0069】
懸濁培養の誘導
カルス材料の生重量1gを、各種に適当な液体培地(第3表参照)を25ml含む125 mlのエルレンマイアーフラスコへ無菌的に移植した。例えば、タクスス・シネンシスに対しては培地Dを用いた。フラスコをシリコンフォームキャップ(ベルコ、エヌジェー(Bellco, NJ))で塞いだ後、回転振とう機に置き、暗所で24±1℃、120rpmの条件で振とうした。約3ないし10日で懸濁培養が形成された。初期段階では、ミラクロスフィルタ(カルバイオケム(Calbiochem))を有するブフナー漏斗によってフラスコの含有物を吸引濾過することにより、培地の交換を行った。細胞の増殖段階では、通常、1 〜2g(生重量)の細胞を新しい培地が25ml入った新しい125ml フラスコへ移し、その後週に一回の割合で植え継ぎを行った。
【実施例4】
【0070】
懸濁細胞の増殖
代表的な種の懸濁培養における典型的な増殖速度および細胞密度を第4表に示す。
【0071】
詳細な例として、タクスス・シネンシスK-1系統のバイオマス(生重量および乾燥重量)の経時的な増加を図1に示す。最大増殖速度は、増殖曲線でもっとも急激にバイオマスが増大した点での傾斜をとって測定した。タクスス・シネンシスの細胞培養における増殖は、最大倍加時間が2.5 日であった。この増殖速度は、タクスス種懸濁培養に関して以前に報告されていたものよりも著しく高い。例えば、クリステンらの報告(特許文献3)によれば、培養3ないし4週間後でバイオマスが5 〜10倍増加するが、これをタクスス・ブレビフォーリアの平均倍加時間として換算すると7ないし12日となる。
【0072】
高密度での培養細胞の能力は、細胞培養プロセスの容積生産性(volumetric productivity)を最大限にする上で重要である。タクスス・ブレビフォーリアの培養において達成された細胞密度が1リットルあたりの乾燥重量で1g以下であったのに対し(特許文献3で発表されたデータから計算)、タクスス・シネンシスの懸濁培養では18日間の増殖で密度が1リットルあたりの乾燥重量で8ないし20gまで達した。
【0073】
細胞の生存率は、0.05%フルオレセインジアセテートを含むアセトン(非特許文献23)によって細胞を染色し、倒立蛍光顕微鏡(オリンパス IMT-2、日本)でもって青色光励起により緑色の蛍光を発する細胞の数をカウントすることによって決定した。細胞生存率は、増殖期の初めから終わりまで90%以上であった。
【0074】
急激な細胞増殖状態にあって高生存率を維持しながら高細胞密度まで細胞を培養するための能力が、タキソールおよびタキソール様化合物を生産するための植物細胞培養プロセスの経済的操作にとって重要な前提必要条件である。
【実施例5】
【0075】
タキソールおよびタキサンの分析
5.1. 酵素結合免疫測定法
タキソール(ハワイ生物工学研究所提供)の酵素結合免疫測定法(ELISA)による分析を大規模の細胞系統のスクリーニングに用いた。この方法は高感度(0.1ng/mL)であるが、ポリクロナール抗体を用いるため、他のタキサンとのクロス反応性が観察される。分画コレクションを有する予備的な(分析規模の)高速液体クロマトグラフィ(HPLC)は、未同定のタキサンと同様に、10−デアセチルタキソール、7キシロシル−10−デアセチルタキソール、セファロマンニン、10−デアセチル−7−エピタキソール、7エピタキソールとの交差反応性を示した。そのようなクロス反応性にもかかわらず、この方法はタキサン生産物の検出のために非常に有益であると見出され、多数の細胞を迅速にスクリーニングすることを可能にした。タキサンの明白な生成を示す細胞抽出をその後、以下に概要を示すHPLC手順を用いて詳細に分析した。
【0076】
5.2.タキソールおよび関連するタキサンの抽出
上清からのタキサンの抽出を、培地中の濃度に依存する2つの方法によって実行した。液体培地中にタキサンが十分な量存在するとき、サンプルを非常に手早くかつ効率的に準備した。培地(2mL)を完全に(真空で)乾燥させ、計量した量のメタノール(0.5−2.0mL)を加えた。サンプルの完全な溶解または分散を達成するまで、この混合物を超音波的に撹拌した。HPLC分析前に遠心分離によって固形物を除去した。検出レベルが0.1mg/Lよりかなり下で、量的な回収は、1mg/Lレベルで得られた。
【0077】
培養上清中のタキサン濃度が低いときは、その培地を、メチレンクロライドとイソプロピルアルコール(IPA)との混合物(体積比で9:1)で3度抽出した。抽出ごとの混合物の量は同一とした。乾燥性となるまで有機層を減少し、計量した量のメタノール(50−250mL)中において組成を再構成した。マルチ抽出では、典型的にタキソール、セファロマンニンおよびバッカチンIIIの90−95%を0.6mg/Lレベルで回収した。
【0078】
細胞材料を、新たに採取した細胞を−5℃で冷凍し、続いて真空乾燥し、50サイクルのメタノールソックスレーによって抽出を行った。タキサンの70〜80%を、10−15%測定可能な分解物として回収した。固形培地およびカルスの抽出を、細胞の抽出と同様に達成したが、最終的なメタノール抽出物のメチレンクロライド/IPA混合物と水への分配を常に行った。
【0079】
5.3.高速液体クロマトグラフィ法
分析的な高速液体クロマトグラフィ(HPLC)を、CM3500/CM3200 ポンプ、CM4100可変量自動サンプラおよび総合周辺486 パーソナルコンピュータに連結したSM50000 フォトダイオードアレイ検出器からなるLDC 分析二値勾配高圧混合システムを備えた高炭素ロード(load)ジフェニルカラム(Supelco製、5mM、4.6mm×25cm)で行った。カラム温度を、Eldex CH150 カラムオーブンで35℃に調整した。タクススの定量的なHPLC分析を、次のような二値勾配溶出の略表を用いて達成した。
【0080】
時間 %溶出液A %溶出液B 流速
(mg/分)
0 75 25 1
40 35 65 1
42 25 75 1
47 25 75 1
50 75 25 1
溶出液Aは、0.015mM のKH2PO4をトリフルオロ酢酸でpH3.5に調製したものであり、溶出液Bはアセトニトリルである。
【0081】
上記クロマトグラフィ法としては、トリフルオロ酢酸を含有するリン酸緩衝液および長い勾配が用いられてきた以外は幾つかの公知の方法(非特許文献24)に似た方法を用いた。これらの違いは、混合物からのタキソールおよび他のタキサンの解像度を明白に改良するものである。タキサンに関して観察された相対的な保持時間は以下に示される。タキソールは、用いられるカラムおよびハードウエアに依存して31分と33分との間に溶出する。
【0082】
【表1】

【0083】
タキソール、セファロマンニンおよびバッカチンIIIの保持時間を、国立ガン研究所から入手した真正サンプルを用いて決定した。上記に掲げた他のタキサンの保持時間を、ハウザー化学(Hauser Chemical (Boulder CO))によって提供された分析用標準品の保持時間と比較した。既知のタキサンの同定は、保持時間および紫外線スペクトル比較を基礎とした。タキソール、セファロマンニンおよびバッカチンIIIの定量は、真正材料から決定された応答因子を基礎とした。10−デアセチルバッカチンIIIの定量は、バッカチンIIIに関して決定された応答因子を用いて行われた。残りのタキソール誘導体の定量は、タキソールに関して測定された応答因子を基礎とした。
【0084】
各標準品(10mL)を注入し(初期に標準品を注入した後に3または4のサンプルを注入し)、上記3成分の各々の領域を合わせた。各成分に関する応答因子はデータの線形最小二乗分析によって得られた。10mLの各サンプルを注入し、注入ごとの量を標準データの回帰曲線を基礎として算出した。これらの結果をリッター当たりまたは乾燥重量%の量に換算した。第4図及び第5図は、上清サンプルの典型的なクロマトグラムを示す。
【0085】
5.4.タキソールのMS/MS確認
細胞培養の上清中のタキソールの同定を、MS/MS 法(図7〜図10おいて示した)を用いて確認した。その方法は、フローインジェクションをイオンスプレイ大気圧での化学的イオン化に組み合わせるものである。図7〜図10に掲げられたデータを得るために用いられた手順の詳細は次のようである。マススペクトロメータ:大気圧イオン化源を備えたSciex API 3のトリプル四重極質量分析計を用いた。窒素をカーテンガスとして用い、アルゴンをCID スペクトラのための衝突ガスとして用いた。インタフェース:イオン蒸発イオン化(Ion Evaporation Ionization (Electrospray))によってイオンを生産するイオンスプレイインタフェースを用いた。ゼロエア(Zero air)を霧吹きガスとして用いた。LCポンプ:5μL/分で操作するABI 140Bの二重シリンジポンプを用いた。溶媒:2mM NH4OAc、+0.1 %蟻酸を含む50/50 のアセトニトリル/H2O を用いた。注入量:5μL 。フローインジェクション分析によってとられた全スペクトラ。この方法は、細胞培養サンプルにおけるタキソールの存在のための明確な確認を与え、HPLCによる結果ときわめてよく一致する定量結果を与えた。
【実施例6】
【0086】
種々の種(species)によるタキソール生産
種々のタクスス属種の細胞培養によって生産されたタキソールは第5表に要約されている。カルスを各種ごとに特定の固体培地上に置き、20日間、暗所で培養した。細胞および培地を乾燥し、共にメタノール抽出し、上記に示したELISAまたはHPLCのいずれかの方法によって検定した。タクスス・シネンシス(Taxus chinensis)培養で得られた結果を実施例7および8にさらに詳述する。
【実施例7】
【0087】
7.1.成長培地中での生産
タキソールおよび同族のタキサンの生産は、成長培地A中に送り込まれた最初の2日間の内に始まった。観察された最大タキソールは、15日目のもので、8.81μg/フラスコであり、これは0.44mg/Lのタキソールに相当するものであった。その46.1%はその細胞外の培地中に存在した。15日目において、タキサンの合計濃度は、72.87μg/フラスコまたは3.6mg/Lであり、その58.6%はその細胞外の培地中に存在した。細胞の生育率は蛍光染色法による測定で常に90%以上であり(実施例4)、これは細胞外のタキソールおよびタキサンの存在は細胞溶解が原因というよりはむしろ分泌によるものであったことを示唆している。細胞がタキソールおよびタキサンを分泌する能力は、連続運転の重要な局面となるものである。
【0088】
7.2.生産性促進のための培地交換
タキソールおよび合計タキサンの生産性における大幅な改良は、9日目において成長培地Aを無菌状態で吸い出し、新しい培地と交換して、12日目にこの手順を繰り返すことによって、得られたものである。この実験は15日目に中止し、その結果は図2に示した。培地交換による生産性の大幅な増加は、第6表にまとめられている。生産されたタキソールおよびタキサンの合計量は、培地の交換をした場合では、培地交換をしない場合に比較して、約4.6 倍高かった。重要なことには、培地交換処理をしない場合に比較して、約4.9 倍高いタキソール、および約5.9倍高い合計タキサンが、細胞外培地内において、回収された。
【0089】
タキソールおよび合計タキサン生産性を大幅に促進し、そして、さらに細胞外の生産物蓄積を引き起こす能力は、バイオマスを再使用し、簡略化された下流側の精製(downstream purification)を含む効果的な連続プロセスの操作にとって重要である。
【0090】
7.3.成長培地中のタキサン生産における光の効果
光は、光合成にばかりでなく、植物細胞培養物内での二次代謝の様々な局面においても、重要な役割を果たすものとして、知られている(非特許文献22)。実施例4、7.1 、および7.2 に記載された実験は、暗所にて処理されたが、タクスス・シネンシス培養物の光に対する反応をここに説明する。
【0091】
タクスス・シネンシス系統K-1の7日経過後の細胞の生重量1グラムを、125mlのエルレンマイアーフラスコ内の25ml成長培地A(第2表参照)中に接種し、回転数120rpmの回転振とう機上で24±1℃で培養した。同じ二つのフラスコの一方を暗所に置き、他方を3フィートの距離にある標準GroLuxランプの点灯下に置いた。このランプの特性は図3に示した。結果は第7表に示した。
【0092】
培養物を光に曝しても、合計タキサンのレベルまたは細胞外蓄積の量に影響しなかった。しかし、タキサンのプロフィールには、前記の二つの処理フラスコにおいてはかなりな変化があった。例えば、光の中で培養した細胞は、暗所で培養した細胞のより2.8倍高いタキソールを生産した。また、細胞外タキソールの割合は、暗所培養におけるものより、かなり高いものであった(76%対56%)。したがって、光を用いた培養は、特に固有スペクトル特性で、タキソール生産の細胞培養プロセスにおいて、非常に有益となろう。
【実施例8】
【0093】
エリシター(elicitors)
エリシターという用語は、植物細胞培養物に添加されると二次代謝の増加をもたらす、生物学的な(または生物の)および非生物学的な(または非生物の)由来(origin)の化合物に対して用いられる。
【0094】
数多くのエリシターが有益であると判明しているが、ここでは、代表的な説明可能な例を、すなわち、グルタミン酸キトサン(chitosan glutamate)を詳しく説明する。以前にキトサンがいくつかの植物細胞培養物システムにおけるエリシターとして試みられたが、褐変および生存率の低下などの有毒反応が同時に生じて、その実用を不可能にしている(非特許文献25)。実に、このような毒性側の反応は、文献中に報告されている多くのエリシターの一般的な欠点である。毒性側の作用を回避しながら、グルタミン酸キトサンなどの化学修飾されたキトサンをタキソールおよびタクススの生合成を誘発するために特に用いることは、新規な研究方法である。
【0095】
7から8日間、培地Dの中で成長したタクスス・シネンシスK-1系統の懸濁液を、ミラクロス(Calbiochem社)フィルターが取り付けられた殺菌されたバックナー漏斗を無菌状態で用いて、吸引濾過した。生重量が2gの細胞を無菌状態で125mlのエルレンマイアーフラスコ内の25mlの培地C(第2表参照)中に転送した。グルタミン酸キトサンの0.05%溶液を新たに調製し、0.22ミクロンのカートリッジフィルターにより濾過滅菌した。この溶液の825 μLを実験の開始時に前記フラスコに添加した。この溶液量は、細胞の乾燥重量1グラム当たり165mgのエリシターのレベルに対応している。このフラスコを暗所内の回転数110rpmの回転振とう機上で24±1℃で培養した。このフラスコから15日目に破壊的に試料採取し、成長の観察、細胞と培地の色および細胞の生存率を記録した。凍結乾燥試料を、実施例5で説明したように、タキソールおよびタキサンを得るために、メタノール抽出し、HPLCにより分析した。この実験の結果を第8表に示す。
【0096】
エリシター処理では、非処理の場合より細胞当たりの合計タキサン生産において幾分かの改善が得られた(タキサンの乾燥重量で、0.42%に対して0.53%)。エリシターが非毒性であることは、両方の処理において観察された高い生存率(75〜80%)から明らかである。実際に、エリシター処理なしの場合に比べたエリシター処理での乾燥重量の増加は、繰り返し観察された(乾燥重量で、10.1g/Lに対して14.2g/L)。より高い細胞密度では、合計タキサンの力価で、例えば、エリシター処理しない場合における42.4mg/Lに対して、エリシター処理では75.8mg/Lのように、エリシター処理の場合の方が、1.8 倍大きい結果となった。
【0097】
エリシター処理では、タキソールの生合成においては、細胞当たり(タキソールの乾燥重量で、0.054 %に対して0.098 %で1.8 倍の増加)および、力価の比較(5.4mg/Lに対して13.9mg/Lで2.6 倍の増加)の両方とも増加する結果となった。分泌量については、エリシター処理しない場合に比べてエリシター処理の方が高かった(細胞外生産で、72%に対して85%)。
【0098】
ここで説明したエリシター処理では、タキソール生産の増加、より好適な生産プロフィール、生産物分泌の促進および高い細胞生存率の維持が、得られる結果となった。これらの生産特性は、タキソール生産における細胞培養工程の大幅な改良がなされたことを、表している。
【実施例9】
【0099】
生産培地の開発
実施例6に記載したレベルを越えるようなタキソール生産性の増大を得るために、栄養レベルを操作して特別な「生産培地(production media)」を処方した。培地Dで増殖する7ないし8日経過したタクスス・シネンシス細胞系統K-1の懸濁液をミラクロスフィルタ(カルバイオケム(Calbiochem))が設けられた滅菌ブフナー漏斗を用いて無菌的に吸引濾過した。生重量が500mgの細胞を無菌的に5mlの生産培地BおよびC(第2表参照)に移した。容器を、暗所、24±1℃、110rpmの条件でもって回転振とう機により18、25、および42日間のいろいろな期間にわたってインキュベーションした。
【0100】
このような処理を施したものに対して破壊的サンプリングを実施し、増殖、細胞および培地の色、および細胞の生存率を観察記録した。凍結乾燥試料を、実施例5に記載したようにメタノール処理してタキソールおよびタキサンの抽出を行い、HPLCでもって分析した。
【0101】
9.1. 18日間培養の結果
タクスス・シネンシス細胞培養は、顕著なレベルのタキサンおよびタキソールを生産することによって修正培地組成物に反応した。これらのデータを第9表にまとめ、また試料のクロマトグラムは図4及び図5に示した。培地Bでは、精製タキソール24.1mg/Lとともに全体で99.8mg/Lのタキサンが生産された。培地Cでは、タキソール21.3mg/Lとともに合計で110mg/リットルのタキサンが生産された。乾燥重量に換算すると、細胞が生産したタキソールの乾燥重量は、培地Bで0.18%、また培地Cで0.065%であった。
【0102】
9.2.延長培養
培養期間を25および42日間として、タクスス・シネンシス細胞(K-1系統)を培地Cで培養した場合のタキソールおよびタキサン生産を調べた。その結果を、第5表にまとめた。以下のような重要な観察値を要約することができる。
(i) タクスス懸濁培養によって顕著なレベルのタキソールおよび他のタキサンが生産可能である。42日目で、乾燥重量で0.32%のタキソールおよび0.62%の合計タキサンを有する最も高い蓄積が観察され、これは、最終培地容積に対して153mg/Lタキソールおよび295mg/L合計タキサンの力価に相当する。図7〜図10に示すように、タンデムマススペクトロメトリーによるこの試料の分析によってタキソールの存在が確認された。MS/MS による定量は、HPLCとたいへんよく一致した。
(ii) 25日目と42日目とのあいだの17日間にわたるタキソール生合成速度は、この期間において生産が直線的に行われたと仮定した場合、約7.6mgタキソール/L/日であった。この速度は、最初の25日間の生産速度によりも顕著に高い。25日目と42日目とのあいだにおける全タキサン生合成速度は、12.3mg/L/日であった。
(iii) 生産培地処方によって、実施例7に記載したような急増殖条件の場合と比較して、特定のタキソール含有量を45倍まで増加させることができる。
(iv) 望ましくないタキサンの生産を最小限にしつつ、生合成が要求最終産物タキソールに集中するように、生産物スペクトルを操作することができる。例えば、タキソールがタキサン全体のうちたったの12.2%しか占めていない成長培地(実施例7.1参照)と比較して、タキソールがタキサン全体を占める割合が25日目では28%であり、42日目では52%であった。生産物プロフィールを操作するこのような能力は、下流側精製および生産物純度に関連した制御的問題に対して重大な影響を及ぼすであろう。例えば、タキサンの副産物であるセファロマンニンの生産を抑制する能力は、樹皮組織からのタキソール精製と比較して下流側の精製を大いに単純化することができた。
(v) 大量のタキソール(42日目で87%)および他のタキサンを分泌するために、タクスス細胞培養が誘導されてきた。細胞溶解によるよりもむしろ分泌による細胞外タキソールおよびタキサンの存在がいくつかの別個の観察によって確証される。すなわち、(a) 25目から45日目の間に連続した生合成が起こる。このことは細胞が生存し、かつ活動的であることを示唆している。別個の観察によれば、生産培地での培養18日目以降に70%を上回る生存率が認められた。(b) 異なるタキサンが異なる比率で分泌された。もし、細胞が溶解した場合、培地中の比率は異なるタキサンで類似すると考えられる。
(vi) 増殖し、かつタキソールを細胞外環境へ大量かつ高率に生産するタクスス細胞系統の能力は、特に注目すべき価値がある。
(vii) それらの結果が得られたタクスス細胞系統は、高密度になるまで急激に増殖することも可能である。また、急増殖条件下で20世代後に報告された生産能を発現する。このことは、それの安定性および商業的潜在能力を証明するものである。
【0103】
本願に記載した条件下でタクスス・シネンシスの細胞系統によって生産されるタキソールおよびタキサンのレベルは、以前報告されたものよりも高く、35ないし150倍である。例えば、クリステンら(特許文献3)は、培養2ないし4週間後のタクスス・ブレビフォーリアの懸濁培養によって、1ないし3mg/Lのタキソールが生産されると報告している。また、Wickeramesinhe and Arteca(1991)は、タクスス・メディアの細胞培養で乾燥重量0.009%のタキソールが生産されることを報告している。
【0104】
要約すると、われわれのデータは、タクスス・シネンシスの培養を注意深く誘導し、かつ選択することによって、また成長培地を特別に処方することによって、細胞を高密度に達するまで急激に増殖させることができることを示している。このような細胞を生産培地条件に移した場合、細胞は高生存率を維持する一方で顕著な濃度からなるタキソールおよび他のタキサンを期間を延ばして生合成および分泌することができる。定期的な培地の交換、生産培地に光およびエリシターを取り込むことによって、相乗的な生産性増大が得られる。これらの特性は、組織培養技術を用いたタキソールおよびタキサン生産のための効率的な商業的プロセスにとって決定的な前提必要条件である。
【0105】
【表2】

【0106】
【表3】

【0107】
【表4】

【0108】
【表5】

【0109】
【表6】

【0110】
【表7】

【0111】
【表8】

【0112】
【表9】

【0113】
【表10】

【0114】
【表11】

【0115】
【表12】

【0116】
【表13】

【0117】
【表14】

【0118】
【表15】

【図面の簡単な説明】
【0119】
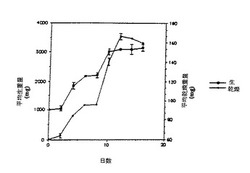
【図1】培地Aにおける典型的なバッチ成長サイクルに対するタクスス・シネンシス懸濁培養系統K-1のバイオマス増加を示す。誤差バーは2つのフラスコから測定した標準偏差を表わす。
【図2】15日間の実験において第9日と第12日に行う培地交換のタキソール(A)および総タキサン(B)の生産性への効果を示す。各ボックス内の数字は生産物が生産される時間間隔(日数)を表す。セル内のボックスの塗りつぶし部分は実験開始時の細胞接種材料の中に存在するタキソールまたは総タキサンを表す。処理はすべて二重に行った。第2表に示すようにタクスス・シネンシス懸濁培養細胞系統K-1を培地Aとともに使用した。
【図3】実施例7.3 で使用した標準グローラックスランプ(GTE Sylvania, Danvers, MA )のスペクトル特性を示す。
【図4】タクスス・シネンシス細胞懸濁液K-1におけるタキサン生産を示す。10分ないし40分のクロマトグラムの部分を示す。選択されたタキサンのピークのダイオード・アレイ・スキャンは特徴的なタキサンのUV吸収スペクトルを示し、ピークは227nm である。
【図5】タクスス・シネンシス細胞懸濁液K-1におけるタキサン生産を示す。10分ないし40分のクロマトグラムの部分を示す。選択されたタキサンのピークのダイオード・アレイ・スキャンは特徴的なタキサンのUV吸収スペクトルを示し、ピークは227nm である。
【図6】タクスス・シネンシス細胞系統K-1を培地C中で長期間培養して生産されるタキソールとタキサンを示す。上方のパネルは既知および未知のタキサンについてのデータを表にしたものであり、下方のパネルは25日ないし42日の期間におけるタキソールおよびタキサン生産の増加量を表したものである。
【図7】細胞培養上清中のタキソールのMS/MS 確認を示す。パネルAは真正タキソールのイオンスプレーAPCIマススペクトルを示す。
【図8】細胞培養上清中のタキソールのMS/MS 確認を示す。パネルBは親ピークの娘イオンスペクトルを示す(m/z871=タキソール+NN4+)。
【図9】細胞培養上清中のタキソールのMS/MS 確認を示す。パネルCは粗細胞培養抽出物からのイオンスプレーAPCIマススペクトルを表し、タキソールのm/z 854および871 特徴を示す。
【図10】細胞培養上清中のタキソールのMS/MS 確認を示す。パネルDは対応する娘スペクトルm/z 871を示し、細胞培養上清中にタキソールが存在することの明瞭な証拠を提示している。
【技術分野】
【0001】
本発明はタクスス属種(Taxus species)の細胞培養によるタキソールおよびタキサンの増強された生産方法に関するものである。
【背景技術】
【0002】
タキソール供給問題と可能な解決策
タキソールは最初はパシフィック・イュー(pacific yew ;北米太平洋岸産のイチイ属の植物)、すなわちタクスス・ブレヴィフォリア(Taxus brevifolia)(非特許文献1)の樹皮から単離されたジテルペノイド・アルカロイドである。
【0003】
タキソールに関心がもたれたのは、米国国立癌研究所(NCI )が大規模なスクリーニング・プログラムにおいて粗樹皮抽出物が抗腫瘍活性を示すことを見いだしたときが始めである。それ以来、臨床的試みでタキソールは難治の卵巣癌や乳癌その他の癌に対して非常に有効であることが確認されている。タキソールはその細胞毒性の機構が基本的に異なるため、即ち、微小管(microtubule )の脱重合の阻止によっているため、化学療法における突破口であるとされている(非特許文献2参照)。
【0004】
タキソール方程式におけるもっとも気持を挫けさせる変数はこれまでのところ供給である。一人の患者を治療するのに樹齢100年のパシフィック・イューを3本から6本必要とするが、これはタキソールの平均収率が乾燥樹皮および針葉の約0.01%と低いからである(非特許文献3)。治療および検査に必要な量のタキソールを生産するには数万本のイチイの伐採を必要とする。これまで世界の供給のすべてが太平洋北西岸の太古の森林に生育するこれらのずんぐりした成長の遅い針葉樹を収穫することにより得られている。不運なことに、イチイは伐採搬出によりほぼ絶滅しかけている。保存論者は、危険にさらされているキタブチフクロウ(Northern spotted owl)その他の野生生物の隠れ家となっている太古の森林に生育する樹木を大規模に犠牲にすることに対して成功裡に反対運動を展開している。パシフィック・イューの本数が減っているので、医療研究は将来のタキソールへの希望を新しい代替供給源にかけている。これまで考慮された3つの供給源は化学合成、半合成および植物細胞培養である。
【0005】
タキソールはこれまで全化学合成ができなかった大きな、複雑な構造をもつ化学分子である。従って、簡単な入手可能な薬品から大規模合成することは来る二、三年間に実行しえるオプションとなることはありそうにない。
【0006】
大規模生産の可能なオプションとしては半合成、即ち、農業的に生産されたタキソール前駆体、バッカチン(baccatin)、に側鎖を化学的に付着させることである。この側鎖の合成について顕著な発展がなされた(非特許文献4)。側鎖をバッカチンに結合する方法も開発された(特許文献1;特許文献2)。しかしながら、タクスス・プランテーションの針葉からバッカチンを農業的に供給することは決してとるに足らないことではなく、現在では先の報告(非特許文献5、0.1 重量%)はバッカチン含有量について最近の報告(非特許文献3、0.03重量%)よりもより楽観的であったことから再評価されつつある。要約すると、化学合成および半合成の世界的な化学療法用途にタキソールを供給する能力は確保されていない。代替生産手段を探求開発する強い理由が存在する。
【0007】
本発明はタキソールや他のタキサンを供給するための植物細胞培養に基づくプロセスの開発に関するものである。
【0008】
植物由来の薬品の供給源としての組織培養
種々の異なる培養方法における植物細胞の分裂、成長および二次的中間代謝物を生産する能力は多数のグループによって十分に証明されている。現在、2つの化合物、シコニン(shikonin)(赤色染料および抗炎症剤)とギンセンゴシド(ginsengoside)(東洋医薬の強壮薬)が日本で組織培養プロセスにより生産されている。他の多くのプロセスは報告によると製品の市販が間近であり、これらにはヴァニリン(vanillin)、ベルベリン(berberine )、ロスマリン酸(rosmarinic acid)が含まれる(非特許文献6)。
【0009】
タキソールに対する植物細胞培養プロセスには多くの利点がある。(i) 細胞培養プロセスは製品の無限、連続的かつ均一供給を保証する。(ii)細胞培養は大きなバイオリアクター内で行い環境条件を操作することによりタキソールの過剰生産を誘発させることができる。(iii) 細胞培養は樹皮や針葉に比べて生産する化合物のスペクトルがより単純であり、分離精製がかなり単純化する。(iv)細胞培養プロセスは農業に基づくプロセスよりも需要の急速な変化に迅速に適応することができる。(v) タキソールを供給する以外にも細胞培養プロセスはタキソールその他の活性誘導体に半合成的に転換することができるバッカチンのようなタキサン前駆体をも生産することができる。
【0010】
無菌大規模植物細胞培養は本来的に高価であり、細胞培養方法が商業的に適切となるのはこれらのコストが迅速な細胞成長と高い中間代謝物生産性によって相殺される場合に限られる。あらゆる植物種および標的中間代謝物は異なっており、異なるアプローチが特定の系ごとに必要となる。本発明はタキソールおよびタキサン生産のための迅速に成長し生産性の高い植物細胞培養を得るための創造的かつ熟練したアプローチに焦点を合わせている。
【0011】
木本植物および針葉樹の組織培養に伴う問題
文献を歴史的に概観すると、草本植物は培養において比較的容易に操作されてきたのに対して、木本植物および針葉樹の培養を達成するのは困難であった。
【0012】
二次的中間代謝物生産裸子植物−および針葉樹培養の成長は一般に低い。例えば、Thuja occidentalisの培養が18日間で約30%だけそれらのバイオマスを増加させたことを見い出した(非特許文献7)。Callitris drummondiiの懸濁培養について21日間でバイオマスの増加が20-50 %であることを報告した(非特許文献8)。裸子植物Cephalotaxus harringtonia の懸濁培養について約10日の倍加時間を報告した(非特許文献9)。非特許文献10によりまとめられたように、とうひ属植物の懸濁培養(Picea abies )用の培地開発に向けて非常に多くの努力がなされた。この集合的仕事により裸子植物の懸濁培養は実際に迅速な成長をすることができるが、一般的原則は適用することができず、異なる細胞系統に対する培地処方は独立に最適化しなければならないことが実証されている。
【0013】
裸子植物培養の二次的中間代謝物の生産性を概観するとこれも草本種に比べて迅速な生合成を誘発するのは困難であることを示している。たとえば、セファロタクスス・ハリントニア(Cephalotaxus harringtonia)の培養ではテルペン・アルカロイドを親植物で見られるレベルのわずか1%ないし3%のレベルで生産した(非特許文献11)。成功したエリシテーション(elicitation )でさえも、親植物で生産されたレベルに近づくことができただけである(約0.04乾燥重量%総アルカロイド)(非特許文献12)。針葉樹Callitris drummondiiの懸濁培養を誘導してポドフィロトキシン(podophyllotoxin )を生産させることができたが、針葉により生産されるレベルのわずか十分の一のレベルだけであった(非特許文献8)。Thuja occidentalisの顕著なレベルのモノテルペン類(10-20mg/L )およびジテルペノイド・デヒドロフェルギノール(diterpenoid dehydroferruginol )(2-8mg/L )を生産する能力は納得のゆくように実証されている(非特許文献7)。しかしながら、これらの結果は成長の遅い(18日間でバイオマスが30%増加)、低細胞密度(1リットル当り5ないし7グラムの乾燥重量)の培養で得られたものである。
【0014】
【非特許文献1】エム.シィー.ワニ,エイチ.エル.テイラー,エム.イー.ウォール,ピー.コゴンおよびエム.ティー.マックフェイル.1971. 植物性抗腫瘍剤.VI.タクスス・ブレビフォリアからのタキソール、新規抗白血病剤および抗腫瘍剤の分離および構造.J.Am.Chem.Soc., 93, 2325-2327.(M.C.Wani, H.L.Taylor, M.E.Wall, P.Coggon and M.T.McPhail. 1971. Plant Antitumor Agents. VI. Isolation and Structure of Taxol, a Novel Antileukemic and Antitumor Agent from Taxus brevitolia. J.Am.Chem.Soc.,93, 2325-2327.)
【非特許文献2】イー.ケイ.ロビンスキー.,エル.エー.カゼナベおよびアール.シィー.ドネハゥワー.1990. タキソール:新規な検査的抗微小管剤.J.Natl.Cancer Inst., 82, 1247-1259. (E.K.Rowinsky, L.A.Cazenave and R.C.Donehower. 1990. Taxol: A Novel Investigational Antimicrotubule Agent. J.Natl.Cancer Inst., 82, 1247-1259. )
【非特許文献3】ケイ.エム.ウィゼラップ,エス.エー.ルック,エム.ダブリュ.スタスコ,ティー.ジェイ.ジオルジおよびジィー.エム.ムシィク.1990. タクスス・ブレビフォリアの樹皮に匹敵する量のタキソールを含む針葉:分析および単離.1990.Journal of Natural Products. 53, 1249-1255.(K.M.Witherup, S.A.Look, M.W.Srasko, T.J.Ghiorzi, G.M.Muschik. 1990. Taxus spp. Neddles Contain Amounts of Taxol Comparable to the Bark of Taxus brevifolia: Analysis and Isolation. Journal of Natural Products. 53, 1249-1255.)
【非特許文献4】ジェイ.エヌ.デニス,エー.コレアおよびエー.イー.グリーン.1991.S−デキストロフェニルグリシンからのタキソールおよびタキソテレ側鎖の直接高効率合成.J.Org.Chem.,56,6939-6942.(J.N.Denis, A.Correa and A.E.Greene. 1991. Direct Highly Efficient Synthesis from S-Dextro Phenylglycine of the Taxol and Taxotere Side Chains. J.Org.Chem.,56,6939-6942. )
【非特許文献5】ジェイ.エヌ.デニス,エー.イー.グリーン,ディー.ジェナード,エフ.ジェリット−ヴォーゲレイン,エル.マンガタルおよびピー.ポーチャー.1988. 天然タキソールへの高効率な実用的アプローチ.J.Am.Chem.Soc.,110,5917-5919. (J.N.Denis,A.E.Greene, D.Guenard, F.Gueritte-Voegelein,L.Mangatal and P.Potier. 1988. Highly Efficient Practical Approach to Natural Taxol. J.Am.Chem.Soc.,110,5917-5919.)
【非特許文献6】ジー.エフ.パイネ,ヴィ.ブリンギ,シィー.プリンスおよびエム.エル.シュラー.1991. 植物細胞および液系における組織培養.Hanser Publishers,Munich.(G.F.Payne, V.Bringi, C.Prince and M.L.Shuler. 1991. Plant Cell and Tissue Culture in Liquid Systems, Hanser Publishers,Munich.)
【非特許文献7】ジェイ.ベルリンおよびエル.ウィッテ.1988.チュージャ オシデンタリスの培養された細胞によるモノおよびジテルペン類の生成.Phytochemistry. 27, 127-132.(J.Berlin and L.Witte. 1988. Formation of Mono- and Diterpenoids by Cultured Cells of Thuja Occidentalis. Phytochemistry. 27,127-132.)
【非特許文献8】ダブリュ.ヴァン ウーデン,エヌ.プラスおよびティー.エム.マリングレ.1990. コニファ カリトリス ドルモンディ由来の細胞懸濁培養によるポドフィロトキシン−B−D−グリコシドの蓄積.Plant Cell Reports. 9, 257-260. (W.van Uden, N.Pras and T.M.Malingre. 1990. The Accumulation of Podophyllotoxin-B-D-glycoside by Cell Suspension Cultures Derived from the Conifer Callitris drummondii. Plant Cell Reports. 9, 257-260.)
【非特許文献9】ピー.ジェイ.ウエストゲート,エー.エイチ.エメリー,ピー.エム.ハセガワおよびピー.エフ.ハインステイン.1991. セファロタクスス・ハリントニア植物細胞培地の成長.Appl.Microbial Biotechn ol. 34, 798-803.(P.J.Westgate, A.H.Emery, P.M.Hasegawa and P.F.Heinstein. 1991. Growth of Cephalotaxus harringtonia Plant Cell Cuiltures. Appl.Microbial Biotechn ol. 34, 798-803. )
【非特許文献10】シー.エイチ.ボーンマン.1983. ピセア アビエスのコチレドナリー ニードルからの生体外での木の再生についての可能性および制約.Physiol.Plants. 57,5-16.(C.H.Bornman. 1983. Possibilities and Constraints in the Regeneration of Trees from Cotyledonary needles of Picea abies in vitro. Physiol.Plants. 57,5-16. )
【非特許文献11】エヌ.イー.デルフェルおよびジェイ.エー.ロスファス.1977. セファロタキサス ハリングトニアのカルス培養中の抗腫瘍アルカノイド類.Phytochemistry. 16,1595-1598. (N.E.Delfel and J.A.Rothfus. 1977. Antitumor Alkaloids in Callus Cultures of Cephalotaxus harringtonia. Phytochemistry. 16,1595-1598. )
【非特許文献12】ピー.エフ.ハインスタイン.1985. 植物細胞懸濁培養における二次天然生産物生成への未来のアプロ濁チ.Journal of Natural Products. 48, 1-9.(P.F.Heinstein. 1985. Future Approaches to the Formation of Secondary Natural Products in Plant Cell Suspension Cultures. Journal of Natural Products. 48, 1-9.)
【非特許文献13】エム.ジャジリ,ビー.エム.ディアロ,エム.エイチ.ヴァンヘーレン−ファストル,エー.ジリ,エー.ジー.ベクおよびジェイ.ホームズ.1991. タククス属種および組織培養におけるタキソールに関するタキサンジテルペン類の検出および半定量的同定のための酵素結合免疫吸着剤分析評価.J.Pharm.Belg.,46, 93-99.(M.Jaziri, B.M.Diallo, M.H.Vanhaelen, R.J.Vanhaelen-Fastre, A.Zhiri, A.G.Becu and J.Homes. 1991. Enzyme-linked Immunosorbent Assay for the Detection and the Semi-Quantitative Determination of Taxane Diterpenoids Related to Taxol in Taxus sp. and Tissue Cultures. J.Pharm.Belg.,46, 93-99.)
【非特許文献14】イー.アール.エム.ウィッケルアメシンヘおよびアール.エヌ.アルテカ.1991.タキソール源としてのタクスス・メディア カルティバ ヒックシの習慣性のカルス培養(要約).Plant Physiol., 96, (Supplement) p.97.(E.R.M.Wickeramesinhe and R.N.Arteca. 1991. Habituated Callus Cultures of Taxus media cultivar Hicksii as a Source fo Taxol(Abstract). Plant Physiol., 96,(Supplement)p.97. )
【非特許文献15】エル.エックス.クーおよびエー.アール.リュー.1991. タクスス・シネンシスにおけるタキソールのHLPC法による決定.Acta Pharmeceutica Sinica, 26, 537-540.(L.X.Xu and A.R.Liu. 1991. Determination of Taxol in Taxus chinensis by HPLC Method. Acta Pharmeceutica Sinica, 26, 537-540.)
【非特許文献16】ユー.エイラート.1987. エリシテーション:「植物の細胞培養および細胞遺伝」における用途の方法論および様相.4 巻,F.Constabel and I.K. Vasil(eds.) Academic Press, New York, pp.153-196.(U.Eilert. 1987. Elicitaion: Methodology and Aspects of Application. In "Cell Culture and Somatic Genetics of Plants," Vol.4, F.Constabel and I.K. Vasil(eds.) Academic Press, New York,pp.153-196. )
【非特許文献17】ジェイ.エベル. 1984. エリシターによる微生物感染または処理に続く植物のフィトアレキシン合成の誘発.Bioregulators: Chemistry and Uses. 257-271.(J.Ebel. 1984. Induction of Phytoalexin Synthesis in Plants Following Microbial Infection or Treatment with Elicitors.Bioregulators: Chemistry and Uses. 257-271.)
【非特許文献18】エー.ジー.ダルヴィルおよびピー.アルベルシェイム.1984. 植物中の微生物感染に対するフィトアレキシンおよびそれらのエリシター−A防御.Ann.Rev.Plant Physiol. 35,243-275.(A.G.Darvill and P.Albersheim. 1984. Phytoalexins and their Elicitors-A Defense Against Microbial Infection in Plants. Ann.Rev.Plant Physiol. 35,243-275. )
【非特許文献19】アール.ジェイ.ロビンスおよびエム.ジェイ.シィー.ローデス.1986. 重合性吸着剤を有するシンコナレジェリアナ培養により生産されたアントラキノンの刺激性.Appl.Microbiol.Biotechnol., 24, 35-41.(R.J.Robins and M.J.C.Rhodes. 1986.The Stimulation of Anthrawuinone Production by Cinchona ledgeriana Cultures with Polymeric Adsorbents. Appl.Microbiol.Biotechnol., 24, 35-41.)
【非特許文献20】エム.アサダおよびエム.エル.シューラー.1989. カタランタス ロゼウスからのアジマリン生産および排出の刺激:本来の位置への吸着、エリシターおよびアルギン酸塩固定化の効果.Appl.Microbiol.Biotechnol.,30,475-481. (M.Asada and M.L.Shuler. 1989. Stimulation of Ajmalicine Production and Excretion from Catharanthus roseus: Effects of adsorption in situ,Elicitors,and Alginate Immobilizaion. Appl.Microbiol. Biotechnol.,30,475-481.)
【非特許文献21】エイチ.ミヤサカ,エム.ナス,ティー.ヤマモト,ワイ.エンドーおよびケイ.ヨネダ.1986. サルビア属ミルティオリーザの細胞懸濁培養におけるフェルギノールおよびクリプトタンシノン生合成の調節.Phytochemistry. 25, 637-640.(H.Miyasaka, M.Nasu, T.Yamamoto, Y.Endo and K.Yoneda. 1986.Regulation of Ferruginol and Cryptotanshinore Biosynthesis in Cell Suspension Culture s of Salvia Miltiorrhiza. Phytochemistry. 25, 637-640.)
【非特許文献22】エム.セイバートおよびピー.ジー.カドカデ.1980. 「生化学の起源としての植物組織培養」における光. E.J.Staba(ed), CRC Press,Boca Raton, Florida, pp.123-141.(M.Seibert and P.G.Kadkade.1980. Light.In 'Plant Tissue Culture as a Source of Biochemicals'. E. J.Staba(ed),CRC Press,Boca Raton, Florida, pp.123-141.)
【非特許文献23】ジェイ.エム.ウィドホルム.1972. 培養植物細胞の生育力を決定するためのフルアレセインジアセテートおよびフェノサフラニンの使用.Stain Technol., 47, 189-194.(J.M.Widholm. 1972. The Use of Fluorescein Diacetate and Phenosafranine for Determining Viability of Cultured Plant Cells. Stain Technol., 47, 189-194.)
【非特許文献24】ケイ.エム.ウィゼラップ,エス.エー.ルック,エム.ダブリュ.スタスコ,ティー.ジィー.マッククロウド,エイチ.ジェイ.イサックおよびジィー.エム.ムシィク.1989. タクスス・ブレビフォリアからのタキソールおよび関連化合物のHPLC分離.J.Liq.Chrom., 12, 2117-2132.(K.M.Witherup, S.A.Look, M.W.Stasko, T.G.McCloud, H.J.Issaq and G.M.Muschik. 1989. HPLC Separation of Taxol and Related Compounds from Taxus brevifolia. J.Liq.Chrom., 12, 2117-2132.)
【非特許文献25】エム.ディー.ビューモントおよびディー.ノル.1987. 培養されたセレリー(アピウム グラベオレンス)細胞の生存率における固定化剤および手順の効果.Biotechnol.Lett.9,377-382.(M.D.Beaumont and D.Knorr. 1987. Effects of immobilizing agents and Procedures on Viability of Cultured Celery (Apium graveolens) Cells. Biotechnol.Lett.9,377-382. )
【特許文献1】米国特許第4,924,011 号明細書
【特許文献2】米国特許第5,015,744 号明細書
【特許文献3】米国特許第5,019,504 号明細書
【発明の開示】
【発明が解決しようとする課題】
【0015】
タキソール生産用細胞培養:従前の努力
裸子植物懸濁培養における迅速な成長および高生産性を達成することが困難であることはタキソール生産についてのこれまでの3編の報告に反映されている。最近タクスス・バッカータ(Taxus baccata)のカルス培養を誘導したが、彼らの免疫吸着アッセイを使用してタキソールを検出することができなかった(非特許文献13)。タクスス・メディア(Taxus media)(cv. hicksii) のカルス培養中に0.009 %の乾燥重量のタキソールが存在することを報告したが(非特許文献14)、倍加時間、細胞密度、報告されたタキソールが生産される時間の尺度は示されていない。
【0016】
タクスス・ブレヴィフォリアの細胞培養によるタキサンおよびタキサン様化合物の生産および回収を記載している(特許文献3)。これらの研究者は2ないし4週間の時間枠内で1ないし3mg/Lのレベルのタキソール生産を報告した。彼らはまた「3-4 週間で5ないし10倍」の細胞マスの増加を報告したが、これは約7ないし12日の倍加時間に相当する。
【課題を解決するための手段】
【0017】
本発明者らはタキソール、タキソール様化合物またはタキサンはすべてのタクスス属の種即ち、ブレヴィフォリア(brevifolia)、 カナデンシス(canadensis)、 カスピダータ(cuspidata )、 バッカータ(baccata )、 グロボーサ(globosa )、 フロリダーナ(floridana )、 ワリキアーナ(wallichiana )、 メディア(media )およびシネンシス(chinensis )から非常に高収率生産することができることを見い出した。特に、本発明者らはタクスス・シネンシス種は迅速に成長することができ、非常に高いレベルのタキソールおよびタキサンを短期間に生産することができることを見い出した。
【0018】
特許文献3に記載の発明を改良して、本発明者らはここに異なるタクスス属種からの細胞培養は迅速かつ効率的に誘導することができると共に、人工栄養培地上にうまく成長させることができ、しかも無傷の植物体におけるのと同じ化学療法的に活性なタキサン・アルカロイドが、細胞培養中に生産されることを発見した。
【0019】
さらに、本発明の方法により従前に報告されたよりもずっと短い時間枠内でタキソールを得ることが可能である。タクスス・シネンシス種では、本発明者らは細胞を操作して他のタクスス属種の組織培養から得られる量をはるかに越える量のタキソールを生産することができた。さらに、タクスス・シネンシス細胞培養の成長速度は特許文献3に記載のタクスス・ブレヴィフォリアに対するものよりも顕著に高く、3ないし6倍である。
【0020】
本発明の目的はタクスス属の種々の種(スペシーズ)からの細胞培養を迅速かつ効率的に誘導することを含む。
【0021】
本発明の目的は迅速な成長、高い細胞密度および高い細胞生存率を促す特別の環境条件を形成することを含む。本発明で達成された成長特性は重要な因子について従前の結果を上回っている。
【0022】
本発明の目的は(a) 栄養の濃度の注意深い操作(生産培地の処方)、(b) 光の使用、(c) 定期的な培地交換のプロトコルの使用、(d) エリシター(elicitors)の使用によりタキソールとタキサンの迅速かつ長期間の生合成および分泌を誘導する能力を含む。
【0023】
本発明の目的は培地処方と環境条件を変えることにより生産されるタキサンのプロフィールを操作する能力を含む。特に、細胞は優勢なタキサン生産物としてタキソールを生産するように馴らされた。さらに、副産物であるセファロマンニン(cephalomannine)の生産が抑制され、それにより高価かつ重要な下流の分離精製問題に対するエレガントな生物学的解決を与えている。
【0024】
本発明の目的はそれ自体薬理作用を示すか、あるいは薬理作用を持つ化合物に修飾または転換することができるタキソール以外の種々のタキサンを生産する能力を含む。
【0025】
本発明の目的はタクスス・シネンシスの細胞培養を誘導して野生の植物体で生産されるレベル(0.003 ないし0.03%乾燥重量、非特許文献15)をはるかに越えるレベルのタキソール(0.32%乾燥重量)を生産するように誘導する能力を含む。
【発明を実施するための最良の形態】
【0026】
植物は長らく製薬および特殊薬品の材料源となってきた。これらの製品は典型的には収穫された植物材料の抽出または化学合成により得られた。タキソールは最近天然物のスクリーニングから出現したもっとも重要で可能性の高い抗ガン剤の一つとなった。
【0027】
本明細書において使用されるように、タキソールおよびタキソール様化合物、またはタキサンという用語はタキサン環を有する化合物を記述するために互換的に使用される。これらの化合物はそれ自体抗新生作用を持っていてもよく、修飾されて生物活性化合物を生じてもよい。
【0028】
本明細書において使用されるように、「カルス」という用語は構造的に未分化であり固体培地上に培養される培養された植物細胞の塊を記述するのに使用される。本明細書において使用されるように、「懸濁培養」という用語は液体栄養培地中に分散された構造的に未分化の細胞を記述するのに使用される。懸濁培養は種々の段階の集合状態にある細胞を含むと了解される。集合体のサイズの範囲は本発明において記載されているサスペンジョンにおいて出会うが、サイズは直径数十ミクロン(単一細胞または集合した数個の細胞)から数千個の細胞からなる直径数ミリメートルの集合体までの範囲である。
【0029】
本発明において有用な植物材料は既知のすべてのタクスス属の種即ち、ブレヴィフォリア(brevifolia)、カナデンシス(canadensis)、カスピダータ(cuspidata )、バッカータ(baccata )、グロボーサ(globosa )、フロリダーナ(floridana )、ワリキアーナ(wallichiana )、メディア(media )およびシネンシス(chinensis )から得られた。特に、本発明者らはタクスス・シネンシスを短かい培養時間で顕著量のタキソールおよびタキサンを生産し、所望の化合物を培地中に連続的に分泌する能力を有するものとして同定した。
【0030】
本発明者らの見出したところによると、特定のタキソールの含有量は植物種によって変動し、同じ種内では組織源と特定の樹木個体によって変動する。高収率のタキソール生産源を選択することは治療用途のタキソールを十分量提供するための重要な第一の工程である。
【0031】
タクスス細胞系統の誘導
タクスス植物材料は全北米からおよび他の大陸からも集めることができる。培養は適当なタクススの組織を成長のために選択することによって誘導される。この植物の樹皮、形成層、針葉、茎、種子、きゅう果(cone)および根を含む任意の部分からの組織をカルスを誘導するのに選択することができる。しかしながら、タキソールの収率を最適にするためには、針葉および植物部分の分裂組織領域が好ましい。最も好ましいのは新しく成長した針葉(例えば1ないし3カ月令)であり、これらは一般に浅緑色により同定することができる。「新しく成長した」(new growth)という用語は広くその年の成長シーズン内の植物の針葉生成を意味するものとして意図されている。
【0032】
培養の汚染を防止するために、組織は培地に導入するに先立って表面滅菌しなければならない。任意の従来の滅菌技術例えば「クロロックス」(Clorox)(Clorox社の所有する漂白剤の商標)処理が効果的であろう。さらに、セフォキシチン(cefoxitin)、ベンレート(benlate)、クロキサシリン(cloxacillin)、アンピシリン(ampicillin)、ゲンタマイシンサルフェート(gentamycin sulfate)、フォスフォマイシン(phosphomycin)のような抗微生物剤を植物材料の表面滅菌に使用してもよい。
【0033】
カルス成長
培養は典型的に成長形態、生産性、生産物プロフィールその他の特徴において変異性を示す。個々の細胞系統は成長培地の構成成分に対する好みが異なるので、多くの異なる成長培地をカルスの誘導および増殖に使用することになるかも知れない。
【0034】
適当な培地組成は培養する種によって変わる。異なる種に対する好ましい培地は第3表にリストされている。例えば、他のものも使用することができるが、タクスス・シネンシス用の2つの好ましい成長栄養培地はAとDである。これらの培地は第2表にリストされた成分を含有しているのが好ましい。例えば、培地Aを使用するときは、成長ホルモンまたは調節剤が培地中に1ppbないし10ppm、好ましくは2ppbないし1ppm、の量で導入される。培地Dを使用するときは、成長ホルモンまたは調節剤が培地中に1ppbないし10ppmのレベルの範囲、好ましくは2ppbないし2ppm、で導入される。他の培地成分の量は第2表に示されている濃度の10分の1ないし3倍であるが、第2表に示すレベルで導入するのが好ましい。
【0035】
懸濁成長
タクスス懸濁培養は他の植物細胞培養と同様に迅速な成長速度および高細胞密度の能力を有する。しかしながら、最適条件は細胞系統ごとに変動するため、与えられた細胞系統に対する迅速な最適化に導く方法を考慮する必要がある。
【0036】
種々のタクスス属種の初期培養は第3表にリストされているマクロおよびミクロ栄養、有機塩および成長ホルモンを含有する培地に移すことにより継代培養する。量は一般に次の範囲である。すなわち、第2表に示す各培地成分の10分の1の濃度から3倍の濃度までである。好ましいレベルは第2表にリストされているものである。
【0037】
液体培養は空気に曝され、好ましくは振とうその他により穏やかに動かして空気を培地に導入するか、あるいは管を通して空気を培養器に導入してもよい。培養は適当な成長条件下20℃ないし26℃に維持される。pHは約3ないし7、好ましくは4ないし6であってもよい。培養は完全な暗黒から種々の期間の完全な明光(狭いバンドおよび/または広いスペクトル)の間の範囲の光条件下で成長することができる。露光下の培養において総タキソール生産が最も高いので、これが好ましい。典型的な光強度条件は約100ないし約3,000フート燭光(foot candle power )の範囲である。
【0038】
懸濁培養は継代培養から1ないし8週間維持されるが、その後培養の成長は減少する。培養物は成長培地を例えば濾過により除去することにより収穫される。収穫された培養物は秤量し、例えば凍結乾燥により乾燥し、微粉末に粉砕し、従来の溶媒抽出技術を使用してタキソールを抽出することができる。
【0039】
倍加時間はバイオマスの経時的増加をモニタすることにより、あるいは単に継代培養中に成長指数をモニタすることにより測定されている。最大乾燥重量密度15-24グラム/リットルが達成された。種々のタクスス属種懸濁培養の成長特性が実施例4に詳述されている。
【0040】
分析方法
細胞および培地からのタキソールとタキサンの抽出・回収方法は従来の技法に従って行われ、実施例5に詳細に述べる。イムノアッセイ(ELISA)技法は主に市販キット中のハワイ・バイオテクノロジー社により供給されたプロトコルに従った。強力液体クロマトグラフィー法は実施例5に詳述するように既存のプロトコルを少し変えた。本発明において使用した条件下では、解像度のよいタキサンのピークが得られ、精確な検出と定量ができた。非タキサン成分が一緒に溶離する可能性があるため、タキサンと思われるピークごとにスペクトルの純度をダイオードアレイにより検査してからピーク領域を統合した。タキサン標準品の滞留時間を実施例5にリストする、サンプル・クロマトグラムを第4図及び図5に含めた。
【0041】
生産培地条件
本明細書において使用されるように、「栄養培地」という用語は植物細胞カルスおよび懸濁培養の培養に適した培地を記述するのに使用される。「栄養培地」という用語は一般的であり「成長培地」と「生産培地」の双方を含む。「成長培地」という用語は培養細胞の迅速な成長に有利な栄養培地を記述するのに使用される。「生産培地」という用語は培養細胞のタキソールおよびタキサンの生合成に有利な栄養培地を指称する。成長は生産培地で起きることがあり得るとともに、生産が成長培地で起きることがあり得るし、単一の栄養培地中で最適の成長と生産が起きることがあり得ることが了解される。
【0042】
栄養培地の一定のクラスの添加物は本発明において特殊な名称で指称されており、本明細書中に定義されている。本明細書中において使用されているように、「抗褐変剤」(anti-browning agents)という用語は細胞培養の間に色素が形成されるのを防止するために栄養培地に添加される成分を指称する。これらの色素には一般に細胞の成長、生存率および生産物の形成に有害な効果を有すると観察されているフェノール化合物およびそれらの関連化合物が含まれる。本明細書中に使用されているように、「生合成前駆体」という用語は栄養培地へ添加された化合物であって細胞により代謝・導入されてタキソールおよびタキサンになるものを記述するのに使用される。本明細書中に使用されているように、「代謝阻害剤」(metabolic inhibitor)という用語は栄養培地に添加された化合物であって特定の生合成経路を妨害するものを指称する。例えば、代謝阻害剤はタキソールと初期の生合成前駆体について競争する異なる経路を阻止することによりタキソール生合成を高めるのに使用することができる。本明細書中において使用されるように、スチムレータ(刺激剤)またはアクチベータ(活性化剤)という用語は栄養培地に添加された化合物であって特定の生合成経路、例えばタキソール生合成に導く生合成経路を刺激または活性化するものを記述するのに使用される。上述の添加物の作用の機構は完全には分かっていないことが了解される。
【0043】
懸濁培養において二次的中間代謝物の形成が成長と同時に起きるならば、この中間代謝物は成長関連と呼ばれ、単一の培地処方で良好な成長と高レベルの生産を達成するのに十分であることがある。他の多くの系では、迅速な成長と高い生産物形成が同時には起きないことが見出されている。そのような場合は、成長期と生産期が分離されており、各期用の培地が独立に開発されている(Payneらにより再調査された、非特許文献6)。タクスス・シネンシスにおけるタキソールとタキサンの生産の場合、成長と迅速な生産物形成は分離されており、独立の培地がそれぞれについて開発されていた。しかしながら、単一の成長/生産培地をこの培養のために処方してもよいことが了解される。本発明において開発された生産培地は総タキソールおよびタキサン形成を増加させるだけでなく細胞生合成をタキソール生産に振り向ける。さらに、セファロマンニンのような阻害的副産物の生産が樹皮組織と比べて最小限である。本発明において開発された生産培地は、また、細胞の長期生存率および生合成を促進し、さらに高レベルの生産物を細胞外培地中に分泌させる。これらの特徴は効率的な商業規模のタキソール生産方法の操作に非常に重要である。
【0044】
他のものも使用することができるが、種々の種に対する好適な生産培地を第5表に示す。例えば、他のものを使用することができるが、タクスス・シネンシス用の好適な生産培地はBおよびCである。これらの培地は第2表にリストされた成分を含有しているのが好ましい。これらの培地は主要および微量無機塩類、有機物および成長ホルモンもしくは成長調整物質を含有しているのが好ましい。量は一般に以下の、第2表に示す各培地成分の濃度の10分の1ないし3倍の範囲内である。しかしながら、好適なレベルは第2表に示すものである。
【0045】
培地Bを使用する場合、成長調整物質は培地中に0.1ppmないし20ppm、好ましくは1ppmないし10ppmの量で導入される。培地Cを使用するときは、成長調製物質は0.1ppmないし5ppmのレベルの範囲で導入するのが好ましい。
【0046】
この培地に他の従来の塩組成物(例えば有機物、ビタミン、アミノ酸、前駆体、アクチベータ、および阻害剤)の置換、種々の成分、成長調整物質の追加または削除、あるいは割合の変更のような修飾をすることができることが了解される。
【0047】
非揮発性の溶解された栄養物質以外に、気体状成分、主として酸素、二酸化炭素、エチレン(植物ホルモン)が成長および生産物形成に重要な役割を果たしている。2つのパラメータが重要である。成長とタキソール形成に有利な溶存ガス濃度は明らかに重要である。それは該濃度がリアクタの操作条件を規定しているからである。さらに、消費または生産速度をリアクタ設計に取り入れて最適の特定濃度が維持できるようにする必要がある。
【0048】
呼吸における重要性以外に、酸素は二次的生合成速度に劇的な影響を及ぼすことができる。二次的生合成経路の酸素要求工程に対する高飽和定数は細胞がリアクタ内で高酸素レベルに曝されることを要求することがある。高成長速度を維持する際のCO2補給の重要性が文献に示されている。エチレン、植物ホルモン、は二次的代謝を含めて植物成長および発生のすべての局面において多面発現的役割を果たす(例えば、非特許文献6参照)。
【0049】
エリシター
細胞培養中のタキソールおよび他の関連タキサンの収率を改善するために、本発明者らは数多くのアプローチを行った。生産性を高めるのに使用されたこれらのアプローチの一つはいわゆるエリシターを使用することである。本明細書において使用されるように、エリシターという用語は生物学的由来および非生物由来の化合物であって植物または植物細胞培養に適用されたときに二次的中間代謝物生産の増加を引き起こすものに対して使用される(非特許文献16; 非特許文献17; および非特許文献18)。多くの異なる化合物が由来の特質と細胞代謝への作用のモードとに応じてエリシターとして作用することができる。本発明においては、本発明者らは2種類の主要なエリシター類:1)通常、選ばれたグループの真菌、バクテリア、酵母からの細胞壁の抽出物または濾過物並びにそれらの精製フラクションを含む生物エリシター類、2)化学ストレス剤および生物由来の若干の化合物を含む非生物エリシター類を使用した(第1表にリストしたエリシター類参照)。
【0050】
真菌のエリシター類の使用およびタクスス・ブレヴィフォリアの懸濁によるタキソールの生産のために選ばれた化合物を報告している(特許文献3)。しかしながら、エリシター処理によるタキソール蓄積のレベルの増加は特に記されていない。
【0051】
一般に、エリシテーション(細胞培養中にタキサンが蓄積することおよび培地中へそれを分泌すること)が起きる程度はエリシターごとに、かつ種ごとに異なるものの、いずれの種類のエリシター類もともに有効である。最高の生産増加はグルタミン酸キトサン、リケナン、フェルラ酸および安息香酸を用いて達成された。キトサンとリケナンは微生物の細胞壁由来の複合多糖類である。キトサンは単独で使用すると培地に不溶性であり、毒性があり永久的な細胞障害を引き起こす。他方、グルタミン酸キトサンは培地に容易に溶解し、細胞の生存率に影響しない。フェルラ酸と安息香酸は生物由来の合成された薬品であり、一般に生物学的系において抗酸化剤として使用される。
【0052】
エリシター類は溶存ガスと多くの仕方で相互作用する。酸素要求性はエリシテーションをすると変わることがある。負傷反応としての呼吸速度の増加は植物細胞培養において普通に観察される。重要なのは、エリシター類はエチレンを介してそれらの作用を媒介する。そのような場合、微生物エリシター標品をエチレンと置き換えて、多分このエリシター標品中の他の微生物成分と結びついた毒性を予防することが望ましいことがある。
【0053】
エリシターおよび代謝ストレス剤は、本発明に従い、エリシター特異性および濃度、時機および継続時間を培養時間と培地成分の関数として算定することによりタキソールの生産および組織培養中への分泌を最大にするために使用することもできる。
【0054】
生産性を向上させるための迅速な培地交換
実施例7.3 に記載したように、使用済み培地の除去および新しい培地の補充を3日おきに行うと総タキサンおよびタキソールの生産が顕著に向上するのに寄与するとともに、細胞外生産物の量の増加にも寄与する。
【0055】
培地交換の刺激効果はin situでの生産物の除去によっていたことが考えられ、フィードバック阻害および生産物の分解を防止するものと思われる。in situでの生産物の除去による二次的中間代謝物の生産および懸濁培養への分泌に対するそのような積極的効果は、就中、非特許文献19ならびに非特許文献20により報告されている。使用済み培地を定期的に除去すると上述の利点が取り入れられ、さらに培地から他の非タキサン系阻害成分(フェノール化合物のような)を除去することにより二次的生合成の抑制解除に役立つことがある。
【0056】
新しい培地を活発な生合成を行いつつある細胞に補充すると枯渇した必須栄養物質を提供することにより生産を向上することもある。例えば、サルヴィア・ミルチオリザ(Salvia miltiorhiza)の定常期の細胞を刺激してジテルペン中間代謝物であるクリプトタンシノンとフェルギノールを生産させることができたが(非特許文献21)、これは単に培地にスクロースを添加することによって行われた。推測では、定常期における炭素の制限により生合成が停止したものと思われる。本発明において使用する定期的培地交換プロトコルは上述のファクターの何れの結果としても有益であると考えられる。
【0057】
交換される培地の量、交換の頻度、および補充される培地の組成は変えることができるものと了解される。
【0058】
定期的培地交換により生合成および分泌を刺激することができることは連続、半連続またはフェッド−バッチ(fed-batch)モードの効率的な商業的プロセスの設計および操作に対する重要な示唆を与える。
【0059】
光
高等植物にとって光は無傷の植物および細胞培養のいずれにおいても二次的代謝における有力なファクターである。光の強度と波長はともに重要である(非特許文献22)。例えば、フラボノイドおよびアントシアニン生合成は通常高強度連続光により促進されるが、暗所培養体は他の中間代謝物にとって好ましいことがある。培養された細胞の緑化または光合成能力の向上も生産物形成または生産物スペクトルを増加させる。本発明者らの研究は広いバンドの光源および特定の狭いバンドの光源の使用を含む。実施例7.3 に示すように、露光するとタキソールの蓄積が増えるとともに培地中への分泌が増加する。タキソール生産に対する光の刺激効果はタキサンの生合成に対する特異な制御機構が存在することを示唆する。光受容体の性質と光誘導促進の成果学的特徴は未だ明らかでない。
【0060】
プロセス操作のモード
植物細胞培養プロセスに対する操作のモードは栄養物質、細胞および生産物が時間に関して添加または除去される仕方をいう(非特許文献6)。すべての栄養物質が最初に供給され、細胞と生産物を含む培養内容物が培養期間末に収穫されるときは操作のモードは「一段階バッチプロセス」と呼ばれる。バッチ方法が2つの連続する期、成長期と生産期、に分割されこれら2つの期の間で培地が交換されるときは、操作のモードは「二段階バッチプロセス」と呼ばれる。
【0061】
「フェッド−バッチ」操作では、個々の培地添加物と栄養物質は一段階または二段階バッチ培養の間中、定期的または連続的に供給される。
【0062】
バッチ培養の内容物の全部ではないが実質的部分が収穫され、連続的細胞成長および生産のための新しい培地が添加されると、このプロセスは「反復的ドロー・アンド・フィル(引き出しおよび充填)操作」に似るため「半連続的プロセス」と呼ばれる。
【0063】
新しい培地を連続的に供給し、溢れた培地を連続的に除去すると、このプロセスは「連続的」と呼ばれる。細胞がリアクタ内に保持されると、このプロセスは「潅流モード」と呼ばれる。細胞が連続的に溢れた培地とともに除去されると、この連続的プロセスは「ケモスタット」と呼ばれる。
【0064】
これらの種々のプロセス操作のモードは上述のタキソール生産系と適合性を有するものと了解される。
【0065】
実施例
以下の実施例は、本発明を実施する上で用いられる材料と方法をさらに記載したものである。これらの実施例は、本発明を説明するためのものであって、いかなる場合においても本発明を限定するものではない。
【実施例1】
【0066】
カルス誘導
タクスス属植物材料のサンプルを、多数の野生植物および培養植物から採取した。これらの試料を研究室に到着した時に処理するか、もしくは使用するまで4℃で保存した。
【0067】
最初に材料を希釈石鹸溶液で洗浄し、水ですすぎを行った後、クロロックス(Clorox)溶液(1%次亜塩素酸塩、pH7)に10分間浸して表面の滅菌を行った。滅菌条件下、材料を滅菌水を用いて3回すすいだ。次に、100mg/L のアスコルビン酸を含む1%ポリビニルピロリドン(PVP )溶液中で針葉(needles )を切断した。そして、切断端とともに針葉を培地E(第2表参照)に置いた。1枚あたり30ないし40の外植片(explants)を含む培地プレートを、24±1℃、暗所でインキュベートした。これらのプレートの観察を毎日実施し、微生物による汚染が生じているかどうかを調べた。汚染が認められた場合、汚染されていない針葉を新しい培地Eのプレートに移しかえた。培養20日目までに実質的なカルス形成が観察された。カルスを外植体から分離し、第3表に示す種々のカルス成長培地に置いた。例えば、タクスス・シネンシスのカルスは培地D(第2表参照)に移した。この誘導方法は、たいへん効率が良く、低い汚染率で高頻度のカルス誘導が得られ、誘導処理した外植体のうち90%以上にカルスが認められた。同様の方法をうまく用いて、タクスス・ブレビフォーリア、タクスス・カナデンシス、タクスス・カスピダータ、タクスス・バッカータ、タクスス・グロボーサ、タクスス・フロリダーナ、タクスス・ワリチアーナ、タクスス・メディア、およびタクスス・シネンシスの培養を誘導した。
【実施例2】
【0068】
カルスの増殖
カルスを外植片から除去するとともに、除去したカルスを24±1℃、暗所で培養した。10日毎にカルスの健康な部分を新しい培地に移した。この移植頻度は、褐変を抑えることおよびカルスの維持期間を延ばすことにとってたいへん重要であることがわかった。種々のカルスにとって好ましい成長培地および維持培地を第3表にまとめた。
【実施例3】
【0069】
懸濁培養の誘導
カルス材料の生重量1gを、各種に適当な液体培地(第3表参照)を25ml含む125 mlのエルレンマイアーフラスコへ無菌的に移植した。例えば、タクスス・シネンシスに対しては培地Dを用いた。フラスコをシリコンフォームキャップ(ベルコ、エヌジェー(Bellco, NJ))で塞いだ後、回転振とう機に置き、暗所で24±1℃、120rpmの条件で振とうした。約3ないし10日で懸濁培養が形成された。初期段階では、ミラクロスフィルタ(カルバイオケム(Calbiochem))を有するブフナー漏斗によってフラスコの含有物を吸引濾過することにより、培地の交換を行った。細胞の増殖段階では、通常、1 〜2g(生重量)の細胞を新しい培地が25ml入った新しい125ml フラスコへ移し、その後週に一回の割合で植え継ぎを行った。
【実施例4】
【0070】
懸濁細胞の増殖
代表的な種の懸濁培養における典型的な増殖速度および細胞密度を第4表に示す。
【0071】
詳細な例として、タクスス・シネンシスK-1系統のバイオマス(生重量および乾燥重量)の経時的な増加を図1に示す。最大増殖速度は、増殖曲線でもっとも急激にバイオマスが増大した点での傾斜をとって測定した。タクスス・シネンシスの細胞培養における増殖は、最大倍加時間が2.5 日であった。この増殖速度は、タクスス種懸濁培養に関して以前に報告されていたものよりも著しく高い。例えば、クリステンらの報告(特許文献3)によれば、培養3ないし4週間後でバイオマスが5 〜10倍増加するが、これをタクスス・ブレビフォーリアの平均倍加時間として換算すると7ないし12日となる。
【0072】
高密度での培養細胞の能力は、細胞培養プロセスの容積生産性(volumetric productivity)を最大限にする上で重要である。タクスス・ブレビフォーリアの培養において達成された細胞密度が1リットルあたりの乾燥重量で1g以下であったのに対し(特許文献3で発表されたデータから計算)、タクスス・シネンシスの懸濁培養では18日間の増殖で密度が1リットルあたりの乾燥重量で8ないし20gまで達した。
【0073】
細胞の生存率は、0.05%フルオレセインジアセテートを含むアセトン(非特許文献23)によって細胞を染色し、倒立蛍光顕微鏡(オリンパス IMT-2、日本)でもって青色光励起により緑色の蛍光を発する細胞の数をカウントすることによって決定した。細胞生存率は、増殖期の初めから終わりまで90%以上であった。
【0074】
急激な細胞増殖状態にあって高生存率を維持しながら高細胞密度まで細胞を培養するための能力が、タキソールおよびタキソール様化合物を生産するための植物細胞培養プロセスの経済的操作にとって重要な前提必要条件である。
【実施例5】
【0075】
タキソールおよびタキサンの分析
5.1. 酵素結合免疫測定法
タキソール(ハワイ生物工学研究所提供)の酵素結合免疫測定法(ELISA)による分析を大規模の細胞系統のスクリーニングに用いた。この方法は高感度(0.1ng/mL)であるが、ポリクロナール抗体を用いるため、他のタキサンとのクロス反応性が観察される。分画コレクションを有する予備的な(分析規模の)高速液体クロマトグラフィ(HPLC)は、未同定のタキサンと同様に、10−デアセチルタキソール、7キシロシル−10−デアセチルタキソール、セファロマンニン、10−デアセチル−7−エピタキソール、7エピタキソールとの交差反応性を示した。そのようなクロス反応性にもかかわらず、この方法はタキサン生産物の検出のために非常に有益であると見出され、多数の細胞を迅速にスクリーニングすることを可能にした。タキサンの明白な生成を示す細胞抽出をその後、以下に概要を示すHPLC手順を用いて詳細に分析した。
【0076】
5.2.タキソールおよび関連するタキサンの抽出
上清からのタキサンの抽出を、培地中の濃度に依存する2つの方法によって実行した。液体培地中にタキサンが十分な量存在するとき、サンプルを非常に手早くかつ効率的に準備した。培地(2mL)を完全に(真空で)乾燥させ、計量した量のメタノール(0.5−2.0mL)を加えた。サンプルの完全な溶解または分散を達成するまで、この混合物を超音波的に撹拌した。HPLC分析前に遠心分離によって固形物を除去した。検出レベルが0.1mg/Lよりかなり下で、量的な回収は、1mg/Lレベルで得られた。
【0077】
培養上清中のタキサン濃度が低いときは、その培地を、メチレンクロライドとイソプロピルアルコール(IPA)との混合物(体積比で9:1)で3度抽出した。抽出ごとの混合物の量は同一とした。乾燥性となるまで有機層を減少し、計量した量のメタノール(50−250mL)中において組成を再構成した。マルチ抽出では、典型的にタキソール、セファロマンニンおよびバッカチンIIIの90−95%を0.6mg/Lレベルで回収した。
【0078】
細胞材料を、新たに採取した細胞を−5℃で冷凍し、続いて真空乾燥し、50サイクルのメタノールソックスレーによって抽出を行った。タキサンの70〜80%を、10−15%測定可能な分解物として回収した。固形培地およびカルスの抽出を、細胞の抽出と同様に達成したが、最終的なメタノール抽出物のメチレンクロライド/IPA混合物と水への分配を常に行った。
【0079】
5.3.高速液体クロマトグラフィ法
分析的な高速液体クロマトグラフィ(HPLC)を、CM3500/CM3200 ポンプ、CM4100可変量自動サンプラおよび総合周辺486 パーソナルコンピュータに連結したSM50000 フォトダイオードアレイ検出器からなるLDC 分析二値勾配高圧混合システムを備えた高炭素ロード(load)ジフェニルカラム(Supelco製、5mM、4.6mm×25cm)で行った。カラム温度を、Eldex CH150 カラムオーブンで35℃に調整した。タクススの定量的なHPLC分析を、次のような二値勾配溶出の略表を用いて達成した。
【0080】
時間 %溶出液A %溶出液B 流速
(mg/分)
0 75 25 1
40 35 65 1
42 25 75 1
47 25 75 1
50 75 25 1
溶出液Aは、0.015mM のKH2PO4をトリフルオロ酢酸でpH3.5に調製したものであり、溶出液Bはアセトニトリルである。
【0081】
上記クロマトグラフィ法としては、トリフルオロ酢酸を含有するリン酸緩衝液および長い勾配が用いられてきた以外は幾つかの公知の方法(非特許文献24)に似た方法を用いた。これらの違いは、混合物からのタキソールおよび他のタキサンの解像度を明白に改良するものである。タキサンに関して観察された相対的な保持時間は以下に示される。タキソールは、用いられるカラムおよびハードウエアに依存して31分と33分との間に溶出する。
【0082】
【表1】

【0083】
タキソール、セファロマンニンおよびバッカチンIIIの保持時間を、国立ガン研究所から入手した真正サンプルを用いて決定した。上記に掲げた他のタキサンの保持時間を、ハウザー化学(Hauser Chemical (Boulder CO))によって提供された分析用標準品の保持時間と比較した。既知のタキサンの同定は、保持時間および紫外線スペクトル比較を基礎とした。タキソール、セファロマンニンおよびバッカチンIIIの定量は、真正材料から決定された応答因子を基礎とした。10−デアセチルバッカチンIIIの定量は、バッカチンIIIに関して決定された応答因子を用いて行われた。残りのタキソール誘導体の定量は、タキソールに関して測定された応答因子を基礎とした。
【0084】
各標準品(10mL)を注入し(初期に標準品を注入した後に3または4のサンプルを注入し)、上記3成分の各々の領域を合わせた。各成分に関する応答因子はデータの線形最小二乗分析によって得られた。10mLの各サンプルを注入し、注入ごとの量を標準データの回帰曲線を基礎として算出した。これらの結果をリッター当たりまたは乾燥重量%の量に換算した。第4図及び第5図は、上清サンプルの典型的なクロマトグラムを示す。
【0085】
5.4.タキソールのMS/MS確認
細胞培養の上清中のタキソールの同定を、MS/MS 法(図7〜図10おいて示した)を用いて確認した。その方法は、フローインジェクションをイオンスプレイ大気圧での化学的イオン化に組み合わせるものである。図7〜図10に掲げられたデータを得るために用いられた手順の詳細は次のようである。マススペクトロメータ:大気圧イオン化源を備えたSciex API 3のトリプル四重極質量分析計を用いた。窒素をカーテンガスとして用い、アルゴンをCID スペクトラのための衝突ガスとして用いた。インタフェース:イオン蒸発イオン化(Ion Evaporation Ionization (Electrospray))によってイオンを生産するイオンスプレイインタフェースを用いた。ゼロエア(Zero air)を霧吹きガスとして用いた。LCポンプ:5μL/分で操作するABI 140Bの二重シリンジポンプを用いた。溶媒:2mM NH4OAc、+0.1 %蟻酸を含む50/50 のアセトニトリル/H2O を用いた。注入量:5μL 。フローインジェクション分析によってとられた全スペクトラ。この方法は、細胞培養サンプルにおけるタキソールの存在のための明確な確認を与え、HPLCによる結果ときわめてよく一致する定量結果を与えた。
【実施例6】
【0086】
種々の種(species)によるタキソール生産
種々のタクスス属種の細胞培養によって生産されたタキソールは第5表に要約されている。カルスを各種ごとに特定の固体培地上に置き、20日間、暗所で培養した。細胞および培地を乾燥し、共にメタノール抽出し、上記に示したELISAまたはHPLCのいずれかの方法によって検定した。タクスス・シネンシス(Taxus chinensis)培養で得られた結果を実施例7および8にさらに詳述する。
【実施例7】
【0087】
7.1.成長培地中での生産
タキソールおよび同族のタキサンの生産は、成長培地A中に送り込まれた最初の2日間の内に始まった。観察された最大タキソールは、15日目のもので、8.81μg/フラスコであり、これは0.44mg/Lのタキソールに相当するものであった。その46.1%はその細胞外の培地中に存在した。15日目において、タキサンの合計濃度は、72.87μg/フラスコまたは3.6mg/Lであり、その58.6%はその細胞外の培地中に存在した。細胞の生育率は蛍光染色法による測定で常に90%以上であり(実施例4)、これは細胞外のタキソールおよびタキサンの存在は細胞溶解が原因というよりはむしろ分泌によるものであったことを示唆している。細胞がタキソールおよびタキサンを分泌する能力は、連続運転の重要な局面となるものである。
【0088】
7.2.生産性促進のための培地交換
タキソールおよび合計タキサンの生産性における大幅な改良は、9日目において成長培地Aを無菌状態で吸い出し、新しい培地と交換して、12日目にこの手順を繰り返すことによって、得られたものである。この実験は15日目に中止し、その結果は図2に示した。培地交換による生産性の大幅な増加は、第6表にまとめられている。生産されたタキソールおよびタキサンの合計量は、培地の交換をした場合では、培地交換をしない場合に比較して、約4.6 倍高かった。重要なことには、培地交換処理をしない場合に比較して、約4.9 倍高いタキソール、および約5.9倍高い合計タキサンが、細胞外培地内において、回収された。
【0089】
タキソールおよび合計タキサン生産性を大幅に促進し、そして、さらに細胞外の生産物蓄積を引き起こす能力は、バイオマスを再使用し、簡略化された下流側の精製(downstream purification)を含む効果的な連続プロセスの操作にとって重要である。
【0090】
7.3.成長培地中のタキサン生産における光の効果
光は、光合成にばかりでなく、植物細胞培養物内での二次代謝の様々な局面においても、重要な役割を果たすものとして、知られている(非特許文献22)。実施例4、7.1 、および7.2 に記載された実験は、暗所にて処理されたが、タクスス・シネンシス培養物の光に対する反応をここに説明する。
【0091】
タクスス・シネンシス系統K-1の7日経過後の細胞の生重量1グラムを、125mlのエルレンマイアーフラスコ内の25ml成長培地A(第2表参照)中に接種し、回転数120rpmの回転振とう機上で24±1℃で培養した。同じ二つのフラスコの一方を暗所に置き、他方を3フィートの距離にある標準GroLuxランプの点灯下に置いた。このランプの特性は図3に示した。結果は第7表に示した。
【0092】
培養物を光に曝しても、合計タキサンのレベルまたは細胞外蓄積の量に影響しなかった。しかし、タキサンのプロフィールには、前記の二つの処理フラスコにおいてはかなりな変化があった。例えば、光の中で培養した細胞は、暗所で培養した細胞のより2.8倍高いタキソールを生産した。また、細胞外タキソールの割合は、暗所培養におけるものより、かなり高いものであった(76%対56%)。したがって、光を用いた培養は、特に固有スペクトル特性で、タキソール生産の細胞培養プロセスにおいて、非常に有益となろう。
【実施例8】
【0093】
エリシター(elicitors)
エリシターという用語は、植物細胞培養物に添加されると二次代謝の増加をもたらす、生物学的な(または生物の)および非生物学的な(または非生物の)由来(origin)の化合物に対して用いられる。
【0094】
数多くのエリシターが有益であると判明しているが、ここでは、代表的な説明可能な例を、すなわち、グルタミン酸キトサン(chitosan glutamate)を詳しく説明する。以前にキトサンがいくつかの植物細胞培養物システムにおけるエリシターとして試みられたが、褐変および生存率の低下などの有毒反応が同時に生じて、その実用を不可能にしている(非特許文献25)。実に、このような毒性側の反応は、文献中に報告されている多くのエリシターの一般的な欠点である。毒性側の作用を回避しながら、グルタミン酸キトサンなどの化学修飾されたキトサンをタキソールおよびタクススの生合成を誘発するために特に用いることは、新規な研究方法である。
【0095】
7から8日間、培地Dの中で成長したタクスス・シネンシスK-1系統の懸濁液を、ミラクロス(Calbiochem社)フィルターが取り付けられた殺菌されたバックナー漏斗を無菌状態で用いて、吸引濾過した。生重量が2gの細胞を無菌状態で125mlのエルレンマイアーフラスコ内の25mlの培地C(第2表参照)中に転送した。グルタミン酸キトサンの0.05%溶液を新たに調製し、0.22ミクロンのカートリッジフィルターにより濾過滅菌した。この溶液の825 μLを実験の開始時に前記フラスコに添加した。この溶液量は、細胞の乾燥重量1グラム当たり165mgのエリシターのレベルに対応している。このフラスコを暗所内の回転数110rpmの回転振とう機上で24±1℃で培養した。このフラスコから15日目に破壊的に試料採取し、成長の観察、細胞と培地の色および細胞の生存率を記録した。凍結乾燥試料を、実施例5で説明したように、タキソールおよびタキサンを得るために、メタノール抽出し、HPLCにより分析した。この実験の結果を第8表に示す。
【0096】
エリシター処理では、非処理の場合より細胞当たりの合計タキサン生産において幾分かの改善が得られた(タキサンの乾燥重量で、0.42%に対して0.53%)。エリシターが非毒性であることは、両方の処理において観察された高い生存率(75〜80%)から明らかである。実際に、エリシター処理なしの場合に比べたエリシター処理での乾燥重量の増加は、繰り返し観察された(乾燥重量で、10.1g/Lに対して14.2g/L)。より高い細胞密度では、合計タキサンの力価で、例えば、エリシター処理しない場合における42.4mg/Lに対して、エリシター処理では75.8mg/Lのように、エリシター処理の場合の方が、1.8 倍大きい結果となった。
【0097】
エリシター処理では、タキソールの生合成においては、細胞当たり(タキソールの乾燥重量で、0.054 %に対して0.098 %で1.8 倍の増加)および、力価の比較(5.4mg/Lに対して13.9mg/Lで2.6 倍の増加)の両方とも増加する結果となった。分泌量については、エリシター処理しない場合に比べてエリシター処理の方が高かった(細胞外生産で、72%に対して85%)。
【0098】
ここで説明したエリシター処理では、タキソール生産の増加、より好適な生産プロフィール、生産物分泌の促進および高い細胞生存率の維持が、得られる結果となった。これらの生産特性は、タキソール生産における細胞培養工程の大幅な改良がなされたことを、表している。
【実施例9】
【0099】
生産培地の開発
実施例6に記載したレベルを越えるようなタキソール生産性の増大を得るために、栄養レベルを操作して特別な「生産培地(production media)」を処方した。培地Dで増殖する7ないし8日経過したタクスス・シネンシス細胞系統K-1の懸濁液をミラクロスフィルタ(カルバイオケム(Calbiochem))が設けられた滅菌ブフナー漏斗を用いて無菌的に吸引濾過した。生重量が500mgの細胞を無菌的に5mlの生産培地BおよびC(第2表参照)に移した。容器を、暗所、24±1℃、110rpmの条件でもって回転振とう機により18、25、および42日間のいろいろな期間にわたってインキュベーションした。
【0100】
このような処理を施したものに対して破壊的サンプリングを実施し、増殖、細胞および培地の色、および細胞の生存率を観察記録した。凍結乾燥試料を、実施例5に記載したようにメタノール処理してタキソールおよびタキサンの抽出を行い、HPLCでもって分析した。
【0101】
9.1. 18日間培養の結果
タクスス・シネンシス細胞培養は、顕著なレベルのタキサンおよびタキソールを生産することによって修正培地組成物に反応した。これらのデータを第9表にまとめ、また試料のクロマトグラムは図4及び図5に示した。培地Bでは、精製タキソール24.1mg/Lとともに全体で99.8mg/Lのタキサンが生産された。培地Cでは、タキソール21.3mg/Lとともに合計で110mg/リットルのタキサンが生産された。乾燥重量に換算すると、細胞が生産したタキソールの乾燥重量は、培地Bで0.18%、また培地Cで0.065%であった。
【0102】
9.2.延長培養
培養期間を25および42日間として、タクスス・シネンシス細胞(K-1系統)を培地Cで培養した場合のタキソールおよびタキサン生産を調べた。その結果を、第5表にまとめた。以下のような重要な観察値を要約することができる。
(i) タクスス懸濁培養によって顕著なレベルのタキソールおよび他のタキサンが生産可能である。42日目で、乾燥重量で0.32%のタキソールおよび0.62%の合計タキサンを有する最も高い蓄積が観察され、これは、最終培地容積に対して153mg/Lタキソールおよび295mg/L合計タキサンの力価に相当する。図7〜図10に示すように、タンデムマススペクトロメトリーによるこの試料の分析によってタキソールの存在が確認された。MS/MS による定量は、HPLCとたいへんよく一致した。
(ii) 25日目と42日目とのあいだの17日間にわたるタキソール生合成速度は、この期間において生産が直線的に行われたと仮定した場合、約7.6mgタキソール/L/日であった。この速度は、最初の25日間の生産速度によりも顕著に高い。25日目と42日目とのあいだにおける全タキサン生合成速度は、12.3mg/L/日であった。
(iii) 生産培地処方によって、実施例7に記載したような急増殖条件の場合と比較して、特定のタキソール含有量を45倍まで増加させることができる。
(iv) 望ましくないタキサンの生産を最小限にしつつ、生合成が要求最終産物タキソールに集中するように、生産物スペクトルを操作することができる。例えば、タキソールがタキサン全体のうちたったの12.2%しか占めていない成長培地(実施例7.1参照)と比較して、タキソールがタキサン全体を占める割合が25日目では28%であり、42日目では52%であった。生産物プロフィールを操作するこのような能力は、下流側精製および生産物純度に関連した制御的問題に対して重大な影響を及ぼすであろう。例えば、タキサンの副産物であるセファロマンニンの生産を抑制する能力は、樹皮組織からのタキソール精製と比較して下流側の精製を大いに単純化することができた。
(v) 大量のタキソール(42日目で87%)および他のタキサンを分泌するために、タクスス細胞培養が誘導されてきた。細胞溶解によるよりもむしろ分泌による細胞外タキソールおよびタキサンの存在がいくつかの別個の観察によって確証される。すなわち、(a) 25目から45日目の間に連続した生合成が起こる。このことは細胞が生存し、かつ活動的であることを示唆している。別個の観察によれば、生産培地での培養18日目以降に70%を上回る生存率が認められた。(b) 異なるタキサンが異なる比率で分泌された。もし、細胞が溶解した場合、培地中の比率は異なるタキサンで類似すると考えられる。
(vi) 増殖し、かつタキソールを細胞外環境へ大量かつ高率に生産するタクスス細胞系統の能力は、特に注目すべき価値がある。
(vii) それらの結果が得られたタクスス細胞系統は、高密度になるまで急激に増殖することも可能である。また、急増殖条件下で20世代後に報告された生産能を発現する。このことは、それの安定性および商業的潜在能力を証明するものである。
【0103】
本願に記載した条件下でタクスス・シネンシスの細胞系統によって生産されるタキソールおよびタキサンのレベルは、以前報告されたものよりも高く、35ないし150倍である。例えば、クリステンら(特許文献3)は、培養2ないし4週間後のタクスス・ブレビフォーリアの懸濁培養によって、1ないし3mg/Lのタキソールが生産されると報告している。また、Wickeramesinhe and Arteca(1991)は、タクスス・メディアの細胞培養で乾燥重量0.009%のタキソールが生産されることを報告している。
【0104】
要約すると、われわれのデータは、タクスス・シネンシスの培養を注意深く誘導し、かつ選択することによって、また成長培地を特別に処方することによって、細胞を高密度に達するまで急激に増殖させることができることを示している。このような細胞を生産培地条件に移した場合、細胞は高生存率を維持する一方で顕著な濃度からなるタキソールおよび他のタキサンを期間を延ばして生合成および分泌することができる。定期的な培地の交換、生産培地に光およびエリシターを取り込むことによって、相乗的な生産性増大が得られる。これらの特性は、組織培養技術を用いたタキソールおよびタキサン生産のための効率的な商業的プロセスにとって決定的な前提必要条件である。
【0105】
【表2】

【0106】
【表3】

【0107】
【表4】

【0108】
【表5】

【0109】
【表6】

【0110】
【表7】

【0111】
【表8】

【0112】
【表9】

【0113】
【表10】

【0114】
【表11】

【0115】
【表12】

【0116】
【表13】

【0117】
【表14】

【0118】
【表15】

【図面の簡単な説明】
【0119】
【図1】培地Aにおける典型的なバッチ成長サイクルに対するタクスス・シネンシス懸濁培養系統K-1のバイオマス増加を示す。誤差バーは2つのフラスコから測定した標準偏差を表わす。
【図2】15日間の実験において第9日と第12日に行う培地交換のタキソール(A)および総タキサン(B)の生産性への効果を示す。各ボックス内の数字は生産物が生産される時間間隔(日数)を表す。セル内のボックスの塗りつぶし部分は実験開始時の細胞接種材料の中に存在するタキソールまたは総タキサンを表す。処理はすべて二重に行った。第2表に示すようにタクスス・シネンシス懸濁培養細胞系統K-1を培地Aとともに使用した。
【図3】実施例7.3 で使用した標準グローラックスランプ(GTE Sylvania, Danvers, MA )のスペクトル特性を示す。
【図4】タクスス・シネンシス細胞懸濁液K-1におけるタキサン生産を示す。10分ないし40分のクロマトグラムの部分を示す。選択されたタキサンのピークのダイオード・アレイ・スキャンは特徴的なタキサンのUV吸収スペクトルを示し、ピークは227nm である。
【図5】タクスス・シネンシス細胞懸濁液K-1におけるタキサン生産を示す。10分ないし40分のクロマトグラムの部分を示す。選択されたタキサンのピークのダイオード・アレイ・スキャンは特徴的なタキサンのUV吸収スペクトルを示し、ピークは227nm である。
【図6】タクスス・シネンシス細胞系統K-1を培地C中で長期間培養して生産されるタキソールとタキサンを示す。上方のパネルは既知および未知のタキサンについてのデータを表にしたものであり、下方のパネルは25日ないし42日の期間におけるタキソールおよびタキサン生産の増加量を表したものである。
【図7】細胞培養上清中のタキソールのMS/MS 確認を示す。パネルAは真正タキソールのイオンスプレーAPCIマススペクトルを示す。
【図8】細胞培養上清中のタキソールのMS/MS 確認を示す。パネルBは親ピークの娘イオンスペクトルを示す(m/z871=タキソール+NN4+)。
【図9】細胞培養上清中のタキソールのMS/MS 確認を示す。パネルCは粗細胞培養抽出物からのイオンスプレーAPCIマススペクトルを表し、タキソールのm/z 854および871 特徴を示す。
【図10】細胞培養上清中のタキソールのMS/MS 確認を示す。パネルDは対応する娘スペクトルm/z 871を示し、細胞培養上清中にタキソールが存在することの明瞭な証拠を提示している。
【特許請求の範囲】
【請求項1】
タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法であって、
(a)培養細胞の迅速な成長に好適な第一の栄養培地中で、タクスス・シネンシスのカルス組織由来の細胞を、懸濁細胞培養で培養する工程、
(b)第一の培地とは分離されて、独立した第二の栄養培地中でタキソール及び他のタキサンを生産する工程であって、前記第二の培地は、培養細胞中でのタキソール及びタキサンの生合成に適しており、前記第二の培地はエリシターを含む工程、および、
(c)前記細胞および/または前記細胞培養の前記生産培地からタキソール及び他のタキサンを回収する工程
を含むことを特徴とする方法。
【請求項2】
前記エリシターがメチルジャスモネートであることを特徴とする請求項1に記載の方法。
【請求項3】
タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法であって、
(a)培養細胞の迅速な成長に好適な第一の栄養培地中で、タクスス・シネンシスのカルス組織由来の細胞を、懸濁細胞培養で培養する工程、
(b)第一の培地とは分離されて、独立した第二の栄養培地中でタキソール及び他のタキサンを生産する工程であって、前記第二の培地は、培養細胞中でのタキソール及びタキサンの生合成に適しており、前記第二の培地は硝酸銀を含む工程、および、
(c)前記細胞および/または前記細胞培養の前記生産培地からタキソール及び他のタキサンを回収する工程
を含むことを特徴とする方法。
【請求項4】
タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法であって、
(a)培養細胞の迅速な成長に好適な第一の栄養培地中で、タクスス・シネンシスのカルス組織由来の細胞を、懸濁細胞培養で培養する工程、
(b)第一の培地とは分離されて、独立した第二の栄養培地中でタキソール及び他のタキサンを生産する工程であって、前記第二の培地は、培養細胞中でのタキソール及びタキサンの生合成に適しており、前記第二の培地はフェニルアラニンを含む工程、および、
(c)前記細胞および/または前記細胞培養の前記生産培地からタキソール及び他のタキサンを回収する工程
を含むことを特徴とする方法。
【請求項5】
さらに定期的な栄養培地の交換を含むことを特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項6】
さらに定期的なタキソール及びタキサンの除去を含むことを特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項7】
二段階バッチ法、フェッド−バッチ法、半連続的方法、連続的方法または、それらの変形方法であることをと特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項8】
グルタミンまたは蛋白質の加水分解物であることを特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項9】
一または複数の栄養培地が、ピクロラム、β−ナフタレン酢酸、N6―ベンジルアデニン、カイネチンおよびジメチルアリルアミノプリンからなる群から選ばれた植物ホルモンを含むことを特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項10】
請求項1の方法により得られたタキソール及び他のタキサンを用いて癌を治療する方法。
【請求項1】
タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法であって、
(a)培養細胞の迅速な成長に好適な第一の栄養培地中で、タクスス・シネンシスのカルス組織由来の細胞を、懸濁細胞培養で培養する工程、
(b)第一の培地とは分離されて、独立した第二の栄養培地中でタキソール及び他のタキサンを生産する工程であって、前記第二の培地は、培養細胞中でのタキソール及びタキサンの生合成に適しており、前記第二の培地はエリシターを含む工程、および、
(c)前記細胞および/または前記細胞培養の前記生産培地からタキソール及び他のタキサンを回収する工程
を含むことを特徴とする方法。
【請求項2】
前記エリシターがメチルジャスモネートであることを特徴とする請求項1に記載の方法。
【請求項3】
タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法であって、
(a)培養細胞の迅速な成長に好適な第一の栄養培地中で、タクスス・シネンシスのカルス組織由来の細胞を、懸濁細胞培養で培養する工程、
(b)第一の培地とは分離されて、独立した第二の栄養培地中でタキソール及び他のタキサンを生産する工程であって、前記第二の培地は、培養細胞中でのタキソール及びタキサンの生合成に適しており、前記第二の培地は硝酸銀を含む工程、および、
(c)前記細胞および/または前記細胞培養の前記生産培地からタキソール及び他のタキサンを回収する工程
を含むことを特徴とする方法。
【請求項4】
タクスス・シネンシスの細胞培養からタキソール及び他のタキサンの合計の収量および回収を増強させる方法であって、
(a)培養細胞の迅速な成長に好適な第一の栄養培地中で、タクスス・シネンシスのカルス組織由来の細胞を、懸濁細胞培養で培養する工程、
(b)第一の培地とは分離されて、独立した第二の栄養培地中でタキソール及び他のタキサンを生産する工程であって、前記第二の培地は、培養細胞中でのタキソール及びタキサンの生合成に適しており、前記第二の培地はフェニルアラニンを含む工程、および、
(c)前記細胞および/または前記細胞培養の前記生産培地からタキソール及び他のタキサンを回収する工程
を含むことを特徴とする方法。
【請求項5】
さらに定期的な栄養培地の交換を含むことを特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項6】
さらに定期的なタキソール及びタキサンの除去を含むことを特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項7】
二段階バッチ法、フェッド−バッチ法、半連続的方法、連続的方法または、それらの変形方法であることをと特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項8】
グルタミンまたは蛋白質の加水分解物であることを特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項9】
一または複数の栄養培地が、ピクロラム、β−ナフタレン酢酸、N6―ベンジルアデニン、カイネチンおよびジメチルアリルアミノプリンからなる群から選ばれた植物ホルモンを含むことを特徴とする請求項1から4のいずれか一項に記載の方法。
【請求項10】
請求項1の方法により得られたタキソール及び他のタキサンを用いて癌を治療する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2008−131955(P2008−131955A)
【公開日】平成20年6月12日(2008.6.12)
【国際特許分類】
【出願番号】特願2008−31160(P2008−31160)
【出願日】平成20年2月12日(2008.2.12)
【分割の表示】特願2005−262536(P2005−262536)の分割
【原出願日】平成5年2月22日(1993.2.22)
【出願人】(503289975)ディー・エフ・ビー バイオテック インコーポレイテッド (2)
【Fターム(参考)】
【公開日】平成20年6月12日(2008.6.12)
【国際特許分類】
【出願日】平成20年2月12日(2008.2.12)
【分割の表示】特願2005−262536(P2005−262536)の分割
【原出願日】平成5年2月22日(1993.2.22)
【出願人】(503289975)ディー・エフ・ビー バイオテック インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

