タモギタケ抽出物を有効成分とする抗カンジダ菌剤ならびにカンジダ症予防および/または治療剤
【課題】 菌の増殖抑制効果を備えるなどの優れた抗菌活性を有し、かつ、食用キノコであるタモギタケ由来であることから高い安全性を有する抗菌剤、ヒトにおいて各種ヒトβディフェンシンの産生を促進することができるβディフェンシン産生促進剤、ならびにカンジダ症予防および/または治療剤を提供する。
【解決手段】 タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする。
【解決手段】 タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、タモギタケ抽出物を有効成分とする抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤に関し、より詳細には、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドの少なくともいずれかを有効成分とする、抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤に関する。
【背景技術】
【0002】
タモギタケ(Pleurotus cornucopiae var. citrinopileatus)はキシメジ科ヒラタケ属に属するキノコである。タモギタケは主に北海道や東北において自生し、食用に用いられており、近年は人工栽培品も販売されている。
【0003】
タモギタケは食品産業、健康産業、化粧品産業、医薬品産業などにおいて有用な種々の成分を有することが知られており、例えば、特許文献1にはタモギタケの水抽出物を有効成分とする抗菌剤が、特許文献2および特許文献3には本発明者らによりタモギタケの熱水抽出物を有効成分とする抗腫瘍性免疫賦活剤ならびにタモギタケ由来のセラミドを有効成分とする皮膚炎治療剤および皮膚保湿剤が、特許文献4にはタモギタケ由来のエルゴチオネインを有効成分とする抗酸化剤、チロシナーゼ活性阻害剤、リパーゼ活性阻害剤、5α−レダクターゼ活性阻害剤、抗老化剤および抗メタボリックシンドローム剤が、特許文献5にはタモギタケ由来のエルゴステロールパーオキサイドを有効成分とする食品用の変色防止・酸化防止剤がそれぞれ開示されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2007−1961号
【特許文献2】国際公開WO2006/038527号パンフレット
【特許文献3】特開2007−308394号
【特許文献4】特開2009−126863号
【特許文献5】特開2009−183266号
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、特許文献1に開示されているタモギタケの水抽出物を有効成分とする抗菌剤は、培養培地において菌の増殖を抑制することが示されているに過ぎず、動物個体で菌の増殖を抑制することは示されていない。また、特許文献2〜特許文献5に記載のタモギタケ熱水抽出物、タモギタケ由来のセラミド、タモギタケ由来のエルゴチオネインおよびタモギタケ由来のエルゴステロールパーオキサイドはいずれも、抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤として用いられているものではない。
【0006】
本発明は、上述の問題点を解決するためになされたものであって、菌の増殖抑制効果を備えるなどの優れた抗菌活性を有し、かつ、食用キノコであるタモギタケ由来であることから高い安全性を有する抗菌剤、ヒトにおいて各種ヒトβディフェンシンの産生を促進することができるβディフェンシン産生促進剤、ならびにカンジダ症予防および/または治療剤を提供することを目的としている。
【課題を解決するための手段】
【0007】
本発明者らは、鋭意研究の結果、タモギタケの熱水抽出物が培養培地および口腔カンジダ症モデルマウスの口腔内においてカンジダ菌の増殖を抑制すること、ならびにタモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドがβディフェンシンの産生を促進することを見出し、下記の各発明を完成した。
【0008】
(1)タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする抗菌剤。
【0009】
(2)水系溶媒抽出物が熱水抽出物である、(1)に記載の抗菌剤。
【0010】
(3)タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とするβディフェンシン産生促進剤。
【0011】
(4)βディフェンシンがヒトβディフェンシン−1、ヒトβディフェンシン−2およびヒトβディフェンシン−3からなる群から選択される1または2以上のβディフェンシンである、(3)に記載のβディフェンシン産生促進剤。
【0012】
(5)水系溶媒抽出物が熱水抽出物である、(3)または(4)に記載のβディフェンシン産生促進剤。
【0013】
(6)タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とするカンジダ症予防および/または治療剤。
【0014】
(7)口腔乾燥症の患者に用いる、(6)に記載のカンジダ症予防および/または治療剤。
【0015】
(8)水系溶媒抽出物が熱水抽出物である、(6)または(7)に記載のカンジダ症予防および/または治療剤。
【発明の効果】
【0016】
本発明によれば、菌の増殖抑制効果を備えるなどの優れた抗菌活性を有し、かつ、食用キノコであるタモギタケ由来であることから高い安全性を有する抗菌剤、ヒトにおいて各種ヒトβディフェンシンの産生を促進することができるβディフェンシン産生促進剤、ならびにカンジダ症予防および/または治療剤を得ることができる。
【図面の簡単な説明】
【0017】
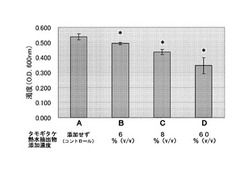
【図1】タモギタケ熱水抽出物を添加した培地でカンジダ菌を培養した後、培地の濁度を測定した結果を示す図である。縦軸は濁度(600nmにおける吸光度)を、横軸はタモギタケ熱水抽出物の添加濃度を変えた各サンプルを示す。
【図2】タモギタケ熱水抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ熱水抽出物の添加濃度を変えた各サンプルを示す。
【図3】タモギタケ熱水抽出物の濾液、濾物およびタモギタケ熱水抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸は交換培地にタモギタケ熱水抽出物の濾液、濾物およびタモギタケ熱水抽出物を添加した各サンプルを示す。
【図4】タモギタケ水抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ水抽出物の添加濃度を変えた各サンプルを示す。
【図5】タモギタケ酸性水系溶媒抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ酸性水系溶媒抽出物の添加濃度を変えた各サンプルを示す。
【図6】タモギタケ塩基性水系溶媒抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ塩基性水系溶媒抽出物の添加濃度を変えた各サンプルを示す。
【図7】タモギタケ由来エルゴチオネインを添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ由来エルゴチオネインの添加濃度を変えた各サンプルを示す。
【図8】タモギタケ由来エルゴステロールパーオキサイドを添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ由来エルゴステロールパーオキサイドの添加濃度を変えた各サンプルを示す。
【図9】タモギタケ由来グルコシルセラミドを添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ由来グルコシルセラミドの添加濃度を変えた各サンプルを示す。
【図10】タモギタケ熱水抽出物を添加した培地で24時間培養したNHEK細胞における、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ熱水抽出物の添加濃度を変えた各サンプルを示す。
【図11】タモギタケ熱水抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ熱水抽出物の添加濃度を変えた各サンプルを示す。
【図12】タモギタケ熱水抽出物の濾液、濾物およびタモギタケ熱水抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸は交換培地にタモギタケ熱水抽出物の濾液、濾物およびタモギタケ熱水抽出物を添加した各サンプルを示す。
【図13】タモギタケ熱水抽出物の超音波処理物を添加した培地で2時間培養したHaCaT細胞における、hBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ熱水抽出物の超音波処理物の添加濃度を変えた各サンプルを示す。
【図14】タモギタケ水抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ水抽出物の添加濃度を変えた各サンプルを示す。
【図15】タモギタケ酸性水系溶媒抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ酸性水系溶媒抽出物の添加濃度を変えた各サンプルを示す。
【図16】タモギタケ塩基性水系溶媒抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ塩基性水系溶媒抽出物の添加濃度を変えた各サンプルを示す。
【図17】タモギタケ由来エルゴチオネインを添加した培地で2時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ由来エルゴチオネインの添加濃度を変えた各サンプルを示す。
【図18】スエヒロタケ由来βグルカンまたはマイコプラズマ由来ジアシルリポペプチド(FSL−1)と共にタモギタケ熱水抽出物を添加した培地で2時間培養したNHEK細胞における、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸は交換培地にスエヒロタケ由来βグルカン、大麦由来βグルカン、FSL−1、タモギタケ熱水抽出物、タモギタケ熱水抽出物+スエヒロタケ由来βグルカン、FSL−1+スエヒロタケ由来βグルカンおよびタモギタケ熱水抽出物+FSL−1を添加した各サンプルを示す。
【図19】タモギタケ熱水抽出物を含有する口腔用ジェルを投与した口腔カンジダ症モデルマウスの舌における、カンジダ菌の生菌数を示すグラフである。縦軸はカンジダ菌の生菌数を、横軸は口腔用ジェルを投与しなかった群(コントロール群)および口腔用ジェルを投与した群(ジェル投与群)を示す。
【発明を実施するための形態】
【0018】
以下、本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤について詳細に説明する。本発明に係る抗菌剤は、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする。
【0019】
本発明において、タモギタケは天然に自生しているものでもよく、人工栽培されたものでもよい。また、生のタモギタケでもよく、乾燥させたものや、乾燥させた上で粉末にしたものなど、採取した後に加工を施されたものでもよい。
【0020】
本発明において、タモギタケの水系溶媒抽出物とは、水系溶媒によりタモギタケから抽出された成分を含有する液体状、半固体状または固体状の物質、もしくはこれらの物質から選択される1または2以上の物質の混合物をいう。ここで、本発明において、水系溶媒とは極性溶媒を主体とした溶媒であれば特に限定されず、1種類の溶媒からなるものでもよく、2種類以上の溶媒を混合したものでもよい。そのような極性溶媒としては、例えば、水、メタノール、エタノール、酢酸、ギ酸、1−ブタノール、1−プロパノール、2−プロパノールなどを挙げることができるが、水が好ましい。
【0021】
また、本発明において、水系溶媒は、水または水系溶媒に予め適当な溶質を混合または溶解させて水系溶媒としてもよく、そのような水系溶媒としては、例えば、水にクエン酸を混合または溶解させたもの、水に重曹を混合または溶解させたもの、食塩を酢酸に混合または溶解させたものなどを挙げることができるが、クエン酸水溶液、重曹水溶液および食塩酢酸溶液が好ましい。
【0022】
また、本発明において、水系溶媒は、酸性、中性および塩基性のいずれでもよく、水系溶媒の温度もまた、その機能が損なわれない限りにおいて特に限定されず、低温の他、常温、高温でもよい。なお、本発明においては、熱水を好適な水系溶媒として用いることができる。
【0023】
本発明において、タモギタケの水系溶媒抽出物は定法に従い製造することができ、例えば、水系溶媒にタモギタケを投入し、加熱または粉砕・攪拌した後、濾過などにより固液分離し、液体成分を回収することにより製造することができる。製造されたタモギタケの水系溶媒抽出物は、さらに、限外濾過や超音波処理などを行ってもよく、そのような限外濾過物(濾液および濾物)や超音波処理物などもまた、タモギタケの水系溶媒抽出物であり、本発明に包含される。
【0024】
本発明において、タモギタケから抽出されるグルコシルセラミドは、当業者が適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、茹でたタモギタケを乾燥させ、粉砕して粉末としたものをエタノールに入れて加熱・抽出し、得られた抽出液をNaOH水溶液によりケン化した後、希塩酸によりpHを調整し、遠心分離を行って上清を除去したものにエタノールを添加して沈殿物を回収し、この沈殿物について、シリカゲルカラムとクロロホルム/メタノール溶液とを用いてカラムクロマトグラフィーによる精製を繰り返すという方法を挙げることができる。
【0025】
本発明において、タモギタケから抽出されるエルゴチオネインもまた、当業者により適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、タモギタケを煮出して得た煮汁をイオン交換樹脂に供した後、その樹脂から陽イオン性化合物を溶出し、溶出液を濃縮し、これを高速液体クロマトグラフィーにより分離・精製し、凍結乾燥するという方法を挙げることができる。
【0026】
本発明において、タモギタケから抽出されるエルゴチステロールパーオキサイドもまた、当業者により適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、上述のグルコシルセラミドを製造する方法と同様の方法を行い、カラムクロマトグラフィーによる精製の際に、グルコシルセラミドに代えてエルゴステロールパーオキサイドを含む溶出液を選択するという方法を挙げることができる。
【0027】
本発明において、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドの製造の際には、必要とする純度や形状などに応じて、粉砕、精製、濃縮、乾燥、滅菌などを行ってもよい。
【0028】
粉砕方法としては、例えば、ロール式粉砕機などにより押しつぶす方法、フードプロセッサーなどにより切断する方法、ボールミル粉砕機などにより磨り潰す方法、ハンマー式粉砕機などにより打撃を与えて粉砕する方法などを、精製方法としては、例えば、濾過法、蒸留法、再結晶法、再沈殿法、各種のクロマトグラフィーを用いた方法などを、濃縮方法としては、例えば、煮沸濃縮法、エバポレーターなどによる真空濃縮(減圧濃縮)法、凍結濃縮法、逆浸透膜などを用いた膜濃縮法などを、滅菌方法としては、例えば、オートクレーブを用いた方法、高周波法、フィルター濾過法などを、それぞれ挙げることができる。
【0029】
本発明に係る抗菌剤は、微生物の増殖を抑制する作用を有しているが、本発明において、「微生物の増殖を抑制する」とは、微生物の分裂を抑制することにより増殖を抑制する場合のほか、微生物を殺傷することにより増殖を抑制する場合が含まれる。
【0030】
また、「微生物の増殖を抑制する作用」には、微生物に直接的に働きかけることにより微生物の増殖を抑制する作用(直接的作用)のほか、生体の抗菌ペプチド産生細胞に作用して抗菌ペプチドの産生を促進させ、産生された抗菌ペプチドが微生物の増殖を抑制する作用(間接的作用)が含まれる。
【0031】
なお、本発明において「増殖を抑制する」は、「増殖を阻害する」、「増殖を阻止する」、「増殖を予防する」と、「産生を促進する」は、「産生を増大させる」、「産生を増強させる」、「産生を増進する」、「産生を亢進する」、「産生を刺激する」、「産生能を賦活する」と交換可能に用いられる。
【0032】
抗菌ペプチドとは、微生物からヒトを含めた動物や植物まで、幅広い生物の細胞において産生され、微生物に対する殺傷作用、あるいは分裂の抑制、阻害などのような静菌的作用を有するペプチドの総称である。なお、本発明において抗菌ペプチドは特に限定されず、例えば、αディフェンシン、βディフェンシン、θディフェンシン、Cathelicidin、ダームシジン、Hepcidin/LEAP−1、ヒスタチンなどを挙げることができる。
【0033】
すなわち、本発明に係る抗菌剤は、微生物の増殖抑制や、微生物により引き起こされる疾病の予防や治療に有効であり、例えば、ヒトを含む動物に対して医薬品や医薬部外品に添加、配合して用いることができるほか、農作物などの植物の疫病を防ぐ農薬に用いることができる。また、微生物は、細菌や真菌のみならず、例えば、ウイルス、ウイロイド、リケッチア、クラミジア、マイコプラズマ、スピロヘータ、原虫、蠕虫など、あらゆる微生物を挙げることができる。このような微生物により引き起こされる疾病としては、微生物の感染による感染症のほか、微生物の生産する毒素による中毒症やアレルギー症などを挙げることができ、例えば、カンジダ症、クリプトコッカス感染症、アスペルギルス症、ニューモシスチス肺炎、う蝕、食中毒、HIV感染症、白癬(水虫、たむし、しらくもなど)、とびひ、水痘、ヘルペスウィルス感染症、サイトメガロウイルス感染症、MRSA感染症、緑膿菌感染症、レジオネラ肺炎、セラチア感染症、トキソプラズマ症、クリプトスポリジウム症などを挙げることができる。
【0034】
本発明に係る抗菌剤はまた、食品や化粧料に添加して、その保存性を高めるために用いることができるほか、物品に添加、配合して腐食を防ぐため、衛生的状態を保持するため、あるいは悪臭を防ぐために用いることができる。
【0035】
次に、本発明は、βディフェンシン産生促進剤を提供する。本発明に係るβディフェンシン産生促進剤は、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする。
【0036】
抗菌ペプチドの一種であるディフェンシンは、分子内にシステイン残基を有し、それがジスルフィド結合により高次構造を形成していることを特徴とする抗菌ペプチドのファミリーのひとつであり、αディフェンシン、βディフェンシンおよびθディフェンシンに大別される。ディフェンシンは、陽性荷電しているため、陰性に荷電した菌体膜に挿入されて小孔を形成し、菌体内容物が小孔から流出することにより抗菌作用を発揮することが知られている。
【0037】
βディフェンシンは、生体内において主に白血球や上皮細胞から産生されるディフェンシンであり、近年、局所の感染防御のみならず、上皮組織の組織修復や樹状細胞、Tリンパ球、単球などを遊走させることによる獲得免疫にも関与していることが報告されている(Yang D.ら、Science、第286巻、第525頁、1999年;Territo M.C.ら、J.Clin.Invest.第84巻、第2017頁、1989年;Lillard J.W.Jr.ら、Proc.Natl.Acad.Sci.、第96巻、第651頁、1999年;長岡 功ら、臨床免疫、第33巻、第577頁、2000年)。また、腫瘍免疫を誘導して、抗腫瘍効果を発揮することやガン細胞で増殖抑制作用があることも報告されている(長岡 功ら、臨床免疫、第40巻、第4号、第424頁、2003年;Byragyn Aら、J.Immunol.、第167巻、第6644頁、2001年)。
【0038】
すなわち、本発明に係るβディフェンシン産生促進剤は、微生物により引き起こされる疾病の予防や治療に有効であり、例えば、ヒトを含む動物に対して医薬品や医薬部外品に添加、配合して用いることができるほか、農作物などの植物の疫病を防ぐ農薬に用いることができる。また、本発明に係るβディフェンシン産生促進剤は、感染、炎症その他の傷害からの回復、癌の治療、免疫増強、荒れ肌・乾燥肌・手荒れなどのスキンケア、口臭防止、足臭防止などのために用いることができる。
【0039】
本発明において、βディフェンシンの種類としては、例えば、βディフェンシン−1、βディフェンシン−2、βディフェンシン−3、βディフェンシン−4などを挙げることができ、由来する生物としては、例えば、Lactococcus lactisなどの細菌、アシタバ、カラシナなどの植物、クロチャワンタケなどの菌類、クモ、サソリ、トンボなどの昆虫、イガイなどの軟体動物、イセエビなどの甲殻類、ニワトリなどの鳥類、カエルなどの両生類、ヒト、サル(ヒトを除く霊長目)、牛、ブタ、羊、ヤギ、イヌ、ネコなどの哺乳類などを挙げることができるが、ヒトが好ましい。
【0040】
次に、本発明は、カンジダ症予防および/または治療剤を提供する。本発明に係るカンジダ症予防および/または治療剤は、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする。
【0041】
カンジダ症はC.albicansに代表されるカンジダ菌により引き起こされる感染症である。カンジダ菌はヒトの体表や消化管、膣粘膜などに常時生息しており、健常人には特に何の影響も与えないが、体調が悪いときや免疫力が低下しているときなどに、疾病を引き起こす日和見感染菌である。本発明に係るカンジダ症予防および/または治療剤は、カンジダ菌に直接的に働きかけることによってその増殖を抑制する作用(直接的作用)のほか、生体の抗菌ペプチド産生細胞に作用して抗菌ペプチドの産生を促進させ、産生された抗菌ペプチドがカンジダ菌の増殖を抑制する作用(間接的作用)を有している。
【0042】
本発明におけるカンジダ症としては、例えば、皮膚カンジダ症、口腔カンジダ症、性器カンジダ症、口内炎、口角炎、胃鼓脹症、カンジダ敗血症などを挙げることができ、このうちの口腔カンジダ症は、口腔乾燥症(ドライマウス)の患者に頻発することが知られている。口腔乾燥症(ドライマウス)は口腔内が乾燥して、喉や口の渇き、痛み、口臭、味覚異常などの症状を呈する疾病であるが、口腔内の乾燥は、粘膜上皮の抵抗力低下や口腔内常在菌のバランスの崩れを招くことから、カンジダ菌が口腔上皮内に侵入して口腔カンジダ症を引き起こすと考えられている。本発明に係るカンジダ症および/または治療剤は、このような口腔カンジダ症に、特に有効である。
【0043】
本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤の製剤化には、当業者に公知の方法を用いることができる。投与形態もまた、当業者によって適宜選択することができる投与形態でよく、そのような投与形態としては、例えば、経口投与製剤として調製する場合の、錠剤、顆粒剤、散剤、カプセル剤、コーティング剤、液剤、懸濁剤などの形態を挙げることができ、非経口投与製剤にする場合の、ジェル剤、吸入剤、注射剤、点滴剤、座薬、塗布剤、噴霧剤、貼付剤、軟膏、クリームなどの形態を挙げることができる。また、その投与量は、医薬組成物の製剤形態、投与方法、使用目的およびこれに適用される投与対象の年齢、体重、症状によって適宜設定することができる。
【0044】
皮膚外用剤として用いられる場合は、その剤型は適宜選択することができ、例えば、溶液系、可溶化系、乳化系、粉末分散系、水−油二層系、水−油−粉末三層系、ジェル、ミスト、スプレー、ムース、ロールオン、スティックなどの他、不織布などのシートに含浸ないし塗布した製剤などを挙げることができる。また、本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤に、例えば、植物油などの油脂類、ラノリンやミツロウなどのロウ類、炭化水素類、脂肪酸、高級アルコール類、エステル類、各種界面活性剤、色素、香料、ビタミン類、植物や動物の抽出成分、紫外線吸収剤、抗酸化剤、防腐剤、殺菌剤などの、通常の皮膚外用剤の原料として使用されているものを適宜配合し、皮膚外用剤を製造することができる。また、抗炎症性の皮膚外用剤原料であるグリチルレチン酸などの甘草抽出成分、塩酸ジフェンヒドラミン、アズレン、dl−α−トコフェロールおよびその誘導体、ビタミンB2、ビタミンB6などとともに用いることができる。
【0045】
食品添加物として用いられる場合は、その形態は適宜選択することができ、例えば、本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤をそのまま食品として調製したもの、他の食品に添加したもの、あるいは、カプセル、錠剤等、食品または健康食品に通常用いられる任意の形態を挙げることができる。また、食品中に配合して摂取あるいは投与する場合には、適宜、賦形剤、増量剤、結合剤、増粘剤、乳化剤、着色料、香料、食品添加物、調味料などと混合し、用途に応じて、粉末、顆粒、錠剤等の形に成形することができる。さらには、食品原料中に混合して食品を調製し、機能性食品として製品化することによって摂取することができる。
【0046】
以下、本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤について、実施例に基づいて説明する。なお、本発明の技術的範囲は、これらの実施例によって示される特徴に限定されない。
【実施例】
【0047】
<実施例1>カンジダ菌増殖抑制効果の確認
(1)タモギタケ熱水抽出物の調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して150Lの濾液を得ることにより、タモギタケ熱水抽出物を調製した。
【0048】
(2)サンプルの調製
6ウェルプレート(IWAKI社)の各ウェルにブレインハートフュージョン培地(BHI培地;栄研化学社)を入れたものを4枚準備し、A、B、CおよびDとして、計4サンプルを調製した。各サンプルの各ウェルに、カンジダ菌(Candida albicans ATCC90028株)を、培養液の600nmにおける吸光度が0.01〜0.05となるよう植菌した後、B、CおよびDの各ウェルに、本実施例(1)で調製したタモギタケ熱水抽出物を、それぞれ、6%(v/v)、8%(v/v)および60%(v/v)となるように添加した。なお、何も添加しないAのウェルをコントロールとした。
【0049】
(3)カンジダ菌の培養および濁度の測定
本実施例(2)のA、B、CおよびDを25℃にて16時間培養した。次に、カンジダ菌生菌数の指標として、培養後の培地について、分光光度計(BioRad社)を用いて波長600nmにおける吸光度を測定することにより、濁度を求めた。続いて、サンプルごとに各ウェルにおける濁度の平均値と標準偏差を算出した。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図1に示す。図中の*は、検定の結果、統計的に有意であることを示す(p<0.05)。
【0050】
図1に示すように、濁度の大きさはA>B>C>Dであり、Aにおける濁度を100%とすると、B、CおよびDにおける濁度はそれぞれ約92%、約82%および58〜71%であった。すなわち、培地に添加したタモギタケ熱水抽出物の濃度が大きい場合ほど、カンジダ菌の生菌数が小さいことが確認された。
【0051】
これらの結果から、タモギタケ熱水抽出物はカンジダ菌の増殖を抑制することが明らかになった。
【0052】
<実施例2>ヒトβ−ディフェンシン産生促進効果の検討
(1)タモギタケ熱水抽出物のヒトβ−ディフェンシン産生促進効果の検討
[1−1]サンプルの調製および培養
ウシ胎児血清(FBS;Gibco−BRL社)およびペニシリン・ストレプトマイシン(シグマ社)をそれぞれ10%(v/v)および2%(v/v)の終濃度で含むDMEM培地(シグマ社)を調製し、F−P−DMEM培地とした。F−P−DMEM培地に、ヒト不死化ケラチノサイト細胞(HaCaT細胞;東京歯科大学病理学講座村松敬氏提供)を1×105個/mLとなるよう添加して、細胞懸濁液を調製した。この細胞懸濁液3mLを60mmディッシュ(IWAKI社)に入れたものを5枚準備し、A、B、C、DおよびEとして、計5サンプルを調製した。続いて、各サンプルを37℃、CO25%(v/v)の環境下にて、80%コンフルエントに達するまで、約3日間培養した。
【0053】
[1−2]タモギタケ熱水抽出物を添加した培地での培養
実施例1(1)で調製したタモギタケ熱水抽出物を、DDWを用いて希釈して、それぞれ、2%(v/v)、20%(v/v)および40%(v/v)の熱水抽出物水溶液を調製した。次に、DDW、2%(v/v)、20%(v/v)、40%(v/v)の熱水抽出物水溶液および実施例1(1)で調製したタモギタケ熱水抽出物をそれぞれ25%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地とタモギタケ熱水抽出物を下記の終濃度で含む交換培地とを調製した。本実施例(1)[1−1]の各サンプルの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0054】
交換培地に添加したものおよびタモギタケ熱水抽出物の終濃度
A :DDW (コントロール用交換培地)
B :タモギタケ熱水抽出物 終濃度0.5%(v/v)
C :タモギタケ熱水抽出物 終濃度 5%(v/v)
D :タモギタケ熱水抽出物 終濃度 10%(v/v)
E :タモギタケ熱水抽出物 終濃度 25%(v/v)
【0055】
[1−3]RNAの抽出およびcDNAの作製
本実施例(1)[1−2]の各サンプルから細胞を回収した後、TRIzol reagent(Invitrogen社)を用いて細胞中の全RNAを抽出した。続いて、抽出した全RNAの10%(v/v)容量のクロロホルムを添加して、13000rpm、4℃の条件下で10分間遠心分離を行った後、水層を回収した。次に、等量のイソプロパノールを添加して、13000rpm、4℃の条件下で10分間遠心分離を行った後、上清を除去し、70%(v/v)エタノール600μLを添加して沈殿物を洗浄した。その後、沈殿物を滅菌DEPC処理水に溶解し、全RNA溶液を得た。この全RNA溶液から適量を分取し、分光光度計NanoDrop ND−1000(NanoDrop products社)を用いて波長260nmにおける吸光度を測定することにより、濃度を測定した。
【0056】
続いて、全RNA2μgを含む全RNA溶液を鋳型として、オリゴdT12−18プライマー(Invitrogen社)およびSuperScript逆転写酵素(Invitrogen社)を用いて、付属の使用書に従い、cDNAを作製した。
【0057】
[1−4]定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(1)[1−3]のcDNAを鋳型として、ヒトβ−ディフェンシン−1(hBD−1)、ヒトβ−ディフェンシン−2(hBD−2)、ヒトβ−ディフェンシン−3(hBD−3)およびグリセルアルデヒド3リン酸脱水素酵素(GAPDH)について、Taq Man 7300 Real−Time PCR System(Applied Biosystems社)およびTaq Man Universal Master Mix(Applied Biosystems社)を用いて、付属の使用書に従い、定量PCR法を行い、一定の増幅産物量になるサイクル数(Ct値)を測定した。定量PCR法に用いたプライマーおよびプローブは下記のとおりである。
【0058】
定量PCRに用いたプライマー・プローブ
Taq Man Gene Expression Assays(Applied Biosystems社);
hBD−1の増幅に用いたプライマー・プローブ:AssayID Hs00608345_m1
hBD−2の増幅に用いたプライマー・プローブ:AssayID Hs00823638_m1
hBD−3の増幅に用いたプライマー・プローブ:AssayID Hs00218678_m1
GAPDHの増幅に用いたプライマー・プローブ:AssayID Hs99999905_m1
【0059】
続いて、測定した結果に基づき、AにおけるCt値を基準値とし、GAPDHのCt値を内在コントロールとして比較Ct法を行うことにより、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を算出した。
【0060】
本実施例(1)[1−1]〜[1−4]の実験を3回以上繰り返し、各サンプルにおけるhBD−1、hBD−2およびhBD−3のmRNA相対発現量について、平均値および標準偏差を算出した。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図2に示す。図中の*は、検定の結果、統計的に有意であることを示す(p<0.05)。
【0061】
図2上段に示すように、hBD−1のmRNA相対発現量について、B、C、DおよびEのいずれも、Aとほとんど変わらなかった。
【0062】
また、図2中段に示すように、hBD−2のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、CおよびEは、Aと比較して大きい傾向があり、DはAと比較して有意に大きかった。すなわち、タモギタケ熱水抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−2のmRNA発現量が増加することが確認された。
【0063】
また、図2下段に示すように、hBD−3のmRNA相対発現量について、BおよびEは、Aと比較して大きい傾向があり、CおよびDは、Aと比較して有意に大きかった。すなわち、タモギタケ熱水抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0064】
これらの結果から、タモギタケ熱水抽出物は、HaCaT細胞に24時間作用させた場合に、hBD−2およびhBD−3の産生を促進することが明らかになった。
【0065】
(2)タモギタケ熱水抽出物の濾液および濾物のヒトβ−ディフェンシン産生促進効果の検討
[2−1]タモギタケ熱水抽出物の濾液および濾物の調製
実施例1(1)で調製したタモギタケ熱水抽出物150mLについて、分画分子量1000の限外濾過膜を用いて限外濾過を行い、25mLの濾液および濾物(乾燥重量;0.2g)を得た。
【0066】
[2−2]サンプルの調製および培養
本実施例(1)[1−1]に記載の方法により、A、B、CおよびDの計4サンプルをを調製し、培養した。
【0067】
[2−3]タモギタケ熱水抽出物の濾液および濾物を添加した培地での培養
本実施例(2)[2−1]の濾物をDDWに溶解し、1mg/mLの濾物水溶液を調製した。次に、DDW、本実施例(2)[2−1]の濾液、濾物水溶液および実施例1(1)で調製した熱水抽出物をそれぞれ10%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地と濾液、濾物およびタモギタケ熱水抽出物を含む交換培地とを調製した。本実施例(2)[2−2]のA、B、CおよびDの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0068】
交換培地に添加したもの
A :DDW(コントロール用交換培地)
B :濾液
C :濾物
D :タモギタケ熱水抽出物
【0069】
[2−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるhBD−3mRNAの定量
本実施例(2)[2−3]の各サンプルについて、本実施例(1)[1−3]に記載の方法によりRNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、hBD−3mRNAの定量を行った。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図3に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0070】
図3に示すように、hBD−3のmRNA相対発現量について、その大きさはA<B<C<Dであり、B、CおよびDは、Aと比較していずれも有意に大きかった。
【0071】
これらの結果から、タモギタケ熱水抽出物について、分画分子量1000の限外濾過膜を通過した画分(濾液)とそれを通過しなかった画分(濾物)とは、いずれもHaCaT細胞に24時間作用させた場合に、hBD−3の産生を促進することが明らかになった。
【0072】
(3)タモギタケ水抽出物のヒトβ−ディフェンシン産生促進効果の検討
[3−1]タモギタケ水抽出物の調製
フードプロセッサーに生のタモギタケ100gと水100gとを投入し、粉砕した後、濾布を用いて濾過し、70mLの濾液を得た。得られた濾液のpHを測定したところ、pH6.08であった。続いて、オートクレーブ装置を用いて、濾液を120℃で15分間滅菌処理した。
【0073】
[3−2]サンプルの調製および培養、ならびにタモギタケ水抽出物を添加した培地での培養
本実施例(1)[1−1]に記載の方法により、A、B、C、DおよびEの計5サンプルを調製し、培養した。続いて、実施例1(1)で調製したタモギタケ熱水抽出物に代えて、本実施例(3)[3−1]で調製したタモギタケ水抽出物を用いて、本実施例(1)[1−2]に記載の方法により、タモギタケ水抽出物を添加した培地での培養を行った。
【0074】
[3−3]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(3)[3−2]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図4に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0075】
図4上段に示すように、hBD−1のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、C、DおよびEは、Aと比較して有意に大きかった。すなわち、タモギタケ水抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−1のmRNA発現量が増加することが確認された。
【0076】
また、図4中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0077】
また、図4下段に示すように、hBD−3のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、DおよびEは、Aと比較して有意に大きかった。すなわち、タモギタケ水抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0078】
これらの結果から、タモギタケ水抽出物は、HaCaT細胞に24時間作用させた場合に、hBD−1およびhBD−3の産生を促進することが明らかになった。
【0079】
(4)タモギタケ酸性溶媒抽出物のヒトβ−ディフェンシン産生促進効果の検討
[4−1]タモギタケ酸性溶媒抽出物の調製
水を0.4%(w/w)クエン酸水溶液に代えて、本実施例(3)[3−1]に記載の方法によりタモギタケの抽出物を調製し、これをタモギタケ酸性溶媒抽出物とした。なお、オートクレーブによる滅菌処理を行う前の濾液のpHは、pH4.61であった。
【0080】
[4−2]サンプルの調製および培養、ならびにタモギタケ酸性溶媒抽出物を添加した培地での培養
本実施例(1)[1−1]に記載の方法により、A、B、C、DおよびEの計5サンプルをを調製し、培養した。続いて、実施例1(1)で調製したタモギタケ熱水抽出物に代えて、本実施例(4)[4−1]で調製したタモギタケ酸性溶媒抽出物を用いて、本実施例(1)[1−2]に記載の方法により、タモギタケ酸性溶媒抽出物を添加した培地での培養を行った。
【0081】
[4−3]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(4)[4−2]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図5に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0082】
図5上段に示すように、hBD−1のmRNA相対発現量について、B、CおよびDは、Aと比較してほとんど変わらなかったが、EはAと比較して有意に大きかった。すなわち、タモギタケ酸性溶媒抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−1のmRNA発現量が増加することが確認された。
【0083】
また、図5中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0084】
また、図5下段に示すように、hBD−3のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、DおよびEは、Aと比較して有意に大きかった。すなわち、タモギタケ酸性溶媒抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0085】
これらの結果から、タモギタケ酸性溶媒抽出物は、HaCaT細胞に24時間作用させた場合に、hBD−1およびhBD−3の産生を促進することが明らかになった。
【0086】
(5)タモギタケ塩基性溶媒抽出物のヒトβ−ディフェンシン産生促進効果の検討
[5−1]タモギタケ塩基性溶媒抽出物の調製
水を1%(w/w)重曹水溶液に代えて、本実施例(3)[3−1]に記載の方法により、タモギタケの抽出物を調製し、これをタモギタケ塩基性溶媒抽出物とした。なお、オートクレーブによる滅菌処理を行う前の濾液のpHは、pH7.6であった。
【0087】
[5−2]サンプルの調製および培養、ならびにタモギタケ塩基性溶媒抽出物を添加した培地での培養
本実施例(1)[1−1]に記載の方法により、A、B、C、DおよびEの計5サンプルを調製し、培養した。続いて、実施例1(1)で調製したタモギタケ熱水抽出物に代えて、本実施例(5)[5−1]で調製したタモギタケ塩基性溶媒抽出物を用いて、本実施例(1)[1−2]に記載の方法により、タモギタケ塩基性溶媒抽出物を添加した培地での培養を行った。
【0088】
[5−3]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(5)[5−2]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図6に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0089】
図6上段に示すように、hBD−1のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、C、DおよびEは、Aと比較して有意に大きかった。すなわち、タモギタケ塩基性溶媒抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−1のmRNA発現量が増加することが確認された。
【0090】
また、図6中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0091】
また、図6下段に示すように、hBD−3のmRNA相対発現量について、B、C、Dのいずれも、Aと比較して有意に大きかった。すなわち、タモギタケ塩基性溶媒抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0092】
これらの結果から、タモギタケ塩基性溶媒抽出物は、HaCaT細胞に24時間作用させた場合に、hBD−1およびhBD−3の産生を促進することが明らかになった。
【0093】
(6)タモギタケ由来エルゴチオネインのヒトβ−ディフェンシン産生促進効果の検討
[6−1]タモギタケ由来エルゴチオネインの調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して150Lの濾液を得た。この濾液について、5000rpm、10℃の条件下で30分間遠心分離を行って135Lの上清を回収した。5×30cmのカラムに充填したイオン交換樹脂(アンバーライトIR120B H型;オルガノ社)に、回収した上清のうちの7.5Lを入れ、一晩自然落下させた。続いて、イオン交換樹脂を回収し、蒸留水2.5Lを用いて洗浄して糖質成分を除去した後、0.28%(w/w)アンモニア水10Lを用いて溶出し、イオン交換樹脂に吸着していた陽イオン性化合物を含む溶出液10mLを得た。ロータリーエバポレーターを用いてこの溶出液を濃縮した後、下記の条件により定法に従って高速液体クロマトグラフィー(HPLC)を行い、流出開始3〜4分に検出されるピークの画分を分取した。
【0094】
HPLCの条件
HPLCシステム;日立高速液体クロマトグラフLaChrom Elite
溶離溶媒;0〜1%(v/v)アセトニトリル水溶液
カラム;Inertsil ODS−SP(ジーエルサイエンス社)
検出器;UV検出器
検出条件;250nm
【0095】
分取した画分を合わせた後、凍結乾燥機を用いて凍結乾燥し、粉末状のタモギタケ由来エルゴチオネイン1.7g(7.4mmol)を得た。
【0096】
[6−2]サンプルの調製および培養
本実施例(1)[1−1]に記載の方法により、A、B、およびCの計3サンプルを調製し、培養した。
【0097】
[6−3]タモギタケ由来エルゴチオネインを添加した培地での培養
本実施例(6)[6−1]で調製したタモギタケ由来エルゴチオネインをDDWに溶解して、それぞれ、10mmol/Lおよび100mmol/Lのエルゴチオネイン水溶液を調製した。次に、DDW、10mmol/Lおよび500mmol/Lのエルゴチオネイン水溶液をそれぞれ1%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地とタモギタケ由来エルゴチオネインを下記の終濃度で含む交換培地とを調製した。本実施例(6)[6−2]の各サンプルの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0098】
交換培地に添加したものおよびタモギタケ由来エルゴチオネインの終濃度
A :DDW (コントロール用交換培地)
B :タモギタケ由来エルゴチオネイン 終濃度100μmol/L
C :タモギタケ由来エルゴチオネイン 終濃度 5mmol/L
【0099】
[6−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(6)[6−3]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したBおよびCにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図7に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0100】
図7上段に示すように、hBD−1のmRNA相対発現量について、BおよびCは、Aと比較して有意に大きかった。すなわち、タモギタケ由来エルゴチオネインを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−1のmRNA発現量が増加することが確認された。
【0101】
また、図7中段に示すように、hBD−2のmRNA相対発現量について、BおよびCのいずれも、Aと比較してほとんど変わらなかった。
【0102】
また、図7下段に示すように、hBD−3のmRNA相対発現量について、BおよびCのいずれも、Aと比較して有意に大きかった。すなわち、タモギタケ由来エルゴチオネインを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0103】
これらの結果から、タモギタケ由来エルゴチオネインは、HaCaT細胞に24時間作用させた場合に、hBD−1およびhBD−3の産生を促進することが明らかになった。
【0104】
(7)タモギタケ由来エルゴステロールパーオキサイドのヒトβ−ディフェンシン産生促進効果の検討
[7−1]タモギタケ由来エルゴステロールパーオキサイドの調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して濾物(残渣)を得た。この濾物を加熱して乾燥させた後、粉砕機を用いて粒子径が0.1mmとなるまで粉砕し、12kgの粉末を得た。99.5%(v/v)エタノールを、この粉末100g当たりに500mL〜1000mL添加して加熱し、粉末に含まれる成分を溶解させた。この溶液を冷却した後、5000rpm、10℃の条件下で30分間遠心分離を行って上清を回収し、1mol/LのNaOH水溶液を等量添加して室温下で2時間攪拌することによりケン化反応を行った。続いて、6mol/Lの塩酸水溶液を適量添加することによりpHを5〜6に調整した後、5000rpm、10℃の条件下で30分間遠心分離を行った。上清を除去した後、沈殿物に100mLのエタノールを添加して攪拌し、減圧下でエタノールを留去して、白色の沈殿物10〜50gを得て、これを脂質粗抽出物とした。
【0105】
次に、脂質粗抽出物10〜50gをクロロホルム/メタノール{クロロホルム:メタノール=95:5(v/v)}30mLに溶解した後、粒子径100〜210μmのシリカゲル60(関東化学社)を充填した8×80cmのシリカゲルカラムに注入した。続いて、クロロホルム/メタノール{クロロホルム:メタノール=90:10(v/v)}1000mLにより溶出して、溶出液を500mLずつ分取した。分取した各溶出液から適量を採取して、定法に従い薄層クロマトグラフィー{展開溶媒;クロロホルム:メタノール:水=80:20:0.2(v/v)}に供し、エルゴステロールパーオキサイドを含む溶出液を選択した後、選択した溶出液の溶媒を減圧下で留去し、エルゴステロールパーオキサイド粗精製物を得た。
【0106】
続いて、エルゴステロールパーオキサイド粗精製物をクロロホルム/メタノール{クロロホルム:メタノール=95:5(v/v)}に溶解した後、粒子径40〜100μmのシリカゲル60(関東化学社)を充填した3×60cmのシリカゲルカラムに注入した。クロロホルム/メタノール{クロロホルム:メタノール=95:5(v/v)}1000mL、クロロホルム/メタノール{クロロホルム:メタノール=90:10(v/v)}1000mL、クロロホルム/メタノール{クロロホルム:メタノール=85:15(v/v)}1000mLおよびクロロホルム/メタノール{クロロホルム:メタノール=80:20(v/v)}1000mLにより溶出して、溶出液を18〜50mLずつ分取した。分取した各溶出液から適量を採取して、定法に従い薄層クロマトグラフィー{展開溶媒;クロロホルム:メタノール:水=80:20:0.2(v/v)}に供し、エルゴステロールパーオキサイドを含む溶出液を選択した後、選択した画分の溶媒を減圧下で留去し、精製されたタモギタケ由来エルゴステロールパーオキサイド3〜4g(7.0〜9.3mmol)を得た。
【0107】
[7−2]サンプルの調製および培養
本実施例(1)[1−1]に記載の方法により、A、B、およびCの計3サンプルを調製し、培養した。
【0108】
[7−3]タモギタケ由来エルゴステロールパーオキサイドを添加した培地での培養
本実施例(7)[7−1]で調製したタモギタケ由来エルゴステロールパーオキサイドをジメチルスルホキシドに溶解して、それぞれ、100μmol/Lおよび1mmol/Lのエルゴステロールパーオキサイド水溶液を調製した。次に、ジメチルスルホキシド、100μmol/Lおよび1mmol/Lのエルゴステロールパーオキサイド水溶液をそれぞれ1%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地とタモギタケ由来エルゴステロールパーオキサイドを下記の終濃度で含む交換培地とを調製した。本実施例(7)[7−2]の各サンプルの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0109】
交換培地に添加したものおよびタモギタケ由来エルゴステロールパーオキサイドの終濃度
A :ジメチルスルホキシド (コントロール用交換培地)
B :タモギタケ由来エルゴステロールパーオキサイド 終濃度 1μmol/L
C :タモギタケ由来エルゴステロールパーオキサイド 終濃度10μmol/L
【0110】
[7−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(7)[7−3]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により、定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したBおよびCにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図8に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0111】
図8上段に示すように、hBD−1のmRNA相対発現量について、BおよびCのいずれも、Aと比較してほとんど変わらなかった。
【0112】
また、図8中段に示すように、hBD−2のmRNA相対発現量について、BおよびCのいずれも、Aと比較して有意に大きかった。すなわち、タモギタケ由来エルゴステロールパーオキサイドを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−2のmRNA発現量が増加することが確認された。
【0113】
また、図8下段に示すように、hBD−3のmRNA相対発現量について、CはAと比較して大きい傾向があり、BはAと比較して有意に大きかった。すなわち、タモギタケ由来エルゴステロールパーオキサイドを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0114】
これらの結果から、タモギタケ由来エルゴステロールパーオキサイドは、HaCaT細胞に24時間作用させた場合に、hBD−2およびhBD−3の産生を促進することが明らかになった。
【0115】
(8)タモギタケ由来グルコシルセラミドのヒトβ−ディフェンシン産生促進効果の検討
[8−1]タモギタケ由来グルコシルセラミドの調製
シリカゲルカラムからの各溶出液について、薄層クロマトグラフィーにより含有成分を確認し、選択する際に、エルゴステロールパーオキサイドに代えてグルコシルセラミドを含む溶出液を選択して、本実施例(7)[7−1]に記載の方法を行うことにより、精製されたタモギタケ由来グルコシルセラミド20〜25g(0.028〜0.034mol)を得た。
【0116】
[8−2]サンプルの調製および培養
本実施例(1)[1−1]に記載の方法により、A、B、C、DおよびEの計5サンプルを調製し、培養した。
【0117】
[8−3]タモギタケ由来グルコシルセラミドを添加した培地での培養
本実施例(8)[8−1]で調製したタモギタケ由来グルコシルセラミドをジメチルスルホキシドに溶解して、それぞれ、100μmol/L、1mmol/L、10mmol/Lおよび100mmol/Lのグルコシルセラミド水溶液を調製した。次に、ジメチルスルホキシド、100μmol/L、1mmol/L、10mmol/Lおよび100mmol/Lのグルコシルセラミド水溶液をそれぞれ0.1%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地とタモギタケ由来グルコシルセラミドを下記の終濃度で含む交換培地とを調製した。本実施例(8)[8−2]の各サンプルの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0118】
交換した培地に添加したものおよびタモギタケ由来グルコシルセラミドの終濃度
A :ジメチルスルホキシド (コントロール用交換培地)
B :タモギタケ由来グルコシルセラミド 終濃度0.1μmol/L
C :タモギタケ由来グルコシルセラミド 終濃度 1μmol/L
D :タモギタケ由来グルコシルセラミド 終濃度 10μmol/L
E :タモギタケ由来グルコシルセラミド 終濃度100μmol/L
【0119】
[8−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(8)[8−2]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により、定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図9に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0120】
図9上段に示すように、hBD−1のmRNA相対発現量について、B、CおよびDは、Aと比較して有意差は見られず、EにおけるmRNA相対発現量は、AにおけるmRNA相対発現量と比較して有意に小さかった。
【0121】
また、図9中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較して有意差は見られなかった。
【0122】
また、図9下段に示すように、hBD−3のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、CおよびDは、Aと比較して大きい傾向があり、EはAと比較して有意に大きかった。すなわち、タモギタケ由来グルコシルセラミドを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0123】
これらの結果から、タモギタケ由来グルコシルセラミドは、HaCaT細胞に24時間作用させた場合に、hBD−3の産生を促進することが明らかになった。
【0124】
<実施例3>NHEK細胞におけるヒトβ−ディフェンシン産生促進効果の検討
(1)サンプルの調製および培養
実施例2(1)[1−1]に記載の方法により、A、B、CおよびDの計4サンプルを調製した。ただし、HaCaT細胞に代えて正常ヒト表皮角化細胞(NHEK細胞;三光純薬社)を用い、培養時間は3日間に代えて2日間とした。
【0125】
(2)タモギタケ熱水抽出物を添加した培地での培養
本実施例(1)の各サンプルについて、実施例2(1)[1−2]に記載の方法により、タモギタケ熱水抽出物を添加した培地での培養を行った。ただし、各サンプルに用いた交換培地は下記のとおりとした。
【0126】
交換培地に添加したものおよびタモギタケ熱水抽出物の終濃度
A :DDW (コントロール用交換培地)
B :タモギタケ熱水抽出物 終濃度0.5%(v/v)
C :タモギタケ熱水抽出物 終濃度 5%(v/v)
D :タモギタケ熱水抽出物 終濃度 25%(v/v)
【0127】
(3)RNAの抽出およびcDNAの作製、ならびに定量PCR法によるhBD−2mRNAおよびhBD−3mRNAの定量
本実施例(2)の各サンプルについて、実施例2(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、実施例2(1)[1−4]に記載の方法により定量PCR法を行い、hBD−2mRNAおよびhBD−3mRNAの定量を行った。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図10に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0128】
図10上段に示すように、hBD−2のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、CおよびDは、Aと比較して有意に大きかった。
【0129】
また、図10下段に示すように、hBD−3のmRNA相対発現量についても、BはAと比較してほとんど変わらなかったが、CおよびDは、Aと比較して有意に大きかった。すなわち、タモギタケ熱水抽出物を添加した培地でNHEK細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−2およびhBD−3のmRNA発現量が増加することが確認された。
【0130】
これらの結果から、タモギタケ熱水抽出物は、HaCaT細胞のみならずNHEK細胞においても、hBD−2およびhBD−3の産生を促進することが明らかになった。
【0131】
<実施例4>ヒトβ−ディフェンシン産生促進効果を奏する時間の検討
(1)タモギタケ熱水抽出物
実施例2(1)[1−1]〜[1−4]に記載の方法により、実験を行った。ただし、タモギタケ熱水抽出物を添加した培地での培養時間は24時間に代えて2時間とし、定量PCR法によるヒトβ−ディフェンシンmRNAの定量は、hBD−2およびhBD−3について行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図11に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0132】
図11上段に示すように、hBD−2のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、DおよびEは、Aと比較して有意に大きかった。
【0133】
また、図11下段に示すように、hBD−3のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、C、DおよびEは、Aと比較して有意に大きかった。
【0134】
これらの結果から、タモギタケ熱水抽出物は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様に、hBD−2およびhBD−3の産生を促進することが明らかになった。また、タモギタケ熱水抽出物がhBD−2およびhBD−3の産生を促進する程度は、24時間作用させた場合と比較して、2時間作用させた場合の方が大きいことが明らかになった。
【0135】
(2)タモギタケ熱水抽出物の濾液および濾物
実施例2(2)[2−1]〜[2−4]に記載の方法により、実験を行った。ただし、タモギタケ熱水抽出物の濾液および濾物を添加した培地での培養時間は24時間に代えて2時間とした。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図12に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0136】
図12に示すように、hBD−3のmRNA相対発現量について、BはAと比較して大きい傾向があり、CおよびDは、Aと比較して有意に大きかった。
【0137】
これらの結果から、タモギタケ熱水抽出物の濾液は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様にhBD−3の産生を促進する傾向があることが明らかになった。また、タモギタケ熱水抽出物の濾物も、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様にhBD−3の産生を促進することが明らかになった。またタモギタケ熱水抽出物の濾液および濾物がhBD−3の産生を促進する程度は、24時間作用させた場合と比較して、24間作用させた場合の方がやや大きいことが明らかになった。
【0138】
(3)タモギタケ熱水抽出物の超音波処理物
[3−1]タモギタケ熱水抽出物の超音波処理物の調製
実施例1(1)で調製したタモギタケ熱水抽出物20mLをネジ口瓶に入れ、超音波発生器を用いて、40kHzの超音波を50分間照射することにより、タモギタケ熱水抽出物の超音波処理物を得た。
【0139】
[3−2]サンプルの調製および培養
実施例2(1)[1−1]に記載の方法により、A、B、およびCの計3サンプルを調製し、培養した。
【0140】
[3−3]タモギタケ熱水抽出物の超音波処理物を添加した培地での培養
DDWを用いて本実施例(3)[3−1]のタモギタケ熱水抽出物の超音波処理物を希釈して、10%(v/v)の超音波処理物水溶液を調製した。次に、DDW、10%(v/v)の超音波処理物水溶液および本実施例(3)[3−1]のタモギタケ熱水抽出物の超音波処理物を、それぞれ10%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地と、タモギタケ熱水抽出物の超音波処理物を下記の終濃度で含む交換培地とを調製した。本実施例(3)[3−2]の培地を、調製した交換培地に下記のとおり交換した後、実施例2(1)[1−1]に記載の環境下にて、さらに2時間培養した。
【0141】
交換培地に添加したものおよびタモギタケ熱水抽出物の超音波処理物の終濃度
A :DDW (コントロール用交換培地)
B :タモギタケ熱水抽出物の超音波処理物 終濃度 1%(v/v)
C :タモギタケ熱水抽出物の超音波処理物 終濃度10%(v/v)
【0142】
[3−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるhBD−3mRNAの定量
本実施例(3)[3−3]の各サンプルについて、実施例2(1)[1−3]に記載の方法によりRNAの抽出およびcDNAの作製を行った後、実施例2(1)[1−4]に記載の方法により定量PCR法を行い、hBD−3mRNAの定量を行った。また、算出したBおよびCにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図13に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0143】
図13に示すように、hBD−3のmRNA相対発現量について、BおよびCは、Aと比較していずれも大きく、mRNA相対発現量の大きさの順はA<B<Cであった。
【0144】
これらの結果から、タモギタケ熱水抽出物の超音波処理物は、HaCaT細胞に2時間作用させた場合に、hBD−3の産生を促進することが明らかになった。
【0145】
(4)タモギタケ水抽出物
実施例2(3)[3−1]〜[3−3]に記載の方法により、実験を行った。ただし、タモギタケ水抽出物を添加した培地での培養時間は24時間に代えて2時間とした。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図14に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0146】
図14上段に示すように、hBD−1のmRNA相対発現量について、BおよびDは、Aと比較してほとんど変わらなかったが、CおよびEは、Aと比較して有意に大きかった。
【0147】
また、図14中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0148】
また、図14下段に示すように、hBD−3のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、CおよびEは、Aと比較して有意に大きかった。
【0149】
これらの結果から、タモギタケ水抽出物は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様に、hBD−1およびhBD−3の産生を促進することが明らかになった。また、タモギタケ水抽出物がhBD−1およびhBD−3の産生を促進する程度は、2時間作用させた場合と比較して、24時間作用させた場合の方が大きいことが明らかになった。
【0150】
(5)タモギタケ酸性溶媒抽出物
実施例2(4)[4−1]〜[4−3]に記載の方法により、実験を行った。ただし、タモギタケ酸性溶媒抽出物を添加した培地での培養時間は24時間に代えて2時間とした。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図15に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0151】
図15上段に示すように、hBD−1のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、DおよびEは、Aと比較して有意に大きかった。
【0152】
また、図15中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0153】
また、図15下段に示すように、hBD−3のmRNA相対発現量について、CおよびEは、Aと比較してほとんど変わらなかったが、BおよびDは、Aと比較して有意に大きかった。
【0154】
これらの結果から、タモギタケ酸性溶媒抽出物は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様に、hBD−1およびhBD−3の産生を促進することが明らかになった。また、タモギタケ酸性溶媒抽出物がhBD−1の産生を促進する程度は、2時間作用させた場合と24時間作用させた場合とで同程度であり、hBD−3の産生を促進する程度は、2時間作用させた場合と比較して、24時間作用させた場合の方が大きいことが明らかになった。
【0155】
(6)タモギタケ塩基性溶媒抽出物
実施例2(5)[5−1]〜[5−3]に記載の方法により、実験を行った。ただし、タモギタケ塩基性溶媒抽出物を添加した培地での培養時間は24時間に代えて2時間とした。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図16に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0156】
図16上段に示すように、hBD−1のmRNA相対発現量について、B、C、DおよびEは、Aと比較して有意に大きかった。
【0157】
また、図16中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0158】
また、図16下段に示すように、hBD−3のmRNA相対発現量について、BおよびDは、Aと比較してほとんど変わらなかったが、CおよびEは、Aと比較して有意に大きかった。
【0159】
これらの結果から、タモギタケ塩基性溶媒抽出物は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様に、hBD−1およびhBD−3の産生を促進することが明らかになった。また、タモギタケ塩基性溶媒抽出物がhBD−1およびhBD−3の産生を促進する程度は、2時間作用させた場合と24時間作用させた場合とでは、ほとんど変わらないことが明らかになった。
【0160】
(7)タモギタケ由来エルゴチオネイン
実施例2(6)[6−1]〜[6−4]に記載の方法により、実験を行った。ただし、タモギタケ由来エルゴチオネインを添加した培地での培養時間は24時間に代えて2時間とした。また、算出したBおよびCにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図17に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0161】
図17上段、中段および下段に示すように、hBD−1、hBD−2およびhBD−3のmRNA相対発現量のいずれについても、BおよびCは、Aと比較して有意に大きかった。
【0162】
これらの結果から、タモギタケ由来エルゴチオネインは、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様にhBD−1およびhBD−3の産生を促進するのみならず、24時間作用させた場合には促進しなかったhBD−2の産生も促進することが明らかになった。また、タモギタケ由来エルゴチオネインがhBD−1およびhBD−3の産生を促進する程度は、2時間作用させた場合と比較して、24時間作用させた場合の方がやや大きいことが明らかになった。
【0163】
<実施例5>βグルカンまたはマイコプラズマ由来ジアシルリポペプチド(FSL−1)と共にタモギタケ熱水抽出物を添加した場合のヒトβ−ディフェンシン産生促進効果の検討
(1)サンプルの調製および培養
実施例2(1)[1−1]に記載の方法により、A、B、C、D、E、F、GおよびHの計8サンプルを調製した。ただし、HaCaT細胞に代えてNHEK細胞(三光純薬社)を用い、培養時間は3日間に代えて2日間とした。
【0164】
(2)βグルカン、FSL−1およびタモギタケ熱水抽出物を添加した培地での培養
スエヒロタケ由来βグルカン(ソニフィラン;科研製薬社)、大麦由来βグルカン(MP Biomedicals社)、Toll Like Receptor(TLR)−2およびTLR−6のアゴニストであるマイコプラズマ由来ジアシルリポペプチド(FSL−1;InvivoGen社)および実施例1(1)で調製したタモギタケ熱水抽出物を、DDWを用いて希釈またはDDWに溶解し、下記のb、c、d、eおよびgの水溶液を調製した。また、タモギタケ熱水抽出物にスエヒロタケ由来βグルカンまたはFSL−1を溶解することにより、下記のfおよびhのタモギタケ熱水抽出物溶液を調製した。
【0165】
水溶液およびタモギタケ熱水抽出物溶液の濃度
b:スエヒロタケ由来βグルカン 100μg/mL
c:大麦由来βグルカン 100μg/mL
d:FSL−1 100ng/mL
e:タモギタケ熱水抽出物 50%(v/v)
f:タモギタケ熱水抽出物 100%(v/v)+スエヒロタケ由来βグルカン 200μg/mL
g:FSL−1 200μg/mL+スエヒロタケ由来βグルカン 200μg/mL
h:タモギタケ熱水抽出物 100%(v/v)+FSL−1 200μg/mL
【0166】
次に、DDW、調製した各水溶液および各タモギタケ熱水抽出物溶液をそれぞれ5%(v/v)となるようF−P−DMEM培地に添加して、スエヒロタケ由来βグルカン(ソニフィラン;科研製薬社)、大麦由来βグルカン(MP Biomedicals社)、FSL−1(InvivoGen)およびタモギタケ熱水抽出物を下記の終濃度で含む交換培地とコントロール用交換培地とを調製した。本実施例(1)の培地を、調製した交換培地に下記のとおり交換した後、実施例2(1)[1−1]に記載の環境下にて、さらに2時間培養した。
【0167】
交換培地に添加したものおよびその終濃度
A:DDW (コントロール用交換培地)
B:スエヒロタケ由来βグルカン 終濃度10μg/mL
C:大麦由来βグルカン 終濃度10μg/mL
D:FSL−1 終濃度10ng/mL
E:タモギタケ熱水抽出物 終濃度 5%(v/v)
F:タモギタケ熱水抽出物 終濃度5%(v/v)+スエヒロタケ由来βグルカン 終濃度10μg/mL
G:FSL−1 終濃度10ng/mL+スエヒロタケ由来βグルカン 終濃度10μg/mL
H:タモギタケ熱水抽出物 終濃度5%(v/v)+FSL−1 終濃度10ng/mL
【0168】
(3)RNAの抽出およびcDNAの作製、ならびに定量PCR法によるhBD−2mRNAおよびhBD−3mRNAの定量
本実施例(2)の各サンプルについて、実施例2(1)[1−3]に記載の方法によりRNAの抽出およびcDNAの作製を行った後、実施例2(1)[1−4]に記載の方法により定量PCR法を行い、hBD−2mRNAおよびhBD−3mRNAの定量を行った。また、算出したB、C、D、E、F、GおよびHにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図18に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0169】
図18上段に示すように、hBD−2のmRNA相対発現量について、B、C、D、EおよびHのいずれも、Aと比較してやや大きく、FおよびGは、Aと比較して顕著に大きかった。
【0170】
また、図18下段に示すように、hBD−3のmRNA相対発現量についても、hBD−2と同様、B、C、D、Eのいずれも、Aと比較してやや大きく、FおよびGは、Aと比較して顕著に大きかった。
【0171】
これらの結果から、タモギタケ熱水抽出物は、βグルカンと共に作用させることにより、hBD−2およびhBD−3の産生を促進する効果が向上することが明らかになった。
【0172】
<実施例6>口腔カンジダ症モデルマウスにおける抗菌効果の確認
(1)タモギタケ熱水抽出物を含有する口腔用ジェルの調製 実施例1(1)で調製したタモギタケ熱水抽出物と白色ワセリン(ヤクハン製薬社)とを歯科用ダッペングラスに入れ、プラスチックのセメントスパチュラを用いて攪拌・混合することにより、タモギタケ熱水抽出物を60%(w/w)含有する口腔用ジェルを調製した。
【0173】
(2)口腔カンジダ症モデルマウスの作製
既報(Takakuraら、Microbiol.Immunol.、第47巻、第5号、第321−326頁、2003年)に従い、口腔カンジダ症モデルマウスを作製した。具体的には、6週齢のC3H/HeJJcl雄マウス(日本クレア社)15匹に、マウス体重1kg当たり100mgの量のプレドニゾロンを皮下注射した。続いて、滅菌した水道水に塩酸クロルテトラサイクリンを0.83mg/mLとなるよう添加したものを飲料水として自由摂取させながら24時間飼育した後、マウス1個体あたり、2mg/mLのクロルプロマジン塩酸塩水溶液50mLを大腿部に筋肉注射した。30分経過後、1×108cfu/mLのカンジダ菌(Candida albicans ATCC90028株)懸濁液を滅菌綿棒に付着させ、これを用いてマウスの舌と口腔内へカンジダ菌の播種を行った。
【0174】
(3)タモギタケ熱水抽出物を含有する口腔用ジェルの投与
本実施例(2)のマウス15匹を7匹と8匹とに分け、7匹からなる群をコントロール群、8匹からなる群をジェル投与群として、各群のマウスを3日間飼育した。この間、ジェル投与群にのみ、本実施例(1)の口腔用ジェルを1匹当たり0.05g、口腔内に塗布することを1日3回行った。
【0175】
(4)カンジダ菌数の測定
本実施例(3)の各群のマウスから舌を摘出し、舌の重量100mgあたり1mLの生理食塩水を添加してホモジナイズし、懸濁液とした。この懸濁液100μLについて、CHIROMagar選択培地(CHIROMagar社)を用いて定法に従い平板法を行うことにより、カンジダ菌生菌数を測定し、群ごとに生菌数の平均値と標準偏差を求めた。また、算出したジェル投与群における結果について、コントロール群における結果との間でマンホイットニーのU検定を行った。その結果を図19に示す。図中の*は、検定の結果、統計的に有意であることを示す(p<0.05)。
【0176】
図19に示すように、ジェル投与群におけるカンジダ菌の生菌数は、コントロール群におけるカンジダ菌の生菌数と比較して顕著に少なく、コントロール群におけるカンジダ菌の生菌数を100%とすると、ジェル投与群におけるカンジダ菌の生菌数は77.5%であった。すなわち、タモギタケ熱水抽出物を含有する口腔用ジェルは、口腔カンジダ症モデルマウスの口腔内におけるカンジダ菌の増殖を抑制することが確認された。
【0177】
この結果から、タモギタケ熱水抽出物を含有する口腔用ジェルは、口腔カンジダ症の予防または治療に有効であることが明らかになった。
【技術分野】
【0001】
本発明は、タモギタケ抽出物を有効成分とする抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤に関し、より詳細には、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドの少なくともいずれかを有効成分とする、抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤に関する。
【背景技術】
【0002】
タモギタケ(Pleurotus cornucopiae var. citrinopileatus)はキシメジ科ヒラタケ属に属するキノコである。タモギタケは主に北海道や東北において自生し、食用に用いられており、近年は人工栽培品も販売されている。
【0003】
タモギタケは食品産業、健康産業、化粧品産業、医薬品産業などにおいて有用な種々の成分を有することが知られており、例えば、特許文献1にはタモギタケの水抽出物を有効成分とする抗菌剤が、特許文献2および特許文献3には本発明者らによりタモギタケの熱水抽出物を有効成分とする抗腫瘍性免疫賦活剤ならびにタモギタケ由来のセラミドを有効成分とする皮膚炎治療剤および皮膚保湿剤が、特許文献4にはタモギタケ由来のエルゴチオネインを有効成分とする抗酸化剤、チロシナーゼ活性阻害剤、リパーゼ活性阻害剤、5α−レダクターゼ活性阻害剤、抗老化剤および抗メタボリックシンドローム剤が、特許文献5にはタモギタケ由来のエルゴステロールパーオキサイドを有効成分とする食品用の変色防止・酸化防止剤がそれぞれ開示されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2007−1961号
【特許文献2】国際公開WO2006/038527号パンフレット
【特許文献3】特開2007−308394号
【特許文献4】特開2009−126863号
【特許文献5】特開2009−183266号
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、特許文献1に開示されているタモギタケの水抽出物を有効成分とする抗菌剤は、培養培地において菌の増殖を抑制することが示されているに過ぎず、動物個体で菌の増殖を抑制することは示されていない。また、特許文献2〜特許文献5に記載のタモギタケ熱水抽出物、タモギタケ由来のセラミド、タモギタケ由来のエルゴチオネインおよびタモギタケ由来のエルゴステロールパーオキサイドはいずれも、抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤として用いられているものではない。
【0006】
本発明は、上述の問題点を解決するためになされたものであって、菌の増殖抑制効果を備えるなどの優れた抗菌活性を有し、かつ、食用キノコであるタモギタケ由来であることから高い安全性を有する抗菌剤、ヒトにおいて各種ヒトβディフェンシンの産生を促進することができるβディフェンシン産生促進剤、ならびにカンジダ症予防および/または治療剤を提供することを目的としている。
【課題を解決するための手段】
【0007】
本発明者らは、鋭意研究の結果、タモギタケの熱水抽出物が培養培地および口腔カンジダ症モデルマウスの口腔内においてカンジダ菌の増殖を抑制すること、ならびにタモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドがβディフェンシンの産生を促進することを見出し、下記の各発明を完成した。
【0008】
(1)タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする抗菌剤。
【0009】
(2)水系溶媒抽出物が熱水抽出物である、(1)に記載の抗菌剤。
【0010】
(3)タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とするβディフェンシン産生促進剤。
【0011】
(4)βディフェンシンがヒトβディフェンシン−1、ヒトβディフェンシン−2およびヒトβディフェンシン−3からなる群から選択される1または2以上のβディフェンシンである、(3)に記載のβディフェンシン産生促進剤。
【0012】
(5)水系溶媒抽出物が熱水抽出物である、(3)または(4)に記載のβディフェンシン産生促進剤。
【0013】
(6)タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とするカンジダ症予防および/または治療剤。
【0014】
(7)口腔乾燥症の患者に用いる、(6)に記載のカンジダ症予防および/または治療剤。
【0015】
(8)水系溶媒抽出物が熱水抽出物である、(6)または(7)に記載のカンジダ症予防および/または治療剤。
【発明の効果】
【0016】
本発明によれば、菌の増殖抑制効果を備えるなどの優れた抗菌活性を有し、かつ、食用キノコであるタモギタケ由来であることから高い安全性を有する抗菌剤、ヒトにおいて各種ヒトβディフェンシンの産生を促進することができるβディフェンシン産生促進剤、ならびにカンジダ症予防および/または治療剤を得ることができる。
【図面の簡単な説明】
【0017】
【図1】タモギタケ熱水抽出物を添加した培地でカンジダ菌を培養した後、培地の濁度を測定した結果を示す図である。縦軸は濁度(600nmにおける吸光度)を、横軸はタモギタケ熱水抽出物の添加濃度を変えた各サンプルを示す。
【図2】タモギタケ熱水抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ熱水抽出物の添加濃度を変えた各サンプルを示す。
【図3】タモギタケ熱水抽出物の濾液、濾物およびタモギタケ熱水抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸は交換培地にタモギタケ熱水抽出物の濾液、濾物およびタモギタケ熱水抽出物を添加した各サンプルを示す。
【図4】タモギタケ水抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ水抽出物の添加濃度を変えた各サンプルを示す。
【図5】タモギタケ酸性水系溶媒抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ酸性水系溶媒抽出物の添加濃度を変えた各サンプルを示す。
【図6】タモギタケ塩基性水系溶媒抽出物を添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ塩基性水系溶媒抽出物の添加濃度を変えた各サンプルを示す。
【図7】タモギタケ由来エルゴチオネインを添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ由来エルゴチオネインの添加濃度を変えた各サンプルを示す。
【図8】タモギタケ由来エルゴステロールパーオキサイドを添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ由来エルゴステロールパーオキサイドの添加濃度を変えた各サンプルを示す。
【図9】タモギタケ由来グルコシルセラミドを添加した培地で24時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ由来グルコシルセラミドの添加濃度を変えた各サンプルを示す。
【図10】タモギタケ熱水抽出物を添加した培地で24時間培養したNHEK細胞における、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ熱水抽出物の添加濃度を変えた各サンプルを示す。
【図11】タモギタケ熱水抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ熱水抽出物の添加濃度を変えた各サンプルを示す。
【図12】タモギタケ熱水抽出物の濾液、濾物およびタモギタケ熱水抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸は交換培地にタモギタケ熱水抽出物の濾液、濾物およびタモギタケ熱水抽出物を添加した各サンプルを示す。
【図13】タモギタケ熱水抽出物の超音波処理物を添加した培地で2時間培養したHaCaT細胞における、hBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ熱水抽出物の超音波処理物の添加濃度を変えた各サンプルを示す。
【図14】タモギタケ水抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ水抽出物の添加濃度を変えた各サンプルを示す。
【図15】タモギタケ酸性水系溶媒抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ酸性水系溶媒抽出物の添加濃度を変えた各サンプルを示す。
【図16】タモギタケ塩基性水系溶媒抽出物を添加した培地で2時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ塩基性水系溶媒抽出物の添加濃度を変えた各サンプルを示す。
【図17】タモギタケ由来エルゴチオネインを添加した培地で2時間培養したHaCaT細胞における、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸はタモギタケ由来エルゴチオネインの添加濃度を変えた各サンプルを示す。
【図18】スエヒロタケ由来βグルカンまたはマイコプラズマ由来ジアシルリポペプチド(FSL−1)と共にタモギタケ熱水抽出物を添加した培地で2時間培養したNHEK細胞における、hBD−2およびhBD−3のmRNA相対発現量を示す図である。縦軸はmRNAの相対発現量を、横軸は交換培地にスエヒロタケ由来βグルカン、大麦由来βグルカン、FSL−1、タモギタケ熱水抽出物、タモギタケ熱水抽出物+スエヒロタケ由来βグルカン、FSL−1+スエヒロタケ由来βグルカンおよびタモギタケ熱水抽出物+FSL−1を添加した各サンプルを示す。
【図19】タモギタケ熱水抽出物を含有する口腔用ジェルを投与した口腔カンジダ症モデルマウスの舌における、カンジダ菌の生菌数を示すグラフである。縦軸はカンジダ菌の生菌数を、横軸は口腔用ジェルを投与しなかった群(コントロール群)および口腔用ジェルを投与した群(ジェル投与群)を示す。
【発明を実施するための形態】
【0018】
以下、本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤について詳細に説明する。本発明に係る抗菌剤は、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする。
【0019】
本発明において、タモギタケは天然に自生しているものでもよく、人工栽培されたものでもよい。また、生のタモギタケでもよく、乾燥させたものや、乾燥させた上で粉末にしたものなど、採取した後に加工を施されたものでもよい。
【0020】
本発明において、タモギタケの水系溶媒抽出物とは、水系溶媒によりタモギタケから抽出された成分を含有する液体状、半固体状または固体状の物質、もしくはこれらの物質から選択される1または2以上の物質の混合物をいう。ここで、本発明において、水系溶媒とは極性溶媒を主体とした溶媒であれば特に限定されず、1種類の溶媒からなるものでもよく、2種類以上の溶媒を混合したものでもよい。そのような極性溶媒としては、例えば、水、メタノール、エタノール、酢酸、ギ酸、1−ブタノール、1−プロパノール、2−プロパノールなどを挙げることができるが、水が好ましい。
【0021】
また、本発明において、水系溶媒は、水または水系溶媒に予め適当な溶質を混合または溶解させて水系溶媒としてもよく、そのような水系溶媒としては、例えば、水にクエン酸を混合または溶解させたもの、水に重曹を混合または溶解させたもの、食塩を酢酸に混合または溶解させたものなどを挙げることができるが、クエン酸水溶液、重曹水溶液および食塩酢酸溶液が好ましい。
【0022】
また、本発明において、水系溶媒は、酸性、中性および塩基性のいずれでもよく、水系溶媒の温度もまた、その機能が損なわれない限りにおいて特に限定されず、低温の他、常温、高温でもよい。なお、本発明においては、熱水を好適な水系溶媒として用いることができる。
【0023】
本発明において、タモギタケの水系溶媒抽出物は定法に従い製造することができ、例えば、水系溶媒にタモギタケを投入し、加熱または粉砕・攪拌した後、濾過などにより固液分離し、液体成分を回収することにより製造することができる。製造されたタモギタケの水系溶媒抽出物は、さらに、限外濾過や超音波処理などを行ってもよく、そのような限外濾過物(濾液および濾物)や超音波処理物などもまた、タモギタケの水系溶媒抽出物であり、本発明に包含される。
【0024】
本発明において、タモギタケから抽出されるグルコシルセラミドは、当業者が適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、茹でたタモギタケを乾燥させ、粉砕して粉末としたものをエタノールに入れて加熱・抽出し、得られた抽出液をNaOH水溶液によりケン化した後、希塩酸によりpHを調整し、遠心分離を行って上清を除去したものにエタノールを添加して沈殿物を回収し、この沈殿物について、シリカゲルカラムとクロロホルム/メタノール溶液とを用いてカラムクロマトグラフィーによる精製を繰り返すという方法を挙げることができる。
【0025】
本発明において、タモギタケから抽出されるエルゴチオネインもまた、当業者により適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、タモギタケを煮出して得た煮汁をイオン交換樹脂に供した後、その樹脂から陽イオン性化合物を溶出し、溶出液を濃縮し、これを高速液体クロマトグラフィーにより分離・精製し、凍結乾燥するという方法を挙げることができる。
【0026】
本発明において、タモギタケから抽出されるエルゴチステロールパーオキサイドもまた、当業者により適宜選択することができる公知あるいは新たな手法に従って製造することができ、例えば、上述のグルコシルセラミドを製造する方法と同様の方法を行い、カラムクロマトグラフィーによる精製の際に、グルコシルセラミドに代えてエルゴステロールパーオキサイドを含む溶出液を選択するという方法を挙げることができる。
【0027】
本発明において、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドの製造の際には、必要とする純度や形状などに応じて、粉砕、精製、濃縮、乾燥、滅菌などを行ってもよい。
【0028】
粉砕方法としては、例えば、ロール式粉砕機などにより押しつぶす方法、フードプロセッサーなどにより切断する方法、ボールミル粉砕機などにより磨り潰す方法、ハンマー式粉砕機などにより打撃を与えて粉砕する方法などを、精製方法としては、例えば、濾過法、蒸留法、再結晶法、再沈殿法、各種のクロマトグラフィーを用いた方法などを、濃縮方法としては、例えば、煮沸濃縮法、エバポレーターなどによる真空濃縮(減圧濃縮)法、凍結濃縮法、逆浸透膜などを用いた膜濃縮法などを、滅菌方法としては、例えば、オートクレーブを用いた方法、高周波法、フィルター濾過法などを、それぞれ挙げることができる。
【0029】
本発明に係る抗菌剤は、微生物の増殖を抑制する作用を有しているが、本発明において、「微生物の増殖を抑制する」とは、微生物の分裂を抑制することにより増殖を抑制する場合のほか、微生物を殺傷することにより増殖を抑制する場合が含まれる。
【0030】
また、「微生物の増殖を抑制する作用」には、微生物に直接的に働きかけることにより微生物の増殖を抑制する作用(直接的作用)のほか、生体の抗菌ペプチド産生細胞に作用して抗菌ペプチドの産生を促進させ、産生された抗菌ペプチドが微生物の増殖を抑制する作用(間接的作用)が含まれる。
【0031】
なお、本発明において「増殖を抑制する」は、「増殖を阻害する」、「増殖を阻止する」、「増殖を予防する」と、「産生を促進する」は、「産生を増大させる」、「産生を増強させる」、「産生を増進する」、「産生を亢進する」、「産生を刺激する」、「産生能を賦活する」と交換可能に用いられる。
【0032】
抗菌ペプチドとは、微生物からヒトを含めた動物や植物まで、幅広い生物の細胞において産生され、微生物に対する殺傷作用、あるいは分裂の抑制、阻害などのような静菌的作用を有するペプチドの総称である。なお、本発明において抗菌ペプチドは特に限定されず、例えば、αディフェンシン、βディフェンシン、θディフェンシン、Cathelicidin、ダームシジン、Hepcidin/LEAP−1、ヒスタチンなどを挙げることができる。
【0033】
すなわち、本発明に係る抗菌剤は、微生物の増殖抑制や、微生物により引き起こされる疾病の予防や治療に有効であり、例えば、ヒトを含む動物に対して医薬品や医薬部外品に添加、配合して用いることができるほか、農作物などの植物の疫病を防ぐ農薬に用いることができる。また、微生物は、細菌や真菌のみならず、例えば、ウイルス、ウイロイド、リケッチア、クラミジア、マイコプラズマ、スピロヘータ、原虫、蠕虫など、あらゆる微生物を挙げることができる。このような微生物により引き起こされる疾病としては、微生物の感染による感染症のほか、微生物の生産する毒素による中毒症やアレルギー症などを挙げることができ、例えば、カンジダ症、クリプトコッカス感染症、アスペルギルス症、ニューモシスチス肺炎、う蝕、食中毒、HIV感染症、白癬(水虫、たむし、しらくもなど)、とびひ、水痘、ヘルペスウィルス感染症、サイトメガロウイルス感染症、MRSA感染症、緑膿菌感染症、レジオネラ肺炎、セラチア感染症、トキソプラズマ症、クリプトスポリジウム症などを挙げることができる。
【0034】
本発明に係る抗菌剤はまた、食品や化粧料に添加して、その保存性を高めるために用いることができるほか、物品に添加、配合して腐食を防ぐため、衛生的状態を保持するため、あるいは悪臭を防ぐために用いることができる。
【0035】
次に、本発明は、βディフェンシン産生促進剤を提供する。本発明に係るβディフェンシン産生促進剤は、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする。
【0036】
抗菌ペプチドの一種であるディフェンシンは、分子内にシステイン残基を有し、それがジスルフィド結合により高次構造を形成していることを特徴とする抗菌ペプチドのファミリーのひとつであり、αディフェンシン、βディフェンシンおよびθディフェンシンに大別される。ディフェンシンは、陽性荷電しているため、陰性に荷電した菌体膜に挿入されて小孔を形成し、菌体内容物が小孔から流出することにより抗菌作用を発揮することが知られている。
【0037】
βディフェンシンは、生体内において主に白血球や上皮細胞から産生されるディフェンシンであり、近年、局所の感染防御のみならず、上皮組織の組織修復や樹状細胞、Tリンパ球、単球などを遊走させることによる獲得免疫にも関与していることが報告されている(Yang D.ら、Science、第286巻、第525頁、1999年;Territo M.C.ら、J.Clin.Invest.第84巻、第2017頁、1989年;Lillard J.W.Jr.ら、Proc.Natl.Acad.Sci.、第96巻、第651頁、1999年;長岡 功ら、臨床免疫、第33巻、第577頁、2000年)。また、腫瘍免疫を誘導して、抗腫瘍効果を発揮することやガン細胞で増殖抑制作用があることも報告されている(長岡 功ら、臨床免疫、第40巻、第4号、第424頁、2003年;Byragyn Aら、J.Immunol.、第167巻、第6644頁、2001年)。
【0038】
すなわち、本発明に係るβディフェンシン産生促進剤は、微生物により引き起こされる疾病の予防や治療に有効であり、例えば、ヒトを含む動物に対して医薬品や医薬部外品に添加、配合して用いることができるほか、農作物などの植物の疫病を防ぐ農薬に用いることができる。また、本発明に係るβディフェンシン産生促進剤は、感染、炎症その他の傷害からの回復、癌の治療、免疫増強、荒れ肌・乾燥肌・手荒れなどのスキンケア、口臭防止、足臭防止などのために用いることができる。
【0039】
本発明において、βディフェンシンの種類としては、例えば、βディフェンシン−1、βディフェンシン−2、βディフェンシン−3、βディフェンシン−4などを挙げることができ、由来する生物としては、例えば、Lactococcus lactisなどの細菌、アシタバ、カラシナなどの植物、クロチャワンタケなどの菌類、クモ、サソリ、トンボなどの昆虫、イガイなどの軟体動物、イセエビなどの甲殻類、ニワトリなどの鳥類、カエルなどの両生類、ヒト、サル(ヒトを除く霊長目)、牛、ブタ、羊、ヤギ、イヌ、ネコなどの哺乳類などを挙げることができるが、ヒトが好ましい。
【0040】
次に、本発明は、カンジダ症予防および/または治療剤を提供する。本発明に係るカンジダ症予防および/または治療剤は、タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする。
【0041】
カンジダ症はC.albicansに代表されるカンジダ菌により引き起こされる感染症である。カンジダ菌はヒトの体表や消化管、膣粘膜などに常時生息しており、健常人には特に何の影響も与えないが、体調が悪いときや免疫力が低下しているときなどに、疾病を引き起こす日和見感染菌である。本発明に係るカンジダ症予防および/または治療剤は、カンジダ菌に直接的に働きかけることによってその増殖を抑制する作用(直接的作用)のほか、生体の抗菌ペプチド産生細胞に作用して抗菌ペプチドの産生を促進させ、産生された抗菌ペプチドがカンジダ菌の増殖を抑制する作用(間接的作用)を有している。
【0042】
本発明におけるカンジダ症としては、例えば、皮膚カンジダ症、口腔カンジダ症、性器カンジダ症、口内炎、口角炎、胃鼓脹症、カンジダ敗血症などを挙げることができ、このうちの口腔カンジダ症は、口腔乾燥症(ドライマウス)の患者に頻発することが知られている。口腔乾燥症(ドライマウス)は口腔内が乾燥して、喉や口の渇き、痛み、口臭、味覚異常などの症状を呈する疾病であるが、口腔内の乾燥は、粘膜上皮の抵抗力低下や口腔内常在菌のバランスの崩れを招くことから、カンジダ菌が口腔上皮内に侵入して口腔カンジダ症を引き起こすと考えられている。本発明に係るカンジダ症および/または治療剤は、このような口腔カンジダ症に、特に有効である。
【0043】
本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤の製剤化には、当業者に公知の方法を用いることができる。投与形態もまた、当業者によって適宜選択することができる投与形態でよく、そのような投与形態としては、例えば、経口投与製剤として調製する場合の、錠剤、顆粒剤、散剤、カプセル剤、コーティング剤、液剤、懸濁剤などの形態を挙げることができ、非経口投与製剤にする場合の、ジェル剤、吸入剤、注射剤、点滴剤、座薬、塗布剤、噴霧剤、貼付剤、軟膏、クリームなどの形態を挙げることができる。また、その投与量は、医薬組成物の製剤形態、投与方法、使用目的およびこれに適用される投与対象の年齢、体重、症状によって適宜設定することができる。
【0044】
皮膚外用剤として用いられる場合は、その剤型は適宜選択することができ、例えば、溶液系、可溶化系、乳化系、粉末分散系、水−油二層系、水−油−粉末三層系、ジェル、ミスト、スプレー、ムース、ロールオン、スティックなどの他、不織布などのシートに含浸ないし塗布した製剤などを挙げることができる。また、本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤に、例えば、植物油などの油脂類、ラノリンやミツロウなどのロウ類、炭化水素類、脂肪酸、高級アルコール類、エステル類、各種界面活性剤、色素、香料、ビタミン類、植物や動物の抽出成分、紫外線吸収剤、抗酸化剤、防腐剤、殺菌剤などの、通常の皮膚外用剤の原料として使用されているものを適宜配合し、皮膚外用剤を製造することができる。また、抗炎症性の皮膚外用剤原料であるグリチルレチン酸などの甘草抽出成分、塩酸ジフェンヒドラミン、アズレン、dl−α−トコフェロールおよびその誘導体、ビタミンB2、ビタミンB6などとともに用いることができる。
【0045】
食品添加物として用いられる場合は、その形態は適宜選択することができ、例えば、本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤をそのまま食品として調製したもの、他の食品に添加したもの、あるいは、カプセル、錠剤等、食品または健康食品に通常用いられる任意の形態を挙げることができる。また、食品中に配合して摂取あるいは投与する場合には、適宜、賦形剤、増量剤、結合剤、増粘剤、乳化剤、着色料、香料、食品添加物、調味料などと混合し、用途に応じて、粉末、顆粒、錠剤等の形に成形することができる。さらには、食品原料中に混合して食品を調製し、機能性食品として製品化することによって摂取することができる。
【0046】
以下、本発明に係る抗菌剤、βディフェンシン産生促進剤ならびにカンジダ症予防および/または治療剤について、実施例に基づいて説明する。なお、本発明の技術的範囲は、これらの実施例によって示される特徴に限定されない。
【実施例】
【0047】
<実施例1>カンジダ菌増殖抑制効果の確認
(1)タモギタケ熱水抽出物の調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して150Lの濾液を得ることにより、タモギタケ熱水抽出物を調製した。
【0048】
(2)サンプルの調製
6ウェルプレート(IWAKI社)の各ウェルにブレインハートフュージョン培地(BHI培地;栄研化学社)を入れたものを4枚準備し、A、B、CおよびDとして、計4サンプルを調製した。各サンプルの各ウェルに、カンジダ菌(Candida albicans ATCC90028株)を、培養液の600nmにおける吸光度が0.01〜0.05となるよう植菌した後、B、CおよびDの各ウェルに、本実施例(1)で調製したタモギタケ熱水抽出物を、それぞれ、6%(v/v)、8%(v/v)および60%(v/v)となるように添加した。なお、何も添加しないAのウェルをコントロールとした。
【0049】
(3)カンジダ菌の培養および濁度の測定
本実施例(2)のA、B、CおよびDを25℃にて16時間培養した。次に、カンジダ菌生菌数の指標として、培養後の培地について、分光光度計(BioRad社)を用いて波長600nmにおける吸光度を測定することにより、濁度を求めた。続いて、サンプルごとに各ウェルにおける濁度の平均値と標準偏差を算出した。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図1に示す。図中の*は、検定の結果、統計的に有意であることを示す(p<0.05)。
【0050】
図1に示すように、濁度の大きさはA>B>C>Dであり、Aにおける濁度を100%とすると、B、CおよびDにおける濁度はそれぞれ約92%、約82%および58〜71%であった。すなわち、培地に添加したタモギタケ熱水抽出物の濃度が大きい場合ほど、カンジダ菌の生菌数が小さいことが確認された。
【0051】
これらの結果から、タモギタケ熱水抽出物はカンジダ菌の増殖を抑制することが明らかになった。
【0052】
<実施例2>ヒトβ−ディフェンシン産生促進効果の検討
(1)タモギタケ熱水抽出物のヒトβ−ディフェンシン産生促進効果の検討
[1−1]サンプルの調製および培養
ウシ胎児血清(FBS;Gibco−BRL社)およびペニシリン・ストレプトマイシン(シグマ社)をそれぞれ10%(v/v)および2%(v/v)の終濃度で含むDMEM培地(シグマ社)を調製し、F−P−DMEM培地とした。F−P−DMEM培地に、ヒト不死化ケラチノサイト細胞(HaCaT細胞;東京歯科大学病理学講座村松敬氏提供)を1×105個/mLとなるよう添加して、細胞懸濁液を調製した。この細胞懸濁液3mLを60mmディッシュ(IWAKI社)に入れたものを5枚準備し、A、B、C、DおよびEとして、計5サンプルを調製した。続いて、各サンプルを37℃、CO25%(v/v)の環境下にて、80%コンフルエントに達するまで、約3日間培養した。
【0053】
[1−2]タモギタケ熱水抽出物を添加した培地での培養
実施例1(1)で調製したタモギタケ熱水抽出物を、DDWを用いて希釈して、それぞれ、2%(v/v)、20%(v/v)および40%(v/v)の熱水抽出物水溶液を調製した。次に、DDW、2%(v/v)、20%(v/v)、40%(v/v)の熱水抽出物水溶液および実施例1(1)で調製したタモギタケ熱水抽出物をそれぞれ25%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地とタモギタケ熱水抽出物を下記の終濃度で含む交換培地とを調製した。本実施例(1)[1−1]の各サンプルの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0054】
交換培地に添加したものおよびタモギタケ熱水抽出物の終濃度
A :DDW (コントロール用交換培地)
B :タモギタケ熱水抽出物 終濃度0.5%(v/v)
C :タモギタケ熱水抽出物 終濃度 5%(v/v)
D :タモギタケ熱水抽出物 終濃度 10%(v/v)
E :タモギタケ熱水抽出物 終濃度 25%(v/v)
【0055】
[1−3]RNAの抽出およびcDNAの作製
本実施例(1)[1−2]の各サンプルから細胞を回収した後、TRIzol reagent(Invitrogen社)を用いて細胞中の全RNAを抽出した。続いて、抽出した全RNAの10%(v/v)容量のクロロホルムを添加して、13000rpm、4℃の条件下で10分間遠心分離を行った後、水層を回収した。次に、等量のイソプロパノールを添加して、13000rpm、4℃の条件下で10分間遠心分離を行った後、上清を除去し、70%(v/v)エタノール600μLを添加して沈殿物を洗浄した。その後、沈殿物を滅菌DEPC処理水に溶解し、全RNA溶液を得た。この全RNA溶液から適量を分取し、分光光度計NanoDrop ND−1000(NanoDrop products社)を用いて波長260nmにおける吸光度を測定することにより、濃度を測定した。
【0056】
続いて、全RNA2μgを含む全RNA溶液を鋳型として、オリゴdT12−18プライマー(Invitrogen社)およびSuperScript逆転写酵素(Invitrogen社)を用いて、付属の使用書に従い、cDNAを作製した。
【0057】
[1−4]定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(1)[1−3]のcDNAを鋳型として、ヒトβ−ディフェンシン−1(hBD−1)、ヒトβ−ディフェンシン−2(hBD−2)、ヒトβ−ディフェンシン−3(hBD−3)およびグリセルアルデヒド3リン酸脱水素酵素(GAPDH)について、Taq Man 7300 Real−Time PCR System(Applied Biosystems社)およびTaq Man Universal Master Mix(Applied Biosystems社)を用いて、付属の使用書に従い、定量PCR法を行い、一定の増幅産物量になるサイクル数(Ct値)を測定した。定量PCR法に用いたプライマーおよびプローブは下記のとおりである。
【0058】
定量PCRに用いたプライマー・プローブ
Taq Man Gene Expression Assays(Applied Biosystems社);
hBD−1の増幅に用いたプライマー・プローブ:AssayID Hs00608345_m1
hBD−2の増幅に用いたプライマー・プローブ:AssayID Hs00823638_m1
hBD−3の増幅に用いたプライマー・プローブ:AssayID Hs00218678_m1
GAPDHの増幅に用いたプライマー・プローブ:AssayID Hs99999905_m1
【0059】
続いて、測定した結果に基づき、AにおけるCt値を基準値とし、GAPDHのCt値を内在コントロールとして比較Ct法を行うことにより、hBD−1、hBD−2およびhBD−3のmRNA相対発現量を算出した。
【0060】
本実施例(1)[1−1]〜[1−4]の実験を3回以上繰り返し、各サンプルにおけるhBD−1、hBD−2およびhBD−3のmRNA相対発現量について、平均値および標準偏差を算出した。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図2に示す。図中の*は、検定の結果、統計的に有意であることを示す(p<0.05)。
【0061】
図2上段に示すように、hBD−1のmRNA相対発現量について、B、C、DおよびEのいずれも、Aとほとんど変わらなかった。
【0062】
また、図2中段に示すように、hBD−2のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、CおよびEは、Aと比較して大きい傾向があり、DはAと比較して有意に大きかった。すなわち、タモギタケ熱水抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−2のmRNA発現量が増加することが確認された。
【0063】
また、図2下段に示すように、hBD−3のmRNA相対発現量について、BおよびEは、Aと比較して大きい傾向があり、CおよびDは、Aと比較して有意に大きかった。すなわち、タモギタケ熱水抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0064】
これらの結果から、タモギタケ熱水抽出物は、HaCaT細胞に24時間作用させた場合に、hBD−2およびhBD−3の産生を促進することが明らかになった。
【0065】
(2)タモギタケ熱水抽出物の濾液および濾物のヒトβ−ディフェンシン産生促進効果の検討
[2−1]タモギタケ熱水抽出物の濾液および濾物の調製
実施例1(1)で調製したタモギタケ熱水抽出物150mLについて、分画分子量1000の限外濾過膜を用いて限外濾過を行い、25mLの濾液および濾物(乾燥重量;0.2g)を得た。
【0066】
[2−2]サンプルの調製および培養
本実施例(1)[1−1]に記載の方法により、A、B、CおよびDの計4サンプルをを調製し、培養した。
【0067】
[2−3]タモギタケ熱水抽出物の濾液および濾物を添加した培地での培養
本実施例(2)[2−1]の濾物をDDWに溶解し、1mg/mLの濾物水溶液を調製した。次に、DDW、本実施例(2)[2−1]の濾液、濾物水溶液および実施例1(1)で調製した熱水抽出物をそれぞれ10%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地と濾液、濾物およびタモギタケ熱水抽出物を含む交換培地とを調製した。本実施例(2)[2−2]のA、B、CおよびDの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0068】
交換培地に添加したもの
A :DDW(コントロール用交換培地)
B :濾液
C :濾物
D :タモギタケ熱水抽出物
【0069】
[2−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるhBD−3mRNAの定量
本実施例(2)[2−3]の各サンプルについて、本実施例(1)[1−3]に記載の方法によりRNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、hBD−3mRNAの定量を行った。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図3に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0070】
図3に示すように、hBD−3のmRNA相対発現量について、その大きさはA<B<C<Dであり、B、CおよびDは、Aと比較していずれも有意に大きかった。
【0071】
これらの結果から、タモギタケ熱水抽出物について、分画分子量1000の限外濾過膜を通過した画分(濾液)とそれを通過しなかった画分(濾物)とは、いずれもHaCaT細胞に24時間作用させた場合に、hBD−3の産生を促進することが明らかになった。
【0072】
(3)タモギタケ水抽出物のヒトβ−ディフェンシン産生促進効果の検討
[3−1]タモギタケ水抽出物の調製
フードプロセッサーに生のタモギタケ100gと水100gとを投入し、粉砕した後、濾布を用いて濾過し、70mLの濾液を得た。得られた濾液のpHを測定したところ、pH6.08であった。続いて、オートクレーブ装置を用いて、濾液を120℃で15分間滅菌処理した。
【0073】
[3−2]サンプルの調製および培養、ならびにタモギタケ水抽出物を添加した培地での培養
本実施例(1)[1−1]に記載の方法により、A、B、C、DおよびEの計5サンプルを調製し、培養した。続いて、実施例1(1)で調製したタモギタケ熱水抽出物に代えて、本実施例(3)[3−1]で調製したタモギタケ水抽出物を用いて、本実施例(1)[1−2]に記載の方法により、タモギタケ水抽出物を添加した培地での培養を行った。
【0074】
[3−3]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(3)[3−2]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図4に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0075】
図4上段に示すように、hBD−1のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、C、DおよびEは、Aと比較して有意に大きかった。すなわち、タモギタケ水抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−1のmRNA発現量が増加することが確認された。
【0076】
また、図4中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0077】
また、図4下段に示すように、hBD−3のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、DおよびEは、Aと比較して有意に大きかった。すなわち、タモギタケ水抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0078】
これらの結果から、タモギタケ水抽出物は、HaCaT細胞に24時間作用させた場合に、hBD−1およびhBD−3の産生を促進することが明らかになった。
【0079】
(4)タモギタケ酸性溶媒抽出物のヒトβ−ディフェンシン産生促進効果の検討
[4−1]タモギタケ酸性溶媒抽出物の調製
水を0.4%(w/w)クエン酸水溶液に代えて、本実施例(3)[3−1]に記載の方法によりタモギタケの抽出物を調製し、これをタモギタケ酸性溶媒抽出物とした。なお、オートクレーブによる滅菌処理を行う前の濾液のpHは、pH4.61であった。
【0080】
[4−2]サンプルの調製および培養、ならびにタモギタケ酸性溶媒抽出物を添加した培地での培養
本実施例(1)[1−1]に記載の方法により、A、B、C、DおよびEの計5サンプルをを調製し、培養した。続いて、実施例1(1)で調製したタモギタケ熱水抽出物に代えて、本実施例(4)[4−1]で調製したタモギタケ酸性溶媒抽出物を用いて、本実施例(1)[1−2]に記載の方法により、タモギタケ酸性溶媒抽出物を添加した培地での培養を行った。
【0081】
[4−3]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(4)[4−2]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図5に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0082】
図5上段に示すように、hBD−1のmRNA相対発現量について、B、CおよびDは、Aと比較してほとんど変わらなかったが、EはAと比較して有意に大きかった。すなわち、タモギタケ酸性溶媒抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−1のmRNA発現量が増加することが確認された。
【0083】
また、図5中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0084】
また、図5下段に示すように、hBD−3のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、DおよびEは、Aと比較して有意に大きかった。すなわち、タモギタケ酸性溶媒抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0085】
これらの結果から、タモギタケ酸性溶媒抽出物は、HaCaT細胞に24時間作用させた場合に、hBD−1およびhBD−3の産生を促進することが明らかになった。
【0086】
(5)タモギタケ塩基性溶媒抽出物のヒトβ−ディフェンシン産生促進効果の検討
[5−1]タモギタケ塩基性溶媒抽出物の調製
水を1%(w/w)重曹水溶液に代えて、本実施例(3)[3−1]に記載の方法により、タモギタケの抽出物を調製し、これをタモギタケ塩基性溶媒抽出物とした。なお、オートクレーブによる滅菌処理を行う前の濾液のpHは、pH7.6であった。
【0087】
[5−2]サンプルの調製および培養、ならびにタモギタケ塩基性溶媒抽出物を添加した培地での培養
本実施例(1)[1−1]に記載の方法により、A、B、C、DおよびEの計5サンプルを調製し、培養した。続いて、実施例1(1)で調製したタモギタケ熱水抽出物に代えて、本実施例(5)[5−1]で調製したタモギタケ塩基性溶媒抽出物を用いて、本実施例(1)[1−2]に記載の方法により、タモギタケ塩基性溶媒抽出物を添加した培地での培養を行った。
【0088】
[5−3]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(5)[5−2]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図6に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0089】
図6上段に示すように、hBD−1のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、C、DおよびEは、Aと比較して有意に大きかった。すなわち、タモギタケ塩基性溶媒抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−1のmRNA発現量が増加することが確認された。
【0090】
また、図6中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0091】
また、図6下段に示すように、hBD−3のmRNA相対発現量について、B、C、Dのいずれも、Aと比較して有意に大きかった。すなわち、タモギタケ塩基性溶媒抽出物を添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0092】
これらの結果から、タモギタケ塩基性溶媒抽出物は、HaCaT細胞に24時間作用させた場合に、hBD−1およびhBD−3の産生を促進することが明らかになった。
【0093】
(6)タモギタケ由来エルゴチオネインのヒトβ−ディフェンシン産生促進効果の検討
[6−1]タモギタケ由来エルゴチオネインの調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して150Lの濾液を得た。この濾液について、5000rpm、10℃の条件下で30分間遠心分離を行って135Lの上清を回収した。5×30cmのカラムに充填したイオン交換樹脂(アンバーライトIR120B H型;オルガノ社)に、回収した上清のうちの7.5Lを入れ、一晩自然落下させた。続いて、イオン交換樹脂を回収し、蒸留水2.5Lを用いて洗浄して糖質成分を除去した後、0.28%(w/w)アンモニア水10Lを用いて溶出し、イオン交換樹脂に吸着していた陽イオン性化合物を含む溶出液10mLを得た。ロータリーエバポレーターを用いてこの溶出液を濃縮した後、下記の条件により定法に従って高速液体クロマトグラフィー(HPLC)を行い、流出開始3〜4分に検出されるピークの画分を分取した。
【0094】
HPLCの条件
HPLCシステム;日立高速液体クロマトグラフLaChrom Elite
溶離溶媒;0〜1%(v/v)アセトニトリル水溶液
カラム;Inertsil ODS−SP(ジーエルサイエンス社)
検出器;UV検出器
検出条件;250nm
【0095】
分取した画分を合わせた後、凍結乾燥機を用いて凍結乾燥し、粉末状のタモギタケ由来エルゴチオネイン1.7g(7.4mmol)を得た。
【0096】
[6−2]サンプルの調製および培養
本実施例(1)[1−1]に記載の方法により、A、B、およびCの計3サンプルを調製し、培養した。
【0097】
[6−3]タモギタケ由来エルゴチオネインを添加した培地での培養
本実施例(6)[6−1]で調製したタモギタケ由来エルゴチオネインをDDWに溶解して、それぞれ、10mmol/Lおよび100mmol/Lのエルゴチオネイン水溶液を調製した。次に、DDW、10mmol/Lおよび500mmol/Lのエルゴチオネイン水溶液をそれぞれ1%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地とタモギタケ由来エルゴチオネインを下記の終濃度で含む交換培地とを調製した。本実施例(6)[6−2]の各サンプルの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0098】
交換培地に添加したものおよびタモギタケ由来エルゴチオネインの終濃度
A :DDW (コントロール用交換培地)
B :タモギタケ由来エルゴチオネイン 終濃度100μmol/L
C :タモギタケ由来エルゴチオネイン 終濃度 5mmol/L
【0099】
[6−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(6)[6−3]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したBおよびCにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図7に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0100】
図7上段に示すように、hBD−1のmRNA相対発現量について、BおよびCは、Aと比較して有意に大きかった。すなわち、タモギタケ由来エルゴチオネインを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−1のmRNA発現量が増加することが確認された。
【0101】
また、図7中段に示すように、hBD−2のmRNA相対発現量について、BおよびCのいずれも、Aと比較してほとんど変わらなかった。
【0102】
また、図7下段に示すように、hBD−3のmRNA相対発現量について、BおよびCのいずれも、Aと比較して有意に大きかった。すなわち、タモギタケ由来エルゴチオネインを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0103】
これらの結果から、タモギタケ由来エルゴチオネインは、HaCaT細胞に24時間作用させた場合に、hBD−1およびhBD−3の産生を促進することが明らかになった。
【0104】
(7)タモギタケ由来エルゴステロールパーオキサイドのヒトβ−ディフェンシン産生促進効果の検討
[7−1]タモギタケ由来エルゴステロールパーオキサイドの調製
生のタモギタケ150kg〜200kgを水200Lに入れて加熱し、沸騰させた状態で5分間煮出した後、濾過して濾物(残渣)を得た。この濾物を加熱して乾燥させた後、粉砕機を用いて粒子径が0.1mmとなるまで粉砕し、12kgの粉末を得た。99.5%(v/v)エタノールを、この粉末100g当たりに500mL〜1000mL添加して加熱し、粉末に含まれる成分を溶解させた。この溶液を冷却した後、5000rpm、10℃の条件下で30分間遠心分離を行って上清を回収し、1mol/LのNaOH水溶液を等量添加して室温下で2時間攪拌することによりケン化反応を行った。続いて、6mol/Lの塩酸水溶液を適量添加することによりpHを5〜6に調整した後、5000rpm、10℃の条件下で30分間遠心分離を行った。上清を除去した後、沈殿物に100mLのエタノールを添加して攪拌し、減圧下でエタノールを留去して、白色の沈殿物10〜50gを得て、これを脂質粗抽出物とした。
【0105】
次に、脂質粗抽出物10〜50gをクロロホルム/メタノール{クロロホルム:メタノール=95:5(v/v)}30mLに溶解した後、粒子径100〜210μmのシリカゲル60(関東化学社)を充填した8×80cmのシリカゲルカラムに注入した。続いて、クロロホルム/メタノール{クロロホルム:メタノール=90:10(v/v)}1000mLにより溶出して、溶出液を500mLずつ分取した。分取した各溶出液から適量を採取して、定法に従い薄層クロマトグラフィー{展開溶媒;クロロホルム:メタノール:水=80:20:0.2(v/v)}に供し、エルゴステロールパーオキサイドを含む溶出液を選択した後、選択した溶出液の溶媒を減圧下で留去し、エルゴステロールパーオキサイド粗精製物を得た。
【0106】
続いて、エルゴステロールパーオキサイド粗精製物をクロロホルム/メタノール{クロロホルム:メタノール=95:5(v/v)}に溶解した後、粒子径40〜100μmのシリカゲル60(関東化学社)を充填した3×60cmのシリカゲルカラムに注入した。クロロホルム/メタノール{クロロホルム:メタノール=95:5(v/v)}1000mL、クロロホルム/メタノール{クロロホルム:メタノール=90:10(v/v)}1000mL、クロロホルム/メタノール{クロロホルム:メタノール=85:15(v/v)}1000mLおよびクロロホルム/メタノール{クロロホルム:メタノール=80:20(v/v)}1000mLにより溶出して、溶出液を18〜50mLずつ分取した。分取した各溶出液から適量を採取して、定法に従い薄層クロマトグラフィー{展開溶媒;クロロホルム:メタノール:水=80:20:0.2(v/v)}に供し、エルゴステロールパーオキサイドを含む溶出液を選択した後、選択した画分の溶媒を減圧下で留去し、精製されたタモギタケ由来エルゴステロールパーオキサイド3〜4g(7.0〜9.3mmol)を得た。
【0107】
[7−2]サンプルの調製および培養
本実施例(1)[1−1]に記載の方法により、A、B、およびCの計3サンプルを調製し、培養した。
【0108】
[7−3]タモギタケ由来エルゴステロールパーオキサイドを添加した培地での培養
本実施例(7)[7−1]で調製したタモギタケ由来エルゴステロールパーオキサイドをジメチルスルホキシドに溶解して、それぞれ、100μmol/Lおよび1mmol/Lのエルゴステロールパーオキサイド水溶液を調製した。次に、ジメチルスルホキシド、100μmol/Lおよび1mmol/Lのエルゴステロールパーオキサイド水溶液をそれぞれ1%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地とタモギタケ由来エルゴステロールパーオキサイドを下記の終濃度で含む交換培地とを調製した。本実施例(7)[7−2]の各サンプルの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0109】
交換培地に添加したものおよびタモギタケ由来エルゴステロールパーオキサイドの終濃度
A :ジメチルスルホキシド (コントロール用交換培地)
B :タモギタケ由来エルゴステロールパーオキサイド 終濃度 1μmol/L
C :タモギタケ由来エルゴステロールパーオキサイド 終濃度10μmol/L
【0110】
[7−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(7)[7−3]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により、定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したBおよびCにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図8に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0111】
図8上段に示すように、hBD−1のmRNA相対発現量について、BおよびCのいずれも、Aと比較してほとんど変わらなかった。
【0112】
また、図8中段に示すように、hBD−2のmRNA相対発現量について、BおよびCのいずれも、Aと比較して有意に大きかった。すなわち、タモギタケ由来エルゴステロールパーオキサイドを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−2のmRNA発現量が増加することが確認された。
【0113】
また、図8下段に示すように、hBD−3のmRNA相対発現量について、CはAと比較して大きい傾向があり、BはAと比較して有意に大きかった。すなわち、タモギタケ由来エルゴステロールパーオキサイドを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0114】
これらの結果から、タモギタケ由来エルゴステロールパーオキサイドは、HaCaT細胞に24時間作用させた場合に、hBD−2およびhBD−3の産生を促進することが明らかになった。
【0115】
(8)タモギタケ由来グルコシルセラミドのヒトβ−ディフェンシン産生促進効果の検討
[8−1]タモギタケ由来グルコシルセラミドの調製
シリカゲルカラムからの各溶出液について、薄層クロマトグラフィーにより含有成分を確認し、選択する際に、エルゴステロールパーオキサイドに代えてグルコシルセラミドを含む溶出液を選択して、本実施例(7)[7−1]に記載の方法を行うことにより、精製されたタモギタケ由来グルコシルセラミド20〜25g(0.028〜0.034mol)を得た。
【0116】
[8−2]サンプルの調製および培養
本実施例(1)[1−1]に記載の方法により、A、B、C、DおよびEの計5サンプルを調製し、培養した。
【0117】
[8−3]タモギタケ由来グルコシルセラミドを添加した培地での培養
本実施例(8)[8−1]で調製したタモギタケ由来グルコシルセラミドをジメチルスルホキシドに溶解して、それぞれ、100μmol/L、1mmol/L、10mmol/Lおよび100mmol/Lのグルコシルセラミド水溶液を調製した。次に、ジメチルスルホキシド、100μmol/L、1mmol/L、10mmol/Lおよび100mmol/Lのグルコシルセラミド水溶液をそれぞれ0.1%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地とタモギタケ由来グルコシルセラミドを下記の終濃度で含む交換培地とを調製した。本実施例(8)[8−2]の各サンプルの培地を、調製した交換培地に下記のとおり交換した後、本実施例(1)[1−1]に記載の環境下にて、さらに24時間培養した。
【0118】
交換した培地に添加したものおよびタモギタケ由来グルコシルセラミドの終濃度
A :ジメチルスルホキシド (コントロール用交換培地)
B :タモギタケ由来グルコシルセラミド 終濃度0.1μmol/L
C :タモギタケ由来グルコシルセラミド 終濃度 1μmol/L
D :タモギタケ由来グルコシルセラミド 終濃度 10μmol/L
E :タモギタケ由来グルコシルセラミド 終濃度100μmol/L
【0119】
[8−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるヒトβ−ディフェンシンmRNAの定量
本実施例(8)[8−2]の各サンプルについて、本実施例(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、本実施例(1)[1−4]に記載の方法により、定量PCR法を行い、ヒトβ−ディフェンシンmRNAの定量を行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図9に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0120】
図9上段に示すように、hBD−1のmRNA相対発現量について、B、CおよびDは、Aと比較して有意差は見られず、EにおけるmRNA相対発現量は、AにおけるmRNA相対発現量と比較して有意に小さかった。
【0121】
また、図9中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較して有意差は見られなかった。
【0122】
また、図9下段に示すように、hBD−3のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、CおよびDは、Aと比較して大きい傾向があり、EはAと比較して有意に大きかった。すなわち、タモギタケ由来グルコシルセラミドを添加した培地でHaCaT細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−3のmRNA発現量が増加することが確認された。
【0123】
これらの結果から、タモギタケ由来グルコシルセラミドは、HaCaT細胞に24時間作用させた場合に、hBD−3の産生を促進することが明らかになった。
【0124】
<実施例3>NHEK細胞におけるヒトβ−ディフェンシン産生促進効果の検討
(1)サンプルの調製および培養
実施例2(1)[1−1]に記載の方法により、A、B、CおよびDの計4サンプルを調製した。ただし、HaCaT細胞に代えて正常ヒト表皮角化細胞(NHEK細胞;三光純薬社)を用い、培養時間は3日間に代えて2日間とした。
【0125】
(2)タモギタケ熱水抽出物を添加した培地での培養
本実施例(1)の各サンプルについて、実施例2(1)[1−2]に記載の方法により、タモギタケ熱水抽出物を添加した培地での培養を行った。ただし、各サンプルに用いた交換培地は下記のとおりとした。
【0126】
交換培地に添加したものおよびタモギタケ熱水抽出物の終濃度
A :DDW (コントロール用交換培地)
B :タモギタケ熱水抽出物 終濃度0.5%(v/v)
C :タモギタケ熱水抽出物 終濃度 5%(v/v)
D :タモギタケ熱水抽出物 終濃度 25%(v/v)
【0127】
(3)RNAの抽出およびcDNAの作製、ならびに定量PCR法によるhBD−2mRNAおよびhBD−3mRNAの定量
本実施例(2)の各サンプルについて、実施例2(1)[1−3]に記載の方法により、RNAの抽出およびcDNAの作製を行った後、実施例2(1)[1−4]に記載の方法により定量PCR法を行い、hBD−2mRNAおよびhBD−3mRNAの定量を行った。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図10に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0128】
図10上段に示すように、hBD−2のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、CおよびDは、Aと比較して有意に大きかった。
【0129】
また、図10下段に示すように、hBD−3のmRNA相対発現量についても、BはAと比較してほとんど変わらなかったが、CおよびDは、Aと比較して有意に大きかった。すなわち、タモギタケ熱水抽出物を添加した培地でNHEK細胞を培養した場合は、それを添加しないで培養した場合と比較して、hBD−2およびhBD−3のmRNA発現量が増加することが確認された。
【0130】
これらの結果から、タモギタケ熱水抽出物は、HaCaT細胞のみならずNHEK細胞においても、hBD−2およびhBD−3の産生を促進することが明らかになった。
【0131】
<実施例4>ヒトβ−ディフェンシン産生促進効果を奏する時間の検討
(1)タモギタケ熱水抽出物
実施例2(1)[1−1]〜[1−4]に記載の方法により、実験を行った。ただし、タモギタケ熱水抽出物を添加した培地での培養時間は24時間に代えて2時間とし、定量PCR法によるヒトβ−ディフェンシンmRNAの定量は、hBD−2およびhBD−3について行った。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図11に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0132】
図11上段に示すように、hBD−2のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、DおよびEは、Aと比較して有意に大きかった。
【0133】
また、図11下段に示すように、hBD−3のmRNA相対発現量について、BはAと比較してほとんど変わらなかったが、C、DおよびEは、Aと比較して有意に大きかった。
【0134】
これらの結果から、タモギタケ熱水抽出物は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様に、hBD−2およびhBD−3の産生を促進することが明らかになった。また、タモギタケ熱水抽出物がhBD−2およびhBD−3の産生を促進する程度は、24時間作用させた場合と比較して、2時間作用させた場合の方が大きいことが明らかになった。
【0135】
(2)タモギタケ熱水抽出物の濾液および濾物
実施例2(2)[2−1]〜[2−4]に記載の方法により、実験を行った。ただし、タモギタケ熱水抽出物の濾液および濾物を添加した培地での培養時間は24時間に代えて2時間とした。また、算出したB、CおよびDにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図12に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0136】
図12に示すように、hBD−3のmRNA相対発現量について、BはAと比較して大きい傾向があり、CおよびDは、Aと比較して有意に大きかった。
【0137】
これらの結果から、タモギタケ熱水抽出物の濾液は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様にhBD−3の産生を促進する傾向があることが明らかになった。また、タモギタケ熱水抽出物の濾物も、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様にhBD−3の産生を促進することが明らかになった。またタモギタケ熱水抽出物の濾液および濾物がhBD−3の産生を促進する程度は、24時間作用させた場合と比較して、24間作用させた場合の方がやや大きいことが明らかになった。
【0138】
(3)タモギタケ熱水抽出物の超音波処理物
[3−1]タモギタケ熱水抽出物の超音波処理物の調製
実施例1(1)で調製したタモギタケ熱水抽出物20mLをネジ口瓶に入れ、超音波発生器を用いて、40kHzの超音波を50分間照射することにより、タモギタケ熱水抽出物の超音波処理物を得た。
【0139】
[3−2]サンプルの調製および培養
実施例2(1)[1−1]に記載の方法により、A、B、およびCの計3サンプルを調製し、培養した。
【0140】
[3−3]タモギタケ熱水抽出物の超音波処理物を添加した培地での培養
DDWを用いて本実施例(3)[3−1]のタモギタケ熱水抽出物の超音波処理物を希釈して、10%(v/v)の超音波処理物水溶液を調製した。次に、DDW、10%(v/v)の超音波処理物水溶液および本実施例(3)[3−1]のタモギタケ熱水抽出物の超音波処理物を、それぞれ10%(v/v)となるようF−P−DMEM培地に添加して、コントロール用交換培地と、タモギタケ熱水抽出物の超音波処理物を下記の終濃度で含む交換培地とを調製した。本実施例(3)[3−2]の培地を、調製した交換培地に下記のとおり交換した後、実施例2(1)[1−1]に記載の環境下にて、さらに2時間培養した。
【0141】
交換培地に添加したものおよびタモギタケ熱水抽出物の超音波処理物の終濃度
A :DDW (コントロール用交換培地)
B :タモギタケ熱水抽出物の超音波処理物 終濃度 1%(v/v)
C :タモギタケ熱水抽出物の超音波処理物 終濃度10%(v/v)
【0142】
[3−4]RNAの抽出およびcDNAの作製、ならびに定量PCR法によるhBD−3mRNAの定量
本実施例(3)[3−3]の各サンプルについて、実施例2(1)[1−3]に記載の方法によりRNAの抽出およびcDNAの作製を行った後、実施例2(1)[1−4]に記載の方法により定量PCR法を行い、hBD−3mRNAの定量を行った。また、算出したBおよびCにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図13に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0143】
図13に示すように、hBD−3のmRNA相対発現量について、BおよびCは、Aと比較していずれも大きく、mRNA相対発現量の大きさの順はA<B<Cであった。
【0144】
これらの結果から、タモギタケ熱水抽出物の超音波処理物は、HaCaT細胞に2時間作用させた場合に、hBD−3の産生を促進することが明らかになった。
【0145】
(4)タモギタケ水抽出物
実施例2(3)[3−1]〜[3−3]に記載の方法により、実験を行った。ただし、タモギタケ水抽出物を添加した培地での培養時間は24時間に代えて2時間とした。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図14に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0146】
図14上段に示すように、hBD−1のmRNA相対発現量について、BおよびDは、Aと比較してほとんど変わらなかったが、CおよびEは、Aと比較して有意に大きかった。
【0147】
また、図14中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0148】
また、図14下段に示すように、hBD−3のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、CおよびEは、Aと比較して有意に大きかった。
【0149】
これらの結果から、タモギタケ水抽出物は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様に、hBD−1およびhBD−3の産生を促進することが明らかになった。また、タモギタケ水抽出物がhBD−1およびhBD−3の産生を促進する程度は、2時間作用させた場合と比較して、24時間作用させた場合の方が大きいことが明らかになった。
【0150】
(5)タモギタケ酸性溶媒抽出物
実施例2(4)[4−1]〜[4−3]に記載の方法により、実験を行った。ただし、タモギタケ酸性溶媒抽出物を添加した培地での培養時間は24時間に代えて2時間とした。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図15に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0151】
図15上段に示すように、hBD−1のmRNA相対発現量について、BおよびCは、Aと比較してほとんど変わらなかったが、DおよびEは、Aと比較して有意に大きかった。
【0152】
また、図15中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0153】
また、図15下段に示すように、hBD−3のmRNA相対発現量について、CおよびEは、Aと比較してほとんど変わらなかったが、BおよびDは、Aと比較して有意に大きかった。
【0154】
これらの結果から、タモギタケ酸性溶媒抽出物は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様に、hBD−1およびhBD−3の産生を促進することが明らかになった。また、タモギタケ酸性溶媒抽出物がhBD−1の産生を促進する程度は、2時間作用させた場合と24時間作用させた場合とで同程度であり、hBD−3の産生を促進する程度は、2時間作用させた場合と比較して、24時間作用させた場合の方が大きいことが明らかになった。
【0155】
(6)タモギタケ塩基性溶媒抽出物
実施例2(5)[5−1]〜[5−3]に記載の方法により、実験を行った。ただし、タモギタケ塩基性溶媒抽出物を添加した培地での培養時間は24時間に代えて2時間とした。また、算出したB、C、DおよびEにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図16に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0156】
図16上段に示すように、hBD−1のmRNA相対発現量について、B、C、DおよびEは、Aと比較して有意に大きかった。
【0157】
また、図16中段に示すように、hBD−2のmRNA相対発現量について、B、C、DおよびEのいずれも、Aと比較してほとんど変わらなかった。
【0158】
また、図16下段に示すように、hBD−3のmRNA相対発現量について、BおよびDは、Aと比較してほとんど変わらなかったが、CおよびEは、Aと比較して有意に大きかった。
【0159】
これらの結果から、タモギタケ塩基性溶媒抽出物は、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様に、hBD−1およびhBD−3の産生を促進することが明らかになった。また、タモギタケ塩基性溶媒抽出物がhBD−1およびhBD−3の産生を促進する程度は、2時間作用させた場合と24時間作用させた場合とでは、ほとんど変わらないことが明らかになった。
【0160】
(7)タモギタケ由来エルゴチオネイン
実施例2(6)[6−1]〜[6−4]に記載の方法により、実験を行った。ただし、タモギタケ由来エルゴチオネインを添加した培地での培養時間は24時間に代えて2時間とした。また、算出したBおよびCにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図17に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0161】
図17上段、中段および下段に示すように、hBD−1、hBD−2およびhBD−3のmRNA相対発現量のいずれについても、BおよびCは、Aと比較して有意に大きかった。
【0162】
これらの結果から、タモギタケ由来エルゴチオネインは、HaCaT細胞に2時間作用させた場合は、24時間作用させた場合と同様にhBD−1およびhBD−3の産生を促進するのみならず、24時間作用させた場合には促進しなかったhBD−2の産生も促進することが明らかになった。また、タモギタケ由来エルゴチオネインがhBD−1およびhBD−3の産生を促進する程度は、2時間作用させた場合と比較して、24時間作用させた場合の方がやや大きいことが明らかになった。
【0163】
<実施例5>βグルカンまたはマイコプラズマ由来ジアシルリポペプチド(FSL−1)と共にタモギタケ熱水抽出物を添加した場合のヒトβ−ディフェンシン産生促進効果の検討
(1)サンプルの調製および培養
実施例2(1)[1−1]に記載の方法により、A、B、C、D、E、F、GおよびHの計8サンプルを調製した。ただし、HaCaT細胞に代えてNHEK細胞(三光純薬社)を用い、培養時間は3日間に代えて2日間とした。
【0164】
(2)βグルカン、FSL−1およびタモギタケ熱水抽出物を添加した培地での培養
スエヒロタケ由来βグルカン(ソニフィラン;科研製薬社)、大麦由来βグルカン(MP Biomedicals社)、Toll Like Receptor(TLR)−2およびTLR−6のアゴニストであるマイコプラズマ由来ジアシルリポペプチド(FSL−1;InvivoGen社)および実施例1(1)で調製したタモギタケ熱水抽出物を、DDWを用いて希釈またはDDWに溶解し、下記のb、c、d、eおよびgの水溶液を調製した。また、タモギタケ熱水抽出物にスエヒロタケ由来βグルカンまたはFSL−1を溶解することにより、下記のfおよびhのタモギタケ熱水抽出物溶液を調製した。
【0165】
水溶液およびタモギタケ熱水抽出物溶液の濃度
b:スエヒロタケ由来βグルカン 100μg/mL
c:大麦由来βグルカン 100μg/mL
d:FSL−1 100ng/mL
e:タモギタケ熱水抽出物 50%(v/v)
f:タモギタケ熱水抽出物 100%(v/v)+スエヒロタケ由来βグルカン 200μg/mL
g:FSL−1 200μg/mL+スエヒロタケ由来βグルカン 200μg/mL
h:タモギタケ熱水抽出物 100%(v/v)+FSL−1 200μg/mL
【0166】
次に、DDW、調製した各水溶液および各タモギタケ熱水抽出物溶液をそれぞれ5%(v/v)となるようF−P−DMEM培地に添加して、スエヒロタケ由来βグルカン(ソニフィラン;科研製薬社)、大麦由来βグルカン(MP Biomedicals社)、FSL−1(InvivoGen)およびタモギタケ熱水抽出物を下記の終濃度で含む交換培地とコントロール用交換培地とを調製した。本実施例(1)の培地を、調製した交換培地に下記のとおり交換した後、実施例2(1)[1−1]に記載の環境下にて、さらに2時間培養した。
【0167】
交換培地に添加したものおよびその終濃度
A:DDW (コントロール用交換培地)
B:スエヒロタケ由来βグルカン 終濃度10μg/mL
C:大麦由来βグルカン 終濃度10μg/mL
D:FSL−1 終濃度10ng/mL
E:タモギタケ熱水抽出物 終濃度 5%(v/v)
F:タモギタケ熱水抽出物 終濃度5%(v/v)+スエヒロタケ由来βグルカン 終濃度10μg/mL
G:FSL−1 終濃度10ng/mL+スエヒロタケ由来βグルカン 終濃度10μg/mL
H:タモギタケ熱水抽出物 終濃度5%(v/v)+FSL−1 終濃度10ng/mL
【0168】
(3)RNAの抽出およびcDNAの作製、ならびに定量PCR法によるhBD−2mRNAおよびhBD−3mRNAの定量
本実施例(2)の各サンプルについて、実施例2(1)[1−3]に記載の方法によりRNAの抽出およびcDNAの作製を行った後、実施例2(1)[1−4]に記載の方法により定量PCR法を行い、hBD−2mRNAおよびhBD−3mRNAの定量を行った。また、算出したB、C、D、E、F、GおよびHにおける結果について、Aにおける結果との間でマンホイットニーのU検定を行った。その結果を図18に示す。図中の*は、U検定の結果、統計的に有意であることを示す(p<0.05)。
【0169】
図18上段に示すように、hBD−2のmRNA相対発現量について、B、C、D、EおよびHのいずれも、Aと比較してやや大きく、FおよびGは、Aと比較して顕著に大きかった。
【0170】
また、図18下段に示すように、hBD−3のmRNA相対発現量についても、hBD−2と同様、B、C、D、Eのいずれも、Aと比較してやや大きく、FおよびGは、Aと比較して顕著に大きかった。
【0171】
これらの結果から、タモギタケ熱水抽出物は、βグルカンと共に作用させることにより、hBD−2およびhBD−3の産生を促進する効果が向上することが明らかになった。
【0172】
<実施例6>口腔カンジダ症モデルマウスにおける抗菌効果の確認
(1)タモギタケ熱水抽出物を含有する口腔用ジェルの調製 実施例1(1)で調製したタモギタケ熱水抽出物と白色ワセリン(ヤクハン製薬社)とを歯科用ダッペングラスに入れ、プラスチックのセメントスパチュラを用いて攪拌・混合することにより、タモギタケ熱水抽出物を60%(w/w)含有する口腔用ジェルを調製した。
【0173】
(2)口腔カンジダ症モデルマウスの作製
既報(Takakuraら、Microbiol.Immunol.、第47巻、第5号、第321−326頁、2003年)に従い、口腔カンジダ症モデルマウスを作製した。具体的には、6週齢のC3H/HeJJcl雄マウス(日本クレア社)15匹に、マウス体重1kg当たり100mgの量のプレドニゾロンを皮下注射した。続いて、滅菌した水道水に塩酸クロルテトラサイクリンを0.83mg/mLとなるよう添加したものを飲料水として自由摂取させながら24時間飼育した後、マウス1個体あたり、2mg/mLのクロルプロマジン塩酸塩水溶液50mLを大腿部に筋肉注射した。30分経過後、1×108cfu/mLのカンジダ菌(Candida albicans ATCC90028株)懸濁液を滅菌綿棒に付着させ、これを用いてマウスの舌と口腔内へカンジダ菌の播種を行った。
【0174】
(3)タモギタケ熱水抽出物を含有する口腔用ジェルの投与
本実施例(2)のマウス15匹を7匹と8匹とに分け、7匹からなる群をコントロール群、8匹からなる群をジェル投与群として、各群のマウスを3日間飼育した。この間、ジェル投与群にのみ、本実施例(1)の口腔用ジェルを1匹当たり0.05g、口腔内に塗布することを1日3回行った。
【0175】
(4)カンジダ菌数の測定
本実施例(3)の各群のマウスから舌を摘出し、舌の重量100mgあたり1mLの生理食塩水を添加してホモジナイズし、懸濁液とした。この懸濁液100μLについて、CHIROMagar選択培地(CHIROMagar社)を用いて定法に従い平板法を行うことにより、カンジダ菌生菌数を測定し、群ごとに生菌数の平均値と標準偏差を求めた。また、算出したジェル投与群における結果について、コントロール群における結果との間でマンホイットニーのU検定を行った。その結果を図19に示す。図中の*は、検定の結果、統計的に有意であることを示す(p<0.05)。
【0176】
図19に示すように、ジェル投与群におけるカンジダ菌の生菌数は、コントロール群におけるカンジダ菌の生菌数と比較して顕著に少なく、コントロール群におけるカンジダ菌の生菌数を100%とすると、ジェル投与群におけるカンジダ菌の生菌数は77.5%であった。すなわち、タモギタケ熱水抽出物を含有する口腔用ジェルは、口腔カンジダ症モデルマウスの口腔内におけるカンジダ菌の増殖を抑制することが確認された。
【0177】
この結果から、タモギタケ熱水抽出物を含有する口腔用ジェルは、口腔カンジダ症の予防または治療に有効であることが明らかになった。
【特許請求の範囲】
【請求項1】
タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする抗菌剤。
【請求項2】
水系溶媒抽出物が熱水抽出物である、請求項1に記載の抗菌剤。
【請求項3】
タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とするβディフェンシン産生促進剤。
【請求項4】
βディフェンシンがヒトβディフェンシン−1、ヒトβディフェンシン−2およびヒトβディフェンシン−3からなる群から選択される1または2以上のβディフェンシンである、請求項3に記載のβディフェンシン産生促進剤。
【請求項5】
水系溶媒抽出物が熱水抽出物である、請求項3または請求項4に記載のβディフェンシン産生促進剤。
【請求項6】
タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とするカンジダ症予防および/または治療剤。
【請求項7】
口腔乾燥症の患者に用いる、請求項6に記載のカンジダ症予防および/または治療剤。
【請求項8】
水系溶媒抽出物が熱水抽出物である、請求項6または請求項7に記載のカンジダ症予防および/または治療剤。
【請求項1】
タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とする抗菌剤。
【請求項2】
水系溶媒抽出物が熱水抽出物である、請求項1に記載の抗菌剤。
【請求項3】
タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とするβディフェンシン産生促進剤。
【請求項4】
βディフェンシンがヒトβディフェンシン−1、ヒトβディフェンシン−2およびヒトβディフェンシン−3からなる群から選択される1または2以上のβディフェンシンである、請求項3に記載のβディフェンシン産生促進剤。
【請求項5】
水系溶媒抽出物が熱水抽出物である、請求項3または請求項4に記載のβディフェンシン産生促進剤。
【請求項6】
タモギタケの水系溶媒抽出物、タモギタケから抽出されるグルコシルセラミド、タモギタケから抽出されるエルゴチオネインおよびタモギタケから抽出されるエルゴステロールパーオキサイドからなる群から選択される1または2以上の物質を有効成分とするカンジダ症予防および/または治療剤。
【請求項7】
口腔乾燥症の患者に用いる、請求項6に記載のカンジダ症予防および/または治療剤。
【請求項8】
水系溶媒抽出物が熱水抽出物である、請求項6または請求項7に記載のカンジダ症予防および/または治療剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【公開番号】特開2012−56914(P2012−56914A)
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願番号】特願2010−203803(P2010−203803)
【出願日】平成22年9月11日(2010.9.11)
【特許番号】特許第4831711号(P4831711)
【特許公報発行日】平成23年12月7日(2011.12.7)
【出願人】(500451632)株式会社スリービー (4)
【出願人】(505116781)学校法人東日本学園・北海道医療大学 (13)
【Fターム(参考)】
【公開日】平成24年3月22日(2012.3.22)
【国際特許分類】
【出願日】平成22年9月11日(2010.9.11)
【特許番号】特許第4831711号(P4831711)
【特許公報発行日】平成23年12月7日(2011.12.7)
【出願人】(500451632)株式会社スリービー (4)
【出願人】(505116781)学校法人東日本学園・北海道医療大学 (13)
【Fターム(参考)】
[ Back to top ]

