タンパク質、ポリペプチドまたはペプチド薬物伝達用高分子及びその製造方法、並びにタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物及びその製造方法
【課題】初期過多放出の問題がなく、薬物の持続放出性に優れ、毒性がなく、タンパク質、ポリペプチドまたはペプチド薬物の徐放性伝達用として特に適した高分子及び薬物伝達体で、これを含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物を提供する。
【解決手段】上記課題を解決できた徐放性伝達用高分子は、数平均分子量が7,000ダルトン以下の化学式1のポリ乳酸誘導体化合物である。
【解決手段】上記課題を解決できた徐放性伝達用高分子は、数平均分子量が7,000ダルトン以下の化学式1のポリ乳酸誘導体化合物である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、タンパク質、ポリペプチドまたはペプチド薬物伝達用高分子及びその製造方法、並びにこれを含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物に関する。さらに詳しくは、数平均分子量が7,000ダルトン以下の下記化学式1のポリ乳酸誘導体化合物及びその製造方法、並びにそれを用いたタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物及びその製造方法に関するものである:
【0002】
【化1】

【0003】
(式中、X、X’、Y、Z、R、m、n、a及びbは本明細書の定義と同義である。)
【背景技術】
【0004】
遺伝子工学分野の飛躍的な発展に伴い、タンパク質またはペプチドの機能と役割が明らかになってきており、これらの大量生産が可能になった。その結果、多数のタンパク質またはペプチド薬物が商用化され、またこれらを活用した新薬開発のための努力が続けられている。
【0005】
タンパク質またはペプチドは、経口で投与する場合に、腸壁の通過が難しく、消化管内で容易に変性するか、酵素により分解されるため、生体利用率が非常に低く、注射剤の形態として開発されている。
【0006】
注射製剤の場合、頻繁な投与による患者の不便を解消するために、1回投与で長期間薬効が持続される徐放性製剤を開発するための様々な方法が試みられており、このような試みの例が多くの文献に紹介されている(非特許文献1、2)。
【0007】
商用化された徐放性タンパク質製剤として、ポリエチレングリコール(PEG)とタンパク質を接合(conjugation)したPEGylation技術をインターフェロンに適用した製品(PEGasys(登録商標)、PEGintron(登録商標))、GCSF(Neulasta(登録商標))、Asparaginase(Oncaspar(登録商標))、Adenosinedeaminase(Adagen(登録商標))などがあるが、これらは分子量5,000〜50,000ダルトンのPEGとタンパク質の接合体であり、新規化合物に該当し、他のタンパク質に応用するためには生物学的安全性及び有効性の検証が必須的に求められ、生産に高価のコストが必要とされる短所がある。
【0008】
一方、生分解性高分子のポリ乳酸またはポリ乳酸−グリコール酸高分子を微粒子伝達体として利用して、酢酸ロイプロリド(Lupron(登録商標)Depot)、オクトレオチド(Sandostatin(登録商標))、酢酸ゴセレリン(Zoladex(登録商標))、Triptorelin Pamoate(Trelatar(登録商標)Depot)などのペプチド薬物に対する徐放性製剤が商用化されたものがあるが、その持続放出効果などが依然として満たされていない。
【0009】
タンパク質薬物については、ヒト成長ホルモンの徐放性製剤(Nutropin(登録商標)Depot)が唯一、米国FDAの承認を得ているが、毎日投与する製剤に比べて、効果が不十分で、2004年市場から完全に撤収した。
【0010】
このように、タンパク質またはペプチド薬物に対して、現在まで開発されたポリ乳酸またはポリ乳酸−グリコール酸高分子微粒子を用いた製剤は、初期過多放出及び不十分な持続放出効果など徐放性製剤としての解決しなければならない課題を依然として抱えている。また、製造工程中、薬物の変性及び過多の薬物損失による製造原価の上昇など経済的な要因も問題点として指摘されている。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Khaled Al-Tahami et al., "Smart Polymer Based Delivery Systems for Peptides and Proteins", Recent Patents on Drug Delivery & Formulation 2007, Vol. 1, No. 1, pp. 65-71, 2007
【非特許文献2】Fei Wu et al., "Polymer-Based Sustained-Release Dosage Forms for Protein Drugs, Challenges, and Recent Advances", AAPS PharmSciTech, Vol. 9, No. 4, pp. 1 1218-1229, 2008
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、前述のような従来技術の問題点を解決するためのものである。本発明の技術的課題は初期過多放出の問題がなく、薬物の持続放出性に優れ、毒性がなく、タンパク質、ポリペプチドまたはペプチド薬物の徐放性伝達用として特に適した高分子及び薬物伝達体を提供すること、そして、薬物伝達体として同じものを含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物を提供することにある。
【0013】
別の側面では、本発明の技術的課題は本発明に係る徐放性組成物を、有機溶媒を用いることなく、効率的に製造する方法を提供することにある。
【課題を解決するための手段】
【0014】
前述した技術的課題を解決するために、本発明は、数平均分子量が7,000ダルトン以下の下記化学式1のポリ乳酸誘導体化合物を提供する:
【0015】
【化2】

【0016】
{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
Y及びZは独立して存在しないか、またはアルカリ金属であり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
前記で“Y及びZが独立して存在しない”とは、Y及びZに独立して結合した酸素が負電荷の形態、即ち、−O−の形態であることを意味する。
【0017】
本発明の別の側面によると、1)遊離酸またはラクトン形態の乳酸またはその誘導体とジカルボン酸を重合して、両末端にカルボン酸を有するポリ乳酸誘導体を得る工程;及び2)前記工程1)で得られたポリ乳酸誘導体を有機溶媒に溶解した後、アルカリ金属塩水溶液を添加し、ポリ乳酸誘導体の塩を得る工程;を含む、下記化学式2のポリ乳酸誘導体化合物の製造方法が提供される:
【0018】
【化3】

【0019】
(式中、X、X’、R、m、n、a及びbは本明細書の定義と同義であり、Y’及びZ’は独立してアルカリ金属である。)
本発明のさらに別の側面によると、数平均分子量が7,000ダルトン以下の化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体及びこれを含む徐放性組成物が提供される。
【0020】
本発明のさらに別の側面によると、i)活性成分としてタンパク質、ポリペプチドまたはペプチド、ii)薬物伝達体として、化学式1のポリ乳酸誘導体化合物、及びiii)多価金属イオンを含む、タンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物が提供される。
【0021】
本発明のさらに別の側面によると、i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)薬物伝達体として、化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体を含む、タンパク質、ポリペプチド、またはペプチド薬物の徐放性組成物が提供される。この徐放性組成物は、化学式1のポリ乳酸誘導体化合物と多価金属イオンが形成する複合体に、タンパク質、ポリペプチドまたはペプチドなどの活性成分が封入された微粒子を含む。
【0022】
本発明のさらに別の側面によると、a)i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)化学式1のポリ乳酸誘導体化合物を含有する水溶液を調製する工程;及びb)工程a)の水溶液を、多価金属イオンを含む水溶液に滴下し、沈澱物を得る工程;を含む、タンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物を製造する方法が提供される。
【発明の効果】
【0023】
本発明に係る高分子を用いた徐放性薬物伝達組成物は、活性成分のタンパク質、ポリペプチドまたはペプチドの徐放性放出を可能にする。また、前記組成物を製造する方法は、有機溶媒を用いないため、製造工程中の薬物の変性を防止し、薬理効果を最大限に高めることができる。更に、別途の有機溶媒除去工程を必要としない。しかもタンパク質、ポリペプチドまたはペプチドの封入効率を90%以上達成できるので、製造工程中の薬物の損失を最小化することができる。
【図面の簡単な説明】
【0024】
【図1】製造例1で製造されたポリ乳酸誘導体化合物をCDCl3に溶解して得た1H−NMRスペクトルである。
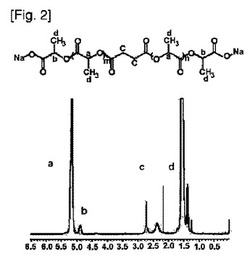
【図2】実施例1で製造された前記化学式1のポリ乳酸誘導体ナトリウム塩をCDCl3に溶解して得た1H−NMRスペクトルである。
【図3】実験例1で得たラットにおいて、ヒト成長ホルモン含有製剤の薬物動態を試験した結果を示すグラフである。
【図4】実験例2で得た脳下垂体を摘出したラットにヒト成長ホルモン含有製剤を皮下注射した後、生成される血中IGF−1濃度を測定した結果を示すグラフである。
【図5】実験例2で得た脳下垂体を摘出したラットにヒト成長ホルモン含有製剤を皮下注射した後、体重の増加を測定した結果を示すグラフである。
【図6】実験例3で得たラットにおいてエリスロポエチン含有製剤の薬物動態を試験した結果を示すグラフである。
【図7】実験例4で得たラットにおいてエクセナチド含有製剤の薬物動態を試験した結果を示すグラフである。
【発明を実施するための形態】
【0025】
以下、本発明について、さらに詳しく説明する。
【0026】
1.ポリ乳酸誘導体化合物及びその製造方法
本発明によって提供される、タンパク質、ポリペプチドまたはペプチド薬物の徐放性伝達用ポリ乳酸誘導体化合物は、両末端にカルボキシル基を有し、下記化学式1で示される:
【0027】
【化4】

【0028】
{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
Y及びZは独立して存在しないか、またはアルカリ金属であり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
前記で“Y及びZが独立して存在しない”とは、Y及びZに独立して連結された酸素が負電荷の形態、即ち、−O−の形態であることを意味する。
【0029】
本発明の実施態様によると、前記化学式1において、X及びX’は、独立して水素、炭素数1〜4のアルキルまたは炭素数1〜4のアルキルで非置換の、または置換されたの炭素数6のアリールであり、好ましくは、水素、メチルまたはフェニルであり、さらに好ましくはメチルである。
【0030】
本発明の実施態様によると、前記化学式1において、Y及びZは、独立して存在しないか、またはアルカリ金属である。Y及びZがアルカリ金属の場合には、具体的に下記化学式2で示すことができる。存在しない場合には、化学式1の高分子末端がアニオン形態を意味し、具体的には化学式3で示すことができる。アルカリ金属は、具体的には独立してナトリウム、カリウムまたはリチウムであってもよい:
【0031】
【化5】

【0032】
(式中、X、X’、R、m、n、a及びbは本明細書の定義と同義であり、Y’及びZ’は独立してアルカリ金属である。)
【0033】
【化6】

【0034】
(式中、X、X’、R、m、n、a及びbは前記定義と同義であり、
本発明の実施態様によると、Rは−(CH2)k−であり、ここで、kは0〜10の整数である。)
前記化学式1において、Rが炭素数2〜10の二価アルケニルまたは炭素数6〜20の二価アリールの場合、これらはそれぞれ独立して、ヒドロキシ基またはC1〜C5のアルキルで置換されていてもよい。
【0035】
前記化学式1において、m及びnは、好ましくは10<m+n<70を満たす。
【0036】
本発明の好ましい実施態様によると、前記ポリ乳酸誘導体化合物は下記化学式4で示される:
【0037】
【化7】

【0038】
(式中、Y、Z、R、m、n、a及びbは本明細書の定義と同義である。)
本発明の化学式1のポリ乳酸誘導体化合物は水溶性であり、その数平均分子量は7,000ダルトン以下、好ましくは500〜7,000ダルトン、より好ましくは700〜5、000ダルトン、より一層好ましくは1,000〜4,000ダルトンである。数平均分子量が7,000ダルトンを超えると、ポリ乳酸誘導体化合物が水に溶解されず、薬物伝達体として用いるのに適しない。また、数平均分子量が500ダルトン未満のとき、分子量が小さく、体内分解が速すぎて、薬物の持続放出を期待するのが困難である。
【0039】
本発明のポリ乳酸誘導体化合物は、ジカルボン酸を中心に、例えば、ポリ乳酸、ポリラクチド、ポリグリコリド、ポリマンデル酸、ポリカプロラクトン及びこれらの共重合体よりなる群から選ばれる2個のブロックを含む。本発明の実施態様によると、前記ポリ乳酸誘導体化合物はポリ乳酸、乳酸とマンデル酸の共重合体、乳酸とグリコール酸の共重合体及び乳酸とカプロラクトンの共重合体よりなる群から選ばれる2個のブロックを含む。さらに具体的に、前記ポリ乳酸化合物はポリ乳酸の2個のブロックを含む。
【0040】
前記ジカルボン酸として、好ましくは、炭素数3〜10個のジカルボン酸、例えば、シュウ酸、マロン酸、リンゴ酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸、アゼライン酸、セバシン酸、ドデカン二酸、またはこれらの混合物を使用できる。さらに、フマル酸またはマレイン酸などのC4〜C12の不飽和ジカルボン酸、フタル酸またはテレフタル酸などのC8〜C22のアリールジカルボン酸も使用可能である。
【0041】
本発明の化学式1のポリ乳酸誘導体化合物は、両末端がイオン性であり、両末端はアルカリ金属イオンとイオン結合をするか、またはしない。具体的に、それぞれ化学式2または化学式3の形態であってもよい。前記末端のアニオンは、直接多価金属イオンと結合するか、またはアルカリ金属イオンの場合には、多価金属イオンにより置換され、イオン結合錯体を形成することができる。
【0042】
本発明の別の側面によると、1)遊離酸またはラクトン形態の乳酸またはその誘導体とジカルボン酸を重合し、両末端にカルボン酸を有するポリ乳酸誘導体を得る工程;及び2)前記工程1)で得られたポリ乳酸誘導体を有機溶媒に溶解した後、アルカリ金属塩水溶液を添加し、ポリ乳酸誘導体の塩を得る工程を含む、前記化学式2のポリ乳酸誘導体化合物の製造方法が提供される。
【0043】
本発明のポリ乳酸誘導体化合物の製造方法の工程1)において、単量体として使用可能な遊離酸またはラクトン形態の乳酸またはその誘導体は、例えば、乳酸、ラクチド、グリコリド、マンデル酸、カプロラクトン、及びこれらの混合物からなる群から選択できる。
【0044】
前記遊離酸またはラクトン形態の乳酸またはその誘導体とジカルボン酸の使用量の割合には特に制限がなく、化学式1のポリ乳酸誘導体化合物を得ることができる範囲内で自由に選択できる。本発明の実施態様によると、遊離酸またはラクトン形態の乳酸またはその誘導体の100重量部当たり、ジカルボン酸1〜20重量部を使用してもよい。
【0045】
より具体的に、本発明のポリ乳酸誘導体化合物の製造方法の工程1)では、前記遊離酸またはラクトン形態の乳酸またはその誘導体の単量体と炭素数3〜10個のジカルボン酸の混合物を80℃〜180℃に加熱し、0.5〜4時間、水を除去した後、150〜250℃の温度で10〜48時間、重合反応し、両末端にカルボン酸を有するポリ乳酸誘導体を製造できる。上記の製造工程過程で、水を除去した後の重合反応において、反応温度が150℃未満、または反応時間が10時間未満であれば、所望の分子量の高分子を得ることが困難であり、反応温度が250℃超え、または反応時間が48時間を超えると、高分子の熱分解が発生する問題点がある。
【0046】
本発明のポリ乳酸誘導体化合物の製造方法の工程2)は、前記工程1)で得られた両末端にカルボン酸を有するポリ乳酸誘導体を有機溶媒に溶解した後、アルカリ金属塩水溶液を添加して、化学式2のポリ乳酸誘導体化合物を得るものである。
【0047】
前記アルカリ金属は、例えば、炭酸水素ナトリウム、炭酸ナトリウム、炭酸水素カリウム、炭酸カリウム、炭酸リチウム及びこれらの混合物よりなる群から選択できる。具体的には、炭酸水素ナトリウムまたは炭酸水素カリウムを使用できる。前記有機溶媒として水混和性有機溶媒を使用でき、具体的にはアセトニトリルまたはアセトンを使用できる。工程2)において、前記両末端にカルボン酸を有するポリ乳酸誘導体とアルカリ金属塩の使用量の割合は特に制限がなく、化学式2のポリ乳酸誘導体化合物を得ることができる範囲内で自由に選択することができる。本発明の実施態様によると、両末端にカルボン酸を有するポリ乳酸誘導体1モルに対して、アルカリ金属塩2〜10モルを使用できる。
【0048】
本発明のポリ乳酸誘導体化合物の製造方法は、前記工程2)の後、得られた高分子溶液に、例えば、塩化ナトリウムを添加した後、有機溶媒層を分離して回収し、回収された有機溶媒層から有機溶媒を真空乾燥して除去する工程を、更に含んでもよく、これにより、化学式2のポリ乳酸誘導体化合物を得ることができる。
【0049】
2.錯体、徐放性組成物及びその製造方法
本発明の他の側面によると、薬物伝達体として有用な、数平均分子量が7,000ダルトン以下の前記化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体が提供される。
【0050】
本発明の化学式1のポリ乳酸誘導体は前述のように、末端がアニオンである。従って、多価金属イオンと2モル以上の前記化学式1のポリ乳酸誘導体化合物はイオン結合を通して錯体を形成することができる。本発明の前記錯体において、多価金属イオンは二価または三価の金属イオンである。例えば、亜鉛、カルシウム、マグネシウム及び鉄よりなる群から選択された金属の多価イオンであってもよい。前記多価金属イオンは、例えば、これらの金属の塩化塩のような塩化合物の形態で提供されてもよいが、これに特に制限されるものではない。
【0051】
本発明の錯体の実施態様によると、前記化学式1のポリ乳酸誘導体化合物は、前述した化学式3のポリ乳酸誘導体化合物である。
【0052】
本発明のさらに別の側面によると、i)活性成分としてタンパク質、ポリペプチドまたはペプチド、ii)薬物伝達体として、前記化学式1のポリ乳酸誘導体化合物、及びiii)多価金属イオンを含む、タンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物が提供される。
【0053】
本発明のさらに別の側面によると、i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)薬物伝達体として、前記化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体を含む、タンパク質、ポリペプチド、またはペプチド薬物の徐放性組成物が提供される。
【0054】
本発明の徐放性組成物の実施態様によると、前記多価金属イオンと2モル以上の前記化学式1のポリ乳酸誘導体化合物とイオン結合を通して錯体を形成することができ、この錯体が薬物伝達体として機能し、その内部に活性成分が封入されて微粒子を形成する。
【0055】
本発明の徐放性組成物の実施態様によると、前記化学式1のポリ乳酸誘導体化合物は、前述した化学式3のポリ乳酸誘導体化合物である。
【0056】
本発明の徐放性組成物において、活性成分は、タンパク質、ポリペプチドまたはペプチドであり、本明細書で、これらの用語のいずれか一つを単独で使われた場合でも、特に言及された場合以外は、タンパク質、ポリペプチドまたはペプチドを全て指名するものとして理解しなければならない。
【0057】
本明細書において、“徐放性”、“徐放性伝達”または“徐放性薬物伝達”の用語は、1回投与で薬物の有効血中の濃度を長時間、例えば、72時間以上保持することを意味する。特に、ポリペプチドの一般的な投与経路は皮下、筋肉または静脈注射などであるが、効果的な治療のために、頻繁に注射しなければならない短所があった。本発明は、このような頻繁な投与による不便を解消するための徐放性伝達体の開発及び提供を目指すものである。
【0058】
本発明の徐放性組成物において、前記活性成分の例には、成長ホルモン、エリスロポエチン、単一クローン抗体、顆粒球コロニー刺激因子、マクロファージコロニー刺激因子、顆粒球-マクロファージコロニー刺激因子、トロンボポエチン、インスリン様成長因子、上皮成長因子、血小板由来成長因子、線維芽細胞成長因子、トランスフォーミング成長因子、インターフェロン、インターロイキン、腫瘍壊死因子、ストレプトキナーゼ、ウロキナーゼ、スタフィロキナーゼ、デオキシリボヌクレアーゼ(DNAse)、グルコセレブロシダーゼ、アルファ(α)ガラクトシダーゼ、エクセナチド、オクトレオチド、インスリン、グルカゴン、黄体形成ホルモン放出ホルモン、ゴセレリン(Goserelin)、リュープロレリン(Leuprorelin)、濾胞刺激ホルモン、甲状腺刺激ホルモン、フェルチレリン(Fertirelin)、カルシトニン(Calcitonin)、コルチコトロピン放出因子(Corticotropin Releasing Factor)、脳性ナトリウム利尿ペプチド(Brain Natriuretic Peptide)、チモペンチン(Thymopentin)、コルチコトロピン(Corticotropin)、エルカトニン(Elcatonin)、ベータアミロイド(Beta Amyloid)、トリプトレリン(Triptorelin)、ブセレリン(Buserelin)、サイモシン(Thymosin)、ソマトスタチン(Somatostatin)、アラレリン(Alarelin)、アンギオテンシン(Angiotensin)、アルギプレシン(Argipressin)、アトシバン(Atosiban)、ビバリルジン(Bivalirudin)、セトロレリクス(Cetrorelix)、デスロレリン(Deslorelin)、デスモプレシン(Desmopressin)、エルカトニン(Elcatonin)、エンフビルチド(Enfuvirtide)、エプチフィバチド(Eptifibatide)、GLP−1、ゴナドレリン(Gonandorelin)、リプレッシン(Lyspressin)、ナファレリン(Nafarelin)、ネシリチド(Nesiritide)、オキシトシン(Oxytocin)、プラムリンチド(Pramlintide)、セクレチン(Secretin)、テリパラチド(Teriparatide)、テルリプレシン(Terlipressin)、テトラコサクチド(Tetracosactide)、バプレオチド(Vapreotide)またはこれらの混合物が挙げられる。
【0059】
本発明の徐放性組成物において、前記活性成分は、本発明の徐放性組成物乾燥重量を基準に、0.01〜60重量%、具体的に0.05〜50重量%になるように使用できる。活性成分の含量が、徐放性組成物乾燥重量の0.01重量%未満のとき、意図した薬理効果を得ることが困難であり、60重量%を超えると、薬物の初期過多放出による問題がある。
【0060】
本発明の徐放性組成物において、前記化学式1のポリ乳酸誘導体化合物は、本発明の徐放性組成物乾燥重量を基準に39.9〜99.9重量%、具体的に50〜99重量%で含まれるように使用できる。前記ポリ乳酸誘導体化合物含量が徐放性組成物乾燥重量の39.9重量%未満のとき、徐放性放出効果が得られなく、99.9重量%を超えると、通常的な方法で人体に1回投与できる用量を超えてしまう問題がある。
【0061】
本発明の徐放性組成物において、前記多価金属イオンは、本発明の徐放性組成物乾燥重量を基準に、好ましくは0.01〜20重量%、より好ましくは0.05〜15重量%で含まれるように使用することができる。多価金属イオンの含量が徐放性組成物乾燥重量の0.01重量%未満のとき、徐放性放出効果が得られなく、20重量%を超えると、金属イオンによる毒性が発現される問題がある。
【0062】
このように形成された活性成分含有高分子複合体は、水溶液で粒子として沈澱される。
【0063】
本発明に係るポリペプチドなどを含有した徐放性微粒子組成物は、5〜250μm、具体的に50〜150μmの均一したサイズの微粒子である。
【0064】
本発明の徐放性組成物は、上記した成分以外に防腐剤、安定化剤、水和剤または浸透圧調節のための塩及び/又は緩衝液などの薬剤学的補助剤及びその他の治療的に有用な物質を、更に含有していてもよい。本発明のタンパク質、ポリペプチドまたはペプチド薬物含有徐放性組成物は、薬学的に使用可能な分散媒に分散して、人体に投与できる。前記分散媒の例は、注射用蒸留水、5%ブドウ糖、生理食塩水、ミネラル油、モノ−、ジ−及びトリ−グリセリドなどが挙げられる。
【0065】
本発明のさらに別の側面によると、a)i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)前記化学式1のポリ乳酸誘導体化合物を含有する水溶液を調製する工程;及びb)前記工程a)水溶液を、多価金属イオンを含む水溶液に滴下し、沈澱物を得る工程を含む、タンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物を製造する方法が提供される。
【0066】
具体的に、本発明の徐放性組成物製造方法の工程a)では、まず活性成分と前記化学式2のポリ乳酸誘導体化合物を同時に添加または一方の成分を添加した後、他方の成分を添加する順次添加により水溶液を調製することができる。例えば、(a−1)活性成分及び前記化学式2のポリ乳酸誘導体化合物を水に溶解して、水溶液を調製するか;(a−2)まず、両末端にカルボン酸を有するポリ乳酸誘導体及びアルカリ金属塩水溶液を水に溶解して、前記化学式2のポリ乳酸誘導体化合物を製造し、活性成分を添加して、水溶液を調製するか;または(a−3)まず、両末端にカルボン酸を有するポリ乳酸誘導体及び活性成分を水に溶解し、そこにアルカリ金属塩水溶液を添加し、前記化学式2のポリ乳酸誘導体化合物及び活性成分を含有する水溶液を調製することによって水溶液を調製できる。
【0067】
即ち、本発明の徐放性組成物の製造は、前記化学式2のポリ乳酸誘導体化合物を開始物質として使用することもでき(a−1)、代案として、両末端にカルボン酸を有するポリ乳酸誘導体から出発して、これをアルカリ金属塩により前記化学式2のポリ乳酸誘導体化合物に変化させた後、使用することができる(a−2及びa−3)。
【0068】
本発明の徐放性組成物製造方法の実施態様によると、前記水溶液を構成する水性媒体は、蒸留水、またはアセテート塩、クエン酸塩、グリシン塩、リン酸塩及び炭酸塩の緩衝液よりなる群から選択される一つ以上の緩衝液であってもよい。タンパク質、ポリペプチドまたはペプチド薬物は製剤の組成、特にpHに敏感に反応し、それにより、構造が変化するか、活性が減少される。
【0069】
本発明の徐放性組成物製造方法の前記工程b)では、前記工程a)で得られた水溶液を、多価金属イオンを含む水溶液にゆっくり滴下して沈澱物を形成させる。このとき、活性成分は、前記化学式1のポリ乳酸誘導体化合物と多価金属イオンとの錯体内部に分散されて沈殿され得る。この工程で多価金属イオンとしては、例えば、亜鉛、カルシウム、マグネシウム及び鉄よりなる群から選択された金属の多価イオンであってもよい。前記多価金属イオンは、例えば、これらの金属の塩化塩のような塩化合物の形態で提供できるが、これらに特に制限されるものではない。多価イオン水溶液の濃度は1〜300mg/mLであり、具体的に1〜100mg/mLである。高分子錯体が形成される場合、多価金属イオンは、前記化学式1のポリ乳酸誘導体化合物のアニオンと直接イオン結合をするか、アルカリ金属イオンを置換しながらイオン結合をして錯体となる。そして、この錯体内部には、ポリペプチドなどの活性成分が封入され、このように形成された活性成分含有高分子複合体は、水溶液中に微粒子として沈澱される。本発明の実施態様によると、前記工程a)の活性成分及び前記化学式1のポリ乳酸誘導体化合物を含む水溶液は、工程b)で、体積比1〜30倍の多価イオン水溶液に滴下して沈殿することができる。
【0070】
本発明の徐放性組成物製造方法は、前記工程b)の後に、前記工程b)で得た沈澱物を遠心分離した後、水で洗浄する工程c)を、更に含んでいてもよい。この工程c)は、低温、例えば、4℃が保持される遠心分離機で、工程b)の沈澱物を遠心分離して上清と沈澱物を分離した後、沈澱物を水で洗浄する方式で遂行できる。
【0071】
また、本発明の徐放性組成物製造方法は、前記工程c)の後に、前記工程c)で分離された沈澱物を凍結乾燥する工程d)を、更に含んでいてもよい。この工程d)で、凍結乾燥時、凍結乾燥補助剤を添加できる。凍結乾燥補助剤には、糖、糖アルコールまたはこれらの混合物が含まれる。前記糖は、ラクトース、マルトース、スクロース及びトレハロースよりなる群から選択される一つ以上であり、前記糖アルコールはマンニトール、ソルビトール、マルチトール、キシリトール及びラクチトールよりなる群から選択される一つ以上であってもよい。本発明の実施態様で、凍結乾燥補助剤の含量は、凍結乾燥組成物全体乾燥重量を基準に、1〜50重量%、より好ましくは1〜30重量%である。
【0072】
本発明に係る、ポリペプチドなどを含有した徐放性微粒子組成物は、工程b)、c)またはd)の後、任意に電動篩を利用して粉砕するか、超音波粉砕方法などを通して好ましくは5〜250μm、より好ましくは50〜150μmの均一なサイズの微粒子にしてもよい。
【0073】
本発明の徐放性組成物製造方法は、有機溶媒を用いることなく、水溶液を使用するため、工程中に別途の有機溶媒除去工程が必要とされず、製造工程中、薬物の変性を防止して薬理効果を最大限に高めることができる長所がある。また、タンパク質、ポリペプチドまたはペプチドの封入効率が90%以上であり、製造工程中、薬物の損失を最小化することができる。
【0074】
本発明に係る徐放性組成物が体内に投与されると、複合体を構成する高分子が体内で分解されながら内部に封入された薬物をゆっくり放出する。従来には、徐放性、即ち、薬物の放出時間を遅延するために分子量が数万ダルトン以上の高分子量の高分子を使用しければならなかったが、このような高分子量の高分子は、水に溶解されないため、微粒子のような伝達体の製造工程でタンパク質またはペプチドの変性を引き起こす有機溶媒を使用しなければならない短所があった。しかし、本発明に係る徐放性微粒子組成物は、水に溶解される低分子量の高分子を使用するので、徐放性組成物製造時に有機溶媒の使用が不要である。また、多価金属イオンにより高分子が錯体を形成することができるので、本発明の徐放性組成物を体内に投与すると、優れた持続放出効果が得られる。
【実施例】
【0075】
以下、本発明を製造例、実施例及び実験例などを通して、さらに詳しく説明するが、これらは本発明を説明するためのものであり、本発明の範囲がこれらによって制限されるものではない。
【0076】
[製造例1]ポリ乳酸誘導体の製造
D,L−乳酸500g(5.56モル)とコハク酸18.9g(0.16モル)を1Lの2口−丸底フラスコに入れ、磁石棒で撹拌しながら窒素パージした。加熱用油槽を160℃に加熱し、窒素を2000mL/minの流速で反応物内部にパージした。反応中に生成される水は、窒素の流れに沿って反応器外に排出した。水を1時間除去した後、油槽を200℃に加熱した。24時間反応した後、反応を終結した。その結果、両末端にカルボン酸を有する粗D,L−ポリ乳酸誘導体368gを得た。製造されたポリ乳酸誘導体のNMRスペクトルを図1に示す。下記NMR分析法で測定した結果、製造されたポリ乳酸誘導体の数平均分子量は2,315ダルトンであった。
<1H−NMRスキャンのピーク面積から数平均分子量の計算>
〔式1〕
数平均分子量(ダルトン)={(A+B)/(C/N)}×72.1
(式中、AはD,L−ポリ乳酸誘導体のメチレンプロトンのピーク面積であり、
Bは高分子末端D,L−乳酸誘導体のメチレンプロトンのピーク面積であり、
Cはジカルボン酸のメチレンプロトンのピーク面積であり、
Nはジカルボン酸のメチレンプロトンの個数である。)
【0077】
[製造例2]ポリ乳酸誘導体の製造
コハク酸39.3g(0.33モル)を用いたこと以外は、製造例1と同様にして、ポリ乳酸誘導体を重合した。その結果、両末端にカルボン酸を有する粗ポリ乳酸誘導体348gを得た。前記NMR分析法で測定した結果、その数平均分子量は1,155ダルトンであった。
【0078】
[製造例3]ポリ乳酸誘導体の精製
製造例1で得られたポリ乳酸誘導体100gと炭酸水素ナトリウム(NaHCO3)20gを2Lのビーカーに入れ、蒸留水(1L)を添加した。混合物を60℃に加熱し、撹拌しながら1時間、高分子を溶解した。高分子を溶解した後、室温で塩化水素(HCl)水溶液(1N)を、高分子水溶液に滴下しながら高分子を析出した。析出された高分子をろ過し、蒸留水で洗浄した。洗浄及びろ過を3回繰り返し、塩化水素を除去した。得られた高分子は48時間、凍結乾燥した。その結果、両末端にカルボン酸を有する粗ポリ乳酸誘導体72.4gを得た。前記NMR分析法で測定した結果、その数平均分子量は2,703ダルトンであった。
【0079】
[製造例4]ポリ乳酸誘導体の製造
コハク酸の代わりにグルタル酸21.1g(0.16モル)を用いたこと以外は、製造例1と同様にして、両末端にカルボン酸を有するポリ乳酸誘導体381gを得た。前記NMR分析法で測定した結果、その数平均分子量は2,360ダルトンであった。
【0080】
[製造例5]ポリ乳酸誘導体の製造
D,L−乳酸500g(5.56モル)を1Lの2口−丸底フラスコに入れ、磁石棒で撹拌しながら窒素パージした。加熱用油槽を160℃に加熱し、窒素を2000mL/minの流速で反応物内部にパージした。反応中に生成される水は、窒素の流れに沿って反応器外に排出した。水を1時間除去した後、油槽を200℃に加熱した。24時間反応後、反応を終結した。その結果、両末端に、それぞれ、ヒドロキシル基とカルボン酸を有する粗D,L−ポリ乳酸を得た。生成物に無水コハク酸35g(0.35モル)を添加し、120℃で6時間加熱し、ポリ乳酸末端基のヒドロキシル基と反応するようにした。製造されたポリ乳酸誘導体を前記NMR分析法で測定した結果、その数平均分子量は2,240ダルトンであった。
【0081】
[実施例1]ポリ乳酸誘導体ナトリウム塩の製造
製造例1で得られたポリ乳酸誘導体100gにアセトニトリル150mLを加え、溶解した。そこに、炭酸水素ナトリウム水溶液150mL(0.1g/mL)をゆっくり添加した。室温で2時間撹拌して、高分子を中和し、ポリ乳酸誘導体ナトリウム塩を製造した。
【0082】
次いで、塩析出法により製造された高分子を精製した。即ち、得られた反応溶液に塩化ナトリウム(NaCl)15gを撹拌しながら添加して溶解し、分液ロートで2時間層分離し、水溶液層を除去した。
【0083】
得られた有機溶媒層高分子溶液に、蒸留水100mLと塩化ナトリウム10gを再度加えて溶解し、分液ロートを用いて再び層分離し、水溶液層を除去した。得られた高分子を含む有機溶媒層溶液を50℃で回転分留し、有機溶媒と少量の蒸留水を完全に除去した。
【0084】
有機溶媒と蒸留水を除去した後に、得られた高分子に、無水アセトン500mLを添加して、高分子を溶解し、溶解されない沈澱物はろ紙を用いて除去した。ろ過された高分子溶液を、50℃で2時間回転分留し、アセトンを完全に除去した。
【0085】
アセトンが除去された高分子を、50℃真空オーブン内で3日間真空乾燥した。その結果、両末端にカルボン酸ナトリウム塩を有する、粗ポリ乳酸誘導体のナトリウム塩91gを得た。製造されたポリ乳酸誘導体塩のNMRスペクトルを図2に示す。前記NMR分析法で測定した結果、その数平均分子量は2,178ダルトンであった。
【0086】
[実施例2]ポリ乳酸誘導体ナトリウム塩の製造
製造例2で得られたポリ乳酸誘導体100gを用いて実施例1と同様の方法で、両末端にカルボン酸ナトリウム塩を有する、精製されたポリ乳酸誘導体の塩93gを得た。前記NMR分析法で測定した結果、その数平均分子量は1,125ダルトンであった。
【0087】
[実施例3]ポリ乳酸誘導体ナトリウム塩の製造
製造例4で得られたポリ乳酸誘導体100gを用いて実施例1と同様の方法で、両末端がカルボン酸ナトリウム塩を有する、精製されたポリ乳酸誘導体の塩91gを得た。前記NMR分析法で測定した結果、その数平均分子量は2,250ダルトンであった。
【0088】
[実施例4]ポリ乳酸誘導体ナトリウム塩の製造
製造例5で得られたポリ乳酸誘導体100gを用いて実施例1と同様の方法で、両末端にカルボン酸ナトリウム塩を有する、精製されたポリ乳酸誘導体の塩90gを得た。前記NMR分析法で測定した結果、その数平均分子量は2,080ダルトンであった。
【0089】
[実施例5]ヒト成長ホルモン(hGH)含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩4.5gとヒト成長ホルモン500mg(3.0IU/mg)を20mLの水に溶解し、hGH−高分子水溶液を調製した。
【0090】
多価金属塩として塩化亜鉛(ZnCl2)水溶液250mL(50mg/mL)を用意した。この溶液に前記hGH−高分子水溶液を滴下し、ヒト成長ホルモン含有組成物の沈澱物を生成した。この混合物を4℃に保持された遠心分離機を用いて、3,500rpmで10分間遠心分離し、上清と沈澱物を分離した。
【0091】
沈澱物をろ過した後、蒸留水500mLを加えて2回洗浄し、凍結乾燥した。凍結乾燥した組成物を100〜400メッシュの篩にかけ、50〜150μmの微粒子組成物を得た。
【0092】
得られた凍結乾燥微粒子組成物内のヒト成長ホルモンを下記のBCAアッセイ(Micro BCA Protein Assay Kit, Thermo Scientific)を用いて定量した。定量結果、hGHの含量及び封入効率は、それぞれ9.54重量%及び92.6%であった。
【0093】
<BCAアッセイ(Micro BCA Protein Assay Kit, Thermo Scientific)を用いたタンパク質の含量及び封入効率の測定>
(1)タンパク質含量の測定
〔式2〕
含量(%)={微粒子に封入されたペプチドまたはタンパク質の量(g)/微粒子組成物の全体量(g)}×100
(2)タンパク質封入効率の測定
〔式3〕
封入効率(%)={微粒子に封入されたペプチドまたはタンパク質の量(g)/微粒子組成物の製造に使われた量(g)}×100
【0094】
[実施例6]ヒト成長ホルモン含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩4.75gとヒト成長ホルモン(3.0IU/mg)250mgを用いたこと以外は、実施例5と同様にして、ヒト成長ホルモン含有微粒子組成物を製造した。製造された組成物内のヒト成長ホルモンを前記BCAアッセイで定量した結果、hGHの含量及び封入効率はそれぞれ4.72重量%及び91.7%であった。
【0095】
[実施例7]ヒト成長ホルモン含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩4.75gとヒト成長ホルモン100mg(3.0IU/mg)を用いたこと以外は、実施例5と同様にして、ヒト成長ホルモン含有微粒子組成物を製造した。製造された組成物内のヒト成長ホルモンを前記BCAアッセイで定量した結果、hGHの含量及び封入効率はそれぞれ1.93重量%及び93.7%であった。
【0096】
[実施例8]ヒト成長ホルモン含有徐放性組成物の製造
実施例2で製造したポリ乳酸誘導体ナトリウム塩を用いたこと以外は、実施例6と同様にして、ヒト成長ホルモン含有微粒子組成物を製造した。製造された組成物内のヒト成長ホルモンを前記BCAアッセイで定量した結果、hGHの含量及び封入効率はそれぞれ4.72重量%及び91.7%であった。
【0097】
[実施例9]ヒト成長ホルモン含有徐放性組成物の製造
製造例3で精製されたポリ乳酸誘導体ナトリウム塩4.9g、ヒト成長ホルモン100mg(3.0IU/mg)を20mLの水に溶解し、そこに炭酸水素ナトリウム0.3g(NaHCO3)を加え、hGH−高分子水溶液を調製した。
【0098】
多価金属塩として塩化亜鉛(ZnCl2)水溶液250mL(50mg/mL)を用意し、この溶液を撹拌しながら、そこに前記hGH−高分子水溶液を滴下し、ヒト成長ホルモン含有組成物の沈澱物を生成した。この混合物を4℃に保持された遠心分離機を用いて、3,500rpmで10分間遠心分離し、上清と沈澱物を分離した。
【0099】
沈澱物をろ過した後、蒸留水500mLを加え、2回洗浄し、凍結乾燥した。凍結乾燥した組成物を100〜400メッシュの篩にかけ、50〜150μmの微粒子組成物を得た。
【0100】
得られた凍結乾燥微粒子組成物内のヒト成長ホルモンを前記BCAアッセイで定量した結果、hGHの含量及び封入効率はそれぞれ4.86重量%及び94.4%であった。
【0101】
[実施例10]エリスロポエチン(EPO)含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩1gとエリスロポエチン0.4mg(41IU/mg)を5mLの水に溶解し、EPO−高分子水溶液を調製した。
【0102】
多価金属塩として塩化亜鉛(ZnCl2)水溶液5.5mL(12.5mg/mL)を用意し、この溶液を撹拌しながら、そこに前記EPO−高分子水溶液を加え、エリスロポエチン含有組成物の沈澱物を生成した。この混合物を4℃に保持される遠心分離機を用いて、3,500rpmで10分間遠心分離し、上清と沈澱物を分離した。
【0103】
上清を完全に除去した後、得られた沈澱物を凍結乾燥した。凍結乾燥した組成物を100〜400メッシュの篩にかけ、50〜150μmの微粒子組成物を得た。
【0104】
得られた凍結乾燥微粒子組成物内のエリスロポエチンを前記BCAアッセイで定量した結果、エリスロポエチンの含量及び封入効率はそれぞれ0.038重量%及び92.2%であった。
【0105】
[実施例11]エクセナチド含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩4.9gとエクセナチド100mgを45mLの水に溶解した水溶液を調製した後、0.45μmフィルタを用いて不純物を除去した。
【0106】
多価金属塩として塩化亜鉛(ZnCl2)水溶液500mL(25mg/mL)を用意し、そこに前記エクセナチド−高分子水溶液を3mL/minの速度で滴下しながら120rpmで撹拌し、エクセナチドの含有組成物の沈澱物を得た。
【0107】
沈澱物をろ過し、蒸留水500mLを加え、2回洗浄した後、室温で1日間真空乾燥した。乾燥された組成物を粉砕機で粉砕し、100〜400メッシュの篩にかけ、50〜150μmの微粒子組成物を得た。
【0108】
得られた乾燥微粒子組成物内のエクセナチドを前記BCAアッセイで定量した結果、エクセナチドの含量及び封入効率はそれぞれ1.97重量%及び95.6%であった。
【0109】
[実施例12]エクセナチド含有徐放性組成物の製造
多価金属塩として塩化亜鉛(ZnCl2)の代りに塩化カルシウム(CaCl2)を用いたこと以外は、実施例11と同様にして、エクセナチド含有微粒子組成物を製造した。得られた乾燥微粒子組成物内のエクセナチドを前記BCAアッセイで定量した結果、エクセナチドの含量及び封入効率はそれぞれ1.92重量%及び93.2%であった。
【0110】
[実施例13]エクセナチド含有徐放性組成物の製造
実施例3で製造したポリ乳酸誘導体ナトリウム塩4.9gを用いたこと以外は、実施例11と同様にしてエクセナチド含有微粒子組成物を製造した。得られた乾燥微粒子組成物内のエクセナチドを前記BCAアッセイで定量した結果、エクセナチドの含量及び封入効率はそれぞれ1.94重量%及び94.2%であった。
【0111】
[比較例1]ヒト成長ホルモン(hGH)水溶液組成物の製造
下記表1に記載された組成物を10mLの注射用水に溶解し、ヒト成長ホルモン水溶液を調製した。
【0112】
【表1】

【0113】
[比較例2]エリスロポエチン(EPO)水溶液組成物の製造
下記表2に記載された組成物を1.0mLの注射用水に溶解し、エリスロポエチン水溶液を調製した。
【0114】
【表2】

【0115】
[実験例1]ヒト成長ホルモン(hGH)含有組成物の薬物動態試験
実施例5〜9及び比較例1で製造したヒト成長ホルモン(hGH)含有組成物の薬物動態試験を実施した。
【0116】
S.D.ラット(190±20g、5〜6週齢)をCharles River Laboratories(Orient、Korea)から供給を受け、恒温、恒湿が保持された飼育室で一週間以上適応させた後、一般状態を観察し、外観上健常な動物を選別し、実験に用いた。実験動物は、12時間間隔で、照度300〜500ルクスの人工照明にて、温度23±1℃、相対湿度65±10%の条件下で飼育し、滅菌された固形飼料と水道水は自由に与えた。
【0117】
それぞれの組成物を5mg/kgの投与量で、ラットに皮下注射した後(n=5)、一定時間の間隔で10日間血液を採取し、Quantikineh GHイムノアッセイキット(R&D Systems)で血中hGHを定量した。この定量結果を図3に示す。図3に示されるように、本発明に係るヒト成長ホルモン含有組成物は、10日以上、1ng/mL以上の血中ヒト成長ホルモン濃度を保持していた。更に、解剖検査の結果、本発明の組成物による毒性は観察されなかった。
【0118】
[実験例2]ヒト成長ホルモン含有組成物の効能試験
実施例5〜6及び比較例1で製造したヒト成長ホルモン含有組成物を、脳下垂体を摘出して成長ホルモン欠乏を誘発したラット(hypophysectomized rats)に投与して、効能試験を実施した。
【0119】
疾患モデル動物として脳下垂体を摘出したS.D.ラット(90±10g、4週齢、JapanSLC, Inc.)を恒温、恒湿が保持される飼育室で、一週間適応させた後、一般状態を観察し、外観上、健常で体重変化が起きない動物を選別し、実験に用いた。実験動物は12時間間隔で、照度300〜500ルクスの人工照明にて、温度23±1℃、相対湿度65±10%の条件下で飼育し、滅菌された固形飼料と水道水は自由に与えた。
【0120】
実施例5及び6の組成物は5mg/kgの投与量で1回皮下注射し、比較例1の組成物は0.71mg/kgの投与量で1日1回、7日間皮下注射した(n=6)。一定時の間隔で血液を採取し、Quantikine IGF−1 イムノアッセイキット(R&D Systems)で血中IGF−1(Insulin Like Growth Factor-1)の濃度を定量した。また、動物の体重を測定し、体重の変化を記録した。定量及び体重測定の結果を図4及び図5に示す。
【0121】
図4に示されるように、成長ホルモンにより生成されるIGF−1の血中濃度において、本発明の組成物を1回投与した場合に、既存市販製剤の組成物を7日間、毎日1回投与した場合に比べて優れた結果を示す。
【0122】
また、図5に示されるように、本発明の組成物を1回投与した場合に、2週間経過後の体重が約20%増加しており、既存の市販製剤の組成物を7日間、毎日1回投与の場合に比べて優れた結果を示す。成長ホルモンを投与しない陰性対照群(No Treatment)は体重増加を示さなかった。解剖検査結果、本発明の組成物による毒性は観察されなかった。
【0123】
[実験例3]エリスロポエチン(EPO)含有組成物の薬物動態試験
実施例10及び比較例2で製造したエリスロポエチン(EPO)含有組成物の薬物動態試験を実施した。
【0124】
S.D.ラット(190±20g、5〜6週齢)をCharles River Laboratories(Orient, Korea)から供給を受け、実験例1と同じ条件下で動物を管理した。
【0125】
それぞれの組成物を2000IU/kgの投与量でラットに皮下注射した後(n=6)、一定時間の間隔で血液を採取し、エンザイムイムノアッセイキット(DEP00, R&D systems)を用いて、血中エリスロポエチン濃度を定量した。定量結果を図6に示す。図6に示されるように、本発明に係るエリスロポエチン含有組成物は、連日投与する市販組成物に比べて血中濃度を保持する時間が遅延され、1週間の持続放出効果を示す。解剖検査の結果、本発明の組成物による毒性は観察されなかった。
【0126】
[実験例4]エクセナチド含有組成物の薬物動態試験
実施例11〜13で製造したエクセナチド含有組成物の薬物動態試験を実施した。
【0127】
S.D.ラット(190±20g、5〜6週齢)をCharles River Laboratories(Orient, Korea)から供給を受け、実験例1と同じ条件下で動物を管理した。
【0128】
実施例11の組成物(400μg/ラット、800μg/ラット)と実施例12及び13の組成物(400μg/ラット)を、ラットに皮下注射した後(n=6)、一定時間の間隔で血液を採取し、エンザイムイムノアッセイキット(EK-070-94 , Phoenix Pharmaceuticals, Inc.)を用いて、血中エクセナチドの濃度を定量した。定量結果を図7に示す。図7に示されるように、本発明に係るエクセナチド含有組成物は、1回投与で1週間以上、0.1ng/mL以上の血中濃度を保持した。解剖検査の結果、本発明の組成物による毒性は観察されなかった。
【技術分野】
【0001】
本発明は、タンパク質、ポリペプチドまたはペプチド薬物伝達用高分子及びその製造方法、並びにこれを含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物に関する。さらに詳しくは、数平均分子量が7,000ダルトン以下の下記化学式1のポリ乳酸誘導体化合物及びその製造方法、並びにそれを用いたタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物及びその製造方法に関するものである:
【0002】
【化1】

【0003】
(式中、X、X’、Y、Z、R、m、n、a及びbは本明細書の定義と同義である。)
【背景技術】
【0004】
遺伝子工学分野の飛躍的な発展に伴い、タンパク質またはペプチドの機能と役割が明らかになってきており、これらの大量生産が可能になった。その結果、多数のタンパク質またはペプチド薬物が商用化され、またこれらを活用した新薬開発のための努力が続けられている。
【0005】
タンパク質またはペプチドは、経口で投与する場合に、腸壁の通過が難しく、消化管内で容易に変性するか、酵素により分解されるため、生体利用率が非常に低く、注射剤の形態として開発されている。
【0006】
注射製剤の場合、頻繁な投与による患者の不便を解消するために、1回投与で長期間薬効が持続される徐放性製剤を開発するための様々な方法が試みられており、このような試みの例が多くの文献に紹介されている(非特許文献1、2)。
【0007】
商用化された徐放性タンパク質製剤として、ポリエチレングリコール(PEG)とタンパク質を接合(conjugation)したPEGylation技術をインターフェロンに適用した製品(PEGasys(登録商標)、PEGintron(登録商標))、GCSF(Neulasta(登録商標))、Asparaginase(Oncaspar(登録商標))、Adenosinedeaminase(Adagen(登録商標))などがあるが、これらは分子量5,000〜50,000ダルトンのPEGとタンパク質の接合体であり、新規化合物に該当し、他のタンパク質に応用するためには生物学的安全性及び有効性の検証が必須的に求められ、生産に高価のコストが必要とされる短所がある。
【0008】
一方、生分解性高分子のポリ乳酸またはポリ乳酸−グリコール酸高分子を微粒子伝達体として利用して、酢酸ロイプロリド(Lupron(登録商標)Depot)、オクトレオチド(Sandostatin(登録商標))、酢酸ゴセレリン(Zoladex(登録商標))、Triptorelin Pamoate(Trelatar(登録商標)Depot)などのペプチド薬物に対する徐放性製剤が商用化されたものがあるが、その持続放出効果などが依然として満たされていない。
【0009】
タンパク質薬物については、ヒト成長ホルモンの徐放性製剤(Nutropin(登録商標)Depot)が唯一、米国FDAの承認を得ているが、毎日投与する製剤に比べて、効果が不十分で、2004年市場から完全に撤収した。
【0010】
このように、タンパク質またはペプチド薬物に対して、現在まで開発されたポリ乳酸またはポリ乳酸−グリコール酸高分子微粒子を用いた製剤は、初期過多放出及び不十分な持続放出効果など徐放性製剤としての解決しなければならない課題を依然として抱えている。また、製造工程中、薬物の変性及び過多の薬物損失による製造原価の上昇など経済的な要因も問題点として指摘されている。
【先行技術文献】
【非特許文献】
【0011】
【非特許文献1】Khaled Al-Tahami et al., "Smart Polymer Based Delivery Systems for Peptides and Proteins", Recent Patents on Drug Delivery & Formulation 2007, Vol. 1, No. 1, pp. 65-71, 2007
【非特許文献2】Fei Wu et al., "Polymer-Based Sustained-Release Dosage Forms for Protein Drugs, Challenges, and Recent Advances", AAPS PharmSciTech, Vol. 9, No. 4, pp. 1 1218-1229, 2008
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、前述のような従来技術の問題点を解決するためのものである。本発明の技術的課題は初期過多放出の問題がなく、薬物の持続放出性に優れ、毒性がなく、タンパク質、ポリペプチドまたはペプチド薬物の徐放性伝達用として特に適した高分子及び薬物伝達体を提供すること、そして、薬物伝達体として同じものを含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物を提供することにある。
【0013】
別の側面では、本発明の技術的課題は本発明に係る徐放性組成物を、有機溶媒を用いることなく、効率的に製造する方法を提供することにある。
【課題を解決するための手段】
【0014】
前述した技術的課題を解決するために、本発明は、数平均分子量が7,000ダルトン以下の下記化学式1のポリ乳酸誘導体化合物を提供する:
【0015】
【化2】

【0016】
{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
Y及びZは独立して存在しないか、またはアルカリ金属であり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
前記で“Y及びZが独立して存在しない”とは、Y及びZに独立して結合した酸素が負電荷の形態、即ち、−O−の形態であることを意味する。
【0017】
本発明の別の側面によると、1)遊離酸またはラクトン形態の乳酸またはその誘導体とジカルボン酸を重合して、両末端にカルボン酸を有するポリ乳酸誘導体を得る工程;及び2)前記工程1)で得られたポリ乳酸誘導体を有機溶媒に溶解した後、アルカリ金属塩水溶液を添加し、ポリ乳酸誘導体の塩を得る工程;を含む、下記化学式2のポリ乳酸誘導体化合物の製造方法が提供される:
【0018】
【化3】

【0019】
(式中、X、X’、R、m、n、a及びbは本明細書の定義と同義であり、Y’及びZ’は独立してアルカリ金属である。)
本発明のさらに別の側面によると、数平均分子量が7,000ダルトン以下の化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体及びこれを含む徐放性組成物が提供される。
【0020】
本発明のさらに別の側面によると、i)活性成分としてタンパク質、ポリペプチドまたはペプチド、ii)薬物伝達体として、化学式1のポリ乳酸誘導体化合物、及びiii)多価金属イオンを含む、タンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物が提供される。
【0021】
本発明のさらに別の側面によると、i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)薬物伝達体として、化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体を含む、タンパク質、ポリペプチド、またはペプチド薬物の徐放性組成物が提供される。この徐放性組成物は、化学式1のポリ乳酸誘導体化合物と多価金属イオンが形成する複合体に、タンパク質、ポリペプチドまたはペプチドなどの活性成分が封入された微粒子を含む。
【0022】
本発明のさらに別の側面によると、a)i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)化学式1のポリ乳酸誘導体化合物を含有する水溶液を調製する工程;及びb)工程a)の水溶液を、多価金属イオンを含む水溶液に滴下し、沈澱物を得る工程;を含む、タンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物を製造する方法が提供される。
【発明の効果】
【0023】
本発明に係る高分子を用いた徐放性薬物伝達組成物は、活性成分のタンパク質、ポリペプチドまたはペプチドの徐放性放出を可能にする。また、前記組成物を製造する方法は、有機溶媒を用いないため、製造工程中の薬物の変性を防止し、薬理効果を最大限に高めることができる。更に、別途の有機溶媒除去工程を必要としない。しかもタンパク質、ポリペプチドまたはペプチドの封入効率を90%以上達成できるので、製造工程中の薬物の損失を最小化することができる。
【図面の簡単な説明】
【0024】
【図1】製造例1で製造されたポリ乳酸誘導体化合物をCDCl3に溶解して得た1H−NMRスペクトルである。
【図2】実施例1で製造された前記化学式1のポリ乳酸誘導体ナトリウム塩をCDCl3に溶解して得た1H−NMRスペクトルである。
【図3】実験例1で得たラットにおいて、ヒト成長ホルモン含有製剤の薬物動態を試験した結果を示すグラフである。
【図4】実験例2で得た脳下垂体を摘出したラットにヒト成長ホルモン含有製剤を皮下注射した後、生成される血中IGF−1濃度を測定した結果を示すグラフである。
【図5】実験例2で得た脳下垂体を摘出したラットにヒト成長ホルモン含有製剤を皮下注射した後、体重の増加を測定した結果を示すグラフである。
【図6】実験例3で得たラットにおいてエリスロポエチン含有製剤の薬物動態を試験した結果を示すグラフである。
【図7】実験例4で得たラットにおいてエクセナチド含有製剤の薬物動態を試験した結果を示すグラフである。
【発明を実施するための形態】
【0025】
以下、本発明について、さらに詳しく説明する。
【0026】
1.ポリ乳酸誘導体化合物及びその製造方法
本発明によって提供される、タンパク質、ポリペプチドまたはペプチド薬物の徐放性伝達用ポリ乳酸誘導体化合物は、両末端にカルボキシル基を有し、下記化学式1で示される:
【0027】
【化4】

【0028】
{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
Y及びZは独立して存在しないか、またはアルカリ金属であり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
前記で“Y及びZが独立して存在しない”とは、Y及びZに独立して連結された酸素が負電荷の形態、即ち、−O−の形態であることを意味する。
【0029】
本発明の実施態様によると、前記化学式1において、X及びX’は、独立して水素、炭素数1〜4のアルキルまたは炭素数1〜4のアルキルで非置換の、または置換されたの炭素数6のアリールであり、好ましくは、水素、メチルまたはフェニルであり、さらに好ましくはメチルである。
【0030】
本発明の実施態様によると、前記化学式1において、Y及びZは、独立して存在しないか、またはアルカリ金属である。Y及びZがアルカリ金属の場合には、具体的に下記化学式2で示すことができる。存在しない場合には、化学式1の高分子末端がアニオン形態を意味し、具体的には化学式3で示すことができる。アルカリ金属は、具体的には独立してナトリウム、カリウムまたはリチウムであってもよい:
【0031】
【化5】

【0032】
(式中、X、X’、R、m、n、a及びbは本明細書の定義と同義であり、Y’及びZ’は独立してアルカリ金属である。)
【0033】
【化6】

【0034】
(式中、X、X’、R、m、n、a及びbは前記定義と同義であり、
本発明の実施態様によると、Rは−(CH2)k−であり、ここで、kは0〜10の整数である。)
前記化学式1において、Rが炭素数2〜10の二価アルケニルまたは炭素数6〜20の二価アリールの場合、これらはそれぞれ独立して、ヒドロキシ基またはC1〜C5のアルキルで置換されていてもよい。
【0035】
前記化学式1において、m及びnは、好ましくは10<m+n<70を満たす。
【0036】
本発明の好ましい実施態様によると、前記ポリ乳酸誘導体化合物は下記化学式4で示される:
【0037】
【化7】

【0038】
(式中、Y、Z、R、m、n、a及びbは本明細書の定義と同義である。)
本発明の化学式1のポリ乳酸誘導体化合物は水溶性であり、その数平均分子量は7,000ダルトン以下、好ましくは500〜7,000ダルトン、より好ましくは700〜5、000ダルトン、より一層好ましくは1,000〜4,000ダルトンである。数平均分子量が7,000ダルトンを超えると、ポリ乳酸誘導体化合物が水に溶解されず、薬物伝達体として用いるのに適しない。また、数平均分子量が500ダルトン未満のとき、分子量が小さく、体内分解が速すぎて、薬物の持続放出を期待するのが困難である。
【0039】
本発明のポリ乳酸誘導体化合物は、ジカルボン酸を中心に、例えば、ポリ乳酸、ポリラクチド、ポリグリコリド、ポリマンデル酸、ポリカプロラクトン及びこれらの共重合体よりなる群から選ばれる2個のブロックを含む。本発明の実施態様によると、前記ポリ乳酸誘導体化合物はポリ乳酸、乳酸とマンデル酸の共重合体、乳酸とグリコール酸の共重合体及び乳酸とカプロラクトンの共重合体よりなる群から選ばれる2個のブロックを含む。さらに具体的に、前記ポリ乳酸化合物はポリ乳酸の2個のブロックを含む。
【0040】
前記ジカルボン酸として、好ましくは、炭素数3〜10個のジカルボン酸、例えば、シュウ酸、マロン酸、リンゴ酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸、アゼライン酸、セバシン酸、ドデカン二酸、またはこれらの混合物を使用できる。さらに、フマル酸またはマレイン酸などのC4〜C12の不飽和ジカルボン酸、フタル酸またはテレフタル酸などのC8〜C22のアリールジカルボン酸も使用可能である。
【0041】
本発明の化学式1のポリ乳酸誘導体化合物は、両末端がイオン性であり、両末端はアルカリ金属イオンとイオン結合をするか、またはしない。具体的に、それぞれ化学式2または化学式3の形態であってもよい。前記末端のアニオンは、直接多価金属イオンと結合するか、またはアルカリ金属イオンの場合には、多価金属イオンにより置換され、イオン結合錯体を形成することができる。
【0042】
本発明の別の側面によると、1)遊離酸またはラクトン形態の乳酸またはその誘導体とジカルボン酸を重合し、両末端にカルボン酸を有するポリ乳酸誘導体を得る工程;及び2)前記工程1)で得られたポリ乳酸誘導体を有機溶媒に溶解した後、アルカリ金属塩水溶液を添加し、ポリ乳酸誘導体の塩を得る工程を含む、前記化学式2のポリ乳酸誘導体化合物の製造方法が提供される。
【0043】
本発明のポリ乳酸誘導体化合物の製造方法の工程1)において、単量体として使用可能な遊離酸またはラクトン形態の乳酸またはその誘導体は、例えば、乳酸、ラクチド、グリコリド、マンデル酸、カプロラクトン、及びこれらの混合物からなる群から選択できる。
【0044】
前記遊離酸またはラクトン形態の乳酸またはその誘導体とジカルボン酸の使用量の割合には特に制限がなく、化学式1のポリ乳酸誘導体化合物を得ることができる範囲内で自由に選択できる。本発明の実施態様によると、遊離酸またはラクトン形態の乳酸またはその誘導体の100重量部当たり、ジカルボン酸1〜20重量部を使用してもよい。
【0045】
より具体的に、本発明のポリ乳酸誘導体化合物の製造方法の工程1)では、前記遊離酸またはラクトン形態の乳酸またはその誘導体の単量体と炭素数3〜10個のジカルボン酸の混合物を80℃〜180℃に加熱し、0.5〜4時間、水を除去した後、150〜250℃の温度で10〜48時間、重合反応し、両末端にカルボン酸を有するポリ乳酸誘導体を製造できる。上記の製造工程過程で、水を除去した後の重合反応において、反応温度が150℃未満、または反応時間が10時間未満であれば、所望の分子量の高分子を得ることが困難であり、反応温度が250℃超え、または反応時間が48時間を超えると、高分子の熱分解が発生する問題点がある。
【0046】
本発明のポリ乳酸誘導体化合物の製造方法の工程2)は、前記工程1)で得られた両末端にカルボン酸を有するポリ乳酸誘導体を有機溶媒に溶解した後、アルカリ金属塩水溶液を添加して、化学式2のポリ乳酸誘導体化合物を得るものである。
【0047】
前記アルカリ金属は、例えば、炭酸水素ナトリウム、炭酸ナトリウム、炭酸水素カリウム、炭酸カリウム、炭酸リチウム及びこれらの混合物よりなる群から選択できる。具体的には、炭酸水素ナトリウムまたは炭酸水素カリウムを使用できる。前記有機溶媒として水混和性有機溶媒を使用でき、具体的にはアセトニトリルまたはアセトンを使用できる。工程2)において、前記両末端にカルボン酸を有するポリ乳酸誘導体とアルカリ金属塩の使用量の割合は特に制限がなく、化学式2のポリ乳酸誘導体化合物を得ることができる範囲内で自由に選択することができる。本発明の実施態様によると、両末端にカルボン酸を有するポリ乳酸誘導体1モルに対して、アルカリ金属塩2〜10モルを使用できる。
【0048】
本発明のポリ乳酸誘導体化合物の製造方法は、前記工程2)の後、得られた高分子溶液に、例えば、塩化ナトリウムを添加した後、有機溶媒層を分離して回収し、回収された有機溶媒層から有機溶媒を真空乾燥して除去する工程を、更に含んでもよく、これにより、化学式2のポリ乳酸誘導体化合物を得ることができる。
【0049】
2.錯体、徐放性組成物及びその製造方法
本発明の他の側面によると、薬物伝達体として有用な、数平均分子量が7,000ダルトン以下の前記化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体が提供される。
【0050】
本発明の化学式1のポリ乳酸誘導体は前述のように、末端がアニオンである。従って、多価金属イオンと2モル以上の前記化学式1のポリ乳酸誘導体化合物はイオン結合を通して錯体を形成することができる。本発明の前記錯体において、多価金属イオンは二価または三価の金属イオンである。例えば、亜鉛、カルシウム、マグネシウム及び鉄よりなる群から選択された金属の多価イオンであってもよい。前記多価金属イオンは、例えば、これらの金属の塩化塩のような塩化合物の形態で提供されてもよいが、これに特に制限されるものではない。
【0051】
本発明の錯体の実施態様によると、前記化学式1のポリ乳酸誘導体化合物は、前述した化学式3のポリ乳酸誘導体化合物である。
【0052】
本発明のさらに別の側面によると、i)活性成分としてタンパク質、ポリペプチドまたはペプチド、ii)薬物伝達体として、前記化学式1のポリ乳酸誘導体化合物、及びiii)多価金属イオンを含む、タンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物が提供される。
【0053】
本発明のさらに別の側面によると、i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)薬物伝達体として、前記化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体を含む、タンパク質、ポリペプチド、またはペプチド薬物の徐放性組成物が提供される。
【0054】
本発明の徐放性組成物の実施態様によると、前記多価金属イオンと2モル以上の前記化学式1のポリ乳酸誘導体化合物とイオン結合を通して錯体を形成することができ、この錯体が薬物伝達体として機能し、その内部に活性成分が封入されて微粒子を形成する。
【0055】
本発明の徐放性組成物の実施態様によると、前記化学式1のポリ乳酸誘導体化合物は、前述した化学式3のポリ乳酸誘導体化合物である。
【0056】
本発明の徐放性組成物において、活性成分は、タンパク質、ポリペプチドまたはペプチドであり、本明細書で、これらの用語のいずれか一つを単独で使われた場合でも、特に言及された場合以外は、タンパク質、ポリペプチドまたはペプチドを全て指名するものとして理解しなければならない。
【0057】
本明細書において、“徐放性”、“徐放性伝達”または“徐放性薬物伝達”の用語は、1回投与で薬物の有効血中の濃度を長時間、例えば、72時間以上保持することを意味する。特に、ポリペプチドの一般的な投与経路は皮下、筋肉または静脈注射などであるが、効果的な治療のために、頻繁に注射しなければならない短所があった。本発明は、このような頻繁な投与による不便を解消するための徐放性伝達体の開発及び提供を目指すものである。
【0058】
本発明の徐放性組成物において、前記活性成分の例には、成長ホルモン、エリスロポエチン、単一クローン抗体、顆粒球コロニー刺激因子、マクロファージコロニー刺激因子、顆粒球-マクロファージコロニー刺激因子、トロンボポエチン、インスリン様成長因子、上皮成長因子、血小板由来成長因子、線維芽細胞成長因子、トランスフォーミング成長因子、インターフェロン、インターロイキン、腫瘍壊死因子、ストレプトキナーゼ、ウロキナーゼ、スタフィロキナーゼ、デオキシリボヌクレアーゼ(DNAse)、グルコセレブロシダーゼ、アルファ(α)ガラクトシダーゼ、エクセナチド、オクトレオチド、インスリン、グルカゴン、黄体形成ホルモン放出ホルモン、ゴセレリン(Goserelin)、リュープロレリン(Leuprorelin)、濾胞刺激ホルモン、甲状腺刺激ホルモン、フェルチレリン(Fertirelin)、カルシトニン(Calcitonin)、コルチコトロピン放出因子(Corticotropin Releasing Factor)、脳性ナトリウム利尿ペプチド(Brain Natriuretic Peptide)、チモペンチン(Thymopentin)、コルチコトロピン(Corticotropin)、エルカトニン(Elcatonin)、ベータアミロイド(Beta Amyloid)、トリプトレリン(Triptorelin)、ブセレリン(Buserelin)、サイモシン(Thymosin)、ソマトスタチン(Somatostatin)、アラレリン(Alarelin)、アンギオテンシン(Angiotensin)、アルギプレシン(Argipressin)、アトシバン(Atosiban)、ビバリルジン(Bivalirudin)、セトロレリクス(Cetrorelix)、デスロレリン(Deslorelin)、デスモプレシン(Desmopressin)、エルカトニン(Elcatonin)、エンフビルチド(Enfuvirtide)、エプチフィバチド(Eptifibatide)、GLP−1、ゴナドレリン(Gonandorelin)、リプレッシン(Lyspressin)、ナファレリン(Nafarelin)、ネシリチド(Nesiritide)、オキシトシン(Oxytocin)、プラムリンチド(Pramlintide)、セクレチン(Secretin)、テリパラチド(Teriparatide)、テルリプレシン(Terlipressin)、テトラコサクチド(Tetracosactide)、バプレオチド(Vapreotide)またはこれらの混合物が挙げられる。
【0059】
本発明の徐放性組成物において、前記活性成分は、本発明の徐放性組成物乾燥重量を基準に、0.01〜60重量%、具体的に0.05〜50重量%になるように使用できる。活性成分の含量が、徐放性組成物乾燥重量の0.01重量%未満のとき、意図した薬理効果を得ることが困難であり、60重量%を超えると、薬物の初期過多放出による問題がある。
【0060】
本発明の徐放性組成物において、前記化学式1のポリ乳酸誘導体化合物は、本発明の徐放性組成物乾燥重量を基準に39.9〜99.9重量%、具体的に50〜99重量%で含まれるように使用できる。前記ポリ乳酸誘導体化合物含量が徐放性組成物乾燥重量の39.9重量%未満のとき、徐放性放出効果が得られなく、99.9重量%を超えると、通常的な方法で人体に1回投与できる用量を超えてしまう問題がある。
【0061】
本発明の徐放性組成物において、前記多価金属イオンは、本発明の徐放性組成物乾燥重量を基準に、好ましくは0.01〜20重量%、より好ましくは0.05〜15重量%で含まれるように使用することができる。多価金属イオンの含量が徐放性組成物乾燥重量の0.01重量%未満のとき、徐放性放出効果が得られなく、20重量%を超えると、金属イオンによる毒性が発現される問題がある。
【0062】
このように形成された活性成分含有高分子複合体は、水溶液で粒子として沈澱される。
【0063】
本発明に係るポリペプチドなどを含有した徐放性微粒子組成物は、5〜250μm、具体的に50〜150μmの均一したサイズの微粒子である。
【0064】
本発明の徐放性組成物は、上記した成分以外に防腐剤、安定化剤、水和剤または浸透圧調節のための塩及び/又は緩衝液などの薬剤学的補助剤及びその他の治療的に有用な物質を、更に含有していてもよい。本発明のタンパク質、ポリペプチドまたはペプチド薬物含有徐放性組成物は、薬学的に使用可能な分散媒に分散して、人体に投与できる。前記分散媒の例は、注射用蒸留水、5%ブドウ糖、生理食塩水、ミネラル油、モノ−、ジ−及びトリ−グリセリドなどが挙げられる。
【0065】
本発明のさらに別の側面によると、a)i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)前記化学式1のポリ乳酸誘導体化合物を含有する水溶液を調製する工程;及びb)前記工程a)水溶液を、多価金属イオンを含む水溶液に滴下し、沈澱物を得る工程を含む、タンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物を製造する方法が提供される。
【0066】
具体的に、本発明の徐放性組成物製造方法の工程a)では、まず活性成分と前記化学式2のポリ乳酸誘導体化合物を同時に添加または一方の成分を添加した後、他方の成分を添加する順次添加により水溶液を調製することができる。例えば、(a−1)活性成分及び前記化学式2のポリ乳酸誘導体化合物を水に溶解して、水溶液を調製するか;(a−2)まず、両末端にカルボン酸を有するポリ乳酸誘導体及びアルカリ金属塩水溶液を水に溶解して、前記化学式2のポリ乳酸誘導体化合物を製造し、活性成分を添加して、水溶液を調製するか;または(a−3)まず、両末端にカルボン酸を有するポリ乳酸誘導体及び活性成分を水に溶解し、そこにアルカリ金属塩水溶液を添加し、前記化学式2のポリ乳酸誘導体化合物及び活性成分を含有する水溶液を調製することによって水溶液を調製できる。
【0067】
即ち、本発明の徐放性組成物の製造は、前記化学式2のポリ乳酸誘導体化合物を開始物質として使用することもでき(a−1)、代案として、両末端にカルボン酸を有するポリ乳酸誘導体から出発して、これをアルカリ金属塩により前記化学式2のポリ乳酸誘導体化合物に変化させた後、使用することができる(a−2及びa−3)。
【0068】
本発明の徐放性組成物製造方法の実施態様によると、前記水溶液を構成する水性媒体は、蒸留水、またはアセテート塩、クエン酸塩、グリシン塩、リン酸塩及び炭酸塩の緩衝液よりなる群から選択される一つ以上の緩衝液であってもよい。タンパク質、ポリペプチドまたはペプチド薬物は製剤の組成、特にpHに敏感に反応し、それにより、構造が変化するか、活性が減少される。
【0069】
本発明の徐放性組成物製造方法の前記工程b)では、前記工程a)で得られた水溶液を、多価金属イオンを含む水溶液にゆっくり滴下して沈澱物を形成させる。このとき、活性成分は、前記化学式1のポリ乳酸誘導体化合物と多価金属イオンとの錯体内部に分散されて沈殿され得る。この工程で多価金属イオンとしては、例えば、亜鉛、カルシウム、マグネシウム及び鉄よりなる群から選択された金属の多価イオンであってもよい。前記多価金属イオンは、例えば、これらの金属の塩化塩のような塩化合物の形態で提供できるが、これらに特に制限されるものではない。多価イオン水溶液の濃度は1〜300mg/mLであり、具体的に1〜100mg/mLである。高分子錯体が形成される場合、多価金属イオンは、前記化学式1のポリ乳酸誘導体化合物のアニオンと直接イオン結合をするか、アルカリ金属イオンを置換しながらイオン結合をして錯体となる。そして、この錯体内部には、ポリペプチドなどの活性成分が封入され、このように形成された活性成分含有高分子複合体は、水溶液中に微粒子として沈澱される。本発明の実施態様によると、前記工程a)の活性成分及び前記化学式1のポリ乳酸誘導体化合物を含む水溶液は、工程b)で、体積比1〜30倍の多価イオン水溶液に滴下して沈殿することができる。
【0070】
本発明の徐放性組成物製造方法は、前記工程b)の後に、前記工程b)で得た沈澱物を遠心分離した後、水で洗浄する工程c)を、更に含んでいてもよい。この工程c)は、低温、例えば、4℃が保持される遠心分離機で、工程b)の沈澱物を遠心分離して上清と沈澱物を分離した後、沈澱物を水で洗浄する方式で遂行できる。
【0071】
また、本発明の徐放性組成物製造方法は、前記工程c)の後に、前記工程c)で分離された沈澱物を凍結乾燥する工程d)を、更に含んでいてもよい。この工程d)で、凍結乾燥時、凍結乾燥補助剤を添加できる。凍結乾燥補助剤には、糖、糖アルコールまたはこれらの混合物が含まれる。前記糖は、ラクトース、マルトース、スクロース及びトレハロースよりなる群から選択される一つ以上であり、前記糖アルコールはマンニトール、ソルビトール、マルチトール、キシリトール及びラクチトールよりなる群から選択される一つ以上であってもよい。本発明の実施態様で、凍結乾燥補助剤の含量は、凍結乾燥組成物全体乾燥重量を基準に、1〜50重量%、より好ましくは1〜30重量%である。
【0072】
本発明に係る、ポリペプチドなどを含有した徐放性微粒子組成物は、工程b)、c)またはd)の後、任意に電動篩を利用して粉砕するか、超音波粉砕方法などを通して好ましくは5〜250μm、より好ましくは50〜150μmの均一なサイズの微粒子にしてもよい。
【0073】
本発明の徐放性組成物製造方法は、有機溶媒を用いることなく、水溶液を使用するため、工程中に別途の有機溶媒除去工程が必要とされず、製造工程中、薬物の変性を防止して薬理効果を最大限に高めることができる長所がある。また、タンパク質、ポリペプチドまたはペプチドの封入効率が90%以上であり、製造工程中、薬物の損失を最小化することができる。
【0074】
本発明に係る徐放性組成物が体内に投与されると、複合体を構成する高分子が体内で分解されながら内部に封入された薬物をゆっくり放出する。従来には、徐放性、即ち、薬物の放出時間を遅延するために分子量が数万ダルトン以上の高分子量の高分子を使用しければならなかったが、このような高分子量の高分子は、水に溶解されないため、微粒子のような伝達体の製造工程でタンパク質またはペプチドの変性を引き起こす有機溶媒を使用しなければならない短所があった。しかし、本発明に係る徐放性微粒子組成物は、水に溶解される低分子量の高分子を使用するので、徐放性組成物製造時に有機溶媒の使用が不要である。また、多価金属イオンにより高分子が錯体を形成することができるので、本発明の徐放性組成物を体内に投与すると、優れた持続放出効果が得られる。
【実施例】
【0075】
以下、本発明を製造例、実施例及び実験例などを通して、さらに詳しく説明するが、これらは本発明を説明するためのものであり、本発明の範囲がこれらによって制限されるものではない。
【0076】
[製造例1]ポリ乳酸誘導体の製造
D,L−乳酸500g(5.56モル)とコハク酸18.9g(0.16モル)を1Lの2口−丸底フラスコに入れ、磁石棒で撹拌しながら窒素パージした。加熱用油槽を160℃に加熱し、窒素を2000mL/minの流速で反応物内部にパージした。反応中に生成される水は、窒素の流れに沿って反応器外に排出した。水を1時間除去した後、油槽を200℃に加熱した。24時間反応した後、反応を終結した。その結果、両末端にカルボン酸を有する粗D,L−ポリ乳酸誘導体368gを得た。製造されたポリ乳酸誘導体のNMRスペクトルを図1に示す。下記NMR分析法で測定した結果、製造されたポリ乳酸誘導体の数平均分子量は2,315ダルトンであった。
<1H−NMRスキャンのピーク面積から数平均分子量の計算>
〔式1〕
数平均分子量(ダルトン)={(A+B)/(C/N)}×72.1
(式中、AはD,L−ポリ乳酸誘導体のメチレンプロトンのピーク面積であり、
Bは高分子末端D,L−乳酸誘導体のメチレンプロトンのピーク面積であり、
Cはジカルボン酸のメチレンプロトンのピーク面積であり、
Nはジカルボン酸のメチレンプロトンの個数である。)
【0077】
[製造例2]ポリ乳酸誘導体の製造
コハク酸39.3g(0.33モル)を用いたこと以外は、製造例1と同様にして、ポリ乳酸誘導体を重合した。その結果、両末端にカルボン酸を有する粗ポリ乳酸誘導体348gを得た。前記NMR分析法で測定した結果、その数平均分子量は1,155ダルトンであった。
【0078】
[製造例3]ポリ乳酸誘導体の精製
製造例1で得られたポリ乳酸誘導体100gと炭酸水素ナトリウム(NaHCO3)20gを2Lのビーカーに入れ、蒸留水(1L)を添加した。混合物を60℃に加熱し、撹拌しながら1時間、高分子を溶解した。高分子を溶解した後、室温で塩化水素(HCl)水溶液(1N)を、高分子水溶液に滴下しながら高分子を析出した。析出された高分子をろ過し、蒸留水で洗浄した。洗浄及びろ過を3回繰り返し、塩化水素を除去した。得られた高分子は48時間、凍結乾燥した。その結果、両末端にカルボン酸を有する粗ポリ乳酸誘導体72.4gを得た。前記NMR分析法で測定した結果、その数平均分子量は2,703ダルトンであった。
【0079】
[製造例4]ポリ乳酸誘導体の製造
コハク酸の代わりにグルタル酸21.1g(0.16モル)を用いたこと以外は、製造例1と同様にして、両末端にカルボン酸を有するポリ乳酸誘導体381gを得た。前記NMR分析法で測定した結果、その数平均分子量は2,360ダルトンであった。
【0080】
[製造例5]ポリ乳酸誘導体の製造
D,L−乳酸500g(5.56モル)を1Lの2口−丸底フラスコに入れ、磁石棒で撹拌しながら窒素パージした。加熱用油槽を160℃に加熱し、窒素を2000mL/minの流速で反応物内部にパージした。反応中に生成される水は、窒素の流れに沿って反応器外に排出した。水を1時間除去した後、油槽を200℃に加熱した。24時間反応後、反応を終結した。その結果、両末端に、それぞれ、ヒドロキシル基とカルボン酸を有する粗D,L−ポリ乳酸を得た。生成物に無水コハク酸35g(0.35モル)を添加し、120℃で6時間加熱し、ポリ乳酸末端基のヒドロキシル基と反応するようにした。製造されたポリ乳酸誘導体を前記NMR分析法で測定した結果、その数平均分子量は2,240ダルトンであった。
【0081】
[実施例1]ポリ乳酸誘導体ナトリウム塩の製造
製造例1で得られたポリ乳酸誘導体100gにアセトニトリル150mLを加え、溶解した。そこに、炭酸水素ナトリウム水溶液150mL(0.1g/mL)をゆっくり添加した。室温で2時間撹拌して、高分子を中和し、ポリ乳酸誘導体ナトリウム塩を製造した。
【0082】
次いで、塩析出法により製造された高分子を精製した。即ち、得られた反応溶液に塩化ナトリウム(NaCl)15gを撹拌しながら添加して溶解し、分液ロートで2時間層分離し、水溶液層を除去した。
【0083】
得られた有機溶媒層高分子溶液に、蒸留水100mLと塩化ナトリウム10gを再度加えて溶解し、分液ロートを用いて再び層分離し、水溶液層を除去した。得られた高分子を含む有機溶媒層溶液を50℃で回転分留し、有機溶媒と少量の蒸留水を完全に除去した。
【0084】
有機溶媒と蒸留水を除去した後に、得られた高分子に、無水アセトン500mLを添加して、高分子を溶解し、溶解されない沈澱物はろ紙を用いて除去した。ろ過された高分子溶液を、50℃で2時間回転分留し、アセトンを完全に除去した。
【0085】
アセトンが除去された高分子を、50℃真空オーブン内で3日間真空乾燥した。その結果、両末端にカルボン酸ナトリウム塩を有する、粗ポリ乳酸誘導体のナトリウム塩91gを得た。製造されたポリ乳酸誘導体塩のNMRスペクトルを図2に示す。前記NMR分析法で測定した結果、その数平均分子量は2,178ダルトンであった。
【0086】
[実施例2]ポリ乳酸誘導体ナトリウム塩の製造
製造例2で得られたポリ乳酸誘導体100gを用いて実施例1と同様の方法で、両末端にカルボン酸ナトリウム塩を有する、精製されたポリ乳酸誘導体の塩93gを得た。前記NMR分析法で測定した結果、その数平均分子量は1,125ダルトンであった。
【0087】
[実施例3]ポリ乳酸誘導体ナトリウム塩の製造
製造例4で得られたポリ乳酸誘導体100gを用いて実施例1と同様の方法で、両末端がカルボン酸ナトリウム塩を有する、精製されたポリ乳酸誘導体の塩91gを得た。前記NMR分析法で測定した結果、その数平均分子量は2,250ダルトンであった。
【0088】
[実施例4]ポリ乳酸誘導体ナトリウム塩の製造
製造例5で得られたポリ乳酸誘導体100gを用いて実施例1と同様の方法で、両末端にカルボン酸ナトリウム塩を有する、精製されたポリ乳酸誘導体の塩90gを得た。前記NMR分析法で測定した結果、その数平均分子量は2,080ダルトンであった。
【0089】
[実施例5]ヒト成長ホルモン(hGH)含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩4.5gとヒト成長ホルモン500mg(3.0IU/mg)を20mLの水に溶解し、hGH−高分子水溶液を調製した。
【0090】
多価金属塩として塩化亜鉛(ZnCl2)水溶液250mL(50mg/mL)を用意した。この溶液に前記hGH−高分子水溶液を滴下し、ヒト成長ホルモン含有組成物の沈澱物を生成した。この混合物を4℃に保持された遠心分離機を用いて、3,500rpmで10分間遠心分離し、上清と沈澱物を分離した。
【0091】
沈澱物をろ過した後、蒸留水500mLを加えて2回洗浄し、凍結乾燥した。凍結乾燥した組成物を100〜400メッシュの篩にかけ、50〜150μmの微粒子組成物を得た。
【0092】
得られた凍結乾燥微粒子組成物内のヒト成長ホルモンを下記のBCAアッセイ(Micro BCA Protein Assay Kit, Thermo Scientific)を用いて定量した。定量結果、hGHの含量及び封入効率は、それぞれ9.54重量%及び92.6%であった。
【0093】
<BCAアッセイ(Micro BCA Protein Assay Kit, Thermo Scientific)を用いたタンパク質の含量及び封入効率の測定>
(1)タンパク質含量の測定
〔式2〕
含量(%)={微粒子に封入されたペプチドまたはタンパク質の量(g)/微粒子組成物の全体量(g)}×100
(2)タンパク質封入効率の測定
〔式3〕
封入効率(%)={微粒子に封入されたペプチドまたはタンパク質の量(g)/微粒子組成物の製造に使われた量(g)}×100
【0094】
[実施例6]ヒト成長ホルモン含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩4.75gとヒト成長ホルモン(3.0IU/mg)250mgを用いたこと以外は、実施例5と同様にして、ヒト成長ホルモン含有微粒子組成物を製造した。製造された組成物内のヒト成長ホルモンを前記BCAアッセイで定量した結果、hGHの含量及び封入効率はそれぞれ4.72重量%及び91.7%であった。
【0095】
[実施例7]ヒト成長ホルモン含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩4.75gとヒト成長ホルモン100mg(3.0IU/mg)を用いたこと以外は、実施例5と同様にして、ヒト成長ホルモン含有微粒子組成物を製造した。製造された組成物内のヒト成長ホルモンを前記BCAアッセイで定量した結果、hGHの含量及び封入効率はそれぞれ1.93重量%及び93.7%であった。
【0096】
[実施例8]ヒト成長ホルモン含有徐放性組成物の製造
実施例2で製造したポリ乳酸誘導体ナトリウム塩を用いたこと以外は、実施例6と同様にして、ヒト成長ホルモン含有微粒子組成物を製造した。製造された組成物内のヒト成長ホルモンを前記BCAアッセイで定量した結果、hGHの含量及び封入効率はそれぞれ4.72重量%及び91.7%であった。
【0097】
[実施例9]ヒト成長ホルモン含有徐放性組成物の製造
製造例3で精製されたポリ乳酸誘導体ナトリウム塩4.9g、ヒト成長ホルモン100mg(3.0IU/mg)を20mLの水に溶解し、そこに炭酸水素ナトリウム0.3g(NaHCO3)を加え、hGH−高分子水溶液を調製した。
【0098】
多価金属塩として塩化亜鉛(ZnCl2)水溶液250mL(50mg/mL)を用意し、この溶液を撹拌しながら、そこに前記hGH−高分子水溶液を滴下し、ヒト成長ホルモン含有組成物の沈澱物を生成した。この混合物を4℃に保持された遠心分離機を用いて、3,500rpmで10分間遠心分離し、上清と沈澱物を分離した。
【0099】
沈澱物をろ過した後、蒸留水500mLを加え、2回洗浄し、凍結乾燥した。凍結乾燥した組成物を100〜400メッシュの篩にかけ、50〜150μmの微粒子組成物を得た。
【0100】
得られた凍結乾燥微粒子組成物内のヒト成長ホルモンを前記BCAアッセイで定量した結果、hGHの含量及び封入効率はそれぞれ4.86重量%及び94.4%であった。
【0101】
[実施例10]エリスロポエチン(EPO)含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩1gとエリスロポエチン0.4mg(41IU/mg)を5mLの水に溶解し、EPO−高分子水溶液を調製した。
【0102】
多価金属塩として塩化亜鉛(ZnCl2)水溶液5.5mL(12.5mg/mL)を用意し、この溶液を撹拌しながら、そこに前記EPO−高分子水溶液を加え、エリスロポエチン含有組成物の沈澱物を生成した。この混合物を4℃に保持される遠心分離機を用いて、3,500rpmで10分間遠心分離し、上清と沈澱物を分離した。
【0103】
上清を完全に除去した後、得られた沈澱物を凍結乾燥した。凍結乾燥した組成物を100〜400メッシュの篩にかけ、50〜150μmの微粒子組成物を得た。
【0104】
得られた凍結乾燥微粒子組成物内のエリスロポエチンを前記BCAアッセイで定量した結果、エリスロポエチンの含量及び封入効率はそれぞれ0.038重量%及び92.2%であった。
【0105】
[実施例11]エクセナチド含有徐放性組成物の製造
実施例1で製造したポリ乳酸誘導体ナトリウム塩4.9gとエクセナチド100mgを45mLの水に溶解した水溶液を調製した後、0.45μmフィルタを用いて不純物を除去した。
【0106】
多価金属塩として塩化亜鉛(ZnCl2)水溶液500mL(25mg/mL)を用意し、そこに前記エクセナチド−高分子水溶液を3mL/minの速度で滴下しながら120rpmで撹拌し、エクセナチドの含有組成物の沈澱物を得た。
【0107】
沈澱物をろ過し、蒸留水500mLを加え、2回洗浄した後、室温で1日間真空乾燥した。乾燥された組成物を粉砕機で粉砕し、100〜400メッシュの篩にかけ、50〜150μmの微粒子組成物を得た。
【0108】
得られた乾燥微粒子組成物内のエクセナチドを前記BCAアッセイで定量した結果、エクセナチドの含量及び封入効率はそれぞれ1.97重量%及び95.6%であった。
【0109】
[実施例12]エクセナチド含有徐放性組成物の製造
多価金属塩として塩化亜鉛(ZnCl2)の代りに塩化カルシウム(CaCl2)を用いたこと以外は、実施例11と同様にして、エクセナチド含有微粒子組成物を製造した。得られた乾燥微粒子組成物内のエクセナチドを前記BCAアッセイで定量した結果、エクセナチドの含量及び封入効率はそれぞれ1.92重量%及び93.2%であった。
【0110】
[実施例13]エクセナチド含有徐放性組成物の製造
実施例3で製造したポリ乳酸誘導体ナトリウム塩4.9gを用いたこと以外は、実施例11と同様にしてエクセナチド含有微粒子組成物を製造した。得られた乾燥微粒子組成物内のエクセナチドを前記BCAアッセイで定量した結果、エクセナチドの含量及び封入効率はそれぞれ1.94重量%及び94.2%であった。
【0111】
[比較例1]ヒト成長ホルモン(hGH)水溶液組成物の製造
下記表1に記載された組成物を10mLの注射用水に溶解し、ヒト成長ホルモン水溶液を調製した。
【0112】
【表1】

【0113】
[比較例2]エリスロポエチン(EPO)水溶液組成物の製造
下記表2に記載された組成物を1.0mLの注射用水に溶解し、エリスロポエチン水溶液を調製した。
【0114】
【表2】

【0115】
[実験例1]ヒト成長ホルモン(hGH)含有組成物の薬物動態試験
実施例5〜9及び比較例1で製造したヒト成長ホルモン(hGH)含有組成物の薬物動態試験を実施した。
【0116】
S.D.ラット(190±20g、5〜6週齢)をCharles River Laboratories(Orient、Korea)から供給を受け、恒温、恒湿が保持された飼育室で一週間以上適応させた後、一般状態を観察し、外観上健常な動物を選別し、実験に用いた。実験動物は、12時間間隔で、照度300〜500ルクスの人工照明にて、温度23±1℃、相対湿度65±10%の条件下で飼育し、滅菌された固形飼料と水道水は自由に与えた。
【0117】
それぞれの組成物を5mg/kgの投与量で、ラットに皮下注射した後(n=5)、一定時間の間隔で10日間血液を採取し、Quantikineh GHイムノアッセイキット(R&D Systems)で血中hGHを定量した。この定量結果を図3に示す。図3に示されるように、本発明に係るヒト成長ホルモン含有組成物は、10日以上、1ng/mL以上の血中ヒト成長ホルモン濃度を保持していた。更に、解剖検査の結果、本発明の組成物による毒性は観察されなかった。
【0118】
[実験例2]ヒト成長ホルモン含有組成物の効能試験
実施例5〜6及び比較例1で製造したヒト成長ホルモン含有組成物を、脳下垂体を摘出して成長ホルモン欠乏を誘発したラット(hypophysectomized rats)に投与して、効能試験を実施した。
【0119】
疾患モデル動物として脳下垂体を摘出したS.D.ラット(90±10g、4週齢、JapanSLC, Inc.)を恒温、恒湿が保持される飼育室で、一週間適応させた後、一般状態を観察し、外観上、健常で体重変化が起きない動物を選別し、実験に用いた。実験動物は12時間間隔で、照度300〜500ルクスの人工照明にて、温度23±1℃、相対湿度65±10%の条件下で飼育し、滅菌された固形飼料と水道水は自由に与えた。
【0120】
実施例5及び6の組成物は5mg/kgの投与量で1回皮下注射し、比較例1の組成物は0.71mg/kgの投与量で1日1回、7日間皮下注射した(n=6)。一定時の間隔で血液を採取し、Quantikine IGF−1 イムノアッセイキット(R&D Systems)で血中IGF−1(Insulin Like Growth Factor-1)の濃度を定量した。また、動物の体重を測定し、体重の変化を記録した。定量及び体重測定の結果を図4及び図5に示す。
【0121】
図4に示されるように、成長ホルモンにより生成されるIGF−1の血中濃度において、本発明の組成物を1回投与した場合に、既存市販製剤の組成物を7日間、毎日1回投与した場合に比べて優れた結果を示す。
【0122】
また、図5に示されるように、本発明の組成物を1回投与した場合に、2週間経過後の体重が約20%増加しており、既存の市販製剤の組成物を7日間、毎日1回投与の場合に比べて優れた結果を示す。成長ホルモンを投与しない陰性対照群(No Treatment)は体重増加を示さなかった。解剖検査結果、本発明の組成物による毒性は観察されなかった。
【0123】
[実験例3]エリスロポエチン(EPO)含有組成物の薬物動態試験
実施例10及び比較例2で製造したエリスロポエチン(EPO)含有組成物の薬物動態試験を実施した。
【0124】
S.D.ラット(190±20g、5〜6週齢)をCharles River Laboratories(Orient, Korea)から供給を受け、実験例1と同じ条件下で動物を管理した。
【0125】
それぞれの組成物を2000IU/kgの投与量でラットに皮下注射した後(n=6)、一定時間の間隔で血液を採取し、エンザイムイムノアッセイキット(DEP00, R&D systems)を用いて、血中エリスロポエチン濃度を定量した。定量結果を図6に示す。図6に示されるように、本発明に係るエリスロポエチン含有組成物は、連日投与する市販組成物に比べて血中濃度を保持する時間が遅延され、1週間の持続放出効果を示す。解剖検査の結果、本発明の組成物による毒性は観察されなかった。
【0126】
[実験例4]エクセナチド含有組成物の薬物動態試験
実施例11〜13で製造したエクセナチド含有組成物の薬物動態試験を実施した。
【0127】
S.D.ラット(190±20g、5〜6週齢)をCharles River Laboratories(Orient, Korea)から供給を受け、実験例1と同じ条件下で動物を管理した。
【0128】
実施例11の組成物(400μg/ラット、800μg/ラット)と実施例12及び13の組成物(400μg/ラット)を、ラットに皮下注射した後(n=6)、一定時間の間隔で血液を採取し、エンザイムイムノアッセイキット(EK-070-94 , Phoenix Pharmaceuticals, Inc.)を用いて、血中エクセナチドの濃度を定量した。定量結果を図7に示す。図7に示されるように、本発明に係るエクセナチド含有組成物は、1回投与で1週間以上、0.1ng/mL以上の血中濃度を保持した。解剖検査の結果、本発明の組成物による毒性は観察されなかった。
【特許請求の範囲】
【請求項1】
数平均分子量が7,000ダルトン以下の下記化学式1のポリ乳酸誘導体化合物:
【化1】

{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
Y及びZは独立して存在しないか、またはアルカリ金属であり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
【請求項2】
前記化合物が、下記化学式2のポリ乳酸誘導体化合物である請求項1に記載の化学式1のポリ乳酸誘導体化合物:
【化2】

{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
Y’及びZ’は独立してアルカリ金属であり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
【請求項3】
前記化合物が、下記化学式3のポリ乳酸誘導体化合物である請求項1に記載の化学式1のポリ乳酸誘導体化合物:
【化3】

{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
【請求項4】
1)遊離酸またはラクトン形態の乳酸またはその誘導体とジカルボン酸を重合して、両末端にカルボン酸を有するポリ乳酸誘導体を得る工程、及び
2)前記工程1)で得られたポリ乳酸誘導体を有機溶媒に溶解し、アルカリ金属塩の水溶液を添加して、ポリ乳酸誘導体の塩を得る工程
を含む、請求項2に記載のポリ乳酸誘導体化合物の製造方法。
【請求項5】
前記遊離酸またはラクトン形態の乳酸またはその誘導体が乳酸、ラクチド、グリコリド、マンデル酸、カプロラクトン、及びこれらの混合物よりなる群から選ばれるものである請求項4に記載のポリ乳酸誘導体化合物の製造方法。
【請求項6】
前記ジカルボン酸が、シュウ酸、マロン酸、リンゴ酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸、アゼライン酸、セバシン酸、ドデカン二酸、フマル酸、マレイン酸、フタル酸、テレフタル酸、及びこれらの混合物よりなる群から選ばれるものである請求項4に記載のポリ乳酸誘導体化合物の製造方法。
【請求項7】
前記アルカリ金属塩が、炭酸水素ナトリウム、炭酸ナトリウム、炭酸水素カリウム、炭酸カリウム、炭酸リチウム、及びこれらの混合物よりなる群から選ばれるものである請求項4に記載のポリ乳酸誘導体化合物の製造方法。
【請求項8】
数平均分子量が7,000ダルトン以下である請求項1に記載の化学式1のポリ乳酸誘導体化合物と、多価金属イオンとの錯体。
【請求項9】
前記多価金属イオンが、亜鉛、カルシウム、マグネシウム及び鉄よりなる群から選ばれた金属の多価イオンである請求項8に記載の錯体。
【請求項10】
i)活性成分としてタンパク質、ポリペプチドまたはペプチド、
ii)薬物伝達体として請求項1に記載のポリ乳酸誘導体化合物、及び
iii)多価金属イオン
を含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物。
【請求項11】
i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及び
ii)薬物伝達体として化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体
を含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物。
【請求項12】
前記活性成分を、前記組成物の乾燥重量に対して、0.01〜60重量%含むものである請求項10または11に記載の徐放性組成物。
【請求項13】
前記薬物伝達体を、前記組成物の乾燥重量に対して、39.9〜99.9重量%含むものである請求項10または11に記載の徐放性組成物。
【請求項14】
前記活性成分が、成長ホルモン、エリスロポエチン、単一クローン抗体、顆粒球コロニー刺激因子、マクロファージコロニー刺激因子、顆粒球−マクロファージコロニー刺激因子、トロンボポエチン、インスリン様成長因子、上皮成長因子、血小板由来成長因子、線維芽細胞成長因子、トランスフォーミング成長因子、インターフェロン、インターロイキン、腫瘍壊死因子、ストレプトキナーゼ、ウロキナーゼ、スタフィロキナーゼ、デオキシリボヌクレアーゼ(DNAse)、グルコセレブロシダーゼ、アルファ(α)ガラクトシダーゼ、エクセナチド、オクトレオチド、インスリン、グルカゴン、黄体形成ホルモン放出ホルモン、ゴセレリン(Goserelin)、リュープロレリン(Leuprorelin)、濾胞刺激ホルモン、甲状腺刺激ホルモン、フェルチレリン(Fertirelin)、カルシトニン(Calcitonin)、コルチコトロピン放出因子(Corticotropin Releasing Factor)、脳性ナトリウム利尿ペプチド(Brain Natriuretic Peptide)、チモペンチン(Thymopentin)、コルチコトロピン(Corticotropin)、エルカトニン(Elcatonin)、ベータアミロイド(BetaAmyloid)、トリプトレリン(Triptorelin)、ブセレリン(Buserelin)、サイモシン(Thymosin)、ソマトスタチン(Somatostatin)、アラレリン(Alarelin)、アンギオテンシン(Angiotensin)、アルギプレシン(Argipressin)、アトシバン(Atosiban)、ビバリルジン(Bivalirudin)、セトロレリクス(Cetrorelix)、デスロレリン(Deslorelin)、デスモプレシン(Desmopressin)、エルカトニン(Elcatonin)、エンフビルチド(Enfuvirtide)、エプチフィバチド(Eptifibatide)、GLP−1、ゴナドレリン(Gonandorelin)、リプレッシン(Lyspressin)、ナファレリン(Nafarelin)、ネシリチド(Nesiritide)、オキシトシン(Oxytocin)、プラムリンチド(Pramlintide)、セクレチン(Secretin)、テリパラチド(Teriparatide)、テルリプレシン(Terlipressin)、テトラコサクチド(Tetracosactide)、バプレオチド(Vapreotide)、またはこれらの混合物である請求項10または11に記載の徐放性組成物。
【請求項15】
a)i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)請求項1に記載のポリ乳酸誘導体化合物を含有する水溶液を調製する工程、及び
b)前記工程a)の水溶液を、多価金属イオンを含む水溶液に滴下し、沈澱物を得る工程
を含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項16】
前記活性成分が、成長ホルモン、エリスロポエチン、単一クローン抗体、顆粒球コロニー刺激因子、マクロファージコロニー刺激因子、顆粒球-マクロファージコロニー刺激因子、トロンボポエチン、インスリン様成長因子、上皮成長因子、血小板由来成長因子、線維芽細胞成長因子、トランスフォーミング成長因子、インターフェロン、インターロイキン、腫瘍壊死因子、ストレプトキナーゼ、ウロキナーゼ、スタフィロキナーゼ、デオキシリボヌクレアーゼ(DNAse)、グルコセレブロシダーゼ、アルファ(α)ガラクトシダーゼ、エクセナチド、オクトレオチド、インスリン、グルカゴン、黄体形成ホルモン放出ホルモン、ゴセレリン(Goserelin)、リュープロレリン(Leuprorelin)、濾胞刺激ホルモン、甲状腺刺激ホルモン、フェルチレリン(Fertirelin)、カルシトニン(Calcitonin)、コルチコトロピン放出因子(Corticotropin Releasing Factor)、脳性ナトリウム利尿ペプチド(Brain Natriuretic Peptide)、チモペンチン(Thymopentin)、コルチコトロピン(Corticotropin)、エルカトニン(Elcatonin)、ベータアミロイド(BetaAmyloid)、トリプトレリン(Triptorelin)、ブセレリン(Buserelin)、サイモシン(Thymosin)、ソマトスタチン(Somatostatin)、アラレリン(Alarelin)、アンギオテンシン(Angiotensin)、アルギプレシン(Argipressin)、アトシバン(Atosiban)、ビバリルジン(Bivalirudin)、セトロレリクス(Cetrorelix)、デスロレリン(Deslorelin)、デスモプレシン(Desmopressin)、エルカトニン(Elcatonin)、エンフビルチド(Enfuvirtide)、エプチフィバチド(Eptifibatide)、GLP−1、ゴナドレリン(Gonandorelin)、リプレッシン(Lyspressin)、ナファレリン(Nafarelin)、ネシリチド(Nesiritide)、オキシトシン(Oxytocin)、プラムリンチド(Pramlintide)、セクレチン(Secretin)、テリパラチド(Teriparatide)、テルリプレシン(Terlipressin)、テトラコサクチド(Tetracosactide)、バプレオチド(Vapreotide)またはこれらの混合物である請求項15に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項17】
前記多価金属イオンが、亜鉛、カルシウム、マグネシウム、及び鉄よりなる群から選ばれた金属の多価イオンである請求項15に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項18】
前記工程a)の水溶液は、
前記活性成分及び請求項2に記載のポリ乳酸誘導体化合物を水に溶解するか、または
両末端がカルボン酸のポリ乳酸誘導体及びアルカリ金属塩水溶液を水に溶解し、請求項2に記載のポリ乳酸誘導体化合物を製造した後、前記活性成分を添加するか、または
両末端がカルボン酸のポリ乳酸誘導体及び前記活性成分を水に溶解した後、前記アルカリ金属塩の水溶液を添加し、請求項2に記載のポリ乳酸誘導体化合物及び前記活性成分を含有する水溶液を調製するものである請求項15に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項19】
前記工程b)の後に、前記工程b)で得られた沈澱物を遠心分離した後、水で洗浄する工程c)を、更に含むものである請求項15に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項20】
前記工程c)の後に、前記工程c)で分離された沈澱物を凍結乾燥する工程d)を、更に含むものである請求項19に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項1】
数平均分子量が7,000ダルトン以下の下記化学式1のポリ乳酸誘導体化合物:
【化1】

{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
Y及びZは独立して存在しないか、またはアルカリ金属であり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
【請求項2】
前記化合物が、下記化学式2のポリ乳酸誘導体化合物である請求項1に記載の化学式1のポリ乳酸誘導体化合物:
【化2】

{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
Y’及びZ’は独立してアルカリ金属であり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
【請求項3】
前記化合物が、下記化学式3のポリ乳酸誘導体化合物である請求項1に記載の化学式1のポリ乳酸誘導体化合物:
【化3】

{式中、X及びX’は独立して水素、アルキルまたはアリールであり、
m及びnは独立して0〜95の整数であり、但し、5<m+n<100であり、
a及びbは独立して1〜6の整数であり、
Rは非置換の、または置換された−(CH2)k−(ここで、kは0〜10の整数である)、炭素数2〜10の二価アルケニル、炭素数6〜20の二価アリール、またはこれらの組み合わせである。}
【請求項4】
1)遊離酸またはラクトン形態の乳酸またはその誘導体とジカルボン酸を重合して、両末端にカルボン酸を有するポリ乳酸誘導体を得る工程、及び
2)前記工程1)で得られたポリ乳酸誘導体を有機溶媒に溶解し、アルカリ金属塩の水溶液を添加して、ポリ乳酸誘導体の塩を得る工程
を含む、請求項2に記載のポリ乳酸誘導体化合物の製造方法。
【請求項5】
前記遊離酸またはラクトン形態の乳酸またはその誘導体が乳酸、ラクチド、グリコリド、マンデル酸、カプロラクトン、及びこれらの混合物よりなる群から選ばれるものである請求項4に記載のポリ乳酸誘導体化合物の製造方法。
【請求項6】
前記ジカルボン酸が、シュウ酸、マロン酸、リンゴ酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸、アゼライン酸、セバシン酸、ドデカン二酸、フマル酸、マレイン酸、フタル酸、テレフタル酸、及びこれらの混合物よりなる群から選ばれるものである請求項4に記載のポリ乳酸誘導体化合物の製造方法。
【請求項7】
前記アルカリ金属塩が、炭酸水素ナトリウム、炭酸ナトリウム、炭酸水素カリウム、炭酸カリウム、炭酸リチウム、及びこれらの混合物よりなる群から選ばれるものである請求項4に記載のポリ乳酸誘導体化合物の製造方法。
【請求項8】
数平均分子量が7,000ダルトン以下である請求項1に記載の化学式1のポリ乳酸誘導体化合物と、多価金属イオンとの錯体。
【請求項9】
前記多価金属イオンが、亜鉛、カルシウム、マグネシウム及び鉄よりなる群から選ばれた金属の多価イオンである請求項8に記載の錯体。
【請求項10】
i)活性成分としてタンパク質、ポリペプチドまたはペプチド、
ii)薬物伝達体として請求項1に記載のポリ乳酸誘導体化合物、及び
iii)多価金属イオン
を含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物。
【請求項11】
i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及び
ii)薬物伝達体として化学式1のポリ乳酸誘導体化合物と多価金属イオンの錯体
を含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物。
【請求項12】
前記活性成分を、前記組成物の乾燥重量に対して、0.01〜60重量%含むものである請求項10または11に記載の徐放性組成物。
【請求項13】
前記薬物伝達体を、前記組成物の乾燥重量に対して、39.9〜99.9重量%含むものである請求項10または11に記載の徐放性組成物。
【請求項14】
前記活性成分が、成長ホルモン、エリスロポエチン、単一クローン抗体、顆粒球コロニー刺激因子、マクロファージコロニー刺激因子、顆粒球−マクロファージコロニー刺激因子、トロンボポエチン、インスリン様成長因子、上皮成長因子、血小板由来成長因子、線維芽細胞成長因子、トランスフォーミング成長因子、インターフェロン、インターロイキン、腫瘍壊死因子、ストレプトキナーゼ、ウロキナーゼ、スタフィロキナーゼ、デオキシリボヌクレアーゼ(DNAse)、グルコセレブロシダーゼ、アルファ(α)ガラクトシダーゼ、エクセナチド、オクトレオチド、インスリン、グルカゴン、黄体形成ホルモン放出ホルモン、ゴセレリン(Goserelin)、リュープロレリン(Leuprorelin)、濾胞刺激ホルモン、甲状腺刺激ホルモン、フェルチレリン(Fertirelin)、カルシトニン(Calcitonin)、コルチコトロピン放出因子(Corticotropin Releasing Factor)、脳性ナトリウム利尿ペプチド(Brain Natriuretic Peptide)、チモペンチン(Thymopentin)、コルチコトロピン(Corticotropin)、エルカトニン(Elcatonin)、ベータアミロイド(BetaAmyloid)、トリプトレリン(Triptorelin)、ブセレリン(Buserelin)、サイモシン(Thymosin)、ソマトスタチン(Somatostatin)、アラレリン(Alarelin)、アンギオテンシン(Angiotensin)、アルギプレシン(Argipressin)、アトシバン(Atosiban)、ビバリルジン(Bivalirudin)、セトロレリクス(Cetrorelix)、デスロレリン(Deslorelin)、デスモプレシン(Desmopressin)、エルカトニン(Elcatonin)、エンフビルチド(Enfuvirtide)、エプチフィバチド(Eptifibatide)、GLP−1、ゴナドレリン(Gonandorelin)、リプレッシン(Lyspressin)、ナファレリン(Nafarelin)、ネシリチド(Nesiritide)、オキシトシン(Oxytocin)、プラムリンチド(Pramlintide)、セクレチン(Secretin)、テリパラチド(Teriparatide)、テルリプレシン(Terlipressin)、テトラコサクチド(Tetracosactide)、バプレオチド(Vapreotide)、またはこれらの混合物である請求項10または11に記載の徐放性組成物。
【請求項15】
a)i)活性成分としてタンパク質、ポリペプチドまたはペプチド、及びii)請求項1に記載のポリ乳酸誘導体化合物を含有する水溶液を調製する工程、及び
b)前記工程a)の水溶液を、多価金属イオンを含む水溶液に滴下し、沈澱物を得る工程
を含むタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項16】
前記活性成分が、成長ホルモン、エリスロポエチン、単一クローン抗体、顆粒球コロニー刺激因子、マクロファージコロニー刺激因子、顆粒球-マクロファージコロニー刺激因子、トロンボポエチン、インスリン様成長因子、上皮成長因子、血小板由来成長因子、線維芽細胞成長因子、トランスフォーミング成長因子、インターフェロン、インターロイキン、腫瘍壊死因子、ストレプトキナーゼ、ウロキナーゼ、スタフィロキナーゼ、デオキシリボヌクレアーゼ(DNAse)、グルコセレブロシダーゼ、アルファ(α)ガラクトシダーゼ、エクセナチド、オクトレオチド、インスリン、グルカゴン、黄体形成ホルモン放出ホルモン、ゴセレリン(Goserelin)、リュープロレリン(Leuprorelin)、濾胞刺激ホルモン、甲状腺刺激ホルモン、フェルチレリン(Fertirelin)、カルシトニン(Calcitonin)、コルチコトロピン放出因子(Corticotropin Releasing Factor)、脳性ナトリウム利尿ペプチド(Brain Natriuretic Peptide)、チモペンチン(Thymopentin)、コルチコトロピン(Corticotropin)、エルカトニン(Elcatonin)、ベータアミロイド(BetaAmyloid)、トリプトレリン(Triptorelin)、ブセレリン(Buserelin)、サイモシン(Thymosin)、ソマトスタチン(Somatostatin)、アラレリン(Alarelin)、アンギオテンシン(Angiotensin)、アルギプレシン(Argipressin)、アトシバン(Atosiban)、ビバリルジン(Bivalirudin)、セトロレリクス(Cetrorelix)、デスロレリン(Deslorelin)、デスモプレシン(Desmopressin)、エルカトニン(Elcatonin)、エンフビルチド(Enfuvirtide)、エプチフィバチド(Eptifibatide)、GLP−1、ゴナドレリン(Gonandorelin)、リプレッシン(Lyspressin)、ナファレリン(Nafarelin)、ネシリチド(Nesiritide)、オキシトシン(Oxytocin)、プラムリンチド(Pramlintide)、セクレチン(Secretin)、テリパラチド(Teriparatide)、テルリプレシン(Terlipressin)、テトラコサクチド(Tetracosactide)、バプレオチド(Vapreotide)またはこれらの混合物である請求項15に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項17】
前記多価金属イオンが、亜鉛、カルシウム、マグネシウム、及び鉄よりなる群から選ばれた金属の多価イオンである請求項15に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項18】
前記工程a)の水溶液は、
前記活性成分及び請求項2に記載のポリ乳酸誘導体化合物を水に溶解するか、または
両末端がカルボン酸のポリ乳酸誘導体及びアルカリ金属塩水溶液を水に溶解し、請求項2に記載のポリ乳酸誘導体化合物を製造した後、前記活性成分を添加するか、または
両末端がカルボン酸のポリ乳酸誘導体及び前記活性成分を水に溶解した後、前記アルカリ金属塩の水溶液を添加し、請求項2に記載のポリ乳酸誘導体化合物及び前記活性成分を含有する水溶液を調製するものである請求項15に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項19】
前記工程b)の後に、前記工程b)で得られた沈澱物を遠心分離した後、水で洗浄する工程c)を、更に含むものである請求項15に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【請求項20】
前記工程c)の後に、前記工程c)で分離された沈澱物を凍結乾燥する工程d)を、更に含むものである請求項19に記載のタンパク質、ポリペプチドまたはペプチド薬物の徐放性組成物の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2013−515833(P2013−515833A)
【公表日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願番号】特願2012−547015(P2012−547015)
【出願日】平成22年12月28日(2010.12.28)
【国際出願番号】PCT/KR2010/009421
【国際公開番号】WO2011/081406
【国際公開日】平成23年7月7日(2011.7.7)
【出願人】(511285358)サムヤン バイオファーマシューティカルズ コーポレイション (4)
【Fターム(参考)】
【公表日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願日】平成22年12月28日(2010.12.28)
【国際出願番号】PCT/KR2010/009421
【国際公開番号】WO2011/081406
【国際公開日】平成23年7月7日(2011.7.7)
【出願人】(511285358)サムヤン バイオファーマシューティカルズ コーポレイション (4)
【Fターム(参考)】
[ Back to top ]

