タンパク質の可溶性タンパク質としての製造方法
【課題】組換えタンパク質発現系を用いて、目的タンパク質を可溶性タンパク質として製造すること。
【解決手段】分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法、それに用いられる発現ベクターなどを提供する。
【解決手段】分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法、それに用いられる発現ベクターなどを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、目的タンパク質を可溶性タンパク質として製造する方法に関する。より詳しくは、分泌シグナルペプチドと塩基性アミノ酸に富むペプチドとを用いて目的タンパク質を可溶性タンパク質として製造する方法に関する。
【背景技術】
【0002】
これまでに、細菌、酵母、昆虫、トランスジェニック動物、トランスジェニック植物などの宿主内での組換えタンパク質発現系、無細胞翻訳系などの多くの組換えタンパク質発現系が開発されている。なかでも大腸菌は高密度に増殖させることが容易であり、しかも宿主ベクター系の研究が進んでいることから、異種タンパク質の発現系として広く利用されている。
一方、これらの組換えタンパク質発現系で目的タンパク質を発現させた場合、発現されたタンパク質が正確に折り畳まれないためにそのタンパク質本来の機能を発現できなかったり、封入体と呼ばれる不溶性の凝集体が形成されることが少なくない。このような場合、例えば封入体を変性(可溶化)した後、再折り畳みを行っても、必ずしも正常に折り畳まれた本来の機能を有するタンパク質が得られるとは限らない。また、本来の機能を発現するタンパク質が得られたとしても、満足な回収率が得られないことも多い。
このような背景において、現在まで発現組換え目的タンパク質の封入体の形成を抑制する方法は、確立されていない。その代法として、可溶性の高い分子量4万のマルトース結合タンパク質またはグルタチオンSトランスフェラーゼ(GST)と不溶性目的タンパク質とを融合させることにより可溶性蛋白として発現さすることが試みられている(非特許文献1:Fox,J.D.and Waugh, D.S. (2003) Maltose-binding protein as a solubility enhancer. Methods Mol. Biol.205:99-117、非特許文献2:Ausubel, F.M. et al. eds. (1996) Current Protocols in Molecular Biology, Vol. 2, 16.0.1)。しかし、可溶性タンパクが本来の活性を示さないこと、マルトース結合タンパク質またはGSTを削除した場合、目的タンパク質が不溶化する等の問題があった。
【0003】
レニラルシフェリン結合タンパク質(以下RLBPと略記する)は、ウミシイタケ(Renilla reniformis)由来のカルシウム誘発ルシフェリン結合タンパク質(Calcium-triggered luciferin-bindihg protein)として知られている。RLBPはアポタンパク質(アポRLBP)とセレンテラジン(ルシフェリン)の非共有結合複合体である(非特許文献3:J. Biol. Chem. 254, 769-780 (1979))。RLBPがカルシウムイオンと結合すると、セレンテラジンが放出される。放出されたセレンテラジンは、セレンテラジンを発光基質とするレニラルシフェラーゼ、エビルシフェラーゼ、ガウシアルシフェラーゼ等によるルシフェリン−ルシフェラーゼの発光反応に用いられる。
【0004】
大腸菌L−アスパラギナーゼ遺伝子をpelBリーダー配列およびN末端6×ヒスチジンタグと融合させることにより、組換え大腸菌L−アスパラギナーゼを菌体外である培養ろ液に発現させ、Ni−NTAアフィニティークロマトグラフィーで精製する方法が報告されている(非特許文献4:Protein Express. Purif. 38, 29-36 (2004))。
【非特許文献1】Fox,J.D.and Waugh, D.S. (2003) Maltose-binding protein as a solubility enhancer. Methods Mol. Biol.205:99-117
【非特許文献2】Ausubel, F.M. et al. eds. (1996) Current Protocols in Molecular Biology, Vol. 2, 16.0.1
【非特許文献3】J. Biol. Chem. 254, 769-780 (1979)
【非特許文献4】Protein Express. Purif. 38, 29-36 (2004)
【発明の開示】
【発明が解決しようとする課題】
【0005】
上記状況において、組換えタンパク質発現系を用いて、目的タンパク質を可溶性タンパク質として製造することが、有用タンパク質の生産のために産業上強く望まれている。また、タンパク質の機能や構造の研究といった研究分野においても強い要望がある。
【課題を解決するための手段】
【0006】
本発明者らは、上記課題を解決するために鋭意研究を重ねた結果、シグナルペプチドをコードするポリヌクレオチドと塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドを目的タンパク質をコードするポリヌクレオチドと結合させたポリヌクレオチドを含有する発現ベクターを用いて、グラム陰性菌中で目的タンパク質を発現させると、目的タンパク質が可溶性タンパク質として発現されることを見出した。さらに、このようにして得られた目的タンパク質は、本来の機能を有していることが確認された。これらの知見に基づいてさらに検討を重ねた結果、本発明を完成するに至った。
【0007】
すなわち、本発明は、
(1) 分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法、
(2) タンパク質の発現が宿主細胞内で行われる上記(1)記載の方法、
(3) 宿主細胞がグラム陰性菌である上記(2)記載の方法、
(4) グラム陰性菌が大腸菌属の細菌である上記(3)記載の方法、
(5) 分泌シグナルペプチドがグラム陰性菌由来の分泌シグナルペプチドである上記(1)〜(4)のいずれかに記載の方法、
(6) グラム陰性菌由来の分泌シグナルペプチドが、通性嫌気性桿菌由来の分泌シグナルペプチドである上記(5)記載の方法、
(7) グラム陰性菌由来ののシグナルペプチドが、大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)またはコレラ菌由来コレラトキシン由来の分泌シグナルペプチドである上記(5)記載の方法、
(8) 塩基性アミノ酸に富むポリペプチドが5〜12アミノ酸残基からなるポリペプチドである上記(1)〜(7)のいずれかに記載の方法、
(9) 塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸の含有率が60%以上である上記(1)〜(8)のいずれかに記載の方法、
(10) 塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸がヒスチジン、アルギニンおよびリジンから選択される上記(1)〜(9)のいずれかに記載の方法、
(11) 塩基性アミノ酸に富むポリペプチドがポリヒスチジンである上記(1)〜(9)のいずれかに記載の方法、
(12) 目的タンパク質の発現が、該目的タンパク質をコードするポリヌクレオチドを含有する発現ベクターを用いて行われる上記(1)〜(11)のいずれかに記載の方法、
(13) グラム陰性菌の分泌シグナルペプチドをコードするポリヌクレオチドと、5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてグラム陰性菌内でタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法、
(14) OmpAをコードするポリヌクレオチドと、ポリヒスチジンをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いて大腸菌属の細菌内でタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法、
(15) 目的タンパク質が異種タンパク質である上記(1)〜(14)のいずれかに記載の方法、
(16) 目的タンパク質が、アポRLBP、アポイクオリン、アポクライチィン、アポオベリンおよびアポマイトロコミンからなる群より選択されるいずれかである上記(1)〜(14)のいずれかに記載の方法、
(17) 目的タンパク質がアポRLBPである上記(16)記載の方法、
(18) グラム陰性菌の分泌シグナルペプチドをコードするポリヌクレオチドと、5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードするポリヌクレオチドと、アポRLBPをコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてグラム陰性菌内でタンパク質を発現させることを特徴とするアポRLBPの製造方法、
(19) OmpAをコードするポリヌクレオチドと、ポリヒスチジンをコードするポリヌクレオチドと、アポRLBPをコードするポリヌクレオチドとを含有するポリヌクレオチドを用いて大腸菌内でタンパク質を発現させ、発現されたタンパク質をペリプラズムスペースに蓄積させることを特徴とするアポRLBPの製造方法、
(20) 上記(17)〜(19)のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とを接触させることを特徴とするRLBPの製造方法、
(21) 上記(17)〜(19)のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とを接触させてRLBPを調製することを特徴とする、セレンテラジンまたはその誘導体の保存方法、
(22) 上記(17)〜(19)のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とからなるRLBP、
(23)(a)分泌シグナルペプチドをコードする第1コード領域、
(b)塩基性アミノ酸に富むポリペプチドをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター、
(23a) 前記第1コード領域がプロモーターに有効に連結している上記(23)記載の方法、
(23b) 前記第1コード領域、前記第2コード領域および前記制限酵素サイトが同じ読み枠内にある上記(23)記載の方法、
(23c) 前記第2コード領域が前記第1コード領域の下流にあり、前記制限酵素サイトが前記第2コード領域の下流にある上記(23)記載の方法、
(23d) 前記制限酵素サイトがマルチクローニングサイトである上記(23)記載の方法、
(24) 分泌シグナルペプチドがグラム陰性菌由来の分泌シグナルペプチドである上記(23)記載の発現ベクター、
(25) グラム陰性菌由来の分泌シグナルペプチドが通性嫌気性桿菌由来の分泌シグナルペプチドである上記(24)記載の発現ベクター、
(26) グラム陰性菌由来の分泌シグナルペプチドが、大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)またはコレラ菌由来コレラトキシン由来の分泌シグナルペプチドである上記(24)記載の発現ベクター、
(27) 塩基性アミノ酸に富むポリペプチドが5〜12アミノ酸残基からなるポリペプチドである上記(23)〜(26)のいずれかに記載の発現ベクター、
(28) 塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸の含有率が60%以上である上記(23)〜(27)のいずれかに記載の発現ベクター、
(29) 塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸がヒスチジン、アルギニンおよびリジンから選択される上記(23)〜(28)のいずれかに記載の発現ベクター、
(30) 塩基性アミノ酸に富むポリペプチドがポリヒスチジンである上記(23)〜(27)のいずれかに記載の発現ベクター、
(31)(a)グラム陰性菌由来の分泌シグナルペプチドをコードする第1コード領域、
(b)5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター、
(32)(a)OmpAをコードする第1コード領域、
(b)ポリヒスチジンをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター
などを提供する。
【発明の効果】
【0008】
本発明によれば、目的タンパク質を組換えタンパク質発現系を用いて製造する場合に、目的タンパク質を可溶性タンパク質として製造することができるので、目的タンパク質を変性(可溶化)させる必要がない。よって、本発明によれば、目的タンパク質を効率的に、高い回収率で得ることができる。
したがって、本発明は有用タンパク質や、機能や構造の解析対象となるタンパク質などのタンパク質の製造方法として極めて有用である。
【発明を実施するための最良の形態】
【0009】
本発明は、分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする前記目的タンパク質の製造方法、前記製造方法に使用することができる発現ベクターなどを提供する。本発明の製造方法によれば、分泌シグナルペプチドおよび塩基性アミノ酸に富むポリペプチドと融合された状態で目的タンパク質を発現させることにより、目的タンパク質が正常に折り畳まれずに封入体などを形成することを防止して、目的タンパク質を可溶化された状態で、正常に折り畳まれた本来の機能を有するタンパク質として製造することができる。
以下、本発明の目的タンパク質の製造方法などについて詳細に説明する。
【0010】
1.目的タンパク質の製造方法
本発明は、(1)分泌シグナルペプチドをコードするポリヌクレオチドと、(2)塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、(3)目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする目的タンパク質の製造方法を提供する。以下、より詳細に説明する。
(1)分泌シグナルペプチド
分泌シグナルペプチドとは、当該分泌シグナルペプチドに結合されたタンパク質またはポリペプチドを、細胞膜透過させる役割を担うペプチド領域を意味する。このような分泌シグナルペプチドのアミノ酸配列およびそれをコードする核酸配列は、当技術分野において周知であり、報告されている(例えばvon Heijine G (1988) Biochim. Biohys. Acra 947: 307-333、von Heijine G (1990) J. Membr. Biol. 115: 195-201など参照。
分泌シグナルペプチドは、通常10〜50個程度のアミノ酸残基からなるアミノ酸配列を有し、そのアミノ酸残基の多く(通常55〜60%程度)は疎水性である。本発明で用いられる分泌シグナルペプチドとしては、好ましくは原核生物由来、より好ましくはグラム陰性菌由来、さらに好ましくは通性嫌気性桿菌由来、特に好ましくは大腸菌属、緑膿菌属、サルモネラ菌属またはコレラ菌属の細菌由来の分泌シグナルペプチドが好ましい。また、分泌シグナルペプチドとしては、例えばvon Heijine G & Abrahmsen, L. (1989) FEBS Lett. 244:439-446. Tjalsma, H. et al. (2000) Microbiol.Mol Rev. 515-547などに記載されてるものなども挙げられ、とりわけ大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)(Ghrayeb, J. et al. (1984) EMBO J. 3:2437-2442)、コレラ菌由来コレラトキシン由来の分泌シグナルペプチドなどが好ましい。
本発明で用いられる分泌シグナルペプチドは、当該分泌シグナルペプチドに結合されたタンパク質またはポリペプチドを細胞膜透過させる活性を有していればよいので、変異体であってもよい。変異体としては、分泌シグナルペプチドのアミノ酸配列において、1もしくは複数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなり、かつ当該分泌シグナルペプチドに結合されたタンパク質またはポリペプチドを、細胞膜透過させる活性を有するペプチドなどが挙げられる。このようなペプチドとしては、分泌シグナルペプチドのアミノ酸配列において、例えば、1〜10個、1〜9個、1〜8個、1〜7個、1〜6個(1〜数個)、1〜5個、1〜4個、1〜3個、1〜2個、1個のアミノ酸残基が欠失、置換、挿入および/または付加されたアミノ酸配列からなり、かつ当該ペプチドに結合されたタンパク質またはポリペプチドを細胞膜透過させる活性を有するペプチドが挙げられる。上記アミノ酸残基の欠失、置換、挿入および/または付加の数は、一般的には小さい程好ましい。欠失、置換、挿入及び付加のうち2種以上が同時に生じてもよい。また、このようなタンパク質としては、目的タンパク質のアミノ酸配列と80%以上、85%以上、90%以上、93%以上、95%以上、97%以上、98%以上、99%以上、99.5%以上99.8%以上99.9%以上の同一性を有するアミノ酸配列を有し、かつ当該ペプチドに結合されたタンパク質またはポリペプチドを細胞膜透過させる活性を有するペプチドが挙げられる。上記相同性の数値は一般的に大きい程好ましい。
分泌シグナルペプチドは、一般的には、膜透過に伴ってシグナルペプチダーゼによって切断される切断部位を有する。本発明で用いられる分泌シグナルペプチドとしては、シグナルペプチダーゼによる切断部位を有しなくてもよいが、切断部位を有するのが好ましい。切断部位としては、目的タンパク質の発現に用いられる宿主(例えば、大腸菌など)の分泌シグナルペプチダーゼによって切断されうるものが好ましく用いられる。
【0011】
(2)塩基性アミノ酸に富むポリペプチド
本発明で用いられる塩基性アミノ酸に富むポリペプチドとしては、塩基性アミノ酸を含み、目的タンパク質のN末端側に融合させて発現させた場合に目的タンパク質の溶解性を増大しうるものであればよい。塩基性アミノ酸に富むポリペプチドとしては、例えば、等電点が生理的pHよりアルカリ側にあるポリペプチド、ポリペプチドを構成する全アミノ酸残基に対する塩基性アミノ酸残基の数の割合(含有率)が30%以上であるポリペプチドなどが挙げられる。塩基性アミノ酸残基の含有率は、60%以上であるのが好ましく、さらに80%以上であるのが好ましく、特に100%であるのが好ましい。
本発明で用いられる塩基性アミノ酸に富むポリペプチドに含まれるアミノ酸残基数としては、3〜20残基であるのが好ましく、さらに5〜12残基であるのが好ましく、特に5〜8残基であるのが好ましく、とりわけ6残基であるのが好ましい。
塩基性アミノ酸とは、塩基性側鎖を有するアミノ酸を意味する。塩基性アミノ酸としては、例えば、ヒスチジン、アルギニン、リジンなどが挙げられる。本発明で用いられる塩基性アミノ酸としては、ヒスチジン、アルギニン、リジンが好ましく、特にヒスチジンが好ましい。
塩基性アミノ酸に富むポリペプチドに含まれる塩基性アミノ酸残基に対するヒスチジン残基の数の割合(含有率)としては、60%以上であるのが好ましく、さらに80%以上であるのが好ましく、特に100%であるのが好ましい。
本発明で用いられる塩基性アミノ酸に富むポリペプチドとしては、なかでもポリヒスチジンが好ましい。ポリヒスチジンに含まれるヒスチジン残基数としては、5〜12残基であるのが好ましく、さらに5〜8残基であるのが好ましく、特に6残基(ヒスチジンヘキサマー)であるのが好ましい。
【0012】
(3)目的タンパク質
本発明の製造方法における目的タンパク質には特に制限はない。例えば、組換えタンパク質発現系で発現させた場合に封入体を形成しやすいタンパク質も可溶性タンパク質として製造しうるので、好ましく用いることができる。また、目的タンパク質は、アポタンパク質、すなわちホロタンパク質のタンパク質部分であってもよい。アポタンパク質としては、例えば、アポRLBP(FEBS Lett. 268, 287-290 (1990)など参照)、アポイクオリン(Proc. Natl. Acad. Sci. USA 82, 3154-3158 (1985)など参照 )、アポクライチィン(FEBS Lett. 315, 343-346 (1993)など参照)、アポマイトロコミン(FEBS Lett. 333, 301-305 (1993)など参照)、アポオベリン(Gene 153,273-274 (1995)など参照)などが挙げられる。アポRLBPのアミノ酸配列を配列番号:1に示す。
また、B型肝炎ウィルス、C型肝炎ウィルス、HIV、インフルエンザなどの病原性ウィルスゲノムにコードされる、外被タンパク質、コアタンパク質、プロテアーゼ、逆転写酵素、インテグラーゼなどのタンパク質(ウィルス抗原);抗体のFab、(Fab)2;血小板由来増殖因子(PDGF)、幹細胞成長因子(SCF)、肝細胞成長因子(HGF)、トランスフォーミング成長因子(TGF)、神経成長因子(NGF)、上皮細胞増殖因子(EGF)、線維芽細胞増殖因子(FGF)、インスリン様成長因子(IGF)などの増殖因子;腫瘍壊死因子、インターフェロン、インターロイキンなどのサイトカイン類;エリスロポエチン、顆粒球コロニー刺激因子、顆粒球マクロファージコロニー刺激因子、マクロファージコロニー刺激因子、トロンボポエチンなどの造血因子;黄体形成ホルモン放出ホルモン(LH−RH)、甲状腺刺激ホルモン放出ホルモン(TRH)、インスリン、ソマトスタチン、成長ホルモン、プロラクチン、副腎皮質刺激ホルモン(ACTH)、メラノサイト刺激ホルモン(MSH)、甲状腺刺激ホルモン(TSH)、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、バソプレシン、オキシトシン、カルシトニン、副甲状腺ホルモン(PTH)、グルカゴン、ガストリン、セクレチン、パンクレオザイミン、コレシストキニン、アンジオテンシン、ヒト胎盤ラクトーゲン、ヒト絨毛性ゴナドトロピン(HCG)、セルレイン、モチリンなどのペプチドホルモン;エンケファリン、エンドルフィン、ディノルフィン、キョウトルフィンなどの鎮痛性ペプチド;スーパーオキシドディスミュターゼ(SOD)、ウロキナーゼ、ティシュープラスミノーゲンアクティベーター(TPA)、アスパラギナーゼ、カリクレインなどの酵素;ボムベシン、ニュウロテンシン、ブラジキニン、サブスタンスPなどのペプチド性神経伝達物質;アルブミン;コラーゲン;プロインスリン;レニン;α1アンチトリプシンなども挙げられるが、これらに限定されない。
【0013】
本発明の目的タンパク質には、上記タンパク質の変異体も含まれる。そのような変異体としては、例えば、上記タンパク質のアミノ酸配列において、1もしくは複数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなり、かつ目的タンパク質と同質の活性を有するタンパク質も含まれる。このようなタンパク質としては、上記タンパク質のアミノ酸配列において、例えば、1〜100個、1〜90個、1〜80個、1〜70個、1〜60個、1〜50個、1〜40個、1〜30個、1〜20個、1〜10個、1〜9個、1〜8個、1〜7個、1〜6個(1〜数個)、1〜5個、1〜4個、1〜3個、1〜2個、1個のアミノ酸残基が欠失、置換、挿入および/または付加されたアミノ酸配列からなり、かつ目的タンパク質と同質の活性を有するタンパク質が挙げられる。上記アミノ酸残基の欠失、置換、挿入および/または付加の数は、一般的には小さい程好ましい。欠失、置換、挿入及び付加のうち2種以上が同時に生じてもよい。本明細書において、アポRLBPとは、配列番号:1で表されるアミノ酸配列を有するタンパク質のみならず、その変異体をも意味する。
【0014】
本発明の目的タンパク質には、目的タンパク質の「部分ペプチド」も含まれる。タンパク質の部分ペプチドとしては、目的タンパク質のアミノ酸配列の一部の連続するアミノ酸配列からなる部分ペプチドが挙げられ、目的タンパク質の活性と同質の活性を有するものが好ましい。例えば、目的タンパク質のアミノ酸配列において、少なくとも20個、好ましくは少なくとも50個のアミノ酸残基からなるアミノ酸配列を有するポリペプチドなどが挙げられる。好ましくは、これらのポリペプチドは、目的タンパク質の活性に関与する部分に対応するアミノ酸配列を含有する。また、本発明で使用される部分ペプチドは、上記のポリペプチドにおいて、そのアミノ酸配列中の1または複数個(例えば、1〜20個程度、より好ましくは1〜10個程度、さらにより好ましくは1〜5個程度)のアミノ酸残基が欠失、付加、置換、または挿入により変更されているものでもよい。
本発明で用いられる部分ペプチドは抗体作成のための抗原としても用いることができる。
【0015】
(4)本発明で用いられるポリヌクレオチド
本発明で用いられるポリヌクレオチドとしては、前述した分泌シグナルペプチド、塩基性アミノ酸に富むポリペプチドまたは目的タンパク質をコードする塩基配列を含有するものであればいかなるものであってもよいが、好ましくはDNAである。DNAとしては、ゲノムDNA、ゲノムDNAライブラリー、細胞・組織由来のcDNA、細胞・組織由来のcDNAライブラリー、合成DNAなどが挙げられる。本発明の目的タンパク質をコードするポリヌクレオチドの例として、アポRLBPをコードする合成DNAの塩基配列を配列番号:2に示す。
ライブラリーに使用するベクターは、特に制限はなく、バクテリオファージ、プラスミド、コスミド、ファージミドなどいずれであってもよい。また、前記した細胞・組織からtotalRNAまたはmRNA画分を調製したものを用いて直接 Reverse Transcription Polymerase Chain Reaction(以下、RT-PCR法と略称する)によって増幅することもできる。
本発明で用いられる分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチド(DNA)は、目的タンパク質をコードするポリヌクレオチドと、分泌シグナルペプチドをコードするポリヌクレオチドまたは塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドとの間に、さらに切断可能なペプチドリンカーをコードするポリヌクレオチドを有していてもよい。切断可能なペプチドリンカーとは、酵素的または化学的切断物質により切断することができるペプチド配列を意味する。酵素(プロテアーゼ)または化学物質により切断されるペプチド配列は多数知られている(例えば、Harlow and Lane, Antibodies:A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1988);Walsh, Proteins Biochemistry and Biotechnology, John Wiley & Sons, LTD., West Sussex, England (2002)など参照)。切断物質とは、ポリペプチドにおける切断部位を認識し、ポリペプチド内の結合の切断によりポリペプチドを2つのポリペプチドに分割する化学物質または酵素である。切断物質としては、例えば、化学物質、プロテアーゼなどが挙げられる。
【0016】
(5)目的タンパク質の製造
本発明の目的タンパク質は、具体的には、例えば分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチド(DNA)(以下、目的タンパク質の製造の説明においては、「本発明で用いられるポリヌクレオチド」と称することがある。)を連結(導入)した発現ベクターを用いて目的タンパク質を発現させ、生成した目的タンパク質を分離・精製することによって製造することができる。発現ベクターを用いた目的タンパク質の発現は、宿主細胞内、無細胞翻訳系などのタンパク質発現系で行うことができる。目的タンパク質の発現は、前記した発現ベクターの導入によって形質転換された宿主細胞(形質転換体)内で行うのが好ましい。前記形質転換体を、導入された発現ベクターに連結(導入)された本発明で用いられるポリヌクレオチド(DNA)が発現可能な条件下で培養し、目的タンパク質を精製・蓄積させ、分離・精製することによって製造することができる。宿主細胞としては、グラム陰性菌が好ましく、特に大腸菌が好ましく用いられる。グラム陰性菌を宿主細胞として用いた場合には、発現された目的タンパク質は、好ましくは、分泌シグナルペプチドによって細胞内膜を透過し、ペリプラズムスペースまたは外膜を通過し培養上清中に分泌される。ここで、本発明の目的タンパク質は、異種タンパク質であってもよい。異種タンパク質とは、宿主細胞などのタンパク質発現系において、天然には産生されないタンパク質を意味する。
以下、本発明の目的タンパク質の製造方法について、さらに詳細に説明する。
【0017】
(発現ベクターの作成)
本発明で用いられる発現ベクターは、本発明で用いられるポリヌクレオチドを含有する。 本発明の組換えベクターは、適当なベクターに本発明で用いられるポリヌクレオチド(DNA)を連結(挿入)することにより得ることができる。より具体的には、精製された本発明で用いられるポリヌクレオチド(DNA)を適当な制限酵素で切断し、適当なベクターの制限酵素サイトまたはマルチクローニングサイトに挿入して、ベクターに連結することにより得ることができる。本発明で用いられるポリヌクレオチドを挿入するためのベクターは、宿主中で複製可能なものであれば特に限定されず、例えば、プラスミド、バクテリオファージなどが挙げられる。プラスミドとしては、例えば、大腸菌由来のプラスミド(例えばpUC8, pUC118, pUC119, pBR322, pBR325等)などがあげられる。バクテリオファージとしては、例えば、λファージなどがあげられる。
【0018】
本発明のポリヌクレオチドは、通常、適当なベクター中のプロモーターの下流に、発現可能なように連結される。用いられるプロモーターとしては、宿主中で発現可能なものが好ましい。より具体的には、例えば、形質転換する際の宿主が大腸菌属の細菌である場合は、lppプロモーター、Trpプロモーター、T7プロモーター、lacプロモーター、recAプロモーター、λPLプロモーターなどが好ましい。
本発明の組換えベクターには、以上の他に、所望によりリボソーム結合配列(SD配列)、選択マーカーなどを含有しているものを用いることができる。選択マーカーとしては、例えば、ジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子などがあげられる。
【0019】
(形質転換体の作成)
本発明で用いられる形質転換体には、本発明で用いられるポリヌクレオチド(DNA)が発現可能なように、本発明で用いられる発現ベクターが導入されている。上述したようにして得られた本発明で用いられるポリヌクレオチド(DNA)を含有する発現ベクターを、適当な宿主中に導入することによって、形質転換体を作成することができる。宿主としては、本発明で用いられるポリヌクレオチド(DNA)を発現できるものであれば特に限定されるものではなく、例えば、グラム陰性菌が挙げられる。グラム陰性菌としては、例えば、通性嫌気性桿菌などが挙げられる。通性嫌気性桿菌としては、例えば、大腸菌属、緑膿菌属またはサルモネラ菌属の細菌などがあげられる。大腸菌属の細菌としては、例えば、大腸菌などがあげられる。緑膿菌属の細菌としては、例えば、緑膿菌などがあげられる。サルモネラ菌属の細菌としては、例えば、サルモネラ菌などがあげられる。宿主としては、なかでも、グラム陰性菌が好ましく、通性嫌気性桿菌がより好ましく、さらに大腸菌属の細菌が好ましく、特に大腸菌が好ましい。
【0020】
発現ベクターの宿主への導入方法およびこれによる形質転換方法は、一般的な各種方法によって行うことができる。発現ベクターの宿主細胞への導入方法としては、例えば、リン酸カルシウム法(Virology, 52, 456-457 (1973))、エレクトロポレーション法(EMBO J., 1, 841-845 (1982))などがあげられる。大腸菌属の細菌の形質転換方法としては、例えば、Proc. Natl. Acad. Sci. USA, 69, 2110 (1972)、Gene, 17, 107 (1982)などに記載の方法などがあげられる。緑膿菌属の細菌の形質転換方法としては、例えば、エレクトロポレーション法などがあげられる。サルモネラ菌属の細菌の形質転換方法としては、例えば、エレクトロポレーション法などがあげられる。
このようにして、本発明で用いられるポリヌクレオチド(DNA)を含有する発現ベクターで形質転換された形質転換体を得ることができる。
(形質転換体の培養)
本発明で用いられる形質転換体の培養は、宿主の培養に用いられる通常の方法に従って行うことができる。該培養によって、形質転換体によって目的タンパク質が生成され、ペリプラズムスペースまたは培養液中などに目的タンパク質が蓄積される。
【0021】
宿主が大腸菌属、緑膿菌属またはサルモネラ菌属の細菌である形質転換体を培養する培地としては、該形質転換体の生育に必要な炭素源、窒素源、無機塩類等を含有し、形質転換体の培養を効率的に行うことができる培地であれば、天然培地、合成培地のいずれを用いてもよい。炭素源としては、グルコース、フラクトース、スクロース、デンプンなどの炭水化物、酢酸、プロピオン酸などの有機酸、エタノール、プロパノール等のアルコール類が用いられる。窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウムなどの無機酸もしくは有機酸のアンモニウム塩またはその他の含窒素化合物のほか、ペプトン、肉エキス、コーンスティープリカーなどが用いられる。無機塩類としては、リン酸第一カリウム、リン酸第二カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸銅、炭酸カルシウムなどが用いられる。培養中は必要に応じてアンピシリンやテトラサイクリン等の抗生物質を培地に添加してもよい。プロモーターとして誘導性のプロモーターを用いた発現ベクターで形質転換した形質転換体を培養する場合は、必要に応じてインデューサーを培地に添加してもよい。例えば、Lacプロモーターを用いた発現ベクターで形質転換した形質転換体を培養するときにはイソプロピル-β-D-チオガラクトピラノシド(IPTG)などを、trpプロモーターを用いた発現ベクターで形質転換した形質転換体を培養するときにはインドールアクリル酸(IAA)などを培地に添加してもよい。
【0022】
宿主が大腸菌属、緑膿菌属またはサルモネラ菌属の細菌の場合、培養は通常約15〜43℃で約3〜24時間行い、必要により、通気や撹拌を加える。
【0023】
(目的タンパク質の分離・精製)
上記培養物から、目的タンパク質を分離・精製することによって、本発明の目的タンパク質を得ることができる。ここで、培養物とは、培養液、培養菌体もしくは培養細胞、または培養菌体もしくは培養細胞の破砕物のいずれをも意味する。目的タンパク質の分離・精製は、通常の方法に従って行うことができる。
【0024】
具体的には、目的タンパク質がペリプラズムスペース中に蓄積される場合には、培養終了後、通常の方法(例えば浸透圧ショック法など)により目的タンパク質を含む抽出液を得ることができる。目的タンパク質が培養液中に蓄積される場合には、培養終了後、通常の方法(例えば、遠心分離、ろ過など)により菌体もしくは細胞と培養上清とを分離することにより、本発明のタンパク質を含む培養上清を得ることができる。目的タンパク質が培養菌体内もしくは培養細胞内に蓄積される場合には、培養後、通常の方法(例えば、超音波、リゾチーム、凍結融解など)で菌体もしくは細胞を破砕した後、通常の方法(例えば、遠心分離、ろ過など)により目的タンパク質の抽出液を得ることができる。
【0025】
このようにして得られた抽出液もしくは培養上清中に含まれる目的タンパク質の精製は、通常の分離・精製方法に従って行うことができる。分離・精製方法としては、例えば、硫酸アンモニウム沈殿、ゲルろ過クロマトグラフィー、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、逆相高速液体クロマトグラフィー、透析法、限外ろ過法などを単独で、または適宜組み合わせて用いることができる。
【0026】
目的タンパク質がアポタンパク質である場合には、通常の方法、例えば、得られたアポタンパク質と非タンパク質成分とを接触させることにより、ホロタンパク質を製造することができる。例えば、上記のようにして得られたアポタンパク質がセレンテラジンを結合するルシフェリン結合タンパク質のアポタンパク質(例えば、アポRLBP、アポイクオリン、アポクライチィンなど)である場合には、該アポタンパク質をセレンテラジンまたはその誘導体(例えば、h-セレンテラジン、e-セレンテラジン、Bis-セレンテラジンなど)と接触させることにより、該ルシフェリン結合タンパク質のホロタンパク質(例えば、RLBP、アポRLBP、アポイクオリンなど)を得ることができる。より具体的には、RLBPは、Charbonneau, H. and Cormier, M. J. Ca2+ -induced bioluminescence in Renilla reniformis. Purification and characterization of a calcium-triggered luciferin-binding protein. (1979) J.Biol.Chem. 254, 769-780などに記載の製造方法に従って製造することができる。イクオリンは、例えば、Shimomura, O. and Inouye, S. (1999) The in situ regeneration and extraction of recombinant aequorin from Escherichia coli cells and the purification of extracted aequorin. Protein Expression and Purification. 16: 91-95などに記載の製造方法に従って調製することができる。
セレンテラジンおよびセレンテラジン誘導体は溶液中では不安定であるが、本発明の製造方法によって得られるルシフェリン結合タンパク質のホロタンパク質中に結合した状態では安定である。したがって、本発明の製造方法によって得られるアポRLBPなどのルシフェリン結合タンパク質のアポタンパク質は、セレンテラジンおよびその誘導体などのルシフェリンを安定に保存するために好適に使用することができる。
本明細書において、ルシフェリン結合タンパク質のホロタンパク質とは、ルシフェリン結合タンパク質のアポタンパク質とルシフェリン(例えば、セレンテラジンなど)とからなるものを含み、さらにルシフェリン結合タンパク質のアポタンパク質とルシフェリン誘導体(例えば、h−セレンテラジン、e−セレンテラジン、Bis−セレンテラジンなどのセレンテラジン誘導体など)とからなるものも含む。RLBPとは、アポRLBPとセレンテラジンとからなるものを含み、さらにアポRLBPとセレンテラジン誘導体とからなるものも含む。
【0027】
2.本発明の発現ベクター
さらに、本発明は、(a)分泌シグナルペプチドをコードする第1コード領域、(b)塩基性アミノ酸に富むポリペプチドをコードする第2コード領域、および(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイトを含有することを特徴とする発現ベクターも提供する。本発明の発現ベクターは、(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイトに、上述の目的タンパク質をコードするポリヌクレオチドを連結(挿入)することにより、上述の目的タンパク質の製造に好適に使用することができる。
(a)分泌シグナルペプチドをコードする第1コード領域にコードされるシグナルペプチドとしては、上述の目的タンパク質の製造方法に記載されているものと同様のものが挙げられる。
(b)塩基性アミノ酸に富むポリペプチドをコードする第2コード領域にコードされる塩基性アミノ酸に富むポリペプチドとしては、上述の目的タンパク質の製造方法に記載されているものと同様のものが挙げられる。
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイトは、目的タンパク質をコードする第3コード領域を挿入することができる制限酵素認識部位を有するポリヌクレオチドを含有するものである。前記制限酵素サイトとしては、目的タンパク質をコードする第3コード領域を挿入することができればよく、特に制限はないが、いわゆるマルチクローニングサイトであるのが好ましい。マルチクローニングサイトなどの制限酵素サイトは、当技術分野において周知であり、報告されている(例えば、Yanisch-Perron, C., Vieira, J. and Messing, J. Gene 33 (1985) 103-119、Improved M13 phage cloning vectors and host strains: Nucleotide sequences of the M13mp18 and pUC19 vectors. Gene 33 (1985) 103-119など参照)。
目的タンパク質としては、上述の目的タンパク質の製造方法に記載されているものと同様のものが挙げられる。
【0028】
本発明の発現ベクターは、宿主中で複製可能なものであれば特に限定されず、例えば、プラスミド、バクテリオファージなどが挙げられる。プラスミドとしては、例えば、大腸菌由来のプラスミド(例えばpUC8, pUC118, pUC119, pBR322, pBR325等)などがあげられる。バクテリオファージとしては、例えば、λファージなどがあげられる。上述の目的タンパク質の製造で用いられる宿主としてグラム陰性菌が好ましく、通性嫌気性桿菌がより好ましく、さらに大腸菌属、緑膿菌属またはサルモネラ菌属の細菌が好ましく、特に大腸菌属の細菌であるのが好ましいので、本発明の発現ベクターとしては、これらの細菌中で複製可能なものが好ましく、さらに大腸菌属の細菌中で複製可能なものが好ましく、特に大腸菌由来のプラスミドが好ましい。
【0029】
本発明の発現ベクターにおいては、通常、前記第1コード領域は、プロモーターに有効に連結している。用いられるプロモーターとしては、宿主が大腸菌属の細菌である場合は、lppプロモーター、Trpプロモーター、T7プロモーター、lacプロモーター、recAプロモーター、λPLプロモーターなどが好ましい。上述の目的タンパク質の製造で用いられる宿主として、グラム陰性菌が好ましく、通性嫌気性桿菌がより好ましく、さらに大腸菌属、細菌が好ましく、特に大腸菌であるのが好ましいので、用いられるプロモーターとしては、これらの細菌中で発現可能なものが好ましく、さらに大腸菌属の細菌中で発現可能なものが好ましく、特に大腸菌中で発現可能なものが好ましい。より具体的には、lppプロモーター、Trpプロモーター、T7プロモーター、lacプロモーター、recAプロモーター、λPLプロモーターなどが好ましい。
【0030】
前記第1コード領域、前記第2コード領域および前記制限酵素サイトは、同じ読み枠内にあるように配置される。前記第2コード領域は、前記第1コード領域の下流にあるのが好ましい。前記制限酵素サイトは、前記第2コード領域の下流にあるのが好ましい。
本発明の発現ベクターとしては、前記制限酵素サイトに、目的タンパク質をコードするポリヌクレオチドを含有する第3コード領域が組み込まれているものも好ましい。
また、前記タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイトと、前記第1コード領域または前記第2コード領域との間に、さらに切断可能なペプチドリンカーをコードする領域を有していてもよい。切断可能なペプチドリンカーとは、上述の目的タンパク質の製造方法に記載されているものと同様の意味を表す。プロテアーゼまたは化学物質で処理して切断可能なペプチドリンカーの切断部位を切断することにより、第3コード領域にコードされる目的タンパク質を切り離すことができる。
【0031】
発明を実施するための最良の形態及び実施例に特に説明がない場合には、J. Sambrook, E. F. Fritsch & T. Maniatis (Ed.), Molecular cloning, a laboratory manual (3rd edition), Cold Spring Harbor Press, Cold Spring Harbor, New York (2001); F. M. Ausubel, R. Brent, R. E. Kingston, D. D. Moore, J.G. Seidman, J. A. Smith, K. Struhl (Ed.), Current Protocols in Molecular Biology, John Wiley & Sons Ltd.などの標準的なプロトコール集に記載の方法、あるいはそれを修飾したり、改変した方法を用いる。また、市販の試薬キットや測定装置を用いる場合には、特に説明が無い場合、それらに添付のプロトコールを用いる。
なお、本発明の目的、特徴、利点、及びそのアイデアは、本明細書の記載により、当業者には明らかであり、本明細書の記載から、当業者であれば、容易に本発明を実施できる。発明を実施するための最良の形態及び具体的な実施例などは、本発明の好ましい実施態様を示すものであり、例示又は説明のために示されているのであって、本発明をそれらに限定するものではない。本明細書で開示されている本発明の意図ならびに範囲内で、本明細書の記載に基づき、様々に修飾ができることは、当業者にとって明らかである。
【実施例】
【0032】
以下に実施例により本発明を説明するが、実施例は本発明を制限するものではない。
[材料と方法]
まず、本実施例で用いた材料と方法について説明する。
(1)材料
セレンテラジンおよびセレンテラジン誘導体は市販品を用いた。セレンテラジン(チッソ株式会社製)、h-セレンテラジン(チッソ株式会社製)、e-セレンテラジン(和光純薬工業社製)、Bis-セレンテラジン(チッソ株式会社製)。
Renilla reniformisの組換えRenillaルシフェラーゼは文献記載の方法に従って調製した(Biochem. Biophys. Res. Commun. 233, 249-353 (1997)参照)。以下の材料は市販のものを用いた:キレート・セファロース・ファーストフロー、セファデックスG25(スーパーファイングレード)(アマシャム・バイオサイエンス);イミダゾール、ジチオスレイトール(DTT)、エチレンジアミン四酢酸(EDTA)、硫酸ニッケル六水塩(和光純薬工業)。
(2)質量分析
マトリックス支援レーザーイオン化飛行時間型質量分析(MALDI-TOF-MS)をオートFLEX(ブルーカー・ダルトニクス)上で、マトリックスとしてシナピン酸(アルドリッチ−シグマ)を用いて、Anal. Biochem. 316, 216-222 (2003)に記載の方法に従って測定した。データはポジティブリフレクターモードで得た。時間−質量変換をアポミオグロビン(ウマ、m/z = 16952.6)を標準に用いた外部較正により行った。分子量の計算値をプログラムExPASy PeptideMass(http://www.expasy.ch/cgi-bin/peptide-mass.pl)を用いて得た。
(3) タンパク質濃度をブラッドフォードの色素結合法(Anal. Biochem. 72, 248-254 (1976))により、市販のキット(バイオラド)および標準物質としてウシ血清アルブミン(ピアス)を用いて測定した。SDS-PAGE分析を還元条件下で、12%分離ゲル(テフコ)を用いて、Laemmli法(Nature 227, 680-658 (1970))に従って行った。
【0033】
参考例1
(アポイクオリン発現ベクターpiP−HEの構築)
OmpAをコードする配列を有し、塩基性アミノ酸に富むポリペプチドをコードする配列を有さないアポイクオリン発現ベクターpiP−HEは、Proc. Natl. Acad. Sci. USA 82, 3154-3158 (1985)、J. Biochem. 105, 473-477 (1989)、特開昭63−102695号公報などに記載の方法に従って構築した。具体的には、以下のようにして構築した。
(1)piQ8−HEの作成
高コピーのクローニングベクターpUC8のEcoRI-HindIII部分を、それぞれの制限酵素で消化後、その部分に特開昭61−135586号公報に記載の方法に従って得たcDNAクローンpAQ440より得られたイクオリンcDNAのEcoRI-HindIIIフラグメントを、サブクローニングを行うことによりpiQ8−HEを作成した。
(2)piP−HEの作成
piQ8−HEをScaI-HindIIIで消化後、その部分にpIN-III 113 ompA-1から切り出したリポプロテインのプロモーター(lpp)、lacオペレーターおよびompA遺伝子を含むScaI-HindIIIフラグメントを挿入し、piP−HEを作成した。
【0034】
参考例2
(アポイクオリン発現ベクターpiP−His6−HEの構築)
OmpAおよびヒスチジンヘキサマーをコードする配列を有するアポイクオリン発現ベクターpiP−His−HEは、以下のようにして構築した。
参考例1記載の方法に従って得られたアポイクオリン分泌発現ベクターpiP−HEより、カルボキシ末端側のEcoRIをKlenow fragmentでfill-inすることにより削除したpiP-HEΔ2Eを使用し、piP-HEΔ2EのHindIII-EcoRI サイトに、6個のヒスチジンからなる配列をコードするオリゴヌクレオチド(Eco-His6-Hind Linker: 5' AAT-TCC-CAC-CAT-CAC-CA-T-CAC-CAT-GGT 3'(配列番号:3)、および Eco-His6-Hind Linker: 5'-AG-CTT-ACC-ATG-GTG-ATG-GTG-GG 3'(配列番号:4)を挿入してpiP−His6−HEを作製した。
【0035】
参考例3
(アポRLBPをコードする遺伝子の設計および化学合成)
アポRLBPのcDNAは未だ単離されていないので、PCR手順を用いたオリゴヌクレオチドアセンブリ法によってアポRLBPをコードする遺伝子を化学合成した。
アポRLBP(184アミノ酸残基)をコードする遺伝子は、DNASISソフトウェアVer.3.7(日立ソフトウェアエンジニアリング)を用いてデザインした。この際、大腸菌で好ましいコドンを用いず、アポRLBPの552ヌクレオチドの配列中に11の制限酵素部位を導入した。20ヌクレオチドが重複するオリゴヌクレオチド(40 mer×28、35 mer×1)をミリポアDNAシンセサイザー(モデルExpedite)を用いたホスホアミデート法により50 nmolスケールで合成し、ゲル精製法により精製し、真空乾燥した。遺伝子アセンブリーを以下のようなPCR法(Gene 164, 49-53 (1995))を用いて行った;乾燥したオリゴを蒸留水に約3.3 μg/μlの濃度(250 mM)で再懸濁し、内部オリゴの溶液各1 μlを合わせ、混合液(0.4 μl)を各0.25 mMのdNTP、5単位のExTaqポリメラーゼ(宝酒造)および4 μlの10×ExTaq緩衝液(緩衝液組成は製品添付書には示されていない)を含有する40 μlのPCR反応混合液に添加した。PCRプログラムとして、94℃−30秒、50℃−30秒、72℃−60秒を55サイクル行った(パーキン・エルマー)。アセンブリー反応混合液(2.5 μl)を、両者外側のプライマーセット(3.3 μg);HindIII部位を下線で示した15NL 5' GGCAAGCTT-CCA-GAA-GTT-ACT-GCC-AGC-GAA-CGT-GCT-TAC-C 3'(配列番号:5)とBam HI部位を下線で示した33RL 5' GCCGGATCC-TTA-TAA-TAA-ATC-ACC-ATA-AAA-TGC-ATT-AGC-C 3'(配列番号:6)による増幅に用いた(94℃−30秒、50℃−30秒、72℃−60秒を30サイクル)。1.2%アガロースゲル上の増幅断片(約550塩基対)を6 M NaIを用いて溶出し、PCR精製キット(キアゲン)を用いて精製した。分離した断片をHindIIIとBamHIで消化し、HindIII-BamHI断片を得た。得られた合成アポRLBP遺伝子のHindIII-BamHI断片は、184アミノ酸残基に対応し、512ヌクレオチド中に11個の制限酵素認識部位を有していた(図1)。このようにして得たHindIII-BamHI断片をpUC9-2(Gene 30, 247-250 (1984))のHindIII/BamHI部位に連結し、p92−RLBPを得た。DNA配列をアプライドシステムズDNAシーケンサー(モデル377および310)を用いて決定した。
【0036】
参考例4
(OmpAを有し、塩基性アミノ酸に富むポリペプチドを有さない組換えアポRLBPの大腸菌での発現)
(1)piP−RLBPの構築
参考例1で得られたpiP−HE中のアポイクオリンcDNAのHindIII-BamHI断片を、参考例3で得られたp92−RLBPのHindIII-BamHI断片と置換することによって、OmpAのシグナルペプチドを有するアポRLBPの発現プラスミドpiP−RLBPを構築した(図2)。用いた宿主は大腸菌BL21株(アマシャム・バイオサイエンス)であった。
(2)組換えアポRLBPの大腸菌での発現
上記(1)で得られた発現プラスミドpiP−RLBPを有する細菌株の種培養をアンピシリン(50 μg/ml)を含む5 mlのルリア−ベルターニ培地で、30℃で16時間行い、500 mlの坂口フラスコ中の80 mlのLB培地に添加した。16時間、37℃の培養の後、細胞を5000g、5分間の遠心により回収し、20 mlの50 mM Tris-HCl (pH7.6)に懸濁し、氷中でブラブソン・モデル250 ソニファイヤーを用いた超音波破砕を行った。SDS-PAGE分析の結果、ヒスチジンを持たないアポRLBPの発現が確認された。しかしながら、発現されたアポRLBPは、菌体中に封入体として存在していた(図3A、レーン4)。
【0037】
実施例1
(OmpAおよびヒスチジンヘキサマーを有する組換えアポRLBPの大腸菌での発現)
(1)piP−His−RLBPの構築
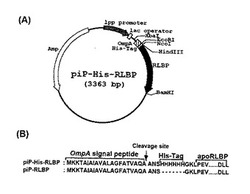
参考例2で得られたpiP−His6−HEのアポイクオリンcDNAのHindIII-BamHI断片を、参考例3で得られたp92−RLBPのHindIII-BamHI断片と置換することによって、OmpAのシグナルペプチドおよびヒスチジンヘキサマーを有するアポRLBPの発現プラスミドpiP−His−RLBPを構築した(図2A)。用いた宿主は大腸菌BL21株(アマシャム・バイオサイエンス)であった。
(2)組換えアポRLBPの大腸菌での発現および精製
上記(1)で得られた発現プラスミドpiP−His−RLBPを有する細菌株の種培養をアンピシリン(50 μg/ml)を含む5 mlのルリア−ベルターニ培地で、30℃で16時間行い、500 mlの坂口フラスコの80 mlのLB培地に添加した。16時間、37℃の培養の後、細胞を5000g、5分間の遠心により回収し、20 mlの50 mM Tris-HCl (pH7.6)に懸濁し、氷中でブラブソン・モデル250 ソニファイヤーを用いた超音波破砕を行った。
SDS-PAGE分析の結果piP-His-RLBP発現ベクターを用いて可溶性タンパク質として発現されていることを確認した(図3A、レーン3)。次に、培養細胞の超音波破砕物を12000g、10分間遠心して得られた上清(20 ml)を50 mM Tris-HCl (pH7.6)で平衡化したニッケル−キレートカラム(1.5×4 cm)にアプライした。カラムを50 mlの50 mM Tris-HCl (pH7.6)で洗浄し、吸着したタンパク質を0.05 M、0.1 M、0.3 M、0.5 M、および1 Mのイミダゾールを含む50 mM Tris-HCl (pH7.6)を各20 mlのステップワイズにより溶出した。ヒスチジンタグのついたアポRLBPの画分を0.1-0.3 M濃度のイミダゾールで溶出し、SDS-PAGEで解析した。アポRLBP画分を合わせ、4 Lの50 mM重炭酸アンモニウム(pH8.3)に透析し、-80℃で保存した。精製アポRLBPの収量は80 mlの培養した細胞から18.2 mgであった。
熱処理および還元条件下でのSDS-PAGE分析により、精製アポRLBPは95%以上の純度で、分子量24 kDaを示した(図3B、レーン2)。この結果は、大腸菌細胞におけるアポRLBPの発現量が細菌細胞から抽出される全タンパク質の10%以上であることを示唆している。これは、本発明の製造方法が、大量の目的タンパク質を、可溶性タンパク質として製造できることを示している。
精製アポRLBPにおいて、OmpAシグナルペプチドが正確に切断されていること及びヒスチジンヘキサマーを有するアポRLBPを確認するために、MALDI-TOF-MSを用いて質量分析を行った。[M+H]+に対するm/z 21931.7および[M+2H]2+に対するm/z 10965.9の質量値が観察された。これらの値はOmpAシグナルペプチドをもたないヒスチジンヘキサマーを有するアポRLBPに対する計算平均質量21932.9によく一致していた。この結果は、ヒスチジンヘキサマーを有するアポRLBPのOmpAシグナルペプチドが、大腸菌細胞中で細胞質からペリプラズム部分への移行中に正しく切断されたことを示している。
【0038】
実施例2
(アポRLBPからのRLBPの調製)
実施例1で得られた精製アポRLBP(1 mg = 46 nmol)を10 mM EDTAおよび0.66 mM DTTを含む30 mM Tris-HCl (pH7.6) 5 mlに溶解し、アポRLBPからRLBPへの変換をセレンテラジン(20 μg = 47 nmol)を添加することにより開始した。16時間、4℃で静置した後、混合液を遠心フィルター(アミコン・ウルトラ、分子量カット:10000)を用いて、4℃で、0.5 mlまで濃縮し、黄緑色の溶液を得た。結合していないセレンテラジンを除去するために、この溶液を10 mM EDTAを含む30 mM Tris-HCl (pH7.6)で平衡化したセファデックスG-25カラム(1×6 cm)にかけ、同緩衝液で溶出した。画分(0.5 ml)を1分あたり0.5 mlの流速で回収し、280 nmと446 nmの吸収でモニターした。RLBPの主画分を0.5 mlから1.0 mlで溶出した。タンパク質の回収率は80%であった。得られた精製RLBPの、熱処理および還元条件下でのSDS-PAGE分析の結果を図3Bのレーン3に示す。精製RLBPの純度は、天然のRLBPの吸収スペクトルのデータ(J. Biol. Chem. 254, 769-780 (1979))と比較することにより、95%以上であると推測された。
この結果は、実施例1で得られたアポRLBPが、天然のRLBPと同様に、セレンテラジンと結合してホロタンパク質であるRLBPを形成することを示している。これにより、実施例1で得られた組換えアポRLBPが、本来の機能を有していることが確認された。
【0039】
実施例3
(組換えRLBPのスペクトル分析)
精製した組換えRLBPの吸収スペクトルを2 mM EDTAまたは10 mM CaCl2を含む20 mM Tris-HCl (pH7.6)中で、ジャスコ(東京)V-560 分光光度計(バンドパス 0.5 nm;応答 Quick;スキャン速度 100 nm/分)、25℃で、石英キュベット(10 mm光路)を用いて測定した。カルシウムイオンの存在下および非存在下での組換えRLBPの吸収スペクトルを図4に示す。組換えRLBPは、475 nmに肩のある、277 nmと446 nmに二つの特徴的な最大吸収を有し、これは天然のRLBPのスペクトルとほとんど一致している(J. Biol. Chem. 254, 769-780 (1979))。277 nmと446 nmにおける組換えRLBPの吸光係数(ε)はそれぞれ、24900(E0.1% = 1.13)および9300(E0.1% = 0.42)であった。組換えRLBPの277 nm/446 nmの吸収比は2.68であり、天然のRLBPの277 nm/446 nm比の2.7から2.8(J. Biol. Chem. 254, 769-780 (1979))に近い。10 mMのカルシウムイオン存在下で、組換えRLBPの277 nmと446 nmのピークは265 nmと434 nmにシフトし、天然のRLBPに類似した特性を示した(J. Biol. Chem. 254, 769-780 (1979))。10 mM EDTAを含む同一の緩衝液中のセレンテラジンの420 nm(ε= 9300)の吸収ピークは、10 mMのカルシウムイオン存在下で432 nm(ε= 10000)にシフトした。この吸収ピークは、10 mMのカルシウムイオン存在下での組換えRLBPの434 nmに近かった。
また、蛍光スペクトルをジャスコ FP-6500 W 蛍光分光光度計(発光および励起バンドパス 5 nm;応答 0.5秒;スキャン速度 100 nm/分)を用いて測定した。446 nmで励起したRLBPの蛍光スペクトルは、1/2のバンド幅 86 nmで、530 nmにおいて発光ピークを示し、発光ピークの強度はカルシウムイオンの添加により、4倍に増加した。
これらのスペクトル変化のデータは、組換えRLBPは天然のRLBPと同様な高次構造をとっていることを示し、正常に折り畳まれていることをも示唆している。
吸収スペクトルの変化がないことから判断すると、組換えRLBPの溶液は、4℃および-80℃で6ヶ月以上安定であった。このことは、一般にセレンテラジンの中性付近の水溶液を4℃で保存した場合、半減期は約3日であるが、組換えRLBPを使用することより安定に保存可能であることも示している。
【0040】
実施例4
(RLBPとRenillaルシフェラーゼによる発光反応)
50 mM Tris-HCl (pH7.6)、10 mM CaCl2および実施例3で得られた組換えRLBP5 μgを含む反応混合液(100 μl)に、Renillaルシフェラーゼ(0.08 μg)を添加し、発光活性を光電子倍増管(R4220P、浜松ホトニクス)を装備したルミノメーター(AB2200、アトー社製(東京))を用いて測定したところ、連続的な発光が観察された(図5)。これは、カルシウムイオンがRLBPに結合することよって、RLBP分子内に内包していたセレンテラジンが放出され、放出されたセレンテラジンがRenillaルシフェラーゼの基質となり触媒作用によって酸化されたた結果、発光したことを示している。この結果は、実施例2で得られたRLBP(実施例1で得られたアポRLBPとセレンテラジンが結合したもの)が、カルシウムイオンによってセレンテラジンを放出することを示している。これにより、実施例1で得られた組換えアポRLBPおよび実施例3で得られた組換えRLBPが、本来の機能を有していることが確認された。
【0041】
実施例5
(アポRLBPとセレンテラジン誘導体からのRLBPの調製)
実施例2で記載したアポRLBPとセレンテラジンによるRLBPの調製法と同様にして、セレンテラジン誘導体を用いて新規RLBPを調製した。セレンテラジン誘導体として、h-セレンレたジン、e-セレンテラジン、Bis-セレンテラジンを用いて、対応するRLBP、すなわちh−RLBP、e−RLBP、Bis−RLBPを得た。アポRLBP、セレンテラジンおよび上記のようにして得られたRLBPの、カルシウムイオン(Ca2+)非存在下および存在下における吸収スペクトルデータを表1に示した。吸収スペクトルは、2 mM EDTAまたは10 mM CaCl2を含む50 mM Tris-HCl (pH7.6)中で、実施例3と同様にして測定した。得られたRLBPを4℃および-80℃で6ヶ月以上保存しても、これらの吸収スペクトルには、ほとんど変化が認められなかった。この結果は、組換えRLBPの溶液は、4℃および-80℃で6ヶ月以上安定であることを示している。すなわち、セレンテラジンと同様に、セレンテラジン誘導体も溶液中では不安定であるが、アポRLBPを使用することより安定に保存可能であることが示された。
【表1】

【0042】
実施例6
(アミノ末端にヒスチジン配列を持つ分泌タンパク質を発現するための新規基本ベクター、piP−H6−M(11)、の構築)
目的タンパク質を可溶性タンパク質として発現させるための基本ベクター、piP−H6−M(11)、は以下の手順で構築した。出発となるベクターpiP−His6−HEは、参考例2に記載の方法に従って作製した。さらに、piP−His6−HEベクターのHindIII-BamHI サイトに、マルチクローニングサイト(NcoI/ HindIII/ NdeI/ SacI/ KpnI/ XhoI/ BamHI/ EcoRI/ SalI/ PstI/ XbaI)をもつリンカーを挿入し、piP−H6−M(11)を構築した。基本ベクターpiP−H6−M(11)は、大腸菌のリポプロテインのプロモーター、ラクトースのオペレーターに制御され、分泌のためのOmpA配列、6個のヒスチジンからなる配列、マルチクローニングサイト(EcoRI/ NcoI/ HindIII/ NdeI/ SacI/ KpnI/ XhoI/ BamHI/ EcoRI/SalI/ PstI/ XbaI/ BamHI)を有する(図6)。
【産業上の利用可能性】
【0043】
本発明の目的タンパク質の製造によれば、目的タンパク質を可溶性タンパク質として製造することができるので、目的タンパク質を変性(可溶化)させる必要がない。よって、本発明によれば、目的タンパク質を効率的に、高い回収率で得ることができる。したがって、本発明は有用タンパク質や、機能や構造の解析対象となるタンパク質などのタンパク質の製造方法として極めて有用である。
また、本発明の発現ベクターは、目的タンパク質をコードする遺伝子を制限酵素サイトに挿入して発現させることによって、目的タンパク質を可溶性タンパク質として製造することができるので、有用タンパク質など所望のタンパク質の製造に好適に用いることができる。
【図面の簡単な説明】
【0044】
【図1】図1は、参考例3で得られた合成アポRLBP遺伝子の塩基配列および制限酵素認識部位、並びにアポRLBPのアミノ酸配列を示す。(A)制限酵素地図を示す。斜線部分はEFハンドモチーフのループ領域を示す。(B)合成アポRLBP遺伝子の塩基配列を示す。四角で囲まれた部分はEFハンドモチーフのループ領域を示す。
【図2】図2は、実施例1で得られたOmpAのシグナルペプチドおよびヒスチジンヘキサマーを有するアポRLBPの発現ベクターpiP−His−RLBPおよび参考例4で得られたOmpAのシグナルペプチドを有するアポRLBPの発現ベクターpiP−RLBPを示す。(A)piP−His−RLBPの制限酵素地図を示す。(B)piP−His−RLBPおよびpiP−RLBPのアミノ末端のアミノ酸配列、およびシグナルペプチド配列の切断部位を示す。
【図3】図3は、実施例1で得られた組換えアポRLBP、実施例2で得られた組換えRLBPおよび参考例4で得られた組換えアポRLBPのSDS−PAGE分析の結果を示す。各レーンの試料は次の通りである。(A)レーン1:タンパク質分子量マーカー(テフコ社):β−ガラクトシダーゼ(116,000)、ホスホリパーゼB(97,400)、ウシ血清アルブミン(69,000)、グルタミン酸デヒドロゲナーゼ(55,000)、乳酸デヒドロゲナーゼ(36,500)、炭酸脱水素酵素(29,000)、トリプシンインヒビター(20,100);レーン2:実施例1における培養細胞piP−His−RLBP/BL21(40μl)の超音波破砕物を遠心して得られた沈殿;レーン3:実施例1における培養細胞piP−His−RLBP/BL21(40μl)の超音波破砕物を遠心して得られた上清;レーン4:参考例4における培養細胞piP−RLBP/BL21(40μl)の超音波破砕物を遠心して得られた沈殿;レーン5:参考例4における培養細胞piP−RLBP/BL21(40μl)の超音波破砕物を遠心して得られた上清。(B)レーン1:タンパク質分子量マーカー;レーン2:実施例1で得られたヒスチジンヘキサマーが結合した精製アポRLBP(2.2μg);レーン3:実施例2で得られたヒスチジンヘキサマーが結合した精製RLBP(3.5μg)。
【図4】図4は、実施例3におけるカルシウムイオンの非存在下および存在下での組換えRLBPの吸収スペクトルを示す。実線および破線は、それぞれカルシウムイオン非存在下および存在下の吸収スペクトルを示す。タンパク質濃度は0.45 mg/mlであった。
【図5】図5は、実施例4における、実施例3で得られた組換えRLBPとRenillaルシフェラーゼによる発光反応を示す。挿入図は、矢印で示した部分を拡大したものを示す。
【図6】図6は、実施例6で得られた発現ベクターpiP−H6−M(11)を示す。
【配列表フリーテキスト】
【0045】
[配列番号:1]アポRLBPのアミノ酸配列を示す。
[配列番号:2]アポRLBPをコードする合成DNAの塩基配列を示す。
[配列番号:3]参考例2および実施例6で用いられた6個のヒスチジンからなる配列をコードするオリゴヌクレオチドの塩基配列を示す。
[配列番号:4]参考例2および実施例6で用いられた6個のヒスチジンからなる配列をコードするオリゴヌクレオチドの塩基配列を示す。
[配列番号:5]参考例3で用いられたプライマーの塩基配列を示す。
[配列番号:6]参考例3で用いられたプライマーの塩基配列を示す。
【技術分野】
【0001】
本発明は、目的タンパク質を可溶性タンパク質として製造する方法に関する。より詳しくは、分泌シグナルペプチドと塩基性アミノ酸に富むペプチドとを用いて目的タンパク質を可溶性タンパク質として製造する方法に関する。
【背景技術】
【0002】
これまでに、細菌、酵母、昆虫、トランスジェニック動物、トランスジェニック植物などの宿主内での組換えタンパク質発現系、無細胞翻訳系などの多くの組換えタンパク質発現系が開発されている。なかでも大腸菌は高密度に増殖させることが容易であり、しかも宿主ベクター系の研究が進んでいることから、異種タンパク質の発現系として広く利用されている。
一方、これらの組換えタンパク質発現系で目的タンパク質を発現させた場合、発現されたタンパク質が正確に折り畳まれないためにそのタンパク質本来の機能を発現できなかったり、封入体と呼ばれる不溶性の凝集体が形成されることが少なくない。このような場合、例えば封入体を変性(可溶化)した後、再折り畳みを行っても、必ずしも正常に折り畳まれた本来の機能を有するタンパク質が得られるとは限らない。また、本来の機能を発現するタンパク質が得られたとしても、満足な回収率が得られないことも多い。
このような背景において、現在まで発現組換え目的タンパク質の封入体の形成を抑制する方法は、確立されていない。その代法として、可溶性の高い分子量4万のマルトース結合タンパク質またはグルタチオンSトランスフェラーゼ(GST)と不溶性目的タンパク質とを融合させることにより可溶性蛋白として発現さすることが試みられている(非特許文献1:Fox,J.D.and Waugh, D.S. (2003) Maltose-binding protein as a solubility enhancer. Methods Mol. Biol.205:99-117、非特許文献2:Ausubel, F.M. et al. eds. (1996) Current Protocols in Molecular Biology, Vol. 2, 16.0.1)。しかし、可溶性タンパクが本来の活性を示さないこと、マルトース結合タンパク質またはGSTを削除した場合、目的タンパク質が不溶化する等の問題があった。
【0003】
レニラルシフェリン結合タンパク質(以下RLBPと略記する)は、ウミシイタケ(Renilla reniformis)由来のカルシウム誘発ルシフェリン結合タンパク質(Calcium-triggered luciferin-bindihg protein)として知られている。RLBPはアポタンパク質(アポRLBP)とセレンテラジン(ルシフェリン)の非共有結合複合体である(非特許文献3:J. Biol. Chem. 254, 769-780 (1979))。RLBPがカルシウムイオンと結合すると、セレンテラジンが放出される。放出されたセレンテラジンは、セレンテラジンを発光基質とするレニラルシフェラーゼ、エビルシフェラーゼ、ガウシアルシフェラーゼ等によるルシフェリン−ルシフェラーゼの発光反応に用いられる。
【0004】
大腸菌L−アスパラギナーゼ遺伝子をpelBリーダー配列およびN末端6×ヒスチジンタグと融合させることにより、組換え大腸菌L−アスパラギナーゼを菌体外である培養ろ液に発現させ、Ni−NTAアフィニティークロマトグラフィーで精製する方法が報告されている(非特許文献4:Protein Express. Purif. 38, 29-36 (2004))。
【非特許文献1】Fox,J.D.and Waugh, D.S. (2003) Maltose-binding protein as a solubility enhancer. Methods Mol. Biol.205:99-117
【非特許文献2】Ausubel, F.M. et al. eds. (1996) Current Protocols in Molecular Biology, Vol. 2, 16.0.1
【非特許文献3】J. Biol. Chem. 254, 769-780 (1979)
【非特許文献4】Protein Express. Purif. 38, 29-36 (2004)
【発明の開示】
【発明が解決しようとする課題】
【0005】
上記状況において、組換えタンパク質発現系を用いて、目的タンパク質を可溶性タンパク質として製造することが、有用タンパク質の生産のために産業上強く望まれている。また、タンパク質の機能や構造の研究といった研究分野においても強い要望がある。
【課題を解決するための手段】
【0006】
本発明者らは、上記課題を解決するために鋭意研究を重ねた結果、シグナルペプチドをコードするポリヌクレオチドと塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドを目的タンパク質をコードするポリヌクレオチドと結合させたポリヌクレオチドを含有する発現ベクターを用いて、グラム陰性菌中で目的タンパク質を発現させると、目的タンパク質が可溶性タンパク質として発現されることを見出した。さらに、このようにして得られた目的タンパク質は、本来の機能を有していることが確認された。これらの知見に基づいてさらに検討を重ねた結果、本発明を完成するに至った。
【0007】
すなわち、本発明は、
(1) 分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法、
(2) タンパク質の発現が宿主細胞内で行われる上記(1)記載の方法、
(3) 宿主細胞がグラム陰性菌である上記(2)記載の方法、
(4) グラム陰性菌が大腸菌属の細菌である上記(3)記載の方法、
(5) 分泌シグナルペプチドがグラム陰性菌由来の分泌シグナルペプチドである上記(1)〜(4)のいずれかに記載の方法、
(6) グラム陰性菌由来の分泌シグナルペプチドが、通性嫌気性桿菌由来の分泌シグナルペプチドである上記(5)記載の方法、
(7) グラム陰性菌由来ののシグナルペプチドが、大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)またはコレラ菌由来コレラトキシン由来の分泌シグナルペプチドである上記(5)記載の方法、
(8) 塩基性アミノ酸に富むポリペプチドが5〜12アミノ酸残基からなるポリペプチドである上記(1)〜(7)のいずれかに記載の方法、
(9) 塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸の含有率が60%以上である上記(1)〜(8)のいずれかに記載の方法、
(10) 塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸がヒスチジン、アルギニンおよびリジンから選択される上記(1)〜(9)のいずれかに記載の方法、
(11) 塩基性アミノ酸に富むポリペプチドがポリヒスチジンである上記(1)〜(9)のいずれかに記載の方法、
(12) 目的タンパク質の発現が、該目的タンパク質をコードするポリヌクレオチドを含有する発現ベクターを用いて行われる上記(1)〜(11)のいずれかに記載の方法、
(13) グラム陰性菌の分泌シグナルペプチドをコードするポリヌクレオチドと、5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてグラム陰性菌内でタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法、
(14) OmpAをコードするポリヌクレオチドと、ポリヒスチジンをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いて大腸菌属の細菌内でタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法、
(15) 目的タンパク質が異種タンパク質である上記(1)〜(14)のいずれかに記載の方法、
(16) 目的タンパク質が、アポRLBP、アポイクオリン、アポクライチィン、アポオベリンおよびアポマイトロコミンからなる群より選択されるいずれかである上記(1)〜(14)のいずれかに記載の方法、
(17) 目的タンパク質がアポRLBPである上記(16)記載の方法、
(18) グラム陰性菌の分泌シグナルペプチドをコードするポリヌクレオチドと、5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードするポリヌクレオチドと、アポRLBPをコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてグラム陰性菌内でタンパク質を発現させることを特徴とするアポRLBPの製造方法、
(19) OmpAをコードするポリヌクレオチドと、ポリヒスチジンをコードするポリヌクレオチドと、アポRLBPをコードするポリヌクレオチドとを含有するポリヌクレオチドを用いて大腸菌内でタンパク質を発現させ、発現されたタンパク質をペリプラズムスペースに蓄積させることを特徴とするアポRLBPの製造方法、
(20) 上記(17)〜(19)のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とを接触させることを特徴とするRLBPの製造方法、
(21) 上記(17)〜(19)のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とを接触させてRLBPを調製することを特徴とする、セレンテラジンまたはその誘導体の保存方法、
(22) 上記(17)〜(19)のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とからなるRLBP、
(23)(a)分泌シグナルペプチドをコードする第1コード領域、
(b)塩基性アミノ酸に富むポリペプチドをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター、
(23a) 前記第1コード領域がプロモーターに有効に連結している上記(23)記載の方法、
(23b) 前記第1コード領域、前記第2コード領域および前記制限酵素サイトが同じ読み枠内にある上記(23)記載の方法、
(23c) 前記第2コード領域が前記第1コード領域の下流にあり、前記制限酵素サイトが前記第2コード領域の下流にある上記(23)記載の方法、
(23d) 前記制限酵素サイトがマルチクローニングサイトである上記(23)記載の方法、
(24) 分泌シグナルペプチドがグラム陰性菌由来の分泌シグナルペプチドである上記(23)記載の発現ベクター、
(25) グラム陰性菌由来の分泌シグナルペプチドが通性嫌気性桿菌由来の分泌シグナルペプチドである上記(24)記載の発現ベクター、
(26) グラム陰性菌由来の分泌シグナルペプチドが、大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)またはコレラ菌由来コレラトキシン由来の分泌シグナルペプチドである上記(24)記載の発現ベクター、
(27) 塩基性アミノ酸に富むポリペプチドが5〜12アミノ酸残基からなるポリペプチドである上記(23)〜(26)のいずれかに記載の発現ベクター、
(28) 塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸の含有率が60%以上である上記(23)〜(27)のいずれかに記載の発現ベクター、
(29) 塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸がヒスチジン、アルギニンおよびリジンから選択される上記(23)〜(28)のいずれかに記載の発現ベクター、
(30) 塩基性アミノ酸に富むポリペプチドがポリヒスチジンである上記(23)〜(27)のいずれかに記載の発現ベクター、
(31)(a)グラム陰性菌由来の分泌シグナルペプチドをコードする第1コード領域、
(b)5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター、
(32)(a)OmpAをコードする第1コード領域、
(b)ポリヒスチジンをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター
などを提供する。
【発明の効果】
【0008】
本発明によれば、目的タンパク質を組換えタンパク質発現系を用いて製造する場合に、目的タンパク質を可溶性タンパク質として製造することができるので、目的タンパク質を変性(可溶化)させる必要がない。よって、本発明によれば、目的タンパク質を効率的に、高い回収率で得ることができる。
したがって、本発明は有用タンパク質や、機能や構造の解析対象となるタンパク質などのタンパク質の製造方法として極めて有用である。
【発明を実施するための最良の形態】
【0009】
本発明は、分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする前記目的タンパク質の製造方法、前記製造方法に使用することができる発現ベクターなどを提供する。本発明の製造方法によれば、分泌シグナルペプチドおよび塩基性アミノ酸に富むポリペプチドと融合された状態で目的タンパク質を発現させることにより、目的タンパク質が正常に折り畳まれずに封入体などを形成することを防止して、目的タンパク質を可溶化された状態で、正常に折り畳まれた本来の機能を有するタンパク質として製造することができる。
以下、本発明の目的タンパク質の製造方法などについて詳細に説明する。
【0010】
1.目的タンパク質の製造方法
本発明は、(1)分泌シグナルペプチドをコードするポリヌクレオチドと、(2)塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、(3)目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする目的タンパク質の製造方法を提供する。以下、より詳細に説明する。
(1)分泌シグナルペプチド
分泌シグナルペプチドとは、当該分泌シグナルペプチドに結合されたタンパク質またはポリペプチドを、細胞膜透過させる役割を担うペプチド領域を意味する。このような分泌シグナルペプチドのアミノ酸配列およびそれをコードする核酸配列は、当技術分野において周知であり、報告されている(例えばvon Heijine G (1988) Biochim. Biohys. Acra 947: 307-333、von Heijine G (1990) J. Membr. Biol. 115: 195-201など参照。
分泌シグナルペプチドは、通常10〜50個程度のアミノ酸残基からなるアミノ酸配列を有し、そのアミノ酸残基の多く(通常55〜60%程度)は疎水性である。本発明で用いられる分泌シグナルペプチドとしては、好ましくは原核生物由来、より好ましくはグラム陰性菌由来、さらに好ましくは通性嫌気性桿菌由来、特に好ましくは大腸菌属、緑膿菌属、サルモネラ菌属またはコレラ菌属の細菌由来の分泌シグナルペプチドが好ましい。また、分泌シグナルペプチドとしては、例えばvon Heijine G & Abrahmsen, L. (1989) FEBS Lett. 244:439-446. Tjalsma, H. et al. (2000) Microbiol.Mol Rev. 515-547などに記載されてるものなども挙げられ、とりわけ大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)(Ghrayeb, J. et al. (1984) EMBO J. 3:2437-2442)、コレラ菌由来コレラトキシン由来の分泌シグナルペプチドなどが好ましい。
本発明で用いられる分泌シグナルペプチドは、当該分泌シグナルペプチドに結合されたタンパク質またはポリペプチドを細胞膜透過させる活性を有していればよいので、変異体であってもよい。変異体としては、分泌シグナルペプチドのアミノ酸配列において、1もしくは複数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなり、かつ当該分泌シグナルペプチドに結合されたタンパク質またはポリペプチドを、細胞膜透過させる活性を有するペプチドなどが挙げられる。このようなペプチドとしては、分泌シグナルペプチドのアミノ酸配列において、例えば、1〜10個、1〜9個、1〜8個、1〜7個、1〜6個(1〜数個)、1〜5個、1〜4個、1〜3個、1〜2個、1個のアミノ酸残基が欠失、置換、挿入および/または付加されたアミノ酸配列からなり、かつ当該ペプチドに結合されたタンパク質またはポリペプチドを細胞膜透過させる活性を有するペプチドが挙げられる。上記アミノ酸残基の欠失、置換、挿入および/または付加の数は、一般的には小さい程好ましい。欠失、置換、挿入及び付加のうち2種以上が同時に生じてもよい。また、このようなタンパク質としては、目的タンパク質のアミノ酸配列と80%以上、85%以上、90%以上、93%以上、95%以上、97%以上、98%以上、99%以上、99.5%以上99.8%以上99.9%以上の同一性を有するアミノ酸配列を有し、かつ当該ペプチドに結合されたタンパク質またはポリペプチドを細胞膜透過させる活性を有するペプチドが挙げられる。上記相同性の数値は一般的に大きい程好ましい。
分泌シグナルペプチドは、一般的には、膜透過に伴ってシグナルペプチダーゼによって切断される切断部位を有する。本発明で用いられる分泌シグナルペプチドとしては、シグナルペプチダーゼによる切断部位を有しなくてもよいが、切断部位を有するのが好ましい。切断部位としては、目的タンパク質の発現に用いられる宿主(例えば、大腸菌など)の分泌シグナルペプチダーゼによって切断されうるものが好ましく用いられる。
【0011】
(2)塩基性アミノ酸に富むポリペプチド
本発明で用いられる塩基性アミノ酸に富むポリペプチドとしては、塩基性アミノ酸を含み、目的タンパク質のN末端側に融合させて発現させた場合に目的タンパク質の溶解性を増大しうるものであればよい。塩基性アミノ酸に富むポリペプチドとしては、例えば、等電点が生理的pHよりアルカリ側にあるポリペプチド、ポリペプチドを構成する全アミノ酸残基に対する塩基性アミノ酸残基の数の割合(含有率)が30%以上であるポリペプチドなどが挙げられる。塩基性アミノ酸残基の含有率は、60%以上であるのが好ましく、さらに80%以上であるのが好ましく、特に100%であるのが好ましい。
本発明で用いられる塩基性アミノ酸に富むポリペプチドに含まれるアミノ酸残基数としては、3〜20残基であるのが好ましく、さらに5〜12残基であるのが好ましく、特に5〜8残基であるのが好ましく、とりわけ6残基であるのが好ましい。
塩基性アミノ酸とは、塩基性側鎖を有するアミノ酸を意味する。塩基性アミノ酸としては、例えば、ヒスチジン、アルギニン、リジンなどが挙げられる。本発明で用いられる塩基性アミノ酸としては、ヒスチジン、アルギニン、リジンが好ましく、特にヒスチジンが好ましい。
塩基性アミノ酸に富むポリペプチドに含まれる塩基性アミノ酸残基に対するヒスチジン残基の数の割合(含有率)としては、60%以上であるのが好ましく、さらに80%以上であるのが好ましく、特に100%であるのが好ましい。
本発明で用いられる塩基性アミノ酸に富むポリペプチドとしては、なかでもポリヒスチジンが好ましい。ポリヒスチジンに含まれるヒスチジン残基数としては、5〜12残基であるのが好ましく、さらに5〜8残基であるのが好ましく、特に6残基(ヒスチジンヘキサマー)であるのが好ましい。
【0012】
(3)目的タンパク質
本発明の製造方法における目的タンパク質には特に制限はない。例えば、組換えタンパク質発現系で発現させた場合に封入体を形成しやすいタンパク質も可溶性タンパク質として製造しうるので、好ましく用いることができる。また、目的タンパク質は、アポタンパク質、すなわちホロタンパク質のタンパク質部分であってもよい。アポタンパク質としては、例えば、アポRLBP(FEBS Lett. 268, 287-290 (1990)など参照)、アポイクオリン(Proc. Natl. Acad. Sci. USA 82, 3154-3158 (1985)など参照 )、アポクライチィン(FEBS Lett. 315, 343-346 (1993)など参照)、アポマイトロコミン(FEBS Lett. 333, 301-305 (1993)など参照)、アポオベリン(Gene 153,273-274 (1995)など参照)などが挙げられる。アポRLBPのアミノ酸配列を配列番号:1に示す。
また、B型肝炎ウィルス、C型肝炎ウィルス、HIV、インフルエンザなどの病原性ウィルスゲノムにコードされる、外被タンパク質、コアタンパク質、プロテアーゼ、逆転写酵素、インテグラーゼなどのタンパク質(ウィルス抗原);抗体のFab、(Fab)2;血小板由来増殖因子(PDGF)、幹細胞成長因子(SCF)、肝細胞成長因子(HGF)、トランスフォーミング成長因子(TGF)、神経成長因子(NGF)、上皮細胞増殖因子(EGF)、線維芽細胞増殖因子(FGF)、インスリン様成長因子(IGF)などの増殖因子;腫瘍壊死因子、インターフェロン、インターロイキンなどのサイトカイン類;エリスロポエチン、顆粒球コロニー刺激因子、顆粒球マクロファージコロニー刺激因子、マクロファージコロニー刺激因子、トロンボポエチンなどの造血因子;黄体形成ホルモン放出ホルモン(LH−RH)、甲状腺刺激ホルモン放出ホルモン(TRH)、インスリン、ソマトスタチン、成長ホルモン、プロラクチン、副腎皮質刺激ホルモン(ACTH)、メラノサイト刺激ホルモン(MSH)、甲状腺刺激ホルモン(TSH)、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、バソプレシン、オキシトシン、カルシトニン、副甲状腺ホルモン(PTH)、グルカゴン、ガストリン、セクレチン、パンクレオザイミン、コレシストキニン、アンジオテンシン、ヒト胎盤ラクトーゲン、ヒト絨毛性ゴナドトロピン(HCG)、セルレイン、モチリンなどのペプチドホルモン;エンケファリン、エンドルフィン、ディノルフィン、キョウトルフィンなどの鎮痛性ペプチド;スーパーオキシドディスミュターゼ(SOD)、ウロキナーゼ、ティシュープラスミノーゲンアクティベーター(TPA)、アスパラギナーゼ、カリクレインなどの酵素;ボムベシン、ニュウロテンシン、ブラジキニン、サブスタンスPなどのペプチド性神経伝達物質;アルブミン;コラーゲン;プロインスリン;レニン;α1アンチトリプシンなども挙げられるが、これらに限定されない。
【0013】
本発明の目的タンパク質には、上記タンパク質の変異体も含まれる。そのような変異体としては、例えば、上記タンパク質のアミノ酸配列において、1もしくは複数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなり、かつ目的タンパク質と同質の活性を有するタンパク質も含まれる。このようなタンパク質としては、上記タンパク質のアミノ酸配列において、例えば、1〜100個、1〜90個、1〜80個、1〜70個、1〜60個、1〜50個、1〜40個、1〜30個、1〜20個、1〜10個、1〜9個、1〜8個、1〜7個、1〜6個(1〜数個)、1〜5個、1〜4個、1〜3個、1〜2個、1個のアミノ酸残基が欠失、置換、挿入および/または付加されたアミノ酸配列からなり、かつ目的タンパク質と同質の活性を有するタンパク質が挙げられる。上記アミノ酸残基の欠失、置換、挿入および/または付加の数は、一般的には小さい程好ましい。欠失、置換、挿入及び付加のうち2種以上が同時に生じてもよい。本明細書において、アポRLBPとは、配列番号:1で表されるアミノ酸配列を有するタンパク質のみならず、その変異体をも意味する。
【0014】
本発明の目的タンパク質には、目的タンパク質の「部分ペプチド」も含まれる。タンパク質の部分ペプチドとしては、目的タンパク質のアミノ酸配列の一部の連続するアミノ酸配列からなる部分ペプチドが挙げられ、目的タンパク質の活性と同質の活性を有するものが好ましい。例えば、目的タンパク質のアミノ酸配列において、少なくとも20個、好ましくは少なくとも50個のアミノ酸残基からなるアミノ酸配列を有するポリペプチドなどが挙げられる。好ましくは、これらのポリペプチドは、目的タンパク質の活性に関与する部分に対応するアミノ酸配列を含有する。また、本発明で使用される部分ペプチドは、上記のポリペプチドにおいて、そのアミノ酸配列中の1または複数個(例えば、1〜20個程度、より好ましくは1〜10個程度、さらにより好ましくは1〜5個程度)のアミノ酸残基が欠失、付加、置換、または挿入により変更されているものでもよい。
本発明で用いられる部分ペプチドは抗体作成のための抗原としても用いることができる。
【0015】
(4)本発明で用いられるポリヌクレオチド
本発明で用いられるポリヌクレオチドとしては、前述した分泌シグナルペプチド、塩基性アミノ酸に富むポリペプチドまたは目的タンパク質をコードする塩基配列を含有するものであればいかなるものであってもよいが、好ましくはDNAである。DNAとしては、ゲノムDNA、ゲノムDNAライブラリー、細胞・組織由来のcDNA、細胞・組織由来のcDNAライブラリー、合成DNAなどが挙げられる。本発明の目的タンパク質をコードするポリヌクレオチドの例として、アポRLBPをコードする合成DNAの塩基配列を配列番号:2に示す。
ライブラリーに使用するベクターは、特に制限はなく、バクテリオファージ、プラスミド、コスミド、ファージミドなどいずれであってもよい。また、前記した細胞・組織からtotalRNAまたはmRNA画分を調製したものを用いて直接 Reverse Transcription Polymerase Chain Reaction(以下、RT-PCR法と略称する)によって増幅することもできる。
本発明で用いられる分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチド(DNA)は、目的タンパク質をコードするポリヌクレオチドと、分泌シグナルペプチドをコードするポリヌクレオチドまたは塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドとの間に、さらに切断可能なペプチドリンカーをコードするポリヌクレオチドを有していてもよい。切断可能なペプチドリンカーとは、酵素的または化学的切断物質により切断することができるペプチド配列を意味する。酵素(プロテアーゼ)または化学物質により切断されるペプチド配列は多数知られている(例えば、Harlow and Lane, Antibodies:A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1988);Walsh, Proteins Biochemistry and Biotechnology, John Wiley & Sons, LTD., West Sussex, England (2002)など参照)。切断物質とは、ポリペプチドにおける切断部位を認識し、ポリペプチド内の結合の切断によりポリペプチドを2つのポリペプチドに分割する化学物質または酵素である。切断物質としては、例えば、化学物質、プロテアーゼなどが挙げられる。
【0016】
(5)目的タンパク質の製造
本発明の目的タンパク質は、具体的には、例えば分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチド(DNA)(以下、目的タンパク質の製造の説明においては、「本発明で用いられるポリヌクレオチド」と称することがある。)を連結(導入)した発現ベクターを用いて目的タンパク質を発現させ、生成した目的タンパク質を分離・精製することによって製造することができる。発現ベクターを用いた目的タンパク質の発現は、宿主細胞内、無細胞翻訳系などのタンパク質発現系で行うことができる。目的タンパク質の発現は、前記した発現ベクターの導入によって形質転換された宿主細胞(形質転換体)内で行うのが好ましい。前記形質転換体を、導入された発現ベクターに連結(導入)された本発明で用いられるポリヌクレオチド(DNA)が発現可能な条件下で培養し、目的タンパク質を精製・蓄積させ、分離・精製することによって製造することができる。宿主細胞としては、グラム陰性菌が好ましく、特に大腸菌が好ましく用いられる。グラム陰性菌を宿主細胞として用いた場合には、発現された目的タンパク質は、好ましくは、分泌シグナルペプチドによって細胞内膜を透過し、ペリプラズムスペースまたは外膜を通過し培養上清中に分泌される。ここで、本発明の目的タンパク質は、異種タンパク質であってもよい。異種タンパク質とは、宿主細胞などのタンパク質発現系において、天然には産生されないタンパク質を意味する。
以下、本発明の目的タンパク質の製造方法について、さらに詳細に説明する。
【0017】
(発現ベクターの作成)
本発明で用いられる発現ベクターは、本発明で用いられるポリヌクレオチドを含有する。 本発明の組換えベクターは、適当なベクターに本発明で用いられるポリヌクレオチド(DNA)を連結(挿入)することにより得ることができる。より具体的には、精製された本発明で用いられるポリヌクレオチド(DNA)を適当な制限酵素で切断し、適当なベクターの制限酵素サイトまたはマルチクローニングサイトに挿入して、ベクターに連結することにより得ることができる。本発明で用いられるポリヌクレオチドを挿入するためのベクターは、宿主中で複製可能なものであれば特に限定されず、例えば、プラスミド、バクテリオファージなどが挙げられる。プラスミドとしては、例えば、大腸菌由来のプラスミド(例えばpUC8, pUC118, pUC119, pBR322, pBR325等)などがあげられる。バクテリオファージとしては、例えば、λファージなどがあげられる。
【0018】
本発明のポリヌクレオチドは、通常、適当なベクター中のプロモーターの下流に、発現可能なように連結される。用いられるプロモーターとしては、宿主中で発現可能なものが好ましい。より具体的には、例えば、形質転換する際の宿主が大腸菌属の細菌である場合は、lppプロモーター、Trpプロモーター、T7プロモーター、lacプロモーター、recAプロモーター、λPLプロモーターなどが好ましい。
本発明の組換えベクターには、以上の他に、所望によりリボソーム結合配列(SD配列)、選択マーカーなどを含有しているものを用いることができる。選択マーカーとしては、例えば、ジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子などがあげられる。
【0019】
(形質転換体の作成)
本発明で用いられる形質転換体には、本発明で用いられるポリヌクレオチド(DNA)が発現可能なように、本発明で用いられる発現ベクターが導入されている。上述したようにして得られた本発明で用いられるポリヌクレオチド(DNA)を含有する発現ベクターを、適当な宿主中に導入することによって、形質転換体を作成することができる。宿主としては、本発明で用いられるポリヌクレオチド(DNA)を発現できるものであれば特に限定されるものではなく、例えば、グラム陰性菌が挙げられる。グラム陰性菌としては、例えば、通性嫌気性桿菌などが挙げられる。通性嫌気性桿菌としては、例えば、大腸菌属、緑膿菌属またはサルモネラ菌属の細菌などがあげられる。大腸菌属の細菌としては、例えば、大腸菌などがあげられる。緑膿菌属の細菌としては、例えば、緑膿菌などがあげられる。サルモネラ菌属の細菌としては、例えば、サルモネラ菌などがあげられる。宿主としては、なかでも、グラム陰性菌が好ましく、通性嫌気性桿菌がより好ましく、さらに大腸菌属の細菌が好ましく、特に大腸菌が好ましい。
【0020】
発現ベクターの宿主への導入方法およびこれによる形質転換方法は、一般的な各種方法によって行うことができる。発現ベクターの宿主細胞への導入方法としては、例えば、リン酸カルシウム法(Virology, 52, 456-457 (1973))、エレクトロポレーション法(EMBO J., 1, 841-845 (1982))などがあげられる。大腸菌属の細菌の形質転換方法としては、例えば、Proc. Natl. Acad. Sci. USA, 69, 2110 (1972)、Gene, 17, 107 (1982)などに記載の方法などがあげられる。緑膿菌属の細菌の形質転換方法としては、例えば、エレクトロポレーション法などがあげられる。サルモネラ菌属の細菌の形質転換方法としては、例えば、エレクトロポレーション法などがあげられる。
このようにして、本発明で用いられるポリヌクレオチド(DNA)を含有する発現ベクターで形質転換された形質転換体を得ることができる。
(形質転換体の培養)
本発明で用いられる形質転換体の培養は、宿主の培養に用いられる通常の方法に従って行うことができる。該培養によって、形質転換体によって目的タンパク質が生成され、ペリプラズムスペースまたは培養液中などに目的タンパク質が蓄積される。
【0021】
宿主が大腸菌属、緑膿菌属またはサルモネラ菌属の細菌である形質転換体を培養する培地としては、該形質転換体の生育に必要な炭素源、窒素源、無機塩類等を含有し、形質転換体の培養を効率的に行うことができる培地であれば、天然培地、合成培地のいずれを用いてもよい。炭素源としては、グルコース、フラクトース、スクロース、デンプンなどの炭水化物、酢酸、プロピオン酸などの有機酸、エタノール、プロパノール等のアルコール類が用いられる。窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウムなどの無機酸もしくは有機酸のアンモニウム塩またはその他の含窒素化合物のほか、ペプトン、肉エキス、コーンスティープリカーなどが用いられる。無機塩類としては、リン酸第一カリウム、リン酸第二カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸銅、炭酸カルシウムなどが用いられる。培養中は必要に応じてアンピシリンやテトラサイクリン等の抗生物質を培地に添加してもよい。プロモーターとして誘導性のプロモーターを用いた発現ベクターで形質転換した形質転換体を培養する場合は、必要に応じてインデューサーを培地に添加してもよい。例えば、Lacプロモーターを用いた発現ベクターで形質転換した形質転換体を培養するときにはイソプロピル-β-D-チオガラクトピラノシド(IPTG)などを、trpプロモーターを用いた発現ベクターで形質転換した形質転換体を培養するときにはインドールアクリル酸(IAA)などを培地に添加してもよい。
【0022】
宿主が大腸菌属、緑膿菌属またはサルモネラ菌属の細菌の場合、培養は通常約15〜43℃で約3〜24時間行い、必要により、通気や撹拌を加える。
【0023】
(目的タンパク質の分離・精製)
上記培養物から、目的タンパク質を分離・精製することによって、本発明の目的タンパク質を得ることができる。ここで、培養物とは、培養液、培養菌体もしくは培養細胞、または培養菌体もしくは培養細胞の破砕物のいずれをも意味する。目的タンパク質の分離・精製は、通常の方法に従って行うことができる。
【0024】
具体的には、目的タンパク質がペリプラズムスペース中に蓄積される場合には、培養終了後、通常の方法(例えば浸透圧ショック法など)により目的タンパク質を含む抽出液を得ることができる。目的タンパク質が培養液中に蓄積される場合には、培養終了後、通常の方法(例えば、遠心分離、ろ過など)により菌体もしくは細胞と培養上清とを分離することにより、本発明のタンパク質を含む培養上清を得ることができる。目的タンパク質が培養菌体内もしくは培養細胞内に蓄積される場合には、培養後、通常の方法(例えば、超音波、リゾチーム、凍結融解など)で菌体もしくは細胞を破砕した後、通常の方法(例えば、遠心分離、ろ過など)により目的タンパク質の抽出液を得ることができる。
【0025】
このようにして得られた抽出液もしくは培養上清中に含まれる目的タンパク質の精製は、通常の分離・精製方法に従って行うことができる。分離・精製方法としては、例えば、硫酸アンモニウム沈殿、ゲルろ過クロマトグラフィー、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、逆相高速液体クロマトグラフィー、透析法、限外ろ過法などを単独で、または適宜組み合わせて用いることができる。
【0026】
目的タンパク質がアポタンパク質である場合には、通常の方法、例えば、得られたアポタンパク質と非タンパク質成分とを接触させることにより、ホロタンパク質を製造することができる。例えば、上記のようにして得られたアポタンパク質がセレンテラジンを結合するルシフェリン結合タンパク質のアポタンパク質(例えば、アポRLBP、アポイクオリン、アポクライチィンなど)である場合には、該アポタンパク質をセレンテラジンまたはその誘導体(例えば、h-セレンテラジン、e-セレンテラジン、Bis-セレンテラジンなど)と接触させることにより、該ルシフェリン結合タンパク質のホロタンパク質(例えば、RLBP、アポRLBP、アポイクオリンなど)を得ることができる。より具体的には、RLBPは、Charbonneau, H. and Cormier, M. J. Ca2+ -induced bioluminescence in Renilla reniformis. Purification and characterization of a calcium-triggered luciferin-binding protein. (1979) J.Biol.Chem. 254, 769-780などに記載の製造方法に従って製造することができる。イクオリンは、例えば、Shimomura, O. and Inouye, S. (1999) The in situ regeneration and extraction of recombinant aequorin from Escherichia coli cells and the purification of extracted aequorin. Protein Expression and Purification. 16: 91-95などに記載の製造方法に従って調製することができる。
セレンテラジンおよびセレンテラジン誘導体は溶液中では不安定であるが、本発明の製造方法によって得られるルシフェリン結合タンパク質のホロタンパク質中に結合した状態では安定である。したがって、本発明の製造方法によって得られるアポRLBPなどのルシフェリン結合タンパク質のアポタンパク質は、セレンテラジンおよびその誘導体などのルシフェリンを安定に保存するために好適に使用することができる。
本明細書において、ルシフェリン結合タンパク質のホロタンパク質とは、ルシフェリン結合タンパク質のアポタンパク質とルシフェリン(例えば、セレンテラジンなど)とからなるものを含み、さらにルシフェリン結合タンパク質のアポタンパク質とルシフェリン誘導体(例えば、h−セレンテラジン、e−セレンテラジン、Bis−セレンテラジンなどのセレンテラジン誘導体など)とからなるものも含む。RLBPとは、アポRLBPとセレンテラジンとからなるものを含み、さらにアポRLBPとセレンテラジン誘導体とからなるものも含む。
【0027】
2.本発明の発現ベクター
さらに、本発明は、(a)分泌シグナルペプチドをコードする第1コード領域、(b)塩基性アミノ酸に富むポリペプチドをコードする第2コード領域、および(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイトを含有することを特徴とする発現ベクターも提供する。本発明の発現ベクターは、(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイトに、上述の目的タンパク質をコードするポリヌクレオチドを連結(挿入)することにより、上述の目的タンパク質の製造に好適に使用することができる。
(a)分泌シグナルペプチドをコードする第1コード領域にコードされるシグナルペプチドとしては、上述の目的タンパク質の製造方法に記載されているものと同様のものが挙げられる。
(b)塩基性アミノ酸に富むポリペプチドをコードする第2コード領域にコードされる塩基性アミノ酸に富むポリペプチドとしては、上述の目的タンパク質の製造方法に記載されているものと同様のものが挙げられる。
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイトは、目的タンパク質をコードする第3コード領域を挿入することができる制限酵素認識部位を有するポリヌクレオチドを含有するものである。前記制限酵素サイトとしては、目的タンパク質をコードする第3コード領域を挿入することができればよく、特に制限はないが、いわゆるマルチクローニングサイトであるのが好ましい。マルチクローニングサイトなどの制限酵素サイトは、当技術分野において周知であり、報告されている(例えば、Yanisch-Perron, C., Vieira, J. and Messing, J. Gene 33 (1985) 103-119、Improved M13 phage cloning vectors and host strains: Nucleotide sequences of the M13mp18 and pUC19 vectors. Gene 33 (1985) 103-119など参照)。
目的タンパク質としては、上述の目的タンパク質の製造方法に記載されているものと同様のものが挙げられる。
【0028】
本発明の発現ベクターは、宿主中で複製可能なものであれば特に限定されず、例えば、プラスミド、バクテリオファージなどが挙げられる。プラスミドとしては、例えば、大腸菌由来のプラスミド(例えばpUC8, pUC118, pUC119, pBR322, pBR325等)などがあげられる。バクテリオファージとしては、例えば、λファージなどがあげられる。上述の目的タンパク質の製造で用いられる宿主としてグラム陰性菌が好ましく、通性嫌気性桿菌がより好ましく、さらに大腸菌属、緑膿菌属またはサルモネラ菌属の細菌が好ましく、特に大腸菌属の細菌であるのが好ましいので、本発明の発現ベクターとしては、これらの細菌中で複製可能なものが好ましく、さらに大腸菌属の細菌中で複製可能なものが好ましく、特に大腸菌由来のプラスミドが好ましい。
【0029】
本発明の発現ベクターにおいては、通常、前記第1コード領域は、プロモーターに有効に連結している。用いられるプロモーターとしては、宿主が大腸菌属の細菌である場合は、lppプロモーター、Trpプロモーター、T7プロモーター、lacプロモーター、recAプロモーター、λPLプロモーターなどが好ましい。上述の目的タンパク質の製造で用いられる宿主として、グラム陰性菌が好ましく、通性嫌気性桿菌がより好ましく、さらに大腸菌属、細菌が好ましく、特に大腸菌であるのが好ましいので、用いられるプロモーターとしては、これらの細菌中で発現可能なものが好ましく、さらに大腸菌属の細菌中で発現可能なものが好ましく、特に大腸菌中で発現可能なものが好ましい。より具体的には、lppプロモーター、Trpプロモーター、T7プロモーター、lacプロモーター、recAプロモーター、λPLプロモーターなどが好ましい。
【0030】
前記第1コード領域、前記第2コード領域および前記制限酵素サイトは、同じ読み枠内にあるように配置される。前記第2コード領域は、前記第1コード領域の下流にあるのが好ましい。前記制限酵素サイトは、前記第2コード領域の下流にあるのが好ましい。
本発明の発現ベクターとしては、前記制限酵素サイトに、目的タンパク質をコードするポリヌクレオチドを含有する第3コード領域が組み込まれているものも好ましい。
また、前記タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイトと、前記第1コード領域または前記第2コード領域との間に、さらに切断可能なペプチドリンカーをコードする領域を有していてもよい。切断可能なペプチドリンカーとは、上述の目的タンパク質の製造方法に記載されているものと同様の意味を表す。プロテアーゼまたは化学物質で処理して切断可能なペプチドリンカーの切断部位を切断することにより、第3コード領域にコードされる目的タンパク質を切り離すことができる。
【0031】
発明を実施するための最良の形態及び実施例に特に説明がない場合には、J. Sambrook, E. F. Fritsch & T. Maniatis (Ed.), Molecular cloning, a laboratory manual (3rd edition), Cold Spring Harbor Press, Cold Spring Harbor, New York (2001); F. M. Ausubel, R. Brent, R. E. Kingston, D. D. Moore, J.G. Seidman, J. A. Smith, K. Struhl (Ed.), Current Protocols in Molecular Biology, John Wiley & Sons Ltd.などの標準的なプロトコール集に記載の方法、あるいはそれを修飾したり、改変した方法を用いる。また、市販の試薬キットや測定装置を用いる場合には、特に説明が無い場合、それらに添付のプロトコールを用いる。
なお、本発明の目的、特徴、利点、及びそのアイデアは、本明細書の記載により、当業者には明らかであり、本明細書の記載から、当業者であれば、容易に本発明を実施できる。発明を実施するための最良の形態及び具体的な実施例などは、本発明の好ましい実施態様を示すものであり、例示又は説明のために示されているのであって、本発明をそれらに限定するものではない。本明細書で開示されている本発明の意図ならびに範囲内で、本明細書の記載に基づき、様々に修飾ができることは、当業者にとって明らかである。
【実施例】
【0032】
以下に実施例により本発明を説明するが、実施例は本発明を制限するものではない。
[材料と方法]
まず、本実施例で用いた材料と方法について説明する。
(1)材料
セレンテラジンおよびセレンテラジン誘導体は市販品を用いた。セレンテラジン(チッソ株式会社製)、h-セレンテラジン(チッソ株式会社製)、e-セレンテラジン(和光純薬工業社製)、Bis-セレンテラジン(チッソ株式会社製)。
Renilla reniformisの組換えRenillaルシフェラーゼは文献記載の方法に従って調製した(Biochem. Biophys. Res. Commun. 233, 249-353 (1997)参照)。以下の材料は市販のものを用いた:キレート・セファロース・ファーストフロー、セファデックスG25(スーパーファイングレード)(アマシャム・バイオサイエンス);イミダゾール、ジチオスレイトール(DTT)、エチレンジアミン四酢酸(EDTA)、硫酸ニッケル六水塩(和光純薬工業)。
(2)質量分析
マトリックス支援レーザーイオン化飛行時間型質量分析(MALDI-TOF-MS)をオートFLEX(ブルーカー・ダルトニクス)上で、マトリックスとしてシナピン酸(アルドリッチ−シグマ)を用いて、Anal. Biochem. 316, 216-222 (2003)に記載の方法に従って測定した。データはポジティブリフレクターモードで得た。時間−質量変換をアポミオグロビン(ウマ、m/z = 16952.6)を標準に用いた外部較正により行った。分子量の計算値をプログラムExPASy PeptideMass(http://www.expasy.ch/cgi-bin/peptide-mass.pl)を用いて得た。
(3) タンパク質濃度をブラッドフォードの色素結合法(Anal. Biochem. 72, 248-254 (1976))により、市販のキット(バイオラド)および標準物質としてウシ血清アルブミン(ピアス)を用いて測定した。SDS-PAGE分析を還元条件下で、12%分離ゲル(テフコ)を用いて、Laemmli法(Nature 227, 680-658 (1970))に従って行った。
【0033】
参考例1
(アポイクオリン発現ベクターpiP−HEの構築)
OmpAをコードする配列を有し、塩基性アミノ酸に富むポリペプチドをコードする配列を有さないアポイクオリン発現ベクターpiP−HEは、Proc. Natl. Acad. Sci. USA 82, 3154-3158 (1985)、J. Biochem. 105, 473-477 (1989)、特開昭63−102695号公報などに記載の方法に従って構築した。具体的には、以下のようにして構築した。
(1)piQ8−HEの作成
高コピーのクローニングベクターpUC8のEcoRI-HindIII部分を、それぞれの制限酵素で消化後、その部分に特開昭61−135586号公報に記載の方法に従って得たcDNAクローンpAQ440より得られたイクオリンcDNAのEcoRI-HindIIIフラグメントを、サブクローニングを行うことによりpiQ8−HEを作成した。
(2)piP−HEの作成
piQ8−HEをScaI-HindIIIで消化後、その部分にpIN-III 113 ompA-1から切り出したリポプロテインのプロモーター(lpp)、lacオペレーターおよびompA遺伝子を含むScaI-HindIIIフラグメントを挿入し、piP−HEを作成した。
【0034】
参考例2
(アポイクオリン発現ベクターpiP−His6−HEの構築)
OmpAおよびヒスチジンヘキサマーをコードする配列を有するアポイクオリン発現ベクターpiP−His−HEは、以下のようにして構築した。
参考例1記載の方法に従って得られたアポイクオリン分泌発現ベクターpiP−HEより、カルボキシ末端側のEcoRIをKlenow fragmentでfill-inすることにより削除したpiP-HEΔ2Eを使用し、piP-HEΔ2EのHindIII-EcoRI サイトに、6個のヒスチジンからなる配列をコードするオリゴヌクレオチド(Eco-His6-Hind Linker: 5' AAT-TCC-CAC-CAT-CAC-CA-T-CAC-CAT-GGT 3'(配列番号:3)、および Eco-His6-Hind Linker: 5'-AG-CTT-ACC-ATG-GTG-ATG-GTG-GG 3'(配列番号:4)を挿入してpiP−His6−HEを作製した。
【0035】
参考例3
(アポRLBPをコードする遺伝子の設計および化学合成)
アポRLBPのcDNAは未だ単離されていないので、PCR手順を用いたオリゴヌクレオチドアセンブリ法によってアポRLBPをコードする遺伝子を化学合成した。
アポRLBP(184アミノ酸残基)をコードする遺伝子は、DNASISソフトウェアVer.3.7(日立ソフトウェアエンジニアリング)を用いてデザインした。この際、大腸菌で好ましいコドンを用いず、アポRLBPの552ヌクレオチドの配列中に11の制限酵素部位を導入した。20ヌクレオチドが重複するオリゴヌクレオチド(40 mer×28、35 mer×1)をミリポアDNAシンセサイザー(モデルExpedite)を用いたホスホアミデート法により50 nmolスケールで合成し、ゲル精製法により精製し、真空乾燥した。遺伝子アセンブリーを以下のようなPCR法(Gene 164, 49-53 (1995))を用いて行った;乾燥したオリゴを蒸留水に約3.3 μg/μlの濃度(250 mM)で再懸濁し、内部オリゴの溶液各1 μlを合わせ、混合液(0.4 μl)を各0.25 mMのdNTP、5単位のExTaqポリメラーゼ(宝酒造)および4 μlの10×ExTaq緩衝液(緩衝液組成は製品添付書には示されていない)を含有する40 μlのPCR反応混合液に添加した。PCRプログラムとして、94℃−30秒、50℃−30秒、72℃−60秒を55サイクル行った(パーキン・エルマー)。アセンブリー反応混合液(2.5 μl)を、両者外側のプライマーセット(3.3 μg);HindIII部位を下線で示した15NL 5' GGCAAGCTT-CCA-GAA-GTT-ACT-GCC-AGC-GAA-CGT-GCT-TAC-C 3'(配列番号:5)とBam HI部位を下線で示した33RL 5' GCCGGATCC-TTA-TAA-TAA-ATC-ACC-ATA-AAA-TGC-ATT-AGC-C 3'(配列番号:6)による増幅に用いた(94℃−30秒、50℃−30秒、72℃−60秒を30サイクル)。1.2%アガロースゲル上の増幅断片(約550塩基対)を6 M NaIを用いて溶出し、PCR精製キット(キアゲン)を用いて精製した。分離した断片をHindIIIとBamHIで消化し、HindIII-BamHI断片を得た。得られた合成アポRLBP遺伝子のHindIII-BamHI断片は、184アミノ酸残基に対応し、512ヌクレオチド中に11個の制限酵素認識部位を有していた(図1)。このようにして得たHindIII-BamHI断片をpUC9-2(Gene 30, 247-250 (1984))のHindIII/BamHI部位に連結し、p92−RLBPを得た。DNA配列をアプライドシステムズDNAシーケンサー(モデル377および310)を用いて決定した。
【0036】
参考例4
(OmpAを有し、塩基性アミノ酸に富むポリペプチドを有さない組換えアポRLBPの大腸菌での発現)
(1)piP−RLBPの構築
参考例1で得られたpiP−HE中のアポイクオリンcDNAのHindIII-BamHI断片を、参考例3で得られたp92−RLBPのHindIII-BamHI断片と置換することによって、OmpAのシグナルペプチドを有するアポRLBPの発現プラスミドpiP−RLBPを構築した(図2)。用いた宿主は大腸菌BL21株(アマシャム・バイオサイエンス)であった。
(2)組換えアポRLBPの大腸菌での発現
上記(1)で得られた発現プラスミドpiP−RLBPを有する細菌株の種培養をアンピシリン(50 μg/ml)を含む5 mlのルリア−ベルターニ培地で、30℃で16時間行い、500 mlの坂口フラスコ中の80 mlのLB培地に添加した。16時間、37℃の培養の後、細胞を5000g、5分間の遠心により回収し、20 mlの50 mM Tris-HCl (pH7.6)に懸濁し、氷中でブラブソン・モデル250 ソニファイヤーを用いた超音波破砕を行った。SDS-PAGE分析の結果、ヒスチジンを持たないアポRLBPの発現が確認された。しかしながら、発現されたアポRLBPは、菌体中に封入体として存在していた(図3A、レーン4)。
【0037】
実施例1
(OmpAおよびヒスチジンヘキサマーを有する組換えアポRLBPの大腸菌での発現)
(1)piP−His−RLBPの構築
参考例2で得られたpiP−His6−HEのアポイクオリンcDNAのHindIII-BamHI断片を、参考例3で得られたp92−RLBPのHindIII-BamHI断片と置換することによって、OmpAのシグナルペプチドおよびヒスチジンヘキサマーを有するアポRLBPの発現プラスミドpiP−His−RLBPを構築した(図2A)。用いた宿主は大腸菌BL21株(アマシャム・バイオサイエンス)であった。
(2)組換えアポRLBPの大腸菌での発現および精製
上記(1)で得られた発現プラスミドpiP−His−RLBPを有する細菌株の種培養をアンピシリン(50 μg/ml)を含む5 mlのルリア−ベルターニ培地で、30℃で16時間行い、500 mlの坂口フラスコの80 mlのLB培地に添加した。16時間、37℃の培養の後、細胞を5000g、5分間の遠心により回収し、20 mlの50 mM Tris-HCl (pH7.6)に懸濁し、氷中でブラブソン・モデル250 ソニファイヤーを用いた超音波破砕を行った。
SDS-PAGE分析の結果piP-His-RLBP発現ベクターを用いて可溶性タンパク質として発現されていることを確認した(図3A、レーン3)。次に、培養細胞の超音波破砕物を12000g、10分間遠心して得られた上清(20 ml)を50 mM Tris-HCl (pH7.6)で平衡化したニッケル−キレートカラム(1.5×4 cm)にアプライした。カラムを50 mlの50 mM Tris-HCl (pH7.6)で洗浄し、吸着したタンパク質を0.05 M、0.1 M、0.3 M、0.5 M、および1 Mのイミダゾールを含む50 mM Tris-HCl (pH7.6)を各20 mlのステップワイズにより溶出した。ヒスチジンタグのついたアポRLBPの画分を0.1-0.3 M濃度のイミダゾールで溶出し、SDS-PAGEで解析した。アポRLBP画分を合わせ、4 Lの50 mM重炭酸アンモニウム(pH8.3)に透析し、-80℃で保存した。精製アポRLBPの収量は80 mlの培養した細胞から18.2 mgであった。
熱処理および還元条件下でのSDS-PAGE分析により、精製アポRLBPは95%以上の純度で、分子量24 kDaを示した(図3B、レーン2)。この結果は、大腸菌細胞におけるアポRLBPの発現量が細菌細胞から抽出される全タンパク質の10%以上であることを示唆している。これは、本発明の製造方法が、大量の目的タンパク質を、可溶性タンパク質として製造できることを示している。
精製アポRLBPにおいて、OmpAシグナルペプチドが正確に切断されていること及びヒスチジンヘキサマーを有するアポRLBPを確認するために、MALDI-TOF-MSを用いて質量分析を行った。[M+H]+に対するm/z 21931.7および[M+2H]2+に対するm/z 10965.9の質量値が観察された。これらの値はOmpAシグナルペプチドをもたないヒスチジンヘキサマーを有するアポRLBPに対する計算平均質量21932.9によく一致していた。この結果は、ヒスチジンヘキサマーを有するアポRLBPのOmpAシグナルペプチドが、大腸菌細胞中で細胞質からペリプラズム部分への移行中に正しく切断されたことを示している。
【0038】
実施例2
(アポRLBPからのRLBPの調製)
実施例1で得られた精製アポRLBP(1 mg = 46 nmol)を10 mM EDTAおよび0.66 mM DTTを含む30 mM Tris-HCl (pH7.6) 5 mlに溶解し、アポRLBPからRLBPへの変換をセレンテラジン(20 μg = 47 nmol)を添加することにより開始した。16時間、4℃で静置した後、混合液を遠心フィルター(アミコン・ウルトラ、分子量カット:10000)を用いて、4℃で、0.5 mlまで濃縮し、黄緑色の溶液を得た。結合していないセレンテラジンを除去するために、この溶液を10 mM EDTAを含む30 mM Tris-HCl (pH7.6)で平衡化したセファデックスG-25カラム(1×6 cm)にかけ、同緩衝液で溶出した。画分(0.5 ml)を1分あたり0.5 mlの流速で回収し、280 nmと446 nmの吸収でモニターした。RLBPの主画分を0.5 mlから1.0 mlで溶出した。タンパク質の回収率は80%であった。得られた精製RLBPの、熱処理および還元条件下でのSDS-PAGE分析の結果を図3Bのレーン3に示す。精製RLBPの純度は、天然のRLBPの吸収スペクトルのデータ(J. Biol. Chem. 254, 769-780 (1979))と比較することにより、95%以上であると推測された。
この結果は、実施例1で得られたアポRLBPが、天然のRLBPと同様に、セレンテラジンと結合してホロタンパク質であるRLBPを形成することを示している。これにより、実施例1で得られた組換えアポRLBPが、本来の機能を有していることが確認された。
【0039】
実施例3
(組換えRLBPのスペクトル分析)
精製した組換えRLBPの吸収スペクトルを2 mM EDTAまたは10 mM CaCl2を含む20 mM Tris-HCl (pH7.6)中で、ジャスコ(東京)V-560 分光光度計(バンドパス 0.5 nm;応答 Quick;スキャン速度 100 nm/分)、25℃で、石英キュベット(10 mm光路)を用いて測定した。カルシウムイオンの存在下および非存在下での組換えRLBPの吸収スペクトルを図4に示す。組換えRLBPは、475 nmに肩のある、277 nmと446 nmに二つの特徴的な最大吸収を有し、これは天然のRLBPのスペクトルとほとんど一致している(J. Biol. Chem. 254, 769-780 (1979))。277 nmと446 nmにおける組換えRLBPの吸光係数(ε)はそれぞれ、24900(E0.1% = 1.13)および9300(E0.1% = 0.42)であった。組換えRLBPの277 nm/446 nmの吸収比は2.68であり、天然のRLBPの277 nm/446 nm比の2.7から2.8(J. Biol. Chem. 254, 769-780 (1979))に近い。10 mMのカルシウムイオン存在下で、組換えRLBPの277 nmと446 nmのピークは265 nmと434 nmにシフトし、天然のRLBPに類似した特性を示した(J. Biol. Chem. 254, 769-780 (1979))。10 mM EDTAを含む同一の緩衝液中のセレンテラジンの420 nm(ε= 9300)の吸収ピークは、10 mMのカルシウムイオン存在下で432 nm(ε= 10000)にシフトした。この吸収ピークは、10 mMのカルシウムイオン存在下での組換えRLBPの434 nmに近かった。
また、蛍光スペクトルをジャスコ FP-6500 W 蛍光分光光度計(発光および励起バンドパス 5 nm;応答 0.5秒;スキャン速度 100 nm/分)を用いて測定した。446 nmで励起したRLBPの蛍光スペクトルは、1/2のバンド幅 86 nmで、530 nmにおいて発光ピークを示し、発光ピークの強度はカルシウムイオンの添加により、4倍に増加した。
これらのスペクトル変化のデータは、組換えRLBPは天然のRLBPと同様な高次構造をとっていることを示し、正常に折り畳まれていることをも示唆している。
吸収スペクトルの変化がないことから判断すると、組換えRLBPの溶液は、4℃および-80℃で6ヶ月以上安定であった。このことは、一般にセレンテラジンの中性付近の水溶液を4℃で保存した場合、半減期は約3日であるが、組換えRLBPを使用することより安定に保存可能であることも示している。
【0040】
実施例4
(RLBPとRenillaルシフェラーゼによる発光反応)
50 mM Tris-HCl (pH7.6)、10 mM CaCl2および実施例3で得られた組換えRLBP5 μgを含む反応混合液(100 μl)に、Renillaルシフェラーゼ(0.08 μg)を添加し、発光活性を光電子倍増管(R4220P、浜松ホトニクス)を装備したルミノメーター(AB2200、アトー社製(東京))を用いて測定したところ、連続的な発光が観察された(図5)。これは、カルシウムイオンがRLBPに結合することよって、RLBP分子内に内包していたセレンテラジンが放出され、放出されたセレンテラジンがRenillaルシフェラーゼの基質となり触媒作用によって酸化されたた結果、発光したことを示している。この結果は、実施例2で得られたRLBP(実施例1で得られたアポRLBPとセレンテラジンが結合したもの)が、カルシウムイオンによってセレンテラジンを放出することを示している。これにより、実施例1で得られた組換えアポRLBPおよび実施例3で得られた組換えRLBPが、本来の機能を有していることが確認された。
【0041】
実施例5
(アポRLBPとセレンテラジン誘導体からのRLBPの調製)
実施例2で記載したアポRLBPとセレンテラジンによるRLBPの調製法と同様にして、セレンテラジン誘導体を用いて新規RLBPを調製した。セレンテラジン誘導体として、h-セレンレたジン、e-セレンテラジン、Bis-セレンテラジンを用いて、対応するRLBP、すなわちh−RLBP、e−RLBP、Bis−RLBPを得た。アポRLBP、セレンテラジンおよび上記のようにして得られたRLBPの、カルシウムイオン(Ca2+)非存在下および存在下における吸収スペクトルデータを表1に示した。吸収スペクトルは、2 mM EDTAまたは10 mM CaCl2を含む50 mM Tris-HCl (pH7.6)中で、実施例3と同様にして測定した。得られたRLBPを4℃および-80℃で6ヶ月以上保存しても、これらの吸収スペクトルには、ほとんど変化が認められなかった。この結果は、組換えRLBPの溶液は、4℃および-80℃で6ヶ月以上安定であることを示している。すなわち、セレンテラジンと同様に、セレンテラジン誘導体も溶液中では不安定であるが、アポRLBPを使用することより安定に保存可能であることが示された。
【表1】

【0042】
実施例6
(アミノ末端にヒスチジン配列を持つ分泌タンパク質を発現するための新規基本ベクター、piP−H6−M(11)、の構築)
目的タンパク質を可溶性タンパク質として発現させるための基本ベクター、piP−H6−M(11)、は以下の手順で構築した。出発となるベクターpiP−His6−HEは、参考例2に記載の方法に従って作製した。さらに、piP−His6−HEベクターのHindIII-BamHI サイトに、マルチクローニングサイト(NcoI/ HindIII/ NdeI/ SacI/ KpnI/ XhoI/ BamHI/ EcoRI/ SalI/ PstI/ XbaI)をもつリンカーを挿入し、piP−H6−M(11)を構築した。基本ベクターpiP−H6−M(11)は、大腸菌のリポプロテインのプロモーター、ラクトースのオペレーターに制御され、分泌のためのOmpA配列、6個のヒスチジンからなる配列、マルチクローニングサイト(EcoRI/ NcoI/ HindIII/ NdeI/ SacI/ KpnI/ XhoI/ BamHI/ EcoRI/SalI/ PstI/ XbaI/ BamHI)を有する(図6)。
【産業上の利用可能性】
【0043】
本発明の目的タンパク質の製造によれば、目的タンパク質を可溶性タンパク質として製造することができるので、目的タンパク質を変性(可溶化)させる必要がない。よって、本発明によれば、目的タンパク質を効率的に、高い回収率で得ることができる。したがって、本発明は有用タンパク質や、機能や構造の解析対象となるタンパク質などのタンパク質の製造方法として極めて有用である。
また、本発明の発現ベクターは、目的タンパク質をコードする遺伝子を制限酵素サイトに挿入して発現させることによって、目的タンパク質を可溶性タンパク質として製造することができるので、有用タンパク質など所望のタンパク質の製造に好適に用いることができる。
【図面の簡単な説明】
【0044】
【図1】図1は、参考例3で得られた合成アポRLBP遺伝子の塩基配列および制限酵素認識部位、並びにアポRLBPのアミノ酸配列を示す。(A)制限酵素地図を示す。斜線部分はEFハンドモチーフのループ領域を示す。(B)合成アポRLBP遺伝子の塩基配列を示す。四角で囲まれた部分はEFハンドモチーフのループ領域を示す。
【図2】図2は、実施例1で得られたOmpAのシグナルペプチドおよびヒスチジンヘキサマーを有するアポRLBPの発現ベクターpiP−His−RLBPおよび参考例4で得られたOmpAのシグナルペプチドを有するアポRLBPの発現ベクターpiP−RLBPを示す。(A)piP−His−RLBPの制限酵素地図を示す。(B)piP−His−RLBPおよびpiP−RLBPのアミノ末端のアミノ酸配列、およびシグナルペプチド配列の切断部位を示す。
【図3】図3は、実施例1で得られた組換えアポRLBP、実施例2で得られた組換えRLBPおよび参考例4で得られた組換えアポRLBPのSDS−PAGE分析の結果を示す。各レーンの試料は次の通りである。(A)レーン1:タンパク質分子量マーカー(テフコ社):β−ガラクトシダーゼ(116,000)、ホスホリパーゼB(97,400)、ウシ血清アルブミン(69,000)、グルタミン酸デヒドロゲナーゼ(55,000)、乳酸デヒドロゲナーゼ(36,500)、炭酸脱水素酵素(29,000)、トリプシンインヒビター(20,100);レーン2:実施例1における培養細胞piP−His−RLBP/BL21(40μl)の超音波破砕物を遠心して得られた沈殿;レーン3:実施例1における培養細胞piP−His−RLBP/BL21(40μl)の超音波破砕物を遠心して得られた上清;レーン4:参考例4における培養細胞piP−RLBP/BL21(40μl)の超音波破砕物を遠心して得られた沈殿;レーン5:参考例4における培養細胞piP−RLBP/BL21(40μl)の超音波破砕物を遠心して得られた上清。(B)レーン1:タンパク質分子量マーカー;レーン2:実施例1で得られたヒスチジンヘキサマーが結合した精製アポRLBP(2.2μg);レーン3:実施例2で得られたヒスチジンヘキサマーが結合した精製RLBP(3.5μg)。
【図4】図4は、実施例3におけるカルシウムイオンの非存在下および存在下での組換えRLBPの吸収スペクトルを示す。実線および破線は、それぞれカルシウムイオン非存在下および存在下の吸収スペクトルを示す。タンパク質濃度は0.45 mg/mlであった。
【図5】図5は、実施例4における、実施例3で得られた組換えRLBPとRenillaルシフェラーゼによる発光反応を示す。挿入図は、矢印で示した部分を拡大したものを示す。
【図6】図6は、実施例6で得られた発現ベクターpiP−H6−M(11)を示す。
【配列表フリーテキスト】
【0045】
[配列番号:1]アポRLBPのアミノ酸配列を示す。
[配列番号:2]アポRLBPをコードする合成DNAの塩基配列を示す。
[配列番号:3]参考例2および実施例6で用いられた6個のヒスチジンからなる配列をコードするオリゴヌクレオチドの塩基配列を示す。
[配列番号:4]参考例2および実施例6で用いられた6個のヒスチジンからなる配列をコードするオリゴヌクレオチドの塩基配列を示す。
[配列番号:5]参考例3で用いられたプライマーの塩基配列を示す。
[配列番号:6]参考例3で用いられたプライマーの塩基配列を示す。
【特許請求の範囲】
【請求項1】
分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法。
【請求項2】
タンパク質の発現が宿主細胞内で行われる請求項1記載の方法。
【請求項3】
宿主細胞がグラム陰性菌である請求項2記載の方法。
【請求項4】
グラム陰性菌が大腸菌属の細菌である請求項3記載の方法。
【請求項5】
分泌シグナルペプチドがグラム陰性菌由来の分泌シグナルペプチドである請求項1〜4のいずれかに記載の方法。
【請求項6】
グラム陰性菌由来の分泌シグナルペプチドが、通性嫌気性桿菌由来の分泌シグナルペプチドである請求項5記載の方法。
【請求項7】
グラム陰性菌由来の分泌シグナルペプチドが、大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)またはコレラ菌由来コレラトキシン由来の分泌シグナルペプチドである請求項5記載の方法。
【請求項8】
塩基性アミノ酸に富むポリペプチドが5〜12アミノ酸残基からなるポリペプチドである請求項1〜7のいずれかに記載の方法。
【請求項9】
塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸の含有率が60%以上である請求項1〜8のいずれかに記載の方法。
【請求項10】
塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸がヒスチジン、アルギニンおよびリジンから選択される請求項1〜9のいずれかに記載の方法。
【請求項11】
塩基性アミノ酸に富むポリペプチドがポリヒスチジンである請求項1〜9のいずれかに記載の方法。
【請求項12】
目的タンパク質の発現が、該目的タンパク質をコードするポリヌクレオチドを含有する発現ベクターを用いて行われる請求項1〜11のいずれかに記載の方法。
【請求項13】
グラム陰性菌の分泌シグナルペプチドをコードするポリヌクレオチドと、5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてグラム陰性菌内でタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法。
【請求項14】
OmpAをコードするポリヌクレオチドと、ポリヒスチジンをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いて大腸菌属の細菌内でタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法。
【請求項15】
目的タンパク質が異種タンパク質である請求項1〜14のいずれかに記載の方法。
【請求項16】
目的タンパク質が、アポRLBP、アポイクオリン、アポクライチィン、アポオベリンおよびアポマイトロコミンからなる群より選択されるいずれかである請求項1〜14のいずれかに記載の方法。
【請求項17】
目的タンパク質がアポRLBPである請求項16記載の方法。
【請求項18】
グラム陰性菌の分泌シグナルペプチドをコードするポリヌクレオチドと、5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードするポリヌクレオチドと、アポRLBPをコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてグラム陰性菌内でタンパク質を発現させることを特徴とするアポRLBPの製造方法。
【請求項19】
OmpAをコードするポリヌクレオチドと、ポリヒスチジンをコードするポリヌクレオチドと、アポRLBPをコードするポリヌクレオチドとを含有するポリヌクレオチドを用いて大腸菌内でタンパク質を発現させ、発現されたタンパク質をペリプラズムスペースに蓄積させることを特徴とするアポRLBPの製造方法。
【請求項20】
請求項17〜19のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とを接触させることを特徴とするRLBPの製造方法。
【請求項21】
請求項17〜19のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とを接触させてRLBPを調製することを特徴とする、セレンテラジンまたはその誘導体の保存方法。
【請求項22】
請求項17〜19のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とからなるRLBP。
【請求項23】
(a)分泌シグナルペプチドをコードする第1コード領域、
(b)塩基性アミノ酸に富むポリペプチドをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター。
【請求項24】
分泌シグナルペプチドがグラム陰性菌由来の分泌シグナルペプチドである請求項23記載の発現ベクター。
【請求項25】
グラム陰性菌由来の分泌シグナルペプチドが通性嫌気性桿菌由来の分泌シグナルペプチドである請求項24記載の発現ベクター。
【請求項26】
グラム陰性菌由来の分泌シグナルペプチドが、大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)またはコレラ菌由来コレラトキシン由来の分泌シグナルペプチドである請求項24記載の発現ベクター。
【請求項27】
塩基性アミノ酸に富むポリペプチドが5〜12アミノ酸残基からなるポリペプチドである請求項23〜26のいずれかに記載の発現ベクター。
【請求項28】
塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸の含有率が60%以上である請求項23〜27のいずれかに記載の発現ベクター。
【請求項29】
塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸がヒスチジン、アルギニンおよびリジンから選択される請求項23〜28のいずれかに記載の発現ベクター。
【請求項30】
塩基性アミノ酸に富むポリペプチドがポリヒスチジンである請求項23〜27のいずれかに記載の発現ベクター。
【請求項31】
(a)グラム陰性菌由来の分泌シグナルペプチドをコードする第1コード領域、
(b)5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター。
【請求項32】
(a)OmpAをコードする第1コード領域、
(b)ポリヒスチジンをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター。
【請求項1】
分泌シグナルペプチドをコードするポリヌクレオチドと、塩基性アミノ酸に富むポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを、この順に含有するポリヌクレオチドを用いてタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法。
【請求項2】
タンパク質の発現が宿主細胞内で行われる請求項1記載の方法。
【請求項3】
宿主細胞がグラム陰性菌である請求項2記載の方法。
【請求項4】
グラム陰性菌が大腸菌属の細菌である請求項3記載の方法。
【請求項5】
分泌シグナルペプチドがグラム陰性菌由来の分泌シグナルペプチドである請求項1〜4のいずれかに記載の方法。
【請求項6】
グラム陰性菌由来の分泌シグナルペプチドが、通性嫌気性桿菌由来の分泌シグナルペプチドである請求項5記載の方法。
【請求項7】
グラム陰性菌由来の分泌シグナルペプチドが、大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)またはコレラ菌由来コレラトキシン由来の分泌シグナルペプチドである請求項5記載の方法。
【請求項8】
塩基性アミノ酸に富むポリペプチドが5〜12アミノ酸残基からなるポリペプチドである請求項1〜7のいずれかに記載の方法。
【請求項9】
塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸の含有率が60%以上である請求項1〜8のいずれかに記載の方法。
【請求項10】
塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸がヒスチジン、アルギニンおよびリジンから選択される請求項1〜9のいずれかに記載の方法。
【請求項11】
塩基性アミノ酸に富むポリペプチドがポリヒスチジンである請求項1〜9のいずれかに記載の方法。
【請求項12】
目的タンパク質の発現が、該目的タンパク質をコードするポリヌクレオチドを含有する発現ベクターを用いて行われる請求項1〜11のいずれかに記載の方法。
【請求項13】
グラム陰性菌の分泌シグナルペプチドをコードするポリヌクレオチドと、5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてグラム陰性菌内でタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法。
【請求項14】
OmpAをコードするポリヌクレオチドと、ポリヒスチジンをコードするポリヌクレオチドと、目的タンパク質をコードするポリヌクレオチドとを含有するポリヌクレオチドを用いて大腸菌属の細菌内でタンパク質を発現させることを特徴とする前記目的タンパク質を可溶性タンパク質として製造する方法。
【請求項15】
目的タンパク質が異種タンパク質である請求項1〜14のいずれかに記載の方法。
【請求項16】
目的タンパク質が、アポRLBP、アポイクオリン、アポクライチィン、アポオベリンおよびアポマイトロコミンからなる群より選択されるいずれかである請求項1〜14のいずれかに記載の方法。
【請求項17】
目的タンパク質がアポRLBPである請求項16記載の方法。
【請求項18】
グラム陰性菌の分泌シグナルペプチドをコードするポリヌクレオチドと、5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードするポリヌクレオチドと、アポRLBPをコードするポリヌクレオチドとを含有するポリヌクレオチドを用いてグラム陰性菌内でタンパク質を発現させることを特徴とするアポRLBPの製造方法。
【請求項19】
OmpAをコードするポリヌクレオチドと、ポリヒスチジンをコードするポリヌクレオチドと、アポRLBPをコードするポリヌクレオチドとを含有するポリヌクレオチドを用いて大腸菌内でタンパク質を発現させ、発現されたタンパク質をペリプラズムスペースに蓄積させることを特徴とするアポRLBPの製造方法。
【請求項20】
請求項17〜19のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とを接触させることを特徴とするRLBPの製造方法。
【請求項21】
請求項17〜19のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とを接触させてRLBPを調製することを特徴とする、セレンテラジンまたはその誘導体の保存方法。
【請求項22】
請求項17〜19のいずれかに記載の製造方法によって製造されたアポRLBPとセレンテラジンまたはその誘導体とからなるRLBP。
【請求項23】
(a)分泌シグナルペプチドをコードする第1コード領域、
(b)塩基性アミノ酸に富むポリペプチドをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター。
【請求項24】
分泌シグナルペプチドがグラム陰性菌由来の分泌シグナルペプチドである請求項23記載の発現ベクター。
【請求項25】
グラム陰性菌由来の分泌シグナルペプチドが通性嫌気性桿菌由来の分泌シグナルペプチドである請求項24記載の発現ベクター。
【請求項26】
グラム陰性菌由来の分泌シグナルペプチドが、大腸菌の外膜タンパク質A由来の分泌シグナルペプチド(OmpA)またはコレラ菌由来コレラトキシン由来の分泌シグナルペプチドである請求項24記載の発現ベクター。
【請求項27】
塩基性アミノ酸に富むポリペプチドが5〜12アミノ酸残基からなるポリペプチドである請求項23〜26のいずれかに記載の発現ベクター。
【請求項28】
塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸の含有率が60%以上である請求項23〜27のいずれかに記載の発現ベクター。
【請求項29】
塩基性アミノ酸に富むポリペプチドにおける塩基性アミノ酸がヒスチジン、アルギニンおよびリジンから選択される請求項23〜28のいずれかに記載の発現ベクター。
【請求項30】
塩基性アミノ酸に富むポリペプチドがポリヒスチジンである請求項23〜27のいずれかに記載の発現ベクター。
【請求項31】
(a)グラム陰性菌由来の分泌シグナルペプチドをコードする第1コード領域、
(b)5ないし12個の塩基性アミノ酸残基からなるポリペプチドをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター。
【請求項32】
(a)OmpAをコードする第1コード領域、
(b)ポリヒスチジンをコードする第2コード領域、および
(c)目的タンパク質をコードする第3コード領域を挿入することができる少なくとも1つの制限酵素サイト
を含有することを特徴とする発現ベクター。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2007−325521(P2007−325521A)
【公開日】平成19年12月20日(2007.12.20)
【国際特許分類】
【出願番号】特願2006−158222(P2006−158222)
【出願日】平成18年6月7日(2006.6.7)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成17年度、独立行政法人 医薬基盤研究所基盤研究推進事業、産業活力再生特別措置法第30条の適用を受ける特許出願
【出願人】(000002071)チッソ株式会社 (658)
【Fターム(参考)】
【公開日】平成19年12月20日(2007.12.20)
【国際特許分類】
【出願日】平成18年6月7日(2006.6.7)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成17年度、独立行政法人 医薬基盤研究所基盤研究推進事業、産業活力再生特別措置法第30条の適用を受ける特許出願
【出願人】(000002071)チッソ株式会社 (658)
【Fターム(参考)】
[ Back to top ]

