タンパク質の固定化方法
【課題】タンパク質を任意の位置に固定化する。
【解決手段】一本鎖核酸を結合させた一種以上のタンパク質を混合し、核酸のハイブリダイゼーションを利用して、任意の位置にタンパク質を固定化する方法。
【解決手段】一本鎖核酸を結合させた一種以上のタンパク質を混合し、核酸のハイブリダイゼーションを利用して、任意の位置にタンパク質を固定化する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸のハイブリダイゼーションを利用し、任意の核酸配列を付加したタンパク質を任意の位置に固定化する技術に関する。また、該方法を用いて調製されたタンパク質複合体にも関する。
【背景技術】
【0002】
近年、プロテインチップを用いた発現解析や相互作用解析技術が注目を浴びるようになっている。しかし、タンパク質を固定化する技術は確立されたとはいい難い。一般的に行われるスポッティングは、時間が掛かり、また、タンパク質が乾燥し活性を失ってしまうなどの問題を抱えている。
【0003】
また、タンパク質をスポットした後のチップの保存方法も確立されているとはいえない。タンパク質は保存中に活性を失うことが多く、使用する直前に固定化することが好ましいといわれている。そこで、使用する直前に、迅速にタンパク質を任意の位置に固定化する方法が望まれていた。
【0004】
また近年、タンパク質の細胞内局在化(localization)研究が盛んになり、様々なタンパク質が細胞内で、三次元的に局在し、お互いに位置関係を保ちながら相互作用していることが明らかとなりつつある。また、多くのものが複合体として存在し、それらが一まとまりとして働いている分子も多数確認されてきている。例えば、MAPキナーゼカスケードに関与している分子において、MAPKKKとMAPKKなどは複合体として存在していることが明らかとなっている。更に、代謝系やエネルギー伝達系などにおいても、酵素同士がお互いに位置を保ちながら存在している場合が多い。
【0005】
それらの分子においては位置関係が大変重要であり、研究する場合、それを再構成する必要がある。しかし、単にタンパク質同士を混合しただけでは複合体を形成できない場合も多く、効果的にタンパク質分子を任意の距離を保って配位させる技術が求められている。
【発明の開示】
【発明が解決しようとする課題】
【0006】
上に述べたような理由から、タンパク質を任意の位置に固定化することが求められていた。すなわち、本発明の目的は、任意の位置に任意のタンパク質を固定化する技術を提供することである。また、本発明の目的は、1本鎖核酸を結合させたタンパク質の調製方法を提供することにある。
【課題を解決するための手段】
【0007】
前述の目的を達成するために、本発明者らは鋭意検討重ね、一本鎖核酸をタンパク質に結合させる方法を確立し、核酸のハイブリダイゼーションを利用したタンパク質の固定化方法によりタンパク質を固定化できることを見出し、本発明を完成させるに至った。
【0008】
即ち、本発明は以下の項目からなる。
【0009】
1. 一本鎖核酸を結合させた一種以上のタンパク質を混合し、核酸のハイブリダイゼーションを利用して、任意の位置にタンパク質を固定化する方法。
【0010】
2. 第1の一本鎖核酸に結合した一種以上のタンパク質と、第2の一本鎖核酸に結合した対象物を、一本鎖核酸同士のハイブリダイゼーションを利用して、該対象物に対し該タンパク質を特定の相互位置に固定化することを特徴とする項1に記載の方法。
【0011】
3. 前記対象物がタンパク質である項2に記載の方法。
【0012】
4. 前記対象物が担体である項2に記載の方法。
【0013】
5. 担体が、樹脂、ナイロン、ニトロセルロース、多糖、ガラスまたは金属から選択される材料の膜、ビーズ、ゲルまたは基板であり、該担体は必要に応じてガラス、セラミックス、金属、プラスチック等の支持体上にあることを特徴とする項4に記載の方法。
【0014】
6. ハイブリダイゼーションにより2以上の一本鎖核酸部分を生じさせるように設計された、異なる配列を有する複数の一本鎖核酸をハイブリダイズさせ、さらに、該一本鎖核酸部分に相補的な配列を有し且つタンパク質を結合した2以上の一本鎖核酸を混合しハイブリダイズさせることにより特定の相互位置に2以上のタンパク質を固定化することを特徴とする項1〜3のいずれかに記載の方法。
【0015】
7. ハイブリダイゼーションにより2以上の一本鎖核酸部分を生じさせるように設計された、異なる配列を有する複数の一本鎖核酸をハイブリダイズさせ、さらに、該一本鎖核酸部分の1つに相補的な配列を有する一本鎖核酸に結合させた担体と、他の一本鎖核酸部分に相補的な配列を有し且つタンパク質を結合した少なくとも1つの一本鎖核酸を混合しハイブリダイズさせることにより、担体に固定化され、かつ、該担体と少なくとも一種のタンパク質が特定の相互位置に固定化されることを特徴とする項1、2または4に記載の方法。
【0016】
8. 核酸がDNA、RNA、PNAのいずれかである項1〜7のいずれかに記載の方法。
【0017】
9. タンパク質が酵素、リセプター、リガンド、抗体、レクチン、アフィニティータンパク質のいずれかであることを特徴とする項1〜8のいずれかに記載の方法。
【0018】
10. タンパク質への核酸の結合が、共有結合であることを特徴とする項1〜9のいずれかに記載の方法。
【0019】
11. タンパク質への核酸の結合が、無細胞タンパク質合成を介する方法により形成されたものであることを特徴とする、項1〜10のいずれかに記載の方法。
【0020】
12. タンパク質への核酸の結合が、アフィニティー結合であることを特徴とする項1〜9のいずれかに記載の方法。
【0021】
13. アフィニティー結合が、アビジン−ビオチン反応、GST−グルタチオン、MBP(マルトース結合蛋白)−アミロース、キレート、もしくは抗体−抗原反応、のいずれかであることを特徴とする項12に記載の方法。
【0022】
14. 三以上の一本鎖部分を有する核酸複合体の二以上の一本鎖部分に一本鎖核酸のハイブリダイゼーションにより二以上のタンパク質を固定化し、1つの一本鎖部分を介して担体に固定化してなる、タンパク質複合体。
【0023】
15. 少なくとも1種のタンパク質が酵素である項14に記載の複合体。
【0024】
16. 項15に記載のタンパク質複合体に基質を添加し、酵素反応を行うことを特徴とする方法。
【0025】
17. 項14に記載のタンパク質複合体のタンパク質間の相互作用を測定することを特徴とする方法。
【発明の効果】
【0026】
本発明によれば、対象物(タンパク質または担体)等に固定された一本鎖核酸(または一本鎖核酸部分)とハイブリダイズし得る一本鎖核酸に任意のタンパク質を結合させることができ、ハイブリダイズし得る一本鎖核酸に結合したタンパク質の種類を変えることで、任意の組合せで、任意の位置にタンパク質を固定化することができる。
【発明を実施するための最良の形態】
【0027】
本発明は、一本鎖核酸を結合させた一種以上のタンパク質を、核酸のハイブリダイゼーションを利用して、任意の位置にタンパク質を固定化する方法であり、任意の位置に一種以上の一本鎖核酸配列を生じさせるように設計された複数の異なる配列を有する一本鎖核酸をハイブリダイズさせ、さらに、該核酸配列に相補的配列を有する一本鎖核酸を結合させた一種以上のタンパク質を混合しハイブリダイズさせることにより任意の位置にタンパク質を固定化する方法である。
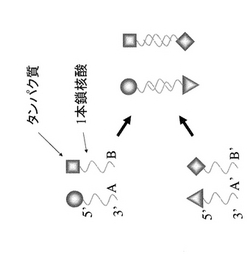
本明細書において「固定化」とは、図2,4のようにタンパク質と固相(担体)が特定の位置関係に固定化する場合だけでなく、図1,3のように2以上のタンパク質同士が特定の相互位置関係に維持(固定化)される場合も含まれる。
【0028】
具体的には、図1、2に示すように、1本鎖核酸Aとそれと相補的配列を有するA’がハイブリダイゼーションする性質を利用し、タンパク質同士を一定の位置に固定化する、もしくは、A’を固定化した固相(担体)の任意の位置に、任意のタンパク質を固定化する方法である。
【0029】
また具体的には、図3、4に示すように、任意の位置に一種以上の一本鎖核酸配列を生じさせるように設計された複数の異なる配列を有する一本鎖核酸をハイブリダイズさせた核酸複合体を用いて複数のタンパク質を一定の相互位置関係に固定化する、もしくは、更に固相の任意の位置に複数のタンパク質を同時に固定化する方法である。
【0030】
この用途に用いられる核酸は、DNA、RNA、PNAが好ましく用いられる。核酸の長さは特に規定されないが、ハイブリダイゼーションに必要な長さが必要であり、それぞれのハイブリダイぜーション部分それぞれについて好ましくは15塩基、更に好ましくは20塩基以上が好ましい。また、タンパク質間の距離を違えて実験を行う場合は、任意に設定することができる。
【0031】
タンパク質を固定化するための固相ないし担体としては、樹脂、ナイロン、ニトロセルロース、多糖、ガラスまたは金属から選択される材料の膜、ビーズ、ゲルまたは基板であり、該担体は必要に応じてガラス、セラミックス、金属、プラスチック等の支持体上にある。
【0032】
本発明の方法で用いられるタンパク質は、特に限定されないが、酵素、リセプター、リガンド、抗体、レクチン、アフィニティータンパク質などが好ましく用いられる。また、融合タンパク質なども好ましく用いられ、複数の蛍光タンパク質との融合タンパク質も用いることができる。例えば、蛍光共鳴エネルギー移動(FRET)を用いることも可能である。
【0033】
タンパク質への核酸の結合は、タンパク質表面の官能基を介した化学的結合法を用いることができる。好ましくは、アミノ基や、カルボキシル基、チオール基などを用い、核酸の末端に導入した官能基と反応させて結合させる。しかし、この方法を用いた場合、タンパク質の活性を損ねてしまう可能性が大きいため、あらかじめ実験をしておく必要がある。
【0034】
そこで、更に好ましくは無細胞タンパク質合成を介して核酸を固定化する方が好ましいといえる。
【0035】
種々の機能側鎖を持つ非天然アミノ酸を合成し、それらを天然のアミノ酸と同様に位置特異的に導入する非天然アミノ酸導入法は、タンパク質の機能をほとんど損なわずにさまざまな機能基を導入できるという点で優れているといえる。化学修飾法と比較しても、機能基を導入する位置を任意に決定することが可能であるため、タンパク質の本来の機能を損なう危険性を大幅に減じることができる。
【0036】
天然のタンパク質は、前述のように20種類のアミノ酸から構成されており、そのアミノ酸配列は、そのタンパク質をコードしている遺伝子によって規定されている。遺伝子はDNA上の連続した3つの塩基の組み合わせからなる遺伝暗号(コドン)によりアミノ酸を指定している。塩基は、アデニン(A)、チミン(T)、シトシン(C)、グアニン(G)の4種類があり、それらの組み合わせからなる3塩基コドンの総数は4x4x4=64種類であるが、その大半である61種類のコドンは天然の20種類のアミノ酸に割り当てられている。残りの3種類、TAG、TAA、TGAの3種のコドンは終止コドンとよばれ、20種類のどのアミノ酸にも対応せず、タンパク質のアミノ酸配列の終止を規定している。
【0037】
非天然アミノ酸をタンパク質へ位置特異的に導入するには、それらを指定する専用のコドンが必要となる。しかしながら前述の様に3つの塩基で構成可能な64種類のコドンは、すべて指定する情報が規定されている。
【0038】
Schultzら(Noren, C. J. et al. (1989) Science, 244, 182−188) やChambarlinら(Bain, J. D. et al. (1989) J. Am. Chem, Soc., 111, 8013−8014)は、終止コドンの一つであるTAGを非天然アミノ酸に割り当てることを報告している。タンパク質上の任意のコドンをTAGに置き換え、天然には存在しない、終止コドンTAGに対応するアンチコドンCUAを持つtRNAを合成し、非天然アミノ酸を担持させて非天然アミノ酸を位置特異的に導入する。
【0039】
また、非天然アミノ酸の位置を決めるもう一つの手法として、通常の3塩基コドンを拡張した4塩基コドンを用いるという方法がある(Hohsaka, T., et al. (1996) ibid., 118, 9778−9779)。この方法では、たとえばCGGGからなる4塩基コドンが、4塩基のアンチコドンをもつ人工的に合成したtRNAによって翻訳されると、非天然アミノ酸が導入された完全長のタンパクが合成される。一方、CGGの3塩基のみに対する3塩基アンチコドンをもつ天然のtRNAによって翻訳されると、その後のコドンの読み枠がシフトし、終止コドンに出会うことによってタンパク質の合成は途中で終止してしまうことになる。このように、4塩基コドンを用いる方法は、64種類存在する通常の3塩基コドンとは事実上独立に非天然アミノ酸を規定できる点が特徴であり、前述の終止コドンを用いる方法とくらべて多種類の非天然アミノ酸を同一のタンパク質分子にそれぞれ位置特異的に導入し、機能発現させることも可能である。実際に、一例としてストレプトアビジンの54位に電子受容基を持つ非天然アミノ酸ニトロフェニルアラニンを、84位に蛍光基を持つ非天然アミノ酸アンスラニルアミドアラニンを導入した変異タンパク質を合成した報告がある(Hohsaka, T., et al. (1999) ibid., 121, 12194−12195)。その合成された非天然二重変異タンパク質は予測通り蛍光消光を示した。また更に最近、5塩基コドンも非天然アミノ酸を指定できることが明らかになっている(Hohsaka, T., et al., submitted.)。
【0040】
非天然アミノ酸導入法は、任意の非天然アミノ酸を担持させたtRNAを細胞内で発現させることが困難なことから、通常は無細胞タンパク質合成系を用いて行われている。無細胞タンパク質合成系は、様々な利点を持つタンパク質合成法として近年注目を浴びるようになってきた技術である。この無細胞タンパク質合成法の利点は、これまで用いられてきたタンパク質合成の手段として組換え微生物や培養細胞などを用いる方法と比べ、1)生体に負に作用するようなタンパク質(翻訳系に影響を及ぼすものは除く)の合成が比較的容易である、2)簡便に条件を決定することができる(微生物などを用いる場合、最低一ヶ月程度を要するのが普通である)、3)非天然型アミノ酸を用いることができる、ことなどを挙げることができる。このようなことから今後、無細胞タンパク質合成は多種類のタンパク質を短時間で合成する必要がある場合や、組み換え生物による生産の困難なタンパク質の合成などの幅広い用途に使用されることが期待されている。現在、無細胞タンパク質合成系は、生体細胞からの抽出液を用いたものが主流であり、その中でも、大腸菌、コムギ胚芽、ウサギ網状赤血球に由来するものが特に広く用いられている。特に大腸菌に由来する系は、原料の供給が比較的容易であることもあり、他の二つの系と比較してもより一般的に用いられている。しかしながら、大腸菌は原核細胞であり、真核細胞由来のタンパク質、特にヒト由来のタンパク質を合成しようとした場合、合成システムがうまく適合せずに合成に失敗する例が数多く見られる。中でも、受容体、プロテインキナーゼ、プロテインフォスファターゼ、転写因子など、癌などの原因因子としても特に研究が盛んであるシグナル伝達系のタンパク質は、大腸菌由来の無細胞タンパク質合成系が最も不得手とするタンパク質であるが、逆にその機能解析に応用するため最も非天然アミノ酸を導入する需要が高いタンパク質でもある。このようなことから、これらのタンパク質の合成は、コムギ胚芽系もしくはウサギ網状赤血球を用いる系が好ましいといえる。
【0041】
本発明の方法において、無細胞タンパク質合成法を用いて核酸をタンパク質に導入する系としては特に限定されないが、1本鎖核酸を結合したアミノ酸を担持したtRNAを、直接無細胞タンパク質合成法を用いてタンパク質に導入することは困難であると考えられるため、図5に示すような方法を用いることが好ましいといえる。すなわち、図5に示されるように、例えばアンバーサプレッサーtRNAlys(以下tRNASup・lysと表示)にaminoacyl−tRNA synthaseを作用させリジンを導入した後に、側鎖のアミノ基を介して官能基(以下SAC(Specific Acceptor for Coupling)と表示)を導入しておく(SAC−Lys−tRNASup・lys)。無細胞タンパク質合成の鋳型としては、目的タンパク質をコードする遺伝子(cDNA clone)の任意の位置に前述のTAG配列(終止コドン)を導入したものを準備しておき(Nonsense-mutated mRNA)、SAC−Lys−tRNASup・lysを合成時に混合し、TAG配列部分でタンパク質に導入する(SAC Protein)。
【0042】
なお、アンバー変異はナンセンス変異のうちの一つで、あるアミノ酸のコドンが変異し、終結コドンの一つのアンバーコドン(UAG)となる。UAGの分でタンパク質は終結するようになり、タンパク質は未成熟のままとなる。アンバーサプレッサーはナンセンスサプレッサーの一つで、アンバーコドン(UAG)をあるアミノ酸に対応するコドンとして読み取ることにより、中断、終了されるはずのタンパク質合成を回復することを可能とする。例えば、リジンのアンチコドン配列(AAG)が変異してUAGになった場合、サプレッサーtRNA(Lys)が認識し、アンバー終止コドンがLysとして読み取られることになる。本発明の一つの実施形態では、このサプレッサーtRNAにアミノ酸をチャージさせ、それをさらに修飾したものを使用する。
【0043】
また、一方において、核酸を準備する必要がある。一例として、5’末端アミノ化合成オリゴDNA(図5の”NH2-5’-oligo”)に、SACとカップリング可能な官能基(以下SDC(Specific Donor for Coupling)と表示)を有する、例えばSDC−NHSを反応させ、SDC−オリゴDNA(SDC-oligo)を合成する。
【0044】
次に、このようにして得られたSACを導入したタンパク質と、SDCオリゴDNAをカップリングさせ、DNA側鎖を有するタンパク質を合成する([SAC-SDC-oligo]-Protein)。SACとしては特に限定されないが、SHA(Salicylhydroxamic acid)やVersalinxTM SA(OMe)−Y−NHS(PROLINX社製)などを挙げることができる。最も好ましくは、アミノ末端を有する化合物と反応するように至適化された試薬がPROLINX社(www.prolinx.com)より販売されており、それが好適に用いられる。詳細は実施例にて示す。
【0045】
一方、SDCとしては特に限定されないが、PBA(Phenyl boronic acid)などが好ましく用いられる。特に、PROLINX社より販売されているPFP−(PBA)nが好適に使用される。
【0046】
次に、SAC結合タンパク質とSDC結合核酸は、適切な条件でカップリングさせる。例えば、SHA(Salicylhydroxamic acid)やVersalinxTM SA(OMe)−Y−NHSを結合させたタンパク質と、PBA(Phenyl boronic acid)を結合させた核酸は混合し、数十分間放置することにより、安定な複合体を形成させることができる。また、この反応は適当な条件を用いることで、再度解離させることもでき、大変便利である。
【0047】
このようにして合成した、タンパク質−核酸複合体は、そのままでも十分使用可能であるが、適当な緩衝液に置換して用いるのがより好ましい。
【0048】
また、本発明はタンパク質への核酸の結合が、アフィニティー結合であることを特徴とするタンパク質固定化方法である。具体的には、ストレプトアビジン−ビオチン、マルトース結合タンパク質−アミロース、グルタチオントランスフェラーゼ−グルタチオン、抗体−抗原などの組み合わせで用いるのが好ましい。特にストレプトアビジン−ビオチンの組み合わせは、ビオチン化した核酸、およびストレプトアビジン融合タンパク質は一般の研究室でも比較的入手しやすく、好ましいといえる。その原理を図6に示した。
【0049】
ビオチン化オリゴ核酸は、合成機を用いて合成する。5’末端にビオチンを付加するのが一般的であるが、3’末端でも良い。一方、タンパク質はストレプトアビジンとの融合タンパク質として発現する。ストレプトアビジンは目的タンパク質の性質に従って、その活性を損なわない末端に付加するのが好ましい。また、場合によっては、適当なリンカー配列を挿入することもできる。
本方法による、核酸と目的タンパク質の結合は、混合するだけで良い。ただ、適切な方法で、未反応の核酸を除去する方が好ましい。
【0050】
本発明の産業への応用としては、プロテインチップ、プロテインアレイ、バイオリアクター、タンパク質複合体形成等が考えられる。
【0051】
本発明方法を用いることにより、プロテインチップをまず安定なDNA固相化プレートとして準備しておき、必要な時にタンパク質をスポッティングなしにチップ化(アレイ化)することが可能となる。周知のごとくタンパク質は不安定であり、用事調製することが好ましく、本方法を用いることにより、より安定した結果を導くことが可能となる。
【0052】
また、本方法によりタンパク質の任意の距離に結合させることにより、同一代謝系にあるような酵素システムをより効率的に働かせることができるようになると考えられる。これはバイオリアクター等の産業利用が可能であり、また、学術的知見もあたえてくれるものと思われる。
【0053】
本発明の一態様としては、SAC導入用無細胞タンパク質合成システム、オリゴDNA修飾試薬、反応用バッファーをセットにしたタンパク質−DNA複合体調製試薬(キット)を挙げることができる。
【0054】
また更なる本発明の一態様としては、タンパク質と結合させたDNAと相補するように設計されたDNAを固相化した結合用固相(ナイロン膜、ガラス板、プラスチック板、プレート)などを考えることができる。
【実施例】
【0055】
本願発明の詳細を実施例で説明する。本願発明はこれら実施例によって何ら限定されるものではない。
実施例1 無細胞タンパク質発現用遺伝子の調製
本発明を実証するために、2種類の遺伝子(大腸菌DHFR(Dihydrofolate Reductase)のC末端に6XHISタグ配列もしくはMycタグ配列を付加したもの)をコムギ無細胞タンパク質合成キット(PROTEIOS Wheat germ cell−free protein synthesis kit(東洋紡製))の専用ベクターpEU3−NIIのEcoRV−BamHIサイトへクローニングする。クローニングは、大腸菌由来DNAを配列1、2もしくは配列3、4に記載のプライマーを用い、PCR増幅にて得られたDNA断片を用いて行う。具体的には、大腸菌ゲノムDNA100ngをKOD -Plus−(東洋紡製)を用いて、プロトコール通りの組成にて、30サイクルの増幅を行う。続いて、DNA断片の精製をMagExtractor -PCR&Gel Clean up−キット(東洋紡製)を用いて行う。続いて、精製断片をEcoRVとBamHIにて消化したpEU3−NIIベクターへLigation high(東洋紡製)を用いて連結し、大腸菌を形質転換する。次に、インサートの導入が確認されたクローンから一般的な方法を用いてプラスミドを抽出し、配列を確認し、目的クローン(pEU−DHFR/His−tag、pEU−DHFR/Myc−tag)を得る。
実施例2 遺伝子への変異導入
次に、実施例1で得られたpEU−DHFR/6XHIS、pEU−DHFR/Myc遺伝子配列のDHFRタンパク質76Lysの位置にTAG配列を導入する。具体的には、配列番号5、6のDNAを用いて、Quickchange site directed mutagenesis kit(Stratagene社製)にて変異導入を行う。具体的には、キットの取扱い説明書に従って行う。すなわち、精製したプラスミド100ngを用い、熱サイクルを25サイクル行った後に、制限酵素DpnIで処理し、処理液を用いて大腸菌を形質転換する。得られたクローンはプラスミを精製した後に、シーケンス確認を行い、変異導入の有無を確認し使用する。この変異で得られるDHFR遺伝子は、226−228のAAG配列がTAGに置換されたものである。以下、pEU−DHFR76TAG/His−tag、pEU−DHFR76TAG/Myc−tagとする。
実施例3 Lysyl tRNASup・lysのアミノアシル化
まず、大腸菌アンバーサプレッサーtRNAlys(tRNASup・lys)(シグマ製)を、リジンを基質としてアミノアシル化する。具体的には、100μlの反応液(20mM imidazole−HCl(pH7.5)、10mM MgCl2、1mM Lysine、2mM ATP、150mM NaCl)中に約1500pmoleのtRNAを溶解し、過剰量のaminoacyl tRNA−synthase (シグマ製)を添加し、37℃にて45分間反応させる。反応後、フェノール/クロロホルム処理を行った後、0.1容量の3M 酢酸ナトリウムと2.5容量のエタノールを添加し、15,000で10分間遠心し、沈殿を回収する。沈殿は、70%エタノールで洗浄し、適量の滅菌水で溶解する。
実施例4 Lysyl tRNASup・lysのSA(OMe)−Y化
1nmolのアミノアシル化tRNASupを炭酸ナトリウムバッファー(pH8.0)に10nmol/mlとなるように溶解する。一方で、50mMとなるようにSA(OMe)−Y−NHS(PROLINX社製)をDMFに溶解する。オリゴDNA溶液90μlとSA(OMe)−Y−NHS溶液10μlを混合し、氷上で約1時間反応させる。その後、ゲル濾過カラム(NAP25 column;ファルマシア社製)にて精製する。精製し、減圧乾燥する。使用時に適量の滅菌蒸留水に溶解して使用する。
実施例5 オリゴDNAのSA(OMe)−PBA化
5’アミノ化オリゴDNA(配列番号7、8)を90μlの0.1M NaHCO3(pH8.0)に10nmol/mlとなるように溶解する。配列番号9のオリゴDNAを以下A、配列番号10のオリゴDNAをBとする。その後、PFP−(PBA)n(PROLINX社製) 1mgを130μlのDMFに溶解し、アミノアシル化tRNASupに20μl添加し、室温で約3.5時間反応させる。DMFを減圧により蒸発させた後、1mlの滅菌蒸留水で溶解し、ゲル濾過カラム(NAP25 column;ファルマシア社製)にて精製し、減圧乾燥する。使用時に適量の滅菌蒸留水に溶解して使用する。
実施例6 無細胞タンパク質合成
無細胞タンパク質合成は、PROTEIOS cell−free protein synthesis kit (東洋紡績社製)を用いて行う。この方法は、ベクターをT7 RNAポリメラーゼにて転写し、精製したものを用いるが、その方法も取扱い説明書に従って実施する。合成し、精製したmRNAはぞれぞれmRNA−DHFR/His−tag、mRNA−DHFR/Myc−tagとする。無細胞タンパク質合成反応も、基本的には、取扱い説明書記載のバッチ法プロトコールに従って行い、それぞれのmRNAと実施例6で合成したLysyl tRNASup・lysのSA(OMe)−Y化を20μl反応に約1μgとなるよう添加し、約1時間、26℃にて反応を実施する。
【0056】
反応後、用事調製した2M NH2OH, 2mM EDTA, 2mM NaHCO3 (pH10)を20μl添加し、4℃にて4時間静置する。この処理により、活性なヒドロキサム酸基が露出される。
実施例7 カップリング反応(核酸−タンパク質カップリング反応)
実施例5および6で調製したサンプルを、それぞれ等量混合する。室温で約1時間複合体形成させた後、NAP−10カラムにてゲル濾過し、減圧乾燥後、適量の滅菌蒸留水にて溶解し、−80℃に保存する。
【0057】
反応は、His−tagタンパク質とオリゴヌクレオチドA、Myc−tagタンパク質とオリゴヌクレオチドBの組み合わせで行った。以降、タンパク質DNA複合体A、タンパク質DNA複合体Bと呼ぶ。
実施例8 ハイブリダイゼーション、検出
ストレプトアビジンコートされた96穴プレートに5’ビオチン化された配列番号9、10のオリゴDNA(10pmol/μl:滅菌蒸留水)100μlを次の組み合わせで添加する(配列番号11は配列番号9と相補的:以下A’、配列番号12は配列番号10と相補的:以下B’とする)。すなわち、ウェル1、2、3にA’、ウェル4、5、6にB’、ウェル7、8、9にA’+B’を添加し、室温で1時間反応させ、300μlの0.03%Tween20/PBS(−)にて各ウェルを3回づつ洗浄する。この時、同じプレートを2枚作成しておく(プレートI、II)。反応させた後2枚のプレートそれぞれについて、ウェル1、4、7にタンパク質DNA複合体A、ウェル2、5、8にタンパク質DNA複合体B、ウェル3、6、9にタンパク質DNA複合体AとBの等量混合物をそれぞれ20μlづつ添加する。1時間後、各ウェルを3回づつ洗浄した後、プレートIに約1/1000倍希釈した抗ヒスタグ抗体をプレート2に約1/1000倍希釈した抗Myc抗体それぞれ50μlを1時間反応させ、各ウェルを3回づつ洗浄する。その後、各ウェルに1/500倍希釈した、ペルオキシダーゼラベル抗IgG抗体50μlを添加し、37℃、1時間反応させ、各ウェルを3回づつ洗浄し、TMBZ(同仁社製)溶液を50μl添加し、37℃にて発色させ、等量の1N 硫酸を加えることにより反応を停止させる(抗体は、全てsantacruz社製を使用した)。その後、450nmにて吸光度を測定する。その結果を、図7に示す。図に示すように、A配列はHis−tag特異的な検出パターンが、配列BにはMyc−tag特異的な検出パターンを得ることができる。
【図面の簡単な説明】
【0058】
【図1】タンパク質を一本鎖核酸のハイブリダイゼーションにより固定する1つの実施形態を模式的に示す。
【図2】タンパク質を一本鎖核酸のハイブリダイゼーションにより担体(固相)に固定化する1つの実施形態を模式的に示す。
【図3】非相補的部分(一本鎖核酸部分に相当する)を有する複数のポリヌクレオチドをハイブリダイズさせて、複数の一本鎖核酸部分を形成させ、次に該部分にタンパク質をハイブリダイゼーションにより固定する方法を模式的に示す。
【図4】複数のタンパク質を担体(固相)に固定化する1つの実施形態を模式的に示す。
【図5】アンバーサプレッサー変異に従い、無細胞タンパク質合成法を用いて核酸をタンパク質に導入する系を例示する。
【図6】タンパク質と核酸をストレプトアビジン−ビオチン系を使用して連結する方法を模式的に示す。
【図7】一本鎖核酸に結合されたHis−tag、Myc−tagが、基板上に結合されたオリゴDNA(A‘,B’,A‘+B’)に結合され、対応する抗体で認識可能であることを示す)。
【技術分野】
【0001】
本発明は、核酸のハイブリダイゼーションを利用し、任意の核酸配列を付加したタンパク質を任意の位置に固定化する技術に関する。また、該方法を用いて調製されたタンパク質複合体にも関する。
【背景技術】
【0002】
近年、プロテインチップを用いた発現解析や相互作用解析技術が注目を浴びるようになっている。しかし、タンパク質を固定化する技術は確立されたとはいい難い。一般的に行われるスポッティングは、時間が掛かり、また、タンパク質が乾燥し活性を失ってしまうなどの問題を抱えている。
【0003】
また、タンパク質をスポットした後のチップの保存方法も確立されているとはいえない。タンパク質は保存中に活性を失うことが多く、使用する直前に固定化することが好ましいといわれている。そこで、使用する直前に、迅速にタンパク質を任意の位置に固定化する方法が望まれていた。
【0004】
また近年、タンパク質の細胞内局在化(localization)研究が盛んになり、様々なタンパク質が細胞内で、三次元的に局在し、お互いに位置関係を保ちながら相互作用していることが明らかとなりつつある。また、多くのものが複合体として存在し、それらが一まとまりとして働いている分子も多数確認されてきている。例えば、MAPキナーゼカスケードに関与している分子において、MAPKKKとMAPKKなどは複合体として存在していることが明らかとなっている。更に、代謝系やエネルギー伝達系などにおいても、酵素同士がお互いに位置を保ちながら存在している場合が多い。
【0005】
それらの分子においては位置関係が大変重要であり、研究する場合、それを再構成する必要がある。しかし、単にタンパク質同士を混合しただけでは複合体を形成できない場合も多く、効果的にタンパク質分子を任意の距離を保って配位させる技術が求められている。
【発明の開示】
【発明が解決しようとする課題】
【0006】
上に述べたような理由から、タンパク質を任意の位置に固定化することが求められていた。すなわち、本発明の目的は、任意の位置に任意のタンパク質を固定化する技術を提供することである。また、本発明の目的は、1本鎖核酸を結合させたタンパク質の調製方法を提供することにある。
【課題を解決するための手段】
【0007】
前述の目的を達成するために、本発明者らは鋭意検討重ね、一本鎖核酸をタンパク質に結合させる方法を確立し、核酸のハイブリダイゼーションを利用したタンパク質の固定化方法によりタンパク質を固定化できることを見出し、本発明を完成させるに至った。
【0008】
即ち、本発明は以下の項目からなる。
【0009】
1. 一本鎖核酸を結合させた一種以上のタンパク質を混合し、核酸のハイブリダイゼーションを利用して、任意の位置にタンパク質を固定化する方法。
【0010】
2. 第1の一本鎖核酸に結合した一種以上のタンパク質と、第2の一本鎖核酸に結合した対象物を、一本鎖核酸同士のハイブリダイゼーションを利用して、該対象物に対し該タンパク質を特定の相互位置に固定化することを特徴とする項1に記載の方法。
【0011】
3. 前記対象物がタンパク質である項2に記載の方法。
【0012】
4. 前記対象物が担体である項2に記載の方法。
【0013】
5. 担体が、樹脂、ナイロン、ニトロセルロース、多糖、ガラスまたは金属から選択される材料の膜、ビーズ、ゲルまたは基板であり、該担体は必要に応じてガラス、セラミックス、金属、プラスチック等の支持体上にあることを特徴とする項4に記載の方法。
【0014】
6. ハイブリダイゼーションにより2以上の一本鎖核酸部分を生じさせるように設計された、異なる配列を有する複数の一本鎖核酸をハイブリダイズさせ、さらに、該一本鎖核酸部分に相補的な配列を有し且つタンパク質を結合した2以上の一本鎖核酸を混合しハイブリダイズさせることにより特定の相互位置に2以上のタンパク質を固定化することを特徴とする項1〜3のいずれかに記載の方法。
【0015】
7. ハイブリダイゼーションにより2以上の一本鎖核酸部分を生じさせるように設計された、異なる配列を有する複数の一本鎖核酸をハイブリダイズさせ、さらに、該一本鎖核酸部分の1つに相補的な配列を有する一本鎖核酸に結合させた担体と、他の一本鎖核酸部分に相補的な配列を有し且つタンパク質を結合した少なくとも1つの一本鎖核酸を混合しハイブリダイズさせることにより、担体に固定化され、かつ、該担体と少なくとも一種のタンパク質が特定の相互位置に固定化されることを特徴とする項1、2または4に記載の方法。
【0016】
8. 核酸がDNA、RNA、PNAのいずれかである項1〜7のいずれかに記載の方法。
【0017】
9. タンパク質が酵素、リセプター、リガンド、抗体、レクチン、アフィニティータンパク質のいずれかであることを特徴とする項1〜8のいずれかに記載の方法。
【0018】
10. タンパク質への核酸の結合が、共有結合であることを特徴とする項1〜9のいずれかに記載の方法。
【0019】
11. タンパク質への核酸の結合が、無細胞タンパク質合成を介する方法により形成されたものであることを特徴とする、項1〜10のいずれかに記載の方法。
【0020】
12. タンパク質への核酸の結合が、アフィニティー結合であることを特徴とする項1〜9のいずれかに記載の方法。
【0021】
13. アフィニティー結合が、アビジン−ビオチン反応、GST−グルタチオン、MBP(マルトース結合蛋白)−アミロース、キレート、もしくは抗体−抗原反応、のいずれかであることを特徴とする項12に記載の方法。
【0022】
14. 三以上の一本鎖部分を有する核酸複合体の二以上の一本鎖部分に一本鎖核酸のハイブリダイゼーションにより二以上のタンパク質を固定化し、1つの一本鎖部分を介して担体に固定化してなる、タンパク質複合体。
【0023】
15. 少なくとも1種のタンパク質が酵素である項14に記載の複合体。
【0024】
16. 項15に記載のタンパク質複合体に基質を添加し、酵素反応を行うことを特徴とする方法。
【0025】
17. 項14に記載のタンパク質複合体のタンパク質間の相互作用を測定することを特徴とする方法。
【発明の効果】
【0026】
本発明によれば、対象物(タンパク質または担体)等に固定された一本鎖核酸(または一本鎖核酸部分)とハイブリダイズし得る一本鎖核酸に任意のタンパク質を結合させることができ、ハイブリダイズし得る一本鎖核酸に結合したタンパク質の種類を変えることで、任意の組合せで、任意の位置にタンパク質を固定化することができる。
【発明を実施するための最良の形態】
【0027】
本発明は、一本鎖核酸を結合させた一種以上のタンパク質を、核酸のハイブリダイゼーションを利用して、任意の位置にタンパク質を固定化する方法であり、任意の位置に一種以上の一本鎖核酸配列を生じさせるように設計された複数の異なる配列を有する一本鎖核酸をハイブリダイズさせ、さらに、該核酸配列に相補的配列を有する一本鎖核酸を結合させた一種以上のタンパク質を混合しハイブリダイズさせることにより任意の位置にタンパク質を固定化する方法である。
本明細書において「固定化」とは、図2,4のようにタンパク質と固相(担体)が特定の位置関係に固定化する場合だけでなく、図1,3のように2以上のタンパク質同士が特定の相互位置関係に維持(固定化)される場合も含まれる。
【0028】
具体的には、図1、2に示すように、1本鎖核酸Aとそれと相補的配列を有するA’がハイブリダイゼーションする性質を利用し、タンパク質同士を一定の位置に固定化する、もしくは、A’を固定化した固相(担体)の任意の位置に、任意のタンパク質を固定化する方法である。
【0029】
また具体的には、図3、4に示すように、任意の位置に一種以上の一本鎖核酸配列を生じさせるように設計された複数の異なる配列を有する一本鎖核酸をハイブリダイズさせた核酸複合体を用いて複数のタンパク質を一定の相互位置関係に固定化する、もしくは、更に固相の任意の位置に複数のタンパク質を同時に固定化する方法である。
【0030】
この用途に用いられる核酸は、DNA、RNA、PNAが好ましく用いられる。核酸の長さは特に規定されないが、ハイブリダイゼーションに必要な長さが必要であり、それぞれのハイブリダイぜーション部分それぞれについて好ましくは15塩基、更に好ましくは20塩基以上が好ましい。また、タンパク質間の距離を違えて実験を行う場合は、任意に設定することができる。
【0031】
タンパク質を固定化するための固相ないし担体としては、樹脂、ナイロン、ニトロセルロース、多糖、ガラスまたは金属から選択される材料の膜、ビーズ、ゲルまたは基板であり、該担体は必要に応じてガラス、セラミックス、金属、プラスチック等の支持体上にある。
【0032】
本発明の方法で用いられるタンパク質は、特に限定されないが、酵素、リセプター、リガンド、抗体、レクチン、アフィニティータンパク質などが好ましく用いられる。また、融合タンパク質なども好ましく用いられ、複数の蛍光タンパク質との融合タンパク質も用いることができる。例えば、蛍光共鳴エネルギー移動(FRET)を用いることも可能である。
【0033】
タンパク質への核酸の結合は、タンパク質表面の官能基を介した化学的結合法を用いることができる。好ましくは、アミノ基や、カルボキシル基、チオール基などを用い、核酸の末端に導入した官能基と反応させて結合させる。しかし、この方法を用いた場合、タンパク質の活性を損ねてしまう可能性が大きいため、あらかじめ実験をしておく必要がある。
【0034】
そこで、更に好ましくは無細胞タンパク質合成を介して核酸を固定化する方が好ましいといえる。
【0035】
種々の機能側鎖を持つ非天然アミノ酸を合成し、それらを天然のアミノ酸と同様に位置特異的に導入する非天然アミノ酸導入法は、タンパク質の機能をほとんど損なわずにさまざまな機能基を導入できるという点で優れているといえる。化学修飾法と比較しても、機能基を導入する位置を任意に決定することが可能であるため、タンパク質の本来の機能を損なう危険性を大幅に減じることができる。
【0036】
天然のタンパク質は、前述のように20種類のアミノ酸から構成されており、そのアミノ酸配列は、そのタンパク質をコードしている遺伝子によって規定されている。遺伝子はDNA上の連続した3つの塩基の組み合わせからなる遺伝暗号(コドン)によりアミノ酸を指定している。塩基は、アデニン(A)、チミン(T)、シトシン(C)、グアニン(G)の4種類があり、それらの組み合わせからなる3塩基コドンの総数は4x4x4=64種類であるが、その大半である61種類のコドンは天然の20種類のアミノ酸に割り当てられている。残りの3種類、TAG、TAA、TGAの3種のコドンは終止コドンとよばれ、20種類のどのアミノ酸にも対応せず、タンパク質のアミノ酸配列の終止を規定している。
【0037】
非天然アミノ酸をタンパク質へ位置特異的に導入するには、それらを指定する専用のコドンが必要となる。しかしながら前述の様に3つの塩基で構成可能な64種類のコドンは、すべて指定する情報が規定されている。
【0038】
Schultzら(Noren, C. J. et al. (1989) Science, 244, 182−188) やChambarlinら(Bain, J. D. et al. (1989) J. Am. Chem, Soc., 111, 8013−8014)は、終止コドンの一つであるTAGを非天然アミノ酸に割り当てることを報告している。タンパク質上の任意のコドンをTAGに置き換え、天然には存在しない、終止コドンTAGに対応するアンチコドンCUAを持つtRNAを合成し、非天然アミノ酸を担持させて非天然アミノ酸を位置特異的に導入する。
【0039】
また、非天然アミノ酸の位置を決めるもう一つの手法として、通常の3塩基コドンを拡張した4塩基コドンを用いるという方法がある(Hohsaka, T., et al. (1996) ibid., 118, 9778−9779)。この方法では、たとえばCGGGからなる4塩基コドンが、4塩基のアンチコドンをもつ人工的に合成したtRNAによって翻訳されると、非天然アミノ酸が導入された完全長のタンパクが合成される。一方、CGGの3塩基のみに対する3塩基アンチコドンをもつ天然のtRNAによって翻訳されると、その後のコドンの読み枠がシフトし、終止コドンに出会うことによってタンパク質の合成は途中で終止してしまうことになる。このように、4塩基コドンを用いる方法は、64種類存在する通常の3塩基コドンとは事実上独立に非天然アミノ酸を規定できる点が特徴であり、前述の終止コドンを用いる方法とくらべて多種類の非天然アミノ酸を同一のタンパク質分子にそれぞれ位置特異的に導入し、機能発現させることも可能である。実際に、一例としてストレプトアビジンの54位に電子受容基を持つ非天然アミノ酸ニトロフェニルアラニンを、84位に蛍光基を持つ非天然アミノ酸アンスラニルアミドアラニンを導入した変異タンパク質を合成した報告がある(Hohsaka, T., et al. (1999) ibid., 121, 12194−12195)。その合成された非天然二重変異タンパク質は予測通り蛍光消光を示した。また更に最近、5塩基コドンも非天然アミノ酸を指定できることが明らかになっている(Hohsaka, T., et al., submitted.)。
【0040】
非天然アミノ酸導入法は、任意の非天然アミノ酸を担持させたtRNAを細胞内で発現させることが困難なことから、通常は無細胞タンパク質合成系を用いて行われている。無細胞タンパク質合成系は、様々な利点を持つタンパク質合成法として近年注目を浴びるようになってきた技術である。この無細胞タンパク質合成法の利点は、これまで用いられてきたタンパク質合成の手段として組換え微生物や培養細胞などを用いる方法と比べ、1)生体に負に作用するようなタンパク質(翻訳系に影響を及ぼすものは除く)の合成が比較的容易である、2)簡便に条件を決定することができる(微生物などを用いる場合、最低一ヶ月程度を要するのが普通である)、3)非天然型アミノ酸を用いることができる、ことなどを挙げることができる。このようなことから今後、無細胞タンパク質合成は多種類のタンパク質を短時間で合成する必要がある場合や、組み換え生物による生産の困難なタンパク質の合成などの幅広い用途に使用されることが期待されている。現在、無細胞タンパク質合成系は、生体細胞からの抽出液を用いたものが主流であり、その中でも、大腸菌、コムギ胚芽、ウサギ網状赤血球に由来するものが特に広く用いられている。特に大腸菌に由来する系は、原料の供給が比較的容易であることもあり、他の二つの系と比較してもより一般的に用いられている。しかしながら、大腸菌は原核細胞であり、真核細胞由来のタンパク質、特にヒト由来のタンパク質を合成しようとした場合、合成システムがうまく適合せずに合成に失敗する例が数多く見られる。中でも、受容体、プロテインキナーゼ、プロテインフォスファターゼ、転写因子など、癌などの原因因子としても特に研究が盛んであるシグナル伝達系のタンパク質は、大腸菌由来の無細胞タンパク質合成系が最も不得手とするタンパク質であるが、逆にその機能解析に応用するため最も非天然アミノ酸を導入する需要が高いタンパク質でもある。このようなことから、これらのタンパク質の合成は、コムギ胚芽系もしくはウサギ網状赤血球を用いる系が好ましいといえる。
【0041】
本発明の方法において、無細胞タンパク質合成法を用いて核酸をタンパク質に導入する系としては特に限定されないが、1本鎖核酸を結合したアミノ酸を担持したtRNAを、直接無細胞タンパク質合成法を用いてタンパク質に導入することは困難であると考えられるため、図5に示すような方法を用いることが好ましいといえる。すなわち、図5に示されるように、例えばアンバーサプレッサーtRNAlys(以下tRNASup・lysと表示)にaminoacyl−tRNA synthaseを作用させリジンを導入した後に、側鎖のアミノ基を介して官能基(以下SAC(Specific Acceptor for Coupling)と表示)を導入しておく(SAC−Lys−tRNASup・lys)。無細胞タンパク質合成の鋳型としては、目的タンパク質をコードする遺伝子(cDNA clone)の任意の位置に前述のTAG配列(終止コドン)を導入したものを準備しておき(Nonsense-mutated mRNA)、SAC−Lys−tRNASup・lysを合成時に混合し、TAG配列部分でタンパク質に導入する(SAC Protein)。
【0042】
なお、アンバー変異はナンセンス変異のうちの一つで、あるアミノ酸のコドンが変異し、終結コドンの一つのアンバーコドン(UAG)となる。UAGの分でタンパク質は終結するようになり、タンパク質は未成熟のままとなる。アンバーサプレッサーはナンセンスサプレッサーの一つで、アンバーコドン(UAG)をあるアミノ酸に対応するコドンとして読み取ることにより、中断、終了されるはずのタンパク質合成を回復することを可能とする。例えば、リジンのアンチコドン配列(AAG)が変異してUAGになった場合、サプレッサーtRNA(Lys)が認識し、アンバー終止コドンがLysとして読み取られることになる。本発明の一つの実施形態では、このサプレッサーtRNAにアミノ酸をチャージさせ、それをさらに修飾したものを使用する。
【0043】
また、一方において、核酸を準備する必要がある。一例として、5’末端アミノ化合成オリゴDNA(図5の”NH2-5’-oligo”)に、SACとカップリング可能な官能基(以下SDC(Specific Donor for Coupling)と表示)を有する、例えばSDC−NHSを反応させ、SDC−オリゴDNA(SDC-oligo)を合成する。
【0044】
次に、このようにして得られたSACを導入したタンパク質と、SDCオリゴDNAをカップリングさせ、DNA側鎖を有するタンパク質を合成する([SAC-SDC-oligo]-Protein)。SACとしては特に限定されないが、SHA(Salicylhydroxamic acid)やVersalinxTM SA(OMe)−Y−NHS(PROLINX社製)などを挙げることができる。最も好ましくは、アミノ末端を有する化合物と反応するように至適化された試薬がPROLINX社(www.prolinx.com)より販売されており、それが好適に用いられる。詳細は実施例にて示す。
【0045】
一方、SDCとしては特に限定されないが、PBA(Phenyl boronic acid)などが好ましく用いられる。特に、PROLINX社より販売されているPFP−(PBA)nが好適に使用される。
【0046】
次に、SAC結合タンパク質とSDC結合核酸は、適切な条件でカップリングさせる。例えば、SHA(Salicylhydroxamic acid)やVersalinxTM SA(OMe)−Y−NHSを結合させたタンパク質と、PBA(Phenyl boronic acid)を結合させた核酸は混合し、数十分間放置することにより、安定な複合体を形成させることができる。また、この反応は適当な条件を用いることで、再度解離させることもでき、大変便利である。
【0047】
このようにして合成した、タンパク質−核酸複合体は、そのままでも十分使用可能であるが、適当な緩衝液に置換して用いるのがより好ましい。
【0048】
また、本発明はタンパク質への核酸の結合が、アフィニティー結合であることを特徴とするタンパク質固定化方法である。具体的には、ストレプトアビジン−ビオチン、マルトース結合タンパク質−アミロース、グルタチオントランスフェラーゼ−グルタチオン、抗体−抗原などの組み合わせで用いるのが好ましい。特にストレプトアビジン−ビオチンの組み合わせは、ビオチン化した核酸、およびストレプトアビジン融合タンパク質は一般の研究室でも比較的入手しやすく、好ましいといえる。その原理を図6に示した。
【0049】
ビオチン化オリゴ核酸は、合成機を用いて合成する。5’末端にビオチンを付加するのが一般的であるが、3’末端でも良い。一方、タンパク質はストレプトアビジンとの融合タンパク質として発現する。ストレプトアビジンは目的タンパク質の性質に従って、その活性を損なわない末端に付加するのが好ましい。また、場合によっては、適当なリンカー配列を挿入することもできる。
本方法による、核酸と目的タンパク質の結合は、混合するだけで良い。ただ、適切な方法で、未反応の核酸を除去する方が好ましい。
【0050】
本発明の産業への応用としては、プロテインチップ、プロテインアレイ、バイオリアクター、タンパク質複合体形成等が考えられる。
【0051】
本発明方法を用いることにより、プロテインチップをまず安定なDNA固相化プレートとして準備しておき、必要な時にタンパク質をスポッティングなしにチップ化(アレイ化)することが可能となる。周知のごとくタンパク質は不安定であり、用事調製することが好ましく、本方法を用いることにより、より安定した結果を導くことが可能となる。
【0052】
また、本方法によりタンパク質の任意の距離に結合させることにより、同一代謝系にあるような酵素システムをより効率的に働かせることができるようになると考えられる。これはバイオリアクター等の産業利用が可能であり、また、学術的知見もあたえてくれるものと思われる。
【0053】
本発明の一態様としては、SAC導入用無細胞タンパク質合成システム、オリゴDNA修飾試薬、反応用バッファーをセットにしたタンパク質−DNA複合体調製試薬(キット)を挙げることができる。
【0054】
また更なる本発明の一態様としては、タンパク質と結合させたDNAと相補するように設計されたDNAを固相化した結合用固相(ナイロン膜、ガラス板、プラスチック板、プレート)などを考えることができる。
【実施例】
【0055】
本願発明の詳細を実施例で説明する。本願発明はこれら実施例によって何ら限定されるものではない。
実施例1 無細胞タンパク質発現用遺伝子の調製
本発明を実証するために、2種類の遺伝子(大腸菌DHFR(Dihydrofolate Reductase)のC末端に6XHISタグ配列もしくはMycタグ配列を付加したもの)をコムギ無細胞タンパク質合成キット(PROTEIOS Wheat germ cell−free protein synthesis kit(東洋紡製))の専用ベクターpEU3−NIIのEcoRV−BamHIサイトへクローニングする。クローニングは、大腸菌由来DNAを配列1、2もしくは配列3、4に記載のプライマーを用い、PCR増幅にて得られたDNA断片を用いて行う。具体的には、大腸菌ゲノムDNA100ngをKOD -Plus−(東洋紡製)を用いて、プロトコール通りの組成にて、30サイクルの増幅を行う。続いて、DNA断片の精製をMagExtractor -PCR&Gel Clean up−キット(東洋紡製)を用いて行う。続いて、精製断片をEcoRVとBamHIにて消化したpEU3−NIIベクターへLigation high(東洋紡製)を用いて連結し、大腸菌を形質転換する。次に、インサートの導入が確認されたクローンから一般的な方法を用いてプラスミドを抽出し、配列を確認し、目的クローン(pEU−DHFR/His−tag、pEU−DHFR/Myc−tag)を得る。
実施例2 遺伝子への変異導入
次に、実施例1で得られたpEU−DHFR/6XHIS、pEU−DHFR/Myc遺伝子配列のDHFRタンパク質76Lysの位置にTAG配列を導入する。具体的には、配列番号5、6のDNAを用いて、Quickchange site directed mutagenesis kit(Stratagene社製)にて変異導入を行う。具体的には、キットの取扱い説明書に従って行う。すなわち、精製したプラスミド100ngを用い、熱サイクルを25サイクル行った後に、制限酵素DpnIで処理し、処理液を用いて大腸菌を形質転換する。得られたクローンはプラスミを精製した後に、シーケンス確認を行い、変異導入の有無を確認し使用する。この変異で得られるDHFR遺伝子は、226−228のAAG配列がTAGに置換されたものである。以下、pEU−DHFR76TAG/His−tag、pEU−DHFR76TAG/Myc−tagとする。
実施例3 Lysyl tRNASup・lysのアミノアシル化
まず、大腸菌アンバーサプレッサーtRNAlys(tRNASup・lys)(シグマ製)を、リジンを基質としてアミノアシル化する。具体的には、100μlの反応液(20mM imidazole−HCl(pH7.5)、10mM MgCl2、1mM Lysine、2mM ATP、150mM NaCl)中に約1500pmoleのtRNAを溶解し、過剰量のaminoacyl tRNA−synthase (シグマ製)を添加し、37℃にて45分間反応させる。反応後、フェノール/クロロホルム処理を行った後、0.1容量の3M 酢酸ナトリウムと2.5容量のエタノールを添加し、15,000で10分間遠心し、沈殿を回収する。沈殿は、70%エタノールで洗浄し、適量の滅菌水で溶解する。
実施例4 Lysyl tRNASup・lysのSA(OMe)−Y化
1nmolのアミノアシル化tRNASupを炭酸ナトリウムバッファー(pH8.0)に10nmol/mlとなるように溶解する。一方で、50mMとなるようにSA(OMe)−Y−NHS(PROLINX社製)をDMFに溶解する。オリゴDNA溶液90μlとSA(OMe)−Y−NHS溶液10μlを混合し、氷上で約1時間反応させる。その後、ゲル濾過カラム(NAP25 column;ファルマシア社製)にて精製する。精製し、減圧乾燥する。使用時に適量の滅菌蒸留水に溶解して使用する。
実施例5 オリゴDNAのSA(OMe)−PBA化
5’アミノ化オリゴDNA(配列番号7、8)を90μlの0.1M NaHCO3(pH8.0)に10nmol/mlとなるように溶解する。配列番号9のオリゴDNAを以下A、配列番号10のオリゴDNAをBとする。その後、PFP−(PBA)n(PROLINX社製) 1mgを130μlのDMFに溶解し、アミノアシル化tRNASupに20μl添加し、室温で約3.5時間反応させる。DMFを減圧により蒸発させた後、1mlの滅菌蒸留水で溶解し、ゲル濾過カラム(NAP25 column;ファルマシア社製)にて精製し、減圧乾燥する。使用時に適量の滅菌蒸留水に溶解して使用する。
実施例6 無細胞タンパク質合成
無細胞タンパク質合成は、PROTEIOS cell−free protein synthesis kit (東洋紡績社製)を用いて行う。この方法は、ベクターをT7 RNAポリメラーゼにて転写し、精製したものを用いるが、その方法も取扱い説明書に従って実施する。合成し、精製したmRNAはぞれぞれmRNA−DHFR/His−tag、mRNA−DHFR/Myc−tagとする。無細胞タンパク質合成反応も、基本的には、取扱い説明書記載のバッチ法プロトコールに従って行い、それぞれのmRNAと実施例6で合成したLysyl tRNASup・lysのSA(OMe)−Y化を20μl反応に約1μgとなるよう添加し、約1時間、26℃にて反応を実施する。
【0056】
反応後、用事調製した2M NH2OH, 2mM EDTA, 2mM NaHCO3 (pH10)を20μl添加し、4℃にて4時間静置する。この処理により、活性なヒドロキサム酸基が露出される。
実施例7 カップリング反応(核酸−タンパク質カップリング反応)
実施例5および6で調製したサンプルを、それぞれ等量混合する。室温で約1時間複合体形成させた後、NAP−10カラムにてゲル濾過し、減圧乾燥後、適量の滅菌蒸留水にて溶解し、−80℃に保存する。
【0057】
反応は、His−tagタンパク質とオリゴヌクレオチドA、Myc−tagタンパク質とオリゴヌクレオチドBの組み合わせで行った。以降、タンパク質DNA複合体A、タンパク質DNA複合体Bと呼ぶ。
実施例8 ハイブリダイゼーション、検出
ストレプトアビジンコートされた96穴プレートに5’ビオチン化された配列番号9、10のオリゴDNA(10pmol/μl:滅菌蒸留水)100μlを次の組み合わせで添加する(配列番号11は配列番号9と相補的:以下A’、配列番号12は配列番号10と相補的:以下B’とする)。すなわち、ウェル1、2、3にA’、ウェル4、5、6にB’、ウェル7、8、9にA’+B’を添加し、室温で1時間反応させ、300μlの0.03%Tween20/PBS(−)にて各ウェルを3回づつ洗浄する。この時、同じプレートを2枚作成しておく(プレートI、II)。反応させた後2枚のプレートそれぞれについて、ウェル1、4、7にタンパク質DNA複合体A、ウェル2、5、8にタンパク質DNA複合体B、ウェル3、6、9にタンパク質DNA複合体AとBの等量混合物をそれぞれ20μlづつ添加する。1時間後、各ウェルを3回づつ洗浄した後、プレートIに約1/1000倍希釈した抗ヒスタグ抗体をプレート2に約1/1000倍希釈した抗Myc抗体それぞれ50μlを1時間反応させ、各ウェルを3回づつ洗浄する。その後、各ウェルに1/500倍希釈した、ペルオキシダーゼラベル抗IgG抗体50μlを添加し、37℃、1時間反応させ、各ウェルを3回づつ洗浄し、TMBZ(同仁社製)溶液を50μl添加し、37℃にて発色させ、等量の1N 硫酸を加えることにより反応を停止させる(抗体は、全てsantacruz社製を使用した)。その後、450nmにて吸光度を測定する。その結果を、図7に示す。図に示すように、A配列はHis−tag特異的な検出パターンが、配列BにはMyc−tag特異的な検出パターンを得ることができる。
【図面の簡単な説明】
【0058】
【図1】タンパク質を一本鎖核酸のハイブリダイゼーションにより固定する1つの実施形態を模式的に示す。
【図2】タンパク質を一本鎖核酸のハイブリダイゼーションにより担体(固相)に固定化する1つの実施形態を模式的に示す。
【図3】非相補的部分(一本鎖核酸部分に相当する)を有する複数のポリヌクレオチドをハイブリダイズさせて、複数の一本鎖核酸部分を形成させ、次に該部分にタンパク質をハイブリダイゼーションにより固定する方法を模式的に示す。
【図4】複数のタンパク質を担体(固相)に固定化する1つの実施形態を模式的に示す。
【図5】アンバーサプレッサー変異に従い、無細胞タンパク質合成法を用いて核酸をタンパク質に導入する系を例示する。
【図6】タンパク質と核酸をストレプトアビジン−ビオチン系を使用して連結する方法を模式的に示す。
【図7】一本鎖核酸に結合されたHis−tag、Myc−tagが、基板上に結合されたオリゴDNA(A‘,B’,A‘+B’)に結合され、対応する抗体で認識可能であることを示す)。
【特許請求の範囲】
【請求項1】
一本鎖核酸を結合させた一種以上のタンパク質を混合し、核酸のハイブリダイゼーションを利用して、任意の位置にタンパク質を固定化する方法。
【請求項2】
第1の一本鎖核酸に結合した一種以上のタンパク質と、第2の一本鎖核酸に結合した対象物を、一本鎖核酸同士のハイブリダイゼーションを利用して、該対象物に対し該タンパク質を特定の相互位置に固定化することを特徴とする請求項1に記載の方法。
【請求項3】
前記対象物がタンパク質である請求項2に記載の方法。
【請求項4】
前記対象物が担体である請求項2に記載の方法。
【請求項5】
担体が、樹脂、ナイロン、ニトロセルロース、多糖、ガラスまたは金属から選択される材料の膜、ビーズ、ゲルまたは基板であり、該担体は必要に応じてガラス、セラミックス、金属、プラスチック等の支持体上にあることを特徴とする請求項4に記載の方法。
【請求項6】
ハイブリダイゼーションにより2以上の一本鎖核酸部分を生じさせるように設計された、異なる配列を有する複数の一本鎖核酸をハイブリダイズさせ、さらに、該一本鎖核酸部分に相補的な配列を有し且つタンパク質を結合した2以上の一本鎖核酸を混合しハイブリダイズさせることにより特定の相互位置に2以上のタンパク質を固定化することを特徴とする請求項1〜3のいずれかに記載の方法。
【請求項7】
ハイブリダイゼーションにより2以上の一本鎖核酸部分を生じさせるように設計された、異なる配列を有する複数の一本鎖核酸をハイブリダイズさせ、さらに、該一本鎖核酸部分の1つに相補的な配列を有する一本鎖核酸に結合させた担体と、他の一本鎖核酸部分に相補的な配列を有し且つタンパク質を結合した少なくとも1つの一本鎖核酸を混合しハイブリダイズさせることにより、担体に固定化され、かつ、該担体と少なくとも一種のタンパク質が特定の相互位置に固定化されることを特徴とする請求項1、2または4に記載の方法。
【請求項8】
核酸がDNA、RNA、PNAのいずれかである請求項1〜7のいずれかに記載の方法。
【請求項9】
タンパク質が酵素、リセプター、リガンド、抗体、レクチン、アフィニティータンパク質のいずれかであることを特徴とする請求項1〜8のいずれかに記載の方法。
【請求項10】
タンパク質への核酸の結合が、共有結合であることを特徴とする請求項1〜9のいずれかに記載の方法。
【請求項11】
タンパク質への核酸の結合が、無細胞タンパク質合成を介する方法により形成されたものであることを特徴とする、請求項1〜10のいずれかに記載の方法。
【請求項12】
タンパク質への核酸の結合が、アフィニティー結合であることを特徴とする請求項1〜9のいずれかに記載の方法。
【請求項13】
アフィニティー結合が、アビジン−ビオチン反応、GST−グルタチオン、MBP(マルトース結合蛋白)−アミロース、キレート、もしくは抗体−抗原反応、のいずれかであることを特徴とする請求項12に記載の方法。
【請求項14】
三以上の一本鎖部分を有する核酸複合体の二以上の一本鎖部分に一本鎖核酸のハイブリダイゼーションにより二以上のタンパク質を固定化し、1つの一本鎖部分を介して担体に固定化してなる、タンパク質複合体。
【請求項15】
少なくとも1種のタンパク質が酵素である請求項14に記載の複合体。
【請求項16】
請求項15に記載のタンパク質複合体に基質を添加し、酵素反応を行うことを特徴とする方法。
【請求項17】
請求項14に記載のタンパク質複合体のタンパク質間の相互作用を測定することを特徴とする方法。
【請求項1】
一本鎖核酸を結合させた一種以上のタンパク質を混合し、核酸のハイブリダイゼーションを利用して、任意の位置にタンパク質を固定化する方法。
【請求項2】
第1の一本鎖核酸に結合した一種以上のタンパク質と、第2の一本鎖核酸に結合した対象物を、一本鎖核酸同士のハイブリダイゼーションを利用して、該対象物に対し該タンパク質を特定の相互位置に固定化することを特徴とする請求項1に記載の方法。
【請求項3】
前記対象物がタンパク質である請求項2に記載の方法。
【請求項4】
前記対象物が担体である請求項2に記載の方法。
【請求項5】
担体が、樹脂、ナイロン、ニトロセルロース、多糖、ガラスまたは金属から選択される材料の膜、ビーズ、ゲルまたは基板であり、該担体は必要に応じてガラス、セラミックス、金属、プラスチック等の支持体上にあることを特徴とする請求項4に記載の方法。
【請求項6】
ハイブリダイゼーションにより2以上の一本鎖核酸部分を生じさせるように設計された、異なる配列を有する複数の一本鎖核酸をハイブリダイズさせ、さらに、該一本鎖核酸部分に相補的な配列を有し且つタンパク質を結合した2以上の一本鎖核酸を混合しハイブリダイズさせることにより特定の相互位置に2以上のタンパク質を固定化することを特徴とする請求項1〜3のいずれかに記載の方法。
【請求項7】
ハイブリダイゼーションにより2以上の一本鎖核酸部分を生じさせるように設計された、異なる配列を有する複数の一本鎖核酸をハイブリダイズさせ、さらに、該一本鎖核酸部分の1つに相補的な配列を有する一本鎖核酸に結合させた担体と、他の一本鎖核酸部分に相補的な配列を有し且つタンパク質を結合した少なくとも1つの一本鎖核酸を混合しハイブリダイズさせることにより、担体に固定化され、かつ、該担体と少なくとも一種のタンパク質が特定の相互位置に固定化されることを特徴とする請求項1、2または4に記載の方法。
【請求項8】
核酸がDNA、RNA、PNAのいずれかである請求項1〜7のいずれかに記載の方法。
【請求項9】
タンパク質が酵素、リセプター、リガンド、抗体、レクチン、アフィニティータンパク質のいずれかであることを特徴とする請求項1〜8のいずれかに記載の方法。
【請求項10】
タンパク質への核酸の結合が、共有結合であることを特徴とする請求項1〜9のいずれかに記載の方法。
【請求項11】
タンパク質への核酸の結合が、無細胞タンパク質合成を介する方法により形成されたものであることを特徴とする、請求項1〜10のいずれかに記載の方法。
【請求項12】
タンパク質への核酸の結合が、アフィニティー結合であることを特徴とする請求項1〜9のいずれかに記載の方法。
【請求項13】
アフィニティー結合が、アビジン−ビオチン反応、GST−グルタチオン、MBP(マルトース結合蛋白)−アミロース、キレート、もしくは抗体−抗原反応、のいずれかであることを特徴とする請求項12に記載の方法。
【請求項14】
三以上の一本鎖部分を有する核酸複合体の二以上の一本鎖部分に一本鎖核酸のハイブリダイゼーションにより二以上のタンパク質を固定化し、1つの一本鎖部分を介して担体に固定化してなる、タンパク質複合体。
【請求項15】
少なくとも1種のタンパク質が酵素である請求項14に記載の複合体。
【請求項16】
請求項15に記載のタンパク質複合体に基質を添加し、酵素反応を行うことを特徴とする方法。
【請求項17】
請求項14に記載のタンパク質複合体のタンパク質間の相互作用を測定することを特徴とする方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2006−132980(P2006−132980A)
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願番号】特願2004−319610(P2004−319610)
【出願日】平成16年11月2日(2004.11.2)
【出願人】(000003160)東洋紡績株式会社 (3,622)
【出願人】(504145342)国立大学法人九州大学 (960)
【Fターム(参考)】
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願日】平成16年11月2日(2004.11.2)
【出願人】(000003160)東洋紡績株式会社 (3,622)
【出願人】(504145342)国立大学法人九州大学 (960)
【Fターム(参考)】
[ Back to top ]

