タンパク質の検出・定量方法及びタンパク質の検出・定量用試薬キット
【課題】
生化学や化学実験の経験の乏しい測定者であっても簡易に実施でき、また屋外や現場でも実施できる簡便な手段で、微量のタンパク質の存在を検出し、定量することができる作業性に優れた、簡易で迅速で鋭敏な再現性の高いタンパク質の検出・定量方法を提供することを目的とする。
【解決手段】
測定する試料液にタンパク質変性剤とTbイオンを加えて混合してTbイオンとタンパク質を配位させ、次いでCeイオンを加えて混合した試料溶液を近紫外線で励起したときにタンパク質が存在すると発する可視光部の蛍光で測定する。
生化学や化学実験の経験の乏しい測定者であっても簡易に実施でき、また屋外や現場でも実施できる簡便な手段で、微量のタンパク質の存在を検出し、定量することができる作業性に優れた、簡易で迅速で鋭敏な再現性の高いタンパク質の検出・定量方法を提供することを目的とする。
【解決手段】
測定する試料液にタンパク質変性剤とTbイオンを加えて混合してTbイオンとタンパク質を配位させ、次いでCeイオンを加えて混合した試料溶液を近紫外線で励起したときにタンパク質が存在すると発する可視光部の蛍光で測定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微量のタンパク質を検出・定量する方法、及びそれらの方法を使ったタンパク質の検出・定量用試薬キットに関するものである。
【背景技術】
【0002】
タンパク質とは多数のアミノ酸がアミノ結合によって直線状に繋がったものであり、そのアミノ酸の種類、アミノ酸の数、アミノ酸の配列によってそれぞれが異なる性質をもつ多くの分子種の総称である。タンパク質はそれぞれ固有の機能を有しており、個々のタンパク質の存在の有無やその量を調べることが、疾病の検査や治療など医薬医療分野だけでなく農林畜産水産分野や食品分野においても基礎技術として重要とされてきた。そのためそれらの多くの分子種が混在した試料の中から個々のタンパク質を分離して、検出し、定量する方法が多数考案されてきた。個々のたんぱく質に分離するとそれだけ検出対象であるタンパク質の量は減少する。近年のタンパク質分離技術の発展によりナノグラムレベルの微量のタンパク質を鋭敏に検出・定量できる方法が必要とされるようになり、これまでにいくつかの方策が考案されてきた。
タンパク質の検出方法で一般的な技術の一つはそのアミド結合による280nm近傍の紫外線の吸収(UV法)で測定する方法である。またタンパク質を特異的に染める染料で染めて透過光あるいは蛍光で検出する方法(CBB染色法、銀染色法、SYPRO Rubby法など)も採られる。また抗原抗体反応を使って特定のたんぱく質を捕捉した後で、その抗体に結合する別の分子種に酵素反応できる機能を付加してその酵素反応によって検出する方法もよく用いられる(イムノアッセイ法、イムノ染色法)。いずれの方法もその感度や操作の煩雑さに問題があり、簡便で、鋭敏な検出方法の開発が望まれている。
【0003】
鋭敏にタンパク質を検出する技術としては、特許文献1及び特許文献2に記載のタンパク質を蛍光性プローブで標識して蛍光時間分解によって検出する方法がある。さらにビオチン固定化酵素とその基質との特異的結合を利用して検出する方法が特許文献3に記載されている。また簡便にタンパク質を検出する技術としては非特許文献1に記載のTbイオンとGdイオンとアニオン系界面活性剤を試料に加えてその蛍光を測定する方法、及び非特許文献2に記載TbイオンとGdイオンとカチオン系界面活性剤を試料に加えてその蛍光を測定する方法がある。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】WO2003/076938
【特許文献2】WO2007/026808
【特許文献3】特開2008−237163
【非特許文献】
【0005】
【非特許文献1】Chemical Physics Letters Vol.398 No.4/6 P.343-350(2004)
【非特許文献2】Talanta Vol.76 No.5 P.1047-1052(2008)
【非特許文献3】Dojin News No.116,P.1-7(2005)
【非特許文献4】Inorganic Chemistry Vol.45 No.10,P.4088−4096(2006)
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら上記従来の技術においては、以下のような課題を有していた。
(1)(特許文献1)乃至(特許文献3)に記載の技術は、実施するには相当な生化学実験に対する技術素養と熟練と特殊な機器が必要であり、簡便な利用は不可能であるという課題を有していた。
(2)(非特許文献1)及び(非特許文献2)に記載の技術は、その蛍光強度がタンパク質の量に対して一定せず、タンパク質の定量には適さないという課題を有していた。またナノグラム/mLレベルの低いタンパク質濃度に対してはシグナルの強度が低く正確な測定が難しいという課題を有していた。
(3)(非特許文献3)及び(非特許文献4)に記載の技術は希土類のEuを用いて生体分子を標識して検出する方法であるが実施するには相当な生化学実験に対する技術素養と熟練と特殊な機器が必要であり、簡便な利用は不可能であるという課題を有していた。
【0007】
本発明は上記従来の課題を解決するもので、簡単な操作で鋭敏により微量のタンパク質を検出、定量できるタンパク質の検出・定量方法とそれを用いたタンパク質の検出・定量用試薬キットを提供することを目的とする。
【課題を解決するための手段】
【0008】
上記従来の課題を解決するために本発明のタンパク質の検出方法・定量方法及びそれを用いたタンパク質の検出・定量用試薬キットは、以下の構成を有している。
本発明の請求項1に記載のタンパク質の検出・定量方法は、測定する試料液にタンパク質変性剤とTbイオンとCeイオンを加えて、近紫外線で励起したときに発する蛍光で測定することを特徴とする構成を有している。
この構成により、以下のような作用が得られる。
(1)タンパク質変性剤によってタンパク質の高次構造が破壊されて、測定試料溶液の中での形状の自由度が増して、加えられたTbイオンに配位しやすくなる。タンパク質と配位したTbイオンの濃度は測定試料中のタンパク質の濃度に比例する。
(2)Tbイオンはタンパク質と配位することで波長350nm近傍の光線を吸収して可視光領域の蛍光(最大波長543nm)を発するようになる。
(3)Ceイオンは測定試料中で変性したタンパク質とTbイオンと同様に配位する。タンパク質と配位したCeイオンの濃度は測定試料中のタンパク質の濃度に比例する。
(4)タンパク質と配位したCeイオンは波長255nm近傍の紫外線を吸収して350nmを最大波長と蛍光を発する。これはタンパク質と配位したTbイオンの最大吸収波長(350nm)と同じであるためにCeイオンが吸収した励起エネルギーはタンパク質と配位したTbイオンに渡される。これによりタンパク質と配位したTbイオンは高効率で蛍光を発することができる。
(5)タンパク質が存在すると、近紫外線(波長220nm以上390nm以下)での励起により、高効率で可視光領域に蛍光(最大波長543nm)を発する。この蛍光と励起光の最大波長が離れているために、測定シグナルの分離が容易で、装置を簡略化しやすい上に、測定のノイズが低くなり、精度の高い測定ができる。
(6)測定試料が発する可視光領域の蛍光の強度は試料液中のタンパク質の濃度に比例する。このため蛍光の強度を測定することで微量なタンパク質の検出・定量が可能となる。
【0009】
ここで測定するタンパク質は測定時の最終濃度で1.0×10-9g/mL以上1.0×10-3g/mL未満になるように適宜、濃縮あるいは希釈して使用する。1.0×10-9g/mL未満では蛍光シグナルが低く測定誤差が大きくなって実用的でない。1.0×10-3g/mL以上では液の散乱による測定誤差が大きくなって実用的でない。また測定試料はTris塩酸やリン酸カリウム/リン酸ナトリウムなどの緩衝液を用いてpHを6〜8の中性に保つのが好ましい。測定は0℃〜30℃で実施するのが好ましい。
【0010】
ここで、タンパク質変性剤とはタンパク質の高次構造を破壊する薬剤である。タンパク質は個々の種類毎に特有の形状にコンパクトに折り畳まれた構造(高次構造)をとり、その機能を果たしている。しかしタンパク質の検出や定量においてはタンパク質の種類による差異を無くすために、タンパク質の高次構造を壊してその個性を剥ぎ取る必要がある。このタンパク質の高次構造を壊すことをタンパク質の変性と称し、それを起こす薬剤をタンパク質変性剤と称する。酸やアルカリ、塩類、アルコール、界面活性剤など多くの物質に変成作用があることが知られている。
【0011】
ここで、TbやCeは解離したイオンの形で測定試料に加えることができればよく、試料溶液に可溶であれば、塩あるいは水酸化物、酸化物などのいずれの形態で測定試料に加えてもよい。Tbイオンの濃度は1×10-6M以上1×10-3M以下が好ましい。またCeイオンとTbイオンの測定試料中のモル濃度比は(Tbイオン1に対して)5以上20以下が好ましい。
【0012】
ここで、近紫外線とは波長200nm以上380nm未満の光線を指す。配位したCeイオンの吸収スペクトルの最大波長が255nmであり、発する蛍光の最大波長が350nmであるることから励起に用いる近紫外線は波長350nm未満であることが望ましい。また測定したい配位したTbイオンの蛍光のピークが543nmであることから、励起光の倍光による影響を避けるためは270nm付近での励起は望ましくない。よって好ましくは波長230nm以上260nm未満または波長280nm以上320nm未満の光線で励起することがよい。
【0013】
本発明の請求項2に記載の発明は、請求項1に記載のタンパク質の検出・定量方法であって、前記タンパク質変性剤がアルキルベンゼンスルホン酸塩又はアルファオレインスルホン酸塩の内いずれか1以上のアニオン系界面活性剤である構成を有している。
この構成により、請求項1の作用に加えて、以下のような作用が得られる。
請求項2に記載のタンパク質変性剤はそのアルキル鎖がタンパク質を安定化する効果をもち、過度な変性を抑え、この測定に適した変性状態とする。タンパク質の変性が不十分であると、その高次構造が保持され、イオンがうまく配位できなくて蛍光強度が下がってしまう。また配位する数が一定せず、その測定誤差が大きくなる。一方、変性が強すぎても、タンパク質の構造が硬直化し、イオンがうまく配位できなくなり蛍光強度が下がる。
このタンパク質変性剤はそのスルホン酸基に由来するマイナス電荷により、タンパク質変性剤が結合したタンパク質の近傍にTbイオンやCeイオンが近づき易くなり、結果としてこれらのイオンとタンパク質の配位を形成し易くする。
さらにこのタンパク質変性剤がもつベンゼン環が試料溶液中で疎水結合により周りのタンパク分子を集める働きをして、タンパク質の濃度が薄い試料でも十分な数がイオンに配位できるようにする。
【0014】
ここで、アルキルベンゼンスルホン酸塩としてはドデシルベンゼンスルホン酸ナトリウム(SDBS)などの炭素数10以上25以下のアルキル基を有し、ナトリウム塩やカリウム塩が使用できる。アルファオレインスルホン酸塩としてはテトラデセンスルホン酸ナトリウムなどの炭素数10以上25以下のナトリウム塩やカリウム塩が使用できる。アニオン系界面活性剤の濃度は測定試料の最終濃度として1×10-5M以上1×10-3M未満が好ましい。1×10-3M以上では蛍光ノイズが増加して測定に適さない。また1×10-5M未満では変成作用が十分に作用せず、Tbイオンとタンパク質の配位が少なくなり、蛍光強度が下がるために、測定感度が下がり実用的でない。
【0015】
本発明の請求項3に記載の発明は、請求項1に記載のタンパク質の検出・定量方法であって、前記タンパク質変性剤がハロゲン化アルキルピリジニウムを含有するカチオン系界面活性剤である構成を有している。
この構成により、請求項1の作用に加え、以下のような作用が得られる。
(1)請求項3に記載のタンパク質変性剤はそのアルキル鎖がタンパク質を安定化する効果をもち、過度な変性を抑え、この測定に適した変性状態とする。タンパク質の変性が不十分であると、その高次構造が保持され、イオンがうまく配位できなくて蛍光強度が下がってしまう。また配位する数が一定せず、その測定誤差が大きくなる。一方、変性が強すぎても、タンパク質の構造が硬直化し、イオンがうまく配位できなくなり蛍光強度が下がる。
(2)このタンパク質変性剤由来のハロゲンイオンの強い電気陰性度により、タンパク質変性剤が結合したタンパク質(プラスに荷電)とともにカチオンであるTbイオンやCeイオンを集め、これらのイオンを配位し易くする。
(3)生体由来の測定試料には脂質などマイナス電荷を帯びた物質が多く含まれており、タンパク質に付着して相互作用をしていることが多い。このタンパク質変性剤のプラス電荷がそれらのマイナス電荷を帯びた物質と結合するためにタンパク質への付着物が減り、TbイオンやCeイオンと配位しやすくなる。
(4)タンパク質の研究ではその実験に応じて様々な界面活性剤を使用するため、測定試料も様々な界面活性剤を含みうる。タンパク質変性剤の使用できる範囲が広がることで適用できる試料の範囲が拡大する。
【0016】
ここで、ハロゲン化アルキルピリジニウムとしては塩化物、臭化物などが使用できる。またアルキル基としては炭素数10以上25以下のものが望ましい。例えば臭化ヘキサデシルピリジニウム(HDP)などが使用できる。カチオン系界面活性剤の濃度は測定試料の最終濃度として1×10-5M以上1×10-3M未満が好ましい。1×10-3M以上では蛍光ノイズが増加して測定に適さない。また1×10-5M未満では変成作用が十分に作用せず、Tbイオンとタンパク質の配位が少なくなり、測定感度が下がり実用的でない。
【0017】
この構成は非特許文献2とは異なり、Tbイオンに加えるイオンがCeイオンである。配位したCeイオンの発する蛍光の波長は配位したGdイオンの発する蛍光の波長よりも配位したTbイオンの吸収波長に近い。そのため、励起光のエネルギーが効率よくTbイオンに渡される。結果として非特許文献2よりも蛍光シグナルが大きくなり、測定感度と定量精度が高くなる。
【0018】
本発明の請求項4に記載の発明は、請求項1乃至請求項3の内のいずれか1に記載のタンパク質の検出・定量方法であって、エチルアルコール又はプロピルアルコールなど炭素数2以上6以下のアルコールを加えて蛍光強度を増強して感度を上げた構成を有している。
この構成により、請求項1乃至請求項3の内のいずれか1の作用に加え、以下のような作用が得られる。
(1)アルコールの添加により水とタンパク質の間の相互作用が弱まる。これにより、タンパク質の構造の自由度がさらに高まり、TbイオンやCeイオンとの配位がさらに容易となる。またアルコールが測定試料中の水分子を抱え込み、タンパク質とイオン類の濃度が相対的に上昇したこととなる。これらの相乗作用によってシグナルの強度が上昇し検出感度と検出精度が上る。
【0019】
ここで、添加するアルコールの量は測定時の最終濃度で1×10-6M以上5×10-4M未満が好ましい。アルコールの濃度が1×10-6M未満ではアルコールの添加の効果はほとんど見られなくなる。しまう。またアルコール濃度5×10-4M以上ではタンパク質の変性が過剰に起こり、Tbイオンとの相互作用が阻害されるため蛍光強度は下がってしまう。
【0020】
本発明の請求項5に記載の発明は、請求項4に記載のタンパク質の検出・定量の方法であって、前記Ceイオンに代えてGdイオンを用いた構成を有している。
この構成より請求項4の作用に加えて以下のような作用が得られる。
(1)加えられたアルコールによりタンパク質と水分子との相互作用が弱まり、残存していた2次構造が破壊され、ペプチド鎖の自由度が高まる。これによりタンパク質がTbイオンやCeイオンと配位しやすくなる。そのためにタンパク質を検出するシグナル強度が増大し、検出感度と検出精度が上る。
【0021】
ここで、Gdは解離したイオンの形で測定試料に加えることができればよく、試料溶液に可溶であれば、塩あるいは水酸化物、酸化物などのいずれの形態で測定試料に加えてもよい。またGdイオンとTbイオンの測定試料中の濃度比は(Tbイオン1に対して)5以上20以下が好ましい。
非特許文献1の構成もTbイオンとSDBSであり、感度増強のために使うイオンがGdイオンである。Gdイオンの蛍光最大波長310nmがCeイオンの蛍光最大波長350nmと比べてTbイオンの吸収最大波長350nmから離れているためにエネルギーの受け渡し効率が低くなりタンパク質検出感度が低かった。本発明では、アルコール添加により検出感度を1.5倍から3倍に増強しその感度低下を補っている。
【0022】
本発明の請求項6に記載の発明は、請求項1乃至請求項5の内のいずれか1に記載のタンパク質の検出・定量の方法であって、試薬の混合順序が、最初にタンパク質変性剤とTbイオンを混合し十分に配位させる配位工程と、次いでCeイオン又はGdイオンを加えて蛍光強度を増強して感度を上げる増感工程とを備えた構成を有している。
この構成により、請求項1乃至請求項5の内いずれか1で得られる作用に加え、以下のような作用が得られる。
(1)Tbイオンが変性したタンパク質と十分に配位したあとで、CeイオンあるいはGdイオンが加えられるので、Tbイオンとタンパク質の配位が競合阻害を受けない。これにより後から加えたCeイオンあるいはGdイオンがその感度増強作用を最大限に果たすことができる。
【0023】
ここでTbイオンを混合した後のタンパク質との配位工程に要する時間は,試料10mlの場合10秒以上の混合であればよく、その後で感度増強用のCeイオンまたはGdイオンを加えればよい。アルコールの添加時期は感度増強用のCeイオンまたはGdイオンの添加と同時あるいはその後であれば適宜に決めることができる。
【0024】
本発明の請求項7に記載の発明は、タンパク質の検出・定量用の試薬キットであってタンパク質変性剤として界面活性剤を含む変性液と、Tbイオンを含む配位液と、Ceイオンをを含む増感液との3種類の液を備えた構成を有している。
この構成により、以下のような作用が得られる。
(1)測定者が個別に試薬類を調製することなく、測定試料とキットに含まれる液を指示に従って加えていくだけで、測定準備が完了するので、生化学的な経験や知識が乏しい測定者であっても非常に簡便にタンパク質の検出ができる。
(2)測定の都度に試薬液を調製しないので、毎回同じ条件で測定できる。
(3)標準試料として既知の濃度のタンパク質溶液があれば、それとの比較で簡便にタンパク質の定量ができる。
【0025】
ここで界面活性剤としては炭素数10以上25以下のアルキル基を有するアルキルベンゼンスルホン酸塩や炭素数10以上25以下のアルファオレインスルホン酸塩、炭素数10以上25以下のハロゲン化アルキルピリジニウムなどが使用できる。例えばドデシルベンゼンスルホン酸ナトリウム(SDBS)、テトラデセンスルホン酸カリウム、臭化ヘキサデシルピリジニウム(HDP)などが使用できる。界面活性剤の濃度は測定試料の最終濃度として1×10-5M以上1×10-3M未満となることが好ましい。
【0026】
ここでTbイオンの濃度は測定試料の最終濃度として1×10-6M以上1×10-3M以下となることが好ましい。CeイオンとTbイオンの測定試料中のモル濃度比は(Tbイオン1に対して)5以上20以下となることが好ましい。
【0027】
本発明の請求項8に記載の発明は、請求項7に記載のタンパク質の検出・定量用の試薬キットであって、変性液と配位液と増感液との3種類の液の内のいずれか2以上があらかじめ混合されていることを特徴とする構成を有している。
この構成により、以下のような作用が得られる。
(1)液の種類が少ないため、経験の乏しい作業者でも混合ミスが少なくなる。
(2)試薬の混合比が一定となるため、再現性の高い結果を得やすくなる。
【0028】
ここで変性液と配位液を混合したものを測定セルに封入したり、測定基材片に塗布させたものを使用してもよい。測定試料を加えて、増感液を添加するとそのまま測定することが可能となる。
【発明の効果】
【0029】
以上のように、本発明のタンパク質の検出・定量方法及びそれを用いたタンパク質の検出・定量用試薬キットによれば、以下のような有利な効果が得られる。
請求項1に記載の発明によれば、
(1)簡便な操作で迅速にタンパク質の検出をする方法を提供することができるので、医療・医薬・食品など様々な分野の検査を簡便化できる。
(2)試料中の微量のタンパク質の有無を検出できる方法を提供することができるので人の手や細菌などによる工業製品の汚染の有無の検査が簡便に可能となる。
(3)既存およびこれから開発されるであろうタンパク質の分離技術に対して、その分離された個々のタンパク質を迅速かつ鋭敏に検出・定量できる方法を提供することができるのでライフサイエンス分野の研究開発を促進できる。この発明を用いて病理検査機器や、疾病の検査キットや食品の検査キットなど様々な機器やキットの設計が可能となる。
【0030】
請求項2に記載の発明によれば、請求項1の効果に加え、
(1)高感度で、迅速なタンパク質の検出・定量の方法とそれに用いる試薬キットを提供することができるので、熟練をした技術者でなくても再現性よく微量なタンパク質の検出・定量が可能となる。
(2)迅速な測定方法とそれに用いる試薬キットを提供することができるので医療や食品など様々な分野での検査が迅速化できる。
【0031】
請求項3に記載の発明によれば、請求項1の効果に加え、
(1)カチオン系界面活性剤は殺菌作用があるため、医療分野でよく用いられている。そのため細菌検査など感染性の試料に対する測定方法を提供することができる。
【0032】
請求項4に記載の発明によれば、請求項1乃至3の内の1の効果に加え、
(1)より感度の高いタンパク質の検出・定量の方法を提供することができる。また医療分野などで殺菌・消毒のためにアルコールが含まれている試料も簡便に測定できる方法を提供できる。
【0033】
請求項5に記載の発明によれば、請求項4の効果に加え、
(1)類似の系で異なる測定方法を提供することができる。これによりさらに別の蛍光シグナルを用いる測定と組み合わせることが可能となり、より高度な研究開発や医療分野での応用が可能となる。
【0034】
請求項6に記載の発明によれば、請求項1乃至5の内いずれか1の効果に加え、
(1)より高感度で、精度の高い測定方法を提供することができる。この発明を自動化
測定器の設計に組み込めば広く産業界での利用が可能となる。
【0035】
請求項7に記載の発明によれば、
(1)生化学的手法に不慣れな作業者であっても簡便に、タンパク質の検出・定量が現場等で簡易・迅速に実施できる。これにより製品汚染の検査など広い分野での利用が可能となる。
【0036】
請求項8に記載の発明よれば、
(1)分析や測定などの細かい作業に不慣れな作業者であっても、簡便に再現性よくタンパク質の検出・定量が実施できる。液数が少ないので携帯するのも楽であり、屋外などでも検査が可能となる。
【図面の簡単な説明】
【0037】
【図1】Tbイオン:SDBS:Ceイオン系によるコラーゲン検出時の蛍光スペクトル
【図2】Tbイオン:SDBS:Ceイオン系によるエラスチン検出時の蛍光スペクトル
【図3】Tbイオン:SDBS:Ceイオン系による牛血清アルブミン検出時の蛍光スペクトル
【図4】Tbイオン:HDP:Ceイオン系によるタンパク質の検出時の蛍光スペクトル
【図5】Tbイオン:SDBS:Gdイオン:エチルアルコール系によるコラーゲンの検出時の蛍光スペクトル
【図6】Tbイオン:SDBS:Ceイオン系によるコラーゲンの検出時の蛍光スペクトル
【図7】タンパク質の濃度と蛍光強度の関係を示すグラフ
【発明を実施するための形態】
【0038】
本発明は微量のタンパク質を検出するものであるので、濃厚な試料の場合は水または緩衝液で適宜希釈して測定する。タンパク質濃度は測定時の最終濃度で1ng/mL以上1mg/mL以下が望ましい。
本発明で添加するTbイオンや界面活性剤、感度増強用のイオン、アルコールは予め最終濃度の5倍から1000倍濃度で調製しておくと使い易い。
測定用の試料セルに測定試料を一定量入れ、ここに残りの試薬類を添加してよく混合した後で、紫外線で励起し、Tbイオンによる543nmの蛍光を測定する。
【実施例】
【0039】
以下、本発明を実施例により具体的に説明する。なお、本発明はこれらの実施例に限定されるものではない。
(実施例1)Tb:SDBS:Ce系によるコラーゲンの検出
精製されたタンパク質として安価で手に入れ易いコラーゲン(牛アキレス腱由来)の水溶液を用いた場合について記載する。
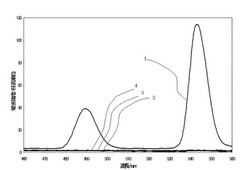
コラーゲンを1.0×10-4g/mLの濃度に溶かしたタンパク質溶液100μLを20mL試験管に取り、そこに蒸留水7740μLとTris塩酸緩衝液(5.0×10-4M、pH7.0)1000μLと、アニオン系界面活性剤のドデシルベンゼンスルホン酸ナトリウム(SDBS)の水溶液(濃度1.0×10-3M)1000μLと、TbCl3水溶液(濃度1.0×10-2M)10μLと、CeCl3水溶液(濃度1.0×10-2M)150μLを加えて、ゴム栓をして10秒間振り混ぜ、蛍光測定セルに移して分光蛍光光度計(HITACHI F−4500)で蛍光スペクトルを測定した。励起波長は290nmを用いた。試料溶液の主要構成要素の最終組成を表1に示す。結果を図1の線1に示す。
【0040】
(比較例1)実施例1でSDBSとCeイオンを欠いた場合
実施例1に記載の実験条件から表1に記載のとおり構成要素のうちSDBSとCeイオンを欠いた場合について実施例1と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表1に示す。結果を図1の線2に示す。
【0041】
(比較例2)実施例1でコラーゲンとCeイオンを欠いた場合
実施例1に記載の実験条件から表1に記載のとおり構成要素のうちコラーゲンとCeイオンを欠いた場合について実施例1と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表1に示す。結果を図1の線3に示す。
【0042】
(比較例3)実施例1でCeイオンを欠いた場合
実施例1に記載の実験条件から表1に記載のとおり構成要素のうちCeイオンを欠いた場合について実施例1と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表1に示す。結果を図1の線4に示す。
【0043】
【表1】

【0044】
図1の線1に示したようにTb:SDBS:Ce系ではコラーゲンが存在すると配位したTbイオンに由来する490nmと543nmの蛍光が観察された(実施例1)。一方で構成要素を欠いた比較例1(線2:SDBSとCeイオンを欠いた場合)、比較例2(線3:タンパク質とCeイオンを欠いた場合)、比較例3(線4:Ceイオンを欠いた場合)では490nmと534nmのどちらにも蛍光のピークは見られなかった。
【0045】
(実施例2)Tb:SDBS:Ce系によるエラスチンの検出
タンパク質としてコラーゲン同様に安価で手に入り易いエラスチン(牛頚部靭帯由来)の水溶液を用いた場合に実施例1と同じ方法で表2に記載の最終濃度実験条件で蛍光スペクトルを測定した。結果を図2の線5に示す。
【0046】
(比較例4)実施例2でSDBSとCeイオンを欠いた場合
実施例2に記載の実験条件から表2に記載のとおり構成要素のうちSDBSとCeイオンを欠いた場合について実施例2と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表2に示す。結果を図2の線6に示す。
【0047】
(比較例5)実施例2でコラーゲンとCeイオンを欠いた場合
実施例2に記載の実験条件から表2に記載のとおり構成要素のうちコラーゲンとCeイオンを欠いた場合について実施例2と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表2に示す。結果を図2の線7に示す。
【0048】
(比較例6)実施例2でCeイオンを欠いた場合
実施例2に記載の実験条件から表2に記載のとおり構成要素のうちCeイオンを欠いた場合について実施例1と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表2に示す。結果を図2の線8に示す。
【0049】
【表2】

【0050】
図2の線5から明らかなようにTb:SDBS:Ce系ではタンパク質をエラスチンに代えてもコラーゲンの場合と同じように配位したTbイオンに由来する490nmと543nmにピークをもつ蛍光が観察された(実施例2)。一方で構成要素を欠いた比較例4(線6:界面活性剤とCeイオンを欠いた場合)、比較例5(線7:タンパク質とCeイオンを欠いた場合)、比較例6(線8:Ceイオンを欠いた場合)では490nmと534nmのどちらにも蛍光のピークは見られなかった。
【0051】
(実施例3)Tb:SDBS:Ce系による牛血清アルブミンの検出
タンパク質としてコラーゲン同様に安価で手に入り易い牛血清アルブミン(BSA)の水溶液を用いた場合に実施例1と同じ方法で表3に記載の最終濃度実験条件で蛍光スペクトルを測定した。結果を図3の線9に示す。
【0052】
(比較例7)実施例3でSDBSとCeイオンを欠いた場合
実施例3に記載の実験条件から表3に記載のとおり構成要素のうちSDBSとCeイオンを欠いた場合について実施例3と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表3に示す。結果を図3の線10に示す。
【0053】
(比較例8)実施例3でコラーゲンとCeイオンを欠いた場合
実施例3に記載の実験条件から表3に記載のとおり構成要素のうちコラーゲンとCeイオンを欠いた場合について実施例3と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表3に示す。結果を図3の線11に示す。
【0054】
(比較例9)実施例3でCeイオンを欠いた場合
実施例3に記載の実験条件から表3に記載のとおり構成要素のうちCeイオンを欠いた場合について実施例3と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表3に示す。結果を図3の線12に示す。
【0055】
【表3】

【0056】
図3の線9から明らかなようにTb:SDBS:Ce系ではタンパク質をBSAに代えてもコラーゲンやエラスチンと同じように配位したTbイオンに由来する490nmと543nmにピークをもつ蛍光が観察された(実施例3)。一方で構成要素を欠いた比較例7(線10:界面活性剤とCeイオンを欠いた場合)、比較例8(線11:タンパク質とCeイオンを欠いた場合)、比較例9(線12:Ceイオンを欠いた場合)では490nmと534nmのどちらにも蛍光のピークは見られなかった。
【0057】
Tb:HDP:Ce系によるたんぱく質の検出
(実施例4)実施例1の界面活性剤をカチオン系界面活性剤臭化ヘキサデシルピリジニウム(HDP)に変更して実施例1と同様にBSAの水溶液について蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表4に示す。結果を図4の線13に示す。
(実施例5)実施例4のタンパク質をBSAからエラスチンに変更して実施例4と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表4に示す。結果を図4の線14に示す。
(実施例6)実施例4のタンパク質をBSAからコラーゲンに変更して実施例4と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表4に示す。結果を図4の線15に示す。
【0058】
【表4】

【0059】
図4の線13(実施例4:BSAの場合)、線14(実施例5:エラスチンの場合)、線15(実施例6コラーゲンの場合)から明らかなように界面活性剤をカチオン系のHDPに変更したTb:HDP:Ce系においてもタンパク質が存在すると配位したTbイオンに由来する543nmにピークをもつ蛍光が観察され、この系がタンパク質の検出・定量に使用できることが示された。490nmの蛍光のピークはBSAでのみ観察された。Tbイオンへのエネルギーの伝達においてSDBSの場合と違いがあるためと考えられる。
【0060】
(実施例7)Tbイオン:SDBS:Gdイオン:アルコール系によるコラーゲンの検出
コラーゲン溶液にTbイオンと界面活性剤SDBSとGdイオンを加え混合し、次いでエチルアルコールを最終濃度1.0×10-4Mとなるように加えて混合し、励起波長290nmによる蛍光スペクトルを測定した。試料の主要構成要素の最終濃度組成を表5に示す。結果を図5の線16に示す。
【0061】
(比較例10)実施例7からアルコールを欠いた場合
実施例7の実験条件から表5に記載のとおりエチルアルコールを欠いた場合について実施例7と同様に蛍光スペクトルを測定した。主要構成要素の最終濃度組成を表5に示す。結果を図5の線17に示す。
(比較例11)実施例7より過剰にアルコールを入れた場合
実施例7の実験条件よりも表5に記載のとおりエチルアルコール過剰に加えた場合について実施例7と同様に蛍光スペクトルを測定した。主要構成要素の最終濃度組成を表5に示す。結果を図5の線18に示す。
【0062】
【表5】

【0063】
図5の線16で明らかなようにTbイオン:SDBS:Gdイオンの系においてエチルアルコールを添加すると(線16:実施例7)、エチルアルコールを加えない場合(比較線17:例10)に比べてTbイオンによる543nmの蛍光ピークはおよそ3割増大する。エチルアルコールがコラーゲンから水分子を奪うことで未変性で残っていたコラーゲンの高次構造を破壊したことで、TbイオンやGdイオンなどと配位できる部位が増えたためと考えられる。
過剰にエチルアルコールを加えた場合(線18:比較例11)では逆にTbイオンによる543nmの蛍光強度は減少した。過剰のエチルアルコールを加えると水分子を奪われた結果としてペプチド鎖の自由度が下がり、TbイオンやGdイオンなどに配位できる部位が減るために蛍光強度が下がったと考えられる。この系でコラーゲンの検出の感度を増大するためのエチルアルコールの最適濃度は5.0×10-5Mから5.0×10-4Mの間にあった。
【0064】
(実施例8)Tbイオン:SDBS:Ceイオン系によるコラーゲン検出に対する試薬の添加順序の効果
コラーゲン溶液にTbイオンと界面活性剤SDBSを加えて混合した。そのまま20秒静置してからCeイオンを加えて混合して励起波長は290nmで蛍光スペクトルを測定した。試料溶液の最終組成を表6に示す。結果を図6の線19に示す。
(比較例12)
実施例8とまったく同じ試料と同じ濃度条件において、Tbイオンと界面活性剤を加えるときに同時にCeイオンを加えて混合し、そのまま20秒静置してから実施例8と同様に蛍光スペクトルを測定した。試料溶液の最終組成を表6に示す。結果を図6の線20に示す。
【0065】
【表6】

【0066】
図6の線19と線20で明らかなように、Tbイオンとタンパク質の配位を最初にさせて、次いで増強用のCeイオンを加えた場合(線19:実施例8)の方が試薬を同時に混合して測定した場合(線20:比較例12)に比べて、配位したTbイオンによる543nmの蛍光は増大した。先にTbイオンとタンパク質を配位させておくと、Tbイオンがタンパク質の殻に覆われたようになり、増強用のCeイオンが加えられても、イオンの交換反応が起こりにくなる。そのためタンパク質との配位においてTbイオンとCeイオンが競合して、配位したTbイオンの濃度を下げることがないため蛍光強度が高くなるのに対して、試薬を同時に混合するとタンパク質との配位においてTbイオンとCeイオンが競合して、配位したTbイオンの濃度が下がってしまい蛍光強度が低くなるのだと考えられる。
【0067】
タンパク質の濃度と蛍光強度の関係
(実施例9)濃度を1.0×10-6g/mL、2.0×10-6g/mL、4.0×10-6g/mLと3段階に調製したコラーゲン水溶液を使って実施例1と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線21に示す。
(実施例10)実施例9においてタンパク質をコラーゲンからエラスチンに変更して、実施例10と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線22に示す。
(実施例11)実施例9においてタンパク質をコラーゲンからBSAに変更して、実施例10と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線23に示す。
(実施例12)実施例9においてタンパク質をコラーゲンから合成ペプチド1に変更して、実施例10と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線24に示す。合成ペプチド1のアミノ酸配列はDSRMIAGLKTLHDである。
(実施例13)実施例9においてタンパク質をコラーゲンから合成ペプチド2に変更して、実施例10と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線25に示す。合成ペプチド2のアミノ酸配列はTTTPGTTTAGTTTSRである。
【0068】
【表7】

【0069】
図7の線21から線25で明らかなように3種のタンパク質と2種の合成ペプチドは、本発明による方法でその濃度に比例した蛍光を発した(線21:コラーゲンの場合:実施例9)(線22:エラスチンの場合:実施例10)(線23:BSAの場合:実施例11)(線24:合成ペプチド1の場合:実施例12)(線25:合成ペプチド2の場合:実施例13)。タンパク種による違いは明確には認めらず、合成ペプチドからコラーゲンまでほぼ同じ蛍光強度とタンパク質濃度の比例関係を示した。したがってこの測定に用いた試験液をあらかじめ調製してキットとすれば簡便に迅速に再現性よくタンパク質の検出と定量ができることが示された。
【符号の説明】
【0070】
1 実施例1の蛍光スペクトル
2 比較例1の蛍光スペクトル
3 比較例2の蛍光スペクトル
4 比較例3の蛍光スペクトル
5 実施例2の蛍光スペクトル
6 比較例4の蛍光スペクトル
7 比較例5の蛍光スペクトル
8 比較例6の蛍光スペクトル
9 実施例3の蛍光スペクトル
10 比較例7の蛍光スペクトル
11 比較例8の蛍光スペクトル
12 比較例9の蛍光スペクトル
13 実施例4の蛍光スペクトル
14 実施例5の蛍光スペクトル
15 実施例6の蛍光スペクトル
16 実施例7の蛍光スペクトル
17 比較例10の蛍光スペクトル
18 比較例11の蛍光スペクトル
19 実施例8の蛍光スペクトル
20 比較例12の蛍光スペクトル
21 実施例9の蛍光強度
22 実施例10の蛍光強度
23 実施例11の蛍光強度
24 実施例12の蛍光強度
25 実施例13の蛍光強度
【技術分野】
【0001】
本発明は、微量のタンパク質を検出・定量する方法、及びそれらの方法を使ったタンパク質の検出・定量用試薬キットに関するものである。
【背景技術】
【0002】
タンパク質とは多数のアミノ酸がアミノ結合によって直線状に繋がったものであり、そのアミノ酸の種類、アミノ酸の数、アミノ酸の配列によってそれぞれが異なる性質をもつ多くの分子種の総称である。タンパク質はそれぞれ固有の機能を有しており、個々のタンパク質の存在の有無やその量を調べることが、疾病の検査や治療など医薬医療分野だけでなく農林畜産水産分野や食品分野においても基礎技術として重要とされてきた。そのためそれらの多くの分子種が混在した試料の中から個々のタンパク質を分離して、検出し、定量する方法が多数考案されてきた。個々のたんぱく質に分離するとそれだけ検出対象であるタンパク質の量は減少する。近年のタンパク質分離技術の発展によりナノグラムレベルの微量のタンパク質を鋭敏に検出・定量できる方法が必要とされるようになり、これまでにいくつかの方策が考案されてきた。
タンパク質の検出方法で一般的な技術の一つはそのアミド結合による280nm近傍の紫外線の吸収(UV法)で測定する方法である。またタンパク質を特異的に染める染料で染めて透過光あるいは蛍光で検出する方法(CBB染色法、銀染色法、SYPRO Rubby法など)も採られる。また抗原抗体反応を使って特定のたんぱく質を捕捉した後で、その抗体に結合する別の分子種に酵素反応できる機能を付加してその酵素反応によって検出する方法もよく用いられる(イムノアッセイ法、イムノ染色法)。いずれの方法もその感度や操作の煩雑さに問題があり、簡便で、鋭敏な検出方法の開発が望まれている。
【0003】
鋭敏にタンパク質を検出する技術としては、特許文献1及び特許文献2に記載のタンパク質を蛍光性プローブで標識して蛍光時間分解によって検出する方法がある。さらにビオチン固定化酵素とその基質との特異的結合を利用して検出する方法が特許文献3に記載されている。また簡便にタンパク質を検出する技術としては非特許文献1に記載のTbイオンとGdイオンとアニオン系界面活性剤を試料に加えてその蛍光を測定する方法、及び非特許文献2に記載TbイオンとGdイオンとカチオン系界面活性剤を試料に加えてその蛍光を測定する方法がある。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】WO2003/076938
【特許文献2】WO2007/026808
【特許文献3】特開2008−237163
【非特許文献】
【0005】
【非特許文献1】Chemical Physics Letters Vol.398 No.4/6 P.343-350(2004)
【非特許文献2】Talanta Vol.76 No.5 P.1047-1052(2008)
【非特許文献3】Dojin News No.116,P.1-7(2005)
【非特許文献4】Inorganic Chemistry Vol.45 No.10,P.4088−4096(2006)
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら上記従来の技術においては、以下のような課題を有していた。
(1)(特許文献1)乃至(特許文献3)に記載の技術は、実施するには相当な生化学実験に対する技術素養と熟練と特殊な機器が必要であり、簡便な利用は不可能であるという課題を有していた。
(2)(非特許文献1)及び(非特許文献2)に記載の技術は、その蛍光強度がタンパク質の量に対して一定せず、タンパク質の定量には適さないという課題を有していた。またナノグラム/mLレベルの低いタンパク質濃度に対してはシグナルの強度が低く正確な測定が難しいという課題を有していた。
(3)(非特許文献3)及び(非特許文献4)に記載の技術は希土類のEuを用いて生体分子を標識して検出する方法であるが実施するには相当な生化学実験に対する技術素養と熟練と特殊な機器が必要であり、簡便な利用は不可能であるという課題を有していた。
【0007】
本発明は上記従来の課題を解決するもので、簡単な操作で鋭敏により微量のタンパク質を検出、定量できるタンパク質の検出・定量方法とそれを用いたタンパク質の検出・定量用試薬キットを提供することを目的とする。
【課題を解決するための手段】
【0008】
上記従来の課題を解決するために本発明のタンパク質の検出方法・定量方法及びそれを用いたタンパク質の検出・定量用試薬キットは、以下の構成を有している。
本発明の請求項1に記載のタンパク質の検出・定量方法は、測定する試料液にタンパク質変性剤とTbイオンとCeイオンを加えて、近紫外線で励起したときに発する蛍光で測定することを特徴とする構成を有している。
この構成により、以下のような作用が得られる。
(1)タンパク質変性剤によってタンパク質の高次構造が破壊されて、測定試料溶液の中での形状の自由度が増して、加えられたTbイオンに配位しやすくなる。タンパク質と配位したTbイオンの濃度は測定試料中のタンパク質の濃度に比例する。
(2)Tbイオンはタンパク質と配位することで波長350nm近傍の光線を吸収して可視光領域の蛍光(最大波長543nm)を発するようになる。
(3)Ceイオンは測定試料中で変性したタンパク質とTbイオンと同様に配位する。タンパク質と配位したCeイオンの濃度は測定試料中のタンパク質の濃度に比例する。
(4)タンパク質と配位したCeイオンは波長255nm近傍の紫外線を吸収して350nmを最大波長と蛍光を発する。これはタンパク質と配位したTbイオンの最大吸収波長(350nm)と同じであるためにCeイオンが吸収した励起エネルギーはタンパク質と配位したTbイオンに渡される。これによりタンパク質と配位したTbイオンは高効率で蛍光を発することができる。
(5)タンパク質が存在すると、近紫外線(波長220nm以上390nm以下)での励起により、高効率で可視光領域に蛍光(最大波長543nm)を発する。この蛍光と励起光の最大波長が離れているために、測定シグナルの分離が容易で、装置を簡略化しやすい上に、測定のノイズが低くなり、精度の高い測定ができる。
(6)測定試料が発する可視光領域の蛍光の強度は試料液中のタンパク質の濃度に比例する。このため蛍光の強度を測定することで微量なタンパク質の検出・定量が可能となる。
【0009】
ここで測定するタンパク質は測定時の最終濃度で1.0×10-9g/mL以上1.0×10-3g/mL未満になるように適宜、濃縮あるいは希釈して使用する。1.0×10-9g/mL未満では蛍光シグナルが低く測定誤差が大きくなって実用的でない。1.0×10-3g/mL以上では液の散乱による測定誤差が大きくなって実用的でない。また測定試料はTris塩酸やリン酸カリウム/リン酸ナトリウムなどの緩衝液を用いてpHを6〜8の中性に保つのが好ましい。測定は0℃〜30℃で実施するのが好ましい。
【0010】
ここで、タンパク質変性剤とはタンパク質の高次構造を破壊する薬剤である。タンパク質は個々の種類毎に特有の形状にコンパクトに折り畳まれた構造(高次構造)をとり、その機能を果たしている。しかしタンパク質の検出や定量においてはタンパク質の種類による差異を無くすために、タンパク質の高次構造を壊してその個性を剥ぎ取る必要がある。このタンパク質の高次構造を壊すことをタンパク質の変性と称し、それを起こす薬剤をタンパク質変性剤と称する。酸やアルカリ、塩類、アルコール、界面活性剤など多くの物質に変成作用があることが知られている。
【0011】
ここで、TbやCeは解離したイオンの形で測定試料に加えることができればよく、試料溶液に可溶であれば、塩あるいは水酸化物、酸化物などのいずれの形態で測定試料に加えてもよい。Tbイオンの濃度は1×10-6M以上1×10-3M以下が好ましい。またCeイオンとTbイオンの測定試料中のモル濃度比は(Tbイオン1に対して)5以上20以下が好ましい。
【0012】
ここで、近紫外線とは波長200nm以上380nm未満の光線を指す。配位したCeイオンの吸収スペクトルの最大波長が255nmであり、発する蛍光の最大波長が350nmであるることから励起に用いる近紫外線は波長350nm未満であることが望ましい。また測定したい配位したTbイオンの蛍光のピークが543nmであることから、励起光の倍光による影響を避けるためは270nm付近での励起は望ましくない。よって好ましくは波長230nm以上260nm未満または波長280nm以上320nm未満の光線で励起することがよい。
【0013】
本発明の請求項2に記載の発明は、請求項1に記載のタンパク質の検出・定量方法であって、前記タンパク質変性剤がアルキルベンゼンスルホン酸塩又はアルファオレインスルホン酸塩の内いずれか1以上のアニオン系界面活性剤である構成を有している。
この構成により、請求項1の作用に加えて、以下のような作用が得られる。
請求項2に記載のタンパク質変性剤はそのアルキル鎖がタンパク質を安定化する効果をもち、過度な変性を抑え、この測定に適した変性状態とする。タンパク質の変性が不十分であると、その高次構造が保持され、イオンがうまく配位できなくて蛍光強度が下がってしまう。また配位する数が一定せず、その測定誤差が大きくなる。一方、変性が強すぎても、タンパク質の構造が硬直化し、イオンがうまく配位できなくなり蛍光強度が下がる。
このタンパク質変性剤はそのスルホン酸基に由来するマイナス電荷により、タンパク質変性剤が結合したタンパク質の近傍にTbイオンやCeイオンが近づき易くなり、結果としてこれらのイオンとタンパク質の配位を形成し易くする。
さらにこのタンパク質変性剤がもつベンゼン環が試料溶液中で疎水結合により周りのタンパク分子を集める働きをして、タンパク質の濃度が薄い試料でも十分な数がイオンに配位できるようにする。
【0014】
ここで、アルキルベンゼンスルホン酸塩としてはドデシルベンゼンスルホン酸ナトリウム(SDBS)などの炭素数10以上25以下のアルキル基を有し、ナトリウム塩やカリウム塩が使用できる。アルファオレインスルホン酸塩としてはテトラデセンスルホン酸ナトリウムなどの炭素数10以上25以下のナトリウム塩やカリウム塩が使用できる。アニオン系界面活性剤の濃度は測定試料の最終濃度として1×10-5M以上1×10-3M未満が好ましい。1×10-3M以上では蛍光ノイズが増加して測定に適さない。また1×10-5M未満では変成作用が十分に作用せず、Tbイオンとタンパク質の配位が少なくなり、蛍光強度が下がるために、測定感度が下がり実用的でない。
【0015】
本発明の請求項3に記載の発明は、請求項1に記載のタンパク質の検出・定量方法であって、前記タンパク質変性剤がハロゲン化アルキルピリジニウムを含有するカチオン系界面活性剤である構成を有している。
この構成により、請求項1の作用に加え、以下のような作用が得られる。
(1)請求項3に記載のタンパク質変性剤はそのアルキル鎖がタンパク質を安定化する効果をもち、過度な変性を抑え、この測定に適した変性状態とする。タンパク質の変性が不十分であると、その高次構造が保持され、イオンがうまく配位できなくて蛍光強度が下がってしまう。また配位する数が一定せず、その測定誤差が大きくなる。一方、変性が強すぎても、タンパク質の構造が硬直化し、イオンがうまく配位できなくなり蛍光強度が下がる。
(2)このタンパク質変性剤由来のハロゲンイオンの強い電気陰性度により、タンパク質変性剤が結合したタンパク質(プラスに荷電)とともにカチオンであるTbイオンやCeイオンを集め、これらのイオンを配位し易くする。
(3)生体由来の測定試料には脂質などマイナス電荷を帯びた物質が多く含まれており、タンパク質に付着して相互作用をしていることが多い。このタンパク質変性剤のプラス電荷がそれらのマイナス電荷を帯びた物質と結合するためにタンパク質への付着物が減り、TbイオンやCeイオンと配位しやすくなる。
(4)タンパク質の研究ではその実験に応じて様々な界面活性剤を使用するため、測定試料も様々な界面活性剤を含みうる。タンパク質変性剤の使用できる範囲が広がることで適用できる試料の範囲が拡大する。
【0016】
ここで、ハロゲン化アルキルピリジニウムとしては塩化物、臭化物などが使用できる。またアルキル基としては炭素数10以上25以下のものが望ましい。例えば臭化ヘキサデシルピリジニウム(HDP)などが使用できる。カチオン系界面活性剤の濃度は測定試料の最終濃度として1×10-5M以上1×10-3M未満が好ましい。1×10-3M以上では蛍光ノイズが増加して測定に適さない。また1×10-5M未満では変成作用が十分に作用せず、Tbイオンとタンパク質の配位が少なくなり、測定感度が下がり実用的でない。
【0017】
この構成は非特許文献2とは異なり、Tbイオンに加えるイオンがCeイオンである。配位したCeイオンの発する蛍光の波長は配位したGdイオンの発する蛍光の波長よりも配位したTbイオンの吸収波長に近い。そのため、励起光のエネルギーが効率よくTbイオンに渡される。結果として非特許文献2よりも蛍光シグナルが大きくなり、測定感度と定量精度が高くなる。
【0018】
本発明の請求項4に記載の発明は、請求項1乃至請求項3の内のいずれか1に記載のタンパク質の検出・定量方法であって、エチルアルコール又はプロピルアルコールなど炭素数2以上6以下のアルコールを加えて蛍光強度を増強して感度を上げた構成を有している。
この構成により、請求項1乃至請求項3の内のいずれか1の作用に加え、以下のような作用が得られる。
(1)アルコールの添加により水とタンパク質の間の相互作用が弱まる。これにより、タンパク質の構造の自由度がさらに高まり、TbイオンやCeイオンとの配位がさらに容易となる。またアルコールが測定試料中の水分子を抱え込み、タンパク質とイオン類の濃度が相対的に上昇したこととなる。これらの相乗作用によってシグナルの強度が上昇し検出感度と検出精度が上る。
【0019】
ここで、添加するアルコールの量は測定時の最終濃度で1×10-6M以上5×10-4M未満が好ましい。アルコールの濃度が1×10-6M未満ではアルコールの添加の効果はほとんど見られなくなる。しまう。またアルコール濃度5×10-4M以上ではタンパク質の変性が過剰に起こり、Tbイオンとの相互作用が阻害されるため蛍光強度は下がってしまう。
【0020】
本発明の請求項5に記載の発明は、請求項4に記載のタンパク質の検出・定量の方法であって、前記Ceイオンに代えてGdイオンを用いた構成を有している。
この構成より請求項4の作用に加えて以下のような作用が得られる。
(1)加えられたアルコールによりタンパク質と水分子との相互作用が弱まり、残存していた2次構造が破壊され、ペプチド鎖の自由度が高まる。これによりタンパク質がTbイオンやCeイオンと配位しやすくなる。そのためにタンパク質を検出するシグナル強度が増大し、検出感度と検出精度が上る。
【0021】
ここで、Gdは解離したイオンの形で測定試料に加えることができればよく、試料溶液に可溶であれば、塩あるいは水酸化物、酸化物などのいずれの形態で測定試料に加えてもよい。またGdイオンとTbイオンの測定試料中の濃度比は(Tbイオン1に対して)5以上20以下が好ましい。
非特許文献1の構成もTbイオンとSDBSであり、感度増強のために使うイオンがGdイオンである。Gdイオンの蛍光最大波長310nmがCeイオンの蛍光最大波長350nmと比べてTbイオンの吸収最大波長350nmから離れているためにエネルギーの受け渡し効率が低くなりタンパク質検出感度が低かった。本発明では、アルコール添加により検出感度を1.5倍から3倍に増強しその感度低下を補っている。
【0022】
本発明の請求項6に記載の発明は、請求項1乃至請求項5の内のいずれか1に記載のタンパク質の検出・定量の方法であって、試薬の混合順序が、最初にタンパク質変性剤とTbイオンを混合し十分に配位させる配位工程と、次いでCeイオン又はGdイオンを加えて蛍光強度を増強して感度を上げる増感工程とを備えた構成を有している。
この構成により、請求項1乃至請求項5の内いずれか1で得られる作用に加え、以下のような作用が得られる。
(1)Tbイオンが変性したタンパク質と十分に配位したあとで、CeイオンあるいはGdイオンが加えられるので、Tbイオンとタンパク質の配位が競合阻害を受けない。これにより後から加えたCeイオンあるいはGdイオンがその感度増強作用を最大限に果たすことができる。
【0023】
ここでTbイオンを混合した後のタンパク質との配位工程に要する時間は,試料10mlの場合10秒以上の混合であればよく、その後で感度増強用のCeイオンまたはGdイオンを加えればよい。アルコールの添加時期は感度増強用のCeイオンまたはGdイオンの添加と同時あるいはその後であれば適宜に決めることができる。
【0024】
本発明の請求項7に記載の発明は、タンパク質の検出・定量用の試薬キットであってタンパク質変性剤として界面活性剤を含む変性液と、Tbイオンを含む配位液と、Ceイオンをを含む増感液との3種類の液を備えた構成を有している。
この構成により、以下のような作用が得られる。
(1)測定者が個別に試薬類を調製することなく、測定試料とキットに含まれる液を指示に従って加えていくだけで、測定準備が完了するので、生化学的な経験や知識が乏しい測定者であっても非常に簡便にタンパク質の検出ができる。
(2)測定の都度に試薬液を調製しないので、毎回同じ条件で測定できる。
(3)標準試料として既知の濃度のタンパク質溶液があれば、それとの比較で簡便にタンパク質の定量ができる。
【0025】
ここで界面活性剤としては炭素数10以上25以下のアルキル基を有するアルキルベンゼンスルホン酸塩や炭素数10以上25以下のアルファオレインスルホン酸塩、炭素数10以上25以下のハロゲン化アルキルピリジニウムなどが使用できる。例えばドデシルベンゼンスルホン酸ナトリウム(SDBS)、テトラデセンスルホン酸カリウム、臭化ヘキサデシルピリジニウム(HDP)などが使用できる。界面活性剤の濃度は測定試料の最終濃度として1×10-5M以上1×10-3M未満となることが好ましい。
【0026】
ここでTbイオンの濃度は測定試料の最終濃度として1×10-6M以上1×10-3M以下となることが好ましい。CeイオンとTbイオンの測定試料中のモル濃度比は(Tbイオン1に対して)5以上20以下となることが好ましい。
【0027】
本発明の請求項8に記載の発明は、請求項7に記載のタンパク質の検出・定量用の試薬キットであって、変性液と配位液と増感液との3種類の液の内のいずれか2以上があらかじめ混合されていることを特徴とする構成を有している。
この構成により、以下のような作用が得られる。
(1)液の種類が少ないため、経験の乏しい作業者でも混合ミスが少なくなる。
(2)試薬の混合比が一定となるため、再現性の高い結果を得やすくなる。
【0028】
ここで変性液と配位液を混合したものを測定セルに封入したり、測定基材片に塗布させたものを使用してもよい。測定試料を加えて、増感液を添加するとそのまま測定することが可能となる。
【発明の効果】
【0029】
以上のように、本発明のタンパク質の検出・定量方法及びそれを用いたタンパク質の検出・定量用試薬キットによれば、以下のような有利な効果が得られる。
請求項1に記載の発明によれば、
(1)簡便な操作で迅速にタンパク質の検出をする方法を提供することができるので、医療・医薬・食品など様々な分野の検査を簡便化できる。
(2)試料中の微量のタンパク質の有無を検出できる方法を提供することができるので人の手や細菌などによる工業製品の汚染の有無の検査が簡便に可能となる。
(3)既存およびこれから開発されるであろうタンパク質の分離技術に対して、その分離された個々のタンパク質を迅速かつ鋭敏に検出・定量できる方法を提供することができるのでライフサイエンス分野の研究開発を促進できる。この発明を用いて病理検査機器や、疾病の検査キットや食品の検査キットなど様々な機器やキットの設計が可能となる。
【0030】
請求項2に記載の発明によれば、請求項1の効果に加え、
(1)高感度で、迅速なタンパク質の検出・定量の方法とそれに用いる試薬キットを提供することができるので、熟練をした技術者でなくても再現性よく微量なタンパク質の検出・定量が可能となる。
(2)迅速な測定方法とそれに用いる試薬キットを提供することができるので医療や食品など様々な分野での検査が迅速化できる。
【0031】
請求項3に記載の発明によれば、請求項1の効果に加え、
(1)カチオン系界面活性剤は殺菌作用があるため、医療分野でよく用いられている。そのため細菌検査など感染性の試料に対する測定方法を提供することができる。
【0032】
請求項4に記載の発明によれば、請求項1乃至3の内の1の効果に加え、
(1)より感度の高いタンパク質の検出・定量の方法を提供することができる。また医療分野などで殺菌・消毒のためにアルコールが含まれている試料も簡便に測定できる方法を提供できる。
【0033】
請求項5に記載の発明によれば、請求項4の効果に加え、
(1)類似の系で異なる測定方法を提供することができる。これによりさらに別の蛍光シグナルを用いる測定と組み合わせることが可能となり、より高度な研究開発や医療分野での応用が可能となる。
【0034】
請求項6に記載の発明によれば、請求項1乃至5の内いずれか1の効果に加え、
(1)より高感度で、精度の高い測定方法を提供することができる。この発明を自動化
測定器の設計に組み込めば広く産業界での利用が可能となる。
【0035】
請求項7に記載の発明によれば、
(1)生化学的手法に不慣れな作業者であっても簡便に、タンパク質の検出・定量が現場等で簡易・迅速に実施できる。これにより製品汚染の検査など広い分野での利用が可能となる。
【0036】
請求項8に記載の発明よれば、
(1)分析や測定などの細かい作業に不慣れな作業者であっても、簡便に再現性よくタンパク質の検出・定量が実施できる。液数が少ないので携帯するのも楽であり、屋外などでも検査が可能となる。
【図面の簡単な説明】
【0037】
【図1】Tbイオン:SDBS:Ceイオン系によるコラーゲン検出時の蛍光スペクトル
【図2】Tbイオン:SDBS:Ceイオン系によるエラスチン検出時の蛍光スペクトル
【図3】Tbイオン:SDBS:Ceイオン系による牛血清アルブミン検出時の蛍光スペクトル
【図4】Tbイオン:HDP:Ceイオン系によるタンパク質の検出時の蛍光スペクトル
【図5】Tbイオン:SDBS:Gdイオン:エチルアルコール系によるコラーゲンの検出時の蛍光スペクトル
【図6】Tbイオン:SDBS:Ceイオン系によるコラーゲンの検出時の蛍光スペクトル
【図7】タンパク質の濃度と蛍光強度の関係を示すグラフ
【発明を実施するための形態】
【0038】
本発明は微量のタンパク質を検出するものであるので、濃厚な試料の場合は水または緩衝液で適宜希釈して測定する。タンパク質濃度は測定時の最終濃度で1ng/mL以上1mg/mL以下が望ましい。
本発明で添加するTbイオンや界面活性剤、感度増強用のイオン、アルコールは予め最終濃度の5倍から1000倍濃度で調製しておくと使い易い。
測定用の試料セルに測定試料を一定量入れ、ここに残りの試薬類を添加してよく混合した後で、紫外線で励起し、Tbイオンによる543nmの蛍光を測定する。
【実施例】
【0039】
以下、本発明を実施例により具体的に説明する。なお、本発明はこれらの実施例に限定されるものではない。
(実施例1)Tb:SDBS:Ce系によるコラーゲンの検出
精製されたタンパク質として安価で手に入れ易いコラーゲン(牛アキレス腱由来)の水溶液を用いた場合について記載する。
コラーゲンを1.0×10-4g/mLの濃度に溶かしたタンパク質溶液100μLを20mL試験管に取り、そこに蒸留水7740μLとTris塩酸緩衝液(5.0×10-4M、pH7.0)1000μLと、アニオン系界面活性剤のドデシルベンゼンスルホン酸ナトリウム(SDBS)の水溶液(濃度1.0×10-3M)1000μLと、TbCl3水溶液(濃度1.0×10-2M)10μLと、CeCl3水溶液(濃度1.0×10-2M)150μLを加えて、ゴム栓をして10秒間振り混ぜ、蛍光測定セルに移して分光蛍光光度計(HITACHI F−4500)で蛍光スペクトルを測定した。励起波長は290nmを用いた。試料溶液の主要構成要素の最終組成を表1に示す。結果を図1の線1に示す。
【0040】
(比較例1)実施例1でSDBSとCeイオンを欠いた場合
実施例1に記載の実験条件から表1に記載のとおり構成要素のうちSDBSとCeイオンを欠いた場合について実施例1と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表1に示す。結果を図1の線2に示す。
【0041】
(比較例2)実施例1でコラーゲンとCeイオンを欠いた場合
実施例1に記載の実験条件から表1に記載のとおり構成要素のうちコラーゲンとCeイオンを欠いた場合について実施例1と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表1に示す。結果を図1の線3に示す。
【0042】
(比較例3)実施例1でCeイオンを欠いた場合
実施例1に記載の実験条件から表1に記載のとおり構成要素のうちCeイオンを欠いた場合について実施例1と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表1に示す。結果を図1の線4に示す。
【0043】
【表1】

【0044】
図1の線1に示したようにTb:SDBS:Ce系ではコラーゲンが存在すると配位したTbイオンに由来する490nmと543nmの蛍光が観察された(実施例1)。一方で構成要素を欠いた比較例1(線2:SDBSとCeイオンを欠いた場合)、比較例2(線3:タンパク質とCeイオンを欠いた場合)、比較例3(線4:Ceイオンを欠いた場合)では490nmと534nmのどちらにも蛍光のピークは見られなかった。
【0045】
(実施例2)Tb:SDBS:Ce系によるエラスチンの検出
タンパク質としてコラーゲン同様に安価で手に入り易いエラスチン(牛頚部靭帯由来)の水溶液を用いた場合に実施例1と同じ方法で表2に記載の最終濃度実験条件で蛍光スペクトルを測定した。結果を図2の線5に示す。
【0046】
(比較例4)実施例2でSDBSとCeイオンを欠いた場合
実施例2に記載の実験条件から表2に記載のとおり構成要素のうちSDBSとCeイオンを欠いた場合について実施例2と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表2に示す。結果を図2の線6に示す。
【0047】
(比較例5)実施例2でコラーゲンとCeイオンを欠いた場合
実施例2に記載の実験条件から表2に記載のとおり構成要素のうちコラーゲンとCeイオンを欠いた場合について実施例2と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表2に示す。結果を図2の線7に示す。
【0048】
(比較例6)実施例2でCeイオンを欠いた場合
実施例2に記載の実験条件から表2に記載のとおり構成要素のうちCeイオンを欠いた場合について実施例1と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表2に示す。結果を図2の線8に示す。
【0049】
【表2】

【0050】
図2の線5から明らかなようにTb:SDBS:Ce系ではタンパク質をエラスチンに代えてもコラーゲンの場合と同じように配位したTbイオンに由来する490nmと543nmにピークをもつ蛍光が観察された(実施例2)。一方で構成要素を欠いた比較例4(線6:界面活性剤とCeイオンを欠いた場合)、比較例5(線7:タンパク質とCeイオンを欠いた場合)、比較例6(線8:Ceイオンを欠いた場合)では490nmと534nmのどちらにも蛍光のピークは見られなかった。
【0051】
(実施例3)Tb:SDBS:Ce系による牛血清アルブミンの検出
タンパク質としてコラーゲン同様に安価で手に入り易い牛血清アルブミン(BSA)の水溶液を用いた場合に実施例1と同じ方法で表3に記載の最終濃度実験条件で蛍光スペクトルを測定した。結果を図3の線9に示す。
【0052】
(比較例7)実施例3でSDBSとCeイオンを欠いた場合
実施例3に記載の実験条件から表3に記載のとおり構成要素のうちSDBSとCeイオンを欠いた場合について実施例3と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表3に示す。結果を図3の線10に示す。
【0053】
(比較例8)実施例3でコラーゲンとCeイオンを欠いた場合
実施例3に記載の実験条件から表3に記載のとおり構成要素のうちコラーゲンとCeイオンを欠いた場合について実施例3と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表3に示す。結果を図3の線11に示す。
【0054】
(比較例9)実施例3でCeイオンを欠いた場合
実施例3に記載の実験条件から表3に記載のとおり構成要素のうちCeイオンを欠いた場合について実施例3と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表3に示す。結果を図3の線12に示す。
【0055】
【表3】

【0056】
図3の線9から明らかなようにTb:SDBS:Ce系ではタンパク質をBSAに代えてもコラーゲンやエラスチンと同じように配位したTbイオンに由来する490nmと543nmにピークをもつ蛍光が観察された(実施例3)。一方で構成要素を欠いた比較例7(線10:界面活性剤とCeイオンを欠いた場合)、比較例8(線11:タンパク質とCeイオンを欠いた場合)、比較例9(線12:Ceイオンを欠いた場合)では490nmと534nmのどちらにも蛍光のピークは見られなかった。
【0057】
Tb:HDP:Ce系によるたんぱく質の検出
(実施例4)実施例1の界面活性剤をカチオン系界面活性剤臭化ヘキサデシルピリジニウム(HDP)に変更して実施例1と同様にBSAの水溶液について蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表4に示す。結果を図4の線13に示す。
(実施例5)実施例4のタンパク質をBSAからエラスチンに変更して実施例4と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表4に示す。結果を図4の線14に示す。
(実施例6)実施例4のタンパク質をBSAからコラーゲンに変更して実施例4と同様にして蛍光スペクトルを測定した。試料溶液の主要構成要素の最終組成を表4に示す。結果を図4の線15に示す。
【0058】
【表4】

【0059】
図4の線13(実施例4:BSAの場合)、線14(実施例5:エラスチンの場合)、線15(実施例6コラーゲンの場合)から明らかなように界面活性剤をカチオン系のHDPに変更したTb:HDP:Ce系においてもタンパク質が存在すると配位したTbイオンに由来する543nmにピークをもつ蛍光が観察され、この系がタンパク質の検出・定量に使用できることが示された。490nmの蛍光のピークはBSAでのみ観察された。Tbイオンへのエネルギーの伝達においてSDBSの場合と違いがあるためと考えられる。
【0060】
(実施例7)Tbイオン:SDBS:Gdイオン:アルコール系によるコラーゲンの検出
コラーゲン溶液にTbイオンと界面活性剤SDBSとGdイオンを加え混合し、次いでエチルアルコールを最終濃度1.0×10-4Mとなるように加えて混合し、励起波長290nmによる蛍光スペクトルを測定した。試料の主要構成要素の最終濃度組成を表5に示す。結果を図5の線16に示す。
【0061】
(比較例10)実施例7からアルコールを欠いた場合
実施例7の実験条件から表5に記載のとおりエチルアルコールを欠いた場合について実施例7と同様に蛍光スペクトルを測定した。主要構成要素の最終濃度組成を表5に示す。結果を図5の線17に示す。
(比較例11)実施例7より過剰にアルコールを入れた場合
実施例7の実験条件よりも表5に記載のとおりエチルアルコール過剰に加えた場合について実施例7と同様に蛍光スペクトルを測定した。主要構成要素の最終濃度組成を表5に示す。結果を図5の線18に示す。
【0062】
【表5】

【0063】
図5の線16で明らかなようにTbイオン:SDBS:Gdイオンの系においてエチルアルコールを添加すると(線16:実施例7)、エチルアルコールを加えない場合(比較線17:例10)に比べてTbイオンによる543nmの蛍光ピークはおよそ3割増大する。エチルアルコールがコラーゲンから水分子を奪うことで未変性で残っていたコラーゲンの高次構造を破壊したことで、TbイオンやGdイオンなどと配位できる部位が増えたためと考えられる。
過剰にエチルアルコールを加えた場合(線18:比較例11)では逆にTbイオンによる543nmの蛍光強度は減少した。過剰のエチルアルコールを加えると水分子を奪われた結果としてペプチド鎖の自由度が下がり、TbイオンやGdイオンなどに配位できる部位が減るために蛍光強度が下がったと考えられる。この系でコラーゲンの検出の感度を増大するためのエチルアルコールの最適濃度は5.0×10-5Mから5.0×10-4Mの間にあった。
【0064】
(実施例8)Tbイオン:SDBS:Ceイオン系によるコラーゲン検出に対する試薬の添加順序の効果
コラーゲン溶液にTbイオンと界面活性剤SDBSを加えて混合した。そのまま20秒静置してからCeイオンを加えて混合して励起波長は290nmで蛍光スペクトルを測定した。試料溶液の最終組成を表6に示す。結果を図6の線19に示す。
(比較例12)
実施例8とまったく同じ試料と同じ濃度条件において、Tbイオンと界面活性剤を加えるときに同時にCeイオンを加えて混合し、そのまま20秒静置してから実施例8と同様に蛍光スペクトルを測定した。試料溶液の最終組成を表6に示す。結果を図6の線20に示す。
【0065】
【表6】

【0066】
図6の線19と線20で明らかなように、Tbイオンとタンパク質の配位を最初にさせて、次いで増強用のCeイオンを加えた場合(線19:実施例8)の方が試薬を同時に混合して測定した場合(線20:比較例12)に比べて、配位したTbイオンによる543nmの蛍光は増大した。先にTbイオンとタンパク質を配位させておくと、Tbイオンがタンパク質の殻に覆われたようになり、増強用のCeイオンが加えられても、イオンの交換反応が起こりにくなる。そのためタンパク質との配位においてTbイオンとCeイオンが競合して、配位したTbイオンの濃度を下げることがないため蛍光強度が高くなるのに対して、試薬を同時に混合するとタンパク質との配位においてTbイオンとCeイオンが競合して、配位したTbイオンの濃度が下がってしまい蛍光強度が低くなるのだと考えられる。
【0067】
タンパク質の濃度と蛍光強度の関係
(実施例9)濃度を1.0×10-6g/mL、2.0×10-6g/mL、4.0×10-6g/mLと3段階に調製したコラーゲン水溶液を使って実施例1と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線21に示す。
(実施例10)実施例9においてタンパク質をコラーゲンからエラスチンに変更して、実施例10と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線22に示す。
(実施例11)実施例9においてタンパク質をコラーゲンからBSAに変更して、実施例10と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線23に示す。
(実施例12)実施例9においてタンパク質をコラーゲンから合成ペプチド1に変更して、実施例10と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線24に示す。合成ペプチド1のアミノ酸配列はDSRMIAGLKTLHDである。
(実施例13)実施例9においてタンパク質をコラーゲンから合成ペプチド2に変更して、実施例10と同様にして波長543nmの蛍光強度を測定した。試料溶液の最終濃度組成を表7に示す。測定結果を図7の線25に示す。合成ペプチド2のアミノ酸配列はTTTPGTTTAGTTTSRである。
【0068】
【表7】

【0069】
図7の線21から線25で明らかなように3種のタンパク質と2種の合成ペプチドは、本発明による方法でその濃度に比例した蛍光を発した(線21:コラーゲンの場合:実施例9)(線22:エラスチンの場合:実施例10)(線23:BSAの場合:実施例11)(線24:合成ペプチド1の場合:実施例12)(線25:合成ペプチド2の場合:実施例13)。タンパク種による違いは明確には認めらず、合成ペプチドからコラーゲンまでほぼ同じ蛍光強度とタンパク質濃度の比例関係を示した。したがってこの測定に用いた試験液をあらかじめ調製してキットとすれば簡便に迅速に再現性よくタンパク質の検出と定量ができることが示された。
【符号の説明】
【0070】
1 実施例1の蛍光スペクトル
2 比較例1の蛍光スペクトル
3 比較例2の蛍光スペクトル
4 比較例3の蛍光スペクトル
5 実施例2の蛍光スペクトル
6 比較例4の蛍光スペクトル
7 比較例5の蛍光スペクトル
8 比較例6の蛍光スペクトル
9 実施例3の蛍光スペクトル
10 比較例7の蛍光スペクトル
11 比較例8の蛍光スペクトル
12 比較例9の蛍光スペクトル
13 実施例4の蛍光スペクトル
14 実施例5の蛍光スペクトル
15 実施例6の蛍光スペクトル
16 実施例7の蛍光スペクトル
17 比較例10の蛍光スペクトル
18 比較例11の蛍光スペクトル
19 実施例8の蛍光スペクトル
20 比較例12の蛍光スペクトル
21 実施例9の蛍光強度
22 実施例10の蛍光強度
23 実施例11の蛍光強度
24 実施例12の蛍光強度
25 実施例13の蛍光強度
【特許請求の範囲】
【請求項1】
測定する試料液にタンパク質変性剤とTbイオンとCeイオンを加えて、近紫外線で励起したときに発する蛍光で測定することを特徴とするタンパク質の検出・定量方法。
【請求項2】
請求項1に記載のタンパク質の検出及び定量の方法であって、前記タンパク質変性剤がアルキルベンゼンスルホン酸塩又はアルファオレインスルホン酸塩の内いずれか1以上のアニオン系界面活性剤であることを特徴とするタンパク質の検出・定量方法。
【請求項3】
請求項1に記載のタンパク質の検出及び定量の方法であって、前記タンパク質変性剤がハロゲン化アルキルピリジニウムを含有するカチオン系界面活性剤であることを特徴とするタンパク質の検出・定量方法。
【請求項4】
請求項1乃至請求項3のいずれか1に記載のタンパク質の検出及び定量の方法であって、エチルアルコール又はプロピルアルコールなど炭素数2以上6以下のアルコールを加えて蛍光強度を増強して感度を上げたことを特徴とするタンパク質の検出・定量方法。
【請求項5】
請求項4に記載のタンパク質の検出及び定量の方法であって、前記Ceイオンに代えてGdイオンを用いたことを特徴とするタンパク質の検出および定量の方法。
【請求項6】
請求項1乃至請求項5の内いずれか1に記載のタンパク質の検出及び定量の方法であって、試薬の混合順序が、最初にタンパク質変性剤とTbイオンを混合し十分に配位させる配位工程と、次いでCeイオンあるいはGdイオンを加えて蛍光強度を増強して感度を上げる増感工程とを備えていることを特徴とするタンパク質の検出・定量方法。
【請求項7】
タンパク質変性剤として界面活性剤を含む変性液と、Tbイオンを含む配位液と、Ceイオンを含む増感液との3種類の液を備えることを特徴とするタンパク質の検出・定量用試薬キット。
【請求項8】
請求項7に記載のタンパク質の検出及び定量の試薬キットであって、前記変性液と前記配位液と前記増感液との3種類の液の内のいずれか2以上があらかじめ混合されていることを特徴とするタンパク質の検出・定量用試薬キット。
【請求項1】
測定する試料液にタンパク質変性剤とTbイオンとCeイオンを加えて、近紫外線で励起したときに発する蛍光で測定することを特徴とするタンパク質の検出・定量方法。
【請求項2】
請求項1に記載のタンパク質の検出及び定量の方法であって、前記タンパク質変性剤がアルキルベンゼンスルホン酸塩又はアルファオレインスルホン酸塩の内いずれか1以上のアニオン系界面活性剤であることを特徴とするタンパク質の検出・定量方法。
【請求項3】
請求項1に記載のタンパク質の検出及び定量の方法であって、前記タンパク質変性剤がハロゲン化アルキルピリジニウムを含有するカチオン系界面活性剤であることを特徴とするタンパク質の検出・定量方法。
【請求項4】
請求項1乃至請求項3のいずれか1に記載のタンパク質の検出及び定量の方法であって、エチルアルコール又はプロピルアルコールなど炭素数2以上6以下のアルコールを加えて蛍光強度を増強して感度を上げたことを特徴とするタンパク質の検出・定量方法。
【請求項5】
請求項4に記載のタンパク質の検出及び定量の方法であって、前記Ceイオンに代えてGdイオンを用いたことを特徴とするタンパク質の検出および定量の方法。
【請求項6】
請求項1乃至請求項5の内いずれか1に記載のタンパク質の検出及び定量の方法であって、試薬の混合順序が、最初にタンパク質変性剤とTbイオンを混合し十分に配位させる配位工程と、次いでCeイオンあるいはGdイオンを加えて蛍光強度を増強して感度を上げる増感工程とを備えていることを特徴とするタンパク質の検出・定量方法。
【請求項7】
タンパク質変性剤として界面活性剤を含む変性液と、Tbイオンを含む配位液と、Ceイオンを含む増感液との3種類の液を備えることを特徴とするタンパク質の検出・定量用試薬キット。
【請求項8】
請求項7に記載のタンパク質の検出及び定量の試薬キットであって、前記変性液と前記配位液と前記増感液との3種類の液の内のいずれか2以上があらかじめ混合されていることを特徴とするタンパク質の検出・定量用試薬キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2010−286326(P2010−286326A)
【公開日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願番号】特願2009−139688(P2009−139688)
【出願日】平成21年6月10日(2009.6.10)
【出願人】(802000031)財団法人北九州産業学術推進機構 (187)
【Fターム(参考)】
【公開日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願日】平成21年6月10日(2009.6.10)
【出願人】(802000031)財団法人北九州産業学術推進機構 (187)
【Fターム(参考)】
[ Back to top ]

